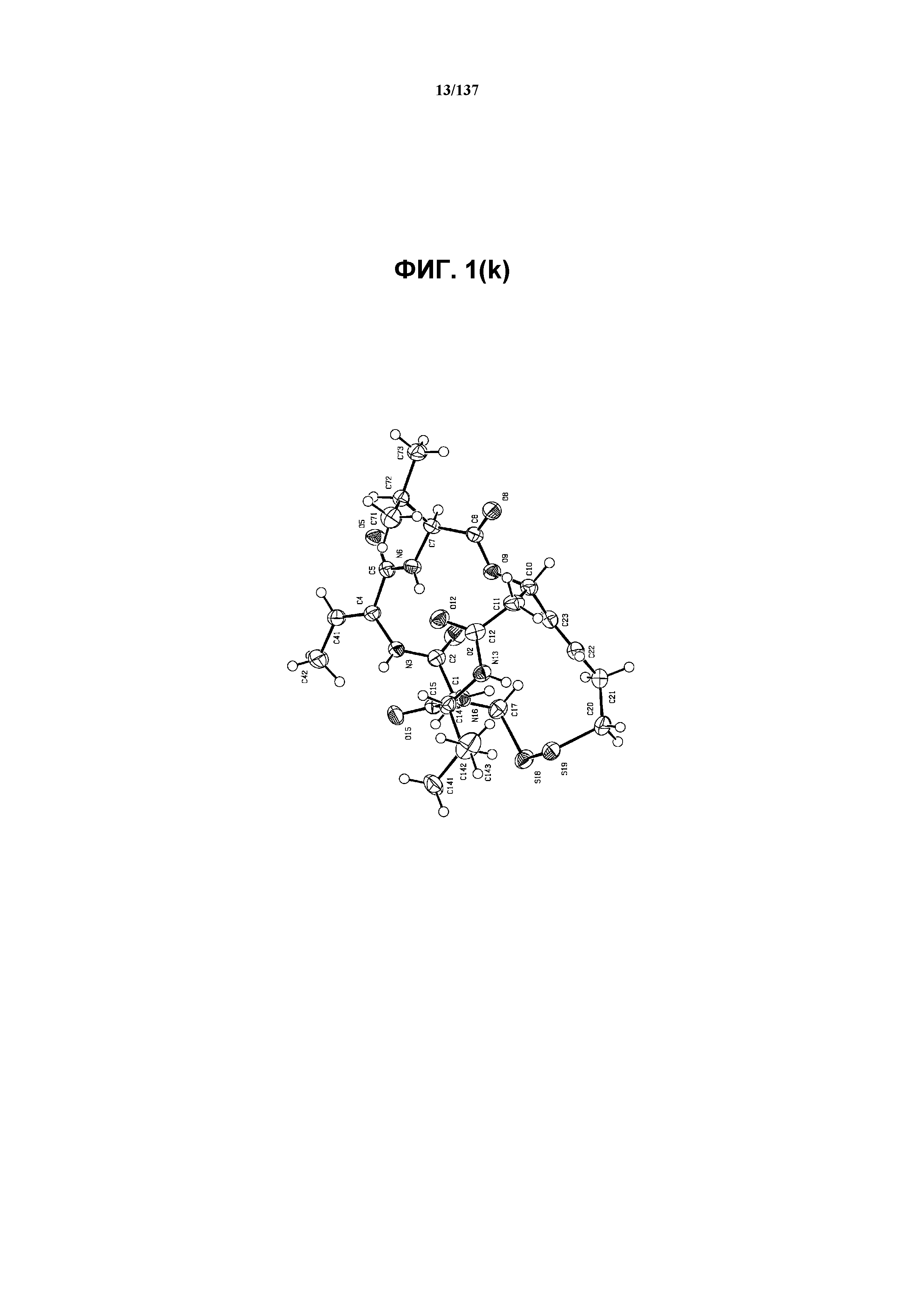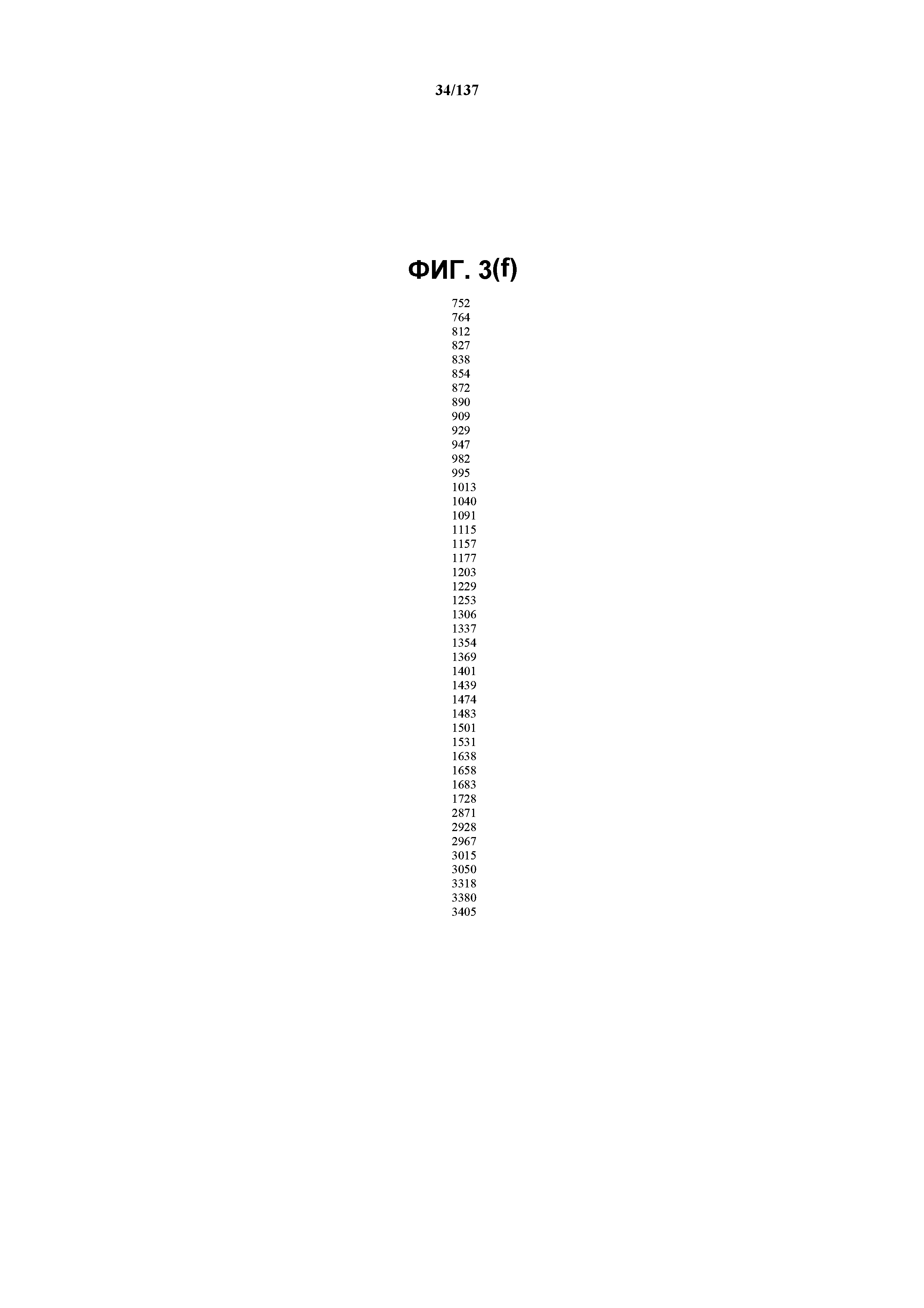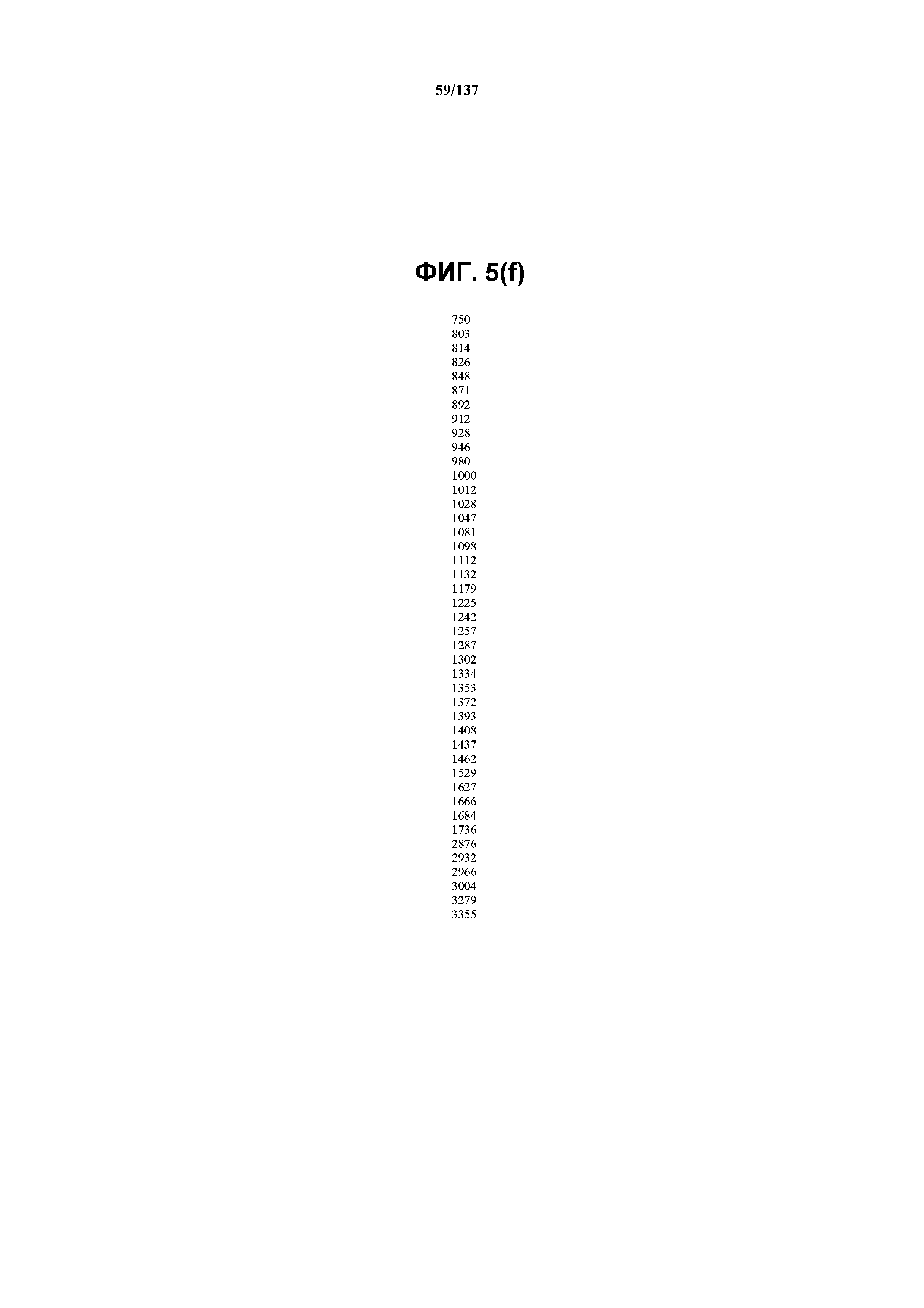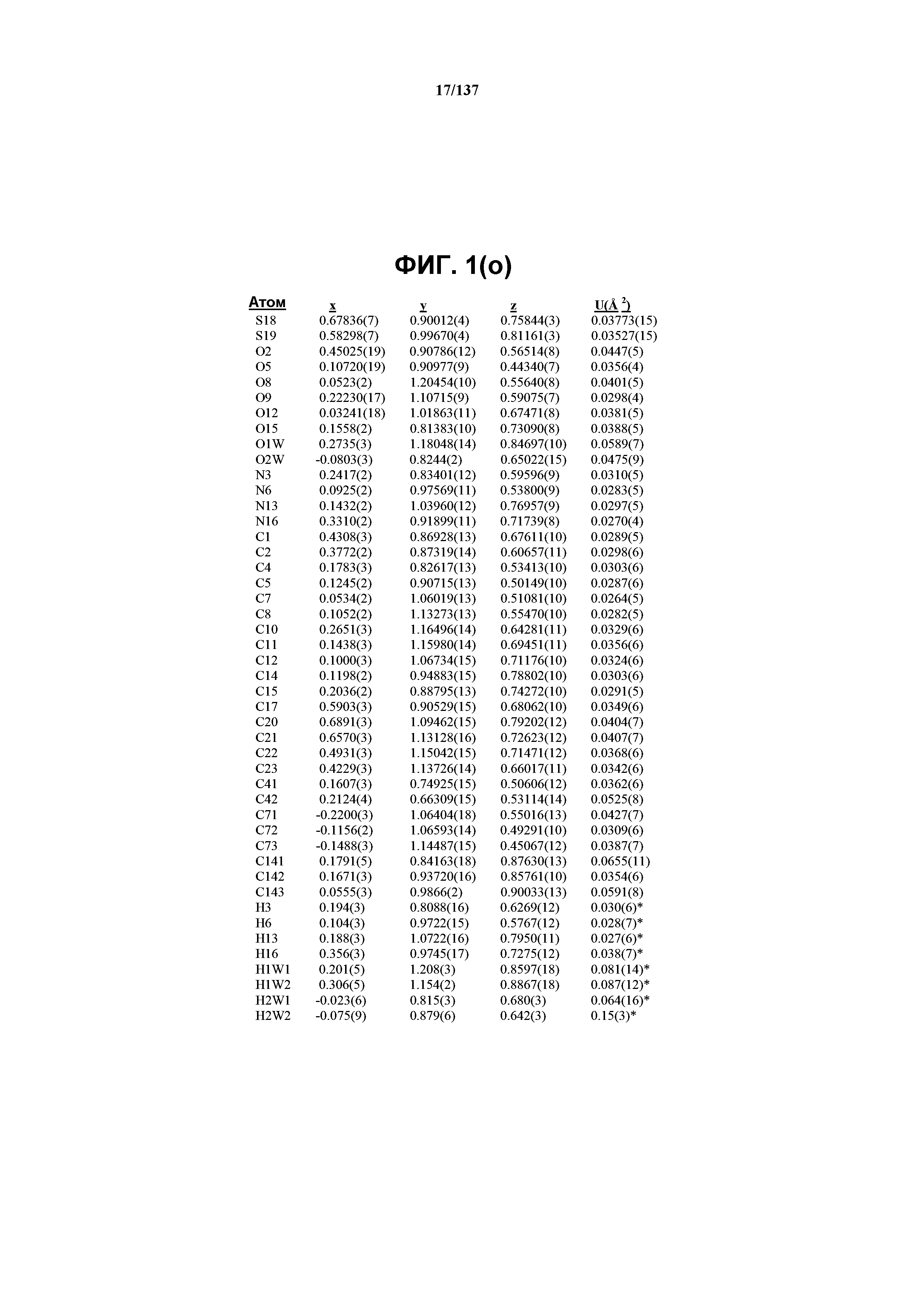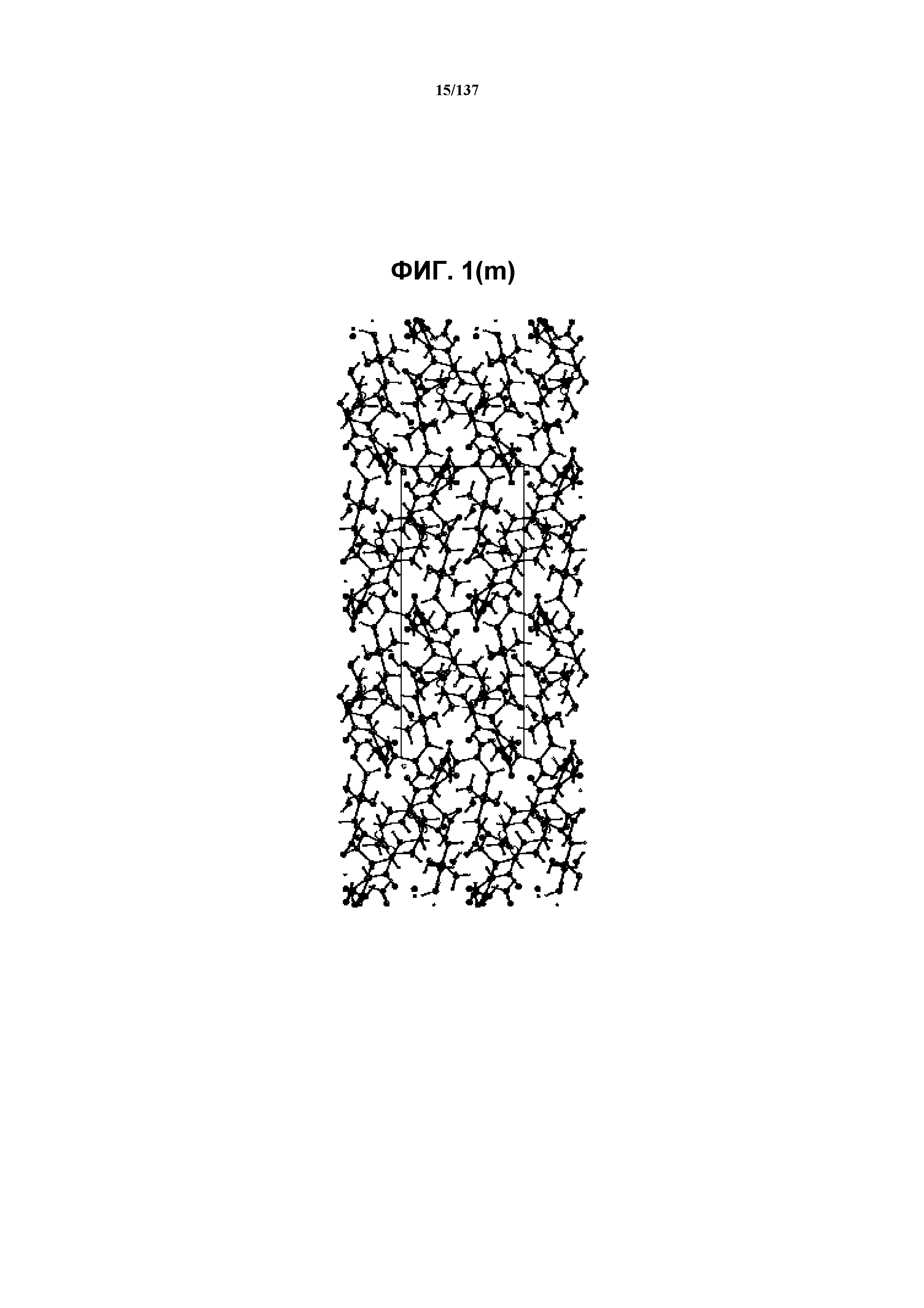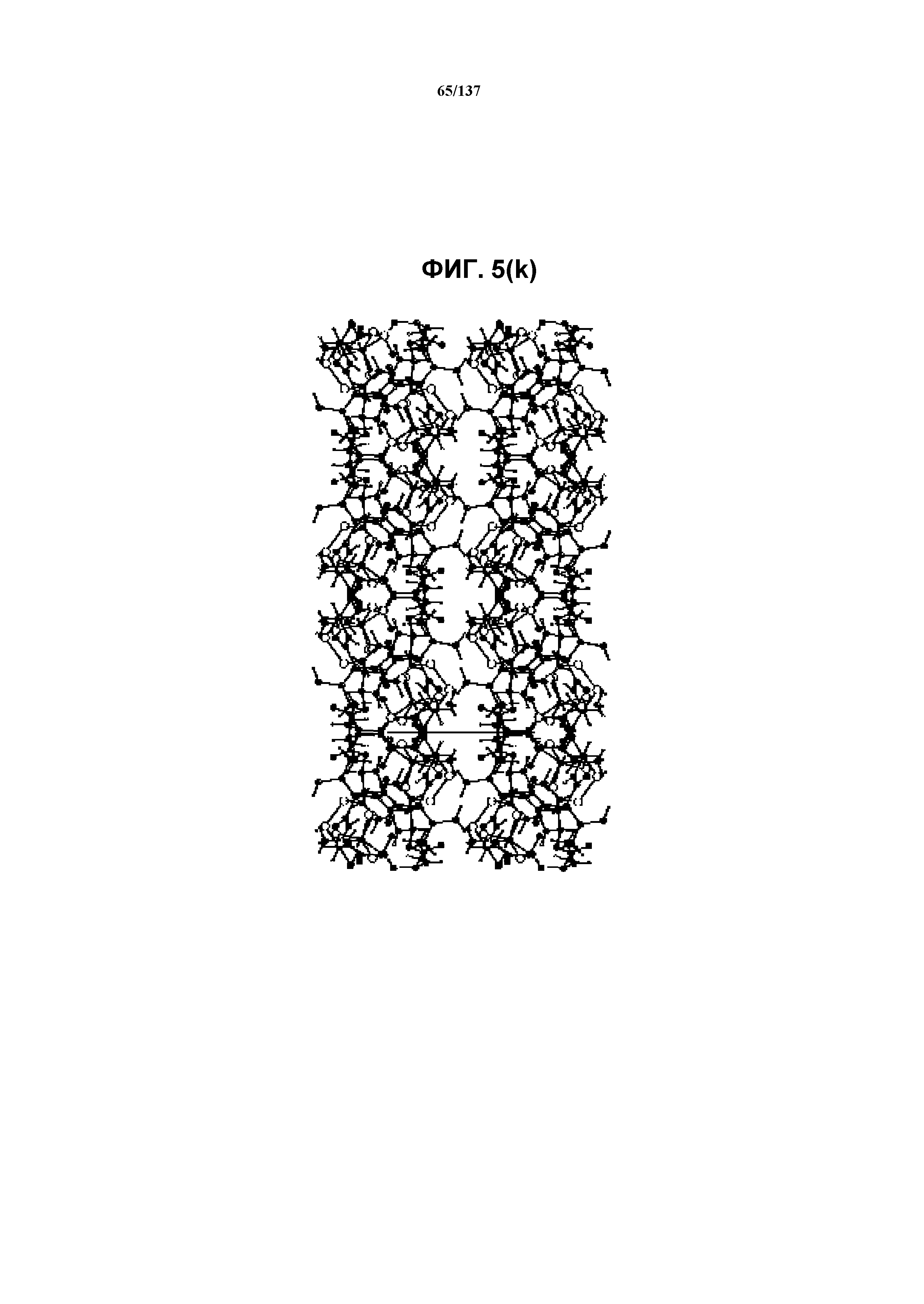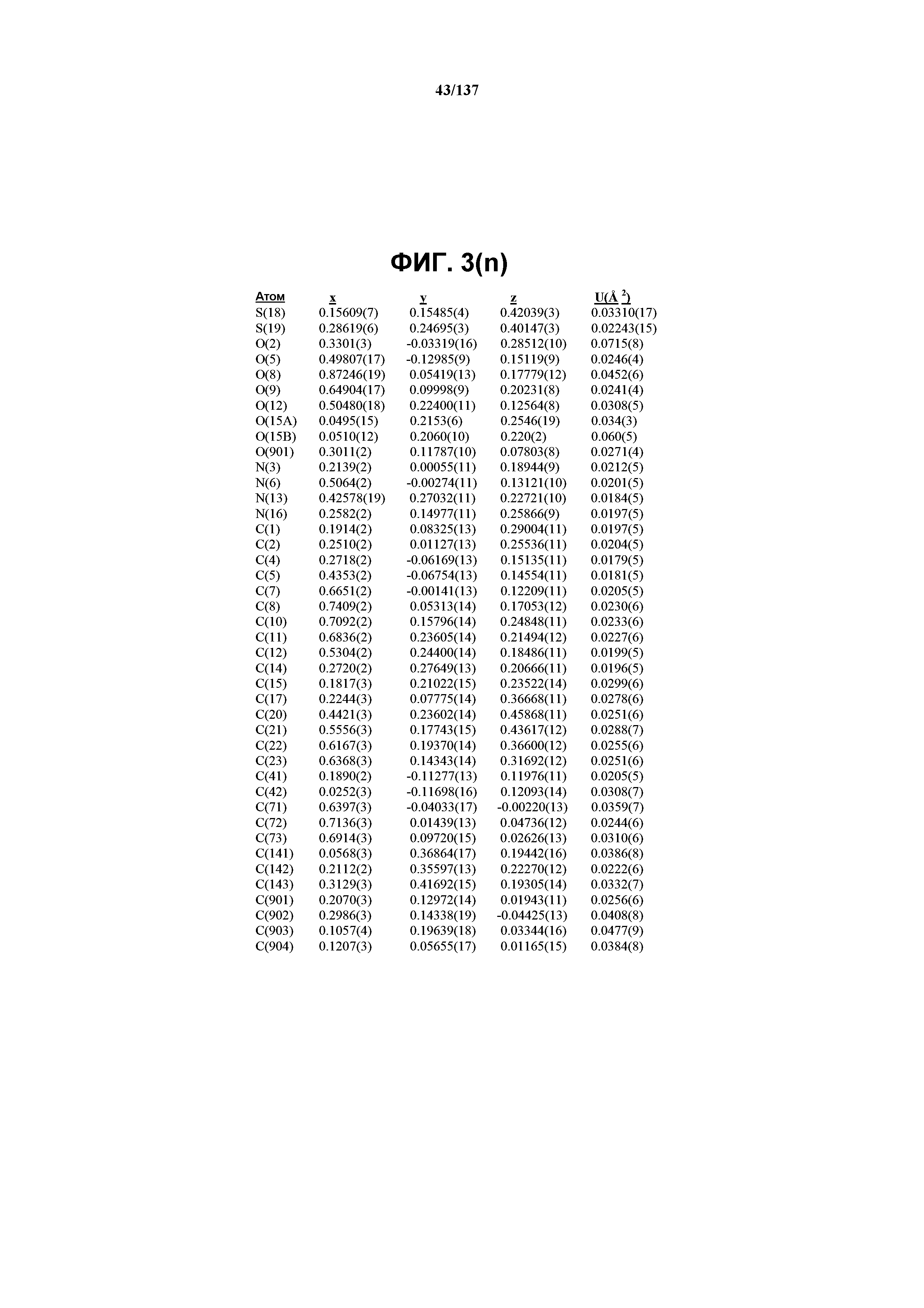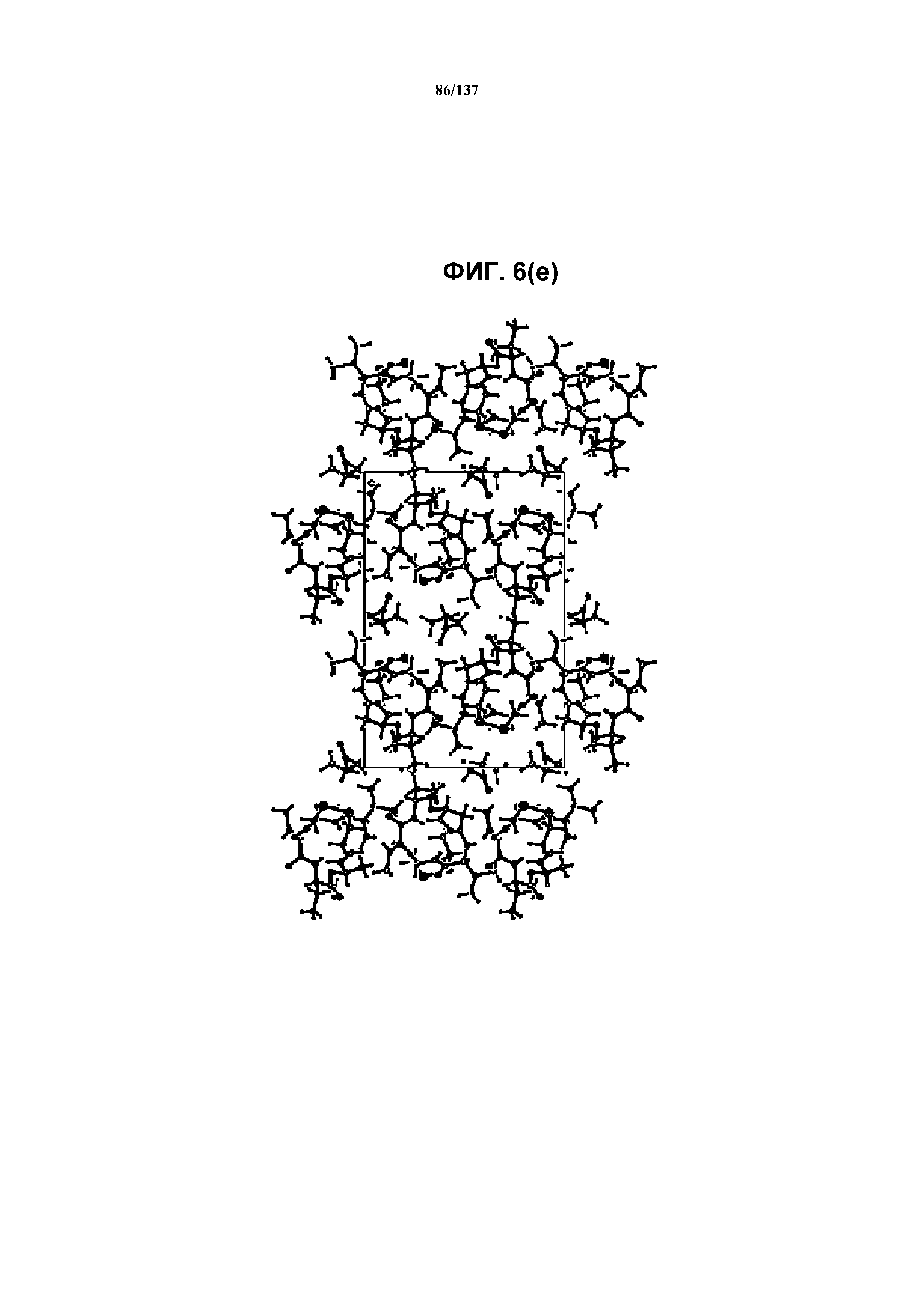Результат интеллектуальной деятельности: ТВЕРДЫЕ ФОРМЫ РОМИДЕПСИНА И ИХ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
В настоящей заявке заявлен приоритет в соответствии с предварительной заявкой США № 61/363522, поданной 12 июля 2010, которая в полном объеме включена в настоящее описание в виде ссылки.
ОБЛАСТЬ ТЕХНИКИ
В настоящей заявке предложены твердые формы ромидепсина и композиции, содержащие такие формы. В некоторых воплощениях предложены полиморфные формы ромидепсина. В некоторых воплощениях предложены сольватные формы ромидепсина. В некоторых воплощениях предложен аморфный ромидепсин. Предложены также способы получения таких форм и содержащие их композиции.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Ромидепсин является природным продуктом, который был выделен из Chromobacterium violaceum компанией Fujisawa Pharmaceuticals. См. публикацию патентной заявки Японии Hei 7 (1995)-64872; а также патент США 4977138, опубликованный 11 сентября 1990, каждая из которых включена в настоящее описание в виде ссылки. Различные виды обработки и очистки ромидепсина описаны в публикации PCT WO 02/20817, которая включена в настоящее описание в виде ссылки.
Он представляет собой бициклический пептид, состоящий из четырех аминокислотных остатков (D-валина, D-цистеина, дегидробутирина и L-валина) и новой кислоты (3-гидрокси-7-меркапто-4-гептеновой кислоты). Ромидепсин является депсипептидом, который содержит как амидные, так и сложноэфирные связи. Помимо продуцирования C. violaceum с помощью ферментации, ромидепсин может быть получен также синтетическим или полусинтетическим путями. Полный синтез ромидепсина, опубликованный Kahn с соавт. (J. Am. Chem. Soc. 118: 7237-7238, 1996), включает 14 стадий и дает общий выход ромидепсина в 18%. Структура ромидепсина показана ниже и далее в настоящем описании будет называться "Соединением I":
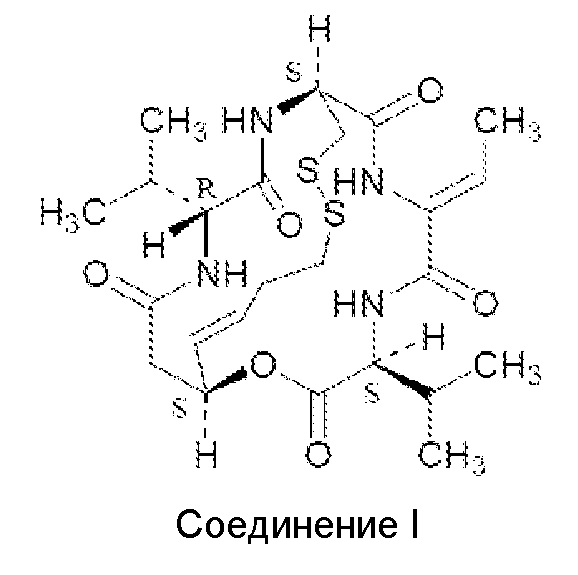
Соединение I
Было показано, что соединение I обладает противомикробной, иммуносупрессорной и противоопухолевой активностями. Соединение I одобрено в США для лечения кожной T-клеточной лимфомы (CTCL) и периферической T-клеточной лимфомы (PTCL), и в настоящее время оно проходит тестирование, например, на предмет его применения для лечения пациентов с другими злокачественными гематологическими заболеваниями (например, с множественной миеломой, и т.д.) и солидными опухолями (например, со злокачественной опухолью предстательной железы, злокачественной опухолью поджелудочной железы и т.д.). Считается, что его действие связано с селективным ингибированием деацетилаз (например, гистондеацетилазы, тубулиндеацетилазы), суля в перспективе новые мишени для разработки нового класса противоопухолевой терапии (Nakajima et al., Experimental Cell Res. 241: 126-133, 1998). Один из способов его действия включает ингибирование одного или нескольких классов гистондеацетилаз (HDAC).
КРАТКОЕ СОДЕРЖАНИЕ ИЗОБРЕТЕНИЯ
В одном из аспектов предложены твердые формы соединения I.
В некоторых воплощениях предложен способ получения кристаллической формы C соединения I и ее характеристика.
В некоторых воплощениях предложен способ получения кристаллической формы D соединения I и ее характеристика.
В некоторых воплощениях предложен способ получения кристаллической формы E соединения I и ее характеристика.
В некоторых воплощениях предложен способ получения кристаллической формы H соединения I и ее характеристика.
В некоторых воплощениях предложен способ получения кристаллической формы F соединения I и ее характеристика.
В некоторых воплощениях предложен способ получения кристаллической формы I соединения I и ее характеристика.
В некоторых воплощениях предложен способ получения кристаллической формы J соединения I и ее характеристика.
В некоторых воплощениях предложен способ получения кристаллической формы K соединения I и ее характеристика.
В некоторых воплощениях предложен способ получения кристаллической формы L соединения I и ее характеристика.
В некоторых воплощениях предложен способ получения кристаллической формы N соединения I и ее характеристика.
В некоторых воплощениях предложен способ получения аморфного соединения I и его характеристика.
В некоторых воплощениях соединение I и его твердые формы используются для изготовления фармацевтических композиций. В некоторых воплощениях предложены композиции и составы (например, фармацевтические композиции и составы), содержащие твердые формы соединения I.
В другом аспекте предложены способы лечения пролиферативных заболеваний, опосредованных иммунной системой заболеваний, инфекционных заболеваний, определенных циркуляторных заболеваний и определенных нейродегенеративных заболеваний с использованием соединения I, его твердых форм и содержащих их композиций. В некоторых воплощениях предложены способы лечения рака. В некоторых воплощениях рак включает, но не ограничиваясь этим, карциномы, саркомы, лейкемии, лимфомы и т.д. В некоторых воплощениях рак представляет собой гематологическое злокачественное новообразование. В некоторых воплощениях рак представляет собой солидную опухоль.
В другом аспекте предложены способы дополнения электролитами пациентов, лечение которых связано с приемом соединения I.
ОПИСАНИЕ ГРАФИЧЕСКОГО МАТЕРИАЛА
На фиг.1(a) изображен репрезентативный спектр 1H-ЯМР в растворе, полученный для соединения I.
На фиг.1(b) изображена молекулярная структура соединения I.
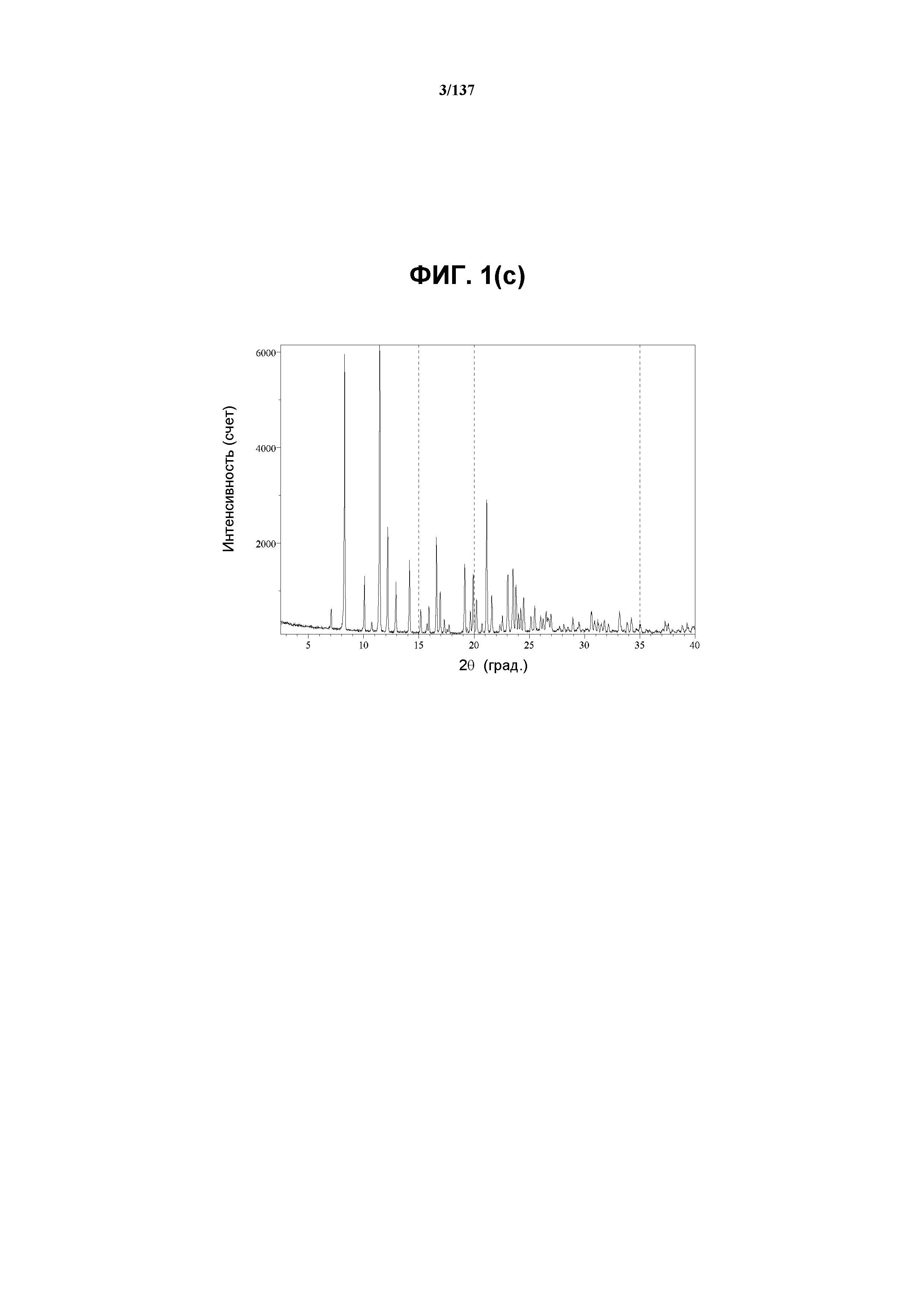
На фиг.1(c) изображена рентгенограмма XRPD формы C соединения I, полученная при комнатной температуре.
На фиг.1(d) сведены в таблицу наблюдаемые пики (часть i); и пики (часть ii), присутствующие в рентгенограмме XRPD фиг.1(c).
На фиг.1(e) изображена термограмма DSC, полученная для формы C соединения I.
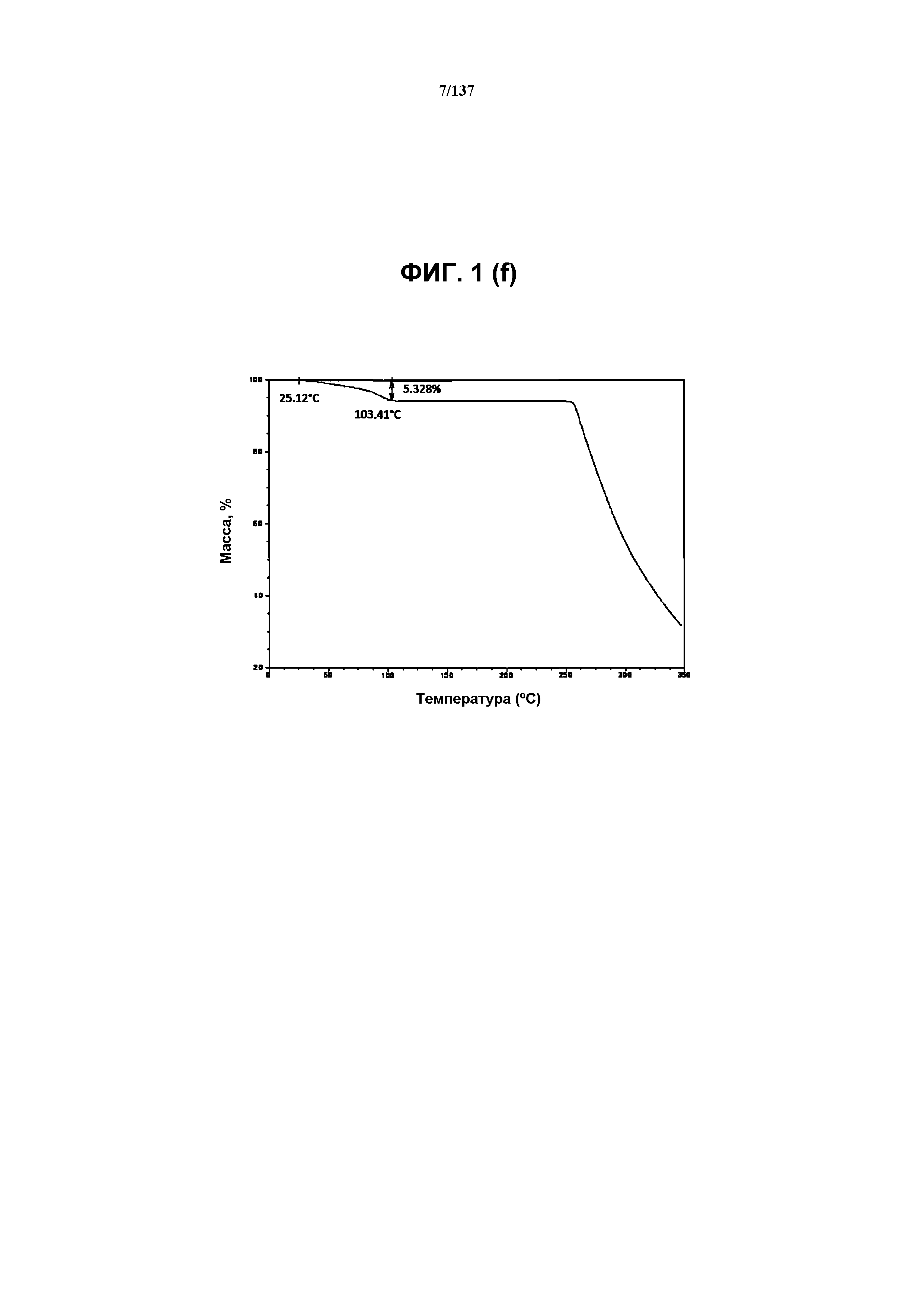
На фиг.1(f) изображена термограмма TGA, полученная для формы C соединения I.
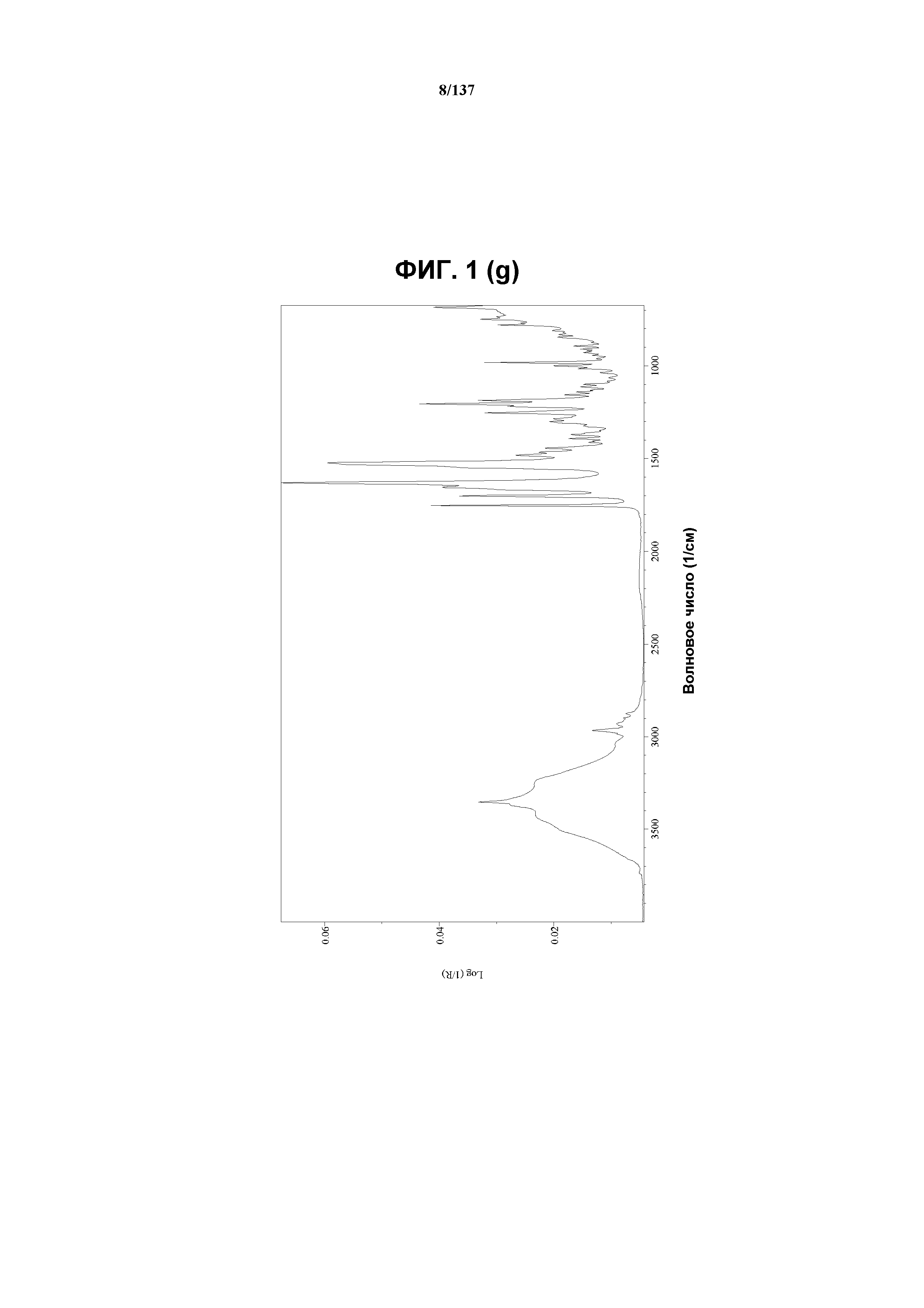
На фиг.1(g) изображен спектр FT-IR [ИК-спектроскопия с Фурье-преобразованием], полученный для формы C соединения I.
На фиг.1(h) сведены в таблицу положения полос, представленных в спектре FT-IR на фиг.1(g).
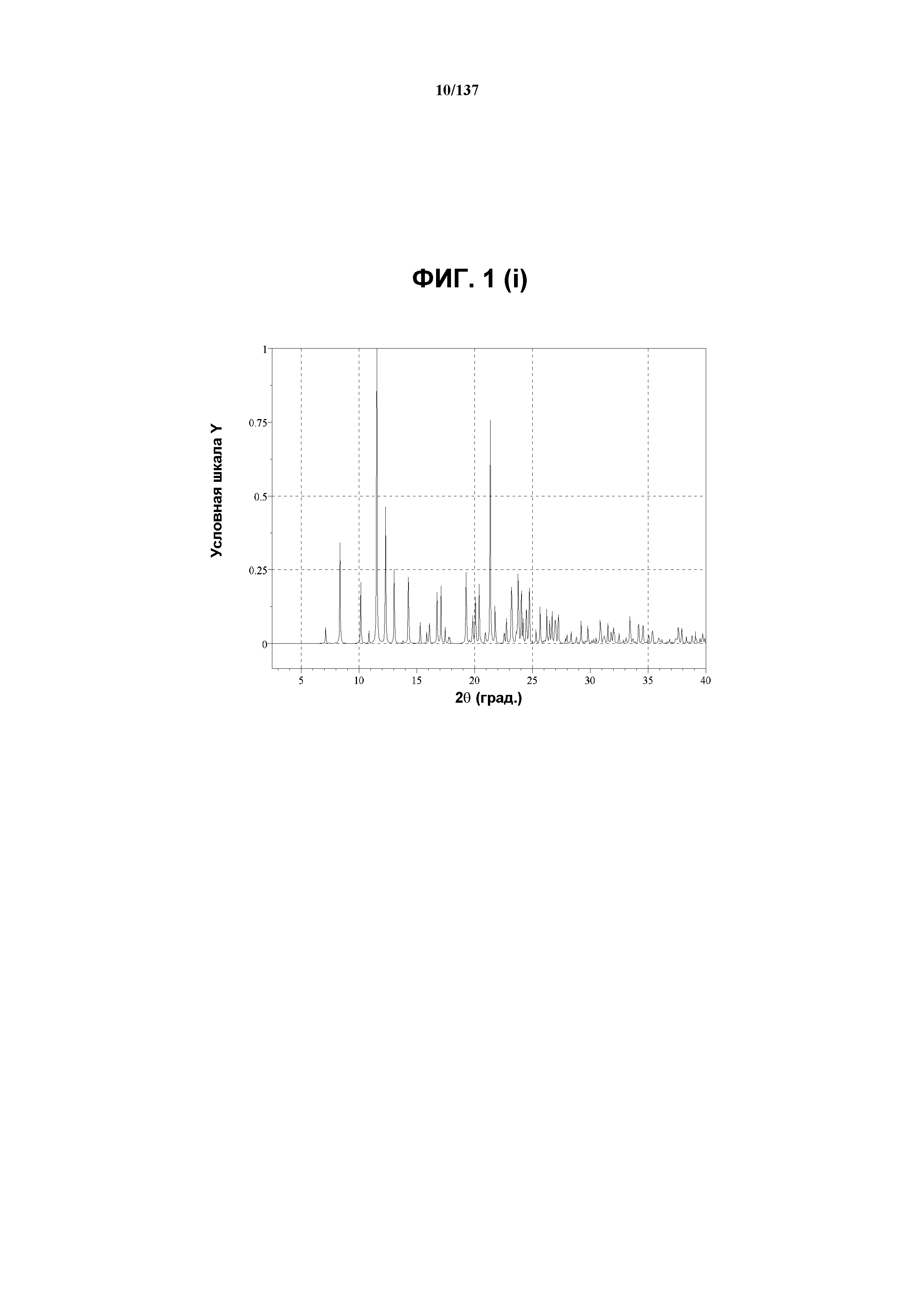
На фиг.1(i) изображена вычисленная рентгенограмма XRPD для формы C соединения I, собранная при температуре ниже температуры окружающей среды.
На фиг.1(j) изображены теоретически наблюдаемые пики (часть i); и репрезентативные пики (часть ii), присутствующие в рентгенограмме XRPD на фиг.1(i).
На фиг.1(k) изображена ORTEP-схема соединения I формы C, молекулы воды не показаны.
На фиг.1(l) изображена схема пространственной упаковки соединения I формы C, рассматриваемой вниз вдоль кристаллографической оси a.
На фиг.1(m) изображена схема пространственной упаковки соединения I формы C, рассматриваемой вниз вдоль кристаллографической оси b.
На фиг.1(n) изображена схема пространственной упаковки соединения I формы C, рассматриваемой вниз вдоль кристаллографической оси c.
На фиг.1(o) сведены в таблицу позиционные параметры и оценочные стандартные отклонения для соединения I формы C.
На фиг.1(p) сведены в таблицу расстояния между связями (в ангстремах) для соединения I формы C.
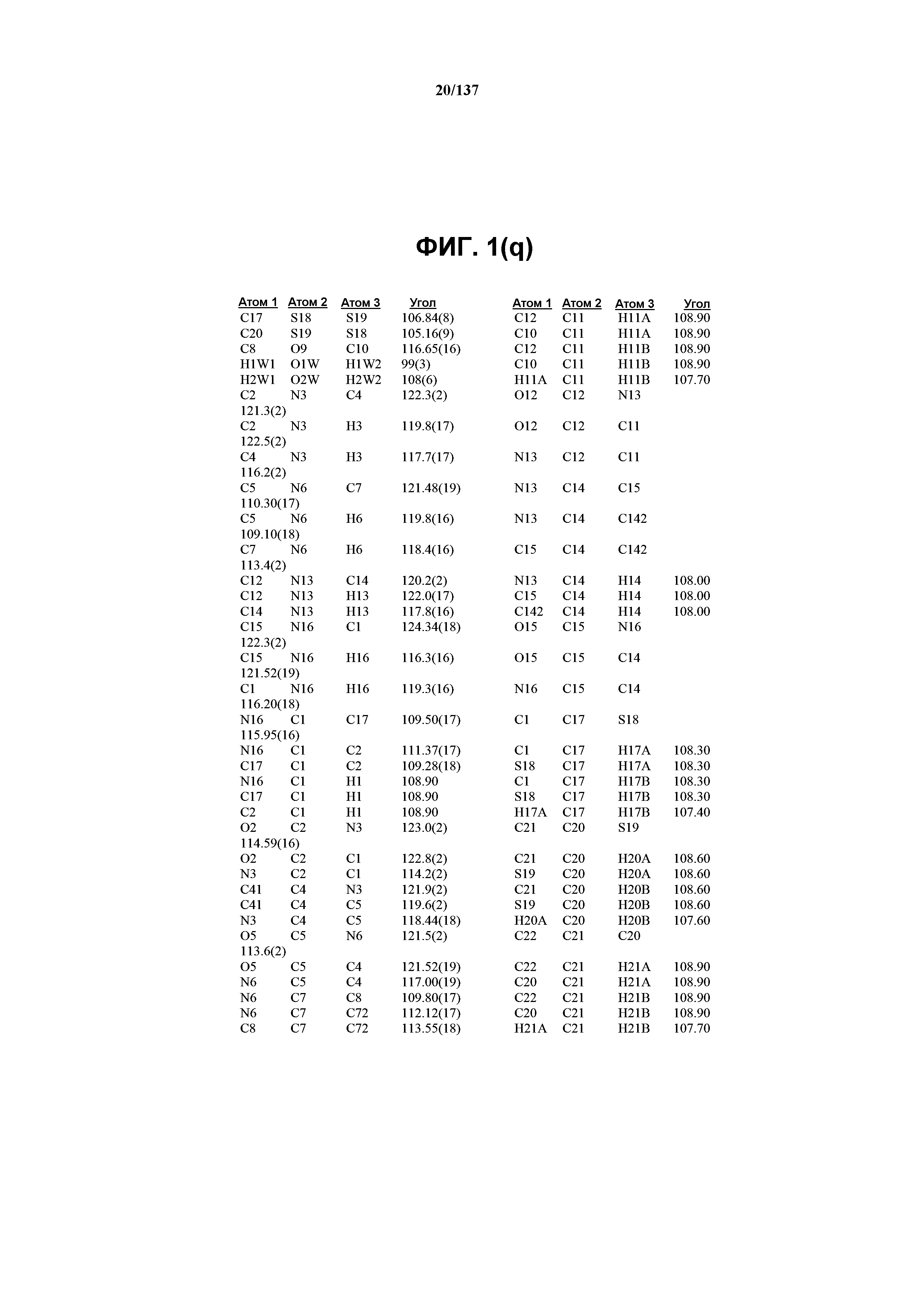
На фиг.1(q) сведены в таблицу углы между связями (в градусах) для соединения I, формы C.
На фиг.2(a) изображена рентгенограмма XRPD для соединения I формы D, собранная при комнатной температуре.
На фиг.2(b) сведены в таблицу наблюдаемые пики (часть i); а также выраженные пики (часть ii), присутствующие в рентгенограмме XRPD на фиг.2(a).
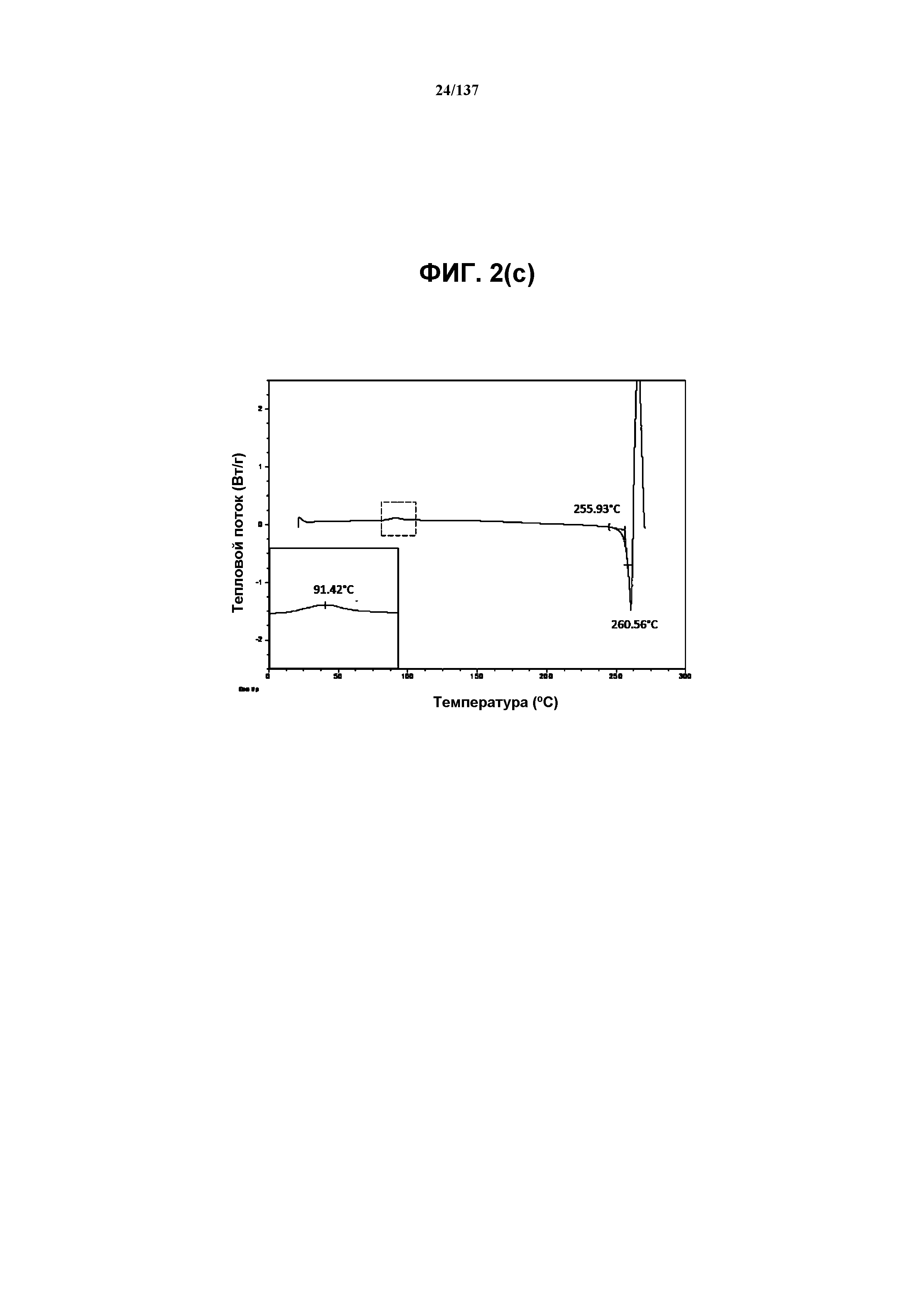
На фиг.2(c) изображена DSC-термограмма, полученная для соединения I формы D.
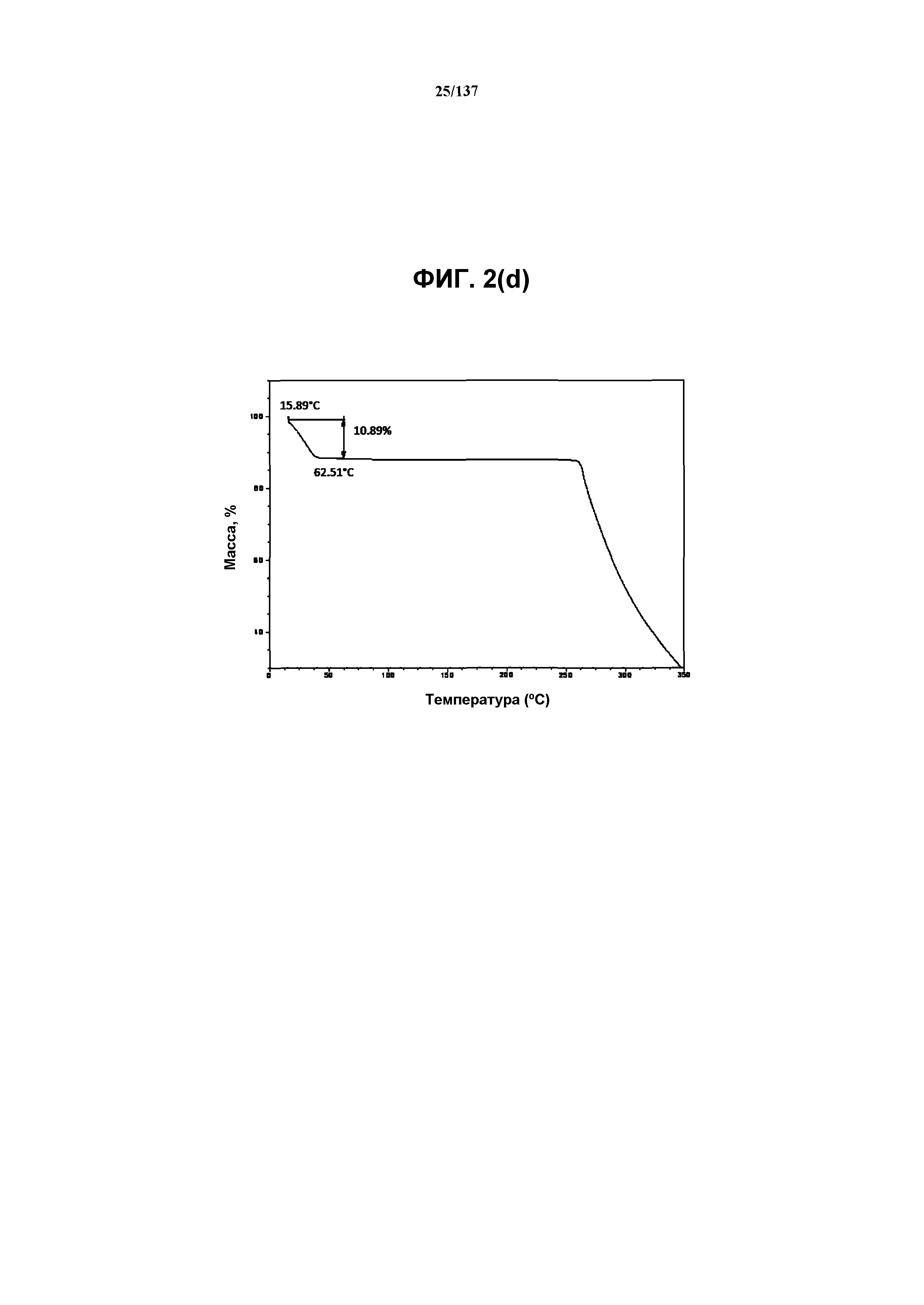
На фиг.2(d) изображена TGA-термограмма, полученная для соединения I формы D.
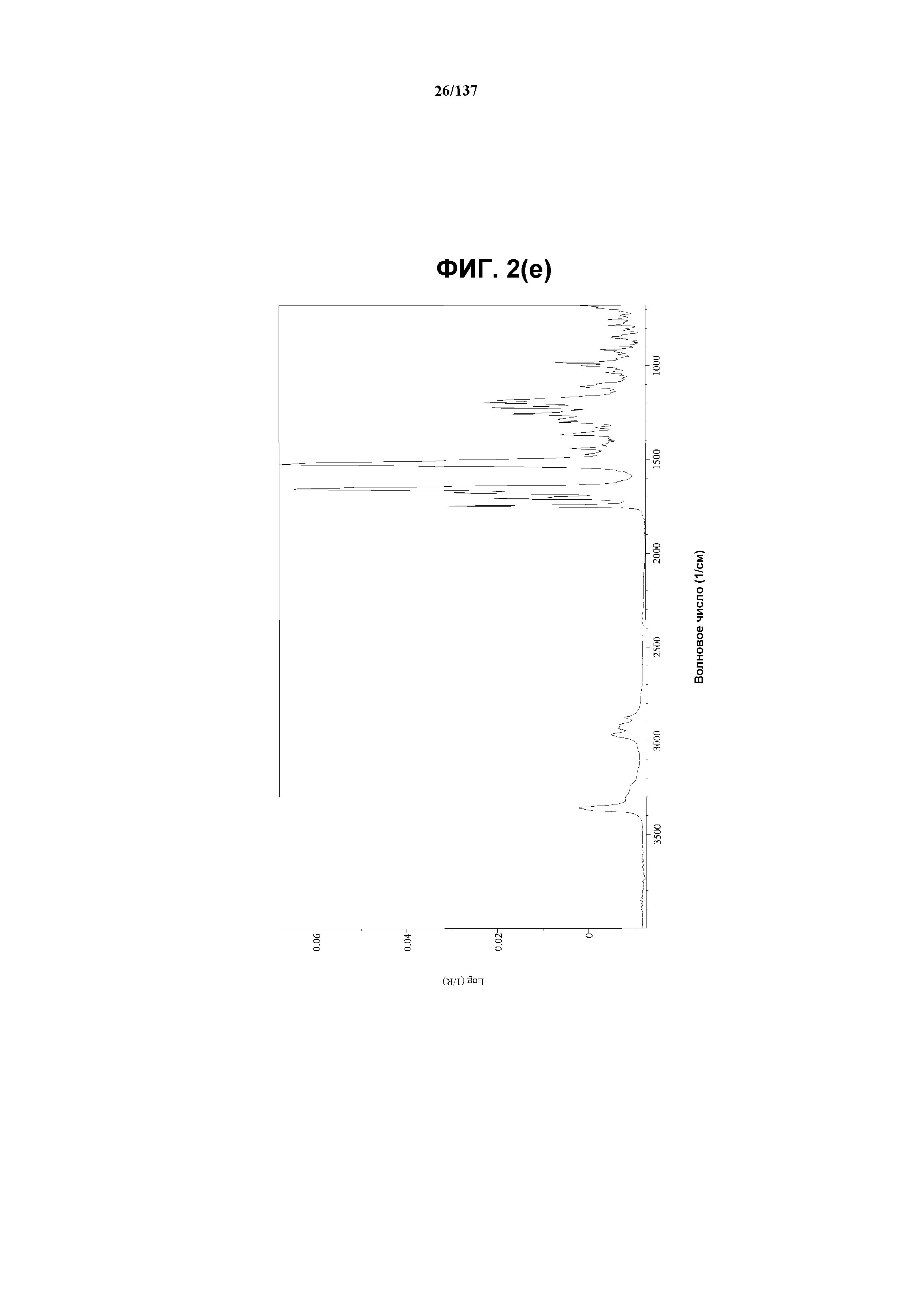
На фиг.2(e) изображен FT-IR-спектр, полученный для соединения I формы D.
На фиг.2(f) сведены в таблицу положения пиков полос, присутствующих в FT-IR-спектре на фиг.2(e).
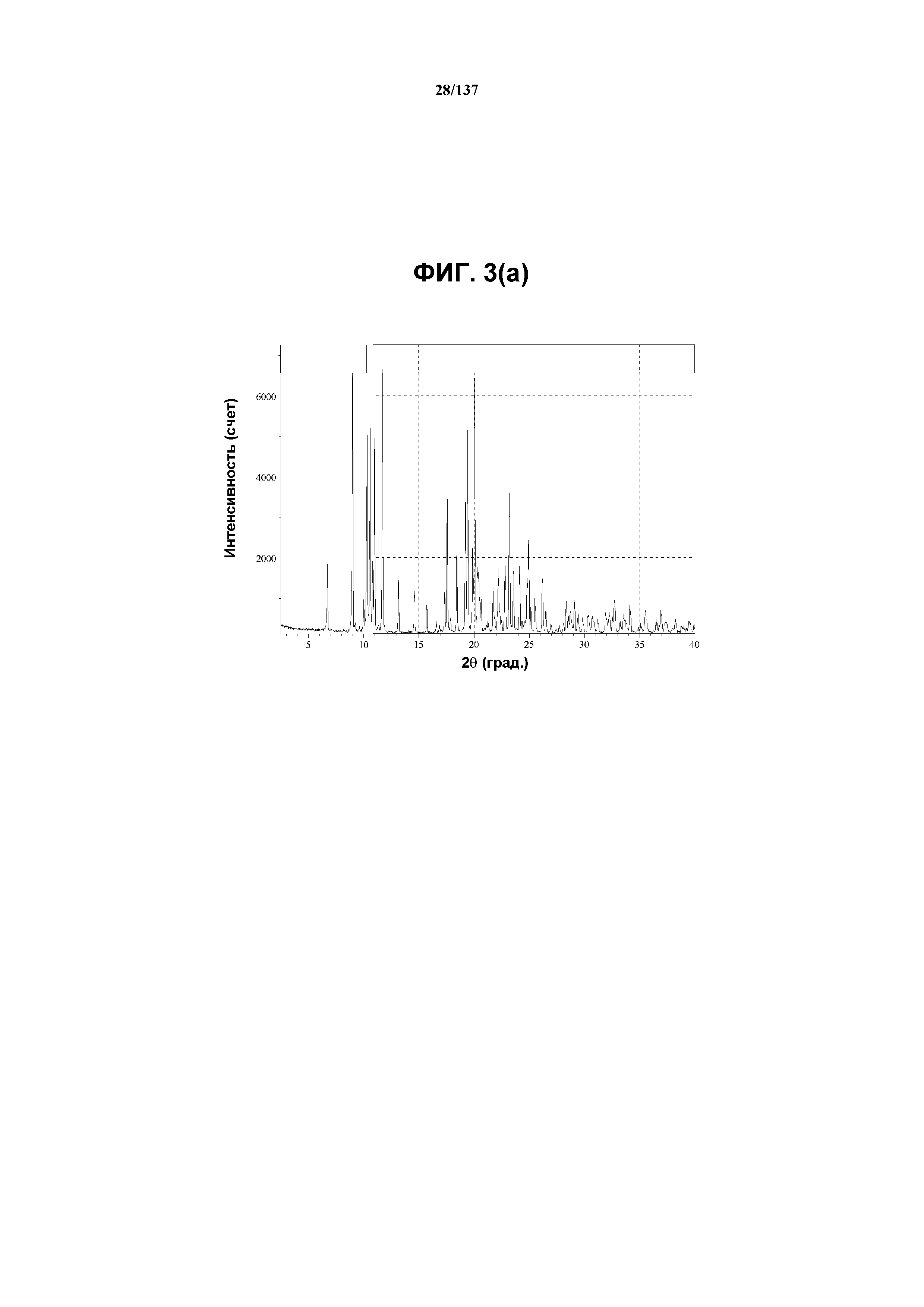
На фиг.3(a) изображена рентгенограмма XRPD для соединения I формы E, собранная при комнатной температуре.
На фиг.3(b) сведены в таблицу наблюдаемые пики (часть i); и выраженные пики (часть ii), присутствующие в рентгенограмме XRPD на фиг.3(a).
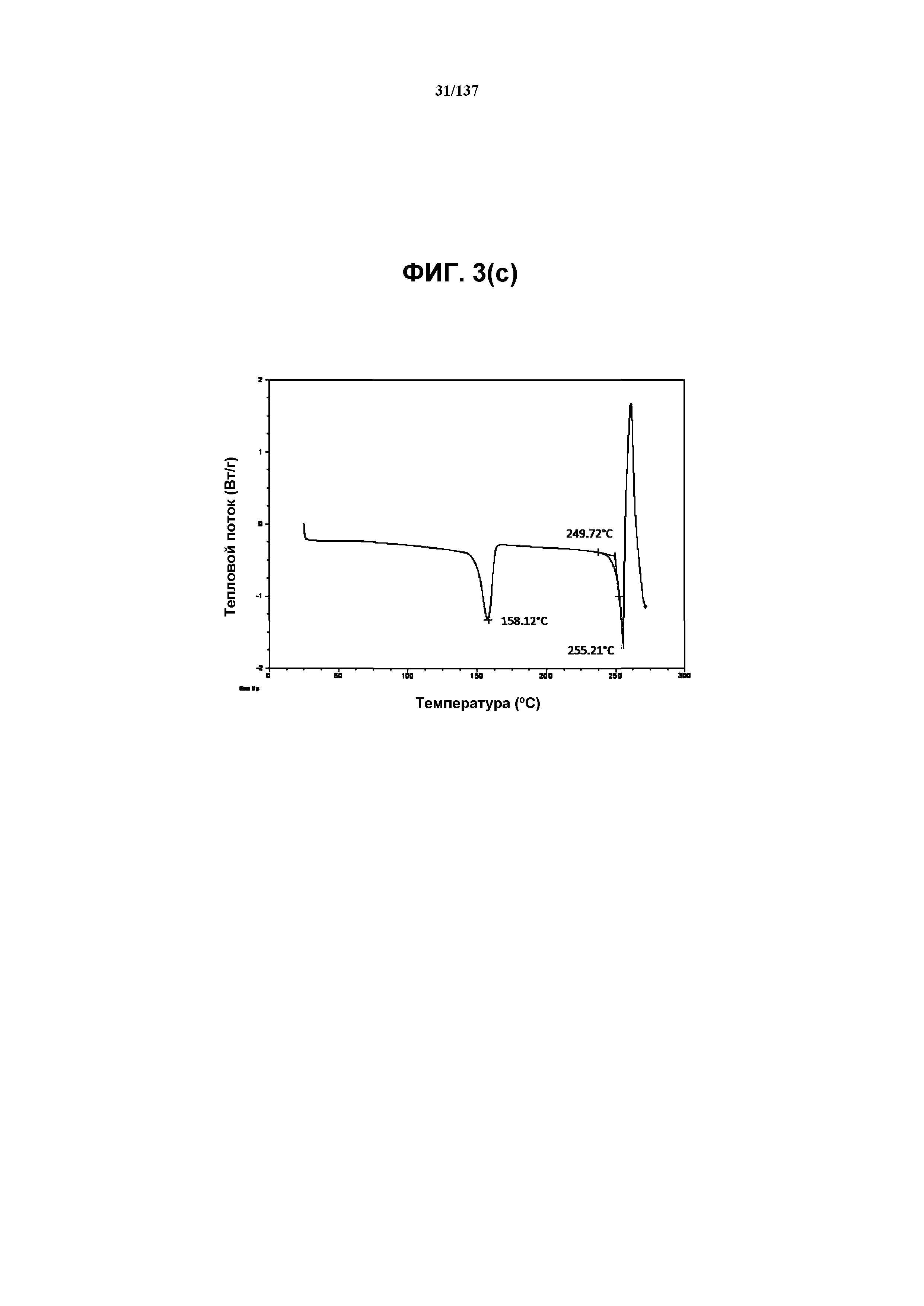
На фиг.3(c) изображена DSC-термограмма, полученная для соединения I формы E.
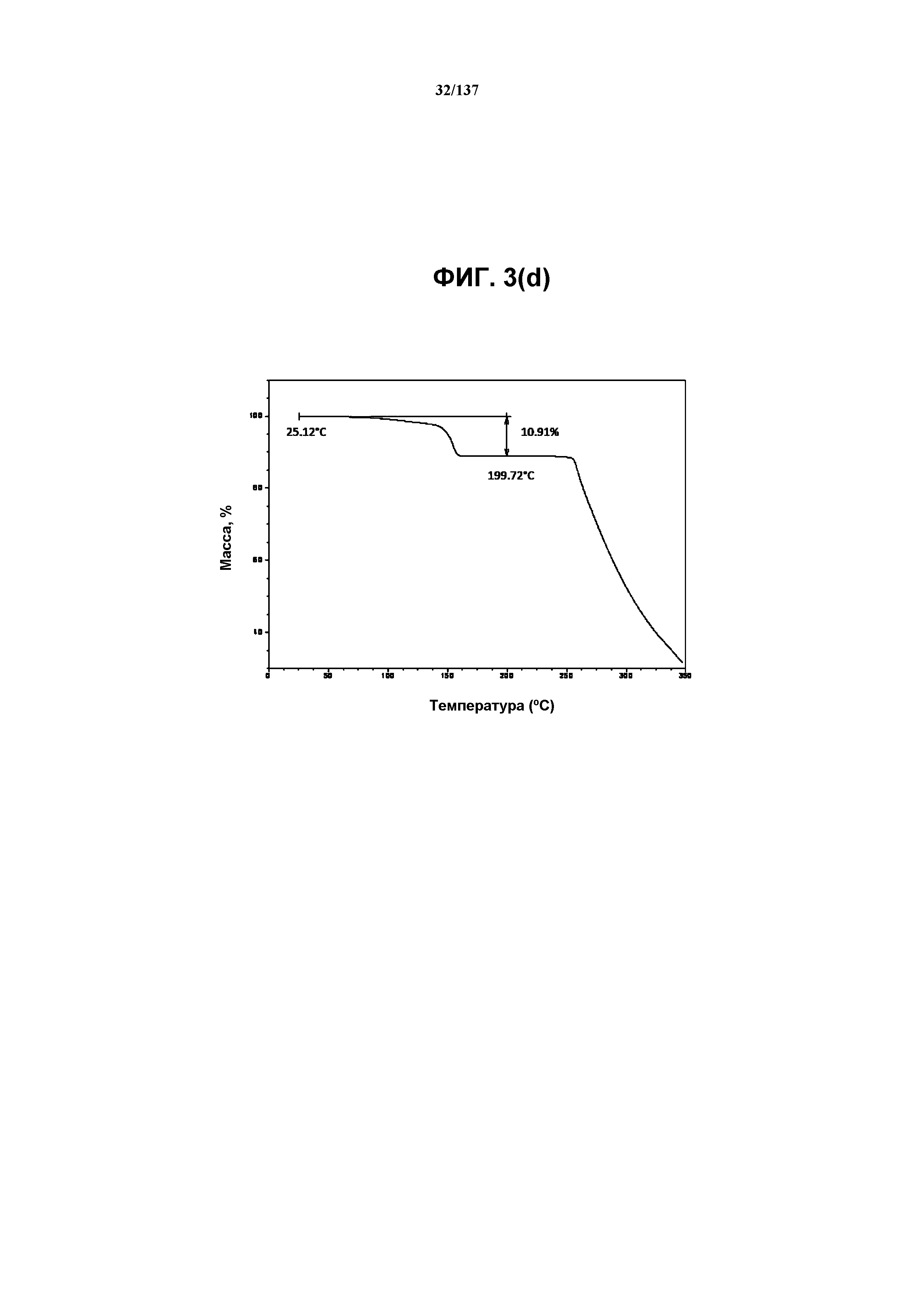
На фиг.3(d) изображена TGA-термограмма, полученная для соединения I формы E.
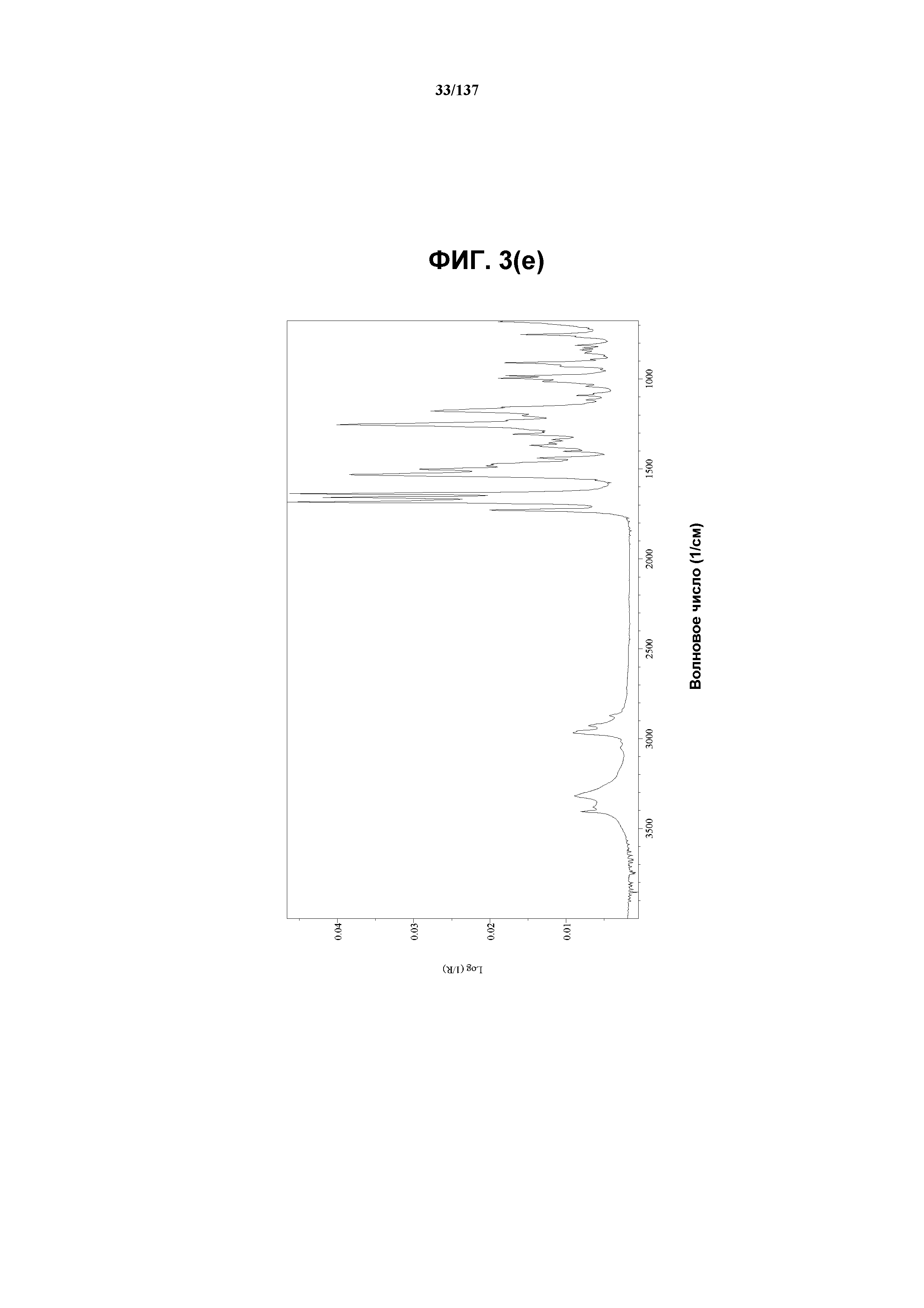
На фиг.3(e) изображен FT-IR-спектр, полученный для соединения I формы E.
На фиг.3(f) сведены в таблицу положения пиков полос, присутствующих в FT-IR-спектре на фиг.3(e).
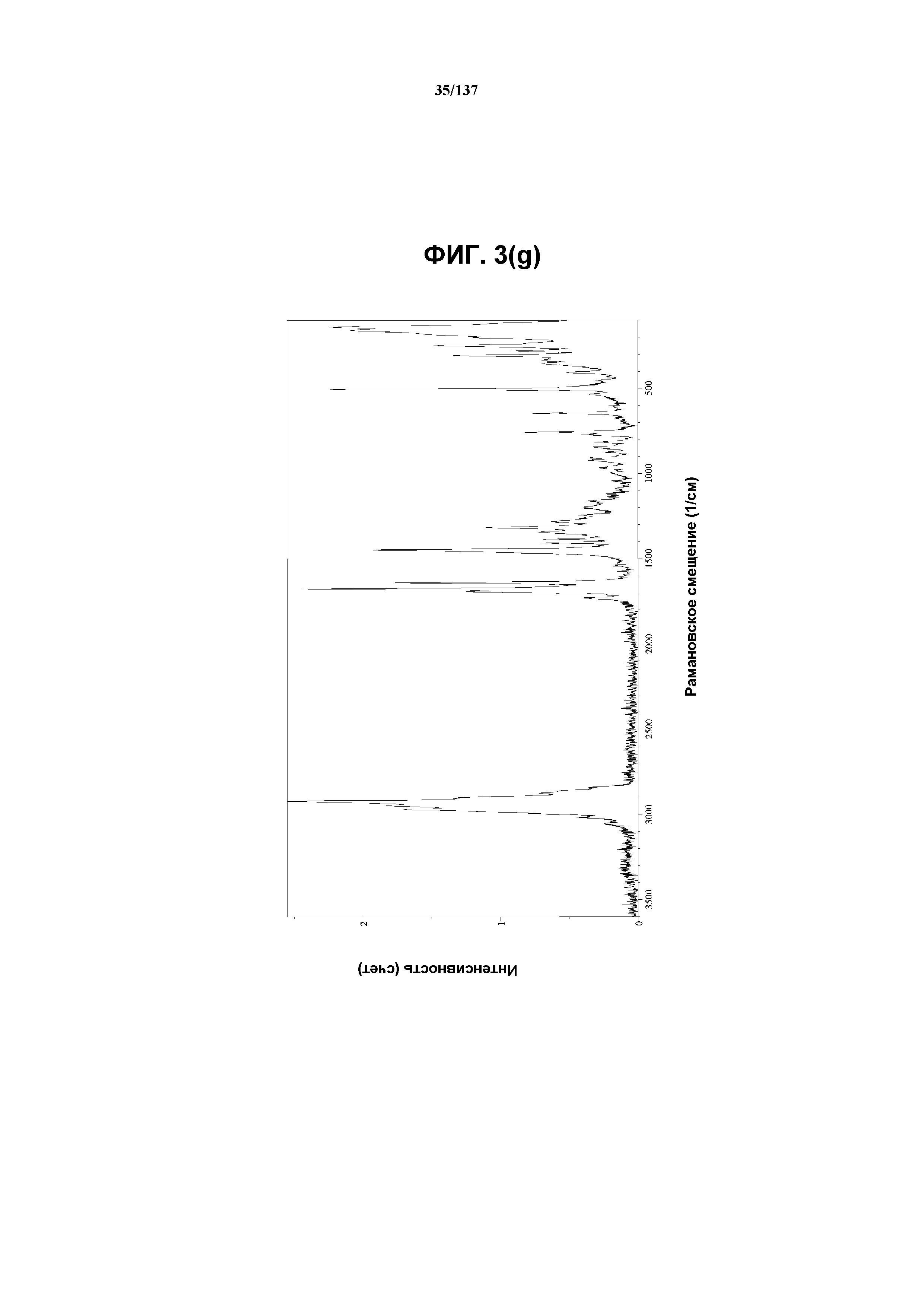
На фиг.3(g) изображен FT-рамановский спектр для соединения I формы E.
На фиг.3(h) изображена вычисленная рентгенограмма XRPD для формы Е соединения I, собранная при температуре ниже температуры окружающей среды.
На фиг.3(i) изображены теоретически наблюдаемые пики (часть i); и репрезентативные пики (часть ii), присутствующие в рентгенограмме XRPD на фиг.3(h).
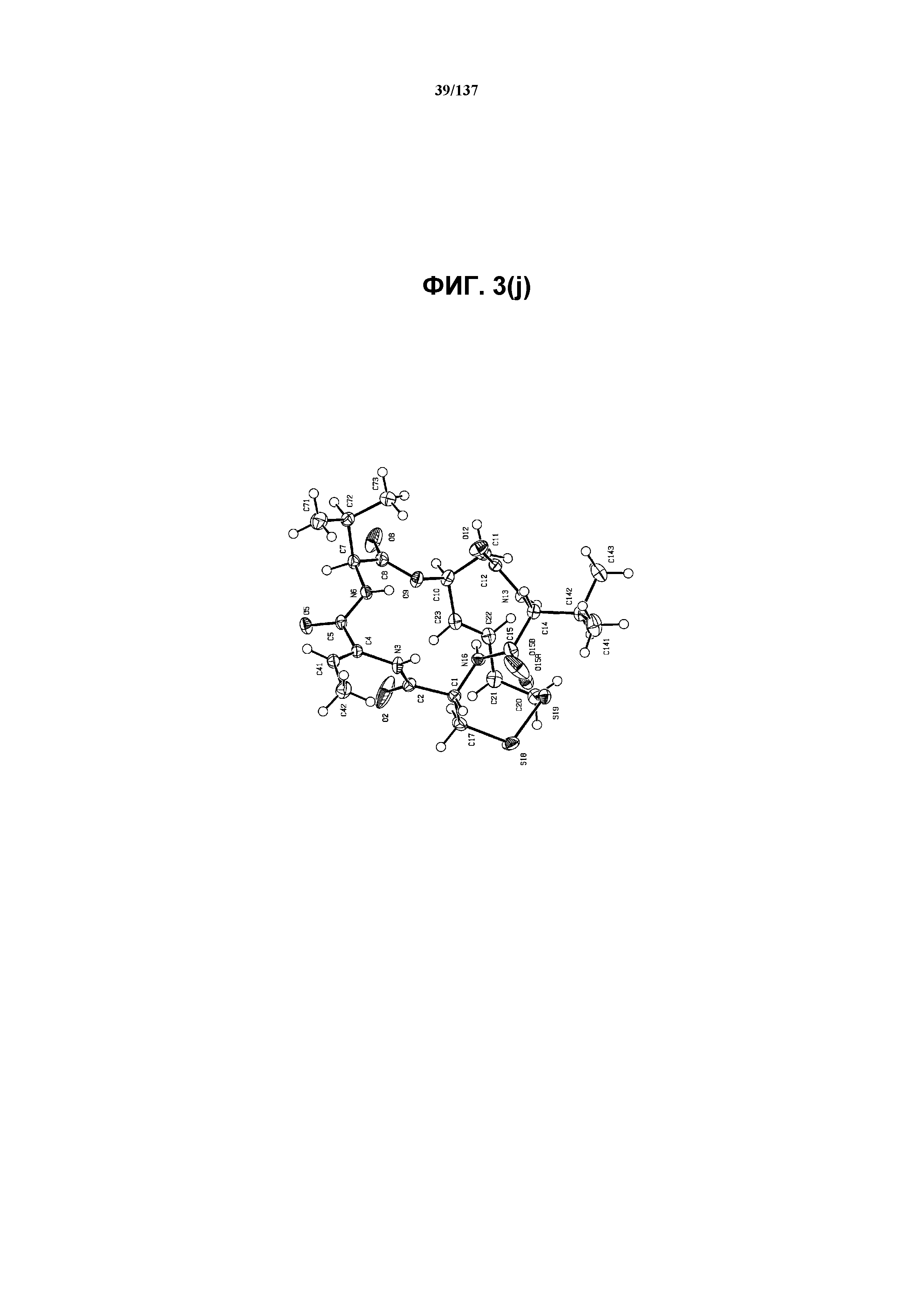
На фиг.3(j) изображена ORTEP-схема формы E соединения I.
На фиг.3(k) изображена схема пространственной упаковки соединения I формы E, рассматриваемой вниз вдоль кристаллографической оси a.
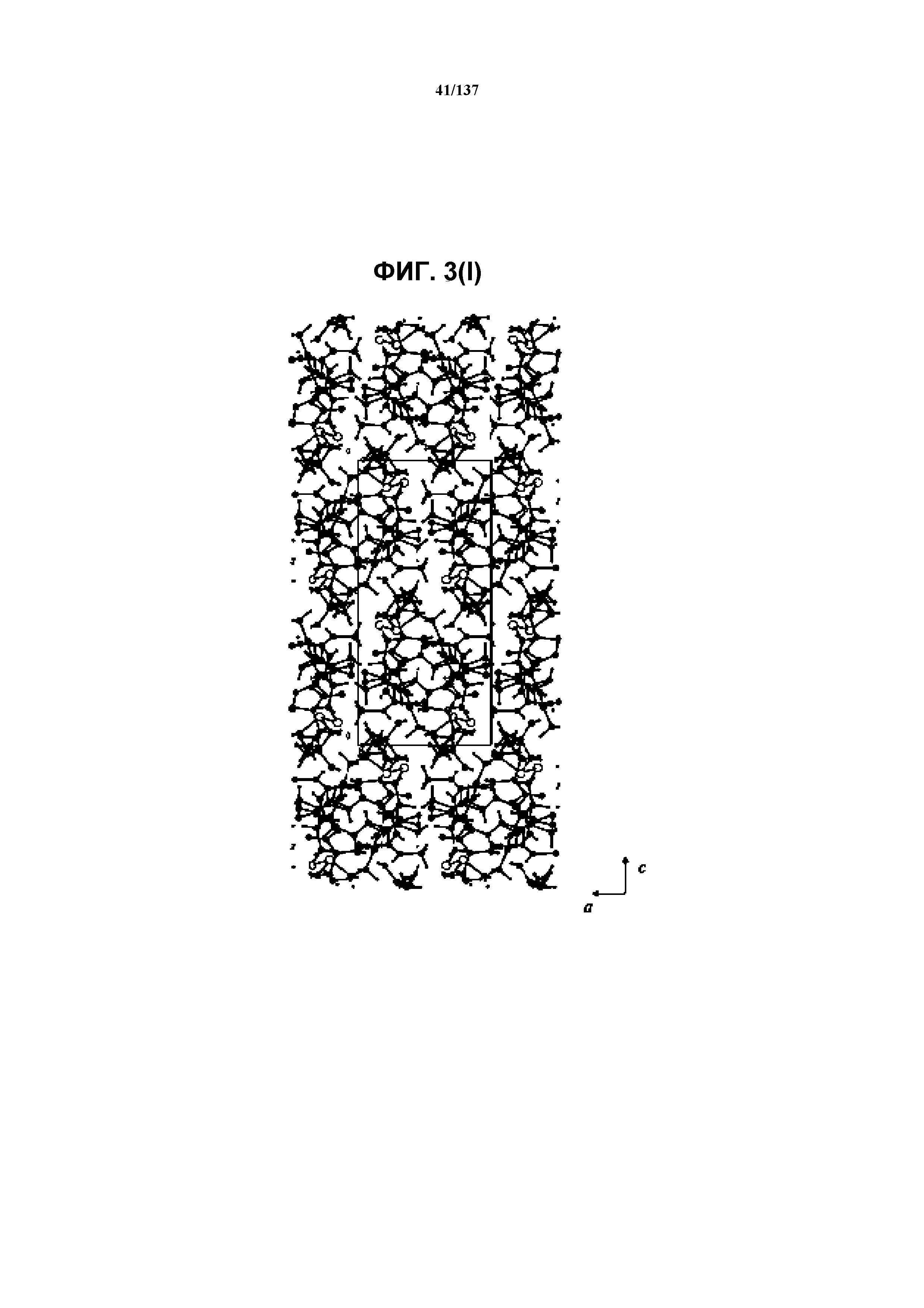
На фиг.3(1) изображена схема пространственной упаковки соединения I формы E, рассматриваемой вниз вдоль кристаллографической оси b.
На фиг.3(m) изображена схема пространственной упаковки соединения I формы E, рассматриваемой вниз вдоль кристаллографической оси c.
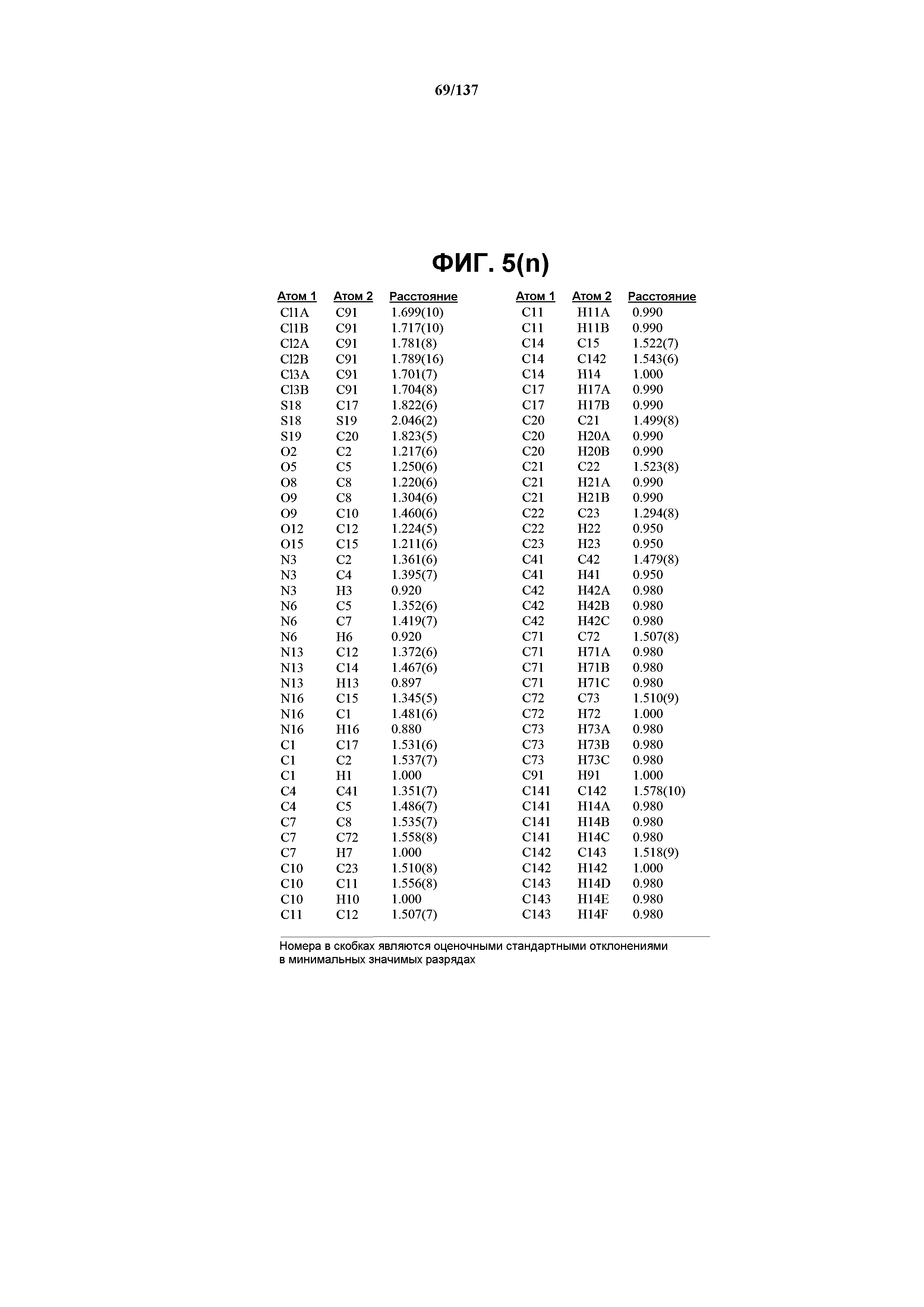
На фиг.3(n) сведены в таблицу позиционные параметры и оценочные стандартные отклонения для соединения I формы E.
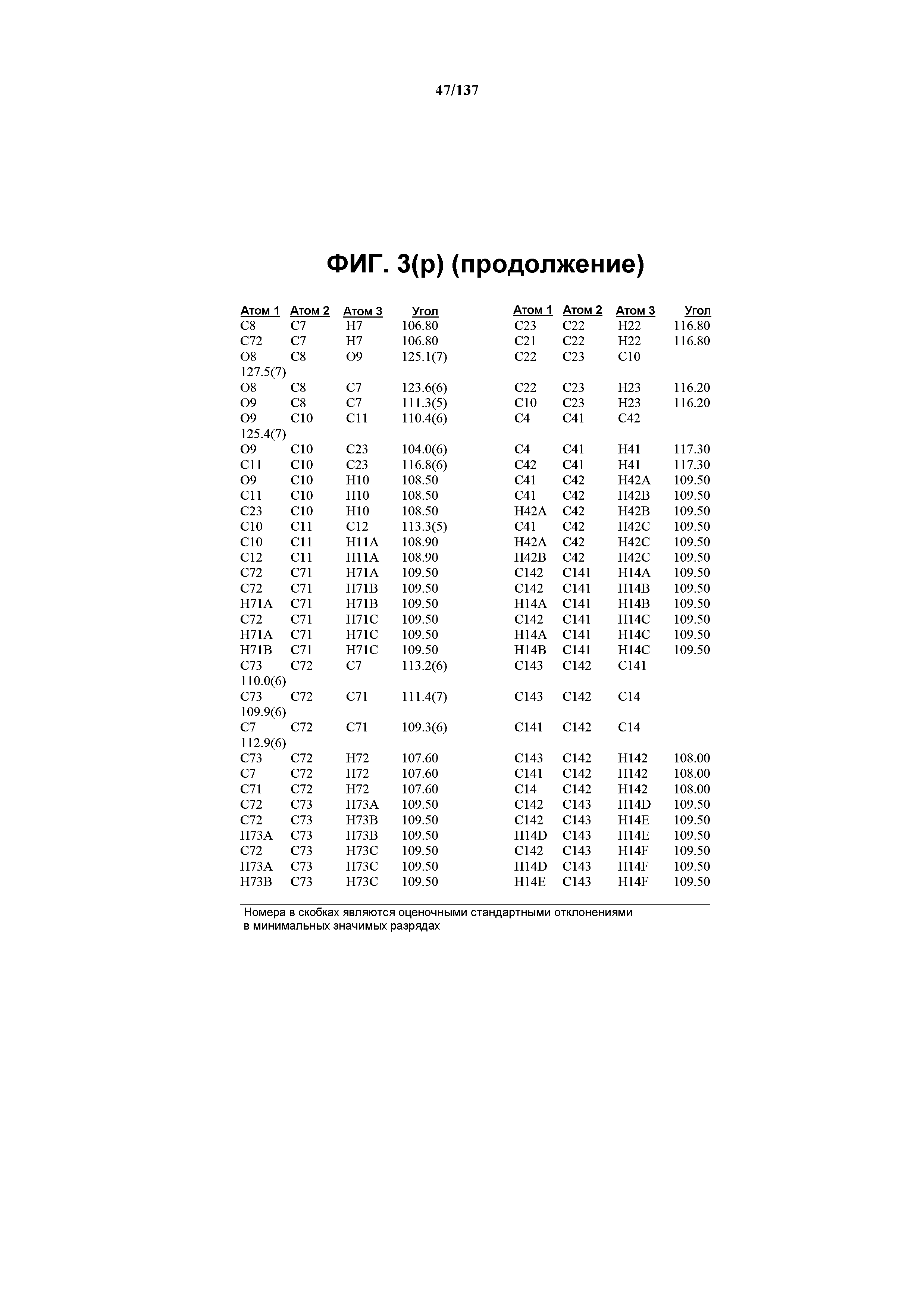
На фиг.3(o) сведены в таблицу расстояния между связями (в ангстремах) для соединения I формы E.
На фиг.3(p) сведены в таблицу углы между связями (в градусах) для соединения I формы E.
На фиг.4(a) изображена рентгенограмма XRPD для соединения I формы H, собранная при комнатной температуре.
На фиг.4(b) сведены в таблицу наблюдаемые пики (часть i); и выраженные пики (часть ii), присутствующие в рентгенограмме XRPD на фиг.4(a).
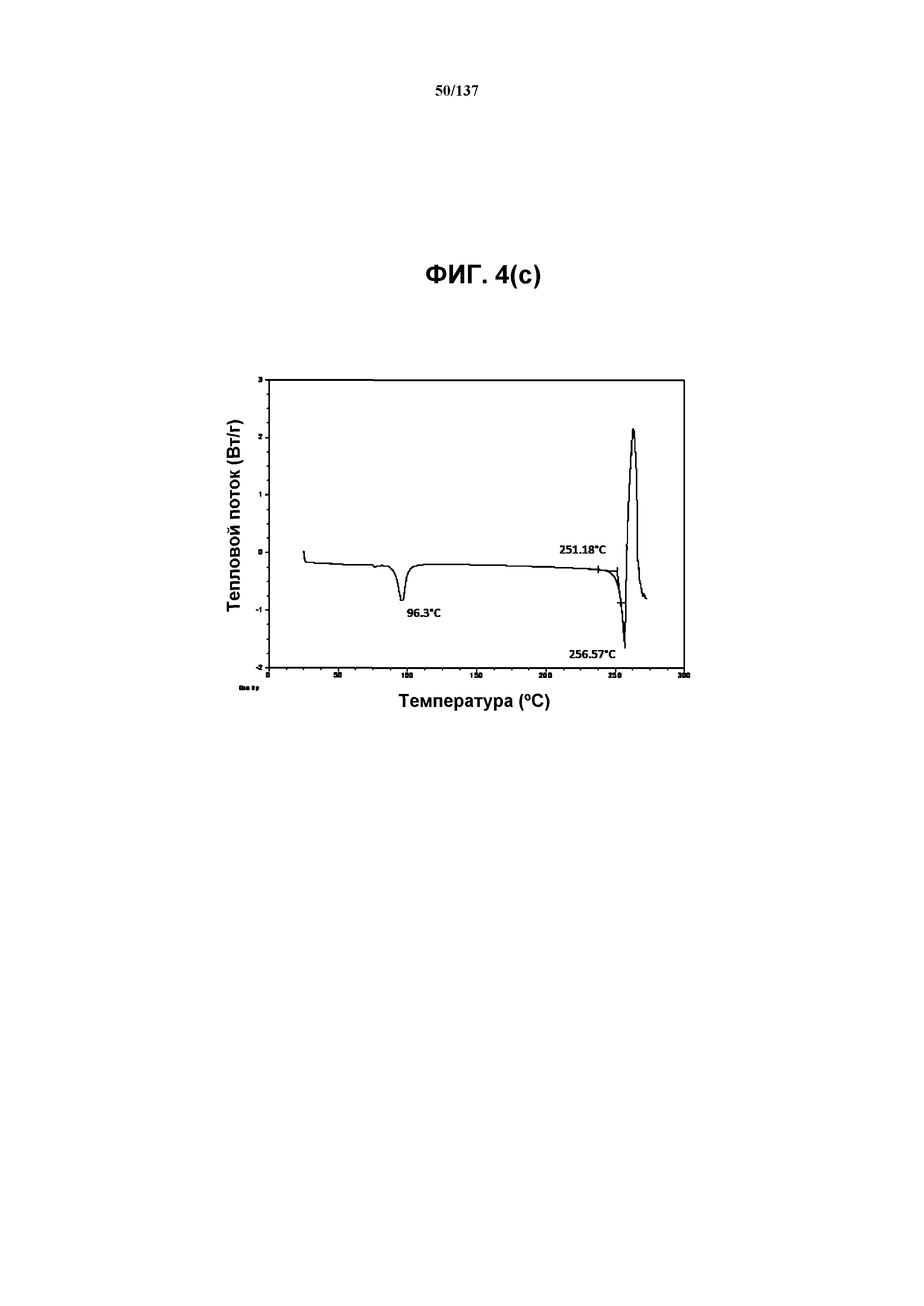
На фиг.4(c) изображена DSC-термограмма, полученная для соединения I формы H.
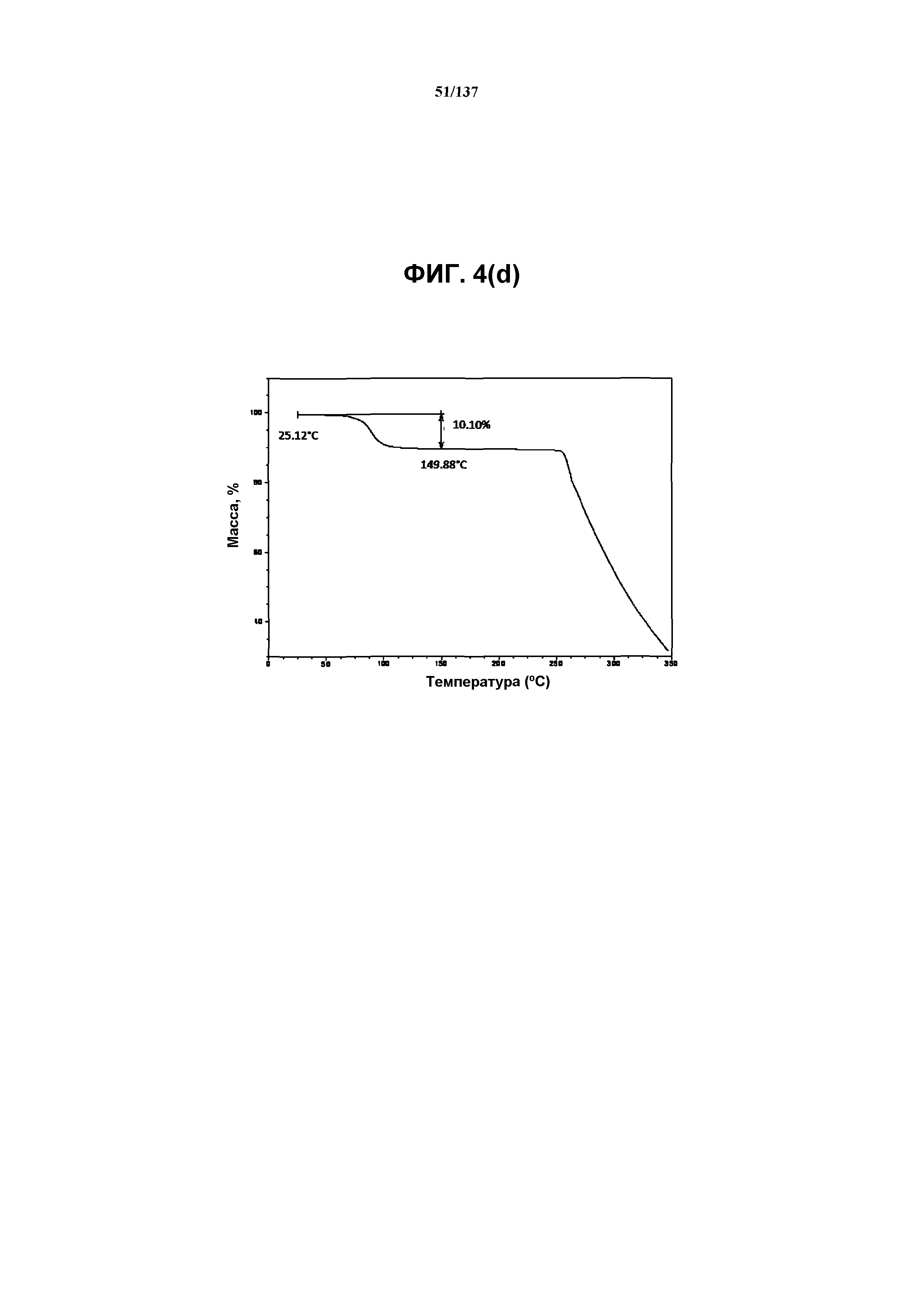
На фиг.4(d)) изображена TGA-термограмма, полученная для соединения I формы H.
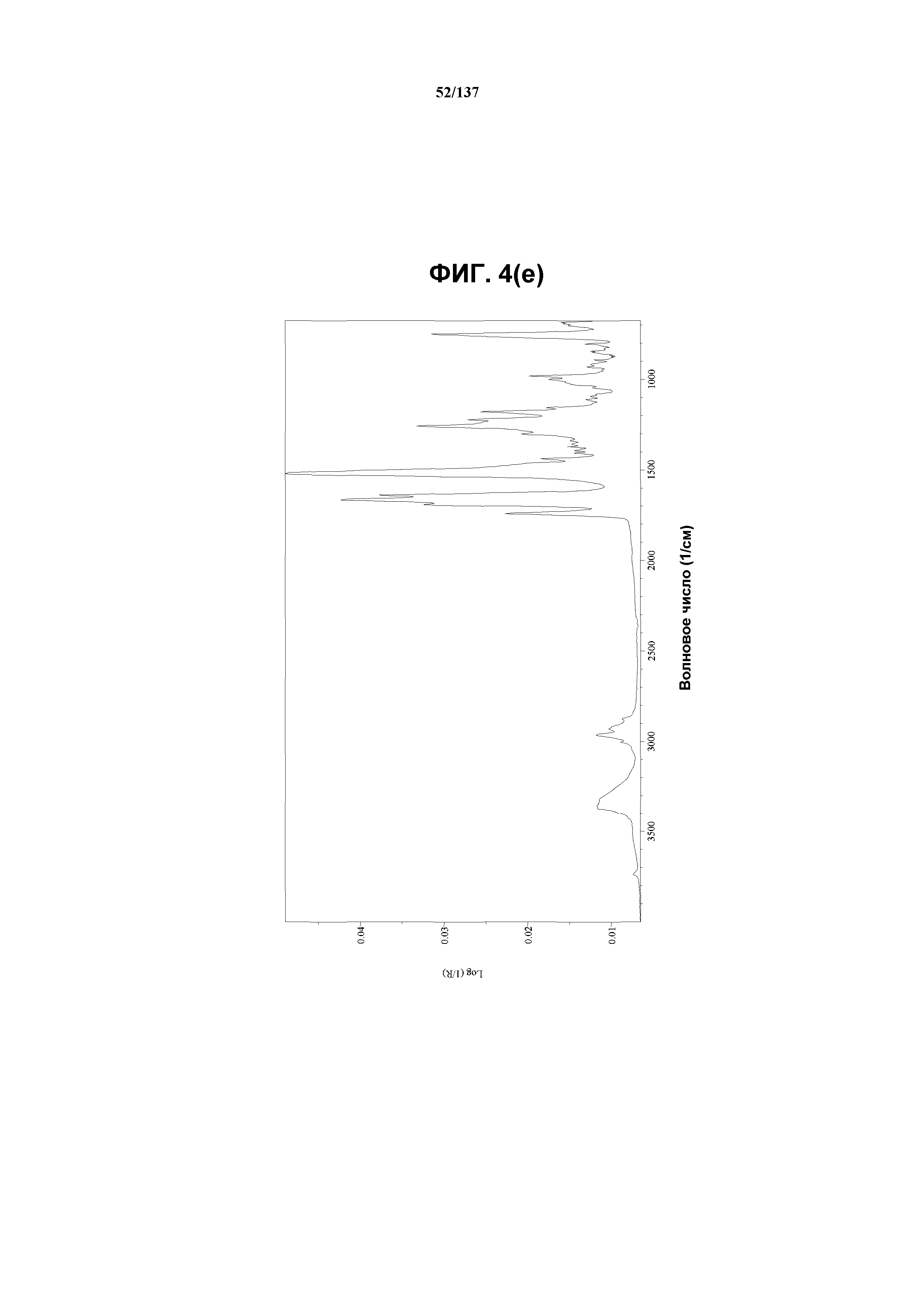
На фиг.4(e) изображен FT-IR-спектр, полученный для соединения I формы H.
На фиг.4(f) сведены в таблицу положения пиков полос, присутствующих в FT-IR-спектре на фиг.4(e).
На фиг.5(a) изображена рентгенограмма XRPD для соединения I формы I, собранная при комнатной температуре.
На фиг.5(b) сведены в таблицу наблюдаемые пики, присутствующие в рентгенограмме XRPD на фиг.5(a).
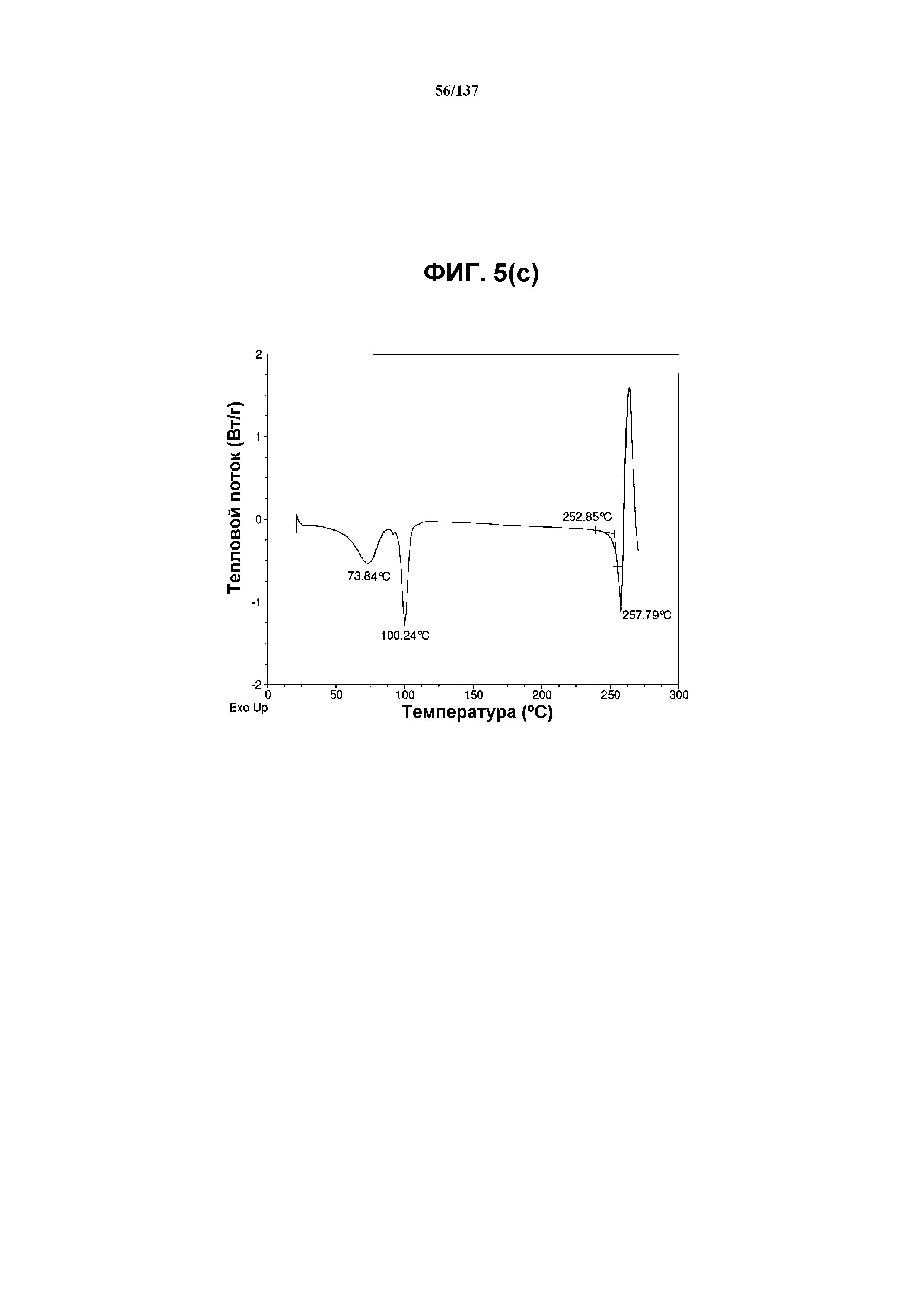
На фиг.5(c) изображена DSC-термограмма, полученная для соединения I формы I.
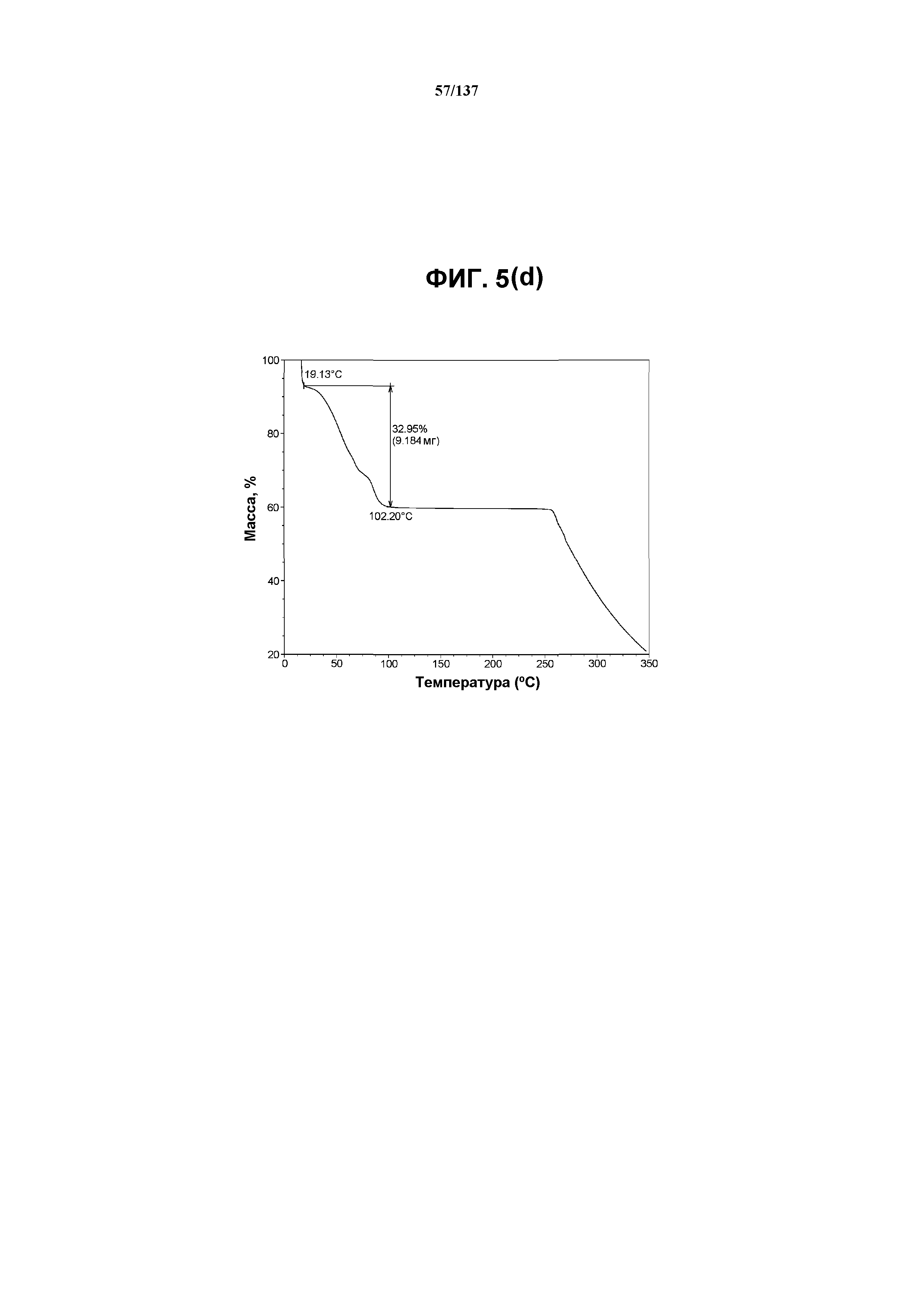
На фиг.5(d) изображена TGA-термограмма, полученная для соединения I формы I.
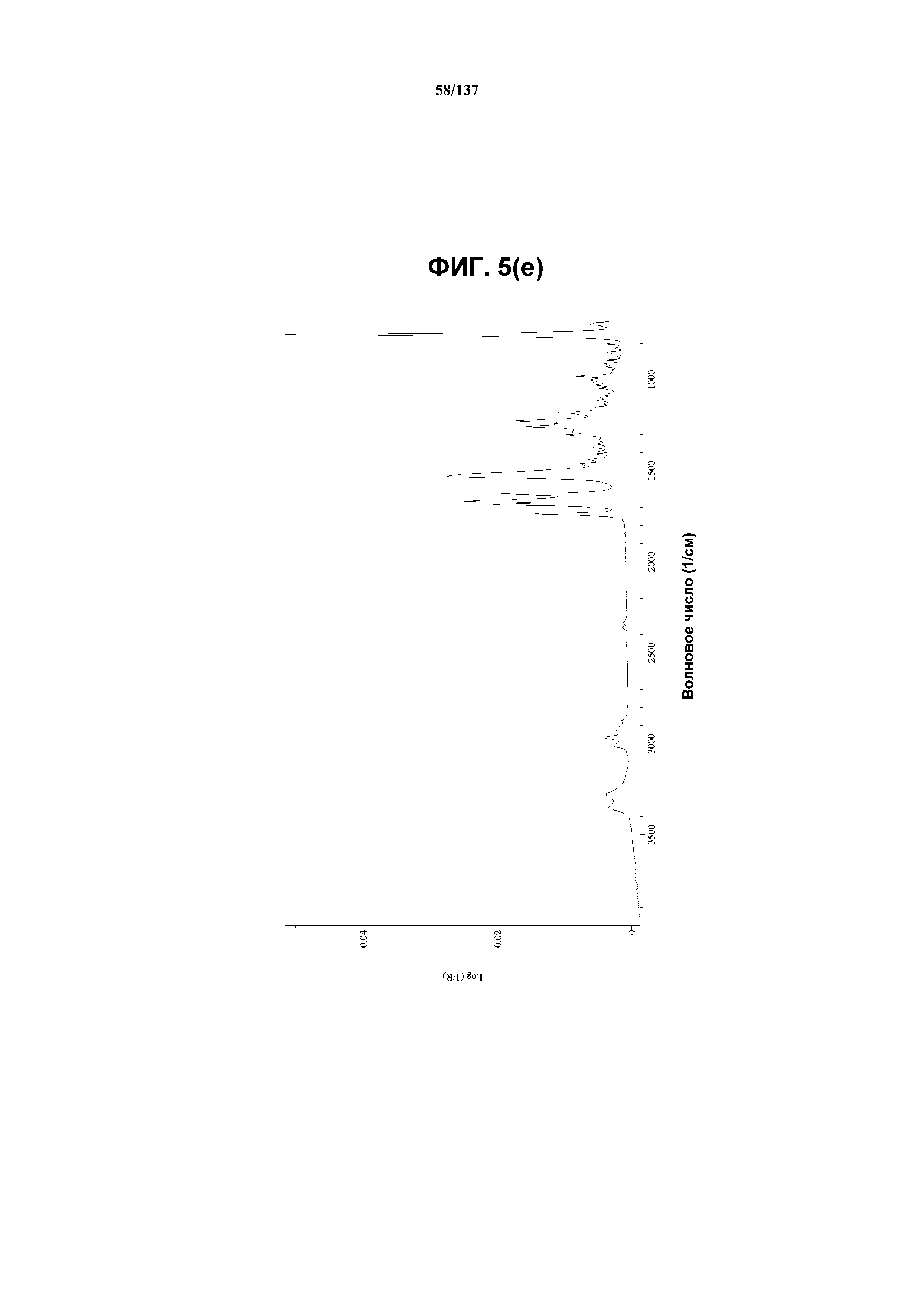
На фиг.5(e) изображен FT-IR-спектр, полученный для соединения I формы I.
На фиг.5(f) сведены в таблицу положения пиков полос, присутствующих в FT-IR-спектре на фиг.5(e).
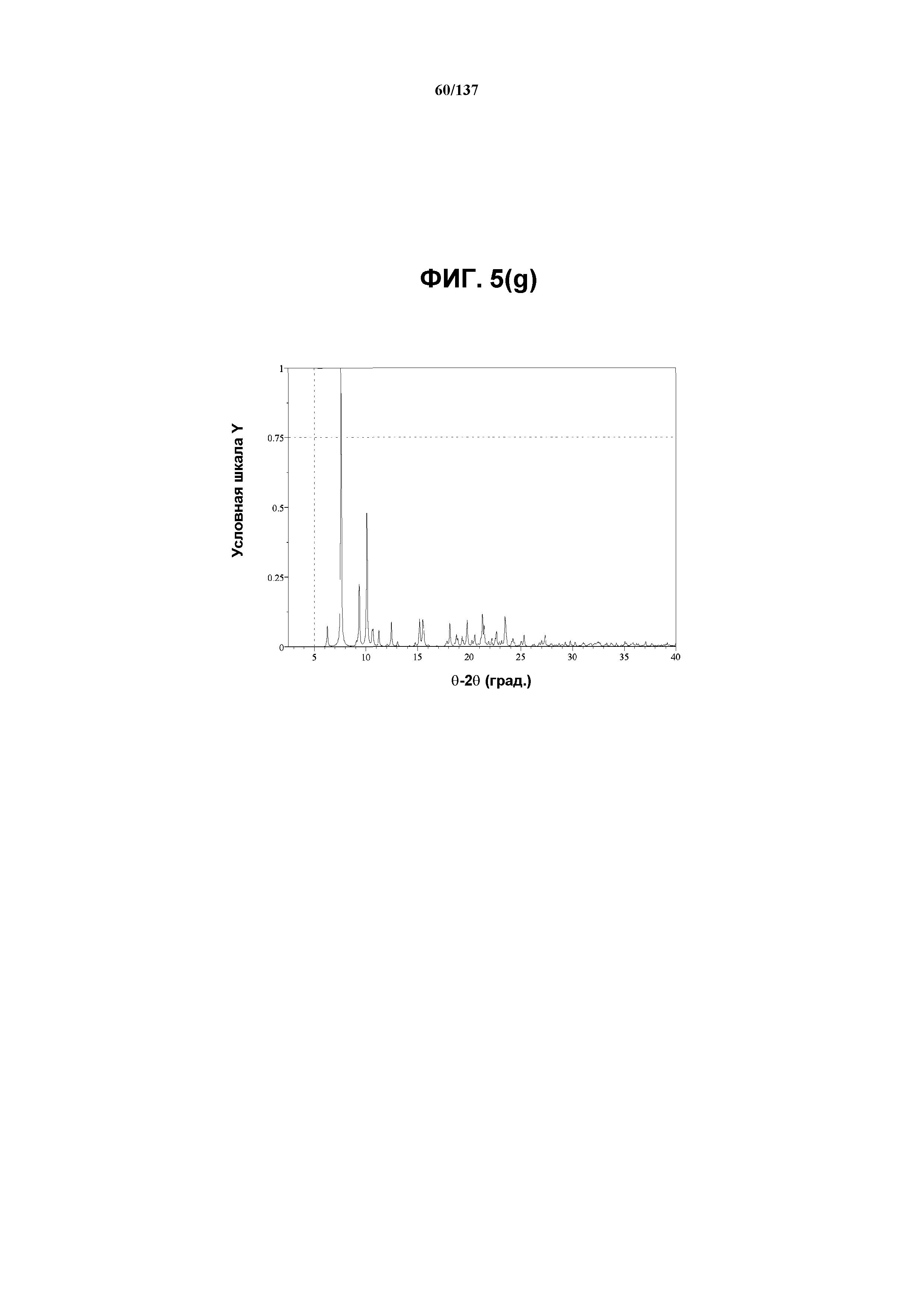
На фиг.5(g) изображена вычисленная рентгенограмма XRPD для формы I соединения I, собранная при температуре ниже температуры окружающей среды.
На фиг.5(h) изображены теоретически наблюдаемые пики (часть i); а также репрезентативные пики (часть ii), присутствующие в рентгенограмме XRPD на фиг.5(g).
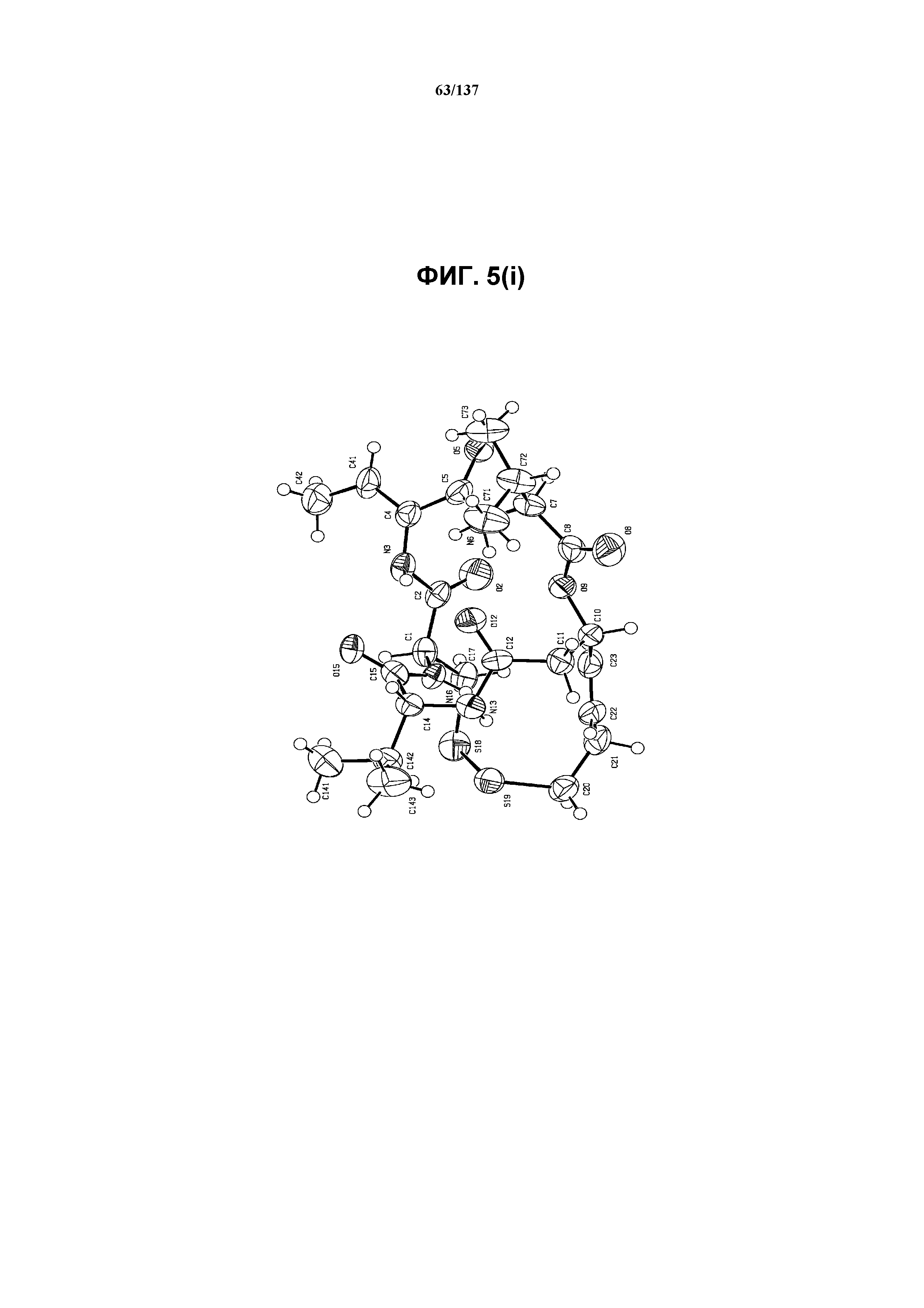
На фиг.5(i) изображена ORTEP-схема соединения I формы I, хлороформ не показан.
На фиг.5(j) изображена схема пространственной упаковки соединения I формы I, рассматриваемой вниз вдоль кристаллографической оси a.
На фиг.5(k) изображена схема пространственной упаковки соединения I формы I, рассматриваемой вниз вдоль кристаллографической оси b.
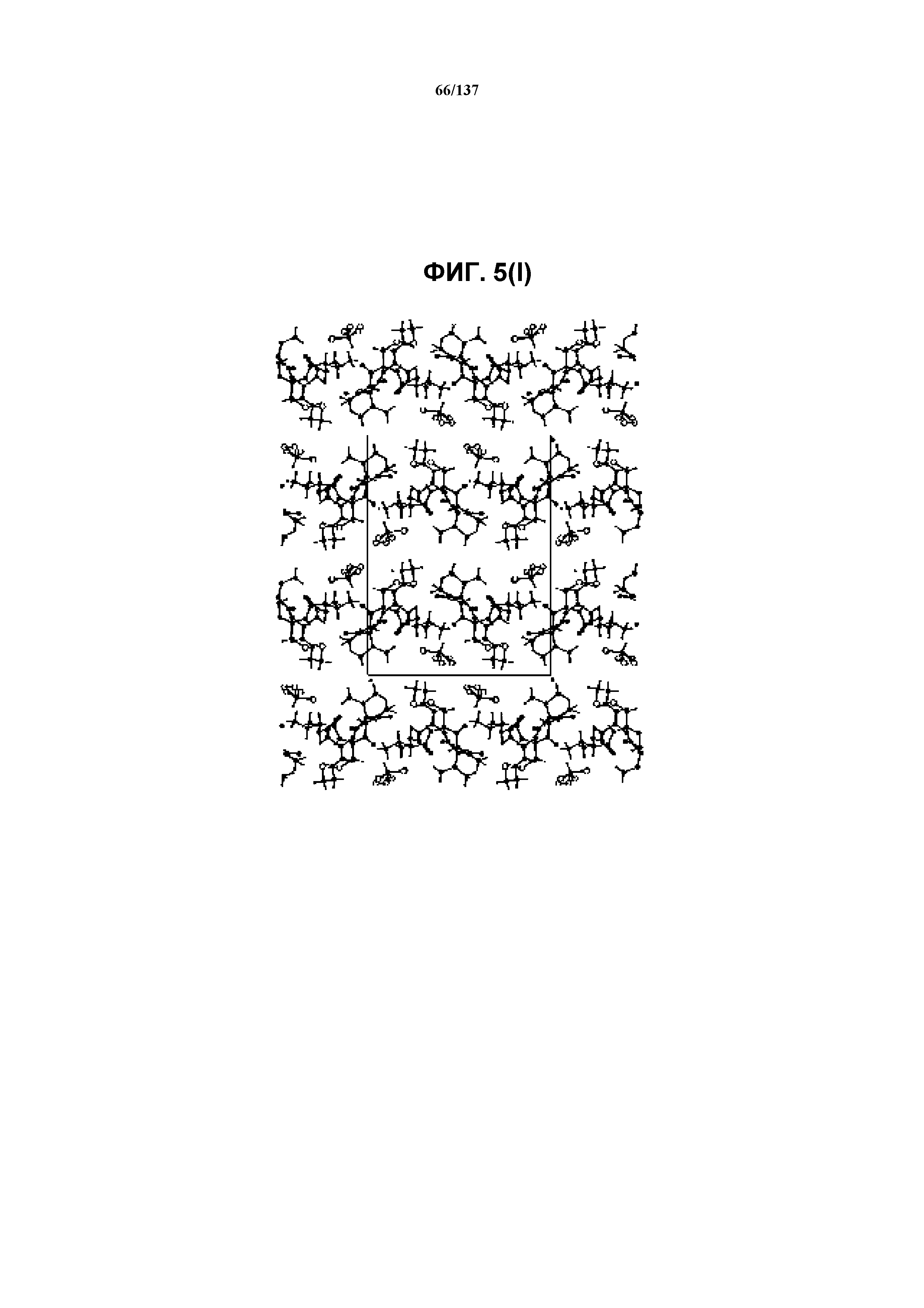
На фиг.5(1) изображена схема пространственной упаковки соединения 1 формы I, рассматриваемой вниз вдоль кристаллографической оси c.
На фиг.5(m) сведены в таблицу позиционные параметры и оценочные стандартные отклонения для соединения I формы I.
На фиг.5(n) сведены в таблицу расстояния между связями (в ангстремах) для соединения I формы I.
На фиг.5(o) сведены в таблицу углы между связями (в градусах) для соединения I формы I.
На фиг.5(p) изображена рентгенограмма XRPD для соединения I формы I.
На фиг.5(q) сведены в таблицу наблюдаемые пики, присутствующие в рентгенограмме XRPD на фиг.5(p).
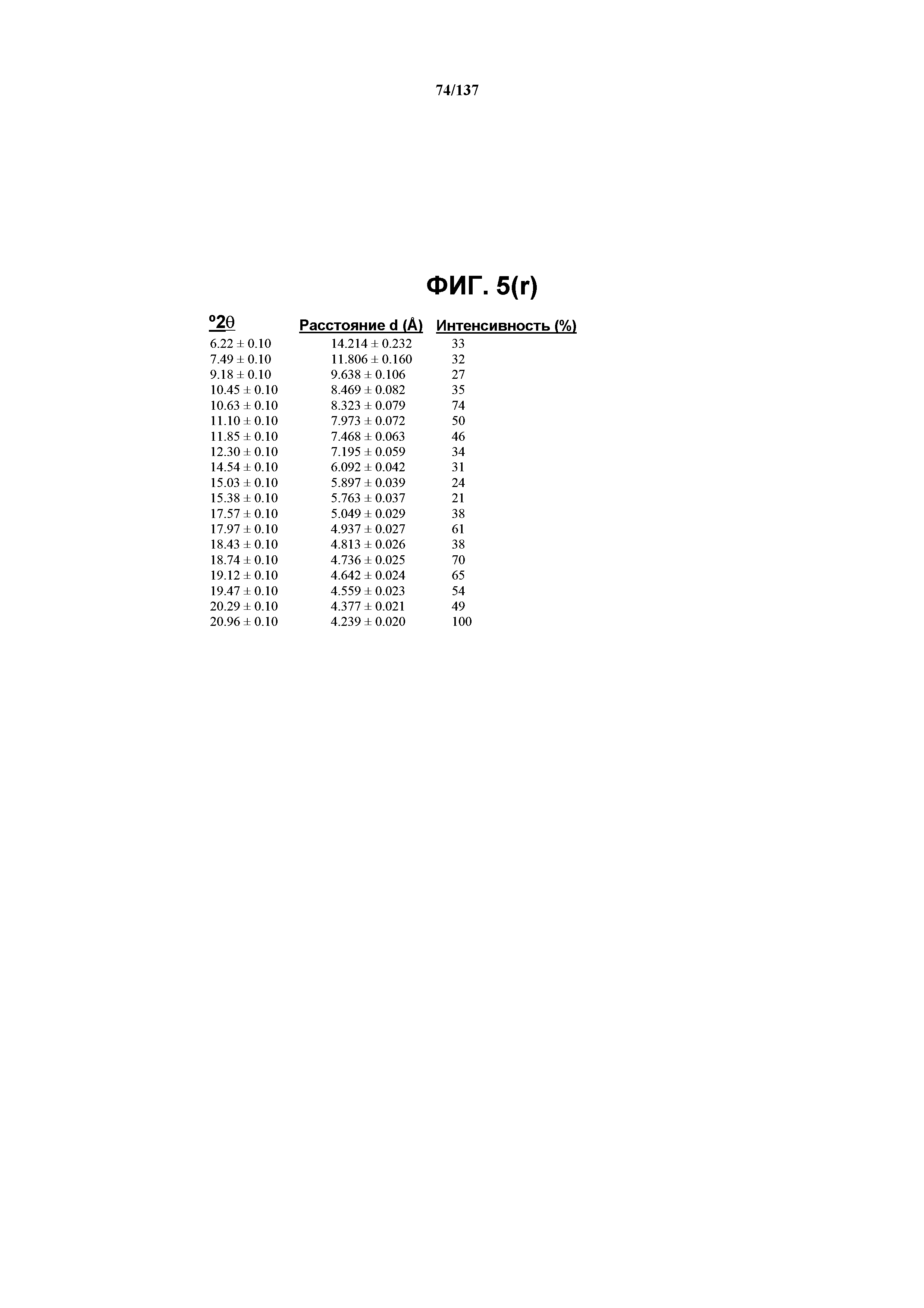
На фиг.5(r) сведены в таблицу выраженные пики, присутствующие в рентгенограмме XRPD на фиг.5(p).
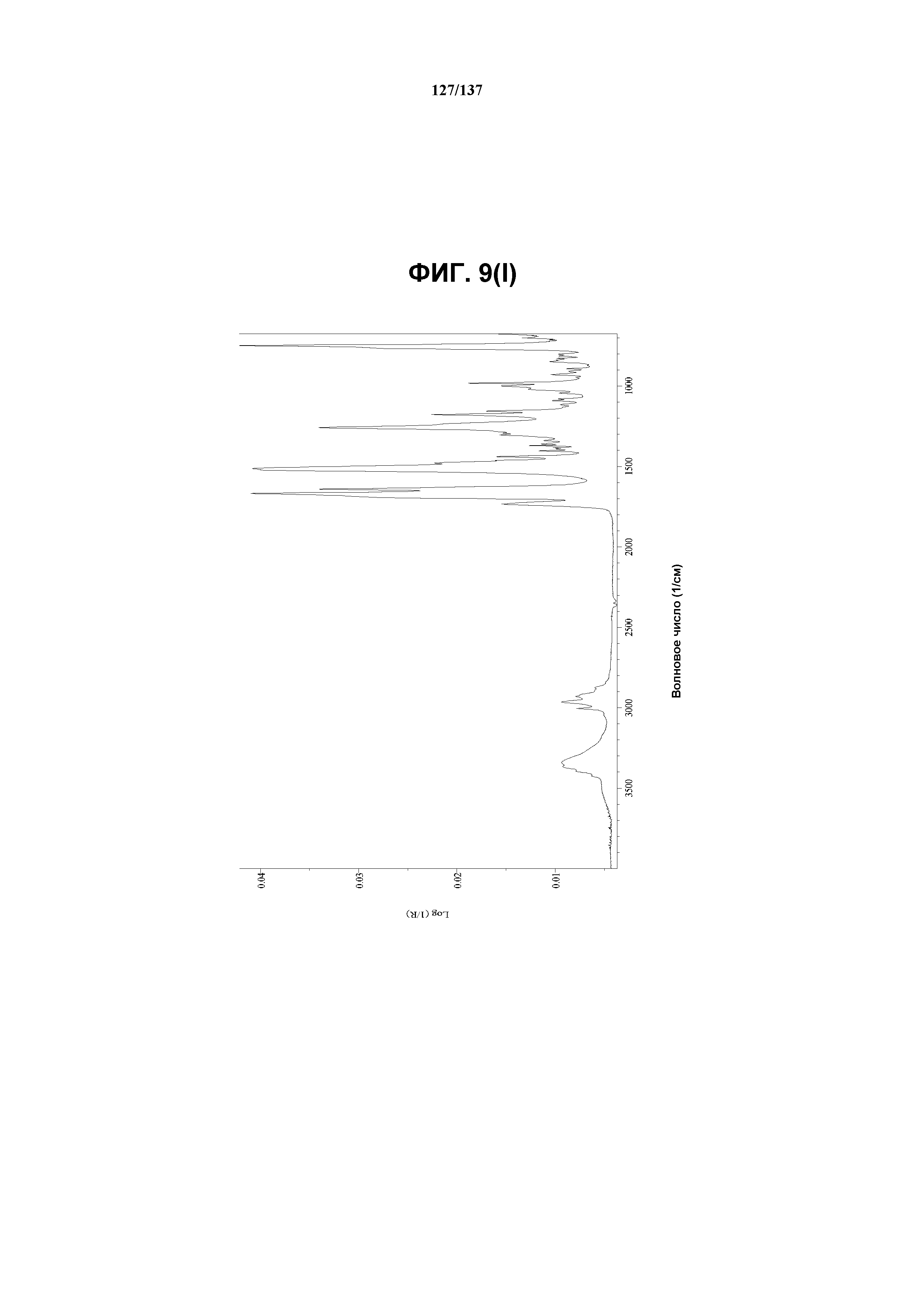
На фиг.5(s) изображен FT-IR-спектр, полученный для соединения I формы I.
На фиг.5(t) сведены в таблицу положения пиков полос, присутствующих в FT-IR-спектре на фиг.5(s).
На фиг.5(u) приведены данные анализа X-Pert Pro MPD PW3040 для соединения I формы I.
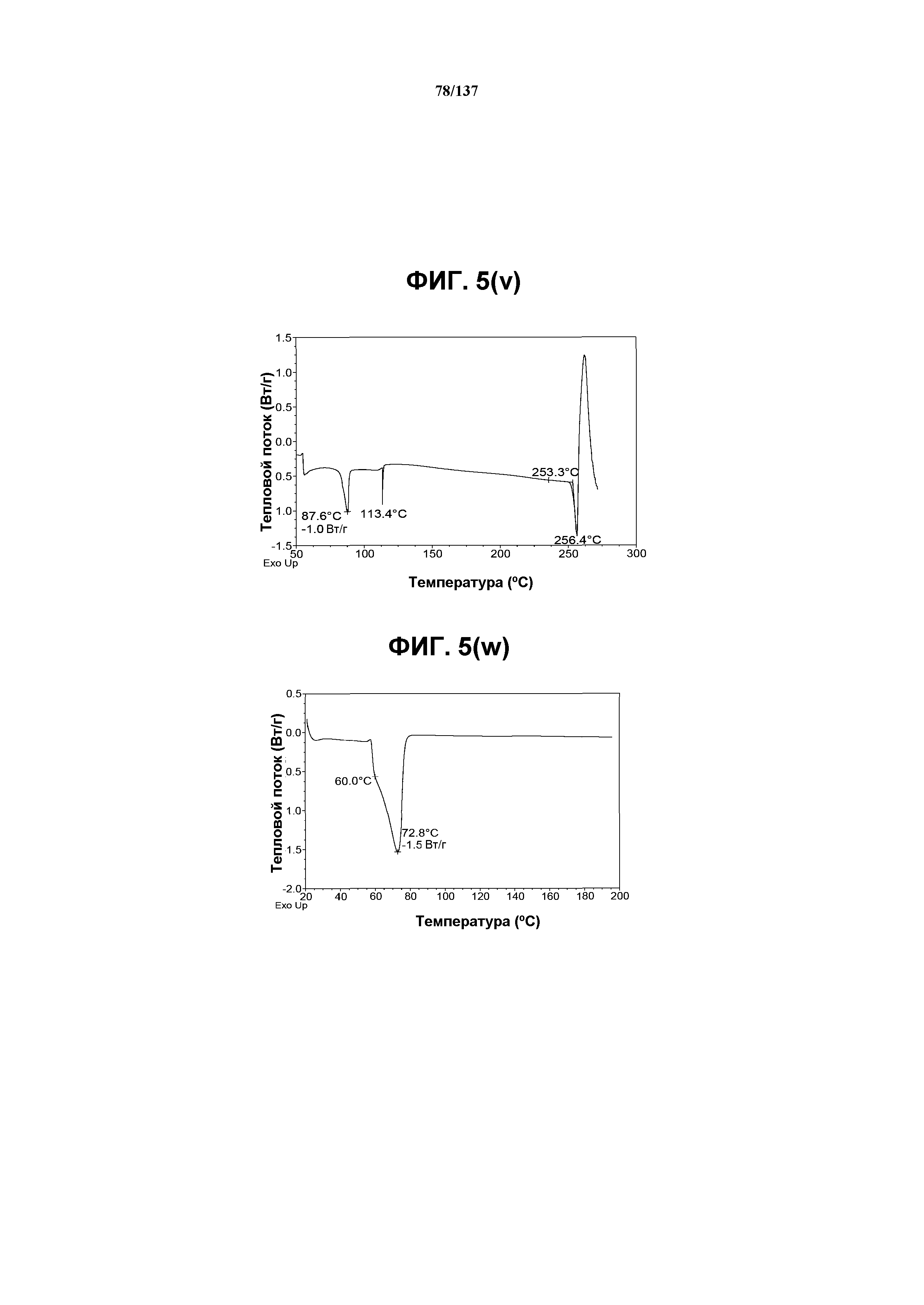
На фиг.5(v) изображена DSC-термограмма, полученная для соединения I формы I.
На фиг.5(w) изображена DSC-термограмма, полученная для соединения I формы I.
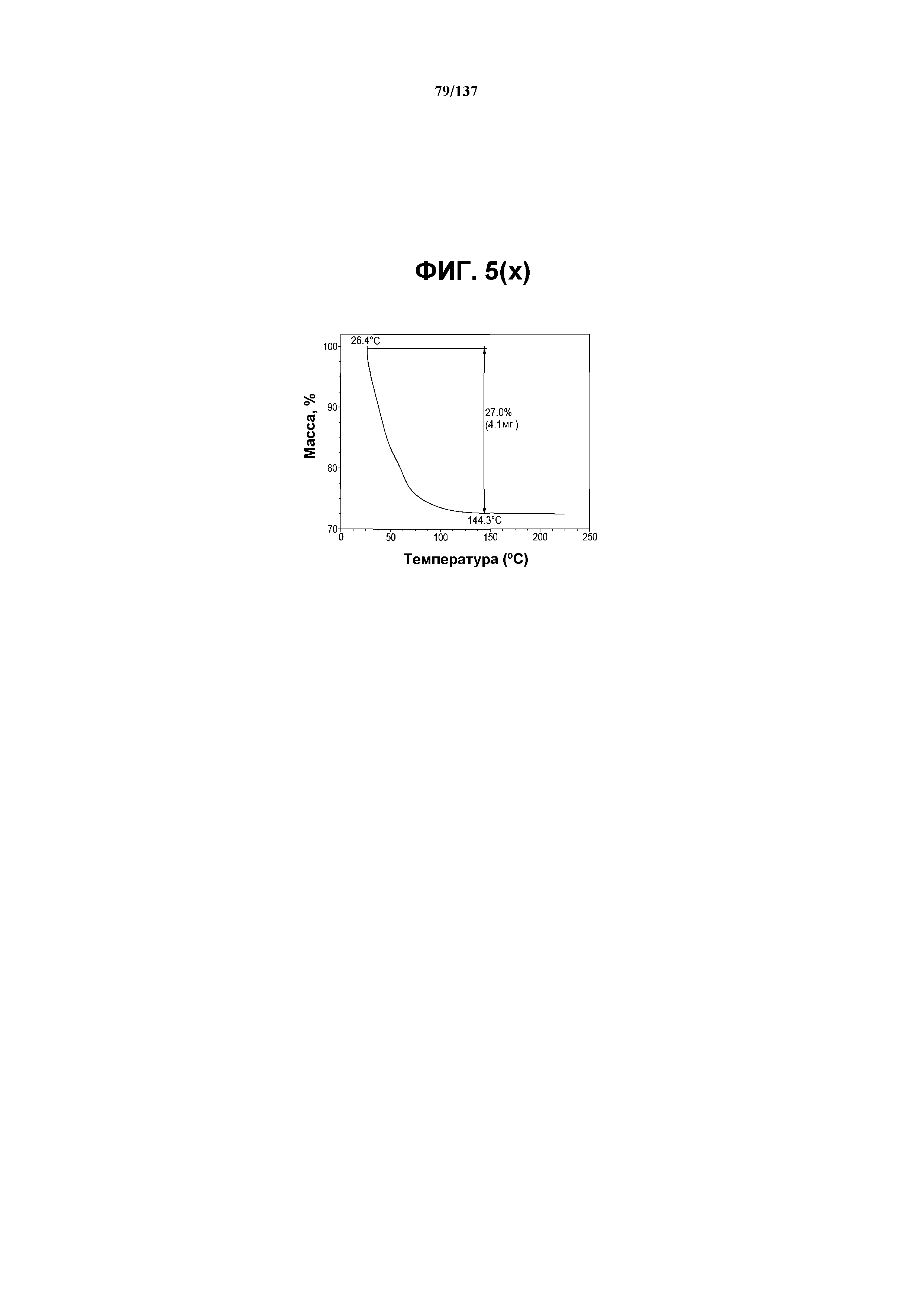
На фиг.5(x) изображена TGA-термограмма, полученная для соединения I формы I.
На фиг.5(y) изображен FT-IR-спектр для соединения I формы I.
На фиг.6(a) изображено перекрывание картины порошковой дифракции рентгеновских лучей формы D соединения 1 и вычисленной картины порошковой дифракции рентгеновских лучей формы J соединения I.
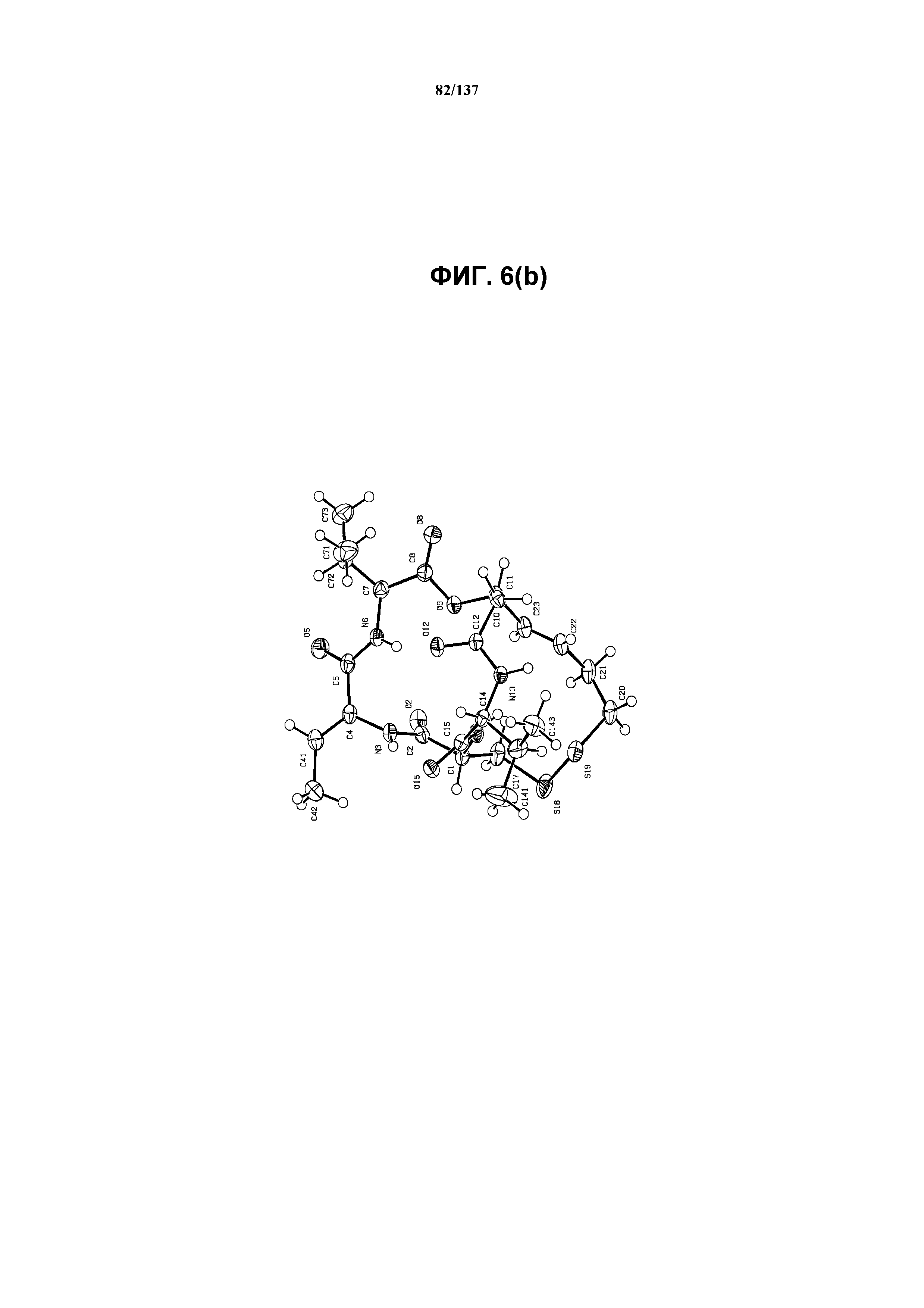
На фиг.6(b) изображена ORTEP-схема монокристаллической структуры соединения I формы J.
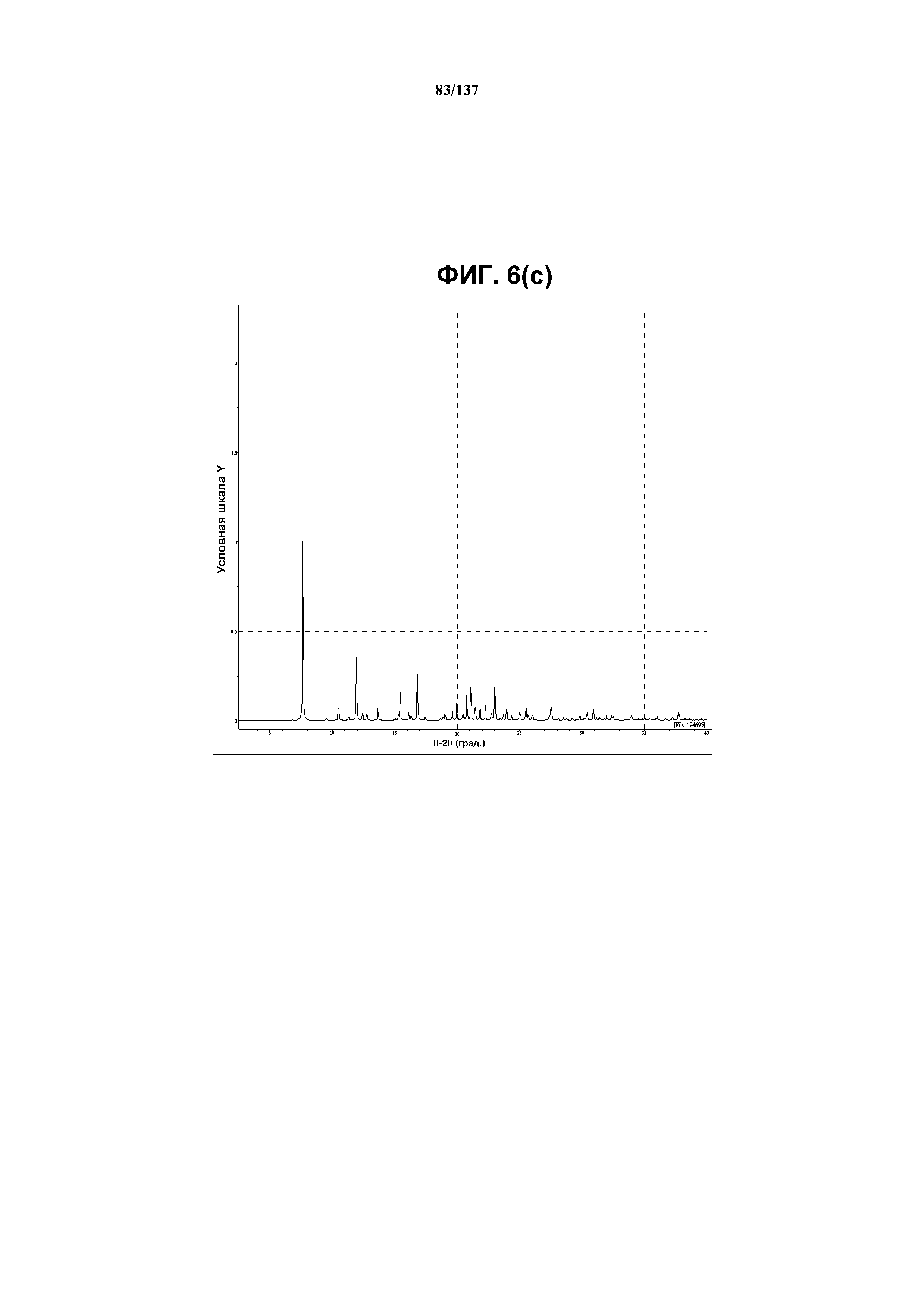
На фиг.6(c) изображена вычисленная рентгенограмма XRPD для соединения I формы J, собранная при температуре ниже температуры окружающей среды.
На фиг.6(d) изображены теоретически наблюдаемые пики (часть i); и выраженные пики (часть ii), присутствующие в рентгенограмме XRPD на фиг.6(c).
На фиг.6(e) изображена схема пространственной упаковки соединения, формы J, рассматриваемой вниз вдоль кристаллографической оси a.
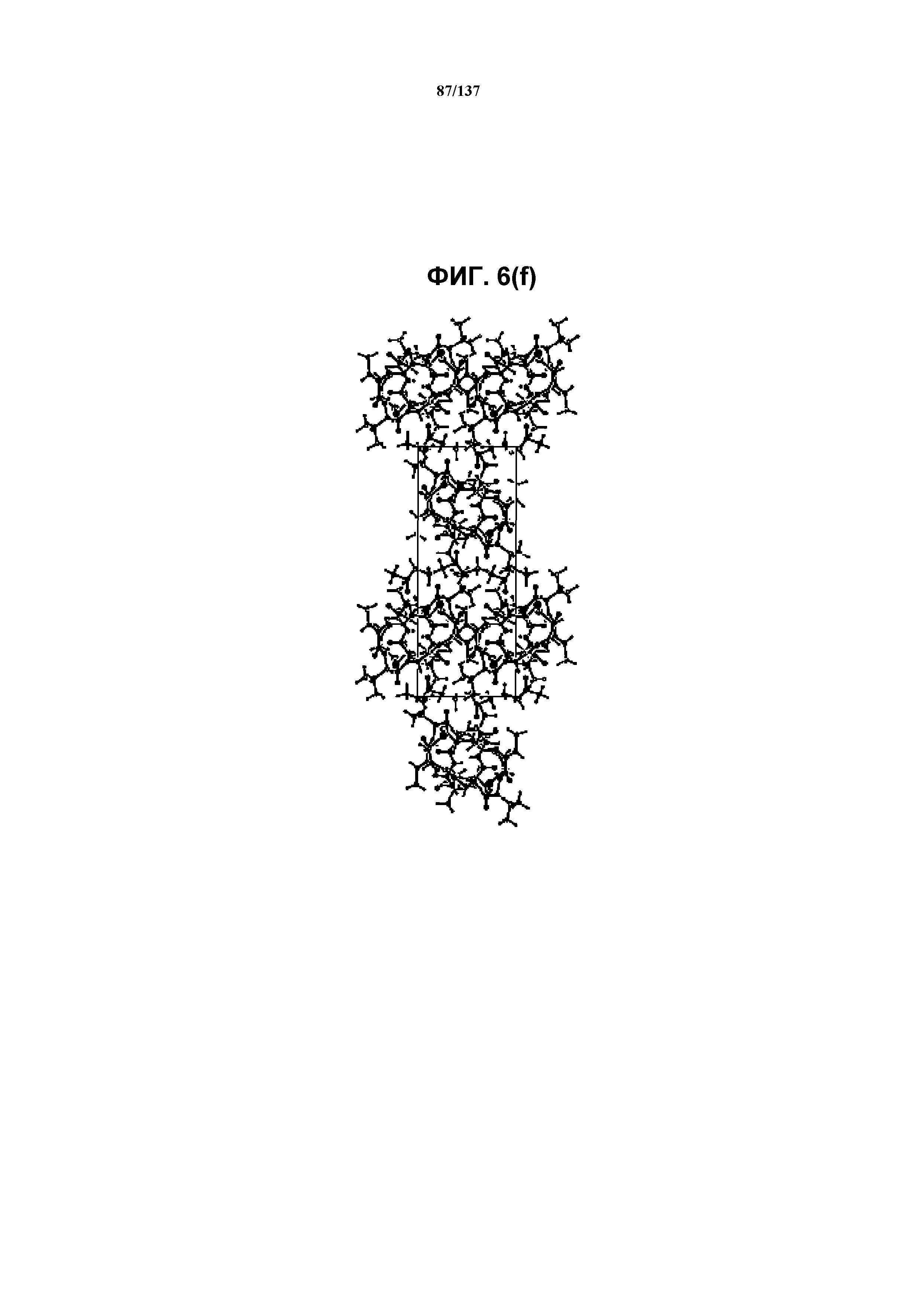
На фиг.6(f) изображена схема пространственной упаковки соединения I формы J, рассматриваемой вниз вдоль кристаллографической оси b.
На фиг.6(g) изображена схема пространственной упаковки соединения I формы J, рассматриваемой вниз вдоль кристаллографической оси c.
На фиг.6(h) сведены в таблицу позиционные параметры и оценочные стандартные отклонения для соединения I формы J.
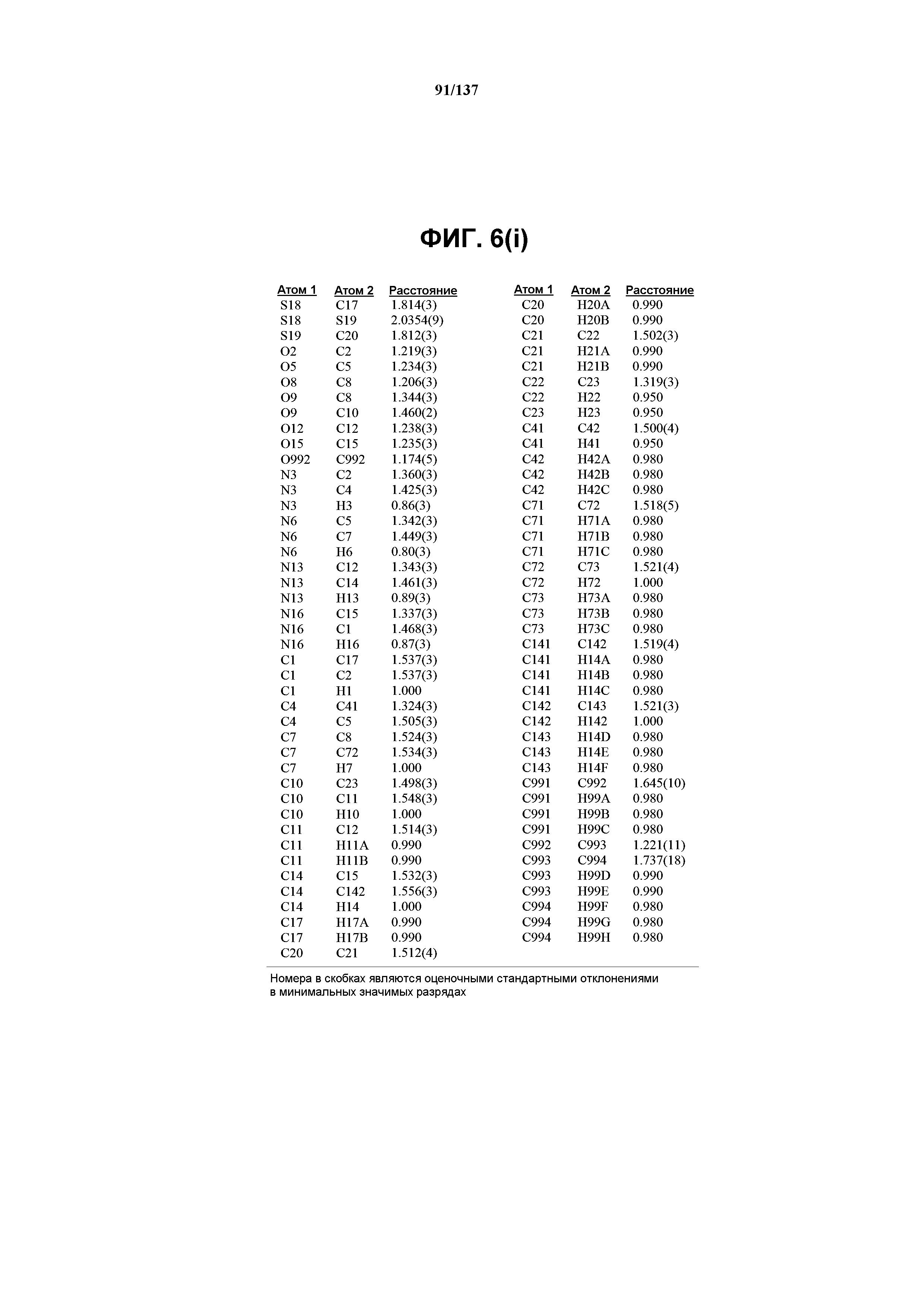
На фиг.6(i) сведены в таблицу расстояния между связями (в ангстремах) для соединения I формы J.
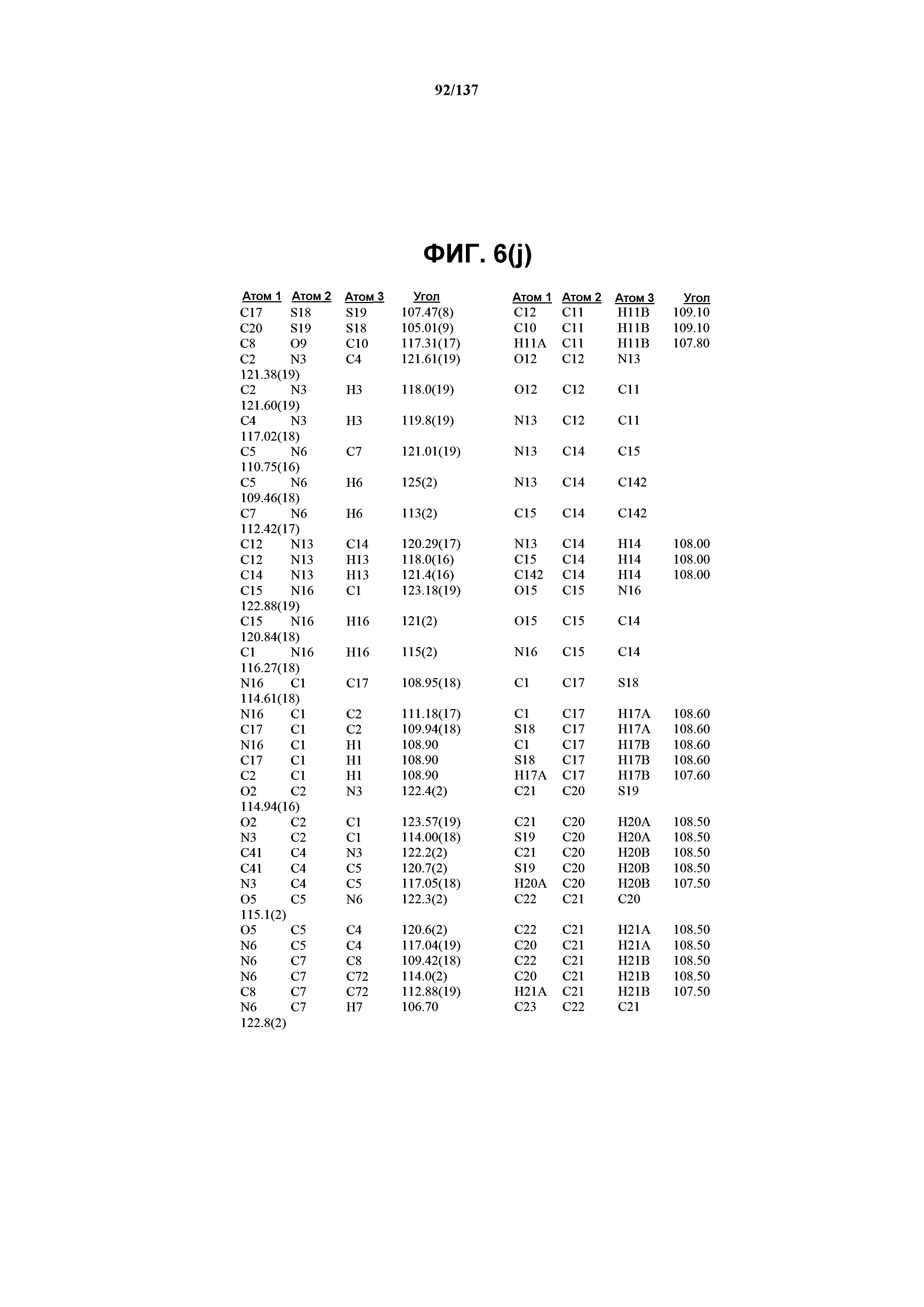
На фиг.6(j) сведены в таблицу углы между связями (в градусах) для соединения I формы J.
На фиг.6(k) изображена рентгенограмма XRPD, полученная для соединения I формы J.
На фиг.6(1) сведены в таблицу наблюдаемые пики, присутствующие в рентгенограмме XRPD на фиг.6(k).
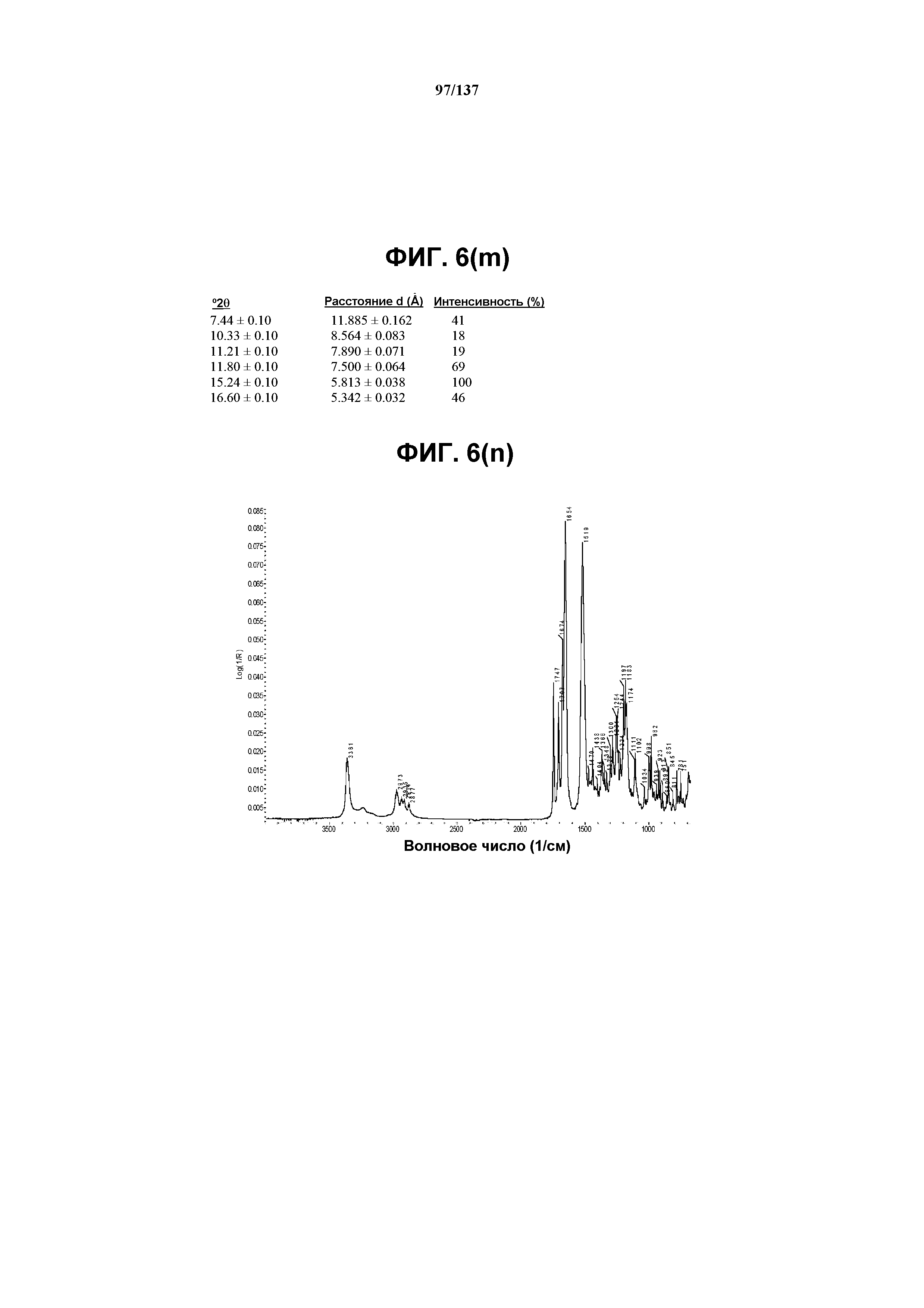
На фиг.6(m) сведены в таблицу выраженные пики, присутствующие в рентгенограмме XRPD на фиг.6(k).
На фиг.6(n) изображен FT-IR-спектр, полученный для соединения I формы J.
На фиг.6(o) сведены в таблицу положения пиков полос, присутствующих в FT-IR-спектре на фиг.6(n).
На фиг.6(p) представлены данные Panalytical X-Pert Pro MPD PW3040 для соединения I формы J.
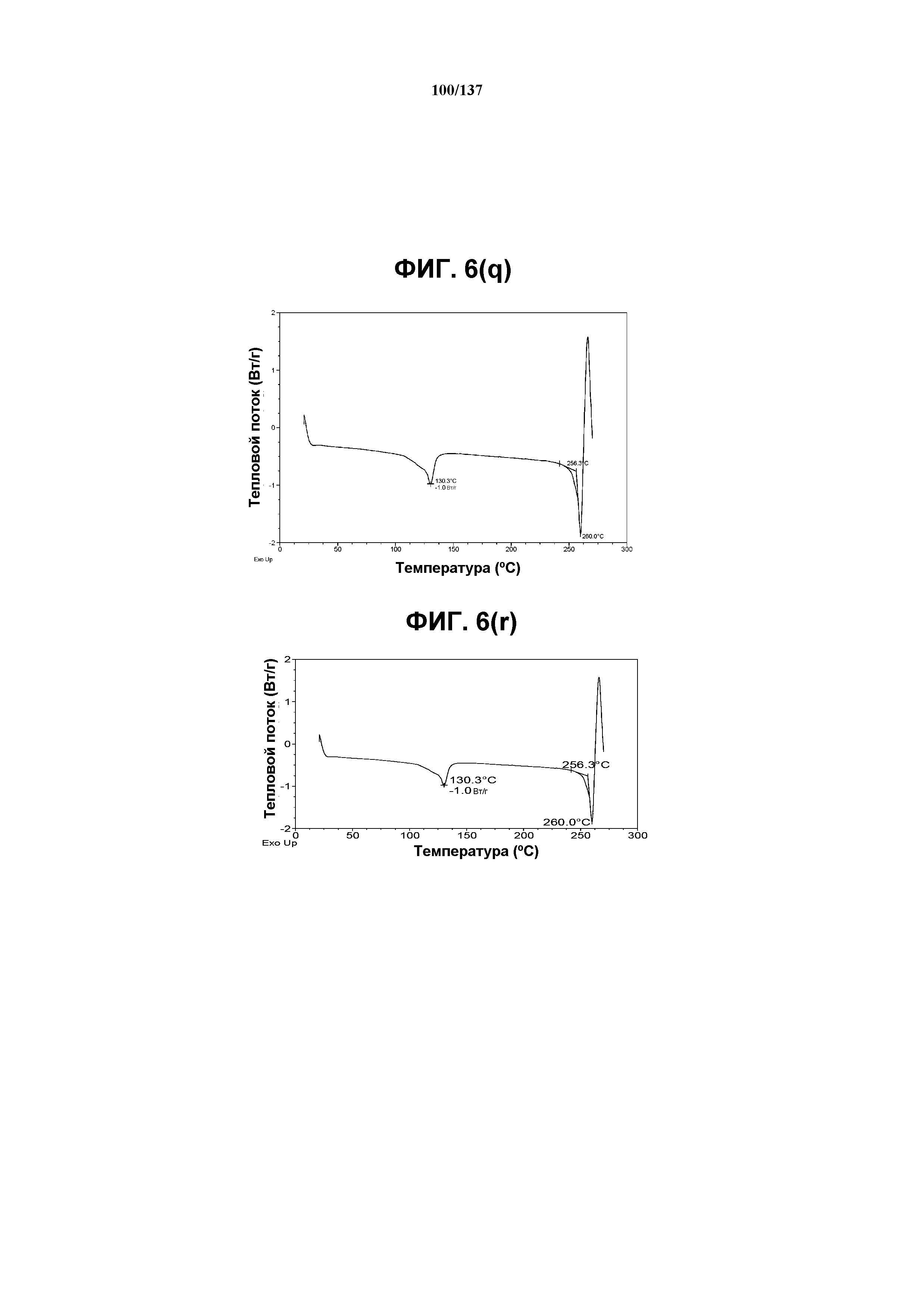
На фиг.6(q) изображена DSC-термограмма, полученная для соединения I формы J.
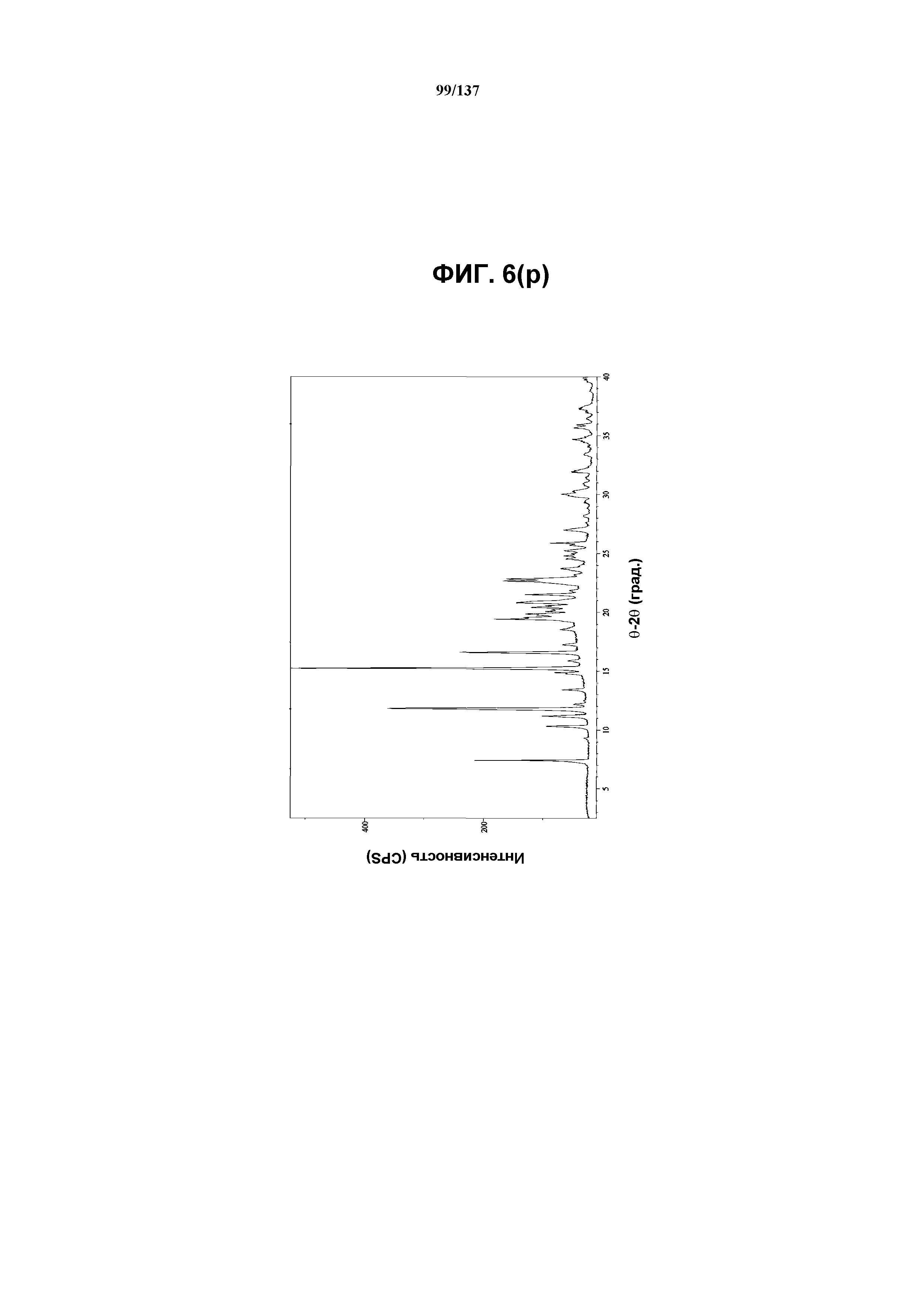
На фиг.6(r) изображена TGA-термограмма, полученная для соединения I формы J.
На фиг.6(s) изображен FT-IR-спектр соединения I формы J.
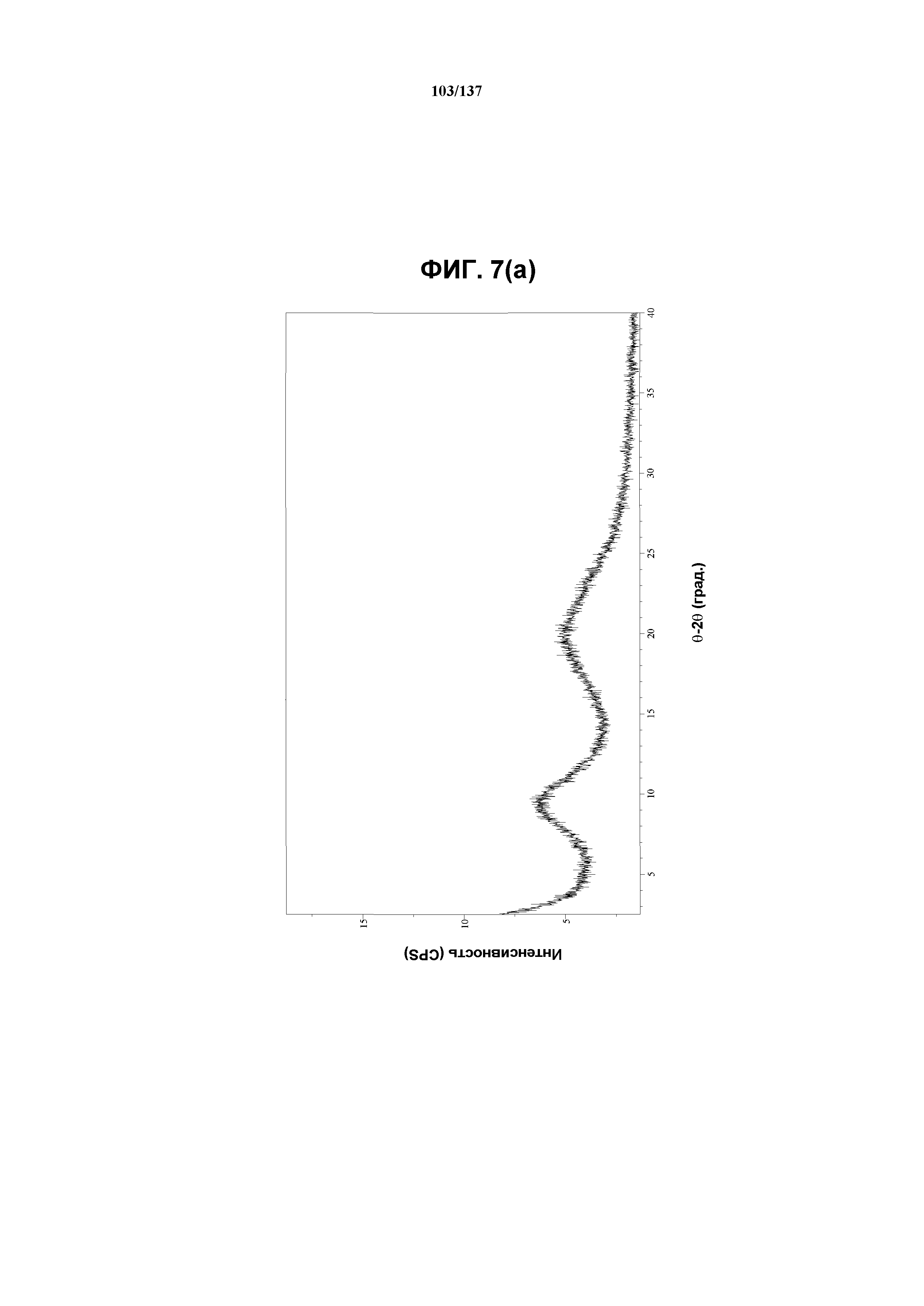
На фиг.7(a) изображена рентгенограмма XRPD, полученная для аморфного соединения I, собранная при комнатной температуре.
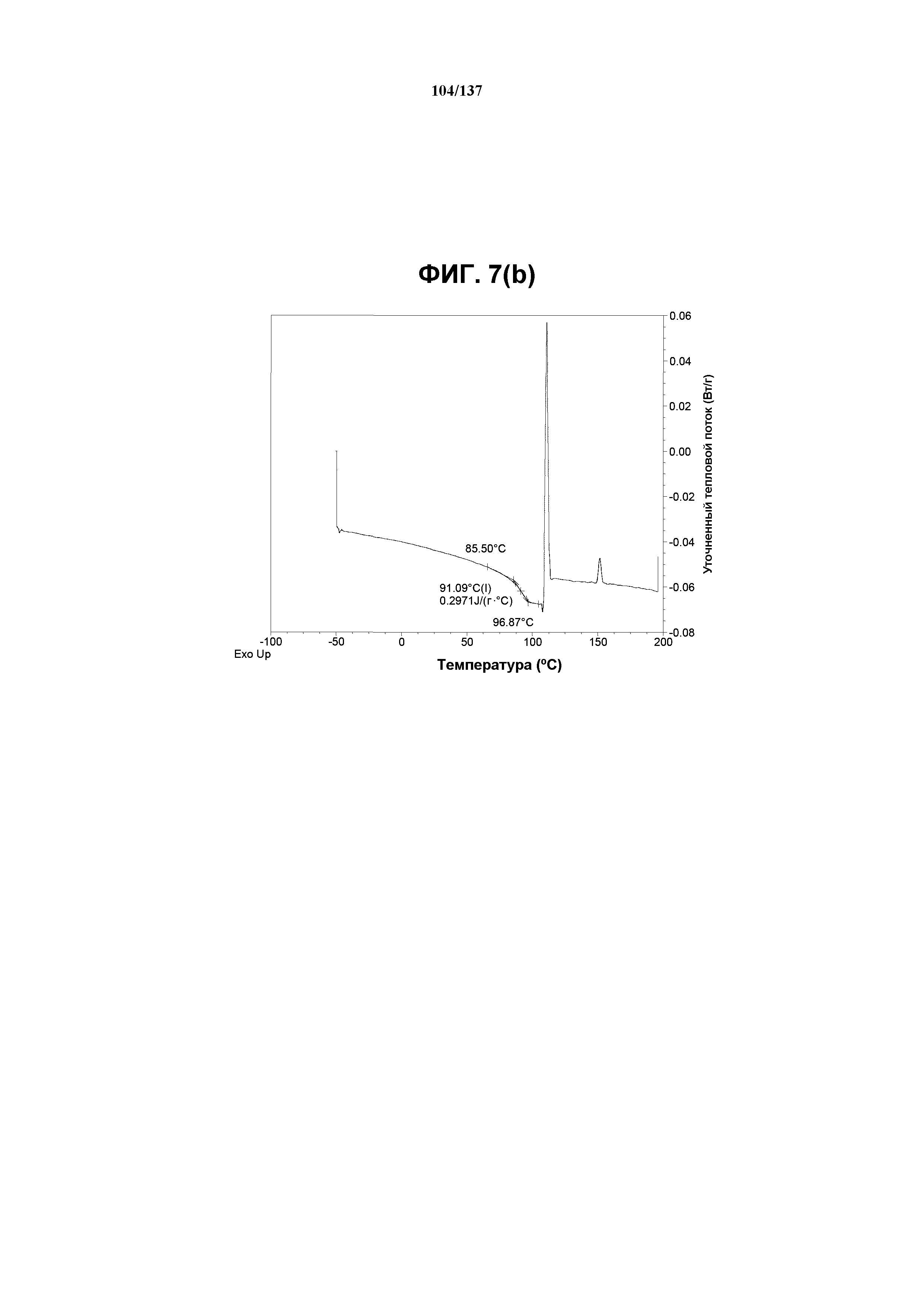
На фиг.7(b) изображена модулированная DSC-термограмма, полученная для аморфного соединения I.
На фиг.7(c) изображена TGA-термограмма, полученная для аморфного соединения I.
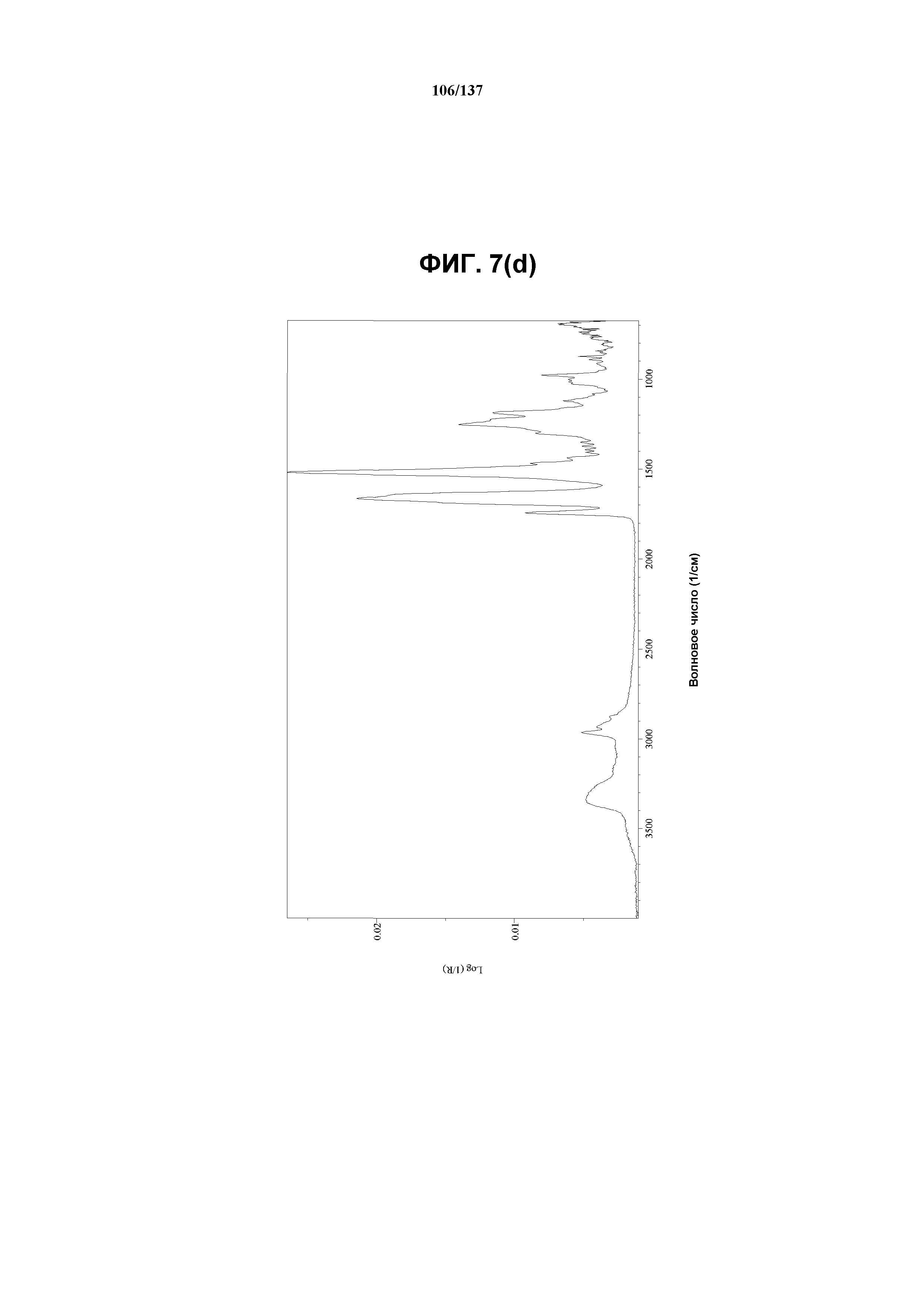
На фиг.7(d) изображен FT-IR-спектр, полученный для аморфного соединения I.
На фиг.7(e) сведены в таблицу положения пиков полос, присутствующих в FT-IR-спектре на фиг.7(d).
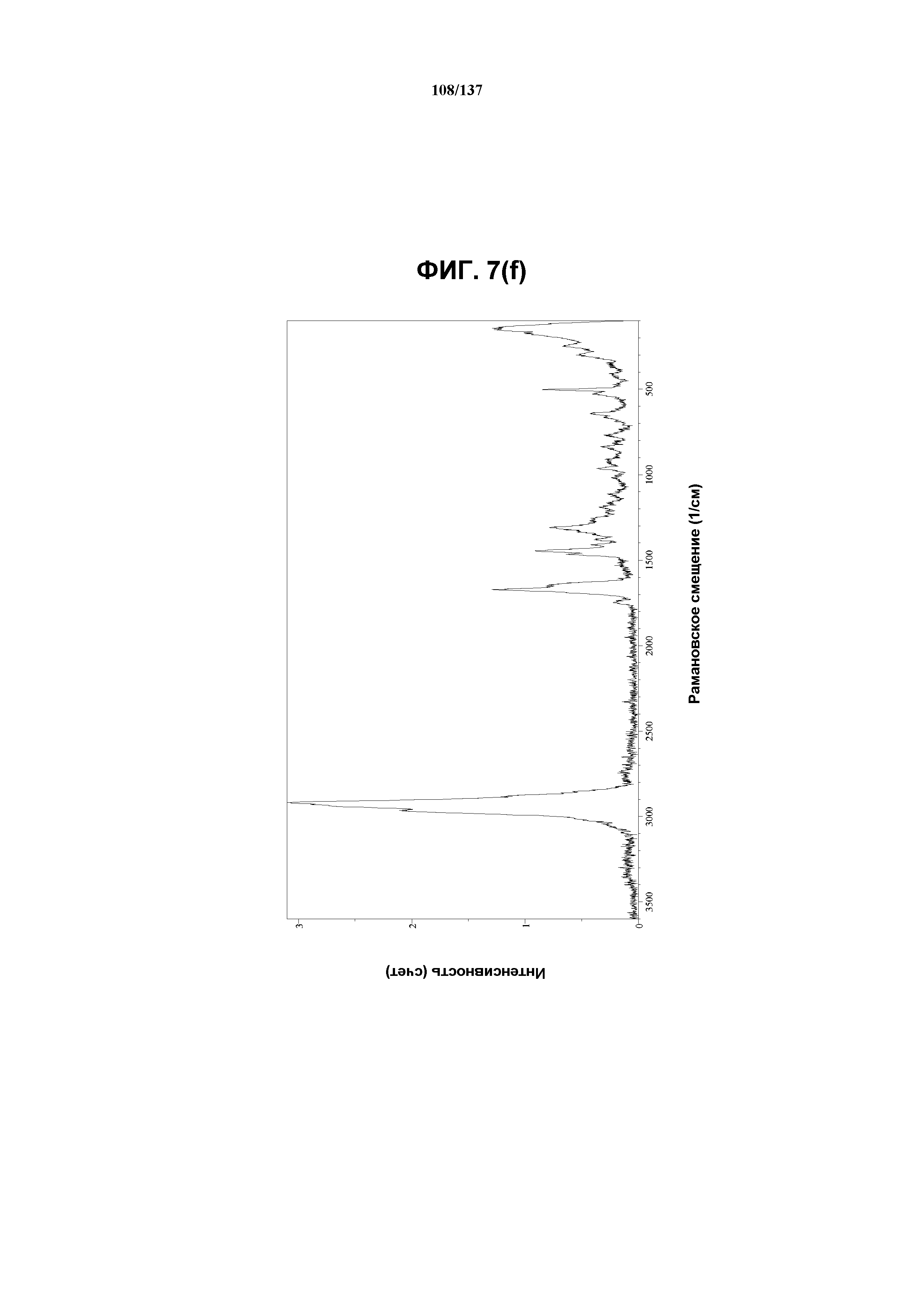
На фиг.7(f) изображен FT-рамановский спектр аморфного соединения I.
На фиг.8(a) изображена рентгенограмма XRPD, полученная для соединения I формы K, собранная при комнатной температуре.
На фиг.8(b) сведены в таблицу наблюдаемые пики (часть i); а также выраженные пики (часть ii), присутствующие в рентгенограмме XRPD на фиг.8(a).
На фиг.8(c) изображена рентгенограмма XRPD, полученная для соединения I формы K.
На фиг.8(d) сведены в таблицу наблюдаемые пики, присутствующие в рентгенограмме XRPD на фиг.8(c).
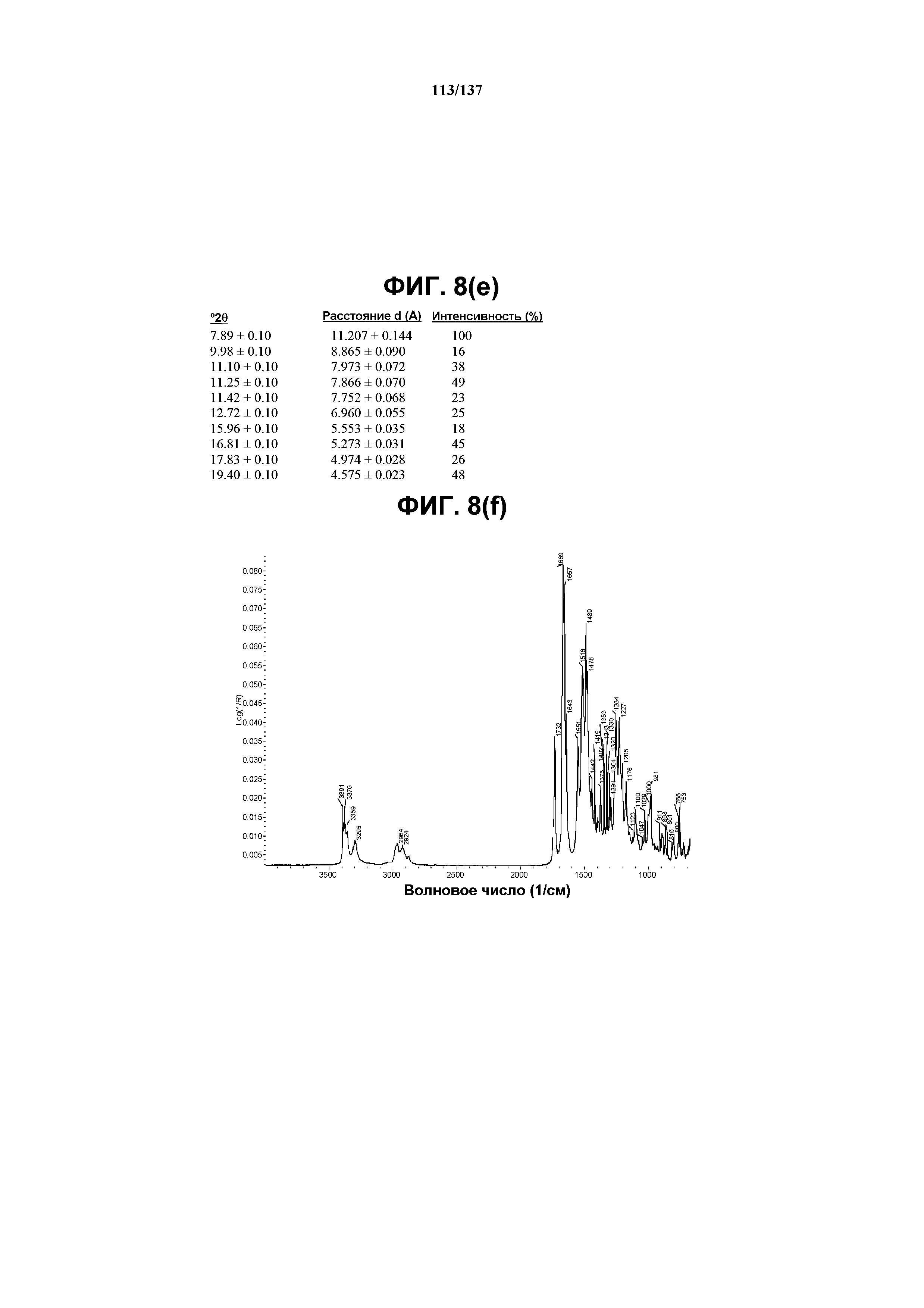
На фиг.8(e) сведены в таблицу выраженные пики, присутствующие в рентгенограмме XRPD на фиг.8(c).
На фиг.8(f) изображен FT-IR-спектр, полученный для соединения I формы K.
На фиг.8(g) сведены в таблицу положения пиков полос, присутствующих в FT-IR-спектре на фиг.8(f).
На фиг.8(h) представлены данные Panalytical X-Pert Pro MPD PW3040, полученные для соединения I формы K.
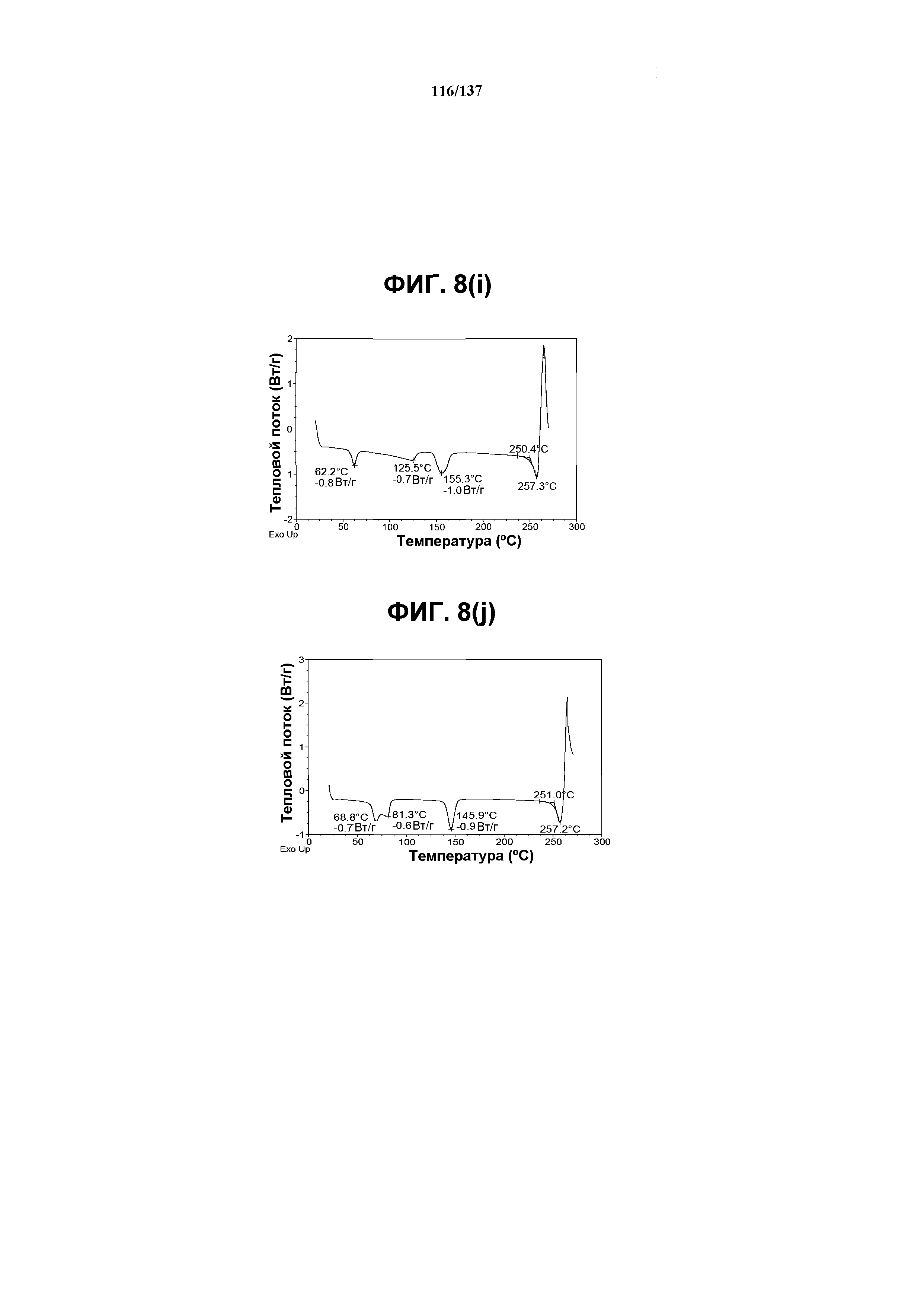
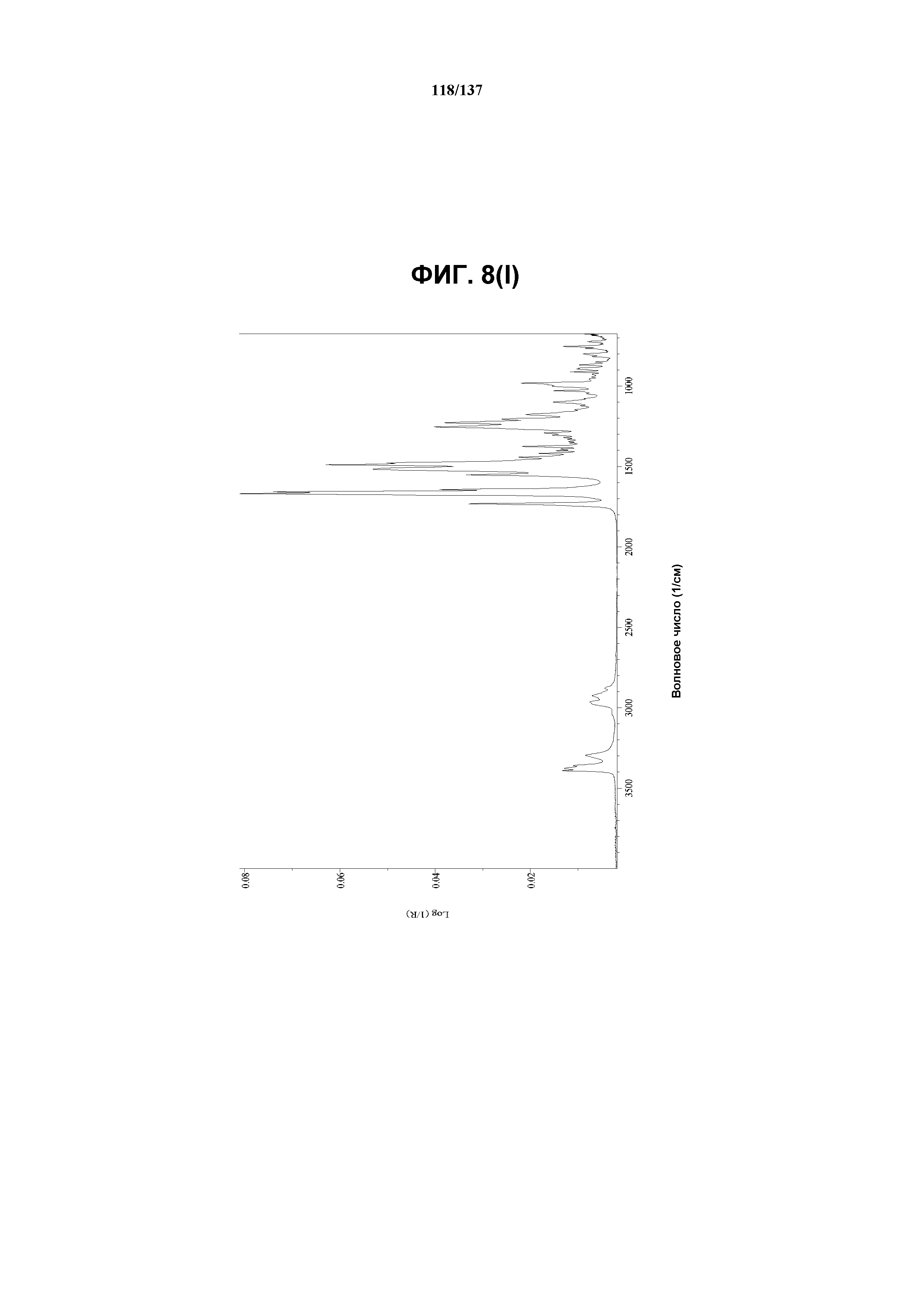
На фиг.8(i) изображена DSC-термограмма, полученная для соединения I формы K.
На фиг.8(j) изображена DSC-термограмма, полученная для соединения I формы K.
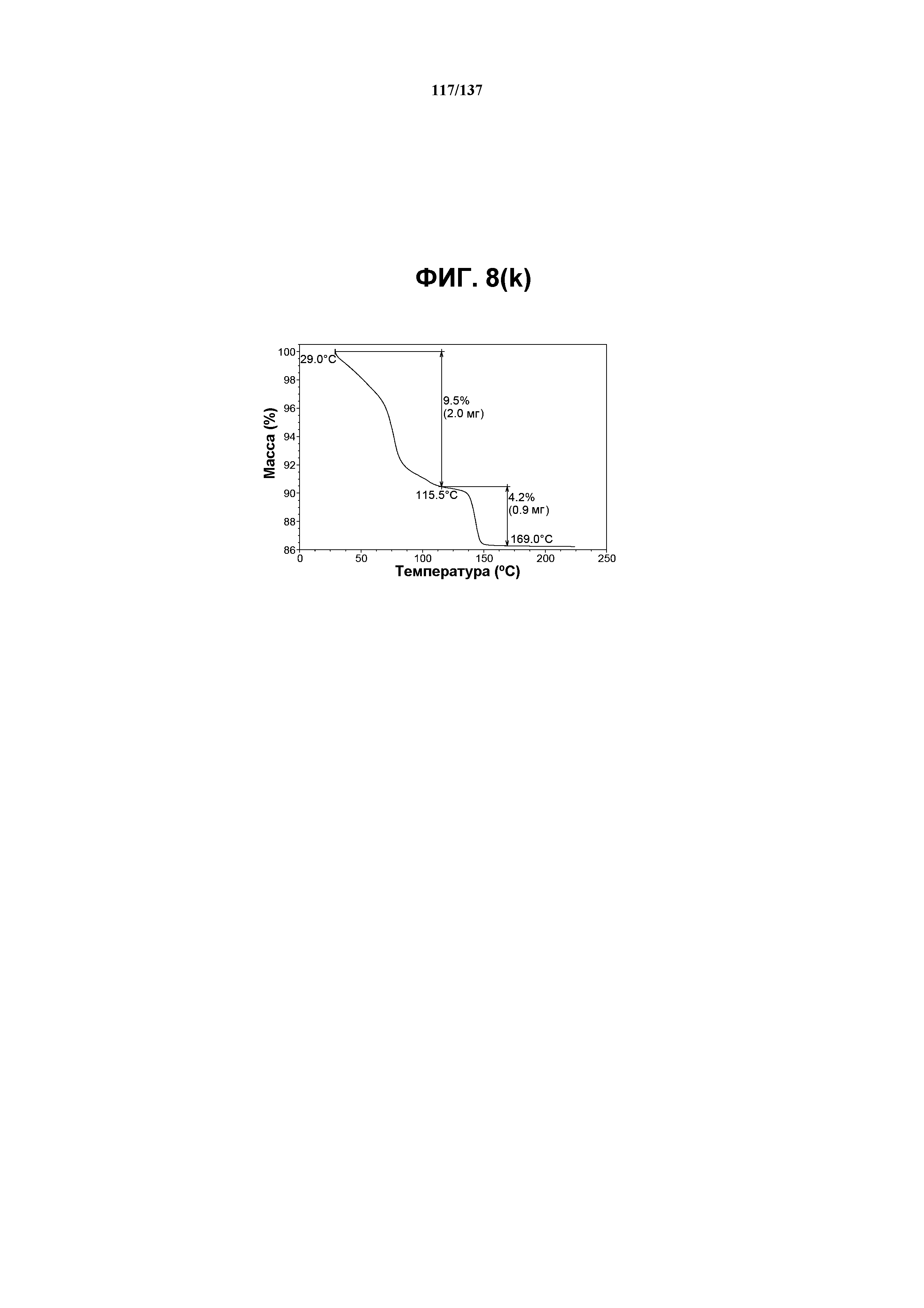
На фиг.8(k) изображена TGA-термограмма, полученная для соединения I формы K.
На фиг.8(l) приведены данные для соединения I формы К.
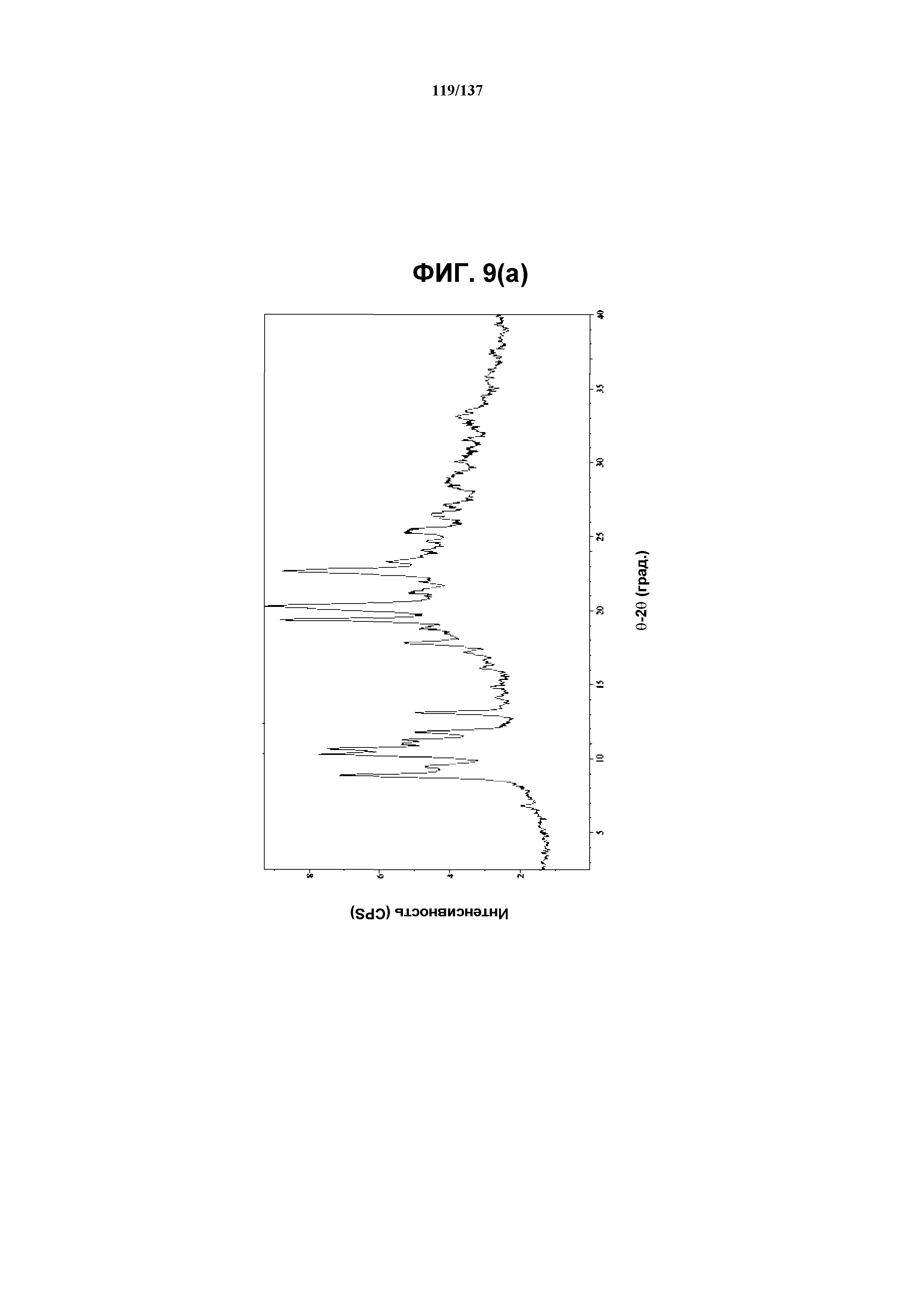
На фиг.9(a) изображена рентгенограмма XRPD, полученная для соединения I формы F.
На фиг.9(b) сведены в таблицу наблюдаемые пики, присутствующие в рентгенограмме XRPD на фиг.9(a).
На фиг.9(c) сведены в таблицу выраженные пики, присутствующие в рентгенограмме XRPD на фиг.9(a).
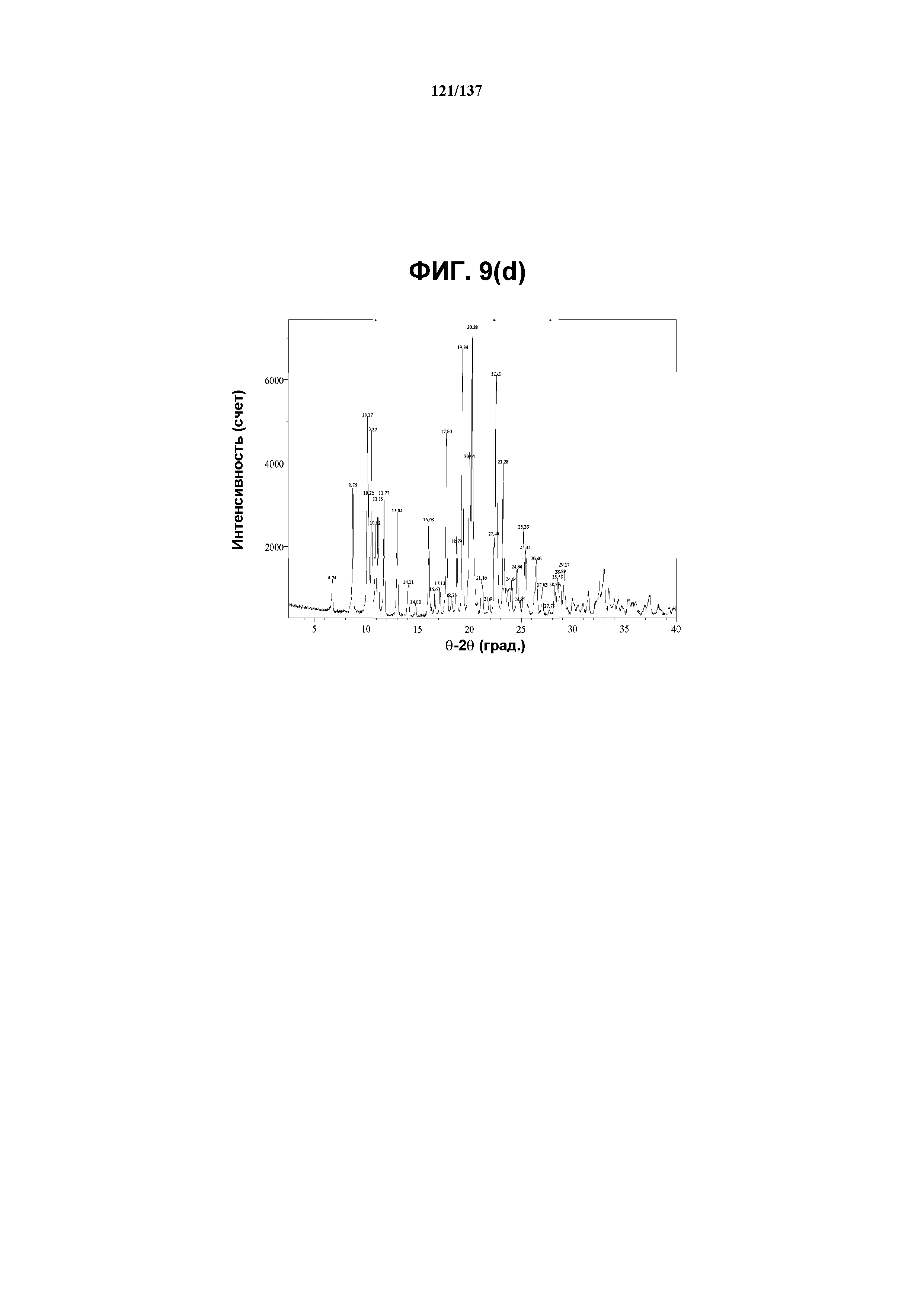
На фиг.9(d) изображена рентгенограмма XRPD, полученная для соединения I формы F.
На фиг.9(e) сведены в таблицу наблюдаемые пики, присутствующие в рентгенограмме XRPD на фиг.9(d).
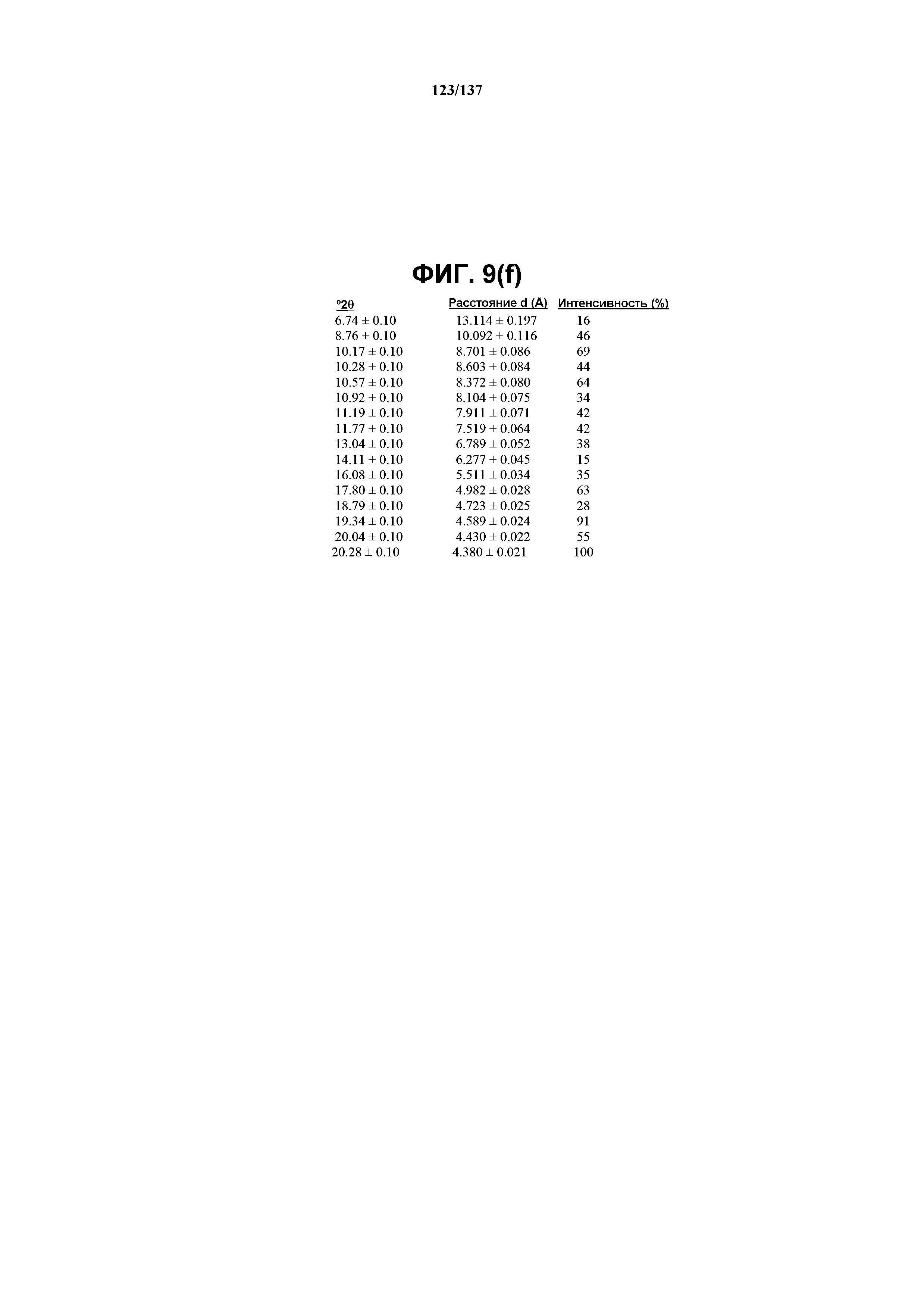
На фиг.9(f) сведены в таблицу выраженные пики, присутствующие в рентгенограмме XRPD на фиг.9(d).
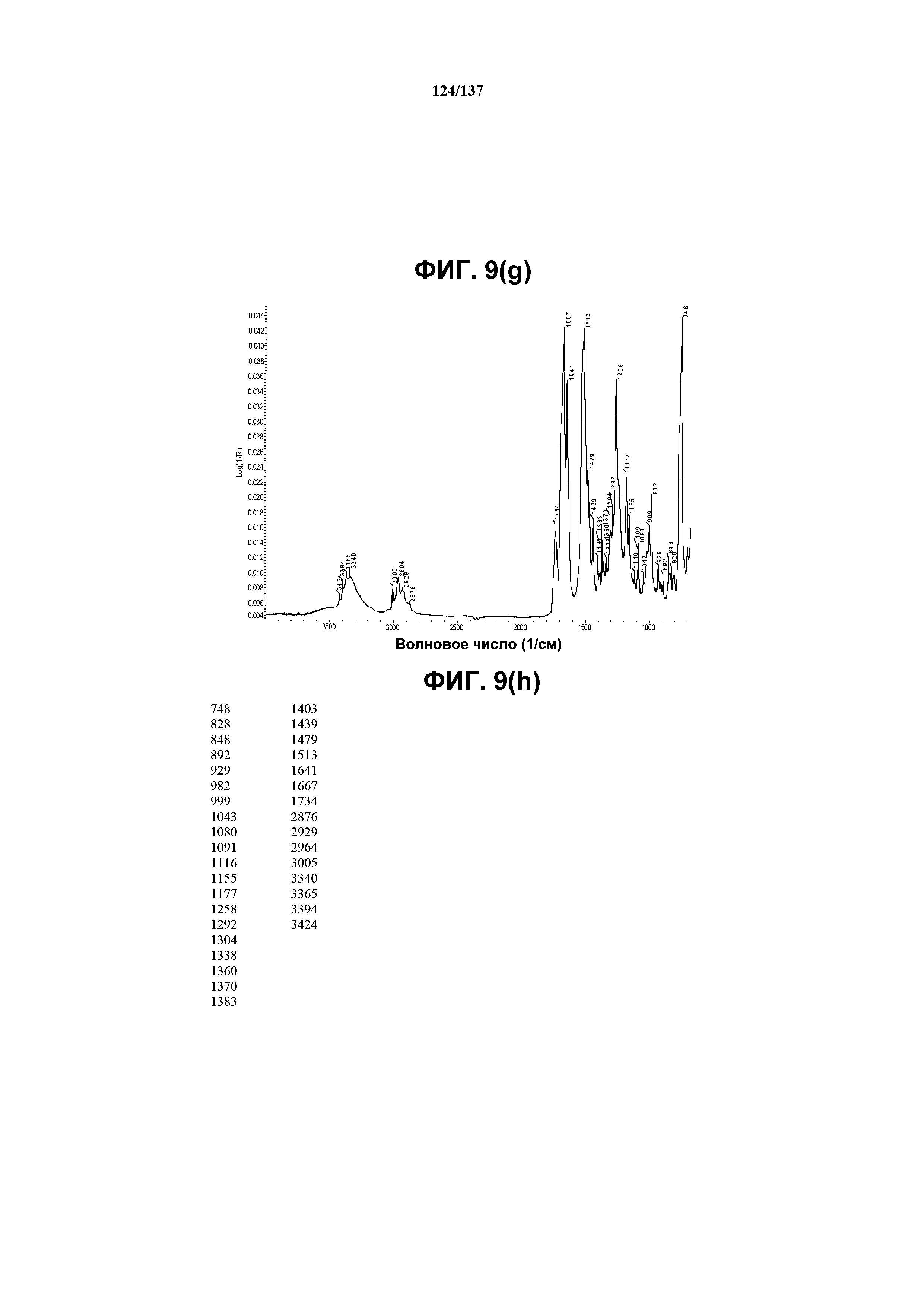
На фиг.9(g) изображен FT-IR-спектр, полученный для соединения I формы F.
На фиг.9(h) сведены в таблицу положения пиков полос, присутствующих в FT-IR-спектре на фиг.9(g).
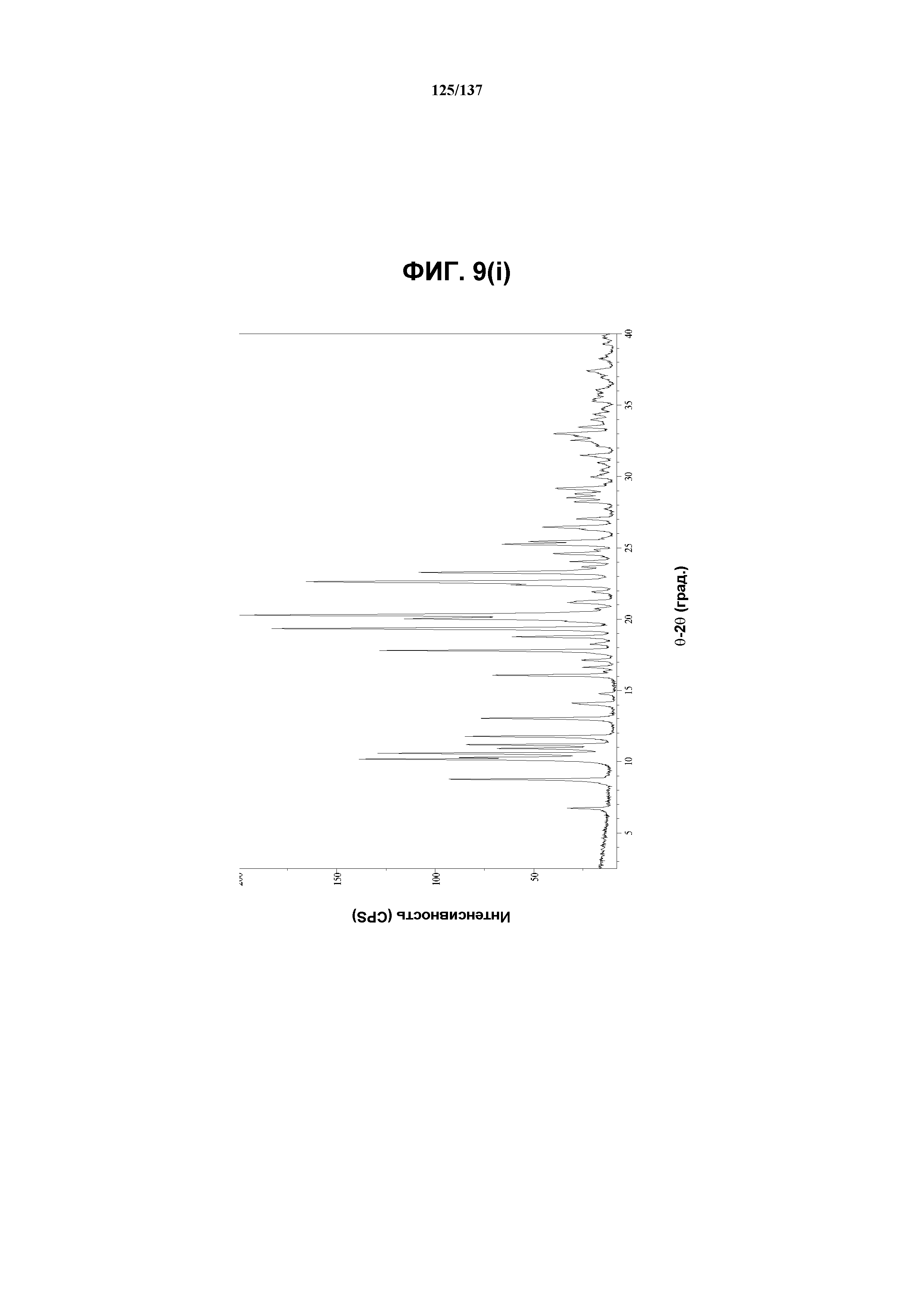
На фиг.9(i) представлены данные Panalytical X-Pert Pro MPD PW3040, полученные для соединения I формы F.
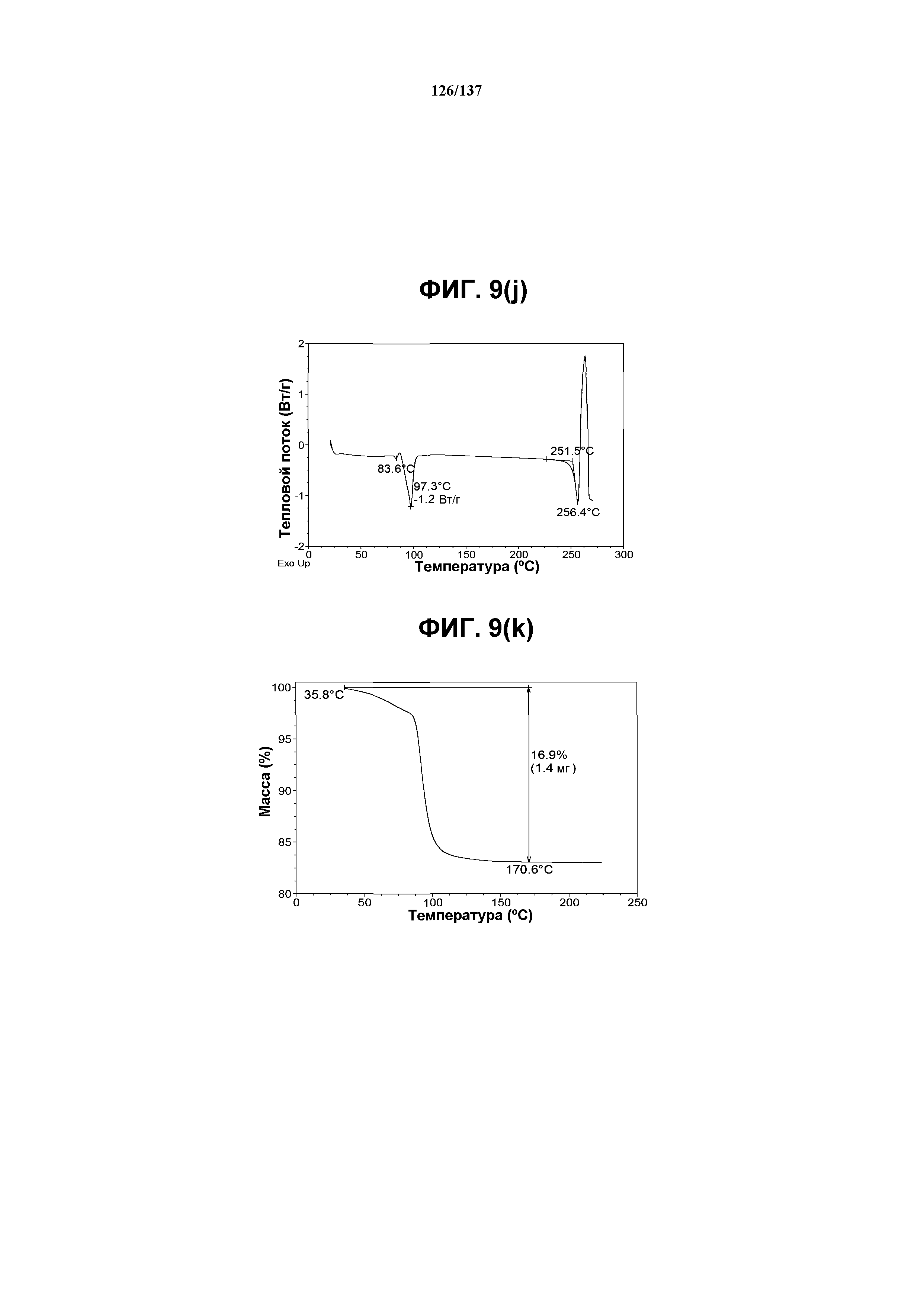
На фиг.9(j) изображена DSC-термограмма, полученная для соединения I формы F.
На фиг.9(k) изображена TGA-термограмма, полученная для соединения I формы F.
На фиг.9(l) изображен FT-IR-спектр для соединения I, формы F.
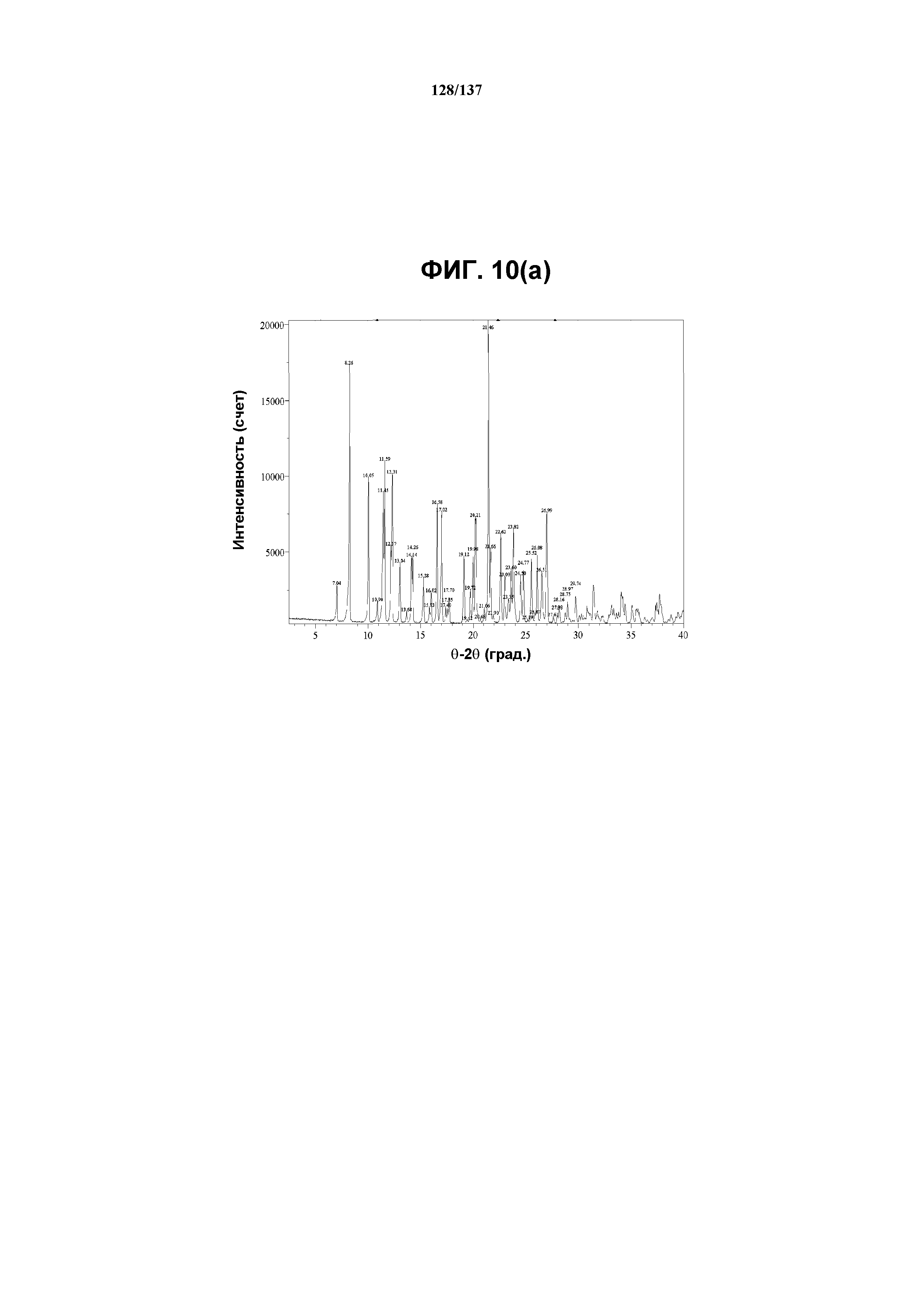
На фиг.10(a) изображена рентгенограмма XRPD, полученная для соединения I формы L.
На фиг.10(b) сведены в таблицу наблюдаемые пики, присутствующие в рентгенограмме XRPD на фиг.10(a).
На фиг.10(c) сведены в таблицу выраженные пики, присутствующие в рентгенограмме XRPD на фиг.10(a).
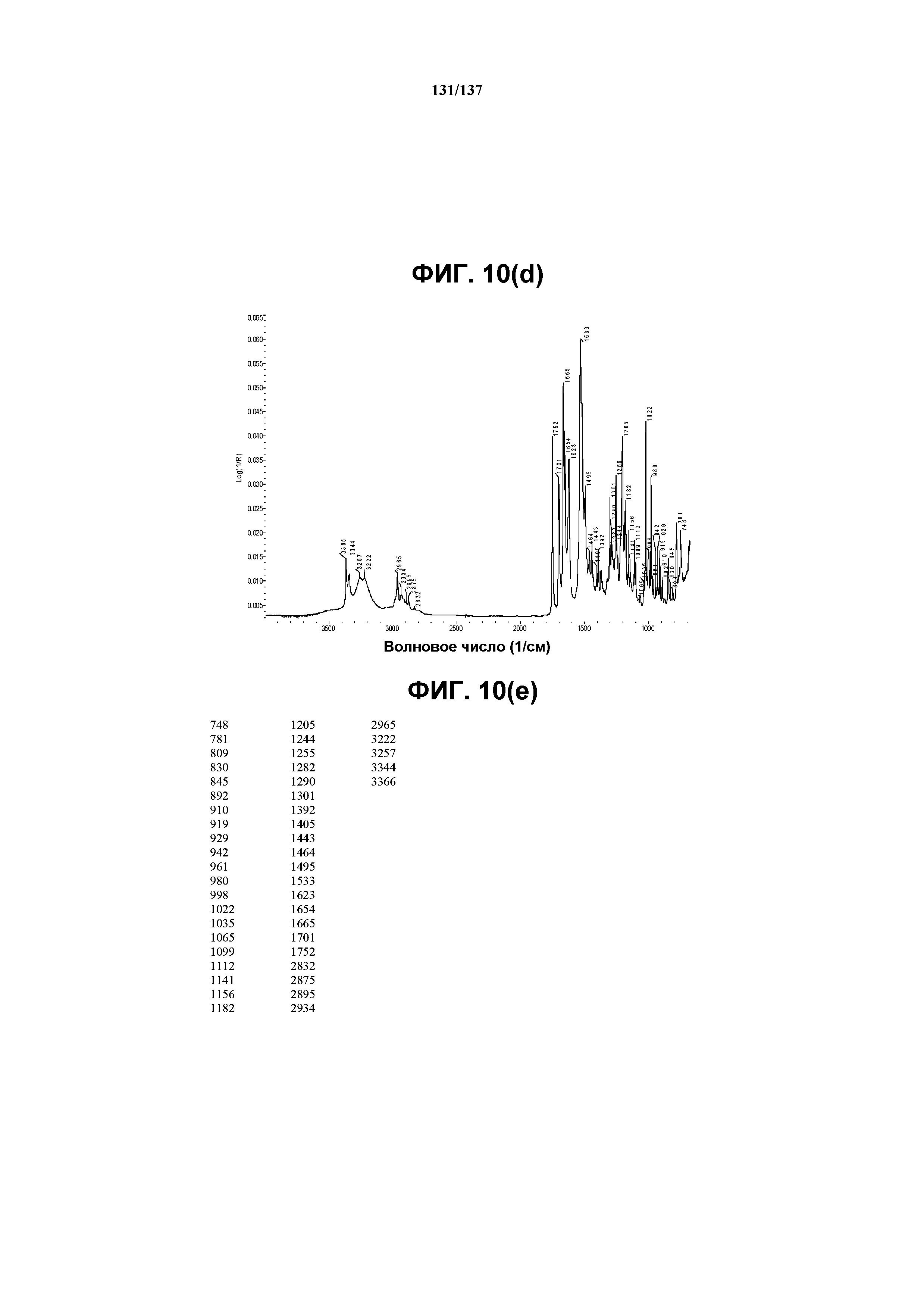
На фиг.10(d) изображен FT-IR-спектр, полученный для соединения I формы L.
На фиг.10(e) сведены в таблицу положения пиков полос, присутствующих в FT-IR-спектре на фиг.10(d).
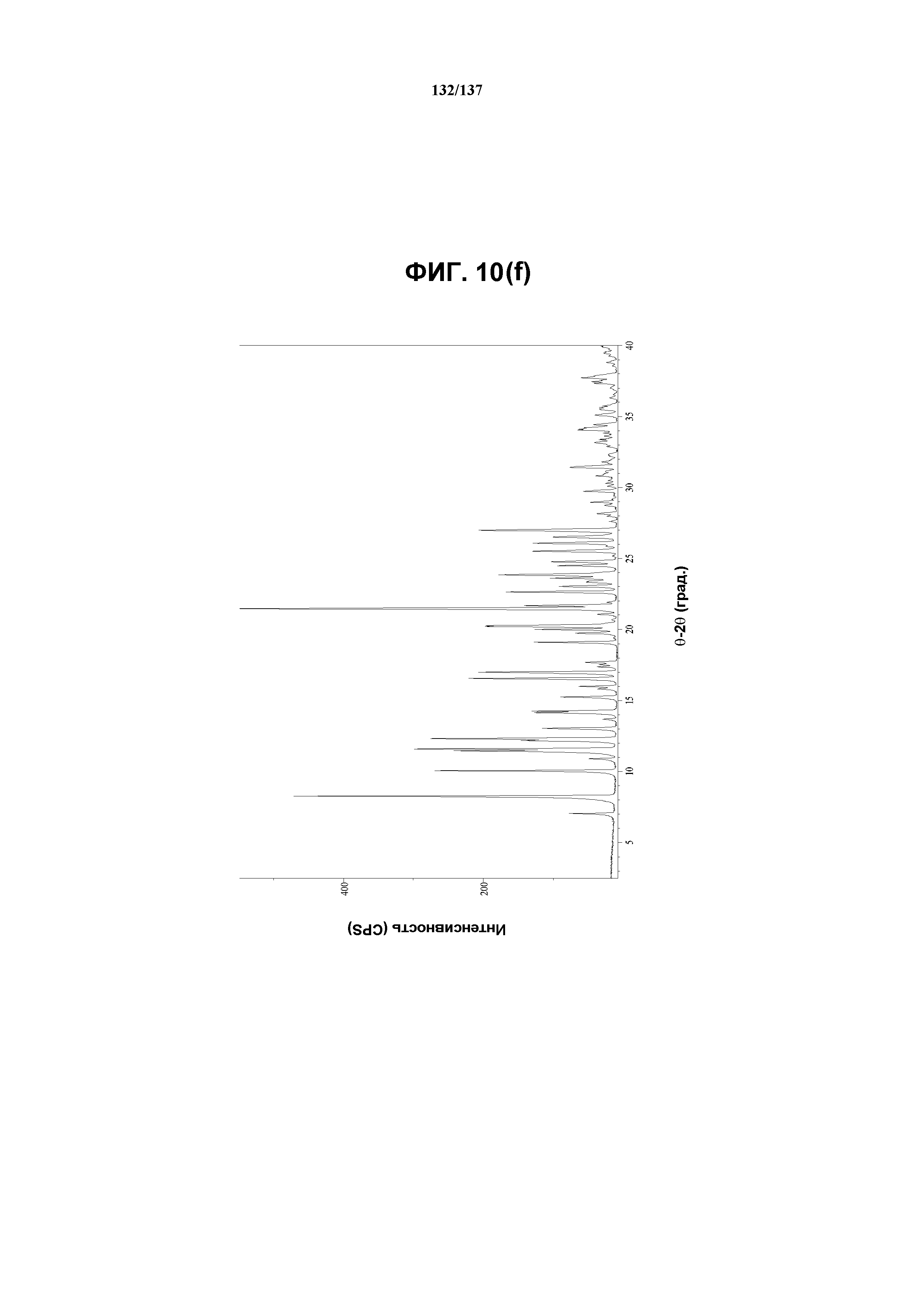
На фиг.10 (f) представлены данные Panalytical X-Pert Pro MPD PW3040, полученные для соединения I формы L.
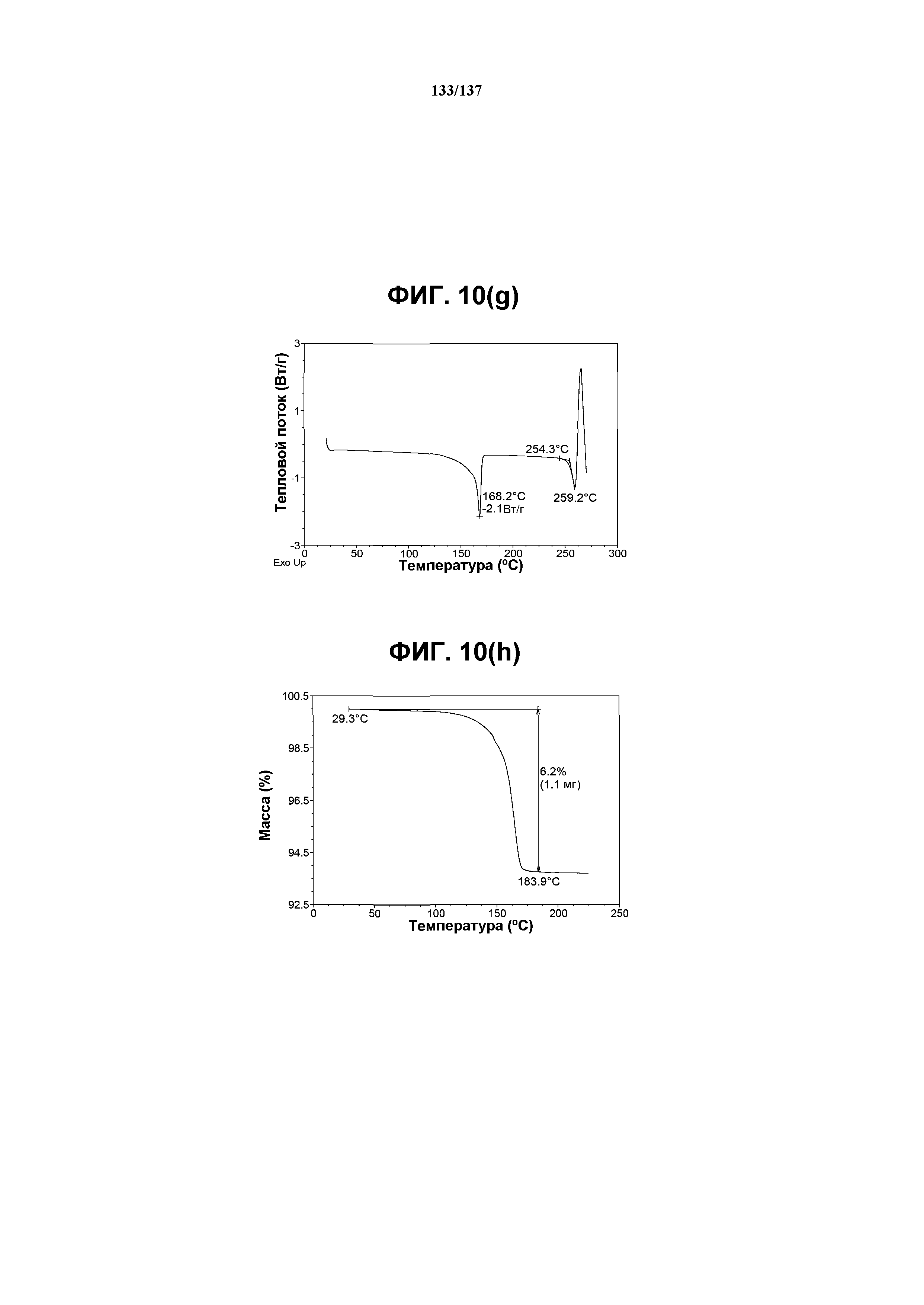
На фиг.10(g) изображена DSC-термограмма, полученная для соединения I формы L.
На фиг.10(h) изображена TGA-термограмма, полученная для соединения I формы L.
На фиг.10(i) представлены данные для соединения I формы L.
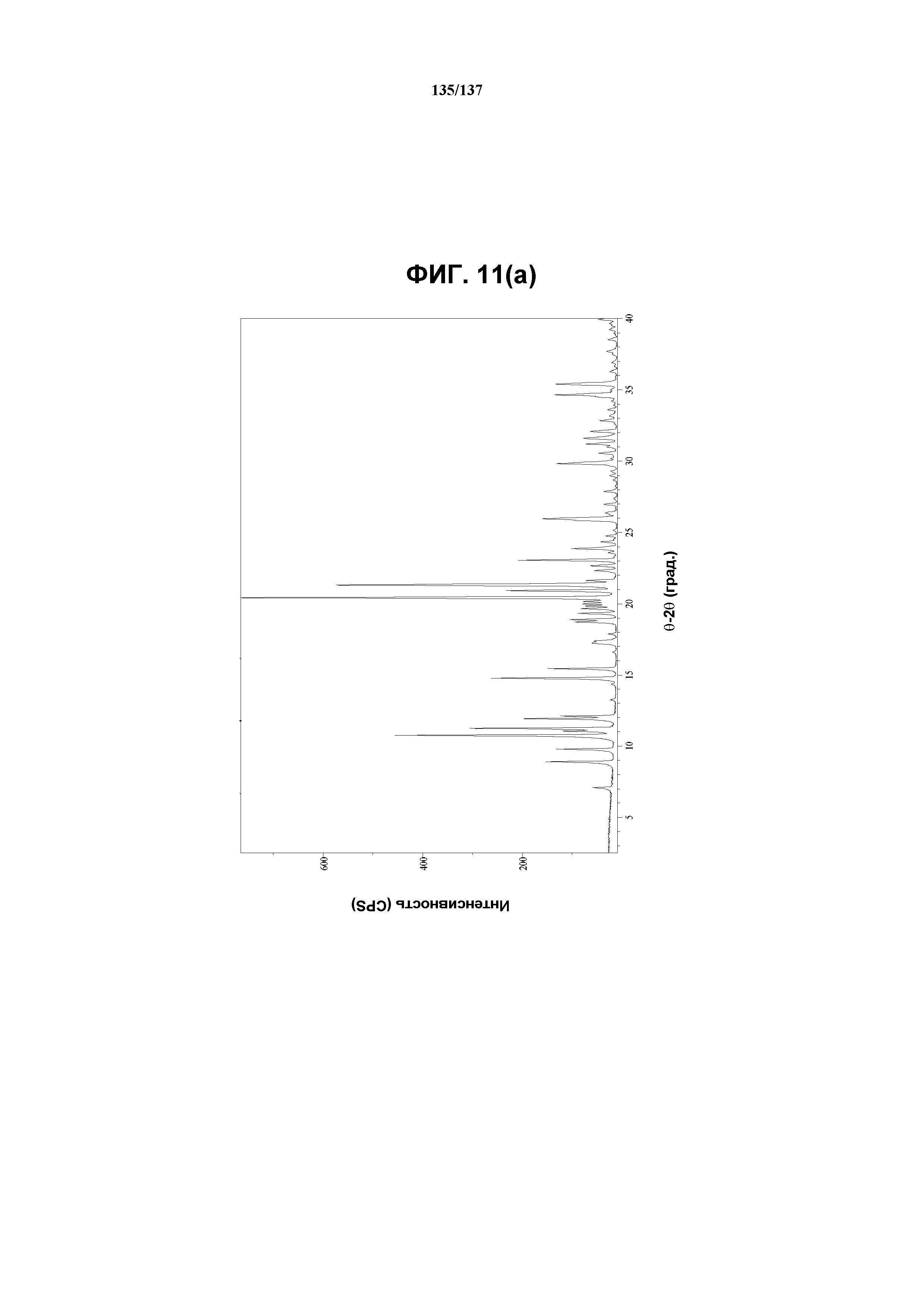
На фиг.11(a) изображена рентгенограмма XRPD, полученная для соединения I формы N.
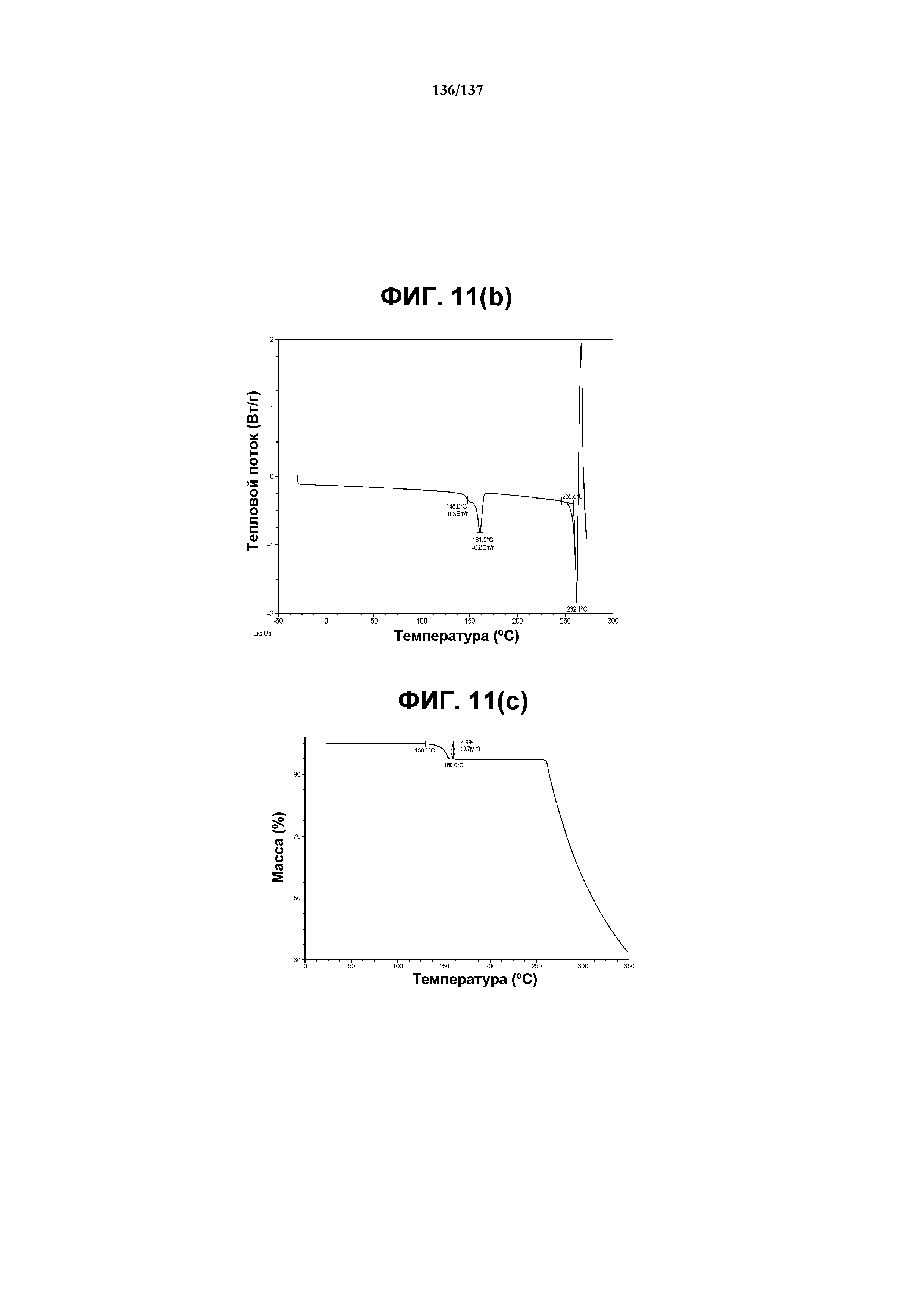
На фиг.11(b) изображена DSC-термограмма, полученная для соединения I формы N.
На фиг.11(c) изображена TGA-термограмма, полученная для соединения I формы N.
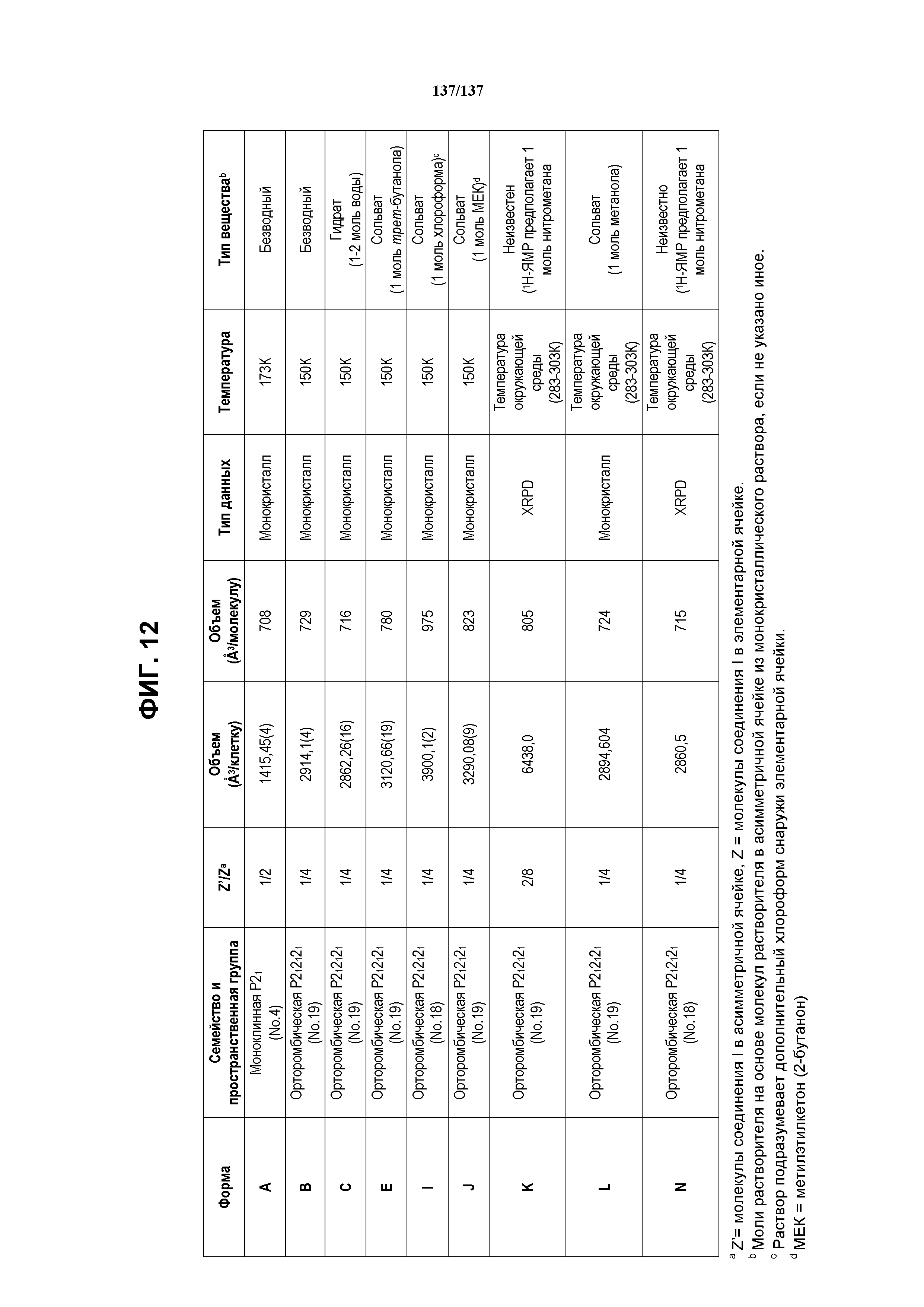
На фиг.12 сведена в таблицу суммарная монокристаллическая структура, полученная для твердых форм соединения I.
ОПРЕДЕЛЕНИЯ
Термины "лечить", "обработка" или "лечение" относятся к способу облегчения или излечения заболевания и/или сопутствующих ему симптомов. Термины "предупреждать", "предупреждение" или "профилактика" относятся к способу предупреждения субъекта от заболевания.
Термин "терапевтически эффективное количество" относится к такому количеству вводимого соединения, которого будет достаточно для предупреждения развития или же до определенной степени облегчения одного или более из симптомов состояния или расстройства, которое предполагается лечить.
Термин "субъект" определяется таким образом, что включает животных, таких как млекопитающие, включая, но не ограничиваясь ими, приматов (например, человека), коров, овец, коз, лошадей, собак, кошек, кроликов, крыс, мышей и т.п. В предпочтительных воплощениях указанным субъектом является человек.
Термин "фармацевтически приемлемые соли" включает соли активных соединений, которые получают с относительно нетоксичными кислотами. Соли присоединения кислот могут быть получены путем приведения нейтральной формы таких соединений в контакт с достаточным количеством соответствующей кислоты, либо неразбавленной, либо в составе с соответствующим инертным растворителем. Примеры фармацевтически приемлемых солей присоединения кислот включают соли, полученные из неорганических кислот наподобие соляной, бромистоводородной, азотной, карбоновой, моногидрокарбоновой, фосфорной, моногидрофосфорной, дигидрофосфорной, серной, моногидросерной, иодистоводородной или фосфористой кислот, и т.д., а также соли, полученные из относительно нетоксичных органических кислот, таких как относительно нетоксичные органические кислоты наподобие уксусной, пропионовой, изомасляной, малеиновой, малоновой, бензойной, янтарной, пробковой, фумаровой, миндальной, фталевой, бензолсульфоновой, пара-толилсульфоновой, лимонной, виннокаменной, метансульфоновой и пр. кислот. Включены также соли аминокислот, такие как аргинат и т.д., а также соли органических кислот, таких как глюкуроновая или галактуроновая кислоты, и т.д. (см., например, Berge, et al. (1977) J. Pharm. Sci. 66: 1-19).
Форма фармацевтически приемлемой соли соединения может быть получена in situ во время окончательного выделения и очистки соединения или, отдельно, в результате реагирования функциональной группы свободного основания с соответствующей органической или неорганической кислотой. Примерами типичных фармацевтически приемлемых, нетоксичных солей присоединения кислот являются соли аминогруппы, образуемые с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота и перхлорная кислота, или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или с применением других способов, используемых в данной области, таких как ионный обмен. Другие фармацевтически приемлемые соли могут включать адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гидроиодид, 2-гидрокси-этансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, пара-толуолсульфонат, ундеканоат, соли валериановой кислоты и т.д. Репрезентативные соли щелочных или щелочноземельных металлов включают соли натрия, лития, калия, кальция, магния и т.д. Дополнительные фармацевтически приемлемые соли могут включать, когда это целесообразно, нетоксичный аммоний, четвертичный аммоний и катионы амина, образованные с помощью противоионов, таких как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, низший алкилсульфонат а и арилсульфонат.
Можно вызвать регенерацию нейтральных форм соединений путем приведения соли в контакт с основанием или кислотой и выделения родительского соединения обычным способом. Родительская форма соединения отличается от различных форм солей определенными физическими свойствами, такими как растворимость в полярных растворителях, но в других отношениях указанные соли эквивалентны родительской форме соединения для целей настоящего изобретения.
Термины "полиморфы" и "полиморфные формы", а также родственные им термины относятся к одной из множества кристаллических структур, которые может принимать конкретное соединение. В некоторых воплощениях полиморфы образуются, когда конкретное химическое соединение может кристаллизоваться в более чем одну структурную конфигурацию. Различные полиморфы могут иметь разные физические свойства, такие, например, как температура плавления, удельная теплота плавления, растворимость, скорость растворения и/или колебательные спектры, как результат конфигурации или конформации молекул в кристаллической решетке. Различия в физических свойствах, проявляемых полиморфами, влияют на фармацевтические параметры, такие как стабильность при хранении, прессуемость и плотность (важно при составлении композиции и изготовлении продукта), а также скорости растворения (важный фактор при определении биодоступности). Различия в стабильности могут быть связаны с изменениями химической реактивности (например, с различной окисленностью, например, лекарственная форма обесцвечивается быстрее, когда содержит один полиморф, чем тогда, когда содержит другой полиморф) или с механическими изменениями (например, таблетки крошатся при хранении, поскольку кинетически предпочтительный полиморф превращается в термодинамически более стабильный полиморф) или же и то, и другое (например, таблетки одного полиморфа являются более подверженными разрушению при высокой влажности). В результате различий в растворимости/растворении, в экстремальном случае некоторые полиморфные переходы могут происходить в отсутствие действующих веществ или, как другая крайность, токсичности. Кроме того, физические свойства кристалла могут быть важны для производства, например, один полиморф может с большей вероятностью образовывать сольваты, или его может быть труднее фильтровать или отмывать от примесей (то есть между одним и другим полиморфами может быть разница в распределении формы и размера частиц).
Полиморфы молекулы могут быть получены путем целого ряда способов, как известно в данной области. Такие способы включают, но не ограничиваясь этим, перекристаллизацию из расплава, охлаждение из расплава, перекристаллизацию из растворителя, десольватацию, быстрое испарение, быстрое охлаждение, медленное охлаждение, диффузию из паровой фазы и сублимацию. Полиморфизм можно детектировать с помощью термического анализа, например, дифференциальной сканирующей калориметрии (DSC) и термогравиметрии (TGA).
Технологии для определения свойств полиморфов включают, но не ограничиваясь этим, дифференциальную сканирующую калориметрию (DSC), рентгеновскую порошковой дифрактометрию (XRPD), рентгеновскую дифрактометрию монокристалла, колебательную спектроскопию, например, IR- и рамановскую спектроскопию, калориметрию растворения, ЯМР в твердой фазе, высокотемпературную оптическую микроскопию, сканирующую электронную микроскопию (SEM), электронную кристаллографию и количественный анализ, анализ размера частиц (PSA), анализ участка поверхности, анализ растворимости и анализ растворения.
Термин "сольват" относится к кристаллической форме вещества, которая содержит растворитель. Термин "гидрат" относится к сольвату, в котором растворителем является вода.
Термин "десольватированный сольват" относится к кристаллической форме вещества, которая может быть получена только путем удаления растворителя из сольвата.
Термин "пролекарство" относится к структурно модифицированным формам соединения, которые с легкостью подвергаются химическим изменениям при физиологических условиях, с образованием указанного соединения. Кроме того, пролекарства могут быть превращены в соединения с помощью химических или биохимических методов в системе ex vivo. Пролекарства часто бывают полезны, поскольку в некоторых ситуациях их оказывается легче вводить, чем само соединение или родительское лекарственное средство. Они могут, например, быть биодоступны при оральном введении, тогда как родительское лекарственное средство может таковым не являться. Указанное пролекарство может иметь также улучшенную растворимость в фармацевтических композициях по сравнению с родительским лекарственным средством. В данной области известно большое разнообразие производных пролекарств, таких как лекарства, основанные на гидролитическом расщеплении или окислительной активации указанного пролекарства. Примером пролекарства могло бы, без ограничения, служить соединение, которое вводят в форме сложного эфира ("пролекарство"), но которое затем метаболически гидролизуется до карбоновой кислоты, активного начала.
Термин "приблизительно", когда его используют в связи с указанным значением углов 2-тета, относится к фактическому значению ±0,1 градуса 2-тета.
Термин "безводный" относится к форме соединения, которая по существу свободна от воды. Специалисту в данной области должно быть понятно, что безводное твердое вещество может содержать различные количества остаточной воды, при этом такая вода не встроена в кристаллическую решетку. Такое включение остаточной воды может зависеть от гигроскопичности и условий хранения соединения.
Термин "гидрат" относится к форме кристалла, принимаемой конкретным соединением, в которой в его кристаллическую решетку встроено либо стехиометрическое, либо нестехиометрическое количество воды.
Термин "носитель" относится к любому химическому продукту (например, растворителям, разбавителям или другим жидким наполнителям, диспергаторам или суспендирующим веществам, поверхностно-активным веществам, изотоническим средствам, загустителям или эмульгирующим средствам, консервантам, твердым связующим веществам, смазывающим веществам и т.п., в соответствии с конкретной требуемой лекарственной формой, Remington's Pharmaceutical Sciences, Fifteenth Edition, E.W. Martin (Mack Publishing Co., Easton, Pa., 1975)), сопоставимому со стабильностью соединения I. В некоторых воплощениях термин "носитель" относится к фармацевтически приемлемому носителю. В настоящем описании характерным носителем является вода.
Термин "характеризующийся [такими-либо свойствами]" означает "связан с конкретным набором данных" (например, с одним или несколькими пиками рентгенограммы XRPD, с точкой плавления, с DSC, TGA, DSC-TGA и/или с другими способами идентификации, известными специалистам в данной области, или с их сочетанием). В некоторых воплощениях твердая форма "характеризуется" набором данных, когда указанный набор данных позволяет отличить данную форму от других известных форм родственного соединения и/или детектировать наличие конкретной формы в композиции, содержащей другие объекты (например, другие формы данного соединения и/или компоненты, которые не являются данным соединением). Настоящее описание содержит репрезентативные данные, полученные в результате изучения множества разных твердых форм; сравнение приведенных данных позволяет специалисту в данной области определить наборы данных, которые "характеризуют" любую из описанных здесь твердых форм.
Термин "дополнение электролитами" относится к введению субъекту композиции, содержащей один или более электролитов, в порядке повышения уровней электролитов в сыворотке крови данного субъекта. В настоящем описании, когда указано, что дополнение электролитами вводят "до, в процессе или после" терапии, это означает, что его можно вводить перед началом комбинированной ингибиторной терапии (то есть до введения любой дозы) или перед введением какой-нибудь конкретной дозы или доз, одновременно или после их введения.
Термин "композиция" относится к композиции, которая включает по меньшей мере одно активное соединение (например, по меньшей мере предлагаемую форму соединения I) в сочетании с одним или более эксципиентами или другими фармацевтическими добавками для введения пациенту. Обычно конкретные эксципиенты и/или другие фармацевтические добавки выбирают, в соответствии с познаниями в данной области, для достижения требуемой стабильности, высвобождения, распределения и/или активности активного соединения(-ий).
Фраза "в сочетании" относится к введению субъекту двух или более средств. Следует отметить, что считается, что два или более средства вводятся "в сочетании" всегда, когда субъект одновременно подвергается действию обоих (или нескольких) средств. Каждое из двух или более средств может быть введено в соответствии с различными схемами; необязательно, чтобы индивидуальные дозы различных средств вводились в одно и то же время или в составе одной и той же композиции. Точнее, пока оба (или несколько) средства пребывают в организме субъекта, считается, что они введены "в сочетании".
Термин "изоструктурный" или "изоструктура" относится к двум или нескольким твердым формам соединения, имеющим по существу одинаковую трехмерную пространственную конфигурацию геометрически сходных структурных элементов. В некоторых воплощениях у "изоструктурных" форм выявляются сходные или идентичные размеры элементарных ячеек, одинаковая пространственная группа и сходные или идентичные координаты одинаковых атомов. В некоторых воплощениях "изоструктурные" формы имеют одинаковую структуру, но неодинаковые размеры элементарных ячеек и неодинаковый химический состав, и имеют сравнимую вариабельность координат их атомов по отношению к размерам элементарных ячеек и химическому составу. В некоторых воплощениях в настоящем описании представлен набор изоструктурных форм соединения I, включая, например, описанные выше формы соединения I. В некоторых воплощениях в настоящем описании представлен набор изоструктурных форм, включая, например, форму J и/или форму D. В некоторых воплощениях в настоящем описании представлен набор изоструктурных форм, включая, например, форму E и/или форму H. В некоторых воплощениях в настоящем описании представлен набор изоструктурных форм, включая, например, форму C и/или сольват метанола, о котором сообщалось в публикации Shigematsu с соавт., The Journal of Antibiotics, Vol. 47, No. 3, "FR901228, A Novel Antitumor Bicyclic Depsipeptide Produced by Chromobacterium violaceum No. 968, pp. 311-314 (March 1994).
Термин "лиофилизировать" относится к способу отделения твердого вещества от раствора и/или удаления растворителя. В некоторых воплощениях это может быть достигнуто с помощью различных технологий, известных специалистам в данной области, включая, например, выпаривание (например, под вакуумом, например, с помощью роторного испарителя), лиофилизацию и/или замораживание раствора и выпаривание замороженного растворителя в условиях вакуума, и т.д.
Термин "парентеральное" включает технологии подкожного, внутривенного, внутримышечного, внутрисуставного, внутрисиновиального, интрастернального, интратекального, внутрипеченочного, внутриочагового и внутричерепного введения путем инъекции или инфузии.
Термин "по существу все", когда относится к описанию пиков дифракции рентгеновских лучей ("XRPD") того или иного соединения, обычно означает, что рентгенограмма XRPD такого соединения включает по меньшей мере приблизительно 80% пиков по сравнению со ссылочными. Например, когда говорят, что рентгенограмма XRPD включает "по существу все" пики из ссылочного списка, или все пики из ссылочной рентгенограммы XRPD, это означает, что рентгенограмма XRPD включает по меньшей мере 80% пиков из конкретно установленной ссылки. В других воплощениях фраза "по существу все" означает, что рентгенограмма XRPD такого соединения включает по меньшей мере приблизительно 85, 90, 95, 97, 98 или 99% пиков по сравнению со ссылочными.
Термин "по существу свободен от" означает содержащий не более чем незначимое количество. В некоторых воплощениях композиция или препарат "по существу свободен от" указанного элемента, если он содержит менее чем 5%, 4%, 3%, 2% или 1% по массе данного элемента. В некоторых воплощениях композиция или препарат содержит менее чем 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или менее указанного элемента. В некоторых воплощениях композиция или препарат содержит неопределяемое количество указанного элемента.
Термин "по существу сходный" относится к наборам данных (например, спектров/термограмм), которые имеют сходство друг с другом и/или которые отличают их от одного или нескольких ссылочных наборов данных. В некоторых воплощениях наборы данных считаются "по существу сходными" друг с другом, если их сходство друг с другом и отличия от одного или нескольких ссылочных наборов данных являются достаточными для того, чтобы сделать заключение, что два сравниваемых набора данных получены для одной и той же формы соединения, тогда как ссылочный набор данных получен для другой формы указанного соединения. В некоторых воплощениях два "по существу сходных" набора данных являются одинаковыми (то есть являются идентичными в пределах ошибки эксперимента). В некоторых воплощениях наличие в наборе данных одной или нескольких экспериментальных точек, характерных для конкретной формы соединения, но отсутствие некоторых или всех экспериментальных точек, которые являются характерными для другой формы (например, экспериментальных точек, которые обычно присутствуют в ссылочном наборе данных), определяет наборы данных как по существу сходные друг с другом.
Выражение "унифицированная доза" относится к физически дискретной порции композиции, предназначенной для субъекта, которого намереваются лечить (например, в качестве однократной дозы); каждая порция, содержащая предопределенное количество активного средства, выбранного для получения требуемого терапевтического эффекта (следует понимать, что для достижения требуемого или оптимального эффекта могут потребоваться множественные дозы), необязательно вместе с фармацевтически приемлемым носителем, который может быть представлен в предопределенном количестве. Унифицированной дозой может быть, например, объем жидкости (например, приемлемого носителя), содержащий предопределенное количество одного или нескольких терапевтических средств, предопределенное количество одного или нескольких терапевтических средств в твердой форме, композиция с непрерывным высвобождением или устройство для доставки лекарственного средства, содержащее предопределенное количество одного или нескольких терапевтических средств, и т.д. Следует иметь в виду, что единичная доза, помимо указанного терапевтического средства(средств), может содержать различные компоненты. Например, могут быть включены приемлемые носители (например, фармацевтически приемлемые носители), разбавители, стабилизаторы, буферы, консерванты и т.п., как описано ниже. Следует, однако, иметь в виду, что полное суточное потребление композиции согласно настоящему изобретению будет определяться лечащим врачом в рамках обоснованного медицинского заключения. Уровень специфической эффективной дозы для любого конкретного субъекта или организма может зависеть от множества факторов, включая расстройство, которое предполагается лечить, и степень тяжести указанного расстройства; активность используемого специфического активного соединения; используемую специфическую композицию; возраст, массу тела, общее состояние здоровья, пол и диету данного субъекта; время введения и скорость выведения используемого специфического активного соединения; длительность лечения; лекарственные средства и/или дополнительные терапевтические воздействия, используемые в сочетании или совместно с используемым специфическим соединением(-ями), и подобные факторы, хорошо известные специалистам в данной области медицины.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Было установлено, что соединение I может существовать в различных твердых формах. Такие твердые формы включают чистые кристаллические формы. Такие твердые формы включают также сольватированные формы и аморфные формы. В настоящем описании предложены такие конкретные твердые формы соединения I. В некоторых воплощениях в настоящем описании предложены композиции, содержащие соединение I в описанной здесь форме. В некоторых воплощениях предлагаемых композиций соединение I присутствует в виде смеси одной или нескольких твердых форм; в некоторых воплощениях предлагаемых композиций соединение I присутствует только в единственной форме.
В некоторых воплощениях приведенного здесь описания, соединение I представлено в виде кристаллического твердого вещества. В некоторых воплощениях соединение I представлено в виде кристаллического твердого вещества, по существу свободного от аморфного соединения I. В некоторых воплощениях соединение I представлено в виде аморфной формы. В некоторых воплощениях соединение I представлено в виде сольватированной формы.
В некоторых воплощениях все соединения I, которые присутствуют в конкретной композиции, представлены в конкретной форме; в некоторых такого рода воплощениях такая композиция по существу свободна от любой другой формы соединения I. В некоторых воплощениях композиция содержит соединение I, представленное в сочетании различных форм.
В некоторых воплощениях в настоящем описании предложен лиофилизат соединения I, содержащий одну или несколько описанных здесь твердых форм. В некоторых воплощениях лиофилизат содержит аморфное соединение I. В некоторых воплощениях лиофилизат содержит одну или несколько кристаллических форм. В некоторых воплощениях лиофилизат по существу свободен от одной или нескольких кристаллических форм. В некоторых воплощениях лиофилизат по существу свободен от любой кристаллической формы.
В некоторых воплощениях в настоящем описании предложена одна или несколько твердых форм, как описано в настоящей заявке, в сочетании с одним или несколькими другими компонентами. В некоторых таких воплощениях другие компоненты выбраны из группы, состоящей, например, из буферов, носителей, ингибиторов кристаллизации, разбавителей, эксципиентов, средств для доведения pH, растворителей или других фармацевтически приемлемых добавок для введения пациенту.
В некоторых воплощениях, когда соединение I представлено в аморфной форме (например, в некоторых лиофилизатах), такие композиции содержат один или несколько ингибиторов кристаллизации.
Для того чтобы охарактеризовать индивидуальные кристаллические формы конкретного соединения и/или для того чтобы детектировать присутствие конкретной формы в комплексной композиции, используются технологии, известные специалистам в данной области, такие, например, как образцы рентгеновской дифракционной картины, термограммы дифференциальной сканирующей калориметрии, термограммы тепловых гравиметрических анализаторов, информацию о точках плавления, микроскопию в поляризованном свете, микрофотографии высокотемпературной микроскопии, информацию о динамической сорбции/десорбции пара, содержание воды, IR-спектры [ИК-спектры], ЯМР-спектры и профили гигроскопичности. Специалистам в данной области будет понятно, что для выявления совпадения кристаллической формы не требуется точной идентичности всех пиков, например, на картине рентгеновской дифракции. Обычно, для того чтобы охарактеризовать и/или идентифицировать конкретную форму, скорее необходимо и достаточно установление присутствия или отсутствия конкретных характерных пиков и/или форм и интенсивностей пиков.
Твердые формы
В настоящем описании предложены твердые формы соединения I. В некоторых воплощениях в настоящем описании предложено соединение I в кристаллической форме. В некоторых воплощениях кристаллические формы по существу свободны от растворителя. В некоторых воплощениях кристаллические формы являются сольватами. В некоторых воплощениях в настоящем описании предложено соединение I в аморфной форме. Суммарная таблица твердых форм ромидепсина (таблица 1) представлена ниже.
В одном из воплощений предложенные в настоящем описании твердые формы соединения I обладают улучшенными свойствами. Указанные свойства включают, но не ограничиваясь этим, биодоступность, гигроскопичность, стабильность (включая, без ограничения, свето- и термостабильность), растворимость, сжимаемость, текучесть, электростатические свойства, объемную плотность и скорость растворения.
|
|
Кристаллическая форма А и кристаллическая форма В
Известно, что соединение I существует в различных кристаллических формах, известных как форма A и форма B. Указанные формы описаны в публикации PCT № WO02/020817, поданной 22 августа 2001, которая включена в настоящее описание в виде ссылки.
Кристаллическая форма C
В некоторых воплощениях в настоящем описании предложена форма C соединения I, а также композиции, содержащие форму C. В некоторых воплощениях композиция, включающая соединение I, содержит по меньшей мере некоторое количество соединения I в кристаллической форме, где указанная кристаллическая форма содержит форму C.
В одном из воплощений соединение I формы C получено из смеси ацетон/вода.
В одном из воплощений соединение I формы C изучали одним или несколькими способами, включая оптическую микроскопию, порошковую дифракцию рентгеновских лучей, дифференциальную сканирующую калориметрию, модулированную дифференциальную сканирующую калориметрию, термогравиметрический анализ, инфракрасную спектроскопию, спектроскопию методом ядерного магнитного резонанса и рамановскую спектроскопию.
В некоторых воплощениях кристаллическая форма C соединения I характеризуется наличием одного или более, двух или более, трех или более, четырех или более, пяти или более или шести или более пиков из ее рентгенограммы XRPD, при этом указанные пики, взятые отдельно или вместе с другими характеристическими данными, дают возможность, как описано ниже, отличить форму C от других форм. В одном из воплощений соединение I формы C обнаруживает картину рентгеновской дифракции, в которой имеются пики, по существу сходные с таковыми на фиг.1(c). Например, форма C характеризуется пиком в XRPD при приблизительно 11,45 2θ. Другие характерные пики включают 8,28, 12,19 и 21,13 2θ.
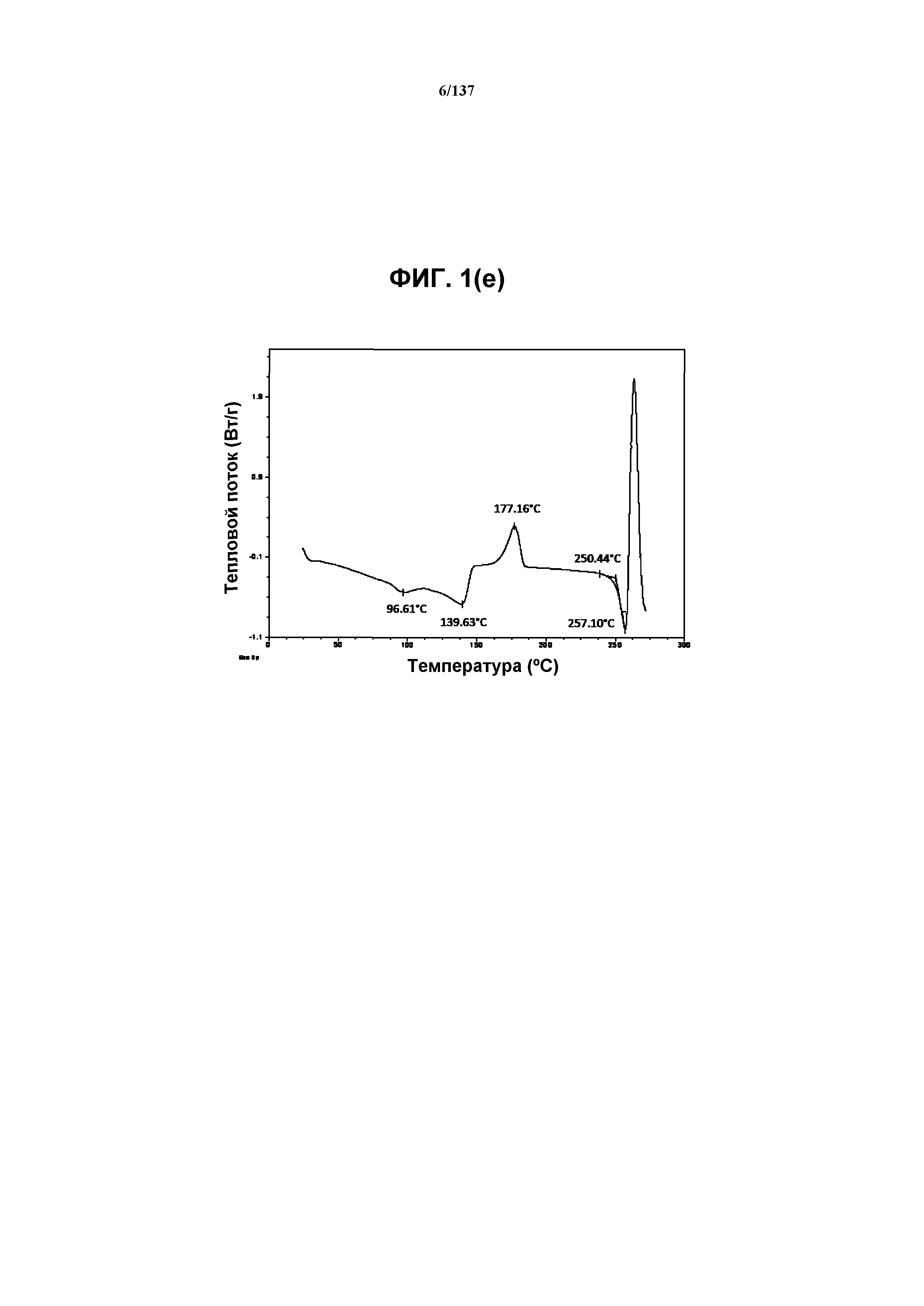
Как описано в настоящей заявке, кристаллическая форма C соединения I характеризуется, например, некоторыми или всеми характерными данными, приведенными ниже на фиг.1(c)-1(q) (и обсуждаемыми в примере 2). В одном из воплощений, в DSC-термограмме, полученной для соединения I формы C, проявляются обширные эндотермические эффекты при ~97ºC и ~140ºC (миним.); эндотерма при ~257ºC (миним.); а также минорный экзотермический эффект при приблизительно 177ºC (макс). В одном из воплощений, в TGA-термограмме, полученной для соединения I формы C, проявляется потеря массы на ~5,3%.
В некоторых воплощениях форма C является изоструктурной метанольной сольватной формой, о которой сообщалось Shigematsu с соавт., The Journal of Antibiotics, Vol. 47(3) "FR901228, A Novel Antitumor Bicyclic Depsipeptide Produced by Chromobacterium violaceum, No. 968, pp. 311-314 (March 1994).
Кристаллическая форма D
В некоторых воплощениях в настоящем описании предложена кристаллическая форма, полученная из ацетона. В некоторых воплощениях ацетон является охлажденным. В некоторых воплощениях ацетон имеет температуру -15ºC или ниже (например, -25ºC, -35ºC, -50ºC, -70ºC или ниже). В некоторых воплощениях такая кристаллическая форма является сольватом. В некоторых воплощениях сольват ацетона называется формой D соединения I. В некоторых воплощениях форма D может быть изоструктурна форме J, описанной выше.
В одном из воплощений соединение I формы D изучали одним или несколькими способами, включая оптическую микроскопию, порошковую дифракцию рентгеновских лучей, дифференциальную сканирующую калориметрию, модулированную дифференциальную сканирующую калориметрию, термогравиметрический анализ, инфракрасную спектроскопию, спектроскопию методом ядерного магнитного резонанса и рамановскую спектроскопию.
В некоторых воплощениях в настоящем описании предложена форма D соединения I, а также композиции, содержащие форму D. В некоторых воплощениях композиция, включающая соединение I, содержит по меньшей мере некоторое количество соединения I в кристаллической форме, при этом указанная кристаллическая форма содержит форму D. В некоторых воплощениях композиция, включающая соединение I, содержит по меньшей мере некоторое количество соединения I в сольватированной кристаллической форме, при этом указанная кристаллическая форма содержит форму D. В некоторых воплощениях указанной сольватированной формой является сольват ацетона.
В некоторых воплощениях кристаллическая форма D соединения I характеризуется наличием одного или более, двух или более, трех или более, четырех или более, пяти или более или шести или более пиков из ее рентгенограммы XRPD, при этом указанные пики, взятые отдельно или вместе с другими характеристическими данными, отличают форму D от других форм, как описано ниже. В одном из воплощений соединение I формы D обнаруживает картину рентгеновской дифракции, в которой имеются пики, по существу сходные с таковыми на фиг.2(a). Например, форма D характеризуется пиком в рентгенограмме XRPD при приблизительно 7,54 2θ. Другие характерные пики включают 11,86 и 16,66 2θ.
Как описано в настоящей заявке, кристаллическая форма D соединения I характеризуется некоторыми или всеми характерными данными, приведенными ниже на фиг.2(a)-2(f) (и обсуждаемыми в примере 3). В одном из воплощений, в DSC-термограмме, полученной для соединения I формы D, проявляется малый эндотермический эффект при ~91ºC (миним.); и эндотерма при ~261ºC (миним.); с наблюдаемой последующей деструкцией. В одном из воплощений, в TGA-термограмме, полученной для соединения I формы D, проявляется потеря массы на ~10,9%.
Кристаллическая форма E
В некоторых воплощениях в настоящем описании предложена кристаллическая форма, полученная из трет-бутанола. В некоторых воплощениях в настоящем описании предложена кристаллическая форма, полученная из смеси трет-бутанола и воды. В некоторых воплощениях такая кристаллическая форма является сольватом. В некоторых воплощениях сольват трет-бутанола называется формой E соединения I. В некоторых воплощениях форма E может быть изоструктурна форме H, описанной выше.
В некоторых воплощениях в настоящем описании предложена форма E соединения I, а также композиции, содержащие форму E. В некоторых воплощениях композиция, включающая соединение I, содержит по меньшей мере некоторое количество соединения I в кристаллической форме, при этом указанная кристаллическая форма содержит форму Е. В некоторых воплощениях композиция, включающая соединение I, содержит по меньшей мере некоторое количество соединения I в сольватированной кристаллической форме, при этом указанная кристаллическая форма содержит форму Е. В некоторых воплощениях указанной сольватированной формой является сольват трет-бутанола.
В одном из воплощений соединение I формы E изучали одним или несколькими способами, включая оптическую микроскопию, порошковую дифракцию рентгеновских лучей, дифференциальную сканирующую калориметрию, модулированную дифференциальную сканирующую калориметрию, термогравиметрический анализ, инфракрасную спектроскопию, спектроскопию методом ядерного магнитного резонанса и рамановскую спектроскопию.
В некоторых воплощениях кристаллическая форма E соединения I характеризуется наличием одного или более, двух или более, трех или более, четырех или более, пяти или более или шести или более пиков из ее рентгенограммы XRPD, при этом указанные пики, взятые отдельно или вместе с другими характеристическими данными, отличают форму Е от других форм, как описано ниже. В одном из воплощений соединение I формы Е обнаруживает картину рентгеновской дифракции, в которой имеются пики, по существу сходные с таковыми на фиг.3(a). Например, форма Е характеризуется пиком в рентгенограмме XRPD при приблизительно 10,3 2θ. Другие характерные пики включают 9,0, 11,7 и 20,04 2θ.
Как описано в настоящей заявке, соединение I формы E характеризуется некоторыми или всеми характерными данными, приведенными ниже на фиг.3(a)-3(p) (и обсуждаемыми в примере 4). В одном из воплощений, в DSC-термограмме, полученной для соединения I формы E, проявляется эндотермический эффект при ~158ºC (миним.); эндотерма при ~255ºC (миним.); с наблюдаемой последующей деструкцией. В одном из воплощений, в TGA-термограмме, полученной для соединения I формы E, проявляется потеря массы на ~10,9%.
Кристаллическая форма F
В некоторых воплощениях в настоящем описании предложена кристаллическая форма, полученная из хлороформа.
В некоторых воплощениях в настоящем описании предложена форма F соединения I, а также композиции, содержащие форму F. В некоторых воплощениях композиция, включающая соединение I, содержит по меньшей мере некоторое количество соединения I в кристаллической форме, при этом указанная кристаллическая форма содержит форму F. В некоторых воплощениях такая кристаллическая форма является сольватом.
В некоторых воплощениях соединение I формы F изучали одним или несколькими способами, включая оптическую микроскопию, порошковую дифракцию рентгеновских лучей, дифференциальную сканирующую калориметрию, модулированную дифференциальную сканирующую калориметрию, термогравиметрический анализ, инфракрасную спектроскопию, спектроскопию методом ядерного магнитного резонанса и рамановскую спектроскопию.
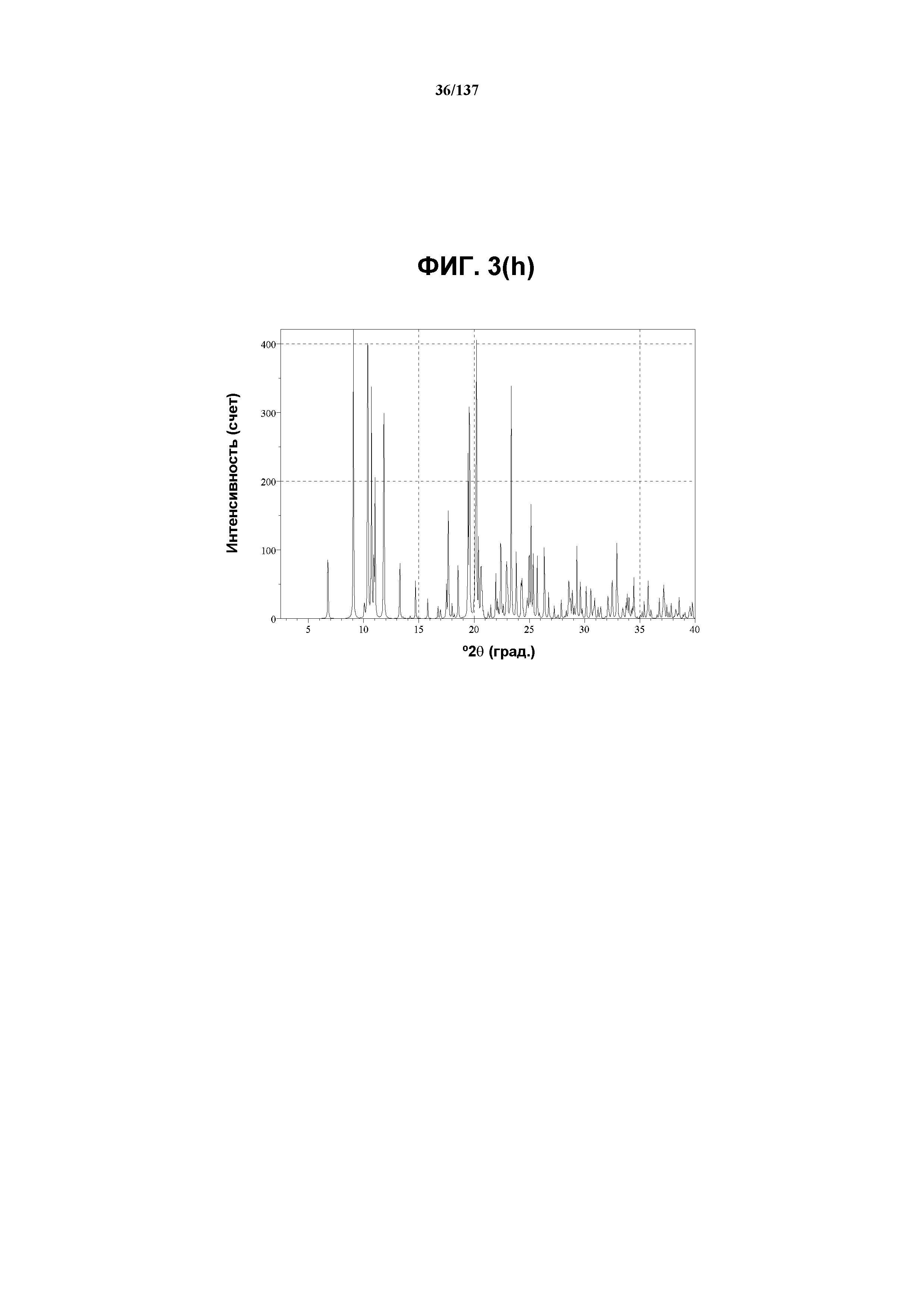
В некоторых воплощениях кристаллическая форма F соединения I характеризуется наличием одного или более, двух или более, трех или более, четырех или более, пяти или более или шести или более пиков из ее рентгенограммы XRPD, при этом указанные пики, взятые отдельно или вместе с другими характеристическими данными, отличают форму F от других форм, как описано ниже. В одном из воплощений соединение I формы F обнаруживает картину рентгеновской дифракции, в которой имеются пики, по существу сходные с таковыми на фиг.9(a) или 9(d). Например, форма F характеризуется пиком в рентгенограмме XRPD при приблизительно 20,28 2θ. Другие характерные пики включают 10,17, 17,8, 19,34, 20,04 и 22,63 2θ.
Как описано в настоящей заявке, соединение I формы F характеризуется некоторыми или всеми характерными данными, приведенными ниже на фиг.9(a)-9(l). В одном из воплощений, в DSC-термограмме, полученной для соединения I формы F, проявляется широкий эндотермический эффект при ~97ºC (миним.); и эндотерма при ~256ºC (миним.). В одном из воплощений в TGA-термограмме, полученной для соединения I формы F, проявляется потеря массы на ~17%. В одном из воплощений представлены данные Panalytical X-Pert Pro MPD PW3040 для соединения I формы F, полученные при следующих условиях: рентгеновская трубка: Cu(1,54059 Å), напряжение: 45 кВ; сила тока: 40 мА; область сканирования: 1,00-39,98º 2θ; размер шага: 0,017º 2θ; время собирания: 721 сек; скорость сканирования: 3,2º/мин; щель: DS: 1/2º; SS: нуль; время одного оборота: 1,0 сек, метод: трансмиссия. В одном из воплощений предложены данные для формы F соединения I, полученной при следующих условиях: детектор: DTGS KBr; число сканов: 512; разрешение: 2 см-1.
Кристаллическая форма H
В некоторых воплощениях в настоящем описании предложена кристаллическая форма, полученная из хлороформа. В некоторых воплощениях такая кристаллическая форма является сольватом. В некоторых воплощениях сольват хлороформа называется формой H соединения I. В некоторых воплощениях форма H может быть изоструктурна форме E, описанной выше.
В некоторых воплощениях в настоящем описании предложена форма H соединения I, а также композиции, содержащие форму H. В некоторых воплощениях композиция, включающая соединение I, содержит по меньшей мере некоторое количество соединения I в кристаллической форме, при этом указанная кристаллическая форма содержит форму H. В некоторых воплощениях композиция, включающая соединение I, содержит по меньшей мере некоторое количество соединения I в сольватированной кристаллической форме, где указанная кристаллическая форма содержит форму H. В некоторых воплощениях указанной сольватированной формой является сольват хлороформа.
В некоторых воплощениях соединение I формы H изучали одним или несколькими способами, включая оптическую микроскопию, порошковую дифракцию рентгеновских лучей, дифференциальную сканирующую калориметрию, модулированную дифференциальную сканирующую калориметрию, термогравиметрический анализ, инфракрасную спектроскопию, спектроскопию методом ядерного магнитного резонанса и рамановскую спектроскопию.
В некоторых воплощениях кристаллическая форма H соединения I характеризуется наличием одного или более, двух или более, трех или более, четырех или более, пяти или более или шести или более пиков из ее рентгенограммы XRPD, при этом указанные пики, взятые отдельно или вместе с другими характеристическими данными, отличают форму Н от других форм, как описано ниже. В одном из воплощений соединение I формы Н обнаруживает картину рентгеновской дифракции, в которой имеются пики, по существу сходные с таковыми на фиг.4(a). Например, форма Н характеризуется пиком в рентгенограмме XRPD при приблизительно 10,67 2θ. Другие характерные пики включают 8,94, 9,69, 10,51, 13,13 и 19,43 2θ.
Как описано в настоящей заявке, соединение I формы H характеризуется некоторыми или всеми характерными данными, приведенными ниже на фиг.4(a)-4(f) (и обсуждаемыми в примере 6). В одном из воплощений, на DSC-термограмме, полученной для соединения I формы H, проявляется эндотермический эффект при ~96ºC (миним.); и эндотерма при ~257ºC (миним.). В одном из воплощений, на TGA-термограмме, полученной для соединения I формы H, проявляется потеря массы на ~10,1%.
Кристаллическая форма I
В некоторых воплощениях в настоящем описании предложена кристаллическая форма, полученная из хлороформа. В некоторых воплощениях такая кристаллическая форма является сольватом. В некоторых воплощениях сольват хлороформа называется формой I соединения I.
В некоторых воплощениях в настоящем описании предложена форма I соединения I, а также композиции, содержащие форму I. В некоторых воплощениях композиция, включающая соединение I, содержит по меньшей мере некоторое количество соединения I в кристаллической форме, при этом указанная кристаллическая форма содержит форму I. В некоторых воплощениях композиция, включающая соединение I, содержит по меньшей мере некоторое количество соединения I в сольватированной кристаллической форме, где указанная кристаллическая форма содержит форму I. В некоторых воплощениях указанной сольватированной формой является сольват хлороформа.
В некоторых воплощениях соединение I формы I изучали одним или несколькими способами, включая оптическую микроскопию, порошковую дифракцию рентгеновских лучей, дифференциальную сканирующую калориметрию, модулированную дифференциальную сканирующую калориметрию, термогравиметрический анализ, инфракрасную спектроскопию, спектроскопию методом ядерного магнитного резонанса и рамановскую спектроскопию.
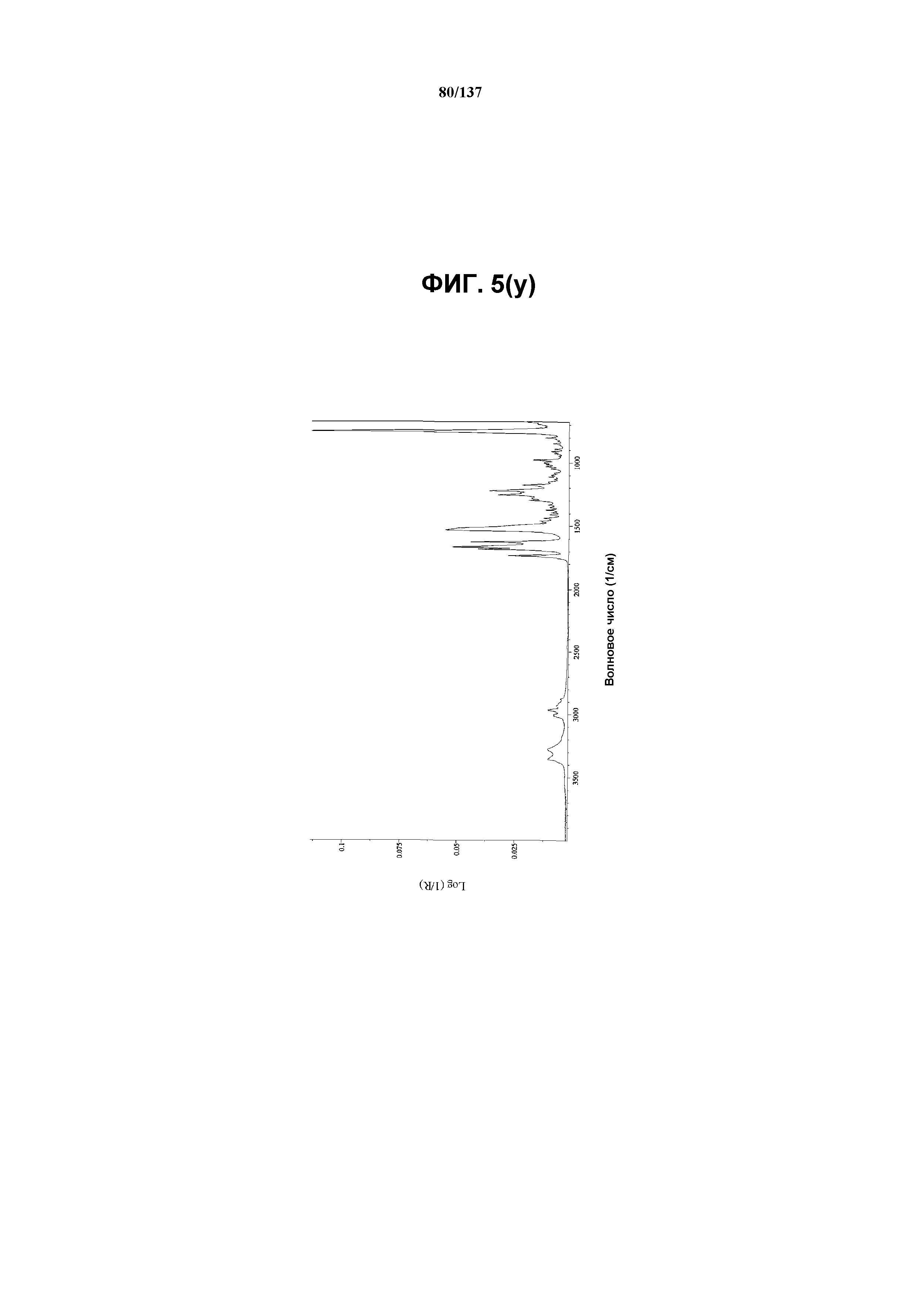
В некоторых воплощениях кристаллическая форма I соединения I характеризуется наличием одного или более, двух или более, трех или более, четырех или более, пяти или более или шести или более пиков из ее рентгенограммы XRPD, при этом указанные пики, взятые отдельно или вместе с другими характеристическими данными, отличают форму I от других форм, как описано ниже. В одном из воплощений соединение I формы I обнаруживает картину рентгеновской дифракции, в которой имеются пики, по существу сходные с таковыми на фиг.5(a) или 5(p). Например, форма I характеризуется пиком в рентгенограмме XRPD при приблизительно 20,96 2θ. Другие характерные пики включают 10,63, 17,97, 18,74, 19,12 и 23,18 2θ.
Как описано в настоящей заявке, кристаллическая форма I соединения I характеризуется некоторыми или всеми характерными данными, приведенными ниже на фиг.5(a)-5(y) (и обсуждаемыми в примере 7). В одном из воплощений, в DSC-термограмме, полученной для соединения I формы I, проявляется широкий эндотермический эффект при ~74ºС (миним.); эндотермический эффект при ~100ºC (миним.); и эндотерма при ~256,4ºC (миним.) (10ºC/мин, C). В другом воплощении, в DSC-термограмме, полученной для соединения I формы I, проявляется широкий эндотермический эффект при ~88ºC (миним.); эндотермический эффект при ~113ºC (миним.); и эндотерма при ~256ºC (миним.) (10ºC/мин, C). В одном из воплощений в TGA-термограмме, полученной для соединения I формы I, проявляется потеря массы на ~33%. В другом воплощении, в TGA-термограмме, полученной для соединения I формы I, проявляется потеря массы на ~27%. В одном из воплощений представлены данные Panalytical X-Pert Pro MPD PW3040 для соединения I формы I, полученные при следующих условиях: рентгеновская трубка: Cu(1,54059 Å), напряжение: 45 кВ; сила тока: 40 мА; область сканирования: 1,00-39,99º 2θ; размер шага: 0,017º 2θ; время собирания: 718 сек; скорость сканирования: 3,3º/мин; щель: DS: 1/2º; SS: нуль; время одного оборота: 1,0 сек, метод: трансмиссия. В одном из воплощений предложены данные для формы I соединения I, полученной при следующих условиях: детектор: DTGS KBr; число сканов: 512; разрешение: 2 см-1.
Кристаллическая форма J
В некоторых воплощениях в настоящем описании предложена кристаллическая форма, полученная из метилэтилкетона. В некоторых воплощениях такая кристаллическая форма является сольватом. В некоторых воплощениях сольват метилэтилкетона называется формой J соединения I. В некоторых воплощениях форма J может быть изоструктурна форме D, описанной выше.
В некоторых воплощениях в настоящем описании предложена форма J соединения I, а также композиции, содержащие форму J соединения I. В некоторых воплощениях композиция, включающая соединение I, содержит по меньшей мере некоторое количество соединения I в кристаллической форме, при этом указанная кристаллическая форма содержит форму J. В некоторых воплощениях композиция, включающая соединение I, содержит по меньшей мере некоторое количество соединения I в сольватированной кристаллической форме, при этом указанная кристаллическая форма содержит форму J. В некоторых воплощениях указанной сольватированной формой является сольват метилэтилкетона.
В некоторых воплощениях соединение I формы J изучали одним или несколькими способами, включая оптическую микроскопию, порошковую дифракцию рентгеновских лучей, дифференциальную сканирующую калориметрию, модулированную дифференциальную сканирующую калориметрию, термогравиметрический анализ, инфракрасную спектроскопию, спектроскопию методом ядерного магнитного резонанса и рамановскую спектроскопию.
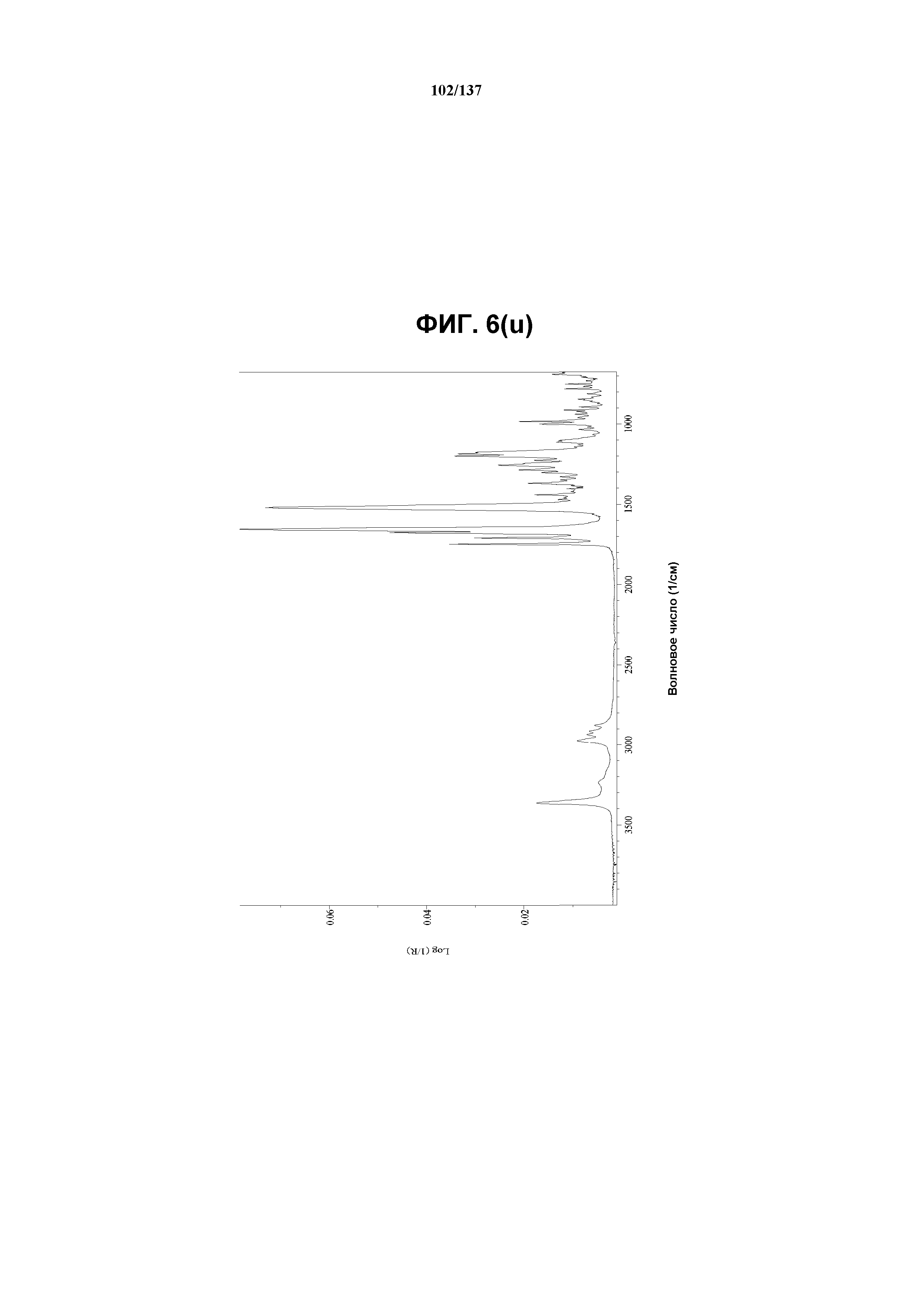
В некоторых воплощениях кристаллическая форма J соединения I характеризуется наличием одного или нескольких, двух или нескольких, трех или нескольких, четырех или нескольких, пяти или нескольких или шести или нескольких пиков из ее XRPD-рентгенограммы, при этом указанные пики, взятые отдельно или вместе с другими характеристическими данными, отличают форму J от других форм, как описано ниже. В одном из воплощений соединение I формы J обнаруживает картину рентгеновской дифракции, в которой имеются пики, по существу сходные с таковыми на фиг.6(k). Например, форма J характеризуется пиком в рентгенограмме XRPD приблизительно в области значений 15,24 2θ. Другие характерные пики включают 7,44, 11,80 и 16,60 2θ.
Как описано в настоящей заявке, кристаллическая форма J соединения I характеризуется некоторыми или всеми характерными данными, приведенными ниже на фиг.6(a)-6(u) (и обсуждаемыми в примере 8). В одном из воплощений, в DSC-термограмме, полученной для соединения I формы J, проявляется широкий эндотермический эффект при ~130ºC (миним.); и эндотерма при ~260ºC (миним.). В одном из воплощений, в TGA-термограмме, полученной для соединения I формы J, проявляется потеря массы на ~12%. В одном из воплощений представлены данные Panalytical X-Pert Pro MPD PW3040 для соединения I формы J, полученные при следующих условиях: рентгеновская трубка: Cu(1,54059 Å), напряжение: 45 кВ; сила тока: 40 мА; область сканирования: 1,00-39,99º 2θ; размер шага: 0,017º 2θ; время собирания: 718 сек; скорость сканирования: 3,3º/мин; щель: DS: 1/2º; SS: нуль; время одного оборота: 1,0 сек, метод: трансмиссия. В одном из воплощений предложены данные для формы J соединения I, полученной при следующих условиях: детектор: DTGS KBr; число сканов: 512; разрешение: 2 см-1.
Кристаллическая форма K
В некоторых воплощениях в настоящем описании предложена форма К соединения I, а также композиции, содержащие форму K. В некоторых воплощениях композиция, включающая соединение I, содержит по меньшей мере некоторое количество соединения I в кристаллической форме, при этом указанная кристаллическая форма содержит форму К. В некоторых воплощениях композиция, включающая соединение I, содержит по меньшей мере некоторое количество соединения I в сольватированной кристаллической форме, при этом указанная кристаллическая форма содержит форму K. В одном из воплощений соединение I формы K получено из нитрометана. В одном из воплощений соединением I формы К является сольват нитрометана.
В некоторых воплощениях соединение I формы K изучали одним или несколькими способами, включая оптическую микроскопию, порошковую дифракцию рентгеновских лучей, дифференциальную сканирующую калориметрию, модулированную дифференциальную сканирующую калориметрию, термогравиметрический анализ, инфракрасную спектроскопию, спектроскопию методом ядерного магнитного резонанса и рамановскую спектроскопию.
В некоторых воплощениях кристаллическая форма K соединения I характеризуется наличием одного или нескольких, двух или нескольких, трех или нескольких, четырех или нескольких, пяти или нескольких или шести или нескольких пиков из ее XRPD-рентгенограммы, при этом указанные пики, взятые отдельно или вместе с другими характеристическими данными, как описано ниже, дают возможность отличить форму К от других форм. В одном из воплощений соединение I формы К обнаруживает картину рентгеновской дифракции, в которой имеются пики, по существу сходные с таковыми на фиг.8(c). Например, форма K характеризуется пиком в рентгенограмме XRPD при приблизительно 7,89 2θ. Другие характерные пики включают 11,25, 16,81, 19,40 и 20,96 2θ.
Как описано в настоящей заявке, форма К соединения I характеризуется некоторыми или всеми характерными данными, приведенными выше на фиг.8(a)-8(l) (и обсуждаемыми в примере 10). В одном из воплощений, в DSC-термограмме, полученной для соединения I формы К, проявляется широкий эндотермический эффект при ~62ºC (миним.); другой широкий эндотермический эффект при ~155ºC (миним.); и эндотерма при ~257ºC (миним.). В другом воплощении, в DSC-термограмме, полученной для соединения I формы К, проявляется широкий эндотермический эффект при ~69ºC и 81ºC; другой широкий эндотермический эффект проявляется при ~146ºC (миним.); и эндотерма при ~257ºC (миним.). В одном из воплощений, в TGA-термограмме, полученной для соединения I формы К, проявляется потеря массы на ~9,5%. В одном из воплощений представлены данные Panalytical X-Pert Pro MPD PW3040 для соединения I формы К, полученные при следующих условиях: рентгеновская трубка: Cu(1,54059 Å), напряжение: 45 кВ; сила тока: 40 мА; область сканирования: 1,00-39,99º 2θ; размер шага: 0,017º 2θ; время собирания: 717 сек; скорость сканирования: 3,3º/мин; щель: DS: 1/2º; SS: нуль; время одного оборота: 1,0 сек, метод: трансмиссия. В одном из воплощений представлены данные для формы К соединения I, полученные при следующих условиях: детектор: DTGS KBr; число сканов: 512; разрешение: 2 см-1.
Кристаллическая форма L
В некоторых воплощениях в настоящем описании предложена кристаллическая форма, полученная из ацетона и рассеиваемая метанолом.
В некоторых воплощениях в настоящем описании предложена форма L соединения I, а также композиции, содержащие форму L. В некоторых воплощениях композиция, содержащая соединение I, включает по меньшей мере некоторое количество соединения I в кристаллической форме, при этом указанная кристаллическая форма содержит форму L. В одном из воплощений соединение I формы L представляет собой сольват метанола.
В некоторых воплощениях соединение I формы L изучали одним или несколькими способами, включая оптическую микроскопию, порошковую дифракцию рентгеновских лучей, дифференциальную сканирующую калориметрию, модулированную дифференциальную сканирующую калориметрию, термогравиметрический анализ, инфракрасную спектроскопию, спектроскопию методом ядерного магнитного резонанса и рамановскую спектроскопию.
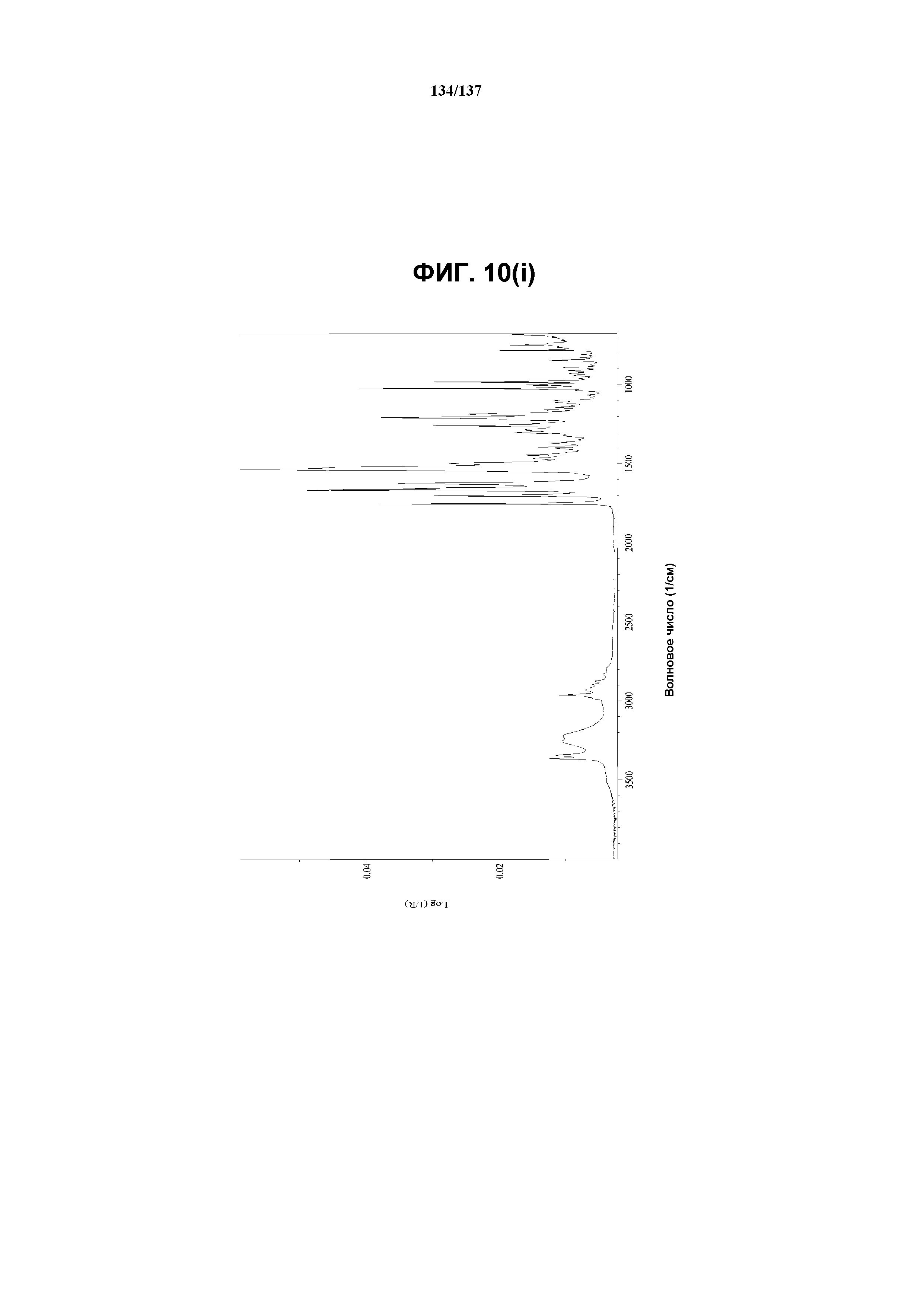
В некоторых воплощениях кристаллическая форма L соединения 1 характеризуется наличием одного или нескольких, двух или нескольких, трех или нескольких, четырех или нескольких, пяти или нескольких или шести или нескольких пиков из ее XRPD-рентгенограммы, при этом указанные пики, взятые отдельно или вместе с другими характеристическими данными, отличают форму L от других форм, как описано ниже. В одном из воплощений соединение I формы L обнаруживает картину рентгеновской дифракции, в которой имеются пики, по существу сходные с таковыми на фиг.10(a). Например, форма L характеризуется пиком в рентгенограмме XRPD при приблизительно 21,46 2θ. Другие характерные пики включают 8,26, 10,05, 11,59 и 12,31 2θ.
Как описано в настоящей заявке, форма L соединения I характеризуется некоторыми или всеми характерными данными, приведенными выше на фиг.10(a)-10(i). В одном из воплощений, в DSC-термограмме, полученной для соединения I формы L, проявляется эндотермический эффект при ~168ºC (миним.); и эндотерма при ~259ºC (миним.). В одном из воплощений, в TGA-термограмме, полученной для соединения I формы L, проявляется потеря массы на ~6%. В одном из воплощений представлены данные Panalytical X-Pert Pro MPD PW3040 для соединения I формы L, полученные при следующих условиях: рентгеновская трубка: Cu(1,54059 Å), напряжение: 45 кВ; сила тока: 40 мА; область сканирования: 1,00-39,98º 2θ; размер шага: 0,017º 2θ; время собирания: 716 сек; скорость сканирования: 3,2º/мин; щель: DS: 1/2º; SS: нуль; время одного оборота: 1,0 сек, метод: трансмиссия. В одном из воплощений представлены данные для формы L соединения I, полученные при следующих условиях: детектор: DTGS KBr; число сканов: 512; разрешение: 2 см-1.
Кристаллическая форма N
В некоторых воплощениях в настоящем описании предложена кристаллическая форма, полученная из нитрометана.
В некоторых воплощениях в настоящем описании предложена форма N соединения I, а также композиции, содержащие форму N. В некоторых воплощениях композиция, содержащая соединение I, включает по меньшей мере некоторое количество соединения I в кристаллической форме, при этом указанная кристаллическая форма содержит форму N. В одном из воплощений соединение I формы N представляет собой сольват нитрометана.
В некоторых воплощениях соединение I формы N изучали одним или несколькими способами, включая оптическую микроскопию, порошковую дифракцию рентгеновских лучей, дифференциальную сканирующую калориметрию, модулированную дифференциальную сканирующую калориметрию, термогравиметрический анализ, инфракрасную спектроскопию, спектроскопию методом ядерного магнитного резонанса и рамановскую спектроскопию.
В некоторых воплощениях кристаллическая форма N соединения I характеризуется наличием одного или нескольких, двух или нескольких, трех или нескольких, четырех или нескольких, пяти или нескольких или шести или нескольких пиков из ее XRPD-рентгенограммы, при этом указанные пики, взятые отдельно или вместе с другими характеристическими данными, дают возможность отличить, как описано ниже, форму N от других форм. В одном из воплощений соединение I формы N обнаруживает картину рентгеновской дифракции, в которой имеются пики, по существу сходные с таковыми на фиг.11(a). Например, форма N характеризуется пиком в рентгенограмме XRPD при приблизительно 8,92 2θ. Другие характерные пики включают 7,07, 9,76, 10,75, 11,22, 15,46, 20,37 и 21,31 2θ.
Как описано в настоящей заявке, форма N соединения I характеризуется некоторыми или всеми характерными данными, приведенными выше на фиг.11(a)-11(d). В одном из воплощений, в DSC-термограмме, полученной для соединения I формы N проявляется эндотерма при ~150ºC (миним.). В одном из воплощений, в TGA-термограмме, полученной для соединения I формы N, проявляется потеря массы на ~5%. В одном из воплощений представлены данные Panalytical X-Pert Pro MPD PW3040 для соединения I формы N, полученные при следующих условиях: рентгеновская трубка: Cu(1,.54059 Å), напряжение: 45 кВ; сила тока: 40 мА; область сканирования: 1,00-39,99º 2θ; размер шага: 0,017º 2θ; время собирания: 717 сек; скорость сканирования: 3,3º/мин; щель: DS: 1/2º; SS: нуль; время одного оборота: 1,0 сек, метод: трансмиссия.
Аморфная форма
В некоторых воплощениях в настоящем описании предложено аморфное соединение I, а также композиции, содержащие аморфное соединение I. В некоторых воплощениях в настоящем описании предложены композиции, содержащие соединение I, в которых по существу все соединения I представлены в аморфной форме (то есть такая композиция по существу свободна от кристаллического соединения I). В некоторых воплощениях в настоящем описании предложены композиции, содержащие соединение I, в которых по меньшей мере некоторое количество соединения I представлено в форме, отличной от аморфной (например, представлено в кристаллической форме, такой, например, как форма A, форма B, форма C, форма D, форма E, форма F, форма H, форма I, форма J, форма K, форма L, форма N и их сочетания).
В некоторых воплощениях аморфное соединение I характеризуется отсутствием некоторых пиков выше фона в рентгенограмме XRPD. В некоторых воплощениях аморфное соединение I характеризуется отсутствием характерных пиков, которые могут быть представлены в соединении I формы A, формы B, формы C, формы D, формы E, формы F, формы H, формы I, формы J, формы K, формы L, формы N и их сочетаниях. В некоторых воплощениях аморфное соединение I характеризуется картиной рентгеновской дифракции, по существу сходной с таковой на фиг.7(a). В некоторых воплощениях аморфное соединение I получено из смеси вода/дихлорметан или из смеси изопропанол-трифторэтанол/метанол.
Как описано в настоящей заявке, аморфное соединение I характеризуется типовыми данными, представленными ниже на фиг.7(a)-7(f) (см. пример 9). В одном из воплощений, в DSC-термограмме, полученной для аморфного соединения I, проявляется температура стеклования ~91ºC. В одном из воплощений, в TGA-термограмме, полученной для аморфного соединения I, проявляется потеря массы на ~3,5%.
КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ПРЕДЛОЖЕННЫЕ ФОРМЫ СОЕДИНЕНИЯ I
В настоящем описании предложены композиции, которые содержат и/или которые получены из твердых форм соединения I, как описано в настоящей заявке. Любая из предлагаемых здесь форм соединения I может быть включена в композицию. В некоторых воплощениях в настоящем описании предложены фармацевтические композиции, которые содержат и/или которые получены из твердых форм соединения I, как описано в настоящей заявке. В некоторых воплощениях фармацевтическая композиция содержит терапевтически эффективное количество соединения I и по меньшей мере один фармацевтически приемлемый носитель или эксципиент.
В некоторых воплощениях композиции, содержащие соединение I, представлены в виде лиофилизатов. В некоторых воплощениях в настоящем описании предложен лиофилизат соединения I, содержащий одну или несколько описанных здесь твердых форм. В некоторых воплощениях лиофилизат содержит аморфное соединение I. В некоторых воплощениях лиофилизат содержит одну или несколько кристаллических форм. В некоторых воплощениях лиофилизат является по существу свободным от одной или нескольких кристаллических форм. В некоторых воплощениях лиофилизат по существу свободен от любой кристаллической формы.
В некоторых воплощениях в настоящем описании предложены композиции, содержащие описанные здесь твердые формы соединения I или полученные из них, при этом указанные композиции дополнительно включают один или несколько добавочных компонентов.
В некоторых воплощениях предложенные композиции содержат, помимо соединения I, по меньшей мере один другой компонент, такой как носитель (например, фармацевтически приемлемый носитель). За исключением случаев, когда любая обычная среда-носитель не совместима с описанными здесь соединениями или формами, например, вызывает какой-нибудь нежелательный биологический эффект или, говоря иначе, взаимодействует нежелательным образом с любым другим компонентом(-ами) композиции, и/или с их применением, она считается включенной в объем, охватываемый настоящим изобретением.
В некоторых воплощениях материалы, которые могут служить в качестве приемлемых носителей (например, фармацевтически приемлемые носители), включают, но не ограничиваясь этим, сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натрий карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; порошок трагакантовой камеди; солод; желатин; тальк; кремофор; солютол; эксципиенты, такие как масло какао и воска для суппозиториев; масла, такие как арахисовое масло, хлопковое масло; масло подсолнечника; кунжутное масло; оливковое масло; кукурузное масло и масло соевых бобов; гликоли, такие как пропиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; забуферивающие средства, такие как гидроокись магния и гидроокись алюминия; альгиновую кислоту; апирогенную воду; изотонический физиологический раствор; раствор Рингера; этиловый спирт и растворы фосфатного буфера; а также другие нетоксичные совместимые смазывающие вещества, такие как лаурилсульфат натрия и стеарат магния; а также окрашивающие средства, разделительные средства, средства для покрытия, подсластители, вкусовые и ароматизирующие средства, консерванты и антиоксиданты, которые также могут присутствовать в композиции, в соответствии с решением разработчика рецептур.
Композиции, содержащие соединение I, как описано в настоящей заявке, могут быть составлены для орального, парентерального введения, введения путем ингаляционного спрея, для местного, ректального, назального, буккального, вагинального введения или введения посредством имплантируемого резервуара. В некоторых воплощениях композиции вводят оральным или парентеральным путями.
В некоторых воплощениях композиции вводят парентерально. В некоторых воплощениях композиции вводят внутрибрюшинно или внутривенно.
Как известно в данной области, композиции для инъекций часто бывают представлены в виде растворов или суспензий, например, водных или маслянистых суспензий. Такие растворы или суспензии могут быть составлены согласно технологии, известной в данной области, например, с использованием соответствующих диспергирующих или увлажняющих средств и суспендирующих средств. Обычно композиции для инъекций являются стерильными. В некоторых воплощениях раствор или суспензия для инъекций содержит нетоксичный парентерально приемлемый разбавитель или растворитель. Типичные носители и растворители, которые обычно используются, включают воду, раствор Рингера, изотонический раствор хлорида натрия, ацетон, хлороформ, дихлорметан, изопропанол, метанол, метилэтилкетон, трет-бутиловый спирт, трифторэтанол и 1,3-бутандиол и их сочетания.
В некоторых воплощениях стерильные жирные масла обычно используют в качестве растворителя или суспендирующей среды. Может быть использовано любое жирное масло, включая синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, часто используют в изготовлении инъецируемых композиций в качестве природных фармацевтически приемлемых масел, таких как оливковое масло или касторовое масло, включая их полиоксиэтилированные версии. В некоторых воплощениях такие масляные растворы или суспензии содержат длинноцепочечный спиртовый разбавитель или диспергатор, такой как карбоксиметилцеллюлоза или сходные диспергирующие средства, которые обычно используются при составлении фармацевтически приемлемых дозированных лекарственных форм, включая эмульсии и суспензии. В некоторых воплощениях для создания композиций могут быть использованы также обычно применяемые поверхностно-активные вещества, такие как Tween, Span и другие эмульгирующие средства или усилители биодоступности, которые, как правило, используются в производстве приемлемых (например, фармацевтически приемлемых) твердых, жидких или других дозированных лекарственных форм.
Орально приемлемые дозированные формы включают, но не ограничиваясь этим, капсулы, таблетки, водные суспензии или растворы. В случае таблеток для орального применения, носители, которые обычно используются, включают лактозу и кукурузный крахмал. Смазывающие вещества, такие как стеарат магния, также являются обычно используемыми. Для орального введения в виде капсул используемые разбавители обычно включают лактозу и высушенный кукурузный крахмал. Когда изготавливают водные суспензии для оральной доставки, активный ингредиент обычно комбинируют с эмульгиирующими и суспендирующими средствами, необязательно подобно тому, как обсуждалось выше в связи с парентеральными композициями. Если требуется, могут быть добавлены также определенные подсластители, ароматизирующие или красящие средства.
Введение оральных композиций может быть связано с периодами приема пищи. Например, в некоторых воплощениях оральные композиции принимают вместе с едой; в некоторых воплощениях оральные композиции принимают без приема пищи или в конкретных временных рамках по отношению к приему пищи. В некоторых воплощениях оральные композиции вводят, сопровождая это малым количеством пищи, или вне зависимости от режима приема пищи.
Композиции для орального приема могут быть составлены в виде твердого или жидкого препарата. В некоторых воплощениях жидкую композицию, такую как сироп, композицию для инъекций, глазные капли или т.п., изготавливают с добавками средства для доведения pH (например, соляной кислоты), солюбилизатора, средства для установления изотоничности или т.п., а также с солюбилизирующими добавками, добавками стабилизатора, забуферивающего средства, суспендирующего средства, антиоксиданта и т.п., если это необходимо. В некоторых воплощениях жидкая композиция является лиофилизированной, и инъекции вводят внутривенно, подкожно или внутримышечно. Суспендирующие средства, которые могут быть использованы, включают, но не ограничиваясь этим, метилцеллюлозу, полисорбат 80, гидроксиэтилцеллюлозу, гуммиарабик, порошок трагаканта, натрия карбоксиметилцеллюлозу, полиоксиэтиленсорбитанмонолаурат и т.п. Солюбилизирующие добавки, которые могут быть использованы, включают, но не ограничиваясь этим, полиоксиэтилен-гидрогенизированное касторовое масло, полисорбат 80, никотинамид, полиоксиэтиленсорбитанмонолаурат и т.д. Стабилизирующие средства, которые могут быть использованы, включают, но не ограничиваясь этим, сульфит натрия, метасульфит натрия, простой эфир и т.п. Консерванты, которые могут быть использованы, включают, но не ограничиваясь этим, метилпараоксибензоат, этилпараоксибензоат, сорбиновую кислоту, фенол, крезол, хлорокрезол и т.п.
В некоторых воплощениях предлагаемые композиции могут быть составлены для ректального введения, например, в виде суппозиториев. Такие ректально приемлемые формы могут быть получены, например, путем смешивания указанного средства с соответствующим не раздражающим эксципиентом, который является твердым при комнатной температуре, но жидким при ректальной температуре, и, следовательно, будет плавиться в прямой кишке с высвобождением лекарственного средства. Такие материалы включают масло какао, пчелиный воск и/или полиэтиленгликоли.
В некоторых воплощениях предлагаемые композиции составлены для местного введения, например, места введения включают области или органы, легко доступные для местного нанесения, например, глаз, кожа или нижний отдел кишечного тракта.
Местное введение в нижний отдел кишечного тракта часто может быть осуществлено с помощью композиции ректального суппозитория (см. выше) или подходящей композиции для клизмы. В некоторых воплощениях могут быть использованы местные или трансдермальные пластыри.
В некоторых воплощениях местные композиции изготавливают в составе соответствующей мази, содержащей активный компонент, суспендированный или растворенный в одном или нескольких носителях. Носители для местного введения обычно включают, но не ограничиваясь этим, минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль, полиоксиэтилен, полиоксипропиленовое соединение, эмульгирующий воск и воду. Местные композиции могут быть составлены в виде соответствующего лосьона или крема, например, содержащего один или несколько активных компонентов, суспендированных или растворенных в одном или нескольких фармацевтически приемлемых носителях. Подходящие носители могут включать, но не ограничиваясь этим, минеральное масло, сорбитанмоностеарат, полисорбат 60, воски цетиловых эфиров, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и воду и их сочетания.
Составы для офтальмической доставки часто изготавливают в виде растворов или суспензий (например, изотонического, стерильного физиологического раствора с доведенным значением рН). В некоторых воплощениях включенными являются также один или несколько консервантов (например, бензилалкония хлорид). Офтальмические композиции могут быть составлены в виде мази, такой как вазелин.
Композиции для назальной доставки обычно составляют в виде аэрозолей. Такие аэрозольные композиции могут, например, быть или включать растворы или суспензии (например, в физиологическом растворе), необязательно содержащие один или несколько консервантов (например, бензиловый спирт), промоторов абсорбции (например, для усиления биодоступности), и/или солюбилизирующих или диспергирующих средств (например, фторуглеродов).
В некоторых воплощениях композиции (например, фармацевтические композиции), как описано в настоящей заявке, могут включать один или несколько эмульгирующих средств и/или ингибиторов кристаллизации, или их сочетания.
В некоторых воплощениях предложенные композиции содержат одно или несколько эмульгирующих средств. В некоторых воплощениях указанным эмульгирующим средством является вода. В некоторых воплощениях эмульгирующим средством является трет-бутиловый спирт. В некоторых воплощениях эмульгирующим средством является тальк. В некоторых воплощениях эмульгирующим средством является лактоза. В некоторых воплощениях эмульгирующим средством является осажденный карбонат кальция. В некоторых воплощениях эмульгирующим средством является диоксид титана. В некоторых воплощениях эмульгирующим средством является диоксид кремния. В некоторых воплощениях эмульгирующим средством является микрокристаллическая целлюлоза.
В некоторых воплощениях предлагаемые композиции содержат один или несколько ингибиторов кристаллизации. В некоторых воплощениях ингибитор кристаллизации является водорастворимым. В некоторых воплощениях ингибитор кристаллизации является водонерастворимым.
Типичные ингибиторы кристаллизации включают, но не ограничиваясь этим, поливинилпирролидон (PVP или повидон), включая гомо- и сополимеры поливинилпирролидона и гомополимеры или сополимеры N-винилпирролидона; кросповидон; камеди; производные целлюлозы (например, полимеры HPMC, гидроксипропилцеллюлоза, этилцеллюлоза, гидроксиэтилцеллюлоза, натрия карбоксиметилцеллюлоза, кальция карбоксиметилцеллюлоза, натрия карбоксиметилцеллюлоза); декстран; гуммиарабик; гомо- и сополимеры виниллактама, а также их смеси; циклодекстрины; желатины; фталат гипромеллозы; сахара; сахарные спирты, включая маннит; многоатомные спирты; полиэтиленгликоль (ПЭГ); полиэтиленоксиды; полиоксиэтиленовые производные; поливиноловый спирт; производные пропиленгликоля и т.п., SLS, твины, эудрагиты (сополимеры метакриловой кислоты); а также их сочетания; аминокислоты, такие как пролин.
В некоторых воплощениях соединение I в указанной композиции является аморфным. В некоторых воплощениях ингибитором кристаллизации является поливинилпирролидон (PVP или повидон). В некоторых воплощениях ингибитором кристаллизации является повидон USP/NF, Ph. Eur или JPE. В некоторых воплощениях, количество соединения I и количество повидона присутствует в композиции в соотношении приблизительно 1:2 (по массе). В некоторых воплощениях количество соединения I и количество повидона присутствует в композиции в соотношении приблизительно 1:1 (по массе). В некоторых воплощениях количество соединения I и количество повидона присутствует в композиции в соотношении приблизительно 2:1 (по массе). В некоторых воплощениях количество соединения I и количество повидона присутствует в композиции в соотношении приблизительно 3:1 (по массе). В некоторых воплощениях количество соединения I и количество повидона присутствует в композиции в соотношении приблизительно 4:1 (по массе). В некоторых воплощениях количество соединения I и количество повидона присутствует в композиции в соотношении приблизительно 5:1 (по массе).
В некоторых воплощениях ингибитором кристаллизации, используемым в настоящем изобретении, является полимер PVP.
В некоторых воплощениях полимеры PVP, используемые в настоящем изобретении, имеют молекулярную массу от приблизительно 2000 до приблизительно 50000 Дальтон, от приблизительно 2000 до приблизительно 30000 Дальтон, от приблизительно 2000 до приблизительно 20000 Дальтон, от приблизительно 2500 до приблизительно 15000 Дальтон, от приблизительно 2500 до приблизительно 10000 Дальтон или от приблизительно 3000 до приблизительно 10000 Дальтон.
В некоторых воплощениях полимеры PVP, используемые в настоящем изобретении, имеют динамическую вязкость (10% в воде при 20ºC), составляющую от приблизительно 1,3 до приблизительно 700, от приблизительно 1,5 до приблизительно 500, от приблизительно 1,8 до приблизительно 300, от приблизительно 2,0 до приблизительно 200, от приблизительно 2,2 до приблизительно 150, от приблизительно 2,5 до приблизительно 100, от приблизительно 2,8 до приблизительно 70, от приблизительно 3,0 до приблизительно 40, от приблизительно 3,2 до приблизительно 25 или от приблизительно 3,5 до приблизительно 8,5 мПа·с.
В предлагаемых композициях может быть использован любой тип повидона. В некоторых воплощениях повидон выбран из PVP-полимеров Пласдон®, которые являются синтетическими водорастворимыми гомополимерами N-винил-2-пирролидона. Полимеры Пласдон®, используемые в предложенных здесь композициях, включают, без ограничения, Пласдон C-12 и Пласдон C-17.
В некоторых воплощениях повидон имеет значения K между 12 и 17. В некоторых воплощениях повидон имеет значения K между 12 и 15.
В некоторых воплощениях PVP-полимеры, используемые в настоящем описании, выбраны из PVP-полимеров серии Коллидон® (например, Коллидон® 12PF, Коллидон® 17PF).
В некоторых воплощениях ингибитором кристаллизации, используемым в настоящем описании, является полимер ПЭГ.
В некоторых воплощениях полимеры ПЭГ, используемые в настоящем описании, имеют среднюю молекулярную массу приблизительно 5000-20000 Дальтон, приблизительно 5000-15000 Дальтон или приблизительно 5000-10000 Дальтон.
В некоторых воплощениях ингибитором кристаллизации, используемым в настоящем описании, является поверхностно-активное вещество. В некоторых воплощениях ингибитором кристаллизации является поверхностно-активное вещество твин®. Типичные вещества из серии Твин® включают Твин® 20, Твин® 40, Твин® 60, Твин® 65 и Твин® 80.
В некоторых воплощениях ингибитором кристаллизации, используемым в настоящем описании, является полимер HPMC (гидроксипропилметилцеллюлоза).
Полимеры HPMC различаются по длине цепи целлюлозного скелета и, следовательно, по вязкости, измеряемой, например, при 2% (масс./масс.) в воде. В некоторых воплощениях полимер HPMC имеет вязкость в воде (при концентрации 2% (масс./масс.)), составляющую от приблизительно 100 до приблизительно 100000 сП, от приблизительно 1000 до приблизительно 15000 сП, например, приблизительно 4000 сП. В некоторых воплощениях молекулярная масса полимера HPMC составляет более чем приблизительно 10000, но не более чем приблизительно 1500000, не более чем приблизительно 1000000, не более чем приблизительно 500000 или не более чем приблизительно 150000.
Полимеры HPMC различаются также и по относительной степени замещения гидроксильных групп на их целлюлозном скелете метокси- и гидроксипропокси-группами. С увеличением гидроксипропокси-замещения образующийся в результате полимер HPMC становится по своей природе более гидрофильным. В некоторых воплощениях полимер HPMC имеет от приблизительно 15% до приблизительно 35%, от приблизительно 19% до приблизительно 32% или от приблизительно 22% до приблизительно 30% метокси-замещения и имеет от приблизительно 3% до приблизительно 15%, от приблизительно 4% до приблизительно 12% или от приблизительно 7% до приблизительно 12% гидроксипропокси-замещения.
Типичные полимеры HPMC включают, но не ограничиваясь этим, гидроксипропилметилцеллюлозу (HPMC), ацетатфталат гидроксипропилметилцеллюлозы (HPMC-AP), ацетатсукцинат гидроксипропилметилцеллюлозы (HPMC-AS), ацетаттримеллитат гидроксипропилметилцеллюлозы (HPMC-AT) и фталат гидроксипропилметилцеллюлозы (HPMC-P).
Градации гидроксипропилметилцеллюлозы (HPMC) включают, но не ограничиваясь этим, 3FG, 4FG, 5FG, 6FG, 15FG, 50FG и K100M. Градации ацетатсукцината гидроксипропилметилцеллюлозы (HPMC-AS) включают HPMC-AS-LF, HPMC-AS-MF, HPMC-AS-HF, HPMC-AS-LG, HPMC-AS-MG и HPMC-AS-HG. Градации фталата гидроксипропилметилцеллюлозы (HPMC-P) включают 50, 55, 55S.
Другие типичные полимеры HPMC доступны под торговыми названиями MethocelTM от компании Dow Chemical Co. и MetoloseTM от компании Shin-Etsu Chemical Co. Примеры подходящих полимеров HPMC, имеющих среднюю вязкость, включают MethocelTM E4M, а также MethocelTM K4M, оба из которых имеют вязкость, составляющую приблизительно 4000 сП при 2% (масс./масс.) воды. Примеры полимеров HPMC, имеющих более высокую вязкость, включают MethocelTM E10M, MethocelTM K15M, и MethocelTM K100M, относительная вязкость которых составляет приблизительно 10000 сП, 15000 сП и 100000 сП при 2% (масс./масс.) в воде.
В некоторых воплощениях предлагаемая композиция может включать один или несколько ингибиторов кристаллизации. В некоторых воплощениях вторым ингибитором кристаллизации является полимер PVP. В некоторых воплощениях вторым ингибитором кристаллизации является полимер ПЭГ. В некоторых воплощениях вторым ингибитором кристаллизации является поверхностно-активное вещество Твин®. В некоторых воплощениях указанный состав или композиция содержит количество одного или нескольких ингибиторов кристаллизации, составляющее по меньшей мере приблизительно 1%, 5%, 10%, 12%, 15%, 18%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99% (масс./масс.) от общей массы указанного состава или композиции.
В некоторых воплощениях композицию получают путем лиофилизации из раствора. В конкретных воплощениях композицию получают путем лиофилизации из раствора трет-бутанол/вода (60:40) (об./об.). В некоторых воплощениях растворителем является трет-бутанол. В некоторых воплощениях растворителем является смесь трет-бутанола и воды. В некоторых воплощениях средством для доведения pH является соляная кислота.
Марка ISTODAX®
ISTODAX® поставляется в виде набора, который включает стерильный лиофилизированный порошок в одноразовом пузырьке, содержащем 10 мг соединения I и 20 мг средства-наполнителя, повидона, USP. Кроме того, каждый набор включает 1 стерильный пузырек, содержащий 2 мл разбавителя, составленного из 80% пропиленгликоля, USP, и 20% абсолютного спирта, USP.
Значение K повидона USP составляет 17. Молекулярная масса повидона USP приблизительно составляет 10000 Дальтон.
ISTODAX® вводят в дозе 14 мг/м2 внутривенно в течение 4-часового периода на дни 1-й, 8-й и 15-й 28-дневного цикла. Циклы повторяют каждые 28 дней.
ПРИМЕНЕНИЯ
Состояния, подлежащие лечению
Предложены способы и композиции, связанные с лечением пролиферативных клеточных расстройств, заболеваний или состояний. Пролиферативные клеточные расстройства, заболевания или состояния включают целый ряд состояний, характеризующихся аномальным клеточным ростом, предпочтительно, аномально повышенной клеточной пролиферацией. Пролиферативные клеточные расстройства, заболевания или состояния, которые можно лечить с помощью предлагаемых композиций и способов, включают, но не ограничиваясь этим, рак, иммуноопосредованные реакции и заболевания (например, отторжение трансплантата, болезнь трансплантат против хозяина, иммунная реакция на генную терапию, аутоиммунные заболевания, иммунная дизрегуляция, вызванная патогеном, и т.п.), определенные циркуляторные заболевания и определенные нейродегенеративные заболевания.
В некоторых воплощениях предложены способы лечения рака. Рак представляет собой группу заболеваний, которые характеризуются неконтролируемым ростом и распространением аномальных клеток. Рак включает, но не ограничиваясь этим, карциномы, саркомы, лейкемии, лимфомы и т.п. В некоторых воплощениях рак представляет собой гематологическое злокачественное новообразование. В некоторых воплощениях раком является солидная опухоль.
В некоторых воплощениях настоящее описание связано с лечением гематологических злокачественных новообразований. Проявления гематологических злокачественных новообразований включают циркулирующие злокачественные клетки и скопления злокачественных клеток. Гематологические злокачественные новообразования являются разновидностями рака, которые поражают кровь, костный мозг и/или лимфатические узлы. Гематологические злокачественные новообразования, которые можно лечить с помощью ромидепсина, включают, но не ограничиваясь этим, острую лимфобластную лейкемию (ALL), острую миелогенную лейкемию (AML), хроническую миелогенную лейкемию (CML), хроническую лимфоцитарную лейкемию (CLL), волосатоклеточную лейкемию, болезнь Ходжкина, неходжкинскую лимфому, кожную T-клеточную лимфому (CTCL), периферическую T-клеточную лимфому (PTCL), множественной миеломой и миелодиспластическими синдромами. В некоторых воплощениях ромидепсин используется для лечения множественной миеломы. В некоторых конкретных воплощениях указанной разновидностью рака является рецидивирующая и/или резистентная множественная миелома. В других воплощениях ромидепсин используется для лечения хронической лимфоцитарной лейкемии (CLL). В некоторых конкретных воплощениях указанной разновидностью рака является рецидивирующая и/или резистентная CLL. В других воплощениях ромидепсин используется для лечения хронической миелогенной лейкемии (CML). В некоторых воплощениях ромидепсин используется для лечения острой лимфобластной лейкемии (ALL). В некоторых воплощениях ромидепсин используется для лечения острой миелогенной лейкемии (AML). В некоторых воплощениях указанным раком является кожная T-клеточная лимфома (CTCL). В других воплощениях указанным раком является периферическая T-клеточная лимфома (PTCL). В некоторых воплощениях рак представляет собой миелодиспластический синдром.
В некоторых воплощениях настоящего описания подвергаемый лечению рак включает, но не ограничиваясь этим, лейкемии и лимфомы, такие как кожная T-клеточная лимфома (CTCL), периферическая T-клеточная лимфома, лимфомы, ассоциированные с лимфотропным T-клеточным вирусом человека (HTLV), такие как T-клеточная лейкемия/лимфома взрослых (ATLL), B-клеточные лимфомы, острая лимфоцитарная лейкемия, острая нелимфоцитарная лейкемия, хроническая лимфоцитарная лейкемия, хроническая миелогенная лейкемия, острая миелогенная лейкемия, болезнь Ходжкина, неходжкинские лимфомы, множественная миелома, миелодиспластические синдромы.
В некоторых таких воплощениях настоящее описание связано с лечением солидных опухолей, таких как опухоли легких, молочной железы, толстой кишки, печени, поджелудочной железы, почек, предстательной железы, яичника и/или головного мозга. В некоторых воплощениях настоящее описание связано с лечением рака поджелудочной железы. В некоторых воплощениях настоящее описание связано с лечением рака почки. В некоторых воплощениях настоящее описание связано с лечением рака предстательной железы. В некоторых воплощениях настоящее описание связано с лечением сарком. В некоторых воплощениях настоящее описание связано с лечением сарком мягких тканей.
В некоторых воплощениях раком, который подлежит лечению, являются солидные злокачественные опухоли, которые включают, но не ограничиваясь этим, мезотелиому, широко распространенные солидные опухоли взрослых, такие как рак головы и шеи (например, оральные, гортанные и относящиеся к пищеводу), рак мочеполовой системы (например, предстательной железы, мочевого пузыря, почек, матки, яичника, яичек, прямой кишки и толстой кишки), меланому и другие виды рака кожи, рак желудка, опухоли головного мозга, рак печени и рак щитовидной железы, и/или солидные опухоли детского возраста, такие как опухоли головного мозга, нейробластома, ретинопатия, опухоль Вильмса, опухоли кости, а также саркомы мягких тканей. В некоторых воплощениях настоящее описание связано с лечением солидных опухолей.
Рак, который может быть подвергнут лечению с помощью предлагаемых здесь способов, включая комбинированную терапию, включает, но не ограничиваясь этим, рак толстой кишки, рак легкого, рак кости, рак поджелудочной железы, рак желудка, рак пищевода, рак кожи, рак головного мозга, рак печени, рак яичника, рак шейки матки, рак матки, рак яичка, рак предстательной железы, рак мочевого пузыря, рак почки и рак нейроэндокринной системы.
В некоторых воплощениях раком является рак поджелудочной железы. В некоторых воплощениях раком является рак предстательной железы. В некоторых специфических воплощениях раком предстательной железы является гормонорезистентный рак предстательной железы.
В некоторых конкретных воплощениях предложены способы лечения лейкемий. В некоторых воплощениях лейкемией является хроническая лимфоцитарная лейкемия, хроническая миелогенная лейкемия, острая лимфоцитарная лейкемия, острая миелогенная лейкемия или T-клеточная лейкемия/лимфома взрослых.
В некоторых воплощениях предложены способы лечения лимфом. В некоторых воплощениях лимфомой является болезнь Ходжкина или неходжкинская лимфома (например, T-клеточные лимфомы, такие как периферическая T-клеточная лимфома, кожная T-клеточная лимфома и т.п.).
В некоторых воплощениях настоящее описание связано с лечением множественной миеломы и/или миелодиспластических синдромов.
В некоторых воплощениях предложены способы лечения одной или нескольких иммуноопосредованных реакций и заболеваний, включая, но не ограничиваясь перечисленным, реакцию отторжения после трансплантации синтетических или органических пересаженных материалов, клеток, органов или тканей с целью полного или частичного замещения функции тканей, таких как сердце, почка, печень, костный мозг, кожа, роговица, сосуды, легкое, поджелудочная железа, кишечник, конечность, мышца, нервная ткань, двенадцатиперстная кишка, тонкий кишечник, клетки панкреатических островков, включая ксенотрансплантаты, и т.п.; болезнь трансплантат против хозяина; аутоиммунные заболевания, такие как ревматоидный артрит, системная красная волчанка, тиреоидит, тиреоидит Хашимото, рассеянный склероз, миастения gravis, диабет I типа, ювенильный или поздний сахарный диабет, увеит, болезнь Грейвса, псориаз, атопический дерматит, болезнь Крона, язвенный колит, васкулит, заболевания, опосредованные аутоантителами, апластическая анемия, синдром Эвана, аутоиммунная гемолитическая анемия и т.д.
В некоторых воплощениях предложены способы лечения одного или нескольких инфекционных заболеваний, вызывающих аномальный иммунный ответ и/или активацию, таких как дизрегуляция иммунной системы, вызванная травматическим или патогенным воздействием, включая, например, такую, которую вызывает инфекция гепатита B и C, ВИЧ, инфекция Staphylococcus aureus, вирусный энцефалит, сепсис, паразитарные заболевания, при которых повреждение индуцировано воспалительным ответом (например, лепра).
В некоторых воплощениях предложены способы лечения болезни трансплантат против хозяина, ревматоидного артрита, системной красной волчанки, псориаза, атопического дерматита, болезни Крона, язвенного колита или множественного склероза.
В некоторых воплощениях предложены способы лечения иммунного ответа, ассоциированного с лечением методами генной терапии, такими как введение чужеродных генов в аутологичные клетки и экспрессия кодируемого продукта. В некоторых воплощениях предложены способы лечения циркуляторных заболеваний, таких как артериосклероз, атеросклероз, васкулит, узелковый полиартрит или миокардит.
В некоторых воплощениях предложены способы лечения любого из множества нейродегенеративных заболеваний, неполный список которых включает следующее:
I. Расстройства, характеризующиеся прогрессирующей деменцией в отсутствие других выраженных неврологических симптомов, такие как болезнь Альцгеймера; старческое слабоумие наподобие болезни Альцгеймера; и болезнь Пика (долевая атрофия);
II. Синдромы, объединяющие прогрессирующую деменцию с другими выраженными неврологическими аномалиями, такие как: A) синдромы, появляющиеся в основном у взрослых (например, болезнь Хантингтона, множественная системная атрофия, объединяющая деменцию с атаксией и/или манифестациями болезни Паркинсона, прогрессирующий супрануклеарный паралич (синдром Стила-Ричардсона-Ольшевского), болезнь диффузных телец Леви, а также кортико-дентато-нигральная дегенерация); и B) синдромы, появляющиеся в основном у детей или у молодежи (например, болезнь Галлервордена-Шпатца и прогрессирующая семейная миоклоническая эпилепсия);
III. Синдромы постепенно развивающихся аномалий позы и движения, такие как дрожательные параличи (болезнь Паркинсона), стрионигральная дегенерация, прогрессирующий супрануклеарный паралич, торсионная дистония (торсионный спазм; деформирующая мышечная дистония), спастическая кривошея и другие дискинезии, семейный тремор и синдром Жиля де ля Туретта;
IV. Синдромы прогрессирующей атаксии, такие как мозжечковые дегенерации (например, мозжечковая кортикальная дегенерация и оливопонтоцеребеллярная атрофия (OPCA)); и спиноцеребеллярная дегенерация (наследственная атаксия Фридрейха и связанные с ней расстройства);
V. Синдромы отказа центральной вегетативной нервной системы (синдром Ши-Дрегера);
VI. Синдромы мышечной слабости и истощения без изменений чувствительности (болезнь мотонейронов, такая как амиотрофический латеральный склероз, спинальная мышечная атрофия (например, спинальная мышечная атрофия у детей (болезнь Верднига-Гоффмана), ювенильная спинальная мышечная атрофия (болезнь Вольфарта-Кугельберга-Веландера) и другие формы семейной спинальной мышечной атрофии), первичный латеральный склероз и наследственная спастическая параплегия;
VII. Синдромы сочетания мышечной слабости и истощения с изменениями чувствительности (прогрессирующая нервно-мышечная атрофия; хронические семейные полинейропатии), такие как перонеальная мышечная атрофия (синдром Шарко-Мари-Тута), гипертрофическая интерстициальная полиневропатия (болезнь Дежерин-Сотта), а также смешанные формы хронической прогрессирующей невропатии;
VIII. Синдромы прогрессирующей потери зрения, такие как пигментная дегенерация сетчатки (retinitis pigmentosa) и наследственная атрофия зрительного нерва (болезнь Лебера).
В некоторых воплощениях указанным нейродегенеративным заболеванием является болезнь Альцгеймера, болезнь Паркинсона и/или болезнь Хантингтона.
В некоторых воплощениях указанные заболевания или состояния ассоциированы с реконструкцией хроматина.
Введение лекарственных дозировок
В некоторых воплощениях соединение I и/или композиции, содержащие соединение I, вводят в соответствии со стандартной схемой введения дозировок. В некоторых воплощениях соединение I и/или композиции, содержащие соединение I, вводят в соответствии с ускоренной схемой введения дозировок.
Стандартная схема введения дозировок соединения I
В некоторых воплощениях единичные дозы соединения I находятся в интервале от приблизительно 0,5 мг/м2 до приблизительно 28 мг/м2 площади поверхности тела. В некоторых воплощениях используют интервал от приблизительно 6 до приблизительно 18 мг/м2. В некоторых воплощениях указанный интервал составляет от приблизительно 10 мг/м2 до приблизительно 17 мг/м2. В некоторых воплощениях конкретные единичные дозы составляют 10 мг/м2, 12 мг/м2, 13 мг/м2 14 мг/м2 и 15 мг/м2.
В некоторых воплощениях соединение 1 вводят внутривенно. В некоторых воплощениях схемы внутривенного введения доз включают ежедневное введение в течение 2 недель, введение два раза в неделю в течение 4 недель, трехкратное введение в неделю, в течение 4 недель, и разные другие промежуточные схемы (например, в дни 1, 3 и 5; в дни 4 и 10; в дни 1, 8 и 15; в дни 1 и 15; в дни 5 и 12; или в дни 5, 12 и 19 из 21-дневного или 28-дневного циклов).
В некоторых воплощениях соединение I вводят в индивидуальных единичных дозах свыше 4 часов в дни 1, 8 и 15, курсами, повторяющимися каждые 28 дней. Часто назначают несколько курсов (например, по меньшей мере 4, по меньшей мере 6 или более). На самом деле в литературе описаны случаи, когда было назначено 72 курса. В некоторых воплощениях индивидуальные единичные дозы вводили путем 4-часовой инфузии.
Ускоренная схема введения дозировок соединения I
Могут быть использованы ускоренные схемы введения дозировок соединения I, в которых одну или несколько индивидуальных единичных доз вводят внутривенно в течение периода, который меньше или равен примерно одному часу. В некоторых воплощениях одну или несколько индивидуальных единичных доз вводят внутривенно в течение периода, который составляет менее чем приблизительно 50 минут, 40 минут, 30 минут, 20 минут или менее. Любая схема, которая включает по меньшей мере одну единичную дозу, вводимую в течение периода, который составляет менее чем приблизительно один час (60 минут), может, согласно настоящему изобретению, считаться ускоренной схемой введения дозировок.
В некоторых воплощениях все единичные дозы в рамках схемы вводят внутривенно в течение периода, который меньше или равен примерно одному часу. В некоторых воплощениях только некоторые из единичных доз в рамках схемы вводят в течение периода, который меньше или равен примерно одному часу. В некоторых воплощениях одну или нескольких единичных доз в рамках схемы вводят, используя иной путь введения, нежели внутривенное введение (например, оральный, подкожный, назальный, местный и т.д.).
Ускоренные схемы введения дозировок соединения I могут вводиться без существенного увеличения токсичности или нежелательных явлений, в частности, серьезных нежелательных явлений, по сравнению со сравнимой схемой (например, со схемой, идентичной в других отношениях), в которой индивидуальные единичные дозы вводят внутривенно в течение 4-часового периода. Ускоренные схемы введения дозировок могут вводиться без существенного увеличения токсичности или нежелательных явлений, в частности, серьезных нежелательных явлений, по сравнению со стандартной схемой введения соединения I, вводимого путем 4-часовой внутривенной инфузии дозы приблизительно в 6-14 мг/м2 в дни 1-й, 8-й и 15-й 28-дневного цикла.
В некоторых воплощениях соединение I вводят в ускоренном режиме дозирования, который идентичен стандартному режиму дозирования (см. выше), за исключением того, что одну или нескольких единичных доз вводят в течение временнóго периода, составляющего менее чем приблизительно 1 час (например, вместо того, чтобы вводить в течение временного периода, составляющего приблизительно 4 часа).
В некоторых воплощениях единичные дозы соединения I находятся в интервале от приблизительно 0,5 мг/м2 до приблизительно 28 мг/м2. В некоторых воплощениях единичные дозы находятся в интервале от приблизительно 1 мг/м2 до приблизительно 25 мг/м2. В некоторых воплощениях единичные дозы находятся в интервале от приблизительно 0,5 мг/м2 до приблизительно 15 мг/м2. В некоторых воплощениях единичные дозы находятся в интервале от приблизительно 1 мг/м2 до приблизительно 15 мг/м2. В некоторых воплощениях единичные дозы находятся в интервале от приблизительно 1 мг/м2 до приблизительно 8 мг/м2. В некоторых воплощениях единичные дозы находятся в интервале от приблизительно 0,5 мг/м2 до приблизительно 5 мг/м2. В некоторых воплощениях единичные дозы находятся в интервале от приблизительно 2 мг/м2 до приблизительно 10 мг/м2. В некоторых воплощениях единичные дозы находятся в интервале от приблизительно 10 мг/м2 до приблизительно 20 мг/м2. В некоторых воплощениях единичные дозы находятся в интервале от приблизительно 5 мг/м2 до приблизительно 10 мг/м2. В некоторых воплощениях единичные дозы находятся в интервале от приблизительно 10 мг/м2 до приблизительно 15 мг/м2. В некоторых воплощениях единичные дозы составляют от приблизительно 6 до приблизительно 19 мг/м2. В некоторых воплощениях единичные дозы составляют приблизительно 8 мг/м2. В других воплощениях единичные дозы составляют приблизительно 9 мг/м2. В других воплощениях единичные дозы составляют приблизительно 10 мг/м2. В других воплощениях единичные дозы составляют приблизительно 11 мг/м2. В других воплощениях единичные дозы составляют приблизительно 12 мг/м2. В других воплощениях единичные дозы составляют приблизительно 13 мг/м2. В других воплощениях единичные дозы составляют приблизительно 14 мг/м2. В других воплощениях единичные дозы составляют приблизительно 15 мг/м2. В других воплощениях единичные дозы составляют приблизительно 30 мг/м2.
В некоторых воплощениях различные индивидуальные единичные дозы в рамках схемы терапии на основе соединения I отличаются друг от друга. В некоторых воплощениях в течение цикла вводят увеличивающиеся дозы соединения I. В некоторых воплощениях вводят дозу приблизительно в 8 мг/м2, с последующей дозой приблизительно в 10 мг/м2, затем в рамках цикла можно ввести дозу приблизительно 12 мг/м2.
Количество соединения I, вводимого в индивидуальных единичных дозах, варьирует в зависимости от формы соединения I, которую предполагается вводить. Приведенные здесь дозировки являются эквивалентами доз в отношении активного ингредиента, соединения I.
В некоторых воплощениях индивидуальные единичные дозы соединения I вводят в такой день, когда в течение нескольких предыдущих дней соединение I не вводилось. В некоторых воплощениях соединение I вводят два раза в неделю. В некоторых воплощениях соединение I вводят один раз в неделю. В других воплощениях соединение I вводят один раз в две недели.
В некоторых воплощениях соединение I вводят ежедневно (например, в течение 2 недель), дважды в неделю (например, в течение 4 недель), трижды в неделю (например, в течение 4 недель), или в виде любой из множества других промежуточных схем (например, на дни 1-й, 3-й и 5-й; на дни 4-й и 10-й; на дни 1-й и 15-й; на дни 5-й и 12-й; или на дни 5-й, 12-й и 19-й из 21-дневного или 28-дневного циклов).
В некоторых воплощениях соединение I вводят в 1-й, 8-й и 15-й дни 28-дневного цикла. В некоторых конкретных воплощениях дозу соединения I в 8 мг/м2 вводят в день 1-й, a дозу соединения I в 10 мг/м2 вводят на 8-й день, и дозу соединения I в 12 мг/м2 вводят на 15-й день. В некоторых воплощениях соединение I вводят в дни 1-й и 15-й 28-дневного цикла, пропуская 8-й день. 28-Дневный цикл дозирования может быть повторен. В некоторых воплощениях 28-дневный цикл повторяют 2-10, 2-7, 2-5 или 3-10 раз. В некоторых воплощениях указанное лечение включает 5 циклов. В некоторых воплощениях лечение включает 6 циклов. В некоторых воплощениях лечение включает 7 циклов. В некоторых воплощениях такое лечение включает 8 циклов. В некоторых воплощениях вводят 10 циклов. В некоторых воплощениях вводят более 10 циклов.
В некоторых воплощениях одна или несколько единичных доз в рамках схемы введения доз соединения I могут быть введены с использованием другого пути, нежели внутривенный путь введения. В некоторых воплощениях одна или несколько доз могут быть введены оральным путем. В некоторых воплощениях соединение I вводят оральным путем в интервале доз от 10 мг/м2 до 300 мг/м2. В некоторых воплощениях соединение I вводят оральным путем в интервале доз от 25 мг/м2 до 100 мг/м2. В некоторых воплощениях соединение I вводят оральным путем в интервале доз от 100 мг/м2 до 200 мг/м2. В некоторых воплощениях соединение I вводят оральным путем в интервале доз от 200 мг/м2 до 300 мг/м2. В некоторых воплощениях соединение I вводят оральным путем в дозах, составляющих более чем 300 мг/м2. В некоторых воплощениях соединение I вводят оральным путем в интервале доз от 50 мг/м2 до 150 мг/м2. В других воплощениях интервал оральных доз составляет от 25 мг/м2 до 75 мг/м2.
В некоторых воплощениях соединение I вводят оральным путем на ежедневной основе. В некоторых воплощениях соединение I вводят оральным путем через день. В других воплощениях соединение I вводят оральным путем каждый третий, четвертый, пятый или шестой день. В некоторых воплощениях соединение I вводят оральным путем один раз в неделю. В некоторых воплощениях соединение I вводят оральным путем один раз в две недели.
В некоторых воплощениях одну или несколько единичных доз соединения I вводят местно.
Как будет понятно специалистам в данной области, дозировка, времена и/или пути введения конкретных единичных доз соединения I могут варьировать в зависимости от конкретного пациента и состояния, подлежащего лечению. В некоторых воплощениях указанные циклы продолжают проводить до тех пор, пока пациент отвечает на лечение. Терапию можно прекратить сразу же, как только будет отмечено прогрессирование заболевания, достигнуто излечение или состояние ремиссии или же если побочные эффекты станут нестерпимыми. Неблагоприятные побочные эффекты могут также служить сигналом к снижению дозировки вводимого соединения I или к тому, чтобы откорректировать схему введения дозировок.
Токсичность и неблагоприятные побочные эффекты соединения I
Соединение вводили пациентам в целом ряде различных клинических случаев и исследований. Наблюдаемые проявления токсичности включали утомляемость, тошноту, рвоту и миелосупрессию (тромбоцитопения и/или нейтропения, например, 3 степени). Неспецифические изменения S-T-сегмента на ЭКГ и удлинение интервала QTc имели место у многих пациентов. Выраженность наблюдаемых проявлений токсичности была от слабой до умеренной. Наблюдаемые изменения ЭКГ не коррелировали с повышением последовательных уровней тропонина в сыворотке крови и результатами сканирования при многопроекционном радиоизотопном исследовании сердца (MUGA), причем оба из указанных показателей соответствовали норме.
В начале разработки при проведении клинических исследований соединения I имели место 6 смертельных случаев (из более чем 450 пациентов). Во всех случаях смерти, кроме одного, были существенные факторы риска сердечно-сосудистых заболеваний, которые либо уже имелись во время начала исследования эффектов соединения I, либо появлялись в процессе данного исследования. У шестого пациента в истории болезни был саркоидоз, и он одновременно принимал другое лекарственное средство, о котором известно, что оно вызывает удлинение интервала QTc.
Гематологические эффекты
Введение соединения I может вызвать нейтропению и/или тромбоцитопению. Обычно рекомендуется отказывать в дальнейшем лечении пациентам с нейтропенией или тромбоцитопенией 3 или 4 степени, пока их специфическая цитопения не вернется на уровень 1 степени (то есть пока их показатель ANC не восстановится до уровней >1,9×109/л, а количество тромбоцитов не восстановится до уровней ≥75×109/л) или ниже, при котором терапия может быть продолжена в полной дозе. Если степень 4 нейтропении или тромбоцитопении длится более 5 дней или связана с кровотечением, тогда обычно рекомендуют отказывать в лечении, пока специфическая цитопения не вернется на уровень 1-й степени или ниже, при котором терапия может быть продолжена, предпочтительно, в уменьшенной дозе (например, 10 мг/м2). Если наблюдается 4 степень пиретической (≥38,5°C) нейтропении или тромбоцитопении, которая требует трансфузии тромбоцитов, тогда обычно рекомендуют отказать в лечении, пока специфическая цитопения не вернется на уровень 1-й степени или ниже, при котором терапию можно продолжить, предпочтительно, в уменьшенной дозе (например, 10 мг/м2).
Степень выраженности наблюдаемых гематологических эффектов, как правило, составляла приблизительно 21-52% при стандартных режимах дозирования соединения I (National Cancer Institute IND 57,810 Annual Report, 2007). Например, в годовом отчете NCI 2007 предлагаются следующие оценки в отношении выраженности следующих аномалий крови и костного мозга: тромбоциты (52%), гемоглобин/анемия (41%), аномальное количество белых клеток крови (39%), аномальное отношение ANC/AGC (37%) и лимфопения (21%) (National Cancer Institute IND 57,810 Annual Report, 2007).
Явления со стороны сердца
Явления, наблюдаемые со стороны сердца в связи с введением соединения I, могут включать любой или все из нижеследующих эффектов:
- Удлинение интервала QTc, достигающее ≥500 мсек, или увеличение, достигающее ≥60 мсек, считая от исходного уровня, наблюдаемого после предварительной обработки для проведения данного цикла лечения;
- Вентрикулярную аритмию (то есть вентрикулярную тахикардию или вентрикулярную фибрилляцию (≥3 ударов подряд));
- Синусовую тахикардию (пульс >140/мин после лежачего положения);
- Новое возникновение предсердных аритмий (SVT, фибрилляция предсердий или трепетание предсердий), изменения ST и зубца Т свидетельствуют о реполяризационных нарушениях или ишемии (например, депрессия ST ≥2 мм [измеряется от изоэлектрической линии до сегмента ST] и/или инверсия зубца T≥4 мм [измеряется от изоэлектрической линии до пика зубца Т], при том, что главный вектор QRS положителен).
В литературе сообщается, что среднее изменение по сравнению с исходным QTc составляет 16,5 миллисекунды (см., Piekarz et al., Clin Cancer Res 12: 3762, 2006). В таблице 2 представлены общие рекомендации по модификации доз для случаев, когда наблюдаются явления со стороны сердца.
|
Явления со стороны сердца обычно наблюдаются при степени выраженности приблизительно 24% при стандартных режимах дозирования соединения I (National Cancer Institute IND 57,810 Annual Report, 2007).
Желудочно-кишечные явления
Желудочно-кишечные явления обычно наблюдаются при степени выраженности приблизительно 15-64% при стандартных режимах дозирования соединения I (National Cancer Institute IND 57,810 Annual Report, 2007). Например, в годовом отчете NCI 2007 предлагаются следующие оценки в отношении выраженности следующих явлений со стороны желудочно-кишечного тракта: тошнота (64%), анорексия (39%), рвота (39%), запоры (19%), дисгевзия (18%) и диарея (15%) (National Cancer Institute IND 57,810 Annual Report, 2007).
Соединение I можно вводить в ускоренных дозовых режимах без клинически заметного нарастания связанной с этим токсичности (например, в степени выраженности и/или тяжести одной или нескольких ограничивающих дозу токсичностей, тяжелых нежелательных явлений и/или побочных эффектов). В некоторых воплощениях предложены ускоренные режимы дозирования соединения I, при которых степень выраженности наблюдаемых токсических эффектов (например, утомляемости, гематологических проявлений токсичности, проявлений токсичности со стороны сердца, проявлений токсичности со стороны желудочно-кишечного тракта, общей системной токсичности или их сочетаний) не намного выше, чем токсичность, наблюдаемая при сопоставимом режиме дозирования, который отличается только тем, что единичные дозы соединения I вводят внутривенно в течение периода, составляющего приблизительно 4 часа. В некоторых воплощениях предложены ускоренные режимы дозирования соединения I, при которых степень выраженности наблюдаемой токсичности не значительно выше, чем токсичность, наблюдаемая при проведении терапии на основе соединения I по стандартной схеме.
В некоторых воплощениях предложены ускоренные режимы дозирования соединения I, при которых субъект, которому вводят соединение I, не страдает от одного или нескольких конкретных побочных явлений или серьезных побочных явлений в назначенный период. В некоторых воплощениях указанным назначенным периодом является период проведения ускоренного режима дозирования. В некоторых воплощениях указанный назначенный период составляет от приблизительно 2 до приблизительно 6 часов после окончания инфузии ускоренной дозы. В некоторых воплощениях назначенным периодом является промежуток времени, составляющий приблизительно 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40 42, 44, 46, 48 или более часов после окончания инфузии ускоренной дозы.
В назначенном периоде может отсутствовать любой побочный эффект, токсичность или нежелательное явление. В некоторых воплощениях, показатель QTc у субъекта в течение назначенного периода остается ниже, чем приблизительно 500 мсек; в некоторых воплощениях субъект в течение назначенного периода не страдает от вентрикулярной аритмии; в некоторых воплощениях субъект в течение назначенного периода не страдает от синусовой тахикардии; в некоторых воплощениях субъект в течение назначенного периода не страдает от предсердной аритмии; в некоторых воплощениях субъект в течение назначенного периода не страдает от изменений сегмента ST или зубца T, свидетельствующих о реполяризации.
Комбинированная терапия
В некоторых воплощениях соединение I вводят в сочетании с одним или несколькими другими фармацевтическими средствами. В некоторых воплощениях соединение I вводят в сочетании с одним или несколькими другими химиотерапевтическими средствами и/или в сочетании с одним или несколькими другими фармацевтическими средствами (например, болеутоляющими лекарственными средствами, противовоспалительными лекарственными средствами, антибиотиками, стероидными средствами, антифолатами, киназными ингибиторами, ингибиторами метилтрансферазы, антителами и т.п.).
В определенных воплощениях соединение I вводят в сочетании с одним или несколькими цитотоксическими средствами. Характерные цитотоксические средства включают, но не ограничиваясь этим, гемцитабин, децитабин и флавопиридол. В опеделенных воплощениях соединение I вводят в сочетании с одним или несколькими таксанами и/или с одним или несколькими протеасомными ингибиторами. Характерные протеасомные ингибиторы включают, но не ограничиваясь этим, бортезомиб (VELCADE®), пептидные боронаты, салиноспорамид A (NPI-0052), лактацистин, эпоксомицин (Ac(Me)-Ile-Ile-Thr-Leu-EX), MG-132 (Z-Leu-Leu-Leu-al), PR-171, PS-519, эпонемицин, аклациномицин A, CEP-1612, CVT-63417, PS-341 (пиразил-карбонил-Phe-Leu-боронат), PSI (Z-Ile-Glu(OtBu)-Ala-Leu-al), MG-262 (Z-Leu-Leu-Leu-bor), PS-273 (MNLB), омуралид (класто-лактацистин-β-лактон), NLVS (Nip-Leu-Leu-Leu-винилсульфон), YLVS (Tyr-Leu-Leu-Leu-vs), дигидроэпонемицин, DFLB (дансил-Phe-Leu-боронат), ALLN (Ac-Leu-Leu-Nle-al), 3,4-дихлоризокумарин, 4-(2-аминоэтил)бензолсульфонилфторид, TMC-95A, глиотоксин, EGCG ((-)-эпигаллокатехин-3-галлат), YUlOl (Ac-hFLFL-ex) и их сочетания.
В определенных воплощениях соединение I вводят в сочетании с одним или несколькими антифолатами. В некоторых таких воплощениях соединение I вводят в сочетании с одним или несколькими из следующих веществ: формилтетрагидрофолиевой кислотой (лейковорин), метотрексатом, пралатрексатом, премекстредом, триазинатом или их сочетаниями.
В определенных воплощениях киназными ингибиторами (например, ингибиторами тирозинкиназы). В некоторых воплощениях соединение I вводят в сочетании с одним или несколькими антителами, которые действуют в качестве киназных ингибиторов. В некоторых воплощениях соединение I вводят в сочетании с одним или несколькими из ABT-869, AC220, AZD7762, BIBW 2992, BMS-690154, CDKIAT7519, CYC 116, ISIS3521, GSK690693, GSK-461364, MK-0457, MLN8054, MLN8237, MP470, ON 01910.Na, OSI-930, PHA-739358, R935788, SNS-314, TLN-232, XL147, XL228, XL281, XL418 или XL765.
В определенных воплощениях соединение I вводят в сочетании с одним или несколькими метилтрансферазными ингибиторами.
В определенных воплощениях соединение I вводят в сочетании с одним или несколькими терапевтическими антителами. В некоторых воплощениях соединение I вводят в сочетании с одним или несколькими из следующих средств: бевацизумабом, цетуксимабом, дазатинибом, эрлотинибом, гефтинибом, иматинибом, лапатинибом, нилотинибом, панитумумабом, пегаптанибом, ранибизумабом, сорафенибом, сунитинибом, трастузумабом или с любым антителом, которое связывается с антигеном, связанным с одним из указанных веществ.
В некоторых воплощениях соединение I вводят в сочетании с противовоспалительным лекарственным средством, болеутоляющим лекарственным средством, противотошнотным или антипиретическим лекарственным средством. Противовоспалительные лекарственные средства, применимые в предлагаемых здесь способах, включают, но не ограничиваясь этим, аспирин, ибупрофен и ацетаминофен и т.д.
В определенных воплощениях соединение I вводят в сочетании со стероидным средством. В определенных воплощениях соединение I вводят в сочетании со стероидным средством, выбранным из группы, состоящей из алклометазона дипропионата, амцинонида, беклометазона дипропионата, бетаметазона, бетаметазона бензоата, бетаметазона дипропионата, бетаметазона натрия фосфата, бетаметазона натрия фосфата и ацетата, бетаметазона валерата, клобетазола пропионата, клокортолона пивалата, кортизола (гидрокортизон) ацетата, кортизола (гидрокортизон) бутирата, кортизола (гидрокортизон) ципионата, кортизола (гидрокортизон) натрия фосфата, кортизола (гидрокортизон) натрия сукцината, кортизола (гидрокортизон) валерата, кортизона ацетата, дезонида, дезоксиметазона, дексаметазона, дексаметазона ацетата, дексаметазона натрия фосфата, дифлоразона диацетата, флудрокортизона ацетата, флунизолида, флуоцинолона ацетонида, флуоцинонида, фторометолона, фторандренолида, галцинонида, медризона, метилпреднизолона, метилпреднизолона ацетата, метилпреднизолона натрия сукцината, мометазона фуроата, параметазона ацетата, преднизолона, преднизолона ацетата, преднизолона натрия фосфата, преднизолона тебутата, преднизона, триамцинолона, триамцинолона ацетонида, триамцинолона диацетата, триамцинолона гексацетонида или их сочетания. В некоторых воплощениях соединение I вводят в сочетании с дексаметазоном.
В определенных воплощениях соединение I вводят в сочетании со средством для лечения желудочно-кишечных расстройств, таких как тошнота, рвота и диарея. Такие средства могут включать противорвотные, противодиарейные средства, средства, восстанавливающие потерю жидкости, возмещающие уровень электролитов, и т.п.
В определенных воплощениях соединение I вводят в сочетании со средством, возмещающим или дополняющим уровень электролитов, таких как калий, магний и кальций. В определенных воплощениях соединение I вводят в сочетании со средством, возмещающим или дополняющим уровень электролитов, таких как калий, магний.
В определенных воплощениях соединение I вводят в сочетании с антиаритмическим средством.
В определенных воплощениях соединение I вводят в сочетании со средством, которое увеличивает продукцию тромбоцитов.
В определенных воплощениях соединение I вводят в сочетании со средством для усиления продуцирования клеток крови. В определенных воплощениях указанным средством является эритропоэтин.
В некоторых воплощениях соединение I вводят в сочетании со средством для предотвращения гипергликемии.
В определенных воплощениях соединение I вводят в сочетании с другим ингибитором HDAC или DAC.
Дополнение электролитами
В некоторых воплощениях субъектам, получающим лечение на основе соединения I, назначают дополнение электролитами. Индивиды с низкими уровнями электролитов (например, с низкими уровнями калия и/или магния) подвержены развитию нежелательных побочных эффектов под действием терапии на основе соединения I (см., например, опубликованную заявку № US 2008/0124403, которая включена в настоящее описание в виде ссылки).
Такие пациенты могут быть особенно склонны к развитию сердечных эффектов реполяризации, включая удлинение QTc (хоть потенциально и без существенных изменений сердечных функций), и/или сердечных аритмий. Конкретные аномалии, которые могут наблюдаться, включают повышенный интервал QTc и/или аномалии сегмента ST (например, депрессия сегмента ST) и/или зубца T (например, сглаживание зубца T) на ЭКГ.
Индивид с концентрацией калия в сыворотке крови ниже приблизительно 3,5 ммоль/л (3,5 мг-экв/л) и/или с концентрацией магния в сыворотке крови ниже приблизительно 0,8 ммоль/л (1,95 мг-экв/л) страдает повышенным риском развития сердечных эффектов реполяризации и/или аритмий.
Обычно концентрации калия в сыворотке крови считаются "нормальными", когда они находятся в интервале приблизительно 3,5-5,5 мг-экв/л или приблизительно 3,5-5,0 мг-экв/л. Часто бывает необходимо убедиться в том, что концентрация калия в сыворотке крови индивида находится в этих пределах, до (и/или в процессе) проведения лечения на основе соединения I.
Концентрации магния в сыворотке крови обычно считаются "нормальными", когда они заключены в интервале приблизительно 1,5-2,5 мг-экв/л или приблизительно 1,5-2,2 мг-экв/л, или приблизительно 1,25-2,5 мг-экв/л, или приблизительно 1,25-2,2 мг-экв/л. Часто бывает необходимо убедиться в том, что концентрация магния в сыворотке крови индивида находится в этих пределах, до (и/или в процессе) проведения лечения на основе соединения I.
В некоторых воплощениях концентрация(-ии) калия и/или магния в сыворотке крови индивида находится на верхней границе нормы до (и/или в процессе) проведения лечения на основе соединения I. В некоторых воплощениях концентрация калия в сыворотке крови индивида составляет по меньшей мере приблизительно 3,8 мг-экв/л, 3,9 мг-экв/л, 4,0 мг-экв/л или более до и/или в процессе проведения лечения на основе соединения I. В некоторых воплощениях предпринимаются меры предосторожности, чтобы концентрация калия в сыворотке крови не увеличивалась выше приблизительно 5,0 мг-экв/л, 5,2 мг-экв/л, или 5,5 мг-экв/л. В некоторых воплощениях концентрация магния в сыворотке крови индивида составляет по меньшей мере приблизительно 1,9 мг-экв/л или более до и/или в процессе проведения лечения на основе соединения I. В некоторых воплощениях предпринимаются меры предосторожности, чтобы концентрация магния в сыворотке крови не увеличивалась выше приблизительно 2,5 мг-экв/л.
В некоторых воплощениях настоящего изобретения, концентрация калия в сыворотке крови индивида составляет по меньшей мере приблизительно 3,5 мг-экв/л (в некоторых воплощениях по меньшей мере приблизительно 3,8 мг-экв/л, 3,9 мг-экв/л, 4,0 мг-экв/л, или выше), а концентрация магния в сыворотке крови индивида составляет по меньшей мере приблизительно 1,85 мг-экв/л (в некоторых воплощениях по меньшей мере приблизительно 1,25 мг-экв/л, 1,35 мг-экв/л, 1,45 мг-экв/л, 1,55 мг-экв/л, 1,65 мг-экв/л, 1,75 мг-экв/л, 1,85 мг-экв/л, 1,95 мг-экв/л или выше) до и/или в процессе проведения лечения на основе соединения I.
В некоторых воплощениях уровни электролитов (например, уровни калия и/или магния, необязательно уровни кальция) в процессе проведения курса терапии на основе соединения I определяют более одного раза; в некоторых воплощениях разные определения разделены регулярными интервалами (например, в 0,5 дней или менее, в 1 день, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней, 8 дней, 9 дней, 10 дней, 11 дней, 12 дней, 13 дней, 14 дней, 1 месяц, 2 месяца, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев, и т.д.). В некоторых воплощениях уровни электролитов определяют перед каждым введением соединения I.
Уровни калия и/или магния в сыворотке крови индивида и/или концентрация(-ии) других электролитов могут быть установлены доступными путями. Например, образцы могут быть получены из венозной или артериальной крови и обработаны для анализа плазмы или сыворотки. В некоторых воплощениях используются венозные образцы. Для определения может быть использован любой доступный анализ. В некоторых воплощениях калий определяют методом пламенной фотометрии, прямой потенциометрии (см., например, Koch et al, Clin. Chem. 29: 1090, 1983), ферментативными методами (например, с использованием триптофаназы; см., например, Kimura et al, Clin. Chem. 38:44, 1992), колориметрическими методами (например, с использованием тетрафенилбората), и т.д. В некоторых воплощениях магний определяют путем комплексометрического титрования, методом эмиссионной фотометрии пламени, методом атомно-абсорбционной спектрофотометрии, другими спектрофотометрическими методами, включая ферментативные технологии и методы связывания красителей (например, методом связывания красителя Magnon и бихроматического поглощения; см., например, Barbour et al., Clin. Chem. 34: 2103, 1988; методом устранения интерференции посредством билирубина; см., например, Rehak et al., Clin. Chem 35: 1031, 1989; и т.д.). Во многих воплощениях анализы проводятся в автоматизированном клиническом химическом анализаторе (например, Abbott ARCHITECT®, и др.).
Когда оценивают уровни и калия, и магния, они могут быть оценены по отдельности или вместе. Оценка уровней калия и/или магния может быть предпринята до, во время и/или после начала лечения на основе соединения I.
В некоторых воплощениях, если у индивида в сыворотке крови определяется концентрация(-ии) калия и/или магния, которая(-ые) ниже нормы или ниже верхней границы нормы, как описано в настоящей заявке, добавку калия и/или магния назначают до, во время или после начала терапии на основе соединения I. В некоторых воплощениях терапию на основе соединения I задерживают или откладывают до тех пор, пока уровни калия и/или магния в сыворотке крови повысятся. В некоторых воплощениях терапию на основе соединения I задерживают или откладывают до тех пор, пока уровни калия и/или магния в сыворотке крови повысятся до уровня, попадающего в рамки интервала нормальных значений, или до верхней границы нормального интервала. В некоторых воплощениях терапию на основе соединения I задерживают или откладывают до тех пор, пока концентрация калия в сыворотке крови не станет выше, чем приблизительно 3,5 мг-экв/л; или выше, чем приблизительно 3,8 мг-экв/л. В некоторых воплощениях терапию на основе соединения I задерживают или откладывают до тех пор, пока концентрация магния в сыворотке крови не станет выше, чем приблизительно 1,25 мг-экв/л; или выше, чем приблизительно 1,8 мг-экв/л; или выше, чем приблизительно 1,9 мг-экв/л. В некоторых воплощениях терапию на основе соединения I задерживают или откладывают до тех пор, пока повысятся, как описано, и концентрация калия в сыворотке крови, и концентрация магния в сыворотке крови.
В некоторых воплощениях дополнение электролитами можно вводить до, одновременно и/или после начала терапии на основе соединения I, и такое дополнение может включать калий и/или магний. В некоторых воплощениях дополнение электролитами может включать дополнение одним или несколькими электролитами, выбранных из группы, состоящей из натрия, калия, хлора, кальция, магния, бикарбоната, фосфата, сульфата и их сочетаний.
Доступен целый ряд различных форм дополнения калием (см., например, web-сайт со следующим электронным адресом в Интернете: pdrhealth.com). Например, могут быть легко получены дополнения калием в виде хлорида калия, цитрата калия, глюконата калия, бикарбооната калия, аспартата калия и/или оротата калия.
Одной из форм дополнения калием являются овощные соки с высоким содержанием калия (вплоть до 800 мг на порцию), с низким содержанием натрия. Калием богаты некоторые безалкогольные напитки. Некоторые безалкогольные напитки содержат глюконат калия, у которого менее горький вкус, чем у некоторых других калиевых добавок. Много калия содержится в заместителях соли.
Определенные продукты питания, богатые калием, такие как изюм, инжир, абрикосы, сардины, телятина, бананы, авокадо и брокколи, могут быть использованы в качестве калиевых добавок. Продукты питания, богатые калием, могут обеспечивать потребность в калии, который легко усваивается и/или может снижать побочные эффекты со стороны желудочно-кишечного тракта, ассоциированные с введением солей калия. Калиевая добавка может быть представлена также в виде части поливитаминного препарата.
Обычно калий доставляется орально или внутривенно, хотя другие способы доставки также входят в объем, охватываемый настоящим изобретением.
Определенные коммерчески доступные формы калиевых добавок включают, например, ацетат калия (например, 2 мг-экв/мл или 4 мг-экв/мл для инъекций); ацетат калия (например, 75 мг, 95 мг, 99 мг и 180 мг в таблетках и/или 2 мг-экв/мл, 10 мг-экв/50 мл, 20 мг-экв/50 мл, 10 мг-экв/100 мл, 20 мг-экв/100 мл, 30 мг-экв/100 мл, 40 мг-экв/100 мл для инъекций и/или 20 мг-экв/15 мл, 40 мг-экв/15 мл жидкости, и/или 20 мг-экв или 25 мг-экв порошка для разбавления, и/или 9 мг-экв, 10 мг-экв, или 20 мг-экв в таблетках с замедленным высвобождением), а также глюконат калия (например, 486 мг, 500 мг, 550 мг, 595 мг, 610 мг и 620 мг, в таблетках).
Доступен целый ряд различных форм дополнения магнием. Например, могут быть легко получены дополнения магнием в виде хлорида магния, глюконата магния, лактата магния, оксида магния и/или сульфата магния.
Определенные продукты питания, богатые магнием, такие как артишоки, бананы, инжир, миндаль, кешью, кедровые орехи, бразильские орехи, бобы, шпинат и помидоры, могут быть использованы в качестве магниевых добавок. Магниевая добавка также может быть представлена в виде части поливитаминного препарата.
Определенные коммерчески доступные формы магниевых добавок включают хлорид магния (например, 200 мг/мл, для инъекций, 535 мг в таблетках с замедленным высвобождением), глюконат магния (3,25 мг/мл, 1000 мг/5 мл жидкости; 500 мг в таблетках); лактат магния (84 мг в таблетках с замедленным высвобождением); оксид магния (например, 140 мг, 600 мг в капсулах, в порошке и/или 200 мг, 250 мг, 400 мг, 420 мг и 500 мг в таблетках), сульфат магния (например, 40 мг/мл, 80 мг/мл, 125 мг/мл, 500 мг/мл для инъекций).
В некоторых воплощениях дополнение электролитами вводят в количестве, достаточном для уменьшения или отсрочивания начала одной или нескольких кардиотоксичностей, связанных с терапией на основе соединения I. В некоторых воплощениях введение электролита может ослабить также одно или нескольких из таких проявлений как тошнота, рвота, утомляемость (вялость, чувство беспокойства, астения), повышенный уровень креатинфосфокиназы (CPK), гиперурикемия, гипокальциемия, гипергликемия, лихорадка, гастрит, диарея, абдоминальная боль, дегидратация, потеря массы, гипофосфатемия, гипонатриемия, гипокалиемия, гипомагнезиемия, синкопа, гипоксия, плевральная эффузия, гипотензия, ишемия миокарда, повышенный уровень сердечного тропонина I, спутанность сознания и/или миелосупрессия, а также их сочетания.
В некоторых воплощениях токсические эффекты в отношении сердца выбраны из группы, состоящей из регулируемого частотой сердечных сокращений удлинения интервала QT (QTc), суправентрикулярных аритмий (суправентрикулярная тахикардия (SVT)/фибрилляция/трепетание предсердий), а также их сочетания. В некоторых воплощениях удлинение QTc и/или другие электрофизиологические изменения после дополнения электролитами снижаются до нормальных значений или попадают в интервал нормальных показателей.
Если специально не оговорено иначе, все используемые здесь технические и научные термины соответствуют значениям, обычно известным специалистам в данной области. Все публикации, патенты, опубликованные патентные заявки и другие указанные здесь источники в полном объеме включены в настоящее описание в виде ссылок. Воплощения, описанные в настоящей заявке, не следует расценивать как взаимоисключающие, и их можно использовать в сочетании друг с другом.
ПРИМЕРЫ
Общие процедуры для определения характеристик твердых форм
Предложен ассортимент характеристической информации для описания форм соединения I. Следует понимать, однако, что не все эти сведения необходимы специалисту в данной области для того, чтобы определить, что именно такая конкретная форма присутствует в данной композиции, но что определение конкретной формы может быть достигнуто при использовании любой части характеристической информации, которую специалист в данной области сочтет достаточной для установления наличия конкретной формы, например, даже одного отличительного пика может быть достаточно специалисту в данной области, чтобы установить, что такая конкретная форма присутствует. Фармакопея Соединенных Штатов (USP) предлагает дополнительное руководство в отношении определения характеристик кристаллических форм (см. X-Ray Diffraction, <941>. United States Pharmacopeia, 31st ed. Rockville, MD: United States Pharmacopeial Convention; 2008: 372-374), которое включено в настоящее описание в виде ссылки.
Материалы
Растворители, если не указано иное, были либо HPLC-категории, либо ACS-категории. Образцы были получены их твердых форм А соединения I или из образцов, полученных из указанных твердых форм. Обозначение таких материалов было основано на дифракции рентгеновских лучей (XRPD). Если не указано иное, для защиты образцов от света предпринимались специальные меры. Перед снятием характеристических данных твердые формы хранили в следующих условиях: форму A и форму B (которая могла содержать также и твердую форму A) хранили в условиях окружающей среды, форму E и форму H в процессе обезвоживания хранили в морозильной камере, форму C в контакте с маточной жидкостью хранили в холодильнике, форму D в контакте с маточной жидкостью хранили в морозильной камере, а форму I в контакте с маточной жидкостью хранили в условиях окружающей среды или в морозильной камере. По причине кажущейся нестабильности формы D все характеристические данные, за исключением спектроскопии протонного ядерного магнитного резонанса в растворе (1Н-ЯМР), для формы D собирали в один и тот же день. Хотя анализ 1Н-ЯМР был запущен только через несколько дней, раствор для анализа готовили в тот же самый день, когда собирали все остальные характеристические данные.
Инструментальные технологии
Оптическая микроскопия
Оптическую микроскопию выполняли, используя стереомикроскоп Leica MZ12.5. Образцы просматривали in situ или на предметном стекле (иногда покрытым маслом Paratone-N) со скрещенными поляризаторами и красным компенсатором первого порядка. Были использованы различные объективы, начиная от 0,8-10×.
Дифракция рентгеновских лучей (XRPD) (Inel)
Образцы XRPD собирали с помощью дифрактометра Inel XRG-3000, оснащенного изогнутым позиционно-чувствительным детектором с 2θ в диапазоне 120º. Падающий пучок излучения Cu Kα (40 кВ, 30 мА) использовали для сбора данных в режиме реального времени с разрешением в 0,03º 2θ. До анализа исследовали силиконовый стандарт (NIST SRM 640c) на предмет верификации положения пика Si 111. Образцы подготавливали для анализа путем упаковки их в тонкостенные стеклянные капилляры. Каждый капилляр устанавливали на гониометрическую головку и вращали во время сбора данных. Щель монохроматора устанавливали на 5 мм по 160 мкм. Параметры сбора данных для каждого образца отображали над изображением в окошке для ввода данных.
Трансмиссия дифрактометра PANalytical
Рентгенограммы XRPD собирали с помощью дифрактометра PANalytical X'Pert Pro. Падающий пучок излучения Cu Kα продуцировали с помощью длинного, остро сфокусированного источника Optix. Эллиптически отградуированное многослойное зеркало было использовано для фокусировки Cu Kα X-лучей источника через образец и на детектор. Данные собирали и изучали с помощью программного обеспечения по сбору данных X'Pert Pro (v.2.2b). До анализа исследовали кремниевый стандарт (NIST SRM 640c) на предмет верификации положения пика Si 111. Образец зажимали между пленками толщиной в 3 мкм, анализировали с помощью геометрии трансмиссии и вращали, чтобы оптимизировать статистику ориентации. Для минимизации фона, порожденного рассеянием воздуха, был использован стоячий пучок (иногда с газом гелием). Для падающего и дифрагированного пучков были использованы щели Соллера, чтобы свести к минимуму осевую дивергенцию. Дифрактограммы собирали с помощью сканирующего позиционно-чувствительного детектора (X'Celerator), расположенного в 240 миллиметрах от образца.
Отражение дифрактометра PANalytical
Рентгенограммы XRPD собирали с помощью дифрактометра PANalytical X'Pert Pro. Падающий пучок излучения Cu Kα продуцировали с помощью керамической трубки с длинным, остро сфокусированным источником и никелевым фильтром. Дифрактометр был отконфигурирован с использованием симметричной геометрии Брегга-Брентано со стадией отражения и управляемым вручную счетчиком. Данные собирали и изучали с помощью программного обеспечения X'Pert Pro Data Collector (v. 2.2b). До анализа исследовали кремниевый стандарт (NIST SRM 640c) на предмет верификации положения пика Si 111. Образец подготавливали в виде тонкого круглого слоя в центре кремниевого субстрата с нулевым фоном. Противорассеивающие щели были использованы для минимизации фона, порожденного рассеянием воздуха. Щели Соллера были использованы для падающего и дифрагированного пучков, чтобы свести к минимуму осевую дивергенцию. Дифрактограммы собирали с помощью сканирующего позиционно-чувствительного детектора (X'Celerator), расположенного в 240 миллиметрах от образца. Параметры сбора данных для каждого образца отображали над изображением в окошке для ввода данных.
Процесс идентификации пиков (XRPD)
Пики отбирали в интервале приблизительно вплоть до 30º 2θ. Различные алгоритмы округления были использованы для округления каждого пика с точностью до 0,1º или 0,01º 2θ, в зависимости от инструментов, используемых для сбора данных, и/или присущей дискретности пиков. Локализацию пиков вдоль оси Х (º2θ), как на фигурах, так и в таблицах, автоматически определяли с помощью соответствующего программного обеспечения (PatternMatchTM 3.0.4) и округляли до одной или двух значащих цифр после запятой на основе указанных выше критериев. Вариабельность положений пиков приведена с точностью ±0,1º 2θ на основе рекомендаций, изложенных в обсуждении USP изменчивости в дифракции рентгеновских лучей (Фармакопея Соединенных Штатов, USP 32, NF 27, Vol. 1, pg. 392, May 1, 2009 <941> X-Ray Diffraction). Для составления перечня расстояний d, длина волны, используемая для расчета расстояний d, составляла 1,541874 Å, средневзвешенная длин волн Cu-Kα1 и Cu-Kα2 (a. SSCI Laboratory Notebook 4005-87; b. Phys. Rev. A56(6) 4554-4568 (1997)). Вариабельность, ассоциированная с оценками расстояний d, была рассчитана на основе рекомендаций USP при каждом расстоянии d и приведена в таблицах с соответствующими данными.
Для образцов только с одним шаблоном XRPD и без каких-либо других средств для оценки того, обеспечивает ли образец хорошее приближение порошка в среднем, в таблицах пиков содержатся данные, идентифицируемые только как "выраженные пики". Эти пики являются подмножеством всего наблюдаемого перечня пиков. Выраженные пики выбраны из наблюдаемых пиков путем выявления предпочтительно неперекрывающихся, низкоугловых пиков с сильной интенсивностью.
Если имеется несколько дифракционных картин, тогда возможна оценка статистики частиц (PS) и/или их преимущественной ориентации (PO). Воспроизводимость между рентгенограммами XRPD из нескольких образцов, проанализированных на одном дифрактометре, означает, что статистики частиц являются адекватными. Сопоставимость относительной интенсивности между рентгенограммами XRPD из нескольких дифрактометров указывает на хорошую статистику ориентации. Альтернативно, наблюдаемую картину XRPD можно сравнить с характером вычисленной рентгенограммы XRPD на основе монокристаллической структуры, если она доступна. Образцы двумерного рассеяния, полученные с помощью индикаторов площади, могут быть использованы также для оценки PS/PO. Если эффекты обоих показателей, PS и PO, незначительны, то картина XRPD отражает среднюю порошковую интенсивность для данного образца, и выраженные пики могут быть идентифицированы как "репрезентативные пики".
"Характеристические пики" являются подгруппой репрезентативных пиков и используются для того, чтобы отличить один кристаллический полиморф от другого кристаллического полиморфа. Характеристические пики определяются путем оценки того, какие репрезентативные пики, если они есть, присутствуют в одном кристаллическом полиморфе соединения по сравнению со всеми остальными известными кристаллическими полиморфами указанного соединения с точностью до ±0,1º 2θ. Не все кристаллические полиморфы соединения обязательно должны иметь по меньшей мере один характеристический пик.
Дифференциальная сканирующая калориметрия (DSC)
Анализ DSC предпринимали с использованием дифференциального сканирующего калориметра TA Instruments Q2000. Температурную калибровку осуществляли с помощью NIST-эталонного металла индия. Образец помещали в алюминиевый кристаллизатор DSC, и точно регистрировали его массу. Кристаллизатор накрывали крышкой, а крышку гофрировали. Взвешенный гофрированный алюминиевый кристаллизатор помещали на ссылочной стороне ячейки. Кюветы с образцом уравновешивали при начальной температуре и нагревали при продувке азотом. Данные собранных параметров для термограммы отображали над изображением в окошке для ввода данных. Сообщаемыми температурами, если не указано иное, являются температуры в максимумах перехода.
Модулируемая дифференциальная сканирующая калориметрия (MDSC)
Данные MDSC были получены на дифференциальном сканирующем калориметре TA Instruments Q2000, оснащенном замороженной системой охлаждения (RCS). Температурную калибровку осуществляли с помощью NIST-эталонного металла индия. Образец помещали в DSC-кристаллизатор и точно регистрировали его массу. Кристаллизатор закрывали крышкой, перфорированной крошечным лазерным отверстием, и крышку гофрировали или же гофрировали, а затем герметически закрывали кристаллизатор. Взвешенный гофрированный алюминиевый кристаллизатор помещали на ссылочной стороне ячейки. Данные получали с помощью амплитуды модулирующего сигнала ±0,50ºC и 60-секундного периода с исходной скоростью нагревания в 2,00ºC/минуту от -50,00 до 200,00ºC. Представленные температуры стеклования получены из точки перегиба пошагового изменения в реверсивном тепловом потоке на кривой зависимости от температуры.
Термогравиметрический анализ (TGA)
TG-анализ осуществляли с помощью термогравиметрического анализатора TA Instruments 2050. Температурную калибровку осуществляли с помощью никеля и AlumelTM. Образец помещали в алюминиевый кристаллизатор и вставляли в термокамеру TG. В одном из воплощений кристаллизатор оставляли открытым. Кювету с образцом уравновешивали при начальной температуре, и термокамеру нагревали в атмосфере азота. В другом воплощении прибор работал в условиях потока гелия при 10 и 90 см3/мин для продувки и балансировки, соответственно, и термокамеру нагревали в атмосфере гелия со скоростью 20ºС/мин до конечной температуры 250ºС.
Инфракрасная спектроскопия (FT-IR)
В одном из воплощений FT-IR-спектры для описанных здесь твердых форм были получены на инфракрасном спектрофотометре Magna-IR 860® (FT-IR) с Фурье-преобразованием (Thermo Nicolet), оснащенном средним/дальним ИК-источником Ever-Glo, светоделителем с расширенной областью из бромида калия (KBr) и детектором из дейтерированного триглицинсульфата (DTGS). Некоторые FT-IR-спектры аморфных твердых форм были получены с помощью Nexus 670®, оснащенного таким же образом, как описано выше для Magna-IR 860®. Проверку длин волн для Magna-IR 860® и Nexus 670® осуществляли с помощью NIST SRM 1921b (по полистиролу). Для сбора данных использовали устройство для ослабленного полного внутреннего отражения (ATR) (ThunderdomeTM, Thermo Spectra-Tech) с кристаллом германия (Ge). Данные собранных параметров для каждого образца помещали над изображением в окошке для ввода данных. Набор исходных данных получали с чистого кристалла Ge. Log 1/R (R = отражение) спектр получали путем взятия отношения этих двух наборов данных друг относительно друга.
В другом воплощении FT-IR-спектры были получены на инфракрасном спектрофотометре Nexus 670® с Фурье-преобразованием (Thermo Nicolet), оснащенном средним/дальним ИК-источником Ever-Glo, светоделителем с расширенной областью из бромида калия (KBr) и детектором из дейтерированного триглицинсульфата (DTGS). Проверку длин волн осуществляли с помощью NIST SRM 1921b (по полистиролу). Для сбора данных использовали устройство для ослабленного полного внутреннего отражения (ATR) (ThunderdomeTM, Thermo Spectra-Tech) с кристаллом германия (Ge). Каждый спектр представляет собой 512 добавленных вместе сканов, регистрируемых при спектральной чувствительности 2 см-1. Набор исходных данных получали с чистого кристалла Ge. Log 1/R (R = отражение) спектр получали путем взятия отношение этих двух наборов данных относительно друг друга.
Положения пиков определяли с помощью стандартного спектрального программного обеспечения. Вариабельность положений пиков приведена с точностью ±2 см-1 на основе наблюдаемой остроты выбранных пиков и сбора данных с использованием интервала 1 см-1 точки на графике (разрешение 2 см-1). Достоверность и точность, ассоциированные с любым конкретным измерением, приводимым в настоящем документе, не были определены.
Ядерный магнитный резонанс (ЯМР)
Спектры протонного ядерного магнитного резонанса в растворе (1Н-ЯМР) были получены на спектрометре Varian UNTTY INOVA-400. Образцы готовили в виде растворов в дейтерированном диметилсульфоксиде (DMSO-d6).
Рамановская спектроскопия
Рамановские спектры были получены на спектрометре FT-Raman 960 (Thermo Nicolet), снабженном детектором из германия (Ge). Проверку длин волн осуществляли с помощью серы или циклогексана. Каждый образец подготавливали для анализа путем помещения указанного образца в покрытую золотом чашу диаметром в 13 мм и выравнивания уровня материала. Каждый спектр представляет собой 512 добавленных вместе сканов, регистрируемых при спектральной чувствительности 2 см-1.
ПРИМЕР 1: Общее получение соединения I
Различные способы получения и очистки соединения I были описаны в патенте США 4977138, опубликованном 11 декабря 1990, и в публикации международной заявки PCT WO 02/20817, поданной 22 августа 2001, каждая из которых в полном объеме включена в настоящее описание в виде ссылки.
В некоторых воплощениях было обнаружено, что продуцирование, очистка и/или хранение соединения I при кажущемся pH менее чем приблизительно 6,5 и/или при кажущемся значении pH приблизительно менее чем примерно 6,0, препятствует образованию димеризованного, олигомеризованного или полимеризованного соединения I, как описано в публикации патентной заявки США № US 20090186382, поданной 28 декабря 2007, которая включена в настоящее описание в виде ссылки. В одном из воплощений одну или несколько стадий очистки предпринимают при кажущемся pH менее чем 6,5. В другом воплощении одну или несколько стадий очистки предпринимают при кажущемся pH менее чем 6,0. В некоторых воплощениях одну или несколько стадий очистки предпринимают при кажущемся pH в области от 4,0 до 6,0. В некоторых воплощениях все стадии очистки проводят при кажущемся pH в интервале от приблизительно 4,0 до приблизительно 6,0. Чтобы предотвратить образование нежелательных загрязнений, не допускают, чтобы кажущееся значение pH раствора, содержащего соединение I, достигало кажущегося значения pH выше приблизительно 7,0 или более предпочтительно выше приблизительно 6,0. Предпочтительно, чтобы кажущееся значение pH всех процессов очистки подвергалось мониторингу и, если потребуется, последующему доведению до кажущегося значения pH ниже приблизительно 6,0. В некоторых воплощениях оно поддерживается в области кажущегося значения pH от приблизительно 4,0 до приблизительно 6,0. Контроль кажущегося значения pH при стадиях очистки ближе к концу процесса или стадиях, проводимых с использованием водных растворов, как было показано, особенно полезен для уменьшения или исключения образования нежелательных загрязнений. Для контроля pH может быть использована любая кислота или буфер. В некоторых воплощениях органическая кислота, такая как уксусная кислота или муравьиная кислота, используются для контроля pH в одной или нескольких стадиях очистки. В некоторых воплощениях используют органическую кислоту, такую как фосфорная кислота или соляная кислота.
Любая процедура для очистки соединения I, от ферментации, полусинтеза или полного синтеза, может быть модифицирована на основании настоящего изобретения с целью предотвращения образования нежелательных побочных продуктов путем мониторинга кажущегося значения pH и, если это необходимо, снижения кажущегося значения pH.
Иллюстративные данные для соединения I в виде 1H-ЯМР представлены на фиг.1(a), а молекулярная структура соединения I представлена на фиг.1(b). 1H-ЯМР, представленный на фиг.1(a), отражает химические сдвиги и интеграцию, соответствующие соединению I, содержит остаточный ацетон (при приблизительно 2,08 м.д.) и усеченный пик воды (появляющийся при 3,33 м.д.).
ПРИМЕР 2: Получение и характеристические свойства формы C и/или композиций, содержащих форму C
Соединения I формы C получали посредством серийной затравки насыщенных растворов ромидепсина формы A твердой фазой, содержащей соединение I формы C, с получением картины дифракции рентгеновских лучей (XRPD) генерируемого материала, в каждом из которых проявляется больше отраженных сигналов, присутствующих в соединении I формы C, чем в предыдущем. Указанные серии включали три эксперимента: (a) первую процедуру затравки; (b) вторую процедуру затравки; и (c) окончательное получение соединения I формы C. Рентгенограмма XRPD, собираемая для конечного продукта соединения I формы C, не содержит видимых отраженных сигналов от соединения I формы A. Эксперименты проводили следующим образом:
(a) Первая процедура затравки - получение образцов порции 1 и порции 2
Соединение I формы A (103 мг, 0,2 ммоль) и ацетон (5 мл) вносили в стеклянный пузырек и встряхивали в течение приблизительно 1 минуты, с получением прозрачного раствора. Пузырек погружали в баню с температурой -5ºC, измеряемой NIST-калибровочным термометром. Указанный образец оставляли в такой бане без встряхивания в течение приблизительно 26 часов, в результате чего образовывался легкий осадок. Осадок извлекали путем фильтрации через диск нейлонового фильтра с размером пор 0,2 мкм в чистый стеклянный пузырек, с получением прозрачного раствора.
Пока раствор оставался холодным, добавляли холодную воду (15 мл), без встряхивания. Раствор оставался прозрачным и холодным, без видимых признаков осаждения, и образец вновь погружали в баню с температурой -5ºC. Указанный образец оставляли в такой бане без встряхивания в течение приблизительно 5 дней. После первой ночи пузырек осторожно взбалтывали, прежде чем вновь погрузить в ту же баню, и это не приводило ни к каким видимым изменениям в образце. Через 5 дней на дне пузырька наблюдалось образование твердой фазы.
Супернатант отбрасывали, а твердую фазу осторожно растирали, с получением взвеси. Порцию полученной взвеси ("порция 1") центрифугировали малыми аликвотами при температуре окружающей среды в 1,0 мм стеклянном капилляре, для анализа методом дифракции рентгеновских лучей. Центрифугирование производили с приращениями времени вращения в несколько секунд, доводя до приблизительно 10 минут, при этом общее время центрифугирования составляло более чем 20 минут. Анализ дифракции рентгеновских лучей выявил очевидное наличие отраженных сигналов соединения I формы A и соединения I формы C, что свидетельствовало о том, что полученная твердая фаза представляла собой смесь указанных твердых форм.
Вторую порцию ("порция 2") оставляли открытой в пузырьке при температуре окружающей среды, чтобы частично подсушить твердую фазу, пока шла подготовка капилляра. Как капиллярные образцы, так и объемные образцы, до и после анализа хранили в холодильнике. Капиллярный образец исследовали вскоре после его получения, а объемный образец использовали в качестве затравки в тот же день, когда он был выделен.
(b) Вторая процедура затравки
Соединение I формы A (1,03 г, 1,9 ммоль) и ацетон (37 мл) вносили в стеклянный пузырек и встряхивали в течение короткого периода, с получением прозрачного раствора. Пузырек погружали в баню с температурой -5ºC, измеряемой NIST-калибровочным термометром. Образец оставляли в такой бане без перемешивания в течение приблизительно 1,5 часов, в результате чего образовывалось относительно малое количество осадка. Осадок извлекали путем холодной фильтрации через диск нейлонового фильтра с размером пор 0,2 мкм в чистую стеклянную круглодонную колбу.
Колба содержала твердую фазу "порции 2" (приблизительно такое количество, которое помещается на кончике шпателя) в качестве затравки для стимуляции образования формы C соединения I. Осадка заметно не было, но твердые частички затравки оставались. Дополнительно добавляли твердую фазу из "порции 2" (приблизительно такое количество, которое помещается на кончике шпателя). Осадка заметно не было, но твердые частички затравки оставались.
Холодную воду (111 мл) вливали всю сразу. Через несколько минут появлялся легкий осадок. Колбу на всю ночь погружали в баню с температурой -5ºC. Наблюдался лишь легкий осадок. Образец осторожно взбалтывали, прежде чем вновь погрузить в ту же баню приблизительно на 2 часа, и это не приводило к образованию существенного осадка. Твердую фазу осторожно соскребывали со стенок колбы.
Целевую твердую фазу на дне колбы, "порцию 3", центрифугировали малыми аликвотами при температуре окружающей среды в 1,0 мм стеклянном капилляре, чтобы подвергнуть анализу дифракции рентгеновских лучей. Центрифугирование производили с приращениями времени вращения в несколько секунд. Анализ дифракции рентгеновских лучей позволил выявить образование твердой фазы, в основном состоящей из формы C соединения I, а также указывал на наличие формы A соединения I.
Образец хранили в холодильнике до и после анализа, но не подвергали анализу раньше, чем на следующий день. Анализ производили вскоре после изъятия образца из холодильника ("порция 4"). "Порцию 4" оставляли в закрытом состоянии при температуре окружающей среды, пока шла подготовка капилляра, затем возвращали в баню с температурой -5ºC и оставляли в ней в течение приблизительно 3 дней, после чего в течение короткого периода хранили в холодильнике перед использованием в качестве затравки.
(c) Окончательное получение соединения I формы C
Соединение I формы A (1,09 г, 2,0 ммоль) и ацетон (39 мл) вносили в стеклянный пузырек, встряхивали и в течение короткого периода обрабатывали в ванночке ультразвуком, в результате чего образовывался прозрачный раствор. Пузырек погружали в баню с температурой -5ºC, измеряемой NIST-калибровочным термометром. Образец оставляли в такой бане без перемешивания в течение приблизительно 2,5 часов, в результате чего образовывалось относительно малое количество осадка. Твердый осадок извлекали путем холодной фильтрации через диск нейлонового фильтра с размером пор 0,2 мкм и переносили в чистую стеклянную круглодонную колбу, с получением прозрачного раствора.
В колбу добавляли затравку из "порции 4" (приблизительно 1 мл), чтобы стимулировать образование формы C соединения I. Осадка заметно не было, но твердые частички затравки оставались.
Холодную воду (400 мл) вливали всю сразу. Наблюдались лишь образование очень слабого осадка и персистенция затравки твердой фазы. Дополнительно добавляли взвесь твердой фазы из "порции 4" (приблизительно 1 мл), с получением такого же результата даже после кратковременного вращения колбы. Колбу погружали в баню с температурой -5ºC приблизительно на 3 дня, замораживая растворитель.
После выдерживания колбы в холодильнике в течение ночи растворитель расплавлялся, но твердая фаза сохранялась. Колбы вращали, и образец центрифугировали в 50 мл аликвотах при температуре окружающей среды в двух пластиковых центрифужных пробирках одновременно. Центрифугирование производили с приращениями времени вращения приблизительно в 5-10 минут, чтобы минимизировать нагревание образца и обеспечить образование прозрачного супернатанта. Полученный в результате супернатант декантировали в чистую бутылку HDPE. Конечная аликвота в колбе включала однократную промывку жидкостью из бутылки (несколько мл), чтобы собрать дополнительные частицы твердой фазы со стенок колбы. Указанные частицы твердой фазы были не новым осадком, а остатками на стенках колбы, когда образец из колбы переливали в пробирки. В колбе оставалось незначительное количество образца, и этот остаток уже не собирали. После того как образцы из колбы были изъяты, отцентрифугированные образцы собирали в одной пробирке, остальные пробирки дважды промывали жидкостью из бутылки (приблизительно по 15 мл на промывку). Конечный супернатант оставляли совместно с твердой фазой. Пробирки, колбу и бутылку, когда их не использовали, хранили в холодильнике. Этот период включал хранение в течение ночи, поскольку центрифугирование завершалось через два дня, и твердую фазу отделяли не раньше, чем на следующий день после центрифугирования.
Целевую твердую фазу на дне пробирки, порцию конечного продукта соединения I формы C, центрифугировали малыми аликвотами при температуре окружающей среды в 1,0 мм стеклянном капилляре, чтобы немедленно подвергнуть анализу дифракции рентгеновских лучей. Центрифугирование производили с приращениями времени вращения в несколько секунд.
Характерные данные для соединения I формы C в виде рентгенограмм порошковой дифракции рентгеновских лучей (XRPD), термограмм дифференциальной сканирующей калориметрии (DSC), термограмм термогравиметрического анализа (TGA), инфракрасных спектров (FT-IR), а также данные по структуре монокристаллов (например, ORTEP-схемы, схемы пространственной упаковки, позиционные параметры, расстояния между связями и углы между связями) изображены на фиг.1(c)-1(q), выше. Итоговыми характерными данными, представленными на фиг.1(c)-1(q), являются следующие.
Форма C является кристаллическим нестехиометрическим гидратом соединения I, что определяется из данных по монокристаллам (см. фиг.1(i)-1(q)). Кристаллическая структура содержит одну полностью занятую молекулу воды и участок второй молекулы воды с уточненным заполнением на приблизительно 73%. Характеристические особенности соединения I формы C суммированы в таблице 3.
|
Сравнение характера рентгенограмм XRPD конечного продукта для формы С соединения I (см. фиг.1(c) и 1(d)); и характера вычисленной рентгенограммы, собранной при температуре ниже температуры окружающей среды (см. фиг.1(i) и 1(j)) из структуры формы С соединения I, предполагает, что рентгенограммы XRPD являются однофазными и что ни один из наблюдаемых рефлексов не относится к форме A соединения I. Данные по монокристаллам собирали при криогенной температуре, поэтому наблюдалось незначительное, неравномерное смещение положений пиков 2θ вследствие температурных эффектов.
Термограмма дифференциальной сканирующей калориметрии (DSC) для формы C соединения I (см. фиг.1(e)) характеризуется широкими эндотермическими эффектами при приблизительно 97ºC и 140ºC (миним.), которые относят за счет потери растворителя, исходя из 5,3% потери массы, наблюдаемой в термограмме при термогравиметрическом анализе (TGA) (см. фиг.1(f)). Такая потеря массы соответствует приблизительно 1,7 моль воды, что сходно с результатом, полученным из данных по монокристаллам. Однако потеря массы может включать ацетон, поскольку данный образец кристаллизовали из смеси ацетон/вода. Термограмма DSC характеризуется также эндотермой при 257ºC (миним.) (см. фиг.1(e)). Указанная эндотерма, по всей видимости, соответствует плавлению формы А соединения I и кажущейся десольватации твердой фазы. Минорный экзотермический эффект наблюдался при приблизительно 177ºC (см. фиг.1(e)). Если исходить из кажущейся температуры плавления, указанное, по всей видимости, представляет собой перекристаллизацию в форму А соединения I. Конечная потеря массы из TGA свидетельствует о том, что деструкция происходит одновременно с кажущимся плавлением, наблюдаемым посредством DSC, как это было в случае формы А соединения I. Твердую фазу сушили на воздухе под лабораторным вытяжным устройством при температуре окружающей среды в течение приблизительно 2,5 часов для удаления остатков растворителя до начала анализа, с целью получения репрезентативных калориметрических данных для формы C соединения I.
Специалист в данной области на основании представленных здесь данных с легкостью установит, что форма C может быть изоструктурна сольвату метанола, о котором сообщалось в публикации Shigematsu et al., The Journal of Antibiotics, Vol. 47, No. 3, "FR901228, A Novel Antitumor Bicyclic Depsipeptide Produced by Chromobacterium violaceum No. 968, pp. 311-314 (March 1994).
ПРИМЕР 3: Получение и характеристические свойства формы D и/или композиций, содержащих форму D соединения I
Соединение I формы A (1,20 г, 2,2 ммоль) и ацетон (38 мл) вносили в стеклянную коническую колбу Эрленмейера, встряхивали ее, переворачивали и в ванночке обрабатывали ультразвуком в течение нескольких минут, растворяя большую часть твердой фазы. Не растворившуюся твердую фазу удаляли путем фильтрации через через диск нейлонового фильтра с размером пор 0,2 мкм в чистую стеклянную колбу Эрленмейера, с получением прозрачного раствора. Добавляли гексаны (152 мл), которые без встряхивания вызывали немедленное осаждение твердой фазы. Колбу оставляли на ночь в морозильной камере, давая возможность твердой фазе осесть на дно колбы. Прозрачный супернатант декантировали, и аликвоты твердой фазы немедленно подвергали анализу методом дифракции рентгеновских лучей. Анализ показал, что твердая фаза состоит из формы D соединения 1. Твердую фазу восстанавливали из анализируемого образца для термального и спектроскопического анализов. Неиспользованный материал хранили в морозильной камере.
Характерные данные для соединения I формы D в виде XRPD, DSC, TGA и FT-IR изображены выше на фиг.2(a)-2(f). Итоговыми характерными данными, представленными на фиг.2(a)-2(f), являются следующие. Как описано в примере 8, специалист в данной области с легкостью определит из представленных здесь данных, что соединение I формы D может быть изоструктурно сольвату MEK (соединение I формы J).
Форма D является нестабильным кристаллическим сольватом ацетона соединения I, который в условиях окружающей среды превращается в форму A. Кристалл, полученный из холодного раствора ацетона, был индексирован. Было определено, что индексированный раствор имеет структуру орторомбической элементарной ячейки со следующими параметрами ячейки и рассчитанным объемом: a=9,093, b=15,581, c=23,141 Å, V=3278,57(9) Å (a. SSCI Laboratory Notebook 4005-87; b. Phys. Rev. A56(6) 4554-4568 (1997)). Было определено, что молекулярная масса по формуле соединения составляет 598,81 г/моль. Параметры ячейки сходны с ячейкой, полученной из кристаллической структуры формы J соединения I. Сходство между указанными двумя элементарными ячейками и рентгенограммы XRPD соединения I формы D и соединения I формы J свидетельствуют о том, что два указанных образца являются родственными кристаллическими формами. Поскольку было определено, что соединение I формы J является моносольватом метилэтилкетона соединения I, вполне вероятно, что форма D также является моносольватом соединения I. Характеристические особенности формы D соединения I суммированы в таблице 4.
|
Экспериментальная рентгенограмма соединения I формы D представлена на фиг.2(a) с соответствующим перечнем на фиг.2(b). Данная рентгенограмма соответствует рентгенограмме соединения I формы D и сходна с таковой соединения I формы J, что наблюдается в случае наложения картин XRPD, представленных на фиг.6(a). Данный образец высокого разрешения, представленный на фиг.2(a), собирали после хранения материала в морозильной камере, и обнаружили наличие формы D соединения I и формы A соединения I, что свидетельствует о смеси фаз, поэтому образец, полученный из материала после хранения в морозильной камере использовали для получения соответствующего перечня пиков для соединения I формы D (см. фиг.2(b)).
Спектр FT-ER соединения I формы D и сопровождающий перечень пиков представлены на фиг.2(e) и фиг.2(f). Чтобы избежать потенциальной возможности превращения форм при потере растворителя, данные FT-IR для твердой фазы собирали незамедлительно после изъятия из морозильной камеры.
Термограмма TGA для соединения I формы D (см. фиг.2(d)) характеризуется потерей массы на приблизительно 10,9%, а термограмма DSC (см. фиг.2(c)) характеризуется малым экзотермическим эффектом при приблизительно 91ºC. Указанные явления, по всей видимости, в основном связаны с десольватацией и перекристаллизацией, соответственно, в форму А соединения I, если учитывать нестабильность соединения I формы D и тенденцию его превращения в форму А соединения I. Потеря массы, наблюдаемая методом TGA, соответствует немногим более чем молю ацетона. Чтобы избежать потенциальной возможности превращения форм при потере растворителя, твердую фазу исследовали сразу же после изъятия из морозильной камеры. Поскольку до начала данного анализа никакой потери массы не наблюдалось, обнаруживаемую потерю массу относят за счет потери растворителя из кристаллической решетки, что также предполагает, что соединение I формы D является сольватом ацетона. Термограмма DSC также характеризуется эндотермой при приблизительно 261ºC (миним.). По всей видимости, указанная эндотерма соответствует плавлению соединения I формы A, на основе данных, собранных при предварительном полиморфном скрининге (см. пример 11), и кажущейся десольватации твердого вещества. Конечная потеря массы из TGA позволяет предположить, что деструкция происходит одновременно с кажущимся плавлением, наблюдаемым путем DSC, как это происходило в случае соединения I формы A.
ПРИМЕР 4: Получение и характеристические свойства формы Е и/или композиций, содержащих форму Е
Соединение I формы A (2,75 г, 5,1 ммоль) и раствор, содержащий смесь трет-бутанола и воды [60:40 (объем/объем)] (31 мл) вносили в 50 мл колбу Эрленмейера. Твердая фаза сохранялась. Образец перемешивали в течение ночи при температуре окружающей среды, и полученную твердую фазу собирали путем вакуумной фильтрации. Полученную твердую фазу переносили на взвешенную бумагу и сушили в условиях окружающей среды в течение приблизительно 2 часов. Высушенную твердую фазу переносили в стеклянный пузырек и хранили в условиях окружающей среды. Изучение методом дифракции рентгеновских лучей показало, что твердая фаза состоит из соединения I формы E. Выход твердого вещества составил 2,79 г (89%).
Характерные данные для соединения I формы Е в виде XRPD, DSC, TGA, FT-IR, рамановского спектра и данных по структуре монокристаллов (например, ORTEP-схемы, схемы пространственной упаковки, позиционные параметры, расстояния между связями и углы между связями) изображены на фиг.3(a)-3(p), выше. Итоговыми характерными данными, представленными на фиг.3(а)-3(р), являются следующие. Специалист в данной области с легкостью определит из представленных здесь данных, что соединение I формы E может быть изоструктурно соединению I формы H (см. пример 6).
Соединение I формы E является кристаллическим моносольватом трет-бутанола соединения I, как определено из данных по монокристаллам (см. фиг.3(h)-3(p)). Характеристические особенности соединения I формы E суммированы в таблице 5.
|
Проведено сравнение экспериментального (см. фиг.3(a) и 3(b)) и вычисленного (см. фиг.3(h) и 3(i)) образцов рентгенограммы XRPD и сопровождающий перечень пиков формы E соединения I. Данные по монокристаллам собирали при криогенной температуре, поэтому наблюдалось незначительное, неравномерное смещение положений пиков 2θ вследствие температурных эффектов. Получены FT-IR с сопроводительным перечнем пиков (см. фиг.3(e) и 3(f)), а также FT-рамановские спектры (см. фиг.3(g)) соединения I формы E.
На DSC-термограмме соединения I формы E (см. фиг.3(c)) эндотермический эффект, относимый за счет десольватации, если исходить из TGA-термограммы (см. фиг.3(d)), проявляется при приблизительно 158ºC (миним.), а методом высокотемпературной микроскопии он был выявлен в виде потери двулучепреломления при приблизительно 157ºC. Методом высокотемпературной микроскопии было показано, что данный образец плавится при приблизительно 243ºC, при этом на эндотерме методом DSC это выявлено при приблизительно 250ºC (миним.). Если исходить из температуры плавления, то по всей видимости, десольватация указанного образца в форму А соединения I происходит еще до плавления. Конечная потеря массы из TGA свидетельствует о том, что деструкция происходит одновременно с плавлением, наблюдаемым посредством высокотемпературной микроскопии, как это имело место в случае формы А соединения I.
ПРИМЕР 5: Получение и характеристические свойства формы F и/или композиций, содержащих форму F
В одном из воплощений соединение I формы A (Fujisawa lot 005033L [I], 105,9 мг, 0,2 ммоль) и хлороформ (4 мл) вносили в стеклянный пузырек и обрабатывали в ванночке ультразвуком в течение приблизительно 1 минуты, с получением прозрачного раствора с некоторым количеством нерастворенных частиц. Добавляли дополнительное количество соединения I формы A (Fujisawa lot 005Q33L, 281,7 мг, 0,5 ммоль), полученную в результате взвесь перемешивали на карусельном столе в условиях окружающей среды в течение ~12 часов. Образец доставали из карусельного стола и предоставляли возможность оставшимся твердым частицам всплыть на поверхность раствора, затем раствор отсасывали пипеткой, и часть его фильтровали через диск нейлонового фильтра с размером пор 0,2 мкм в чистый стеклянный пузырек. Пузырек оставляли открытым для выпаривания под лабораторным вытяжным устройством при температуре окружающей среды. Полученную твердую фазу изучали методом порошковой дифракции рентгеновских лучей (XRPD). Полученная в результате картина характеризуется разрешающей способностью отраженных сигналов, указывающей на кристаллический материал. Поскольку картина была уникальной, материал был назван образом F.
В другом воплощении соединение I формы A (Sandoz lot 49800203, 740 мг, 1,4 ммоль) и хлороформ (30 мл) вносили в стеклянный пузырек и в течение нескольких минут в ванночке обрабатывали ультразвуком, с получением прозрачного раствора. Соединение I формы A (Sandoz lot 49800203, 750 мг, 1,4 ммоль) добавляли для гарантии того, что там достаточно твердого вещества для образования взвеси. Полученный в результате образец перемешивали на карусельном столе в течение приблизительно 4 дней. Оставшаяся твердая фаза при стоянии всплывала на поверхность, образуя прозрачный раствор на дне пузырька. Приблизительно 1/4 раствора переносили в чистый стеклянный пузырек, и твердое вещество осаждали путем медленного выпаривания растворителя (пузырек накрывали перфорированной алюминиевой фольгой) под лабораторным вытяжным устройством. Через приблизительно 2 дня растворителя уже не было видно. Твердое вещество оставляли в запаянном пузырьке при температуре окружающей среды в течение приблизительно 1 дня, а затем хранили в морозильной камере.
Характерные данные для соединения I формы F в виде XRPD и FT-IR изображены на фиг.9(a)-9(l), выше.
Соединение I формы F является кристаллическим сольватом хлороформа соединения I. Характеристические особенности соединения I формы F суммированы в таблице 6.
|
ПРИМЕР 6: Получение и характеристические свойства формы H и/или композиций, содержащих форму H
Соединение I формы A (500 мг, 0,9 ммоль) и хлороформ (5 мл) вносили в стеклянный пузырек, и в ванночке обрабатывали ультразвуком в течение приблизительно 20 минут, в результате чего образовывался прозрачный раствор. Легкое вибрационное взбалтывание вызывало образование осадка твердой фазы. Полученную смесь в течение ночи перемешивали на карусельном столе при температуре окружающей среды. Твердые частицы всплывали на поверхность жидкости, затем жидкость удаляли пипеткой. Приблизительно 1/3 твердой фазы высушивали на роторном испарителе в течение приблизительно 15 минут, с использованием водяной бани. Температурные колебания в бане в процессе выпаривания составляли от 57 до 64ºC, что измерялось NIST-калибровочным термометром. Полученную твердую фазу до осуществления анализа методом XRPD хранили в условиях окружающей среды. Анализ показал, что твердая фаза состоит из формы H соединения I. После анализа XRPD образец хранили в морозильной камере с осушителем. Выход твердого вещества составил 178 мг.
Характерные данные для соединения I формы H в виде XRPD, DSC, TGA и FT-IR приведены на фиг.4(a)-4(f), выше. Итоговыми характерными данными, представленными на фиг.4(а)-4(f), являются следующие. Специалист в данной области с легкостью определит из представленных здесь данных, что соединение I формы H может быть изоструктурно соединению I формы E (см. пример 4).
Соединения I формы H является кристаллическим сольватом хлороформа соединения I. Характеристические особенности соединения I формы H суммированы в таблице 7.
|
Образец рентгенограммы XRPD высокого разрешения соединения I формы H и сопровождающий перечень данных представлены на фиг.4(a) и 4(b). FT-IR-спектр соединения I формы H и сопровождающий перечень данных представлены на фиг.4(e) и 4(f).
Изучение исторических данных XRPD свидетельствуют о том, что прежняя рентгенограмма XRPD соединения I формы H, наблюдаемая при предварительном полиморфном скрининге (см. пример 11), на рентгенограмме порошковой дифракции характеризуется отраженными сигналами от обеих форм соединения I, формы H и формы A, что свидетельствует о том, что исследуемый образец является смесью. Следовательно, картина XRPD, которую дает форма H соединения I, соответствует форме H в указанном образце. Однако для подтверждения указанного наблюдения необходима дополнительная проверка данных XRPD. Если структура формы Н соединения I не может быть определена по монокристаллической рентгенограмме полученных кристаллов, можно предложить индексирование рентгенограммы XRPD высокого разрешения для подтверждения того, что собранная картина характеризует однофазный образец.
На DSC-термограмме в случае соединения I формы H (см. фиг.4(c)) проявляется эндотермический эффект при приблизительно 96ºC (миним.). Указанный эффект, по всей видимости, связан главным образом с десольватацией, если исходить из потери массы на приблизительно 10,1%, наблюдаемой на термограмме TGA для соединения I формы H (см. фиг.4(d)). Это соответствует более чем 0,5 моль хлороформа. Чтобы избежать потенциальной возможности превращения форм при потере растворителя, твердую фазу исследовали сразу же после изъятия из морозильной камеры. Поскольку до начала данного анализа никакой потери массы не наблюдалось, обнаруживаемую потерю массу относят за счет потери растворителя из кристаллической решетки, что свидетельствует о том, что соединение I формы Н является сольватом. Термограмма DSC (см. фиг.4(c)) также характеризуется эндотермой при приблизительно 256ºC (миним.). По всей видимости, указанная эндотерма соответствует плавлению соединения I формы A, на основе данных, собранных при предварительном полиморфном скрининге (см. пример 11), и кажущейся десольватации твердого вещества. Конечная потеря массы из TGA (см. фиг.4(d)) свидетельствует о том, что деструкция происходит одновременно с кажущимся плавлением, наблюдаемым посредством DSC, как это имело место в случае соединения I формы A.
ПРИМЕР 7: Получение и характеристические свойства формы I и/или композиций, содержащих форму I
В одном из воплощений соединение I формы A (500 мг, 0,9 ммоль) и хлороформ (5 мл) вносили в стеклянный пузырек и в ванночке обрабатывали ультразвуком в течение приблизительно 20 минут, и получали прозрачный раствор. Легкое вибрационное взбалтывание вызывало образование осадка твердой фазы. Полученную смесь перемешивали на карусельном столе при температуре окружающей среды в течение менее одного часа, и часть твердой фазы для получения картины дифракции рентгеновских лучей (XRPD) извлекали путем фильтрации через нейлоновый фильтр с размером пор 0,22 мкм в толщу миллипорового фильтра Swinnex. Осадок из фильтра не вымывали, и твердая фаза при восстановлении выглядела сухой. Перед анализом XRPD твердую фазу осторожно измельчали путем раздавливания. Указанный анализ выявил наличие формы I соединения I и формы H соединения I, что свидетельствует о том, что полученное твердое вещество представляет собой смесь фаз.
Оставшийся образец возвращали на карусельный стол для дальнейшего формирования взвеси в течение ночи. Твердые частицы всплывали на поверхность жидкости, затем жидкость удаляли пипеткой. Оставшуюся твердую фазу хранили в запечатанном пузырьке в морозильной камере над осушителем. Попытка собрать данные рентгенограммы XRPD высокого разрешения показала, что твердые вещества превратились в форму H соединения I до анализа.
В другом воплощении соединение I формы A (517 мг, 1,0 ммоль) и хлороформ (5 мл) вносили в стеклянный пузырек и в ванночке обрабатывали ультразвуком в течение приблизительно 20 минут, с получением прозрачного раствора со следами твердого вещества. Полученную в результате смесь перемешивали на карусельном столе в течение приблизительно 1 месяца при температуре окружающей среды. Твердые вещества хранили в маточной жидкости в холодильнике. Порцию твердых веществ ("порция 1") для получения картины дифракции рентгеновских лучей (XRPD) извлекали путем фильтрации через нейлоновый фильтр с размером пор 0,22 мкм в толщу миллипорового фильтра Swinnex. Осадок из фильтра не вымывали, и твердая фаза при восстановлении выглядела сухой. Перед анализом XRPD твердую фазу осторожно измельчали путем раздавливания. Указанный анализ показал, что твердая фаза состоит из формы I соединения I. Другую порцию ("порция 2") твердых веществ для осуществления спектроскопии протонного ядерного магнитного резонанса в растворе (1Н-ЯМР) переносили с помощью пипетки в чистый стеклянный пузырек, а жидкость декантировали. До проведения анализа образцы XRPD и 1H-ЯМР хранили при температуре окружающей среды в закупоренных пузырьках.
Еще в одном воплощении форму А соединения I (образец SSCI 4043-93-03 (SSCI Report to Celgene Corporation, Preparation & Characterization of Select Romidepsin Materials, 12/17/2010, SR-20101273.01), полученный из Sandoz lot 49800203, ~180 мг, 0,3 ммоль) вносили в стеклянный пузырек. Пузырек оставляли незакупоренным в стеклянном сосуде, содержащем хлороформ (~10 мл), чтобы твердая фаза находилась под давлением пара. Твердое вещество находилось под давлением в течение приблизительно 7 дней до того как его переносили в морозильную камеру, где оно оставалось под испарениями хлороформа.
Характерные данные для формы I соединения I в виде результатов анализов XRPD, DSC, TGA, FT-IR и данных по структуре монокристаллов (например, ORTEP-схемы, схемы пространственной упаковки, позиционные параметры, расстояния между связями и углы между связями) изображены на фиг.5(a)-5(y), выше. Итоговыми характерными данными, представленными на фиг.5(а)-5(y), являются следующие.
Соединение I формы I представляет собой кристаллический сольват хлороформа соединения I, который превращается в форму H в условиях окружающей среды. Было определено, что структура представляет собой кристалл, полученный из хлороформной взвеси. На основании рентгенограммы XRPD формы I соединения I из порции общей массы твердых веществ было сделано заключение, что указанным кристаллом является форма I соединения I. Данные по монокристаллам (см. фиг.5(g)-5(o)) указывают на сольват хлороформа, структуру, состоящую из слоев молекул соединения I, разделенных остаточной электронной плотностью, по-видимому, образованной свободным хлороформом, и карманами, содержащими молекулы очищенного хлороформа.
Экспериментальные данные для соединения I формы I представлены на фиг.5(a)-5(y). Характеристические особенности формы I соединения I суммированы в таблице 8.
|
Как первоначальный осадок, так и изолированные твердые вещества из взвеси в хлороформе характеризовались рентгенограммой XRPD, соответствующей форме I соединения I. Образец рентгенограммы XRPD высокого разрешения, собранный на образце из общей массы твердых веществ, был идентифицирован как форма H соединения I. Поскольку форма H соединения I была получена при предварительном полиморфном скрининге (см. пример 11) путем высушивания твердой фазы, характеризующейся рентгенограммой XRPD для соединения I формы I, вполне вероятно, что данный образец превратился в форму I соединения I в процессе сбора данных. И наоборот, первоначальные данные XRPD для твердой фазы формы I соединения I собирали на твердых веществах в стеклянном капилляре, таким образом задерживая сушку указанных твердых веществ.
Термограмма DSC для соединения I формы I (см. фиг.5(c)) характеризуется широким эндотермическим эффектом при приблизительно 74°C и эндотермическим эффектом при приблизительно 100ºC (миним.). Указанные явления, по всей видимости, связаны главным образом с десольватацией, если исходить из потери массы на приблизительно 33% от 19 до 102ºC, наблюдаемой на термограмме TGA (см. фиг.5(d)). Это соответствует более чем 2 молям хлороформа. Термограмма TGA также характеризуется потерей массы до 19ºC, которая, скорее всего, происходит за счет остаточного хлороформа; однако, как представляется, это четко переходит в основную потерю массы. DSC-термограмма (см. фиг.5(c)) также характеризуется эндотермой при приблизительно 258ºC (миним.). По всей видимости, данная эндотерма соответствует плавлению формы А соединения I, если исходить из данных, собранных при предварительном полиморфном скрининге (см. пример 11), и кажущейся десольватации твердого вещества. Конечная потеря массы из TGA позволяет предположить, что деструкция происходит одновременно с кажущимся плавлением, наблюдаемым посредством DSC, как это имело место в случае формы А соединения I. Пытаясь избежать потенциальную возможность превращения форм при потере растворителя, твердую фазу исследовали сразу же после изъятия из морозильной камеры.
Получен FT-IR-спектр формы I соединения I (см. фиг.5(e) и 5(s)). Чтобы избежать потенциальную возможность превращения форм при потере растворителя, твердую фазу исследовали сразу же после изъятия из морозильной камеры.
ПРИМЕР 8: Получение и характеристические свойства формы J и/или композиций, содержащих форму J
В одном из воплощений форму J соединения I (56,4 мг) растворяли в метилэтилкетоне (4,5 мл). Раствор фильтровали через нейлоновый фильтр с размером пор 0,2 мкм. Образец помещали в пузырек, закрытый перфорированной алюминиевой фольгой (одно отверстие), под лабораторным вытяжным устройством, предоставляя возможность выпаривания растворителя при температуре окружающей среды. Образец хранили при температуре окружающей среды до его индексации с помощью рентгенограммы монокристаллов. Кристаллизация может быть осуществлена способами, известными специалистам в данной области.
В другом воплощении форму А соединения I (Sandoz lot 49800203, 1,03 г, 1,9 ммоль) и метилэтилкетон (80 мл) вносили в колбу Эрленмейера, слегка взбалтывали и в ванночке обрабатывали ультразвуком в течение нескольких минут с получением прозрачного раствора. Приблизительно половину данного раствора фильтровали через нейлоновый фильтр с размером пор 0,2 мкм в чистый стеклянный пузырек. Пузырек закрывали и помещали в морозильную камеру, чтобы осадить твердую фазу из раствора. Приблизительно через 5 дней указанный образец доставали из морозильной камеры, и осадок твердого вещества отделяли путем декантации от прозрачного супернатанта. Твердое вещество хранили в увлажненном растворителем состоянии в морозильной камере.
Характерные данные для формы J соединения I в виде монокристаллической структуры (например, ORTEP-схемы, схемы пространственной упаковки, позиционные параметры, расстояния между связями и углы между связями) изображены на фиг.6(a)-6(j), выше. Итоговыми характерными данными, представленными на фиг.6(а)-6(j), являются следующие.
Монокристаллическая структура соединения I формы J подтвердила молекулярную структуру и содержание элементарной ячейки. Образец кристаллизовался в хиральной орторомбической системе пространственных групп Р212121 и был определен как сольват метилэтилкетона (MEK) соединения I. Структура соединения I формы J (сольват MEK) состоит из слоев молекул соединения I, связанных водородными связями с соседними молекулами соединения I, перпендикулярными кристаллографической оси c. Отраженные сигналы в экспериментальном образце сольвата ацетона (соединение I формы D) представлены в расчетной картине XRPD сольвата MEK (форма J соединения I), что свидетельствует о том, что указанные две формы могут быть изоструктурными (см. пример 3).
Форма J соединения I представляет собой кристаллический сольват метилэтилкетона соединения I. Экспериментальные данные для формы J соединения I представлены на фиг.6(a)-6(s). Характеристические данные формы J соединения I суммированы в таблице 9.
|
ПРИМЕР 9: Получение и характеристические особенности аморфного соединения I и/или композиций, содержащих аморфное соединение I
Получение из смеси диоксан/вода 9:1
Соединение I (1,0652 г) растворяли в смеси диоксан/вода 9:1 (10 мл). Раствор фильтровали через нейлоновый фильтр с размером пор 0,2 мкм и замораживали в 300 мл круглодонных колбах, погруженных в баню с сухим льдом и изопропанолом. Колбу, содержащую замороженный образец, прикрепляли к лиофилизатору и сушили в течение приблизительно 4 дней. После сушки твердые вещества отделяли и до их использования хранили в морозильной камере над осушителем.
Получение с помощью роторного испарителя
Соединение I (133,4 мг) растворяли в дихлорметане (1,5 мл). Раствор фильтровали через нейлоновый фильтр с размером пор 0,2 мкм. Пузырек с образцом помещали на роторный испаритель и погружали в водяную баню при температуре окружающей среды. Растворитель быстро испарялся досуха под вакуумом. Затем твердые вещества до их использования хранили в морозильной камере над осушителем.
Получение путем быстрого испарения
Соединение I (24,7 мг) растворяли в бинарной смеси растворителей - вода (1,5 мл) и дихлорметан (0,5 мл). Раствор фильтровали через нейлоновый фильтр с размером пор 0,2 мкм. Не закрытый колпачком образец помещали под лабораторным вытяжным устройством и давали ему испариться досуха в условиях окружающей среды. Твердые вещества до их использования хранили в условиях окружающей среды.
Характерные данные для аморфного соединения I в виде рентгенограмм XRPD, модулированной DSC-термограммы, TGA, FT-IR, FT-рамановской спектроскопии и 1H-ЯМР представлены на фиг.7(a)-7(f), выше. Итоговые характерные данные (например, суммарные данные по результатам рентгенограмм XRPD в таблице 10) представлены для аморфного соединения I, ниже.
Образец рентгенограммы XRPD высокого разрешения для аморфного соединения I представлен на фиг.7(a). Модулированная DSC-термограмма для аморфного соединения I (см. фиг.7(b)) характеризуется температурой стеклования при приблизительно 91ºC. Потерю массы приблизительно на 3,5% наблюдали на TGA-термограмме (см. фиг.7(c)). Представлены также FT-IR-спектр аморфного соединения I (см. фиг.7(d) и 7(e)) и FT-рамановский спектр (см. фиг.7(f)).
|
|
ПРИМЕР 10: Получение и характеристические особенности формы К соединения I
В одном из воплощений соединение I формы A (Sandoz lot 49800203, 410 мг, 0,8 ммоль) и нитрометан (20 мл) вносили в стеклянный пузырек и в ванночке обрабатывали ультразвуком в течение нескольких минут с получением прозрачного раствора. Раствор фильтровали через нейлоновый фильтр с размером пор 0,2 мкм в чистый стеклянный пузырек и давали медленно испаряться (пузырек закрывали перфорированной алюминиевой фольгой) под лабораторным вытяжным устройством. Приблизительно через 12 дней образец для ускорения выпаривания делили на приблизительно четыре равные части. Медленное выпаривание образца продолжали в течение дополнительных 7 дней. Два из четырех пузырьков оставались открытыми (быстрое выпаривание), и их оставляли выпариваться в течение ночи. На следующий день малое количество растворителя было заметно только в одном из образцов. После того как основная часть растворителя была удалена путем декантации, выпавшие в осадок твердые вещества из остальных трех образцов объединяли в пул исходного образца. Объединенные твердые вещества хранили в закупоренном пузырьке в морозильной камере.
Медленное выпаривание (SE)
В другом воплощении растворы получали в различных растворителях при температуре окружающей среды и пропускали через нейлоновый фильтр с размером пор 0,2 мкм в стеклянный пузырек. Отфильтрованный раствор оставляли выпариваться при температуре окружающей среды в пузырьке, закрытом алюминиевой фольгой, перфорированной в одном или нескольких местах. Все образовавшиеся твердые вещества были выделены и подвергнуты анализу. Твердые вещества, полученные из нитрометана путем медленного выпаривания, обнаруживали рентгенограмму XRPD, характерную для формы K соединения I (фиг.8(a)).
Диффузия из паровой фазы
Еще в одном из воплощений растворы получали с различными растворителями при температуре окружающей среды и пропускали через нейлоновый фильтр с размером пор 0,2 мкм в стеклянный пузырек. Такой заполненный пузырек помещали в стеклянный сосуд, содержащий противорастворитель, и закрывали пробкой. Обычно такой противорастворитель смешивается с раствором и, как правило, бывает более летучим, чем растворитель. Эксперимент оставляли в неподвижном состоянии при температуре окружающей среды. Все образовавшиеся твердые вещества были выделены и подвергнуты анализу.
Были предприняты две попытки лиофилизации с увеличением масштаба (приблизительно на 2 г с использованием смеси диоксан/вода (9:1) (объем/объем). Первая попытка привела к образованию неупорядоченного кристаллического материала с проявлением пиков, обнаруживаемых также в форме A и форме К при визуальном сравнении рентгенограмм XRPD. Первая попытка привела к образованию неупорядоченного кристаллического материала с проявлением пиков, обнаруживаемых при визуальном сравнении также и в форме K.
Форма К соединения I представляет собой кристаллический сольват нитрометана соединения I. Экспериментальные данные для формы K соединения I представлены на фиг.8(a)-8(l). Характеристические данные формы К соединения I суммированы в таблице 11.
|
ПРИМЕР 11: Получение и характеристические особенности формы L соединения I
Форму А соединения I (Sandoz lot 49800203, 910 мг, 1,7 ммоль) и ацетон (48 мл) вносили в стеклянный химический стакан и перемешивали в течение нескольких минут с получением прозрачного раствора. Раствор фильтровали через нейлоновый фильтр с размером пор 0,2 мкм в чистый стеклянный химический стакан, и стакан оставляли открытым в стеклянном сосуде, содержащем метанол (~50 мл), чтобы осадить твердые вещества из раствора путем диффузии из паровой фазы. Приблизительно через 12 дней выпавшие в осадок твердые вещества изолировали путем декантации прозрачного супернатанта. Твердые вещества переносили в чистый стеклянный пузырек и хранили под парами метанола в морозильной камере.
Форма L соединения I представляет собой кристаллический сольват метанола соединения I. Экспериментальные данные для формы K соединения I представлены на фиг.10(a)-10(i). Характеристические данные формы L соединения I суммированы в таблице 12.
|
ПРИМЕР 12: Получение и описание свойств формы N соединения I
В одном из воплощений форму N соединения I сушили под вакуумом при температуре окружающей среды в течение приблизительно 5 часов, при приблизительно 50 мТорр, теряя приблизительно 12,4% исходной массы. Полученные в результате твердые вещества были охарактеризованы методом протонной ЯМР-спектроскопии. Спектр показал, что твердые вещества содержат приблизительно 1/3 моля нитрометана. Впоследствии высушенный образец был охарактеризован методом DSC. Наблюдаемые результаты зависят от условий, используемых во время анализа. Данные DSC, собранные в гофрированном кристаллизаторе, характеризуются минорным эндотермическим эффектом при приблизительно 150ºC, который может быть связан с потерями летучих веществ при нагревании, а также интенсивной эндотермой при приблизительно 256ºC (начало процесса). Оставшиеся твердые вещества (43 мг) сушили в течение приблизительно 22 часов в вакуумном сушильном шкафу при приблизительно 42ºC, при приблизительно 20 мТорр. Потерю массы не определяли, но высушенные твердые вещества были охарактеризованы рентгенограммой XRPD. Полученная в результате рентгенограмма содержит пики XRPD формы N, но характеризуется и дополнительными неизвестными пиками, что свидетельствует о том, что произошла конверсия. Следовательно, последующие эксперименты по удалению растворителя проводились при температуре окружающей среды.
Форму A (предположительно 1,6 г) суспендировали в нитрометане (9 мл) в течение приблизительно 5 дней. Твердые вещества получали путем вакуумной фильтрации и промывали нитрометаном (2×1 мл). Твердые вещества оставляли на фильтре под вакуумом в течение нескольких минут. Получали приблизительно 1,3 г твердого вещества. Твердые вещества методом микроскопии в поляризованном свете характеризовались смесью прямоугольных пластин и призм, сходных с предшествующими наблюдениями формы N. Полученная в результате рентгенограмма XRPD высокого разрешения соответствовала форме N.
Было предпринято два эксперимента в попытке удаления нитрометана из формы N посредством вакуумной сушки при температуре окружающей среды. В одном из воплощений 94,0 мг твердого вещества сушили в течение приблизительно 16,5 часов, при приблизительно 20 мТорр, теряя приблизительно 0,7% исходной массы. В другом воплощении 308,3 мг твердого вещества сушили в течение приблизительно 5 дней, при приблизительно 5 мТорр, выигрывая приблизительно 0,7% исходной массы (приблизительно 0,1% выигрыша от 3 до 5 дней). Методом микроскопии в поляризованном свете не было обнаружено никаких изменений в указанных твердых веществах, и оба образца характеризовались формой N при анализе методом XRPD высокого разрешения. В одном из воплощений на рентгенограммах появлялся неизвестный пик при приблизительно 9,1º 2θ, который более выражен в случае 5-дневного образца, чем в случае 16,5-часового образца. Оба образца содержали приблизительно 1/3 моля нитрометана, согласно протонной ЯМР-спектроскопии.
В одном из воплощений указанный образец был охарактеризован термограммами DSC и TGA в конфигурации открытого кристаллизатора, чтобы удостовериться в том, что растворитель может свободно испаряться во время проведения анализа. Наблюдаемые результаты обусловлены условиями, используемыми во время проведения анализа. Результирующая термограмма DSC характеризуется широким эндотермическим эффектом при приблизительно 161ºC, с плечом при приблизительно 148ºC. Этот эффект, по-видимому, возникает одновременно с потерей массы на приблизительно 4,9% от 130 до 160ºC, наблюдаемой на термограмме TGA, что коррелирует примерно с 1/2 моля нитрометана, и можно предположить, что потеря массы происходит только за счет потери растворителя. На термограмме проявляется эндотерма при приблизительно 256-259ºC (начало процесса). Конечная потеря массы из TGA свидетельствует о том, что деструкция происходит одновременно с появлением указанной эндотермы.
В одном из воплощений, в порядке удаления нитрометана из образца формы N, 152,4 мг твердого вещества суспендировали в ацетонитриле (1 мл) в течение приблизительно 1 часа. Твердые вещества получали в результате вакуумной фильтрации, промывки ацетонитрилом (4×1 мл). Твердые вещества оставляли на фильтре под вакуумом в течение нескольких минут для подсушивания твердых веществ. Получали 97,7 мг твердого вещества. В другом воплощении 309,5 мг твердого вещества суспендировали в воде (4 мл) в течение приблизительно 24,5 часов. Твердые вещества получали в результате вакуумной фильтрации, промывки водой (2×1 мл). Твердые вещества оставляли на фильтре под вакуумом в течение приблизительно 1,5 часов для подсушивания твердых веществ. Получали 270,4 мг твердого вещества. Методом микроскопии в поляризованном свете не было обнаружено никаких изменений в указанных твердых веществах; однако при анализе XRPD образец T получался из ацетонитрила, а смесь форм C и A образовывалась из воды. Рентгенограмма XRPD высокого разрешения для твердых веществ из водяной взвеси характеризовалась дополнительными пиками, присутствующими в форме N на рентгенограмме XRPD, что свидетельствует о неполной конверсии.
Кроме того, данные протонной ЯМР-спектроскопии для формы N свидетельствуют о том, что настоящий материал содержит приблизительно 1/3 моля нитрометана. Пространственная группа раствора формы N (Р21212) могут характеризоваться только менее чем одной молекулой растворителя в асимметричной ячейке, если положение растворителя частично занято, то есть некоторые из асимметричных ячеек содержат молекулы растворителя, а другие нет.
Экспериментальные данные для соединения I формы N представлены на фиг.11(a)-11(c). Характеристические данные формы N соединения I суммированы в таблице 13.
|
Характеристические данные твердых веществ из препарата формы N соединения I суммированы в таблице 14.
|
ПРИМЕР 13: Изучение растворимостей
При температуре окружающей среды данные относительно растворимости формы A соединения I (непосредственно после получения) суммированы в таблице 15. Твердые вещества характеризуются кажущейся растворимостью значительно более 100 мг/мл в случае диметилформамида (DMF), дихлорметана (DCM) и 2,2,2-трифторэтанола (TFE). Указанный материал характеризовался умеренной растворимостью (например, >10 мг/мл) в большинстве тестируемых растворителей и сочетании растворителей. Единственным исключением был изопропанол (IPA), при 4,6 мг/мл. Некоторые данные по растворимости были получены на многочисленных образцах, как представлено ниже в таблице 15.
|
|
ПРИМЕР 14: Полиморфный скрининг
Была налажена серия экспериментов на основе растворителей с использованием взвеси, выпаривания, интенсивного осаждения и технологии диффузии из паровой фазы. Были получены образцы с соединением I формы A, и экспериментальные результаты суммированы в таблицах 16 и 17.
В одном из воплощений эксперименты с использованием растворителей из процессов кристаллизации для форм A и B привели к тому, что были охарактеризованы выборочные твердые вещества, полученные в указанных экспериментах, которые имели уникальные рентгенограммы XRPD, обозначенные как формы A-E, H и J, и которые описаны ниже. Несколько уникальных рентгенограмм XRPD было получено также из экспериментов с другими условиями, включая таковую рентгенологически аморфного твердого вещества. Никаких других характеристических свойств указанных твердых веществ определено не было. Суммарные иллюстративные результаты XRPD, полученные в экспериментах по кристаллизации, представлены в таблице 16.
|
|
|
ПРИМЕР 15: Композиция/Состав
Данный пример иллюстрирует различные компоненты, присутствующие в репрезентативной композиции, содержащей соединение I согласно настоящему изобретению, которая была составлена в виде партии объемного раствора с использованием следующих стадий: (a) получение твердой формы соединения I; (b) получение смешанного раствора, содержащего трет-бутиловый спирт и воду; (c) объединение твердой формы соединения I и смешанного раствора с образованием смеси; (d) добавление повидона к указанной смеси; (e) доведение pH указанной смеси путем добавления раствора соляной кислоты с получением композиционного раствора-рецептуры; (f) осуществление стерильной фильтрации композиционного раствора-рецептуры; и (g) лиофилизацию композиционного раствора-рецептуры в асептических условиях с получением конечной композиции, содержащей соединение I. Указанные стадии подробно описаны ниже в таблице 18.
|
|
ПРИМЕР 16: Получение лиофилизата
Приготовление смешанного раствора
После подготовки и стерилизации компонентов необходимого оборудования (крышки и пузырьки) все технологическое оборудование подвергали проверке, чтобы убедиться, что оно свободно от остаточной воды для ополаскивания. Сосуд 1, 20-галлонный, обшитый снаружи, сосуд из нержавеющей стали, промывали азотом NF/EP. Требуемое количество трет-бутилового спирта добавляли в сосуд 1. Температуру трет-бутилового спирта и сосуда для получения смеси заранее доводили до 28-32°C для поддержания данного сырого материала в виде свободнотекучей жидкости. После добавления трет-бутилового спирта и начала смешивания, добавляли требуемое количество воды для инъекций (WFI), и полученный раствор перемешивали до завершения процесса в течение 10±2 минут с получением конечного смешанного раствора объемом 56 л. Часть (25%) указанного смешанного раствора переносили во второй обшитый снаружи сосуд из нержавеющей стали меньшего размера, (сосуд 2) для использования на последующих стадиях смешивания. Температура обоих сосудов поддерживалась в пределах 28-32ºC, а сосуд 1 содержали под слоем азота NF/EP.
Приготовление композиционного раствора-рецептуры большого объема
Твердую форму лекарственного вещества соединения I взвешивали в изоляторе, а затем переносили непосредственно в резервуар со смешанным раствором (сосуд 1) с помощью одноразового сменного мешка для переноса в изолятор, с образованием раствора с лекарственным веществом. Переносной мешок 3 раза ополаскивали частью смешанного раствора из сосуда 2, и каждый раз раствор, которым ополаскивали, добавляли в резервуар со смешанным раствором.
Раствор лекарственного вещества перемешивали в течение 30±5 минут при 28-32ºC. После растворения аморфного соединения I, точно установленное количество повидона, USP, добавляли в сосуд для смешивания. Контейнер, в котором производили взвешивание, один раз ополаскивали частью смешанного раствора, и раствор, которым ополаскивали, добавляли в резервуар со смешанным раствором, который перемешивали в течение 20±5 минут при 28-32ºC, пока растворится повидон.
pH раствора большого объема доводили предварительно установленным количеством 0,1н раствора HCl и перемешивали в течение 10±2 минут при 28-32ºC с образованием композиционного раствора-рецептуры большого объема. Брали образец композиционного раствора-рецептуры большого объема и проверяли кажущееся значение pH, которое должно составлять от 3,6 до 4,0. Объем QS смешанного раствора, необходимый для достижения расчетной целевой массы, переносили из сосуда 2 в сосуд 1. Композиционный раствор-рецептуру большого объема перемешивали в течение 10±2 минут при 28-32ºC, а затем брали образец этого раствора для проверки контроля качества (QC), включая его анализ, внешний вид, плотность, pH и биологические показатели. В резервуар со смешанным раствором вносили затравку, и до осуществления стерильной фильтрации температуру поддерживали на уровне 28-32ºC.
Стерильная фильтрация композиционного раствора-рецептуры большого объема
Резервуар со смешанным раствором, содержащий композиционный раствор-рецептуру большого объема, переносили из системы компаундирования класса 100000 в форкамеру, соседнюю с системой наполнения класса 10000. Композиционный раствор-рецептуру большого объема переносили посредством оплетенного шланга 3/8" из нержавеющей стали производства Teflon®, пропуская через отверстие в стенке системы стерильного заполнения в саму систему стерильного заполнения под действием повышенного давления, создаваемого стерильным азотом, NF/EP. Композиционный раствор-рецептуру большого объема сначала осветляли, пропуская через фильтр Millipore Opticap® (мембрана Durapore® с размером пор 0,22 мкм), а затем стерилизовали путем фильтрации через систему фильтров, находящуюся внутри асептической сердцевины, содержащей 2 последовательно соединенных фильтра Millipore Millipak® Durapore® с размером пор 0,22 мкм, в стерильный принимающий сосуд. Целостность стерилизующих продукт фильтров проверяли по давлению и потоку до и после фильтрации, используя в качестве увлажняющего раствора систему изопропиловый спирт с водой (IPA)/вода (60%/40%). Минимальное значение выдерживаемого давления составляло 10 psi (68947,6 Па) до фильтрации, а максимальный поток составлял 1,3 мл/мин при 12 psi (82737,12 Па) после фильтрации. Образец отфильтрованного стерильным способом композиционного раствора-рецептуры большого объема брали для QC-тестирования, включая его внешний вид, анализ, плотность и pH.
Асептическое заполнение пузырьков при производстве лекарственного средства
Асептическое заполнение и закупоривание стерильных пузырьков осуществляли в условиях класса 100 с использованием автоматической линии наполнения TL. Контроль процесса включал проверку установленной массы пузырьков с целью выверки точности заполняемого объема в процессе операции заполнения.
Сразу же после заполнения каждого пузырька стерильную лиофилизационную пробку частично вставляли в пузырек, и каждая кассета с заполненными пузырьками передвигалась к месту загрузки лиофилизатора внутри асептической области класса 100. Кассеты сразу же помещались на предварительно охлажденные полки в лиофилизаторе.
Лиофилизация
Пузырьки, содержащие композиции, лиофилизировали в асептических условиях, используя предварительно запрограммированный цикл лиофилизации. Суммарное изложение способа осуществления и контроля цикла лиофилизации представлены в таблице 19.
|
|
В одном из воплощений дополнительная стадия после вторичной сушки после стадии 11 (таблица 19) включает высушивание пузырьков при температуре 50ºC вплоть до 24 часов при давлении 50 мкм Hg. В другом воплощении дополнительная стадия включает высушивание пузырьков при температуре 50ºC вплоть до 48 часов при давлении 50 мкм Hg.
В другом воплощении дополнительная стадия после вторичной сушки после стадии 11 (таблица 19) включает высушивание пузырьков при температуре 60ºC вплоть до 3 часов при давлении 100 мкм Hg. Еще в одном воплощении, дополнительная стадия включает высушивание пузырьков при температуре 60ºC вплоть до 6 часов при давлении 100 мкм Hg. В другом воплощении дополнительная стадия включает высушивание пузырьков при температуре 60ºC вплоть до 12 часов при давлении 100 мкм Hg. В другом воплощении дополнительная стадия включает высушивание пузырьков при температуре 60ºC вплоть до 24 часов при давлении 100 мкм Hg. В другом воплощении дополнительная стадия включает высушивание пузырьков при температуре 60ºC вплоть до 48 часов при давлении 100 мкм Hg.
В другом воплощении дополнительная стадия после вторичной сушки после стадии 11 (таблица 19) включает высушивание пузырьков при температуре 70ºC вплоть до 24 часов при давлении 25 мм Hg. В другом воплощении дополнительная стадия включает высушивание пузырьков при температуре 70ºC вплоть до 48 часов при давлении 25 мм Hg.
После завершения цикла (сегмент 12) пузырьки заполняли стерильным азотом, NF/EP, при атмосферном давлении, и задвижки были полностью установлены до открытия камеры лиофилизатора. Поддоны выгружали и переносили в зону герметического закупоривания пузырьков.
Пузырьки, содержащие композиции, закупоривали сразу же после выгрузки из лиофилизационной камеры. Каждое запаивание сопровождалось впечатыванием номера партии композиции, которое обеспечивалось струйным видеопринтером, встроенным в автоматическую линию запаивания. Контроль запаивания осуществляли каждые 15 минут в процессе проведения операции запаивания.
После операций запаивания пузырьки, содержащие композицию соединения I, проверяли, прикрепляли к ним ярлык и упаковывали, после чего осуществляли соответствующий способ валидации и/или оценки.
Эквиваленты
Специалист в данной области обнаружит или сможет в рамках рутинного экспериментирования установить множество эквивалентов описанных здесь специфических воплощений данного изобретения. Предполагается, что приведенное выше описание не предназначено для ограничения объема настоящего изобретения, который определяется прилагаемой формулой изобретения.
В формуле изобретения при употреблении единственного и множественного числа может подразумеваться "один" или "более чем один", если не указано обратное или если это с очевидностью не следует из контекста. Формула изобретения или описание, включающие слово "или" между двумя или несколькими членами группы, считаются удовлетворительными, если один, более чем один или все из членов данной группы присутствуют, используются или каким-нибудь иным образом связаны с данным продуктом или способом, если не указано обратное или если это с очевидностью не следует из контекста. Данное описание включает воплощения, в которых определенно один из членов группы присутствует, используется или каким-нибудь иным образом связан с данным продуктом или способом. Настоящее описание включает воплощения, в которых более чем один или все из членов данной группы присутствуют, используются или каким-нибудь иным образом связаны с данным продуктом или способом. Кроме того, следует понимать, что настоящее описание охватывает все вариации, комбинации и перестановки, при которых одно или несколько ограничений, элементов, пунктов, описательных терминов и т.д. из одного или нескольких из перечисленных пунктов формулы изобретения вводится в другой пункт. Например, любой пункт, который зависит от другого пункта, может быть модифицирован таким образом, чтобы включать одно или несколько ограничений, обнаруживаемых в любом другом пункте, который зависит от того же самого независимого пункта.
Когда элементы представлены в виде списков, например, в формате группы Маркуша, следует понимать, что каждая подгруппа элементов также описана, и любой элемент(-ы) может быть удален из данной группы. Следует понимать, что обычно, когда в описании или в аспектах описания указано, что они содержат конкретные элементы, признаки и т.д., определенные воплощения описания или аспекты описания состоят или по существу состоят из таких элементов, признаков и т.д. В целях упрощения указанные воплощения не были здесь особо описаны, чтобы не загромождать текст. Следует отметить, что здесь подразумевается, что термин "включающий" является открытым и допускает включение дополнительных элементов или стадий.
Когда приведены интервалы, крайние точки считаются включенными. Кроме того, следует понимать, что если не указано иное или если это как-нибудь с очевидностью не следует из контекста и его понимания специалистом в данной области, значения, которые выражены в виде интервалов значений, могут принимать любое конкретное значение или субинтервал значений внутри указанных областей в различных воплощениях настоящего изобретения, до десятых долей значения нижнего предела указанной области, если из контекста с очевидностью не следует иное.
Кроме того, следует понимать, что любое конкретное воплощение настоящего изобретения, которое попадает в область предшествующего уровня техники, может быть без колебаний исключено из какого-нибудь одного или нескольких из пунктов формулы изобретения. Поскольку предполагается, что такие воплощения известны специалистам в данной области, они могут быть исключены даже в том случае, если указанное исключение здесь в явной форме не изложено. Любое конкретное воплощение составных частей описания (например, целевого фрагмента, любого заболевания, расстройства и/или состояния, любого связующего средства, любого способа введения, любого терапевтического применения, и т.д.) может быть исключено из какого-нибудь одного или нескольких пунктов формулы изобретения по любой из причин, независимо от того, связаны ли они или не связаны с наличием предшествующего уровня техники.
Публикации, обсуждавшиеся выше и по всему тексту, приведены исключительно в силу того, что они были представлены до даты подачи настоящей заявки. Ничего из представленного здесь не должно быть истолковано как допущение, что авторы изобретения задним числом включают в описание тот или иной фрагмент незаконно, на основании того, что он описан в предшествующем уровне техники.