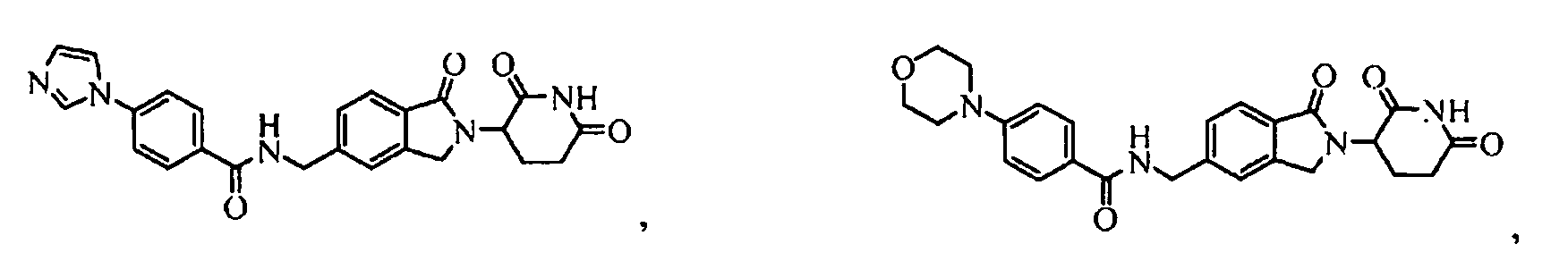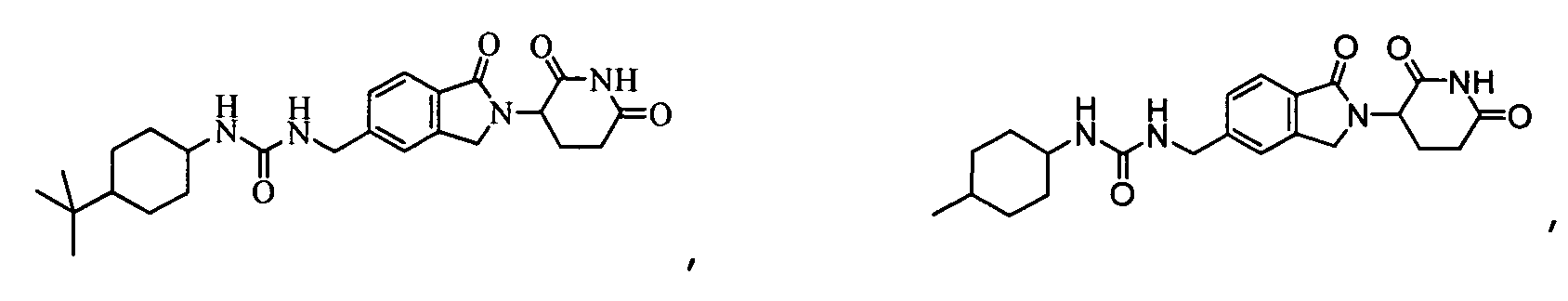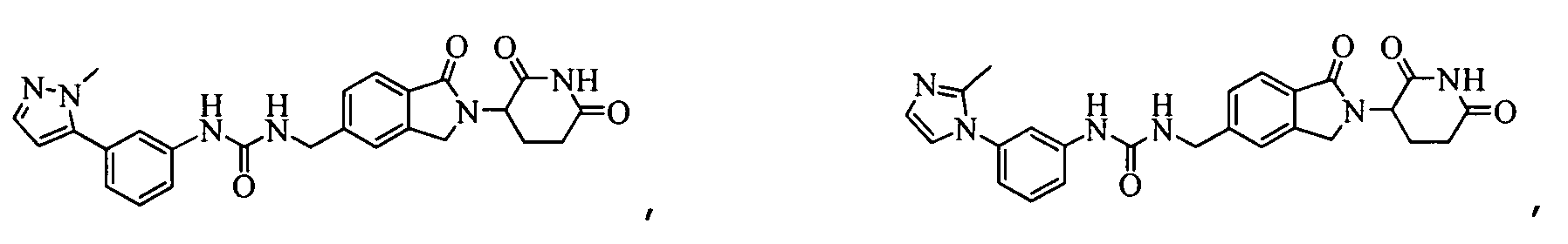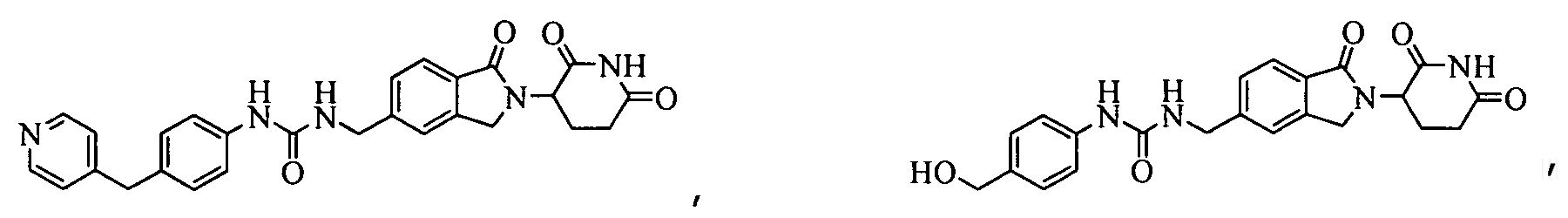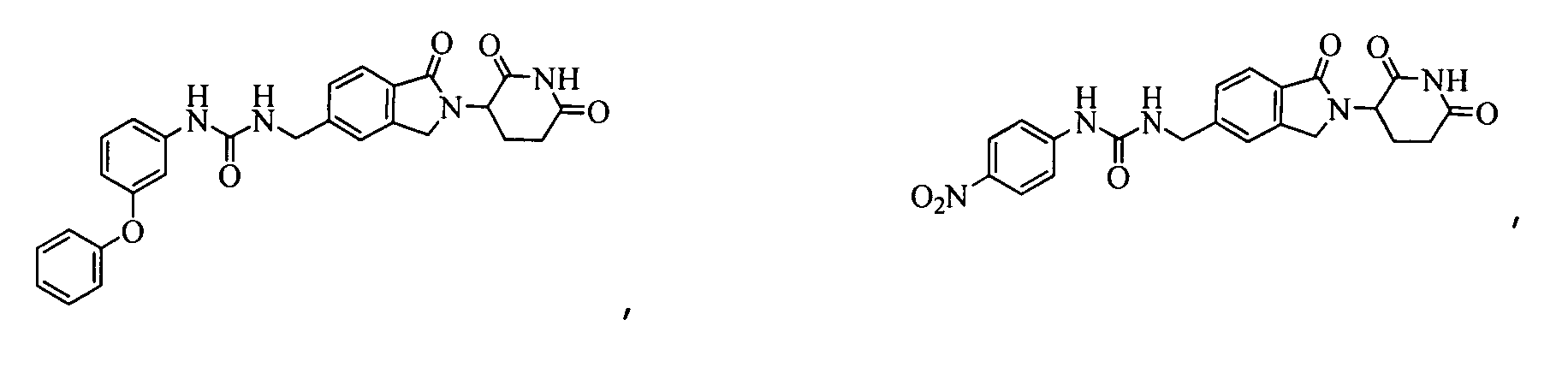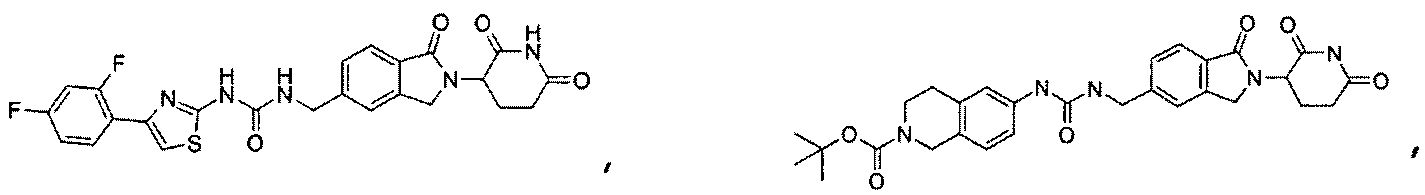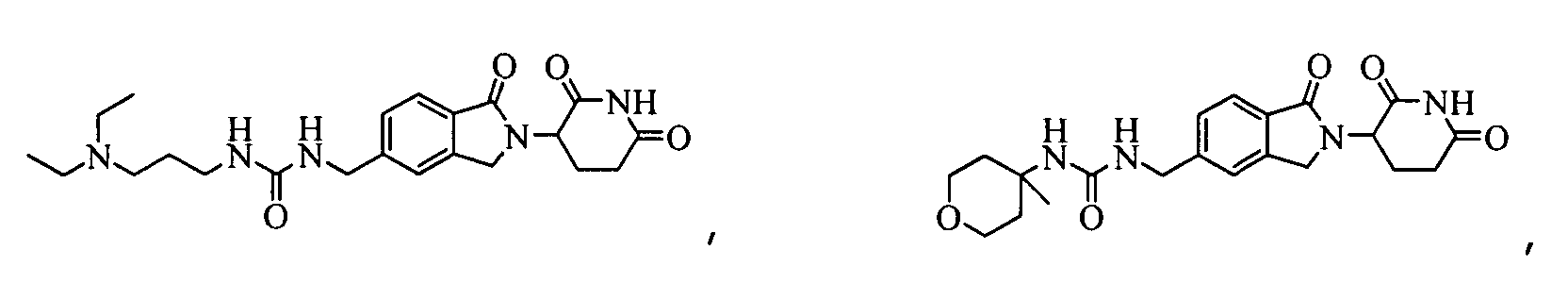Результат интеллектуальной деятельности: ИЗОИНДОЛИНОВЫЕ СОЕДИНЕНИЯ ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ РАКА
Вид РИД
Изобретение
1. ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к изоиндолиновым соединениям, фармацевтическим композициям, содержащим одно или несколько таких соединений, и способам их применения для лечения, предупреждения или контролирования различных заболеваний.
2. УРОВЕНЬ ТЕХНИКИ
2.1. ПАТОБИОЛОГИЯ РАКА И ДРУГИХ ЗАБОЛЕВАНИЙ
Рак характеризуется главным образом увеличением числа атипичных клеток, происходящих из исходной нормальной ткани, инвазией прилегающих тканей данными атипичными клетками или распространением по лимфатическим или кровеносным сосудам малигнизированных клеток в региональные лимфоузлы и отдаленные органы (метастазирование). Клинические данные и исследования молекулярной биологии указывают, что рак является многостадийным процессом, который начинается с небольших пренеопластических изменений, которые в определенных условиях могут прогрессировать в неоплазию. Неопластическое образование может разрастаться в результате деления клеток и обнаруживать повышенную способность к инвазии, росту, метастазированию и гетерогенности, особенно в условиях, при которых неопластические (опухолевые) клетки не распознаются иммунной системой организма-носителя (Roitt et al, Immunology 17.1-17.12 (3rd ed., Mosby, St. Louis, Mo., 1993)).
Существует много разновидностей рака, которые подробно описаны в медицинской литературе. Примеры включают рак легкого, толстой кишки, прямой кишки, предстательной железы, молочной железы, мозга и кишечника. Число случаев возникновения рака продолжает расти по мере старения населения, выявления нового рака и роста численности восприимчивых групп людей (например, ВИЧ-инфицированных людей или чрезмерно подвергающихся воздействию солнечных лучей). Однако возможные варианты лечения рака ограничены. Например, в случае рака системы крови (например, миеломной болезни) доступно немного вариантов, особенно в случае, когда традиционная химиотерапия оказывается неудачной и нет возможности для пересадки костного мозга. Поэтому существует громадная потребность в новых способах и композициях, которые могут применяться для лечения пациентов с раком.
Большинство типов рака связано с формированием новых кровеносных сосудов - процессом, известным как ангиогенез. Выявлено несколько механизмов, вовлеченных в стимулируемый опухолью ангиогенез. Наиболее прямым из данных механизмов является секреция клетками опухоли цитокинов с ангиогенными свойствами. Примеры данных цитокинов включают кислотный и основный фактор роста фибробластов (α,β-ФРФ (α,β-FGF)), ангиогенин, фактор роста эндотелия сосудов (ФРЭС, VEGF) и ФНО-α (TNF-α). В качестве альтернативы, опухолевые клетки могут выделять ангиогенные пептиды посредством продукции протеаз и последующего расщепления внеклеточного матрикса, где хранятся некоторые цитокины (например, β-ФРФ (β-FGF)). Ангиогенез может также опосредованно индуцироваться посредством рекрутирования клеток воспаления (в частности, макрофагов) и последующего выделения ими ангиогенных цитокинов (например, ФНО-α, β-ФРФ).
Целый ряд других заболеваний или расстройств также связан с, или характеризуется, нежелательным ангиогенезом. Например, повышенный или нерегулируемый ангиогенез вовлечен в ряд заболеваний или медицинских состояний, включая, в качестве неограничивающих примеров, неоваскулярные заболевания глаз, хориоидальные неоваскулярне заболевания, неоваскулярные заболевания сетчатки, рубеоз (неоваскуляризация угла передней камеры), вирусные заболевания, генетические заболевания, воспалительные заболевания, аллергические заболевания и аутоиммунные заболевания. Примеры таких заболеваний и состояний включают в качестве неограничивающих примеров диабетическую ретинопатию, ретинопатию недоношенных, отторжение трансплантата роговицы, неоваскулярную глаукому, ретролентальную фиброплазию, артрит и пролиферативную витреоретинопатию.
Соответственно, соединения, которые могут контролировать ангиогенез или ингибировать продукцию определенного рода цитокинов, включая ФНО-α, могут быть полезны при лечении и предупреждении различных заболеваний и состояний.
2.2. СПОСОБЫ ЛЕЧЕНИЯ РАКА
В настоящее время терапия рака может включать хирургическую операцию, химиотерапию, гормонотерапию и/или лучевую терапию для уничтожения неопластических клеток у пациента (см., например, Stockdale, 1998, Medicine, vol. 3, Rubenstein и Federman, eds., Chapter 12, Section IV). В последнее время терапия рака могла также включать биологическую терапию или иммунотерапию. Все данные подходы представляют собой значительные препятствия для пациента. Хирургическая операция, например, может быть противопоказана в связи со здоровьем пациента или может быть неприемлема для пациента. Кроме того, хирургическая операция может не полностью удалить неопластическую ткань. Лучевая терапия является эффективной только тогда, когда неопластическая ткань проявляет большую чувствительность к облучению, чем нормальная ткань. Лучевая терапия может также часто вызывать серьезные побочные эффекты. Гормонотерапия редко применяется одна. Хотя гормонотерапия может быть эффективной, ее часто применяют для предотвращения или отсрочки рецидива рака после других способов лечения, в результате которых удалили большую часть опухолевых клеток. Число вариантов биологической терапии и иммунотерапии ограничено, и они могут приводить к побочным эффектам, таким как сыпь или отеки, гриппоподобные симптомы, включая жар, озноб и усталость, проблемы с желудочно-кишечным трактом или аллергические реакции.
В отношении химиотерапии существуют различные химитерапевтические агенты, предлагаемые для лечения рака. В основном препараты для химитерапии рака действуют путем ингибирования синтеза ДНК, либо непосредственно, либо опосредованно путем ингибирования биосинтеза предшественников дезоксирибонуклеотидтрифосфата для предотвращения репликации ДНК и сопутствующего деления клеток (Gilman et al., Goodman and Gilman's: The Pharmacological Basis of Therapeutics, Tenth Ed. (McGraw Hill, New York)).
Несмотря на доступность различных химиотерапевтических агентов химиотерапия имеет много препятствий (Stockdale, Medicine, vol. 3, Rubenstein and Federman, eds., Chapter. 12, sect. 10, 1998). Почти все химиотерапевтические агенты являются токсичными, и химиотерапия вызывает сильные и часто очень опасные побочные эффекты, включая сильную тошноту, подавление деятельности костного мозга и угнетение иммунитета. Кроме того, даже при введении комбинаций химиотерапевтических агентов многие опухолевые клетки являются резистентными или развивается резистентность в отношении химиотерапевтических агентов. В действительности, эти клетки, резистентные к конкретным химиотерапевтическим агентам, используемым в протоколе лечения, часто оказываются резистентными к другим лекарственным средствам, даже если данные агенты действуют посредством механизмов, отличных от механизмов лекарственных средств, применяемых в конкретном лечении. Из-за лекарственной резистентности многие раки оказываются или становятся невосприимчивыми к стандартным протоколам химиотерапевтического лечения.
Другие заболевания или состояния, связанные с, или характеризующиеся нежелательным ангиогенезом также с трудом поддаются лечению. Однако предполагается, что некоторые соединения, такие как протамин, гепарин и стероиды, полезны при лечении некоторых специфических заболеваний (Taylor et al., Nature 297:307 (1982); Folkman et al., Science 221:719 (1983) и патенты США № 5001116 и 4994443.
До сих пор существует сильная потребность в эффективных способах лечения, предупреждения и контролирования рака и других заболеваний и состояний, в частности для заболеваний, которые являются невосприимчивыми к стандартным способам лечения, таким как хирургическая операция, лучевая терапия, химиотерапия и гормонотерапия, наряду с этим позволяющих уменьшить или избежать токсичности и/или побочных эффектов, связанных с традиционными способами лечения.
3. СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Предлагаются изоиндолиновые соединения и их фармацевтически приемлемые соли, сольваты, пролекарства или стереоизомеры.
Также предлагаются фармацевтические композиции, содержащие предлагаемое соединение, например соединение Формулы I, включая его индивидуальный энантиомер, смесь энантиомеров или смесь диастереомеров; или его фармацевтически приемлемую соль, сольват или пролекарство; в комбинации с одним или несколькими фармацевтически примлемыми носителями.
Кроме того, предлагаются способы лечения, предупреждения или контролирования различных заболеваний у субъекта, которые включают введение субъекту терапевтически эффективного количества предлагаемого соединения, например соединения Формулы I, включая его индивидуальный энантиомер, смесь энантиомеров или смесь диастереомеров, или его фармацевтически приемлемую соль, сольват или пролекарство.
4. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
4.1. ОПРЕДЕЛЕНИЯ
Для облегчения понимания излагаемого в описании раскрытия ниже даны определения ряда терминов.
В целом, используемая номенклатура и описанные лабораторные методики органической химии, медицинской химии и фармакологии хорошо известны и обычно применяются в данной области техники. Если не указано иное, все используемые в описании технические и научные термины обычно имеют то же самое значение, которое обычно понимает любой средний специалист в области техники, к которой относится данное описание.
Термин «субъект» относится к животному, включая, в качестве неограничивающих примеров, примата (например, человека), корову, овцу, козу, лошадь, собаку, кошку, кролика, крысу или мышь. Термины «субъект» и «пациент» используются взаимозаменяемо по отношению, например, к субъекту-млекопитающему, такому как человек.
Термины «лечить», «осуществляющий лечение» и «лечение» относятся к ликвидации или уменьшению интенсивности заболевания или расстройства, или одного или нескольких симптомов, связанных заболеванием или расстройством. В общем, лечение протекает после начала заболевания или расстройства. В некоторых примерах осуществления изобретения термины относятся к минимизации распространения или ухудшения заболевания или расстройства в результате введения одного или нескольких профилактических или терапевтических агентов субъекту с таким заболеванием или расстройством.
Термины «предупреждать», «предупреждающий» и «предупреждение» относятся к предупреждению начала, рецидива или распространения заболевания или расстройства или одного или нескольких их симптомов. В общем, предупреждение осуществляется до начала заболевания или расстройства.
Термины «контролировать», «контролирующий» и «контролирование» относятся к предупреждению или замедлению прогрессирования, распространения или ухудшения заболевания или расстройства, или одного или нескольких их симптомов. Иногда положительные эффекты, которые субъект получает от профилактического или терапевтического агента, не приводят к лечению заболевания или расстройства.
Термин «терапевтически эффективное количество» предназначен для того, чтобы охватывать количество соединения, которое при введении является достаточным для предупреждения развития или облегчения до некоторой степени одного или нескольких симптомов расстройства, заболевания или состояния, подвергаемого лечению. Термин «терапевтически эффективное количество» также относится к количеству соединения, которое является достаточным для достижения биологического или медицинского ответа клетки, ткани, системы, животного или человека, которого добивается исследователь, ветеринар, доктор или клиницист.
Термин «IC50» относится к количеству, концентрации или дозе соединения, которые требуются для 50% ингибирования максимального ответа в тесте, в котором оценивается данный ответ.
Термин «фармацевтически приемлемый носитель», «фармацевтически приемлемое вспомогательное вещество», «физиологически приемлемый носитель» или «физиологически приемлемое вспомогательное вещество» относится к фармацевтически приемлемому материалу, композиции или среде, таким как жидкий или твердый наполнитель, разбавитель, вспомогательное вещество, растворитель или материал для инкапсулирования. В одном примере осуществления каждый компонент является «фармацевтически приемлемым» в том смысле, что является совместимым с другими компонентами фармацевтического состава и подходит для применения в контакте с тканью или органом людей или животных без возникновения повышенной токсичности, раздражения, аллергической реакции, иммуногенности или других проблем или осложнений, в соответствии с целесообразным соотношением риск/польза. См. «Remington: The Science and Practice of Pharmacy», 21st Edition, Lippincott Williams & Wilkins: Philadelphia, PA, 2005; «Handbook of Pharmaceutical Excipients», 5th Edition, Rowe et al., Eds., The Pharmaceutical Press and the American Pharmaceutical Association, 2005; «Handbook of Pharmaceutical Additives», 3rd Edition, Ash and Ash Eds., Gower Publishing Company, 2007; «Pharmaceutical Preformulation and Formulation», Gibson Ed., CRC Press LLC: Boca Raton, FL, 2004.
Термин «приблизительно» означает допустимую погрешность для конкретной величины, что определяется любым средним специалистом в данной области техники, которая зависит частично от того, как величина измеряется или определяется. В некоторых примерах осуществления изобретения термин «приблизительно» означает в пределах 1, 2, 3 или 4 стандартных отклонений. В некоторых примерах осуществления изобретения термин «приблизительно» означает в пределах 50%, 20%, 15%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,5% или 0,05% данной величины или диапазона.
Термины «активный компонент» и «активная субстанция» относятся к соединению, которое вводится одно или в комбинации с одним или несколькими фармацевтически приемлемыми вспомогательными веществами субъекту для лечения, предупреждения или уменьшения интенсивности одного или нескольких симптомов состояния, расстройства или заболевания. Как используется, «активный компонент» и «активная субстанция» может быть оптически активным изомером раскрываемого соединения.
Термины «лекарственное средство», «терапевтический агент» и «химиотерапевтический агент» относятся к соединению или фармацевтической композиции, которая вводится субъекту для лечения, предупреждения или уменьшения интенсивности одного или нескольких симптомов состояния, расстройства или заболевания.
Термин «алкил» относится к линейному или разветвленному насыщенному одновалентному углеводородному радикалу, где алкил может необязательно быть замещен одним или несколькими заместителями. Термин «алкил» также охватывает как линейный, так и разветвленный алкил, за исключением особо указанных случаев. В некоторых примерах осуществления алкил представляет собой линейный и насыщенный одновалентный углеводородный радикал, который имеет 1-20 (C1-20), 1-15 (C1-15), 1-12 (C1-12), 1-10 (C1-10) или 1-6 (C1-6) атомов углерода, или разветвленный насыщенный одновалентный углеводородный радикал из 3-20 (C3-20), 3-15 (C3-15), 3-12 (C3-12), 3-10 (C3-10) или 3-6 (C3-6) атомов углерода. Как используется, линейные C1-6 и разветвленные C3-6 алкильные группы также называются «низший алкил». Примеры алкильных групп включают, в качестве неограничивающих примеров, метил, этил, пропил (включая все изомерные формы), н-пропил, изопропил, бутил (включая все изомерные формы), н-бутил, изобутил, трет-бутил, пентил (включая все изомерные формы) и гексил (включая все изомерные формы). Например, C1-6 алкил относится к линейному насыщенному одновалентному углеводородному радикалу с 1-6 атомами углерода или разветвленному насыщенному одновалентному углеводородному радикалу с 3-6 атомами углерода.
Термин «алкенил» относится к линейному или разветвленному одновалентному углеводородному радикалу, который содержит одну или несколько, в одном примере осуществления одну-пять, углерод-углеродных двойных связей. Алкенил может необязательно быть замещен одним или несколькими заместителями. Термин «алкенил» также включает радикалы с «цис-» и «транс-» конфигурациями или, альтернативно, «E-» и «Z-» конфигурациями, что ясно специалистам в данной области техники. Как используется, термин «алкенил» охватывает как линейный, так и разветвленный алкенил, за исключением особо указанных случаев. Например, C2-6 алкенил относится к линейному ненасыщенному одновалентному углеводородному радикалу с 2-6 атомами углерода или разветвленному ненасыщенному одновалентному углеводородному радикалу с 3-6 атомами углерода. В некоторых примерах осуществления изобретения алкенил представляет собой линейный одновалентный углеводородный радикал с 2-20 (C2-20), 2-15 (C2-15), 2-12 (C2-12), 2-10 (C2-10) или 2-6 (C2-6) атомами углерода или разветвленный одновалентный углеводородный радикал с 3-20 (C3-20), 3-15 (C3-15), 3-12 (C3-12), 3-10 (C3-10) или 3-6 (C3-6) атомами углерода. Примеры алкенильных групп включают, в качестве неограничивающих примеров, этенил, пропен-1-ил, пропен-2-ил, аллил, бутенил и 4-метилбутенил.
Термин «алкинил» относится к линейному или разветвленному одновалентному углеводородному радикалу, который содержит одну или несколько, в одном примере осуществления одну-пять, углерод-углеродных тройных связей. Алкинил может необязательно быть замещен одним или несколькими заместителями. Термин «алкинил» также охватывает как линейный, так и разветвленный алкинил, за исключением особо указанных случаев. В некоторых примерах осуществления изобретения алкинил представляет собой линейный одновалентный углеводородный радикал с 2-20 (C2-20), 2-15 (C2-15), 2-12 (C2-12), 2-10 (C2-10) или 2-6 (C2-6) атомами углерода или разветвленный одновалентный углеводородный радикал с 3-20 (C3-20), 3-15 (C3-15), 3-12 (C3-12), 3-10 (C3-10) или 3-6 (C3-6) атомами углерода. Примеры алкинильных групп включают, в качестве неограничивающих примеров, этинил (-C≡CH) и пропаргил (-CH2C≡CH). Например, C2-6 алкинил относится к линейному ненасыщенному одновалентному углеводородному радикалу с 2-6 атомами углерода или разветвленному ненасыщенному одновалентному углеводородному радикалу с 3-6 атомами углерода.
Термин «циклоалкил» относится к циклическому насыщенному мостиковому и/или немостиковому одновалентному углеводородному радикалу, который может необязательно быть замещен одним или несколькими заместителями. В некоторых примерах осуществления изобретения циклоалкил имеет от 3 до 20 (C3-20), от 3 до 15 (C3-15), от 3 до 12 (C3-12), от 3 до 10 (C3-10) или от 3 до 7 (C3-7) атомов углерода. Примеры циклоалкильных групп включают, в качестве неограничивающих примеров, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, декалинил и адамантил.
Термин «арил» относится к моноциклической ароматической группе и/или полициклической одновалентной ароматической группе, которая содержит по меньшей мере одно ароматическое углеводородное кольцо. В некоторых примерах осуществления изобретения арил имеет от 6 до 20 (C6-20), от 6 до 15 (C6-15) или от 6 до 10 (C6-10) атомов в кольце. Примеры арильных групп включают, в качестве неограничивающих примеров, фенил, нафтил, флуоренил, азуленил, антрил, фенантрил, пиренил, бифенил и трифенил. Арил также относится к бициклическим или трициклическим углеродным кольцам, где одно из колец является ароматическим, а другие могут быть насыщенными, частично ненасыщенными или ароматическими, например дигидронафтил, инденил, инданил или тетрагидронафтил (тетралинил). В некоторых примерах осуществления изобретения арил может также необязательно быть замещенным одним или несколькими заместителями.
Термин «аралкил» или «арил-алкил» относится к одновалентной алкильной группе, замещенной арилом. В некоторых примерах осуществления изобретения как алкил, так и арил может необязательно быть замещен одним или несколькими заместителями.
Термин «гетероарил» относится к моноциклической ароматической группе и/или полициклической ароматической группе, которая содержит по меньшей мере одно ароматическое кольцо, где по меньшей мере одно ароматическое кольцо содержит один или несколько гетероатомов, независимо выбранных из O, S и N. Каждое кольцо гетероарильной группы может содержать один или два атома O, один или два атома S и/или один-четыре атома N, при условии, что общее количество гетероатомов в каждом кольце равно четырем или меньше и каждое кольцо содержит содержит по меньшей мере один атом углерода. Гетероарил может быть присоединен к главной структуре по любому гетероатому или атому углерода, что приводит к формированию стабильного соединения. В некоторых примерах осуществления изобретения гетероарил имеет от 5 до 20, от 5 до 15 или от 5 до 10 атомов в кольце. Примеры моноциклических гетероарильных групп включают, в качестве неограничивающих примеров, пирролил, пиразолил, пиразолинил, имидазолил, оксазолил, изоксазолил, тиазолил, тиадиазолил, изотиазолил, фуранил, тиенил, оксадиазолил, пиридил, пиразинил, пиридинил, пиридазинил и триазинил. Примеры бициклических гетероарильных групп включают, в качестве неограничивающих примеров, индолил, бензотиазолил, бензоксазолил, бензотиенил, хинолинил, тетрагидроизохинолинил, изохинолинил, бензимидазолил, бензопиранил, индолизинил, бензофуранил, изобензофуранил, хромонил, кумаринил, циннолинил, хиноксалинил, индазолил, пуринил, пирролопиридинил, фуропиридинил, тиенопиридинил, дигидроизоиндолил и тетрагидрохинолинил. Примеры трициклических гетероарильных групп включают, в качестве неограничивающих примеров, карбазолил, бензиндолил, фенантролин, акридинил, фенантридинил и ксантенил. В некоторых примерах осуществления изобретения гетероарил может также необязательно быть замещен одним или несколькими заместителями.
Термин «гетероциклил» или «гетероциклический» относится к моноциклической неароматической кольцевой системе и/или полициклической кольцевой системе, которая содержит по меньшей мере одно неароматическое кольцо, где один или несколько атомов в неароматическом кольце являются гетероатомами, независимо выбранными из O, S или N; и оставшиеся атомы в кольце являются атомами углерода. В некоторых примерах осуществления изобретения гетероциклил или гетероциклическая группа имеет от 3 до 20, от 3 до 15, от 3 до 10, от 3 до 8, от 4 до 7 или от 5 до 6 атомов в кольце. В некоторых примерах осуществления изобретения гетероциклил является моноциклической, бициклической, трициклической или тетрациклический кольцевой системой, которая может включать конденсированную или мостиковую кольцевую систему и в которой атомы азота или серы могут быть необязательно окисленными, атомы азота могут необязательно быть кватернизованы и некоторые кольца могут быть частично или полностью насыщенными или ароматическими. Гетероциклил может быть присоединен к главной структуре по любому гетероатому или атому углерода, что приводит к формированию стабильного соединения. Примеры таких гетероциклических радикалов включают, в качестве неограничивающих примеров, акридинил, азепинил, бензимидазолил, бензиндолил, бензоизоксазолил, бензизоксазинил, бензодиоксанил, бензодиоксолил, бензофуранонил, бензофуранил, бензонафтофуранил, бензопиранонил, бензопиранил, бензотетрагидрофуранил, бензотетрагидротиенил, бензотиадиазолил, бензотиазолил, бензотиофенил, бензотриазолил, бензотиопиранил, бензоксазинил, бензоксазолил, бензотиазолил, β-карболинил, карбазолил, хроманил, хромонил, циннолинил, кумаринил, декагидроизохинолинил, дибензофуранил, дигидробензизотиазинил, дигидробензизоксазинил, дигидрофурил, дигидропиранил, диоксоланил, дигидропиразинил, дигидропиридинил, дигидропиразолил, дигидропиримидинил, дигидропирролил, диоксоланил, 1,4-дитианил, фуранонил, фуранил, имидазолидинил, имидазолинил, имидазолил, имидазопиридинил, имидазотиазолил, индазолил, индолинил, индолизинил, индолил, изобензотетрагидрофуранил, изобензотетрагидротиенил, изобензотиенил, изохроманил, изокумаринил, изоиндолинил, изоиндолил, изохинолинил, изотиазолидинил, изотиазолил, изоксазолидинил, изоксазолил, морфилинил, нафтиридинил, октагидроиндолил, октагидроизоиндолил, оксадиазолил, оксазолидинонил, оксазолидинил, оксазолопиридинил, оксазолил, оксиранил, перимидинил, фенантридинил, фенатролинил, фенарсазинил, феназинил, фенотиазинил, феноксазинил, фталазинил, пиперазинил, пиперидинил, 4-пиперидонил, птеридинил, пуринил, пиразинил, пиразолидинил, пиразолил, пиридазинил, пиридинил, пиридопиридинил, пиримидинил, пирролидинил, пирролинил, пирролил, хиназолинил, хинолинил, хиноксалинил, хинуклидинил, тетрагидрофурил, тетрагидрофуранил, тетрагидроизохинолинил, тетрагидропиранил, тетрагидротиенил, тетразолил, тиадиазолопиримидинил, тиадиазолил, тиаморфилинил, тиазолидинил, тиазолил, тиенил, триазинил, триазолил и 1,3,5-тритианил. В некоторых примерах осуществления изобретения гетероцикл может также необязательно быть замещен одним или несколькими заместителями.
Термин «галоген» или «галогенид» относится к фтору, хлору, брому и/или йоду.
Термины «оптически активный» и «энантиомерно активный» относится к совокупности молекул, где энантиомерный избыток (энантиомерная чистота) составляет не менее приблизительно 50%, не менее приблизительно 70%, не менее приблизительно 80%, не менее приблизительно 90%, не менее приблизительно 91%, не менее приблизительно 92%, не менее приблизительно 93%, не менее приблизительно 94%, не менее приблизительно 95%, не менее приблизительно 96%, не менее приблизительно 97%, не менее приблизительно 98%, не менее приблизительно 99%, не менее приблизительно 99,5% или не менее приблизительно 99,8%.
При описании оптически активного соединения префиксы R и S используются для указания абсолютной конфигурации молекулы в ее хиральном(ых) центре(ах). Знаки (+) и (-) используются для указания оптического вращения соединения, то есть направления, в котором плоскость поляризованного света вращается оптически активным соединением. Префикс (-) указывает на то, что соединение является левовращающим, то есть соединение вращает плоскость поляризованного света влево или против часовой стрелки. Префикс (+) указывает на то, что соединение является правовращающим, то есть вращает плоскость поляризованного света вправо или по часовой стрелке. Однако знак оптического вращения (+) и (-) не связан с абсолютной конфигурацией молекулы - R и S.
Термин «сольват» относится к предлагаемому соединению или его соли, которая дополнительно содержит стехиометрическое или нестехиометрическое количество растворителя, связанного нековалентными силами межмолекулярного взаимодействия. Когда растворителем является вода, сольват представляет собой гидрат.
4.2. СОЕДИНЕНИЯ
Описание предлагает изоиндолиновые соединения, фармацевтические композиции, содержащие одно или несколько таких соединений, и способы их применения для лечения, предупреждения или контролирования различных заболеваний.
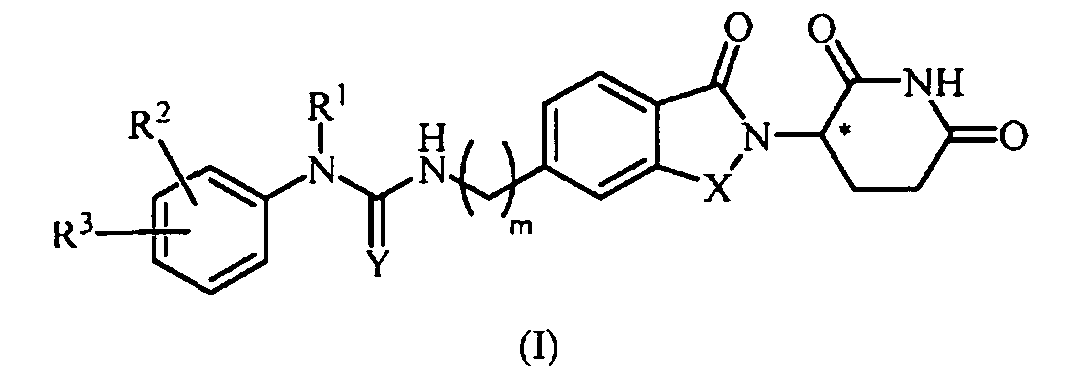
В одном примере осуществления обеспечивается соединение Формулы I:
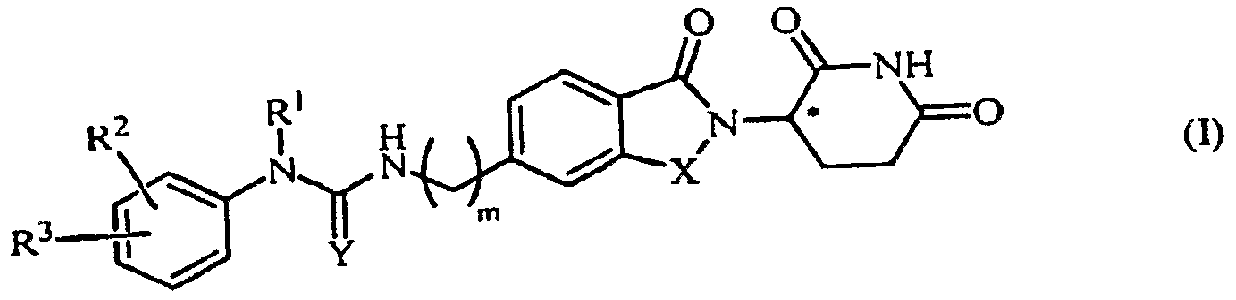
или его фармацевтически приемлемая соль, сольват, пролекарство или стереоизомер, где
X представляет собой C(=O) или CH2;
Y представляет собой O, цианамидо 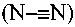 или амидо (NH);
или амидо (NH);
m представляет собой целое число 0, 1, 2 или 3;
R1 представляет собой водород или C1-6 алкил;
R2 представляет собой водород, -NO2, C1-10 алкил, C0-6 алкил-(5-10-членный гетероарил), C0-6 алкил-(5-6-членный гетероциклил), C0-6 алкил-OH, C0-4 алкил-NH2, -NHCO-C1-6 алкил, -OR21 или -(CH2-Z)0-2-(5-10-членный гетероарил), где каждый гетероарил и гетероциклил необязательно замещен одним или несколькими C1-6 алкилами;
R3 представляет собой водород, галоген, -NO2, C0-6 алкил-(5-10-членный гетероарил), C0-6 алкил-(5-6-членный гетероциклил), C0-6 алкил-OH, C0-4 алкил-NH2, -NHCO-C1-6 алкил, -OR21 или -(CH2-Z)0-2-(5-10-членный гетероарил), где каждый гетероарил и гетероциклил необязательно замещен одним или несколькими С1-6 алкилами;
R21 представляет собой C6-10 арил, 5-10-членный гетероарил, 5-6-членный гетероциклил или -CO(CH2)0-2R22, где арил, гетероарил и гетероциклил, каждый, необязательно замещен одним или несколькими C1-6 алкилами;
R22 представляет собой -NH2 или 5-6-членный гетероциклил; и
Z представляет собой CH2, NH или O;
при условии, что когда R1 представляет собой водород, тогда R2 не является водородом или C1-10 алкилом;
при условии, что когда Y представляет собой O, тогда R3 не является галогеном; и
при условии, что когда Y представляет собой O и R3 представляет собой галоген, тогда R2 представляет собой C0-6 алкил-(5-6-членный гетероциклил).
В некоторых примерах осуществления изобретения X представляет собой CH2. В некоторых примерах осуществления изобретения X представляет собой C(=O).
В некоторых примерах осуществления изобретения Y представляет собой O. В некоторых примерах осуществления изобретения Y представляет собой цианамидо. В некоторых примерах осуществления изобретения Y представляет собой амидо.
В некоторых примерах осуществления изобретения Z представляет собой CH2. В некоторых примерах осуществления изобретения Z представляет собой NH. В некоторых примерах осуществления изобретения Z представляет собой O.
В некоторых примерах осуществления изобретения m равно 0. В некоторых примерах осуществления изобретения m равно 1. В некоторых примерах осуществления изобретения m равно 2. В некоторых примерах осуществления изобретения m равно 3.
В некоторых примерах осуществления изобретения R1 представляет собой водород. В некоторых примерах осуществления изобретения R1 представляет собой C1-6 алкил, необязательно замещенный одним, двумя или тремя заместителями Q, описанными здесь. В некоторых примерах осуществления изобретения R1 представляет собой метил.
В некоторых примерах осуществления изобретения R2 представляет собой водород. В некоторых примерах осуществления изобретения R2 представляет собой галоген. В некоторых примерах осуществления изобретения R2 представляет собой нитро. В некоторых примерах осуществления изобретения R2 представляет собой C1-10 алкил. В некоторых примерах осуществления изобретения R представляет собой C0-6 алкил-(5-10-членный гетероарил), где гетероарил необязательно замещен одним или несколькими C1-6 алкилами. В некоторых примерах осуществления изобретения R2 представляет собой C0-6 алкил-(5-6-членный гетероциклил), где гетероциклил необязательно замещен одним или несколькими C1-6 алкилами. В некоторых примерах осуществления изобретения R2 представляет собой C0-6 алкил-OH. В некоторых примерах осуществления изобретения R2 представляет собой C0-4 алкил-NH2. В некоторых примерах осуществления изобретения R2 представляет собой -NHCO-C1-6 алкил. В некоторых примерах осуществления изобретения R2 представляет собой -OR21, где R21 описан здесь. В некоторых примерах осуществления изобретения R2 представляет собой -(CH2-Y)0-2-(5-10-членный гетероарил), где гетероарил необязательно замещен одним или несколькими C1-6 алкилами. В некоторых примерах осуществления изобретения R2 представляет собой водород, амино, ацетамидо, гидрокси, нитро, аминометил, гидроксиметил, 2-метил-1H-имидазол-1-ил, 3-метил-1,2,4-оксадиазол-5-ил, 4-(метилпиперазин-1-ил)метил, 2-метил-2H-пиразол-3-ил, 1-метил-1H-пиразол-3-ил, 2-метилтиазол-4-ил, 4-метил-4H-1,2,4-триазол-3-ил, морфолинометил, (пиридин-4-ил)метил, (пиридин-4-илокси)метил, фенокси, пиридин-2-илокси, пиперидин-4-илокси, 2-аминоацетокси или 2-пиперазин-1-илацетокси.
В некоторых примерах осуществления изобретения R3 представляет собой водород. В некоторых примерах осуществления изобретения R3 представляет собой нитро. В некоторых примерах осуществления изобретения R3 представляет собой C0-6 алкил-(5-10-членный гетероарил), где гетероарил необязательно замещен одним или несколькими C1-6 алкилами. В некоторых примерах осуществления изобретения R3 представляет собой C0-6 алкил-(5-6-членный гетероциклил), где гетероциклил необязательно замещен одним или несколькими С1-6 алкилами. В некоторых примерах осуществления изобретения R3 представляет собой С0-6 алкил-OH. В некоторых примерах осуществления изобретения R3 представляет собой C0-4 алкил-NH2. В некоторых примерах осуществления изобретения R3 представляет собой -NHCO-C1-6 алкил. В некоторых примерах осуществления изобретения R3 представляет собой -OR21, где R21 описан здесь. В некоторых примерах осуществления изобретения R3 представляет собой -(CH2-Y)0-2-(5-10-членный гетероарил), где гетероарил необязательно замещен одним или несколькими C1-6 алкилами. В некоторых примерах осуществления изобретения R3 представляет собой водород, амино, ацетамидо, гидрокси, нитро, метил, аминометил, гидроксиметил, 2-метил-1H-имидазол-1-ил, 3-метил-1,2,4-оксадиазол-5-ил, 4-(метилпиперазин-1-ил)метил, 2-метил-2H-пиразол-3-ил, 1-метил-1H-пиразол-3-ил, 2-метилтиазол-4-ил, 4-метил-4H-1,2,4-триазол-3-ил, морфолинометил, (пиридин-4-ил)метил, (пиридин-4-илокси)метил, фенокси, пиридин-2-илокси, пиперидин-4-илокси, 2-аминоацетокси или 2-пиперазин-1-илацетокси.
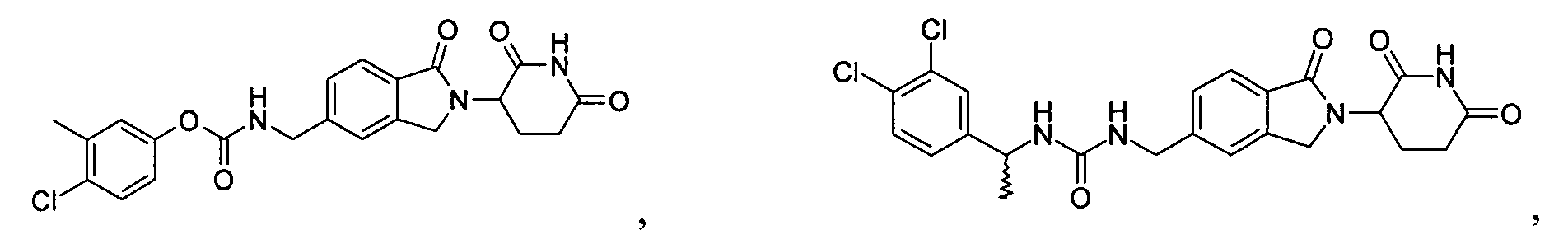
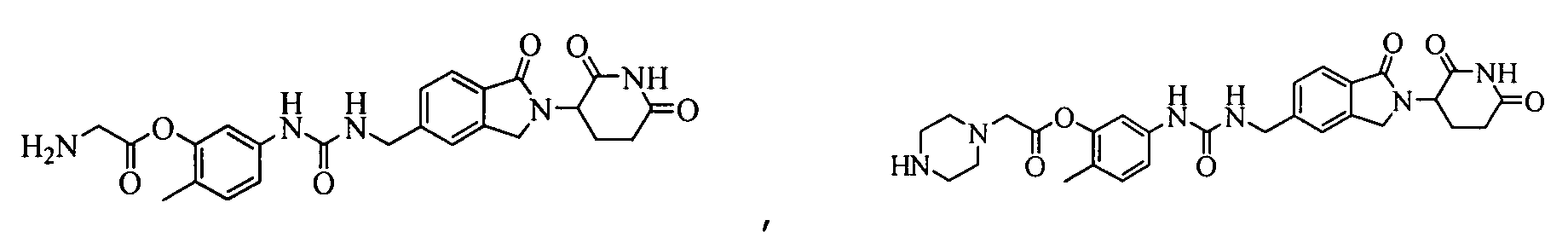
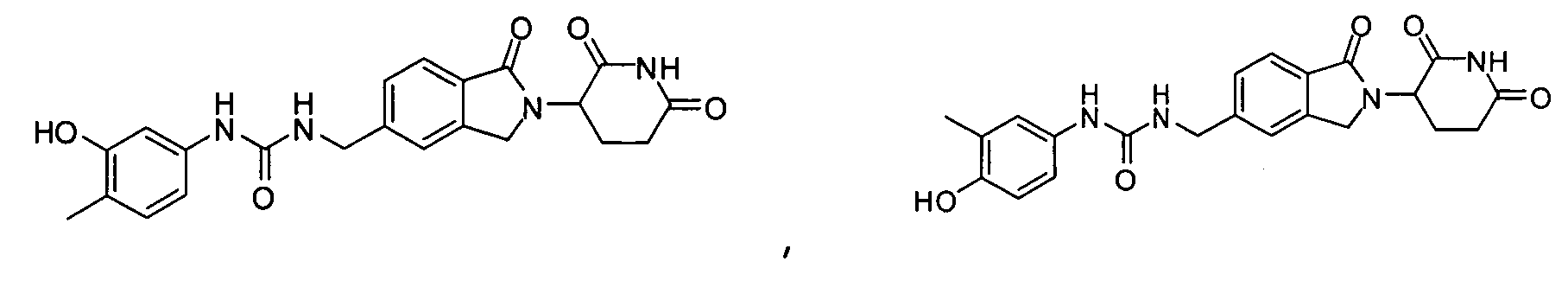
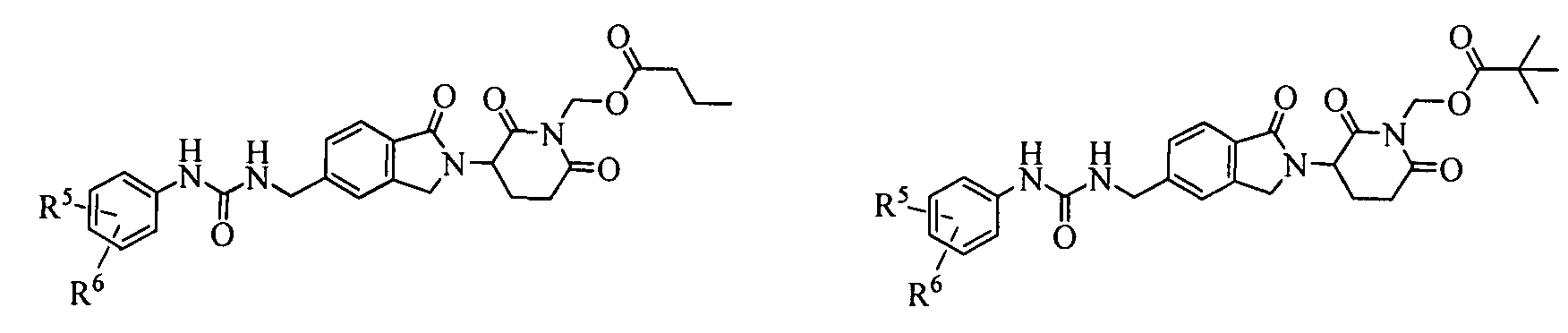
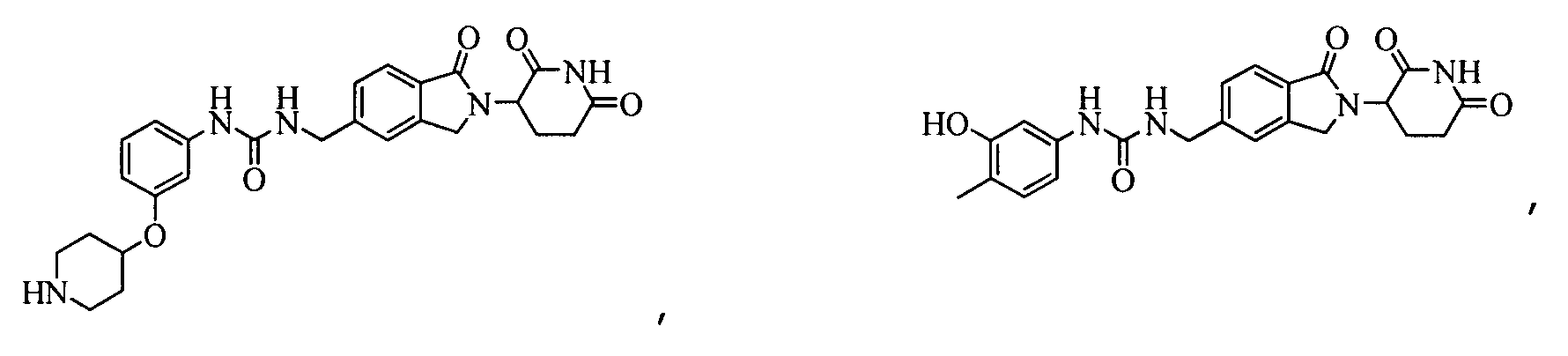
В одном примере осуществления соединение представляет собой:
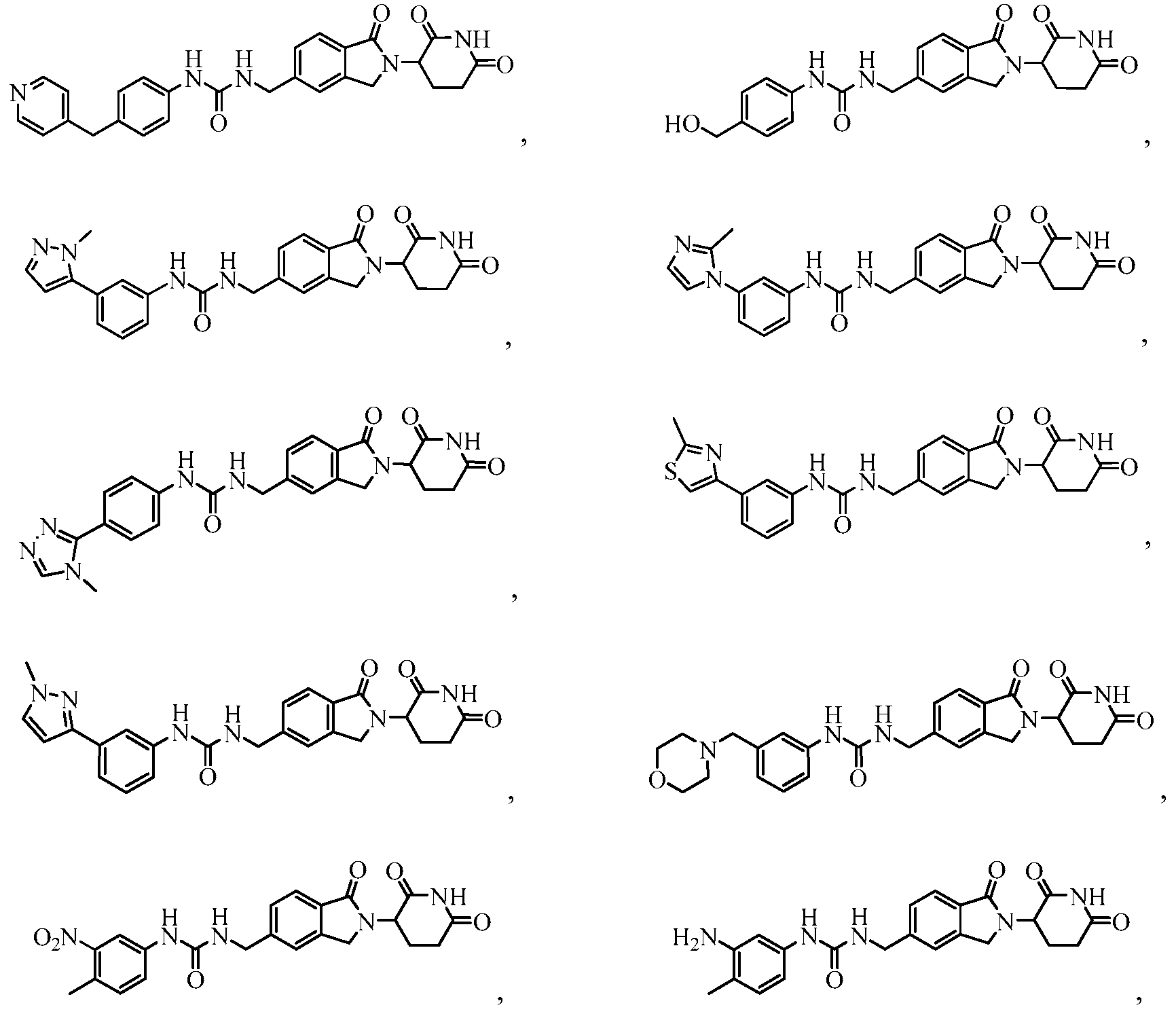
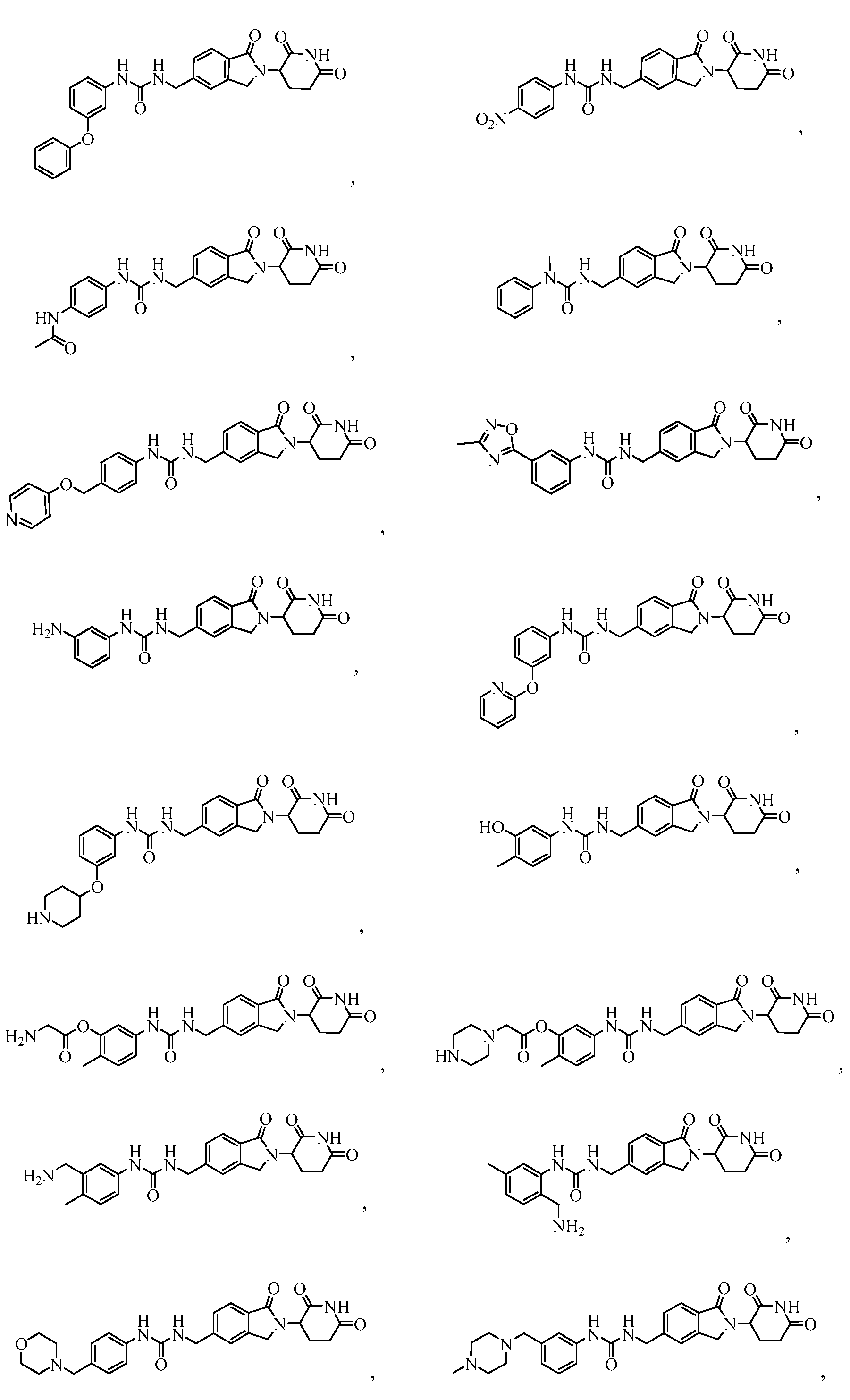
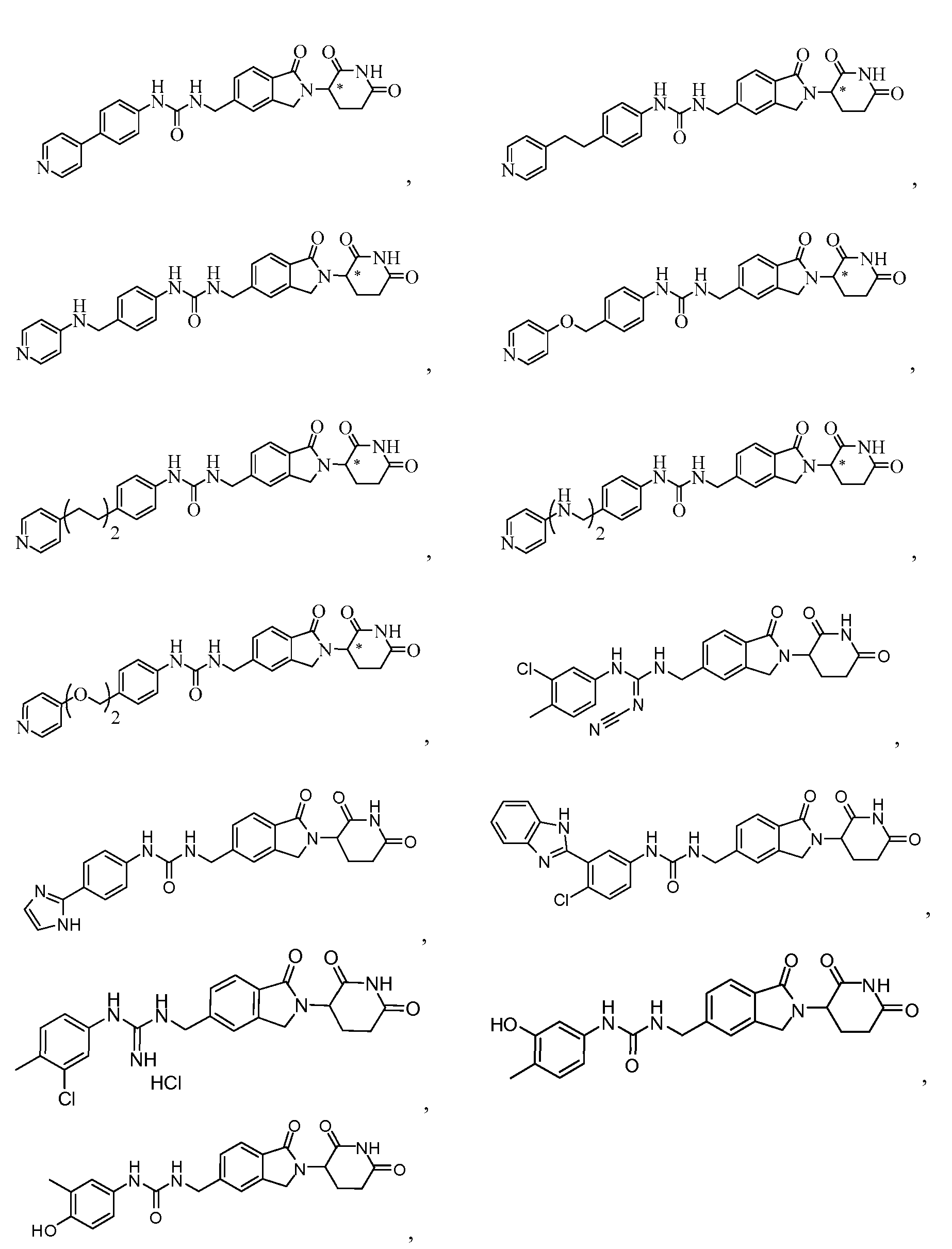
или его фармацевтически приемлемую соль, сольват, пролекарство и стереоизомер.
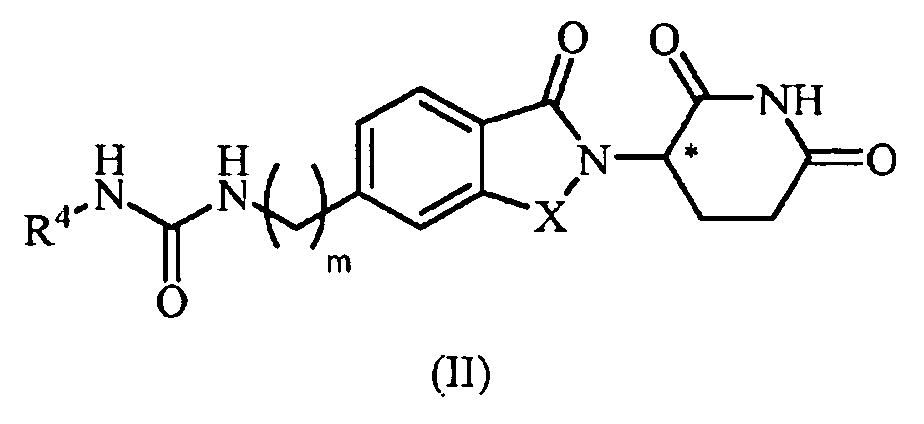
В другом примере осуществления обеспечивается соединение Формулы II:
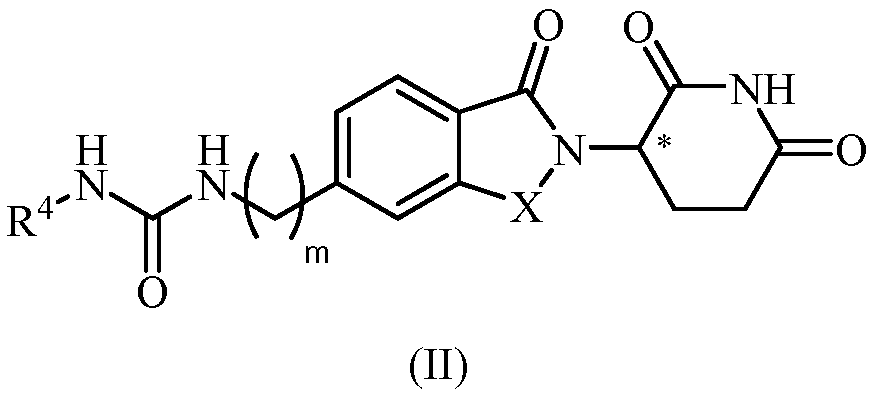
или его фармацевтически приемлемая соль, сольват, пролекарство или стереоизомер, где
X представляет собой C(=O) или CH2;
m равно целому числу 0, 1, 2 или 3;
R4 представляет собой C3-10 циклоалкил, 5-10-членный гетероциклил, 5-10-членный гетероарил или C0-4 алкил-NR41R42; где циклоалкил, гетероциклил и гетероарил, каждый, необязательно замещен одним или несколькими галогенами, C1-6 алкилами, -CO-NR43R44, -COOR45 или C0-4 алкил-C6-10 арилами, где арил может необязательно быть замещен одним или несколькими галогенами; и
R41, R42, R43, R44 и R45, каждый, независимо представляет собой водород или С1-6 алкил.
В некоторых примерах осуществления изобретения X представляет собой CH2. В некоторых примерах осуществления изобретения X представляет собой C(=O).
В некоторых примерах осуществления изобретения m равно 0. В некоторых примерах осуществления изобретения m равно 1. В некоторых примерах осуществления изобретения m равно 2. В некоторых примерах осуществления изобретения m равно 3.
В некоторых примерах осуществления изобретения R4 представляет собой C3-10 циклоалкил, необязательно замещенный одним или несколькими (C1-6) алкилами или C0-4 алкил-C6-10 арилами. В некоторых примерах осуществления изобретения R4 представляет собой 5-6-членный гетероциклил, необязательно замещенный одним или несколькими (C1-6) алкилами или C0-4 алкил-C6-10 арилами. В некоторых примерах осуществления изобретения R4 представляет собой C0-4 алкил-NR41R42, где R41 и R42, каждый, описаны здесь.
В некоторых примерах осуществления изобретения R4 представляет собой 3-(N,N-диэтиламино)пропил, 4-ацетамидофенил, 3-(2-аминоацетокси)-4-метилфенил, 3-аминометил-4-метилфенил, 2-аминометил-5-метилфенил, 3-аминофенил, 3-амино-4-метилфенил, 3-хлор-4-метилфенил, 4-гидроксиметилфенил, 3-гидрокси-4-метилфенил, 3-(2-метил-1H-имидазол-1-ил)фенил, 4-метил-3-нитрофенил, 3-(3-метил-1,2,4-оксадиазол-5-ил)фенил, 4-метил-3-(2-пиперазин-1-илацетокси)фенил, 3-((4-метилпиперазин-1-ил)метил)фенил, 3-(1-метил-1H-пиразол-3-ил)фенил, 3-(2-метил-2H-пиразол-3-ил)фенил, 3-(2-метилтиазол-4-ил)фенил, 4-(4-метил-4H-1,2,4-триазол-3-ил)фенил, 3-(морфолинометил)фенил, 4-(морфолинометил)фенил, 4-нитрофенил, фенил, 3-(пиперидин-4-илокси)фенил, 4-(пиридин-4-ил)метилфенил, 4-((пиридин-4-илокси)метил)фенил, 3-(пиридин-2-илокси)фенил, 3-феноксифенил, 4-трет-бутилциклогексил, цис-4-трет-бутилциклогексил, транс-4-трет-бутилциклогексил, 4-метилциклогексил, цис-4-метилциклогексил, транс-4-метилциклогексил, 1-бензилпиперидин-4-ил, 4-метилтетрагидро-2H-пиран-4-ил, пиперидин-4-ил, 4-фенилциклогексил, цис-4-фенилциклогексил или транс-4-фенилциклогексил.
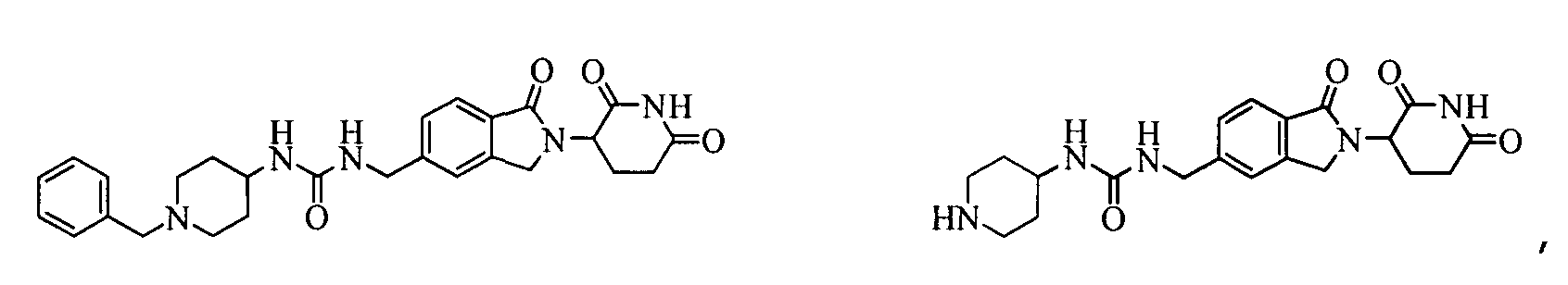
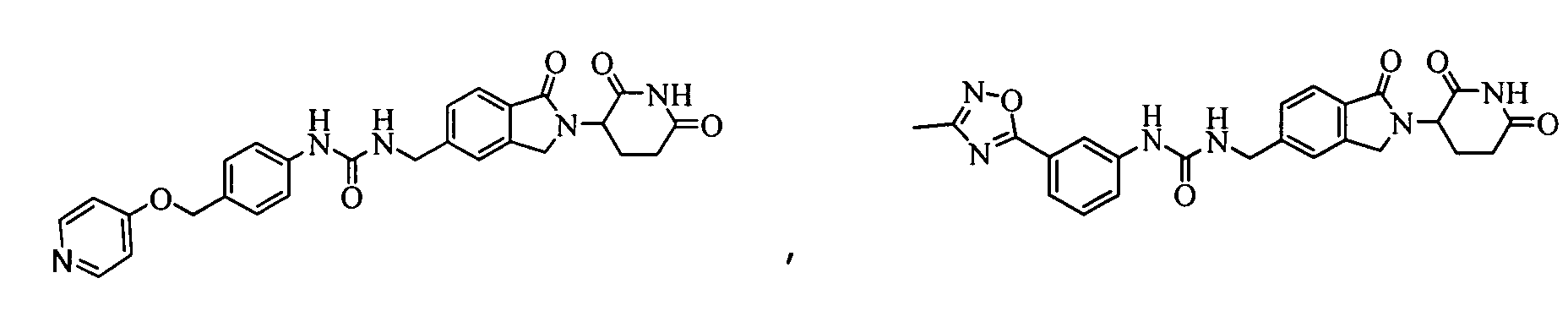
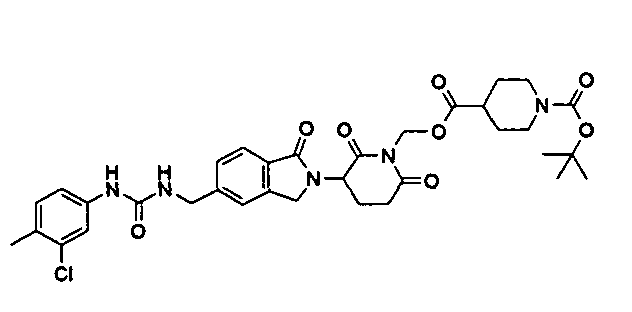
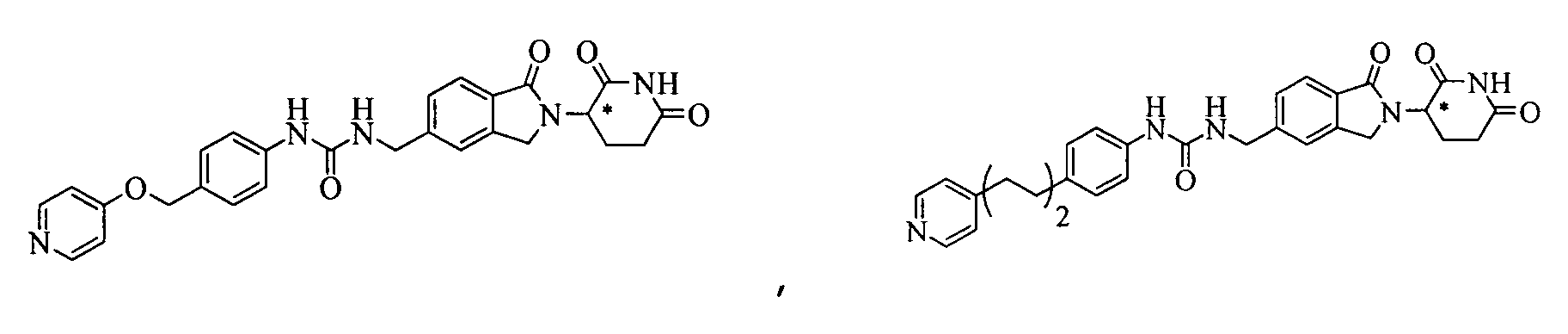
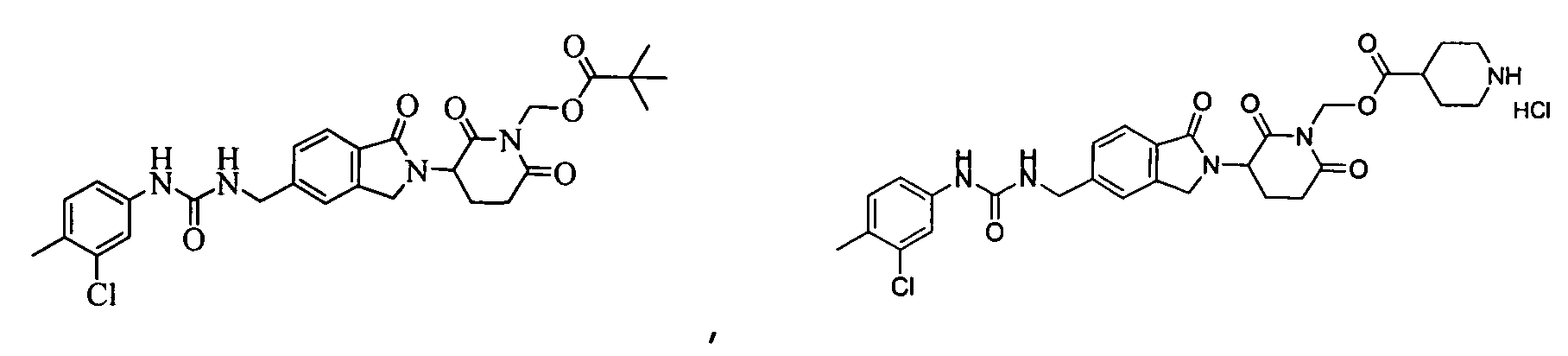
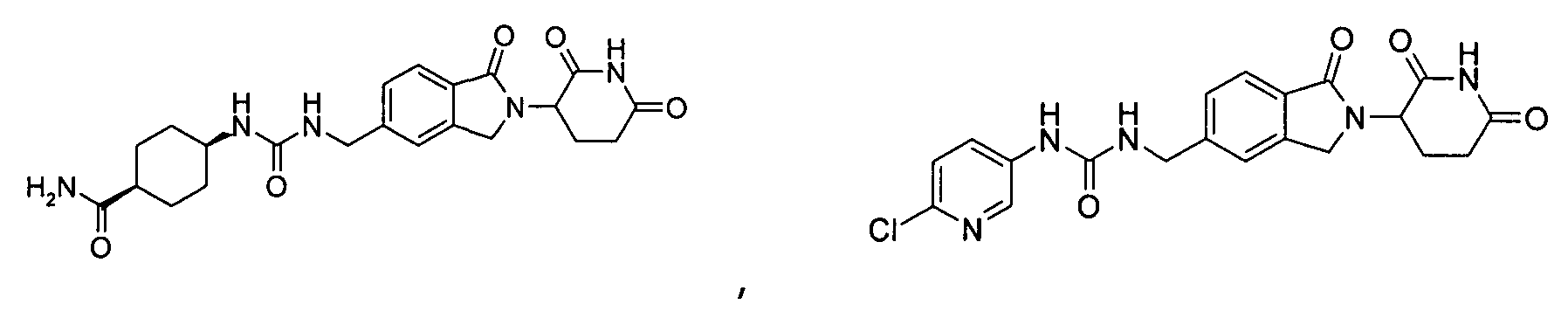
В одном примере осуществления соединение представляет собой:
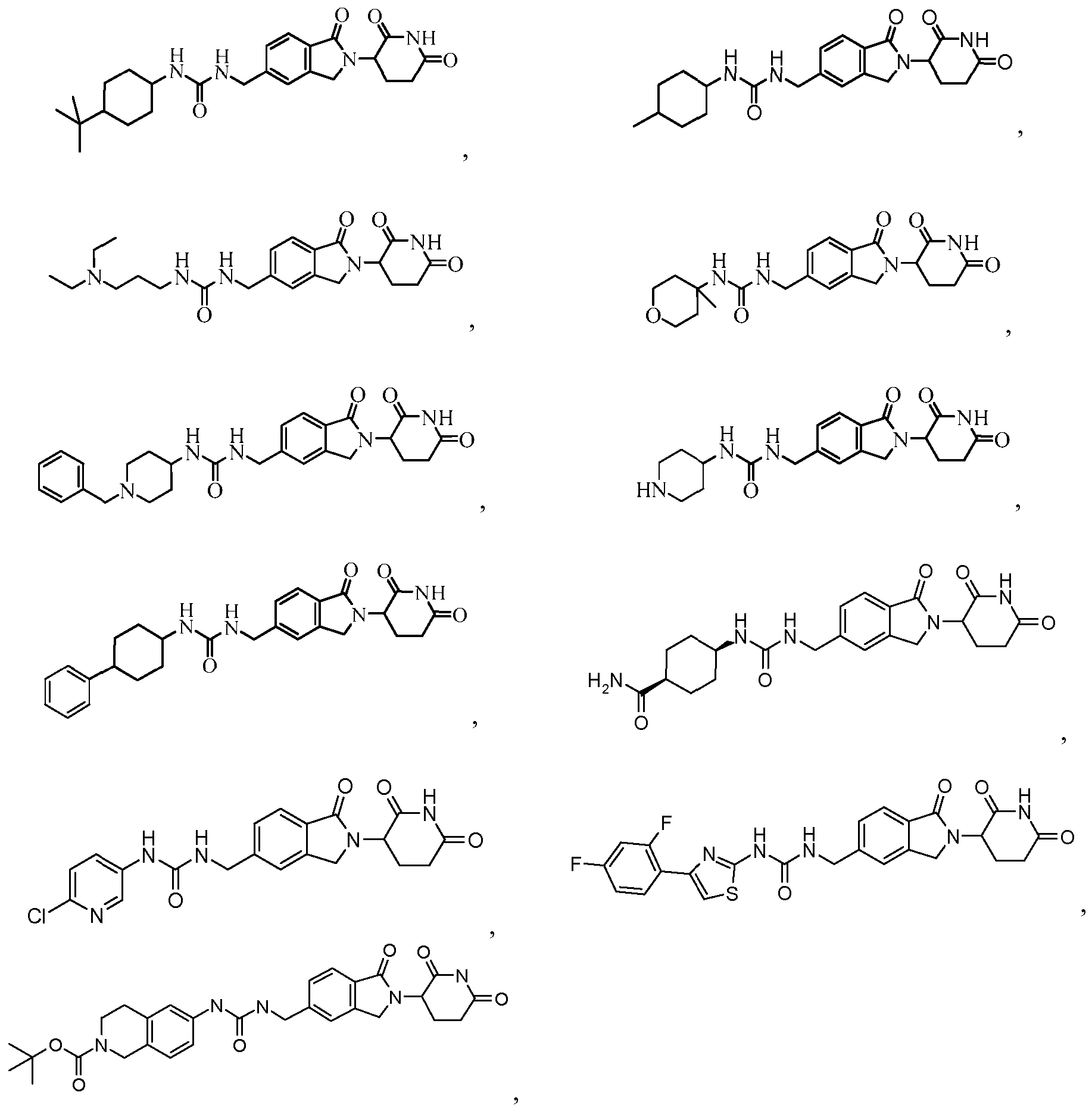
или его фармацевтически приемлемую соль, сольват, пролекарство или стереоизомер.
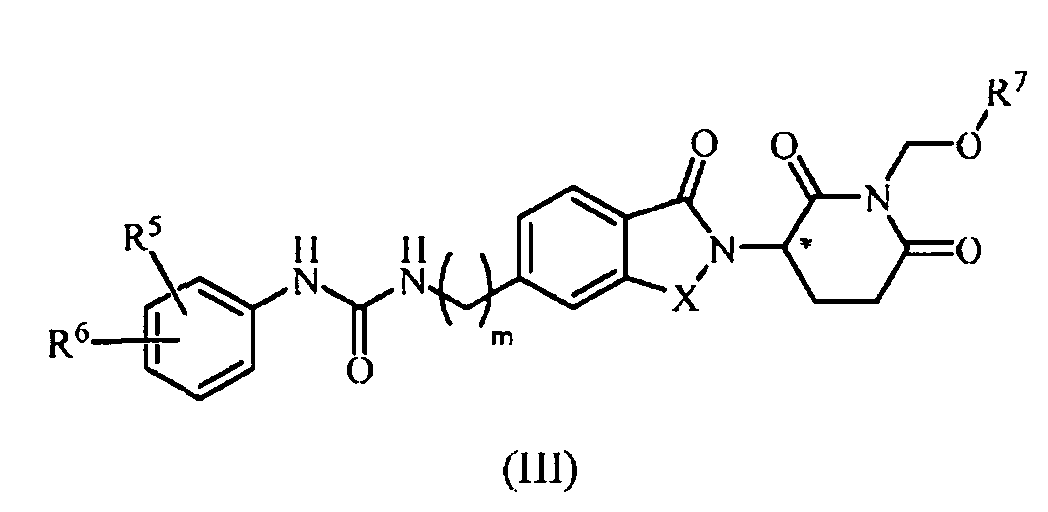
В еще другом примере осуществления обеспечивается соединение Формулы III:
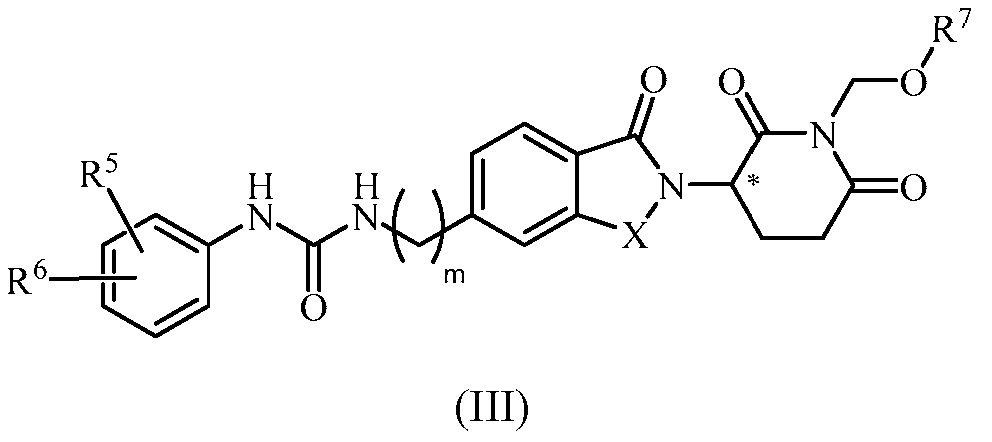
или его фармацевтически приемлемая соль, сольват, пролекарство или стереоизомер, где
X представляет собой C(=O) или CH2;
m равно целому числу 0, 1, 2 или 3;
R5 и R6, каждый, независимо представляет собой водород, галоген, C1-6 алкил, оксо, -NO2, C1-6 алкокси, -Z-C1-6 алкил, C0-6 алкил-(5-10-членный гетероарил), C0-6 алкил-(5-6-членный гетероциклил), C0-6 алкил-OH, C0-4 алкил-NH2, -NHCO-C1-6 алкил, -OR21 или -(CH2-Y)0-2-(5-10-членный гетероарил),
где Z представляет собой S или SO2;
где R21 определен выше;
где каждый гетероарил и гетероциклил, выше, необязательно замещен одним или несколькими C1-6 алкилами; и
где алкил или алкокси, выше, может необязательно быть замещен одним или несколькими галогенами; циано; нитро; амино; C1-6 алкилидендиокси, C1-6 алкокси, необязательно замещенным одним или несколькими галогенами, или C1-6 алкилтио, необязательно замещенным одним или несколькими галогенами;
R7 представляет собой -COR71 или -PO(OR72)(OR73);
R71 представляет собой C1-10 алкил, C6-10 арил или 5-6-членный гетероциклил, где алкил, арил, гетероциклил может необязательно быть замещен одним или несколькими амино, C1-6 алкиламино, ди(C1-6 алкил)амино или -COOR74; и
R72, R73 и R74, каждый, независимо представляет собой водород или C1-10 алкил.
В некоторых примерах осуществления изобретения X представляет собой CH2. В некоторых примерах осуществления изобретения X представляет собой C(=O).
В некоторых примерах осуществления изобретения m равно 0. В некоторых примерах осуществления изобретения m равно 1. В некоторых примерах осуществления изобретения m равно 2. В некоторых примерах осуществления изобретения m равно 3.
В некоторых примерах осуществления изобретения R5 представляет собой водород. В некоторых примерах осуществления изобретения R5 представляет собой галоген. В некоторых примерах осуществления изобретения R5 представляет собой фтор или хлор.
В некоторых примерах осуществления изобретения R6 представляет собой водород. В некоторых примерах осуществления изобретения R6 представляет собой галоген. В некоторых примерах осуществления изобретения R6 представляет собой фтор или хлор.
В некоторых примерах осуществления изобретения R7 представляет собой -COR41, где R41 описан здесь. В некоторых примерах осуществления изобретения R7 представляет собой -PO(OR42))(OR43), где R42 и R43, каждый, независимо описаны здесь.
В одном примере осуществления соединение представляет собой:
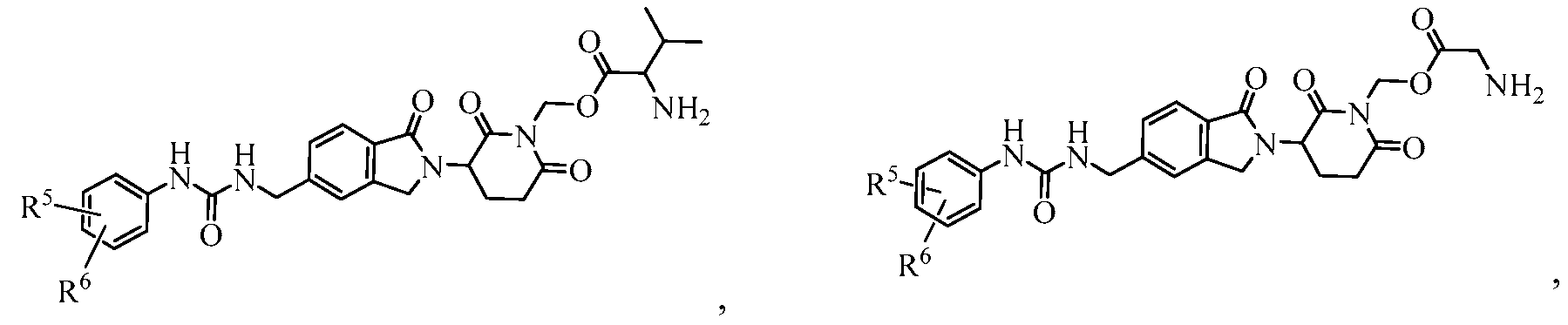
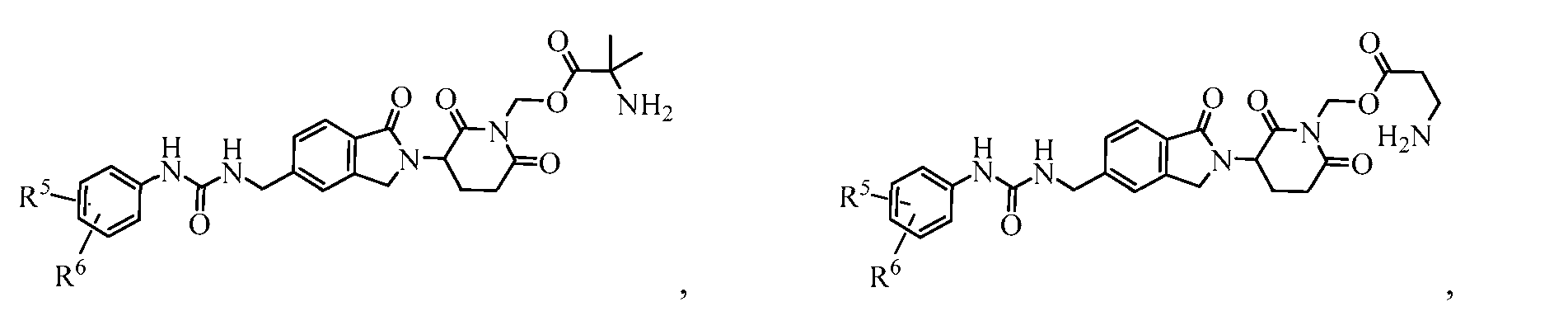
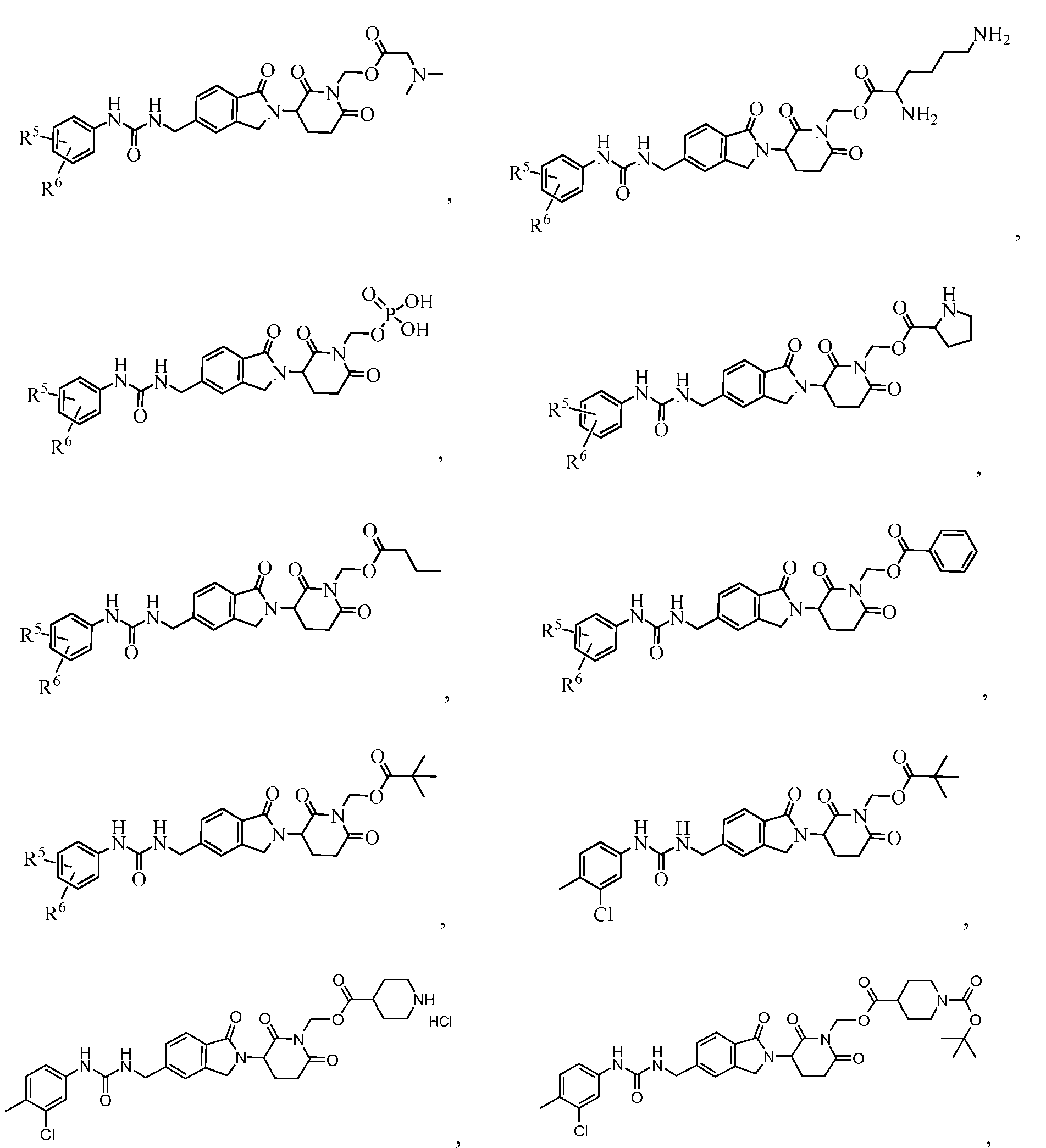
или его фармацевтически приемлемую соль, сольват, пролекарство или стереоизомер, где R5 и R6 описаны выше.
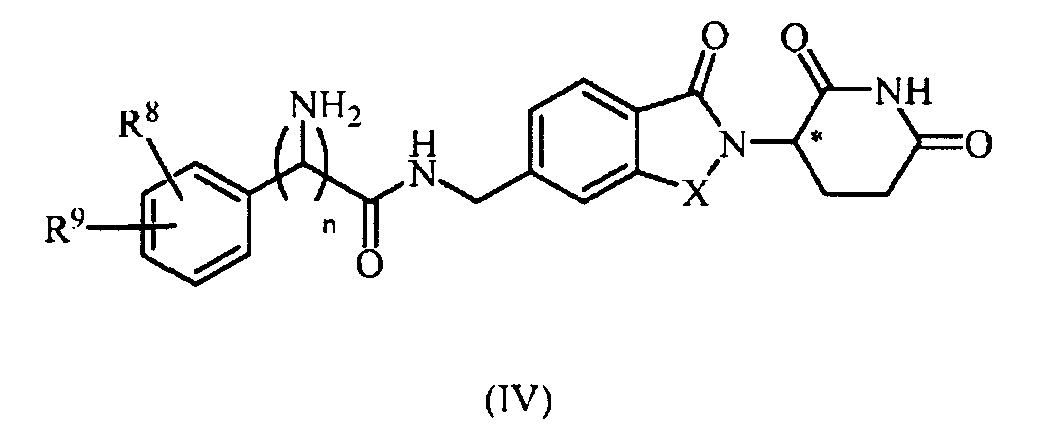
В еще другом примере осуществления обеспечивается соединение Формулы IV:
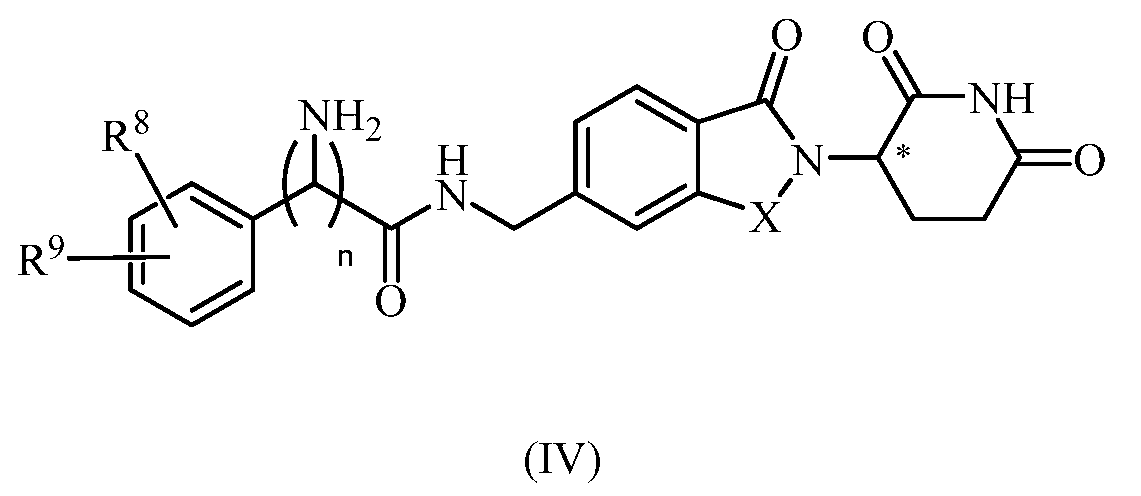
или его фармацевтически приемлемая соль, сольват, пролекарство или стереоизомер, где
X представляет собой C(=O) или CH2;
n представляет собой целое число 0 или 1;
R8 представляет собой водород или галоген; и
R9 представляет собой водород, амино или 5-10-членный гетероарил или гетероциклил;
при условии, что когда m равно 0, R9 не является водородом.
В некоторых примерах осуществления изобретения X представляет собой CH2. В некоторых примерах осуществления изобретения X представляет собой C(=O).
В некоторых примерах осуществления изобретения n равно 0. В некоторых примерах осуществления изобретения n равно 1.
В некоторых примерах осуществления изобретения R8 представляет собой водород. В некоторых примерах осуществления изобретения R8 представляет собой галоген. В некоторых примерах осуществления изобретения R8 представляет собой фтор или хлор.
В некоторых примерах осуществления изобретения R9 представляет собой водород. В некоторых примерах осуществления изобретения R9 представляет собой амино. В некоторых примерах осуществления изобретения R9 представляет собой 5-10-членный гетероарил. В некоторых примерах осуществления изобретения R9 представляет собой 5-10-членный гетероциклил.
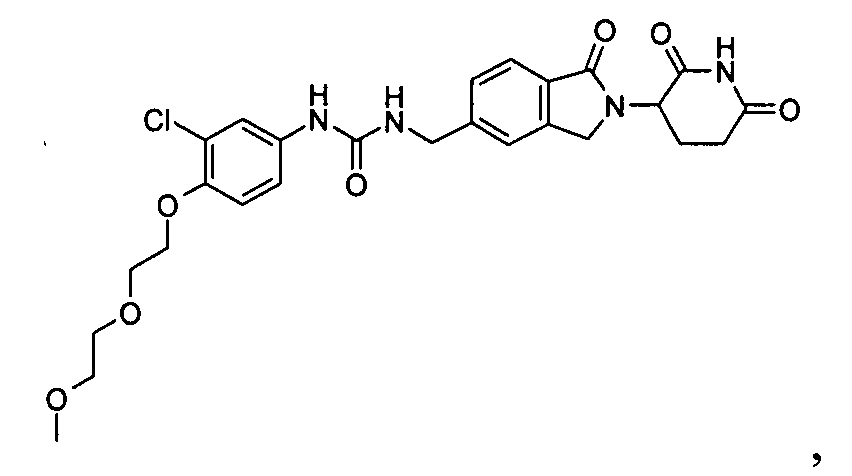
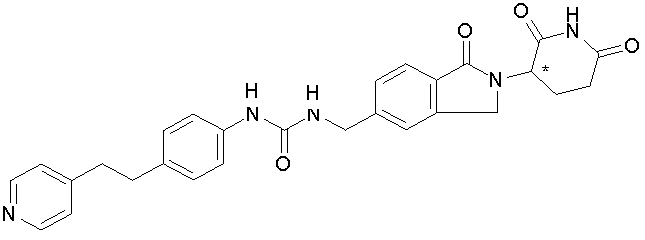
В одном примере осуществления соединение представляет собой:
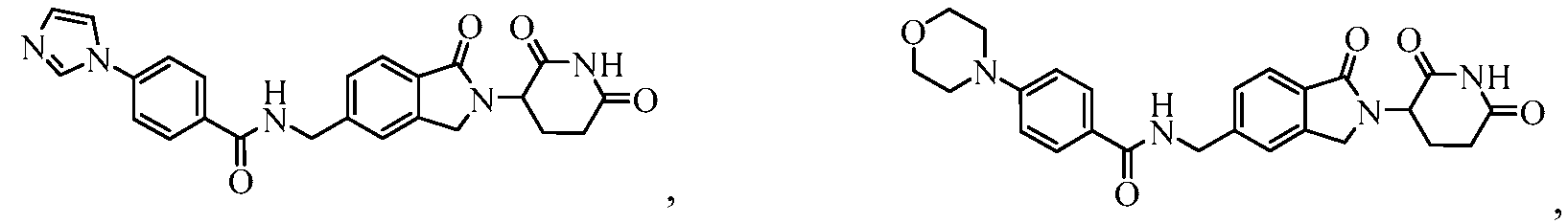

или его фармацевтически приемлемую соль, сольват, пролекарство или стереоизомер.
В еще другом примере осуществления обеспечивается соединение Формулы V:
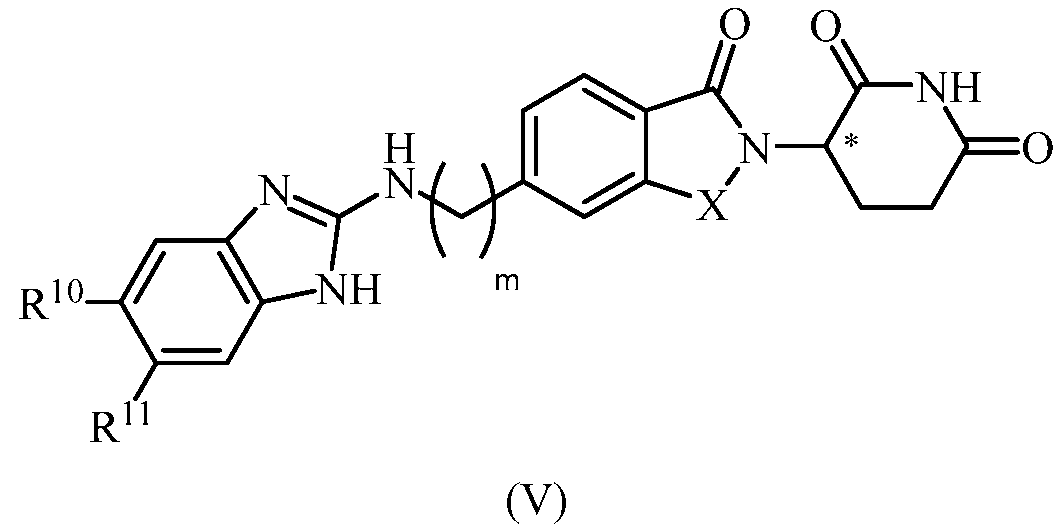
или его фармацевтически приемлемая соль, сольват, пролекарство или стереоизомер, где
X представляет собой C(=О) или CH2;
m равно целому числу 0, 1, 2 или 3;
R10 и R11, каждый, независимо представляет собой водород, галоген, C1-6 алкил или C6-10 арилокси, где алкил и арил, каждый, необязательно замещен одним или несколькими галогенами.
В некоторых примерах осуществления изобретения X представляет собой CH2. В некоторых примерах осуществления изобретения X представляет собой C(=O).
В некоторых примерах осуществления изобретения m равно 0. В некоторых примерах осуществления изобретения m равно 1. В некоторых примерах осуществления изобретения m равно 2. В некоторых примерах осуществления изобретения m равно 3.
В некоторых примерах осуществления изобретения R10 представляет собой водород. В некоторых примерах осуществления изобретения R10 представляет собой галоген. В некоторых примерах осуществления изобретения R10 представляет собой фтор или хлор. В некоторых примерах осуществления изобретения R10 представляет собой C1-6 алкил, необязательно замещенный одним или несколькими галогенами. В некоторых примерах осуществления изобретения R10 представляет собой C6-10 арилокси, необязательно замещенный одним или несколькими галогенами.
В некоторых примерах осуществления изобретения R11 представляет собой водород. В некоторых примерах осуществления изобретения R11 представляет собой галоген. В некоторых примерах осуществления изобретения R11 представляет собой фтор или хлор. В некоторых примерах осуществления изобретения R11 представляет собой C1-6 алкил, необязательно замещенный одним или несколькими галогенами. В некоторых примерах осуществления изобретения R11 представляет собой C6-10 арилокси, необязательно замещенный одним или несколькими галогенами.
В одном примере осуществления соединение представляет собой:
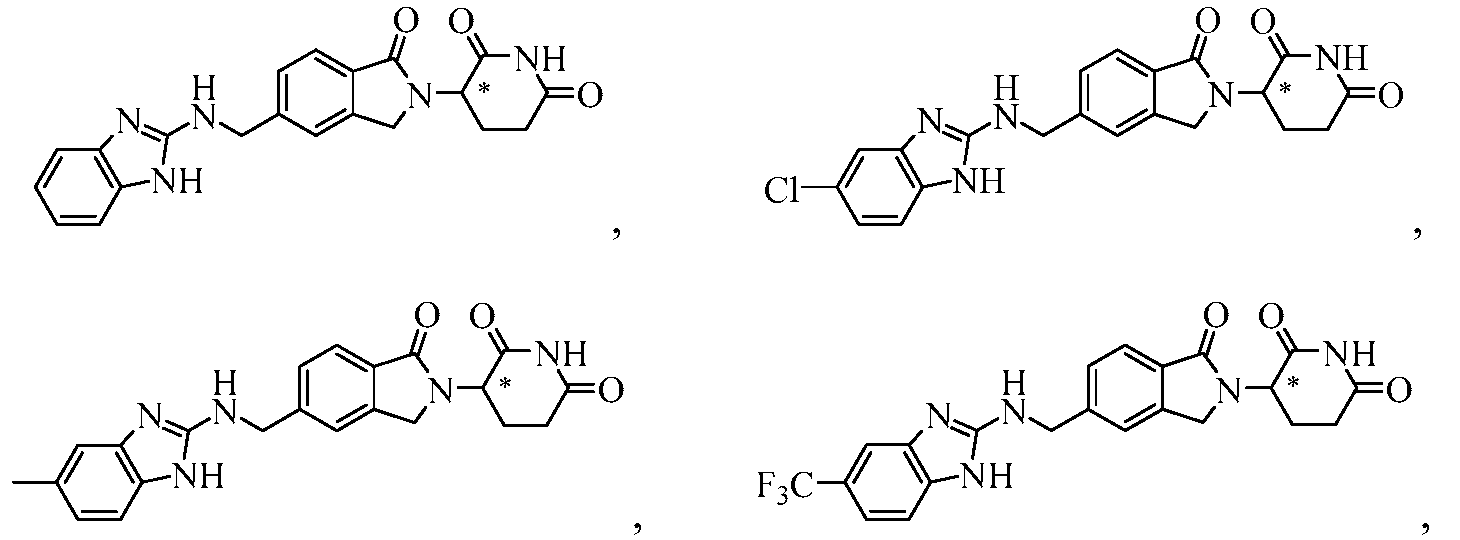
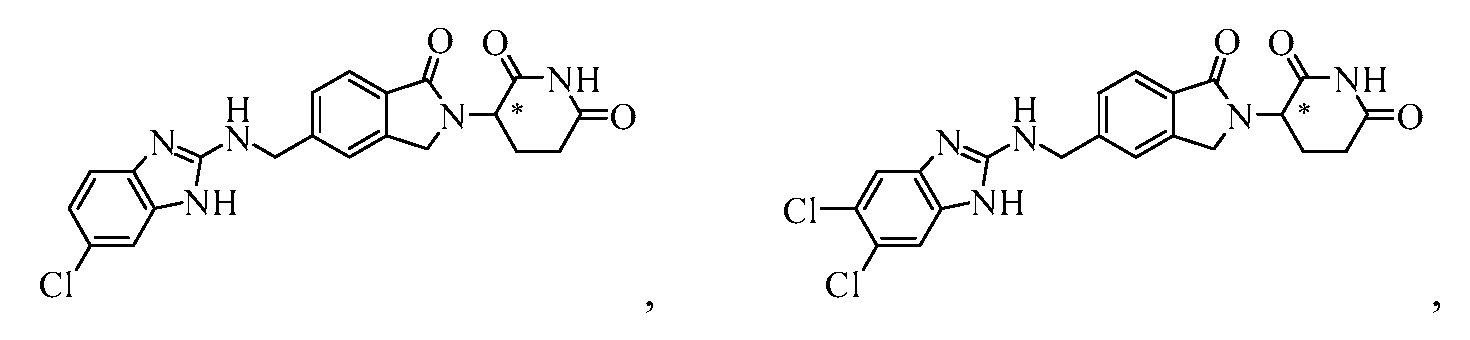
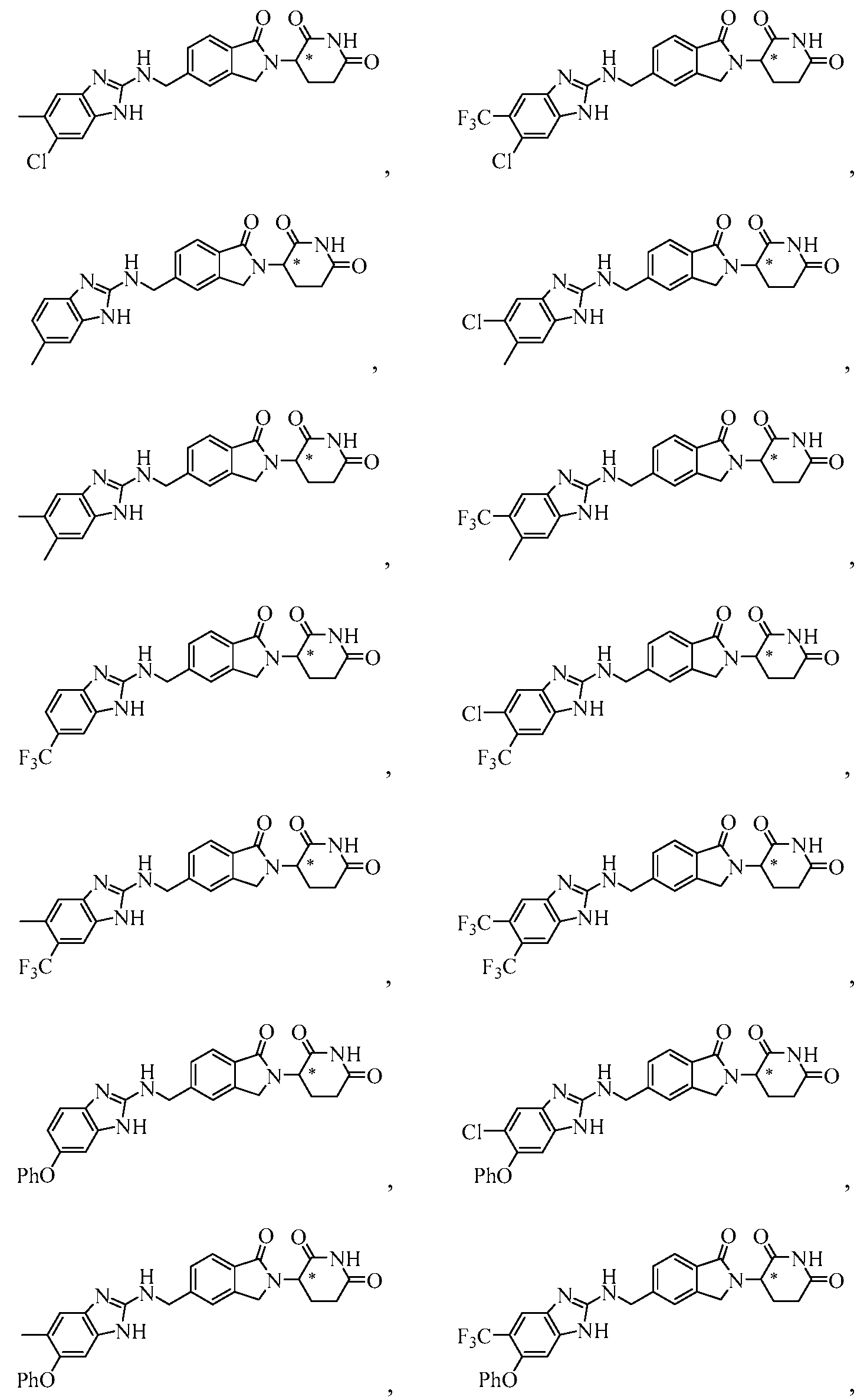
или его фармацевтически приемлемую соль, сольват, пролекарство или стереоизомер.
В еще другом примере осуществления обеспечивается соединение Формулы VI:
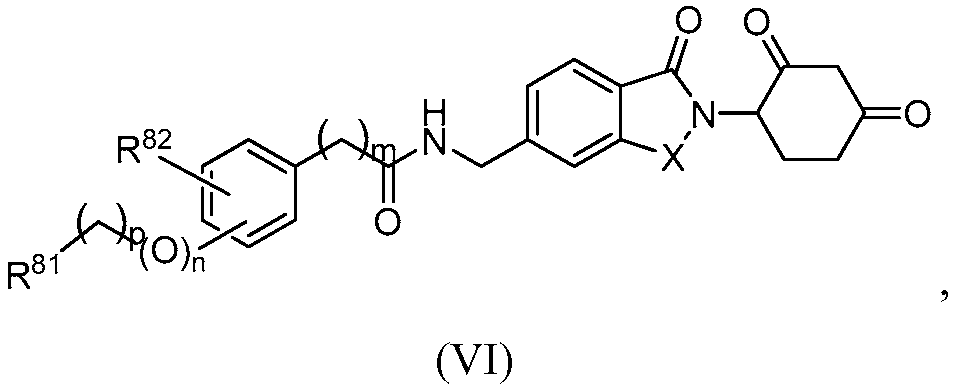
или его фармацевтически приемлемая соль, сольват, пролекарство или стереоизомер, где
X представляет собой CH2 или C=O,
m и n, каждый, независимо равен 0 или 1;
p равен 0, 1, 2 или 3;
R81 представляет собой 5-6-членный гетероциклил, необязательно замещенный C1-6 алкилом; и
R82 представляет собой водород или галоген.
В одном примере осуществления X представляет собой CH2. В другом примере осуществления X представляет собой C=O.
В одном примере осуществления m равно 0. В другом примере осуществления m равно 1. В другом примере осуществления n равно 0. В другом примере осуществления n равно 1.
В одном примере осуществления p равен 0. В другом примере осуществления p равен 1. В другом примере осуществления p равен 2. В другом примере осуществления p равен 3.
В одном примере осуществления R81 представляет собой 5-членный гетероцикл. В другом примере осуществления 5-членный гетероцикл замещен С1-6 алкилом. В другом примере осуществления R81 представляет собой 6-членный гетероцикл. В другом примере осуществления 6-членный гетероцикл замещен С1-6 алкилом.
В одном примере осуществления R82 представляет собой водород. В другом примере осуществления R82 представляет собой галоген.
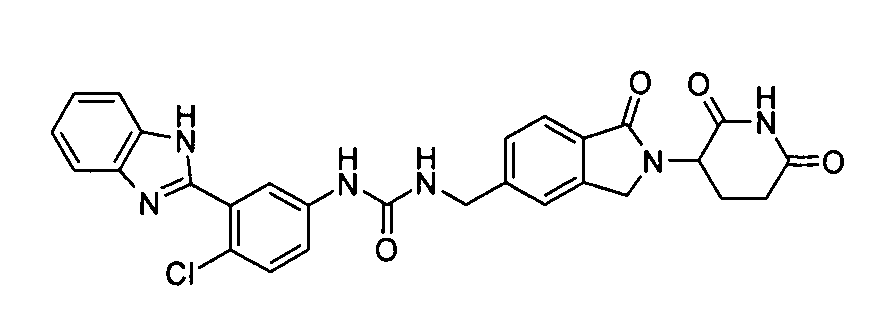
В одном примере осуществления соединение представляет собой:
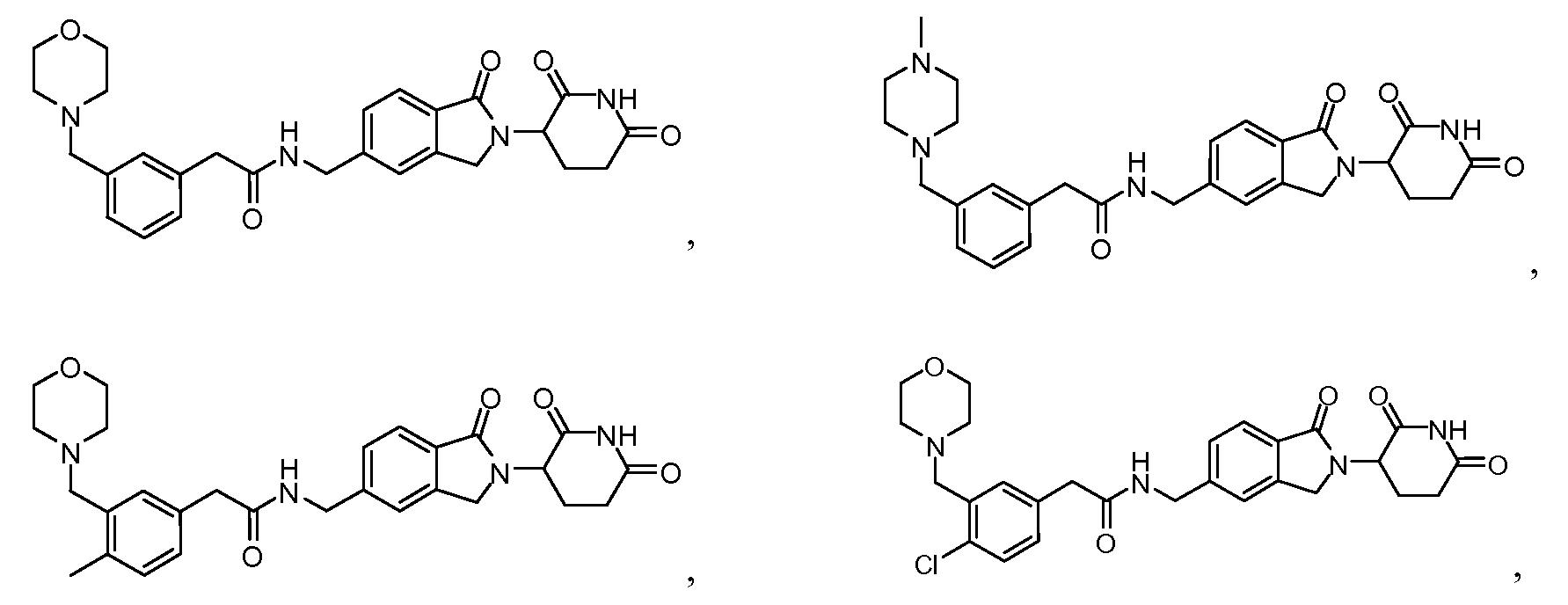
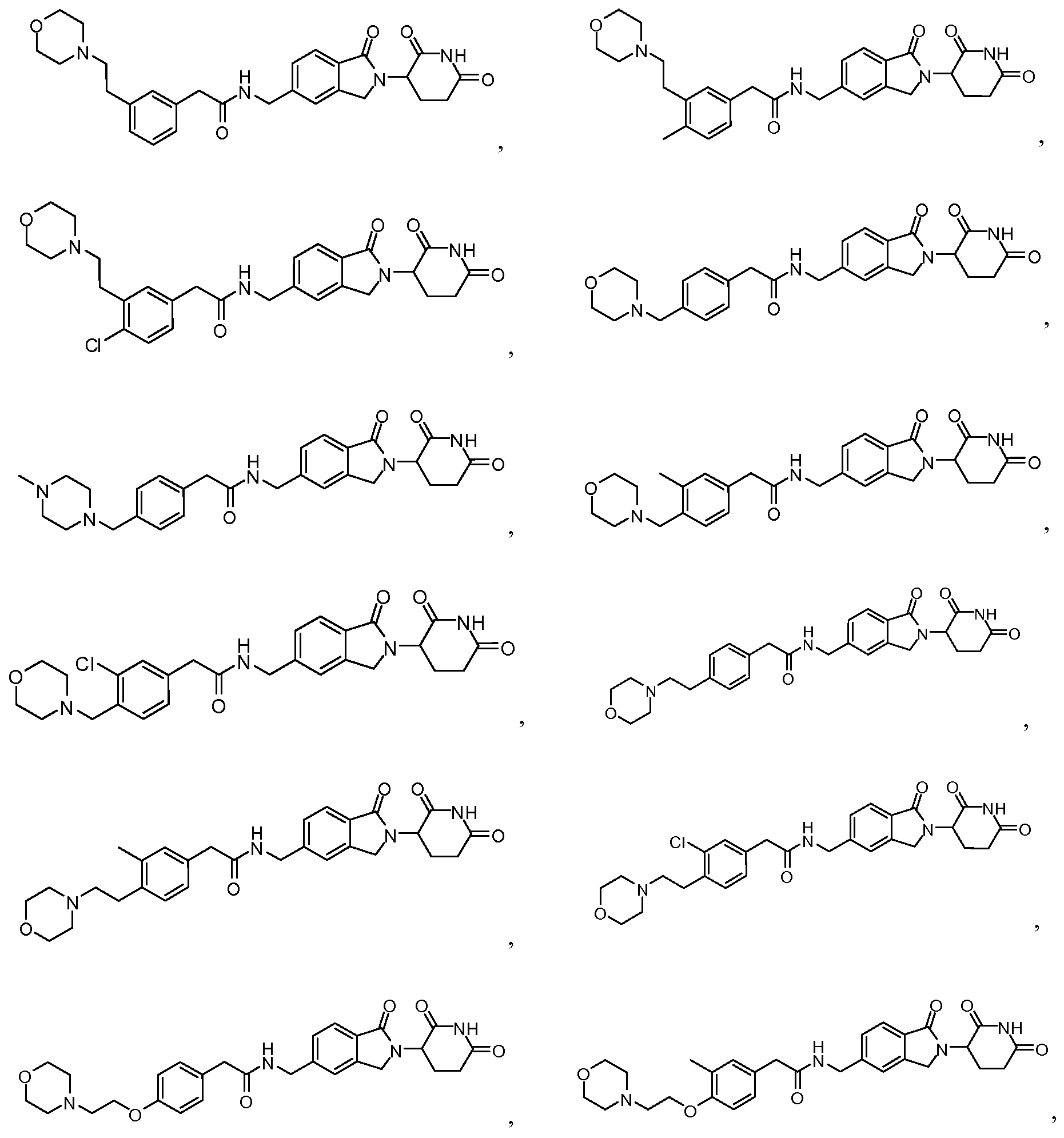
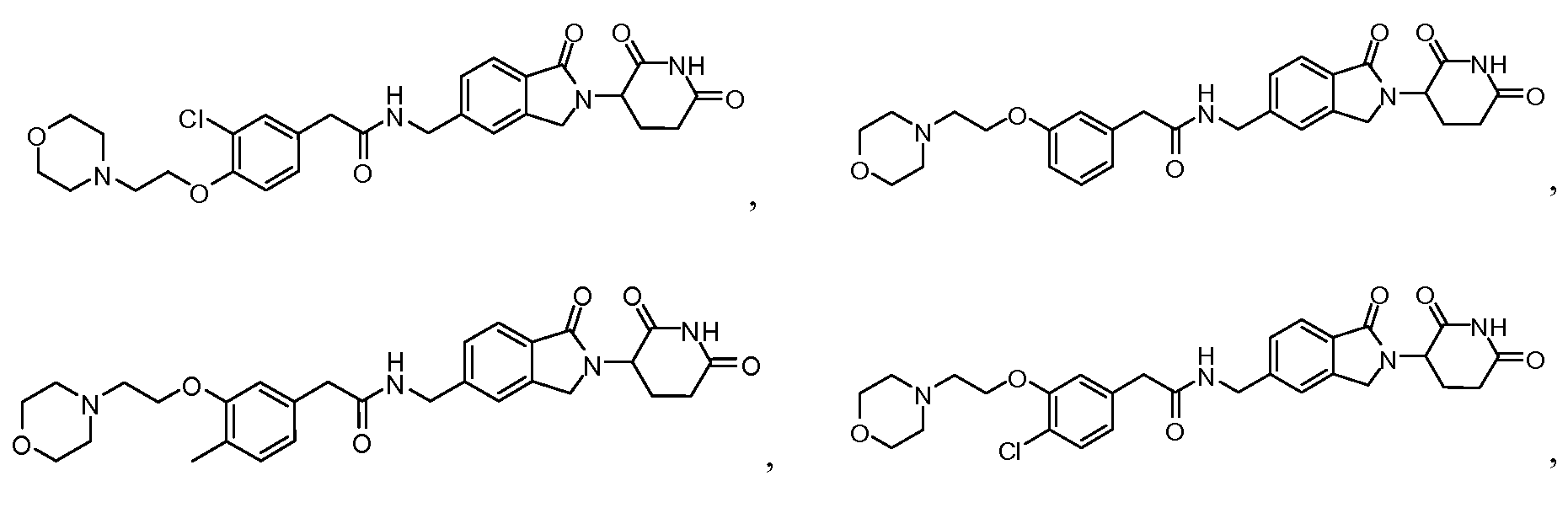
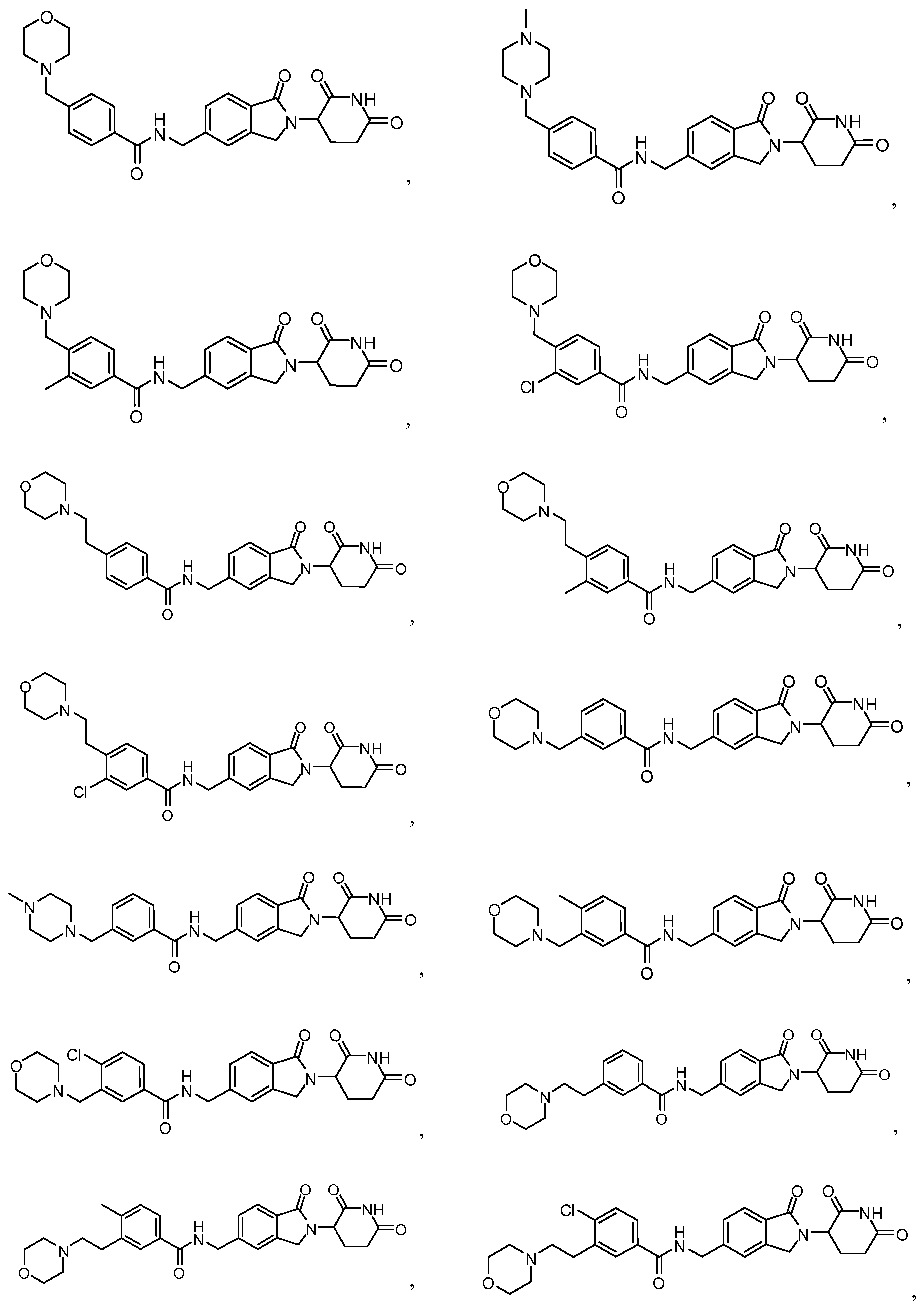
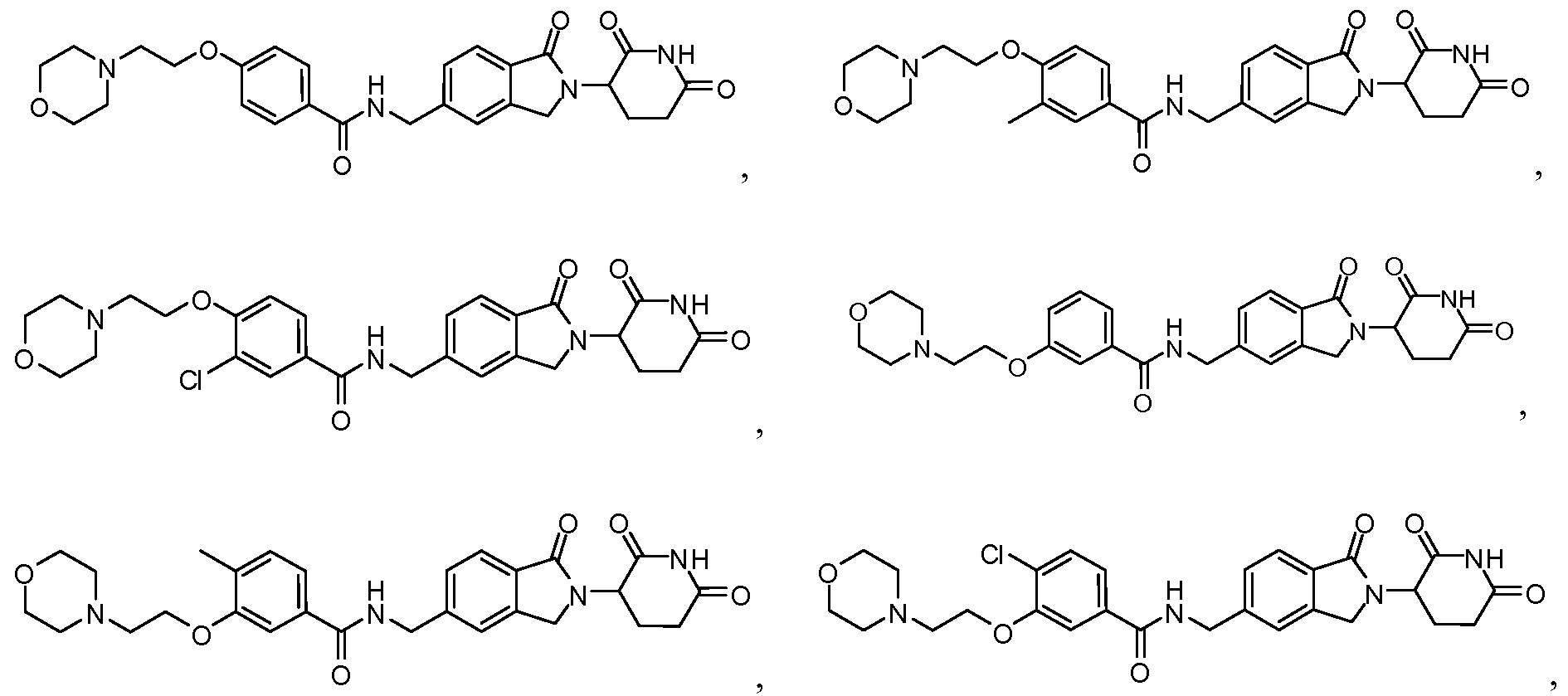
или его фармацевтически приемлемую соль, сольват, пролекарство или стереоизомер.
В еще другом примере осуществления предлагается соединение следующей формулы:
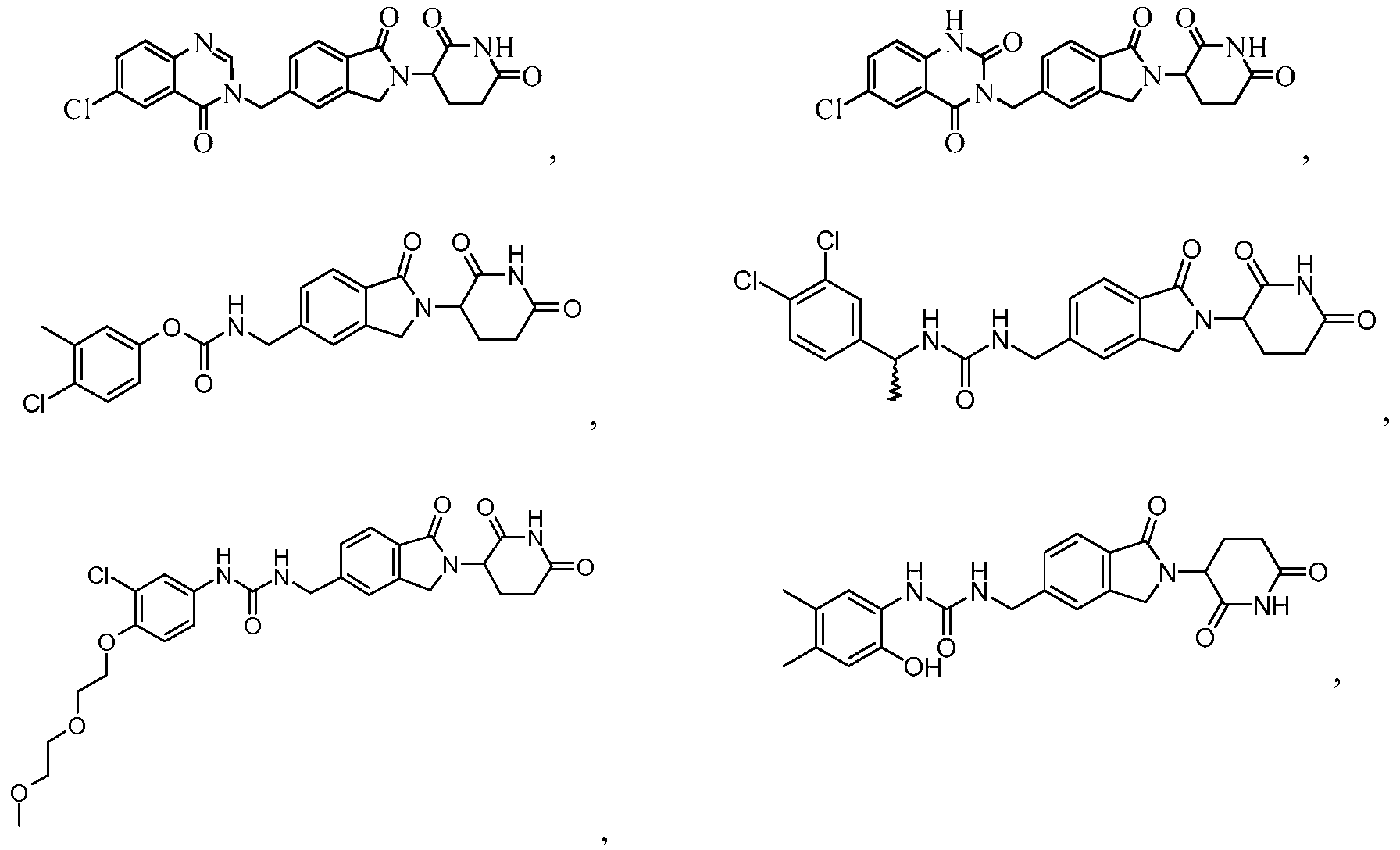
или его фармацевтически приемлемая соль, сольват, пролекарство или стереоизомер.
Предлагаемые соединения охватывают все возможные стереоизомеры, если не указана конкретная стереохимия. В тех случаях когда предлагаемое соединение содержит алкенильную или алкениленовую группу, соединение может существовать в виде одного или смеси геометрических цис/транс (или Z/E) изомеров. В тех случаях когда структурные изомеры являются взаимопревращаемыми, преодолевая низкий энергетический барьер, соединение может существовать в виде одного таутомера или смеси таутомеров. Это может выражаться в протонной таутомерии в соединении, которое содержит, например, имино-, кето- или оксимную группу, или так называемой валентной таутомерии в соединении, которое содержит ароматический фрагмент. Из этого следует, что одно соединение может проявлять более одного типа изомерии.
Предлагаемые в описании соединения могут быть энантиомерно чистыми, такими как один энантиомер или один диастереомер, или представлять собой смесь стереоизомеров, такую как смесь энантиомеров, рацемическая смесь или смесь диастереомеров. В связи с этим специалисту в данной области техники будет понятно, что введение соединения в его (R)-форме эквивалентно, в случае соединений, которые подвергаются эпимеризации in vivo, введению соединения в его (S)-форме. Общепринятые способы получения/выделения индивидуальных энантиомеров включают синтез из подходящего оптически чистого предшественника, асимметрический синтез из ахиральных исходных веществ или разделение смеси энантиомеров, например, с помощью хиральной хроматографии, перекристаллизации, разделения, формирования диастереомерных солей или дериватизации в диастереомерные аддукты с последующим разделением.
Когда предлагаемое соединение содержит кислотную или основную группу, оно может также обеспечиваться в виде фармацевтически приемлемой соли (см., Berge et al., J. Pharm. Sci., 1977, 66, 1-19 и «Handbook of Pharmaceutical Salts, Properties, and Use», Stahl and Wermuth, Ed., Wiley-VCH and VHCA, Zurich, 2002).
Подходящие кислоты для получения фармацевтически приемлемых солей включают, в качестве неограничивающих примеров, уксусную кислоту, 2,2-дихлоруксусную кислоту, ацетилированные аминокислоты, адипиновую кислоту, альгиновую кислоту, аскорбиновую кислоту, L-аспарагиновую кислоту, бензолсульфоновую кислоту, бензойную кислоту, 4-ацетамидобензойную кислоту, борную кислоту, (+)-камфорную кислоту, камфорсульфоновую кислоту, (+)-(1S)-камфор-10-сульфоновую кислоту, каприновую кислоту, капроновую кислоту, каприловую кислоту, коричную кислоту, лимонную кислоту, цикламовую кислоту, циклогексансульфамидную кислоту, додецилсерную кислоту, этан-1,2-дисульфоновую кислоту, этансульфоновую кислоту, 2-гидроксиэтансульфоновую кислоту, муравьиную кислоту, фумаровую кислоту, галактаровую кислоту, гентизиновую кислоту, глюкогептоновую кислоту, D-глюконовую кислоту, D-глюкуроновую кислоту, L-глутаминовую кислоту, α-оксоглутаровую кислоту, гликолевую кислоту, гиппуровую кислоту, бромистоводородную кислоту, хлористоводородную кислоту, йодистоводородную кислоту, (+)-L-молочную кислоту, (±)-DL-молочную кислоту, лактобионовую кислоту, лауриновую кислоту, малеиновую кислоту, (-)-L-яблочную кислоту, малоновую кислоту, (±)-DL-миндальную кислоту, метансульфоновую кислоту, нафталин-2-сульфоновую кислоту, нафталин-1,5-дисульфоновую кислоту, 1-гидрокси-2-нафтойную кислоту, никотиновую кислоту, азотную кислоту, масляную кислоту, оротовую кислоту, щавелевую кислоту, пальмитиновую кислоту, памовую кислоту, перхлорную кислоту, фосфорную кислоту, L-пироглутаминовую кислоту, сахарную кислоту, салициловую кислоту, 4-аминосалициловую кислоту, себациновую кислоту, стеариновую кислоту, янтарную кислоту, серную кислоту, дубильную кислоту, (+)-L-винную кислоту, тиоциановую кислоту, п-толуолсульфоновую кислоту, ундециленовую кислоту и валериановую кислоту.
Подходящие основания для получения фармацевтически приемлемых солей включают, в качестве неограничивающих примеров, неорганические основания, такие как магния гидроксид, кальция гидроксид, калия гидроксид, цинка гидроксид или натрия гидроксид, и оранические основания, такие как первичные, вторичные, третичные и четвертичные, алифатические и ароматические амины, включая L-аргинин, бенетамин, бензатин, холин, деанол, диэтаноламин, диэтиламин, диметиламин, дипропиламин, диизопропиламин, 2-(диэтиламино)этанол, этаноламин, этиламин, этилендиамин, изопропиламин, N-метилглюкамин, гидрабамин, 1Н-имидазол, L-лизин, морфилин, 4-(2-гидроксиэтил)морфилин, метиламин, пиперидин, пиперазин, пропиламин, пирролидин, 1-(2-гидроксиэтил)пирролидин, пиридин, хинуклидин, хинолин, изохинолин, вторичные амины, триэтаноламин, триметиламин, триэтиламин, N-метил-D-глюкамин, 2-амино-2-(гидроксиметил)-1,3-пропандиол и трометамин.
Предлагаемое соединение может быть также обеспечено в виде пролекарства, которое является функциональным производным соединения и легко превращается в родительское соединение in vivo. Пролекарства часто являются полезными, поскольку, в некоторых случаях, они могут более легко вводиться, чем родительское соединение. Они могут, например, быть биодоступны при пероральном введении, в то время как родительское соединение - нет. Пролекарство может также обладать повышенной растворимостью в фармацевтических композициях по сравнению с родительским соединением. Пролекарство может превращаться в родительское лекарственное средство путем различных механизмов, включая ферментативные процессы и метаболической трансформации путем гидролиза. См. Harper, Progress in Drug Research 1962, 4, 221-294; Morozowich et al. in "Design of Biopharmaceutical Properties through Prodrugs and Analogs," Roche Ed., APHA Acad. Pharm. Sci. 1977; "Bioreversible Carriers in Drug in Drug Design, Theory and Application," Roche Ed., APHA Acad. Pharm. Sci. 1987; "Design of Prodrugs", Bundgaard, Elsevier, 1985; Wang et al., Curr. Pharm. Design 1999, 5, 265-287; Pauletti et al., Adv. Drug. Delivery Rev. 1997, 27, 235-256; Mizen et al., Pharm. Biotech. 1998, 11, 345-365; Gaignault et al., Pract. Med. Chem. 1996, 671-696; Asgharnejad in "Transport Processes in Pharmaceutical Systems", Amidon et al., Ed., Marcell Dekker, 185-218, 2000; Balant et al., Eur. J. Drug Metab. Pharmacokinet. 1990, 15, 143-53; Balimane and Sinko, Adv. Drug Delivery Rev. 1999, 39, 183-209; Browne, Clin. Neuropharmacol. 1997, 20, 1-12; Bundgaard, Arch. Pharm. Chem. 1979, 86, 1-39; Bundgaard, Controlled Drug Delivery 1987, 17, 179-96; Bundgaard, Adv. Drug Delivery Rev. 1992, 8, 1-38; Fleisher et al., Adv. Drug Delivery Rev. 1996, 19, 115-130; Fleisher et al., Methods Enzymol. 1985, 112, 360-381; Farquhar et al., J. Pharm. Sci. 1983, 72, 324-325; Freeman et al., J. Chem. Soc., Chem. Commun. 1991, 875-877; Friis and Bundgaard, Eur. J. Pharm. Sci. 1996, 4, 49-59; Gangwar et al., Des. Biopharm. Prop. Prodrugs Analogs, 1977, 409-421; Nathwani and Wood, Drugs 1993, 45, 866-94; Sinhababu and Thakker, Adv. Drug Delivery Rev. 1996, 19, 241-273; Stella et al., Drugs 1985, 29, 455-73; Tan et al., Adv. Drug Delivery Rev. 1999, 39, 117-151; Taylor, Adv. Drug Delivery Rev. 1996, 19, 131-148; Valentino and Borchardt, Drug Discovery Today 1997, 2, 148-155; Wiebe and Knaus, Adv. Drug Delivery Rev. 1999, 39, 63-80; и Waller et al., Br. J. Clin. Pharmac. 1989, 28, 497-507.
4.3. СПОСОБЫ ЛЕЧЕНИЯ, ПРЕДУПРЕЖДЕНИЯ И КОНТРОЛИРОВАНИЯ
В одном примере осуществления предлагаются способы лечения, предупреждения и/или контролирования различных заболеваний или расстройств, применяя предлагаемые в описании соединения, включая его один энантиомер, смесь энантиомеров или смесь диастереомеров, или его фармацевтически приемлемую соль, сольват или пролекарство. Не ограничиваясь конкретным предположением, предлагаемые соединения могут контролировать ангиогенез или ингибировать продукцию некоторых цитокинов, включая, в качестве неограничивающих примеров, ФНО-α, IL-1β, IL-12, IL-18, ГМКСФ (GM-CSF, гранулоцито-макрофаго-колониестимулирующий фактор) и/или IL-6. Не ограничиваясь конкретным предположением, предлагаемые соединения могут стимулировать продукцию некоторых других цитокинов, включая IL-10, а также действовавать в качестве костимулирующего сигнала для активации Т-клеток, приводя к повышенной продукции цитокинов, таких как, в качестве неограничивающих примеров, IL-12 и/или ИФН-γ (IFN-γ). Кроме того, предлагаемые соединения могут повышать действие NK-клеток (естественные киллеры) и антителозависимую клеточную цитотоксичность (АЗКЦ, ADCC). Кроме того, предлагаемые соединения могут быть иммуномодулирующими и/или цитотоксичными и, таким образом, могут быть применимы в качестве химиотерапевтических агентов. Следовательно, не ограничиваясь конкретным предположением, некоторые или все такие характеристики, которыми обладают предлагаемые соединения, могут делать их полезными для применения при лечении, контролировании и/или предупреждении различных заболеваний или расстройств. В одном примере осуществления предлагаемые соединения являются цитотоксичными.
Заболевания или расстройства, поддающиеся лечению предлагаемыми способами, включают, в качестве неограничивающих примеров, рак, расстройства, связанные с ангиогенезом, боль, включая комплексный регионарный болевой синдром («КРБС»), макулярную дегенерацию («МД») и связанные с ней синдромы, заболевания кожи, нарушения в легких, вызванные асбестом расстройства, паразитарные болезни, иммунодефицитные состояния, нарушения ЦНС, травму ЦНС, атеросклероз и связанные с ним расстройства, нарушение сна и связанные с ним расстройства, гемоглобинопатия и связанные с ней расстройства (например, анемия), связанные с ФНОα и другими цитокинами расстройства и другие различные заболевания и расстройства.
Примеры рака и предопухолевых состояний включают, в качестве неограничивающих примеров, описанные в патентах США № 6281230 и 5635517 Muller et al., в публикациях патентов США Zeldis, включая публикации № 2004/0220144Al, опубликованную 4 ноября 2004 года (Treatment of Myelodysplastic Syndrome), 2004/0029832A1, опубликованную 12 февраля 2004 года (Treatment of Varions Types of Cancer), и 2004/0087546, опубликованную 6 мая 2004 года (Treatment of Myeloproliferative Diseases). Примеры также включают заболевания, описанные в PCT/US04/14004, зарегистрированной 5 мая 2004 года. Все данные ссылки включены в настоящее описание в полном объеме посредством ссылки.
Примеры рака включают, в качестве неограничивающих примеров, раки кожи, такие как меланома; лимфоузла; молочной железы; шейки матки; матки; желудочно-кишечного тракта; легкого; яичника; предстательной железы; толстой кишки; прямой кишки; рта; мозга; головы и шеи; горла; яичек; щитовидной железы; почки; поджелудочной железы; кости; селезенки; печени; мочевого пузыря; гортани; носовых ходов и связанный со СПИД рак. Предлагаемые соединения полезны для лечения рака крови и костного мозга, такого как миеломная болезнь и острый или хронический лейкоз, например лимфобластный, миелогенный, лимфоцитарный и миелоцитарный лейкозы. Предлагаемые соединения могут применяться для лечения, предупреждения или контролирования первичной или метастатической опухолей.
Другие примеры рака включают, в качестве неограничивающих примеров, опухоль на поздней стадии, амилоидоз, нейробластому, менингиому, гемангиоперицитому, множественные метастазы мозга, полиморфные глиобластомы, глиобластому, глиому ствола мозга, неблагоприятный прогноз рака мозга, злокачественную глиому, рецидивирующую злокачественную глиому, анапластическую астроцитому, анапластическую олигодендроглиому, нейроэндокринную опухоль, ректальную аденокарциному, колоректальный рак стадий C и D по Дюку, нерезектабельную колоректальную карциному, метастатическую гепатоцеллюлярную карциному, саркому Капоши, острый миелобластный лейкоз с различным кариотипом, хронический лимфоцитарный лейкоз (ХЛЛ), лимфому Ходжкина, неходжскинскую лимфому, кожную Т-клеточную лимфому, кожную B-клеточную лимфому, диффузную крупноклеточную B-клеточную лимфому, низкой степени злокачественности фолликулярную лимфому, метастатическую меланому (локализованную меланому, включая, в качестве неограничивающих примеров, меланому глаза), злокачественную мезотелиому, синдром плеврального выпота при злокачественной мезотелиоме, перитонеальную карциному, папиллярную серозную карциному, гинекологическую саркому, саркому мягких тканей, склеродерму, кожный васкулит, гистиоцитоз из клеток Лангерганса, леймиосаркому, фибродисплазию оссифицирующую прогрессирующую, гормонорезистентный рак предстательной железы, резецированную саркому мягких тканей с высоким риском, нерезектабельную гепатоцеллюлярную карциному, макроглобулинемию Вальденстрема, «тлеющую» миелому, вялотекущую миелому, рак фаллопиевой трубы, андроген-независимый рак предстательной железы, андроген-зависимый неметастатический рак предстательной железы стадии IV, гормононечувствительный рак предстательной железы, нечувствительный к химиотерапии рак предстательной железы, папиллярную карциному щитовидной железы, фолликулярную карциному щитовидной железы, медуллярную карциному щитовидной железы и лейомиому. В некоторых примерах осуществления изобретения рак является метастатическим. В некоторых примерах осуществления изобретения рак является невосприимчивыми или резистентным к химиотерапии или излучению.
В другом примере осуществления предлагаются способы лечения, предупреждения или контролирования различных форм лейкоза, таких как хронический лимфоцитарный лейкоз, хронический миелоцитарный лейкоз, острый лимфобластный лейкоз, острый миелогенный лейкоз и острый миелобластный лейкоз, включая лейкозы, которые являются рецидивирующими, невосприимчивыми или резистентными, как описано в публикации патента США № 2006/0030594, опубликованной 9 февраля 2006 года, которая включена в настоящее описание посредством ссылки в полном объеме. Термин «лейкоз» относится к раку кроветворных тканей. Лейкозы включают, в качестве неограничивающих примеров, хронический лимфоцитарный лейкоз, хронический миелоцитарный лейкоз, острый лимфобластный лейкоз, острый миелогенный лейкоз и острый миелобластный лейкоз. Лейкоз может быть рецидивирующим, невосприимчивым или резистентным к традицианной терапии. Термин «рецидивирующий» относится к ситуации, когда у пациентов, которые имели ремиссию лейкоза после терапии, возвращаются лейкозные клетки в костном мозге и происходит уменьшение нормальных клеток крови. Термин «невосприимчивые или резистентные» относится к случаям, когда у пациентов даже после интенсивной терапии присутствуют остаточные лейкозные клетки в их костном мозге.
В еще другом примере осуществления предлагаются способы лечения, предупреждения или контролирования различных типов лимфом, включая неходжскинскую лимфому (НХЛ, NHL). Термин «лимфома» относится к гетерогенной группе опухолей, возникающих в ретикулоэндотелиальной и лимфатической системах. «НХЛ» относится к злокачественной моноклональной пролиферации лимфоидных клеток в участках иммунной системы, включая лимфоузлы, костный мозг, селезенку, печень и желудочно-кишечный тракт. Примеры НХЛ включают, в качестве неограничивающих примеров, лимфому из клеток зоны мантии, MCL, лимфоцитарную лимфому с промежуточной дифференцировкой, промежуточную лимфоцитарную лимфому, ILL, диффузную низкодифференцированную лимфоцитарную лимфому, PDL, центроцитарную лимфому, диффузную мелкоклеточную с расщепленными ядрами лимфому, DSCCL, фолликулярную лимфому и любой тип лимфом из клеток зоны мантии, которые могут быть видны под микроскопом (узловую, диффузную, бластическую и области мантии лимфому).
Примеры заболеваний и расстройств, связанных с или характеризующихся нежелательным ангиогенезом, включают, в качестве неограничивающих примеров, воспалительные заболевания, аутоиммунные заболевания, вирусные заболевания, генетические заболевания, аллергические заболевания, бактериальные заболевания, неоваскулярные заболевания глаз, хориоидальные неоваскулярные заболевания, неоваскулярные заболевания сетчатки и рубеоз (неоваскуляризация угла передней камеры). Конкретные примеры заболеваний и расстройств, связанных с или характеризующихся нежелательным ангиогенезом, включают, в качестве неограничивающих примеров, эндометриоз, болезнь Крона, сердечную недостаточность, прогрессирующую сердечную недостаточность, почечную недостаточность, эндотоксикоз, синдром токсического шока, остеоартрит, репликацию ретровируса, истощение, менингит, вызванный силикагелем фиброз, вызванный асбестом фиброз, ветеринарные расстройства, вызванную раком гиперкальциемию, удар, циркуляторный шок, периодонтит, гингивит, макроцитарную анемию, рефрактерную анемию и синдром с делецией 5q.
Примеры боли включают, в качестве неограничивающих примеров, описанные в публикации патента США № 2005/0203142, опубликованной 15 сентября 2005 года, который включен в настоящее описание посредством ссылки. Конкретные типы боли включают, в качестве неограничивающих примеров, ноцицептивную боль, нейропатическую боль, смешанную боль ноцицептивной и нейропатической боли, висцеральную боль, мигрень, головную боль и послеоперационную боль.
Примеры ноцицептивной боли включают, в качестве неограничивающих примеров, боль, связанную с химическими или тепловыми ожогами, порезы на коже, ушибы на коже, остеоартрит, ревматоидный артрит, тендинит и миофасциальную боль.
Примеры нейропатической боли включают, в качестве неограничивающих примеров, КРБС типа I, КРБС типа II, рефлекторную симпатическую дистрофию (РСД, RSD), рефлекторную нейроваскулярную дистрофию, рефлекторную дистрофию, посттравматический остеопороз, каузальгию, атрофию Зудека кости, алгонейродистрофию, синдром плеча, посттравматическую дистрофию, невралгию тройничного нерва, постгерпетическую невралгию, связанную с раком боль, фантомную боль в конечностях, фибромиалгию, синдром хронической усталости, боль из-за повреждения спинного мозга, таламическую боль, радикулопатию, диабетическую невропатию, постинсультную боль, сифилитическую невропатию и другие болевые нейропатические состояния, такие как индуцированные лекарственными средствами, такими как винкристин и велкад. Как используется, термины «комплексный регионарный болевой синдром», «КРБС» и «КРБС и связанные с ними синдромы» означают хроническое болевое расстройство, характеризующееся одним или несколькими из следующих: боль, спонтанная или вызванная, включая аллодинию (болевой ответ на стимул, который обычно не является болевым) и гипералгезию (ненормально увеличенный ответ на стимул, который обычно является только слегка болезненным), боль, которая является непропорциональной вызвавшему его событию (например, например годы сильной боли после растяжения связок голеностопного сустава), региональную боль, которая не ограничивается локализацией одного периферического нерва, и вегетативную дисрегуляцию (например, отек, изменение в токе крови и повышенное потоотделение), связанную с трофическими изменениями кожи (нарушения роста волос и ногтей и изъязвление кожи).
Примеры МД и связанные с ней синдромы включают, в качестве неограничивающих примеров, описанные в публикации патента США № 2004/0091455, опубликованной 13 мая 2004 года, которая включена в настоящее описание посредством ссылки. Конкретные примеры включают, в качестве неограничивающих примеров, атрофическую (сухую) МД, экссудативную (влажную) МД, возрастную макулопатию (ВМП), хороидальную неоваскуляризацию (ХНВ, CNVM), отслоение ретинального пигментного эпителия (ОПЭ, PED) и атрофию ретинального пигментного эпителия (РПЭ, RPE).
Примеры заболеваний кожи включают, в качестве неограничивающих примеров, описанные в публикации США № 2005/0214328 A1, опубликованной 29 сентября 2005 года, которая включена в настоящее описание посредством ссылки. Конкретные примеры включают, в качестве неограничивающих примеров, кератозы и связанные с ними симптомы, кожные заболевания или расстройства, характеризующиеся избыточным ростом эпидермиса, акне и морщин. Как используется, термин «кератоз» относится к любому повреждению эпидермиса, характеризующемуся присутствием ограниченного избыточного роста рогового слоя, включая в качестве неограничивающих примеров актиничный кератоз, себорейный кератоз, кератоакантому, кератоз фолликулярный (болезнь Дарье), инвертированный фолликулярный кератоз, ладонно-подошвенную кератодермию (ЛПК, PPK, keratosis palmaris et plantaris), волосяной кератоз и штукатурный кератоз. Термин «актиничный кератоз» также относится к сенильному кератозу, старческому кератозу, старческой бородавке, plana senilis, солнечному кератозу, кератодермии или кератоме. Термин «себорейный кератоз» также относится к себорейной бородавке, сенильный бородавке или базальноклеточной папилломе. Кератоз характеризуется одним или несколькими следующими симптомами: появление неровности, чешуйчатый, эритематозные папулы, бляшки, спикулы или узелка на открытых поверхностях (например, лице, руках, ушах, ногах и груди), патологическое разрастание кератина, называемое как кожные рога, гиперкератоз, телеангиэктазия, эластоз, пигментированный лентигиноз, акантоз, паракератоз, дискератозы, папилломатоз, гиперпигментация базальных клеток, клеточная атипия, митотические фигуры, атипичная межклеточная адгезия, плотные воспалительные инфильтраты и малое распространение плоскоклеточных карцином.
Примеры кожных заболеваний или расстройств, характеризующихся избыточным ростом эпидермиса включают, в качестве неограничивающих примеров, любые состояния, заболевания или расстройства, отличающиеся наличием избыточного роста эпидермиса, включая, в качестве неограничивающих примеров, инфекции, связанные с вирусом папилломы, арсенокератозы, симптом Лезера-Трела, бородавчатую дискератому (БД, WD), пучкообразные волосы (ПВ, TS), эритрокератодермию вариабельную (ЭКВ, EKV), десквамативную эритродерму новорожденных (ихтиоз Арлекина), врожденная узловатость пальцев кисти, кожную меланоакантому, порокератоз, псориаз, плоскоклеточную карциному, сливающийся папулезный папилломатоз (СПП, CRP), мягкие бородавки, кожный рог, болезнь Каудена (синдром полиморфной гамартомы), папулезный дерматоз чернокожих (ПДЧ, DPN), синдром эпидермального невуса (СЭН, ENS), вульгарный ихтиоз, контагиозный моллюск, узловатую почесуху и черный акантоз (ЧА, AN).
Примеры нарушений в легких включают, в качестве неограничивающих примеров, описанные в публикации США № 2005/0239842 A1, опубликованной 27 октября 2005 года, которая включена в настоящее описание посредством ссылки. Конкретные примеры включают легочную гипертензию и связанные с ней расстройства. Примеры легочной гипертензии и связанные с ней расстройства включают, в качестве неограничивающих примеров, первичную легочную гипертензию (ПЛГ, PPH), вторичную легочную гипертензию (ВЛГ, SPH), семейную ПЛГ, спорадическую ПЛГ, прекапиллярную легочную гипертензию, легочную артериальную гипертензию (ЛАГ, PAH), гипертензию легочной артерии, идиопатическую легочную гипертензию, тромботическую легочную артериопатию (ТЛА, TPA), плексогенную легочную артериопатию, функциональные классы I-IV легочной гипертензии и легочную гипертензию, связанную с, относящуюся к или являющуюся осложнением в результате дисфункции левого желудочка, митрального порока сердца, констриктивного перикардита, стеноза устья аорты, кардиомиопатии, фиброза средостения, аномального легочного венозного возврата, окклюзионного поражения легочных вен, коллагеноза сосудов, врожденного порока сердца, ВИЧ-вирусной инфекции, лекарственных средств и токсинов, таких как фенфлурамины, врожденного порока сердца, легочной венозной гипертензии, хронического обструктивного заболевания легких, интерстициального заболевания легких, нарушения дыхания во сне, альвеолярной гиповентиляции, хронического воздействия большой высоты, болезнь легких у новорожденных, альвеолярно-капиллярной дисплазии, серповидно-клеточной анемии, других нарушений коагуляции, хронической тромбоэмболии, болезни соединительной ткани, волчанки, включая системную и кожную волчанку, шистосомоза, саркоидоза или легочного капиллярного гемангиоматоза.
Примеры вызванных асбестом расстройств включают, в качестве неограничивающих примеров, описанные в публикации США № 2005/0100529, опубликованной 12 мая 2005 года, которая включена в настоящее описание посредством ссылки. Конкретные примеры включают, в качестве неограничивающих примеров, мезотелиому, асбестоз, злокачественный плевральный выпот, доброкачественный экссудативный выпот, плевральные бляшки, плевральную кальцификацию, диффузное плевральное наслоение, круглый ателектаз, фиброзные массы и рак легкого.
Примеры паразитарных болезней включают, в качестве неограничивающих примеров, описанные в публикации США № 2006/0154880, опубликованной 13 июля 2006 года, которая включена в настоящее описание посредством ссылки. Паразитарные болезни включают заболевания и расстройства, вызванные внутриклеточными паразитами человека, такими как, в качестве неограничивающих примеров, P. falcifarium, P. ovale, P. vivax, P. malariae, L. donovari, L. infantum, L. aethiopica, L. major, L. tropica, L. mexicana, L. braziliensis, T. gondii, B. microti, B. divergens, B. coli, C. parvum, C. cayetanensis, E. histolytica, I. belli, S. mansonii, S. haematobium, Trypanosoma ssp., Toxoplasma ssp., и O. volvulus. Также охватываются другие заболевания и расстройства, вызываемые не относящимися к человеку внутриклеточными паразитами, такими как, в качестве неограничивающих примеров, Babesia bovis, Babesia canis, Banesia Gibsoni, Besnoitia darlingi, Cytauxzoon felis, Eimeria ssp., Hammondia ssp. и Theileria ssp. Конкретные примеры включают в качестве неограничивающих примеров малярию, бабезиоз, трипанозомоз, лейшманиоз, токсоплазмоз, менингоэнцефалит, кератит, амебиаз, лямблиоз, криптоспоридиоз, изоспороз, циклоспороз, микроспоридиоз, аскаридоз, трихоцефалез, анкилостомоз, стронгилоидоз, токсокароз, трихиноз, филяриатоз лимфоузлов, онхоцеркоз, филяриоз, шистосомоз и дерматит, вызванный шистосомами.
Примеры иммунодефицитных состояний включают, в качестве неограничивающих примеров, описанные в публикации США № 2006/0188475, опубликованной 24 августа 2006 года, которая включена в настоящее описание посредством ссылки. Конкретные примеры включают, в качестве неограничивающих примеров, дефицит аденозиндезаминазы, недостаточность антител с нормальным или повышенным уровнем иммуноглобулинов (Ig), атаксию-телеангиэктазию, синдром голых лимфоцитов, вариабельный неклассифицируемый иммунодефицит, дефицит Ig с чрезмерно высоким IgM, делеции тяжелых цепей Ig, дефицит IgA, иммунодефицит с тимомой, ретикулярную дисгенезию, синдром Незелофа, изолированную недостаточность подклассов IgG-типа, транзиторную гипогаммаглобулинемию новорожденных, синдром Вискотта-Олдрича, агаммаглобулинемия, сцепленная с Х-хромосомой, тяжелый комбинированный иммунодефицит, сцепленный с Х-хромосомой.
Примеры нарушений ЦНС включают, в качестве неограничивающих примеров, описанные в публикации США № 2005/0143344 A1, опубликованной 30 июня 2005 года, которая включена в настоящее описание посредством ссылки. Конкретные примеры включают, в качестве неограничивающих примеров, амиотрофический боковой склероз, болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, рассеянный склероз, другие нейроиммунологические расстройства, такие как синдром Туретта, делирий или нарушения в сознании, которые происходят за короткий период времени, и амнестический синдром или небольшие нарушения памяти, которые происходят в отсутствие других ухудшений центральной нервной системы.
Примеры травм ЦНС и связанных с ними синдромов включают, в качестве неограничивающих примеров, описанные в публикации США № 2006/0122228, опубликованной 8 июня 2006 года, которая включена в настоящее описание посредством ссылки. Конкретные примеры включают, в качестве неограничивающих примеров, травму/повреждение ЦНС и связанные с ними синдромы, включают, в качестве неограничивающих примеров, первичную травму мозга, вторичную травму мозга, травматическое повреждение мозга, очаговую травму мозга, диффузную аксональную травму, травму головы, сотрясение, постконтузионный синдром, ушиб и разрыв мозга, субдуральную гематому, эпидермальную гематому, посттравматическую эпилепсию, хроническое вегетативное состояние, полное ПСМ (повреждение спинного мозга, SCI), неполное ПСМ, острое ПСМ, подострое ПСМ, хроническое ПСМ, синдром центрального паралича, синдром Броун-Секара, синдром паралича в результате нарушений в передней части спинного мозга, синдром мозгового конуса, синдром конского хвоста, нейрогенный шок, спинальный шок, изменение уровня сознания, головную боль, тошноту, рвоту, потерю памяти, головокружение, двоение в глазах, нечеткость зрения, эмоциональную неустойчивость, нарушения сна, раздражительность, неспособность сконцентрироваться, повышенную возбудимость, поведенческие нарушения, нарушение познавательных способностей и припадки.
Другие заболевания или расстройства включают, в качестве неограничивающих примеров, вирусные, генетические, аллергические и аутоиммунные заболевания. Конкретные примеры включают, в качестве неограничивающих примеров, ВИЧ, гепатит, синдром острой дыхательной недостаточности у взрослых, заболевания резорбции костной ткани, хронические воспалительные заболевания легких, дерматит, муковисцидоз, септический шок, сепсис, эндотоксический шок, гемодинамический шок, септический синдром, постишемическое реперфузионное повреждение, менингит, псориаз, фиброзное заболевание, кахексию, реакцию трансплантат-против-хозяина, отторжение трансплантата, аутоиммунное заболевание, ревматоидный спондилит, болезнь Крона, язвенный колит, воспалительные заболевания кишечника, рассеянный склероз, системную красную волчанку, ENL при проказе, лучевое поражение, рак, астму или гипероксическое альвеолярное повреждение.
Примеры атеросклероза и связанных с ним состояний включают, в качестве неограничивающих примеров, описанные в публикации США № 2002/0054899, опубликованной 9 мая 2002 года, которая включена в настоящее описание посредством ссылки. Конкретные примеры включают, в качестве неограничивающих примеров, все виды состояний, относящиеся к атеросклерозу, включая рестеноз после вмешательства на сосудах, такого как ангиопластика, стентирование, атерэктомия и трансплантация. Все виды вмешательств на сосудах рассмотрены в описании, включая заболевания сердечно-сосудистой и мочевой системы, такие как, в качестве неограничивающих примеров, ангиопластика почечных сосудов, чрескожное коронарное вмешательство (ЧКВ, PCI), чрескожная транслюминальная коронарная ангиопластика (ЧТКА, PTCA), чрезкожная транслюминальная ангиопластика сонной артерии (ЧТА, PTA), трансплантация коронарного шунтирования, ангиопластика с имплантацией стента, периферическое чрескожное транслюминальное вмешательство на подвздошной, бедренной или подколенной артериях и операция с применением импрегнированных искусственных трансплантатов. В следующей части представлен список основных системных артерий, для которых может быть необходимо лечение, которые, все, рассмотрены в описании:
|
Примеры нарушения сна и связанные с этим синдромы включают, в качестве неограничивающих примеров, описанные в публикации США № 2005/0222209 A1, опубликованной 6 октября 2005 года, которая включена в настоящее описание посредством ссылки. Конкретные примеры включают, в качестве неограничивающих примеров, храп, апноэ во сне, бессонницу, нарколепсию, синдром усталых ног, страх сна, ходьба во время сна, принятие пищи во время сна и нарушение сна, связанное с хроническими неврологическими или воспалительными состояниями. Хронические неврологические или воспалительные состояния включают, в качестве неограничивающих примеров, комплексный регионарный болевой синдром, хроническую боль в нижней части спины, мышечноскелетную боль, артрит, радикулопатию, боль, связанную с раком, фибромиалгию, синдром хронической усталости, висцеральную боль, боль в мочевом пузыре, хронический панкреатит, нейропатии (диабетическую, постгерпетическую, травматическую или воспалительную) и нейродегенеративные заболевания, такие как болезнь Паркинсона, болезнь Альцгеймера, амиотрофический боковой склероз, рассеянный склероз, болезнь Хантингтона, брадикинезия; мышечную ригидность; паркинсонический тремор; паркинсоническую походку; двигательную заторможенность; депрессию; нарушенную долговременную память, синдром Рубинштейна-Тэйби (СРТ, RTS); слабоумие; постуральную неустойчивость; гипокинетические расстройства; обусловленные синуклеинами расстройства; множественные системные атрофии; стриатонигральную дегенерацию; оливомостомозжечковую атрофию; синдром Шая-Дрейджера; болезнь двигательного нейрона с паркинсоническими чертами; болезнь диффузных телец Леви; связанные с патологией Tau расстройства; прогрессирующий надъядерный паралич; кортико-базальную дегенерацию; лобно-височную деменцию; связанные с амилоидной патологией расстройства; умеренные когнитивные нарушения; болезнь Альцгеймера с паркинсонизмом; болезнь Вильсона; болезнь Галлервордена-Шпатца; болезнь Чедиака-Хигаши; спинально-церебеллярную атаксию степени 3 SCA-3; Х-сцепленный синдром «дистония-паркинсонизм»; прионную болезнь; гиперкинезы; хорею; баллизм; дистонию-тремор; амиотрофический боковой склероз (АБС, ALS); травму ЦНС и миоклонус.
Примеры гемоглобинопатии и связанных с ней расстройств включают, в качестве неограничивающих примеров, описанные в публикации США № 2005/0143420 A1, опубликованной 30 июня 2005 года, которая включена в настоящее описание посредством ссылки. Конкретные примеры включают, в качестве неограничивающих примеров, гемоглобинопатию, серповидноклеточную анемию и любые другие расстройства, относящиеся к дифференциации клеток CD34+.
Примеры расстройств, связанных с ФНОα и другими цитокинами, включают, в качестве неограничивающих примеров, описанные в WO 98/03502 и WO 98/54170, обе включены в настоящее описание посредством ссылки в полном объеме. Конкретные примеры включают, в качестве неограничивающих примеров, эндотоксикоз или синдром токсического шока; кахексию; синдром острой дыхательной недостаточности у взрослых; заболевания резорбции костной ткани, такие как артрит; гиперкальциемию; реакцию трансплантат-против-хозяина; церебральную малярию; воспаление; опухолевый рост; хронические воспалительные заболевания легких; реперфузионное повреждение; инфаркт миокарда; удар; циркуляторный шок; ревматоидный артрит; болезнь Крона; ВИЧ-инфекцию и СПИД; другие расстройства, такие как ревматоидный артрит, ревматоидный спондилит, остеоартрит и другие артритические состояния, септический шок, сепсис, эндотоксический шок, реакция трансплантат-против-хозяина, истощение, болезнь Крона, язвенный колит, рассеянный склероз, системная красная волчанка, ENL при проказе, ВИЧ, СПИД и оппортунистические инфекции при СПИД; связанные с цАМФ расстройства, такие как септический шок, сепсис, эндотоксический шок, гемодинамический шок и септический синдром, постишемическое реперфузионное повреждение, малярия, микобактериальная инфекция, менингит, псориаз, застойная сердечная недостаточность, фиброзное заболевание, кахексия, отторжение трансплантата, онкогенные или раковые состояния, астма, аутоиммунная болезнь, лучевые поражения и гипероксическое альвеолярное повреждение; вирусные инфекции, такие как вызываемые вирусами герпеса; вирусный конъюнктивит или атопический дерматит.
В некоторых примерах осуществления изобретения также осуществляется применение предлагаемых соединений в различных иммунологических приложениях, в частности в качестве адъювантов в вакцинах, особенно адъювантов в противораковых вакцинах, как описано в публикации США № 2007/0048327, опубликованной 1 марта 2007 года, которая включена в настоящее описание посредством ссылки в полном объеме. Данная сторона описания также относится к применению предлагаемых соединений в комбинации с вакцинами для лечения или предупреждения рака или инфекционных заболеваний и другим различным применениям иммуномодулирующих соединений, таким как редукция или десенсибилизация аллергических реакций.
В зависимости от состояния, расстройства или заболеваний, которые подвергаются лечению, и состояния субъекта предлагаемое соединение может вводиться с помощью перорального, парентерального (например, внутримышечно, интраперитонеально, внутривенно, ICV (внутрь желудочков головного мозга), интрацистемальной инъекцией или инфузией, подкожной инъекцией или импланта), ингаляционного, назального, вагинального, ректального, сублингвального и/или местного (например, трансдермального или локального) способов введения и может быть составлено одно или вместе в подходящую единицу дозы с фармацевтически приемлемым наполнителем, носителем, разбавителем, вспомогательным веществом или их смесью, подходящими для каждого способа введения.
Доза может быть в виде одной, двух, трех, четырех, пяти, шести или более субдоз, которые вводятся через подходящие промежутки времени в течение дня. Доза или субдозы могут вводиться в виде единиц доз, содержащих от приблизительно 0,1 до приблизительно 1000 мг, от приблизительно 0,1 до приблизительно 500 мг или от 0,5 приблизительно до приблизительно 100 мг активного агента(ов) на единицу дозы, и, если состояние пациента требует, доза может, в качестве альтернативы, вводиться путем непрерывной инфузии.
В некоторых примерах осуществления изобретения подходящий уровень дозы составляет приблизительно 0,01 - приблизительно 100 мг на кг массы тела пациента в день (мг/кг в день), приблизительно 0,01 - приблизительно 50 мг/кг в день, приблизительно 0,01 - приблизительно 25 мг/кг в день или приблизительно 0,05 - приблизительно 10 мг/кг в день, которая может быть введена в однократной или многократной дозах. Подходящий уровень дозы может составлять приблизительно 0,01 - приблизительно 100 мг/кг в день, приблизительно 0,05 - приблизительно 50 мг/кг в день или приблизительно 0,1 - приблизительно 10 мг/кг в день. Внутри этого диапазона доза может составлять приблизительно 0,01 - приблизительно 0,1, приблизительно 0,1 - приблизительно 1,0, приблизительно 1,0 - приблизительно 10 или приблизительно 10 - приблизительно 50 мг/кг в день.
Для перорального введения фармацевтические композиции могут обеспечиваться в виде таблеток, содержащих 1,0-1000 мг активного агента, в частности приблизительно 1, приблизительно 5, приблизительно 10, приблизительно 15, приблизительно 20, приблизительно 25, приблизительно 50, приблизительно 75, приблизительно 100, приблизительно 150, приблизительно 200, приблизительно 250, приблизительно 300, приблизительно 400, приблизительно 500, приблизительно 600, приблизительно 750, приблизительно 800, приблизительно 900 и приблизительно 1000 мг активного агента для симптоматического подбора дозы у пациента, подвергаемого лечению. Композиции могут вводиться по схеме приема 1-4 раза в день, включая однократно, двукратно, трехкратно или четыре раза в день.
Однако будет понятно, что конкретная доза и кратность приема для любого конкретного пациента может варьироваться в зависимости от целого ряда факторов, включая активность конкретного применяемого соединения, метаболическую устойчивость и длительность действия данного соединения, возраст, массу тела, общее состояние здоровья, пол, диету, способ и время введения, скорость экскреции, комбинации лекарственнх средств, тяжести конкретного состояния и организма, подвергаемого лечению.
4.4. ДОПОЛНИТЕЛЬНЫЕ АКТИВНЫЕ АГЕНТЫ
Предлагаемые соединения могут также комбинироваться или применяться в комбинации с другими терапевтическими агентами, применяемыми при лечении, предупреждении и/или контролировании различных заболеваний или расстройств, для которых применяются предлагаемые соединения. Предполагают, что некоторые комбинации могут работать синергистически при лечении конкретных типов заболеваний или расстройств, а также состояний и симптомов, связанных с такими заболеваниями или расстройствами. Предлагаемое соединение, включая его один энантиомер, смесь энантиомеров или смесь диастереомеров или его фармацевтически приемлемую соль, сольват или пролекарство, может также работать для облегчения неблагоприятных действий, связанных с определенными дополнительными активными агентами, и наоборот.
Как используется, термин «в комбинации» включает применение более одного терапевтического агента. Однако применение термина «в комбинации» не ограничивает порядок или способ, которым терапевтические агенты вводятся субъекту с состоянием или расстройством. Первый терапевтическ агент (например, терапевтический агент, такой как предлагаемое соединение) может вводиться до (например, за 5 мин, 15 мин, 30 мин, 45 мин, 1 ч, 2 ч, 4 ч, 6 ч, 12 ч, 24 ч, 48 ч, 72 ч, 96 ч, 1 нед., 2 нед., 3 нед., 4 нед., 5 нед., 6 нед., 8 нед. или 12 нед. перед), одновременно с или после (например, через 5 мин, 15 мин, 30 мин, 45 мин, 1 ч, 2 ч, 4 ч, 6 ч, 12 ч, 24 ч, 48 ч, 72 ч, 96 ч, 1 нед., 2 нед., 3 нед., 4 нед., 5 нед., 6 нед., 8 нед. или 12 нед. после) введения дополнительного терапевтического агента субъекту, подвергаемому лечению.
Подходящий конкретный способ введения, применяемый для конкретного активного агента, будет зависеть от самого активного агента (например, может ли он вводиться перорально без разрушения до попадания в кровоток) и подвергаемого лечению заболевания. В некоторых примерах осуществления изобретения способ введения предлагаемых соединений является пероральным. В некоторых примерах осуществления изобретения способы введения дополнительных активных компонентов или предлагаемых компонентов описаны в «Physicians' Desk Reference», 1755-1760 (56th ed., 2002).
В одном примере осуществления дополнительный активный агент вводится внутривенно или подкожно и один раз или дважды в день в количестве от приблизительно 1 до приблизительно 1000 мг, от приблизительно 5 до приблизительно 500 мг, от приблизительно 10 до приблизительно 350 мг или от приблизительно 50 до приблизительно 200 мг. Конкретное количество дополнительного активного агента будет зависеть от конкретного агента, типа подвергаемого лечению или контролируемого заболевания, тяжести или стадии заболевания и количества предлагаемых соединений и любых необязательных добавочных активных агентов, одновременно вводимых пациенту.
В некоторых примерах осуществления изобретения предлагается способ уменьшения, лечения и/или предупреждения неблагоприятных или нежелательных эффектов, связанных с традиционным лечением, включая, в качестве неограничивающих примеров, хирургическую операцию, химиотерапию, лучевую терапию, гормонотерапию, биологическую терапию и иммунотерапию. Предлагаемые соединения и другие активные агенты могут вводиться пациенту до, в течение или после появления неблагоприятного действия, связанного с традиционной терапией.
Когда предлагаемое соединение применяется одновременно с одним или несколькими терапевтическими агентами, может применяться фармацевтическая композиция, содержащая такие другие агенты дополнительно к предлагаемому соединению, но это не является необходимым. Таким образом, предлагаемые фармацевтические композиции включают композиции, которые также содержат один или несколько других терапевтических агентов, в дополнение к предлагаемому соединению.
Один или несколько дополнительных активных компонентов или агентов могут применяться в предлагаемых способах или композициях. Дополнительные активные агенты могут представлять собой крупные молекулы (например, белки) или малые молекулы (например, синтетические неорганические, органометаллические или органические молекулы).
Примеры активных агентов с крупными молекулами включают, в качестве неограничивающих примеров, гематопоэтические факторы роста, цитокины и моноклональные и поликлональные антитела. Конкретные примеры активных агентов представляют собой моноклональные антитела против CD40 (такие как, например, SGN-40, герцептин, ритуксимаб); ингибиторы гистондеацетилазы (такие как, например, SAHA и LAQ 824); ингибиторы белка теплового шока 90 (такие как, например, 17-AAG); ингибиторы киназы рецептора инсулиноподобного фактора роста-1; ингибиторы киназы рецептора фактора роста эндотелия сосудов (такие как, например, PTK787); ингибиторы рецептора инсулинового фактора роста, ингибиторы ацилтрансферазы лизофосфатидовой кислоты; ингибиторы киназы IkB, ингибиторы p38MAPK; ингибиторы РЭФР (EGFR, рецептор эпидермального фактора роста) (такие как, например, гефитиниб и эрлотиниб HCL), антитела к HER-2 (такие как, например, трастузумаб (Herceptin®) и пертузумаб (Omnitarg™)); антитела к РФРЭС (рецептор ФРЭС, VEGFR) (такие как, например, бевацизумаб (Avastin™)); ингибиторы РФРЭС (такие как, например, ингибиторы специфической киназы flk-1, SU5416 и ptk787/zk222584); ингибиторы P13K (такие как, например, вортманнин); ингибиторы C-Met (такие как, например, PHA-665752); моноклональные антитела (такие как, например, ритуксимаб (Rituxan®), тоситумомаб (Bexxar®), эдреколомаб (Panorex®) и G250) и антитела против ФНО-α. Примеры активных агентов с малыми молекулами включают, в качестве неограничивающих примеров, противоопухолевые агенты с малой молекулой и антибиотики (например, кларитромицин).
Конкретные дополнительные активные соединения, которые можно комбинировать с предлагаемыми соединениями, меняются в зависимости от конкретных показаний, которые подвергают лечению, предупреждению или контролированию.
Например, для лечения, предупреждения или контролирования рака дополнительные активные компоненты включают, в качестве неограничивающих примеров, земаксаниб, циклоспорин, этанерцепт, доксициклин, бортезомиб, ацивицин, акларубицин, акодазола гидрохлорид, акронин, адозелезин, альдеслейкин, альтретамин, амбомицин, аметантрона ацетат, амсакрин, анастрозол, антрамицин, аспарагиназа, асперлин, азацитидин, азетепа, азотомицин, батимастат, бензодепа, бикалутамид, бисантрена гидрохлорид, биснафида димезилат, бизелезин, блеомицина сульфат, бреквинар натрия, бропиримин, бусульфан, кактиномицин, калустерон, карацемид, карбетимер, карбоплатин, кармустин, карубицина гидрохлорид, карзелезин, цедефингол, целекоксиб, хлорамбуцил, циролемицин, цисплатин, кладрибин, криснатола мезилат, циклофосфамид, цитарабин, дакарбазин, дактиномицин, даунорубицина гидрохлорид, децитабин, дексормаплатин, дезагуанин, дезагуанина мезилат, диазиквон, доцетаксел, доксорубицин, доксорубицина гидрохлорид, дролоксифен, дролоксифена цитрат, дромостанолона пропионат, дуазомицин, эдатрексат, эфлорнитина гидрохлорид, элсамитруцин, энлоплатин, энпромат, эпипропидин, эпирубицина гидрохлорид, эрбулозол, эзорубицина гидрохлорид, эстрамустин, эстрамустина фосфат натрия, этанидазол, этопозид, этопозид фосфат, этоприн, фадразола гидрохлорид, фазарабин, фенретинид, флоксуридин, флударабина фосфат, фторурацил, флуроцитабин, фосквидон, фостриецин натрия, гемцитабин, гемцитабина гидрохлорид, гидроксимочевина, идарубицина гидрохлорид, ифосфамид, илмофозин, ипроплатин, иринотекан, иринотекана гидрохлорид, ланреотида ацетат, летрозол, лейпролида ацетат, лиарозола гидрохлорид, лометрексол натрия, ломустин, лозоксантрона гидрохлорид, мазопрокол, маитанзин, мехлоретамина гидрохлорид, мегестрола ацетат, меленгестрола ацетат, мелфалан, меногарил, меркаптопурин, метотрексат, метотрексат натрия, метоприн, метуредепа, митиндомид, митокарцин, митокромин, митогиллин, митомалцин, митомицин, митоспер, митотан, митоксантрона гидрохлорид, микофеноловую кислоту, нокодазол, ногаламицин, ормаплатин, оксисуран, паклитаксел, пегаспаргазу, пелиомицин, пентамустин, пепломицина сульфат, перфосфамид, пипоброман, пипосульфан, пироксантрона гидрохлорид, пликамицин, пломестан, порфимер натрия, порфиромицин, преднимустин, прокарбазина гидрохлорид, пуромицин, пуромицина гидрохлорид, пиразофурин, рибоприн, сафингол, сафингола гидрохлорид, семустин, симтразен, спарфозат натрия, спарсомицин, спирогермания гидрохлорид, спиромустин, спироплатин, стрептонигрин, стрептозоцин, сулофенур, тализомицин, текогалан натрия, таксотер, тегафур, телоксантрона гидрохлорид, темопорфин, тенипозид, тероксирон, тестолактон, тиамиприн, тиогуанин, тиотепа, тиазофурин, тирапазамин, торемифена цитрат, трестолона ацетат, трицирибина фосфат, триметрексат, триметрексата глюкуронат, трипторелин, тубулозола гидрохлорид, урацил иприт, уредепа, вапреотид, вертепорфин, винбластина сульфат, винкристина сульфат, виндезин, виндезина сульфат, винепидина сульфат, винглицината сульфат, винлейрозина сульфат, винорелбина тартрат, винрозидина сульфат, винзолидина сульфат, ворозол, зениплатин, зиностатин и зорубицина гидрохлорид.
Другие дополнительные активные агенты включают, в качестве неограничивающих примеров, 20-эпи-1,25 дигидроксивитамин D3; 5-этинилурацил; абиратерон; акларубицин; ацилфулвен; адеципенол; адозелезин; алдеслейкин; антагонисты ALL-TK; алтретамин; амбамустин; амидокс; амифостин; аминолевулиновую кислоту; амрубицин; амсакрин; анагрелид; анастрозол; андрографолид; ингибиторы ангиогенеза; антагонист D; антагонист G; антареликс; антидорсализирующий морфогенетический белок-1; антиандроген, в случае карциномы простаты; антиэстроген; антинеопластон; антисенсовые олигонуклеотиды; афидиколина глицинат; модуляторы гена апоптоза; регуляторы апоптоза; апуриновую кислоту; ara-CDP-DL-PTBA; аргинин-дезаминазу; асулакрин; атаместан; атримустин; аксинастатин 1; аксинастатин 2; аксинастатин 3; азасетрон; азатоксин; азатирозин; производные баккатина III; баланол; батимастат; антагонисты BCR/ABL; бензохлорины; бензоилстауроспорин; бета-лактамные производные; бета-алетин; бетакламицин B; бетулиновую кислоту; ингибитор оФРФ (bFGF, основной фактор роста фибробластов); бикалутамид; бизантрен; бисазиридинилспермин; биснафид; бистратен A; бизелезин; брефлат; бропиримин; будотитан; бутионина сульфоксимин; кальципотриол; калфостин C; производные камптотецина; капецитабин; аминотриазол-карбоксамид; карбоксиамидотриазол; CaRest M3; CARN 700; происходящий из хряща ингибитор; карзелезин; ингибиторы казеин-киназы (ICOS); кастаноспермин; цекропин B; цетрореликс; хлорины; хлорхиноксалина сульфамид; цикапрост; цис-порфирин; кладрибин; аналоги кломифена; клотримазол; коллисмицин A; коллисмицин B; комбретастатин A4; аналоги комбретастатина; конагенин; крамбесцидин 816; криснатол; криптофицин 8; производные криптофицина A; курацин A; циклопентантрахиноны; циклоплатам; ципемицин; цитарабина окфосфат; цитолитический фактор; цитостатин; дакликсимаб; децитабин; дегидродидемнин B; деслорелин; дексаметазон; дексифосфамид; дексразоксан; дексверапамил; диазикуон; дидемнин B; дидокс; диэтилнорспермин; дигидро-5-азацитидин; дигидротаксол; диоксамицин; дифенилспиромустин; доцетаксел; докозанол; доласетрон; доксифлуридин; доксорубицин; дролоксифен; дронабинол; дуокармицин SA; эбселен; экомустин; эделфозин; эдреколомаб; эфлорнитин; элемен; эмитефур; эпирубицин; эпристерид; аналог эстрамустина; агонисты эстрогена; антагонисты эстрогена; этанидазол; этопозида фосфат; эксеместан; фадрозол; фазарабин; фенретинид; филграстим; финастерид; флавопиридол; флезеластин; флуастерон; флударабин; фтордауноруницина гидрохлорид; форфенимекс; форместан; фостриецин; фотемустин; гадолиния тексафирин; галлия нитрат; галоцитабин; ганиреликс; ингибиторы желатиназы; гемцитабин; ингибиторы глутатиона; гепсульфам; херегулин; гексаметилена бисацетамид; гиперицин; ибандроновую кислоту; идарубицин; идоксифен; идрамантон; илмофозин; иломастат; иматиниб (Gleevec®), имиквимод; иммуностимулирующие пептиды; ингибитор рецептора инсулиноподобного фактора роста-1; агонисты интерферона; интерфероны; интерлейкины; иобенгуан; йододоксорубицин; 4-ипомеанол; иропласт; ирсогладин; изобенгазол; изогомогаликондрин B; итасетрон; ясплакинолид; кахалалид F; ламелларин-N триацетат; ланреотид; лейнамицин; ленограстим; лентинана сульфат; лептолстатин; летрозол; ингибирующий фактор лейкоза; альфа-интерферон лейкоцита; лейпролид + эстроген + прогестерон; лейпрорелин; левамизол; лиарозол; аналог линейного полиамина; липофильный дисахарид-пептид; липофильные соединения платины; лиссоклинамид 7; лобаплатин; ломбрицин; лометрексол; лонидамин; лозоксантрон; локсорибин; луртотекан; лютеция тексафирин; лизофуллин; лизирующие пептиды; майтансин; манностатин A; маримастат; мазопрокол; маспин; ингибиторы матрилизина; ингибиторы матриксной металлопротеиназы; меногарил; мербарон; метерелин; метиониназу; метоклопрамид; ингибитор МИФ (MIF, фактор, ингибирующий миграцию макрофагов); мифепристон; милтефозин; миримостин; митогуазон; митолактол; аналоги митомицина; митонафид; митотоксин фактор роста фибробластов-сапорин; митоксантрон; мофаротен; молграмостин; Эрбитукс, человеческий хорионгонадотропин; монофосфорилированный липид A + стрептокиназа миобактериальной клеточной стенки; мопидамол; ипритовый противораковый агент; микапероксид B; экстракт миобактериальной клеточной стенки; мириапорон; N-ацетилдиналин; N-замещенные бензамиды; нафарелин; нагрестип; налоксон + пентазоцин; напавин; нафтерпин; нартограстим; недаплатин; неморубицин; неридроновую кислоту; нилутамид; нисамуцин; модуляторы оксида азота; нитроксидный антиоксидант; нитруллин; облимерсен (Genasense®); O6-бензилгуанин; октреотид; окиценон; олигонуклеотиды; онапристон; ондансетрон; ондансетрон; орацин; пероральный цитокиновый индуктор; ормаплатин; осатерон; оксалиплатин; оксауномицин; паклитаксел; аналоги паклитаксела; производные паклитаксела; палауамин; пальмитоилризоксин; памидроновую кислоту; панакситриол; паномифен; парабактин; пазеллиптин; пэгаспаргаза; пелдезин; пентосана полисульфат натрия; пентостатин; пентрозол; перфлуброн; перфосфамид; периллиловый спирт; феназиномицин; фенилацетат; ингибиторы фосфатазы; пицибанил; пилокарпина гидрохлорид; пирарубицин; пиритрексим; плацетин A; плацетин B; ингибитор активатора плазминогена; комплекс платины; соединения платины; комплекс платина-триамин; порфимер натрия; порфиромицин; преднизон; пропилбис-акридон; простагландин J2; ингибиторы протеосомы; иммуномодулятор на основе белка А; ингибитор протеинкиназы C; ингибиторы протеинкиназы C, микроводорослей; ингибиторы тирозиновой протеинфосфатазы; ингибиторы фосфорилазы пуриновых нуклеозидов; пурпурины; пиразолоакридин; конъюгат пиридоксилированный гемоглобин-полиоксиэтилен; raf-антагонисты; ралтитрексед; рамосетрон; ингибиторы фарнезил-протеинтрансферазы ras; ингибиторы ras; ингибитор ras-GAP; диметилированный ретеллиптин; рутения Re 186 этидронат; ризоксин; рибозимы; RII ретинамид; рохитукин; ромуртид; роквинимекс; рубигинон B1; рубоксил; сафингол; сайнтопин; SarCNU; саркофитол A; сарграмостин; миметики Sdi 1 (senescent cell-derived inhibitor 1); семустин; приводящий к старению ингибитор 1; сенсовые олигонуклеотиды; ингибиторы сигнальной трансдукции; сизофиран; собузоксан; натрия боркаптат; натрия фенилацетат; солверол; соматомедин-связывающий белок; сонермин; спарфозовую кислоту; спикамицин D; спиромустин; спленопентин; спонгистатин 1; скваламин; стипиамид; ингибиторы стромелизина; сулфинозин; антагонист сверхактивного вазоактивного интестинального пептида; сурадиста; сурамин; сваинсонин; таллимустин; тамоксифена метйодид; тауромустин; тазаротен; текогалан натрия; тегафур; теллурапирилий; ингибиторы теломеразы; темопорфин; тенипозид; тетрахлордекаоксид; тетразомин; талибластин; тиокоралин; тромбопоэтин; миметик тромбопоэтина; тимальфазин; агонист рецептора тимопоэтина; тимотринан; тиреостимулирующий гормон; олово-этилэтиопурпурин; тирапазамин; титаноцена дихлорид; топсентин; торемифен; ингибиторы трансляции; третиноин; триацетилуридин; трицирибин; триметрексат; трипторелин; трописетрон; туростерид; ингибиторы тирозинкиназы; тирфостины; ингибиторы UBC; убенимекс; фактор, ингибирующий рост мочеполового синуса; антагонисты урокиназного рецептора; вапреотид; вариолин B; веларезол; верамин; вердины; вертепорфин; винорелбин; винксалтин; витаксин; ворозол; занотерон; зениплатин; зиласкорб и зиностатин стималамер.
Конкретные дополнительные активные агенты включают, в качестве неограничивающих примеров, 2-метоксиэстрадиол, теломестатин, индукторы апоптоза клеток множественной миеломы (такие как, например, TRAIL), статины, семаксаниб, циклоспорин, этанецепт, доксициклин, бортезомиб, облимерсен (Genasense®), ремикад, доцетаксел, целекоксиб, мелфалан, дексаметазон (Decadron®), стероиды, гемцитабин, цисплатин, темозоломид, этопозид, циклофосфамид, темодар, карбоплатин, прокарбазин, глиадел, тамоксифен, топотекан, метотрексат, Ариза (Arisa®), таксол, таксотер, фторурацил, лейковорин, иринотекан, кселода, CPT-11, альфа-интерферон, ПЭГилированный альфа-интерферон (например, PEG INTRON-A), капецитабин, цисплатин, тиотепа, флударабин, карбоплатин, липосомальный даунорубицин, цитарабин, доксетаксол, пацилитаксел, винбластин, IL-2 (IL-2), ГМ-КСФ (GM-CSF, гранулоцитарно-макрофагальный колониестимулирующий фактор), дакарбазин, винорелбин, золедроновую кислоту, пальмитронат, биаксин, бусульфан, преднизон, бисфосфонат, триоксид мышьяка, винкристин, доксорубицин (Doxil®), паклитаксел, ганцикловир, адриамицин, эстрамустина натрия фосфат (Emcyt®), сулиндак и этопозид.
Аналогично, примеры конкретных дополнительных агентов в зависимости от показаний для лечения, предупреждения или контролирования могут быть обнаружены в следующих ссылках, которые включены в настоящее описание в полном объеме: патенты США № 6281230 и 5635517; заявка на патент США № 10/411649, 10/483213, 10/411656, 10/693794, 10/699154 и 10/981189; и предварительных заявках на патент США № 60/554923, 60/565172, 60/626975, 60/630599, 60/631870 и 60/533862.
Примеры дополнительных активных агентов, которые могут применяться для лечения, предупреждения или контролирования боли, включают в качестве неограничивающих примеров традиционные лекарственные средства, которые используются для лечения или предупреждения боли, такие как антидепрессанты, противосудорожные средства, антигипертензивные средства, анксиолитики, блокаторы кальциевых каналов, миорелаксанты, ненаркотические анальгетики, опиоидные анальгетики, противовоспалительные средства, ингибиторы ЦОГ-2, иммуномодулирующие агенты, агонисты или антагонисты альфа-адренергических рецепторов, иммуносупрессивные агенты, кортикостероиды, гипербарический кислород, кетамин, другие анестетики, агонисты NMDA (N-метил-D-аспартат) и другие лекарственные средства, найденные, например, в «Physician's Desk Reference» 2003. Конкретные примеры включают, в качестве неограничивающих примеров, ацетат салициловой кислоты (Aspirin®), целекоксиб (Celebrex®), Enbrel®, кетамин, габапентин (Neurontin®), фенитоин (Dilantin®), карбамазепин (Tegretol®), оксакарбазепин (Trileptal®), вальпроевая кислота (Depakene®), морфина сульфат, гидроморфон, преднизон, гризеофульвин, пентоний, алендронат, дифенгидрамид, гуанетидин, кеторолак (Acular®), тирокальцитонин, диметилсульфоксид (ДМСО), клонидин (Catapress®), бретилий, кетансерин, резерпин, дроперидол, атропин, фентоламин, бупивакаин, лидокаин, ацетаминофен, нортриптилин (Pamelor®), амитриптилин (Elavil®), имипрамин (Tofranil®), доксепин (Sinegvan®), кломипрамин (Anafranil®), флуоксетин (Prozac®)), сертралин (Zoloft®), нефазодон (Serzone®), венлафаксин (Effexor®), тразодон (Desyrel®), бупропион (Wellbutrin®), мексилетин, нифедипин, пропранолол, трамадол, ламотригин, зиконотид, кетамин, декстрометорфан, бензодиазепины, баклофен, тизанидин и феноксибензамин.
Примеры дополнительных активных агентов, которые могут применяться для лечения, предупреждения или контролирования МД и связанных с ней синдромов, включают, в качестве неограничивающих примеров, стероид, фотосенсибилизатор, интегрин, антиоксидант, интерферон, производное ксантина, гормон роста, нейротрофный фактор, регулятор образования новых сосудов, антитело против ФРЭС, простагландин, антибиотик, фитоэстроген, противовоспалительное соединение или предотвращающее развитие кровеносных сосудов соединение или их комбинацию. Конкретные примеры включают, в качестве неограничивающих примеров, вертепорфин, пурлитин, ангиостатические стероиды, ранибизумаб (rhuFab), интерферон-2α, пентоксифиллин, комплекс олова с этиопурпурином, мотексафин лютеция, 9-фтор-11,21-дигидрокси-16,17-l-метилэтилиденбис(окси)прегна-1,4-диен-3,20-дион, латанопрост (см. патент США № 6225348), тетрациклин и его производные, рифамицин и его производные, макролиды, метронидазол (патенты США № 6218369 и 6015803), генистеин, генистин, 6'-O-малонилгенистин (6'-O-Mal генистин), 6'-O-ацетилгенистин (6'-О-Ac генистин), даидзеин, даидзин, 6'-O-малонилдаидзин (6'-O-Mal даидзин), 6'-О-ацетилдаидзин (6'-О-Ac даидзин), глицитеин, глицитин, 6'-О-малонилглицитин (6'-O-Mal глицитин), биоханин A, формононетин (патент США № 6001368), триамцинолона ацетомид, дексаметазон (патент США № 5770589), талидомид, глутатион (патент США № 5632984), основной фактор роста фибробластов (оФРФ), трансформирующий фактор роста b (ТФР-b, TGF-b), нейротрофический фактор головного мозга (BDNF), фактор активатор плазминогена типа 2 (PAI-2), EYE101 (Eyetech Pharmaceuticals), LY333531 (Eli Lilly), Миравант и имплант RETISERT (Bausch & Lomb). Все упомянутые выше ссылки включены в настоящее описание в полном объеме посредством ссылки.
Примеры дополнительных активных агентов, которые могут применяться для лечения, предупреждения и/или контролирования заболеваний кожи, включают, в качестве неограничивающих примеров, кератолитики, ретиноиды, α-гидроксикислоты, антибиотики, коллаген, ботулотоксин, интерферон и иммуномодулирующие агенты. Конкретные примеры включают, в качестве неограничивающих примеров, 5-фторурацил, мазопрокол, трихлоруксусную кислоту, салициловую кислоту, молочную кислоту, лактат аммония, мочевину, третиноин, изотретиноин, антибиотики, коллаген, ботулотоксин, интерферон, кортикостероид, транс-ретиноевую кислоту и коллагены, такие как плацентарный коллаген человека, плацентарный коллаген животного, Дермалоген, АллоДерм, Фасция, Циметра, Автологен, Зидерм, Зипласт, Резопласт и Изолаген.
Примеры дополнительных активных агентов, которые могут применяться для лечения, предупреждения или контролирования легочной гипертензии и связанных с ней расстройств, включают, в качестве неограничивающих примеров, антикоагулянты, диуретики, сердечные гликозиды, блокаторы кальциевых каналов, вазодилаторы, аналоги простациклина, антагонисты эндотелина, ингибиторы фосфодиэстеразы (например, ингибиторы ФДЭ V (PDE V)), ингибиторы эндопептидазы, гиполипидемические агенты, ингибиторы тромбоксана и другие лекарственные средства, которые, как известно, снижают давление в легочной артерии. Конкретные примеры включают, в качестве неограничивающих примеров, варфарин (Coumadin®), диуретик, сердечные гликозиды, дигоксин-кислород, дилтиазем, нифедипин, вазодилатор, такой как простациклин (например, простагландин I2 (ПГI2 (PGI2)), эпопростенол (EPO, Floran®), трепростинил (Remodulin®), оксид азота (NO), бозентан (Tracleer®), амлодипин, эпопростенол (Floran®), трепростинил (Remodulin®), простациклин, тадалафил (Cialis®), симвастатин (Zocor®), омапатрилат (Vanlev®), ирбесартан (Avapro®), правастатин (Pravachol®), дигоксин, L-аргинин, илопрост, бетапрост и силденафил (Viagra®).
Примеры дополнительных активных агентов, которые могут применяться для лечения, предупреждения или контролирования вызванных асбестом расстройств, включают, в качестве неограничивающих примеров, антрациклин, платинум, алкилирующий агент, облимерсен (Genasense®), цисплатинум, циклофосфамид, темодар, карбоплатин, прокарбазин, глиадел, тамоксифен, топотекан, метотрексат, таксотер, иринотекан, капецитабин, цисплатин, тиотепа, флударабин, карбоплатин, липосомальный даунорубицин, цитарабин, доксетаксол, пацилитаксел, винбластин, IL-2, ГМ-КСФ, дакарбазин, винорелбин, золедроновую кислоту, палмитронат, биаксин, бусульфан, преднизон, бисфосфонат, триоксид мышьяка, винкристин, доксорубицин (Doxil®), паклитаксел, ганцикловир, адриамицин, блеомицин, гиалуронидазу, митомицин C, мепакрин, тиотепу, тетрациклин и гемцитабин.
Примеры дополнительных активных агентов, которые могут применяться для лечения, предупреждения или контролирования паразитарных болезней, включают, в качестве неограничивающих примеров, хлорохин, хинин, хинидин, пириметамин, сульфадиазин, доксициклин, клиндамицин, мефлохин, галофантрин, примахин, гидроксихлорохин, прогуанил, атовакуон, азитромицин, сурамин, пентамидин, меларсопрол, нифуртимокс, бензнидазол, амфотерицин B, соединения пятивалентной сурьмы (например, натрия стибоглюкуронат), гамма-интерферон, итраконазол, сочетание убитых промастигот и БЦЖ (бацилла Кальметта-Герена, BCG), лейковорин, кортикостероиды, сульфонамид, спирамицин, IgG (серология), триметоприм и сульфаметоксазол.
Примеры дополнительных активных агентов, которые могут применяться для лечения, предупреждения или контролирования иммунодефицитных состояний, включают, в качестве неограничивающих примеров, антибиотики (терапевтические или профилактические), такие как, но без ограничения этим, ампициллин, кларитромицин, тетрациклин, пенициллин, цефалоспорины, стрептомицин, канамицин и эритромицин; противовирусные средства, такие как, но без ограничения этим, амантадин, римантадин, ацикловир и рибавирин; иммуноглобулин; плазму; иммуноповышающие агенты, такие как, но без ограничения этим, левамизол и изопринозин; биопрепараты, такие как, но без ограничения этим, гамма-глобулин, фактор переноса, интерлейкины и интерфероны; гормоны, такие как, но без ограничения этим, тимусный; и другие иммунологические агенты, такие как, но без ограничения этим, стимуляторы B-клеток (например, BAFF/BlyS (B lymphocyte stimulator), цитокины (например, IL-2, IL-4 и IL-5), ростовые факторы (например, ТФР-α), антитела (например, анти-CD40 и IgM), олигонуклеотиды, содержащие неметилированные CpG-мотивы (ЦГ-мотивы), и вакцины (например, вирусные и опухолевые пептидные вакцины).
Примеры дополнительных активных агентов, которые могут применяться для лечения, предупреждения или контролирования нарушений ЦНС, включают, в качестве неограничивающих примеров, агонист или антагонист допамина, такой как, но без ограничения этим, леводопа, L-ДОПА, кокаин, α-метилтирозин, резерпин, тетрабеназин, бензотропин, паргилин, фенодолпама мезилат, каберголин, прамипексола дигидрохлорид, ропинорол, амантадина гидрохлорид, селегилина гидрохлорид, карбидопа, перголида мезилат, Синемет-СР (Sinemet CR) и Симметрел (Symmetrel); ингибитор МАО, такой как, но без ограничения этим, ипрониазид, клоргилин, фенелзин и изокарбоксазид; ингибитор COMT (катехин-O-метилтрансфераза), такой как, но без ограничения этим, толкапон и энтакапон; ингибитор холинэстеразы, такой как, но без ограничения этим, физостигмина салицилат, физостигмина сульфат, физостигмина бромид, меостигмина бромид, неостигмина метилсульфат, амбенонима хлорид, эдрофония хлорид, такрин, пралидоксима хлорид, обидоксима хлорид, тримедоксима бромид, диацетилмоноксим, эндрофоний, пиридостигмин и демекариум; противовоспалительный агент, такой как, но без ограничения этим, напроксен натрия, диклофенак натрия, диклофенак калия, целекоксиб, сулиндак, оксапрозин, дифлунизал, этодолак, мелоксикам, ибупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномид, сульфасалазин, соли золота, Rho-D иммуноглобулин, микофенилат мофетил, циклоспорин, азатиоприн, такролимус, базиликсимаб, даклизумаб, салициловая кислота, ацетилсалициловая кислота, метилсалицилат, дифлунизал, салсалат, олсалазин, сульфасалазин, ацетаминофен, индометацин, сулиндак, мефенаминовая кислота, меклофенамат натрия, толметин, кеторолак, диклофенак, флурбипрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, пивоксикам, теноксикам, фенилбутазон, оксифенбутазон, антипирин, аминопирин, апазон, зилеутон, ауротиоглюкоза, тималат золота-натрия, ауранофин, метотрексат, колхицин, аллопуринол, пробенецид, сульфинпиразон и бензбромарон или бетаметазон и другие глюкокортикоиды; и противорвотное средство, такое как, но без ограничения этим, метоклопромид, домперидон, прохлорперазин, прометазин, хлорпромазин, триметобензамид, ондансетрон, гранисетрон, гидроксизин, ацетиллейцина моноэтаноламиновая соль, ализаприд, азасетрон, бензхинамид, биетанаутин, бромоприд, буклизин, клебоприд, циклизин, дименгидринат, дифенидол, доласетрон, меклизин, металлатал, метопимазин, набилон, оксипендил, пипамазин, скополамин, сульпирид, тетрагидроканнабинол, тиэтилперазин, тиопроперазин, трописетрон и их смеси.
Примеры дополнительных активных агентов, которые могут применяться для лечения, предупреждения или контролирования травм ЦНС и связанных с ними синдромов, включают, в качестве неограничивающих примеров, иммуномодулирующие агенты, иммуносупрессоры, антигипертензивные средства, противосудорожные средства, фибринолитические средства, антиагрегантные средства, нейролептики, антидепрессанты, бензодиазепины, буспирон, амантадин и другие известные или традиционные средства, применяемые у пациентов с травмой/повреждением ЦНС и связанными с этим синдромами. Конкретные примеры включают, но без ограничения этим, стероиды (например, глюкокортикоиды, такие как, но без ограничения этим, метилпреднизолон, дексаметазон и бетаметазон); противовоспалительный агент, включая, но без ограничения этим, напроксен натрия, диклофенак натрия, диклофенак калия, целекоксиб, сулиндак, оксапрозин, дифлунизал, этодолак, мелоксикам, ибупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномид, сульфасалазин, соли золота, иммуноглобулин RHo-D, микофенилата мофетил, циклоспорин, азатиоприн, такролимус, базиликсимаб, даклизумаб, салициловую кислоту, ацетилсалициловую кислоту, метилсалицилат, дифлунизал, салсалат, олсалазин, сульфасалазин, ацетаминофен, индометацин, сулиндак, мефенаминовую кислоту, меклофенамат натрия, толметин, кеторолак, диклофенак, флурбипрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, пивоксикам, теноксикам, фенилбутазон, оксифенбутазон, антипирин, аминопирин, апазон, зилеутон, ауротиоглюкоза, тиомалат золота-натрия, ауранофин, метотрексат, колхицин, аллопуринол, пробенецид, сульфинпиразон и бензбромарон; аналог цАМФ, включая, но без ограничения этим, дБ-цАМФ (db-cAMP); агент, содержащий действующее вещество метилфенидат, который содержит l-треометилфенидат, d-треометилфенидат, dl-треометилфенидат, l-эритрометилфенидат, d-эритрометилфенидат, dl-эритрометилфенидат и их смеси; и диуретическое средство, такое как, но без ограничения этим, маннит, фуросемид, глицерин и мочевина.
Примеры дополнительного активного агента, который может применяться для лечения, предупреждения или контролирования нарушение сна и связанных с ним синдромов, включают, в качестве неограничивающих примеров, трициклический антидепрессант, селективный ингибитор обратного захвата серотонина, противоэпилептическое средство (габапентин, прегабалин, карбамазепин, окскарбазепин, левитирацетам, топирамат), антиаритмическое средство, блокирующее натриевый канал средство, селективный ингибитор медиатора воспаления, опиоидное средство, второе иммуномодулирующее соединение, комбинированное средство и другие известные или традиционные средства, применяемые при лечении сном. Конкретные примеры включают в себя, но без ограничения этим, нейронтин, оксиконтин, морфин, топирамат, амитриптилин, нортриптилин, карбамазепин, леводопа, L-ДОПА, кокаин, α-метилтирозин, резерпин, тетрабеназин, бензотропин, паргилин, фенодолпама мезилат, каберголин, прамипексола дигидрохлорид, ропинорол, амантадина гидрохлорид, селегилина гидрохлорид, карбидопу, перголида мезилат, синемет-СР, симметрел, ипрониазид, клоргилин, фенелзин, изокарбоксазид, толкапон, энтакапон, физостигмина салицилат, физостигмина сульфат, физостигмина бромид, меостигмина бромид, неостигмина метилсульфат, амбенония хлорид, эдрофония хлорид, такрин, пралидоксима хлорид, обидоксима хлорид, тримедоксима бромид, диацетилмоноксим, эндрофоний, пиридостигмин, демекарий, напроксен натрия, диклофенак натрия, диклофенак калия, целекоксиб, сулиндак, оксапрозин, дифлунизал, этодолак, мелоксикам, ибупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномид, сульфасалазин, соли золота, иммуноглобулин RHo-D, микофенилата мофетил, циклоспорин, азатиоприн, такролимус, базиликсимаб, даклизумаб, салициловую кислоту, ацетилсалициловую кислоту, метилсалицилат, дифлунизал, салсалат, олсалазин, сульфасалазин, ацетаминофен, индометацин, сулиндак, мефенаминовую кислоту, меклофенамат натрия, толметин, кеторолак, диклофенак, флурбипрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, пивоксикам, теноксикам, фенилбутазон, оксифенбутазон, антипирин, аминопирин, апазон, зилеутон, ауротиоглюкозу, тималат золота-натрия, ауранофин, метотрексат, колхицин, аллопуринол, пробенецид, сульфинпиразон, бензбромарон, бетаметазон и другие глюкокортикоиды, метоклопромид, домперидон, проклорперазин, прометазин, хлорпромазин, триметобензамид, ондансетрон, гранисетрон, гидроксизин, ацетиллейцина моноэтаноламин, ализаприд, азасетрон, бензхинамид, биетанаутин, бромоприд, буклизин, клебоприд, циклизин, дименгидринат, дифенидол, доласетрон, меклизин, металлатал, метопимазин, набилон, оксипендил, пипамазин, скополамин, сульпиридин, тетрагидроканнабинол, тиэтилперазин, тиопроперазин, трописетрон и их смеси.
Примеры дополнительных активных агентов, которые могут применяться для лечения, предупреждения или контролирования гемоглобинопатии и связанных с ней расстройств, включают, в качестве неограничивающих примеров, интерлейкины, такие как IL-2 (включая рекомбинантный IL-II (rIL2) и IL-2 оспы канареек (canarypox)), IL-10, IL-12 и IL-18; интерфероны, такие как интерферон альфа-2a, интерферон альфа-2b, интерферон альфа-n1, интерферон альфа-n3, интерферон бета-Ia и интерферон гамма-Ib; и Г-КСФ (G-CSF, гранулоцитарный колониестимулирующий фактор); гидроксимочевину; бутираты или производные бутирата; закись азота; ГЕМОКСИН™ (НИПРИСАН™, см. патент США № 5800819); антагонисты Gardos-канала (Ca2+-активируемый К+-канал), такие как клотримазол и триарилметановые производные; дефероксамин; белок C и переливания крови или кровезаменителя, такого как Hemospan™ или Hemospan™ PS (Sangart).
Применяемые дозы будут зависеть от скоростей всасывания, инактивации и выведения лекарственного средства, а также других факторов, известных специалистам в данной области техники. Следует отметить, что величина дозы будет также варьировать в зависимости от тяжести состояния, которое облегчается. Кроме того, следует понимать, что для любого конкретного субъекта конкретные схемы и режимы дозирования следует корректировать с течением времени в соответствии с индивидульными потребностями и профессиональным суждением осуществляющего введение или контролирующего введение композиций.
Массовое соотношение предлагаемого соединения и дополнительного активного агента зависит от эффективной дозы каждого компонента. Обычно каждый будет применяться в эффективной дозе. Таким образом, например, когда предлагаемое соединение комбинируется с агонистом PPAR (рецептор, активируемый пролифератором пероксисом) массовое соотношение предлагаемого соединения и агониста PPAR будет обычно составлять от приблизительно 1000:1 до приблизительно 1:1000 или приблизительно 200:1 - приблизительно 1:200. Комбинации предлагаемого соединения и других активных агентов обычно также будут в пределах упомянутого выше диапазона, но в каждом случае следует применять эффективную дозу каждого активного агента.
4.5. ЦИКЛИЧЕСКАЯ ТЕРАПИЯ
В некоторых примерах осуществления изобретения предлагаемые профилактические или терапевтические агенты вводятся пациенту циклически. Циклическая терапия предполагает введение активного агента в течение периода времени с последующим отдыхом в течение промежутка времени и повторения данного последовательного введения. Циклическая терапия может уменьшить развитие резистентности к одной или нескольким терапиям, позволить избежать или уменьшить побочные эффекты одной из терапий и/или улучшить эффективность лечения.
В некоторых примерах осуществления изобретения предлагаемое соединение вводится ежедневно в виде разовой или разделенной на несколько приемов дозе в течение четырех-шестинедельного цикла с периодом отдыха приблизительно неделя или две недели. Изобретение дополнительно делает возможным увеличивать частоту, число и длительность циклов дозирования. В некоторых примерах осуществления изобретения предлагаемое соединение вводится в течение больших циклов, чем обычно, когда вводится одно. В некоторых примерах осуществления изобретения предлагаемое соединение вводится в течение большего количества циклов, что могло бы обычно вызвать дозозависимую токсичность у пациента, которому дополнительный активный агент также не вводится.
В одном примере осуществления предлагаемое соединение вводится ежедневно и постоянно в течение трех или четырех недель в дозе от приблизительно 0,1 мг до приблизительно 500 мг в день с последующим перерывом в одну или две недели. В случае других примеров осуществления доза может составлять от приблизительно 1 мг до приблизительно 300 мг, от приблизительно 0,1 мг до приблизительно 150 мг, от приблизительно 1 мг до приблизительно 200 мг, от приблизительно 10 мг до приблизительно 100 мг, от приблизительно 0,1 мг до приблизительно 50 мг, от приблизительно 1 мг до приблизительно 50 мг, от приблизительно 10 мг до приблизительно 50 мг, от приблизительно 20 мг до приблизительно 30 мг или от приблизительно 1 мг до приблизительно 20 мг с последующим перерывом.
В одном примере осуществления предлагаемое соединение и дополнительный активный агент вводятся перорально, с введением предлагаемого соединения, протекающим за 30-60 минут до дополнительного активного компонента, в течение цикла четырех-шести недель. В другом примере осуществления комбинация предлагаемого соединения и дополнительного активного агента вводится путем внутривенного вливания в течение приблизительно 90 минут каждого цикла. В некоторых примерах осуществления изобретения количество циклов, в течение которых для пациента осуществляется комбинированная терапия, составляет от приблизительно одного до приблизительно 24 циклов, от приблизительно двух до приблизительно 16 циклов или от приблизительно четырех до приблизительно трех циклов.
4.6. ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ЛЕКАРСТВЕННЫЕ ФОРМЫ
Фармацевтические композиции могут применяться для получения индивидуальных дозированных лекарственных форм для однократного введения. Предлагаемые фармацевтические композиции и лекарственные формы содержат предлагаемое соединение или его фармацевтически приемлемую соль, сольват, стереоизомер или пролекарство. Предлагаемые фармацевтические композиции и лекарственные формы могут дополнительно содержать одно или несколько вспомогательных веществ.
Предлагаемые фармацевтические композиции и лекарственные формы также могут содержать один или несколько дополнительных активных агентов. Примеры необязательных дополнительных или добавочных активных агентов раскрыты в Разделе 4.4 выше.
Предлагаемые дозированные лекарственные формы для однократного введения являются подходящими для введения пациенту перорально, через слизистую (например, назальное, сублингвальное, вагинальное, буккальное или ректальное), парентерально (например, подкожное, внутривенное, болюсной инъекцией, внутримышечное или внутриартериальное), местно (например, глазные капли или другие офтальмические препараты), трансдермально или чрескожно. Примеры лекарственных форм включают, в качестве неограничивающих примеров, таблетки, каплеты, капсулы, такие как мягкие желатиновые капсулы, крахмальные облатки, лепешки, леденцы, дисперсии, суппозитории, порошки, аэрозоли (например, назальные спреи или ингаляторы), гели, жидкие лекарственные формы, подходящие для введения перорально или через слизистую пациента, включая суспензии (например, водные или неводные жидкие суспензии, эмульсии «масло-в-воде» или жидкие эмульсии «вода-в-масле»), растворы и эликсиры, жидкие лекарственные формы, подходящие для парентерального введения пациенту, глазные капли или другие офтальмические препараты, подходящие для местного введения, и стерильные твердые формы (например, кристаллические или аморфные твердые формы), которые могут быть восстановлены с получением жидких лекарственных форм, подходящих для парентерального введения пациенту.
Состав, форма и тип предлагаемых лекарственных форм будет обычно варьировать в зависимости от их применения. Например, лекарственная форма, применяемая для экстренного лечения заболевания, может иметь в своем составе большее количество одного или нескольких активных компонентов, которые она содержит, чем лекарственная форма, применяемая при длительном лечении того же самого заболевания. Аналогично, парентеральная лекарственная форма может иметь в своем составе меньшее количество одного или нескольких активных компонентов, которые она содержит, чем пероральная лекарственная форма, применяемая для лечения того же самого заболевания. Эти и другие способы, в которых конкретные лекарственные формы по данному изобретению будут отличаться одна от другой, будут легко очевидны специалистам в данной области. См., например, «Remington's Pharmaceutical Sciences», 18th ed., Mack Publishing, Easton PA (1990).
В некоторых примерах осуществления изобретения предлагаемые фармацевтические композиции и лекарственные формы содержат одно или несколько вспомогательных веществ. Подходящие вспомогательные вещества хорошо известны специалистам в области фармации и предлагаются неограничивающие примеры подходящих вспомогательных веществ. Будет ли конкретное вспомогательное вещество подходить для введения в фармацевтическую композицию или лекарственную форму зависит от разнообразных факторов, хорошо известных в области техники, включая, но не ограничиваясь этим, способ, которым лекарственная форма будет вводиться пациенту. Например, пероральные лекарственные формы, такие как таблетки, могут содержать вспомогательные вещества, не подходящие для применения в парентеральных лекарственных формах. Пригодность конкретного вспомогательного вещества может также зависеть от конкретных активных компонентов в лекарственной форме. Например, разложение некоторых активных компонентов может ускоряться некоторыми вспомогательными веществами, такими как лактоза, или при воздействии воды. Активные компоненты, которые содержат первичные или вторичные амины, в частности, подвержены такому ускоренному разложению. Соответственно, данное описание охватывает фармацевтические композиции и лекарственные формы, которые почти не содержат лактозу или другие моно- или дисахариды. Как используется, термин «свободный от лактозы» означает, что количество лактозы, которое присутствует, если это имеет место, является недостаточным для существенного повышения скорости разрушения активного компонента.
Предлагаемые свободные от лактозы композиции могут содержать вспомогательные вещества, которые хорошо известны в данной области и перечислены, например, в Фармакопее США (USP) 25-NF20 (2002). Как правило, свободные от лактозы композиции содержат активные компоненты, связующее/наполнитель и скользящее вещество в фармацевтически совместимых и фармацевтически приемлемых количествах. В некоторых примерах осуществления изобретения предлагаемые свободные от лактозы лекарственные формы содержат активные компоненты, микрокристаллическую целлюлозу, прежелатинизированный крахмал и стеарат магния.
Данное изобретение дополнительно охватывает безводные фармацевтические композиции и лекарственные формы, содержащие активные компоненты, так как вода может способствовать разрушению некоторых соединений. Например, добавление воды (например, 5%) широко распространено в фармацевтической технологии как способ имитирования длительного хранения для оценки таких характеристик, как срок годности или стабильность составов на протяжении всего времени. См., например, Jens T. Carstensen «Drug Stability: Principles & Practice», 2d. Ed., Marcel Dekker, NY, NY, 1995, pp. 379-80. На самом деле вода и нагревание ускоряют разложение некоторых соединений. Таким образом, воздействие воды на состав может иметь большое значение, так как обычно сталкиваются с влагой и/или влажностью в течение производства, обращения, фасовки, хранения, транспортировки и применения составов.
Предлагаемые безводные фармацевтические композиции и лекарственные формы могут быть получены с применением безводных или с низким содержанием влаги компонентов и в условиях с низкой влагой или низкой влажностью. В некоторых примерах осуществления изобретения фармацевтические композиции и лекарственные формы, которые содержат лактозу и по меньшей мере один активный компонент, который содержит первичный или вторичный амин, являются безводными, когда предполагается значительный контакт с влагой и/или влажностью в течение производства, фасовки и/или хранения.
Безводную фармацевтическую композицию следуют изготавливать и хранить так, чтобы поддерживать ее безводное состояние. В некоторых примерах осуществления изобретения безводные композиции упаковывают с применением материалов, известных как предотвращающие воздействие воды, так что они могут быть включены в соответствующие формулярные комплекты. Примеры подходящего упаковывания включают, в качестве неограничивающих примеров, герметично запечатанную фольгу, пластики, контейнеры с дозой для одного приема (например, флаконы), блистерные упаковки и контурные упаковки.
Изобретение дополнительно охватывает фармацевтические композиции и лекарственные формы, которые содержат одно или несколько соединений, снижающих скорость, с которой будет разлагаться активный компонент. Такие соединения, называемые «стабилизаторы», включают, в качестве неограничивающих примеров, антиоксиданты, такие как аскорбиновая кислота, pH-буферы или солевые буферы. Подобно количествам и типу вспомогательных веществ, количества и конкретные типы активных компонентов в лекарственной форме может различаться в зависимости от факторов, таких как, в качестве неограничивающих примеров, путь, которым они будут вводиться пациентам. В некоторых примерах осуществления изобретения предлагаемые лекарственные формы содержат предлагаемое соединение в количестве от приблизительно 0,10 до приблизительно 500 мг. В некоторых примерах осуществления изобретения предлагаемые лекарственные формы содержат предлагаемое соединение в количестве приблизительно 0,1, 1, 2, 5, 7,5, 10, 12,5, 15, 17,5, 20, 25, 50, 100, 150, 200, 250, 300, 350, 400, 450 или 500 мг.
В некоторых примерах осуществления изобретения лекарственные формы содержат дополнительный активный агент в количестве 1 - приблизительно 1000 мг, от приблизительно 5 до приблизительно 500 мг, от приблизительно 10 до приблизительно 350 мг или от приблизительно 50 до приблизительно 200 мг. Конечно, конкретное количество дополнительного активного агента будет зависеть от конкретного применяемого агента, типа заболевания, подвергаемого лечению или контролированию, и количества предлагаемого соединения(й) и любых необязательных дополнительных активных агентов, одновременно вводимых пациенту.
4.6.1. ПЕРОРАЛЬНЫЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ
Предлагаемые фармацевтические композиции, которые являются приемлемыми для перорального введения, могут быть представлены в виде разделенных на несколько частей лекарственных форм, таких как, но не ограничиваясь этим, таблетки (например, жевательные таблетки), каплеты, капсулы и жидкости (например, ароматизированные сиропы). Такие лекарственные формы содержат предварительно определенные количества активных компонентов и могут быть получены фармацевтическими способами, хорошо известными специалистам в данной области. См., в общих чертах, «Remington's Pharmaceutical Sciences», 18th ed., Mack Publishing, Easton PA (1990).
В некоторых примерах осуществления изобретения предлагаемые пероральные лекарственные формы получают путем объединения активных компонентов при тщательном смешивании с по меньшей мере одним вспомогательным веществом в соответствии с обычными способами составления смесей в фармацевтике. Вспомогательные вещества могут иметь большое разнообразие форм в зависимости от формы, требуемой для введения. Например, вспомогательные вещества, подходящие для применения в пероральных жидкостях или аэрозольных лекарственных формах, включают, но не ограничиваясь этим, воду, гликоли, масла, спирты, ароматизирующие вещества, консерванты и красители. Примеры вспомогательных веществ, подходящих для применения в твердых пероральных лекарственных формах (например, порошки, таблетки, капсулы и каплеты), включают, но не ограничиваясь этим, крахмалы, сахара, микрокристаллическую целлюлозу, разбавители, гранулирующие агенты, скользящие вещества, связующие и дезинтегрирующие агенты. Из-за легкости введения таблетки и капсулы представляют собой наиболее удобные пероральные лекарственные формы, в случае которых применяют твердые вспомогательные вещества. Если необходимо, таблетки могут быть покрыты с помощью стандартных с применением воды или безводных способов. Такие лекарственные формы могут быть получены любым из способов фармации. Как правило, фармацевтические композиции и лекарственные формы получают путем однородного и тщательного смешивания активных компонентов с жидкими носителями, тонко измельченными твердыми носителями, или и тем и другим, и затем формуют продукт в желаемую для выпуска форму, если необходимо.
Например, таблетка может быть получена путем прессования или формования. Прессованные таблетки могут быть получены путем прессования в подходящем устройстве активных компонентов в сыпучей форме, такой как порошок или гранулы, необязательно смешанных с вспомогательным веществом. Тритурационные таблетки могут быть получены путем формования, в подходящем устройстве, смеси измельченного в порошок соединения, смоченного инертным жидким разбавителем.
Примеры вспомогательных веществ, которые могут применяться для предлагаемых пероральных лекарственных форм, включают, в качестве неограничивающих примеров, связующие, наполнители, дезинтегрирующие агенты и скользящие вещества. Связующие, подходящие для применения в фармацевтических композициях и лекарственных формах, включают, в качестве неограничивающих примеров, кукурузный крахмал, картофельный крахмал или другие крахмалы, желатин, природные и синтетические камеди, такие как аравийская камедь, альгинат натрия, альгиновую кислоту, другие альгинаты, измельченный в порошок трагакант, гуаровую камедь, целлюлозу и ее производные (например, этилцеллюлозу, ацетат целлюлозы, кальций-карбоксиметилцеллюлозу, натрий-карбоксиметилцеллюлозу), поливинилпирролидон, метилцеллюлозу, прежелатинизированный крахмал, гидроксипропилметилцеллюлозу (например, № 2208, 2906, 2910), микрокристаллическую целлюлозу и их смеси.
Подходящие типы микрокристаллической целлюлозы включают, в качестве неограничивающих примеров, материалы, продаваемые под маркой AVICEL-PH-101, AVICEL-PH-103, AVICEL RC-581, AVICEL-PH-105 (доступные от FMC Corporation, American Viscose Division, Avicel Sales, Маркус Хук, Пенсильвания) и их смеси. Конкретным связующим является смесь микрокристаллической целлюлозы и натрий-карбоксиметилцеллюлозы, продаваемая под маркой AVICEL RC-581. Подходящие безводные или с низким содержанием влаги вспомогательные вещества или добавки включают AVICEL-PH-103™ и крахмал 1500 LM.
Примеры наполнителей, подходящих для использования в фармацевтических композициях и лекарственных формах, раскрываемых в описании, включают, в качестве неограничивающих примеров, тальк, кальция карбонат (например, гранулы или порошок), микрокристаллическую целлюлозу, измельченную в порошок целлюлозу, декстраны, каолин, маннит, кремниевую кислоту, сорбит, крахмал, прежелатинизированный крахмал и их смеси. В некоторых примерах осуществления связующее или наполнитель в предлагаемых фармацевтических композициях присутствуют в количестве от приблизительно 50 до приблизительно 99 массовых процентов фармацевтической композиции или лекарственной формы.
Дезинтегрирующие агенты используются в предлагаемых композициях для обеспечения таблеток, которые распадаются при воздействии водного окружения. Таблетки, которые содержат слишком много дезинтегрирующего агента, могут распадаться при хранении, в то время как те, которые содержат слишком мало, могут не распадаться с желаемой скоростью или в желаемых условиях. Таким образом, достаточное количество дезинтегрирующего агента, которое является либо не слишком большим, либо не слишком малым, чтобы с ущербом изменять высвобождение активных компонентов, следует использовать для формирования предлагаемых твердых пероральных лекарственных форм. Количество используемого дезинтегрирующего агента изменяется в зависимости от вида состава и очевидно любому специалисту в данной области. В некоторых примерах осуществления предлагаемые фармацевтические композиции включают от приблизительно 0,5 до приблизительно 15% масс. дезинтегрирующего агента или от приблизительно 1 до приблизительно 5% масс. дезинтегрирующего агента.
Дезинтегрирующие агенты, которые могут использоваться в предлагаемых фармацевтических композициях и лекарственных формах, включают, в качестве неограничивающих примеров, агар-агар, альгиновую кислоту, кальция карбонат, микрокристаллическую целлюлозу, кросскармеллозу натрия, кросповидон, полакрилин калия, натрий-крахмалгликолят, картофельный или тапиоковый крахмал, другие крахмалы, прежелатинизированный крахмал, другие крахмалы, глины, другие альгины, другие целлюлозы, камеди и их смеси.
Скользящие вещества, которые могут использоваться в предлагаемых фармацевтических композициях и лекарственных формах, включают, в качестве неограничивающих примеров, кальция стеарат, стеарат магния, минеральное масло, легкое минеральное масло, глицерин, сорбит, маннит, полиэтиленгликоль, другие гликоли, стеариновую кислоту, натрия лаурилсульфат, тальк, гидрогенизированное растительное масло (например, арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло), цинка стеарат, этилолеат, этиллаурат, агар и их смеси. Дополнительные скользящие вещества включают, например, силигагель силоид (AEROSIL 200, произведенный W.R. Grace Co., Балтимор, Мериленд), коагулированный аэрозоль синтетического диоксида кремния (продается Degussa Co., Пиано, Техас), CAB-O-SIL (пирогенный диоксид кремния, продукт Cabot Co., Бостон, Массачусетс) и их смеси. При использовании скользящие вещества применяются обычно в количестве менее приблизительно 1% масс. фармацевтических композиций или лекарственных форм, в которые они добавляются.
Предлагаемая пероральная твердая лекарственная форма содержит предлагаемое соединение, безводную лактозу, микрокристаллическую целлюлозу, поливинилпирролидон, стеариновую кислоту, коллоидный безводный силикагель и желатин.
4.6.2. ЛЕКАРСТВЕННЫЕ ФОРМЫ С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ
Предлагаемые активные агенты могут вводиться с помощью средств с контролируемым высвобождением или с помощью устройств для доставки, которые хорошо известны среднему специалисту в данной области. Примеры включают, в качестве неограничивающих примеров, все описанные в патентах США № 3845770, 3916899, 3536809, 3598123 и 4008719, 5674533, 5059595, 5591767, 5120548, 5073543, 5639476, 5354556 и 5733566, каждый из которых включен в настоящее описание посредством ссылки. Такие лекарственные формы могут использоваться для обеспечения медленного или контролируемого высвобождения одного или нескольких активных компонентов, используя, например, гидроксипропилметилцеллюлозу, другие полимерные матрицы, гели, проницаемые мембраны, осмотические системы, многослойные покрытия, микрочастицы, липосомы, микросферы или их комбинацию для обеспечения желаемого профиля высвобождения в различных количественных соотношениях. Подходящие составы с контролируемым высвобождением, известные среднему специалисту в данной области, включая описанные, могут быть легко отобраны для применения с предлагаемыми активными компонентами. Изобретение также охватывает дозированные лекарственные формы для однократного введения, подходящие для перорального введения, такие как, в качестве неограничивающих примеров, таблетки, капсулы, желатиновые капсулы и каплеты, которые модифицируют для контролируемого высвобождения.
Все фармацевтические продукты с контролируемым высвобождением имеют общей целью улучшение лекарственной терапии относительно того, что достигается с помощью их аналогов с неконтролируемым высвобождением. В идеальном случае, применение оптимально составленного препарата с контролируемым высвобождением в медицинском лечении отличается применением минимума лекарственного средства для излечивания или контролирования состояния за минимальный период времени. Преимущества составов с контролируемым высвобождением включают длительную активность лекарственного средства, уменьшенную частоту введения доз и повышенную степень соблюдения режима терапии пациентом. Кроме того, составы с контролируемым высвобождением могут применяться для изменения времени начала действия или других характеристик, таких как уровни лекарственного средства в крови, и могут таким образом влиять на возникновение побочных (например, неблагоприятных) эффектов.
Большинство составов с контролируемым высвобождением разрабатываются, чтобы сначала высвободить количество лекарственного средства (активного компонента), которое быстро приведет к желаемому терапевтическому эффекту, и постепенно и непрерывно высвобождать последующие количества лекарственного средства для поддержания терапевтического или профилактического эффекта на данном уровне в течение длительного периода времени. Для поддержания данного постоянного уровня лекарственного средства в организме лекарственное средство должно высвобождаться из лекарственной формы со скоростью, которая позволит восполнять количество лекарственного средства, которое метаболизировалось и экскретировалось из организма. Контролируемое высвобождение активного компонента может стимулироваться различными состояниями, включая, в качестве неограничивающих примеров, pH, температуру, ферменты, воду или другие физиологические состояния или соединения.
4.6.3. ЛЕКАРСТВЕННЫЕ ФОРМЫ ДЛЯ ПАРЕНТЕРАЛЬНОГО ВВЕДЕНИЯ
Парентеральные лекарственные формы могут вводиться пациентам различными путями, включая, в качестве неограничивающих примеров, подкожное, внутривенное (включая болюсной инъекцией), внутримышечное и внутриартериальное. Поскольку их введение обычно минует естественную защитную систему пациентов в отношении примесей, парентеральные лекарственные формы являются предпочтительно стерильными или с возможностью подвергаться стерилизации перед введением пациенту. Примеры парентеральных лекарственных форм включают, в качестве неограничивающих примеров, готовые растворы для инъекций, сухие продукты, готовые для растворения или суспендирования в фармацевтически приемлемой среде для инъекций, готовые суспензии для инъекций и эмульсии.
Подходящие среды, которые могут использоваться для получения предлагаемых парентеральных лекарственных форм, хорошо известны специалисту в данной области. Примеры включают, в качестве неограничивающих примеров, воду для инъекций (чистота в соответствии с Фармакопеей США (USP), водные среды, такие как, в качестве неограничивающих примеров, раствор для инъекций хлорида натрия, раствор Рингера для инъекций, раствор декстрозы для инъекций, раствор декстрозы и хлорида натрия для инъекций и раствор Рингера с лактатом для инъекций, смешиваемые с водой среды, такие как, в качестве неограничивающих примеров, этиловый спирт, полиэтиленгликоль и полипропиленгликоль, и неводные среды, такие как, в качестве неограничивающих примеров, кукурузное масло, хлопковое масло, арахисовое масло, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат.
В парентеральные лекарственные формы по изобретению могут также добавляться соединения, которые увеличивают растворимость одного или нескольких активных компонентов, раскрытых в настоящем описании. Например, для повышения растворимости предлагаемого иммуномодулирующего соединения и его производных может применяться циклодекстрин и его производные. См., например, патент США № 5134127, который включен в настоящее описание посредством ссылки.
4.6.4. ЛЕКАРСТВЕННЫЕ ФОРМЫ ДЛЯ МЕСТНОГО И НА СЛИЗИСТЫЕ ПРИМЕНЕНИЯ
Предлагаемые для местного применения и введения через слизистые лекарственные формы включают, в качестве неограничивающих примеров, спреи, аэрозоли, растворы, эмульсии, суспензии, глазные капли или другие офтальмические препараты или другие формы, известные специалисту в данной области. См., например, «Remington's Pharmaceutical Sciences», 16th and 18th eds., Mack Publishing, Easton PA (1980 и 1990) и «Introduction to Pharmaceutical Dosage Forms», 4th ed., Lea & Febiger, Philadelphia (1985). Лекарственные формы, подходящие для лечения слизистых тканей в полости рта, могут быть составлены в виде жидкости для полоскания полости рта или гелей для полости рта.
Подходящие вспомогательные вещества (например, носители и разбавители) и другие материалы, которые могут применяться для получения для местного применения и на слизистые лекарственных форм, охватываемые данным изобретением, будут хорошо известны специалистам в фармацевтической промышленности и зависят от конкретной ткани, для которой данная фармацевтическая композиция или лекарственная форма будет применяться. Учитывая этот факт, типичные вспомогательные вещества включают, но не ограничиваясь этим, воду, ацетон, этанол, этиленгликоль, пропиленгликоль, бутан-1,3-диол, изопропилмиристат, изопропилпальмитат, минеральное масло и их смеси для получения растворов, эмульсий или гелей, которые являются нетоксичными и фармацевтически приемлемыми. При желании могут быть добавлены увлажнители в фармацевтические композиции и лекарственные формы. Примеры таких дополнительных компонентов хорошо известны в данной области техники. См., например, «Remington's Pharmaceutical Sciences», 16th и 18th eds., Mack Publishing, Easton PA (1980 & 1990).
pH фармацевтической композиции или лекарственной формы может также регулироваться для улучшения доставки одного или нескольких активных компонентов. Аналогично, для улучшения доставки может регулироваться полярность носителя растворителя, его ионная сила или тоничность. Также в фармацевтические композиции или лекарственные формы для улучшения доставки могут быть добавлены такие соединения, как стеараты, преимущественно для изменения гидрофильности или липофильности одного или нескольких активных компонентов. В этой связи, стеараты могут служить в качестве липидной среды для лекарственного состава, в качестве эмульгирующего агента или поверхностно-активного вещества и как повышающий доставку или повышающий проникновение агент. Могут применяться различные соли, гидраты или сольваты активных компонентов для дополнительной корректировки свойств конечной композиции.
4.7. НАБОРЫ
Предлагаемые соединения могут также обеспечиваться в виде изделия промышленного производства, используя упаковочные материалы, хорошо известные специалистам в данной области техники. См., например, патенты США № 5323907, 5052558 и 5033252. Примеры упаковочных материалов в фармацевтической промышленности включают, в качестве неограничивающих примеров, блистерные упаковки, бутыли, тубы, ингаляторы, помпы, пакеты, пузырьки, контейнеры, шприцы и любые упаковочные материалы, подходящие для выбранного состава и предполагаемого типа введения или лечения.
Также предлагаются наборы, которые, когда применяются врачом-терапевтом, могут упрощать введение соответствующих количеств активных компонентов субъекту. В некоторых примерах осуществления изобретения предлагаемый набор включает контейнер и лекарственную форму предлагаемого соединения, включая его один энантиомер, смесь энантиомерной пары, один диастереомер или смесь диастереомеров или его фармацевтически приемлемую соль, сольват или пролекарство.
В некоторых примерах осуществления изобретения набор включает контейнер, содержащий лекарственную форму предлагаемого соединения, включая его один энантиомер, смесь энантиомерной пары, один диастереомер или смесь диастереомеров или его фармацевтически приемлемую соль, сольват или пролекарство, где контейнер содержит один или несколько других терапевтических агентов, описанных здесь. Предлагаемые наборы могут дополнительно содержать дополнительные активные агенты, такие как облимерсен (Genasense®), мелфалан, Г-КСФ, ГМКСФ, EPO (эритропоэтин), топотекан, дакарбазин, иринотекан, таксотер, ИФН, ингибитор ЦОГ-2, пентоксифиллин, ципрофлоксацин, дексаметазон, IL2, IL8, IL18, Ara-C, винорелбин, изотретиноин, 13-цис-ретиноевая кислота, или их фармакологически активные мутанты или производные или их комбинацию. Примеры дополнительных активных агентов включают, в качестве неограничивающих примеров, все описанные здесь.
Предлагаемые наборы могут дополнительно включать устройства, которые применяются для введения активных компонентов. Примеры таких устройств включают, в качестве неограничивающих примеров, шприцы, безыгольные инъекторы, пакеты для капельного вливания, трансдермальные системы доставки и ингаляторы. Предлагаемые наборы могут также содержать презервативы для введения активных агентов.
Предлагаемые наборы могут дополнительно содержать фармацевтически приемлемые среды, которые могут применяться для введения одного или нескольких активных компонентов. Например, если активный компонент обеспечен в твердой форме, которая должна быть разведена для парентерального введения, набор может содержать герметично закупоренный контейнер с подходящей средой, в которой активный компонент может быть растворен с образованием свободного от частиц стерильного раствора, который является приемлемым для парентерального введения. Примеры фармацевтически приемлемых сред включают, в качестве неограничивающих примеров, водные среды, включая, в качестве неограничивающих примеров, воду для инъекций (чистота в соответствии с Фармакопеей США (USP), раствор для инъекций хлорида натрия, раствор Рингера для инъекций, раствор декстрозы для инъекций, раствор декстрозы и хлорида натрия для инъекций и раствор Рингера с лактатом для инъекций; смешиваемые с водой среды, такие как, в качестве неограничивающих примеров, этиловый спирт, полиэтиленгликоль и полипропиленгликоль, и неводные среды, такие как, в качестве неограничивающих примеров, кукурузное масло, хлопковое масло, арахисовое масло, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат.
Изобретение будет более понятно из следующих ниже не ограничивающих его примеров.
5. ПРИМЕРЫ
5.1. 1-[2-(2,6-Диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-(4-пиридин-4-илметилфенил)мочевина
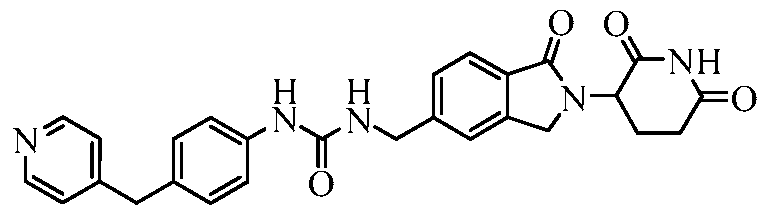
К суспензии соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона и метансульфоновой кислоты (0,18 г, 0,5 ммоль) в ДМФА (2 мл) добавляли КДИ (CDI, 1,1-карбонилдиимидазол) (81 мг, 0,5 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Добавляли к смеси 4-пиридин-4-илметилфениламин (92 мг, 0,5 ммоль) и смесь перемешивали при комнатной температуре в течение 4 ч. Затем температуру повышали до 40°C и смесь перемешивали при данной температуре в течение 8 ч. Смесь охлаждали до комнатной температуры, добавляли воду (5 мл) и перемешивали в течение 10 мин. Суспензию фильтровали и осадок промывали водой (20 мл), EtOAc (20 мл) и CH3CN (20 мл) с получением продукта в виде твердого вещества грязно-белого цвета (100 мг, выход 41%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент 5%-100% за 5 мин, CH3CN/0,1% H3PO4, 4,69 мин (94%); Тпл: 290-292°C; 1H ЯМР (ДМСО-d6) δ 1,93-2,06 (м, 1H, CHH), 2,29-2,44 (м, 1H, CHH), 2,54-2,68 (м, 1H, CHH), 2,82-3,02 (м, 1H, CHH), 3,88 (с, 2H, CH2), 4,24-4,54 (м, 4H, CH2, CH2), 5,10 (дд, J=5,0, 13,7 Гц, 1H, NCH), 6,70 (с, 1H, NH), 7,10 (д, J=8,3 Гц, 2H, Ar), 7,22 (д, J=5,3 Гц, 2H, Ar), 7,34 (д, J=8,3 Гц, 2H, Ar), 7,39-7,48 (м, 1H, Ar), 7,51 (с, 1H, Ar), 7,69 (д, J=7,7 Гц, 1H, Ar), 8,40-8,52 (м, 2H, Ar), 8,59 (с, 1H, NH), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,49, 31,20, 40,63, 42,76, 47,12, 51,56, 118,03, 121,83, 122,91, 123,99, 126,86, 129,06, 130,27, 132,08, 138,75, 142,36, 144,87, 149,42, 155,22, 163,87, 167,93, 170,98, 172,85; ЖХ-МС MH+=484; аналитически вычислено для C27H25N5O4 + 1,5 H2O: C, 63,52; H, 5,53; N, 13,72; S, 6,55; найдено: C, 63,68; H, 5,24; N, 13,79.
5.2. 1-[2-(2,6-Диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-(4-гидроксиметилфенил)мочевина
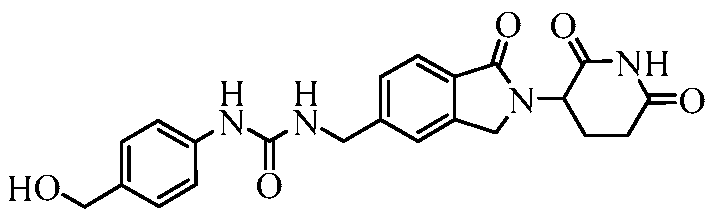
К суспензии соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона и метансульфоновой кислоты (0,18 г, 0,5 ммоль) в ДМФА (2 мл) добавляли КДИ (81 мг, 0,5 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Добавляли к смеси 4-аминобензиловый спирт (62 мг, 0,5 ммоль) и смесь перемешивали при комнатной температуре в течение 4 ч. Затем температуру повышали до 40°C и смесь перемешивали при данной температуре в течение 8 ч. Смесь охлаждали до комнатной температуры, добавляли воду (5 мл) и перемешивали в течение 10 мин. Суспензию фильтровали и осадок промывали водой (20 мл), EtOAc (20 мл) и CH3CN (20 мл) с получением твердого вещества красноватого цвета (100 мг, выход 41%). Осадок очищали на ISCO колонке с силикагелем, используя метанол и ДХМ в качестве элюента, с получением продукта в виде твердого вещества белого цвета (30 мг, выход 15%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент 5%-100% за 5 мин, CH3CN/0,1% H3PO4, 4,99 мин (97%); Тпл: 309-311°C; 1H ЯМР (ДМСО-d6) δ 1,92-2,10 (м, 1H, CHH), 2,20-2,47 (м, 1H, CHH), 2,54-2,69 (м, 1H, CHH), 2,80-3,07 (м, 1H, CHH), 4,19-4,54 (м, 6H, CH2, CH2, CH2), 4,94-5,05 (м, 1H, OH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CHN), 6,70 (т, J=6,0 Гц, 1H, NH), 7,16 (д, J=8,7 Гц, 2H, Ar), 7,28-7,40 (м, 2H, Ar), 7,39-7,48 (м, 1H, Ar), 7,52 (с, 1H, Ar), 7,69 (д, J=7,7 Гц, 1H, Ar), 8,57 (с, 1H, NH), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,49, 31,18, 42,77, 47,12, 51,56, 62,67, 117,49, 121,89, 122,93, 126,91, 127,05, 130,29, 135,22, 138,99, 142,38, 144,88, 155,25, 167,95, 170,99, 172,85; ЖХ-МС MH+=423; аналитически вычислено для C22H22N4O5+0,4 H2O: C, 61,50; H, 5,35; N, 13,04; найдено: C, 61,21; H, 5,05; N, 12,80.
5.3. 1-[2-(2,6-Диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-[3-(2-метил-2H-пиразол-3-ил)фенил]мочевина
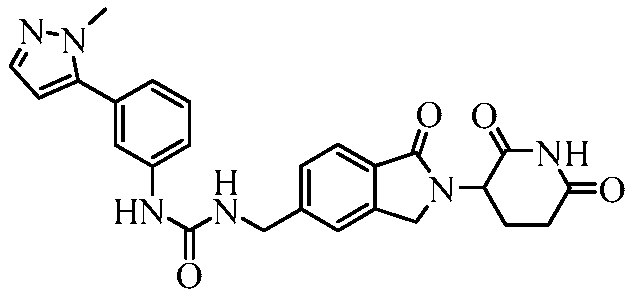
К смеси 5-(3-изоцианатофенил)-1-метил-1H-пиразола (0,22 г, 1,1 ммоль) и соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона и метансульфоновой кислоты (0,40 г, 1,1 ммоль) в ацетонитриле (5 мл) добавляли ТЭА (0,31 мл, 2,2 ммоль) при комнатной температуре и смесь выдерживали в течение 22 ч. К смеси добавляли воду (25 мл) и смесь перемешивали при комнатной температуре в течение 3 ч. Суспензию фильтровали и осадок промывали водой (20 мл), EtOAc (20 мл) и водой (20 мл) с получением осадка. Осадок очищали с помощью препаративной ВЭЖХ с получением продукта в виде твердого вещества белого цвета (122 мг, 24% выход). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CΗ3CN/0,1% H3PO4, 3,34 мин (99,8%); Тпл: 260-262°C; 1H ЯМР (ДМСО-d6) δ 1,88-2,10 (м, 1H, CHH), 2,27-2,47 (м, 1H, CHH), 2,55-2,66 (м, 1H, CHH), 2,80-3,02 (м, 1H, CHH), 3,84 (с, 3H, CH3), 4,30 (д, J=17,6 Гц, 1H, CHH), 4,40-4,50 (м, 3H, CHH, CH2), 5,11 (дд, J=5,2, 13,3 Гц, 1H, NCH), 6,35 (д, J=1,9 Гц, 1H, Ar), 6,83 (т, J=6,1 Гц, 1H, NH), 7,06 (дт, J=1,4, 7,6 Гц, 1H, Ar), 7,31-7,38 (м, 1H, Ar), 7,40-7,48 (м, 3H, Ar), 7,53 (д, J=0,4 Гц, 1H, Ar), 7,63 (т, J=1,9 Гц, 1H, Ar), 7,70 (д, J=7,9 Гц, 1H, Ar), 8,82 (с, 1H, NH), 10,98 (ушир.с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,48, 31,19, 37,45, 42,78, 47,11, 51,55, 105,55, 117,62 (2 углерода методом HMQC), 121,18, 121,87, 122,93, 126,87, 129,08, 130,29, 130,51, 137,86, 140,73, 142,38, 142,82, 144,76, 155,21, 167,94, 170,98, 172,84; ЖХ-МС MH+=473; аналитически вычислено для C25H24N6O4: C, 63,55; H, 5,12; N, 17,79; найдено: C, 63,36; H, 5,17; N, 17,72.
5.4. 1-[2-(2,6-Диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-[3-(2-метилимидазол-1-ил)фенил]мочевина; муравьиная кислота
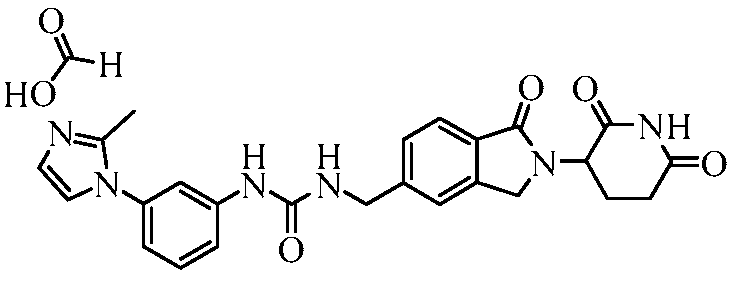
Смесь соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона и метансульфоновой кислоты (0,40 г, 1,1 ммоль) и КДИ (0,19 г, 1,2 ммоль) в ДМФА (5 мл) перемешивали при комнатной температуре в течение 18 ч. К смеси добавляли 3-(2-метилимидазол-1-ил)фениламин (0,19 г, 1,1 ммоль) при комнатной температуре и смесь перемешивали при 60°C в течение 24 ч. К смеси добавляли воду (25 мл) и простой эфир (20 мл). Смесь перемешивали при комнатной температуре в течение 2 ч. Суспензию фильтровали и осадок промывали водой (20 мл), этилацетатом (20 мл) и водой (20 мл) с получением осадка. Осадок очищали с помощью препаративной ВЭЖХ с получением продукта в виде твердого вещества белого цвета (100 мг, выход 20%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент 5%-95% за 5 мин, CH3CN/0,1% H3PO4, 4,48 мин (96,8%); Тпл: 218-220°C; 1H ЯМР (ДМСО-d6) δ 1,89-2,12 (м, 1H, CHH), 2,25-2,29 (м, 3H, CH3), 2,30-2,46 (м, 1H, CHH), 2,54-2,68 (м, 1H, CHH), 2,78-3,04 (м, 1H, CHH), 4,31 (д, J=17,4 Гц, 1H, CHH), 4,38-4,53 (м, 3H, CHH, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 6,89 (д, J=1,3 Гц, 1H, Ar), 6,92-7,05 (м, 2H, Ar, NH), 7,23 (д, J=1,3 Гц, 1H, Ar), 7,32-7,40 (м, 2H, Ar), 7,41-7,49 (м, 1H, Ar), 7,52 (с, 1H, Ar), 7,57-7,65 (м, 1H, Ar), 7,69 (д, J=7,9 Гц, 1H, Ar), 8,18 (с, 1H, HCOOH), 9,03 (с, 1H, NH), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 13,60, 22,49, 31,20, 42,77, 47,12, 51,58, 114,22, 116,89, 117,61, 120,68, 121,88, 122,93, 126,89, 127,13, 129,63, 130,30, 137,90, 141,50, 142,38, 143,43, 144,69, 155,16, 163,44, 167,93, 170,98, 172,85; ЖХ-МС MH+=473; аналитически вычислено для C25H24N6O4 + HCOOH + 1,5 H2O: C, 57,24; H, 5,36; N, 15,40; найдено: C, 57,43; H, 5,11; N, 15,57.
5.5. 1-[2-(2,6-Диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-[4-(4-метил-4H-[1,2,4]триазол-3-ил)фенил]мочевина
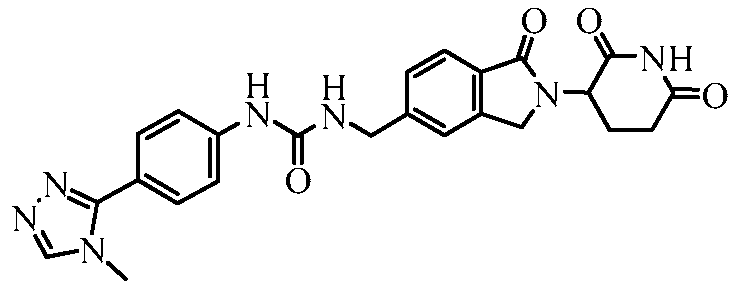
К перемешиваемой суспензии 4-(4-метил-4H-[1,2,4]триазол-3-ил)фениламина (0,31 г, 1,77 ммоль) в ДМФА (10 мл) при 40°C добавляли КДИ (0,32 г, 1,94 ммоль). Смесь перемешивали в течение 15 мин, затем добавляли соль 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона и метансульфоновой кислоты (0,65 г, 1,77 ммоль). Нагревание прекращали через 1,5 ч и смесь перемешивали при комнатной температуре в течение ночи. Растворитель упаривали и остаток очищали с помощью препаративной ВЭЖХ с получением продукта в виде твердого вещества белого цвета (0,13 г, выход 15%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 14/86 CH3CN/0,1% H3PO4, 4,70 мин (93,9%); Тпл: 248-250°C; 1H ЯМР (ДМСО-d6) δ 1,93-2,06 (м, 1H, CHH), 2,29-2,46 (м, 1H, CHH), 2,55-2,70 (м, 1H, CHH), 2,82-3,02 (м, 1H, CHH), 3,72 (с, 3H, CH3), 4,24-4,55 (м, 4H, CH2, CH2), 5,11 (дд, J=4,9, 13,2 Гц, 1H, NCH), 6,95 (т, J=5,7 Гц, 1H, NH), 7,41-7,81 (м, 7H, ArH), 8,51 (с, 1H, ArH), 9,02 (с, 1H, NH), 10,99 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,49, 31,20, 31,94, 42,79, 47,13, 51,58, 117,50, 119,49, 121,88, 122,94, 126,91, 128,80, 130,32, 141,84, 142,39, 144,72, 145,76, 153,08, 155,12, 167,95, 170,99, 172,85; ЖХ-МС MH+=474; аналитически вычислено для C24H23N7O4: C, 60,88; H, 4,90; N, 20,71, найдено: C, 58,28; H, 4,67; N, 19,49. (Примечание: данный анализ был неудачен и ВЭЖХ и 1H ЯМР показали 6% примеси).
5.6. 1-[2-(2,6-Диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-[3-(2-метилтиазол-4-ил)фенил]мочевина
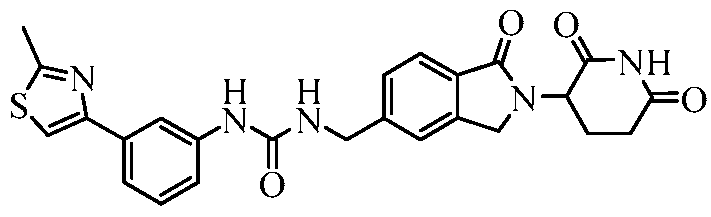
К смеси 4-(3-изоцианатофенил)-2-метилтиазола (0,25 г, 1,2 ммоль) и соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона и метансульфоновой кислоты (0,43 г, 1,2 ммоль) в ацетонитриле (5 мл) добавляли ТЭА (0,33 мл, 2,3 ммоль) при комнатной температуре и смесь выдерживали в течение 3 ч. Воду (25 мл) добавляли к смеси и смесь перемешивали при комнатной температуре в течение 3 ч. Суспензию фильтровали и осадок промывали водой (20 мл), этилацетатом (20 мл) и водой (20 мл) с получением осадка. Осадок очищали с помощью препаративной ВЭЖХ с получением продукта в виде твердого вещества белого цвета (160 мг, 28% выход). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 5,93 мин (99,4%); Тпл: 252-254°C; 1H ЯМР (ДМСО-d6) δ 1,92-2,06 (м, 1H, CHH), 2,27-2,47 (м, 1H, CHH), 2,54-2,66 (м, 1H, CHH), 2,71 (с, 3H, CH3), 2,81-3,01 (м, 1H, CHH), 4,31 (д, J=17,6 Гц, 1H, CHH), 4,38-4,53 (м, 3H, CHH, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 6,74 (т, J=6,0 Гц, 1H, NH), 7,20-7,32 (м, 1H, Ar), 7,40 (ддд, J=1,1, 2,3, 8,1 Гц, 1H, Ar), 7,46 (дкв, J=1,4, 7,6 Гц, 2H, Ar), 7,53 (с, 1H, Ar), 7,70 (д, J=7,9 Гц, 1H, Ar), 7,81 (с, 1H, Ar), 8,02 (т, J=1,9 Гц, 1H, Ar), 8,79 (с, 1H, NH), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 18,91, 22,51, 31,18, 42,79, 47,12, 51,56, 113,55, 115,55, 117,28, 118,86, 121,86, 122,94, 126,89, 129,01, 130,29, 134,58, 140,82, 142,39, 144,90, 153,89, 155,21, 165,29, 167,95, 170,99, 172,85; ЖХ-МС MH+=490; аналитически вычислено для C25H23N5O4S: C, 61,34; H, 4,74; N, 14,31; S, 6,55; найдено: C, 61,09; H, 4,60; N, 14,19; С, 6,49.
5.7. 1-[2-(2,6-Диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-[3-(1-метил-1H-пиразол-3-ил)фенил]мочевина
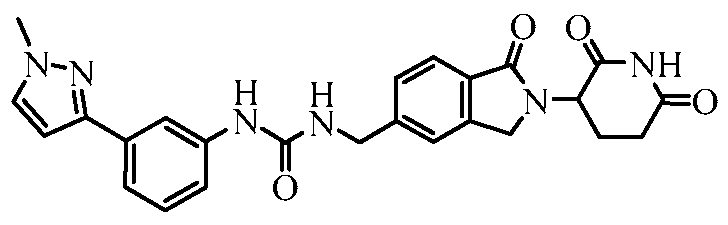
К перемешиваемой суспензии 3-(3-изоцианатофенил)-1-метил-1H-пиразола (0,25 г, 1,25 ммоль) и соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона и метансульфоновой кислоты (0,46 г, 1,25 ммоль) в ацетонитриле (5 мл) при комнатной температуре добавляли ТЭА (0,35 мл, 2,51 ммоль). Смесь перемешивали в течение 4 ч с последующим добавлением 1н. HCl (10 мл), которую перемешивали в течение 10 мин. Смесь очищали препаративной ВЭЖХ с получением продукта в виде твердого вещества грязно-белого цвета (0,22 г, выход 38%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 25/75 CΗ3CN/0,1% H3PO4, 5,99 мин (99,9%); Тпл: 232-234°C; 1H ЯМР (ДМСО-d6) δ 1,93-2,07 (м, 1H, CHH), 2,29-2,46 (м, 1H, CHH), 2,55-2,68 (м, 1H, CHH), 2,82-3,01 (м, 1H, CHH), 3,87 (с, 3Н, СН3), 4,24-4,55 (м, 4H, CH2, CH2), 5,11 (дд, J=5,0, 13,3 Гц, 1H, NCH), 6,57 (д, J=2,3 Гц, 1H, ArH), 6,73 (т, J=5,9 Гц, 1H, NH), 7,18-7,37 (м, 3H, ArH), 7,46 (д, J=7,9 Гц, 1H, ArH), 7,53 (с, 1H, ArH), 7,65-7,77 (м, 2H, ArH), 7,89 (с, 1H, ArH), 8,71 (с, 1H, NH), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,51, 31,18, 38,60, 42,79, 47,13, 51,58, 102,33, 114,31, 116,77, 118,16, 121,86, 122,93, 126,89, 128,85, 130,29, 132,17, 133,85, 140,66, 142,39, 144,91, 150,03, 155,22, 167,95, 170,99, 172,85; ЖХ-МС MH+=473; аналитически вычислено для C25H24N6O4 + 0,5 H2O: C, 62,36; H, 5,23; N, 17,45, найдено: C, 62,06; H, 5,19; N, 17,28.
5.8. 1-((2-(2,6-Диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(3-(морфолинометил)фенил)мочевина формиат
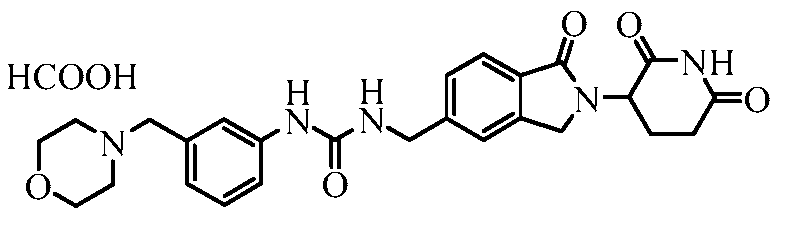
К перемешиваемой смеси 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона гидрохлорида (0,37 г, 1,00 ммоль) и 4-(3-изоцианатобензил)морфолина (0,22 г, 1,00 ммоль) в ацетонитриле (10 мл) добавляли ТЭА (0,28 мл, 2,00 ммоль) при комнатной температуре в атмосфере азота. Через 2 ч добавляли дополнительно 4-(3-изоцианатобензил)морфолин (0,22 г, 1,00 ммоль) и ТЭА (0,28 мл, 2,00 ммоль). Через 12 ч нежелательный осадок отфильтровывали и фильтрат концентрировали. Остаток растворяли в ацетонитриле и очищали препаративной ВЭЖХ (градиент: CH3CN + 0,1% муравьиной кислоты/H2O + 0,1% муравьиной кислоты: 10/90 в течение 5 мин, до 100/0 в течение 10 мин, 100/0 в течение 5 мин). После упаривания растворителя остаток растирали в простом эфире (20 мл) в течение 1 ч. Продукт затем выделяли путем фильтрования и сушили в вакууме с получением продукта в виде твердого вещества бежевого цвета (0,16 г, выход 30%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент: CH3CN/0,1% H3PO4: 10/90-90/10 в течение 10 мин, 90/10 (5 мин): 4,64 мин (95,84%); Тпл: 198-200°C; 1H ЯМР (ДМСО-d6) δ 1,83-2,12 (м, 1H, CHH), 2,21-2,47 (м, 5H, CHH, CH2, CH2), 2,54-2,69 (м, J=11,0 Гц, 1H, CHH), 2,79-3,03 (м, 1H, CHH), 3,38 (с, 2H, CH2), 3,52-3,72 (м, 4H, CH2, CH2), 4,31 (д, J=17,2 Гц, 1H, CHH), 4,37-4,55 (м, 3H, CHH, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 6,83 (д, J=7,6 Гц, 1H, Ar), 6,99 (т, J=5,6 Гц, 1H, NH), 7,15 (т, J=7,7 Гц, 1H, Ar), 7,32 (д, J=8,3 Гц, 1H, Ar), 7,39 (с, 1H, Ar), 7,44 (д, J=7,7 Гц, 1H, Ar), 7,52 (с, 1H, Ar), 7,69 (д, J=7,7 Гц, 1H, Ar), 8,29 (ушир.с, 1H, HCOO), 8,90 (с, 1H, NH), 10,98 (ушир.с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,51, 31,20, 42,73, 47,12, 51,56, 53,20, 62,69, 66,17, 116,42, 118,13, 121,72, 121,83, 122,90, 126,86, 128,34, 130,25, 138,24, 140,48, 142,36, 144,99, 155,31, 164,30, 167,95, 170,98, 172,85; ЖХ-МС: MH+=492; аналитически вычислено для C27H31N5O7 + 3 H2O: C, 54,82; H, 6,30; N, 11,84; найдено: C, 55,12; H, 6,12; N, 11,72.
5.9. 1-((2-(2,6-Диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(4-метил-3-нитрофенил)мочевина
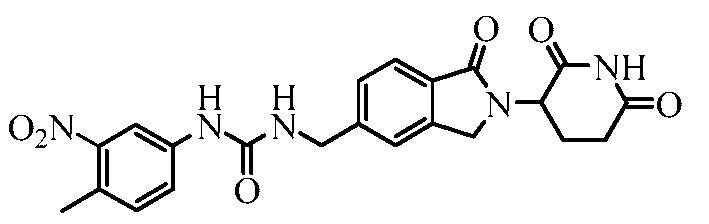
К перемешиваемой смеси 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона гидрохлорида (1,00 г, 2,70 ммоль) и 4-метил-3-нитрофенилизоцианата (0,48 мл, 2,70 ммоль) в ацетонитриле (20 мл) добавляли ТЭА (0,75 мл, 5,40 ммоль) при комнатной температуре в атмосфере азота. Через 2 ч добавляли 1н. HCl (20 мл) и осадок отделяли фильтрованием и промывали водой (3×20 мл). Сырой продукт растирали в EtOAc (50 мл) в течение 12 ч. Продукт отделяли фильтрованием и сушили в вакууме с получением продукта в виде твердого вещества желтого цвета (0,74 г, выход 61%): ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент: CH3CN/0,1% H3PO4: 10/90-90/10 за 10 мин, 90/10 (5 мин): 7,94 мин (96,79%); Тпл: 230-232°C; 1H ЯМР (ДМСО-d6) δ 1,87-2,08 (м, 1H, CHH), 2,26-2,48 (м, 3H, CHH, CH3), 2,60 (д, J=17,6 Гц, 1H, CHH), 2,79-3,07 (м, 1H, CHH), 4,31 (д, J=17,4 Гц, 1H, CHH), 4,38-4,55 (м, 3H, CHH, CH2), 5,11 (дд, J=5,0, 13,3 Гц, 1H, CH), 6,92 (т, J=5,9 Гц, 1H, NH), 7,34 (д, J=8,3 Гц, 1H, Ar), 7,45 (д, J=7,9 Гц, 1H, Ar), 7,49-7,60 (м, 2H, Ar), 7,70 (д, J=7,7 Гц, 1H, Ar), 8,26 (д, J=2,3 Гц, 1H, Ar), 9,07 (с, 1H, NH), 10,99 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 18,95, 22,49, 31,20, 42,82, 47,12, 51,56, 112,74, 121,92, 122,45, 122,94, 124,71, 126,92, 130,33, 132,84, 139,46, 142,38, 144,59, 148,72, 155,02, 167,93, 170,98, 172,85; ЖХ-МС: MH+=452; аналитически вычислено для C22H21N4O6: C, 58,53; H, 4,69; N, 15,51; найдено: C, 58,23; H, 4,58; N, 15,34.
5.10. 1-(3-Амино-4-метилфенил)-3-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)мочевина
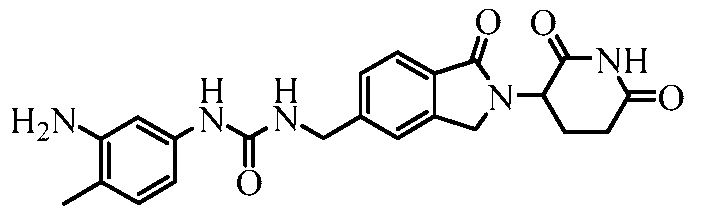
К раствору 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(4-метил-3-нитрофенил)мочевины (0,30 г, 0,66 ммоль) в ДМФА (50 мл) добавляли Pd-C (0,10 г, 10% по массе). Реакционную смесь гидрировали в шейкере Парра при 379 кПа (55 psi). Через 16 ч смесь отфильтровывали через слой целита, который промывали дополнительно ДМФА (20 мл). Затем фильтрат упаривали и остаток перемешивали в воде (100 мл) в течение 3 ч. Осадок отфильтровывали, промывали дополнительно водой (50 мл) и высушивали. Сырой зеленый продукт растворяли в ДМФА (100 мл), добавляли уголь для обесцвечивания и реакционную смесь перемешивали в течение 3 ч. Смесь затем фильтровали через слой целита, который промывали дополнительно ДМФА (50 мл). Затем фильтрат упаривали и остаток перемешивали в воде (100 мл) в течение 4 ч. осадок отфильтровывали, промывали дополнительно водой (50 мл) и сушили в вакууме. Осадок растирали в простом эфире в течение 1 ч и продукт отделяли фильтрованием с получением продукта в виде твердого вещества бледно-зеленого цвета (0,22 г, выход 79%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент: CH3CN/0,1% H3PO4: 10/90-90/10 за 10 мин, 90/10 (5 мин): 4,50 мин (96,74%); Тпл: 228-230°C; 1H ЯМР (ДМСО-d6) δ 1,82-2,10 (м, 4H, CHH, CH3), 2,25-2,47 (м, 1H, CHH), 2,59 (д, J=18,3 Гц, 1H, CHH), 2,77-3,02 (м, 1H, CHH), 4,30 (д, J=17,6 Гц, 1H, CHH), 4,35-4,53 (м, 3H, CH2, CHH), 4,93 (ушир.с, 2H, NH2), 5,11 (дд, J=5,0, 12,9 Гц, 1H, CH), 6,51 (дд, J=1,9, 7,9 Гц, 1H, Ar), 6,58 (т, J=5,7 Гц, 1H, NH), 6,75 (д, J=8,5 Гц, 2H, Ar), 7,43 (д, J=7,9 Гц, 1H, Ar), 7,50 (с, 1H, Ar), 7,69 (д, J=7,7 Гц, 1H, Ar), 8,23 (с, 1H, NH), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 16,75, 22,49, 31,20, 42,74, 47,10, 51,56, 104,16, 106,57, 114,59, 121,86, 122,90, 126,89, 129,79, 130,25, 138,75, 142,36, 145,06, 146,12, 155,22, 167,95, 170,98, 172,85; ЖХ-МС: MH+=422; аналитически вычислено для C22H23N5O4 + 0,1 H2O + 0,5 Et2O: C, 62,62; H, 6,17; N, 15,21; найдено: C, 62,30; H, 5,89; N, 14,89.
5.11. 1-[2-(2,6-Диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-(3-феноксифенил)мочевина
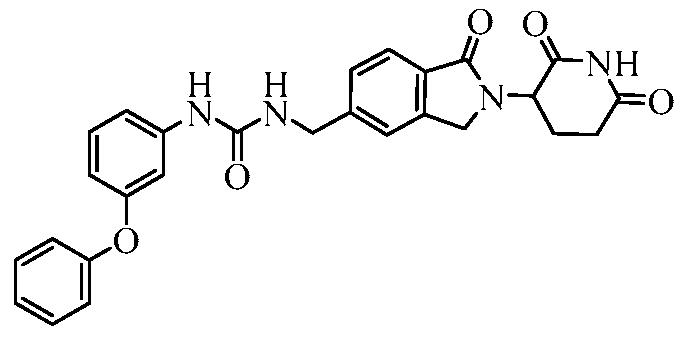
К перемешиваемой смеси 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона метансульфоната (0,37 г, 1,00 ммоль) и 1-изоцианато-3-феноксибензола (0,212 г, 1,00 ммоль) в ацетонитриле (10 мл) в атмосфере азота при комнатной температуре добавляли TEA (0,20 г, 2,00 ммоль). Через 3 ч добавляли 1н. HCl (10 мл) и смесь перемешивали в течение 10 мин. Осадок отделяли фильтрованием и промывали водой (20 мл) и ацетонитрилом (10 мл). Сырой продукт растворяли в минимальном количестве ДМФА и продукт осаждали путем медленного добавления воды (~30 мл). Осадок собирали фильтрованием, промывали Et2O и сушили в вакууме в течение 18 ч с получением продукта в виде твердого вещества белого цвета (422 мг, 87%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 35/65, CH3CN/0,1% H3PO4, 3,76 мин (99,3%); Тпл: 224-226°C; 1H ЯМР (ДМСО-d6) δ 1,99 (с, 4H, CH, CH3), 2,29-2,46 (м, 1H, CH), 2,55-2,66 (м, 1H, CH), 2,80-3,01 (м, 1H, CH), 4,18-4,56 (м, 4H, CH2, CH2), 5,10 (дд, J=4,9, 13,2 Гц, 1H, CH), 6,71 (т, J=5,9 Гц, 1H, NH), 7,23-7,36 (м, 1H, Ar), 7,36-7,48 (м, 2H, Ar), 7,51 (с, 1H, Ar), 7,69 (д, J=7,7 Гц, 1H, Ar), 8,55 (с, 1H, NH), 9,75 (с, 1H, NH), 10,67-11,27 (м, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,49, 23,82, 31,18, 42,77, 47,12, 51,56, 118,12, 119,57, 121,85, 122,91, 126,88, 130,26, 133,18, 135,70, 142,36, 144,94, 155,29, 167,67, 167,95, 170,98, 172,85; ЖХ-МС: MH+=485; аналитически вычислено для C27H24N4O5: C, 66,93; H, 4,99; N, 11,56, найдено: C, 67,03; H, 4,72; N, 11,41.
5.12. 1-((2-(2,6-Диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(4-нитрофенил)мочевина
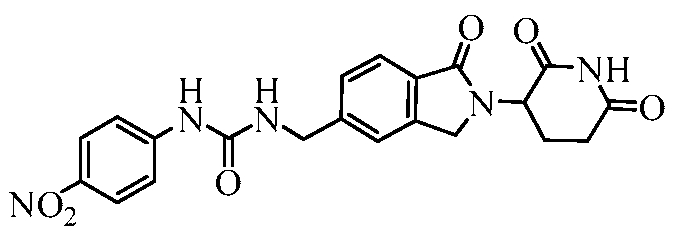
К перемешиваемой смеси 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона метансульфоната (0,37 г, 1,0 ммоль) и 1-изоцианато-4-нитробензола (164 мг, 1,0 ммоль) в ацетонитриле (10 мл) в атмосфере азота добавляли TEA (0,20 г, 2,0 ммоль). Смесь перемешивали при комнатной температуре в течение 3 ч, в течение которых она оставалась суспензией. Добавляли 1н. HCl раствор (10 мл) и смесь перемешивали в течение 10 мин. Осадок отделяли фильтрованием и промывали дополнительно водой (20 мл) и ацетонитрилом (10 мл). Осадок растворяли в минимальном количестве ДМФА и продукт осаждали путем медленного добавления воды (~30 мл). Осадок собирали фильтрованием и промывали Et2O для удаления большей части оставшейся желтизны. Полученный осадок высушивали в вакуумном сушильном шкафу в течение ночи для получения продукта в виде твердого вещества грязно-белого цвета (330 мг, 75%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70, CH3CN/0,1% H3PO4, 6,15 мин (97,1%); Тпл: 272-274°C; 1H ЯМР (ДМСО-d6) δ 1,84-2,13 (м, 1H, CHH), 2,24-2,44 (м, 1H, CHH), 2,55-2,66 (м, 1H, CHH), 2,77-3,02 (м, 1H, CHH), 4,16-4,55 (м, 4H, CH2, CH2), 5,11 (дд, J=4,7, 13,0 Гц, 1H, CH), 7,07 (т, J=5,6 Гц, 1H, NH), 7,37-7,83 (м, 5H, Ar), 8,15 (д, J=8,9 Гц, 2H, Ar), 9,48 (с, 1H, NH), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,48, 31,17, 42,83, 47,11, 51,57, 116,97, 121,94, 122,96, 125,09, 126,93, 130,38, 140,48, 142,41, 144,26, 147,04, 154,51, 167,91, 170,98, 172,85; ЖХ-МС: MH+=438; аналитически вычислено для C21H19N5O6 + 0,5 H2O: C, 56,50; H, 4,52; N, 15,69; найдено: C, 56,45; H, 4,31; N, 15,71.
5.13. N-(4-{3-[2-(2,6-Диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]уреидо}фенил)ацетамид
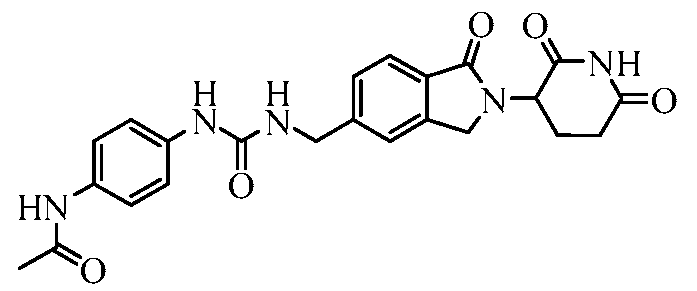
Стадия 1: Получение 1-(4-аминофенил)-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевины. К перемешиваемой смеси 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(4-нитрофенил)мочевины (150 мг, 0,343 ммоль) в EtOH (2 мл) добавляли натрия дитионит (597 мг, 3,43 ммоль) в воде (2 мл). Полученную смесь нагревали до 60°C в течение 20 мин, по завершении которых ЖХ-МС показало полное исчезновение исходного нитросоединения. Реакционную смесь смешивали с сырым продуктом из отдельной реакции и концентрировали в вакууме. Остаток растворяли в минимальном количестве ДМФА и хроматографировали на колонке C-18 для препаративной ВЭЖХ, снабженной масс-управляемым коллектором фракций. Нужные фракции объединяли и концентрировали в вакууме с получением 1-(4-аминофенил)-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевина в виде твердого вещества бледно-желтого цвета (90 мг, 40% суммарный средний выход из двух отдельных реакций). Тпл: >400°C; ЖХ-МС: MH+=408.
Стадия 2: Получение N-(4-{3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]уреидо}фенил)ацетамида. 1-(4-Аминофенил)-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевину (64 мг, 0,157 ммоль) перемешивали при комнатной температуре в уксусном ангидриде (5 мл) в течение 2 ч. Летучие вещества удаляли в вакууме, остаток растворяли в минимальном количестве ДМФА и очищали на колонке C-18 для препаративной ВЭЖХ. Нужные фракции объединяли и концентрировали в вакууме с получением продукта в виде твердого вещества бледно-желтого цвета (37 мг, выход 52%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 17/83, CΗ3CN/0,1% H3PO4, 5,19 мин (97,4%); Тпл: 265-267°C; 1H ЯМР (ДМСО-d6) δ 1,99 (с, 4H, CH, CH3), 2,29-2,46 (м, 1H, CH), 2,55-2,66 (м, 1H, CH), 2,80-3,01 (м, 1H, CH), 4,18-4,56 (м, 4H, CH2, CH2), 5,10 (дд, J=4,9, 13,2 Гц, 1H, CH), 6,71 (т, J=5,9 Гц, 1H, NH), 7,23-7,36 (м, 1H, Ar), 7,36-7,48 (м, 2H, Ar), 7,51 (с, 1H, Ar), 7,69 (д, J=7,7 Гц, 1H, Ar), 8,55 (с, 1H, NH), 9,75 (с, 1H, NH), 10,67-11,27 (м, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,49, 23,82, 31,18, 42,77, 47,12, 51,56, 118,12, 119,57, 121,85, 122,91, 126,88, 130,26, 133,18, 135,70, 142,36, 144,94, 155,29, 167,67, 167,95, 170,98, 172,85; ЖХ-МС: MH+=450; аналитически вычислено для C23H23N5O5 + 1,0 H2O: C, 59,09; H, 5,39; N, 14,98; найдено: C, 58,75; H, 4,99; N, 14,59.
5.14. 3-[2-(2,6-Диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-1-метил-1-фенилмочевина
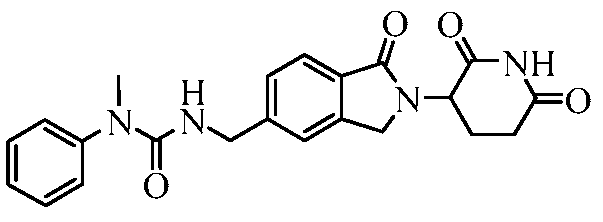
К суспензии соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой (0,18 г, 0,5 ммоль) в CH3CN (10 мл) добавляли ДИПЭА (DIPEA) (0,4 мл, 2,5 ммоль) и хлорангидрид N-метилфенилкарбаминовой кислоты (178 мг, 1,05 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Суспензию фильтровали и осадок промывали водой (20 мл), этилацетатом (20 мл) и CH3CN (20 мл) с получением продукта в виде твердого вещества белого цвета (200 мг, выход 47%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 3,56 мин (96%); Тпл: 168-170°C; 1H ЯМР (ДМСО-d6) δ 1,89-2,07 (м, 1H, CHH), 2,30-2,47 (м, 1H, CHH), 2,55-2,69 (м, 1H, CHH), 2,79-3,01 (м, 1H, CHH), 3,18 (с, 3H, CH3), 4,22-4,58 (м, 4H, CH2, CH2), 5,11 (дд, J=5,0, 13,3 Гц, 1H, NCH), 6,68 (т, J=5,9 Гц, 1H, NH), 7,16-7,35 (м, 3H, Ar), 7,36-7,44 (м, 3H, Ar), 7,46 (с, 1H, Ar), 7,66 (д, J=7,7 Гц, 1H, Ar), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,51, 31,21, 37,14, 43,76, 47,10, 51,55, 121,85, 122,71, 125,78, 126,54, 126,86, 129,23, 130,04, 142,19, 144,02, 145,41, 156,74, 168,02, 171,02, 172,86; ЖХ-МС MH+=407; аналитически вычислено для C22H22N4O4 + 0,5 H2O: C, 63,60; H, 5,58; N, 13,49; C, 6,55; найдено: C, 63,61; H, 5,51; N.
5.15 1-Бифенил-4-ил-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевина
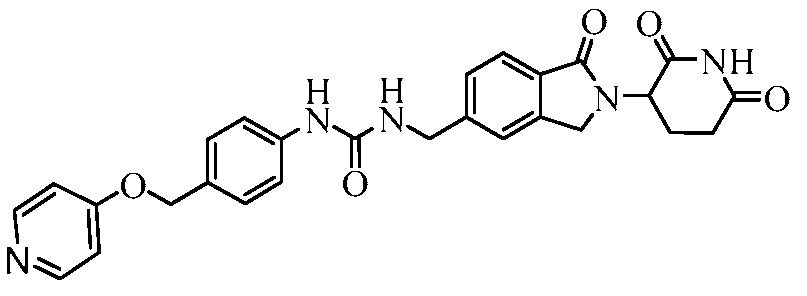
К суспензии соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой (0,37 г, 1 ммоль) в ДМФА (2 мл) добавляли КДИ (162 мг, 1 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Добавляли к смеси 4-фениланилин (169 мг, 1 ммоль) и смесь перемешивали при комнатной температуре в течение 4 ч. Затем температуру повышали до 40°C и смесь перемешивали при данной температуре в течение 8 ч. Смесь охлаждали до комнатной температуры. Суспензию фильтровали, к фильтрату добавляли CH3CN (5 мл) и полученную суспензию фильтровали. Собранный осадок перекристаллизовывали из ДМФА с получением продукта в виде твердого вещества белого цвета (30 мг, выход 15%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 50/50 CH3CN/0,1% H3PO4, 2,78 мин (95%); 1H ЯМР (ДМСО-d6) δ 2,02 (ушир.с, 1H, CHH), 2,28-2,47 (м, 1H, CHH), 2,60 (д, J=18,5 Гц, 1H, CHH), 2,82-3,04 (м, 1H, CHH), 4,23-4,59 (м, 4H, CH2, CH2), 5,11 (дд, J=4,9, 13,2 Гц, 1H, NCH), 6,73-6,83 (м, 1H, NH), 7,22-7,35 (м, 1H, Ar), 7,37-7,66 (м, 10H, Ar), 7,70 (д, J=7,9 Гц, 1H, Ar), 8,75 (с, 1H, NH), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,51, 31,20, 42,80, 47,13, 51,58, 118,09, 121,89, 122,94, 125,99, 126,64, 126,85, 128,82, 130,30, 132,86, 139,93, 142,40, 144,81, 155,18, 167,95, 170,99, 172,85; ЖХ-МС MH+=423.
5.16 1-[2-(2,6-Диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-[3-(3-метил-[1,2,4]оксадиазол-5-ил)фенил]мочевина
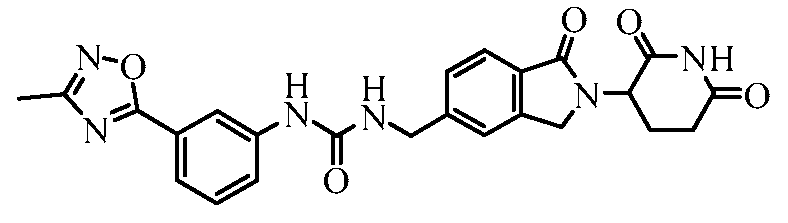
К перемешиваемой суспензии 3-(3-метил-[1,2,4]оксадиазол-5-ил)фениламина (0,22 г, 1,09 ммоль) и соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой (0,40 г, 1,09 ммоль) в ацетонитриле (5 мл) при комнатной температуре добавляли ТЭА (0,31 мл, 2,19 ммоль). Смесь перемешивали в течение 3 ч с последующим добавлением 1н. HCl (10 мл), которую перемешивали в течение 10 мин. Смесь очищали препаративной ВЭЖХ с получением продукта в виде твердого вещества белого цвета (0,10 г, выход 19%). ВЭЖХ, Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 4,37 мин (99,3%); Тпл: 242-244°C; 1H ЯМР (ДМСО-d6) δ 1,92-2,07 (м, 1H, CHH), 2,30-2,46 (м, 4H, CH3, CHH), 2,55-2,67 (м, 1H, CHH), 2,82-3,02 (м, 1H, CHH), 4,24-4,56 (м, 4H, CH2, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 6,91 (т, J=5,8 Гц, 1H, NH), 7,39-7,80 (м, 6H, ArH), 8,37 (с, 1H, ArH), 9,05 (с, 1H, NH), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 11,25, 22,49, 31,20, 42,83, 47,12, 51,58, 116,37, 120,24, 121,93, 121,96, 122,94, 123,77, 126,94, 129,90, 130,33, 141,41, 142,39, 144,68, 155,10, 167,61, 167,93, 170,99, 172,85, 174,86, ЖХ-МС MH=475; аналитически вычислено для C24H22N6O5 + 0,4 H2O: C, 59,85; H, 4,77; N, 17,45; найдено: C, 59,53; H, 4,68; N, 17,30.
5.17. 1-(3-Аминофенил)-3-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)мочевина
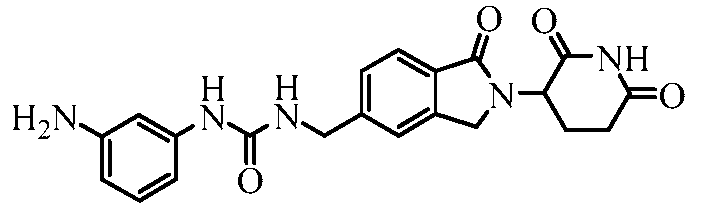
Стадия 1: К перемешиваемой смеси 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-дион гидрохлорида (0,74 г, 2,00 ммоль) и 3-нитрофенилизоцианата (0,33 г, 2,00 ммоль) в ацетонитриле (20 мл) добавляли ТЭА (0,56 мл, 4,00 ммоль) при комнатной температуре в атмосфере азота. Через 12 ч осадок отфильтровывали и очищали препаративной ВЭЖХ (градиент: CH3CN/H2O: 15/85 в течение 5 мин, до 100/0 в течение 10 мин, 100/0 в течение 5 мин). После упаривания растворителя остаток растирали в простом эфире (20 мл) в течение 1 ч. Продукт затем выделяли путем фильтрования и сушили в вакууме с получением 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(3-нитрофенил)мочевины в виде твердого вещества желтого цвета (0,34 г, выход 39%).
Стадия 2: К раствору 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(3-нитрофенил)мочевины (0,33 г, 0,80 ммоль) в ДМФА (80 мл) добавляли Pd-C (0,10 г, <10% по массе). Реакционную смесь гидрировали в шейкере Парра при 379 кПа (55 psi). После 12 ч смесь отфильтровывали через слой целита, который промывали дополнительно ДМФА (50 мл). Затем фильтрат упаривали и остаток перемешивали в воде (150 мл) в течение 3 ч. Осадок отфильтровывали, промывали дополнительно водой (50 мл) и высушивали. Сырой продукт растворяли в ДМФА (50 мл), добавляли уголь для обесцвечивания и реакционную смесь перемешивали в течение 12 ч. Смесь затем фильтровали через слой целита, который промывали дополнительно ДМФА (50 мл). Затем фильтрат упаривали и остаток перемешивали в воде (100 мл) в течение 3 ч. Осадок отфильтровывали, промывали дополнительно водой (50 мл) и сушили в вакууме с получением продукта в виде твердого вещества бледно-желтого цвета (0,24 г, выход 77%). ВЭЖХ: X-Terra RP 18, 3,9×150 мм, 5 мкм, 1 мл/мин, 240 нм, CH3CN/0,1% (HCO2)NH4: 15/85, 7,95 мин (95,27%); Тпл: 233-235°C; 1H ЯМР (ДМСО-d6) δ 1,78-2,08 (м, 1H, CHH), 2,38 (квд, J=4,5, 13,2 Гц, 1H, CHH), 2,59 (д, J=17,8 Гц, 1H, CHH), 2,79-3,06 (м, 1H, CHH), 4,18-4,36 (м, 1H, CHH), 4,36-4,60 (м, 3H, CHH, CH2), 4,91-5,36 (м, 3H, NH2, CH), 6,15 (ддд, J=0,9, 2,1, 7,9 Гц, 1H, Ar), 6,48-6,58 (м, 1H, Ar), 6,63 (т, J=6,0 Гц, 1H, NH), 6,76 (т, J=2,0 Гц, 1H, Ar), 6,85 (т, J=7,9 Гц, 1H, Ar), 7,44 (д, J=7,7 Гц, 1H, Ar), 7,51 (с, 1H, Ar), 7,69 (д, J=7,9 Гц, 1H, Ar), 8,32 (с, 1H, NH), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,51, 31,20, 42,73, 47,12, 51,58, 103,78, 106,20, 107,79, 121,86, 122,91, 126,89, 128,89, 130,26, 140,92, 142,38, 144,99, 148,44, 155,16, 167,95, 170,99, 172,85; ЖХ-МС: MH+=408; аналитически вычислено для C21H21N5O4: C, 61,91, H, 5,20, N, 17,19; найдено: C, 62,40, H, 5,67, N, 15,59.
5.18. 1-[2-(2,6-Диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-[3-(пиридин-2-илокси)фенил]мочевина
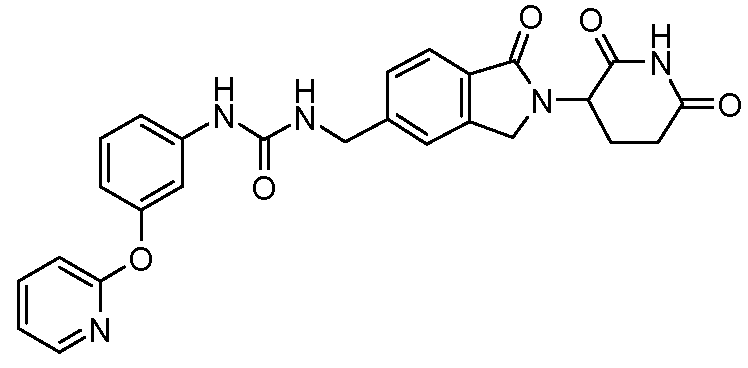
3-(5-Аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-дион метансульфонат (1,11 г, 3,0 ммоль) и 1,1'-карбонилдиимидазол (535 мг, 3,3 ммоль) суспендировали в сухом ДМФА (20 мл) и смесь перемешивали при комнатной температуре в течение 24 ч. Пока перемешивали, часть реакционной смеси (6,7 мл, ~1 ммоль) переносили в пробирку, содержащую 3-(пиридин-2-илокси)фениламин (205 мг, 1,1 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи и протекание реакции контролировали с помощью ЖХ-МС. Через 48 ч дополнительный 3-(пиридин-2-илокси)фениламин (37 мг, 0,2 ммоль) переносили в реакционную смесь и продолжали перемешивание в течение еще 24 ч. Реакционную смесь подкисляли с помощью кислоты и воды. Летучие вещества удаляли в вакууме, остаток растворяли в ДМФА и очищали, используя C-18 для препаративной ВЭЖХ, с получением 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-[3-(пиридин-2-илокси)фенил]мочевины в виде твердого вещества белого цвета (310 мг, выход 64%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 4,81 мин (98,6%); Тпл: 298-300°C; 1H ЯМР (ДМСО-d6) δ 1,84-2,06 (м, 1H, CHH), 2,19-2,44 (м, 1H, CHH), 2,54-2,68 (м, 1H, CHH), 2,79-3,05 (м, 1H, CHH), 4,08-4,60 (м, 4H, CH2, CH2), 5,10 (дд, J=5,1, 13,2 Гц, 1H, CH), 6,64 (дд, J=1,4, 8,0 Гц, 1H, Ar), 6,81 (т, J=5,9 Гц, 1H, NH), 6,99 (д, J=8,3 Гц, 1H, Ar), 7,07-7,18 (м, 2H, Ar), 7,24 (т, J=8,1 Гц, 1H, Ar), 7,33 (т, J=2,1 Гц, 1H, Ar), 7,43 (д, J=7,7 Гц, 1H, Ar), 7,50 (с, 1H, Ar), 7,68 (д, J=7,7 Гц, 1H, Ar), 7,78-7,97 (м, 1H, Ar), 8,16 (дд, J=1,5, 4,9 Гц, 1H, Ar), 8,82 (с, 1H, NH), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,49, 31,18, 42,73, 47,12, 51,56, 110,23, 111,51, 113,54, 113,68, 118,99, 121,85, 122,93, 126,86, 129,56, 130,29, 140,10, 141,79, 142,39, 144,77, 147,52, 154,37, 155,09, 163,03, 167,93, 170,99, 172,85; ЖХ-МС: MH=486; аналитически вычислено для C26H23N5O5 + 0,3 H2O: C, 63,61; H, 4,85; N, 14,27, найдено: C, 63,62; H, 4,62; N, 14,18.
5.19. 1-((2-(2,6-Диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(3-(пиперидин-4-илокси)фенил)мочевина
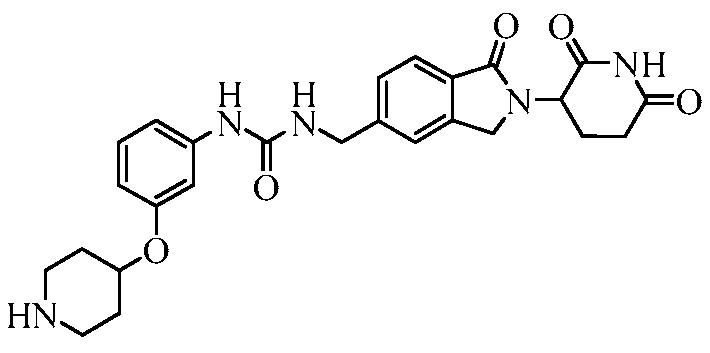
Используя методику, описанную в разделе 5.15, продукт получали из 3-(пиперидин-4-илокси)анилина и соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой.
5.20. 1-((2-(2,6-Диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(3-гидрокси-4-метилфенил)мочевина
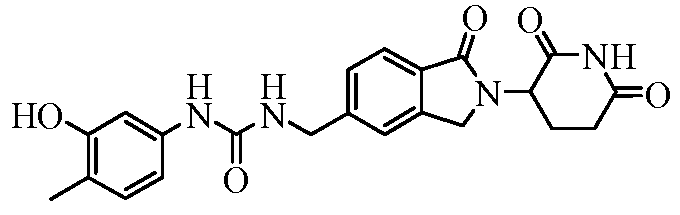
Стадия 1: Используя методику, описанную в разделе 5.15, 1-(3-(трет-бутилдиметилсилилокси)-4-метилфенил)-3-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)мочевина получали из 3-(трет-бутилдиметилсилилокси)-4-метиланилина и соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой.
Стадия 2: Смесь 1-(3-(трет-бутилдиметилсилилокси)-4-метилфенил)-3-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)мочевины (0,54 г, 1,0 ммоль) и фторида цезия (0,15 г, 1,0 ммоль) в ДМФА (10 мл) нагревали до 70°C в течение 8 ч. Смесь охлаждали и разбавляли водой (10 мл). Твердый осадок отфильтровывали, промывали водой (10 мл) и высушивали в вакууме с получением продукта.
5.21. 5-(3-((2-(2,6-Диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)уреидо)-2-метилфенил-2-аминоацетата гидрохлорид
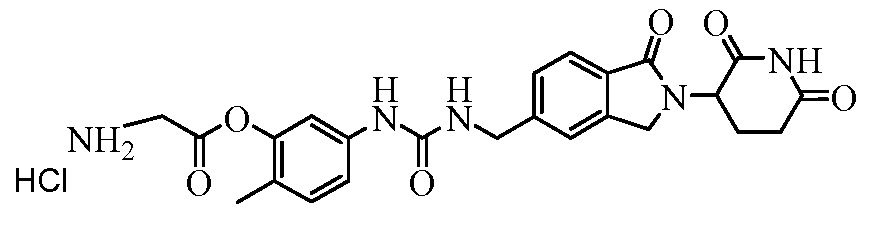
Стадия 1: Используя методику, описанную в разделе 5.15, 5-(3-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)уреидо)-2-метилфенил-2-(трет-бутоксикарбониламино)ацетат получали из 5-амино-2-метилфенил-2-(трет-бутоксикарбониламино)ацетата и соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой.
Стадия 2: К смеси 5-(3-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)уреидо)-2-метилфенил-2-(трет-бутоксикарбониламино)ацетата (0,58 г, 1,0 ммоль) в ДХМ (50 мл) добавляли 2M HCl в диэтиловом эфире (1 мл) и смесь перемешивали в течение 24 ч. Твердый осадок отфильтровывали, промывали ДХМ (10 мл) и высушивали в вакууме с получением продукта.
5.22. 5-(3-((2-(2,6-Диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)уреидо)-2-метилфенил-2-(пиперазин-1-ил)ацетата гидрохлорид
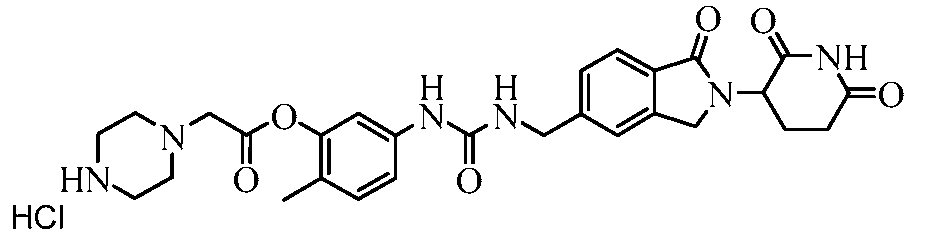
Стадия 1: Используя методику, описанную в разделе 5.15, трет-бутил-4-(2-(5-(3-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)уреидо)-2-метилфенокси)-2-оксоэтил)пиперазин-1-карбоксилат получали из трет-бутил-4-(2-(5-амино-2-метилфенокси)-2-оксоэтил)пиперазин-1-карбоксилата и соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой.
Стадия 2: К смеси трет-бутил-4-(2-(5-(3-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)уреидо)-2-метилфенокси)-2-оксоэтил)пиперазин-1-карбоксилата (0,65 г, 1,0 ммоль) в метиленхлориде (50 мл) добавляли 2M HCl в простом эфире (1 мл) и смесь перемешивали в течение 24 ч. Твердый осадок отфильтровывали, промывали ДХМ (10 мл) и высушивали в вакууме с получением продукта.
5.23. 1-(3-(Аминометил)-4-метилфенил)-3-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)мочевина
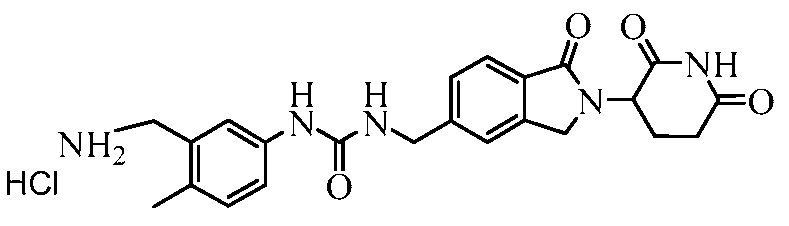
Стадия 1: Используя методику, описанную в разделе 5.15, 1-(3-циано-4-метилфенил)-3-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)мочевину получали из 5-амино-2-метилбензонитрила и соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой.
Стадия 2: Смесь 1-(3-циано-4-метилфенил)-3-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)мочевины (0,54 г, 1,0 ммоль), оксида платины (0,1 г) и 5-6M HCl в изопропаноле (2 мл) в уксусной кислоте (15 мл) гидрировали при давлении водорода 345 кПа (50 psi) в течение 48 ч. Смесь фильтровали через целит, фильтрат упаривали в вакууме и остаток очищали препаративной ВЭЖХ с получением продукта.
5.24. 1-(2-(Аминометил)-5-метилфенил)-3-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)мочевина
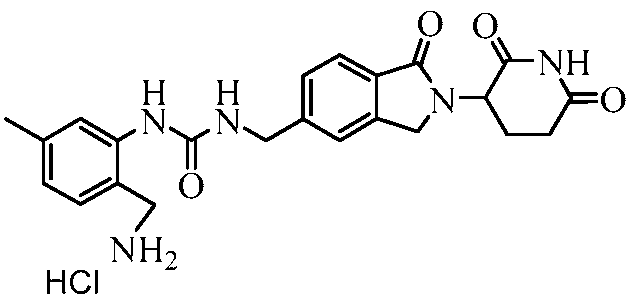
Стадия 1: Используя методику, описанную в разделе 5.15, 1-(2-циано-5-метилфенил)-3-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)мочевину получали из 2-амино-4-метилбензонитрила и соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой.
Стадия 2: Смесь 1-(2-циано-5-метилфенил)-3-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)мочевины (0,54 г, 1,0 ммоль), оксида платины (0,1 г) и 5-6M HCl в изопропаноле (2 мл) в уксусной кислоте (15 мл) гидрировали при давлении водорода 345 кПа (50 psi) в течение 48 ч. Смесь фильтровали через целит, фильтрат упаривали в вакууме и остаток очищали препаративной ВЭЖХ с получением продукта.
5.25 1-((2-(2,6-Диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(4-(морфолинометил)фенил)мочевина
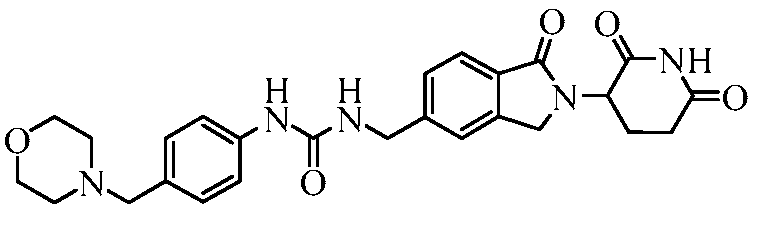
Используя методику, описанную в разделе 5.15, продукт получали из 4-(морфолинометил)анилина и соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой.
5.26. 1-((2-(2,6-Диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(3-((4-метилпиперазин-1-ил)метил)фенил)мочевина
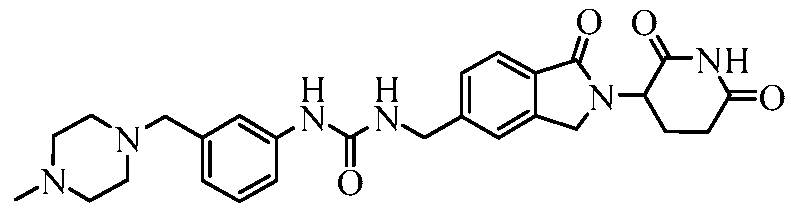
Используя методику, описанную в разделе 5.15, продукт получали из 3-((4-метилпиперазин-1-ил)метил)анилина и соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой.
5.27. Изоиндолиновые соединения
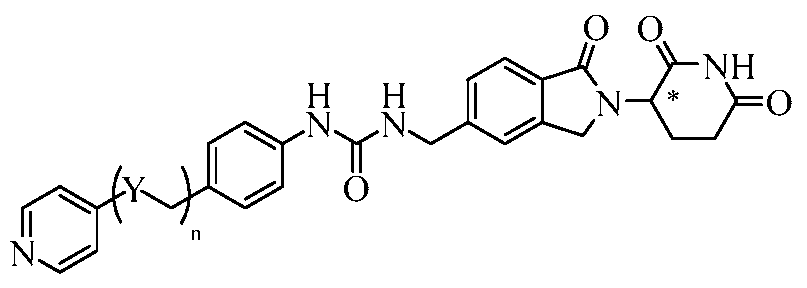
Изоиндолиновые соединения, представленные выше, получали, используя методику, описанную в разделе 5.15.
5.28. Соль 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-[4-(2-пиридин-4-ил-этил)фенил]мочевины с хлористоводородной кислотой
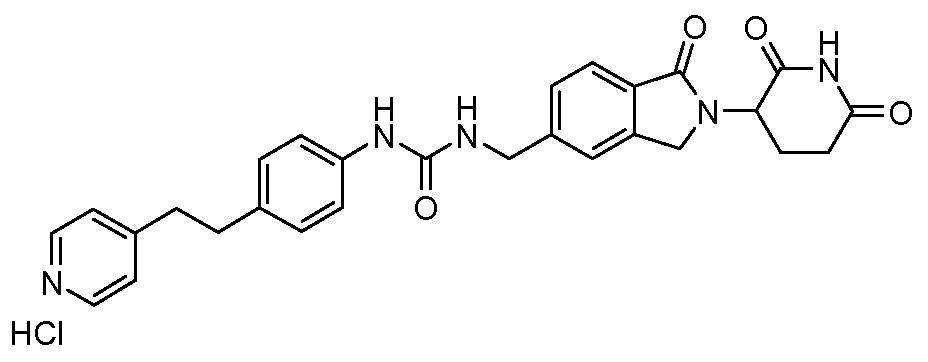
Стадия 1: Получение 4-[2-(4-нитрофенил)винил]пиридина
К CH3CN раствору 1-йод-4-нитробензола (498 мг, 2 ммоль) и 4-винилпиридина (262 мг, 2,5 ммоль) добавляли ТЭА (350 мкл, 2,5 ммоль) и Pd(OAc)2 (0,45 мг, 0,2 ммоль). Смесь нагревали до 100°C в течение 48 ч в закрытой пробирке из стекла пирекс. Затем охлаждали до комнатной температуры, гасили 1н. HCl (20 мл) и концентрировали при пониженном давлении. Смесь фильтровали и осадок переносили в EtOAc (30 мл) и промывали 1н. NaOH (30 мл). Органический слой концентрировали, высушивали над Na2SO4 и концентрировали с получением 4-[2-(4-нитрофенил)винил]пиридина в виде твердого вещества желтого цвета (160 мг, 37%).
Стадия 2: Получение 4-(2-пиридин-4-илэтил)фениламина
К EtOAc раствору (30 мл) 4-[2-(4-нитрофенил)винил]пиридина (160 мг, 0,71 ммоль) добавляли палладий-на-угле (0,1 г, 50% смоченный). Суспензию гидрировали при давлении водорода 345 кПа (50 psi) в течение 2 часов. Смесь фильтровали через слой целита. Фильтрат концентрировали с получением 4-(2-пиридин-4-илэтил)фениламина в виде твердого вещества желтого цвета (140 мг, 100%).
Стадия 3: Получение соли 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-[4-(2-пиридин-4-илэтил)фенил]мочевины с хлористоводородной кислотой
К суспензии соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой (0,37 г, 1 ммоль) в ДМФА (2 мл) добавляли карбонилдиимидазол (162 мг, 1 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. 4-Пиридин-4-илэтилфениламин (140 мг, 0,7 ммоль) добавляли к смеси и смесь перемешивали при 40°C в течение ночи, затем при 80°C в течение 1,5 часов. Смесь охлаждали до комнатной температуры, добавляли воду (5 мл) и перемешивали в течение 10 мин. Суспензию фильтровали, фильтрат концентрировали и очищали препаративной ВЭЖХ. Полученное после очистки твердое вещество перемешивали с 1н. HCl, фильтровали и фильтрат концентрировали с получением соли 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-[4-(2-пиридин-4-илэтил)фенил]мочевины с хлористоводородной кислотой в виде твердого вещества грязно-белого цвета (30 мг, 8% выход). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент 5% - 95% в течение 5 мин, CH3CN/0,1% H3PO4,: tR=4,70 мин (92%); Тпл: >400°C; 1H ЯМР (ДМСО-d6) δ 1,89-2,06 (м, 1H, CHH), 2,37 (ушир.с, 1H, CHH), 2,55-2,67 (м, 1H, CHH), 2,82-3,01 (м, 3H, CH2, CHH), 3,12 (д, J=7,7 Гц, 2H, CH2), 4,20-4,53 (м, 5H, CH2, CH2), 5,11 (дд, J=4,8, 13,3 Гц, 1H, NCH), 6,89 (ушир.с, 1H, NH), 7,07 (д, J=8,3 Гц, 2H, Ar), 7,32 (д, J=8,3 Гц, 2H, Ar), 7,44 (д, J=7,9 Гц, 1H, Ar), 7,51 (с, 1H, Ar), 7,69 (д, J=7,7 Гц, 1H, Ar), 7,83 (д, J=5,5 Гц, 2H, Ar), 8,71-8,78 (м, 2H, Ar), 8,80 (с, 1H, NH), 10,98 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 22,44, 31,13, 34,25, 36,52, 42,64, 47,05, 51,49, 117,59, 121,78, 122,84, 126,56, 126,78, 128,49, 130,19, 132,39, 138,59, 142,12, 142,28, 144,86, 155,24, 167,86, 170,91, 172,78; ЖХ-МС MH=498; аналитически вычислено для C28H27N5O4 + 1,55 HCl + 0,75 H2O + 0,15 CH3CN C, 56,78; H, 5,29; N, 11,64; Cl, 8,87; найдено: C, 56,47; H, 5,15; N, 11,99; Cl, 8,85.
5.29. Изоиндолиновые соединения
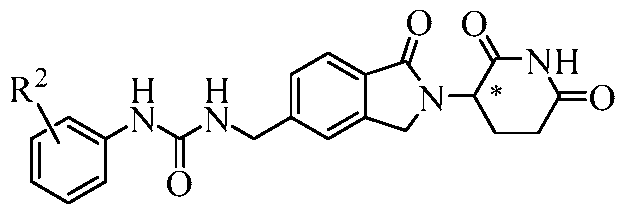
Данные изоиндолиновые соединения, представленные выше, получали, используя методику, описанную в разделе 5.15.
5.30. N''-(3-Хлор-4-метилфенил-N'-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-N-цианогуанидин
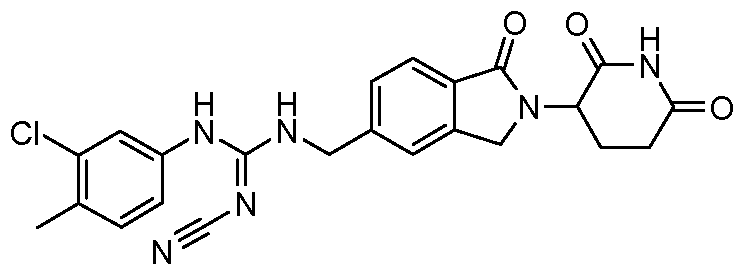
Стадия 1: Получение фенилового эфира (3-хлор-4-метилфенил)карбаминовой кислоты
Растворяли 2-хлор-4-аминотолуол (282 мг, 2 ммоль) в ТГФ (10 мл). К смеси добавляли гидрид натрия (128 мг, 3,2 ммоль) и перемешивали при комнатной температуре в течение 15 минут. Добавляли дифенил(N-циано)имидокарбонат (715 мг, 3,0 ммоль) и смесь нагревали до кипения в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры, гасили насыщенным раствором NH4Cl (10 мл), фильтровали и осадок высушивали в сушильном шкафу с получением фенилового эфира (3-хлор-4-метилфенил)карбаминовой кислоты в виде твердого вещества (0,5 г, 87%).
Стадия 2: Получение N''-(3-хлор-4-метилфенил)-N'-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-N-цианогуанидина
К суспензии соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой (0,18 г, 0,5 ммоль) в ДМФА (2 мл) добавляли фениловый эфир (3-хлор-4-метилфенил)карбаминовой кислоты (143 мг, 0,5 ммоль) и ДИПЭА (83 мкл, 0,5 ммоль). Смесь перемешивали при 100°C в течение 4 часов. Смесь концентрировали при пониженном давлении для удаления ДМФА, очищали на колонке с силикагелем, используя в качестве элюента метанол и метиленхлорид, с получением N''-(3-хлор-4-метилфенил)-N'-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-N-цианогуанидина в виде твердого вещества белого цвета (40 мг, выход 17%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 50/50, CH3CN/0,1% H3PO4,: tR=3,06 мин (96,5%); Тпл: 325-327°C; 1H ЯМР (ДМСО-d6) δ 1,93-2,09 (м, 1H, CHH), 2,25-2,32 (м, 3H, CH3), 2,33-2,45 (м, 1H, CHH), 2,55-2,67 (м, 1H, CHH), 2,82-3,01 (м, 1H, CHH), 4,27-4,57 (м, 4H, CH2, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 7,13 (дд, J=2,3, 8,1 Гц, 1H, Ar), 7,32 (д, J=1,5 Гц, 2H, Ar), 7,43 (д, J=7,7 Гц, 1H, Ar), 7,51 (с, 1H, Ar), 7,71 (д, J=7,7 Гц, 1H, Ar), 7,85 (с, 1H, NH), 9,20 (с, 1H, NH), 10,99 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 18,98, 22,49, 31,20, 44,70, 47,15, 51,58, 116,88, 121,98, 122,94, 124,33, 126,97, 130,52, 131,41, 132,08, 133,10, 136,46, 142,36, 142,97, 158,15, 167,86, 170,98, 172,86; ЖХ-МС: 465; аналитически вычислено для C23H21ClN6O3 + 0,6 H2O + 0,2 EtOAc: C, 57,94; H, 4,86; N, 17,03; найдено: C, 57,66; H, 4,81; N, 17,10.
5.31. 1-[2-(2,6-Диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-[4-(1Н-имидазол-2-ил)фенил]мочевина
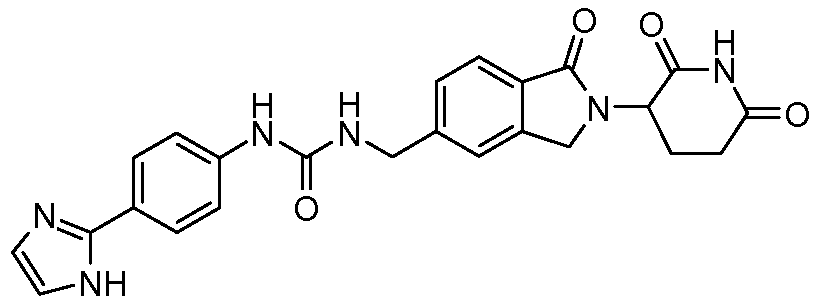
Смесь соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой (0,40 г, 1,1 ммоль) и КДИ (0,19 г, 1,2 ммоль) в ДМФА (5 мл) перемешивали при комнатной температуре в течение 18 часов. К смеси добавляли 4-(1Н-имидазол-2-ил)фениламин (0,17 г, 1,1 ммоль) при комнатной температуре и смесь перемешивали при 60°C в течение 1 дня. К смеси добавляли воду (25 мл) и этилацетат (20 мл). Смесь перемешивали при комнатной температуре в течение 2 ч. Суспензию фильтровали и осадок промывали водой (20 мл), этилацетатом (20 мл) и водой (20 мл) с получением осадка. Осадок очищали с помощью препаративной ВЭЖХ с получением 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-[4-(1Н-имидазол-2-ил)фенил]мочевины в виде твердого вещества белого цвета (150 мг, выход 30%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент 5/95-95/5 в течение 5 мин, CH3CN/0,1% H3PO4, 4,41 мин (95,9%); Тпл: 190-192°C; 1H ЯМР (ДМСО-d6) δ 1,91-2,08 (м, 1H, CHH), 2,27-2,47 (м, 1H, CHH), 2,54-2,66 (м, 1H, CHH), 2,81-3,01 (м, 1H, CHH), 4,31 (д, J=17,4 Гц, 1H, CHH), 4,38-4,52 (м, 3H, CHH, CH2), 5,11 (дд, J=5,0, 13,3 Гц, 1H, NCH), 6,78 (т, J=6,0 Гц, 1H, NH), 7,33-7,76 (м, 9H, Ar), 8,17 (с, 1H, HCOOH), 8,67 (с, 1H, NH), 10,99 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,41, 31,10, 42,69, 47,02, 51,49, 114,17 (ушир.), 117,80, 121,79, 122,84, 124,55, 126,81, 126,98, 130,19, 135,46, 138,55, 142,31, 144,83, 155,14, 163,19 (HCOOH), 167,88, 170,92, 172,77; ЖХ-МС MH=459; аналитически вычислено для C24H22N6O4 + 2 H2O + 0,7 HCOOH + 0,3 DMF: C, 56,04; H, 5,42; N, 16,08; найдено: C, 55,84; H, 5,34; N, 16,11.
5.32. 1-[3-(1Н-Бензимидазол-2-ил)-4-хлорфенил]-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевина
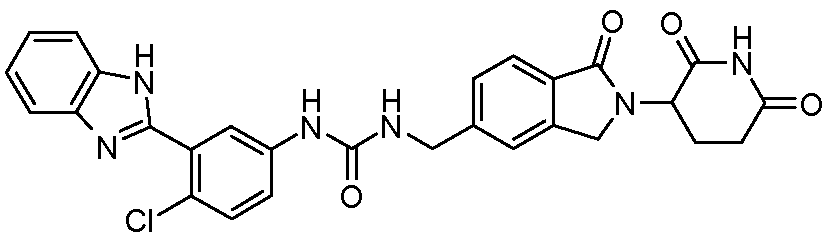
Смесь соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой (0,40 г, 1,1 ммоль) и КДИ (0,21 г, 1,3 ммоль) в ДМФА (5 мл) перемешивали при комнатной температуре в течение 18 ч. К смеси добавляли 3-(1Н-бензимидазол-2-ил)-4-хлорфениламин (0,32 г, 1,3 ммоль) при комнатной температуре и смесь перемешивали при 100°C в течение 18 часов. К смеси добавляли воду (25 мл) и простой эфир (20 мл). Смесь перемешивали при комнатной температуре в течение 2 часов. Растворитель декантировали. Осадок очищали с помощью препаративной ВЭЖХ с получением 1-[3-(1Н-бензимидазол-2-ил)-4-хлорфенил]-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевины в виде твердого вещества белого цвета (130 мг, выход 22%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% H3PO4, 4,44 мин (99,2%); Тпл: 275-277°C; 1H ЯМР (ДМСО-d6) δ 1,90-2,10 (м, 1H, CHH), 2,23-2,46 (м, 1H, CHH), 2,54-2,68 (м, 1H, CHH), 2,80-3,02 (м, 1H, CHH), 4,31 (д, J=17,4 Гц, 1H, CHH), 4,37-4,51 (м, 3H, CHH, CH2), 5,11 (дд, J=5,0, 13,3 Гц, 1H, NCH), 6,89 (т, J=5,9 Гц, 1H, NH), 7,23 (д, J=4,5 Гц, 2H, Ar), 7,40-7,76 (м, 7H, Ar), 8,07 (д, J=2,5 Гц, 1H, Ar), 9,02 (с, 1H, NH), 10,98 (с, 1H, NH), 12,64 (ушир.с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,39, 31,10, 42,75, 47,02, 51,48, 111,62, 118,88, 120,11, 120,62, 121,55, 121,83, 122,56, 122,85, 126,85, 129,79, 130,23, 130,35, 134,56, 139,56, 142,29, 143,00, 144,58, 149,12, 154,96, 162,96, 167,86, 170,91, 172,76; ЖХ-МС MH=543, 545; аналитически вычислено для C28H23N6O4Cl + 3 H2O: C, 56,33; H, 4,90; N, 14,08; найдено: C, 56,73; H, 4,67; N, 14,09.
5.33. N-(3-Хлор-4-метилфенил)-N'-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]гуанидина гидрохлорид
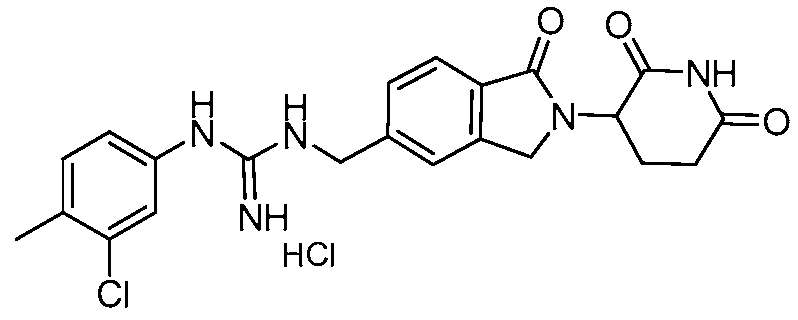
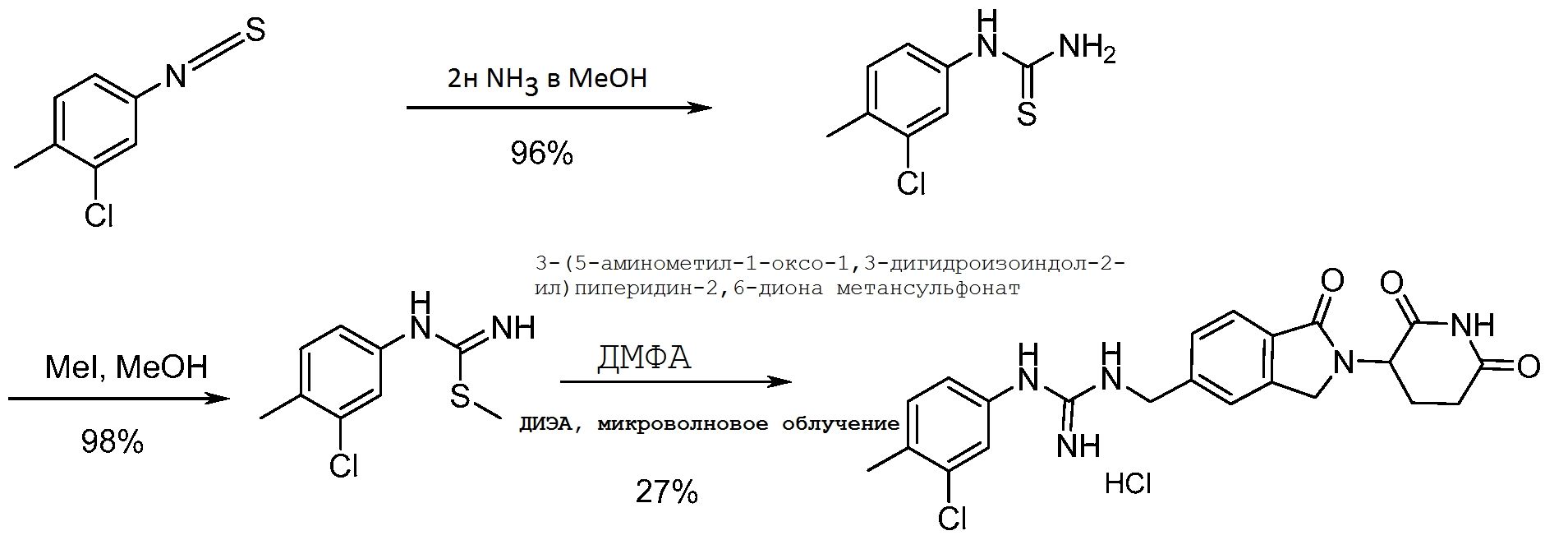
Стадия 1: 3-(Хлор-4-метилфенил)тиомочевина
К раствору 2-хлор-4-изотиоцианато-1-метилбензола (2 г, 10,89 ммоль) в сухом ацетонитриле (10 мл) добавляли раствор NH3 в MeOH (2н., 6 мл) и смесь перемешивали при комнатной температуре в течение 2 ч. Добавляли к реакционной смеси воду, вызывая образование осадка. Реакционную суспензию концентрировали в вакууме до ~1/4 объема и белый осадок собирали фильтрованием и высушивали в вакуумном сушильном шкафу с получением 2,1 г (выход 96%) 3-хлор-4-метилфенил)тиомочевины в виде твердого вещества белого цвета, которое использовали без дополнительной очистки. ЖХ-МС: MH=201.
Стадия 2: 1-(3-Хлор-4-метилфенил)-2-метилизотиомочевина гидройодид
К суспензии 3-хлор-4-метилфенилтиомочевины (2,1 г, 10,46 ммоль) в MeOH (15 мл) добавляли метилйодид (2,5 мл, 40 ммоль) и смесь перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь концентрировали досуха и до остатка, добавляли небольшую порцию дихлорметана и удаляли летучие вещества в вакууме. Данный процесс повторяли еще дважды, чтобы получить желтовато-коричневую пену, которую высушивали в вакуумном сушильном шкафу в течение ночи с получением 3,5 г (выход 98%) неочищенного (2×) 1-(3-хлор-4-метилфенил)-2-метилизотиомочевина гидройодида. Было обнаружено, что данное вещество является очень гигроскопичным и хранилось в эксикаторе для дальнейшего использования. ЖХ-МС: MH = 215.
Стадия 3: N-(3-Хлор-4-метилфенил)-N'-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]гуанидина гидрохлорид
В пробирке для облучения микроволнами, снабженной якорем магнитной мешалки, смешивали 1-(3-хлор-4-метилфенил)-2-метилизотиомочевина гидройодид (597 мг, 1,74 ммоль), 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона метансульфонат (560 мг, 1,52 ммоль) и ДИЭА (DIEA) (1,1 мл, 6,06 ммоль) в безводном ДМФА (5 мл). Пробирку закрывали и подвергали облучению в микроволновой печи в течение 30 мин при 120°C. К реакционной смеси добавляли дополнительно 100 мг 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона метансульфоната и реакцию облучали в течение 30 мин при 120°C. Данный процесс повторяли еще дважды, чтобы израсходовалось все исходное вещество 1-(3-хлор-4-метилфенил)-2-метилизотиомочевина гидройодид, что обнаруживали путем совместного элюирования с желаемым продуктом на ЖХ-МС. Реакционную смесь подкисляли уксусной кислотой и упаривали летучие вещества в вакууме. Остаток растворяли в минимальном количестве ДМФА, фильтровали и очищали, используя C-18 препаративную ВЭЖХ. Добавляли к объединенным фракциям, содержащим желаемый продукт, 1 н. HCl и растворители удаляли в вакууме. Полученный белый осадок растворяли в минимальном количестве воды и лиофилизовали с получением 180 мг (выход 27%) N-(3-хлор-4-метилфенил)-N'-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]гуанидина гидрохлорида. ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% H3PO4, 3,73 мин (97,4%); Тпл: >400°C; 1H ЯМР (ДМСО-d6) δ 1,91-2,09 (м, 1H, CHH), 2,33 (с, 3H, CH3), 2,41 (дд, J=4,3, 13,2 Гц, 1H, CHH), 2,54-2,68 (м, 1H, CHH), 2,80-3,05 (м, 1H, CHH), 4,21-4,56 (м, 2H, CH2), 4,66 (д, J=5,7 Гц, 2H, CH2), 5,13 (дд, J=4,9, 13,2 Гц, 1H, CH), 7,14 (дд, J=1,9, 8,1 Гц, 1H, Ar), 7,34 (д, J=1,9 Гц, 1H, Ar), 7,42 (д, J=8,1 Гц, 1H, Ar), 7,51 (д, J=7,9 Гц, 1H, Ar), 7,61 (с, 1H, Ar), 7,76 (д, J=7,7 Гц, 1H, Ar), 7,98 (ушир.с, 1H, NH), 8,62 (ушир.с, 1H, NH), 10,16 (с, 1H, NH), 11,00 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,04, 24,19, 32,95, 46,33, 49,85, 54,03, 124,13, 125,48, 125,79, 127,28, 129,17, 132,57, 134,20, 135,82, 135,95, 136,64, 143,17, 144,68, 156,84, 170,94, 173,00, 175,82; ЖХ-МС: MH=440, 442; аналитически вычислено для C22H23Cl2N5O3 + 2,3 H2O + 1,9 HC1 + 0,2 HCOOH: C, 44,72; H, 5,05; N, 11,74; Cl, 23,19; найдено: C, 44,55; H, 4,71; N, 11,48; Cl, 22,92.
5.34. 1-((2-(2,6-Диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(3-гидрокси-4-метилфенил)мочевина
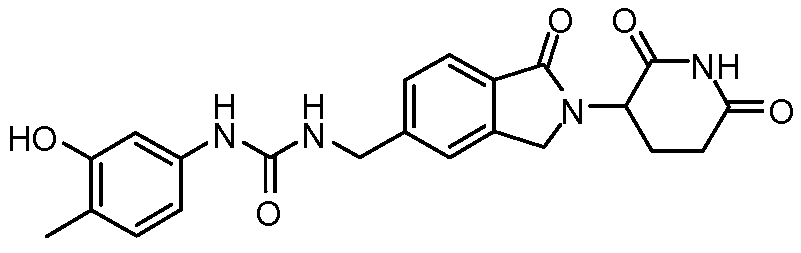
Стадия 1: Смесь 2-метил-5-нитрофенола (3,0 г, 19,6 ммоль), TBS-Cl (трет-бутилдиметилсилилхлорид) (3,0 г, 19,6 ммоль) и ТЭА (2,2 г, 21,6 ммоль) в ДМФА (30 мл) перемешивали при температуре окружающей среды в течение 16 ч. Смесь упаривали под вакуумом. Остаток растворяли в этилацетате (100 мл) и промывали водой (3×100 мл) и упаривали под вакуумом. Остаток хроматографировали в градиенте гексаны-этилацетат, получая 4,7 г трет-бутилдиметил(2-метил-5-нитрофенокси)силана, с выходом 91%; 1H ЯМР (ДМСО-d6) δ 0,27 (с, 6H), 1,01 (с, 9H), 2,27 (с, 3H), 7,47 (д, J=8,5 Гц, 1H), 7,52 (д, J=2,3 Гц, 1H), 7,78 (дд, J=2,3, 8,3 Гц, 1H).
Стадия 2: Смесь продукта со Стадии 1 (4,7 г, 17,6 ммоль) и 10% Pd-C (1,0 г, 50% смоченный) в этилацетате гидрировали при давлении водорода 345 кПа (50 psi) в течение 16 ч. Смесь затем фильтровали через целит и фильтрат упаривали под вакуумом, получая 3,9 г 3-(трет-бутилдиметилсилилокси)-4-метиланилин с выходом 94%; 1H ЯМР (ДМСО-d6) δ 0,17 (с, 6H), 0,97 (с, 9H), 1,96 (с, 3H), 4,81 (с, 2H), 6,00-6,21 (м, 2H), 6,74 (д, J=7,9 Гц, 1H).
Стадия 3: Смесь 3-(5-(аминометил)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона метансульфоната (0,74 г, 2,0 ммоль) и КДИ (0,32 г, 2,0 ммоль) в ДМФА (30 мл) перемешивали при комнатной температуре в течение 3 ч и затем добавляли продукт со Стадии 2 (0,47 г, 2,0 ммоль). Смесь нагревали до 70°C в течение 16 ч. Затем смесь охлаждали до комнатной температуры и гасили с помощью 1н. HCl (30 мл). Полученную смесь упаривали под вакуумом и остаток очищали с помощью препаративной ВЭЖХ, используя градиент ацетонитрил-вода и получая 0,38 г 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(3-гидрокси-4-метилфенил)мочевины в виде твердого вещества белого цвета с выходом 46%; ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 25/75 CH3CN/0,1% H3PO4, 4,80 мин (100,00%); Тпл 273-275°C; 1H ЯМР (ДМСО-d6) δ 2,02 (с, 4H), 2,27-2,47 (м, 1H), 2,63 (м, 1H), 2,80-3,04 (м, 1H), 4,17-4,59 (м, 4H), 5,11 (дд, J=4,7, 13,0 Гц, 1H), 6,47-6,72 (м, 2H), 6,86 (д, J=7,9 Гц, 1H), 7,04 (с, 1H), 7,44 (д, J=7,7 Гц, 1H), 7,51 (с, 1H), 7,69 (д, J=7,7 Гц, 1H), 8,39 (с, 1H), 9,13 (с, 1H), 10,98 (с, 1H); 13C ЯМР (ДМСО-d6) δ 15,35, 22,49, 31,20, 42,74, 47,12, 51,58, 104,76, 108,45, 116,48, 121,86, 122,91, 126,91, 130,19, 130,26, 138,92, 142,36, 144,96, 155,18, 155,29, 167,95, 170,99, 172,85; ЖХ-МС MH=423; аналитически вычислено для C22H22N4O5: C, 62,55; H, 5,25; N, 13,26; найдено: C, 62,27; H, 5,15; N, 13,18.
5.35. 1-((2-(2,6-Диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(4-гидрокси-3-метилфенил)мочевина
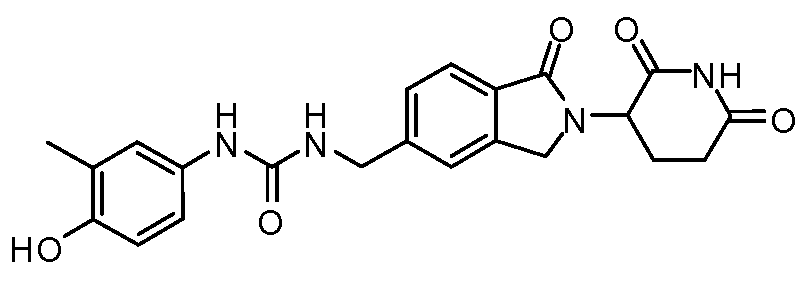
Стадия 1: Смесь 2-метил-4-нитрофенола (3,0 г, 19,6 ммоль), TBS-Cl (3,0 г, 19,6 ммоль) и ТЭА (2,2 г, 21,6 ммоль) в ДМФА (30 мл) перемешивали при температуре окружающей среды в течение 16 ч. Смесь распределяли между 10% водным раствором бикарбоната натрия (100 мл) и этилацетатом (100 мл) и водный слой экстрагировали этилацетатом (100 мл). Объединенные органические слои промывали 10% водным раствором бикарбонатом натрия (3×100 мл) и водой (100 мл) и упаривали под вакуумом. Остаток хроматографировали в градиенте гексаны-этилацетат, получая 3,9 г трет-бутилдиметил(2-метил-4-нитрофенокси)силана с выходом 75%; 1H ЯМР (ДМСО-d6) δ 0,29 (с, 6H), 1,00 (с, 9H), 2,24 (с, 3H), 7,03 (д, J=8,9 Гц, 1H), 8,02 (дд, J=2,8, 8,9 Гц, 1H), 8,12 (д, J=2,5 Гц, 1H).
Стадия 2: Смесь продукта со Стадии 1 (3,9 г, 14,6 ммоль) и 10% Pd-C (0,5 г, 50% влажн.) в этилацетате гидрировали при давлении водорода 345 кПа (50 psi) в течение 18 ч. Смесь фильтровали через целит и фильтрат упаривали, получая 3,2 г 4-(трет-бутилдиметилсилилокси)-3-метиланилина с выходом 93%.
Стадия 3: Смесь 3-(5-(аминометил)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона метансульфоната (0,74 г, 2,0 ммоль) и КДИ (0,32 г, 2,0 ммоль) в ДМФА (30 мл) перемешивали при комнатной температуре в течение 3 ч и затем добавляли продукт со Стадии 2 (0,47 г, 2,0 ммоль). Смесь нагревали до 70°C в течение 30 ч. Затем смесь охлаждали до комнатной температуры и гасили с помощью 1н. HCl (30 мл), приводя к образованию осадка. Данный осадок очищали путем хроматографирования на колонке с силикагелем, используя градиент метиленхлорида-метанола и получая 0,59 г 1-(4-(трет-бутилдиметилсилилокси)-3-метилфенил)-3-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)мочевины в виде твердого вещества грязно-белого цвета с выходом 55%; 1H ЯМР (ДМСО-d6) δ 0,16 (с, 6H), 0,97 (с, 9H), 1,88-2,06 (м, 1H), 2,10 (с, 3H), 2,25-2,47 (м, 1H), 2,53-2,70 (м, 1H), 2,80-3,02 (м, 1H), 4,31 (д, J=17,4 Гц, 1H), 4,36-4,52 (м, 3H), 5,11 (дд, J=4,9, 13,2 Гц, 1H), 6,51-6,74 (м, 2H), 7,08 (дд, J=2,5, 8,6 Гц, 1H), 7,18 (д, J=2,3 Гц, 1H), 7,43 (д, J=7,7 Гц, 1H), 7,50 (с, 1H), 7,69 (д, J=7,7 Гц, 1H), 8,35 (с, 1H), 10,98 (с, 1H).
Стадия 4: К раствору продукта со Стадии 3 (0,5 г, 0,9 ммоль) в метиленхлориде (20 мл) добавляли 2 н. HCl в диэтиловом эфире (2 мл). Смесь перемешивали в течение 16 ч при температуре окружающей среды. Осажденный продукт отделяли фильтрованием и промывали метиленхлоридом (20 мл) и высушивали под вакуумом, получая 0,4 г 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(4-гидрокси-3-метилфенил)мочевины в виде твердого вещества грязно-белого цвета, с количественным выходом; ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 1,88 мин (96,4%); Тпл 210-212°C; 1H ЯМР (ДМСО-d6) δ 1,94-2,18 (м, 4H), 2,30-2,51 (м, 1H), 2,58-2,72 (м, 1H), 2,87-3,06 (м, 1H), 4,25-4,56 (м, 4H), 5,15 (дд, J=5,0, 13,3 Гц, 1H), 6,67 (д, J=8,5 Гц, 1H), 7,02 (дд, J=2,5, 8,6 Гц, 1H), 7,12 (д, J=2,3 Гц, 1H), 7,47 (д, J=7,7 Гц, 1H), 7,54 (с, 1H), 7,73 (д, J=7,7 Гц, 1H), 8,32 (ушир.с, 1H), 11,02 (с, 1H); 13C ЯМР (ДМСО-d6) δ 16,15, 22,51, 31,20, 42,77, 47,12, 51,56, 114,47, 117,11, 121,32, 121,83, 122,88, 123,61, 126,86, 130,22, 131,72, 142,35, 145,17, 150,10, 155,58, 170,99, 172,85; ЖХ-МС MH=423; аналитически вычислено для C22H22N4O5 + 0,25 CH2Cl2: C, 60,23; H, 5,11; N, 12,63; найдено: C, 60,14; H, 5,43; N, 12,54.
5.36 1-(4-трет-Бутилциклогексил)-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевина
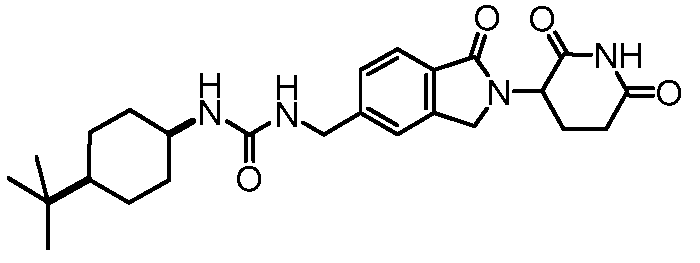
К перемешиваемой суспензии 4-трет-бутилциклогексиламина (0,20 г, 1,28 ммоль) в ДМФА (5 мл) при 40°C добавляли КДИ (0,23 г, 1,40 ммоль). Смесь перемешивали в течение 15 мин с последующим добавлением соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой (0,47 г, 1,28 ммоль). Нагревание прекращали через 1,5 ч и смесь перемешивали при комнатной температуре в течение ночи. Растворитель упаривали и остаток очищали с помощью препаративной ВЭЖХ с получением продукта в виде твердого вещества белого цвета (0,076 г, выход 13%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 35/65 CH3CN/0,1% H3PO4, 13,37 мин (44,7%), 14,68 мин (54,3%); Тпл: 182-184°C; 1H ЯМР (ДМСО-d6) δ 0,83 (с, 9H, CH3, CH3, CH3), 0,90-1,21 (м, 4H, CH2, CH2), 1,30-1,58 (м, 2H, CHH, CHH), 1,61-1,78 (м, 2H, CHH, CHH), 1,87 (ушир.с, 1H, СНН), 1,95-2,06 (м, 1H, CHH), 2,28-2,47 (м, 1H, CHH), 2,63 (ушир.с, 1H, CHH), 2,83-3,00 (м, 1H, CHH), 3,78 и 3,27 (2с, 1H, CH), 4,23-4,50 (м, 4H, CH2, CH2), 5,11 (дд, J=5,0, 13,1 Гц, 1H, NCH), 5,79-6,12 (м, 1H, NH), 6,25-6,44 (м, 1H, NH), 7,38 (т, J=6,8 Гц, 1H, ArH), 7,45 (д, J=6,2 Гц, 1H, ArH), 7,67 (дд, J=4,1, 7,6 Гц, 1H, ArH), 10,99 (с, 1H, NH); (Примечание: 1H ЯМР показывал приблизительно 55% к 45% соотношение изомеров); 13C ЯМР (ДМСО-d6) δ 21,33, 22,49, 25,95, 27,38, 27,45, 31,02, 31,20, 32,06, 32,26, 33,76, 42,87, 43,43, 46,81, 47,10, 47,42, 48,69, 51,56, 121,76, 121,88, 122,83, 122,90, 126,81, 126,88, 130,11, 130,19, 142,29, 142,35, 145,36, 145,52, 157,35, 167,98, 170,99, 172,85, ЖХ-МС MH+=455; аналитически вычислено для C25H34N4O4 + 0,7 H2O: C, 64,27; H, 7,64; N, 11,99; найдено: C, 63,98; H, 7,98; N, 11,92.
5.37. 1-[2-(2,6-Диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-(4-метилциклогексил)мочевина
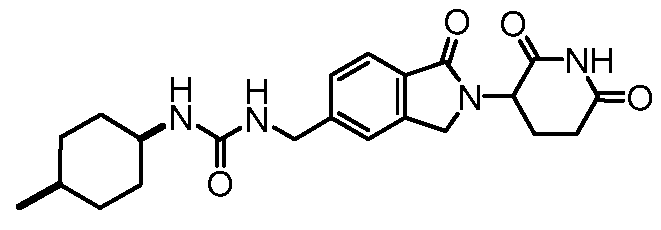
К перемешиваемой суспензии 4-метилциклогексиламина (смесь цис/транс изомеров, 0,21 г, 1,86 ммоль) в ДМФА (10 мл) при 40°C добавляли КДИ (0,33 г, 2,04 ммоль). Смесь перемешивали в течение 15 мин с последующим добавлением соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой (0,69 г, 1,86 ммоль). Нагревание прекращали через 1,5 ч и смесь перемешивали при комнатной температуре в течение ночи. Растворитель упаривали и остаток очищали с помощью препаративной ВЭЖХ с получением продукта в виде твердого вещества белого цвета (0,14 г, 18% выход). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 25/75 CH3CN/0,1% H3PO4, 11,33 мин (59,1%), 12,41 мин (39,7%); Тпл: 223-225°C; 1H ЯМР (ДМСО-d6) δ 0,81-0,93 (м, 3Н, CH3), 0,95-1,35 (м, 3H, CHH, CHH, CHH), 1,37-1,57 (м, 4H, CHH, CHH, CHH, CH), 1,58-1,70 (м, 1H, CHH), 1,73-1,88 (м, 1H, СНН), 1,92-2,07 (м, 1H, CHH), 2,30-2,47 (м, 1H, CHH), 2,54-2,67 (м, 1H, CHH), 2,83-3,00 (м, 1H, CHH), 3,20-3,75 (м, 1H, CH), 4,21-4,51 (м, 4H, CH2, CH2), 5,11 (дд, J=5,0, 13,1 Гц, 1H, NCH), 5,78-6,11 (м, 1H, NH), 6,24-6,40 (м, 1H, NH), 7,34-7,42 (м, 1H, ArH), 7,42-7,50 (м, 1H, ArH), 7,63-7,72 (м, 1H, ArH), 10,98 (с, 1H, NH); (Примечание: 1H ЯМР показывал приблизительно 60% к 40% соотношение изомеров); 13C ЯМР (ДМСО-d6) δ 21,47, 22,17, 22,49, 29,42, 29,77, 30,42, 31,20, 31,50, 33,28, 33,73, 42,86, 44,54, 47,09, 48,37, 51,56, 121,78, 122,87, 126,81, 130,16, 142,33, 145,44, 145,52, 157,33, 167,98, 170,99, 172,85; ЖХ-МС MH+=413; аналитически вычислено для C22H28N4O4 + 0,4 H2O: C, 63,23; H, 6,90; N, 13,41; найдено: C, 62,93; H, 6,92; N, 13,09.
5.38. Соль 1-(3-Диэтиламинопропил)-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевины с муравьиной кислотой
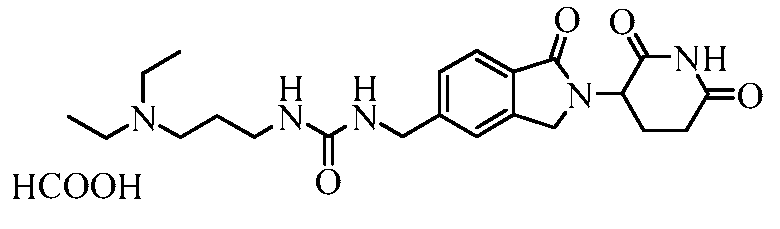
К раствору паранитрофенилхлорформиата (202 мг, 1 ммоль) в CH3CN (5 мл) добавляли по каплям при 0°C раствор N,N-диэтилпропан-1,3-диамина (130 мг, 1 ммоль) и ДИПЭА (0,082 мл, 1 ммоль) в CH3CN (5 мл). Смесь перемешивали при 0°C в течение 10 мин. Добавляли соль 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой (0,37 г, 1 ммоль) с последующим добавлением ДИПЭА (0,082 мл, 1 ммоль). Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение ночи при комнатной температуре. К смеси добавляли 1н. HCl (15 мл) и фильтровали. Полученный осадок очищали препаративной ВЭЖХ с получением продукта в виде твердого вещества грязно-белого цвета (280 мг, выход 65%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент 5%-100% в течение 5 мин, CH3CN/0,1% H3PO4, 4,46 мин (97%); Тпл: 90-92°C; 1H ЯМР (ДМСО-d6) δ 1,01 (т, J=7,1 Гц, 6H, CH3, CH3), 1,58 (квин., J=7,1 Гц, 2H, CH2), 1,94-2,06 (м, 1H, CHH), 2,39 (квд, J=4,5, 13,2 Гц, 1H, CHH), 2,55-2,73 (м, 7H, CH2, CH2, CH2, CHH), 2,83-2,99 (м, 1H, CHH), 3,05 (д, J=5,3 Гц, 2H, CH2), 4,15-4,56 (м, 4H, CH2, CH2), 5,10 (дд, J=5,1, 13,4 Гц, 1H, NCH), 6,17 (ушир.с, 1H, NH), 6,60 (с, 1H, NH), 7,39 (д, J=7,7 Гц, 1H, Ar), 7,45 (с, 1H, Ar), 7,67 (д, J=7,9 Гц, 1H, Ar), 8,25 (ушир.с, 1H, HCOOH), 10,98 (ушир.с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 10,25, 22,49, 26,14, 31,20, 37,39, 42,93, 46,11, 47,09, 51,56, 121,73, 122,81, 126,76, 130,13, 142,27, 145,54, 158,18, 167,99, 171,01, 172,86; ЖХ-МС MH+=430; аналитически вычислено для C23H33N5O6 + 2 H2O: C, 54,00; H, 7,29; N, 13,69; найдено: C, 54,04; H, 6,92; N, 13,63.
5.39. 1-[2-(2,6-Диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-(4-метилтетрагидропиран-4-ил)мочевина
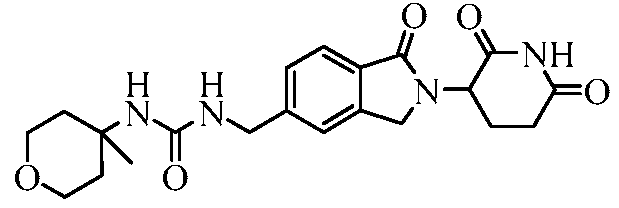
К раствору паранитрофенилхлорформиата (202 мг, 1 ммоль) в CH3CN (5 мл) добавляли по каплям при 0°C раствор 4-метилтетрагидропиран-4-иламина (150 мг, 1 ммоль) и ДИПЭА (0,082 мл, 1 ммоль) в CH3CN (5 мл). Смесь перемешивали при 0°C в течение 10 мин. Добавляли соль 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой (0,37 г, 1 ммоль) с последующим добавлением ДИПЭА (0,082 мл, 1 ммоль). Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение ночи при комнатной температуре. К смеси добавляли 1н. HCl (15 мл) и фильтровали. Полученный осадок очищали препаративной ВЭЖХ с получением твердого вещества. Твердое вещество перекристаллизовывали из ДМФА (1 мл) и воды (1 мл) с получением продукта в виде твердого вещества белого цвета (55 мг, выход 12%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент 5%-100% в течение 5 мин, CH3CN/0,1% H3PO4, 5,02 мин (98%); Тпл: 158-160°C; 1H ЯМР (ДМСО-d6) δ 1,29 (с, 3H, CH3), 1,40-1,58 (м, 2H, CHH), 1,84-1,96 (м, 2H, CHH, CHH), 1,99 (с, 1H, CHH), 2,30-2,45 (м, 1H, CHH), 2,55-2,65 (м, 1H, CHH), 2,84-2,99 (м, 1H, CHH), 3,44-3,68 (м, 4H, CH2, СН2), 4,22-4,58 (м, 4H, СН2, СН2), 4,95-5,29 (м, 1H, NCH), 5,85 (с, 1H, NH), 6,08-6,52 (м, 1H, NH), 7,33-7,42 (м, 1Н, Ar), 7,45 (с, 1H, Ar), 7,68 (д, J=7,6 Гц, 1Н, Ar), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,48, 27,00, 31,20, 36,93, 42,58, 47,10, 48,85, 51,56, 62,92, 120,99, 121,67, 122,88, 126,69, 142,35, 145,48, 157,22, 167,98, 171,01, 172,86; ЖХ-МС MH+=415; аналитически вычислено для C21H26N4O5 + 0,5 H2O: C, 59,56; H, 6,43; N, 13,23; найдено: C, 59,34; H, 6,35; N, 13,21.
5.40. 1-(1-Бензилпиперидин-4-ил)-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевина
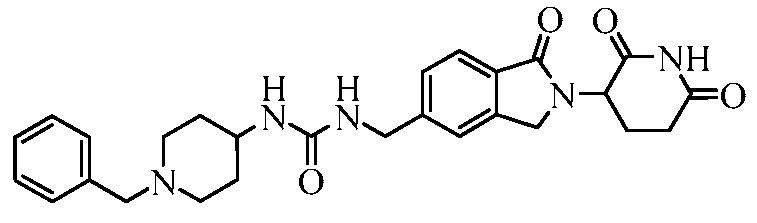
К раствору паранитрофенилхлорформиата (202 мг, 1 ммоль) в CH3CN (5 мл) добавляли по каплям при 0°C раствор 4-аминобензилпиперидина (190 мг, 1 ммоль) и ДИПЭА (0,082 мл, 1 ммоль) в CH3CN (5 мл). Смесь перемешивали при 0°C в течение 10 мин. Добавляли соль 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой (0,37 г, 1 ммоль) с последующим добавлением ДИПЭА (0,082 мл, 1 ммоль). Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение ночи при комнатной температуре. К смеси добавляли 1н. HCl (15 мл) и фильтровали. Полученный осадок очищали препаративной ВЭЖХ с получением липкого твердого вещества. Осадок растворяли в ДМФА (1 мл) и добавляли по каплям насыщенный раствор NaHCO3 до тех пор, пока не начнется образование осадка. Оставляли оседать при комнатной температуре в течение 30 мин и осадок отфильтровывали с получением продукта в виде твердого вещества белого цвета (55 мг, выход 12%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент 5%-100% в течение 5 мин, CH3CN/0,1% H3PO4, 4,64 мин (99%); Тпл: 208-210°C; 1H ЯМР (ДМСО-d6) δ 1,21-1,52 (м, 2H, CHH), 1,63-1,82 (м, 2H, CHH), 1,89-2,14 (м, 3H, CHH, CHH, CHH), 2,39 (д, J=13,6 Гц, 1H, CHH), 2,55-2,65 (м, 1H, CHH), 2,64-2,75 (м, 2H, CHH, CHH), 2,83-3,02 (м, 1H, CHH), 3,37-3,41 (м, 1H, CH), 3,43 (с, 2H, CH2), 4,21-4,50 (м, 3H, CH2, CH2), 5,10 (дд, J=5,0, 13,3 Гц, 1H, NCH), 5,94 (д, J=7,9 Гц, 1H, NH), 6,34 (т, J=6,0 Гц, 1H, NH), 7,13-7,48 (м, 6H, Ar), 7,66 (д, J=7,6 Гц, 1H, Ar), 10,97 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,49, 31,20, 32,46, 42,86, 46,43, 47,09, 51,55, 51,90, 62,19, 121,78, 122,84, 126,79, 128,10, 128,69, 130,13, 138,64, 142,29, 145,44, 157,32, 167,96, 170,99, 172,85; ЖХ-МС MH+=490; аналитически вычислено для C21H26N4O5 + 0,5 H2O: C, 59,56; H, 6,43; N, 13,23; найдено: C, 59,34; H, 6,35; N, 13,21.
5.41. 1-[2-(2,6-Диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-пиперидин-4-илмочевина гидрохлорид
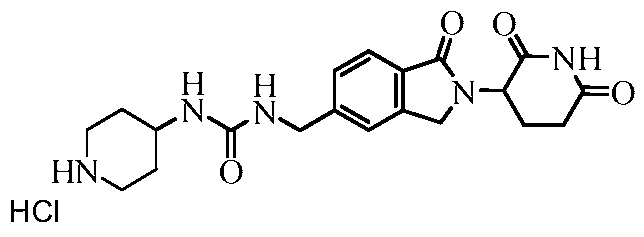
Стадия 1. Смесь соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой (1,25 г, 3,39 ммоль) и КДИ (0,61 г, 3,73 ммоль) в ДМФА (10 мл) перемешивали при комнатной температуре в течение ночи. Затем добавляли трет-бутиловый эфир 4-аминопиперидин-1-карбоновой кислоты (0,68 г, 3,39 ммоль) и смесь перемешивали в течение ночи. Смесь очищали препаративной ВЭЖХ с получением трет-бутилового эфира 4-{3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]уреидо}пиперидин-1-карбоновой кислоты в виде твердого вещества грязно-белого цвета (0,46 г, выход 27%). Продукт использовали на следующей стадии без дополнительной очистки. ВЭЖХ, Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CΗ3CN/0,1% H3PO4, 4,35 мин (99,4%).
Стадия 2: Смесь трет-бутилового эфира 4-{3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]уреидо}пиперидин-1-карбоновой кислоты (0,45 г, 0,90 ммоль) в 2M растворе гидрохлорида в диэтиловом эфире (30 мл, 9,01 ммоль) перемешивали в течение ночи. Белую суспензию фильтровали и промывали диэтиловым эфиром. Полученный белый осадок перемешивали в ацетонитриле (80 мл) при 50°C в течение ночи. Суспензию фильтровали, промывали ацетонитрилом и высушивали в вакууме с получением продукта в виде твердого вещества белого цвета (0,34 г, выход 86%). ВЭЖХ: Waters Xterra C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент от 5/95 CH3CN/0,1% HCOONH4 до 95/5 в течение 5 мин, продолжая в течение 5 мин, 3,10 мин (95,1%); Тпл: 340-342°C; 1H ЯМР (ДМСО-d6) δ 1,46-1,65 (м, 2H, CHH, CHH), 1,85-2,05 (м, 3Н, CHH, CHH, CHH), 2,30-2,47 (м, 1H, CHH), 2,55-2,67 (м, 1H, CHH), 2,83-3,03 (м, 3H, CHH, CHH, CHH), 3,15-3,27 (м, 2H, CHH, CHH), 3,59-3,77 (м, 1H, CH), 4,23-4,51 (м, 4H, CH2, CH2), 5,11 (дд, J=4,9, 13,2 Гц, 1H, NCH), 6,40-6,57 (м, 2H, NH, NH), 7,39 (д, J=7,9 Гц, 1H, ArH), 7,45 (с, 1H, ArH), 7,67 (д, J=7,7 Гц, 1H, ArH), 8,75 (ушир.с, 2H, ClH2N), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,49, 28,92, 31,20, 41,96, 42,82, 43,95, 47,09, 51,55, 121,76, 122,84, 126,76, 130,14, 142,29, 145,35, 157,32, 167,98, 171,01, 172,87; ЖХ-МС MH+=400; аналитически вычислено для C20H26N504Cl + 1,7 H2O: C, 51,49; H, 6,35; N, 15,01; Cl, 7,60; найдено: C, 51,18; H, 6,15; N, 14,90; Cl, 7,51.
5.42. Изоиндолиновые соединения
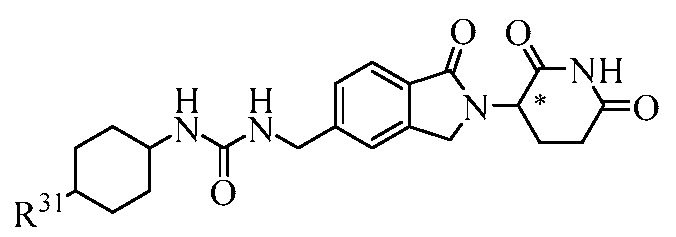
Изоиндолиновые соединения, представленные выше, получали в соответствии с методикой, описанной в Разделе 5.15.
5.43. Амид 4-{3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]уреидо}циклогексанкарбоновой кислоты
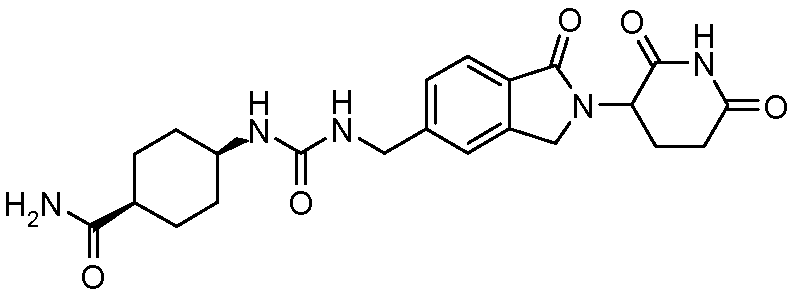
К раствору паранитрофенилхлорформиата (200 мг, 1 ммоль) в CH3CN (5 мл) добавляли по каплям раствор в CH3CN (5 мл) амида 4-аминоциклогексанкарбоновой кислоты (210 мг, 1 ммоль) и ДИПЭА (0,3 мл, 2 ммоль) при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 10 мин. Добавляли соль 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой (0,37 г, 1 ммоль) с последующим добавлением ДИПЭА (0,15 мл, 1 ммоль). Смесь перемешивали в течение ночи при температуре окружающей среды. Затем смесь фильтровали. Фильтрат очищали препаративной ВЭЖХ с получением амида 4-{3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]уреидо}циклогексанкарбоновой кислоты в виде твердого вещества белого цвета (130 мг, выход 30%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент 5%-95% в течение 5 мин, CH3CN/0,1% H3PO4,: tR=4,78 мин (92%); Тпл: 195-197°C; 1H ЯМР (ДМСО-d6) δ 1,32-1,73 (м, 8H, CHH+CHH+CHH+CHH), 1,97 (ушир.с, 1H, CHH), 2,09-2,21 (м, 1H, CHH), 2,40 (д, J=13,4 Гц, 1H, CHH), 2,62 (ушир.с, 1H, CHH), 2,80-3,03 (м, 1H, CHH), 3,70 (ушир.с, 1H, CHH), 4,18-4,58 (м, 4H, CH2+CH2), 5,11 (дд, 1H, CHN), 6,15 (д, J=7,9 Гц, 1H, NH), 6,38 (т, J=5,9 Гц, 1H, NH), 6,67 (ушир.с, 1H, NH), 7,19 (ушир.с, 1H, NH), 7,38 (д, J=7,7 Гц, 1H, Ar), 7,45 (с, 1H, Ar), 7,67 (д, J=7,9 Гц, 1H, Ar), 10,98 (ушир.с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 0,03, 22,42, 24,06, 24,19, 29,73, 41,73, 42,79, 44,16, 47,03, 51,49, 121,68, 122,80, 126,71, 130,09, 142,26, 145,37, 157,28, 163,37, 167,89, 170,92, 172,78, 176,83; ЖХ-МС: 442; аналитически вычислено для C22H27N5O5 + 0,5 HCOOH + 1 H2O + 0,2 CH3CN: C, 56,05; H, 6,21; N, 14,84; найдено: C, 55,70; H, 6,46; N, 14,78.
5.44. 1-(6-Хлорпиридин-3-ил)-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевина
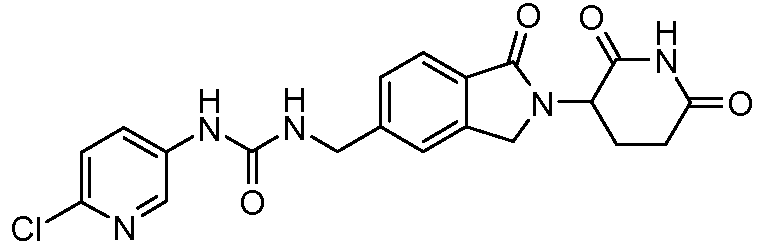
К суспензии соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой (0,37 г, 1 ммоль) в ДМФА (3 мл) добавляли карбонилдиимидазол (162 мг, 1 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли 5-амино-2-хлорпиридин (128,5 мг, 1 ммоль) и смесь нагревали при 80°C в течение 6 часов. Смесь затем концентрировали при пониженном давлении и полученную смесь очищали на колонке с силикагелем, элюируя метиленхлоридом и метанолом, с получением 11-(6-хлорпиридин-3-ил)-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевины в виде твердого вещества грязно-белого цвета (20 мг, выход 5%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент 5%-95% в течение 5 мин, CH3CN/0,1% H3PO4, tR=5,43 мин (97%); Тпл: 224-226°C; 1H ЯМР (ДМСО-d6) δ 1,89-2,09 (м, 1H, CHH), 2,29-2,44 (м, 1H, CHH), 2,54-2,66 (м, 1H, CHH), 2,83-3,04 (м, 1H, CHH), 4,20-4,57 (м, 4H, CH2, CH2), 5,11 (дд, J=5,0, 13,3 Гц, 1H, NCH), 6,99 (т, J=6,2 Гц, 1H, NH), 7,37 (д, J=8,5 Гц, 1H, Ar), 7,45 (д, J=7,7 Гц, 1H, Ar), 7,52 (с, 1H, Ar), 7,70 (д, J=7,7 Гц, 1H, Ar), 7,95 (дд, J=2,8, 8,7 Гц, 1H, Ar), 8,42 (д, J=2,3 Гц, 1H, Ar), 9,03 (с, 1H, NH), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,49, 31,18, 42,86, 47,12, 51,58, 121,91, 122,94, 123,89, 126,92, 128,37, 130,42, 136,75, 139,04, 142,39, 144,50, 154,97, 167,93, 171,01, 172,86, 215,61; ЖХ-МС: 428; аналитически вычислено для C20H18N5O4Cl + 0,1 H2O C, 55,91; H, 4,27; N, 16,30; Cl, 8,25; найдено: C, 56,31; H, 4,51; N, 15,92; Cl, 8,47.
5.45. 1-[4-(2,4-Дифторфенил)тиазол-2-ил]-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевина
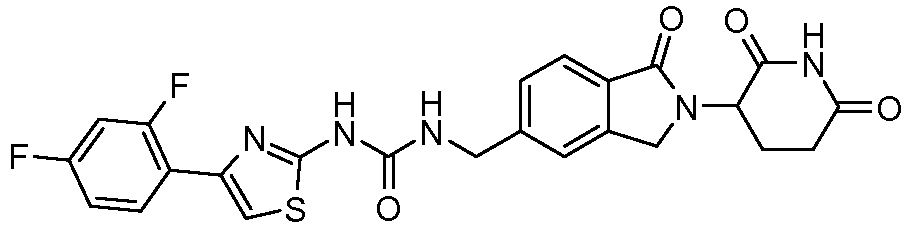
Смесь соли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой (0,40 г, 1,1 ммоль) и КДИ (0,18 г, 1,1 ммоль) в ДМФА (5 мл) перемешивали при комнатной температуре в течение 18 ч. К смеси добавляли 4-(2,4-дифторфенил)тиазол-2-иламин (0,23 г, 1,1 ммоль) при комнатной температуре и смесь перемешивали при 100°C в течение 2 дней. К смеси добавляли воду (25 мл) и этилацетат (20 мл). Смесь перемешивали при комнатной температуре в течение 2 часов. Суспензию фильтровали и осадок промывали водой (20 мл), этилацетатом (20 мл) и водой (20 мл) с получением осадка. Осадок очищали препаративной ВЭЖХ с получением 1-[4-(2,4-дифторфенил)тиазол-2-ил]-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевины в виде твердого вещества белого цвета (70 мг, выход 13%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 6,43 мин (97,7%); Тпл: 264-266°C; 1H ЯМР (ДМСО-d6) δ 1,93-2,05 (м, 1H, CHH), 2,30-2,45 (м, 1H, CHH), 2,55-2,68 (м, 1H, CHH), 2,82-3,00 (м, 1H, CHH), 4,32 (д, J=17,4 Гц, 1H, CHH), 4,41-4,54 (м, 3Н, СН2, CHH), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 7,09-7,24 (м, 2H, Ar, NH), 7,28-7,41 (м, 2H, Ar), 7,46 (д, J=7,7 Гц, 1H, Ar), 7,53 (с, 1H, Ar), 7,71 (д, J=7,9 Гц, 1H, Ar), 7,93-8,10 (м, 1H, Ar), 10,85 (с, 1H, NH), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,48, 31,18, 42,94, 47,12, 51,57, 104,54 (т, JC-F=26,4 Гц), 110,67 (д, JC-F=14,3 Гц), 111,81 (дд, JC-F=3,3, 20,9 Гц), 118,91 (дд, JC-F=2,8, 11,6 Гц), 121,95, 123,03, 126,95, 130,29 (дд, JC-F=4,4, 9,9 Гц), 130,49, 141,44, 142,45, 143,95, 154,02, 159,48 (дд, JC-F=252,2, 12,1 Гц), 159,36, 161,24 (дд, JC-F=246,9, 13,2 Гц), 167,88, 170,98, 172,85; ЖХ-МС MH=512; аналитически вычислено для C24H19N5O4F2S: C, 56,36; H, 3,74; N, 13,69; найдено: C, 56,16; H, 3,80; N, 14,07.
5.46. Трет-бутиловый эфир 6-{3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]уреидо}-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты
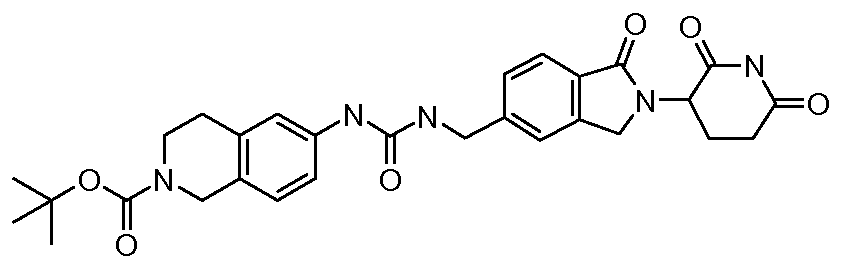
Суспендировали 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона метансульфонат (1,11 г, 3,0 ммоль) и 1,1'-карбонилдиимидазол (535 мг, 3,3 ммоль) в сухом ДМФА (20 мл) и смесь перемешивали при комнатной температуре в течение 24 ч. Во время перемешивания часть реакционной смеси (6,7 мл, ~1 ммоль) переносили в пробирку, содержащую трет-бутил-6-амино-3,4-дигидроизохинолин-2(1H)-карбоксилат (273 мг, 1,1 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи и протекание реакции контролировали с помощью ЖХ-МС. Через 48 ч в реакционную смесь вносили дополнительно трет-бутил-6-амино-3,4-дигидроизохинолин-2(1H)-карбоксилат (50 мг, 0,2 ммоль) и перемешивание продолжали в течение еще 24 ч. Реакционную смесь подкисляли с помощью кислоты и воды. Летучие вещества удаляли в вакууме и остаток растворяли в ДМФА и очищали, используя C-18 препаративную ВЭЖХ, с получением трет-бутилового эфира 6-{3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]уреидо}-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты в виде твердого вещества белого цвета (290 мг, выход 53%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 5,02 мин (96,5%); Тпл: 230-232°C; 1H ЯМР (ДМСО-d6) δ 1,42 (с, 9H, (СН3)3), 1,90-2,11 (м, 1H, CHH), 2,23-2,47 (м, 1H, CHH), 2,60 (д, J=17,9 Гц, 1H, CHH), 2,70 (т, J=5,6 Гц, 2H, CH2), 2,81-3,06 (м, 1H, CHH), 3,51 (т, J=5,7 Гц, 2H, CH2), 4,18-4,58 (м, 6H, CH2, CH2, CH2), 5,11 (дд, J=4,9, 13,2 Гц, 1H, CH), 6,72 (т, J=5,9 Гц, 1H, NH), 7,00 (д, J=8,3 Гц, 1H, Ar), 7,17 (д, J=8,1 Гц, 1H, Ar), 7,27 (ушир.с, 1H, Ar), 7,44 (д, J=7,9 Гц, 1H, Ar), 7,51 (с, 1H, Ar), 7,69 (д, J=7,9 Гц, 1H, Ar), 8,56 (с, 1H, NH), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,46, 28,07, 28,44, 31,16, 41,51, 42,75, 45,04, 47,08, 51,55, 78,81, 116,01, 117,49, 121,87, 122,90, 126,20, 126,36, 126,88, 130,25, 134,70, 138,56, 142,35, 144,86, 153,97, 155,21, 167,93, 170,96, 172,83; ЖХ-МС: MH=548; аналитически вычислено для С29Н33Н5О6 + 1,1 H2O: C, 61,39; H, 6,25; N, 12,34, найдено: C, 61,38; H, 6,11; N, 12,29.
5.47. Изоиндолиновые соединения Формулы III
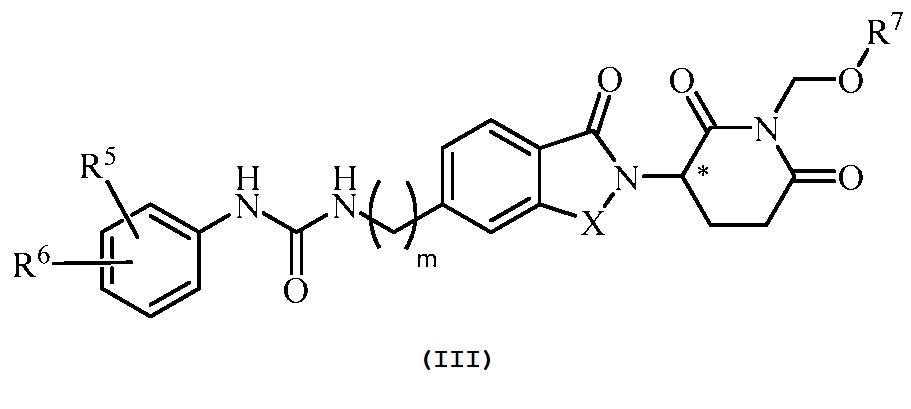
Изоиндолиновые соединения Формулы III получали, как представлено на Схеме 1.
Схема 1
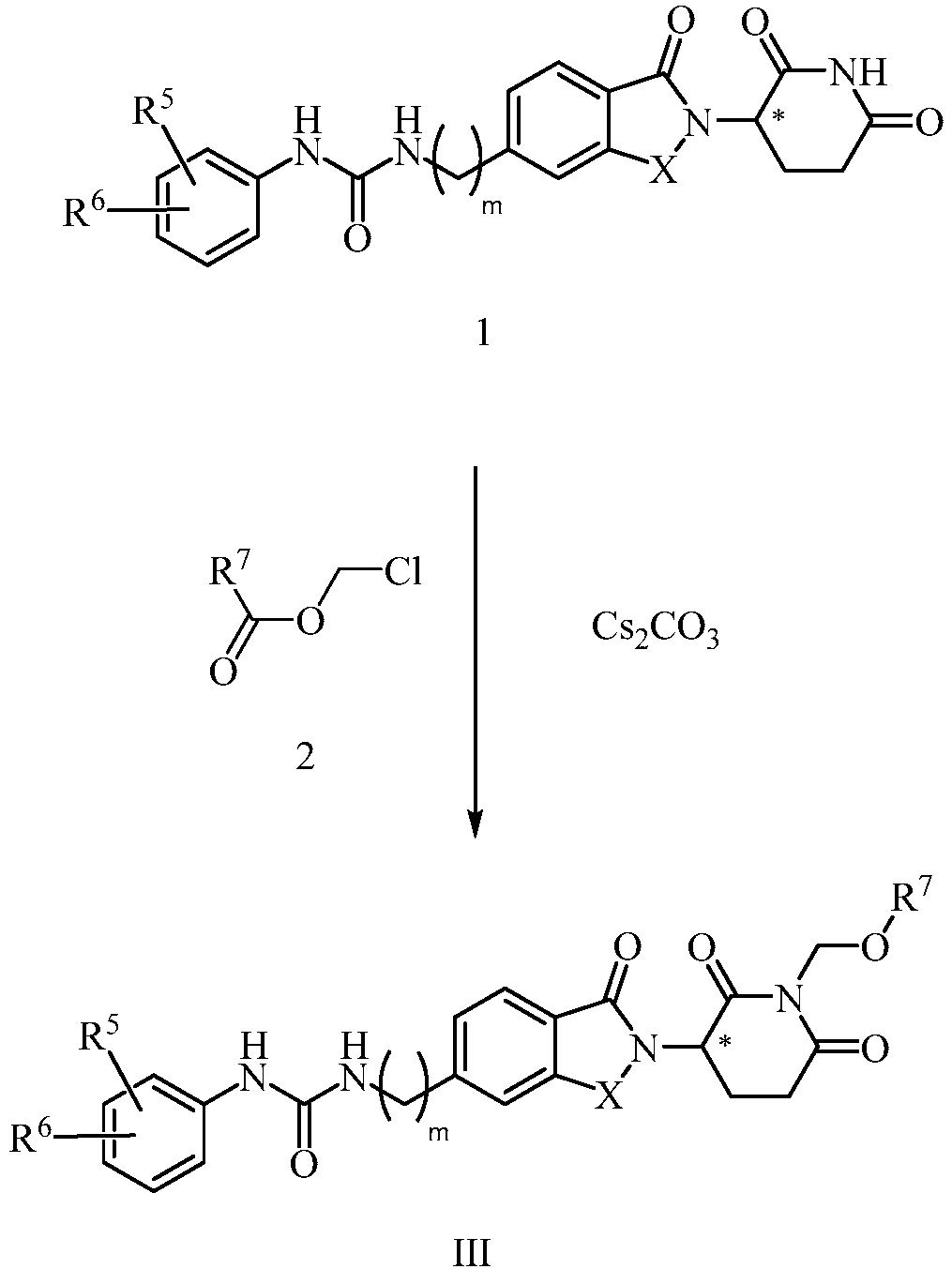
К раствору 5-аминометилизоиндолинон-глутаримида 1 (1,134 ммоль) в сухом ДМФА (10 мл) добавляли Cs2CO3 (406 мг, 1,248 ммоль). Через 5 минут перемешивания добавляли соответствующий хлорметоксикарбонильный реагент 2 (1,248 ммоль) и полученную смесь перемешивали при 50°C в течение ночи. Реакционную смесь нейтрализовали с помощью 0,5 н. HCl и затем концентрировали досуха в вакууме. Остаток очищали препаративной ВЭЖХ с последующим удалением защитных групп, если необходимо, в стандартных условиях с получением соединения Формулы III.
5.48. 3-{5-[3-(3-Хлор-4-метилфенил)уреидометил]-1-оксо-1,3-дигидроизоиндол-2-ил}-2,6-диоксопиперидин-1-илметиловый эфир 2,2-диметилпропионовой кислоты
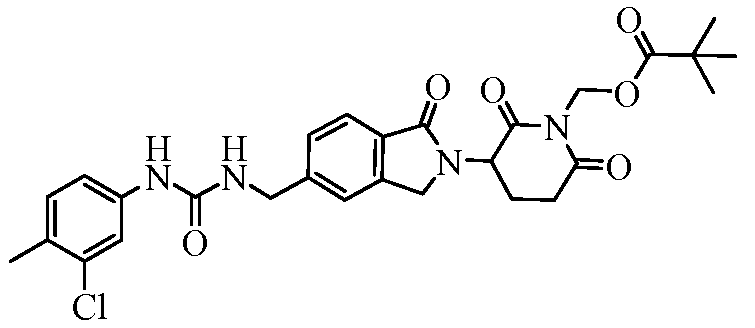
К раствору 1-(3-хлор-4-метилфенил)-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевины (500 мг, 1,134 ммоль) в сухом ДМФА (10 мл) добавляли Cs2CO3 (406 мг, 1,248 ммоль). После 5 мин перемешивания добавляли хлорметилпивалат (188 мг, 1,248 ммоль) и полученную смесь перемешивали при 50°C в течение ночи. Реакционную смесь нейтрализовали с помощью 0,5 н. HCl и затем концентрировали досуха в вакууме. Остаток растворяли в ацетонитриле и медленно добавляли воду, что приводит к формированию осадка. Осадок собирали фильтрованием и растворяли в ДМФА для очистки на колонке для препаративной ВЭЖХ C-18 (50/50 CΗ3CN/вода). Объединяли фракции, содержащие желаемый продукт, концентрировали в вакууме для удаления большей части CH3CN и затем лиофилизовали для получения продукта в виде твердого вещества белого цвета (81 мг, 13% выход). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 55/45 CH3CN/0,1% H3PO4, 4,58 мин (97,2%); Тпл: 155-157°C; 1H ЯМР (ДМСО-d6) δ 0,95-1,23 (м, 9H, tBu), 1,96-2,15 (м, 1H, CH), 2,23 (с, 3H, CH3), 2,31-2,47 (м, 1H, CH), 2,83 (д, J=16,6 Гц, 1H, CH), 3,00-3,22 (м, 1H, CH), 4,17-4,60 (м, 4H, CH2, CH2), 5,30 (дд, J=5,0, 13,3 Гц, 1H, CH), 5,47-5,83 (м, 2H, CH2), 6,79 (т, J=5,9 Гц, 1H, CH2NH), 7,02-7,28 (м, 2H, Ar), 7,36-7,60 (м, 2H, Ar), 7,60-7,86 (м, 2H, Ar), 8,74 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 18,73, 21,56, 26,62, 31,21, 38,21, 42,79, 47,04, 52,01, 63,39, 116,45, 117,66, 121,95, 123,01, 126,98, 127,42, 130,11, 131,00, 132,99, 139,58, 142,36, 144,87, 155,07, 167,96, 170,13, 171,23, 176,51; ЖХ-МС: MH+=555, 557; аналитически вычислено для C28H31C1N4O6 + 0,2 H2O: C, 60,20; H, 5,67; N, 10,03; Cl, 6,35; найдено: C, 60,20; H, 5,74; N, 9,94; Cl, 6,39.
5.49. (3-(5-((3-(3-Хлор-4-метилфенил)уреидо)метил)-1-оксоизоиндолин-2-ил)-2,6-диоксопиперидин-1-ил)метилпиперидин-4-карбоксилата гидрохлорид
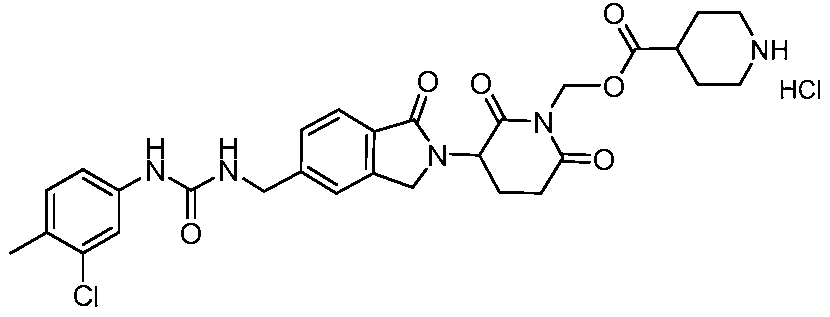
1-трет-Бутил-4-(3-(5-((3-(3-хлор-4-метилфенил)уреидо)метил)-1-оксоизоиндолин-2-ил)-2,6-диоксопиперидин-1-ил)метилпиперидин-1,4-дикарбоксилату (300 мг, 0,44 ммоль, полученному как описано в предыдущем примере) добавляли 2 н. HCl в Et2O (15 мл). Суспензию интенсивно перемешивали в течение 2 ч при комнатной температуре. Осадок отфильтровывали, промывали обильно Et2O и высушивали в вакуумном сушильном шкафу в течение ночи с получением (3-(5-((3-(3-хлор-4-метилфенил)уреидо)метил)-1-оксоизоиндолин-2-ил)-2,6-диоксопиперидин-1-ил)метилпиперидин-4-карбоксилата гидрохлорида в виде твердого вещества белого цвета (285 мг, 105% выход). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 3,26 мин (98,2%); Тпл: 234-236°C; 1H ЯМР (ДМСО-d6) δ 1,62-1,81 (м, 2H, CHH, CHH), 1,87-2,01 (м, 2H, CHH, CHH), 2,02-2,16 (м, 1H, CHH), 2,16-2,29 (м, 3H, CH3), 2,32-2,47 (м, 1H, CHH), 2,59-2,76 (м, 1H, CHH), 2,77-2,99 (м, 3H, CHH, CHH, CHH), 3,00-3,28 (м, 3H, CHH, CHH, CHH), 4,15-4,66 (м, 4H, CH2, CH2), 5,26 (дд, J=4,9, 13,2 Гц, 1H, CH), 5,55-5,80 (м, 2H, CH2O), 7,02 (т, J=5,9 Гц, 1H, NH), 7,09-7,29 (м, 2H, Ar), 7,45 (д, J=7,9 Гц, 1H, Ar), 7,53 (с, 1H, Ar), 7,62-7,82 (м, 2H, Ar), 8,41-8,96 (м, 2H, NH, NH), 9,09 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 18,73, 21,46, 24,31, 31,24, 37,30, 42,00, 42,73, 47,20, 52,09, 63,40, 116,31, 117,50, 121,91, 122,99, 126,97, 127,27, 130,09, 130,99, 132,96, 139,69, 142,38, 144,94, 155,21, 167,96, 170,19, 171,29, 172,20; ЖХ-МС: MH=582, 584; аналитически вычислено для C29H33Cl2N5O6 + 1,6 H2O + 0,6 HCl + 0,2 Et2O + 0,4 tBuCl: C, 53,35; H, 6,05; N, 9,91; Cl, 13,04, найдено: C, 53,13; H, 6,06; N, 9,70; Cl, 13,25.
5.50. 1-Трет-бутил-4-(3-(5-((3-(3-хлор-4-метилфенил)уреидо)метил)-1-оксоизоиндолин-2-ил)-2,6-диоксопиперидин-1-ил)метилпиперидин-1,4-дикарбоксилат
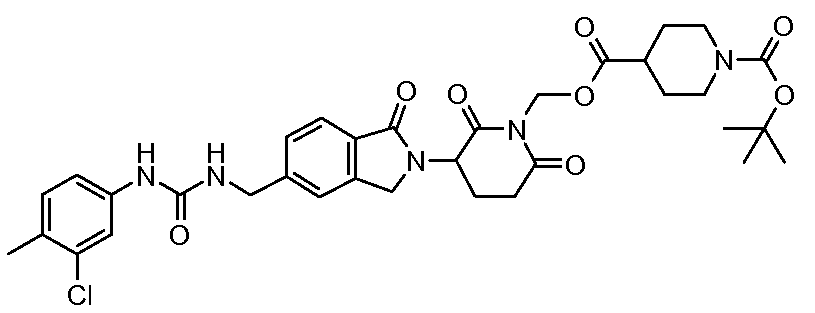
Стадия 1: 1-трет-бутил-4-хлорметилпиперидин-1,4-дикарбоксилат
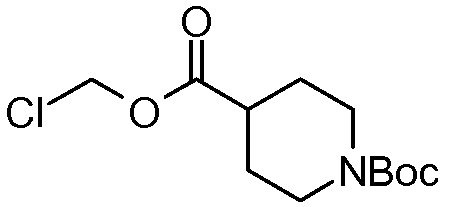
К смеси 1-(трет-бутоксикарбонил)пиперидин-4-карбоновой кислоты (3 г, 13,1 ммоль) в дихлорметане (40 мл) и воды (50 мл) добавляли NaHCO3 (4,4 г, 52,3 ммоль) и тетра-бутиламмоний гидросульфат (444 мг, 1,3 ммоль). После перемешивания смеси на бане со льдом при 0°C в течение ~10 мин по каплям добавляли хлорметилхлорсульфат (2,59 г, 15,7 ммоль) в 10 мл дихлорметана. Реакционной смеси позволяли нагреться до комнатной температуры и перемешивали интенсивно в течение ночи. Смесь переносили в делительную воронку с дихлорметаном и водой (по 200 мл каждого). Органический слой промывали дополнительно водой и насыщенным раствором соли, высушивали (Na2SO4) и концентрировали в вакууме с получением 1-трет-бутил-4-хлорметилпиперидин-1,4-дикарбоксилата в виде прозрачного масла (3,5 г, выход 96%). Данное вещество использовали без дополнительной очистки. 1H ЯМР (ДМСО-d6) δ 1,26-1,48 (м, 11H, CHH, CHH, трет-Bu), 1,83 (дд, J=3,0, 13,2 Гц, 2H, CHH, CHH), 2,58-2,75 (м, 1H, CH), 2,74-2,99 (м, 2H, CHH, CHH), 3,61-4,02 (м, 2H, CHH, CHH), 5,87 (с, 2H, CH2O); 13C ЯМР (ДМСО-d6) δ 27,16, 27,98, 39,58, 42,35, 69,41, 78,67, 153,75, 172,25; ЖХ-МС: MH=278.
Стадия 2: 1-трет-бутил-4-йодметилпиперидин-1,4-дикарбоксилат
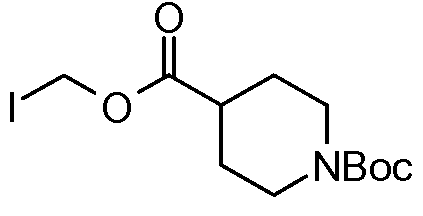
К раствору NaI (1,6 г, 11,09 ммоль) в сухом ацетонитриле (8 мл) добавляли по каплям 1-трет-бутил-4-хлорметилпиперидин-1,4-дикарбоксилат (2,8 г, 10,08 ммоль) в 2 мл ацетонитрила. Смесь становилась темно-оранжевой и ее перемешивали при комнатной температуре в темноте в течение 24 ч. Реакционную смесь фильтровали для удаления NaCl и фильтрат концентрировали в вакууме. Оставшийся остаток перераспределяли между ДХМ и 5% водным раствором NaHSO3. Органический слой промывали водой и насыщенным раствором соли, высушивали (Na2SO4) и концентрировали в вакууме с получением 1-трет-бутил-4-йодметилпиперидин-1,4-дикарбоксилата в виде бледно-желтого масла (3,5 г, 94%). Попытки охарактеризовать методом ЯМР в ДМСО-d6 приводили к быстрому разложению. Вещество хранили в темноте при -20°C для минимизации разложения перед использованием. ЖХ-МС: MH = 370.
Стадия 3: 1-трет-бутил-4-(3-(5-((3-(3-хлор-4-метилфенил)уреидо)метил)-1-оксоизоиндолин-2-ил)-2,6-диоксопиперидин-1-ил)метилпиперидин-1,4-дикарбоксилат
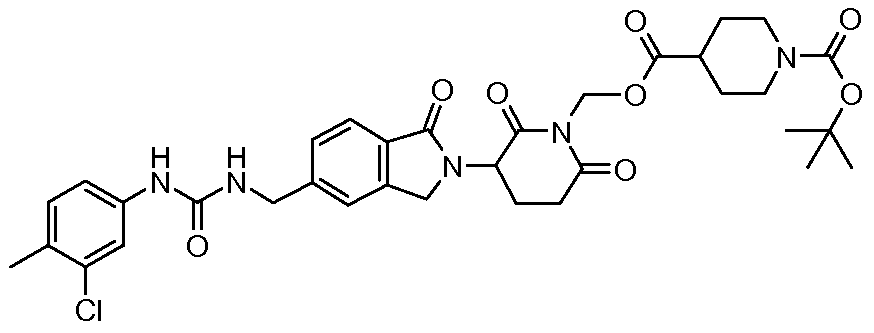
1-(3-Хлор-4-метилфенил)-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевину (400 мг, 0,907 ммоль) и NaH (43,5 мг, 1,82 ммоль) перемешивали в сухом ДМФА (15 мл) в течение ~10 мин. К смеси добавляли 1-трет-бутил-4-йодметилпиперидин-1,4-дикарбоксилат (402 мг, 1,09 ммоль) и реакцию перемешивали в темноте при комнатной температуре в течение 2 ч. Реакцию гасили с помощью уксусной кислоты (5 мл) и концентрировали в вакууме. Осадок распределяли между водой и EtOAc (по 100 мл каждого). Отделенный органический слой промывали дополнительно водой и насыщенным раствором соли, высушивали (Na2SO4) и концентрировали в вакууме с получением 1,4 г желтоватого твердого вещества, которое растворяли в ДМФА для очистки на колонке C-18 для препаративной ВЭЖХ. Объединяли фракции, содержащие желаемый продукт, концентрировали в вакууме для удаления большей части CH3CN и затем лиофилизовали с получением 1-трет-бутил-4-(3-(5-((3-(3-хлор-4-метилфенил)уреидо)метил)-1-оксоизоиндолин-2-ил)-2,6-диоксопиперидин-1-ил)метилпиперидин-1,4-дикарбоксилата в виде твердого вещества белого цвета (380 мг, 49% от теоретического выхода из двух отдельных реакций, которые объединяли перед препаративной ВЭЖХ). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 55/45 CH3CN/0,1% H3PO4, 5,82 мин (99,4%); Тпл: 157-159°C; 1H ЯМР (ДМСО-d6) δ 1,23-1,51 (м, 11H, (CH3)3, CHH, CHH), 1,68-1,84 (м, 2H, CHH, CHH), 1,97-2,13 (м, 1H, CHH), 2,15-2,31 (м, 4H, CH3, CH), 2,32-2,46 (м, 1H, CHH), 2,68-2,94 (м, 3H, CHH, CHH, CHH), 2,98-3,21 (м, 1H, CHH), 3,69-3,89 (м, 2H, CHH, CHH), 4,20-4,57 (м, 4H, CH2, CH2), 5,27 (дд, J=5,0, 13,3 Гц, 1H, CH), 5,53-5,73 (м, 2H, CH2O), 6,81 (т, J=5,9 Гц, 1H, NH), 7,06-7,24 (м, 2H, Ar), 7,45 (д, J=7,9 Гц, 1H, Ar), 7,53 (с, 1H, NH), 7,67 (д, J=1,9 Гц, 1H, Ar), 7,71 (д, J=7,7 Гц, 1H, Ar), 8,76 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 18,66, 21,39, 27,38, 27,97, 31,16, 42,72, 47,08, 51,98, 63,15, 78,60, 116,37, 117,60, 121,88, 122,93, 126,91, 127,34, 130,06, 130,94, 132,91, 139,52, 142,32, 144,82, 153,74, 155,01, 167,90, 170,11, 171,18, 172,97 (два сигнала в 13C от кольца пиперидина не наблюдали из-за перекрывания с ДМСО-d6); ЖХ-МС: MH=682, 684; аналитически вычислено для C34H40ClN5O8 + 1,0 H2O: C, 58,32; H, 6,05; N, 10,00; Cl, 5,06, найдено: C, 58,41; H, 5,93; N,9,96; Cl, 5,22.
5.51. N-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-4-имидазол-1-илбензамид
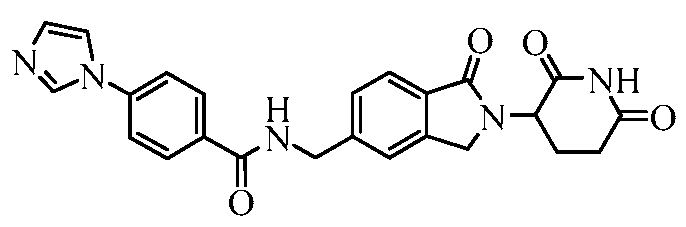
Смесь 4-имидазол-1-илбензойной кислоты (0,21 г, 1,1 ммоль) и КДИ (0,19 г, 1,2 ммоль) в ДМФА (14 мл) перемешивали при 40°C в течение 2 ч. К суспензии добавляли соль 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой (0,40 г, 1,1 ммоль) и смесь перемешивали при 40°C в течение 20 ч. К реакционной смеси добавляли воду (20 мл) и смесь перемешивали при комнатной температуре в течение 30 мин. Суспензию фильтровали и осадок промывали водой (20 мл), этилацетатом (20 мл) и водой (20 мл) с получением продукта в виде твердого вещества белого цвета (340 мг, выход 71%). ВЭЖХ: Waters Xterra C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент 5%-95% в течение 5 мин, CH3CN/0,1% NH4OOCH, 3,92 мин (99,0%); Тпл: 268-270°C; 1H ЯМР (ДМСО-d6) δ 1,90-2,08 (м, 1H, CHH), 2,24-2,47 (м, 1H, CHH), 2,54-2,67 (м, 1H, CHH), 2,82-3,02 (м, 1H, CHH), 4,31 (д, J=17,4 Гц, 1H, CHH), 4,45 (д, J=17,4 Гц, 1H, CHH), 4,62 (д, J=5,7 Гц, 2H, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, NCH), 7,14 (с, 1H, Ar), 7,49 (д, J=7,9 Гц, 1H, Ar), 7,56 (с, 1H, Ar), 7,71 (д, J=7,7 Гц, 1H, Ar), 7,77-7,91 (м, 3H, Ar), 8,05 (д, J=8,7 Гц, 2H, Ar), 8,39 (с, 1H, Ar), 9,24 (т, J=5,9 Гц, 1H, NH), 10,98 (ушир.с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,49, 31,20, 42,79, 47,13, 51,58, 117,78, 119,59, 122,10, 122,97, 127,08, 129,02, 130,20, 130,39, 132,07, 135,60, 138,99, 142,40, 143,83, 165,25, 167,92, 170,99, 172,86; ЖХ-МС: MH+=444; аналитически вычислено для C24H21N5O4 + 1,5 H2O: C, 61,27; H, 5,14; N, 14,89; найдено: C, 61,03; H, 4,93; N, 14,75.
5.52. N-[2-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-4-морфолин-4-илбензамид
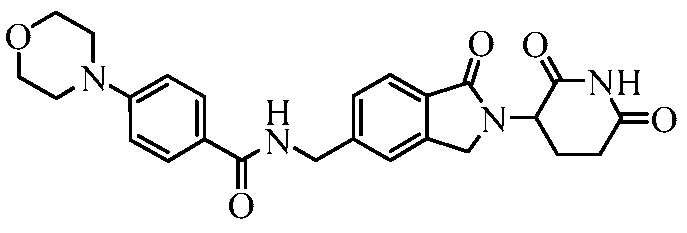
Смесь 4-морфолин-4-илбензойной кислоты (0,22 г, 1,1 ммоль) и КДИ (0,19 г, 1,2 ммоль) в ДМФА (4 мл) перемешивали при 40°C в течение 2 ч. К суспензии добавляли соль 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой (0,40 г, 1,1 ммоль) и смесь перемешивали при 40°C в течение 2 ч. К реакционной смеси добавляли воду (20 мл) и смесь перемешивали при комнатной температуре в течение 30 мин. Суспензию фильтровали и осадок промывали водой (20 мл), этилацетатом (20 мл) и водой (20 мл) с получением продукта в виде белого твердого вещества (370 мг, выход 74%). ВЭЖХ: Waters Xterra C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент 5%-95% в течение 5 мин, CH3CN/0,1% NH4OOCH, 1,10 мин (96,5%); Тпл: 275-277°C; 1H ЯМР (ДМСО-d6) δ 2,00 (д, J=5,1 Гц, 1H, CHH), 2,38 (м, 1H, CHH), 2,54-2,66 (м, 1H, CHH), 2,81-3,01 (м, 1H, CHH), 3,15-3,28 (м, 4H, CH2, CH2), 3,65-3,80 (м, 4H, CH2, CH2), 4,30 (д, J=17,4 Гц, 1H, CHH), 4,44 (д, J=17,6 Гц, 1H, CHH), 4,56 (д, J=5,9 Гц, 2H, CH2), 5,10 (дд, J=5,1, 13,2 Гц, 1H, NCH), 6,98 (д, J=9,1 Гц, 2H, Ar), 7,45 (д, J=7,9 Гц, 1H, Ar), 7,51 (с, 1H, Ar), 7,68 (д, J=7,9 Гц, 1H, Ar), 7,81 (д, J=8,9 Гц, 2H, Ar), 8,88 (с, 1H, NH), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,46, 31,15, 42,54, 47,07, 47,33, 51,53, 65,86, 113,40, 121,96, 122,86, 123,72, 126,99, 128,50, 130,24, 142,31, 144,38, 152,95, 165,87, 167,91, 170,96, 172,83; ЖХ-МС: MH+=463; аналитически вычислено для C25H26N4O5 + 0,6 H2O: C, 63,44; H, 5,79; N, 11,84; найдено: C, 63,19; H, 5,42; N, 12,09.
5.53. 2-Амино-2-(4-хлорфенил)-N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)ацетамида гидрохлорид
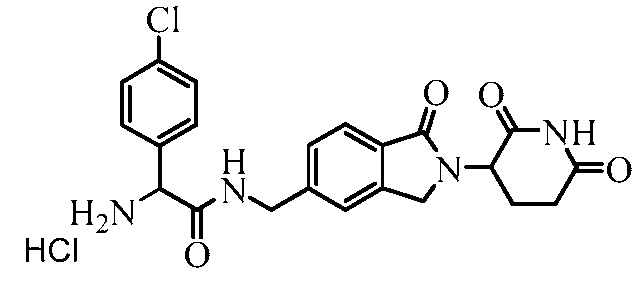
Стадия 1: К перемешиваемому раствору N-Boc-(4'-хлорфенил)глицина (1,16 г, 4,10 ммоль) в ДМФА (20 мл) добавляли КДИ (0,69 г, 4,30 ммоль). Реакционную смесь нагревали до 40°C в течение 2 ч. Затем добавляли 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона гидрохлорид (1,50 г, 4,10 ммоль). Через 3,5 ч при 40°C добавляли воду (70 мл). Осажденное твердое вещество отделяли фильтрованием, промывали водой (3×20 мл) и сушили в вакууме с получением трет-бутил-1-(4-хлорфенил)-2-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метиламино)-2-оксоэтилкарбамата в виде твердого вещества белого цвета (1,77 г, выход 80%). Неочищенный продукт использовали на следующей стадии без дополнительной очистки.
Стадия 2: К перемешиваемому раствору трет-бутил-1-(4-хлорфенил)-2-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метиламино)-2-оксоэтилкарбамата (0,84 г, 1,50 ммоль) в EtOAc (35 мл) добавляли разбавленный раствор HCl (2н. в простом эфире, 30 мл). Через 3 дня осадок отделяли фильтрованием, промывали диэтиловым эфиром (3×10 мл) и сушили в вакууме. Твердое вещество растворяли в воде (100 мл) и экстрагировали EtOAc (2×50 мл). Водную фазу концентрировали и остаток растирали с простым эфиром в течение 1 ч. Продукт отделяли фильтрованием и сушили в вакууме с получением продукта в виде твердого вещества белого цвета (0,65 г, выход 88%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент CH3CN/0,1% H3PO4: 10/90-90/10 в течение 10 мин, 90/10 (5 мин), 4,91 мин (98,00%); Тпл: 255-257°C; 1H ЯМР (ДМСО-d6) δ 1,93-2,09 (м, 1H, CHH), 2,39 (квд, J=4,4, 13,1 Гц, 1H, CHH), 2,54-2,69 (м, 1H, CHH), 2,82-3,03 (м, 1H, CHH), 4,24 (д, J=17,4 Гц, 1H, CHH), 4,30-4,54 (м, 3H, CH2, CHH), 5,02-5,19 (м, 2H, CH, CH), 7,22-7,41 (м, 2H, Ar), 7,47-7,71 (м, 5H, Ar), 9,35 (т, J=5,9 Гц, 1H, NH), 10,99 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,48, 31,20, 42,26, 47,03, 51,59, 54,80, 121,89, 121,96, 122,85, 126,97, 128,80, 129,81, 130,49, 133,02, 133,99, 142,27, 142,70, 167,22, 167,82, 170,98, 172,85; ЖХ-МС: MH+=441/443; аналитически вычислено для C22H22N4O4Cl2 + 0,6 H2O: C, 54,13; H, 4,79; N, 11,48; найдено: C, 53,89; H, 4,82; N, 11,60.
5.54. 2-Амино-5-хлор-N-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]бензамид
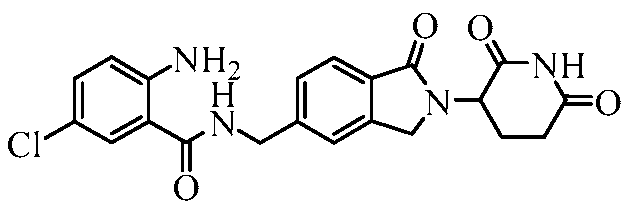
ДИПЭА (1,46 мл, 8,12 ммоль) добавляли к перемешиваемой смеси 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона метансульфоната (1,0 г, 2,71 ммоль) и 5-хлоризатового ангидрида 3 (0,535 г, 2,71 ммоль) в ацетонитриле (10 мл) в атмосфере азота. Реакционную смесь нагревали до кипения с обратным холодильником в течение 14 ч, на этот момент ЖХ-МС показала завершение реакции. К суспензии добавляли воду и осадок собирали фильтрованием, промывали дополнительно водой и сушили в вакууме с получением продукта в виде белого твердого вещества (860 мг, выход 74%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 6,30 мин (98,7%); Тпл: 242-244°C; 1H ЯМР (ДМСО-d6) δ 1,79-2,16 (м, 1H, CHH), 2,29-2,46 (м, 1H, CHH), 2,60 (д, J=16,6 Гц, 1H, CHH), 2,74-3,08 (м, 1H, CHH), 4,08-4,69 (м, 4H, CH2, CH2), 5,11 (дд, J=4,9, 13,2 Гц, 1H, CH), 6,60 (с, 2H, NH2), 6,73 (д, J=8,7 Гц, 1H, Ar), 7,18 (дд, J=2,4, 8,8 Гц, 1H, Ar), 7,46 (д, J=7,9 Гц, 1H, Ar), 7,53 (с, 1H, Ar), 7,59-7,76 (м, 2H, Ar), 9,01 (т, J=5,8 Гц, 1H, NH), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,51, 31,20, 42,44, 47,12, 51,56, 114,81, 117,71, 118,12, 122,07, 122,91, 127,07, 127,33, 130,35, 131,60, 142,38, 143,92, 148,78, 167,67, 167,92, 170,98, 172,85; ЖХ-МС: MH+=427, 429; аналитически вычислено для C21H19ClN4O4 + 0,2H2O: C, 58,73; H, 4,32; N, 13,05; найдено: C, 58,68; H, 4,26; N, 12,80.
5.55. Изоиндолиновые соединения
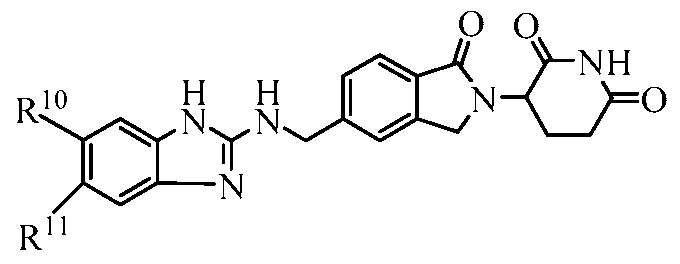
Изоиндолиновые соединения, представленные выше, получали по Схеме 2.
Схема 2
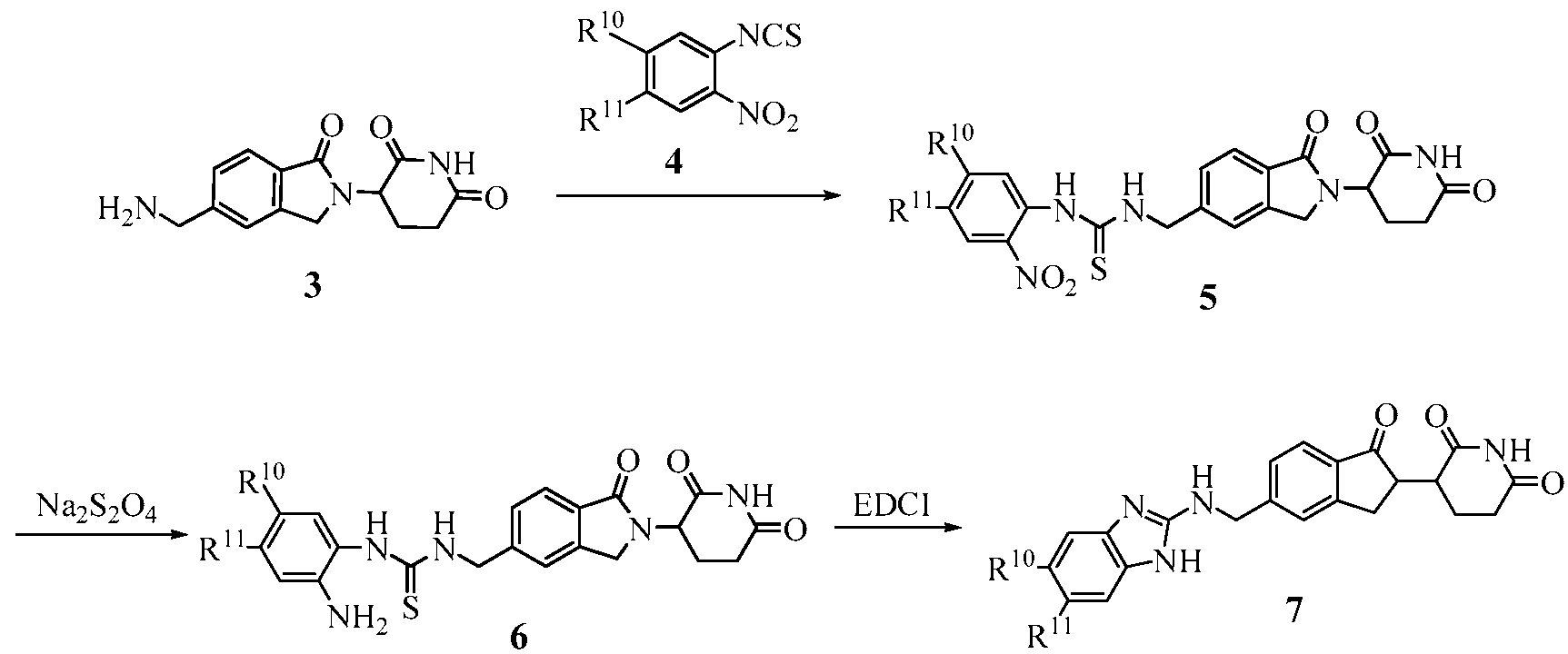
Стадия 1: Добавляли ДИПЭА (2,0 ммоль, 2 экв.) к перемешиваемой смеси 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-дион метансульфоната 3 (0,26 г, 1,0 ммоль) и соответствующий нитрофенилизотиоцианат 4 (1,1 ммоль) в ацетонитриле (10 мл) в атмосфере азота. Смесь перемешивали при комнатной температуре в течение 12 ч. Добавляли 1н. раствор HCl (10 мл) и полученный осадок фильтровали, промывали дополнительно водой и высушивали с получением замещенной 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(2-нитрофенил)тиомочевины 5.
Стадия 2: К перемешиваемой смеси данного промежуточного соединения 5 (1,0 ммоль) в EtOH (10 мл) добавляли раствор натрия дитионата (1,74 г, 10 ммоль) в воде (10 мл). Смесь нагревали до 60°C в течение 1 ч. Реакционную смесь концентрировали досуха с получением соединения 6, которое использовали непосредственно на следующей стадии без дополнительной очистки.
Стадия 3: Соединение 6 суспендировали в ДМФА и добавляли ЭДКИ (EDCI, N-этил-N'-(3-диметиламинопропил)карбодиимид, 0,19 г, 1,0 ммоль). Смесь перемешивали в течение ночи и реакционную смесь гасили, добавляя уксусную кислоту (2 мл). Сырой продукт очищали, используя препаративную ВЭЖХ, с получением соединения 7.
5.56. Изоиндолиновые соединения
Следуя методикам, представленным в разделах 5.34-5.35, получали 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(2-гидрокси-4,5-диметилфенил)мочевину, используя в качестве исходного вещества 4,5-диметил-2-нитрофенол.
Общая методика A: Смесь соответствующей исходной карбоновой кислоты (2,0 ммоль) и КДИ (0,32 г, 2,0 ммоль) в ДМФА (30 мл) перемешивали в течение 2 часов при 40°C и затем добавляли 3-(5-(аминометил)-1-оксоизоиндолин-2-ил)пиперидин-2,6-диона метансульфонат (0,74 г, 2,0 ммоль) и продолжали перемешивать в течение 24 часов. Смесь упаривали под вакуумом и остаток очищали препаративной ВЭЖХ.
Используя общую методику A, получали следующие соединения:
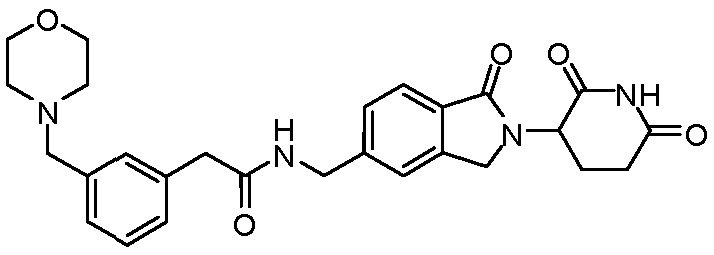
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-2-(3-(морфолинометил)фенил)ацетамид;
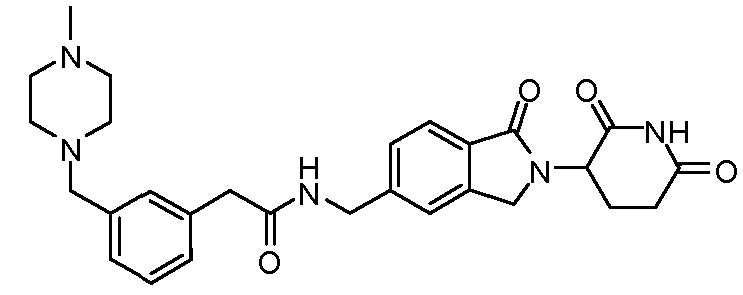
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-2-(3-((4-метилпиперазин-1-ил)метил)фенил)ацетамид;
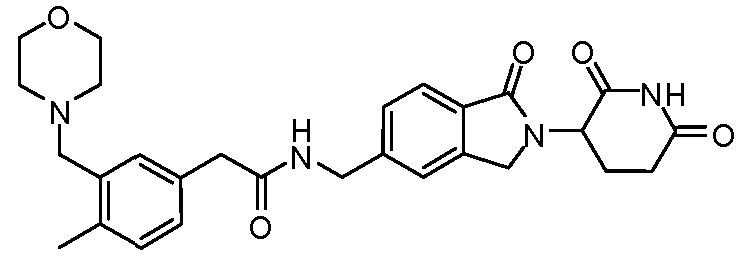
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-2-(4-метил-3-(морфолинометил)фенил)ацетамид;
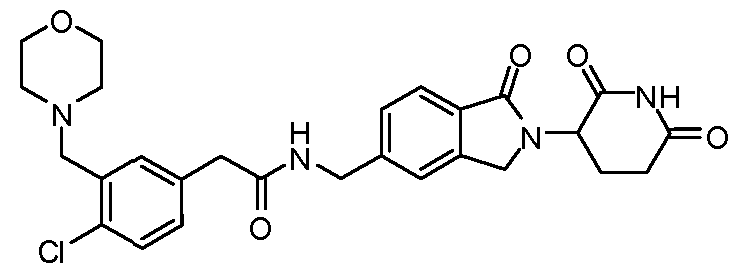
2-(4-хлор-3-(морфолинометил)фенил)-N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)ацетамид;
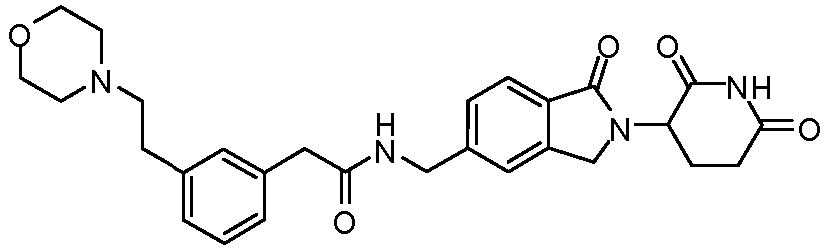
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-2-(3-(2-морфолиноэтил)фенил)ацетамид;
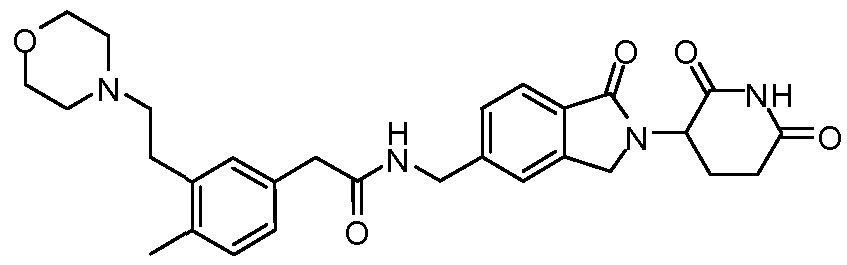
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-2-(4-метил-3-(2-морфолиноэтил)фенил)ацетамид;
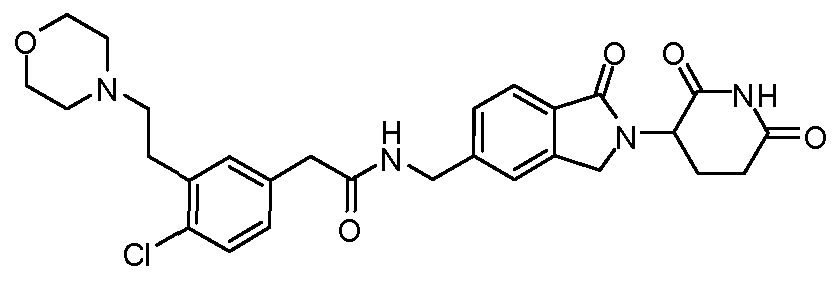
2-(4-хлор-3-(2-морфолиноэтил)фенил)-N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)ацетамид;
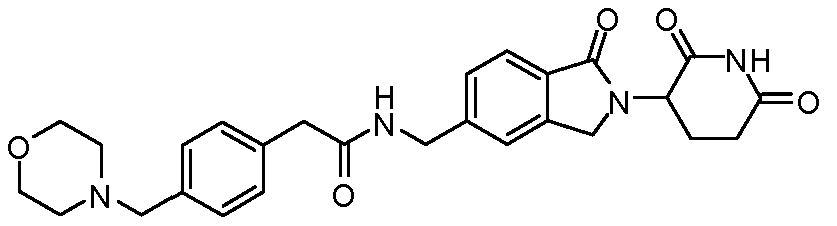
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-2-(4-(морфолинометил)фенил)ацетамид;
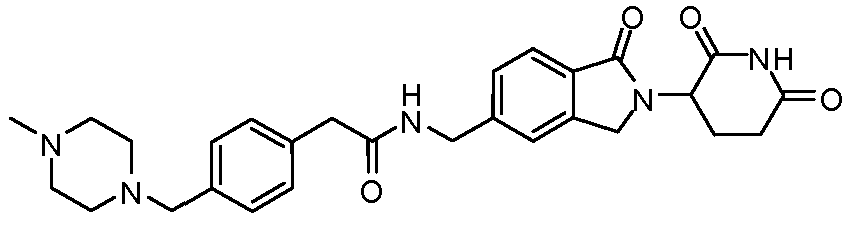
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-2-(4-((4-метилпиперазин-1-ил)метил)фенил)ацетамид;
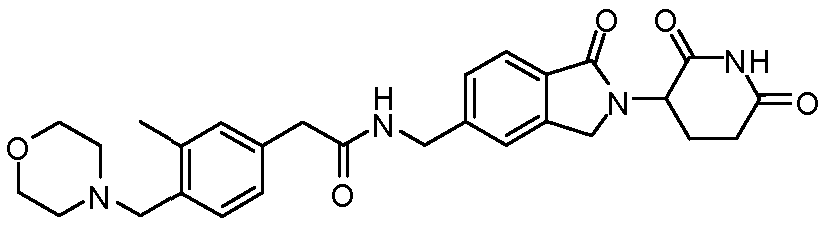
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-2-(3-метил-4-(морфолинометил)фенил)ацетамид;
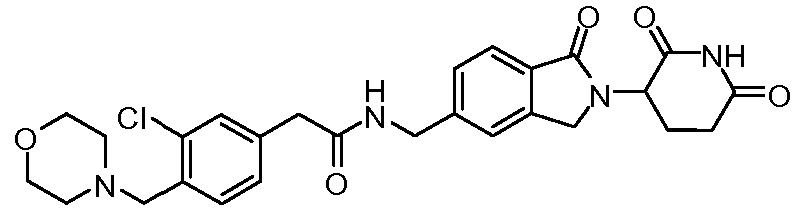
2-(3-хлор-4-(морфолинометил)фенил)-N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)ацетамид;
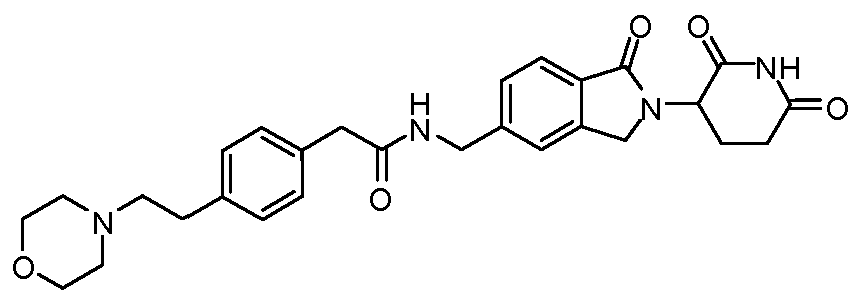
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-2-(4-(2-морфолиноэтил)фенил)ацетамид;
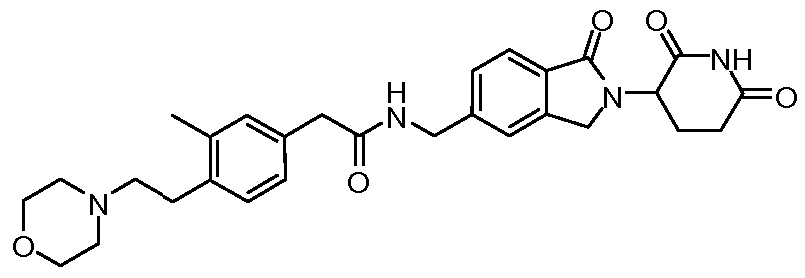
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-2-(3-метил-4-(2-морфолиноэтил)фенил)ацетамид;
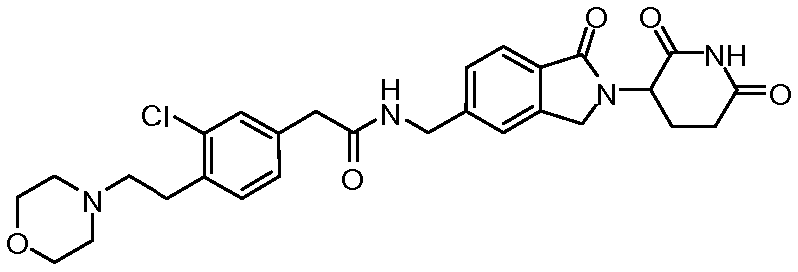
2-(3-хлор-4-(2-морфолиноэтил)фенил)-N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)ацетамид;
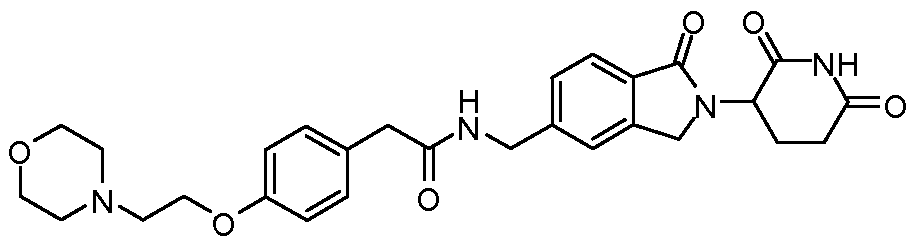
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-2-(4-(2-морфолиноэтокси)фенил)ацетамид;
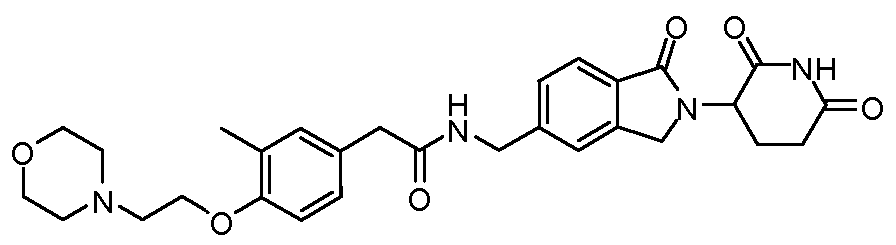
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-2-(3-метил-4-(2-морфолиноэтокси)фенил)ацетамид;
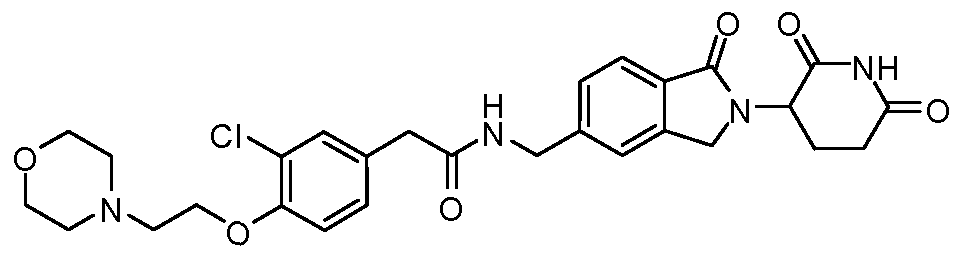
2-(3-хлор-4-(2-морфолиноэтокси)фенил)-N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)ацетамид;
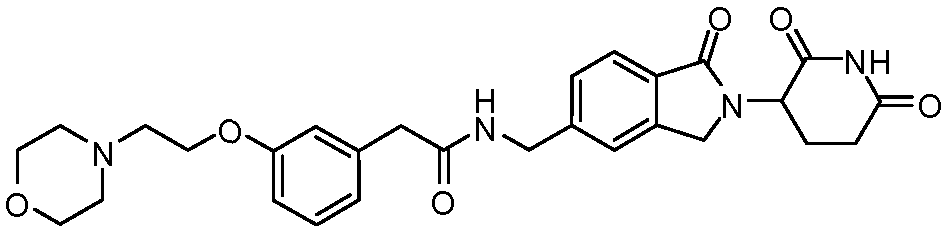
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-2-(3-(2-морфолиноэтокси)фенил)ацетамид;
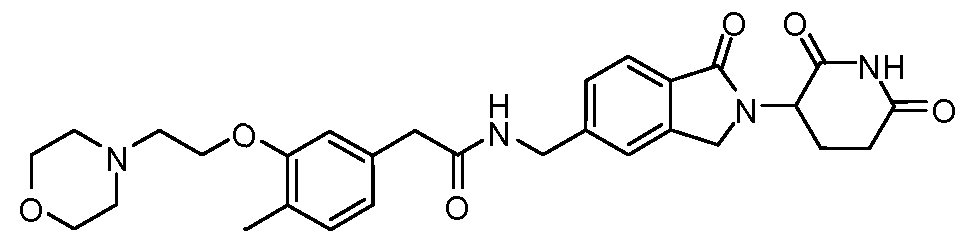
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-2-(4-метил-3-(2-морфолиноэтокси)фенил)ацетамид;
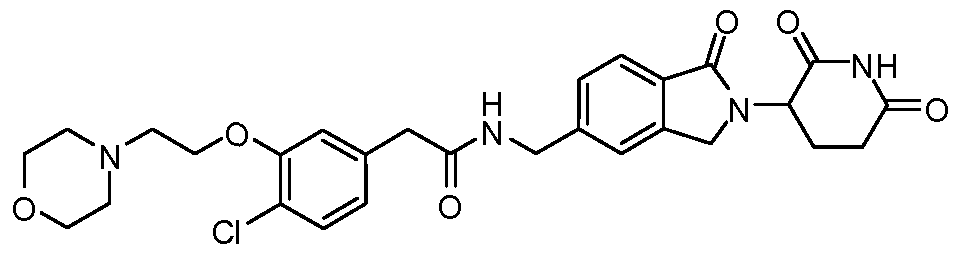
2-(4-хлор-3-(2-морфолиноэтокси)фенил)-N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)ацетамид;
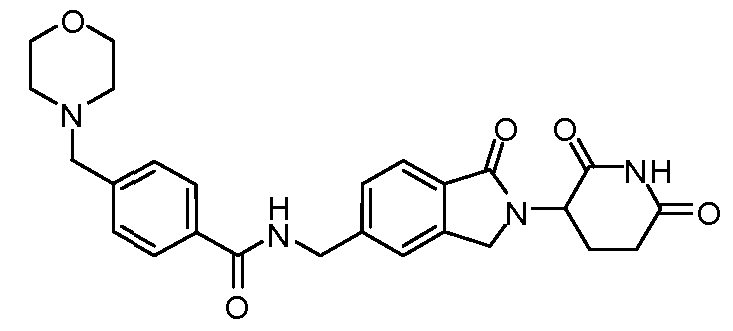
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-4-(морфолинометил)бензамид;
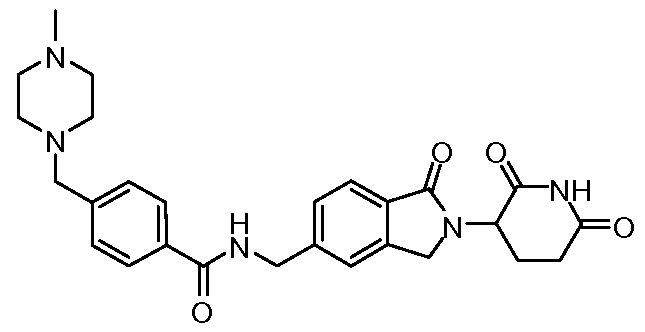
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-4-((4-метилпиперазин-1-ил)метил)бензамид;
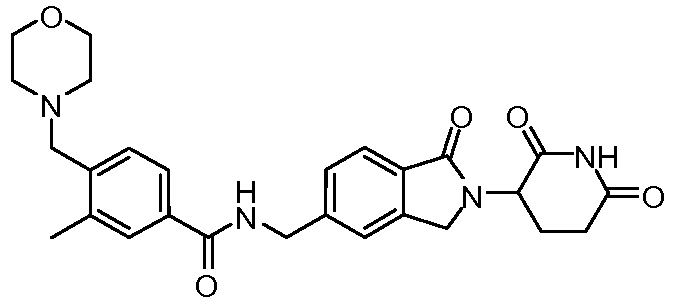
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-метил-4-(морфолинометил)бензамид;
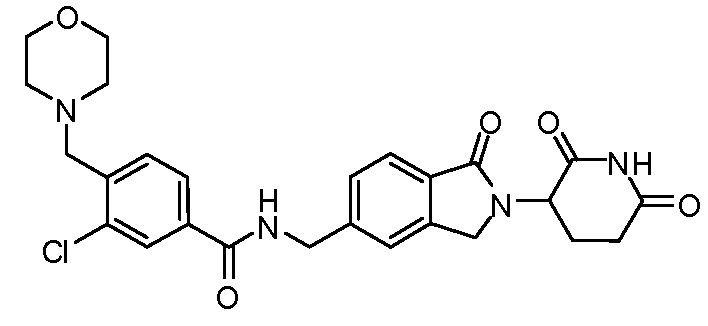
3-хлор-N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-4-(морфолинометил)бензамид;
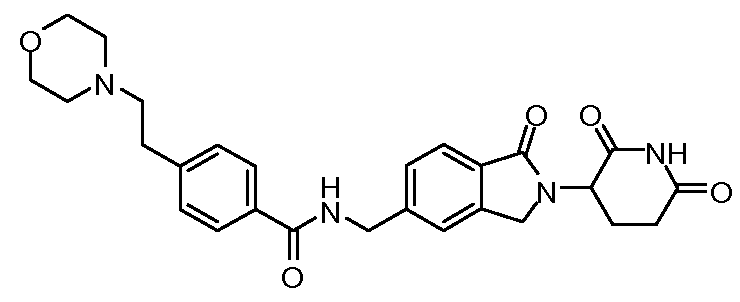
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-4-(2-морфолиноэтил)бензамид;
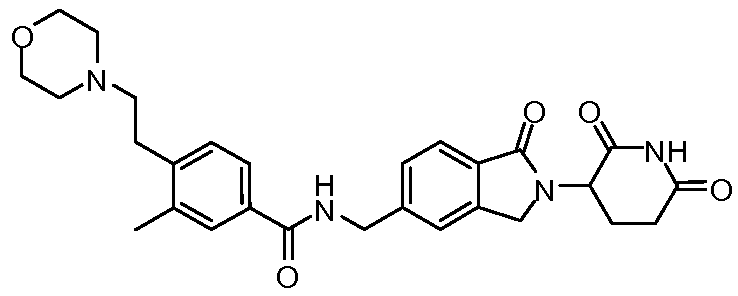
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-метил-4-(2-морфолиноэтил)бензамид;
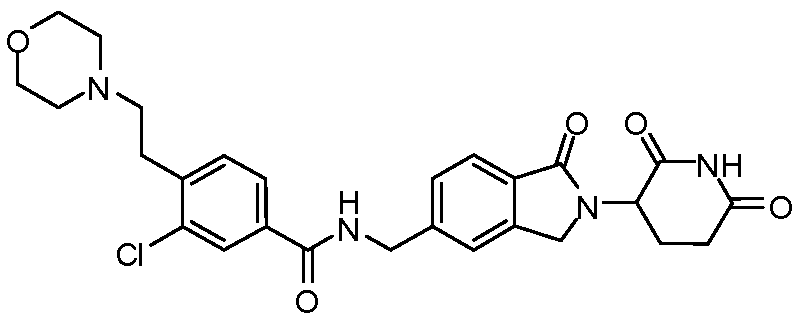
3-хлор-N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-4-(2-морфолиноэтил)бензамид;
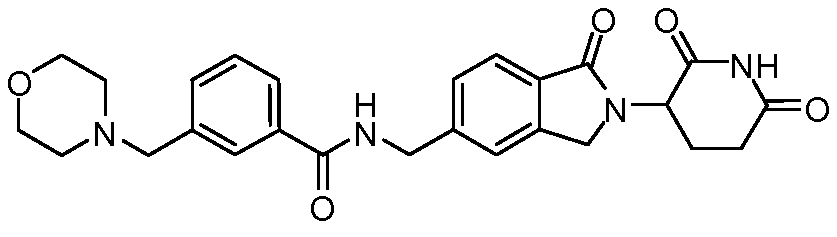
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(морфолинометил)бензамид;
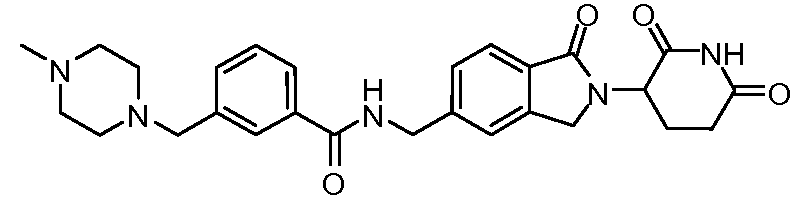
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-((4-метилпиперазин-1-ил)метил)бензамид;
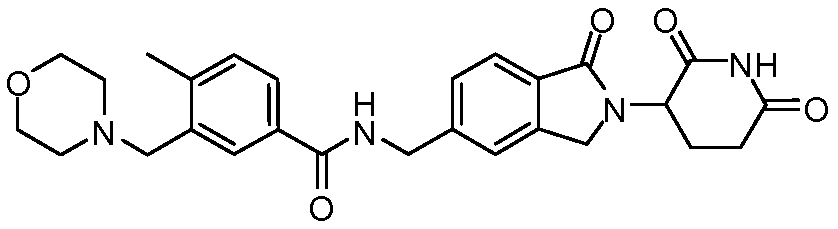
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-4-метил-3-(морфолинометил)бензамид;
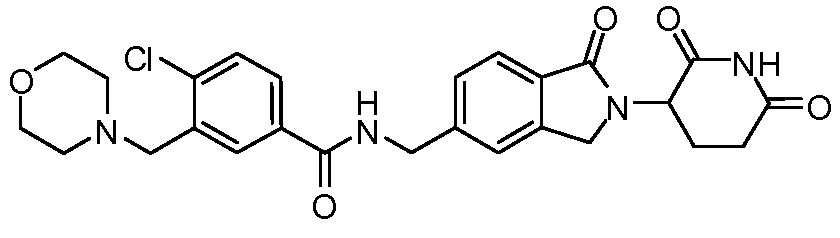
4-хлор-N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(морфолинометил)бензамид;
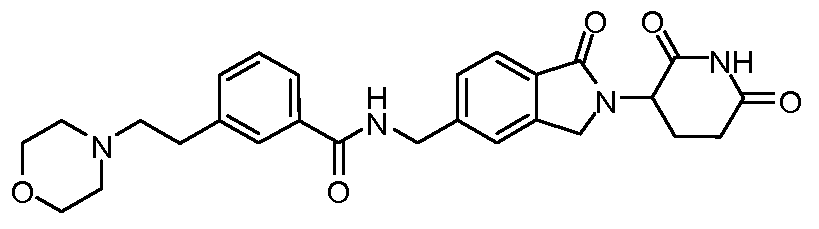
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(2-морфолиноэтил)бензамид;
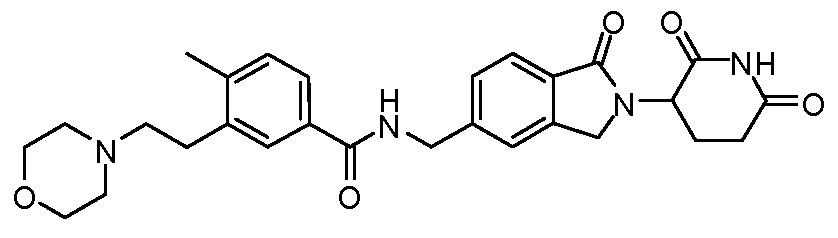
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-4-метил-3-(2-морфолиноэтил)бензамид;
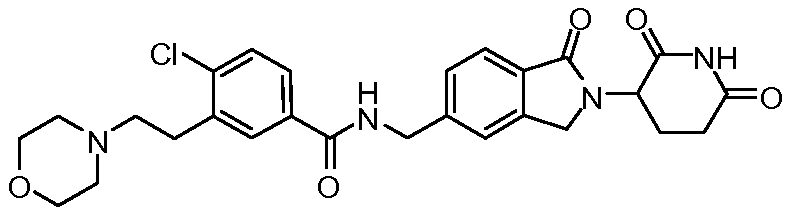
4-хлор-N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(2-морфолиноэтил)бензамид;
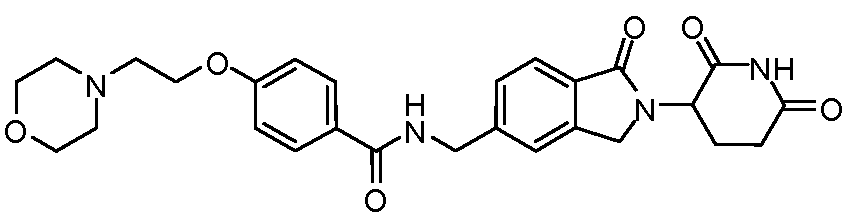
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-4-(2-морфолиноэтокси)бензамид;
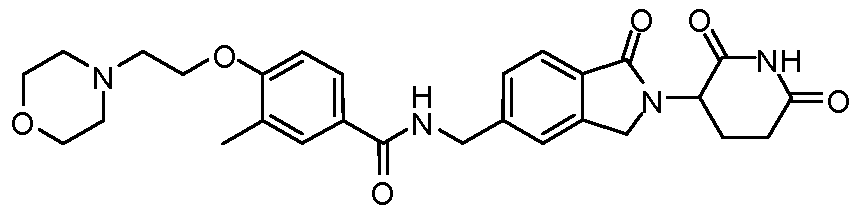
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-метил-4-(2-морфолиноэтокси)бензамид;
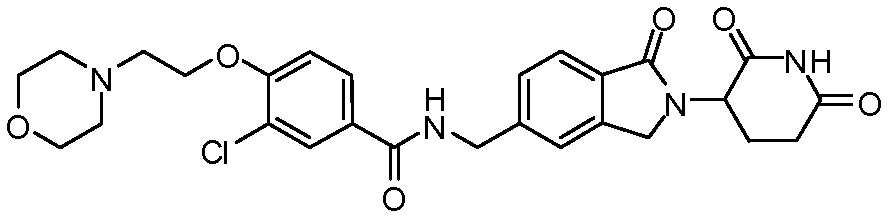
3-хлор-N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-4-(2-морфолиноэтокси)бензамид;
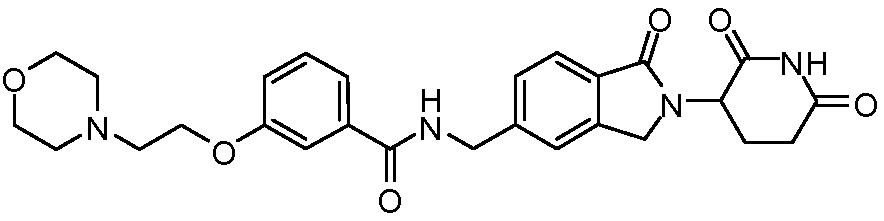
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(2-морфолиноэтокси)бензамид;
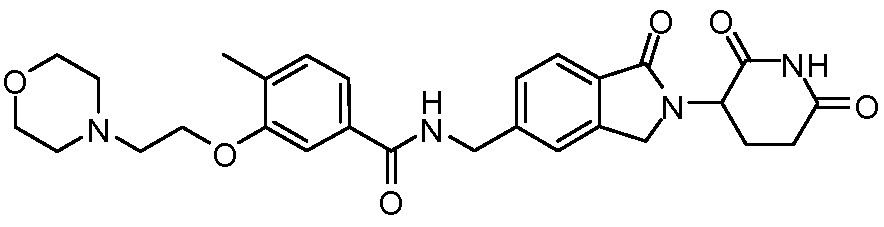
N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-4-метил-3-(2-морфолиноэтокси)бензамид и
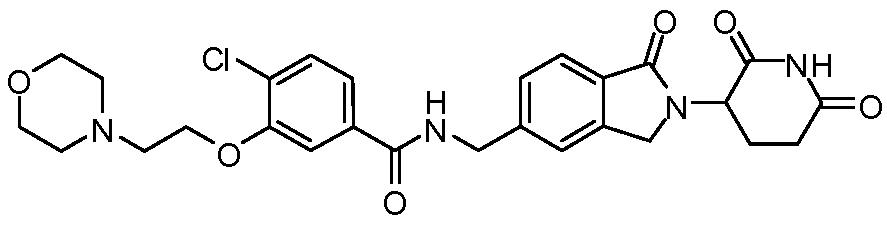
4-хлор-N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(2-морфолиноэтокси)бензамид.
5.57. 3-[5-(6-Хлор-4-оксо-4H-хиназолин-3-илметил)-1-оксо-1,3-дигидроизоиндол-2-ил]пиперидин-2,6-дион
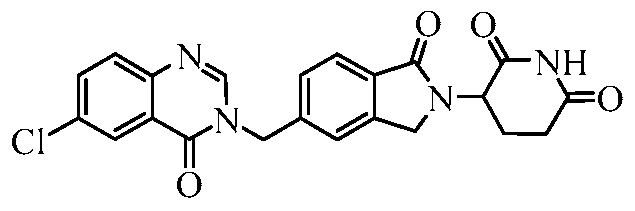
2-Амино-5-хлор-N-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]бензамид (250 мг, 0,586 ммоль) суспедировали в триметилортоформиате (3 мл) и смесь нагревали до 85°C в течение ночи. Добавляли в реакцию муравьиную кислоту (100 л) и смесь нагревали в течение 1 ч. В реакцию добавляли воду, получая белый осадок. Осадок отфильтровывали, промывали дополнительно водой и высушивали в вакуумном сушильном шкафу с получением продукта в виде твердого вещества белого цвета (140 мг, выход 55%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CΗ3CN/0,1% H3PO4, 7,20 мин (97,9%); Тпл: 308-310°C; 1H ЯМР (ДМСО-d6) δ 1,90-2,08 (м, 1H, CHH), 2,37 (квд, J=4,3, 13,2 Гц, 1H, CHH), 2,59 (д, J=17,6 Гц, 1H, CHH), 2,78-3,03 (м, 1H, CHH), 4,23-4,35 (м, 1H, NCHH), 4,38-4,51 (м, 1H, NCHH), 5,10 (дд, J=5,0, 13,1 Гц, 1H, NCH), 5,33 (с, 2H, NCH2), 7,52 (д, J=7,7 Гц, 1H, Ar), 7,59 (с, 1H, Ar), 7,67-7,80 (м, 2H, Ar), 7,88 (дд, J=2,5, 8,7 Гц, 1H, Ar), 8,09 (д, J=2,3 Гц, 1H, Ar), 8,66 (с, 1H, NCHN), 10,98 (с, 1H, CONH); 13C ЯМР (ДМСО-d6) δ 22,45, 31,17, 47,13, 49,20, 51,59, 122,68, 122,91, 123,23, 125,11, 127,56, 129,59, 131,14, 131,50, 134,59, 140,45, 142,59, 146,68, 148,47, 159,20, 167,63, 170,92, 172,82; ЖХ-МС: MH+=437, 439; аналитически вычислено для C22H17C1N4O4 + 0,4 H2O: C, 59,51; H, 4,04; N, 12,62; 7,98, Cl; найдено: C, 59,29; H, 3,66; N, 12,39; 7,82, Cl.
5.58. 6-Хлор-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-1Н-хиназолин-2,4-дион
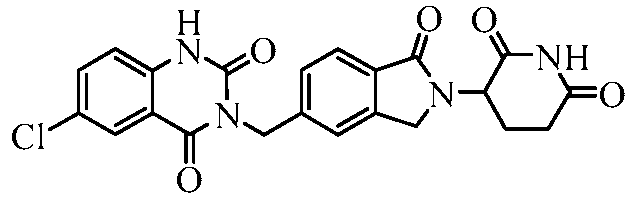
К суспензии 2-амино-5-хлор-N-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]бензамида (250 мг, 0,586 ммоль) в ацетонитриле (5 мл) добавляли ДИПЭА (0,204 мл, 1,171 ммоль), затем фосген (0,62 мл, 1,171 ммоль). Реакционную смесь нагревали до 60°C. Через 4 ч добавляли дополнительно фосген (0,31 мл) и продолжали перемешивание в течение 1 ч, после которого ЖХ-МС показала завершение реакции. Реакционную суспензию гасили с помощью разбавленной HCl, белый осадок собирали фильтрованием и промывали дополнительно водой и обильно Et2O. Осадок высушивали в вакуумном сушильном шкафу с получением продукта в виде твердого вещества белого цвета (185 мг, выход 84%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CΗ3CN/0,1% H3PO4, 7,97 мин (97,6%); Тпл: 358-360°C; 1H ЯМР (ДМСО-d6) δ 1,88-2,07 (м, 1H, CHH), 2,24-2,45 (м, 1H, CHH), 2,53-2,68 (м, 1H, CHH), 2,79-3,01 (м, 1H, CHH), 4,17-4,36 (м, 1H, CHH), 4,36-4,54 (м, 1H, CHH), 5,09 (дд, J=4,9, 13,2 Гц, 1H, CH), 5,19 (с, 2H, PhCH2), 7,24 (д, J=8,7 Гц, 1H, Ar), 7,47 (д, J=7,9 Гц, 1H, Ar), 7,54 (с, 1H, Ar), 7,68 (д, J=7,7 Гц, 1H, Ar), 7,74 (дд, J=2,4, 8,8 Гц, 1H, Ar), 7,89 (д, J=2,3 Гц, 1H, Ar), 10,98 (с, 1H, NH), 11,72 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,46, 31,18, 43,50, 47,12, 51,58, 115,11, 117,49, 122,29, 122,96, 126,37, 126,54, 127,29, 130,65, 135,04, 138,38, 141,17, 142,39, 149,90, 161,08, 167,79, 170,94, 172,83, ЖХ-МС: MH=453, 455; аналитически вычислено для C22H17C1N4O5 + 0,3 H2O: C, 57,66; H, 3,87; N, 12,23; Cl, 7,74; найдено: C, 57,60; H, 3,90; N, 11,97; Cl, 7,72.
5.59. 4-Хлор-3-метилфениловый эфир [2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]карбаминовой кислоты
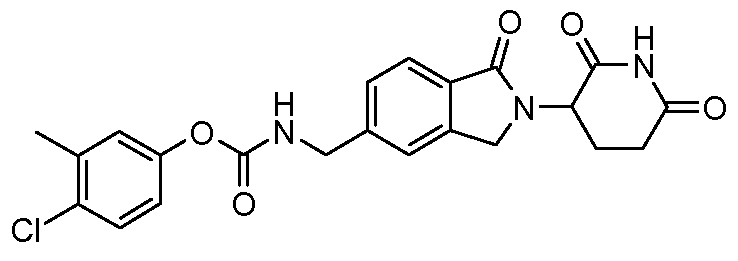
К раствору паранитрофенилхлорформиата (1000 мг, 0,5 ммоль) в CH3CN (5 мл) добавляли по каплям раствор в CH3CN (5 мл) 4-хлор-м-крезола (71,3 мг, 0,5 ммоль) и ДИПЭА (0,24 мл, 1,5 ммоль) при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 10 мин. Добавляли соль 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона с метансульфоновой кислотой (0,37 г, 1 ммоль) с последующим добавлением ДИПЭА (0,24 мл, 1,5 ммоль). Смесь перемешивали в течение ночи при температуре окружающей среды. Смесь затем фильтровали. Полученный осадок очищали на колонке с силикагелем, элюируя с помощью метанола и метиленхлорида, с получением 4-хлор-3-метилфенилового эфира [2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]карбаминовой кислоты в виде твердого вещества белого цвета (30 мг, выход 14%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 50/50, CH3CN/0,1% H3PO4, tR=3,0 мин (97%); Тпл 225-227°C; 1H ЯМР (ДМСО-d6) δ 1,91-2,08 (м, 1H, CHH), 2,32 (с, 3H, CH3), 2,40 (дд, J=4,3, 12,8 Гц, 1H, CHH), 2,63 (ушир.с, 1H, CHH), 2,83-3,02 (м, 1H, CHH), 4,22-4,56 (м, 4H, CH2, CH2), 5,12 (дд, J=5,1, 13,2 Гц, 1H, NCH), 7,01 (дд, J=2,3, 8,7 Гц, 1H, Ar), 7,17 (д, J=2,3 Гц, 1H, Ar), 7,40 (д, J=8,7 Гц, 1H, Ar), 7,46 (д, J=7,4 Гц, 1H, Ar), 7,55 (с, 1H, Ar), 7,72 (д, J=7,9 Гц, 1H, Ar), 8,47 (т, J=6,0 Гц, 1H, NH), 10,99 (с, 1H, NH). 13C ЯМР (ДМСО-d6) δ 19,52, 22,49, 31,20, 44,04, 47,15, 51,59, 121,03, 122,04, 123,04, 124,43, 127,01, 129,33, 130,58, 136,54, 142,45, 143,35, 145,35, 149,62, 154,43, 167,87, 170,99, 172,86; ЖХ-МС: 442; аналитически вычислено для C22H20ClN3O6 C, 59,80; H, 4,56; N, 9,51; найдено: C, 59,74; H, 4,45; N, 9,58.
5.60. 1-[1-(3,4-Дихлорфенил)этил]-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевина
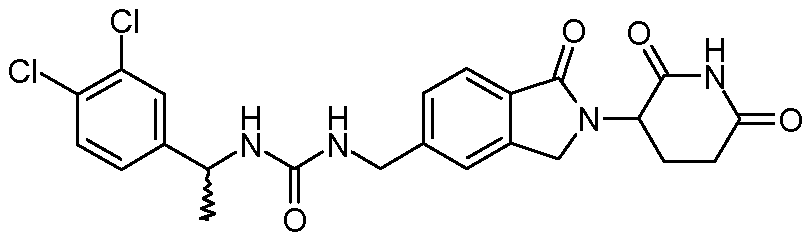
Перемешиваемую смесь 3-(5-аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона метансульфоната (0,37 г, 1,00 ммоль) и КДИ (0,18 г, 1,10 ммоль) в N,N-диметилформамиде (10 мл) нагревали до 40°C в атмосфере азота в течение ночи. Затем добавляли 1-(3,4-дихлорфенил)этиламин (0,19 г, 1,00 ммоль) и смесь нагревали при 40°C в течение ночи. Добавляли воду (60 мл), полученный осадок фильтровали, промывали водой (30 мл) и очищали препаративной ВЭЖХ (градиент CH3CN/H2O: 10/90 в течение 5 мин, до 100/0 в течение 10 мин, 100/0 в течение 5 мин). Растворитель упаривали и остаток растирали в простом эфире (20 мл) в течение 1 ч. Продукт затем выделяли путем фильтрования и сушили в вакууме с получением 1-[1-(3,4-дихлорфенил)этил]-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевины в виде твердого вещества белого цвета (0,084 г, выход 17%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, градиент CH3CN/0,1% H3PO4: 10/90-90/10 в течение 10 мин, 90/10 (5 мин), 8,57 мин (96,68%); Тпл: 200-202°C; 1H ЯМР (ДМСО-d6) δ 1,32 (д, J=7,0 Гц, 3H, CH3), 1,88-2,13 (м, 1H, CHH), 2,28-2,47 (м, 1H, CHH), 2,55-2,70 (м, 1H, CHH), 2,79-3,04 (м, 1H, CHH), 4,18-4,55 (м, 4H, CH2, CH2), 4,74 (квин, J=7,0 Гц, 1H, CH), 5,11 (дд, J=4,9, 13,2 Гц, 1H, CH), 6,51 (с, 1H, NH), 6,66 (д, J=7,9 Гц, 1H, NH), 7,20-7,46 (м, 3H, Ar), 7,48-7,62 (м, 2H, Ar), 7,65 (д, J=7,7 Гц, 1H, Ar), 10,99 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,51, 22,80, 31,20, 42,86, 47,07, 48,18, 51,55, 121,61, 122,81, 126,28, 126,70, 127,78, 128,79, 130,14, 130,38, 130,77, 142,26, 145,29, 147,41, 157,20, 167,95, 170,98, 172,85; ЖХ-МС: MH=489, 491; аналитически вычислено для C23H22N4O4C12 + 0,9 H2O: C, 54,64, H, 4,75, N, 11,08; найдено: C, 54,27, H, 4,66, N, 10,98.
5.61. 1-(3-Хлор-4-(2-(2-метоксиэтокси)этокси)фенил-3-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)мочевина
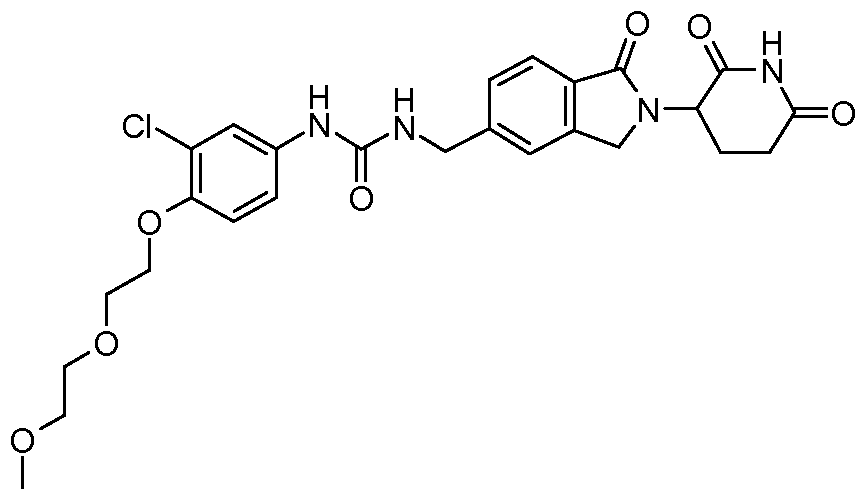
3-(5-Аминометил-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона метансульфонат (1,11 г, 3,0 ммоль) и 1,1'-карбонилдиимидазол (535 мг, 3,3 ммоль) суспендировали в сухом ДМФА (20 мл) и смесь перемешивали при комнатной температуре в течение 24 ч. При перемешивании часть реакционной смеси (6,7 мл, ~1 ммоль) переносили в пробирку, содержащую 3-хлор-4-(2-(2-метоксиэтокси)этокси)анилина гидрохлорид (310 мг, 1,1 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи и протекание реакции контролировали с помощью ЖХ-МС. Через 48 ч в реакционную смесь вносили дополнительно 3-хлор-4-(2-(2-метоксиэтокси)этокси)анилина гидрохлорид (56 мг, 0,2 ммоль) и перемешивание продолжали в течение дополнительных 24 ч. Реакционную смесь подкисляли с помощью 1 н. HCl и добавляли при перемешивании воду до формирования осадка. Осадок собирали фильтрованием, высушивали с отсасыванием, затем растворяли в ДМФА и очищали, используя препаративную ВЭЖХ C-18 с получением 1-(3-хлор-4-(2-(2-метоксиэтокси)этокси)фенил)-3-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)мочевины в виде твердого вещества белого цвета (390 мг, выход 72%). ВЭЖХ: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 5,40 мин (99,8%); Тпл: 188-190°C; 1H ЯМР (ДМСО-d6) δ 1,92-2,10 (м, 1H, CHH), 2,29-2,47 (м, 1H, CHH), 2,60 (дд, J=2,2, 15,4 Гц, 1H, CHH), 2,82-3,01 (м, 1H, CHH), 3,25 (с, 3H, CH3), 3,46 (дд, J=3,7, 5,6 Гц, 2H, CH2), 3,61 (дд, J=3,8, 5,7 Гц, 2H, CH2), 3,73 (д, J=4,7 Гц, 2H, CH2), 4,09 (т, J=4,9 Гц, 2H, CH2), 4,24-4,55 (м, 4H, CH2, CH2), 5,11 (дд, J=5,1, 13,2 Гц, 1H, CH), 6,77 (т, J=5,9 Гц, 1H, NH), 7,04 (д, J=9,1 Гц, 1H, Ar), 7,19 (дд, J=2,5, 9,0 Гц, 1H, Ar), 7,38-7,49 (м, 1H, Ar), 7,51 (с, 1H, Ar), 7,64 (д, J=2,6 Гц, 1H, Ar), 7,69 (д, J=7,7 Гц, 1H, Ar), 8,65 (с, 1H, NH), 10,98 (с, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,51, 31,20, 42,80, 47,12, 51,56, 58,05, 68,80, 68,85, 69,84, 71,29, 114,66, 117,58, 119,49, 121,24, 121,88, 122,91, 126,89, 130,29, 134,53, 142,38, 144,84, 148,40, 155,25, 167,95, 171,01, 172,86; ЖХ-МС: MH=545, 547; аналитически вычислено для C26H29ClN4O7 + 0,4 H2O: C, 56,55; H, 5,44; N, 10,15, найдено: C, 56,64; H, 5,34; N, 10,15.
5.62. Тестирование
5.62.1 Тестирование ингибирования ФНОα в МКПК
Получали моноядерные клетки периферической крови (МКПК, PBMC) от обычных доноров путем центрифугирования в градиенте плотности на Ficoll Hypaque (Pharmacia, Пискатавей, Нью-Джерси, США). Клетки культивировали в RPMI 1640 (Life Technologies, Гранд-Айленд, Нью-Йорк, США), поддержанной 10% AB+ сыворотки человека (Gemini Bio-продукты, Вудленд, Калифорния, США), 2 мМ L-глутамина, 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина (Life Technologies).
МКПК (2×105 клеток) высевали в 96-луночные плоскодонные планшеты для культивирования тканей Costar (Corning, Нью-Йорк, США) в трех повторах. Клетки стимулировали с помощью ЛПС (от Salmonella abortus equi, Sigma, номер по каталогу L-1887,Сент-Льюис, Миссури, США) при 1 нг/мл в конце в отсутствие или в присутствии соединений. Предлагаемые соединения растворяли в ДМСО (Sigma) и осуществляли дополнительное разбавление в культуральной среде непосредственно перед использованием. Конечная концентрация ДМСО во всех образцах составляла 0,25%. Соединения добавляли к клеткам за один час до стимуляции с помощью ЛПС. Клетки затем инкубировали в течение 18-20 часов при 37°C в 5% CO2 и супернатанты затем собирали, разбавляли культуральной средой и проводили количественное определение уровней ФНО-α методом ELISA (Endogen, Бостон, Массачусетс, США). Величины IC50 рассчитывали, используя нелинейную регрессию, сигмоидальную зависимость доза-эффект, стремящуюся сверху к 100% и снизу к 0%, дающую переменный наклон (GraphPad Prism v3.02).
5.62.2. Продукция IL-2 и MIP-3α Т-клетками
Обедняли МКПК адгезивными моноцитами, помещая 1×108 МКПК в 10 мл полной среды (RPMI 1640, поддержанную 10% термоинактивированной эмбриональной бычьей сыворотки, 2 мМ L-глутамина, 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина) на 10-см чашке Петри в инкубатор при 37°C, 5% CO2 на 30-60 мин. Чашки промывали средой для отделения всех неприкрепленных МКПК. Т-клетки очищали путем негативной селекции, используя следующую смесь антител (Pharmingen) и микросфер Dynabead (Dynal) для каждых 1×108 неприкрепленных МКПК: 0,3 мл микросфер с антителами овцы против мышиного IgG, 15 мкл анти-CD16, 15 мкл анти-CD33, 15 мкл анти-CD56, 0,23 мл микросфер с антителами против CD19, 0,23 мл микросфер с антителами против HLA класса II и 56 мкл анти-CD14 микросфер. Клетки и смесь микросфер/антител вращали, переворачивая вверх дном, в течение 30-60 мин при 4°C. Очищенные Т-клетки отделяли от микросфер, используя магнит Dynal. Типичный выход составляет приблизительно 50% Т-клеток, чистота 87-95% CD3+, что оценивается методом проточной цитометрии.
Покрывали 96-луночные плоскодонные планшеты для культивирования тканей анти-CD3 антителом OKT3 при 5 мкг/мл в ФСБ, 100 мкл на лунку, инкубировали при 37°C в течение 3-6 ч, затем промывали 4 раза полной средой 100 мкл/лунка непосредственно перед добавлением Т-клеток. Соединения разводили до 20 раз в конце в круглодонном 96-луночном планшете. Конечные концентрации составляли приблизительно 10 мкМ - приблизительно 0,00064 мкМ. 10 мМ исходный раствор предлагаемых соединений разводили 1:50 полностью для первого 20-кратного разведения для 200 мкМ в 2% ДМСО и разводили серийно 1:5 в 2% ДМСО. Добавляли каждое соединение при 10 мкл на 200 мкл культуры с получением конечной концентрации ДМСО 0,1%. Культуры инкубировали при 37°C, 5% CO2 в течение 2-3 дней и супернатанты анализировали для определения IL-2 и MIP-3α (макрофагальный белок воспаления 3α) методом ELISA (R&D Systems). Уровни IL-2 и MIP-3α нормализовали к количеству, продуцирумому в присутствии количества предлагаемого соединения, и рассчитывали IC50, используя нелинейную регрессию, сигмоидальную зависимость доза-эффект, стремящуюся сверху к 100% и снизу к 0%, дающую переменный наклон (GraphPad Prism v3.02).
5.62.3. Тестирование пролиферации клеток
Линии клеток Namalwa, MUTZ-5 и UT-7 получали от банка данных Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (Брауншвейг, Германия). Линию клеток KG-I получали от Американской коллекции типовых культур (Манассас, Вирджиния, США). Пролиферацию клеток, на что указывает встраивание 3H-тимидина, определяли во всех клеточных линиях следующим образом.
Клетки высевали в среде в 96-луночные планшеты при 6000 клеток на лунку. Клетки предварительно обрабатывали соединениями при приблизительно 100, 10, 1, 0,1, 0,01, 0,001, 0,0001 и 0 мкМ в конечной концентрации ДМСО приблизительно 0,25% в трехкратных повторах при 37°C во влажной камере при 5% CO2 в течение 72 ч. Затем в каждую лунку добавляли один микрокюри 3H-тимидина (Amersham) и клетки инкубировали снова при 37°C во влажной камере при 5% CO2 в течение 6 ч. Клетки собирали на фильтровальных планшетах UniFilter GF/C (Perkin Elmer) с помощью сборщика клеток (Tomtec) и планшеты оставляли сушить в течение ночи. Добавляли Microscint 20 (Packard) (25 мкл/лунка) и планшеты анализировали в устройстве TopCount NXT (Packard). Каждую лунку считывали в течение одной минуты. Процент ингибирования пролиферации клеток рассчитывали, вычисляя среднее из трех повторов, и нормализовали к ДМСО-контролю (0% ингибирования). Каждое соединение тестировали для каждой линии клеток в трех отдельных экспериментах. Окончательное значение IC50 рассчитывали, используя нелинейную регрессию, сигмоидальную зависимость доза-эффект, стремящуюся сверху к 100% и снизу к 0%, дающую переменный наклон (GraphPad Prism v3.02).
5.62.4. Иммунопреципитация и иммуноблоттинг
Клетки Namalwa обрабатывали ДМСО или количеством предлагаемого соединения в течение 1 ч, затем стимулировали с помощью 10 Ед/мл Epo (R&D Systems) в течение 30 мин. Получали лизаты клеток и либо осуществляли иммунопреципитацию с помощью антитела к рецептору Epo, либо сразу разделяли с помощью ДСН-ПААГ-электрофореза. Иммуноблоты зондировали с помощью антител к Akt, фосфо-Akt (Ser473 или Thr308), фосфо-Gab1 (Y627), Gab1, IRS2, актину и IRF-I и анализировали на устройстве для получения изображения Storm 860, используя программное обеспечение ImageQuant (Molecular Dynamics).
5.62.5. Анализ клеточного цикла
Клетки обрабатывали ДМСО или количеством предлагаемого соединения в течение ночи. Осуществляли окрашивание пропидиум йодидом для определения клеточного цикла, используя CycleTEST PLUS (Becton Dickinson) в соответствии с протоколом производителя. После прокрашивания клетки анализировали в проточном цитометре FACSCalibur, используя программное обеспечение ModFit LT (Becton Dickinson).
5.62.6. Оценка апоптоза
Клетки обрабатывали ДМСО или количеством предлагаемого соединения в течение различных промежутков времени, затем промывали с аннексин V промывным буфером (BD Biosciences). Клетки инкубировали с аннексин V связывающим белком и пропидиум йодидом (BD Biosciences) в течение 10 мин. Образцы анализировали с помощью проточной цитометрии.
5.62.7. Люциферазный тест
Клетки Namalwa трансфицировали 4 мкг конструкции AP1-luciferase (Stratagene) на 1×106 клеток и 3 мкл препарата Липофектамина 2000 (Invitrogen), следуя инструкциям производителя. Через шесть часов после трансфекции клетки обрабатывали ДМСО или количеством предлагаемого соединения. Активность люциферазы анализировали, используя люциферазный лизирующий буфер и субстрат (Promega), и измеряли с помощью люминометра (Turner Designs).
5.62.8. Антипролиферативный тест
День 1: Клетки высевали в 96-луночный планшет при 50 мкл/лунка в 10% ФСБ RPMI (без глутамина, без пенициллина и стрептомицина) на ночь. Применяли следующие клетки:
Клетки колоректального рака: Colo 205 3200 клеток/лунка; положительный контроль иринотекан
Клетки рака поджелудочной железы: BXPC-3 1200 клеток/лунка; положительный контроль гемцитабин
Клетки рака предстательной железы: PC3 1200 клеток/лунка; положительный контроль доцетаксел
Клетки рака молочной железы: MDA-MB-231 2400 клеток/лунка; положительный контроль паклитаксел.
День 2: Проводили серийное разведение соединений от 0,00001 мкМ до ~10 мкМ (или 0,000001~1 мкМ) при 50 мкл/лунку (2×) и добавляли в планшеты в двух повторах с положительным контролем. Затем планшеты инкубировали при 37°C в течение 72 часов.
День 5: Результаты детектировали методом CellTiter Glo. В планшеты добавляли 100 мкл/лунка реагента CellTiter Glo и инкубировали в течение 10 минут при комнатной температуре, а затем анализировали в аппарате для чтения планшетов Top Count. Значение IC50 для каждого соединения обычно определяли на основании результатов двух или более отдельных экспериментов.
5.63. Ингибирование ФНОα
Свойства некоторых предлагаемых соединений в ингибировании ФНОα оценивали, используя методики по существу аналогичные методикам, описанным в Разделе 6.62.1 выше. Тестируемые соединения включают 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-(4-пиридин-4-илметилфенил)мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-(4-гидроксиметилфенил)мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-[3-(2-метил-2Η-пиразол-3-ил)фенил]мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-[3-(2-метилимидазол-1-ил)фенил]мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-[4-(4-метил-4Η-[1,2,4]триазол-3-ил)фенил]мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-[3-(2-метилтиазол-4-ил)фенил]мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-[3-(1-метил-1Η-пиразол-3-ил)фенил]мочевину; 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(3-(морфолинометил)фенил)мочевину; 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(4-метил-3-нитрофенил)мочевину; 1-(3-амино-4-метилфенил)-3-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)мочевина; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-(3-феноксифенил)мочевину; 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(4-нитрофенил)мочевину; N-(4-{3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]уреидо}фенил)ацетамид; 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(3-гидрокси-4-метилфенил)мочевину; 1-[3-(1H-бензимидазол-2-ил)-4-хлорфенил]-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевину; 1-(4-трет-бутилциклогексил)-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-(4-метилциклогексил)мочевину; 1-(6-хлорпиридин-3-ил)-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]мочевину; 1-[4-(2,4-дифторфенил)тиазол-2-ил]-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевину и 3-{5-[3-(3-хлор-4-метилфенил)уреидометил]-1-оксо-1,3-дигидроизоиндол-2-ил}-2,6-диоксопиперидин-1-илметиловый эфир 2,2-диметилпропионовой кислоты. Были определены значения IC50 для всех тестируемых соединений, которые находились в диапазоне приблизительно 0,2-300 нМ.
5.64. Антипролиферативный эффект на клетках Νamalwa
Антипролиферативное действие некоторых предлагаемых соединений оценивали, используя линию клеток Νamalwa, следуя методикам, по существу аналогичным описанным в Разделе 5.62.3 выше. Тестируемые соединения включают 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-(4-пиридин-4-илметилфенил)мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-(4-гидроксиметилфенил)мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-[3-(2-метил-2Η-пиразол-3-ил)фенил]мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-[3-(2-метилимидазол-1-ил)фенил]мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-[3-(2-метилтиазол-4-ил)фенил]мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-[3-(1-метил-1Η-пиразол-3-ил)фенил]мочевину; 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(3-(морфолинометил)фенил)мочевину; 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(4-метил-3-нитрофенил)мочевину; 1-(3-амино-4-метилфенил)-3-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-(3-феноксифенил)мочевину; 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(4-нитрофенил)мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-[3-(3-метил-[1,2,4]оксадиазол-5-ил)фенил]мочевину; 1-(4-трет-бутилциклогексил)-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-(4-метилциклогексил)мочевину и 3-{5-[3-(3-хлор-4-метилфенил)уреидометил]-1-оксо-1,3-дигидроизоиндол-2-ил}-2,6-диоксопиперидин-1-илметиловый эфир 2,2-диметилпропионовой кислоты. Были определены значения IC50 для всех тестируемых соединений, которые находились в диапазоне приблизительно 0,02-40 нМ.
5.65. Антипролиферативный эффект на клетках PC3
Антипролиферативное действие некоторых предлагаемых соединений оценивали, используя линию клеток PC3, следуя методикам, по существу аналогичным описанным в Разделе 5.62.8 выше. Тестируемые соединения включают 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-(4-пиридин-4-илметилфенил)мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-[3-(2-метил-2Η-пиразол-3-ил)фенил]мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-[3-(2-метилтиазол-4-ил)фенил]мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-[3-(1-метил-1Η-пиразол-3-ил)фенил]мочевину; 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(3-(морфолинометил)фенил)мочевину; 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(4-метил-3-нитрофенил)мочевину; 1-(3-амино-4-метилфенил)-3-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)мочевина; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-(3-феноксифенил)мочевину; 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(4-нитрофенил)мочевину; 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(3-гидрокси-4-метилфенил)мочевину; 1-[3-(1Η-бензимидазол-2-ил)-4-хлорфенил]-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевину; 1-(4-трет-бутилциклогексил)-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-(4-метилциклогексил)мочевину; 1-(6-хлорпиридин-3-ил)-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Η-изоиндол-5-илметил]мочевину; 1-[4-(2,4-дифторфенил)тиазол-2-ил]-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевину; 3-{5-[3-(3-хлор-4-метилфенил)уреидометил]-1-оксо-1,3-дигидроизоиндол-2-ил}-2,6-диоксопиперидин-1-илметиловый эфир 2,2-диметилпропионовой кислоты и 1-[1-(3,4-дихлорфенил)этил]-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевину. Были определены значения IC50 для всех тестируемых соединений, которые находились в диапазоне приблизительно 0,001-0,74 мкМ.
5.66. Антипролиферативный эффект на клетках BxPC3
Антипролиферативное действие некоторых предлагаемых соединений оценивали, используя линию клеток BxPC3, следуя методикам, по существу аналогичным описанным в Разделе 5.62.8 выше. Тестируемые соединения включают 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-(4-пиридин-4-илметилфенил)мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-[3-(2-метил-2Η-пиразол-3-ил)фенил]мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-[3-(2-метилтиазол-4-ил)фенил]мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-[3-(1-метил-1Η-пиразол-3-ил)фенил]мочевину; 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(3-(морфолинометил)фенил)мочевину; 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(4-метил-3-нитрофенил)мочевину; 1-(3-амино-4-метилфенил)-3-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-(3-феноксифенил)мочевину; 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(4-нитрофенил)мочевину; 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(3-гидрокси-4-метилфенил)мочевину; 1-[3-(1Η-бензимидазол-2-ил)-4-хлорфенил]-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевину; 1-(4-трет-бутилциклогексил)-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-(4-метилциклогексил)мочевину; 1-[4-(2,4-дифторфенил)тиазол-2-ил]-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Η-изоиндол-5-илметил]мочевину; 3-{5-[3-(3-хлор-4-метилфенил)уреидометил]-1-оксо-1,3-дигидроизоиндол-2-ил}-2,6-диоксопиперидин-1-илметиловый эфир 2,2-диметилпропионовой кислоты и 1-[1-(3,4-дихлорфенил)этил]-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевину. Были определены значения IC50 для всех тестируемых соединений, которые находились в диапазоне приблизительно 0,01-0,94 мкМ.
5.67. Антипролиферативный эффект на клетках MDAMB321
Антипролиферативное действие некоторых предлагаемых соединений оценивали, используя линию клеток MDAMB321, следуя методикам, по существу аналогичным описанным в Разделе 5.62.8 выше. Тестируемые соединения включают 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-(4-пиридин-4-илметилфенил)мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-[3-(2-метил-2Η-пиразол-3-ил)фенил]мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-[3-(2-метилтиазол-4-ил)фенил]мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-[3-(1-метил-1Η-пиразол-3-ил)фенил]мочевину; 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(3-(морфолинометил)фенил)мочевину; 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(4-метил-3-нитрофенил)мочевина; 1-(3-амино-4-метилфенил)-3-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-(3-феноксифенил)мочевину; 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(4-нитрофенил)мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-[3-(3-метил-[1,2,4]оксадиазол-5-ил)фенил]мочевину; 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(3-гидрокси-4-метилфенил)мочевину; 1-[3-(1Η-бензимидазол-2-ил)-4-хлорфенил]-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевину; 1-(4-трет-бутилциклогексил)-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-(4-метилциклогексил)мочевину; 1-(6-хлорпиридин-3-ил)-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Η-изоиндол-5-илметил]мочевину; 1-[4-(2,4-дифторфенил)тиазол-2-ил]-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевину; 3-{5-[3-(3-хлор-4-метилфенил)уреидометил]-1-оксо-1,3-дигидроизоиндол-2-ил}-2,6-диоксопиперидин-1-илметиловый эфир 2,2-диметилпропионовой кислоты и 1-[1-(3,4-дихлорфенил)этил]-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевину. Были определены значения IC50 для всех тестируемых соединений, которые находились в диапазоне приблизительно 0,4-380 нМ.
5.68. Антипролиферативный эффект на клетках Colo205
Антипролиферативное действие некоторых предлагаемых соединений оценивали, используя линию клеток Colo205, следуя методикам, по существу аналогичным описанным в Разделе 5.62.8 выше. Тестируемые соединения включают 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-илметил]-3-(4-пиридин-4-илметилфенил)мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-[3-(2-метил-2Η-пиразол-3-ил)фенил]мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-[3-(2-метилтиазол-4-ил)фенил]мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-[3-(1-метил-1Η-пиразол-3-ил)фенил]мочевину; 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(3-(морфолинометил)фенил)мочевину; 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(4-метил-3-нитрофенил)мочевину; 1-(3-амино-4-метилфенил)-3-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-(3-феноксифенил)мочевину; 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(4-нитрофенил)мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-[3-(3-метил-[1,2,4]оксадиазол-5-ил)фенил]мочевину; 1-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)-3-(3-гидрокси-4-метилфенил)мочевину; 1-[3-(1Η-бензимидазол-2-ил)-4-хлорфенил]-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевину; 1-(4-трет-бутилциклогексил)-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевину; 1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]-3-(4-метилциклогексил)мочевину; 1-(6-хлорпиридин-3-ил)-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевину; 1-[4-(2,4-дифторфенил)тиазол-2-ил]-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевину; 3-{5-[3-(3-хлор-4-метилфенил)уреидометил]-1-оксо-1,3-дигидроизоиндол-2-ил}-2,6-диоксопиперидин-1-илметиловый 2,2-диметилпропионовой кислоты и 1-[1-(3,4-дихлорфенил)этил]-3-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1H-изоиндол-5-илметил]мочевину. Были определены значения IC50 для всех тестируемых соединений, которые находились в диапазоне приблизительно 0,15-130 нМ.
Вышеизложенные примеры представлены для того, чтобы среднему специалисту в данной области техники дать полное раскрытие и описание того, как осуществлять и применять заявленные примеры осуществления, и не предназначены ограничивать объем раскрытого изобретения. Модификации, которые являются очевидными специалистам в данной области техники, входят в объем нижеследующей формулы изобретения. Все публикации, патенты и заявки на патент, цитируемые в данном описании, включены посредством ссылки в полном объеме, как если бы каждая такая публикация, патент или заявка на патент конкретно и каждая в отдельности была бы включена в настоящее описание посредством ссылки.