Результат интеллектуальной деятельности: 6-, 7- ИЛИ 8-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ХИНАЗОЛИНОНА И КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ ИХ, И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ
Вид РИД
Изобретение
1. ОБЛАСТЬ ИЗОБРЕТЕНИЯ
В настоящем описании описываются производные хиназолинона. Описываются также фармацевтические композиции, включающие данные соединения и способы лечения, предотвращения или профилактики и регулирования различных расстройств.
2. ИЗВЕСТНЫЙ УРОВЕНЬ ТЕХНИКИ
2.1 ПАТОБИОЛОГИЯ РАКА И ДРУГИХ ЗАБОЛЕВАНИЙ
Рак характеризуется прежде всего увеличением числа аномальных клеток, происходящих из какой-либо определенной нормальной ткани, инвазией данных аномальных клеток в соседние ткани или лимфатическим или кроветворным распространением злокачественных клеток в региональные лимфатические узлы и в отдаленные участки (метастаз). Клинические данные и молекулярно-биологические исследования указывают на то, что рак является многостадийным процессом, который начинается с незначительных преднеопластических изменений, которые могут в определенных условиях прогрессировать до неоплазии. Неопластическое повреждение может клонально развиваться и развивать увеличивающуюся способность в отношении инвазии, роста, метастаза и гетерогенности, особенно в условиях, в которых неопластические клетки избегают иммунного контроля хозяина. Roitt I., Brostoff J. and Kale D., Immunology, 17.1-17.12 (3rd ed., Mosby, St. Louis, Mo., 1993).
Существует огромное разнообразие раковых заболеваний, которые описаны подробно в медицинской литературе. Примерами являются рак легких, толстой кишки, прямой кишки, простаты, груди, головного мозга и кишечника. Сфера действия рака продолжает подниматься по мере того, как стареет общее население, развиваются новые виды рака, и с ростом восприимчивых популяций (например, люди, инфицированные СПИДом или избыточно подверженные воздействию солнечного света). Однако возможности выбора лечения рака ограничены. Например, в случае рака крови (например, множественной миеломы) выбор лечения почти недоступен, особенно когда обычная химиотерапия терпит неудачу, а трансплантация костного мозга является невозможной. Поэтому существует громаднейшая потребность в новых методах и композициях, которые могут использоваться для лечения пациентов с заболеваниями рака.
Многие типы рака связаны с образованием новых кровеносных сосудов, процессом, известным как ангиогенез. Было объяснено несколько механизмов, вовлеченных в индуцируемый опухолью ангиогенез. Наиболее прямым или непосредственным из данных механизмов является секреция опухолевыми клетками цитокинов с ангиогенными свойствами. Примеры данных цитокинов включают в себя кислотный и основной фибробластный фактор роста (a,b-FGF), ангиогенин, фактор сосудистого эндотелиального роста (VEGF) и TNF-α. Альтернативно, опухолевые клетки могут высвобождать ангиогенные пептиды через продуцирование протеаз и последующее разрушение внеклеточного матрикса, где хранятся некоторые цитокины (например, b-FGF). Ангиогенез может также индуцироваться непосредственно через задействование воспалительных клеток (особенно макрофагов) и их последующее высвобождение ангиогенных цитокинов (например, TNF-α, b-FGF).
Множество других болезней и расстройств связаны также с или характеризуются нежелательным ангиогенезом. Например, усиленный или нерегулируемый ангиогенез вовлечен в ряд заболеваний и медицинских состояний, включающих, но не ограниченных ими, неоваскулярные заболевания глаз, относящиеся к сосудистой оболочке глаз неоваскулярные заболевания, неоваскулярные заболевания сетчатки, покраснение (неоваскуляризация уголков), вирусные заболевания, генетические заболевания, воспалительные, аллергические и аутоиммунные заболевания. Примеры таких заболеваний и состояний включают, но не ограничиваются ими: диабетическую ретинопатию; ретинопатию состояния незрелости или преждевременного развития недоношенности; отторжение трансплантата роговицы; неоваскулярную глаукому; ретролентальную фиброплазию; артрит; и пролиферативную витреоретинопатию.
Соответственно, соединения, которые могут регулировать ангиогенез или ингибировать продуцирование некоторых цитокинов, включая TNF-α, могут быть полезны при лечении или профилактике различных заболеваний и состояний.
2.2 СПОСОБЫ ЛЕЧЕНИЯ РАКА
Текущая терапия рака может вовлекать хирургию, химиотерапию, гормональную терапию и/или радиационное лечение для ликвидации неопластических клеток у пациентов (см., например, Stockdale, 1998, Medicine, vol. 3, Rubenstein and Federman, eds., Chapter 12, Section IV). В последнее время терапия рака могла бы также вовлекать биологическую терапию или иммунотерапию. Все эти подходы составляют значительные препятствия или недостатки для пациента. Хирургия, например, может быть противопоказана вследствие состояния здоровья пациента или может быть неприемлемой для пациента. Кроме того, хирургия может не полностью удалять неопластические ткани. Радиационная терапия эффективна, только когда неопластическая ткань проявляет более высокую восприимчивость к радиации, чем нормальная ткань. Радиационная терапия может также давать часто серьезные побочные эффекты. Гормональная терапия редко удается в качестве единственного агента. Хотя гормональная терапия может быть и эффективной, она часто используется для предотвращения или отсрочки повторного возникновения рака после того, как другие виды лечения удалили большинство раковых клеток. Виды биологической терапии и иммунотерапии ограничены по числу и могут давать побочные эффекты, такие как сыпи или припухлости, симптомы эпидемического гриппа, включая лихорадку, озноб и усталость, проблемы пищеварительного тракта или аллергические реакции.
Что касается химиотерапии, имеется множество химиотерапевтических агентов, доступных для лечения рака. Множество химиотерапевтических средств от рака действуют путем ингибирования синтеза ДНК, или непосредственно, или косвенно, путем ингибирования биосинтеза предшественников трифосфата дезоксирибонуклеотида для предотвращения репликации ДНК и сопутствующего деления клеток. Gilman et al., Goodman and Gilman's: The Pharmacological Basis of Therapeutics, Tenth Ed. (McGraw Hill, Нью-Йорк).
Несмотря на доступность множества химиотерапевтических агентов химиотерапия имеет много недостатков. Stockdale, Medicine, vol. 3, Rubenstein and Federman, eds., ch. 12, sect. 10, 1998. Почти все химиотерапевтические агенты являются токсичными, и химиотерапия вызывает значительные и часто опасные побочные эффекты, включая тяжелую тошноту, депрессию костного мозга и иммуносупрессию. Кроме того, даже с введением комбинаций химиотерапевтических агентов многие опухолевые клетки являются устойчивыми или развивают стойкость к химиотерапевтическим агентам. Действительно, те клетки, которые устойчивы к конкретным химиотерапевтическим агентам, используемым согласно протоколу лечения, часто оказываются устойчивыми к другим лекарствам, даже если данные агенты действуют по механизму, отличному от механизмов лекарств, используемых при каком-либо конкретном лечении. Данное явление называют как плейотропное лекарство или множественная лекарственная стойкость.
Вследствие лекарственной стойкости многие раковые заболевания оказываются или становятся невосприимчивыми к стандартным химиотерапевтическим методам лечения.
Другие заболевания или состояния, связанные с или характеризуемые нежелательным ангиогенезом, также трудно лечить. Однако высказывалось предположение, что некоторые соединения, такие как протамин, гепаин и стероиды, полезны при лечении некоторых специфических заболеваний. Taylor et al., Nature 297:307 (1982), Folkman et al., Science 221:719 (1983); и патенты США № 5001116 и 4994443.
Существует все еще значительная потребность в эффективных способах лечения, профилактики и управления с раковыми и другими заболеваниями и состояниями, включая заболевания, которые являются невосприимчивыми к стандартным методам лечения, таким как хирургия, радиационная терапия, химиотерапия и гормональная терапия, при снижении или избегании при этом токсичности и/или побочных эффектов, связанных с обычными методами терапии.
3. КРАТКОЕ СОДЕРЖАНИЕ ИЗОБРЕТЕНИЯ
В настоящем описании предлагаются хиназолиноновые соединения и их фармацевтически приемлемые соли, сольваты (например, гидраты), пролекарства, клатраты или стереоизомеры.
Предлагаются также способы лечения и излечения различных заболеваний или расстройств. Данные способы предусматривают введение пациенту, нуждающемуся в таком лечении или излечении или страдающему таким заболеванием или расстройством, терапевтически эффективного количества соединения, описываемого в настоящем изобретении, или его фармацевтически приемлемой соли, сольвата, пролекарства, клатрата или стереоизомера.
В настоящем описании предлагаются также способы профилактики различных заболеваний и расстройств, которые предусматривают введение пациенту, нуждающемуся в такой профилактике или рискующему заболеть таким заболеванием или расстройством, профилактически эффективного количества соединения, описываемого в настоящем изобретении, или его фармацевтически приемлемой соли, сольвата, пролекарства, клатрата или стереоизомера.
В настоящем описании предлагаются также фармацевтические композиции, формы дозированных единиц, режимы дозировки и наборы, которые включают описываемое здесь соединение или его фармацевтически приемлемую соль, сольват, пролекарство, клатрат или стереоизомер.
4. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В соответствии с одним воплощением предлагаются хиназолиноновые соединения и их фармацевтически приемлемые соли, сольваты, пролекарства, клатраты и стереоизомеры.
В соответствии с еще одним воплощением предлагаются способы лечения, излечения и профилактики различных заболеваний и расстройств, которые предусматривают введение пациенту терапевтически или профилактически эффективного количества соединения, описываемого в настоящем изобретении, или его фармацевтически приемлемой соли, сольвата, пролекарства, клатрата или стереоизомера. Примеры заболеваний и расстройств описываются в данном изобретении.
В соответствии с другими воплощениями соединение, описываемое в данном изобретении, или его фармацевтически приемлемая соль, сольват, пролекарство, клатрат или стереоизомер вводится в сочетании с еще одним лекарством (“второй активный агент”) или методом лечения. Вторыми активными агентами являются небольшие молекулы и крупные молекулы (например, белки и антитела), примеры которых даются в настоящем описании, так же как и стволовые клетки. Способы или методы терапии, которые могут использоваться в сочетании с введением описываемых в настоящем изобретении соединений, включают, но не ограничиваются ими, хирургию, переливание крови, иммунотерапию, биологическую терапию, радиационную терапию и другие не основанные на лекарствах методы терапии, используемые в настоящее время для лечения, профилактики или избавления от различных расстройств, описываемых в изобретении.
Предлагаются также фармацевтические композиции (например, формы дозированных единиц), которые могут использоваться в описываемых в данном изобретении способах. Согласно одному воплощению фармацевтические композиции включают описываемое здесь соединение или его фармацевтически приемлемую соль, сольват, пролекарство, клатрат или стереоизомер и необязательно еще один активный агент.
4.1 СОЕДИНЕНИЯ
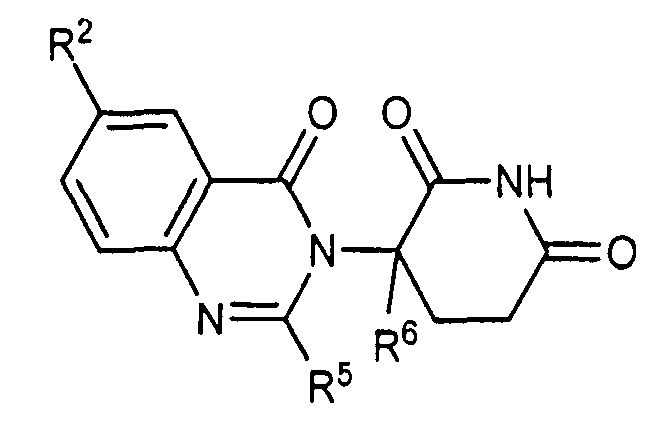
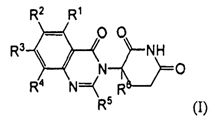
Согласно одному воплощению соединения, предлагаемые в настоящем описании для использования в фармацевтических композициях и способах, имеют формулу (I):
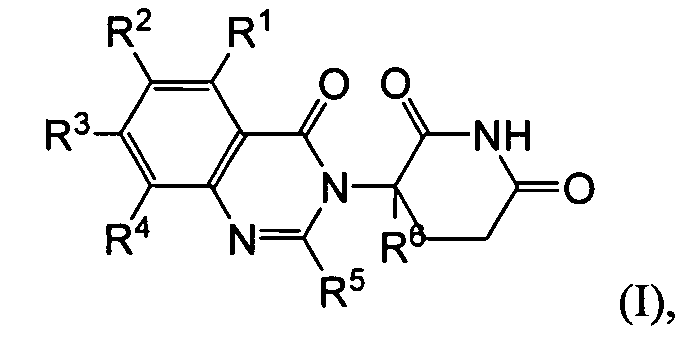
или являются их фармацевтически приемлемыми солями, сольватами и стереоизомерами, где:
R1 представляет собой водород;
каждый из R2, R3 и R4 представляет собой независимо: водород; галоген; -(CH2)nOH; (C1-C6)алкил, необязательно замещенный одним или более галогенами; (C1-C6)алкокси, необязательно замещенный одним или более галогенами; или
-CH2NHRa, где Ra представляет собой:
водород;
(C1-C6)алкил, необязательно замещенный одним или более галогенами;
-(CH2)n-(6-10-членный арил);
-С(О)-(CH2)n-(6-10-членный арил) или -С(О)-(CH2)n-(6-10-членный гетероарил), в которых арил или гетероарил необязательно замещен одним или более из:
галогена; -SCF3; (C1-C6)алкила, указанный алкил сам необязательно замещен одним или более галогенами; или (C1-C6)алкокси, причем сам указанный алкокси необязательно замещен одним или более галогенами;
-С(О)-(C1-C8)алкил, где алкил необязательно замещен одним или более галогенами;
-С(О)-(CH2)n(C3-C10-циклоалкил);
-C(O)-(CH2)n-NRbRc, где Rb и Rc представляют каждый независимо:
водород;
(C1-C6)алкил, необязательно замещенный одним или более галогенами;
(C1-C6)алкокси, необязательно замещенный одним или более
галогенами; или
6-10-членный арил, необязательно замещенный одним или более из:
галогена; (C1-C6)алкила, необязательно замещенного
одним или более галогенами; или (C1-C6)алкокси, необязательно замещенного одним или более галогенами;
-С(О)-(CH2)n-О-(C1-C6)алкил; или
-С(О)-(CH2)n-О-(CH2)n-(6-10-членный арил); или
два R1-R4 вместе могут образовывать 5- или 6-членное кольцо, необязательно замещенное одним или более из:
галогена; (C1-C6)алкила, необязательно замещенного одним или более галогенами; и (C1-C6)алкокси, необязательно замещенного одним или более галогенами;
R5 представляет собой водород; -(CH2)nOH; фенил; -О-(C1-C6)алкил; или (C1-C6)алкил, необязательно замещенный одним или более галогенами;
R6 представляет водород; или (C1-C6)алкил, необязательно замещенный одним или более галогенами; и
n представляет 0, 1 или 2.
Согласно еще одному воплощению в настоящем описании предлагаются соединения формулы (II):
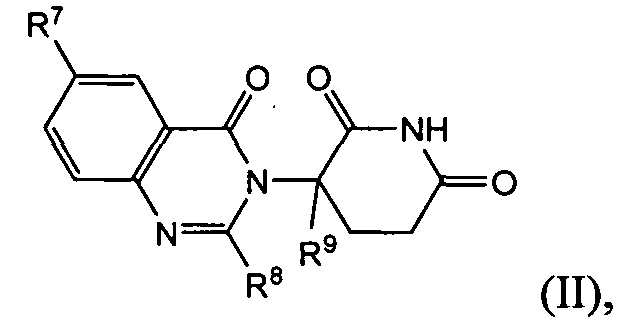
и их фармацевтически приемлемые соли, сольваты и стереоизомеры, где:
R7 представляет: водород; галоген; (CH2)nOH; (C1-C6)алкил, необязательно замещенный одним или более галогенами; (C1-C6)алкокси, необязательно замещенный одним или более галогенами; или
-(CH2)nNHRd, где Rd представляет:
водород;
(C1-C6)алкил, необязательно замещенный одним или более галогенами;
-(CH2)n-(6-10-членный арил);
-С(О)-(CH2)n-(6-10-членный арил) или -С(О)-(CH2)n-(6-10-членный гетероарил), где арил или гетероарил необязательно замещен одним или более из: галогена;
-SCF3; (C1-C6)алкила, необязательно замещенного одним или более галогенами; или (C1-C6)алкокси, необязательно замещенного одним или более галогенами;
-С(О)-(C1-C8)алкил, в котором алкил необязательно замещен одним или более галогенами;
-С(О)-(CH2)n(C3-C10-циклоалкил);
-С(О)-(CH2)n-NReRf, где Re и Rf представляют каждый независимо:
водород;
(C1-C6)алкил, необязательно замещенный одним или более галогенами;
(C1-C6)алкокси, необязательно замещенный одним или более галогенами; или
6-10-членный арил, необязательно замещенный одним или более из: галогена; (C1-C6)алкила, самого необязательно замещенного одним или более галогенами; (C1-C6)алкокси, самого необязательно замещенного одним или более галогенами;
-С(О)-(CH2)n-О-(C1-C6)алкил; или
-С(О)-(CH2)n-О-(CH2)n-(6-10-членный арил);
R8 представляет собой водород; -(CH2)nOH; фенил; -О-(C1-C6)алкил; или (C1-C6)алкил, необязательно замещенный одним или более галогенами;
R9 представляет водород; или (C1-C6)алкил, необязательно замещенный одним или более галогенами; и
n представляет 0, 1 или 2.
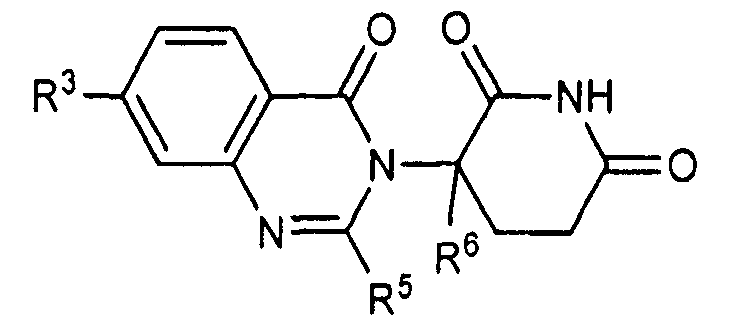
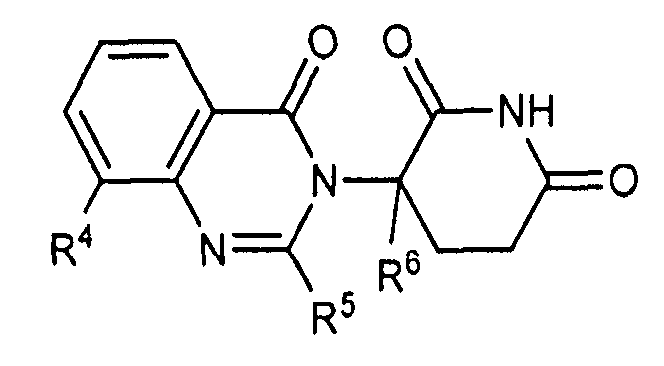
Согласно еще одному воплощению в настоящем описании предлагаются соединения формулы (III):
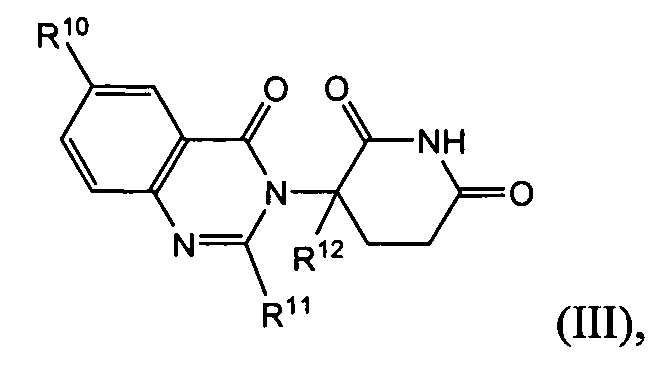
и их фармацевтически приемлемые соли, сольваты и стереоизомеры, где:
R10 представляет: водород; галоген; (CH2)nOH; (C1-C6)алкил, необязательно замещенный одним или более галогенами; или (C1-C6)алкокси, необязательно замещенный одним или более галогенами;
R11 представляет собой водород; -(CH2)nOH; фенил; -О-(C1-C6)алкил; или (C1-C6)алкил, необязательно замещенный одним или более галогенами;
R12 представляет собой: водород; или (C1-C6)алкил, необязательно замещенный одним или более галогенами; и
n представляет 0, 1 или 2.
Согласно еще одному воплощению R10 представляет водород. Согласно еще одному воплощению R10 представляет галоген. Согласно еще одному воплощению R10 представляет (C1-C6)алкил, необязательно замещенный одним или более галогенами. Согласно еще одному воплощению R10 представляет (CH2)nOH или гидроксил. Согласно еще одному воплощению R10 представляет (C1-C6)алкокси, необязательно замещенный одним или более галогенами.
Согласно еще одному воплощению R11 представляет водород. Согласно еще одному воплощению R11 представляет (CH2)nOH или гидроксил. Согласно еще одному воплощению R11 представляет фенил. Согласно еще одному воплощению R11 представляет -О-(C1-C6)алкил, необязательно замещенный одним или более галогенами. Согласно еще одному воплощению R11 представляет (C1-C6)алкил, необязательно замещенный одним или более галогенами.
Согласно еще одному воплощению R12 представляет водород. Согласно еще одному воплощению R12 представляет (C1-C6)алкил, необязательно замещенный одним или более галогенами.
Согласно еще одному воплощению n представляет 0. Согласно еще одному воплощению n представляет 1. Согласно еще одному воплощению n представляет 2.
Соединения, предлагаемые в настоящем описании, охватывают любые из сочетаний R10, R11, R12 и n, описанных выше.
Согласно одному конкретному воплощению R10 представляет галоген. Согласно еще одному воплощению R10 представляет гидроксил. Согласно еще одному воплощению R10 представляет метил.
Согласно одному конкретному воплощению R11 представляет водород. Согласно еще одному воплощению R11 представляет метил.
Согласно одному конкретному воплощению R12 представляет водород. Согласно еще одному воплощению R12 представляет метил.
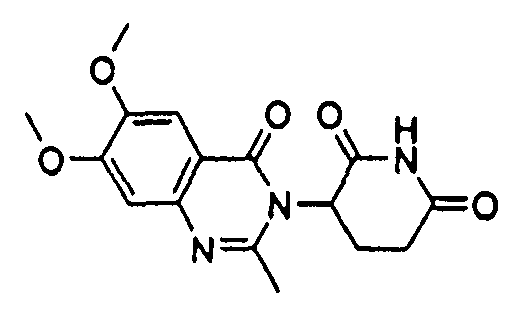
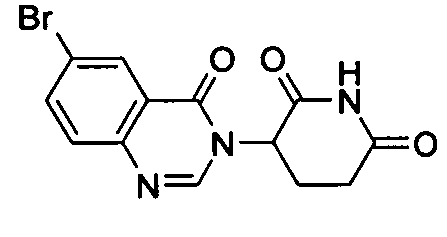
Конкретные соединения включают, но не ограничиваются ими:
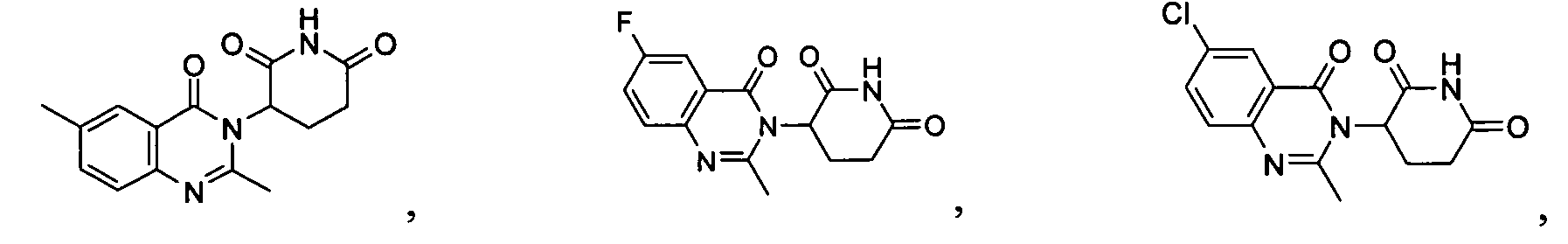
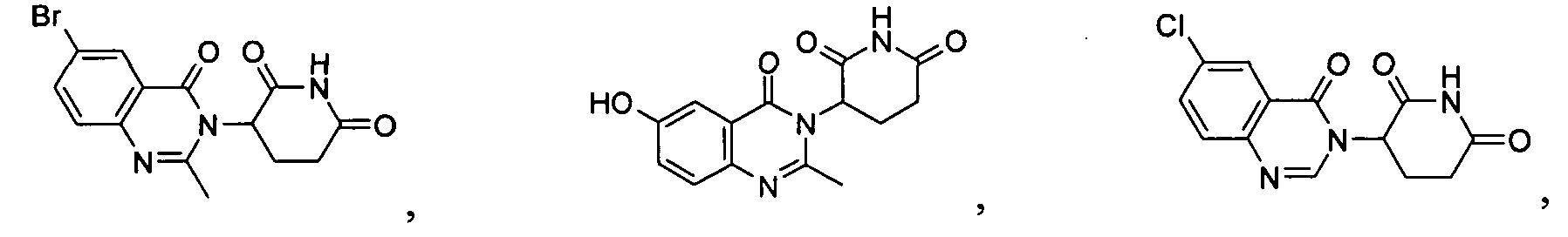
 или
или 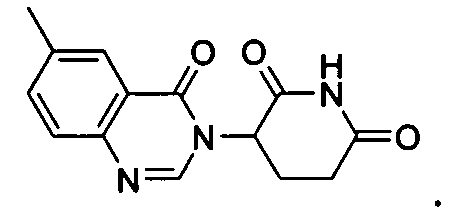
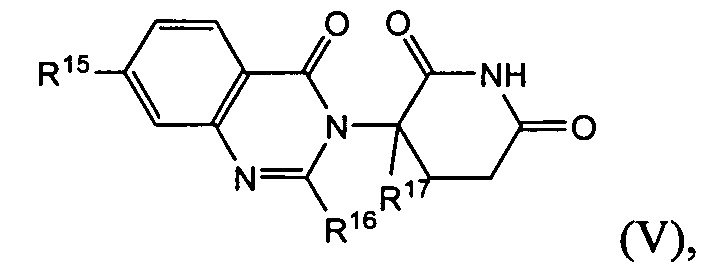
Согласно еще одному воплощению в настоящем описании предлагаются соединения формулы (IV):
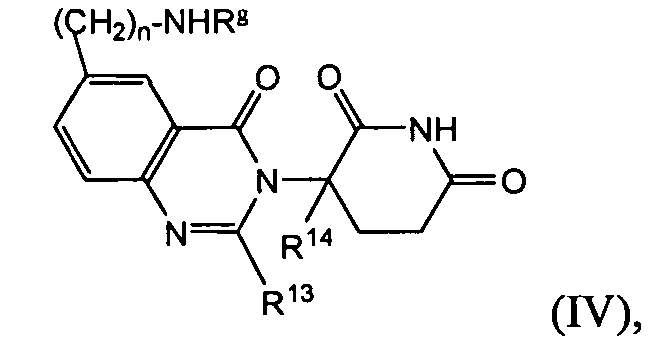
и их фармацевтически приемлемые соли, сольваты и стереоизомеры, где:
Rg представляет:
водород;
(C1-C6)алкил, необязательно замещенный одним или более галогенами;
-(CH2)n(6-10-членный арил);
-С(О)-(CH2)n-(6-10-членный арил) или -С(О)-(CH2)n-(6-10-членный гетероарил), где арил или гетероарил необязательно замещен одним или более из: галогена; -SCF3; (C1-C6)алкила, самого необязательно замещенного одним или более галогенами; или (C1-C6)алкокси, самого необязательно замещенного одним или более галогенами;
-С(О)-(C1-C8)алкил, в котором алкил необязательно замещен одним или более галогенами;
-С(О)-(CH2)n(C3-C10-циклоалкил);
-С(О)-(CH2)n-NRhRi, где Rh и Ri представляют каждый независимо:
водород;
(C1-C6)алкил, необязательно замещенный одним или более галогенами;
(C1-C6)алкокси, необязательно замещенный одним или более галогенами; или
6-10-членный арил, необязательно замещенный одним или более из: галогена; (C1-C6)алкила, самого необязательно замещенного одним или более галогенами; или (C1-C6)алкокси, самого необязательно замещенного одним или более галогенами;
-С(О)-(CH2)n-О-(C1-C6)алкил; или
-С(О)-(CH2)n-О-(CH2)n-(6-10-членный арил);
R13 представляет собой водород; -(CH2)nOH; фенил; -О-(C1-C6)алкил; или (C1-C6)алкил, необязательно замещенный одним или более галогенами;
R14 представляет водород; или (C1-C6)алкил, необязательно замещенный одним или более галогенами; и
n представляет 0, 1 или 2.
Согласно одному воплощению R8 представляет водород. Согласно еще одному воплощению R8 представляет (C1-C6)алкил, необязательно замещенный одним или более галогенами. Согласно еще одному воплощению R8 представляет -(CH2)n-(6-10-членный арил). Согласно еще одному воплощению R8 представляет -С(О)-(CH2)n-(6-10-членный арил) или -С(О)-(CH2)n-(6-10-членный гетероарил), где арил или гетероарил необязательно замещен, как описано выше. Согласно еще одному воплощению R8 представляет -С(О)-(C1-C6)алкил, в котором алкил необязательно замещен одним или более галогенами. Согласно еще одному воплощению R8 представляет -С(О)-(CH2)n(C3-C10-циклоалкил). Согласно еще одному воплощению R8 представляет -С(О)-(CH2)n-NRhRi, где Rh и Ri имеют значения, описанные выше. Согласно еще одному воплощению R8 представляет -С(О)-(CH2)n-О-(C1-C6)алкил. Согласно еще одному воплощению R8 представляет -С(О)-(CH2)n-О-(CH2)n-(6-10-членный арил).
Согласно еще одному воплощению R13 представляет водород. Согласно еще одному воплощению R13 представляет -(CH2)nOH или гидроксил. Согласно еще одному воплощению R13 представляет фенил. Согласно еще одному воплощению R13 представляет -О-(C1-C6)алкил, необязательно замещенный одним или более галогенами. Согласно еще одному воплощению R13 представляет (C1-C6)алкил, необязательно замещенный одним или более галогенами.
Согласно одному воплощению R14 представляет водород. Согласно еще одному воплощению R14 представляет (C1-C6)алкил, необязательно замещенный одним или более галогенами.
Согласно одному воплощению n представляет 0. Согласно еще одному воплощению n представляет 1. Согласно еще одному воплощению n представляет 2.
Соединения, предлагаемые в настоящем описании, охватывают любые из сочетаний R8, R13, R14 и n, описанных выше.
Согласно еще одному воплощению R8 представляет водород и n представляет 0 или 1. Согласно еще одному воплощению R8 представляет -С(О)-(C1-C6)алкил. Согласно еще одному воплощению R8 представляет -С(О)-фенил, необязательно замещенный одним или более метилами, галогенами и/или (C1-C6)алкокси.
Согласно одному конкретному воплощению R13 представляет метил. Согласно еще одному воплощению R14 представляет водород.
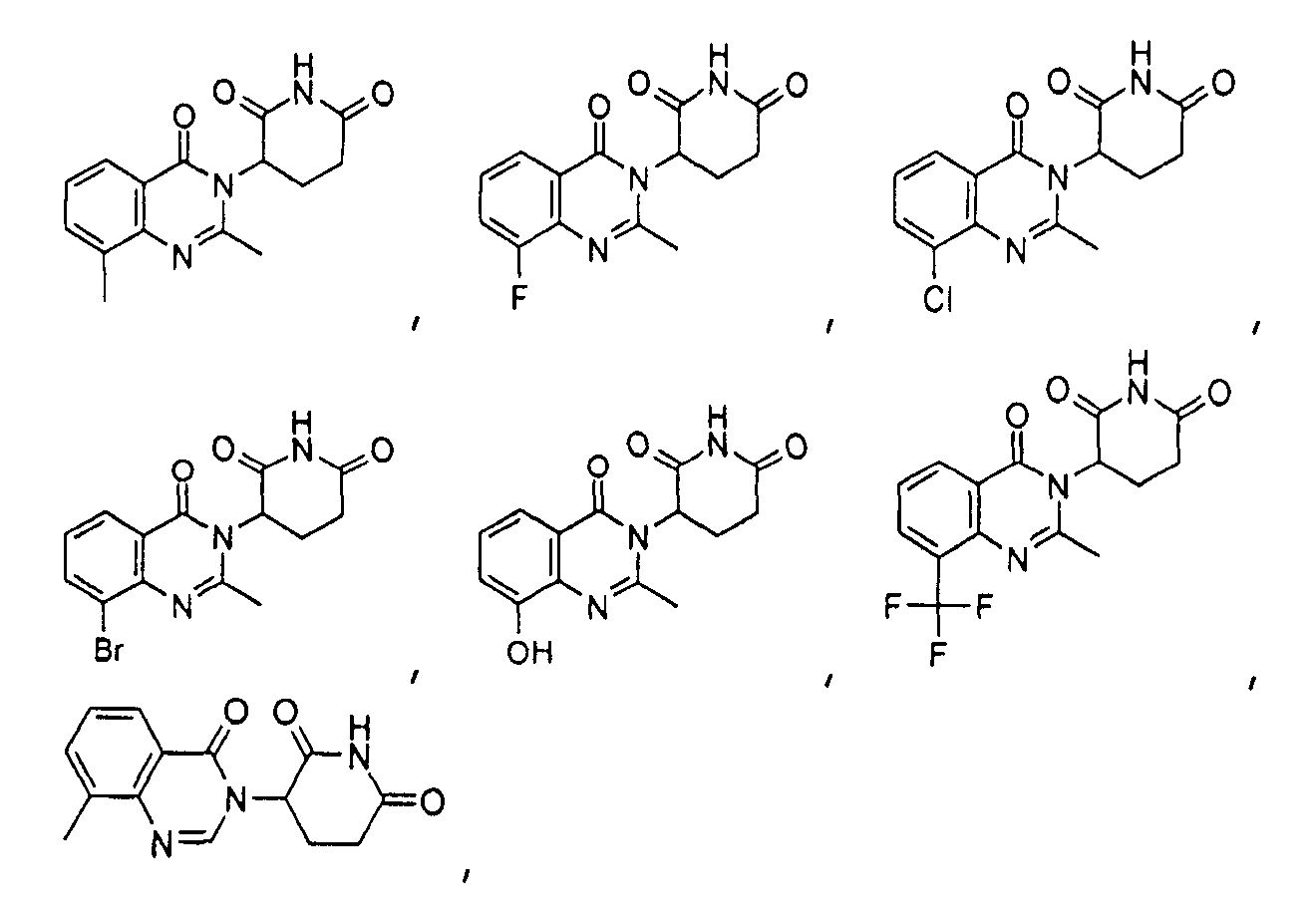
Конкретные соединения включают, но не ограничиваются ими:
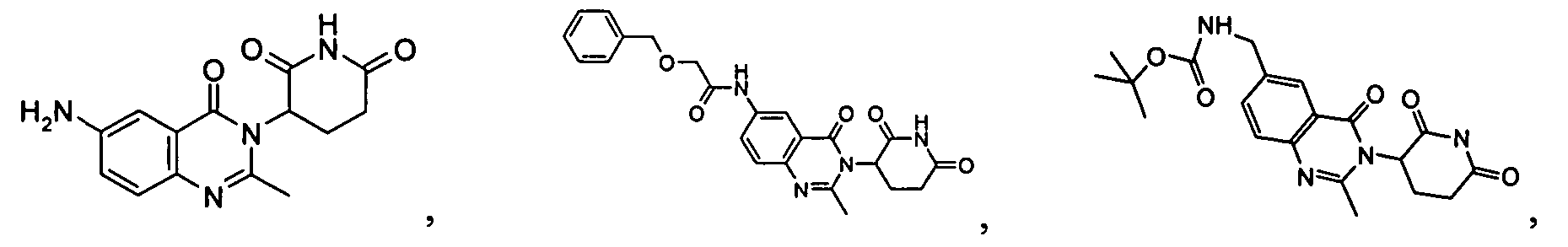
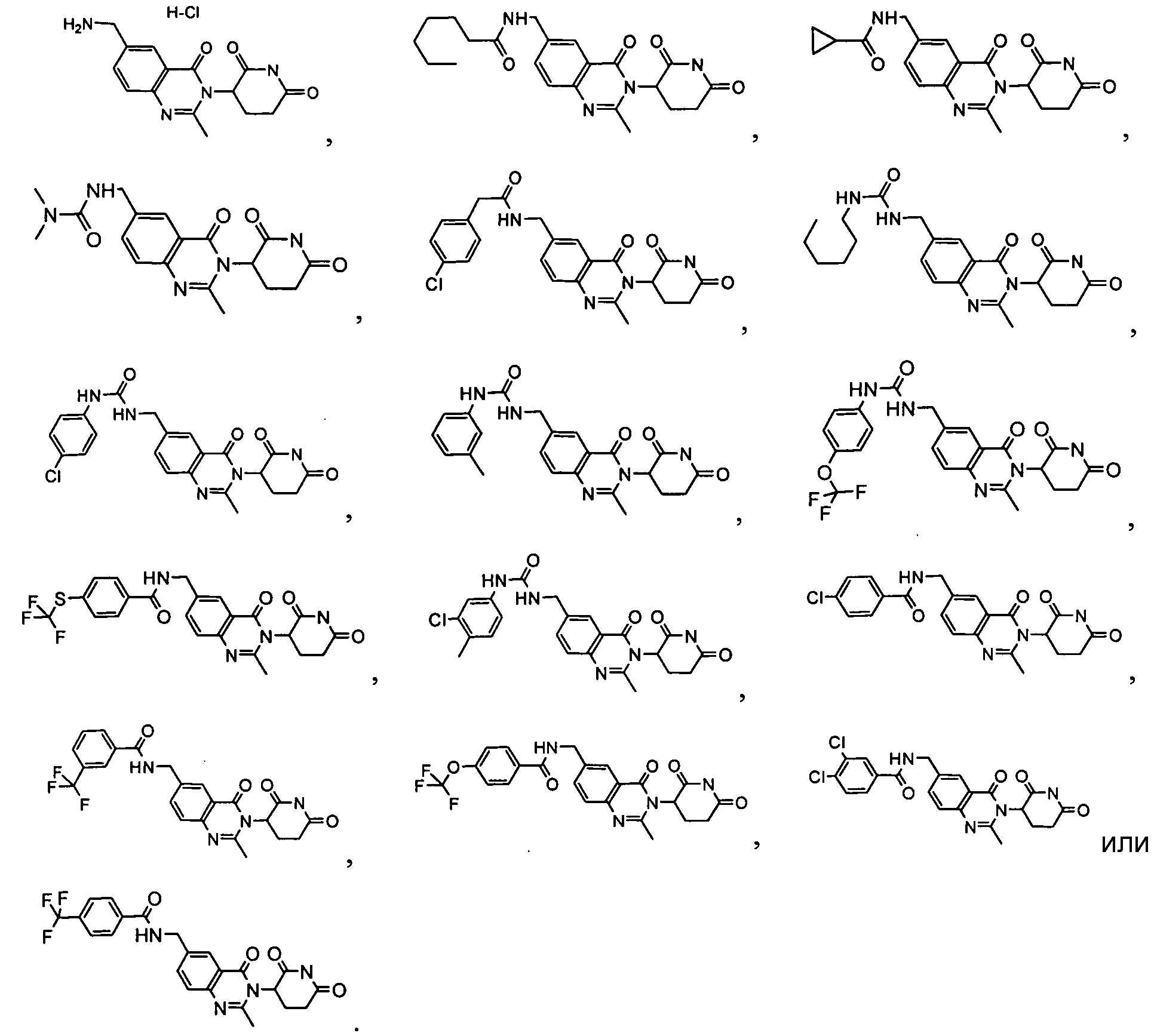
Согласно еще одному воплощению в настоящем описании предлагаются соединения формулы (V):
и их фармацевтически приемлемые соли, сольваты и стереоизомеры, где:
R15 представляет: водород; галоген; (CH2)nOH; (C1-C6)алкил, необязательно замещенный одним или более галогенами; (C1-C6)алкокси, необязательно замещенный одним или более галогенами; или
-CH2NHRj, где Rj представляет собой:
водород;
(C1-C6)алкил, необязательно замещенный одним или более галогенами;
-(CH2)n-(6-10-членный арил);
-С(О)-(CH2)n-(6-10-членный арил) или -С(О)-(CH2)n-(6-10-членный гетероарил), в которых арил или гетероарил необязательно замещен одним или более из:
галогена; -SCF3; (C1-C6)алкила, указанный алкил сам необязательно замещен одним или более галогенами; или (C1-C6)алкокси, причем сам указанный алкокси необязательно замещен одним или более галогенами;
-С(О)-(C1-C8)алкил, где алкил необязательно замещен одним или более галогенами;
-С(О)-(CH2)n(C3-C10-циклоалкил);
-C(O)-(CH2)n-NRkRl, где Rk и Rl представляют каждый независимо:
водород;
(C1-C6)алкил, необязательно замещенный одним или более галогенами;
(C1-C6)алкокси, необязательно замещенный одним или более галогенами; или
6-10-членный арил, необязательно замещенный одним или более из: галогена; (C1-C6)алкила, самого необязательно замещенного одним или более галогенами; (C1-C6)алкокси, самого необязательно замещенного одним или более галогенами;
-С(О)-(CH2)n-О-(C1-C6)алкил; или
-С(О)-(CH2)n-О-(CH2)n-(6-10-членный арил);
R16 представляет собой водород; -(CH2)nOH; фенил; -О-(C1-C6)алкил; или (C1-C6)алкил, необязательно замещенный одним или более галогенами;
R17 представляет водород; или (C1-C6)алкил, необязательно замещенный одним или более галогенами; и
n представляет 0, 1 или 2.
Согласно одному воплощению R15 представляет водород. Согласно еще одному воплощению R15 представляет галоген. Согласно еще одному воплощению R15 представляет (C1-C6)алкил, необязательно замещенный одним или более галогенами. Согласно еще одному воплощению R15 представляет (CH2)nOH или гидроксил. Согласно еще одному воплощению R15 представляет (C1-C6)алкокси, необязательно замещенный одним или более галогенами.
Согласно одному воплощению R15 представляет -(CH2)nNHRj. Согласно одному воплощению R15 представляет -(CH2)nNHRj, Rj представляет водород. Согласно еще одному воплощению Rj представляет (C1-C6)алкил, необязательно замещенный одним или более галогенами. Согласно еще одному воплощению Rj представляет -(CH2)n-(6-10-членный арил). Согласно еще одному воплощению Rj представляет -С(О)-(CH2)n-(6-10-членный арил) или -С(О)-(CH2)n-(6-10-членный гетероарил), где арил или гетероарил необязательно замещен, как описано выше. Согласно еще одному воплощению Rj представляет -С(О)-(C1-C8)алкил, где алкил необязательно замещен одним или более галогенами. Согласно еще одному воплощению Rj представляет -С(О)-(CH2)n(C3-C10-циклоалкил). Согласно еще одному воплощению Rj представляет -С(О)-(CH2)n-NRkRl, где Rk и Rl имеют значения, описанные выше. Согласно еще одному воплощению Rj представляет -С(О)-(CH2)n-О-(C1-C6-алкил). Согласно еще одному воплощению Rj представляет -С(О)-(CH2)n-О-(CH2)n-(6-10-членный арил).
Согласно одному воплощению R16 представляет водород. Согласно еще одному воплощению R16 представляет -(CH2)nOH или гидроксил. Согласно еще одному воплощению R16 представляет фенил. Согласно еще одному воплощению R16 представляет -О-(C1-C6)алкил, необязательно замещенный одним или более галогенами. Согласно еще одному воплощению R16 представляет (C1-C6)алкил, необязательно замещенный одним или более галогенами.
Согласно одному воплощению R17 представляет водород. Согласно еще одному воплощению R17 представляет (C1-C6)алкил, необязательно замещенный одним или более галогенами.
Согласно одному воплощению n представляет 0. Согласно еще одному воплощению n представляет 1. Согласно еще одному воплощению n представляет 2.
Соединения, предлагаемые в настоящем описании, охватывают любые из сочетаний R15, R16, R17 и n, описанных выше.
Согласно одному конкретному воплощению R15 представляет метил. Согласно еще одному воплощению R15 представляет галоген. Согласно еще одному воплощению R15 представляет -CF3. Согласно еще одному воплощению R15 представляет -(CH2)nNHRj.
Согласно одному конкретному воплощению R15 представляет -(CH2)nNHRj, Rj представляет водород и n представляет 0 или 1. Согласно еще одному воплощению R15 представляет -(CH2)nNHRj, Rj представляет -С(О)-(О)-(C1-C6-алкил).
Согласно одному конкретному воплощению R16 представляет водород. Согласно еще одному воплощению R16 представляет метил. Согласно еще одному воплощению R17 представляет водород или метил.
Конкретные соединения включают, но не ограничиваются ими:
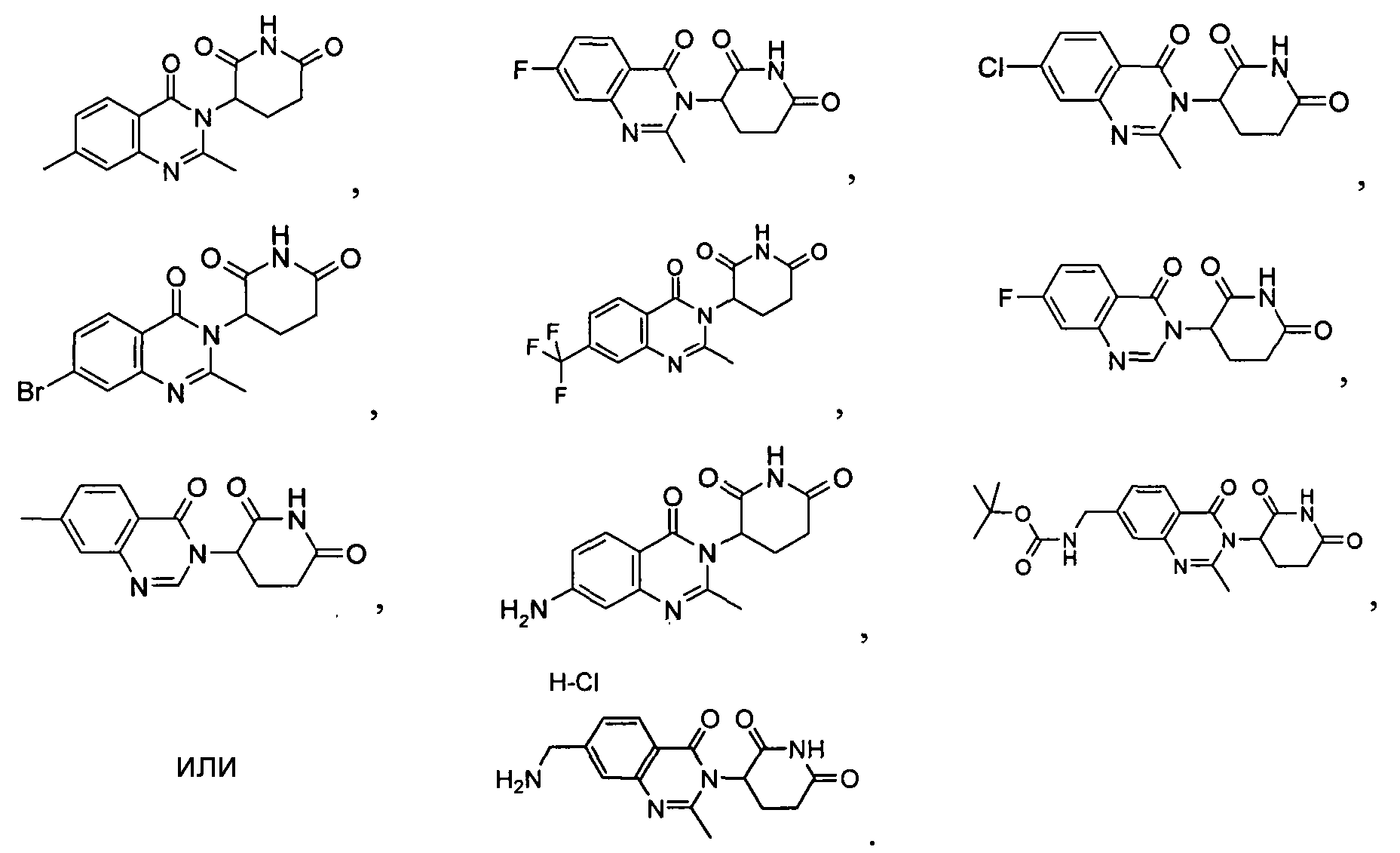
Согласно еще одному воплощению в настоящем описании предлагаются соединения формулы (VI):
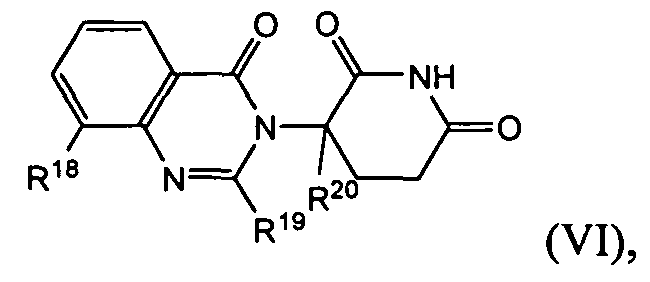
и их фармацевтически приемлемые соли, сольваты и стереоизомеры, где:
R18 представляет: водород; галоген; (CH2)nOH; (C1-C6)алкил, необязательно замещенный одним или более галогенами; (C1-C6)алкокси, необязательно замещенный одним или более галогенами; или
-(CH2)nNHRm, где Rm представляет:
водород;
(C1-C6)алкил, необязательно замещенный одним или более галогенами;
-(CH2)n-(6-10-членный арил);
-С(О)-(CH2)n-(6-10-членный арил) или -С(О)-(CH2)n-(6-10-членный гетероарил), где арил или гетероарил необязательно замещен одним или более из: галогена;
-SCF3; (C1-C6)алкила, самого необязательно замещенного одним или более галогенами; или (C1-C6)алкокси, самого необязательно замещенного одним или более галогенами;
-С(О)-(C1-C8)алкил, в котором алкил необязательно замещен одним или более галогенами;
-С(О)-(CH2)n(C3-C10-циклоалкил);
-С(О)-(CH2)n-NRnRo, где Rn и Ro представляют каждый независимо:
водород;
(C1-C6)алкил, необязательно замещенный одним или более галогенами;
(C1-C6)алкокси, необязательно замещенный одним или более галогенами; или
6-10-членный арил, необязательно замещенный одним или более из: галогена; (C1-C6)алкила, самого необязательно замещенного одним или более галогенами; (C1-C6)алкокси, самого необязательно замещенного одним или более галогенами;
-С(О)-(CH2)n-О-(C1-C6)алкил; или
-С(О)-(CH2)n-О-(CH2)n-(6-10-членный арил);
R19 представляет собой водород; -(CH2)nOH; фенил; -О-(C1-C6)алкил; или (C1-C6)алкил, необязательно замещенный одним или более галогенами;
R20 представляет водород; или (C1-C6)алкил, необязательно замещенный одним или более галогенами; и
n представляет 0, 1 или 2.
Согласно одному воплощению R18 представляет водород. Согласно еще одному воплощению R18 представляет галоген. Согласно еще одному воплощению R18 представляет (C1-C6)алкил, необязательно замещенный одним или более галогенами. Согласно еще одному воплощению R18 представляет (CH2)nOH или гидроксил. Согласно еще одному воплощению R18 представляет (C1-C6)алкокси, необязательно замещенный одним или более галогенами.
Согласно еще одному воплощению R18 представляет -(CH2)nNHRm. Согласно одному воплощению, в котором R18 представляет -(CH2)nNHRs, Rs представляет водород. Согласно еще одному воплощению Rm представляет (C1-C6)алкил, необязательно замещенный одним или более галогенами. Согласно еще одному воплощению Rm представляет -(CH2)n-(6-10-членный арил). Согласно еще одному воплощению Rm представляет -С(О)-(CH2)n-(6-10-членный арил) или -С(О)-(CH2)n-(6-10-членный гетероарил), где арил или гетероарил необязательно замещен, как описано выше. Согласно еще одному воплощению Rs представляет -С(О)-(C1-C8)алкил, в котором алкил необязательно замещен одним или более галогенами. Согласно еще одному воплощению Rm представляет -С(О)-(CH2)n(C3-C10-циклоалкил). Согласно еще одному воплощению Rm представляет -С(О)-(CH2)n-NRnRo, где Rn и Ro имеют значения, описанные выше. Согласно еще одному воплощению Rm представляет -С(О)-(CH2)n-О-(C1-C6)алкил. Согласно еще одному воплощению Rm представляет -С(О)-(CH2)n-О-(CH2)n-(6-10-членный арил).
Согласно еще одному воплощению R19 представляет собой водород. Согласно еще одному воплощению R19 представляет -(CH2)nOH или гидроксил. Согласно еще одному воплощению R19 представляет фенил. Согласно еще одному воплощению R19 представляет -О-(C1-C6)алкил, необязательно замещенный одним или более галогенами. Согласно еще одному воплощению R19 представляет (C1-C6)алкил, необязательно замещенный одним или более галогенами.
Согласно одному воплощению R20 представляет водород. Согласно еще одному воплощению R20 представляет (C1-C6)алкил, необязательно замещенный одним или более галогенами.
Согласно одному воплощению n представляет 0. Согласно еще одному воплощению n представляет 1. Согласно еще одному воплощению n представляет 2.
Соединения, предлагаемые в настоящем описании, охватывают любые из сочетаний R18, R19, R20 и n, описанных выше.
Согласно одному конкретному воплощению R18 представляет метил. Согласно еще одному воплощению R18 представляет галоген. Согласно еще одному воплощению R18 представляет гидроксил. Согласно еще одному воплощению R18 представляет -CF3.
Согласно одному конкретному воплощению R19 представляет водород. Согласно еще одному воплощению R19 представляет метил. Согласно еще одному конкретному воплощению R20 представляет водород.
Конкретные соединения включают, но не ограничиваются ими:
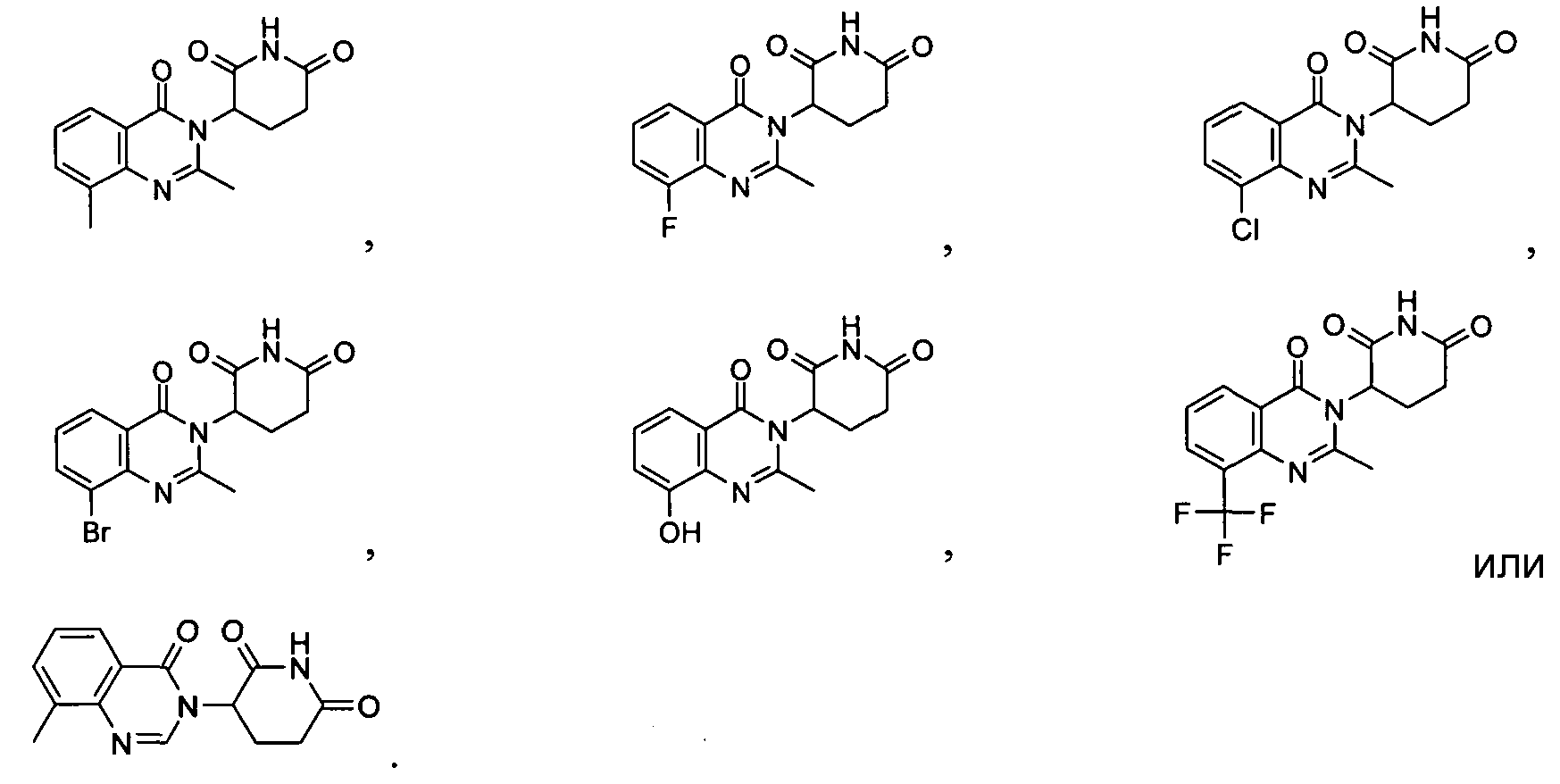
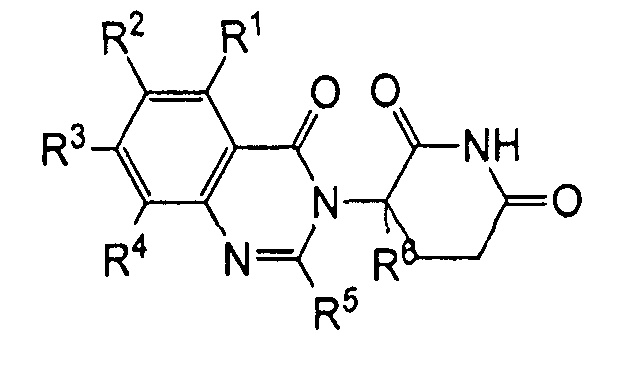
Согласно еще одному воплощению в настоящем описании предлагаются соединения формулы (VII):
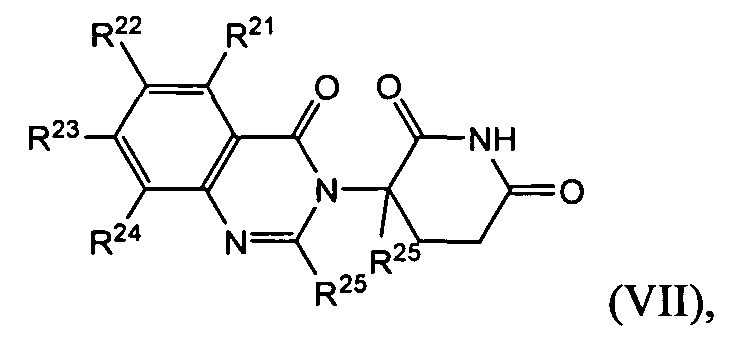
и их фармацевтически приемлемые соли, сольваты и стереоизомеры, где:
R21 представляет собой водород;
R22, R23 и R24 каждый представляет собой независимо: галоген; -(CH2)nOH; (C1-C6)алкил, необязательно замещенный одним или более галогенами; (C1-C6)алкокси, необязательно замещенный одним или более галогенами; или
два R21-R24 вместе образуют 5- или 6-членное кольцо, необязательно замещенное одним или более из:
галогена; (C1-C6)алкила, необязательно замещенного одним или более галогенами; и (C1-C6)алкокси, необязательно замещенного одним или более галогенами;
R25 представляет собой водород; -(CH2)nOH; фенил; -О-(C1-C6)алкил; или (C1-C6)алкил, необязательно замещенный одним или более галогенами;
R26 представляет водород; или (C1-C6)алкил, необязательно замещенный одним или более галогенами; и
n представляет 0, 1 или 2.
Согласно одному воплощению два из R22-R24 представляют галоген. Согласно еще одному воплощению два из R22-R24 представляет (C1-C6)алкил, необязательно замещенный одним или более галогенами. Согласно еще одному воплощению два из R22-R24 представляют (C1-C6)алкокси, необязательно замещенный одним или более галогенами.
Согласно еще одному воплощению один из R22-R24 представляет галоген, а еще один из R22-R24 представляет (C1-C6)алкил, необязательно замещенный одним или более галогенами. Согласно еще одному воплощению один из R22-R24 представляет галоген, а еще один из R22-R24 представляет (C1-C6)алкокси, необязательно замещенный одним или более галогенами. Согласно еще одному воплощению один из R22-R24 представляет (C1-C6)алкокси, необязательно замещенный одним или более галогенами, а еще один из R22-R24 представляет (C1-C6)алкил, необязательно замещенный одним или более галогенами.
Согласно еще одному воплощению два из R22-R24 вместе образуют 5-6-членное кольцо. Согласно одному конкретному воплощению R22 и R23 вместе образуют 5-6-членное кольцо. Согласно одному конкретному воплощению R22 и R23 вместе образуют фенильное кольцо. Согласно еще одному воплощению кольцо, образованное R22 и R23, необязательно замещено одним или более из: галогена; (C1-C6)алкила, необязательно замещенного одним или более галогенами; и (C1-C6)алкокси, необязательно замещенного одним или более галогенами.
Согласно одному воплощению R25 представляет водород. Согласно еще одному воплощению R25 представляет -(CH2)nOH или гидроксил. Согласно еще одному воплощению R25 представляет фенил. Согласно еще одному воплощению R25 представляет -О-(C1-C6)алкил, необязательно замещенный одним или более галогенами. Согласно еще одному воплощению R25 представляет (C1-C6)алкил, необязательно замещенный одним или более галогенами.
Согласно одному воплощению R26 представляет водород. Согласно еще одному воплощению R26 представляет (C1-C6)алкил, необязательно замещенный одним или более галогенами.
Согласно одному воплощению n представляет 0. Согласно еще одному воплощению n представляет 1. Согласно еще одному воплощению n представляет 2.
Соединения, предлагаемые в настоящем описании, охватывают любые из сочетаний R21, R22, R23, R24, R25, R26 и n, описанных выше.
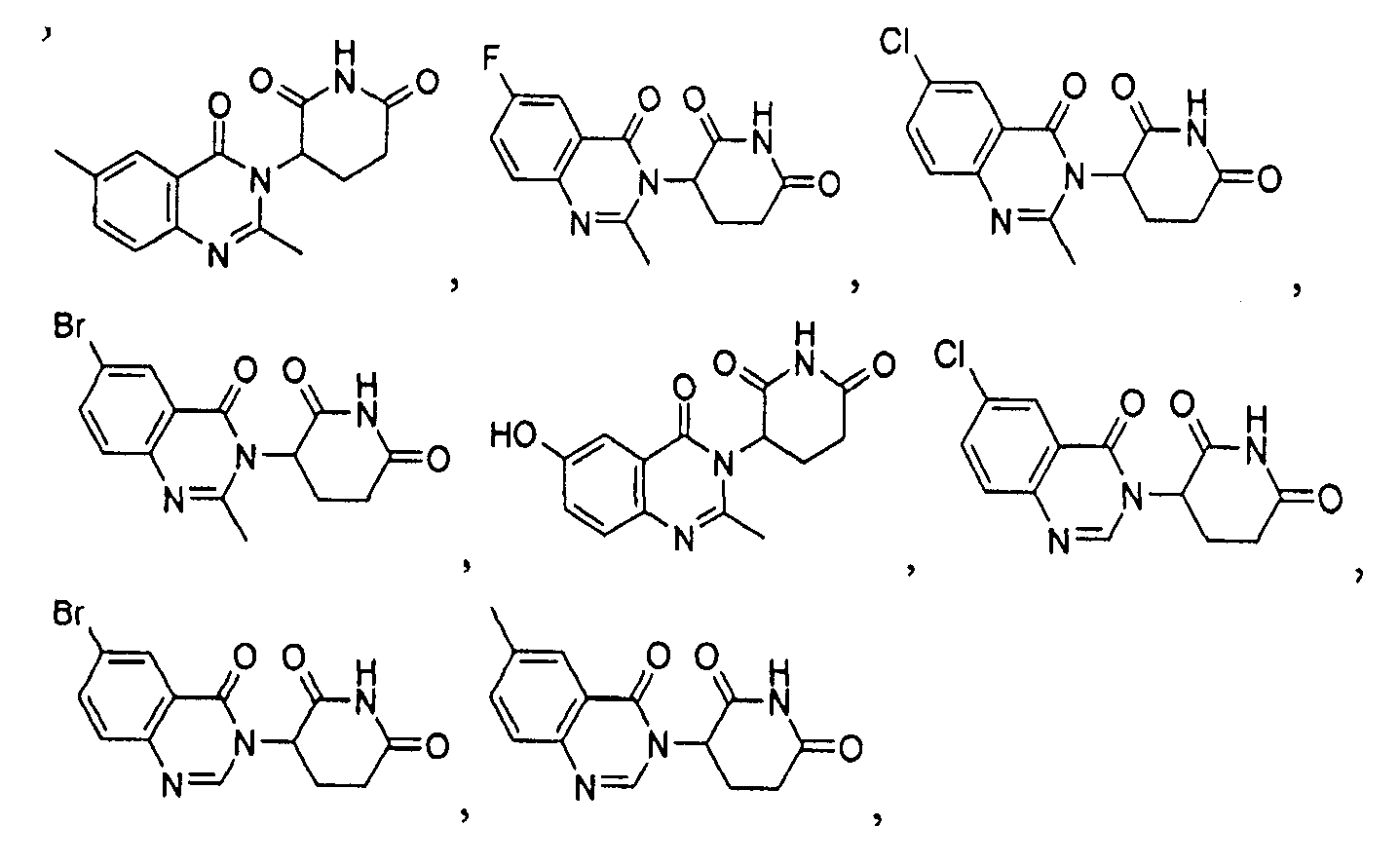
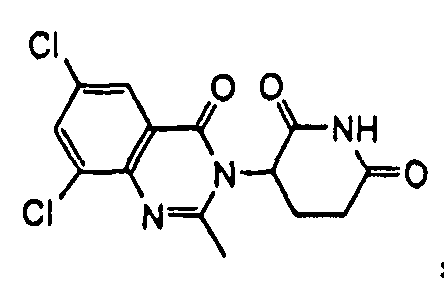
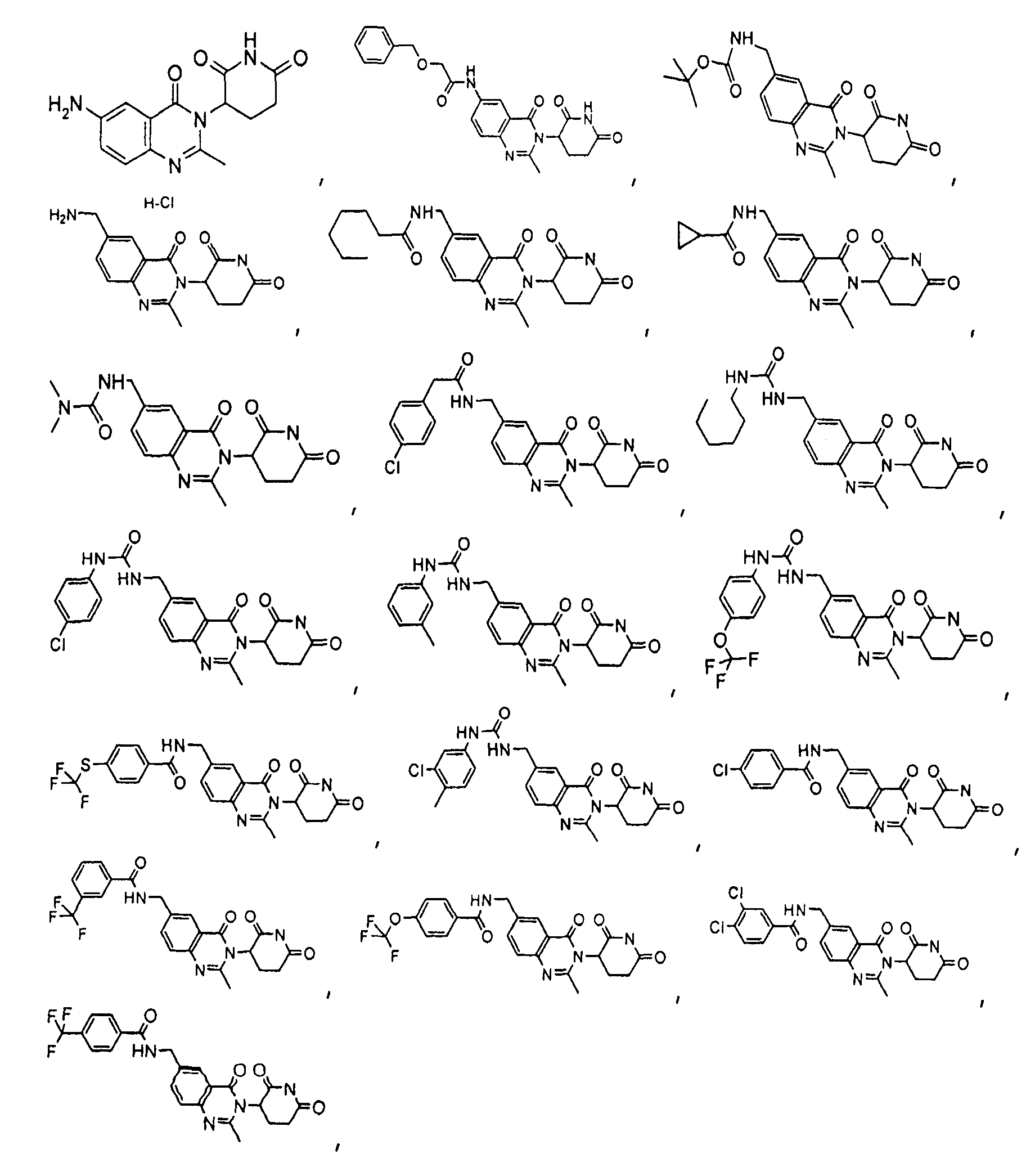
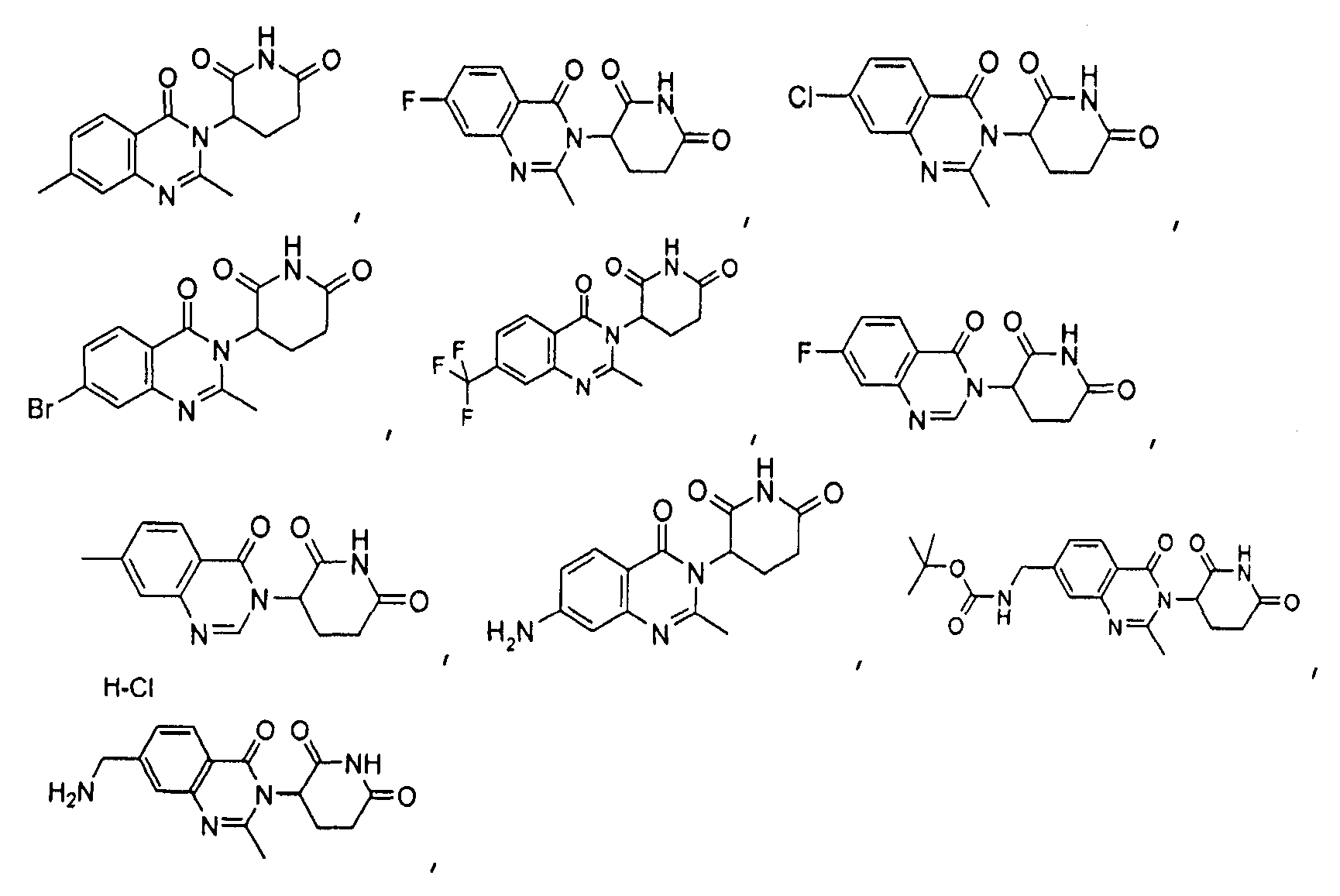
Конкретные соединения включают, но не ограничиваются ими:
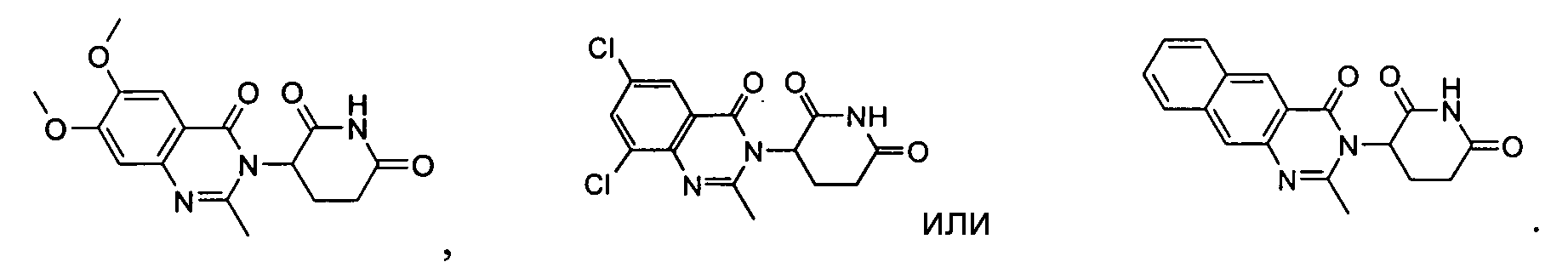
Если не указано иное, используемый в данном описании термин “фармацевтически приемлемая соль” относится к солям, получаемым из фармацевтически приемлемых нетоксичных кислот, включая неорганические и органические кислоты. Подходящие нетоксичные кислоты включают неорганические кислоты и органические кислоты, такие как, не ограниченные ими, уксусная, альгиновая, антраниловая, бензолсульфоновая, бензойная, камфорсульфоновая, лимонная, этенсульфоновая, муравьиная, фумаровая, фуровая, глюконовая, глютамовая, глюкореновая, галактуроновая, глицидная, бромистоводородная, соляная, изетионовая, молочная, малеиновая, яблочная, миндальная, метансульфоновая, слизевая, азотная, памовая, пантотеновая, фенилуксусная, пропионовая, фосфорная, салициловая, стеариновая, сукциновая, сульфаниловая, серная, винная, п-толуолсульфоновая и аналогичные. Согласно одному воплощению подходящими являются соляная, бромистоводородная, фосфорная и серная кислоты.
Если не указано иное, используемый в данном описании термин “сольват” обозначает соединение, которое дополнительно включает стехиометрическое или не стехиометрическое количество растворителя, связанного с помощью не ковалентных межмолекулярных связей. Когда растворителем является вода, сольватом является гидрат.
Если не указано иное, используемый в данном описании термин “пролекарство” обозначает производное соединения, которое может гидролизоваться, окисляться или реагировать иным образом в биологических условиях (in vitro или in vivo), давая это соединение. Примеры пролекарств включают, но не ограничиваются ими, соединения, которые включают биогидролизуемые фрагменты, такие как биогидролизуемые амиды, биогидролизуемые сложные эфиры, биогидролизуемые карбаматы, биогидролизуемые карбонаты, биогидролизуемые уреиды и биогидролизуемые фосфатные аналоги. Другие примеры пролекарств включают соединения, которые включают фрагменты -NO, -NO2, -ONO- -ONO2. Пролекарства могут обычно получаться с использованием хорошо известных способов, таких как способы, описанные в работах Burger's Medicinal Chemistry and Drug Discovery, 172-178, 949-982 (Manfred E. Wolff ed., 5th ed. 1995), и Design of Prodrugs (H. Bundgaard ed., Elselvier, New York 1985).
Если не указано иное, используемый в данном описании термин “биогидролизуемый карбамат”, “биогидролизуемый карбонат”, “биогидролизуемый уреид” и “биогидролизуемый фосфат” обозначают карбамат, карбонат, уреид и фосфат соответственно соединения, которое или: 1) не мешает биологической активности данного соединения, но может затем придавать данному соединению благоприятные свойства in vivo, такие как восприимчивость, длительность действия или наступление действия; или 2) является биологически неактивным, но превращается in vivo в биологически активное соединение. Примеры биогидролизуемых карбаматов включают, но не ограничиваются ими, карбаматы, которые включают низший алкиламиновый, замещенный этилендиаминовый, аминокислотный, гидроксиалкиламиновый, гетероциклический и гетероароматический аминовый и низший полиэфираминовый фрагменты.
Если не указано иное, используемый в данном описании термин “стереоизомер” охватывает все энантиомерно/стереомерно чистые и энантиомерно/стереомерно обогащенные соединения, предлагаемые изобретением.
Если не указано иное, используемый в данном описании термин “стереомерно чистый” обозначает композицию или состав, который включает один стереоизомер соединения и по существу свободен от других стереоизомеров данного соединения. Например, стереомерно чистый состав соединения, имеющего один хиральный центр, будет по существу свободным от противоположного энантиомера данного соединения. Стереомерно чистый состав соединения, имеющего два хиральных центра, по существу свободен от других диастереомеров данного соединения. Типичное стереомерно чистое соединение включает более чем примерно 80% по весу одного стереоизомера данного соединения и менее чем примерно 20% по весу других стереоизомеров данного соединения, более чем примерно 90% по весу одного стереоизомера данного соединения и менее чем примерно 10% по весу других стереоизомеров данного соединения, более чем примерно 95% по весу одного стереоизомера данного соединения и менее чем примерно 5% по весу других стереоизомеров данного соединения или более чем примерно 97% по весу одного стереоизомера данного соединения и менее чем примерно 3% по весу других стереоизомеров данного соединения.
Если не указано иное, используемый в данном описании термин “стереомерно обогащенный” обозначает состав, который включает более чем примерно 55% по весу одного стереоизомера соединения, более чем примерно 60% по весу одного стереоизомера соединения, более чем примерно 70% по весу или более чем примерно 80% по весу одного стереоизомера соединения.
Если не указано иное, используемый в данном описании термин “энантиомерно чистый” обозначает стереомерно чистый состав соединения, имеющего один хиральный центр. Аналогичным образом, термин “энантиомерно обогащенный” обозначает стереомерно обогащенный состав соединения, имеющего один хиральный центр.
Если не указано иное, используемый в данном описании термин “алкил” относится к насыщенному углеводороду с прямой или разветвленной цепью, имеющему число атомов углерода, как указано в описании. Характерные насыщенные алкилы с прямой цепью включают -метил, -этил, -н-пропил, -н-бутил, н-пентил и -н-гексил; тогда как насыщенные алкилы с разветвленной цепью включают -изопропил, -втор-бутил, -изобутил, -трет-бутил, изопентил, 2-метилбутил, 3-метилбутил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2-метилгексил, 3-метилгексил, 4-метилгексил, 5-метилгексил, 2,3-диметилбутил и аналогичные. Термин “алкил” охватывает также циклоалкил.
Если не указано иное, используемый в данном описании термин “циклоалкил” обозначает вид алкила, содержащего от 3 до 15 атомов углерода, без чередования или резонирования двойных связей между атомами углерода. Он может содержать от 1 до 4 колец. Примеры ненасыщенных циклоалкилов включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил, циклогексил и адамантил. Циклоалкил может быть замещен одним или более заместителями.
Используемый в данном описании термин “арил” обозначает карбоциклическое ароматическое кольцо, содержащее от 5 до 14 кольцевых атомов. Все кольцевые атомы карбоциклической арильной группы являются атомами углерода. Арильные кольцевые структуры включают соединения, имеющие одну или более кольцевых структур, такие как моно-, би- или трициклические соединения, так же как и бензосконденсированные карбоциклические фрагменты, такие как 5,6,7,8-тетрагидронафтил и аналогичные. В частности, арильной группой является моноциклическое или бициклическое кольцо. Характерные арильные группы включают фенил, антраценил, флуоренил, инденил, азуленил, фенантренил и нафтил.
Следует отметить, что, если имеет место несоответствие между изображаемой структурой и наименованием, даваемым этой структуре, изображаемую структуру следует считать более весомой. В дополнение к сказанному, если стереохимия структуры или части структуры не указывается, например, жирной или помеченной штрихами линиями, данную структуру или часть структуры следует рассматривать как охватывающую все ее стереоизомеры.
4.2 СПОСОБЫ ЛЕЧЕНИЯ, ПРОФИЛАКТИКИ И ИЗЛЕЧЕНИЯ
Данным изобретением предлагаются способы лечения, профилактики и/или излечения различных заболеваний или расстройств с использованием соединения, характеризуемого в описании, или его фармацевтически приемлемой соли, сольвата (например, гидрата), пролекарства, клатрата или стереоизомера. Без ограничения какой-либо конкретной теорией характеризуемые в описании соединения могут регулировать (контролировать) ангиогенез или ингибировать продуцирование некоторых цитокинов, включающих, но не ограниченных ими, TNF-α, IL-1β, IL-12, IL-18, GM-CSF и/или IL-6. Без ограничения какой-либо конкретной теорией характеризуемые в описании соединения могут стимулировать продуцирование некоторых других цитокинов, включая IL-10, а также действовать как костимуляторный сигнал для активации Т клеток, приводят в результате к повышенному продуцированию цитокинов, таких как, но без ограничения ими, IL-12 и/или IFN-γ. Кроме того, предлагаемые изобретением соединения могут усиливать действие NK клеток и антителоопосредуемой клеточной цитотоксичности (ADCC). Далее, предлагаемые изобретением соединения могут быть иммуномодуляторными и/или цитотоксичными и, таким образом, могут быть полезными в качестве химиотерапевтических агентов. Следовательно, без ограничения какой-либо конкретной теорией некоторые или все такие характеристики, которыми обладают характеризуемые в описании соединения, могут делать их полезными при лечении, излечении и/или профилактике различных заболеваний или расстройств.
Примеры заболеваний или расстройств включают, но не ограничиваются ими, рак, расстройства, связанные с ангионезом, боль, включающую, но не ограниченную ими, комплексный региональный болевой синдром (“CRPS”), макулярную дегенерацию (“MD”) и родственные синдромы, заболевания кожи, легочные расстройства, асбест-связанные расстройства, паразитарные заболевания, иммунодефицитные расстройства, ЦНС расстройства, ЦНС повреждение, атеросклероз и родственные расстройства, дисфункциональный сон и родственные расстройства, гемоглобинопатию и родственные расстройства (например, анемию), TNFα связанные расстройства и другие разнообразные заболевания и расстройства. Если не указано иное, используемые в данном описании термины “лечить” и “лечение” относятся к уничтожению или облегчению заболевания или расстройства или одного или более симптомов, связанных с заболеванием или расстройством. Согласно некоторым воплощениям данные термины относятся к минимизации распространения или ухудшения заболевания или расстройства, являющегося результатом введения субъекту с таким заболеванием или расстройством одного или более профилактических или терапевтических агентов. Согласно некоторым воплощениям данные термины относятся к введению описываемого в описании соединения с использованием или без использования другого дополнительного активного агента после наступления симптомов конкретной болезни.
Если не указано иное, используемые в данном описании термины “предотвращать”, “предотвращение” и “профилактика” относятся к предотвращению начала, рецидива или распространения болезни или расстройства или одного или более их симптомов. Согласно некоторым воплощениям данные термины относятся к лечению с помощью введения характеризуемого в описании соединения с использованием или без использования другого дополнительного активного соединения до начала появления симптомов, в частности пациентам, подверженным риску описываемых здесь заболеваний или расстройств. Данные термины охватывают ингибирование или снижение симптомов конкретного заболевания. Согласно некоторым воплощениям кандидатами для режимов превентивного лечения являются особенно также пациенты с наследственной историей заболевания. В дополнение, пациенты, которые имеют историю рецидива симптомов, также являются потенциальными кандидатами для профилактики. В данном отношении термин “профилактика” может использоваться взаимозаменяемо с термином “профилактическое лечение”.
Если не указано иное, используемый в данном описании термин “излечивать”, “излечение (или управление болезнью)” относятся к предотвращению или замедлению прогрессирования, распространения или ухудшения заболевания или расстройства или одного или более их симптомов. Часто благоприятные эффекты, которые субъект получает от профилактического и/или терапевтического агента, не являются результатом лечения заболевания или расстройства. В данном отношении термин “управление или излечение” охватывает лечение пациента, который пострадал от конкретной болезни в попытке предотвратить или минимизировать рецидив болезни.
Если не указано иное, используемый в данном описании термин “терапевтически эффективное количество” соединения обозначает количество, достаточное для обеспечения терапевтической пользы или выгоды при лечении или управлении болезнью или расстройства или для отсрочки или минимизации одного или более симптомов, связанных с болезнью или расстройством. Терапевтически эффективное количество соединения обозначает количество терапевтического агента, одного или в сочетании с другими средствами терапии, которое является достаточным для обеспечения терапевтической пользы или выгоды при лечении или управлении болезнью или расстройством. Термин “терапевтически эффективное количество” может охватывать количество, которое улучшает общую терапию, снижает или избегает симптомов или причин заболевания или расстройства или усиливает терапевтическую эффективность еще одного терапевтического агента.
Если не указано в описании иное, используемый в данном описании термин “профилактически эффективное количество” соединения обозначает количество, достаточное для предотвращения заболевания или расстройства или для предотвращения его рецидива. Профилактически эффективное количество соединения обозначает количество терапевтического агента, одного или в сочетании с другими агентами, которое обеспечивает профилактическую пользу или выгоду при профилактике болезни. Термин “профилактически эффективное количество” может охватывать количество, которое улучшает общую терапию или усиливает профилактическую эффективность еще одного терапевтического агента.
Примеры рака и предраковых состояний включают, но не ограничиваются ими, болезни или состояния, описанные в патентах США № 6281230 и 5635517 авторов Muller et al., в различных патентных публикациях США в Zeldis, включая публикацию № 2004/0220144А1, опубликованную 4 ноября 2004 г. (Лечение миелодиспластического синдрома); № 2004/0029832А1, опубликованную 12 февраля 2004 г. (Лечение различных типов рака); и 2004/0087546, опубликованную 6 мая 2004 г. (Лечение миелопролиферативных заболеваний). Примеры включают также болезни и состояния, описанные в WO 2004/103274, опубликованной 2 декабря 2004 г. Все данные источники полностью включены в описание путем ссылки на них.
Конкретные примеры видов рака включают, но не ограничиваются ими, рак кожи, такой как меланома; лимфатических узлов; груди; шейки матки; желудочно-кишечного тракта; легких; яичников, простаты; толстой кишки; прямой кишки; рта; мозга; головы и шеи; горла; семенника (яичка); поджелудочной железы; кости; селезенки; печени; мочевого пузыря; гортани; носовых проходов; и СПИД родственных видов рака. Соединения полезны также для лечения раков крови и костного мозга, таких как множественная миелома и острая и хроническая лейкемия, например лимфобластная, миелогенная, лимоцитарная и миелоцитарная лейкемии. Соединения, предлагаемые изобретением, могут использоваться для лечения, профилактики или излечения или первичной, или метастатической опухолей.
Другие конкретные примеры раков включают, но не ограничиваются ими, неотложную злокачественность, амилоидоз, нейробластому, менингиому, гемангиоперицитому, множественный метастаз головного мозга, полиморфную глиобластому, глиобластому, глиому ствола мозга, злокачественную опухоль головного мозга с плохим прогнозом, злокачественную глиому, рецидивную злокачественную глиому, анапластическую астроцитому, анапластическую олигодендроглиому, нейроэндокринную опухоль, ректальную аденокарциному, Dukes C & D колоректальный рак, неоперабельную ректальную карциному, метастатическую гепатоклеточную карциному, саркому Капоши, каротипную острую миелобластную лейкемию, хроническую лимфоцитарную лейкемию (CLL), лимфому Ходжкина, не-ходжкинскую лимфому, кожную лимфому Т-клеток, кожную лимфому В-клеток, диффузную лимфому крупных В-клеток, низкосортную фолликулярную лимфому, метастатическую меланому (локализованная меланома, включающая, но не ограниченная ею, окулярная меланома), злокачественную мезотелиому, синдром злокачественной мезотелиомы с плевральным выпотом, перитонеальную карциному, папиллярную сывороточную карциному, гинекологическую саркому, саркому мягких тканей, склеродерму, кожный васкулит, гистиоцитоз Langerhans клеток, лейомиосаркому, прогрессивную оссифицирующую фибродисплазию, гормональный рефракторный рак простаты, резецируемую с высоким риском саркому мягких тканей, неоперабельную гепатоклеточную карциному, макроглобулинемию Waldenstrom'a, тлеющую миелому, безболезненную миелому, рак фаллопиевых труб, андроген-независимый рак простаты, андроген-зависимый IV стадии неметастатический рак простаты, гормон-нечувствительный рак простаты, химиотерапия-нечуствительный рак простаты, папиллярную тироидную карциному, фоликуллярную тироидную карциному, медуллярную тироидную карциному и лейомиому. Согласно конкретному воплощению рак является метастатическим. Согласно еще одному воплощению рак является невосприимчивым или стойким к химиотерапии или облучению.
Согласно одному воплощению изобретением предлагаются способы лечения, профилактики или усмирения (излечения) различных форм лейкемий, таких как хроническая лимфоцитарная лейкемия, хроническая миелоцитарная лейкемия, острая лимфобластная лейкемия, острая миелогенная лейкемия и острая миелобластная лейкемия, включая лейкемии, которые являются рецидивными, невосприимчивыми или стойкими, как описаны в публикации США № 2006/0030594, опубликованной 9 февраля 2006 г., содержание которой целиком включено в описание путем ссылки на нее.
Термин “лейкемия” относится к злокачественным неоплазмам кроветворных тканей. Лейкемия включает, но не ограничивается ими, хроническую лимфоцитарную лейкемию, хроническую миелоцитарную лейкемию, острую лимфобластную лейкемию, острую миелогенную лейкемию и острую миелобластную лейкемию. Лейкемия может быть рецидивной, невосприимчивой или устройчивой к обычной терапии. Термин “рецидивный или возвратный” относится к ситуации, когда у пациентов, у которых уже была ремиссия лейкемии, после терапии имеет место возврат лейкемических клеток в костный мозг и снижение нормальных кровяных клеток. Термин “невосприимчивый или стойкий” относится к обстоятельству, при котором пациенты, даже после интенсивного лечения, имеют в их костном мозге остаточные лейкемические клетки.
Согласно еще одному воплощению настоящим изобретением предлагаются способы лечения, профилактики или усмирения различных типов лимфом, включая не-ходжкинскую лимфому (NHL). Термин “лимфома” относится к гетерогенной группе неоплазм, возникающих в ретикулоэндотелиальной и лимфатической системах. “NHL” относится к злокачественной моноклональной пролиферации лимфоидных клеток в участках иммунной системы, включая лимфатические узлы, костный мозг, селезенку, печень и желудочно-кишечный тракт. Примеры NHL включают, но не ограничиваются ими, лимфому клеток мантии (MCL), лимфоцитарную лимфому промежуточной дифференциации, промежуточную лимфоцитарную лимфому (ILL), диффузную плохо дифференцируемую лимфоцитарную лимфому (PDL), центроцитарную лимфому, диффузную мелко-раскалываемую клеточную лимфому (DSCCL), фолликулярную лимфому и любой тип лимфом клеток мантии, которые могут быть видны под микроскопом (нодулярная (узелковая), диффузная, бластная и лимфома мантийной зоны).
Примеры заболеваний и расстройств, связанных с или характеризуемых нежелательным ангиогенезом, включают, но не ограничиваются ими, воспалительные, аутоиммунные, вирусные, генетические, аллергические, бактериальные, окулярные неоваскулярные, хородальные неоваскулярные заболевания, неоваскулярные заболевания сетчатки и покраснение (реваскуляризация уголков). Конкретные примеры заболеваний и расстройств, связанных с или характеризуемых нежелательным ангиогенезом, включают, но не ограничиваются ими, артрит, эндометриоз, болезнь Крона, сердечную недостаточность, неотложную сердечную недостаточность, ренальное ухудшение, эндотоксемию, синдром токсического шока, остеоартрит, ретровирусную репликацию, истощение, менингит, кремнезем-индуцируемый фиброз, асбест-индуцируемый фиброз, ветеринарные расстройства, связанную со злокачественностью гиперкальцемию, тромбоз или кровоизлияние, циркуляторный шок, периодонтит, гингивит, макроцитарную анемию, невосприимчивую анемию и синдром 5q-делеции.
Примеры боли включают, но не ограничиваются болями, описанными в патентной публикации США № 2005/0203142, опубликованной 15 сентября 2005 г., содержание которой включено в описание ссылкой на нее. Конкретные типы боли включают, но не ограничиваются ими, ноцицептивную боль, нейропатическую боль, смешанную боль из ноцицептивной и нейропатической боли, висцеральную боль, мигрень, головную боль и постоперативную боль.
Примеры ноцицептивной боли включают, но не ограничиваются ими, боль, связанную с химическим или термическим ожогами, порезами кожи, контузиями кожи, остеоартритом, ревматоидным артритом, тендонитом, и миофасциальную боль.
Примеры нейропатической боли включают, но не ограничиваются ими, CRPS типа I, CRPS типа II, рефлекс симпатетическую дистрофию (RSD), рефлекс нейроваскулярную дистрофию, рефлекс дистрофию, синдром симпатически удерживаемой боли, каузалгию, атрофию костей Sudesk, альгонейродистрофию, синдром плеча и руки, посттравматическую дистрофию, тригеминальную невралгию, постгерпетическую невралгию, боль, связанную с раком, фантомную боль конечностей, фибромиалгию, синдром хронической усталости, боль при повреждении спинного мозга, центральную посттромбозную боль, радикулопатию, диабетическую нейропатию, посттромбозную боль, люэтическую нейропатию и другие болевые нейропатические состояния, такие как состояния, индуцируемые лекарствами, такими как винкристин и велкад.
Используемые в описании термины “комплексный региональный болевой синдром”, “CRPS” и “CRPS и родственные синдромы” обозначают хроническое болевое расстройство, характеризуемое одной или более из следующих: боль, является ли она спонтанной или вызываемой, включая аллодинию (болевая ответная реакция на стимул, который обычно не является болезненным) и гипералгезию (преувеличенная ответная реакция на стимул, который обычно является только слегка болезненным); боль, которая является непропорциональной подстрекающему событию (например, годы тяжелой боли после растяжения голеностопного сустава); региональную боль, которая не ограничивается одним периферическим нервным распространением; и автономную дисрегуляцию (например, эдема, альтерация кровяного потока и гипергидроз), связанную с трофическими кожными изменениями (отклонения в росте волос и ногтей и кожные изъязвления).
Примеры MD и родственных синдромов включают, но не ограничиваются ими, синдромы, описанные в патентной публикации США № 2004/0091455, опубликованной 13 мая 2004 г., содержание которой включено в описание путем ссылки на нее. Конкретные примеры включают, но не ограничиваются ими, атрофический (сухой) MD, экссудативный (влажный) MD, возрастную макулопатию (ARM), хороидальную реваскуляризацию (CNVM), отслоение ретинального пигментного эпителия (PED) и атрофию ретинального пигментного эпителия (RPE).
Примеры кожных болезней включают, но не ограничиваются ими, болезни, описанные в публикации США № 2005/0214328А1, опубликованной 29 сентября 2005 г., содержание которой включено в описание путем ссылки на нее. Конкретные примеры включают, но не ограничиваются ими, кератозы и родственные симптомы, кожные заболевания или расстройства, характеризуемые разрастанием эпидермиса, угрей и морщин.
Используемый в описании термин “кератоз” относится к любому повреждению на эпидермисе, отмеченному присутствием ограниченных разрастаний рогового слоя, включающими, но не ограниченные ими, актиничный кератоз, себорейный кератоз, кератоакантому, кератоз фолликулярный (болезнь Darier'a), инвертируемый фолликулярный кератоз, пальмоплантарную кератодерму (РРК, ладонный и подошвенный кератоз), волосистый кератоз и штукатурный кератоз. Термин “актиничный кератоз” также относится к сенильному или старческому кератозу, сенильному бородавчатому, висцеральному сенильному, солнечному кератозу, кератодерме или кератоме. Термин “себорейный кератоз” относится также к себорейным бородавкам, старческим бородавкам или базальноклеточной папилломе. Кератоз характеризуется одним или более из следующих симптомов: появляющаяся грубость, чешуйчатость, эритематозные папулы, бляшки, спикулы или узелки на открытых поверхностях (например, лице, руках, ушах, шее, ногах и грудной клетке), наросты или разрастания кератина, называемые кожными рожками, гиперкератоз, телеангиэктазия, эластоз, пигментный лентигиноз, акантоз, паракератоз, дискератоз, папилломатоз, гиперпигментация базальных клеток, клеточная атипия, митотические фигуры, аномальная адгезия клетка к клетке, плотные воспалительные инфильтраты и небольшая распространенность карцином сквамозных клеток.
Примеры кожных заболеваний или расстройств, характеризуемых разрастаниями эпидермиса, включают, но не ограничиваются ими, любые состояния, заболевания или расстройства, отмечаемые присутствием разрастаний эпидермиса, включающими, но не ограниченными ими, инфекции, связанные с вирусом папилломы, мышьяковые кератозы, признаки Leser-Trelat, бородавчатую дискератому (WD), трихостаз игольчатый (TS), эритрокератодерму вариабельную (EKV), фетальный ихтиоз (арлекиновый ихтиоз), суставные подушечки, кожную меланоакантому, порокератоз, псориаз, сквамозную клеточную карциному, сливной и покрываемый сетчатым узором папилломатоз (CRP), мягкие бородавки, кожный рог, болезнь Коуден (синдром множественной гамартомы), дерматоз папулезный негроидный (DPN), синдром эпидермального невуса (ENS), ихтиоз обычный, моллюск контагиозный, пруриго нодулярная (узелковая) и акантоз чернеющий (AN).
Примеры легочных расстройств включают, но не ограничиваются ими, расстройства, описанные в публикации США № 2005/0239842А1, опубликованной 27 октября 2005 г., содержание которой включено в данное описание путем ссылки на нее. Специфические примеры включают легочную гипертензию и связанные с ней расстройства. Примеры легочной гипертензии и связанных с ней расстройств включают, но не ограничиваются ими, первичную легочную гипертензию (PPH); вторичную легочную гипертензию (SPH); наследственную РРН; спорадическую PPH; предкапиллярную легочную гипертензию; легочную артериальную гипертензию (РАН); гипертензию легочной артерии; идиопатичесекую легочную гипертензию; тромботическую легочную артериопатию (ТРА); плексогенную легочную артериопатию; легочную гипертензию функциональных классов I-IV; и легочную гипертензию, ассоциируемую с указанными, связанную с ними, или вторичную по отношению к дисфункции левого желудочка, болезни митрального клапана, констриктивному (сдавливающему) периокардиту, стенозу аорты, кардиомиопатии, средостенному фиброзу, аномальному легочному венозному дренированию, легочной веноокклюзивной болезни, коллагеновой сосудистой болезни, врожденной болезни сердца, ВИЧ вирусной инфекции, лекарствам и токсинам, таким как фенфлурамины, врожденной болезни сердца, легочной венозной гипертензии, хронической обструктивной болезни легких, интерстициальной болезни легких, нарушенному дыханию во время сна, альвеолярному гиповентилляционному расстройству, подверганию действия высоты, легочной болезни новорожденных, альвеолярно-капиллярной дисплазии, серповидноклеточной болезни, другим коагуляционным расстройствам, хронической тромбоэмболии, болезни соединительной ткани, волчанке, включающей системную и кожную волчанку, шистозомиазу, саркоидозу или легочному капиллярному гемангиоматозу.
Примеры, связанных с асбестом расстройств, включают, но не ограничиваются ими, расстройства, описанные в публикации США № 2005/0100529, опубликованной 12 мая 2005 г., содержание которой включено в данное описание путем ссылки на нее. Конкретные примеры включают, но не ограничиваются ими, мезотелиому, асбестоз, злокачественный плевральный выпот, доброкачественный экссудативный выпот, плевральные бляшки, плевральную кальцификацию, диффузные плевральные утолщения, полный ателектаз (спадение легкого), фибротические массы и рак легких.
Примеры паразитических заболеваний включают, но не ограничиваются ими, заболевания, описанные в публикации США № 2006/0154880, опубликованной 13 июля 2006 г., содержание которой включено в данное описание путем ссылки на нее. Паразитические заболевания включают болезни и расстройства, вызываемые внутриклеточными паразитами человека, такими как, но не ограниченными ими, P. falcifarium, P. ovale, P. vivax, P. malariae, L. donovari, L. infantum, L. aethiopica, L. major, L. tropica, L. mexicana, L. braziliensis, T. Gondii, B. microti, B. divergens, B. coli, C. parvum, C. cayetanensis, E. histolytica, I. belli, S. mansonii, S. haematobium, Trypanosoma ssp., Toxoplasma ssp. и O. volvulus. Изобретение охватывает также другие болезни и расстройства, вызываемые внутриклеточными паразитами не человека, включают такие как, но не ограниченные ими, Babesia bovis, Babesia canis, Banesia Gibsoni, Besnoitia darlingi, Cytauxzoon felis, Eimeria ssp. Hammondia ssp. и Theileria ssp. Конкретные примеры включают, но не ограничиваются ими, малярию, бабешиоз, трипанозомиаз, лейшманиоз, токсоплазмоз, менингоэнцефалит, кератит, амебиаз, гиардиоз, криптоспоридиоз, изоспориаз, циклоспориаз, микроспоридиоз, аскаридоз, трихиуриаз, анкилостомоз, стронгилоидаз, токсокариаз, трихиноз, лимфатический филяриоз, онхоцеркоз, филяриоз, шистосомоз и дерматит, вызываемый шистосомами животных.
Примеры расстройств иммунодефицита включают, но не ограничиваются ими, расстройства, описанные в публикации США № 2006/0188475, опубликованной 24 августа 2006 г. Конкретные примеры включают, но не ограничиваются ими, дефицит аденозиндезаминазы, дефицит антител с нормальными или повышенными показателями Igs, атаксию-тенлангиэктасию, синдром оголенных лимфоцитов, общий вариабельный иммунодефицит, дефицит Ig с гипер-IgM, делеции Ig тяжелых цепей, дефицит IgA, иммунодефицит с тимомой, ретикулярный дисгенез, синдром Nezelof, селективный дефицит IgG подкласса, преходящую гипогаммаглобулинемию грудного возраста, синдром Wistcott-Aldrich, Х-связанную агаммаглобулинемию, Х-связанный тяжелый объединенный иммунодефицит.
Примеры расстройств ЦНС включают, но не ограничиваются ими, расстройства, описанные в публикации США № 2005/0143344, опубликованной 30 июня 2005 г., содержание которой включено в данное описание путем ссылки на нее. Конкретные примеры включают, но не ограничиваются ими, амиотрофический боковой склероз, болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, рассеянный склероз и другие нейроиммунологические расстройства, такие как синдром Tourette, бредовое состояние (делирий) или нарушения сознания, которые происходят на протяжении короткого периода времени, и амнестические расстройства, некоторые ухудшения памяти, которые происходят в отсутствие других ухудшений центральной нервной системы.
Примеры нарушений ЦНС и связанных с ними синдромов включают, но не ограничиваются ими, нарушения и синдромы, описанные в патентной публикации США № 2006/0122228, опубликованной 8 июня 2006 г., содержание которой включено в данное описание путем ссылки на нее. Конкретные примеры включают, но не ограничиваются ими, повреждения/нарушения и связанные с ними синдромы ЦНС, первичные повреждения головного мозга, вторичные повреждения головного мозга, травматические, фокальные или точечные повреждения головного мозга, диффузное аксональное повреждение, повреждение головы, сотрясение, синдром постсотрясения, церебральную контузию и размозжение, субдуральную гематому, эпидермальную гематому, посттравматическую эпилепсию, хроническое вегетативное состояние, полный SCI, неполный SCI, острый SCI, субострый SCI, хронический SCI, центральный синдром спинного мозга (или пуповины), синдром Brown-Sequard, передний синдром спинного мозга, синдром медуллярного конуса, синдром конского хвоста, нейрогенный шок, спинальный или спинномозговой шок, измененный уровень сознания, головную боль, тошноту, рвоту, потерю памяти, головокружение, диплопию, размазанное видение, эмоциональную неустойчивость, нарушение сна, раздражительность, неспособность сконцентрироваться, нервозность, ухудшение поведения, познавательный дефицит и приступ.
Другие болезни или расстройства включают, но не ограничиваются ими, вирусные, генетические, аллергические и аутоиммунные болезни. Конкретные примеры включают, но не ограничиваются ими, ВИЧ, гепатит, синдром респираторного дистресса взрослых, болезни резорбции костей, хронические легочные воспалительные заболевания, дерматит, цистический фиброз, септическй шок, сепсис, эндотоксический шок, гемодинамический шок, синдром сепсиса, постишемическое реперфузионное повреждение, менингит, псориаз, фибротическое заболевание, кахексию, болезнь трансплантат против хозяина, отторжение транплантата, аутоиммунное заболевание, ревматоидный спондилит, болезнь Крона, язвенный колит, воспалительную болезнь кишечника, рассеянный склероз, системную эритематозную волчанку, ENL при лепре, радиационное повреждение, рак, астму или гипероксическое альвеолярное повреждение.
Примеры атеросклероза и родственных состояний включают, но не ограничиваются ими, состояния, описанные в патентной публикации США № 2002/0054899, опубликованной 2 мая 2002 г., содержание которой включено в данное описание путем ссылки на нее. Конкретные примеры включают, но не ограничиваются ими, все формы состояний, вовлекающих или затрагивающих атеросклероз, включая рестеноз после вмешательства, такого как ангиопластика, стентирование, атерэктомия и трансплантация. В данной заявке рассматриваются все формы сосудистого вмешательства, включающие болезни сердечно-сосудистой и ренальной системы, такие как, но не ограниченные ими, почечную ангиопластику, чрескожное коронарное вмешательство (PCI), чрескожную транслюминальную коронарную ангиопластику (PTCA), каротидную чрескожную транслюминальную ангиопластику (PTA), трансплантацию с коронарным шунтированием, ангиопластику с имплантацией стента, периферическое чрескожное транслюминальное вмешательтсво в подвздошую, бедренную или подколенную артерии и хирургическое вмешательство с использованием пропитываемых искусственных трансплантатов. Следующая схема или таблица дает перечень главных системных артерий, которые могут нуждаться в лечении, все из которых рассматриваются в описании:
|
Примеры дисфункционального сна и связанных с ним синдромов включают, но не ограничиваются ими, те, что описаны в патентной публикации США № 2005/0222209А1, опубликованной 6 октября 2005 г., содержание которой включено в данное описание путем ссылки на нее. Конкретные примеры включают, но не ограничиваются ими, храп, асфиксию во сне, бессонницу, нарколепсию, синдром беспокойных ног, кошмары во сне, хождение во сне, еду во сне и дисфункциональный сон, связанный с хроническими неврологическими или воспалительными состояниями. Хронические неврологические или воспалительные состояния включают, но не ограничиваются ими, синдром комплексной региональной боли, хроническую боль в нижней части спины, мышечноскелетную боль, артрит, радикулопатию, боль, связанную с раком, фибромиалгию, синдром хронической усталости, висцеральную боль, боль в мочевом пузыре, хронический панкреатит, нейропатии (диабетическую, постгерпетическую, травматическую или воспалительную) и нейродегенеративные расстройства, такие как болезнь Паркинсона, болезнь Альцгеймера, амиотрофический боковой склероз, рассеянный склероз, болезнь Хантингтона, брадикинез; мышечную ригидность; тремор при паркинсонизме; походка при паркинсонизме; двигательное замораживание; депрессию; дефектную долговременную память; синдром Rubinstein-Taybi (RTS); деменцию; постуральную или связанную с позой нестабильность; гипокинетические расстройства; синуклеиновые расстройства; множественные системные атрофии; дегенерацию эфферентной связи между полосатым телом и черным веществом; оливопонтоцеребеллярную атрофию; синдром Shy-Drager; моторно-нейронную болезнь с признаками паркинсонизма; деменцию Lewy body; патологические расстройства Tau; прогрессивный надъядерный паралич; кортикобазальную дегенерацию; лобновисочное слабоумие или деменцию; амилоидно-патологические расстройства; умеренное ухудшение познавательной способности; болезнь Альцгеймера с паркинсонизмом; болезнь Willson; болезнь Hallervorden-Spatz; болезнь Chediak-Hagashi; SCA-3 спиноцеребеллярную атаксию; паркинсонизм с Х-связанной дистонией; прионную инфекцию; гиперкинетические расстройства; хорею; движения в виде резких подергиваний или дрожания; дистонические треморы; амиотрофический боковой склероз (ALS); травмы ЦНС и миоклонус.
Примеры гемоглобинопатии и связанных с ней расстройств включают, но не ограничиваются ими, расстройства, описанные в патентной публикации США № 2005/0143420А1, опубликованной 30 июня 2005 г., содержание которой включено в данное описание путем ссылки на нее. Конкретные примеры включают, но не ограничиваются ими, гемоглобинопатию, серповидно-клеточную анемию и другие расстройства, связанные с дифференциацией CD34+ клеток.
Примеры TNFα связанных расстройств включают, но не ограничиваются ими, расстройства, описанные в WO 98/03502 и WO 98/54170, содержание которых целиком включено в данное описание путем ссылки на них. Конкретные примеры включают, но не ограничиваются ими: эндотаксемию или синдром токсического шока; кахексию; синдром респираторного дистресса взрослых; заболевания резорбции костей, такие как артрит; гиперкальцемию; реакцию трансплантат против хозяина; церебральную малярию; воспаление; рост опухоли; хронические легочные воспалительные заболевания; реперфузионное повреждение; инфаркт миокарда; кровоизлияние; циркуляторный шок; ревматоидный артрит; болезнь Крона; ВИЧ инфекцию и СПИД; другие расстройства, такие как ревматоидный артрит, ревматоидный спондилит, остеоартрит, псориатический артрит и другие артритные состояния, септический шок, сепсис, эндотоксический шок, болезнь трансплантат против хозяина, истощение, болезнь Крона, язвенный колит, рассеянный склероз, системную красную волчанку, ENL при лепре, ВИЧ, СПИД и условно-патогенные инфекции при СПИДе; расстройства, такие как септический шок, сепсис, эндотоксический шок, гемодинамический шок и синдром сепсиса, постишемическое реперфузионное повреждение, малярию, микобактериальные инфекции, менингит, псориаз, застойную сердечную недостаточность, фибротическую болезнь, кахексию, отторжение трансплантата, онкогенные или раковые состояния, астму, аутоиммунную болезнь, радиационные повреждения и гипероксическое альвеолярное повреждение; вирусные инфекции, такие как инфекции, вызываемые вирусами герпес; вирусный конъюнктивит; или атопический дерматит.
Согласно другим воплощениям изобретением охватывается также применение описываемых в заявке соединений при различных иммунологических применениях, в частности, в качестве адьювантов для вакцин, особенно, адъювантов противораковых вакцин, описанных в публикации США № 2007/048327, опубликованной 1 марта 2007 г., содержание которой включено в данное описание путем ссылки на нее. Данные воплощения относятся также к применению описываемых в заявке соединений в сочетании с вакцинами для лечения или профилактики рака и инфекционных заболеваний и других различных применений иммуномодуляторных соединений, таких как снижение или десенсибилизация аллергических реакций.
Дозы предлагаемого изобретением соединения или его фармацевтически приемлемой соли, сольвата, клатрата, стереоизомера или пролекарства варьируют в зависимости от таких факторов, как: конкретное указание болезни, подвергаемой лечению, профилактике или излечению или усмирению; возраст и состояние пациента; и количество еще одного или дополнительного активного агента, если он используется. Обычно предлагаемое в заявке соединение или его фармацевтически приемлемая соль, сольват, клатрат, стереоизомер или пролекарство может использоваться в количестве от примерно 0,1 мг до около 500 мг в день и может регулироваться общепринятым образом (например, то же самое количество вводится ежедневно на протяжении периода лечения, предотвращения или усмирения), циклами (например, неделю через неделю), или в количестве, которое на протяжении курса лечения, предотвращения или усмирения увеличивается или снижается. Согласно другим воплощениям доза может составлять от около 1 мг до около 300 мг, от около 0,1 мг до около 150 мг, от около 1 мг до около 200 мг, от около 10 мг до около 100 мг, от около 0,1 мг до около 50 мг, от около 1 мг до около 50 мг, от около 10 мг до около 50 мг, от около 20 мг до около 30 мг или от около 1 мг до около 20 мг.
4.3 ВТОРЫЕ (ДОПОЛНИТЕЛЬНЫЕ) АКТИВНЫЕ АГЕНТЫ
В способах или композициях, описываемых в заявке, предлагаемое соединение или его фармацевтически приемлемая соль, сольват, пролекарство, клатрат или стереоизомер может комбинироваться с другими фармакологически активными соединениями (“вторыми или дополнительными активными агентами”). Некоторые комбинации или сочетания могут действовать синергистически при лечении конкретных типов заболеваний или расстройств и состояний и симптомов, связанных с заболеваниями или расстройствами. Описываемое в заявке соединение или его фармацевтически приемлемая соль, сольват, клатрат, стереоизомер или пролекарство может также действовать в направлении облегчения пагубных эффектов, связанных с некоторыми дополнительными активными агентами и наоборот.
В описываемых в заявке способах и композициях могут использоваться один или более дополнительных активных ингредиентов или агентов. Дополнительные активные агенты могут быть крупными молекулами (например, белки) или мелкими молекулами (например, синтетические неорганические, металлоорганические или органические молекулы).
Примеры крупных молекул активных агентов включают, но не ограничиваются ими, гематопоэтические факторы роста, цитокины и моноклональные и поликлональные антитела. Конкретными примерами активных агентов являются анти-CD40 моноклональные антитела (такие как, например, SGN-40); гистон дезацетилазные ингибиторы (такие как, например, SAHA и LAQ 824); теплошоковые ингибиторы протеина-90 (такие как, например, 17-AAG); ингибиторы рецепторной киназы инсулинподобного фактора-1 роста; ингибиторы рецепторной киназы сосудисто-эндотелиального фактора роста (такие как, например, PTK 787); ингибиторы рецептор инсулинового фактора роста; ингибиторы лизофосфатидно-кислотной ацилтрансферазы; ингибиторы IkB киназы; ингибиторы p38MAPK; EGFR ингибиторы (такие как, например, гефитиниб и эрлотиниб HCl); HER-2 антитела (такие как, например, трастузумаб (Herceptin®) и пертузумаб (OmnitargTM); VEGFR антитела (такие как, например, бевацизумаб (AvastinTM)); VEGFR ингибиторы (такие как, например, ингибиторы flk-1 специфической киназы, SU5416 и ptk787/zk222584); P13K ингибиторы (такие как, например, уортманнин); C-Met ингибиторы (такие как, например, РНА-665752); моноклональные антитела (такие как, например, ритуксимаб (Rituxan®), тоситумомаб (Bexxar®), эдреколомаб (Panorex®) и G250); и анти- TNF-α антитела. Примеры небольших молекул активных агентов включают, но не ограничиваются ими, противораковые агенты и антибиотики (например, кларитромицин).
Конкретные дополнительные активные соединения, которые могут комбинироваться с описываемыми в данной заявке соединениями, варьируют в зависимости от конкретного назначения для лечения, профилактики или смягчения (усмирения, излечения).
Например, для лечения, профилактики или смягчения рака дополнительные активные агенты включают, но не ограничиваются ими, семаксаниб; циклоспорин; этанерцепт; доксициклин; бортезониб; ацивицин; акларубицин; акодазол гидрохлорид; акронин; адоцелезин; альдеслейкин; альтретамин; амбомицин; аметантрон ацетат; амсакрин; анастрозол; антрамицин; аспарагиназу; асперлин; азацитидин; азетепа; азотомицин; батимастат; бензодепа; бикалютамид; бизантрен гидрохлорид; биснафид димезилат; бицелезин; блеомицин сульфат; бреквинар натрий; бропиримин; бусульфан; кактиномицин; калустерон; карацемид; карбетимер; карбоплатин; кармустин; карубицин гидрохлорид; карцелезин; цедефингол; целекоксиб; хлорамбуцил; циролемицин; цисплатин; кладрибин; криснатол мезилат; циклофосфамид; цитарабин; дакарбазин; дактиномицин; даунорубицин гидрохлорид; децитабин; дексормаплатин; дезагуанин; дезагуанин мезилат; диациквон; доцетаксел; доксорубицин; доксорубицин гидрохлорид; дролоксифен; дролоксифен цитрат; дромостанолон пропионат; дуазомицин; эдатрексат; эфлорнитин гидрохлорид; элзамитруцин; энлоплатин; энпромат; эпипропидин; эпирубицин гидрохлорид; эрбулозол; эзорубицин гидрохлорид; эстрамустин; эстрамустин фосфат натрий; этанидазол; этопозид; этопозид фосфат; этоприн; фадразол гидрохлорид; фазарабин; фенритинид; флоксуридин; флударабин фосфат; фторурацил; фторцитабин; фосквидон; фостриецин натрий; гемцитабин; гемцитабин гидрохлорид; гидроксимочевину, идарубицин гидрохлорид; ифосфамид; илмофосин; ипроплатин; иринотекан; иринотекан гидрохлорид; ланреотид ацетат; летрозол; лейпролид ацетат; лиарозол гидрохлорид; лометрексол натрий; ломустин; лозоксантрон гидрохлорид; мазопрокол; мэйтансин; мехлорэтамин гидрохлорид; мегестрол ацетат; меленгестрол ацетат; мельфалан; меногарил; меркаптопурин; метотрексат; метотрексат натрий; метоприн; метуредепа; митиндомид; митокарцин; митокромин; митогиллин; митомальцин; митомицин; митоспер; митотан; митоксантрон гидрохлорид; микофеноловую кислоту; нокодазол; ногаламицин; ормаплатин; оксисуран; паклитаксел; пегаспаргазу; пелиомицин; пентамустин; пепломицин сульфат; перфосфамид; пипоброман; пипосульфан; пироксантрон гидрохлорид; пликамицин; пломестан; порфимер натрий; порфиромицин; преднимустин; прокарбазин гидрохлорид; пуромицин; пуромицин гидрохлорид; пиразофурин; рибоприн; сафингол; сафингол гидрохлорид; семустин; симтразен; спарфосат натрий; спарзомицин; спирогерманий гидрохлорид; спиромустин; спироплатин; стрептонигрин; стрептозоцин; сулофенур; тализомицин; текогалан натрий; таксотер; тегафур; телоксантрон гидрохлорид; темопорфин; тенипозид; тероксирон; тестолактон; тиамиприн; тиогуанин; тиотепа; тиазофурин; тирапазамин; торемифен цитрат; трестолон ацетат; трицирибин фосфат; триметрексат; триметрексат глюкуронат; трипторелин; тубулозол гидрохлорид; урациловую горчицу; уредепу; вапреотид; вертепорфин; винбластин сульфат; винкристин сульфат; виндезин; виндезин сульфат; винепидин сульфат; винглицинат сульфат; винлейрозин сульфат; винорелбин тартрат; винрозидин сульфат; винзолидин сульфат; ворозол; цениплатин; циностатин; и зорубицин гидрохлорид.
Другие дополнительные агенты включают, но не ограничиваются ими, 20-эпи-1,25 дигидроксивитамин D3; 5-этинилурацил; абиратерон; акларубицин; ацилфульвен; адеципенол; адоцелезин; альдеслейкин; ALL-TK антагонисты; альтретамин; амбамустин; амидокс; амифостин; аминолевулиновую кислоту; амрубицин; амсакрин; анагрелид; анастрозол; андрографолид; ингибиторы ангиогенеза; антагонист D; антагонист G; антреликс; анти-дорсализирующий морфогенетический протеин-1; антиандроген, простатическую карционому; антиэстроген; антинеопластон; антисмысловые олигонуклеотиды; афидиколин глицинат; модуляторы гена апоптоза; регуляторы апоптоза; апуриновую кислоту; ara-CDP-DL-PTBA; аргининдезаминазу; асулакрин; атаместан; атримустин; аксинастатин 1; аксинастатин 2; аксинастатин 3; азасетрон; азатоксин; азатирозин; производные баккатина III; баланол; батимастат; BCR/ABL антагонисты; бензохлорины; бензоилстауроспорин; производные бета-лактама; бета-алетин; бета-кламицин В; бетулиновую кислоту; bFGF ингибитор; бикалютамид; бисантрен; бисазиридинилспермин; биснафид; бистратен А; бицелезин; брефлат; бропиримин; будотитан; бутионин сульфоксимин; кальципотриол; кальфостин С; производные камптотецина; капецитабин; карбоксамид-амино-триазол; карбоксиамидотриазол; CaRest M3; CARN 700; ингибитор хрящевого происхождения; карцелезин; ингибиторы казеинкиназы (ICOS); кастаноспермин; цекропин В; цетрореликс; хлорины; хлорхиноксалин сульфонамид; цикапрост; цис-порфирин; кладрибин; аналоги кломифена; клотримазол; коллисмицин А; коллисмицин В; комбретастатин А4; аналоги комбрестатина; конагенин; крамбесцидин 816; криснатол; криптофицин 8; производные криптофицина А; курацин А; циклопентантрахиноны; циклоплатам; ципемицин; цитарабин окфосфат; цитолитический фактор; цитостатин; дакликсимаб; децитабин; дегидродидемнин В; деслорелин; дексаметазон; дексифосфамид; дексразоксан; дексверапамил; диазиквон; дидемнин В; дидокс; диэтилнорспермин; дигидро-5-азацитидин; дигидротаксол, 9-; диоксамицин; дифенилспиромустин; доцетаксел; докозанол; доласетрон; доксифлуридин; доксорубицин; дролоксифен; дронабинол; дуокармицин SA; эбселен; экомустин; эдельфосин; эдреколомаб; эфлорнитин; элемен; эмитефур; эпирубицин; эпристерид; аналоги эстрамустина; агонисты эстрогена; антагонисты эстрогена; этанидазол; этопозид фосфат; эксеместан; фадрозол; фазарабин; фенретинид; филграстим; финастерид; флавопиридол; флецеластин; флуастерон; флударабин; фтордауноруницин гидрохлорид; форфенимекс; форместан; фостриецин; фотемустин; гадолинийтексафирин; нитрат галлия; галоцитабин; ганиреликс; ингибиторы желатиназы; гемцитабин; ингибиторы глютатиона; гепсульфам; герегулин; гексаметилен-бисацетамид; гиперицин; ибандроновую кислоту; идарубицин; идоксифен; идрамантон; илмофосин; иломастат; иматиниб (Gleevec®), имихимод; иммуностимулирующие пептиды; ингибитор рецептора инсулин-подобного фактора-1 роста; агонисты интерферона; интерфероны; интерлейкины; иобенгуан; иододоксорубицин; ипомеанол, 4-; ироплакт; ирсогладин; изобенгазол; изогомогаликондрин В; итасетрон; джасплакинолид; кагалалид F; ламелларин-N триацетат; ланреотид; лейнамицин; ленограстим; лентинансульфат; лептолстатин; летрозол; фактор ингибирования лейкемии; лейкоцит-альфа-интерферон; лейпролид+эстроген+прогестерон; лейпрорелин; левамизол; лиарозол, линейный полиаминовый аналог; липофильный дисахарид-пептид; липофильные соединения платины; лиссоклинамид 7; лобаплатин; ломбрицин; лометрексол; лонидамин; лозоксантрон; локсорибин; луртотекан; лютеций тексафирин; лизофиллин; литические пептиды; маитанзин; манностатин А; маримастат; мазопрокол; маспин; ингибиторы матрилизина; ингибиторы матриксной металлопротеиназы; меногарил; мербарон; метерелин; метиониназу; метоклопрамид; MIF ингибитор; мифепристон; милтефосин; миримостим; митогуазон; митолактол; аналоги митомицина; митонафид; митотоксин фибробластный фактор роста-сапорин; митоксантрон; мофаротен; молграмостин; Эрбитукс, хориальный гонадотрофин человека; монофосфорил липид А+клеточные стенки микобактерий sk; мопидамол; горчичный противораковый агент; микапероксид В; экстракт микобактериальных клеточных стенок; мириапорон; N-ацетилдиналин; N-замещенные бензамиды; нафарелин; нагрестип; налоксон+пентазоцин; напавин; нафтерпин; нартограстим; недаплатин; неморубицин; неридроновую кислоту; нилютамид; низамицин; модуляторы оксида азота; нитроксидный антиоксидант; нитруллин; облимерсен (Genasense®); О6-бензилгуанин; октреотид; окиценон; олигонуклеотиды; онапристон; ондасетрон; орацин; оральный цитокиновый индуктор; ормаплатин; осатерон; оксалиплатин; оксауномицин; паклитаксел; аналоги паклитаксела; производные паклитаксела; палауамин; пальмитоилризоксин; памидроновую кислоту; панакситриол; паномифен; парабактин; пацеллиптин; пегаспаргазу, пелдесин; пентозан полисульфат натрий; пентостатин; пентрозол; перфлуброн; перфосфамид; периллиловый спирт; феназиномицин; фенилацетат; ингибиторы фосфатазы; пицибанил; пилокарпин гидрохлорид; пирарубицин; пиритрексин, плацетин А; плацетин В; ингибитор активатора плазминогена; платиновый комплекс; соединения платины; платина-триаминовый комплекс; порфимер натрий; порфиромицин; преднизон; пропил бис-акридон; простагландин J2; ингибиторы протеасома; иммуномодулятор на основе протеина А; ингибитор протеинкиназы С; ингибиторы протеинкиназы С; микроальгал; ингибиторы протеинтирозинфосфатазы; ингибиторы пурин-нуклеозид-фосфорилазы; пурпурины; пиразолоакридин; придоксилированный гемоглобин-полиоксиэтиленовый конъюгат; raf антагонисты; ралтитрексед; рамосетрон; ингибиторы ras фарнезил-протеин-трансферазы; ras ингибиторы; ras-GAP ингибитор; ретеллиптин деметилированный; рений Re 186 этидронат; ризоксин; рибозимы; RII ретинамид; рогитукин; ромуртид; роквинимекс; рубигинон В1; рубоксил; сафингол; саинтопин; SarCNU; саркофитол А; сарграмостим; Sdi 1 миметики; семустин; ингибитор 1, получающийся при физиологическом старении; смысловые олигонуклеотиды; ингибиторы сигнальной трансдукции; сизофиран; собузоксан; брокаптат натрия; фенилацетат натрия; сольверол; соматомедин связывающий белок; сонермин; спарфосовую кислоту; спикамицин D; спиромустин; спленопентин; спонгистатин 1; скваламин; стипиамид; ингибиторы стромелизина; сульфинозин; антагонист суперактивного вазоактивного кишечного пептида; сурадиста; сурамин; свайнсонин; таллимустин; тамоксифен метиодид; тауромустин; тазаротен; текогалан натрий; тегафур; теллурапирилий; ингибиторы теломеразы; темопорфин; тенипозид; тетрахлордекаоксид; тетразомин; талибластин; тиокоралин; тромбопоэтин; миметик тромбопоэтина; тималфазин; агонист рецептор тимопоэтина; тимотринан; тироид стимулирующий гормон; олово-этил-этиопурпурин; тирапазамин; титаноцен бихлорид; топсентин; торемифен; ингибиторы трасляции; третиноин; триацетилуридин; трицирибин; триметрексат; трипторелин; трописетрон; туростерид; ингибиторы тирозинкиназы; тирфостины; UBC ингибиторы; убенимекс; ингибирующий фактор роста происхождения из урогенитального синуса; антагонисты рецептора урокиназы; вапреотид; ваиролин В; веларезол; верамин; вердины; вертепорфин; винорелбин; винксалтин; витаксин, ворозол; занотерон; цениплатин; циласкорб; и циностатиновый стималамер.
Конкретные дополнительные активные агенты включают, но не ограничиваются ими, 2-метоксиэстрадиол, теломестатин, индукторы апоптоза в рассеянных клетках миеломы (такие как, например, TRAIL), статины, семаксаниб, циклоспорин; этанерцепт, доксициклин, бортезомиб, облимерсен (Genasense®), ремикад, доцетаксел, целекоксиб, мельфалан, дексаметазон (Decadron®), стероиды, гемцитабин, цисплатину; темозоломид, этопозид, циклофосфамид, темодар, карбоплатин, прокарбазин, глиадел, тамоксифен, топотекан, метотрексат, Arisa®, таксол, таксотер, фторурацил, лейковорин, иринотекан, кселоду, CPT-11, интерферон альфа, пегилированный интерферон альфа (например, PEG INTRON-A), капецитабин, цисплатин, тиотепу, флударабин, карбоплатин, липосомный даунорубицин, цитарабин, доксетаксол, пацилитаксел, винбластин, IL-2, GM-CSF, дакарбазин, винорелбин, золедроновую кислоту, пальмитронат, биаксин, бусульфан, преднизон, бисфосфонат, триоксид мышьяка, винкристин, доксорубицин (Doxil®), паклитаксел, ганцикловир, адриамицин, эстрамустин-натрий-фосфат (Emcyt®), сулиндак и этопозид.
Согласно еще одному воплощению примеры конкретных дополнительных агентов для назначения при лечении, профилактике или облегчении можно найти в следующих источниках, содержание которых включено в данное описание путем ссылки на них: патенты США № 6281230 и 5635517; и публикации США № 2004/0220144, 2004/0190609, 2004/0087546, 2005/0203142, 2004/0091455, 2005/0100529, 2005/0214328, 2005/0239842, 2006/0154880, 2006/0188475, 2006/0122228 и 2005/0143344.
Примеры дополнительных активных агентов, которые могут использоваться для лечения, профилактики и/или облегчения или излечения боли, включают, но не ограничиваются ими, общепринятые терапевтические средства, используемые для лечения или профилактики боли, такие как антидепрессанты, противоконвульсивные агенты, антигипертензивные агенты, анксиолитики, блокаторы кальциевых каналов, мышечные релаксанты, не наркотические анальгетики, опиоидные анальгетики, противовоспалительные агенты, сох-2 ингибиторы, иммуномодулирующие агенты, агонисты или антагонисты альфа-адренергических рецепторов, иммуносуппрессивные агенты, кортикостероиды, гипербарический кислород, кетамин, другие анестетические агенты, NMDA антагонисты и другие терапевтические средства, которые можно найти, например, в Physician's Desk Reference 2003. Конкретные примеры включают, но не ограничиваются ими, ацетат салициловой кислоты (Aspirin®), целекоксиб (Celebrex®), Enbrel®, кетамин, габапентин (Neurontin®), фенитоин (Dilantin®), карбамазепин (Targetol®), оксарбазепин (Trileptal®), вальпроновую кислоту (Depaken®), сульфат морфина, гидроморфон, преднизон, гризеофульвин, пентоний, алендронат, дифенгидрамид, гуанэтидин, кеторолак (Acular®), тирокальцитонин, диметилсульфоксид (ДМСО), клонидин (Catapress®), бретилий, кетансерин, резерпин, дроперидол, атропин, фентоламин, бупивакаин, лидокаин, ацетаминофен, нортриптилин (Pamelor®), амитриптилин (Elavil®), имипрамин (Tofranil®), доксепин (Sinequan®), кломипрамин (Anafranil®), флуоксетин (Prozac®), сертралин (Zoloft®), напроксен, нефазодон (Serzone®), венлафаксин (Effexor®), тразодон (Desyrel®), бупропион (Wellbutrin®), мексилетин, нифедипин, пропранолол, трамадол, ламотригин, виокс, зиконотид, кетамин, декстрометорфан, бензодиазепины, баклофен, тизанидин и феноксибензамин.
Примеры дополнительных активных агентов, которые могут использоваться для лечения, профилактики и/или облегчения макулярной дегенерации и связанных с ней синдромов, включают, но не ограничиваются ими, стероиды, светосенсибилизаторы, интегрины, антиоксиданты, интерферон, производные ксантина, гормоны роста, нейтротрофные факторы, регуляторы реваскуляризации, анти-VEGF антитела, простагландины, антибиотики, фитоэстрогены, противовоспалительные соединения или противоангиогенезные соединения или их сочетания. Конкретные примеры включают, но не ограничиваются ими, вертепорфин, пурлитин, ангиостатические стероиды, rhuFab, интерферон-2α, пентоксифиллин, олово этиопурпурин, мотексафин, люцентис (lucentis), лютеций, 9-фтор-11,21-дигидрокси-16,17-1-метилэтилиденбис(окси)прегна-1,4-диен-3,20-дион, латанопрост (см. патент США № 6225348), тетрациклин и его производные, рифамицин и его производные, макролиды, метронидазол (патенты США № 6218369 и 6015803), генистеин, генистин, 6'-O-Mal генистин, 6'-O-Ac генистин, даидзеин, даидзин, 6'-O-Mal даидзин, 6'-O-Ac даидзин, глицитеин, глицитин, 6'-O-Mal глицитин, биоканин А, формононетин (патент США № 6001368), триамцинолон ацетомид, дексаметазон (патент США № 5770589), талидомид, глютатион (патент США № 5632984), фактор роста основного фибробласта (bFGF), фактор b трансформирующего роста (TGF-b), нейротропный фактор мозгового происхождения (BDNF), фактор активатора плазминогена типа 2 (PAI-2), EYE101 (Eyetech Pharmaceuticals), LY333531 (Eli Lilly), Миравант, и RETISERT имплантат (Bausch & Lomb). Все упоминаемые в описании источники включены в данное описание путем ссылки на них.
Примеры дополнительных активных агентов, которые могут использоваться для лечения, профилактики и/или облегчения заболеваний кожи, включают, но не ограничиваются ими: кератолитики, ретиноиды, α-гидрокси кислоты, антибиотики, коллаген, токсин ботулинический, интерферон, стероиды и иммуномодулирующие агенты. Конкретные примеры включают, но не ограничиваются ими, 5-фторурацил, мазопрокол, трихлоруксусную кислоту, салициловую кислоту, молочную кислоту, ацетат аммония, мочевину, третиноин, изотретиноин, антибиотики, коллаген, токсин ботулинический, интерферон, кортикостероиды, трансретиноевую кислоту и коллагены, такие как плацентарный коллаген человека, плацентарный коллаген животных, Dermalogen, AlloDerm, Fascia, Cymetra, Autologen, Zyderm, Zyplast, Resoplast и Isolagen.
Примеры дополнительных активных агентов, которые могут использоваться для лечения, профилактики и/или облегчения легочной гипертензии и связанных с ней расстройств, включают, но не ограничиваются ими: антикоагулянты, диуретики, кардиальные гликозиды, блокаторы кальциевых каналов, сосудорасширяющие средства, аналоги простациклина, антагонисты эндотелина, ингибиторы фосфодиэстеразы (например, PDE V ингибиторы), ингибиторы эндопептидазы, агенты, понижающие уровень липидов, ингибиторы тромбоксана и другие терапевтические агенты, о которых известно, что они понижают давление в легочных артериях. Конкретные примеры включают, но не ограничиваются ими, варфарин (Coumadin®), диуретики, кардиальные гликозиды, дигоксин-кислород, дилтиазем, нифедипин, вазодиляторы, такие как простациклин (например, простагландин I2 (PGI2), эпопростенол (EPO, Floran®), трепростинил (Remodulin®), оксид азота (NO), босентан (Tracleer®), амлодипин, эпопростенол (Floran®), трептостинил (Remodulin®), простациклины, тадалафил (Cialis®), симвастатин (Zocor®), омапартрилат (Vanlev®), ирбесартан (Avapro®), правастатин Pravachol®), дигоксин, L-аргинин, илопрост, бетапрост и силденафил (Viagra ®).
Примеры дополнительных активных агентов, которые могут использоваться для лечения, профилактики и/или облегчения связанных с асбестом расстройств, включают, но не ограничиваются ими: антрациклин, платину, алкилирующие агенты, облимерсен (Genasense®), цисплатину, циклофосфамид, темодар, карбоплатин, прокарбазин, глиадел, тамоксифен, топотекан, метотрексат, таксотер, иринотекан, капецитабин, цисплатин, тиотепа, флударабин, карбоплатин, липосомный даунорубицин, цитарабин, доксетаксол, пацилитаксел, винбластин, IL-2, GM-CSF, дакарбазин, винорелбин, золедроновую кислоту, пальмитронат, биаксин, бусульфан, преднизон, бифосфонат, триоксид мышьяка, винкристин, доксорубицин (Doxil®), паклитаксел, ганцикловир, адриамицин, блеомицин, гиалуронидазу, митомицин С, мепакрин, тиотепа, тетрациклин и гемцитабин.
Примеры дополнительных активных агентов, которые могут использоваться для лечения, профилактики и/или облегчения паразитарных заболеваний, включают, но не ограничиваются ими: хлорохин, хинин, хинидин, пириметамин, сульфадиазин, доксициклин, клиндамицин, мефлохин, галофантрин, примахин, гидроксихлорохин, прогуанил, атовахон, азитромицин, сурамин, пентамидин, меларсопрол, нифуртимокс, бензнидазол, амфотерицин В, соединения пятивалентной сурьмы (например, стибоглюкуронат натрия), интерферон гамма, итраконазол, сочетание мертвых промастиготов и BCG, лейковорин, кортикостероиды, сульфонамид, спирамицин, IgG (серология), триметоприм и сульфметоксазол.
Примеры дополнительных активных агентов, которые могут использоваться для лечения, профилактики и/или облегчения расстройств иммунодефицита, включают, но не ограничиваются ими: антибиотики (терапевтические или профилактические), такие как, но не ограниченные ими, ампициллин, тетрациклин, пенициллин, цефалоспорины, стрептомицин, канамицин и эритромицин; антивирусные агенты, такие как, но не ограниченные ими, амантадин, римантадин, ацикловир и рибавирин; иммуноглобулин; плазму; иммунологические усиливающие лекарства, такие как, но не ограниченные ими, левамизол и изопринозин; биологические агенты, такие как, но не ограниченные ими, гаммаглобулин, фактор переноса, интерлейкины и интерфероны; гормоны, такие как, но не ограниченные ими, тимусные и другие иммунологические агенты, такие как, но не ограниченные ими, стимуляторы В клеток, (например, BAFF/BlyS), цитокины (например, IL-2, IL-4 и IL-5), факторы роста (например, TGF-α), антитела (например, анти-CD40 и IgM), содержащие олигонуклеотиды неметилированные CpG мотивы и вакцины (например, вирусные и опухолевые пептидные вакцины).
Примеры дополнительных активных агентов, которые могут использоваться для лечения, профилактики и/или облегчения расстройств ЦНС, включают, но не ограничиваются ими: опиоиды; агонисты или антагонисты допамина, такие как, но не ограниченные ими, Левадопа, L-DOPA, кокаин, α-метилтирозин, резерпин, тетрабеназин, бензотропин, паргилин, фенодолпам мезилат, каберголин, прамипексол дигидрохлорид, ропинорол, амантадин гидрохлорид, селегилин гидрохлорид, карбидопа, перголид мезилат, Sinemet CR и Symmetrel; MAO ингибиторы, такие как, но не ограниченные ими, ипрониазид, клоргилин, фенелзин и изокарбоксазид; COMT ингибиторы, такие как, но не ограниченные ими, толкапон и энтакапон; ингибиторы холинэстеразы, такие как, но не ограниченные ими, физостигмин салицилат, физостигмин сульфат, физостигмин бромид, меостигмин бромид, неостигмин метилсульфат, амбеноним хлорид, эдрофонийхлорид, такрин, пралидоксимхлорид, обидоксимхлорид, тримедоксимбромид, диацетилмоноксим, эндрофониум, пиридостигмин и демекариум; противовоспалительные агенты, такие как, но не ограниченные ими, напроксен-натрий, диклофенак-натрий, диклофенак-калий, целекоксиб, сулиндак, оксапрозин, дифлунисал, этодолак, мелоксикам, ибупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномид, сульфасалазин, соли золота, RHo-D иммуноглобулин, микофенилат-мофетил, циклоспорин, азатиоприн, такролимус, базиликсимаб, даклизумаб, салициловую кислоту, ацетилсалициловую кислоту, метилсалицилат, дифлунисал, салсалат, олсалазин, сульфасалазин, ацетаминофен, индометацин, сулиндак, мефенамовую кислоту, меклофенамат натрий, толметрин, кеторолак, диклофенак, флурбипрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, пивоксикам, теноксикам, фенилбутазон, оксифенбутазон, антипирин, аминопирин, апазон, зилейтон, ауротиоглюкозу, натрийтиомалат золота, ауранофин, метотрексат, колхицин, аллопуринол, пробенецид, сульфинпиразон и бензбромарон или бетаметазон и другие глюкокортикоиды; и противорвотные агенты, такие как, но не ограниченные ими, метоклопромид, домперидон, прохлорперазин, прометазин, хлорпромазин, триметобензамид, ондансетрон, гранисетрон, гидроксизин, ацетиллейцин моноэтаноламин, ализаприд, азасетрон, бензхинамид, биэтанаутин, бромоприд, буклизин, клебоприд, циклизин, дименгидринат, дифенидол, доласетрон, меклизин, металлатал, метопимазин, набилон, оксипиридил, пипамазин, скополамин, сульпирид, тетрагидроканнабинол, тиэтилперазин, тиопроперазин, трописетрон и их смеси.
Примеры дополнительных активных агентов, которые могут использоваться для лечения, профилактики и/или облегчения расстройств ЦНС и связанных с ними синдромов, включают, но не ограничиваются ими: иммуномодуляторные агенты, иммуносуппрессивные агенты, антигипертензивные, антиконвульсивные средства, фибринолитические, антитромбоцитные, антипсихотические агенты, антидепрессанты, бензодиазепины, буспирон, амантадин и другие известные или общепринятые агенты, используемые на пациентах с повреждениями ЦНС и связанными с ними синдромами. Конкретные примеры включают, но не ограничиваются ими, стероиды (например, глюкокортикоиды, такие как, но не ограниченные ими, метилпреднизолон, дексаметазон и бетаметазон); противовоспалительные агенты, включающие, но не ограниченные ими, напроксен-натрий, диклофенак-натрий, диклофенак-калий, целекоксиб, сулиндак, оксапрозин, дифлунисал, этодолак, мелоксикам, ибупрофен, кетопрофен, набуметон, рефекоксиб, метатрексат, лефлуномид, сульфасалазин, соли золота, RHo-D иммуноглобулин, микофенилат мофетил, циклоспорин, азатиоприн, такролимус, базиликсимаб, даклизумаб, салициловую кислоту, ацетилсалициловую кислоту, метилсалицилат, дифлунисал, салсалат, олсалазин, сульфасалазин, ацетаминофен, индометацин, сулиндак, мефенамовую кислоту, меклофенамат натрий, толметин, кеторолак, диклофенак, флурбинпрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, пивоксикам, теноксикам, фенилбутазон, оксифенбутазон, антипирин, аминопирин, апазон, зилеутон, ауротиоглюкоза, натрийтиомалат золота, ауронофин, метотрексат, колхицин, аллопуринол, пробенецид, сульфинпиразон и бензобромарон; сАМР аналоги, включающие, но не ограниченные ими, db-cAMP; агент, включающий лекарство метилфенидат, который включает l-трео-метилфенидат, d-трео-метилфенидат, dl-трео-метилфенидат, l-эритро-метилфенидат, d-эритро-метилфенидат, dl-эритро-метилфенидат и их смеси; и диуретические агенты, такие как, но не ограниченные ими, манит, фуросемид, глицерин и мочевина.
Примеры дополнительных активных агентов, которые могут использоваться для лечения, профилактики и/или облегчения функциональной аномалии сна и связанных с ней синдромов, включают, но не ограничиваются ими, трициклические антидепрессантные агенты, ингибитор селективного повторного поглощения серотонина, антиэпилептические агенты (габапентин, прегабалин, карбамазепин, окскарбазепин, левитриацетам, топирамат), антиаритмические агенты, агенты, блокирующие натриевые каналы, ингибиторы селективных воспалительных медиаторов, опиоидные агенты, дополнительные иммуномодуляторные соединения, комбинационные агенты и другие известные или общепринятые агенты, используемые при лечении сна. Конкретные примеры включают, но не ограничиваются ими, нейронтин, оксиконтин, морфин, топирамат, амитриптилин, нортриптилин, карбамазепин, леводопа, L-DOPA, кокаин, α-метилтирозин, резерпин, тетрабеназин, бензотропин, паргилин, фенодолпам мезилат, каберголин, прамипексол дигидрохлорид, ропинорол, амантадин гидрохлорид, селегилин гидрохлорид, карбидопа, перголид мезилат, синемет CR, симметрел, ипрониазид, клоргилин, фенелзин, изокарбоксазид, толкапон, энтакапон, физостигмин салицилат, физостигмин сульфат, физостигмин бромид, меостигмин бромид, неостигмин метилсульфат, амбеноним хлорид, эдрофонийхлорид, такрин, пралидоксимхлорид, обидоксимхлорид, тримедоксимбромид, диацетилмоноксим, эндрофониум, пиридостигмин, демекариум, напроксен-натрий, диклофенак-натрий, диклофенак-калий, целекоксиб, сулиндак, оксапрозин, дифлунисал, этодолак, мелоксикам, ибупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномид, сульфасалазин, соли золота, RHo-D иммуноглобулин, микофенилат-мофетил, циклоспорин, азатиоприн, такролимус, базиликсимаб, даклизумаб, салициловую кислоту, ацетилсалициловую кислоту, метилсалицилат, дифлунисал, салсалат, олсалазин, сульфасалазин, ацетаминофен, индометацин, сулиндак, мефенамовую кислоту, меклофенамат натрий, толметин, кеторолак, диклофенак, флурбипрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, пивоксикам, теноксикам, фенилбутазон, оксифенбутазон, антипирин, аминопирин, апазон, зилейтон, ауротиоглюкозу, натрийтиомалат золота, ауронофин, метотрексат, колхицин, аллопуринол, пробенецид, сульфинпиразон, бензбромарон, бетаметазон и другие глюкокортикоиды, метоклопромид, домперидон, прохлорперазин, прометазин, хлорпромазин, триметобензамид, ондансетрон, гранисетрон, гидроксизин, ацетиллейцин моноэтаноламин, ализаприд, азасетрон, бензхинамид, биэтанаутин, бромоприд, буклизин, клебоприд, циклизин, дименгидринат, дифенидол, доласетрон, меклизин, металлатал, метопимазин, набилон, оксипиридил, пипамазин, скополамин, сульпирид, тетрагидроканнабинол, тиэтилперазин, тиопроперазин, трописетрон и их смеси.
Примеры дополнительных активных агентов, которые могут использоваться для лечения, профилактики и/или облегчения гемоглобинопатии и связанных с ней расстройств, включают, но не ограничиваются ими, интерлейкины, такие как IL-2 (включая рекомбинанатный IL-II (“rIL2”) и канарипокс IL-2), IL-10, IL-12 и IL-18; интерфероны, такие как альфа-2а, интерферон альфа-2b, интерферон альфа-n1, интерферон альфа-n3, интерферон бета-Ia и интерферон гамма-Ib; и G-CSF; гидроксимочевины, бутираты или производные бутиратов; оксид трехвалетного азота; гидроксимочевину; HEMOXIN™ (NIPRISAN™; см. патент США № 5800819); антагонисты Gardos каналов, такие как клотримазол и триарилметановые производные; Дефероксамин; протеин С; и агенты переливания крови или кровезаменители, такие как Hemospan™ или Hemospan™ PS (Sangart).
Введение описываемого в заявке соединения или его фармацевтически приемлемой соли, сольвата, клатрата, стереоизомера или пролекарства и дополнительных активных агентов пациентам может осуществляться одновременно или последовательно с помощью одного и того же или различных способов введения. Пригодность конкретного способа введения, применяемого для конкретного активного агента, будет зависеть от самого активного агента (например, может ли он вводиться орально без разложения перед вхождением в поток крови) и подвергаемого лечению заболевания. Одним из способов введения предлагаемых изобретением соединений является оральный. Способы введения дополнительных активных агентов или ингредиентов известны обычным специалистам в данной области, см., например, Physicians' Desk Reference (60th ed., 2006).
Согласно одному из воплощений дополнительный активный агент вводят внутривенно или подкожно и один или два раза ежедневно в количестве примерно от 1 до примерно 1000 мг, примерно от 5 до примерно 500 мг, примерно от 10 до примерно 350 мг или примерно от 50 до примерно 200 мг. Конкретное количество дополнительного активного агента зависит от конкретно используемого агента, типа заболевания, подвергаемого лечению или облегчению, тяжести и стадии заболевания и количества (количеств) описываемых в заявке соединений и необязательных дополнительных активных агентов, параллельно вводимых пациенту.
Как описывалось где-либо еще в описании, заявка охватывает также способ снижения, лечения и/или предотвращения пагубных или нежелательных эффектов, связанных с обычной терапией, включающей, но не ограниченной ею, хирургию, химиотерапию, радиационную терапию, гормональную, биологическую терапию и иммунотерапию. Предлагаемые в заявке соединения и другие активные ингредиенты могут вводиться пациенту до, во время или после возникновения вредного эффекта, связанного с общепринятой терапией.
4.4 ЦИКЛИЧЕСКАЯ ИЛИ ПЕРИОДИЧЕСКИ ПОВТОРЯЮЩАЯСЯ ТЕРАПИЯ
В соответствии с некоторыми воплощениями описываемые в заявке профилактические или терапевтические агенты вводятся пациенту с периодическим повторением. Периодически повторяющаяся терапия предусматривает введение активного агента в течение периода времени с последующим перерывом (т.е. прерыванием продолжения введения) на протяжении некоторого периода времени и повторением данного последовательного введения. Циклическая терапия может снижать развитие стойкости к одному или более видов терапии, избегать или снижать побочные эффекты одной из терапий и/или улучшать эффективность лечения.
Поэтому в соответствии с одним из воплощений предлагаемым изобретением соединение вводится ежедневно в виде одной или раздельных доз на протяжении цикла от четырех до шести недель с периодом отдыха около одной или двух недель. Далее, циклическая терапия допускает увеличение частоты, числа и длительности циклов дозирования. Таким образом, еще одно воплощение изобретения охватывает введение описываемого в заявке соединения в течение большего числа циклов, чем обычно, когда оно вводится в одном цикле. В соответствии с еще одним воплощением описываемое в заявке соединение вводится в течение большего количества циклов, чем обычно вызывала бы ограничивающая дозу токсичность у пациента, которому не вводится также дополнительный активный агент.
Согласно еще одному воплощению описываемое в заявке соединение вводится ежедневно и непрерывно в течение трех или четырех недель в дозе примерно от 0,1 до примерно 500 мг в день с последующим отдыхом в одну или две недели. Согласно еще одному воплощению доза может составлять примерно от 1 до примерно 300 мг, примерно от 0,1 до примерно 150 мг, примерно от 1 до примерно 200 мг, примерно от 10 до примерно 100 мг, примерно от 0,1 до примерно 50 мг, примерно от 1 до примерно 50 мг, примерно от 10 до примерно 50 мг, примерно от 20 до примерно 30 мг, примерно от 1 до примерно 20 мг с последующим отдыхом.
Согласно одному воплощению описываемое в заявке соединение и еще один активный ингредиент вводятся орально, причем введение описываемого в заявке соединения происходит за 30-60 минут до дополнительного активного ингредиента, в течение цикла четырех-шести недель. Согласно еще одному воплощению сочетание описываемого в заявке соединения и еще одного активного ингредиента вводится с помощью внутривенного вливания на протяжении каждого цикла около 90 минут.
Обычно число циклов, во время которых пациенту вводится комбинационное лечение, составляет примерно от одного до примерно 24 циклов, примерно от двух до примерно 16 циклов или примерно от четырех до примерно трех циклов.
4.5 ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ФОРМЫ ДОЗИРОВКИ
Фармацевтические композиции могут использоваться при получении индивидуальной, одной из форм дозированных единиц. Фармацевтические композиции и формы дозировки, описываемые в заявке, включают описываемое в заявке соединение или его фармацевтически приемлемую соль, сольват, стереоизомер, клатрат или пролекарство. Фармацевтические композиции и дозированные формы могут дополнительно включать один или более эксципиентов.
Фармацевтические композиции и дозированные формы, описываемые в заявке, могут также включать один или более дополнительных активных ингредиентов. Примеры необязательного еще одного (второго) или дополнительного активного ингредиента обсуждаются в Разделе 4.3 выше.
Отдельные формы дозированных единиц, описываемых в заявке, являются подходящими для орального, слизистого (например, назального, подъязычного, вагинального, щечного или ректального), парентерального (например, подкожного, внутривенного, болюсной инъекции, внутримышечного или внутриартериального), местного (например, глазные капли или другие офтальмические препараты), трансдермального или чрескожного введения пациенту. Примеры дозированных форм, включают, но не ограничиваются ими, таблетки; таблетки в форме капсул; капсулы, такие как мягкие эластичные желатиновые капсулы; облатки; пастилки; лепешки; дисперсии; медицинские свечи; порошки; аэрозоли (например, спреи для носа или ингаляторы); гели; жидкие дозированные формы, подходящие для орального или слизистого введения пациенту, включая суспензии (например, водные или не водные жидкие суспензии, эмульсии масло-в-воде или жидкие эмульсии вода-в-масле), растворы и эликсиры; жидкие дозированные формы, подходящие для парентерального введения пациенту; глазные капли или другие офтальмические препараты, подходящие для местного введения; и стерильные твердые вещества (например, кристаллические или аморфные твердые вещества), которые могут воссоздаваться для обеспечения жидких дозированных форм, подходящих для парентерального введения пациенту.
Состав, вид и тип дозированных форм будет обычно зависеть от их использования. Например, дозированная форма, используемая при остром лечении болезни, может содержать большие количества одного или более активных ингредиентов, чем содержит дозированная форма, используемая при хроническом лечении той же болезни. Аналогичным образом, парентеральная дозированная форма может содержать меньшие количества одного или более активных ингредиентов, чем содержит оральная дозированная форма, используемая при хроническом лечении той же болезни. Данные и другие пути, в которых используются конкретные дозированные формы, варьируют друг от друга и известны специалистам в данной области. См., например, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton PA (1990).
Согласно одному воплощению фармацевтические композиции и дозированные формы включают один или более эксципиентов. Подходящие эксципиенты хорошо известны специалистам в области фармацевтики, а в описании даются не ограничивающие примеры подходящих эксципиентов. Является ли подходящим конкретный эксципиент для включения в состав фармацевтической композиции или дозированной формы, зависит от множества факторов, хорошо известных в данной области, включающих, но не ограниченных ими, путь, которым вводится пациенту дозированная форма. Например, оральные дозироваые формы, такие как таблетки, могут содержать эксципиенты, не подходящие для использования в парентеральных дозированных формах. Пригодность конкретного эксципиента может также зависеть от конкретных активных ингредиентов в дозированной форме. Например, некоторыми эксципиентами, такими как лактоза, или при подвергании действию воды разложение некоторых активных ингредиентов может ускоряться. Активные ингредиенты, которые включают в себя первичные или вторичные амины, особенно чувствительны к такому ускоренному разложению. Поэтому предлагаются фармацевтические композиции и дозированные формы, которые содержат очень мало, если и содержат, лактозу и другие моно- или дисахариды. Используемый в описании термин “свободный от лактозы” обозначает, что количество присутствующей лактозы, если она и присутствует, является достаточным для существенного увеличения скорости разложения активного ингредиента.
Свободные от лактозы композиции могут включать в свой состав эксципиенты, которые хорошо известны в данной области техники и перечислены, например, в U.S. Pharmacopeia (USP) 25-NF20 (2002). Обычно свободные от лактозы композиции включают в свой состав активные ингредиенты, связующее/наполнитель и смазочный агент в фармацевтически совместимых и фармацевтически приемлемых количествах. Согласно одному из воплощений свободные от лактозы дозированные формы включают активные ингредиенты, микрокристаллическую целлюлозу, предварительно желатинизированный крахмал и стеарат магния.
Предлагаются также безводные фармацевтические композиции и дозированные формы, включающие в состав активные ингредиенты, поскольку вода может облегчать разложение некоторых соединений. Например, добавление воды (например, 5%) широко признается в фармацевтических отраслях в качестве средств имитирования или воспроизведения длительного хранения для того, чтобы определить такие характеристики, как срок службы или стабильность рецептур на протяжении времени. См., например, Jens T. Carstensen, Drug Stability: Principles & Practice, 2d. Ed., Marcel Dekker, NY, NY, 1995, стр. 379-80. В действительности вода и тепло ускоряют разложение некоторых соединений. Так, действие воды на рецептуру может иметь большое значение, поскольку с влагой и/или влажностью обычно сталкиваются во время производства лекарств, обращения, упаковывания, хранения, отгрузки и использования рецептур.
Безводные фармацевтические композиции и дозированные формы могут изготавливаться с использованием безводных ингредиентов или ингредиентов, почти не содержащих влаги и в условиях очень низкой влаги или влажности практически не содержащих их. Фармацевтические композиции и дозированные формы, которые включают в состав лактозу и, по крайней мере, один активный ингредиент, который включает в себя первичный или вторичный амин, являются предпочтительно безводными, если во время производства лекарств, упаковки и/или хранения ожидается существенный контакт с влагой и/или влажностью.
Безводные фармацевтические композиции следует изготавливать и хранить так, чтобы сохранялся их безводный характер. Соответственно, согласно одному из воплощений безводные композиции упаковываются с использованием материалов, о которых известно, что они предотвратят подвергание действию воды так, чтобы их можно было включить в состав подходящих рецептурных наборов или комплектов. Примеры подходящей упаковки включают, но не ограничиваются ими, герметически запечатываемые виды фольги, пластики, контейнеры для дозированных единиц (например, ампул), блистерные упаковки и упаковки в виде полосок.
Предлагаются также фармацевтические композиции и дозированные формы, которые включают одно или более соединений, которые снижают скорость, с которой будет разлагаться активный ингредиент. Такие соединения, которые называются в описании “стабилизаторами”, включают, но не ограничиваются ими, антиоксиданты, такие как аскорбиновая кислота, рН буферы или буферы соли.
Как количества и типы эксципиентов, так и количества и конкретные типы активных ингредиентов в дозированной форме, могут различаться в зависимости от факторов, таких как, но не ограниченных ими, путь, которым ее предполагается вводить пациенту. Согласно одному воплощению дозированные формы включают в себя описываемое в заявке соединение в количестве примерно от 0,10 до примерно 500 мг. Согласно другим воплощениям дозированные формы включают описываемое в заявке соединение в количестве около 0,1, 1, 2, 5, 7,5, 10, 12,5, 15, 17,5, 20, 25, 50, 100, 150, 200, 250, 300, 350, 400, 450 или 500 мг.
Согласно другим воплощениям дозированные формы содержат дополнительный активный ингредиент в количестве примерно от 1 до примерно 1000 мг, примерно от 5 до примерно 500 мг, примерно от 10 до примерно 350 мг или примерно от 50 до примерно 200 мг. Конечно, конкретное количество дополнительного активного агента зависит от конкретно используемого агента, заболеваний или расстройств, подвергаемых лечению или облегчению, и от количества (количеств) описываемого в заявке соединения и любых необязательных дополнительных активных агентов, вводимых параллельно пациенту.
4.5.1 ОРАЛЬНЫЕ ДОЗИРОВАННЫЕ ФОРМЫ
Фармацевтические композиции, которые являются подходящими для орального введения, могут предоставляться в виде дискретных дозированных форм, таких как, но не ограниченные ими, таблетки (например, жевательные таблетки), таблетки в форме капсул, капсулы и жидкости (например, ароматизированные сиропы). Такие дозированные формы содержат заданные количества активных ингредиентов и могут изготавливаться с помощью фармацевтических методов, хорошо известных специалистам в данной области. См. Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton PA (1990).
Описываемые в заявке оральные дозированные формы приготавливаются путем комбинирования активных ингредиентов в тесной смеси с, по крайней мере, одним эксципиентом в соответствии с общепринятыми технологическими приемами фармацевтического компаундирования. Эксципиенты могут принимать широкое разнообразие форм в зависимости от формы препарата, желаемой для введения. Например, эксципиенты, подходящие для использования в оральных жидких или аэрозольных дозированных формах, включают, но не ограничиваются ими, воду, гликоли, масла, спирты, вкусовые или ароматизирующие агенты, консерванты и окрашивающие агенты. Примеры эксципиентов, подходящих для использования в твердых оральных дозированных формах (например, порошки, таблетки, капсулы и таблетки в форме капсул), включают, но не ограничиваются ими, крахмалы, сахара, микрокристаллическую целлюлозу, разбавители, гранулирующие агенты, смазочные агенты, связующие и дезинтегрирующие агенты.
Согласно одному воплощению оральными дозированными формами являются таблетки или капсулы, в случае которых применяются твердые эксципиенты. Согласно еще одному воплощению на таблетки могут наноситься покрытия с помощью стандартных водных или безводных приемов. Такие дозированные формы могут изготаливаться с помощью любого метода фармацевтики. Обычно фармацевтические композиции и дозированные формы приготавливаются с помощью однородного и тесного смешения активных агентов с жидкими носителями, тонкоизмельченными твердыми носителями или обоими, а затем придания желаемой формы продукту, если необходимо.
Например, таблетка может приготавливаться путем сжатия. Прессованные таблетки могут изготавляться в подходящем устройстве активных ингредиентов в свободно сыпучем виде, таком как порошок или гранулы, необязательных смешанных с эксципиентом. Формованные таблетки могут изготавливаться в подходящем устройстве смеси порошкообразного соединения, увлажненного инертным жидким разбавителем.
Примеры эксципиентов, которые могут использоваться в оральных дозированных формах, включают, но не ограничиваются ими, связующие, наполнители и смазочные агенты. Носители, подходящие для использования в фармацевтических композициях и дозированных формах, включают, но не ограничиваются ими, кукурузный крахмал, картофельный крахмал или другие крахмалы, желатин, природные и синтетические камеди, такие как камедь акации, альгинат натрия, альгиновую кислоту, другие альгинаты, порошкообразный трагакант, гуаровую смолу, целлюлозу и ее производные (например, этилцеллюлозу, ацетат целлюлозы, кальциевую карбоксиметилцеллюлозу, натриевую карбоксиметилцеллюлозу), поливинилпирролидон, метилцеллюлозу, пре-желатинизированный крахмал, гидроксипропилметилцеллюлозу (например, № 2208, 2906, 2910), микрокристаллическую целлюлозу и их смеси.
Подходящие формы микрокристаллической целлюлозы включают, но не ограничиваются ими, материалы, продаваемые под марками AVICEL-PH-101, AVICEL-PH-103, AVICEL-RC-581, AVICEL-PH-105 (доступными от фирмы FMC Corporation, American Viscose Division, Avicel Sales, Marcus Hook, PA), и их смеси. Конкретным связующим является смесь микрокристаллической целлюлозы и натриевой карбоксиметилцеллюлозы, продаваемая под маркой AVICEL RC-581. Подходящие безводные или с низким содержанием влаги эксципиенты или добавки включают AVICEL-PH-103ТМ и Starch 1500 LM.
Примеры наполнителей, подходящих для использования в фармацевтических композициях и дозированных формах, описываемых в заявке, включают, но не ограничиваются ими, тальк, карбонат кальция (например, гранулы или порошок), микрокристаллическую целлюлозу, порошкообразную целлюлозу, декстраты, каолин, манит, кремниевую кислоту, сорбит, крахмал, пре-желатинизированный крахмал и их смеси. Связующее или наполнитель в фармацевтической композиции согласно одному воплощению присутствует в количестве примерно от 50 до примерно 99% по весу фармацевтической композиции или дозированной формы.
В композициях могут использоваться дезинтегрирующие агенты для получения таблеток, которые дезинтегрируют, когда они подвергаются действию водных условий окружающей среды. Таблетки, которые содержат слишком много дезинтегрирующего агента, могут распадаться или разрушаться при хранении, тогда как таблетки, которые содержат слишком мало, не могут разрушаться с желаемой скоростью и в желаемых условиях. Таким образом, для образования твердых оральных дозированных форм может использоваться достаточное количество дезинтегрирующих агентов, которое является не слишком большим и не слишком малым для разрушения после высвобождения активных ингредиентов. Используемое количество дезинтегрирующего агента варьирует на основе типа рецептурной формы и является заметным средним специалистам в данной области техники. Согласно одному воплощению фармацевтические композиции включают в свой состав примерно от 0,5 до примерно 15 весовых процентов дезинтегрирующего агента или примерно от 1 до примерно 5 вес. процентов указанного агента.
Дезинтегрирующие агенты, которые могут использоваться в фармацевтических композициях и дозированных формах, включают, но не ограничиваются ими, агар-агар, альгиновую кислоту, карбонат кальция, микрокристаллическую целлюлозу, натриевую кросскармелозу, кросповидон, калиевый полакрилин, крахмальный гликолят натрия, картофельный крахмал или крахмал тапиоки, другие крахмалы, пре-желатинизированный крахмал, другие крахмалы, глины, другие альгины, другие целлюлозы, камеди и их смеси.
Смазочные агенты, которые могут использоваться в фармацевтических композициях и дозированных формах, включают, но не ограничиваются ими, стеарат кальция, стеарат магния, минеральное масло, легкое минеральное масло, глицерин, сорбит, маннит, полиэтиленгликоль, другие гликоли, стеариновую кислоту, лаурилсульфат натрия, тальк, гидрированное растительное масло (например, масло земляного ореха (арахисовое), хлопковых семян, подсолнечное, кунжутное, оливковое, кукурузное и соевое масло), стеарат цинка, этилолеат, этиллауреат, агар и их смеси. Дополнительные смазочные агенты включают, например, силоидный силикагель (AEROSIL200, производимый фирмой W.R. Grace Co. из Baltimore, MD), коагулированный аэрозоль синтетической двуокиси кремния (продаваемый фирмой Degussa Co. из Plano, TX), CAB-O-SIL (пирогенный продукт диоксида кремния, продаваемый фирмой Cabot Co. из Boston, MA), и их смеси. Если они вообще применяются, смазочные агенты могут использоваться в количестве менее чем примерно 1 весовой процент от фармацевтических композиций или дозированных форм, в которые они включаются.
Согласно одному воплощению твердая оральная дозированная форма включает в свой состав описываемое в заявке соединение, безводную лактозу, микрокристаллическую целлюлозу, поливинилпирролидон, стеариновую кислоту, коллоидную безводную двуокись кремния и желатин.
4.5.2 ДОЗИРОВАННЫЕ ФОРМЫ РЕГУЛИРУЕМОГО ВЫСВОБОЖДЕНИЯ
Активные ингредиенты, описанные в заявке, могут вводиться с помощью средств регулируемого высвобождения или устройств доставки, которые хорошо известны среднему специалисту в данной области. Примеры включают, но не ограничиваются ими, средства, описанные в патентах США № 3845770; 3916899; 3536809; 3598123; и 4008719, 5674533, 5059595, 5591767, 5120548, 5073543, 5639476, 5354556 и 5733566, содержание каждого из которых включено в описание путем ссылки на него. Такие дозированные формы могут использоваться для обеспечения медленного или регулируемого высвобождения одного или более активных ингредиентов с использованием, например, гидропропилметилцеллюлозы, других полимерных матриц, гелей, проницаемых мембран, осмотических систем, многослойных покрытий, микрокапсул, микрочастиц, липосом, микросфер или их сочетания для обеспечения желаемого профиля высвобождения в меняющихся пропорциях. Для использования с активными агентами, описываемыми в заявке, могут свободно выбираться подходящие рецептурные формы регулируемого высвобождения, известные среднему специалисту в данной области, включающие описанные в заявке формы. Согласно одному воплощению предлагаются отдельные дозированные формы единиц, подходящие для орального введения, такие как, но не ограниченные ими, таблетки, капсулы, желатиновые капсулы и таблетки в форме капсул, которые приспособлены для регулируемого или контролируемого высвобождения.
Согласно одному воплощению фармацевтические продукты регулируемого высвобождения улучшают лекарственную терапию по сравнению с той, которая достигается с помощью их нерегулируемых составных компонентов. Согласно еще одному воплощению использование в медицинском лечении препаратов регулируемого высвобождения характеризуется минимумом лекарственного вещества, применяемого для лечения или контроля состояния в минимальное количество времени. Преимуществами рецептурных форм регулируемого высвобождения являются расширенная активность лекарства, пониженная частота дозировок и увеличенная сговорчивость пациента. В дополнение к сказанному, рецептуры регулируемого высвобождения могут использоваться для оказания влияния на время начала действия или другие характеристики, такие как уровни лекарства в крови, и могут таким образом влиять на возникновение побочных (например, вредных) эффектов.
Согласно еще одному воплощению рецептуры регулируемого высвобождения предназначаются для первоначального высвобождения количества лекарства (активного ингредиента), которое быстро дает желаемый терапевтический или профилактический эффект, и для постепенного и непрерывного высвобождения других количеств лекарства для поддержания данного уровня терапевтического или профилактического эффекта на протяжении расширенного периода времени. Согласно одному воплощению для того, чтобы поддерживать постоянный уровень лекарства в организме, лекарство может высвобождаться из дозированной формы со скоростью, которая будет заменять количество усваиваемого лекарства и выводимого из организма. Регулируемое высвобождение активного ингредиента может стимулироваться различными условиями, включающими, но не ограниченными ими, рН, температуру, ферменты, воду или другие физиологические условия или соединения.
4.5.3 ПАРЕНТЕРАЛЬНЫЕ ДОЗИРОВАННЫЕ ФОРМЫ
Парентеральные дозированные формы могут вводиться пациентам различными путями, включающими, но не ограниченными ими, подкожный, внутривенный (включая болюсные инъекции), внутримышечный и внутриартериальный. Согласно некоторым воплощениям введение парентеральной дозированной формы обходит природные защитные силы пациента от загрязнений, и таким образом согласно данным воплощениям парентеральные дозированные формы являются стерильными или способными стерилизоваться перед введением пациенту. Примеры парентеральной дозированной формы включают, но не ограничиваются ими, растворы, готовые для инъекции, сухие продукты, готовые растворяться или суспендироваться в фармацевтически приемлемом носителе, для инъекции, суспензии, готовые для инъекции, и эмульсии.
Подходящие носители, которые могут использоваться для обеспечения парентеральных дозированных форм, хорошо известны специалистам в данной области. Примеры включают, но не ограничиваются ими: воду для инъекции USP; водные носители, такие как, но не ограниченные ими, инъекционный хлорид натрия, инъекцию Рингера, декстрозную инъекцию, инъекцию декстрозы и хлорида натрия и секретируемую из молочных желез инъекцию Рингера; смешиваемые с водой наполнители, такие как, но не ограниченные ими, этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные носители, такие как, но не ограниченные ими, кукурузное масло, хлопковое, арахисовое, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат.
Соединения, которые увеличивают растворимость одного или более активных ингредиентов, описываемых в заявке, также могут включаться в состав парентеральных дозированных форм. Например, циклодекстрин и его производные могут использоваться для увеличения растворимости предлагаемого в заявке соединения. См., например, патент США № 5134127, содержание которого включено в описание путем ссылки на него.
4.5.4 МЕСТНЫЕ И СЛИЗИСТЫЕ ДОЗИРОВАННЫЕ ФОРМЫ
Описываемые в заявке местные и слизистые дозированные формы включают, но не ограничиваются ими, спреи, аэрозоли, растворы, эмульсии, суспензии, глазные капли или другие офтальмические препараты или другие формы, известные специалистам в данной области. См., например, Remington's Pharmaceutical Sciences, 16th и 18th eds., Mack Publishing, Easton PA (1980 & 1990); и Introduction to Pharmaceutical Dosage Forms, 4th ed., Lea & Febiger, Philadelphia (1985). Дозированные формы, подходящие для лечения слизистых тканей в ротовой полости, могут формироваться в виде полосканий для рта или оральных гелей.
Подходящие эксципиенты (например, носители и разбавители) и другие материалы, которые могут использоваться для обеспечения местных и слизистых дозированных форм, охватываемых описанием, хорошо известны специалистам в области фармацевтики и зависят от конкретной ткани, к которой будет применяться данная фармацевтическая композиция или дозированная форма. Согласно одному воплощению эксципиенты включают, но не ограничиваются ими, воду, ацетон, этанол, этиленгликоль, пропиленгликоль, бутан-1,3-диол, изопропилмиристат, изопропилпальмитат, минеральное масло и их смеси с образованием растворов, эмульсий или гелей, которые являются нетоксичными и фармацевтически приемлемыми. К фармацевтическим композициям и дозированным формам могут также добавляться увлажнители или влагоудерживающие вещества. Примеры дополнительных ингредиентов хорошо известны в данной области. См., например, Remington's Pharmaceutical Sciences, 16th and 18th eds., Mack Publishing, Easton PA (1980 & 1990).
Величину рН фармацевтической композиции или дозированной формы также можно регулировать для улучшения доставки одного или более активных ингредиентов. Для улучшения доставки может также регулироваться полярность носителя-растворителя, его ионная сила или тоничность. Для изменения гидрофильности или липофильности одного или более активных ингредиентов так, чтобы улучшить доставку, к фармацевтическим композициям и дозированным формам могут также добавляться такие соединения, как стеараты. Согласно другим воплощениям стеараты могут служить в качестве носителя липида для рецептурной формы, в качестве эмульгирующего агента или поверхностно-активного вещества или в качестве усиливающего доставку или проникновение агента. Согласно другим воплощениям для дополнительного регулирования свойств получающейся в результате композиции могут использоваться соли, сольваты, пролекарства, клатраты или стереоизомеры активных ингредиентов.
4.6 НАБОРЫ
Согласно одному воплощению описываемые в заявке активные ингредиенты не вводятся пациенту в одно и то же время или одним и тем же способом введения. Согласно еще одному воплощению описываются наборы, которые могут упрощать введение соответствующих количеств активных ингредиентов.
Согласно одному воплощению набор включает дозированную форму предлагаемого в заявке соединения. Набор может дополнительно включать в себя дополнительные активные ингредиенты, такие как облимерсен (Генасенс®), мельфалан, G-CSF, GM-CSF, EPO, топотекан, дакарбазин, иринотекан, таксотер, IFN, ингибитор COX-2, пентоксифиллин, ципрофлоксацин, дексаметазон, IL2, IL8, IL18, Ara-C, винорелбин, изотретиноин, 13 цис-ретиноевая кислота, или фармакологически активный мутант, или его производные, или их сочетание. Примеры дополнительных активных ингредиентов включают, но не ограничиваются ими, раскрываемые в описании (см., например, раздел 4.3).
Согласно другим воплощениям наборы могут дополнительно включать устройства, которые используются для введения активных ингредиентов. Примеры таких устройств включают, но не ограничиваются ими, шприцы, капельницы, пластыри и ингаляторы.
Наборы могут дополнительно включать клетки или кровь для трансплантации, а также фармацевтически приемлемые носители, которые могут использоваться для введения одного или более активных ингредиентов. Например, если активный ингредиент предоставляется в твердой форме, которая должна воссоздаваться для парентерального введения, набор может включать запечатанный контейнер с подходящим носителем, в котором активный агент может растворяться, образуя свободный от частичек стерильный раствор, который является подходящим для парентерального введения. Примеры фармацевтически приемлемых носителей включают, но не ограничиваются ими, воду для инъекций USP; водные наполнители, такие как, но не ограниченные ими, инъекционный раствор (инъекцию) хлорида натрия, инъекционный раствор Рингера, инъекцию декстрозы, инъекцию декстрозы и хлорида натрия и секретируемую из молочных желез инъекцию Рингера; смешиваемые с водой наполнители, такие как, но не ограниченные ими, этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные носители, такие как, но не ограниченные ими, кукурузное масло, хлопковое масло, арахисовое масло, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат.
5. ПРИМЕРЫ
Некоторые воплощения изобретения иллюстрируются следующими не ограничивающими примерами.
5.1 3-(2,6-Диметил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
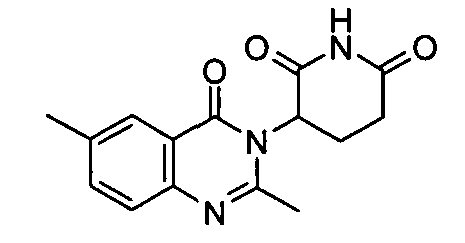
К перемешиваемой смеси 2-амино-5-метилбензойной кислоты (4,8 г, 32 ммоль) и имидазола (2,6 г, 38 ммоль) в ацетонитриле (100 мл) при комнатной температуре добавляли ацетилхлорид (2,7 мл, 38 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли гидрохлорид 3-аминопиперидин-2,6-диона (5,2 г, 32 ммоль), имидазол (4,7 г, 70 ммоль) и трифенилфосфит (9,9 мл, 38 ммоль) и ее нагревали до температуры кипения с обратным холодильником в течение 22 часов. К смеси добавляли воду (100 мл). Суспензию фильтровали и промывали водой (2×100 мл), этилацетатом (2×100 мл), бикарбонатом натрия (насыщенным, 100 мл) и водой (100 мл), получая белое твердое вещество, которое перемешивали в DMF (40 мл) в течение ночи. Суспензию фильтровали и промывали DMF (5 мл), получая белое твердое вещество. Твердое вещество перемешивали в воде (100 мл) при 60°С в течение 2 часов, затем при комнатной температуре в течение ночи. Суспензию фильтровали и промывали водой (2×50 мл), получая 3-(2,6-диметил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (3,4 г, 38% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% H3PO4, 5,37 мин (99,8%); т.пл.: 270-272°С; 1H ЯМР (ДМСО-d6) δ 2,10-2,22 (м, 1H, CHH), 2,43 (c, 3H, CH3), 2,56-2,72 (м, 5H, CH3, 2CHH), 2,76-2,92 (м, 1H, CHH), 5,24 (дд, J=6, 11 Гц, 1H, NCH), 7,52 (д, J=8 Гц, 1H, Ar), 7,64 (дд, J=2, 8 Гц, 1H, Ar), 7,82 (c, 1H, Ar), 11,02 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,76, 20,95, 23,34, 30,60, 56,47, 120,05, 125,20, 126,39, 135,96, 136,19, 144,87, 153,99, 160,40, 169,53, 172,62; LCMS: MH=286; Анализ Вычислено для C15H15N3O3 + 2H2O: C, 56,07; H, 5,96; N, 13,08. Найдено: C, 55,73; H, 5,75; N, 13,01.
5.2 2-Бензилокси-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-ил]ацетамид
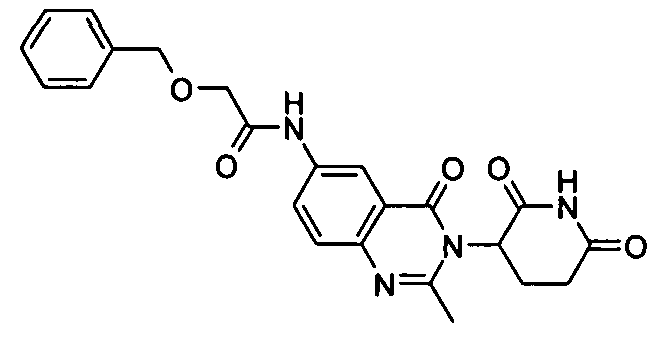
Стадия 1: К перемешиваемой смеси 5-амино-N-карбоксиантранилового ангидрида (1,0 г, 5,6 ммоль) и триэтиламина (0,8 мл, 9,0 ммоль) в ацетонитриле (15 мл) при комнатной температуре по каплям добавляли бензилоксиацетилхлорид (0,87 мл, 5,6 ммоль). Смесь выдерживали при комнатной температуре в течение ночи. К смеси добавляли триэтиламин (3,1 мл, 22 ммоль), гидрохлорид 3-аминопиперидин-2,6-диона (0,92 г, 5,6 ммоль) и уксусную кислоту (3,2 мл, 56 ммоль). Смесь нагревали при 80°С в течение 8 часов. К смеси добавляли воду (75 мл). Суспензию фильтровали и промывали водой (75 мл) и этилацетатом (75 мл), получая темное твердое вещество, которое очищали с помощью колоночной хроматографии (Силикагель, метанол/метиленхлорид 0-10% в течение 15 мин), получая 2-амино-5-(2-бензилоксиацетиламино)-N-(2,6-диоксопиперидин-3-ил)бензамид в виде белого твердого вещества (0,28 г, 12% выход): 1H ЯМР (ДМСО-d6) δ 1,92-2,18 (м, 2H, 2CHH), 2,50-2,55 (м, 1H, CHH), 2,72-2,84 (м, 1H, CHH), 4,03 (c, 2H, CH2), 4,61 (c, 2H, CH2), 4,68-4,77 (м, 1H, NCH), 6,19 (ушир, 2H, NH2), 6,68 (д, J=9 Гц, 1H, Ar), 7,30-7,42 (м, 6H, Ar), 7,62 (д, J=2 Гц, 1H, Ar), 8,43 (д, J=8 Гц, 1H, NH), 9,44 (c, 1H, NH), 10,84 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 24,09, 30,96, 49,12, 69,37, 72,35, 114,27, 116,23, 121,11, 125,99, 126,13, 127,64, 127,77, 128,27, 137,68, 146,19, 167,28, 168,36, 172,35, 173,01.
Стадия 2: Раствор 2-амино-5-(2-бензилоксиацетиламино)-N-(2,6-диоксопиперидин-3-ил)бензамида (0,26 г, 0,6 ммоль) и триметилортоформиата (2 мл) и п-толуолсульфоновой кислоты (60 мг) в ацетонитриле (10 мл) нагревали до температуры кипения с обратным холодильником в течение 21 часа. К смеси добавляли воду (25 мл) и простой эфир (25 мл). Суспензию фильтровали и промывали водой (50 мл) и этилацетатом (50 мл), получая 2-бензилокси-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-ил]ацетамид в виде белого твердого вещества (180 мг, 72% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 2,87 мин (99,3%); т.пл.: 248-250°С; 1H ЯМР (ДМСО-d6) δ 2,14-2,16 (м, 1H, CHH), 2,62-2,87 (м, 3H, CH2, CHH), 4,15 (c, 2H, CH2), 4,64 (c, 2H, CH2), 5,49-5,50 (м, 1H, NCH), 7,31-7,41 (м, 5H, Ar), 7,68 (д, J=9 Гц, 1H, Ar), 8,06-8,10 (м, 1H, NH), 8,28 (c, 1H, CH), 8,55 (ушир, 1H, Ar), 10,24 (c, 1H, NH), 11,16 (c, 1H, NH); 13C ЯМР(ДМСО-d6) δ 23,05, 31,48, 58 (ушир), 69,87, 72,92, 115,69, 122,15, 127,30, 128,16, 128,28, 128,34, 128,77, 137,98, 138,14, 144,06, 146,48, 160,10, 168,93, 170,43, 172,90; LCMS: MH=421; Анализ Вычислено для C22H20N4O5: C, 62,85; H, 4,79; N, 13,33. Найдено: C, 60,60; H, 4,29; N, 12,54.
5.3 3-(6-Фтор-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
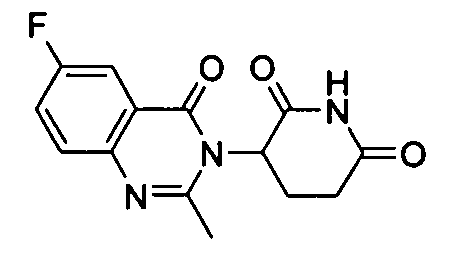
К перемешиваемой смеси 2-амино-5-фторбензойной кислоты (1,2 г, 7,8 ммоль) и имидазола (0,63 г, 9,3 ммоль) в ацетонитриле (15 мл) при комнатной температуре добавляли ацетилхлорид (0,66 мл, 9,3 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли гидрохлорид 3-аминопиперидин-2,6-диона (1,3 г, 7,7 ммоль), имидазол (1,2 г, 17 ммоль) и трифенилфосфит (2,2 мл, 8,5 ммоль) и ее нагревали до температуры кипения с обратным холодильником в течение 22 часов. Суспензию фильтровали и промывали водой (2×50 мл), этилацетатом (2×50 мл) и водой (50 мл), получая 3-(6-Фтор-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (1,2 г, 53% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% H3PO4, 5,99 мин (99,3%); т.пл.: 273-275°С; 1H ЯМР (ДМСО-d6) δ 2,13-2,23 (м, 1H, CHH), 2,57-2,71 (м, 5H, CH3, 2CHH), 2,75-2,95 (м, 1H, CHH), 5,30 (дд, J=6, 11 Гц, 1H, NCH), 7,70-7,73 (м, 3H, Ar), 11,06 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,82, 23,31, 30,58, 56,63, 110,54 (д, JC-F=23 Гц), 121,40 (д, JC-F=8 Гц), 123,24 (д, JC-F=24 Гц), 129,47 (д, JC-F=8 Гц), 143,75, 154,45, 159,83 (д, JC-F=245 Гц), 159,86 (д, JC-F=3 Гц), 169,37, 172,58; LCMS: MH=290; Анализ Вычислено для C14H12N3O3F + 1,3 H2O: C, 53,78; H, 4,71; N, 13,44. Найдено: C, 53,75; H, 4,61; N, 13,50.
5.4 3-(6-Хлор-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
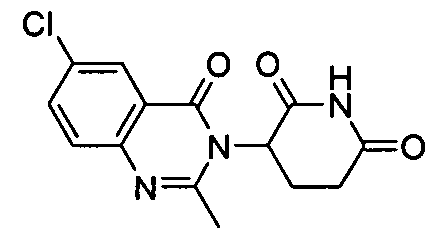
К перемешиваемой смеси 2-амино-5-хлорбензойной кислоты (2,0 г, 12 ммоль) и имидазола (1,0 г, 14 ммоль) в ацетонитриле (30 мл) при комнатной температуре добавляли ацетилхлорид (1,0 мл, 14 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли гидрохлорид 3-аминопиперидин-2,6-диона (1,9 г, 12 ммоль), имидазол (1,8 г, 26 ммоль) и трифенилфосфит (3,7 мл, 26 ммоль) и ее нагревали до температуры кипения с обратным холодильником в течение 22 часов. К смеси добавляли воду (60 мл). Суспензию фильтровали и промывали водой (2×50 мл), этилацетатом (2×50 мл) и водой (50 мл), получая 3-(6-хлор-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (2,9 г, 80% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 25/75 CH3CN/0,1% H3PO4, 6,65 мин (98,5%); т.пл.: 276-278°С; 1H ЯМР (ДМСО-d6) δ 2,15-2,24 (м, 1H, CHH), 2,58-2,71 (м, 5H, CH3, 2CHH), 2,78-2,92 (м, 1H, CHH), 5,30 (дд, J=6, 11 Гц, 1H, NCH), 7,66 (д, J=9 Гц, 2H, Ar), 7,85 (дд, J=3, 9 Гц, 1H, Ar), 7,98 (д, J=2 Гц, 1H, Ar), 11,06 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,79, 23,45, 30,57, 56,71, 121,47, 124,89, 128,89, 130,77, 134,87, 145,57, 155,67, 159,53, 169,31, 172,56; LCMS: MH=306, 308; Анализ Вычислено для C14H12N3O3Cl + 2H2O: C, 49,20; H, 4,72; N, 12,30; Cl, 10,37. Найдено: C, 49,34; H, 4,57; N, 12,20; Cl, 10,39.
5.5 3-(6-Бром-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
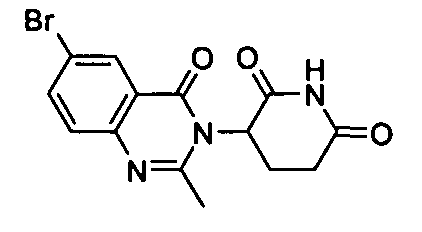
Стадия 1: Перемешиваемую смесь 5-бром-N-карбоксиантранилового ангидрида (6,0 г, 25 ммоль), гидрохлорида 3-аминопиперидин-2,6-диона (4,1 г, 25 ммоль), триэтиламина (18 мл, 129 ммоль) и уксусной кислоты (15 мл, 262 ммоль) в ацетонитриле (60 мл) нагревали при 90°С в течение 18 часов. Суспензию фильтровали и промывали ацетонитрилом (2×80 мл), водой (2×80 мл) и этилацетатом (2×80 мл), получая 2-амино-N-(2,6-диоксопиперидин-3-ил)-5-бромбензамид в виде белого твердого вещества (5,8 г, 72% выход): LCMS: МН=326,328. Образец использовали в следующей стадии без дальнейшей очистки.
Стадия 2: Раствор 2-амино-N-(2,6-диоксопиперидин-3-ил)-5-бромбензамида (1,0 г, 3 ммоль) и триметилортоацетата (1,6 мл) и п-толуолсульфоновой кислоты (250 мг) в ацетонитриле (10 мл) нагревали до температуры кипения с обратным холодильником в течение 7 дней. Суспензию фильтровали и промывали этилацетатом (10 мл), метанолом (5 мл) и этилацетатом (10 мл), получая 3-(6-бром-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде не совсем белого твердого вещества (108 мг, 10% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 5,17 мин (98,7%); т.пл.: 273-275°С; 1H ЯМР (ДМСО-d6) δ 2,14-2,27 (м, 1H, CHH), 2,56-2,69 (м, 2H, 2CHH), 2,64 (c, 3H, CH3), 2,72 -2,90 (м, 1H, CHH), 5,29 (дд, J=6, 11 Гц, 1H, NCH), 7,58 (д, J=9 Гц, 1H, Ar), 7,98 (дд, J=2, 9 Гц, 1H, Ar), 8,12 (д, J=2 Гц, 1H, Ar), 11,06 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,72, 23,42, 30,50, 56,64, 118,80, 121,77, 127,94, 128,95, 137,51, 145,76, 155,74, 159,32, 167,24, 172,49; LCMS: MH=350, 352; Анализ Вычислено для C14H12N3O3Br: C, 48,02; H, 3,45; N, 12,00. Найдено: C, 48,02; H, 3,18; N, 11,76.
5.6 3-(6-Гидрокси-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
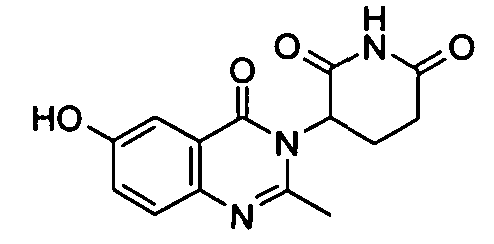
К перемешиваемой смеси 2-амино-5-гидроксибензойной кислоты (5,1 г, 33 ммоль) и имидазола (5,0 г, 73 ммоль) в ацетонитриле (60 мл) при комнатной температуре добавляли ацетилхлорид (5,2 мл, 73 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли гидрохлорид 3-аминопиперидин-2,6-диона (6,0 г, 37 ммоль), имидазол (5,0 г, 73 ммоль) и трифенилфосфит (10,5 мл, 40 ммоль) и ее нагревали до температуры кипения с обратным холодильником в течение 22 часов. К смеси добавляли воду (100 мл) и конц. HCl до значения рН ~1. Растворитель удаляли в вакууме. К остатку добавляли воду (50 мл). Водный слой экстрагировали этилацетатом (50 мл). К водному слою добавляли этилацетат (50 мл) и смесь перемешивали при комнатной температуре, получая суспензию. Суспензию фильтровали, получая твердое вещество, которое перемешивали в метаноле (50 мл) в течение ночи. Суспензию фильтровали и промывали метанолом (2×30 мл) и водой, получая 3-(6-гидрокси-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде не совсем белого твердого вещества (2,97 г, 31% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 5/95 град 95/5 в 5 мин CH3CN/0,1% H3PO4, 4,50 мин (96,8%); т.пл.: 315-317°С; 1H ЯМР (ДМСО-d6) δ 2,13-2,18 (м, 1H, CHH), 2,58 (c, 3H, CH3), 2,62-2,71 (м, 2H, 2CHH), 2,78-2,91 (м, 1H, CHH), 5,22 (дд, J=6, 11 Гц, 1H, NCH), 7,24-7,32 (м, 2H, Ar), 7,49 (д, J=9 Гц, 1H, Ar), 10,07 (c, 1H, OH), 11,00 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,97, 23,10, 30,59, 56,36, 108,59, 121,24, 124,13, 128,19, 140,14, 151,39, 155,89, 160,24, 169,58, 172,63; LCMS: MH=288; Анализ Вычислено для C14H13N3O4+ 1 H2O: C, 55,08; H, 4,95; N, 13,76. Найдено: C, 54,82; H, 4,74; N, 13,54.
5.7 3-(6-Хлор-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
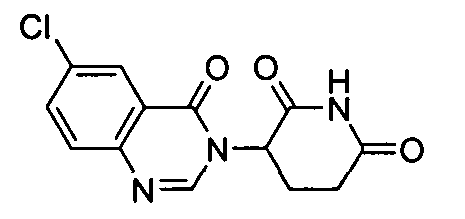
Стадия 1: Перемешиваемую смесь 5-хлор-N-карбоксиантранилового ангидрида (0,51 г, 2,5 ммоль), гидрохлорида 3-аминопиперидин-2,6-диона (0,42 г, 2,5 ммоль), триэтиламина (1,8 мл, 12,7 ммоль) и уксусной кислоты (1,5 мл, 25,3 ммоль) в ацетонитриле (5 мл) нагревали при 150°С в микроволновой печи в течение 5 минут. Суспензию фильтровали и промывали водой (50 мл) и этилацетатом (20 мл), получая 2-амино-N-(2,6-диоксопиперидин-3-ил)-5-хлорбензамид в виде белого твердого вещества (0,31 г, 42% выход): 1H ЯМР (ДМСО-d6) δ 1,91-2,12 (м, 2H, 2CHH), 2,50-2,56 (м, 1H, CHH), 2,72-2,80 (м, 1H, CHH), 4,71-4,76 (м, 1H, NCH), 6,58 (ушир.с, 2H, NH2), 6,74 (д, J=8 Гц, 1H, Ar), 7,19 (дд, J=2, 9 Гц, 1H, Ar), 7,58 (т; J=2 Гц, 1H, Ar), 8,62 (д, J=8 Гц, 1H, NH), 10,86 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 23,99, 30,89, 49,00, 114,62, 117,60, 118,04, 127,25, 131,63, 148,61, 167,37, 172,20, 172,93; LCMS: MH= 282, 284.
Стадия 2: Раствор 2-амино-N-(2,6-диоксопиперидин-3-ил)-5-хлорбензамида (0,31 г, 1,1 ммоль) и триметилортоформиата (4 мл) и п-толуолсульфоновой кислоты (50 мг) нагревали до 150°С в микроволновой печи в течение 10 минут. Суспензию фильтровали и промывали этилацетатом (10 мл), метанолом (5 мл) и этилацетатом (10 мл), получая 3-(6-хлор-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде не совсем белого твердого вещества (230 мг, 74% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 4,01 мин (100%); т.пл.: 302-305°С; 1H ЯМР (ДМСО-d6) δ 2,13-2,20 (м, 1H, CHH), 2,62-2,93 (м, 3H, CH2, CHH), 5,52 (ушир, 1H, NCH), 7,76 (д, J=9 Гц, 1H, Ar), 7,91 (дд, J=2, 9 Гц, 1H, Ar), 8,10 (д, J=2 Гц, 1H, Ar), 8,41 (c, 1H, CH), 11,19 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,39, 30,87, 56,29 (ушир.), 122,56, 125,05, 129,47, 131,59, 134,82, 146,19, 147,75, 158,73, 169,68, 172,39; LCMS: MH=292, 294; Анализ Вычислено для C13H10N3O3Cl: C, 53,53; H, 3,46; N, 14,41. Найдено: C, 53,43; H, 3,21; N, 14,27.
5.8 3-(6-Бром-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
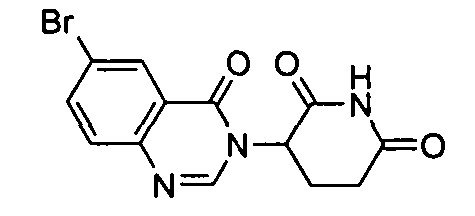
Стадия 1: Перемешиваемую смесь 5-бром-N-карбоксиантранилового ангидрида (6,0 г, 25 ммоль), гидрохлорида 3-аминопиперидин-2,6-диона (4,1 г, 25 ммоль), триэтиламина (18 мл, 129 ммоль) и уксусной кислоты (15 мл, 262 ммоль) в ацетонитриле (60 мл) нагревали при 90°С в течение 18 часов. Суспензию фильтровали и промывали ацетонитрилом (2×80 мл), водой (2×80 мл) и этилацетатом (2×80 мл), получая 2-амино-N-(2,6-диоксопиперидин-3-ил)-5-бромбензамид в виде белого твердого вещества (5,8 г, 72% выход): LCMS: МН=326,328. Образец использовали в следующей стадии без дальнейшей очистки.
Стадия 2: Раствор 2-амино-N-(2,6-диоксопиперидин-3-ил)-5-бромбензамида (0,51 г, 1,5 ммоль) и триметилортоформиата (2 мл) и п-толуолсульфоновой кислоты (150 мг) в ацетонитриле (10 мл) нагревали до температуры кипения с обратным холодильником в течение 12 часов. К смеси добавляли воду (70 мл) и перемешивали при комнатной температуре в течение 2 часов. Суспензию фильтровали и промывали этилацетатом (10 мл). Твердое вещество в NMP (3 мл) нагревали при 80°С. К раствору добавляли воду (1,5 мл) и смеси давали охладиться до комнатной температуры. Суспензию фильтровали и промывали NMP (1 мл) и этилацетатом (10 мл), получая 3-(6-бром-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (350 мг, 68% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 4,18 мин (99,9%); т.пл.: 312-314°С; 1H ЯМР (ДМСО-d6) δ 2,14-2,21 (м, 1H, CHH), 2,60-2,74 (м, 2H, 2CHH), 2,83-2,93 (м, 1H, CHH), 5,51 (ушир.с, 1H, NCH), 7,68 (д, J=9 Гц, 1H, Ar), 8,03 (дд, J=2, 9 Гц, 1H, Ar), 8,24 (д, J=2 Гц, 1H, Ar), 8,42 (c, 1H, CH), 11,19 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,45, 30,93, 55,49, 119,83, 122,96, 128,23, 129,65, 137,61, 146,52, 147,94, 158,66, 169,75, 172,46; LCMS: MH = 336, 338; Анализ Вычислено для C13H10N3O3Br + 0,3 H2O: C, 45,72; H, 3,13; N, 12,30; Br, 23,39. Найдено: C, 45,46; H, 2,75; N, 12,15; Br, 22,81.
5.9 3-(6-Метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
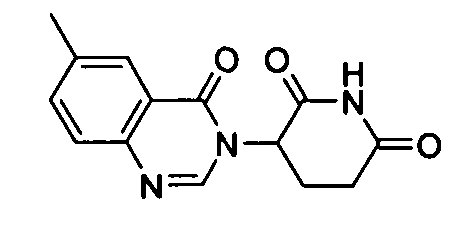
Стадия 1: Смесь 2-амино-5-метилбензойной кислоты (1,0 г, 6,6 ммоль) и CDI (1,0 г, 6,1 ммоль) в ацетонитриле (15 мл) перемешивали при комнатной температуре в течение 1,5 часов. К суспензии добавляли гидрохлорид 3-аминопиперидин-2,6-диона (1,0 г, 6,1 ммоль) и бикарбонат натрия (0,45 мл, 3,6 ммоль) и смесь нагревали при 50°С в течение 21 часа. Суспензия охлаждалась до комнатной температуры в течение 1 часа. Суспензию фильтровали и промывали ацетонитрилом (20 мл), водой (2×20 мл) и этилацетатом (20 мл), получая 2-амино-N-(2,6-диоксопиперидин-3-ил)-5-метилбензамид в виде голубого твердого вещества (1,1 г, 63% выход): 1H ЯМР (ДМСО-d6) δ 1,91-1,98 (м, 1H, CHH), 2,05-2,14 (м, 1H, CHH), 2,17 (c, 3H, CH3), 2,50-2,56 (м, 1H, CHH), 2,73-2,85 (м, 1H, CHH), 4,69-4,77 (м, 1H, NCH), 6,20 (ушир, 2H, NH2), 6,63 (д, J=9 Гц, 1H, Ar), 7,00 (дд, J=2, 8 Гц, 1H, Ar), 7,34 (д, J=2 Гц, 1H, Ar), 8,43 (д, J=8 Гц, 1H, NH); 10,84 (c, 1H,NH); 13C ЯМР (ДМСО-d6) δ 19,89, 24,13, 30,92, 48,93, 113,87, 116,48, 122,81, 127,87, 132,72, 147,40, 168,55, 172,40, 172,97.
Стадия 2: Раствор 2-амино-N-(2,6-диоксопиперидин-3-ил)-5-метилбензамида (0,45 г, 1,7 ммоль) и триметилортоформиата (4 мл) и п-толуолсульфоновой кислоты (80 мг) нагревали до 160°С в микроволновой печи в течение 8 минут. К суспензии добавляли метанол (20 мл), метиленхлорид (20 мл) и Целит (5 мл). Растворитель удаляли в вакууме. Остаток помещали в SIM и очищали с помощью колоночной хроматографии (Силикагель, метанол/метиленхлорид 0% градиент 10% в течение 15 мин), получая 3-(6-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде голубого твердого вещества (50 мг, 9% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 2,78 мин (96,1%); т.пл.: 285-287°С; 1H ЯМР (ДМСО-d6) δ 2,11-2,18 (м, 1H, CHH), 2,46 (c, 3H, CH3), 2,56-2,74 (м, 2H, 2CHH), 2,82-2,93 (м, 1H, CHH), 5,48 (ушир, 1H, NCH), 7,61 (д, J=8 Гц, 1H, Ar), 7,70 (дд, J=2, 8 Гц 1H, Ar), 7,94 (ушир, 1H, Ar), 8,33 (c, 1H, CH), 11,15 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,72, 22,51, 30,91, 57,00 (ушир), 121,09, 125,38, 127,00, 135,89, 137,07, 145,46, 146,45, 159,60, 169,88, 172,44; LCMS: MH = 272; Анализ Вычислено для C14H13N3O3: C, 61,99; H, 4,83; N, 15,49. Найдено: C, 61,78; H, 4,57; N, 15,34.
5.10 3-(6-Амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
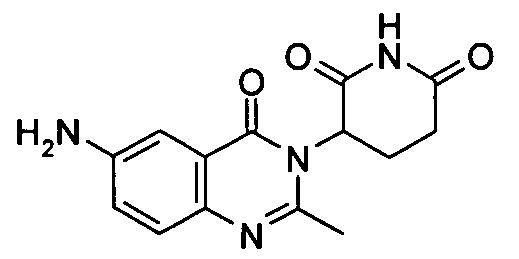
Стадия 1: К перемешиваемой смеси 2-амино-5-нитробензойной кислоты (5,0 г, 28 ммоль) и имидазола (2,2 г, 33 ммоль) в ацетонитриле (50 мл) при комнатной температуре добавляли ацетилхлорид (2,3 мл, 33 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли гидрохлорид 3-аминопиперидин-2,6-диона (4,5 г, 28 ммоль), имидазол (4,1 г, 60 ммоль) и трифенилфосфит (8,7 мл, 33 ммоль) и смесь нагревали до температуры кипения с обратным холодильником в течение 22 часов. К смеси добавляли воду (60 мл). Суспензию фильтровали и промывали водой (2×50 мл), этилацетатом (2×50 мл) и водой (50 мл), получая 3-(2-метил-6-нитро-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде не совсем белого твердого вещества (5,3 г, 61% выход): 1H ЯМР (ДМСО-d6) δ 2,19-2,26 (м, 1H, CHH), 2,60-2,69 (м, 2H, 2CHH), 2,72 (c, 3H, CH3), 2,79-2,87 (м, 1H, CHH), 5,37 (дд, J=5, 11 Гц, 1H, NCH), 7,83 (д, J=9 Гц, 1H, Ar), 8,56 (дд, J=3, 9 Гц, 1H, Ar), 8,74 (дт, J=3 Гц 1H, Ar), 11,12 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,69, 23,82, 30,57, 56,98, 119,46, 120,20, 122,21, 128,45, 128,74, 144,90, 150,85, 159,13, 159,78, 169,12, 172,53.
Стадия 2: Суспензию 3-(2-метил-6-нитро-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (4,1 г, 13 ммоль) и 20% Pd(OH)2/C (0,9 г) в циклогексене (20 мл) и DMF (60 мл) нагревали в 125°С масляной бане в течение ночи. Суспензию фильтровали через Целитную подушку и промывали DMF (30 мл). Раствор DMF и Charcoal (4 г) перемешивали при комнатной температуре в течение 5 часов. Суспензию фильтровали через Целитную подушку. Растворитель удаляли в вакууме. К остатку добавляли DMF (20 мл), а затем воду (80 мл), получая суспензию. Суспензию фильтровали и промывали водой (50 мл), этилацетатом (50 мл) и водой (50 мл), получая коричневое твердое вещество, которое очищали с помощью препаративной HPLC (С18 5/95 в течение 2 минут, затем градиентом 50/50 в течение 18 минут CH3CN/H2O), получая 3-(6-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (1,15 г, 31% выход): HPLC: Waters Xterra C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% NH4HCO2, 5,31 мин (99,8%); т.пл.: 314-316°С; 1H ЯМР (ДМСО-d6) δ 2,08-2,14 (м, 1H, CHH), 2,54 (c, 3H, CH3), 2,55-2,67 (м, 2H, 2CHH), 2,75-2,90 (м, 1H, CHH), 5,16 (дд, J=5, 11 Гц, 1H, NCH), 5,59 (ушир.с, 2H, NH2), 7,04-7,08 (м, 2H, Ar), 7,31-7,34 (м, 1H, Ar), 10,97 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,06, 22,96, 30,62, 56,22, 105,89, 121,34, 122,61, 127,35, 137,89, 147,63, 149,24, 160,39, 169,68, 172,66; LCMS: MH=287; Анализ Вычислено для C14H14N4O3+ 1 H2O: C, 55,26; H, 5,30; N, 18,41. Найдено: C, 54,99; H, 5,22; N, 18,35.
5.11 Трет-бутиловый эфир [3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]карбаминовой кислоты
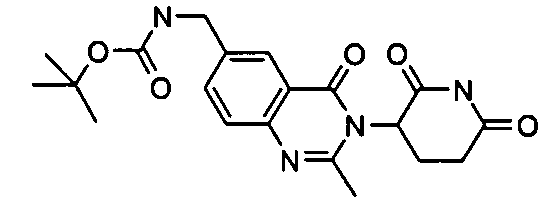
Стадия 1: Смесь метилового эфира 5-метил-2-нитробензойной кислоты (93,95 г, 481,35 ммоль), 1,3-дибром-5,5-диметилгидантиона (75,70 г, 264,74 ммоль) в метилацетате (550 мл) нагревали при 78°С в течение 40 минут при перемешивании механической мешалкой. Затем добавляли раствор 2,2'-азобисизобутиро-нитрила (3,95 г, 24,07 ммоль) в метилацетате (80 мл) и смесь нагревали примерно до 75°С в течение 13 часов. Смеси давали охладиться до 15°С и перемешивали в течение 2 часов, получая осадок. Суспензию фильтровали, промывали 10°С метилацетатом (2×50 мл), получая коричневый фильтрат. К фильтрату добавляли гептан (500 мл). Органический слой промывали 2% солевым раствором (2×500 мл) и водой (2×500 мл) и концентрировали примерно до 2 объемов. К смеси добавляли трет-бутилметиловый эфир (или MTBE, 300 мл). Смесь нагревали примерно при 70°С в течение 15 минут, охлаждали до примерно 53°С на протяжении одного часа, затравляли продуктом (примерно 250 мг или просто перекристаллизовывали) при 45°С, затем при 20~25°С при продувании азотом через стеклянную пипетку в течение ночи. Полученное твердое вещество фильтровали через воронку со средним размером пор, промывали предварительно охлажденным 10°С смешанным раствором гептана/МТВЕ (1/2 объем/объем) и сушили с отсасыванием в вытяжном колпаке в течение ночи, получая метиловый эфир 5-бромметил-2-нитробензойной кислоты в виде не совсем белого твердого вещества (58,3 г, 44% выход). Твердое вещество использовали в следующей стадии без дальнейшей очистки.
Стадия 2: Перемешиваемую смесь метилового эфира 5-бромметил-2-нитробензойной кислоты (50,5 г, 184 ммоль), ди-трет-бутилиминодикарбоксилата (40,15 г, 185 ммоль), карбоната цезия (123,1 г, 377,7 ммоль) и иодида лития (1,23 г, 9,21 ммоль) в 2-бутаноне (556 мл) нагревали до температуры кипения с обратным холодильником в 100°С масляной бане в течение 12 часов при перемешивании механической мешалкой. Смеси давали охладиться до комнатной температуры. К смеси добавляли солевой раствор (300 мл), воду (300 мл) и этилацетат (750 мл) и смесь перемешивали в течение 10 минут. Суспензию фильтровали через Целитную подушку. Два слоя разделяли и органический слой выпаривали до меньшего объема. Водный слой экстрагировали этилацетатом (2×150 мл). Объединенные органические слои промывали солевым раствором (500 мл), сушили над сульфатом магния, в то же время обесцвечивали активированным углем при комнатной температуре при перемешивании в течение 30 минут. Черную смесь фильтровали через Целитную подушку. Фильтрат выпаривали, получая метиловый эфир 5-(ди-трет-бутоксикарбониламинометил)-2-нитробензойной кислоты в виде коричневого масла (74,18 г, 98% выход). Продукт использовали в следующей стадии без дальнейшей очистки.
Стадия 3: К перемешиваемому коричневому раствору метилового эфира 5-(ди-трет-бутоксикарбониламинометил)-2-нитробензойной кислоты (74,18 г, 180,7 ммоль) в метиленхлориде (700 мл) добавляли трифторуксусную кислоту (26,2 мл, 352,4 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. К раствору добавляли насыщенный раствор бикарбоната натрия (400 мл) и смесь перемешивали в течение 10 минут. Органический слой отделяли, сушили над сульфатом магния и выпаривали, получая метиловый эфир 5-(трет-бутоксикарбониламинометил)-2-нитробензойной кислоты в виде коричневого масла (52,5 г, 94% сырой выход). Продукт использовали в следующей стадии без дальнейшей очистки.
Стадия 4: Смесь метилового эфира 5-(трет-бутоксикарбониламинометил)-2-нитробензойной кислоты (52,5 г, 169,3 ммоль), гидроксида лития (4,86 г, 203,1 ммоль) в метаноле (546 мл) и воде (273 мл) перемешивали механической мешалкой при комнатной температуре в течение ночи. Метанол выпаривали и к водному раствору добавляли 1н. HCl (270 мл) с образованием осадка. Добавляли простой эфир (350 мл) и смесь перемешивали при 0°С в течение 2 часов. Смесь выпаривали. К остатку добавляли воду (500 мл). Водный слой экстрагировали метиленхлоридом (3×100 мл). Объединенные органические слои разделяли, сушили над сульфатом магния и концентрировали, получая 5-(трет-бутоксикарбониламинометил)-2-нитробензойную кислоту в виде коричневого масла (21,0 г, 41% выход). Продукт использовали в следующей стадии без дальнейшей очистки.
Стадия 5: Смесь 5-(трет-бутоксикарбониламинометил)-2-нитробензойной кислоты (21,0 г, 70,9 ммоль) в метаноле (210 мл) и палладия на угле (2 г) гидрировали с помощью Parr-шейкера в течение ночи при 51 пси (3,47 атм). Черную смесь фильтровали через Целитную подушку и фильтрат выпаривали, получая коричневое масло, которое перемешивали в простом эфире (300 мл) в течение ночи. Эфирную суспензию фильтровали, получая 2-амино-5-(трет-бутоксикарбониламинометил)-2-нитробензойную кислоту в виде коричневого твердого вещества (9,3 г, 49% выход). Продукт использовали в следующей стадии без дальнейшей очистки.
Стадия 6: К перемешиваемому раствору 2-амино-5-(трет-бутоксикарбониламинометил)-2-нитробензойной кислоты (9,3 г, 34,9 ммоль), имидазола (2,85 г, 41,9 ммоль) в ацетонитриле (120 мл) добавляли ацетилхлорид (3,0 мл, 41,9 ммоль) и перемешивали при комнатной температуре в течение ночи. Затем к смеси добавляли гидрохлорид 3-аминопиперидин-2,6-диона (5,74 г, 34,9 ммоль), имидазол (4,76 г, 69,8 ммоль) и трифенилфосфит (11,0 мл, 41,9 ммоль) и смесь нагревали до кипения с обратным холодильником в течение 6 часов. Смеси давали охладиться до комнатной температуры и добавляли воду (примерно 400 мл). Суспензию фильтровали и промывали водой (50 мл), этилацетатом (20 мл), простым эфиром (50 мл) и сушили отсасыванием, получая трет-бутиловый эфир [3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]карбаминовой кислоты в виде не совсем белого твердого вещества (9,7 г, 70% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% H3PO4, с градиентом до 95/5 в течение 5 мин, выдерживалось 5 мин, 5,95 мин (96,7%); т.пл.: 212,5-214,5°С; 1H ЯМР (ДМСО-d6) δ 1,40 (c, 9H, CMe3), 2,15-2,18 (м, 1H, CHR), 2,57-2,86 (м, 6H, CHCH2, CH3), 4,23 (д, J=6 Гц, 2H, CH2NH), 5,26 (дд, J=6, 11 Гц, 1H, CH), 7,52 (т, J=6 Гц, 1H, CH2NH), 7,56-7,88 (м, 3H, Ar), 11,03 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,92, 23,40, 28,20, 30,62, 42,97, 56,52, 77,94, 119,98, 123,50, 126,51, 133,74, 138,76, 145,75, 154,52, 155,79, 160,44, 169,47, 172,61. LCMS MH=401; Анализ Вычислено для C20H24N4O5: C, 59,99; H, 6,04; N, 13,99. Найдено: C, 59,83; H, 5,98; N, 13,85.
5.12 Гидрохлорид 3-(6-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона
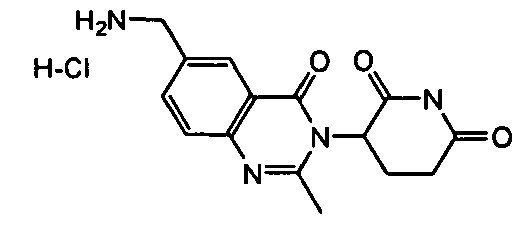
Стадия 1: К перемешиваемому коричневому раствору трет-бутилового эфира [3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]карбаминовой кислоты (3,5 г, 8,7 ммоль) в метаноле (36 мл) и метиленхлориде (36 мл) добавляли 2 М HCl в простом эфире (102 мл) и смесь перемешивали в течение ночи. Растворитель выпаривали, и остаток перемешивали в простом эфире (100 мл) в течение 2 часов. Суспензию фильтровали, получая гидрохлорид 3-(6-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона в виде желтого твердого вещества (3,2 г, 109% грубый выход). Продукт использовали в следующей стадии без дальнейшей очистки.
Стадия 2: Гидрохлорид 3-(6-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,95 г) растворяли в воде (100 мл). Раствор промывали этилацетатом (2×100 мл). Водный слой выпаривали, получая гидрохлорид 3-(6-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона в виде не совсем белого твердого вещества (0,79 г, 84% выход); HPLC: Waters Xterra RP 18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, Waters LC Module 1, 05/95 CH3CN/0,1% (HCO2)NH4 представляет коэффициент °C, 4,67 мин (98,5%); т.пл.: 299-301°С; 1H ЯМР (ДМСО-d6) δ 2,18-2,24 (м, 1H, CHH), 2,59-2,89 (м, 6H, CHCH2, CH3), 4,14-4,19 (м, 2H, ArCH2), 5,34 (дд, J=5, 11 Гц, 1H, CH), 7,71-8,20 (м, 3H, Ar), 8,54 (ушир.с, 3H, ClNH3), 11,08 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,86, 22,97, 30,60, 41,61, 56,75, 119,85, 125,75, 126,83, 132,81, 135,80, 145,35, 156,51, 159,96, 169,23, 172,59. LCMS MH=301; Анализ Вычислено для C15H17N4O3Cl + 1,0 H2O и + 0,8 HCl: C, 46,92; H, 5,20; N, 14,59; Cl, 16,62. Найдено: C, 46,72; H, 5,15; N, 14,29; Cl, 16,59.
5.13 [3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]амид гептановой кислоты
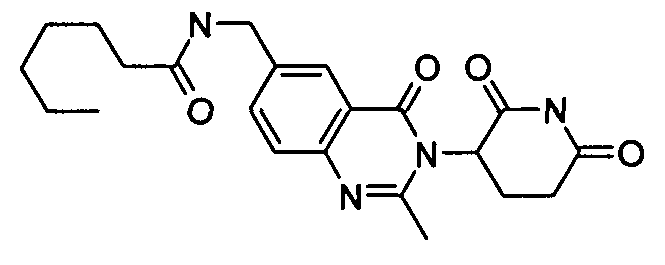
К перемешиваемой суспензии гидрохлорида 3-(6-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,49 г, 1,5 ммоль) в ацетонитриле (10 мл) добавляли гептаноилхлорид (0,34 мл, 2,2 ммоль) и N,N-диизопропилэтиламин (0,60 мл, 3,7 ммоль). Смесь перемешивали при комнатной температуре в течение одного часа. Растворитель выпаривали и остаток очищали с помощью колоночной флеш-хроматографии (Силикагель, метанол/метиленхлорид 4%/96%), получая [3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]амид гептановой кислоты в виде не совсем белого твердого вещества (349 мг, 58% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% H3PO4, с градиентом до 95/5 в течение 5 мин, выдерживалось 5 мин, 6,12 мин (96,3%); т.пл.: 223-225°С; 1H ЯМР (ДМСО-d6) δ 0,84 (т, J=6 Гц, 3H, CH3 длинной цепи), 1,24-2,20 (м, 11H, CH2CH2CH2CH2CH2, CHH), 2,57-2,86 (м, 6H, CHCH2, CH3), 4,36 (д, J=6 Гц, 2H, CH2NH), 5,26 (дд, J=6, 11 Гц, 1H, CH), 7,56-7,88 (м, 3H, Ar), 8,41 (т, J=6 Гц, 1H, CH2NH), 11,03 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 13,86, 20,92, 21,95, 23,39, 25,23, 28,31, 30,61, 30,99, 35,33, 41,57, 56,51, 119,99, 123,79, 126,51, 133,96, 138,38, 145,74, 154,53, 160,40, 169,47, 172,25, 172,60. LCMS MH=413; Анализ Вычислено для C22H28N4O4: C, 64,06; H, 6,84; N, 13,58. Найдено: C, 63,76; H, 6,68; N, 13,42.
5.14 [3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]амид циклопропанкарбоновой кислоты
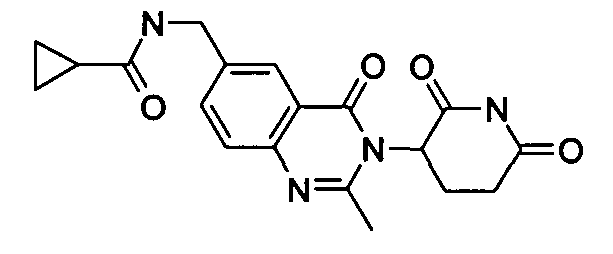
К перемешиваемой суспензии гидрохлорида 3-(6-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,51 г, 1,5 ммоль) в ацетонитриле (10 мл) добавляли циклопропанкарбонилхлорид (0,21 мл, 2,3 ммоль) и N,N-диизопропилэтиламин (0,62 мл, 3,8 ммоль). Смесь перемешивали при комнатной температуре в течение одного часа. Растворитель выпаривали и остаток очищали с помощью колоночной флеш-хроматографии (Силикагель, метанол/метиленхлорид 4%/96%), получая [3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]амид циклопроанкарбоновой кислоты в виде не совсем белого твердого вещества (233 мг, 42% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% H3PO4, с градиентом до 95/5 в течение 5 мин, выдерживалось 5 мин, 5,01 мин (98,4%); т.пл.: 281-283°С; 1H ЯМР (ДМСО-d6) δ 0,64-0,74 (м, 4H, CH2CH2 циклопропанового кольца), 1,57-1,66 (м, 1H, CH циклопропанового кольца), 2,15-2,21 (м, 1H, CH), 2,57-2,89 (м, 6H, CHCH2, CH3), 4,39 (д, J=5 Гц, 2H, CH2NH), 5,26 (дд, J=6, 11 Гц, 1H, CH), 7,57-7,89 (м, 3H, Ar), 8,68 (т, J=6 Гц, 1H, CH2NH), 11,03 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 6,31, 13,55, 20,93, 23,40, 30,61, 41,77, 56,53, 120,01, 123,78, 126,58, 134,02, 138,34, 145,78, 154,55, 160,44, 169,47, 172,62, 172,70. LCMS MH=413; Анализ Вычислено для C19H20N4O4: C, 61,95; H, 5,47; N, 15,21. Найдено: C, 61,86; H, 5,49; N, 15,04.
5.15 [3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-1,1-диметилмочевина
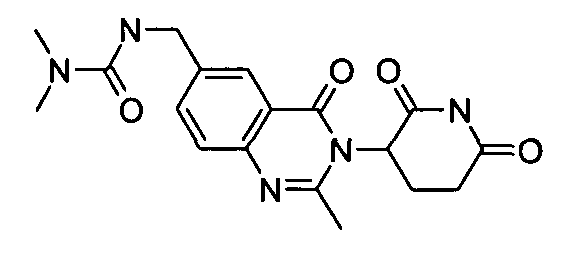
К перемешиваемой суспензии гидрохлорида 3-(6-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,50 г, 1,5 ммоль) в ацетонитриле (10 мл) добавляли диметилкарбамилхлорид (0,21 мл, 2,2 ммоль) и N,N-диизопропилэтиламин (0,62 мл, 3,8 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали и остаток очищали с помощью колоночной флеш-хроматографии (Силикагель, метанол/метиленхлорид 4%/96%), получая 3-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-1,1-диметилмочевину в виде не совсем белого твердого вещества (290 мг, 52% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% H3PO4, с градиентом до 95/5 в течение 5 мин, выдерживалось 5 мин, 4,66 мин (98,7%); т.пл.: 264-268°С; 1H ЯМР (ДМСО-d6) δ 2,14-2,20 (м, 1H, CH), 2,56-2,86 (м, 12H, N(CH3)2, CHCH2, CH3), 4,31 (д, J=5 Гц, 2H, CH2NH), 5,26 (дд, J=6, 11 Гц, 1H, CH), 7,00 (т, J=5 Гц, 1H, CH2NH), 7,54-7,89 (м, 3H, Ar), 11,03 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,95, 23,38, 30,61, 35,85, 43,20, 56,49, 119,88, 123,54, 126,30, 133,91, 139,98, 145,59, 154,27, 158,09, 160,50, 169,49, 172,62. LCMS MH=372; Анализ Вычислено для C18H21N5O4 + 0,5 H2O: C, 56,83; H, 5,83; N, 18,41. Найдено: C, 56,71; H, 5,81; N, 18,18.
5.16 2-(4-Хлорфенил)-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]ацетамид
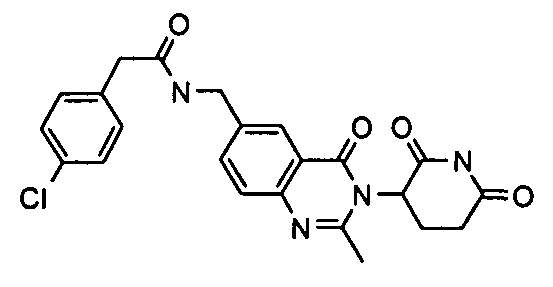
К перемешиваемому раствору (4-хлорфенил)уксусной кислоты (0,30 г, 1,8 ммоль) в DMF (8 мл) в 40°С масляной бане добавляли 1,1'-карбонилдиимидазол (0,31 г, 1,9 ммоль) и смесь перемешивали в течение одного часа. Затем добавляли гидрохлорид 3-(6-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,59 г, 1,7 ммоль) и смесь перемешивали в течение 15 минут. Растворитель выпаривали и остаток очищали с помощью колоночной флеш-хроматографии (Силикагель, метанол/метиленхлорид 4%/96%), получая 2-(4-хлорфенил)-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]ацетамид в виде белого твердого вещества (550 мг, 70% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% H3PO4, с градиентом до 95/5 в течение 5 мин, выдерживалось 5 мин, 6,00 мин (98,7%); т.пл.: 229,5-231,5°С; 1H ЯМР (ДМСО-d6) δ 2,15-2,21 (м, 1H, CHH), 2,57-2,89 (м, 6H, CHCH2, CH3), 3,50 (c, 2H, ArCH2), 4,37 (д, J=5 Гц, 2H, CH2NH), 5,26 (дд, J=6, 11 Гц, 1H, CH), 7,27-7,90 (м, 7H, Ar), 8,67 (т, J=5 Гц, 1H, CH2NH), 11,03 (c, 1H, NH; 13C ЯМР (ДМСО-d6) δ 20,92, 23,40, 30,63, 41,39, 41,87, 56,53, 120,02, 123,99, 126,57, 128,13, 130,87, 131,09, 134,03, 135,21, 137,97, 145,81, 154,61, 160,38, 169,47, 169,85, 172,61. LCMS MH=453, 455; Анализ Вычислено для C23H21N4O4Cl: C, 61,00; H, 4,67; N, 12,37; Cl, 7,83. Найдено: C, 60,88; H, 4,60; N, 12,27; Cl, 7,89.
5.17 1-[3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-3-гексилмочевина
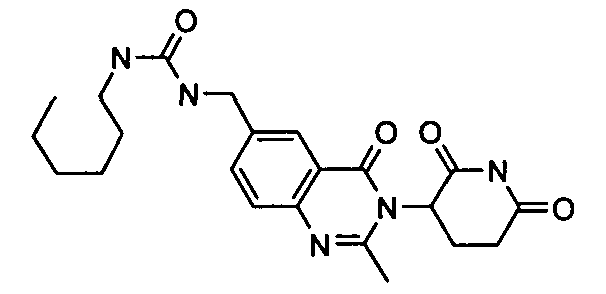
К перемешиваемой суспензии гидрохлорида 3-(6-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,50 г, 1,5 ммоль) и триэтиламина (0,29 мл, 2,1 ммоль) в ТГФ (12 мл) при 5~10°С добавляли гексилизоцианат (0,25 г, 1,9 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Смесь гасили метанолом (~1 мл) и растворитель выпаривали. Остаток очищали с помощью колоночной флеш-хроматографии (Силикагель, метанол/метиленхлорид 4%/96%), получая 1-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-3-гексилмочевину в виде не совсем белого твердого вещества (410 мг, 65% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% H3PO4, с градиентом до 95/5 в течение 5 мин, выдерживалось 5 мин, 6,05 мин (99,0%); т.пл.: 220-222°С; 1H ЯМР (ДМСО-d6) δ 0,85 (т, J=6 Гц, 3H, CH3CH2CH2), 1,24-1,38 (м, 8H, CH2CH2CH2CH2), 2,15-2,20 (м, 1H, CHH), 2,56-3,03 (м, 6H, CHCH2, CH4), 4,30 (д, J=6 Гц, 2H, ArCH2NH), 5,26 (дд, J=6, 11 Гц, 1H, CH), 5,97 (т, J=5 Гц, 1H, CH2NH), 6,40 (т, J=6 Гц, 1H, ArCH2NH), 7,55-7,89 (м, 3H, Ar), 11,02 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 13,88, 20,93, 22,05, 23,38, 26,03, 29,94, 30,63, 31,02, 39,35, 42,44, 56,51, 119,96, 123,46, 126,40, 133,81, 139,87, 145,64, 154,36, 157,99, 160,46, 169,47, 172,60. LCMS MH=428; Анализ Вычислено для C22H29N5C4 C, 61,81; H, 6,84; N, 16,38. Найдено: C, 61,50; H, 6,82; N, 16,23.
5.18 1-(4-Хлорфенил)-3-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]мочевина
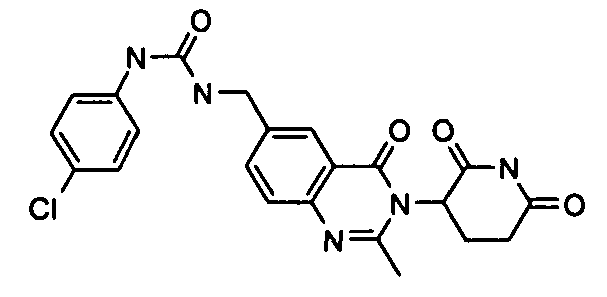
К перемешиваемой суспензии гидрохлорида 3-(6-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,47 г, 1,4 ммоль) и триэтиламина (0,27 мл, 2,0 ммоль) в ТГФ (8 мл) при 5~10°С добавляли 4-хлорфенилизоцианат (0,28 г, 1,8 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Смесь гасили метанолом (~1 мл) и растворитель выпаривали. Остаток очищали с помощью колоночной флеш-хроматографии (Силикагель, метанол/метиленхлорид 4%/96%), получая 1-(4-хлорфенил)-3-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]мочевину в виде не совсем белого твердого вещества (400 мг, 63% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% H3PO4, с градиентом до 95/5 в течение 5 мин, выдерживалось 5 мин, 6,18 мин (98,9%); т.пл.: 225-227°С; 1H ЯМР (ДМСО-d6) δ 2,15-2,20 (м, 1H, CHH), 2,56-2,91 (м, 6H, CHCH2, CH3), 4,41 (д, J=5 Гц, 2H, CH2NH), 5,26 (дд, J=6, 11 Гц, 1H, СН), 6,81 (т, J=6 Гц, 1H, CH2NH), 7,23-7,95 (м, 7H, Ar), 8,80 (c, 1H, NH), 11,02 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,93, 23,38, 30,61, 42,33, 56,54, 119,23, 120,01, 123,67, 124,57, 126,53, 128,42, 133,95, 139,05, 139,37, 145,74, 154,53, 155,09, 160,46, 169,47, 172,60. LCMS MH=454, 456; Анализ Вычислено для C22H20N5O4Cl + 0,8 H2O: C, 56,43; H, 4,65; N, 14,95; Cl, 7,57. Найдено: C, 56,45; H, 4,56; N, 14,87; Cl, 7,69.
5.19 1-[3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-3-м-толилмочевина
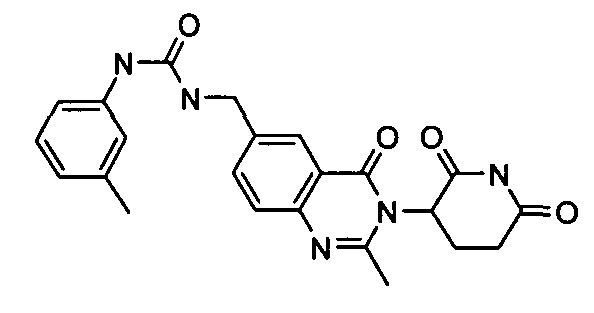
К перемешиваемой суспензии гидрохлорида 3-(6-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,50 г, 1,5 ммоль) и триэтиламина (0,29 мл, 2,1 ммоль) в ТГФ (12 мл) при 5~10°С добавляли м-толуилизоцианат (0,25 мл, 1,9 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Смесь гасили метанолом (~1 мл) и растворитель выпаривали. Остаток очищали с помощью колоночной флеш-хроматографии (Силикагель, метанол/метиленхлорид 4%/96%), получая 1-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-3-м-толилмочевину в виде не совсем белого твердого вещества (437 мг, 68% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% H3PO4, с градиентом до 95/5 в течение 5 мин, выдерживалось 5 мин, 5,95 мин (99,0%); т.пл.: 200-202°С; 1H ЯМР (ДМСО-d6) δ 2,07-2,24 (м, 4H, ArCH3, CHH), 2,56-2,88 (м, 6H, CHCH2, CH3), 4,40 (д, J=5 Гц, 2H, CH2NH), 5,26 (дд, J=6, 11 Гц, 1H, CH), 6,70-7,95 (м, 8H, Ar и CH2NH), 8,54 (c, 1H, NH), 11,01 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,92, 21,19, 23,39, 30,61, 42,30, 56,53, 114,93, 118,27, 120,00, 121,87, 123,63, 126,53, 128,44, 133,94, 137,70, 139,23, 140,26, 145,73, 154,50, 155,22, 160,46, 169,48, 172,61. LCMS MH=434; Анализ Вычислено для C23H23N5O4 + 1,4 H2O: C, 60,23; H, 5,67; N, 15,27. Найдено: C, 60,18; H, 5,44; N, 15,09.
5.20 1-[3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-3-(4-трифторметоксифенил)мочевина
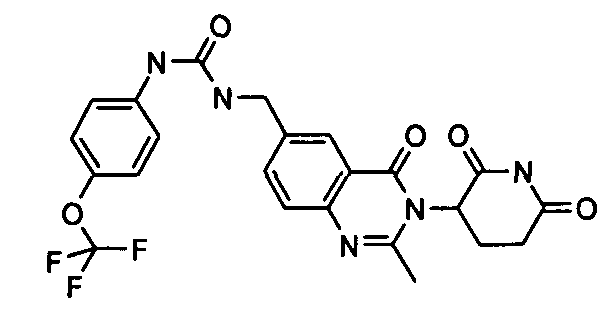
К перемешиваемой суспензии гидрохлорида 3-(6-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,49 г, 1,5 ммоль) и триэтиламина (0,28 мл, 2,1 ммоль) в ТГФ (12 мл) при 5~10°С добавляли трифторметоксифенилизоцианат (0,29 мл, 1,9 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Смесь гасили метанолом (~1 мл) и растворитель выпаривали. Остаток очищали с помощью колоночной флеш-хроматографии (Силикагель, метанол/метиленхлорид 4%/96%), получая 1-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-3-(4-трифторметоксифенил)мочевину в виде не совсем белого твердого вещества (490 мг, 67% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% H3PO4, с градиентом до 95/5 в течение 5 мин, выдерживалось 5 мин, 6,47 мин (98,6%); т.пл.: 201-203°С; 1H ЯМР (ДМСО-d6) δ 2,15-2,20 (м, 1H, CHH), 2,56-2,90 (м, 6H, CHCH2, CH3), 4,42 (д, J=5 Гц, 2H, CH2NH), 5,26 (дд, J=6, 11 Гц, 1H, CH), 6,84 (т, J=6 Гц, 1H, CH2NH), 7,21-7,96 (м, 7H, Ar), 8,88 (c, 1H, NH), 11,02 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,93, 23,39, 30,61, 42,33, 56,53, 118,81, 120,01, 120,17 (кв, JC-F=255 Гц), 121,54, 123,66, 126,54, 133,93, 139,04, 139,69, 142,08, 145,76, 154,52, 155,12, 160,46, 169,48, 172,60. LCMS MH=504; Анализ Вычислено для C23H20N5O5F3 + 0,2 H2O: C, 54,48; H, 4,06; N, 13,81; F, 11,24. Найдено: C, 54,25; H, 4,00; N, 13,59; F, 11,24.
5.21 N-[3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-4-трифторметилсульфанилбензамид
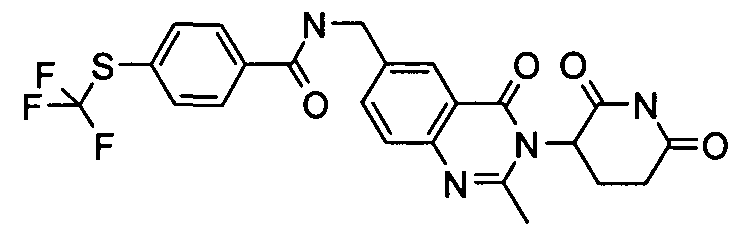
К перемешиваемой суспензии гидрохлорида 3-(6-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,47 г, 1,4 ммоль) в ацетонитриле (10 мл) добавляли 4-трифторметилтио-бензоилхлорид (0,35 мл, 2,1 ммоль) и N,N-диизопропилэтиламин (0,58 мл, 3,5 ммоль). Смесь перемешивали при комнатной температуре в течение одного часа. Растворитель выпаривали и остаток очищали с помощью колоночной флеш-хроматографии (Силикагель, метанол/метиленхлорид 4%/96%), получая N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-4-трифторметил-сульфанилбензамид в виде не совсем белого твердого вещества (470 мг, 66% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% H3PO4, с градиентом до 95/5 в течение 5 мин, выдерживалось 5 мин, 6,63 мин (96,8%); т.пл.: 169-171°С; 1H ЯМР (ДМСО-d6) δ 2,15-2,20 (м, 1H, CHH), 2,56-2,86 (м, 6H, CHCH2, CH3), 4,60 (д, J=5 Гц, 2H, CH2NH), 5,26 (дд, J=6, 11 Гц, 1H, CH), 7,59-8,03 (м, 7H, Ar), 9,35 (т, J=5 Гц, 1H, CH2NH), 11,02 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,89, 23,41, 30,60, 42,38, 56,52, 120,01, 123,90, 126,33, 126,64, 128,64, 129,46 (кв, JC-F=307 Гц), 134,09, 135,91, 136,69, 137,86, 145,85, 154,64, 160,41, 165,28, 169,47, 172,62. LCMS MH=505; Анализ Вычислено для C23H19N4O4F3S +0,8 H2O: C, 53,24; H, 4,00; N, 10,80; F, 10,98; S, 6,18. Найдено: C, 53,17; H, 3,83; N, 10,60; F, 10,74; S, 6,14.
5.22 1-(3-Хлор-4-метилфенил)-3-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]мочевина
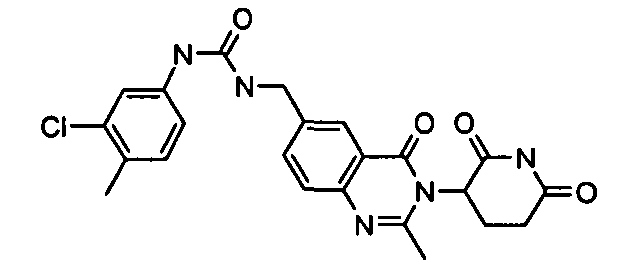
К перемешиваемой суспензии гидрохлорида 3-(6-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,46 г, 1,4 ммоль) и триэтиламина (0,27 мл, 1,9 ммоль) в ТГФ (10 мл) при 5~10°С добавляли 3-хлор-4-метилфенилизоцианат (0,24 мл, 1,8 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Смесь гасили метанолом (~1 мл) и растворитель выпаривали. Остаток очищали с помощью колоночной флеш-хроматографии (Силикагель, метанол/метиленхлорид 4%/96%), получая 1-(3-хлор-4-метилфенил)-3-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]мочевину в виде не совсем белого твердого вещества (450 мг, 70% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% H3PO4, с градиентом до 95/5 в течение 5 мин, выдерживалось 5 мин, 6,38 мин (98,4%); т.пл.: 186-188°С; 1H ЯМР (ДМСО-d6) δ 2,15-2,23 (м, 4H, CHH и CH3Ar), 2,56-2,86 (м, 6H, CHCH2, CH3), 4,40 (д, J=6 Гц, 2H, CH2NH), 5,26 (дд, J=6, 11 Гц, 1H, CH), 6,81 (т, J=5 Гц, 1H, CH2NH), 7,11-7,95 (м, 6H, Ar), 8,75 (c, 1H, NH), 11,02 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 18,71, 20,93, 23,39, 30,61, 42,34, 56,53, 116,45, 117,66, 120,01, 123,67, 126,54, 127,39, 130,99, 132,96, 133,95, 139,05, 139,58, 145,76, 154,51, 155,08, 160,47, 169,47, 172,60. LCMS МН=468, 470; Анализ Вычислено для C23H22N5O4Cl + 0,6 H2O: C, 57,71; H, 4,88; N, 14,63; Cl, 7,41. Найдено: C, 57,63; H, 4,96; N, 14,50; Cl, 7,64.
5.23 4-Хлор-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]бензамид
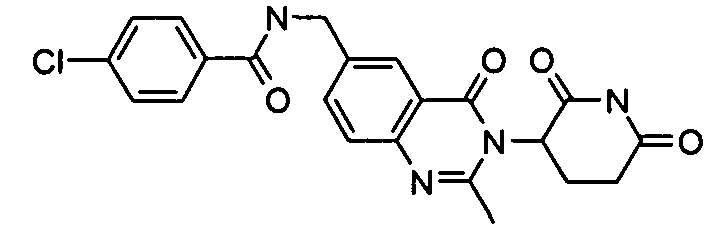
К перемешиваемой суспензии гидрохлорида 3-(6-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,54 г, 1,6 ммоль) в ацетонитриле (10 мл) добавляли 4-дихлорбензоилхлорид (0,31 мл, 2,4 ммоль) и N,N-диизопропилэтиламин (0,66 мл, 4,0 ммоль). Смесь перемешивали при комнатной температуре в течение 30 минут. Растворитель выпаривали и остаток очищали с помощью колоночной флеш-хроматографии (Силикагель, метанол/метиленхлорид 4%/96%), получая 4-хлор-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]бензамид в виде белого твердого вещества (298 мг, 42% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% H3PO4, с градиентом до 95/5 в течение 5 мин, выдерживалось 5 мин, 6,00 мин (99,0%); т.пл.: 267-269°С; 1H ЯМР (ДМСО-d6) δ 2,15-2,18 (м, 1H, CHH), 2,57-2,85 (м, 6H, CHCH2, CH3), 4,59 (д, J=5 Гц, 2H, CH2NH), 5,26 (дд, J=6, 11 Гц, 1H, CH), 7,54-7,95 (м, 7H, Ar), 9,24 (т, J=5 Гц, 1H, CH2NH), 11,02 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,91, 23,40, 30,60, 42,33, 56,52, 120,01, 123,89, 126,62, 128,44, 129,15, 132,84, 134,09, 136,16, 138,02, 145,83, 154,60, 160,43, 165,23, 169,45, 172,60. LCMS МН=439, 441; Анализ Вычислено для C22H19N4O4Cl + 0,3 H2O: C, 59,48; H, 4,45; N, 12,61; Cl, 7,98. Найдено: C, 59,32; H, 4,10; N, 12,50; Cl, 7,99.
5.24 N-[3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-3-трифторметилбензамид
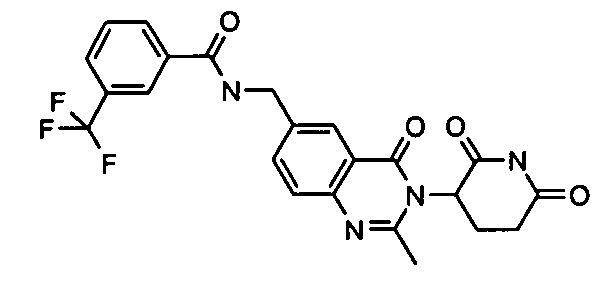
К перемешиваемому раствору 3-трифторметилбензойной кислоты (0,30 г, 1,6 ммоль) в DMF (8 мл) в 40°С масляной бане добавляли 1,1'-карбонилдиимидазол (0,28 г, 1,7 ммоль) и смесь перемешивали в течение одного часа. Затем добавляли гидрохлорид 3-(6-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,53 г, 1,6 ммоль) и смесь перемешивали в течение 15 минут. Растворитель выпаривали и остаток очищали с помощью колоночной флеш-хроматографии (Силикагель, метанол/метиленхлорид 4%/96%), получая N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-3-трифторметилбензамид в виде не совсем белого твердого вещества (430 мг, 59% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% H3PO4, с градиентом до 95/5 в течение 5 мин, выдерживалось 5 мин, 6,20 мин (98,5%); т.пл.: 220-222°С; 1H ЯМР (ДМСО-d6) δ 2,15-2,20 (м, 1H, CHH), 2,56-2,91 (м, 6H, CHCH2, CH3), 4,62 (д, J=5 Гц, 2H, CH2NH), 5,26 (дд, J=6, 11 Гц, 1H, CH), 7,59-8,25 (м, 7H, Ar), 9,42 (т, J=5 Гц, 1H, CH2NH), 11-02 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,90, 23,41, 30,60, 42,45, 56,53, 120,02, 123,79 (кв, JC-F=11 Гц), 123,79 (д, JC-F=3 Гц), 123,95 (кв, JC-F=275 Гц), 124,04, 126,67, 127,96 (д, JC-F=3 Гц), 129,19 (д, JC-F=32 Гц), 129,74, 131,38, 134,18, 134,88, 137,81, 145,88, 154,65, 160,43, 164,73, 169,45, 172,59. LCMS МН=473; Анализ Вычислено для C23H19N4O4F3 + 0,3 H2O: C, 57,81; H, 4,13; N, 11,73; F, 11,93. Найдено: C, 57,77; H, 4,11; N, 11,69; F, 11,97.
5.25 N-[3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-4-трифторметоксибензамид
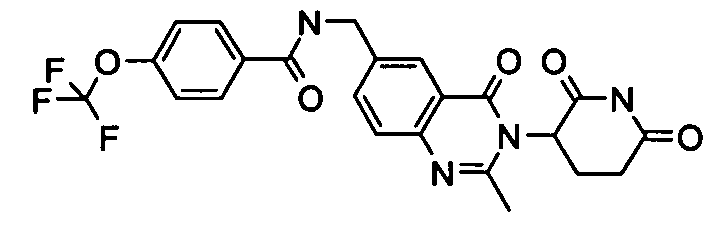
К перемешиваемой суспензии гидрохлорида 3-(6-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,49 г, 1,4 ммоль) в ацетонитриле (10 мл) добавляли 4-трифторметоксибензоилхлорид (0,34 мл, 2,2 ммоль) и N,N-диизопропилэтиламин (0,63 мл, 3,6 ммоль). Смесь перемешивали при комнатной температуре в течение одного часа. Растворитель выпаривали и остаток очищали с помощью колоночной флеш-хроматографии (Силикагель, метанол/метиленхлорид 4%/96%), получая N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-4-трифторметоксибензамид в виде не совсем белого твердого вещества (500 мг, 71% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% H3PO4, с градиентом до 95/5 в течение 5 мин, выдерживалось 5 мин, 6,40 мин (99,5%); т.пл.: 165-167°С; 1H ЯМР (ДМСО-d6) δ 2,15-2,20 (м, 1H, CHH), 2,56-2,88 (м, 6H, CHCH2, CH3), 4,60 (д, J=5 Гц, 2H, CH2NH), 5,26 (дд, J=6, 11 Гц, 1H, CH), 7,458-8,04 (м, 7H, Ar), 9,28 (т, J=5 Гц, 1H, CH2NH), 11,02 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,90, 23,40, 30,60, 42,35, 56,53, 119,93 (кв, JC-F=257 Гц), 120,01, 120,67, 123,87, 126,62, 129,56, 133,19, 134,17, 134,07, 137,97, 145,83, 150,35, 154,61, 160,43, 165,06, 169,45, 172,59. LCMS МН=489; Анализ Вычислено для C23H19N4O5F3 + 1,1 H2O: C, 54,36; H, 4,20; N, 11,02; F, 11,21. Найдено: C, 54,40; H, 3,89; N, 10,67; F, 11,06.
5.26 3,4-Дихлор-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]бензамид
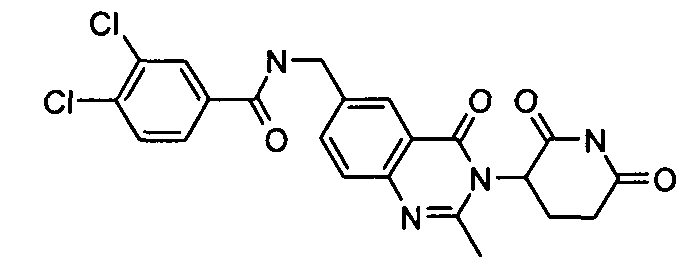
К перемешиваемой суспензии гидрохлорида 3-(6-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,45 г, 1,4 ммоль) в ацетонитриле (10 мл) добавляли 3,4-дихлорбензоилхлорид (0,34 г, 1,6 ммоль) и N,N-диизопропилэтиламин (0,54 мл, 3,2 ммоль). Смесь перемешивали при комнатной температуре в течение 15 минут. Растворитель выпаривали и остаток очищали с помощью колоночной флеш-хроматографии (Силикагель, метанол/метиленхлорид 4%/96%), получая 3,4-дихлор-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]бензамид в виде не совсем белого твердого вещества (290 мг, 46% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% H3PO4, с градиентом до 95/5 в течение 5 мин, выдерживалось 5 мин, 6,45 мин (99,6%); т.пл.: 177-179°С; 1H ЯМР (ДМСО-d6) δ 2,16-2,18 (м, 1H, CHH), 2,56-2,84 (м, 6H, CHCH2, CH3), 4,59 (д, J=5 Гц, 2H, CH2NH), 5,26 (дд, J=5, 9 Гц, 1H, CH), 7,58-8,14 (м, 6H, Ar), 9,34 (т, J=5 Гц, 1H, CH2NH), 11,02 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,91, 23,41, 30,61, 42,47, 56,54, 120,01, 124,04, 126,66, 127,56, 129,20, 130,77, 131,32, 134,17, 134,37, 137,71, 145,88, 154,65, 160,42, 164,00, 169,45, 172,60. LCMS МН=473, 475; Анализ Вычислено для C22H18N4O4Cl2+ 1,0 CH2Cl2: C, 53,78; H, 4,10; N, 11,40; Cl, 14,43. Найдено: C, 53,44; H, 4,11; N, 11,27; Cl, 14,80.
5.27 N-[3-(2,6-Диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-4-трифторметилбензамид
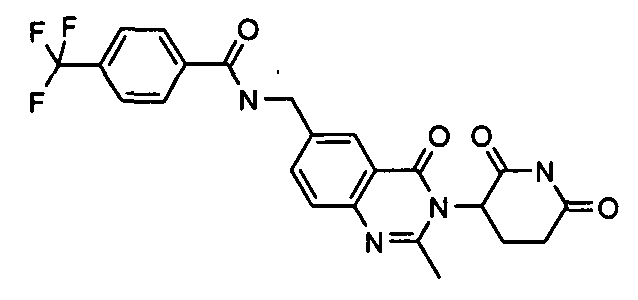
К перемешиваемому раствору 4-трифторметилбензойной кислоты (0,30 г, 1,6 ммоль) в ДМФ (8 мл) в 40°С масляной бане добавляли 1,1'-карбонилдиимидазол (0,29 г, 1,8 ммоль) и смесь перемешивали в течение одного часа. Затем добавляли гидрохлорид 3-(6-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (0,54 г, 1,6 ммоль) и смесь перемешивали в течение 15 минут. Растворитель выпаривали и остаток очищали с помощью колоночной флеш-хроматографии (Силикагель, метанол/метиленхлорид 4%/96%), получая N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-4-трифторметилбензамид в виде не совсем белого твердого вещества (500 мг, 67% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% H3PO4, с градиентом до 95/5 в течение 5 мин, выдерживалось 5 мин, 6,33 мин (99,1%); т.пл.: 221-223°С; 1H ЯМР (ДМСО-d6) δ 2,14-2,20 (м, 1H, CHH), 2,56-2,88 (м, 6H, CHCH2, CH3), 4,62 (д, J=5 Гц, 2H, CH2NH), 5,26 (дд, J=6, 11 Гц, 1H, CH), 7,59-8,11 (м, 7H, Ar), 9,40 (т, J=5 Гц, 1H, CH2NH), 11,02 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,90, 23,41, 30,60, 42,41, 56,53, 120,03, 123,90 (кв, JC-F=253 Гц), 123,95, 125,36 (д, JC-F=3 Гц), 125,45 (д, JC-F=3 Гц), 126,65, 128,14, 131,23 (д, JC-F=31 Гц), 134,11, 137,83, 145,87, 154,64, 160,42, 165,12, 169,45, 172,59. LCMS МН=473; Анализ Вычислено для C23H19N4O4F3: C, 58,48; H, 4,05; N, 11,86; F, 12,06. Найдено: C, 58,36; H, 3,96; N, 11,75; F, 11,84.
5.28 3-(2,7-Диметил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
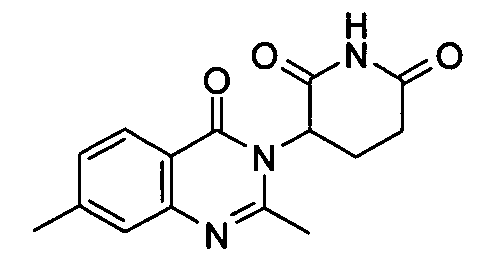
К перемешиваемой смеси 2-амино-4-метилбензойной кислоты (2,0 г, 13 ммоль) и имидазола (1,1 г, 16 ммоль) в ацетонитриле (20 мл) при комнатной температуре добавляли ацетилхлорид (1,1 мл, 16 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли гидрохлорид 3-аминопиперидин-2,6-диона (2,2 г, 13 ммоль), имидазол (2,0 г, 30 ммоль) и трифенилфосфит (4,2 мл, 16 ммоль) и ее нагревали до температуры кипения с обратным холодильником в течение 22 часов. К смеси добавляли воду (60 мл). Суспензию фильтровали и промывали водой (2×50 мл), этилацетатом (2×50 мл) и водой (50 мл), получая 3-(2,7-диметил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (2,52 г, 67% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% H3PO4, 5,13 мин (99,9%); т.пл.: 305°С (разложение); 1H ЯМР (ДМСО-d6) δ 2,08-2,24 (м, 1H, CHH), 2,45 (c, 3H, CH3), 2,56-2,75 (м, 5H, CH3, 2CHH), 2,81-2,91 (м, 1H, CHH), 5,24 (дд, J=6, 11 Гц, 1H, NCH), 7,32 (дд, J=1, 8 Гц 1H, Ar), 7,43 (c, 1H, Ar), 7,91 (д, J=8 Гц, 1H, Ar), 11,00 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,00, 21,35, 23,45, 30,61, 56,43, 117,94, 125,80, 126,10, 127,97, 145,21, 146,98, 154,96, 160,34, 169,56, 172,62; LCMS: МН=286; Анализ Вычислено для C15H12N3O3: C, 63,15; H, 5,21; N, 14,73. Найдено: C, 63,14; H, 5,21; N, 14,76.
5.29 3-(7-Фтор-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
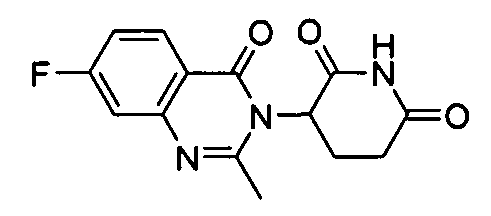
К перемешиваемой смеси 2-амино-4-фторбензойной кислоты (2,5 г, 16 ммоль) и имидазола (1,3 г, 19 ммоль) в ацетонитриле (25 мл) при комнатной температуре добавляли ацетилхлорид (1,4 мл, 19 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли гидрохлорид 3-аминопиперидин-2,6-диона (2,7 г, 16 ммоль), имидазол (2,4 г, 36 ммоль) и трифенилфосфит (5,1 мл, 19 ммоль) и ее нагревали до температуры кипения с обратным холодильником в течение 22 часов. К смеси добавляли воду (60 мл). Суспензию фильтровали и промывали водой (2×50 мл), этилацетатом (2×50 мл) и водой (50 мл), получая 3-(7-фтор-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (2,5 г, 52% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 25/75 CH3CN/0,1% H3PO4, 3,83 мин (100%); т.пл.: 243-245°С; 1H ЯМР (ДМСО-d6) δ 2,15-2,22 (м, 1H, CHH), 2,58-2,71 (м, 5H, CH3, 2CHH), 2,79-2,86 (м, 1H, CHH), 5,28 (дд, J=5, 11 Гц, 1H, NCH), 7,34-7,44 (м, 2H, Ar), 8,10 (дд, J=6, 9 Гц, 1H, Ar), 11,05 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,89, 23,50, 30,58, 56,59, 111,62 (д, JC-F=22 Гц), 115,26 (д, Jc-F=24 Гц), 117,32, 129,19 (д, JC-F=11 Гц), 148,97 (д, JC-F=13 Гц), 156,65, 159,77, 165,83 (д, JC,F=252 Гц), 169,41, 172,59; LCMS: МН=290; Анализ Вычислено для C14H12N3O3F: C, 58,13; H, 4,18; N, 14,53; F, 6,57. Найдено: C, 58,09; H, 4,08; N, 14,42; F, 6,72.
5.30 3-(7-Хлор-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
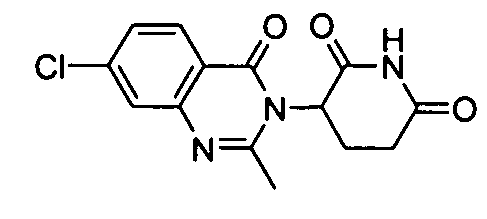
К перемешиваемой смеси 2-амино-4-хлорбензойной кислоты (5,0 г, 29 ммоль) и имидазола (2,4 г, 35 ммоль) в ацетонитриле (50 мл) при комнатной температуре добавляли ацетилхлорид (2,5 мл, 35 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли гидрохлорид 3-аминопиперидин-2,6-диона (4,8 г, 29 ммоль), имидазол (4,4 г, 64 ммоль) и трифенилфосфит (8,4 мл, 32 ммоль) и ее нагревали до температуры кипения с обратным холодильником в течение 22 часов. Суспензию фильтровали и промывали ацетонитрилом (50 мл), водой (2×50 мл), получая 3-(7-хлор-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (6,5 г, 73% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 4,36 мин (99,9%); т.пл.: 291-293°С; 1H ЯМР (ДМСО-d6) δ 2,16-2,23 (м, 1H, CHH), 2,59-2,72 (м, 5H, CH3, 2CHH), 2,79-2,92 (м, 1H, CHH), 5,29 (дд, J=5, 11 Гц, 1H, NCH), 7,53 (дд, J=2, 9 Гц, 1H, Ar), 7,69 (д, J=8 Гц, 1H, Ar), 8,03 (д, J=8 Гц, 1H, Ar), 11,07 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,84, 23,53, 30,58, 56,65, 19,06, 125,70, 126,91, 128,07, 139,30, 147,89, 156,74, 159,89, 169,35, 172,58; LCMS: МН=306, 308; Анализ Вычислено для C14H12N3O3Cl: C, 55,00; H, 3,96; N, 13,74; Cl, 11,60. Найдено: C, 55,24; H, 3,78; N, 13,74; Cl, 12,01.
5.31 3-(7-Бром-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
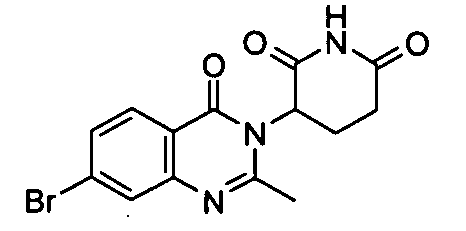
К перемешиваемой смеси 2-амино-4-бромбензойной кислоты (2,0 г, 9,3 ммоль) и имидазола (0,8 г, 11 ммоль) в ацетонитриле (20 мл) при комнатной температуре добавляли ацетилхлорид (0,8 мл, 11 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли гидрохлорид 3-аминопиперидин-2,6-диона (1,5 г, 9,3 ммоль), имидазол (1,4 г, 20 ммоль) и трифенилфосфит (2,9 мл, 11 ммоль) и ее нагревали до температуры кипения с обратным холодильником в течение 22 часов. К смеси добавляли воду (30 мл). Суспензию фильтровали и промывали водой (2×50 мл), этилацетатом (2×50 мл) и водой (50 мл), получая 3-(7-бром-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (2,4 г, 75% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% H3PO4, 18,65 мин (98,9%); т.пл.: 315-317°С; 1H ЯМР (ДМСО-d6) δ 2,08-2,22 (м, 1H, CHH), 2,62-2,79 (м, 5H, CH3, 2CHH), 2,80-2,91 (м, 1H, CHH), 5,28 (дд, J=6, 11 Гц, 1H, NCH), 7,66 (дд, J=2, 8 Гц, 1H, Ar), 7,84 (д, J=2 Гц 2H, Ar), 7,95 (д, J=8 Гц, 1H, Ar), 11,05 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,83, 23,53, 24,02, 30,58, 56,67, 119,36, 128,06, 128,29, 128,80, 129,67, 147,93, 156,69, 160,02, 169,33, 172,57; LCMS: МН=350, 352; Анализ Вычислено для C14H12N3O3Br: C, 48,02; H, 3,45; N, 12,00; Br, 22,82. Найдено: C, 47,94; H, 3,17; N, 11,85; Br, 20,65.
5.32 3-(2-Метил-4-оксо-7-трифторметил-4Н-хиназолин-3-ил)пиперидин-2,6-дион
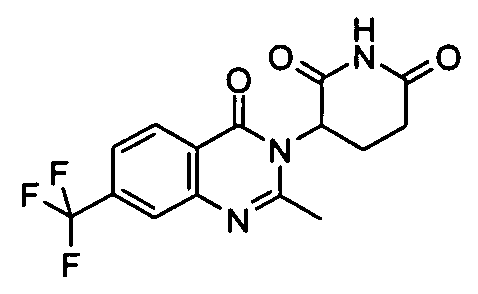
К перемешиваемой смеси 2-амино-4-(трифторметил)бензойной кислоты (3,0 г, 15 ммоль) и имидазола (1,2 г, 18 ммоль) в ацетонитриле (30 мл) при комнатной температуре добавляли ацетилхлорид (1,3 мл, 18 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли гидрохлорид 3-аминопиперидин-2,6-диона (2,4 г, 15 ммоль), имидазол (2,2 г, 32 ммоль) и трифенилфосфит (4,6 мл, 18 ммоль) и ее нагревали до температуры кипения с обратным холодильником в течение 22 часов. К смеси добавляли воду (100 мл). Суспензию фильтровали и промывали водой (2×50 мл), этилацетатом (2×50 мл), бикарбонатом натрия (насыщенным, 50 мл) и водой (50 мл), получая белое твердое вещество, которое растворяли в ДМСО (10 мл). К раствору добавляли воду (3 мл), получая суспензию. Суспензию фильтровали и промывали ДМСО (2 мл), получая белое твердое вещество. Твердое вещество перемешивали в воде (50 мл) при 60°С в течение 2 часов, затем при комнатной температуре в течение ночи. Суспензию фильтровали и промывали водой (2×50 мл), получая 3-(2-метил-4-оксо-7-трифторметил-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (1,17 г, 24% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 8,14 мин (99,9%); т.пл.: 277-279°С; 1H ЯМР (ДМСО-d6) δ 2,18-2,25 (м, 1H, CHH), 2,59-2,74 (м, 5H, CH2, 2CHH), 2,81-2,88 (м, 1H, CHH), 5,34 (дд, J=6, 11 Гц, 1H, NCH), 7,80 (дд, J=2, 8 Гц, 1H, Ar), 7,96 (c, 1H, Ar), 8,24 (д, J=8 Гц, 1H, Ar), 11,09 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,73, 23,54, 30,57, 56,82, 122,30 (кв, JC-F=3 Гц), 122,99, 123,45 (кв, JC-F=273 Гц), 123,74 (кв, Jc-F=4 Гц), 127,85, 134,22 (кв, JC-F=32 Гц), 146,84, 156,98, 159,80, 169,24, 172,56; LCMS: МН=340; Анализ Вычислено для C15H12N3O3F3: C, 53,10; H, 3,57; N, 12,39; F, 16,80. Найдено: C, 52,55; H, 3,42; N, 12,21; F, 17,18.
5.33 3-(7-Фтор-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
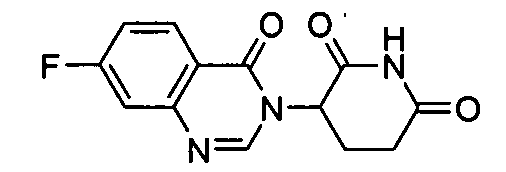
Стадия 1: Смесь 2-амино-4-фторбензойной кислоты (2,5 г, 16 ммоль) и CDI (2,4 г, 15 ммоль) в ацетонитриле (30 мл) перемешивали при комнатной температуре в течение 1,5 часов. К суспензии добавляли гидрохлорид 3-аминопиперидин-2,6-диона (2,4 г, 15 ммоль) и бикарбонат натрия (1,6 г, 19 ммоль) и смесь нагревали при 50°С в течение 21 часа. Суспензия охлаждалась до комнатной температуры в течение 1 часа. Суспензию фильтровали и промывали ацетонитрилом (5 мл) и водой (2×20 мл). Твердое вещество перемешивали в метаноле (15 мл) в течение ночи. Суспензию фильтровали и промывали метанолом (15 мл), получая 2-амино-N-(2,6-диоксопиперидин-3-ил)-4-фторбензамид в виде не совсем белого твердого вещества (1,9 г, 45% выход): 1H ЯМР (ДМСО-d6) δ 1,91-1,96 (м, 1H, CHH), 2,04-2,18 (м, 1H, CHH), 2,50-2,56 (м, 1H, CHH), 2,73-2,85 (м, 1H, CHH), 4,67-4,76 (м, 1H, NCH), 6,35 (дт, J=2, 9 Гц, 1H, Ar), 6,48 (дд, J=2, 12 Гц, 1H, Ar), 6,76 (ушир.с, 2H, NH2), 7,58 (дд, J=7, 8 Гц, 1H, Ar), 8,50 (д, J=8 Гц, 1H, NH), 10,84 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 24,06, 30,91, 48,98, 101,30 (д, JC-F=23 Гц), 101,60 (д, JC-F=22 Гц), 110,60, 130,66 (д, JC-F=11 Гц), 152,16 (д, JC-F=12 Гц), 164,46 (д, JC-F=246 Гц), 167,80, 172,30, 172,94.
Стадия 2: Раствор 2-амино-N-(2,6-диоксопиперидин-3-ил)-4-фторбензамида (0,9 г, 3,4 ммоль) и триметилортоформиата (4 мл) и п-толуолсульфоновой кислоты (110 мг) нагревали до 160°С в микроволновой печи в течение 15 минут. К смеси добавляли метанол (10 мл) и смесь перемешивали в течение 10 минут. Суспензию фильтровали и промывали метанолом, получая 3-(7-фтор-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде не совсем белого твердого вещества (650 мг, 70% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 2,45 мин (96,1%); т.пл.: 296-298°С; 1H ЯМР (ДМСО-d6) δ 2,13-2,19 (м, 1H, CHH), 2,63-2,73 (м, 2H, 2CHH), 2,82-2,93 (м, 1H, CHH), 5,50 (ушир, 1H, NCH), 7,46 (дт, J=3, 9 Гц, 1H, Ar), 7,53 (дд, J=3, 10 Гц, 1H, Ar), 8,22 (дд, J=6, 9 Гц, 1H, Ar), 8,42 (c, 1H, CH), 11,18 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 22,45, 30,88, 56,43, 112,3 (д, JC-F=22 Гц), 115,91 (д, JC-F=23 Гц), 118,38, 129,32 (д, JC-F=11 Гц), 148,71, 149,65 (д, JC-F=14 Гц), 159,00, 165,70 (д, JC-F=252 Гц), 169,76, 172,41; LCMS: МН=276; Анализ Вычислено для C13H10N3O3F: C, 56,73; H, 3,66; N, 15,27. Найдено: C, 56,39; H, 3,60; N, 15,16.
5.34 3-(7-Метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
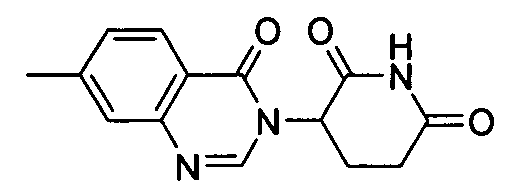
Стадия 1: Смесь 2-амино-4-метилбензойной кислоты (2,0 г, 13 ммоль) и CDI (2,0 г, 12 ммоль) в ацетонитриле (20 мл) перемешивали при комнатной температуре в течение 1,5 часов. К суспензии добавляли гидрохлорид 3-аминопиперидин-2,6-диона (2,0 г, 12 ммоль) и бикарбонат натрия (1,3 г, 16 ммоль) и смесь нагревали при 50°С в течение 21 часа. Суспензия охлаждалась до комнатной температуры в течение 1 часа. Суспензию фильтровали и промывали водой (50 мл) и этилацетатом (20 мл). Твердое вещество сушили в вакуумной печи в течение ночи, получая 2-амино-N-(2,6-диоксопиперидин-3-ил)-4-метилбензамид в виде белого твердого вещества (2,2 г, 69% выход): 1H ЯМР (ДМСО-d6) δ 1,90-1,96 (м, 1H, CHH), 2,05-2,14 (м, 1H, CHH), 2,18 (c, 3H, CH3), 2,49-2,55 (м, 1H, CHH), 2,72-2,84 (м, 1H, CHH), 4,67-4,75 (м, 1H, NCH), 6,36 (дд, J=2, 8 Гц, 1H, Ar), 6,43 (ушир, 2H, NHH, Ar), 6,51 (c, 1H, NHH), 7,43 (д, J=8 Гц, 1H, Ar), 8,38 (д, J=8 Гц, 1H, NH), 10,83 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,05, 24,21, 30,99, 48,97, 111,26, 115,74, 116,48, 128,09, 141,71, 149,96, 168,54, 172,50, 173,04; LCMS: МН=262.
Стадия 2: Раствор 2-амино-N-(2,6-диоксопиперидин-3-ил)-4-метилбензамида (1,0 г, 3,8 ммоль) и триметилортоформиата (10 мл) и п-толуолсульфоновой кислоты (250 мг) нагревали до 160°С в микроволновой печи в течение 30 минут. Суспензию фильтровали и промывали метанолом (20 мл), водой (20 мл) и метанолом (20 мл), получая 3-(7-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде не совсем белого твердого вещества (880 мг, 85% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% H3PO4, 5,14 мин (97,1%); т.пл.: 313-315°С; 1H ЯМР (ДМСО-d6) δ 2,11-2,18 (м, 1H, CHH), 2,48 (c, 3H, CH3), 2,61-2,74 (м, 2H, 2CHH), 2,82-2,92 (м, 1H, CHH), 5,46 (ушир, 1H, NCH), 7,41 (дд, J=1, 8 Гц, 1H, Ar), 7,53 (c, 1H, Ar), 8,03 (д, J=8 Гц, 1H, Ar), 8,33 (c, 1H, CH), 11,15 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,23, 22,51, 30,91, 56,74, 118,95, 125,93, 126,74, 128,66, 145,27, 147,35, 147,59, 159,54, 169,88, 172,44; LCMS: МН=272; Анализ Вычислено для C14H13N3O3 + 0,1 H2O: C, 61,58; H, 4,87; N, 15,39. Найдено: C, 61,41; H, 4,87; N, 15,15.
5.35 3-(7-Амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
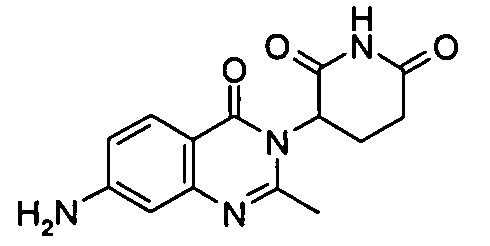
Стадия 1: К перемешиваемой смеси 2-амино-4-нитробензойной кислоты (5,0 г, 28 ммоль) и имидазола (2,2 г, 33 ммоль) в ацетонитриле (50 мл) при комнатной температуре добавляли ацетилхлорид (2,3 мл, 33 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли гидрохлорид 3-аминопиперидин-2,6-диона (4,5 г, 28 ммоль), имидазол (4,1 г, 60 ммоль) и трифенилфосфит (8,7 мл, 33 ммоль) и ее нагревали до температуры кипения с обратным холодильником в течение 22 часов. К смеси добавляли воду (60 мл). Суспензию фильтровали и промывали водой (2×50 мл), этилацетатом (2×50 мл) и водой (50 мл), получая 3-(2-метил-7-нитро-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде не совсем белого твердого вещества (4,8 г, 55% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% H3PO4, 5,69 мин (95,4%); 1H ЯМР (ДМСО-d6) δ 2,15-2,25 (м, 1H, CHH), 2,59-2,69 (м, 2H, 2CHH), 2,70 (c, 3H, CH3), 2,79-2,87 (м, 1H, CHH), 5,35 (дд, J=6, 12 Гц, 1H, NCH), 8,20-8,29 (м, 2H, Ar), 8,34 (д, J=2 Гц, 1H, Ar), 11,10 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,60, 23,53, 30,49, 56,85, 120,26, 121,58, 124,35, 128,30, 147,08, 151,30, 157,61, 159,52, 160,09, 172,48; LCMS: МН=317.
Стадия 2: Суспензию 3-(2-метил-7-нитро-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (4,8 г, 13 ммоль) и 20% Pd(OH)2/C (1,0 г) в циклогексане (15 мл) и DMF (60 мл) нагревали в 125°С масляной бане в течение ночи. Суспензию фильтровали через Целитную подушку и промывали DMF (30 мл). К фильтрату добавляли воду (150 мл), получая суспензию. Суспензию фильтровали и промывали водой (50 мл), получая 3-(7-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде не совсем белого твердого вещества (3,07 г, 71% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 5/95 градиент 95/5 в течение 5 мин. CH3CN/0,1% H3PO4, 4,08 мин (97,3%) [образец растворялся в 0,1% H3PO4]; т.пл.: 305-307°С; 1H ЯМР (ДМСО-d6) δ 2,05-2,16 (м, 1H, CHH), 2,53 (c, 3H, CH3), 2,58-2,69 (м, 2H, 2CHH), 2,75-2,86 (м, 1H, CHH), 5,10 (дд, J=6, 11 Гц, 1H, NCH), 6,11 (ушир, 2H, NH2), 6,54 (д, J=2 Гц, 1H, Ar), 6,68 (дд, J=2, 8 Гц, 1H, Ar), 10,93 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,36, 23,43, 30,63, 55,97, 106,12, 109,17, 114,70, 127,28, 148,95, 154,42, 154,61, 159,85, 169,87, 172,67; LCMS: МН=287; Анализ Вычислено для C14H14N4O3: C, 58,74; H, 4,93; N, 19,57. Найдено: C, 58,60; H, 4,83; N, 19,40.
5.36 Трет-бутиловый эфир [3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-7-илметил]карбаминовой кислоты
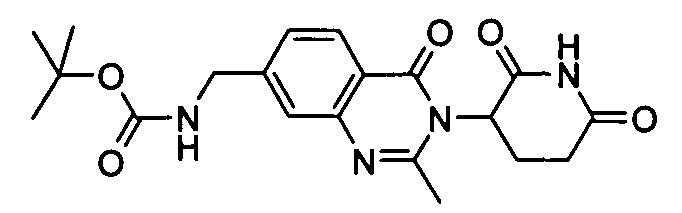
Стадия 1: К перемешиваемому раствору метилового эфира 4-метил-2-нитробензойной кислоты (108,5 г, 555,7 ммоль) в ацетонитриле (750 мл) добавляли NBS (97,9 г, 550,1 ммоль). Смесь нагревали до слабой реакции с помощью освещения 200 Вт лампой в течение 5,5 часов. Растворитель выпаривали и остаток растворяли в этилацетате (1500 мл). Раствор промывали водой (2×600 мл) и солевым раствором (300 мл), сушили над сульфатом магния и концентрировали, получая коричневое масло. К маслу добавляли т-бутилметиловый эфир (300 мл). Смесь нагревали при 70°С в течение 15 минут. Смеси давали охладиться до примерно 53°С в течение одного часа, затем до 45°С, а затем при 20~25°С, продувая при этом азотом через стеклянную пипетку в течение ночи. Суспензию фильтровали через воронку со средним размером пор. Твердое вещество промывали предварительно охлажденным 10°С перемешанным раствором гептана/МТВЕ(1/2 об./об.) и сушили отсасыванием в вытяжном колпаке в течение ночи, получая метиловый эфир 4-бромметил-2-нитробензойной кислоты в виде не совсем белого твердого вещества (66 г, 43% выход). Твердое вещество использовали в следующей стадии без дальнейшей очистки.
Стадия 2: Смесь метилового эфира 4-бромметил-2-нитробензойной кислоты (66,3 г, 241,9 ммоль), ди-трет-бутилиминодикарбоксилата (52,72 г, 242,6 ммоль), карбоната цезия (161,58 г, 495,9 ммоль) и иодида лития (1,62 г, 12 ммоль) в 2-бутаноне (700 мл) нагревали до температуры кипения в 100°С масляной бане в течение 12 часов при перемешивании механической мешалкой. Смеси давали охладиться до комнатной температуры. К смеси добавляли солевой раствор (300 мл), воду (300 мл) и этилацетат (600 мл) и смесь перемешивали в течение 10 минут. Суспензию фильтровали через Целитную подушку. Два слоя разделялись, и органический слой выпаривали до меньшего объема. Водный слой экстрагировали этилацетатом (2×150 мл). Объединенные органические слои промывали солевым раствором (1×500 мл), сушили над сульфатом магния, при этом в то же самое время обесцвечивая шарколем при комнатной температуре с перемешиванием в течение 30 минут. Черную смесь фильтровали через Целитную подушку и фильтрат выпаривали, получая метиловый эфир 4-(ди-трет-бутоксикарбониламинометил)-2-нитробензойной кислоты в виде коричневого масла (96,0 г, 96,7% выход). Продукт использовали в следующей стадии без дальнейшей очистки.
Стадия 3: К перемешиваемому коричневому раствору метилового эфира 4-(ди-трет-бутоксикарбониламинометил)-2-нитробензойной кислоты (95,97 г, 233,8 ммоль) в метиленхлориде (800 мл) добавляли трифторуксусную кислоту (33,87 мл, 455,9 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. К раствору добавляли насыщенный раствор бикарбоната натрия (500 мл) и смесь перемешивали в течение 10 минут. Органический слой отделяли, сушили над сульфатом магния и выпаривали, получая метиловый эфир 4-(трет-бутоксикарбониламинометил)-2-нитробензойной кислоты в виде коричневого масла (64,36 г, 88% сырой выход). Продукт использовали в следующей стадии без дальнейшей очистки.
Стадия 4: Смесь метилового эфира 4-(трет-бутоксикарбониламинометил)-2-нитробензойной кислоты (64,36 г, 207,4 ммоль), гидроксида лития (5,96 г, 248,9 ммоль) в метаноле (500 мл) и воде (250 мл) перемешивали механической мешалкой при комнатной температуре в течение ночи. Метанол выпаривали и к водному раствору добавляли 1н. HCl (300 мл) с образованием осадка. Добавляли простой эфир (350 мл) и смесь перемешивали при 0°С в течение 2 часов. Образовывался нежелательный осадок. Смесь выпаривали. К смеси добавляли воду (500 мл). Водный слой экстрагировали этилацетатом (5×120 мл). Объединенные органические слои разделяли, сушили над сульфатом магния и концентрировали, получая 4-(трет-бутоксикарбониламинометил)-2-нитробензойную кислоту в виде коричневого масла (56,69 г, 92% выход). Продукт использовали в следующей стадии без дальнейшей очистки.
Стадия 5: Смесь 4-(трет-бутоксикарбониламинометил)-2-нитробензойной кислоты (56,57 г, 190,9 ммоль) в метаноле (250 мл) и палладия на угле (5,66 г, 10% вес.) подвергали гидрированию в Parr-шейкере в течение ночи при 51 пси (3,47 атм). Черную смесь фильтровали через Целитную подушку и фильтрат выпаривали, получая коричневое масло, которое перемешивали в простом эфире (300 мл) в течение ночи. Жидкий эфирный шлам фильтровали, получая 2-амино-4-(трет-бутоксикарбониламинометил)бензойную кислоту в виде твердого вещества (42,0 г, 84% выход). Продукт использовали в следующей стадии без дальнейшей очистки.
Стадия 6: К перемешиваемому раствору 2-амино-4-(трет-бутоксикарбониламинометил)бензойной кислоты (24,75 г, 92,94 ммоль), имидазола (7,59 г, 111,53 ммоль) в ацетонитриле (300 мл) добавляли ацетилхлорид (7,96 мл, 111,53 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли гидрохлорид 3-аминопиперидин-2,6-диона (15,30 г, 92,94 ммоль), имидазол (12,66 г, 185,89 ммоль) и трифенилфосфит (29,23 мл, 111,53 ммоль) и смесь нагревали до температуры кипения с обратным холодильником в течение 6 часов. Смесь охлаждали до комнатной температуры и коричневую смесь фильтровали. Фильтрат выпаривали и затем очищали с помощью колоночной флеш-хроматографии (Силикагель, метанол/метиленхлорид 4%/96%), получая трет-бутиловый эфир [3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-7-илметил]карбаминовой кислоты в виде светло-желтого твердого вещества (24,57 г, 66% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 10/90 CH3CN/0,1% H3PO4, с градиентом до 95/5 в течение 5 мин, выдерживалось 5 мин, 5,97 мин (99,7%); т.пл.: 240-242°С; 1H ЯМР (ДМСО-d6) δ 1,29 (ушир.с, 1H, CH для BOC группы), 1,40 (c, 8H, 8CH для BOC группы), 2,11-2,19 (м, 1H, CHH), 2,56-2,91 (м, 6H, CHCH2, CH3), 4,26 (д, J=6 Гц, 2H, CH2NH), 5,25 (дд, J=5, 11 Гц, 1H, CH), 7,35-7,99 (м, 4H, Ar и NHCH2), 11,02 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,97, 23,49, 28,19, 30,60, 43,22, 56,48, 78,00, 118,84, 123,99, 125,41, 126,00, 146,93, 147,55, 155,15, 155,81, 160,29, 169,51, 172,61. LCMS МН=401; Анализ Вычислено для C20H24N4O5: C, 59,99; H, 6,04; N, 13,99. Найдено: C, 59,78; H, 5,78; N, 13,85.
5.37 Гидрохлорид 3-(7-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона
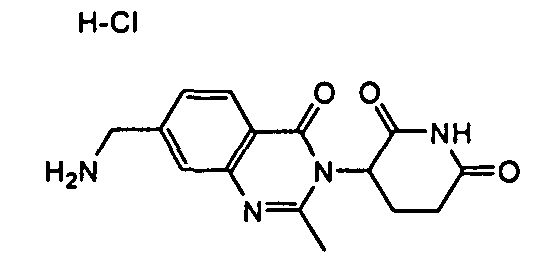
Стадия 1: К перемешиваемому коричневому раствору трет-бутилового эфира [3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-7-илметил]карбаминовой кислоты (14,7 г, 36,8 ммоль) в метаноле (200 мл) и метиленхлориде (200 мл) добавляли 2М HCl в простом эфире (320 мл) и смесь перемешивали в течение ночи. Растворитель выпаривали и остаток перемешивали в простом эфире (100 мл) в течение 2 часов. Суспензию фильтровали, получая гидрохлорид 3-(7-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона в виде светло-желтого твердого вещества (13,2 г, 106% грубый выход). Продукт использовали в следующей стадии без дальнейшей очистки.
Стадия 2: Гидрохлорид 3-(7-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона (1,00 г) растворяли в воде (100 мл). Раствор промывали этилацетатом (2×100 мл). Водный слой выпаривали, получая гидрохлорид 3-(7-аминометил-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-диона в виде не совсем белого твердого вещества (0,86 г, 86% выход); HPLC: Waters Xterra RP 18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, Waters LC Module 1, 05/95 CH3CN/0,1% (HCO2)NH4, 6,27 мин (98,7%); т.пл.: 313-315°С; 1H ЯМР (ДМСО-d6) δ 2,17-2,24 (м, 1H, CHH), 2,58-2,89 (м, 6H, CHCH2, CH3), 4,20 (кв, J=5 Гц, 2H, ArCH2), 5,34 (дд, J=6, 11 Гц, 1H, CH, перекрывание водяным пиком), 7,64-8,09 (м, 3H, Ar), 8,72 (ушир.с, 3H, ClNH3), 11,07 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,88, 22,97, 30,57, 41,69, 56,71, 119,61, 125,38, 126,42, 127,25, 141,34, 145,36, 156,66, 159,83, 169,25, 172,57. LCMS МН=301; Анализ Вычислено для C15H17N4O3Cl + 1,0 H2O и + 0,9 HCl: C, 46,48; H, 5,17; N, 14,45; Cl, 17,38. Найдено: C, 46,68; H, 5,15; N, 14,32; Cl, 17,05.
5.38 3-(2,8-Диметил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
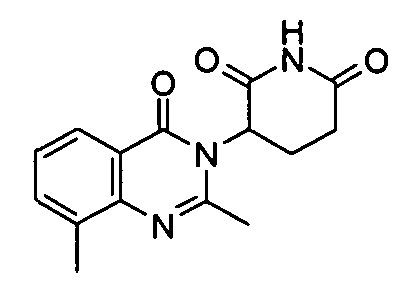
К перемешиваемой смеси 2-амино-3-метилбензойной кислоты (3,0 г, 20 ммоль) и имидазола (1,6 г, 24 ммоль) в ацетонитриле (30 мл) при комнатной температуре добавляли ацетилхлорид (1,7 мл, 24 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли гидрохлорид 3-аминопиперидин-2,6-диона (3,3 г, 20 ммоль), имидазол (3,0 г, 68 ммоль) и трифенилфосфит (6,2 мл, 24 ммоль) и ее нагревали до температуры кипения с обратным холодильником в течение 22 часов. К смеси добавляли воду (60 мл). Суспензию фильтровали и промывали водой (2×100 мл), этилацетатом (2×100 мл), бикарбонатом натрия (насыщенным, 100 мл) и водой (100 мл), получая белое твердое вещество, которое перемешивали в ДМСО (20 мл) при 65°С. Смесь осветляли, фильтровали и промывали ДМСО (10 мл). К фильтрату добавляли воду (100 мл), получая суспензию. Суспензию фильтровали и промывали водой (2×50 мл), получая 3-(2,8-диметил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (3,2 г, 56% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 25/75 CH3CN/0,1% H3PO4, 5,85 мин (99,6%); т.пл.: 296-298°С; 1H ЯМР (ДМСО-d6) δ 2,12-2,24 (м, 1H, CHH), 2,51 (c, 3H, CH3), 2,48-2,74 (м, 2H, 2CHH), 2,66 (c, 3H, CH3), 2,76-2,91 (м, 1H, CHH), 5,27 (дд, J=6, 11 Гц, 1H, NCH), 7,38 (т, J=8 Гц, 1H, Ar), 7,67 (д, J=7 Гц, 1H, Ar), 7,86 (дд, J=0,6, 8 Гц, 1H, Ar), 11,02 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 16,91, 20,91, 23,80, 30,60, 56,51, 120,23, 123,59, 126,05, 134,72, 134,94, 145,25, 153,82, 160,71, 169,51, 172,62; LCMS: МН=286; Анализ Вычислено для C15H15N3O3 + 0,2 H2O: C, 62,36; H, 5,37; N, 14,54. Найдено: C, 62,21; H, 5,31; N, 14,43.
5.39 3-(8-Фтор-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
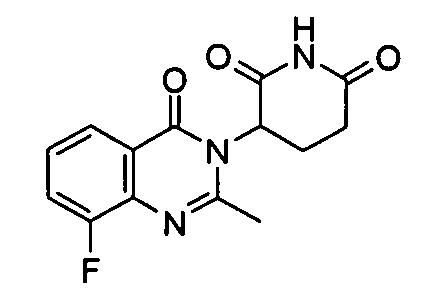
К перемешиваемой смеси 2-амино-3-фторбензойной кислоты (3,0 г, 19 ммоль) и имидазола (1,6 г, 23 ммоль) в ацетонитриле (30 мл) при комнатной температуре добавляли ацетилхлорид (1,7 мл, 23 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли гидрохлорид 3-аминопиперидин-2,6-диона (3,2 г, 19 ммоль), имидазол (2,9 г, 43 ммоль) и трифенилфосфит (6,1 мл, 23 ммоль) и ее нагревали до температуры кипения с обратным холодильником в течение 22 часов. К смеси добавляли воду (60 мл). Суспензию фильтровали и промывали водой (2×50 мл), этилацетатом (2×50 мл) и водой (50 мл), получая белое твердое вещество, которое очищали с помощью препаративной HPLC (С18 20/80 CH3CN/H2O), получая белое твердое вещество. Белое твердое вещество в ДМСО (20 мл) нагревали при 60°С в течение 30 минут. К раствору добавляли воду (10 мл). Суспензию охлаждали до комнатной температуры. Суспензию фильтровали и промывали ДМСО (4 мл) и водой (20 мл), получая 3-(8-фтор-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (3,11 г, 67% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% H3PO4, 4,7 мин (99,7%); т.пл.: 305°С (разложение); 1H ЯМР (ДМСО-d6) δ 2,16-2,23 (м, 1H, CHH), 2,43-2,76 (м, 5H, СН3, 2CHH), 2,79-2,92 (м, 1H, CHH), 5,32 (дд, J=6, 11 Гц, 1H, NCH), 7,46-7,53 (м, 1H, Ar), 7,67-7,73 (м, 1H, Ar), 7,84-7,94 (м, 1H, Ar), 11,06 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,80, 23,67, 30,58, 56,71, 120,04 (д, JC-F=19 Гц), 121,71 (д, JC-F=4 Гц), 122,31, 126,91 (д, JC-F=8 Гц), 136,04 (д, JC-F=12 Гц), 155,93 (д, JC-F=254 Гц), 155,93, 159,62 (д, JC-F=3 Гц), 169,32, 172,57; LCMS: МН=290; Анализ Вычислено для C14H12N3O3F: C, 58,13; H, 4,18; N, 14,53; F, 6,57. Найдено: C, 57,87; H, 3,94; N, 14,35; F, 6,91.
5.40 3-(8-Хлор-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
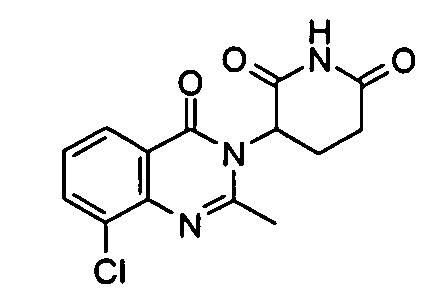
К перемешиваемой смеси 2-амино-3-хлорбензойной кислоты (2,2 г, 13 ммоль) и имидазола (1,1 г, 16 ммоль) в ацетонитриле (30 мл) при комнатной температуре добавляли ацетилхлорид (1,1 мл, 16 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли гидрохлорид 3-аминопиперидин-2,6-диона (2,3 г, 14 ммоль), имидазол (1,9 г, 28 ммоль) и трифенилфосфит (4,0 мл, 15 ммоль) и ее нагревали до температуры кипения с обратным холодильником в течение 22 часов. К смеси добавляли воду (60 мл). Суспензию фильтровали и промывали водой (2×50 мл), этилацетатом (2×50 мл) и водой (50 мл), получая белое твердое вещество, которое перемешивали в метаноле (50 мл) в течение ночи. Суспензию фильтровали и промывали метанолом (30 мл) и водой (30 мл), получая 3-(8-хлор-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (1,5 г, 38% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 25/75 CH3CN/0,1% H3PO4, 6,51 мин (99,6%); т.пл.: 290-292°С; 1H ЯМР (ДМСО-d6) δ 2,16-2,23 (м, 1H, CHH), 2,59-2,69 (м, 5H, CH3, 2CHH), 2,79-2,87 (м, 1H, CHH), 5,32 (дд, J=5, 11 Гц, 1H, NCH), 7,48 (т, J=8 Гц, 1H, Ar), 7,96-8,02 (м, 2H, Ar), 11,07 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,68, 23,75, 30,51, 56,68, 121,87, 125,08, 126,91, 130,03, 134,69, 143,14, 156,14, 159,88, 169,23, 172,51; LCMS: МН=306, 308; Анализ Вычислено для C14H12N3O3Cl: C, 55,00; H, 3,96; N, 13,74; Cl, 11,60. Найдено: C, 54,73; H, 3,96; N, 13,58; Cl, 11,03.
5.41 3-(8-Бром-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
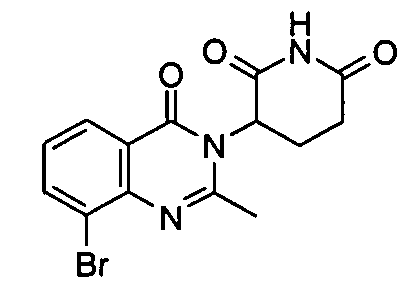
К перемешиваемой смеси 2-амино-3-бромбензойной кислоты (1,0 г, 4,6 ммоль) и имидазола (0,38 г, 5,5 ммоль) в ацетонитриле (10 мл) при комнатной температуре добавляли ацетилхлорид (0,6 мл, 8,3 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли гидрохлорид 3-аминопиперидин-2,6-диона (0,76 г, 4,6 ммоль), имидазол (0,7 г, 10 ммоль) и трифенилфосфит (1,5 мл, 5,6 ммоль) и ее нагревали до температуры кипения с обратным холодильником в течение 22 часов. К смеси добавляли воду (60 мл). Суспензию фильтровали и промывали водой (2×50 мл), этилацетатом (2×50 мл) и водой (50 мл), получая 3-(8-бром-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (0,34 г, 21% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 25/75 CH3CN/0,1% H3PO4, 9,47 мин (99,6%); т.пл.: 307-309°С; 1H ЯМР (ДМСО-d6) δ 2,16-2,23 (м, 1H, CHH), 2,58-2,67 (м, 2H, 2CHH), 2,68 (c, 3H, CH3), 2,76-2,92 (м, 1H, CHH), 5,31 (дд, J=5, 11 Гц, 1H, NCH), 7,41 (т, J=8 Гц, 1H, Ar), 8,04 (дд, J=2, 8 Гц 1H, Ar), 8,15 (дд, J=1, 8 Гц 1H, Ar), 11,07 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,73, 23,85, 30,57, 56,76, 121,09, 121,82, 125,86, 127,47, 138,08, 144,23, 156,23, 159,97, 169,29, 172,58; LCMS: МН=350, 352; Анализ Вычислено для C14H12N3O3Br: C, 48,02; H, 3,45; N, 12,00; Br, 22,82. Найдено: C, 47,74; H, 3,23; N, 11,85; Br, 22,42.
5.42 3-(8-Гидрокси-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
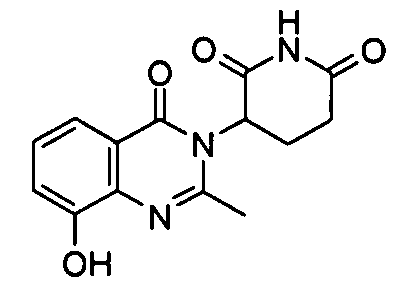
К перемешиваемой смеси 2-амино-3-гидроксибензойной кислоты (2,0 г, 13,1 ммоль) и имидазола (2,0 г, 29,4 ммоль) в ацетонитриле (30 мл) при комнатной температуре добавляли ацетилхлорид (2,0 мл, 28,7 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли гидрохлорид 3-аминопиперидин-2,6-диона (2,2 г, 13,1 ммоль), имидазол (2,0 г, 29,4 ммоль) и трифенилфосфит (4,11 мл, 15,7 ммоль) и ее нагревали до температуры кипения с обратным холодильником в течение 22 часов. К смеси добавляли воду (60 мл) и конц. HCl до значения рН ~1. Растворитель удаляли в вакууме. К остатку добавляли воду (50 мл). Водный слой экстрагировали этилацетатом (2×50 мл). К водному слою добавляли бикарбонат натрия (1,8 г) до значения рН 7-8 и смесь перемешивали при комнатной температуре, получая суспензию. Суспензию фильтровали, получая 3-(8-гидрокси-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде не совсем белого твердого вещества (0,6 г, 16% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% H3PO4, 3,03 мин (99,3%); т.пл.: 266-268°С; 1H ЯМР (ДМСО-d6) δ 2,10-2,22 (м, 1H, CHH), 2,57-2,72 (м, 5H, CH3, 2CHH), 2,78-2,92 (м, 1H, CHH), 5,25 (дд, J=5, 11 Гц, 1H, NCH), 7,19 (дд, J=1, 8 Гц, 1H, Ar), 7,30 (т, J=8 Гц, 1H, Ar), 7,45 (дд, J=1, 8 Гц, 1H, Ar), 9,65 (c, 1H, OH), 11,02 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,92, 23,37, 30,59, 56,45, 115,62, 118,51, 121,19, 127,05, 135,91, 152,34, 153,09, 160,45, 169,52, 172,62; LCMS: МН=288; Анализ Вычислено для C14H13N3O4+ 1 H2O: C, 55,08; H, 4,95; N, 13,76. Найдено: C, 54,88; H, 4,97; N, 13,77.
5.43 3-(2-Метил-4-оксо-8-трифторметил-4Н-хиназолин-3-ил)пиперидин-2,6-дион
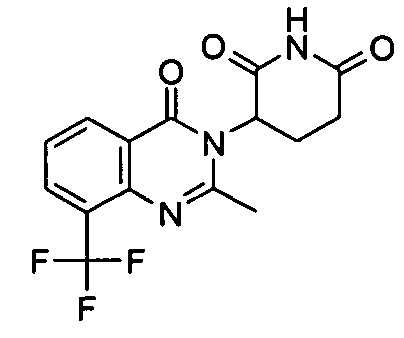
К перемешиваемой смеси 2-амино-3-(трифторметил)бензойной кислоты (2,0 г, 9,8 ммоль) и имидазола (0,8 г, 12 ммоль) в ацетонитриле (20 мл) при комнатной температуре добавляли ацетилхлорид (0,83 мл, 12 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли гидрохлорид 3-аминопиперидин-2,6-диона (1,6 г, 9,8 ммоль), имидазол (1,5 г, 22 ммоль) и трифенилфосфит (3,1 мл, 12 ммоль) и ее нагревали до температуры кипения с обратным холодильником в течение 22 часов. К смеси добавляли воду (60 мл). Суспензию фильтровали и промывали водой (2×50 мл), этилацетатом (2×50 мл), бикарбонатом натрия (насыщенным, 50 мл) и водой (50 мл), получая 3-(2-метил-4-оксо-8-трифторметил-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (0,32 г, 10% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 35/65 CH3CN/0,1% H3PO4, 7,57 мин (99,8%); т.пл.: 351-353°С; H ЯМР (ДМСО-d6) δ 2,19-2,26 (м, 1H, CHH), 2,59-2,70 (м, 5H, CH3, 2CHH), 2,81-2,93 (м, 1H, CHH), 5,34 (дд, J=5, 11 Гц, 1H, NCH), 7,64 (т, J=8 Гц, 1H, Ar), 8,20 (д, J=8 Гц 1H, Ar), 8,31 (д, J=8 Гц, 1H, Ar), 11,09 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,67, 24,05, 30,57, 56,84, 121,48, 123,52 (кв, JC-F=274 Гц), 124,77 (кв, JC-F=30 Гц), 125,98, 130,74, 132,29 (кв, JC-F=5 Гц), 144,20, 156,71, 159,68, 169,28, 172,58; LCMS: МН=340; Анализ Вычислено для C15H12N3O3F3 + 0,3 H2O + 0,1 CH3CN: C, 52,34; H, 3,72; N, 12,45; F, 16,34. Найдено: C, 52,71; H, 3,52; N, 12,31; F, 15,99.
5.44 3-(8-Метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
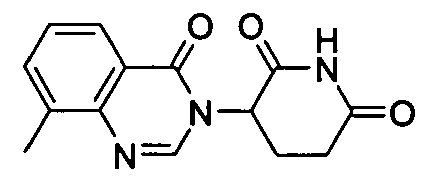
Стадия 1: Смесь 2-амино-3-метилбензойной кислоты (2,1 г, 14 ммоль) и CDI (1,9 г, 12 ммоль) в ацетонитриле (25 мл) перемешивали при комнатной температуре в течение 5 часов. К суспензии добавляли гидрохлорид 3-аминопиперидин-2,6-диона (2,3 г, 14 ммоль), триэтиламин (7,2 мл, 66 ммоль) и уксусную кислоту (8 мл, 132 ммоль) и смесь нагревали до температуры кипения с обратным холодильником в течение 16 часов. К смеси добавляли воду (75 мл) и перемешивали при комнатной температуре в течение 2 часов. Суспензию фильтровали и промывали водой (50 мл) и этилацетатом (20 мл), получая 2-амино-N-(2,6-диоксопиперидин-3-ил)-3-метилбензамид в виде белого твердого вещества (1,9 г, 61% выход): 1H ЯМР (ДМСО-d6) δ 1,92-1,99 (м, 1H, CHH), 2,06 (c, 3H, CH3), 2,04-2,14 (м, 1H, CHH), 2,51-2,56 (м, 1H, CHH), 2,73-2,85 (м, 1H, CHH), 4,69-4,78 (м, 1H, NCH), 6,22 (ушир.с, 2H, NH2), 6,50 (т, J=8 Гц, 1H, Ar), 7,10 (д, J=8 Гц, 1H, Ar), 7,40 (д, J=8 Гц, 1H, Ar), 8,47 (д, J=8 Гц, 1H, NH), 10,83 (c, 1H, NH); LCMS: МН=262.
Стадия 2: Перемешиваемый раствор 2-амино-N-(2,6-диоксопиперидин-3-ил)-3-метилбензамида (0,9 г, 3,4 ммоль) и триметилортоформиата (4,5 мл) и п-толуолсульфоновой кислоты (250 мг) в ацетонитриле (20 мл) нагревали до температуры кипения с обратным холодильником в течение 17 часов. К смеси добавляли воду (75 мл) и перемешивали в течение 20 минут. Суспензию фильтровали и промывали метанолом (20 мл), водой (20 мл) и этилацетатом (20 мл), получая твердое вещество пурпурного цвета. Твердое вещество в NMP (4 мл) нагревали при 80°С в течение 30 минут. К раствору добавляли воду (1 мл) и смеси давали охладиться до комнатной температуры. Суспензию фильтровали и промывали водой (30 мл), получая 3-(8-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде светло-пурпурного твердого вещества (660 мг, 72% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 3,07 мин (98,6%); т.пл.: 290-292°С; 1H ЯМР (ДМСО-d6) δ 2,11-2,19 (м, 1H, CHH), 2,56 (c, 3H, CH3), 2,62-2,93 (м, 3H, CH2, CHH), 5,48 (ушир, 1H, NCH), 7,46 (т, J=8 Гц, 1H, Ar), 7,73 (д, J=8 Гц, 1H, Ar), 7,99 (д, J=8 Гц, 1H, Ar), 8,38 (c, 1H, CH), 11,16 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 17,01, 22,53, 30,97, 56,22, 121,36, 123,79, 126,51, 126,86, 135,03, 135,47, 136,39, 145,96, 146,36, 159,97, 169,92, 172,52; LCMS: МН=272; Анализ Вычислено для C14H13N3O3: C, 61,99; H, 4,83; N, 15,49. Найдено: C, 61,70; H, 4,68; N, 15,40.
5.45 3-(6,7-Диметокси-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
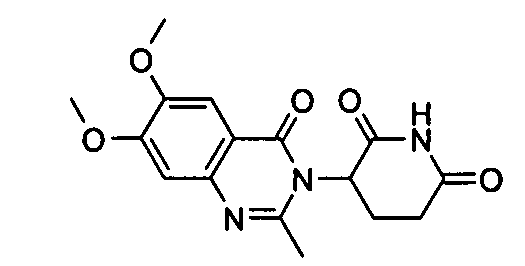
К перемешиваемой смеси 2-амино-4,5-диметоксибензойной кислоты (5,0 г, 25 ммоль) и имидазола (2,1 г, 30 ммоль) в ацетонитриле (50 мл) при комнатной температуре добавляли ацетилхлорид (2,2 мл, 30 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли гидрохлорид 3-аминопиперидин-2,6-диона (4,2 г, 25 ммоль), имидазол (3,8 г, 56 ммоль) и трифенилфосфит (7,3 мл, 28 ммоль) и ее нагревали до температуры кипения с обратным холодильником в течение 22 часов. Суспензию фильтровали и промывали ацетонитрилом (50 мл) и водой (2×50 мл), получая твердое вещество. Твердое вещество перемешивали в бикарбонате натрия (насыщ., 50 мл) и воде (50 мл) в течение 1 часа. Суспензию фильтровали и промывали водой (2×50 мл) и этилацетатом (30 мл), получая 3-(6,7-диметокси-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (5,7 г, 68% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 20/80 CH3CN/0,1% H3PO4, 3,26 мин (99,8%); т.пл.: 325°С (разложение); 1H ЯМР (ДМСО-d6) δ 2,15-2,19 (м, 1H, CHH), 2,56-2,88 (м, 6H, CH3, CH2, CHH), 3,85 (c, 3H, CH3), 3,90 (c, 3H, CH3), 5,22 (дд, J=5, 11 Гц, 1H, NCH), 7,09 (c, 1H, Ar), 7,35 (c, 1H, Ar), 10,99 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,12, 23,21, 30,62, 55,63, 55,97, 56,38, 104,98, 107,31, 113,27, 143,09, 148,40, 153,24, 154,83, 159,76, 169,61, 172,64; LCMS: МН=332; Анализ Вычислено для C16H17N3O5: C, 58,00; H, 5,17; N, 12,68. Найдено: C, 57,88; H, 5,06; N, 12,77.
5.46 3-(6,8-Дихлор-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион
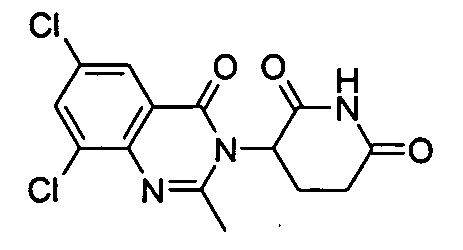
К перемешиваемой смеси 2-амино-3,5-дихлорбензойной кислоты (5,0 г, 24 ммоль) и имидазола (1,9 г, 28 ммоль) в ацетонитриле (60 мл) при комнатной температуре добавляли ацетилхлорид (2,0 мл, 28 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли гидрохлорид 3-аминопиперидин-2,6-диона (3,9 г, 24 ммоль), имидазол (3,5 г, 52 ммоль) и трифенилфосфит (6,8 мл, 26 ммоль) и ее нагревали до температуры кипения с обратным холодильником в течение 22 часов. Суспензию фильтровали и промывали ацетонитрилом (30 мл), водой (2×30 мл) и этилацетатом (30 мл), получая 3-(6,8-дихлор-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион в виде белого твердого вещества (4,65 г, 58% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 40/60 CH3CN/0,1% H3PO4, 4,78 мин (100%); т.пл.: 238-240°С; 1H ЯМР (ДМСО-d6) δ 2,15-2,22 (м, 1H, CHH), 2,55-2,69 (м, 5H, CH2, 2CHH), 2,78-2,91 (м, 1H, CHH), 5,33 (дд, J=6, 11 Гц, 1H, NCH), 7,96 (д, J=2 Гц, 1H, Ar), 8,15 (д, J=2 Гц, 1H, Ar), 11,09 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 20,63, 23,85, 30,54, 56,92, 122,55, 124,24, 130,51, 131,72, 134,38, 142,25, 156,80, 159,07, 169,12, 172,53; LCMS: МН=340, 342; Анализ Вычислено для C14H11N3O3Cl2: C, 49,43; H, 3,26; N, 12,35; Cl, 20,84. Найдено: C, 49,21; H, 3,11; N, 12,30; Cl, 19,43.
5.47 3-(2-Метил-4-оксо-4Н-бензо[g]хиназолин-3-ил)пиперидин-2,6-дион
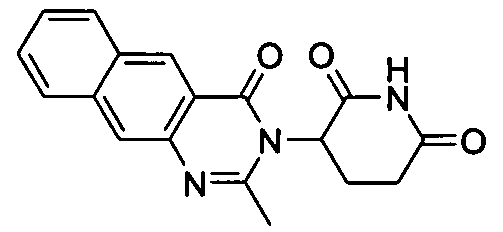
К перемешиваемой смеси 3-амино-2-нафтоловой кислоты (5,4 г, 29 ммоль) и имидазола (2 г, 29 ммоль) в ацетонитриле (60 мл) при комнатной температуре добавляли ацетилхлорид (2,1 мл, 29 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли гидрохлорид 3-аминопиперидин-2,6-диона (4 г, 25 ммоль), имидазол (3,7 г, 54 ммоль) и трифенилфосфит (7,1 мл, 27 ммоль) и ее нагревали до температуры кипения с обратным холодильником в течение 22 часов. Суспензию фильтровали и промывали ацетонитрилом (30 мл), водой (2×30 мл) и этилацетатом (30 мл), получая 3-(2-метил-4-оксо-4Н-бензо[g]хиназолин-3-ил)пиперидин-2,6-дион в виде мутновато-белого твердого вещества (6,3 г, 79% выход): HPLC: Waters Symmetry C18, 5 мкм, 3,9×150 мм, 1 мл/мин, 240 нм, 30/70 CH3CN/0,1% H3PO4, 4,59 мин (99,7%); т.пл.: 307°С (разложение); 1H ЯМР (ДМСО-d6) δ 2,17-2,26 (м, 1H, CHH), 2,60-2,94 (м, 6H, CH3, CH2, CHH), 5,29 (дд, J=5, 11 Гц, 1H, NCH), 7,55-7,60 (м, 1H, Ar), 7,64-7,69 (м, 1H, Ar), 8,09 (д, J=8 Гц, 1H, Ar), 8,18-8,20 (м, 2H, Ar), 8,75 (c, 1H, Ar), 11,06 (c, 1H, NH); 13C ЯМР (ДМСО-d6) δ 21,16, 23,60, 30,71, 56,45, 119,52, 123,86, 126,25, 127,47, 127,77, 128,58, 129,24, 129,53, 136,26, 142,20, 153,87, 160,97, 169,70, 172,68; LCMS: МН=322; Анализ Вычислено для C18H15N3O3 + 0,1 H2O: C, 66,91; H, 4,74; N, 13,00. Найдено: C, 66,78; H, 4,76; N, 12,95.
5.48 АНАЛИЗЫ
5.48.1 Анализ ингибирования TNFα в PMBC
Моноядерные клетки периферической крови (PBMC) от нормальных доноров получают с помощью центрифугирования плотности Ficoll Hypaque (Pharmacia, Piscataway, NJ, USA). Клетки культивируют в RPMI 1640 (Life Technologies, Grand Island, NY, USA) с добавлением 10% АВ+человеческая сыворотка (Gemini Bio-products, Woodland, CA, USA), 2 мМ L-глютамина, 100 Ед./мл пенициллина и 100 мкг/мл стрептомицина (Life Technologies).
PBMC (2×105 клеток) помещают в 96-луночные плоскодонные планшеты для культуры ткани Costar (Corning, NY, USA) в трехкратном повторении. Клетки стимулируют LPS (из Salmonella abortus equi, Sigma cat. No L-1887, St.Louis, MO, USA) при конечной концентрации 1 нг/мл в отсутствие или в присутствии соединений. Предлагаемые в заявке соединения растворяют в ДМСО (Sigma) и производят дополнительные разведения в культуральной среде непосредственно перед использованием. Конечная концентрация ДМСО во всех анализах может составлять около 0,25%. Соединения добавляют к клеткам за 1 час до LPS стимуляции. Клетки затем инкубируют в течение 18-20 часов при 37°С в 5% CO2 и супернатанты затем собирают, разбавляют культуральной средой и анализируют на уровне TNFα с помощью ELISA (Endogen, Boston, MA, США). Показатели ИК50 вычисляют с использованием нелинейной регрессии, сигмоидальной функции доза-ответ, с ограничением верха до 100% и низа до 0%, с допуском вариаций наклона (программа GraphPad Prism v3.02).
5.48.2 IL-2 и MIP-3α продуцирование Т клетками
PBMC освобождают от присоединенных моноцитов помещением 1×108 РВМС в 10 мл полной среды (RPMI 1640 с добавлением 10% тепло-неактивированной плодной бычьей сыворотки, 2 мМ L-глютамина, 100 Ед./мл пенициллина и 100 мкг/мл стрептомицина) на 10 см кювету для тканевой культуры, в 37°С, 5% СО2 инкубаторе на 30-60 минут. Кювету прополаскивают средой для удаления всех неприсоединенных PBMC. Т клетки очищают с помощью негативного отбора с использованием следующей смеси антител (Pharmingen) и Dynabead (Dynal) на каждые 1×108 неприсоединенных РВМС: 0,3 мл Sheep (овечьих) анти-мышиных IgG бусинок, 15 мкл анти-CD16, 15 мкл анти-CD33, 15 мкл анти-CD56, 0,23 мл анти-CD19 бусинок, 0,23 мл анти-HLA класса II бусинок и 56 мкл анти-CD14 бусинок. Клетки и смесь бусинок/антител чередуют (вращают) конец-через-конец в течение 30-60 минут при 4°С. Очищенные Т клетки удаляют от бусинок с использованием Dynal магнита. Обычный выход составляет примерно 50% Т клеток, 87-95% CD3+ по данным поточной цитометрии.
96-луночные плоскодонные планшеты для культуры ткани покрывают анти-CD3 антителами OKT3 при 5 мкг/мл в PBS, 100 мкл на лунку, инкубируют при 37°С в течение 3-6 часов, затем промывают четыре раза полной средой 100 мкл/лунку непосредственно перед тем, как добавляют Т клетки. Соединения разбавляют до 20 раз в круглодонной 96-луночной планшете для культуры ткани. Конечные концентрации составляют около 10 мкМ до около 0,00064 мкМ. 10 мМ запас описываемых в описании соединений разбавляют в целом 1:50 в течение первого 20× разведения 200 мкМ в 2% ДМСО и серийно разводят 1:5 в 2% ДМСО. Соединение добавляют в количестве 10 мкл на 200 мкл культуры с получением конечной концентрации ДМСО 0,1%. Культуры инкубируют при 37°С, 5% СО2 в течение 2-3 дней и супернатанты анализируют на IL-2 и MIP-3α с помощью ELISA (R&D Systems). Уровни IL-2 и MIP-3α нормализуют до количества, продуцируемого в присутствии количества предлагаемого в описании соединения, и вычисляют показатели ЕС50 с использованием нелинейной регрессии, сигмоидальной функции доза-ответ, с ограничением верха до 100% и низа до 0%, с допуском вариаций наклона (программа GraphPad Prism v3.02).
5.48.3 Анализ клеточной пролиферации
Линии клеток Namalwa, MUTZ-5 и UT-7 получают у фирмы Deutsche Sammlung von Microorganismen und Zellkulturen GmbH (Braunschweig, Германия). Линию клеток KG-1 получают из Американской коллекции типов культур (American Type Culture Collection) (Manassas, VA, USA). Клеточную пролиферацию, указанную включением 3Н-тимидина измеряют во всех линиях клеток следующим образом.
Клетки помещают на 96-луночные планшеты в среде в количестве 6000 клеток на лунку. Клетки предварительно обрабатывают соединением при 100, 10, 1, 0,1, 0,01, 0,001, 0,0001 и 0 мкМ в конечной концентрации около 0,25% ДМСО троекратно и инкубируют при 37°С в увлажняемом инкубаторе при 5% СО2 в течение 72 часов. Затем в каждую лунку добавляют один микрокюри 3Н-тимидина (Amersham) и клетки инкубируют снова при 37°С при 5% СО2 в течение 6 часов. Клетки собирают на фильтровальные планшеты UniFilter GF/C (Perkin Elmer) с использованием сборщика клеток (Tomtec) и планшеты оставляют сушить на протяжении ночи. Добавляют Microscint 20 (Packard) (25 мкл/лунку) и планшеты анализируют в TopCount NXT (Packard). Каждую лунку обсчитывают в течение одной минуты. Процентное ингибирование клеточной пролиферации вычисляют усреднением всех трех повторов и нормализацией до ДМСО контроля (0% ингибирование). Каждое соединение испытывают на каждой линии клеток в трех отдельных экспериментах. Конечные показатели ИК50 вычисляют с использованием нелинейной регрессии, сигмоидальной функции доза-ответ, с ограничением верха до 100% и низа до 0%, с допуском вариаций наклона (программа GraphPad Prism v3.02).
5.48.4 Иммуноосаждение и Иммуноблот
Клетки Namalwa обрабатывают ДМСО или некоторым количеством предлагаемого в описании соединения в течение 1 часа, затем стимулируют 10 Ед./мл Epo (R&D Systems) в течение 30 минут. Получают лизаты клеток и или иммуноосаждают с помощью Еро рецептора Ab, или сразу же отделяют с помощью SDS-PAGE. Исследуют иммуноблоты с Akt, фосфо-Akt (Ser473 или Thr308), фосфо-Gab1 (Y627), Gab1, IRS2, актином и IRF-1 Abs и анализируют на Storm 860 Imager (визуализаторе) с использованием программного обеспечения ImageQuant (Molecular Dynamics).
5.48.5 Анализ клеточного цикла
Клетки обрабатывают ДМСО или некоторым количеством предлагаемого в описании соединения на протяжении ночи. Проводят окрашивание иодидом пропидия для клеточного цикла с использованием CycleTEST PLUS (Becton Dickinson) в соответствии с инструкцией производителя. После окрашивания клетки анализируют с помощью FACSCalibur поточного цитометра с использованием программного обеспечения ModFit LT (Becton Dickinson).
5.48.6 Анализ апоптоза
Клетки обрабатывают ДМСО или некоторым количеством предлагаемого в описании соединения в разные моменты времени, затем промывают аннексин-V промывочным буфером (BD Biosciences). Клетки инкубируют с аннексин-V связывающим белком и иодидом пропидия (BD Biosciences) в течение 10 минут. Образцы анализируют с помощью поточной цитометрии.
5.48.7 Анализ люциферазы
Клетки Namalwa трансфектируют 4 мкг AP1-люцеферазы (Stratagene) на 1×106 клеток и 3 мкл реагента липофектамина 2000 (Invitrogen) в соответствии с инструкцией производителя. Через шесть часов после трансфекции клетки обрабатывают ДМСО или некоторым количеством предлагаемого в описании соединения. Активность люциферазы анализируют с использованием лизисного буфера люциферазы и субстрата (Promega) и измеряют с использованием люминометра (Turner Designs).
5.48.8 Анализ антипролиферации
День 1: Клетки высевают в 96-луночную планшету 50 мкл/лунку в 10% FBS RPMI (wl Glutamine, w/о pen-strip) на протяжении ночи. Используют следующие клетки:
Клетки колореактального рака: Colo 205 3200 клеток/лунку; положительный контроль иринотекан
Клетки рака поджелудочной железы: BXPC-3 1200 клеток/лунку; положительный контроль гемцитабин
Клетки рака простаты: РС3 1200 клеток/лунку; положительный контроль доцетаксел
Клетки рака груди: MDA-MB-231 2400 клеток/лунку; положительный контроль паклитаксел
День 2: Соединения серийно разбавляют от 0,00001 мкм~10 мкм (или 0,000001~1 мкМ) 50 мкл/лунку (2×) и добавляют в планшеты с двойным повтором с относительным положительным контролем. Планшеты затем инкубируют при 37°С в течение 72 часов.
День 5: Результаты определяют по методу CellTiter Glo. 100 мкл/лунку реагента CellTiter Glo добавляют в планшеты и инкубируют в течение 10 минут при комнатной температуре, а затем анализируют на считывающем устройстве Top Count. Показатель ИК50 каждого соединения обычно основывается на результате двух или более отдельных экспериментов.
5.49 ИНГИБИРОВАНИЕ TNFα
Способности некоторых соединений в отношении ингибирования TNFα определяли с использованием процедур, сходных по существу с процедурами, описанными в Разделе 5.48.1 выше.
Испытуемые соединения включали в себя: 3-(7-амино-2-метил-4-оксо-4H-хиназолин-3-ил)пиперидин-2,6-дион; 3-(2,7-диметил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион; 3-(2,8-диметил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион; 3-(6,7-диметокси-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион; 3-(7-фтор-2-метил-4-оксо-4H-хиназолин-3-ил)пиперидин-2,6-дион; 3-(7-хлор-2-метил-4-оксо-4H-хиназолин-3-ил)пиперидин-2,6-дион; 3-(7-бром-2-метил-4-оксо-4H-хиназолин-3-ил)пиперидин-2,6-дион; 3-(8-бром-2-метил-4-оксо-4H-хиназолин-3-ил)пиперидин-2,6-дион; 3-(8-гидрокси-2-метил-4-оксо-4H-хиназолин-3-ил)пиперидин-2,6-дион; 3-(2-метил-4-оксо-8-трифторметил-4H-хиназолин-3-ил)пиперидин-2,6-дион; [3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]амид гептановой кислоты; [3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]амид циклопропанкарбоновой кислоты; 2-(4-хлорфенил)-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]ацетамид; 1-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-3-гексилмочевину; 1-(4-хлорфенил)-3-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]мочевину; 1-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-3-м-толилмочевину; 1-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-3-(4-трифторметоксифенил)мочевину; N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-4-трифторметил-сульфанилбензамид; 1-(3-хлор-4-метилфенил)-3-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]мочевину; 4-хлор-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]бензамид; N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-3-трифторметилбензамид; N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-4-трифторметоксибензамид; 3,4-дихлор-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]бензамид; и N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-4-трифторметилбензамид. По данным испытаний определили, что величины ИК50 испытуемых соединений составляют в пределах 0,01-25 мкМ.
5.50 ПРОДУЦИРОВАНИЕ IL-2
Способности некоторых соединений в отношении стимулирования продуцирования IL-2 определяли с использованием процедур, сходных по существу с процедурами, описанными в Разделе 5.48.2 выше.
Испытуемые соединения включали в себя:
3-(6-амино-2-метил-4-оксо-4H-хиназолин-3-ил)пиперидин-2,6-дион; 3-(7-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион; 3-(7-фтор-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион; 3-(7-хлор-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион; 3-(7-бром-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион; 3-(6-гидрокси-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион; 1-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-3-гексилмочевину; и 1-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-3-(4-трифторметоксифенил)мочевину. По данным испытаний определили, что величины ЕС50 испытуемых соединений составляют в пределах 0,1-3,5 мкМ.
5.51 КЛЕТОЧНАЯ ПРОЛИФЕРАЦИЯ
Способности некоторых соединений в отношении ингибирования пролиферации клеток Namalwa AG4 определяли с использованием процедур, сходных по существу с процедурами, описанными в Разделе 5.48.3 выше.
Испытуемые соединения включали в себя: 3-(6-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион; 3-(7-амино-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион; 3-(7-фтор-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион; 3-(7-хлор-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион; 3-(7-бром-2-метил-4-оксо-4Н-хиназолин-3-ил)пиперидин-2,6-дион; [3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]амид гептановой кислоты; 2-(4-хлорфенил)-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]ацетамид; 1-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-3-гексилмочевину; 1-(4-хлорфенил)-3-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]мочевину; 1-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-3-м-толилмочевину; 1-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-3-(4-трифторметоксифенил)мочевину; N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-4-трифторметил-сульфанилбензамид; 1-(3-хлор-4-метилфенил)-3-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]мочевину; N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-3-трифторметилбензамид; N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-4-трифторметоксибензамид; 3,4-дихлор-N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-5-илметил]бензамид; и N-[3-(2,6-диоксопиперидин-3-ил)-2-метил-4-оксо-3,4-дигидрохиназолин-6-илметил]-4-трифторметилбензамид. По данным испытаний определили, что величины ИК50 испытуемых соединений составляют в пределах 0,01-5,5 мкМ.
Воплощения изобретения, описанные выше, представлены лишь в качестве примеров, и специалисты в данной области очевидно осознают или способны установить с использованием не более чем обычного экспериментирования многочисленные эквиваленты конкретных соединений, материалов и процедур. Считается, что все такие эквиваленты находятся в объеме изобретения и охватываются прилагаемыми пунктами формулы изобретения.
Все патенты, патентные заявки и публикации, на которые даются ссылки в описании, целиком включены в описание. Цитирование или идентификация любой ссылки не допускается, чтобы такая ссылка не была доступной в качестве источника, известного в данной области техники до данного изобретения. Полный объем изобретения лучше понятен при обращении к прилагаемой формуле изобретения.