Результат интеллектуальной деятельности: СПОСОБ ТЕРАПИИ ПОВРЕЖДЕНИЙ КОЖИ И БИОТРАНСПЛАНТАТ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ
Вид РИД
Изобретение
Изобретение относится к медицине, к области биотехнологий и клеточным технологиям и может быть использовано для лечения некротических тканевых дефектов, в частности нейротрофических язв нижних конечностей при сахарном диабете - (СД), трофических язв и пролежней, в геронтологии, комбустиологии, а также в молекулярной фармакологии для разработки методов генно-клеточной терапии и в научных исследованиях.
Известно, что при биологическом старении, наряду с уменьшением количества тканевых фибробластов, последние характеризуются снижением пролиферативной активности и восприимчивости (реакционноспособности) к факторам роста [Campisi J. Molecular mechanisms of intrinsic aging // Ann. Dermatol. Venereol. - 2002. - Vol. 129. - P. 1100]. В результате снижается синтез фибробластами белков коллагена и эластина, а также компонентов аморфного вещества соединительной ткани дермы и в то же время интенсивность синтеза фибробластами металлопротеиназ, разрушающих коллаген и эластин, возрастает [Jenkins G. Molecular mechanisms of skin ageing. // Mech. Ageing. Dev. 2002 Apr; 123(7):801-10; 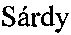 M. Role of matrix metalloproteinases in skin ageing. // Connect Tissue Res. 2009; 50(2):132-8]. Это сопровождается истончением кожных покровов, повышенной склонностью к травматизации, а при СД - нарушением трофики и снижением чувствительности нервных окончаний, что значительно снижает эффективность терапии повреждений кожи.
M. Role of matrix metalloproteinases in skin ageing. // Connect Tissue Res. 2009; 50(2):132-8]. Это сопровождается истончением кожных покровов, повышенной склонностью к травматизации, а при СД - нарушением трофики и снижением чувствительности нервных окончаний, что значительно снижает эффективность терапии повреждений кожи.
Поэтому в настоящее время сохраняется актуальность проблемы терапии трофических и нейротрофических язв, ожогов, пролежней. Наиболее преспективным направлением считается применение тканеинженерных конструкций на основе жизнеспособных культивированных клеток [Husing В., Buhrlen В., Gaisser S. Human Tissue Engineered Products - Today′s Markets В., Buhrlen В., Gaisser S. Human Tissue Engineered Products - Today's Markets and Future Prospects // Fraunhafer Institutr for Systems and Innovation Research, Karlsruher, Germany, 2003, Р60]. С целью создания тканеинженерных конструкций применяются клетки кожи, получаемые от пациента в результате биопсии (аутологичные клетки), или клетки типовых клеточных линий (аллогенные клетки). После выращивания необходимого количества клетки комбинируют с биоразлагаемой матрицей (применяют биоразлагаемые нетоксичные полимеры - коллаген, декстраны, фибрин, полилактон и их комбинации), а полученная тканеинженерная конструкция используется для восполнения дефектов кожи [Зорин В.Л. с соавт. Характеристика мирового рынка клеточных технологий. Клеточная трансплантология и тканевая инженерия. 2010, T.V, №3, с. 96-115].
Однако, как показывает клинический опыт, эффективность применения таких конструкций при нейротрофических язвах нижних конечностей остается невысокой. Так, эффективность применения наиболее распространенного продукта в мире Apligraf® на основе аллогенных клеток не превышает 56% [http://www.drugs.com/drp/apligraf.html], а эффективность BioSeed® (на основе аутологичных клеток), как было показано в мультицентровом плацебо контролируемом клиническом исследовании - 38.3% [Vanscheidt W., Ukat A., Horak V. et al. Treatment of recalcitrant venous leg ulcers with autologous keratinocytes in fibrin sealant: a multinational randomized controlled clinical trial // Wound Repair Regen. 2007 May-Jun; 15(3):308-15].
Анализ причин невысокой эффективности клеточной терапии повреждений кожи продемонстрировал ее обусловленность тремя причинами:
1. В случае использования аллогенных клеток типовых линий наблюдается только временный эффект вследствие отторжения и последующего разрушения генетически чужеродных клеток.
2. При использовании аутологичных клеток последние ускоренно утрачивают восстановительный потенциал вследствие их интенсивного деления и, тем самым, достижения клетками барьера Хейфика, что особенно выражено у пациентов старших возрастных групп.
3. В условиях раны создаются неблагоприятные условия для жизнедеятельности как аллогенных, так и аутологичных клеток - недостаток кислорода, пластических и энергетических субстратов, воздействие токсичных веществ, факторов воспаления и пр., вследствие чего часть нанесенных на рану наименее жизнеспособных клеток гибнет уже в первые сутки.
Известны исследования, направленные на повышение жизнеспособности клеток в раневом окружении путем дополнительной стимуляции их пролиферации, применения антиоксидантов, метаболитов, создания барьера между трансплантированными клетками и агрессивным раневым содержимым [Horáková L., Licht A., Sandig G. et al., Standardized extracts of flavonoids increase the viability of PC12 cells treated with hydrogen peroxide: effects on oxidative injury. // Arch / Toxicol. 2003 Jan; 77(l):22-9. Epub 2002 Oct 16; Levit R.D. et al. Cellular encapsulation enhances cardiac repair. // J. Am. Heart Assoc. 2013; 2: е00036; Sokolova T.V., Furaev V.V., Avrova N.F., Victorov I.V., Andreeva N.A. Stimulation by gangliosides of viability of rat brain neurons and of neuronal PC12 cell line under conditions of oxidative stress // Journal of Evolutionary Biochemistry and Physiology. 2005. T. 41. №4. C. 415-423].
Однако данные способы оказывают или кратковременный эффект или, в случае применения факторов роста, приводят к ускоренному истощению регенераторного потенциала трансплантированных клеток вследствие достижения последними барьера Хейфика.
Как было показано ранее, эффективность коррекции возрастных изменений кожи посредством трансплантации аутологичных фибробластов зависит от длины теломерных концов хромосом, сокращающихся при каждом делении клетки [Макеев О.Г., Улыбин А.И., Зубанов П.С., Малишевская Е.Г. Отчет о трехлетних испытаниях аутологичных дермальных фибробластов для коррекции дефектов кожи. // Вестник Уральской медицинской академической науки. Екатеринбург, 2008, №4. С. 63-70].
Основной механизм восстановления длины теломер в неопухолевых клетках обеспечивается ферментом теломеразой. Однако в прогениторных и дифференцированных клетках, в том числе в фибробластах, кератиноцитах, эпителиоцитах экспрессия гена теломеразы необратимо подавлена.
Наиболее близким решением является патент ЕР 02133908 А2, предусматривающий создание тканеинженерной конструкции на основе клеток и биоразлагаемого матрикса с возможностью включения в состав матрикса дополнительных средств поддержания жизнедеятельности клеток.
Однако данный способ не позволяет поддерживать регенераторный потенциал клеток, поскольку не предполагает стимуляции синтеза клетками теломеразы и удлинения теломер, продлевающих функциональную активность и продолжительность жизни клеток.
Задачей изобретения является повышение качества лечения повреждений кожи путем поддержания регенераторного потенциала трансплантируемых клеток посредством повышения экспрессии гена теломеразы в культурах фибробластов, наносимых на раневую поверхность, без изменения общей схемы их применения.
Задача решается тем, что в процессе культивирования фибробласты предварительно трансфецируют генетическими плазмидными векторами, обеспечивающими эктопическую экспрессию гена теломеразы. При этом первичную культуру клеток фибробластического дифферона получают из эксплантата, взятого под местной анестезией с ягодичной области самого пациента, и трансфецируют плазмидными векторами pLPC myc hPOT1 (Adgene Plasmid 12387) и pLPC myc hPOT1 delta OB (Adgene Plasmid 13241) [Loayza D. et al POT1 as a terminal transducer of TRF1 telomere length control // Nature. 2003 Jun 26. 423(6943); Veldman Т., Etheridge K.T., Counter C.M. Loss of hPot1 Function Leads to Telomere Instability and a cut-like Phenotype. // Current Biology, Volume 14, Issue 24, 2264-2270, 29 December 2004] с использованием набора Lipofectamine™ 2000 (Invitrogen) согласно протоколу производителя, причем об эффективности трансфекции судят по количеству живых клеток в среде, содержащей 1 мкг/мл пуромицина (Sigma).
После получения резистентной к пуромицину клеточной культуры, трансфецированные генами теломеразы клетки наносят на биоразлагаемую матрицу на основе полимеризованной гиалуроновой кислоты с плотностью не менее 0,3*106 клеток на см2 не более чем за 24 часа до наложения полученного биотрансплантата на раневую поверхность клетками к ране. Наложенный биотрансплантат фиксируют на ране адсорбирующей повязкой для «влажного» заживления, при этом векторы функционируют в фибробластах биотрансплантата в течение первых 3-4 недель, обеспечивая устойчивость клеток к агрессивному раневому содержимому.
Способ осуществляют последовательно в следующем порядке.
Первичную культуру клеток фибробластического дифферона получают по способу получения культуры клеток кожи (См. Патент РФ №2345781. Бюл. изобр. РФ №4, 10.02.2009).
Клетки снимают с культуральной поверхности флаконов с использованием раствора трипсина - версена (Sigma) по стандартной методике. Снятые клетки помещают в 24 луночные планшеты. По достижении 70% конфлюентности клетки инкубируют в среде DMEM с добавлением 10% FBS, 10 нг/мл FGF, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина (Sigma) и трансфецируют генами, встроенными в векторы: pLPC myc hPOT1 (Adgene Plasmid 12387) и pLPC myc hPOT1 delta OB (Adgene Plasmid 13241) [Loayza D. et al POT1 as a terminal transducer of TRF1 telomere length control // Nature. 2003 Jun 26. 423(6943); Veldman Т., Etheridge K.T., Counter C.M. Loss of hPot1 Function Leads to Telomere Instability and a cut-like Phenotype. // Current Biology, Volume 14, Issue 24, 2264-2270, 29 December 2004] с использованием набора Lipofectamine™ 2000 (Invitrogen) согласно протокола производителя. Клетки продолжают культивировать в среде DMEM с добавлением 10% FBS, 10 нг/мл FGF, 100 ед/мл пенициллина, 100 мкг/мл стрептомицина и 1 мкг/мл пуромицина, поскольку обе плазмиды в качестве селективной метки содержат ген устойчивости к пуромицину (Sigma). Смену среды производят каждые 3 дня. Об эффективности трансфекции судят по количеству живых клеток в среде.
Оценку жизнеспособности фибробластов проводят, окрашивая клетки 0,4% раствором трипанового синего (Sigma). Окрашенные образцы исследуют под световым микроскопом в камере Горяева и подсчитывают окрашенные и неокрашенные клетки в количестве не менее 500 клеток в каждом образце, рассчитывая процент жизнеспособных клеток от общего количества подсчитанных клеток. Полученные результаты обрабатывают с использованием пакета непараметрической оценки Simple cell. Различия между опытной и контрольной группой считают достоверными при p<0.05 (Таблица 1).

Как следует из полученных данных (Таблица 1), доля жизнеспособных фибробластов, после их трансфекции генами теломеразы, достаточно высока (96,4%) и воспроизводима (отклонение менее 3,5%).
Пример 1.
В опытах исследовали параметры 30 суточных культур фибробластов (5-6 пассаж), полученных из кожных эксплантатов с ягодичной области, взятых от 15 различных доноров, возраст которых составлял от 45 до 59 лет, во время плановых оперативных вмешательств, предполагающих иссечение участка кожи.
Первичную культуру клеток фибробластического дифферона получают по способу получения культуры клеток кожи (См. Патент РФ №2345781. Бюл. изобр. РФ №4, 10.02.2009).
Клетки снимают с культуральной поверхности флаконов с использованием раствора трипсина - версена (Sigma) по стандартной методике. Снятые клетки каждой линии разделяют на две равные части - контрольную группу (15 клеточных линий - по одной от каждого пациента) и опытную группу (15 клеточных линий - по одной от каждого пациента) и помещают в 24 луночные планшеты. По достижении 70% конфлюентности контрольную группу клеток продолжают инкубировать в среде DMEM с добавлением 10% FBS, 10 нг/мл FGF, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина (Sigma), а опытную группу клеток трансфецируют векторами: pLPC myc hPOT1 (Adgene Plasmid 12387) и pLPC myc hPOT1 delta OB (Adgene Plasmid 13241) [Loayza D. et al POT1 as a terminal transducer of TRF1 telomere length control // Nature. 2003 Jun 26. 423(6943); Veldman Т., Etheridge K.T., Counter CM. Loss of hPotl Function Leads to Telomere Instability and a cut-like Phenotype. // Current Biology, Volume 14, Issue 24, 2264-2270, 29 December 2004] с использованием набора Lipofectamine™ 2000 (Invitrogen) согласно протоколу производителя и затем культивируют в среде DMEM с добавлением 10% FBS, 10 нг/мл FGF, 100 ед/мл пенициллина, 100 мкг/мл стрептомицина и 1 мкг/мл пуромицина (Sigma). Смену среды производят каждые 3 дня.
Специфическую функцию фибробластов оценивали по включению в макромолекулы меченых селективных предшественников синтеза ДНК (214С-тимидин), коллагена (L-U14C-пролин) и кислых ГАГов (D-63Н-глюкозамин гидрохлорид). Для оценки количества теломер использовали сайтспецифичный олигонуклеотидный зонд (СССТАА)3 с включением в структуру зонда меченого по тритию дезоксицитидина (все радиофармпрепараты Amersham Pharmacia Biotech). Радионуклиды с активностью 37 кБк/мл среды вносили на 75 см2 матрасы одновременно с 0.5×106 фибробластов из вторичной 30-суточной культуры. Эксперимент прерывали через трое суток культивирования, фибробласты снимали с флаконов раствором трипсина-версена по стандартной методике и подсчитывали на гематологическом анализаторе. Оценку количества теломер методом гибридизации проводили после выделения ДНК культивированных клеток и отжига цепей. Полученные комплексы осаждали на нитроцеллюлозных фильтрах (Sartorius, Германия).
Подсчет радиоактивности производили в спирто-толуоловом сцинтилляторе на жидкостном сцинтилляционном счетчике Бета-2 (эффективность счета по углероду - 98%, по тритию - 56%). Результаты выражали в беккерелях на 106 клеток.
Для оценки синтетической активности по включению 214С-тимидина клетки отмывали от свободной радиоактивности переосаждением в изотоническом растворе и трехкратно - этанолом. Гидролиз ДНК проводили 5% раствором муравьиной кислоты при нагревании с последующим упариванием и перерастворением в этаноле для подсчета радиоактивности.
С целью изучения синтеза коллагена, после удаления фибробластов 0.25% раствором трипсина, не повреждающим коллагеновые волокна, матрасы многократно отмывали от невключившегося меченого L-пролина. Адгезированные на пластике волокна двухкратно обезвоживали пропанолом, а пролин и оксипролин экстрагировали с культуральной поверхности кислым этанолом при нагревании. Полученные экстракты упаривали и перед радиометрией перерастворяли в этаноле.
Применение глюкозамина, содержащего тритий в шестом положении, позволяет оценить синтез в культуре гидрофильных высокомолекулярных ГАГов (глюкуроновая кислота и хондроитин сульфат) и пренебречь возможностью его окисления (при окислении N-63Н удаляется с образованием 3Н2О). После подсчета клеток культуру инкубировали в 5% растворе трипсина при 37°С для отделения связанных с ГАГами белков. Из экстракта высокополимерные ГАГи выделяли трехкратным переосаждением смесью этанол-эфир. Препарат ГАГов перерастворяли в воде и радиометрировали в гетерогенной системе с введением в сцинтилляционную жидкость детергента тритон Х-100.
Для исследования деструктивных потенций культивируемых фибробластов использовали наборы реагентов для количественного определения металлопротеиназы-1 (Cusabio) согласно протоколу изготовителя. Полученные значения выражали в нанограммах на миллилитр культуральной среды (Таблица 2).
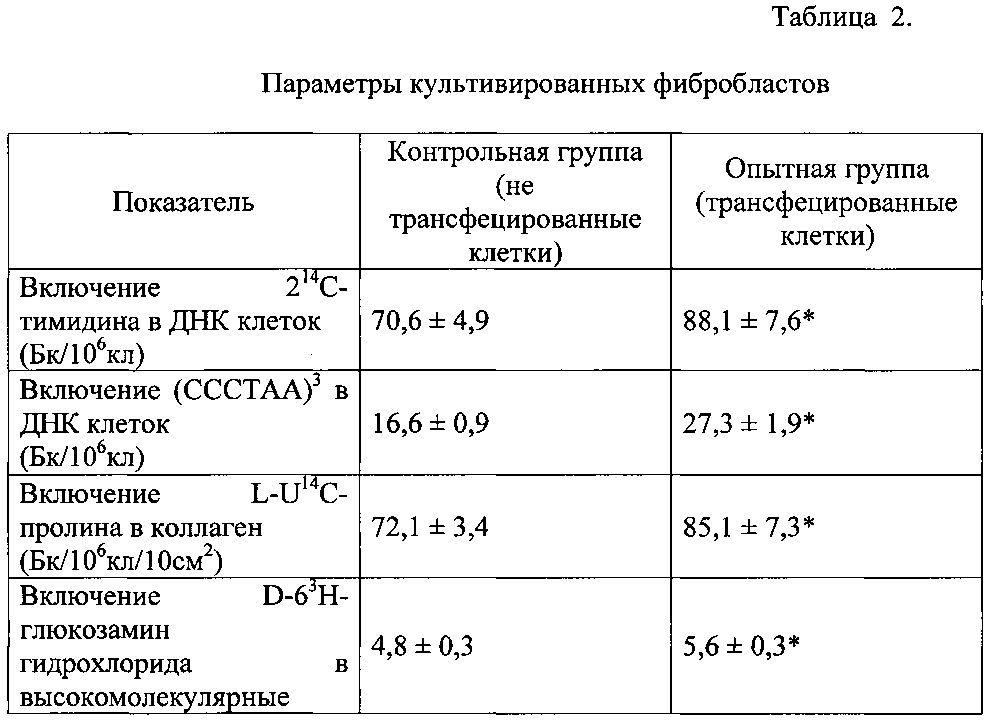

Как следует из полученных данных (Табл. 2), трансфецированные генами теломеразы клетки отличаются от контрольной группы большей длиной теломер (на 64% по включению (СССТАА)3 в ДНК клеток). Увеличение длины теломер сопровождается повышением пролиферативного потенциала трансфецированных клеток (на 24% по включению 214С-тимидина в ДНК по сравнению с контрольной группой), большей интенсивностью синтеза коллагена и глюкозамингликанов (на 18% и 17% соответственно) и снижением активности металлопротеиназ. Таким образом, клетки, трансфецированные геном теломеразы, обладают большим восстановительным потенциалом в отношении синтеза основных макромолекул соединительной ткани по сравнению с нетрансфецированными, а снижение металлопротеиназной активности способно не только обеспечить большую сохранность новообразованных молекул коллагена, но и ускорить процесс заживления повреждений кожи.
Пример 2. В эксперименте использовались старые (4-5 лет) кролики-самцы породы Шиншилла (n=20). Животные были разделены на две равные группы: контрольную и опытную по случайному принципу. У всех животных до начала эксперимента с области спины был взят кожный эксплантат. Параллельно с получением необходимой клеточной массы, всем животным наносилась кожная рана СО2-лазером, путем трехкратного прохождения по участку кожи спины лазером на общую глубину 150 мкм (толщина сосочкового слоя и эпидермиса 300 мкм) по 50 мкм за каждый проход. Перед нанесением раны участок кожи освобождался от шерсти. Площадь кожной раны составила 1 см2. После получения необходимого количества фибробластов, клетки контрольной группы продолжали культивировать по стандартной методике, а клетки опытной группы трансфецировали векторами генов теломеразы: pLPC myc hPOT1 (Adgene Plasmid 12387) и pLPC myc hPOT1 delta OB (Adgene Plasmid 13241) с использованием набора Lipofectamine™ 2000 (Invitrogen) согласно протоколу производителя и затем культивировали в среде DMEM с добавлением 10% FBS, 10 нг/мл FGF, 100 ед/мл пенициллина, 100 мкг/мл стрептомицина и 1 мкг/мл пуромицина (Sigma). Через 7 дней после трансфецирования клетки обеих групп наносили на биоразлагаемую матрицу на основе полимеризованной гиалуроновой кислоты из расчета не менее 0,3*106 клеток на см2 и через 24 часа - животным контрольной группы - биотрансплантаты с нетрансфецированными клетками, а опытной группы - биотрансплантаты с трансфецированными клетками - на область кожной раны, со строгим соблюдением принципа аутологичности. Через месяц после нанесения клеток, у обеих групп животных производилась биопсия области кожной раны для гистологической оценки восстановления дермы и оценки эффективности предложенного способа.
На Фигурах 1; 2; 3 представлены фото микропрепаратов образцов кожи кроликов до и в процессе эксперимента.
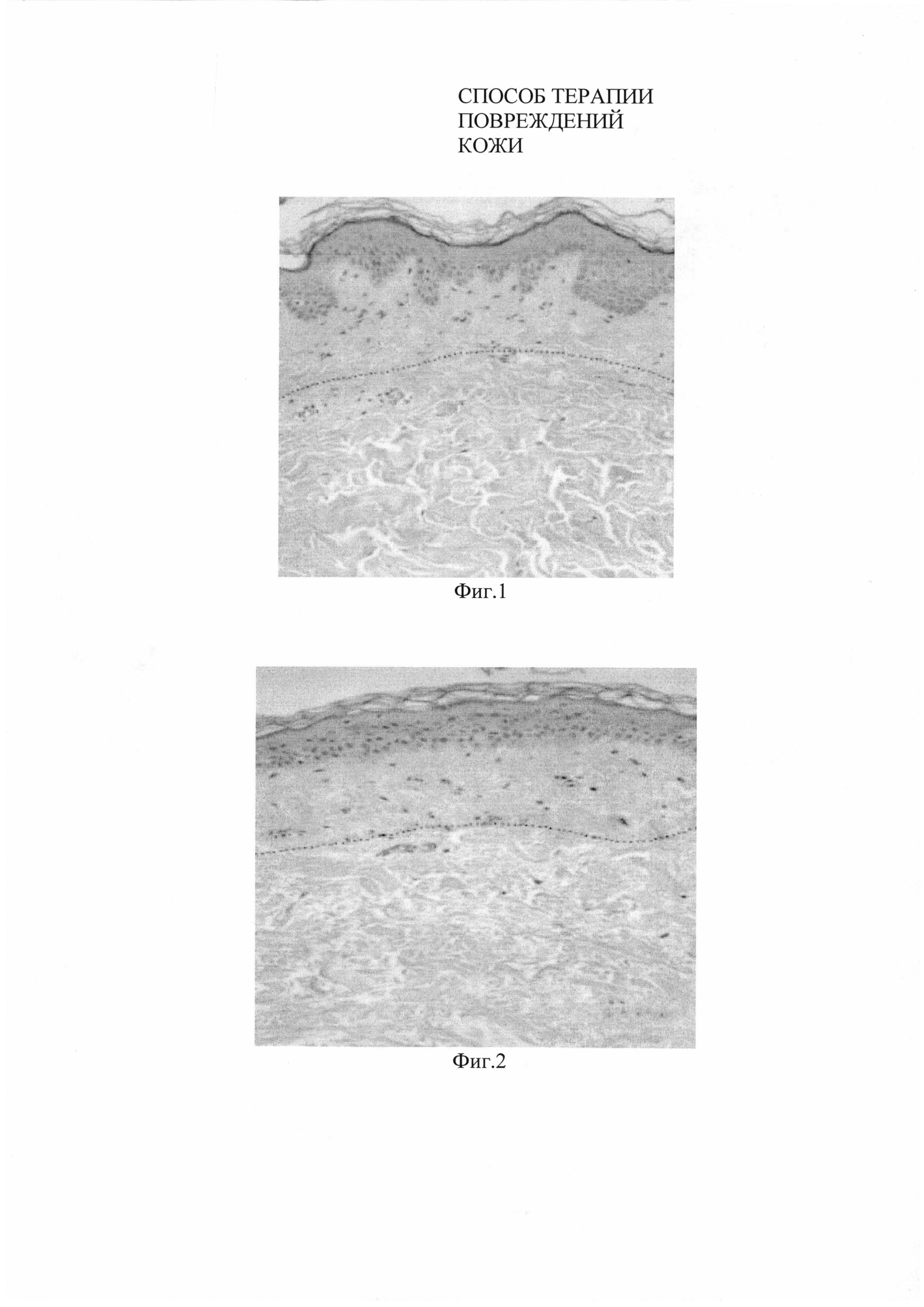
Фиг. 1. Микропрепарат кожи кролика до нанесения кожной раны. Отчетливо виден выраженный сосочковый слой. Окраска гематоксилин/эозин. Ув. x 200.
Фиг. 2. Микропрепарат кожи кролика через 30 дней после нанесения биотрансплантата на основе нетрансфецированных фибробластов. Сосочковый слой не выражен. Окраска гематоксилин/эозин. Ув. x 200.
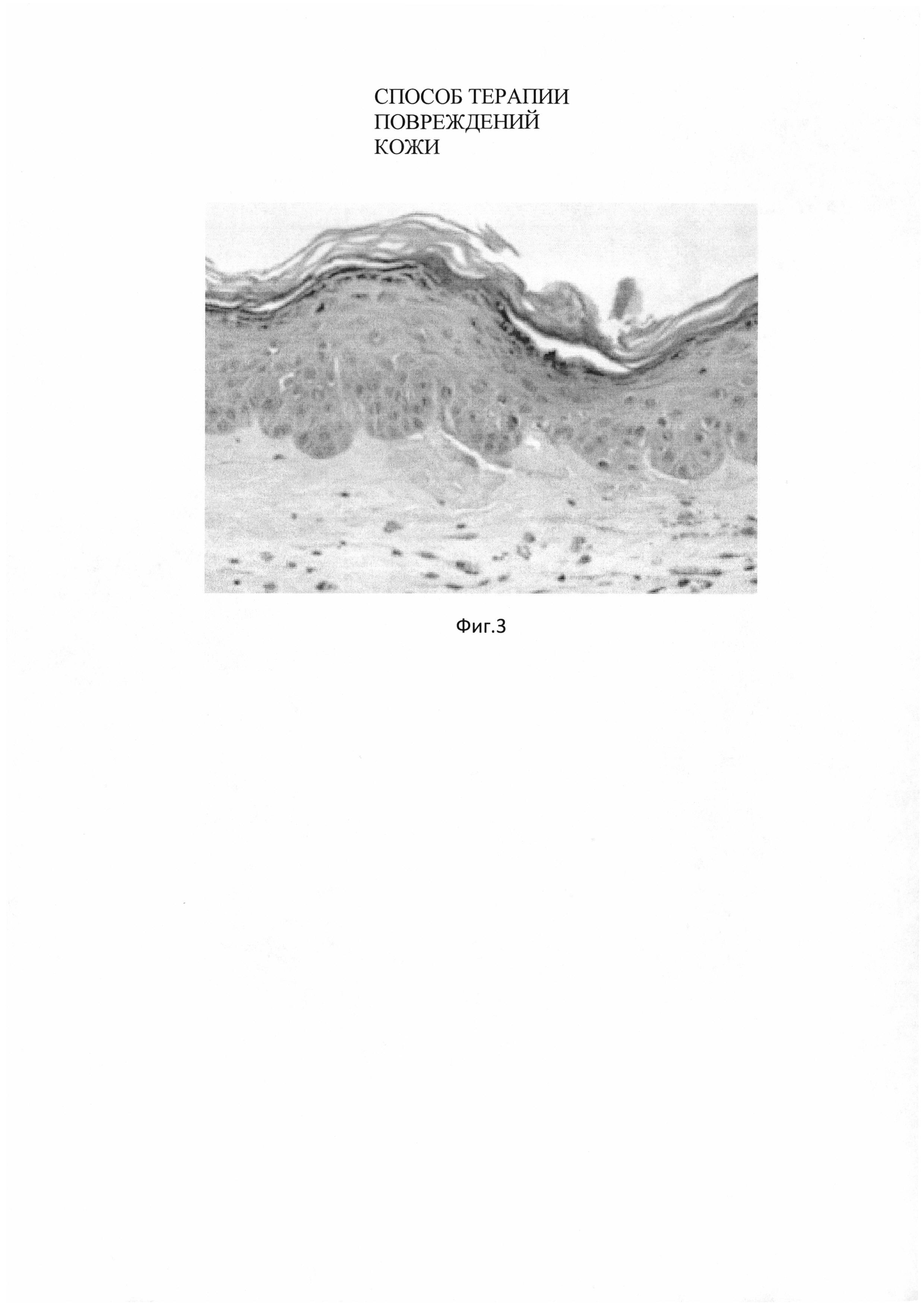
Фиг. 3. Микропрепарат кожи кролика опытной группы через 30 дней после нанесения биотрансплантата на основе трансфецированных фибробластов. Восстановление структуры сосочкового слоя. Окраска гематоксилин/эозин. Ув. x 200.
Пример 3. Клинические испытания разработанного способа проводили после согласования протокола с ЛЭК ГБОУ ВПО Уральского государственного медицинского университета Минздрава России.
Первичную культуру клеток фибробластического дифферона получали по способу получения культуры клеток кожи (См. Патент РФ №2345781 Бюл. изобр. РФ №4, 10.02.2009) из эксплантата, взятого под местной анестезией с ягодичной области самого пациента. Испытания проводили при строгом соблюдении принципа аутологичности с разведением манипуляций с культурами клеток каждого пациента по расстоянию и времени.
Клетки снимали с культуральной поверхности флаконов с использованием раствора трипсина - версена (Sigma) по стандартной методике. Снятые клетки каждого пациента помещали в 24 луночные планшеты. По достижении 70% конфлюентности культуры клеток трансфецировали векторами генов теломеразы: pLPC myc hPOT1 (Adgene Plasmid 12387) и pLPC myc hPOT1 delta OB (Adgene Plasmid 13241) с использованием набора Lipofectamine™ 2000 (Invitrogen) согласно протоколу производителя и затем культивировали в среде DMEM с добавлением 10% FBS, 10 нг/мл FGF, 100 ед/мл пенициллина, 100 мкг/мл стрептомицина и 1 мкг/мл пуромицина (Sigma), поскольку обе плазмиды в качестве селективной метки содержат ген устойчивости к пуромицину. Смену среды производили каждые 3 дня.
Оценка безопасности полученных культур клеток
Потенциальную инфицированность испытуемых возбудителями социально-значимых заболеваний (ВИЧ, вирусные гепатиты В, С, цитомегаловирусная инфекция, туберкулез, токсоплазмоз, инфекции, вызываемые Chlamydia spp.) исключали иммунофлюоресцентным и иммунополяризационным методами с использованием закрытых систем (AbbotLab) на анализаторе AxSym или с помощью ПЦР-анализа (с применением наборов Flash).
Анализ ДНК на наличие мутаций в трансфецированных клетках проводили в соответствии с трехэтапной схемой: 1) скрининг на наличие изменения структуры экзонов генов-супрессоров опухолевого роста и протоонкогенов с использованием SSCP-анализа; 2) уточнение структурных изменений в экзонах посредством аллель-специфичной ПЦР и рестрикционного анализа экзонов; 3) верифицикация типа и положения мутации, а также количества мутантных аллелей в образце в ходе RT-ПЦР.
По результатам проведенных анализов культуры клеток были признаны безопасными для их применения в клинических испытаниях.
На Фигурах 4; 5; 6; 7; 8 представлены фотоснимки этапов применения способа лечения язв конечностей у пациентов при клинических испытаниях в ГКБ №40 г. Екатеринбург.
За 24 часа до начала испытаний трансфецированные клетки отмывали от культуральной среды и наносили на биоразлагаемую матрицу на основе полимеризованной гиалуроной кислоты в количестве не менее 0,3*106 клеток на см2 и после адгезии клеток на матрице биотрансплантат наносили на раневую поверхность клетками к ране и фиксировали адсорбирующей повязкой «Тиелле» (для «влажного» заживления). Количество клеток на биотрансплантате определялось площадью раневого дефекта и тканеинженерной конструкции для полного закрытия краев раны.
Для определения площади раневого дефекта и соответствующего биотрансплантата использовали формулу определения площади круга: S=πR2, но так как края раны чаще были неровными, за радиус принимали среднее значение, получаемое сложением двух радиусов (самого большого и самого малого) с последующим делением на 2.
Пациент №1 (возраст 68, лет, пол женский).
Диагноз: Сахарный диабет 2 типа, тяжелой степени, инсулинозависимый, субкомпенсация. Синдром диабетической стопы, нейро-ишемический тип. Ангиопатия сосудов нижних конечностей. Трофическая язва левой стопы.
Стаж заболевания 25 лет. В 2007 году была выполнена экзартикуляция I и II пальцев с резекцией плюсневых костей, некрэктомия, вскрытие, дренирование флегмоны левой стопы. Повторно госпитализирована в 4 хирургическое отделение ГКБ №40 г. Екатеринбурга через 7 недель с гранулирующей раной левой стопы размерами 6×5 см. Выполнена свободная аутодермопластика, лоскут прижился на участке площадью 0,5 см2. Хирургические вмешательства оказались малоэффективны. Рекомендована ампутация стопы. К моменту забора кожного эксплантата на протяжении более 3 месяцев имелся язвенный дефект на левой стопе размерами 6,7×5,9 см.
Язва санировалась ежедневно с применением стандартного марлевого перевязочного материала. Область вокруг язвенного дефекта обрабатывалась 70% спиртовым раствором. Обработка раны производилась хлоргексидином 0,05%. Санация раны производилась Левомеколем.
Конечность иммобилизировали с помощью повязки Total Contact Cast.
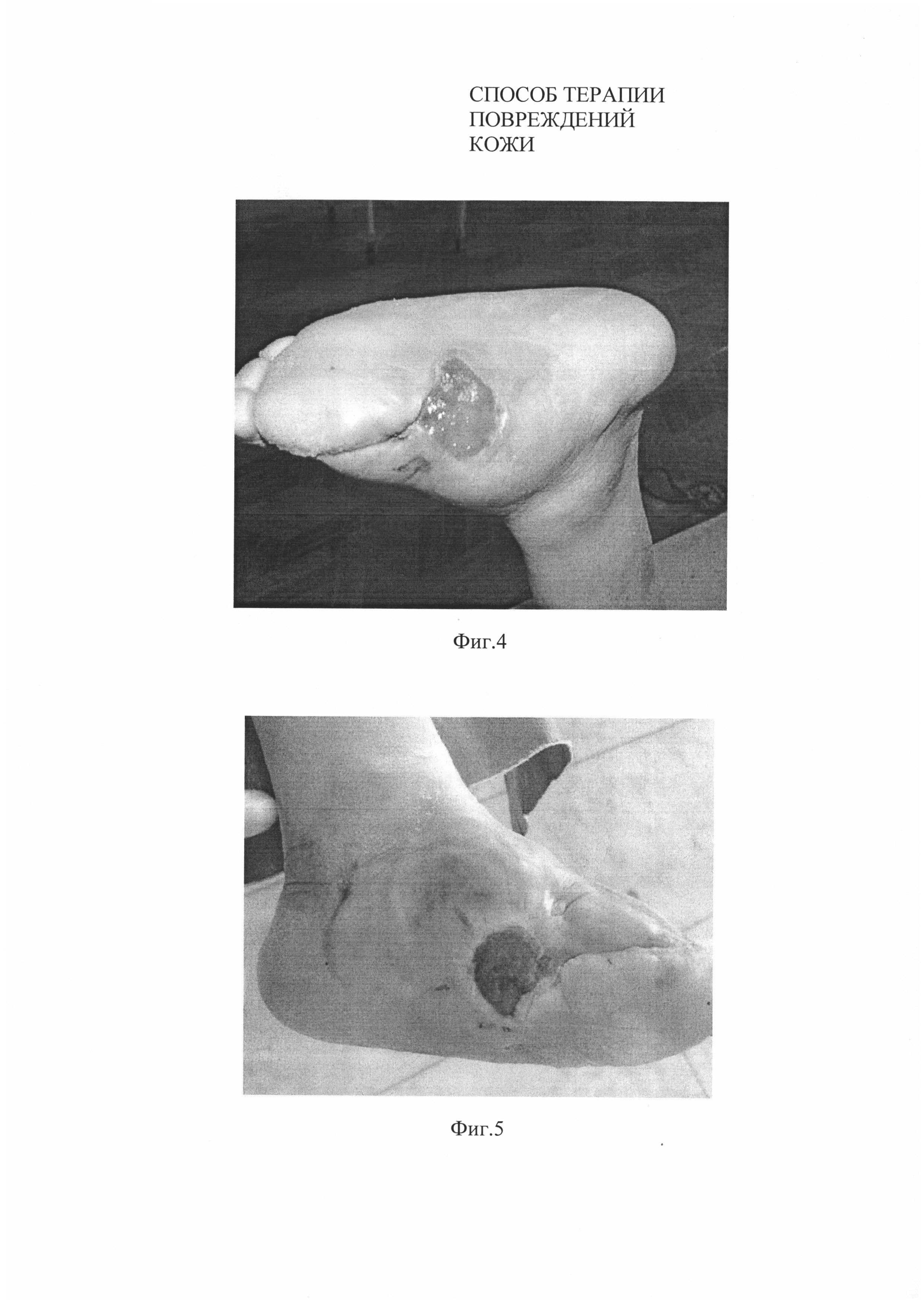
На момент проведения испытания размеры язвенного дефекта левой стопы 6×5 см (S=24 см2) (Фиг. 4).
Культуру трансфецированных аутофибробластов, нанесенную на биоразлагаемую матрицу площадью 30 см2 и содержащую 12×106 клеток, наносили на язвенный дефект, закрепляя на ране повязкой «Тиелле».
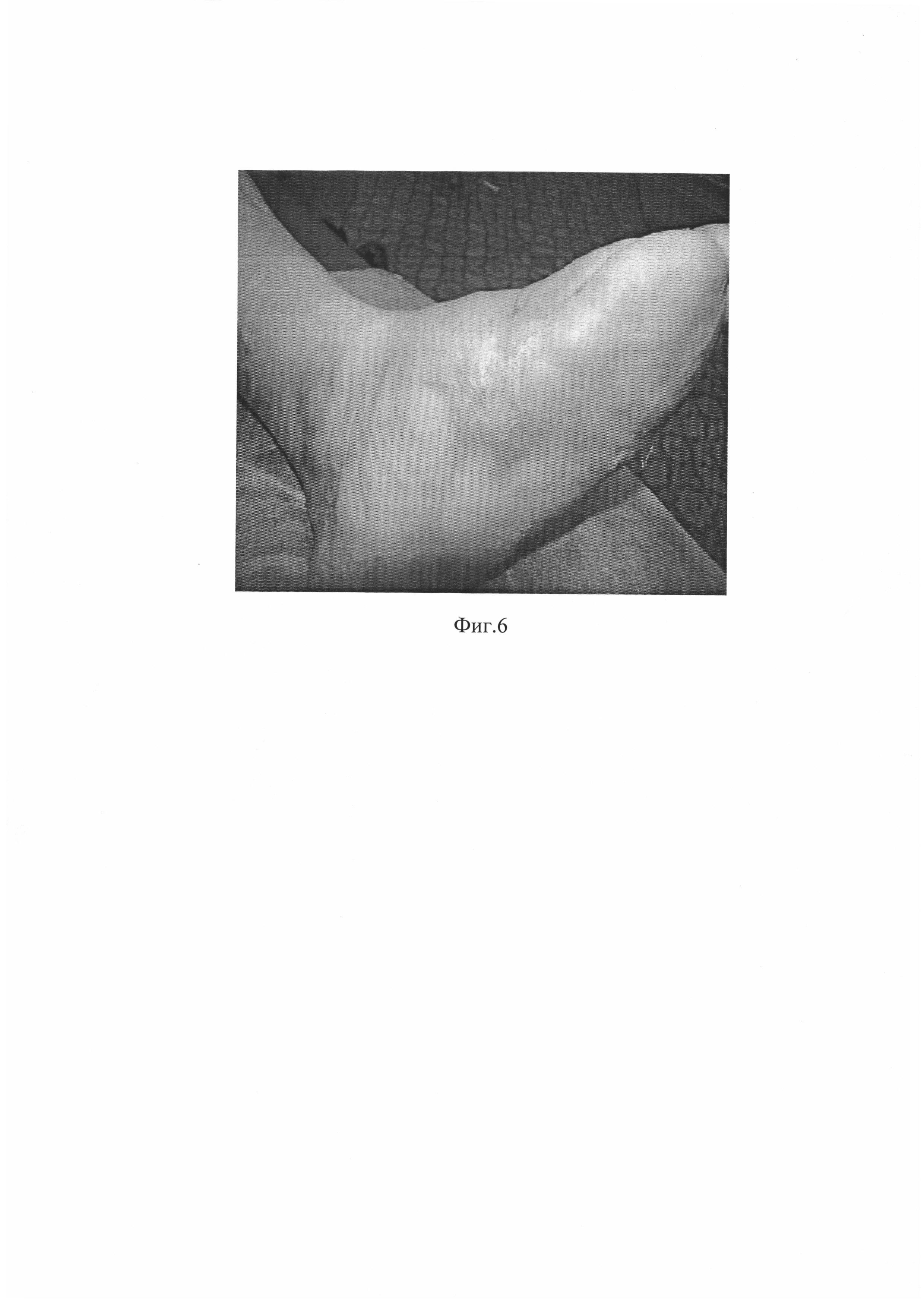
Через одну неделю после нанесения биотрансплантата язвенный дефект сократился на 60%, а площадь раневой поверхности составила 9,6 см2 (3,5×3,5 см) с активными грануляциями по краям и в центре раны (Фиг. 5). Полная эпителизация была достигнута на пятой неделе (Фиг. 6).
На Фиг. 4. Вид язвенного дефекта у пациента №1 до нанесения биотрансплантата.
На Фиг. 5. Вид язвенного дефекта у пациента №1 спустя 1 неделю после нанесения биотрансплантата.
На Фиг. 6. Вид язвенного дефекта у пациента №1 через 5 недель после нанесения биотрансплантата.
Пациент №2 (возраст 40 лет, пол женский).
Диагноз: Сахарный диабет 2 типа, тяжелой степени, инсулинозависимый, субкомпенсация. Синдром диабетической стопы, нейро-ишемический тип. Диабетическая остеоартропатия, хроническая стадия. Трофическая язва подошвенной поверхности правой стопы.
Стаж заболевания 9 лет. Инсулин принимает в течение 8 лет. Принимала манинил 5 (1 таблетка 3 раза в день до еды). Язвенный дефект правой стопы возник 2 года назад. Через год на фоне язвенного дефекта развился остеомиелит плюсневых костей. Тогда же выполнены: вскрытие флегмоны, остеонекрэктомия. К моменту начала испытаний разработанного способа язвенный дефект имелся в течение 11 месяцев.
После взятия у пациента №2 кожного эксплантата, язву санировали в течение 40 суток ежедневно с применением стандартного марлевого перевязочного материала. Область вокруг язвенного дефекта обрабатывалась спиртовым раствором 70%. Обработка раны производилась хлоргексидином 0,05%. Санация раны производилась левомеколем.
Конечность иммобилизировали с помощью повязки Total Contact Cast.
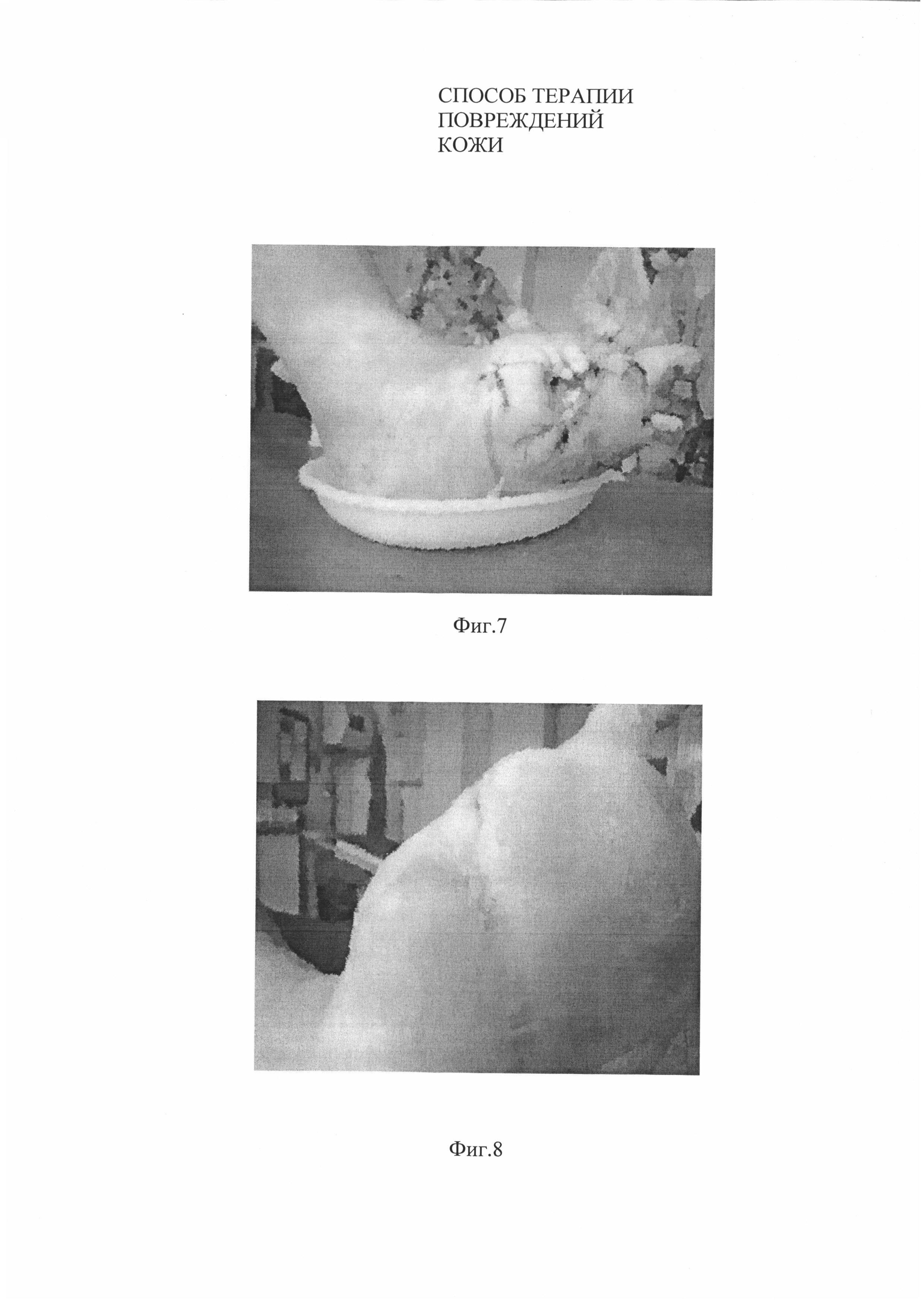
На момент проведения испытаний размеры язвы составляли 2×2,5 см (S=4 см2), глубиной до 1 см (Фиг. 7).
Было произведено нанесение биотрансплантата с трансфецированными аутологичными фибробластами в количестве 3,15*106 клеток на см2, биоразлагаемой матрицы на основе полимеризованной гиалуроновой кислоты площадью 7 см2, раневой дефект с биотрансплантатом закрывали повязкой «Тиелле».
Через неделю площадь дефекта сократилась на 85% и составила 0,6 см2 (1×0,6 см), наблюдались активные грануляции и отсутствие отделяемого.
На 6 неделе площадь язвенного дефекта сократилась на 95% от исходного (0,3×0,2 см) и к 8 неделе язва закрылась полностью (Фиг. 8).
На Фиг. 7. Вид язвенного дефекта у пациента №2 до нанесения биотрансплантата.
На Фиг. 8. Вид язвенного дефекта у пациента №2 через 8 недель после нанесения биотрансплантата.
Пациент №3 (возраст 11 лет, пол мужской).
Диагноз: Ожог 2-3 степени 26% тела.
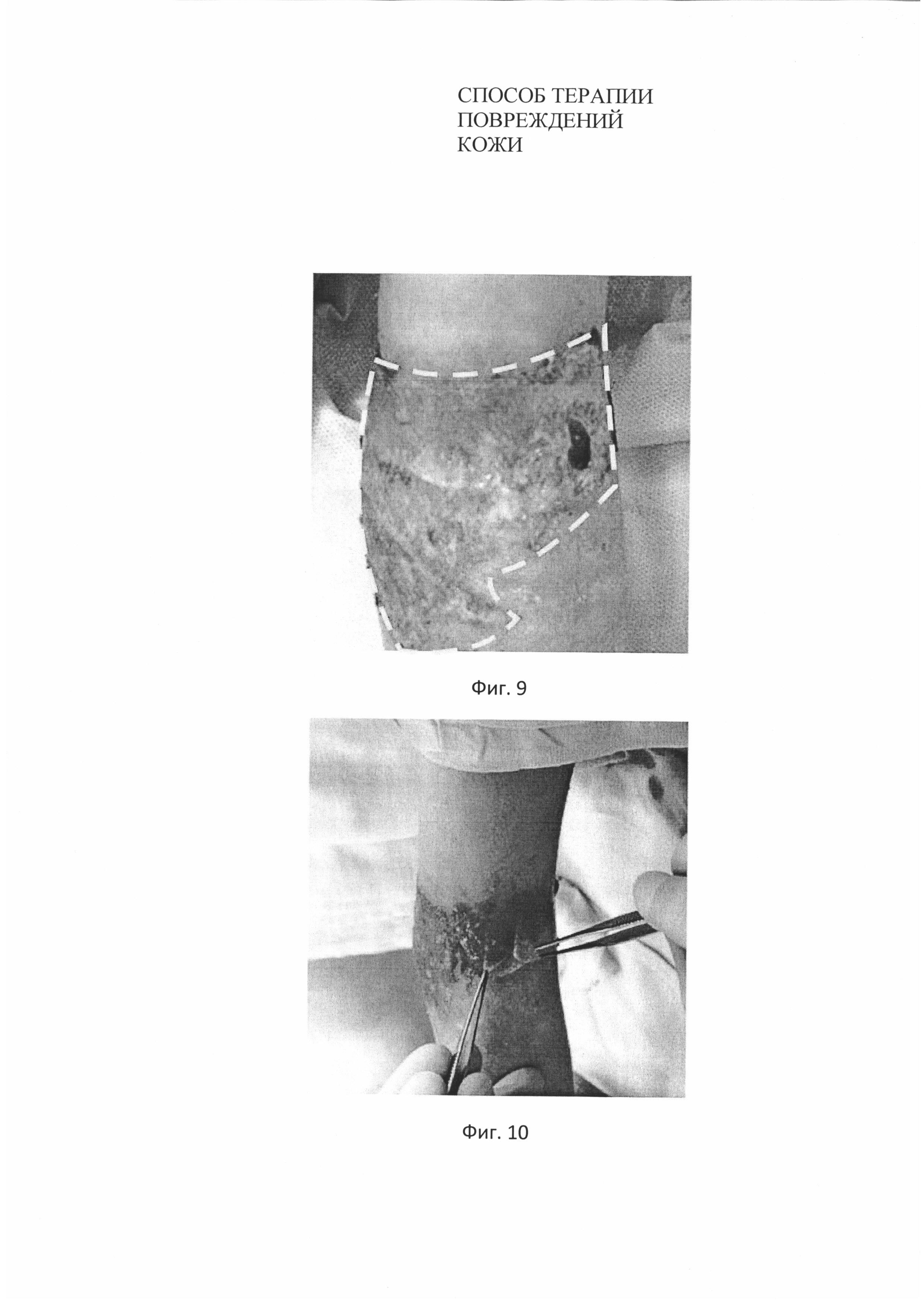
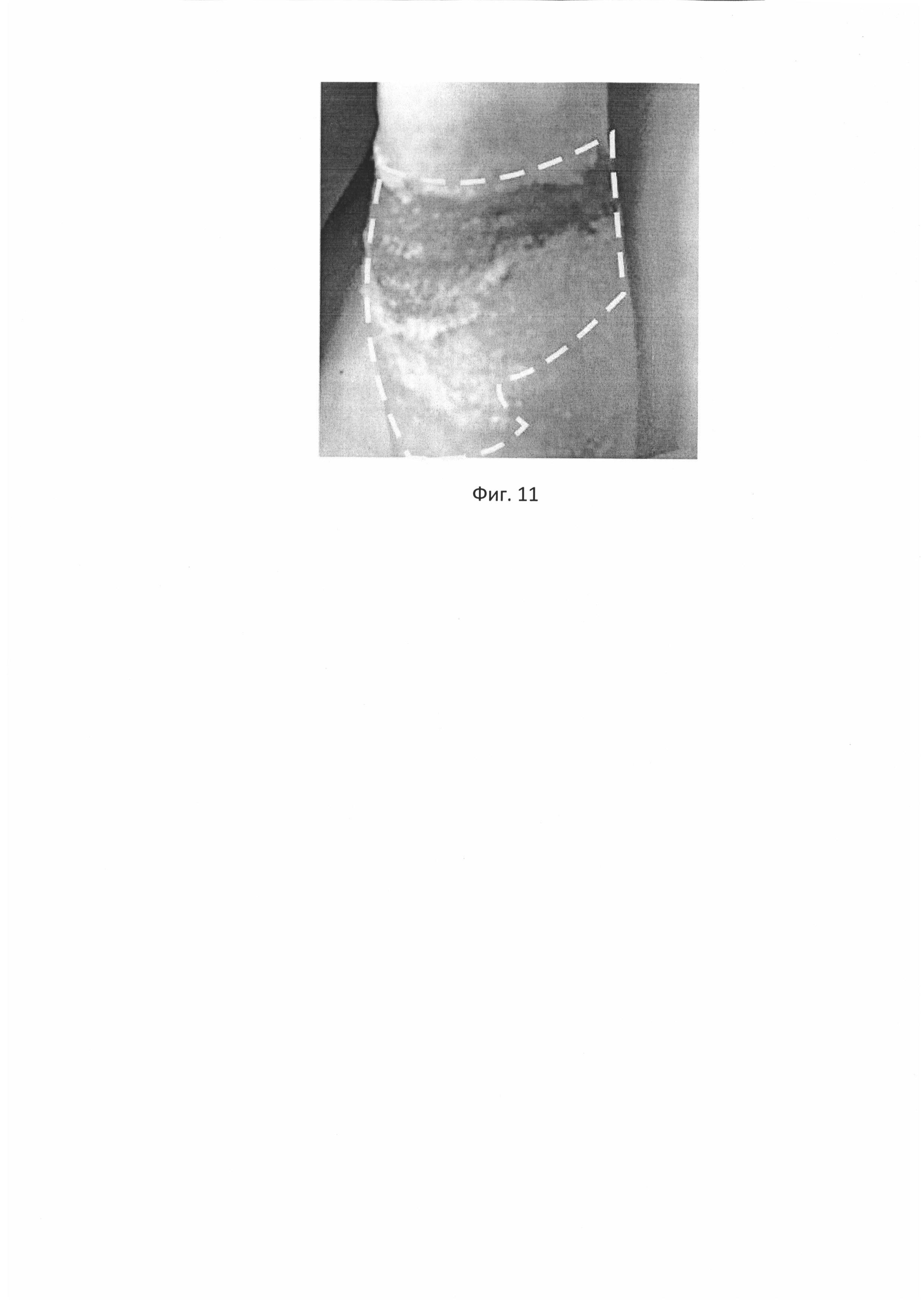
С целью изучения возможности применения разработанного биотрансплантата при ожогах, на один из участков ожога верхней конечности в области локтевого сгиба (Фиг. 9) было произведено нанесение биотрансплантата с трансфецированными аутологичными фибробластами в количестве 3,15*106 клеток на см2 биоразлагаемой матрицы на основе полимеризованной гиалуроновой кислоты площадью 10 см2 (Фиг. 10), раневой дефект с биотрансплантатом закрывали повязкой «Тиелле».
Спустя одну неделю наблюдались свежие грануляции, эпителизация ожоговой поверхности с краев раны, значительное сокращение площади ожоговой раны (Фиг. 10).
На Фиг. 9. Вид области ожога у пациента №3 до нанесения биотрансплантата. Пунктиром выделены границы повреждения кожи.
На Фиг. 10. Нанесение биотрансплантата на область ожога у пациента №3.
На Фиг. 11. Вид области ожога у пациента №3 через 1 неделю после трансплантации.
Проведенные клинические испытания по применению предложенного способа и биотрансплантата для лечения язв и термических повреждений кожи свидетельствуют о технической осуществимости способа и создании практической основы для разработки безопасной и эффективной технологии генно-клеточной терапии повреждений кожных покровов. Применение способа позволяет значительно сократить сроки лечения при приближающейся к 100% результативности, расширяя возможности использования разработанного биотрансплантата на основе аутологичных клеток, трансфецированных векторами, несущими гены теломеразы, для повышения регенераторного потенциала клеток и их устойчивости к агрессивному раневому содержимому.