Результат интеллектуальной деятельности: СПОСОБ ЛЕЧЕНИЯ КОРОНАРНОЙ НЕДОСТАТОЧНОСТИ
Вид РИД
Изобретение
Изобретение относится к молекулярной медицине и может быть использовано для лечения коронарной недостаточности при ишемической болезни сердца и кардиомиопатии и исследованиях патогенеза сосудистых заболеваний.
Сосудистые заболевания, и прежде всего ишемическая болезнь сердца и инсульт, являются одной из главных причин смертности взрослого населения промышленно развитых стран [Шумаков В.И., Шевченко О.П., Орлова О.В., Онищенко Н.А., Гуреев СВ. Связь воспаления и апоптоза с эффективностью трансплантации клеток костного мозга больным с хронической сердечной недостаточностью // Вестник Российской АМН. - 2006. - №11, - с. 14-21]. Несмотря на достигнутые успехи в лечении этих заболеваний, показатели смертности населения вследствие сосудистой патологии количественно не меняются, а хирургические методы, с которыми связывались большие надежды, для значительной части пациентов неприменимы, так как имеют абсолютные противопоказания для реваскуляризации с применением эндоваскулярной баллонной ангиопластики, стентирования или шунтирования [Смолянинов А.Б., Арьев А.Л., Афанасьев Б.В., Кириллов Д.А., Кованько Г.Н. Современные методы в репаративной кардиологии: опыт применения клеточных технологий // Молекулярная медицина. - 2008. - №1, - с. 7-14]. Означенное связано с тем, что только у каждого четвертого пациента с сосудистой недостаточностью развиваются коллатеральные сосуды, что обусловлено генетическими факторами [Wustmann К., Zbinden S., Windecker S., et al. Is there functional collateral flow during vascular occlusion in angiographically normal coronary arteries? // Circulation. - 2003. - vol. 107, - p. 2213-2220].
Перспективным направлением лечения сосудистой недостаточности представляется разработка технологий генотерапии, предусматривающих прямое введение встроенных в векторную систему генов факторов роста сосудов в миокард, скелетные мышцы или непосредственно в сосудистую стенку [Leeuw K.D., Kusumanto Y., Smit A. J., et al. Hospers Skin capillary permeability in the diabetic foot with critical limb ischaemia: the effects of a ph VEGF165 gene product // Diabet Med. - 2008. - vol. 10. - р. 1241-1244].
Вектор представляет собой двунитевую суперспирализованную замкнутую в кольцо молекулу ДНК, несущую «полезный ген» - полный аналог такового из генома человека и служебные гены, обеспечивающие полноценное функционирование полезного гена в ядре клетки.
Однако введение отдельных генов, как было показано в целом ряде плацебо-контролируемых исследований, не сопровождалось значимым клиническим эффектом. Как было показано в исследованиях AGENT [Grines C.L. The AGENT clinical trials programme. //Eur. Heart. J. Suppl. (2004) 6 (suppl E): E18-E23], введение в миокард вектора с геном фактора роста фибробластов (FGF) на фоне ишемической болезни сердца продемонстрировало только «тенденцию к улучшению», при этом отличия толерантности пациентов к физической нагрузке и величины зон ишемического дефекта были статистически недостоверны. Отсутствие клинических эффектов наблюдалось и в ходе исследования PREVENT [Mann M.J., Whittemore A.D., Donaldson M.C. et al. Ex-vivo gene therapy of human vascular bypass grafts with E2F decoy: the PREVENT single-centre, randomised, controlled trial. //Lancet 1999; 354: 1493-1498, Alexander J.H., Hafley G., Harrington R.A., Peterson E.D., et al. Efficacy and safety of edifoligide, an E2F transcription factor decoy, for prevention of vein graft failure following coronary artery bypass graft surgery: PREVENT IV: a randomized controlled trial. //JAMA. 2005 Nov 16;294(19):2446-54] как при введении пациентам гена эпидермального фактора роста (E2F), так и гена фактора роста эндотелия сосудов (VEGF) - в исследовании КАТ [Hedman М., Hartikainen J., Syvanne М. et al. Safety and feasibility of catheter-based local intracoronary vascular endothelial growth factor gene transfer in the prevention of postangioplasty and in-stent restenosis and in the treatment of chronic myocardial ischemia: phase II results of the Kuopio Angiogenesis Trial (KAT). //Circulation 2003; 107: 2677-83].
Неэффективность моногенной терапии обусловлена тем, что в образовании полноценной сосудистой сети принимают участие продукты, кодируемые более чем тридцатью генами.
Известно также, что главными генами, ответственными за образование и рост сосудистой сети как в период роста организма, так и у взрослых, являются гены факторов транскрипции НIF, получившие название гипоксией индуцируемые факторы [Wang G.L., Semenza G.L. Purification and characterization of hypoxia-inducible factor 1. //J. Biol. Chem. 1995; 270(3): 1230-7].
В результате дефицита факторов HIF, ответственных за инициацию транскрипции широкого спектра ангиопоэтинов (более 30), в ишемизированной ткани в ответ на гипоксию развиваются некробиотические процессы с последующим замещением дефекта соединительной тканью и соответствующим снижением функциональной активности органа наряду с возрастанием риска повторных сосудистых катастроф.
Следующими по значимости для ангиогенеза являются продукты интегрального гена VEGF. В результате альтернативного сплайсинга VEGF 225 образуется 6 эндотелиальных факторов роста сосудов: VEGF-A (VEGF-1), VEGF-B (VEGF-3), VEGF-C (VEGF-2), VEGF-D, VEGF-E и PIGF, которые являются секретируемыми белками и связываются с тремя типами рецепторов на наружной клеточной мембране эндотелиоцитов: Flt-1 (VEGFR-1), Flk-2 (VEGFR-2), Flt-4 (VEGFR-3).
Однако уже с момента рождения, экспрессия VEGF в различных тканях выражена в разной степени и с возрастом прогрессивно снижается (наименьшая экспрессия выявлена в высокоспециализированных тканях, в том числе в сердце и ЦНС) [Carmeliet P. Angiogenesis, in health and disease. //Nat. Med. 2003; 9(6): 653-60], а у 9-18% населения в гене VEGF имеются фенотипически значимые мутации, снижающие активность образующихся белков [Ferrara N., Gerber H.P., LeCouter J. The biology of VEGF and its receptors. //Nat. Med. 2013; 9(6): 669-76].
В свою очередь, экспрессия генов HIF также возрастозависима и у большинства людей по достижении среднего возраста в высокоспециализированных тканях практически отсутствует [Chan-Hyung Kim, Young-Suk Cho, Yang-Sook Chun, Jong-Wan Park, Myung-Suk Kim Early Expression of Myocardial HIF-1a* in Response to Mechanical Stresses //Circulation Research. 2002; 90: p 25-33].
Известно также, что изолированная экспрессия VEGF не сопровождается образованием полноценных сосудов, а на начальном этапе резко повышает проницаемость существующего сосудистого русла [Dvorak H.F., Brown L.F., Detmar М., Dvorak A.M. Vascular permeability factor/vascular endothelial growth factor, microvascular hyperpermeability, and angiogenesis. //Am. J. Pathol. 1995; 146(5): 1029-39], в то время как будучи экспрессированы в комплексе с прочими ангиогенными факторами, белки VEGF стимулируют рост и развитие новой сосудистой сети [Thurston G, Suri С, Smith К, et al. Leakage-resistant blood vessels in mice transgenically overexpressing angiopoietin-1. Science 1999; 286(5449): 2511-4; Bruick RK, McKnight SL. Building better vasculature. Genes Dev 2001; 15(19): 2497-502].
Более того, известно, что недостаточная экспрессия генов прочих факторов роста сосудов сопровождается и развитием дефицита мышечных элементов сосудистой стенки [Schultz К., Fanburg B.L., Beasley D. Hypoxia and hypoxia-inducible factor-lalpha promote growth factor-induced proliferation of human vascular smooth muscle cells. //Am. J. Physiol. Heart Circ. Physiol. 2006; 290(6): H2528-34; Schultz K., Murthy V., Tatro J.B., Beasley D. Prolyl hydroxylase 2 deficiency limits proliferation of vascular smooth muscle cells by hypoxia-inducible factor-1 {alpha}-dependent mechanisms. //Am. J. Physiol. Lung. Cell. Mol. Physiol. 2009; 296(6): L921-7; Takahashi M., Oka M., Ikeda Т., et al. Role of thrombospondin-1 in hypoxia-induced migration of human vascular smooth muscle cells. //Yakugaku Zasshi 2008; 128(3):377-83] вследствие недостаточной миграции в зону ишемии и пролиферации гладкомышечных клеток сосудистой стенки.
Последнее в полной мере относится и к циркулирующим сосудообразующим клеткам, под которыми понимают стволовые клетки (CAС), дающие начало тканям сосуда [Rehman J., Li J., Orschell СМ., March K.L. Peripheral blood "endothelial progenitor cells" are derived from monocyte/macrophages and secrete angiogenic growth factors. //Circulation 2003; Jiang M., Wang В., Wang C, et al. Angiogenesis by transplantation of HIF-1 alpha modified EPCs into ischemic limbs. //J. Cell. Biochem. 2008; 103(1): 321-34; Sottile J. Regulation of angiogenesis by extracellular matrix. //Biochim. Biophys. Acta 2004; 1654(1): 13-22; Chun T.H, Sabeh F, Ota I., et al. MT1-MMP-dependent neovessel formation within the confines of the three-dimensional extracellular matrix. //J. Cell. Biol. 2004; 167(4): 757-67; Lee S., Jilani S.M., Nikolova G.V., et al. Processing of VEGF-A by matrix metalloproteinases regulates bioavailability and vascular patterning in tumors. //J. Cell. Biol 2005; 169(4): 681-91]. В настоящее время общепризнано, что замещение функций «неработающих» генов может быть достигнуто только введением (трансфекцией) в клетки недостающих генов, кодирующих необходимые факторы роста сосудов.
Известен также способ лечения, описанный в патенте RU№ 2444378 «Способ лечения коронарной недостаточности при моделируемой ишемии миокарда». Способ осуществляют путем прямого введения в миокард гена фактора роста эндотелиоцитов сосудов, в котором в качестве гена фактора роста эндотелиоцитов вводят вектор VEGF 165 из расчета 50-100 мкг/см2 зоны ишемии с шагом по площади зоны 5 мм, с добавлением 2-диметиламиноэтанола.
Вектор на основе плазмиды, в состав которой входит ген VEGF165, вводили интрамиокардиально после частичной окклюзии передней нисходящей артерии у кроликов, что обеспечило стимуляцию ангиогенеза в ишемизированном участке миокарда. Однако неоангиогенез, вызванный введением препарата, не в полной мере полноценен. Во-первых, под влиянием препарата образовывались только капилляры, что недостаточно для восстановления перфузии органа. Во-вторых, не выявлено образования анастамозов с существующей сосудистой сетью. В-третьих, изолированное воздействие VEGF165 сопровождается повышением проницаемости уже существующего сосудистого русла, формированием отеков, что способно выступать в качестве самостоятельного повреждающего эффекта, снижающего качество лечения.
Задачей изобретения является достижение полноценного неоангиогенеза за счет активации большего количества факторов роста, участвующих в ангиогенезе и, как следствие, восстановление нормального уровня перфузии в ишемизированной области ткани.
Задача решается тем, что при ишемии миокарда лечение осуществляют путем прямого одновременного введения в миокард комплекса встроенных в векторы четырех генов HIF1a, HIF1b, VEGF165, VEGF225 в оптимальном соотношении из расчета 50-200 мкг ДНК на см2 зоны ишемии и шагом по площади 2-10 мм, с добавлением адъювантов, повышающих уровень трансфекции клеток, причем для прямого введения в миокард используются встроенные в векторы гены HIF1a, HIF1b, VEGF165, VEGF225 в стехиометрическом соотношении 1:0,2:0,5:0,3 соответственно с добавлением в готовый раствор в качестве адъюванта 2-диметиламиноэтанола (ДМАЭ) в концентрации 2,5 ммоль/л, что даже при невысокой эффективности трансфекции, обеспечивает стабильную секрецию трансфектированными клетками факторов роста в течение времени, достаточного для формирования сосудистой сети как на периферии, так и в очаге поражения, а также высокую избирательность и безопасность терапии при одновременном однократном введении в область поражения комплекса генов.
Добавление в готовый раствор адъювантов, в частности 2-диметиламиноэтанола (ДМАЭ), способно повысить уровень трансфекции до 10%.
Предлагаемый способ осуществляется следующим образом.
Пример 1.
Эксперимент проведен на кроликах-самцах породы Шиншилла массой 2,8-3,2 кг и возрастом 1-1,2 года. Животным после премедикации атропином 0,04 мг/кг, для предотвращения отека слизистой трахеи, под тиопенталовым наркозом (внутрибрюшинно, 40 мг/кг) в условиях искусственной вентиляции легких проводят левую стернотомию. С целью обеспечения неполной окклюзии передней нисходящей артерии сердца выполняют перевязку ее проксимального сегмента на мандрене, сужающую просвет сосуда на 80%. Двум группам животных №1 - контрольная (n=10) и №2 - опытная (n=10) сразу после наложения лигатуры интрамиокардиально однократно вводили встроенные в векторы гены факторов роста VEGF165 (группа №1) в концентрации 100 мкг/мл физиологического раствора, из расчета 50 мкг/см2 зоны ишемии с шагом по площади зоны 2-10 мм (проколы распределяют равномерно по всей площади зоны ишемии) или во второй группе одновременно однократно комплекс четырех генов HIF1a, HIF1b, VEGF165, VEGF225 в стехиометрическом соотношении (1:0,2:0,5:0,3, группа №2) в концентрации 400 мкг/мл физиологического раствора из расчета 200 мкг ДНК на см2 зоны ишемии и шагом по площади 2-10 мм, с добавлением адъюванта. В качестве адъюванта, для повышения эффективности трансфекции миокардиоцитов, в готовый раствор добавляют 2-диметиламиноэтанол в концентрации 2,5 ммоль/л (концентрация ДМАЭ от 2,5 до 10 мМоль/л не вызывает гибели клеток и является относительно безопасной. ДМАЭ принимает участие в эндоцитозе путем торможения процессов рециклинга рецепторов к факторам роста и регуляции и повышает эффективность трансфекции миокардиоцитов).
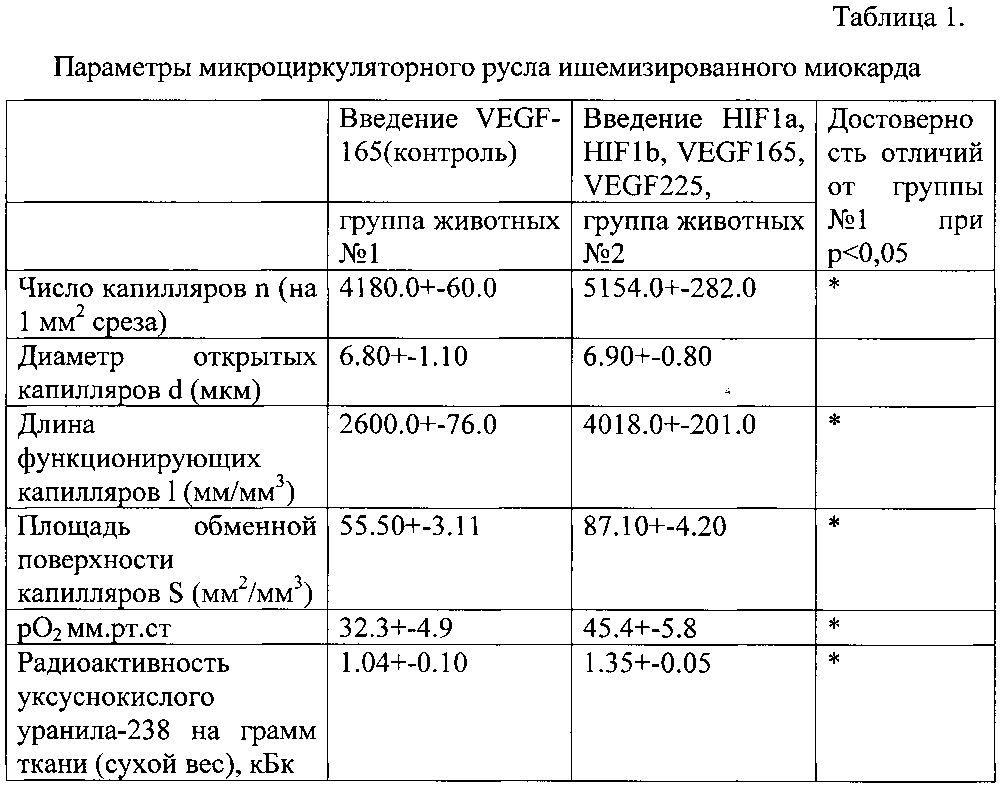
Уровень ангиогенеза оценивали на 30-е сутки после операции. Кровеносные сосуды и их взаимоотношения с сердечными мышечными волокнами выявляли с помощью метода внутрисосудистой инъекции контрастными взвесями с последующей гистологической обработкой [Авантадилов Г.Г. Медицинская морфометрия. Руководство. - Медицина, 1990.-384 с.:ил.]. На микроскопических срезах миокарда, окрашенных гематоксилин-эозином, подсчитывали число капилляров d (на 1 мм среза), диаметр открытых капилляров d (мкм), рассчитывали длину функционирующих капилляров l (мм/мм3), площадь обменной поверхности капилляров S (мм2/мм3). Изучение рО2 в зоне повреждения на открытом сердце проводили полярографическим методом с использованием генерирующей пары медная амальгама - кадмий. Радиоактивность ткани после тугого заполнения сосудистого русла раствором уксуснокислого уранила-238 определяли на сцинтилляционном счетчике ГСУ-1М и выражали в кБк на грамм ткани (сухой вес).
Статистическая обработка проводилась с использованием пакета прикладных программ Statistica 3.04. Результаты считали достоверными при р<=0,05.
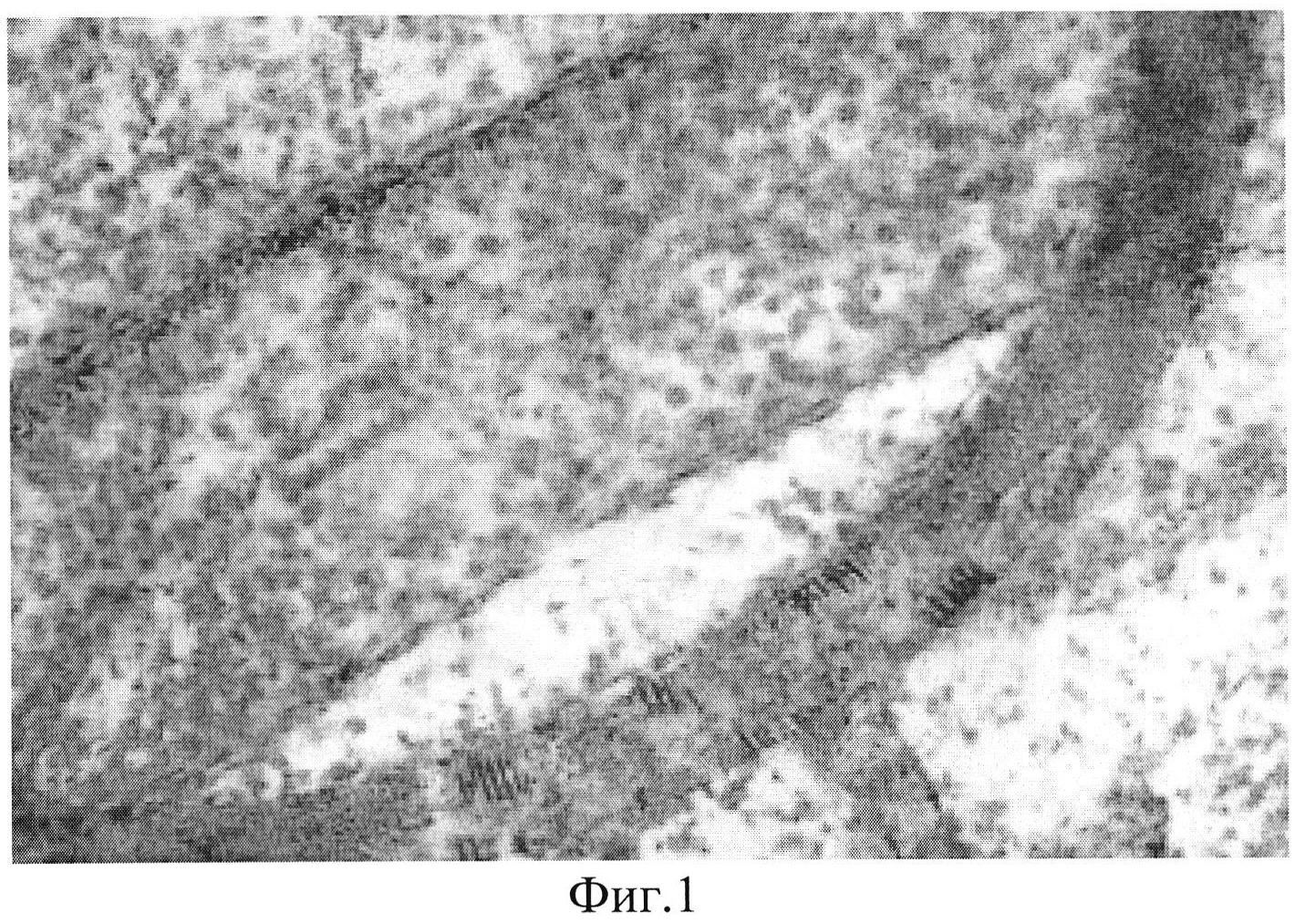
Данные исследования приведены в Таблице 1 и на Фигуре. 1.
Фиг. 1. Представлено формирование артериол в зоне ишемии после однократного введения комплекса четырех генов HIF1a, HIF1b, VEGF165 и VEGF225. Гематоксилин/эозин. Ув. х200.
Полученные результаты (Таблица 1 и Фиг. 1) свидетельствуют о том, что трансфекция клеток комбинацией четырех генов факторов роста сосудов оказывает более выраженный эффект, чем трансфекция только геном VEGF165 (контроль). Кроме того, наряду с формированием капиллярной сети, трансфекция комбинацией факторов роста сосудов сопровождается образованием артериол (Фиг. 1), что является неочевидным эффектом предложенного способа.
Пример 2.
Эксперимент проведен на кроликах-самцах породы Шиншилла массой 2,8-3,2 кг и возрастом 1-1,2 года. Животным после премедикации атропином 0,04 мг/кг, для предотвращения отека слизистой трахеи, под тиопенталовым наркозом (внутрибрюшинно, 40 мг/кг) в условиях искусственной вентиляции легких проводят левую стернотомию. С целью обеспечения неполной окклюзии передней нисходящей артерии сердца выполняют перевязку ее проксимального сегмента на мандрене, сужающую просвет сосуда на 80%. Группам животных №1 (n=10, контроль) и №2 (n=10, опыт), сразу после наложения лигатуры интрамиокардиально однократно вводили встроенные в векторы гены факторов роста VEGF165 (группа №1) в концентрации 100 мкг/мл физиологического раствора, из расчета 50 мкг/см2 зоны ишемии с шагом по площади зоны 2-10 мм (проколы распределяют равномерно по всей площади зоны ишемии) или комплекс из четырех генов HIF1a, HIF1b, VEGF165, VEGF225 в стехиометрическом соотношении (1:0,2:0,5:0,3 соответственно, группа №2) в концентрации 400 мкг/мл физиологического раствора из расчета 200 мкг ДНК на см2 зоны ишемии и шагом по площади 2-10 мм, с добавлением адъювантов. В качестве адъюванта для повышения эффективности трансфекции миокардиоцитов в готовый раствор для обеих групп добавляют 2-диметиламиноэтанол в концентрации 2,5 ммоль/л.
Уровень ангиогенеза оценивали на 30-е сутки после операции. Кровеносные сосуды и их взаимоотношения с сердечными мышечными волокнами выявляли с помощью метода внутрисосудистой инъекции контрастными взвесями с последующей гистологической обработкой [Авантадилов Г.Г. Медицинская морфометрия. Руководство. - Медицина, 1990.-384 с.:ил.] и на микроскопических срезах миокарда, окрашенных гематоксилин-эозином.
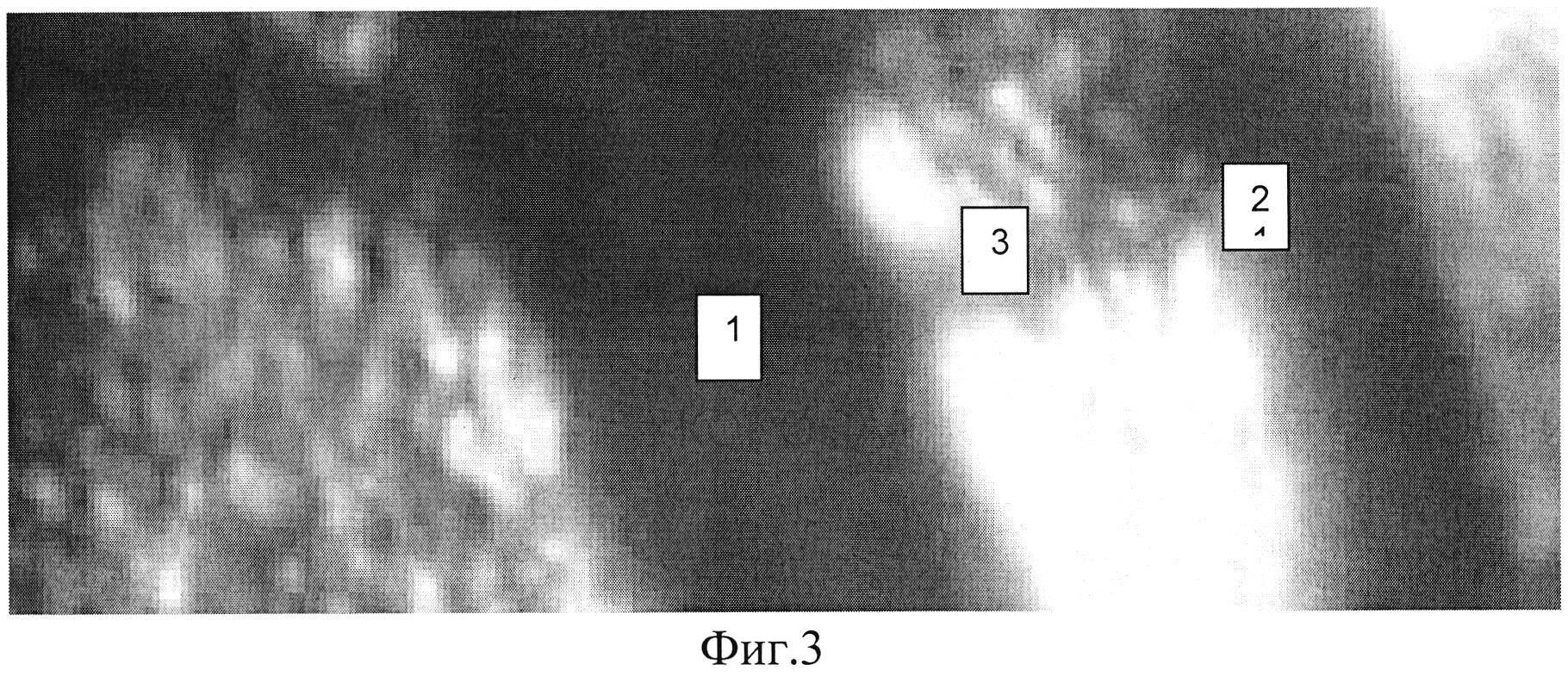
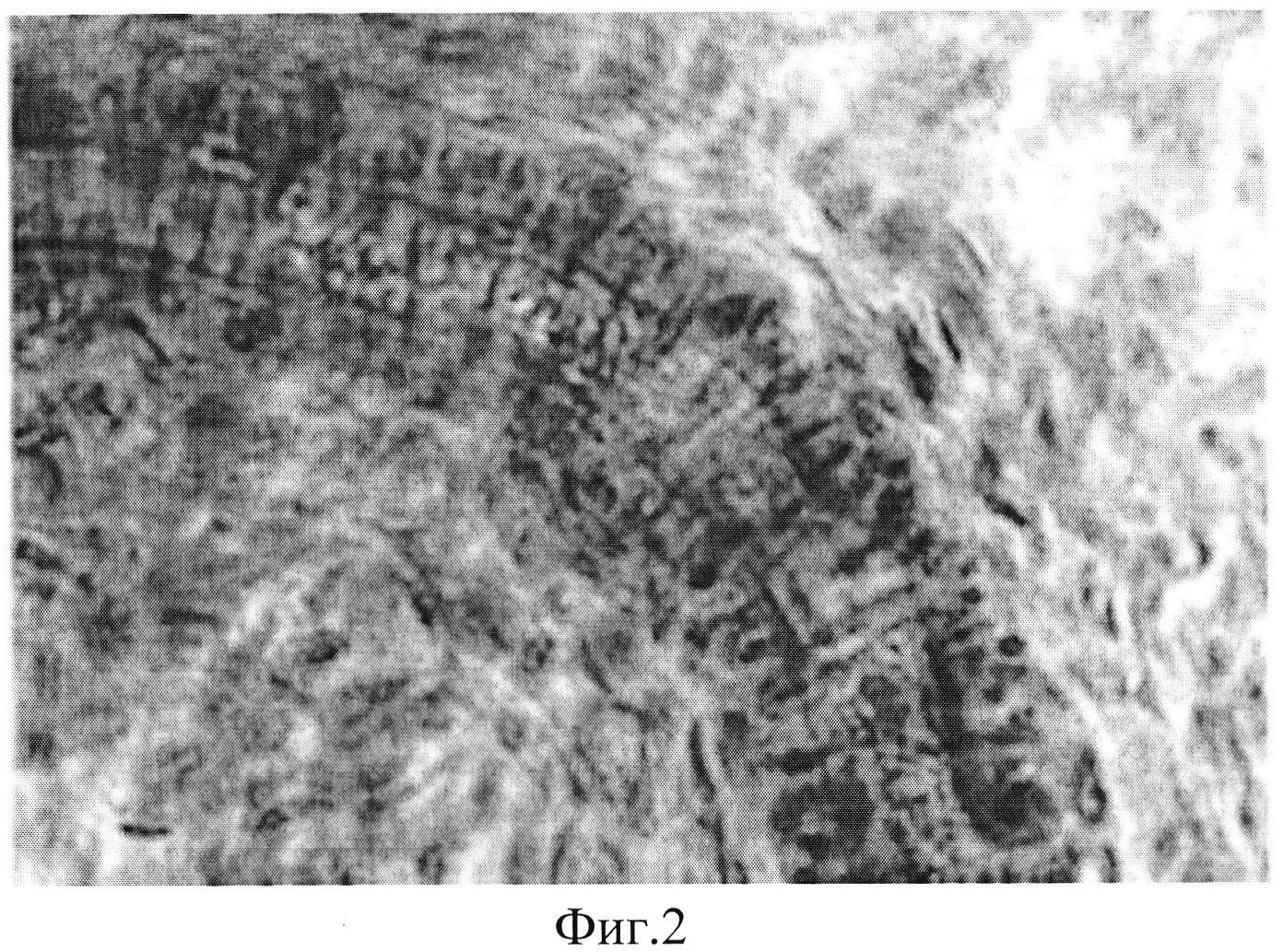
Полученные результаты свидетельствуют о том, что однократное интрамиокардиальное введение гена VEGF165 в условиях моделируемой ишемии вызывает усиление неоангиогенеза в виде формирования новых капилляров. В то же время одновременное введение комплекса четырех генов HIF1a, HIF1b, VEGF165, VEGF225 вызывает более выраженный эффект, заключающийся в образовании истинных сосудов (Фиг. 2), а также формировании анастомозов между новообразованными сосудами и сосудами неповрежденной ишемией ткани сердца (Фиг. 3).
Фиг. 2. Сформировавшиеся в зоне ишемии сосуды в результате введения комплекса генов HIF1a, HIF1b, VEGF165, VEGF225. Гематоксилин/эозин. Ув. х400.
Фиг. 3. Сформировавшиеся в зоне ишемии сосуды в результате введения комплекса из четырех генов HIF1a, HIF1b, VEGF165, VEGF225. 1 - артериола в зоне, прилегающей к ишемии, 2 - вновь сформированная артериола, 3 - анастомоз. Гематоксилин/эозин. Ув. х400.
Пример 3.
Эксперимент проведен на кроликах-самцах породы Шиншилла массой 2,8-3,2 кг и возрастом 1-1,2 года. Животным после премедикации атропином 0,04 мг/кг, для предотвращения отека слизистой трахеи, под тиопенталовым наркозом (внутрибрюшинно, 40 мг/кг) в условиях искусственной вентиляции легких проводят левую стернотомию. С целью обеспечения неполной окклюзии передней нисходящей артерии сердца выполняют перевязку ее проксимального сегмента на мандрене, сужающую просвет сосуда на 80%.Группам животных №1 (n=10, контроль) и №2 (n=10, опыт), сразу после наложения лигатуры интрамиокардиально однократно вводили встроенные в векторы гены факторов роста VEGF165 (группа №1) в концентрации 100 мкг/мл физиологического раствора, из расчета 50 мкг/см2 зоны ишемии с шагом по площади зоны 2-10 мм (проколы распределяют равномерно по всей площади зоны ишемии) или комплекс из четырех генов HIF1a, HIF1b, VEGF165, VEGF225 в стехиометрическом соотношении (1:0,2:0,5:0,3 соответственно, группа №2) в концентрации 400 мкг/мл физиологического раствора из расчета 200 мкг ДНК на см2 зоны ишемии и шагом по площади 2-10 мм, с добавлением адъювантов. В качестве адъюванта для повышения эффективности трансфекции миокардиоцитов в готовый раствор для обеих групп добавляют 2-диметиламиноэтанол в концентрации 2,5 ммоль/л.
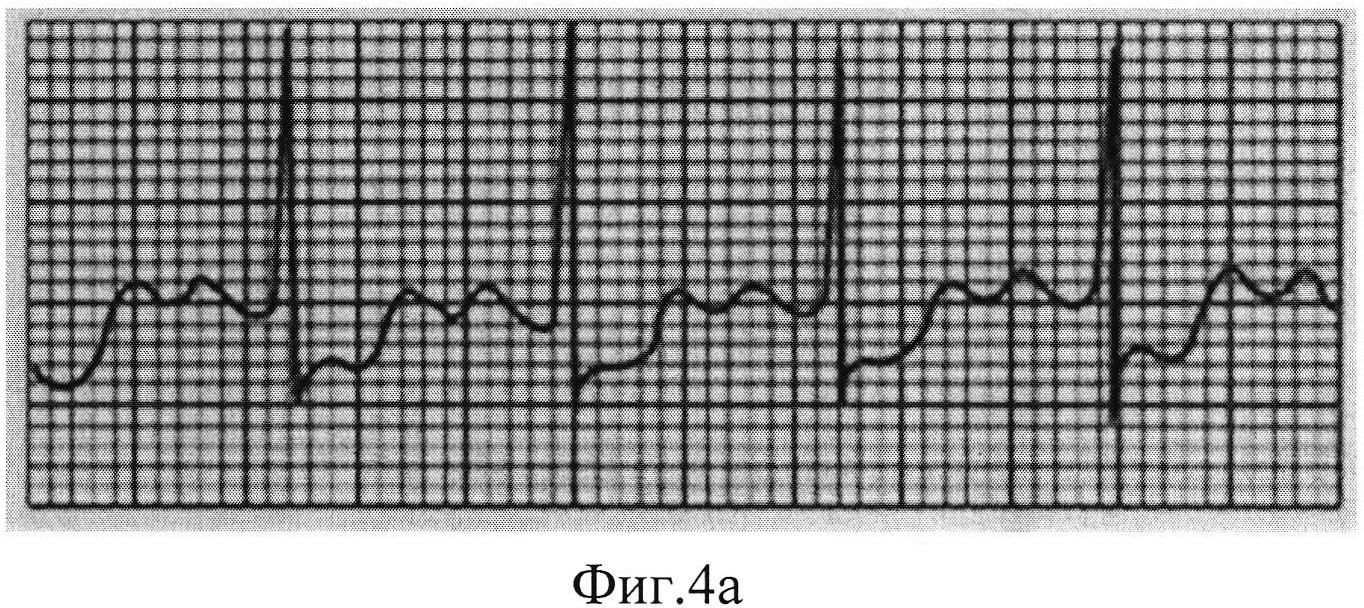
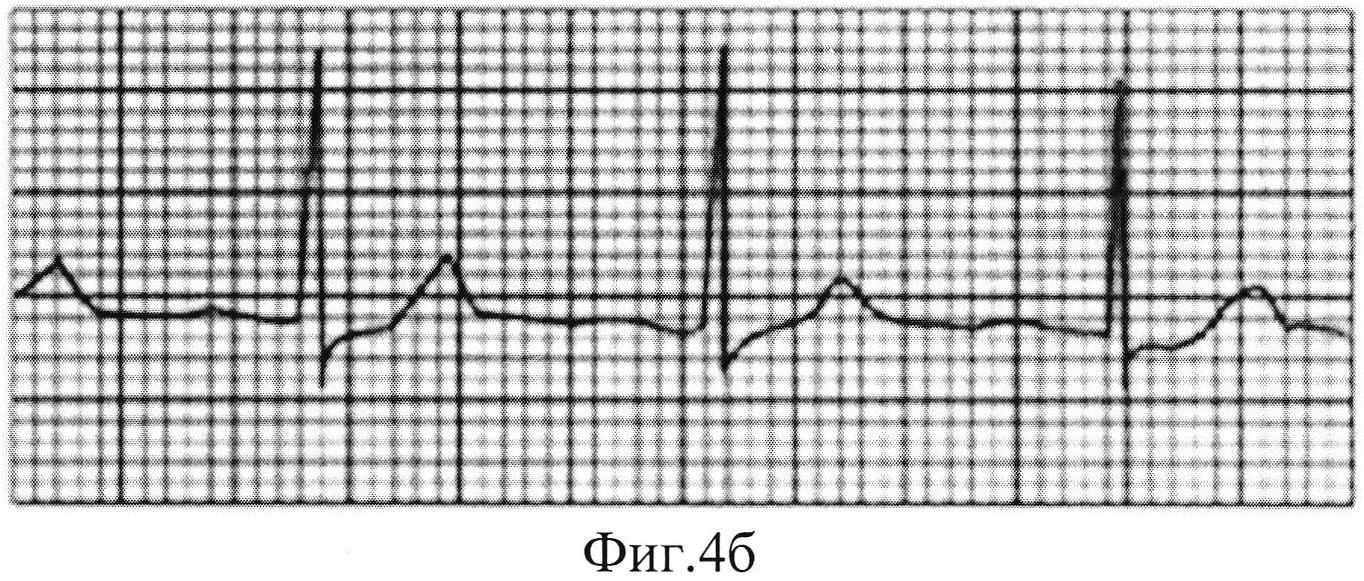
Спустя 30 суток животным проводили фармакологическую нагрузочную пробу с дипиридамолом в суммарной дозе из расчета 0,75 мг на 1 кг массы тела 0,5%-ного раствора и снимали электрокардиограмму, результаты которой представлены на Фиг. 4а и Фиг. 4б.
На Фиг. 4а представлена ЭКГ контрольной группы №1 (введение гена VEGF 165) в отведении V4. Положительная нагрузочная ЭКГ-проба. Через 4,5 мин нагрузки появилась горизонтальная депрессия сегмента ST на 0,3 мВ (3 мм). Это признак ишемии миокарда.
На Фиг. 4б. Опытная группа №2 (ведение HIF1a, HIF1b, VEGF165, VEGF225). Отрицательная нагрузочная ЭКГ-проба - депрессия сегмента ST отсутствует.
Пример 4.
Эксперимент проведен на кроликах-самцах породы Шиншилла массой 2,8-3,2 кг и возрастом 1-1,2 года. Животным после премедикации атропином 0,04 мг/кг, для предотвращения отека слизистой трахеи, под тиопенталовым наркозом (внутрибрюшинно, 40 мг/кг) в условиях искусственной вентиляции легких проводят левую стернотомию. С целью обеспечения неполной окклюзии передней нисходящей артерии сердца выполняют перевязку ее проксимального сегмента на мандрене, сужающую просвет сосуда на 80%. Группам животных №1 (n=10), №2 (n=5) и №3 (n=5) сразу после наложения лигатуры интрамиокардиально однократно вводили встроенные в векторы гены факторов роста HIF1a, HIF1b, VEGF165, VEGF225 в стехиометрическом соотношении (1:0,2:0,5:0,3 соответственно) в концентрации 400 мкг/мл физиологического раствора из расчета 200 (группа №1), 100 (группа №2) и 50 (группа №3) мкг ДНК на см2 зоны ишемии и шагом по площади 2-10 мм (проколы распределяли равномерно по всей площади зоны ишемии), с добавлением адъювантов. В качестве адъюванта для повышения эффективности трансфекции миокардиоцитов в готовый раствор для обеих групп добавляют 2-диметиламиноэтанол в концентрации 2,5 ммоль/л.
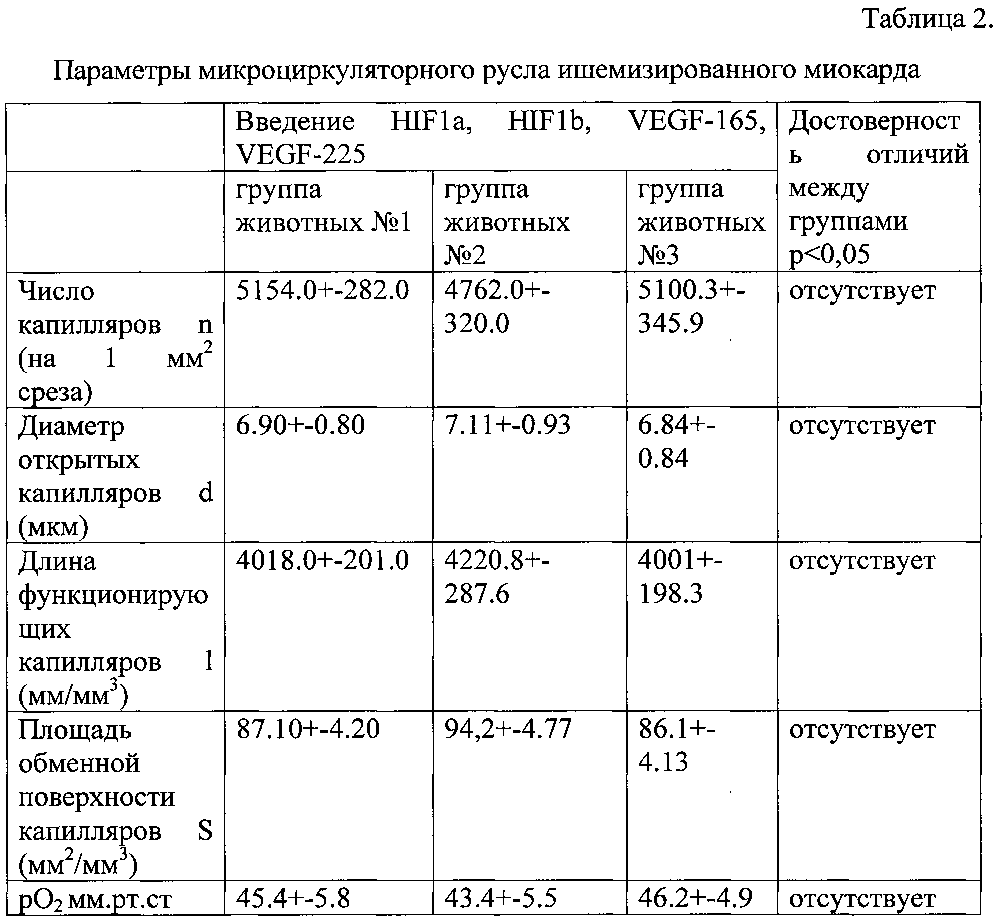
Уровень ангиогенеза оценивали на 30-е сутки после операции. Кровеносные сосуды и их взаимоотношения с сердечными мышечными волокнами выявляли с помощью метода внутрисосудистой инъекции контрастными взвесями с последующей гистологической обработкой [Авантадилов Г.Г. Медицинская морфометрия. Руководство. - Медицина, 1990.-384 с.:ил.]. На микроскопических срезах миокарда, окрашенных гематоксилин-эозином, подсчитывали число капилляров d (на 1 мм среза), диаметр открытых капилляров d (мкм), рассчитывали длину функционирующих капилляров 1 (мм/мм3), площадь обменной поверхности капилляров S (мм2/мм3). Изучение рO2 в зоне повреждения на открытом сердце проводили полярографическим методом с использованием генерирующей пары медная амальгама - кадмий. Результаты представлены в таблице 2.
Как следует из полученных данных (табл. 2), изменение количества вводимых векторов со встроенными генами HIF1a, HIF1b, VEGF165, VEGF225 в пределах от 50 до 200 мкг ДНК на см зоны ишемии в стехиометрическом соотношении 1:0,2:0,5:0,3 не сказывается на уровне инициируемого ангиогенеза. Последнее обусловлено тем, что эффект оказывает не вводимый вектор, а продукт полезного гена, образующийся в результате транскрипции и трансляции, выраженность которых мало обусловлена числом копий гена.
Как следует из таблицы 2, однократное введение в ишемизированный миокард комплекса встроенных в векторы четырех генов HIF1a, HIF1b, VEGF165, VEGF225 в соотношении 1:0,2:0,5:0,3 соответственно сопровождается значимым улучшением показателей микроциркуляторного русла. Так, по сравнению с монотерапией встроенным в вектор геном VEGF165 (прототип по патенту RU№ 2444378), применение комплекса генов обеспечивает увеличение числа капилляров в миокарде на 23,3%, длины функционирующих капилляров - на 54,5%, и, соответственно, площади обменной поверхности капилляров на 56,9%, но не диаметра открытых капилляров (данный показатель является высококонсервативным и видоспецифичным, а потому сохраняется неизменным в ряду мышь-слон). Больший объем доставки крови находит отражение в увеличении парциального давления кислорода в ишемизированной области миокарда более чем на 40% при использовании комплекса генов.
Тугое заполнение сосудистого русла радиоактивным уксуснокислым уранилом (не приникает через гематопаренхиматозный барьер и не покидает сосудистое русло) с последующим подсчетом радиоактивности показало, что объем заполненного сосудистого русла, включающего все его составляющие (артерии, артериолы, капилляры, венулы и вены, а также анастомозы) при введении комплекса генов, увеличивается на 30% и достоверно превышает аналогичный показатель при монотерапии встроенным в вектор геном VEGF165.
Об увеличении объема кровеносного русла свидетельствуют данные морфологических исследований. При этом введение в миокард комплекса встроенных в векторы генов HIF1a, HIF1b, VEGF165, VEGF225 находит проявление не только в появлении новообразованных капилляров с большей длиной и обменной поверхностью, но и в виде оптически визуализируемой формирующейся и вновь сформированной полноценной сосудистой сети, включающей артериолы с признаками мышечной стенки (Фиг. 1,3), венулы (Фиг. 2) и анастомозы с сосудами неповрежденного миокарда соседних участков (Фиг. 3).
Полученные в опытах результаты свидетельствуют о том, что при введении комплекса из четырех генов, их проникновения в клетки, транскрипции и трансляции, происходит выделение широкого спектра факторов неоангиогенеза, ремоделирующего сосудистую сеть ишемизированного миокарда. При формировании полноценного сосудистого русла наблюдается нормализация метаболических процессов в зоне поврежденного миокарда, о чем свидетельствует динамика изменения электрокардиограммы (ЭКГ) в ходе выполнения нагрузочной пробы (Фиг. 4а и 4б). Анализ ЭКГ после введения вектора с геном VEGF165 спустя 5 минут нагрузки (проба с дипиридамилом) указывает на появление горизонтальной депрессии сегмента ST (V4) на 0,3 мВ (3 мм). Это может расцениваться как признак ишемии миокарда. В свою очередь, при введении комплекса векторов с генами HIF1a, HIF1b, VEGF165, VEGF225 наблюдается отрицательная ЭКГ-проба - отсутствие депрессии сегмента ST в ответ на нагрузку.
Подтверждением специфичности действия комбинации четырех генов является сохранение количественных параметров ангиопоэтического ответа как при введении ДНК в дозе 200 мкг на см2 (при которой количество гена VEGF165 соответствует контролю-прототипу - 50 мкг на см2), так и при двух- и четырехкратном уменьшении количества вводимой ДНК. Последнее обусловлено тем, что эффект оказывает не количество применяемых генов, а их продукты -факторы роста сосудов, образующиеся в трансфецированных клетках.
Таким образом, предложенный способ с использованием встроенных в векторы комплекса четырех генов позволяет более эффективно стимулировать ангиогенез и ремоделировать сосудистую сеть в ишемизированном миокарде, чем техническое решение по прототипу.
В свою очередь, эпигеномная локализация генных конструктов, благодаря модифицированному участку Ori применяемых генных векторов, и ограниченный срок пребывания в клетке являются достаточными для экспрессии вводимых генов и формирования полноценной сосудистой сети.
В отличие от применения пептидных факторов роста, требующих регулярного введения, использование генных конструкций с четырьмя генами факторов, регулирующих ангиогенез, обеспечивается их однократным интрамиокардиальным введением.