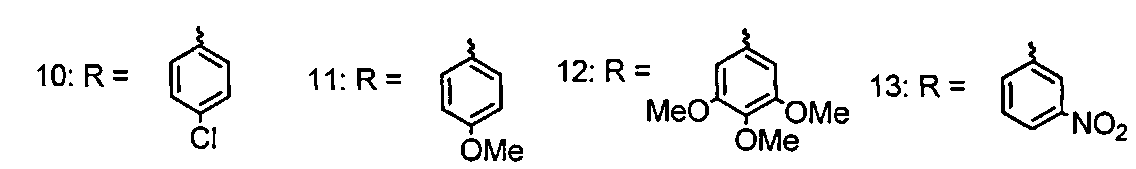Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ УСНИНОВОЙ КИСЛОТЫ КАК ПРОТИВООПУХОЛЕВЫЕ АГЕНТЫ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к медицинской химии и касается производных усниновой кислоты, содержащих бензилиденфураноновый фрагмент. Указанные соединения могут быть использованы в качестве лекарственных средств, обладающих противоопухолевой активностью.
Уровень техники
Современные схемы лечения различного типа злокачественных опухолей используют хирургические методы в комплексе в высокодозной агрессивной терапией, серьезным недостатком которой является высокая токсичность современных противоопухолевых препаратов в отношении жизненноважных органов и систем организма. Сопутствующие побочные эффекты снижают эффективность, а в ряде случаев ограничивают применение противоопухолевых средств. Другой проблемой в лечении онкологических заболеваний является проблема остаточного опухолевого клона. Опухолевые клетки, пережившие химиотерапию, обычно проявляют лекарственную устойчивость к широкому кругу препаратов и вызывают рецидив заболевания в более тяжелой форме.
В связи с этим актуальным является поиск новых противоопухолевых препаратов, обеспечивающих высокую избирательность и эффективность лечения.
Важным направлением медицинской химии, позволяющим получать новые, эффективные противоопухолевые препараты, является использование синтетических трансформаций растительных метаболитов. Наиболее приемлемым считается исследование растительных метаболитов, о биологической активности которых имеются достоверные сведения и которые являются доступными в настоящее время или станут доступными в ближайшем будущем по мере формирования сырьевой базы. К данному классу соединений относится усниновая кислота, широкий спектр биологической активности которой (противовоспалительная, противовирусная, противоопухолевая и т.д.) приковывает к ней пристальный интерес исследователей.
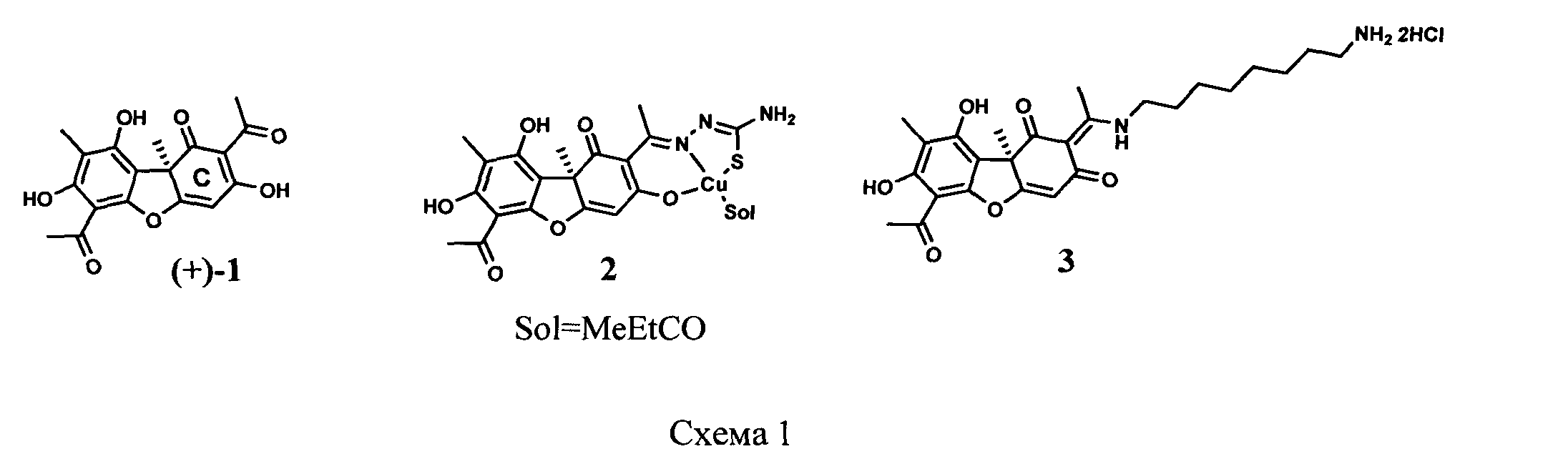
Антипролиферативная активность природной усниновой кислоты (1) (Схема 1) описана в литературе, оба ее энантиомера проявляют умеренную цитотоксическую активность в отношении широкого ряда опухолевых клеточных культур.
Первые упоминания о цитотоксической активности усниновой кислоты относятся к 1975 г, в работе [S. Kupchan, H. Kopperman 1-Usnic Acid: Tumor Inhibitor Isolated from Lichens Experientia V.31, Fasc.6, 625] рассматривалась выживаемость мышей с перевитой карциномой Льюиса, выживаемость возрастала до 135-152% при обработке (-)-усниновой кислотой в дозах 20-200 мг/кг.
Данные о цитотоксичности (-)-усниновой кислоты и ряда ее производных на клетках карциномы легких (L1210) и лейкемии (P388) опубликованы в работе [М. Takai, Y. Uehara, J. Beisler Usnic acid derivatives as potential antineoplastic agents Journal of Medicinal chemistry, 1979, V.22, N.11, 1380-1384]. Высокую степень ингибирования (более 90%) в концентрации 140 µМ проявили сама (-)-усниновая кислота, а также ряд ее наиболее липофильных производных, модифицированных по кольцу A. Снижение цитотоксической активности наблюдалось при переходе к производным, модификация которых включала разрушение трикетонной системы кольца C.
(+)-Усниновая кислота (1) (Схема 1) также проявляет заметный цитотоксический эффект, что наблюдалось авторами работы [B. Burlando, E. Ranzato, A. Volante, G. Appendino, F. Pollastro, L. Verotta Antiproliferative Effects on Tumour Cells and Promotion of Keratinocyte Wound Healing by Different Lichen Compounds Planta Med 2009; 75: 607-613] в отношении ряда опухолевых клеток мезотелиомы ММ98, эпидермоидной карциномы А431 и кератиноцитов человека НаСаТ, ингибирующая концентрация (+)-усниновой кислоты IC50 составила от 23 до 76 µM, что было существенно ниже, чем у ряда других лишайниковых кислот.
Цитотоксическую активность (+)-усниновой кислоты против HeLa cells in vitro исследовали авторы статьи [M. Natić, Z. Tesbrevelić, K. Andbarelković, I. Brcbreveleski, S. Radulović, S. Manić, D. Sladić Synthesis and Biological Activity of Pd(II) and Cu(II) Complexes with Acylhydrazones of Usnic Acid Synthesis and Reactivity in Inorganic and Metal-Organic Chemistry Vol.34, No.1, pp.101-113, 2004], IC50 достигало 14.9 µM, увеличение цитотоксической активности против данной линии клеток (карцинома шейки матки) наблюдалось при использовании ее производных, а особенно тиосемикарбазона усниновой кислоты и его комплекса с медью (2) (Схема 1), IC50 этих соединений составило 2.4 и 1.8 µM соответственно.
Широкий спектр опухолевых клеточных культур исследовался в работах [М. Bazin, A. Le Lamer, J. Delcros, I. Rouaud, P. Uriac, J. Boustie, J. Corbel, S. Tomasi Synthesis and cytotoxic activities of usnic acid derivatives Bioorganic and Medicinal Chemistry, 2008, V.16, 6860-6866 и С. Bezivin, S. Tomasi, I. Rouaud, J. Delcros, J. Boustie Cytotoxic activity of compounds from Lichen: Cladonia convolute Planta Med 2004; 70: 874-877], посвященных (+)- и (-)-усниновым кислотам и полиаминопроизводным (+)-усниновой кислоты. Причем оба энантиомера усниновой кислоты проявили умеренную цитотоксическую активность в отношении клеточных линий L1210 (лейкемия), CHO (рак яичников), 3LL (карцинома легких), DU145 (рак простаты), MCF7 (аденокарцинома груди), K-562 (лейкемия), U251 (глиобластома) с концентрацией IC50 от 17 до 105 µM. Существенную цитотоксическую активность, большую, чем нативная усниновая кислота, проявило соединение (3) (Схема 1), полученное по реакции усниновой кислоты и диаминооктана, IC50 соединения 3 в отношении клеток L1210 составил 2.7 µM.
(+)- И (-)-усниновые кислоты исследовались [Einarsdottir E, Groeneweg J, Bjornsdottir GG, Harethardottir G, Omarsdottir S, Ingolfsdottir K, Ogmundsdottir HM (2010) Cellular mechanisms of the anticancer effects of the lichen compound usnic acid. Planta Med 76(10): 969-974] на цитотоксическую активность в отношении клеток рака груди T-47D и рака печени Capan-2. Оба энантиомера проявили сходное антипролиферативное действие против обеих клеточных линий. IC50 составила 4.2 мкг/мл и 4.0 мкг/мл для (+) и (-)-усниновых кислот в отношении T-47D, 5.3 мкг/мл и 5.0 мкг/мл против Capan-2 соответственно. При этом авторы не наблюдали проявлений классического апоптоза клеток с фрагментацией ДНК, однако, наблюдаемая потеря митохондриального мембранного потенциала указывает на то, что эти соединения используют механизм митохондриального апоптоза в соответствующем сигнальном пути гибели клетки.
Усниновая кислота, авторы не уточняют какой из энантиомеров, проявляет цитотоксическую активность в отношении клеток рака груди (wild-type p53 MCF7 и non- functional p53 MDA-MB-231) и рака легких (H1299) в концетрации 29 µМ [Mayer М, O′Neill MA, Murray KE, Santos-Magalhaes NS, Carneiro-Leao AM, Thompson AM, Appleyard VC (2005) Usnic acid: a non-genotoxic compound with anti-cancer properties. Anticancer Drugs 16(8):805-809].
Недостатками природных усниновых кислот являются относительно низкая эффективность по сравнению с существующими препаратами и плохая биодоступность. Хорошие результаты получены на некоторых полусинтетических производных, модифицированных по различным функциональным группам усниновой кислоты, что может свидетельствовать о перспективности синтетических модификаций растительных метаболитов.
Раскрытие изобретения
Задачей изобретения является создание новых эффективных, низкотоксичных лекарственных средств, обладающих противоопухолевым действием и получаемых из доступного растительного сырья.
Поставленная задача решается применением соединений, которые являются полусинтетическими производными (S)-усниновой кислоты, содержащими бензилиденфураноновый фрагмент, проявляющими цитотоксическую активность в отношении опухолевых клеток линий СЕМ-13, U-937, МТ-4.
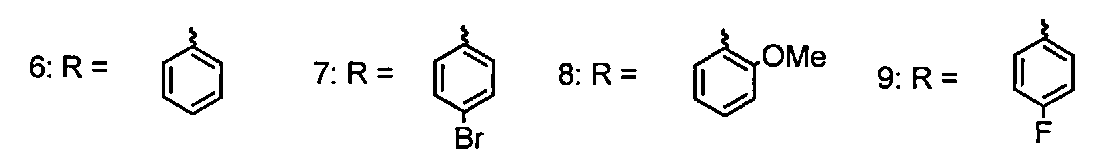
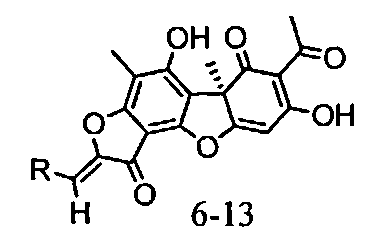
Для достижения поставленной цели мы провели ряд химических модификаций, представленных на схеме 2, синтез целевых соединений описан в статье [Соколов Д.Н., Лузина О.А., Шернюков А.В., Салахутдинов Н.Ф. Синтез ауронов на основе усниновой кислоты. Химия природных соединений. 2012. №3. С. 350-355]. В качестве исходного соединения была взята (S)-усниновая кислота, полученная экстракцией лишайника Cladonia stellaris по методике [Н.Ф. Салахутдинов, М.П. Половинка, М.Ю. Панченко, Пат. РФ №2317076С1; Бюл. Изобр. 2008, №5]. Бромирование усниновой кислоты бромом в присутствии бромоводорода дает производное 4, обработка которого ацетатом калия приводит к внутримолекулярной циклизации с образованием соединения с фураноновым фрагментом 5. Следующим этапом было получение целевых соединений с противоопухолевой активностью реакцией соединения 5 с рядом ароматических альдегидов.

Было исследовано влияние усниновой кислоты (1) и бензилиденфураноновых производных (6-13) на жизнеспособность клеток карциномных линий человека. Значения CCID усниновой кислоты (1) и ее производных (6-13) для различных карциномных линий клеток человека приведены в таблице 1. В качестве препаратов сравнения использовали (+)-усниновую кислоту (1). В результате было показано, что (+)усниновая кислота (1) проявляет умеренную, а заявляемые соединения (6-13) - высокую противоопухолевую активность по отношению ко всем использованным опухолевым клеточным культурам, а именно CEM-13, U-937, MT-4. Показано, что значения CCID50 для соединений (6-13) имеют сходный порядок величины для всех опухолевых клеток и лежат в диапазоне 0.6-9.0 мкг/мл. Для наиболее активных соединений (6, 9, 10) дополнительно была исследована их способность индуцировать апоптоз в опухолевых клетках. Установлено, что эти соединения способны индуцировать апоптоз в опухолевых клетках моноцитарного происхождения U-937 от 28 до 69% и в опухолевых клетках лимфоидного происхождения MT-4 от 6 до 19%. Полученные данные по противоопухолевой активности соединений (6-13) позволяют рассматривать их как перспективные лекарственные агенты. Изобретение иллюстрируется следующими примерами.
Пример 1.
Взаимодействие (+)-усниновой кислоты с двукратным избытком брома
К 1 ммоль усниновой кислоты (344 мг) добавляли комплекс бромдиоксана (2 ммоль брома (0.10 мл) растворяли в 14 мл диоксана), несколько капель HBr и оставили на 7 суток при комнатной температуре. После концентрирования реакционной смеси на ротационном испарителе хроматографировали полученный остаток на силикагеле (60-200µ), элюент - CH2Cl2.
(S)-2-ацетил-6-(2-бромацетил)-3,7,9-тригидрокси-8,9b-диметилдибензо[b,d]фуран-1(9bH)-он 4. Выход 283 мг (67%). Т.пл. 97-100°C. [α]D+349 (c 0.5; CHCl3). ЯМР 1H (CDCl3, δ, м.д., J Гц): 1.75 (3H, c, H-15), 2.08 (3H, c, H-10), 2.64 (3H, c, H-12), 4.52 (2H, дд, J=12.4, J=14.0, H-14), 6.00(1H, c, H-4), 11.17 (1H, c, OH-9), 12.68 (1H, c, OH-7), 18.81 (1H, c, OH-3). ЯМР 13C (CDCl3, δ, м.д.): 7.5 (C-10), 27.7 (C-12), 31.9 (C-15), 34.5 (C-14), 61.6 (C-9b), 98.7 (C-4), 99.0 (C-6), 104.3 (C-9a), 105.1 (C-2), 109.6 (C-8), 154.3 (C-5a), 158.4 (C-9), 164.1 (C-7), 178.5 (C-4aa), 191.5 (C-3), 192.7 (C-13), 197.7 (C-1), 201.7 (C-11). ИК спектр (ν, см-1): 842, 1140, 1292, 1458, 1628, 3013, 3497. Найдено: m/z 421.9976 [M]+ C18H15O7Br. Вычислено: M=421.9996.
Пример 2
Взаимодействие соединения 4 с ацетатом калия
К раствору 1 ммоль соединения 4 (423 мг) в 25 мл ацетона добавили 150 мг (1.5 ммоль) ацетата калия и кипятили реакционную смесь в течение 2 часов. Затем разбавили водой (до -50-60 мл), подкислили HCl (1:4) до pH=3-4. Экстрагировали CH2Cl2 (3×10 мл), сушили над прокаленным MgSO4, удаляли растворитель и хроматографировали остаток на колонке с силикагелем, элюент - CH2Cl2.
(10S)-8,13-дигидрокси-7,10-диметил-5,16-диоксатетрацикло[7.7.0.02.6.010.15]гексадека-1,6,8,12-пентаен-3,11-дион 5. Выход 308 мг (90%). Т.пл. 202-203°С.[α]D+397 (c 0.5; CHCl3). ЯМР 1H (CDCl3, δ, м.д., J Гц): 1.73 (3H, с, H-15), 2.13 (3H, c, H-10), 2.64 (3H, c, H-12), 4.66 (2H, c, H-14), 6.02 (1H, c, H-4), 11.27 (1H, c, OH-9), 18.82 (1H, c, OH-3). ЯМР 13C (CDCl3, δ, м.д.): 6.91 (C-10), 27.80 (C-12), 31.91 (C-15), 58.71 (C-9b), 75.70 (C-14), 99.01 (C-4), 100.61 (C-9a), 105.10 (C-6), 105.7 (C-2), 107.10 (C-8), 149.13 (C-5a), 159.80 (C-9), 173.81 (C-7), 179.61 (C-4a), 191.61 (C-3), 194.10 (C-13), 197.90 (C-1), 201.71 (C-11). Найдено: m/z 342.0736 [M]+ C18H14O7. Вычислено: M=342.0734.
Пример 3
Взаимодействие соединения 5 с альдегидами (общая методика)
К раствору 1 ммоль соединения 5 (342 мг) в 24 мл MeOH добавили 1.1 ммоль соответствующего альдегида, 1 мл 50% водного раствора KOH и нагревали (в случае получения соединений 6-12) или перемешивали при комнатной температуре в течение 1.5 часов (в случае получения соединения 13). Затем реакционную смесь разбавили водой (до -50-60 мл), подкислили HCl (1:4) до pH=3-4. Экстрагировали CH2Cl2 (3×10 мл), сушили над прокаленным MgSO4, удаляли растворитель и хроматографировали остаток на колонке с силикагелем, элюент - CH2Cl2.
(10S,4Z)-8,13-дигидрокси-7,10-диметил-4-(фенилметилиден)-5,16-диоксатетрациклор[7.7.0.02.6.010.15]гексадека-1,6,8,12,14-пентаен-3,11-дион 6. Выход 262 мг (61%). Т.пл. 203°C. [α]D+267 (c 0.45; CHCl3). ЯМР 1H (CDCl3, δ, м.д.): 1.78 (3H, c, H-15), 2.32 (3H, c, H-10), 2.67 (3H, c, H-12), 6.07 (1H, c, H-4), 6.81 (1H, c, H-16), 7.39 (1H, м, H-20), 7.46 (2H, м, H-19, H-21), 7.87 (2H, м, H-18, H-22), 11.42 (1H, c, OH-9), 18.86 (1H, с, OH-3). ЯМР 13C (CDCl3, δ, м.д.): 7.50 (C-10), 27.86 (C-12), 31.96 (C-15), 58.70 (C-9b), 99.13 (C-4), 100.85 (C-6), 105.12 (C-2), 105.77 (C-8), 108.23 (C-9a), 112.12 (C-16), 128.81 (C-18, C-22), 129.69 (C-20), 131.23 (C-19, C-21), 132.13 (C-17), 147.44 (C-14), 149.81 (C-5a), 159.36 (C-9), 165.72 (C-7), 179.57 (C-13, C-4a), 191.62 (C-3), 197.86 (C-1), 201.79 (C-11). Найдено:m/z 430.1039 [M]+ C25H18O7. Вычислено: M=430.1047.
(10S,4Z)-8,13-дигидрокси-7,10-диметил-4-(n-бромфенилметилиден)-5,16-диоксатетрацикло[7.7.0.02.6.010.15]гексадека-1,6,8,12,14-пентаен-3,11-дион 7. Выход 270 мг (53%). Т.пл. 218-219°C.[α]D+406 (c 0.3; CHCl3). ЯМР 1H (CDCl3, δ, м.д.): 1.76 (3H, c, H-15), 2.28 (3H, c, H-10), 2.65 (3H, c, H-12), 6.06 (1H, , H-4), 6.72 (1H, c, H-16), 7.56 (2H, м, H-19, H-21), 7.70 (2H, м, H-18, H-22), 11.44 (1H, c, OH-9), 18.84 (1H, c, OH-3). ЯМР 13C (CDCl3, δ, м.д.): 7.19 (C-10), 27.53 (C-12), 31.63 (C-15), 58.35 (C-9b), 98.88 (C-4), 100.41 (C-6), 104.81 (C-2), 105.49 (C-8), 108.05 (C-9a), 110.23 (C-16), 123.72 (C-20), 130.76 (C-17), 131.75 (C-19, C-21), 132.10 (C-18, C-22), 147.36 (C-14), 149.54 (C-5a), 159.18 (C-9), 165.28 (C-7), 178.97 (C-4a), 179.14 (C-13), 191.30 (C-3), 197.51 (C-1), 201.48 (C-11). Найдено: m/z 508.0161 [M]+ C25H17O7Br. Вычислено: M=508.0152.
(10S,4Z)-8,13-дигидрокси-7,10-диметил-4-(o-метоксифенилметилиден)-5,16-диоксатетрацикло[7.7.0.02.6.010.15]гексадека-1,6,8,12,14-пентаен-3,11-дион 8. Выход 340 мг (74%). Т.пл. 206-208 °C. [α]D+362 (c 0.4; CHCl3). ЯМР 1H (CDCl3, 8, м.д., J/Гц): 1.76 (3H, c, H-15), 2.29 (3H, c, H-10), 2.65 (3H, c, H-14), 3.89 (3H, c, H-23), 6.06 (1H, c, H-4), 6.91 (1H, дд, J19, 20=8.3, J19, 21=0.7, H-19), 7.05 (1H, ддд, J21, 22=7.8, J21, 20=7.4, J21, 19=0.7, H-21), 7.35 (1H, ддд, J20, 19=8.3, J20, 21=7.4, J20, 22=1.7, H-20), 7.39 (1H, c, H-16), 8.23 (1H, дд, J22, 21=7.8, J22, 20=1.7, H-22), 11.37 (1H, c, OH-9), 18.86 (1H, c, OH-3). ЯМР 13C (CDCl3, δ, м.д.): 7.54 (C-10), 27.94 (C-12), 31.99 (C-15), 55.46 (C-23), 58.77 (C-9b), 99.08 (C-4), 101.14 (C-6), 105.11 (C-2), 105.69 (C-8), 106.26 (C-16), 108.02 (C-9a), 110.63 (C-19), 120.75 (C-21), 121.15 (C-17), 131.29 (C-20), 131.56 (C-22), 147.49 (C-14), 149.74 (C-5a), 158.65 (C-18), 159.06 (C-9), 165.62 (C-7), 179.60 (C-13), 179.76 (C-4a), 191.65 (C-3), 197.91 (C-1), 201.82 (C-11). Найдено: m/z 460.1154 [М]+ C26H20O8. Вычислено: M=460.1153.
(10S,4Z)-8,13-дигидрокси-7,10-диметил-4-(n-фторфенилметилиден)-5,16-диоксатетрацикло[7.7.0.02.6.010.15]гексадека-1,6,8,12,14-пентаен-3,11-дион 9. Выход 273 мг (61%). Т.пл. 198°C.[α]D+281 (c 0.4; CHCl3). ЯМР 1H (CDCl3, δ, м.д.): 1.75 (3H, с, H-15), 2.26 (3H, c, H-10), 2.66 (3H, c, H-12), 6.04 (1H, c, H-4), 6.69 (1H, c, H-16), 7.10 (2H, м, H-19, H-21), 7.81 (2H, м, H-18, H-22), 11.39 (1H, c, OH-9), 18.84 (1H, с, OH-3). ЯМР 13C (CDCl3, 5, м.д., J/Гц): 7.48 (C-10), 27.82 (C-12), 31.95 (C-15), 58.67 (C-9b), 99.10 (C-4), 100.76 (C-6), 105.10 (С-2), 105.69 (С-8), 108.27 (С-9а), 110.67 (C-16), 116.00 (д, JC-F=22 Гц, C-19, C-21), 128.43 (д, JC-F=3.18 Гц, C-17), 133.10 (д, JC-F=8.41 Гц, C-18, C-22), 147.01 (д, JC-F=2.64 Гц, C-14), 149.76 (C-5a), 159.29 (C-9), 163.00 (д, JC-F=252.39 Гц, C-20), 165.55 (C-7), 179.22 (C-4a), 179.48 (C-13), 191.60 (C-3), 197.82 (C-1), 201.77 (C-11). Найдено: m/z 448.0957 [М]+ C25H17O7F1. Вычислено: M=448.0953.
(10S,4Z)-8,13-дигидрокси-7,10-диметил-4-(n-хлорфенилметилиден)-5,16-диоксатетрацикло[7.7.0.02.6.010.15]гексадека-1,6,8,12,14-пентаен-3,11-дион 10. Выход 255 мг (55%). Т.пл. 217°C. [α]D+262 (c 0.3; CHCl3). ЯМР 1H (CDCl3, δ, м.д.): 1.75 (H, c, H-15), 2.26 (3H, c, H-10), 2.66 (3H, c, H-12), 6.04 (1H, c, H-4), 6.67 (1H, c, H-16), 7.36 (2H, м, H-19, H-21), 7.74 (2H, м, H-18, H-22), 11.41 (1H, c, OH-9), 18.84 (1H, c, OH-3). ЯМР 13C (CDCl3, δ, м.д.): 7.49 (C-10), 27.84 (C-12), 31.96 (C-15), 58.66 (C-9b), 99.14 (C-4), 100.68 (C-6), 105.12 (C-2), 105.75 (C-8), 108.35 (C-9a), 110.42 (C-16), 129.06 (C-19, C-21), 130.64 (C-17), 132.21 (C-18, C-22), 135.54 (C-14), 147.52 (C-20), 149.80 (C-5a), 159.41 (C-9), 165.53 (C-7), 179.15 (C-4a), 179.43 (C-13), 191.59 (C-3), 197.81 (C-1), 201.77 (C-11). Найдено: m/z 464.0660 [М]+ C25H17O7C11. Вычислено: M=464.0657.
(10S,4Z)-8,13-дигидрокси-7,10-диметил-4-(n-метоксифенилметилиден)-5,16-диоксатетрацикло[7.7,0.02.6.010.15]гексадека-1,6,8,12,14-пентаен-3,11-дион 11. Выход 300 мг (65%). Т.пл. 258-260°C. [α]D+300 (c 0.45; CHCl3). ЯМР 1H (CDCl3, δ, м.д.): 1.75 (3H, c, H-15), 2.29 (3H, c, H-10), 2.65 (3H, c, H-12), 3.84 (3H, c, H-23), 6.04 (1H, c, H-4), 6.78 (1H, c, H-16), 6.95 (2H, м, H-19, H-21), 7.81 (2H, м, H-18, H-22), 11.34 (1H, c, OH-9), 18.83 (1H, c, OH-3). ЯМР 13C (CDCl3, δ, м.д.): 7.54 (C-10), 27.88 (C-12), 32.00 (C-15), 55.28 (C-23), 58.80 (C-9b), 99.06 (C-4), 102.93 (C-6), 105.14 (C-2), 105.65 (C-8), 108.06 (C-9a), 112.38 (C-16), 114.43 (C-19, C-21), 124.92 (C-17), 133.10 (C-18, C-22), 146.42 (C-14), 149.81 (C-5a), 158.99 (C-9), 160.85 (C-20), 165.56 (C-7), 179.42 (C-4a), 179.77 (C-13), 191.65 (C-3), 197.94 (C-1), 201.79 (C-11). Найдено: m/z 460.1148 [M]+ C26H20O8. Вычислено: M=460.1153.
(10S,4Z)-8,13-дигидрокси-7,10-диметил-4-(3,4,5-триметоксифенилметилиден)-5,16-диоксатетрацикло[7.7.0.02.6.010.15]гексадека-1,6,8,12,14-пентаен-3,11-дион 12. Выход 385 мг (72%). Т.пл. 174-176°C. [α]D+224 (c 0.4; CHCl3). ЯМР 1H (CDCl3, δ, м.д.): 1.72 (3H, c, H-15), 2.23 (3H, c, H-10), 2.63 (3H, c, H-12), 3.87 (3H, c, H-24), 3.89 (6H, c, H-23, H-25), 6.02 (1H, c, H-4), 6.65 (1H, c, H-16), 7.09 (2H, c, H-18, H-22), 11.39 (1H, c, OH-9), 18.82 (1H, с, OH-3). ЯМР 13C (CDCl3, δ, м.д.): 7.28 (C-10), 27.80 (C-12), 31.98 (C-15), 55.80 (C-24, c-25), 58.67 (C-9b), 60.83 (C-23), 99.11 (C-4), 100.87 (C-6), 105.09 (C-2), 105.32 (C-8), 108.24 (C-9a), 108.30 (C-18, C-22), 112.23 (C-16), 127.43 (C-17), 139.56 (C-20), 146.95 (C-14), 149.79 (C-5a), 153.04 (C-19, C-21), 159.15 (C-9), 165.41 (C-7), 179.11 (C-4a), 179.47 (C-13), 191.61 (C-3), 197.80 (C-1), 201.79 (C-11). Найдено: m/z 520.1374 [M]+ C28H24O10. Вычислено: M=520.1364.
(10S,4Z)-8,13-дигидрокси-7,10-диметил-4-(м-нитрофенилметилиден)-5,16-диоксатетрацикло[7.7.0.02.6.010.15]гексадека-1,6,8,12,14-пентаен-3,11-дион 13. Выход 167 мг (35%). Т.пл. 230°C с разл. [α]D+364 (c 0.2; CH2Cl2). ЯМР 1H (CD2Cl2 δ, м.д.): 1.80 (3H, c, H-15), 2.34 (3H, c, H-10), 2.66 (3H, c, H-12), 6.09 (1H, c, H-4), 6.77 (1H, c, H-16), 7.64, 8.12, 8.21 (3H, 3м, H-20, H-21, H-22), 8.83 (4H, c, H-18), 11.53 (1H, c, OH-9), 18.88 (1H, c, OH-3). ЯМР 13C (CD2Cl2, δ, м.д.): 6.34 (C-10), 27.26 (C-12). 31.34 (C-15), 58.39 (C-9b), 98.81 (C-4), 100.05 (C-6), 104.89 (C-2), 105.63 (C-8), 107.73 (C-16), 108.49 (C-9a), 123.21, 124.81, 129.43, 136.06 (C-18, C-19, C-20, C-21), 133.60 (C-17), 148.17 (C-14), 148.46 (C-5a), 159.57 (C-9), 165.33 (C-7), 178.45 (C-4a), 179.09 (C-13), 191.38 (C-3), 197.70 (C-1), 201.62 (C-11). Найдено: m/z 475.0895 [M]+ C25H17O9N1. Вычислено: M=475.0898.
Пример 4.
Влияние усниновой кислоты (1), ее фуранонового производного (5) и соединений (6-13) на жизнеспособность опухолевых клеток Т-клеточного лейкоза человека МТ-4.
Клетки линии МТ-4 (клетки Т-клеточного лейкоза человека) культивировали в среде RPMI 1640, содержащей 10%-ную эмбриональную телячью сыворотку, антибиотики (100 ед./мл пенициллина и 0.1 мг/мл стрептомицина), в атмосфере 5%-ного Co2 при 37°C. Жизнеспособность клеток после инкубации с соединениями (1, 6-13) определяли с помощью МТТ теста, который основан на способности живых клеток превращать соединения на основе тетразола (МТТ) в ярко окрашенные кристаллы формазана, что позволяет спектрофотометрически оценивать количество живых клеток в препарате. Для этого клетки высаживали в 96-луночные планшеты (100 мкл клеток с концентрацией 500 тыс. клеток/мл). Затем к клеткам добавляли раствор соединений (1,5-13) в ДМСО до конечной концентрации в среде от 0.1 до 100 мкг/мл. Клетки инкубировали в присутствии соединений еще в течение 3-х суток в тех же условиях. По окончании инкубации, без смены среды, к клеткам добавляли раствор МТТ (5 мг/мл) в фосфатно-солевом буфере до концентрации 0.5 мг/мл и инкубировали в течение 3 ч в тех же условиях. Среду удаляли, к клеткам добавляли по 100 мкл ДМСО, в котором происходит растворение образовавшихся в клетках кристаллов формазана, и измеряли оптическую плотность на многоканальном спектрофотометре на длинах волн 570 и 630 нм, где А570 - поглощение формазана, а A570 - фон клеток. Данные представляли в виде количества живых клеток относительно контроля. За 100% принимали количество клеток в контроле, где клетки инкубировали в отсутствии соединения, но в присутствии растворителя ДМСО.
Значения CD50 - концентрация соединения, при которой наблюдается гибель 50% клеток, а также CD80 и CD90 (концентрации, при которых наблюдается гибель 80 и 90% клеток, соответственно) приведены в таблице 1.
Из данных, приведенных в таблице 1, видно, что соединения (6-13) обладают более выраженным противоопухолевым эффектом в отношении исследованных опухолевых клеток МТ-4 по сравнению с (+)-усниновой кислоты (1).
Пример 5.
Влияние усниновой кислоты (1) и соединений (6-13) на жизнеспособность опухолевых клеток Т-клеточного лейкоза человека СЕМ-13.
Клетки линии СЕМ-13 (линия клеток Т-клеточного лейкоза человека) культивировали в среде RPMI 1640, содержащей 10%-ную эмбриональную телячью сыворотку, антибиотики (100 ед./мл пенициллина и 0.1 мг/мл стрептомицина), в атмосфере 5%-ного CO2 при 37°C.
Жизнеспособность клеток после инкубации с соединениями (1, 6-13) определяли с помощью МТТ теста, который основан на способности живых клеток превращать соединения на основе тетразола (МТТ) в ярко окрашенные кристаллы формазана, что позволяет спектрофотометрически оценивать количество живых клеток в препарате. Для этого клетки высаживали в 96-луночные планшеты (100 мкл клеток с концентрацией 500 тыс. клеток/мл). Затем к клеткам добавляли раствор соединений (1, 5-13) в ДМСО до конечной концентрации в среде от 0.1 до 100 мкг/мл. В качестве препарата сравнения использовали (+)-усниновую кислоту (1). Клетки инкубировали в присутствии исследуемых соединений еще в течение 3-х суток в тех же условиях. По окончании инкубации, без смены среды, к клеткам добавляли раствор МТТ (5 мг/мл) в фосфатно-солевом буфере до концентрации 0.5 мг/мл и инкубировали в течение 3 ч в тех же условиях. Среду удаляли, к клеткам добавляли по 100 мкл ДМСО, в котором происходит растворение образовавшихся в клетках кристаллов формазана, и измеряли оптическую плотность на многоканальном спектрофотометре на длинах волн 570 и 630 нм, где A570 - поглощение формазана, а A630 - фон клеток. Подсчет значений CD проводили, как описано в примере 4. Значения CD50 - концентрация соединения, при которой наблюдается гибель 50% клеток, а также CD80 и CD90 (концентрации, при которых наблюдается гибель 80 и 90% клеток, соответственно) приведены в таблице 1. Все исследованные соединения (6-13) обладают более выраженным противоопухолевым эффектом в отношении исследованных опухолевых клеток СЕМ-13 по сравнению с (+)-усниновой кислотой (1).
Пример 6.
Влияние усниновой кислоты (1) и соединений (6-13) на жизнеспособность опухолевых клеток человека U-937
Клетки линии U-937 (опухолевая линия моноцитов человека) культивировали в среде RPMI 1640, содержащей 10%-ную эмбриональную телячью сыворотку, антибиотики (100 ед./мл пенициллина и 0.1 мг/мл стрептомицина), в атмосфере 5%-ного CO2 при 37°C. Жизнеспособность клеток после инкубации с соединениями (1, 6-13) определяли с помощью МТТ теста, который основан на способности живых клеток превращать соединения на основе тетразола (МТТ) в ярко окрашенные кристаллы формазана, что позволяет спектрофотометрически оценивать количество живых клеток в препарате. Для этого клетки высаживали в 96-луночные планшеты (100 мкл клеток с концентрацией 400 тыс. клеток/мл). Затем к клеткам добавляли раствор исследуемых соединений в ДМСО до конечной концентрации в среде от 0.1 до 100 мкг/мл. В качестве препарата сравнения использовали (+)-усниновую кислоту (1). Клетки инкубировали в присутствии соединений еще в течение 3-х суток в тех же условиях. По окончании инкубации, без смены среды, к клеткам добавляли раствор МТТ (5 мг/мл) в фосфатно-солевом буфере до концентрации 0.5 мг/мл и инкубировали в течение 3 ч в тех же условиях. Среду удаляли, к клеткам добавляли по 100 мкл ДМСО, в котором происходит растворение образовавшихся в клетках кристаллов формазана, и измеряли оптическую плотность на многоканальном спектрофотометре на длинах волн 570 и 630 нм, где A570 - поглощение формазана, а A630 - фон клеток. Подсчет значений CD проводили, как описано в примере 4.
Из данных, приведенных в таблице 1, видно, что соединения (6-13) обладают более выраженным противоопухолевым эффектом в отношении исследованных опухолевых клеток U-937 по сравнению с (+)-усниновой кислотой (1), за исключением соединения (7), противоопухолевый эффект которого на клетках U-937 менее выражен по сравнению с (+)-усниновой кислотой (1).
Пример 7.
Влияние соединений 6, 9, 10 на индукцию апоптоза в опухолевых клетках человека МТ-4
Для соединений 6, 9, 10 с наиболее высокой цитотоксичностью была определена их способность индуцировать апоптоз в опухолевых клетках.
В результате активации апоптоза происходит фрагментация ДНК за счет активации эндонуклеаз. Для определения фрагментированной ДНК клетки окрашивают красителем пропидиум иодид и затем определяют процент фрагметированной ДНК, с использованием проточного цитофлюориметра. Фиксируют клетки в суспензии в 70% этаноле путем добавления 1 мл клеток, суспендированных в фосфатно-солевом буфере (ФСБ) (1-5×106 клеток), к 9 мл 70% этанола в пробирке на льду. Далее клетки центрифугируют при 200 g, в течение 3 мин, этанол удаляют, клетки суспендируют в 10 мл PBS и центрифугируют при 300 g, в течение 5 мин. Затем клетки суспендируют в 0,5 мл PBS и инкубируют при комнатной температуре в течение 5 мин. После центрифугирования при 300 g в течение 5 мин осадок клеток суспендируют в 1 мл в растворе для окрашивания ДНК. Раствор для окрашивания ДНК готовят следующим образом: растворяют 200 мкг пропидиум иодида в 10 мл ФСБ, а затем добавляют 10 мкл Triton X-100 и 2 мг РНКазы. Полученный раствор инкубируют 15 мин при 70°C. Для окрашивания клетки инкубируют в течение 30 мин при комнатной температуре.
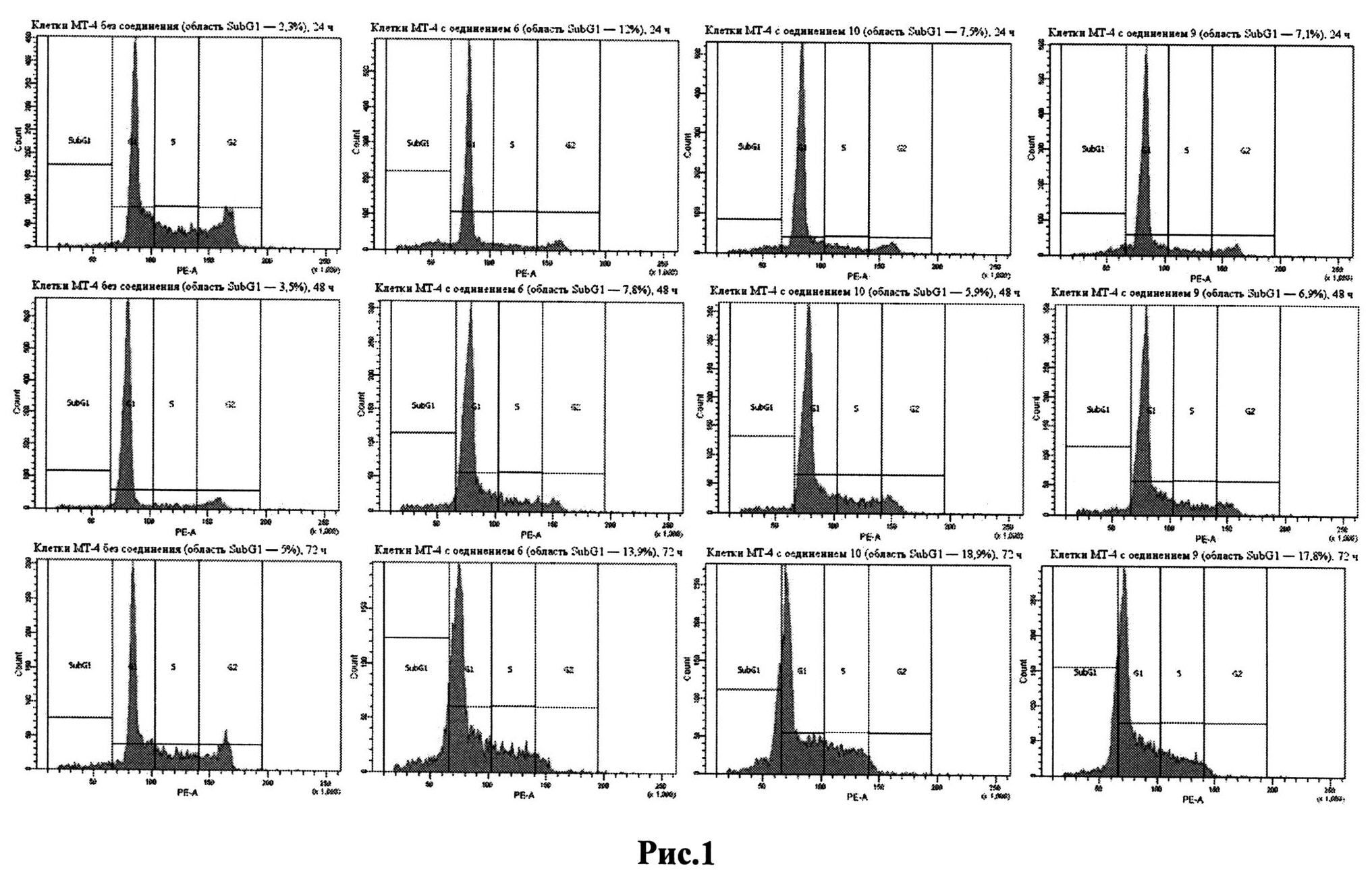
Анализ клеток проводят методом проточной цитометрии на проточном цитофлюориметре Canto FACS. Для возбуждения флюоресценции используют лазер (длина волны 488-нм), измеряют флуоресценцию при длине 600 нм и светорассеяние. Производят подсчет 10000 клеток. Количество клеток, в которых наблюдается апоптоз, соответствует области SubGl. Полученные результаты приведены на рис.1 и таблице 2.
Из этих данных видно, что обработка клеток линии МТ-4 приводит к индукции апоптоза через 24 часа в 6-12% клеток, а через 72 часа - в 13-19% клеток. Наибольшую активность в отношении индукции апоптоза в клетках МТ-4 проявили соединения 9, 10. В таблице приведены данные двух независимых экспериментов, в каждом было просчитано 10 тысяч клеток.
Пример 8.
Влияние соединений 6,9,10 на индукцию апоптоза в опухолевых клетках человека U-937
Для соединений 6, 9, 10 с наиболее высокой цитотоксичностью была определена их способность индуцировать апоптоз в опухолевых клетках.
В результате активации апоптоза происходит фрагментация ДНК за счет активации эндонуклеаз. Для определения фрагментированной ДНК клетки окрашивают красителем пропидиум иодид и затем определяют процент фрагметированной ДНК, с использованием проточного цитофлюориметра. Фиксируют клетки в суспензии в 70% этаноле путем добавления 1 мл клеток, суспендированных в фосфатно-солевом буфере (ФСБ) (1-5×106 клеток), к 9 мл 70% этанола в пробирке на льду. Далее клетки центрифугируют при 200 g, в течение 3 мин, этанол удаляют, клетки суспендируют в 10 мл PBS и центрифугируют при 300 g, в течение 5 мин. Затем клетки суспендируют в 0,5 мл PBS и инкубируют при комнатной температуре в течение 5 мин. После центрифугирования при 300 g в течение 5 мин осадок клеток суспендируют в 1 мл в растворе для окрашивания ДНК. Раствор для окрашивания ДНК готовят следующим образом: растворяют 200 мкг пропидиум иодида в 10 мл ФСБ, а затем добавляют 10 мкл Triton X-100 и 2 мг РНКазы. Полученный раствор инкубируют 15 мин при 70°C. Для окрашивания клетки инкубируют в течение 30 мин при комнатной температуре.
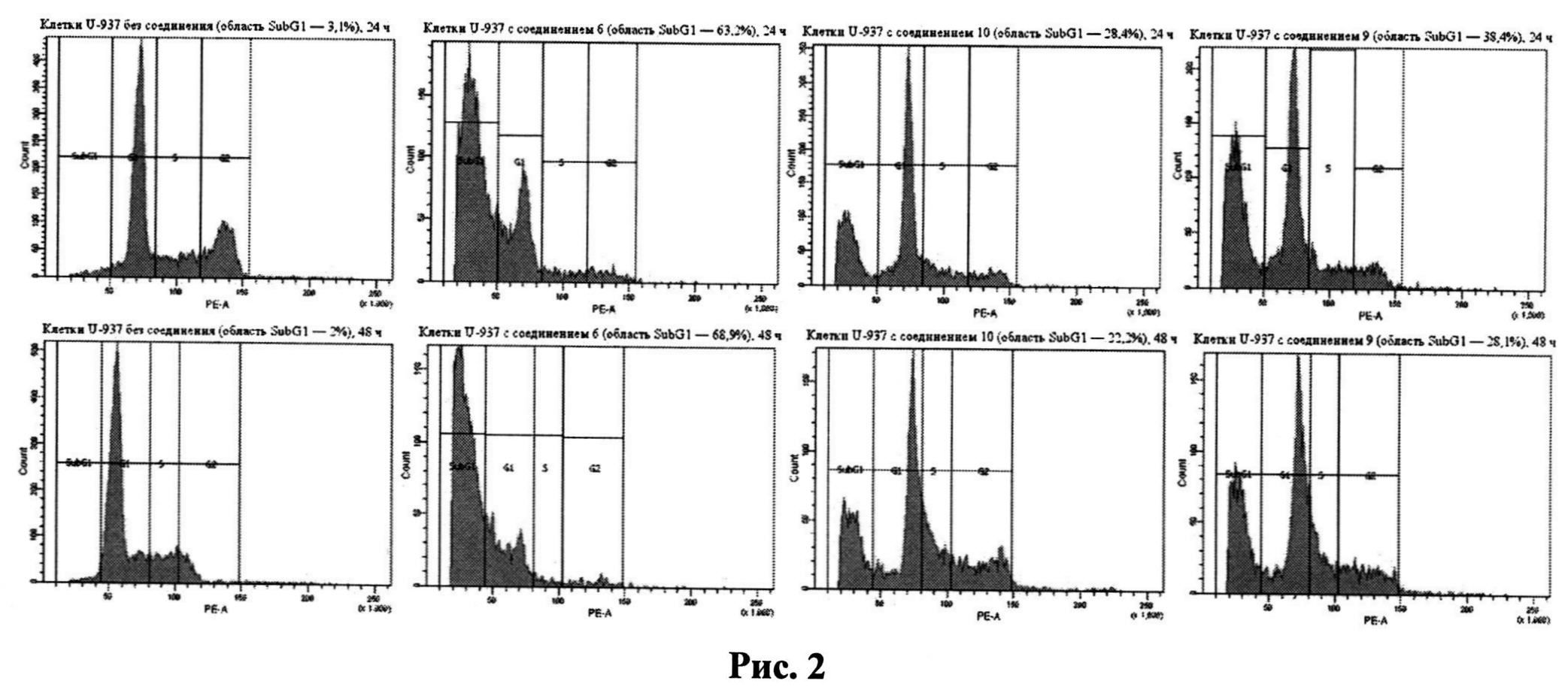
Анализ клеток проводят методом проточной цитометрии на проточном цитофлюориметре Canto FACS. Для возбуждения флюоресценции используют лазер (длина волны 488-нм), измеряют флуоресценцию при длине 600 нм и светорассеяние. Производят подсчет 10000 клеток. Количество клеток, в которых наблюдается апоптоз, соответствует области SubG1. Полученные результаты приведены на рис.2 и таблице 3. Из этих данных видно, что обработка клеток линии U-937 приводит к индукции апоптоза через 24 часа в 28-63% клеток, а через 48 часов - в 28-69% клеток. Наибольшую активность показала соединение 6. В таблице приведены данные двух независимых экспериментов, в каждом было просчитано 10 тысяч клеток.
Таким образом, соединения (6-13) обладают более выраженным противоопухолевым эффектом в отношении исследованных опухолевых клеток МТ-4, СЕМ-13 и U-937 по сравнению с (+)-усниновой кислотой (1).
Таблица 1
|
|