Результат интеллектуальной деятельности: АНТИГИПОКСИЧЕСКОЕ И ГИПОЛИДЕМИЧЕСКОЕ ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО, УЛУЧШАЮЩЕЕ КОРОНАРНЫЙ И МОЗГОВОЙ КРОВОТОК
Вид РИД
Изобретение
Изобретение относится к медицине, более точно к фармации, и может быть использовано для приготовления лекарственного антигипоксического и гиполипидемического средства, улучшающего коронарный и мозговой кровоток. Известно применение в качестве антигипоксических средств, улучшающих кровоток, таких фармацевтических препаратов, как мексидол и мексикор (Машковский М.Д. Лекарственные средства. 1997 г., т.2). Препараты на их основе или на основе солей янтарной кислоты защищены патентами РФ 2205640, 2002 г.; 2205640, 2003; 2366426, 2007 г., 2410094, 2005 г.; 2410094, 2009 г. Однако эти известные препараты не содержат гиполипидемических субстанций, которые бы в сочетании с солями янтарной кислоты могли бы обеспечить выраженный антигипоксический и гиполипидемический эффект, что необходимо при лечении атеросклероза.
Препарат на основе соли янтарной кислоты и гиполипидемического средства аторвастатина описан в патенте №2445091 как антигипоксическое и гиполипидемическое средство, улучшающее коронарный и мозговой кровоток. Это техническое решение выбрано в качестве прототипа заявленного изобретения. Известное средство содержит в масс.%:
|
Однако указанное средство обладает следующими недостатками.
Исследования показали, что известное средство при хранении теряет свою фармакологическую активность за счет деградации аторвастатина. В качестве наиболее вероятных причин химического разрушения структуры аторвастатина кальция можно выделить снижение pH среды, наличие окислителей, повышение температуры и воздействие кислорода воздуха. Реакция циклизации аторвастатина в лактон может быть представлена следующим образом.
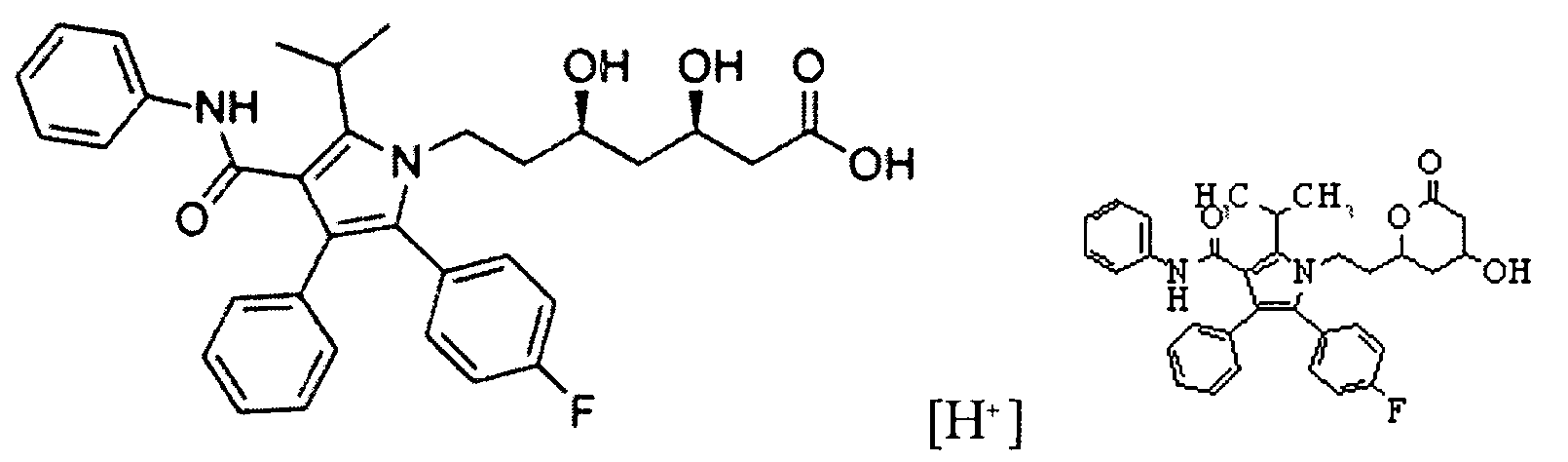
Одним из основных факторов закисления среды в изучаемой комбинации являются химические свойства субстанции этилметилгидроксипиридина сукцината. За счет кислотных свойств этилметилгидроксипиридина сукцината pH среды, в которой находится данное вещество, снижается, что приводит к нестабильности аторвастатина кальция. Предположительно, протон водорода диссоциирует от молекулы этилметилгидроксипиридина сукцината, вступает в реакцию с аторвастатином, что приводит к циклизации аторвастатина в лактон (1). Данная реакция протекает в обычных условиях, повышение температуры может являться катализатором процесса. Изученные литературные источники рекомендуют для решения подобного рода проблемы использовать в качестве вспомогательного сырья вещества с основными свойствами такие, как кальций карбонат, магния оксид, натрия лаурил сульфат и д.р.
Для предотвращения разрушения аторвастатина кальция нужно исключить влияние на показатели качества лекарственной формы непосредственно самой методики пробоподготовки (частично, возможно, что через образование нитрилиевых солей проходит гидратация ацетонитрила, участвующего в анализе в кислой среде до амидов и далее гидролиз до карбоновых кислот, что сдвигает pH):
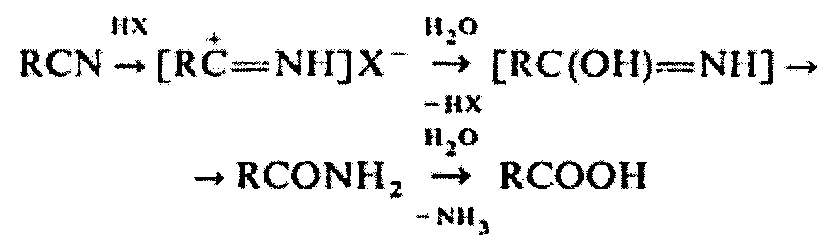
Предлагаемое изобретение предотвращает этот негативный эффект.
Техническим результатом изобретения является повышение фармакологической эффективности действия препарата и увеличение срока его хранения за счет предотвращения деградации аторвастатина в лекарственной форме.
Этот технический результат достигается тем, что в известном антигипоксическом и гиполипидемическом фармацевтическом средстве, улучшающем коронарный и мозговой кровоток, включающем терапевтически эффективное количество этилметилгидроксипиридина сукцинат и аторвастатина кальция, а также вспомогательные вещества в виде лактозы и магния стеарата, заключенные в желатиновые капсулы этилметилгидроксипиридин сукцинат и магния стеарат, помещены во внутреннюю меньшую желатиновую капсулу, размещенную внутри основной внешней желатиновой капсулы, содержащей аторвастатин, лактозу и магния стеарат, при этом во внутренней капсуле соотношение ингредиентов в масс.% составляет:
|
а во внешней капсуле соотношение ингредиентов составляет в масс. %:
|
Терапевтически эффективная доза этилметилгидроксипиридина сукцината может составлять 100-250 мг.
Терапевтически эффективная доза аторвастатина может составлять 10-40 мг.
Предлагаемое фармакологическое средство изготавливают следующим образом.
Для производства использовалось оборудование, позволяющее осуществлять фасовку продукта по технологии «капсула в капсуле». Была использована капсулонаполняющая машина ACG-Pam AF-40T (производительность 40000 капсул в час, производство Индия).
1 этап ТП - приготовление технологической смеси для капсул №3 - состав 1.
2 этап ТП - приготовление технологической смеси для капсул №0 - состав 2.
3 этап ТП - фасовка технологической смеси состав 1 в капсулы №3. На капсулонаполняющую машину устанавливают формат №3 для порошкового наполнения капсул. Загружают капсулы №3 и технологическую смесь - состав 1. После получения необходимого количества капсул выполняют процедуру очистки. Снимают формат №3, устанавливают формат №0 с группой для порошкового наполнения и фасовки капсулы в капсулу.
4 этап ТП - фасовка технологической смеси состава 2 и капсул №3 в капсулы №0. В загрузочный бункер капсул загружают пустые капсулы формата №0. В загрузочный бункер порошкового модуля загружают технологическую смесь - состав 2, а в загрузочный бункер модуля фасовки капсулы в капсулу загружают капсулы №3, содержащие этилметилгидроксипиридина сукцинат. На выходе получают лекарственное средство, изготовленное по принципу «капсула в капсуле», что позволяет разделить две активные субстанции и исключить их влияние друг на друга.
Примеры реализации заявленного средства
Вышеописанным способом были приготовлены 7 образцов средства следующего состава:
Состав №1
Состав смеси во внутренней капсуле:
|
Состав смеси во внешней капсуле:
|
Состав №2
Состав смеси во внутренней капсуле:
|
Состав смеси во внешней капсуле:
|
Состав №3
Состав смеси во внутренней капсуле:
|
Состав смеси во внешней капсуле:
|
Состав №4
Состав смеси во внутренней капсуле:
|
Состав смеси во внешней капсуле:
|
Состав №5
Состав смеси во внутренней капсуле:
|
Состав смеси во внешней капсуле:
|
Состав №6
Состав смеси во внутренней капсуле:
|
Состав смеси во внешней капсуле:
|
Состав №7
Состав смеси во внутренней капсуле:
|
Состав смеси во внешней капсуле:
|
Полученные капсулы были отправлены на хранение при обычной и повышенной температуре 60°C в течение 80 дней, а затем подвергнуты химическому анализу.
Методы исследования
Подтверждение подлинности
ВЭЖХ аторвастатина. Время удержания основного пика на хроматограмме испытуемого раствора должно соответствовать времени удержания основного пика на хроматограмме стандартного раствора аторвастатина кальция тригидрата (Sigma 134523-03-08).
УФ-спектрофотометрия аторвастатина. Около 12 мг препарата помещают в мерную колбу вместимостью 50 мл, растворяют в метаноле, доводят объем раствора метанола до метки и перемешивают 12 мкг/мл. УФ-спектр поглощения полученного раствора, снятый на спектрофотометре в области 220-300 нм в кювете с толщиной слоя 1 см относительно метанола, должен иметь максимум поглощения при длине волны 246±2 нм.
УФ-спектрофотометрия этилметилгидроксипиридина сукцината. Ультрафиолетовые спектры поглощения растворов препарата и раствора стандартного образца этилметилгидроксипиридина сукцината, приготовленные для количественного определения в области 250-350 нм, должны иметь максимум при одних и тех же длинах волн.
ТСХ этилметилгидроксипиридина сукцината. На хроматограмме раствора Б (2 мкг), полученной при определении посторонних примесей, основное пятно должно соответствовать по параметру удерживания R1 пятну на хроматограмме раствора стандартного образца свидетеля этилметилгидроксипиридина сукцината.
Количественное определение субстанций в каждой смеси проводилось раздельно.
1. Методом ВЭЖХ для аторвастатина.
Около 0,10 г (точная навеска) растертого порошка из внешней капсулы помещают в мерную колбу вместимостью 100 мл, прибавляют 70 мл смеси для растворения, перемешивают в течение 30 мин, доводят объем суспензии той же смесью до метки, перемешивают и фильтруют через мембранный фильтр с диаметром пор 0,45 мкм, отбрасывая первые порции фильтрата (испытуемый раствор).
Хроматографические условия:
колонка - 4,6 мм ×25 см Hypersil ODS (5 мкм) или аналогичная;
подвижная фаза - ацетонитрил - тетрагидрофуран - 0,05 М раствор кислоты лимонной (27:20:53);
скорость потока - 1,0 мл/мин;
детектор - спектрофотометрический, 244 нм.
Последовательно хроматографируют по 20 мкл испытуемого раствора и раствора РСО аторвастатина кальция.
Содержание аторвастатина в капсуле в миллиграммах (X) вычисляют по формуле:
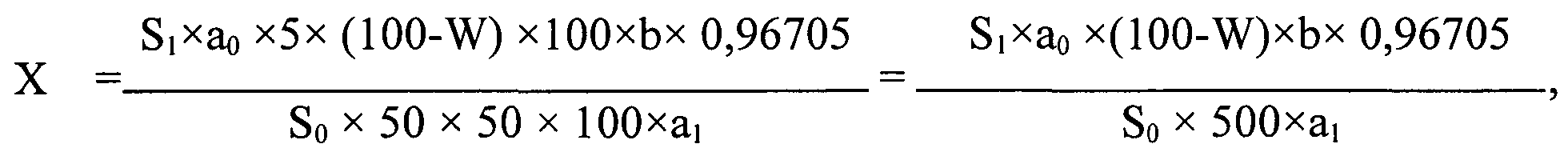
где S1 - площадь пика аторвастатина на хроматограмме испытуемого раствора;
S0 - площадь пика аторвастатина на хроматограмме раствора РСО;
a1 - навеска порошка капсул, в граммах;
a0 - навеска РСО аторвастатина кальция, в миллиграммах;
W - содержание воды в РСО аторвастатина кальция, в процентах;
b - средняя масса содержимого капсулы, в миллиграммах;
0,96705 - коэффициент пересчета аторвастатина кальция безводного на аторвастатин.
Содержание C33H35FN2O5 (аторвастатина) в капсуле должно удовлетворять требованиям ГФ XI, вып.2, считая на среднюю массу содержимого капсулы.
Результаты анализа считаются достоверными, если выполняются требования теста «Проверка пригодности хроматографической системы».
1. Приготовление 0,05 М раствора кислоты лимонной. 9,6 г кислоты лимонной в пересчете на безводную растворяют в 800 мл воды, доводят pH раствора до 4,0±0,1 раствором аммиака концентрированным, доводят объем раствора водой до 1000 мл и перемешивают.
2. Приготовление подвижной фазы. Смешивают ацетонитрил - тетрагидрофуран - 0,05 М раствор кислоты лимонной в соотношении 27:20:53.
3. Приготовление раствора СО аторвастатина кальция. Около 0,054 г (точная навеска) аторвастатина кальция помещают в мерную колбу вместимостью 50 мл, растворяют в смеси ацетонитрил - цитратный буферный раствор с pH 7,4 (1:1), доводят объем раствора той же смесью до метки и перемешивают. 5 мл полученного раствора переносят в мерную колбу вместимостью 50 мл, доводят объем раствора той же смесью до метки и перемешивают.
Раствор используют свежеприготовленным.
4. Проверка пригодности хроматографической системы. Хроматографируют раствор СО аторвастатина кальция. Эффективность колонки (N), рассчитанная по пику аторвастатина, должна быть не менее 3000 теоретических тарелок, фактор асимметрии (Т) пика аторвастатина должен быть не более 2,0. Относительное стандартное отклонение для площади пика аторвастатина при пяти последовательных инжекциях должно быть не более 2,0%.
2. Методом УФ-спектрофотометрии для этилметилгидроксипиридина сукцината. Около 100 мг (точная навеска) содержимого капсул помещают в мерную колбу вместимостью 100 мл, прибавляют 80 мл 0,1 М раствора кислоты хлористоводородной и интенсивно перемешивают в течение 10 мин. Доводят объем раствора до метки 0,1 М раствором кислоты хлористоводородной, перемешивают и фильтруют через фильтр бумажный «синяя лента», отбрасывая первые порции фильтрата.
1 мл фильтрата переносят в мерную колбу вместимостью 100 мл, доводят объем раствора до метки 0,1 М раствором кислоты хлористоводородной и перемешивают (испытуемый раствор).
Измеряют оптическую плотность испытуемого раствора на спектрофотометре в максимуме поглощения при длине волны 297 нм в кювете с толщиной слоя 10 мм. В качестве раствора сравнения используют 0,1 М раствор кислоты хлористоводородной.
Параллельно измеряют оптическую плотность раствора РСО этилметилгидроксипиридина сукцината.
Содержание этилметилгидроксипиридина сукцината в одной капсуле в миллиграммах (X) вычисляют по формуле:
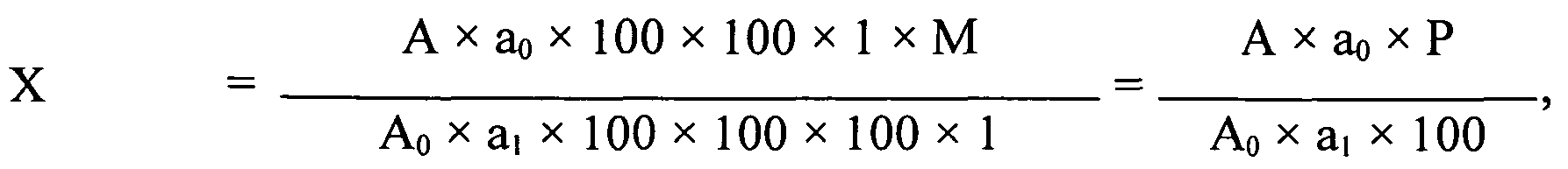
где А - оптическая плотность испытуемого раствора;
A0 - оптическая плотность раствора СО этилметилгидроксипиридина сукцината;
a0 - масса навески СО этилметилгидроксипиридина сукцината, в миллиграммах;
A1 - масса навески растертого гранулята, в миллиграммах;
P - фактическое содержание основного вещества в СО этилметилгидроксипиридина сукцината в пересчете на безводное вещество, в процентах;
М - средняя масса содержимого одной капсулы в миллиграммах.
Содержание C12H17NO5 (этилметилгидроксипиридина сукцината) в одной капсуле, считая на среднюю массу содержимого капсул, должно соответствовать требованиям ГФ XI, вып.2.
Приготовление раствора СО этилметилгидроксипиридина сукцината
Около 100 мг (точная навеска) этилметилгидроксипиридина сукцината (ФСП 42-8455-07, ФСП 42-06502066-06) помещают в мерную колбу вместимостью 100 мл, прибавляют 60 мл 0,1 М раствора кислоты хлористоводородной, перемешивают до полного растворения, доводят объем полученного раствора тем же растворителем до метки и перемешивают. 1 мл полученного раствора помещают в мерную колбу вместимостью 100 мл, доводят объем раствора тем же растворителем до метки и перемешивают.
Оценка влияния вспомогательных веществ и определение примесных соединений в смесях проводилась также раздельно:
- методом ВЭЖХ для аторвастатина.
К 0,10 г растертого порошка из внешней капсулы прибавляют 20 мл смеси для растворения (см. раздел «Количественное определение»), перемешивают в течение 30 мин и фильтруют через мембранный фильтр с диаметром пор 0,45 мкм, отбрасывая первые порции фильтрата (испытуемый раствор). 0,5 мл испытуемого раствора помещают в мерную колбу вместимостью 100 мл, доводят объем раствора смесью для растворения до метки и перемешивают (раствор сравнения).
Последовательно хроматографируют по 20 мкл раствора сравнения и испытуемого раствора в условиях, описанных в разделе «Количественное определение». Время регистрации испытуемого раствора должно не менее чем в 3 раза превышать время удерживания основного пика.
Площадь пика любой посторонней примеси на хроматограмме испытуемого раствора не должна превышать площадь пика аторвастатина на хроматограмме раствора сравнения (не более 0,5%); сумма площадей всех пиков посторонних примесей не должна более чем в 4 раза превышать площадь пика аторвастатина на хроматограмме раствора сравнения (не более 2,0%).
- Метод ТСХ для этилметилгидроксипиридина сукцината. Около 200 мг порошка растертого содержимого внутренних капсул помещают в пробирку с притертой пробкой вместимостью 20 мл, прибавляют 10 мл спирта 96%, встряхивают в течение 2 мин и фильтруют через фильтр бумажный «синяя лента», отбрасывая первые порции фильтрата, или центрифугируют при 3000 об/мин (раствор А).
0,5 мл раствора А помещают в мерную колбу вместимостью 50 мл, доводят объем раствора спиртом этиловым 96% до метки и перемешивают (раствор Б).
На линию старта хроматографической пластинки с закрепленным на алюминиевой подложке слоем силикагеля 60 F254 (типа Merck) размером 10×20 см раздельно наносят по 0,01 мл раствора А (200 мкг), раствора Б (2 мкг), раствора 1 (2 мкг) и раствора 2 (0,5 мкг) СОВС этилметилгидроксипиридинасукцината.
Пластинку с нанесенными пробами высушивают на воздухе в течение 10 мин, помещают в ненасыщенную камеру со смесью ацетон-этилацетат-раствор аммиака концентрированный (50:50:1) и хроматографируют восходящим методом. Когда фронт подвижной фазы пройдет 10 см от линии старта, ее вынимают из камеры, сушат на воздухе в течение 10 мин и просматривают в ультрафиолетовом свете при длине волны 254 нм.
На хроматограмме раствора А пятно одной единичной примеси не должно превышать по совокупности величины и интенсивности поглощения пятна на хроматограмме раствора 1 (не более 1,0%). Допускается пятно на линии старта.
Результаты анализа считаются достоверными, если выполняются требования теста «Проверка пригодности хроматографической системы».
1. Приготовление раствора 1 и 2 СОВС этилметилгидроксипиридина сукцината. 20 мг этилметилгидроксипиридина сукцината (ФСП 42-8455-07, ФСП 42-06502066-06) помещают в мерную колбу вместимостью 100 мл, растворяют в 50 мл спирта этилового 96%, доводят объем раствора тем же растворителем до метки и перемешивают (раствор 1).
К 1 мл раствора 1 прибавляют 3 мл спирта этилового 96% и перемешивают (раствор 2).
2. Проверка пригодности хроматографической системы. Хроматографическая система считается пригодной, если на хроматограмме раствора 2 (0,5 мкг) наблюдается четкое пятно.
Определение pH среды проводилось на автоматическом аппарате pH-метр Sartorius PB-11.
Результаты представлены в таблицах 1, 2 и 3.
В таблице 1 представлены результаты исследования вновь изготовленных средств №1-№7.
В таблице 2 представлены результаты исследования после хранения средств №1-№7 при температуре 25°C в течение 3 лет 6 месяцев.
В таблице 3 представлены результаты исследования после хранения средств №1-№7 при повышенной температуре 60°C в течение 80 дней, что эквивалентно 3 годам 6 месяцам обычного хранения.
Как видно из таблиц 1-3 и на основании полученных данных испытуемых образцов, можно сделать заключение, что в смеси аторвастатина кальция, лактозы и магния стеарата, а также в смеси этилметилгидроксипиридина сукцината и магния стеарата не наблюдается снижение количественного содержания основных действующих веществ.
В то же время при совместном хранении смеси аторвастатина, этилметилгидроксипиридина сукцината, лактозы и магния стеарата наблюдалось увеличение содержания примесных соединений. При повышенной температуре (ускоренное хранение в термостате при 40°С) в этих образцах наблюдалось количество примесей выше, чем в нормальных условиях хранения в естественных условиях. Таким образом, можно сделать вывод о недостаточной стабильности аторвастатина кальция и этилметилгидроксипиридина сукцината в образцах, изготовленных по прототипу, и сохранение химической структуры действующих веществ в препарате, изготовленном согласно изобретению. Сохранение химической структуры соединений в представленных образцах обеспечивает повышение фармакологической активности этих препаратов по сравнению с образцами прототипа.
|
|
|

