Результат интеллектуальной деятельности: СПОСОБ ПРОВЕДЕНИЯ ИНТРАОПЕРАЦИОННОЙ КОМБИНИРОВАННОЙ СПЕКТРОСКОПИЧЕСКОЙ ДИАГНОСТИКИ ОПУХОЛЕЙ ГОЛОВНОГО И СПИННОГО МОЗГА
Вид РИД
Изобретение
Настоящее изобретение относится к медицине, а именно к нейроонкологии, и может быть использовано для интраоперационной диагностики границ опухолей головного и спинного мозга и определения качества резекции опухоли.
В настоящее время наблюдается значительный рост частоты онкологических заболеваний центральной нервной системы. Особую сложность представляет определение границ внутримозговых и интрамедуллярных опухолей. Актуальность проблемы определения границ астроцитарных опухолей обусловлена особенностями их роста вдоль миелинизированных нервных волокон и сосудов, приводящего к инфильтрации здорового белого вещества опухолевыми клетками, что сказывается в высокой частоте послеоперационных рецидивов. Сложность хирургии интрамедуллярных опухолей спинного мозга состоит в том, что опухоль не всегда имеет четкую границу и высок риск травматизации по причине меньших размеров оперируемого участка по сравнению с головным мозгом. Надежная информация касательно объема резецированной опухоли может быть получена путем интраоперационной визуализации. Решение этой проблемы реализуется в основном в трех направлениях: использование интраоперационной компьютерной томографии, магнитно-резонансной томографии и УЗИ-сканирования, и различными комбинациями этих методов [bitraoperative Imaging in Neurosurgery: MRI, CT, U/S, Springer-Verlag, Vienna, 2003; Radiology Research and Practice, Volume 2012 (2012), Article ID 197364, 9 pages; Acta Neurochirurgica (Wien), 2007; 149(4):365-78].
К сожалению, все эти способы интраоперационной диагностики не позволяют проводить исследование тканей в операционной ране в режиме реального времени и/или не обеспечивают одновременный анализ как структурных, так и метаболических изменений.
Между тем, клинические исследования показали значительную корреляцию между уровнем накопления 5-аминолевулиновой кислоты (5-АЛК) - индуцированного протопорфирина DC и скоростью деления клеток, что позволяет использовать это вещество в качестве опухолевого маркера. Однако, ввиду того, что в 20-30% случаев наблюдается лишь незначительное накопление препарата в опухолевых клетках, необходимы дополнительные критерии для интраоперационной диагностики исследуемых тканей. Как известно, опухолевая ткань и здоровая мозговая ткань характеризуются отличиями как по структуре ткани, так и по степени кровенаполненности и оксигенации гемоглобина. Таким образом, одновременное определение этих параметров позволяет повысить чувствительность метода, основанного на определении концентрации опухолевого маркера (5 АЛК-индуцированного протопорфирина IX).
Поэтому весьма актуальной проблемой является разработка способа быстрого интраоперационного анализа тканей по совокупности характерных признаков во время удаления опухолей головного и спинного мозга. Флуоресцентная спектроскопия и спектроскопия диффузного отражения предоставляют точные, быстрые и неинвазивные методы исследования метаболических и структурных изменений, происходящих в тканях.
Ближайшим аналогом к предлагаемому изобретению (прототипом) является способ комбинированной спектроскопии, описанный в статье [Journal of Biomedical Optics 16 (11), 116007-14 (November 2011]. В данной статье предлагается метод комбинированной спектроскопии, сочетающий в себе анализ спектров диффузного рассеяния излучения импульсного широкополосного источника в диапазоне от 450 до 720 нм, полученных для двух расстояний между осветительным и приемным волокнами, и спектра флуоресценции 5-АЛК индуцированного протопорфирина IX и продуктов его фотораспада в диапазоне от 600 до 720 нм, вызванной излучением с длиной волны 405 нм. За несколько часов до операции в организм пациента вводится раствор гидрохлорида 5-АЛК. Затем в процессе операции по резекции опухоли производят последовательные измерения спектра фонового излучения, двух спектров: диффузного рассеяния и спектра флуоресценции. Полное время, требующееся для регистрации всех спектральных зависимостей в каждой точке, составляет порядка трех секунд. Для получения спектральных характеристик используют оптоволоконный зонд, содержащий три осветительных волокна и два приемных. Полученные спектроскопические данные обрабатывают с использованием диффузионного приближения теории распространения излучения в мутной среде, оптические характеристики которой соответствуют оптическим характеристикам исследуемой ткани. Полученные таким образом данные позволяют количественно оценить следующие параметры: концентрацию 5-АЛК-индуцированного протопорфирина IX и продуктов его фотораспада, концентрацию гемоглобина в оксигенированной и редуцированной форме, рассеивающие свойства ткани. Для реализации диагностического алгоритма используется метод опорных векторов, представляющий собой метод классификации «с учителем», в пространстве пяти характеристик, полученных в результате математической обработки спектральных зависимостей. По результатам автоматического анализа делают вывод о радикальности проведенной резекции.
Недостатки данного метода заключаются в последовательной регистрации спектров фонового освещения, диффузного рассеяния и флуоресценции, что требует для проведения измерения всех параметров, необходимых для классификации ткани, около 3 с, и не позволяет проводить измерения в реальном времени и достоверно утверждать, что спектры получены из одной точки в одинаковых условиях. Другим недостатком метода, выбранного нами в качестве прототипа, является использование для возбуждения флуоресценции коротковолнового излучения (длина волны 405 нм), для которого биологическая ткань является средой с низкой прозрачностью, что приводит к флуоресцентному зондированию объема ткани, не превышающего нескольких микрометров, и требует предварительного промывания ткани от крови перед проведением оптического измерения. Эти недостатки усложняют процедуру анализа ткани методом оптической биопсии.
Задачей предлагаемого изобретения является разработка способа, обеспечивающего повышение достоверности измерений, уменьшение времени их осуществления, увеличение глубины зондирования и упрощение процесса регистрации спектров in vivo.
Поставленная задача решается способом интраоперационного проведения спектроскопической диагностики опухолей головного и спинного мозга, включающим предоперационное введение пациенту раствора гидрохлорида 5-АЛК и интраоперационный спектроскопический анализ содержания в исследуемых тканях опухолевого маркера (5-АЛК индуцированного протопорфирина IX), продуктов его фотораспада, оксигенированного и редуцированного гемоглобина, а также изменения рассеивающих свойств с использованием источников широкополосного и лазерного излучения и волоконно-оптического зонда, с последующей автоматической классификацией спектроскопических характеристик, служащей для оценки радикальности проведения резекции. Предложенный способ осуществляют с использованием источника широкополосного излучения в диапазоне длин волн от 500 нм до 600 нм и источника лазерного/светодиодного излучения с длиной волны в области 620-640 нм, регистрацию спектров диффузного отражения и флуоресценции производят одновременно, после чего по уровню накопления опухолевого маркера 5-АЛК индуцированного протопорфирина DC определяется степень принадлежности измеряемого образца ткани к определенным ранее классам, по результатам которой оценивают радикальность резекции опухоли.
Задача также решается тем, что для автоматической обработки спектроскопических характеристик используют классификацию данных методом. К ближайших соседей в пространстве вышеперечисленных характеристик.
Задача решается тем, что по результатам автоматической классификации формируют звуковой сигнал, модулированный по громкости и частоте в зависимости от степени малигнизации исследуемой ткани.
Задача может быть решена тем, что по результатам автоматической классификации формируют карты распределения биомаркеров.
Предложенный способ осуществляется с помощью перекрестной системы осветительных и съемочных фильтров, которая реализует разделение спектрального диапазона на области регистрации спектра диффузного отражения излучения широкополосного источника (в диапазоне от 500 нм до 600 нм), интенсивности рассеяния лазерного излучения (в диапазоне 620-640 нм, что соответствует области длинноволнового пика Q-полосы поглощения протопорфирина DC, в котором биологическая ткань является оптически прозрачной) и спектра флуоресценции (в диапазоне 640-850 нм). Устройство для проведения интраоперационной комбинированной спектроскопической диагностики опухолей головного и спинного мозга соответствует варианту устройства, описанного в патенте РФ №2169590 (МПК A61N 5/06, 2000).
Техническим результатом, обеспечиваемым приведенной совокупностью признаков, является обеспечение возможности быстрого и достоверного получения спектроскопических характеристик из одного и того же объема ткани в операционной зоне для всех указанных характеристик и упрощение процесса за счет исключения необходимости предварительного промывания ткани от крови перед проведением диагностики.
В соответствии с изобретением, в рамках предоперационной подготовки осуществляется пероральное введение в организм пациента раствора гидрохлорида 5-аминолевулиновой кислоты за несколько часов до начала удаления опухоли.
Предлагаемый способ заключается в проведении интраоперационного спектроскопического анализа посредством приведения в мягкий контакт дистального конца оптоволоконного зонда и исследуемого участка ткани. В результате измерения на вход спектрометра поступает диффузно отраженное тканью широкополосное излучение в диапазоне длин волн от 500 до 600 нм, диффузно отраженное тканью и ослабленное на три порядка режекторным фильтром, расположенным на входе спектрометра, лазерное излучение, а также индуцированное лазерным флуоресцентное излучение. Регистрируемые спектральные зависимости подвергаются математической обработке в специальном программном обеспечении для вычисления физиологических характеристик (биомаркеров), оказавших влияние на спектральные зависимости, таких как концентрация протопорфирина IX, гемоглобина в оксигенированной и редуцированной форме и изменения рассеивающих свойств исследуемых тканей.
Классификация регистрируемых таким образом спектроскопических характеристик может быть осуществлена посредством автоматического сопоставления спектроскопических и/или физиологических характеристик с базой данных соответствующих спектроскопических и/или физиологических характеристик тканей, состояние которых было верифицировано посредством гистологического анализа, методами автоматической классификации, по результатам которой формируется заключение о степени отношения исследуемой ткани к той или иной группе в рамках принятой классификации тканей.
Для информирования хирурга о состоянии тканей по результатам автоматической классификации спектроскопических данных возможно использование как визуальной, так и звуковой индикации. Для акцентирования внимания хирурга на изменении спектральных характеристик в процессе операции по результатам их автоматической обработки возможно использование звуковой индикации с модуляцией по громкости и частоте в зависимости от степени малигнизации тканей. Также возможно формирование на экране монитора двумерных карт распределения спектроскопических и/или физиологических характеристик тканей для наглядности представления совместного распределения исследуемых биомаркеров.
Изобретение иллюстрируется следующими рисунками.
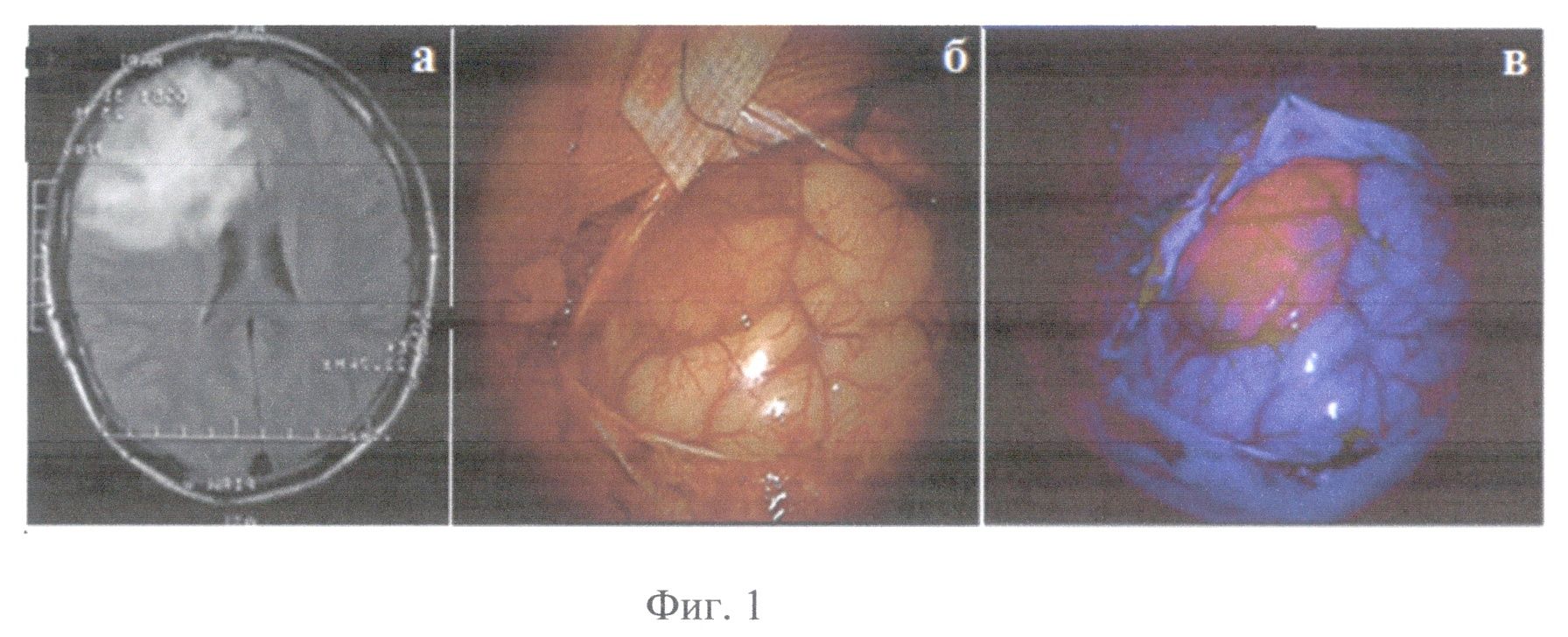
На Фиг.1 приведены для пациента A под пунктом а - предоперационная МРТ; б - фотография коры головного мозга над опухолью в белом свете; в - фотография распределения флуоресценции коры головного мозга над опухолью в режиме Blue 400 интраоперационного микроскопа Opmi Pentera.
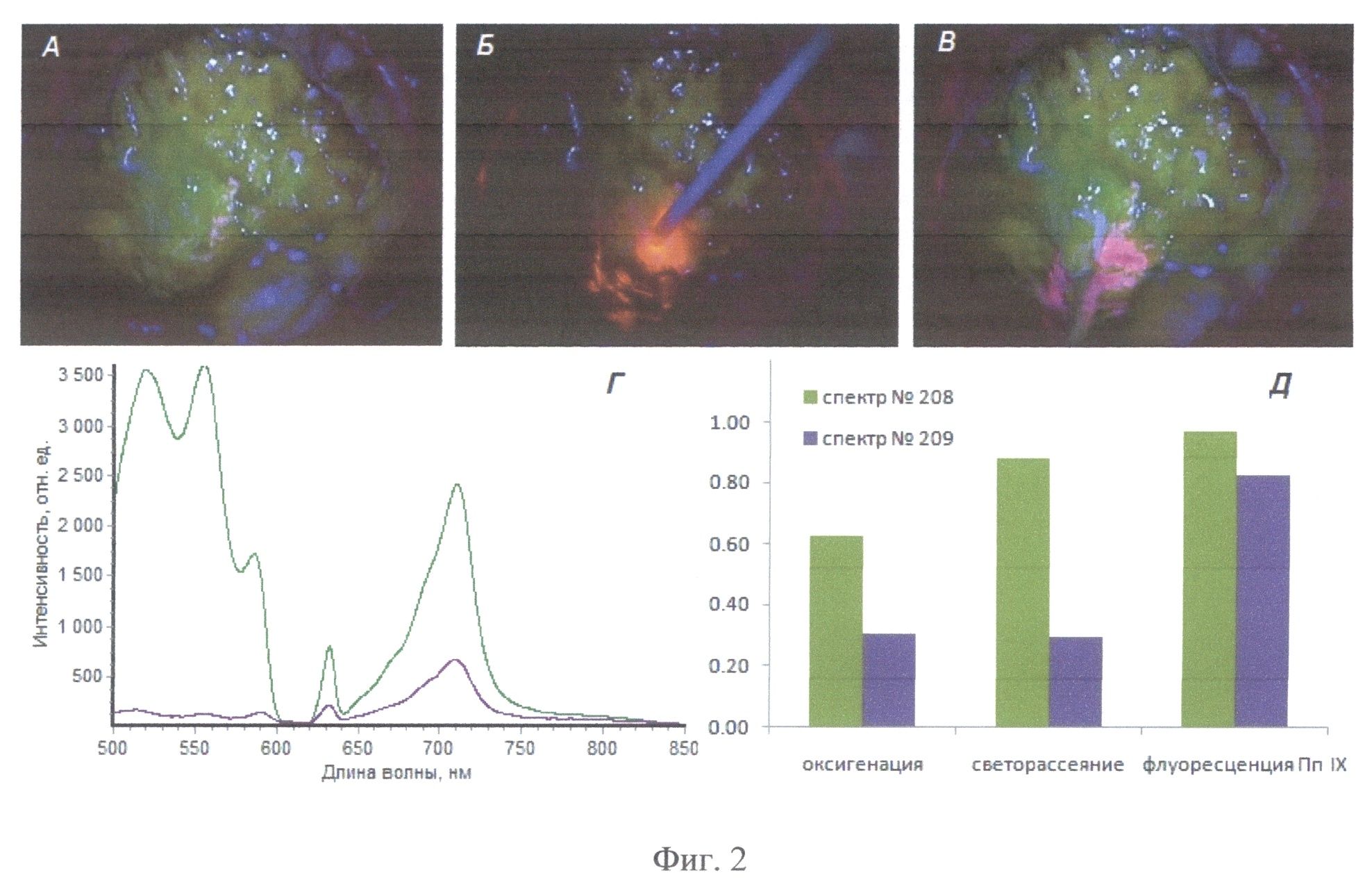
На Фиг.2 приведено для пациента А (а) изображение операционного ложа в режиме Blue 400 (время 18.16.07) до проведения спектроскопического исследования, (б) в момент проведения комбинированной спектроскопии (время 18.16.19-18.16.21), а также в режиме Blue 400 (в) после непродолжительной аспирации в положении проведения комбинированного спектроскопического анализа. Приведены спектры 208-209 (г), зарегистрированные в момент, показанный на фиг.2б, а также соответствующие им значения степени оксигенации, интенсивности светорассеяния и индекса флуоресценции, апостериорно нормированные на максимальные значения, полученные в ходе данного исследования (д). Интраоперационно были получены следующие значения этих параметров: спектр 208 - оксигенация 53%, амплитуда рассеянного назад лазерного излучения 800, индекс флуоресценции 8.7; спектр 209 - оксигенация 26%, амплитуда рассеянного назад лазерного излучения 210, индекс флуоресценции 7.5.
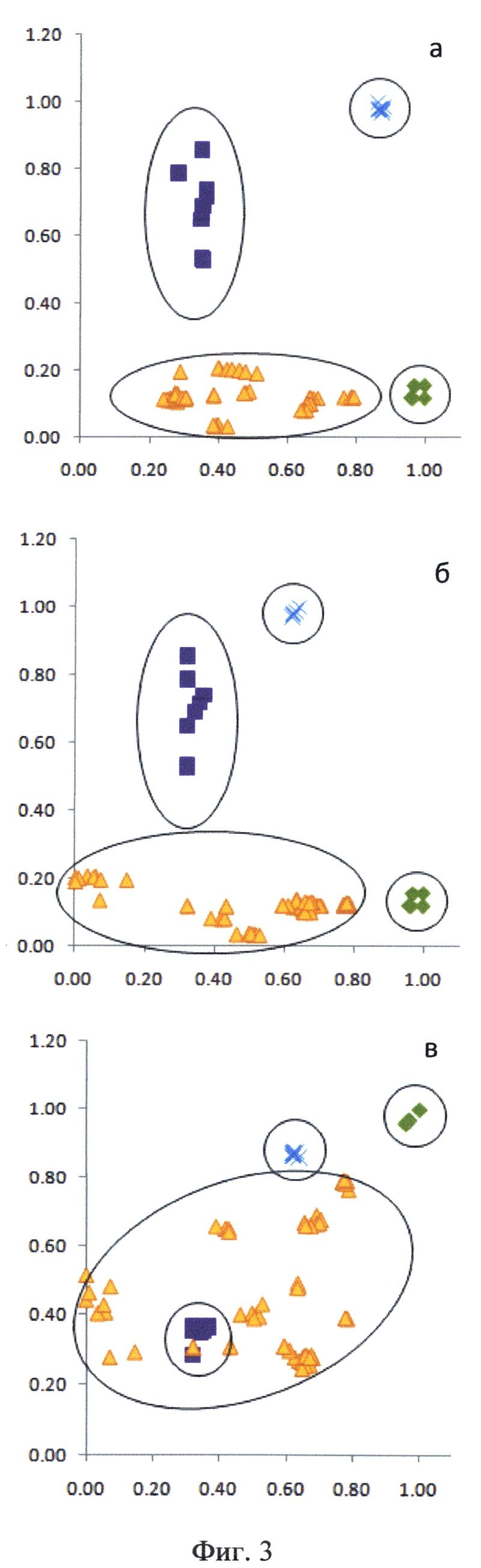
На Фиг.3 представлены карты совместного распределения исследуемых спектроскопических величин для нормальной, опухолевой ткани, а также в операционном ложе после удаления опухоли у пациента А. Использованы следующие обозначения точек в трехмерном пространстве, принадлежащих различным классам: ▲ - край опухоли (перифокальная зона), ■ - опухоль, ✕ - ложе после удаления опухоли, ✖ - интактная нервная ткань. Все значения характеристик нормированы на максимальные величины, полученные в результате исследования. а - по оси абсцисс отложены значения интенсивности рассеянного назад лазерного излучения, по оси ординат - индекса флуоресценции; б - по оси абсцисс отложены значения степени насыщения гемоглобина кислородом, по оси ординат - индекса флуоресценции; в - по оси абсцисс отложены значения степени насыщения гемоглобина кислородом, оп оси ординат - интенсивности рассеянного назад лазерного излучения.
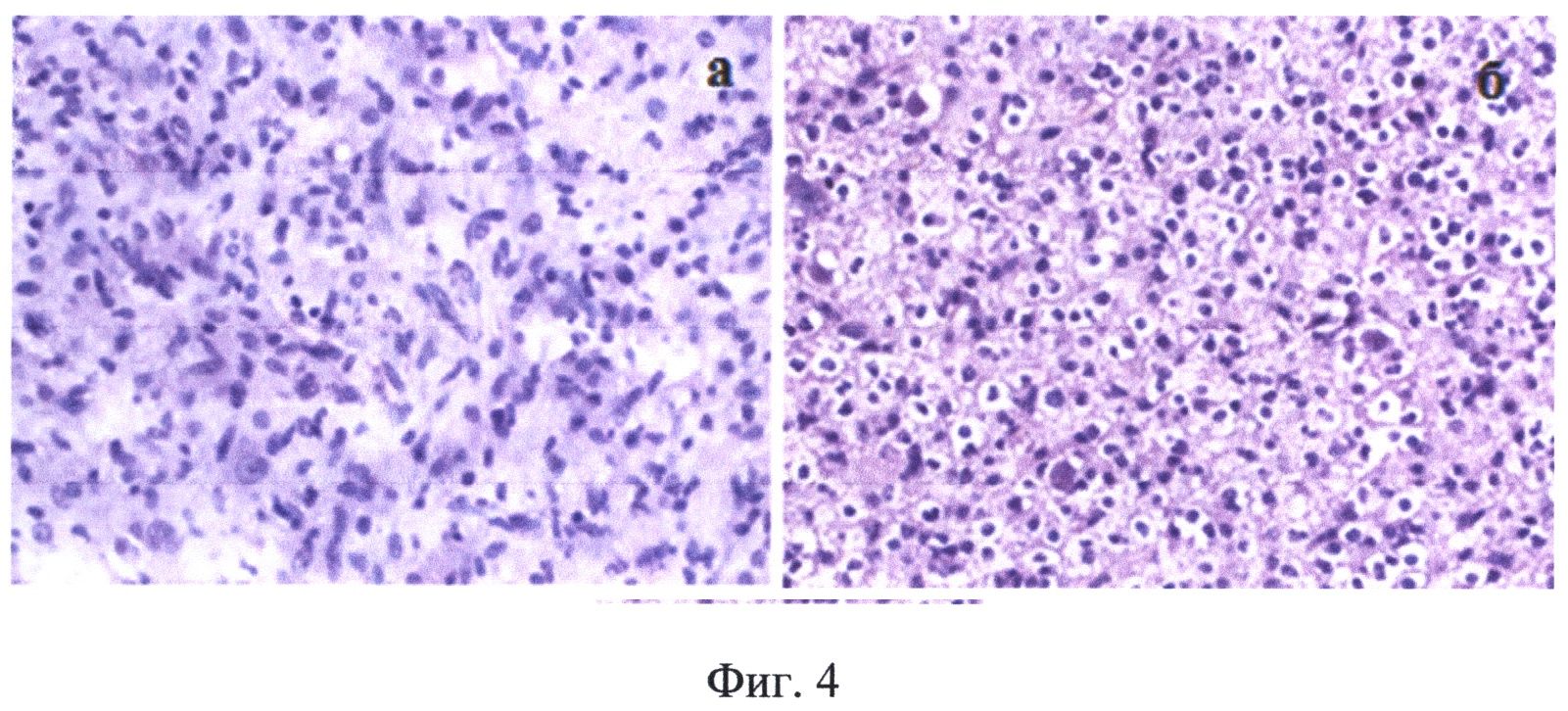
На Фиг.4 приведены результаты морфологического исследования образцов ткани, взятых во время операции пациента А, позволившие сделать окончательное заключение - олигоастроцитома: а - астрокомпонент опухоли, б - олигокомпонент опухоли.
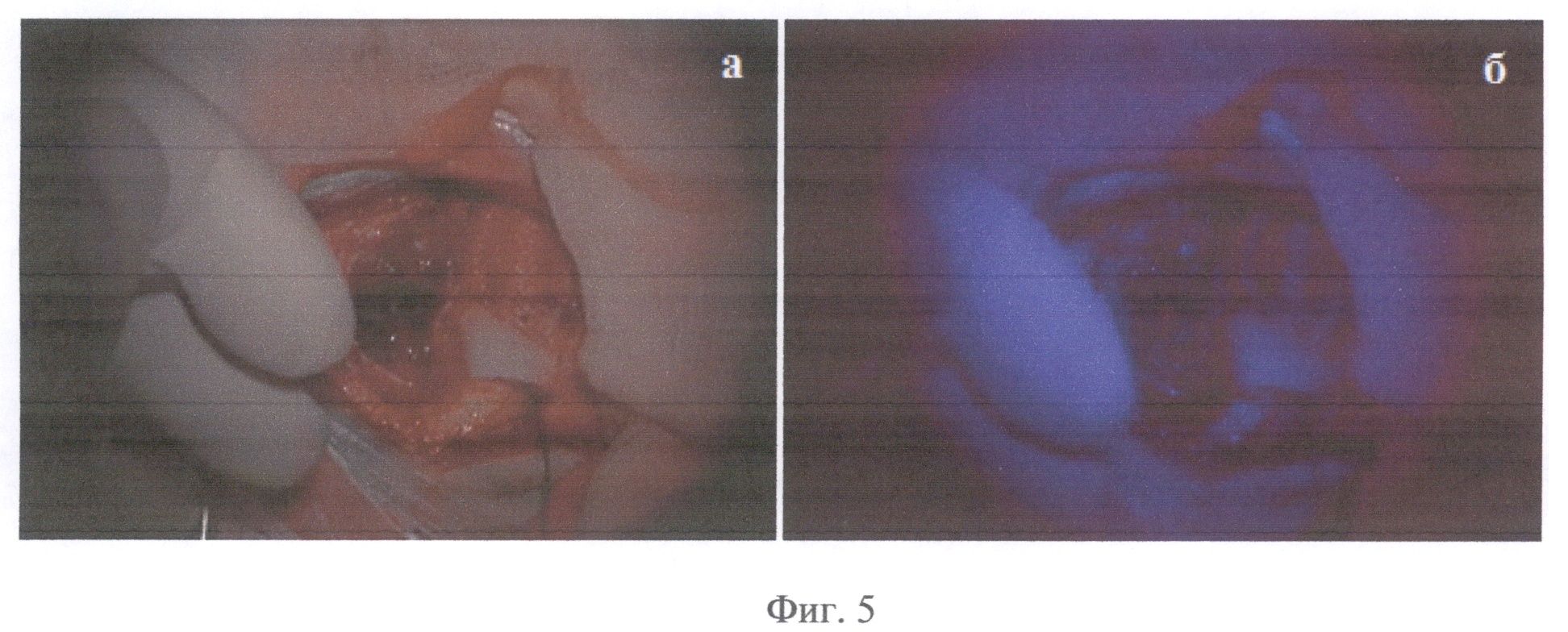
На Фиг.5 присутствуют интраоперационные стоп-кадры операции по удалению опухоли пациента Б в белом свете (а) и в режиме Blue 400 Carl Zeiss Opmi Pentero (б), демонстрирующие наличие крови в операционном ложе и слабую неоднородную флуоресценцию (время 11.04.40-45), не позволяющую сделать однозначный вывод о степени накопления опухолевого маркера в ткани.
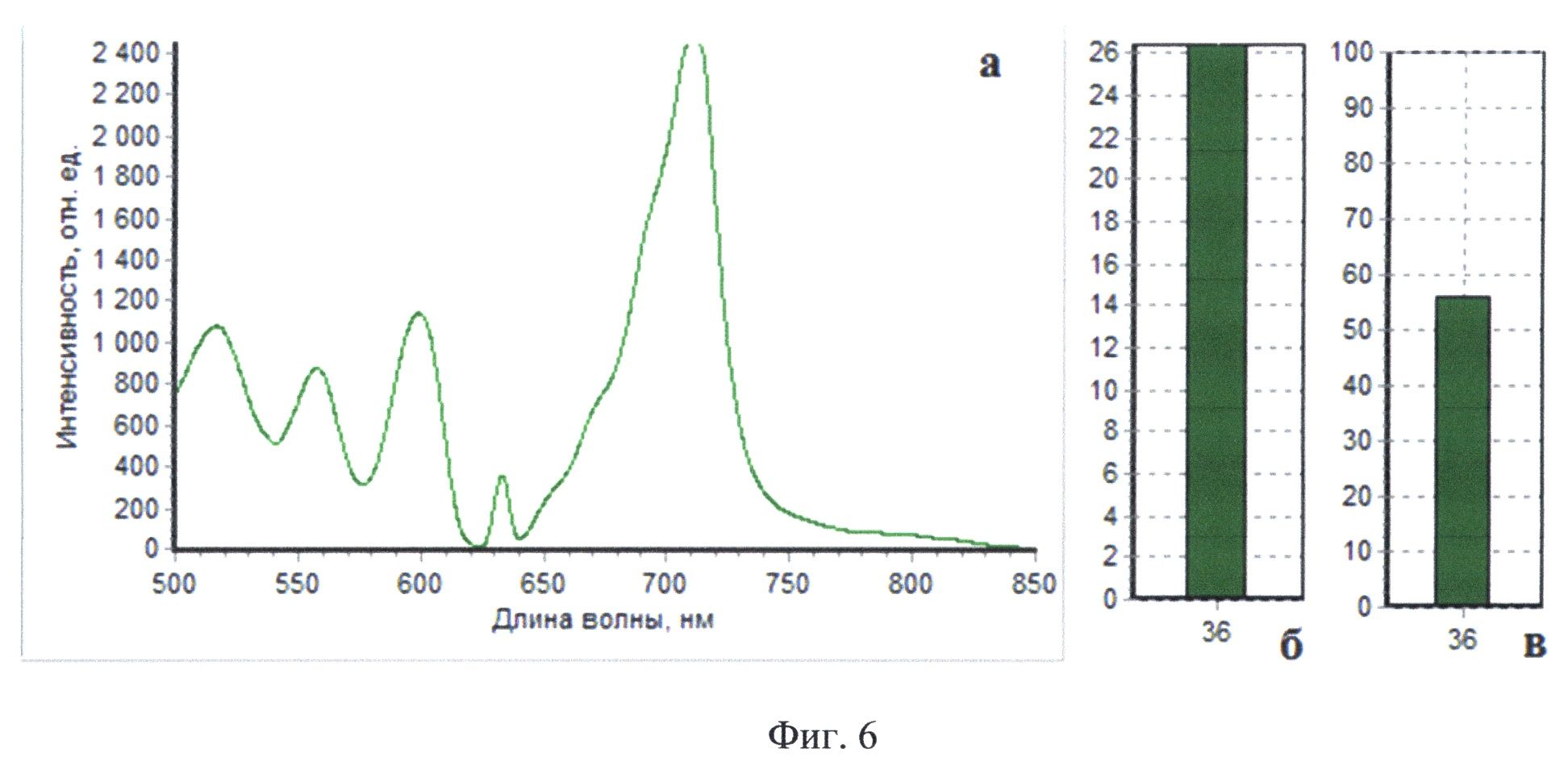
На Фиг.6 приведены результаты комбинированного спектроскопического анализа тканей пациента Б в участке ложа, показанном на фиг.4: интраоперапионный спектр №36 (а), а также соответствующие ему значения индекса флуоресценции (б) и оксигенации (в). Индекс флуоресценции 26, амплитуда рассеянного назад лазерного излучения 350, оксигенация 56%.
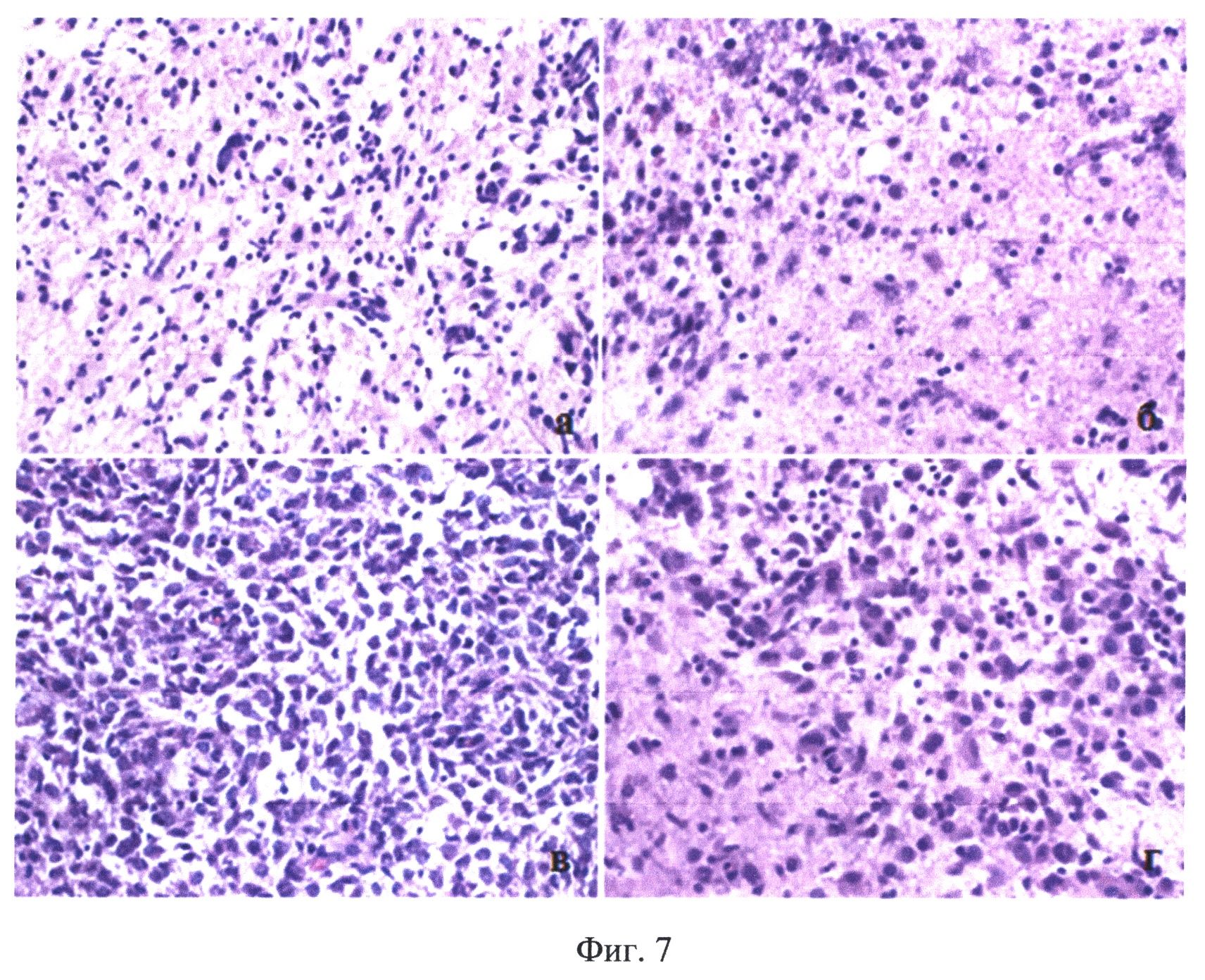
На Фиг.7 показаны результаты морфологического исследования опухоли пациента Б., с окончательным заключением - анапластическая астропитома: а - зона инфильтрации опухоли; б - зона инфильтрации опухоли; в - опухоль; г - опухоль и зона инфильтрации.
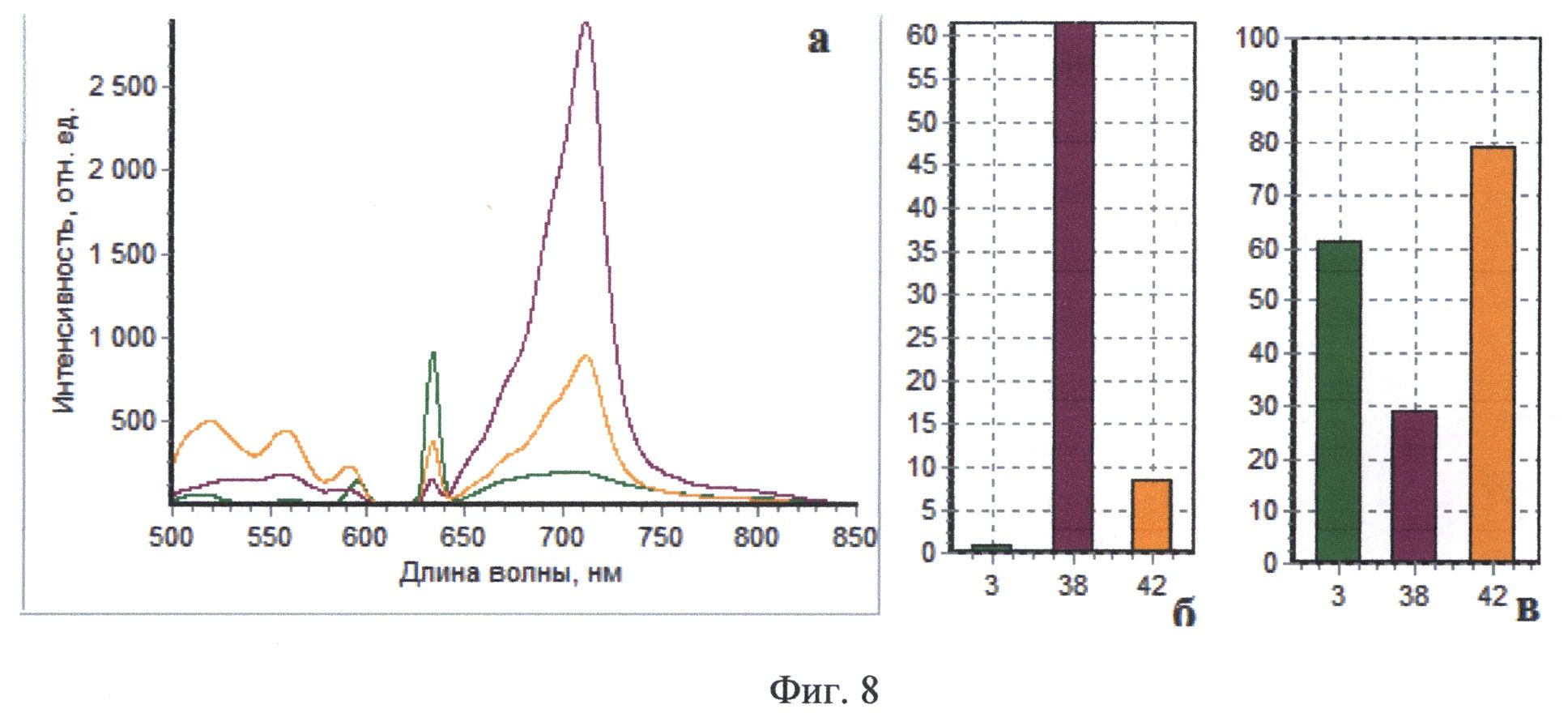
На Фиг.8 приведены интраоперационные спектры, полученные методом комбинированного спектроскопического анализа пациента В. Спектр, маркированный зеленым, соответствует нормальному мозгу, спектр, обозначенный фиолетовьм, получен от опухолевой ткани, спектр, маркированный оранжевым цветом, зарегистрирован от края опухоли.
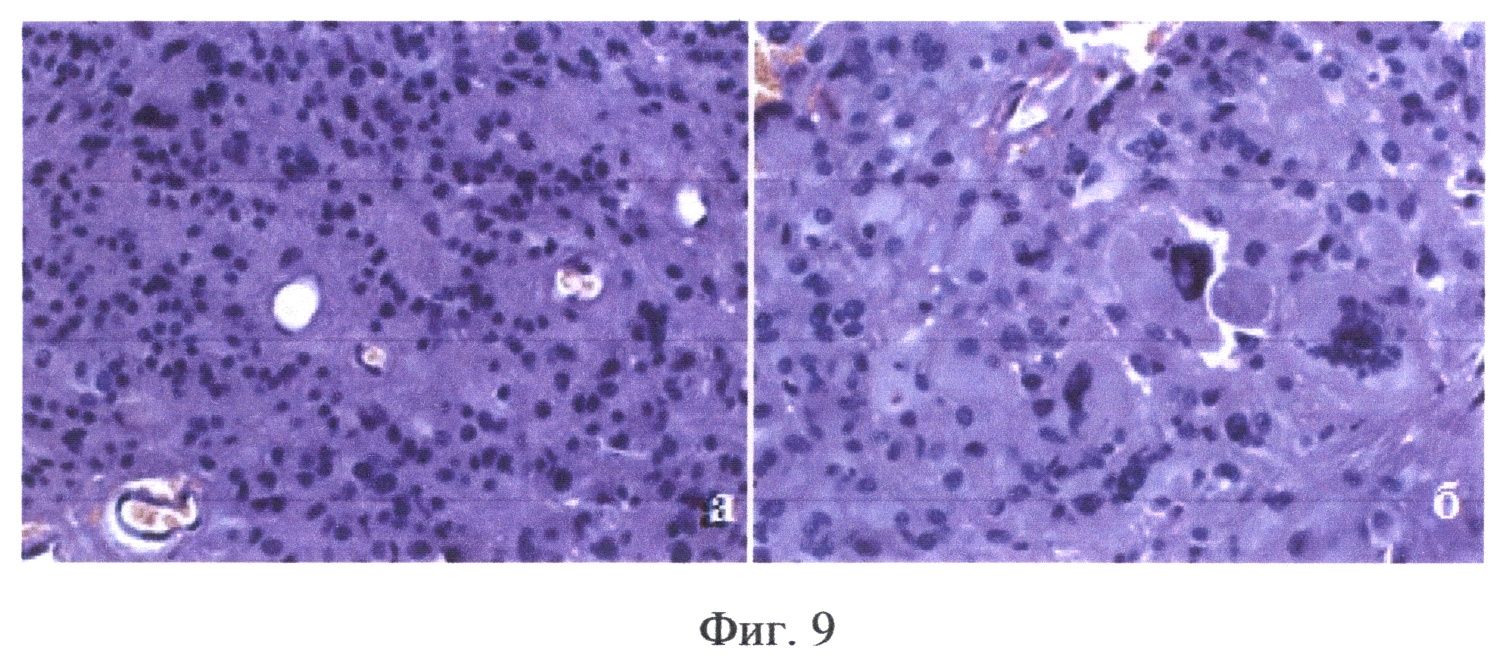
На Фиг.9 показаны результаты морфологического исследования опухоли у пациента В - на препаратах выявлена интрамедуллярная эпендимома.
Нижеприведенные примеры иллюстрируют предлагаемое изобретение.
Пример 1.
Пациент А, 23 года, (окончательный диагноз - олигоастропитома левой лобной доли (Grade II по классификации Всемирной организации здравоохранения)) оперирован 17.04.2012 (впервые). За 2 часа до операции пациенту перорально введен раствор гидрохлорида 5-аминолевулиновой кислоты (Аласенс) в количестве 20 мг/кг веса пациента. После проведения трепанации и вскрытия твердой мозговой оболочки визуализирована кора левой лобной области, на поверхность которой выходит опухолевый узел, ярко флуоресцирующий при подсветке в режиме BL 400 на операционном микроскопе Carl Zeiss Opmi Pentero с флуоресцентным модулем (см. интраоперационные фотографии на фиг.1). На фиг.1. представлена предоперационная МРТ (а) у пациента с внутримозговой опухолью - визуализируется большая опухоль левой лобной доли (Grade II); интраоперационная фотография в белом свете (б) и в режиме Blue 400 Carl Zeiss Opmi Pentero (в), демонстрируют яркую видимую флуоресценцию на первом этапе операции. Начато удаление опухоли. В процессе операции периодически проводилась оценка визуальной флуоресценции операционной раны и контроль маркеров состояния исследуемых тканей с помощью предлагаемого метода комбинированной спектроскопии.
Для этого использовали источник широкополосного излучения в диапазоне 500-600 нм для анализа концентрации гемоглобина в оксигенированной и редуцированной форме и источник лазерного излучения с длиной волны в области 632.8 нм для анализа параметров светорассеяния и возбуждения флуоресценции 5-АЛК индуцированного протопорфирина IX и продуктов его фотораспада. При приведении оптоволоконного зонда в мягкий контакт с тканью производили одновременную регистрацию спектров диффузного отражения и флуоресценции.
Участки интенсивного накопления 5-АЛК удалены полностью, отмечалось постепенное снижение интенсивности видимой флуоресценции в ходе операции по мере углубления операционной раны. В ходе дальнейшей операции опухоль визуально практически не отличалась от мозгового вещества. На этом этапе наиболее чувствительным средством оценки состояния ткани в операционной ране являлся метод комбинированной спектроскопии. Серия интраоперационных кадров и спектральных зависимостей, представленных на фиг.2, демонстрирует спектроскопическое обнаружение флуоресцирующего очага (фиг.2, б), не поддающегося визуализации с помощью видеофлуоресцентного режима Opmi Pentera Blue 400 (фиг.2, а). При исследовании комбинированной спектроскопии выявляется спектр 208 - индекс флуоресценции 8.7, амплитуда рассеянного назад лазерного излучения 800, оксигенация 53%; спектр 209 - индекс флуоресценции 7.5, амплитуда рассеянного назад лазерного излучения 210, оксигенация 26% (фиг.2 г, д).
При проведении комбинированного спектроскопического анализа в реальном времени производили классификацию исследуемой ткани на основе автоматического анализа ее спектроскопических характеристик методом К ближайших соседей. В качестве метода индикации использовались двумерные карты распределения величины исследуемых физиологических маркеров (фиг.3).
В ходе операции проводился забор материала для проведения морфологического анализа образцов тканей в сопоставлении с данными спектрального анализа (фиг.4). Различия в уровне рассеяния, показанные на фиг.2в, соответствующие одинаково эффективному накоплению протопорфирина IX (фиг.2г) можно отнести за счет морфологических отличий участков опухоли, содержащей как астро-, так и олигокомпоненты (фиг.4а, б). После получения показателей комбинированной спектроскопии от стенок ложа удаленной опухоли, идентичных нормальному мозгу, основной этап операции заканчивался.
Пример 2.
Пациент Б, 23 года, (окончательный диагноз - анапластическая астроцитома правой височной доли (Grade III согласно классификации Всемирной организации здравоохранения)) оперирован впервые 07.06.2011 г. За 2 часа до операции пациенту перорально введен раствор гидрохлорида 5-аминолевулиновой кислоты (Аласенс) в количестве 20 мг/кг веса пациента. В ходе операции в белом свете и в режиме Opmi Pentera Blue 400 визуализирувалась солидная часть опухоли в виде участков слабой флуоресценции, периодическое заполнение операционного ложа кровью приводило к затруднению видеонавигации (фиг.5а, б). При проведении резекции опухоли постоянно проводился комбинированный спектральный анализ в операционном ложе (фиг.5, 6а, б, в) с контролем базового уровня сигнала от коры височной доли. Были использованы источник широкополосного излучения в диапазоне 500-600 нм для регистрации спектров диффузного отражения и определения на его основе концентрации гемоглобина в оксигенированной и редуцированной форме и источник лазерного излучения с длиной волны в области 633±5 нм для анализа параметров светорассеяния и возбуждения флуоресценции 5-АЛК индуцированного протопорфирина IX и продуктов его фотораспада. При приведении оптоволоконного зонда в мягкий контакт с тканью производилась одновременная регистрация спектров диффузного отражения и флуоресценции. В реальном времени происходила классификации исследуемой ткани на основе автоматического анализа ее спектроскопических характеристик. По результатам классификации формировался звуковой сигнал, модулированный по громкости и частоте в зависимости от степени малигнизации исследуемой ткани, на экран выводились регистрируемые спектры и карты распределения измерений в координатах регистрируемых характеристик.
При проведении комбинированной спектроскопии максимальный индекс флуоресценции составил 26 отн. ед., амплитуда рассеянного назад лазерного излучения в той же точке составила одну треть от значения этого параметра в нормальной ткани, оксигенация в той же точке составила 56% (фиг.6). Из точек проведения комбинированного спектроскопического анализа были взяты биоптаты исследуемой ткани (фиг.6а, б, в, г). Результаты сопоставления интраоперационных спектральных зависимостей и данных морфологического заключения послужили для пополнения базы данных спектроскопических/физиологических харакетристик для повышения точности определения принадлежности исследуемых тканей к определенным классам.
После получения показателей комбинированной спектроскопии,, от ткани ложа удаленной опухоли, идентичных нормальному мозгу, основной этап операции заканчивался.
Пример 3.
Пациент В, 31 год, (окончательный диагноз - интрамедуллярная опухоль (эпендимома) на уровне Th2-Th3 позвонков) оперирован впервые 03.04.2012 г. За 2 часа до операции пациенту перорально введен раствор гидрохлорида 5-аминолевулиновой кислоты (Аласенс) в количестве 20 мг/кг веса пациента. После осуществления подхода к опухоли проведена оценка видимой флуоресценции с помощью эндоскопа с флуоресцентным модулем - отмечались участки яркой гомогенного типа видимой флуоресценции. При резекции остатков опухоли, ввиду того, что чувствительность эндоскопического видеофлуоресцентного модуля оказалась недостаточной, проводился комбинированный спектроскопический анализ в операционном ложе. Для проведения комбинированной спектроскопии использовались два источника излучения - галогенная лампа с фильтром, пропускающим излучение в диапазоне 500-600 нм и гелий-неоновый лазер (632.8 нм). При приведении оптоволоконного зонда в мягкий контакт с тканью производилась одновременная регистрация спектров диффузного отражения и флуоресценции. В реальном времени происходила классификации исследуемой ткани на основе автоматического анализа ее спектроскопических характеристик. По результатам классификации формировался звуковой сигнал, модулированный по громкости и частоте в зависимости от степени малигнизации исследуемой ткани, на экран выводились регистрируемые спектры. На фиг.8 (а, б, в) показаны три спектра, полученных интраоперационно во время удаления опухоли у пациента В. Спектр, маркированный оранжевым, зарегистрирован от края опухоли, о чем говорят промежуточные между нормой и опухолью значения индекса флуоресценции и интенсивности рассеянного назад лазерного излучения. Легкая дезоксигенация нормальной ткани может быть обусловлена тракцией ткани спинного мозга во время оперативного вмешательства. Результаты спектроскопического анализа были подтверждены морфологическим исследованием образцов ткани, взятых из тех же точек, в которых проводился спектральный анализ (фиг.9а, б). Основной этап операции был закончен после получения спектральных характеристик ложа опухоли, соответствующих нормальной ткани.
Заявляемый способ основан на фактическом материале, полученном нами при анализе 99 пациентов с глиомами головного мозга Grade I-IV (WHO), 16 пациентов с метастазами различных опухолей в головной мозг, а также 21 пациента с менингиомами головного мозга различной степени злокачественности.
Таким образом, предлагаемый метод решает задачи повышения достоверности интраоперационных измерений при проведении нейронавигации, уменьшения времени их осуществления, увеличения глубины зондирования и упрощения процесса регистрации спектров in vivo.