Результат интеллектуальной деятельности: Производные 2-(хромено[4,3-d]пиримидин-5-ил)уксусной кислоты и способ их получения
Вид РИД
Изобретение
Группа изобретений относится к области органической химии и химии красителей, а именно: к ряду новых полифункциональных гетероциклических соединений - производным 2-(хромено[4,3-d]пиримидин-5-ил)уксусной кислоты общей формулы I и к способу их получения, которые могут быть использованы в органическом синтезе и в биохимических исследованиях в качестве флуоресцентных красителей и зондов.
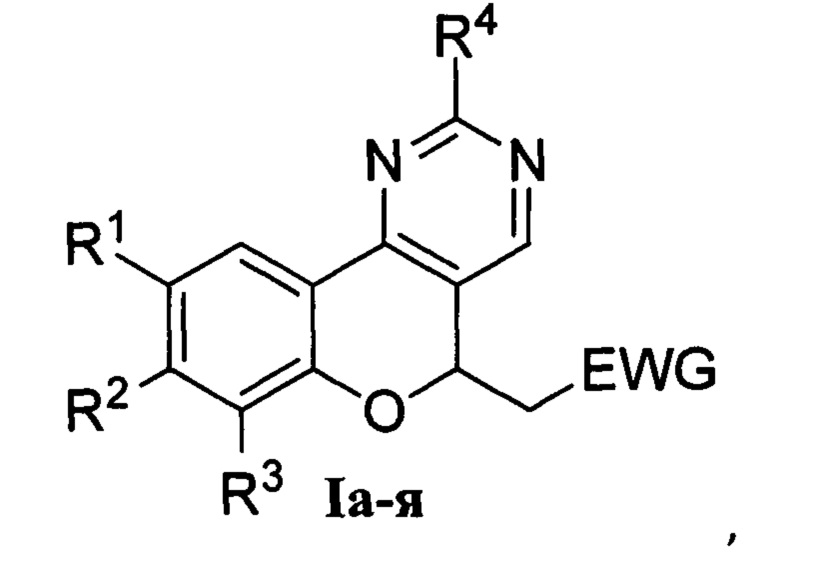
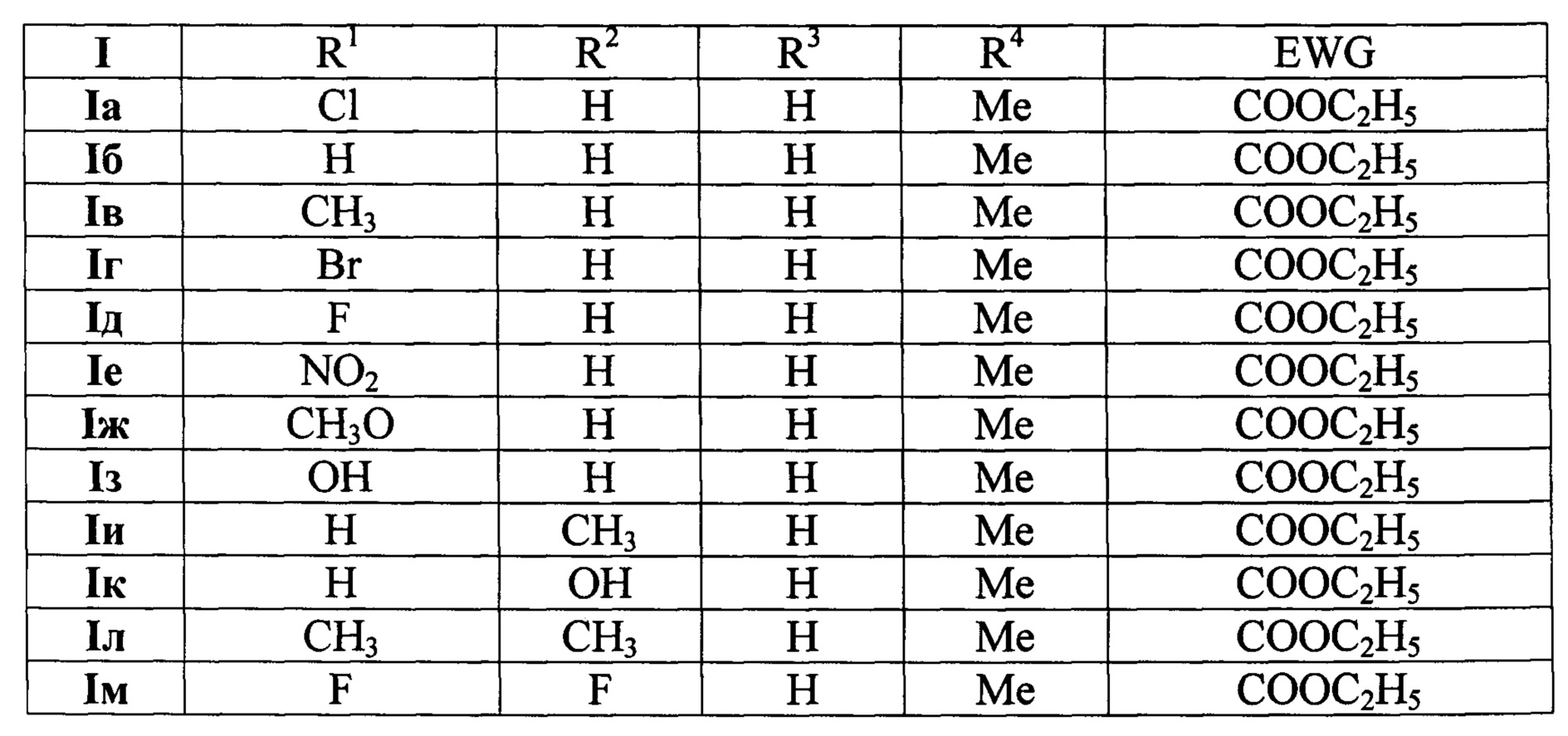
где:
В научно-технической литературе представлено несколько способов построения структуры хромено[4,3-d]пиримидинов, первым и основным из которых является взаимодействие 3-формилхромонов II с бинуклеофильными реагентами III (амидины, гуанидин, производные изомочевин) [Petersen, U. Heterocyclensynthesen mit 4-oxo-4H-chromen-3-carbaldehyd / U. Petersen, H. Heitzer // Liebigs Annalen der Chemie. - 1976. - P. 1663-1673; Bruno, O. New polycyclic pyrimidine derivatives with antiplatelet in vitro activity: synthesis and pharmacological screening / O. Bruno, S. Schenone, A. Ranise, et al. // Bioorganic & Medicinal Chemistry. - 2001. - Vol. 9. - P. 629-636]. Реакцию проводили в воде или спиртах при 70-80°С в присутствии оснований (гидроксид натрия, триэтиламин).
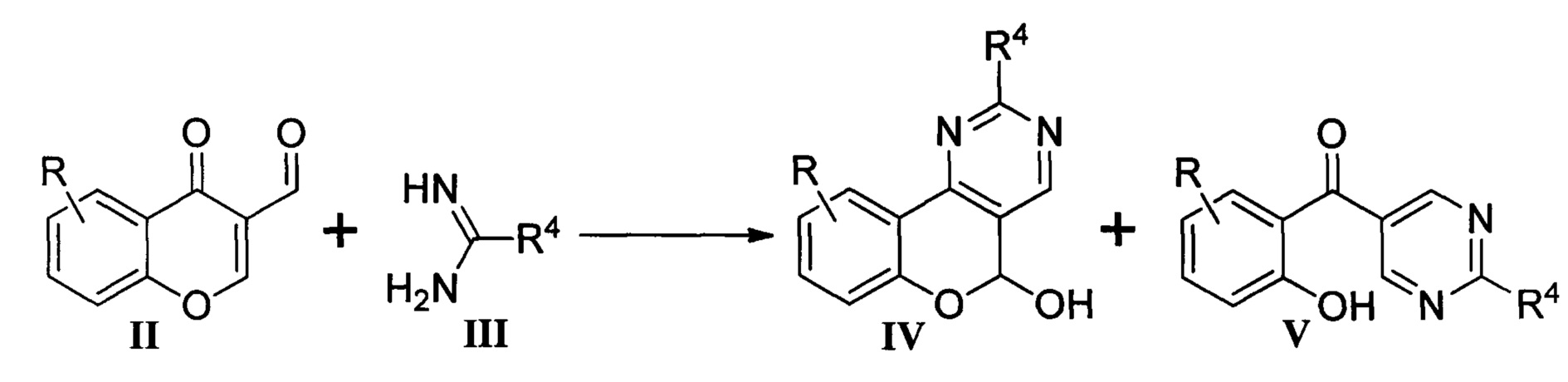
Существенным недостатком данного метода является побочное образование 5-салицилоилпиримидинов V наравне с целевыми соединениями IV, выход которых составляет 31-97%. При этом высокие выходы хромено[4,3-d]пиримидинов IV достигались лишь для ограниченного ряда бинуклеофилов III, например, для S-метилизотиомочевины. Впоследствии данный метод был расширен на 3-бензоилхромоны [Sambaiah, М. Synthesis of novel fused chromone-pyrimidine hybrids and 2,4,5-trisubstituted pyrimidine derivatives via the ANRORC rearrangement / M. Sambaiah, K. Raghavulu, K. Shiva Kumar, et al. // New Journal of Chemistry. - 2017. - Vol. 41. - P. 10020-10026], однако даже достаточно широкое варьирование условий не позволило авторам получать исключительно хромено[4,3-d]пиримидины (выход 57-77%).
Причиной протекания побочной реакции образования 5-салицилоилпиримидинов V можно считать близкую реакционную способность альдегидной группы в положении 3 и оксогруппы в положении 4 хромонов II.
Таким образом, задачей предполагаемой группы изобретений является создание ряда неописанных в литературе хромено[4,3-d]пиримидинов формулы Ia-я, что позволит расширить ассортимент флуоресцентных красителей, находящих применение в биохимических исследованиях.
Техническими результатами, на решение которых направлена группа изобретений, являются получение ряда новых полифункциональных гетероциклических соединений (Ia-я), обладающих флуоресцентными свойствами; простой и эффективный способ их получения из электронодефицитных 3-винилхромонов VIa-x и 1,3-N,N-бинуклеофильных реагентов IIa-ж.
Согласно разработанному способу получения взаимодействие 3-винилхромонов VIa-x и бинуклеофильных реагентов IIa-ж протекает в этаноле при температуре 15-25°С по следующей схеме:
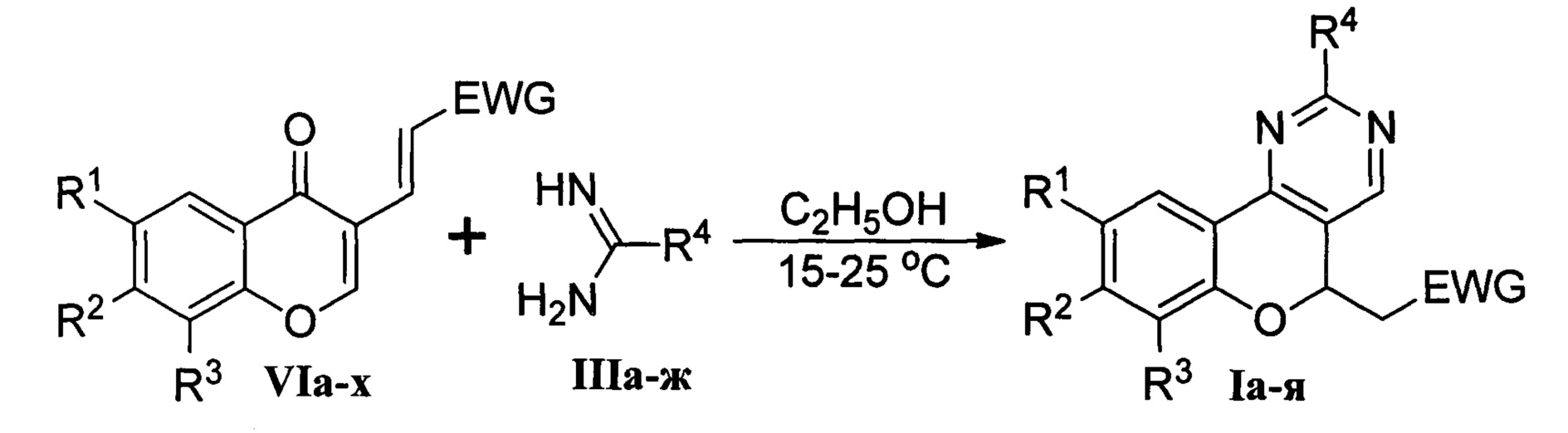
Буниклеофильный реагент IIIa-ж генерируется непосредственно в реакционной массе из его коммерчески доступной соли (хлорид или сульфат) под действием сильного основания (этилат натрия, гидроксид натрия, 1,8-диазабицикло[5.4.0]ундец-7-ен). По завершении реакции выделение хромено[4,3-d]пиримидинов Ia-я выполняется путем выливания реакционной смеси в 1М соляную кислоту или воду. Выход продуктов Ia-я составляет 72-99%.
Повышение выхода целевых продуктов Ia-я и, как следствие, эффективности синтеза связано с использованием в качестве субстратов 3-винилхромонов VIa-x, имеющих в своей структуре электроноакцепторную группу (EWG). Данные соединения характеризуются большой разницей в электрофильности экзоциклической двойной связи и оксогруппы в положении 4 хромонового цикла. В результате взаимодействие соединений VIa-x с бинуклеофильными реагентами III протекает значительно селективнее, чем аналогичная реакция 3-формилхромонов II. В результате единственными продуктами разработанного синтеза являются целевые хромено[4,3-d]пиримидины Iа-я.
Разработанный способ получения хромено[4,3-d]пиримидинов Iа-я изучен и проверен в лабораторных условиях. Структура и чистота полученных продуктов установлены методами спектроскопии ЯМР 1Н, 13С и масс-спектрометрии высокого разрешения (HRMS-ESI).
Изучение фотофизических свойств производных 2-(хромено[4,3-d]пиримидин-5-ил)уксусной кислоты Ia-я показало их способность к флуоресценции в фиолетово-синей области спектра (390-455 нм).
Предлагаемая группа изобретений проиллюстрирована примерами практического осуществления.
Пример 1. Получение этил-2-(2-метил-9-хлор-5H-хромено[4,3-d]пиримидин-5-ил)ацетата (Iа).
Смесь этил-3-(6-хлор-4-оксо-4H-хромен-3-ил)акрилата VIa (556 мг, 2 ммоль), гидрохлорида ацетамидина IIIa (227 мг, 2.4 ммоль) и этилата натрия (163 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 4-6 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 600 мг (выход 94%) соединения Iа в виде белого порошка с Тпл. 102-104°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.18 (т, J=7.0 Гц, 3Н, СН3СН2), 2.67 (с, 3Н, СН3), 2.96 (дд, J=8.8, 15.6 Гц, 1Н, H-2'a), 3.05 (дд, J=4.3, 15.6 Гц, 1Н, H-2'b), 4.10 (м, 2Н, CH3CH2, 5.90 (дд, J=4.3, 8.8 Гц, 1H, Н-5), 7.01 (д, J=8.8 Гц, 1Н, Н-7), 7.50 (дд, J=2.5, 8.8 Гц, 1Н, Н-8), 8.04 (д, J=2.5 Гц, 1H, Н-10), 8.67 (с, 1Н, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δС (м.д.) 14.49, 26.14, 39.34, 60.85, 72.33, 120.20, 121.85 (2С), 124.14, 126.79, 133.62, 152.65, 154.47, 154.53, 167.94, 169.61. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C16H16ClN2O3: 319.0844; найдено: 319.0839.
Пример 2. Получение этил-2-(2-метил-5H-хромено[4,3-d]пиримидин-5-ил)ацетата (Iб).
Смесь этил-3-(4-оксо-4H-хромен-3-ил)акрилата VIб (488 мг, 2 ммоль), гидрохлорида ацетамидина IIIa (227 мг, 2.4 ммоль) и этилата натрия (163 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 4-6 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 525 мг (выход 92%) соединения Iб в виде белого порошка с Тпл. 62-63°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.17 (т, J=7.0 Гц, 3Н, СН3СН2), 2.78 (с, 3Н, СН3), 3.02 (дд, J=4.0, 15.8 Гц, 1Н, H-2'a), 3.12 (дд, J=8.0, 15.8 Гц, 1Н, H-2'b), 4.10 (м, 2Н, СН3СН2), 5.94 (дд, J=4.0, 8.0 Гц, 1Н, Н-5), 7.00 (д, J=8.0 Гц, 1Н, ArH), 7.18 (пс. т, J=7.5 Гц, 1H, ArH), 7.56 (пс. т, J=7.8 Гц, 1Н, ArH), 8.15 (д, 8.0 Гц, 1Н, ArH), 8.85 (с, 1Н, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δС (м.д.) 14.49, 23.97, 39.05, 60.90, 71.73, 118.40, 119.29, 122.79, 123.31, 126.06, 136.15, 149.13, 156.75 (2С), 164.88, 169.55. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C16H17N2O3: 285.1234; найдено: 285.1225.
Пример 3. Получение этил-2-(2,9-диметил-5H-хромено[4,3-d]пиримидин-5-ил)ацетата (Iв).
Смесь этил-3-(6-метил-4-оксо-4H-хромен-3-ил)акрилата VIв (516 мг, 2 ммоль), гидрохлорида ацетамидина IIIa (227 мг, 2.4 ммоль) и этилата натрия (163 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 4-6 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 590 мг (выход 99%) соединения Iв в виде белого порошка с Тпл. 87-89°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.18 (т, J=7.0 Гц, 3Н, СН3СН2), 2.32 (с, 3Н, СН3), 2.65 (с, 3Н, СН3), 2.90 (дд, J=8.8, 15.6 Гц, 1Н, H-2'a), 3.00 (дд, J=4.5, 15.6 Гц, 1H, H-2'b), 4.10 (м, 2Н, СН3СН2), 5.80 (дд, J=4.5, 8.8 Гц, 1Н, Н-5), 6.85 (д, J=8.3 Гц, 1Н, Н-7), 7.27 (д, J=8.3 Гц, 1Н, Н-8), 7.92 (с, 1Н, Н-10), 8.67 (с, 1Н, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δC (м.д.) 14.50, 20.69, 26.17, 39.42, 60.78, 71.90, 117.93, 120.05, 121.97, 124.93, 131.87, 134.80, 153.60, 153.99 (2С), 167.73, 169.72. Масс-спектр HRMS-ESI: m/z [M+H]+ вычислено для C17H19N2O3: 299.1390; найдено: 299.1397.
Пример 4. Получение этил-2-(9-бром-2-метил-5H-хромено[4,3-d]пиримидин-5-ил)ацетата (Iг).
Смесь этил-3-(6-бром-4-оксо-4H-хромен-3-ил)акрилата VIг (646 мг, 2 ммоль), гидрохлорида ацетамидина IIIa (227 мг, 2.4 ммоль) и этилата натрия (163 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 4-6 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 660 мг (выход 91%) соединения Iг в виде белого порошка с Тпл. 99-100°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.18 (т, J=7.0 Гц, 3Н, СН3СН2), 2.66 (с, 3Н, СН3), 2.95 (дд, J=8.8, 15.6 Гц, 1H, H-2'a), 3.05 (дд, J=4.5, 15.6 Гц, 1Н, H-2'b), 4.11 (м, 2Н, СН3СН2), 5.90 (дд, J=4.5, 8.8 Гц, 1H, Н-5), 6.94 (д, J=8.8 Гц, 1Н, Н-7), 7.61 (дд, J=2.5, 8.8 Гц, 1H, Н-8), 8.17 (д, J=2.5 Гц, 1H, Н-10), 8.66 (с, 1Н, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δС (м.д.) 14.49, 26.13, 39.24, 60.85, 72.31, 114.40, 120.55, 121.81, 122.28, 127.08, 136.43, 152.54, 154.51, 154.89, 167.92, 169.59. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C16H16BrN2O3: 363.0339; найдено: 363.0337.
Пример 5. Получение этил-2-(2-метил-9-фтор-5H-хромено[4,3-d]пиримидин-5-ил)ацетата (Iд).
Смесь этил-3-(6-фтор-4-оксо-4H-хромен-3-ил)акрилата VIд (524 мг, 2 ммоль), гидрохлорида ацетамидина IIIa (227 мг, 2.4 ммоль) и этилата натрия (163 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 4-6 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 560 мг (выход 93%) соединения Iд в виде белого порошка с Тпл. 76-77°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.18 (т, J=7.0 Гц, 3Н, СН3СН2), 2.67 (с, 3 Н, СН3), 2.94 (дд, J=8.8, 15.8 Гц, 1H, H-2'a), 3.05 (дд, J=4.5, 15.8 Гц, 1Н, H-2'b), 4.11 (м, 2Н, СН3СН2), 5.85 (дд, J=4.5, 8.8 Гц, 1Н, Н-5), 7.01 (дд, J=8.8 Гц, JHF=4.4 Гц, 1Н, Н-7), 7.33 (пс. тд, J=3.3, 8.8 Гц, JHF=8.8 Гц, 1Н, Н-8), 7.80 (дд, J=3.3 Hz, JHF=8.8 Гц, 1Н, Н-10), 8.67 (с, 1Н, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δC (м.д.) 14.49, 26.14, 39.40, 60.83, 72.18, 110.62 (d, 2JCF=24.2 Гц), 119.96 (д, 3JCF=8.1 Гц), 120.93 (д, 2JCF=24.2 Гц), 121.55 (д, 3JCF=8.1 Гц), 122.02, 151.96, 153.07, 154.44, 157.81 (д, 1JCF=238.3 Гц), 167.92, 169.66. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C16H16FN2O3: 303.1139; найдено: 303.1130.
Пример 6. Получение этил-2-(9-нитро-2-метил-5H-хромено[4,3-d]пиримидин-5-ил)ацетата (Iе).
Смесь этил-3-(6-нитро-4-оксо-4H-хромен-3-ил)акрилата VIe (578 мг, 2 ммоль), гидрохлорида ацетамидина IIIa (227 мг, 2.4 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ена (DBU, 365 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 4-6 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 500 мг (выход 76%) соединения Iе в виде белого порошка с Тпл. 152-154°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.17 (т, J=7.0 Гц, 3Н, СН3СН2), 2.66 (с, 3Н, СН3), 3.01 (дд, J=8.3, 15.8 Гц, 1Н, H-2'a), 3.12 (дд, J=3.0, 15.8 Гц, 1Н, H-2'b), 4.10 (м, 2Н, СН3СН2), 6.03 (дд, J=3.0, 8.3 Гц, 1Н, Н-5), 7.12 (д, J=8.8 Гц, 1Н, Н-7), 8.24 (д, J=8.8 Гц, 1Н, Н-8), 8.69 (с, 1Н, Н-4), 8.76 (с, 1Н, Н-10). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δС (м.д.) 14.46, 26.11, 39.45, 60.92, 73.35, 119.29, 120.28, 120.52, 121.53, 128.98, 142.55, 151.77, 154.89, 160.70, 168.16, 169.46. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C16H16N3O5: 330.1084; найдено: 330.1096.
Пример 7. Получение этил-2-(2-метил-9-метокси-5H-хромено[4,3-d]пиримидин-5-ил)ацетата (Iж).
Смесь этил-3-(6-метокси-4-оксо-4H-хромен-3-ил)акрилата VIж (488 мг, 2 ммоль), гидрохлорида ацетамидина IIIa (227 мг, 2.4 ммоль) и этилата натрия (163 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 4-6 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 560 мг (выход 89%) соединения Iж в виде бледно-желтого порошка с Тпл. 79-80°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.19 (т, J=7.0 Гц, 3Н, СН3СН2), 2.67 (с, 3Н, СН3), 2.91 (дд, J=9.0, 15.6 Гц, 1Н, H-2'a), 3.00 (дд, J=4.5, 15.6 Гц, 1Н, H-2'b), 3.81 (с, 3Н, CH3O), 4.11 (м, 2Н, CH3CH2), 5.77 (дд, J=4.5, 9.0 Гц, 1Н, Н-5), 6.92 (д, J=8.8 Гц, 1Н, Н-7), 7.06 (дд, J=3.3, 8.8 Гц, 1Н, Н-8), 7.60 (д, J=3.3 Гц, 1Н, Н-10), 8.62 (с, 1Н, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δС (м.д.) 14.51, 26.21, 39.25, 56.01, 60.79, 71.88, 107.86, 119.30, 120.83, 121.09, 122.17, 149.64, 153.92, 154.08, 154.95, 167.78, 169.73. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C17H19N2O4: 315.1339; найдено: 315.1342.
Пример 8. Получение этил-2-(9-гидрокси-2-метил-5H-хромено[4,3-d]пиримидин-5-ил)ацетата (Iз).
Смесь этил-3-(6-гидрокси-4-оксо-4H-хромен-3-ил)акрилата VIз (488 мг, 2 ммоль), гидрохлорида ацетамидина IIIa (454 мг, 4.8 ммоль) и этилата натрия (326 мг, 4.8 ммоль) в 10 мл этанола перемешивают в атмосфере азота при 15-25°С в течение 4-6 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 470 мг (выход 78%) соединения Iз в виде желтого порошка с Тпл. 178-180°С. Спектр ЯМР 1H (400 МГц, ДМСО-d6): δH (м.д.) 1.19 (т, J=7.0 Гц, 3Н, СН3СН2), 2.65 (с, 3Н, СН3), 2.89 (дд, J=8.8, 15.6 Гц, 1Н, H-2'a), 2.98 (дд, J=4.5, 15.6 Гц, 1Н, H-2'b), 4.11 (м, 2Н, CH3CH2, 5.72 (дд, J=4.5, 8.8 Гц, 1H, Н-5), 6.80 (д, J=8.8 Гц, 1Н, Н-7), 6.88 (дд, J=3.0, 8.8 Гц, 1H, Н-8), 7.54 (д, J=3.0 Гц, 1Н, Н-10), 8.59 (с, 1Н, Н-4), 9.42 (уш. с, 1Н, ОН). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δС (м.д.) 14.53, 26.19, 39.16, 60.77, 71.73, 110.08, 119.03, 120.90, 121.47, 122.22, 148.39, 152.92, 153.94, 154.19, 167.68, 169.80. Масс-спектр HRMS-ESI: m/z [M+H]+ вычислено для C16H17N2O4: 301.1183; найдено: 301.1169.
Пример 9. Получение этил-2-(2,8-диметил-5H-хромено[4,3-d]пиримидин-5-ил)ацетата (Iи).
Смесь этил-3-(7-метил-4-оксо-4H-хромен-3-ил)акрилата VIи (516 мг, 2 ммоль), гидрохлорида ацетамидина IIIa (227 мг, 2.4 ммоль) и этилата натрия (163 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 4-6 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 570 мг (выход 96%) соединения Iи в виде белого порошка с Тпл. 95-97°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.19 (т, J=7.0 Гц, 3Н, СН3СН2), 2.32 (с, 3Н, СН3), 2.63 (с, 3Н, СН3), 2.90 (дд, J-9.0, 15.6 Гц, 1Н, H-2'a), 3.00 (дд, J=4.5, 15.6 Гц, 1H, H-2'b), 4.10 (м, 2Н, СН3СН2), 5.80 (дд, J=4.5, 9.0 Гц, 1Н, Н-5), 6.78 (с, 1Н, Н-7), 6.95 (д, J=8.0 Гц, 1H, Н-9), 8.00 (д, J=8.0 Гц, 1Н, Н-10), 8.57 (с, 1Н, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δС (м.д.) 14.49, 21.65, 26.18, 39.35, 60.79, 72.03, 117.74, 118.26, 121.44, 123.85, 124.95, 144.77, 153.84, 153.99, 155.72, 167.69, 169.69. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C17H19N2O3: 299.1390; найдено: 299.1388.
Пример 10. Получение этил-2-(8-гидрокси-2-метил-5H-хромено[4,3-d]пиримидин-5-ил)ацетата (Iк).
Смесь этил-3-(7-гидрокси-4-оксо-4H-хромен-3-ил)акрилата VIк (488 мг, 2 ммоль), гидрохлорида ацетамидина IIIa (454 мг, 4.8 ммоль) и этилата натрия (326 мг, 4.8 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение суток. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 540 мг (выход 90%) соединения Iк в виде белого порошка с Тпл. 180-182°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.19 (т, J=6.5 Гц, 3Н, СН3СН2), 2.59 (с, 3Н, СН3), 2.89 (дд, J=8.8, 15.1 Гц, 1Н, H-2'a), 2.96 (дд, J=3.0, 15.1 Гц, 1Н, H-2'b), 4.11 (м, 2Н, CH3CH2), 5.75 (уш. с, 1Н, Н-5), 6.31 (с, 1H, Н-7), 6.57 (д, J=8.0 Гц, 1Н, Н-9), 7.85 (д, J=8.0 Гц, 1Н, Н-10), 8.47 (с, 1Н, Н-4), 10.29 (уш. с, 1Н, ОН). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δС (м.д.) 14.49, 26.17, 39.24, 60.77, 72.22, 104.09, 111.15, 111.91, 120.32, 126.71, 153.20, 154.27, 157.42, 163.10, 167.52, 169.72. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C16H17N2O4 301.1183; найдено: 301.1184.
Пример 11. Получение этил-2-(2,8,9-триметил-5H-хромено[4,3-d]пиримидин-5-ил)ацетата (Iл).
Смесь этил-3-(6,7-диметил-4-оксо-4H-хромен-3-ил)акрилата VIл (544 мг, 2 ммоль), гидрохлорида ацетамидина IIIa (227 мг, 2.4 ммоль) и гидроксида натрия (96 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 4-6 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 570 мг (выход 91%) соединения Iл в виде белого порошка с Тпл. 109-110°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.19 (т, J=7.0 Гц, 3Н, СН3СН2), 2.23 (с, 6 Н, СН3), 2.63 (с, 3Н, СН3), 2.88 (дд, J=8.8, 15.3 Гц, 1Н, H-2'a), 2.97 (дд, J=4.5, 15.3 Гц, 1H, H-2'b), 4.11 (м, 2Н, CH3CH2, 5.77 (дд, J=4.5, 8.8 Гц, 1Н, Н-5), 6.77 (с, 1Н, Н-7), 7.85 (с, 1Н, Н-10), 8.55 (с, 1H, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δC (м.д.) 14.51, 19.02, 20.19, 26.18, 39.45, 60.78, 71.90, 117.73, 118.78, 121.57, 125.23, 130.94, 143.58, 153.73, 153.81, 154.14, 167.85, 169.73. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C18H21N2O3: 313.1547; найдено: 313.1536.
Пример 12. Получение этил-2-(2-метил-8,9-дифтор-5H-хромено[4,3-d]пиримидин-5-ил)ацетата (Iм).
Смесь этил-3-(6,7-дифтор-4-оксо-4H-хромен-3-ил)акрилата VIм (560 мг, 2 ммоль), гидрохлорида ацетамидина IIIa (227 мг, 2.4 ммоль) и гидроксида натрия (96 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 4-6 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 565 мг (выход 88%) соединения Iм в виде белого порошка с Тпл. 82-83°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.18 (т, J=7.0 Гц, 3Н, СН3СН2), 2.63 (с, 3Н, СН3), 2.95 (дд, J=8.8, 15.8 Гц, 1Н, H-2'a), 3.05 (дд, J=4.3, 15.8 Гц, 1Н, H-2'b), 4.11 (кв, J=7.0 Гц, 2Н, СН3СН2), 5.86 (дд, J=4.3, 8.8 Гц, 1Н, Н-5), 7.11 (дд, JHF=6.8, 11.3 Гц, 1Н, Н-7), 7.93 (дд, JHF=9.4, 10.4 Гц, 1Н, Н-10), 8.62 (с, 1Н, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δC (м.д.) 14.42, 26.03, 39.42, 60.87, 72.68, 107.70 (д, JCF=20.9 Гц), 112.80 (дд, JCF=6.1, 20.2 Гц), 117.11, 121.30, 145.85 (дд, JCF=13.5, 241.0 Гц), 152.38, 152.56 (д, JCF=10.8 Гц), 152.90 (дд, JCF=14.8, 251.8 Гц), 154.27, 167.92, 169.51. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C16H15F2N2O3: 321.1045; найдено: 321.1048.
Пример 13. Получение этил-2-(7-бром-2,9-диметил-5H-хромено[4,3-d]пиримидин-5-ил)ацетата (Iн).
Смесь этил-3-(8-бром-6-метил-4-оксо-4H-хромен-3-ил)акрилата VIн (674 мг, 2 ммоль), гидрохлорида ацетамидина IIIa (227 мг, 2.4 ммоль) и этилата натрия (163 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 4-6 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 655 мг (выход 87%) соединения Iн в виде белого порошка с Тпл. 148-149°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.20 (т, J=7.0 Гц, 3Н, СН3СН2), 2.30 (с, 3Н, СН3), 2.63 (с, 3Н, СН3), 2.86 (дд, J=9.8, 15.6 Гц, 1Н, H-2'a), 3.02 (дд, 7=3.5, 15.6 Гц, 1Н, H-2'b), 4.12 (кв, J=7.0 Гц, 2Н, CH3CH2), 5.92 (дд, J=3.5, 9.8 Гц, 1Н, Н-5), 7.54 (с, 1H, ArH), 7.86 (с, 1Н, ArH), 8.63 (с, 1Н, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δС (м.д.) 14.53, 20.30, 26.12, 39.33, 60.97, 72.89, 111.15, 121.57, 121.78, 124.50, 133.38, 137.24, 149.88, 153.24, 154.32, 167.91, 169.43. Масс-спектр HRMS-ESI: m/z [M+H]+ вычислено для C17H18BrN2O3: 377.0495; найдено: 377.0478.
Пример 14. Получение этил-2-(2,9-диметил-7-нитро-5H-хромено[4,3-d]пиримидин-5-ил)ацетата (Iо).
Смесь этил-3-(6-метил-8-нитро-4-оксо-4H-хромен-3-ил)акрилата VIo (606 мг, 2 ммоль), гидрохлорида ацетамидина IIIa (227 мг, 2.4 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ена (DBU, 365 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 4-6 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 560 мг (выход 82%) соединения Iо в виде белого порошка с Тпл. 142-144°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.17 (т, J=7.0 Гц, 3Н, СН3СН2), 2.39 (с, 3Н, СН3), 2.67 (с, 3Н, СН3), 2.91 (дд, J=9.8, 15.6 Гц, 1Н, Н-2'а), 3.06 (дд, J=3.8, 15.6 Гц, 1Н, H-2'b), 4.08 (кв, J=7.0 Гц, 2Н, CH3CH2, 6.02 (дд, J=3.8, 9.8 Гц, 1H, Н-5), 7.91 (с, 1Н, ArH), 8.21 (с, 1Н, ArH), 8.71 (с, 1Н, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δС (м.д.) 14.35, 20.26, 26.14, 39.34, 60.95, 73.55, 121.79, 122.56, 129.03, 130.00, 132.37, 139.60, 146.45, 152.10, 154.75, 168.10, 169.28. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C17H18N3O5: 344.1241; найдено: 344.1240.
Пример 15. Получение этил-2-(9-бром-8-метокси-2-метил-5H-хромено[4,3-d]пиримидин-5-ил)ацетата (Iп).
Смесь этил-3-(6-бром-6-метокси-4-оксо-4H-хромен-3 -ил)акрилата VIп (674 мг, 2 ммоль), гидрохлорида ацетамидина IIIa (227 мг, 2.4 ммоль) и этилата натрия (163 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 4-6 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 670 мг (выход 85%) соединения Iп в виде белого порошка с Тпл. 125-127°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.19 (т, J=7.0 Гц, 3Н, СН3СН2), 2.63 (с, 3Н, СН3), 2.97 (дд, J=8.5, 15.8 Гц, 1Н, H-2'a), 3.06 (дд, J=4.5, 15.8 Гц, 1Н, H-2'b), 3.89 (с, 3Н, СН3), 4.11 (м, 2Н, CH3CH2, 5.87 (дд, J=4.5, 8.5 Гц, 1Н, Н-5), 6.71 (с, 1Н, ArH), 8.18 (с, 1H, ArH), 8.56 (с, 1Н, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δС (м.д.) 14.51, 26.11, 39.46, 57.31, 60.85, 72.69, 102.45, 104.48, 114.15, 120.52, 128.55, 152.93, 153.75, 156.99, 159.89, 167.73, 169.64. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C17H18BrN2O4: 393.0444; найдено: 393.0453.
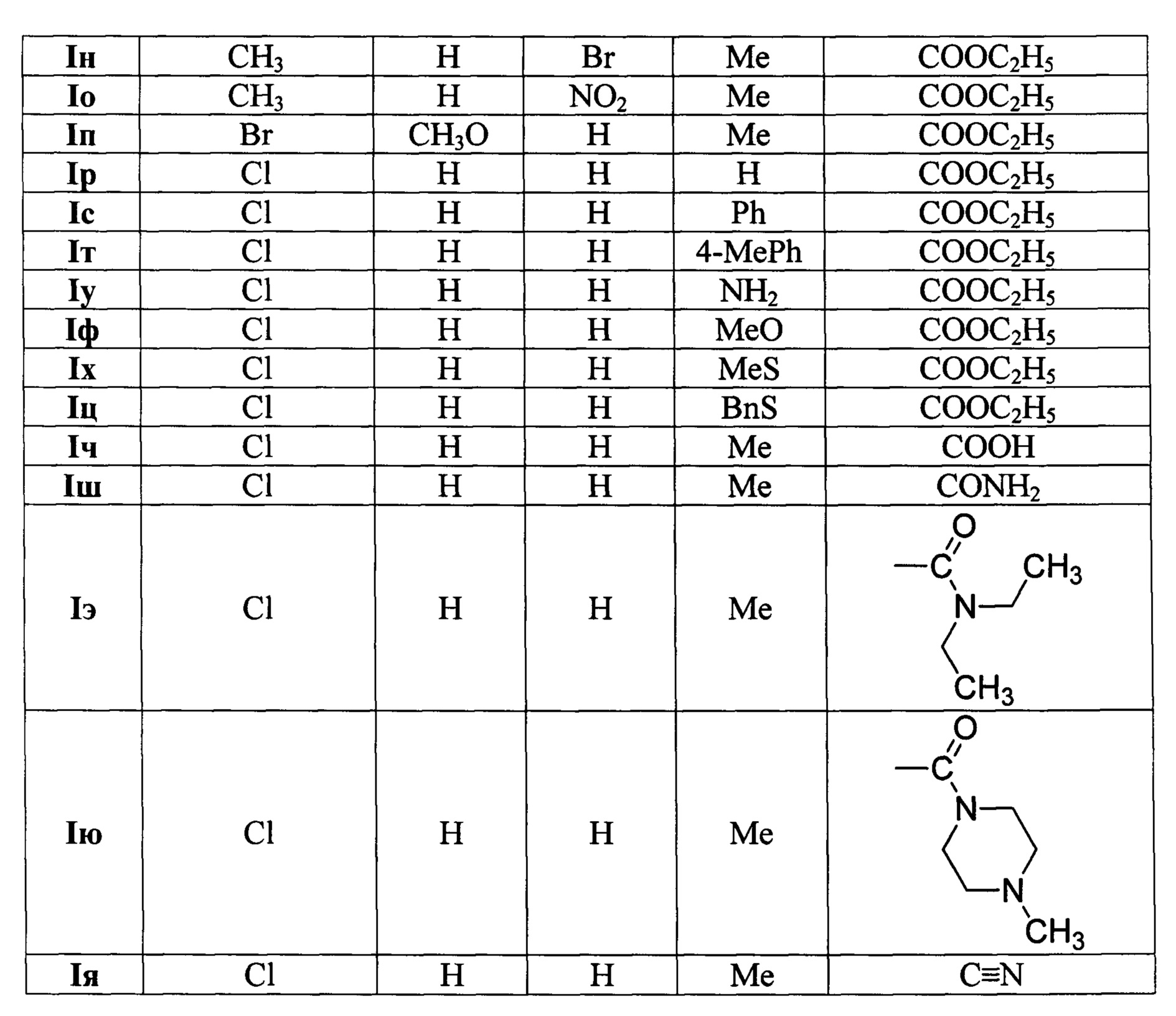
Пример 16. Получение этил-2-(9-хлор-5H-хромено[4,3-d]пиримидин-5-ил)ацетата (Iр).
Смесь этил-3-(6-хлор-4-оксо-4H-хромен-3-ил)акрилата VIa (556 мг, 2 ммоль), гидрохлорида формамидина IIIб (204 мг, 2.4 ммоль) и гидроксида натрия (96 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 4-6 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 560 мг (выход 92%) соединения Iр в виде белого порошка с Тпл. 94-95°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.18 (т, J=7.0 Гц, 3Н, СН3СН2), 3.00 (дд, J=8.8, 15.8 Гц, 1Н, H-2'a), 3.09 (дд, J=4.3, 15.8 Гц, 1Н, H-2'b), 4.11 (м, 2Н, CH3CH2, 5.94 (дд, J=4.3, 8.8 Гц, 1Н, Н-5), 7.03 (д, J=8.5 Гц, 1Н, Н-7), 7.52 (дд, J=2.5, 8.5 Гц, 1Н, Н-8), 8.07 (д, J=2.5 Гц, 1Н, Н-10), 8.79 (с, 1Н, Н-4), 9.18 (с, 1Н, Н-2). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δC (м.д.) 14.49, 39.34, 60.88, 72.26, 120.28, 121.71, 124.27, 124.96, 126.92, 133.89, 152.77, 154.45, 154.51, 158.96, 169.59. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C15H14ClN2O3: 305.0687; найдено: 305.0669.
Пример 17. Получение этил-2-(9-хлор-2-фенил-5H-хромено[4,3-d]пиримидин-5-ил)ацетата (Iс).
Смесь этил-3-(6-хлор-4-оксо-4H-хромен-3-ил)акрилата VIa (556 мг, 2 ммоль), гидрохлорида бензамидина IIIв (313 мг, 2.4 ммоль) и гидроксида натрия (96 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 4-6 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 715 мг (выход 94%) соединения Iс в виде белого порошка с Тпл. 135-136°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.19 (т, J=7.0 Гц, 3Н, СН3СН2), 3.02 (дд, J=8.5, 15.8 Гц, 1Н, H-2'a), 3.12 (дд, J=4.5, 15.8 Гц, 1Н, H-2'b), 4.12 (м, 2Н, CH3CH2, 5.95 (дд, J=4.5, 8.5 Гц, 1H, Н-5), 7.03 (д, J=8.5 Гц, 1Н, Н-7), 7.52 (дд, J=2.5, 8.5 Гц, 1Н, Н-8), 7.56 (м, 3Н, Ph), 8.27 (д, J=2.5 Гц, 1Н, Н-10), 8.51 (м, 2Н, Ph), 8.85 (с, 1Н, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δC (м.д.) 14.50, 39.36, 60.88, 72.42, 120.18, 121.94, 122.93, 124.42, 126.95, 128.35 (2С), 129.22 (2С), 131.57, 133.83, 137.18, 153.18, 154.61, 155.00, 163.65, 169.63. Масс-спектр HRMS-ESI: m/z [M+Na]+ вычислено для C21H17ClN2NaO3: 403.0820; найдено: 403.0816.
Пример 18. Получение этил-2-[9-хлор-2-(n-толил)-5H-хромено[4,3-d]пиримидин-5-ил]ацетата (Iт).
Смесь этил-3-(6-хлор-4-оксо-4H-хромен-3-ил)акрилата VIa (556 мг, 2 ммоль), гидрохлорида n-метилбензамидина IIIв (341 мг, 2.4 ммоль) и гидроксида натрия (96 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 4-6 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 720 мг (выход 91%) соединения Iт в виде белого порошка с Тпл. 128-130°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.18 (т, J=7.0 Гц, 3Н, СН3СН2), 2.39 (с, 3Н, СН3), 3.00 (дд, J=8.8, 15.8 Гц, 1Н, H-2'a), 3.10 (дд, J=4.3, 15.8 Гц, 1Н, H-2'b), 4.12 (кв, J=7.0 Гц, 2Н, CH3CH2, 5.92 (дд, J=4.3, 8.8 Гц, 1Н, Н-5), 7.01 (д, J=8.5 Гц, 1Н, Н-7), 7.34 (д, J=8.0 Гц, 2Н, Ph), 7.51 (дд, J=2.5, 8.5 Гц, 1Н, Н-8), 8.24 (д, J=2.5 Гц, 1Н, Н-10), 8.38 (д, J=8.0 Гц, 2Н, Ph), 8.80 (с, 1Н, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δС (м.д.) 14.50, 21.55, 39.36, 60.87, 72.44, 120.14, 121.98, 122.57, 124.36, 126.89, 128.31 (2С), 129.80 (2С), 133.74, 134.53, 141.41, 153.05, 154.57, 154.88, 163.69, 169.64. Масс-спектр HRMS-ESI: m/z [M+Na]+ вычислено для C22H19ClN2NaO3: 417.0976; найдено: 417.0971.
Пример 19. Получение этил-2-(2-амино-9-хлор-5H-хромено[4,3-d]пиримидин-5-ил)ацетата (Iу).
Смесь этил-3-(6-хлор-4-оксо-4H-хромен-3-ил)акрилата VIa (556 мг, 2 ммоль), гидрохлорида гуанидина IIIг (229 мг, 2.4 ммоль) и этилата натрия (163 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 12-16 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 490 мг (выход 77%) соединения Iу в виде белого порошка с Тпл. 170-172°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.18 (т, J=7.0 Гц, 3Н, СН3СН2), 2.84 (дд, J=8.5, 15.6 Гц, 1Н, H-2'a), 2.94 (дд, J=4.3, 15.6 Гц, 1H, H-2'b), 4.10 (м, 2Н, СН3СН2), 5.70 (дд, J=4.3, 8.5 Гц, 1Н, Н-5), 6.86 (уш. с, 2Н, NH2), 6.96 (д, J=8.8 Гц, 1Н, Н-7), 7.45 (дд, J=2.3, 8.8 Гц, 1Н, Н-8), 7.95 (д, J=2.3 Гц, 1Н, Н-10), 8.23 (с, 1Н, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δС (м.д.) 14.51, 39.34, 60.72, 72.70, 113.59, 120.02, 122.51, 123.98, 126.33, 132.86, 153.28, 154.42, 155.71, 164.02, 169.81. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C15H15ClN3O3: 320.0796; найдено: 320.0801.
Пример 20. Получение этил-2-(2-метокси-9-хлор-5H-хромено[4,3-d]пиримидин-5-ил)ацетата (Iф).
Смесь этил-3-(6-хлор-4-оксо-4H-хромен-3-ил)акрилата VIa (556 мг, 2 ммоль), гемисульфата О-метилизомочевины IIIд (295 мг, 2.4 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ена (DBU, 365 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 4-6 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 550 мг (выход 82%) соединения Iф в виде белого порошка с Тпл. 77-78°С.
Спектр ЯМР 1H (400 МГц, ДМСО-d6): δH (м.д.) 1.18 (т, J=7.0 Гц, 3Н, СН3СН2), 2.93 (дд, J=8.8, 15.8 Гц, 1Н, H-2'a), 3.02 (дд, J=4.3, 15.8 Гц, 1Н, Н-2'b), 3.99 (с, 3Н, CH3O), 4.10 (м, 2Н, СН3СН2), 5.88 (дд, J=4.3, 8.8 Гц, 1Н, Н-5), 7.01 (д, J=8.8 Гц, 1H, Н-7), 7.51 (дд, J=2.5, 8.8 Гц, 1Н, Н-8), 8.02 (д, J=2.5 Гц, 1Н, Н-10), 8.58 (с, 1Н, Н-4). Спектр ЯМР, 13С (100 МГц, ДМСО-d6): δС (м.д.) 14.49, 39.38, 55.25, 60.83, 72.38, 118.72, 120.20, 121.70, 124.28, 126.74, 133.90, 154.56, 155.06, 157.13, 165.59, 169.64. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C16H16ClN2O4: 335.0793; найдено: 335.0781.
Пример 20. Получение этил-2-[2-(метилтио)-9-хлор-5H-хромено[4,3-d]пиримидин-5-ил]ацетата (Iх).
Смесь этил-3-(6-хлор-4-оксо-4H-хромен-3-ил)акрилата VIa (556 мг, 2 ммоль), гемисульфата 3-метилизотиомочевины IIIе (334 мг, 2.4 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ена (DBU, 365 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 4-6 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 625 мг (выход 89%) соединения Iх в виде белого порошка с Тпл. 98-99°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.18 (т, J=7.0 Гц, 3Н, СН3СН2), 2.59 (с, 3Н, CH3S), 2.95 (дд, J=8.8, 15.8 Гц, 1Н, H-2'a), 3.04 (дд, J=4.3, 15.8 Гц, 1Н, H-2'b), 4.10 (м, 2Н, CH3CH2), 5.86 (дд, J=4.3, 8.8 Гц, 1H, Н-5), 7.00 (д, J=8.8 Гц, 1Н, Н-7), 7.51 (дд, J=2.5, 8.8 Гц, 1Н, Н-8), 8.01 (д, J=2.5 Гц, 1H, Н-10), 8.59 (с, 1Н, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δC (м.д.) 14.14, 14.49, 39.36, 60.86, 72.26, 120.22 (2С), 121.38, 124.25, 126.81, 133.99, 153.15, 154.65, 154.86, 169.59, 172.02. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C16H16ClN2O3S: 351.0565; найдено: 351.0568.
Пример 21. Получение этил-2-[2-(бензилтио)-9-хлор-5H-хромено[4,3-d]пиримидин-5-ил]ацетата (Iц).
Смесь этил-3-(6-хлор-4-оксо-4H-хромен-3-ил)акрилата VIa (556 мг, 2 ммоль), гидрохлорида S-бензилизотиомочевины IIIж (486 мг, 2.4 ммоль) и этилата натрия (163 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 4-6 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 740 мг (выход 87%) соединения Iц в виде белого порошка с Тпл. 105-107°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1.17 (т, J=7.0 Гц, 3Н, СН3СН2), 2.95 (дд, J=8.8, 15.8 Гц, 1Н, H-2'a), 3.05 (дд, J=4.3, 15.8 Гц, 1Н, H-2'b), 4.09 (м, 2Н, СН3СН2), 4.49 (с, 2Н, CH2S), 5.86 (дд, J=4.3, 8.8 Гц, 1Н, Н-5), 7.00 (д, J=8.8 Гц, 1Н, Н-7), 7.25 (м, 1Н, Ph), 7.32 (м, 2Н, Ph), 7.48 (м, 2Н, Ph), 7.51 (дд, J=2.5, 8.8 Гц, 1Н, Н-8), 8.03 (д, J=2.5 Гц, 1H, Н-10), 8.61 (с, 1Н, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δС (м.д.) 14.49, 34.90, 39.41, 60.85, 72.26, 120.24, 120.62, 121.37, 124.42, 126.85, 127.58, 128.89 (2С), 129.28 (2С), 134.06, 138.22, 153.36, 154.69, 155.06, 169.61, 171.19. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C22H20ClN2O3S: 427.0878; найдено: 427.0873.
Пример 22. Получение 2-(2-метил-9-хлор-5H-хромено[4,3-d]пиримидин-5-ил)уксусной кислоты (Iч).
Смесь 3-(6-хлор-4-оксо-4H-хромен-3-ил)акриловой кислоты VIc (501 мг, 2 ммоль), гидрохлорида ацетамидина IIIa (454 мг, 4.8 ммоль) и этилата натрия (326 мг, 4.8 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение двух суток. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 420 мг (выход 72%) соединения Iч в виде белого порошка с Тпл. 246-247°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 2.65 (с, 3Н, СН3), 2.88 (дд, J=8.5, 15.8 Гц, 1Н, H-2'a), 2.97 (дд, J=4.5, 15.8 Гц, 1Н, H-2'b), 5.84 (дд, J=4.5, 8.5 Гц, 1Н, Н-5), 7.00 (д, J=8.8 Гц, 1Н, Н-7), 7.48 (дд, J=2.5, 8.8 Гц, 1Н, Н-8), 8.02 (д, J=2.5 Гц, 1Н, Н-10), 8.64 (с, 1H, Н-4), 12.60 (уш. с, 1Н, CO2H). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δС (м.д.) 26.09, 39.30, 72.46, 120.13, 121.85, 122.01, 124.12, 126.71, 133.53, 152.68, 154.37, 154.57, 167.83, 171.13. Масс-спектр HRMS-ESI: m/z [M+H]+ вычислено для C14H12ClN2O3: 291.0531; найдено: 291.0530.
Пример 23. Получение 2-(2-метил-9-хлор-5H-хромено[4,3-d]пиримидин-5-ил)ацетамида (Iш).
Смесь 3-(6-хлор-4-оксо-4H-хромен-3-ил)акрил амида VIт (500 мг, 2 ммоль), гидрохлорида ацетамидина IIIa (227 мг, 2.4 ммоль) и этилата натрия (163 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 4-6 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 540 мг (выход 93%) соединения Iш в виде белого порошка с Тпл. 243-244°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 2.66 (м, 4Н, СН3, H-2'a), 2.76 (дд, J=8.3, 14.8 Гц, 1Н, H-2'b), 5.84 (дд, J=5.9, 8.3 Гц, 1Н, Н-5), 7.00 (уш. с, 1Н, NH2), 7.02 (д, J=8.8 Гц, 1Н, Н-7), 7.40 (уш. с, 1Н, NH2), 7.49 (дд, J=2.5, 8.8 Гц, 1H, Н-8), 8.05 (д, J=2.5 Гц, 1Н, Н-10), 8.58 (с, 1H, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δС (м.д.) 26.13, 40.69, 72.83, 120.35, 121.90, 122.49, 124.07, 126.63, 133.58, 152.61, 154.41, 154.72, 167.81, 170.31. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C14H13ClN3O2: 290.0691; найдено: 290.0681.
Пример 24. Получение N,N-диэтил-2-(2-метил-9-хлор-5H-хромено[4,3-d]пиримидин-5-ил)ацетамида (Iэ).
Смесь N,N-диэтил-3-(6-хлор-4-оксо-4H-хромен-3-ил)акриламида VIy (612 мг, 2 ммоль), гидрохлорида ацетамидина IIIa (227 мг, 2.4 ммоль) и этилата натрия (163 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 4-6 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 565 мг (выход 82%) соединения Iэ в виде белого порошка с Тпл. 118-120°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 0.95 (т, J=7.0 Гц, 3Н, СН3СН2), 1.00 (т, J=7.0 Гц, 3Н, СН3СН2), 2.64 (с, 3Н, СН3), 2.88 (дд, J=5.3, 15.8 Гц, 1Н, H-2'a), 3.05 (дд, J=7.5, 15.8 Гц, 1H, H-2'b), 3.13-3.30 (м, 4Н, СН3СН2), 5.92 (пс. т, J=6.4 Гц, 1Н, Н-5), 6.98 (д, J=8.8 Гц, 1Н, Н-7), 7.46 (дд, 7=2.5, 8.8 Гц, 1Н, Н-8), 8.02 (д, J=2.5 Гц, 1Н, Н-10), 8.60 (с, 1Н, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δC (м.д.) 13.42, 14.66, 26.08, 37.77, 41.83, 72.95, 120.09, 121.90, 122.60, 124.16, 126.53, 133.46, 152.65, 154.63, 154.81, 167.47, 167.64. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C18H21ClN3O2: 346.1317; найдено: 346.1320.
Пример 25. Получение 2-(2-метил-9-хлор-5H-хромено[4,3-d]пиримидин-5-ил)-1-(4-метилпиперазин-1-ил)этанона (Iю).
Смесь 3-(6-хлор-4-оксо-4H-хромен-3-ил)-1-(4-метилпиперазин-1-ил)проп-2-ен-1-она VIф (665 мг, 2 ммоль), гидрохлорида ацетамидина IIIa (227 мг, 2.4 ммоль) и этилата натрия (163 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 4-6 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл воды, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 625 мг (выход 84%) соединения Iю в виде белого порошка с Тпл. 145-147°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 2.15-2.25 (м, 7Н, CH3N, CH2N), 2.64 (с, 3Н, СН3), 2.95 (дд, J=5.5, 16.1 Гц, 1Н, H-2'a), 3.10 (дд, J=7.3, 16.1 Гц, 1H, H-2'b), 3.34 (м, 2Н, CH2N), 3.45 (м, 2Н, CH2N), 5.88 (пс. т, J=6.3 Гц, 1Н, Н-5), 6.99 (д, J=8.8 Гц, 1Н, Н-7), 7.46 (дд, J=2.5, 8.8 Гц, 1Н, Н-8), 8.02 (д, 7=2.5 Гц, 1H, Н-10), 8.61 (с, 1Н, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δС (м.д.) 26.10, 37.62, 41.53, 45.33, 46.02, 54.69, 55.13, 72.76, 120.16, 121.93, 122.52, 124.16, 126.54, 133.46, 152.67, 154.73, 154.81, 167.15, 167.63. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C19H22ClN4O2: найдено: 373.1419.
Пример 26. Получение 2-(2-метил-9-хлор-5H-хромено[4,3-d]пиримидин-5-ил)ацетонитрила (Iя).
Смесь 3-(6-хлор-4-оксо-4H-хромен-3-ил)акрилонитрила VIx (463 мг, 2 ммоль), гидрохлорида ацетамидина IIIa (227 мг, 2.4 ммоль) и этилата натрия (163 мг, 2.4 ммоль) в 10 мл этанола перемешивают при 15-25°С в течение 14-18 часов. Конец реакции определяют по ТСХ (этилацетат/гексан = 3/7, проявление в УФ свете). Затем реакционную массу выливают в 100 мл 1М соляной кислоты, отфильтровывают выпавший осадок продукта и сушат на воздухе. Получают 470 мг (выход 87%) соединения Iя в виде бледно-желтого порошка с Тпл. 156-157°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 2.68 (с, 3Н, СН3), 3.33 (дд, J=4.5, 17.3 Гц, 1Н, H-2'a), 3.41 (дд, J=7.0, 17.3 Гц, 1Н, H-2'b), 5.89 (дд, J=4.5, 7.0 Гц, 1Н, Н-5), 7.10 (д, J=8.8 Гц, 1Н, Н-7), 7.50 (дд, J=2.5, 8.8 Гц, 1Н, Н-8), 8.03 (д, J=2.5 Гц, 1Н, Н-10), 8.70 (с, 1Н, Н-4). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δC (м.д.) 23.52, 26.16, 71.17, 117.75, 120.07, 120.54, 121.57, 124.20, 127.20, 133.78, 152.71, 154.06, 154.59, 168.48. Масс-спектр HRMS-ESI: m/z [М+Н]+ вычислено для C14H11ClN3O: 272.0585; найдено: 272.0583.
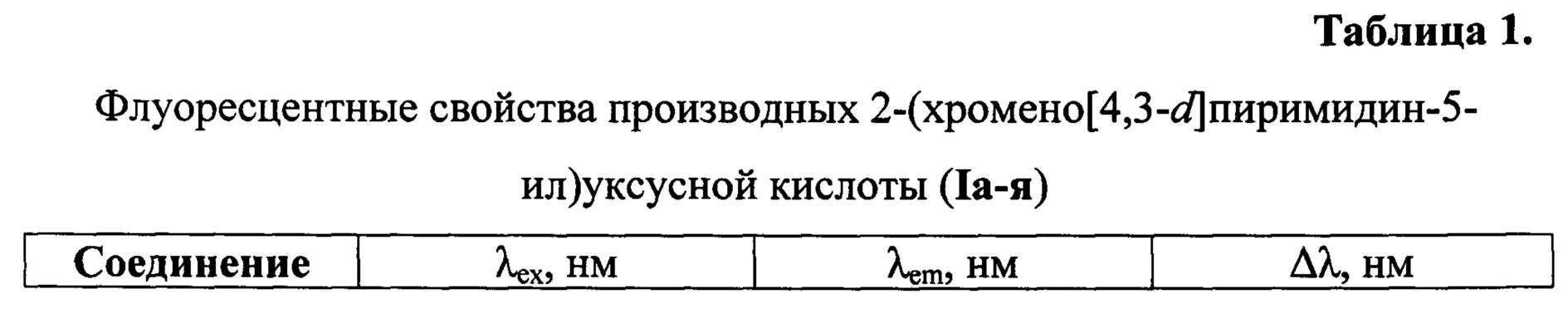
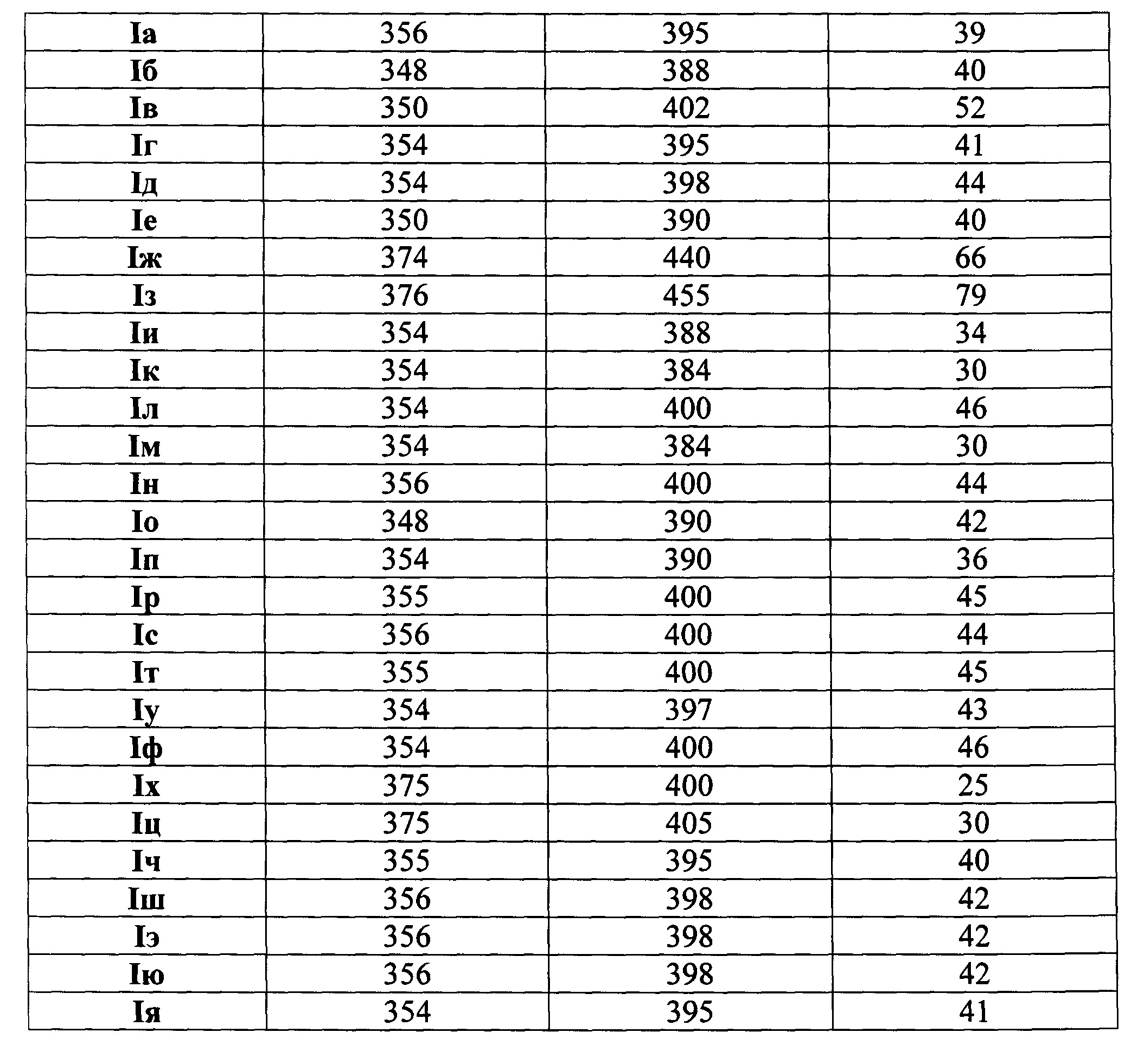
Пример 27. Флуоресцентные свойства производных 2-(хромено[4,3-d]пиримидин-5-ил)уксусной кислоты (Iа-я).
Спектры экстинкции и эмиссии растворов исследуемых соединений Iа-я зарегистрированы на спектрофлуориметре BMG Labtech CLARIOstar. Растворы веществ Ia-я были приготовлены в диметилсульфоксиде в концентрации 10-4 моль/л. Длины волн максимумов поглощения (λex) и флуоресценции (λem) представлены в таблице 1. Сдвиг Стокса (Δλ) рассчитан по формуле (1):

Из полученных данных следует, что синтезированные хромено[4,3-d]пиримидины Ia-я обладают флуоресценцией в фиолетово-синей области спектра (390-455 нм) со стоксовым сдвигом 25-79 нм, что делает данные соединения пригодными для применения в качестве флуоресцентных красителей и/или зондов в биохимических исследованиях.
![Производные 2-(хромено[4,3-d]пиримидин-5-ил)уксусной кислоты и способ их получения](https://fips.edrid.ru/images/rid/ad/5b/7a/d5ff252d4645eb2f29d2197cdf71c701.jpg)
![Производные 2-(хромено[4,3-d]пиримидин-5-ил)уксусной кислоты и способ их получения](https://fips.edrid.ru/images/rid/ad/5b/7a/d5809c8b1de39a9bb913ef981181d2e8.jpg)
![Производные 2-(хромено[4,3-d]пиримидин-5-ил)уксусной кислоты и способ их получения](https://fips.edrid.ru/images/rid/ad/5b/7a/079f2b34a27c9609447b5b16e9fce81f.jpg)

