Результат интеллектуальной деятельности: 2-Арил-6-(метилтио)-4-хлор-2H-пиразоло[3,4-d]пиримидины и способ их получения
Вид РИД
Изобретение
Изобретение относится к области органической и медицинской химии, а именно: к новым соединениям класса гетероциклических систем - производным 2-арил-6-(метилтио)-4-хлор-2H-пиразоло[3,4-d]пиримидинов общей формулы I, которые могут быть использованы для синтеза новых гетероциклических соединений и в медицине в качестве потенциального противомикробного средства, - и к способу их получения.
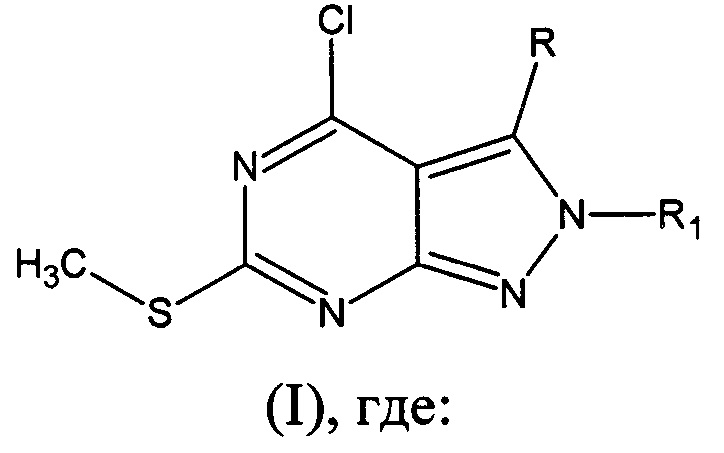
R=H, R1=фенил (Ia) - 6-(метилтио)-2-фенил-4-хлор-2H-пиразоло[3,4-d]пиримидин;
R=H, R1=2-бромфенил (Iб) - 2-(2-бромфенил)-6-(метилтио)-4-хлор-2H-пиразоло[3,4-d]пиримидин;
R=H, R1=2-метилфенил (Iв) - 6-(метилтио)-2-(2-метилфенил)-4-хлор-2H-пиразоло[3,4-d]пиримидин;
R=H, R1=2-метоксифенил (Iг) - 6-(метилтио)-2-(2-метоксифенил)-4-хлор-2H-пиразоло[3,4-d]пиримидин;
R=H, R1=2-нитрофенил (Iд) - 6-(метилтио)-2-(2-нитрофенил)-4-хлор-2H-пиразоло[3,4-d]пиримидин;
R=H, R1=3-бромфенил (Ie) - 2-(3-бромфенил)-6-(метилтио)-4-хлор-2H-пиразоло[3,4-d]пиримидин;
R=H, R1=3-метилфенил (Iж) - 6-(метилтио)-2-(3-метил фенил)-4-хлор-2H-пиразоло[3,4-d]пиримидин;
R=H, R1=3-метоксифенил (Iз) - 6-(метилтио)-2-(3-метоксифенил)-4-хлор-2H-пиразоло[3,4-d]пиримидин;
R=H, R1=3-нитрофенил (Iи) - 6-(метилтио)-2-(3-нитрофенил)-4-хлор-2H-пиразоло[3,4-d]пиримидин;
R=H, R1=4-бромфенил (Iк) - 2-(4-бромфенил)-6-(метилтио)-4-хлор-2H-пиразоло[3,4-d]пиримидин;
R=H, R1=4-метилфенил (Iл) - 6-(метилтио)-2-(4-метилфенил)-4-хлор-2H-пиразоло[3,4-d]пиримидин;
R=H, R1=4-метоксифенил (Iм) - 6-(метилтио)-2-(4-метоксифенил)-4-хлор-2H-пиразоло[3,4-d]пиримидин.
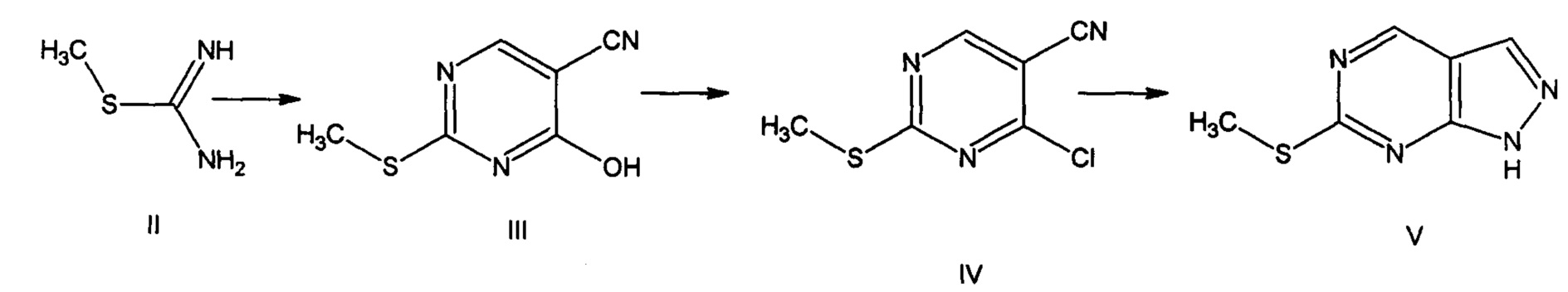
В литературе описан один из способов получения (6-метилтио)-1H-пиразоло[3,4-d]пиримидина [Eur. Journal of Med. Chem. (2012), 56: 30-35]. В качестве исходного соединения для синтеза (6-метилтио)-1H-пиразоло[3,4-d]пиримидина был взят метилимидотиокарбамат (II), который обрабатывают этил-2-циано-3-этоксиакрилатом в присутствие поташа. Полученный 4-гидрокси-2-(метилтио)пиримидин-5-карбонитрил (III) в толуоле и хлорокиси фосфора нагревают в течение 6 ч при 110°С. В результате взаимодействия 2-(метилтио)пиримидин-4-хлор-5-карбонитрила (IV) и гидразингидрата в присутствии н-бутанола (0,5 ч при комнатной температуре) получают необходимый пиразоло[3,4-d] пиримидин.
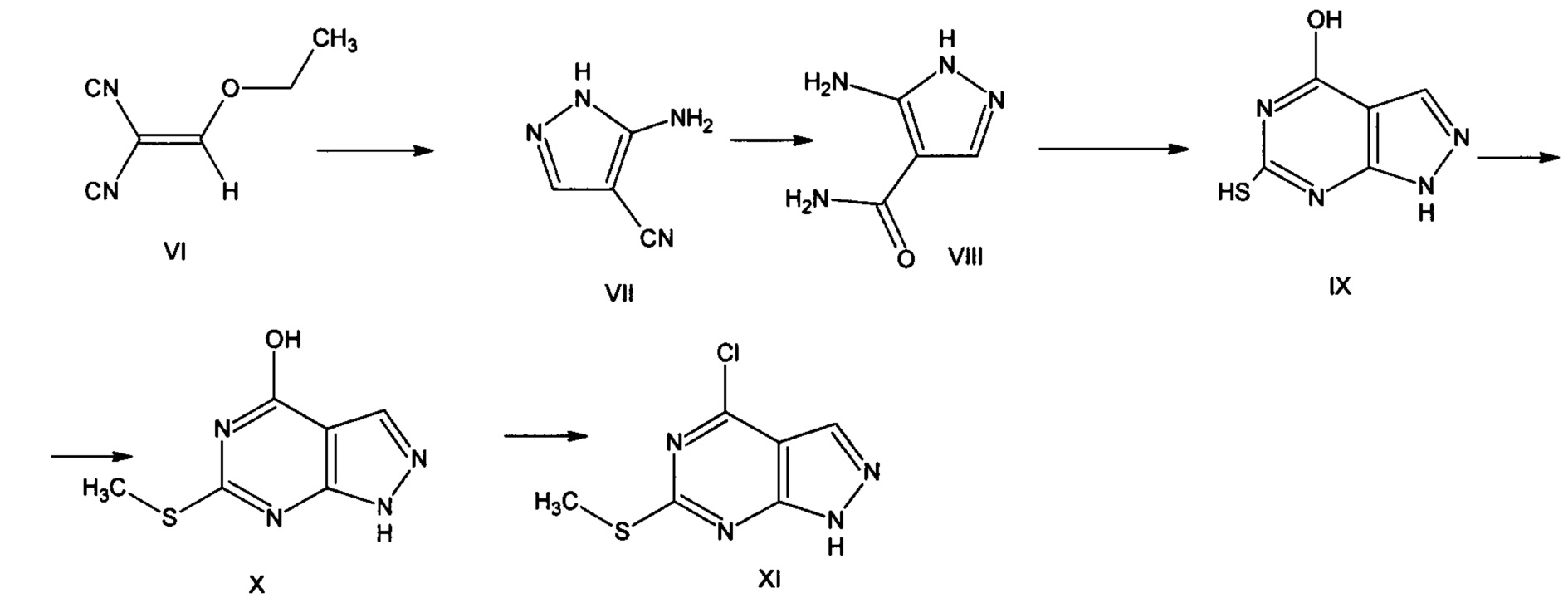
(6-Метилтио)-4-хлор-1H-пиразоло[3,4-d]пиримидин можно получить путем последовательных превращений, исходным соединением для синтеза которого является этоксиметиленмалононитрил (VI) [Eur. Journal of Med. Chem., 38(2003), 525-532]. Этоксиметиленмалононитрил (VI) циклизуется при обработке гидразингидратом, при этом полученный 3-амино-4-цианопиразол (VII) превращают в 3-амино-4-пиразолокарбоксамид (VIII) в результате гидролиза нитрильной группы в присутствии 95% серной кислоты. Продукт гидролиза (3-амино-4-пиразолокарбоксамид (VIII) взаимодействует с тиомочевинной с 70% выходом, при этом был получен целевой пиразолопиримидин (IX). Далее проводят S-алкилирование йодистым метилом с количественным выходом. Гидроксигруппу в молекуле приведенного соединения (X) хлорируют в присутствии хлорокиси фосфора.
В соответствии с данными литературных источников (Bioorganic & Medicinal Chemistry Letters, 21, 2011, 5928-5933) соответствующий пиразолопиримидин синтезируют из замещенного пиразола (XII), который в свою очередь был получен из 2-(фенилэтил)гидразина (R1=H) или 2-(фенилпропил)гидразина (R1=CH3) путем взаимодействия с этил(этоксиметилен)цианоацетатом. Далее пиразол (XIII) обрабатывают бензоилизоцианатом и кипят в безводном тетрагидрофуране в течение 12 ч. Конденсированный пиразоло[3,4-d]пиримидин (XIV) алкилируют по атому серы.

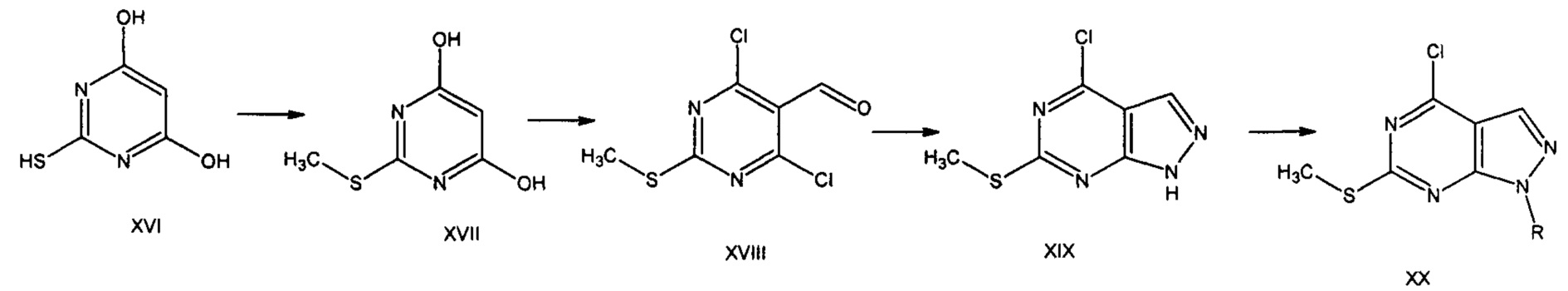
Авторы статьи [ACS Comb. Sci. 2014, 16, 168-175] описывают способ получения (6-метилтио)-4-хлор-пиразоло[3,4-d]пиримидинов через формильное производное, которое было получено в результате формилирования 2-метилтиобарбитуровой кислоты (XVII) по Вильсмайеру-Хааку хлорокисью фосфора. Особенностью данной реакции является параллельное введение формильной группы в молекулу и нуклеофильное замещение гидроксигрупп. Выделенный альдегид (XVIII) взаимодействует с гидразингидратом при комнатной температуре в течение 5 ч в присутствии триэтиламина. Конденсируемый (6-метилтио)-4-хлор-1H-пиразоло[3,4-d]пиримидин (XIX) обрабатывают трифенилфосфином в среде абсолютного тетрагидрофурана в присутствии DIAD (диэтилазодикарбоксилата) в течение 15 мин при 4°С, затем реакционную смесь облучают в микроволновой печи при 100°С (3 мин), остаток хроматографируют. В результате получают замещенный пиразоло[3,4-d]пиримидин (XX)
R=СН2СН2С6Н5; СН2С6Н5; СН2СН(ОМе)С6Н5
Из патентной и научно-технической литературы не выявлены ни способы получения новых, заявляемых авторами соединений, ни сама структура.
Задачей предполагаемой группы изобретений является создание новых неописанных в литературе соединений 2-арил-6-(метилтио)-4-хлор-2H-пиразоло[3,4-d]пиримидинов (I).
Техническими результатами, на решение которых направлена группа изобретений, являются получение новых гетероциклических соединений формулы I, которые могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем и в медицине, например, в качестве антимикробного средства; разработка простого способа их получения с высоким выходом продукта.
Поставленная задача осуществляется путем взаимодействия 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида и соответствующего R1-замещенного фенилгидразина гидрохлорида в присутствии избытка триэтиламина при мольном соотношении 1:1:2 в тетрагидрофуране, реакционную смесь кипятят 5-10 часов, охлаждают, заливают водой, перемешивают 1-3 часа, целевой продукт выделяют в виде перерожденного осадка.
Способ получения производных 2-арил-6-(метилтио)-4-хлор-2H-пиразоло[3,4-d]пиримидинов (I а-м) изучен и проведен в лабораторных условиях на стандартном товарном сырье.
Пример 1. Получение 6-(метилтио)-2-фенил-4-хлор-2H-пиразоло[3,4-d]пиримидина (Ia).
В круглодонную колбу емкостью 25 мл загружают 0,5 г (2,24 ммоль) 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида и 10 мл тетрагидрофурана, а затем добавляют 0,324 г (2,24 ммоль) фенилгидразина солянокислого и 0,62 мл триэтиламина (4,48 ммоль). Реакционную смесь кипятят при активном перемешивании в течение 8 ч. Реакционную массу охлаждают, заливают 30 мл воды и перемешивают в течение 1 ч. В ходе перемешивания происходит перерождение осадка. В результате выпадает осадок желтого цвета. Смесь отфильтровывают и промывают небольшими порциями воды очищенной.
Выделенный продукт светло-желтого цвета составляет 0,527 г, 85% от теоретического из расчета на 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида. Температура плавления 93-95°С. Хроматографическая однородность целевого продукта подтверждалась хроматографированием раствора его в системе метанол: дихлорметан (1:10) в системе. Rf=0,341. Состав синтезированного соединения подтвержден элементным анализом. Брутто-формула: C12H9ClN4S. Найдено %: С - 51,99, Н - 3,25, N - 20,21. Вычислено %: С - 52,08, Н - 3,28, N - 20,24.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1Н и масс-спектрометрией.
В спектре ЯМР 1H полученного соединения в ДМСО-d6 присутствуют сигналы протонов метальной группы (δ 2,64 с), сигналы бензольного кольца: δ 7,40-7,44 м (1H, Наром), δ 7,59-7,63 м (2Н, Наром), δ 8,15 д (1Н, Наром), и сигнал протона пиразольного кольца 5 8,60 с. Также строение полученного вещества было доказано с помощью масс-спектрометрии. Рассчитанная молекулярная масса полностью совпала с экспериментально полученной (М+=276,73).
Пример 2. Получение 2-(2-бромфенил)-6-(метилтио)-4-хлор-2H-пиразоло[3,4-d]пиримидина (Iб).
В круглодонную колбу емкостью 25 мл загружают 0,5 г (2,24 ммоль) 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида и 10 мл тетрагидрофурана, а затем добавляют 0,50 г (2,24 ммоль) о-бромфенилгидразин гидрохлорид и 0,62 мл триэтиламина (4,48 ммоль). Реакционную смесь кипятят при активном перемешивании в течение 10 ч. Охлаждают, заливают 30 мл воды и перемешивают в течение 1 ч. В ходе перемешивания происходит перерождение осадка. В результате выпадает осадок бежевого цвета. Смесь отфильтровывают и промывают небольшими порциями воды очищенной.
Выделенный продукт бежевого цвета составляет 0,566 г, 71% от теоретического из расчета на 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида. Температура плавления 166-168°С. Хроматографическая однородность целевого продукта подтверждалась хроматографированием раствора его в системе метанол: дихлорметан (1:10) в системе. Rf=0,295. Состав синтезированного соединения подтвержден элементным анализом. Брутто-формула: C12H8 BrClN4S. Найдено %: С - 40,62, Н - 2,03, N - 14,55, 0 - 4,12. Вычислено %: С - 40,53, Н - 2,27, N - 15,75.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1Н и масс-спектрометрией.
В спектре ЯМР 1H полученного соединения в ДМСО-d6 присутствуют сигналы протонов метильной группы (δ 2,60 с), сигналы бензольного кольца: δ 7,58-7,61 м (1H, Наром), δ 7,64-7,68 м (1Н, Наром), δ 7,77 д (1H, Наром), δ 7,95 д (1Н, Наром), и сигнал протона пиразольного кольца δ 9,29 с. Также строение полученного вещества было доказано с помощью масс-спектрометрии и рентгено-структурного анализа (см. Фиг.). Рассчитанная молекулярная масса полностью совпала с экспериментально полученной (M+=355,61).
3. Получение 6-(метилтио)-2-(2-метилфенил)-4-хлор-2H-пиразоло[3,4-d]пиримидина (Iв).
В круглодонную колбу емкостью 25 мл загружают 0,5 г (2,24 ммоль) 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида и 10 мл тетрагидрофурана, а затем добавляют 0,356 г (2,24 ммоль) о-метилфенилгидразин гидрохлорид и 0,62 мл триэтиламина (4,48 ммоль). Реакционную смесь кипятят при активном перемешивании в течение 8 ч. Охлаждают, заливают 30 мл воды и перемешивают в течение 1 ч. В ходе перемешивания происходит перерождение осадка. В результате выпадает осадок белого цвета. Смесь отфильтровывают и промывают небольшими порциями воды очищенной.
Выделенный продукт белого цвета составляет 0,521 г, 81% от теоретического из расчета на 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида. Температура плавления 168-170°С. Хроматографическая однородность целевого продукта подтверждалась хроматографированием раствора его в системе этилацетат: дихлорметан (1:2) в системе. Rf=0,595. Состав синтезированного соединения подтвержден элементным анализом. Брутто-формула: C13H11ClN4S. Найдено %: С - 53,65, Н - 3,79, N - 19,25. Вычислено %: С - 53,70, Н - 3,81, N - 19,27.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1Н и масс-спектрометрией.
В спектре ЯМР 1Н полученного соединения в ДМСО-d6 присутствуют сигналы протонов двух метальных групп (δ 2,24 с и δ 2,59 соответственно), сигналы бензольного кольца: δ 7,75 д (1Н, Наром), δ 7,51-7,53 м (2Н, Наром), δ 7,56 д (1Н, Наром), и сигнал протона пиразольного кольца δ 9,17 с. Также строение полученного вещества было доказано с помощью масс-спектрометрии. Рассчитанная молекулярная масса полностью совпала с экспериментально полученной (М+=290,75).
Пример 4. Получение 6-(метилтио)-2-(2-метоксифенил)-4-хлор-2H-пиразоло[3,4-d] пиримидина (Iг).
В круглодонную колбу емкостью 25 мл загружают 0,5 г (2,24 ммоль) 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида и 10 мл тетрагидрофурана, а затем добавляют 0,391 г (2,24 ммоль) о-метоксифенилгидразин гидрохлорида и 0,62 мл триэтиламина (4,48 ммоль). Реакционную смесь кипятят при активном перемешивании в течение 6 ч. Охлаждают, заливают 30 мл воды и перемешивают в течение 1 ч. В ходе перемешивания происходит перерождение осадка. В результате выпадает осадок светло-желтого цвета. Смесь отфильтровывают и промывают небольшими порциями воды очищенной.
Выделенный продукт светло-желтого цвета составляет 0,584 г, 85% от теоретического из расчета на 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида. Температура плавления 146-148°С. Хроматографическая однородность целевого продукта подтверждалась хроматографированием раствора его в системе метанол: дихлорметан (1:10) в системе. Rf=0,743. Состав синтезированного соединения подтвержден элементным анализом. Брутто-формула: C13H11ClN4OS. Найдено %: С - 50,89, Н - 3,59, N - 18,23, О - 5,19. Вычислено %: С - 50,90, Н - 3,61, N - 18,26, О - 5,22.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1Н и масс-спектрометрией.
В спектре ЯМР 1Н полученного соединения в ДМСО-d6 присутствуют сигналы протонов метальной группы (δ 2,59 с), метоксигруппы (δ 3,95 с), сигналы бензольного кольца: δ 7,18-7,21 д (1Н, Наром), δ 7,24-7,27 д (1Н, Наром), δ 7,48 д (1Н, Наром), δ 7,81 д (1Н, Наром), и сигнал протона пиразольного кольца δ 9,14 с. Также строение полученного вещества было доказано с помощью масс-спектрометрии. Рассчитанная молекулярная масса полностью совпала с экспериментально полученной (М+=306,74).
Пример 5. Получение 6-(метилтио)-2-(2-нитрофенил)-4-хлор-2H-пиразоло[3,4-d]пиримидина (Iд).
В круглодонную колбу емкостью 25 мл загружают 0,5 г (2,24 ммоль) 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида и 10 мл тетрагидрофурана, а затем добавляют 0,425 г (2,24 ммоль) о-нитрофенилгидразин гидрохлорида и 0,62 мл триэтиламина (4,48 ммоль). Реакционную смесь кипятят при активном перемешивании в течение 6 ч. Охлаждают, заливают 30 мл воды и перемешивают в течение 1 ч. В ходе перемешивания происходит перерождение осадка. В результате выпадает осадок светло-желтого цвета. Смесь отфильтровывают и промывают небольшими порциями воды очищенной.
Выделенный продукт светло-желтого цвета составляет 0,454 г, 63% от теоретического из расчета на 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида. Температура плавления 155-157°С. Хроматографическая однородность целевого продукта подтверждалась хроматографированием раствора его в системе метанол: дихлорметан (1:10) в системе. Rf=0,705. Состав синтезированного соединения подтвержден элементным анализом. Брутто-формула: C12H8ClN5O2S. Найдено %: С - 44,79, Н - 2,48, N - 21,76, О - 9,93. Вычислено %: С - 44,80, Н - 2,51, N - 21,77, О - 9,95.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1Н и масс-спектрометрией.
В спектре ЯМР 1Н полученного соединения в ДМСО-d6 присутствуют сигналы протонов метильной группы (δ 2,59 с), сигналы бензольного кольца: δ 7,86-7,90 м (1Н, Наром), δ 7,98-8,02 м (1Н, Наром), δ 8,06 д (1Н, Наром), δ 8,23 д (1Н, Наром), и сигнал протона пиразольного кольца δ 9,48 с. Также строение полученного вещества было доказано с помощью масс-спектрометрии. Рассчитанная молекулярная масса полностью совпала с экспериментально полученной (М+=321,71).
Пример 6. Получение 2-(3-бромфенил)-6-(метилтио)-4-хлор-2H-пиразоло[3,4-d] пиримидина (Iе).
В круглодонную колбу емкостью 25 мл загружают 0,5 г (2,24 ммоль) 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида и 10 мл тетрагидрофурана, а затем добавляют 0,50 г (2,24 ммоль) м-бромфенилгидразин гидрохлорид и 0,62 мл триэтиламина (4,48 ммоль). Реакционную смесь кипятят при активном перемешивании в течение 10 ч. Охлаждают, заливают 30 мл воды и перемешивают в течение 1 ч. В ходе перемешивания происходит перерождение осадка. В результате выпадает осадок желтого цвета. Смесь отфильтровывают и промывают небольшими порциями воды очищенной.
Выделенный продукт желтого цвета составляет 0,486 г, 61% от теоретического из расчета на 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида. Температура плавления 98-100°С. Хроматографическая однородность целевого продукта подтверждалась хроматографированием раствора его в системе метанол: дихлорметан (1:10) в системе. Rf=0,740. Состав синтезированного соединения подтвержден элементным анализом. Брутто-формула: C12H8BrClN4S. Найдено %: С - 40,51, Н - 2,25, N - 15,73. Вычислено %: С - 40,53, Н - 2,27, N - 15,75.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1Н и масс-спектрометрией.
В спектре ЯМР 1Н полученного соединения в ДМСО-d6 присутствуют сигналы протонов метильной группы (δ 2,60 с), сигналы бензольного кольца: δ 7,57-7,61 м (1Н, Наром), δ 7,73 д (1Н, Наром), δ 8,17 д (1H, Наром), δ 8,41 с (1Н, Наром), и сигнал протона пиразольного кольца δ 9,64 с. Также строение полученного вещества было доказано с помощью масс-спектрометрии. Рассчитанная молекулярная масса полностью совпала с экспериментально полученной (М+=355,61).
Пример 7. Получение 6-(метилтио)-2-(3-метилфенил)-4-хлор-2H-пиразоло[3,4-d] пиримидина (Iж).
В круглодонную колбу емкостью 25 мл загружают 0,5 г (2,24 ммоль) 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида и 10 мл тетрагидрофурана, а затем добавляют 0,356 г (2,24 ммоль) м-метилфенилгидразин гидрохлорид и 0,62 мл триэтиламина (4,48 ммоль). Реакционную смесь кипятят при активном перемешивании в течение 9 ч. Охлаждают, заливают 30 мл воды и перемешивают в течение 1 ч. В ходе перемешивания происходит перерождение осадка. В результате выпадает осадок светло-желтого цвета. Смесь отфильтровывают и промывают небольшими порциями воды очищенной.
Выделенный продукт светло-желтого цвета составляет 0,567 г, 87% от теоретического из расчета на 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида. Температура плавления 145-147°С. Хроматографическая однородность целевого продукта подтверждалась хроматографированием раствора его в системе метанол: дихлорметан (1:10) в системе. Rf=0,787. Состав синтезированного соединения подтвержден элементным анализом. Брутто-формула: C13H11ClN4S. Найдено %: С - 53,67, Н - 3,79, N - 19,25. Вычислено %: С - 53,70, Н - 3,81, N - 19,27.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1Н и масс-спектрометрией.
В спектре ЯМР 1Н полученного соединения в ДМСО-d6 присутствуют сигналы протонов двух метальных групп (δ 2,39 с и δ 2,60 соответственно), сигналы бензольного кольца: δ 7,19 д (1H, Наром), δ 7,41-7,45 м (1Н, Наром), δ 7,90-7,93 м (1Н, Наром), δ 7,94 д (1Н, Наром), и сигнал протона пиразольного кольца δ 8,52 с. Также строение полученного вещества было доказано с помощью масс-спектрометрии. Рассчитанная молекулярная масса полностью совпала с экспериментально полученной (М+=290,75).
Пример 8. Получение 6-(метилтио)-2-(3-метоксифенил)-4-хлор-2H-пиразоло[3,4-d] пиримидина (Iз).
В плоскодонную колбу емкостью 25 мл загружают 0,5 г (2,24 ммоль) 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида и 10 мл тетрагидрофурана, а затем добавляют 0,391 г (2,24 ммоль) м-метоксибензгидразида и 0,62 мл триэтиламина (4,48 ммоль). Реакционную смесь кипятят при активном перемешивании в течение 8 ч. Охлаждают, заливают 30 мл воды и перемешивают в течение 1 ч. В ходе перемешивания происходит перерождение осадка. В результате выпадает осадок желтого цвета. Смесь отфильтровывают и промывают небольшими порциями воды очищенной.
Выделенный продукт желтого цвета составляет 0,619 г, 90% от теоретического из расчета на 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида. Температура плавления 149-150°С. Хроматографическая однородность целевого продукта подтверждалась хроматографированием раствора его в системе метанол: дихлорметан (1:10) в системе. Rf=0,813. Состав синтезированного соединения подтвержден элементным анализом. Брутто-формула: C13H11ClN4OS. Найдено %: С - 50,87, Н - 3,60, N - 18,23, О - 5,21. Вычислено %: С - 50,90, Н - 3,61, N - 18,26, О - 5,22.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1Н и масс-спектрометрией.
В спектре ЯМР 1Н полученного соединения в ДМСО-d6 присутствуют сигналы протонов метальной группы (δ 2,59 с), метоксигруппы (δ 3,80 с), сигналы бензольного кольца: δ 6,79 д (1Н, Наром), δ 7,29-7,33 м (1Н, Наром), δ 7,43 с (1Н, Наром), δ 7,59 д (1Н, Наром), и сигнал протона пиразольного кольца δ 9,18 с. Также строение полученного вещества было доказано с помощью масс-спектрометрии. Рассчитанная молекулярная масса полностью совпала с экспериментально полученной (М+=306,74).
Пример 9. Получение 6-(метилтио)-2-(3-нитрофенил)-4-хлор-2H-пиразоло[3,4-d]пиримидина (Iи).
В круглодонную колбу емкостью 25 мл загружают 0,5 г (2,24 ммоль) 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида и 10 мл тетрагидрофурана, а затем добавляют 0,425 г (2,24 ммоль) м-нитрофенилгидразин гидрохлорида и 0,62 мл триэтиламина (4,48 ммоль). Реакционную смесь кипятят при активном перемешивании в течение 6 ч. Охлаждают, заливают 30 мл воды и перемешивают в течение 1 ч. В ходе перемешивания происходит перерождение осадка. В результате выпадает осадок белого цвета. Смесь отфильтровывают и промывают небольшими порциями воды очищенной.
Выделенный продукт белого цвета с бежевым оттенком составляет 0,469 г, 65% от теоретического из расчета на 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида. Температура плавления 215-217°С (с разложением). Хроматографическая однородность целевого продукта подтверждалась хроматографированием раствора его в системе метанол: дихлорметан (1:10) в системе. Rf=0,738. Состав синтезированного соединения подтвержден элементным анализом. Брутто-формула: C12H8ClN5O2S. Найдено %: С - 44,78, Н - 2,49, N - 21,75, О - 9,94. Вычислено %: С - 44,80, Н - 2,51, N - 21,77, О - 9,95.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1Н и масс-спектрометрией.
В спектре ЯМР 1Н полученного соединения в ДМСО-d6 присутствуют сигналы протонов метильной группы (δ 2,61 с), сигналы бензольного кольца: δ 7,90-7,94 т (1Н, Наром), δ 8,34 д (1Н, Наром), δ 8,61 д (1H, Наром), δ 8,95 с (1Н, Наром), и сигнал протона пиразольного кольца δ 9,80 с. Также строение полученного вещества было доказано с помощью масс-спектрометрии. Рассчитанная молекулярная масса полностью совпала с экспериментально полученной (М+=321,71).
Пример 10. Получение 2-(4-бромфенил)-6-(метилтио)-4-хлор-2H-пиразоло[3,4-d]пиримидина (Iк).
В круглодонную колбу емкостью 25 мл загружают 0,5 г (2,24 ммоль) 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида и 10 мл тетрагидрофурана, а затем добавляют 0,50 г (2,24 ммоль) п-бромфенилгидразин гидрохлорид и 0,62 мл триэтиламина (4,48 ммоль). Реакционную смесь кипятят при активном перемешивании в течение 8 ч. Охлаждают, заливают 30 мл воды и перемешивают в течение 3 ч. В ходе перемешивания происходит перерождение осадка. В результате выпадает осадок светло-желтого цвета. Смесь отфильтровывают и промывают небольшими порциями воды очищенной.
Выделенный продукт светло-желтого цвета составляет 0,494 г, 62% от теоретического из расчета на 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида. Температура плавления 195-196°С. Хроматографическая однородность целевого продукта подтверждалась хроматографированием раствора его в системе этилацетат: дихлорметан (1:6) в системе. Rf=0,542. Состав синтезированного соединения подтвержден элементным анализом. Брутто-формула: C13H8BrClN4OS. Найдено %: С - 40,62, Н - 2,03, N - 14,55, О - 4,12. Вычислено %: С - 40,70, Н - 2,10, N - 14,60, О - 4,17.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1Н и масс-спектрометрией.
В спектре ЯМР 1Н полученного соединения в ДМСО-d6 присутствуют сигналы протонов метильной группы (δ 2,60 с), сигналы бензольного кольца: δ 7,83 д (2Н, Наром), δ 8,11 д (2Н, Наром), и сигнал протона пиразольного кольца δ 9,58 с. Также строение полученного вещества было доказано с помощью масс-спектрометрии. Рассчитанная молекулярная масса полностью совпала с экспериментально полученной (M+=355,62).
Пример 11. Получение 6-(метилтио)-2-(4-метилфенил)-4-хлор-2H-пиразоло[3,4-d] пиримидина (Iл).
В круглодонную колбу емкостью 25 мл загружают 0,5 г (2,24 ммоль) 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида и 10 мл тетрагидрофурана, а затем добавляют 0,356 г (2,24 ммоль) п-метилфенилгидразин гидрохлорид и 0,62 мл триэтиламина (4,48 ммоль). Реакционную смесь кипятят при активном перемешивании в течение 6 ч. Охлаждают, заливают 30 мл воды и перемешивают в течение 1 ч. В ходе перемешивания происходит перерождение осадка. В результате выпадает осадок светло-желтого цвета. Смесь отфильтровывают и промывают небольшими порциями воды очищенной.
Выделенный продукт светло-желтого цвета составляет 0,586 г, 90% от теоретического из расчета на 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида. Температура плавления 120-122°С. Хроматографическая однородность целевого продукта подтверждалась хроматографированием раствора его в системе этилацетат: дихлорметан (1:6) в системе. Rf=0,643. Состав синтезированного соединения подтвержден элементным анализом. Брутто-формула: C13H11ClN4S. Найдено %: С - 53,69, Н - 3,79, N - 19,26. Вычислено %: С - 53,70, Н - 3,81, N - 19,27.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1Н и масс-спектрометрией.
В спектре ЯМР 1Н полученного соединения в ДМСО-d6 присутствуют сигналы протонов двух метальных групп (δ 2,38 с и δ 2,63 соответственно), сигналы бензольного кольца: δ 7,40 д (2Н, Наром), 8,00 д (2Н, Наром), и сигнал протона пиразольного кольца δ 8,58 с. Также строение полученного вещества было доказано с помощью масс-спектрометрии. Рассчитанная молекулярная масса полностью совпала с экспериментально полученной (М+=290,75).
Пример 12. Получение 6-(метилтио)- 2-(4-метоксифенил)-4-хлор-2H-пиразоло[3,4-d]пиримидина (Iм).
В круглодонную колбу емкостью 25 мл загружают 0,5 г (2,24 ммоль) 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида и 10 мл тетрагидрофурана, а затем добавляют 0,391 г (2,24 ммоль) п-метоксифенилгидразин гидрохлорид и 0,62 мл триэтиламина (4,48 ммоль). Реакционную смесь кипятят при активном перемешивании в течение 5 ч. Охлаждают, заливают 30 мл воды и перемешивают в течение 1 ч. В ходе перемешивания происходит перерождение осадка. В результате выпадает осадок светло-желтого цвета. Смесь отфильтровывают и промывают небольшими порциями воды очищенной.
Выделенный продукт светло-желтого цвета составляет 0,653 г, 92% от теоретического из расчета на 4,6-дихлор-2-(метилтио)пиримидин-5-карбальдегида. Температура разложения 137-140°С. Хроматографическая однородность целевого продукта подтверждалась хроматографированием раствора его в системе метанол: дихлорметан (1:10) в системе. Rf=0,746. Состав синтезированного соединения подтвержден элементным анализом. Брутто-формула: C13H11ClN4OS. Найдено %: С - 50,89, Н - 3,57, N - 18,24, О - 5,20. Вычислено %: С - 50,90, Н - 3,61, N - 18,26, О - 5,22.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1Н и масс-спектрометрией.
В спектре ЯМР 1Н полученного соединения в ДМСО-d6 присутствуют сигналы протонов метальной группы (δ 2,62 с), метоксигруппы (δ 3,84 с), сигналы бензольного кольца: δ 7,15 д (2Н, Наром), δ 8,01 д (2Н, Наром), и сигнал протона пиразольного кольца δ 8,56 с. Также строение полученного вещества было доказано с помощью масс-спектрометрии. Рассчитанная молекулярная масса полностью совпала с экспериментально полученной (М+=306,74).
Пример 13. Соединения (Ia-м) обладают противомикробной активностью. Определение минимально ингибирующих концентраций (МИК) проводили методом серийных разведений в мясопептонном бульоне в отношении тест-культур микроорганизмов Staphylococcus aureus (штамм 209-Р), Escherichia coli (штамм 1257), Candida albicans (штамм АТСС 885-635), рекомендованных Государственной Фармакопеей [Государственная Фармакопея СССР. Вып. 2. Общие методы анализа. Лекарственное растительное сырье / МЗ СССР - 11 изд. доп. - М.: Медицина, 1989. 400 с.]. Исследуемые соединения ограниченно растворяются в воде, поэтому в качестве растворителя использовали 20% раствор ДМСО, не подавляющий роста ни одной из использованных тест-культур в условиях эксперимента. Минимальная ингибирующая концентрация соединения Ia на Е. coli и С. albicans составляет 62,5 и 250 мкг/мл соответственно, а на St. aureus составляет 62,5 мкг/мл, соединения Iб на Е. coli и С. albicans составляет 32 и 125 мкг/мл соответственно, а на St. aureus составляет 16 мкг/мл, соединения Iв на Е. coli и С. albicans составляет 32 и 125 мкг/мл соответственно, а на St. aureus составляет 62,5 мкг/мл, соединения Iг на Е. coli и С. albicans составляет 62,5 и 250 мкг/мл соответственно, а на St. aureus составляет 16 мкг/мл, соединения Iд на Е. coli и С. albicans составляет 62,5 и 125 мкг/мл соответственно, а на St. aureus составляет 16 мкг/мл, соединения Iе на Е. coli и С. albicans составляет 16 и 125 мкг/мл соответственно, а на St. aureus составляет 32 мкг/мл, соединения Iж на Е. coli и С. albicans составляет 32 и 250 мкг/мл соответственно, а на St. aureus составляет 62,5 мкг/мл, соединения 1з на Е. coli и С. albicans составляет 16 и 125 мкг/мл соответственно, а на St. aureus составляет 32 мкг/мл, соединения Iи на Е. coli и С. albicans составляет 32 и 125 мкг/мл соответственно, а на St. aureus составляет 62,5 мкг/мл, соединения Iк на Е. coli и С. albicans составляет 16 и 62,5 мкг/мл соответственно, а на St. aureus составляет 62,5 мкг/мл, соединения Iл на Е. coli и С. albicans составляет 32 и 125 мкг/мл соответственно, а на St. aureus составляет 16 мкг/мл, соединения Iм на Е. coli и С. albicans составляет 16 и 125 мкг/мл соответственно, а на St. aureus составляет 32 мкг/мл, что находится на уровне широко используемого на практике антибиотика (офлоксацин - 16 мкг/мл).
Полученные новые соединения - 2-арил-6-(метилтио)-4-хлор-2H-пиразоло[3,4-d]пиримидины (Ia-м) могут быть использованы для синтеза новых гетероциклических соединений и в медицине в качестве потенциального антимикробного средства; разработан простой способ их синтеза.
![2-Арил-6-(метилтио)-4-хлор-2H-пиразоло[3,4-d]пиримидины и способ их получения](https://fips.edrid.ru/images/rid/96/13/e4/e42a272a898ddadc221e1992636d998d.jpg)
![2-Арил-6-(метилтио)-4-хлор-2H-пиразоло[3,4-d]пиримидины и способ их получения](https://fips.edrid.ru/images/rid/96/13/e4/c178bc04931994fb52f6cd8ae32da4fd.jpg)
![2-Арил-6-(метилтио)-4-хлор-2H-пиразоло[3,4-d]пиримидины и способ их получения](https://fips.edrid.ru/images/rid/96/13/e4/2d77a9370eefcc4e3947f7c0dd3cc7a2.jpg)
![2-Арил-6-(метилтио)-4-хлор-2H-пиразоло[3,4-d]пиримидины и способ их получения](https://fips.edrid.ru/images/rid/96/13/e4/f79dc421c3ddce8072836f7b7c3ec00a.jpg)

