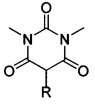
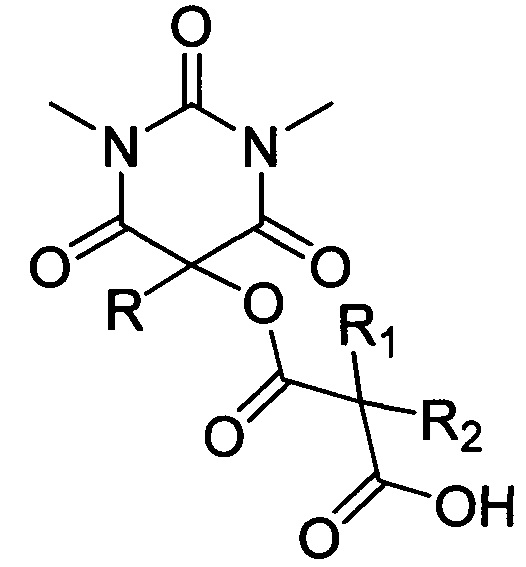
Способ получения ацилоксизамещенных барбитуровых кислот
Вид РИД
Изобретение
Настоящее изобретение относится к области химии гетероциклических соединений, производных барбитуровой кислоты, а именно, к способу получения ацилоксизамещенных в пятое положение 1,3-диметил-2,4,6-тригидроксипиримидинов, которые могут найти применение в медицинской химии и фармакологии.
Химия гетероциклических соединений одна из самых востребованных областей органической химии, поскольку является источником соединений, обладающих широким спектром биологической активности. Одними из азотсодержащих гетероциклов, получивших широкое применение в медицине, являются барбитураты. Представители этого класса присутствуют на фармакологическом рынке, как быстродействующие средства для срочной анестезии, а также для снятия судорог и предотвращения эпилептических приступов [Р.Я. Левина, Ф.К. Величко, Успехи химии барбитуровых кислот, Успехи химии, 1960, Том 29, 8, С.929-971.]. Наличие высокой биологической активности способствует поддержанию интереса к этому классу соединений и стимулирует поиск эффективных и одновременно безопасных производных барбитуровой кислоты.
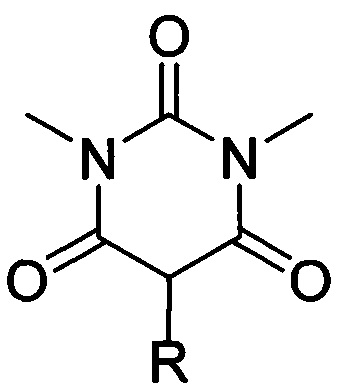
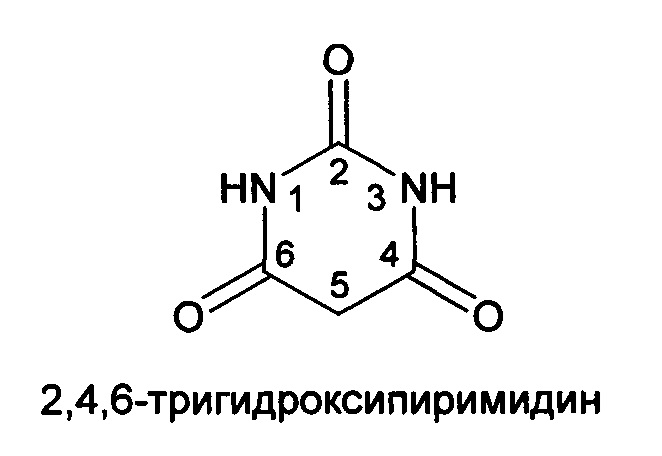
В барбитуратах, представленных на фармацевтическом рынке, фармакофорным фрагментом является 2,4,6-тригидроксипиримидин (2,4,6-пиримидинтрион) [ Sans R,
Sans R,  Chozas М. Historical aspects and applications of barbituric acid derivatives. A review. Pharmazie. 1988, 43(12), 827-829. PMID: 3073393.] формулы:
Chozas М. Historical aspects and applications of barbituric acid derivatives. A review. Pharmazie. 1988, 43(12), 827-829. PMID: 3073393.] формулы:
Заместители в 1, 3 и 5 положениях могут варьироваться в широких пределах без потери активности, что подтверждается разнообразием действующих веществ, коммерчески доступных барбитуратов.
Распространенной модификацией барбитуровой кислоты является введение различного рода заместителей в 5 положение. Известно большое количество представителей класса барбитуровых кислот, коммерчески доступных, где в 5 положение присутствует один, или чаще два заместителя, которые вводятся в целевую молекулу до стадии сборки гетероциклического фрагмента - фенобарбитал [Michelucci, R., Pasini, Е. and Tassinari, С.А. (2009) Phenobarbital, Primidone and Other Barbiturates, in The Treatment of Epilepsy, Third Edition (eds S. Shorvon, E. Perucca and J. Engel), Wiley-Blackwell, Oxford, UK. doi: 10.1002/9781444316667.ch46], пентобарбитал, амобарбитал, буталбитал, секобарбитал и другие. [Barceloux, D. G. (2012) Barbiturates: (Amobarbital, Butalbital, Pentobarbital, Secobarbital), in Medical Toxicology of Drug Abuse: Synthesized Chemicals and Psychoactive Plants, John Wiley & Sons, Inc., Hoboken, NJ, USA. doi: 10.1002/9781118105955.ch23; Shorvon, S. (2010) The Antiepileptic Drugs, in Handbook of Epilepsy Treatment, Third Edition, Wiley-Blackwell, Oxford, UK. doi: 10.1002/9781444325201.ch8].
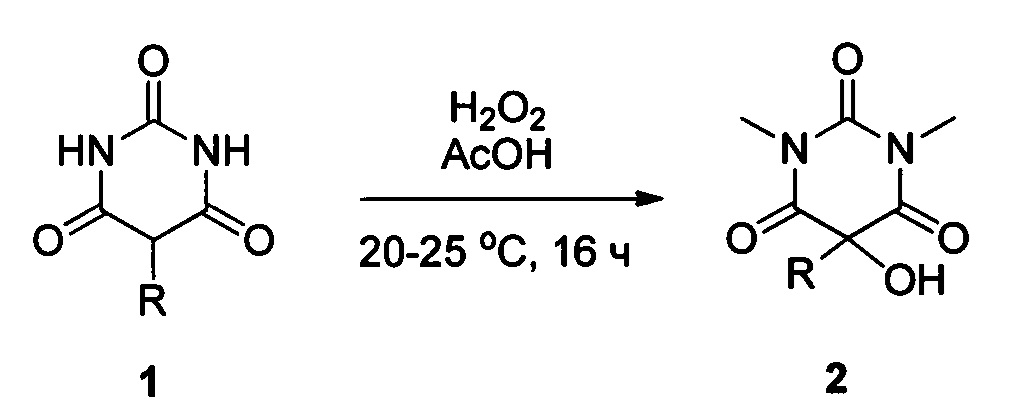
Некоторые коммерчески доступные барбитураты:
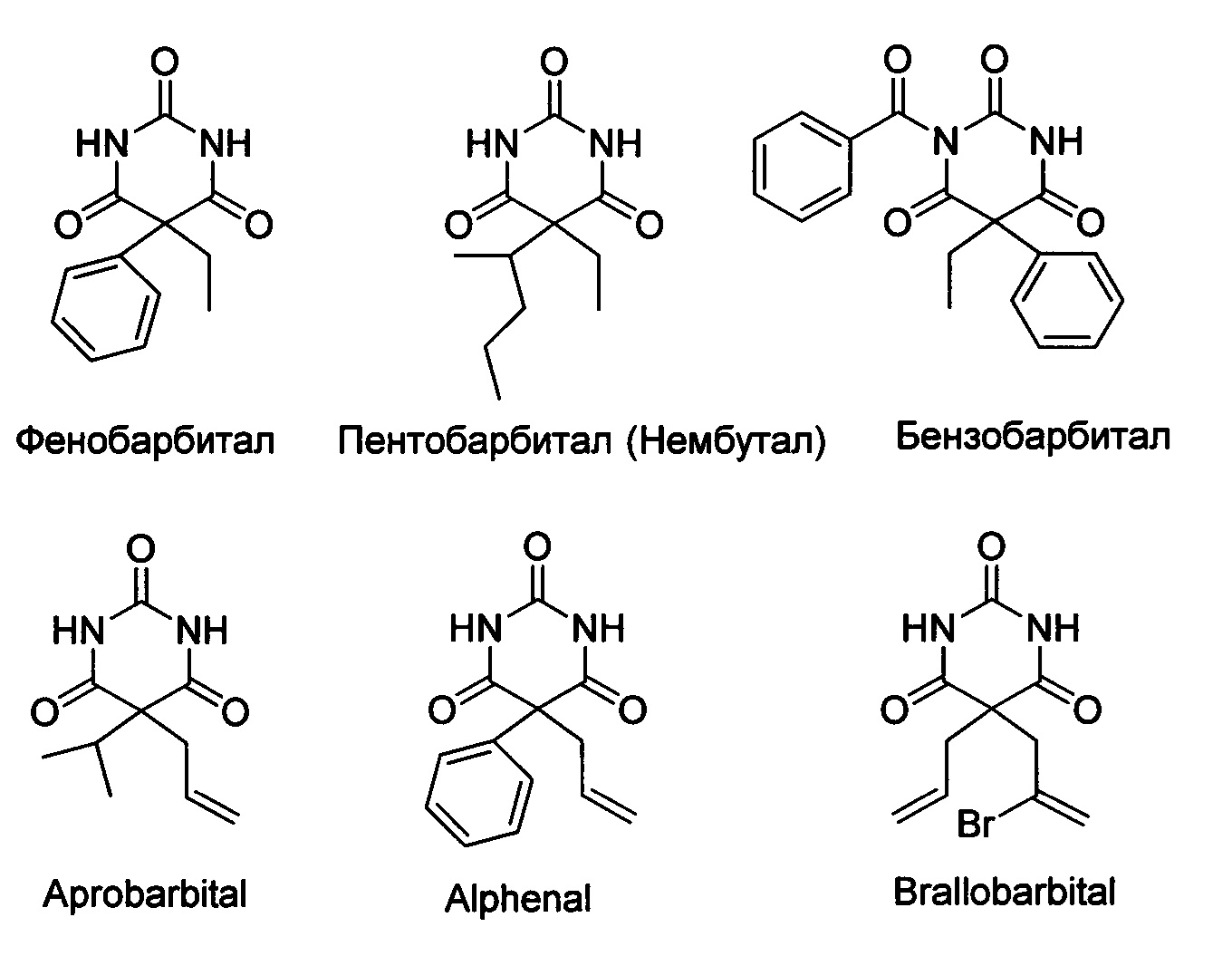
Непосредственное же введение в 5 положение различных О-заместителей представляется трудной задачей ввиду отсутствия химических способов, позволяющих проводить подобное превращение. Более того, анализ научно-технической и патентной литературы за последние сто лет демонстрирует, что среди свыше двух тысяч различных соединений класса барбитуратов, известны лишь единичные примеры с О-заместителями в 5 положении. Известен способ получения 5-гидроксизамещенных барбитуровых кислот 2, где R=фенил, замещенный или незамещенный бензил [Julius A. Vida, Carlos М. Samour, Mary Н. O'Dea, Theodore S. Т. Wang, William R. Wilber, John F. Reinhard, Analgesics. 1. Selected 5-substituted 5-propionoxybarbituric acids, J. Med. Chem., 1974, 17(7), 732-736]. Согласно этому способу исходную монозамещенную в 5-ом положении барбитуровую кислоту 1 с различными заместителями R, такими как фенил, замещенный или незамещенный бензил (1 ммоль) добавляют к смеси 30% водного раствора пероксида водорода (3.7 ммоль) и уксусной кислоты (0.4 мл), по завершении реакции выделяют 5-гидроксибарбитуровую кислоту 2 с различными заместителями R в 5-ом положении, такими как фенил, замещенный или незамещенный бензил с выходом от 66 до 83%. Известный способ позволяет получать только гидроксипродукт с умеренным выходом. Процесс протекает по следующей схеме:
Известен трехстадийный способ получения 5-н-гексаноилокси-5-(1-фенилэтил)барбитуровой кислоты, путем взаимодействия на первой стадии 5-(1-фенилэтил)барбитуровой кислоты с трет-бутилгидропероксидом с образованием 5-трет-бутилперокси-5-(1-фенилэтил)барбитуровой кислоты, которая в дальнейшем переводится в 5-н-гексаноилокси-5-(1-фенилэтил)барбитуровую кислоту. [Julius A. Vida, Carlos М. Samour, Mary Н. O'Dea, Theodore S. Т. Wang, John F. Reinhard, Analgesics. 2. Selected 5-substituted 5-(1-phenylethyl)barbituric acids. J. Med. Chem., 1974, 17 (11), 1194-1197] Согласно этому способу исходную 5-(1-фенилэтил)барбитуровую кислоту (1 ммоль) добавляют к смеси трет-бутилгидропероксида (10 ммоль) и ацетата меди (0.012 ммоль), по завершении реакции выделяют 5-трет-бутилперокси-5-(1-фенилэтил)барбитуровую кислоту с выходом 55%. Далее 5-трет-бутилперокси-5-(1-фенилэтил)барбитуровую кислоту (1 ммоль) обрабатывают боргидридом натрия (16.8 ммоль) с образованием 5-гидрокси-5-(1-фенилэтил)барбитуровой кислоты с выходом 45.6%. Полученную 5-гидрокси-5-(1-фенилэтил)барбитуровую кислоту обрабатывают хлорангидридом гексановой кислоты в присутствии пиридина с образованием 5-н-гексаноилокси-5-(1-фенилэтил)барбитуровой кислоты с выходом 23%.
Недостатком способа является проведение процесса в три последовательные стадии с умеренным выходом на каждой стадии, что увеличивает стоимость и значительно снижает выход целевого продукта. Также, известный способ пригоден только для получения гексаноилокси-производных барбитуровой кислоты.
Известен двухстадийный способ получения 5-ацилоксизамещенных барбитуровых кислот, принятый за прототип, путем взаимодействия на первой стадии монозамещенной в 5-ом положении барбитуровой кислоты с различными заместителями R, такими как фенил, замещенный или незамещенный бензил с пероксидом водорода с образованием 5-гидроксибарбитуровой кислоты с различными заместителями в 5-ом положении, которая на второй стадии обрабатывается карбоновой кислотой. [Julius A. Vida, Carlos М. Samour, Mary Н. O'Dea, Theodore S. Т. Wang, William R. Wilber, John F. Reinhard, Analgesics. 1. Selected 5-substituted 5-propionoxybarbituric acids, J. Med. Chem., 1974, 17(7), 732-736] Согласно этому способу исходную монозамещенную в 5-ом положении барбитуровую кислоту с различными заместителями R, такими как фенил, замещенный или незамещенный бензил (1 ммоль) добавляют к смеси 30% водного раствора пероксида водорода (3.7 ммоль) и уксусной кислоты (0.4 мл), по завершении реакции выделяют 5-гидроксибарбитуровую кислоту с различными заместителями в 5-ом положении, такими как фенил, замещенный или незамещенный бензил с выходом от 66 до 83%. Далее 5-гидроксибарбитуровую кислоту (1 ммоль) обрабатывают серной кислотой (0.380 мл) и карбоновой кислотой, где R1=Et (2 мл) с образованием 5-ацилокси производных барбитуровой кислоты 3 с выходом от 43 до 69%. Процесс протекает по следующей схеме:
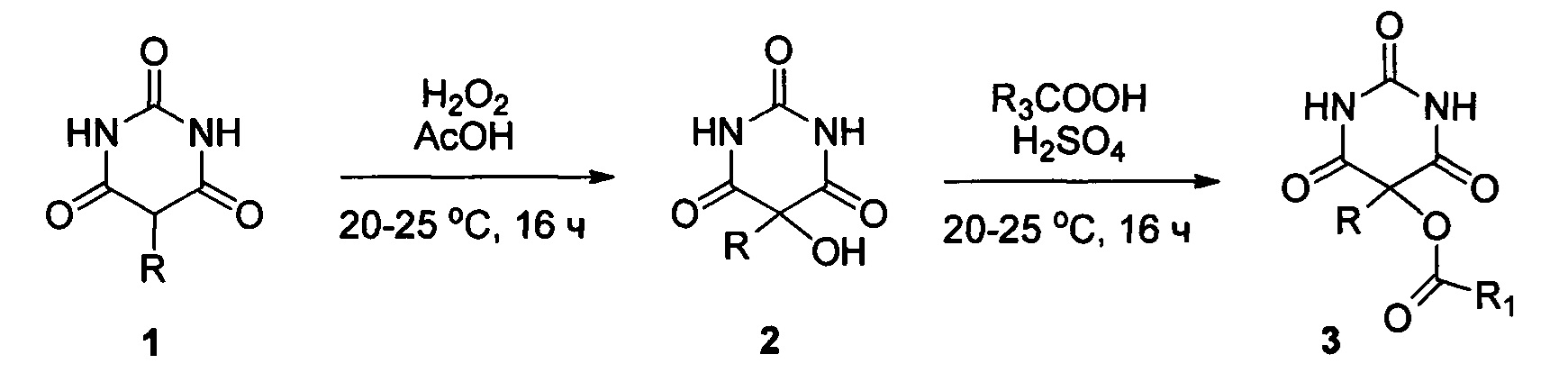
Недостатком способа является проведение процесса в две последовательные стадии, что увеличивает стоимость и значительно снижает выход целевого продукта. Кроме этого, и это основное, известным способом невозможно получить соединения, содержащие дополнительные функциональные группы в ацилоксизаместителе.
Введение фрагментов свободных карбоновых кислот является распространенным способом повышения растворимости действующего лекарственного вещества в воде, что, в свою очередь, повышает биодоступность препарата.
Технической задачей настоящего изобретения создание способа, позволяющего получать в одну стадию с высоким выходом новые неописанные в литературе производные барбитуровой кислоты, способные к дальнейшей модификации и обладающие при этом достаточно высокой водорастворимостью.
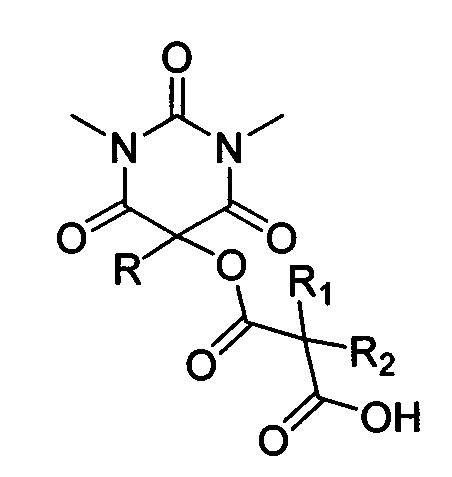
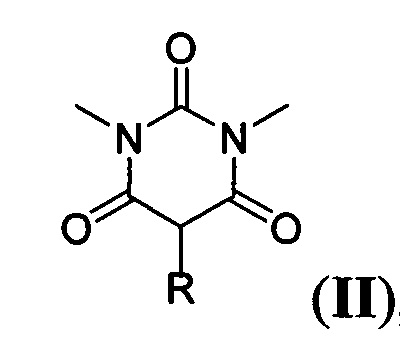
Поставленная техническая задача достигается предлагаемым способом получения новых ацилоксизамещенных барбитуровых кислот в пятом положении, а именно, к ацилоксизамещенным 1,3-диметил-2,4,6-тригидроксипиримидинам общей формулы:
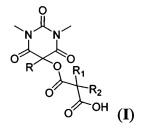 ,
,
где R=фенил, замещенный или незамещенный бензил; R1 и R2=Et либо R1+R2=(СН2)2, (СН2)3 или (СН2)4, путем взаимодействия соответствующих 1,3-диметил-2,4,6-тригидроксипиримидинов общей формулы:
 ,
,
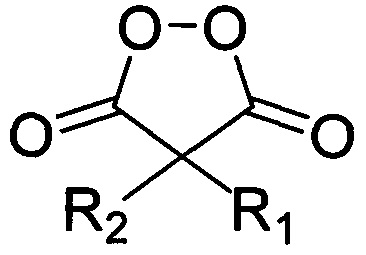
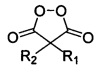
где R имеет вышеуказанные значения, с соответствующими малонил пероксидами общей формулы:
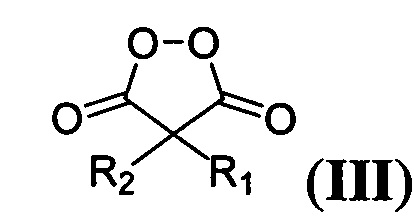 ,
,
где R1 и R2 имеют вышеуказанные значения, в присутствии трифторэтанола или гексафторизопропанола, и процесс проводят при мольном соотношении 1,3-диметил-2,4,6-тригидроксипиримидин : малонил пероксид : трифторэтанол или гексафторизопропанол 1 : 1,1 : 19-28.
Процесс проводят при комнатной температуре (20-25°C) в течение 6-24 часов по следующей схеме:
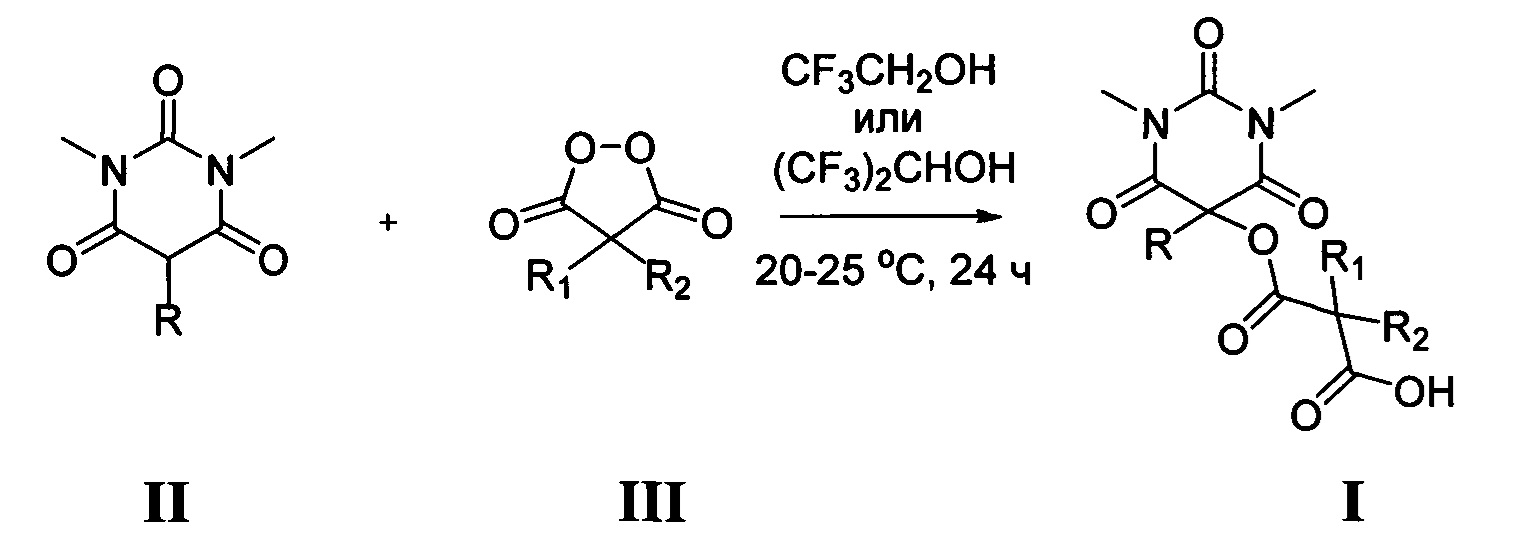
Проведение процесса в присутствии трифторэтанола или гексафторизопропанола и указанные соотношения реагентов позволяют получать целевые продукты с выходом до 90%. Трифторэтанол или гексафторизопропанол играют одновременно роль как катализатора, так и растворителя.
Использование малонил пероксида одновременно в качестве окислителя и реагента позволяет обеспечить селективность окислительного процесса и избежать образование отходов в реакции (абсолютную атом-экономичность). Предлагаемые новые соединения имеют достаточно высокую водорастворимость для применения в фармацевтике [a) Serajuddin, А.Т. М., Solid dispersion of poorly water-soluble drugs: Early promises, subsequent problems, and recent breakthroughs. J. Pharm. Sci, 1999, 88: 1058-1066. doi: 10.1021/js9804031. b) Colin W. Pouton, Formulation of poorly water-soluble drugs for oral administration: Physicochemical and physiological issues and the lipid formulation classification system, European Journal of Pharmaceutical Sciences, 2006, 29, 3, 278-287. c) Chau Le-Ngoc Vo, Chulhun Park, Beom-Jin Lee, Current trends and future perspectives of solid dispersions containing poorly water-soluble drugs, European Journal of Pharmaceutics and Biopharmaceutics, 2013, 85, 3, 799-813.]
Техническим результатом предлагаемого способа является получение новых, неописанных в литературе, ацилоксипроизводных барбитуровой кислоты, а именно, ацилоксизамещенных в пятом положении 1,3-диметил-2,4,6-тригидроксипиримидинов, в одну стадию с высоким выходом от 81 до 90%. При этом введение функциональных заместителей в 5 положение открывает возможность для дальнейшей их модификации, а также позволяет достигнуть высокой растворимости их в воде, а, следовательно, достаточной биодоступности, так как введение фрагментов свободных карбоновых кислот является распространенным способом повышения растворимости действующего лекарственного вещества в воде.
Изобретение соответствует критерию «новизна», так как в известной научно-технической и патентной литературе отсутствует полная совокупность признаков, характеризующих предлагаемое изобретение. Предлагаемое изобретение соответствует критерию «изобретательский уровень», так как до настоящего времени система малонил пероксид - фторированный спирт не использовалась в реакциях ацилоксилирования 1,3-диметил-2,4,6-тригидроксипиримидинов. Кроме того, до настоящего времени не проводилась одностадийное введение ацилокси-фрагментов в пятое положение 1,3-диметил-2,4,6-тригидроксипиримидинов. Именно предложенный растворитель-катализатор (трифторэтанол или гексафторизопропанол) и малонил пероксид, как окислитель и реагент одновременно, позволяют получать ацилоксизамещенные в пятом положении 1,3-диметил-2,4,6-тригидроксипиримидины.
Изначально неочевидной была возможность проведения одностадийного окислительного введения ацилокси-фрагмента в пятое положение 1,3-диметил-2,4,6-тригидроксипиримидинов, так как из литературы известно, что органические пероксиды в реакциях окисления традиционно переносят только активный кислород, а не выступают в роли второго реагента [а) Nicholas A. Milas, Douglas М. Surgenor, Studies in Organic Peroxides. VIII. t-Butyl Hydroperoxide and Di-t-butyl Peroxide. J. Am. Chem. Soc, 1946, 68 (2), 205-208. b) Mimoun, H., Oxygen Transfer from Inorganic and Organic Peroxides to Organic Substrates: A Common Mechanism?. Angew. Chem. Int. Ed. 1982, 21, 734-750. c) Yaremenko, I. A.; Vil', V.A.; Demchuk, D. V.; Terent'ev, A. O. Rearrangements of organic peroxides and related processes. Beilstein J. Org. Chem. 2016, 12, 1647-1748.] В условиях данного изобретения О-функционализированные в пятое положение 1,3-диметил-2,4,6-тригидроксипиримидины получены с выходом до 90% при использовании малонил пероксидов одновременно в роли окислителя и реагента.
Неочевидной являлась возможность использования трифторэтанола или гексафторизопропанола одновременно в качестве растворителя и катализатора, поскольку номенклатура растворителей очень широка и каждый, тем более фторированный растворитель имеет свою специфику и реакционную способность.
Изобретение соответствует условию «промышленная применимость», так как ацилоксизамещенные в пятом положении 1,3-диметил-2,4,6-тригидроксипиримидины, содержащие свободную карбоксильную группу, могут найти применение в медицинской химии и фармакологии для получения лекарственных препаратов, так как в своей молекуле предлагаемые соединения одновременно содержат фармакофорный фрагмент барбитуровой кислоты - 2,4,6-тригидроксипиримидин (2,4,6-пиримидинтрион), а также свободную карбоксильную группу, отвечающую как за возможность дальнейшей модификации, так и достаточно высокую водорастворимость, и, следовательно, хорошую биодоступность.
Изобретение иллюстрируется следующими примерами, не ограничивающими его объем.
Пример 1
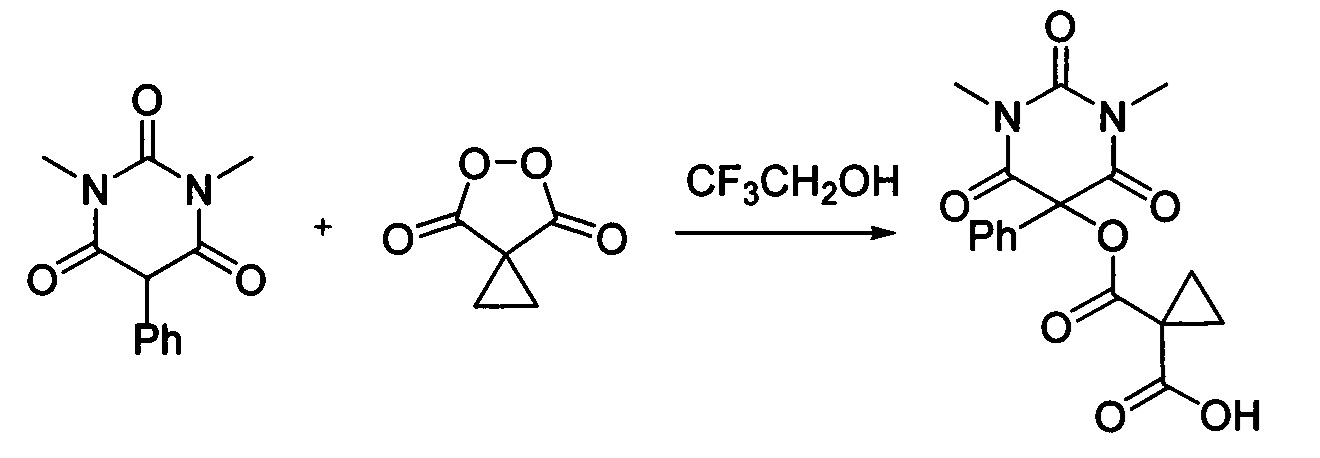
Циклопропил малонил пероксид (140.9 мг, 1.10 ммоль) добавляли при перемешивании к раствору 1,3-диметил-5-фенилбарбитуровой кислоты (232.2 мг, 1.00 ммоль) в CF3CH2OH (2 мл). Смесь перемешивали при 20-25°С в течение 24 часов. Растворитель упаривали в вакууме водоструйного насоса. Продукт выделяли хроматографией на SiO2 с использованием элюента CH2Cl2-EtOAc с увеличением доли EtOAc от 5 до 50 объемных процентов. Получали 1-(((1,3-диметил-2,4,6-триоксо-5-фенилгексагидропиримидин-5-ил)окси)карбонил)циклопропан-1-карбоновую кислоту, выход: 85% (306.3 мг, 0.85 ммоль), белый порошок, т.пл. 133-135°С. Rf=0.70 (РЕ:EtOAc=2:1+2% АсОН).
1Н ЯМР (300 МГц, CDCl3) δ 9.55 (br.s, 1Н), 7.47-7.37 (m, 3Н), 7.33 (d, J=6.9 Гц, 2H), 3.36 (s, 6H), 2.01 (dd, J=7.8, 4.1 Гц, 2H), 1.92 (dd, J=7.8, 4.1 Гц, 2H).
13C ЯМР (75 МГц, CDCl3) δ 173.4, 170.8, 165.8, 150.2, 131.4, 131.0, 129.6, 126.2, 80.3, 29.5, 26.0, 22.4.
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C17H16N2NaO7]+: 383.0850. Найдено: 383.0849.
Вычислено для C17H16N2O7C: 56.67%, Н: 4.48%, N: 7.77%. Найдено С: 56.59%, Н: 4.53%, N: 7.63%.
ИК (KBr): 3271, 2917, 2599, 1750, 1705, 1693, 1678, 1447, 1376, 1290, 1175, 1140, 1121, 1049, 752,714, 690,511 cm-1.
Пример 2
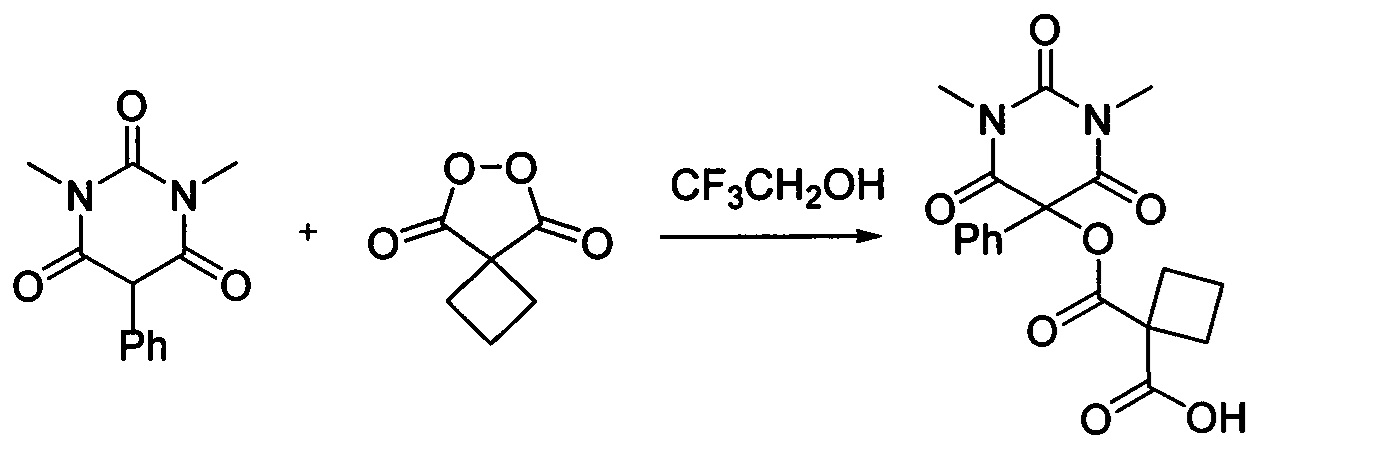
Циклобутил малонил пероксид (156.3 мг, 1.10 ммоль) добавляли при перемешивании к раствору 1,3-диметил-5-фенилбарбитуровой кислоты (232.2 мг, 1.00 ммоль) в CF3CH2OH (2 мл). Смесь перемешивали при 20-25°C в течение 24 часов. Растворитель упаривали в вакууме водоструйного насоса. Продукт выделяли хроматографией на SiO2 с использованием элюента CH2Cl2-EtOAc с увеличением доли EtOAc от 5 до 50 объемных процентов. Получали 1-(((1,3-диметил-2,4,6-триоксо-5-фенилгексагидропиримидин-5-ил)окси)карбонил)циклобутан-1-карбоновую кислоту, выход: 90% (336.9 мг, 0.90 ммоль), белый порошок, т. пл. 135-137°C. Rf=0.33 (РЕ:EtOAc=2:1+2% АсОН).
1Н ЯМР (300 МГц, CDCl3) δ 9.35 (br.s, 1Н), 7.41-7.29 (m, 5Н), 3.37 (s, 6Н), 2.83-2.60 (m, 4Н), 2.13-2.01 (m, 2Н).
13С ЯМР (75 МГц, CDCl3) δ 171.31, 171.30, 166.2, 150.5, 132.0, 130.6, 129.5, 126.1,79.8, 29.5,28.9, 16.4.
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C18H18N2NaO7]+: 397.1006. Найдено: 397.1005.
Вычислено для C18H18N2O7C: 57.75%, Н: 4.85%, N: 7.48%. Найдено С: 57.67%, Н: 4.76%, N: 7.25%.
ИК (KBr): 3172, 2959, 1733, 1708, 1687, 1662, 1447, 1373, 1289, 1133, 1047, 759, 687 cm-1.
Пример 3
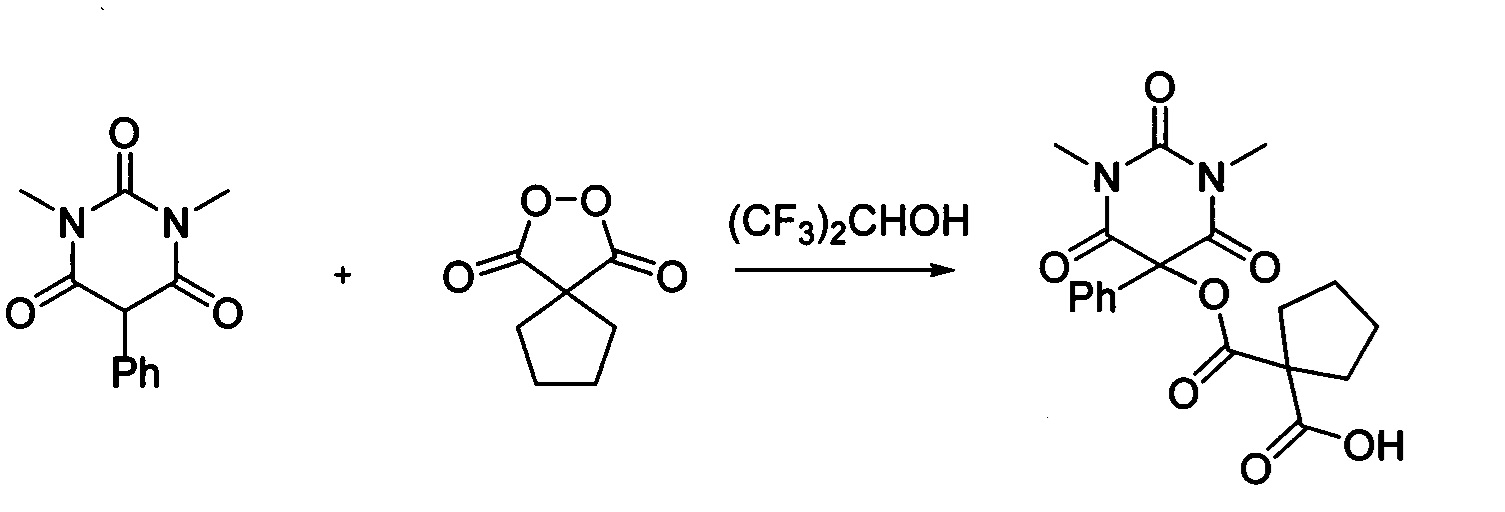
Циклопентил малонил пероксид (171.6 мг, 1.10 ммоль) добавляли при перемешивании к раствору 1,3-диметил-5-фенилбарбитуровой кислоты (232.2 мг, 1.00 ммоль) в (CF3)2СНОН (2 мл). Смесь перемешивали при 20-25°C в течение 24 часов. Растворитель упаривали в вакууме водоструйного насоса. Продукт выделяли хроматографией на SiO2 с использованием элюента CH2Cl2-EtOAc с увеличением доли EtOAc от 5 до 50 объемных процентов. Получали 1-(((1,3-диметил-2,4,6-триоксо-5-фенилгексагидропиримидин-5-ил)окси)карбонил) циклопентан-1-карбоновую кислоту, выход: 82% (318.5 мг, 0.82 ммоль), белый порошок, т. пл. 129-130°C. Rf=0.48 (РЕ:EtOAc=2:1+2% АсОН).
1H ЯМР (300 МГц, CDCl3) δ 7.42-7.34 (m, 5Н), 3.36 (s, 6Н), 2.47-2.24 (m, 4Н), 1.81-1.70 (m, 4Н).
13С ЯМР (75 МГц, CDCl3) δ 175.3, 172.4, 166.2, 150.6, 132.3, 130.6, 129.5, 126.1, 79.9, 59.8, 34.9, 29.4, 25.7.
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C19H20N2NaO7]+: 411.1163. Найдено: 411.1152.
Вычислено для C19H20N2O7 С: 58.76%, Н: 5.19%, N: 7.21%. Найдено С: 58.63%, Н: 5.08%, N: 7.14%.
Пример 4
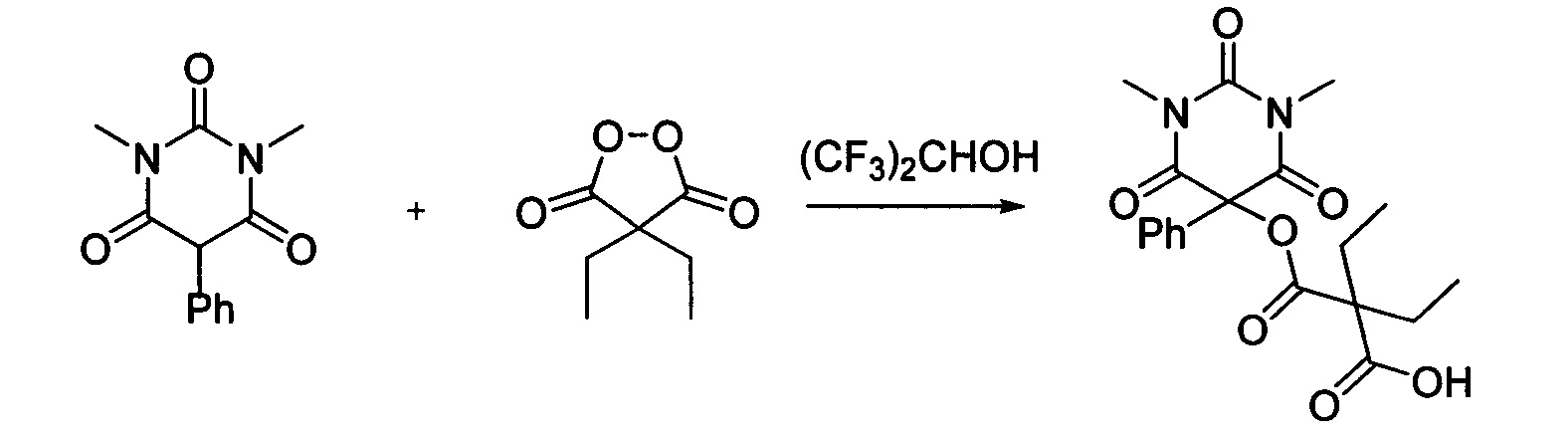
Диэтил малонил пероксид (173.8 мг, 1.10 ммоль) добавляли при перемешивании к раствору 1,3-диметил-5-фенилбарбитуровой кислоты (232.2 мг, 1.00 ммоль) в (CF3)2CHOH (2 мл). Смесь перемешивали при 20-25°C в течение 24 часов. Растворитель упаривали в вакууме водоструйного насоса. Продукт выделяли хроматографией на SiO2 с использованием элюента CH2Cl2-EtOAc с увеличением доли EtOAc от 5 до 50 объемных процентов. Получали 2-(((1,3-диметил-2,4,6-триоксо-5-фенилгексагидропиримидин-5-ил)окси)карбонил)-2-этилбутановую кислоту, выход: 77% (300.6 мг, 0.77 ммоль), белый порошок, т. пл. 109-110°C. Rf=0.66 (РЕ:EtOAc=2:1+2% АсОН).
1Н ЯМР (300 МГц, CDCl3) δ 9.91 (br.s, 1Н), 7.44-7.34 (m, 5Н), 3.35 (s, 6Н), 2.08 (q, J=7.4 Гц, 4Н), 0.96 (t, J=7.5 Гц, 6Н).
13С ЯМР (75 МГц, CDCl3) δ 174.6, 172.5, 166.1, 150.5, 132.2, 130.6, 129.5, 126.1, 79.8, 58.5, 29.5, 26.4, 8.5.
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C19H22N2NaO7]+: 413.1319. Найдено: 413.1317.
Вычислено для C19H22N2O7C: 58.46%, Н: 5.68%, N: 7.18%. Найдено С: 58.84%, Н:5.75%, N: 7.08%.
Пример 5
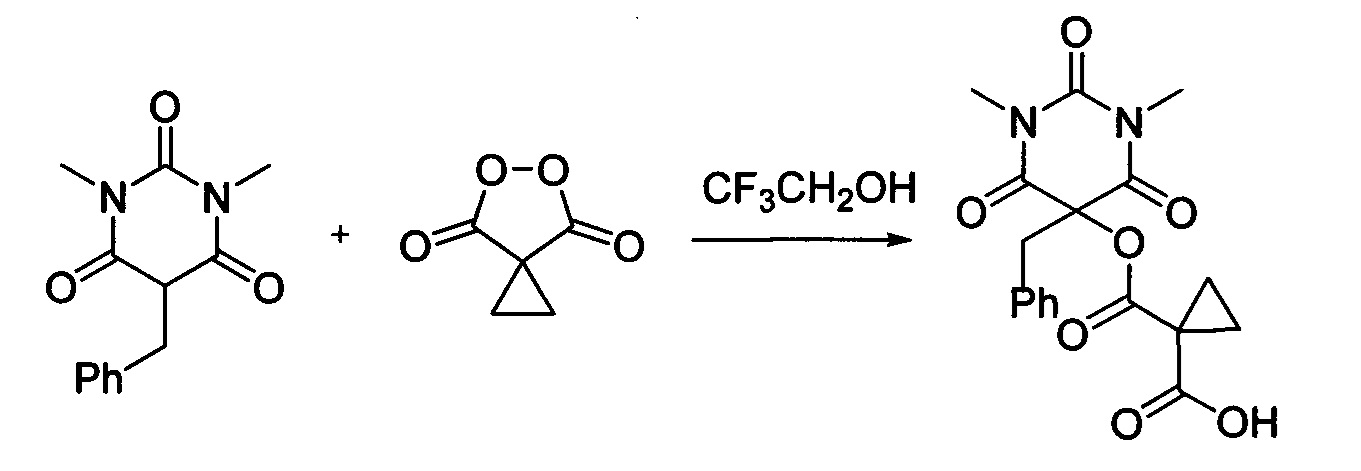
Циклопропил малонил пероксид (140.9 мг, 1.10 ммоль) добавляли при перемешивании к раствору 1,3-диметил-5-бензилбарбитуровой кислоты (246.2 мг, 1.00 ммоль) в CF3CH2OH (2 мл). Смесь перемешивали при 20-25°C в течение 24 часов. Растворитель упаривали в вакууме водоструйного насоса. Продукт выделяли хроматографией на SiO2 с использованием элюента CH2Cl2-EtOAc c с увеличением доли EtOAc от 5 до 50 объемных процентов. Получали 1-(((5-бензил-1,3-диметил-2,4,6-триоксогексагидропиримидин-5-ил)окси)карбонил)циклопропан-1-карбоновую кислоту, выход: 78% (292.0 мг, 0.78 ммоль), белый порошок, т.пл. 136-138°C. Rf=0.29 (РЕ:EtOAc=2:1+2% АсОН).
1H ЯМР (300 МГц, CDCl3) δ 10.20 (br.s, 1Н), 7.34-7.22 (m, 3Н), 6.96-6.90 (m, 2Н), 3.34 (s, 2Н), 3.07 (s, 6Н), 2.01 (dd, J=7.7, 4.1 Гц, 2Н), 1.92 (dd, J=7.7, 3.8 Гц, 2Н).
13С ЯМР (75 МГц, CDCl3) δ 173.1, 170.6, 166.5, 149.4, 129.8, 129.4, 129.1, 128.9, 79.3, 43.9, 28.7, 25.8, 22.5.
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C18H18N2NaO7]+: 397.1006. Найдено: 397.0999.
Вычислено для C18H18N2O7C: 57.75%, Н: 4.85%, N: 7.48%. Найдено С: 57.74%, Н: 4.51%, N: 7.36%.
ИК (KBr): 3195, 2582, 1741, 1726, 1702, 1666, 1445, 1398, 1311, 1271, 1193, 1181, 1170, 1112, 1047, 976, 836, 778, 753, 742, 704, 504 cm-1.
Пример 6
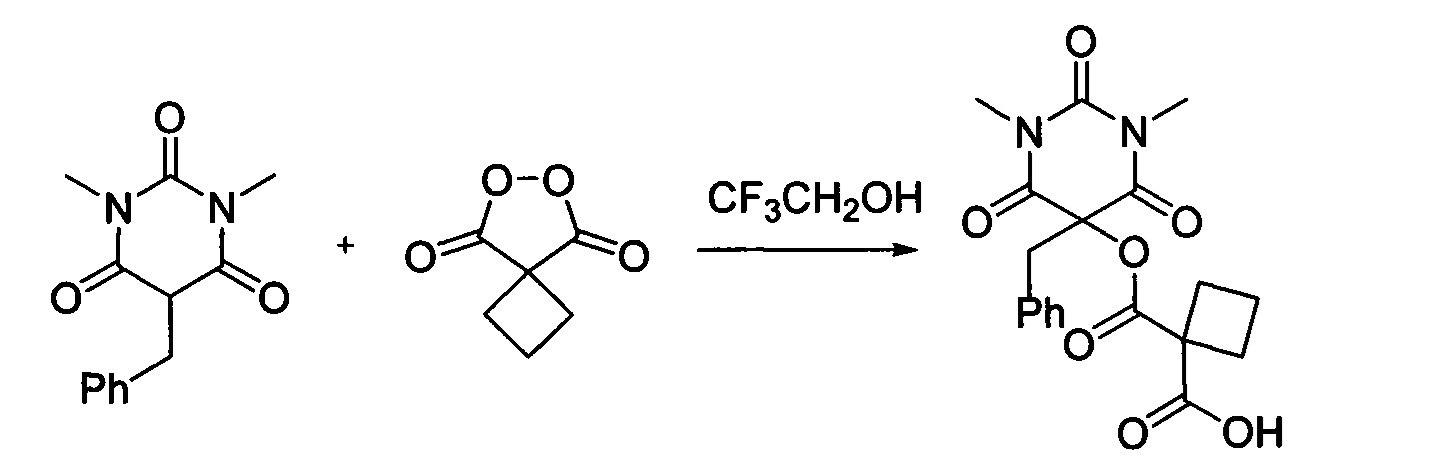
Циклобутил малонил пероксид (156.3 мг, 1.10 ммоль) добавляли при перемешивании к раствору 1,3-диметил-5-бензилбарбитуровой кислоты (246.2 мг, 1.00 ммоль) в CF3CH2OH (2 мл). Смесь перемешивали при 20-25°C в течение 24 часов. Растворитель упаривали в вакууме водоструйного насоса. Продукт выделяли хроматографией на SiO2 с использованием элюента CH2Cl2-EtOAc с увеличением доли EtAOc от 5 до 50 объемных процентов. Получали 1-(((5-бензил-1,3-диметил-2,4,6-триоксогексагидропиримидин-5-ил)окси)карбонил)циклобутан-1-карбоновую кислоту, выход: 69% (268.0 мг, 0.69 ммоль), белый порошок, т. пл. 134-135°C. Rf=0.56 (РЕ:EtOAc=2:1+2% АсОН).
1Н ЯМР (300 МГц, CDCl3) δ 10.80 (br.s, 1Н), 7.31-7.23 (m, 3Н), 7.02-6.95 (m, 2Н), 3.45 (s, 2Н), 3.09 (s, 6Н), 2.69 (t, J=1.1 Гц, 4Н), 2.14-2.00 (m, 2Н).
13С ЯМР (75 МГц, CDCl3) δ 175.0, 170.9, 167.1, 149.6, 130.3, 129.5, 128.9, 128.8, 79.1, 43.8, 28.8, 28.6, 16.3.
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C19H20N2NaO7]+: 411.1163. Найдено: 411.1156.
Вычислено для C19H20N2O7C: 58.76%, Н: 5.19%, N: 7.21%. Найдено С: 58.80%, Н:5.15%, N: 7.13%.
ИК (KBr): 3002, 2954, 2668, 2557, 1750, 1693, 1495, 1445, 1389, 1301, 1282, 1194, 1146, 1103, 1037, 935, 748, 707, 507 cm-1.
Пример 7
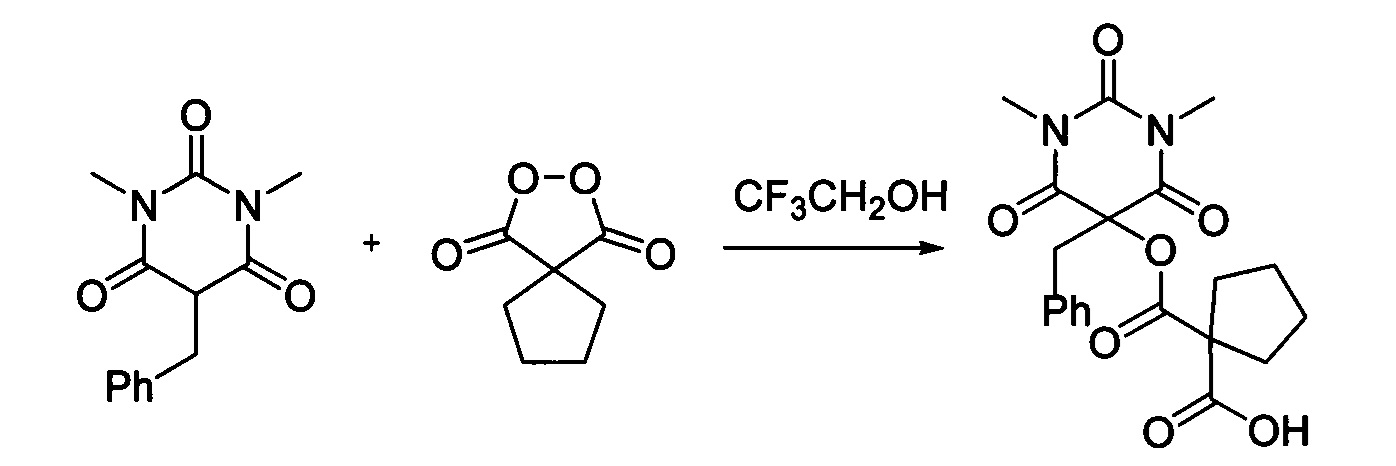
Циклопентил малонил пероксид (171.6 мг, 1.10 ммоль) добавляли при перемешивании к раствору 1,3-диметил-5-бензилбарбитуровой кислоты (246.2 мг, 1.00 ммоль) в CF3CH2OH (2 мл). Смесь перемешивали при 20-25°C в течение 24 часов. Растворитель упаривали в вакууме водоструйного насоса. Продукт выделяли хроматографией на SiO2 с использованием элюента CH2Cl2-EtOAc с увеличением доли EtOAc от 5 до 50 объемных процентов. Получали 1-(((5-бензил-1,3-диметил-2,4,6-триоксогексагидропиримидин-5-ил)окси)карбонил)циклопентан-1-карбоновую кислоту, выход: 70% (281.7 мг, 0.70 ммоль), белый порошок, т. пл. 135-136°C. Rf=0.64 (РЕ: EtOAc=2:1+2% АсОН).
1H ЯМР (300 МГц, CDCl3) δ 9.83 (br.s, 1Н), 7.34-7.21 (m, 3Н), 7.00-6.95 (m, 2Н), 3.43 (s, 2Н), 3.07 (s, 6Н), 2.44-2.20 (m, 4Н), 1.85-1.68 (m, 4Н).
13С ЯМР (75 МГц, CDCl3) δ 175.8, 171.9, 167.1, 149.6, 130.3, 129.5, 128.9, 128.8, 79.1, 59.5, 43.8, 34.8, 28.6, 25.7.
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C20H22N2NaO7]+: 425.1319. Найдено: 425.1311.
Вычислено для C20H22N2O7C: 59.70%, Н: 5.51%, N: 6.96%. Найдено С: 59.69%, Н: 5.54%, N: 7.08%.
ИК (KBr): 2959, 2660, 1752, 1693, 1494, 1447, 1432, 1388, 1294, 1169, 1103, 1045, 922, 749, 705, 476 cm-1.
Пример 8
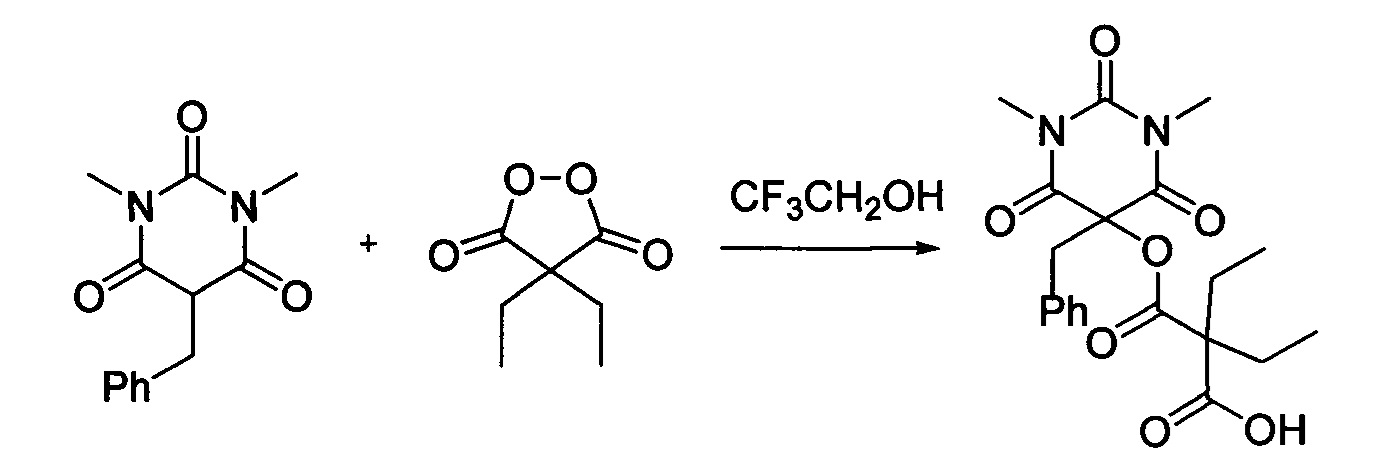
Диэтил малонил пероксид (173.8 мг, 1.10 ммоль) добавляли при перемешивании к раствору 1,3-диметил-5-бензилбарбитуровой кислоты (246.2 мг, 1.00 ммоль) в CF3CH2OH (2 мл). Смесь перемешивали при 20-25°С в течение 24 часов. Растворитель упаривали в вакууме водоструйного насоса. Продукт выделяли хроматографией на SiO2 с использованием элюента CH2Cl2-EtOAc с увеличением доли EtOAC от 5 до 50 объемных процентов. Получали 2-(((5-бензил-1,3-диметил-2,4,6-триоксогексагидропиримидин-5-ил)окси)карбонил)-2-этилбутановую кислоту, выход: 84% (339.7 мг, 0.84 ммоль), белый порошок, т. пл. 92-94°C. Rf=0.53 (РЕ:EtOAc=2:1+2% АсОН).
1Н ЯМР (300 МГц, CDCl3) δ 10.12 (br.s, 1Н), 7.33-7.21 (m, 3Н), 7.01-6.95 (m, 2Н), 3.43 (s, 2Н), 3.08 (s, 6Н), 2.07 (q, J=7.3 Гц, 4Н), 0.95 (t, J=13 Гц, 6Н).
13С ЯМР (75 МГц, CDCl3) δ 174.3, 172.0, 167.0, 149.6, 130.3, 129.5, 128.9, 128.8, 79.0, 58.1, 43.9, 28.6, 26.2, 8.4.
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C20H24N2NaO7]+: 427.1476. Найдено: 427.1461.
Вычислено для C20H24N2O7C: 59.40%, Н: 5.98%, N: 6.93%. Найдено С: 59.32%, Н: 6.03%, N: 6.93%.
ИК (KBr): 3447, 2968, 1734, 1693, 1446, 1432, 1388, 1287, 1233, 1143, 1103, 1043,945, 746, 705 cm-1.
Пример 9
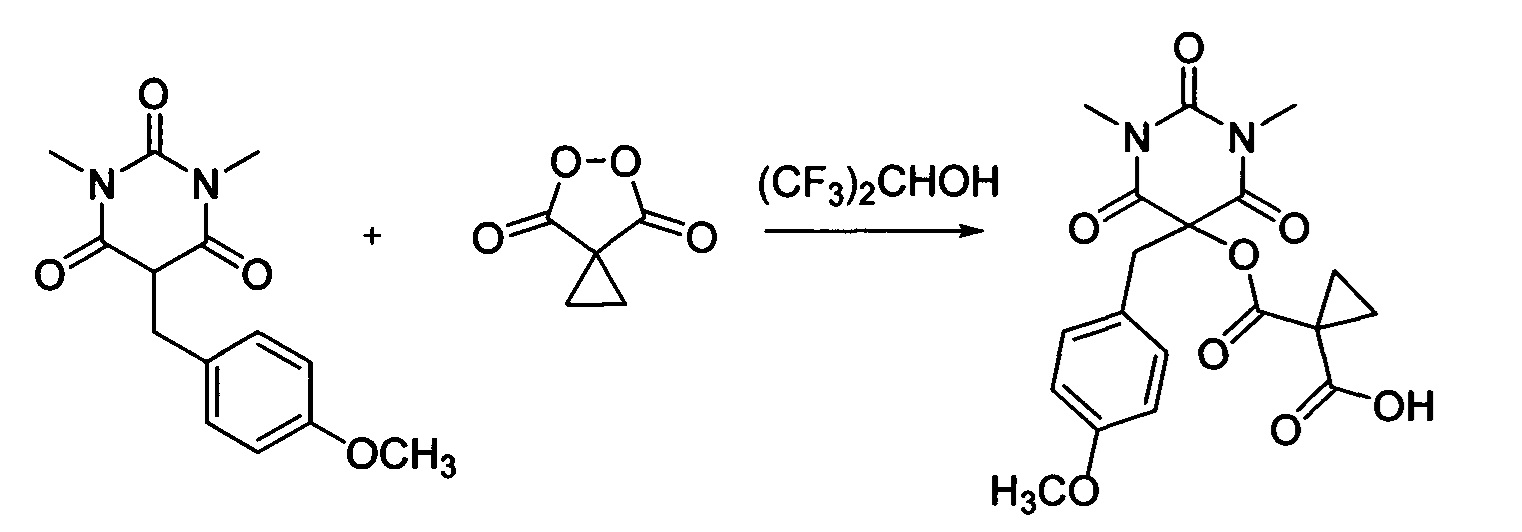
Циклопропил малонил пероксид (140.9 мг, 1.10 ммоль) добавляли при перемешивании к раствору 1,3-диметил-5-(4-метоксибензил)барбитуровой кислоты (276.3 мг, 1.00 ммоль) в (CF3)2CHOH (2 мл). Смесь перемешивали при 20-25°C в течение 24 часов. Растворитель упаривали в вакууме водоструйного насоса. Продукт выделяли хроматографией на SiO2 с использованием элюента CH2Cl2-EtOAc с увеличением доли EtOAc от 5 до 50 объемных процентов. Получали 1-(((5-(4-метоксибензил)-1,3-диметил-2,4,6-триоксогексагидропиримидин-5-ил)окси)карбонил)циклопропан-1-карбоновую кислоту, выход: 74% (299.2 мг, 0.74 ммоль), белый порошок, т. пл. 139-140°C. Rf=0.87 (РЕ:EtOAc=2:1+2% АсОН).
1Н ЯМР (300 МГц, CDCl3) δ 6.86 (d, J=8.4 Гц, 2Н), 6.78 (d, J=8.4 Гц, 2Н), 3.76 (s, 3Н), 3.29 (s, 2Н), 3.11 (s, 6Н), 2.03 (dd, J=7.8, 3.9 Гц, 2Н), 1.94 (dd, J=7.8, 4.0 Гц, 2Н).
13С ЯМР (50 МГц, CDCl3) δ 173.8, 170.3, 166.8, 160.3, 149.6, 130.7, 121.6, 114.4, 79.6, 55.5, 43.4, 28.9, 25.9, 22.8.
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C19H20N2NaO8]+: 427.1112. Найдено: 427.1097.
Вычислено для C19H20N2O8C: 56.43%, Н: 4.99%, N: 6.93%. Найдено С: 56.51%, Н: 5.07%, N: 6.91%.
ИК (KBr): 2935, 2837, 2601, 1739, 1686, 1615, 1516, 1442, 1309, 1254, 1146, 1041,922,408 cm-1.
Пример 10
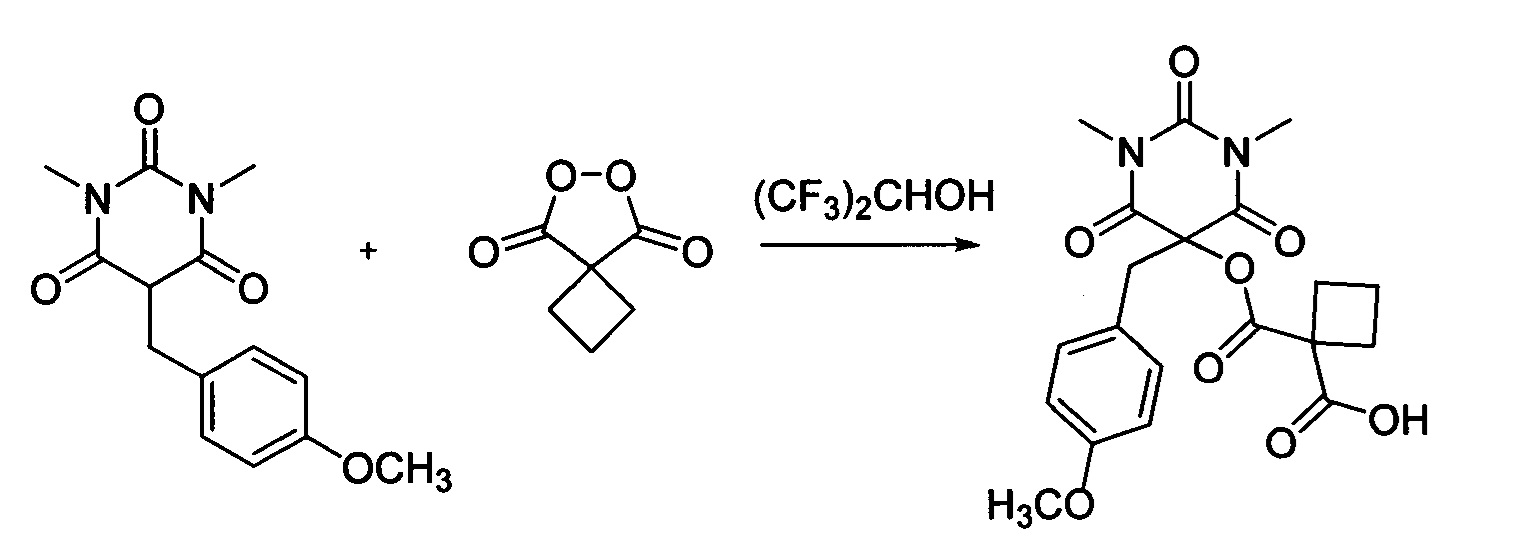
Циклобутил малонил пероксид (156.3 мг, 1.10 ммоль) добавляли при перемешивании к раствору 1,3-диметил-5-(4-метоксибензил)барбитуровой кислоты (276.3 мг, 1.00 ммоль) в (CF3)2CHOH (2 мл). Смесь перемешивали при 20-25°C в течение 24 часов. Растворитель упаривали в вакууме водоструйного насоса. Продукт выделяли хроматографией на SiO2 с использованием элюента CH2Cl2-EtOAc с увеличением доли EtOAc от 5 до 50 объемных процентов. Получали 1-(((5-(4-метоксибензил)-1,3-диметил-2,4,6-триоксогексагидропиримидин-5-ил)окси)карбонил)циклобутан-1-карбоновую кислоту, выход: 76% (318.0 мг, 0.76 ммоль), белый порошок, т.пл. 186-188°C. Rf=0.31 (РЕ:EtOAc=2:1+2% АсОН).
1Н ЯМР (300 МГц, CDCl3) δ 9.58 (br.s, 1Н), 6.88 (d, J=7.5 Гц, 2Н), 6.77 (d, J=7.5 Гц, 2Н), 3.75 (s, 3Н), 3.37 (s, 2Н), 3.10 (s, 6Н), 2.70-2.61 (m, 4Н), 2.12-1.97 (m, 2Н).
13С ЯМР (75 МГц, CDCl3) δ 175.0, 171.2, 167.3, 159.9, 149.7, 130.6, 122.0, 114.2, 79.0, 55.3, 52.0, 43.1, 28.8, 28.7, 16.3.
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C20H22N2NaO8]+: 441.1268. Найдено: 441.1264.
Вычислено для C20H22N2O8 С: 57.41%, Н: 5.30%, N: 6.70%. Found С: 57.39%, Н: 5.32%, N: 6.71%.
ИК (KBr): 2961, 1755, 1695, 1612, 1513, 1444, 1290, 1252, 1092, 1030, 928, 750, 404 cm-1.
Пример 11
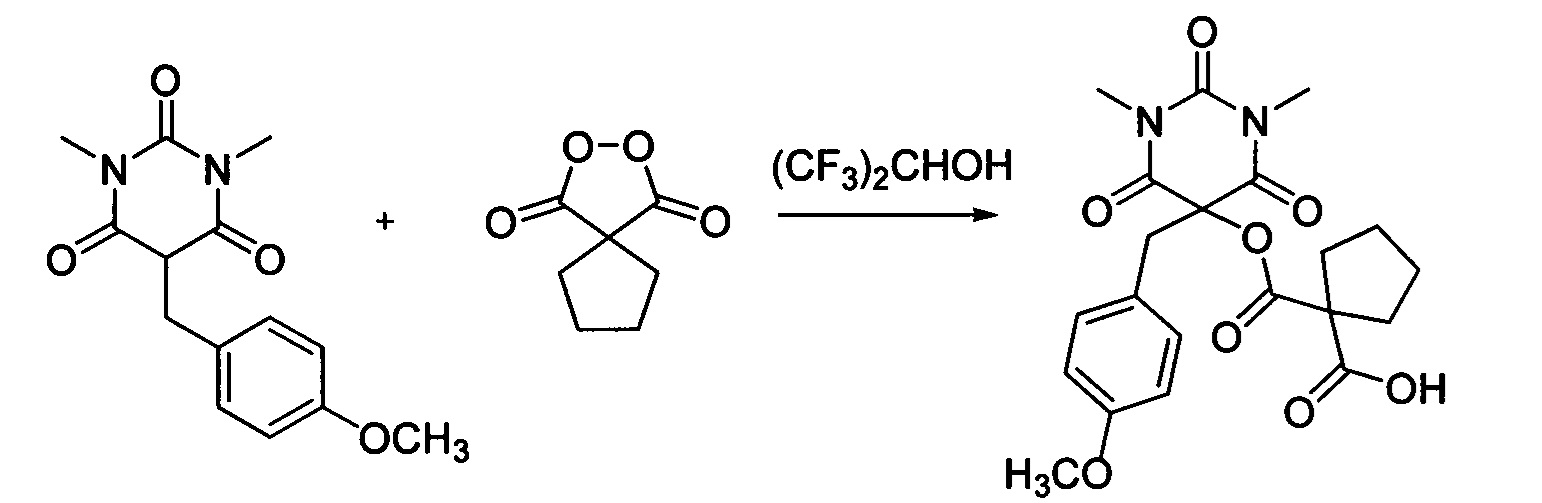
Циклопентил малонил пероксид (171.6 мг, 1.10 ммоль) добавляли при перемешивании к раствору 1,3-диметил-5-(4-метоксибензил)барбитуровой кислоты (276.3 мг, 1.00 ммоль) в (CF3)2CHOH (2 мл). Смесь перемешивали при 20-25°C в течение 24 часов. Растворитель упаривали в вакууме водоструйного насоса. Продукт выделяли хроматографией на SiO2 с использованием элюента CH2Cl2-EtOAc с увеличением доли EtOAc от 5 до 50 объемных процентов. Получали 1-(((5-(4-метоксибензил)-1,3-диметил-2,4,6-триоксогексагидропиримидин-5-ил)окси)карбонил)циклопентан-1-карбоновую кислоту, выход: 81% (350.3 мг, 0.81 ммоль), белый порошок, т. пл. 178-179°C. Rf=0.39 (РЕ:EtOAc=2:1+2% АсОН).
1H ЯМР (300 МГц, CDCl3) δ 9.66 (br.s, 1Н), 6.88 (d, J=8.0 Гц, 2Н), 6.77 (d, J=8.0 Гц, 2Н), 3.75 (s, 3Н), 3.36 (s, 2Н), 3.09 (s, 6Н), 2.38-2.22 (m, 4Н), 1.80-1.66 (m, 4Н).
13С ЯМР (75 МГц, CDCl3) δ 176.0, 172.0, 167.2, 159.9, 149.7, 130.6, 122.0, 114.2, 79.1, 59.6, 55.4, 43.1, 34.8, 28.7, 25.7.
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C21H24N2NaO8]+: 455.1425. Найдено: 455.1432.
Вычислено для C21H24N2O8C: 58.33%, Н: 5.59%, N: 6.48%. Найдено С: 58.17%, H:5.54%,N: 6.41%.
ИК (KBr): 2962, 2933, 2886, 2662, 1761, 1693, 1612, 1514, 1443, 1253, 1177, 1072,911,844, 745 cm-1.
Пример 12
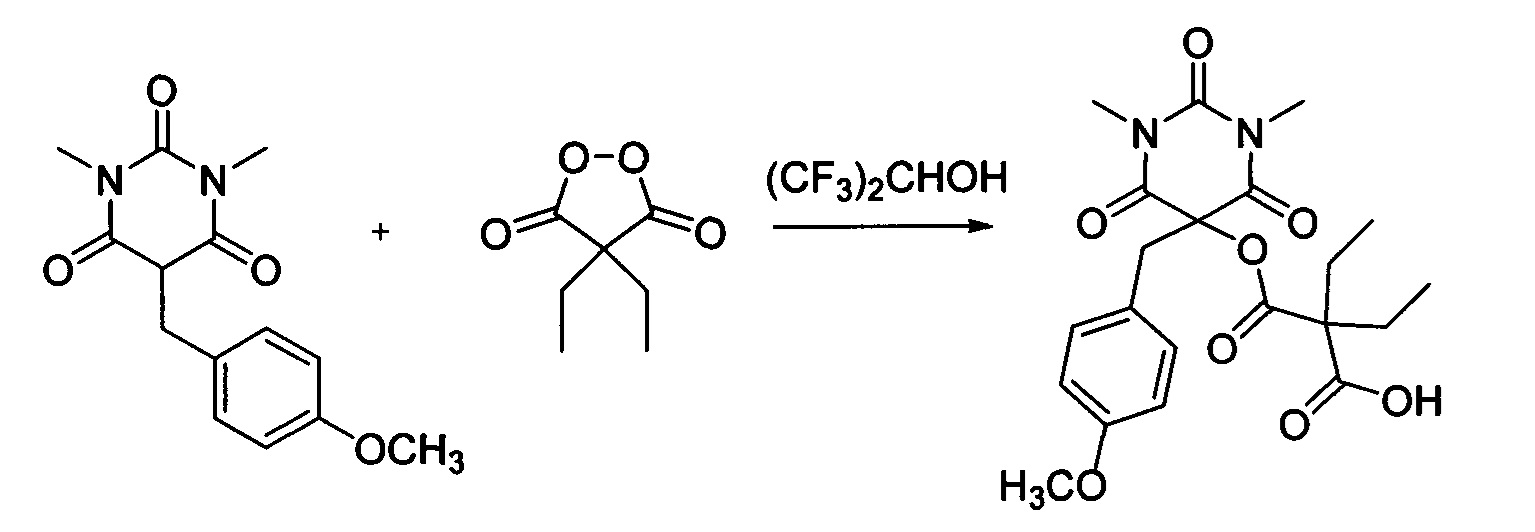
Диэтил малонил пероксид (173.8 мг, 1.10 ммоль) добавляли при перемешивании к раствору 1,3-диметил-5-(4-метоксибензил)барбитуровой кислоты (276.3 мг, 1.00 ммоль) в (CF3)2CHOH (2 мл). Смесь перемешивали при 20-25°C в течение 24 часов. Растворитель упаривали в вакууме водоструйного насоса. Продукт выделяли хроматографией на SiO2 с использованием элюента CH2Cl2-EtOAc с увеличением доли EtOAc от 5 до 50 объемных процентов. Получали 2-этил-2-(((5-(4-метоксибензил)-1,3-диметил-2,4,6-триоксогексагидропиримидин-5-ил)окси)карбонил)бутановую кислоту, выход: 83% (360.6 мг, 0.83 ммоль), белый порошок, т. пл. 112-113°C. Rf=0.64 (РЕ: EtOAc=2:1+2% АсОН).
1Н ЯМР (300 МГц, CDCl3) δ 9.81 (br.s, 1Н), 6.87 (d, J=8.3 Гц, 2Н), 6.77 (d, J=8.4 Гц, 2Н), 3.75 (s, 3Н), 3.37 (s, 2Н), 3.09 (s, 6Н), 2.05 (q, J=7.3 Гц, 4Н), 0.94 (t, J=7.3 Гц, 6Н).
13С ЯМР (75 МГц, CDCl3) δ 174.1, 172.2, 167.1, 159.9, 149.7, 130.6, 121.9, 114.2, 79.0, 58.2, 55.4, 43.2, 28.7, 26.3, 8.4.
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C21H26N2NaO8]+: 457.1581. Найдено: 457.1577.
Вычислено для C21H26N2O8C: 58.06%, Н: 6.03%, N: 6.45%. Найдено С: 58.04%, Н: 6.15%, N: 6.28%.
ИК (KBr): 2976, 2940, 1734, 1690, 1613, 1515, 1444, 1375, 1256, 1233, 1120, 1040, 946, 847, 744 cm-1.
Пример 13
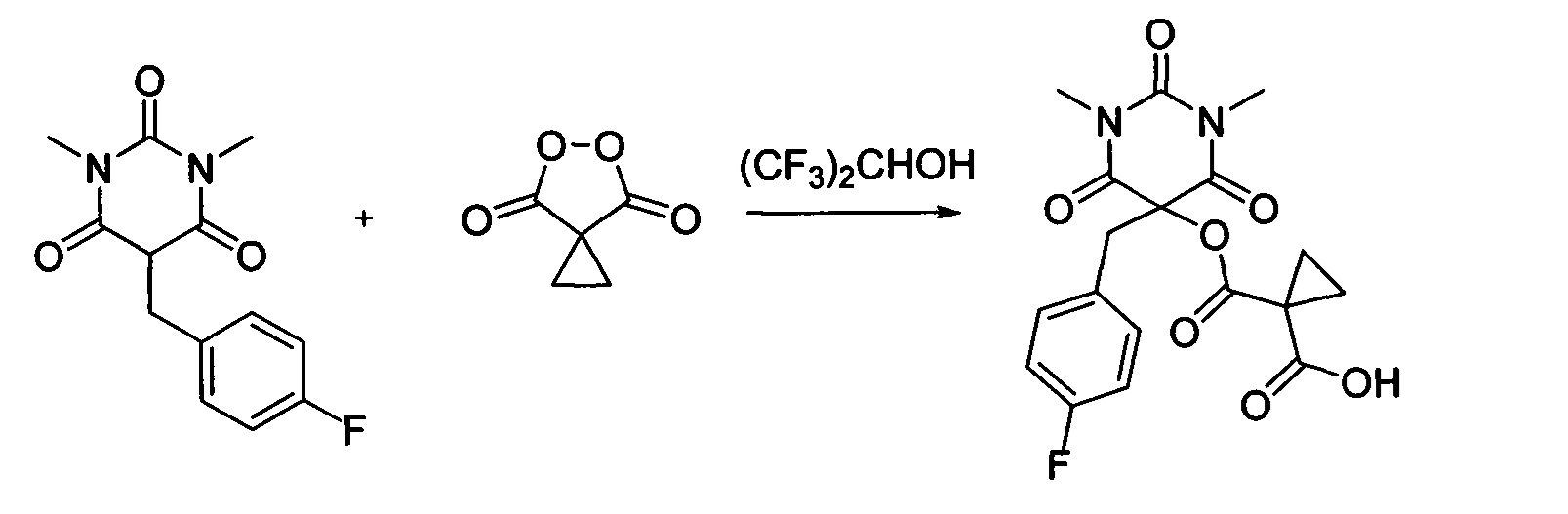
Циклопропил малонил пероксид (140.9 мг, 1.10 ммоль) добавляли при перемешивании к раствору 1,3-диметил-5-(4-фторбензил)барбитуровой кислоты (264.3 мг, 1.00 ммоль) в (CF3)2CHOH (2 мл). Смесь перемешивали при 20-25°C в течение 24 часов. Растворитель упаривали в вакууме водоструйного насоса. Продукт выделяли хроматографией на SiO2 с использованием элюента CH2Cl2-EtOAc с увеличением доли EtOAc от 5 до 50 объемных процентов. Получали 1-(((5-(4-фторбензил)-1,3-диметил-2,4,6-триоксогексагидропиримидин-5-ил)окси)карбонил)циклопропан-1-карбоновую кислоту, выход: 92% (361.0 мг, 0.92 ммоль), белый порошок, т. пл. 140-142°C. Rf=0.43 (РЕ:EtOAc=2:1+2% АсОН).
1Н ЯМР (300 МГц, CDCl3) δ 7.08-6.87 (m, 4Н), 3.32 (s, 2Н), 3.12 (s, 6Н), 2.10-1.85 (m, 4Н).
13С ЯМР (75 МГц, CDCl3) δ 173.3, 170.3, 166.4, 163.0 (d, 1JC-F=249.4 Гц), 149.4, 131.3 (d, 3JC-F=8.2 Гц), 125.7 (d, 4JC-F=3.5 Гц), 116.1 (d, 2JC-F=21.7 Гц), 79.1,43.0, 28.8, 25.8, 22.6.
19F ЯМР (282 МГц, CDCl3) δ - 110.99 (s).
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C18Hi7FN2NaO7]+: 415.0912. Найдено: 415.0907.
Вычислено для C18H17FN2O7 С: 55.10%, Н: 4.37%, N: 7.14%. Найдено С: 55.18%, Н: 4.36%, N: 7.06%.
ИК (KBr): 3202, 1765, 1692, 1606, 1514, 1446, 1392, 1371, 1290, 1232, 1143, 1111, 1045, 858, 745 cm-1.
Пример 14
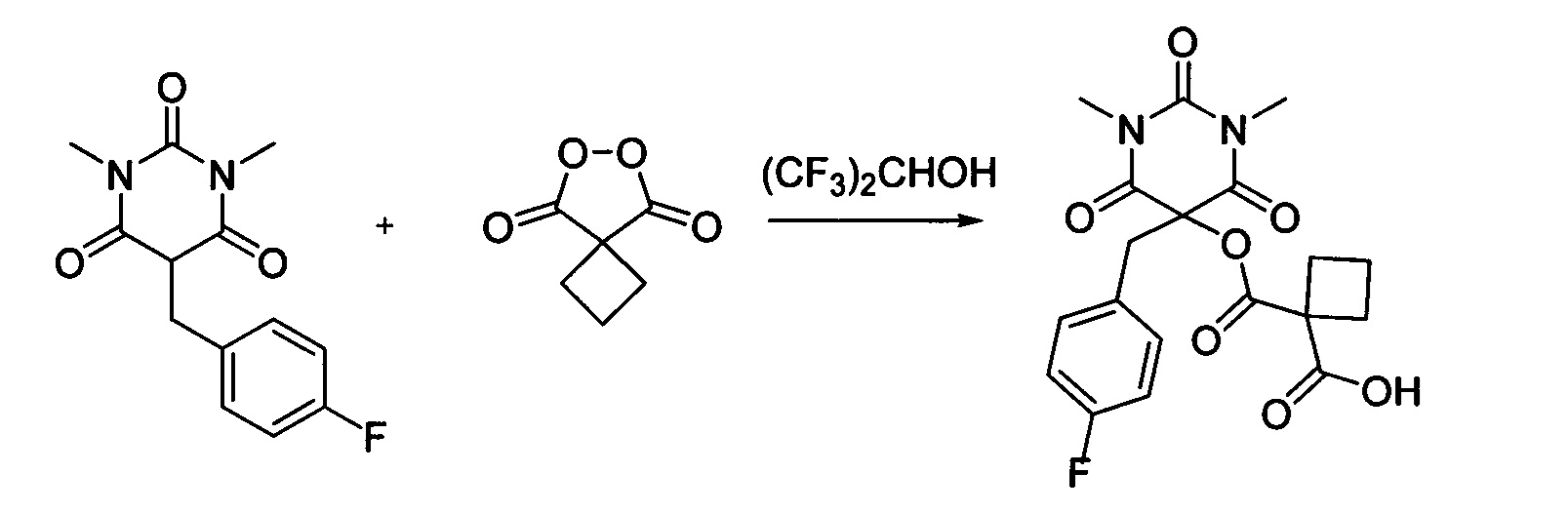
Циклобутил малонил пероксид (156.3 мг, 1.10 ммоль) добавляли при перемешивании к раствору 1,3-диметил-5-(4-фторбензил)барбитуровой кислоты (264.3 мг, 1.00 ммоль) в (CF3)2СНОН (2 мл). Смесь перемешивали при 20-25°C в течение 24 часов. Растворитель упаривали в вакууме водоструйного насоса. Продукт выделяли хроматографией на SiO2 с использованием элюента CH2Cl2-EtOAc с увеличением доли EtOAc от 5 до 50 объемных процентов. Получали 1-(((5-(4-фторбензил)-1,3-диметил-2,4,6-триоксогексагидропиримидин-5-ил)окси)карбонил)циклобутан-1-карбоновую кислоту, выход: 81% (329.2 мг, 0.81 ммоль), белый порошок, т. пл. 166-167°C. Rf=0.53 (РЕ: EtOAc=2:1+2% АсОН).
1Н ЯМР (300 МГц, CDCl3) δ 10.01 (br.s, 1Н), 7.02-6.97 (m, 4Н), 3.43 (s, 2Н), 3.15 (s, 6Н), 2.69 (t, J=8.0 Гц, 4Н), 2.16-1.96 (m, 2Н).
13С ЯМР (75 МГц, CDCl3) δ 174.9, 170.9, 167.0, 162.9 (d, 1JC-F=248.7 Гц), 149.7, 131.3 (d, 3JC-F=8.2 Гц), 126.2 (d, 4JC-F =3.3 Гц), 115.9 (d, 2JC-F=21.6 Гц), 78.8, 51.8, 42.9, 28.8, 28.8, 16.3.
19F ЯМР (282 МГц, CDCl3) δ - 112.18 (s).
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C19H19FN2NaO7]+: 429.1069. Найдено: 429.1065.
Вычислено для C19H19FN2O7 С: 56.16%, Н: 4.71%, N: 6.89%. Найдено С: 56.14%, Н: 4.75%, N: 6.73%.
ИК (KBr): 2994, 2955, 1926, 1754, 1697, 1606, 1515, 1447, 1388, 1307, 1287, 1231, 1108, 745 cm-1.
Пример 15
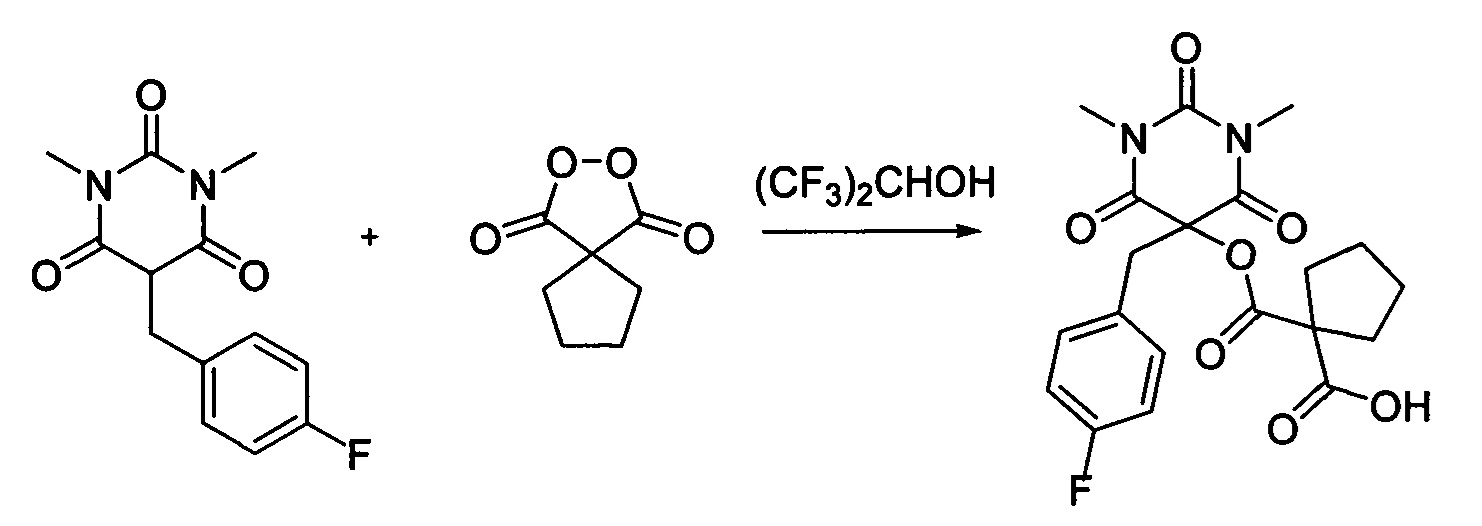
Циклопентил малонил пероксид (171.6 мг, 1.10 ммоль) добавляли при перемешивании к раствору 1,3-диметил-5-(4-фторбензил)барбитуровой кислоты (264.3 мг, 1.00 ммоль) в (CF3)2CHOH (2 мл). Смесь перемешивали при 20-25°C в течение 24 часов. Растворитель упаривали в вакууме водоструйного насоса. Продукт выделяли хроматографией на SiO2 с использованием элюента CH2Cl2-EtOAc с увеличением доли EtOAc от 5 до 50 объемных процентов. Получали 1-(((5-(4-фторбензил)-1,3-диметил-2,4,6-триоксогексагидропиримидин-5-ил)окси)карбонил)циклопентан-1 -карбоновую кислоту, выход: 85% (357.3 мг, 0.85 ммоль), белый порошок, т. пл. 180-181°C. Rf=0.48 (РЕ:EtOAc=2:1+2% АсОН).
1Н ЯМР (300 МГц, DMSO-d6) δ 12.88 (br.s, 1Н), 7.16-7.05 (m, 4Н), 3.37 (s, 2Н), 3.06 (s, 6Н), 2.12 (t, J=6.7 Гц, 4Н), 1.64-1.57 (m, 4Н).
13С ЯМР (75 МГц, DMSO-J6) δ 171.81, 171.75, 166.1, 161.9 (d, 1JC-F=244.5 Гц), 149.4, 131.9 (d, 3JC-F=8.4 Гц), 127.4 (d, 4JC-F=3.1 Гц), 115.2 (d, 2JC-F=21.4 Гц), 78.5, 59.2, 41.4, 33.8, 28.4, 25.0.
19F ЯМР (282 МГц, DMSO-d6) δ - 112.22 (s).
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C20H21FN2NaO7]+: 443.1225. Найдено: 443.1236.
Вычислено для C20H21FN2O7 С: 57.14%, Н: 5.04%, N: 6.66%. Найдено С: 57.16%, Н: 4.89%, N: 6.61%.
ИК (KBr): 2952, 2663, 1753, 1697, 1605, 1515, 1446, 1374, 1288, 1226, 1164, 1111, 1049, 929, 851, 745, 545, 495 cm-1.
Пример 16
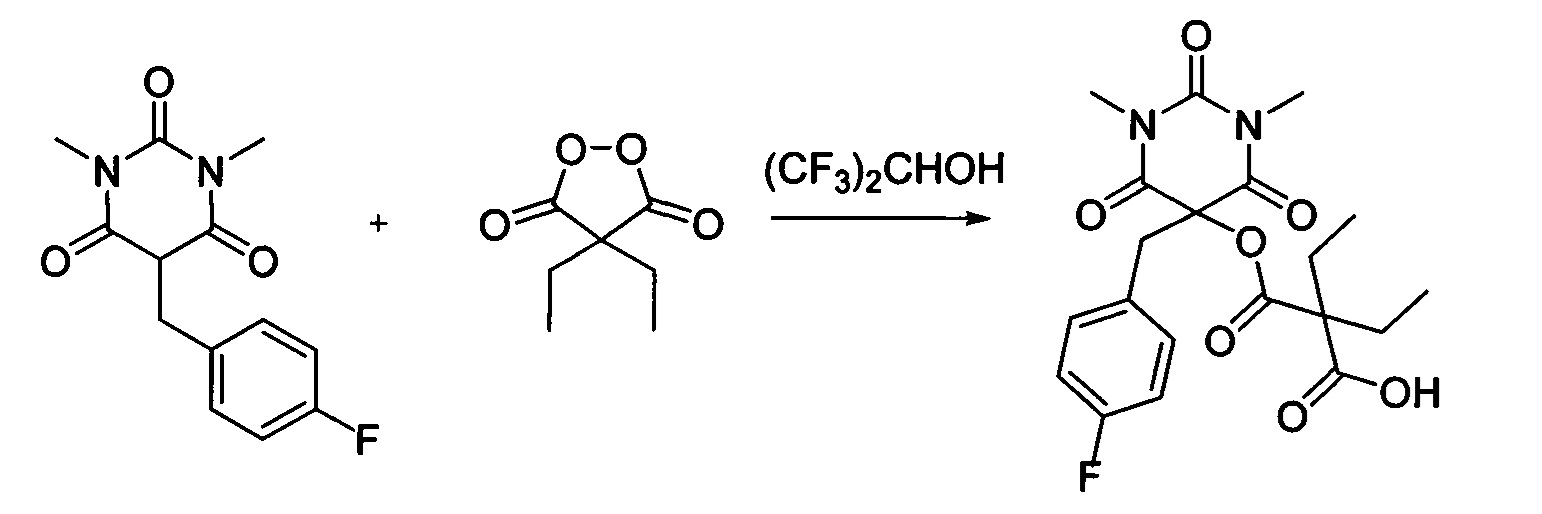
Диэтил малонил пероксид (173.8 мг, 1.10 ммоль) добавляли при перемешивании к раствору 1,3-диметил-5-(4-фторбензил)барбитуровой кислоты (264.3 мг, 1.00 ммоль) в (CF3)2CHOH (2 мл). Смесь перемешивали при 20-25°C в течение 24 часов. Растворитель упаривали в вакууме водоструйного насоса. Продукт выделяли хроматографией на SiO2 с использованием элюента CH2Cl2-EtOAc с увеличением доли EtOAc от 5 до 50 объемных процентов. Получали 2-этил-2-(((5-(4-фторбензил)-1,3-диметил-2,4,6-триоксогексагидропиримидин-5-ил)окси)карбонил)бутановую кислоту, выход: 86% (363.3 мг, 0.86 ммоль), белый порошок, т. пл. 133-134°C. Rf=0.78 (РЕ:EtOAc=2:1+2% АсОН).
1Н ЯМР (300 МГц, CDCl3) δ 10.21 (br.s, 1Н), 6.99-6.94 (m, 4H), 3.40 (s, 2H), 3.11 (s, 6H), 2.05 (q, J=7.4 Гц, 4H), 0.93 (t, J=7.5 Гц, 6H).
13C ЯМР (75 МГц, CDCl3) δ 174.3, 171.9, 166.9, 162.9 (d, 1JC-F=248.8 Гц), 149.6, 131.3 (d, 3JC-F=8.2 Гц), 126.2 (d, 4JC-F=3.4 Гц), 115.9 (d, 2JC-F=21.6 Гц), 78.7, 58.1,43.0, 28.7, 26.1,8.4.
19F ЯМР (282 МГц, CDCl3) δ - 112.13 (s).
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C20H23FN2NaO7]+: 445.1382. Найдено: 445.1377.
Вычислено для C20H23FN2O7 С: 56.87%, Н: 5.49%, N: 6.63%. Найдено С: 57.01%, Н: 5.50%, N: 6.61%.
ИК (KBr): 2980, 2891, 2674, 1734, 1695, 1514, 1446, 1387, 1287, 1228, 1142, 1108, 1057, 945, 850, 826, 743, 548 cm-1.