Результат интеллектуальной деятельности: 8,10-Динитро-дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино[5',6':4,5][1,2,3]триазоло-[2,1-a][1,2,3]бензотриазол-1,3-диоксид и способ его получения
Вид РИД
Изобретение
Предлагаемое изобретение относится к области органической химии, а именно к химии энергоемких гетероциклических соединений, конкретно к новому неописанному в литературе 8,10-динитро-дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино[5',6':4,5]-[1,2,3]триазоло-[2,1-a][1,2,3]бензотриазол-1,3-диоксиду формулы
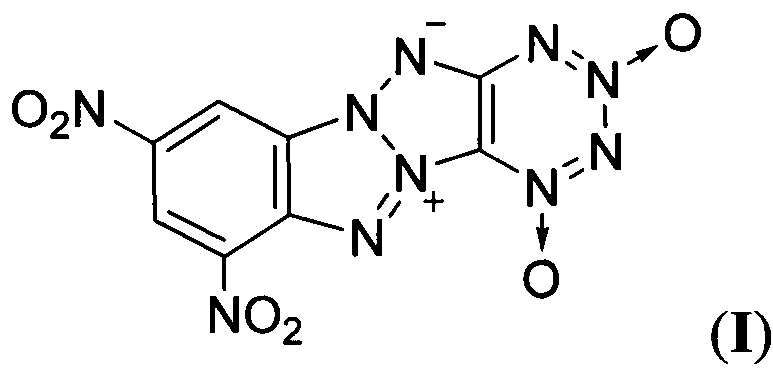
и к способу его получения. Соединение формулы I может найти применение в качестве мощного взрывчатого вещества и компонента высокоимпульсных твердых ракетных топлив.
В литературе описаны высокоэнергетические аналогичные Z-тетраазапенталены (по данным базы SciFinder CAS American Chemical Society), например соединения формулы
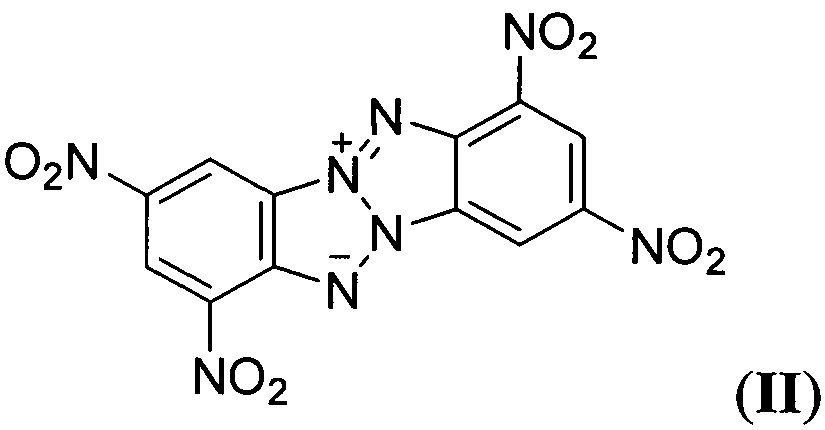
(R.A. Carboni, J.С.Kauer, W.R. Hatchard, R.J. Harder, "Aromatic Azapentalenes. II. Reactions of Monobenzo- and Dibenzo- 1,3 a,4,6a-tetraazapentalenes", J. Am. Chem. Soc, 1967, 89, 2626-2633) и формулы
(К.L. Altmann, A.P. Chafin, L.H. Merwin, W.S. Wilson, "Chemistry of Tetraazapentalenes", J. Org. Chem, 1998, 63, 3352-3356).
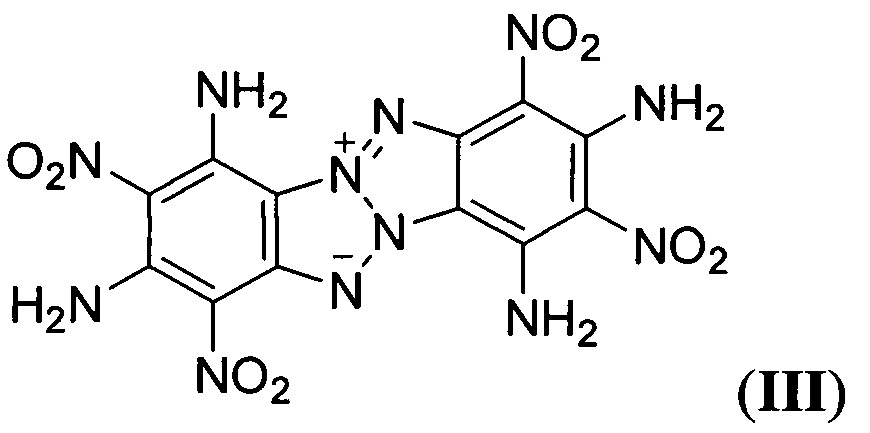
Описаны также аналогичные Z-тетраазапенталены формулы
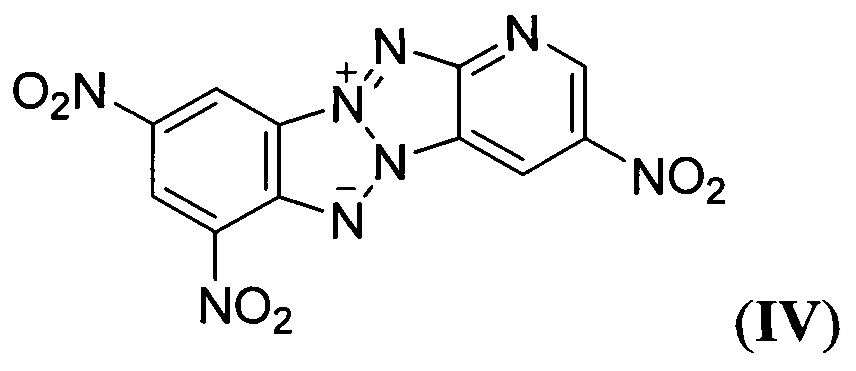
и формулы
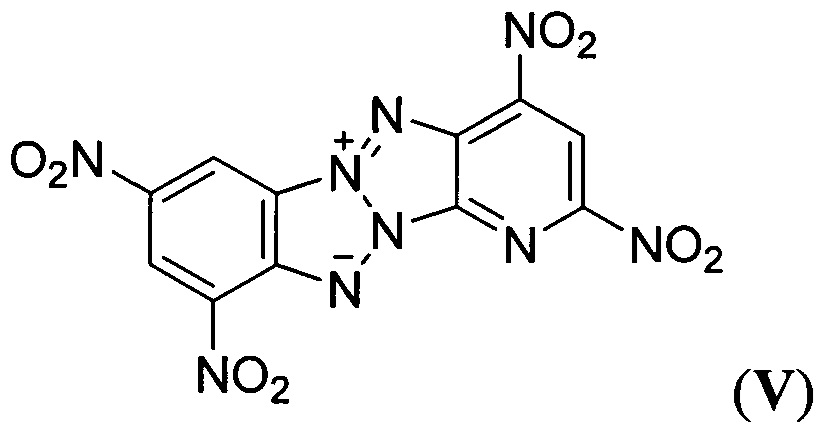
(A. Maquestiau, М. Flammang-Barbieux, Е. Vilain, "Nitration De Pyridinobenzotetraazapentalenes", Bull. Soc. Chim. Belg., 1986, 95, 1117-1122).
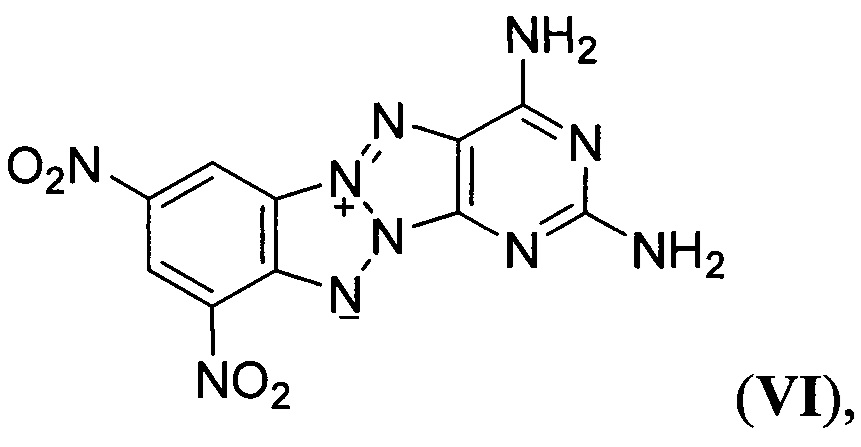
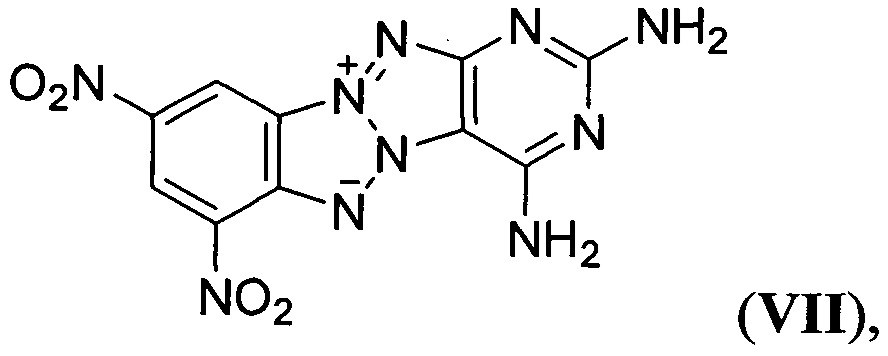
Известны Z-тетраазапенталены формулы
и формулы
заявленные в патенте (US 8273877; 2012), а также соединение формулы
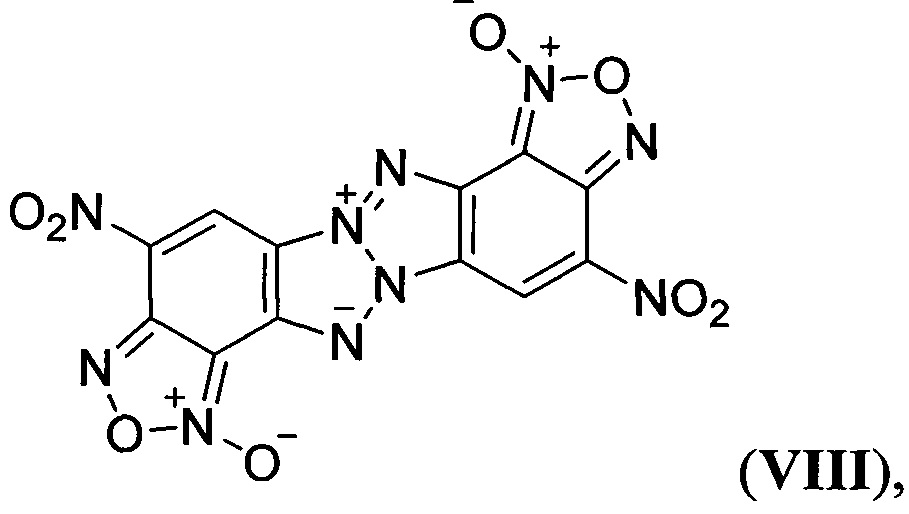
описанное в статье (G. Subramanian, J.Н. Boyer, М.L. Trudell, "Reactions of Benzotriazolo[2,1-a]benzotriazole Derivatives. 1. Synthesis of New Insensitive High-Density Energetic Compounds", J. Org. Chem., 1996, 61, 1898-1900). Описанные структурно аналогичные Z-тетраазапенталены (II-VIII) характеризуются невысокими энтальпией образования, плотностью, сильно отрицательным кислородным балансом и как следствие невысокими детонационными параметрами, что делает малоэффективным их применение в качестве компонентов взрывчатых составов и твердых ракетных топлив.
Технической задачей предлагаемого изобретения является изыскание новых соединений ряда Z-тетраазапенталенов, характеризующихся высоким энергетическим потенциалом, а также разработка способов их получения. Поставленная техническая задача достигается новым неописанным в литературе 8,10-динитро-дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино[5',6':4,5]-[1,2,3]триазоло-[2,1-а][1,2,3]бензотриазол-1,3-диоксидом формулы
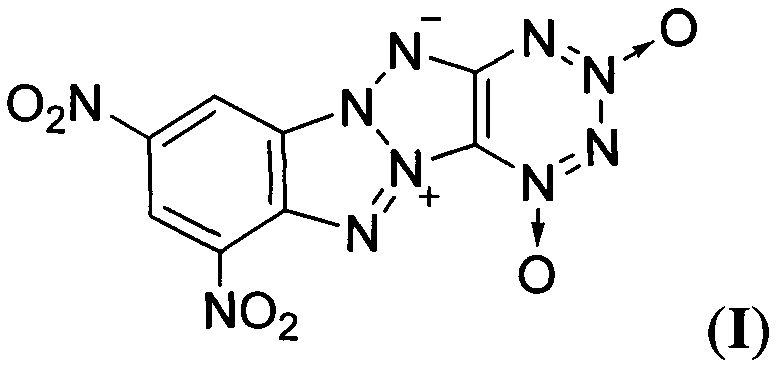
и способом его получения.
Предлагаемое соединение формулы I отличаются от известных Z-тетраазапенталенов наличием в одной молекуле как Z-тетраазапенталенового фрагмента, так и эксплозофорного 1,2,3,4-тетразин-1,3-диоксидного цикла, вместе обеспечивающих высокий энергетический потенциал данного соединения.
Предлагаемый 8,10-динитро-дегидро-1,5-5Н,11 Н-[1,2,3,4]тетразино-[5',6':4,5][1,2,3]триазоло-[2,1-а][1,2,3]бензотриазол-1,3-диоксид (I) получают путем реакции (трет-бутил-NNO-азокси)ацетонитрила (IX) с хлоридом 2-азидофенилдиазония (X) в смеси спирта с водой, в присутствии основания, образующийся при этом (трет-бутил-NNO-азокси)(2-азидофенилгидразоно)ацетонитрил обрабатывают избытком гидрохлорида гидроксиламина в полярном протонном органическом растворителе в присутствии избытка основания, полученный при этом 2-(трет-6утил-NNO-азокси)-N'-гидрокси-2-(2-азидофенилгидразоно)этанимидамид конденсируют с триэтилортоформиатом в присутствии кислоты Льюиса в среде полярного апротонного растворителя с образованием 3-[(2-азидофенил)гидразоно](трет-бутил-NNO-азокси)-1,2,4-оксадиазола, который обрабатывают основанием при пониженной температуре в среде апротонного растворителя, получая при этом 5-(трет-бутил-NNO-азокси)-4-формиламино-2-(2-азидофенил)-2H-1,2,3-триазол, который подвергают взаимодействию со спиртом в присутствии кислоты, образующийся 4-амино-5-(трет-бутил-NNO-азокси)-2-(2-азидофенил)-2H-1,2,3-триазол подвергают последовательно взаимодействию с азотной и серной кислотами в среде уксусного ангидрида с последующим выделением 2-(2-азидофенил)-2Н-[1,2,3]триазоло[4,5-е][1,2,3,4]тетразин 4,6-диоксида, термическая обработка которого при температуре 155-170°С в высококипящем растворителе дает смесь дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино[5',6':4,5][1,2,3]триазоло[2,1-а][1,2,3]бензотриазол-1,3-диоксида и дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино[5',6':4,5]-[1,2,3]триазоло[2,1-а] [1,2,3]бензотриазол-2,4-диоксида, которую подвергают нитрованию под действием азотной и серной кислот с последующим выделением целевого продукта I.
Процесс протекает по следующей схеме:
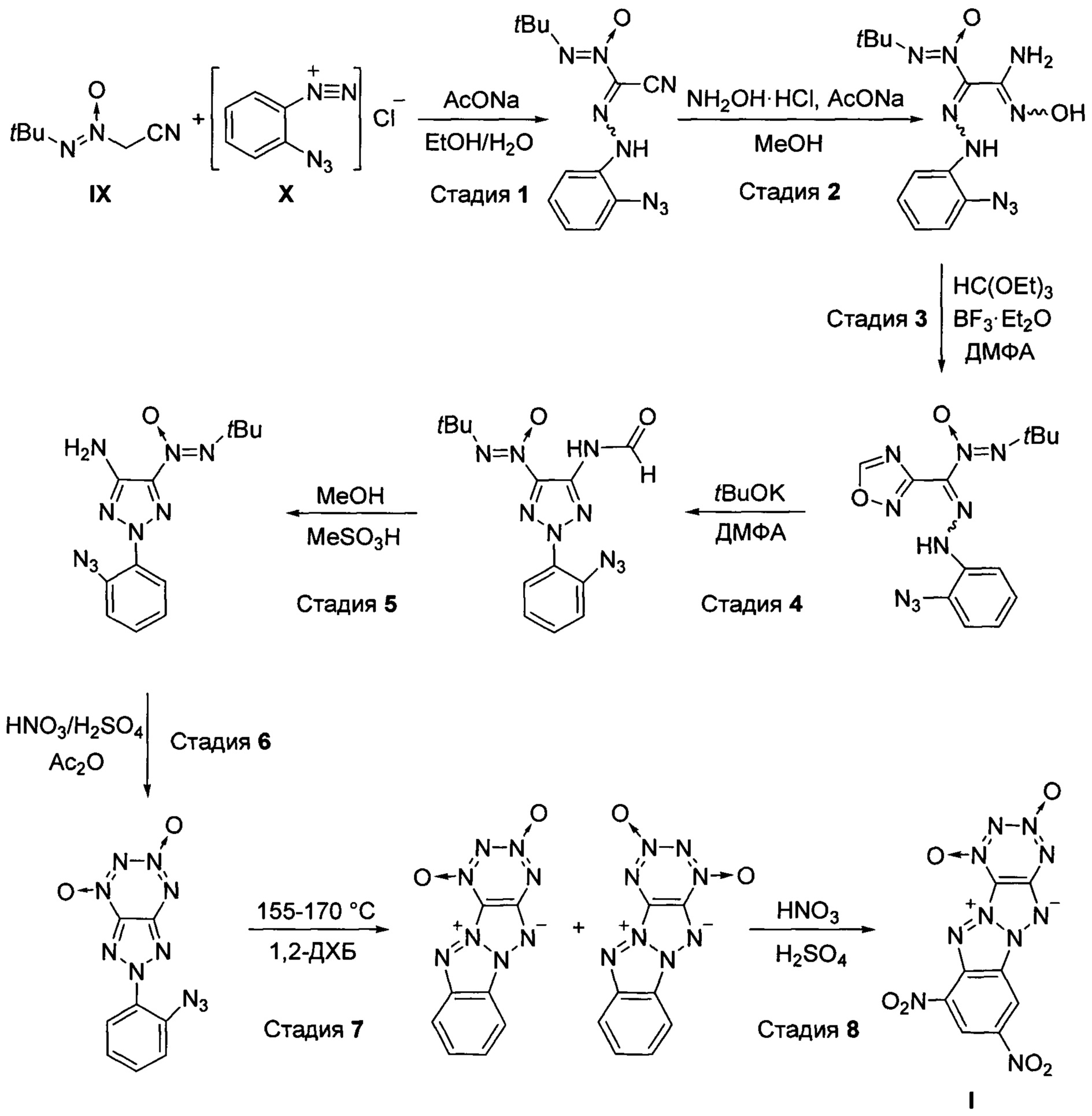
В качестве спирта на стадии 1 получения (трет-бутил-NNO-азокси)(2-азидофенилгидразоно)ацетонитрила используют, например, этанол, а в качестве основания применяют, например, ацетат натрия. Процесс проводят при температуре 0°С, а затем температуру поднимают до 25°С.
В качестве основания на стадии 2 получения 2-(трет-бутил-NNO-азокси)-N'-гидрокси-2-(2-азидофенилгидразоно)этанимидамида используют, например, ацетат натрия, а в качестве полярного протонного органического растворителя применяют, например, метанол. Процесс проводят при 40°С. В качестве полярного апротонного органического растворителя на стадии 3 получения 3-[(2-азидофенил)гидразоно](трет-бутил-NNO-азокси)-1,2,4-оксадиазола используют, например, диметилформамид, а в качестве кислоты Льюиса применяют, например, эфират трехфтористого бора. Процесс проводят при 50°С.
В качестве основания на стадии 4 получения 5-(трет-бутил-NNO-азокси)-4-формиламино-2-(2-азидофенил)-2H-1,2,3-триазола используют, например, трет-бутилат калия. В качестве полярного апротонного органического применяют, например, диметилформамид. Процесс проводят при 0°С.
В качестве кислоты на стадии 5 получения 4-амино-5-(трет-бутил-NNO-азокси)-2-(2-азидофенил)-2H-1,2,3-триазола используют, например, метансульфокислоту, а в качестве спирта применяют, например, метанол. Процесс проводят при температуре от 0 до 25°С.
Процесс получения 2-(2-азидофенил)-2Н-[1,2,3]триазоло[4,5-е][1,2,3,4]тетразин-4,6-диоксида на стадии 6 проводят при температуре от 0 до 25°С. Процесс ведут, предпочтительно, при мольном соотношении азотная кислота:серная кислота 1:2.
В качестве высококипящего растворителя на стадии 7 получения дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино[5',6':4,5][1,2,3]триазоло[2,1-а][1,2,3]бензо-триазол-1,3-диоксида и дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино[5',6':4,5]-[1,2,3]триазоло[2,1-a][1,2,3]бензотриазол-2,4-диоксида используют, например, 1,2-дихлорбензол.
Процесс получения 8,10-динитро-дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино[5',6':4,5][1,2,3]триазоло-[2,1-а][1,2,3]бензотриазол-1,3-диоксида (I) на стадии 8 проводят при температуре от 0 до 40°С. Процесс ведут, предпочтительно, при мольном соотношении азотная кислота:серная кислота 1:2.
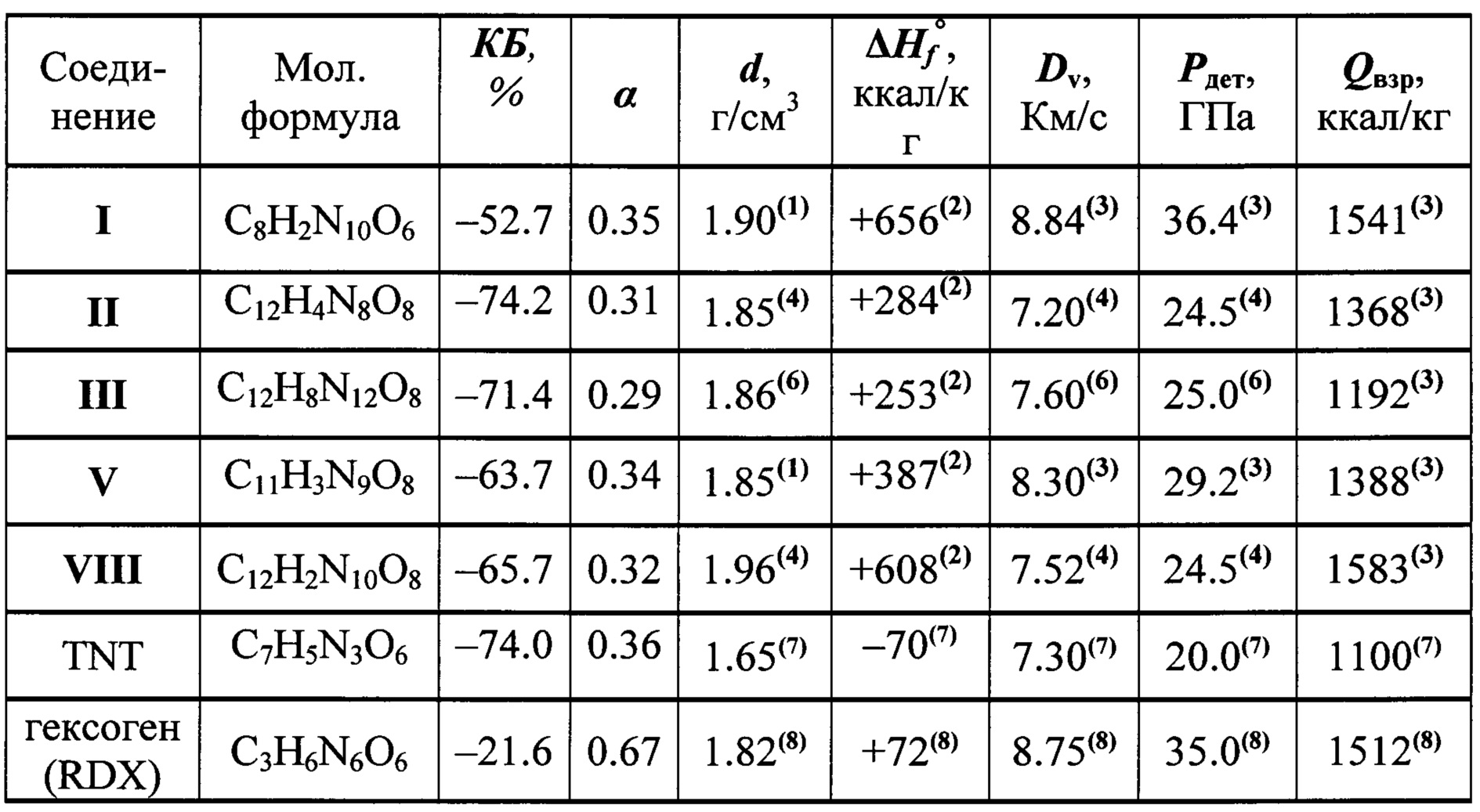
Свойства предложенного соединения формулы I в сравнении с энергоемкими соединениями аналогичного назначения приведены в таблице.
Таблица. Энергетические характеристики 8,10-динитро-дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино[5',6':4,5][1,2,3]триазоло-[2,1-a][1,2,3]бензотриазол-1,3-диоксида (I) в сравнении с "родственными" Z-тетраазапенталенами (II, III, V и VIII) и со штатными взрывчатыми веществами (TNT, гексоген).
Примечания
Условные обозначения: КБ - кислородный баланс, а - коэффициент избытка окислителя, d - плотность, 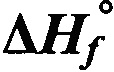 - энтальпия образования в твердой фазе, Dv - скорость детонации, Рдет - давление детонации, Qвзр - теплота взрыва.
- энтальпия образования в твердой фазе, Dv - скорость детонации, Рдет - давление детонации, Qвзр - теплота взрыва.
Список литературы
1 Плотность (d) рассчитана по вкладам фрагментов молекул (А.А. Котомин, А.С.Козлов, "Метод расчета плотности органических соединений по вкладам фрагментов молекул", Журнал прикладной химии, 2009, 6, 966-977).
2 Энтальпия образования (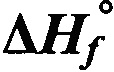 ) рассчитана с помощью программы ChemBioOffice 2014 ChemBio3D Ultra 14.0 полуэмпирическим методом РМ3 и приведена с учетом оценочного значения энтальпии сублимации.
) рассчитана с помощью программы ChemBioOffice 2014 ChemBio3D Ultra 14.0 полуэмпирическим методом РМ3 и приведена с учетом оценочного значения энтальпии сублимации.
3 Скорость детонации (Dv), давление детонации (Рдет) и теплота взрыва (Qвзр) рассчитаны с помощью программы Shock and Detonation (S&D) Version 4.5 (кафедра XTOCA РХТУ им. Д.И. Менделеева).
4 G. Subramanian, J.H. Boyer, D. Buzatu, E.D. Stevens, M.L. Trudell, "Reactions of Benzotriazolo[2,1-ajbenzotriazole Derivatives. 1. Synthesis of New Insensitive High-Density Energetic Compounds", J. Org. Chem. 1995, 60, 6110-6113.
5 P.E. Rouse, Jr., "Enthalpies of formation and calculated detonation properties of some thermally stable explosives", J. Chem. Eng. Data, 1976, 21, 16-20.
6 K.L. Altmann, L.H. Merwin, W.P. Norris, W.S. Wilson, R. Gilardi, "High nitrogen Explosives. Part 2. Dibenzo-l,3a,4,6a-tetraazapentalenes and Benzo-l,2,3,4-tetrazine-l,3-dioxides", Progress Report, Project R2402, R2502, Office of Naval Research, Arlington, VA 1996.
7 В.Л. Збарский, В.Ф. Жилин, "Толуол и его нитропроизводные", Эдиториал УРСС, Москва, 1999, 168-175.
8 R. Meyer, J. Kohler, A. Homburg, "Explosives", sixth edition, Wiley-VCH, Weinheim, 2007, 174-175.
Техническим результатом настоящего изобретения является создание и разработка способа получения соединения нового класса - 8,10-динитро-дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино[5',6':4,5]-[1,2,3]триазоло-[2,1-а][1,2,3]бензотриазол-1,3-диоксида формулы I, имеющего в своей структуре как Z-тетраазапенталеновый фрагмент, так и эксплозофорный 1,2,3,4-тетразин-1,3-диоксидный цикл и которое превосходит по взрывчатым характеристикам такие штатные взрывчатые вещества, как гексоген (RDX) и тротил (ТНТ). Соединение формулы I имеет более высокие энергетические характеристики, чем "родственные" энергоемкие соединения, содержащие Z-тетраазапенталеновую систему, такие как ТАСОТ (II) и другие аналогичные Z-тетраазапенталены (III), (V), (VIII) (см. Таблицу). Благодаря сочетанию лучшего кислородного баланса, высокой энтальпии образования и плотности соединение формулы I может представить интерес для создания мощных взрывчатых составов и в качестве энергетического наполнителя для высокоимпульсных смесевых твердых ракетных топлив (СТРТ).
Исходный (трет-бутил-NNO-азокси)ацетонитрил (IX) получен из диаминофуразана по опубликованной методике (М.S. Klenov, О.V. Anikin, A.A. Guskov, А.М. Churakov, Yu. A. Strelenko, I.V. Ananyev, I.S. Bushmarinov, A.O. Dmitrienko, K.A. Lyssenko, V.A. Tartakovsky, "Serendipitous Synthesis of (tert-Butyl-NNO-azoxy)acetonitrile: Reduction of an Oxime Moiety to a Methylene Unit", Eur. J. Org. Chem, 2016, 22, 3845-3855).
Исходный 2-азидоанилин получен из 2-нитроанилина по опубликованной методике (J.Н, Hall, Е. Patterson, "Formation of cis,cis-1,4-Dicyano-1,3-butadienes by Thermal Decomposition of 1,2-Diazidobenzenes", J. Am. Chem. Soc, 1967, 89, 5856-5861).
Изобретение иллюстрируется следующими примерами, не ограничивающими его объем.
Пример 1. Получение хлорида 2-азидофенилдиазония (X). 2-Азидоанилин (8.1 г, 60 ммоль) и раствор NaNO2 (4.3 г, 62 ммоля) в Н2O (18 мл) последовательно прибавили к 0.8 М НСl (63 мл) при 0°С и интенсивном перемешивании. Реакционную смесь перемешивали при 0°С в течение 15 мин до полного растворения 2-азидоанилина и образования хлорида 2-азидофенилдиазония (X). (J.Н, Hall, Е. Patterson, "Formation of cis,cis-1,4-Dicyano-1,3-butadienes by Thermal Decomposition of 1,2-Diazidobenzenes", J. Am. Chem. Soc, 1967, 89, 5856-5861).
Пример 2. Получение 8,10-динитро-дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино[5',6':4,5][1,2,3]триазоло-[2,1-а][1,2,3]бензотриазол-1,3-диоксида (I).
Стадия 1. Получение (трет-бутил-NNO-азокси)(2-азидофенилгидразоно)ацетонитрила. К раствору AcONa (97.5 г, 1.19 моля) в Н2O (180 мл) последовательно прибавили ЕtOН (180 мл) и (трет-бутил-NNO-азокси)ацетонитрил (IX) (8.5 г, 60 ммоль) при перемешивании при 25°С. Полученный раствор охладили до 0°С и небольшими порциями прибавили раствор хлорида 2-азидофенилдиазония (X) (10.9 г, 60 ммоль), приготовленный как в примере 1. Реакционную смесь плавно нагрели до 25°С, перемешивали 1 ч при этой температуре. Выпавший осадок отфильтровали, сушили в вакуум-эксикаторе над Р4О10. Получили 12.4 г (71%) (трет-бутил-NNO-азокси)(2-азидофенилигидразоно)ацетонитрила в виде светло-коричневых кристаллов, т. пл. 135-137°С. Масс-спектр высокого разрешения (ESI): Найдено: m/z: 309.1183 [M+Na]+. C12H14N8O. Вычислено: m/z: 309.1184 [M+Na]+. ИК-спектр (KBr), ν/см-1: 3435 сл, 3091 сл, 2993 сл, 2974 сл, 2932 сл, 2229 ср, 2134 с, 2104 с, 1601 сл, 1540 с, 1503 ср, 1461 ср, 1398 ср, 1288 ср, 1254 ср. ЯМР 1Н (CD2Cl2, δ, м.д., J/Гц, 500.13 МГц): 1.51 (с, 9 Н, 3 СН3); 7.22-7.23 (м, 3 Н, Аr); 7.65-7.66 (м, Аr); 13.48 (уш.с, 1 Н, NH). Спектр ЯМР 13С (CD2Cl2, δ, м.д., 125.76 МГц): 25.9 (С(СН3)3); 60.9 (С(СН3)3); 112.4 (CN); 115.9 (С(6)); 119.0 (С(3)); 126.4 (С(4) и С(5)); 128.0 (С(2)); 132.3 (С(1)). Спектр ЯМР 14N (CD2Cl2, δ, м.д., 36.14 МГц): -51 (N→O, 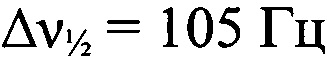 ); -140 (N=N+=N-,
); -140 (N=N+=N-, 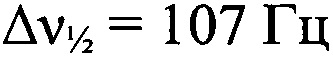 ).
).
Стадия 2. Получение 2-(трет-бутил-NNO-азокси)-N'-гидрокси-2-(2-азидофенилигидразоно)этанимидамида. К суспензии (трет-бутип-NNO-азокси)(2-азидофенилигидразоно)ацетонитрила (12.35 г, 41 ммоль) в МеОН (840 мл) прибавили при перемешивании NH2OH⋅HCl (9.00 г, 130 мммоль) и AcONa (10.63 г, 130 ммоль). Реакционную смесь нагрели до 40°С и перемешивали при этой температуре 3.5 ч. Растворитель упарили в вакууме, остаток промыли водой (50 мл) и полученный продукт очистили перекристаллизацией из AcOEt (100 мл). Получили 10.56 г (77%) 2-(трет-бутил-NNO-азокси)-N'-гидрокси-2-(2-азидофенилигидразоно)-этанимидамида в виде коричневых кристаллов, т. пл. 127-130°С. Смесь E/Z-изомеров по гидразонной группе (соотношение 2.1:1). Масс-спектр высокого разрешения (ESI): Найдено: m/z: 342.1397 [M+Na]+. C12H17N9O2. Вычислено: m/z: 342.1397 [M+Na]+. ИК-спектр (KBr), ν/см-1: 3490 ср, 3386 ср, 3286 ср, 3139 сл, 3073 сл, 2974 сл, 2928 ср, 2137 с, 1654 ср, 1575 с, 1525 ср, 1487 ср, 1437 сл, 1393 сл, 1363 ср, 1301 с, 1246 ср, 1203 сл, 1182 сл. Основной E-изомер. ЯМР 1Н (ацетон-d6, δ, м.д., J/Гц, 500.13 МГц): 1.45 (с, 9 Н, 3 Me); 5.62 (с, 2 Н, NH2); 7.04 (т, 2 Н, Н(4) и Н(5), J=7.6); 7.16 (т, 2Н, Н(4) и Н(5) Аr, J=7.6); 7.22 (д, 1 Н, Н(3), J=7.9); 7.45 (д, 1 Н, Н(6), J=8.2); 10.29 (уш.с, 1 Н, ОН); 12.07 (уш.с, 1 Н, NH). Спектр ЯМР 13С (ацетон-d6, δ, м.д., 125.76 МГц): 25.7 (С(СН3)3); 60.2 (С(СН3)3); 114.7 (С(6')); 119.5 (С(3')); 123.4 (С(4')); 126.3 (С(2')); 126.8 (С(5')); 134.7 (С(2)); 135.4 (С(1')); 147.9 (С1)). Спектр ЯМР 14N (ацетон-d6, δ, м.д., 36.14 МГц): -49 (N→O, 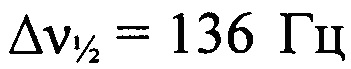 );-139 (N=N+=N-,
);-139 (N=N+=N-, 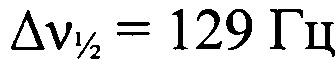 ). Минорный Z-изомер. ЯМР 1Н (ацетон-d6, δ, м.д., J/Гц, 500.13 МГц): 1.49 (с, 9 Н, 3 Me); 5.51 (с, 2 Н, NH2); 7.04 (т, 2 Н, Н(4) и Н(5), J=7.6); 7.16 (т, 2 Н, Н(4) и Н(5) Аr, J=7.6); 7.22 (д, 1 Н, Н(3), J=7.9); 7.66 (д, 1 Н, Н(6), J=8.2); 8.98 (уш.с, 1 Н, NH); 9.57 (уш.с, 1 Н, ОН). Спектр ЯМР 13С (ацетон-d6, δ, м.д., 125.76 МГц): 26.0 (С(СН3)3); 60.7 (С(СН3)3); 114.9 (С(')); 119.3 (С(3')); 123.2 (С(4')); 125.7 (С(2')); 126.8 (С(5')); 134.7 (С(2)); 134.8 (С(1')); 145.8 (С1)). Спектр ЯМР 14N (ацетон-d6, δ, м.д., 36.14 МГц): -56 (N→O,
). Минорный Z-изомер. ЯМР 1Н (ацетон-d6, δ, м.д., J/Гц, 500.13 МГц): 1.49 (с, 9 Н, 3 Me); 5.51 (с, 2 Н, NH2); 7.04 (т, 2 Н, Н(4) и Н(5), J=7.6); 7.16 (т, 2 Н, Н(4) и Н(5) Аr, J=7.6); 7.22 (д, 1 Н, Н(3), J=7.9); 7.66 (д, 1 Н, Н(6), J=8.2); 8.98 (уш.с, 1 Н, NH); 9.57 (уш.с, 1 Н, ОН). Спектр ЯМР 13С (ацетон-d6, δ, м.д., 125.76 МГц): 26.0 (С(СН3)3); 60.7 (С(СН3)3); 114.9 (С(')); 119.3 (С(3')); 123.2 (С(4')); 125.7 (С(2')); 126.8 (С(5')); 134.7 (С(2)); 134.8 (С(1')); 145.8 (С1)). Спектр ЯМР 14N (ацетон-d6, δ, м.д., 36.14 МГц): -56 (N→O, 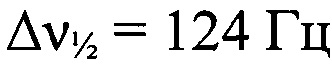 ); -139 (N=N+=N-,
); -139 (N=N+=N-, 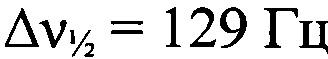 ).
).
Стадия 3. Получение 3-[(2-азидофенил)гидразоно](трет-бутил-NNО-азокси)-1,2,4-оксадиазола. HC(OEt)3 (21.9 мл, 132 ммоля) и BF3Et2O (0.35 мл, 2.9 ммоля) добавили к раствору 2-(трет-бутил-NNO-азокси)-N'-гидрокси-2-(2-азидофенилигидразоно)этанимидамида (3.5 г, 11 ммоль) в сухом ДМФА (115 мл) при 25°С в атмосфере аргона. Реакционную массу нагрели до 50°С и перемешивали 2 часа при этой температуре, затем вылили в Н2O (1000 мл), экстрагировали AcOEt (3×900 мл). Объединенный органический слой промыли Н2O (600 мл), сушили (MgSO4) и упарили в вакууме, продукт очистили препаративной колоночной хроматографией (элюент - петролейный эфир-AcOEt (2:1)). Получили 2.66 г (74%) 3-[(2-азидофенил)гидразоно](трет-бутил-NNO-азокси)-1,2,4-оксадиазола в виде желтых кристаллов, т. пл. 114-116°С (разл.). Масс-спектр высокого разрешения (ESI): Найдено: m/z: 352.1241 [M+Na]+. C13H15N9O2. Вычислено: m/z: 352.1239 [M+Na]+. ИК-спектр (KBr), ν/см-1: 3246 сл, 3110 ср, 2981 ср, 2968 ср, 2932 сл, 2874 сл, 2130 с, 1584 с, 1538 ср, 1517 ср, 1485 ср, 1459 ср, 1408 ср, 1363 ср, 1334 ср, 1288 с, 1236 с, 1186 ср, 1100 ср. Спектр ЯМР 14N (CD2Cl2, δ, м.д., 36.14 МГц): -51 (N→O, 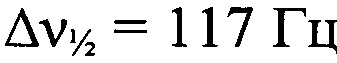 ); -140 N=N+=N-,
); -140 N=N+=N-, 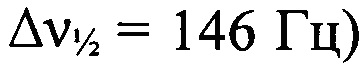 ). Основной E-изомер. ЯМР 1Н (CD2Cl2, δ, м.д., J/Гц, 500.13 МГц): 1.53 (с, 9 Н, 3 Me); 7.07-7.19 (м, 3 Н, Н(4'), Н(3'), и Н(5')); 7.58 (д, 1 Н, Н(6'), J=7.9); 8.83 (с, 1 Н, Н(5)); 12.62 (уш.с, 1 Н, NH). Спектр ЯМР 13С (CD2Cl2, δ, м.д., 125.76 МГц): 26.1 (С(СН3)3); 60.5 (С(СН3)3); 115.3 (С(6')); 118.8 (С(3')); 124.5 (С(4') или С(5')); 124.7 (С(6)); 126.4 (С(4') или С(5')); 126.8 (С(2')); 133.9 (С(1')); 163.2 (С(3)); 165.1 (С5)). Минорный Z-изомер. ЯМР 1Н (CD2Cl2, δ, м.д., J/Гц, 500.13 МГц): 1.48 (с, 9 Н, 3 Me); 7.07-7.19 (м, 3 Н, Н(4'), Н(3'), и Н(5')); 7.58 (д, 1 Н, Н(6'), J=7.9); 8.99 (с, 1 Н, Н(5)); 10.61 (уш.с, 1 Н, NH). Спектр ЯМР 13С (CD2Cl2, δ, м.д., 125.76 МГц): 25.6 (С(СН3)3); 60.3 (С(СН3)3); 115.2 (С(6')); 118.7 (С(3')); 123.9 (С(4') или С(5')); 126.3 (С(4') или С(5')); 126.5 (С(2')); 126.8 (С(1')); 134.7 (С(3)); 133.9 (С(1')); 165.2 (С5)).
). Основной E-изомер. ЯМР 1Н (CD2Cl2, δ, м.д., J/Гц, 500.13 МГц): 1.53 (с, 9 Н, 3 Me); 7.07-7.19 (м, 3 Н, Н(4'), Н(3'), и Н(5')); 7.58 (д, 1 Н, Н(6'), J=7.9); 8.83 (с, 1 Н, Н(5)); 12.62 (уш.с, 1 Н, NH). Спектр ЯМР 13С (CD2Cl2, δ, м.д., 125.76 МГц): 26.1 (С(СН3)3); 60.5 (С(СН3)3); 115.3 (С(6')); 118.8 (С(3')); 124.5 (С(4') или С(5')); 124.7 (С(6)); 126.4 (С(4') или С(5')); 126.8 (С(2')); 133.9 (С(1')); 163.2 (С(3)); 165.1 (С5)). Минорный Z-изомер. ЯМР 1Н (CD2Cl2, δ, м.д., J/Гц, 500.13 МГц): 1.48 (с, 9 Н, 3 Me); 7.07-7.19 (м, 3 Н, Н(4'), Н(3'), и Н(5')); 7.58 (д, 1 Н, Н(6'), J=7.9); 8.99 (с, 1 Н, Н(5)); 10.61 (уш.с, 1 Н, NH). Спектр ЯМР 13С (CD2Cl2, δ, м.д., 125.76 МГц): 25.6 (С(СН3)3); 60.3 (С(СН3)3); 115.2 (С(6')); 118.7 (С(3')); 123.9 (С(4') или С(5')); 126.3 (С(4') или С(5')); 126.5 (С(2')); 126.8 (С(1')); 134.7 (С(3)); 133.9 (С(1')); 165.2 (С5)).
Стадия 4. Получение 5-(трет-бутил-NNO-азокси)-4-формиламино-2-(2-азидофенил)-2H-1,2,3-триазола. t-BuOK (0.88 г, 7.8 ммоля) прибавили к раствору 3-[(2-азидофенил)гидразоно] (трет-бутил-NNO-азокси)-1,2,4-оксадиазола (2.56 г, 7.8 ммоля) в сухом ДМФА (88 мл) при 0°С в атмосфере аргона. Реакционную смесь выдержали при 0°С в течение 30 мин, затем вылили в смесь Н2O (160 мл) и НСl (конц.) (0.85 мл), экстрагировали AcOEt (3×200 мл). Объединенный органический слой промыли Н2O (100 мл), сушили (MgSO4). Растворитель упарили в вакууме, продукт очистили колоночной хроматографией на силикагеле (элюент - петролейный эфир-AcOEt (2:1, затем 1:1)). Получили 2.06 г (81%) 5-(трет-бутил-NNO-азокси)-4-формиламино-2-(2-азидофенил)-2H-1,2,3-триазола в виде желтых кристаллов, т. пл. 95-97°С. Масс-спектр высокого разрешения (ESI): Найдено: m/z: 330.1421 [М+Н]+. C13H15N9O2. Вычислено: m/z: 330.1421 [М+Н]+. ИК-спектр (KBr), ν/cm-1: 3213 сл, 3077 сл, 2974 ср, 2930 сл, 2913 сл, 2881 сл, 2136 с, 1725 с, 1683 ср, 1580 с, 1502 с, 1459 ср, 1472 ср, 1453 ср, 1396 сл, 1366 ср, 1341 сл, 1296 с, 1270 ср, 1224 с, 1163 ср, 1147 ср. ЯМР 1Н (CD2Cl2, δ, м.д., J/Гц, 500.13 МГц): 1.50 (с, 9 Н, 3 Me); 7.31 (т, 1 Н, Н(4'). J=7.6)); 7.38 (д, 1 Н, Н(6'), J=8.2); 7.57 (т, 1 Н, Н(5'), J=7.6); 7.61 (д, 1 Н, Н(3'), J=8.2); 8.80 (уш.с, 1 Н, NH); 9.09 (уш.с, 1 Н, СНО). Спектр ЯМР 13С (CD2Cl2, δ, м.д., 125.76 МГц): 26.9 (С(СН3)3); 60.4 (С(СН3)3); 120.6 (С(6')); 125.7 (С(4')); 126.4 (С(3')); 130.8 (С(2')); 131.7 (С(5')); 135.7 (С(1')); 139.2 (С(4)); 140.3 (С(5)); 160.8 (СНО). Спектр ЯМР 14N (CD2Cl2, δ, м.д., 36.14 МГц): -62 (N→O,  ); -141 (N=N+=N-,
); -141 (N=N+=N-, 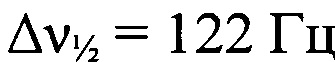 ).
).
Стадия 5. Получение 4-амино-5-(трет-бутил-NNO-азокси)-2-(2-азидофенил)-2H-1,2,3-триазола. К суспензии 5-(трет-бутил-NNO-азокси)-4-формиламино-2-(2-азидофенил)-2H-1,2,3-триазола (500 мг, 1.5 ммолей) в МеОН (11 мл) прибавили MeSO3H (0.375 мл, 5.6 ммолей) при перемешивании при 0°С. Выпал желтый осадок и полученную суспензию перемешивали 20 мин, затем вылили в Н2O (30 мл), экстрагировали AcOEt (2×40 мл), сушили (MgSO4), растворитель удалили в вакууме. Получили 409 мг (89%) 4-амино-5-(трет-бутил-NNO-азокси)-2-(2-азидофенил)-2H-1,2,3-триазола в виде светло-желтых кристаллов, т. пл. 168-170°С (разл.). Масс-спектр высокого разрешения (ESI): Найдено: m/z: 324.1292 [M+Na]+. C12H15N9O. Вычислено: m/z: 324.1293 [M+Na]+. ИК-спектр (KBr), ν/см-1: 3476 с, 3348 с, 3004 сл, 2972 ср, 2927 сл, 2140 с, 2104 с, 1616 с, 1588 ср, 1552 сл, 1504 ср, 1484 ср, 1436 ср, 1392 сл, 1360 ср, 1328 ср, 1308 ср, 1276 сл, 1248 сл, 1180 ср, 1148 ср. ЯМР 1Н (CD2Cl2, δ, м.д., J/Гц, 500.13 МГц): 1.48 (с, 9 Н, 3 Me); 5.11 (уш.с, 2 Н, NH2); 7.26 (т, Н(4'), J=7.6); 7.32 (д, 1 Н, Н(6'), J=7.9); 7.50 (т, 1 Н, Н(5'), J=7.6); 7.57 (д, 1 Н, Н(3'), J=7.9). Спектр ЯМР 13С (CD2Cl2, δ, м.д., 125.76 МГц): 26.0 (С(СН3)3); 59.7 (С(СН3)3); 120.6 (С(6')); 125.6 (С(4')); 127.4 (С(3')); 130.8 (С(5')); 131.4 (С(2')); 126.3 (С(8)); 144.7 (С(9а)); 148.4 (С(2)). Спектр ЯМР 14N (CD2Cl2, δ, м.д., 36.14 МГц): -60 (N→O, 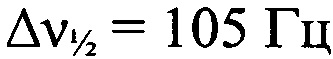 ); -140 (N=N+=N-,
); -140 (N=N+=N-, 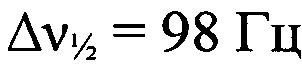 ).
).
Стадия 6. Получение 2-(2-азидофенил)-2Н-[1,2,3]триазоло[4,5-е][1,2,3,4]тетразин 4,6-диоксида. Охлажденный раствор HNO3 (111 мг, 1.76 ммоля, d=1.5 г⋅см-3) в Ас2O (2 мл) и охлажденный раствор 93%-ной H2SO4 (345 мг, 3.53 ммоля, d=1.83 г⋅см-3) в Ас2O (2 мл) последовательно добавили к суспензии 4-амино-5-(трет-бутил-NNO-азокси)-2-(2-азидофенил)-2H-1,2,3-триазола (528 мг, 1.75 ммоль) в Ас2O (6.4 мл) при -15°С и перемешивании. Плавно нагрели реакционную смесь до 25°С и перемешивали 1 ч. Реакционную смесь вылили в воду со льдом (50 мл) и перемешивали 30 мин. Экстрагировали СН2Сl2(3×80 мл), сушили (MgSO4), растворитель упарили в вакууме. Остаток перекристаллизовали из СН2Сl2 и получили 371 мг (78%) 2-(2-азидофенил)-2Н-[1,2,3]триазоло[4,5-е][1,2,3,4]тетразин 4,6-диоксида в виде оранжевых кристаллов, начинающих разлагаться без плавления при 161°С (по данным ДСК). Масс-спектр высокого разрешения (ESI): Найдено: m/z: 290.0855 [M+NH4]+. C8H4N10O2. Вычислено: m/z: 290.0857 [M+NH4]+. ИК-спектр (KBr), ν/см-1: 3069 сл, 3044 сл, 2923 сл, 2852 сл, 2134 с, 1599 сл, 1572 ср, 1545 с, 1508 ср, 1492 ср, 1426 с, 1401 с, 1341 ср, 1295 ср, 1285 ср, 1166 ср, 1084 ср, 1049 ср. ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц, 500.13 МГц): 7.50 (т, 1 Н, Н(5'), J=7.9); 7.82 (д, 1 Н, Н(4'), J=7.6); 7.88 (д, 1 Н, Н(6'), J=7.9). Спектр ЯМР 13С (ДМСО-d6, δ, м.д., 125.76 МГц): 121.6 (С(3')); 126.0 (С(5')); 127.3 (С(6')); 129.1 (С(1')); 133.5 (С(4')); 134.8 (С(2')); 137.5 (С(3а)); 153.1 (С(7а)). Спектр ЯМР 14N (ДМСО-d6, δ, м.д., 36.14 МГц): -51 (оба N→O, 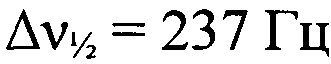 ); -142 (N=N+=N-,
); -142 (N=N+=N-, 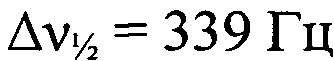 ).
).
Стадия 7. Получение дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино-[5',6':4,5][1,2,3]триазоло[2,1-а][1,2,3]бензотриазол-1,3-диоксида и дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино[5',6':4,5][1,2,3]триазоло[2,1-а][1,2,3]бензотриазол-2,4-диоксида. Суспензию 2-(2-азидофенил)-2Н-[1,2,3]триазоло[4,5-е][1,2,3,4]тетразин 4,6-диоксида (296 мг, 1.09 ммоля) в 1,2-дихлорбензоле (19 мл) перемешивали 2.5 ч при 170°С. Затем растворитель упарили в вакууме, твердый остаток промыли СН2Сl2 (10 мл) и получили 200 мг (75%) смеси дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино-[5',6':4,5][1,2,3]триазоло[2,1-а][1,2,3]бензотриазол-1,3-диоксида и дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино-[5',6':4,5][1,2,3]триазоло[2,1-а][1,2,3]-бензотриазол-2,4-диоксида в виде малинового порошка, разлагающегося без плавления при 250°С (по данным ДСК). Масс-спектр высокого разрешения (ESI): Найдено: m/z: 262.0795 [M+NH4]+. C8H3N11O4 Вычислено: m/z: 262.0795 [M+NH4]+. ИК-спектр (KBr), ν/см-1: 3096 сл, 3070 сл, 3003 сл, 1603 с, 1571 ср, 1545 с, 1527 с, 1500 ср, 1476 ср, 1427 ср, 1403 с, 1382 ср, 1362 с, 1302 сл, 1209 сл, 1130 сл, 1094 ср. Основной изомер. ЯМР 1H (ДМСО-d6, δ, м.д., J/Гц, 600.13 МГц): 7.89-7.95 (м, Н(8) и Н(9)); 8.36 (д, 1 Н, Н(10), J=8.8); 8.42-8.45 (м, Н(7)). Спектр ЯМР 13С (ДМСО-d6, δ, м.д., 150.90 МГц): 111.6 (С(7)); 115.1 (С(12а)); 119.3 (С(10)); 119.6 (С(6а)); 130.0 (С(8) или С(9)); 130.6 (С(8) или С(9)); 146.1 (С(10а)); 155.6 (С(4а)). Спектр ЯМР 14N (ДМСО-d6, δ, м.д., 43.4 МГц): -38 (N→O, 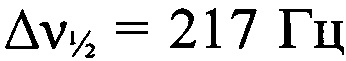 ); -70 (N→O,
); -70 (N→O, 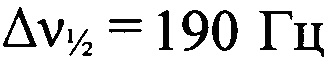 ). Минорный изомер. ЯМР 1H (ДМСО-d6, δ, м.д., J/Гц, 600.13 МГц): 7.79 (т, 1 Н, Н(8), J=8.1); 7.89-7.95 (м, Н(8) и Н(9)); 8.24 (д, 1 Н, Н(10), J=8.8); 8.42-8,45 (м, Н(7)). Спектр ЯМР 13С (ДМСО-d6, δ, м.д., 150.90 МГц): 112.2 (С(7)); 118.2 (С(6а)); 118.5 (С(10)); 127.9 (С(8) или С(9)); 131.3 (С(8) или С(9)); 148.0 (С(10а)). Спектр ЯМР 14N (ДМСО-d6, δ, м.д., 43.4 МГц): -38 (N→O,
). Минорный изомер. ЯМР 1H (ДМСО-d6, δ, м.д., J/Гц, 600.13 МГц): 7.79 (т, 1 Н, Н(8), J=8.1); 7.89-7.95 (м, Н(8) и Н(9)); 8.24 (д, 1 Н, Н(10), J=8.8); 8.42-8,45 (м, Н(7)). Спектр ЯМР 13С (ДМСО-d6, δ, м.д., 150.90 МГц): 112.2 (С(7)); 118.2 (С(6а)); 118.5 (С(10)); 127.9 (С(8) или С(9)); 131.3 (С(8) или С(9)); 148.0 (С(10а)). Спектр ЯМР 14N (ДМСО-d6, δ, м.д., 43.4 МГц): -38 (N→O, 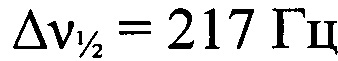 ), -70 (N→O,
), -70 (N→O, 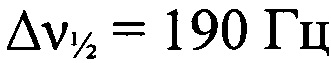 ).
).
Стадия 8. Получение 8,10-динитро-дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино[5',6':4,5] [1,2,3]триазоло-[2,1-а][1,2,3]бензотриазол-1,3-диоксида (I). К охлажденной до 0°С 93%-ной H2SO4 (9.1 г, 92.9 ммоля, d=1.83 г⋅см-3) прибавили порциями смесь дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино[5',6':4,5][1,2,3]триазоло[2,1-а][1,2,3]бензотриазол-1,3-диоксида и дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино[5',6':4,5]-[1,2,3]триазоло[2,1-а][1,2,3]бензотриазол-2,4-диоксида (168 мг, 0.69 ммоль) при перемешивании. Затем прибавили HNO3 (173 мг, 2.75 ммоля, d=1.5 г⋅см-3). Реакционную смесь нагрели до 40°С и перемешивали при этой температуре в течение 3 ч. Затем реакционную смесь вылили в воду со льдом (50 мл) и экстрагировали AcOEt (5×60 мл), сушили (MgSO4), растворитель упарили в вакууме. Твердый остаток перекристаллизовали из AcOEt (30 мл) и получили 110 мг (43%) 8,10-динитро-дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино[5',6':4,5][1,2,3]триазоло-[2,1-а][1,2,3]бензотриазол-1,3-диоксида в виде оранжевых кристаллов, разлагающихся без плавления при 194°С (по данным ДСК). Масс-спектр высокого разрешения (ESI): Найдено: m/z: 357.0057 [M+Na]+. C8H3N11O4. Вычислено: m/z: 357.0051 [M+Na]+. ИК-спектр (KBr), ν/см-1: 3091 ср, 2960 сл, 2924 сл, 2855 сл, 1583 с, 1542 с, 1498 ср, 1427 с, 1401 ср, 1372 ср, 1337 с, 1302 ср, 1276 ср, 1223 ср, 1188 сл, 1122 ср, 1050 ср. ЯМР 1H (ДМСО-d6, δ, м.д., J/Гц, 600.13 МГц): 9.32 (с, 1 Н, Н(9)); 10.00 (с, 1 Н, Н(10)). Спектр ЯМР 13С (ДМСО-d6, δ, м.д., 150.90 МГц): 116.8 (С(12а)); 118.3 (С(7)); 122.2 (С(6а)); 123.4 (С(9)); 137.2 (С(8)); 141.8 (С(10)); 145.3 (С(10а)); 156.8 (С(4а)). Спектр ЯМР 14N (ацетон-d6, δ, м.д., 43.37 МГц): -21 (C-NO2, 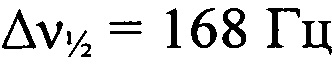 ), -37 (N→O,
), -37 (N→O, 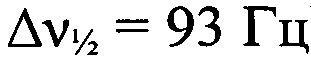 ), -61 (N→O,
), -61 (N→O, 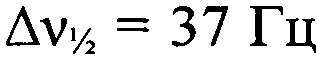 ). Спектр ЯМР 15N (ДМСО-d6, δ, м.д., 50.7 МГц): -9.0 (N(2)); -18.1 (C-NO2); -20.6 (C-NO2); -38.5 (N(3)); -63.6 (N(l)); -94.5 (N(4)); -117.5 (N(6)); -121.5 (N(12)); -137.5 (N(5)); -139.5 (N(11)).
). Спектр ЯМР 15N (ДМСО-d6, δ, м.д., 50.7 МГц): -9.0 (N(2)); -18.1 (C-NO2); -20.6 (C-NO2); -38.5 (N(3)); -63.6 (N(l)); -94.5 (N(4)); -117.5 (N(6)); -121.5 (N(12)); -137.5 (N(5)); -139.5 (N(11)).
![8,10-Динитро-дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино[5',6':4,5][1,2,3]триазоло-[2,1-a][1,2,3]бензотриазол-1,3-диоксид и способ его получения](https://fips.edrid.ru/images/rid/b6/23/1a/e4b23f311f0a7c3bdbc80cc5d1e7dbab.jpg)
![8,10-Динитро-дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино[5',6':4,5][1,2,3]триазоло-[2,1-a][1,2,3]бензотриазол-1,3-диоксид и способ его получения](https://fips.edrid.ru/images/rid/b6/23/1a/7275df38729a61a0e80c234223261fe4.jpg)

