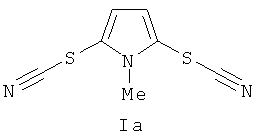Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ N-ЗАМЕЩЕННЫХ 2,5-ДИТИОЦИАНАТО-1Н-ПИРРОЛОВ
Вид РИД
Изобретение
Настоящее изобретение относится к области органической химии, а именно к способу получения N-замещенных 2,5-дитиоцианато-1H-пирролов общей формулы
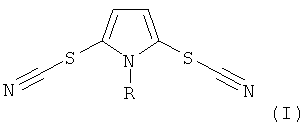
где R = низший алкил или фенил; соединения I обладают противогрибковой активностью.
На основе N-замещенных 2,5-дитиоцианато-1H-пирролов (I) могут быть созданы новые эффективные противогрибковые лекарственные средства.
В связи с ограничениями при применении известных лекарственных средств и постоянно растущей резистентностью к ним продолжается интенсивный поиск веществ с высокой противогрибковой активностью. В этом плане очень перспективными представляются органические тиоцианаты, некоторые представители которых обладают противогрибковой активностью [Н. Dolman, A. Tempel, Н. Koopman, K. Wellinga, D. Hamminga. The chemistry and fungicidal and phytotoxic properties of arylsulfonyl-, arylsulfinyl- and arylthio-alkyl thiocyanates. Recueil des Travaux Chimiques des Pays-Bas. 88, 417 (1969); F. Pavanetto, L. Montanari, T. Modena, B. Conti. Antimycotic Agents - Evaluation of Some Derivatives of 2-Thiocyanobenzoic Acid. Farmaco-Ed. Sci. 40, 576 (1985); П.И. Ягодинец, О.В. Скрипская, Н.Г. Проданчук, И.Н. Чернюк, В.Г Синченко, Г.М. Дозирцив, М.Я. Питык. Синтез и противомикробная активность производных фосфор- и азотсодержащих кумаринов. Химико-фармацевтический журнал. 29, 49 (1995); N.S. Radulovic, М.S. Dekic, Z.Z. Stojanovic-Radic, Antimicrobial volatile glucosinolate autolysis products from Hornungia petraea (L.) Rchb. (Brassicaceae). Phytochemistry Letters. 5, 351 (2012)]. Такие фунгициды, как 2,4-динитрофенилтиоцианат [Патент US 2433106 (1947)] и 2-тиоцианатометилтиобензотиазол [Патент US 0211574А1 (2006)], нашли применение в сельском хозяйстве.
В литературе описано получение 2,5-дитиоцианато-N-метилпиррола [J.S. Yadav, В.V.S. Reddy, S. Shubashree, К. Sadashiv. Iodine/MeOH: а novel and efficient reagent system for thiocyanation of aromatics and heteroaromatics. Tetrahedron Lett. 45, 2951 (2004)], который получается как побочный продукт с выходом 10-15% (определен в статье приблизительно) реакцией N-метилпиррола с тиоцианатом аммония и йодом в метаноле при комнатной температуре. Известный способ не направлен на получение 2,5-дитиоцианато-N-метилпиррола и, как следствие, недостатком является его низкий выход.
Известен и принят нами за прототип способ получения N-замещенных 2,5-дитиоцианато-1H-пирролов общей формулы I, R = Me или фенил, который заключается во взаимодействии тиоцианата калия с соответствующим пирролом под действием Br2 (окислителя) в среде метанола (MeOH) при низких температурах [Патент NL6617755A (1967)]. В диапазоне температур -65 - (-55°С) к смеси 300 г KSCN и 500 мл MeOH добавляли по каплям раствор 74,5 мл Br2 (окислителя) в 200 мл МеОН, затем прикапывали свежеперегнанный раствор 48,6 г N-метилпиррола (0,6 моль) в 200 мл МеОН, перемешивали 40 минут, выливали в 1000 мл воды и перемешивали 0,5 часа, фильтровали выпавший осадок, промывали водой и сушили. Получали 91 г (0,47 моль, выход 78%) N-метил-2,5-дитиоцианато-1H-пиррола, т.пл. 118-120° (этанол). Аналогично получали N-фенил-2,5-дитиоцианато-1H-пиррол (выход не указан), т.пл. 162-164°C (бензол-лигроин). В этом же патенте приводятся данные об изучении противогрибковой активности полученных соединений.
Недостатком известного способа является проведение процесса при низких температурах, а также использование токсичного и опасного реагента Br2.
Задачей настоящего изобретения является упрощение способа получения N-замещенных 2,5-дитиоцианато-1H-пирролов I и повышение безопасности и экологичности процесса.
Поставленная задача достигается предложенным способом получения N-замещенных 2,5-дитиоцианато-1H-пирролов общей формулы I
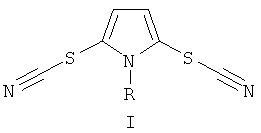
где R = низший алкил или фенил, путем взаимодействия тиоцианата калия (KSCN) с соответствующим N-замещенным-1H-пирролом под действием окислителя в среде органического растворителя, согласно изобретению в качестве окислителя используют пероксодисульфат калия (K2S2O8), в качестве органического растворителя - водный раствор ацетонитрила и процесс ведут в присутствии катализатора водного сульфата меди (CuSO4•5H2O) при комнатной температуре и мольном соотношении KSCN:CuSO4•5H2O:K2S2O8:N-замещенный-1H-пиррол 3-4:0,1-0,2:2:1 по следующей схеме:
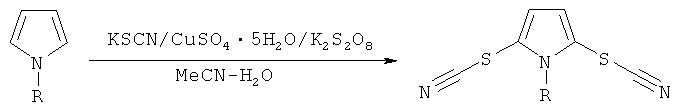
Выход целевого продукта составляет 71-82%.
В предложенном процессе тиоцианирования KSCN является донором тиоцианогруппы; CuSO4•5H2O является катализатором синтеза, в его отсутствие процесс протекает с низкой конверсией исходных N-замещенных-1H-пирролов и низкими выходами N-замещенных 2,5-дитиоцианато-1H-пирролов (I) (сравнительный пример 3). Персульфат калия (K2S2O8) является доступным, технологичным окислителем (широко используется в коммерчески доступных моющих средствах); в прототипе окислителем является токсичный и опасный бром. Использование системы ацетонитрил - вода позволяет увеличить растворимость солей по сравнению с безводным ацетонитрилом, что позволяет более эффективно вводить соли в зону реакции. Проведение процесса при предлагаемом соотношении реагентов (3-4 моль KSCN, 0,1-0,2 моль CuSO4•5H2O и 2 моль K2S2O8 в расчете на 1 моль исходного N-замещенного-1H-пиррола) является существенным для данного процесса. При увеличении (сравнительный пример 4) и уменьшении (сравнительный пример 5) количеств CuSO4•5H2O и K2S2O8 выход N-замещенных 2,5-дитиоцианато-1H-пирролов (I) снижается; в случае увеличения количеств CuSO4•5H2O и K2S2O8 образуются смолы, а в случае уменьшения не достигается полная конверсия исходных N-замещенных-1H-пирролов.
В целом только такая совокупность реакционных условий обеспечивает полную конверсию исходных N-замещенных-1H-пирролов и позволяет получать N-замещенные 2,5-дитиоцианато-1H-пирролы I с высоким выходом.
Технический результат - упрощение и повышение безопасности получения N-замещенных 2,5-дитиоцианато-1H-пирролов за счет замены токсичного и опасного окислителя брома на пероксодисульфат калия и проведения процесса при комнатной температуре, а не при охлаждении - 65 - (-55°C).
Изобретение соответствует критерию «новизна», так как в известной научно-технической и патентной литературе отсутствует полная совокупность признаков, характеризующих предлагаемое изобретение.
Предлагаемое изобретение соответствует критерию «изобретательский уровень». До начала исследований было не очевидно, что дитиоцианаты можно получать таким способом. При использовании других условий синтеза и соотношения реагентов образуются трудноразделимые смеси продуктов моно- и дитиоцианирования и исходных соединений, в результате этого проведение синтеза теряет практический смысл. Также соотношение реагентов влияет на образование полимеров (смол) в реакции; известно, что пирролы легко полимеризуются под действием окислителей и даже при хранении на воздухе [J.М. Nadeau, Т.М. Swager. New β-linked pyrrole monomers: approaches to highly stable and conductive electrochromic polymers. Tetrahedron 60, 7141 (2004)]. Предложенная совокупность отличительных признаков позволила избежать процессов полимеризации (осмоления) как исходных пирролов, так и продуктов реакции.
Изобретение соответствует условию «промышленная применимость», поскольку предложен безопасный способ получения соединений формулы I, которые обладают противогрибковой активностью, аналогичной по уровню флуконазолу и амфотерицину. Поскольку это сравнительно новый класс противогрибковых соединений, то к нему, в отличие от уже существующих препаратов, у грибов не выработалась резистентность. На основе N-замещенных 2,5-дитиоцианато-1H-пирролов могут быть созданы новые эффективные противогрибковые лекарственные средства.
Изобретение иллюстрируется следующими примерами, не ограничивающими его объем.
Пример 1. Получение N-метил-2,5-дитиоцианато-1H-пиррола
Тиоцианат калия 6 ммоль (0,81 г) растворяли в 10 мл MeCN-H2O (7 мл + 3 мл), добавляли при перемешивании CuSO4•5H2O 0,2 ммоля (0,05 г), N-метил-1H-пиррола 2 ммоля (0,16 г) и K2S2O8 4 ммоля (1,08 г). Перемешивали реакционную массу 12 ч, растворитель удаляли в вакууме водоструйного насоса, добавляли 25 мл воды и экстрагировали 5×20 мл CH2Cl2. К объединенным органическим фракциям добавляли 20 мл петролейного эфира, сушили над безводным Na2SO4, фильтровали и растворитель удаляли в вакууме водоструйного насоса. Дальнейшую очистку проводили с использованием колоночной хроматографии на SiO2 (элюент петролейный эфир-этилацетат с увеличением объемной доли последнего от 5% до 20%). Выход N-метил-2,5-дитиоцианато-1N-пиррола (Iа) (1,64 ммоля), 82%. Бесцветные кристаллы. Т.пл. 117-119°C (Лит.118-120°C [Патент NL 6617755A (1967)]). Спектр ЯМР 1H (300,13 МГц, CDCl3): δ 3,90; 6,74. Спектр ЯМР 13C (75,48 МГц, CDCl3): δ 32,86; 108,46; 113,89; 120,89.
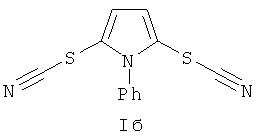
Пример 2. Получение N-фенил-2,5-дитиоцианато-1H-пиррола
Тиоцианат калия 8 ммоль (1,08 г) растворяли в 10 мл MeCN-H2O (7 мл + 3 мл), добавляли при перемешивании CuSO4•5H2O 0,4 ммоля (0,1 г), 1-N-фенил-1H-пиррол 2 ммоля (0,29 г) и K2S2O8 4 ммоля (1,08 г). Перемешивали реакционную массу 12 ч, растворитель удаляли в вакууме водоструйного насоса, добавляли 25 мл воды и экстрагировали 5×20 мл СН2Сl2. К объединенным органическим фракциям добавляли 20 мл петролейного эфира, сушили над безводным Na2SO4, фильтровали и растворитель удаляли в вакууме водоструйного насоса. Дальнейшую очистку проводили с использованием колоночной хроматографии на SiO2 (элюент петролейный эфир-этилацетат с увеличением объемной доли последнего от 5% до 20%).
Выход N-фенил-2,5-дитиоцианато-1H-пиррола (Iб) (1,42) ммоля, 71%. Бесцветные кристаллы. Т. пл. 162-164°C (162-164°C [Патент NL6617755A (1967)]). Спектр ЯМР 1H (300,13 МГц, CDCl3): δ 6,90 (с, 2H); 7,31-7,46 (м, 2H); 7,57-7,74 (м, 3H). Спектр ЯМР 13C (75,48 МГц, CDCl3): δ 109,90; 115,80; 121,33; 128,95; 129,92; 130,60; 135,30.
Пример 3 (сравнительный). Получение N-метил-2,5-дитиоцианато-1H-пиррола без катализатора CuSO4•5H2O
Тиоцианат калия 6 ммоль (0,81 г) растворяли в 10 мл MeCN-H2O (7 мл + 3 мл), добавляли при перемешивании N-метил-1H-пиррол 2 ммоля (0,16 г) и K2S2O8 4 ммоля (1,08 г). Перемешивали реакционную массу 12 ч, растворитель удаляли в вакууме водоструйного насоса, добавляли 25 мл воды и экстрагировали 5×20 мл CH2Cl2. К объединенным органическим фракциям добавляли 20 мл петролейного эфира, сушили над безводным Na2SO4, фильтровали и растворитель удаляли в вакууме водоструйного насоса. Дальнейшую очистку проводили с использованием колоночной хроматографии на SiO2 (элюент петролейный эфир-этилацетат с увеличением объемной доли последнего от 5% до 20%). Выход N-метил-2,5-дитиоцианато-1H-пиррола (0,36 ммоля), 18%. Бесцветные кристаллы. Т.пл. 117-119°C (Лит. 118-120°C [Патент NL 6617755A (1967)]).
Пример 4 (сравнительный). Получение N-фенил-2,5-дитиоцианато-1H-пиррола с увеличенным в четыре раза количеством реагентов CuSO4•5H2O и K2S2O8
Тиоцианат калия 8 ммоль (1,08 г) растворяли в 10 мл MeCN-H2O (7 мл + 3 мл), добавляли при перемешивании CuSO4•5H2O 1,6 ммоля (0,4 г), N-фенил-1H-пиррол 2 ммоля (0,29 г) и K2S2O8 16 ммоля (4,32 г). Перемешивали реакционную массу 12 ч, растворитель удаляли в вакууме водоструйного насоса, получали густую смолистую массу, добавляли 25 мл воды и экстрагировали 5×20 мл CH2Cl2. К объединенным органическим фракциям добавляли 20 мл петролейного эфира, сушили над безводным Na2SO4, фильтровали и растворитель удаляли в вакууме водоструйного насоса. Дальнейшую очистку проводили с использованием колоночной хроматографии на SiO2 (элюент петролейный эфир-этилацетат с увеличением объемной доли последнего от 5% до 20%).
Выход N-фенил-2,5-дитиоцианато-1H-пиррола (0,54 ммоля), 27%. Бесцветные кристаллы. Т.пл. 162-164°C (162-164°C [Патент NL6617755A(1967)]).
Пример 5 (сравнительный). Получение N-фенил-2,5-дитиоцианато-1H-пиррола с уменьшенным в два раза количеством реагентов CuSO4•5H2O и K2S2O8
Тиоцианат калия 8 ммоль (1,08 г) растворяли в 10 мл MeCN-H2O (7 мл +3 мл), добавляли при перемешивании CuSO4•5H2O 0,2 ммоля (0,05 г), N-фенил-1H-пиррол 2 ммоля (0,29 г) и K2S2O8 2 ммоля (0,54 г). Перемешивали реакционную массу 12 ч, растворитель удаляли в вакууме водоструйного насоса, добавляли 25 мл воды и экстрагировали 5×20 мл CH2Сl2. К объединенным органическим фракциям добавляли 20 мл петролейного эфира, сушили над безводным Na2SO4, фильтровали и растворитель удаляли в вакууме водоструйного насоса. Дальнейшую очистку проводили с использованием колоночной хроматографии на SiO2 (элюент петролейный эфир-этилацетат с увеличением объемной доли последнего от 5% до 20%).
Выход N-фенил-2,5-дитиоцианато-1H-пиррола (Iб) (0,74) ммоля, 37%. Бесцветные кристаллы. Т.пл. 162-164°C (162-164°C [Патент NL 6617755A(1967)]).
Определение антигрибковой активности предлагаемых в настоящем способе соединений проводили в соответствии с Методическими указаниями МУК 4.2.1890-04 по определению чувствительности микроорганизмов к антибактериальным препаратам [Н.А. Семина, С.В. Сидоренко, С.П. Резван, С.Л. Грудинина, Л.С Страчунский, О.У. Стецюк, Р.С. Козлов, М.В. Эйдельштейн, Е.А. Ведьмина, Л.Г. Столярова, И.В. Власова, З.С. Середа. Определение чувствительности микроорганизмов к антибактериальным препаратам. Методические указания МУК 4.2.1890-04. Клиническая микробиология и антимикробная химиотерапия. 6, 306 (2004)] и рекомендациями Clinical and Laboratory Standards Institute [Approved standard third edition. M27-A3, Wayne, PA, USA (2008)]. Тестирование проводилось на контрольных штаммах Candida albicans АТСС 43433 (С.А.), Aspergillus niger 37a (A.N.), и клинических изолятах Candida krusei 432M (C.K.), и Candida tropicalis 30.1.9 (С.Т.). Хранение дрожжевых культур (C.A., C.K., С.Т.) осуществлялось в триптиказосоевом бульоне с добавлением 10-15% глицерина при температуре - 75°C. Филаментозные грибные штаммы (A.N.) поддерживали на агаризованной солодовой питательной среде.
Оценку активности образцов в отношении грибных культур проводили микрометодом серийных разведений в среде RPMI 1640 (Gibco) (с глюкозой и не содержащей карбонат).
Для контроля правильности проведенного анализа в качестве стандартов сравнения использовались Amphotericin В (Alpharma) и Fluconazole (Дифлюкан) (Pfizer).
Подготовка образцов для анализа. Образцы N-замещенных 2,5-дитиоцианато-1H-пирролов Iа и Iб растворяли в диметилсульфоксиде (DMSO); концентрация рабочего раствора составляла 10000 мкг/мл.
Подготовка культур для анализа. Для активации культуры высевались на агаризованную среду №1, которую инкубировали 18 часов при температуре 37°C.
Проведение тестирования на активность. Сериями двукратных разведений из N-замещенных 2,5-дитиоцианато-1H-пирролов Iа и Iб готовили образцы в питательной среде объемом 50.0 мкл в 96-луночных планшетах для иммунологических исследований. Начальная концентрация каждого образца составляла 250.0 мкг/мл, конечная - 0.0015 мкг/мл. Раствор DMSO в первой экспериментальной лунке (концентрация 2%) не проявлял антигрибкового действия.
Для приготовления инокулята из изолированных колоний дрожжевых культур (С.А., С.К., С.Т.) готовили суспензию в питательной среде RPM I 1640 по стандарту мутности McFarland 0,5, что соответствует 106KOE/мл.
Серию двукратных разведений испытуемых образцов готовили в объеме 100 мл. После посева дрожжевых культур планшеты инкубировали 48 часов при 30°C.
Для инокулята филаментозных грибов (A.N.) готовили суспензию конидий или спороконидий в титре 1-5×104 KOE/мл. Оценку чувствительности осуществляли после инкубации при 35°С в течение 48-72 часов.
За МПК принимали наименьшую концентрацию растворов образцов, при которой отсутствовал видимый рост микроорганизмов. Все эксперименты повторяли трехкратно.
|