Результат интеллектуальной деятельности: Способ преимплантационного генетического тестирования Гемофилии А
Вид РИД
Изобретение
Изобретение относится к преимплантационному генетическому тестированию моногенных заболеваний. В настоящее время в мире насчитывается более 350 миллионов людей, страдающих редким заболеванием (по данным RARE Project). Общее количество таких заболеваний по подсчетам European Organization for Rare Diseases (EURORDIS) варьируется от 5 до 7 тысяч. При этом около 80% редких заболеваний имеют генетическую причину. Известная генетическая основа заболевания позволяет с высокой точностью предсказать не только здоровье уже родившегося ребенка, но и оценить риск рождения такого ребенка при анализе генотипов родителей, а также провести генетическую диагностику на самых ранних этапах. Преимплантационное генетическое тестирование (ПГТ) моногенного заболевания становится мощным инструментом для профилактики таких заболеваний.
Настоящее изобретение относится к способу преимплантационного генетического тестирования Гемофилии А. Гемофилия А - это наследственная коагулопатия, имеющая Х-сцепленный характер наследования и встречающаяся преимущественно у мальчиков. Гемофилия А встречается с частотой 17.1 на 100000 среди мужского пола. Это заболевание приводит к нарушению механизма свертываемости крови, что приводит к кровотечениям различной локализации. Характерны длительные кровотечения после порезов, травм, хирургических вмешательств и стоматологических манипуляций, внутрисуставные и внутримышечные кровоизлияния, кровотечения в желудочно-кишечном тракте. В тяжелых случаях наблюдаются спонтанные внутренние кровотечения. Изредка, когда заболевание проявляется у женщин, оно вызывает длительные и обильные менструации. Хроническая потеря крови делает больных гемофилией А людей склонными к железодефицитной анемии. При Х-сцепленном рецессивном типе наследования заболевания вероятность рождения ребенка с этим заболеванием в семье составляет около 25% (50% для детей мужского пола).
К заболеванию гемофилия А могут приводить патогенные генетические варианты в гене F8, располагающемся на хромосоме X [Graw, J. et al. Nat Rev Genet 6, 488-501 (2005)]. Этот ген кодирует белок Фактор свертывания крови VIII, играющий важную роль в каскаде реакций коагуляции крови, возникающих в ответ на повреждение сосудистой стенки: при участии других факторов, он активирует фактор свертывания крови X. Посредством следующих реакций каскада, он способствует превращению фибриногена в фибрин - основу тромба.
ПГТ Гемофилии А проводится для семей, имеющих подтвержденную молекулярно-генетическую природу заболевания. Важно отметить, что обоснование патогенности и каузативности генетических вариантов происходит до проведения ПГТ моногенного заболевания и не входит ни цели и задачи ПГТ моногенного заболевания, ни в комплекс мероприятий по проведению ПГТ моногенного заболевания. Оценку патогенности проводят по международному стандарту - по критериям, описанным в 2015 году Американским Колледжем Медицинской генетики и Геномики (American College of Medical Genetics and Genomics-Association for Molecular Pathology (ACMG-AMP)) в ходе поиска молекулярно-генетической причины заболевания. ПГТ рекомендуется семьям с высоким риском рождения ребенка с тяжелым (неизлечимым) наследственным заболеванием с установленным патогенными вариантом, обуславливающим этот риск. ПГТ позволяет выбрать из всех эмбрионов, полученных при ЭКО (экстракорпоральном оплодотворении), эмбрионы без патогенного варианта и, следовательно, без риска развития заболевания.
Основной проблемой при генетической диагностике эмбрионов является малое исходное количество биоматериала, так как биоптат содержит от одной до трех клеток. В этом случае для повышения эффективности и точности анализа важно как полностью исключить возможность контаминации, так и нивелировать возможный эффект неравномерной и/или неполной амплификации, а также деградации биоматериала. Это требует разработки тест-системы с особыми характеристиками. При этом тест-система разрабатывается с учетом возможности использовать биоматериал разного типа - тотальную дезоксирибонуклеиновую, кислоту (ДНК), выделенную из разных тканей, продукт полногеномной амплификации (Whole Genome Amplification, WGA), а также единичные клетки. Сочетание универсальности по отношению к биоматериалу с поэтапной амплификацией целевых фрагментов позволяет проводить анализ нескольких патогенных вариантов для одного образца, в том числе на единичных клетках, а также выявить ситуацию неполной амплификации, контаминации или деградации образца. Еще одной особенностью ПГТ является отсутствие информации о биологических особенностях эмбриона: в отличие от взрослого человека, у эмбриона могут быть любые хромосомные аномалии, которые усложняют задачу оценки статуса эмбриона по конкретному генетическому варианту. Поэтому тест-система для ПГТ моногенного заболевания должна давать возможность выявить такие случаи и оценить их влияние на достоверность результата диагностики.
Наиболее близким техническим решением является проведение ПГТ Гемофилии А предложенное Ming Chen и коллегами [Ming Chen et al., 2016] для диагностики однонуклеотидной замены в одном случае, и классической инверсии экзона 22 гена F8 в другом. Для первой семьи было использовано сочетание прямой диагностики и анализа сцепленных полиморфных маркеров, для второй - только анализ полиморфных маркеров, при этом маркеров в обоих случаях было не более 5-ти. Важным преимуществом предлагаемого нами подхода является использование большего количества полиморфных маркеров для косвенной диагностики, что снижает вероятность недостоверного результата из-за выпадения аллеля или рекомбинации.
Представленный нами метод ПГТ Гемофилии А решает задачу разработки более точного способа преимплантационного генетического тестирования этого моногенного заболевания без использования дорогостоящих приборов и реагентов, который можно было бы применять на биоматериале различного типа: ДНК, выделенную из разных тканей, продукт полногеномной амплификации (WGA), единичные клетки.
Техническим результатом стало создание тест-системы для диагностики патогенного варианта (номер нуклеотида в референсной последовательности геномной ДНК обозначен префиксом NC, номер нуклеотида в референсной последовательности кодирующего транскрипта обозначен префиксом NM): NC_000023.10:g.154221234C>T (NM_000132.3:c.578G>A, p.Gly193Glu) [Santacroce R. (2008) Journal of human genetics. 53. 275-84] в гене F8 с двойной системой детекции - прямой и косвенной. Такая система необходима при работе с малым количеством биоматериала, так как нестабильная амплификация может привести к потере информации или сниженной точности анализа. Прямая диагностика подразумевает анализ непосредственно наличия-отсутствия патогенного варианта. В данном случае для генетического варианта NC_000023.10:g.1542212340Т (NM_000132.3:c.578G>A, p.Gly193Glu) типа однонуклеотидный полиморфизм (ОНП, англ. Single nucleotide polymorphism SNP) были подобраны эндонуклеазы рестрикции, которые позволяют произвести детекцию патогенного варианта методом ПЦР-ПДРФ (полиморфизм длин рестриктных фрагментов), основанным на разнице последовательности в сайте рестрикции у различных аллелей. Косвенная диагностика заключается в анализе наследования молекулярно-генетических маркеров, сцепленных с мутацией, т.е. наследуемых вместе с ней. Для этого на расстоянии не более 4 мБ (что соответствует 4% кроссинговера в среднем) от гена F8 в каждую сторону были выбраны полиморфные локусы, называемые STR (short tandem repeat - короткий тандемный повтор), с гетерозиготностью не менее 0,70 для обеспечения максимальной информативности косвенной диагностики. STR представляют собой повторы 2х и более нуклеотидов расположенные друг за другом (например пара аденин-цитозин (АЦ), повторяющаяся несколько раз подряд: АЦАЦАЦАЦ) и в большом количестве присутствуют в геноме человека. Количество повторов в каждом из них может варьироваться от индивидуума к индивидууму, а также может быть разным у одного и того же человека на 2х гомологичных хромосомах. Гетерозиготность выше 0,70 означает, что высока вероятность того, что у одного и того же человека количество повторов нуклеотидов в данном STR на одной хромосоме будет отличаться от количества повторов в этом же STR на гомологичной хромосоме, другими словами, аллели данного маркера у этого человека будут отличаться между собой по длине. При амплификации фрагмента, содержащего такой маркер, будут получены ампликоны двух разных длин. Проанализировав количество повторов в нескольких маркерах, окружающих патогенный вариант, и изучив то, как они наследуются в тестируемой семье, можно установить сцепление между аллелями маркеров и патогенным вариантом. Диагностическая ценность исследования количества повторов в данных маркерах у эмбрионов состоит в том, что по тому, какой аллель каждого из маркеров был унаследован эмбрионом, можно судить о том, унаследовал ли эмбрион ген F8, несущий патогенный вариант, или же он унаследовал ген F8 с другой, гомологичной хромосомы, не содержащий патогенный вариант. Для каждого из этих локусов были подобраны праймеры для амплификации по типу гнездовой или полугнездовой ПЦР в 2 раунда, позволяющей повысить точность и эффективность амплификации. В тест-систему были включены 18 STR локусов для гена F8: DXS8086, DXS1684, DXS8061, DXS152.5, DXS152.60, DXS152.6, DXS9901, DXS8087, DXS153.3, DXS1073, НА472, DXS154.0, DXS154.6, DXS154.7, DXS154.8, DXS1108, DXS154.9, DXYS154. Праймеры для амплификации находятся на X хромосоме в районе координат 149420414-155078301 (в соответствии с hg19). Последовательности праймеров перечислены в формуле изобретения в перечне SEQ ID NO 1-58. Важно отметить, что при подборе праймеров соблюдали ряд особенных требований: длина продукта с внешними праймерами для первого раунда ПЦР не должна превышать 500 п.н. (для наработки с фрагментов, получаемых при полногеномной амплификации), длина продукта с внутренних праймеров для второго раунда ПЦР от 120 до 350 п.н., высокая специфичность внешних праймеров, температура отжига не отличается более чем на 1°С.
Подготовительный этап ПГТ
На подготовительном этапе проводится отработка тест-системы: подбор условий амплификации, оптимальных для работы праймеров, анализ эффективности и специфичности ПЦР-амплификации в обоих раундах, оценки универсальности тест-системы для биообразцов различного типа (ДНК, продукт WGA, единичные клетки). При отработке тест-системы были приготовлены стоковые разведения праймеров с концентрацией 100 mM, и рабочие разведения комбинаций праймеров (комбинация пар праймеров для 1 и 2 раунда ПЦР) с концентрацией 10 mM каждого праймера в растворе. Последовательности праймеров перечислены в формуле изобретения в перечне SEQ ID NO 1-58. Так как в рамках диагностики клинического материала могут быть использованы различные типы матриц, при отработке тест-системы были использованы две биопсии единичных клеток, находящихся в специальном лизирующем буфере (1×PCR Buffer, 0,1% Tween-20, 0,1% Triton X-100, 1 мкг Proteinase K), два образца продуктов полногеномной амплификации биопсиий эмбриона (WGA), а также тотальной ДНК членов семьи, выделенной из крови, для составления родословной и выявления сцепления патогенного варианта с аллелями полиморфных маркеров.
В рамках гнездовой и полугнездовой ПЦР амплификация проводится в два этапа. На первом этапе проводится мультиплексная ПЦР со всеми внешними праймерами для всех локусов, входящих в тест-систему, для обогащения образца всеми целевыми фрагментами. На втором этапе проводится индивидуальная амплификация каждого фрагмента с внутренними праймерами.
Полугнездовая ПЦР
Для первого этапа были подобраны внешние высокоспецифичные праймеры для амплификации фрагментов от 300 до 500 п. н. Для второго этапа были подобраны праймеры для амплификации фрагментов длиной не более 350 пар оснований, а также были введены метки для детекции методом фрагментного анализа. ПЦР-смесь для первого раунда амплификации содержала 1×ПЦР буфера с Mg2+(Евроген, Россия), 0.1 mM каждого деоксинуклеотида, 0.15 μМ каждого праймера, 2,5 U/μl ДНК полимеразы HsTaq (Евроген, Россия), 6% диметилсульфоксида (DMSO) и 1 мкл тотальной ДНК или 2,5 мкл WGA или 5 мкл лизирующего буфера с образцом в качестве матрицы. Первый этап амплификации проводился по следующему протоколу: этап денатурации 94°С в течение 2 минут, 30 циклов с понижением температуры отжига праймеров с 62 до 45°С в каждом, этап достройки всех матриц 72°С 10 минут. Далее продукты 1-го этапа были разнесены в индивидуальные пробирки с одной парой праймеров на определенный локус.
В состав ПЦР смеси для второго этапа входили 1×PCR буфер с Mg2+(Евроген, Россия), 0.5×RediLoad™ загрузочный буфер (Thermo Fisher Scientific, USA), 0.2 mM каждого деоксинуклеотида, 0.2 μМ каждого праймера, 1U/μl ДНК полимеразы HsTaq (Евроген, Россия), 6% диметилсульфоксида (DMSO) и 1 μl ПЦР-продукта первого этапа амплификации в качестве матрицы. Второй этап амплификации проводился по следующему протоколу: этап денатурации 95°С в течение 2 минут, 35 циклов: денатурация 95°С 30 секунд, отжиг праймеров - 57°С 30 секунд, синтез матрицы - 72°С 1 минута, этап достройки всех матриц 72°С 5 минут. Оценку эффективности и специфичности амплификации проводили с помощью электрофореза в 2% агарозном геле. Результат электрофореза в агарозном геле позволяет определить необходимую степень разведения продуктов амплификации для нанесения на фрагментный анализ (продукты амплификации ДНК членов семьи).
Фрагментный анализ продуктов амплификации проводили с помощью капиллярного электрофореза на приборе 3130×I Genetic Analyzer (Applied Biosystems, USA). По результатам фрагментного анализа составляется родословная и отмечаются информативные полиморфные STR-локусы для каждой семьи, которые в дальнейшем будут использованы в клинической диагностике. Локусы делятся на неинформативыне (носитель патогенного варианта гомозиготен по этому локусу), полуинформативные (на некоторых и родительских хромосом аллели по этому маркеру совпадают), информативные (на всех хромосомах родителей аллели этого маркера разные, что дает возможность отличить каждую из них при анализе генотипа эмбриона).
Полимеразная цепная реакция - полиморфизм длин рестрикционных фрагментов (ПЦР-ПДРФ)
Полиморфизм длин рестрикционных фрагментов (Restriction fragment length polymorphism, RFLP) - это способ исследования геномной ДНК, путем специфичного расщипления ДНК с помощью эндонуклеаз рестрикции и дальнейшего анализа размеров образующихся фрагментов (рестриктов) путем гель-электрофореза. При использовании данного метода наблюдаются фрагменты различной длины в зависимости от различий в последовательности нуклеотидов в сайте рестрикции, что позволяет детектировать однонуклеотидные варианты, если они располагаются в сайте рестрикции. Более точную детекцию патогенного варианта может обеспечить секвенирование по методу Сэнгера, однако в условиях ПГТ метод ПЦР-ПДРФ оказывается более эффективным из-за сниженной вероятность выпадения аллеля (allele drop out, ADO) и, как следствие, ошибочного результата по оценке статуса эмбриона по патогенному варианту.
Для прямой детекции патогенного варианта NC_000023.10:g.154221234С>Т (NM_000132.3:c.578G>A, p.Gly193Glu) была разработана тест-система на основе ПЦР-ПДРФ. Стадия амплификации подробно описана в предыдущем разделе. Были использованы следующие праймеры:
Внешние:
5'-TATTCTCCTTTCCATGAGCAT-3' (прямой) 5'-GATAAAGTCTTCCCTGGTGG-3' (обратный)
Внутренние
5'-ACCCACTGTGCCTTACCTA-3' (обратный для детекции нормального аллеля) в сочетании с внешним прямым
5'-TTGAATTCAGGCCTCACTG-3' (обратный для детекции мутантного аллеля) в сочетании с внешним прямым.
Далее продукты амплификации с внутренних праймеров для детекции патогенного варианта использовали в реакции рестрикции. Эндонуклеаза BspLI разрезает только аллель дикого типа, эндонуклеаза Eco57I разрезает только мутантный аллель варианта NC_000023.10:g.154221234C>T (NM_000132.3:c.578G>A, p.Gly193Glu). Детекция проводилась с помощью электрофореза в 12% полиакриламидном геле.
Пример 1
Пациенты А
В ЦГРМ Генетико обратилась семья А, в которой супруга была носителем патогенного варианта NC_000023.10:g.154221234C>T (NM_000132.3:c.578G>A, p.Gly193Glu) в гене F8, а ее отец страдал заболеванием гемофилия А. Паре было рекомендовано проведение ПГТ заболевания гемофилия А в рамках ЭКО для отбора эмбрионов, не унаследовавших заболевание.
Гаплотипирование семьи
На первом этапе был получен биоматериал (периферическая кровь) членов семьи для детекции патогенного варианта и выявления групп сцепления аллелей полиморфных маркеров. Фрагменты ДНК, содержащие полиморфные маркеры, амплифицировались с помощью праймеров, перечисленных в формуле изобретения в перечне SEQ ID NO 1-58. Было проанализировано 18 STR локусов. Из них 9 оказались информативными по пациентке. Таким образом, образцы эмбрионов тестировались только на информативные маркеры. Аллели полиморфных маркеров, совпадающие у кровных родственников-носителей патогенного варианта с заболеванием Гемофилия А с заранее установленным носительством патогенного варианта NC_000023.10:g.154221234C>Т (NM_000132.3:c.578G>A, p.Gly193Glu) в гене F8, признаются сцепленными с патогенным вариантом и друг с другом. Аллели полиморфных маркеров, не совпадающие у таких родственников, признаются сцепленными друг с другом и с нормальным аллелем гена F8. Аллели полиморфных маркеров здорового члена семьи мужского пола, признаются сцепленными друг с другом и с нормальным геном F8. Косвенная диагностика позволяет сделать вывод о наследовании нормального или мутантного аллеля гена даже в случае выпадения аллеля или непрохождения реакции при амплификации фрагментов ДНК для прямой диагностики.
В результате гаплотипирования и определения групп сцепления для семьи А из примера были получены результаты, представленные в таблице 1. Аллели, указанные на одной строке, располагаются на одной хромосоме, то есть представляют группу сцепления. Таким образом для каждого члена семьи женского пола представлено 2 группы сцепления, соответствующие каждой из двух X хромосом. Партнер мужского пола имеет только 1 X хромосому и только 1 группу сцепления. N в таблице обозначает аллель дикого типа, mut - мутантный аллель. Цифрами записаны длины ампликонов в парах нуклеотидов; их длины зависят от количества повторов в маркере STR. Патогенный вариант NC_000023.10:g.154221234C>T (NM_000132.3:c.578G>A, p.Gly193Glu) в гене F8 в таблице обозначен коротко - F8 c.578G>A.

В результате гаплотипирования был сделан вывод, что у пациентки с патогенным вариантом были сцеплены следующие аллели STR-маркеров: DXS8061 - 150, DXS152.60 - 302, DXS8087 - 218, НА472 - 243, DXS154.8 - 284, DXS154.9-278
Преимплантационное генетическое тестирование
В цикле ЭКО было получено 3 эмбриона, проведена биопсия на 5 день развития (в клинике ЭКО), биоптат в буфере для WGA (1×PBS (Invitrogen, США), 1% поливинилпирролидона (PVP) (Fertipro, Бельгия)) направлен в лабораторию «Генетико». Для контроля контаминации на разных этапах работы с образцом в лаборатории разработана система контролей: контроль контаминации буфера для биопсии, контроль контаминации при транспортировке (одна пробирка с буфером не открывается эмбриологом), контроль контаминации каждого образца (проба среды из последней отмывочной капли биопсиийного материала). Все эти контроли вместе с образцами проходят этап полногеномной амплификации, после которого будет заметно малейшее количество ДНК, контаминировавшей контроли. Полногеномную амлификацию проводили с помощью коммерческого набора SurePlex (Illumina, США).
Продукт полногеномной амплификации, а также ДНК всех членов семьи амплифицировали на 1 этапе в мультиплексной ПЦР с праймерами для детекции - патогенного варианта и праймерами для информативных для семьи А полиморфных маркеров в соответствии с разработанным в рамках подготовительного этапа протоколом для тест-системы. На 2 этапе амплификацию проводили для каждого маркера отдельно в соответствии с разработанным протоколом для тест-системы. Таким образом, были установлены группы сцепления, унаследованные каждым эмбрионом. Полученные результаты представлены в таблице 2.
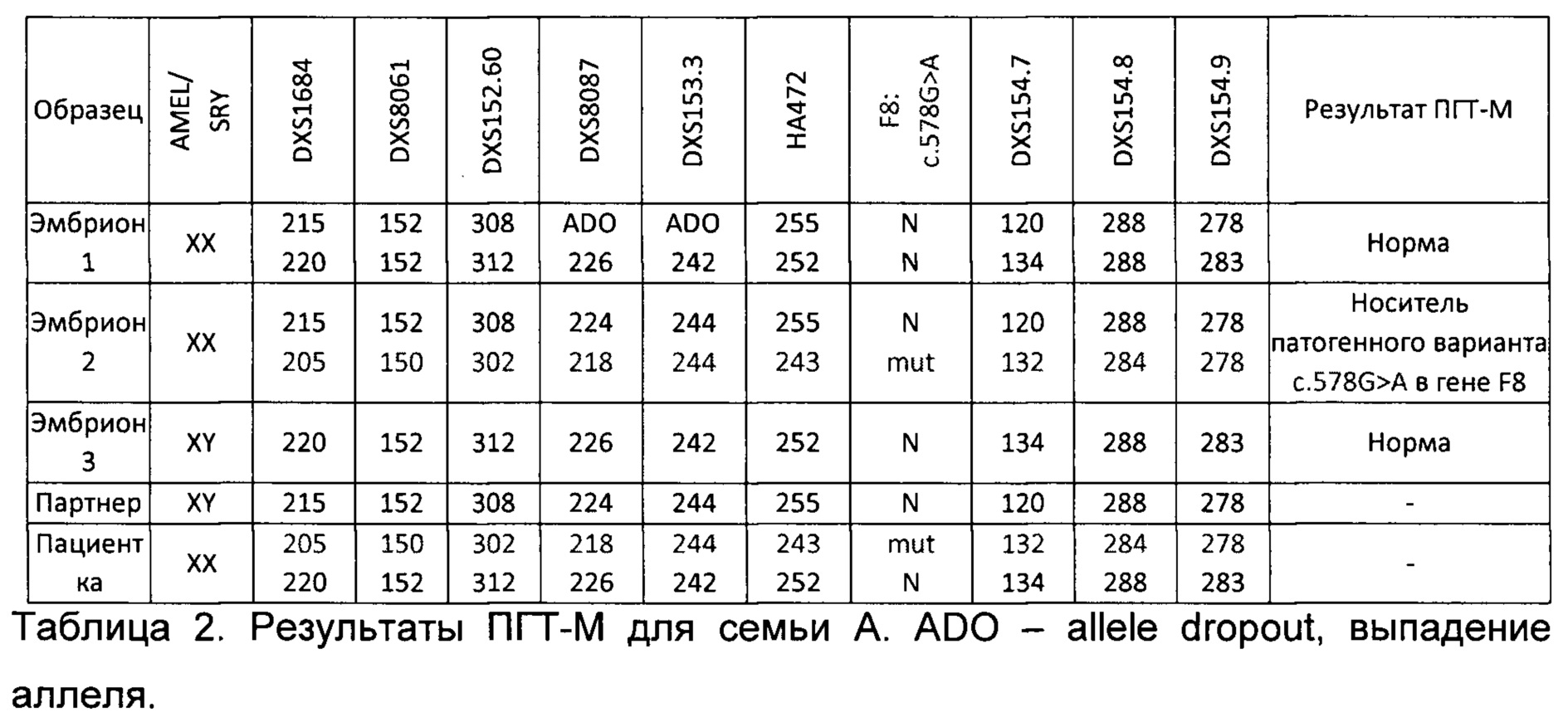
По результатам прямой и косвенной диагностики ни один из эмбрионов не унаследовал заболевание, при этом эмбрион 2 оказался носителем патогенного варианта NC_000023.10:g.154221234C>T (NM_000132.3:c.578G>A, p.Gly193Glu), унаследовав нормальный аллель гена F8 от отца (партнера пациентки) и мутантный аллель гена F8 от матери (пациентки). По запросу родителей для эмбрионов 1 и 3 провели преимплантационный генетический скрининг хромосомных аномалий, в результате которого у эмбриона 3 была выявлена анэуплоидия. По результатам всех проведенных анализов 1 эмбрион (эмбрион 1) был рекомендован к переносу.



