Результат интеллектуальной деятельности: КОДОН-ОПТИМИЗИРОВАННЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ВОССТАНОВЛЕНИЯ КРОВЕНОСНЫХ СОСУДОВ
Вид РИД
Изобретение
Изобретение относится к биотехнологии, а именно к генной инженерии и может быть использовано в создании генно-терапевтических средств.
Разработана генетическая конструкция, которая позволяет одновременно экспрессировать несколько рекомбинантных генов, которая может быть использована в создании лекарственных средств. На базе генетической конструкции pBud(Kan) создана рекомбинантная плазмида, включающая оптимизированные по кодонному составу нуклеотидные последовательности генов сосудистого эндотелиального фактора роста изоформы 165 (англ. Vascular endothelial growth factor 165, VEGF165) и фактора стромальных клеток 1α (англ. Stromal cell-derived factor-1, SDF1-α),
Сосудистый эндотелиальный фактор роста VEGF-A, впервые описанный как сосудистый фактор проницаемости (англ. Vascular permeability factor, VPF), является основным регулятором ангиогенеза и васкулогенеза. VEGF-A - это димерный 34-42 кДа дисульфид-связанный гликопротеин. VEGF-A является специфичным митогеном для сосудистых эндотелиальных клеток. VEGF-A индуцирует пролиферацию эндотелиальных клеток (ЭК), их прорастание и формирование каппилярных трубочек. Он также является мощным фактором выживания для ЭК и индуцирует экспрессию антиапоптозных белков в этих клетках. Делеции генов, кодирующих VEGF-A, приводят к серьезным дефектам и неправильному развитию сердечно-сосудистой системы.
Ген VEGF-A человека расположен в хромосомном локусе 6р21.3. Кодирующая область охватывает около 14 т.п.н. VEGF-A существует в нескольких изоформах: VEGF121, VEGF145, VEGF148, VEGF165, VEGF183, VEGF189, VEGF206, образуемых в результате альтернативного сплайсинга мРНК, которая состоит из 8-ми экзонов. Каждой изоформе VEGF соответствует определенная внеклеточная локализация, основанная на их биохимических различиях в способности связывать гепарин- и гепаран-сульфат. Так, все транскрипты гена VEGF-A у человека содержат экзоны 1-5 и 8, различия же обусловлены альтернативным сплайсингом экзонов 6 и 7.
VEGF165 - изоформа, преобладающая в большинстве тканей и являющаяся наиболее биологически активной, она представляет собой основной белок, способный связывать гепарин, и, хотя значительная доля его остается связанной с клеткой, большая часть свободно секретируется. У данной изоформы отсутствуют аминокислотные остатки, включение которых в белковую молекулу кодируется экзоном 6. Данная изоформа является физиологически самой часто встречающейся и биологически наиболее активной. VEGF165 обычно секретируется в виде 46 кДа гомодимера, обе субъединицы которого имеют массу 23 кДа.
Фактор стромальных клеток 1 альфа (англ. Stromal cell-derived factor-1 alpha, SDF-1 alpha) - небольшой цитокин, принадлежащий к семейству хемокинов, который также называется лиганд хемокина 12 (Chemokine ligand 12, CXCL12 alpha). SDF-1 alpha и beta активируют противовоспалительные процессы. CXCL12 вызывает хемотаксис лимфоцитов.
CXCL12 является лигандом рецептора CXCR4. Передача сигналов CXCR4-CXCL12 вызывает хемотаксис, увеличение пролиферации и снижение апоптоза. Во время эмбриогенеза он управляет миграцией кроветворных клеток из печени плода в костный мозг и формированием крупных кровеносных сосудов. В зрелом возрасте CXCL12 играет важную роль в ангиогенезе путем привлечения эндотелиальных клеток-предшественников (англ. Endothelial progenitor cells, EPCs) из костного мозга через СХС114-зависимый механизм.
Пример применения генно-инженерной конструкции pBud(Kan) заключается в создании рекомбинантной плазмиды pBud(Kan)-coVEGF165-coSDF1-α.. При заболеваниях человека, связанных с нарушением кровоснабжения и повреждениями кровеносных сосудов, формирование новых элементов сосудистой сети благодаря экспрессии факторов VEGF165 и SDF1-α способно восстановить кровоснабжение пораженных тканей и органов, а также вызвать стабильный положительный эффект. При использовании генно-терапевтических препаратов in vivo только часть клеток трансфицируется плазмидной ДНК. При использовании отдельных генетических конструкций для экспрессии индивидуальных терапевтических генов шансы на то, что клетка будет трансфицирована одновременно двумя разными генетическими конструкциями значительно снижаются.
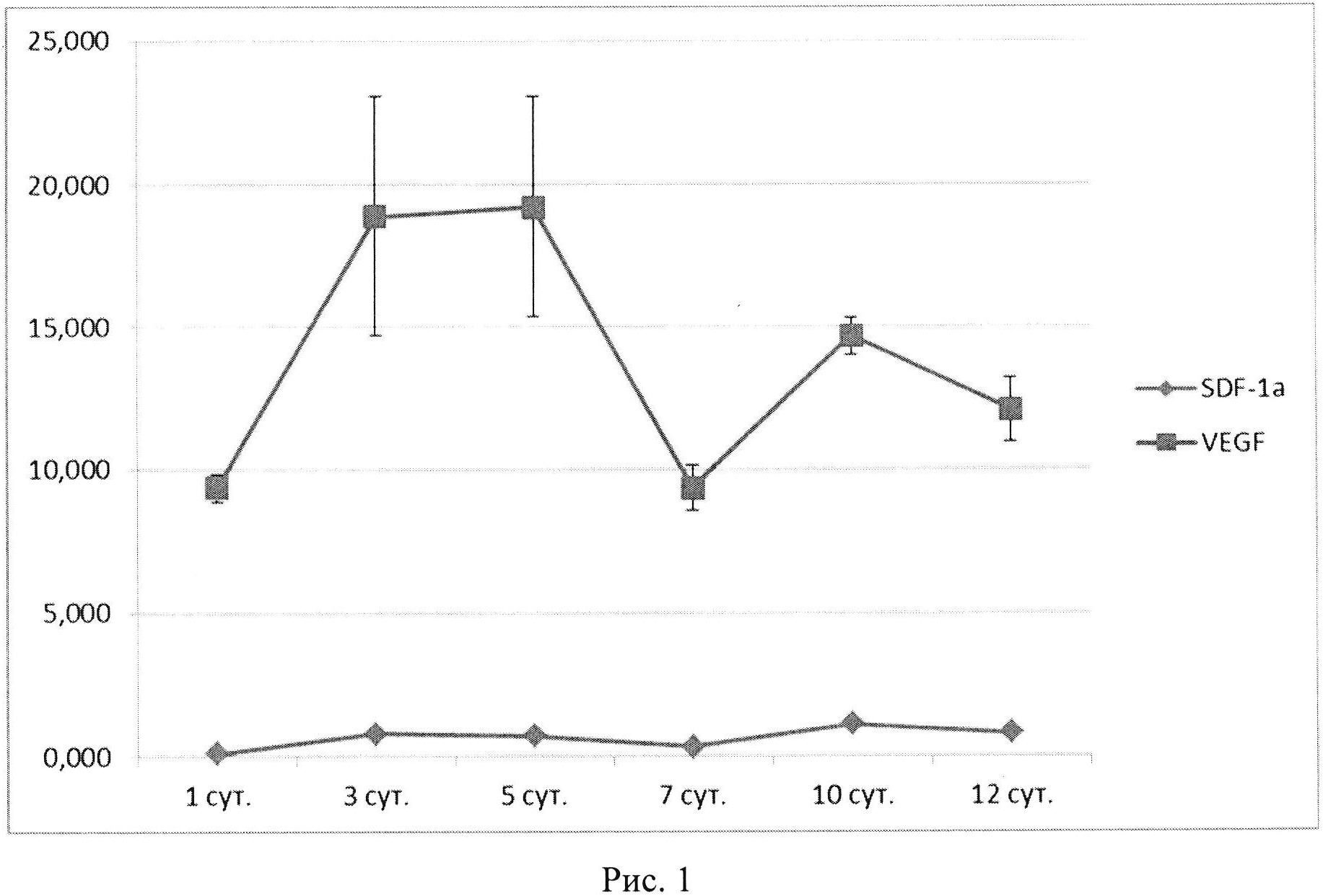
Причиной объединения именно генов vegf и sdf-1 в одной плазмиде явилось установление в процессе исследований потенцирующего эффекта экспрессии указанных генов, проявляющейся не только в повышении продукции терапевтических белков, ими кодируемых, но и в результирующем биологическом эффекте. Кроме того, неожиданно установлено, что трансфекция клеток плазмидой ДНК с геном vegf обеспечивает не только повышение продукции собственно белка VEGF, но также и белка SDF-1 (Рис. 1).
Принцип действия генно-инженерной конструкции pBud(Kan)-coVEGF165-coSDF1-α основан на том, что препарат вводится системно или местно, за этим следует спонтанная трансфекция резидентных клеток, в том числе эндотелиальных, затем экспрессия генов vegf и sdf-1. Экспрессия мРНК генов vegf и sdf-1 контролируется двумя сильными эукариотическими промоторами (немедленный ранний промотор цитомегаловируса CMV и промотор EF1 альфа) и происходит независимо. После процессинга с мРНК генов vegf и sdf-1 синтезируются белки VEGF 165 и SDF1-α, которые проявляют свою нормальную биологическую активность как сосудистый эндотелиальный фактор роста и фактор стромальных клеток.
Работы по использованию VEGF 165 в терапевтическом ангиогенезе широко проводятся во всем мире. Одна из последних опубликованных работ, Favaloro и соавт., приведена как пример клинического использования плазмиды, содержащей VEGF 165 [1]. Важно, что до сегодняшнего дня не зарегистрировано нежелательных или серьезных нежелательных явлений, связанных с применением плазмид, содержащих сосудистый эндотелиальный фактор роста, или осложнений после их применения.
Более того, на современном уровне развития прикладных генных технологий, объединение нескольких генов, кодирующих терапевтические белки, в составе одной генной конструкции становится все более и более распространенным подходом. В частности, известны такие варианты объединения, как гены vegf-165 и bmp-7 в аденовирусном векторе [2], и др. Другим вариантом является полицистронная плазмидная ДНК, кодирующая сразу четыре гена (oct4, sox2, klf4, and c-myc), показанная для репрограммирования соматических клеток в индуцированные плюрипотентные стволовые клетки [3]. Нужно отметить, что некоторые авторы уже упоминали потенциальную целесообразность и выполнимость объединения генов sdf-1 и vegf в одном экспрессионном векторе для терапевтических показаний [4] В вышеупомянутых публикациях исследователи не приводят конкретных описаний нуклеотидных последовательностей и даже не уточняют, какие именно варианты генов sdf-1 и vegf они имели в виду, приводя лишь общие гипотетические посылы, следующие из современного уровня техники. При этом именно выбор конкретных вариантов генов, кодирующего строго определенные изоформы терапевтических белков, корректная оптимизация нуклеотидных последовательностей трансгенов, разработка адекватного экспрессионного вектора определяет достижение основного технического результата, которым может являться только биологическая эффективность разработанной генно-терапевтической конструкции, а не собственно выполнимость ее создания.
Задачей настоящего изобретения является создание плазмидной генно-инженерной конструкции, которая позволяет одновременно экспрессировать несколько рекомбинантных генов, проявляет высокую функциональную активность.
Краткое описание рисунков
Рис. 1. Динамика продукции мРНК генов vegf и sdf-1α культурой ММСК, трансфицированной плазмидой с одним геном vegf.
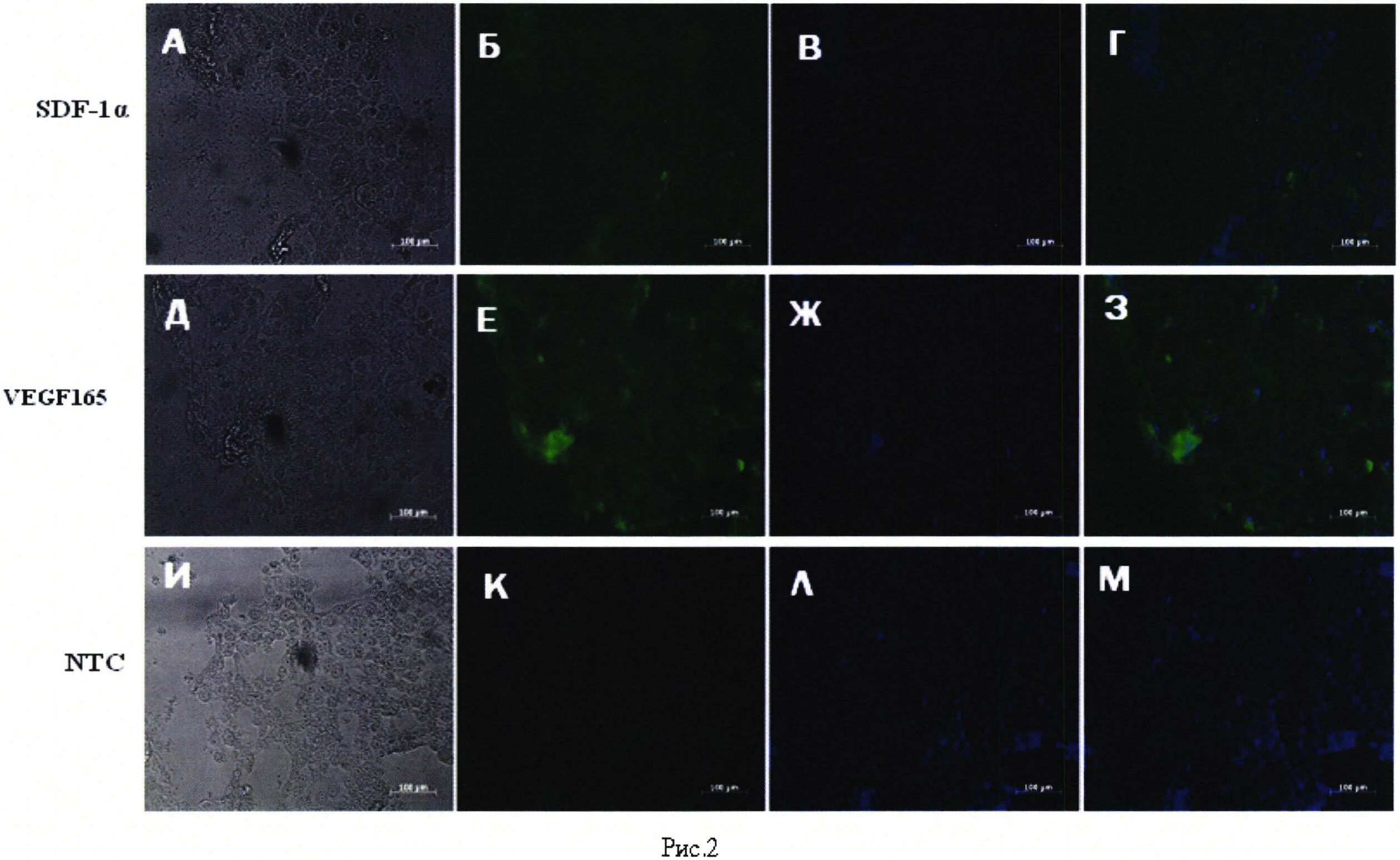
Рис. 2. Иммунофлуоресцентный анализ экспрессии VEGF 165 и SDF-1α в клетках линии SH-SY5Y, трансфицированных плазмидой pBud(Kan)-VEGF 165-SDF-1α. 48 часов инкубации после трансфекции. А, Б, В, Г, Д, Е, Ж, 3 - клетки SH-SY5Y, трансфицированные плазмидой pBud(Kan)-VEGF 165-SDF-1α. И, К, Л, M - нетрансфицированные клетки SH-SY5Y. А, Д, И, - фазово-контрастная световая микроскопия. Б - окрашивание с помощью первичных антител кролика к фактору стромальных клеток 1 и вторичных антител осла к иммуноглобулину G кролика, конъюгированных с флуоресцентной меткой Alexa-488. Ε - окрашивание с помощью первичных антител кролика к сосудистому эндотелиальному фактору роста и вторичных антител осла к иммуноглобулину G кролика, конъюгированных с флуоресцентной меткой Alexa-488. В, Ж, Л - окрашивание флуоресцентным красителем DAPI. Г, З, M - совмещение синего и зеленого спектров флуоресценции. Шкала: 100 мкм.
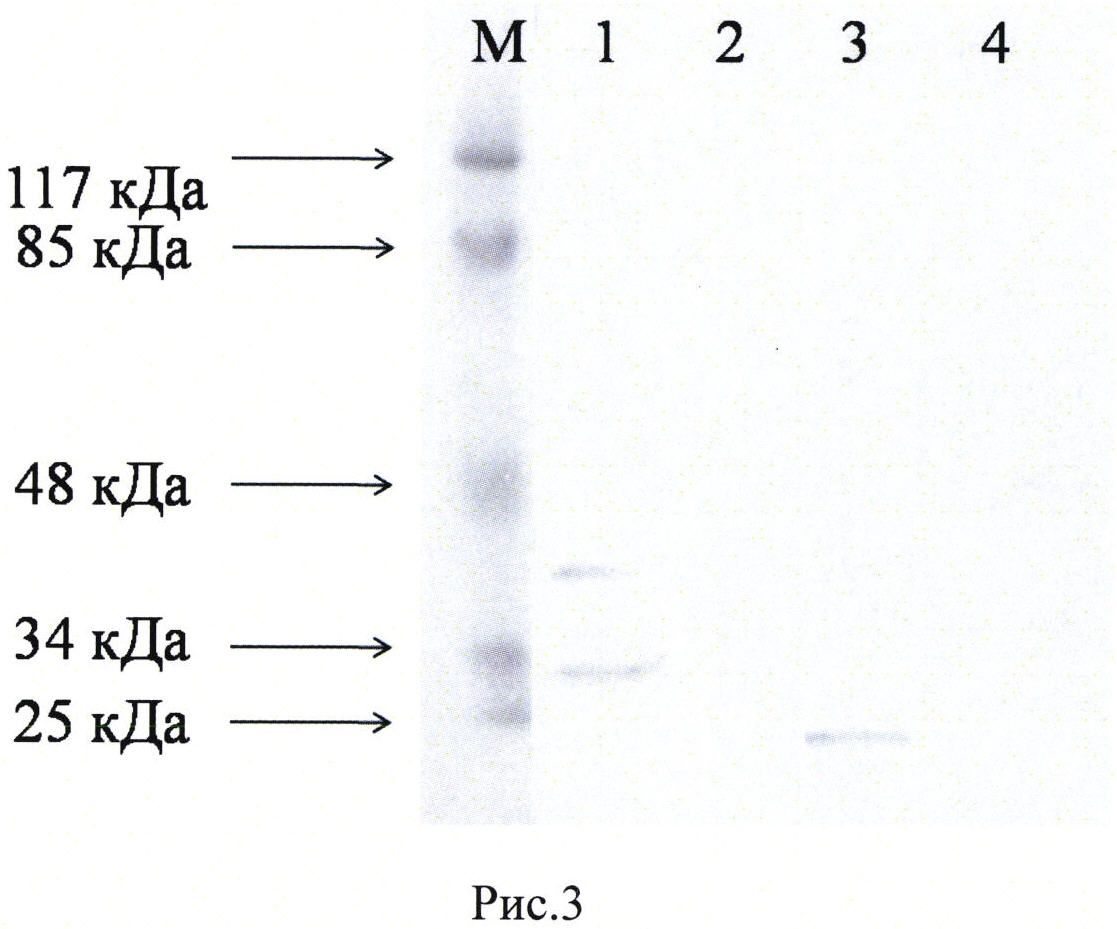
Рис. 3. Вестерн блот анализ экспресии белков VEGF 165 и SDF1-1α в генетически модифицированных клетках HEK293T. Электрофорез в 12% SDS-PAGE геле по системе Лаэмли. Антитела к VEGF (Santa cruz biotechnology; sc-507. Лунки 1 и 2) и антитела к SDF1 (Santa cruz biotechnology; sc-28876. Лунки 3 и 4) использовались в разведении 1:50. Ожидаемый размер белка VEGF 165 - 42 кДа, SDF-1α - 10 кДа. Лунки 1, 3 - клетки НЕК293Т, трансфицированные плазмидой pBud(Kan)-VEGF165-SDF-1α. Лунки 2, 4 - нетрансфицированные клетки HEK293T. M - маркер Prestained Protein Molecular Weight Marker (Thermo Fisher Scientific Inc.).
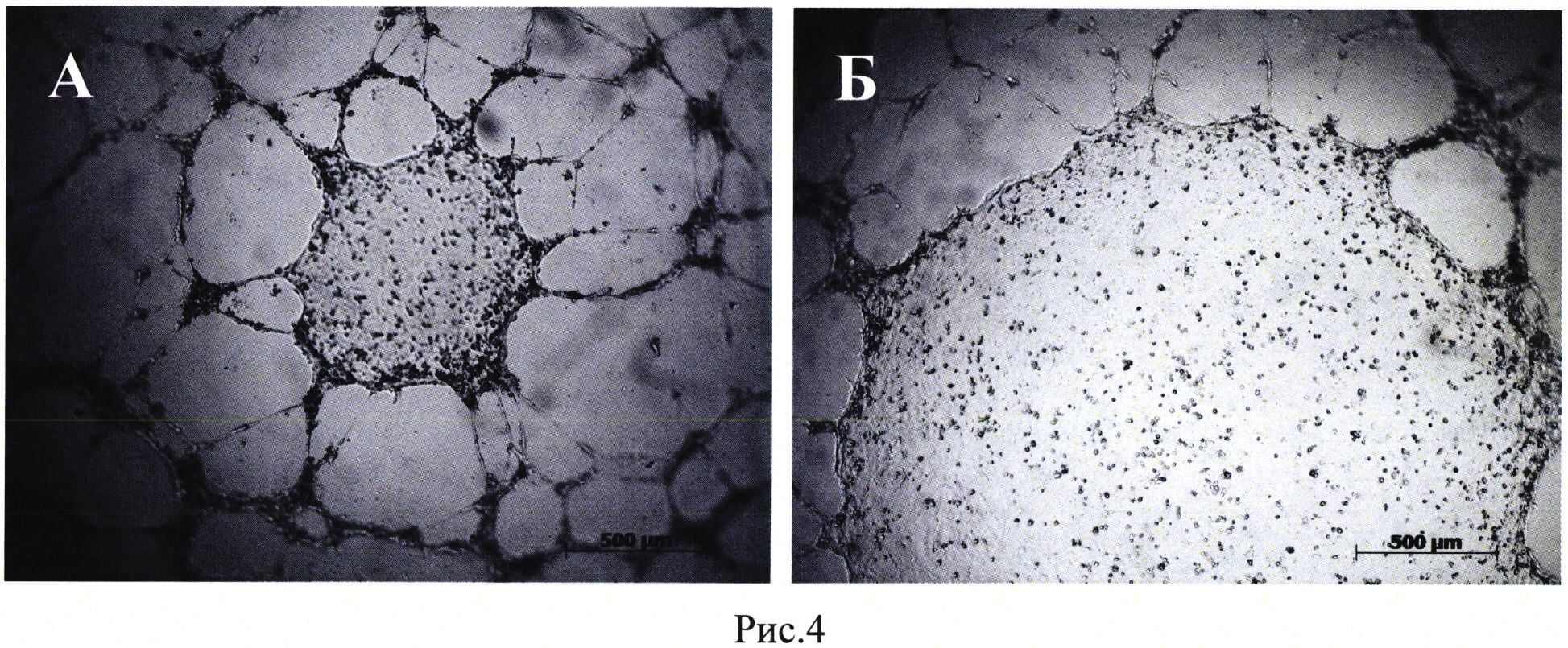
Рис. 4. Формирование капилляро-подобных структур эндотелиальными клетками HUVEC на Матригеле. Добавление культуральной среды в конечной концентрации 30%, собранной с клеток HEK293T, трансфицированных плазмидой pBud(Kan)-VEGF165-SDF-1α (А), Б - культуральная среда нетрансфицированных клеток (NTC) в конечной концентрации 30%. Шкала: 500 мкм.
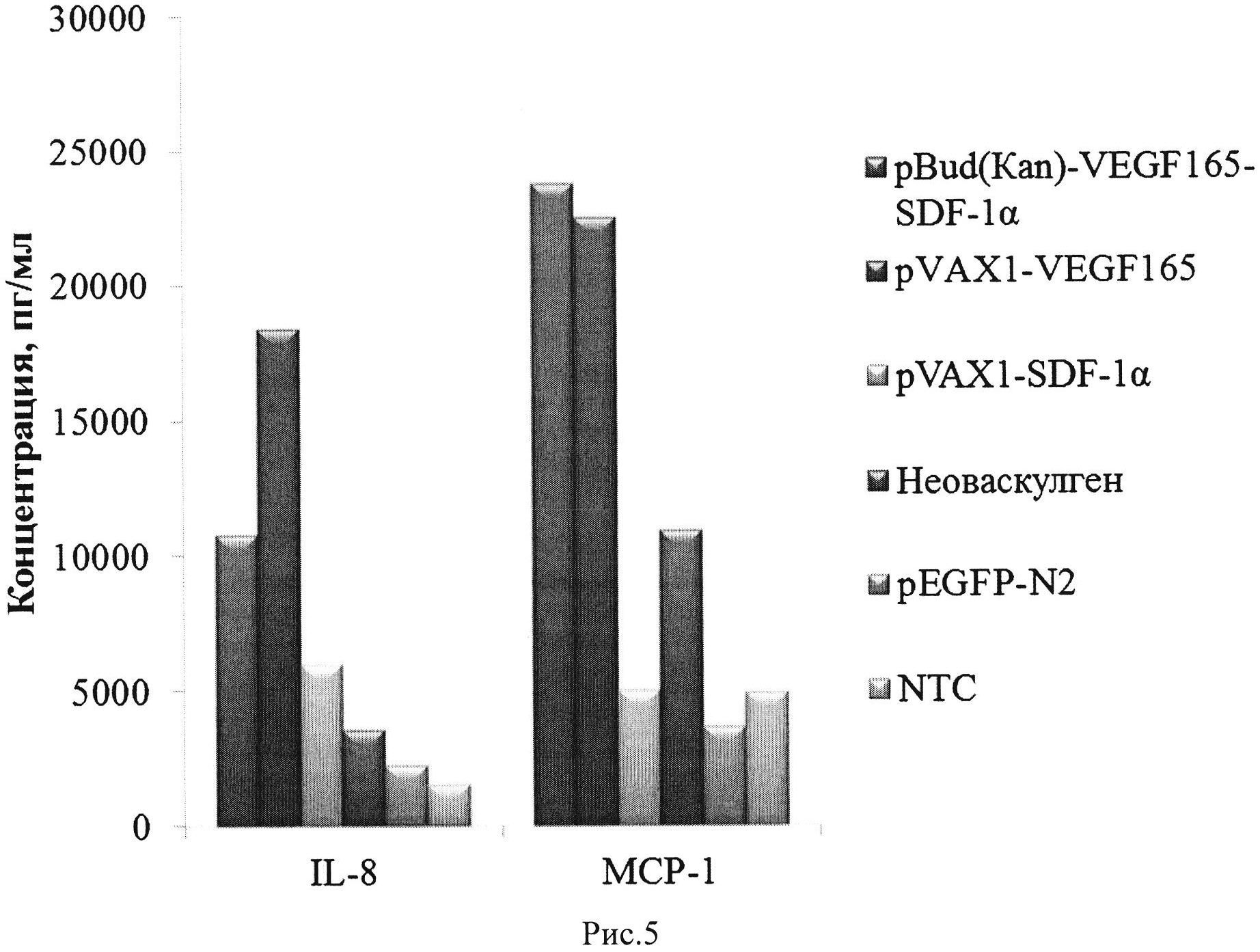
Рис. 5. Продукция хемокинов/цитокинов IL-8 и МСР-1 нативными (NTC) и генетически модифицированными клетками hADSCs.
Для создания конструкции использован экспрессионный вектор pBudCE4.1 (Invitrogen, Catalog #V532-20, США), который содержит промоторы CMV и EF1-α для эффективной экспрессии трансгенов. Нами были внесены изменения в нуклеотидную последовательность плазмидного вектора pBudCE4.1:
1. Последовательность гена устойчивости к зеоцину и его промотор заменены на последовательность гена устойчивости к канамицину. Гены устойчивости к зеоцину и канамицину используют как для селекции плазмидного вектора в клетках бактерий, так и для селекции трансфицированных плазмидным вектором эукариотических клеток. Замена гена устойчивости к зеоцину обусловлена тем, что его экспрессия в эукариотических клетках (в том числе клетках человека) приводит к появлению чужеродного белка (продукта экспрессии гена), который может вызывать появление устойчивости к антибиотику и представлять собой потенциальный аллерген.
2. Удалены последовательности тэгов V5-His и myc-His.
В качестве примера реализации генно-инженерной конструкции pBud(Kan) создана рекомбинантная плазмида pBud(Kan)-coVEGF165-coSDF1-α (SEQ ID NO:1), представляющая собой модифицированную экспрессионную векторную плазмиду pBudCE4.1 в которой клонированы кодон-оптимизированные кДНК, кодирующие фактор стромальных клеток 1 альфа и сосудистый эндотелиальный фактор роста изоформы 165 (по сайтам рестрикции HindIII и XbaI), содержит:
|
Кодонная оптимизация основана на вырожденности генетического кода, при этом в качестве оптимальных кодонов используют наиболее часто встречающиеся синонимические кодоны вырожденного генетического кода. Чем выше частота встречаемости того или иного кодона, используемого для кодирования аминокислоты в организме, тем с большей скоростью он будет транслироваться рибосомами вследствие высокой внутриклеточной концентрации тРНК, узнающей такой ко дон. Для оптимизации кодонного состава генов vegf и sdf-1 использовали алгоритм OptimumGene, который учитывает различные факторы, влияющие на уровни экспрессии генов, такие как смещение кодонов, GC-состав, содержание CpG-динуклеотидов, вторичную структуру мРНК, тандемные повторы, сайты рестрикции, которые могут помешать клонированию, преждевременные сайты полиаденилирования, дополнительные минорные сайты связывания с рибосомой. В качестве матрицы для ко донной оптимизации были взяты нуклеотидные последовательности мРНК генов vegf (GeneBank #AF486837.1, 576 п.н.) и sdf-1 (GeneBank #AY429472.1, 270 п.н.).
Дикий тип нуклеотидных последовательностей кодирующей части генов vegf и sdf-1 содержат тандем редких кодонов, которые могут остановить трансляцию или снизить ее эффективность. При оптимизации кодонного состава дикого типа гена sdf-1 был улучшен индекс адаптации кодонов CAI (англ. Codon Adaptation Index) с 0,77 до 0,88. При оптимизации кодонного состава дикого типа гена VEGF 165 был улучшен индекс адаптации кодонов CAI с 0,81 до 0,87. Для увеличения стабильности мРНК был оптимизирован GC-состав и удалены протяженные участки с высоким сожержанием GC-пар. Кроме того, процесс оптимизации удалил потенциальные цис-действующие сайты. В результате ко донной оптимизации аминокислотные последовательности генов SDF1-A (SEQ ID N0:2) и VEGF165 (SEQ ID NO:3) не изменились и составили 89 и 191 аминокислотных остатков, соответственно.
Синтез de novo нуклеотидной последовательности плазмиды pBud(Kan)-coVEGF165-coSDFl-α, включающей оптимизированные по ко донному составу кДНК генов vegf и sdf-1, был осуществлен компанией GenScript (США). Таким образом, получена плазмида pBud(Kan)-coVEGF165-coSDF1-α, кодирующая оптимизированные по кодонам последовательности генов vegf и sdf-1.
Функциональная активность генетической конструкции подтверждалась анализом экспрессии трансгенов in vitro.
Генную модификацию (трансфекцию) клеточных линий НЕК293Т и SH-SY5Y с помощью полученной генетической конструкции pBud(Kan)-VEGF165-SDF-la проводили трансфекционным агентом TurboFect (Thermo Fisher Scientific Inc., США) в соответствии с методикой, рекомендуемой производителем.
Для оценки экспрессии генов vegf и sdf-1 в трансфицированных клетках НЕК293Т и SH-SY5Y проводили иммунофлуоресцентный и вестерн блот анализы.
Иммунофлуоресцентный анализ клеток SH-SY5Y, трансфицированных плазмидой pBud(Kan)-VEGF165-SDF-la, выявил положительную реакцию с поликлональными антителами кролика к сосудисому эндотелиальному фактору роста и фактору стромальных клеток 1 (Рис. 1).
Белковые лизаты клеток НЕК293Т, трансфицированных плазмидой pBud(Kan)-VEGF165-SDF-1α анализировали с помощью вестерн блот анализа, который показал наличие выраженных полосок, соответствующих ожидаемым молекулярным массам белков VEGF 165 и SDF-1α - 42 кДа и 10 кДа, соответственно (Рис. 2).
После трансфекции клеток линии НЕК293Т генетической конструкцией pBud(Kan)-coVEGF165-coSDF1-α с использованием трансфекционного агента TurboFect (Thermo Fisher Scientific Inc.), анализ экспрессии рекомбинантного белка проводили с помощью иммуноферментного анализа (ИФА).
Сбор культуральной среды из лунок с клетками НЕК-293А, трансфицированных pBud(Kan)-coVEGF165-coSDF1-α, проводили на 1 день после трансфекции. Среду из лунок переносили в 1,5 мл пробирки и центрифугировали в течение 1 минуты при максимальных оборотах для удаления клеточных обломков (дебриса). Супернатант переносили в чистые 1,5 мл пробирки, разводили в 10 раз и использовали для иммуноферментного определения концентрации VEGF. Концентрацию VEGF в культуральной среде определяли с помощью набора VEGF-ИФА-БЕСТ А-8784 (Вектор, Россия) по методике, рекомендуемой производителем. Метод определения основан на твердофазном «сэндвич» варианте иммуноферментного анализа с применением моно- и поликлональных антител к VEGF человека. Диапазон измеряемых концентраций 0-2000 пг/мл, чувствительность анализа - 10 пг/мл. Оптическую плотность в лунках определяли с использованием многофункционального микропланшетного ридера Infinite М200Рго (Тесап) в двухволновом режиме: основной фильтр - 450 нм, референс-фильтр - 655 нм. Исходя из прямой пропорциональности между величиной оптической плотности и концентрацией VEGF в стандартных образцах, вычисляли концентрацию VEGF в исследуемых образцах.
Клетки HEK293T, трансфицированные pBud(Kan)-coVEGF165-coSDF1-α с помощью реагента TurboFect, показывали высокий уровень экспрессии VEGF на 1 день после трансфекции (1542 пг/мл) по сравнению с нативными (нетрансфицированными) клетками (28 пг/мл).
Таким образом, показана экспрессия белка VEGF 165 полученной генетической конструкцией pBud(Kan)-coVEGF 165-coSDF1-α.
Для исследования ангиогенной эффективности продуктов секреции клеток НЕК293Т, трансфицированных плазмидой pBud(Kan)-VEGF165-SDF-1α оценивали влияние кондиционированной среды на формирование капилляро-подобных структур эндотелиальными клетками HUVEC на Матригеле (Matrigel™ Matrix, BD Biosciences, San Diego, CA, США) [2].
Было показано, что кондиционированная среда клеток НЕК293Т, генетически модифицированных плазмидой pBud(Kan)-VEGF 165-SDF-1α, стимулирует формирование капилляро-подобных структур клетками HUVEC in vitro (Рис. 3).
Полученная генно-инженерная конструкция pBud(Kan) может быть использована для создания генно-терапевтических препаратов.
Рекомбинантные плазмиды, созданные на основе генно-инженерной конструкции pBud(Kan), могут быть использованы в составе фармацевтической композиции для получения готовой лекарственной формы.
Фармацевтическая композиция для восстановления кровоснабжения тканей и (или) органов содержит генно-инженерную конструкцию pBud(Kan)-coVEGF165-coSDF1-α в эффективном количестве и фармацевтически допустимые вспомогательные вещества.
В одном из вариантов фармацевтическая композиция может содержать, в том числе, добавку для трансфекции клеток человека (мононуклеарные клетки крови или костного мозга человека, мезенхимные стволовые клетки и др.) в случае реализации генно-клеточного подхода и трансплантации ген-оптимизированных клеток.
Раствор pBud(Kan)-coVEGF165-coSDF1-α, пригодный для последующего получения фармацевтической композиции и готовой лекарственной формы, может быть получен при помощи стандартных методов выделения и очистки ДНК, известных специалисту в данной области техники.
Готовая лекарственная форма pBud(Kan)-coVEGF165-coSDF1-α должна быть пригодна для проведения генной терапии и не должна приводить к существенному изменению свойств основного вещества при продолжительном хранении. Возможная готовая лекарственная форма плазмиды может быть выбрана из группы замороженного раствора, жидкого раствора, лиофилизата, т.е. лиофильно высушенного раствора, аморфной пленки, но не ограничивается ими.
Предпочтительными вариантами готовой лекарственной формы являются жидкий раствор или лиофилизат, поскольку они могут храниться при положительной температуре, т.е. в стандартных фармацевтических холодильниках, и не требуют значительного времени для подготовки к инъекции.
Наиболее предпочтительным вариантом готовой лекарственной формы является лиофилизат, поскольку отсутствие воды потенциально замедляет химические реакции распада цепей ДНК.
Получение лиофилизата, то есть аморфной или микрокристаллической пористой массы, требует присутствия в лиофилизуемом растворе вспомогательных веществ, выполняющих функции криопротектанта, стабилизатора pH, хелатирующего агента, антиоксиданта, наполнителя и т.д. Минимально возможный набор вспомогательных веществ может включать в себя, по меньшей мере, один, криопротектант, обладающий свойствами наполнителя и стабилизатор pH. Вспомогательное вещество, являющееся криопротектантом и наполнителем, может быть выбрано из группы, включающей моно- и дисахариды, полиолы и полимеры, такие как: сахароза, лактоза, трегалоза, маннитол, сорбитол, глюкоза, раффиноза, поливинилпирролидон или их сочетания. Стабилизатор pH может быть выбран из группы, включающей цитрат натрия, фосфат натрия, Трис-HCl, Трис-ацетат, глицин и другие аминокислоты.
Способ получения лиофилизата может предусматривать добавление к раствору очищенной плазмидной ДНК растворов, по меньшей мере, одного криопротектанта, обладающего свойствами наполнителя, и стабилизатора pH с получением изотонического раствора с концентрацией очищенной плазмидной ДНК от 0,1 до 10 мг/мл и pH от 7,0 до 9,0 и последующую лиофилизацию и хранение при температуре от +2°C до +8°C.
Способ применения фармацевтической композиции заключается во введении ее человеку (или животным) таким способом и в таком количестве, которые обеспечат лечебный эффект в зависимости от нозологической формы и медицинских показаний.
Фармацевтическая композиция может вводиться местно - внутримышечно, подкожно, внутрикожно, системно - внутривенно, внутриартериально, аэрозольно, в виде генно-клеточной трансплантации или трансфузии после in vitro обработки различных аутологичных клеток, например гемопоэтических и их более дифференцированных производных, мезенхимных, сосудисто-стромальной фракции, мезангиобластов, миобластов, миосателлитоцитов и др.
Хотя указанные изобретения описаны в деталях, для специалиста в данной области техники, очевидно, что могут быть совершены различные изменения и произведены эквивалентные замены, и такие изменения и замены не выходят за рамки настоящего изобретения.
В настоящее время в мире используется ряд подобных конструкций, где в качестве вставки использована кДНК гена VEGF165, а в качестве вектора - различные плазмиды [3, 4].
По сравнению с существующим прототипом [4], генетической конструкцией pBud-VEGF165-FGF2, генно-инженерная конструкция pBud(Kan)-coVEGF165-coSDF1-α обладает следующими преимуществами:
1. Генно-инженерная конструкция pBud(Kan)-coVEGF165-coSDF1-α содержит оптимизированные по кодонному составу кДНК генов vegf и sdf-1, что улучшает трансляцию продуктов этих генов и снижает возможность гомологичной рекомбинации с соответсвующими последовательностями на хромосомах человека.
2. Генно-инженерная конструкция pBud(Kan)-coVEGF165-coSDF1-α содержит безопасную для клинического применения последовательность гена устойчивости к антибиотику канамицину для селекции плазмиды только в клетках бактерий.
3. Одновременная независимая экспрессия двух факторов VEGF165 и SDF1-α, контролируемая двумя сильными эукариотическими промоторами CMV и EF1-α. Одновременная экспрессия двух генов в одной клетке позволяет достичь более равномерного градиента секретируемых рекомбинантных белков. Кроме того, трансфекция клеток плазмидой pBud(Kan)-coVEGF165-coSDF1-α приводит к более высокой экспрессии хемокинов/цитокинов IL-8 и МСР-1 по сравнению с плазмидой, с одним геном veg/165 (см. Рис. 5).
Стимуляция продукции трансфицированной клеткой одновременно двух генов - vegf и sdf-1 - приводит к еще более высокой экспрессии указанных генов, как привнесенных плазмидой, так и эндогенных. На 12 сут после трансфекции культуры ММСК плазмидой pBud(Kan)-coVEGF165-coSDF1-α концентрация (накопление) белка VEGF в культуральной среде была статистически значимо выше, чем в случае трансфекции аналогичной культуры плазмидой лишь с одним геном VEGF: 3064,61±22,62 пг/мл и 2259,59±171,56 пг/мл. Детализация внутриклеточных механизмов, обеспечивающих такой взаимный потенцирующий эффект экспрессии генов vegf и sdf-1 требует проведения дальнейших исследований, но существование такого явления подтверждено нашими исследованиями. Его биологический смысл состоит в синергичности эффектов, обеспечиваемых белками VEGF и SDF-1. Так, при реализации процессов репаративной регенерации тканей VEGF стимулирует пролиферацию и дифференцировку резидентных эндотелиальных прогениторных клеток, формирование ими капилляроподобных структур. В то же время SDF-1 обеспечивает миграцию дополнительных камбиальных клеток, в том числе эндотелиальных прогениторных клеток и ГСК, по градиенту его концентрации к целевой зоне, в которой они попадают под действие белка VEGF. Таким образом, оба терапевтических белка работают в паре, стимулирую ангиогенез и репаративную регенерацию. Именно такое синергичное действие могло послужить причиной, по которой экспрессия указанных генов имеет прямую пропорциональность, обусловленную, по всей видимости пока не установленными общими внутриклеточными путями регуляция транскрипции.
4. Генно-инженерная конструкция pBud(Kan) не содержит последовательностей тэгов V5-His и myc-His.
Таким образом, конструкция pBud(Kan)-coVEGF165-coSDF1-α имеет важные преимущества с точки зрения безопасности и эффективности ее использования. Структура конструкции pBud(Kan)-coVEGF165-coSD F1-α принципиально отличается от всех существующих аналогов.
Литература
1. Favaloro, L., M. Diez, et al. (2012). "High-dose plasmid-mediated VEGF gene transfer is safe in patients with severe ischemic heart disease (Genesis-I). A phase I, open-label, two-year follow-up trial." Catheter Cardiovasc Interv.
2. Construction of recombinant adeno-associated virus vector co-expressing hVEGF165 and hBMP-7 genes. Huang X., Shi Z., Wang K. et al. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi. 2008; 22(7): 807-13.
3. Induced pluripotent stem cells generated from human adipose-derived stem cells using a non-viral polycistronic plasmid in feeder-free conditions. Qu X, Liu T, Song K, et al. PLoS One. 2012; 7(10):e48161.
4. EP 2520302, 07.11.2012.
5. Benton, G., J. George, et al. (2009). "Advancing science and technology via 3D culture on basement membrane matrix." J Cell Physiol 221(1): 18-25.
6. Cherviakov Iu, V., I.N. Staroverov, et al. (2012). "[Therapeutic angiogenesis in treatment of patients with chronic obliterating diseases of lower limb arteries]." Angiol Sosud Khir 18(3): 19-27.
7. Салафутдинов И.И., Ш.А.К., Ялвач М.Э., Кудряшова H.B., Лагарькова M.A., Шутова М.В., Киселев СЛ., Масгутов Р.Ф., Жданов Р.И., Киясов А.П., Исламов P.P., Ризванов А.А. (2010). "Эффект одновременной экспрессии различных изоформ фактора роста эндотелия сосудов VEGF и основного фактора роста фибробластов FGF2 на пролиферацию эндотелиальных клеток пупочной вены человека HUVEC." Клеточная трансплантология и тканевая инженерия V(2): 62-67.