Результат интеллектуальной деятельности: МОДУЛЯТОРЫ ROR ГАММА (RORγ)
Вид РИД
Изобретение
Связанный с рецептором ретиноевой кислоты рецептор-сирота γt (RORγt) действует как главный регулятор развития клеток TH17, а также как критический компонент в не-TH17 клетках, производящих ИЛ-17, таких как, например, γδ T-клетки. Семейство генов ROR является частью суперсемейства ядерного гормонального рецептора и состоит из трех членов (RORα, RORβ и RORγ). Каждый ген экспрессируется в различных изоформах, различаясь, прежде всего, последовательностью N-окончания. Были идентифицированы две изоформы RORγ: RORγ1 и RORγ2 (также известная как RORγt). Термин RORγ в данном описании относится к обоим RORγ1 и/или RORγ2.
Данное изобретение относится к модуляторам RORγ, к фармацевтическим композициям, содержащим их, и к применению указанных компонентов для лечения RORγ-медиированных заболеваний или состояний, в частности, аутоиммунных заболеваний и воспалительных состояний.
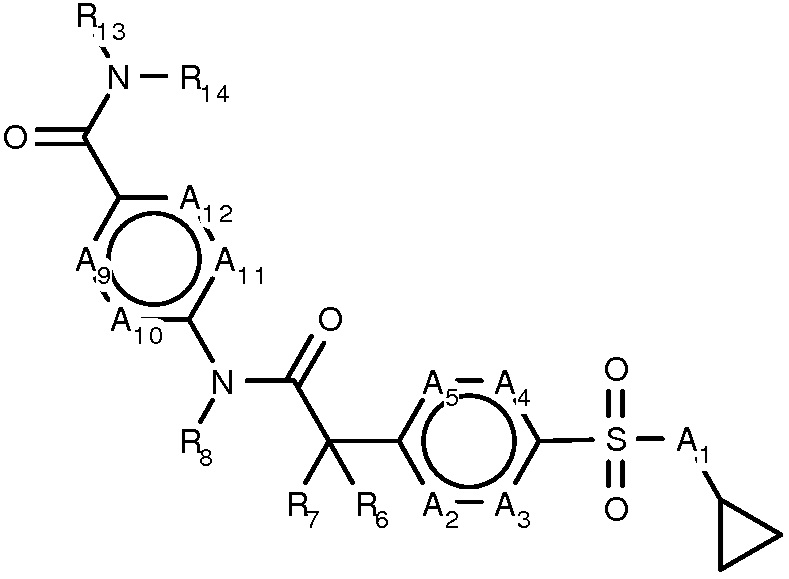
В данном изобретении представлены новые RORγ модулирующие соединения формулы I
 (формула I)
(формула I)
или их фармацевтически приемлемая соль, где:
- A1 является NR1 или CR1, где R1 является H или метилом, где метил, если присутствует, необязательно замещен одним или более F;
- A2-A5 являются N или CR2-CR5, соответственно, при условии, что не более двух из четырех положений A в A2-A5 одновременно могут быть N;
- R2-R5 независимо являются H, галогеном, амино, C(1-3)алкокси, (ди)C(1-3)алкиламино или C(1-6)алкилом;
- R6 и R7 независимо являются H, F, метилом, этилом, гидроксилом или метокси, или R6 и R7 вместе являются карбонилом, все алкильные группы, если присутствуют, необязательно замещены одним или более F;
- R8 является H или C(1-6)алкилом;
- A9-A12 являются N или CR9-CR12, соответственно, при условии, что не более двух из четырех положений A в A9-A12 одновременно могут быть N;
- R9-R12 независимо являются H, галогеном, амино, C(1-3)алкокси, (ди)C(1-3)алкиламино или C(1-6)алкилом;
- R13 является H, C(1-6)алкилом, C(2-6)алкенилом, C(3-6)циклоалкилом, C(3-6)циклоалкил-C(1-4)алкилом, C(2-5)гетероциклоалкилом, C(2-5)гетероциклоалкил-C(1-4)алкилом, C(6-10)арилом, C(6-10)арил-C(1-4)алкилом, C(1-9)гетероарилом или C(1-9)гетероарил-C(1-4)алкилом, все группы необязательно замещены одним или более галогеном, амино, гидроксилом, циано, C(1-3)алкокси, C(1-3)алкоксикарбонилом, (ди)C(1-3)алкиламино или C(1-3)алкилом; и
- R14 является H, C(1-6)алкилом, C(2-6)алкенилом, C(3-6)циклоалкилом, C(3-6)циклоалкил-C(1-4)алкилом, C(2-5)гетероциклоалкилом, C(2-5)гетероциклоалкил-C(1-4)алкилом, C(6-10)арилом, C(6-10)арил-C(1-4)алкилом, C(1-9)гетероарилом или C(1-9)гетероарил-C(1-4)алкилом, все группы необязательно замещены одним или более галогеном, амино, гидроксилом, циано, C(1-3)алкокси, C(1-3)алкоксикарбонилом, (ди)C(1-3)алкиламино или C(1-3)алкилом;
- или R13 и R14 конденсированы и образуют кольцо, имеющее от 5 до 7 атомов объединением R13, являющегося C(1-6)алкилом или C(2-6)алкенилом, и независимым заместителем, определенным в R14, все группы необязательно замещены одним или более галогеном, амино, гидрокси, циано, C(1-3)алкокси, C(1-3)алкоксикарбонилом, (ди)C(1-3)алкиламино или C(1-3)алкилом.
Термин C(1-6)алкил в данном описании означает разветвленную или неразветвленную алкильную группу, содержащую 1-6 атомов углерода, например, метил, этил, пропил, изопропил, бутил, трет-бутил, н-пентил и н-гексил. Все атомы углерода необязательно могут быть замещены одним или более галогеном.
Термин C(1-4)алкил в данном описании означает алкильную группу, содержащую 1-4 атома углерода, т.е. метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил или трет-бутил. Все атомы углерода необязательно могут быть замещены одним или более галогеном.
Термин C(1-3)алкил в данном описании означает алкильную группу, содержащую 1-3 атома углерода, т.е. метил, этил, пропил или изопропил. Все атомы углерода необязательно могут быть замещены одним или более галогеном.
Термин C(1-2)алкил в данном описании означает алкильную группу, содержащую 1-2 атома углерода, т.е. метил или этил. Все атомы углерода необязательно могут быть замещены одним или более галогеном.
Термин C(2-6)алкенил в данном описании означает разветвленную или неразветвленную алкенильную группу, содержащую 2-6 атомов углерода, например, 4-гексенил, бут-2-енил, 1-метиленпропил, 2-пропенил (аллил) и этенил (винил). Все атомы углерода необязательно могут быть замещены одним или более галогеном.
Термин C(6-10)арил в данном описании означает ароматическую углеводородную группу, содержащую 6-10 атомов углерода, например, фенил или нафтил. Предпочтительной ароматической углеводородной группой является фенил. Все атомы углерода необязательно могут быть замещены одним или более галогеном.
Термин C(6-10)арил-C(1-4)алкил в данном описании означает C(6-10)арильную группу, присоединенную к C(1-4)алкильной группе, обе которые имеют значения, описанные выше.
Термин C(6-10)арил-C(1-3)алкил в данном описании означает C(6-10)арильную группу, присоединенную к C(1-3)алкильной группе, обе которые имеют значения, описанные выше.
Термин C(6)арил в данном описании означает ароматическую углеводородную группу, содержащую 6 атомов углерода, т.е. фенил. Все атомы углерода необязательно могут быть замещены одним или более галогеном.
Термин C(6)арил-C(1-4)алкил в данном описании означает C(6)арильную группу, присоединенную к C(1-4)алкильной группе, обе которые имеют значения, описанные выше.
Термин C(6)арил-C(1-3)алкил в данном описании означает C(6)арильную группу, присоединенную к C(1-3)алкильной группе, обе которые имеют значения, описанные выше.
Термин гетероатом в данном описании относится к атому азота, серы или кислорода.
Термин амино в данном описании относится к NH2 группе.
Термин C(1-9)гетероарил в данном описании означает ароматическую группу, содержащую 1-9 атомов углерода и 1-4 гетероатома, которые могут быть присоединены через атом азота, если возможно, или атом углерода. Примеры включают имидазолил, тиадиазолил, пиридинил, пиримидинил, фурил, пиразолил, оксазолил, изоксазолил, тетразолил, тиофенил, тиазолил, тиадиазолил и хинолил. Все атомы углерода необязательно могут быть замещены одним или более галогеном или метилом.
Термин C(1-9)гетероарил-C(1-4)алкил в данном описании означает C(1-9)гетероарильную группу, присоединенную к C(1-4)алкильной группе, обе которые имеют значения, описанные выше.
Термин C(1-9)гетероарил-C(1-3)алкил в данном описании означает C(1-9)гетероарильную группу, присоединенную к C(1-3)алкильной группе, обе которые имеют значения, описанные выше.
Термин C(1-5)гетероарил в данном описании означает ароматическую группу, содержащую 1-5 атомов углерода и 1-4 гетероатома, которые могут быть присоединены через атом азота, если возможно, или атом углерода. Примеры включают имидазолил, тиадиазолил, пиридинил, пиримидинил, фурил, пиразолил, изоксазолил и тетразолил. Все атомы углерода необязательно могут быть замещены одним или более галогеном или метилом.
Термин C(1-5)гетероарил-C(1-4)алкил в данном описании означает C(1-5)гетероарильную группу, присоединенную к C(1-4)алкильной группе, обе которые имеют значения, описанные выше.
Термин C(1-5)гетероарил-C(1-3)алкил в данном описании означает C(1-5)гетероарильную группу, присоединенную к C(1-3)алкильной группе, обе которые имеют значения, описанные выше.
Термин C(3-6)циклоалкил в данном описании означает насыщенный циклический углеводород, содержащий 3-6 атомов углерода, т.е. циклопропил, циклобутил, циклопентил или циклогексил. Все атомы углерода необязательно могут быть замещены одним или более галогеном или метилом.
Термин C(3-6)циклоалкил-C(1-4)алкил в данном описании означает C(3-6)циклоалкильную группу, присоединенную к C(1-4)алкильной группе, обе которые имеют значения, описанные выше. Примером является циклопропилэтил.
Термин C(3-6)циклоалкил-C(1-3)алкил в данном описании означает C(3-6)циклоалкильную группу, присоединенную к C(1-3)алкильной группе, обе которые имеют значения, описанные выше. Примером является циклопропилметил.
Термин циклопропилметил в данном описании означает метильную группу, замещенную циклопропилом. Все атомы углерода необязательно замещены одним или более галогеном или метилом.
Термин C(2-5)гетероциклоалкил в данном описании означает насыщенный циклический углеводород, содержащий 2-5 атомов углерода и 1-3 гетероатомов, которые могут быть присоединены через атом азота, если возможно, или атом углерода. Примеры включают пиперазинил, пиразолидинил, пиперидинил, оксоланил оксетанил, морфолинил, пирролидинил, тетрагидропиранил, бензоксазин. Все атомы углерода необязательно могут быть замещены одним или более галогеном или метилом.
Термин C(2-5)гетероциклоалкил-C(1-4)алкил в данном описании означает C(2-5)гетероциклоалкильную группу, присоединенную к C(1-4)алкильной группе, обе которые имеют значения, описанные выше.
Термин C(2-5)гетероциклоалкил-C(1-3)алкил в данном описании означает C(2-5)гетероциклоалкильную группу, присоединенную к C(1-3)алкильной группе, обе которые имеют значения, описанные выше.
Термин (ди)C(1-3)алкиламино в данном описании означает аминогруппу, которая монозамещена или дизамещена C(1-3)алкильной группой, где последняя имеет значение, определенное выше.
Термин C(1-6)алкокси означает алкоксигруппу, содержащую 1-6 атомов углерода, где алкильная часть разветвлена или не разветвлена. Все атомы углерода необязательно замещены одним или более F.
Термин C(1-3)алкокси означает алкоксигруппу, содержащую 1-3 атома углерода, где алкильная часть разветвлена или не разветвлена. Все атомы углерода необязательно замещены одним или более F.
Термин C(1-3)алкоксикарбонил означает карбонильную группу, замещенную C(1-3)алкокси, где последняя имеет значение, определенное выше.
Термин галоген в данном описании означает Br, Cl или F.
В представленных выше определениях с многофункциональными группами, место присоединения находится на последней группе.
Если, в определении заместителя, указано, что ʺвсе алкильные группыʺ указанного заместителя необязательно замещены, они также включают алкильную часть алкоксигруппы.
Термин ʺзамещенныйʺ означает, что один или более атомов водорода указанного атома/атомов замещены выбором из указанной группы, при условии, что нормальная валентность указанных атомов в существующих условиях не превышена, и что замещение дает стабильное соединение. Сочетания заместителей и/или переменных возможно, только если такие сочетания дают стабильные соединения. ʺСтабильное соединениеʺ или ʺстабильная структураʺ определены как соединение или структура, которые достаточно устойчивы для того, чтобы вынести выделение до полезной степени чистоты из реакционной смеси и составление в эффективный терапевтический агент.
Термин ʺнеобязательно замещенныйʺ означает необязательное замещение указанными группами, радикалами или частями.
Термин фармацевтически приемлемая соль означает такие соли, которые, с медицинской точки зрения, подходят для применения в контакте с тканями человека и низших животных, не вызывая нежелательной токсичности, раздражения, аллергической реакции и подобных, и соразмерны разумному соотношению польза/риск. Фармацевтически приемлемые соли хорошо известны в данной области техники. Они могут быть получены во время конечного выделения и очистки соединений в соответствии с данным изобретением или отдельно, взаимодействием функциональной группы свободного основания с подходящей минеральной кислотой, такой как хлористоводородная кислота, фосфорная кислота или серная кислота, или с органической кислотой, такой как, например, аскорбиновая кислота, лимонная кислота, винная кислота, молочная кислота, малеиновая кислота, малоновая кислота, фумаровая кислота, гликолевая кислота, янтарная кислота, пропионовая кислота, уксусная кислота, метансульфоновая кислота и тому подобное. Функциональная группа кислоты может взаимодействовать с органическим или минеральным основанием, таким как гидроксид натрия, гидроксид калия или гидроксид лития.
В одном варианте, изобретение относится к соединению формулы I, где:
- A1 является NR1 или CR1, где R1 является H;
- A2-A5 являются, соответственно, CR2-CR5;
- или A3 или A4 является N, оставшиеся положения A являются углеродом;
- R2-R5 независимо являются H;
- R6 и R7 независимо являются H;
- R8 является H;
- A9-A12 являются, соответственно, CR9-CR12;
- или A10 или A11 являются N, оставшиеся положения A являются углеродом;
- R9-R12 независимо являются H, галогеном, C(1-3)алкокси или C(1-6)алкилом;
- R13 является H, C(1-6)алкилом, C(2-6)алкенилом, C(3-6)циклоалкилом, C(6-10)арилом, C(6-10)арил-C(1-4)алкилом или C(1-9)гетероарилом, все группы необязательно замещены одним или более гидроксилом или C(1-3)алкилом; и
- R14 является C(1-6)алкилом, C(2-6)алкенилом, C(3-6)циклоалкилом, C(3-6)циклоалкил-C(1-4)алкилом, C(2-5)гетероциклоалкилом, C(2-5)гетероциклоалкил-C(1-4)алкилом, C(6-10)арилом, C(6-10)арил-C(1-4)алкилом, C(1-9)гетероарилом или C(1-9)гетероарил-C(1-4)алкилом, все группы необязательно замещены одним или более галогеном, гидроксилом, циано, C(1-3)алкокси, C(1-3)алкоксикарбонилом или C(1-3)алкилом;
- или R13 и R14 конденсированы и образуют кольцо, содержащее от 5 до 7 атомов объединение R13, являющимся C(1-6)алкилом, с независимым заместителем их определения R14, все группы необязательно замещены одним или более гидрокси, C(1-3)алкокси, (ди)C(1-3)алкиламино или C(1-3)алкилом.
В одном варианте, изобретение также относится к соединению формулы I, где:
- A1 является NR1 или CR1, где R1 является H;
- A2-A5 являются, соответственно, CR2-CR5;
- или A3 или A4 является N, оставшиеся положения А являются углеродом;
- R2-R5 независимо являются H;
- R6 и R7 независимо являются H;
- R8 является H;
- A9-A12 являются, соответственно, CR9-CR12;
- или A10 или A11 является N, оставшиеся положения А являются углеродом;
- R13 является H, метилом, этилом, пропилом, бутилом, изобутилом, пропен-1-илом, циклобутилом, циклопропилом, фенилом, бензилом или пиридинилом, все группы необязательно замещены одним гидроксилом или метилом; и
- R14 является метилом, этилом, пропилом, бутилом, изобутилом, трет-бутилом, пропен-1-илом, циклопропилом, циклобутилом, циклогексилом, циклопропилметилом, циклобутилметилом, пиперидинилом, оксетанилом, оксоланилом, тетрагидропиранилом, морфолинилэтилом, оксоланилпропанилом, фенилом, бензилом, фенилэтилом, пиридинилом, тиазолилом, тиофенилом, пиразолилом, оксазолилом, тиадиазолилом, пиридинилметилом, изоксазолилметилом, фуранилметилом или тиофенилметилом, все группы необязательно замещены одним или более галогеном, гидроксилом, циано, метокси, метоксикарбонилом, этоксикарбонил или метилом;
- или R13 и R14 конденсированы и образуют фенилпирролидин, пиперидин, фенилпиперидин, 4,5,6,7-тетрагидротиено[2,3-c]пиридин, (1,3-тиазолил)пирролидин, (морфолинилметил)пиперидин, 1,2,3,4-тетрагидрохинолин, 2,3-дигидро-2H-изоиндол, фенилпиперазин, 2,3,4,5-тетрагидро-1H-1-бензазепин, 1,4-бензоксазин, 7-окса-4-азаспиро[2.5]октан, все группы необязательно замещены одним или более этоксикарбонилом или метилом.
В одном варианте изобретение также относится к соединению формулы I, где:
- A1 является NR1 или CR1, где R1 является H;
- A2-A5 являются, соответственно, CR2-CR5;
- R2-R5 независимо являются H;
- R6 и R7 независимо являются H;
- R8 является H;
- A9 и A12 являются, соответственно, CR9 и CR12;
- A10 или A11 является N, оставшееся положение A является CR10 или CR11;
- R9-R12 независимо являются H, галогеном, C(1-3)алкокси или C(1-6)алкилом;
- R13 является C(1-6)алкилом, и
- R14 является C(6-10)арилом.
В одном варианте, изобретение относится к соединению формулы I, где:
- A1 является CR1, где R1 является H;
- A2 и A5 являются, соответственно, CR2 и CR5;
- A3 или A4 является N, оставшееся положение A является CR3 или CR4;
- R2-R5 независимо являются H;
- R6 и R7 независимо являются H;
- R8 является H;
- A9-A12 являются, соответственно, CR9-CR12;
- R9-R12 независимо являются H или галогеном;
- R13 является C(1-6)алкилом, все группы необязательно замещены одним или более галогеном; и
- R14 является C(6-10)арилом.
В одном варианте, изобретение также относится к соединению формулы I, где A1 является CR1.
В другом варианте, изобретение относится к соединению формулы I, где A1 является NR1.
В другом варианте, изобретение относится к соединению формулы I, где R1 является водородом.
В одном варианте, изобретение также относится к соединению формулы I, где A1 является CR1 и R1 является водородом.
В другом варианте, изобретение относится к соединению формулы I, где A1 является NR1 и R1 является водородом.
В другом варианте, изобретение относится к соединению формулы I, где все положения А в A2-A5 являются углеродом.
В другом варианте, изобретение относится к соединению формулы I, где все положения А в A2-A5 являются углеродом и все положения R в R2-R5 являются H.
В другом варианте, изобретение относится к соединению формулы I где, по крайней мере, одно, но не более двух из четырех положений A в A2-A5 является азотом.
В еще одном варианте, изобретение относится к соединению формулы I, где одно из положений A в A2-A5 является азотом, и оставшиеся положения A в A2-A5 являются углеродом.
В одном варианте изобретение относится к соединению формулы I, где A2-A5 являются, соответственно, CR2-CR5, или одно из положений A3 или A4 является N, оставшиеся положения А являются углеродом.
В одном варианте изобретение относится к соединению формулы I, где A3 или A4 является N, оставшиеся положения А являются углеродом и A9-A12 являются, соответственно, CR9-CR12.
В еще одном варианте, изобретение относится к соединению формулы I, где R2 является метилом и R3-R5 являются H.
В другом варианте, изобретение относится к соединению формулы I, где R2-R5 являются H.
В другом варианте, изобретение относится к соединению формулы I, где R6 и R7 независимо являются H, метилом или гидроксилом.
В другом варианте, изобретение относится к соединению формулы I, где R6 и R7 является H.
Изобретение также относится к соединению формулы I, где R8 является H или C(1-2)алкилом.
Изобретение также относится к соединению формулы I, где R8 является H.
Изобретение также относится к соединению формулы I, где все положения A в A9-A12 являются углеродом.
В другом варианте, изобретение относится к соединению формулы I, где, по крайней мере, одно, но не более двух из четырех положений А в A9-A12 является азотом.
В еще одном варианте, изобретение относится к соединению формулы I, где одно из положений А в A9-A12 является азотом и оставшиеся положения A в A9-A12 являются углеродом.
В одном варианте изобретение относится к соединению формулы I, где A9-A12 являются, соответственно, CR2-CR5 или одно из положений A9-A12 является N, оставшиеся положения А являются углеродом.
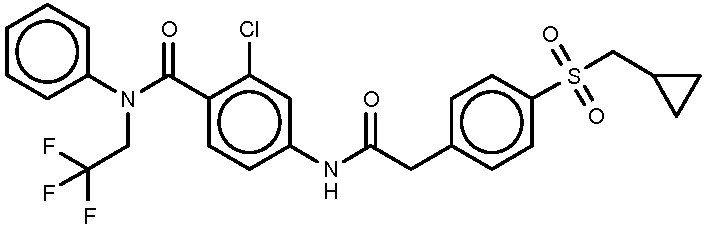
В еще одном варианте, изобретение относится к соединению формулы I, где A9 или A12 является азотом, оставшиеся положения А являются углеродом и A2-A5 являются, соответственно, CR2-CR5.
В еще одном варианте, изобретение относится к соединению формулы I, где A10 или A11 является азотом, и оставшееся положение A в A9-A12 является углеродом.
В еще одном варианте, изобретение относится к соединению формулы I, где все положения А в A9-A12 являются углеродом или где положение A в любом из A9 или A10 является азотом, и оставшиеся положения A являются углеродом.
В другом варианте, изобретение относится к соединению формулы I, где R9-R12 независимо являются H, галогеном, метокси или метилом.
В другом варианте, изобретение относится к соединению формулы I, где R9-R12 независимо являются H.
В другом варианте, изобретение относится к соединению формулы I, где R13 и R14 независимо являются H, C(1-6)алкилом, C(2-6)алкенилом, C(3-6)циклоалкилом, C(3-6)циклоалкил-C(1-4)алкилом, C(2-5)гетероциклоалкилом, C(2-5)гетероциклоалкил-C(1-4)алкилом, C(6-10)арилом, C(6-10)арил-C(1-4)алкилом, C(1-9)гетероарилом или C(1-9)гетероарил-C(1-4)алкилом, все группы необязательно замещены одним или более галогеном, амино, гидроксилом, циано, C(1-3)алкокси, C(1-3)алкоксикарбонилом, (ди)C(1-3)алкиламино или C(1-3)алкилом.
В еще одном варианте, изобретение относится к соединению формулы I, где R13 и R14 независимо являются H, C(1-6)алкилом, C(2-6)алкенилом, C(3-6)циклоалкилом, C(3-6)циклоалкил-C(1-4)алкилом, C(2-5)гетероциклоалкилом, C(2-5)гетероциклоалкил-C(1-4)алкилом, C(6)арилом, C(6)арил-C(1-4)алкилом, C(1-5)гетероарилом или C(1-5)гетероарил-C(1-4)алкилом, все группы необязательно замещены одним или более галогеном, гидрокси, циано, C(1-3)алкокси, C(1-3)алкоксикарбонилом или C(1-3)алкилом.
В еще одном варианте, изобретение относится к соединению формулы I, где
- R13 является H, метилом, этилом, пропилом, бутилом, изобутилом, пропен-1-илом, циклобутилом, циклопропилом, фенилом, бензилом или пиридинилом, все группы необязательно замещены одним гидроксилом или метилом; и
R14 является метилом, этилом, пропилом, бутилом, изобутилом, трет-бутилом, пропен-1-илом, циклопропилом, циклобутилом, циклогексилом, циклопропилметилом, циклобутилметилом, пиперидинилом, оксетанилом, оксоланилом, тетрагидропиранилом, морфолинилэтилом, оксоланилпропанилом, фенилом, бензилом, фенилэтилом, пиридинилом, тиазолилом, тиофенилом, пиразолилом, оксазолилом, тиадиазолилом, пиридинилметилом, изоксазолилметилом, фуранилметилом или тиофенилметилом, все группы необязательно замещены одним или более галогеном, гидроксилом, циано, метокси, метоксикарбонилом, этоксикарбонилом или метилом.
В другом варианте, изобретение относится к соединению формулы I, где R13 и R14 конденсированы и образуют кольцо, включающее от 5 до 7 атомов объединением C(1-6)алкила в R13 с заместителем на R14, выбранным из C(1-6)алкила, C(2-6)алкенила, (3-6)циклоалкила, C(3-6)циклоалкил-C(1-4)алкила, C(2-5)гетероциклоалкила, C(2-5)гетероциклоалкил-C(1-4)алкила, C(6)арила, C(6)арил-C(1-4)алкила, C(1-5)гетероарила или C(1-5)гетероарил-C(1-4)алкила, где все группы необязательно замещены одним или более галогеном, гидрокси, циано, C(1-3)алкокси, C(1-3)алкоксикарбонилом или C(1-3)алкилом.
В еще одном варианте, изобретение относится к соединению формулы I, где R13 и R14 конденсированы и образуют циклический углеводород, включающий 5 или 6 атомов углерода объединением этила или пропила в R13 с R14, выбранным из C(1-6)алкила, C(2-6)алкенила, C(2-5)гетероциклоалкила, C(2-5)гетероциклоалкил-C(1-3)алкила, C(6)арила, C(6)арил-C(1-3)алкила, C(1-5)гетероарила или C(1-5)гетероарил-C(1-3)алкила, где все группы необязательно замещены одним или более галогеном, циано, C(1-3)алкокси, C(1-3)алкоксикарбонилом, (ди)C(1-3)алкиламино или C(1-3)алкилом.
В другом варианте, изобретение относится к соединению формулы I, где R13 и R14 R13 и R14 конденсированы и образуют фенилпирролидин, пиперидин, фенилпиперидин, 4,5,6,7-тетрагидротиено[2,3-c]пиридин, (1,3-тиазолил)пирролидин, (морфолинилметил)пиперидин, 1,2,3,4-тетрагидрохинолин, 2,3-дигидро-2H-изоиндол, фенилпиперазин, 2,3,4,5-тетрагидро-1H-1-бензазепин,,4-бензоксазин, 7-окса-4-азаспиро[2.5]октан, все группы необязательно замещены одним или более метоксикарбонилом, этоксикарбонилом, метиламино или метилом.
Изобретение также относится к тем соединениям, в которых все конкретные определения для A1-A12, R1-R14 и всех замещающих групп в различных аспектах изобретения, определенных выше, существуют в любых сочетаниях в рамках определения соединения формулы I.
В другом аспекте соединение относится к соединениям формулы I, которые имеют pIC50 5 или выше. В еще одном аспекте изобретение относится к соединениям формулы I с pIC50 более 6. В еще одном аспекте изобретение относится к соединениям формулы I с pIC50 более 7. В еще одном аспекте изобретение относится к соединениям формулы I с pIC50 более 8.
В еще одном варианте изобретение относится к соединениям формулы I, выбранным как описано в примерах 1-166.
Соединения формулы I могут образовывать соли, которые также включены в объем данного изобретения. Ссылка на соединение формулы I здесь включает ссылку на его соли, если не указано иначе.
Соединения формулы I могут содержать асимметрические или хиральные центры и, поэтому, существуют в различных стереоизомерных формах. Подразумевается, что все стереоизомерные формы соединений формулы I а также их смеси, включая рацемические смеси, образуют часть данного изобретения.
Диастереомерные смеси могут быть разделены на отдельные диастереомеры на основе их физико-химических различий, способами, хорошо известными специалистам в данной области техники, такими как, например, хроматография и/или фракционная кристаллизация. Энантиомеры могут быть разделены превращением энантиомерной смеси в диастереомерную смесь взаимодействием с подходящим оптически активным соединением (например, хиральной добавкой, такой как хиральный спирт или хлорид кислоты Мошера), разделяя диастереомеры и превращая (например, гидролизом) отдельные диастереомеры в соответствующие чистые энантиомеры. Энантиомеры также могут быть разделены с применением хиральной ВЭЖХ колонки.
Специалисты в данной области техники понимают, что желаемые значения IC50 зависят от тестируемого соединения. Например, соединение со значением IC50 менее 10-5 M обычно считается кандидатом для отбора по чувствительности к лекарственному препарату. Предпочтительно, это значение ниже 10-6 M. Однако соединение, которое имеет более высокое значение IC50, но является селективным к конкретному рецептору, может быть даже лучшим кандидатом.
Соединения в соответствии с данным изобретением ингибируют активность RORγ. Модулирование активности RORγ может быть измерена с применением, например, исследований замещения биофизического (природного) лиганда, биохимическими анализами AlphaScreen или FRET, клеточными анализами гена-репортера GAL4, клеточным анализом промотора-репортера ИЛ-17 или функциональными ELISA анализами ИЛ-17 с применением, например, мышиных спленоцитов или мононуклеарных клеток периферической крови человека (МКПК), культивированных в TH17 поляризующих условиях.
В таких анализах взаимодействие лиганда с RORγ может быть определено измерением, например, лиганд-модулированного взаимодействия кофактор-производных пептидов со связывающим доменом лиганда RORγ или измерением генных продуктов лиганд-модулированной RORγ-медиированной транскрипции, с применением, например, исследований люциферазного репортера или ELISA исследований ИЛ-17.
Данное изобретение также относится к фармацевтической композиции, содержащей соединения или их фармацевтически приемлемые соли, имеющих общую формулу I, в смеси с фармацевтически приемлемыми наполнителями и, необязательно, другие терапевтически активные агенты. Наполнители должны быть ʺприемлемымиʺ в смысле совместимости с другими ингредиентами композиции и не вредящими реципиентам.
Данное изобретение также относится к фармацевтической композиции, содержащей, по крайней мере, один дополнительный терапевтически активный агент.
Изобретение также включает соединение формулы I в сочетании с одним или более другими лекарственными средствами.
Композиции включают, например, композиции, подходящие для перорального, подъязычного, подкожного, внутривенного, внутримышечного, назального, местного или ректального введения, и подобных, все которые имеют стандартную лекарственную форму для введения.
Для перорального введения активный ингредиент может присутствовать в виде отдельных единиц, таких как таблетки, капсулы, порошки, грануляты, растворы, суспензии и подобные.
Для парентерального введения фармацевтическая композиция в соответствии с данным изобретением может присутствовать в однодозных или многодозных контейнерах, например, жидкие инъекции в определенных количествах, например, в герметично закрытых флаконах или ампулах, а также могут храниться в высушенном вымораживанием (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например, воды, перед применением.
При смешивании таких фармацевтически приемлемых добавок активный ингредиент может быть спрессован в твердые лекарственные формы, такие как пилюли, таблетки, или может быть переработан в капсулы или суппозитории. В виде фармацевтически приемлемых жидкостей активный ингредиент может быть нанесен в виде жидкой композиции, например, в виде препарата для инъекций, в форме раствора, суспензии, эмульсии, или в виде спрея, например, назального спрея.
Для получения твердых лекарственных форм рассматривается применение обычных добавок, таких как наполнители, красители, полимерные связующие агенты и подобные. В общем, могут применяться любые фармацевтически приемлемые добавки, которые не взаимодействуют с функциональными группами активных соединений. Подходящие носители, с которыми может вводиться активный агент в соответствии с данным изобретением в виде твердых композиций, включают лактозу, крахмал, производные целлюлозы и подобные, и их смеси, применяемые в подходящих количествах. Для парентерального введения могут применяться водные суспензии, изотонические солевые растворы и стерильные растворы для инъекций, содержащие фармацевтически приемлемые диспергирующие агенты и/или смачивающие агенты, такие как пропиленгликоль или бутиленгликоль.
Изобретение также включает фармацевтическую композицию, как описана выше, в сочетании с упаковкой, подходящей для указанной композиции, где указанная упаковка включает инструкции по применению композиции, для описанного выше применения.
Точная доза и режим введения активного ингредиента или его фармацевтической композиции может варьироваться в зависимости от конкретного соединения, способа введения и возраста и состояния пациента, которому вводят лекарство.
В общем, парентеральное введение требует более низких доз, чем другие способы введения, которые больше зависят от абсорбции. Однако доза для человека предпочтительно включает 0,0001-100 мг на кг массы тела. Желаемая доза может быть представлена в виде однократной дозы или множества субдоз, вводимых с подходящим интервалом в течение суток.
Соединения в соответствии с данным изобретением или их фармацевтически приемлемая соль могут применяться в качестве лекарственного средства в терапии.
Другой аспект изобретения относится к применению соединений в соответствии с данным изобретением или их фармацевтически приемлемой соли для лечения RORγ-медиированных заболеваний или RORγ-медиированных состояний.
Другой аспект изобретения относится к применению соединений общей формулы I или их фармацевтически приемлемой соли для лечения аутоиммунных заболеваний, в частности, таких заболеваний, в которых TH17 клетки и не-TH17 клетки, которые экспрессируют TH17 характерные цитокины, играют важную роль. Оно включает, но не ограничено ими, лечение ревматоидного артрита, псориаза, воспалительного заболевания кишечника, болезнь Крона и рассеянный склероз.
В другом аспекте, соединения общей формулы I или их фармацевтически приемлемая соль могут применяться для лечения воспалительных заболеваний, в которых TH17 клетки и/или не-TH17 клетки, которые экспрессируют TH17 характерные цитокины, играют важную роль, таких как, но не ограниченных ими, респираторные заболевания, остеоартрит и астма. Также соединения или их фармацевтически приемлемая соль формулы I могут применяться для лечения инфекционных заболеваний, в которых TH17 клетки и/или не-TH17 клетки, которые экспрессируют TH17 характерные цитокины, играют важную роль, таких как, но не ограниченных ими, слизистый лейшманиоз.
Соединения общей формулы I или их фармацевтически приемлемая соль также могут применяться для лечения других заболеваний, в которых TH17 клетки и/или не-TH17 клетки, которые экспрессируют TH17 характерные цитокины, играют важную роль, таких как, но не ограниченных ими, болезнь Кавасаки и тиреоидит Хашимото.
В еще одном аспекте изобретения представлено применение соединений общей формулы I для лечения рассеянного склероза, воспалительного заболевания кишечника, болезни Крона, псориаза, ревматоидного артрита, астмы, остеоартрита, болезни Кавасаки, тиреоидита Хашимото, рака и слизистого лейшманиоза.
В другом аспекте соединение в соответствии с данным изобретением может применяться в терапии для лечения или профилактики рассеянного склероза, воспалительного заболевания кишечника, болезни Крона, псориаза и ревматоидного артрита, астмы, остеоартрита, болезни Кавасаки, тиреоидита Хашимото, рака и слизистого лейшманиоза.
В другом аспекте соединение в соответствии с данным изобретением может применяться для лечения или профилактики псориаза.
В другом аспекте соединение в соответствии с данным изобретением может применяться для лечения воспалительного заболевания кишечника.
Изобретение иллюстрировано следующими примерами.
ПРИМЕРЫ
Как изображено в примерах ниже, в определенных типовых вариантах соединения получают в соответствии со следующими общими методами. Должно быть понятно, что хотя в общих способах изображен синтез определенных соединений в соответствии с данным изобретением, следующие общие способы и другие способы, известные специалистам в данной области техники, могут применяться ко всем соединениям и подклассам и видам каждого из этих соединений, как описано здесь.
ОБЩИЕ СПОСОБЫ ПОЛУЧЕНИЯ
Описанные здесь соединения, включая соединения общей формулы I, могут быть легко получены согласно следующим реакционным схемам и примерам, или их модификациям, с применением легкодоступных исходных материалов, реагентов и обычных методов синтеза. Многие реакции также могут проводиться в микроволновых условиях или с применением обычного нагревания, или с применением других технологий, таких как твердофазные реагенты/акцепторы или поточная химия. В этих реакциях также возможно применять варианты, которые сами по себе известны специалистам в данной области техники, но не описаны подробно. Например, если указаны конкретные кислоты, основания, реагенты, сочетающие агенты, растворители и т.д., понятно, что могут применяться другие подходящие кислоты, основания, реагенты, сочетающие агенты, растворители и т.д., которые включены в объем данного изобретения. Более того, другие способы получения соединений в соответствии с данным изобретением очевидны специалисту в данной области техники с учетом следующих реакционных схем и примеров. В случае, когда промежуточные соединения синтеза и конечные продукты содержат потенциально реакционноспособные функциональные группы, например, амино, гидроксил, тиол и группы карбоновой кислоты, которые могут взаимодействовать с желаемой реакцией, может быть предпочтительно применять защищенные формы промежуточного соединения. Способы выбора, введения и последующего удаления защитных групп хорошо известны специалистам в данной области техники. Соединения, полученные с применением общих реакционных последовательностей, могут быть недостаточной чистоты. Соединения могут быть очищены с применением любого способа очистки органических соединений, например, кристаллизации или хроматографии на колонке с силикагелем или окисью алюминия, с применением различных растворителей в подходящих соотношениях. Все возможные стереоизомеры предусматриваются в объеме изобретения. В описании ниже переменные имеют значения, указанные выше, если не указано иначе.
Аббревиатуры, применяемые в этих экспериментах, перечислены ниже, и дополнительные аббревиатуры должны быть известны специалисту в области синтетической химии.
Применяемые аббревиатуры: к.т.: комнатная температура; ГАТУ: гексафторфосфат 2-(7-аза-1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония; ДМФ: диметилформамид; ДИПЭА: диизопропилэтиламин; ДМАП: 4-(диметиламино)пиридин; ДЦК: N,N'-дициклогексилкарбодиимид; мХПБК: 3-хлорпероксибензойная кислота; ТФК: трифторуксусная кислота; ТГФ: Тетрагидрофуран; ДМСО: диметилсульфоксид; PyBOP: гексафторфосфат (бензотриазол-1-илокси)трипирролидинофосфония; EtOH: этанол; ТСХ: тонкослойная хроматография; ЭДКИ: 1-Этил-3-(3-диметиламинопропил)карбодиимид; АИБН: азобисизобутиронитрил; NBS: N-бромсукцинимид; ФТБА: фторид тетра-n-бутиламмония; ЦНТМС: триметилсилилцианид.
Химическими наименованиями являются предпочтительные IUPAC наименования, полученные с применением MarvinSketch, версия 6.3.0.
Если химическое соединение описано с помощью химической структуры и химического наименования, и между структурой и наименованием имеется неясность, преимущественной является структура.
ОБЩИЕ МЕТОДЫ
Схема 1:

Как изображено на схеме 1, производные соединения в соответствии с данным изобретением, имеющие формулу I, могут быть получены способами, известными в области органической химии. Соединения в соответствии с данным изобретением, например, могут быть получены амидным сочетанием между производным (гетеро)арилуксусной кислоты 1, где A1, A2, A3, A4, A5, R6 и R7 имеют описанные выше значения, и амидным производным 2, где A9, A10, A11, A12, R8, R13 и R14 имеют описанные выше значения, которые могут быть легко получены специалистом в области органической химии с применением реагента, такого как ЭДКИ, ГАТУ, ДЦК или PyBOP или подобные, в присутствии подходящего основания, такого как ДИПЭА, или катализатора, такого как ДМАП.
Альтернативно, производное (гетеро)арилуксусной кислоты 1 может быть превращено в хлорангидрид, с применением, например, SOCl2 или оксалилхлорида, которые могут сочетаться в присутствии подходящего основания, такого как Et3N или подобное, с производным амина 2, с получением производных формулы I.
Альтернативно, производное (гетеро)арилуксусной кислоты 1 может быть конденсировано с защищенным подходящей кислотой производны (гетеро)ариламино 3, где A9, A10, A11, A12 и R8 имеют описанные выше значения, с применением описанных выше способов. После удаления защитной группы полученное производное карбоновой кислоты 4 может быть конденсировано с подходящим амином 5, где R13 и R14 имеют описанные выше значения, с применением способов, описанных выше, с получением производных формулы I.
Схема 2:

Условия: i) H2SO4, EtOH, 60°C; ii) (бромметил)циклопропан, K2CO3, CH3CN, к.т.; iii) мХПБК, CH2Cl2, к.т.; iv) 2N NaOH, EtOH, к.т.
Схема 2 иллюстрирует общий способ получения производных 2-(4-циклопропилметансульфонилфенил)уксусной кислоты структурного элемента 1, где A1 является C и A2, A3, A4, A5, R6 и R7 имеют описанные выше значения.
Эстерификация производных 4-меркаптофенилуксусной кислоты 6 в кислых условиях с применением, например, H2SO4 в этаноле, дает производные этилового эфира 4-меркаптофенилуксусной кислоты 7. Алкилирование серной группы с применением (бромметил)циклопропана в присутствии основания, такого как K2CO3, дает соответствующие производные 2-(4-циклопропилметансульфанилфенил)ацетата 8. Окисление с применением, например, мХПБК, дает производные 2-(4-циклопропилметансульфонилфенил)ацетата 9, которые после омыления части сложного эфира в основных условиях, например, NaOH в этаноле, дает соответствующие производные 2-(4-циклопропилметансульфонилфенил)уксусной кислоты структурного элемента 1.
Схема 3:

Условия: (A1=C, A4=N и R6 и R7 являются H): i) Тиомочевина, HCl (водн.), кипение с обратным холодильником; ii) (бромметил)циклопропан, K2CO3, CH3CN, к.т.; iii) мХПБК, CH2Cl2, 0°C→КТ; iv) NBS, АИБН, CH3CN, 60°C; v) ЦНТМС, ФТБА, CH3CN, кипение с обратным холодильником; vi) NaOH, EtOH, кипение с обратным холодильником.
Схема 3 демонстрирует общий способ получения производных 2-(6-алкилсульфонилпиридин-3-ил)уксусной кислоты структурного элемента 1, где A1 является C, A4 является N, R6 и R7 являются H и A2, A3 и A5 имеют описанные выше значения.
Реакция производных 2-бром-5-метилпиридина 10 с тиомочевиной в кислых условиях дает производные 5-метилпиридин-2-тиола 11, которые могут быть алкилированы в присутствии подходящего основания, такого как карбонат калия, с получением соответствующих производных 2-[(циклопропилметил)сульфанил]-5-метилпиридина 12. Окисляют с применением мХПБК, например, до соответствующих сульфоновых производных 13, которые при радикальном бромировании с NBS в присутствии радикального инициатора, такого как АИБН, дают производные 5-(бромметил)-2-[(циклопропилметил)сульфанил]пиридина 14. Эти бромидные производные могут быть превращены в соответствующие нитрильные производные 15 обработкой источником цианида, таким как ЦНТМС или цианид калия, или подобными. Если применяют ЦНТМС, требуется добавлять источник фторида, такой как ФТБА или подобные, для получения цианидного нуклеофила in situ. Гидролиз нитрильных производных 15 дает соответствующие производные карбоновой кислоты структурного элемента 1, где A1 является C и A4 является N.
Некоторые из структурных элементов 1 коммерчески доступны, известны или получены способами, известными специалистам в данной области техники.
Схема 4:

Условия: i) Хлорсульфоновая кислота, CH2Cl2, от 0°C до к.т.; ii) Циклопропиламин, Et3N, CH2Cl2, к.т.; iii) 2N NaOH, EtOH, к.т.
Схема 4 иллюстрирует общий способ получения производных 2-[4-(циклопропилсульфамоил)фенил]уксусной кислоты структурного элемента 1, где A1 является N и A2, A3, A4, A5, R6 и R7 имеют описанные выше значения.
Взаимодействие производных этил 2-фенилацетата 16 с хлорсульфоновой кислотой дает производные этил 2-[4-(хлорсульфонил)фенил]ацетата 17, которые после нуклеофильного замещения циклопропиламином дают производные этил 2-[4-(циклопропилсульфамоил)фенил]ацетата 18. Омыление сложной эфирной части в основных условиях, например, NaOH в этаноле, дает соответствующие производные 2-[4-(циклопропилсульфамоил)фенил]уксусной кислоты структурного элемента 1.
Схема 5:

Условия: i) EtOH, HCl(конц.), к.т.; ii) структурный элемент 1, ЭДКИ, ДМАП, CH2Cl2, 60°C; iii) 2N NaOH, EtOH, кипение с обратным холодильником; iv) подходящий амин, ЭДКИ, ДМАП, CH2Cl2, 60°C.
Схема 5 демонстрирует общий способ получения производных формулы I, где A1, A2, A3, A4, A5, R6, R7, R8, A9, A10, A11, A12, R13 и R14 имеют описанные выше значения.
Взаимодействие производных карбоновой кислоты 19 с подходящим спиртом в кислых условиях дает соответствующие производные сложного эфира 20, которые могут быть конденсированы со структурным элементом 1, в присутствии, например, ЭДКИ и ДМАП, с получением амидных производных 22. После омыления части сложного эфира в основных условиях с применением, например, NaOH в этаноле, полученные производные 23 могут быть конденсированы с подходящим амином в присутствии, например, ЭДКИ и ДМАП, с получением производных формулы I.
Схема 6:

Условия: i) SOCl2, CH2Cl2, к.т.; ii) подходящий амин, триэтиламин, CH2Cl2, к.т.; iii) подходящий амин, ЭДКИ, ДМАП, CH2Cl2, 60°C; iv) порошок цинка, NH4Cl, ТГФ, вода 75°C; v) структурный элемент 1, ЭДКИ, ДМАП, CH2Cl2, 60°C.
Схема 6 демонстрирует альтернативный способ получения производных формулы I, где A1, A2, A3, A4, A5, R6, R7, R8, A9, A10, A11, A12, R13 и R14 имеют описанные выше значения.
Производные 4-нитробензойной кислоты 24 могут быть конденсированы с подходящими аминами в присутствии, например, ЭДКИ и ДМАП, с получением производных 4-нитробензамида 26. Альтернативно, производные 4-нитробензойной кислоты могут быть легко превращены в соответствующие производные 4-нитробензоила 25 с применением, например, SOCl2 или оксалилхлорида, которые затем могут сочетаться с подходящими аминами в присутствии основания, такого как Et3N или подобные.
Нитрогруппа производных 26 может быть восстановлена с применением, например, хлорида олова, железа, в присутствии уксусной кислоты или цинка в присутствии хлорида аммония или формиата аммония, с получением производных 4-аминобензамида 27, которые могут быть конденсированы с производными (гетеро)арилуксусной кислоты 1, в присутствии, например, ЭДКИ и ДМАП, с получением производных формулы I, где R8 является водородом.
Если R13 является C(1-6)алкилом, замещенным одним или более гидроксилом, спирт, содержащийся в амине R13R14NH, может быть защищен в виде силилового эфира до конденсации с производными 4-нитробензойной кислоты 24 или производными 4-нитробензоилхлорида 25, как описано выше. После последующего нитро восстановления и конденсации с производным (гетеро)арилуксусной кислоты 1, производные формулы I могут быть получены снятием защиты с силилового эфира с применением фторида тетрабутиламмония.
Примеры
Все применяемые структурные элементы коммерчески доступны, известны или получены способами, известными специалистам в данной области техники.
Примеры 1-166
1: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-пропилбензамид.

i) К суспензии 4-аминобензойной кислоты (20 г) в метаноле (150 мл) добавляют при комнатной температуре концентрированную HCl (25 мл). Реакционную смесь перемешивают в течение ночи при комнатной температуре. Реакцию гасят добавлением насыщенного водного раствора NaHCO3. Органический растворитель удаляют при пониженном давлении, и водный слой экстрагируют несколько раз этилацетатом. Объединенные органические слои промывают водой, затем насыщенным раствором соли, сушат над MgSO4 и концентрируют при пониженном давлении с получением метил 4-аминобензоата (22,1 g) в виде беловатого твердого вещества. Продукт применяют на следующей стадии без дальнейшей очистки.
ii) К раствору продукта, полученного на предыдущей стадии (710 мг), по каплям добавляют 2-(4-циклопропилметансульфонилфенил)уксусную кислоту (1,0 г) и ДМАП (100 мг) в CH2Cl2 (2 мл) при 0°C раствор ЭДКИ (900 мг) в CH2Cl2. Реакционную смесь перемешивают в течение ночи при комнатной температуре. Органический слой промывают насыщенным водным раствором NaHCO3, водой, затем насыщенным раствором соли, сушат над MgSO4 и концентрируют при пониженном давлении. Остаток очищают на SiO2 с применением 1%-10% этилацетата в гептане в качестве элюента с получением метил 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]бензоата (1,3 г) в виде белого твердого вещества.
iii) Суспензия продукта, полученного на предыдущей стадии (1,3 г) и 2N водный раствор NaOH (6 мл) в этаноле (20 мл) перемешивают в течение ночи при комнатной температуре. Этанол удаляют при пониженном давлении и добавляют воду. Раствор промывают CH2Cl2 и водную фазу подкисляют добавлением 2N водного раствора HCl до pH=1. Продукт экстрагируют в этилацетат, и слой этилацетата промывают водой и насыщенным раствором соли, сушат над MgSO4 и концентрируют при пониженном давлении с получением 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]бензойной кислоты (840 мг). Продукт применяют без дальнейшей очистки.
iv) Раствор продукта, полученного на предыдущей стадии (40 мг), н-пропиламин (12 мкл), ЭДКИ (25 мг) и ДМАП (14 мг) в CH2Cl2 (2 мл) перемешивают в течение ночи при комнатной температуре. Органический слой промывают водой, насыщенным водным раствором NaHCO3, насыщенным раствором соли, сушат над MgSO4 и концентрируют при пониженном давлении. Остаток очищают на ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-пропилбензамида (23 мг) в виде белого твердого вещества. МС(ЭР+) m/z 415,2 (M+H)+.
По методике, аналогичной описанной в примере 1, с применением подходящих исходных материалов получают следующие соединения.
2: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этилбензамид.
 МС(ЭР+) m/z 401,1 (M+H)+.
МС(ЭР+) m/z 401,1 (M+H)+.
3: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-метил-N-фенилбензамид.
 МС(ЭР+) m/z 463,2 (M+H)+.
МС(ЭР+) m/z 463,2 (M+H)+.
4: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N,N-диметилбензамид.
 МС(ЭР+) m/z 401,1 (M+H)+.
МС(ЭР+) m/z 401,1 (M+H)+.
5: N-бензил-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-метилбензамид.
 МС(ЭР+) m/z 477,2 (M+H)+.
МС(ЭР+) m/z 477,2 (M+H)+.
6: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(2-фенилпропан-2-ил)бензамид.
 МС(ЭР+) m/z 491,2 (M+H)+.
МС(ЭР+) m/z 491,2 (M+H)+.
7: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-метил-N-пропилбензамид.
 МС(ЭР+) m/z 428,2 (M+H)+.
МС(ЭР+) m/z 428,2 (M+H)+.
8: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-метил-N-(2-метилпропил)бензамид.
 МС(ЭР+) m/z 443,2 (M+H)+.
МС(ЭР+) m/z 443,2 (M+H)+.
9: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(циклопропилметил)-N-пропилбензамид.
 МС(ЭР+) m/z 469,2 (M+H)+.
МС(ЭР+) m/z 469,2 (M+H)+.
10: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-метил-N-(2-фенилэтил)бензамид.
 МС(ЭР+) m/z 491,2 (M+H)+.
МС(ЭР+) m/z 491,2 (M+H)+.
11: N-трет-бутил-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]бензамид.
 МС(ЭР+) m/z 429,2 (M+H)+.
МС(ЭР+) m/z 429,2 (M+H)+.
12: N,N-дибензил-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]бензамид.
 МС(ЭР+) m/z 553,2 (M+H)+.
МС(ЭР+) m/z 553,2 (M+H)+.
13: N-бензил-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]бензамид.
 МС(ЭР+) m/z 463,2 (M+H)+.
МС(ЭР+) m/z 463,2 (M+H)+.
14: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(1-фенилэтил)бензамид.
 МС(ЭР+) m/z 477,2 (M+H)+.
МС(ЭР+) m/z 477,2 (M+H)+.
15: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N,N-бис(2-метилпропил)бензамид.
 МС(ЭР+) m/z 485,2 (M+H)+.
МС(ЭР+) m/z 485,2 (M+H)+.
16: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этил-N-фенилбензамид.
 МС(ЭР+) m/z 477,2 (M+H)+.
МС(ЭР+) m/z 477,2 (M+H)+.
17: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-метил-N-(пиридин-2-ил)бензамид.
 МС(ЭР+) m/z 464,2 (M+H)+.
МС(ЭР+) m/z 464,2 (M+H)+.
18: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-метил-N-[(1S)-1-фенилэтил]бензамид.
 МС(ЭР+) m/z 491,2 (M+H)+.
МС(ЭР+) m/z 491,2 (M+H)+.
19: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-фенил-N-пропилбензамид.
 МС(ЭР+) m/z 491,2 (M+H)+.
МС(ЭР+) m/z 491,2 (M+H)+.
20: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-пропил-N-(пиридин-3-ил)бензамид.
 МС(ЭР+) m/z 492,2 (M+H)+.
МС(ЭР+) m/z 492,2 (M+H)+.
21: N-бензил-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-пропилбензамид.
 МС(ЭР+) m/z 505,2 (M+H)+.
МС(ЭР+) m/z 505,2 (M+H)+.
22: 4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-фенил-N-пропилбензамид.
 МС(ЭР+) m/z 492,2 (M+H)+.
МС(ЭР+) m/z 492,2 (M+H)+.
23: N-бензил-4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-пропилбензамид.
 МС(ЭР+) m/z 506,2 (M+H)+.
МС(ЭР+) m/z 506,2 (M+H)+.
24: N,N-дибензил-4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}бензамид.
 МС(ЭР+) m/z 554,2 (M+H)+.
МС(ЭР+) m/z 554,2 (M+H)+.
25: этил 1-{4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]benzoyl}пиперидин-3-карбоксилат.
 МС(ЭР+) m/z 513,2 (M+H)+.
МС(ЭР+) m/z 513,2 (M+H)+.
26: N-трет-бутил-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-метилбензамид.
 МС(ЭР+) m/z 443,2 (M+H)+.
МС(ЭР+) m/z 443,2 (M+H)+.
27: N,N-дициклобутил-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]бензамид.
 МС(ЭР+) m/z 481,2 (M+H)+.
МС(ЭР+) m/z 481,2 (M+H)+.
28: 2-(4-циклопропилметансульфонилфенил)-N-[4-(2-метилпиперидин-1-карбонил)фенил]ацетамид.
 МС(ЭР+) m/z 455,2 (M+H)+.
МС(ЭР+) m/z 455,2 (M+H)+.
29: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этил-N-(4-метилфенил)бензамид.
 МС(ЭР+) m/z 491,2 (M+H)+.
МС(ЭР+) m/z 491,2 (M+H)+.
30: метил 3-{N-этил-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]benzamido}бензоат.
 МС(ЭР+) m/z 535,2 (M+H)+.
МС(ЭР+) m/z 535,2 (M+H)+.
31: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этил-N-(3-метилфенил)бензамид.
 МС(ЭР+) m/z 491,2 (M+H)+.
МС(ЭР+) m/z 491,2 (M+H)+.
32: этил 2-(N-бензил-1-{4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]фенил}формамидо)ацетат.
 МС(ЭР+) m/z 549,2 (M+H)+.
МС(ЭР+) m/z 549,2 (M+H)+.
33: этил 6-{4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]бензоил}-4H,5H,6H,7H-тиено[2,3-c]пиридин-2-карбоксилат.
 МС(ЭР+) m/z 567,2 (M+H)+.
МС(ЭР+) m/z 567,2 (M+H)+.
34: N-циклогексил-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-метилбензамид.
 МС(ЭР+) m/z 469,2 (M+H)+.
МС(ЭР+) m/z 469,2 (M+H)+.
35: 2-(4-циклопропилметансульфонилфенил)-N-[4-(2-фенилпирролидин-1-карбонил)фенил]ацетамид.
 МС(ЭР+) m/z 503,2 (M+H)+.
МС(ЭР+) m/z 503,2 (M+H)+.
36: 2-(4-циклопропилметансульфонилфенил)-N-[4-(пиперидин-1-карбонил)фенил]ацетамид.
 МС(ЭР+) m/z 441,2 (M+H)+.
МС(ЭР+) m/z 441,2 (M+H)+.
37: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(2-метилпропил)-N-фенилбензамид.
 МС(ЭР+) m/z 505,2 (M+H)+.
МС(ЭР+) m/z 505,2 (M+H)+.
38: этил 2-(1-{4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]бензоил}пирролидин-2-ил)-1,3-тиазол-4-карбоксилат.
 МС(ЭР+) m/z 582,2 (M+H)+.
МС(ЭР+) m/z 582,2 (M+H)+.
39: 2-(4-циклопропилметансульфонилфенил)-N-{4-[2-(морфолин-4-илметил)пиперидин-1-карбонил]фенил}ацетамид.
 МС(ЭР+) m/z 540,2 (M+H)+.
МС(ЭР+) m/z 540,2 (M+H)+.
40: 2-(4-циклопропилметансульфонилфенил)-N-[4-(1,2,3,4-тетрагидрохинолин-1-карбонил)фенил]ацетамид.
 МС(ЭР+) m/z 489,2 (M+H)+.
МС(ЭР+) m/z 489,2 (M+H)+.
41: 2-(4-циклопропилметансульфонилфенил)-N-[4-(2,3-дигидро-1H-индол-1-карбонил)фенил]ацетамид.
 МС(ЭР+) m/z 475,2 (M+H)+.
МС(ЭР+) m/z 475,2 (M+H)+.
42: N-бензил-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этилбензамид.
 МС(ЭР+) m/z 491,2 (M+H)+.
МС(ЭР+) m/z 491,2 (M+H)+.
43: 4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-этил-N-фенилбензамид.
 МС(ЭР+) m/z 478,2 (M+H)+.
МС(ЭР+) m/z 478,2 (M+H)+.
44: 4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-метил-N-фенилбензамид.
 МС(ЭР+) m/z 464,2 (M+H)+.
МС(ЭР+) m/z 464,2 (M+H)+.
45: 4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-этил-N-(4-метилфенил)бензамид.
 МС(ЭР+) m/z 492,2 (M+H)+.
МС(ЭР+) m/z 492,2 (M+H)+.
46: 4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-этил-N-(3-метилфенил)бензамид.
 МС(ЭР+) m/z 492,2 (M+H)+.
МС(ЭР+) m/z 492,2 (M+H)+.
47: метил 3-(N-этил-4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}бензамидо)бензоат.
 МС(ЭР+) m/z 536,2 (M+H)+.
МС(ЭР+) m/z 536,2 (M+H)+.
48: 2-(4-циклопропилметансульфонилфенил)-N-[4-(3-фенилпиперидин-1-карбонил)фенил]ацетамид.
 МС(ЭР+) m/z 517,2 (M+H)+.
МС(ЭР+) m/z 517,2 (M+H)+.
49: 2-(4-циклопропилметансульфонилфенил)-N-[4-(2-фенилпиперидин-1-карбонил)фенил]ацетамид.
 МС(ЭР+) m/z 517,2 (M+H)+.
МС(ЭР+) m/z 517,2 (M+H)+.
50: 4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-этил-N-(пиридин-3-ил)бензамид.
 МС(ЭР+) m/z 479,2 (M+H)+.
МС(ЭР+) m/z 479,2 (M+H)+.
51: 6-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этил-N-фенилпиридин-3-карбоксамид.
 МС(ЭР+) m/z 478,2 (M+H)+.
МС(ЭР+) m/z 478,2 (M+H)+.
52: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этил-N-(пиридин-3-ил)бензамид.
 МС(ЭР+) m/z 478,2 (M+H)+.
МС(ЭР+) m/z 478,2 (M+H)+.
53: 3-хлор-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этил-N-фенилбензамид.
 МС(ЭР+) m/z 512,2 (M+H)+.
МС(ЭР+) m/z 512,2 (M+H)+.
54: 6-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-этил-N-фенилпиридин-3-карбоксамид.
 МС(ЭР+) m/z 479,2 (M+H)+.
МС(ЭР+) m/z 479,2 (M+H)+.
55: 2-(4-циклопропилметансульфонилфенил)-N-[4-(1,2,3,4-тетрагидроизохинолин-2-карбонил)фенил]ацетамид.
 МС(ЭР+) m/z 489,2 (M+H)+.
МС(ЭР+) m/z 489,2 (M+H)+.
56: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этил-N-[(5-метил-1,2-оксазол-3-ил)метил]бензамид.
 МС(ЭР+) m/z 496,2 (M+H)+.
МС(ЭР+) m/z 496,2 (M+H)+.
57: 2-(4-циклопропилметансульфонилфенил)-N-[4-(4-метил-2-фенилпиперазин-1-карбонил)фенил]ацетамид.
 МС(ЭР+) m/z 532,3 (M+H)+.
МС(ЭР+) m/z 532,3 (M+H)+.
58: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этил-2-метокси-N-фенилбензамид.
 МС(ЭР+) m/z 507,2 (M+H)+.
МС(ЭР+) m/z 507,2 (M+H)+.
59: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(фуран-2-илметил)-N-метилбензамид.
 МС(ЭР+) m/z 467,2 (M+H)+.
МС(ЭР+) m/z 467,2 (M+H)+.
60: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-[2-метил-1-(морфолин-4-ил)пропан-2-ил]бензамид.
 МС(ЭР+) m/z 514,3 (M+H)+.
МС(ЭР+) m/z 514,3 (M+H)+.
61: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N,N-бис(проп-2-ен-1-ил)бензамид.
 МС(ЭР+) m/z 453,2 (M+H)+.
МС(ЭР+) m/z 453,2 (M+H)+.
62: 4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N,N-бис(2-метилпропил)бензамид.
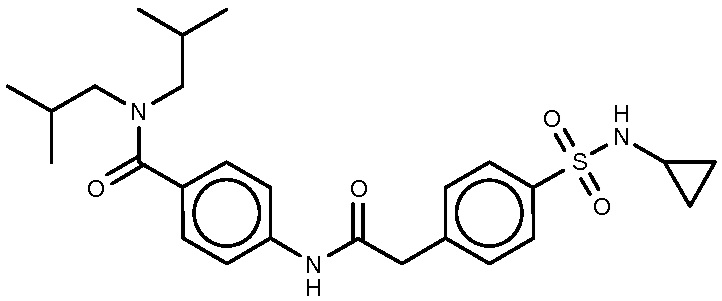 МС(ЭР+) m/z 486,2 (M+H)+.
МС(ЭР+) m/z 486,2 (M+H)+.
63: 2-(4-циклопропилметансульфонилфенил)-N-[4-(2,3,4,5-тетрагидро-1H-1-бензазепин-1-карбонил)фенил]ацетамид.
 МС(ЭР+) m/z 503,2 (M+H)+.
МС(ЭР+) m/z 503,2 (M+H)+.
64: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(4-метил-5-метил-1,3-тиазол-2-ил)-N-этилбензамид.
 МС(ЭР+) m/z 512,2 (M+H)+.
МС(ЭР+) m/z 512,2 (M+H)+.
65: 4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-пропил-N-(пиридин-3-ил)бензамид.
 МС(ЭР+) m/z 493,2 (M+H)+.
МС(ЭР+) m/z 493,2 (M+H)+.
66: 2-[4-(циклопропилсульфамоил)фенил]-N-[4-(2-фенилпиперидин-1-карбонил)фенил]ацетамид.
 МС(ЭР+) m/z 518,2 (M+H)+.
МС(ЭР+) m/z 518,2 (M+H)+.
67: 2-хлор-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-метил-N-(пиридин-2-ил)бензамид.
 МС(ЭР+) m/z 498,2(M+H)+.
МС(ЭР+) m/z 498,2(M+H)+.
68: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-[2-(пиридин-3-ил)пропан-2-ил]бензамид.
 МС(ЭР+) m/z 492,2(M+H)+.
МС(ЭР+) m/z 492,2(M+H)+.
69: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-[(2R)-1,1,1-трифтор-3-метилбутан-2-ил]бензамид.
 МС(ЭР+) m/z 497,2(M+H)+.
МС(ЭР+) m/z 497,2(M+H)+.
70: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-[(1S)-1-(2-метоксифенил)этил]бензамид.
 МС(ЭР+) m/z 507,2(M+H)+.
МС(ЭР+) m/z 507,2(M+H)+.
71: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-[(1S)-1-(2-фторфенил)этил]бензамид.
 МС(ЭР+) m/z 495,2(M+H)+.
МС(ЭР+) m/z 495,2(M+H)+.
72: N-[циано(тиофен-2-ил)метил]-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]бензамид.
 МС(ЭР+) m/z 495,2(M+H)+.
МС(ЭР+) m/z 495,2(M+H)+.
73: N-[циано(фенил)метил]-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]бензамид.
 МС(ЭР+) m/z 488,2(M+H)+.
МС(ЭР+) m/z 488,2(M+H)+.
74: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-[2-(трифторметокси)фенил]бензамид.
 МС(ЭР+) m/z 533,2(M+H)+.
МС(ЭР+) m/z 533,2(M+H)+.
75: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(2,6-диметилфенил)бензамид.
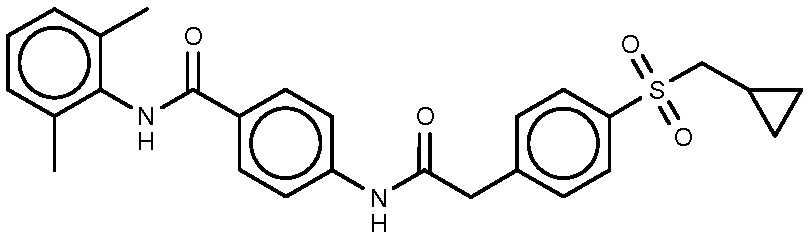 МС(ЭР+) m/z 477,2(M+H)+.
МС(ЭР+) m/z 477,2(M+H)+.
76: N-[(1R)-1-(4-хлорфенил)-2,2,2-трифторэтил]-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]бензамид.
 МС(ЭР+) m/z 565,2(M+H)+.
МС(ЭР+) m/z 565,2(M+H)+.
77: N-циклопропил-4-[[2-[4-(циклопропилметилсульфонил)фенил]ацетил]амино]-N-(2-гидроксиэтил)бензамид.
 МС(ЭР+) m/z 457,1 (M+H)+.
МС(ЭР+) m/z 457,1 (M+H)+.
78: N-циклопропил-4-[[2-[4-(циклопропилметилсульфонил)фенил]ацетил]амино]-N-[(1-гидроксициклобутил)метил]бензамид.
 МС(ЭР+) m/z 497,2 (M+H)+.
МС(ЭР+) m/z 497,2 (M+H)+.
79: N-циклопропил-4-[[2-[4-(циклопропилметилсульфонил)фенил]ацетил]амино]-N-(2-метоксиэтил)бензамид.
 МС(ЭР+) m/z 471,2 (M+H)+.
МС(ЭР+) m/z 471,2 (M+H)+.
80: N-циклопропил-4-[[2-[4-(циклопропилметилсульфонил)фенил]ацетил]амино]-N-тетрагидропиран-4-ил-бензамид.
 МС(ЭР+) m/z 497,2 (M+H)+.
МС(ЭР+) m/z 497,2 (M+H)+.
81: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-пропил-N-(тиофен-3-ил)бензамид.

i) К раствору N-пропилтиофен-3-амина (147 мг) и триэтиламина (283 мкл) в CH2Cl2 (2 мл) добавляют раствор 4-нитробензоилхлорида (218 мг) в CH2Cl2 (2 мл), и реакционную смесь перемешивают в течение ночи при комнатной температуре. Добавляют воду, и органическую фазу промывают 1N водный раствор HCl, воду, насыщенный водный раствор NaHCO3, воду и насыщенный раствор соли. Органическую фазу сушат над MgSO4 и концентрируют при пониженном давлении. Остаток очищают на SiO2 с применением от 10% до 30% этилацетата в толуоле в качестве элюента, с получением 4-нитро-N-пропил-N-(тиофен-3-ил)бензамида (80 мг).
ii) К раствору продукта, полученного на предыдущей стадии (81 мг) в этаноле (20 мл) добавляют при комнатной температуре SnCl2 (264 мг), и реакционную смесь перемешивают в течение 1 часа при 70°C. Реакционную смесь гасят выливанием на лед, и по каплям добавляют 2N водный раствор NaOH до pH=4. Продукт экстрагируют в этилацетат, и органическую фазу промывают водой, насыщенным раствором соли, сушат над MgSO4 и концентрируют при пониженном давлении с получением 4-амино-N-пропил-N-(тиофен-3-ил)бензамида (66 мг). Продукт применяют на следующей стадии без дальнейшей очистки.
iii) По методике, аналогичной описанной в Примере 1, стадия iv), продукт, полученный на предыдущей стадии (66 мг), превращают в указанное в заголовке соединение 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-пропил-N-(тиофен-3-ил)бензамид (72 мг). МС(ЭР+) m/z 496,6 (M+H)+.
По методике, аналогичной описанной в примере 81, с применением подходящих исходных материалов получают следующие соединения.
82: N-бутил-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(1,3-тиазол-2-ил)бензамид.
 МС(ЭР+) m/z 512,2 (M+H)+.
МС(ЭР+) m/z 512,2 (M+H)+.
83: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-пропил-N-(1,3-тиазол-2-ил)бензамид.
 МС(ЭР+) m/z 498,2 (M+H)+.
МС(ЭР+) m/z 498,2 (M+H)+.
84: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этил-N-(1,3-тиазол-2-ил)бензамид.
 МС(ЭР+) m/z 484,2 (M+H)+.
МС(ЭР+) m/z 484,2 (M+H)+.
85: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-метил-N-(1,3-тиазол-2-ил)бензамид.
 МС(ЭР+) m/z 470,2 (M+H)+.
МС(ЭР+) m/z 470,2 (M+H)+.
86: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(1,3-диметил-1H-пиразол-5-ил)-N-пропилбензамид.
 МС(ЭР+) m/z 509,2 (M+H)+.
МС(ЭР+) m/z 509,2 (M+H)+.
87: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(5-метил-1,2-оксазол-3-ил)-N-пропилбензамид.
 МС(ЭР+) m/z 496,2 (M+H)+.
МС(ЭР+) m/z 496,2 (M+H)+.
88: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(1,3-диметил-1H-пиразол-5-ил)-N-этилбензамид.
 МС(ЭР+) m/z 495,2 (M+H)+.
МС(ЭР+) m/z 495,2 (M+H)+.
89: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этил-N-(5-метил-1,2-оксазол-3-ил)бензамид.
 МС(ЭР+) m/z 482,2 (M+H)+.
МС(ЭР+) m/z 482,2 (M+H)+.
90: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-метил-N-(5-метил-1,2-оксазол-3-ил)бензамид.
 МС(ЭР+) m/z 468,2 (M+H)+.
МС(ЭР+) m/z 468,2 (M+H)+.
91: 4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-метил-N-(5-метил-1,2-оксазол-3-ил)бензамид.
 МС(ЭР+) m/z 469,2 (M+H)+.
МС(ЭР+) m/z 469,2 (M+H)+.
92: 4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-(1,3-диметил-1H-пиразол-5-ил)-N-пропилбензамид.
 МС(ЭР+) m/z 510,2 (M+H)+.
МС(ЭР+) m/z 510,2 (M+H)+.
93: 4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-(5-метил-1,2-оксазол-3-ил)-N-пропилбензамид.
 МС(ЭР+) m/z 497,2 (M+H)+.
МС(ЭР+) m/z 497,2 (M+H)+.
94: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этил-N-(3-метил-1,2-оксазол-5-ил)бензамид.
 МС(ЭР+) m/z 482,2 (M+H)+.
МС(ЭР+) m/z 482,2 (M+H)+.
95: 4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-этил-N-(3-метил-1,2-оксазол-5-ил)бензамид.
 МС(ЭР+) m/z 483,2 (M+H)+.
МС(ЭР+) m/z 483,2 (M+H)+.
96: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этил-N-(5-метил-1,3,4-тиадиазол-2-ил)бензамид.
 МС(ЭР+) m/z 499,2 (M+H)+.
МС(ЭР+) m/z 499,2 (M+H)+.
97: 4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-этил-N-(5-метил-1,3,4-тиадиазол-2-ил)бензамид.
 МС(ЭР+) m/z 500,2 (M+H)+.
МС(ЭР+) m/z 500,2 (M+H)+.
98: 4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-этил-3-метокси-N-фенилбензамид.
 МС(ЭР+) m/z 508,2 (M+H)+.
МС(ЭР+) m/z 508,2 (M+H)+.
99: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этил-2-фтор-N-фенилбензамид.
 МС(ЭР+) m/z 495,2 (M+H)+.
МС(ЭР+) m/z 495,2 (M+H)+.
100: 2-хлор-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этил-N-фенилбензамид.
 МС(ЭР+) m/z 512,1 (M+H)+.
МС(ЭР+) m/z 512,1 (M+H)+.
101: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этил-3-метокси-N-фенилбензамид.
 МС(ЭР+) m/z 507,2 (M+H)+.
МС(ЭР+) m/z 507,2 (M+H)+.
102: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этил-3-фтор-N-фенилбензамид.
 МС(ЭР+) m/z 495,2 (M+H)+.
МС(ЭР+) m/z 495,2 (M+H)+.
103: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этил-N-(1,2-оксазол-3-ил)бензамид.
 МС(ЭР+) m/z 468,2 (M+H)+.
МС(ЭР+) m/z 468,2 (M+H)+.
104: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-фенил-N-(2,2,2-трифторэтил)бензамид.
 МС(ЭР+) m/z 531,2 (M+H)+.
МС(ЭР+) m/z 531,2 (M+H)+.
105: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этил-3-метил-N-фенилбензамид.
 МС(ЭР+) m/z 491,2 (M+H)+.
МС(ЭР+) m/z 491,2 (M+H)+.
106: 4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-этил-3-метил-N-фенилбензамид.
 МС(ЭР+) m/z 492,2 (M+H)+.
МС(ЭР+) m/z 492,2 (M+H)+.
107: 4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-(4-метил-5-метил-1,3-тиазол-2-ил)-N-этилбензамид.
 МС(ЭР+) m/z 513,2 (M+H)+.
МС(ЭР+) m/z 513,2 (M+H)+.
108: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(диметил-1,2-оксазол-4-ил)-N-этилбензамид.
 МС(ЭР+) m/z 496,2 (M+H)+.
МС(ЭР+) m/z 496,2 (M+H)+.
109: 4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-фенил-N-(2,2,2-трифторэтил)бензамид.
 МС(ЭР+) m/z 532,2 (M+H)+.
МС(ЭР+) m/z 532,2 (M+H)+.
110: 4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-(диметил-1,2-оксазол-4-ил)-N-этилбензамид.
 МС(ЭР+) m/z 497,2 (M+H)+.
МС(ЭР+) m/z 497,2 (M+H)+.
111: 4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-этил-2-фтор-N-фенилбензамид.
 МС(ЭР+) m/z 496,2 (M+H)+.
МС(ЭР+) m/z 496,2 (M+H)+.
112: 2-хлор-4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-этил-N-фенилбензамид.
 МС(ЭР+) m/z 513,2 (M+H)+.
МС(ЭР+) m/z 513,2 (M+H)+.
113: N-бензил-N-трет-бутил-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]бензамид.
 МС(ЭР+) m/z 519,2 (M+H)+.
МС(ЭР+) m/z 519,2 (M+H)+.
114: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(1-метилпиперидин-4-ил)-N-фенилбензамид.
 МС(ЭР+) m/z 546,3 (M+H)+.
МС(ЭР+) m/z 546,3 (M+H)+.
115: N-(4-бромфенил)-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-фенилбензамид.
 МС(ЭР+) m/z 602,1 (M+H)+.
МС(ЭР+) m/z 602,1 (M+H)+.
116: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-2-фтор-N-метил-N-(2-метилфенил)бензамид.
 МС(ЭР+) m/z 495,2 (M+H)+.
МС(ЭР+) m/z 495,2 (M+H)+.
117: 2-хлор-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-метил-N-(2-метилфенил)бензамид.
 МС(ЭР+) m/z 511,2 (M+H)+.
МС(ЭР+) m/z 511,2 (M+H)+.
118: N-(2-хлорфенил)-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этил-2-фторбензамид.
 МС(ЭР+) m/z 529,2 (M+H)+.
МС(ЭР+) m/z 529,2 (M+H)+.
119: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(2,3-диметилфенил)-N-этил-2-фторбензамид.
 МС(ЭР+) m/z 523,3 (M+H)+.
МС(ЭР+) m/z 523,3 (M+H)+.
120: 2-хлор-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(2,3-диметилфенил)-N-этилбензамид.
 МС(ЭР+) m/z 539,3 (M+H)+.
МС(ЭР+) m/z 539,3 (M+H)+.
121: N-[4-(3-трет-бутил-3,4-дигидро-2H-1,4-бензоксазин-4-карбонил)фенил]-2-(4-циклопропилметансульфонилфенил)ацетамид.
 МС(ЭР+) m/z 547,3 (M+H)+.
МС(ЭР+) m/z 547,3 (M+H)+.
122: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(2-метоксифенил)-N,2-диметилбензамид.
 МС(ЭР+) m/z 507,3 (M+H)+.
МС(ЭР+) m/z 507,3 (M+H)+.
123: 2-хлор-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-фенил-N-(2,2,2-трифторэтил)бензамид.
 МС(ЭР+) m/z 565,2 (M+H)+.
МС(ЭР+) m/z 565,2 (M+H)+.
124: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-2-фтор-N-(2-метоксифенил)-N-метилбензамид.
 МС(ЭР+) m/z 511,3 (M+H)+.
МС(ЭР+) m/z 511,3 (M+H)+.
125: 2-хлор-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(2-метоксифенил)-N-метилбензамид.
 МС(ЭР+) m/z 527,2 (M+H)+.
МС(ЭР+) m/z 527,2 (M+H)+.
126: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-2-фтор-N-(2-фторфенил)-N-метилбензамид.
 МС(ЭР+) m/z 499,2 (M+H)+.
МС(ЭР+) m/z 499,2 (M+H)+.
127: 2-хлор-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(2-фторфенил)-N-метилбензамид.
 МС(ЭР+) m/z 515,2 (M+H)+.
МС(ЭР+) m/z 515,2 (M+H)+.
128: 2-хлор-N-(2-хлорфенил)-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этилбензамид.
 МС(ЭР+) m/z 545,2 (M+H)+.
МС(ЭР+) m/z 545,2 (M+H)+.
129: 2-хлор-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этил-N-(2-метилфенил)бензамид.
 МС(ЭР+) m/z 525,3 (M+H)+.
МС(ЭР+) m/z 525,3 (M+H)+.
130: N-трет-бутил-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-фенилбензамид.
 МС(ЭР+) m/z 505,3 (M+H)+.
МС(ЭР+) m/z 505,3 (M+H)+.
131: N-трет-бутил-4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-фенилбензамид.
 МС(ЭР+) m/z 506,3 (M+H)+.
МС(ЭР+) m/z 506,3 (M+H)+.
132: 4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-(4-метилфенил)-N-[2-(оксолан-2-ил)пропан-2-ил]бензамид.
 МС(ЭР+) m/z 576,2 (M+H)+.
МС(ЭР+) m/z 576,2 (M+H)+.
133: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(4-метилфенил)-N-[2-(оксолан-2-ил)пропан-2-ил]бензамид.
 МС(ЭР+) m/z 575,2 (M+H)+.
МС(ЭР+) m/z 575,2 (M+H)+.
134: N-трет-бутил-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-3-фтор-N-фенилбензамид.
 МС(ЭР+) m/z 523,2 (M+H)+.
МС(ЭР+) m/z 523,2 (M+H)+.
135: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-[2-(оксолан-2-ил)пропан-2-ил]-N-фенилбензамид.
 МС(ЭР+) m/z 561,2 (M+H)+.
МС(ЭР+) m/z 561,2 (M+H)+.
136: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(оксолан-3-ил)-N-(пиридин-2-ил)бензамид.
 МС(ЭР+) m/z 520,1 (M+H)+.
МС(ЭР+) m/z 520,1 (M+H)+.
137: N-циклопропил-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(пиридин-2-ил)бензамид.
 МС(ЭР+) m/z 490,1 (M+H)+.
МС(ЭР+) m/z 490,1 (M+H)+.
138: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(1-гидрокси-2-метилпропан-2-ил)-N-фенилбензамид.
 МС(ЭР+) m/z 521,2 (M+H)+.
МС(ЭР+) m/z 521,2 (M+H)+.
139: N-циклобутил-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(пиридин-2-ил)бензамид.
 МС(ЭР+) m/z 504,2 (M+H)+.
МС(ЭР+) m/z 504,2 (M+H)+.
140: N-циклопропил-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-фенилбензамид.
 МС(ЭР+) m/z 489,1 (M+H)+.
МС(ЭР+) m/z 489,1 (M+H)+.
141: N-циклобутил-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-фенилбензамид.
 МС(ЭР+) m/z 503,2 (M+H)+.
МС(ЭР+) m/z 503,2 (M+H)+.
142: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(1-метилциклопропил)-N-фенилбензамид.
 МС(ЭР+) m/z 503,2 (M+H)+.
МС(ЭР+) m/z 503,2 (M+H)+.
143: N-циклопропил-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(пиридин-3-ил)бензамид.
 МС(ЭР+) m/z 490,1 (M+H)+.
МС(ЭР+) m/z 490,1 (M+H)+.
144: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(3,3-дифторциклобутил)-N-фенилбензамид.
 МС(ЭР+) m/z 539,1 (M+H)+.
МС(ЭР+) m/z 539,1 (M+H)+.
145: метил 2-(1-{4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]фенил}-N-фенилформамидо)-2-метилпропаноат.
 МС(ЭР+) m/z 549,1 (M+H)+.
МС(ЭР+) m/z 549,1 (M+H)+.
146: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-фенил-N-(1,1,1-трифторпропан-2-ил)бензамид.
 МС(ЭР+) m/z 545,1 (M+H)+.
МС(ЭР+) m/z 545,1 (M+H)+.
147: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(2,6-дихлорфенил)бензамид.
 МС(ЭР+) m/z 517,1 (M+H)+.
МС(ЭР+) m/z 517,1 (M+H)+.
148: 4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-фенил-N-(1,1,1-трифторпропан-2-ил)бензамид.
 МС(ЭР+) m/z 546,2 (M+H)+.
МС(ЭР+) m/z 546,2 (M+H)+.
149: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(оксетан-3-ил)-N-фенилбензамид.
 МС(ЭР+) m/z 505,2 (M+H)+.
МС(ЭР+) m/z 505,2 (M+H)+.
150: N-(4-(7-окса-4-азаспиро[2.5]октан-4-карбонил)фенил)-2-(4-((циклопропилметил)сульфонил)фенил)ацетамид.
 МС(ЭР+) m/z 469,2 (M+H)+.
МС(ЭР+) m/z 469,2 (M+H)+.
151: N-(трет-бутил)-4-(2-(4-((циклопропилметил)сульфонил)фенил)ацетамидо)-N-(2-гидроксиэтил)бензамид.

i) К раствору 2-(трет-бутиламино)этан-1-ола (50 мг) и триэтиламина (66 мкл) в CH2Cl2 (2 мл) добавляют трет-бутилхлордифенилсилан (122 мкл) и реакционную смесь перемешивают в течение ночи при комнатной температуре. Реакционную смесь концентрируют при пониженном давлении и очищают на SiO2 с применением от 0% до 2% метанола в дихлорметане в качестве элюента с получением N-(2-((трет-бутилдифенилсилил)окси)этил)-2-метилпропан-2-амина (135 мг).
ii) К раствору продукта, полученного на предыдущей стадии (105 мг) и триэтиламина (79 мкл) в CH2Cl2 (2 мл) добавляют раствор 4-нитробензоилхлорида (50 мг) в CH2Cl2 (1 мл), и реакционную смесь перемешивают в течение ночи при комнатной температуре. Добавляют воду, и органическую фазу отделяют. Водную фазу экстрагируют дихлорметаном. Объединенные органические фазы фильтруют на водоотталкивающем фильтрующем элементе и концентрируют при пониженном давлении. Остаток очищают на SiO2 с применением от 0% до 1% метанола в дихлорметане в качестве элюента с получением N-(трет-бутил)-N-(2-((трет-бутилдифенилсилил)окси)этил)-4-нитробензамида (101 мг) в виде белого твердого вещества.
iii) К раствору продукта, полученного на предыдущей стадии (100 мг) в этаноле (5 мл) добавляют воду (0,5 мл), уксусную кислоту (0,5 мл) и железо (33 мг) при комнатной температуре, и реакционную смесь перемешивают в течение 4 часов при 60°C. Реакционную смесь фильтруют. Фильтрат концентрируют при пониженном давлении, помещают в дихлорметан, промывают водой, насыщенным раствором соли, фильтруют на водоотталкивающем фильтрующем элементе и концентрируют при пониженном давлении с получением 4-амино-N-(трет-бутил)-N-(2-((трет-бутилдифенилсилил)окси)этил)бензамида (100 мг).
iv) Раствор продукта, полученного на предыдущей стадии (103 мг), 2-(4-((циклопропилметил)сульфонил)фенил)уксусной кислоты (50 мг), ЭДКИ (42 мг) и ДМАП (4,8 мг) в CH2Cl2 (3 мл) перемешивают в течение ночи при комнатной температуре. Органический слой промывают водой, насыщенным раствором соли, фильтруют на водоотталкивающем фильтрующем элементе и концентрируют при пониженном давлении. Остаток очищают на SiO2 с применением от 0% до 4% метанола в дихлорметане в качестве элюента с получением указанного в заголовке соединения N-(трет-бутил)-N-(2-((трет-бутилдифенилсилил)окси)этил)-4-(2-(4-(циклопропилметил)сульфонил)фенил)ацетамидо)бензамида (86 мг) в виде белого твердого вещества.
v) К раствору продукта, полученного на предыдущей стадии (86 мг) в ТГФ (3 мл) добавляют 1M раствор фторида тетрабутиламмония в ТГФ (360 мкл), и реакционную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь гасят водой и экстрагируют дихлорметаном. Органическую фазу фильтруют на водоотталкивающем фильтрующем элементе, концентрируют при пониженном давлении и растирают с пентаном/CH2Cl2 (10/1) с получением указанного в заголовке соединения N-(трет-бутил)-4-(2-(4-((циклопропилметил)сульфонил)фенил)ацетамидо)-N-(2-гидроксиэтил)бензамида (22 мг) в виде белого твердого вещества. МС(ЭР+) m/z 473,2 (M+H)+.
По методике, аналогичной описанной в примере 151, с применением подходящих исходных материалов получают следующие соединения.
152: 4-(2-(4-((циклопропилметил)сульфонил)фенил)ацетамидо)-N-(2-гидроксиэтил)-N-изобутилбензамид.
 МС(ЭР+) m/z 473,2 (M+H)+.
МС(ЭР+) m/z 473,2 (M+H)+.
153: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(1-гидрокси-2-метилпропан-2-ил)-N-(4-метилфенил)бензамид.
 МС(ЭР+) m/z 535,2 (M+H)+.
МС(ЭР+) m/z 535,2 (M+H)+.
154: 4-{2-[4-(циклопропилсульфамоил)фенил]ацетамидо}-N-(1-гидрокси-2-метилпропан-2-ил)-N-(4-метилфенил)бензамид.
 МС(ЭР+) m/z 536,2 (M+H)+.
МС(ЭР+) m/z 536,2 (M+H)+.
155: 4-[2-(6-циклопропилметансульфонилпиридин-3-ил)ацетамидо]-N-фенил-N-(2,2,2-трифторэтил)бензамид.

i) К суспензии 2-бром-5-метилпиридина (25 г) в воде (200 мл) добавляют при комнатной температуре водный раствор 8N HCl, затем добавляют тиомочевину (24,2) пока реакционная смесь не станет прозрачным раствором. Реакционную смесь перемешивают при температуре кипения с обратным холодильником в течение 48 часов, во время чего порциями добавляют еще тиомочевину (18 г) до завершения превращения. Реакционную смесь охлаждают до 0°C и гасят добавлением водного раствора 4N NaOH (130 мл). Полученный осадок растворяют в CH2Cl2 (220 мл), и органический слой промывают водой. Водный слой подкисляют до pH=3 и экстрагируют CH2Cl2 3 раза. Объединенные органические слои сушат над MgSO4 и концентрируют в вакууме. Остаток перекристаллизовывают из этанола с получением 5-метилпиридин-2-тиола (11,2 г) в виде белого твердого вещества.
ii) К суспензии продукта, полученного на предыдущей стадии (2,3 г) и K2CO3 (600 мг) в ацетонитриле (45 мл) добавляют при комнатной температуре (бромметил)циклопропан (10,4 мл). После перемешивания в течение 48 часов реакционную смесь фильтруют и фильтрат концентрируют при пониженном давлении с получением 2-[(циклопропилметил)сульфанил]-5-метилпиридина (17 г). Продукт применяют на следующей стадии без дальнейшей очистки.
iii) м-ХПБК (38,1 г) добавляют к ледяному раствору продукта, полученного на предыдущей стадии (17 г) в CH2Cl2 (250 мл). После перемешивания реакционной смеси в течение уикенда при комнатной температуре, реакционную смесь фильтруют, и фильтрат промывают насыщенным водным раствором NaHCO3, водой и насыщенным раствором соли. Органический слой сушат на MgSO4 и концентрируют при пониженном давлении с получением 2-циклопропилметансульфонил-5-метилпиридина (17 г) в виде белого твердого вещества. Продукт применяют на следующей стадии без дальнейшей очистки.
iv) К раствору продукта, полученного на предыдущей стадии (17 г) в ацетонитриле (150 мл) добавляют NBS (15,8 г) и АИБН (660 мг). Реакционную смесь перемешивают в течение 17 часов при температуре кипения с обратным холодильником в атмосфере азота. После охлаждения реакционную смесь фильтруют, и фильтрат концентрируют при пониженном давлении. Неочищенный продукт очищают на SiO2 с применением от 0% до 30% этилацетата в гептане в качестве элюента с получением 5-(бромметил)-2-циклопропилметансульфонилпиридина (10,6 г).
v) К раствору продукта, полученного на предыдущей стадии (9 г) добавляют к продутому азотом раствору триметилсилилцианида (3,1 г) и ФТБА (31 мл) в ацетонитриле (75 мл). Реакционную смесь перемешивают при 90°C в микроволновом реакторе в течение 30 минут. После охлаждения до комнатной температуры реакционную смесь разбавляют 3 к 1 смесью CH2Cl2 и 2-пропанола. Полученную смесь промывают водой, насыщенным раствором соли, сушат на MgSO4, фильтруют и фильтрат концентрируют при пониженном давлении. Неочищенный продукт очищают на SiO2 с применением от 0% до 80% этилацетата в гептане в качестве элюента с получением 2-(6-циклопропилметансульфонилпиридин-3-ил)ацетонитрила (2,1 г) в виде белого твердого вещества.
vi) К раствору продукта, полученного на предыдущей стадии (2,1 г), в этаноле (28 мл) добавляют 2N водный раствор NaOH (28 мл). Реакционную смесь перемешивают в течение 17 часов в микроволновом реакторе при 80°C. После охлаждения до комнатной температуры реакционную смесь промывают CH2Cl2. Водный слой подкисляют до pH=3 и экстрагируют этилацетатом. Объединенные органические слои промывают водой, насыщенным раствором соли, сушат на MgSO4, фильтруют и концентрируют при пониженном давлении с получением 2-(6-циклопропилметансульфонилпиридин-3-ил)уксусной кислоты (1,9 г) в виде неочищенного продукта. Продукт применяют на следующей стадии без дальнейшей очистки.
vii) По методике, аналогичной описанной в примере 1, с применением продукта, полученного на предыдущей стадии и подходящих исходных материалов, получают указанное в заголовке соединение 4-[2-(6-циклопропилметансульфонилпиридин-3-ил)ацетамидо]-N-фенил-N-(2,2,2-трифторэтил)бензамид (63 мг). МС(ЭР+) m/z 532,2 (M+H)+.
По методике, аналогичной описанной в примере 155, с применением подходящих исходных материалов получают следующие соединения.
156: 4-[2-(6-циклопропилметансульфонилпиридин-3-ил)ацетамидо]-N-этил-2-фтор-N-фенилбензамид.
 МС(ЭР+) m/z 496,2 (M+H)+.
МС(ЭР+) m/z 496,2 (M+H)+.
157: 2-хлор-4-[2-(6-циклопропилметансульфонилпиридин-3-ил)ацетамидо]-N-этил-N-фенилбензамид.
 МС(ЭР+) m/z 512,2 (M+H)+.
МС(ЭР+) m/z 512,2 (M+H)+.
158: N-трет-бутил-4-[2-(6-циклопропилметансульфонилпиридин-3-ил)ацетамидо]-N-фенилбензамид.
 МС(ЭР+) m/z 506,2 (M+H)+.
МС(ЭР+) m/z 506,2 (M+H)+.
159: N-трет-бутил-4-[2-(6-циклопропилметансульфонилпиридин-3-ил)ацетамидо]-3-фтор-N-фенилбензамид.
 МС(ЭР+) m/z 524,2 (M+H)+.
МС(ЭР+) m/z 524,2 (M+H)+.
160: 4-[2-(6-циклопропилметансульфонилпиридин-3-ил)ацетамидо]-N-[2-(оксолан-2-ил)пропан-2-ил]-N-фенилбензамид.
 МС(ЭР+) m/z 562,2 (M+H)+.
МС(ЭР+) m/z 562,2 (M+H)+.
161: 4-[2-(6-циклопропилметансульфонилпиридин-3-ил)ацетамидо]-N-(1-гидрокси-2-метилпропан-2-ил)-N-(4-метилфенил)бензамид.

i) Указанное в заголовке соединение 4-[2-(6-циклопропилметансульфонилпиридин-3-ил)ацетамидо]-N-(1-гидрокси-2-метилпропан-2-ил)-N-(4-метилфенил)бензамид получают по методике, аналогичной описанной в примере 151 с применением 2-(6-циклопропилметансульфонилпиридин-3-ил)уксусной кислоты (пример 155, стадия vi) в качестве исходного материала. МС(ЭР+) m/z 536,2 (M+H)+.
162: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этил-2-метил-N-фенилбензамид.

i) По методике, аналогичной описанной в Примере 1, стадия iv), с применением 4-бром-2-метилбензойной кислоты (1,0 г) и N-этиланилина (0,64 мл) в качестве исходных материалов синтезируют 4-бром-N-этил-2-метил-N-фенилбензамид (1,2 г).
ii) К раствору продукта, полученного на предыдущей стадии (0,5 g) в NMP добавляют Cu2O (11 мг) и водный 35% раствор NH4OH (2 мл), и смесь перемешивают в течение 8 часов в герметично закрытой пробирке при 80°C в микроволновой печи. Голубую реакционную смесь выливают в воду, и продукт экстрагируют в этилацетат. Органическую фазу промывают насыщенным раствором соли, сушат на MgSO4 и концентрируют при пониженном давлении с получением 4-амино-N-этил-2-метил-N-фенилбензамида (0,4 г). Неочищенный продукт применяют без дальнейшей очистки на следующей стадии.
iii) По методике, аналогичной описанной в Примере 1, стадия iv), продукт, полученный на предыдущей стадии (54 мг), превращают в указанное в заголовке соединение 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этил-2-метил-N-фенилбензамид (60 мг). МС(ЭР+) m/z 491,2 (M+H)+.
По методике, аналогичной описанной в примере 162, с применением подходящих исходных материалов получают следующие соединения.
163: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N,2-диметил-N-(2-метилфенил)бензамид.
 МС(ЭР+) m/z 491,2 (M+H)+.
МС(ЭР+) m/z 491,2 (M+H)+.
164: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(2,3-диметилфенил)-N-этил-2-метилбензамид.
 МС(ЭР+) m/z 519,3 (M+H)+.
МС(ЭР+) m/z 519,3 (M+H)+.
165: 4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-(2-фторфенил)-N,2-диметилбензамид.
 МС(ЭР+) m/z 495,3 (M+H)+.
МС(ЭР+) m/z 495,3 (M+H)+.
166: N-(2-хлорфенил)-4-[2-(4-циклопропилметансульфонилфенил)ацетамидо]-N-этил-2-метилбензамид.
 МС(ЭР+) m/z 525,3 (M+H)+.
МС(ЭР+) m/z 525,3 (M+H)+.
Пример 167
Анализ гена-репортера RORγ GAL4
Ингибиторы из примеров 1-166 тестируют на способность ингибировать активность RORγ в анализе гена-репортера RORγ GAL4. Методика анализа и результаты описаны ниже.
Описание анализа гена-репортера RORγ GAL4
GAL4 одногибридная система репортера, применяющая люциферазное считывание разработана для определения ингибирования RORγ в клетках 293FT. Лиганд-связывающий RORγ домен (ЛСД) конденсируют с ДНК-связывающим доменом дрожжей GAL4 (ДСД) и помещают под контроль немедленно-раннего промотора цитомегаловируса человека (ЦМВ) с применением вектора экспрессии pFN26A (Promega) и стандартных методов клонирования рекомбинантной ДНК. В качестве контроля в анализе создают подобный вектор, в котором GAL4-ДСД конденсирован с белком 16 вируса простого герпеса (VP16), конститутивным транскрипционным активатором.
Для отслеживания ингибирующего действия соединений на RORγ применяют конструкцию транскрипционного репортера. Вектор pGL4.35 (Promega) содержит девять копий GAL4 активирующей последовательность (UAS). Эта последовательность управляет транскрипцией гена-репортера люциферазы luc2P в ответ на связывание слитого белка, содержащего GAL4 ДНК связывающий домен, такой как, например, экспрессируемый векторами экспрессии GAL4-RORγ-ЛСД и GAL4-VP16, описанными выше. Для того, чтобы GAL4 слитый белок управлял экспрессией репортера люциферазы, вектор экспрессии pGL4.35 и подходящий вектор экспрессии GAL4 слитого белка массово трансфицируют в клетки 293FT с применением стандартных методов трансфекции.
Через день после трансфекции клетки помещают 96-луночные планшеты, добавляют тестируемое соединение и планшеты инкубируют в течение ночи. Затем активность люциферазы светляков количественно оценивают с применением реагента для определения люциферазы и считывания люминесцентности.
Подробное описание анализа
Клетки 293FT (Invitrogen) трансфицируют вектором экспрессии GAL4 слитого белка (как описано выше) и конструкцией транскрипционного репортера (pGL4.35, Promega). 60 мкл реагента трансфекции TransIT-293 (Mirus Bio) добавляют по каплям в 1500 мкл Opti-MEM I восстановленной сывороточной среды (Invitrogen) и инкубируют при комнатной температуре (КТ) в течение от 5 до 20 минут. 1500 мкл этого реагента добавляют к 5 мкг вектора экспрессии GAL4 слитого белка и 5 мкг конструкции транскрипционного репортера, и инкубируют при КТ в течение 20 минут.
Для сбора клеток 293FT из колбы T75, сначала культуральную среду убирают от клеток. Затем клетки промывают физиологическим раствором с фосфатным буфером (ФРФБ) (Lonza), затем ФРФБ удаляют. Для разъединения клеток 1 мл TrypLE Express (Invitrogen) добавляют в колбу, затем инкубируют при КТ до тех пор, пока клетки не начнут визуально разъединяться. Клетки собирают в 5 мл аналитической среды (культуральная среда DMEM (Lonza), 10% диализированного ФРФБ (Invitrogen) и Pen/Strep (Lonza)) для получения суспензии отдельных клеток. 10×106 клеток центрифугируют и ресуспендируют в 10 мл аналитической среды. Затем суспензию клеток добавляют в пробирку с трансфекционной смесью, и затем переносят как единое целое в колбу T75 (Greiner), затем инкубируют в течение ночи (16-24 часов) при 37°C и 5% CO2.
Для скрининга соединения клетки собирают (как описано выше) и считают. 13×106 клетки центрифугируют, надосадочную жидкость отсасывают и клетки ресуспендируют в 17,3 мл аналитической среды с получением суспензии клеток 0,75×106 клеток/мл. 80 мкл суспензии клеток (60000 клеток) помещают на лунку в белые плоскодонные обработанные культурой тканей 96-луночные планшеты для скрининга (Greiner).
Тестируемые соединения разводят, начиная с 10 мМ исходного раствора диметилсульфоксида (ДМСО), до серийных разбавлений в ДМСО при 500× конечной тестируемой концентрации. Затем эти растворы разводят до 5× конечной тестируемой концентрации в две стадии с 10-кратным разведением в аналитической среде. Конечная концентрация ДМСО 5× раствора тестируемого соединения составляет 1%. 20 мкл 5× тестируемого соединения добавляют в каждую тестируемую лунку 96-луночного планшета, предварительно покрытого 80 мкл клеточной суспензии, с получением конечной тестируемой концентрации с 0,2% ДМСО.
Планшеты инкубируют в течение ночи (16-24 часов) при 37°C и 5% CO2.
Для считывания люциферазы, люциферазный реагент (Britelite Plus, Perkin Elmer) доводят до КТ. В каждую тестируемую лунку планшетов для скрининга добавляют 100 мкл 2,5-кратно разведенного реагента Britelite Plus, затем инкубируют при КТ в течение 10 минут. Сигнал люциферазной люминесценции измеряют с применением микропланшетного ридера Wallac Victor Microplate Reader (Perkin Elmer).
Значения половины максимальной ингибирующей концентрации (IC50) для тестируемых соединений рассчитывают из сигнала люциферазы с применением программы GraphPad Prism (GraphPad Software).
Было найдено, что все представленные соединения формулы I (примеры 1-166) имеют средние значения pIC50 выше 5.
Было найдено, что примеры 1-3, 5-76, 79, 81-97, 99-149 и 153-166 имеют средние значения pIC50 выше или равные 6.
Было найдено, что примеры 3, 5, 6, 9, 10, 12, 14-22, 24, 27, 29-32, 35, 37, 40, 42-49, 51-53, 55-59, 61, 63, 64, 66, 71, 74, 75, 81-84, 86-90, 92-96, 99, 100, 102-105, 107-109, 113, 115-146, 148, 149 и 153-166 имеют средние значения pIC50 выше или равные 7.
Было найдено, что примеры 3, 16, 19-21, 29, 31, 32, 37, 40, 43, 45, 46, 49, 63, 64, 81, 83, 86-90, 92-94, 99, 102-104, 109, 113, 117-119, 122-131, 134, 139, 140-142, 144-146, 149, 155, 158, 159, 163, 164 и 166 имеют средние значения pIC50 выше или равные 8.
Пример 168
Анализ мононуклеарных клеток периферической крови (МКПК) ИЛ-17
Примеры ингибиторов 3, 6, 9, 16, 17, 19, 20, 31, 35, 40, 45, 64, 71, 81, 86-89, 94, 103, 104, 115, 121, 130, 131, 133, 135, 137, 140, 144-146, 153, 155 и 158-160 тестируют на способность ингибировать производство ИЛ-17A в анти-CD3/анти-CD28 стимулированных мононуклеарных клетках периферической крови (МКПК), выделенных из крови человека. Методика анализа и результаты описаны ниже.
Описание анализа МКПК ИЛ-17
Этот анализ разработан для измерения уровней ИЛ-17A, секретированного из анти-CD3/анти-CD28 стимулированных МКПК с целью измерения RORγ медиированного ингибирования производства ИЛ-17A.
Аналитическая среда состоит из 90% RPMI 1640 (Lonza), 10% термоинактивированной фетальной бычьей сыворотки (ФБС, Lonza) и 100 ед./мл раствора пенициллина/стрептомицина.
Описание анализа
Анта-CD3 антитело (BD Pharmingen) разводят до 10 мкг/мл в ФРФБ (Lonza). 30 мкл 10 мкг/мл раствора анти-CD3 добавляют во внутренние 60 лунок, исключая лунки с отрицательным контролем, 96-луночного обработанного культурой U-донного планшета (Greiner). Планшеты инкубируют в течение ночи (16-24 часов) при 37°C и 5% CO2.
Мононуклеарные клетки периферической крови отделяют из лейкоцитарной пленки (Sanquin) с применением среды для фракционирования Ficoll-Paque PREMIUM (GE Healthcare Life Sciences) согласно протоколу производителя и ресуспендируют в аналитической среде при 37°C.
Тестируемые соединения разводят, начиная с 10 мМ исходного раствора диметилсульфоксида (ДМСО), до серийных разведений в ДМСО при 200× конечной тестируемой концентрации. Затем эти растворы разводят в две стадии разведения в аналитической среде до 10x конечной тестируемой концентрации. Концентрация ДМСО 10× раствора тестируемого соединения составляет 5%.
Анти-CD28 антитело (BD Pharmingen) разводят до 20 мкг/мл в ФРФБ. МКПК разводят до концентрации 2,5×106 клеток/мл в аналитической среде при 37°C.
Для скрининга соединений покрытые анти-CD3 планшеты промывают три раза ФРФБ, лунки затем отсасывают с помощью вакуума. В каждую лунку для скрининга добавляют 80 мкл суспензии МКПК, 10 мкл раствора анти-CD28 и 10 мкл 10× раствора тестируемого соединения, с получением конечной тестируемой концентрации с 0,5% ДМСО. Все внешние лунки заполняют аналитической средой для предотвращения испарения. Планшеты инкубируют в течение 5 дней при 37°C и 5% CO2.
После инкубирования планшеты центрифугируют при 1500 об./мин в течение 4 минут, и надосадочную жидкость собирают. Затем уровни ИЛ-17A в надосадочных жидкостях определяют с помощью набора IL-17 ELISA (человеческий ИЛ-17 DuoSet, R&D systems) согласно протоколу производителя.
Значения половины максимальной ингибирующей концентрации (IC50) для тестируемых соединений рассчитывают из сигнала ИЛ-17A с применением программы GraphPad Prism (GraphPad Software).
Было найдено, что примеры 3, 6, 9, 16, 17, 19, 20, 31, 35, 40, 45, 64, 71, 81, 86-89, 94, 103, 104, 115, 121, 130, 131, 133, 135, 137, 140, 144-146, 153, 155 и 158-160 имеют средние значения pIC50 выше или равные 6.
Было найдено, что примеры 3, 16, 17, 19, 20, 31, 35, 40, 64, 81, 86-89, 94, 104, 115, 121, 130, 131, 133, 135, 137, 140, 144-146, 153, 155 и 158-160 имеют средние значения pIC50 выше или равные 7.
Было найдено, что примеры 3, 16, 19, 20, 31, 64, 81, 86-89, 94, 104, 115, 130, 133, 140, 144-146, 155 и 158 имеют средние значения pIC50 выше или равные 8.