Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В ФОРМЕ КАПСУЛ, ОБЛАДАЮЩАЯ НООТРОПНЫМ ДЕЙСТВИЕМ
Вид РИД
Изобретение
Изобретение относится к фармацевтической композиции, а именно к капсуле, содержащей в качестве действующего вещества фармацевтическую субстанцию 6-[4метокси-3-(1Н-пиразол-1-илметил)бензил]-1,11диметил-3,6,9-триазатрицикло[7.3.1.1]тетрадекан-4,8,12-триона - бициклононан, а в качестве вспомогательных веществ - альгинат натрия, прежелатинизированный кукурузный крахмал (ПКК), натрия крахмала гликолят, кремния диоксид коллоидный и кальция хлорид - для применения в качестве ноотропного средства при нарушении памяти, головокружении, снижении концентрации внимания, эмоциональной лабильности, деменции вследствие нарушений мозгового кровообращения (ишемического инсульта), травм головного мозга, при болезни Альцгеймера в пожилом возрасте, для улучшения когнитивных показателей после перенесенного повреждения мозга, для лечения абстиненции и психоорганического синдрома при хроническом алкоголизме и нарушениях обучаемости у детей.
Ноотропные лекарственные препараты - особая группа нейропсихотропных лекарственных препаратов, специфический эффект которых характеризуется способностью улучшать память и процессы обучения, интеллектуальные и когнитивные функции у здоровых лиц и нарушенные при различных заболеваниях. В качестве синонима ноотропных лекарственных препаратов в зарубежной литературе применяют термин «усилитель когнитивных функций» (cognition enhancers). Механизмы действия ноотропов до сих пор являются предметом дискуссий вследствие разнородности этой группы лекарственных средств.
Концепцию ноотропных лекарственных средств впервые сформулировали бельгийские фармакологи С. Giurgea и V. Skondia. В 1963 г. они синтезировали пирацетам (ноотропил) - первый препарат этой группы, который вывела на мировой фармацевтический рынок бельгийская фирма UCB Pharma. В 1972 г. Cornelia Giurgea обнаружил, что пирацетам улучшает когнитивные функции и память. После этого в классификацию нейро- и психотропных лекарственных средств был введен новый класс - ноотропы.
Пирацетам влияет на глутаматергическую систему, в частности, способен модулировать эффективность глутаматергической передачи в ЦНС, опосредуемой ионотропными АМРА-рецепторами. По химической структуре пирацетам сходен с нейромедиатором гамма-аминомасляной кислотой (ГАМК, GABA). В относительно больших дозах и при повторном введении пирацетам может усиливать глутаматергические тормозные процессы.
Роль глутамата как нейротрансмиттера в нервной системе была установлена в конце 50-х годов группой ученых под руководством Дэвида Кертиса и Джефри. В своих опытах на изолированном спинном мозге жабы ученые впервые наблюдали эффекты глутамата in vivo: в концентрациях 10-2-10-4 М вещество сначала возбуждало нейроны, а затем, подобно открытой и описанной ранее ГАМК, проявляло тормозящие свойства. Изначально глутамат и близкие к нему по структуре соединения получили название «возбуждающие аминокислоты» (excitatory amino acids). В 70-х годах было выдвинуто предположение о разделении рецепторов возбуждающих аминокислот на NMDA и не-NMDA. АМРА-рецепторы - подтип ионотропных глутаматных рецепторов, способных пропускать положительно заряженные ионы, был назван АМРА в честь избирательного агониста - альфа-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты.
Агонисты способствуют открытию сопряженных с АМРА-рецептором ионных каналов. В зависимости от того - насколько глубокие конформационные изменения антагонисты вызывают в лиганд-связывающем домене - "кармане" S1 - S2, различают полные или частичные агонисты. Последующая за этими изменениями степень десенситизации АМРА-рецептора, соответственно, бывает полной или частичной. Для агонистов характерны высокие терапевтические дозы, короткое время взаимодействия с агонист-связывающим сайтом и быстрый перевод после взаимодействия с биомишенью АМРА-рецептора в десенситизированное состояние.
Положительное потенцирование (или модуляцию) АМРА-рецепторов обнаружили в процессе изучения механизма действия ноотропов, когда была установлена способность анирацетама модулировать функцию АМРА-рецептора, усиливая тем самым глутаматергическую нейропередачу. Этот факт дал толчок к развитию нового направления в нейрофармакологии: создание и изучение механизма действия веществ, являющихся положительными модуляторами АМРА-рецепторов (РАМ АМРА).
Существуют два механизма действия отдельных РАМ АМРА. Отличие выражается в том, что одни РАМ АМРА препятствуют деактивации рецептора, другие блокируют десенситизацию. Обнаружены эффективные потенциаторы АМРА-рецептора, способные влиять как на деактивацию, так и на десенситизацию несмотря на то, что эти процессы различаются. Оба процесса играют существенную роль в работе АМРА-рецептора, так как его функциональным состоянием опосредован характер синаптической передачи и, как следствие, стимуляция процессов формирования памяти и улучшение когнитивных функций.
Важнейшим нейрофизиологическим аспектом действия положительных РАМ АМРА выступает так называемая синаптическая пластичность. Одно из ее следствий - эффект длительной потенциации, который рассматривают как один из основных механизмов нейрональной памяти. Кроме того, основой терапевтического потенциала РАМ АМРА является их способность, вследствие деполяризации постсинаптической мембраны, значительно увеличивать экспрессию нейротрофических факторов - фактора роста нервной ткани NGF (nerve growth factor) и нейротрофического фактора мозга BDNF (brain-derived neurotrophic factor), что, в свою очередь, связано с улучшением когнитивных функций и является мощнейшим механизмом восстановления нервных клеток.
Предполагается, что показания к применению препарата, позитивного модулятора АМРА-рецепторов, но не агониста и не антагониста, будут включать в себя ускорение и улучшение качества реконвалесценции после мозговых катастроф, так как острая фаза и фаза реконвалесценции обеспечиваются различными патогенетическими механизмами.
Прогресс современной фармакологии и клинической медицины во многом определяется открытием новых биологически активных веществ. Это является особенно актуальным для нейро- и психофармакологии, что в значительной степени связано с неуклонным ростом значимости нервной и психической патологии как одной из ведущих причин заболеваемости, инвалидизации и смертности населения, особенно в развитых странах. Одной из наиболее актуальных и привлекающих к себе в последние годы повышенное внимание групп нейро- и психофармакологических средств являются вышеописанные ноотропы.
Главной принципиальной особенностью действия этих средств можно назвать влияние на биохимические процессы, лежащие в основе реализации интеллектуально-мнестических функций, т.е. регуляции познавательных процессов, обучения, памяти - основы высшей нервной деятельности человека. Уникальной стороной действия ноотропов является то обстоятельство, что сфера их применения включает не только различные формы нервной и психической патологии, но и ситуации длительного психоэмоционального стресса. Ведущее место среди фармакологических эффектов ноотропов занимает также когнитивное, церебропротективное и стресс-защитное действие, что определяет целесообразность их применения при определенных условиях у относительно здоровых лиц. Еще одним исключительно важным аспектом действия ноотропных средств является возможность коррекции с их помощью возрастных нарушений метаболических процессов в мозге при старении, служащих фундаментом для развития различных форм возрастной нервно-психической патологии. Подобным комплексным многосторонним спектром фармакологической активности не обладают представители ни одной из других групп нейро- и психофармакологических препаратов.
В настоящее время выделяют девять основных структурных классов позитивных аллостерических модуляторов (РАМ) АМПА: производные пирромицинов; производные бензоилпиперидинов/пирролидинов; производные бензотиадиазинов; производные пиперониловой, безнодиоксанкарбоновой и хиноксалиновой кислот; производные бензофуразанов; производные биарилсульфонамидов; производные сульфонамидов; производные изотиомочевины; производные 3,7-диазабицикло[3.3.1]нонана (биспидина).
В патенте RU 2276992 С2 (приоритет от 12.07.2004) описан состав, обладающий ноотропной активностью. Активное вещество содержит вещество растительного происхождения, а само лекарственное средство схоже по действию с имеющимся на рынке препаратом "Гинсана". Однако препарат обладает довольно отсроченным эффектом действия и имеет существенные противопоказания и побочные эффекты.
Патент RU 2177783 С1 (Приоритет от 02.02.2001) описывает состав ноотропного средства в форме сиропа. Недостатком такой формы является пониженная стабильность при хранении, трудности с дозированием и малая активность активного вещества по сравнению с иными формами, когда речь идет о ноотропном действии.
Существует препарат "Ноотобрил" в форме капсулы, его состав представлен в патентном документе RU 2203660 С1. Недостатком данного препарата является его более узкий спектр назначений.
Кроме того, препаратов, содержащих Пирацетам на рынке более 100, однако их эффективность не сильно варьируется в зависимости от формы и состава, а основной упор при разработке новых составов и форм делается на стабильность активного вещества. Несмотря на насыщенный рынок Пирацетамом, препарат обладает спектром побочных явлений, среди которых существенные неудобства доставляет головная боль и тремор конечностей.
Несмотря на ряд существующих на рынке препаратов, обладающих ноотропным действием, остается актуальной темой применение ноотропов по широкому спектру соответствующих нозологий, а также оптимизация производства и повышение доступности препарата при лечении и профилактики при нарушении памяти, головокружении, снижении концентрации внимания, эмоциональной лабильности, деменции вследствие нарушений мозгового кровообращения (ишемического инсульта), травм головного мозга, при болезни Альцгеймера в пожилом возрасте, для улучшения когнитивных показателей после перенесенного повреждения мозга, для лечения абстиненции и психоорганического синдрома при хроническом алкоголизме и нарушениях обучаемости у детей. Кроме того, на рынке на текущий момент нет лекарственной формы производного 3,7-диазабицикло[3.3.1]нонана и не представлено оптимального состава.
Соответственно, задачей настоящего изобретения является получение на основе производного 3,7-диазабицикло[3.3.1]нонана отечественного лекарственного средства ноотропного действия, стабильного при хранении, обладающего хорошей растворимостью благодаря качественному подбору вспомогательных веществ и количественному содержанию ингредиентов.
Техническим результатом, на достижение которого направлено заявленное изобретение, является создание фармацевтической композиции, обладающей ноотропным действием в капсулах, характеризующейся хорошей растворимостью и стабильностью при хранении.
Технический результат достигается за счет разработки фармацевтической композиции, включающей помимо активного вещества 6-[4метокси-3-(1Н-пиразол-1-илметил)бензил]-1,11диметил-3,6,9-триазатрицикло[7.3.1.1]тетрадекан-4,8,12-триона-бициклононана, вспомогательные вещества - альгинат натрия, прежелатинизированный кукурузный крахмал (ПКК), натрия крахмала гликолят, кремния диоксид коллоидный и кальция хлорид, при следующем соотношении компонентов, мас. %

Наиболее близким аналогом для сравнения составов по принципу действия является "Пирацетам".
Фармацевтическая композиция в виде капсул, содержащая в качестве действующего вещества фармацевтическую субстанцию 6-[4метокси-3-(1Н-пиразол-1-илметил)бензил]-1,11диметил-3,6,9-триазатрицикло[7.3.1.1]тетрадекан-4,8,12-триона-бициклононан (Z-109), относится к фармакотерапевтической группе ноотропных средств, принадлежит к новому классу ампакинов - производных 3,7-диазабицикло[3.3.1]нонана с трициклическим каркасом, обладающих свойствами РАМ АМРА и обеспечивает продолжительную активацию АМРА-рецепторов и выработку нейротрофических факторов. Соответственно, наиболее вероятный механизм действия исследуемого лекарственного средства аналогичен механизму действия ампакинов: аллостерическое связывание с глутаматными рецепторами типа АМРА (АМФК), а также экспрессия нейротрофических факторов BDNF и NGF, запускающих механизмы, отвечающие за выживание существующих нейронов, а также рост и дифференцировку новых нейронов и синапсов.
Фармацевтическая субстанция бициклононана и способ ее получения раскрываются в патенте RU 2480470 С2, (приоритет от 06.04.2011), который описывает трициклические производные 3,7-диазабицикло[3.3.1]нонанов, потенциально обладающие фармакологической активностью. Данный охранный документ раскрывает структуру соединения, обладающего ноотропным действием.
Согласно поставленной задаче экспериментальным путем были предложены и рассмотрены формы и составы лекарственного средства с целью получить количественный и качественный состав в такой форме, которые бы позволили получить стабильный препарат, обладающий хорошей растворимостью, выраженным специфическим действием с минимумом побочных и аллергических реакций.
Еще одной задачей изобретения является расширение линейки отечественных препаратов, обладающих ноотропным действием по широкому спектру назначений.
В процессе исследования вариантов составов было неожиданно обнаружено, что субстанция бициклононана обладает малой растворимостью, потому было принято решение в качестве лекарственной формы выбрать твердые капсулы. Разработанный состав для капсул после ряда экспериментов позволил установить диапазонные количественные характеристики для выбранных вспомогательных веществ. В итоге было усилено действие активного компонента фармацевтической композиции путем экспериментально подобранного состава, в частности улучшена его растворимость, повышена биодоступность. Дополнительным плюсом разработанного лекарственного средства оказалась возможность добиться относительной дешевизны производства в промышленных масштабах, а также показать высокий экологический уровень путем реализации практически безотходного производства готовой лекарственной формы.
В процессе производства фармацевтической композиции в форме твердых капсул фармацевтическая субстанция испытывает щадящую технологическую переработку, что относится к биофармацевтическим преимуществам этой лекарственной формы. Крайне важно отсутствие в технологической схеме стадии прессования, что исключает негативное воздействие на высвобождение фармацевтической субстанции из лекарственной формы. Основным вспомогательным веществом в рецептуре является альгинат натрия в качестве наполнителя и гранулообразователя, который характеризуется не только хорошими технологическим характеристиками, но и благоприятным воздействием на слизистую ткань. Использование спирта этилового в качестве связующего компонента позволяет повысить растворимость фармацевтической субстанции в водной среде, что положительно отражается на биодоступности препарата. Кроме того, технологию получения готовой лекарственной формы фармацевтической композиции бициклононана в форме капсулы отличает простота аппаратурного оформления, низкая энергоемкость процесса, технология является практически безотходной, в процессе производства не используются вредные соединения, загрязняющие окружающую среду.
Полученные в экспериментальных исследованиях результаты свидетельствуют о перспективности применения фармацевтической композиции бициклононана в форме капсулы для терапии когнитивных нарушений и реабилитации пациентов, перенесших острую гипоксию мозга вследствие ишемии, а также других повреждений головного мозга. Разработанный состав в исследованиях показал высокие показатели безопасности.
Важность исследования состава определяется тем фактом, что до 50% проблем с технологией и качеством готовых форм (сыпучесть гранул, процесс таблетирования, распадаемость и растворимость твердых оральных форм и т.п.) зависит от компонентов лекарственной формы.
Хорошо известно, что соблюдения фармакопейных требований к активным субстанциям и вспомогательным веществам недостаточно для обеспечения устойчивости процессов и желаемых фармакокинетических свойств многих лекарственных форм. Определены и оценены физико-химические и биологические свойства фармацевтической субстанции, способные повлиять на действие продукта и его технологичность.
Таким образом в качестве лекарственной формы были разработаны капсулы. Состав вспомогательных веществ обладает синергическим эффектом с активным веществом, что имеет подтверждение в приведенных примерах осуществления изобретения. Заявленный состав и форма решают все поставленные задачи.
Пример 1. Выбор лекарственной формы.
В настоящее время наиболее востребованными твердыми пероральными лекарственными формами являются таблетки и капсулы. Технология таблетированных фармацевтических композиций широко используется производителями. Однако следует учитывать ее особенности: многостадийность, большое количество технологических вспомогательных веществ в рецептурах, воздействие на фармацевтическую субстанцию стрессовых технологических условий, таких как увлажнение, высокие температуры, прессование, способных привести к полиморфным переходам, а также негативно отразиться на стабильности и эффективности фармацевтической субстанции.
Капсулы имеют неоспоримые маркетинговые, биофармацевтические и технологические преимущества. Помимо привлекательного внешнего вида, капсулы маскируют неприятные вкус и запах фармацевтической субстанции, обеспечивают высокую точность дозирования, а главное - фармацевтическая субстанция при производстве капсул не подвергается агрессивному технологическому воздействию, что положительно сказывается на стабильности и эффективности фармацевтический композиции. Биофармацевтические возможности модификации высвобождения субстанции из капсул позволяют варьировать его в широком диапазоне - от быстрого до фазного и пролонгированного. Производители отмечают также экономичность производства капсулированных фармацевтических композиций по сравнению с производством таблеток за счет снижения количества технологических стадий и видов необходимого производственного оборудования.
В настоящее время наиболее распространены капсулы из желатина - натурального продукта гидролиза коллаген содержащего сырья, являющегося отходами предприятий пищевой промышленности: мясо- и рыбокомбинатов. В настоящее время он широко используется в пищевой промышленности [James Swarbrick. Encyclopedia of Pharmaceutical Technology Third Edition New York London edited by PharmaceuTech, Inc. v. 1 Brian E. Jones. - Capsules, Hard. - p. 406-418 и The two-piece gelatin capsule Handbook. - Qualicaps. - 2011. - 43 p.].
Молекула желатина представляет собой полипептид, молекула которого состоит из аминокислот, в числе которых имеются: глицин (около 30%), пролин, оксипролин, аланин, глутаминовую и аспарагиновые кислоты. Поэтому желатин обладает несомненными преимуществами: он биосовместим, легко усваивается и не дает побочных реакций. Аминокислоты желатина обладают действием на организм: улучшают обмен веществ, повышают умственную работоспособность и укрепляют сердечную мышцу, благоприятно воздействуют на ткани опорно-двигательного аппарата, слизистую желудочно-кишечного тракта при эрозиях и язвенной болезни и являются одним из основных источников энергии центральной нервной системы, мышц и головного мозга. Более того, желатин используется в медицине в качестве плазмозамещающего лекарственного средства [Гелоплазма баланс, Гелофузин, Желатиноль, https://www.medsovet.info/herb/5695].
Следует отметить, что желатин являясь природным продуктом, легко усваивается организмом, быстро растворяется в кислой среде желудка (чему способствует наличие желудочной протеазы пепсина) и высвобождает содержимое капсул, способствуя тем самым быстрому поступлению фармацевтической субстанции в организм.
К числу недостатков желатина относят следующие:
- полипептидная структура желатина обусловливает его подверженность микробной контаминации;
- стенки капсул очень чувствительны к изменению влагосодержания. Как повышение, так и понижение влажности капсул негативно сказывается на свойствах фармацевтической композиции;
- желатин, являясь сырьем животного происхождения, имеет ограничения в использовании для определенных категорий потребителей, таких, как вегетарианцы, а также религиозные или этнические группы, которые соблюдают диетические законы, запрещающие использование ряда продуктов животного происхождения;
- желатин может создать угрозу здоровью человека в связи с появлением серьезных заболеваний животных, таких, как губчатая энцефалопатия, свиной грипп и др.
Недостатки, присущие желатиновым капсулам, стимулировали поиск альтернативных материалов для лекарственной формы. Альтернативный материал помимо отсутствия указанных выше недостатков желатина, должен иметь сходные физико-химические свойства для возможности использования разработанных технологий и имеющегося машинного парка без серьезного перепроектирования. Он должен обладать доказанной безопасностью и разрешением к фармацевтическому применению. ГПМЦ (гипромеллоза) стала успешным альтернативным материалом для твердых капсул, которые в настоящее время выведены на рынок [«The two-piece gelatin capsule Handbook. - Qualicaps». - 2011. - 43 p.].
Гипромеллозу получают синтетической модификацией целлюлозы и считают безопасной для потребления человеком [Technical Reference File Hard Gelatin Capsules, 3rd edition. - CAPSUGEL. - 2010. - 55 p., и Н.Б. Демина, M.C. Демин Разработка технологии производства капсульных форм лекарственных препаратов Глава в монографии Фармацевтическая разработка. Концепция и практические рекомендации. Москва Изд-во Перо. - 2015. С. 196-236.]. Она практически не растворима в горячей воде, в ацетоне, в безводном этиловом спирте и в хлороформе, но растворяется в холодной воде с образованием коллоидного раствора, и демонстрирует обратимое температурное гелирование.
Модификация молекулы ГПМЦ метокси- и гидрокси- пропокси- группами позволяет получить продукты с вариациями многих свойств, например, температуры гелирования, вязкости, эластичности, гидратации.
Это дает возможность создания продуктов с модифицированным высвобождением и с повышенной устойчивостью к условиям хранения и механической обработки.
ГПМЦ широко используется в фармацевтической промышленности в качестве покрытий на таблетки и основ для вязко-пластичных форм: гелей и кремов. ГПМЦ хорошо совместима с известными вспомогательными веществами и имеет подобные желатину свойства. Преимущество заключается в том, что ГПМЦ соответствует диетическим и культурным потребностям всех пациентов. Отвечает запросам производства - капсулы могут быть произведены и заполнены на существующем оборудовании. Характеризуется доказанными сведениями о безопасности и разрешена к фармацевтическому применению. Кроме того, обеспечивает улучшение характеристик капсул, их прочности, защиты от влажности от микробной контаминации, высокую совместимость с продуктами.
Гипромеллозные капсулы более стабильны к влаге, по сравнению с желатиновыми. Влажность самих капсул составляет 6-7%, что ниже влажности желатиновых капсул, которая составляет 12-13%. Это крайне важно для гигроскопических фармацевтических субстанций и для условий наполнения, транспортировки, хранения как пустых капсул, так и лекарственных форм. Однако, поскольку ГПМЦ капсулы появились на рынке Российской Федерации недавно, публикаций об их свойствах и применении при создании лекарственного средства практически нет.
Таким образом, поскольку, бициклононан, как было установлено экспериментальным путем, очень мало растворим в воде, в качестве лекарственной формы выбраны не таблетки, а твердые капсулы. В процессе получения таблетированных фармацевтических композиций субстанция подвергается стрессовым технологическим воздействиям (увлажнение, сушка, прессование), способным негативно отразиться на ее и без того низкой растворимости, и возможно в последующем и на биодоступности. Как было сказано выше, в процессе производства фармацевтической композиции в форме твердых капсул фармацевтическая субстанция испытывает щадящую технологическую переработку, что относят к биофармацевтическим преимуществам этой лекарственной формы. Крайне важно отсутствие в технологической схеме стадии прессования, что исключает ее негативное воздействие на высвобождение фармацевтической субстанции из лекарственной формы.
Пример 2. Исследование и выбор формы наполнения капсул.
Традиционно в твердые капсулы помещают фармацевтическую субстанцию в форме порошка или гранул. В случае малой дозировки фармацевтической субстанции, для обеспечения точности дозирования капсулонаполняющим автоматом в рецептуры вводят наполнители (разбавители): маннитол, лактозу, микрокристаллическую целлюлозу, кукурузный крахмал и др. традиционные вспомогательные вещества, одобренные для фармацевтического применения.
Для обеспечения скольжения капсулируемой массы относительно рабочих частей капсулонаполняющей машины в ее состав в небольших количествах (часто это 1-3%) вводят скользящие вещества: магния стеарат, глицерилмоностеарат, стеариновая кислота, тальк, аэросил и др. [Н.Б. Демина, М.С. Демин Разработка технологии производства капсульных форм лекарственных препаратов Глава в монографии Фармацевтическая разработка. Концепция и практические рекомендации. Москва Изд-во Перо. - 2015. С. 196-236.].
Капсулируемая масса при наполнении подвергается сжатию и поэтому нередко в рецептурах присутствуют дезинтегранты: кроскармелоза, кукурузный крахмал, кросповидон, крахмал, альгиновая кислота, натрия глицерилкрахмал и др.
Выбор вспомогательных веществ тесно связан с технологией подготовки капсулируемой смеси к наполнению, для выбора и обоснования технологии подготовки сначала изучали технологические свойства фармацевтической субстанции.
Поскольку дозирование в капсулы осуществляется автоматически, порошкообразное содержимое должно в первую очередь обладать хорошей сыпучестью, чтобы порошок мог передвигаться самотеком из бункера машины в дозирующее устройство. Сыпучесть, в свою очередь, зависит от многих характеристик порошка: от фракционного состава, аморфности и влажности субстанции. Поскольку сыпучесть - сложная характеристика, ее принято определять двумя способами: по скорости истечения из стандартной воронки и по величине угла естественного откоса. Угол естественного откоса - угол между образующей конуса из сыпучего материала и горизонтальной плоскостью. Угол откоса характеризует влияние трения между частицами и влияние гравитации на порошковую массу, дает оценку влияния размера частиц, формы и электростатического взаимодействия между частицами во время высыпания порошка из бункера капсулонаполняющей машины. Величина угла естественного откоса зависит от формы, размеров и когезионных свойств частиц, она варьирует в широких пределах: от 25° до 30° для хорошо сыпучих, от 60° до 70° для плохо сыпучих материалов.
Как и другие характеристики сыпучих масс, насыпная плотность - комплексный показатель, который зависит от многих других: гранулометрического состава, влажности, плотности укладки в слое. Важно, что это - не постоянная величина, она может меняться под влиянием вибрации и даже при хранении на складе. Поэтому различают минимальную насыпную плотность свободно насыпанного порошка и максимальную - насыпную плотность после уплотнения - для порошка, свободно насыпанного, но подвергшегося уплотнению путем встряхивания. Насыпная плотность тесно связана с объемом капсулы, номер которой подбирается в зависимости от массы содержимого капсулы.
Сыпучесть и насыпная плотность, являясь важными характеристиками порошковой массы в фармацевтической технологии, определяют ритмичность и скорость работы капсулонаполняющей машины, а, следовательно, ее производительность. Помимо технологических условий сыпучесть влияет также на однородность массы и плотность капсулируемой массы. Эта характеристика является комплексной и зависит от многих параметров: формы и рельефа поверхности частиц порошков, фракционного состава, влажности и во многом определяет насыпную плотность порошкообразной массы.
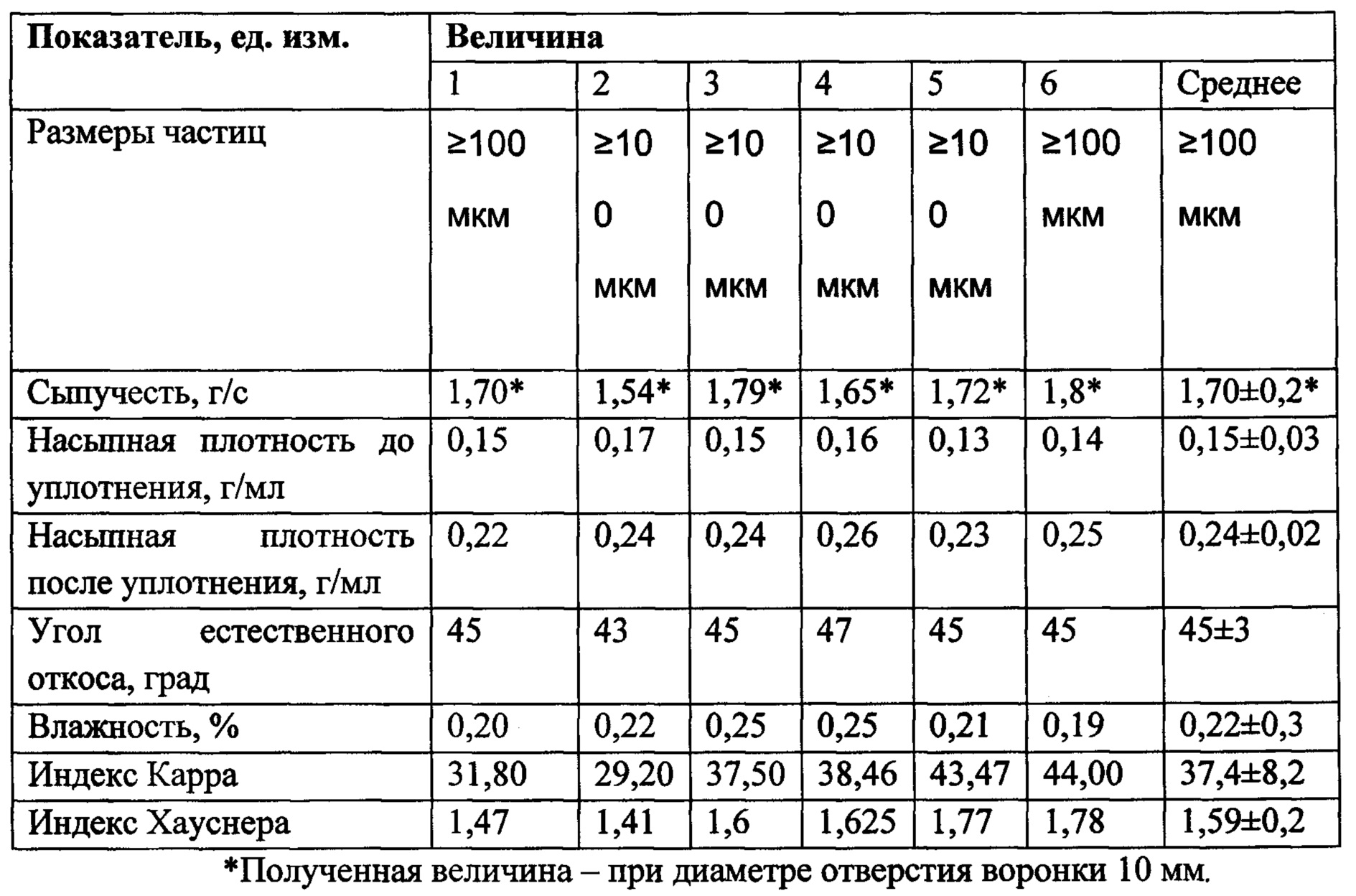
По результатам исследований технологических характеристик субстанции бициклононана, которые отражены в Таблице №1 были получены данные о низких технологических свойствах субстанции. Сыпучесть составила всего 1,5-1,7 г/сек, при этом не весь порошок самотеком высыпался из воронки прибора, часть его зависала. Соответствует низкой сыпучести и угол откоса, он равен 42-48 градусам. Кроме того, порошок пылит и электризуется. Эти характеристики можно оценить только как неудовлетворительные. На основании рассчитанных величин индексов Карра и Хауснера сыпучесть субстанции оценена как «очень плохая».
Таблица 1 - Результаты определения технологических характеристик субстанции бициклононана, полученные в результате измерений 6 образцов.
С учетом малой дозировки субстанции, которая обусловливает необходимость введения в состав лекарственной формы значительного количества наполнителя, скользящего и дезинтегранта, порошковую смесь перед наполнением в капсулы необходимо гранулировать.
Пример 3. Исследование метода гранулирования.
Низкие технологические характеристики фармацевтической субстанции, ее небольшая дозировка, мелкие размеры частиц, их аморфный характер, летучесть послужили обоснованием для гранулирования капсулируемой смеси. Цели, которые достигаются технологией гранулирования являются повышение сыпучести и обеспечение однородности содержания всех компонентов в порошковой смеси.
Методы гранулирования, используемые на производстве в настоящее время в зависимости от консистенции связующего, проводят с увлажнением порошковой массы или без него. Сухое гранулирование подразумевает применение значительных усилий сжатия или плавления массы, что нельзя счесть целесообразным в случае фармацевтической субстанции, нерастворимой в водной среде ввиду возможной потери ее фармакологической активности. Из методов влажного гранулирования наиболее приемлемым является гранулирование с смесителе-грануляторе с высоким усилием сдвига. Образование гранул происходит при увлажнении порошковой смеси раствором склеивающего, который подается с помощью форсунки. Образующиеся агломераты катятся по поверхности вращающегося дна, выполненного в форме тарелки. В процессе происходит их послойное наращивание гранулируемой смесью и одновременно происходит шлифовка поверхности образующихся гранул. Полученные гранулы прочны, имеют сглаженную поверхность. Для выравнивания фракционного состава предусмотрены боковые измельчители. В некоторых случаях еще влажные гранулы калибруют, используя внешнюю насадку. Z-образные лопасти тарельчатого ротора обеспечивают интенсивное перемешивание.
В сравнении с традиционной схемой гранулирования продавливанием использование смесителя-гранулятора снижает энергозатраты, производственные площади, себестоимость продукта. С помощью научно обоснованного подбора вспомогательных веществ в результате применения данной технологии возможна минимизация количества увлажнителя, в результате - возможное исключение из технологического процесса стадии сушки гранулята, сопровождающейся неблагоприятным воздействием температуры на активные фармацевтические ингредиенты и громоздким аппаратурным оформлением процессов воздухоподготовки и воздухоочистки, а также уменьшение длительности и энергоемкости процесса перемешивания увлажненной массы.
Несмотря на множество разработанных и применяющихся технологий гранулирования, в настоящее время предлагаются новые методы, целью которых является минимизация недостатков известных методов. Одной из таких технологий стало влагоактивизированное гранулирование (ВАГ).
ВАГ разработано как альтернатива влажному гранулированию, при котором используется значительное количество гранулирующей жидкости, а гранулируемый материал подвергается не только негативному воздействию влаги, но и проходит стадию термической сушки. Это с одной стороны может оказаться губительным для лабильных биологически активных веществ и с другой - удорожает технологический процесс, поскольку требует значительных энергозатрат и применения нескольких видов специального оборудования.
Главную роль для проведения ВАГ играет правильный выбор вспомогательных веществ, которые должны способствовать образованию агломератов при попадании в порошкообразную смесь мельчайших капель увлажнителя. В качестве последнего необходимо применять жидкости с низкой вязкостью, которая будет способствовать тонкому распылению. С технологической точки зрения хорошим увлажнителем является этиловый спирт, имеющий низкую вязкость, а также вода, которая при обоснованно подобранной рецептуре может использоваться для гранулирования даже гидрофобных ФС [Н.Б. Демина Разработка технологии производства таблеток Глава в монографии Фармацевтическая разработка. Концепция и практические рекомендации. Москва, Изд-во Перо. - 2015. С. 83-134.].
Ранее на кафедре фармацевтической технологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет) были разработаны рецептуры для проведения ВАГ сухих растительных экстрактов и кристаллических веществ [М.В. Ходжава, Н.Б. Демина, С.А. Скатков, В.А. Кеменова Технологические аспекты влагоактивизированного гранулирования. Фармация. - 2013. - №4, - с. 34-36.]. На основании проведенных ранее исследований на иных объектах, в настоящем исследовании в качестве наполнителей изучали: манит, лактозы моногидрат, микрокристаллическую целлюлозу, кукурузный крахмал; в качестве дезинтегрантов - кросповидон, кроскармеллозу натрия; в качестве антиадгезива - коллоидный кремния диоксид.
Пример 4. Исследование состава и выбор вспомогательных веществ.
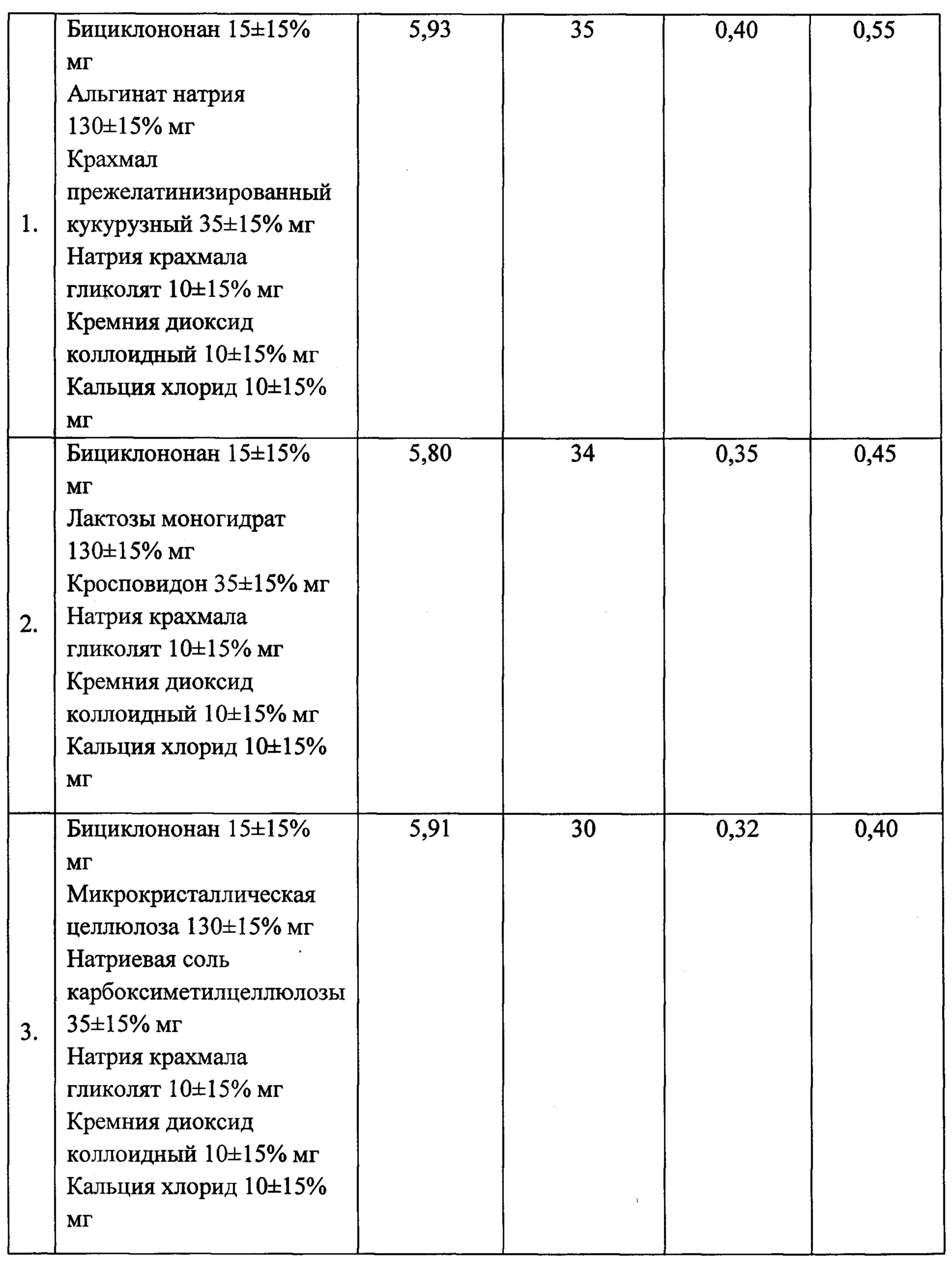
В результате многофакторного эксперимента разработана рецептура лекарственной формы бициклононана. Были приготовлены три модельных состава капсульных масс с использованием разных вспомогательных веществ, которые включали бициклононан и вспомогательное вещество в различных комбинациях. В ходе эксперимента проводилась оценка составов по таким показателям: сыпучесть, угол естественного откоса, насыпная плотность до уплотнения и после уплотнения, однородность дозирования. Результаты указаны в таблице №2. Сыпучесть у образца №1 по сравнению с субстанцией повысилась от 1,7 до 5,93 г/с, угол естественного откоса составил 35 град, насыпная плотность до уплотнения возросла от 0,15 до 0,40 г/мл, насыпная плотность после уплотнения - от 0,24 до 0,55 г/мл, что свидетельствует о целесообразности использования для фармацевтической композиции капсульный состав №1. Впервые для ВАГ бициклононана при проведении настоящего исследования использованы альгинаты натрия, показавшие наилучшие результаты не только по вышеуказанным критериям, но и достичь максимального уровня растворимости субстанции.

Оптимальная композиция с указанием качественного и количественного состава для капсулы любой формы представлена в следующем виде, мас. %:
Бициклононан - 6-8%,
Альгинат натрия - 60-62%,
Прежелатинизированный кукурузный крахмал (ПКК) - 15-17%,
Натрия крахмала гликолят - 3-5%,
Кремния диоксид коллоидный - 3-5%,
Кальция хлорид - 3-5%.
Выбранные вспомогательные вещества обеспечивают необходимый объем и компактность содержимого капсулы.
Пример 5. Подготовка фармацевтической субстанции к наполнению в капсулы. Гранулирование.
При ВАГ в сухую смесь ингредиентов (фармацевтическая субстанция, наполнители, сухие связывающие) при перемешивании тонким распылением вводят увлажнитель для образования агломератов - гранул. Полученные увлажненные гранулы при непрекращающемся перемешивании опудривают диоксидом кремния, который сорбирует и перераспределяют влагу в получаемом продукте, «подсушивает» его. Для равномерного перераспределения влаги гранулы просто оставляют на некоторое время в закрытой емкости в обычном помещении, необходимость проведения операции сушки отпадает, что является несомненным преимуществом при работе с лабильными субстанциями в условиях повышенной влажности и температуры.
Сравнение условий процесса влажного и влагоактивизированного гранулирования представлено в таблице №3.
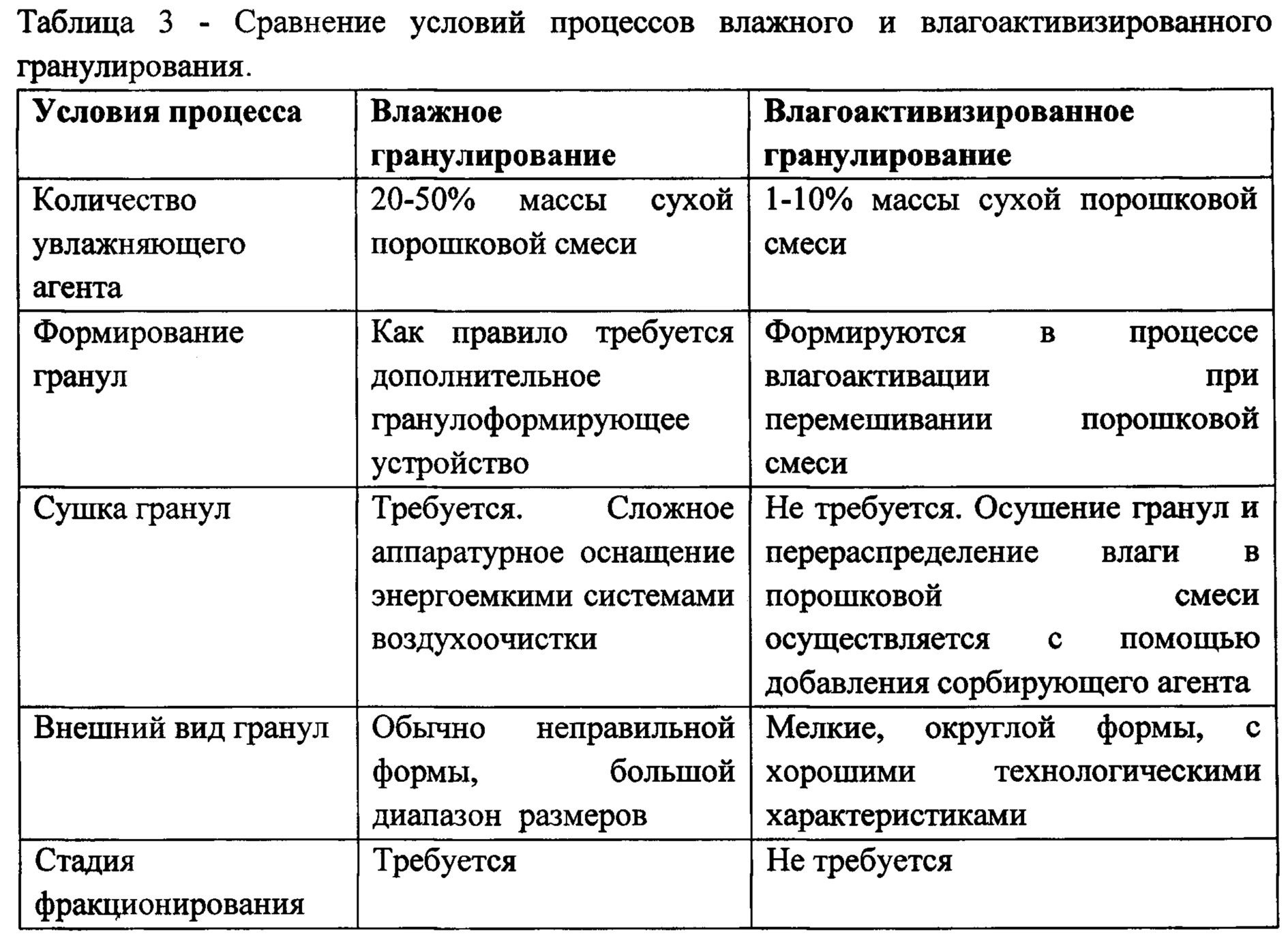

Полученные в результате гранулы имеют близкий фракционный состав, высокую сыпучесть и прессуемость. Их влажность соответствует влажности гранул, полученных по стандартной технологии влажного гранулирования. При необходимости, на заключительном этапе добавляют дезинтегранты и скользящие.
Описание технологии гранулирования. Вспомогательные вещества: альгинат натрия, крахмал прежелатинизированный и натрия крахмала гликолят смешивали, добавляли субстанцию бициклононана и снова тщательно перемешивали, подавали из форсунки увлажнитель для образования агломератов, а затем - кальция хлорид для стимулирования гранулообразования, опудривали предварительно просеянным через сито с отверстиями 0,315 мм аэросилом. После выгрузки из гранулятора продукт оставляли для перераспределения влаги в закрытом бине при комнатной температуре на 10-12 часов.
Подбор увлажнителя. Для ВАГ целесообразно применять низковязкие увлажнители. Наиболее простым, дешевым, экологичным и безопасным в технологическом плане гранулирующим агентом является вода очищенная. Основным ее недостатком считают процессы гидролиза, протекающие при увлажнении. В ходе эксперимента установлено, что образование гранул при увлажнении порошковой смеси водой очищенной, в которой субстанция нерастворима, протекает только за счет прежелатинизированного кукурузного крахмала и частично альгината натрия. Полученный продукт представлен частицами неправильной формы, среди которых присутствовали как гранулы вспомогательных веществ, так и свободные частицы фармацевтической субстанции.
При использовании в качестве гранулирующей жидкости 95% этилового спирта, в котором субстанция хорошо растворима, гранулы имеют более округлую форму и гладкую поверхность, что благоприятно влияет на сыпучесть продукта, частицы субстанции в нем отсутствуют. В данном случае в формировании гранул принимают участие не только наполнители, но также и фармацевтическая субстанция. В результате растворения фармацевтической субстанции в увлажнителе (95% этиловом спирте), при нанесении его на смесь порошкообразных компонентов вспомогательных веществ продукт получается более однородным. Использованный прием позволит обеспечить однородность дозирования, что крайне важно при производстве лекарственных форм с низкой дозировкой субстанции. Количество используемой в процессе гранулирования увлажняющей жидкости точно определялось при проведении эксперимента для каждого состава и не превышало 5% от общей массы порошкообразной смеси.
Результаты определения технологических характеристик гранулята, полученные в результате измерений 6 образцов, приведены в таблице №4.
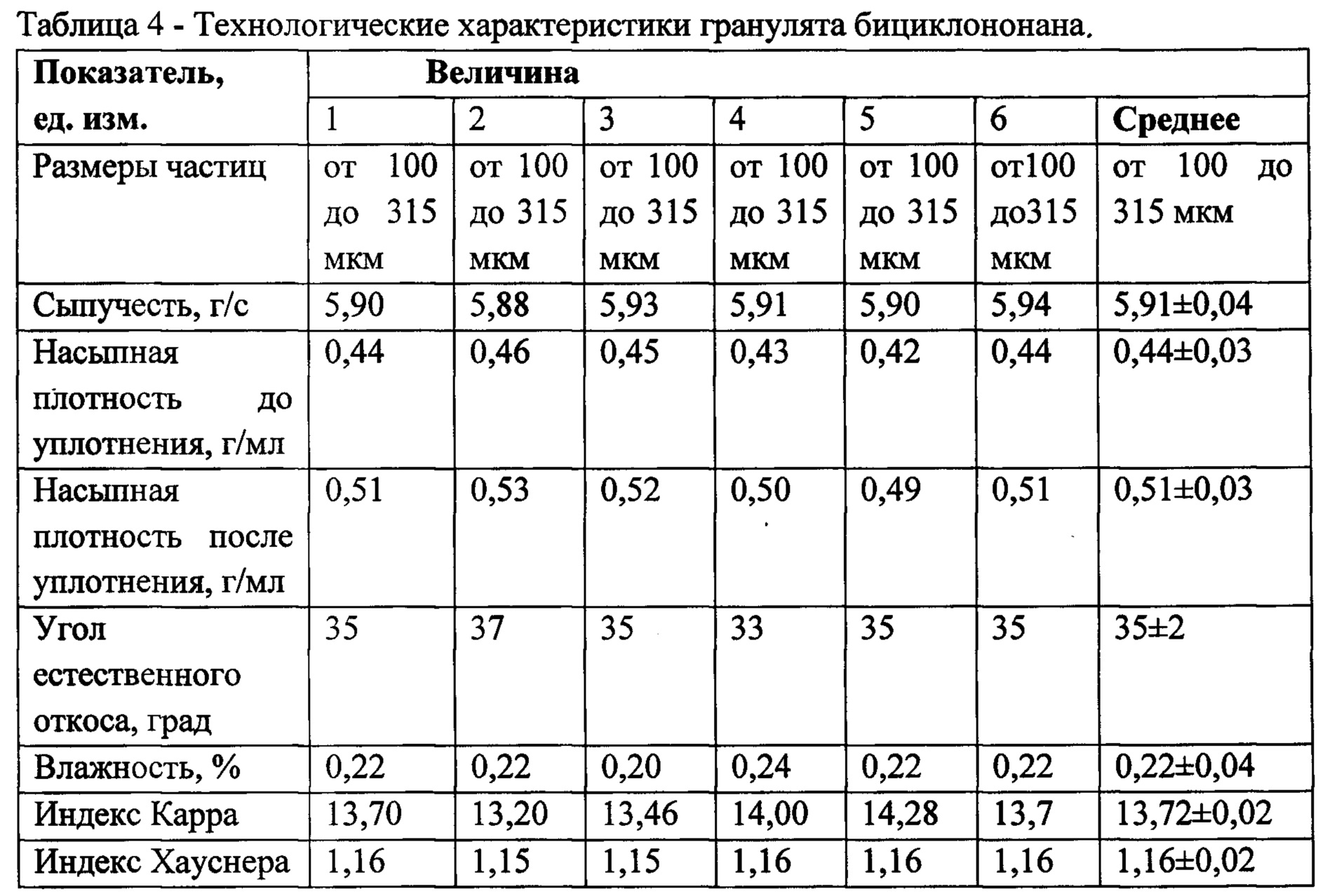
Полученные результаты свидетельствуют о хороших технологических свойствах гранулята: сыпучесть по сравнению с субстанцией (результаты в Таблице №1) повысилась от 1,7 до 5,9 г/с, насыпная плотность до уплотнения возросла от 0,15 до 0,44 г/мл, насыпная плотность после уплотнения - от 0,24 до 0,51 г/мл, что свидетельствует о целесообразности использования для лекарственной формы капсулы №3. На основании рассчитанных величин индексов Карра и Хауснера сыпучесть субстанции оценена как «хорошая». Таким образом, показатели качества гранулята позволяют сделать вывод о рациональности разработанной технологии гранулирования и пригодности полученного продукта для дальнейших исследований.
По результатам исследования удалось разработать оптимальный состав и лекарственную форму в виде капсул, которые обладают такими преимуществами как: высокая биодоступность, щадящая для фармацевтической субстанции технология производства, высокая комплаентность у пациентов и др. Разработанная лекарственная форма отвечает современным требованиям по фармакопейным показателям качества, в том числе по кинетике высвобождения: согласно полученным результатам за 45 минут в среду растворения с рН 4,5 переходит 77,6±2,5% субстанции, что соответствует фармакопейной норме. Следует учесть важный момент, что сама субстанция очень мало растворима в воде, повышение ее растворимости достигнуто в результате предложенной технологии получения лекарственной формы и разработанного оптимального состава.
Пример 6. Исследование фармакокинетики лекарственного средства при однократном и многократном введении.
При однократном введении исследование проводилось как открытое проспективное, с включением животных в различные группы для изучения фармакокинетики и биодоступности. По результатам отбора животных, произведен последовательный набор четырех групп крыс. Всего было использовано 270 самцов крыс (Таблица 5).
За 18-20 часов до исследования животных лишали корма с открытым доступом к воде. Лекарственное средство растворяли в ДМСО, затем в 2% крахмальном геле, вводили перорально атравматическим зондом в объеме 2 мл. Лекарственное средство растворяли в ДМСО, затем в 0,9% физиологическом растворе, вводили внутривенно в объеме 1 мл.
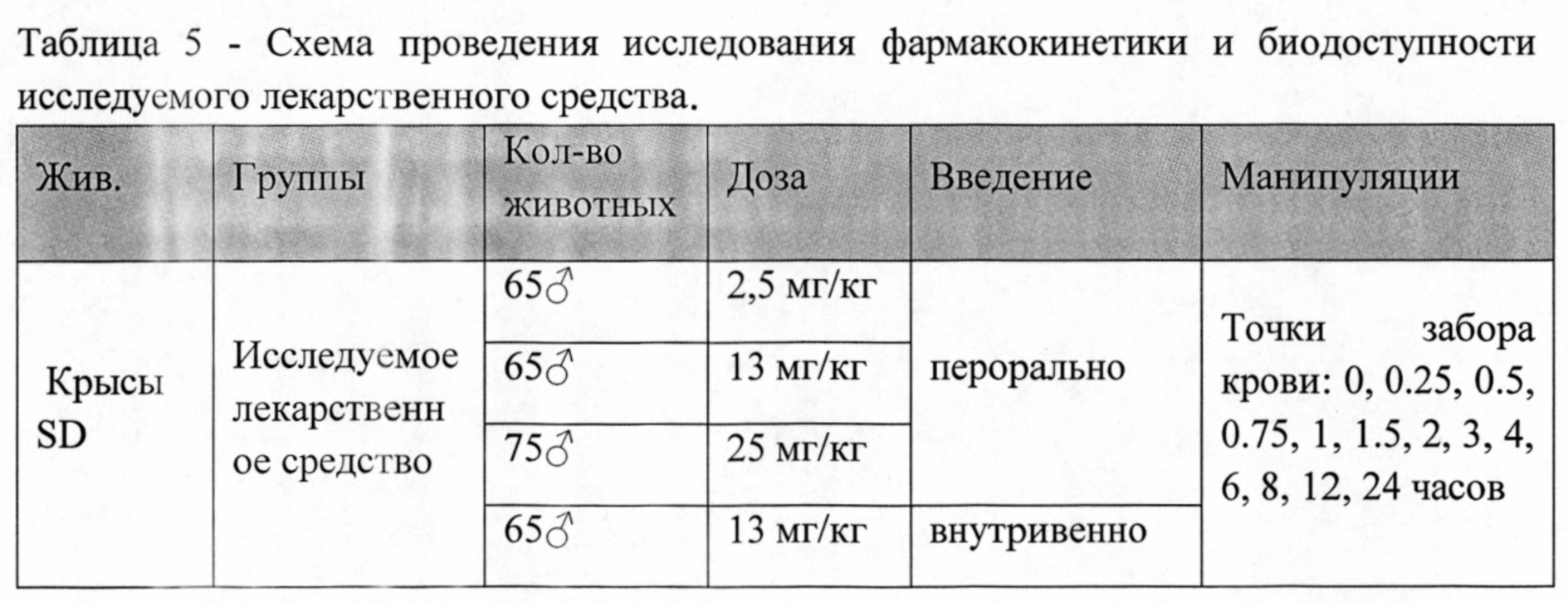
Перед забором крови крыс помещали в СО2 камеру до полной остановки дыхания. Кровь забирали из яремной вены по 1 мл с EDTA в следующие временные точки: 0, 0.25, 0.5, 0.75, 1, 1.5, 2, 3, 4, 6, 8, 12, 24 часов. На одну временную точку приходилось по 5 животных. Также на дозе 25 мг/кг у животных производили забор органов (мозг, тимус, сердце, легкие, печень, почки, селезенка) для изучения распределения лекарственного средства в следующие временные точки: 0, 0.25, 0.5, 0.75, 1, 1.5, 2, 3, 4, 6, 8, 12, 24, 36, 48 часов. Из крови получали плазму обычным методом: центрифугирование - при 3500 об/мин при температуре 4°С и сохранение при минус 20°С в аликвотах по 1 мл.
В ходе всего эксперимента, в том чисел и его биологической части, не было зафиксировано никаких отличий в поведении, внешнем виде и проявлений физиологических функций у подопытных крыс до и после получения ими лекарственного средства.
При определении исследуемого лекарственного средства в плазме крови крыс использовали стандартные методики известные из уровня техники среднему специалисту. Готовили растворы: 0,1% раствор ТФУ в ацетонитриле, 0,1% раствор ТФУ в воде, 50% раствор ацетонитрила. Готовили стоковый раствор СО. Диапазон калибровки для бициклононана: 0,1-100 мкг/мл. Готовили испытуемый раствор. Образцы плазмы поместили в мерную колбу, вместимостью 10 мл, прибавили 9 мл раствора и перемешали до максимального растворения компонентов, довели объем до метки раствором 3. 100 мкл полученного раствора поместили в колбу вместимостью 10 мл и довели раствором 3 до метки. 100 мкл полученного раствора поместили в микропробирку вместимостью 0,5 мл, центрифугировали в течении 2 мин при 14000 об/мин для осаждения нерастворимых компонентов. Супернатант брали для анализа.
Готовили бланк-раствор: 130 мг альгината натрия, 35 мг прежелатинизированного кукурузного крахмала, 10 мг натрия крахмала гликолята, 10 мг кремния диоксида коллоидного и 10 мг кальция хлорида поместили в стакан вместимостью 10 мл, прибавили 9 мл раствора 3 и перемешали до максимального растворения компонентов. Получившийся раствор перенесли в колбу вместимостью 10 мл, довели объем раствора до метки раствором 3, и перемешали. 100 мкл полученного раствора поместили в колбу вместимостью 10 мл и довели раствором 3 до метки. 100 мкл полученного раствора поместили в микропробирку вместимостью 0,5 мл, центрифугировали в течении 2 мин при 14000 об/мин для осаждения нерастворимых компонентов. Супернатант брали для анализа.
Готовили модельный раствор. 15 мг стандартного образца бициклононана, 130 мг альгината натрия, 35 мг прежелатинизированного кукурузного крахмала, 10 мг натрия крахмала гликолята, 10 мг кремния диоксида коллоидного и 10 мг кальция хлорида поместили в стакан вместимостью 10 мл, прибавили 9 мл раствора 3 и перемешали до максимального растворения компонентов. Получившийся раствор перенесли в колбу вместимостью 10 мл, довели объем раствора до метки раствором 3, и перемешали. 100 мкл полученного раствора поместили в колбу вместимостью 10 мл и довели раствором 3 до метки. 100 мкл полученного раствора поместили в микропробирку вместимостью 0,5 мл, центрифугировали в течении 2 мин при 14000 об/мин для осаждения нерастворимых компонентов. Супернатант брали для анализа.
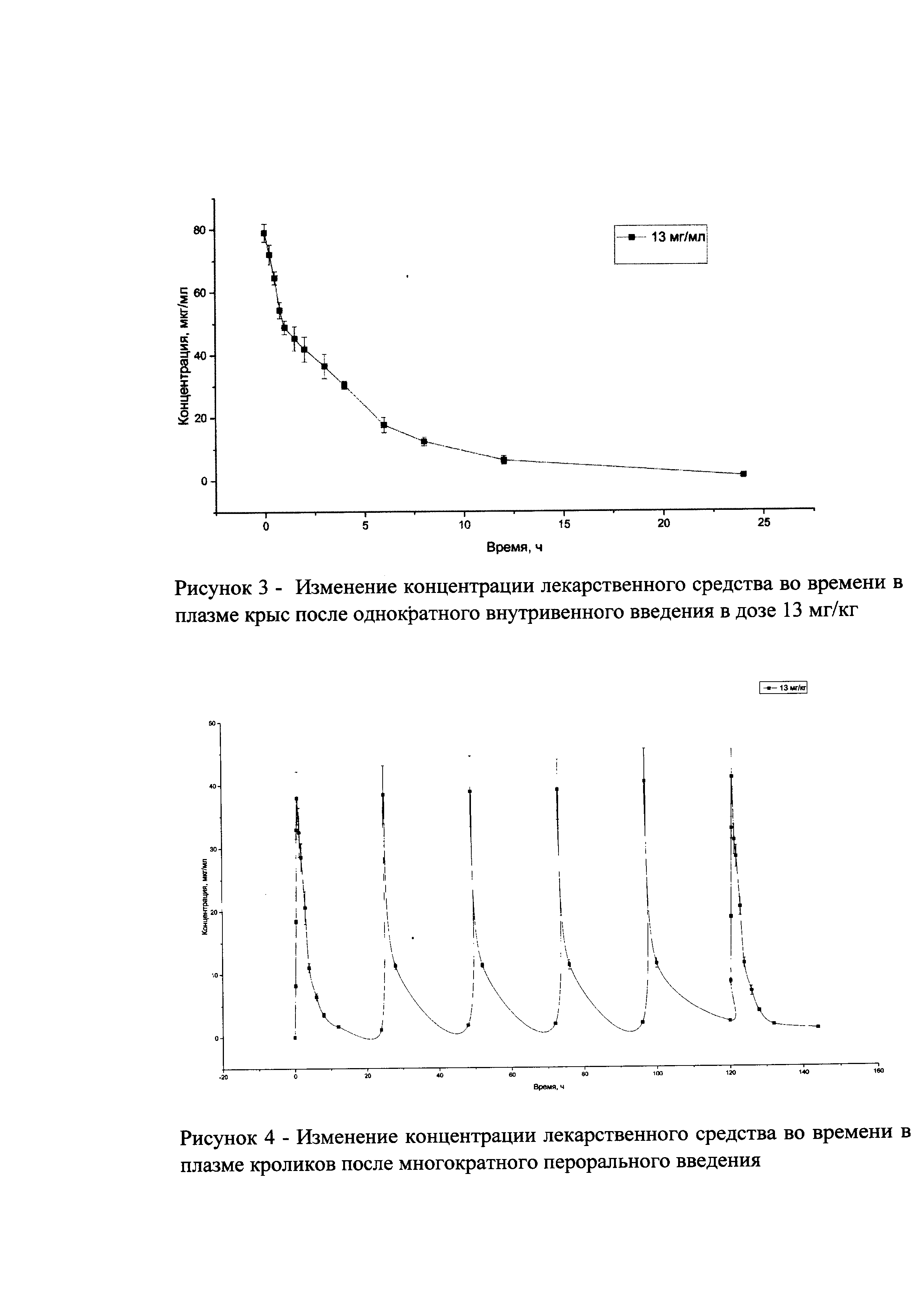
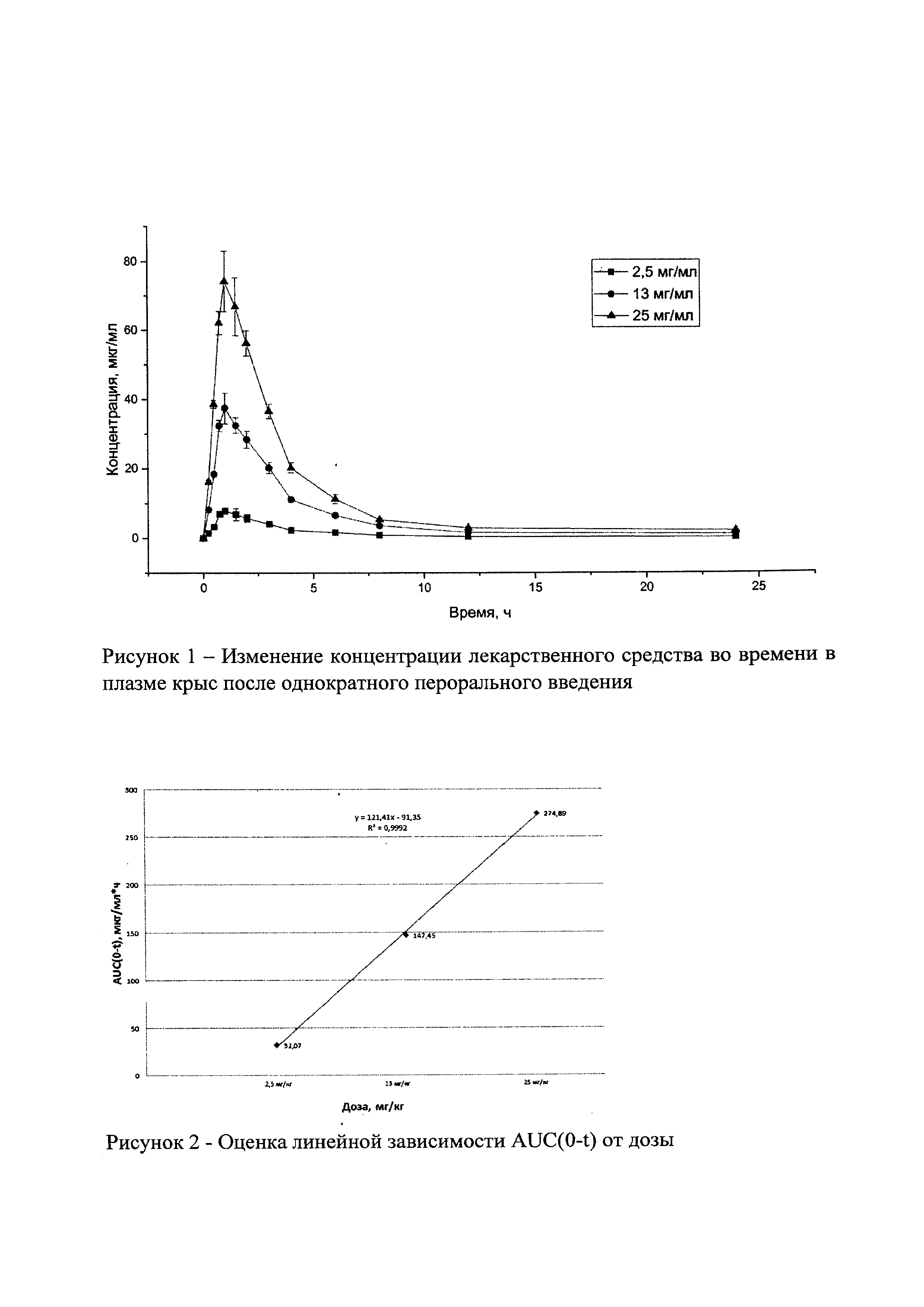
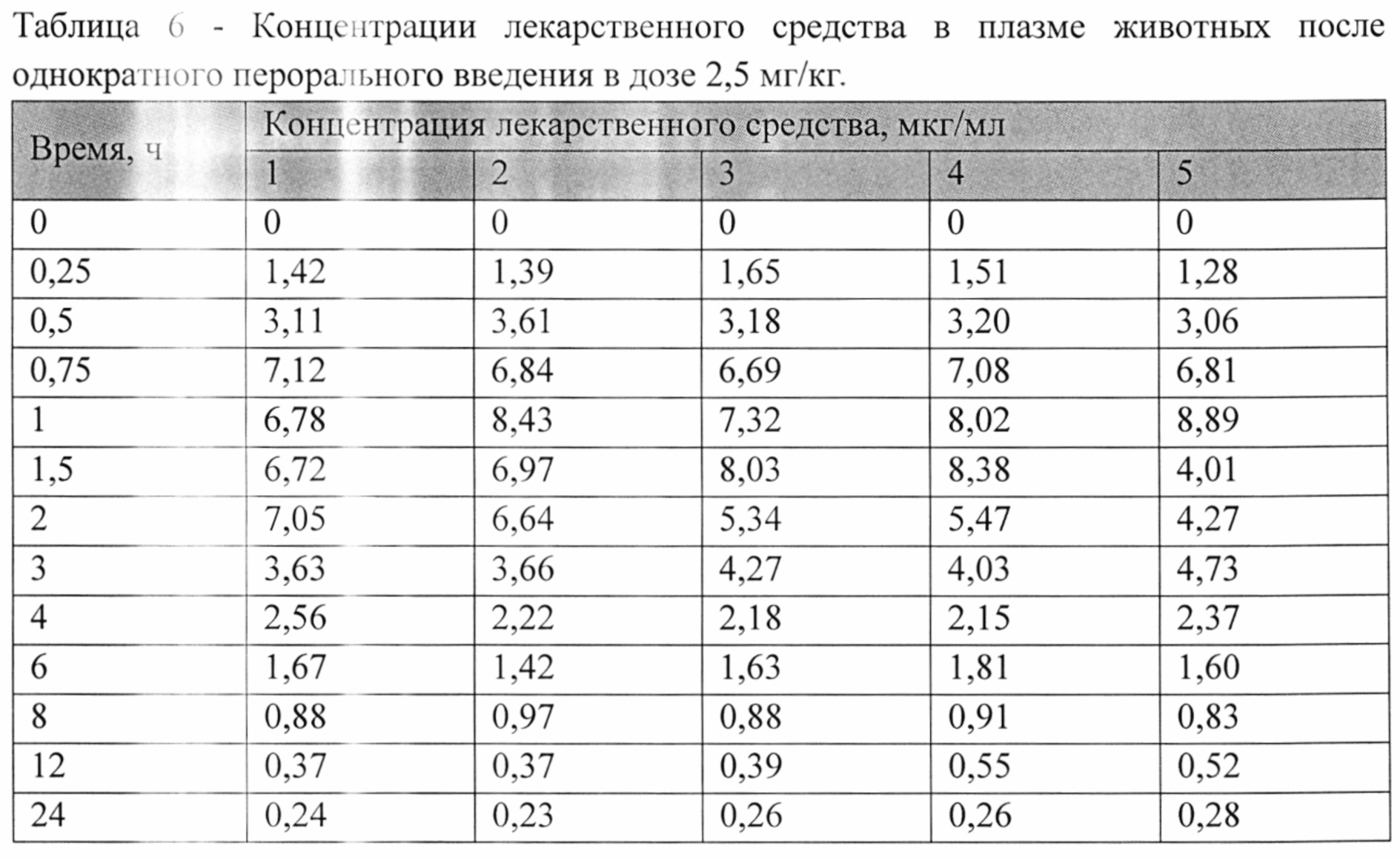
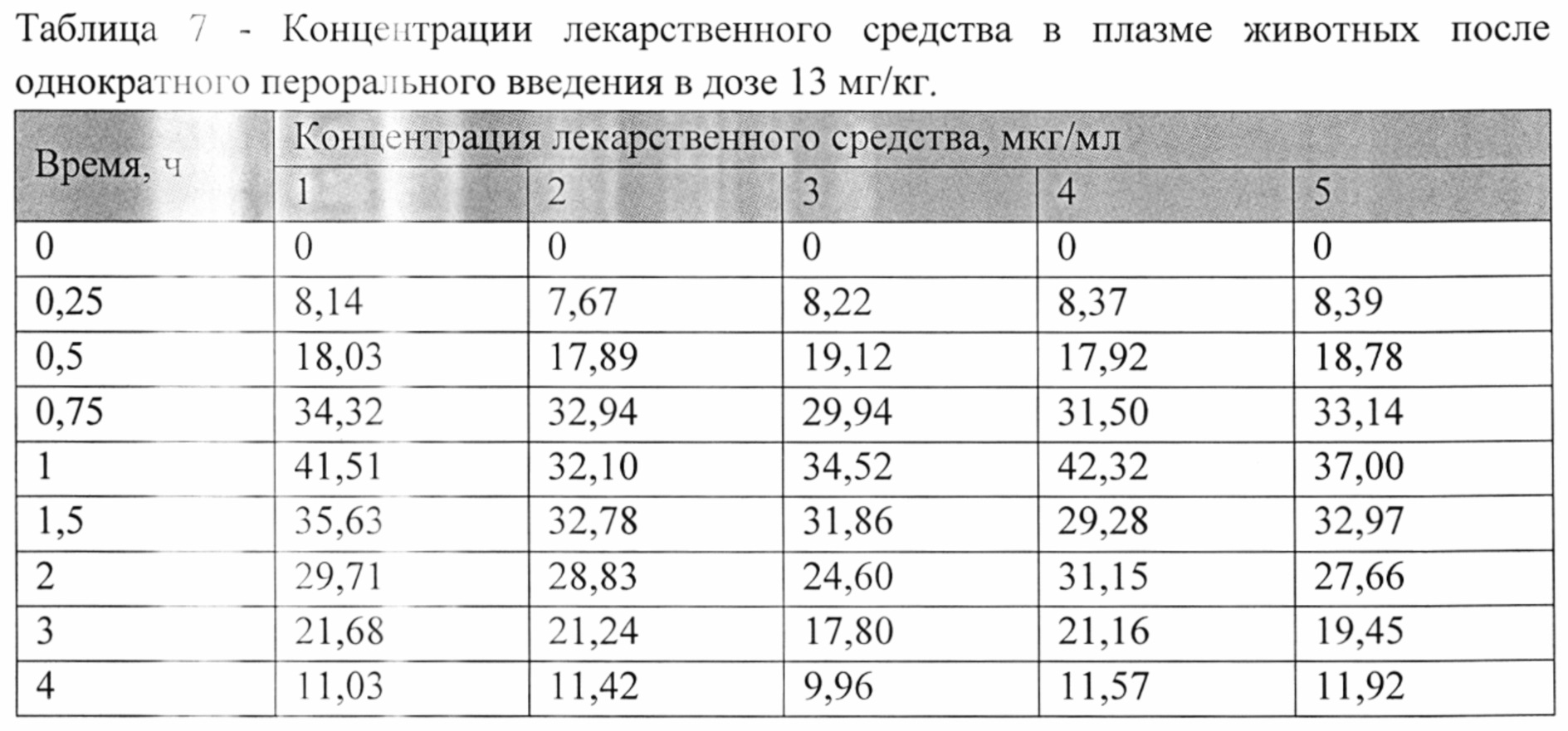
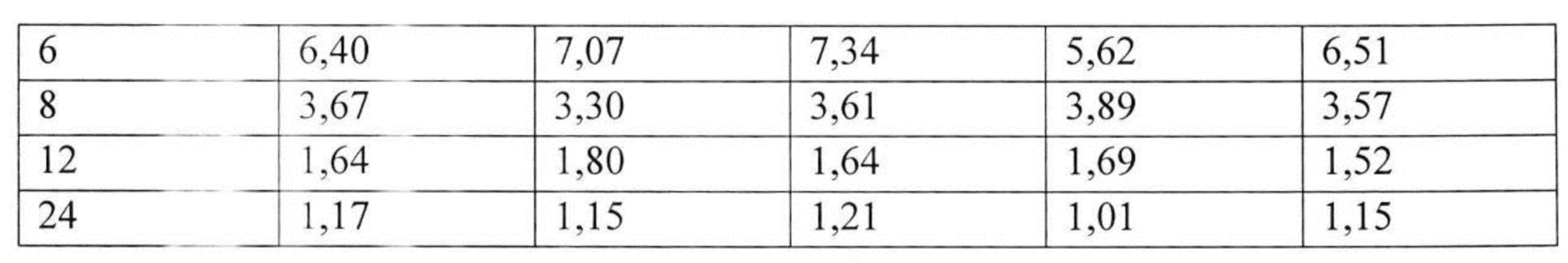
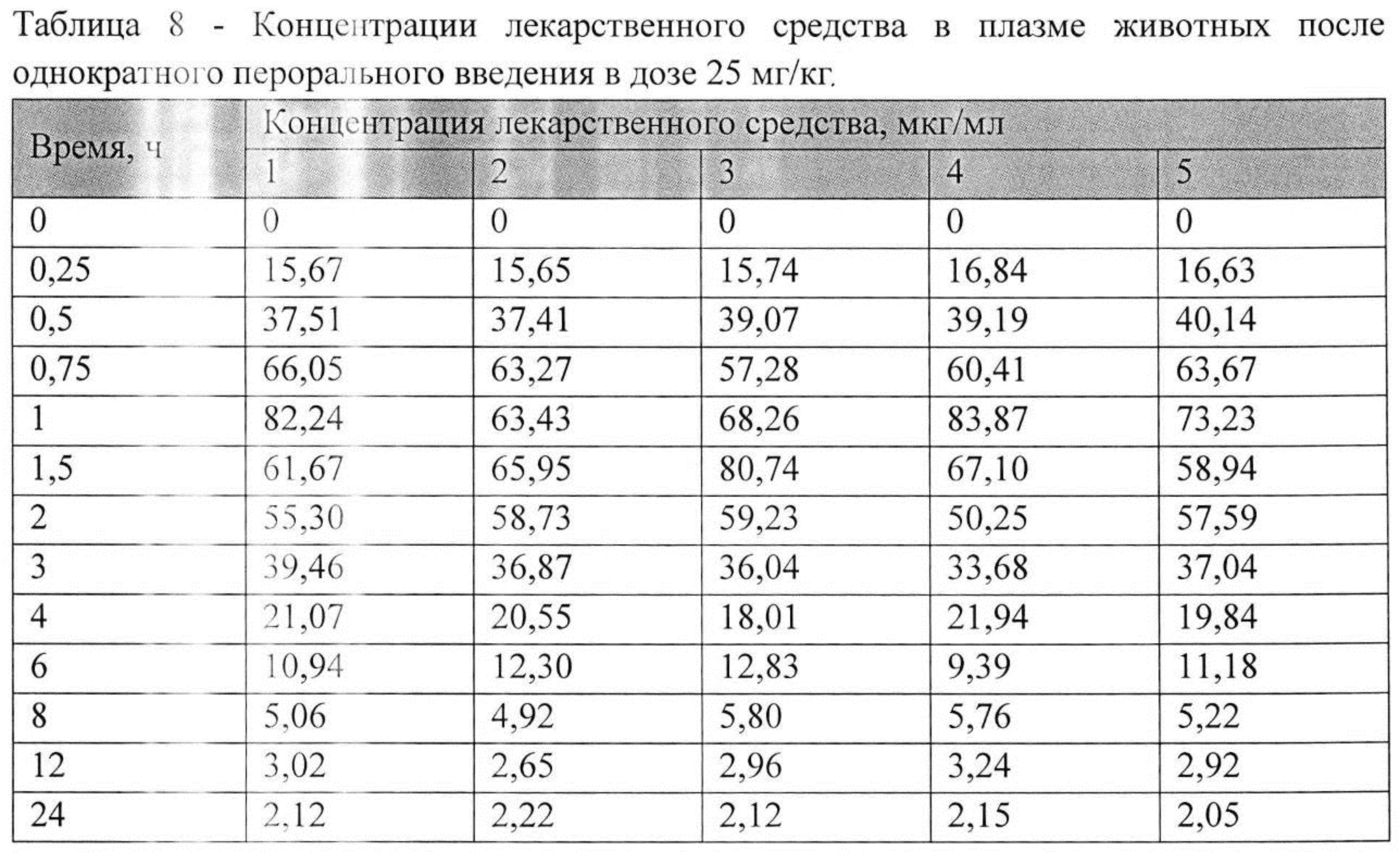
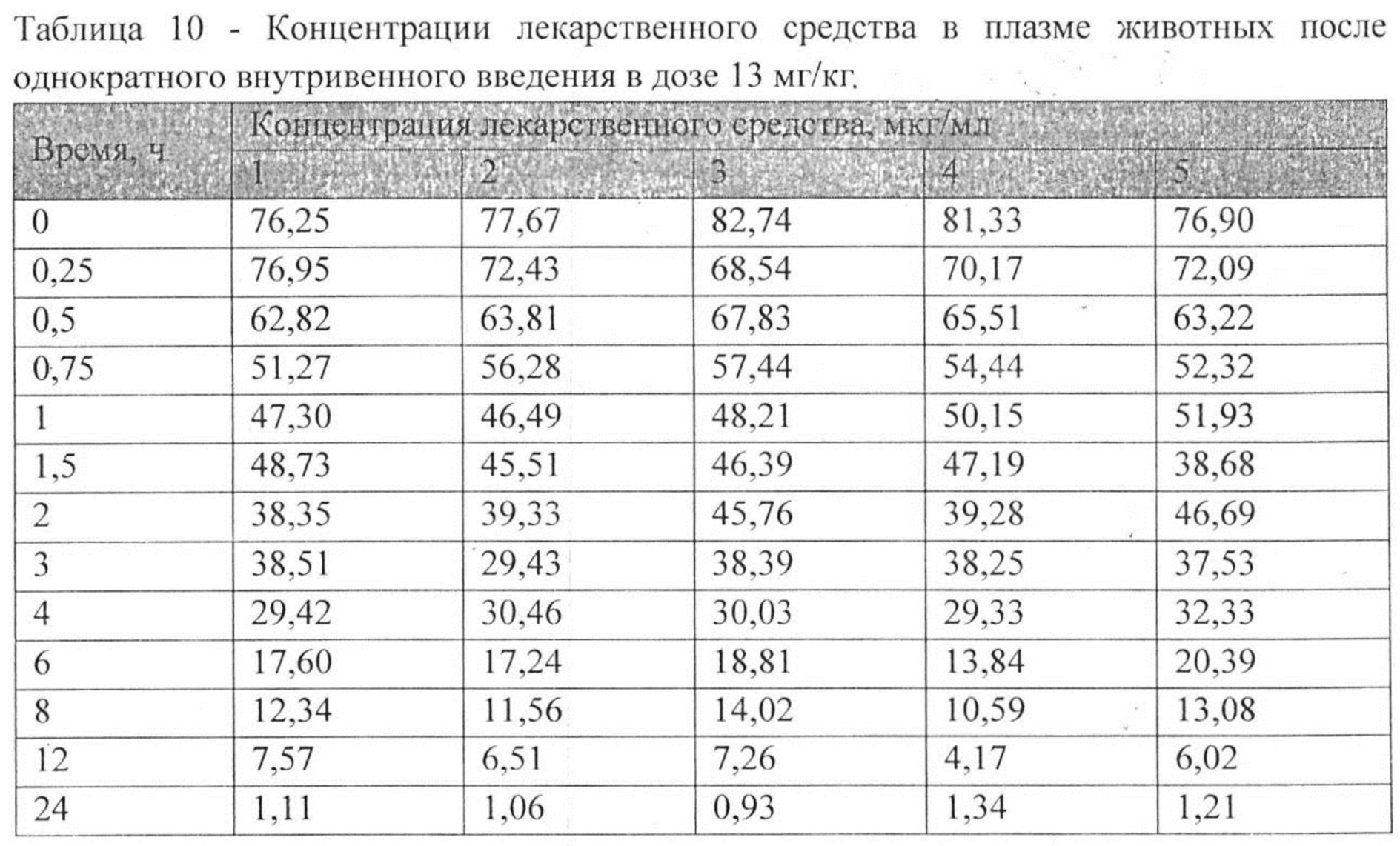
На рисунке 1 представлены экспериментальные данные по определению концентрации исследуемого лекарственного средства в образцах плазмы крови крыс в разные сроки после однократного перорального введения в дозах 2,5 мг/кг, 13 мг/кг и 25 мг/кг. Индивидуальные значения концентрации лекарственного средства в плазме после однократного перорального введения представлены в Таблицах №6-8.
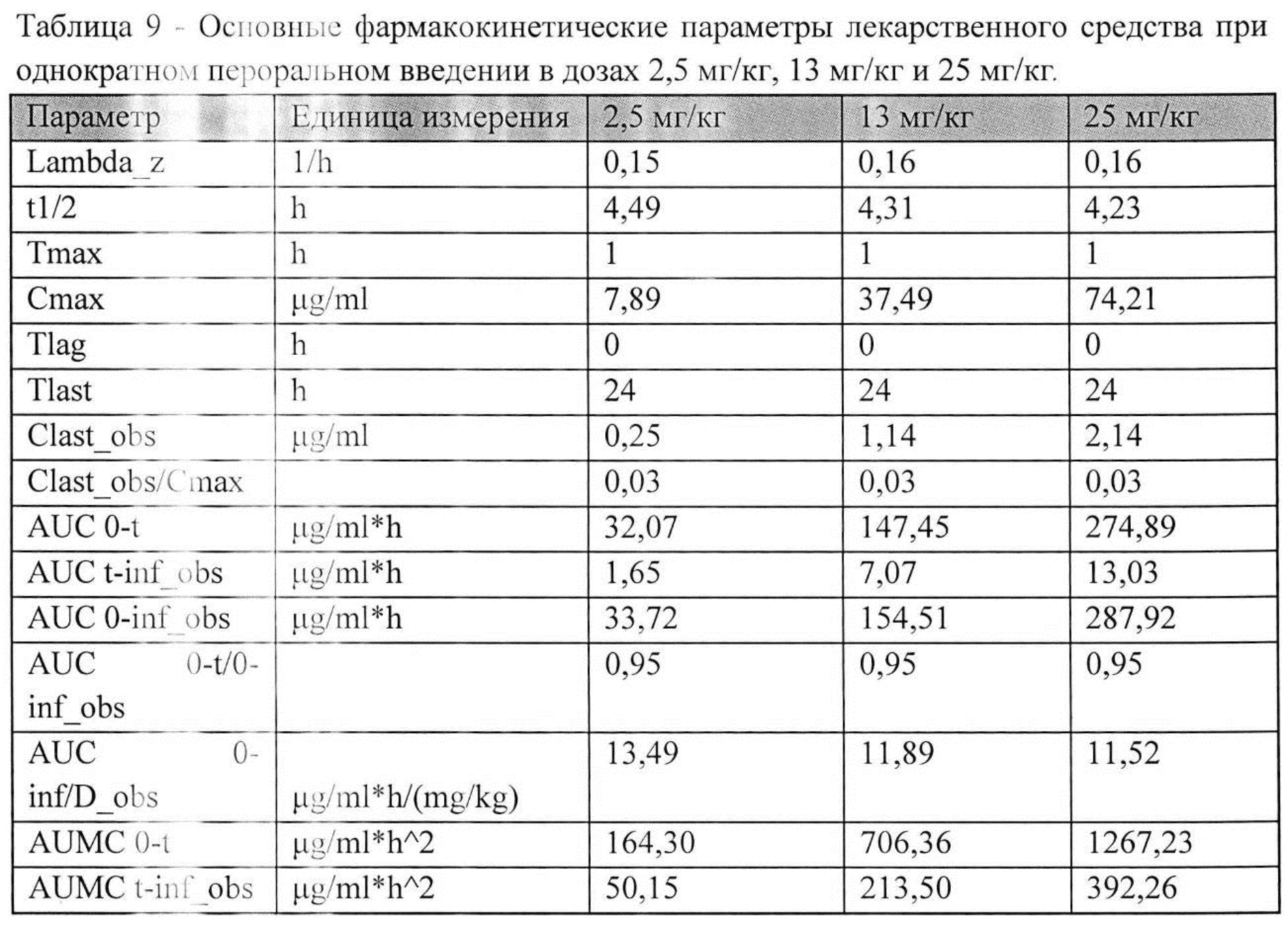
Значения фармакокинетических параметров были получены по экспериментальным данным в автоматическом режиме с использованием программы модуля PK Solver Excel (Таблица №9).
После однократного перорального введения лекарственного средства крысам в трех возрастающих дозировках 2,5 мг/кг, 13 мг/кг и 25 мг/кг изучали линейность фармакокинетики лекарственного средства. На основании полученных данных была выдвинута гипотеза линейности фармакокинетики лекарственного средства. Для проверки этой гипотезы была оценена статистическая достоверность отклонения от нуля свободного члена линейной регрессии AUC(0-t). Расчет представлен на рисунке 2. Полученные результаты показали, что свободный член незначимо отличается от нуля и гипотезу следует считать верной.
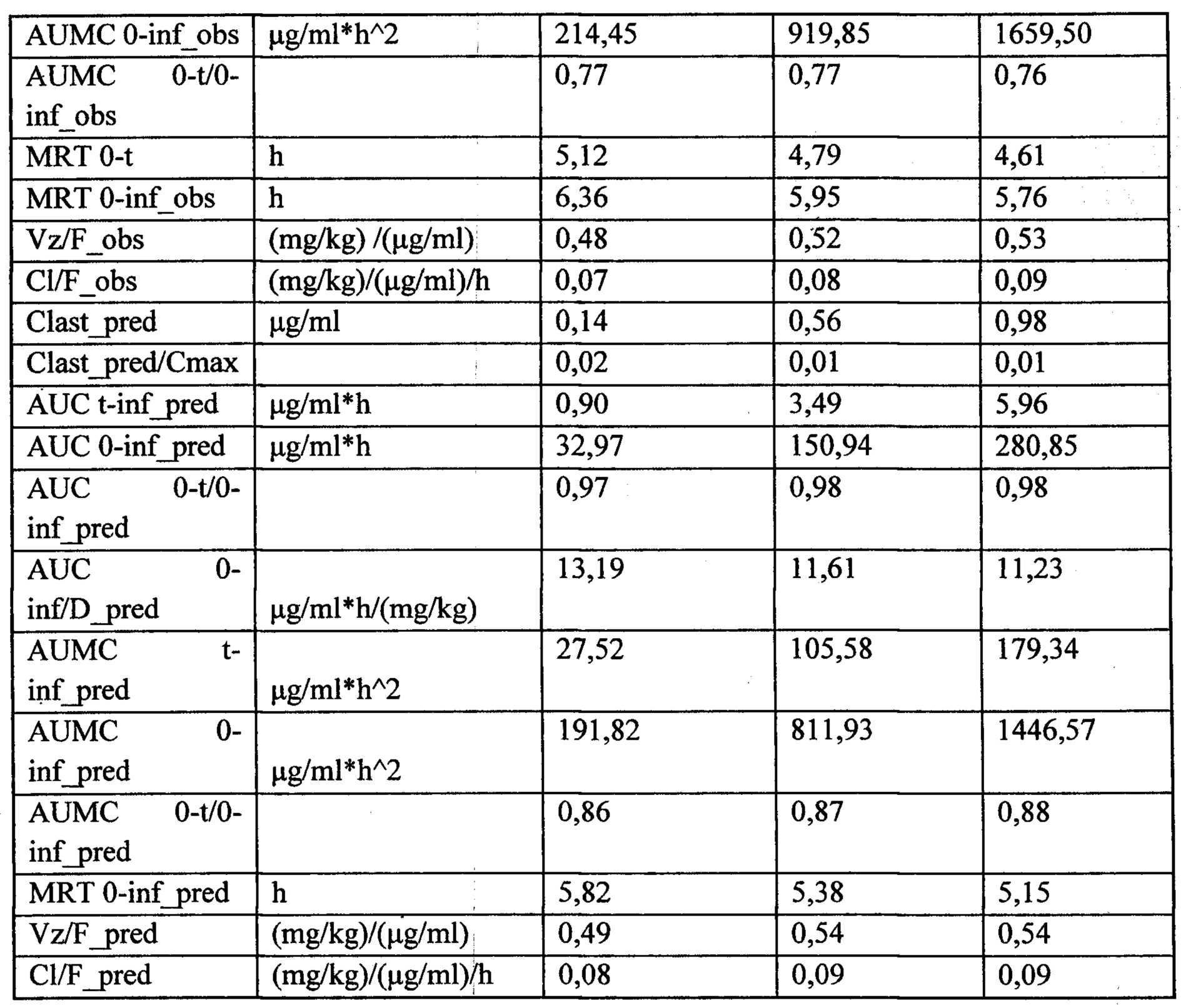
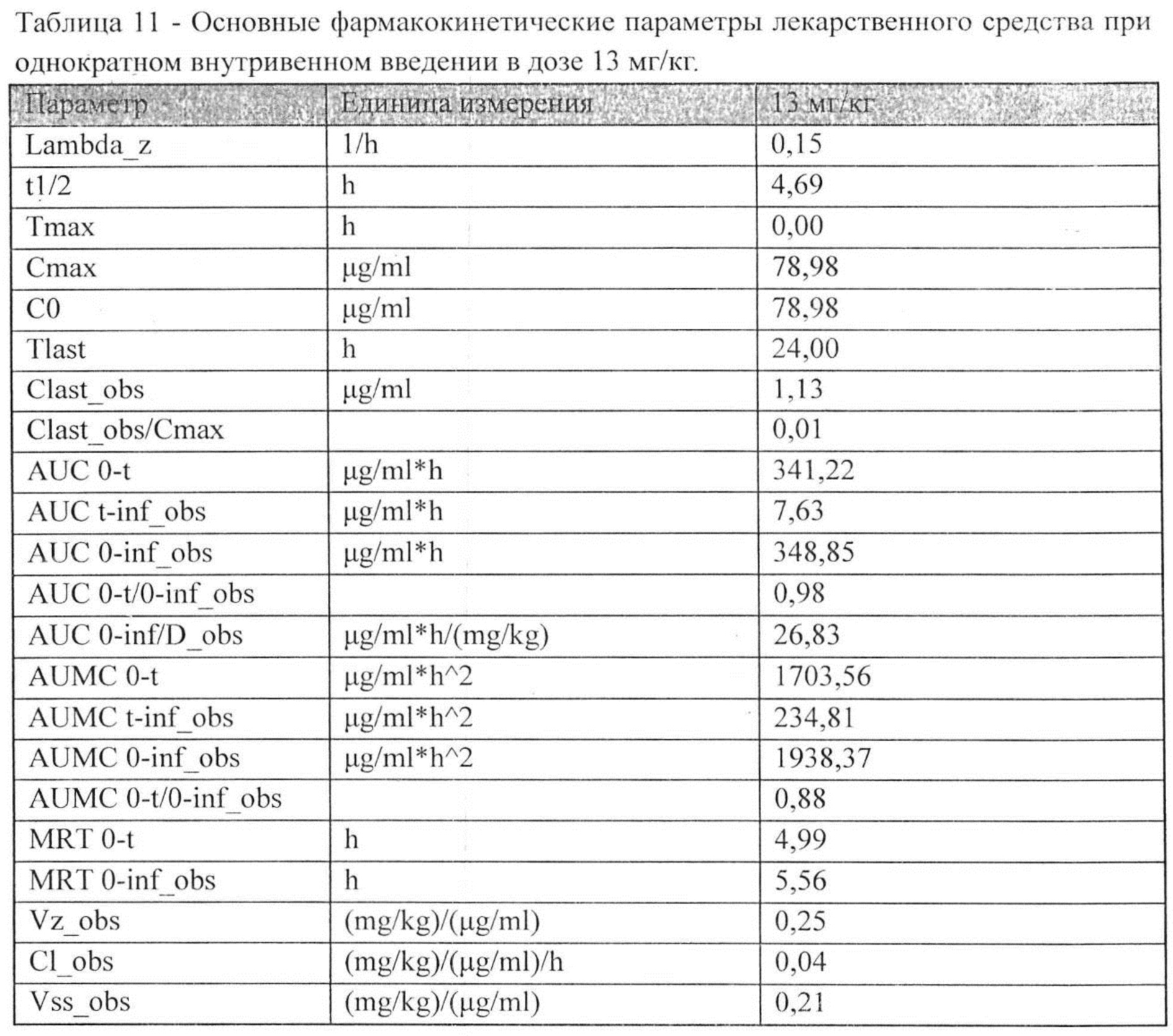
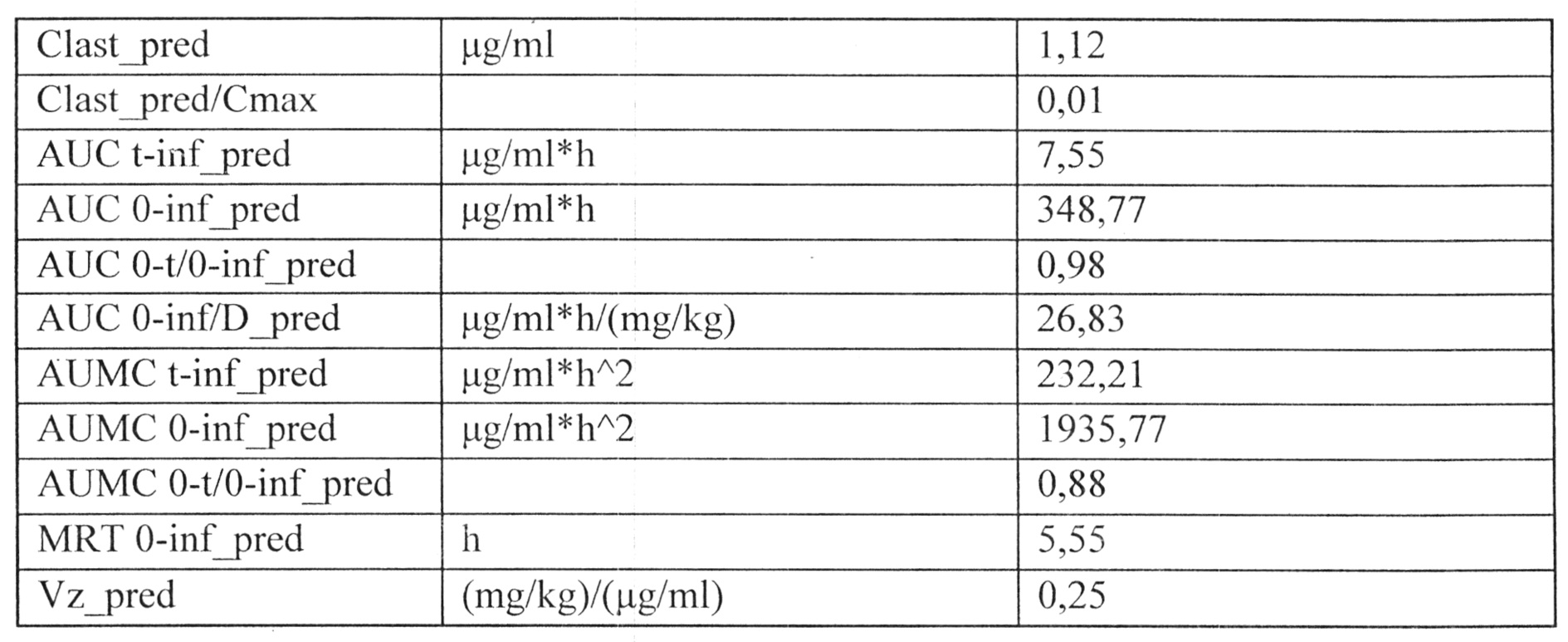
Индивидуальные значения концентрации лекарственного средства в плазме после однократного внутривенного введения представлены в Таблице №10. На рисунке 3 представлены экспериментальные данные по определению концентрации исследуемого лекарственного средства в образцах плазмы крови крыс в разные сроки после однократного внутривенного введения в дозе 13 мг/кг. Значения фармакокинетических параметров были получены по экспериментальным данным в автоматическом режиме с использованием программы модуля PK Solver Excel (Таблица №11).
Относительная биодоступность лекарственного средства при пероральном введении составила 42.3% относительно внутривенного введения данного лекарственного средства. Также проводился анализ концентраций и распределения лекарственного средства в органах животных. Основные фармакокинетические параметры лекарственного средства в органах крыс после однократного перорального введения в дозе 25 мг/кг представлены в Таблице №12.
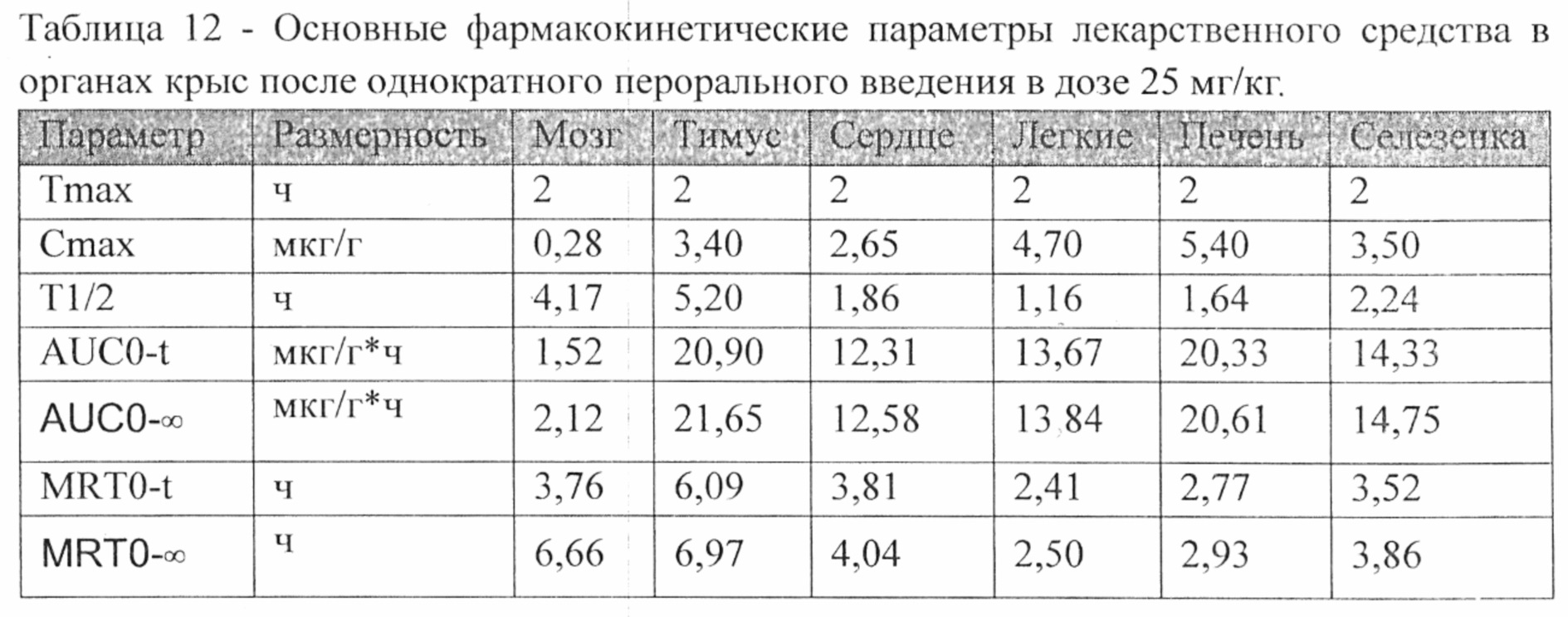
Анализ показал, что наибольшее время удерживания (MRT) лекарственного средства было в следующих органах: тимус (6,09 ч), сердце (3,81 ч) и мозг (3,76 ч). Время полужизни (Т1/2) лекарственного средства было наибольшим для следующих органов: тимус (5,20 ч), мозг (4,17 ч) и селезенка (2,24 ч).
Время полужизни (Т1/2) лекарственного средства в дозах 2,5 мг/кг, 13 мг/кг и 25 мг/кг при пероральном введении составило 4,49 ч, 4,31 ч и 4,23 ч, соответственно. Время достижения максимальной концентрации Tmax составило 1 ч для всех доз при пероральном введении. Среднее время удерживания (MRT) лекарственного средства в дозах 2,5 мг/кг, 13 мг/кг и 25 мг/кг при пероральном введении составило 5,12 ч, 4,79 ч и 4,61 ч, соответственно. Видимый общий клиренс (Cl/F_obs) лекарственного средства в дозах 2,5 мг/кг, 13 мг/кг и 25 мг/кг при пероральном введении составил 0,07 (мг/кг)/(мкг/мл)/ч, 0,08 (мг/кг)/(мкг/мл)/ч, 0,09 (мг/кг)/(мкг/мл)/ч, соответственно.
При многократном введении исследование проводилось как открытое проспективное, с включением животных в различные группы для изучения фармакокинетики и биодоступности. По результатам отбора животных, произведен последовательный набор одной группы кроликов. Всего было использовано 6 самцов кроликов.
За 18-20 часов до исследования животных лишали корма с открытым доступом к воде. Лекарственное средство растворяли в ДМСО, затем в 2% крахмальном геле, вводили перорально атравматическим зондом в объеме 5 мл в дозе 13 мг/кг. Животные получали лекарственное средство каждые 24 часа в течение 6 суток (144 часа).
Кровь забирали из центральной ушной вены по 1 мл с EDTA в следующие временные точки: 0, 0.25, 0.5, 0.75, 1, 1.5, 2, 3, 4, 6, 8, 12, 24, 25, 28, 48, 49, 52, 72, 73, 76, 96, 97, 100, 120, 120.25, 120.5, 120.75, 121, 121.5, 122, 123, 124, 126, 128, 132, 144 часов.
На одну временную точку приходилось по 6 животных. Из крови получали плазму обычным методом: центрифугирование - при 3500 об/мин при температуре 4°С и сохранение при минус 20°С в аликвотах по 1 мл.
При определении исследуемого лекарственного средства в плазме крови кроликов использовали стандартные методики известные из уровня техники среднему специалисту и аналогично ранее описанному принципу.
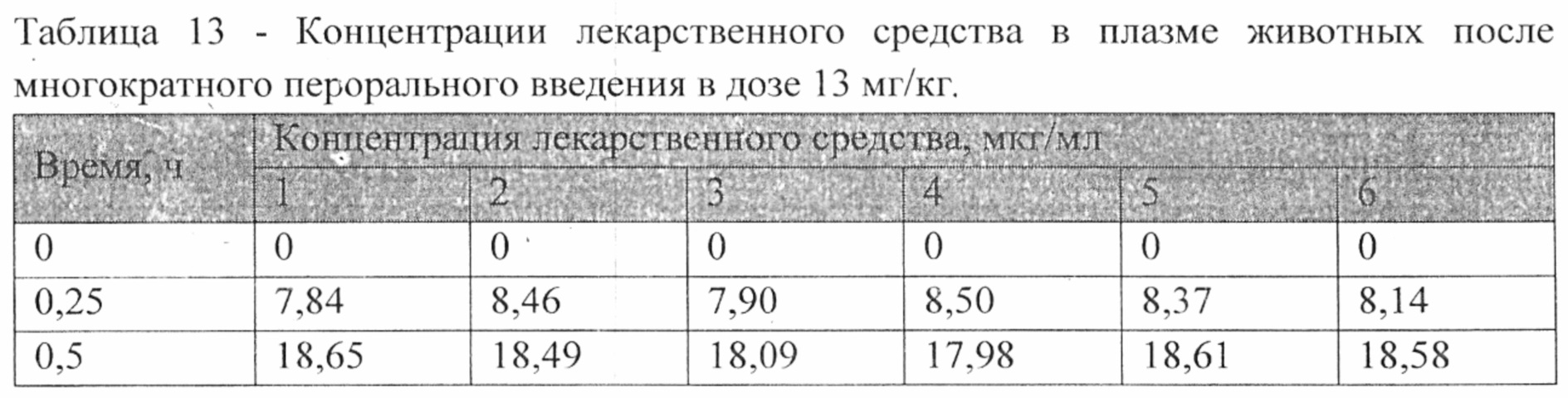
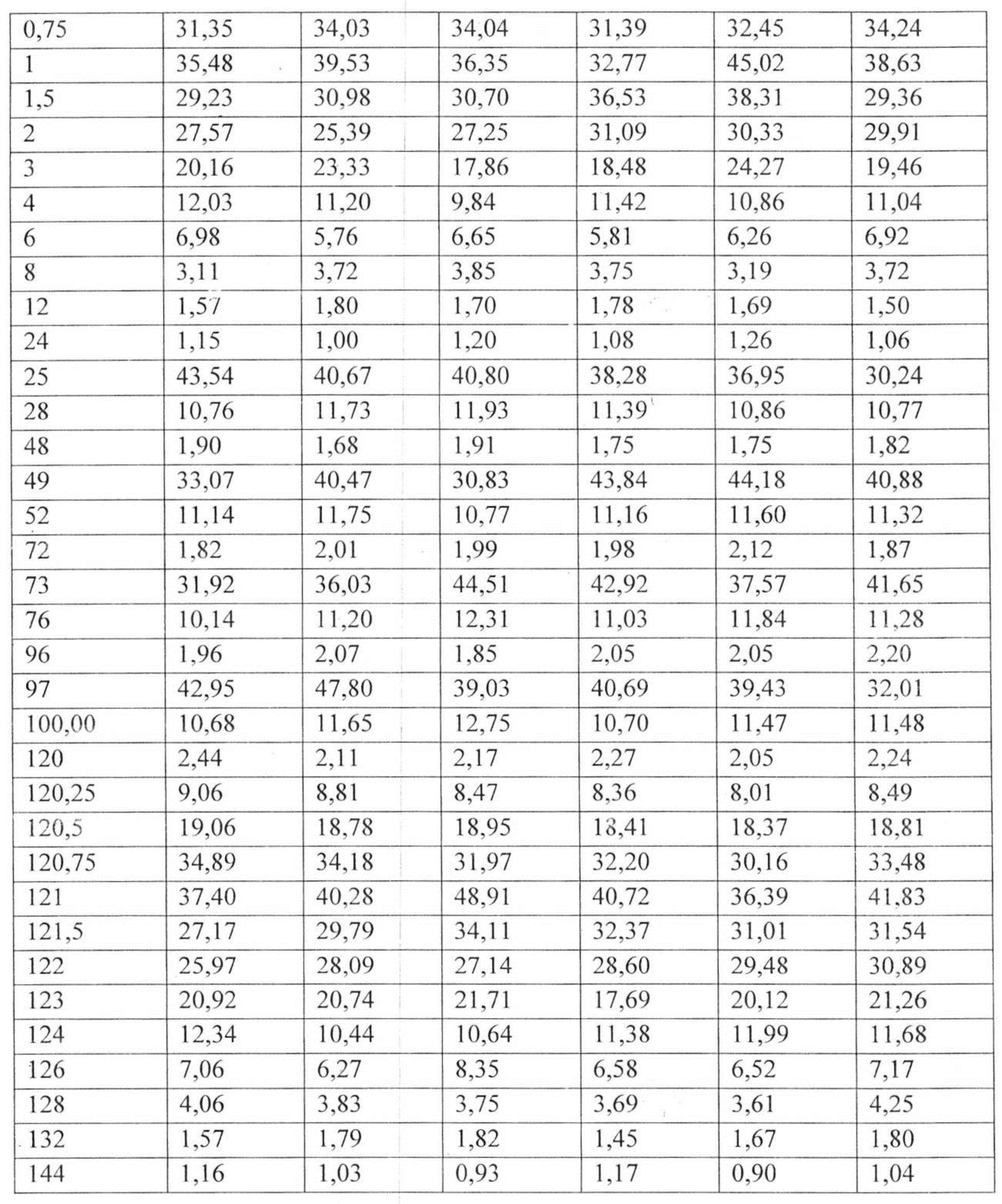
На рисунке 4 представлены экспериментальные данные по определению концентрации исследуемого лекарственного средства в образцах плазмы крови кроликов в разные сроки после многократного перорального введения в дозе 13 мг/кг.
Индивидуальные значения концентрации лекарственного средства в плазме после многократного перорального введения представлены в таблице №13. Значения фармакокинетических параметров были получены по экспериментальным данным в автоматическом режиме с использованием программы модуля PK Solver Excel (таблица №14).
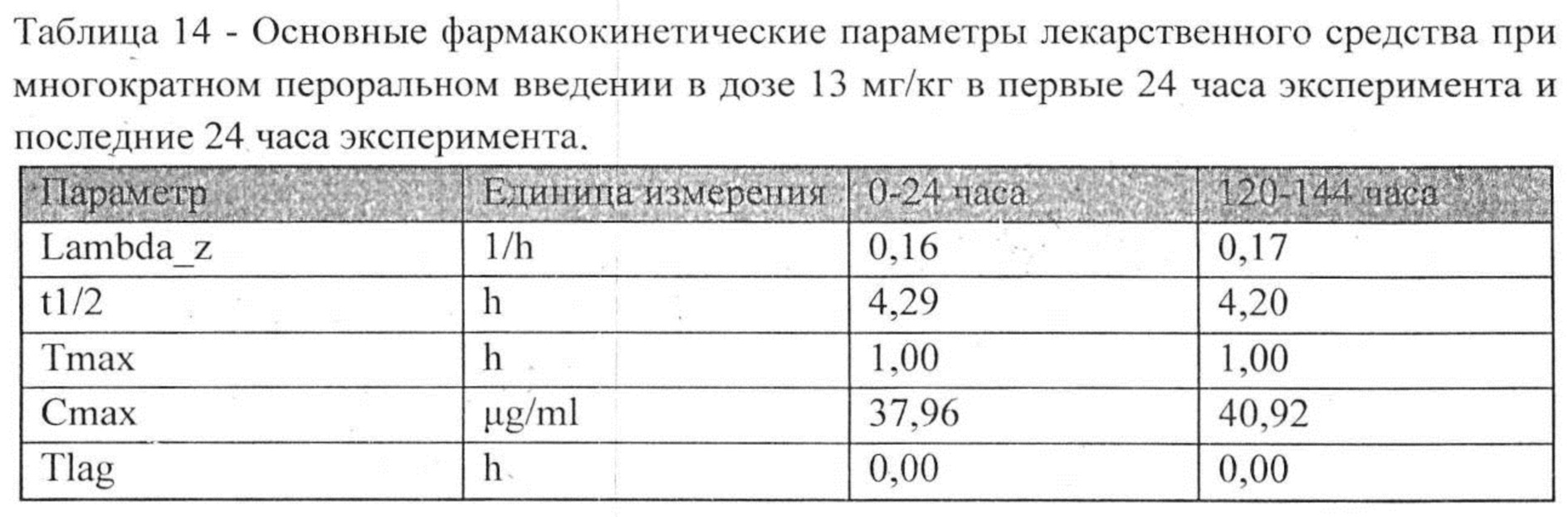
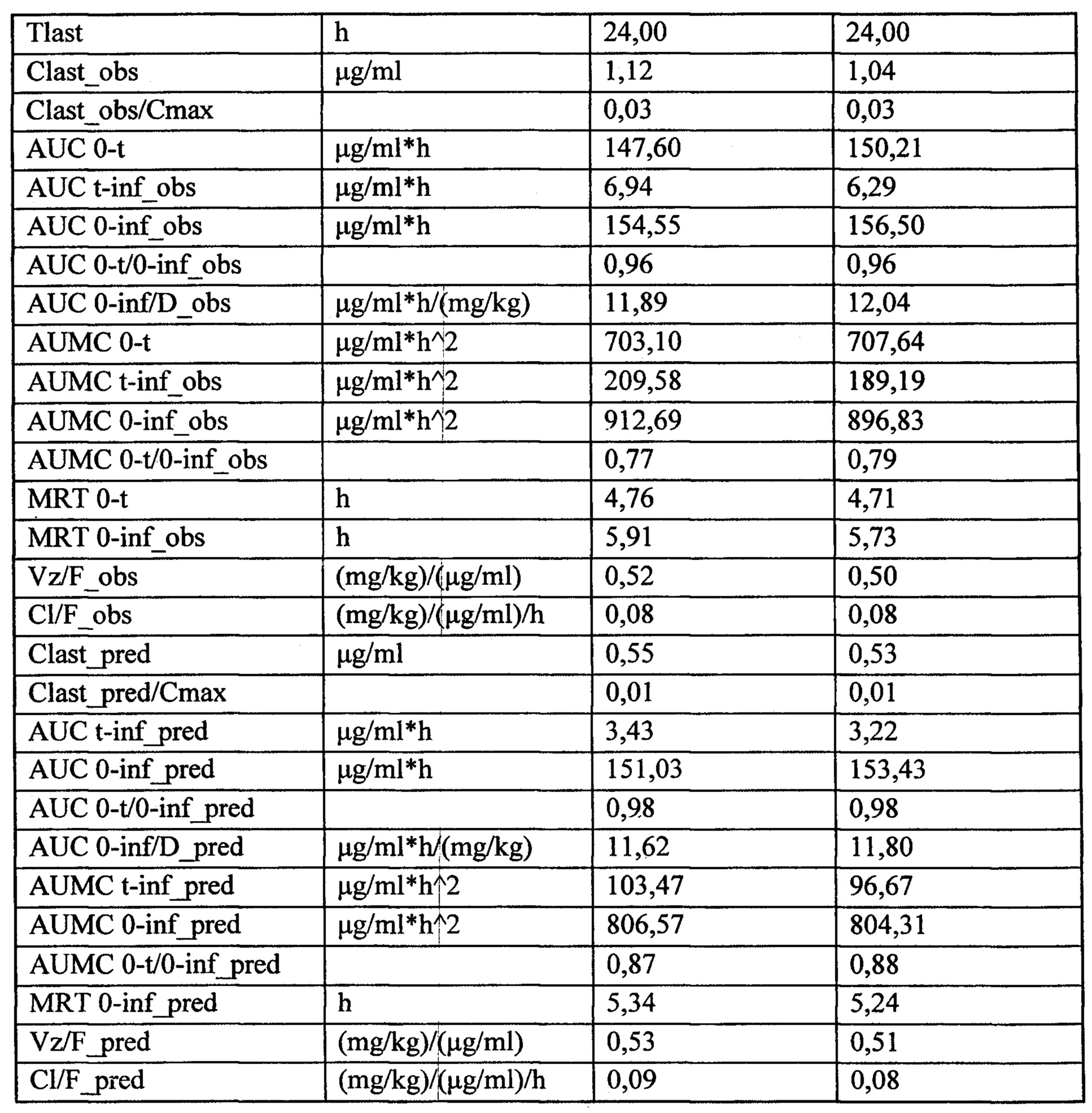
Сопоставление параметров фармакокинетики исследуемого лекарственного средства после многократного введения кроликам в дозе, 13 мг/кг с интервалом дозирования 24 часов, не показало ускорение выведения лекарственного средства из организма после многократного введения. Общий видимый клиренс не изменился, среднее время удержания (MRT) уменьшилось всего на 1,06%. Максимальная концентрация, создающаяся в плазме сразу после очередного введения, составляла 40,92 мкг/мл и достоверно не отличалась от максимальной концентрации в первые 24 часа эксперимента. Можно сделать вывод, что многократное введение лекарственного средства в дозе 13 мг/кг не влияет на его основные фармакокинетические параметры и не происходит кумуляции лекарственного средства в организме.
Пример 7. Острая и хроническая токсичность.
В экспериментах на лабораторных животных изучали острую токсичность лекарственного средства на основе производных бициклононана. В острых опытах крысам и мышам (самцам и самкам) исследуемое лекарственное средство вводили перорально в дозах 600, 1300 и 2000 мг/кг и внутрибрюшинно в дозах 600, 1300 и 2000 мг/кг.
Во всех острых опытах исследуемое лекарственное средство не вызывало ухудшение состояния животных. Спонтанная двигательная активность животных была аналогично контрольной группе. Гибель не отмечали на всех дозах у обоих видов животных. В связи с этим расчет показателей летальных доз оказался не возможен (LD50 больше 2000 мг/кг). Эксперимент по острой токсичности не позволил определить летальные дозы для исследуемого лекарственного средства.
Не было выявлено отставания в приросте массы тела животных (мыши и крысы), получивших исследуемое лекарственное средство от таковой у животных группы контроля.
В ходе исследования не было зарегистрировано отклонений в гематологических и биохимических показателях во всех исследуемых группах по отношению к контролю. Таким образом, эксперименты на мышах и крысах свидетельствуют об отсутствии токсического влияния на кроветворение и биохимию исследуемого лекарственного средства. При микроскопическом исследовании органов мышей и крыс в остром эксперименте во всех группах у животных в месте введения исследуемого лекарственного средства не наблюдалось отклонений от клинической нормы.
Слизистая и внутренности сохраняли целостность. Анализ некропсии не выявил патологические изменений внутренних органов. Результаты исследований показали, что все вводимые дозы исследуемого лекарственного средства не вызывают у животных побочные явления.
В ходе исследования хронической токсичности исследуемого лекарственного средства выявлено отсутствия влияния на динамику набора массы лабораторных животных по сравнению с контролем. Анализ полученных данных показал, что хроническое введение исследуемого лекарственного средства не снижает двигательную и познавательную активности по с равнению с животными контрольной группы на дозе 25 мг/кг. Однако на дозе 2,5 мг/кг и 13 мг/кг двигательная и познавательная активность у животных достоверно повышена, по сравнению с контролем.
Данные анализа мочи крыс и кроликов свидетельствуют об отсутствии патологических изменений почек после 30 дней введения лекарственного средства. В моче животных опытной группы (25 мг/кг - крысы и 10 мг/кг - кролики) не обнаруживаются эритроциты и белок, что указывает на целостность фильтрационного аппарата почечных нефронов. Анализ представленных данных не выявил токсического эффекта исследуемого лекарственного средства на систему крови крыс и кроликов в хроническом эксперименте. Колебания всех величин находилось в пределах физиологической нормы.
Биохимическое исследование сыворотки крови крыс и кроликов опытных групп, получивших исследуемое лекарственное средство не выявило статистически значимого изменения активности ферментов по сравнению с контрольной группой. Все значения биохимических параметров колебались в пределах физиологической нормы для данных видов животных.
Оценка уровня и характер патологических изменений внутренних органов (систем внутренних органов) экспериментальных животных (крысы, кролики) не выявил патологичных изменений.
Гистологический анализ места введения и прилежащих тканей исследуемого лекарственного средства не выявил патологических изменений. Эпителий, выстилающий пищеводную, кардиальную, фундальную и привратниковую части желудка - нормального строения. Подслизистая оболочка образована рыхлой соединительной тканью со значительным содержанием эластических волокон. Тонкий кишечник имеет 3 слоя: слизистая и подслизистая, мышечная и серозная оболочка. Слизистая оболочка тонкой кишки образует ворсинки и крипты, в ее составе бокаловидные клетки и клетки Пакета, в строме лимфоидная инфильтрация с примесью эозинофилов, подслизистая хорошо васкуляризирована. В толстом кишечнике в слизистой крипты, покрытые бокаловидными клетками, в строме более выраженные лимфоидные инфильтраты, вплоть до образования лимфоидных фолликулов. Таким образом, исследуемое лекарственное средство не обладает местно-раздражающим действием.
Фармацевтическая композиция на основе производных бициклононана не влияет на функции внутренних органов и жизненно важных систем организма; не оказывает эффекта отсроченных реакций организм и побочных токсических эффектов, которые могут возникнуть при клинической применении высоких доз лекарственного средства.
Результаты проведенных исследований на крысах показывают, что фармацевтическая композиция на основе производных бициклононана при многократном пероральном введении не обладает репродуктивной токсичностью: он не влияет на репродуктивную (генеративную) функцию самок и самцов и не оказывает эмбрио- и фетотоксического действия, регистрируемого в антенатальном и постнатальном периодах развития
Таким образом, можно заключить, что лекарственное средство не оказывает иммунотоксического действия, не ухудшает пролиферативную активность клеток-продуцентов антител, фагоцитоза, активации макрофагов - основных компонентов активного иммунного ответа. Изучение иммунологической безопасности исследуемого лекарственного средства позволяет утверждать, что в отношении иммунологической безопасности исследуемое лекарственное средство является безопасным в диапазоне испытанных доз.
В результате изучения аллергенного действия лекарственного средства на основе производных бициклононана: конъюнктивальные пробы у морских свинок - отрицательные; тест общей и активной анафилаксии - отрицательный; накожные аппликации - отрицательные. Следовательно, данное исследование показало отсутствие у испытуемого лекарственного средства аллергизирующих свойств в диапазоне испытанных доз.
Пример 8. Исследование специфической активности лекарственного средства.
В исследовании использованы пять экспериментальных групп животных, по десять самцов и десять самок е» каждой группе. Эксперименты проводили в ходе хронического введения исследуемого лекарственного средства и препарата сравнения (Пирацетам, 200 мг/кг). Лекарственное средство растворяли в ДМСО, затем в 2% крахмальном геле и вводили в объеме 2 мл крысам. Животных распределяли по группам случайным образом, используя в качестве критерия массу тела, так, чтобы индивидуальная масса животных не отличалась более чем на 10% от средней массы животных одного пола.
Влияние лекарственного средства на обучаемость в методике условного рефлекса пассивного избегания (УРПИ)
Базисной моделью для оценки влияния веществ на формирование и воспроизведение памятного следа в норме является выработка условного рефлекса пассивного избегания (УРПИ). В данном тесте использовалась установка, состоящая из двух отсеков: затемненного и освещенного, соединенных дверцей. Во время обучения животное помещалось в светлый отсек (хвостом к дверце). Как только животное переходило в темный отсек, дверца закрывалась, а в отсеке по сетчатому металлическому полу наносился по лапам электрической ток, силой 0,5 мА и длительностью 3 секунды. После дверца открывалась. Таким образом, животное обучалось не заходить в темный отсек. При воспроизведении теста замерялся латентный период - тот период, когда животное пассивно избегало темный отсек. В течение суток проводилось обучение животных. Спустя 24 часа после обручения проводился контрольный тест.
Исследование влияния лекарственного средства на процесс ввода и первоначальной обработки информации.
Для получения данных о влиянии лекарственного средства на процесс ввода и первоначальной обработки информации лекарственное средство и препарат сравнения вводились перед процедурой обучения, а проверка обученного осуществлялась через 24 ч. Животное находилось в установке 180 секунд. В качестве препарата сравнения использовался Пирацетам в дозе 200 мг/кг.
В результате статистического анализа, достоверное различие от контроля наблюдалось, как и в группе препарата сравнения, так и группах исследуемого лекарственного средства на всех дозах (р<0,05). Максимальный эффект наблюдался в группе исследуемого лекарственного средства в дозе 13 мг/кг (животные не покидали светлый отсек в течение 180 секунд), а также в группе препарата сравнения. Стоит отметить, что самцы и самки в этом тесте показали схожие результаты.
Исследование влияния лекарственного средства на процесс извлечения информации.
Для получения данных о влиянии лекарственного средства на процесс извлечения информации лекарственное средство и препарат сравнения вводились непосредственно перед воспроизведением рефлекса (через 24 часа после обучения, на 25 час проводился тест). В качестве препарата сравнения использовался Пирацетам в дозе 200 мг/кг.
В результате статистического анализа, достоверное различие от контроля наблюдалось, как и в группе препарата сравнения, так и группах исследуемого лекарственного средства на всех дозах (р<0,05). Максимальный эффект наблюдался в группе исследуемого лекарственного средства в дозе 13 мг/кг (животные не покидали светлый отсек в течение 180 секунд), а также в группе препарата сравнения. Стоит отметить, что самцы и самки в этом тесте показали схожие результаты.
Влияние лекарственного средства на обучаемость в методике условного рефлекса с положительным подкреплением
Условный пищевой рефлекс вырабатывается у животных, как правило, в Т-образном лабиринте. Крыс с пищевой депривацией в течение 48 ч помещали в стартовый отсек Т-образного лабиринта, в одном из рукавов которого помещена кормушка с пищей. Через 30 с после посадки открывали дверцу стартового отсека. Звуковой сигнал служил условным раздражителем. Регистрировалось время пробежки животного от стартового отсека до кормушки.
В течение первых суток проводилось обучение животных. После, в течение 4 суток проводились тесты. Животные получали исследуемое лекарственное средство за 1 час до воспроизведения теста. В качестве препарата сравнения использовался Пирацетам в дозе 200 мг/кг.
В результате статистического анализа, достоверное различие от контроля наблюдалось, как и в группе препарата сравнения, так и группах исследуемого лекарственного средства на всех дозах (р<0,05) во все временные промежутки. На 4 сутки теста максимальный эффект наблюдался в группе исследуемого лекарственного средства на дозе 13 мг/кг, а также в группе препарата сравнения. Достоверных различий между самками и самцами не обнаружено.
Влияние на стратегию поведения в исследовательском радиальном лабиринте.
Данный тест проводился в 3 этапа.
• 1 этап (Привыкание), 4 дня:
Были открыты 4 рукава лабиринта, в каждом лежала приманка. Экспериментальное животное помещалось в центральный отсек. Этап заканчивался, когда крыса находила все 4 приманки или через 15 минут.
• 2 этап (Обучение), 10 дней.
Были открыты 8 рукавов лабиринта, в каждом лежала приманка. Экспериментальное животное помещалось в центральный отсек. Этап заканчивался, когда крыса найдет все 8 приманок; или через 15 минут.
• 3 этап (Проверка рабочей памяти), 10 дней.
Данный этап состоял из двух частей. В первой части были открыты 4 рукава лабиринта, в каждом лежала приманка. Экспериментальное животное помещалось в центральный отсек. Первая часть 3 этапа заканчивалась, когда крыса находила все 4 приманки. После животное извлекалось из лабиринта на 5 минут. Во второй части были открыты все 8 рукавов лабиринта, приманка лежала в 4 рукавах, которые были закрыты в первой части 3 этапа. Этап заканчивался, когда крыса находила все 4 приманки или через 15 минут. Каждый повторный заход в рукав, где находилась приманка в 1 части 3 этапа, засчитывался за ошибку. Результаты рассчитывались по следующей формуле:
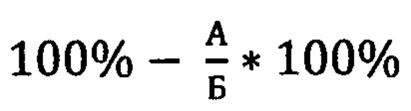
где А - количество ошибок, Б - общее число заходов в рукава.
Все группы животных получали исследуемое лекарственное средство и препарат сравнения в течение 14 суток, во время 1 и 2 этапов, перорально. Животные получали исследуемое лекарственное средство за 1 час до воспроизведения теста на 3 этапе. В качестве препарата сравнения использовался Пирацетам в дозе 200 мг/кг.
В результате статистического анализа, достоверное различие от контроля наблюдалось, как и в группе препарата сравнения, так и группах исследуемого лекарственного средства на всех дозах (р<0,05) во все временные промежутки. В группах исследуемого лекарственного средства и препарата сравнения видна положительная динамика, животные к 10 суткам тестирования достоверно меньше ошибались по сравнению с контролем и по сравнению с начальными временными точками 3 этапа. Максимальный эффект (животные меньше всего ошибались) наблюдался в группе исследуемого лекарственного средства в дозе 13 мг/кг, а также в группе препарата сравнения. Достоверных различий между самками и самцами не обнаружено.
Распознавание новых объектов в процессе исследовательского поведения.
Тест открытое поле проводился в 2 этапа. На 1 этапе на площадку открытого поля помещались 2 одинаковых предмета. Животное помещалось в центр арены на 3 минуты. На 2 этапе (через 24 часа) один из объектов заменялся, животное помещалось на арену на 3 минуты. Рассчитывался индекс распознавания, как отношение времени, проведенного около старого предмета ко времени, которое животное провело около нового предмета. Все группы животных получали исследуемое лекарственное средство и препарат сравнения в течение 7 суток, перорально. На 8 сутки животные получали фармацевтическую композицию за 1 час до начала 1 этапа. На 9 сутки животные получали фармацевтическую композицию за 1 час до начала 2 этапа.
В результате статистического анализа, достоверное различие от контроля наблюдалось только в группах исследуемого лекарственного средства на всех дозах (р<0,05). Наибольший индекс наблюдался в группах исследуемого лекарственного средства в дозах 2,5 и 13 мг/кг. Достоверных различий между самками и самцами не обнаружено.
Тест крестообразный лабиринт проводился в 2 этапа. На 1 этапе в два рукава крестообразного лабиринта напротив друг друга помещались 2 одинаковых предмета. Животное помещалось в центр лабиринта на 3 минуты. На 2 этапе (через 24 часа) один из объектов заменялся, животное помещалось в лабиринт на 3 минуты. Рассчитывался индекс распознавания, как отношение времени, проведенного около старого предмета ко времени, которое животное провело около нового предмета. Животные получали лекарственное средство и препарат сравнения (Пирацетам, 200 мг/кг) за 1 час до начала 1 этапа. На 9 сутки животные получали фармацевтическую композицию и Пирацетам за 1 час до начала 2 этапа.
В результате статистического анализа, достоверное различие от контроля наблюдалось как в группах исследуемого лекарственного средства на всех дозах, так и в группе препарата сравнения (р<0,05). Наибольший индекс распознавания наблюдался в группах исследуемого лекарственного средства в дозах 2,5 и 13 мг/кг. Достоверных различий между самками и самцами не обнаружено.
Водный лабиринт Морриса.
Водный лабиринт Морриса представлял собой циркулярный бассейн (диаметром 150 см), заполненный непрозрачной водой, в которую погружена небольшая платформа (диаметром 10 см), не видимая животному (крысе).
Протокол теста состоял из пяти сеансов обучения, по пять попыток в каждом. Сеансы проводились в одно и то же время суток через 24 часа. Животные помещались с края бассейна. Максимальная длительность первого сеанса составляла 90 с. В том случае, если животное не могло самостоятельно найти платформу, экспериментатор помогал животному. После обнаружения платформы, животное находилось на ней 30 с. Последующие 4 сеанса по продолжительности составляли 60 с. В случае не обнаружения платформы, животное вынималось из бассейна и находилось за границами лабиринта в течение 30 с. Расположение платформы за все время проведения теста не менялось и находилось в противоположном от запуска животного секторе на границе зоны тигмотаксиса. Регистрировалось время, за которое животное находило платформу и взбиралось на нее.
Перед каждым сеансом обучения, животные получали исследуемую фармацевтическую композицию и препарат сравнения (Пирацетам, 200 мг/кг) за 1 час до теста.
В результате статистического анализа, достоверное различие от контроля наблюдалось в группах исследуемого лекарственного средства на 5 сеанс в дозе 2,5 мг/кг и на 4 и 5 сеансы в дозе 13 мг/кг. Достоверных различий между самками и самцами не обнаружено.
Изучение противогипоксических свойств лекарственного средства.
Окклюзию средней мозговой артерии (ОСМА) проводили у наркотизированных («золетил 100», внутримышечно) крыс. В месте шва скуловой кости с лобной делалось отверстие диаметром около двух миллиметров, для того, что увидеть место пересечения средней мозговой артерии с нижней мозговой веной. Под микроскопом под левую среднюю мозговую артерию подводился специальный металлический крючок. С помощью коагулятора производилась окклюзия средней мозговой артерии проксимальнее места ее бифуркации на фронтальную и париетальную ветви. В поле зрения микроскопа наблюдали прекращение тока крови по средней мозговой артерии выше места окклюзии. Все хирургические операции проводились в стерильных условиях.
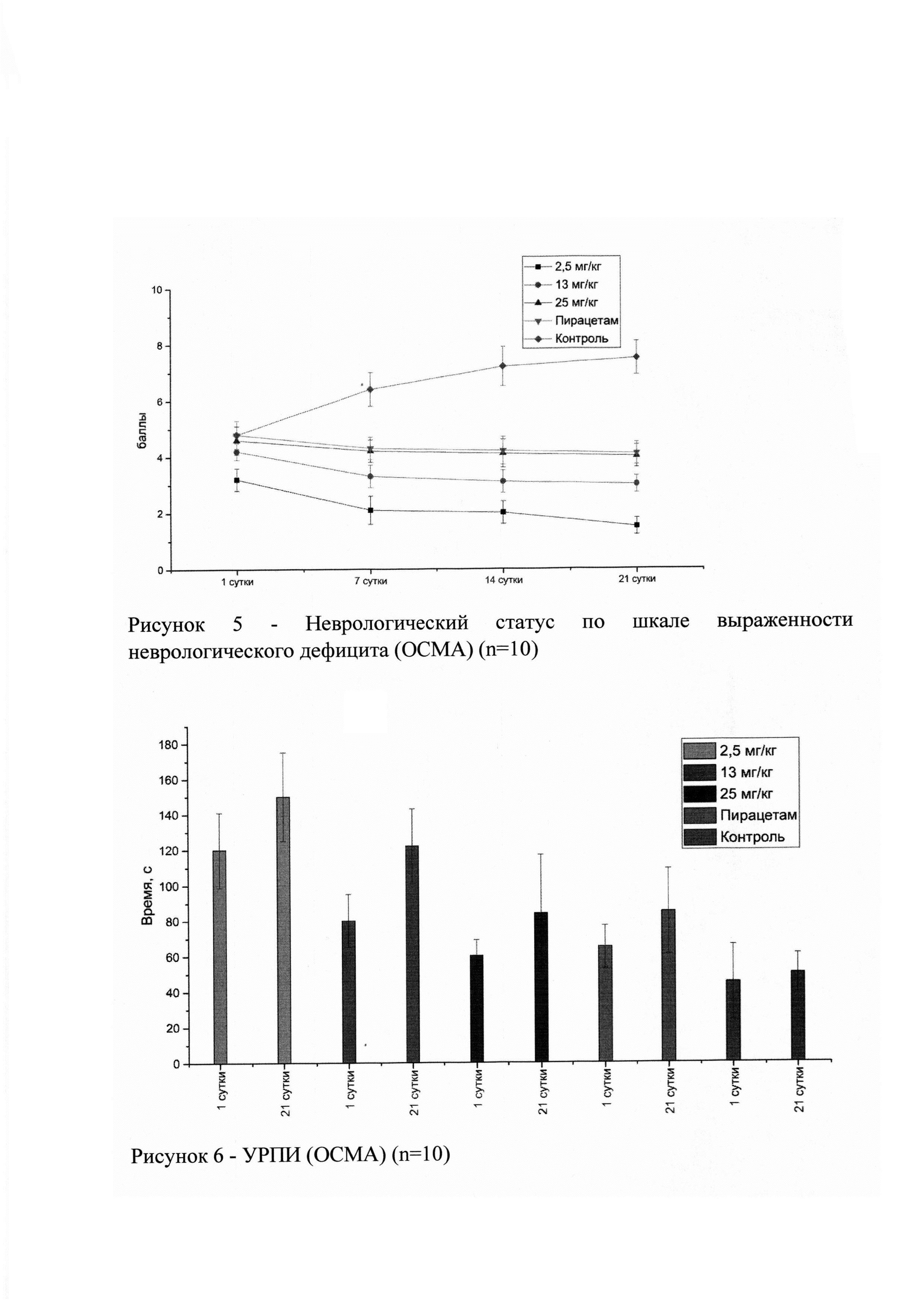
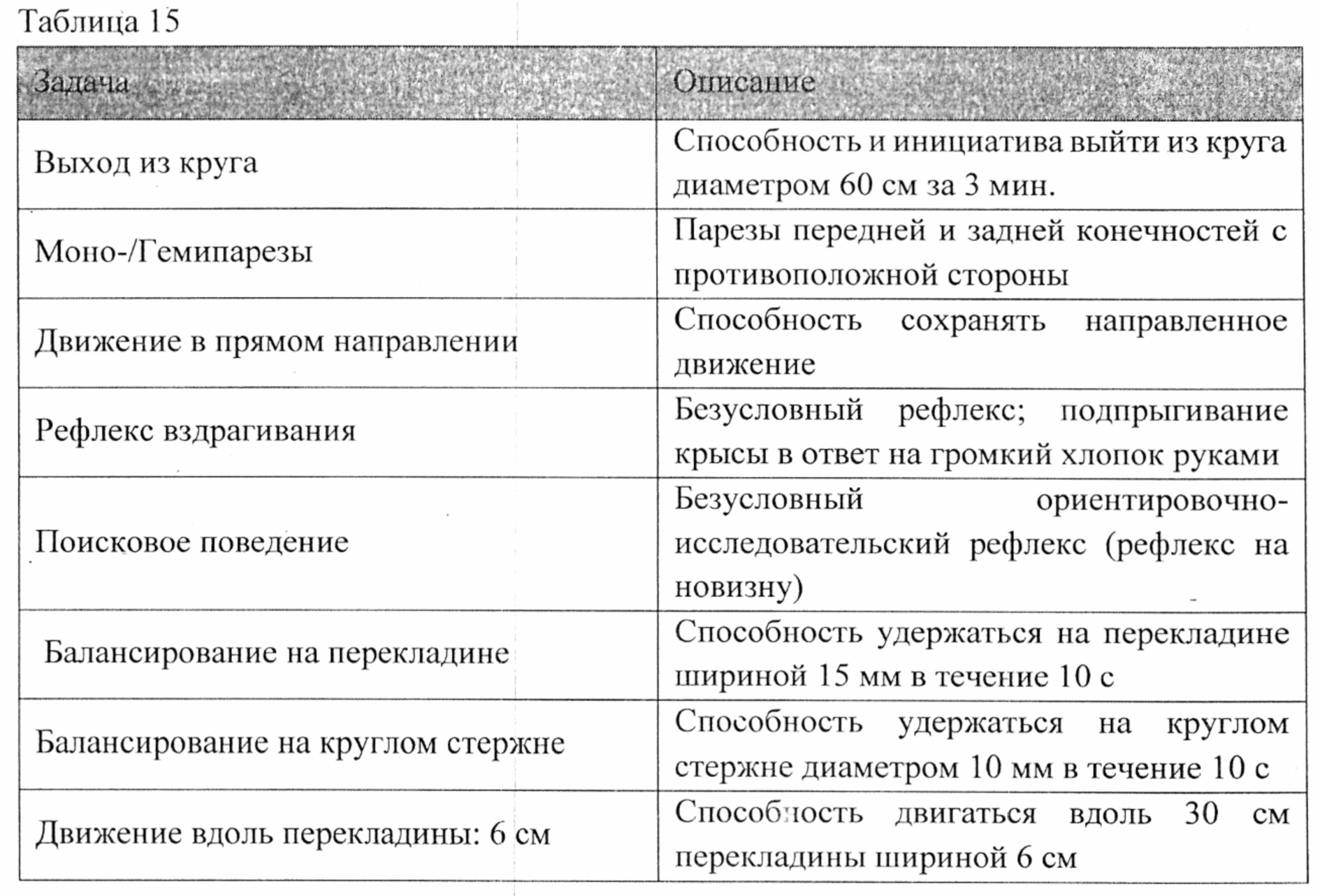
Исследуемое лекарственное средство и препарат сравнения Пирацетам (200 мг/кг) вводились крысам через 4 часа после операции и затем через каждые 24 часа в течение 21 суток. За 2 часа до операции животных обучали условной реакции пассивного избегания (УРПИ). Рефлекс воспроизводился на 1 и 21 сутки после операции. Также критерием эффективности лекарственного средства служил неврологический статус по шкале выраженности неврологического дефицита (NSS). Данный тест оценивает способность животного выполнять 10 различных задач (таблица №15), которые оценивают базовые рефлексы, а также способность к движению и сохранению равновесия. Один балл присваивается за невыполнение задачи, таким образом, нормальное здоровое животное должно иметь 0 баллов по всем пунктам шкалы. Неврологический статус определяли у животных на 1, 7, 14 и 21 сутки после операции.
Интерпретация результатов:
От 7 до 10 баллов - выраженное повреждение ЦНС;
От 4 до 6 баллов - умеренное повреждение ЦНС;
От 1 до 3 баллов - легкое повреждение ЦНС;
На рисунке 5 представлен неврологический статус животных в динамике, у которых моделировали обратимую окклюзию средней мозговой артерии.
В результате статистического анализа, достоверное различие от контроля наблюдалось, как и в группе препарата сравнения, так и группах исследуемого лекарственного средства на всех дозах (р<0,05) к 21 суткам. Максимальный эффект (наименьший неврологический статус) наблюдался в группе исследуемого лекарственного средства в дозе 2,5 мг/кг. Достоверных различий между самками и самцами не обнаружено.
На рисунке 6 представлены результаты теста УРПИ в разные временные точки (1 и 21 сутки). Во всех группах видна положительная динамика (к 21 суткам латентное время во всех группах увеличено). Максимальный эффект (наибольшее латентное время) наблюдался в группе исследуемого лекарственного средства в дозе 2,5 мг/кг. Достоверных различий между самками и самцами не обнаружено.
Пример 9. Фотоиндуцированный тромбоз.
Для воспроизведения одностороннего фотохимического повреждения коры головного мозга крысы голову животного, находившуюся под наркозом (золетил, внутримышечно), фиксировали в головодержателе стереотаксического прибора SR-5R фирмы «Narishige» (Япония). Односторонний фокальный ишемический очаг в префронтальной (поля Fr1 и Fr2) коре головного мозга крыс по атласу G. Paxinos and С. Watson создавали методом фотохимического тромбоза.
Фотохимический тромбоз достигается с помощью лазера TTG001-100 светимостью 100 млВ/см2. Луч света 532 нм подводили к поверхности черепа на расстоянии 0,5 см. Непосредственно перед облучением, наркотизированным животным вводили внутривенно (в яремную вену) 3% раствор фоточувствительного красителя «Бенгальский розовый» в дозе 40 мг/кг. Время световой экспозиции составляло 15 минут. В результате взаимодействия флуоресцентного красителя со световым лучом выделяется свободный кислород, который повреждает эндотелий сосудов, что ведет к адгезии и агрегации тромбоцитов, образованию тромбов и нарушению локального кровотока. Ложная операция производилась по той же схеме, за исключением внутривенного введения красителя «Бенгальский розовый». Все хирургические операции проводились в стерильных условиях.
Исследуемое лекарственное средство и препарат сравнения Пирацетам (200 мг/кг) вводились крысам через 4 часа после операции и затем через каждые 24 часа в течение 21 суток. За 2 часа до операции животных обучали условной реакции пассивного избегания (УРПИ). Рефлекс воспроизводился на 1 и 21 сутки после операции. Также критерием эффективности лекарственного средства служил неврологический статус по шкале выраженности неврологического дефицита (NSS). Неврологический статус определяли у животных на 1, 7, 14 и 21 сутки после операции.
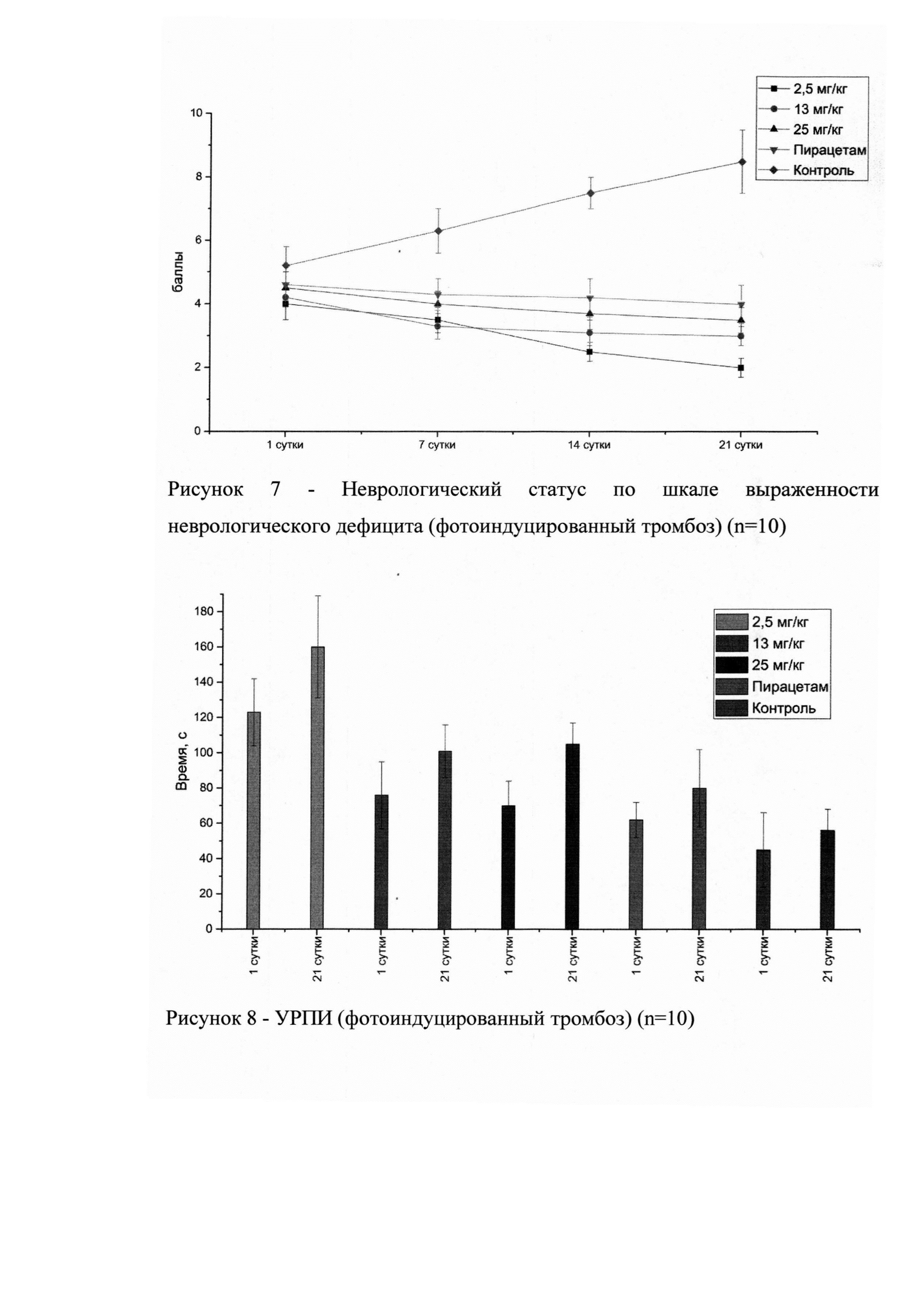
На рисунке 7 представлен неврологический статус животных в динамике, у которых моделировали, фокальный ишемический очаг методом фотохимического тромбоза.
В результате статистического анализа, достоверное различие от контроля наблюдалось, как и в группе препарата сравнения, так и группах исследуемого лекарственного средства на всех дозах (р<0,05) к 21 суткам. Максимальный эффект (наименьший неврологический статус) наблюдался в группе исследуемого лекарственного средства в дозе 2,5 мг/кг. Достоверных различий между самками и самцами не обнаружено.
На рисунке 8 представлены результаты теста УРПИ в разные временные точки (1 и 21 сутки). Во всех группах видна положительная динамика (к 21 суткам латентное время во всех группах увеличено). Максимальный эффект (наибольшее латентное время) наблюдался в группе исследуемого лекарственного средства в дозе 2,5 мг/кг. Достоверных различий между самками и самцами не обнаружено.
Пример 10. Глобальная ишемия мозга.
Глобальная ишемия головного мозга осуществлялась полной перевязкой обеих сонных артерий. Известно, что после перевязки у крыс двух каротидных артерий давление крови в виллизиевом круге мозга падает до 40 мм рт. ст. Развивающаяся ишемия сопровождается массовой адгезией лейкоцитов к стенкам мозговых венул и мельчайших вен. Через два часа после перевязки давление крови в сосудах виллизиевого круга падает до 16-20 мм рт. ст. Количество актов адгезии резко возрастает» В указанных сосудах образуются лейкоцитарные конгломераты, которые вызывают полную окклюзию сосудов и гибель животных. Для моделирования глобальной ишемии мозга делали следующее:
• Провели анестезию («золетил 100», внутримышечно)
• Сделали продольный разрез в области шеи (2-3 см)
• Выделили левую и правую общие сонные артерии
• Провели электрическую коагуляцию ветвей общей сонной артерии
• Лигировали левую и правую общие сонные артерии.
Исследуемое лекарственное средство и препарат сравнения Пирацетам вводились крысам через 4 часа после операции и затем через каждые 24 часа в течение 21 суток. За 2 часа до операции животных обучали условной реакции пассивного избегания (УРПИ). Рефлекс воспроизводился на 1 и 21 сутки после операции. Также критерием эффективности лекарственного средства служил неврологический статус по шкале выраженности неврологического дефицита (NSS). Неврологический статус определяли у животных на 1, 7, 14 и 21 сутки после операции.
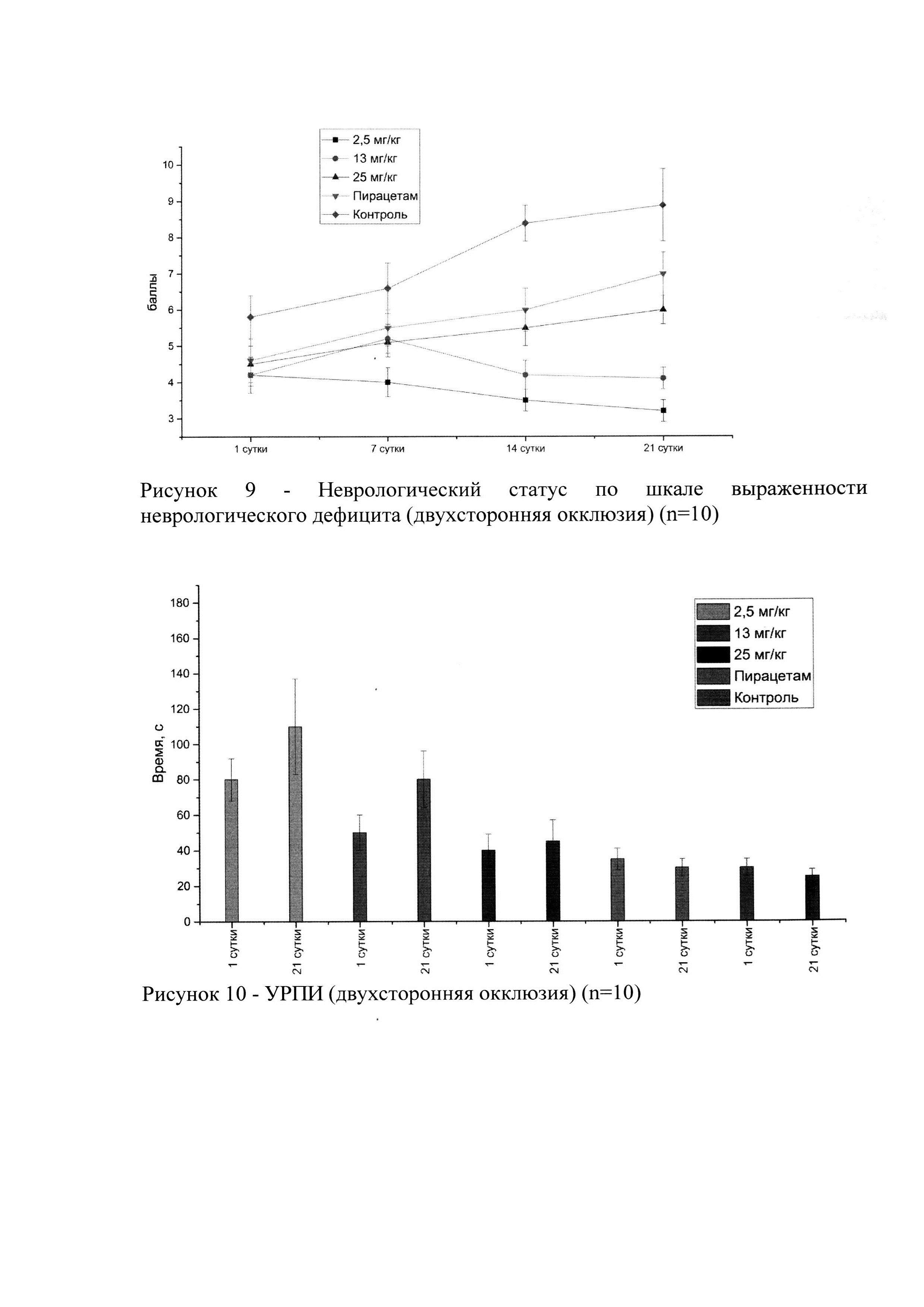
На рисунке 9 представлен неврологический статус животных в динамике, у которых моделировали ишемию мозга путем двухсторонней окклюзии сонных артерий.
В результате статистического анализа, достоверное различие от контроля наблюдалось, как и в группе препарата сравнения, так и группах исследуемого лекарственного средства на всех дозах (р<0,05) к 21 суткам. Максимальный эффект (наименьший неврологический статус) наблюдался в группе исследуемого лекарственного средства в дозе 2,5 мг/кг. Достоверных различий между самками и самцами не обнаружено.
На рисунке 10 представлены результаты теста УРПИ в разные временные точки (1 и 21 сутки). Положительная динамика видна только в группах исследуемого лекарственного средства (к 21 суткам латентное время увеличено). Максимальный эффект (наибольшее латентное время) наблюдался в группе исследуемого лекарственного средства в дозе 2,5 мг/кг. Достоверных различий между самками и самцами не обнаружено.
Моделирование глобальной ишемии мозга путем двухсторонней окклюзии/реперфузии сонных артерий крыс.
Для создания реперфузионной модели ишемического повреждения на обе общие сонные артерии на 1 ч накладывались клипсы, после чего кровоток по общим сонным артериям восстанавливали, добиваясь реперфузии.
Исследуемое лекарственное средство и препарат сравнения Пирацетам вводились крысам через 4 часа после операции и затем через каждые 24 часа в течение 21 суток. За 2 часа до операции животных обучали условной реакции пассивного избегания (УРПИ). Рефлекс воспроизводился на 1 и 21 сутки после операции. Также критерием эффективности препарата служил неврологический статус по шкале выраженности неврологического дефицита (NSS). Неврологический статус определяли у животных на 1, 7, 14 и 21 сутки после операции.
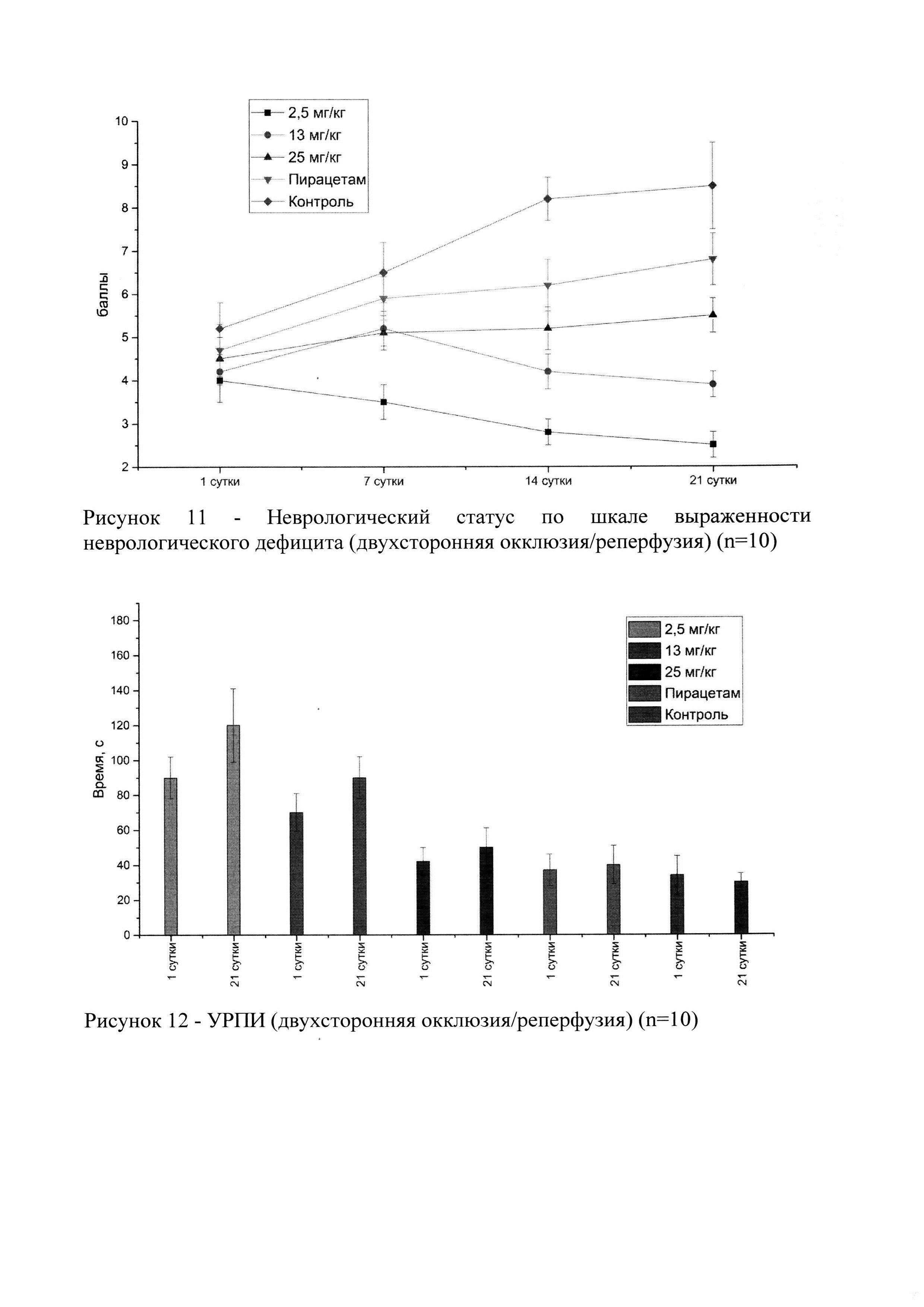
На рисунке 11 представлен неврологический статус животных в динамике, у которых моделировали ишемию мозга путем двухсторонней окклюзии/реперфузии сонных артерий.
В результате статистического анализа, достоверное различие от контроля наблюдалось, как и в группе препарата сравнения, так и группах исследуемого лекарственного средства на всех дозах (р<0,05) к 21 суткам. Максимальный эффект (наименьший неврологический статус) наблюдался в группе исследуемого лекарственного средства в дозе 2,5 мг/кг. Достоверных различий между самками и самцами не обнаружено.
На рисунке 12 представлены результаты теста УРПИ в разные временные точки (1 и 21 сутки). Положительная динамика видна только в группах исследуемого лекарственного средства и препарата сравнения (к 21 суткам латентное время увеличено). Максимальный эффект (наибольшее латентное время) наблюдался в группе исследуемого лекарственного средства в дозе 2,5 мг/кг. Достоверных различий между самками и самцами не обнаружено:
Исследование влияния лекарственного средства на процесс ввода и первоначальной обработки информации на модели УРПИ показало наличие положительного эффекта у исследуемого лекарственного средства во всех дозах (2,5 мг/кг, 13 мг/кг и 25 мг/кг). Максимальный эффект наблюдался в группе исследуемого лекарственного средства в дозе 13 мг/кг. Аналогичные результаты были получены при изучении влияния лекарственного средства на процесс извлечения информации, на обучаемость в методике условного рефлекса с положительным подкреплением и на стратегию поведения в исследовательском радиальном лабиринте.
Распознавание новых объектов в процессе исследовательского поведения в условиях открытого поля, крестообразного лабиринта и водного лабиринта Морриса показало, что исследуемое лекарственное средство улучшало распознавание объектов и повышал эффективность исследовательского поведения крыс. Лучшие результаты были также получены при применении ЛС в дозе 13 мг/кг. Менее результативное использование ЛС в высоких дозах, вероятно, связно с активацией глутаматергических тормозных процессов.
На модели одностороннего фотохимического повреждения коры головного мозга крысы ЛС устраняло неврологический дефицит, при этом максимальный эффект также наблюдался при использовании лекарственного средства в дозе 2,5 мг/кг.
Изучение ЛС на модели глобальной ишемии мозга, воспроизводимой путем двухсторонней окклюзии сонных артерий крыс, выявило его способность способствовать восстановлению мозга после повреждения. Аналогичные данные получены при использовании ЛС при глобальной ишемии мозга, воспроизводимой путем двухсторонней окклюзии/реперфузии сонных артерий крыс. Наибольший эффект наблюдался в группах исследуемого лекарственного средства в дозе 2,5 мг/кг.
Пример 11. Воздействие на репродуктивную систему.
Мутагенное действие лекарственного средства изучали методом учета хромосомных аберраций в клетках костного мозга мышей С57В 1/6 при однократном в дозах 5 и 50 мг/кг и многократном пероральном введении в дозе 5 мг/кг. Группе положительного контроля вводили однократно внутрибрюшинно циклофосфамид в дозе 20 мг/кг. В результате проведенного исследования в группах, получавших исследуемое лекарственное средство в дозах 5 и 50 мг/кг, не выявлено достоверного увеличения количества клеток с хромосомными аберрациями относительно групп негативного контроля, количество клеток с хромосомными аберрациями у животных не превышало 2%. Качественная характеристика повреждений клеток после воздействия исследуемого вещества также не изменялась: основную массу всех перестроек составляли аберрации хроматидного типа (концевые делеции), клетки с множественными аберрациями не выявлены. При однократном и многократном пероральном введении лекарственного средства не выявлено мутагенного действия на соматические клетки. ЛС в тесте Эймса в концентрациях 0,1; 1; 10; 100; 1000 мкг на чашку не обладает мутагенным действием на индикаторные штаммы Salmonella typhimurium.
Результаты проведенных исследований на крысах показывают, что лекарственное средство при многократном пероральном введении не обладает репродуктивной токсичностью: не влияет на репродуктивную (генеративную) функцию самок и самцов и не оказывает эмбрио- и фетотоксического действия, регистрируемого в антенатальном и постнатальном периодах развития.
Итоги проведенных исследований можно зафиксировать нижеследующими тезисами.
Из результатов исследования специфической активности фармацевтической композиции бициклононана следует, что изучаемое лекарственное средство продемонстрировало свойства, подтверждающие наличие у него ноотропных свойств. Фармацевтическая композиция положительно влияла на когнитивную деятельность на различных моделях, а также, судя по результатам применения при кислороддефицитных состояниях, также увеличивала уровни трофических факторов, таких как мозговой нейротрофический фактор, при повреждении головного мозга. Это подтверждает предполагаемый на основе химического строения механизм действия, и соответствует данным предварительных исследований. Особого внимания заслуживает зависимость эффекта от дозы, типичная для модуляторов АМРА-рецепторов.
Исследование специфических видов токсичности (иммунотоксичности, мутагенности, репродуктивной токсичности и аллергенности) показало отсутствие у испытуемого лекарственного средства аллергизирующих свойств в диапазоне испытанных доз: конъюнктивальные пробы у морских свинок - отрицательные; тест общей и активной анафилаксии - отрицательный; накожные аппликации - отрицательные. Лекарственное средство не оказывает иммунотоксического действия, не ухудшает пролиферативную активность клеток-продуцентов антител, фагоцитоза, активации макрофагов - основных компонентов активного иммунного ответа.
Лекарственное средство в дозах 5 и 50 мг/кг, не индуцирует доминантные летальные мутации в зрелых, поздних и ранних сперматозоидах мышей F1 (CBAxC57BL6). Мутагенный эффект, в виде повышенной эмбриональной смертности, не был выявлен.
Проведено исследование механизма действия лекарственного средства. Исследовали влияние производного 3,7-диазабицикло[3.3.1]нонана (ФС) на десенсибилизацию и дезактивацию рецепторов. Показали, что в отсутствии лекарственного средства десенситизация происходила в двух экспоненциальных фазах, имеющих доминирующий компонент в 1,1±0,05 мс и минорный компонент в 4,0±0,3 мс. При добавлении фармацевтической субстанции с увеличением концентрации доминировали более медленные экспоненциальные компоненты десенситизации; сначала стал доминировать 7 мс компонент, а на высоких концентрациях производного 3,7-диазабицикло[3.3.1]нонана появился добавочный компонент в 30 мс. Деактивация токов после быстрого удаления глутамата в отсутствии ЛС описывалась одно-экспоненциальным распадом от 500 до 600 мкс. В присутствии 0,1 мМ производного 3,7-диазабицикло[3.3.1]нонана постоянная времени деактивации удваивалась. Во всем диапазоне концентраций лекарственного средства время дезактивации увеличилось с 0,55±0,19 мс в контроле до 1,95±0,52 мс при 5 мМ лекарственного средства. При стимуляции связь между дезактивацией и концентрацией ЛС описывается устойчивым уменьшением константы скорости закрытия канала. Величина влияния лекарственного средства на десенсибилизацию была большей и имела место при более высокой концентрации лекарственного средства, чем эффект дезактивации.
Бициклононан мало влияет на каинатные АМРА рецепторы. Фармацевтическая композиция приводит к небольшому увеличению амплитуды стационарного состояния, но не оказывает влияния на пик или на временной режим десенситизации или дезактивации.
В результате проделанных работ оценена эффективность и безопасность лекарственного средства на основе производных бициклононана для реабилитации больных после повреждения мозга.
Специалистам в данной области будет понятно, что в описанные выше варианты осуществления можно вносить многочисленные изменения и/или модификации без отклонения от широкого общего объема настоящего изобретения. Таким образом, представленные варианты осуществления следует считать во всех аспектах иллюстративными, но не ограничивающими.