СПОСОБ ОБНАРУЖЕНИЯ НЕЙТРАЛИЗУЮЩИХ АНТИТЕЛ ПРОТИВ РЕКОМБИНАНТНОГО ЧЕЛОВЕЧЕСКОГО ИНСУЛИНА В СЫВОРОТКЕ КРОВИ ЧЕЛОВЕКА
Вид РИД
Изобретение
Область изобретения
Настоящее изобретение относится к способу in vitro обнаружения присутствия нейтрализующих антител против рекомбинантного лекарственного средства, в частности нейтрализующих антител против рекомбинантного человеческого инсулина, в образце сыворотки. Оно также относится к набору для обнаружения присутствия нейтрализующих антител против рекомбинантного человеческого инсулина в образце сыворотки.
Предшествующий уровень техники
Диабет, в частности типа I и типа II, представляет собой расстройство, связанное с отсутствием или недостаточной продукцией инсулина - гормона, который секретируется поджелудочной железой. Он поражает большое число людей по всему миру. Подходы по управлению заболеванием для контроля диабета типа I и типа II, главным образом, нацелены на нормализацию уровней глюкозы в крови для предупреждения кратко- и долгосрочных осложнений, которые обычно осуществляются посредством введения перорального лекарственного средства или инъекции инсулина или аналогов инсулина.
Инсулин имеет многочисленные анаболические эффекты, включающие регуляцию углеводного, белкового и липидного метаболизма. Плейотропные эффекты инсулина опосредованы его связыванием с инсулиновым рецептором поверхности клетки. Инсулиновый рецептор представляет собой гетеротетрамерную тирозинкиназу, состоящую из 2 альфа-субъединиц и 2 бета-субъединиц. Связывание инсулина с внеклеточной альфа-субъединицей инициирует димеризацию рецептора, активацию собственной тирозинкиназной активности бета-субъединицы и трансфосфорилирование рецептора по нескольким остаткам тирозина (Y1146, Y1150, Y1151, Y1316 и Y1322). Киназа активированного инсулинового рецептора затем фосфорилирует многочисленные внутриклеточные субстраты, включающие субстрат инсулинового рецептора-1 (IRS-1), IRS-2 и She. Специфические остатки фосфотирозина дают сайты связывания для нескольких адапторных белков, таким образом, устанавливая стадию передачи инсулинового сигнала, приводящую к пути сигнализации P13K, Сар-Cb1 и MAPK (митогенактивируемая протеинкиназа). Активацию инсулинового рецептора можно измерять посредством количественного измерения степени фосфорилирования инсулинового рецептора прямыми и опосредованными способами.
С успехами в ДНК-технологии была возможной продукция многих рекомбинантных биотерапевтических средств, включая рекомбинантный человеческий инсулин (rHI или RHI). Такие разные препараты rHI доступны для лечения диабета. Однако такой прогресс в технологии часто сопровождается недостатками. Другими словами, данные биотерапевтические средства склонны к генерации нежелательного иммунного ответа у хозяев. Последствия этой иммуногенности варьируют от отсутствия какого-либо эффекта до временного эффекта, до тяжелого или нежелательного эффекта на безопасность, эффективность и фармакокинетику терапевтического белка.
Довольно часто иммуногенность имеет нежелательное влияние на эффективность таких терапевтических белков, особенно при продукции в организме пациента антитела против лекарственного средства (или ADA), которое является нейтрализующим по природе. Нейтрализующее антитело (или NAb), как свидетельствует его название, может нейтрализовать активность терапевтического белка, а также его эндогенного аналога, таким образом, предотвращая выполнение функции биотерапевтического средства.
В WO/2009//022001 раскрыты способы на основе поверхностного плазмонного резонанса, в которых для обеспечения выявления ADA используется стадия кислотной диссоциации и преодолевается мешающее влияние лекарственного средства в присутствии лекарственного средства в сыворотке.
В WO/2015/123315 раскрыт способ анализа Р и A (PEG (полиэтиленгликоль) и кислота (Acid)) для выявления ADA посредством объединения биологического образца, содержащего потенциальные ADA, с избытком лекарственного средства с образованием комплекса, который затем осаждается PEG, с последующей основной или кислотной обработкой для диссоциации комплекса лекарственное средство-Ab, которым затем покрывают углеродную подложку для иммобилизации и отделения от коплекса антитела против лекарственного средства. Затем проводится специфичное выявление общих уровней ADA с использованием меченого лекарственного средства.
В WO/2014/011416 раскрыт способ выявления присутствия нейтрализующих антител против белкового терапевтического средства в образце сыворотки, включающий: приведение в контакт популяции клеток с: i) образцом сыворотки, который может содержать нейтрализующие антитела против белкового терапевтического средства, и ii) белковым терапевтическим средством, где клетки содержат рецептор в отношении белкового терапевтического средства; и выявление биомаркера, указывающего на связывание белкового терапевтического средства с рецептором. Более конкретно, предложен способ выявления присутствия в образце сыворотки нейтрализующих антител против фактора роста, включающий: приведение в контакт популяции клеток с i) образцом сыворотки и ii) фактором роста, где данные клетки содержат рецептор фактора роста; и выявление количества биомаркера в популяции клеток, где данный биомаркер указывает на связывание фактора роста с рецептором фактора роста, и соотношение количества биомаркера с присутствием нейтрализующих антител против фактора роста.
Как и в случае со многими другими терапевтическими средствами на основе человеческих белков, обсуждавшимися выше, NAb продуцируются в организме пациента, получающего rHI, и они предотвращают связывание rHI с рецепторами, приводя к неудаче в управлении диабетом, что могло бы иметь смертельные последствия. Кроме того, rHI, вводящийся хронически, часто на протяжении всей жизни, имеет более высокое системное воздействие, чем большинство других лекарственных средств, и, следовательно, частота образования ADA также является очень высокой. Следовательно, крайне важно то, чтобы были доступны способы выявления таких NAb для точного определения причины неспособности лекарственного средства работать.
Соответственно, существует потребность в высокоселективном и специфичном способе выявления присутствия таких NAb посредством проведения анализа образцов сыворотки пациентов, страдающих диабетом, получающих rHI.
Цели изобретения
Целью настоящего изобретения является предложение высокоселективного и специфичного способа in vitro для выявления присутствия нейтрализующих антител против рекомбинантного человеческого инсулина в образце сыворотки.
Другой целью настоящего изобретения является предложение набора для выявления присутствия данных нейтрализующих антител.
Краткое изложение сущности изобретения
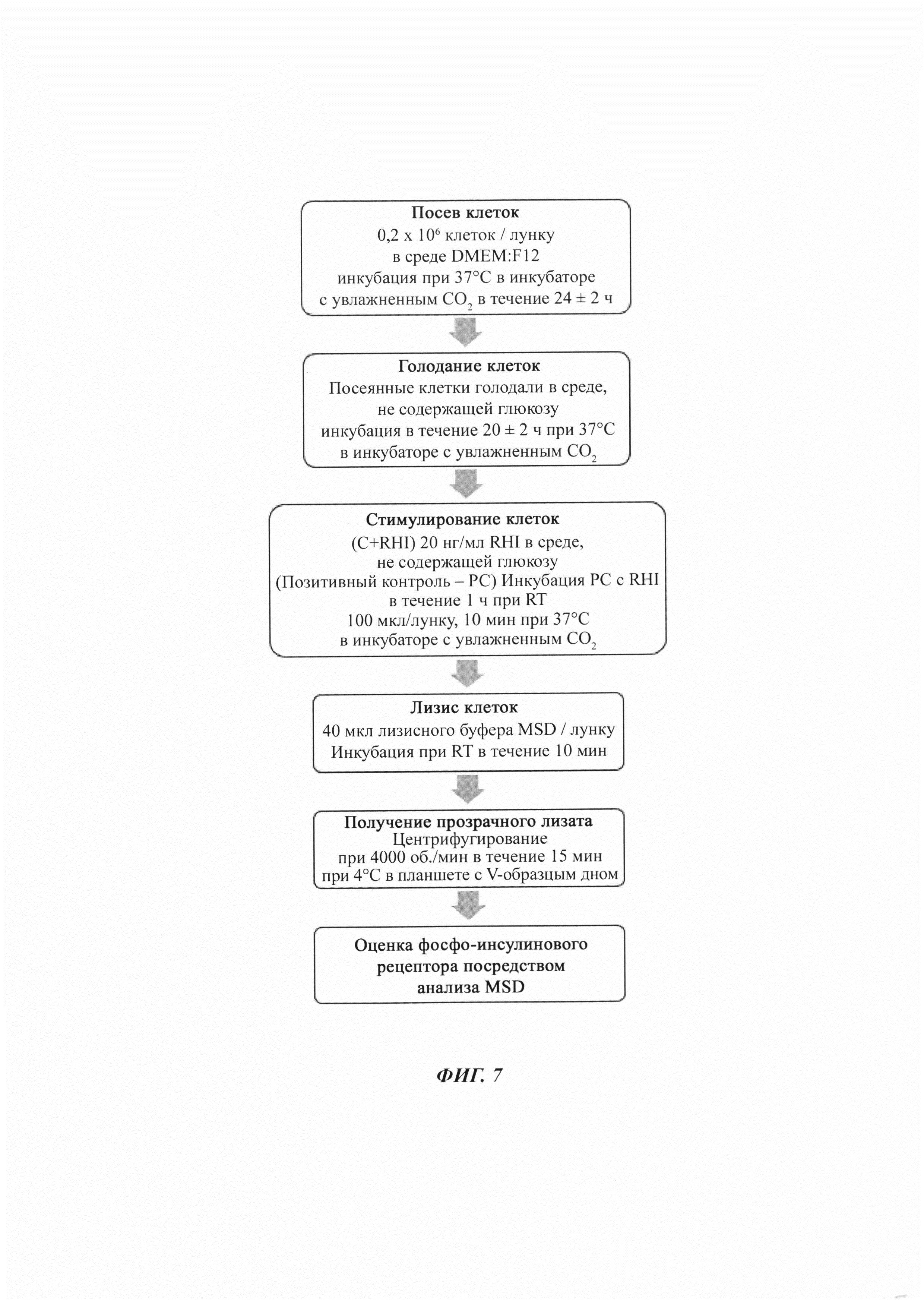
В одном аспекте настоящее изобретение относится к способу in vitro для выявления присутствия нейтрализующих антител против rHI в образце сыворотки, включающему следующие стадии:
(а) предобработка образца сыворотки; и
(б) анализ на основе клеток, где он включает следующие стадии:
i. посев клеток, имеющих рецептор рекомбинантного человеческого инсулина (rHI);
ii. голодание клеток;
iii. стимулирование популяции клеток rHI и предобработанным образцом сыворотки;
iv. лизирование клеток и получение прозрачного лизата; и
v. оценка лизата в отношении фосфорилирования инсулинового рецептора; и
(в) соотношение количества фосфорилирования с плавающей точкой деления.
В другом аспекте данное изобретение относится к набору для способа in vitro выявления присутствия нейтрализующих антител против рекомбинантного человеческого инсулина (rHI) посредством проведения анализа образца сыворотки, включающего следующие стадии:
(а) предобработка образца сыворотки; и
(б) анализ на основе клеток, где он включает следующие стадии:
i. посев клеток, имеющих рецептор rHI;
ii. голодание клеток;
iii. приведение в контакт популяции клеток с rHI и предобработанным образцом сыворотки;
iv. лизирование клеток и получение прозрачного лизата; и
v. оценка лизата в отношении фосфорилирования инсулинового рецептора; и
(в) соотношение количества фосфорилирования с плавающей точкой деления,
где данный набор содержит PEG 6000 (40%), приготовленный в PBS (фосфатно-солевой буферный раствор); уголь с декстраном (3%), приготовленный в PBS; поликлональное антитело против инсулина (PAb); 600 мМ ледяную уксусную кислоту (рН 2,5); 1 М Tris буфер (рН 9,5); фосфатно-солевой буферный раствор (PBS) и рекомбинантный человеческий инсулин.
Краткое описание графических материалов
Приведенные выше и другие аспекты, характеристики и преимущества некоторых типичных воплощений настоящего изобретения будут более очевидными из следующего описания, приведенного в сочетании с сопровождающими графическими материалами.
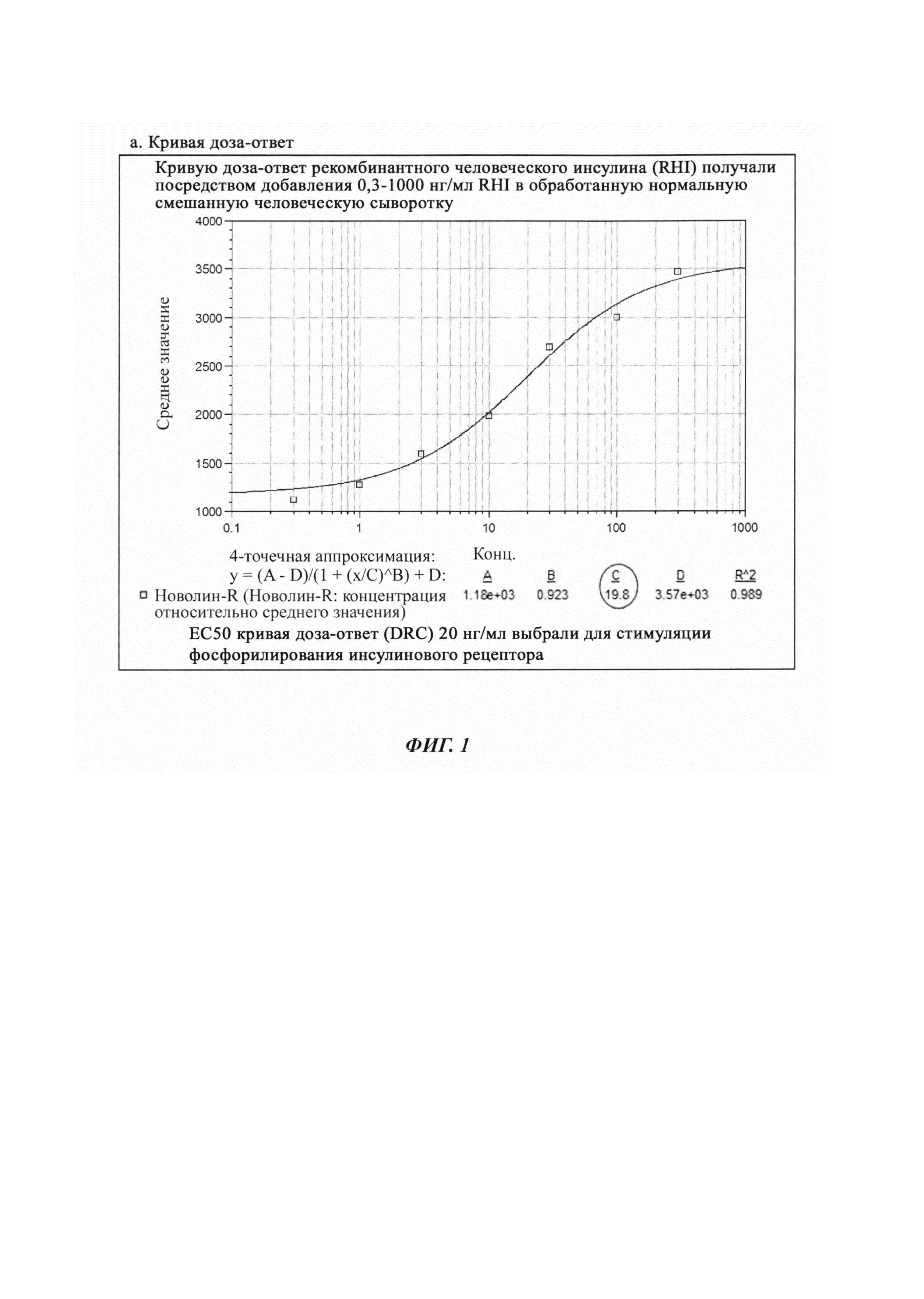
На Фиг. 1 представлен дозозависимый ответ клеток на rHI, и ожидаемый результат фиксируется как увеличение фосфорилирования рецептора с увеличением концентрации rHI с использованием ECL (электрохемилюминисценция) в качестве платформы.
На Фиг. 2 представлены 4 PL кривые для каждого прогона на чувствительность посредством откладывания на графике среднего MoR по ординате и концентрации - по абсциссе.
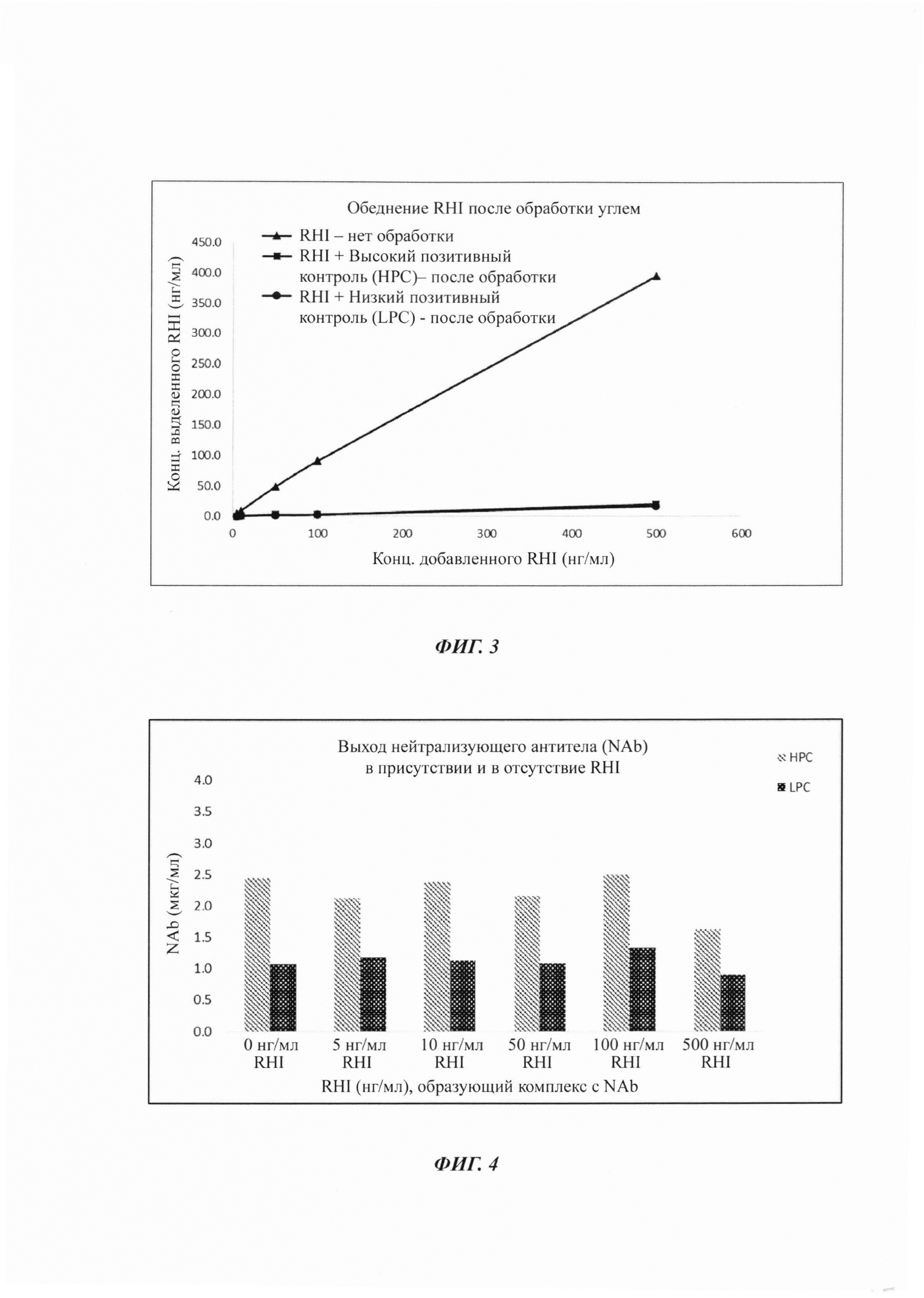
На Фиг. 3 представлено истощение RHI после обработки углем.
На Фиг. 4 представлен выход nAb в присутствии и в отсутствие RHI.
На Фиг. 5 представлен анализ выпадающих значений и анализ распределения данных по точке отсечения посредством программы JMP.
На Фиг. 6 представлена стадия предобработки образца сыворотки.
На Фиг. 7 представлена стадия анализа на основе клеток.
Подробное описание настоящего изобретения
Следующее описание со ссылкой на сопровождающие графические материалы приводится для помощи во всеобъемлющем понимании типичных воплощений данного изобретения. Оно включает разные конкретные подробности для помощи в данном понимании, но их следует рассматривать просто в качестве типичных.
Соответственно, обычным специалистам в данной области будет понятно, что можно делать разные изменения и модификации воплощений, описанных в данном документе, без отступления от объема изобретения. Кроме того, для ясности и краткости опущены описания хорошо известных функций и конструкций.
Термины и слова, используемые в следующем описании и формуле изобретения, не ограничиваются библиографическими значениями, но просто используются автором изобретения для обеспечения ясного и непротиворечивого понимания данного изобретения. Соответственно, для специалистов в данной области должно быть очевидным, что следующее описание типичных воплощений настоящего изобретения приводится лишь с целью иллюстрации, а не с целью ограничения данного изобретения, как определено посредством приложенной формулы изобретения и ее эквивалентов.
Следует понимать, что формы единственного числа включают определяемые объекты во множественном числе, если контекст явно не диктует иное.
Под термином «по существу» подразумевается то, что перечисленные характеристика, параметр или значение не должны точно достигаться, но то, что отклонения или вариации, включающие, например, допуски, ошибку измерения, ограничения точности измерения и другие факторы, известные специалистам в данной области, могут случаться в количествах, которые не предотвращают эффекта, предоставление которого было намечено характеристикой.
Характеристики, которые описываются и/или иллюстрируются по отношению к одному воплощению, могут использоваться таким же способом или аналогичным способом в одном или более чем одном другом воплощении и/или в комбинации с, или вместо характеристик других воплощений.
Следует подчеркнуть, что термин «содержит/содержащий», при использовании в данном описании изобретения, применяется для определения присутствия изложенных характеристик, целых чисел, стадий или компонентов, но не исключает присутствия или добавления одной или более чем одной другой характеристики, целого числа, стадии, компонента или их групп.
«Одни клетки / (от англ. Cells alone - CA)» использовали в качестве клеточного контроля. Он представляет собой базовое фосфорилирование инсулинового рецептора (IR), клетки не стимулируются лекарственным средством.
«Клетки плюс лекарственное средство» (C+RHI) использовали в качестве лекарственного контроля. Он представляет собой фосфорилирование рецепторов IR в присутствии RHI.
«Плавающая точка деления» представляет собой точку деления данного анализа (прямого анализа нейтрализации), представляет собой уровень ответа, при котором или ниже которого образец определяется как позитивный, и выше которого он определяется как негативный в отношении нейтрализующей активности к лекарственному продукту. Плавающая точка деления является предпочтительной для данного анализа из-за варьирующей природы анализов на основе клеток.
«Величина ответа (от англ. magnitude of response - MoR)» представляет собой отношение C+RHI / СА. Она представляет собой фосфорилирование рецепторов IR в присутствии фиксированной концентрации RHI.
«MoR Nab» представляет собой отношение NAb + C+RHI / СА. Оно представляет собой ингибирование фосфорилирования, достигаемое в присутствии NAb.
«% нейтрализации» указывает нейтрализацию фосфорилирования рецепторов IR, индуцированного RHI. % нейтрализации определяли как: (сигнал C+RHI - сигнал NAb) / (сигнал C+RHI - сигнал СА) × 100.
«Образцы РС» - в данном анализе в качестве имитирующего позитивного контроля использовали антитело против RHI морской свинки. NAb добавляли в нормальную смешанную человеческую сыворотку или в среду для анализа с получением образцов позитивного контроля (PC).
«Точность» измеряет степень воспроизводимости способа при нормальных условиях работы.
«Чувствительность» представляет собой наименьшую концентрацию позитивного контроля, дающую положительный ответ анализа или показатель, стабильно равный точке отсечения.
«Специфичность» определяли для установления того, что только позитивный контроль показывает нейтрализующий ответ, а любое другое неспецифичное антитело не показывает данный ответ.
«Селективность» представляет собой способность аналитического способа различать и выявлять аналит в присутствии других компонентов, присутствующих в образце (мешающих веществ). Селективность может варьировать между опытными образцами из-за гетерогенной и полиморфной природы образцов.
Данное изобретение основывается на разработке специфичных и селективных анализов для измерения нейтрализующих антител против рекомбинантного человеческого инсулина (rHI).
Как излагается в предшествующем уровне техники, пациентам, страдающим от диабета типа I и типа II, в частности, пациентам, страдающим от диабета типа I, вводятся инсулин или аналоги инсулина. Часто иммунная система пациента генерирует антитела, которые предотвращают функционирование инсулина или аналога инсулина, главным образом, в случаях, когда пациенту вводится rHI. Такие антитела предотвращают связывание лекарственного средства - rHI - с инсулиновыми рецепторами, при невозможности которого оно не способно выполнять его анаболические функции, включающие углеводный, белковый и липидный метаболизм. Это приводит к неэффективному управлению диабетом и могло бы даже иметь смертельный эффект.
Данные нейтрализующие антитела (NAb), также известные как антитело против лекарственного средства, предотвращают связывание rHI с инсулиновым рецептором и, посредством этого, нейтрализуя эффект лекарственного средства или rHI.
Вышеупомянутые сайты инсулинового рецептора на клетках подвергаются фосфорилированию при связывании с rHI. Соответственно, фосфорилированный инсулиновый рецептор действует в качестве биомаркера, указывающего на связывание rHI с рецептором. Не будучи связанными какой-либо конкретной теорией, считается то, что количество фосфорилированного инсулинового рецептора в клетках будет возрастать с увеличением воздействия rHI, но присутствие нейтрализующих антител в образце сыворотки будет приводить к уменьшению количества фосфорилированного инсулинового рецептора. Авторы настоящего изобретения обнаружили то, что измерение фосфорилированного инсулинового рецептора, в отличие от измерения других последующих эффектов инсулиновой сигнализации, приводит к высокоспецифичной и точной оценке.
Согласно настоящему изобретению предложен способ in vitro для выявления присутствия нейтрализующих антител против рекомбинантного человеческого инсулина (rHI) посредством проведения анализа образца сыворотки, включающий следующие стадии:
(а) предобработка образца сыворотки; и
(б) анализ на основе клеток, где он включает следующие стадии:
i. посев клеток, имеющих рецептор rHI;
ii. голодание клеток;
iii. стимулирование популяции клеток rHI и предобработанным образцом сыворотки;
iv. лизирование клеток и получение прозрачного лизата; и
v. оценка лизата в отношении фосфорилирования инсулинового рецептора; и
(в) соотношение количества фосфорилирования с плавающей точкой деления.
Как указывает данный термин, предобработка включает обработку сыворотки, которая получена от пациента, до анализа. В образцах сыворотки NAb возможно присутствует в виде иммунного комплекса с циркулирующим инсулином. Стадия предобработки образцов сыворотки является необходимой для диссоциации комплекса NAb-инсулин, таким образом, что могут быть выявлены все нейтрализующие антитела, которые присутствуют в образце, без мешающего влияния от инсулина. Истощение остаточного инсулина также является важным, так как исулин, даже в следовых количествах, может мешать методике анализа на основе клеток и приводить к неправильной и ошибочной оценке.
Авторы изобретения обнаружили то, что данная предобработка обеспечивает диссоциацию комплекса NAb-инсулин и проводится посредством кислотной обработки образцов, выбранной из обработки уксусной кислотой и глицином-HCl. Предпочтительной кислотой является уксусная кислота. После подкисления образцы подвергаются обработке углем, который поглощает инсулин и оставляет NAb, свободное для выявления, в анализе на основе клеток. Обеднение остаточным инсулином также является важным, так как инсулин, даже в следовых количествах, может мешать методике анализа на основе клеток. Свободное NAb осаждается в растворе PEG, с последующим ресуспендированием посредством встряхивания с использованием вибромешалки или обработки ультразвуком в ультразвуковой бане в течение примерно 10 минут.
Стадия анализа на основе клеток по изобретению работает по принципу активации рецепторной киназы (KIRA), основанному на измерении индуцированной лигандом активации рецепторной тирозинкиназы в показателях фосфорилирования рецептора.
Фосфорилированный инсулиновый рецептор может быть выявлен любой методикой, известной в данной области, например, посредством анализа ECL. Анализ на основе электрохемилюминисценции (ECL) дает более количественный способ выявления присутствия нейтрализующих антител против rHI. В таких анализах при связывании терапевтического средства с его рецептором во время электрохимических реакций в растворах продуцируется люминисценция, которая изеряется и количественно оценивается.
Линии клеток могут представлять собой любые клетки, содержащие по меньшей мере один рецептор в отношении анализируемого rHI. Предпочтительные линии клеток включают клетки, имеющие на их поверхности большое число рецепторов. В некоторых воплощениях данные линии клеток выбраны из MCF 10А и MCF-7. MCF-7 - линия клеток человеческой аденокарциномы молочной железы -является предпочтительной линией клеток.
Плотность клеток в некоторых воплощениях находится в интервале от примерно 0,05×106 до примерно 0,5×106 клеток на лунку 96 лунок, предпочтительно примерно 0,2×106 клеток на лунку 96 лунок.
Данный способ включает посев клеток в ростовую среду DMEM (среда Игла, модифицированная по Дульбекко): Р12 и их инкубирование при приблизительно 37°С в увлажненном воздухе, содержащем примерно 5% CO2, в течение периода времени от 12 до 16 часов, с последующим голоданием клеток. Клетки голодают в течение периода времени, варьирующего от примерно 18 часов до примерно 26 часов, предпочтительно от примерно 18 часов до примерно 22 часов. Голодание вызывают заменой полной ростовой среды на среду, не содержащую глюкозу, примерно на 24 часа. Среда, использованная для голодания, представляет собой среду DMEM, не содержащую глюкозу.
Клетки затем стимулируются в присутствии образца сыворотки и rHI в течение периода времени, варьирующего от примерно 5 минут до примерно 30 минут, предпочтительно примерно 10 минут при комнатной температуре в подходящей среде. Одновременно также инкубируется PC с rHI от примерно 30 минут до примерно 90 минут при комнатной температуре, предпочтительно в течение примерно 60 минут, с последующей инкубацией в течение 10 минут при 37° в увлажненном инкубаторе с CO2.
Эффективная концентрация rHI для связывания с инсулиновым рецептором и, посредством этого, индуцирования фосфорилирования варьирует от примерно 10 нг/мл до примерно 30 нг/мл, предпочтительно составляет 20 нг/мл. На Фиг. 1 проиллюстрирована кривая доза-ответ, где RHI добавляли в концентрации от 0,3 до 1000 нг/мл в переработанной нормальной человеческой сыворотке.
После стимулирования клетки лизируются. Клетки могут лизироваться в то время, как они все еще прикреплены к культуральным планшетам. Лизис проводится в присутствии общеизвестных лизисных буферов, предпочтительно с использованием лизисного буфера при инкубировании при комнатной температуре в течение периода времени от примерно 5 минут до 30 минут, предпочтительно - 10 минут.
Клеточный лизат, полученный после центрифугирования, оценивается на фосфорилированный инсулиновый рецептор посредством анализа на основе ECL. Анализ для оценки фосфорилирования разрабатывается на платформе MesoScale Discovery (MSD®). Использовали набор для лизирования целых клеток панели инсулиновой сигнализации (фосфобелок) на основе MSD®. Реактивы использовали в том виде, в котором они были предоставлены в наборе, и готовили согласно инструкциям изготовителя. Анализ на основе MSD® проводили с использованием имеющегося в продаже набора для лизирования целых клеток панели инсулиновой сигнализации (фосфобелок). Панель инсулиновой сигнализации (фосфобелок) представляет собой сэндвич-иммуноанализ. Планшет MSD® предварительно покрывают захватывающими антителами против общего IGF-1R, общего IR и общего IRS-1 в пространственно отличных пятнах. На лунки добавляют клеточные лизаты, содержащие фосфорилированные киназные рецепторы, которые выявляются детектирующим антителом - антителом против фосфотирозина, конъюгированным с электрохемилюминисцентным соединением - меткой SulfoTag (MSD®).
Как представлено на Фиг. 1, кривая доза-ответ и нейтрализация rHI-индуцированного фосфорилирования инсулинового рецептора представляют собой надежный ожидаемый результат, который используется в анализе, в виде фосфорилирования рецетора в присутствии инсулина и также чувствительный ответ платформы анализа в выявлении присутствия любого нейтрализующего антитела.
Выявленное количество фосфорилированного инсулинового рецептора в образце сыворотки может быть оценено по сравнению с плавающей точкой деления для установления присутствия нейтрализующих антител против rHI. Плавающая точка деления определяется на основе негативного базового пула, и данная плавающая точка деления коррелирует с присутствием нейтрализующих антител против rHI. Например, когда выявляемое количество фосфорилированного инсулинового рецептора в образце больше, чем плавающая точка деления, тогда образец сыворотки не содержит поддающихся оценке количеств нейтрализующих антител против rHI, и когда выявляемое количество фосфорилированного инсулинового рецептора в образце меньше, чем плавающая точка деления, тогда образец сыворотки содержит поддающиеся оценке количества нейтрализующих антител против rHI.
В некоторых воплощениях данный способ включает позитивный контроль, содержащий нейтрализующее антитело против инсулина. Соответственно данный способ может включать сравнительный анализ образца для того, чтобы оценить присутствие нейтрализующих антител против инсулина.
Авторы настоящего изобретения провели качественную оценку анализа и обнаружили то, что он имеет высокую специфичность и селективность среди других анализов. Для качественной оценки анализа оценивали разные параметры, включающие надежность и точность. Благодаря такой надежности, чувствительности и точности для определения нейтрализующих антител к вводимому лекарственному средству настоящий способ дает очень эффективное средство для прогнозирования безопасности лекарственного средства во время клинических испытаний и, следовательно, поможет противостоять всей надзорной экспертизе и давать стратегическое преимущество по сравнению с конкурентами. Он может создавать основу для разработки сопровождающей диагностики на rHI в качестве потенциального применения, что может помогать лечащему врачу устанавливать то, имеются ли предсуществующие антитела к инсулину, что могло бы содействовать определению дозировки и курса лечения при прописывании лекарственного средства для лечения.
В пределах объема данного изобретения также рассматриваются наборы для проведения способа по изобретению. В одном воплощении данный набор содержит PEG 6000 (40%), приготовленный в PBS; декстран с углем (3%), приготовленный в PBS; поликлональное антитело против инсулина (PAb); 600 мМ ледяную уксусную кислоту (рН 2,5); 1 М Tris буфер (рН 9,5); фосфатно-солевой буферный раствор (PBS) и рекомбинантный человеческий инсулин. Другие компоненты данных наборов возможно могут включать реактивы и/или инструкции для проведения иммуноанализов.
Средства, при помощи которых можно использовать набор и осуществлять анализ, можно легко понять ввиду раскрытия, сделанного в данном документе.
Примеры
Пример 1
Предобработка образца
Образец сыворотки обрабатывали 600 мМ уксусной кислотой. Осуществляли обеднение циркулирующего инсулина 3%-ным раствором декстрана с углем и проводили инкубацию в течение периода примерно 30 минут при комнатной температуре и встряхивании на орбитальном шейкере при 180 об./мин. После этого следовало 10-минутное центрифугирование при 10000 об./мин при 4°С, затем перенос супернатанта. К 550 мкл супернатанта добавляли 150 мкл 1 М буфера Tris, 375 мкл 40%-ного раствора PEG 6000. Данную смесь инкубировали в течение примерно 30 минут при комнатной температуре с круговым встряхиванием при 180 об./мин. Супернатант образцов, осажденных PEG, оценивали на присутствие NAb, что показало отсутствие потерь во время осаждения PEG. Ресуспендирование осадка при 6000 об./мин при 4°С в течение примерно 20 минут в 180 мкл раствора PBS проводили посредством 10-минутной обработки ультразвуком в ультразвуковой бане.
Выход NAb после обработки образца был согласующимся и варьировал от 50 до 70%.
Фиг. 6 представляет собой схематическое представление стадии предобработки данного способа.
Пример 2
Анализ образца на основе клеток
Клетки MCF-7 высевали в 96-луночный планшет в полную ростовую среду, и давали им прикрепляться к поверхности в течение 14 плюс/минус 2 ч. На вторые сутки прикрепленные клетки выдерживали для голодания путем замены полной ростовой среды на среду DMEM, не содержащую глюкозу (без FBS (фетальная телячья сыворотка) и RHI), на 20 плюс/минус 2 ч. На третьи сутки среду, не содержащую глюкозу, удаляли, и образцы добавляли на планшеты согласно схеме эксперимента. После краткого 10-мин периода стимуляции клетки лизируют, и клеточный лизат оценивают на фосфорилированный инсулиновый рецептор посредством набора нанели фосфобелков сигнализации на основе MSD (Фиг. 2).
Пример 3
Оценка нейтрализации фосфорилирования IR рецептора с использованием имеющихся в продаже антител при концентрации RHI 0,1 мкг/мл
Клетки высевали при плотности посева 0,5×106 клеток на лунку. Для стимуляции клеток использовали две концентрации rHI, которые составляли 1 и 0,1 мкг/мл. Три доступных антитела против RHI оценивали на нейтрализацию фосфорилирования IR. Два антитела были получены из коммерческих источников, а именно: Peninsula и Invitrogen соответственно, тогда как третье представляло собой антитело, самостоятельно полученное авторами изобретения. Все антитела оценивали в концентрациях 2, 1 и 0,5 мкг/мл.
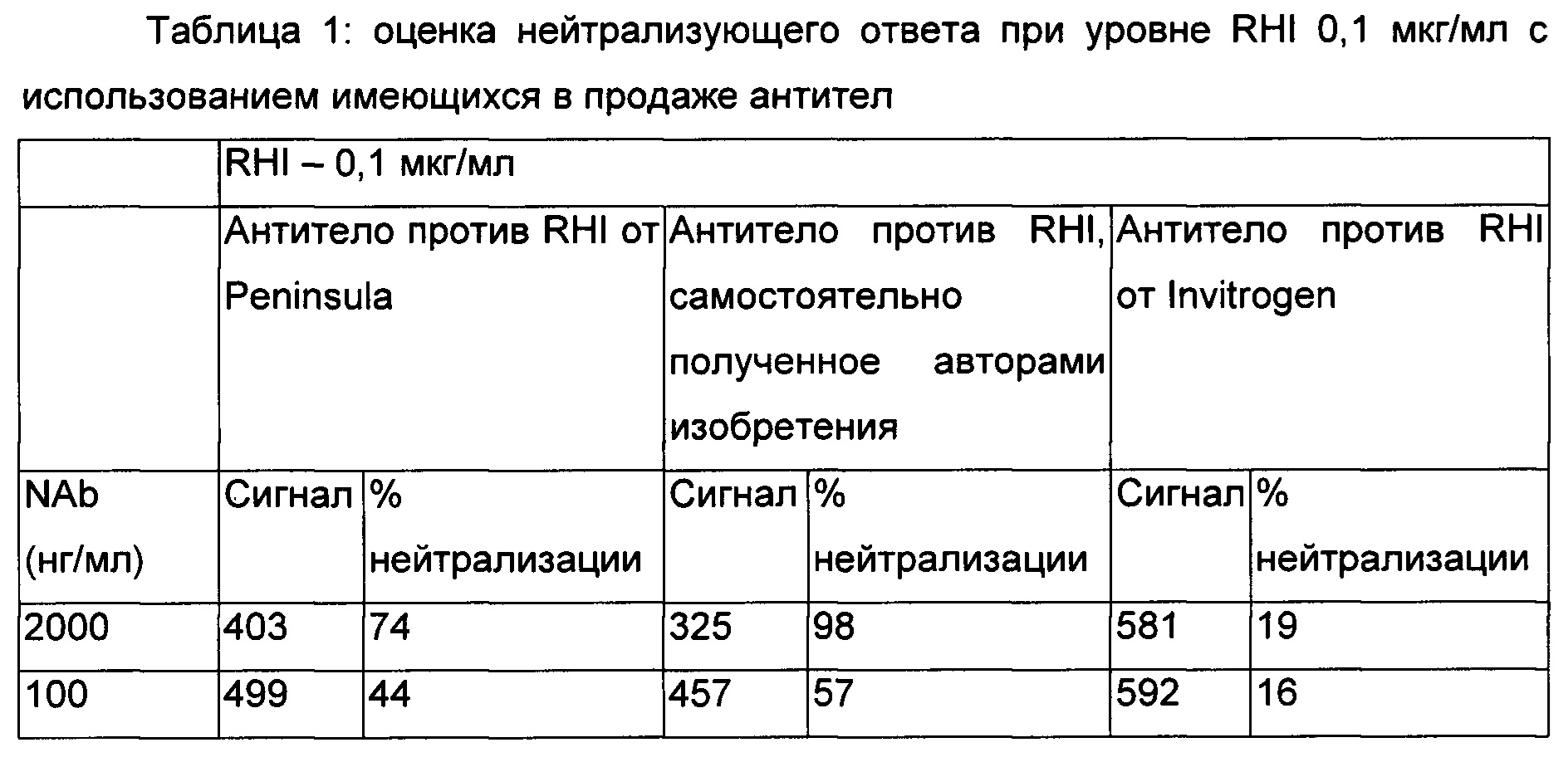
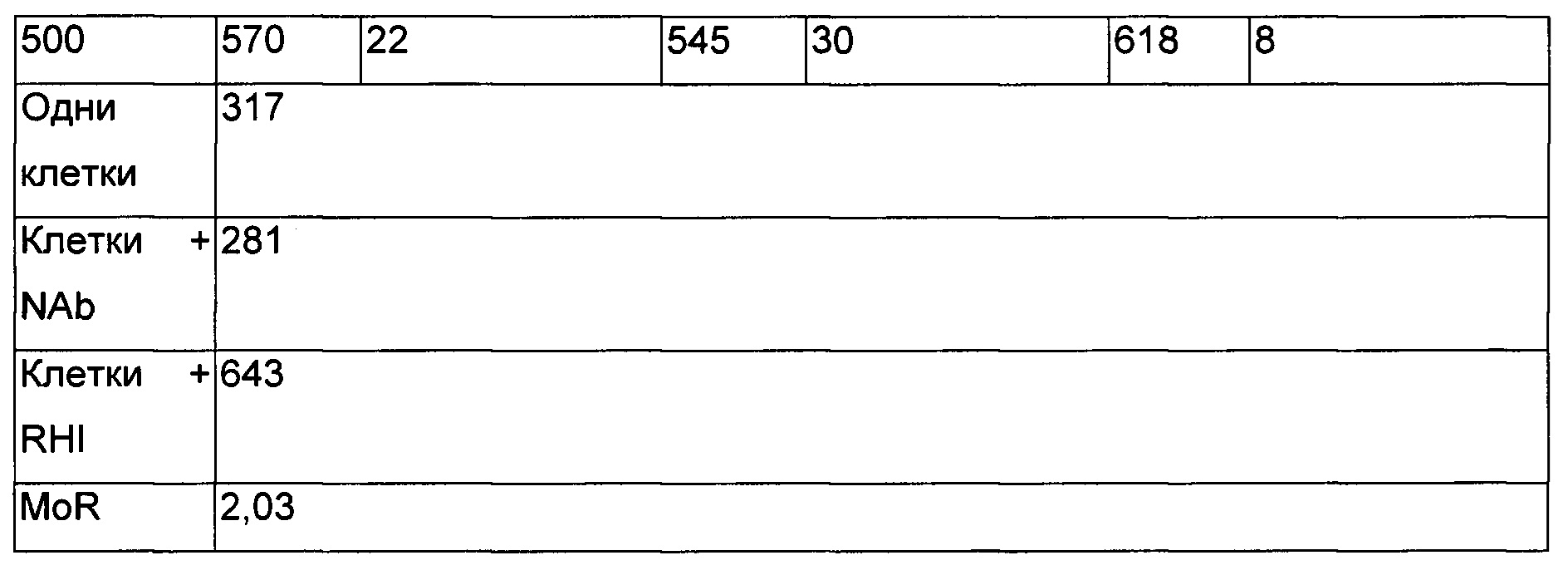
Как наблюдали, происходит нейтрализация фосфорилирования, индуцированного RHI.
Пример 4
Авторы изобретения оценивали нейтрализующую активность антитела против RHI в нормальной смешанной человеческой сыворотке.
Антитело против RHI добавляли в сыворотку, и ее предобрабатывали согласно Примеру 1. Обработанный образец NAb оценивали в данном анализе, как описано в Таблице 2.
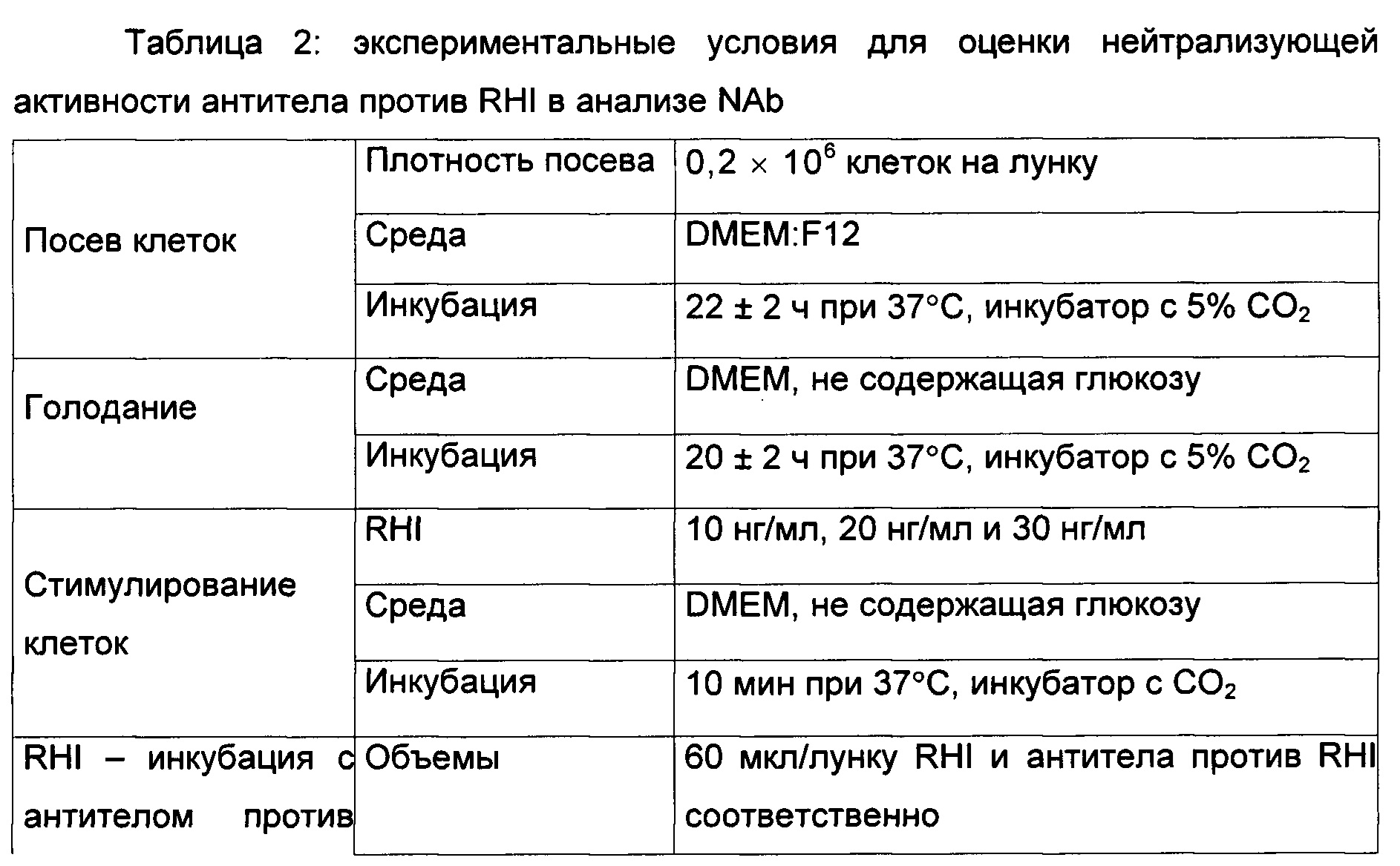

Нейтрализующий ответ оценивали при концентрациях RHI 10 и 20 нг/мл.
В данном анализе в качестве контроля использовали NAb, добавленное в среду для анализа.
Результат: нейтрализация фосфорилирования IR посредством NAb, добавленное в среду для анализа.
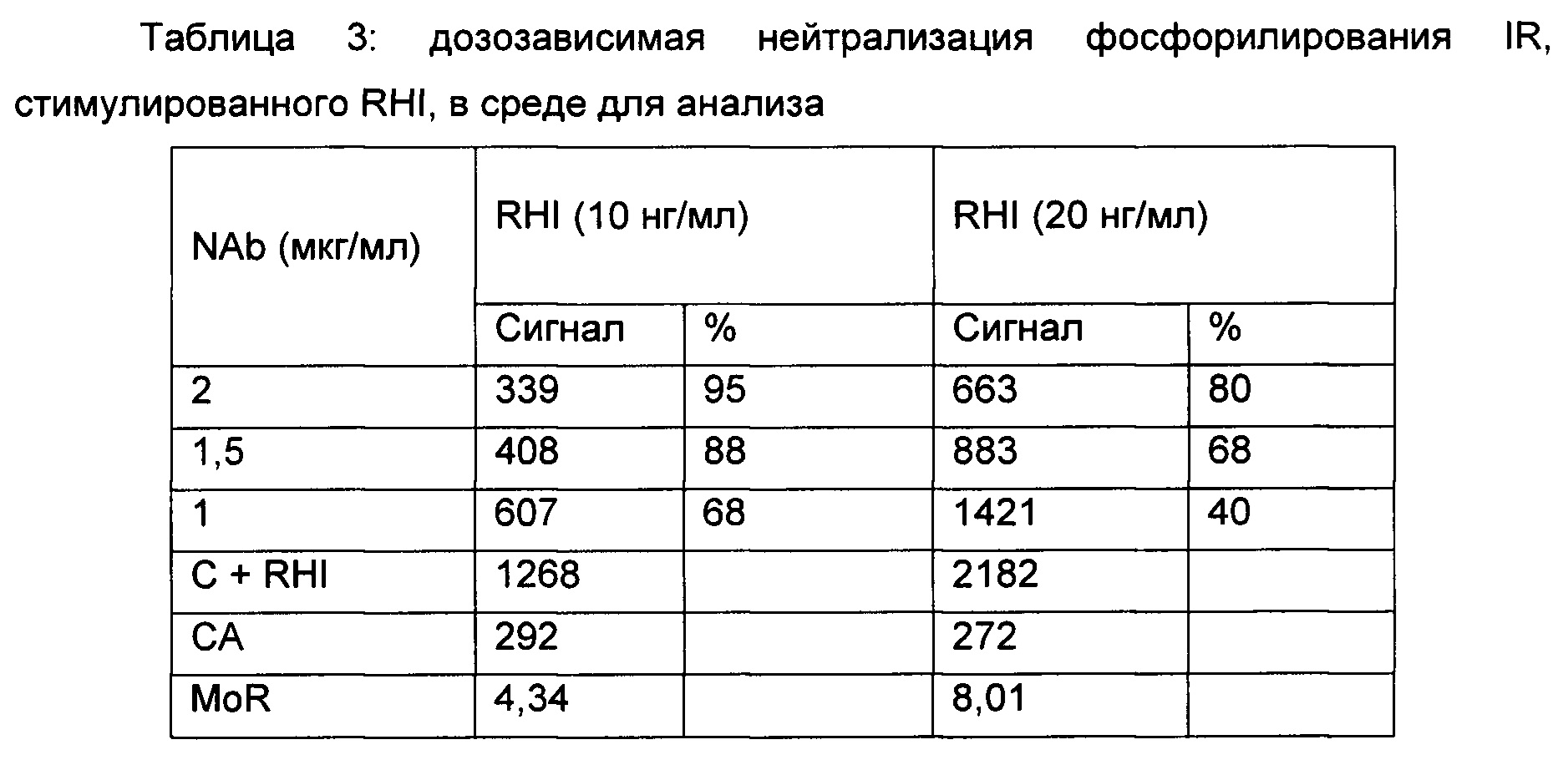
Нейтрализация фосфорилирования IR посредством NAb, добавленного в сыворотку.

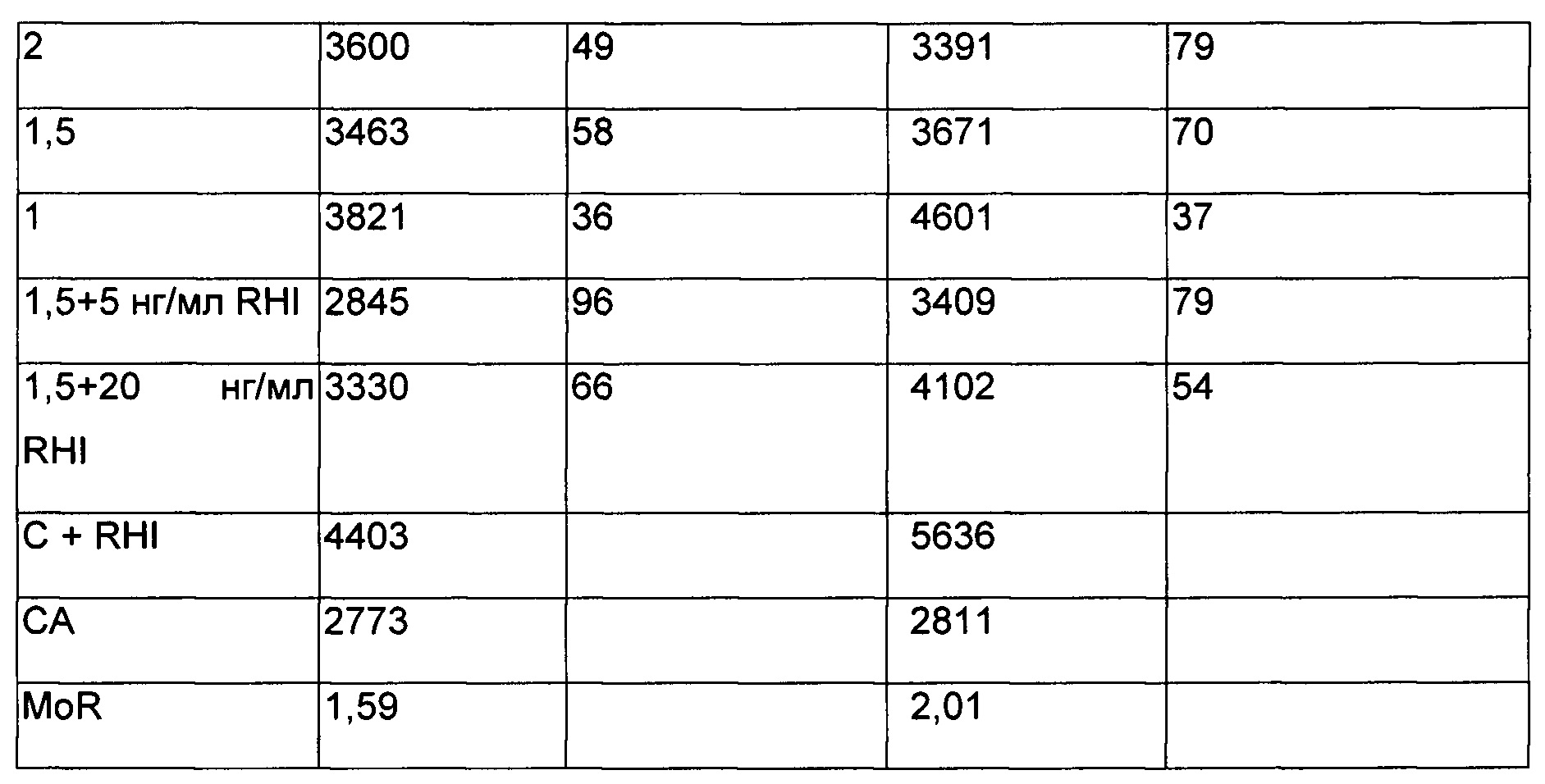
Наблюдаются согласующиеся результаты. Была выбрана стимуляция клеток RHI при концентрации 20 нг/мл.
Пример 5
Для оценки дозозависимого ответа RHI на клетках в матриксе обработанной сыворотки и выбора концентрации RHI для определения нейтрализующего ответа антител против RHI.
Нормальную смешанную человеческую сыворотку обрабатывали согласно методике предобработки образца, как изложено в Примере 1. Готовили интервал концентраций RHI от 0,3 до 1000 нг/мл и добавляли к голодающим клеткам (0,2×106 клеток на лунку). Клеточные лизаты анализировали в анализе MSD. Средние данные MSD приводятся ниже в Таблице 5 и на Фиг. 1.
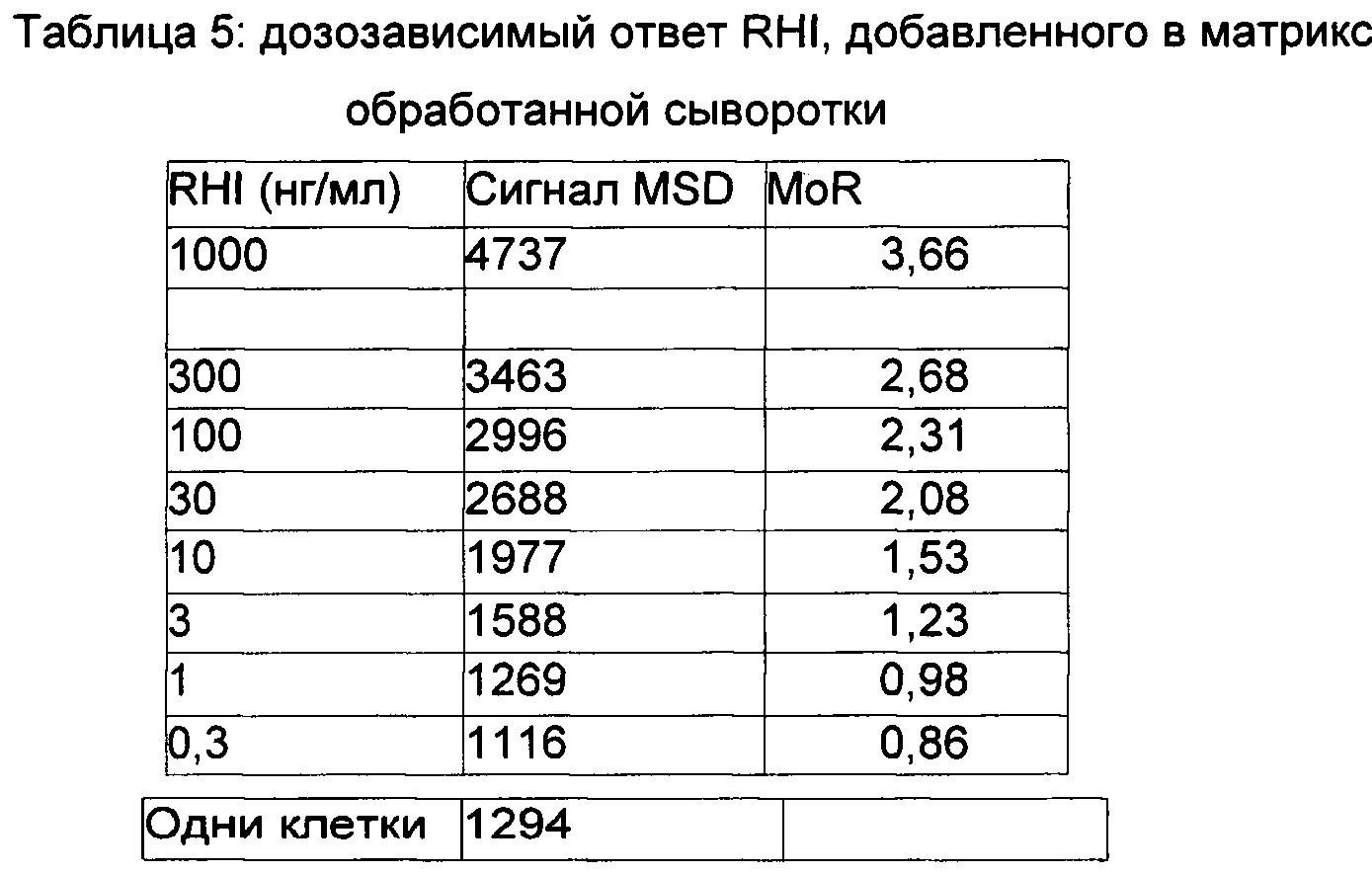
Наблюдали то, что одни клетки были меньше, чем, наблюдавшиеся в предыдущем примере. Дозозависимый ответ RHI наблюдали на культивируемых клетках, как проиллюстрировано на Фиг. 1. ЕС50 (полумаксимальная эффективная концентрация) составляла 19,8 нг/мл, что было аналогично концентрации 20 нг/мл RHI, выбранной в предыдущем эксперименте.
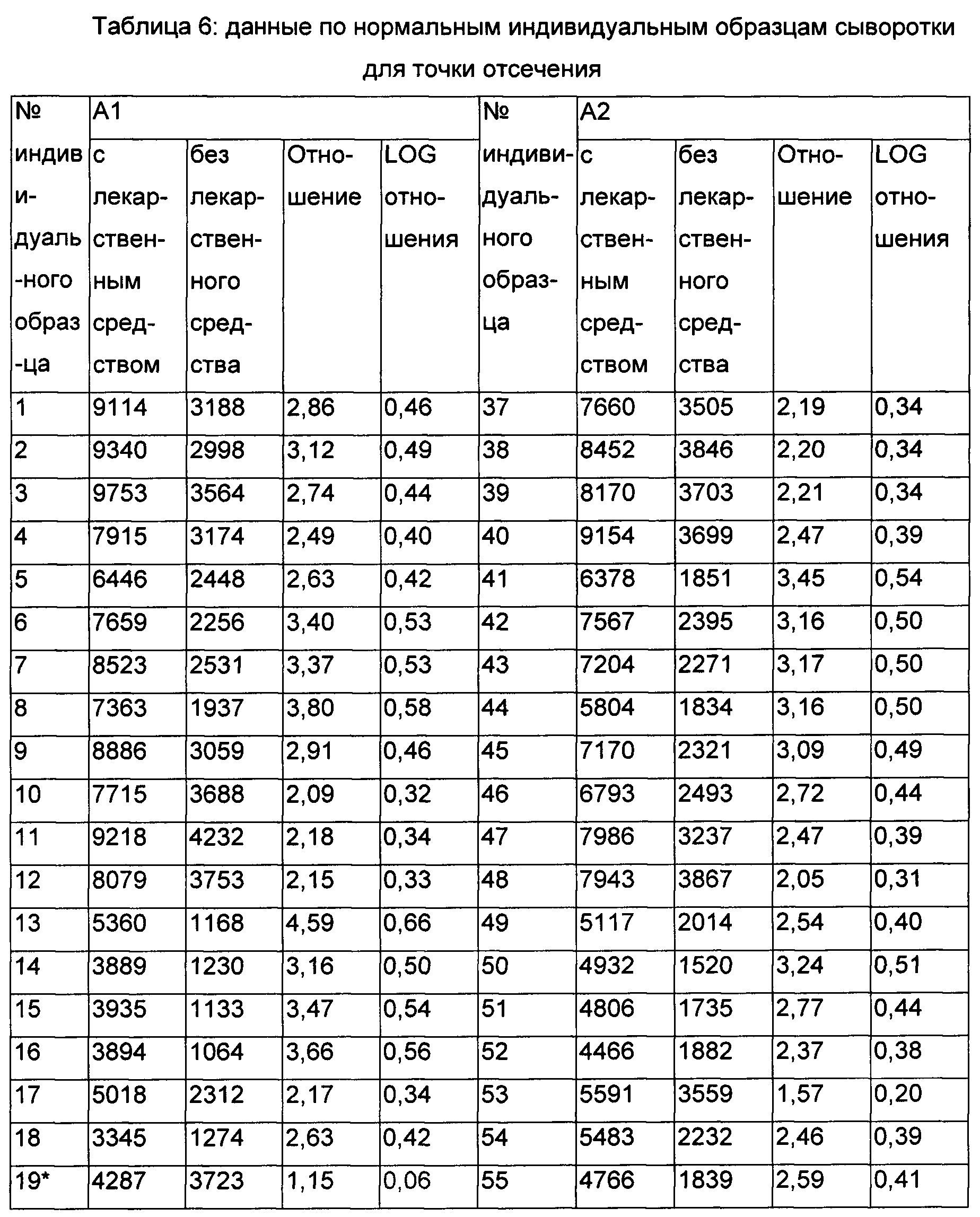
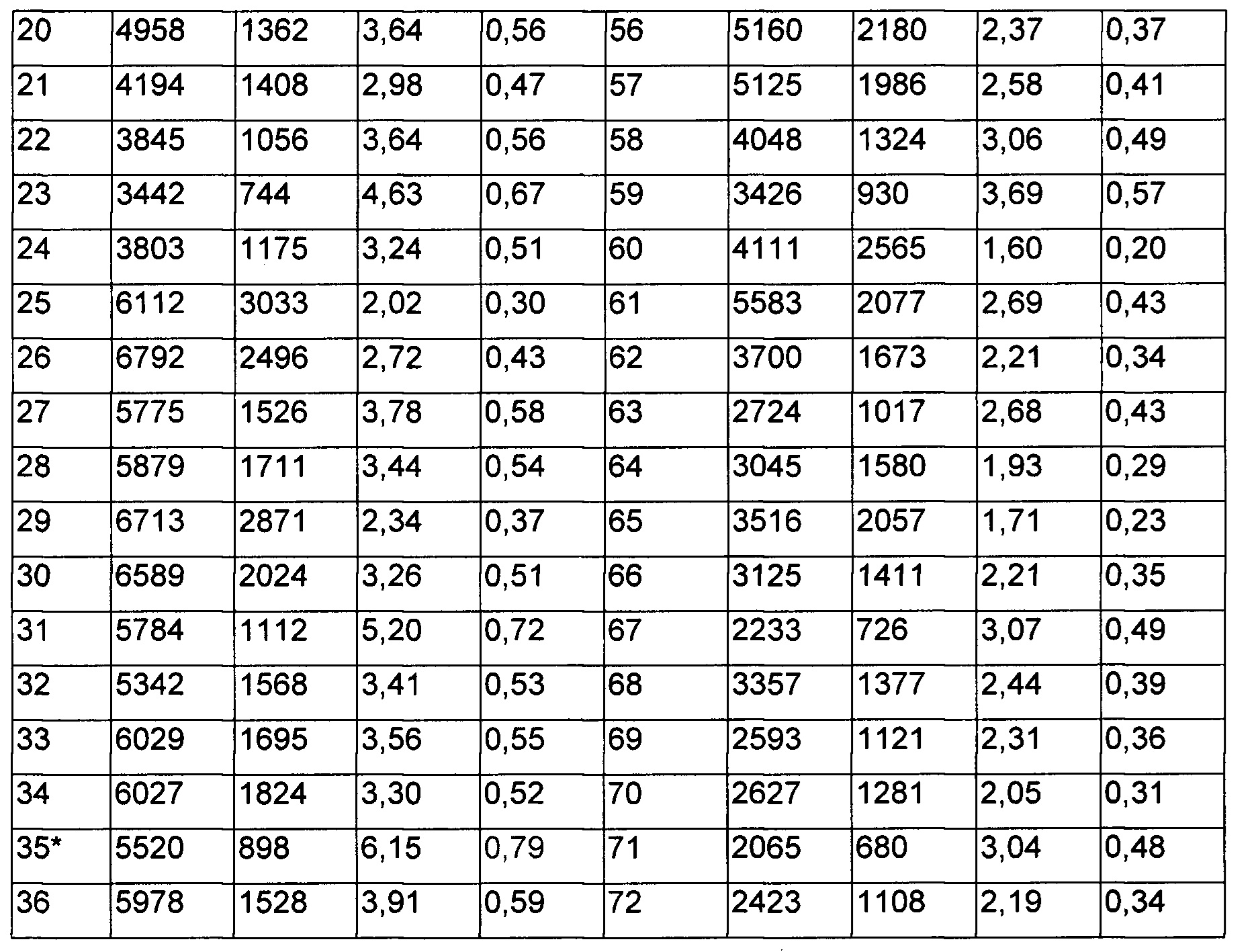
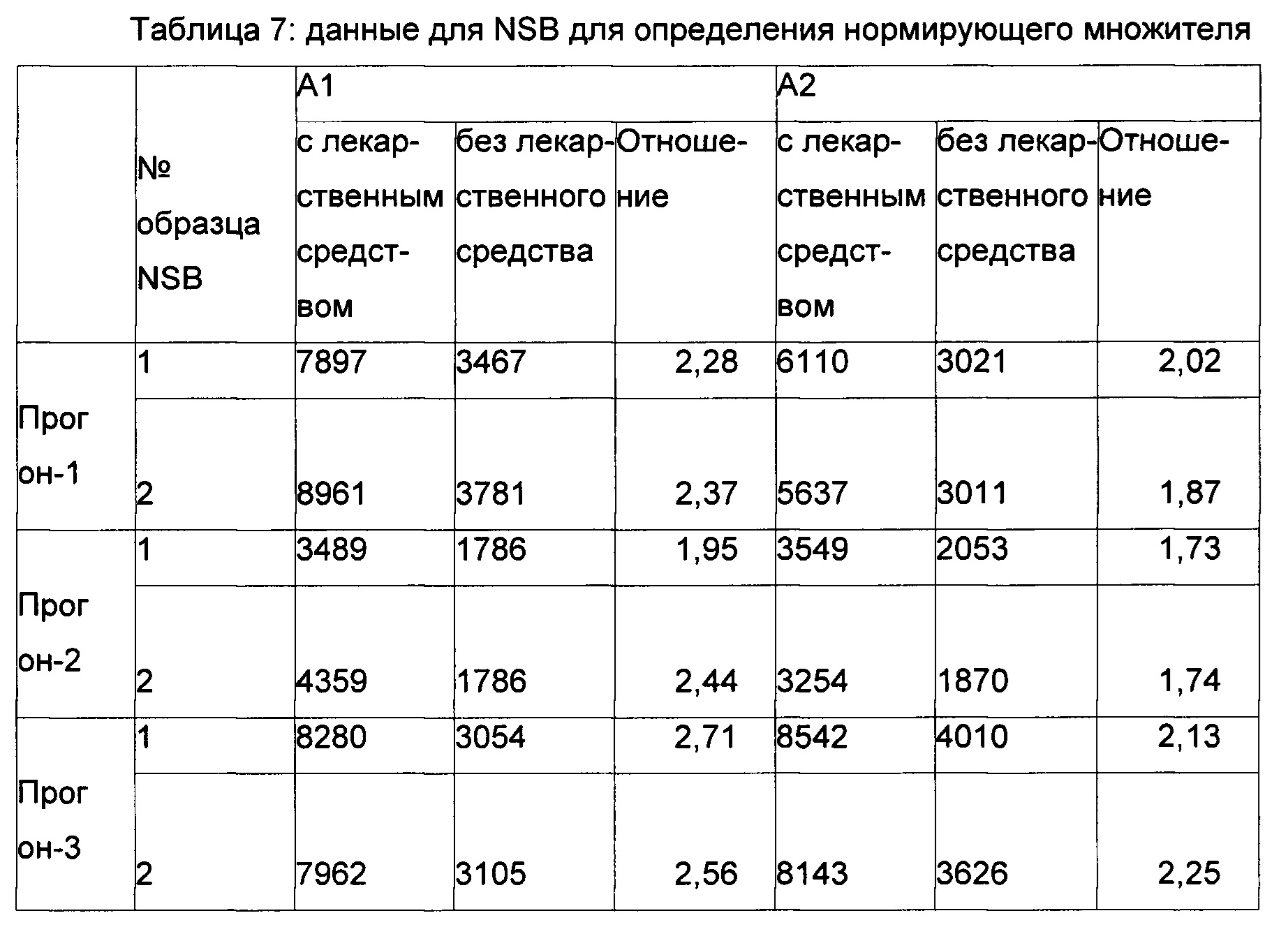
Определение нормирующего множителя для плавающей точки деления: Экспериментальные подробности: точку отсечения определяли с использованием тридцати шести индивидуальных образцов нормальной человеческой сыворотки в сбалансированном плане. Два аналитика (А1 и А2) оценивали образцы в три разных дня, причем каждый аналитик анализирует образец один раз. Определение точки отсечения осуществляли согласно схеме, как упомянуто ниже. Следовательно, для определения точки отсечения всего было отобрано 72 (36×2) точки данных.
Каждый образец анализировали в присутствии и в отсутствие 20 нг/мл RHI, и точка отсечения приводилась в показателях величины ответа (отношение с лекарственным средством и без лекарственного средства). В каждый прогон включали два повторных образца нормальной смешанной человеческой сыворотки (NSB) для того, чтобы определить уровень негативного контроля для данного планшета.
Величину ответа (MoR) определяли для каждого индивидуального образца путем деления сигнала образца с лекарственным средством на сигнал от образца без лекарственного средства. Определяли LOG MoR, и набор данных подвергали анализу посредством программы JMPv 11.2.
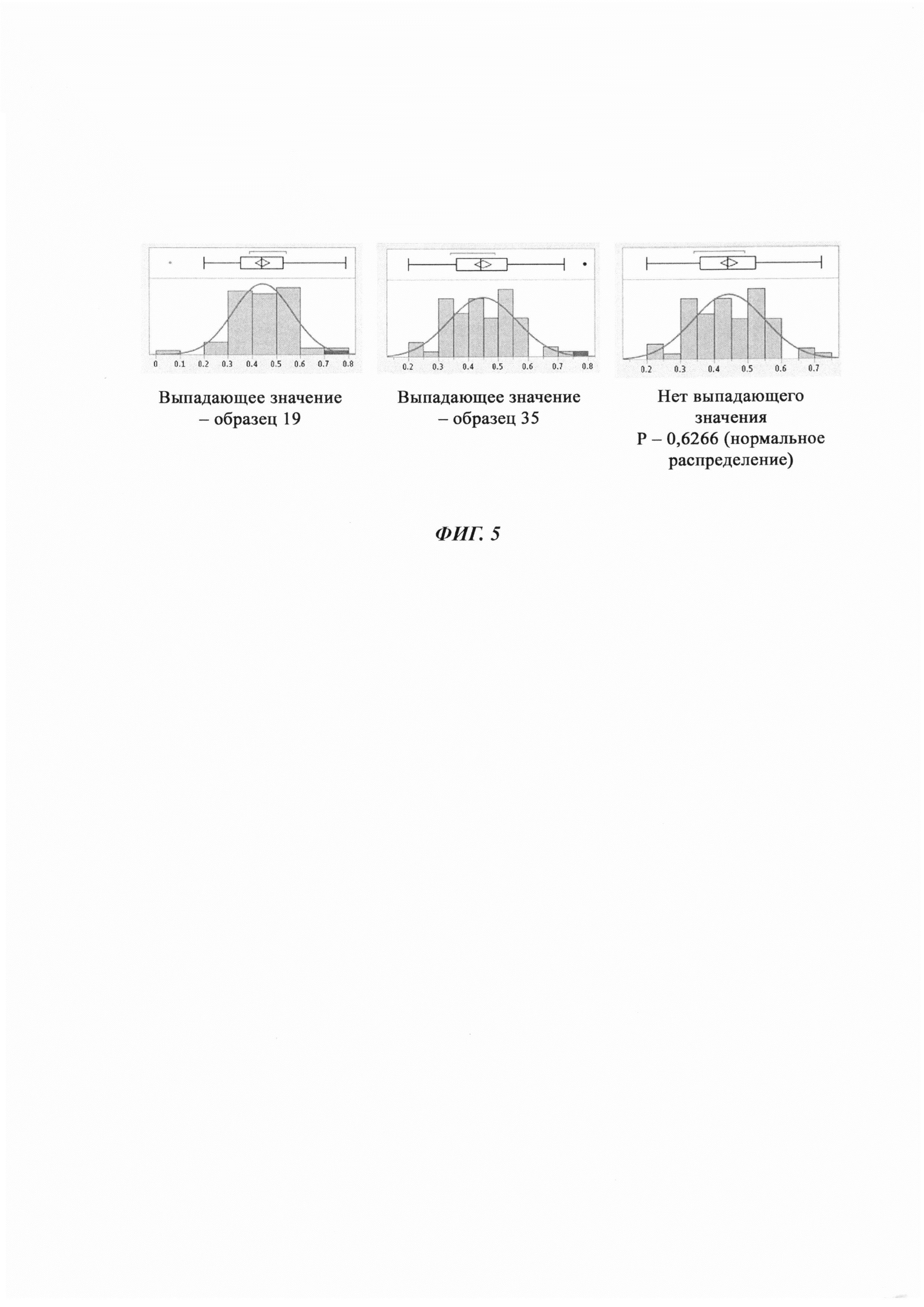
i. Данные оценивали на выпадающие значения посредством анализа с использованием коробчатой диаграммы. Образцы 19 и 35 были идентифицированы как выпадающие значения и, следовательно, были исключены из дальнейшего анализа (Фиг. 5).
ii. Распределение набора данных оценивали после исключения выпадающих значений, обнаружили то, что набор данных был нормально распределен (Фиг. 5).
iii. Применяли параметрический подход для расчета точки отсечения с использованием формулы: Среднее значение - 2,33 × SD (среднеквадратическое отклонение).
iv. Определяли антилогарифм точки отсечения.
v. Определяли среднее значения для NSB по 6 прогонам.
vi. Определяли мультипликативный нормирующий множитель (от англ. Normalization factor - NF) с использованием формулы: Точка отсечения / Среднее значения для NSB.
Данные по точке отсечения и анализ данных представлены в Таблицах 6-8.
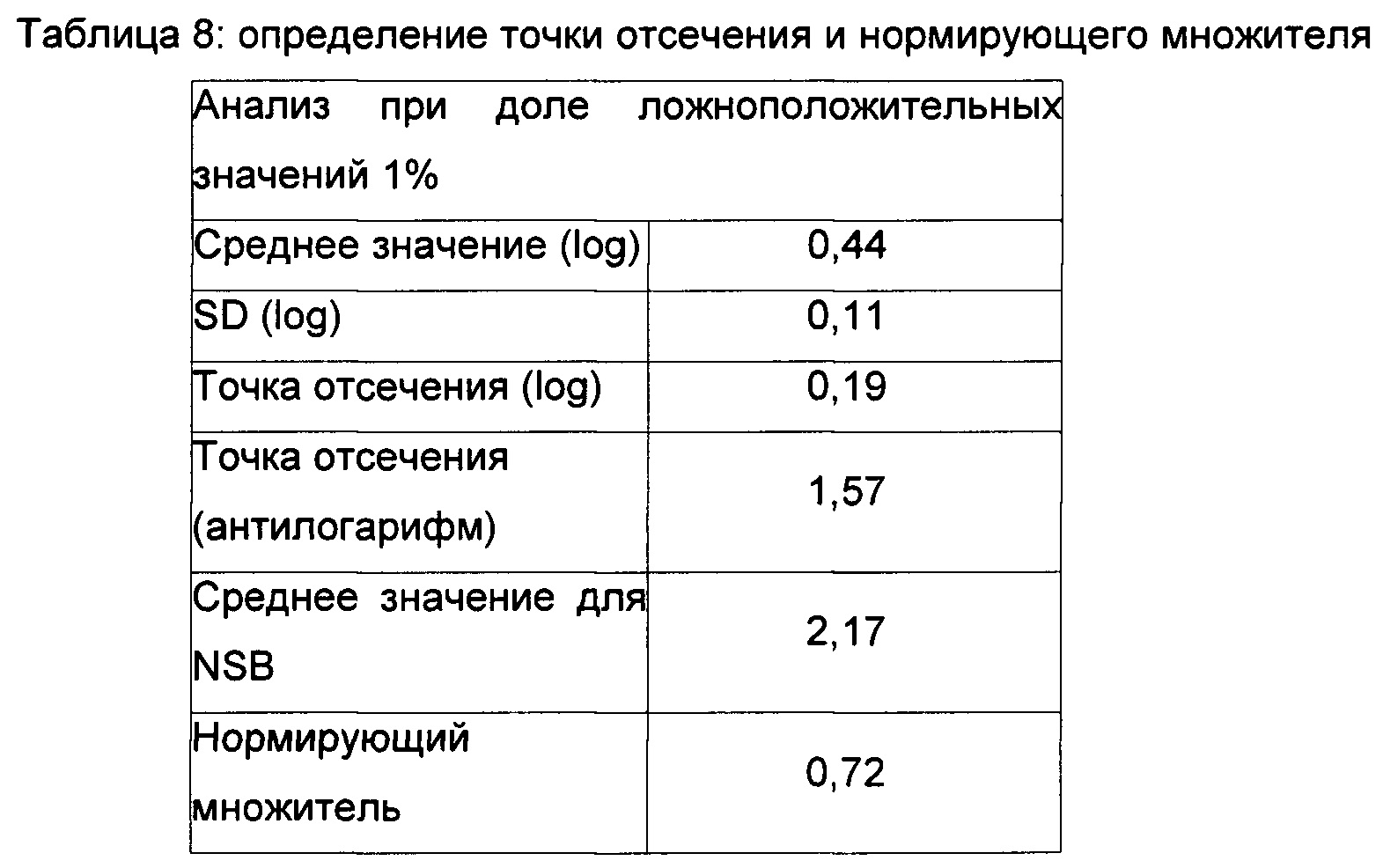
Плавающую точку деления определяли умножением среднего значения для NSB на нормирующий множитель.
Определение чувствительности анализа:
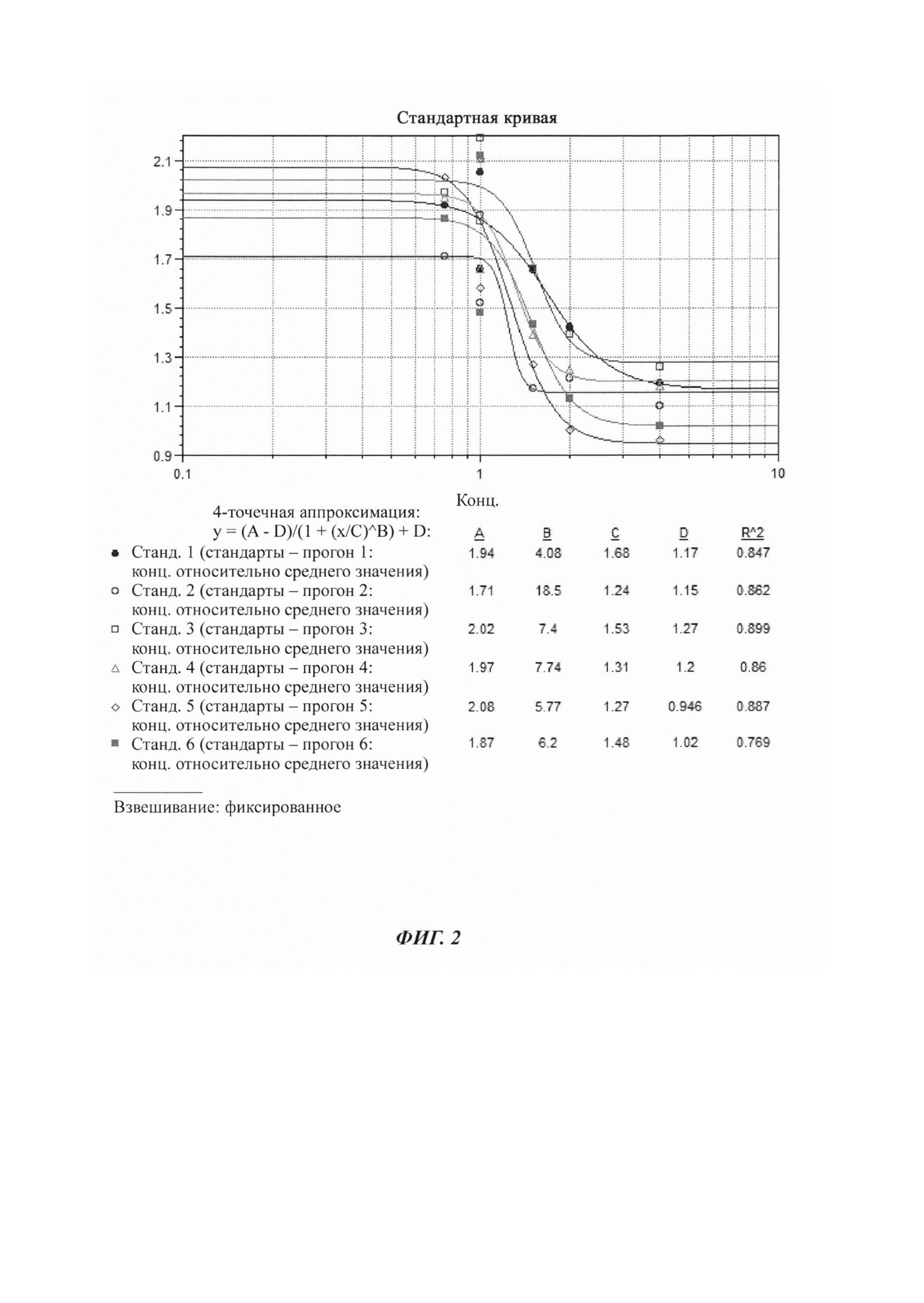
Для установления чувствительности анализа готовили 6 разведений антитела позитивного контроля от 4 мкг/мл до 0,5 мкг/мл в нормальной смешанной человеческой сыворотке. Чувствительность определяли из шести независимых прогонов анализа в трое отдельных суток согласно схеме, представленной ниже в Таблице 9.
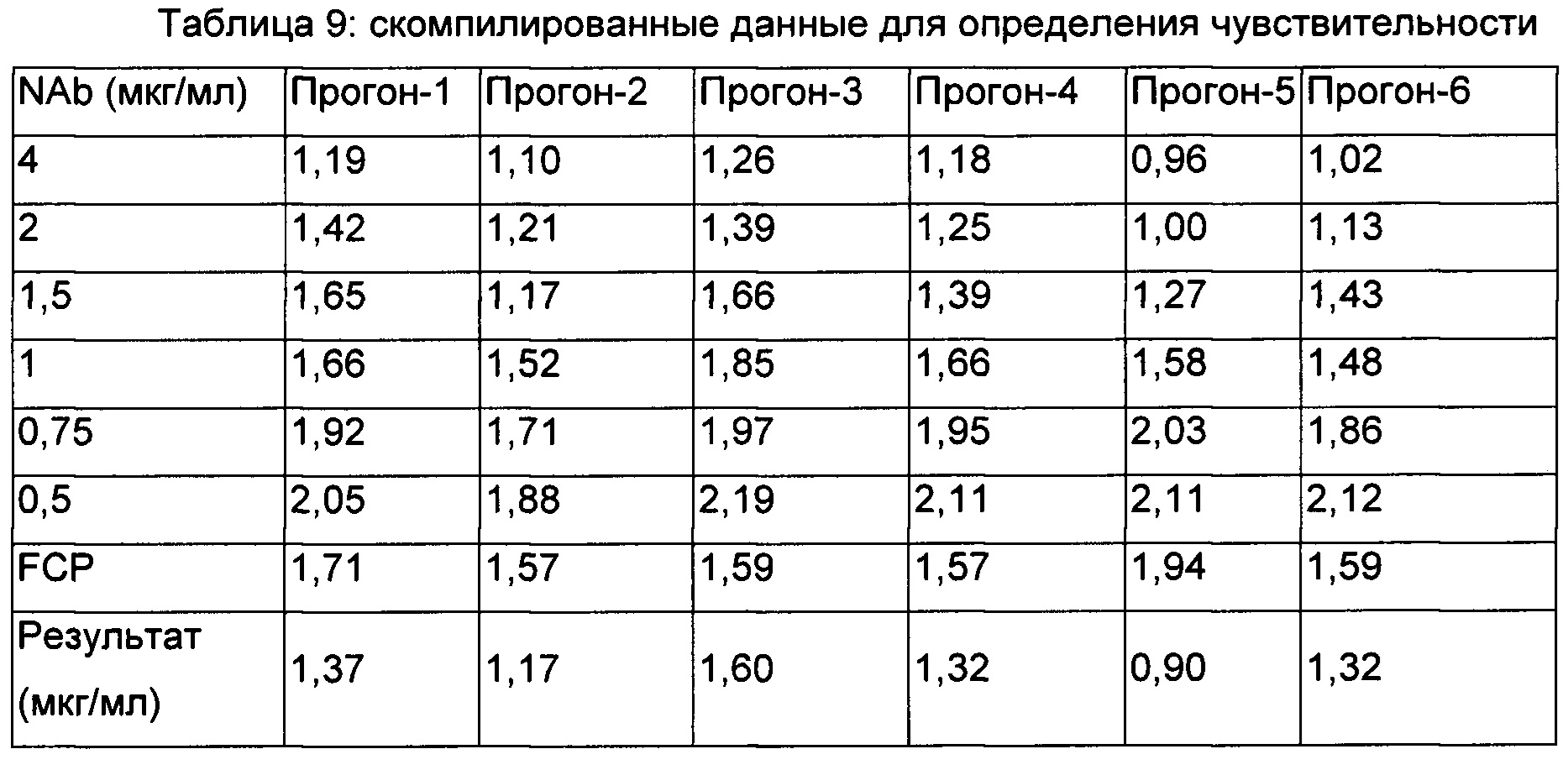
MoR рассчитывали для каждого образца для определения чувствительности, с последующим определением среднего MoR для каждого прогона путем расчета среднего значения трех наборов. Плавающая точка деления, специфичная в отношении прогона, была определена как среднее отношение NSB × нормирующий множитель. Для каждого прогона для определения чувствительности получали 4 кривые PL посредством отложения среднего MoR по ординате и концентрации по абсциссе, как представлено на Фиг. 2. Концентрацию плавающих точек деления, специфичных в отношении прогона, определяли посредством соответствующих кривых. Определяли log концентраций, полученных путем обратного рассчета, и рассчитывали среднее значение и SD.
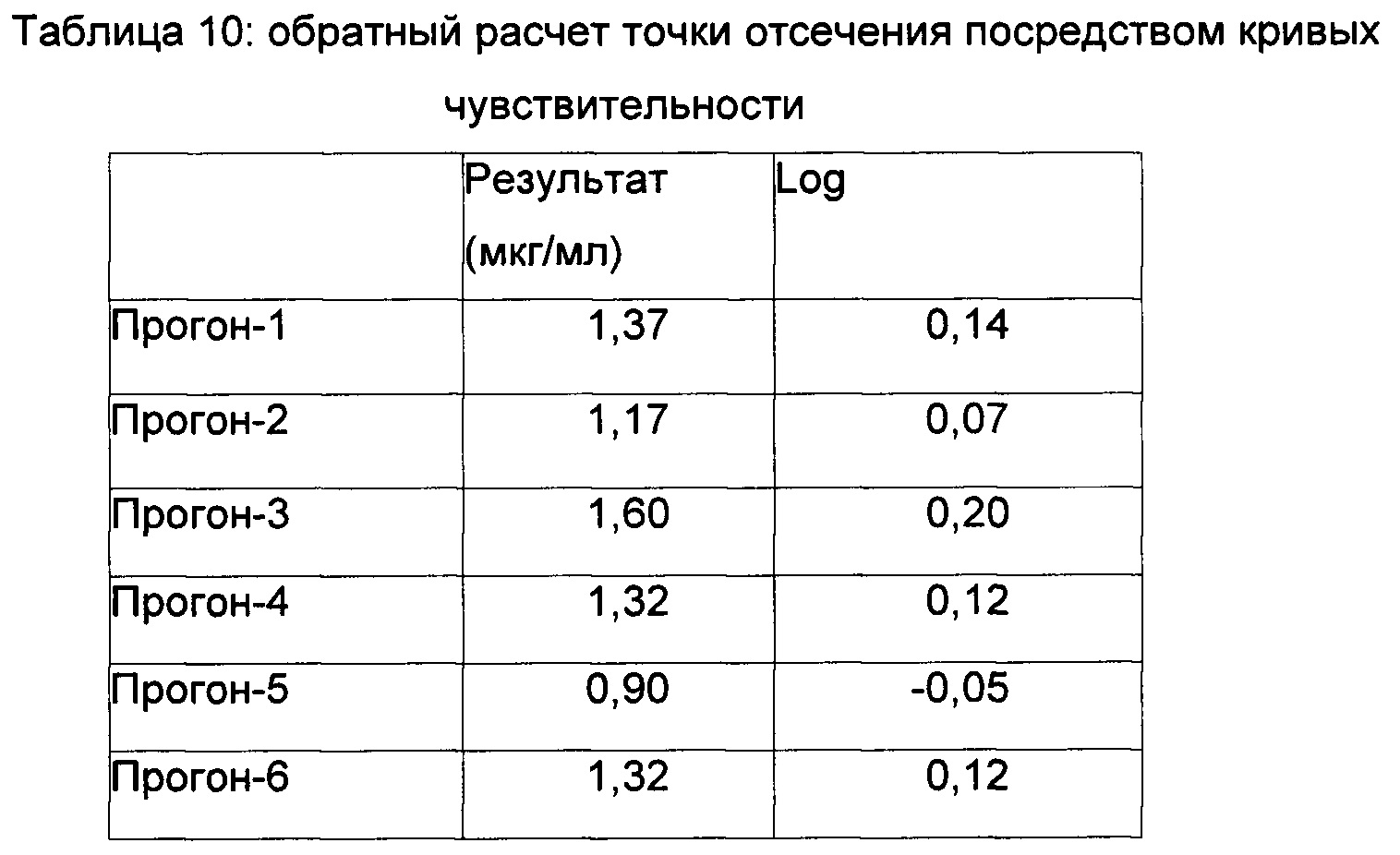
Определение чувствительности -
Среднее равно 0,10
SD равно 0,08
Среднее + t0,05 df × SD=0,10+2,015×0,08=0,25
Антилогарифм равен 1,8 мкг/мл
Чувствительность с 95%-ной взаимосогласованностью определяли с использованием формулы Среднее + t 0,05 df × SD, где t 0,05 представляет собой критическое значение, определенное из t-распределения, соответстующего 5%-ной доле ложноположительных значений, и «df» представляет собой степени свободы (N-1).
Определение низкого позитивного контроля (LPC):
LPC определяли посредством набора данных по чувствительности с использованием формулы:
Среднее + t0,01 df × SD
Среднее равно 0,10
SD равно 0,08
Среднее + t0,01 df × SD=0,10+3,365×0,08=0,36
Антилогарифм равен 2,3 мкг/мл
Позитивные контроли для дальнейшего анализа -
Высокий позитивный контроль (НРС) - 4 мкг/мл
Низкий позитивный контроль (LPC) - 2,5 мкг/мл
Определение точности анализа:
Набор данных по чувствительности использовали для установления точности анализа.
Точность рассчитывали в следующих частях -
Точность внутри суток - вариация между тремя наборами препаратов PC.
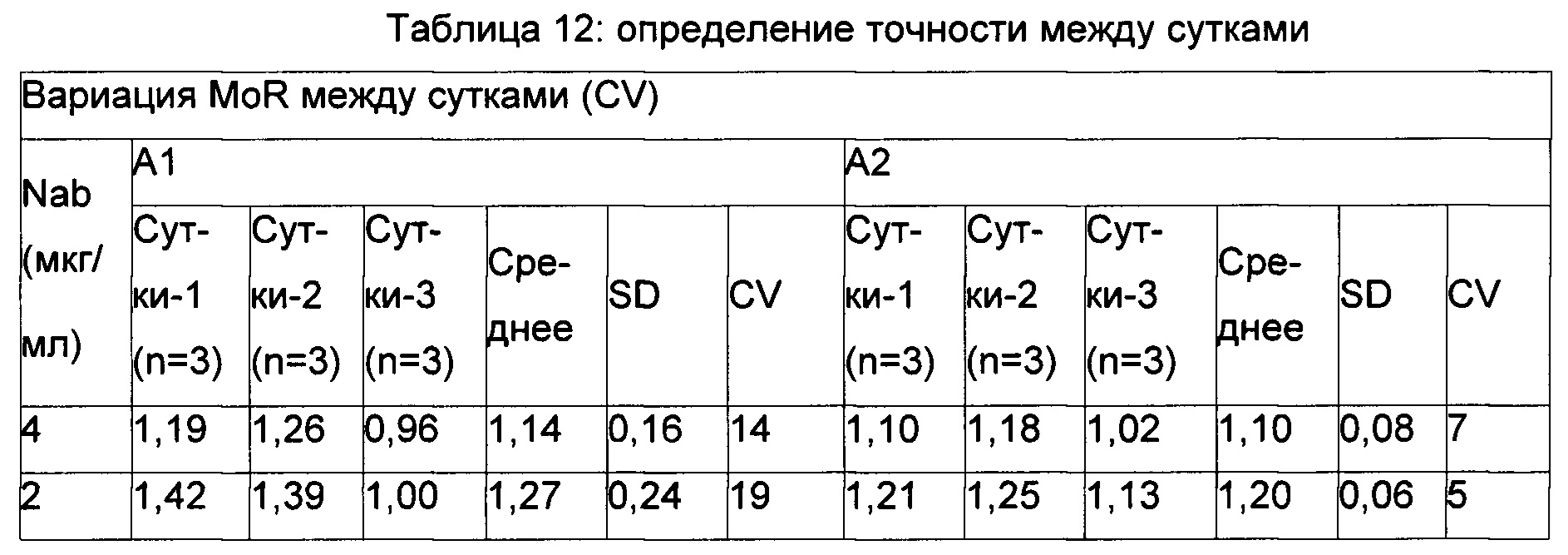
Точность между сутками - вариация между средним трех препаратов в трое разных суток.
Точность между аналитиками - вариация между средними трех препаратов, проанализированных двумя аналитиками.
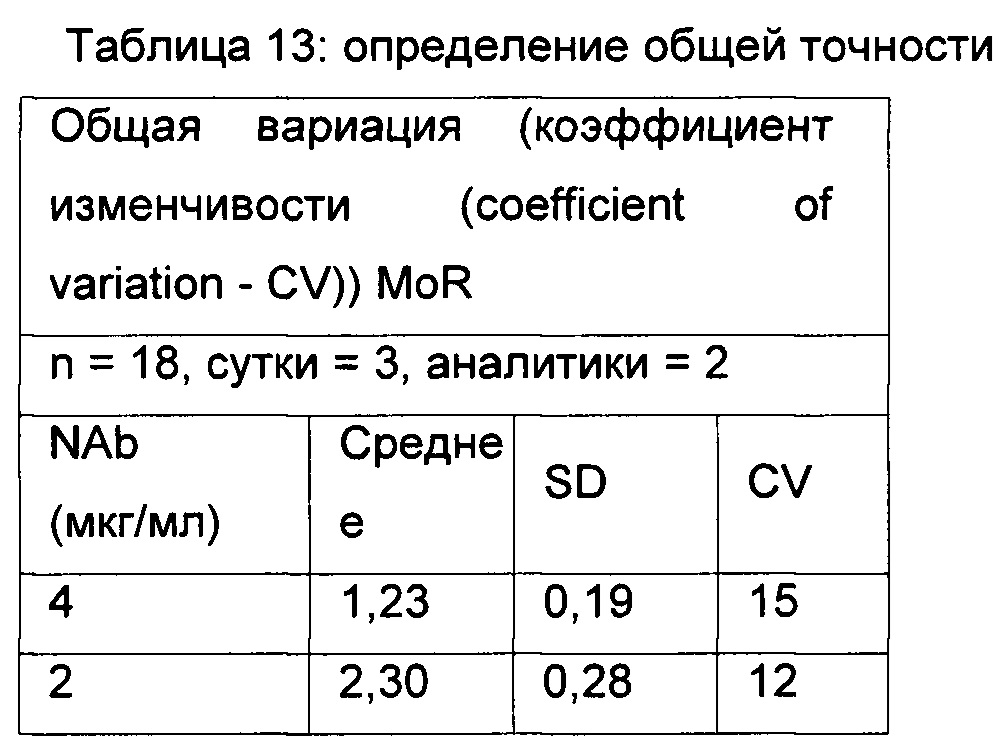
Общая точность - вариация прогонов всех шести наборов в каждые из трех суток при анализе двумя аналитиками.
Результат:
Неточность MoR рассчитывали и приводили в виде коэффициента вариации (CV) и определяли посредством применения формулы - среднеквадратическое отклонение / среднее × 100.
Точность определяли из НРС (4 мкг/мл) и LPC (2 мкг/мл).
Данные по точности представлены в Таблицах 11-13.


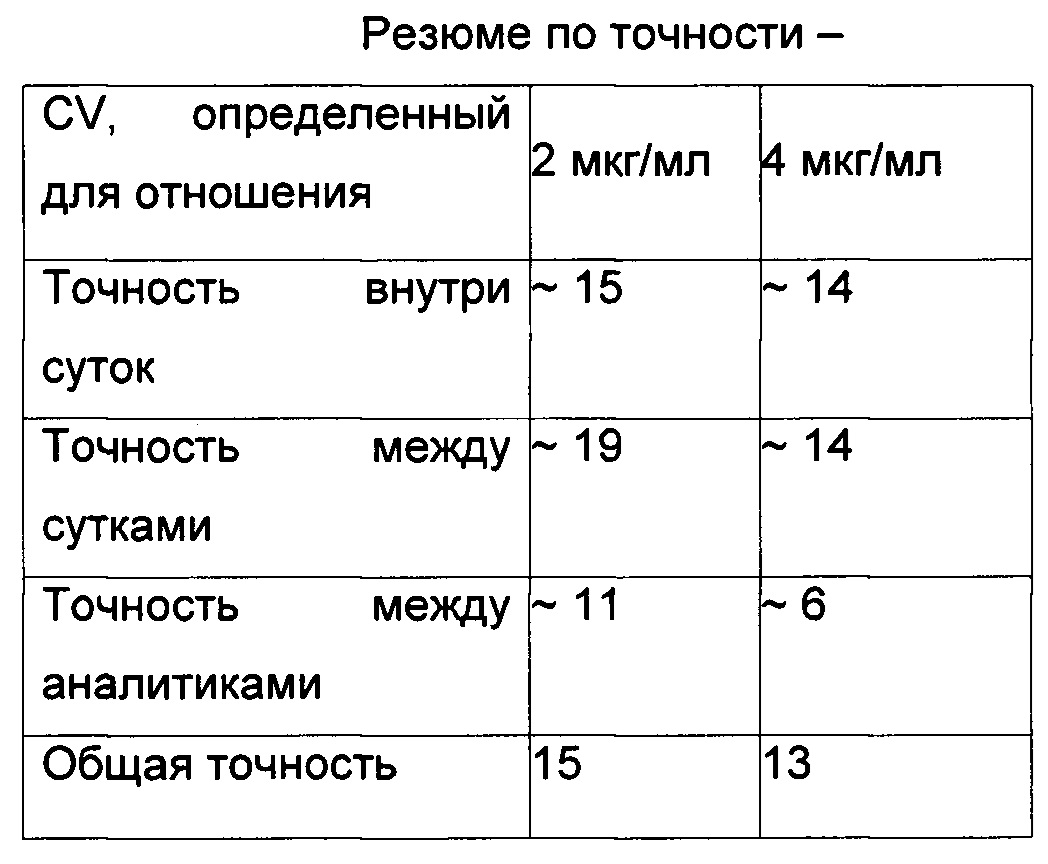
Было обнаружено, что данный анализ является точным, так как точность и внутри и между составляла меньше 20 при обоих уровнях PC.
Определение специфичности анализа:
Кроличье антитело против пептида добавляли в NPHS с уровнями НРС и LPC (4 и 2,5 мкг/мл) и оценивали в данном анализе наряду с антителом против RHI. Два прогона на специфичность повторяли в двое разных суток.
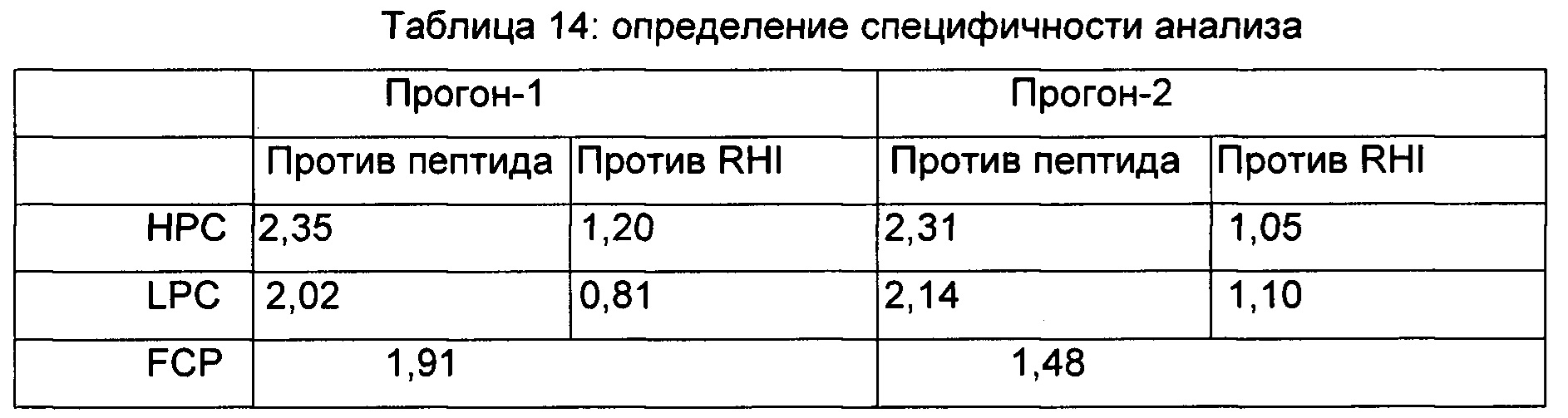
Образцы PC антитела кролика против пептида были негативными в данном анализе, тогда как образцы PC антитела против RHI были позитивными в отношении нейтрализующей активности, таким образом, устанавливая специфичность анализа в отношении антитела против RHI.
Определение селективности анализа:
Селективность оценивали с использованием 10 индивидуальных образцов нормальной человеческой сыворотки (5 мужчин плюс 5 женщин), наряду с образцом нормальной смешанной человеческой сыворотки. В каждый образец добавляли антитело против RHI с уровнями LPC и НРС, и анализировали в анализе NAb. Два прогона осуществляли в двое разных суток.
Результат:
i. MoR определяли для каждого образца для селективности.
ii. Определяли плавающую точку деления.
iii. Образцы с ответом, меньшим или равным плавающей точке деления, определяли как позитивные.
Данные по селективности представлены в Таблице 15.
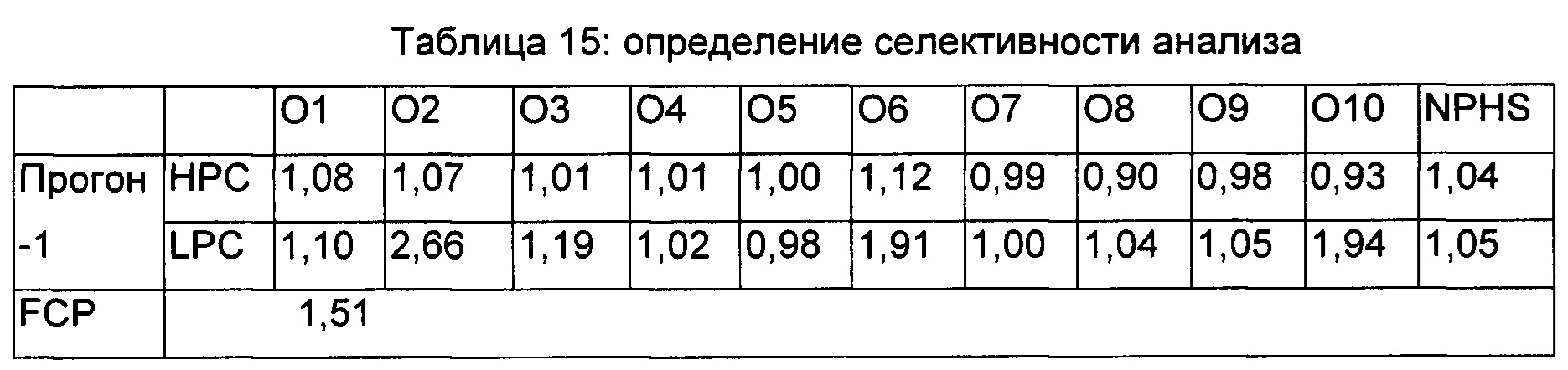
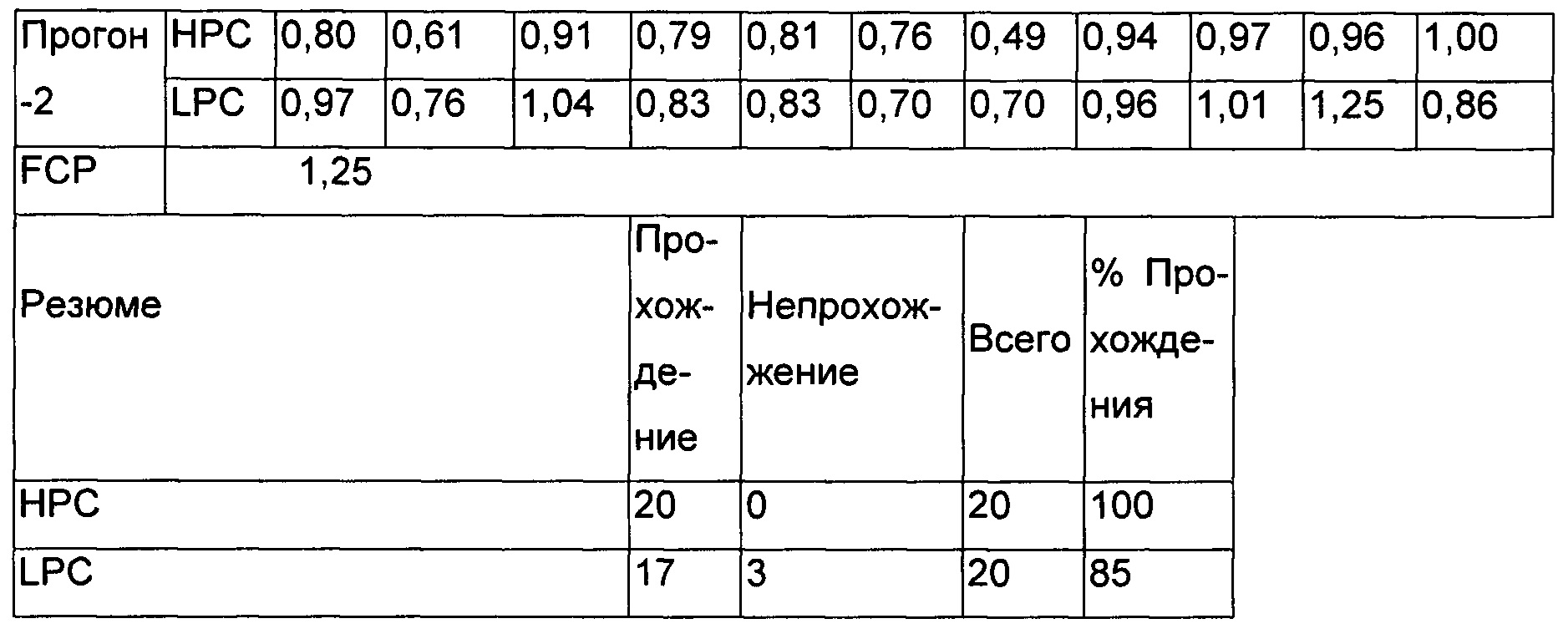
В прогоне-1 и прогоне-2 все образцы НРС на селективность были позитивными в отношении нейтрализующей активности, 3 из 10 образцов LPC демонстрировали негативный нейтрализующий ответ, тогда как все образцы LPC на селективность были позитивными в отношении нейтрализующего ответа в прогоне-2. Следовательно, 100% образцов НРС и 85% образцов LPC были позитивными в отношении нейтрализующего ответа. Образцы LPC и НРС, приготовленные в NPHS, были позитивными в обоих прогонах.
Определение селективности анализа в матриксе при заболевании: Селективность в матриксе при заболевании оценивали посредством добавления антитела против RHI в шесть индивидуальных образцов от пациента с Т1 DM (сахарный диабет типа 1) (4 мужчины и 2 женщины) с уровнями НРС и LPC.
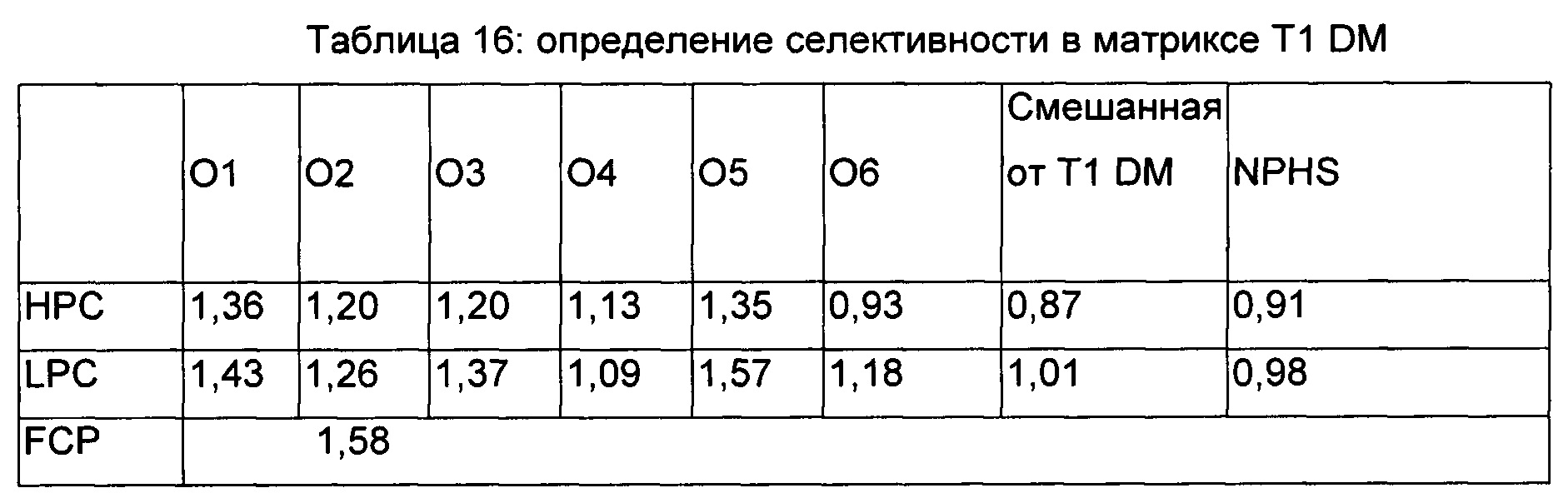
Образцы НРС и LPC в шести матриксах от заболевания, смешанный матрикс от заболеваний (объединение от 12 индивидов) и NPHS демонстрировали позитивный нейтрализующий ответ, который свидетельствует о том, что данный анализ является селективным для выявления антител против RHI.
Определение толерантности к лекарственному средству:
Cmax у пациентов с сахарным диабетом Типа 1 при терапии RHI составляет ~ 100 mU/л, что эквивалентно 3,5 нг/мл RHI. Антитело против RHI при обоих уровнях образовало комплексы с вплоть до 500 нг/мл RHI, что ~ в 140 раз больше, чем ожидаемая Cmax.
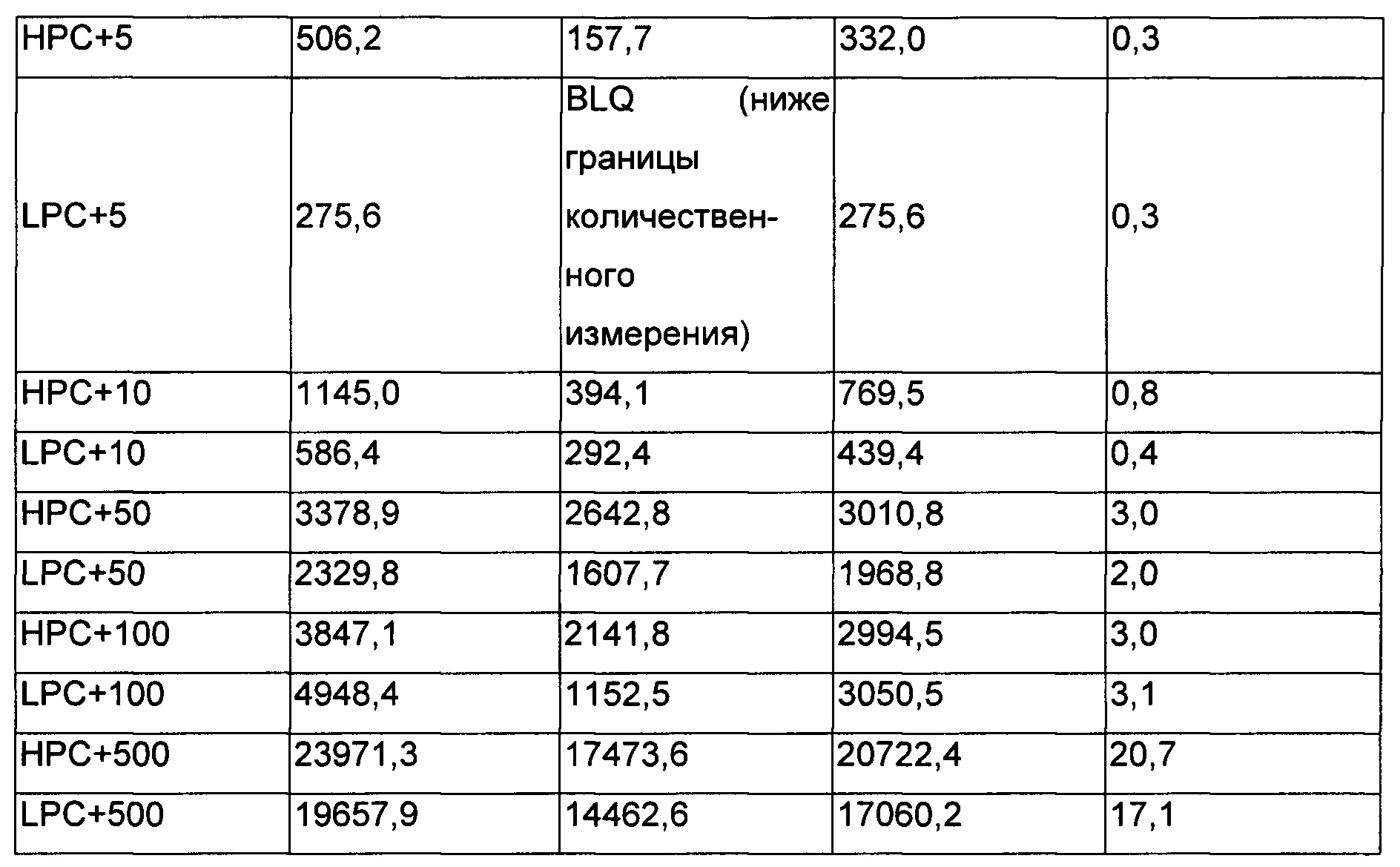
Комплексы НРС и LPC готовили с 5, 10, 50, 100 и 500 нг/мл RHI. Оценку обеднения RHI и выхода антитела против RHI после обработки образца проводили посредством анализа RHI на основе MSD и анализа антитела против RHI на основе ELISA (твердофазный иммуноферментый анализ) соответственно.
Иммунные комплексы (после обработки образца) также оценивали в анализе нейтрализации. В двое разных суток проводили два погона.
В прогоне-1 НРС и LPC образовали комплекс с 10, 100 и 500 нг/мл RHI, тогда как в прогоне-2 НРС и LPC образовали комплекс с 5, 10, 20, 50 и 100 нг/мл RHI. В обоих прогонах антитело против RHI без комплекса тестировали в качестве контроля.
Оценка обедненного RHI:
Обеднение RHI после обработки образца оценивали посредством анализа RHI на основе MSD. Данный анализ представляет собой сэндвич-анализ, в котором RHI в обработанных или необработанных образцах захватывается моноклональным антителом против RHI, которым покрыт планшет MDS, а дальнейшее выявление осуществляется моноклональным антителом против RHI, меченным сульфо-меткой. Данные по обеднению RHI после обработки образца представлены в Таблице 17.
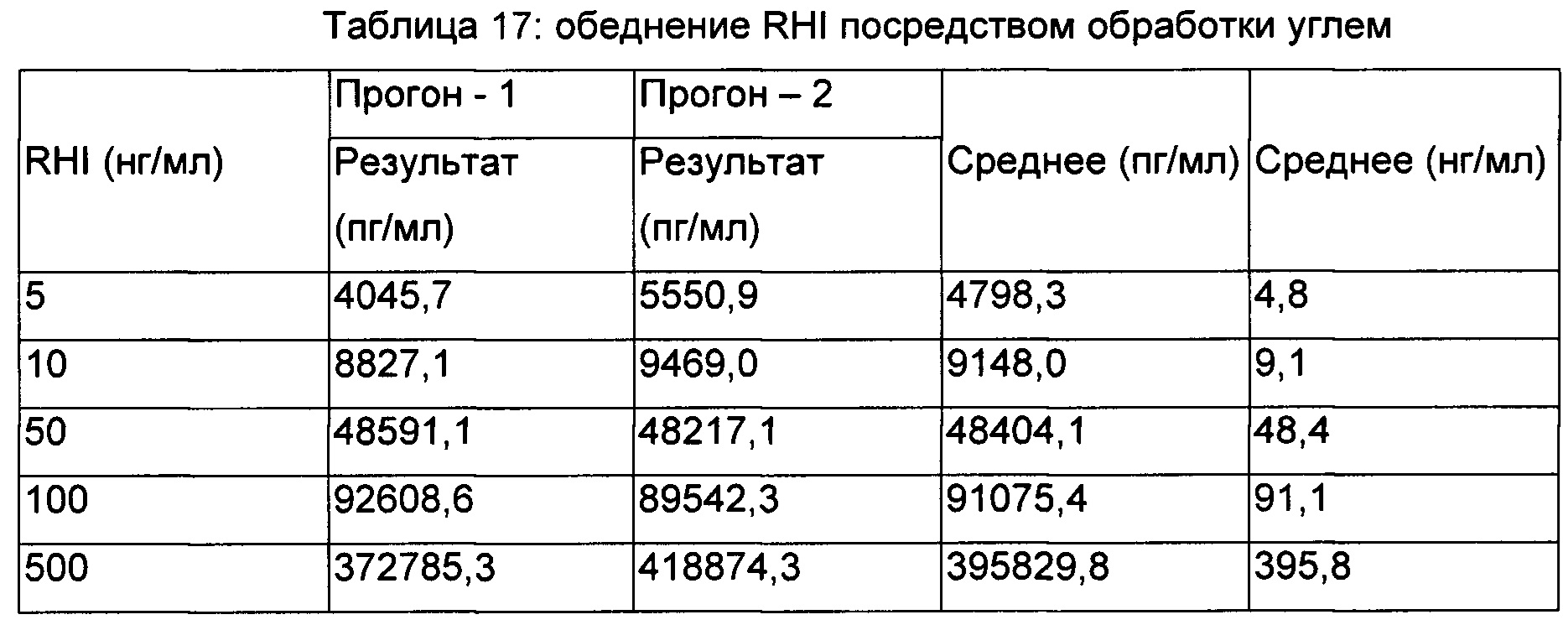
Обеднение RHI посредством обработки углем представлено на Фиг. 3.
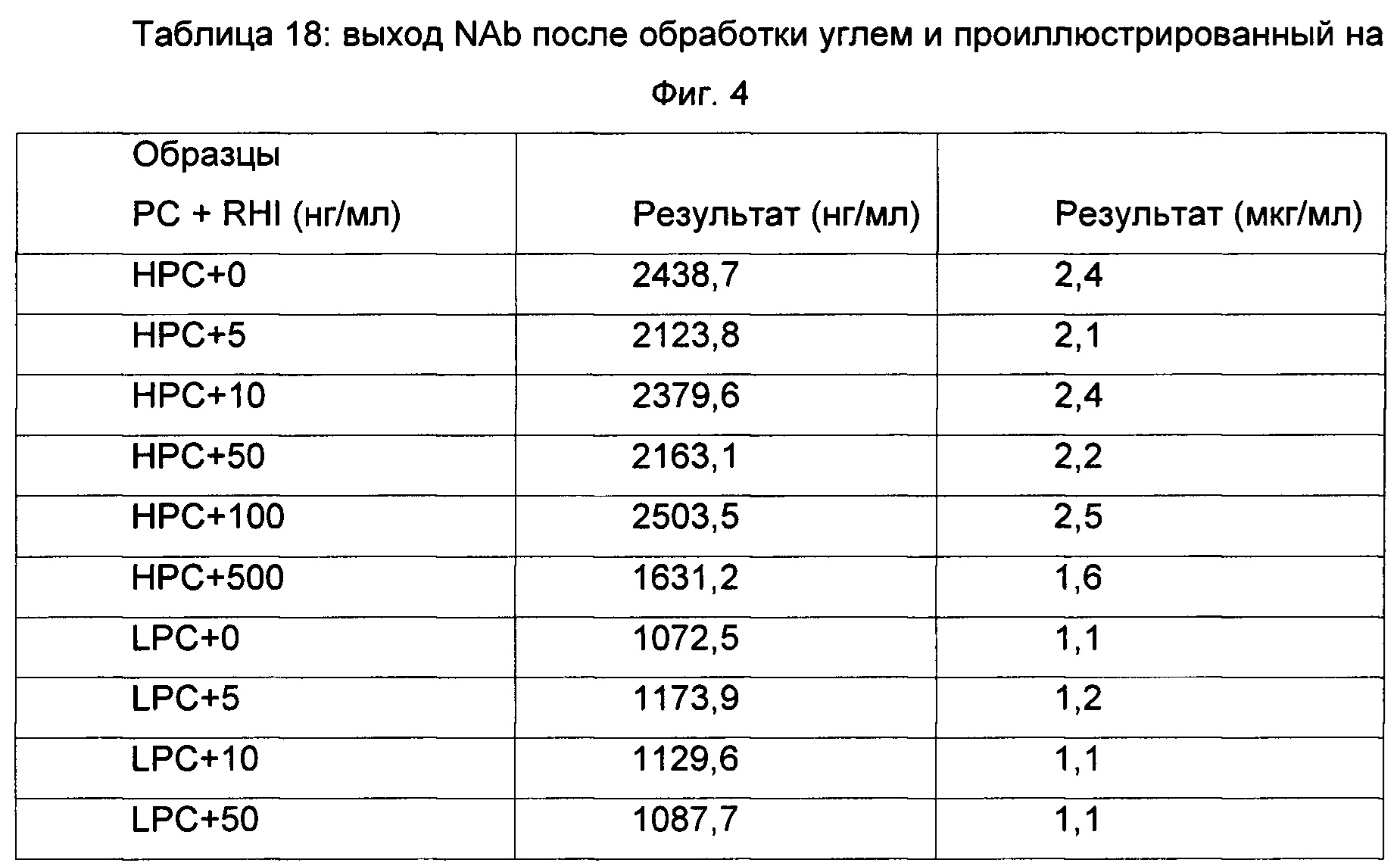
Оценка выхода NAb после обработки образца:
Выделение NAb из иммунных комплексов после обработки определяли посредством ELISA против RHI.
Оценка толерантности к лекарственному средству посредством анализа нейтрализации:
i. MoR определяли для каждого образца для определения толерантности к лекарственному средству.
ii. Определяли плавающую точку деления.
iii. Образцы с MoR, меньшей или равной FCP (плавающая точка деления), определяли как позитивные в отношении нейтрализующего ответа против RHI.


Наблюдали более чем 90%-ное обеднение RHI из иммунного комплекса после обработки образца. Выход NAb после обработки из некомплексированного образца составлял вплоть до 60%, выход НРС в присутствии 5-100 нг/мл RHI варьировал от 53 до 63%, но в присутствии 500 нг/мл RHI выход составлял лишь 41%. Выход LPC из комплексов с 0-100 нг/мл RHI варьировал от 43 до 54%, тогда как в присутствии 500 нг/мл RHI составлял лишь 36%.
Данные по обеднению и выходу коррелировали с данными анализа нейтрализации, где в прогоне-1 LPC не демонстрировал позитивного нейтрализующего ответа в присутствии 500 нг/мл RHI. Обнаружили то, что НРС выдерживает вплоть до 500 нг/мл (16,5 U/л) RHI, a LPC - вплоть до 100 нг/мл (3,3 U/л) RHI.