Результат интеллектуальной деятельности: Терапевтические антитела и их применения
Вид РИД
Изобретение
Область изобретения
Настоящее изобретение относится к антителам, например к полноразмерным антителам или их антигенсвязывающим фрагментам, которые специфично связываются с ВСМА (антиген созревания В-клеток) и/или с CD3 (кластер дифференцировки 3). Изобретение также относится к конъюгатам антител (например к конъюгатам антитело-лекарственное средство), содержащим ВСМА-антитела, к композициям, содержащим ВСМА-антитела, и к способам использования ВСМА-антител и их конъюгатов для лечения состояний, ассоциированных с клетками, экспрессирующими ВСМА, (например рака или аутоиммунных заболеваний). Изобретение также относится к гетеромультимерным антителам, которые специфично связываются с CD3 и с опухолевым клеточным антигеном (например к биспецифическим антителам, которые специфично связываются с CD3 и ВСМА). Также предложены композиции, содержащие такие гетеромультимерные антитела, способы получения и очистки таких гетеродимерных антител и их применение в диагностике и терапии.
Предшествующий уровень техники
Антиген созревания В-клеток (ВСМА, CD269 или TNFRSF17) является представителем суперсемейства рецептора фактора некроза опухоли (TNFR). ВСМА был идентифицирован в злокачественной Т-клеточной лимфоме человека, содержащей транслокацию t(4;16). Ген избирательно экспрессируется в B-клеточной линии, с самым высоким уровнем экспрессии в плазматических бластных клетках и в плазматических клетках, клетках, секретирующих антитела. ВСМА связывается с двумя лигандами, фактором активации В-клеток (BAFF) (также называемым стимулятором В-лимфоцитов (BLyS) и экспрессируемый лейкоцитами лиганд, родственный Apol (TALL-1)) и лигандом, индуцирующим пролиферацию (APRIL) с аффинностью 1 мкМ и 16 нМ соответственно. Связывание APRIL или BAFF с ВСМА стимулирует сигнальный каскад, включающий NF-каппа В, Elk-1, c-Jun N-концевую киназу и митоген-активируемую протеинкиназу р38, которые продуцируют сигналы для выживания и пролиферации клеток.
ВСМА также экспрессируется на злокачественных В-клетках и в нескольких типах рака, в которые вовлечены В-лимфоциты, в том числе множественную миелому, плазмоцитому, лимфому Ходжкина и хронический лимфоцитарный лейкоз. При аутоиммунных заболеваниях, в которые вовлечены плазмобласты, таких как системная красная волчанка (SLE) и ревматоидный артрит, ВСМА-экспрессирующие антителопродуцирующие клетки секретируют аутоантитела, которые атакуют сами себя.
В случае множественной миеломы примерно 24000 новых случаев диагностируют каждый год в Соединенных Штатах, и это число составляет примерно 15% от вновь диагностированных гематологических раковых заболеваний в Соединенных Штатах. В среднем 11000 смертей приходится на множественную миелому каждый год, и средняя 5-летняя выживаемость составляет около 44%, при средней выживаемости 50-55 месяцев. Современное лечение множественной миеломы сосредоточено на апоптозе плазмоцитов и/или уменьшении активности остеокластов (например химиотерапия, талидомид, леналидомид, бисфосфонаты и/или ингибиторы протеасом, такие как бортезомиб (VELCADE®) или карфилзомиб). Однако множественная миелома остается неизлечимой болезнью, и почти у всех пациентов развивается резистентность к этим агентам и в конечном итоге наступает рецидив. Соответственно, альтернативное лечение множественной миеломы, такое как использование антагониста ВСМА, в том числе антител и других иммунотерапевтических агентов (например биспецифических антител или конъюгатов антитела с лекарственным средством), позволит создать эффективный терапевтический агент.
Краткое изложение сущности изобретения
Изобретение, раскрытое в данном документе, относится к терапевтическим антителам, которые связываются с ВСМА и/или с CD3. Также предложены конъюгаты антител (например конъюгаты антитело-лекарственное средство), содержащие ВСМА. Кроме того, предложены гетеромультимерные антитела (например биспецифические антитела), которые специфично связываются с CD3 и антигеном опухолевых клеток (например биспецифические антитела, которые специфично связываются с CD3 и ВСМА).
В одном аспекте изобретения предложено выделенное антитело или его антигенсвязывающий фрагмент, которое(ый) специфично связывается с антигеном созревания В-клеток (ВСМА), где антитело содержит (а) вариабельную область тяжелой цепи (VH), содержащую (1) участок, определяющий комплементарность, один (CDR1) VH, содержащий последовательность SYX1MX2, где X1 представляет собой А или Р; и Х2 представляет собой Т, N или S (SEQ ID NO: 301), GFTFX1SY, где X1 представляет собой G или S (SEQ ID NO: 302), или GFTFX1SYX2MX3, где X1 представляет собой G или S, X2 представляет собой А или Р; и Х3 представляет собой Т, N или S (SEQ ID NO: 303); (2) VH CDR2, содержащий последовательность AX1X2X3X4GX5X6X7X8YADX9X10KG, где X1 представляет собой I, V, Т, Н, L, А или С; Х2 представляет собой S, D, G, Т, I, L, F, М или V; Х3 представляет собой G, Y, L, Н, D, A, S или М; Х4 представляет собой S, Q, Т, А, F или W; Х5 представляет собой G или Т; Х6 представляет собой N, S, Р, Y, W или F; Х7 представляет собой S, Т, I, L, Т, A, R, V, K, G или С; Х8 представляет собой F, Y, Р, W, Н или G; Х9 представляет собой V, R или L; и Х10 представляет собой G или Т (SEQ ID NO: 305) или X1X2X3X4X5X6, где X1 представляет собой S, V, I, D, G, Т, L, F или М; Х2 представляет собой G, Y, L, Н, D, A, S или М; Х3 представляет собой S, G, F или W; Х4 представляет собой G или S; Х5 представляет собой G или Т; и Х6 представляет собой N, S, Р, Y или W (SEQ ID NO: 306); и 3) VH CDR3, содержащий последовательность VSPIX1X2X3X4, где X1 представляет собой А или Y; Х2 представляет собой А или S; и Х3 представляет собой G, Q, L, Р или Е (SEQ ID NO: 307), или YWPMX1X2, где X1 представляет собой D, S, Т или А; и Х2 представляет собой I, S, L, Р или D (SEQ ID NO: 308); и/или (б) вариабельную область легкой цепи (VL), содержащую (1) VL CDR1, содержащий последовательность X1X2X3X4X5X6X7X8X9X10X11X12, где X1 представляет собой R, G, W, А или С; Х2 представляет собой А, Р, G, L, С или S; Х3 представляет собой S, G или R; Х4 представляет собой Q, С, Е, V или I; Х5 представляет собой S, Р, G, A, R или D; Х6 представляет собой V, G, I или L; Х7 представляет собой S, Е, D, Р или G; Х8 представляет собой S, Р, F, А, М, Е, V, N, D или Y; Х9 представляет собой I, Т, V, Е, S, А, М, Q, Y, Н, R или F; X10 представляет собой Y или F; X11 представляет собой L, W или Р; и X12 представляет собой A, S или G (SEQ ID NO: 309); (2) VL CDR2, содержащий последовательность X1ASX2RAX3, где X1 представляет собой G или D; Х2 представляет собой S или I; и Х3 представляет собой Т или Р (SEQ ID NO: 310); и (3) VL CDR3, содержащий последовательность QQYX1X2X3PX4T, где X1 представляет собой G, Q, Е, L, F, A, S, М, K, R или Y; X2 представляет собой S, R, Т, G, V, F, Y, D, А, Н, V, Е, K или С; Х3 представляет собой W, F или S; и Х4 представляет собой L или I (SEQ ID NO: 311), или QQYX1X2X3PX4, где X1 представляет собой G, Q, Е, L, F, A, S, М, R, K или Y; X2 представляет собой S, R, Т, G, R, V, D, А, Н, Е, K, С, F или Y; Х3 представляет собой W, S или F; и Х4 представляет собой L или I (SEQ ID NO: 312).
В другом аспекте изобретения предложено выделенное антитело или его антигенсвязывающий фрагмент, которое(ый) специфично связывается с ВСМА, где антитело содержит: область VH, содержащую VH CDR1, VH CDR2 и VH CDR3 последовательности VH, представленной в SEQ ID NO: 2, 3, 7, 8, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 35, 37, 39, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 83, 87, 92, 95, 97, 99, 101, 104, 106, 110, 112, 114, 118, 120, 122, 125, 127, 313, 314, 363 или 365; и/или область VL, содержащую VL CDR1, VL CDR2 и VL CDR3 последовательности VL, представленной в SEQ ID NO: 1, 4, 5, 6, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 34, 36, 38, 40, 41, 43, 45, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75, 77, 79, 317, 81, 82, 84, 85, 86, 88, 89, 90, 91, 93, 94, 96, 98, 100, 102, 103, 105, 107, 108, 109, 111, 113, 115, 116, 117, 119, 121, 123, 124, 126, 128, 315, 316 или 364. В некоторых воплощениях область VH содержит (1) VH CDR1, содержащий SEQ ID NO: 150, 151, 152, 156 или 157; (2) VH CDR2, содержащий SEQ ID NO: 169, 154, 194, 159, 195, 196, 162, 158, 198, 177, 178, 199, 200, 201, 202, 203, 204, 206, 207, 208, 172, 203 или 204; и (3) VH CDR3, содержащий SEQ ID NO: 155, 161, 197, 205 или 164; и/или где область VL содержит (1) VL CDR1, содержащий SEQ ID NO: 209, 271, 273, 275, 251, 277, 260, 279, 245, 283, 285, 287, 290, 292, 235, 297 или 299; (2) VL CDR2, содержащий SEQ ID NO: 221; и (3) VL CDR3, содержащий SEQ ID NO: 225, 272, 274, 276, 278, 280, 281, 282, 284, 286, 288, 289, 291, 293, 294, 229, 296, 298 или 300. В некоторых воплощениях область VH содержит последовательность, представленную в SEQ ID NO: 112, или вариант с одной или несколькими консервативными аминокислотными заменами в остатках, которые не входят в CDR, и/или область VL содержит аминокислотную последовательность, представленную в SEQ ID NO: 38, или ее вариант с одной или несколькими аминокислотными заменами, которые не входят в CDR. В некоторых воплощениях антитело содержит легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 357, и тяжелую цепь, содержащую последовательность, представленную в SEQ ID NO: 358. В некоторых воплощениях антитело содержит область VH, продуцируемую экспрессионным вектором с регистрационным номером АТСС РТА-122094. В некоторых воплощениях антитело содержит область VL, продуцируемую экспрессионным вектором с регистрационным номером АТСС РТА-122093.
В другом аспекте изобретения предложено выделенное антитело, содержащее ацил-донорный глутамин-содержащий тег, созданный на конкретном сайте ВСМА-антитела по настоящему изобретению. В некоторых воплощениях, этот тег содержит аминокислотную последовательность, выбранную из группы, состоящей из Q, LQG, LLQGG (SEQ ID NO: 318), LLQG (SEQ ID NO: 454), LSLSQG (SEQ ID NO: 455), GGGLLQGG (SEQ ID NO: 456), GLLQG (SEQ ID NO: 457), LLQ, GSPLAQSHGG (SEQ ID NO: 458), GLLQGGG (SEQ ID NO: 459), GLLQGG (SEQ ID NO: 460), GLLQ (SEQ ID NO: 461), LLQLLQGA (SEQ ID NO: 462), LLQGA (SEQ ID NO: 463), LLQYQGA (SEQ ID NO: 464), LLQGSG (SEQ ID NO: 465), LLQYQG (SEQ ID NO: 466), LLQLLQG (SEQ ID NO: 467), SLLQG (SEQ ID NO: 468), LLQLQ (SEQ ID NO: 469), LLQLLQ (SEQ ID NO: 470), LLQGR (SEQ ID NO: 471), LLQGPP (SEQ ID NO: 472), LLQGPA (SEQ ID NO: 473), GGLLQGPP (SEQ ID NO: 474), GGLLQGA (SEQ ID NO: 475), LLQGPGK (SEQ ID NO: 476), LLQGPG (SEQ ID NO: 477), LLQGP (SEQ ID NO: 478), LLQP (SEQ ID NO: 479), LLQPGK (SEQ ID NO: 480), LLQAPGK (SEQ ID NO: 481), LLQGAPG (SEQ ID NO: 482), LLQGAP (SEQ ID NO: 483), и LLQLQG (SEQ ID NO: 484).
В одном варианте изобретения предложено выделенное антитело, содержащее ацил-донорный глутамин-содержащий тег и аминокислотную модификацию в положениях 222, 340 или 370 ВСМА-антитела по настоящему изобретению. В некоторых воплощениях аминокислотная модификация представляет собой замену лизина на аргинин.
В некоторых воплощениях ВСМА-антитело по настоящему изобретению дополнительно содержит линкер. В некоторых воплощениях линкер выбран из группы, состоящей из Ac-Lys-Gly (ацетил-лизин-глицин), аминокапроновой кислоты, Ac-Lys-β-Ala (ацетил-лизин-β-аланин), амино-РЕG2 (полиэтиленгликоль)-С2, амино-PEG3-С2, амино-PEG6-С2, Ac-Lys-Val-Cit-PABC (ацетил-лизин-валин-цитруллин-пара-аминобензилоксикарбонил), амино-PEG6-C2-Val-Cit-PABC, аминокапроил-Val-Cit-PABC, [(3R,5R)-1-{3-[2-(2-аминоэтокси)этокси]пропаноил}пиперидин-3,5-диил]бис-Val-Cit-РАВС, [(3S,5S)-1-{3-[2-(2-аминоэтокси)этокси]пропаноил}пиперидин-3,5-диил] бис-Val-Cit-PABC, путресцина и Ac-Lys-путресцина.
В другом аспекте изобретения предложен конъюгат ВСМА-антитела или антигенсвязывающего фрагмента, как описано в данном документе, где антитело или антигенсвязывающий фрагмент конъюгирован с агентом, выбранным из группы, состоящей из цитотоксического агента, иммуномодулирующего агента, агента визуализации, терапевтического белка, биополимера и олигонуклеотида. В некоторых воплощениях агент представляет собой цитотоксический агент, включающий, без ограничения ими, антрациклин, ауристатин, камптотецин, комбретастатин, доластатин, дуокармицин, энедиин, гелданамицин, индолино-бензодиазепиновый димер, майтанзин, пуромицин, пирролбензодиазепиновый димер, таксан, алкалоид барвинка, тубулизин, гемиастерлин, сплайсостатин, пладиенолид и их стереоизомеры, изостеры, аналоги или производные. Например, цитотоксический агент представляет собой MMAD (Монометил-ауристатин D), 0101 (2-метилаланил-N-[(3R,4S,5S)-3-метокси-1-{(2S)-2-[(1R,2R)-1-метокси-2-метил-3-оксо-3-{[(1S)-2-фенил-1-(1,3-тиазол-2-ил)этил]амино}пропил]пирролидин-1-ил}-5-метил-1-оксогептан-4-ил]-N-метил-L-валинамид), 3377 (N,2-диметилаланил-N-{(1S,2R)-4-{(2S)-2-[(1R,2R)-3-{[(1S)-1-карбоксил-2-фенилэтил]амино}-1-метокси-2-метил-3-оксопропил]пирролидин-1-ил}-2-метокси-1-[(1S)-1-метилпропил]-4-оксобутил}-N-метил-L-валинамид), 0131 (2-метил-L-пролил-N-[(3R,4S,5S)-1-{(2S)-2-[(1R,2R)-3-{[(1S)-1-карбокси-2-фенилэтил]амино}-1-метокси-2-метил-3-оксопропил]пирролидин-1-ил}-3-метокси-5-метил-1-оксогептан-4-ил]-N-метил-L-валинамид) или 0121 (2-метил-L-пролил-N-[(3R,4S,5S)-1-{(2S)-2-[(1R,2R)-3-{[(2S)-1-метокси-1-оксо-3-фенилпропан-2-ил]амино}-1-метокси-2-метил-3-оксопропил]пирролидин-1-ил}-3-метокси-5-метил-1-оксогептан-4-ил]-N-метил-L-валинамид).
В некоторых воплощениях настоящего изобретения предложен конъюгат, включающий формулу: антитело-(ацил-донорный глутамин-содержащий тег)-(линкер)-(цитотоксический агент). В некоторых воплощениях ацил-донорный глутамин-содержащий тег содержит аминокислотную последовательность LLQG (SEQ ID NO: 319) и/или GGLLQGPP (SEQ ID NO: 339), и линкер содержит ацетил-лизин-валин-цитруллин-пара-аминобензилоксикарбонил или амино-PEG6-C2. В некоторых воплощениях конъюгат выбран из группы, состоящей из 1) антитело-GGLLQGPP (SEQ ID NO: 339)-(ацетил-лизин-валин-цитруллин-пара-аминобензилоксикарбонил (AcLys-VC-PABC))-0101; 2) антитело-LLQG (SEQ ID NO: 319)-амино-PEG6-С2-0131; и 3) антитело-LLQG (SEQ ID NO: 319)-амино-PEG6-C2-3377. В некоторых воплощениях конъюгат дополнительно содержит аминокислотную замену лизина на аргинин в положении 222 антитела. В некоторых воплощениях конъюгат дополнительно содержит аминокислотные замены в положении N297Q или N297A антитела.
В другом аспекте предложен способ получения ВСМА-антитела, как описано в данном документе, включающий культивирование клеток-хозяев в условиях, которые приводят к продуцированию ВСМА-антител, и выделение ВСМА-антител из клеток-хозяев или культуры.
В другом аспекте изобретения предложено применение ВСМА-антител или конъюгатов ВСМА-антител, как описано в данном документе, в изготовлении лекарственного средства для лечения состояния (например рака или аутоиммунного нарушения), ассоциированного с экспрессией ВСМА. В некоторых воплощениях предложено применение ВСМА-антител или конъюгатов ВСМА-антител, как описано в данном документе, в изготовлении лекарственного средства для ингибирования роста или прогрессирования опухоли. В некоторых воплощениях предложено применение ВСМА-антител или конъюгатов ВСМА-антител, как описано в данном документе, в изготовлении лекарственного средства для ингибирования метастаз злокачественных клеток, экспрессирующих ВСМА. В некоторых воплощениях предложено применение ВСМА-антител или конъюгатов ВСМА-антител, как описано в данном документе, в изготовлении лекарственного средства для индукции регрессии опухоли.
В другом аспекте изобретения предложено выделенное антитело или его антигенсвязывающий фрагмент, которое(ый) специфично связывается с CD3, где антитело содержит VH CDR1, VH CDR2 и VH CDR3 из последовательности VH, представленной в SEQ ID NO: 320, 322, 324, 326, 328, 330, 345, 347, 349, 351, 444, 354, 356, 378, 442, 380, 382, 384 386, 388, 390, 392, 394, 396, 398 или 400; и/или вариабельную область легкой цепи (VL), содержащую VL CDR1, VL CDR2 и VL CDR3 из последовательности VL, представленной в SEQ ID NO: 319, 321, 323, 325, 327, 329, 344, 346, 348, 350, 352, 355, 377, 443, 445, 379, 381, 383, 385, 387, 389, 391, 393, 395, 397 или 399. В некоторых воплощениях, антитело содержит VH CDR1, VH CDR2 и VH CDR3 из последовательности VH, представленной в SEQ ID NO: 324 или 388; и/или вариабельную область легкой цепи (VL), содержащую VL CDR1, VL CDR2 и VL CDR3 из последовательности VL, представленной в SEQ ID NO: 323 или 387. В некоторых воплощениях VH-область содержит (1) определяющий комплементарность участок один (CDR1) VH, содержащий последовательность, представленную в SEQ ID NO: 331, 332, 333, 401, 402, 403, 407, 408, 415, 416, 418, 419, 420, 424, 425, 426, 446, 447 или 448; (2) VH CDR2, содержащий последовательность, представленную в SEQ ID NO: 334, 336, 337, 338, 339, 404, 405, 409, 410, 411, 412, 413, 414, 417, 418, 421, 422, 427, 428, 449 или 450; и (3) VH CDR3, содержащий последовательность, представленную в SEQ ID NO: 335, 406, 423, 429 или 451; и/или вариабельную область легкой цепи (VL), содержащую (1) VL CDR1, содержащий последовательность, представленную в SEQ ID NO: 340, 343, 430, 431, 435 или 440, 441; (2) VL CDR2, содержащий последовательность, представленную в SEQ ID NO: 341, 433, 452 или 436; и (3) VL CDR3, содержащий последовательность, представленную в SEQ ID NO: 342, 432, 434, 437, 438, 439, 446 или 453. В некоторых воплощениях VH-область содержит (1) определяющий комплементарность участок один (CDR1) VH, содержащий последовательность, представленную в SEQ ID NO: 331, 332, 333, 401, 407 или 408, (2) VH CDR2, содержащий последовательность, представленную в SEQ ID NO: 336, 404, 405 или 417; и (3) VH CDR3, содержащий последовательность, представленную в SEQ ID NO: 335 или 406; и/или вариабельную область легкой цепи (VL), содержащую (1) VL CDR1, содержащий последовательность, представленную в SEQ ID NO: 343 или 441; (2) VL CDR2, содержащий последовательность, представленную в SEQ ID NO: 341 или 436; и (3) VL CDR3, содержащий последовательность, представленную в SEQ ID NO: 342 или 439. В некоторых воплощениях антитело содержит область VH, продуцируемую экспрессионным вектором с регистрационным номером АТСС РТА-122513. В некоторых воплощениях антитело содержит область VL, продуцируемую экспрессионным вектором с регистрационным номером АТСС РТА-122512.
В другом аспекте предложено выделенное антитело, которое специфично связывается с CD3 и конкурирует с анти-CD3 антителом по настоящему изобретению, как описано в данном документе.
В другом аспекте изобретения предложено биспецифическое антитело, которое представляет собой полноразмерное человеческое антитело, содержащее первый антительный вариабельный домен биспецифического антитела, способный рекрутировать активность иммунной эффекторной клетки человека путем специфического связывания с эффекторным антигеном, расположенным на этой иммунной эффекторной клетке человека, и содержащее второй антительный вариабельный домен биспецифического антитела, способный специфически связываться с целевым антигеном, где первый антительный вариабельный домен содержит вариабельную область тяжелой цепи (VH), содержащую VH CDR1, VH CDR2 и VH CDR3 из последовательности VH, представленной в SEQ ID NO: 320, 322, 324, 326, 328, 330, 345, 347, 349, 351, 444, 354, 356, 378, 442, 380, 382, 384 386, 388, 390, 392, 394, 396, 398 или 400; и/или вариабельную область легкой цепи (VL), содержащую VL CDR1, VL CDR2 и VL CDR3 из последовательности VL, представленной в SEQ ID NO: 319, 321, 323, 325, 327, 329, 344, 346, 348, 350, 352, 355, 377, 443, 445, 379, 381, 383, 385, 387, 389, 391, 393, 395, 397 или 399. В некоторых воплощениях первый антительный вариабельный домен содержит вариабельную область тяжелой цепи (VH), содержащую VH CDR1, VH CDR2 и VH CDR3 из последовательности VH, представленной в SEQ ID NO: SEQ ID NO: 331, 332, 333, 401, 402, 403, 407, 408, 415, 416, 418, 419, 420, 424, 425, 426, 446, 447 или 448; (2) VH CDR2, содержащий последовательность, представленную в SEQ ID NO: 334, 336, 337, 338, 339, 404, 405, 409, 410, 411, 412, 413, 414, 417, 418, 421, 422, 427, 428, 449 или 450; и (3) VH CDR3, содержащий последовательность, представленную в SEQ ID NO: 335, 406, 423, 429 или 451; и/или вариабельную область легкой цепи (VL), содержащую (1) VL CDR1, содержащий последовательность, представленную в SEQ ID NO: 340, 343, 430, 431, 435 или 440, 441; (2) VL CDR2, содержащий последовательность, представленную в SEQ ID NO: 341, 433, 452 или 436; и (3) VL CDR3, содержащий последовательность, представленную в SEQ ID NO: 342, 432, 434, 437, 438, 439, 446 или 453. В некоторых воплощениях первый антительный вариабельный домен содержит вариабельную область тяжелой цепи (VH), содержащую VH CDR1, VH CDR2 и VH CDR3 из последовательности VH, представленной в SEQ ID NO: 324 или 388; и/или вариабельную область легкой цепи (VL), содержащую VL CDR1, VL CDR2 и VL CDR3 из последовательности VL, представленной в SEQ ID NO: 323 или 387; и второй антительный вариабельный домен содержит вариабельную область тяжелой цепи (VH), содержащую VH CDR1, VH CDR2 и VH CDR3 из последовательности VH, представленной в SEQ ID NO: 112; и/или вариабельную область легкой цепи (VL), содержащую VL CDR1, VL CDR2 и VL CDR3 из последовательности VL, представленной в SEQ ID NO: 38.
В некоторых воплощениях второй антительный вариабельный домен содержит (а) вариабельную область тяжелой цепи (VH), содержащую (1) определяющий комплементарность участок один (CDR1) VH, содержащий последовательность SYX1X2, где X1 представляет собой А или Р; и Х2 представляет собой Т, N или S (SEQ ID NO: 301), GFTFX1SY, где X1 представляет собой G или S (SEQ ID NO: 302), или GFTFX1SYX2MX3, где X1 представляет собой G или S, Х2 представляет собой А или Р; и Х3 представляет собой Т, N или S (SEQ ID NO: 303); (2) VH CDR2, содержащий последовательность AX1X2X3X4GX5X6X7X8YADX9X10KG, где X1 представляет собой I, V, Т, Н, L, А или С; Х2 представляет собой S, D, G, Т, I, L, F, М или V; Х3 представляет собой G, Y, L, Н, D, A, S или М; Х4 представляет собой S, Q, Т, А, F или W; Х5 представляет собой G or Т; Х6 представляет собой N, S, Р, Y, W или F; Х7 представляет собой S, Т, I, L, Т, A, R, V, K, G или С; Х8 представляет собой F, Y, Р, W, Н или G; Х9 представляет собой V, R или L; и X10 представляет собой G или Т (SEQ ID NO: 305), или Х1Х2Х3Х4Х5Х6, где X1 представляет собой S, V, I, D, G, Т, L, F или М; Х2 представляет собой G, Y, L, Н, D, A, S или М; Х3 представляет собой S, G, F или W; Х4 представляет собой G или S; Х5 представляет собой G или Т; и Х6 представляет собой N, S, Р, Y или W (SEQ ID NO: 306); и (3) VH CDR3, содержащий последовательность VSPIX1X2X3X4, где X1 представляет собой А или Y; Х2 представляет собой А или S; и Х3 представляет собой G, Q, L, Р или Е (SEQ ID NO: 307) или YWPMX1X2, где X1 представляет собой D, S, Т или А; и Х2 представляет собой I, S, L, Р или D (SEQ ID NO: 308); и/или (б) вариабельную область легкой цепи (VL), содержащую (1) VL CDR1, содержащий последовательность Х1Х2Х3Х4Х5Х6Х7Х8Х9Х10Х11Х12, где Х1 представляет собой R, G, W, А или С; Х2 представляет собой А, Р, G, L, С или S; Х3 представляет собой S, G или R; Х4 представляет собой Q, С, Е, V или I; Х5 представляет собой S, L, Р, G, A, R или D; Х6 представляет собой V, G или I; Х7 представляет собой S, Е, D или Р; Х8 представляет собой S, Р, F, А, М, Е, V, N, D или Y; Х9 представляет собой I, Т, V, Е, S, А, М, Q, Y, Н или R; Х10 представляет собой Y или F; Х11 представляет собой L, W или Р; и Х12 представляет собой A, S или G (SEQ ID NO: 309); (2) VL CDR2, содержащий последовательность X1ASX2RAX3, где X1 представляет собой G или D; Х2 представляет собой S или I; и Х3 представляет собой Т или Р (SEQ ID NO: 310); и (3) VL CDR3, содержащий последовательность QQYX1X2X3PX4T, где X1 представляет собой G, Q, Е, L, F, A, S, М, K, R или Y; Х2 представляет собой S, R, Т, G, V, F, Y, D, А, Н, V, Е, K или С; Х3 представляет собой W, F или S; и Х4 представляет собой L или I (SEQ ID NO: 311) или QQYX1X2X3PX4, где X1 представляет собой G, Q, Е, L, F, A, S, М, R, K или Y; Х2 представляет собой S, R, Т, G, R, V, D, А, Н, Е, K, С, F или Y; Х3 представляет собой W, S или F; и Х4 представляет собой L или I (SEQ ID NO: 312). В некоторых воплощениях второй антительный вариабельный домен содержит вариабельную область тяжелой цепи (VH), содержащую (1) VH CDR1, содержащий последовательность, представленную в SEQ ID NO: 150, 151, 152, 156, 157, 348, 349, 353, 354 или 355; (2) VH CDR2, содержащий последовательность, представленную в SEQ ID NO: 169, 154, 194, 159, 195, 196, 162, 158, 198, 177, 178, 199, 200, 201, 202, 203, 204, 206, 207, 208, 172, 203, 204, 350, 351, 356 или 357; и (3) VH CDR3, содержащий последовательность, представленную в SEQ ID NO: 155, 161, 197, 205,164 или 352 или 358; и/или где вариабельная область легкой цепи (VL) содержит (1) VL CDR1, содержащий последовательность, представленную в SEQ ID NO: 209, 271, 273, 275, 251, 277, 260, 279, 245, 283, 285, 287, 290, 292, 235, 297, 299 или 361; (2) VL CDR2, содержащий последовательность, представленную в SEQ ID NO: 221, 359 или 362; и (3) VL CDR3, содержащий последовательность, представленную в SEQ ID N0:211, 225, 272, 274, 276, 278, 280, 281, 282, 284, 286, 288, 289, 291, 293, 294, 229, 296, 298, 300 или 360.
В некоторых воплощениях (а) первый антительный вариабельный домен содержит вариабельную область тяжелой цепи (VH), содержащую (1) определяющий комплементарность участок один (CDR1) VH, содержащий последовательность, представленную в SEQ ID NO: 331, 332, 333, 401, 407 или 408, (2) VH CDR2, содержащий последовательность, представленную в SEQ ID NO: 336, 417, 404 или 405; и (3) VH CDR3, содержащий последовательность, представленную в SEQ ID NO: 335 или 406; и/или вариабельную область легкой цепи (VL), содержащую (1) VL CDR1, содержащий последовательность, представленную в SEQ ID NO: 343 или 441; (2) VL CDR2, содержащий последовательность, представленную в SEQ ID NO: 341 или 436; и (3) VL CDR3, содержащий последовательность, представленную в SEQ ID NO: 342 или 439; и (б) второй антительный вариабельный домен содержит область VH тяжелой цепи, содержащую вариабельную область тяжелой цепи (VH), содержащую (1) VH CDR1, содержащий последовательность, представленную в SEQ ID NO: 151, 156 или 157; (2) VH CDR2, содержащий последовательность, представленную в SEQ ID NO: 158 или 159; и (3) VH CDR3, содержащий SEQ ID NO: 155; и/или, где вариабельная область легкой цепи (VL) содержит (1) VL CDR1, содержащий последовательность, представленную в SEQ ID NO: 209; (2) VL CDR2, содержащий последовательность, представленную в SEQ ID NO: 221; и (3) VL CDR3, содержащий последовательность, представленную в SEQ ID NO: 225.
В некоторых воплощениях и первый и второй антительные вариабельные домена биспецифического антитела содержат аминокислотные модификации в положениях 223, 225 и 228 шарнирной области и в положении 409 или 368 (схема нумерации EU) области СН3 человеческого IgG2 (SEQ ID NO: 493). В некоторых воплощениях биспецифическое антитело, как описано в данном документе, дополнительно содержит аминокислотную модификацию в положении 265 человеческого IgG2.
В другом аспекте изобретения предложены фармацевтические композиции, содержащие любое из антител (например ВСМА, CD3 или биспецифическое) или любой из их конъюгатов (например конъюгат ВСМА-антитела с лекарственным средством), описанных в данном документе.
В другом аспекте изобретения также предложены клеточные линии, которые рекомбинантно продуцируют любое из антител (например ВСМА, CD3 или биспецифическое) или любой из их конъюгатов (например конъюгат ВСМА-антитела с лекарственным средством), описанных в данном документе.
В другом аспекте изобретения также предложены нуклеиновые кислоты, кодирующие любое из антител (например ВСМА, CD3 или биспецифическое) или любой из их конъюгатов (например конъюгат ВСМА-антитела с лекарственным средством), описанных в данном документе. В изобретении также предложены нуклеиновые кислоты, кодирующие вариабельную область тяжелой цепи и/или вариабельную область легкой цепи любого из антител, описанных в данном документе.
В изобретении также предложены наборы, содержащие эффективное количество любого из антител (например ВСМА, CD3 или биспецифического) или их конъюгатов (например конъюгата ВСМА-антитела с лекарственным средством), описанных в данном документе.
В изобретении также предложены способы лечения состояния (например ингибирование роста/прогрессирования опухоли; ингибирование метастаз злокачественных клеток, экспрессирующих ВСМА; индуцирование регрессии опухоли у субъектов со злокачественными клетками, экспрессирующими ВСМА) у нуждающихся в этом субъектов, включающие обеспечение выделенных антител (например ВСМА) или связывающих фрагментов, биспецифических антител (BCMA-CD3 биспецифических) или их конъюгатов (например конъюгатов ВСМА-антитела с лекарственным средством), описанных в данном документе, и введение указанных антител или конъюгатов указанному субъекту.
Также предложены способы лечения состояния, ассоциированного со злокачественными клетками, экспрессирующими опухолевый антиген, у субъекта, включающий введение нуждающемуся в этом субъекту эффективного количества фармацевтических композиций по изобретению. В некоторых воплощениях состояние представляет собой рак. В некоторых воплощениях рак представляет собой рак, связанный с В-клетками, выбранный из группы, состоящей из множественной миеломы, злокачественного плазмоклеточного новообразования, лимфомы Ходжкина, нодулярной лимфомы Ходжкина с лимфоидным преобладанием, болезни Калера и миеломатоза, плазмоклеточного лейкоза, плазмоцитомы, В-клеточного пролимфоцитарного лейкоза, волосатоклеточного лейкоза, В-клеточной неходжкинской лимфомы (NHL), острого миелоидного лейкоза (AML), хронического лимфоцитарного лейкоза (CLL), острого лимфоцитарного лейкоза (ALL), хронического миелоидного лейкоза (CML), фолликулярной лимфомы, лимфомы Беркитта, лимфомы маргинальной зоны, лимфомы мантийных клеток, крупноклеточной лимфомы, лимфобластной лимфомы из предшественников В-клеток, миелоидного лейкоза, макроглобулинемии Вальденстрема, диффузной крупноклеточной В-клеточной лимфомы, фолликулярной лимфомы, лимфомы маргинальной зоны, лимфомы лимфоидной ткани слизистых оболочек, мелкоклеточной лимфоцитарной лимфомы, мантийноклеточной лимфомы, лимфомы Беркитта, первичной медиастинальной (тимусной) Крупноклеточной В-клеточной лимфомы, лимфоплазматической лимфомы, макроглобулинемии Вальденстрема, узловой В-клеточной лимфомы из клеток маргинальной зоны, лимфомы маргинальной зоны селезенки, внутрисосудистой крупноклеточной В-клеточной лимфомы, первичной эффузионной лимфомы, лимфоматоидного гранулематоза, Т-клеточной/богатой гистиоцитами крупноклеточной В-клеточной лимфомы, первичной лимфомы центральной нервной системы, первичной кожной диффузной крупноклеточной В-клеточной лимфомы (ножного типа), EBV-позитивной диффузной крупноклеточной В-клеточной лимфомы пожилых людей, диффузной крупноклеточной В-клеточной лимфомы, ассоциированной с воспалением, внутрисосудистой крупноклеточной В-клеточной лимфомы, ALK-позитивной крупноклеточной В-клеточной лимфомы, плазмобластной лимфомы, крупноклеточной В-клеточной лимфомы, возникающей из HHV8-ассоциированной многоочаговой болезни Кастлемана, неклассифицированной В-клеточной лимфомы с признаками, промежуточными между диффузной крупноклеточной В-клеточной лимфомой и лимфомой Беркитта, неклассифицированной В-клеточной лимфомы с признаками, промежуточными между диффузной крупноклеточной В-клеточной лимфомой и классической лимфомой Ходжкина, и других В-клеточных лимфом. В некоторых воплощениях состояние представляет собой аутоиммунное расстройство, такое как системная красная волчанка или ревматоидный артрит.
В некоторых воплощениях антитела, описанные в данном документе, содержат константную область. В некоторых воплощениях антитела, описанные в данном документе, принадлежат подклассу IgG1, IgG2 или IgG2Δa, IgG3 или IgG4 человека. В некоторых воплощениях антитела, описанные в данном документе, содержат гликозилированную константную область. В некоторых воплощениях антитела, описанные в данном документе, содержат константную область, имеющую повышенную аффинность связывания с одним или более Fc-гамма-рецепторами человека.
Краткое описание графических материалов
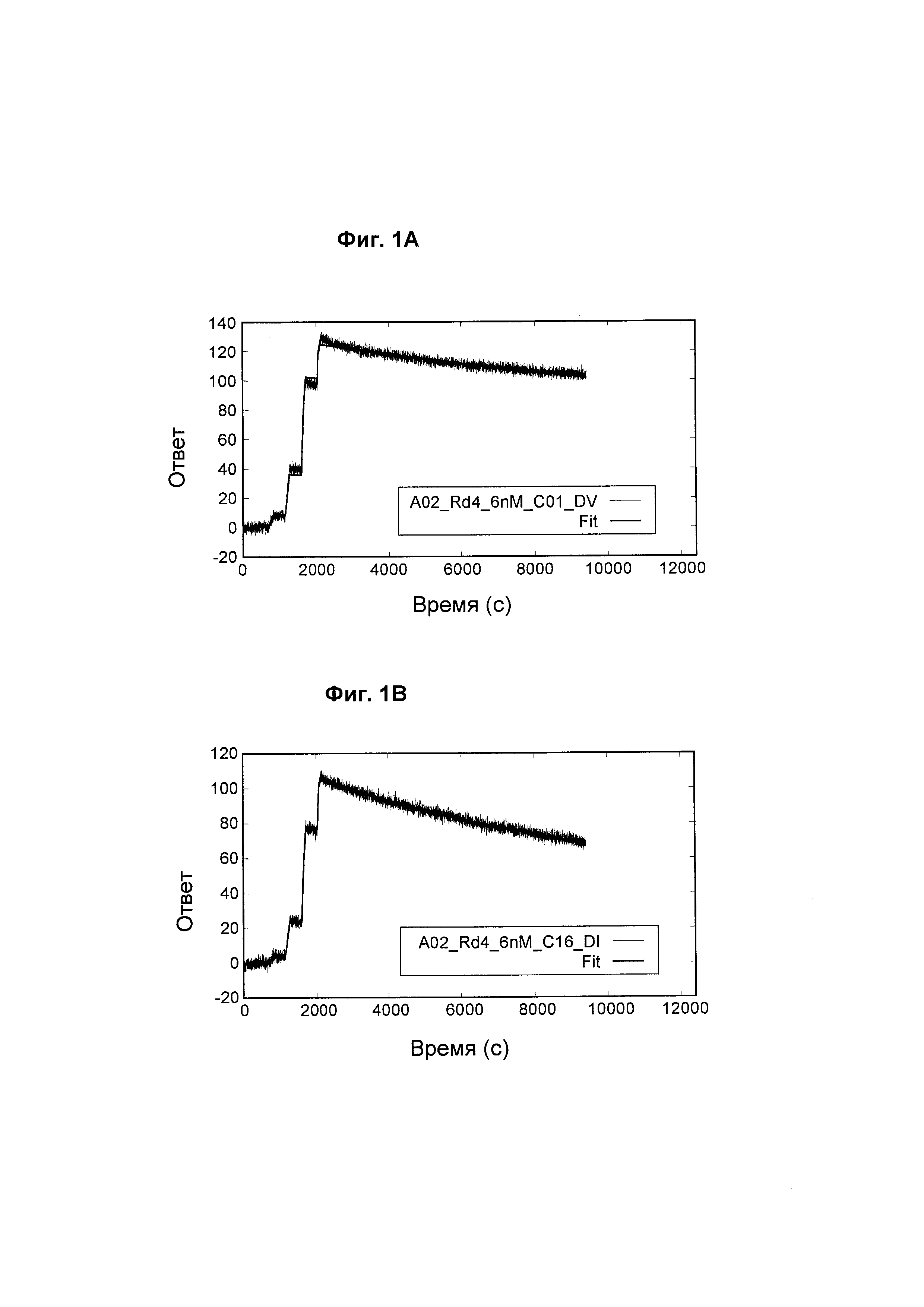
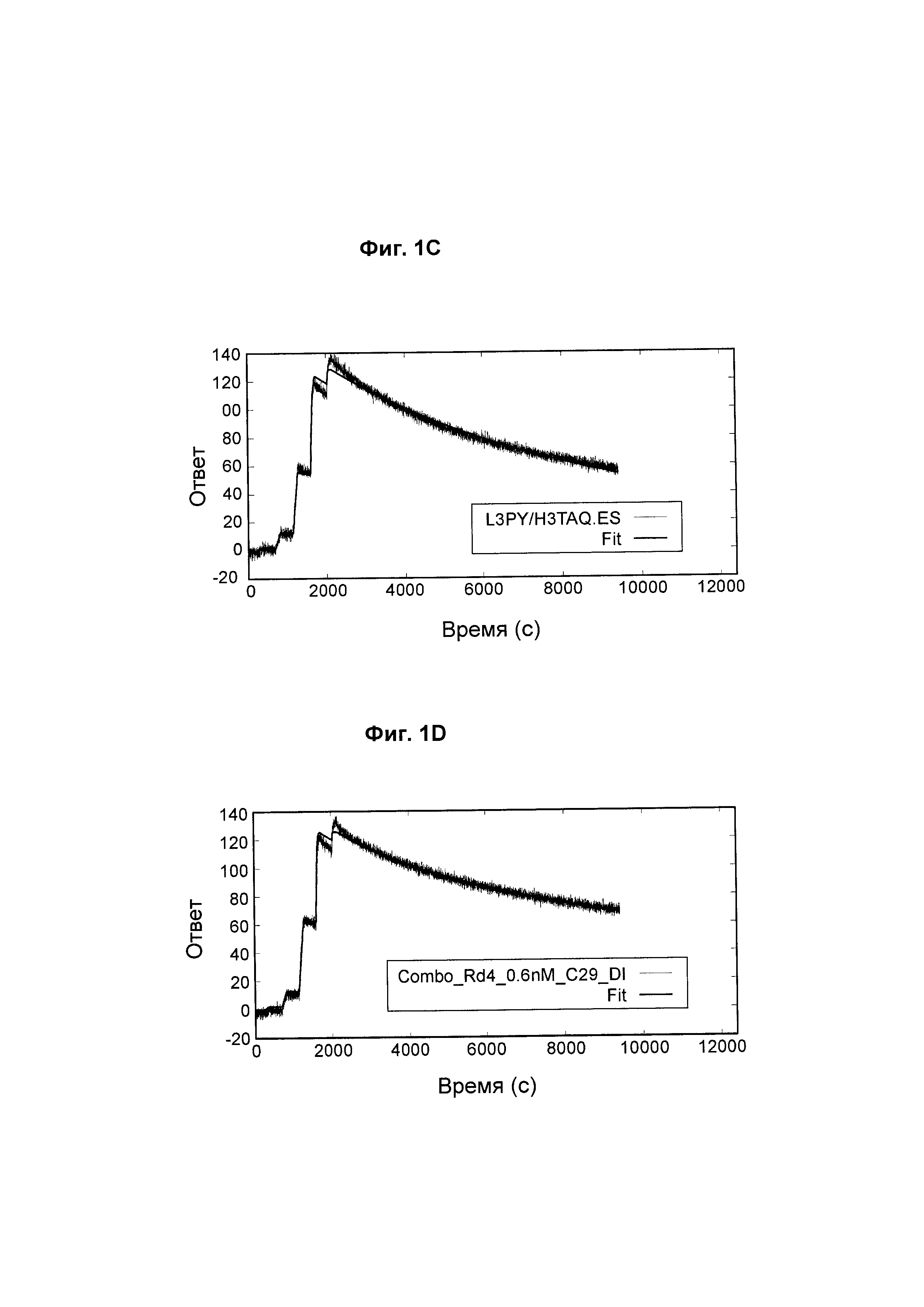
На Фиг. 1А - Фиг. 1D представлены сенсограммы с двойным контролем с аппроксимирующими кривыми для взаимодействия между выбранными анти-ВСМА-антителами по настоящему изобретению и ВСМА человека.
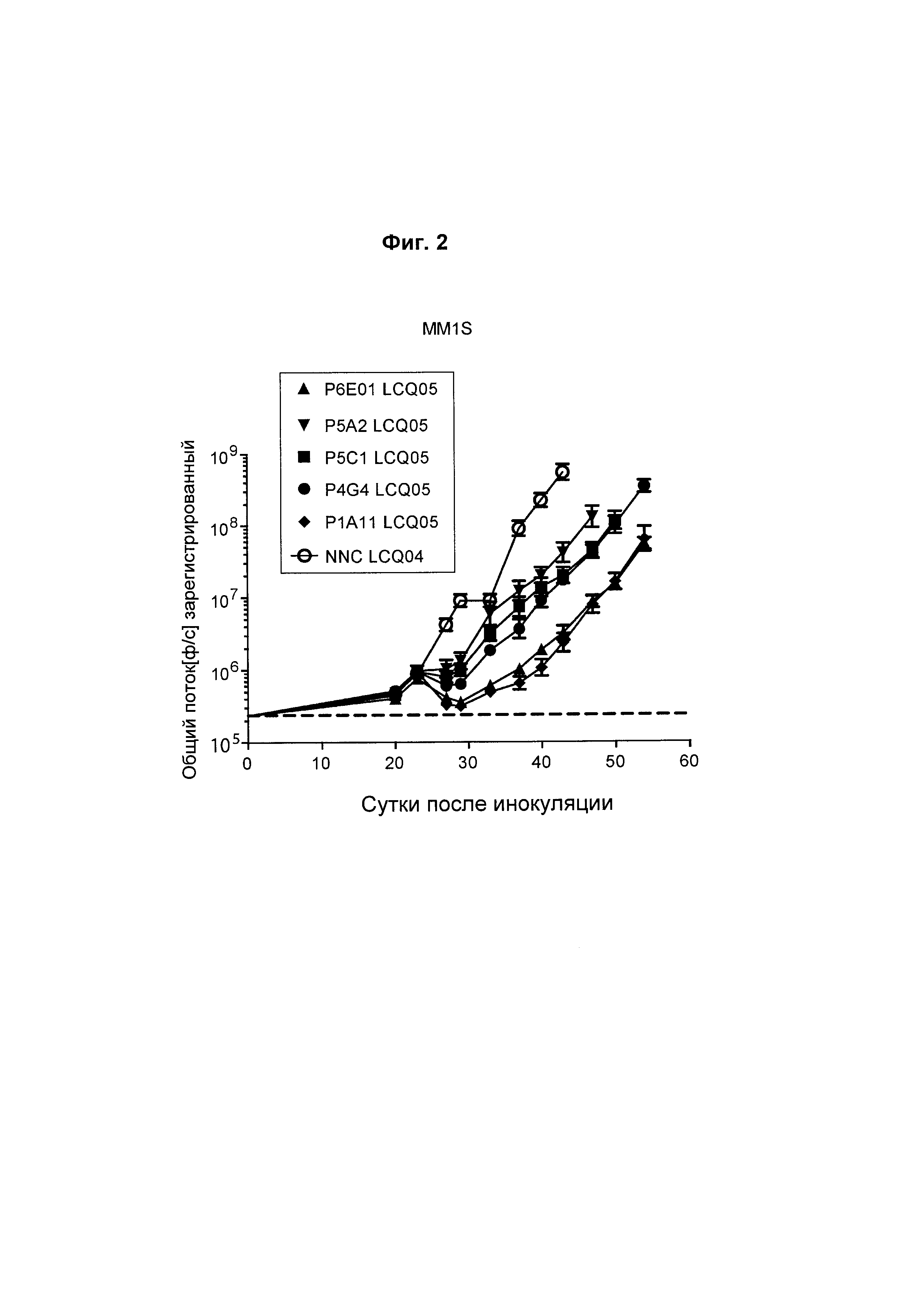
На Фиг. 2 показаны исследования in vivo эффективности различных анти-ВСМА ADC (комплексы антитело-лекарственное средство) в модели ортотопической множественной миеломы MM1S, включающих P6E01_VHVL-AcLys-Val-Cit-PABC-Aur0101; P5A2_VHVL-AcLys-Val-Cit-PABC-Aur0101; P5C1_VHVL-AcLys-Val-Cit-PABC-Aur0101; P4G4-AcLys-Val-Cit-PABC-Aur0101; и P1A11-AcLys-Val-Cit-PABC-Aur0101. NNC представляет собой отрицательный контроль в виде антитела, не являющегося ВСМА-антителом. "LCQ05" и "LCQ04" соответствуют последовательностям глутаминсодержащего трансглутаминазного тега SEQ ID NO: 474 и 475 соответственно.
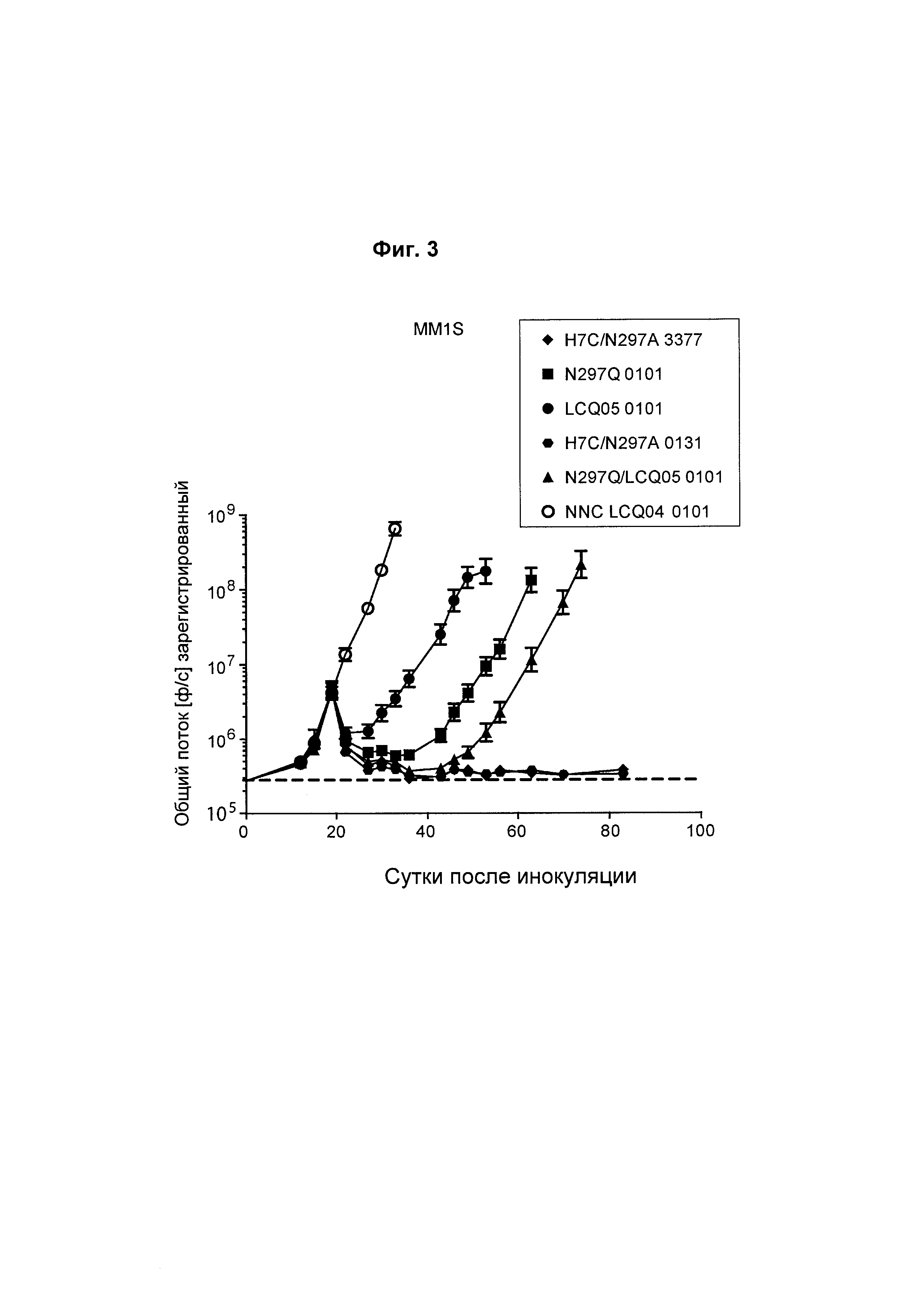
На Фиг. 3 показана in vivo эффективность анти-ВСМА ADC в модели ортотопической множественной миеломы MM1S, включающих антитело L3.PY/P6E01, конъюгированное с 1) H7c/N297A/K222R-амино-PEG6-C2-3377, 2) N297Q/K222R-AcLys-Val-Cit-PABC-0101, 3) LCQ05/K222R-AcLys-Val-Cit-PABC-0101, 4) H7c/N297A/K222R-амино-PEG6-C2-0131 и 5) N297Q/K222R/LCQ05-AcLys-Val-Cit-PABC-Aur0101. NNC представляет собой контрольное антитело, не являющееся ВСМА-антителом. "LCQ05" и Н7с соответствуют последовательности глутаминсодержащего трансглутаминазного тега SEQ ID NO: 474 и SEQ ID NO: 454 соответственно.
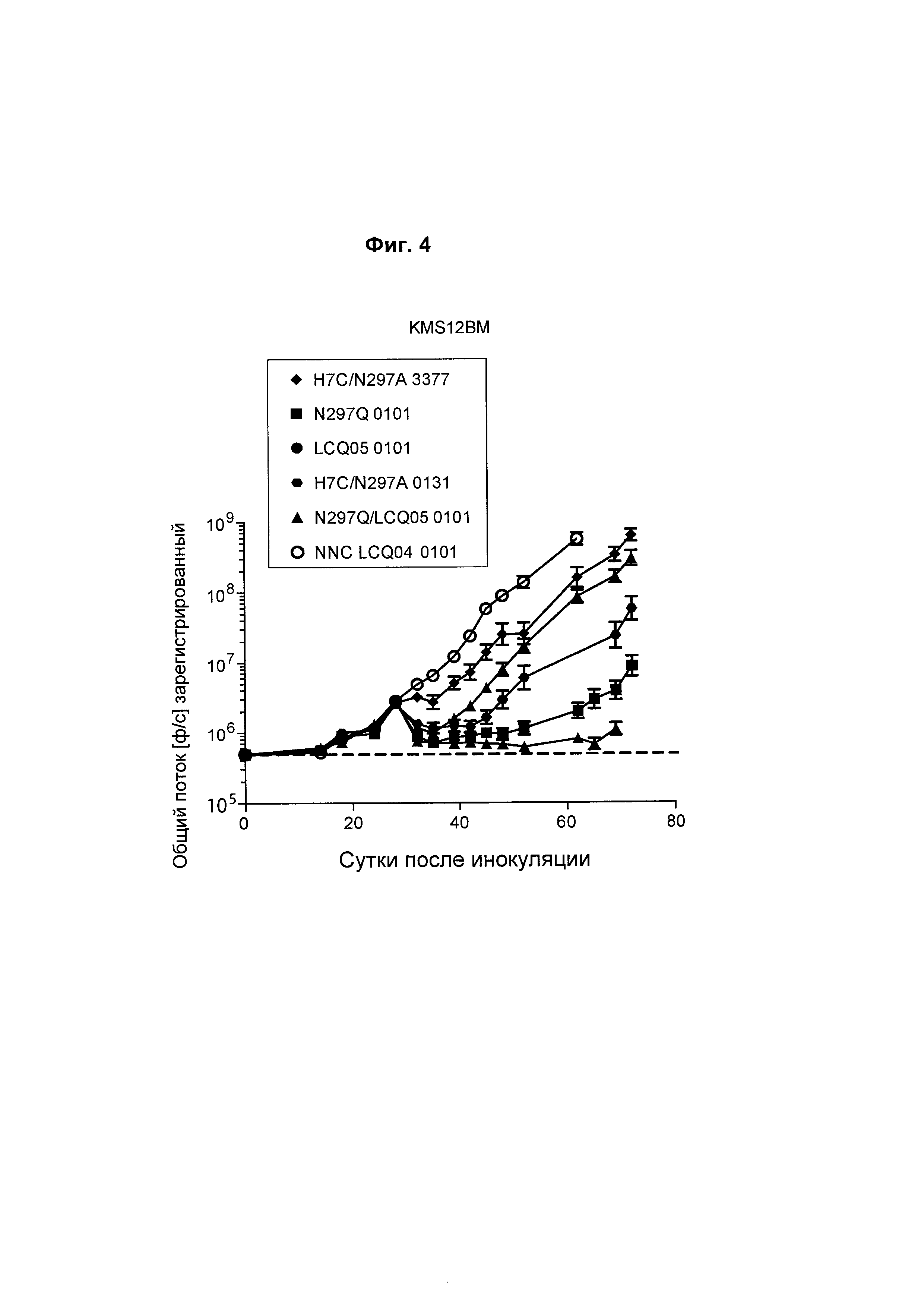
На Фиг. 4 также показана in vivo эффективность анти-ВСМА ADC в модели ортотопической множественной миеломы MM1S, включающих антитело L3.PY/P6E01, конъюгированное с 1) H7c/N297A/K222R-амино-PEG6-C2-3377, 2) N297Q/K222R-AcLys-Val-Cit-PABC-Aur0101, 3) LCQ05/K222R-AcLys-Val-Cit-PABC-Aur0101, 4) H7c/N297A/K222R-амино-PEG6-C2-0131 и 5) N297Q/K222R/LCQ05-AcLys-Val-Cit-PABC-Aur0101. NNC представляет собой контрольное антитело, не являющееся ВСМА-антителом (антитело-N297Q/K222R-AcLys-VC-PABC-0101). "LCQ05" и Н7с соответствуют последовательности глутаминсодержащего трансглутаминазного тега SEQ ID NO: 474 и SEQ ID NO: 454 соответственно.
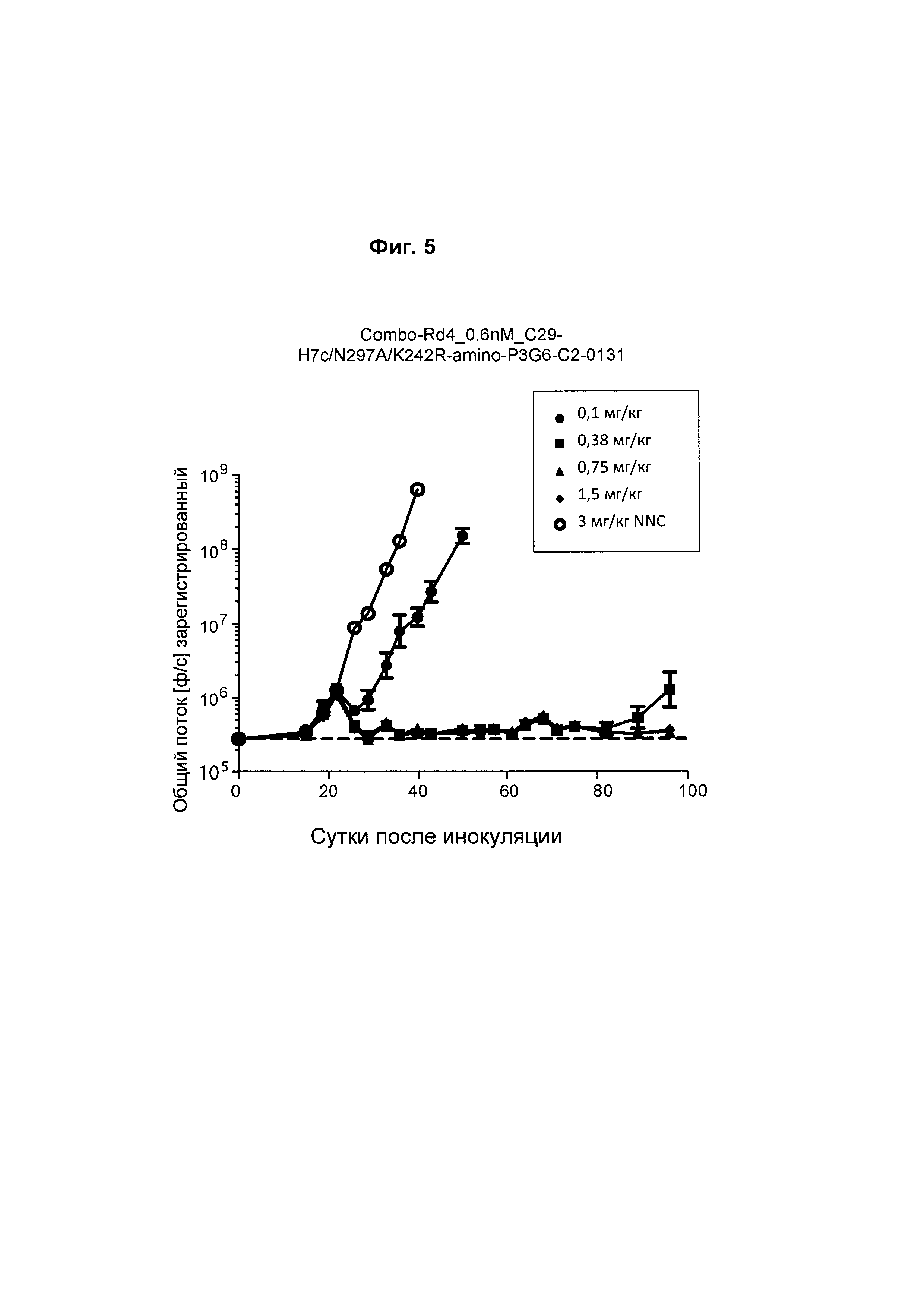
На Фиг. 5 также показана in vivo эффективность анти-ВСМА ADC в модели ортотопической множественной миеломы MM1S. Анти-ВСМА-антитело COMBO_Rd4_0.6nM-C29 ("Combo С29 DI) конъюгировано с H7c/N297A/K222R-амино-РЕG6-С2-131 в дозах от 0,1 мг/кг, 0,38 мг/кг, 0,75 мг/кг, 1,5 мг/кг по сравнению с NNC, контрольным антителом, не являющимся ВСМА-антителом, (антитело-N297Q/K222R-AcLys-VC-РАВС-0101) в дозе 3 мг/кг. Н7с соответствуют последовательности глутамин-содержащего трансглутаминазного тега SEQ ID NO: 454.
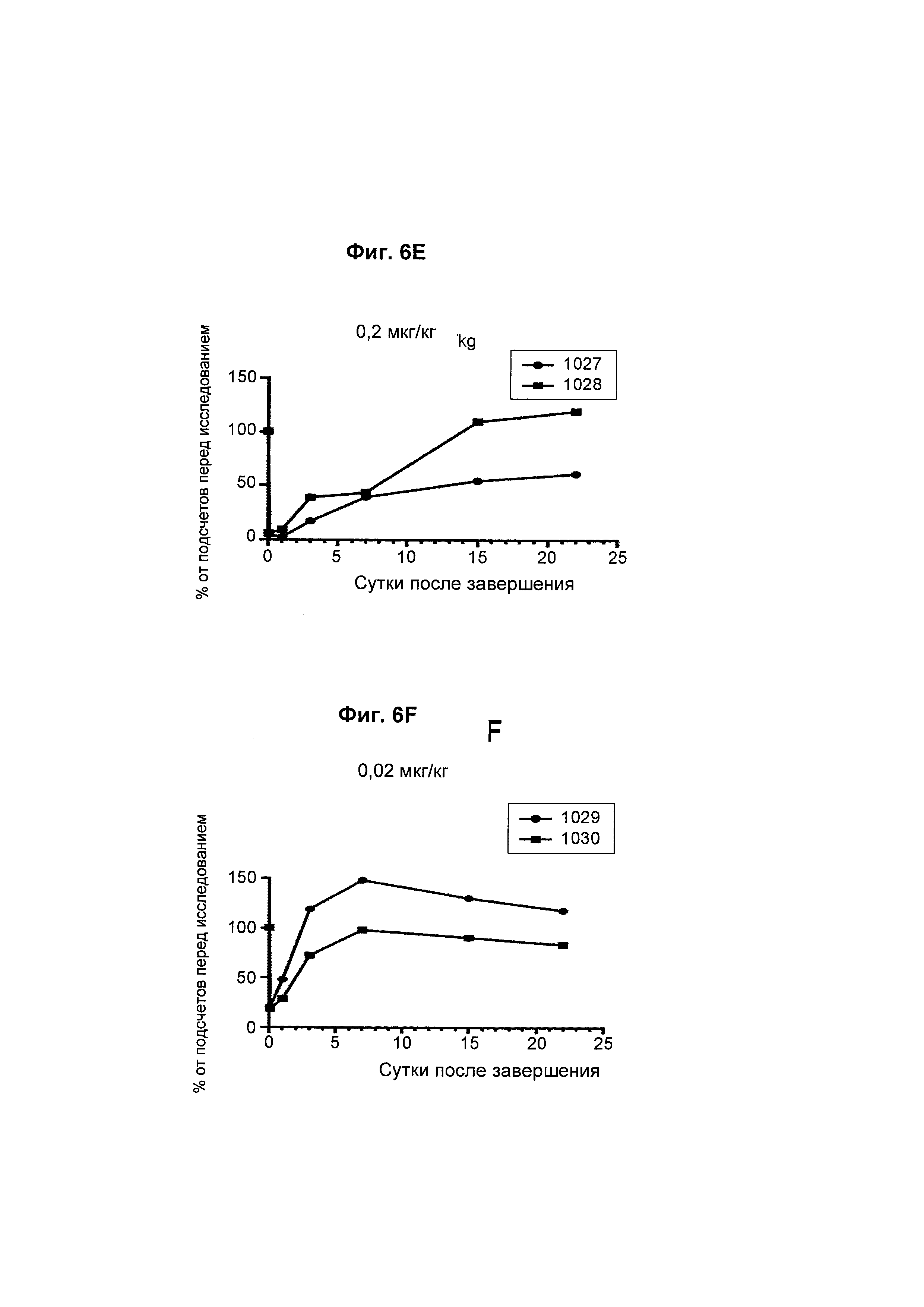
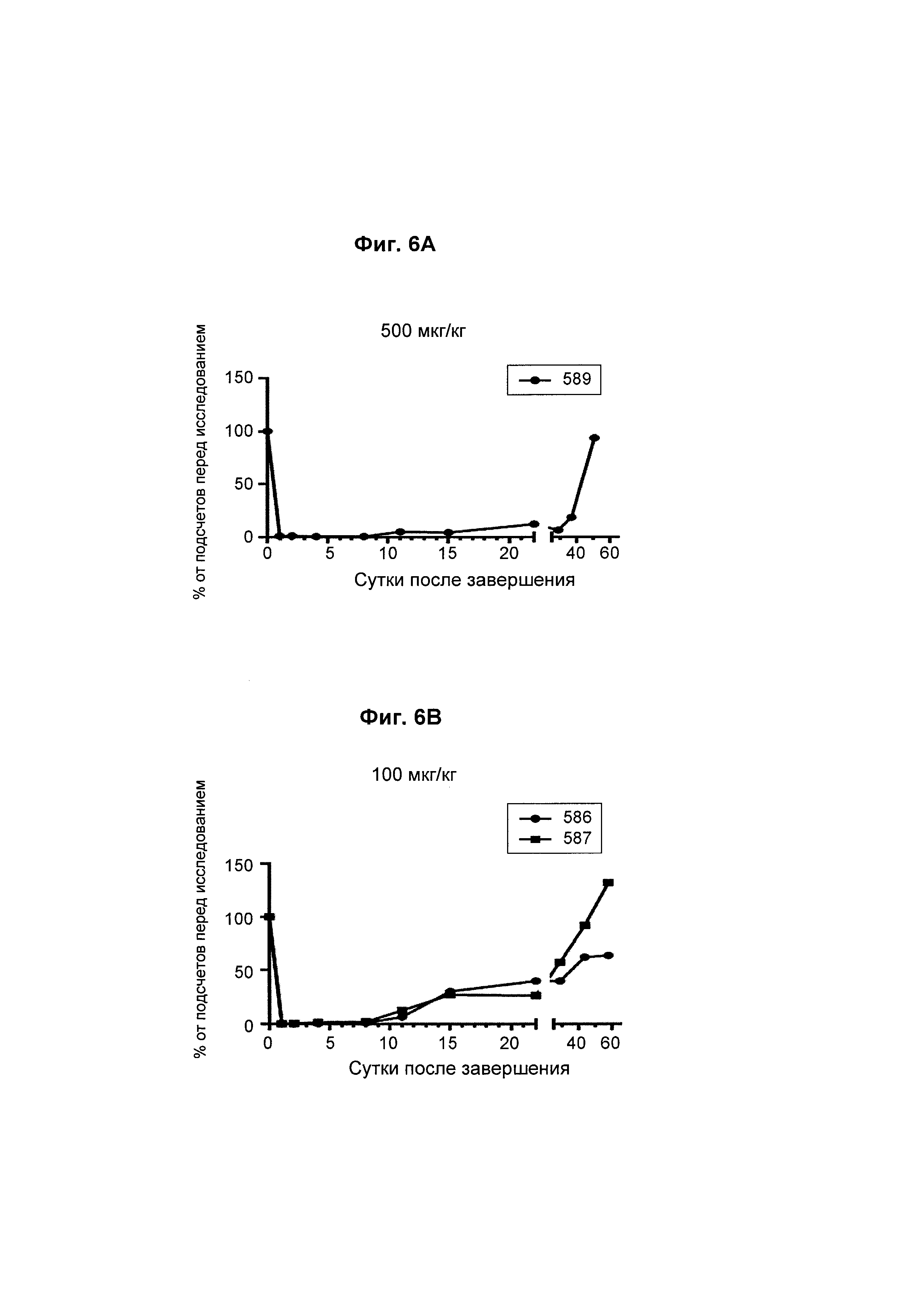
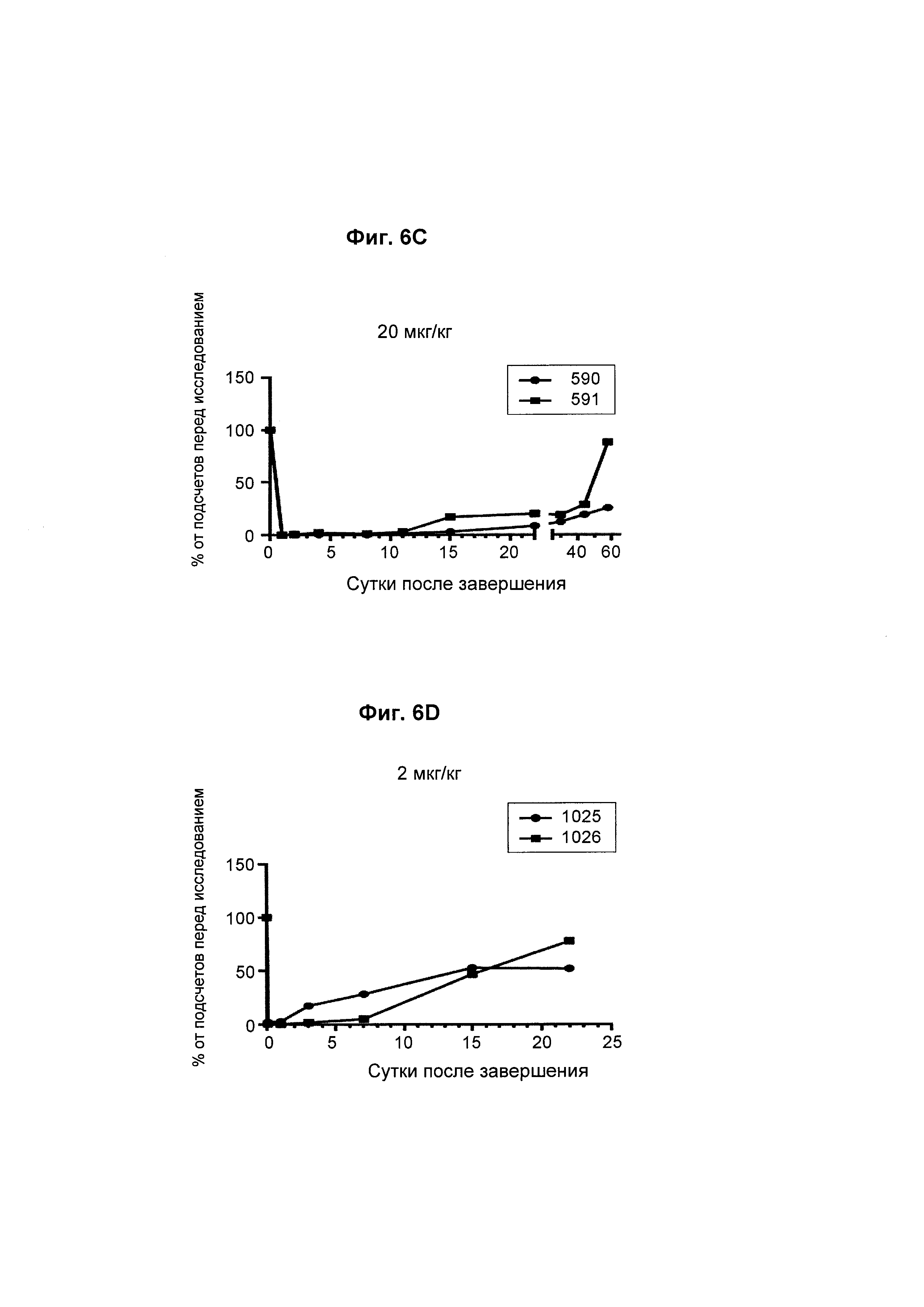
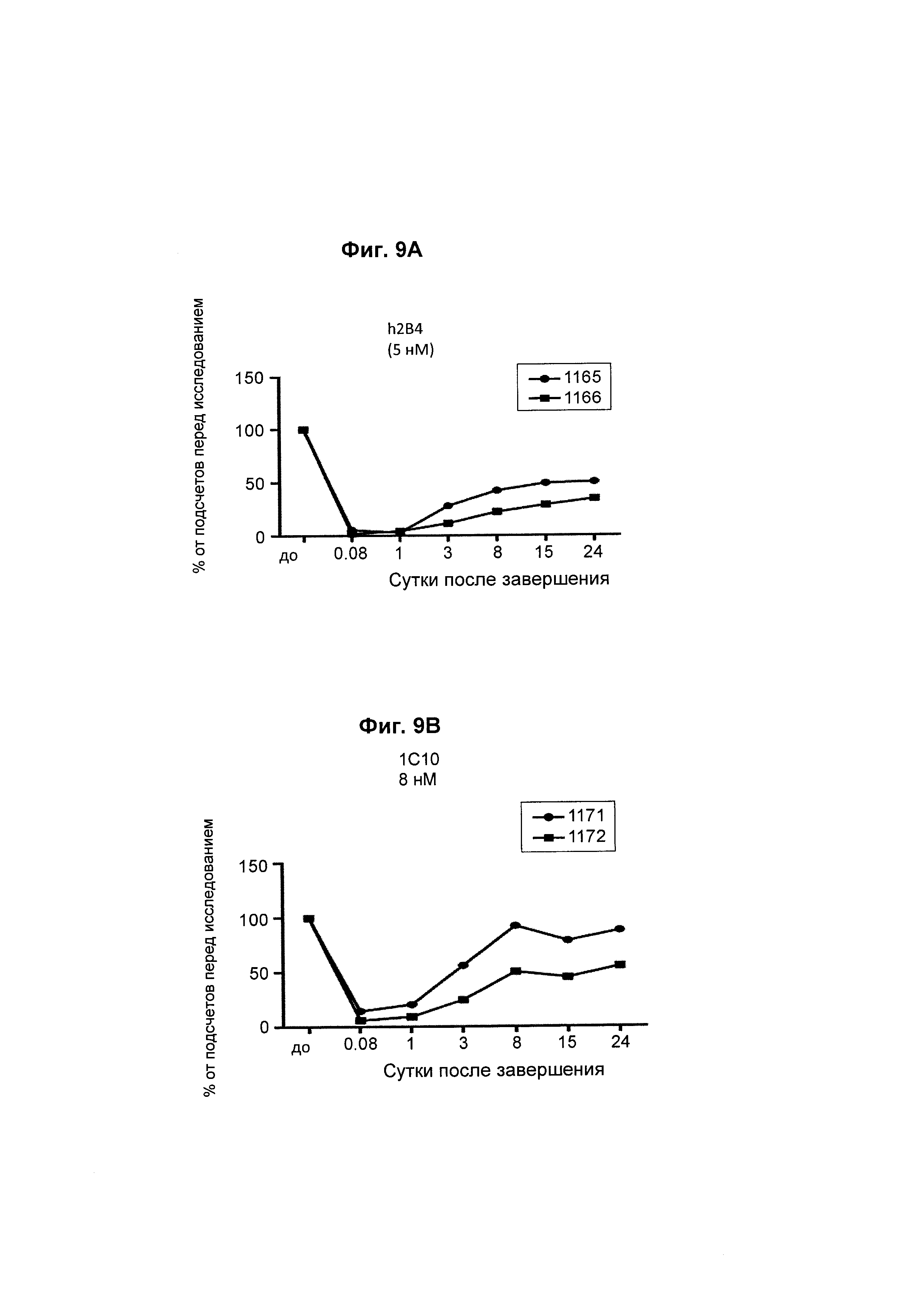
На Фиг. 6А - 6F показана in vivo эффективность биспецифического анти-CD3/анти-CD20 антитела у яванского макака. В-клеточное истощение после однократной дозы биспецифического антитела показано как процент подсчетов перед исследованием.
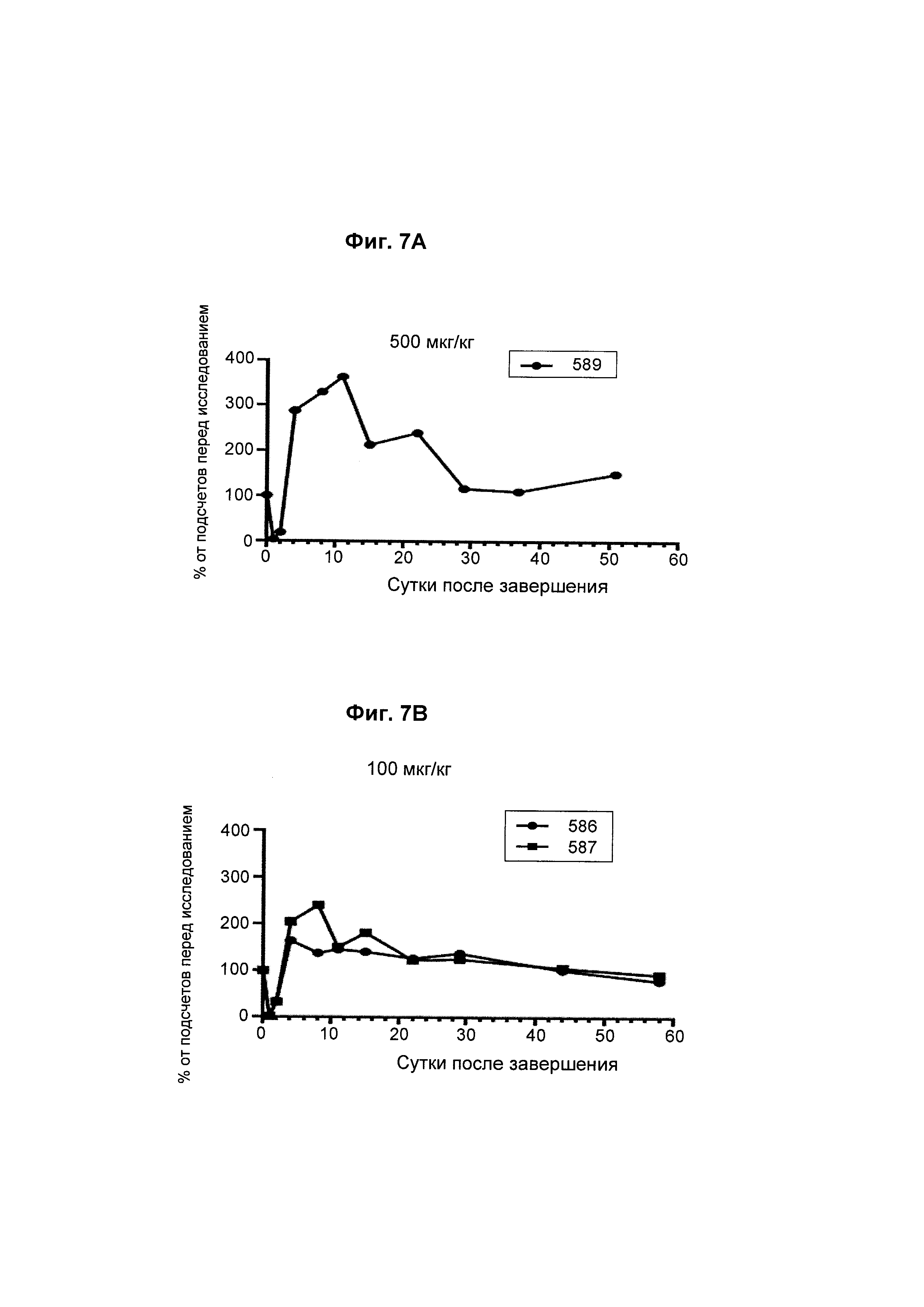
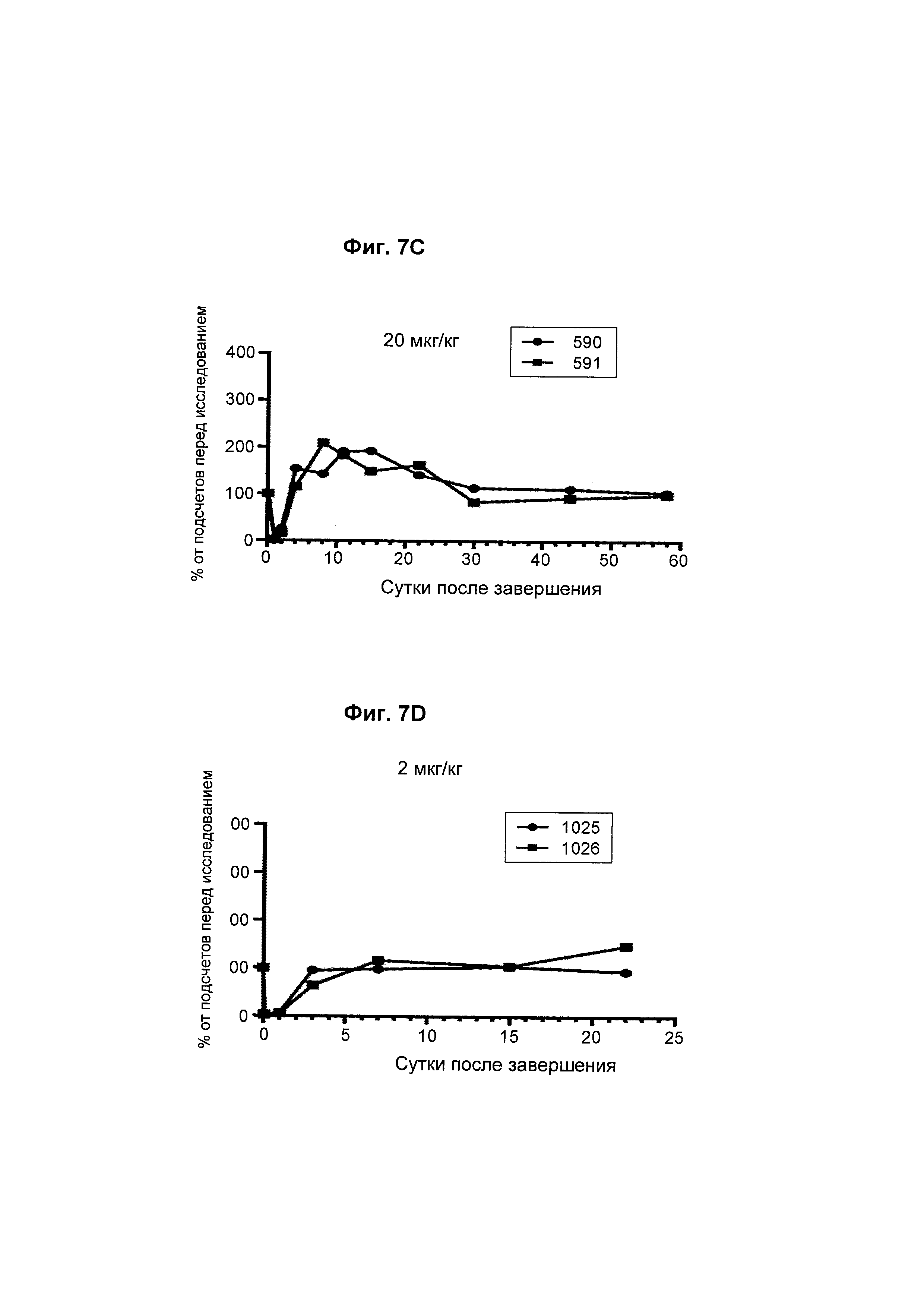
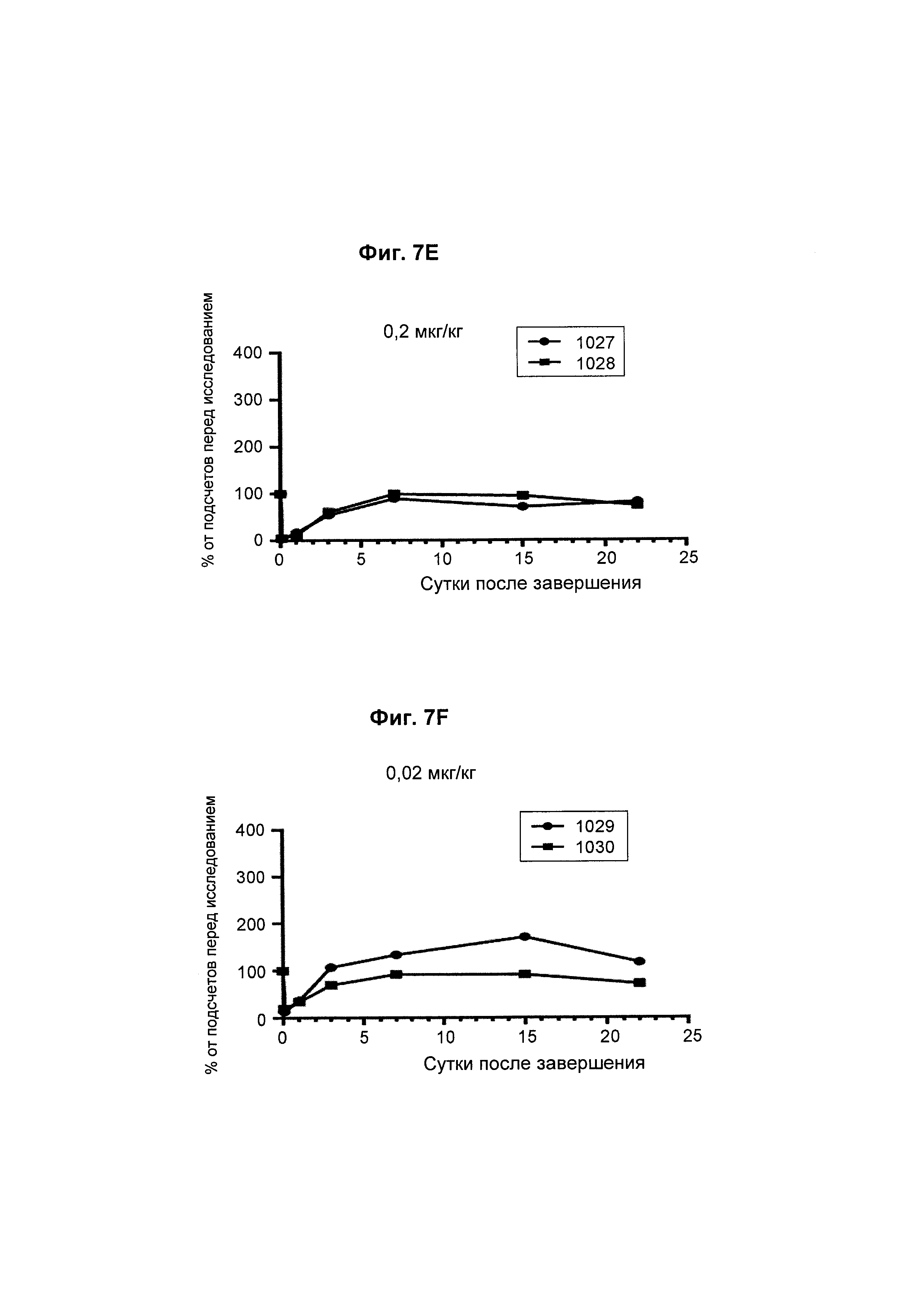
На Фиг. 7А - 7F показана in vivo эффективность биспецифического анти-CD3/анти-CD20 антитела у яванского макака. Определяли CD8+ Т-клеточную кинетику после однократной дозы биспецифического антитела.
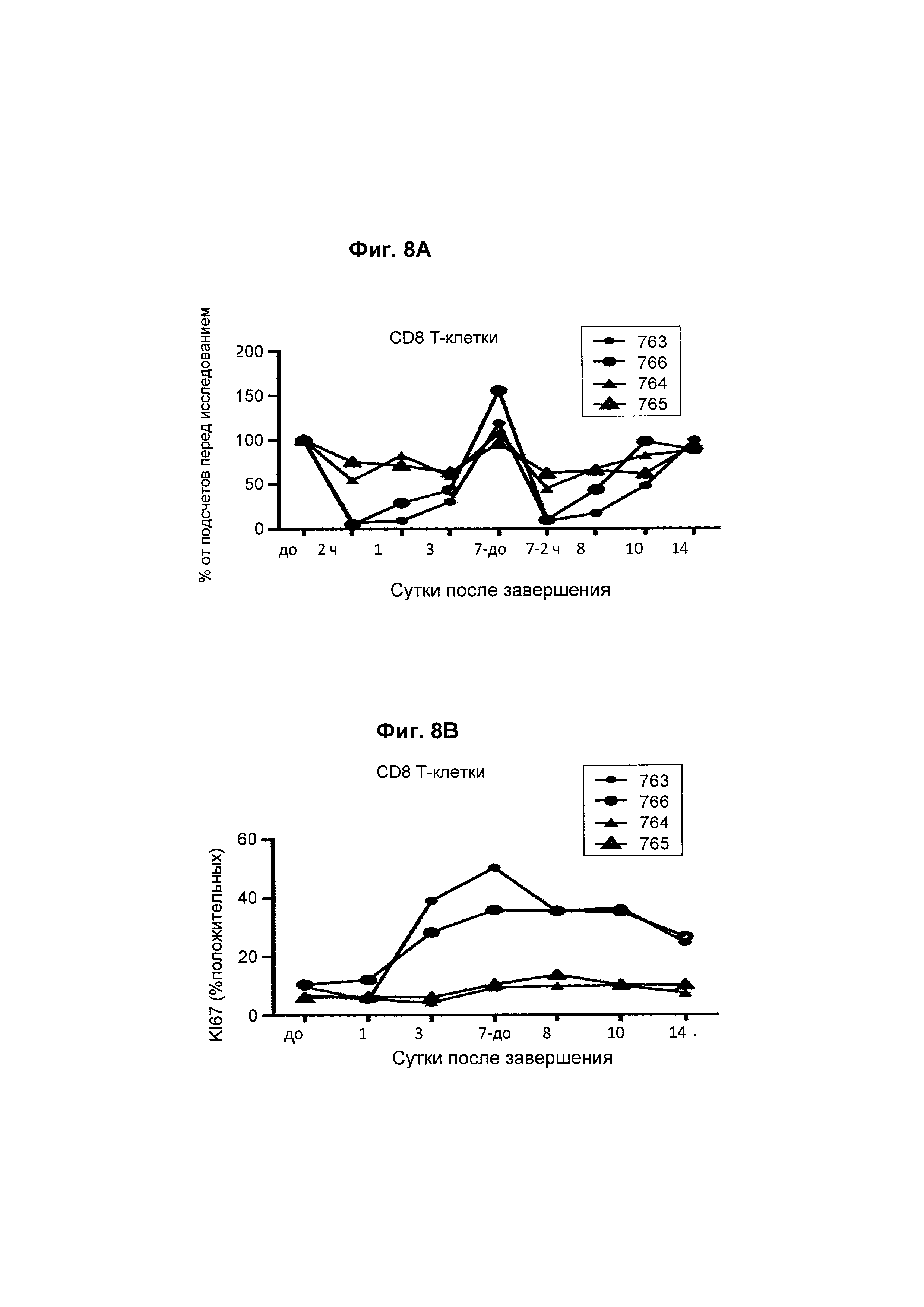
На Фиг. 8А и Фиг. 8В показана in vivo эффективность биспецифического анти-CD3/анти-CD20 антитела у яванского макака. Анализировали влияние моновалентного CD3-антитела на кинетику и пролиферацию Т-клеток.
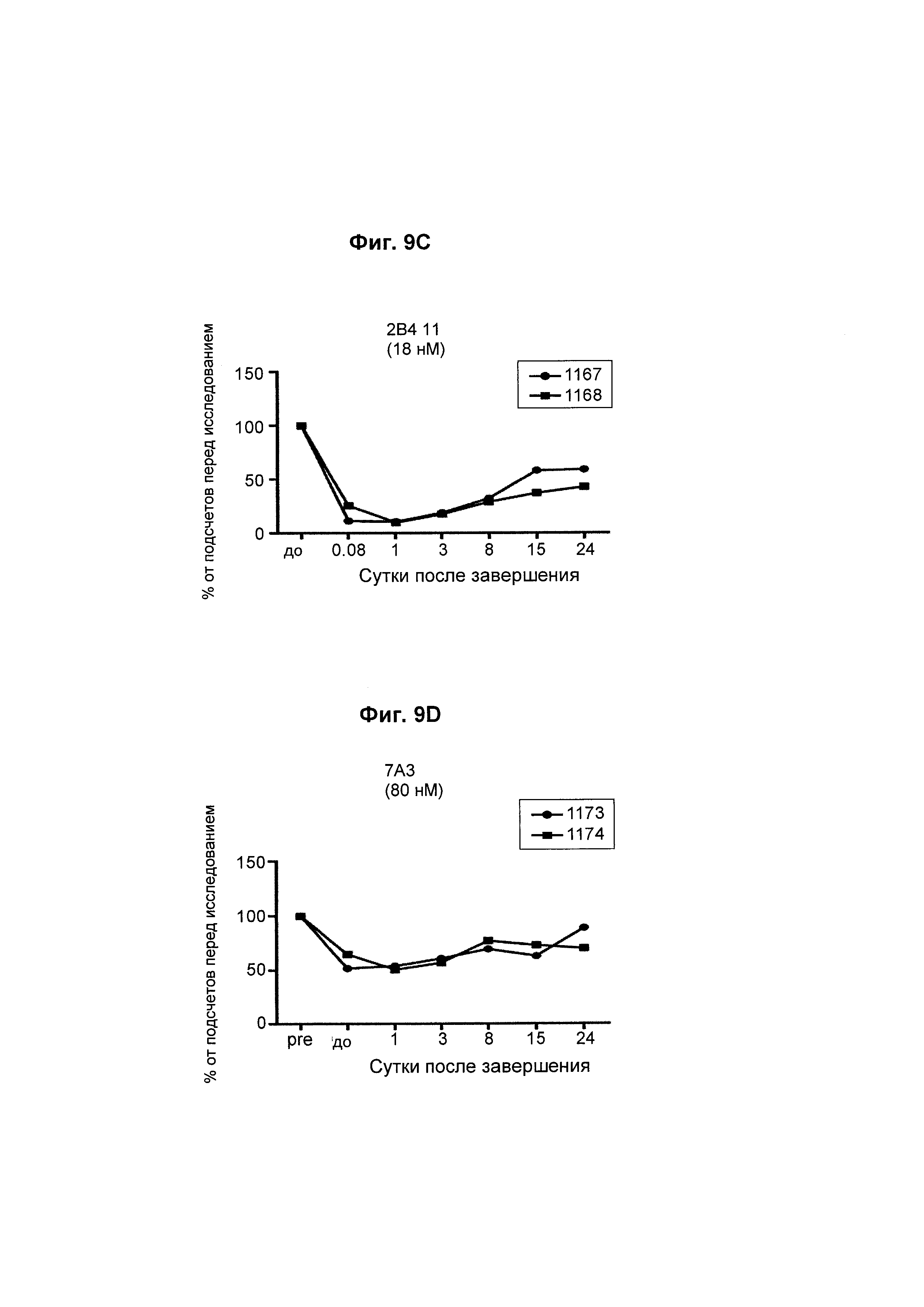
На Фиг. 9А - 9D показана in vivo эффективность биспецифического анти-CD3/анти-CD20 антитела у яванского макака. Анализировали влияние аффинности анти-CD3-фрагмента на истощение В-клеток
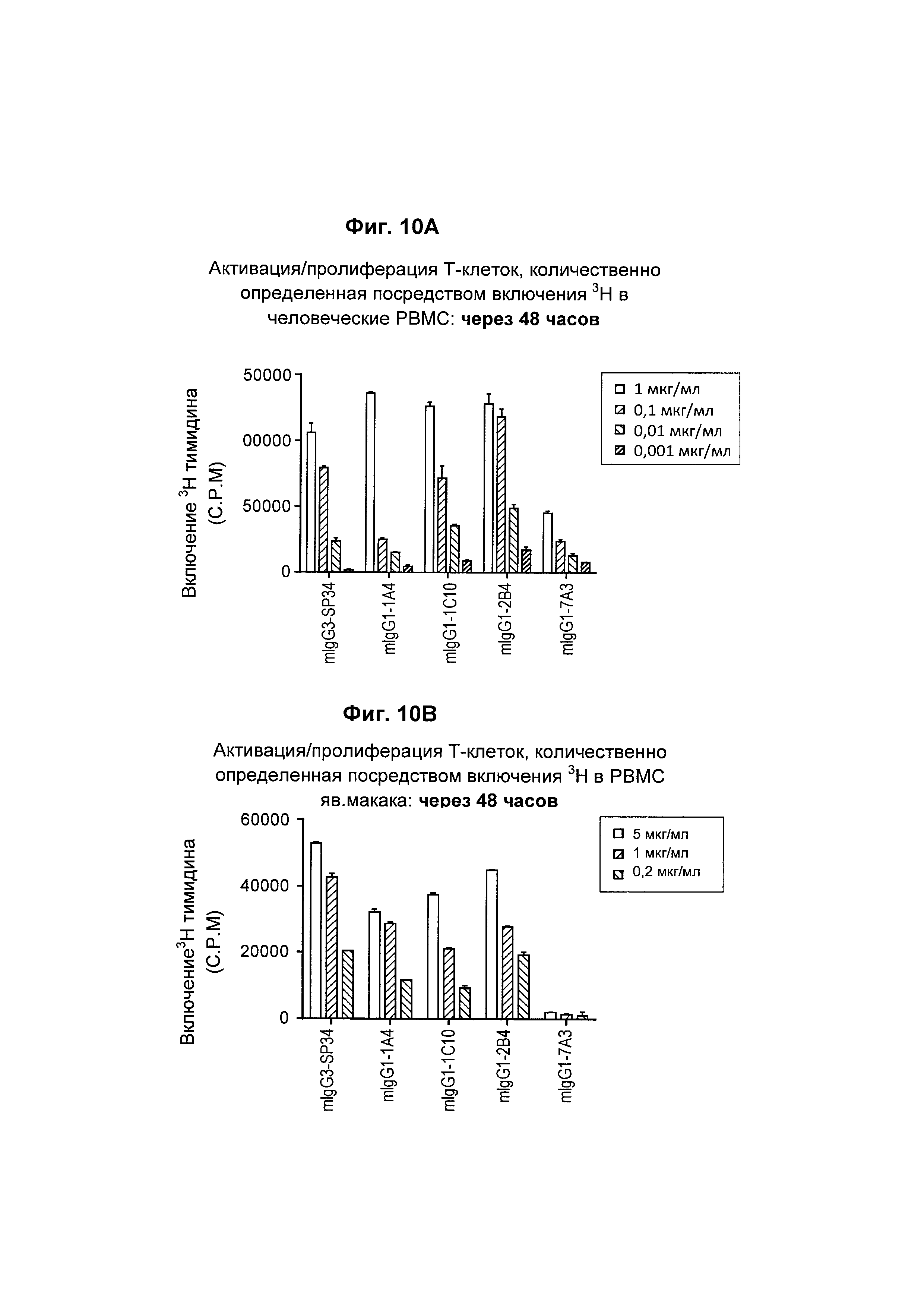
На Фиг. 10А и 10В показано, что выбранные анти-CD3 антитела имели показатели включения тимидина на РВМС (мононуклеары периферической крови) человека и яванского макак.
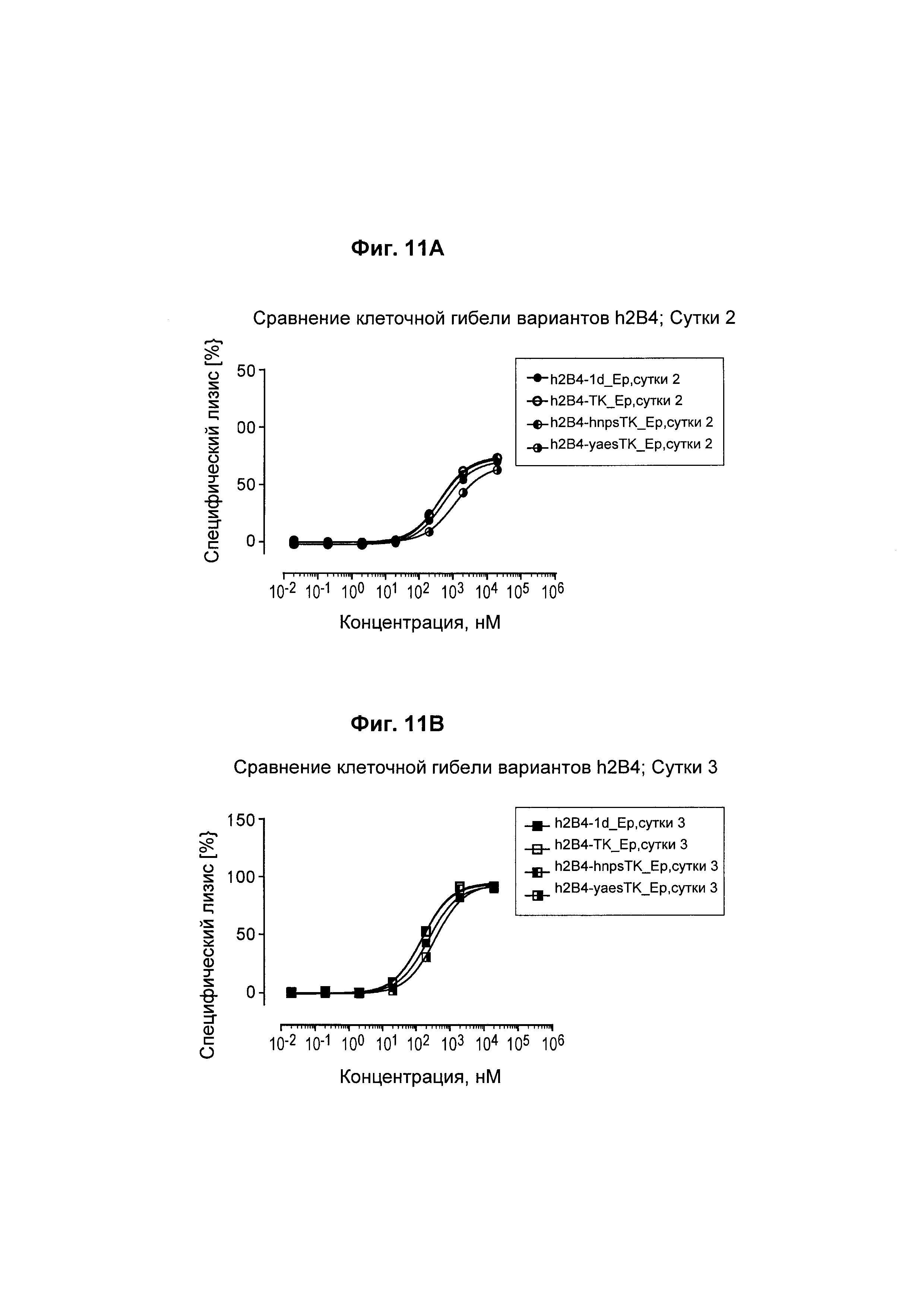
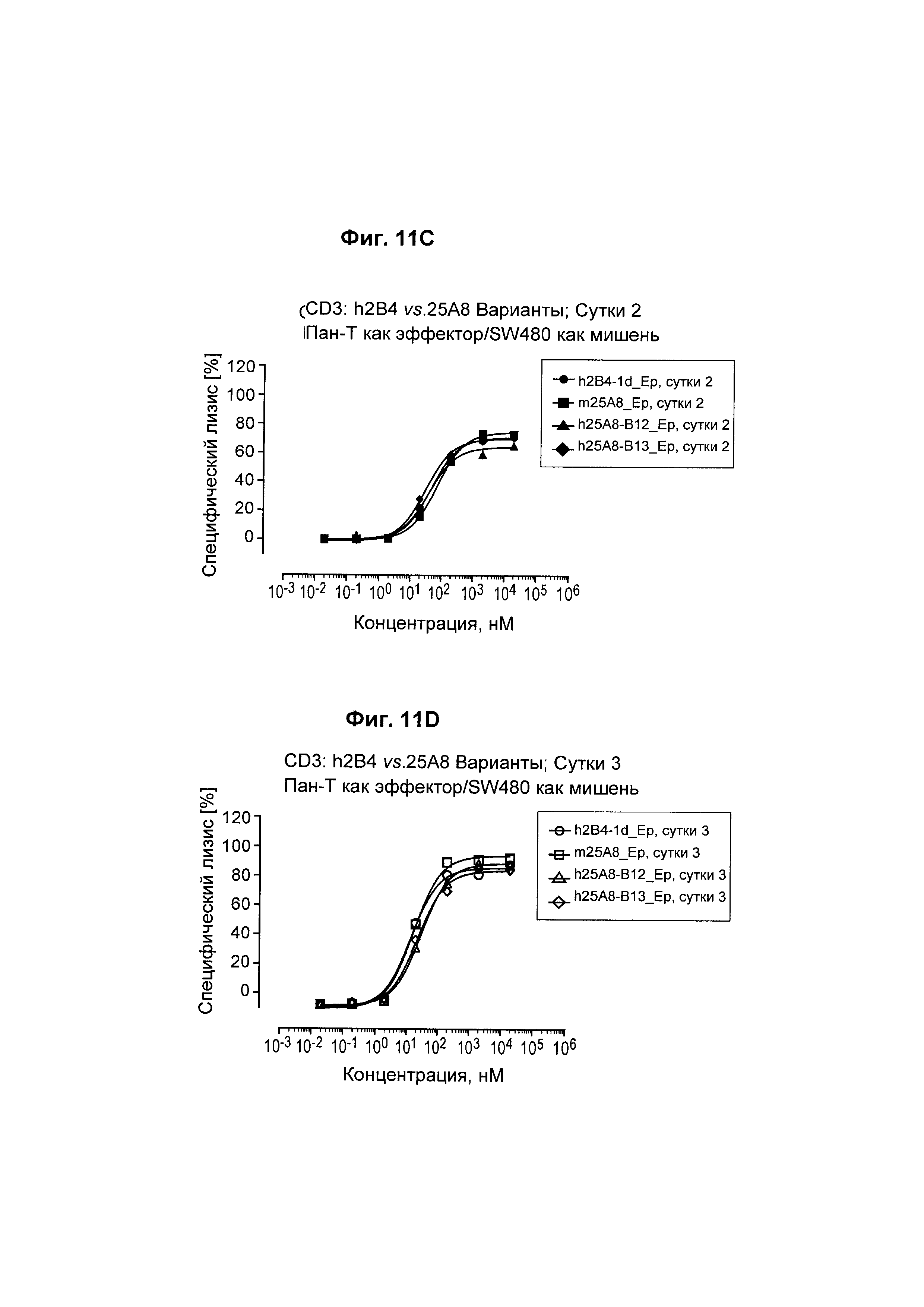
На Фиг. 11А - 11D показано, что все биспецифические анти-EpCam_h2B4 антитела человека обладают активностью уничтожения клеток в услових in vitro.
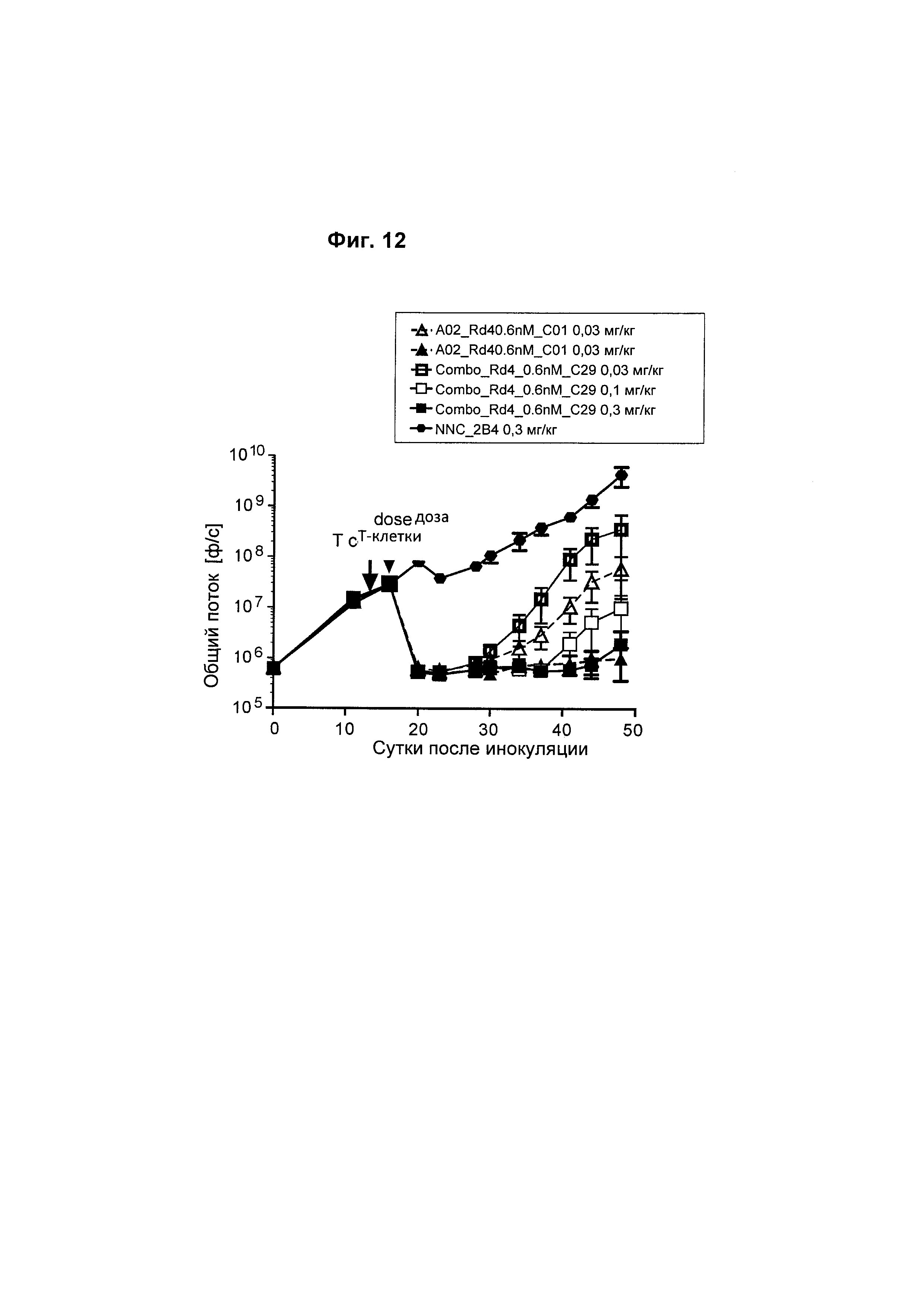
На Фиг. 12 показано, что однократная доза биспецифического анти-BCMA/CD3 антитела человека приводила к регрессии опухоли дозозависимым образом в модели ортотопической миеломы MM1.S.
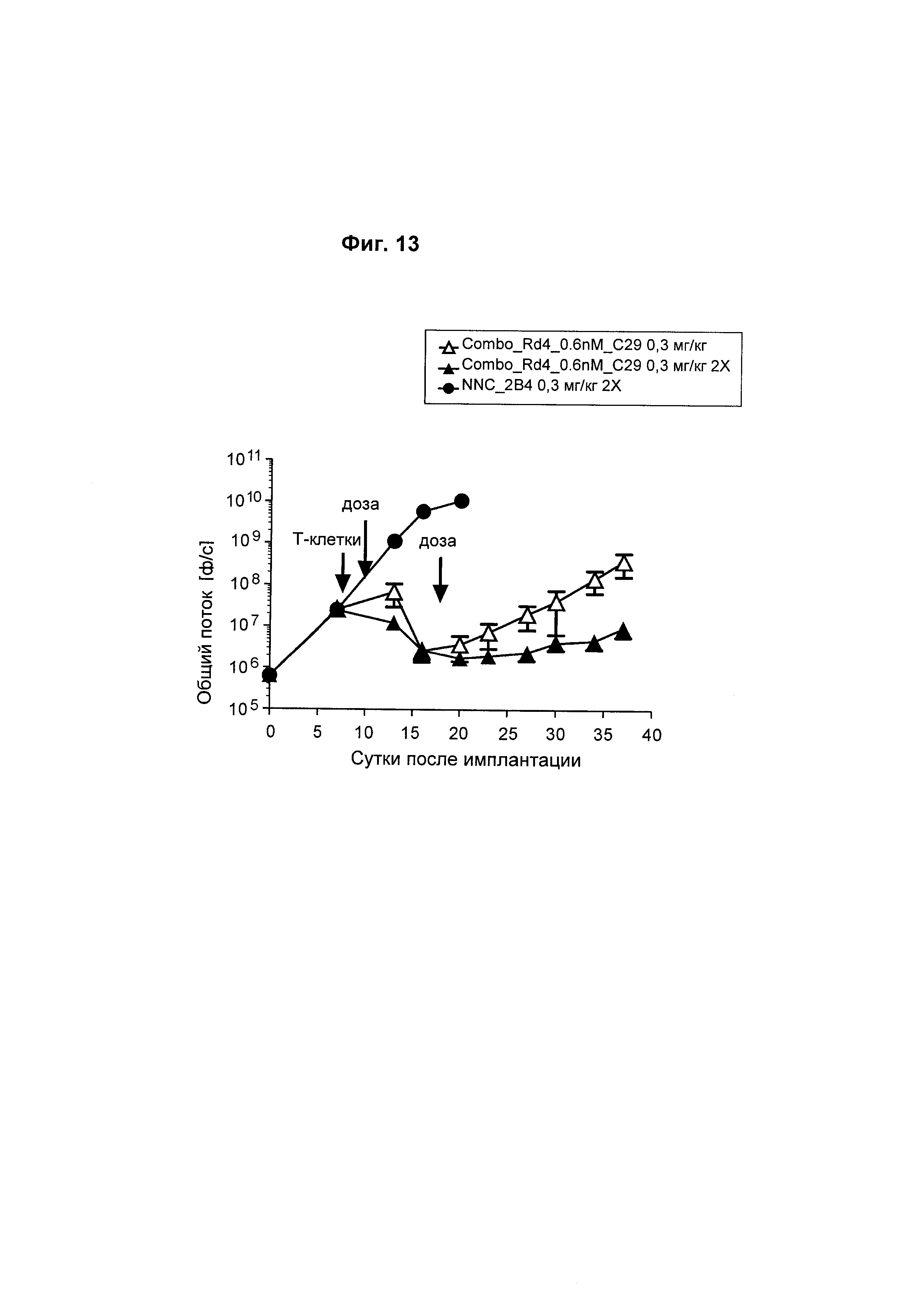
На Фиг. 13 показано, что две дозы человеческого биспецифического анти-ВСМА/CD3 антитела приводили к повышенной регрессии опухоли в модели ортотопической миеломы Molp8.
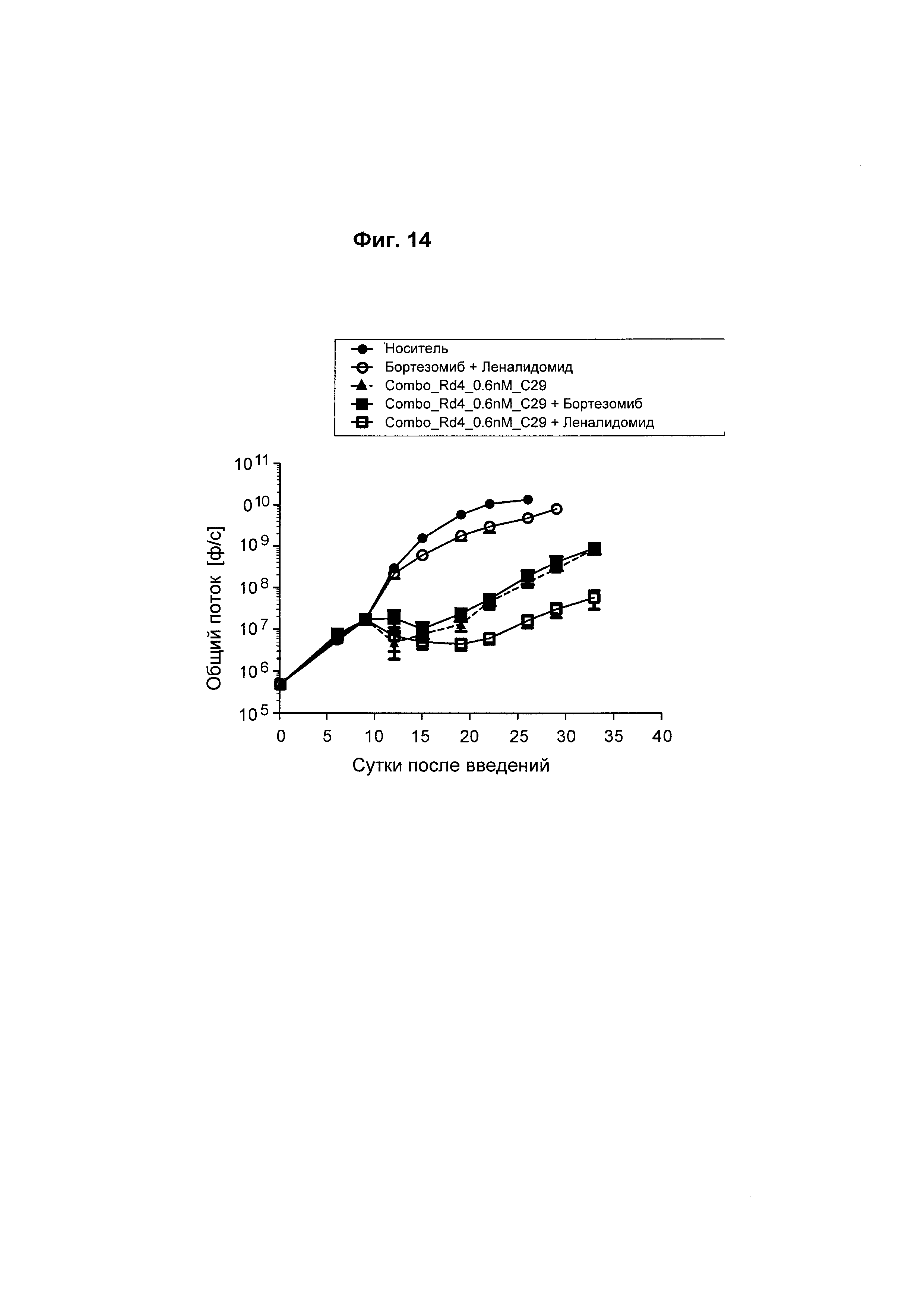
На Фиг. 14 показано, что биспецифическое анти-ВСМА/CD3 антитело само по себе или в комбинации со стандартным лечением множественной миеломы (леналидомид или бортезомиб) является более эффективным, чем комбинация леналидомида и бортезомиба в модели ортотопической опухоли Molp8.
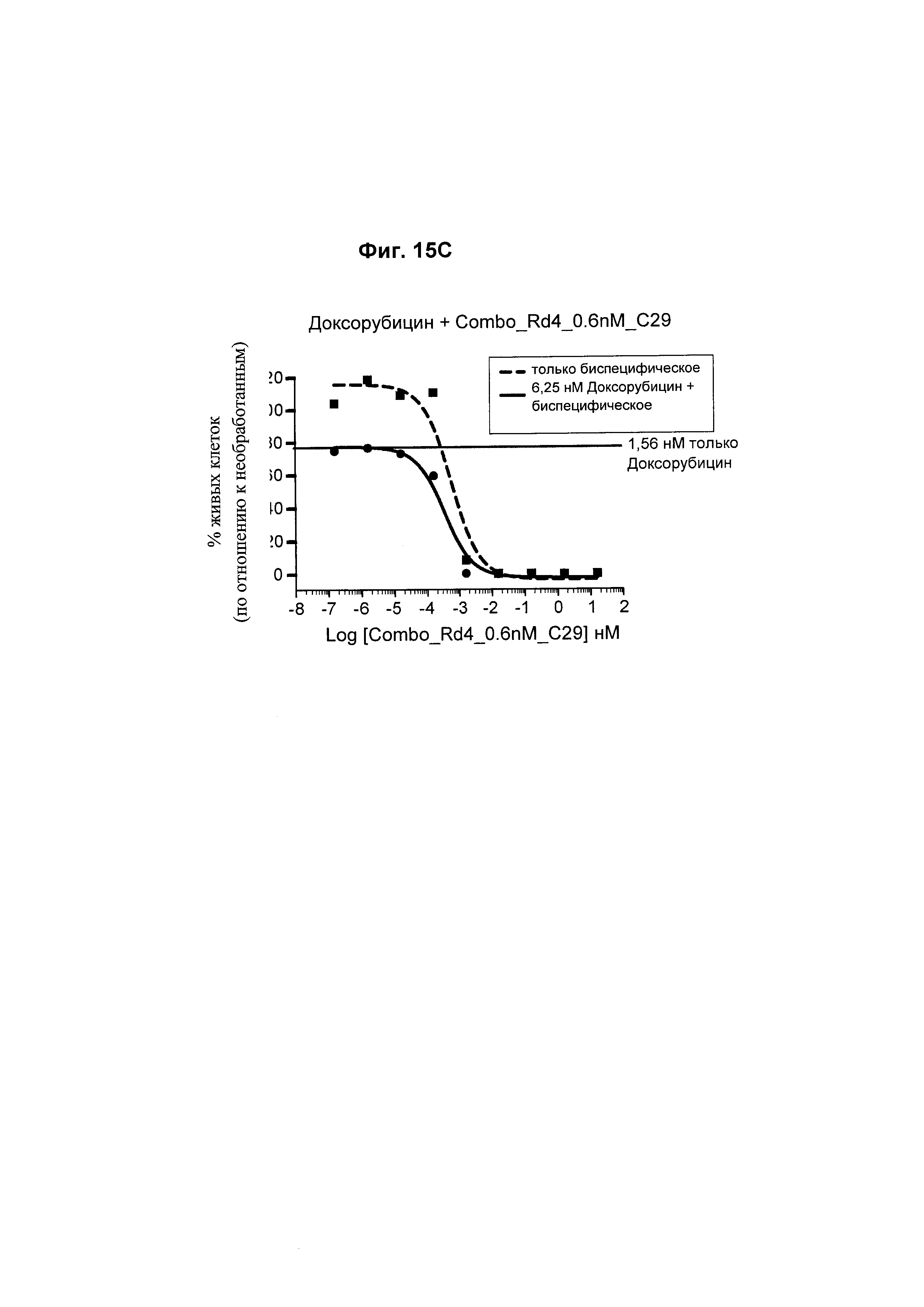
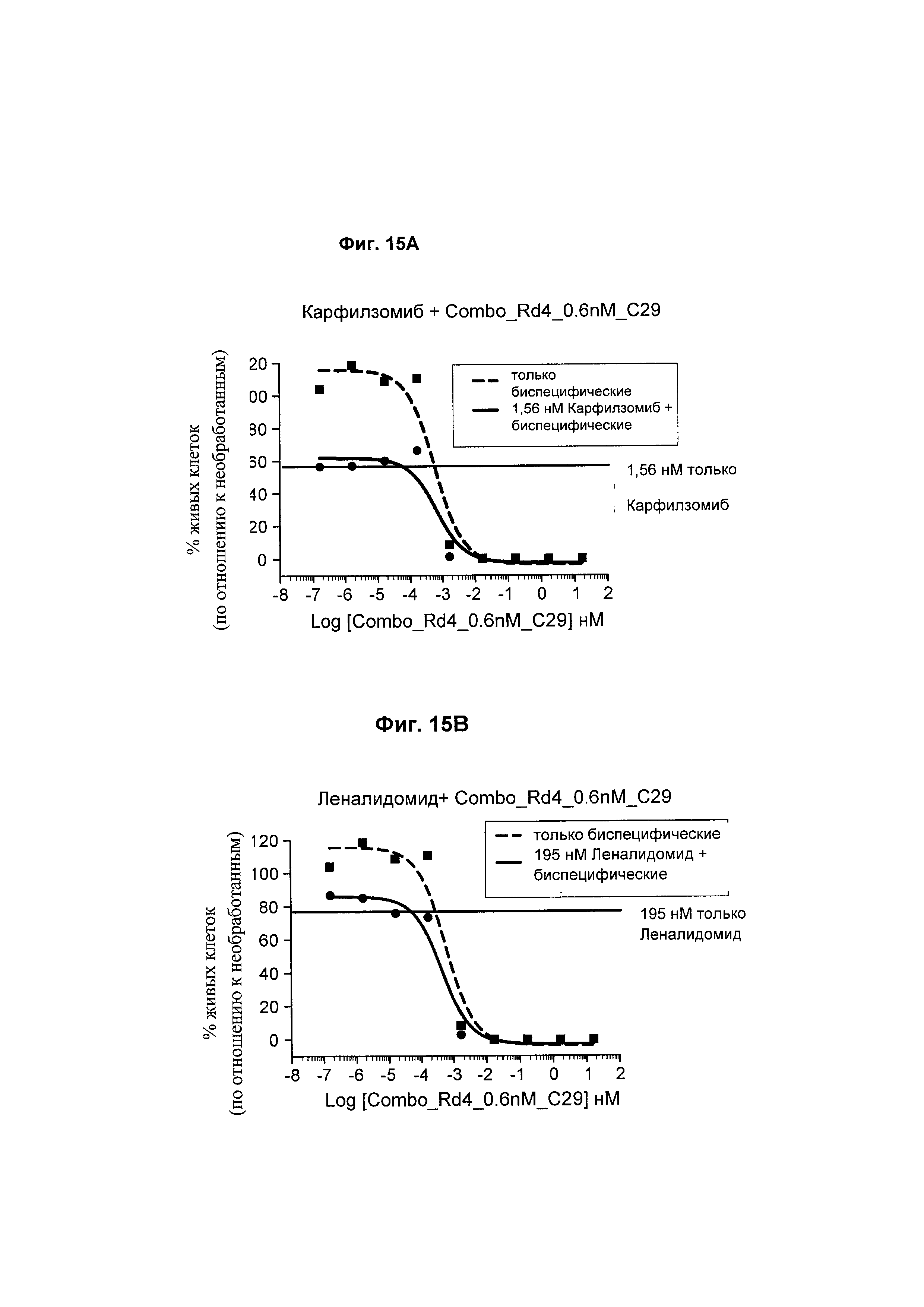
На Фиг. 15А - 15С соответственно показано, что карфилзомиб, леналидомид и доксорубицин не оказывают отрицательного влияния на функцию биспецифического анти-ВСМА/CD3 антитела в клетках ОРМ2 по сравнению с биспецифическим анти-ВСМА/CD3 антителом самим по себе.
На Фиг. 16 показано синергические эффекты на функцию биспецифического анти-ВСМА/CD3 антитела в комбинации с карфилзомибом и леналидомидом по сравнению с каждым веществом по отдельности.
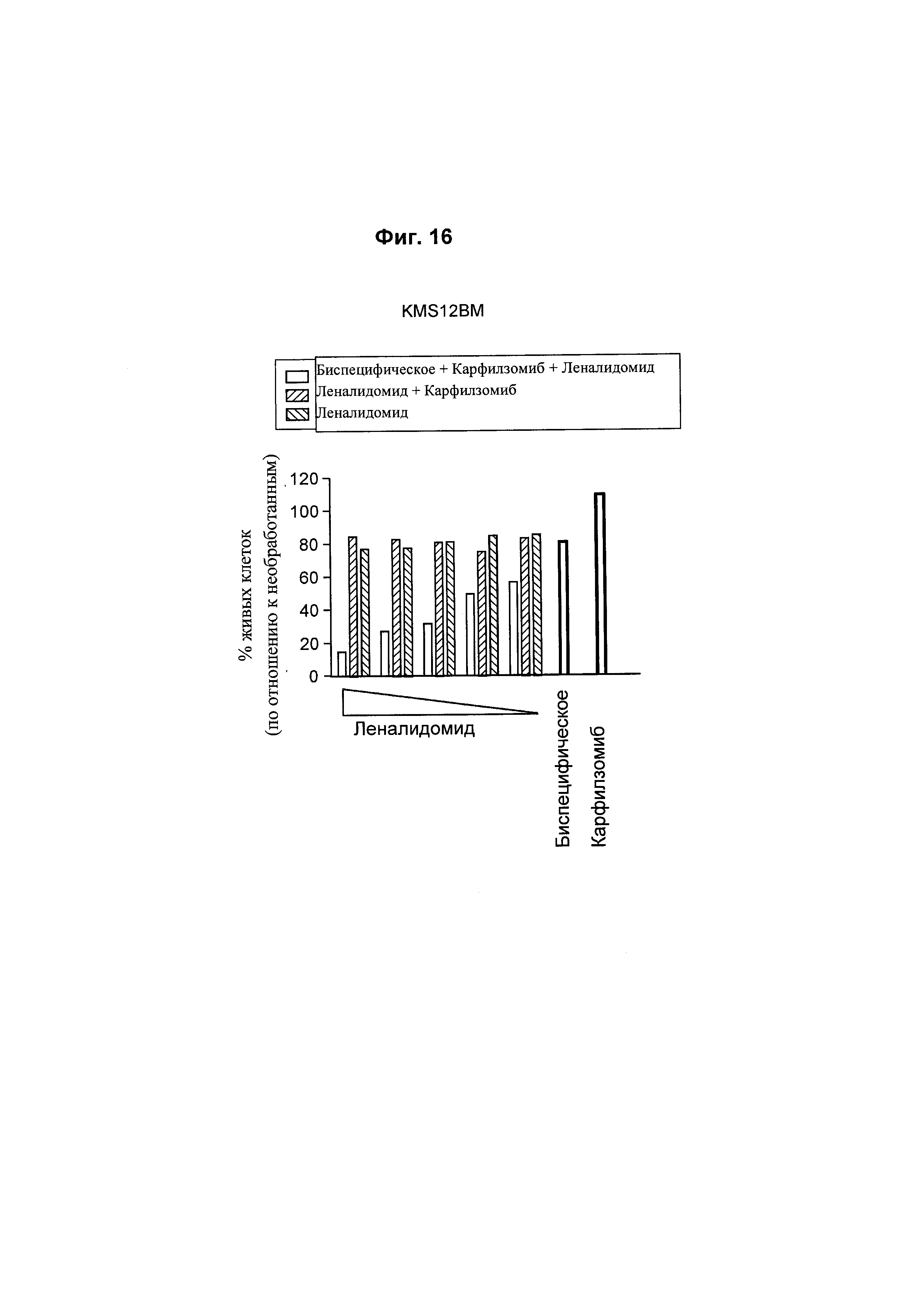
Подробное описание изобретения
В изобретении, раскрытом в данном документе, предложены антитела и конъюгаты антител (например конъюгаты антитело-лекарственное средство), которые специфично связываются с ВСМА (например человеческим ВСМА). В изобретении также предложены полинуклеотиды, кодирующие эти антитела и конъюгаты, композиции, содержащие эти антитела и конъюгаты, и способы получения этих антител и конъюгатов. Кроме того, в изобретении, раскрытом в данном документе, предложены антитела, которые специфично связываются с CD3 (например человеческим CD3), а также гетеродимерные антитела (например биспецифические антитела), которые специфично связываются с CD3 и с опухолевым антигеном (например ВСМА). В изобретении также предложены полинуклеотиды, кодирующие эти антитела, композиции, содержащие эти антитела, и способы получения и использования этих антител. В изобретении также предложены способы лечения состояния, ассоциированного с экспрессией злокачественного ВСМА у субъекта, такого как рак или аутоиммунное заболевание, с использованием антител (например ВСМА, CD3 или биспецифического антитела) или их конъюгатов (конъюгатов ВСМА-антитела с лекарственным средством), как описано в данном документе.
Общие методы
В практическом применении настоящего изобретения будут использованы, если не указано иное, общепринятые методы молекулярной биологии (включая рекомбинантные методы), микробиологии, клеточной биологии, биохимии и иммунологии, которые находятся в компетенции специалистов в данной области. Такие методы полностью описаны в литературе, например в Molecular Cloning: A Laboratory Manual, second edition (Sambrook et al., 1989) Cold Spring Harbor Press; Oligonucleotide Synthesis (M.J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J.E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R.I. Freshney, ed., 1987); Introduction to Cell and Tissue Culture (J.P. Mather and P.E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J.B. Griffiths, and D.G. Newell, eds., 1993-1998) J. Wiley and Sons; Methods in Enzymology (Academic Press, Inc.); Handbook of Experimental Immunology (D.M. Weir and C.C. Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J.M. Miller and M.P. Calos, eds., 1987); Current Protocols in Molecular Biology (F.M. Ausubel et al., eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J.E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C.A. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: a practical approach (D. Catty., ed., IRL Press, 1988-1989); Monoclonal antibodies: a practical approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using antibodies: a laboratory manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M. Zanetti and J.D. Capra, eds., Harwood Academic Publishers, 1995).
Определения
"Антитело" представляет собой молекулу иммуноглобулина, способную специфически связываться с мишенью, такой как углевод, полинуклеотид, липид, полипептид и т.д., посредством по меньшей мере одного антигенраспознающего сайта, находящегося в вариабельной области молекулы иммуноглобулина. При использовании здесь этот термин охватывает не только интактные поликлональные или моноклональные антитела, но и их фрагменты (такие как Fab, Fab', F(ab')2, Fv), одноцепочечные (ScFv) и доменные антитела (включая, например, антитела акул и верблюдов) и слитые белки, содержащие антитело, и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит антигенраспознающий сайт. Антитело включает антитело любого класса, такого как IgG, IgA или IgM (или его подкласса), и антитело не обязательно должно принадлежать к какому-либо конкретному классу. В зависимости от аминокислотной последовательности константной области тяжелых цепей антитела, иммуноглобулины могут быть отнесены к разным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно разделены на подклассы (изотипы), например IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные области тяжелых цепей, которые соответствуют разным классам иммуноглобулинов, называются альфа, дельта, эпсилон, гамма и мю, соответственно. Структуры субъединиц и трехмерные конфигурации разных классов иммуноглобулинов хорошо известны.
Термин "антигенсвязывающий фрагмент" или "антигенсвязывающая часть" антитела, при использовании в данном документе, относится к одному или более фрагментам интактного антитела, который сохраняет способность специфически связываться с данным антигеном (например ВСМА или CD3). Антигенсвязывающие функции антитела могут быть осуществлены фрагментами интактного антитела. Примеры связывающихся фрагментов, охваченных термином "антигенсвязывающий фрагмент" антитела, включают Fab; Fab'; F(ab')2; Fd-фрагмент, состоящий из доменов VH и СН1; фрагмент Fv, состоящий из доменов VL и VH одного плеча антитела; фрагмент однодоменного антитела (dAb) (Ward et al., Nature 341:544-546, 1989) и выделенный участок, определяющий комплементарность (CDR).
Антитело, конъюгат антитела или полипептид, который "предпочтительно связывается" или "специфично связывается" (здесь используются взаимозаменяемо) с мишенью (например с белком ВСМА или белком CD3) представляет собой термин, хорошо известный в данной области, и способы определения такого специфического или предпочтительного связывания также хорошо известны в данной области. Говорят, что молекула проявляет "специфическое связывание" или "предпочтительное связывание", если она взаимодействует или ассоциируется чаще, быстрее, с большей продолжительностью и/или с большей аффинностью с определенной клеткой или веществом, чем с альтернативными клетками или веществами. Антитело "специфично связывается" или "предпочтительно связывается" с мишенью, если оно связывается с большей аффинностью, авидностью, легче и/или более продолжительно, чем оно связывается с другими веществами. Например, антитело, которое специфично или предпочтительно связывается с эпитопом ВСМА или эпитопом CD3, представляет собой антитело, которое связывается с этим эпитопом с большей аффинностью, авидностью, легче и/или более продолжительно, чем оно связывается с другими эпитопами ВСМА, эпитопами, не являющимися ВСМА, эпитопами CD3 или эпитопами, не являющимися CD3. Также из данного определения понятно, что, например, антитело (или группировка или эпитоп), которое специфично или предпочтительно связывается с первой мишенью, может специфично или предпочтительно связываться или не связываться со второй мишенью. Как таковое, "специфичное связывание" или "предпочтительное связывание" не требует (хотя и может включать) обязательного исключительного связывания. Как правило, но не обязательно, упоминание связывания означает предпочтительное связывание.
"Вариабельная область" антитела относится к вариабельной области легкой цепи антитела или к вариабельной области тяжелой цепи антитела, либо отдельно, либо в комбинации. Как известно в данной области, каждая из вариабельных областей тяжелой и легкой цепи состоит из четырех каркасных областей (FR), соединенных тремя участками, определяющими комплементарность (CDR), также известными как гипервариабельные области. CDR в каждой цепи удерживаются вместе в непосредственной близости посредством FR, и вместе с CDR из другой цепи участвуют в формировании антигенсвязывающего сайта антител. Существует по меньшей мере два метода определения CDR: (1) подход, основанный на межвидовой изменчивости последовательности (то есть Kabat et al. Sequences of Proteins of Immunological Interest, (5th ed., 1991, National Institutes of Health, Bethesda MD)); и (2) подход, основанный на кристаллографических исследованиях комплексов антиген-антитело (Al-lazikani et al., 1997, J. Molec. Biol. 273:927-948). При использовании в данном документе, CDR может относиться к CDR, определенным с помощью любого подхода или комбинации обоих подходов.
"CDR" вариабельного домена представляет собой аминокислотные остатки в вариабельной области, которые идентифицированы в соответствии с определениями согласно Kabat, Chothia, суммирования Kabat и Chothia, AbM, контактным и/или конформационным определениями, или любым способом определения CDR, хорошо известным в данной области. CDR антитела могут быть идентифицированы как гипервариабельные области, первоначально определенные согласно Kabat et al. См., например, Kabat et al., 1992, Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, NIH, Washington D.C. Положения CDR также могут быть идентифицированы как структуры из петлевой структуры, первоначально описанной Chothia и другими. См., например, Chothia et al., Nature 342:877-883, 1989. Другие подходы к идентификации CDR включают "определение AbM," которое представляет собой компромисс между Kabat и Chothia и образуется с использованием программного обеспечения для моделирования антител Oxford Molecular's AbM (теперь Accelrys®) или "контактное определение" CDR, основанное на наблюдаемых контактах антигенов, как изложено в MacCallum et al., J. Mol. Biol., 262:732-745, 1996. В другом подходе, упоминаемом здесь как "конформационное определение" CDR, положения CDR могут быть идентифицированы как остатки, которые вносят энтальпический вклад в связывание антигена. См., например, Makabe et al., Journal of Biological Chemistry, 283:1156-1166, 2008. Другие определения границ CDR могут не соответствовать строго одному из вышеуказанных подходов, но, тем не менее, будут перекрываться по меньшей мере с частью CDR по Kabat, хотя они могут быть короче или длиннее с учетом прогнозирования или экспериментальных свидетельств того, что определенные остатки или группы остатков или даже целые CDR не оказывают существенного влияния на связывание антигена. При использовании в данном документе, CDR может относиться к CDR, определенным любым подходом, известным в данной области, включая комбинацию подходов. В используемых здесь способах можно использовать CDR, определенные согласно любому из этих подходов. Для любого данного воплощения, содержащего более одного CDR, CDR могут быть определены в соответствии с любым из определений: Kabat, Chothia, расширенным, AbM, контактным и/или конформационным.
При использовании в данном документе "моноклональное антитело" относится к антителу, полученному из популяции по существу гомогенных антител, то есть отдельные антитела, составляющие популяцию, идентичны, за исключением возможных естественных мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела, будучи направленными против одного антигенного сайта, являются высокоспецифичными. Кроме того, в отличие от препаратов поликлональных антител, которые, как правило, включают разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Определение "моноклональный" указывает на характер антитела, как полученный из по существу гомогенной популяции антител, но его не следует рассматривать как требующий продуцирования антитела каким-либо определенным способом. Например, моноклональные антитела для применения согласно настоящему изобретению могут быть получены с помощью описанного выше гибридомного метода, впервые описанного в Kohler and Milstein, Nature 256:495, 1975, или могут быть получены посредством методов рекомбинантной ДНК, таких как описаны в патенте US 4816567. Моноклональные антитела также могут быть выделены из фаговых библиотек, полученных с использованием методов, описанных, например, в McCafferty et al., Nature 348:552-554, 1990.
При использовании в данном документе "гуманизированное" антитело относится к формам не являющихся человеческими (например мышиных) антител, которые представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие подпоследовательности антител), которые содержат минимальную последовательность, происходящую из иммуноглобулина, не являющегося человеческим. Предпочтительно, гуманизированные антитела представляют собой человеческие иммуноглобулины (реципиентное антитело), в которых остатки из участка, определяющего комплементарность (CDR), реципиента замещены остатками из CDR видов, не являющихся человеком (донорное антитело), таких как мыши, крысы или кролики, имеющих нужную специфичность, аффинность и активность. В некоторых случаях остатки Fv каркасной области (FR) человеческого иммуноглобулина заменяют соответствующими остатками, не являющимися человеческими. Кроме того, гуманизированное антитело может содержать остатки, которые не обнаружены ни в реципиентном антителе, ни в импортированных последовательностях CDR или каркасной области, но включены для дополнительного улучшения и оптимизации харарктеристик антител. В целом, гуманизированное антитело содержит по существу все из по меньшей мере одного и обычно двух вариабельных доменов, где все или практически все участки CDR соответствуют участки CDR иммуноглобулина, не являющегося человеческим, и все или по существу все участки FR представляют собой участки консенсусной последовательности иммуноглобулина человека. Гуманизированное антитело оптимально также содержит по меньшей мере часть константной области иммуноглобулина или домен (Fc), обычно из иммуноглобулина человека. Предпочтительными являются антитела, имеющие области Fc, модифицированные, как описано в WO 99/58572. Другие формы гуманизированных антител имеют один или более CDR (CDR L1, CDR L2, CDR L3, CDR Н1, CDR Н2 или CDR Н3), которые изменены относительно исходного антитела, которые также упоминаются как один или более CDR "полученных из" одного или более CDR исходного антитела.
При использовании в данном документе "человеческое антитело" означает антитело, имеющее аминокислотную последовательность, соответствующую последовательности антитела, продуцируемого человеком, и/или которое было получено с использованием любого из способов получения человеческих антител, известных специалистам в данной области или раскрытых в данном документе. Это определение человеческого антитела включает антитела, содержащие по меньшей мере один полипептид тяжелой цепи человека или по меньшей мере один полипептид легкой цепи человека. Одним таким примером является антитело, содержащее мышиные полипептиды легкой и тяжелой цепи. Человеческие антитела могут быть получены с использованием различных методов, известных в данной области. В одном воплощении человеческое антитело выбрано из фаговой библиотеки, где эта фаговая библиотека экспрессирует человеческие антитела (Vaughan et al., Nature Biotechnology, 14:309-314, 1996; Sheets et al., Proc. Natl. Acad. Sci. (USA) 95:6157-6162, 1998; Hoogenboom and Winter, J. Mol. Biol., 227:381, 1991; Marks et al., J. Mol. Biol., 222:581, 1991). Человеческие антитела также могут быть получены путем иммунизации животных, которым трансгенно вводили локус иммуноглобулина человека вместо эндогенного локуса, например мышей, у которых эндогенные гены иммуноглобулина частично или полностью инактивированы. Такой подход описан в патентах US 5545807; 5545806; 5,569,825; 5625126; 5633425 и 5661016. Альтернативно, человеческое антитело может быть получено путем иммортализации человеческих В-лимфоцитов, которые продуцируют антитело, направленное против целевого антигена (такие В-лимфоциты могут быть получены от субъекта или путем одноклеточного клонирования кДНК или могут быть иммунизированы in vitro). См., например, Cole et al. Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77, 1985; Boerner et al., J. Immunol., 147 (1):86-95, 1991; и патент US 5750373.
Подразумевается, что термин "химерное антитело" означает антитела, последовательности вариабельной области которых происходят из одного вида, а последовательности константной области происходят из другого вида, например антитело, в котором последовательности вариабельной области происходят из мышиного антитела и последовательности константной области происходят из человеческого антитела.
Термины "полипептид", "олигопептид", "пептид" и "белок" используются здесь взаимозаменяемо для обозначения цепей аминокислот любой длины, предпочтительно относительно коротких (например 10-100 аминокислот). Цепь может быть линейной или разветвленной, она может содержать модифицированные аминокислоты и/или может быть прервана не аминокислотами. Эти термины также охватывают аминокислотную цепь, которая модифицированы естественным образом или посредством вмешательства; например, путем образования дисульфидной связи, гликозилирования, липидизации, ацетилирования, фосфорилирования или путем любых других манипуляций или модификаций, таких как конъюгирование с меченым компонентом. В это определение также включены, например, полипептиды, содержащие один или более аналогов аминокислоты (включая, например, не встречающиеся в природе аминокислоты и т.д.), а также другие модификации, известные в данной области. Очевидно, что полипептиды могут находиться в виде одиночных цепей или ассоциированных цепей.
"Моновалентное антитело" содержит один антигенсвязывающий сайт на молекулу (например IgG или Fab). В некоторых случаях моновалентное антитело может иметь более одного антигенсвязывающего сайта, но эти связывающие сайты происходят из разных антигенов.
"Моноспецифическое антитело" содержит два идентичных антигенсвязывающих сайта на молекулу (например IgG), так что эти два сайта связывания соединяются с одним и тем же эпитопом на антигене. Таким образом, они конкурируют друг с другом за связывание с одной молекулой антигена. Большинство обнаруженных в природе антител являются моноспецифическими. В некоторых случаях моноспецифическое антитело также может быть моновалентным антителом (например Fab).
"Бивалентное антитело" содержит два антигенсвязывающих сайта на молекулу (например IgG). В некоторых случаях два сайта связывания имеют одинаковую антигенную специфичность. Однако бивалентные антитела могут быть биспецифическими.
"Биспецифическое антитело" или "антитело с двойной специфичностью" представляет собой гибридное антитело, имеющее два разных антигенсвязывающих сайта. Два антигенсвязывающих сайта биспецифического антитела связываются с двумя разными эпитопами, которые могут находиться на одних и тех же или на разных белковых мишенях.
"Бифункциональное антитело" представляет собой антитело, имеющее идентичные антигенсвязывающие сайты (то есть идентичные аминокислотные последовательности) в двух плечах, но каждый сайт связывания может распознать два разных антигена.
"Гетеромультимер", "гетеромультимерный комплекс" или "гетеромультимерный полипептид" представляет собой молекулу, содержащую по меньшей мере первый полипептид и второй полипептид, где второй полипептид отличается от первого полипептида по меньшей мере одним аминокислотным остатком в аминокислотной последовательности. Гетеромультимер может содержать "гетеродимер", образованный первым и вторым полипептидом, или может образовывать третичные структуры более высокого порядка, где, в дополнение к первому и второму полипептиду, присутствуют полипептиды.
"Гетеродимер," "гетеродимерный белок", "гетеродимерный комплекс" или "гетеромультимерный полипептид" представляет собой молекулу, содержащую первый полипептид и второй полипептид, где аминокислотная последовательность второго полипептида отличается от аминокислотной последовательности первого полипептида по меньшей мере одним аминокислотным остатком.
"Шарнирная область", "шарнирная последовательность" и их варианты, при использовании в данном документе, включают значение, известное в данной области, которое проиллюстрировано, например, в Janeway et al., ImmunoBiology: the immune system in health and disease, (Elsevier Science Ltd., NY) (4th ed., 1999); Bloom et al., Protein Science (1997), 6:407-415; Humphreys et al., J. Immunol. Methods (1997), 209:193-202.
"Иммуноглобулин-подобная шарнирная область", "иммуноглобулин-подобная шарнирная последовательность" и их варианты, при использовании в данном документе, относятся к шарнирной области и шарнирной последовательности иммуноглобулин-подобной или антитело-подобной молекулы (например иммуноадгезинов). В некоторых воплощениях иммуноглобулин-подобная шарнирная область может быть из или происходить от любого субтипа IgG1, IgG2, IgG3 или IgG4, или из IgA, IgE, IgD или IgM, включая их химерные формы, например химерной шарнирной области IgG1/2.
Термин "иммунная эффекторная клетка" или "эффекторная клетка", при использовании в данном документе, относится к клетке в естественном репертуаре клеток иммунной системы человека, которая может быть активирована, чтобы воздействовать на жизнеспособность клетки-мишени. Жизнеспособность клетки-мишени может включать выживаемость клеток, пролиферацию и/или способность взаимодействовать с другими клетками.
Антитела по изобретению могут быть получены с использованием способов, хорошо известных в данной области, например рекомбинантных технологий, метода фагового дисплея, синтетических методов или комбинаций таких или других методов, хорошо известных в данной области техники (см., например, Jayasena, S.D., Clin. Chem., 45: 1628-50, 1999 и Fellouse, F.A., et al, J. Mol. Biol., 373(4):924-40, 2007).
Как известно в данной области, "полинуклеотид" или "нуклеиновая кислота", используемые здесь взаимозаменяемо, относятся к цепочкам нуклеотидов любой длины и включают ДНК и РНК. Нуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания и/или их аналоги или любой субстрат, который может быть включен в цепь при помощи ДНК или РНК-полимеразы. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. При наличии, модификация нуклеотидной структуры может быть проделана до и после сборки цепи. Последовательность нуклеотидов может быть прервана ненуклеотидными компонентами. Полинуклеотид может быть дополнительно модифицирован после полимеризации, например путем конъюгации с меченым компонентом. Другие типы модификации включают, например, "кэпы", замещения одного или более естественных нуклеотидов аналогом, межнуклеотидные модификации, такие как, например, модификации с незаряженными связями (например метилфосфонаты, фосфотриэфиры, фосфорамидаты, карбаматы и т.д.) и с заряженными связями (например фосфотиоаты, фосфородитиоаты и т.д.), модификации, содержащие концевые группировки, такие как, например, белки (например нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин и т.д.), модификации с интеркаляторами (например акридином, псораленом и т.д.), модификации, содержащие хелатирующий агенты (например металлы, радиоактивные металлы, бор, окислительные металлы и т.д.), модификации, содержащие алкилаторы, модификации с модифицированными связями (например альфа-аномерные нуклеиновые кислоты и т.д.), а также немодифицированные формы полинуклеотида(ов). Кроме того, любая из гидроксильных групп, обычно присутствующих в сахарах, может быть заменена, например, фосфонатными группами, фосфатными группами, защищена стандартными защитными группами или активирована для получения дополнительных связей с дополнительными нуклеотидами, или может быть конъюгирована с твердыми подложками. 5'- и 3'-концевой ОН может быть фосфорилирован или заменен аминами или органическими кэп-группировками из 1-20 атомов углерода. Другие гидроксилы также могут быть дериватизированы до стандартных защитных групп. Полинуклеотиды также могут содержать аналогичные формы сахаров рибоза или дезоксирибоза, которые обычно известны в данной области, включая, например, 2'-O-метил-, 2'-O-аллил, 2'-фтор- или 2'-азидо-рибозу, карбоциклические аналоги сахара, альфа- или бета-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и аналоги нуклеозидов без азотистого основания, такие как метилрибозид. Одна или несколько фосфодиэфирных связей могут быть заменены альтернативными связующими группами. Эти альтернативные связующие группы включают, без ограничения ими, воплощения, где фосфат заменен P(O)S ("тиоат"), P(S)S ("дитиоат"), (O)NR2 ("амидат"), P(O)R, P(O)OR', СО или СН2 ("формацеталь"), где каждый R или R' независимо представляет собой Н или замещенный или незамещенный алкил (1-20С), возможно содержащий простую эфирную (-O-) связь, арил, алкенил, циклоалкил, циклоалкенил или аралдил. Не все связи в полинуклеотиде должны быть идентичными. Предыдущее описание относится ко всем полинуклеотидам, упомянутым здесь, включая РНК и ДНК.
Как известно в данной области, "константная область" антитела относится к константной области легкой цепи антитела или константной области тяжелой цепи антитела отдельно или в комбинации.
При использовании в данном документе, "по существу чистый" относится к веществу, которое является по меньшей мере на 50% чистым (то есть не содержащим загрязнений), более предпочтительно по меньшей мере на 90% чистым, более предпочтительно по меньшей мере на 95% чистым, еще более предпочтительно по меньшей мере на 98% чистым и наиболее предпочтительно по меньшей мере на 99% чистым.
"Клетка-хозяин" включает отдельную клетку или культуру клеток, которые могут быть или являются реципиентами вектора(ов) для включения полинуклеотидных вставок. Клетки-хозяева включают потомство одной клетки-хозяина, и это потомство не обязательно должно быть полностью идентичным (по морфологии или комплементу геномной ДНК) исходной родительской клетке из-за естественных, случайных или преднамеренных мутаций. Клетка-хозяин включает клетки, трансфицированные in vivo полинуклеотидом(ами) по данному изобретению.
Как известно в данной области, термин "Fc-область" используется для определения C-концевой области тяжелой цепи иммуноглобулина. "Fc-область" может представлять собой Fc-область с нативной последовательностью или вариант Fc-области. Хотя границы Fc-области тяжелой цепи иммуноглобулина могут варьироваться, Fc-область тяжелой цепи IgG человека обычно определена как участок от аминокислотного остатка в положении Cys226, или от Pro230 до ее карбоксильного конца. Нумерация остатков Fc-области соответствует индексу EU, как в Kabat. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md., 1991. Fc-область иммуноглобулина обычно содержит две константные области, CH2 и CH3.
При использовании в данной области техники, "Fc-рецептор" и "FcR" описывает рецептор, который связывается с Fc-областью антитела. Предпочтительный FcR представляет собой человеческий FcR с нативной последовательностью. Кроме того, предпочтительный FcR представляет собой такой FcR, который связывается с антителом IgG (гамма-рецептор) и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и альтернативно сплайсируемые формы этих рецепторов. Рецепторы FcγRII включают FcγRIIA ("активирующий рецептор") и FcγRIIB ("ингибирующий рецептор"), которые имеют похожие аминокислотные последовательности, которые отличаются, главным образом, своими цитоплазматическими доменами. FcR рассмотрены в Ravetch and Kinet, Ann. Rev. Immunol., 9:457-92, 1991; Capel et al., Immunomethods, 4:25-34, 1994; и de Haas et al., J. Lab. Clin. Med., 126:330-41, 1995. "FcR" также включает неонатальный рецептор FcRn, который отвечает за передачу материнских IgG плоду (Guyer et al., J. Immunol., 117:587, 1976; and Kim et al., J. Immunol., 24:249, 1994).
Термин "конкурировать", при использовании в данном документе в отношении антитела, означает, что первое антитело или его антигенсвязывающий фрагмент (или часть), связывается с эпитопом способом, достаточно похожим на связывание второго антитела или его антигенсвязывающей части, так что результат связывания первого антитела с его когнатным эпитопом заметно снижается в присутствии второго антитела, по сравнению со связыванием первого антитела в отсутствие второго антитела. Альтернативно, связывание второго антитела с его эпитопом также может заметно снижаться в присутствии первого антитела, но это не обязательно. То есть первое антитело может ингибировать связывания второго антитела с его эпитопом без ингибирования вторым антителом связывания первого антитела с его соответствующим эпитопом. Однако, когда каждое антитело обнаруживаемым образом ингибирует связывание другого антитела с его когнатным эпитопом или лигандом, или в такой же или в большей или меньшей степени, говорят, что антитела "перекрестно конкурируют" друг с другом за связывание с их соответствующим(и) эпитопом(ами). Настоящее изобретение включает как конкурирующие, так и перекрестно-конкурирующие антитела. Независимо от механизма такой конкуренции или перекрестной конкуренции (например стерического затруднения, конформационного изменения или связывания с общим эпитопом или его частью), специалист в данной области определит на основании изложенных здесь идей и руководств, что такие конкурирующие и/или перекрестно конкурирующие антитела входят в объем изобретения и могут быть пригодными для описанных здесь способов.
"Функциональная Fc-область" обладает по меньшей мере одной эффекторной функцией Fc-области с нативной последовательностью. Типичные "эффекторные функции" включают связывание C1q; комплемент-зависимую цитотоксичность; связывание Fc-рецептора; антитело-зависимую клеточно-опосредованную цитотоксичность; фагоцитоз; даун-регуляцию рецепторов клеточной поверхности (например В-клеточного рецептора) и т.д. Такие эффекторные функции обычно требуют комбинирования Fc-области со связывающим доменом (например вариабельным доменом антитела) и могут быть оценены с использованием различных анализов оценки таких эффекторных функций антитела, известных в данной области.
"Fc-область с нативной последовательностью" содержит аминокислотную последовательность, идентичную аминокислотной последовательности Fc-области, обнаруженной в природе. "Вариант Fc-области" содержит аминокислотную последовательность, которая отличается от нативной последовательности Fc-области по меньшей мере одной аминокислотной модификацией, при сохранении по меньшей мере одной эффекторной функции Fc-области с нативной последовательностью. В некоторых воплощениях вариант Fc-области имеет по меньшей мере одну аминокислотную замену по сравнению с Fc-областью с нативной последовательностью или с Fc-областью родительского полипептида, например от примерно одной до примерно десяти аминокислотных замен и предпочтительно от примерно одной до примерно пяти аминокислотных замен в Fc-области с нативной последовательностью или в Fc-области родительского полипептида. Вариант Fc-области в данном изобретении предпочтительно обладает по меньшей мере примерно 80% идентичностью последовательности с нативной последовательностью Fc-области и/или с Fc-областью родительского полипептида, и наиболее предпочтительно по меньшей мере примерно 90% идентичностью последовательности с ними, более предпочтительно по меньшей мере примерно 95%, по меньшей мере примерно 96%, по меньшей мере примерно 97%, по меньшей мере примерно 98%, по меньшей мере примерно 99% идентичностью последовательности с ними.
Термин "эффекторная функция" относится к биологическим активностям, обусловленным Fc-областью антитела. Примеры эффекторных функций антитела включают, без ограничения ими, антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC), связывание Fc-рецептора, комплемент-зависимую цитотоксичность (CDC), фагоцитоз, связывание C1q и даун-регуляцию рецепторов клеточной поверхности (например рецептора В-клетки; BCR). См., например, патент US 6737056. Такие эффекторные функции, как правило, требуют комбинирования Fc-области со связывающим доменом (например вариабельным доменом антитела) и могут быть оценены с использованием различных анализов оценки таких эффекторных функций антител, известных в данной области. Типичное измерение эффекторной функции осуществляют посредством связывания Fcγ3 и/или C1q.
При использовании в данном документе "антитело-зависимая клеточно-опосредованная цитотоксичность" или "ADCC" относится к клеточно-опосредованному взаимодействию, в котором неспецифические цитотоксические клетки, которые экспрессируют Fc-рецепторы (FcRs) (например натуральные клетки-киллеры (NK), нейтрофилы и макрофаги) распознают связанное на целевой клетке антитело и затем вызывают лизис клетки-мишени. ADCC-активность интересующей молекулы может быть оценена с использованием анализа ADCC in vitro, такого как описан в патенте US 5500362 или 5821337. Пригодные эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (РВМС) и NK-клетки. Альтернативно или дополнительно, ADCC-активность представляющей интерес молекулы может быть оценена in vivo, например в животной модели, такой как описана в Clynes et al., 1998, PNAS (USA), 95:652-656.
"Комплемент-зависимая цитотоксичность" или "CDC" относится к лизису мишени в присутствии комплемента. Путь активации комплемента инициируется связыванием первого компонента системы комплемента (C1q) с молекулой (например антителом), находящейся в комплексе с когнатным антигеном. Для оценки активации комплемента может быть выполнен анализ CDC, например, как описано в Gazzano-Santoro et al., J. Immunol. Methods, 202: 163 (1996).
При использовании в данном документе "лечение" представляет собой подход для получения полезных или желательных клинических результатов. В контексте настоящего изобретения полезные или желательные клинические результаты включают, без ограничения ими, один или более из следующего: уменьшение пролиферации (или уничтожение) опухолевых или раковых клеток, ингибирование метастаз неопластических клеток, ремиссия ВСМА-ассоциированного заболевания (например рака или аутоиммунного заболевания), уменьшение симптомов, вызванных ВСМА-ассоциированным заболеванием (например раком или аутоиммунным заболеванием), повышение качества жизни людей, страдающих ВСМА-ассоциированным заболеванием (например раком или аутоиммунным заболеванием), снижение дозы других лекарственных средств, необходимых для лечения ВСМА-ассоциированного заболевания (например рака или аутоиммунного заболевания), задержка прогрессирования ВСМА-ассоциированного заболевания (например рака или аутоиммунного заболевания), исцеление от ВСМА-ассоциированного заболевания (например рака или аутоиммунного заболевания) и/или повышение выживаемости пациентов, имеющих ВСМА-ассоциированное заболевание (например рак или аутоиммунное заболевание).
"Улучшение" означает уменьшение или положительную динамику одного или более симптомов по сравнению с отсутствием введения ВСМА-антитела или конъюгата ВСМА-антитела. "Улучшение" также включает сокращение или уменьшение продолжительности симптома.
При использовании в данном документе "эффективная доза" или "эффективное количество" лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для достижения какого-либо одного или более полезных или желательных результатов. Для профилактического применения полезные или желательные результаты включают устранение или уменьшение риска, снижение тяжести или задержку начала заболевания, включая биохимические, гистологические и/или поведенческие симптомы заболевания, его осложнения и промежуточные патологические фенотипы, возникающие при развитии болезни. Для терапевтического применения полезные или желательные результаты включают клинические результаты, такие как снижение частоты возникновения заболевания или улучшение одного или более симптомов различных ВСМА-ассоциированных заболеваний или состояний (например множественной миеломы), снижение дозы других лекарственных средств, необходимых для лечения заболевания, усиление эффекта другого лекарственного средства и/или замедление прогрессирования ВСМА-ассоциированного заболевания у пациентов. Эффективную дозу можно вводить в одном или более введения. В контексте настоящего изобретения эффективная доза лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для осуществления профилактического или терапевтического лечения прямо или косвенно. Как подразумевается в клиническом контексте, эффективная дозировка лекарственного средства, соединения или фармацевтической композиции может быть достигнута или может быть не достигнута в сочетании с другим лекарственным средством, соединением или фармацевтической композицией. Таким образом, "эффективную дозу" можно рассматривать в контексте введения одного или более терапевтических агентов, и один агент можно рассматривать как вводимый в эффективном количестве, если в сочетании с одним или несколькими другими агентами может быть достигнут или достигается желательный результат.
"Субъект" или "субъект" представляет собой млекопитающего, более предпочтительно человека. Млекопитающие также включают, без ограничений ими, сельскохозяйственных животных, спортивных животных, домашних животных, приматов, лошадей, собак, кошек, мышей и крыс.
При использовании в данном документе "вектор" означает конструкцию, которая способна доставлять в клетку-хозяина и, предпочтительно, экспрессировать в ней один или более генов или последовательностей, представляющих интерес. Примеры векторов включают, без ограничения ими, вирусные векторы, экспрессионные векторы на основе голой ДНК или РНК, плазмидные, космидные или фаговые векторы, экспрессионные ДНК- или РНК-векторы, ассоциированные с катионными конденсирующими агентами, экспрессионные ДНК- или РНК-векторы, инкапсулированные в липосомы, и некоторые эукариотические клетки, такие как клетки-продуценты.
При использовании в данном документе "последовательность, контролирующая экспрессию" означает последовательность нуклеиновой кислоты, которая управляет транскрипцией нуклеиновой кислоты. Последовательностью, контролирующей экспрессию, может быть промотор, такой как конститутивный или индуцибельный промотор, или энхансер. Последовательность, контролирующая экспрессию, функционально связана с транскрибируемой последовательностью нуклеиновой кислоты.
При использовании в данном документе "фармацевтически приемлемый носитель" или "фармацевтически приемлемый эксципиент" включает любое вещество, которое в комбинации с активным ингредиентом позволяет ингредиенту сохранять биологическую активность и не взаимодействует с иммунной системой субъекта. Примеры включают, без ограничения ими, любой из стандартных фармацевтических носителей, такой как забуференный фосфатом солевой раствор, вода, эмульсии, такие как эмульсия масло-в-воде, и различные типы увлажнителей. Предпочтительными разбавителями для аэрозольного или парентерального введения являются забуференный фосфатом физиологический раствор (PBS) или нормальный (0,9%) физиологический раствор. Композиции, содержащие такие носители, готовят в виде препаратов хорошо известными традиционными способами (см., например, Remington's Pharmaceutical Sciences, 18th edition, A. Gennaro, ed., Mack Publishing Co., Easton, PA, 1990; и Remington, The Science and Practice of Pharmacy 21st Ed. Mack Publishing, 2005).
Термин "ацил-донорный глутамин-содержащий тег" или "глутаминовый тег", при использовании в данном документе, относится к полипептиду или белку, содержащему один или более остатков Gln, который действует, как аминный трансглутаминазный акцептор. См., например, WO 2012059882 и WO 2015015448.
Термин "kon" или "ka", при использовании в данном документе, относится к константе скорости ассоциации антитела с антигеном. Более конкретно, константы скорости (kon/ka и koff/kd) и равновесные константы диссоциации измеряют, используя целое антитело (то есть бивалентное) и мономерные ВСМА белки.
Термин "koff" или "kd", при использовании в данном документе, относится к константе скорости диссоциации антитела из комплекса антитело/антиген.
Термин "KD", при использовании в данном документе, относится к равновесной константе диссоциации взаимодействия антитело-антиген.
Указание на "примерно" в отношении значения или параметра в данном описании изобретения включает (и описывает) воплощения, которые относятся к этому значению или параметру как таковому. Например, описание, указывающее на "примерно X" включает описание "X." Числовые диапазоны включают значения, определяющие этот диапазон.
Понятно, что во всех воплощениях, описанных в данном документе с помощью слова "содержащий", также представлены в остальном аналогичные воплощения, описанные в терминах "состоящий из" и/или "по существу состоящий".
Когда аспекты или воплощения изобретения описаны в терминах группы Маркуша или другой группы альтернатив, настоящее изобретение охватывает не только всю группу в целом, но каждого представителя группы отдельно и все возможные подгруппы основной группы, а также случаи, когда в основной группе отсутствует один или несколько представителей группы. Настоящее изобретение также предусматривает четко выраженное исключение одного или более представителей группы из заявленного изобретения.
Если не указано иное, все технические и научные термины, используемые здесь, имеют такое же значение, которое обычно используется специалистом в данной области техники, к которой относится это изобретение. В случае конфликта настоящее описание изобретения, включая определения, будет иметь преимущественную силу. Во всему описанию изобретения и формуле изобретения подразумевается, что слово "содержать" или его варианты, такие как "содержит" или "содержащий", включает указанное целое или группу целых, но не исключает какое-либо другое целое или группу целых. Если иное не требуется согласно контексту, термины в единственном числе включают множественное число, а термины во множественном числе включают единственное число.
Примеры методов и материалов описаны в данном документе, хотя методы и материалы, аналогичные или эквивалентные описанным в данном документе, также можно использовать на практическом воплощении или в тестировании настоящего изобретения. Материалы, методы и примеры являются лишь иллюстративными и не предназначены для ограничения изобретения.
ВСМА-антитела и способы их получения
В настоящем изобретении предложено антитело, которое связывается с ВСМА (например человеческим ВСМА (например SEQ ID NO: 353 или с регистрационным номером Q02223-2) и характеризуется одной или более характеристиками: (а) лечение, предупреждение, улучшение одного или более симптомов состояния, ассоциированного со злокачественными клетками, экспрессирующие ВСМА, у субъекта (например рака, ассоциированного с В-клетками, такого как множественная миелома); (б) ингибирование роста или прогрессирования опухоли у субъекта (имеющего злокачественную опухоль, экспрессирующую ВСМА); (в) ингибирование метастаз раковых (злокачественных) клеток, экспрессирующих ВСМА, у субъекта (имеющего одну или более злокачественных клеток, экспрессирующих ВСМА); (г) индуцирование регрессии (например продолжительной регрессии) опухоли, экспрессирующей ВСМА; (д) индуцирование цитотоксической активности в злокачественных клетках, экспрессирующих ВСМА; и (е) блокирование взаимодействия ВСМА с другими, еще не идентифицированными факторами.
В одном аспекте предложено выделенное антитело или его антигенсвязывающий фрагмент, который специфично связывается с антигеном созревания В-клеток (ВСМА), где антитело содержит (а) вариабельную область тяжелой цепи (VH), содержащую (1) участок, определяющий комплементарность, один (CDR1) VH, содержащий последовательность SYX1MX2, где X1 представляет собой А или Р; и Х2 представляет собой Т, N или S (SEQ ID NO: 301), GFTFX1SY, где X1 представляет собой G или S (SEQ ID NO: 302) или GFTFX1SYX2MX3, где X1 представляет собой G или S, Х2 представляет собой А или Р; и Х3 представляет собой Т, N или S (SEQ ID NO: 303); (2) VH CDR2, содержащий последовательность AX1X2X3X4GX5X6X7X8YADX9X10KG, где X1 представляет собой I, V, Т, Н, L, А или С; Х2 представляет собой S, D, G, Т, I, L, F, М или V; Х3 представляет собой G, Y, L, Н, D, A, S или М; Х4 представляет собой S, Q, Т, A, F или W; Х5 представляет собой G или Т; Х6 представляет собой N, S, Р, Y, W или F; Х7 представляет собой S, Т, I, L, Т, A, R, V, K, G или С; Х8 представляет собой F, Y, Р, W, Н или G; Х9 представляет собой V, R или L; и X10 представляет собой G или Т (SEQ ID NO: 305) или X1X2X3X4X5X6, где X1 представляет собой S, V, I, D, G, Т, L, F или М; Х2 представляет собой G, Y, L, Н, D, A, S или М; Х3 представляет собой S, G, F или W; Х4 представляет собой G или S; Х5 представляет собой G или Т; и Х6 представляет собой N, S, Р, Y или W (SEQ ID NO: 306); и 3) VH CDR3, содержащий последовательность VSPIX1X2X3X4, где X1 представляет собой А или Y; Х2 представляет собой А или S; и Х3 представляет собой G, Q, L, Р или Е (SEQ ID NO: 307) или YWPMX1X2, где X1 представляет собой D, S, Т или А; и Х2 представляет собой I, S, L, Р или D (SEQ ID NO: 308); и/или вариабельную область легкой цепи (VL), содержащую (1) VL CDR1, содержащий последовательность Х1Х2Х3Х4Х5Х6Х7Х8Х9Х10Х11Х12, где X1 представляет собой R, G, W, А или С; Х2 представляет собой А, Р, G, L, С или S; Х3 представляет собой S, G или R; Х4 представляет собой Q, С, Е, V или I; Х5 представляет собой S, Р, G, A, R или D; Х6 представляет собой V, G, I или L; Х7 представляет собой S, Е, D, Р или G; Х8 представляет собой S, Р, F, А, М, Е, V, N, D или Y; Х9 представляет собой I, Т, V, Е, S, А, М, Q, Y, Н, R или F; X10 представляет собой Y или F; Х11 представляет собой L, W или Р; и Х12 представляет собой A, S или G (SEQ ID NO: 309); (2) VL CDR2, содержащий последовательность X1ASX2RAX3, где X1 представляет собой G или D; Х2 представляет собой S или I; и Х3 представляет собой Т или Р (SEQ ID NO: 310); и (3) VL CDR3, содержащий последовательность QQYX1X2X3PX4T, где X1 представляет собой G, Q, Е, L, F, A, S, М, K, R или Y; Х2 представляет собой S, R, Т, G, V, F, Y, D, А, Н, V, Е, K или С; Х3 представляет собой W, F или S; и Х4 представляет собой L или I (SEQ ID NO: 311) или QQYX1X2X3PX4, где X1 представляет собой G, Q, Е, L, F, A, S, М, R, K или Y; Х2 представляет собой S, R, Т, G, R, V, D, А, Н, Е, K, С, F или Y; Х3 представляет собой W, S или F; и Х4 представляет собой L или I (SEQ ID NO: 312).
В другом аспекте предложено выделенное антитело или его антигенсвязывающий фрагмент, который специфично связывается с ВСМА, где антитело содержит: VH-область, содержащую VH CDR1, VH CDR2 и VH CDR3 последовательности VH, представленной в SEQ ID NO: 2, 3, 7, 8, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 35, 37, 39, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 83, 87, 92, 95, 97, 99, 101, 104, 106, 110, 112, 114, 118, 120, 122, 112, 125, 127, 313, 314, 363 или 365; и/или VL-область, содержащую VL CDR1, VL CDR2 и VL CDR3 последовательности VL, представленной в SEQ ID NO: 1,4, 5, 6, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 34, 36, 38, 40, 41, 43, 45, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75, 77, 79, 317, 80, 81, 82, 84, 85, 86, 88, 89, 90, 91, 93, 94, 96, 98, 100, 102, 103, 105, 107, 108, 109, 111, 113, 115, 116, 117, 119, 121, 123, 124, 126, 128, 315, 316 или 364.
В некоторых воплощениях предложено антитело, имеющее любую из подпоследовательностей легкой цепи, представленных в Таблице 1, и/или любую их подпоследовательностей тяжелой цепи, представленных в Таблице 1.
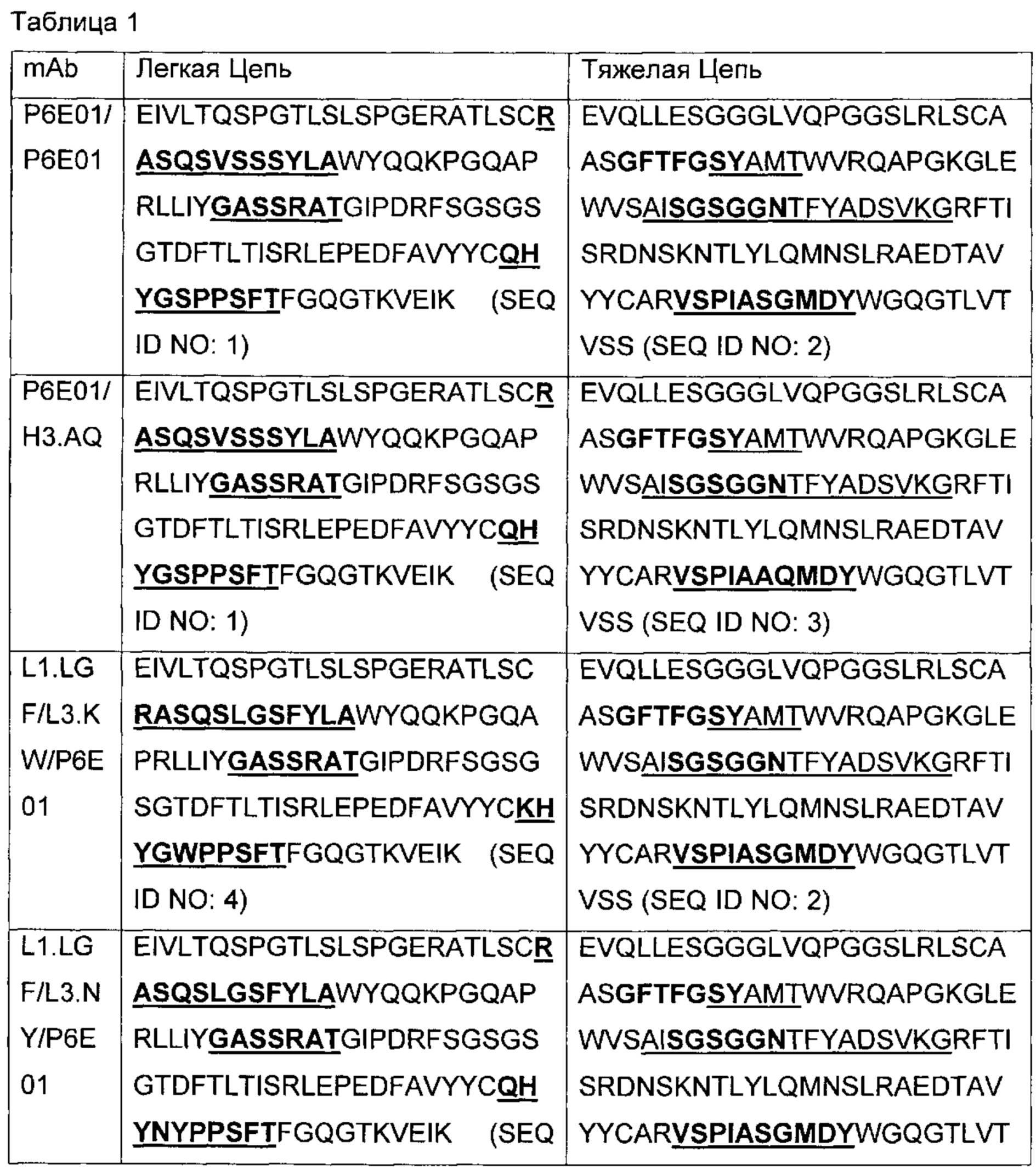
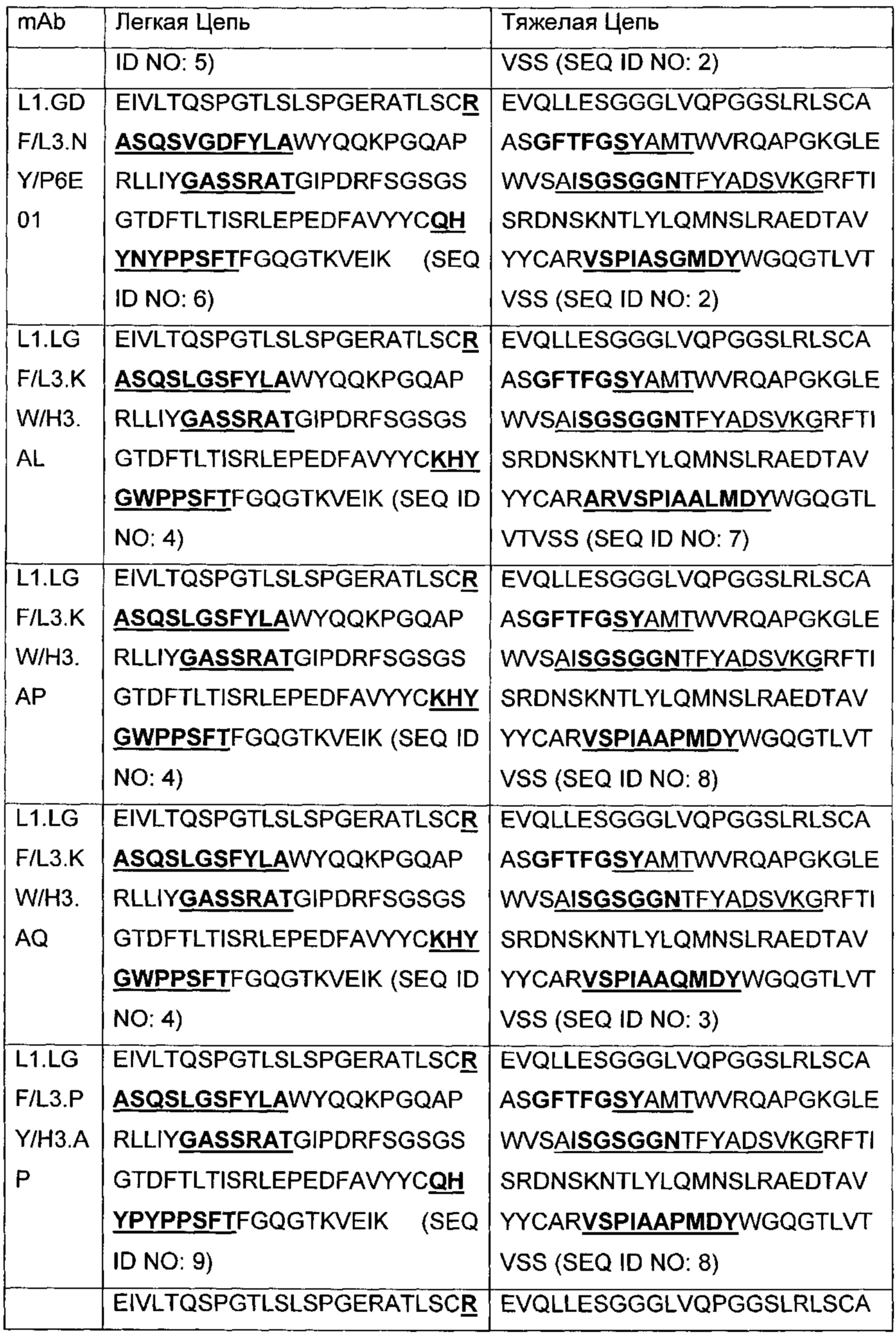
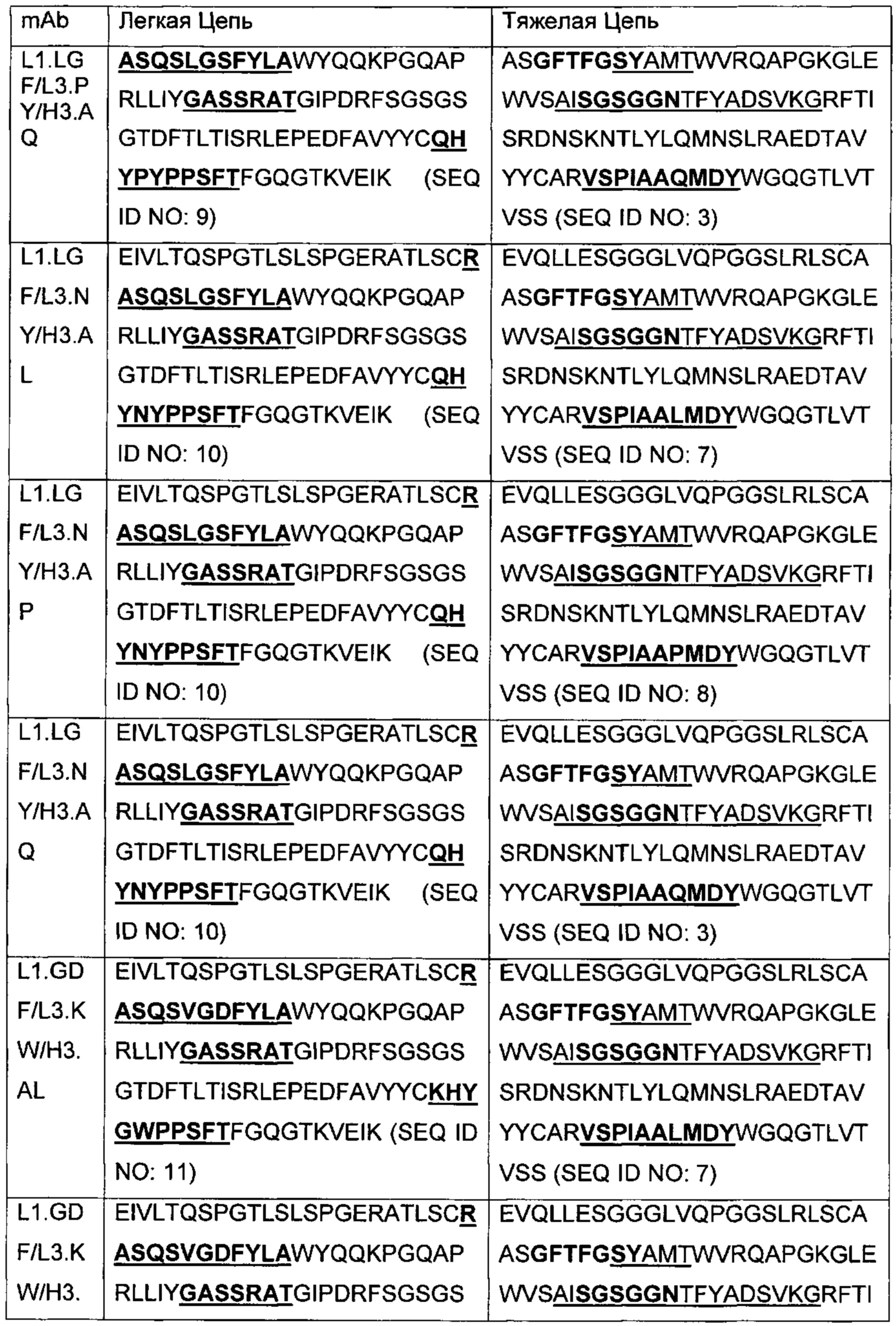
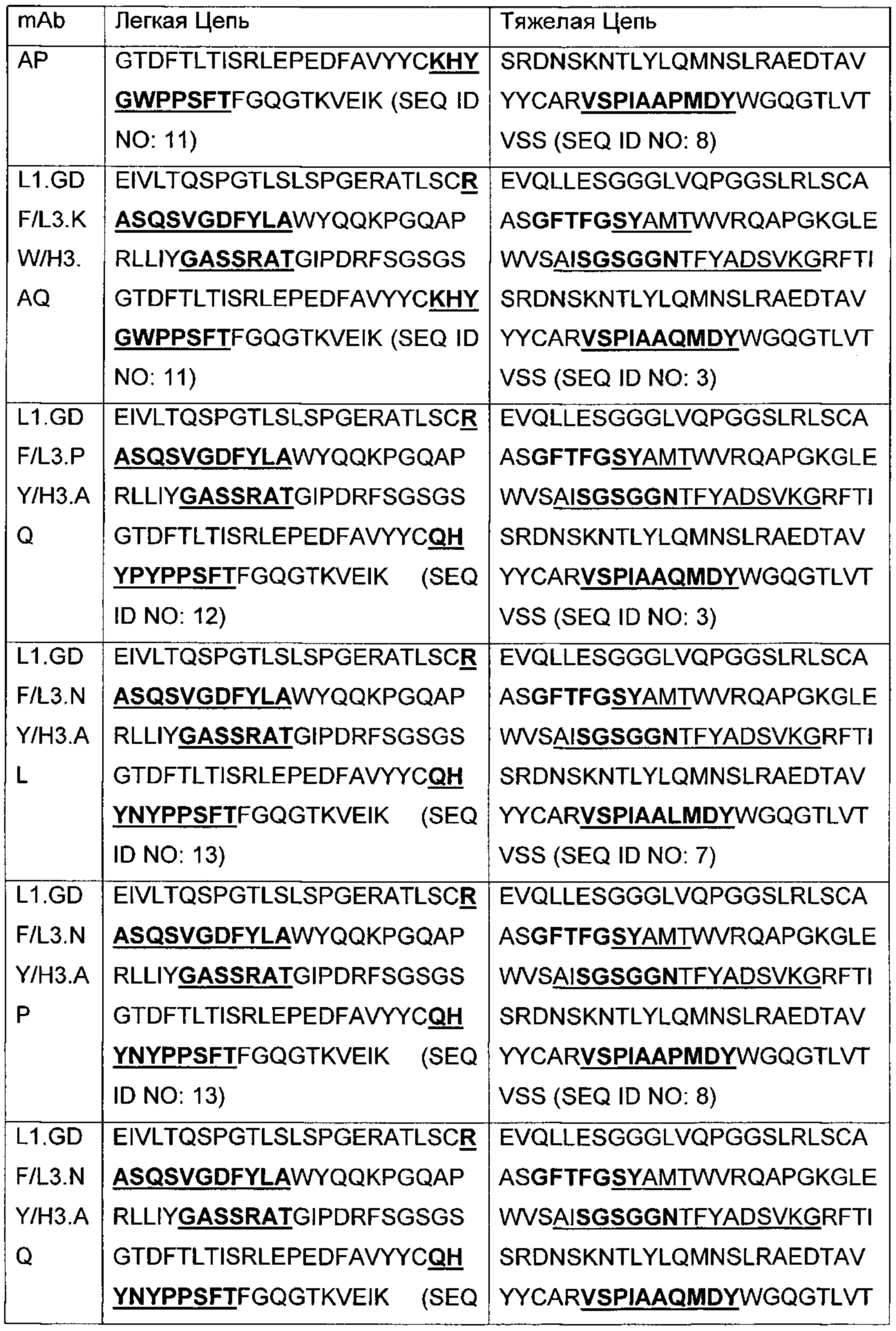

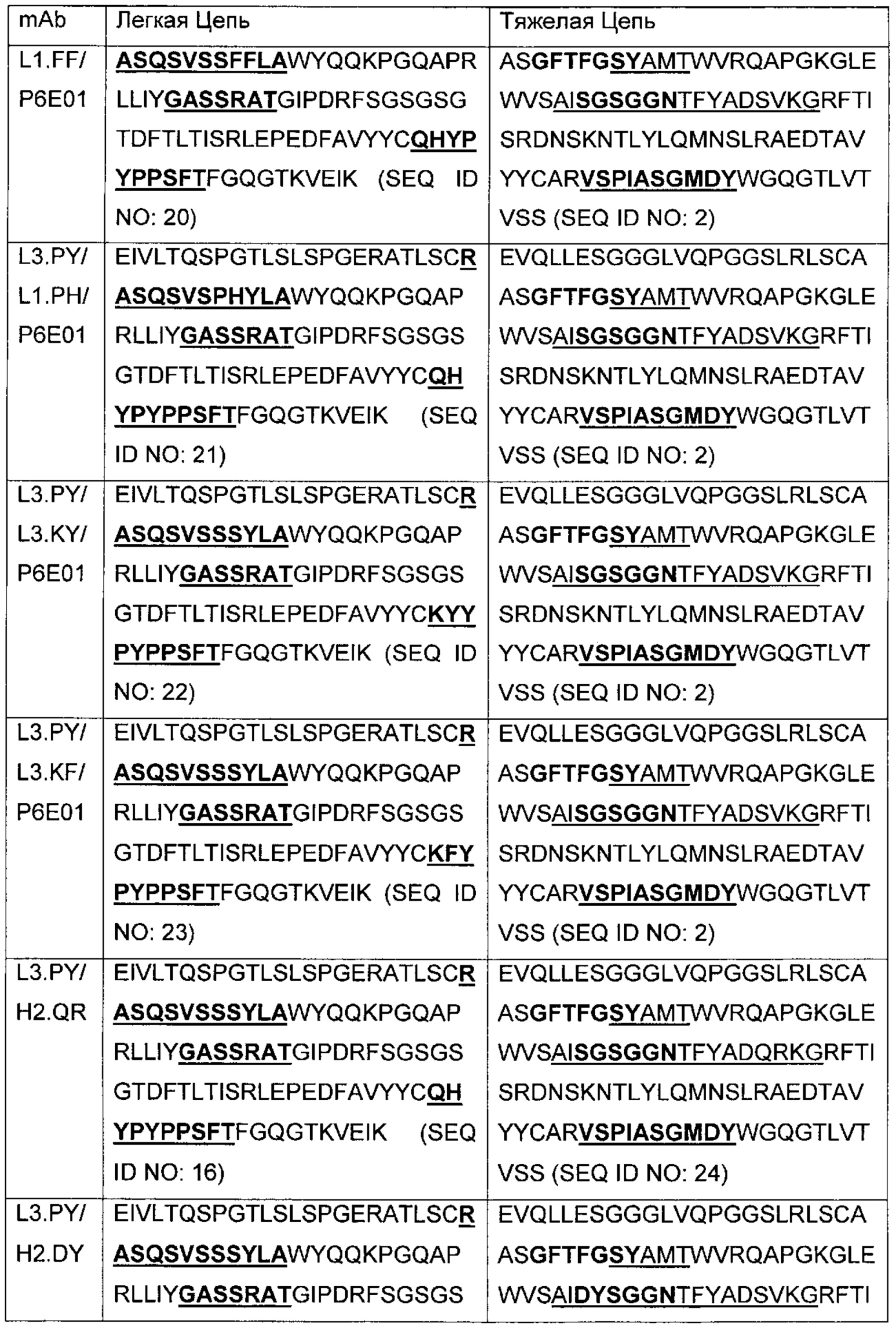
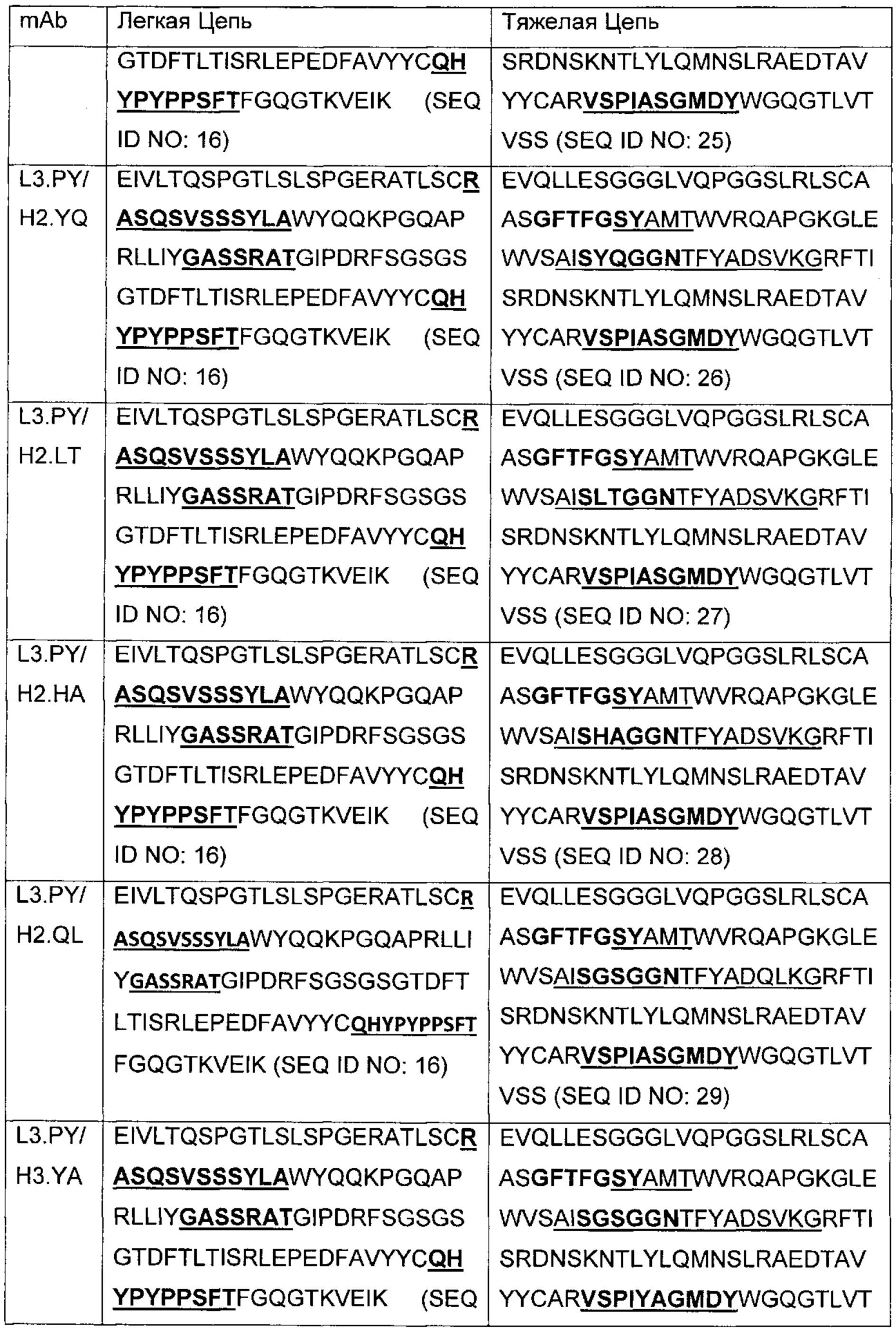
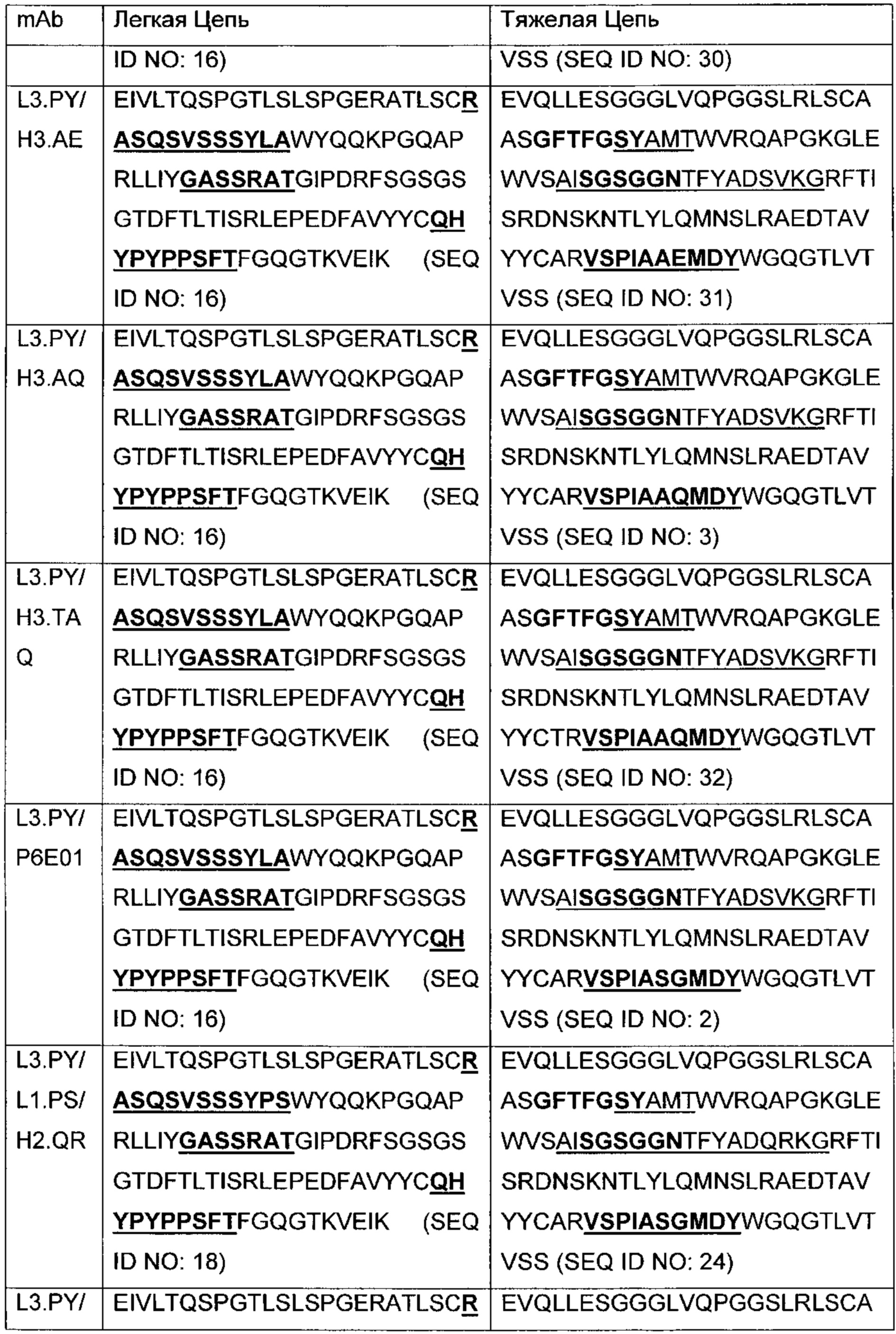
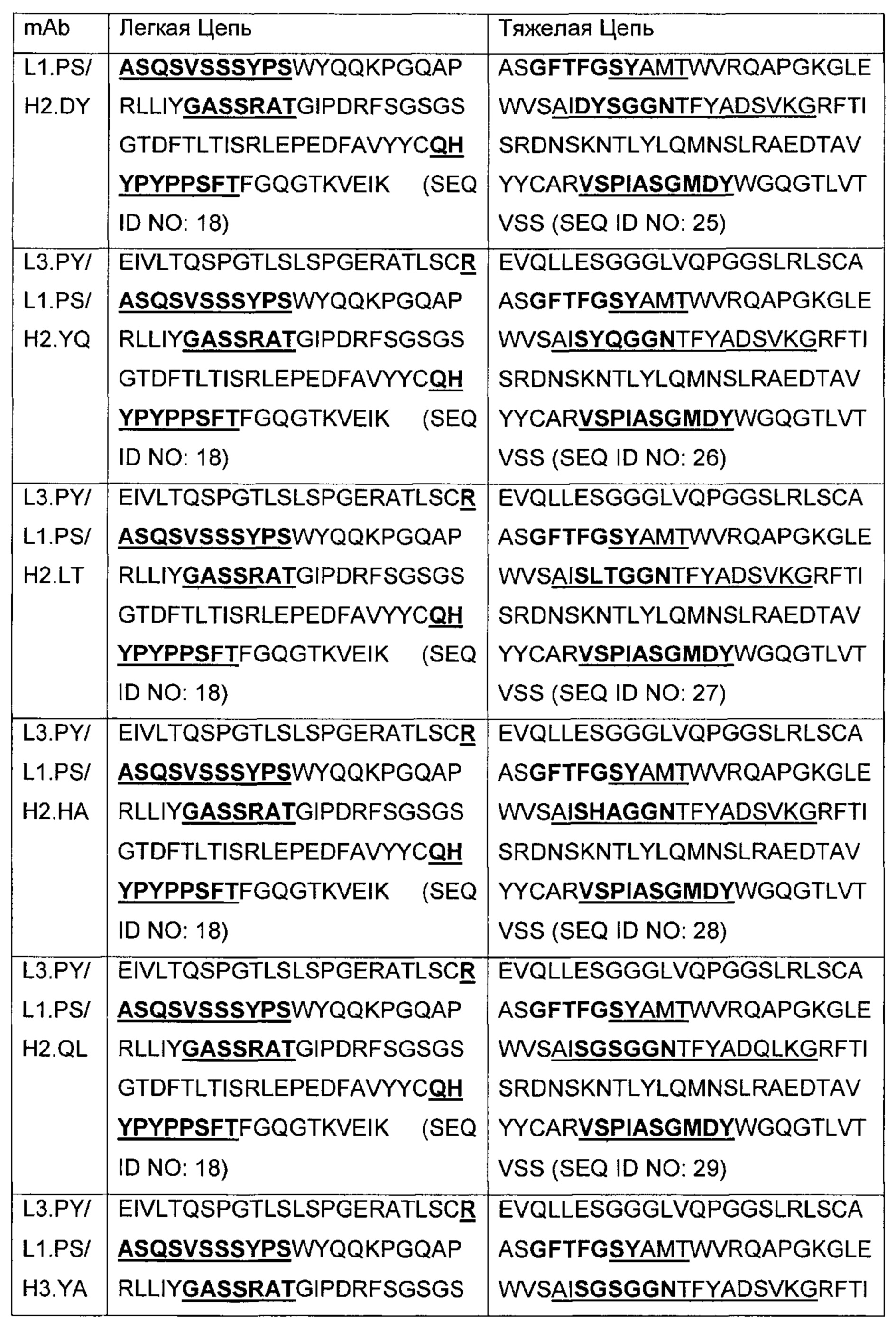
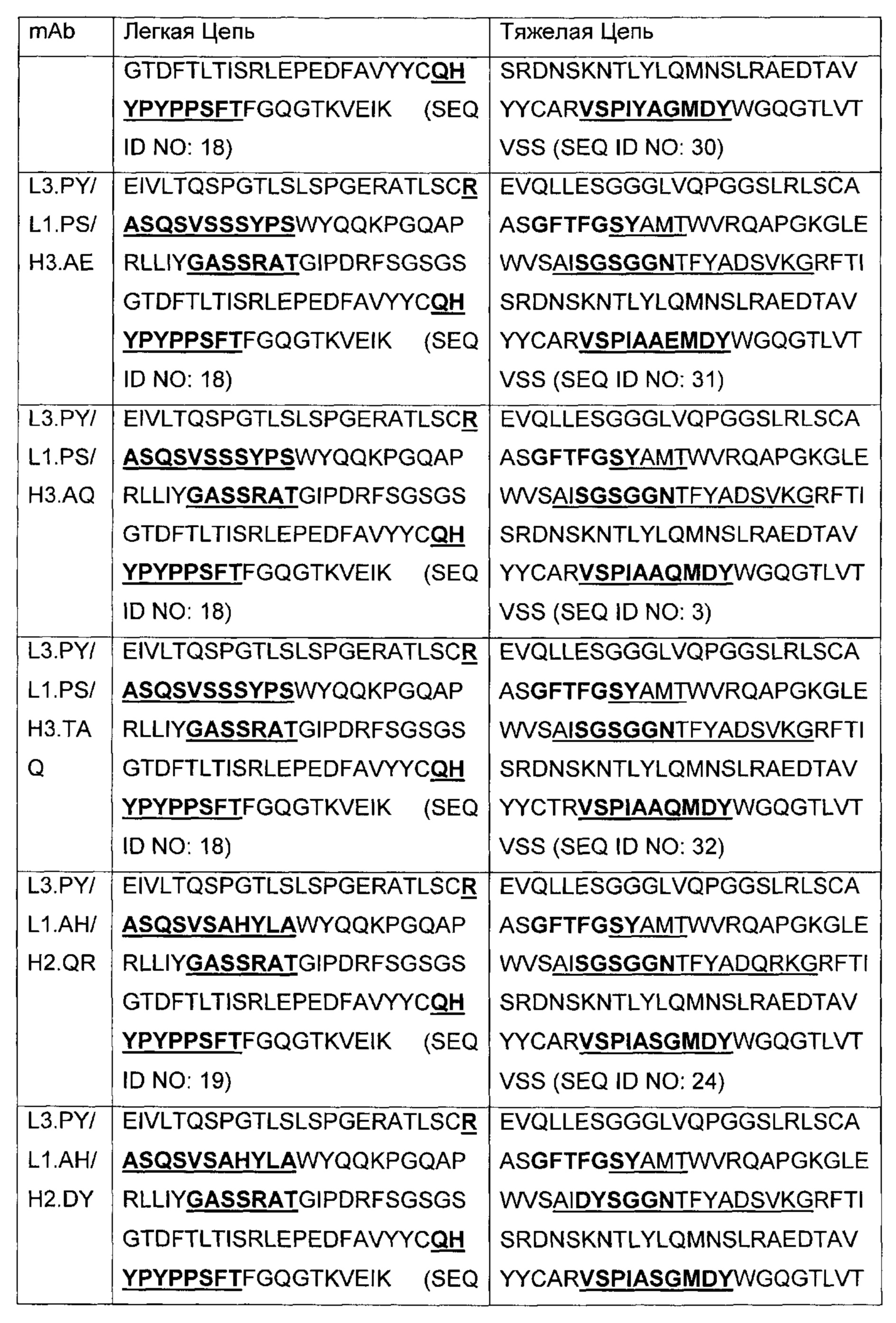
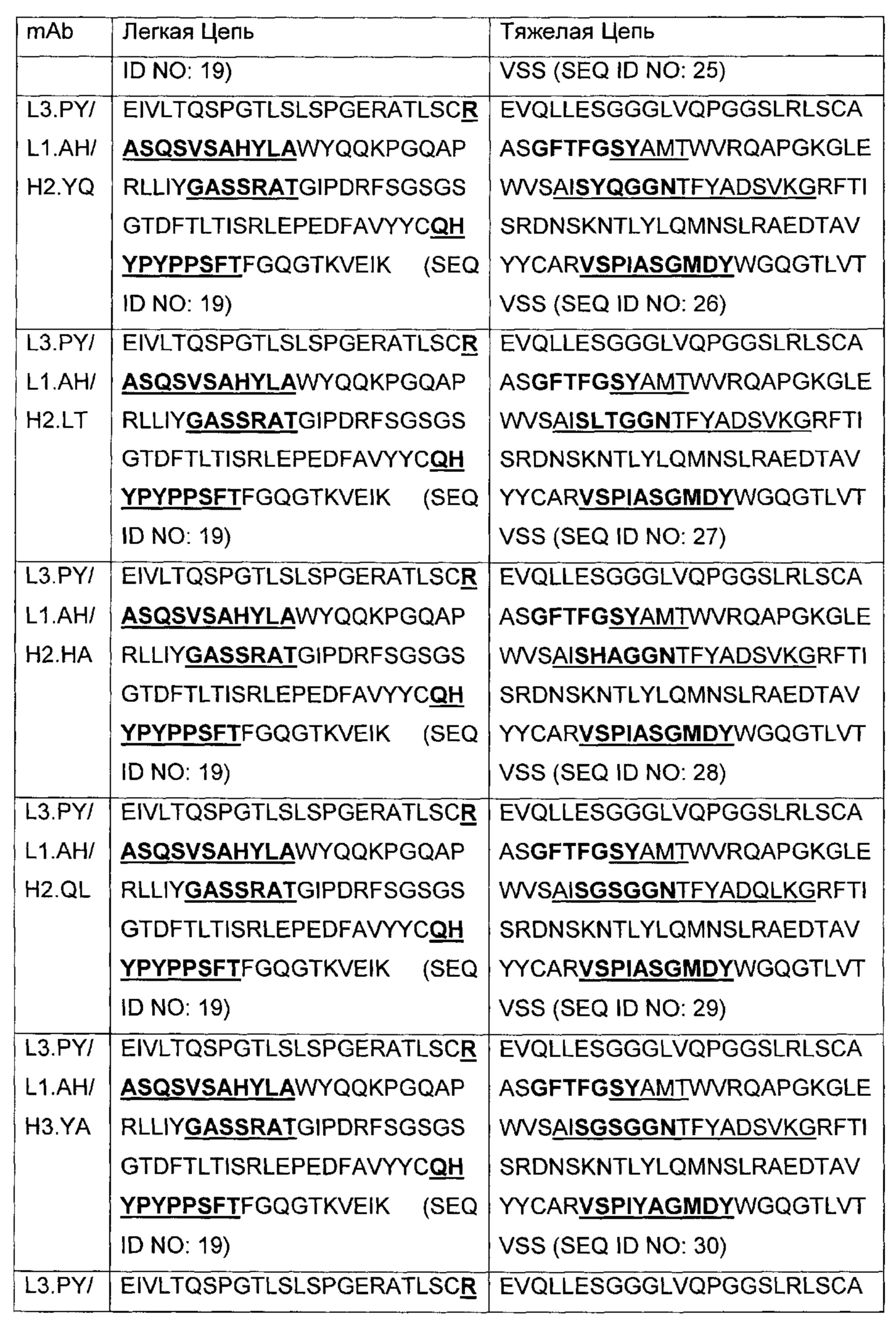
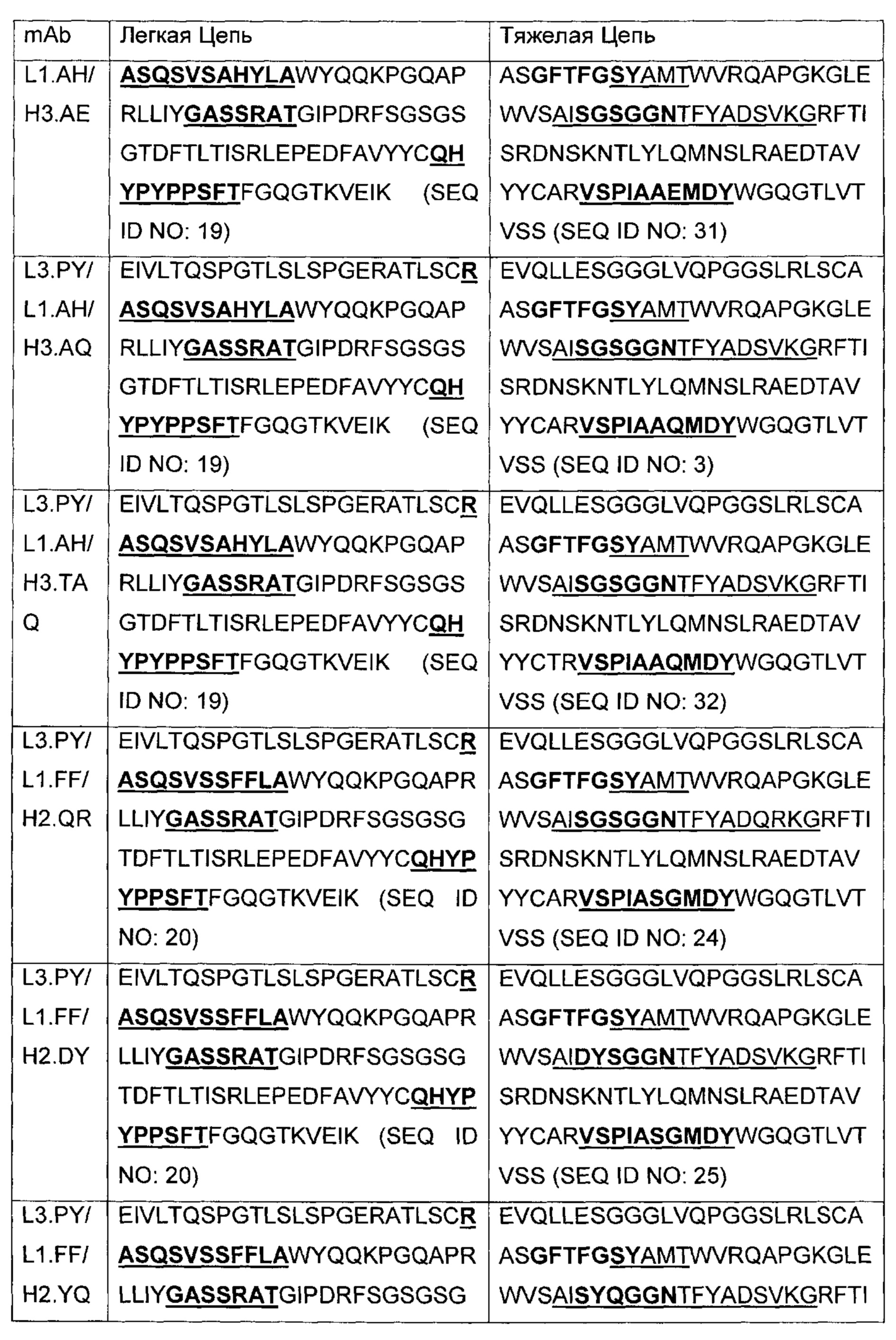
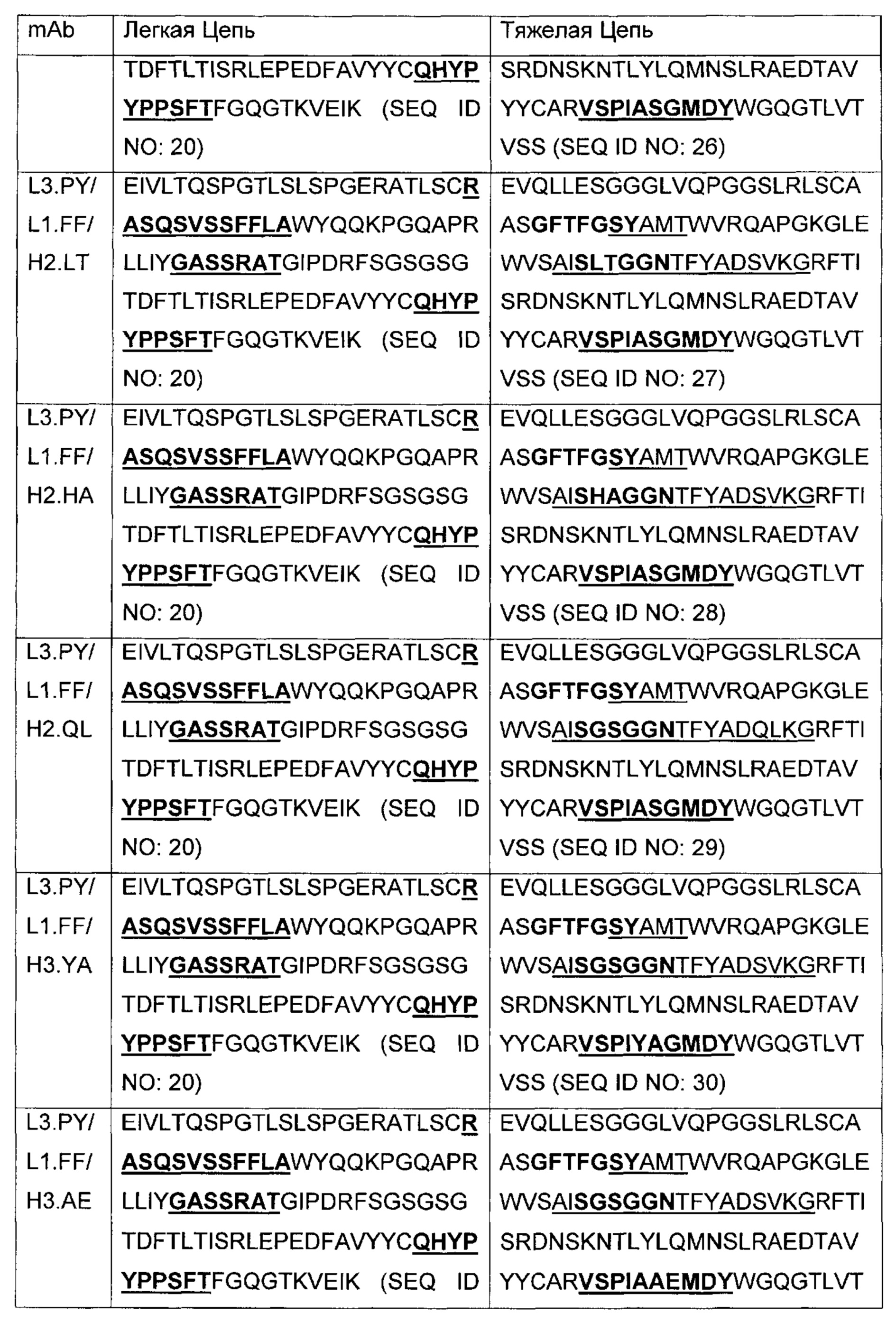


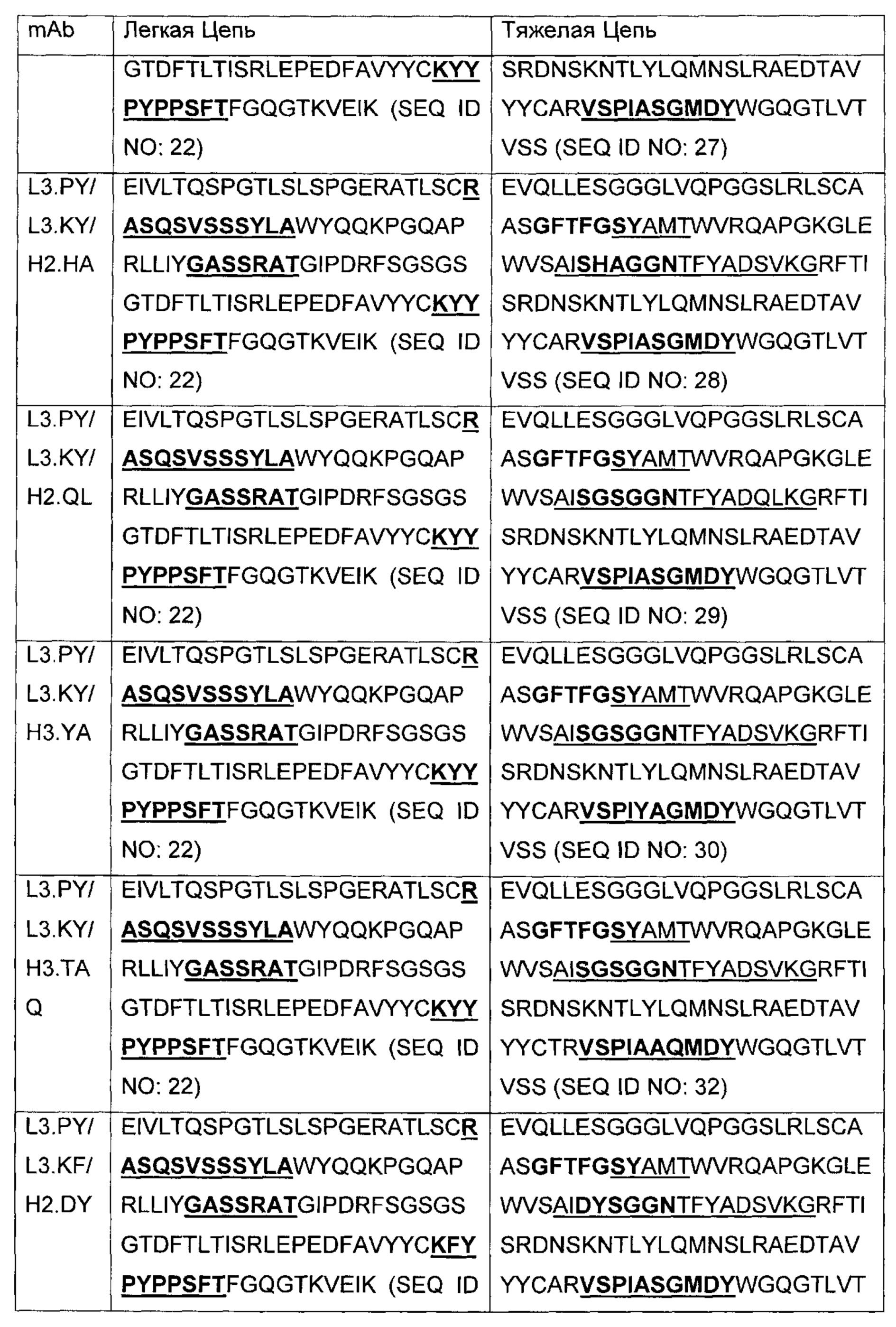
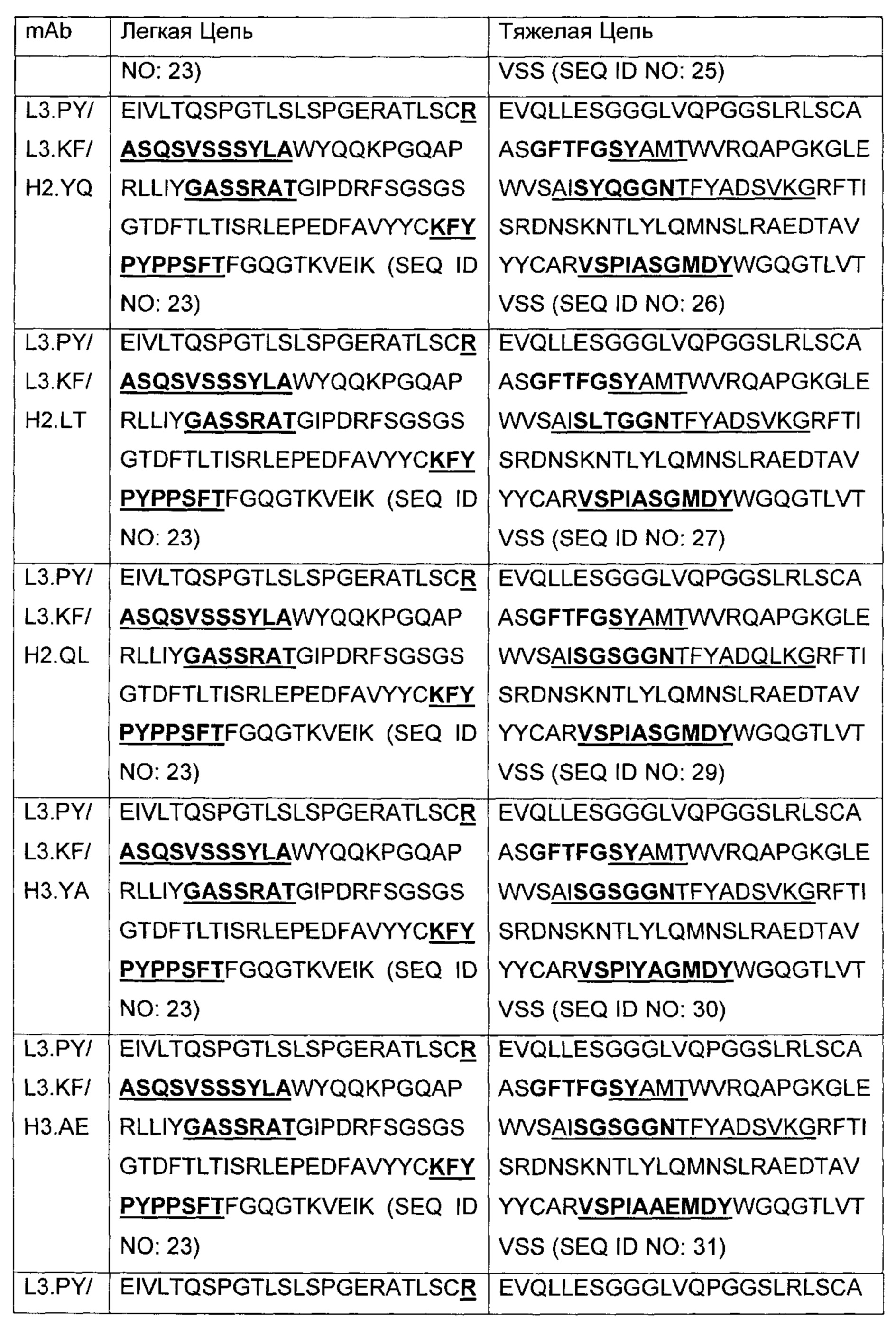

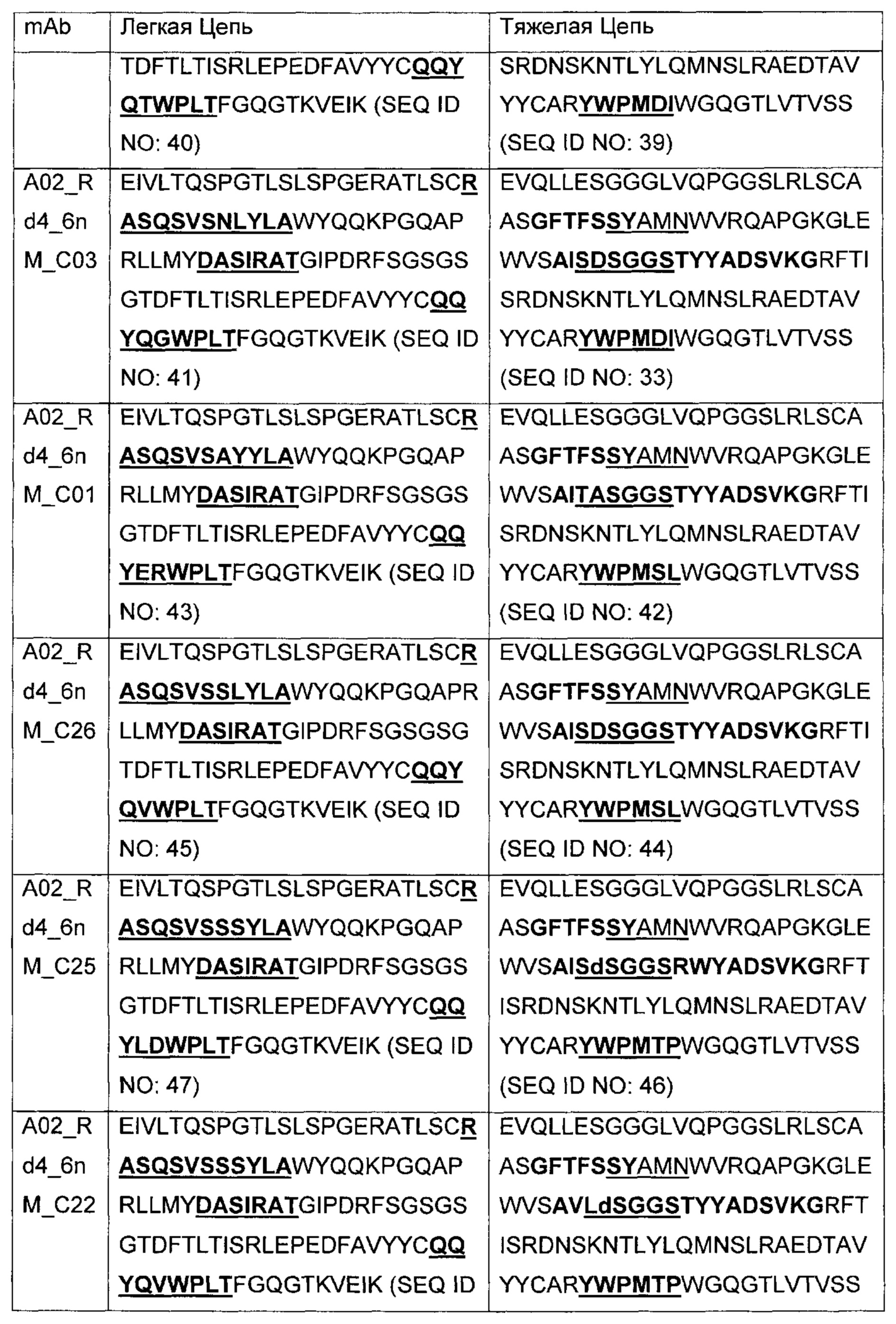
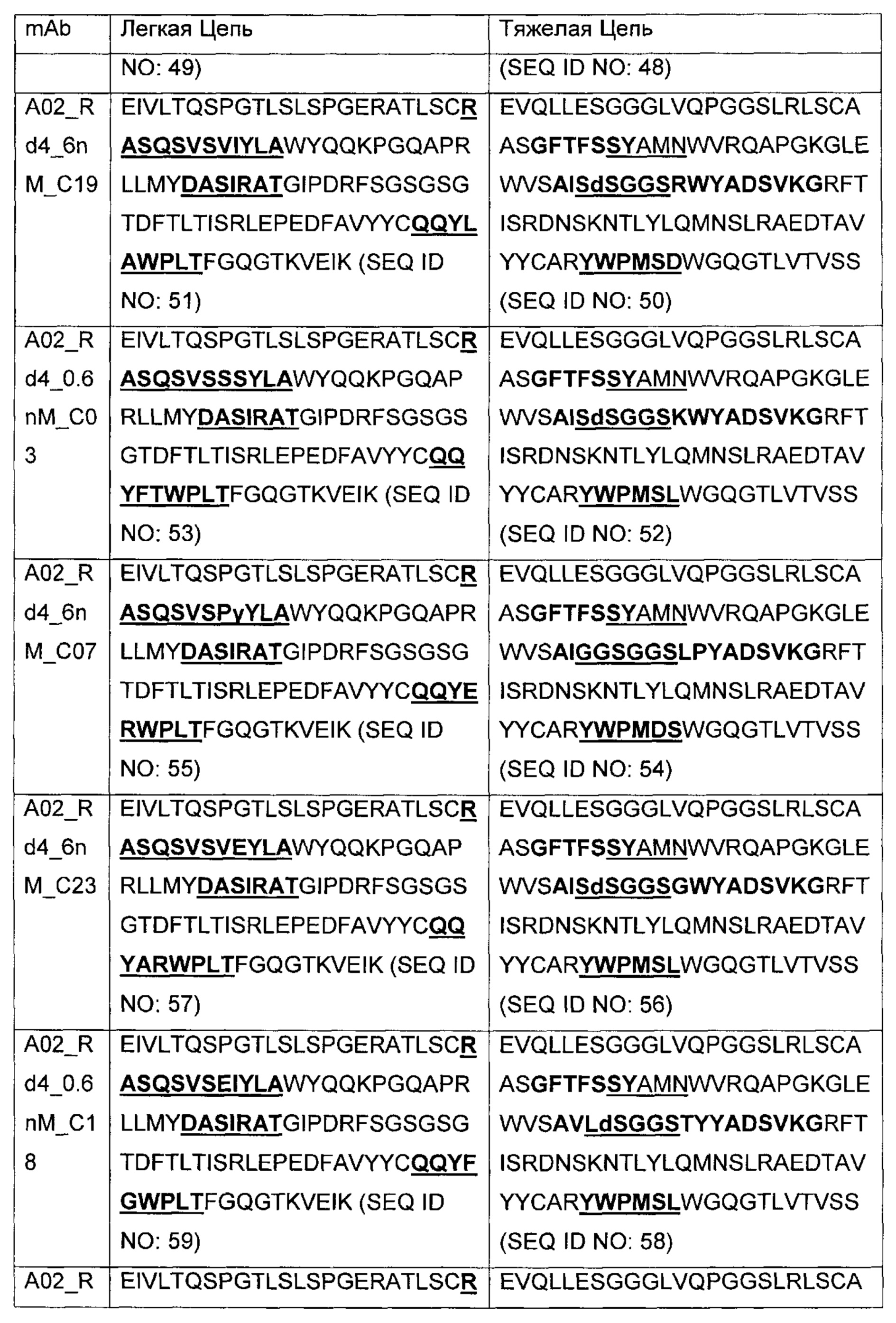

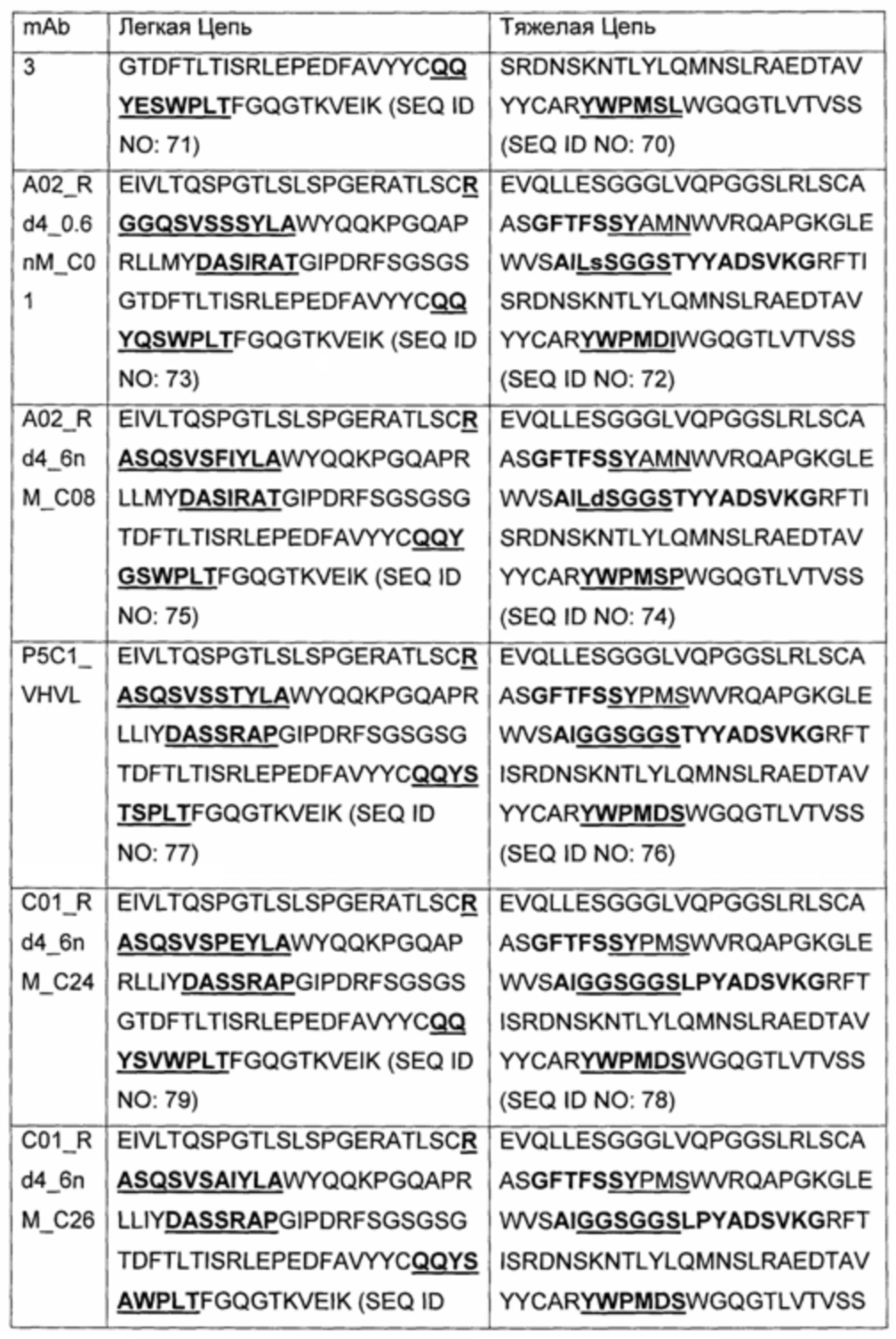
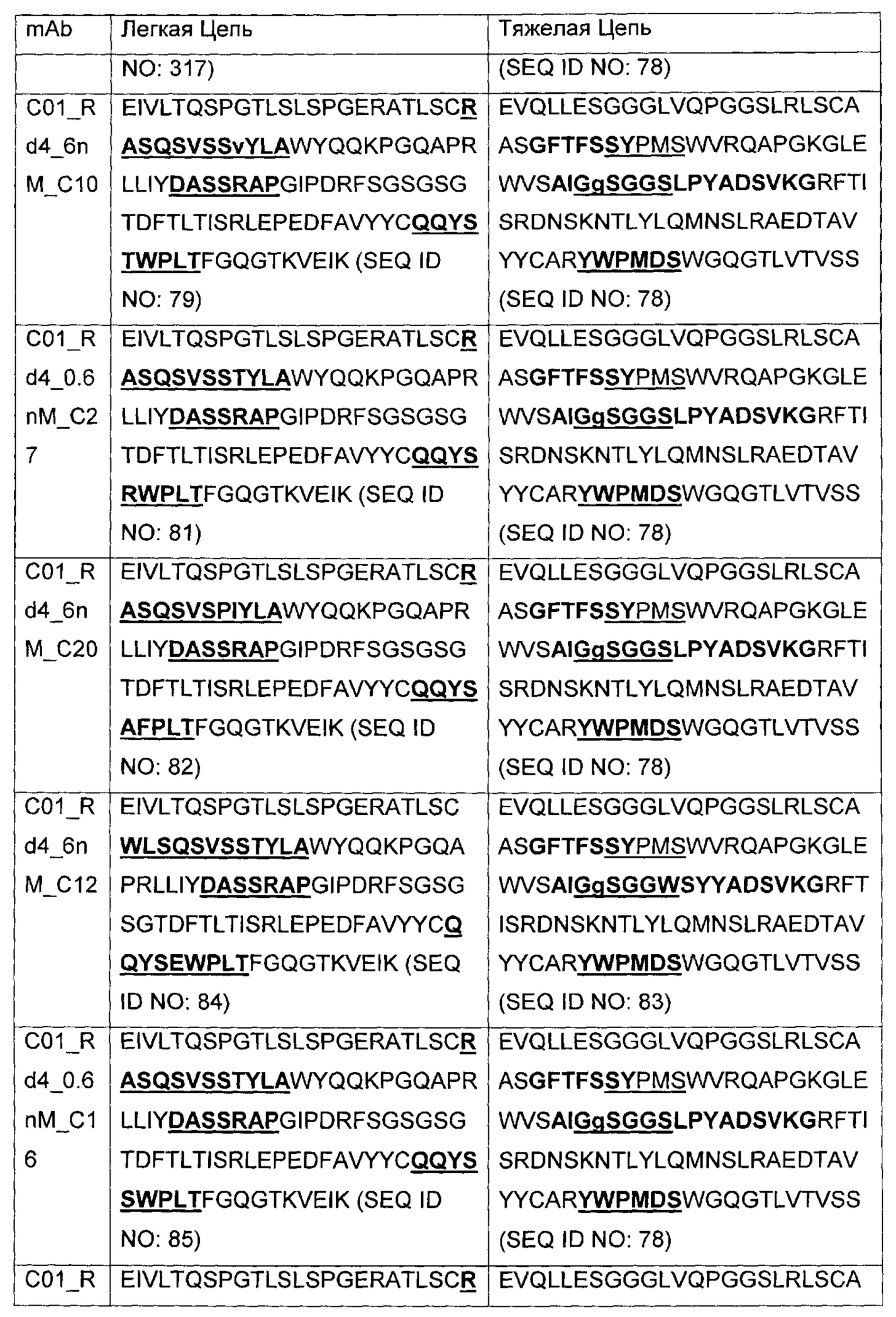

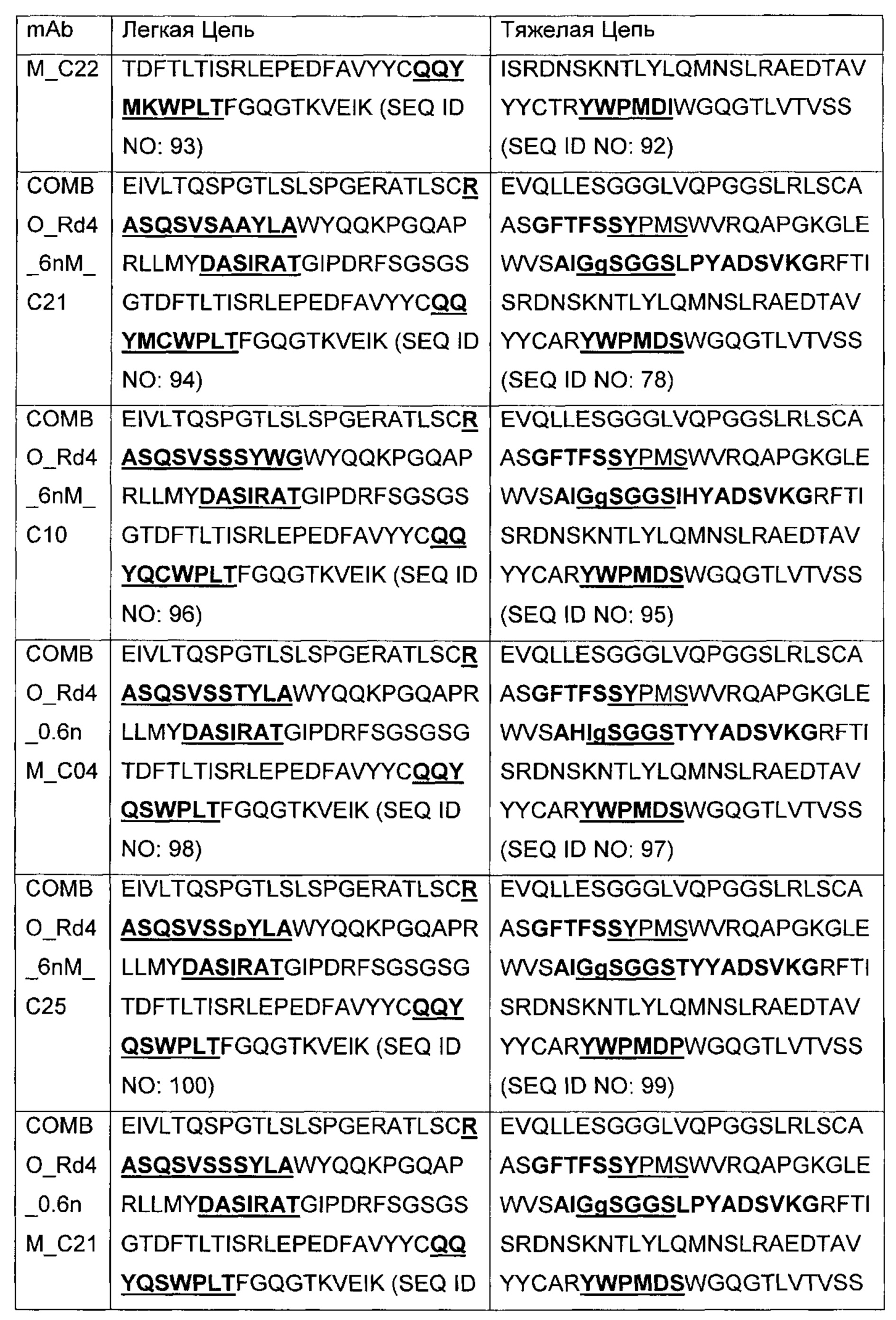
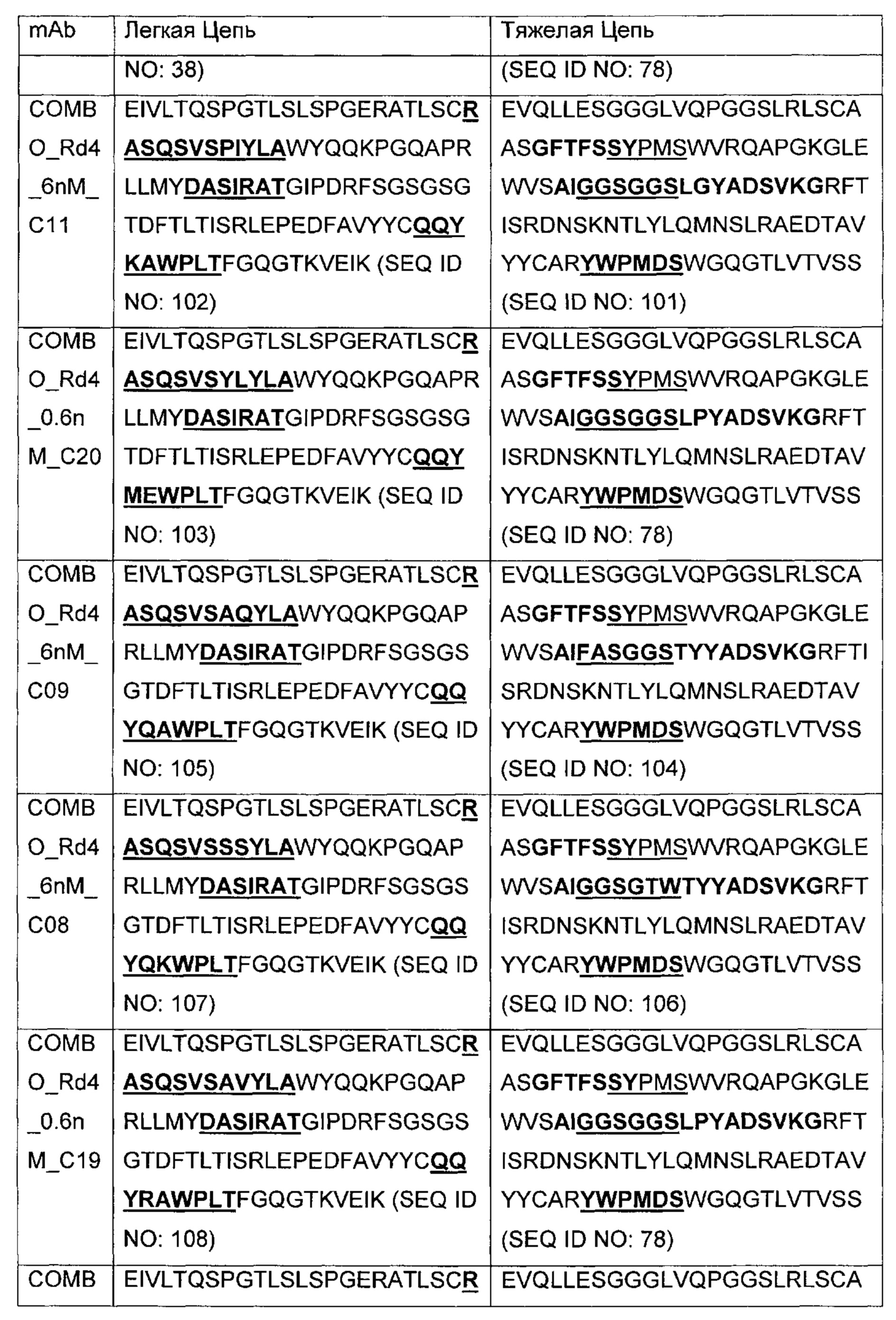





В Таблице 1 подчеркнутые последовательности представляют собой последовательности CDR по Kabat, а выделенные жирным шрифтом - по Chothia, за исключением следующих последовательностей CDR2 тяжелой цепи, в которых подчеркнуты последовательности CDR по Chothia и выделена жирным шрифтом последовательности CDR по Kabat:
P5A2_VHVL, A02_Rd4_0.6nM_C06, A02_Rd4_0.6nM_C09
A02_Rd4_6nM_C16, A02_Rd4_6nM_C03, A02_Rd4_6nM_C01, A02_Rd4_6nM_C26
A02_Rd4_6nM_C25, A02_Rd4_6nM_C22, A02_Rd4_6nM_C19, A02_Rd4_0.6nM_C03
A02_Rd4_6nM_C07, A02_Rd4_6nM_C23, A02_Rd4_0.6nM_C18, A02_Rd4_6nM_C10
A02_Rd4_6nM_C05, A02_Rd4_0.6nM_C10, A02_Rd4_6nM_C04, A02_Rd4_0.6nM_C26
A02_Rd4_0.6nM_C13, A02_Rd4_0.6nM_C01, A02_Rd4_6nM_C08, P5C1_VHVL,
C01_Rd4_6nM_C24, C01_Rd4_6nM_C26, C01_Rd4_6nM_C10, C01_Rd4_0.6nM_C27
C01_Rd4_6nM_C20, C01_Rd4_6nM_C12, C01_Rd4_0.6nM_C16, C01_Rd4_0.6nM_C09
C01_Rd4_6nM_C09, C01_Rd4_0.6nM_C03, C01_Rd4_0.6nM_C06, C01_Rd4_6nM_C04
COMBO_Rd4_0.6nM_C22, COMBO_Rd4_6nM_C21, COMBO_Rd4_6nM_C10, COMBO_Rd4_0.6nM_C04, COMBO_Rd4_6nM_C25, COMBO_Rd4_0.6nM_C21, COMBO_Rd4_6nM_C11, COMBO_Rd4_0.6nM_C20, COMBO_Rd4_6nM_C09, COMBO_Rd4_6nM_C08, COMBO_Rd4_0.6nM_C19, COMBO_Rd4_0.6nM_C02, COMBO_Rd4_0.6nM_C23, COMBO_Rd4_0.6nM_C29, COMBO_Rd4_0.6nM_C09, COMBO_Rd4_6nM_C12, COMBO_Rd4_0.6nM_C30, COMBO_Rd4_0.6nM_C14, COMBO_Rd4_6nM_C07, COMBO_Rd4_6nM_C02, COMBO_Rd4_0.6nM_C05, COMBO_Rd4_0.6nM_C17, COMBO__Rd4_6nM_C22 и COMBO_Rd4_0.6nM_C11.
В изобретении также предложены участки CDR антител к ВСМА (включая CDR по Chothia, Kabat и контактные CDR-участки). Определение областей CDR хорошо известно специалистам. Понятно, что в некоторых воплощениях CDR могут представлять собой комбинацию CDR по Kabat и Chothia (также называемую "комбинированные CR" или "расширенными CDR"). В некоторых воплощениях, CDR представляют собой CDR по Kabat. В других воплощениях CDR представляют собой CDR по Chothia. Другими словами, в воплощениях с более чем одним CDR, эти CDR могут быть любым из Kabat, Chothia, комбинированных CDR или их комбинацией. В Таблице 2 представлены примеры последовательностей CDR, представленных в данном описании изобретения.





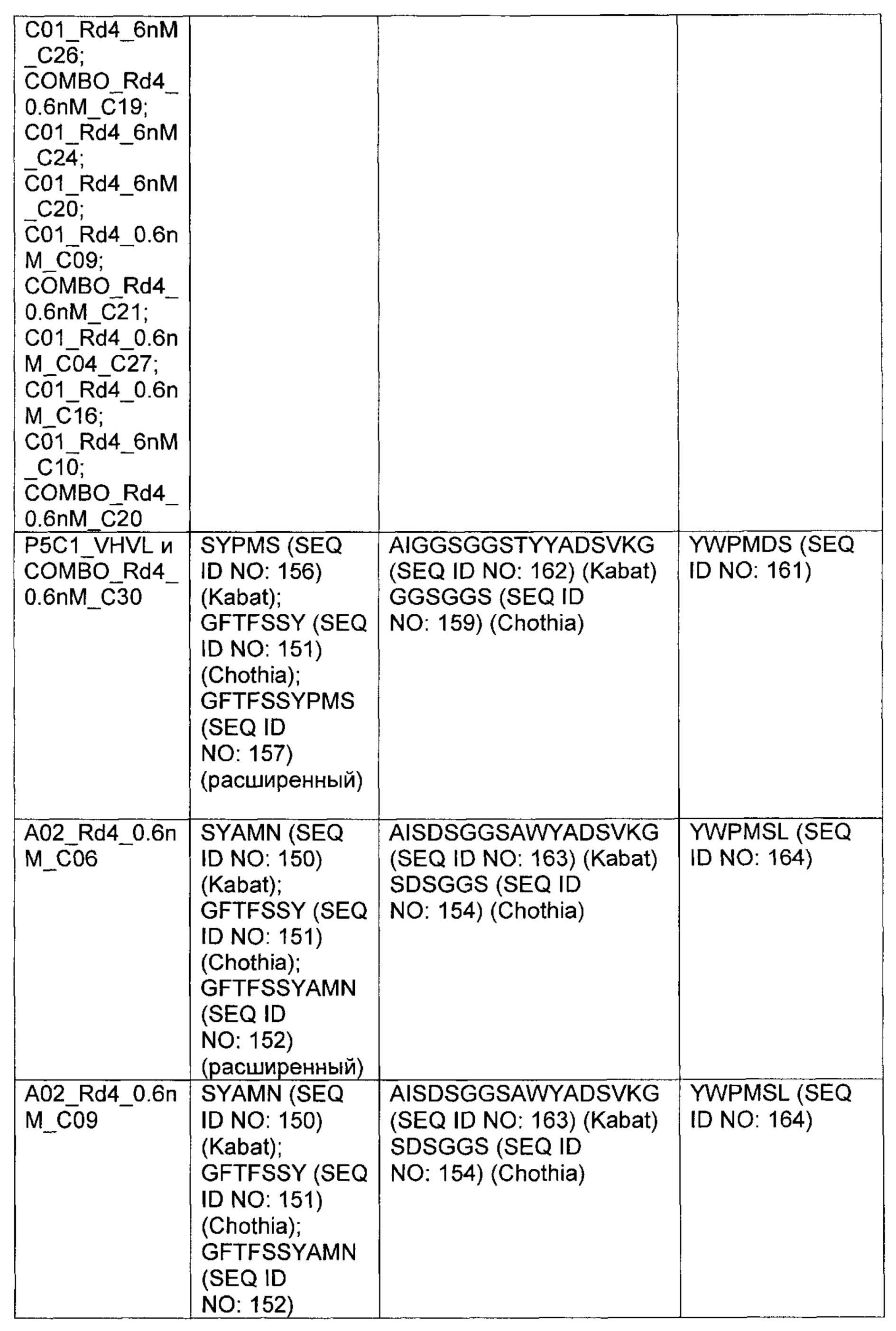



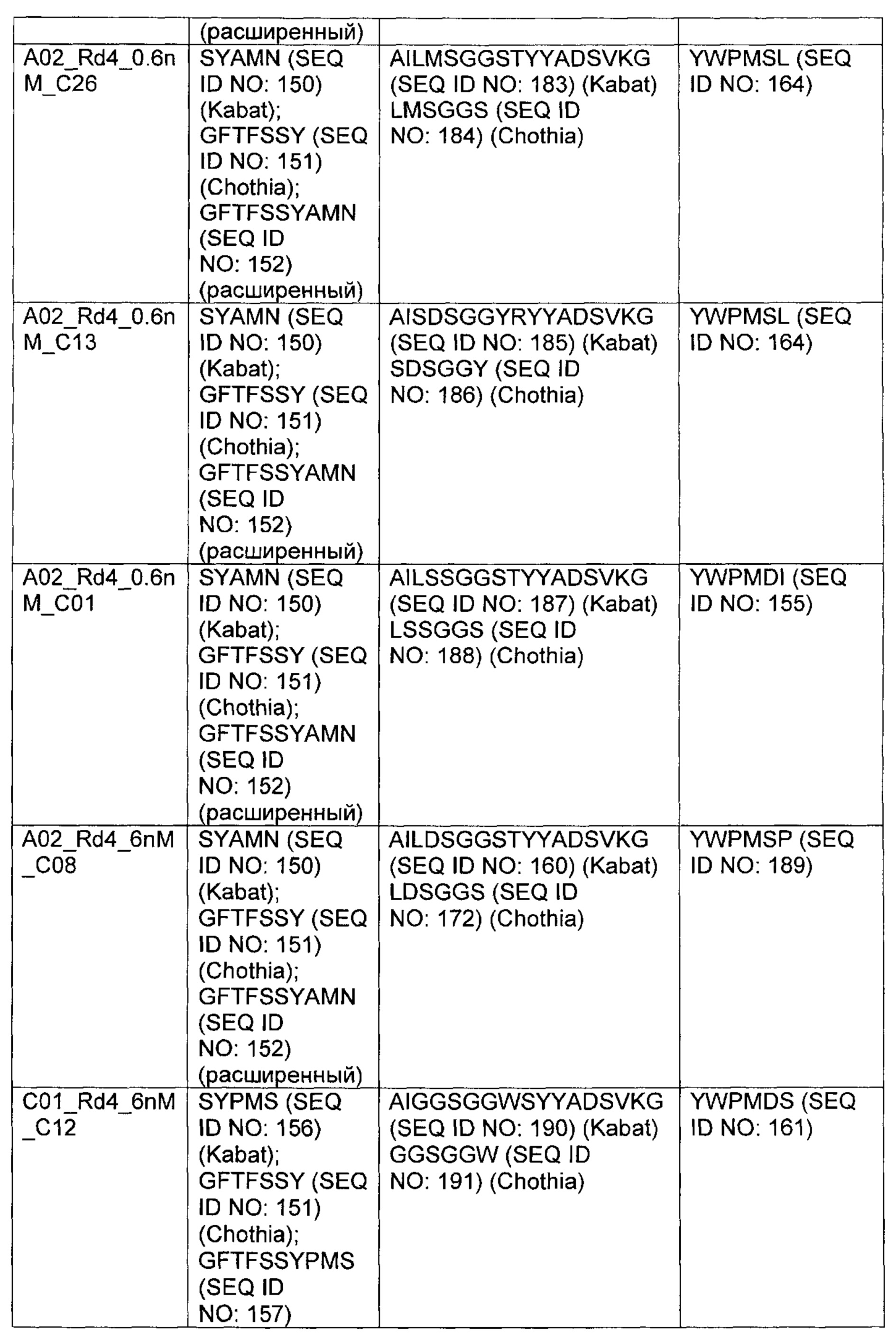
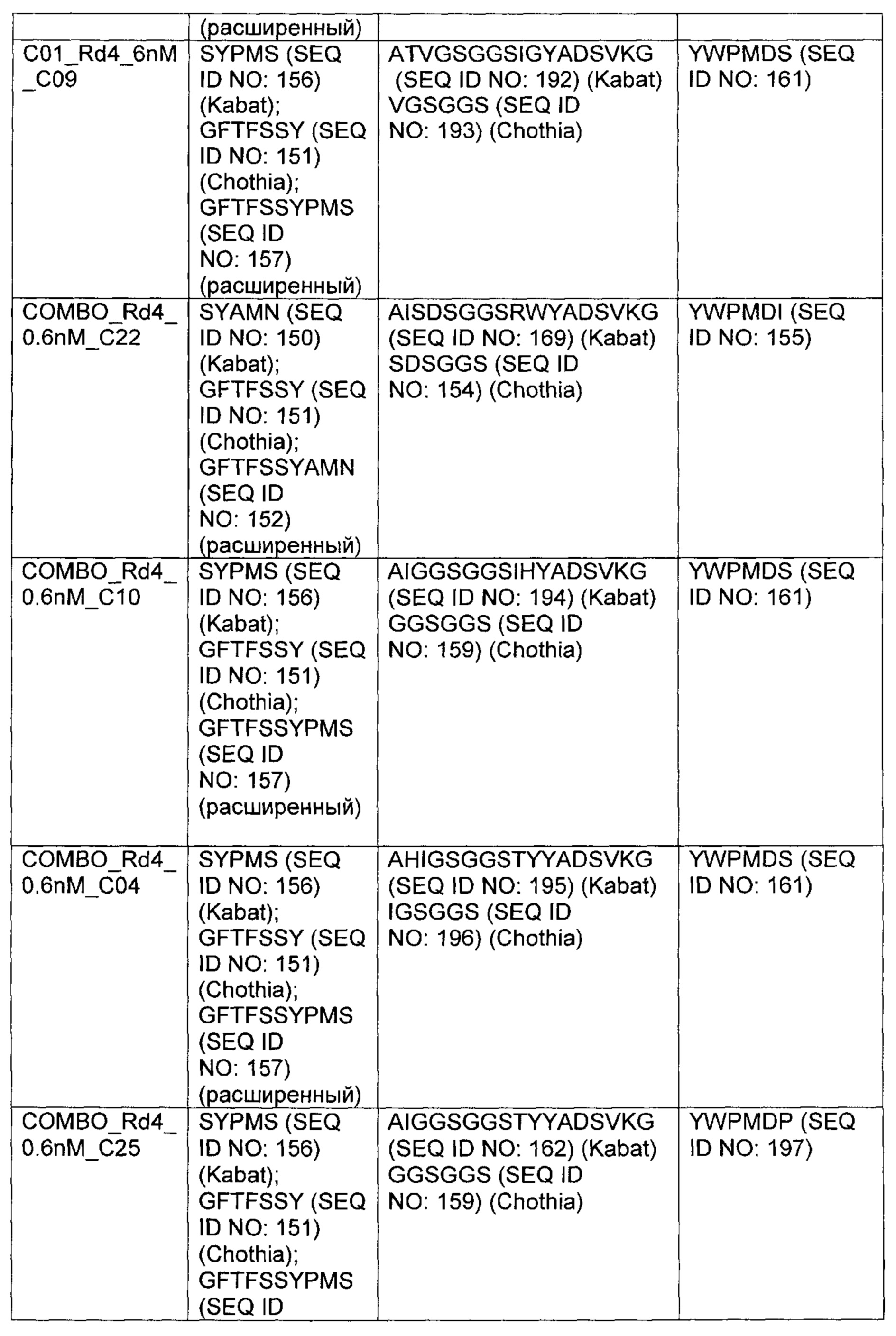
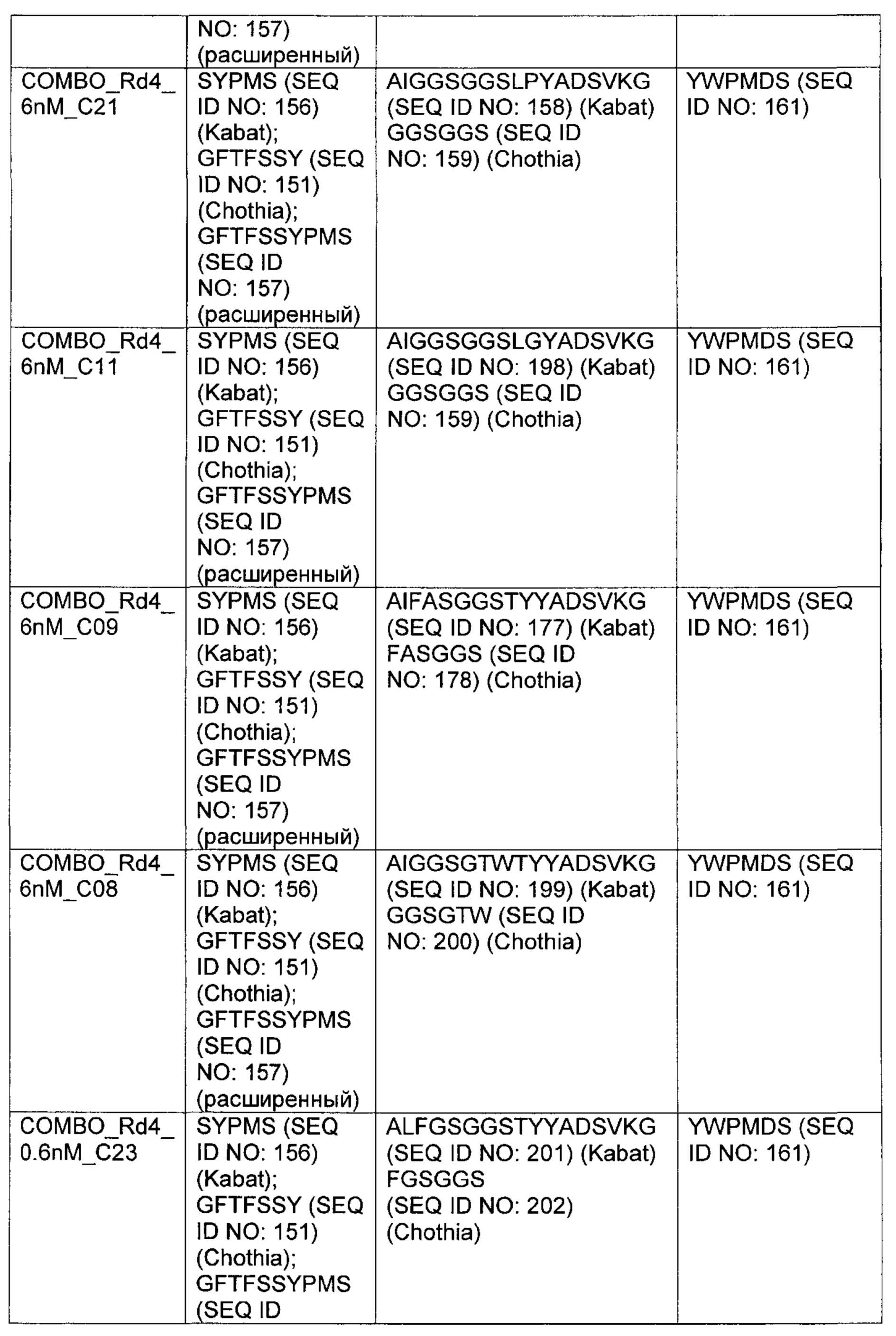
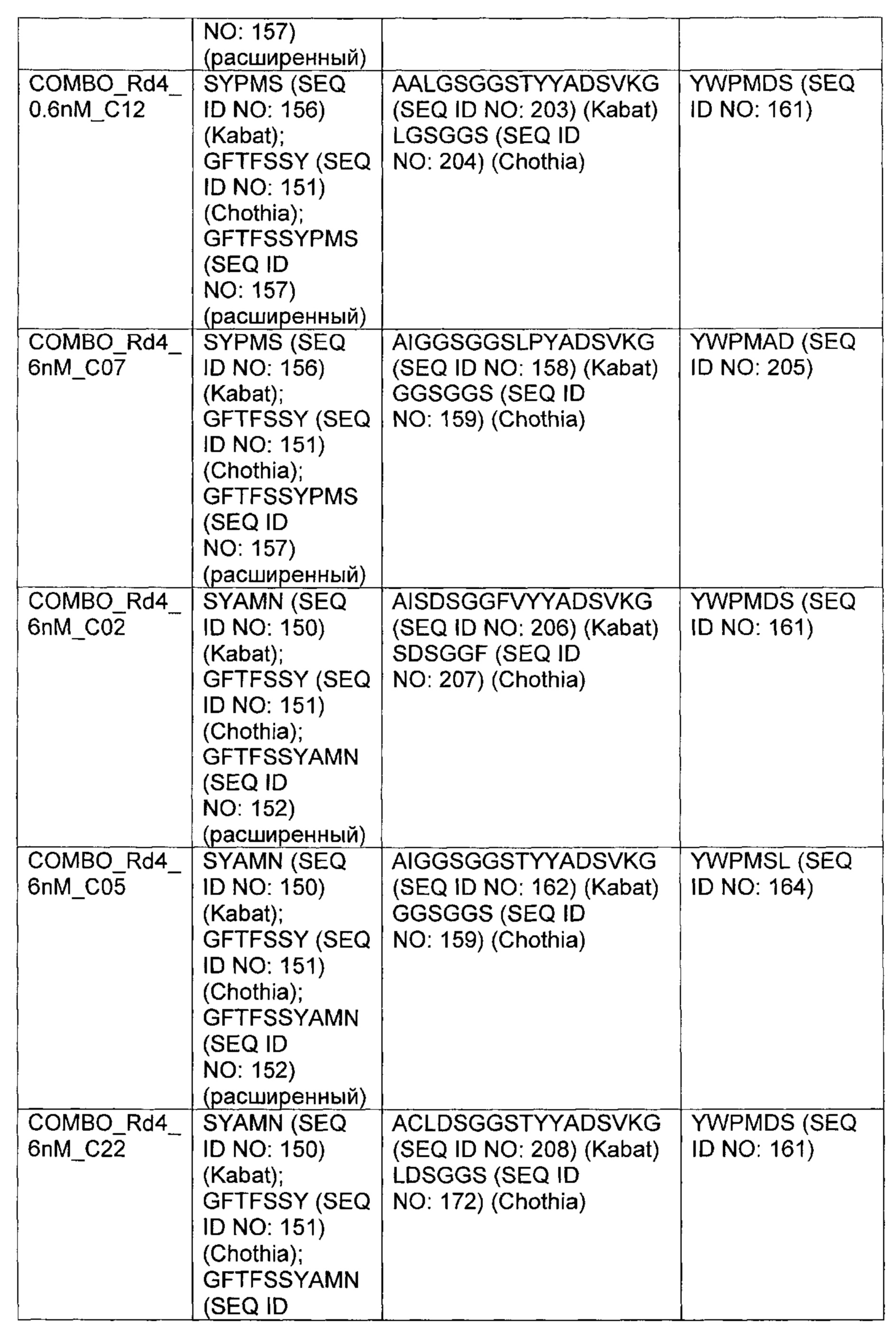
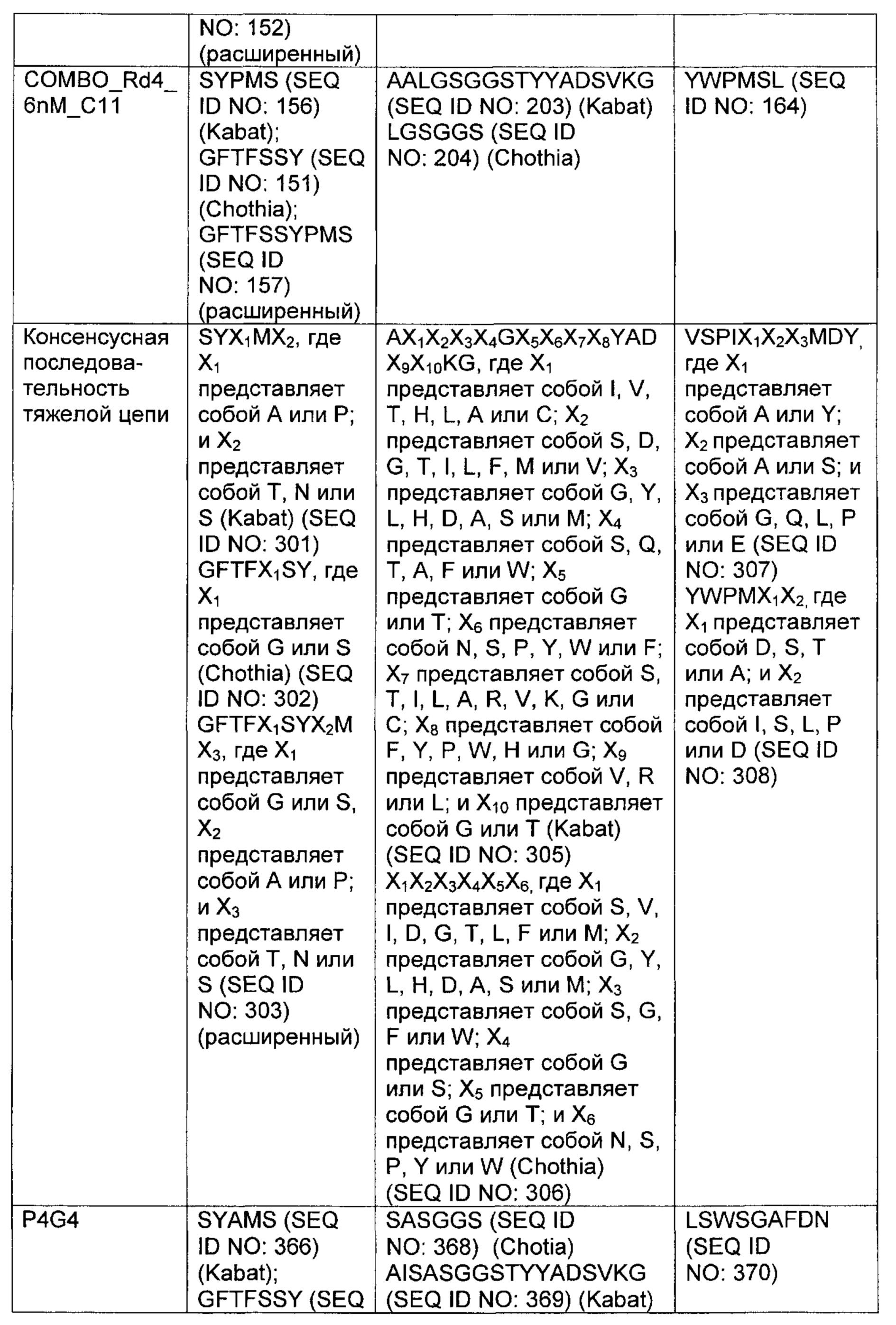
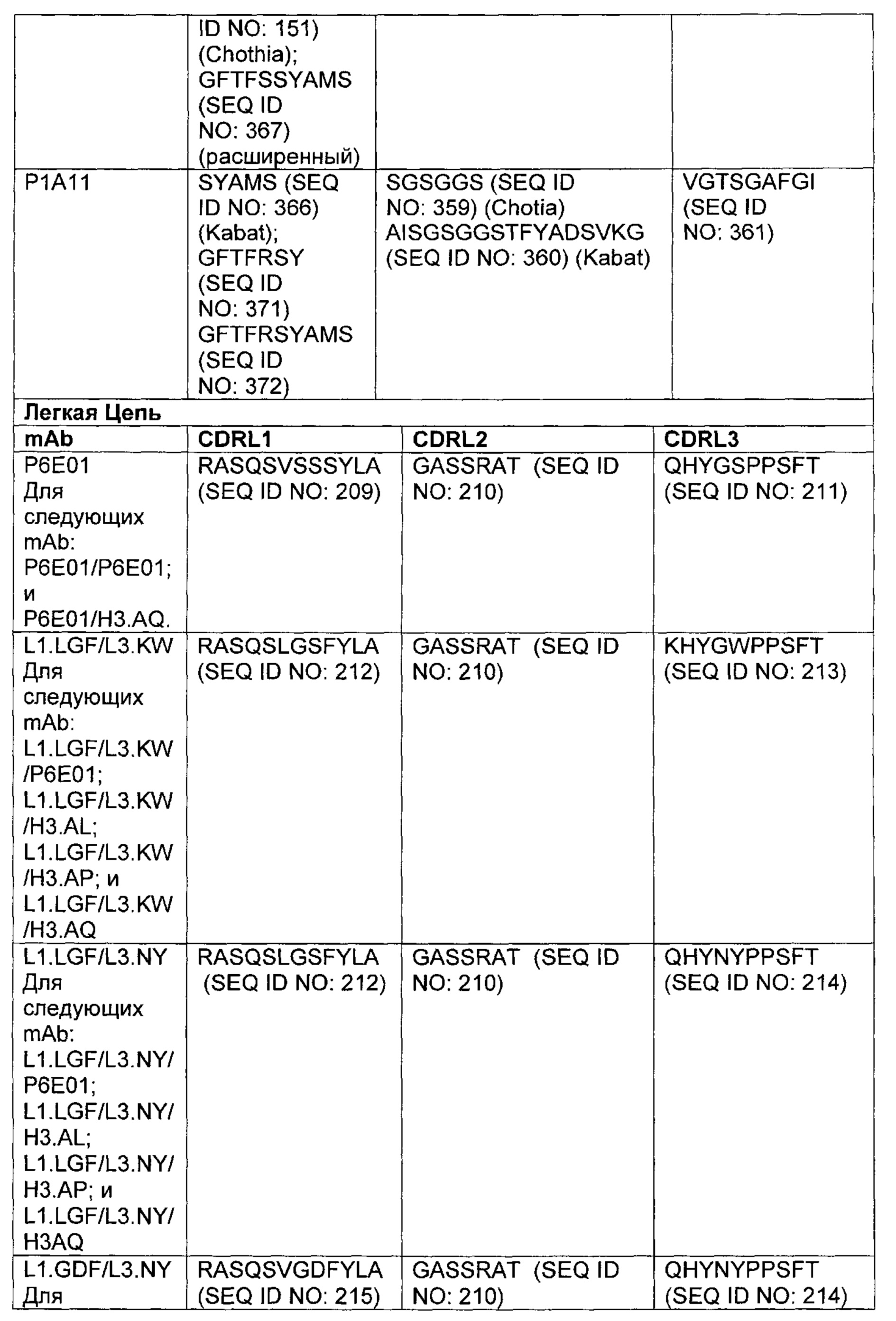



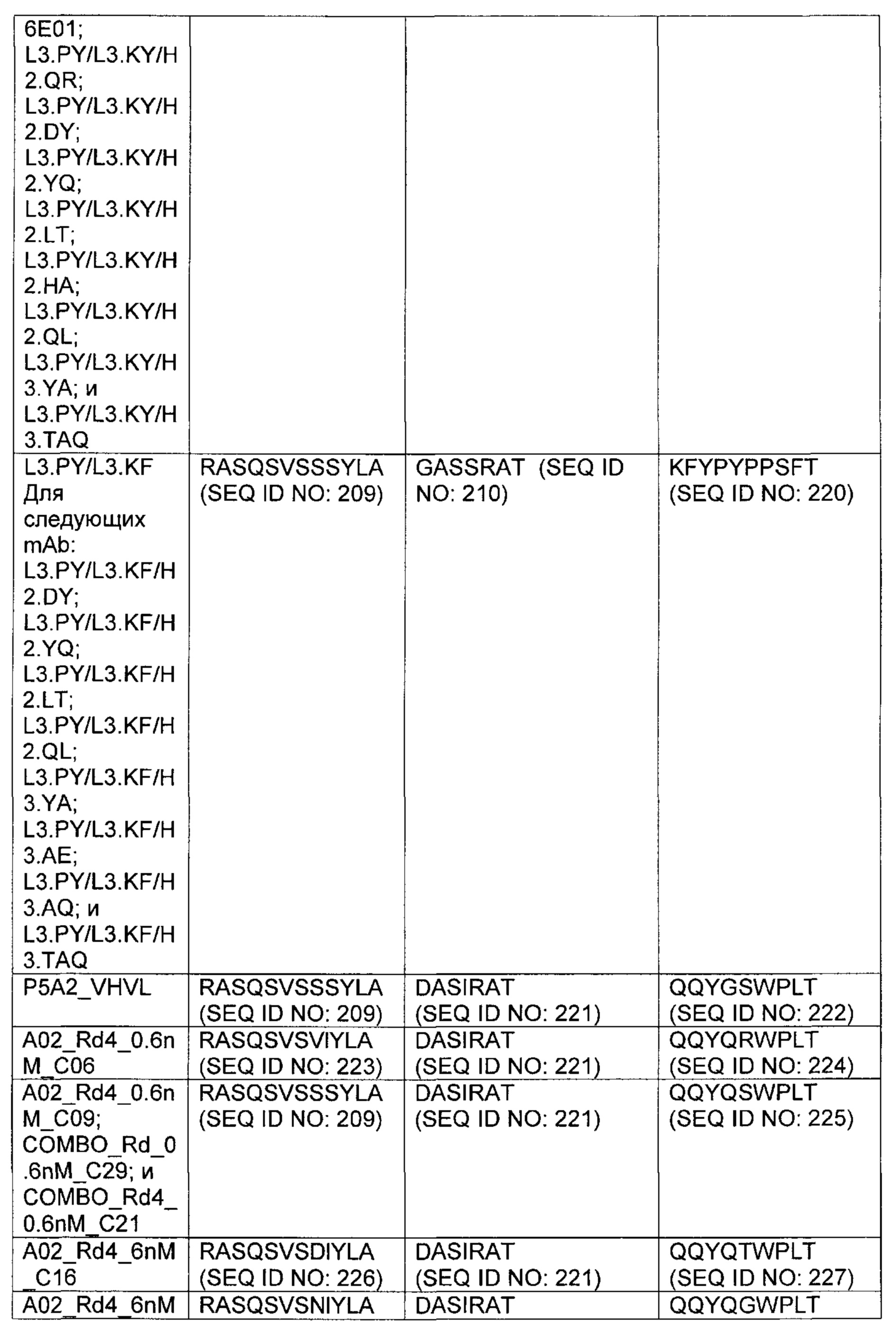
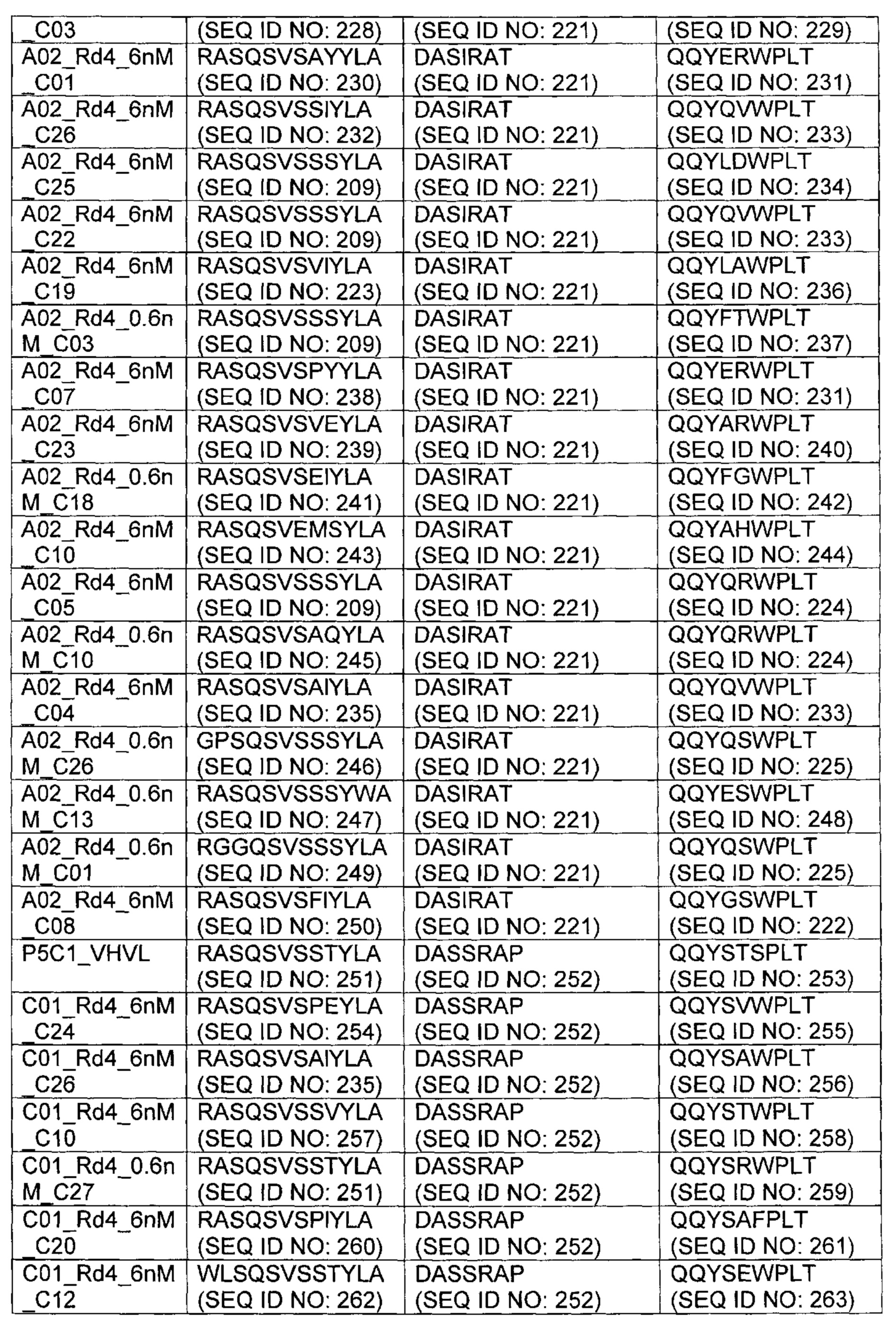
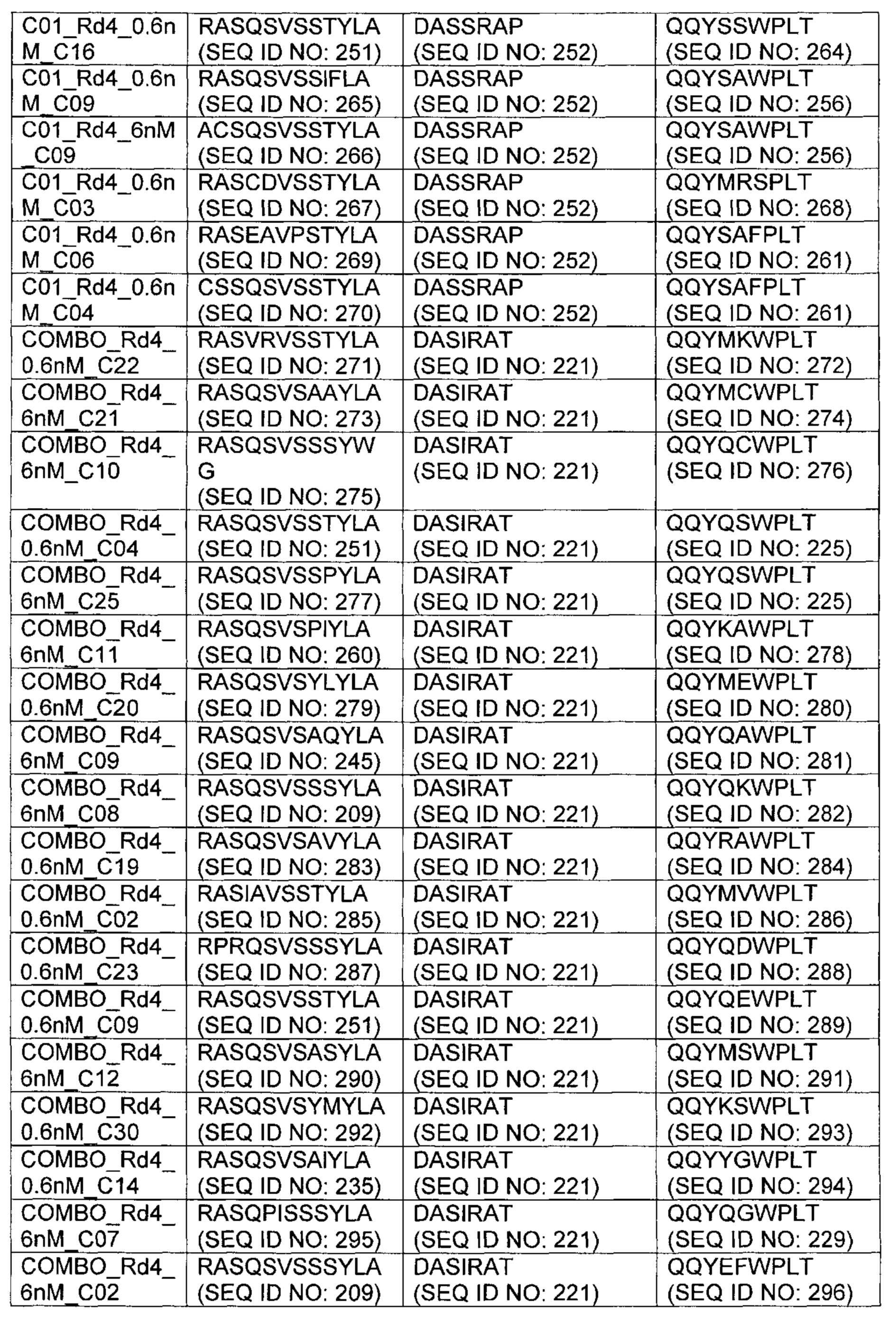
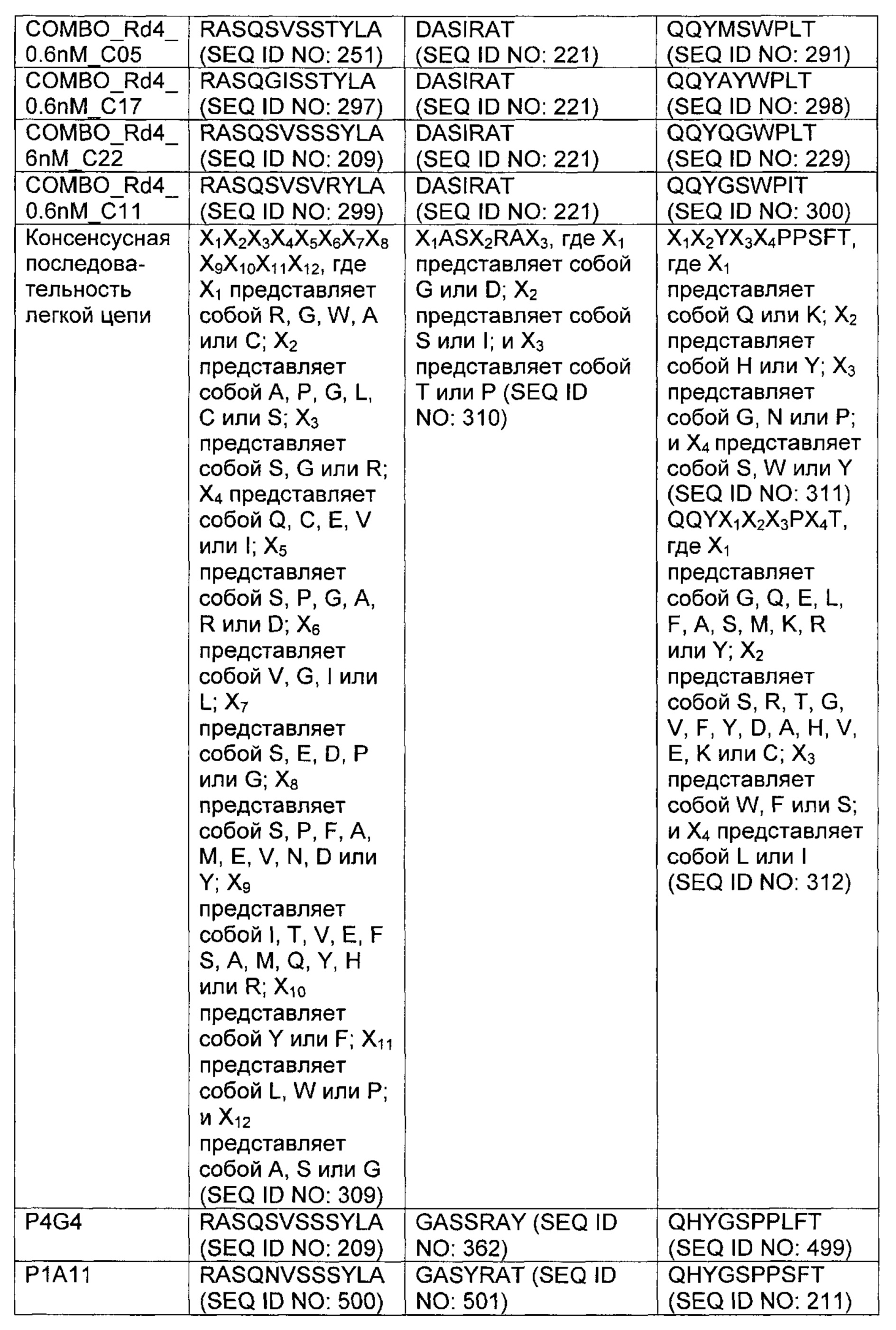
В некоторых воплощениях в настоящем изобретении предложено антитело, которое связывается с ВСМА и конкурирует с антителом, как описано в данном документе, в том числе с Р6Е01/Р6Е01, P6E01/H3.AQ, L1.LGF/L3.KW/P6E01; L1.LGF/L3.NY/P6E01, L1.GDF/L3.NY/P6E01, L1.LGF/L3.KW/H3.AL, L1.LGF/L3.KW/H3.AP, L1.LGF/L3.KW/H3.AQ, L1.LGF/L3.PY/H3.AP, L1.LGF/L3.PY/H3.AQ, L1.LGF/L3.NY/H3.AL, L1.LGF/L3.NY/H3.AP, L1.LGF/L3.NY/H3.AQ, L1.GDF/L3.KW/H3.AL, L1.GDF/L3.KW/H3.AP, L1.GDF/L3.KW/H3.AQ, L1.GDF/L3.PY/H3.AQ, L1.GDF/L3.NY/H3.AL, L1.GDF/L3.NY/H3.AP, L1.GDF/L3.NY/H3.AQ, L3.KW/P6E01, L3.PY/P6E01, L3.NY/P6E01, L3.PY/L1.PS/P6E01, L3.PY/L1.AH/P6E01, L3.PY/L1.FF/P6E01, L3.PY/L1.PH/P6E01, L3.PY/L3.KY/P6E01, L3.PY/L3.KF/P6E01, L3.PY/H2.QR, L3.PY/H2.DY, L3.PY/H2.YQ, L3.PY/H2.LT, L3.PY/H2.HA, L3.PY/H2.QL, L3.PY/H3.YA, L3.PY/H3.AE, L3.PY/H3.AQ, L3.PY/H3.TAQ, L3.PY/P6E01, L3.PY/L1.PS/H2.QR, L3.PY/L1.PS/H2.DY, L3.PY/L1.PS/H2.YQ, L3.PY/L1.PS/H2.LT, L3.PY/L1.PS/H2.HA, L3.PY/L1.PS/H2.QL, L3.PY/L1.PS/H3.YA, L3.PY/L1.PS/H3.АЕ, L3.PY/L1.PS/H3.AQ, L3.PY/L1.PS/H3.TAQ, L3.PY/L1.AH/H2.QR, L3.PY/L1.AH/H2.DY, L3.PY/L1.AH/H2.YQ, L3.PY/L1.AH/H2.LT, L3.PY/L1.АН/Н2.НА, L3.PY/L1.AH/H2.QL, L3.PY/L1.AH/H3.YA, L3.PY/L1.АН/Н3.АЕ, L3.PY/L1.AH/H3.AQ, L3.PY/L1.AH/H3.TAQ, L3.PY/L1.FF/H2.QR, L3.PY/L1.FF/H2.DY, L3.PY/L1.FF/H2.YQ, L3.PY/L1.FF/H2.LT, L3.PY/L1.FF/H2.HA, L3.PY/L1.FF/H2.QL, L3.PY/L1.FF/H3.YA, L3.PY/L1.FF/H3.AE, L3.PY/L1.FF/H3.AQ, L3.PY/L1.FF/H3.TAQ, L3.PY/L1.PH/H2.QR, L3.PY/L1.РН/Н2.НА, L3.PY/L1.РН/Н3.АЕ, L3.PY/L1.PH/H3.AQ, L3.PY/L1.PH/H3.TAQ, L3.PY/L3.KY/H2.QR, L3.PY/L3.KY/H2.DY, L3.PY/L3.KY/H2.YQ, L3.PY/L3.KY/H2.LT, L3.PY/L3.KY/H2.HA, L3.PY/L3.KY/H2.QL, L3.PY/L3.KY/H3.YA, L3.PY/L3.KY/H3.TAQ, L3.PY/L3.KF/H2.DY, L3.PY/L3.KF/H2.YQ, L3.PY/L3.KF/H2.LT, L3.PY/L3.KF/H2.QL, L3.PY/L3.KF/H3.YA, L3.PY/L3.KF/H3.AE, L3.PY/L3.KF/H3.AQ, L3.PY/L3.KF/H3.TAQ, P5A2_VHVL, A02_Rd4_0.6nM_C06, A02_Rd4_0.6nM_C09, A02_Rd4_6nM_C16, A02_Rd4_6nM_C03, A02_Rd4_6nM_C01, A02_Rd4_6nM_C26, A02_Rd4_6nM_C25, A02_Rd4_6nM_C22, A02_Rd4_6nM_C19, A02_Rd4_0.6nM_C03, A02_Rd4_6nM_C07, A02_Rd4_6nM_C23, A02_Rd4_0.6nM_C18, A02_Rd4_6nM_C10, A02_Rd4_6nM_C05, A02_Rd4_0.6nM_C10, A02_Rd4_6nM_C04, A02_Rd4_0.6nM_C26, A02_Rd4_0.6nM_C13, A02_Rd4_0.6nM_C01, A02_Rd4_6nM_C08, P5C1_VHVL, C01_Rd4_6nM_C24, C01_Rd4_6nM_C26, C01_Rd4_6nM_C10, C01_Rd4_0.6nM_C27, C01_Rd4_6nM_C20, C01_Rd4_6nM_C12, C01_Rd4_0.6nM_C16, C01_Rd4_0.6nM_C09, C01_Rd4_6nM_C09, C01_Rd4_0.6nM_C03, C01_Rd4_0.6nM_C06, C01_Rd4_6nM_C04, COMBO_Rd4_0.6nM_C22, COMBO_Rd4_6nM_C21, COMBO_Rd4_6nM_C10, COMBO_Rd4_0.6nM_C04, COMBO_Rd4_6nM_C25, COMBO_Rd4_0.6nM_C21, COMBO_Rd4_6nM_C11, COMBO_Rd4_0.6nM_C20, COMBO_Rd4_6nM_C09, COMBO_Rd4_6nM_C08, COMBO_Rd4_0.6nM_C19, COMBO_Rd4_0.6nM_C02, COMBO_Rd4_0.6nM_C23, COMBO_Rd4_0.6nM_C29, COMBO_Rd4_0.6nM_C09, COMBO_Rd4_6nM_C12, COMBO_Rd4_0.6nM_C30, COMBO_Rd4_0.6nM_C14, COMBO_Rd4_6nM_C07, COMBO_Rd4_6nM_C02, COMBO_Rd4_0.6nM_C05, COMBO_Rd4_0.6nM_C17, COMBO_Rd4_6nM_C22, COMBO_Rd4_0.6nM_C11, COMBO_Rd4_0.6nM_C29, P4G4 или P1A11.
В некоторых воплощениях в настоящем изобретении предложено антитело или антигенсвязывающий фрагмент, которое(ый) специфично связывается с ВСМА, где антитело содержит VH-область, содержащую последовательность, представленную в SEQ ID NO: 112; и/или VL-область, содержащую последовательность, представленную в SEQ ID NO: 38. В некоторых воплощениях антитело содержит легкую цепь, содержащую последовательность
 , и тяжелую цепь, содержащую последовательность
, и тяжелую цепь, содержащую последовательность 

В некоторых воплощениях, в настоящем изобретении предложено антитело или антигенсвязывающий фрагмент, которые специфично связываются с ВСМА, где антитело содержит VH-область, содержащую последовательность, представленную в SEQ ID NO: 2, 32, 42 или 78; и/или VL-область, содержащую последовательность, представленную в SEQ ID NO: 6, 16, 43 или 85.
В некоторых воплощениях в изобретении также предложены участки CDR антител к ВСМА-антителам на основе контактных областей CDR. Контактные области CDR представляют собой области антитела, которые наделяют антитело специфичностью к антигену. В общем случае, контактные области CDR включают положения остатков в CDR и зонах Верньер, которые ограничены для поддержания правильной структуры петли для связывания антитела со специфическим антигеном. См., например, Makabe et al., J. Biol. Chem., 283:1156-1166, 2007. Определение контактных областей CDR хорошо известно специалистам.
Аффинность связывания (KD) ВСМА-антитела, как описано в данном документе, с ВСМА (таким как человеческий ВСМА (например SEQ ID NO: 353)), может составлять от примерно 0,002 нМ до примерно 6500 нМ. В некоторых воплощениях аффинность связывания составляет любое значение из примерно 6500 нМ, 6000 нМ, 5986 нМ, 5567 нМ, 5500 нМ, 4500 нМ, 4000 нМ, 3500 нМ, 3000 нМ, 2500 нМ, 2134 нМ, 2000 нМ, 1500 нМ, 1000 нМ, 750 нМ, 500 нМ, 400 нМ, 300 нМ, 250 нМ, 200 нМ, 193 нМ, 100 нМ, 90 нМ, 50 нМ, 45 нМ, 40 нМ, 35 нМ, 30 нМ, 25 нМ, 20 нМ, 19 нМ, 18 нМ, 17 нМ, 16 нМ, 15 нМ, 10 нМ, 8 нМ, 7,5 нМ, 7 нМ, 6,5 нМ, 6 нМ, 5,5 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ, 1 нМ, 0,5 нМ, 0,3 нМ, 0,1 нМ, 0,01 нМ или 0,002 нМ. В некоторых воплощениях аффинность связывания составляет менее чем любой из примерно 6500 нМ, 6000 нМ, 5500 нМ, 5000 нМ, 4000 нМ, 3000 нМ, 2000 нМ, 1000 нМ, 900 нМ, 800 нМ, 250 нМ, 200 нМ, 100 нМ, 50 нМ, 30 нМ, 20 нМ, 10 нМ, 7.5 нМ, 7 нМ, 6.5 нМ, 6 нМ, 5 нМ, 4,5 нМ, 4 нМ, 3,5 нМ, 3 нМ, 2,5 нМ, 2 нМ, 1,5 нМ, 1 нМ или 0,5 нМ.
В некоторых воплощениях изобретение охватывает композиции, включая фармацевтические композиции, содержащие антитела, описанные в данном документе или полученные способами и имеющие характеристики, которые описаны в данном документе. При использовании в данном документе, композиции содержат одно или более антител, которые связываются с ВСМА, и/или один или более полинуклеотидов, имеющих последовательности, кодирующие одно или более этих антител. Эти композиции могут дополнительно содержать подходящие эксципиенты, такие как фармацевтически приемлемые эксципиенты, включающие буферы, хорошо известные в данной области.
В изобретении также предложены способы получения любого из этих антител. Антитела по данному изобретению могут быть получены способами, хорошо известными в данной области. Полипептиды могут быть получены посредством протеолитического или иного разрушения антител, рекомбинантными способами (то есть одиночные или слитые полипептиды), как описано выше, или посредством химического синтеза. Полипептиды антител, особенно короткие полипептиды, вплоть до примерно 50 аминокислот, обычно получают посредством химического синтеза. Способы химического синтеза известны в данной области и доступны для приобретения. Например, антитело может быть получено посредством автоматического полипептидного синтезатора, использующего твердофазный метод. См. также патенты US 5807715; 4816567 и 6331415.
Данное изобретение также охватывает слитые белки, содержащие один или более фрагментов или участков антител по данному изобретению. В одном воплощении предложен слитый полипептид, который содержит по меньшей мере 10 смежных аминокислот вариабельной области легкой цепи, представленной в SEQ ID NO: 1, 4, 5, 6, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 34, 36, 38, 40, 41, 43, 45, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75, 77, 79, 317, 81, 82, 84, 85, 86, 88, 89, 90, 91, 93, 94, 96, 98, 100, 102, 103, 105, 107, 108, 109, 111, 113, 115, 116, 117, 119, 121, 123, 124, 126, 128, 80, 315, 36 или 364, и/или по меньшей мере 10 аминокислот вариабельной области тяжелой цепи, представленной в SEQ ID NO: 2, 3, 7, 8, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 35, 37, 39, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 83, 87, 92, 95, 97, 99, 101, 104, 106, 110, 112, 114, 118, 120, 122, 112, 125, 127, 313, 314, 363 или 365. В других воплощениях предложен слитый полипептид, который содержит по меньшей мере примерно 10, по меньшей мере примерно 15, по меньшей мере примерно 20, по меньшей мере примерно 25 или по меньшей мере примерно 30 смежных аминокислот вариабельной области легкой цепи, и/или по меньшей мере примерно 10, по меньшей мере примерно 15, по меньшей мере примерно 20, по меньшей мере примерно 25 или по меньшей мере примерно 30 смежных аминокислот вариабельной области тяжелой цепи. В другом воплощении слитый полипептид содержит вариабельную область легкой цепи и/или вариабельную область тяжелой цепи, как показано в любой из пар последовательностей, выбранных из SEQ ID NO: 1 и 2, 1 и 3, 4 и 2, 5 и 2, 6 и 2, 4 и 7, 4 и 8, 4 и 3, 9 и 8, 9 и 3, 10 и 7, 10 и 8, 10 и 3, 11 и 7, 11 и 8, 11 и 3, 12 и 3, 13 и 7, 13 и 8, 14 и 3, 15 и 2, 16 и 2, 17 и 2, 18 и 2, 19 и 2, 20 и 2, 21 и 2, 22 и 2, 23 и 2, 16 и 24, 16 и 25, 16 и 26, 16 и 27, 16 и 28, 16 и 29, 16 и 30, 16 и 31, 16 и 3, 16 и 32, 16 и 2, 18 и 24, 18 и 25, 18 и 26, 18 и 27, 18 и 28, 18 и 29, 18 и 30, 18 и 31, 18 и 3, 18 и 32, 19 и 24, 19 и 25, 19 и 26, 19 и 27, 19 и 28, 19 и 29, 19 и 30, 19 и 31, 19 и 3, 19 и 32, 20 и 24, 20 и 25, 20 и 26, 20 и 27, 20 и 28, 20 и 29, 20 и 30, 20 и 31, 20 и 3, 20 и 32, 21 и 24, 21 и 28, 21 и 31, 21 и 3, 21 и 32, 22 и 24, 22 и 25, 22 и 26, 22 и 27, 22 и 28, 22 и 29, 22 и 30, 22 и 32, 23 и 25, 23 и 26, 23 и 27, 23 и 29, 23 и 30, 23 и 31, 23 и 3, 23 и 32, 34 и 33, 36 и 35, 38 и 37, 40 и 39, 41 и 33, 43 и 42, 45 и 44, 47 и 46, 49 и 48, 51 и 50, 53 и 52, 55 и 54, 57 и 56, 59 и 58, 61 и 60, 63 и 62, 65 и 64, 67 и 66, 69 и 68, 71 и 70, 73 и 72, 75 и 74, 77 и 76, 79 и 78, 317 и 78, 79 и 78, 81 и 78, 82 и 78, 84 и 83, 85 и 78, 86 и 78, 88 и 87, 89 и 78, 90 и 78, 91 и 78, 93 и 92, 94 и 78, 96 и 95, 98 и 97, 38 и 78, 102 и 101, 103 и 78, 105 и 104, 107 и 106, 108 и 78, 109 и 78, 111 и 110, 38 и 112, 113 и 112, 115 и 114, 116 и 76, 117 и 112, 119 и 118, 121 и 120, 123 и 122, 124 и 112, 126 и 125, 128 и 127, 80 и 363, или 364 и 365. В другом воплощении слитый полипептид содержит один или более CDR. В других воплощениях слитый полипептид содержит CDR Н3 (VH CDR3) и/или CDR L3 (VL CDR3). Применительно к данному изобретению, слитый белок содержит одно или более антител и другую аминокислотную последовательность, к которой он не присоединен в нативной молекуле, например гетерологичную последовательность или гомологичную последовательность из другой области. Примеры гетерологичных последовательностей включают, без ограничения ими, "тег", такой как тег FLAG или тег 6His. Теги хорошо известны в данной области техники.
В изобретении также предложены выделенные полинуклеотиды, кодирующие антитела по изобретению, и векторы, а также клетки-хозяева, содержащие полинуклеотид.
В одном воплощении полинуклеотид содержит последовательность, кодирующую вариабельные области тяжелой цепи и/или легкой цепи антитела Р6Е01/Р6Е01, P6E01/H3.AQ, L1.LGF/L3.KW/P6E01; L1.LGF/L3.NY/P6E01, L1.GDF/L3.NY/P6E01, L1.LGF/L3.KW/H3.AL, L1.LGF/L3.KW/H3.AP, L1.LGF/L3.KW/H3.AQ, L1.LGF/L3.PY/H3.AP, L1.LGF/L3.PY/H3.AQ, L1.LGF/L3.NY/H3.AL, L1.LGF/L3.NY/H3.AP, L1.LGF/L3.NY/H3.AQ, L1.GDF/L3.KW/H3.AL, L1.GDF/L3.KW/H3.AP, L1.GDF/L3.KW/H3.AQ, L1.GDF/L3.PY/H3.AQ, L1.GDF/L3.NY/H3.AL, L1.GDF/L3.NY/H3.AP, L1.GDF/L3.NY/H3.AQ, L3.KW/P6E01, L3.PY/P6E01, L3.NY/P6E01, L3.PY/L1.PS/P6E01, L3.PY/L1.AH/P6E01, L3.PY/L1.FF/P6E01, L3.PY/L1.PH/P6E01, L3.PY/L3.KY/P6E01, L3.PY/L3.KF/P6E01, L3.PY/H2.QR, L3.PY/H2.DY, L3.PY/H2.YQ, L3.PY/H2.LT, L3.PY/H2.HA, L3.PY/H2.QL, L3.PY/H3.YA, L3.PY/H3.AE, L3.PY/H3.AQ, L3.PY/H3.TAQ, L3.PY/P6E01, L3.PY/L1.PS/H2.QR, L3.PY/L1.PS/H2.DY, L3.PY/L1.PS/H2.YQ, L3.PY/L1.PS/H2.LT, L3.PY/L1.PS/H2.HA, L3.PY/L1.PS/H2.QL, L3.PY/L1.PS/H3.YA, L3.PY/L1.PS/H3.AE, L3.PY/L1.PS/H3.AQ, L3.PY/L1.PS/H3.TAQ, L3.PY/L1.AH/H2.QR, L3.PY/L1.AH/H2.DY, L3.PY/L1.AH/H2.YQ, L3.PY/L1.AH/H2.LT, L3.PY/L1.AH/H2.HA, L3.PY/L1.AH/H2.QL, L3.PY/L1.AH/H3.YA, L3.PY/L1.АН/Н3.АЕ, L3.PY/L1.AH/H3.AQ, L3.PY/L1.AH/H3.TAQ, L3.PY/L1.FF/H2.QR, L3.PY/L1.FF/H2.DY, L3.PY/L1.FF/H2.YQ, L3.PY/L1.FF/H2.LT, L3.PY/L1.FF/H2.HA, L3.PY/L1.FF/H2.QL, L3.PY/L1.FF/H3.YA, L3.PY/L1.FF/H3.AE, L3.PY/L1.FF/H3.AQ, L3.PY/L1.FF/H3.TAQ, L3.PY/L1.PH/H2.QR, L3.PY/L1.РН/Н2.НА, L3.PY/L1.РН/Н3.АЕ, L3.PY/L1.PH/H3.AQ, L3.PY/L1.PH/H3.TAQ, L3.PY/L3.KY/H2.QR, L3.PY/L3.KY/H2.DY, L3.PY/L3.KY/H2.YQ, L3.PY/L3.KY/H2.LT, L3.PY/L3.KY/H2.НА, L3.PY/L3.KY/H2.QL, L3.PY/L3.KY/H3.YA, L3.PY/L3.KY/H3.TAQ, L3.PY/L3.KF/H2.DY, L3.PY/L3.KF/H2.YQ, L3.PY/L3.KF/H2.LT, L3.PY/L3.KF/H2.QL, L3.PY/L3.KF/H3.YA, L3.PY/L3.KF/H3.AE, L3.PY/L3.KF/H3.AQ, L3.PY/L3.KF/H3.TAQ, P5A2_VHVL, A02_Rd4_0,6nM_C06, A02_Rd4_0,6nM_C09, A02_Rd4_6nM_C16, A02_Rd4_6nM_C03, A02_Rd4_6nM_C01, A02_Rd4_6nM_C26, A02_Rd4_6nM_C25, A02_Rd4_6nM_C22, A02_Rd4_6nM_C19, A02_Rd4_0.6nM_C03, A02_Rd4_6nM_C07, A02_Rd4_6nM_C23, A02_Rd4_0.6nM_C18, A02_Rd4_6nM_C10, A02_Rd4_6nM_C05, A02_Rd4_0.6nM_C10, A02_Rd4_6nM_C04, A02_Rd4_0.6nM_C26, A02_Rd4_0.6nM_C13, A02_Rd4_0.6nM_C01, A02_Rd4_6nM_C08, P5C1_VHVL, C01_Rd4_6nM_C24, C01_Rd4_6nM_C26, C01_Rd4_6nM_C10, C01_Rd4_0.6nM_C27, C01_Rd4_6nM_C20, C01_Rd4_6nM_C12, C01_Rd4_0.6nM_C16, C01_Rd4_0.6nM_C09, C01_Rd4_6nM_C09, C01_Rd4_0.6nM_C03, C01_Rd4_0.6nM_C06, C01_Rd4_6nM_C04, COMBO_Rd4_0.6nM_C22, COMBO_Rd4_6nM_C21, COMBO_Rd4_6nM_C10, COMBO_Rd4_0.6nM_C04, COMBO_Rd4_6nM_C25, COMBO_Rd4_0.6nM_C21, COMBO_Rd4_6nM_C11, COMBO_Rd4_0.6nM_C20, COMBO_Rd4_6nM_C09, COMBO_Rd4_6nM_C08, COMBO_Rd4_0.6nM_C19, COMBO_Rd4_0.6nM_C02, COMBO_Rd4_0.6nM_C23, COMBO_Rd4_0.6nM_C29, COMBO_Rd4_0.6nM_C09, COMBO_Rd4_6nM_C12, COMBO_Rd4_0.6nM_C30, COMBO_Rd4_0.6nM_C14, COMBO_Rd4_6nM_C07, COMBO_Rd4_6nM_C02, COMBO_Rd4_0.6nM_C05, COMBO_Rd4_0.6nM_C17, COMBO_Rd4_6nM_C22, COMBO_Rd4_0.6nM_C11, COMBO_Rd4_0.6nM_C29, P4G4 или P1A11. Последовательность, кодирующая интересующее антитело, может поддерживаться в векторе в клетке-хозяине, и клетку-хозяина можно затем размножить и заморозить для будущего использования. Векторы (включая экспрессионные векторы) и клетки-хозяева дополнительно описаны в данном документе.
Данное изобретение также охватывает scFv антител по изобретению. Одноцепочечные фрагменты вариабельной области получают путем соединения вариабельных областей легкой и/или тяжелой цепи, используя короткий линкерный пептид (Bird et al., Science 242:423-426, 1988). Примером линкерного пептида является (GGGGS)3 (SEQ ID NO: 498), который образует мостик длиной приблизительно 3,5 нм между карбоксильным концом одной вариабельной области и аминным концом другой вариабельной области. Были сконструированы и использованы линкеры с другими последовательностями (Bird et al., 1988, выше). Линкеры должны быть короткими, гибкими полипептидами и предпочтительно содержать менее чем примерно 20 аминокислотных остатков. Линкеры могут, в свою очередь, быть модифицированы для дополнительных функций, таких как прикрепление лекарственных средств или прикрепление к твердым подложкам. Одноцепочечные варианты могут быть получены либо рекомбинантно, либо синтетически. Для синтетического получения scFv можно использовать автоматический синтезатор. Для рекомбинантного продуцирования scFv, подходящую плазмиду, содержащую полинуклеотид, кодирующий scFv, можно ввести в подходящую клетку-хозяина, либо эукариотическую, такую как дрожжи, растения, насекомые или клетки млекопитающих, либо прокариотическую, такую как Е. coli. Полинуклеотиды, кодирующие интересующий scFv, могут быть получены посредством рутинных манипуляций, таких как лигирование полинуклеотидов. Полученный в результате scFv может быть выделен с использованием стандартных методов очистки белка, известных в данной области.
Также включены другие формы одноцепочечных антител, такие как диатела или миниантитела. Диатела представляют собой бивалентные, биспецифические антитела, в которых вариабельные домены тяжелой цепи (VH) и вариабельные домены легкой цепи (VL) экспрессируются на одноцепочечном полипептиде, но с использованием линкера, который является слишком коротоким, чтобы позволить спаривание двух доменов на одной и той же цепи, тем самым заставляя домены спариваться с комплементарными доменами другой цепи и создавая два антигенсвязывающих сайта (см., например, Holliger, P., et al., Proc. Natl. Acad Sci. USA 90:6444-6448, 1993; Poljak, R.J., et al., Structure 2:1121-1123, 1994). Минитело включает VL- и VH-домены нативного антитела, слитого с шарнирной областью, и СН3-домен молекулы иммуноглобулина. См., например, US 5837821.
В другом аспекте изобретения предложены композиции (такие как фармацевтические композиции), содержащие любой из полинуклеотидов по изобретению. В некоторых воплощениях эта композиция содержит экспрессионный вектор, содержащий полинуклеотид, кодирующий любое из антител, описанных в данном документе. В других воплощениях композиция содержит любой из полипептидов или оба полипептида, представленных в SEQ ID NO: 486 и SEQ ID NO: 485 ниже:
COMBO_Rd4_0.6nM_C29 вариабельная область тяжелой цепи

COMBO_Rd4_0.6nM_C29 вариабельная область легкой цепи
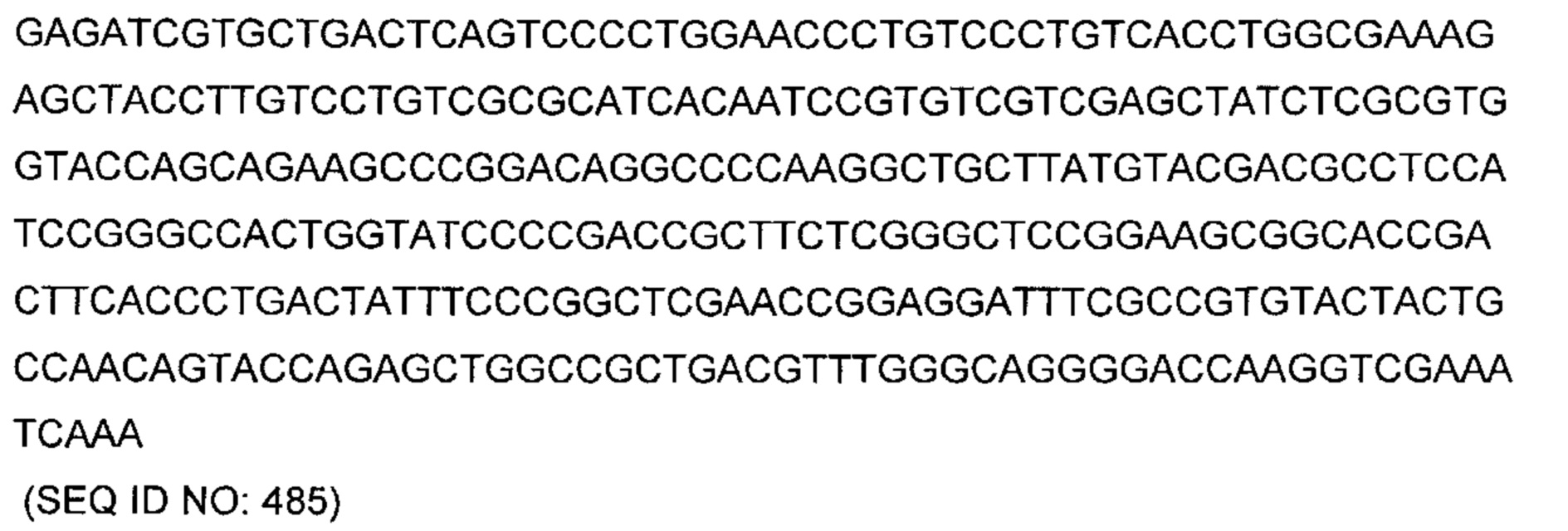
В других воплощениях композиция содержит любой из полипептидов или оба полипептида, представленных в SEQ ID NO: 488 и SEQ ID NO: 487 ниже:
L3.PY/H3TAQ вариабельная область тяжелой цепи
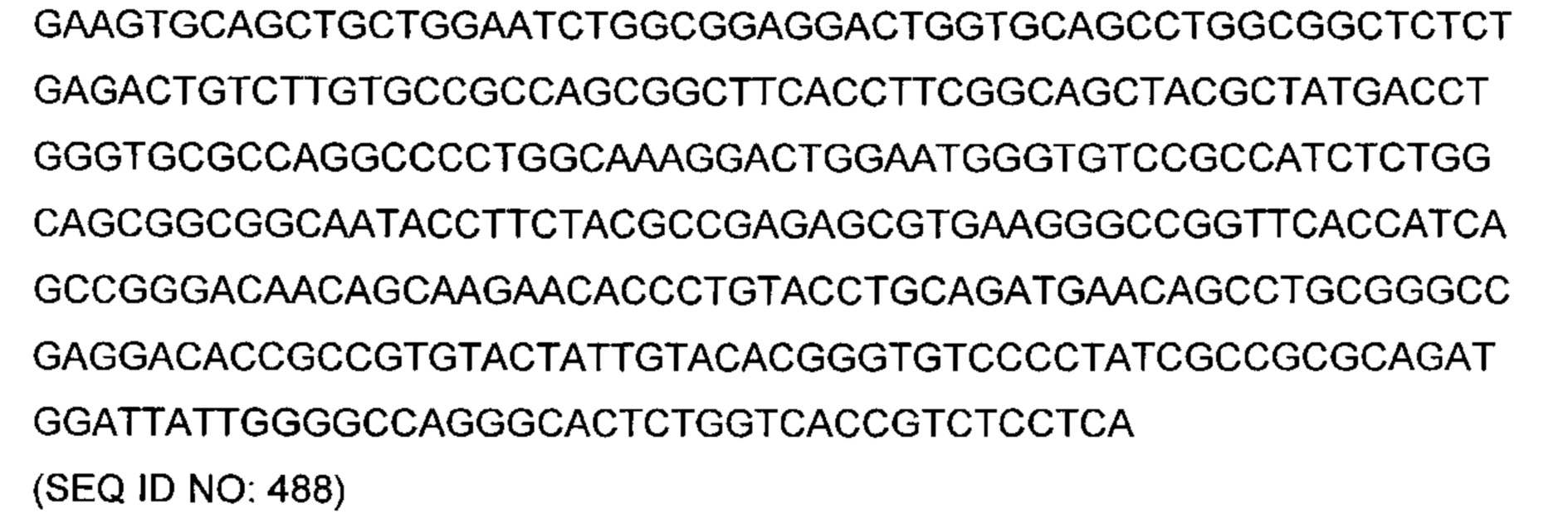
L3.PY/H3TAQ вариабельная область тяжелой цепи
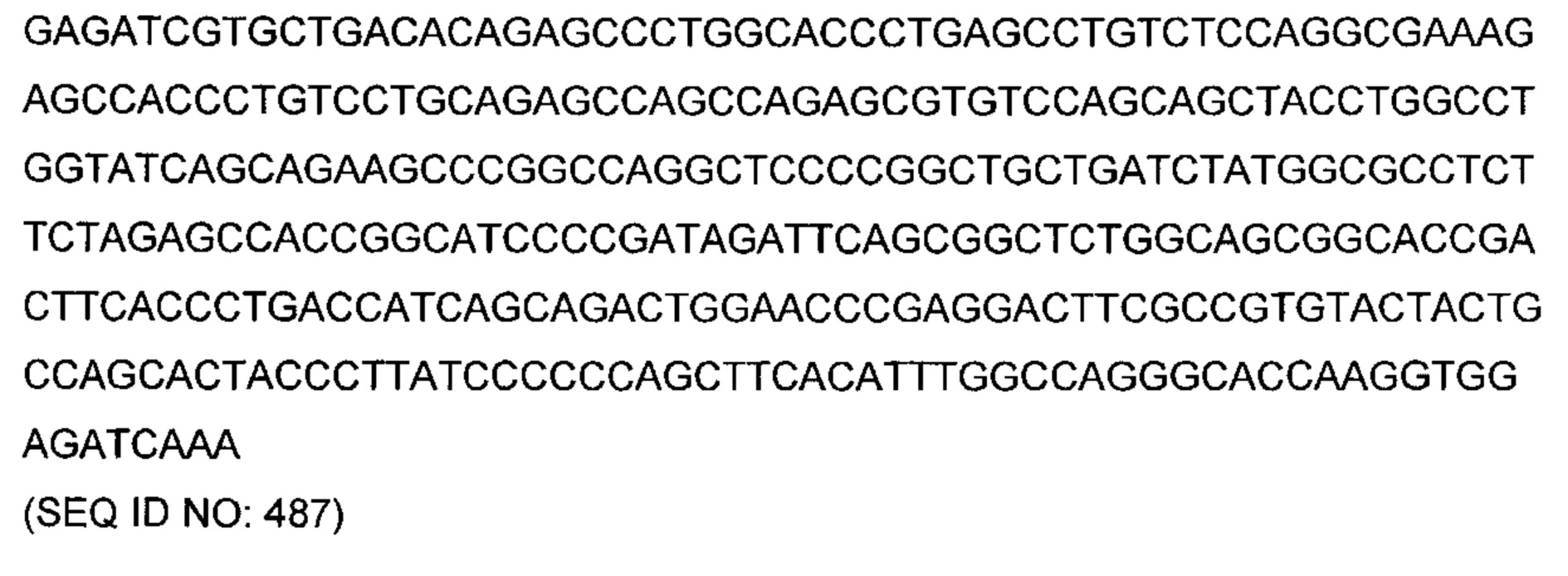
В других воплощениях композиция содержит любой из полипептидов или оба полипептида, представленных в SEQ ID NO: 490 и SEQ ID NO: 489 ниже:
A02_Rd4_0.6nM_C01 вариабельная область тяжелой цепи
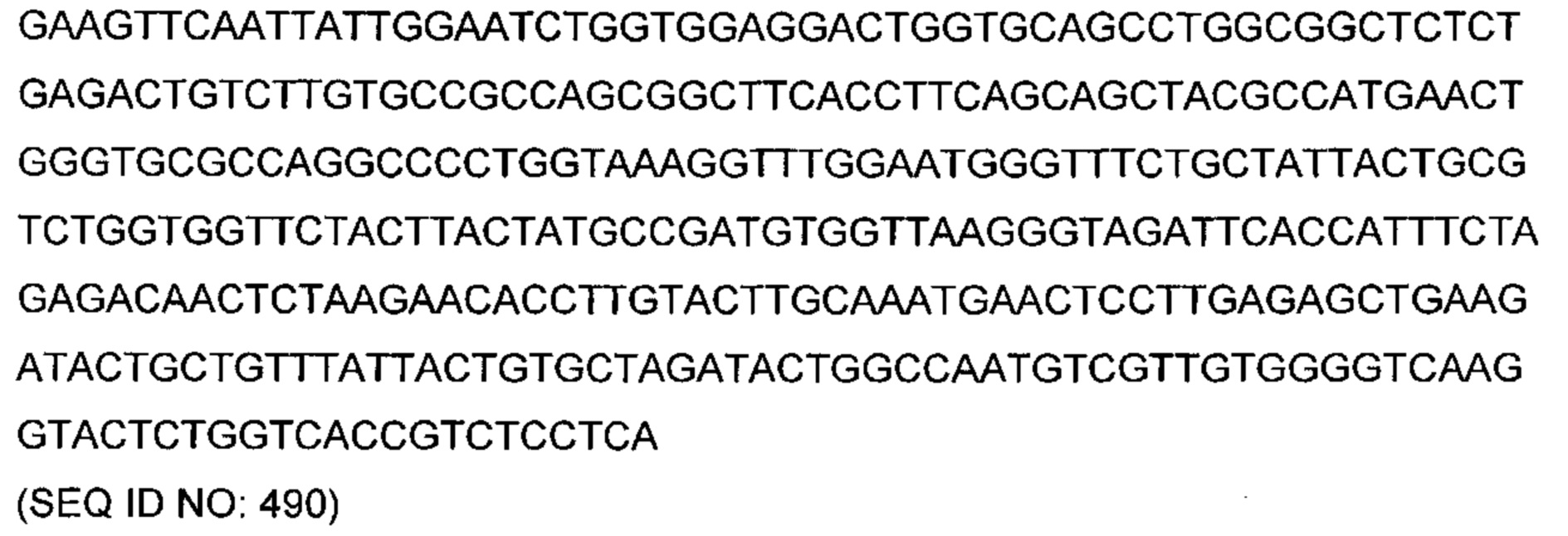
A02_Rd4_0.6nM_C01 вариабельная область легкой цепи
В других воплощениях композиция содержит любой из полипептидов или оба полинуклеотида, представленных в SEQ ID NO: 492 и SEQ ID NO: 491 ниже:
A02_Rd4_0.6nM_C16 вариабельная область тяжелой цепи

A02_Rd4_0.6nM_C16 вариабельная область легкой цепи

Кроме того, в данном документе описаны экспрессионные векторы и введение полинуклеотидных композиций.
В другом аспекте изобретения предложен способ получения любого из полинуклеотидов, описанных в данном документе.
Настоящее изобретение также охватывает полинуклеотиды, комплементарные любой такой последовательности. Полинуклеотиды могут быть одноцепочечными (кодирующими или антисмысловыми) или двухцепочечными и могут представлять собой молекулы ДНК (геномные, кДНК или синтетические) или молекулы РНК. Молекулы РНК включают молекулы гяРНК (гетерогенная ядерная РНК), которые содержат интроны и взаимнооднозначно соответствуют молекуле ДНК, и молекулы мРНК, которые не содержат интронов. Дополнительные кодирующие или некодирующие последовательности могут, но не обязательно должны, присутствовать в полинуклеотиде по настоящему изобретению, и полинуклеотид может, но не обязательно должен, быть связан с другими молекулами и/или веществами подложки.
Полинуклеотиды могут содержать нативную последовательность (то есть эндогенную последовательность, которая кодирует антитело или его часть) или могут содержать вариант такой последовательности. Полинуклеотидные варианты содержат одну или более замен, добавлений, делеций и/или вставок, так что иммунореактивность кодируемого полипептида не уменьшена по сравнению с иммунореактивностью нативной молекулы. Влияние на иммунореактивность кодируемого полипептида, как правило, можно оценить, как описано в данном документе. Варианты предпочтительно демонстрируют по меньшей мере примерно 70%-ную идентичность, более предпочтительно по меньшей мере примерно 80% идентичность, еще более предпочтительно по меньшей мере примерно 90% идентичность и наиболее предпочтительно по меньшей мере примерно 95% идентичность с последовательностью полинуклеотида, которая кодирует нативное антитело или его часть.
Две полинуклеотидные или полипептидные последовательности называются "идентичными", если последовательность нуклеотидов или аминокислот в этих двух последовательностях является одинаковой при выравнивании с максимальным соответствием, как описано ниже. Сравнение двух последовательностей обычно выполняют путем сравнения этих последовательностей в окне сравнения для идентификации и сравнения локальных областей сходства последовательностей. "Окно сравнения", при использовании в данном документе, относится к сегменту из по меньшей мере примерно 20 смежных положений, обычно от 30 до примерно 75, или от 40 до примерно 50, в котором последовательность можно сравнить с эталонной последовательностью с таким же числом смежных положений после оптимального выравнивания этих двух последовательностей.
Оптимальное выравнивание последовательностей для сравнения может быть проведено с использованием программы Megalign в пакете программ для биоинформатики Lasergene (DNASTAR, Inc., Madison, WI) с использованием параметров по умолчанию. В этой программе реализованы несколько схем выравнивания, описанных в следующих ссылках: Dayhoff, М.О., 1978, A model of evolutionary change in proteins - Matrices for detecting distant relationships. In Dayhoff, M.O. (ed.) Atlas of Protein Sequence and Structure, National Biomedical Research Foundation, Washington DC Vol. 5, Suppl. 3, pp. 345-358; Hein J., 1990, Unified Approach to Alignment and Phylogenes pp. 626-645 Methods in Enzymology vol. 183, Academic Press, Inc., San Diego, CA; Higgins, D.G. and Sharp, P.M., 1989, CABIOS 5:151-153; Myers, E.W. and Muller W., 1988, CABIOS 4:11-17; Robinson, E.D., 1971, Comb. Theor. 11:105; Santou, N., Nes, M., 1987, Mol. Biol. Evol. 4:406-425; Sneath, P.H.A. and Sokal, R.R., 1973, Numerical Taxonomy the Principles and Practice of Numerical Taxonomy, Freeman Press, San Francisco, CA; Wilbur, W.J. and Lipman, D.J., 1983, Proc. Natl. Acad. Sci. USA 80:726-730.
Предпочтительно, "процент идентичности последовательности" определяют путем сравнения двух оптимально выровненных последовательностей в окне сравнения из по меньшей мере 20 положений, где часть полинуклеотидной или полипептидной последовательности в окне сравнения может содержать дополнения или делеции (то есть гэпы), составляющие 20 процентов или менее, обычно от 5 до 15 процентов или от 10 до 12 процентов по сравнению с эталонными последовательностями (которые не содержат дополнений или делеций) для оптимального выравнивания двух последовательностей. Процент рассчитывают путем определения числа положений с идентичными нуклеиновокислотными основаниями или аминокислотными остатками в обеих последовательностях для получения числа совпадающих положений, деления числа совпадающих положений на общее число положений в эталонной последовательности (то есть размер окна) и умножения результатов на 100 для получения процента идентичности последовательностей.
Варианты могут быть также, или альтернативно, по существу гомологичны природному гену или его части, или набору генов. Такие полинуклеотидные варианты способны гибридизоваться в умеренно жестких условиях с природной последовательностью ДНК, кодирующей нативное антитело (или с комплементарной последовательностью).
Подходящие "умеренно жесткие условия" включают предварительное промывание в растворе 5×SSC (хлорид натрия/цитрат натрия), 0,5% SDS (додецилсульфат натрия), 1,0 мМ EDTA (рН 8,0); гибридизацию при 50°С-65°С, 5×SSC, в течение ночи; с последующим двухкратным промыванием при 65°С в течение 20 минут каждым из 2×, 0,5× и 0,2× SSC, содержащим 0,1% SDS.
При использовании в данном документе "очень жесткие условия" или "условия высокой жесткости" представляют условия, в которых: (1) используют низкую ионную силу и высокую температуру для промывки, например 0,015 М хлорид натрия/0,0015 М цитрат натрия/0,1% додецилсульфат натрия при 50°С; (2) во время гибридизации используют денатурирующий агент, такой как формамид, например 50% (об./об.) формамид со смесью 0,1% бычьего сывороточного альбумина/0,1% Фиколла/0,1% поливинилпирролидона/50 мМ натрий-фосфатного буфера при рН 6,5 с 750 мМ хлорида натрия, 75 мМ цитрата натрия при 42°С; или (3) используют 50% формамид, 5×SSC (0,75 М NaCl, 0,075 М цитрат натрия), 50 мМ фосфат натрия (рН 6,8), 0,1% пирофосфат натрия, 5× раствор Денхардта, ДНК спермы лосося, обработанную ультразвуком (50 мкг/мл), 0,1% SDS и 10% декстрансульфат при 42°С, с промывками при 42°С в 0,2×SSC (хлорид натрия/цитрат натрия) и 50% формамиде при 55°С, с последующей тщательной промывкой, состоящей из 0,1×SSC, содержащего EDTA при 55°C. Специалист в данной области может определить, как скорректировать температуру, ионную силу и т.д. необходимым образом, чтобы привести их в соответствие таким факторам как длина зонда и тому подобное.
Специалистам в данной области техники понятно, что в результате вырожденности генетического кода существует много нуклеотидных последовательностей, которые кодируют полипептид, описанный в данном документе. Некоторые из этих полинуклеотидов имеют минимальную гомологию с нуклеотидной последовательностью любого нативного гена. Тем не менее, полинуклеотиды, которые отличаются из-за различий в использовании кодонов, конкретным образом предполагаются в настоящем изобретении. Кроме того, аллели генов, содержащих полинуклеотидные последовательности, представленные в данном документе, входят в объем настоящего изобретения. Аллели представляют собой эндогенные гены, которые изменены в результате одной или более мутаций, таких как делеции, добавления и/или замены нуклеотидов. Полученная в результате мРНК и белок могут, но не обязательно должны, иметь измененную структуру или функцию. Аллели могут быть идентифицированы с использованием стандартных методик (таких как гибридизация, амплификация и/или сравнение базы данных последовательностей).
Полинуклеотиды по настоящему изобретению могут быть получены с использованием химического синтеза, рекомбинантных методов или ПЦР. Способы химического синтеза полинуклеотидов хорошо известны в данной области и не нуждаются в подробном описании здесь. Специалист в данной области техники может использовать предложенные здесь последовательности и имеющийся в продаже синтезатор ДНК для получения нужной последовательности ДНК.
Для получения полинуклеотидов с использованием рекомбинантных методов, полинуклеотид, содержащий нужную последовательность, может быть встроен в подходящий вектор, и этот вектор, в свою очередь, может быть введен в подходящую клетку-хозяин для репликации и амплификации, как далее обсуждается здесь. Полинуклеотиды могут быть введены в клетки-хозяева любыми известными в данной области способами. Клетки трансформируют путем введения экзогенного полинуклеотида посредством прямого поглощения, эндоцитоза, трансфекции, F-спаривания или электропорации. После введения экзогенный полинуклеотид можно поддерживать в клетке как неинтегрированный вектор (такой как плазмида) или интегрированным в геном клетки-хозяина. Таким образом амплифицированный полинуклеотид может быть выделен из клетки-хозяина хорошо известными в данной области способами. См., например, Sambrook et al., 1989.
Альтернативно, ПЦР позволяет воспроизводить последовательности ДНК. ПЦР-технология хорошо известна в данной области и описана в патентах US 4683195, 4800159, 4754065 и 4683202, а также в PCR: The Polymerase Chain Reaction, Mullis et al. eds., Birkauswer Press, Boston, 1994.
РНК может быть получена путем использования выделенной ДНК в подходящем векторе и введения ее в подходящую клетку-хозяина. Когда клетка реплицируется и ДНК транскрибируется в РНК, РНК затем может быть выделена с использованием способов, хорошо известных специалистам в данной области, как указано, например, в Sambrook et al., 1989, выше.
Подходящие клонирующие векторы могут быть сконструированы в соответствии со стандартными методами или могут быть выбраны из большого количества клонирующих векторов, доступных в данной области. Хотя выбранный клонирующий вектор может отличаться в зависимости от клетки-хозяина, предназначенной для использования, пригодные клонирующие векторы, как правило, будут обладать способностью к саморепликации, могут иметь одну мишень для конкретной рестрикционной эндонуклеазы и/или могут нести маркерные гены, которые можно использовать при отборе клонов, содержащих вектор. Подходящие примеры включают плазмиды и бактериальные вирусы, например pUC18, pUC19, Bluescript (например pBS SK+) и его производные, mp18, mp19, pBR322, рМВ9, ColE1, pCR1, RP4, фаговые ДНК и челночные векторы, такие как pSA3 и рАТ28. Эти и многие другие клонирующие векторы доступны у коммерческих поставщиков, таких как BioRad, Strategene и Invitrogen.
Экспрессионные векторы обычно являются реплицируемыми полинуклеотидными конструкциями, которые содержат полинуклеотид по изобретению. Подразумевается, что экспрессионный вектор должен реплицироваться в клетках-хозяевах либо в виде эписом, либо как неотъемлемая часть хромосомной ДНК. Подходящие экспрессионные векторы включают, без ограничения ими, плазмиды, вирусные векторы, в том числе аденовирусы, адено-ассоциированные вирусы, ретровирусы, космиды и экспрессирующий(е) вектор(ы), раскрытый(е) в публикации РСТ WO 87/04462. Компоненты вектора, как правило, могут включать, без ограничения ими, один или более из следующих элементов: сигнальную последовательность; точку начала репликации; один или более маркерных гена; подходящие контролирующие транскрипцию элементы (такие как промоторы, энхансеры и терминаторы). Для экспрессии (то есть трансляции) обычно также требуются один или более контролирующих трансляцию элементов, таких как сайты связывания рибосом, сайты инициации трансляции и стоп-кодоны.
Векторы, содержащие интересующие полинуклеотиды, могут быть введены в клетку-хозяина любым из ряда подходящих способов, включающих электропорацию, трансфекцию с использованием хлорида кальция, хлорида рубидия, фосфата кальция, DEAE-декстрана или других веществ; баллистическую трансфекцию; липофекцию; и инфицирование (например, когда вектор представляет собой инфекционный агент, такой как вирус коровьей оспы). Выбор вводимых векторов или полинуклеотидов часто зависит от особенностей клетки-хозяина.
В изобретении также предложены клетки-хозяева, содержащие любой из полинуклеотидов, описанных в данном документе. Любые клетки-хозяева, способные сверхэкспрессировать гетерологичные ДНК, могут быть использованы для выделения генов, кодирующих интересующие антитело, полипептид или белок. Неограничивающие примеры клеток-хозяев млекопитающих включают, без ограничения ими, клетки COS, HeLa и СНО. См. также публикацию РСТ WO 87/04462. Подходящие клетки-хозяева, не являющиеся клетками млекопитающих, включают прокариотов (таких как Е. coli или В. subtillis) и дрожжи (такие как S. cerevisae, S. pombe; или K. lactis). Предпочтительно, клетки-хозяева экспрессируют кДНК на уровне примерно в 5 раз выше, более предпочтительно в 10 раз выше, еще более предпочтительно в 20 раз выше, чем уровень соответствующего эндогенного антитела или белка, представляющего интерес, если они присутствуют, в клетках-хозяевах. Скрининг клеток-хозяев на специфическое связывание с ВСМА или доменом ВСМА (например доменами 1-4) осуществляют посредством иммуноанализа или FACS (сортировка флуоресцентно-активированных клеток). Можно идентифицировать клетку, сверхэкспрессирующую интересующее антитело или белок.
Репрезентативные материалы настоящего изобретения были депонированы в Американской коллекции типовых культур (АТСС) 15 Апреля 2015 года. Вектор с регистрационным номером АТСС РТА-122094 представляет собой полинуклеотид, кодирующий вариабельную область тяжелой цепи гуманизированного ВСМА-антитела, а вектор с регистрационным номером АТСС РТА-122093 представляет собой полинуклеотид, кодирующий вариабельную область легкой цепи гуманизированного ВСМА-антитела. Депозиты были сделаны в соответствии с положениями Будапештского договора о международном признании депонирования микроорганизмов для целей патентной процедуры и директивами согласно этому договору (Будапештский договор). Это гарантирует поддержание жизнеспособной депонированной культуры в течение 30 лет с даты депонирования. Депозит будет предоставлен АТСС в соответствии с положениями Будапештского договора и по согласованию между Pfizer, Inc. и АТСС, что гарантирует постоянную и неограниченную доступность потомства этой депонированной культуры для общественности после выдачи соответствующего патента США или после опубликования в открытом доступе любой американской или иностранной патентной заявки, в зависимости от того, что произойдет раньше, и гарантирует доступность потомства тому, кто определен уполномоченным по патентам и товарным знакам США как имеющий право на это согласно 35 U.S.С. Раздел 122 и правилам уполномоченного в связи с этим (включая 37 C.F.R. Раздел 1.14 с особым акцентом на 886 OG 638).
Патентообладатель настоящей заявки согласен с тем, что в случае гибели, потери или уничтожения при культивировании в подходящих условиях культуры депонированных материалов, эти материалы будут немедленно заменены по уведомлению другого об этом. Доступность депонированного материала не следует истолковывать как лицензию на практическое осуществление изобретения в нарушение прав, предоставляемых в соответствии с законодательством любого государства в соответствии с его патентным законодательством.
Конъюгаты ВСМА-антитела
В настоящем изобретении также предложен конъюгат (или иммуноконъюгат) ВСМА-антитела, как описано в данном документе, или его антигенсвязывающий фрагмент, где антитело или антигенсвязывающий фрагмент конъюгирован с агентом (например цитотоксическим агентом) для направленной иммунотерапии (например конъюгаты антитело-лекарственное средство) непосредственно или опосредованно через линкер. Например, цитотоксический агент может быть связан или конъюгирован с ВСМА-антителом или его антигенсвязывающим фрагментом, как описано в данном документе, для направленной локальной доставки группировки цитотоксического агента в опухоли (например ВСМА-экспрессирующую опухоль).
Способы конъюгирования цитотоксического агента или других терапевтических агентов с антителами описаны в различных публикациях. Например, химическая модификация может быть осуществлена в антителах либо через амины боковой цепи лизина, либо через сульфидрильные группы цистеина, активированные путем восстановления межцепочечных дисульфидных связей, для того чтобы произошла реакция конъюгации. См., например, Tanaka et al., FEBS Letters 579:2092-2096, 2005, и Gentle et al., Bioconjugate Chem. 15:658-663, 2004. Также были описаны реакционноспособные остатки цистеина, сконструированные в конкретных местах антител для конкретного конъюгирования с лекарственным средством, с определенной стехиометрией. См., например, Junutula et al., Nature Biotechnology, 26:925-932, 2008. Конъюгирование с использованием ацил-донорного глутамин-содержащего тега или эндогенного глутамина, сделанного реакционноспособным (то есть способным образовывать ковалентную связь в качестве ацильного донора) с помощью полипептида, сконструированного в присутствии трансглутаминазы и амина (например цитотоксического агента, содержащего реакционноспособный амин или присоединенного к нему) также описано в международных заявках WO 2012/059882 и WO 2015015448.
В некоторых воплощениях ВСМА-антитело или конъюгат, как описано в данном документе, содержит ацил-донорный глутамин-содержащий тег, сконструированный на определенном сайте антитела (например карбоксильном конце, аминоконце или на другом сайте ВСМА-антитела). В некоторых воплощениях тег содержит аминокислоту глутамин (Q) или аминокислотную последовательность LQG, LLQGG (SEQ ID NO: 318), LLQG (SEQ ID NO: 454), LSLSQG (SEQ ID NO: 455), GGGLLQGG (SEQ ID NO: 456), GLLQG (SEQ ID NO: 457), LLQ, GSPLAQSHGG (SEQ ID NO: 458), GLLQGGG (SEQ ID NO: 459), GLLQGG (SEQ ID NO: 460), GLLQ (SEQ ID NO: 461), LLQLLQGA (SEQ ID NO: 462), LLQGA (SEQ ID NO: 463), LLQYQGA (SEQ ID NO: 464), LLQGSG (SEQ ID NO: 465), LLQYQG (SEQ ID NO: 466), LLQLLQG (SEQ ID NO: 467), SLLQG (SEQ ID NO: 468), LLQLQ (SEQ ID NO: 469), LLQLLQ (SEQ ID NO: 470), LLQGR (SEQ ID NO: 471), LLQGPP (SEQ ID NO: 472), LLQGPA (SEQ ID NO: 473), GGLLQGPP (SEQ ID NO: 474), GGLLQGA (SEQ ID NO: 475), LLQGPGK (SEQ ID NO: 476), LLQGPG (SEQ ID NO: 477), LLQGP (SEQ ID NO: 478), LLQP (SEQ ID NO: 479), LLQPGK (SEQ ID NO: 480), LLQAPGK (SEQ ID NO: 481), LLQGAPG (SEQ ID NO: 482), LLQGAP (SEQ ID NO: 483) и LLQLQG (SEQ ID NO: 484).
В некоторых воплощениях ВСМА-антитело или конъюгат, как описано в данном документе, содержит ацил-донорный глутамин-содержащий тег, сконструированный на определенном сайте антитела, где тег содержит аминокислотную последовательность GGLLQGPP (SEQ ID NO: 474) или GGLLQGA (SEQ ID NO: 475), сконструированную на карбоксильном конце легкой цепи ВСМА-антитела. В некоторых воплощениях ВСМА-антитело или конъюгат, как описано в данном документе, содержит ацил-донорный глутамин-содержащий тег, сконструированный на определенном сайте антитела, где тег содержит аминокислотную последовательность LLQG (SEQ ID NO: 454), сконструированную после остатка Т135 в тяжелой цепи ВСМА-антитела. В других воплощениях ВСМА-антитело или конъюгат, как описано в данном документе, содержит ацил-донорный глутамин-содержащий тег, сконструированный на определенном сайте антитела, где тег содержит аминокислотную последовательность LLQGA (SEQ ID NO: 463) или LLQGPP (SEQ ID NO: 472), сконструированную на карбоксильном конце тяжелой цепи ВСМА-антитела, и где удален лизиновый остаток на карбоксильном конце тяжелой цепи. В некоторых воплощениях ВСМА-антитело или конъюгат, как описано в данном документе, содержит аминокислотную замену в положении 297 ВСМА-антитела (схема нумерации ЕС). Например, аминокислота аспарагин (N) может быть заменена глутамином (Q) или аланином (А) в положении 297 ВСМА-антитела.
Также предложено выделенное антитело, содержащее ацил-донорный глутамин-содержащий тег и аминокислотную модификацию в положении 222, 340 или 370 антитела (схема нумерации ЕС), где модификация представляет собой аминокислотную делецию, вставку, замену, мутацию или любую их комбинацию. Соответственно, в некоторых воплощениях предложено ВСМА-антитело или конъюгат, как описано в данном документе, содержащее ацил-донорный глутамин-содержащий тег (например Q, LQG, LLQGG (SEQ ID NO: 318), LLQG (SEQ ID NO: 454), LSLSQG (SEQ ID NO: 455), GGGLLQGG (SEQ ID NO: 456), GLLQG (SEQ ID NO: 457), LLQ, GSPLAQSHGG (SEQ ID NO: 458), GLLQGGG (SEQ ID NO: 459), GLLQGG (SEQ ID NO: 460), GLLQ (SEQ ID NO: 461), LLQLLQGA (SEQ ID NO: 462), LLQGA (SEQ ID NO: 463), LLQYQGA (SEQ ID NO: 464), LLQGSG (SEQ ID NO: 465), LLQYQG (SEQ ID NO: 466), LLQLLQG (SEQ ID NO: 467), SLLQG (SEQ ID NO: 468), LLQLQ (SEQ ID NO: 469), LLQLLQ (SEQ ID NO: 470), LLQGR (SEQ ID NO: 471), LLQGPP (SEQ ID NO: 472), LLQGPA (SEQ ID NO: 473), GGLLQGPP (SEQ ID NO: 474), GGLLQGA (SEQ ID NO: 475), LLQGPGK (SEQ ID NO: 476), LLQGPG (SEQ ID NO: 477), LLQGP (SEQ ID NO: 478), LLQP (SEQ ID NO: 479), LLQPGK (SEQ ID NO: 480), LLQAPGK (SEQ ID NO: 481), LLQGAPG (SEQ ID NO: 482), LLQGAP (SEQ ID NO: 483) и LLQLQG (SEQ ID NO: 484)), конъюгированный на определенном сайте (например на карбоксильном конце тяжелой или легкой цепи, остатке Т135 в тяжелой цепи антитела или на другом сайте) ВСМА-антитела, и аминокислотную модификацию в положении 222, 340 или 370 антитела (схема нумерации ЕС). В некоторых воплощениях аминокислотная модификация представляет собой замену лизина на аргинин (например K222R, K340R или K370R).
В некоторых воплощениях ВСМА-антитело или конъюгат, как описано в данном документе, содержит ацил-донорный глутамин-содержащий тег, содержащий последовательность GGLLQGPP (SEQ ID NO: 474), сконструированную на С-конце легкой цепи ВСМА-антитела, и аминокислотную замену лизина на аргинин в положении 222 антитела (схема нумерации ЕС). В некоторых воплощениях ВСМА-антитело или конъюгат, как описано в данном документе, содержит ацил-донорный глутамин-содержащий тег, содержащую последовательность GGLLQGA (SEQ ID NO: 475), помещенную на С-конце легкой цепи ВСМА-антитела и аминокислотную замену лизина на аргинин в положении 222 антитела (схема нумерации ЕС). В некоторых воплощениях ВСМА-антитело или конъюгат, как описано в данном документе, содержит ацил-донорный глутамин-содержащий тег, содержащий последовательность LLQGA (SEQ ID NO: 463), сконструированную на С-конце тяжелой цепи ВСМА-антитела, и аминокислотную замену лизина на аргинин в положении 222 антитела (схема нумерации ЕС), где удален остаток лизина на карбоксильном конце тяжелой цепи. В некоторых воплощениях ВСМА-антитело или конъюгат, как описано в данном документе, содержит ацил-донорный глутамин-содержащий тег, содержащий последовательность LLQG (SEQ ID NO: 454), сконструированную после остатка Т135 в тяжелой цепи ВСМА-антитела, и аминокислотную замену лизина на аргинин в положении 222 антитела (схема нумерации ЕС).
В некоторых воплощениях ВСМА-антитело или конъюгат, как описано в данном документе, содержит ацил-донорный глутамин-содержащий тег, содержащий глутамин, сконструированный в положении 297, или аминокислотную замену в положении 297 аспарагина (N) на другую аминокислоту в ВСМА-антителе и аминокислотную замену лизина на аргинин в положении 222 антитела (схема нумерации ЕС). Например, в некоторых воплощениях, ВСМА-антитело или конъюгат, как описано в данном документе, содержит ацил-донорный глутамин-содержащий тег, содержащий последовательность GGLLQGPP (SEQ ID NO: 474), сконструированную на С-конце легкой цепи ВСМА-антитела, аминокислотную замену аспарагина (N) на глутамин (Q) в положении 297 ВСМА-антитела и аминокислотную замену лизина на аргинин в положении 222 антитела (схема нумерации ЕС). В некоторых воплощениях ВСМА-антитело или конъюгат, как описано в данном документе, содержит ацил-донорный глутамин-содержащий тег, содержащий последовательность LLQG (SEQ ID NO: 454), сконструированную после остатка Т135 в тяжелой цепи ВСМА-антитела, аминокислотную замену аспарагина (N) на аланин (А) в положении 297 ВСМА-антитела и аминокислотную замену лизина на аргинин в положении 222 антитела (схема нумерации ЕС).
Агенты, которые можно конъюгировать с ВСМА-антителами или антигенсвязывающими фрагментами по настоящему изобретению, включают, без ограничения ими, цитотоксические агенты, иммуномодулирующие агенты, агенты визуализации, терапевтические белки, биополимеры или олигонуклеотиды.
Примеры цитотоксических агентов включают, без ограничения ими, антрациклин, ауристатин, доластатин, комбретастатин, дуокармицин, пирролбензодиазепиновый димер, индолино-бензодиазепиновый димер, энедиин, гелданамицин, майтанзин, пуромицин, таксан, алкалоид барвинка, камптотецин, тубулизин, гемиастерлин, сплайсостатин, пладиенолид и стереоизомеры, изостеры, аналоги или их производные.
Антрациклины получают из бактерий Streptomyces и используют для лечения широкого спектра раковых заболеваний, таких как лейкозы, лимфомы, рак молочной железы, матки, яичников и легкого. Типичные антрациклины включают, без ограничения ими, даунорубицин, доксорубицин (то есть адриамицин), эпирубицин, идарубицин, валрубицин и митоксантрон.
Доластатины и их пептидные аналоги и производные, ауристатины, представляют собой высокоэффективные антимитотические средства, которые, как было показано, обладают противоопухолевой и противогрибковой активностью. См., например, патент US 5663149 и Pettit et al., Antimicrob. Agents Chemother. 42:2961-2965, 1998. Типичные доластатины и ауристатины включают, без ограничения ими, доластатин 10, ауристатин Е, ауристатин ЕВ (АЕВ), ауристатин EFP (AEFP), MMAD (Монометил-ауристатин D или монометил-доластатин 10), MMAF (Монометил-ауристатин F или N-метилвалин-валин-долаизолейин-долапроин-фенилаланин), ММАЕ (Монометил-ауристатин Е или N-метилвалин-валин-долеизолейин-долапроин-норэфедрин), 5-бензоил-валериановая кислота-АЕ эфир (AEVB) и другие новые ауристатины (такие как ауристатины, описанные в публикации US 2013/0129753). В некоторых воплощениях ауристатин представляет собой 0101 (2-метилаланил-N-[(3R,4S,5S)-3-метокси-1-{(2S)-2-[(1R,2R)-1-метокси-2-метил-3-оксо-3-{[(1S)-2-фенил-1-(1,3-тиазол-2-ил)этил]амино}пропил]пирролидин-1-ил}-5-метил-1-оксогептан-4-ил]-N-метил-L-валинамид), имеющий следующую структуру:
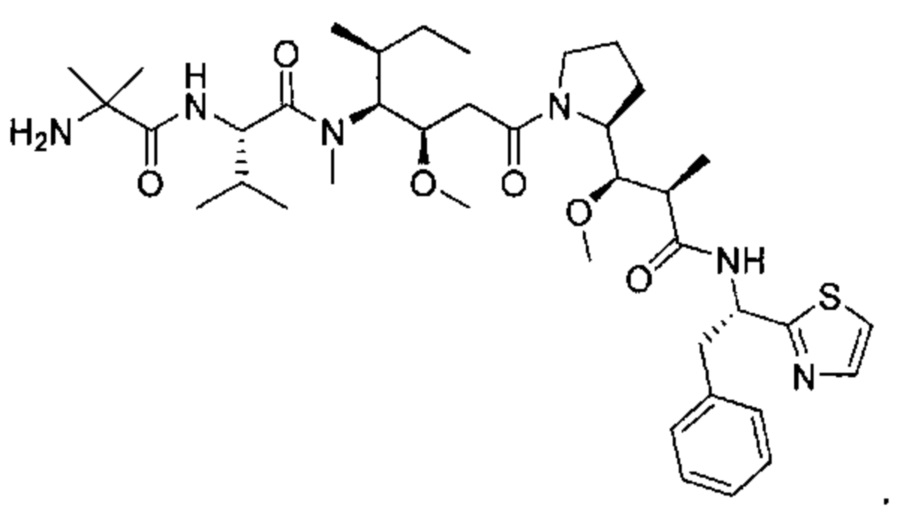
В некоторых воплощениях ауристатин представляет собой 3377 (N,2-диметилаланил-N-{(1S,2R)-4-{(2S)-2-[(1R,2R)-3-{[(1S)-1-карбоксил-2-фенилэтил]амино}-1-метокси-2-метил-3-оксопропил]пирролидин-1-ил}-2-метокси-1-[(1S)-1-метилпропил]-4-оксобутил}-N-метил-L-валинамид), имеющий следующую структуру:
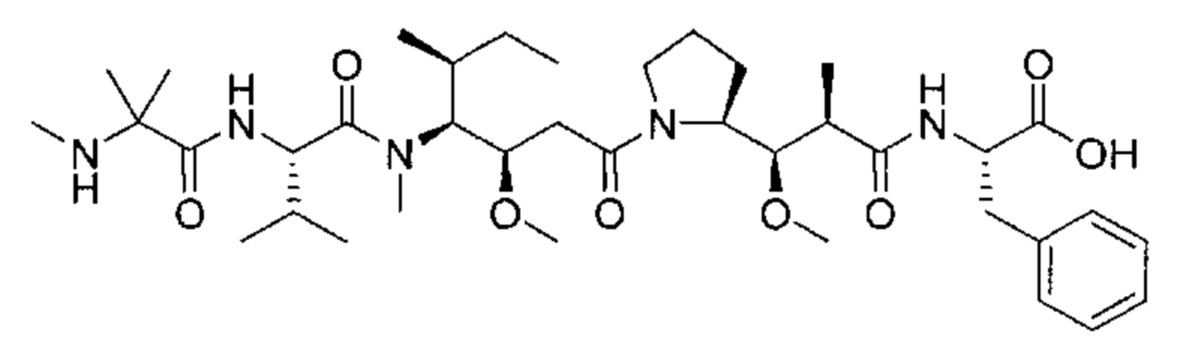
В некоторых воплощениях ауристатин представляет собой 0131-ОМе (N,2-димeтилaлaнил-N-[(3R,4S,5S)-3-мeтoкcи-1-{(2S)-2-[(1R,2R)-1-мeтoкcи-3-{[(2S)-1-метокси-1-оксо-3-фенилпропан-2-ил]амино}-2-метил-3-оксопропил]пирролидин-1-ил}-5-метил-1-оксогептан-4-ил]-N-метил-L-валинамид), имеющий следующую структуру:
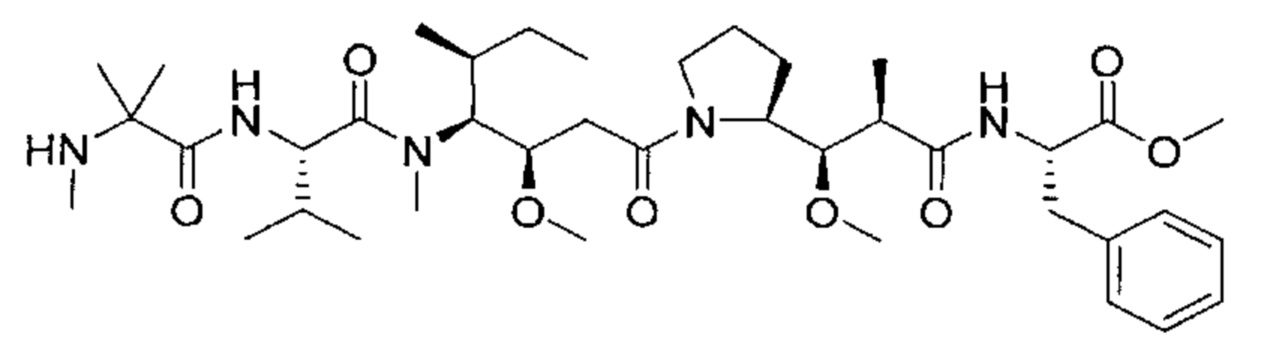
В других воплощениях ауристатин представляет собой 0131 (2-метил-L-пpoлил-N-[(3R,4S,5S)-1-{(2S)-2-[(1R,2R)-3-{[(1S)-1-кapбoкcи-2-фенилэтил]амино}-1-метокси-2-метил-3-оксопропил]пирролидин-1-ил}-3-метокси-5-метил-1-оксогептан-4-ил]-N-метил-1-валинамид), имеющий следующую структуру:
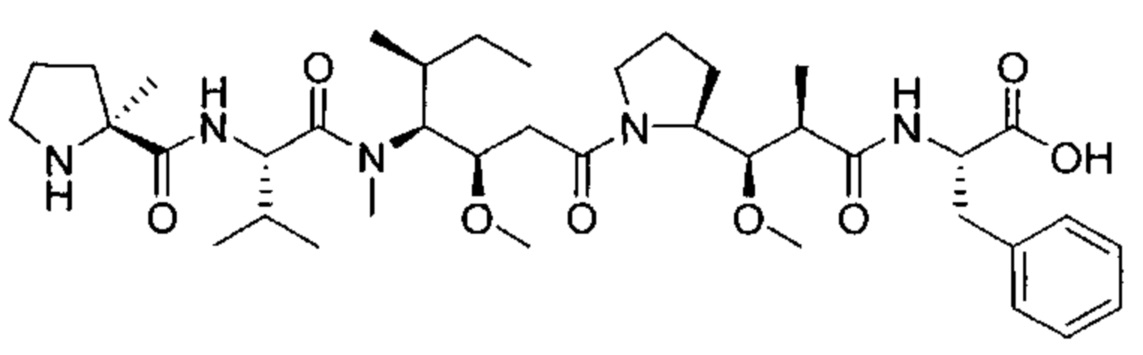
В других воплощениях ауристатин представляет собой 0121 (2-метил-L-пролил-N-[(3R,4S,5S)-1-{(2S)-2-[(1R,2R)-3-{[(2S)-1-метокси-1-оксо-3-фенилпропан-2-ил]амино}-1-метокси-2-метил-3-оксопропил]пирролидин-1-ил}-3-метокси-5-метил-1-оксогептан-4-ил]-N-метил-1-валинамид), имеющий следующую структуру:
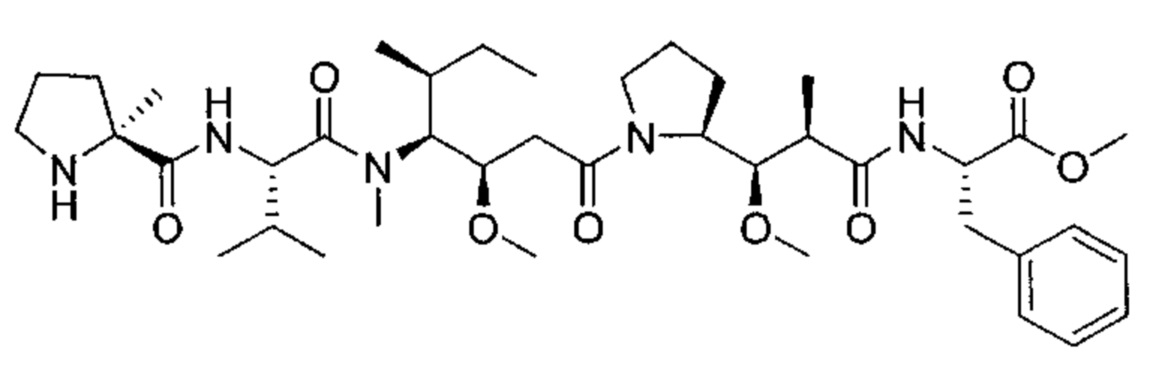
Камптотецин представляет собой цитотоксический хинолиновый алкалоид, который ингибирует фермент топоизомеразу I. Примеры камптотецина и его производных включают, без ограничения ими, топотекан и иринотекан и их метаболиты, такие как SN-38.
Комбретастатины представляют собой природные фенолы, обладающие свойствами разрушения сосудов в опухолях. Типичные комбретастатины и их производные включают, без ограничения ими, комбретастатин А-4 (СА-4) и омбрабулин.
Дуокармицин и СС-1065 представляют собой ДНК-алкилирующие агенты с цитотоксической активностью. См. Boger and Johnson, PNAS 92:3642-3649 (1995). Типичные дуокармицин и СС-1065 включают, без ограничения ими, (+)-дуокармицин А и (+)-дуокармицин SA, (+)-СС-1065 и соединения, раскрытые в международной заявке PCT/IB 2015/050280, включающие, без ограничения ими, N~2~-ацетил-L-лизил-L-валил-N~5~-карбамоил-N-[4-({[(2-{[({(1S)-1-(хлорметил)-3-[(5-{[(1S)-1-(хлорметил)-5-(фосфоноокси)-1,2-дигидро-3Н-бензо[е]индол-3-ил]карбонил}тиофен-2-ил)карбонил]-2,3-дигидро-1Н-бензо[е]индол-5-ил}окси)карбонил](метил)амино}этил)(метил)карбамоил]-окси}метил)фенил]-L-орнитинамид, имеющий структуру:
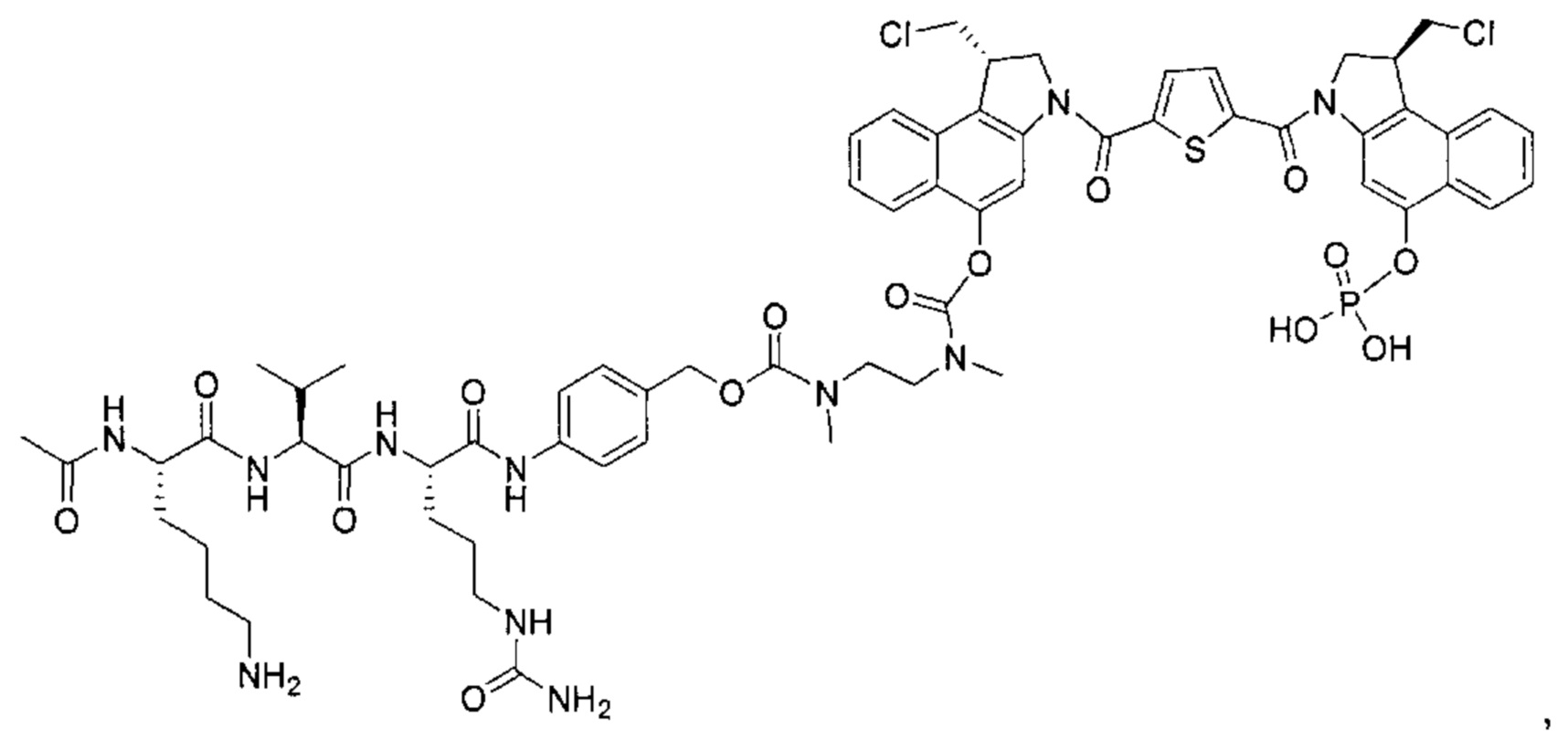
N~2~-ацетил-L-лизил-L-валил-N~5~-карбамоил-N-[4-({[(2-{[({(8S)-8-(хлорметил)-6-[(3-{[(1S)-1-(хлорметил)-8-метил-5-(фосфоноокси)-1,6-дигидропирроло[3,2-е]индол-3(2Н)-ил]карбонил}бицикло[1.1.1]пент-1-ил)карбонил]-1-метил-3,6,7,8-тетрагидропирроло[3,2-е]индол-4-ил}окси)карбонил](метил)амино}этил)(метил)карбамоил]окси}метил)фенил]-L-орнитинамид, имеющий структуру:
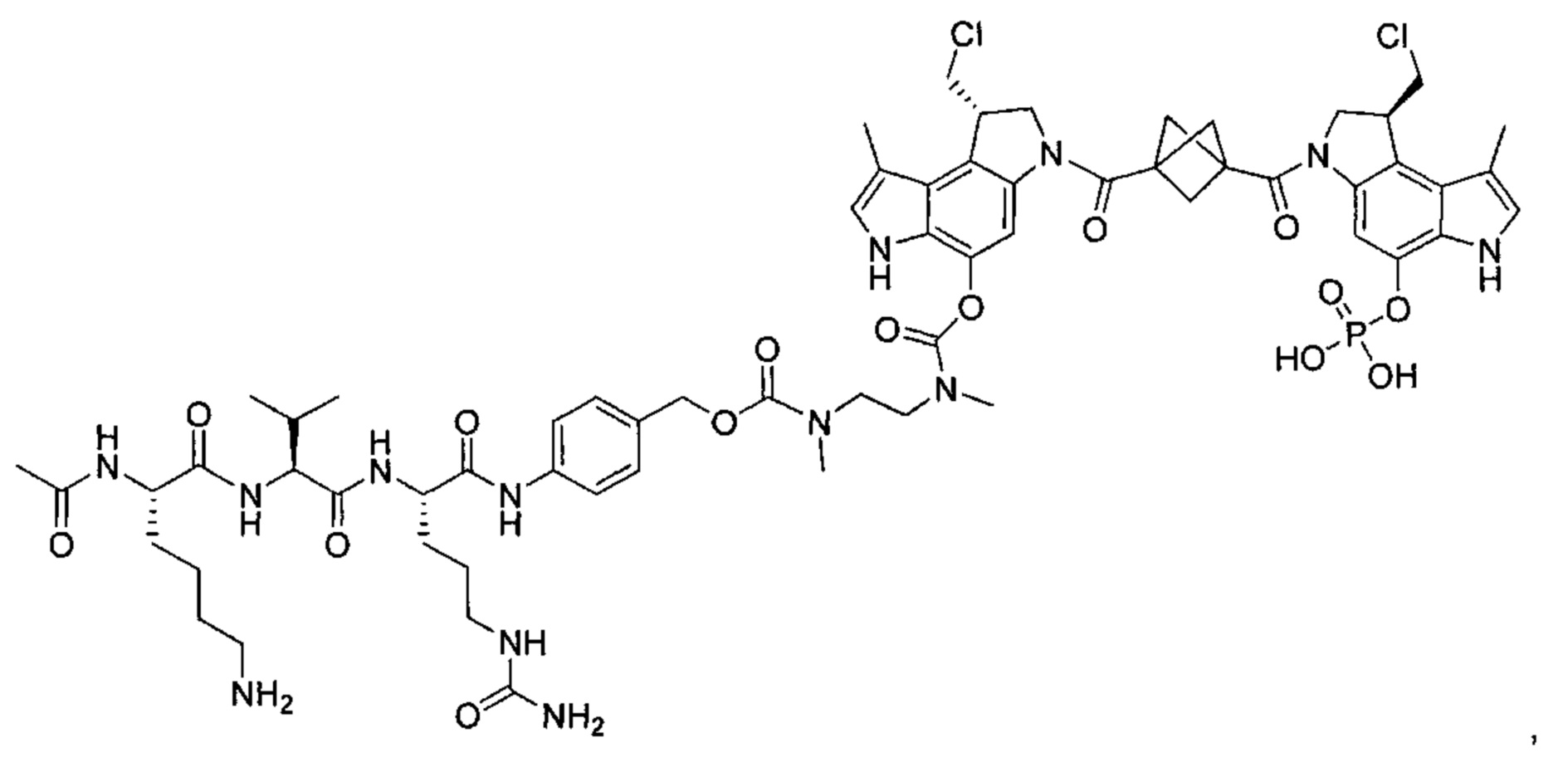
N~2~-ацетил-L-лизил-L-валил-N~5~-карбамоил-N-[4-({[(2-{[({(8S)-8-(хлорметил)-6-[(4-{[(1S)-1-(хлорметил)-8-метил-5-(фосфоноокси)-1,6-дигидропирроло[3,2-е]индол-3(2Н)-ил]карбонил}-пентацикло[4.2.0.0-2,5~.0~3,8~.0-4,7~]окт-1-ил)карбонил]-1-метил-3,6,7,8-тетрагидропирроло[3,2-е]индол-4-ил}окси)карбонил](метил)амино}этил)(метил)-карбамоил]окси}метил)фенил]-L-орнитинамид, имеющий структуру:
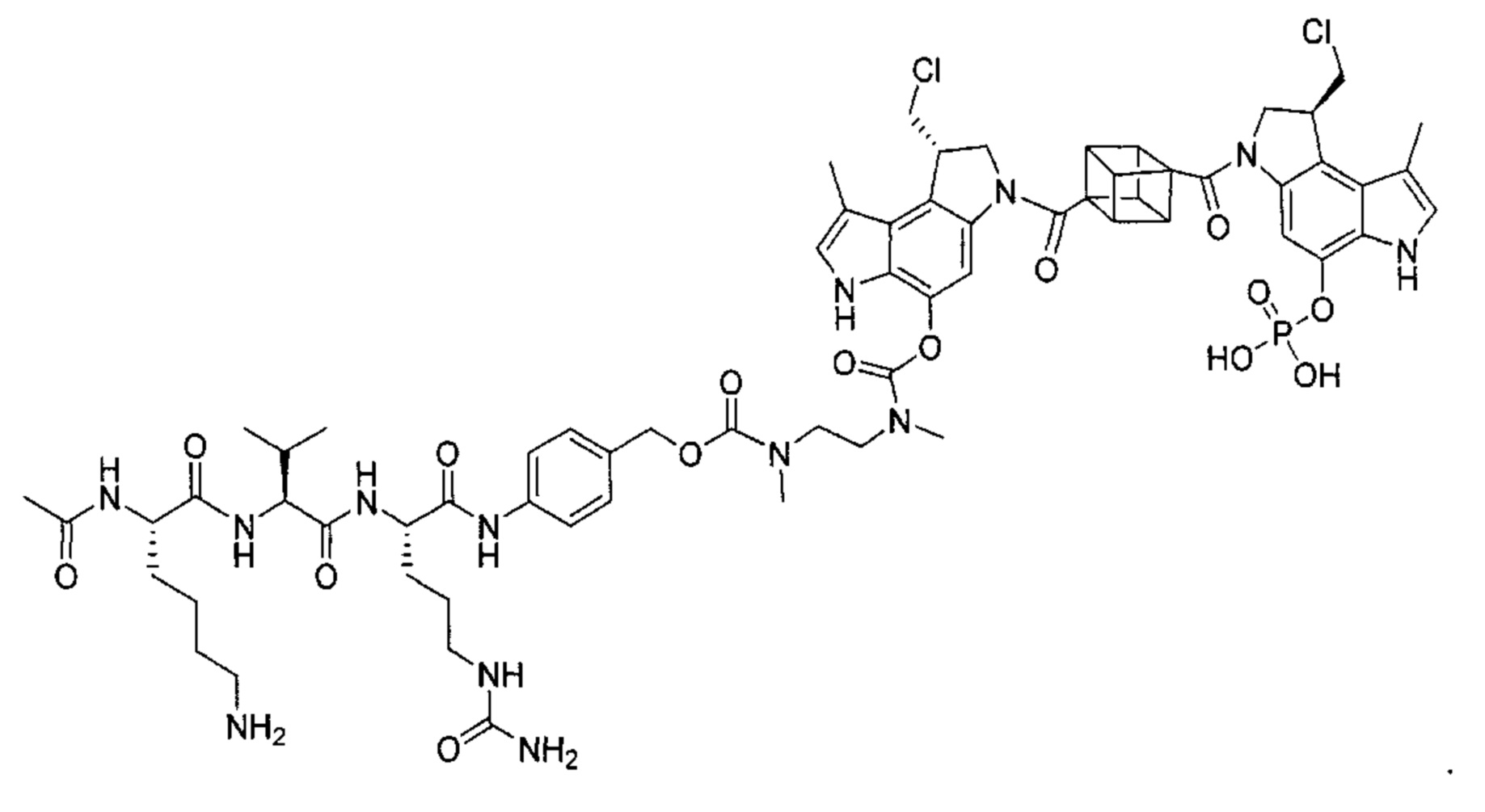
Энедиины представляют собой класс противоопухолевых бактериальных продуктов, характеризующихся либо девяти- или десятичленными кольцами, либо наличием циклической системы сопряженных тройных-двойных-тройных связей. Типичные энедиины включают, без ограничения ими, калихеамицин, эсперамицин, нециаламицин, динемицин и их производные.
Гелданамицины представляют собой бензохинон-ансамициновые антибиотики, которые связывается с Hsp90 (белком теплового шока 90) и используются как противоопухолевые лекарственные средства. Типичные гелданамицины включают, без ограничения ими, 17-AAG (17-N-Аллиламино-17-деметоксигелданамицин) и 17-DMAG (17-Диметиламиноэтиламино-17-деметоксигелданамицин).
Гемиастерлин и его аналоги (например HTI-286) связываются с тубулином, нарушают нормальную динамику микротрубочек и в стехиометрических количествах деполимеризуют микротрубочки.
Майтанзины или их производные майтанзиноиды ингибируют клеточную пролиферацию путем ингибирования образования микротрубочек во время митоза через ингибирование полимеризации тубулина. См. Remillard et al., Science 189:1002-1005, 1975. Типичные майтанзины и майтанзиноиды включают, без ограничения ими, мертанзин (DM1) и его производные, а также ансамитоцин.
Пирролбензодиазепиновые димеры (PBD) и индолино-бензодиазепиновые димеры (IGN) представляют собой противоопухолевые агенты, которые содержат одну или более иминные функциональные группы или их эквиваленты, которые связываются с дуплексной ДНК. Молекулы PBD и IGN основаны на натуральном продукте атрамицине и взаимодействуют с ДНК селективным к последовательности образом, с предпочтением в отношении пурин-гуанин-пуриновых последовательностей. Типичные PBD и их аналоги включают, без ограничения ими, SJG-136.
Сплайсостатины и пладиенолиды представляют собой противоопухолевые соединения, которые ингибируют сплайсинг и взаимодействуют с сплайсосомой SF3b. Примеры сплайсостатинов включают, без ограничения ими, сплайсостатин A, FR901464 и (2S,3Z)-5-{[(2R,3R,5S,6S)-6-{(2E,4E)-5-[(3R,4R,5R,7S)-7-(2-гидpaзинил-2-oкcoэтил)-4-гидpoкcи-1,6-диоксаспиро[2.5]окт-5-ил]-3-метилпента-2,4-диен-1-ил}-2,5-диметилтетрагидро-2Н-пиран-3-ил]амино}-5-оксопент-3-ен-2-ил-ацетат, имеющий структуру
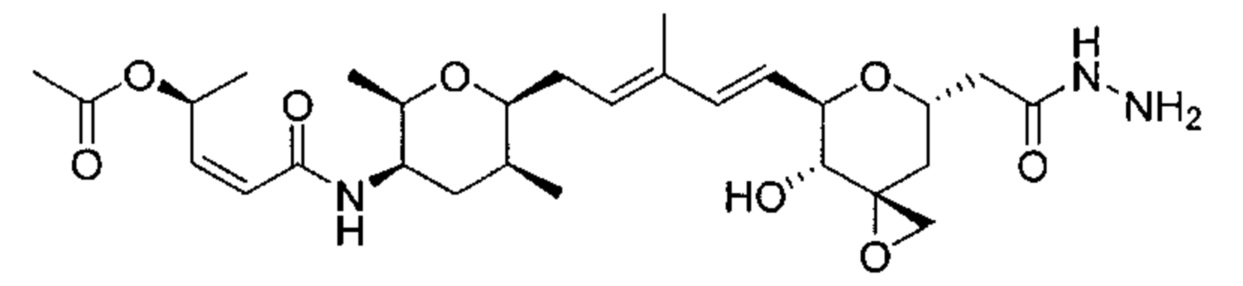
Примеры пладиенолидов включают, без ограничения ими, пладиенолид В, пладиенолид D или Е7107.
Таксаны представляют собой дитерпены, которые действуют, как противотубулиновые агенты или ингибиторы митоза. Типичные таксаны включают, без ограничения ими, паклитаксел (например TAXOL®) и доцетаксел (TAXOTERE®).
Тубулизины представляют собой природные продукты, выделенные из штамма миксобактерий, которые, как было показано, деполимеризуют микротрубочки и индуцируют блокировку митоза. Типичные тубулизины включают, без ограничения ими, тубулизин А, тубулизин В и тубулизин D.
Алкалоиды барвинка также являются противотубулиновыми агентами. Типичные алкалоиды барвинка включают, без ограничения ими, винкристин, винбластин, виндезин и винорелбин.
Соответственно, в некоторых воплощениях цитотоксический агент выбран из группы, которая включает MMAD (Монометил-ауристатин D), 0101 (2-метилаланил-N-[(3R,4S,5S)-3-метокси-1-{(2S)-2-[(1R,2R)-1-метокси-2-метил-3-оксо-3-{[(1S)-2-фенил-1-(1,3-тиазол-2-ил)этил]амино}пропил]пирролидин-1-ил}-5-метил-1-оксогептан-4-ил]-N-метил-L-валинамид), 3377 (N,2-диметилаланил-N-{(1S,2R)-4-{(2S)-2-[(1R,2R)-3-{[(1S)-1-карбоксил-2-фенилэтил]амино}-1-метокси-2-метил-3-оксопропил]пирролидин-1-ил}-2-метокси-1-[(1S)-1-метилпропил]-4-оксобутил}-N-метил-L-валинамид), 0131 (2-метил-L-пролил-N-[(3R,4S,5S)-1-{(2S)-2-[(1R,2R)-3-{[(1S)-1-карбокси-2-фенилэтил]амино}-1-метокси-2-метил-3-оксопропил]пирролидин-1-ил}-3-метокси-5-метил-1-оксогептан-4-ил]-N-метил-1-валинамид), 0131-ОМе (N,2-диметилаланил-N-[(3R,4S,5S)-3-метокси-1-{(2S)-2-[(1R,2R)-1-метокси-3-{[(2S)-1-метокси-1-оксо-3-фенилпропан-2-ил]амино}-2-метил-3-оксопропил]пирролидин-1-ил}-5-метил-1-оксогептан-4-ил]-N-метил-1-валинамид), 0121 (2-метил-L-пролил-N-[(3R,4S,5S)-1-{(2S)-2-[(1R,2R)-3-{[(2S)-1-метокси-1-оксо-3-фенилпропан-2-ил]амино}-1-метокси-2-метил-3-оксопропил]пирролидин-1-ил}-3-метокси-5-метил-1-оксогептан-4-ил]-N-метил-L-валинамид) и (2S,3Z)-5-{[(2R,3R,5S,6S)-6-{(2E,4E)-5-[(3R,4R,5R,7S)-7-(2-гидразинил-2-оксоэтил)-4-гидрокси-1,6-диоксаспиро[2.5]окт-5-ил]-3-метилпента-2,4-диен-1-ил}-2,5-диметилтетрагидро-2Н-пиран-3-ил]амино}-5-оксопент-3-ен-2-ил-ацетата.
В некоторых воплощениях агент представляет собой иммуномодулирующий агент. Примеры иммуномодулирующего агента включают, без ограничения ими, ганцикловир, этанерцепт, такролимус, сиролимус, воклоспорин, циклоспорин, рапамицин, циклофосфамид, азатиоприн, микофенолата мофетил, метотрексат, глюкокортикоид и его аналоги, цитокины, факторы роста стволовых клеток, лимфотоксины, фактор некроза опухоли (TNF), гематопоэтические факторы, интерлейкины (например интерлейкин-1 (IL-1), IL-2, IL-3, IL-6, IL-10, IL-12, IL-18 и IL-21), колониестимулирующие факторы (например гранулоцитарный колониестимулирующий фактор (G-CSF) и гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF)), интерфероны (например интерфероны-α, -β и -γ), фактор роста стволовых клеток, обозначенный как " фактор S1", эритропоэтин и тромбопоэтин, или их комбинацию.
В некоторых воплощениях частью агента является агент визуализации (например флуорофор или хелатирующий агент), такой как флуоресцеин, родамин, лантанидные люминофоры и их производные, или радиоизотоп, связанный с хелатирующим агентом. Примеры флуорофоров включают, без ограничения ими, флуоресцеин-изотиоцианат (FITC) (например 5-FITC), флуоресцеин-амидит (FAM) (например 5-FAM), эозин, карбоксифлуоресцеин, эритрозин, Alexa Fluor® (например Alexa 350, 405, 430, 488, 500, 514, 532, 546, 555, 568, 594, 610, 633, 647, 660, 680, 700 или 750), карбокситетраметилродамин (TAMRA) (например 5, -TAMRA), тетраметилродамин (TMR) и сульфородамин (SR) (например SR101). Примеры хелатирующих агентов включают, без ограничения ими, 1,4,7,10-тетраазациклодекан-N,N',N'',N'''-тетрауксусную кислоту (DOTA), 1,4,7-триазациклононан-1,4,7-ацетилацетоуксусную кислоту (NOTA), 1,4,7-триазациклононан-1-глутаровая кислота-4,7-уксусную кислоту (дефероксамин), диэтилентриаминпентауксусную кислоту (DTPA) и 1,2-бис(орто-аминофенокси)этан-N,N,N',N'-тетрауксусную кислоту) (ВАРТА).
Примеры флуорофоров включают, без ограничения ими, флуоресцеин-изотиоцианат (FITC) (например 5-FITC), флуоресцеин-амидит (FAM) (например 5-FAM), эозин, карбоксифлуоресцеин, эритрозин, Alexa Fluor® (например Alexa 350, 405, 430, 488, 500, 514, 532, 546, 555, 568, 594, 610, 633, 647, 660, 680, 700, или 750), карбокситетраметилродамин (TAMRA) (например 5, -TAMRA), тетраметилродамин (TMR) и сульфородамин (SR) (например SR101).
В некоторых воплощениях терапевтические или диагностические радиоизотопы или другие метки (например метки PET или SPECT) могут быть включены в агент для конъюгации с ВСМА-антителами или антигенсвязывающими фрагментами, как описано в данном документе. Примеры радиоизотопов или других меток включают, без ограничения ими, 3Н, 11С, 13N, 14С, 15N, 15O, 35S, 18F, 32Р, 33Р, 47Sc, 51Cr, 57Со, 58Со, 59Fe, 62Cu, 64Cu, 67Cu, 67Ga, 68Ga, 75Se, 76Br, 77Br, 86Y, 89Zr, 90Y, 94Tc, 95Ru, 97Ru, 99Tc, 103Ru, 105Rh, 105Ru, 107Hg, 109Pd, 111Ag, 111In, 113In, 121Te, 122Te, 123I, 124I, 125I, 125Te, 126I, 131I, 131In, 133I, 142Pr, 143Pr, 153Pb, 153Sm, 161Tb, 165Tm, 166Dy, 166H, 167Tm, 168Tm, 169Yb, 177Lu, 186Re, 188Re, 189Re, 197Pt, 198Au, 199Au, 201Tl, 203Hg, 211At, 212Bi, 212Pb, 213Bi, 223Ra, 224Ac или 225Ac.
В некоторых воплощениях агент представляет собой терапевтический белок, включающий, без ограничения ими, токсин, гормон, фермент и фактор роста.
Примеры белков-токсинов (или полипептидов) включают, без ограничения ими, токсин дифтерии (например А-цепь дифтерии), экзотоксин и эндотоксин Pseudomonas, рицин (например А-цепь рицина), абрин (например А-цепь абрина), модецин (например А-цепь модецина), альфа-сарцин, белки Aleurites fordii, белки диантины, рибонуклеазу (РНКаза), ДНКазу I, стафилококковый энтеротоксин А, антивирусный белок лаконоса, гелонин, дифтерийный токсин, белки лаконоса американского (PAPI, РАРII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор сапонарии лекарственной, митогеллин, рестриктоцин, феномицин, эномицин, трихотецены, пептиды ингибиторного цистинового узла (ICK) (например цератотоксины) и конотоксин (например KIIIA или SmIIIa).
В некоторых воплощениях агент представляет собой биосовместимый полимер. ВСМА-антитела или антигенсвязывающие фрагменты, как описано в данном документе, могут быть конъюгированы с биосовместимым полимером для увеличения периода полувыведения в плазме и биологической активности и/или для увеличения периодов полувыведения in vivo. Примеры биосовместимых полимеров включают водорастворимый полимер, такой как полиэтиленгликоль (ПЭГ) или его производные, и биосовместимые полимеры, содержащие цвиттер-ион (например фосфорилхолинсодержащий полимер).
В некоторых воплощениях агент представляет собой олигонуклеотид, такой как антисмысловые олигонуклеотиды.
В другом аспекте изобретения предложено конъюгат антитела или антигенсвязывающего фрагмента, как описано в данном документе, где конъюгат имеет формулу: антитело-(ацил-донорный глутамин-содержащий тег)-(линкер)-(цитотоксический агент), где ацил-донорный глутамин-содержащий тег сконструирован в определенном месте антитела или антигенсвязывающего фрагмента (например на карбоксильном конце тяжелой или легкой цепи, после остатка Т135 в тяжелой цепи антитела или в другом месте), где тег конъюгирован с линкером (например линкером, содержащим один или более реакционноспособных аминов (например первичный амин NH2)), и где линкер конъюгирован с цитотоксическим агентом (например MMAD или другими ауристатинами, такими как 0101, 0131 или 3377).
Примеры линкера, содержащего один или более реакционноспособных аминов, включают, без ограничения ими, Ac-Lys-Gly (ацетил-лизин-глицин), аминокапроновую кислоту, Ас-Lys-β-Ala (ацетил-лизин-β-аланин), амино-PEG2 (полиэтиленгликоль)-С2, амино-PEG3-C2, амино-PEG6-C2 (или амино PEG6-пропионил), Ac-Lys-Val-Cit-PABC (ацетил-лизин-валин-цитруллин-пара-аминобензилоксикарбонил), амино-PEG6-C2-Val-Cit-PABC, аминокапроил-Val-Cit-PABC, [(3R,5R)-1-{3-[2-(2-аминоэтокси)этокси]пропаноил}пиперидин-3,5-диил]бис-Val-Cit-РАВС, [(3S,5S)-1-{3-[2-(2-аминоэтокси)этокси]пропаноил}-пиперидин-3,5-диил]бис-Vаl-Cit-РАВС, путресцин или Ac-Lys-путресцин.
В некоторых воплощениях конъюгат представляет собой 1) антитело-GGLLQGPP (SEQ ID NO: 474)- AcLys-VC-PABC-0101; 2) антитело-AcLys-VC-РАВС-0101 и содержит N297Q; 3) антитело-GGLLQGPP (SEQ ID NO: 474)-AcLys-VC-PABC-0101 и содержит N297Q; 4) антитело-LLQG (SEQ ID NO: 454)-амино-PEG6-C2-0131 и содержит N297A; 5) антитело-LLQG (SEQ ID NO: 454)-амино-РЕС6-С2-3377 и содержит N297A; 6) антитело-GGLLQGA (SEQ ID NO: 475)-AcLys-VC-PABC-0101. В некоторых воплощениях ацил-донорный глутамин-содержащий тег, содержащий, например, GGLLQGPP (SEQ ID NO: 474) или GGLLQGA (SEQ ID NO: 475), сконструирован на С-конце легкой цепи антитела. В других воплощениях ацил-донорный глутамин-содержащий тег (например LLQGA (SEQ ID NO: 463) или LLQGPP (SEQ ID NO: 472)) сконструирован на С-конце тяжелой цепи антитела, где удален остаток лизина на С-конце. В некоторых воплощениях ацил-донорный глутамин-содержащий тег, содержащий, например, LLQG (SEQ ID NO: 454), сконструирован после остатка Т135 в тяжелой цепи антитела или заменяет аминокислотные остатки E294-N297 в тяжелой цепи антитела. Примеры антител включают, без ограничения ими, Р6Е01/Р6Е01, P6E01/H3.AQ, L1.LGF/L3.KW/P6E01; L1.LGF/L3.NY/P6E01, L1.GDF/L3.NY/P6E01, L1.LGF/L3.KW/H3.AL, L1.LGF/L3.KW/H3.AP, L1.LGF/L3.KW/H3.AQ, L1.LGF/L3.PY/H3.AP, L1.LGF/L3.PY/H3.AQ, L1.LGF/L3.NY/H3.AL, L1.LGF/L3.NY/H3.AP, L1.LGF/L3.NY/H3.AQ, L1.GDF/L3.KW/H3.AL, L1.GDF/L3.KW/H3.AP, L1.GDF/L3.KW/H3.AQ, L1.GDF/L3.PY/H3.AQ, L1.GDF/L3.NY/H3.AL, L1.GDF/L3.NY/H3.AP, L1.GDF/L3.NY/H3.AQ, L3.KW/P6E01, L3.PY/P6E01, L3.NY/P6E01, L3.PY/L1.PS/P6E01, L3.PY/L1.AH/P6E01, L3.PY/L1.FF/P6E01, L3.PY/L1.PH/P6E01, L3.PY/L3.KY/P6E01, L3.PY/L3.KF/P6E01, L3.PY/H2.QR, L3.PY/H2.DY, L3.PY/H2.YQ, L3.PY/H2.LT, L3.PY/H2.HA, L3.PY/H2.QL, L3.PY/H3.YA, L3.PY/H3.AE, L3.PY/H3.AQ, L3.PY/H3.TAQ, L3.PY/P6E01, L3.PY/L1.PS/H2.QR, L3.PY/L1.PS/H2.DY, L3.PY/L1.PS/H2.YQ, L3.PY/L1.PS/H2.LT, L3.PY/L1.PS/H2.НА, L3.PY/L1.PS/H2.QL, L3.PY/L1.PS/H3.YA, L3.PY/L1.PS/H3.AE, L3.PY/L1.PS/H3.AQ, L3.PY/L1.PS/H3.TAQ, L3.PY/L1.AH/H2.QR, L3.PY/L1.AH/H2.DY, L3.PY/L1.AH/H2.YQ, L3.PY/L1.AH/H2.LT, L3.PY/L1.АН/Н2.НА, L3.PY/L1.AH/H2.QL, L3.PY/L1.AH/H3.YA, L3.PY/L1.АН/Н3.АЕ, L3.PY/L1.AH/H3.AQ, L3.PY/L1.AH/H3.TAQ, L3.PY/L1.FF/H2.QR, L3.PY/L1.FF/H2.DY, L3.PY/L1.FF/H2.YQ, L3.PY/L1.FF/H2.LT, L3.PY/L1.FF/H2.HA, L3.PY/L1.FF/H2.QL, L3.PY/L1.FF/H3.YA, L3.PY/L1.FF/H3.AE, L3.PY/L1.FF/H3.AQ, L3.PY/L1.FF/H3.TAQ, L3.PY/L1.PH/H2.QR, L3.PY/L1.РН/Н2.НА, L3.PY/L1.РН/Н3.АЕ, L3.PY/L1.PH/H3.AQ, L3.PY/L1.PH/H3.TAQ, L3.PY/L3.KY/H2.QR, L3.PY/L3.KY/H2.DY, L3.PY/L3.KY/H2.YQ, L3.PY/L3.KY/H2.LT, L3.PY/L3.KY/H2.HA, L3.PY/L3.KY/H2.QL, L3.PY/L3.KY/H3.YA, L3.PY/L3.KY/H3.TAQ, L3.PY/L3.KF/H2.DY, L3.PY/L3.KF/H2.YQ, L3.PY/L3.KF/H2.LT L3.PY/L3.KF/H2.QL, L3.PY/L3.KF/H3.YA, L3.PY/L3.KF/H3.AE, L3.PY/L3.KF/H3.AQ L3.PY/L3.KF/H3.TAQ, P5A2_VHVL, A02_Rd4_0.6nM_C06, A02_Rd4_0.6nM_C09, A02_Rd4_6nM_C16, A02_Rd4_6nM_C03, A02_Rd4_6nM_C01, A02_Rd4_6nM_C26, A02_Rd4_6nM_C25, A02_Rd4_6nM_C22, A02_Rd4_6nM_C19, A02_Rd4_0.6nM_C03, A02_Rd4_6nM_C07, A02_Rd4_6nM_C23, A02_Rd4_0.6nM_C18, A02_Rd4_6nM_C10, A02_Rd4_6nM_C05, A02_Rd4_0.6nM_C10, A02_Rd4_6nM_C04, A02_Rd4_0.6nM_C26, A02_Rd4_0.6nM_C13, A02_Rd4_0.6nM_C01, A02_Rd4_6nM_C08, P5C1_VHVL, C01_Rd4_6nM_C24, C01_Rd4_6nM_C26, C01_Rd4_6nM_C10, C01_Rd4_0.6nM_C27, C01_Rd4_6nM_C20, C01_Rd4_6nM_C12, C01_Rd4_0.6nM_C16, C01_Rd4_0.6nM_C09, C01_Rd4_6nM_C09, C01_Rd4_0.6nM_C03, C01_Rd4_0.6nM_C06, C01_Rd4_6nM_C04, COMBO_Rd4_0.6nM_C22, COMBO_Rd4_6nM_C21, COMBO_Rd4_6nM_C10, COMBO_Rd4_0.6nM_C04, COMBO_Rd4_6nM_C25, COMBO_Rd4_0.6nM_C21, COMBO_Rd4_6nM_C11, COMBO_Rd4_0.6nM_C20, COMBO_Rd4_6nM_C09, COMBO_Rd4_6nM_C08, COMBO_Rd4_0.6nM_C19, COMBO_Rd4_0.6nM_C02, COMBO_Rd4_0.6nM_C23, COMBO_Rd4_0.6nM_C29, COMBO_Rd4_0.6nM_C09, COMBO_Rd4_6nM_C12, COMBO_Rd4_0.6nM_C30, COMBO_Rd4_0.6nM_C14, COMBO_Rd4_6nM_C07, COMBO_Rd4_6nM_C02, COMBO_Rd4_0.6nM_C05, COMBO_Rd4_0.6nM_C17, COMBO_Rd4_6nM_C22, COMBO_Rd4_0.6nM_C11, COMBO_Rd4_0.6nM_C29, P4G4 или P1A11.
В одном варианте конъюгат дополнительно содержит аминокислотную замену лизина на аргинин в положении 222. Соответственно, например, конъюгат представляет собой 1) антитело-GGLLQGPP (SEQ ID NO: 474)-AcLys-VC-PABC-0101 и содержит K222R; 2) антитело-AcLys-VC-PABC-0101 и содержит N297Q и K222R; 3) антитело- GGLLQGPP (SEQ ID NO: 474)-AcLys-VC-РАВС-0101 и содержит N297Q и K222R; 4) антитело-LLQG (SEQ ID NO: 454)-амино-РЕG6-С2-0131 и содержит N297A и K222R; 5) антитело-LLQG (SEQ ID NO: 454)-амино-РЕG6-С2-3377 и содержит N297A и K222R; и 6) антитело-GGLLQGA (SEQ ID NO: 475)-AcLys-VC-PABC-0101 и содержит K222R. В некоторых воплощениях ацил-донорный глутамин-содержащий тег, содержащий, например, GGLLQGPP (SEQ ID NO: 474) или GGLLQGA (SEQ ID NO: 475), сконструирован на С-конце легкой цепи антитела. В других воплощениях ацил-донорный глутамин-содержащий тег (например LLQGA (SEQ ID NO: 473) или LLQGPP (SEQ ID NO: 472)) сконструирован на С-конце тяжелой цепи антитела, где удален остаток лизина на С-конце. В некоторых воплощениях ацил-донорный глутамин-содержащий тег, содержащий, например, LLQG (SEQ ID NO: 454), сконструирован после остатка Т135 в тяжелой цепи антитела или заменяет аминокислотные остатки E294-N297 в тяжелой цепи антитела. Примеры антител включают, без ограничения ими, Р6Е01/Р6Е01, P6E01/H3.AQ, L1.LGF/L3.KW/P6E01; L1.LGF/L3.NY/P6E01, L1.GDF/L3.NY/P6E01, L1.LGF/L3.KW/H3.AL, L1.LGF/L3.KW/H3.AP, L1.LGF/L3.KW/H3.AQ, L1.LGF/L3.PY/H3.AP, L1.LGF/L3.PY/H3.AQ, L1.LGF/L3.NY/H3.AL, L1.LGF/L3.NY/H3.AP, L1.LGF/L3.NY/H3.AQ, L1.GDF/L3.KW/H3.AL, L1.GDF/L3.KW/H3.AP, L1.GDF/L3.KW/H3.AQ, L1.GDF/L3.PY/H3.AQ, L1.GDF/L3.NY/H3.AL, L1.GDF/L3.NY/H3.AP, L1.GDF/L3.NY/H3.AQ, L3.KW/P6E01, L3.PY/P6E01, L3.NY/P6E01, L3.PY/L1.PS/P6E01, L3.PY/L1.AH/P6E01, L3.PY/L1.FF/P6E01, L3.PY/L1.PH/P6E01, L3.PY/L3.KY/P6E01, L3.PY/L3.KF/P6E01, L3.PY/H2.QR, L3.PY/H2.DY, L3.PY/H2.YQ, L3.PY/H2.LT, L3.PY/H2.HA, L3.PY/H2.QL, L3.PY/H3.YA, L3.PY/H3.AE, L3.PY/H3.AQ, L3.PY/H3.TAQ, L3.PY/P6E01, L3.PY/L1.PS/H2.QR, L3.PY/L1.PS/H2.DY, L3.PY/L1.PS/H2.YQ, L3.PY/L1.PS/H2.LT, L3.PY/L1.PS/H2.HA, L3.PY/L1.PS/H2.QL, L3.PY/L1.PS/H3.YA, L3.PY/L1.PS/H3.AE, L3.PY/L1.PS/H3.AQ, L3.PY/L1.PS/H3.TAQ, L3.PY/L1.AH/H2.QR, L3.PY/L1.AH/H2.DY, L3.PY/L1.AH/H2.YQ, L3.PY/L1.AH/H2.LT, L3.PY/L1.АН/Н2.НА, L3.PY/L1.AH/H2.QL, L3.PY/L1.AH/H3.YA, L3.PY/L1.АН/Н3.АЕ, L3.PY/L1.AH/H3.AQ, L3.PY/L1.AH/H3.TAQ, L3.PY/L1.FF/H2.QR, L3.PY/L1.FF/H2.DY, L3.PY/L1.FF/H2.YQ, L3.PY/L1.FF/H2.LT, L3.PY/L1.FF/H2.HA, L3.PY/L1.FF/H2.QL, L3.PY/L1.FF/H3.YA, L3.PY/L1.FF/H3.AE, L3.PY/L1.FF/H3.AQ, L3.PY/L1.FF/H3.TAQ, L3.PY/L1.PH/H2.QR, L3.PY/L1.РН/Н2.НА, L3.PY/L1.PH/H3.AE, L3.PY/L1.PH/H3.AQ, L3.PY/L1.PH/H3.TAQ, L3.PY/L3.KY/H2.QR, L3.PY/L3.KY/H2.DY, L3.PY/L3.KY/H2.YQ, L3.PY/L3.KY/H2.LT, L3.PY/L3.KY/H2.HA, L3.PY/L3.KY/H2.QL, L3.PY/L3.KY/H3.YA, L3.PY/L3.KY/H3.TAQ, L3.PY/L3.KF/H2.DY, L3.PY/L3.KF/H2.YQ, L3.PY/L3.KF/H2.LT L3.PY/L3.KF/H2.QL, L3.PY/L3.KF/H3.YA, L3.PY/L3.KF/H3.AE, L3.PY/L3.KF/H3.AQ L3.PY/L3.KF/H3.TAQ, P5A2_VHVL, A02_Rd4_0.6nM_C06, A02_Rd4_0.6nM_C09 A02_Rd4_6nM_C16, A02_Rd4_6nM_C03, A02_Rd4_6nM_C01, A02_Rd4_6nM_C26, A02_Rd4_6nM_C25, A02_Rd4_6nM_C22, A02_Rd4_6nM_C19, A02_Rd4_0.6nM_C03, A02_Rd4_6nM_C07, A02_Rd4_6nM_C23, A02_Rd4_0.6nM_C18, A02_Rd4_6nM_C10, A02_Rd4_6nM_C05, A02_Rd4_0.6nM_C10, A02_Rd4_6nM_C04, A02_Rd4_0.6nM_C26, A02_Rd4_0.6nM_C13, A02_Rd4_0.6nM_C01, A02_Rd4_6nM_C08, P5C1_VHVL, C01_Rd4_6nM_C24, C01_Rd4_6nM_C26, C01_Rd4_6nM_C10, C01_Rd4_0.6nM_C27, C01_Rd4_6nM_C20, C01_Rd4_6nM_C12, C01_Rd4_0.6nM_C16, C01_Rd4_0.6nM_C09, C01_Rd4_6nM_C09, C01_Rd4_0.6nM_C03, C01_Rd4_0.6nM_C06, C01_Rd4_6nM_C04, COMBO_Rd4_0.6nM_C22, COMBO_Rd4_6nM_C21, COMBO_Rd4_6nM_C10, COMBO_Rd4_0.6nM_C04, COMBO_Rd4_6nM_C25, COMBO_Rd4_0.6nM_C21, COMBO_Rd4_6nM_C11, COMBO_Rd4_0.6nM_C20, COMBO_Rd4_6nM_C09, COMBO_Rd4_6nM_C08, COMBO_Rd4_0.6nM_C19, COMBO_Rd4_0.6nM_C02, COMBO_Rd4_0.6nM_C23, COMBO_Rd4_0.6nM_C29, COMBO_Rd4_0.6nM_C09, COMBO_Rd4_6nM_C12, COMBO_Rd4_0.6nM_C30, COMBO_Rd4_0.6nM_C14, COMBO_Rd4_6nM_C07, COMBO_Rd4_6nM_C02, COMBO_Rd4_0.6nM_C05, COMBO_Rd4_0.6nM_C17, COMBO_Rd4_6nM_C22, COMBO_Rd4_0.6nM_C11, COMBO_Rd4_0.6nM_C29, или P4G4, или P1A11.
CD3-антитела и способы их получения
В настоящем изобретении, кроме того, предлагается антитело, которое связывается с CD3 (например человеческим CD3 (SEQ ID NO: 502; или регистрационный номер: NM_000733.3).
В одном аспекте представлено выделенное антитело или его антигенсвязывающий фрагмент, которые специфично связываются с CD3, где антитело содержит VH CDR1, VH CDR2 и VH CDR3 последовательности VH, представленной в SEQ ID NO: 320, 322, 324, 326, 328, 330, 345, 347, 349, 351, 444, 354, 356, 378, 442, 380, 382, 384 386, 388, 390, 392, 394, 396, 398 или 400; и/или вариабельную область легкой цепи (VL), содержащую VL CDR1, VL CDR2, и VL CDR3 последовательности VL, представленной в SEQ ID NO: 319, 321, 323, 325, 327, 329, 344, 346, 348, 350, 352, 355, 377, 443, 445, 379, 381, 383, 385, 387, 389, 391, 393, 395, 397 или 399.
В другом аспекте предложено выделенное антитело или его антигенсвязывающий фрагмент, которые специфично связываются с CD3, где область VH содержит (1) определяющий комплементарность участок один (CDR1) VH, содержащий последовательность, представленную в SEQ ID NO: 331, 332, 333, 401, 402, 403, 407, 408, 415, 416, 418, 419, 420, 424, 425, 426, 446, 447 или 448, (2) VH CDR2, содержащий последовательность, представленную в SEQ ID NO: 334, 336, 337, 338, 339, 404, 405, 409, 410, 411, 412, 413, 414, 417, 418, 421, 422, 427, 428, 449 или 450; и (3) VH CDR3, содержащий последовательность, представленную в SEQ ID NO: 335, 406, 423, 429 или 451; и/или вариабельную область легкой цепи (VL), содержащую (1) VL CDR1, содержащий последовательность, представленную в SEQ ID NO: 340, 343, 430, 431, 435 или 440, 441; (2) VL CDR2, содержащий последовательность, представленную в SEQ ID NO: 341, 433, 452 или 436; и (3) VL CDR3, содержащий последовательность, представленную в SEQ ID NO: 342, 432, 434, 437, 438, 439, 446 или 453.
В некоторых воплощениях предложено антитело, имеющее любую из частичных последовательности легкой цепи, указанных в Таблице 3, и/или любую из частичных последовательности тяжелой цепи, указанных в Таблице 3.

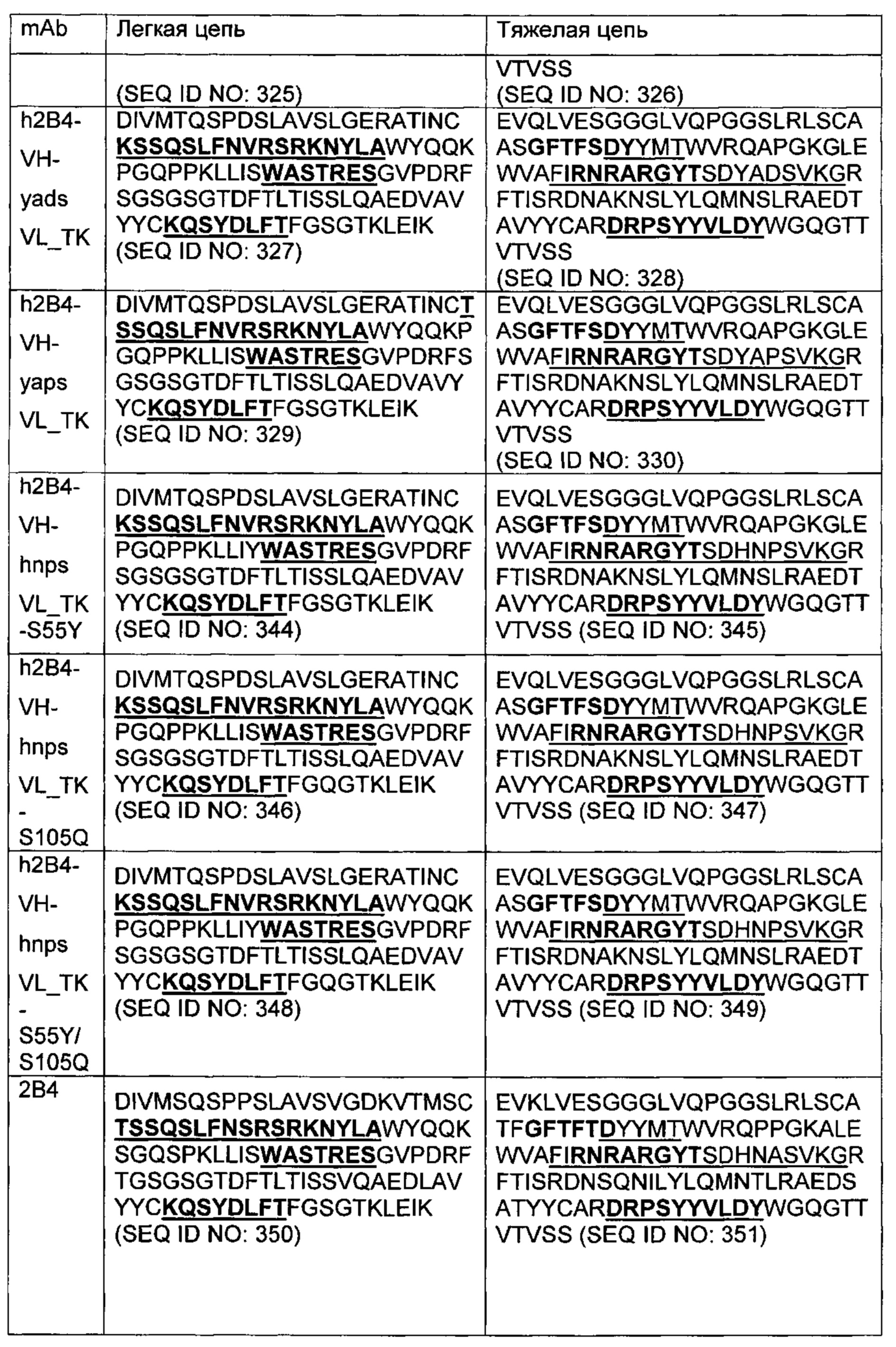
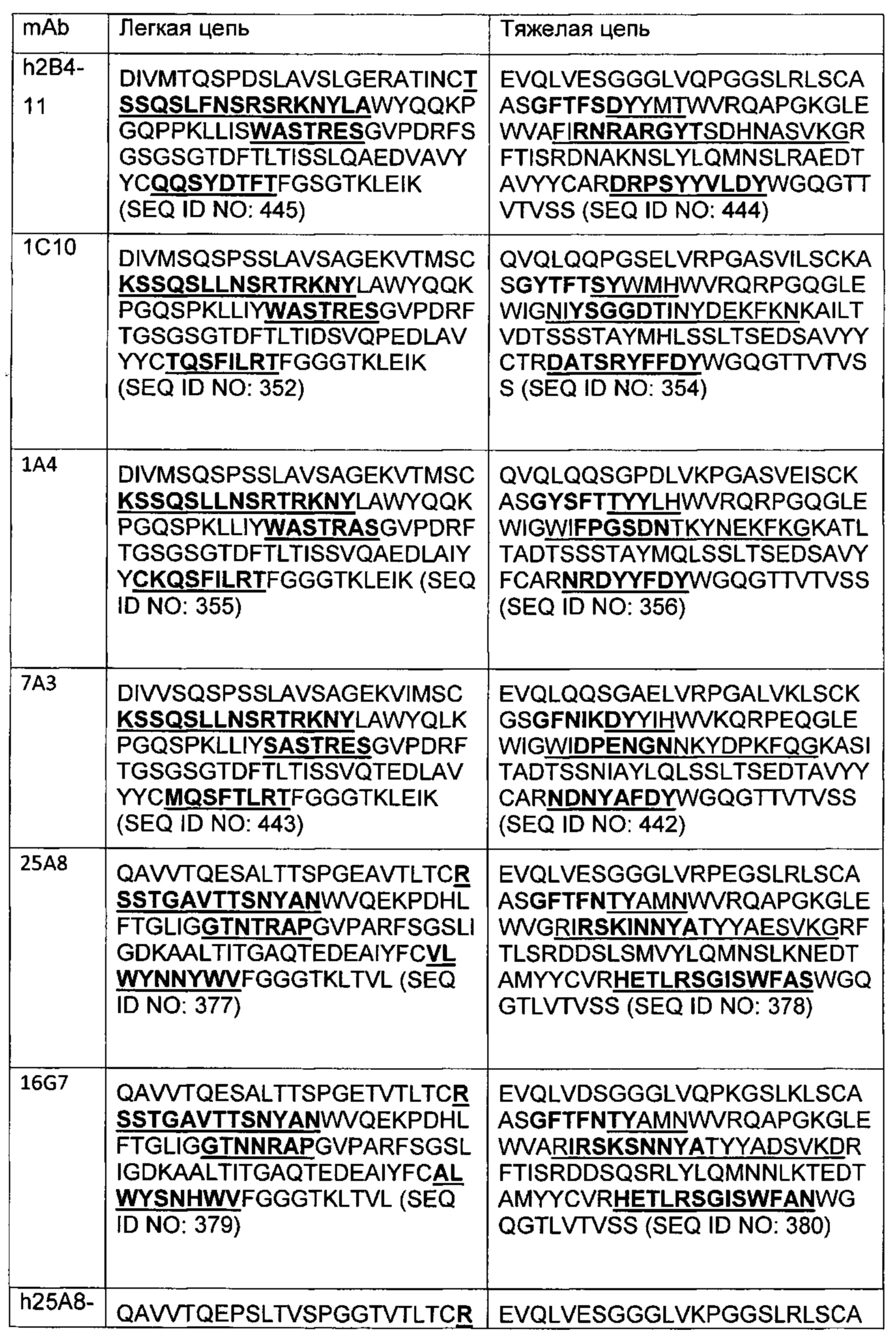
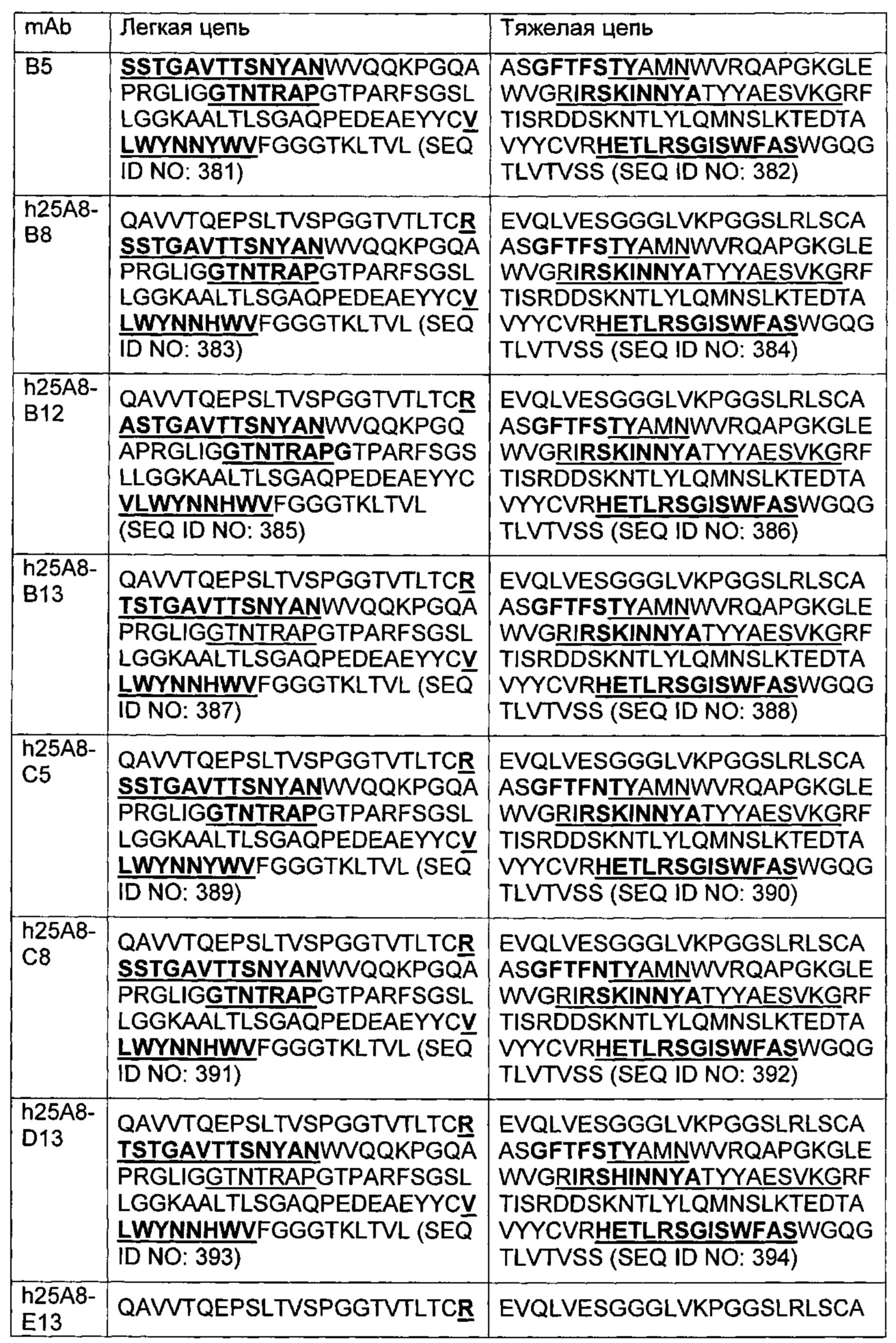

В таблице 3 подчеркнутые последовательности представляют собой последовательности CDR согласно Kabat, а выделенные жирным шрифтом - согласно Chothia.
В изобретении также предложены участки CDR к CD3 (в том числе CDR по Chothia, Kabat и контактные области CDR). Определение областей CDR хорошо известно специалистам. Понятно, что в некоторых воплощениях CDR могут представлять собой комбинацию CDR по Kabat и по Chothia (также называемую "комбинированные CDR" или "расширенные CDR"). В некоторых воплощениях CDR представляют собой CDR по Kabat. В других воплощениях CDR представляют собой CDR по Chothia. Другими словами, в воплощениях с более чем одним CDR, CDR могут быть любыми из CDR по Kabat, по Chothia, комбинированных CDR или их комбинации. В таблице 4 приведены примеры CDR-последовательностей, представленных здесь.

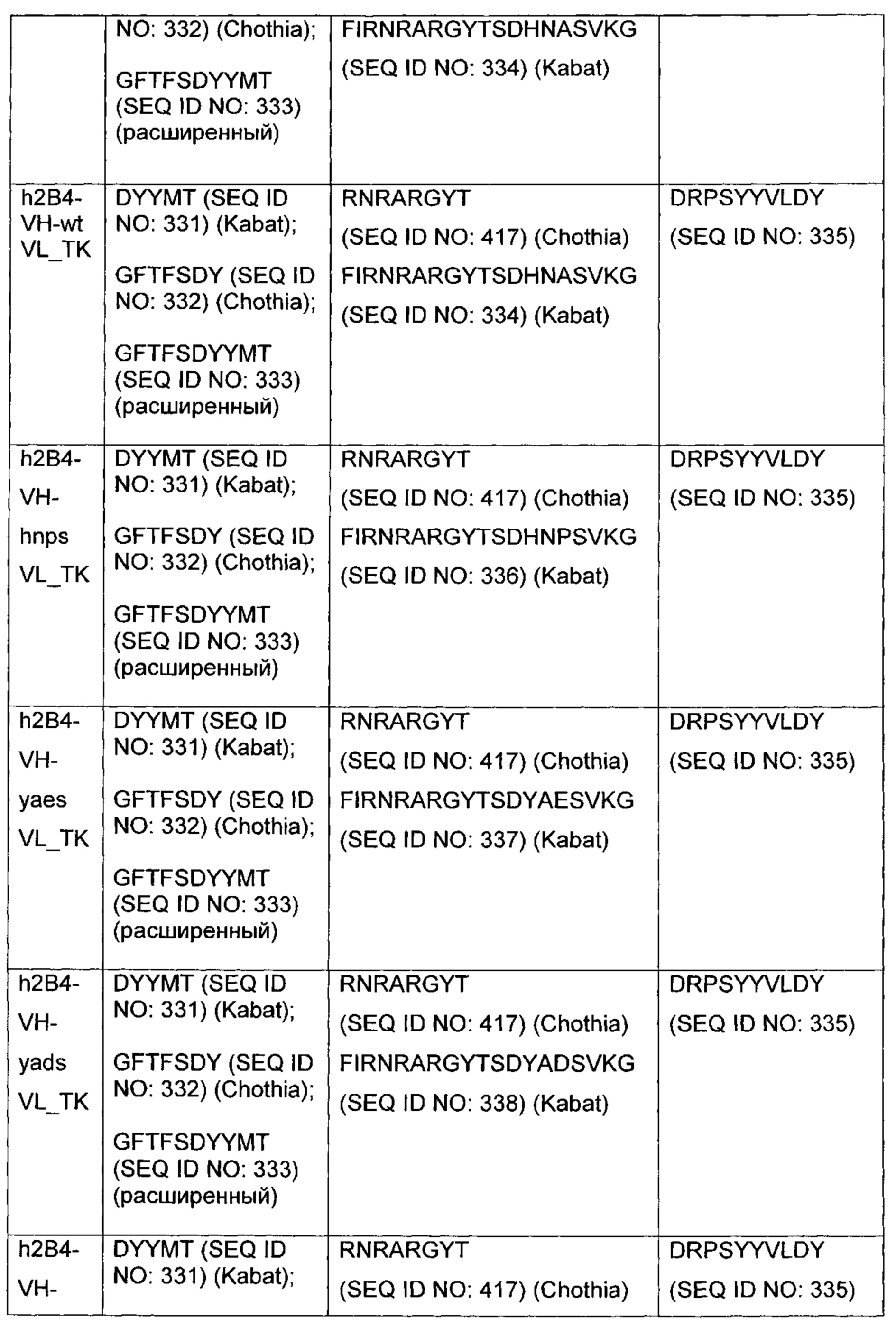

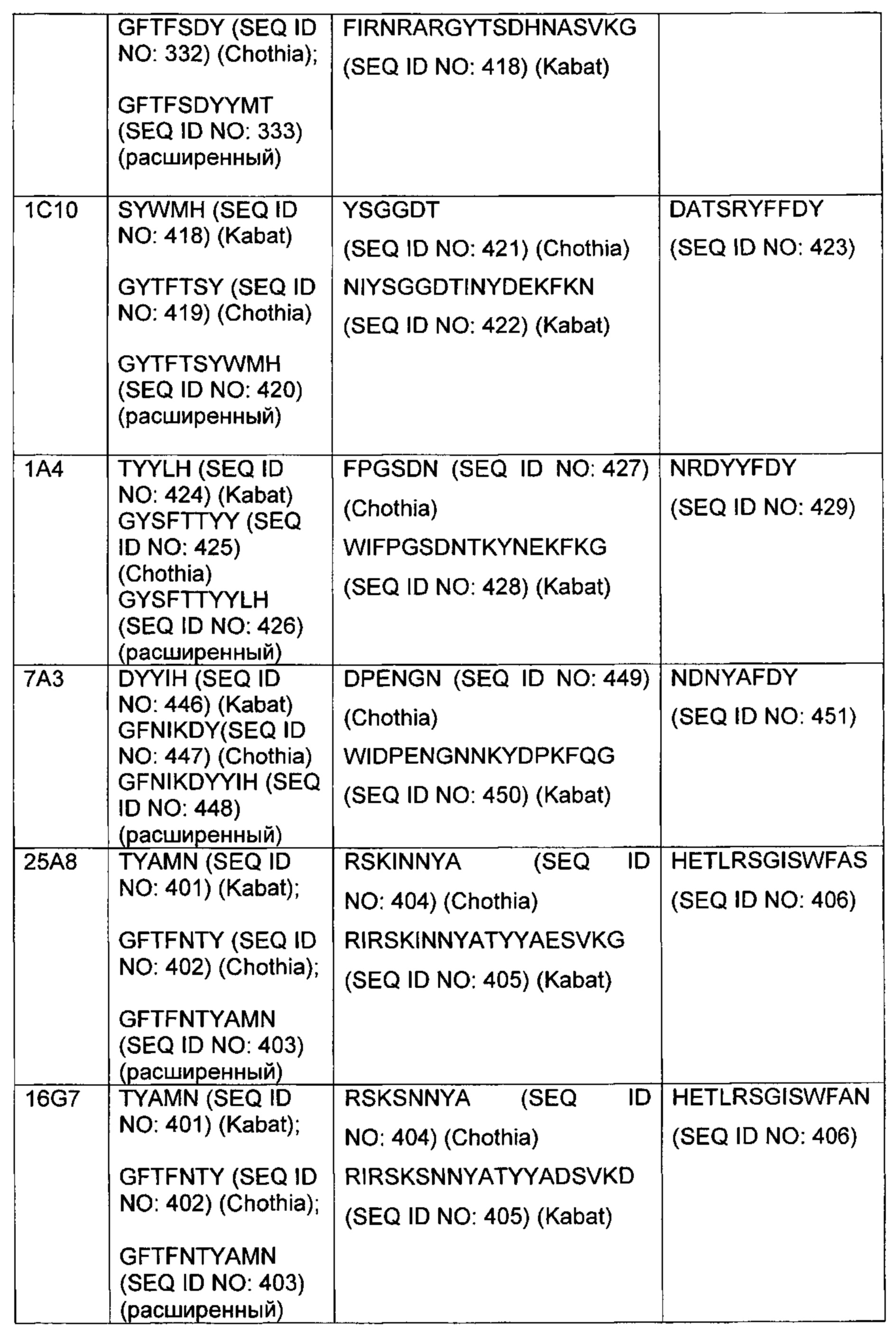
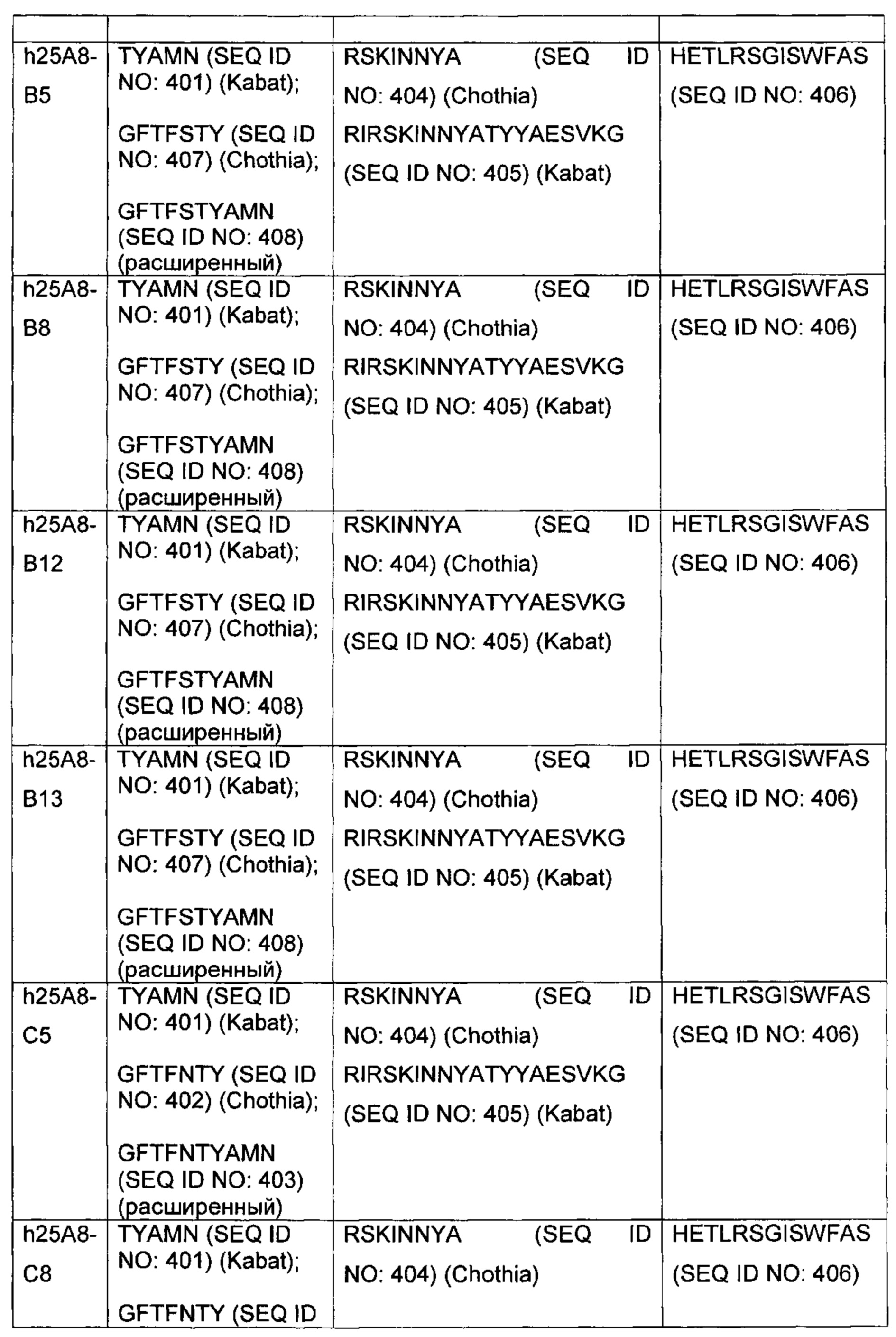
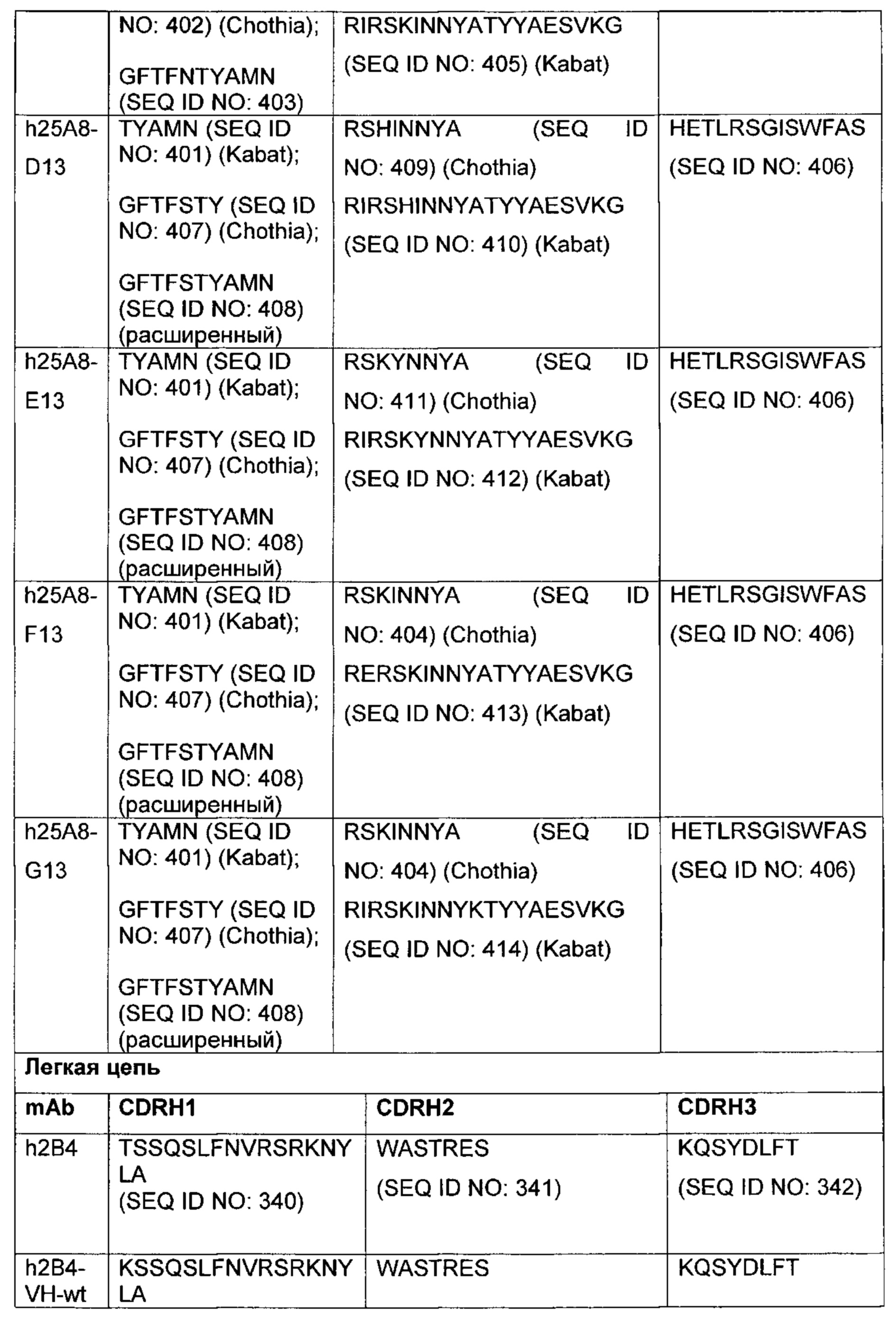
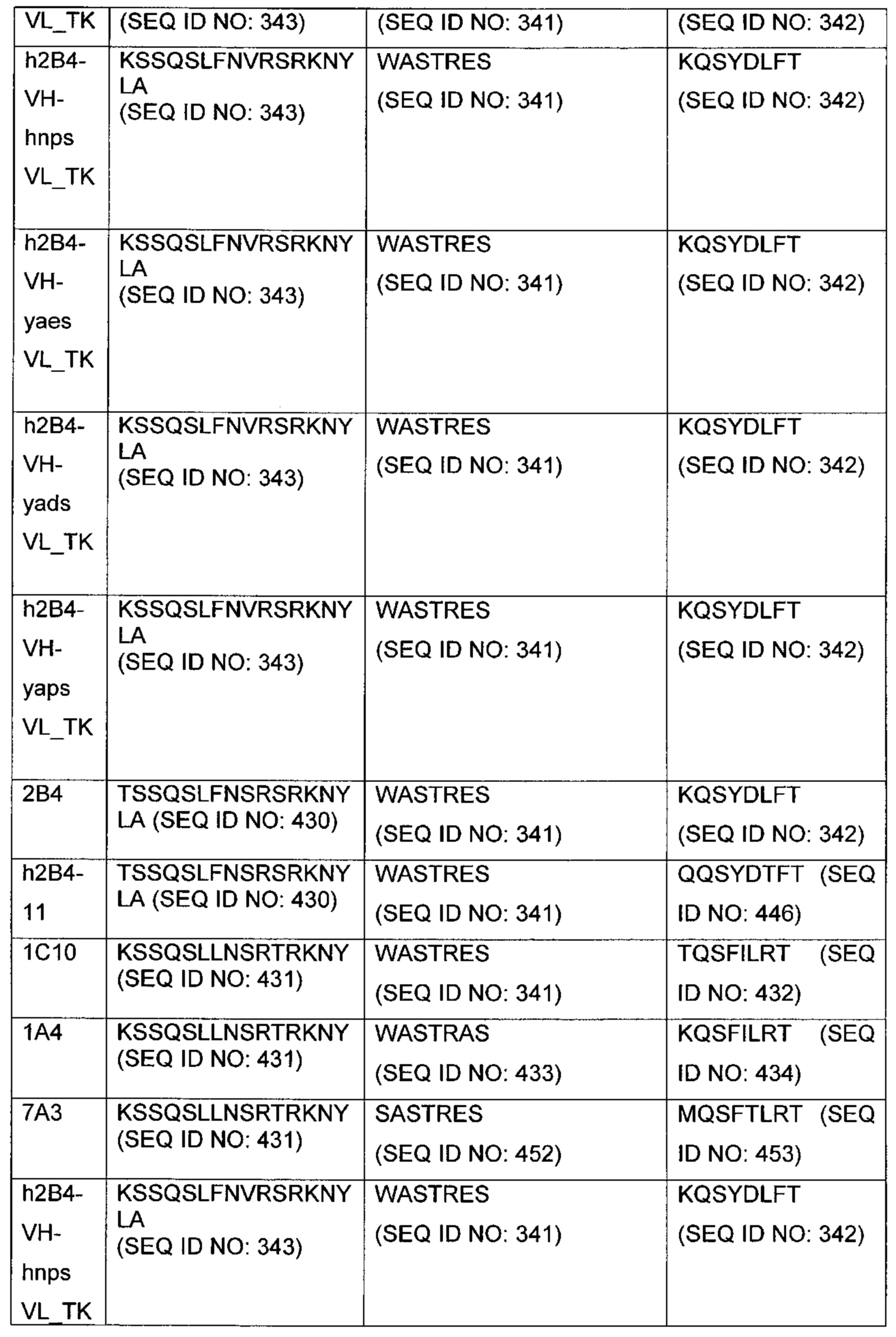
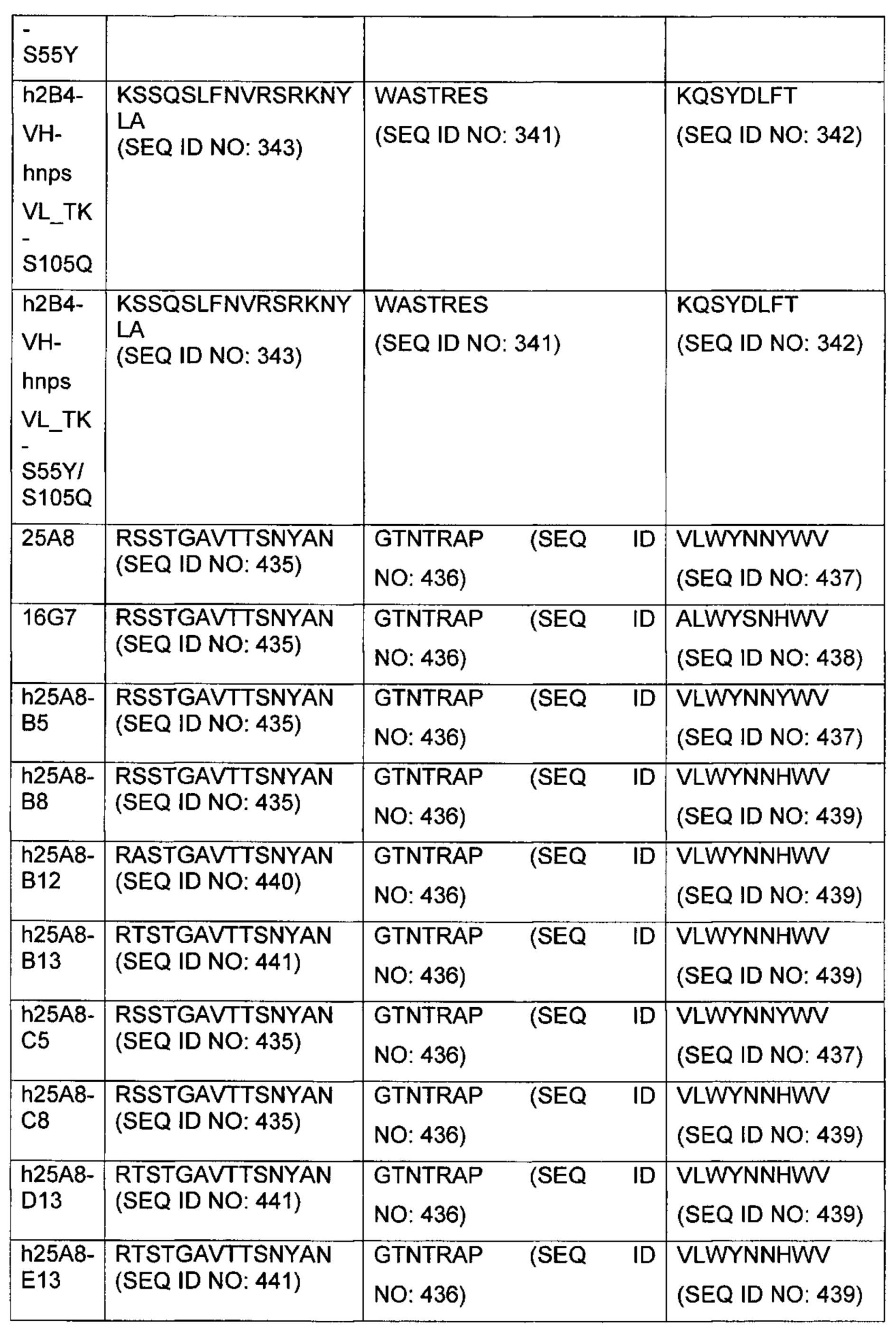
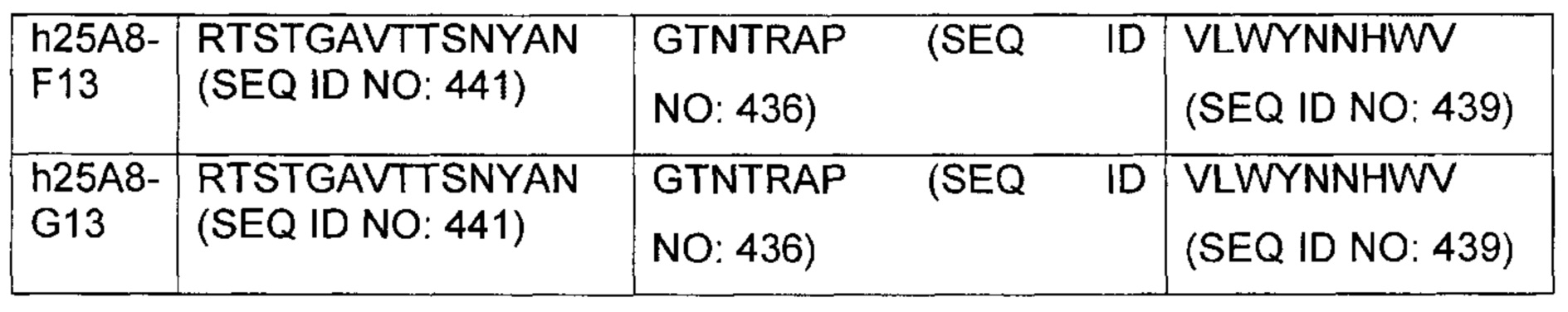
В изобретении также предложены выделенные полинуклеотиды, кодирующие антитела по изобретению, и векторы и клетки-хозяева, содержащие полинуклеотид.
В одном воплощении полинуклеотид содержит последовательность, кодирующую вариабельные области тяжелой и/или легкой цепи антитела h2B4, h2B4-VH-wt VL_TK, h2B4-VH-hnps VL_TK, h2B4-VH-yaes VL_TK, h2B4-VH-yads VL_TK, h2B4-VH-yaps VL_TK, h2B4-VH-hnps VL_TK-S55Y, h2B4-VH-hnps VL_TK-S105Q, h2B4-vH-hnpsVL_TK-S55Y/S105Q, 2B4, h2B4-11, 1C10, 1A4, 7A3, 25A8, 16G7, h25A8-B5, h25A8-B8, h25A8-B12, h25A8-B13, h25A8-C5, h25A8-C8, h25A8-D13, h25A8-E13, h25A8-F13 или h25A8-G13. Последовательность, кодирующая представляющее интерес антитело, может поддерживаться в векторе в клетке-хозяине, а клетку-хозяина затем можно размножать и замораживать для последующего использования. Векторы (включая экспрессионные векторы) и клетки-хозяева описаны в данном документе ниже.
Изобретение также охватывает слитые белки, содержащие один или более фрагментов или областей антител по изобретению. В одном воплощении предложен слитый полипептид, который содержит по меньшей мере 10 смежных аминокислот вариабельной области легкой цепи, представленных в SEQ ID NO: 319, 321, 323, 325, 327, 329, 344, 346, 348, 350, 445, 352, 355, 443, 377. 379, 381, 383, 385, 387, 389, 391, 393, 395, 397 или 399, и/или по меньшей мере 10 аминокислот вариабельной области тяжелой цепи, представленных в SEQ ID NO: 320, 322, 324, 326, 328, 330, 345, 347, 349, 351, 354, 356, 444, 442, 378. 380, 382, 384, 386, 388, 390, 392, 394, 396, 398 или 400. В других воплощениях предложен слитый полипептид, который содержит по меньшей мере примерно 10, по меньшей мере примерно 15, по меньшей мере примерно 20, по меньшей мере примерно 25, или по меньшей мере примерно 30 смежных аминокислот вариабельной области легкой цепи и/или по меньшей мере примерно 10, по меньшей мере примерно 15, по меньшей мере примерно 20, по меньшей мере примерно 25, или по меньшей мере примерно 30 смежных аминокислот вариабельной области тяжелой цепи. В другом воплощении слитый полипептид содержит вариабельную область легкой цепи и/или вариабельную область тяжелой цепи, представленную в любой паре последовательностей, выбранных из SEQ ID NO: 319 и 320, 321 и 322, 323 и 324, 325 и 326, 327 и 328, 329 и 330, 344 и 345, 346 и 347, 348 и 349, 350 и 351, 445 и 444, 352 и 354, 355 и 356, 443 и 442, 377 и 378, 379 и 380, 381 и 382, 383 и 384, 385 и 386, 387 и 388, 389 и 390, 391 и 392, 393 и 394, 395 и 396, 397 и 398, или 399 и 400. В другом воплощении слитый полипептид содержит один или более CDR. В других воплощениях слитый полипептид содержит CDR Н3 (VH CDR3) и/или CDR L3 (VL CDR3). Применительно к данному изобретению, слитый белок содержит одно или более антител и другую аминокислотную последовательность, с которой он не соединен в нативной молекуле, например гетерологичную или гомологичную последовательность из другой области. Типичные гетерологичные последовательности включают, без ограничения ими, "тег", такой как тег FLAG или тег 6His. Теги хорошо известны в данной области.
Слитый полипептид может быть получен посредством хорошо известных в данной области способов, например синтетически или рекомбинантно. Как правило, слитые белки по настоящему изобретению получают путем подготовки экспрессии полинуклеотида, кодирующего их, с использованием рекомбинантных способов, описанных в данном документе, хотя они также могут быть получены другими способами, известными в данной области, включая, например, химический синтез.
Репрезентативные материалы CD3-антитела по настоящему изобретению были депонированы в Американской коллекции типовых культур (АТСС) 11 сентября, 2015. Вектор, имеющий регистрационным номер АТСС РТА-122513, представляет собой полинуклеотид, кодирующий вариабельную область тяжелой цепи гуманизированного CD3-антитела, а вектор, имеющий регистрационным номер АТСС РТА-122512, представляет собой полинуклеотид, кодирующий вариабельную область легкой цепи гуманизированного CD3-антитела. Депозиты были сделаны в соответствии с положениями Будапештского договора о международном признании депонирования микроорганизмов для целей патентной процедуры и директивами согласно этому договору (Будапештский договор). Это гарантирует поддержание жизнеспособной депонированной культуры в течение 30 лет с даты депонирования. Депозит будет предоставлен АТСС в соответствии с положениями Будапештского договора и по согласованию с Pfizer, Inc. и АТСС, что гарантирует постоянную и неограниченную доступность потомства этой депонированной культуры для общественности после выдачи соответствующего патента США или после опубликования в открытом доступе любой американской или иностранной патентной заявки, в зависимости от того, что произойдет раньше, и гарантирует доступность потомства тому, кто определен уполномоченным по патентам и товарным знакам США как имеющий право на это согласно 35 U.S.С. Раздел 122 и правилам уполномоченного в связи с этим (включая 37 C.F.R. Раздел 1.14 с особым акцентом на 886 OG 638).
Патентообладатель настоящей заявки согласен с тем, что в случае гибели, потери или уничтожения при культивировании в подходящих условиях культуры депонированных материалов, эти материалы будут немедленно заменены по уведомлению другого об этом. Доступность депонированного материала не следует истолковывать как лицензию на практическое осуществление изобретения в нарушение прав, предоставляемых в соответствии с законодательством любого государства в соответствии с его патентным законодательством.
Биспецифические антитела и способы получения
Биспецифические антитела, моноклональные антитела, обладающие специфичностью связывания в отношении по меньшей мере двух разных антигенов, могут быть получены с использованием описанных здесь антител. Способы получения биспецифических антител известны в данной области техники (см., например, Suresh et al., Methods in Enzymology 121:210, 1986). Как правило, рекомбинантное производство биспецифических антител основано на коэкспрессии двух пар тяжелая цепь-легкая цепь иммуноглобулина с двумя тяжелыми цепями, имеющими разные специфичности (Millstein and Cuello, Nature 305, 537-539, 1983).
Согласно одному из подходов создания биспецифических антител, вариабельные домены антител с нужной специфичностью связывания (сайты связывания антитело-антиген) сливают с последовательностями константной области иммуноглобулина. Слияние предпочтительно выполняют с константной областью тяжелой цепи иммуноглобулина, содержащей по меньшей мере часть шарнирной области, области СН2 и СН3. Предпочтительно иметь первую константную область (СН1) тяжелой цепи, содержащую сайт, необходимый для связывания легкой цепи, присутствующий по меньшей мере в одном из слияний. ДНК, кодирующие слияния тяжелой цепи иммуноглобулина и, если необходимо, легкой цепи иммуноглобулина, встраивают в отдельные экспрессионные векторы и котрансфецируют в подходящий организм-хозяин. Это обеспечивает большую гибкость в регулировании взаимных пропорций этих трех полипептидных фрагментов в воплощениях, когда неравные пропорции трех полипептидных цепей, используемых в конструкции, обеспечивают оптимальные выходы. Однако можно встроить кодирующие последовательности двух или всех трех полипептидных цепей в один экспрессионный вектор, когда экспрессия по меньшей мере двух полипептидных цепей в равных соотношениях приводит к высоким выходам, или когда эти соотношения не имеют особого значения.
В одном подходе биспецифические антитела состоят из гибридной тяжелой цепи иммуноглобулина с первой специфичностью связывания в одном плече и гибридной пары тяжелая цепь-легкая цепь иммуноглобулина (обеспечивающей вторую специфичность связывания) в другом плече. Эта асимметричная структура с легкой цепью иммуноглобулина только в одной половине биспецифической молекулы облегчает отделение нужного биспецифического компонента от нежелательных комбинаций цепей иммуноглобулина. Этот подход описан в публикации РСТ WO 94/04690.
В другом подходе биспецифические антитела созданы на основе аминокислотной модификации в первой шарнирной области в одном плече, и замещенная/замененная аминокислота в первой шарнирной области имеет заряд, противоположный соответствующей аминокислоте во второй шарнирной области в другом плече. Этот подход описан в международной патентной заявке PCT/US 2011/036419 (WO 2011/143545).
В другом подходе образование нужного гетеромультимерного или гетеродимерного белка (например биспецифического антитела) усиливают путем изменения или создания области контакта между первой и второй иммуноглобулин-подобной Fc-областью (например шарнирной областью и/или областью СН3). В этом подходе биспецифические антитела могут состоять из области СН3, где область СН3 содержит первый полипептид СН3 и второй полипептид СН3, которые взаимодействуют с образованием области контакта СН3, где одна или более аминокислот в области контакта СН3 дестабилизирует образование гомодимера и не является электростатически неблагоприятной для образования гомодимера. Этот подход описан в международной патентной заявке PCT/US 2011/036419 (WO 2011/143545).
В другом подходе биспецифические антитела могут быть образованы с использованием глутамин-содержащего пептидного тега, сконструированного на антителе, направленном на один эпитоп (например ВСМА) в одном плече, и другого пептидного тега (например Lys-содержащего пептидного тега или реакционноспособного эндогенного Lys), сконструированного на втором антителе направленном на второй эпитоп в другом плече, в присутствии трансглутаминазы. Этот подход описан в международной патентной заявке РСТ/IB 2011/054899 (WO 2012/059882).
В другом аспекте изобретения гетеродимерный белок (например биспецифическое антитело), как описано в данном документе, содержит полноразмерное человеческое антитело, где первый антительный вариабельный домен гетеродимерного белка способен осуществлять рекрутинг активности человеческой иммунной эффекторной клетки посредством специфического связывания с эффекторным антигеном, расположенным на человеческой иммунной эффекторной клетке и, где второй антительный вариабельный домен гетеродимерного белка способен специфически связываться с целевым антигеном. В некоторых воплощениях человеческое антитело имеет изотип IgG1, IgG2, IgG3 или IgG4. В некоторых воплощениях гетеродимерный белок содержит иммунологически инертную Fc-область.
Человеческая иммунная эффекторная клетка может представлять собой любую из разнообразных иммунных эффекторных клеток, известных в данной области. Например, иммунная эффекторная клетка может быть представителем линии лимфоидных клеток человека, включая, без ограничения ими, Т-клетки (например цитотоксические Т-клетки), В-клетки и клетки естественных киллеров (NK). Иммунная эффекторная клетка также может быть, например и без ограничения ими, представителем миелоидной линии человека, включая, без ограничения ими, моноцит, нейтрофильный гранулоцит и дендритную клетку. Такие иммунные эффекторные клетки могут оказывать либо цитотоксический, либо апоптотический эффект на клетку-мишень или другой желательный эффект при активации посредством связывания эффекторного антигена.
Эффекторный антиген представляет собой антиген (например белок или полипептид), который экспрессируется на человеческой иммунной эффекторной клетке. Примеры эффекторных антигенов, которые могут быть связаны гетеродимерным белком (например гетеродимерным антителом или биспецифическим антителом), включают, без ограничения ими, человеческий CD3 (или CD3 (кластер дифференцировки) комплекс), CD16, NKG2D, NKp46, CD2, CD28, CD25, CD64 и CD89.
Целевая клетка может быть клеткой, которая является нативной или чужеродной для людей. В случае нативной целевой клетки, эта клетка может быть трансформирована в злокачественную клетку или патологически модифицирована (например нативная целевая клетка, инфицированная вирусом, плазмодием или бактерией). В случае чужеродной клетки-мишени, клетка представляет собой инвазивный патоген, такой как бактерия, плазмодий или вирус.
Целевой антиген экспрессируется на клетке-мишени при заболевании (например воспалительном заболевании, пролиферативном заболевании (например раке), иммунологическом расстройстве, неврологическом заболевании, нейродегенеративном заболеваним, аутоиммунном заболевании, инфекционном заболеваним (например при вирусной инфекции или паразитарной инфекции), аллергической реакции, реакции трансплантат против хозяина или реакции хозяина против трансплантата). Целевой антиген не является эффекторным антигеном. Примеры целевых антигенов включают, без ограничения ими, ВСМА, ЕрСАМ (молекула адгезии эпителиальных клеток), CCR5 (хемокиновый рецептор тип 5), CD19, HER (рецептор эпидермального фактора роста человека)-2/nеu, HER-3, HER-4, EGFR (рецептор эпидермального фактора роста), PSMA, СЕА, MUC-1 (муцин), MUC2, MUC3, MUC4, MUC5AC, MUC5B, MUC7, CIhCG, Lewis-Y, CD20, CD33, CD30, ганглиозид GD3, 9-О-ацетил-GD3, GM2, Globo Н, фукозил GM1, Poly SA, GD2, карбоангидраза IX (MN/CA IX), CD44v6, Shh (Звуковой еж), Wue-1, антиген плазматической клетки, (связанный с мембраной) IgE, MCSP (ассоциированный с меланомой хондроитинсульфат-протеогликан), CCR8, предшественник TNF-альфа, STEAP, мезотелин, антиген А33, PSCA (антиген стволовых клеток предстательной железы), Ly-6; десмоглеин 4, неоэпитоп Е-кадгерина, эмбриональный ацетилхолиновый рецептор, CD25, СА19-9 маркер, СА-125 маркер и MIS (мюллерова ингибирующая субстанция) рецептор типа II, sTn (сиалированный Tn-антиген; TAG-72), FAP (антиген активации фибробластов), эндосиалин, EGFRvIII, LG, SAS и CD63.
В некоторых воплощениях гетеродимерный белок (например биспецифическое антитело), как описано в данном документе, содержит полноразмерное человеческое антитело, где первый вариабельный антительный домен гетеродимерного белка способен осуществлять рекрутмент активности человеческой иммунной эффекторной клетки посредством специфического связывания с эффекторным антигеном (например антигеном CD3), находящимся на человеческой иммунной эффекторной клетке, где второй вариабельный антительный домен гетеродимерного белка способен специфически связываться с целевым антигеном (например антигеном CD20 или ЕрСАМ), где вариабельный домен первого и второго антитела гетеродимерного белка содержит аминокислотные модификации в положениях 223, 225 и 228 (например (С223Е или C223R), (E225R) и (Р228Е или P228R)) в шарнирной области и в положении 409 или 368 (например K409R или L368E (схема нумерации ЕС)) в области СН3 человеческого IgG2 (SEQ ID NO: 493).
В некоторых воплощениях вариабельные домены первого и второго антитела гетеродимерного белка содержат аминокислотные модификации в положениях 221 и 228 (например (D221R или D221E) и (P228R или Р228Е)) в шарнирной области и в положении 409 или 368 (например K409R или L368E (схема нумерации ЕС)) в области СН3 человеческого IgG1 (SEQ ID NO: 494).
В некоторых воплощениях первый и второй вариабельные домены антитела гетеродимерного белка содержат аминокислотные модификации в положениях 228 (например (Р228Е или P228R)) в шарнирной области и в положении 409 или 368 (например R409 или L368E (схема нумерации ЕС)) в области СН3 человеческого IgG4 (SEQ ID NO: 495).
В другом воплощении первый антительный вариабельный домен гетеродимерного белка содержит область VH, содержащую VH CDR1, VH CDR2 и VH CDR3 из последовательности VH, представленной в SEQ ID NO: 320, 322, 324, 326, 328, 330, 345, 347, 349, 351, 444, 354, 356, 378, 442, 380, 382, 384 386, 388, 390, 392, 394, 396, 398 или 400; и/или вариабельную область легкой цепи (VL), содержащую VL CDR1, VL CDR2 и VL CDR3 последовательности VL, представленной в SEQ ID NO: 319, 321, 323, 325, 327, 329, 344, 346, 348, 350, 352, 355, 377, 443, 445, 379, 381, 383, 385, 387, 389, 391, 393, 395, 397 или 399, и второй вариабельный антительный домен гетеродимерного белка содержит область VH, содержащую последовательность VH, представленную в SEQ ID NO: 2, 3, 7, 8, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 35, 37, 39, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 83, 87, 92, 95, 97, 99, 101, 104, 106, 110, 112, 114, 118, 120, 122, 125, 127, 313, 314, 363 или 365; и/или область VL, содержащую VL CDR1, VL CDR2 и VL CDR3 последовательности VL, представленной в SEQ ID NO: 1, 4, 5, 6, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 34, 36, 38, 40, 41, 43, 45, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75, 77, 79, 317, 81, 82, 84, 85, 86, 88, 89, 90, 91, 93, 94, 96, 98, 100, 102, 103, 105, 107, 108, 109, 111, 113, 115, 116, 117, 119, 121, 123, 124, 126, 128, 315 или 364.
В другом воплощении первый антительный вариабельный домен содержит вариабельную область тяжелой цепи (VH), содержащую VH CDR1, VH CDR2 и VH CDR3 из последовательности VH, представленной в SEQ ID NO: 324 или 388; и/или вариабельную область легкой цепи (VL), содержащую VL CDR1, VL CDR2 и VL CDR3 из последовательности VL, представленной в SEQ ID NO: 323 или 387; и второй антительный вариабельный домен содержит вариабельную область тяжелой цепи (VH), содержащую VH CDR1, VH CDR2 и VH CDR3 из последовательности VH, представленной в SEQ ID NO: 112; и/или вариабельную область легкой цепи (VL), содержащую VL CDR1, VL CDR2 и VL CDR3 из последовательности VL, представленной в SEQ ID NO: 38.
Антитела, используемые в настоящем изобретении, могут включать моноклональные антитела, поликлональные антитела, фрагменты антител (например Fab, Fab', F(ab')2, Fv, Fc и т.д.), химерные антитела, биспецифические антитела, гетероконъюгатные антитела, одноцепочечные (ScFv), их мутанты, слитые белки, содержащие антительную часть (например доменное антитело), гуманизированные антитела и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит антигенраспознающий сайт с нужной специфичностью, в том числе гликозилированнные варианты антител, варианты аминокислотной последовательности антител и ковалентно модифицированные антитела. Антитела могут быть мышиными, крысиными, человеческими или любого другого происхождения (в том числе химерными или гуманизированными антителами).
В некоторых воплощениях ВСМА- или CD3-антитело, как описано в данном документе, представляет собой моноклональное антитело. Например, ВСМА- или CD3-антитело представляет собой гуманизированное моноклональное антитело или химерное моноклональное антитело.
В некоторых воплощениях антитело содержит модифицированную константную область, такую как, например и без ограничения, константная область, которая обладает повышенным потенциалом индукции иммунного ответа. Например, константная область может быть модифицирована для увеличения аффинности к Fc-гамма-рецептору, такому как, например, FcγRI, FcγRIIA или FcγIII.
В некоторых воплощениях антитело содержит модифицированную константную область, такую как константная область, которая является иммунологически инертной, то есть имеет уменьшенный потенциал индукции иммунного ответа. В некоторых воплощениях константная область модифицирована, как описано в Eur. J. Immunol., 29:2613-2624, 1999; в заявке PCT/GB 99/01441; и/или в патентной заявке UK 98099518. Fc может представлять собой IgG1 человека, IgG2 человека, IgG3 человека или IgG4 человека. Fc может представлять собой IgG2 человека, содержащий мутацию А330Р331 - S330S331 (IgG2Δa), где аминокислотные остатки пронумерованы на основании последовательности IgG2 дикого типа. Eur. J. Immunol., 29:2613-2624, 1999. В некоторых воплощениях антитело содержит константную область IgG4, содержащую следующие мутации (Armour et al., Molecular Immunology 40 585-593, 2003): E233F234L235 - P233V234A235 (IgG4Δc), где нумерацию выполняют на основании IgG4 дикого типа. В другом воплощении Fc представляет собой IgG4 E233F234L235 - P233V234A235 с делецией G236 (IgG4Δb). В другом воплощении Fc представляет собой любой человеческий IgG4 Fc (IgG4, IgG4Δb или IgG4Δc), содержащий стабилизирующую шарнир мутацию S228 - Р228 (Aalberse et al., Immunology 105, 9-19, 2002). В другом воплощении Fc может представлять собой агликозилированный Fc.
В некоторых воплощениях константная область является агликозилированной в результате мутации остатка присоединения олигосахарида (такого как Asn297) и/или фланкирующих остатков, которые являются частью последовательности распознавания гликозилирования в константной области. В некоторых воплощениях константная область агликозилирована для N-связанного гликозилирования энзиматически. Константная область может быть агликозилирована для N-связанного гликозилирования энзиматически или посредством экспрессии в клетке-хозяине с дефектом гликозилирования.
В некоторых воплощениях константная область имеет модифицированную константную область с удаленным или пониженным связыванием Fc-гамма-рецептора. Например, Fc может представлять собой человеческий IgG2, содержащий мутацию D265, где аминокислотные остатки пронумерованы на основании последовательности IgG2 дикого типа (SEQ ID NO: 493). Соответственно, в некоторых воплощениях константная область имеет модифицированную константную область, имеющую последовательность, представленную в SEQ ID NO: 496:

В некоторых воплощениях константная область имеет модифицированную константную область, имеющую последовательность, представленную в SEQ ID NO: 497:

Одним из способов определения аффинности связывания антител с ВСМА или CD3 является измерение аффинности связывания монофункциональных Fab-фрагментов антитела. Для получения монофункциональных Fab-фрагментов, антитело (например IgG) можно расщепить папаином или рекомбинантно экспрессировать. Аффинность ВСМА Fab-фрагмента антитела можно определить с помощью поверхностного плазмонного резонанса (система поверхностного плазмонного резонанса (SPR) Biacore™3000™, Biacore™, INC, Piscataway NJ), оснащенного сенсорными чипами с предварительно иммобилизованным стрептавидином (SA) или анти-мышиным Fc или анти-человеческим Fc с использованием электродного буфера HBS-EP (0,01 М HEPES, рН 7,4, 0,15 NaCl, 3 мМ EDTA, 0,005% об./об. ПАВ Р20). Биотинилированный или Fc-слитый человеческий ВСМА может быть разбавлен в буфере HBS-EP до концентрации менее 0,5 мкг/мл и введен через отдельные каналы чипов с использованием переменного времени контакта для достижения двух диапазонов плотности антигена, либо 50-200 единиц ответа (RU) для детального кинетического исследования, либо 800-1000 RU для скрининговых анализов. Исследования регенерации показали, что 25 мМ NaOH в 25% об./об. этаноле эффективно удаляет связанный Fab при сохранении активности ВСМА на чипе в течение более чем 200 введений. Как правило, серийные разведения (концентрации, охватывающие диапазон 0,1-10х прогнозируемое значение KD) очищенных образцов Fab вводят в течение 1 мин со скоростью 100 мкл/минута и обеспечивают время диссоциации вплоть до 2 часов. Концентрации белков Fab определяют посредством ELISA и/или SDS-PAGE электрофореза, используя Fab с известной концентрацией (определенной посредством аминокислотного анализа) в качестве стандарта. Кинетические скорости ассоциации (kon) и скорости диссоциации (koff) получают одновременно путем аппроксимации данных в целом к модели связывания Ленгмюра 1:1 (Karlsson, R. Roos, H. Fagerstam, L Petersson, B. (1994). Methods Enzymology 6. 99-110) с использованием программы BIAevaluation. Значения равновесной константы диссоциации (KD) рассчитывают как koff/kon. Этот протокол подходит для использования в определении аффинности связывания антитела с любым ВСМА, в том числе человеческим ВСМА, ВСМА другого млекопитающего (например мышиным ВСМА, крысиным ВСМА или ВСМА примата), а также с разными формами ВСМА (например гликозилированным ВСМА). Аффинность связывания антитела обычно измеряют при 25°С, но также можно измерять при 37°С.
Антитела, как описано в данном документе, могут быть получены посредством любого известного в данной области метода. Для получения гибридомных клеточных линий, способ и схема иммунизации животного-хозяина обычно соответствуют установленным и общепринятым методам стимуляции и продуцирования антител, как описано далее в данном документе. Общие техники получения человеческих и мышиных антител известны в данной области и/или описаны в данном документе.
Предполагается, что можно производить манипуляции с любым млекопитающим субъектом, включая человека или его клетки, продуцирующие антитела, в качестве основы для получения клеточных линий млекопитающих, включая человека, и клеточных линий гибридом. Как правило, животное-хозяин инокулируют внутрибрюшинно, внутримышечно, перорально, подкожно, внутриподошвенно и/или внутрикожно некоторым количеством иммуногена, включая описанное в данном документе.
Гибридомы могут быть получены из лимфоцитов и иммортализованных клеток миеломы с использованием общей методики гибридизации соматических клеток из Kohler, В. and Milstein, С., Nature 256:495-497, 1975 или в модификации Buck, D.W., et al., In Vitro, 18:377-381, 1982. Для гибридизации можно использовать имеющиеся линии миеломы, включая, без ограничения ими, Х63-Ag8.653 и линии из Salk Institute, Cell Distribution Center, San Diego, Calif., USA. Как правило, методика включает слияние клеток миеломы и лимфоидных клеток с использованием фузогенного агента, такого как полиэтиленгликоль, или электрических средств, хорошо известных специалистам в данной области. После слияния клетки отделяют от среды слияния и выращивают в селективной среде роста, такой как среда гипоксантин-аминоптерин-тимидин (HAT), для удаления негибридизированных родительских клеток. Для культивирования гибридом, которые секретируют моноклональные антитела, можно использовать любую среду, описанную в данном документе, с добавлением или без добавления сыворотки. В качестве другой альтернативы методике слияния клеток, для получения моноклональных антител по настоящему изобретению можно использовать иммортализованные в помощью EBV (вирус Эпштейна-Барр) В-клетки. Гибридомы размножают и субклонируют, если необходимо, и супернатанты анализируют на антииммуногенную активность посредством обычных методов иммуноанализа (например радиоиммуноанализа, иммуноферментного анализа или флуоресцентного иммуноанализа).
Гибридомы, которые можно использовать в качестве источника антител, включают все производные, клетки потомства родительских гибридом, которые продуцируют моноклональные антитела, специфичные к ВСМА, CD3, или их фрагменты.
Гибридомы, которые продуцируют такие антитела, могут быть выращены in vitro или in vivo с использованием известных процедур. Моноклональные антитела могут быть выделены из культуральной среды или жидкостей организма с помощью обычных методик очистки иммуноглобулина, таких как осаждение сульфатом аммония, гель-электрофорез, диализ, хроматография и ультрафильтрация, если это необходимо. Нежелательная активность, если она присутствует, может быть удалена, например, посредством пропускания препарата над адсорбентами, образованными из иммуногена, присоединенного к твердой фазе, и элюирования или отделения нужных антител от этого иммуногена. В результате иммунизации животного-хозяина человеческим ВСМА или CD3, или фрагментом, содержащим целевую аминокислотную последовательность, конъюгированную с белком, который является иммуногенным для иммунизируемых видов, например гемоцианином лимфы улитки, сывороточным альбумином, бычьим тиреоглобулином или соевым ингибитором трипсина, с использованием бифункционального или дериватизирующего агента, например малеимидобензоил-сульфосукцинимидного сложного эфира (конъюгирование через остатки цистеина), N-гидроксисукцинимида (через остатки лизина), глутарового альдегида, янтарного ангидрида, SOCl2 или R1N=С=NR, где R и R1 представляют собой разные алкильные группы, можно получить популяцию антител (например моноклональных антител).
Если желательно, интересующее антитело (моноклональное или поликлональное) может быть секвенировано, и полинуклеотидная последовательность затем может быть клонирована в вектор для экспрессии или размножения. Последовательность, кодирующая интересующее антитело, может поддерживаться в векторе в клетке-хозяине, и затем клетка-хозяин может быть размножена и заморожена для будущего использования. Получение рекомбинантных моноклональных антител в клеточной культуре может быть осуществлено путем клонирования генов антител из В-клеток способами, известными в данной области. См., например Tiller et al., J. Immunol. Methods 329, 112, 2008; патент US 7314622.
В альтернативном варианте полинуклеотидная последовательность может быть использована для генетических манипуляций для "гуманизации" антитела или для улучшения аффинности или других характеристик антитела. Например, константная область может быть сконструирована таким образом, чтобы больше напоминать человеческие константные области, чтобы избежать иммунного ответа, если антитело используют в клинических испытаниях и в лечении людей. Может быть желательно генетически манипулировать с последовательностью антитела для получения большей аффинности к ВСМА или CD3 и большей эффективности ингибирования ВСМА.
Существуют четыре основных стадии гуманизации моноклонального антитела. Это: (1) определение нуклеотидной и прогнозируемой аминокислотной последовательности вариабельных доменов легкой и тяжелой цепи исходного антитела; (2) конструирование гуманизированного антитела, то есть принятие решения, какую каркасную область антитела использовать в процессе гуманизации; (3) фактические методики/способы гуманизации и (4) трансфекция и экспрессия гуманизированного антитела. См., например, патенты US 4816567; 5807715; 5866692; 6331415; 5530101; 5693761; 5693762; 5585089; и 6180370.
Был описан ряд молекул "гуманизированного" антитела, содержащих антигенсвязывающий сайт, происходящий из иммуноглобулина, не являющегося человеческим, в том числе химерные антитела, имеющие V-участки грызунов или модифицированные V-участки грызунов и ассоциированные с ними CDR, слитые с человеческими константными областями. См., например, Winter et al. Nature 349:293-299, 1991, Lobuglio et al. Proc. Nat. Acad. Sci. USA 86:4220-4224, 1989, Shaw et al. J Immunol. 138:4534-4538, 1987, и Brown et al. Cancer Res. 47:3577-3583, 1987. Другие документы описывают CDR грызунов, встроенные в поддерживающую каркасную область (FR) человека перед слиянием с соответствующей константной областью человеческого антитела. См., например, Riechmann et al. Nature 332:323-327, 1988, Verhoeyen et al. Science 239:1534-1536, 1988, и Jones et al. Nature 321:522-525, 1986, В другом документе описаны CDR грызунов, поддерживаемые рекомбинантно сконструированными каркасными областями грызунов. См., например, европейскую патентную публикацию 0519596. Эти "гуманизированные" молекулы сконструированы так, чтобы свести к минимуму нежелательный иммунологический ответ на молекулы антитела грызунов против человека, который ограничивает длительность и эффективность терапевтического применения этих группировок у реципиентов-людей. Например, константная область антитела может быть сконструирована так, что она является иммунологически инертной (например не вызывает комплементарный лизис). См., например публикацию PCT/GB 99/01441; патентную заявку UK 9809951.8. Другие способы гуманизации антител, которые также можно использовать, раскрыты в Daugherty et al., Nucl. Acids Res. 19:2471-2476, 1991, и в патентах США 6180377; 6054297; 5997867; 5866692; 6210671; и 6350861; и в РСТ публикации WO 01/27160.
Общие принципы, относящиеся к гуманизированным антителам, рассмотренным выше, также применимы для приспособления антител к применению, например, у собак, кошек, приматов, лошадей и коров. Кроме того, один или более аспектов гуманизации антитела, описанные в данном документе, можно комбинировать, например, с прививкой CDR, мутацией каркасной области и мутацией CDR.
В одном варианте полностью человеческие антитела могут быть получены с использованием имеющихся в продаже мышей, которые были сконструированы для экспрессии конкретных человеческих иммуноглобулиновых белков. Трансгенные животные, которые созданы для получения более желательных (например полностью человеческих антител) или более надежного иммунного ответа, также можно использовать для образования гуманизированных или человеческих антител. Примерами такой технологии являются Xenomouse™ от Abgenix, Inc. (Fremont, CA) и HuMAb-Mouse® и ТС Mouse™ от Medarex, Inc. (Princeton, NJ).
Альтернативно, антитела могут быть получены рекомбинантно и экспрессированы с использованием любого известного в данной области способа. В другом варианте антитела могут быть получены рекомбинантно с помощью технологии фагового дисплея. См., например, патенты US 5565332; 5580717; 5733743 и 6265150; и Winter et al., Annu. Rev. Immunol. 12:433-455, 1994. В качестве альтернативы может быть использована технология фагового дисплея (McCafferty et al., Nature 348:552-553, 1990) для получения человеческих антител и фрагментов антител in vitro из репертуаров генов вариабельных (V) доменов иммуноглобулина от неиммунизированных доноров. Согласно этой методике гены V-домена антитела клонируют в рамке считывания в ген основного или минорного белка оболочки нитевидного бактериофага, такого как М13 или fd, и экспонируют в виде функциональных фрагментов антитела на поверхности фаговой частицы. Поскольку нитевидная частица содержит одноцепочечную копию ДНК фагового генома, селекция, основанная на функциональных свойствах антитела, также приводит к селекции гена, кодирующего антитело, проявляющее эти свойства. Таким образом, фаг имитирует некоторые свойства В-клеток. Фаговый дисплей может быть осуществлен в различных форматах; обзора см., например, в Johnson, Kevin S. and Chiswell, David J., Current Opinion in Structural Biology 3:564-571, 1993. Для фагового дисплея можно использовать несколько источников сегментов V-гена. В Clackson et al., Nature 352:624-628, 1991 выделяли разнотипное множество антиоксазолоновых антител из небольшой случайной комбинаторной библиотеки V-генов, полученных из селезенок иммунизированных мышей. Можно создать репертуар V-генов от неиммунизированных доноров-людей и антитела к разнотипному множеству антигенов (включая аутоантигены) могут быть выделены, главным образом, в соответстии с методами, описанными в Mark et al., J. Mol. Biol. 222:581-597, 1991 или Griffith et al., EMBO J. 12:725-734, 1993. В случае естественного иммунного ответа в генах антитела мутации накапливаются с высокой скоростью (соматическая гипермутация). Некоторые введенные изменения будут придавать более высокую аффинность, и во время последующей антигенной стимуляции преимущественно реплицируются и дифференцируются В-клетки, экспонирующие высокоаффинный поверхностный иммуноглобулин. Этот естественный процесс можно имитировать, используя методику, известную как "перестановка цепей". (Marks et al., Bio/Technol. 10:779-783, 1992). В этом методе аффинность "первичных" человеческих антител, полученных посредством фагового дисплея, может быть улучшена посредством последовательной замены генов V-области тяжелой и легкой цепи репертуарами естественных вариантов (репертуаров) генов V-доменов, полученных от неиммунизированных доноров. Эта методика позволяет получать антитела и фрагменты антител с аффинностью в диапазоне пМ-нМ. Стратегия создания очень большого репертуара фаговых антител (также известных как "the mother-of-all libraries") описана в Waterhouse et al., Nucl. Acids Res. 21:2265-2266, 1993. Перестановку генов также можно быть использовать для получения производных человеческих антител из антител грызунов, где человеческое антитело имеет аффинности и специфичности, аналогичные исходному антителу грызунов. Согласно этому методу, который также называют "эпитопным импринтингом", ген V-домена тяжелой или легкой цепи антител грызунов, полученный методом фагового дисплея, заменяют репертуаром генов V-домена человека, создавая химеры грызун-человек. Отбор по антигену приводит к выделению человеческих вариабельных областей, способных восстанавливать функциональный антигенсвязывающий сайт, то есть эпитоп управляет (осуществляет импринтинг) выбором партнера. Когда процесс повторяют, чтобы заменить оставшийся V-домен грызунов, получают человеческое антитело (см. РСТ публикацию WO 93/06213). В отличие от традиционной гуманизации антител грызунов посредством прививки CDR, этот метод обеспечивает полностью человеческие антитела, которые не имеют каркасных или CDR-остатков, происходящих из грызунов.
Антитела могут быть получены рекомбинантным путем посредством выделения сначала антител и антитело-продуцирующих клеток из животных-хозяев, получения последовательности гена и использования последовательности гена для рекомбинантной экспрессии антитела в клетках-хозяевах (например в клетках СНО). Другим методом, который может быть использован, является экспрессия последовательности антитела в растениях (например в табаке) или в трансгенном молоке. Были раскрыты методы рекомбинантной экспрессии антител в растениях или молоке. См., например, Peeters, et al. Vaccine 19:2756, 2001; Lonberg, N. and D. Huszar Int. Rev. Immunol 13:65, 1995; и Pollock, et al., J Immunol Methods 231:147, 1999. Способы получения производных антител, например гуманизированных, одноцепочечных и т.д., известны в данной области.
Методы иммуноанализа и сортировки посредством проточной цитометрии, такие как сортировка флуоресцентно-активированных клеток (FACS), также можно использовать для выделения антител, специфичных к ВСМА, CD3 или опухолевым антигенам, представляющим интерес.
Антитела, описанные в данном документе, могут быть связаны со многими разными носителями. Носители могут быть активными и/или инертными. Примеры хорошо известных носителей включают полипропилен, полистирол, полиэтилен, декстран, нейлон, амилазы, стекло, природные и модифицированные целлюлозы, полиакриламиды, агарозы и магнетит. Для целей изобретения носитель может быть либо растворимым, либо нерастворимым. Специалисты в данной области техники знают другие подходящие носители для связывания антител или смогут установить их, используя рутинные эксперименты. В некоторых воплощениях носитель содержит группировку, которая нацелена на миокард.
ДНК, кодирующую моноклональные антитела, легко выделяют и секвенируют с использованием обычных процедур (например, используя олигонуклеотидные зонды, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи моноклональных антител). Клетки гибридомы служат предпочтительным источником такой ДНК. После выделения ДНК может быть помещена в экспрессионные векторы (такие как экспрессионные векторы, раскрытые в РСТ публикации WO 87/04462), которые затем трансфицируют в клетки-хозяева, такие как клетки Е. coli, клетки COS обезьян, клетки яичников китайского хомяка (СНО) или миеломные клетки, которые иначе не продуцируют белок иммуноглобулина, для получения синтеза моноклональных антител в рекомбинантных клетках-хозяевах. См., например, РСТ публикацию WO 87/04462. ДНК также может быть модифицирована, например, путем замены последовательностями, кодирующими константные области тяжелой и легкой цепи человека, гомологичных последовательностей мыши, см. Morrison et al., Proc. Nat. Acad. Sci. 81:6851, 1984, или путем ковалентного присоединения к последовательности, кодирующей иммуноглобулин, всей или части последовательности, кодирующей неиммуноглобулиновый полипептид. Таким образом получают "химерные" или "гибридные" антитела, которые в данном изобретении обладают специфичностью связывания моноклональных антител.
Антитела к ВСМА или к интересующему опухолевому антигену, как описано в данном документе, могут быть идентифицированы или охарактеризованы с использованием методов, известных в данной области, посредством которых определяют и/или измеряют снижение уровней экспрессии ВСМА или другого опухолевого антигена. В некоторых воплощениях ВСМА-антитело идентифицируют путем инкубации агента-кандидата с ВСМА и наблюдения за связыванием и/или сопутствующим уменьшением уровней экспрессии ВСМА. Анализ связывания может быть проведен с очищенным(и) ВСМА-полипептидом(ами) или с клетками, естественно экспрессирующими или трансфицированными для экспрессии ВСМА-полипептида(ов). В одном воплощении анализ связывания представляет собой конкурентный анализ связывания, где оценивают способность антитела-кандидата конкурировать с известным ВСМА-антителом за связывание с ВСМА. Этот анализ может быть выполнен в различных форматах, включая формат ELISA.
После первоначальной идентификации активность антитела-кандидата к ВСМА, CD3 или другому опухолевому антигену может быть дополнительно подтверждена и уточнена с помощью биоанализов, которые, как известно, тестируют целевые биологические активности. Альтернативно, биоанализы можно использовать для прямого скрининга кандидатов. Некоторые способы идентификации и характеристики антител подробно описаны в Примерах.
Антитела к ВСМА, CD3 или другому опухолевому антигену могут быть охарактеризованы с использованием хорошо известных в данной области методов. Например, один метод состоит в том, чтобы идентифицировать эпитоп, с которым оно связывается, или "картировать эпитопы". Существует много способов, известных в данной области техники, для картирования и характеристики местонахождения эпитопов в белках, включающих растворение кристаллической структуры комплекса антитело-антиген, конкурентные анализы, анализы экспрессии генных фрагментов, и анализы на основе синтетических пептидов, как описано, например, в главе 11 в Harlow and Lane, Using Antibodies, a Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1999. В дополнительном примере картирование эпитопов можно использовать для определения последовательности, с которой связывается антитело. Картирование эпитопов коммерчески доступно в различных источниках, например в Pepscan Systems (Edelhertweg 15, 8219 PH Lelystad, The Netherlands). Эпитоп может быть линейным эпитопом, то есть содержащимся в одном аминокислотном участке, или конформационным эпитопом, образованным трехмерным взаимодействием аминокислот, которые не обязательно могут находиться в одном участке. Пептиды различной длины (например по меньшей мере 4-6 аминокислот длиной) могут быть выделены или синтезированы (например рекомбинантно) и использованы для анализов связывания с антителами к ВСМА, CD3 или другому опухолевому антигену. В другом примере эпитоп, с которым связываются антитела к ВСМА, CD3 или другому опухолевому антигену, может быть определен в систематическом скрининговом анализе с использованием перекрывающихся пептидов, полученных из последовательности ВСМА, CD3 или другого опухолевого антигена, и определения связывания антителом к ВСМА, CD3 или другому опухолевому антигену. В соответствии с анализами экспрессии фрагмента гена, открытую рамку считывания, кодирующую ВСМА, CD3 или другой опухолевый антиген, фрагментируют либо случайным образом, либо с помощью определенных генетических конструкций и определяют реакционную способность экспрессированных фрагментов ВСМА, CD3 или другого опухолевого антигена с тестируемым антителом. Фрагменты гена могут быть получены, например, с помощью ПЦР, а затем транскрибированы и транслированы в белок in vitro, в присутствии радиоактивных аминокислот. Связывание антитела с радиоактивно мечеными фрагментами ВСМА, CD3 или другого опухолевого антигена затем определяют с помощью иммунопреципитации и гель-электрофореза. Некоторые эпитопы также могут быть идентифицированы с использованием больших библиотек случайных пептидных последовательностей, экспонируемых на поверхности фаговых частиц (фаговые библиотеки). Альтернативно, определенную библиотеку перекрывающихся пептидных фрагментов можно проанализировать на связывание с тестируемым антителом в простых анализах связывания. В дополнительном примере мутагенез антигенсвязывающего домена, эксперименты по замене доменов и аланин-сканирующий мутагенез могут быть выполнены для идентификации остатков, желательных, достаточных и/или необходимых для связывания эпитопа. Например, эксперименты по замене домена могут быть выполнены с использованием мутантного ВСМА, CD3 или другого опухолевого антигена, в которых различные фрагменты белка ВСМА, CD3 или другого опухолевого антигена замещены (заменены) последовательностями ВСМА из других видов (например мыши) или близкородственного, но антигенно отличающегося белка (например Trop-1). Оценивая связывание антитела с мутантным ВСМА, CD3 или другим опухолевым антигеном, можно оценить значение конкретного фрагмента ВСМА, CD3 или другого опухолевого антигена для связывания с антителом.
Еще одним методом, который можно использовать для характеристики антител к ВСМА, CD3 или другому опухолевому антигену является использование конкурентных анализов с другими антителами, которые, как известно, связываются с тем же антигеном, то есть с различными фрагментами на ВСМА, CD3 или другом опухолевом антигене, чтобы определить, связывается ли антитело к ВСМА, CD3 или другому опухолевому антигену с тем же эпитопом, что и другие антитела. Конкурентный анализ хорошо известен специалистам в данной области.
Экспрессионный вектор можно использовать для непосредственной экспрессии антитела к ВСМА, CD3 или другому опухолевому антигену. Специалист в данной области знаком с введением экспрессионных векторов для получения экспрессии экзогенного белка in vivo. См., например, патенты US 6436908; 6413942; и 6376471. Введение экспрессионных векторов включает локальное или системное введение, включающее инъекцию, пероральное введение, генную пушку или введение через катетер, и местное введение. В другом воплощении экспрессионный вектор вводят непосредственно в симпатический ствол, или нервный узел, или в коронарную артерию, предсердие, желудочек сердца или перикард.
Также можно использовать направленную доставку терапевтических композиций, содержащих экспрессионный вектор или субгеномные полинуклеотиды. Методы рецептор-опосредованной доставки ДНК описаны, например, в Findeis et al., Trends Biotechnol., 1993, 11:202; Chiou et al., Gene Therapeutics: Methods And Applications Of Direct Gene Transfer, J.A. Wolff, ed., 1994; Wu et al., J. Biol. Chem., 263:621, 1988; Wu et al., J. Biol. Chem., 269:542, 1994; Zenke et al., Proc. Natl. Acad. Sci. USA, 87:3655, 1990; и Wu et al., J. Biol. Chem., 266:338, 1991. Терапевтические композиции, содержащие полинуклеотид, вводят в диапазоне от примерно 100 нг до примерно 200 мг ДНК для локального введения в протоколе генной терапии. В протоколе генной терапии также можно использовать диапазон концентрации от примерно 500 нг до примерно 50 мг, от примерно 1 мкг до примерно 2 мг, от примерно 5 мкг до примерно 500 мкг, и от примерно 20 мкг до примерно 100 мкг ДНК. Терапевтические полинуклеотиды и полипептиды могут быть доставлены с использованием носителей для доставки генов. Носитель для доставки гена может иметь вирусное или невирусное происхождение (см. в общих чертах Jolly, Cancer Gene Therapy, 1:51, 1994; Kimura, Human Gene Therapy, 5:845, 1994; Connelly, Human Gene Therapy, 1995, 1:185; и Kaplitt, Nature Genetics, 6:148, 1994). Экспрессию таких кодирующих последовательностей можно индуцировать, используя эндогенные промоторы млекопитающих или гетерологичные промоторы. Экспрессия кодирующей последовательности может быть конститутивный или регулируемой.
Вирусные векторы для доставки нужного полинуклеотида и экспрессии в нужной клетке хорошо известны в данной области. Типичные вирусные векторы включают, без ограничения ими, рекомбинантные ретровирусы (см., например, РСТ публикации WO 90/07936; WO 94/03622; WO 93/25698; WO 93/25234; WO 93/11230; WO 93/10218; WO 91/02805; патенты US 5219740 и 4777127; патент Великобритании 2200651; и патент ЕР 0345242), альфавирусные векторы (например векторы на основе вируса Синдбис, вируса леса Семлики (АТСС VR-67; АТСС VR-1247), векторы на основе вируса реки Росс (АТСС VR-373; АТСС VR-1246) и вируса венесуэльского энцефалита лошадей (АТСС VR-923; АТСС VR-1250; АТСС VR 1249; АТСС VR-532)), и аденоассоциированного вируса (AAV) (см., например, РСТ публикации WO 94/12649, WO 93/03769; WO 93/19191; WO 94/28938; WO 95/11984 и WO 95/00655). Также можно использовать введение ДНК, присоединенной к инактивированному аденовирусу, как описано в Curiel, Hum. Gene Ther., 1992, 3:147.
Также могут быть использованы невирусные носители и способы доставки, включая, без ограничения ими, поликатионную конденсированную ДНК, связанную или несвязанную с инактивированным аденовирусом (см., например, Curiel, Hum. Gene Ther., 3:147, 1992); лиганд-связанную ДНК (см., например, Wu, J. Biol. Chem., 264:16985, 1989); носители для доставки на основе эукариотических клеток (см., например, патент US 5814482; публикации РСТ WO 95/07994; WO 96/17072; WO 95/30763; и WO 97/42338) и нейтрализацию зарядов нуклеиновой кислоты или слияние с клеточными мембранами. Также можно использовать голую ДНК. Типичные способы введения голой ДНК описаны в РСТ публикации WO 90/11092 и патенте US 5580859. Липосомы, которые могут действовать как носители для доставки генов, описаны в патенте US 5422120; РСТ публикациях WO 95/13796; WO 94/23697; WO 91/14445; и ЕР 0524968. Дополнительные подходы описаны в Philip, Mol. Cell Biol., 14:2411, 1994 и в Woffendin, Proc. Natl. Acad. Sci., 91:1581, 1994.
В некоторых воплощениях изобретение охватывает композиции, включающие фармацевтические композиции, содержащие антитела, описанные в данном документе, или полученные посредством способов, описанных в данном документе, и имеющие характеристики, описанные в данном документе. При использовании в данном документе, композиции содержат одно или более антител, которые связываются с CD3 и опухолевым антигеном (например ВСМА), и/или один или более полинуклеотидов, содержащих последовательности, кодирующие одно или более этих антител. Эти композиции могут дополнительно содержать подходящие эксципиенты, такие как фармацевтически приемлемые эксципиенты, включающие буферы, которые хорошо известны в данной области.
В данном изобретении также предложены способы получения любого из этих антител. Антитела по настоящему изобретению могут быть получены способами, известными в данной области. Полипептиды могут быть получены посредством протеолитического или другого расщепления антител, рекомбинантными способами (то есть одиночные или слитые полипептиды), как описано выше, или посредством химического синтеза. Полипептиды антител, особенно короткие полипептиды вплоть до примерно 50 аминокислот, успешно изготавливают посредством химического синтеза. Способы химического синтеза известны в данной области и коммерчески доступны. Например, антитело может быть получено с помощью автоматического полипептидного синтезатора, использующего твердофазный метод. См. также патенты US 5807715; 4816567 и 6331415.
Гетероконъюгатные антитела, содержащие два ковалентно соединенных антитела, также входят в объем изобретения. Такие антитела используют для нацеливания клеток иммунной системы на нежелательные клетки (патент US 4676980) и для лечения ВИЧ-инфекции (РСТ публикации WO 91/00360 и WO 92/200373; ЕР 03089). Гетероконъюгатные антитела могут быть получены с использованием любых подходящих методов перекрестного связывания. Подходящие агенты перекрестного связывания и методы хорошо известны в данной области и описаны в патенте US 4676980.
Химерные или гибридные антитела также могут быть получены in vitro с использованием известных методов химии синтетического белка, включая те, в которые вовлечены сшивающие агенты. Например, иммунотоксины могут быть сконструированы с использованием реакции дисульфидного обмена или путем образования тиоэфирной связи. Примеры подходящих реагентов для этой цели включают иминотиолат и метил-4-меркаптобутиримидат.
В рекомбинантных гуманизированных антителах часть Fcγ может быть модифицирована, чтобы избежать взаимодействия с рецептором Fcγ и с системой комплемента и иммунной системой. Способы получения таких антител описаны в WO 99/58572. Например, константная область может быть сконструирована так, чтобы больше напоминать человеческие константные области, чтобы избежать иммунного ответа при использовании антител в клинических испытаниях и в лечении людей. См., например, патенты US 5997867 и 5866692.
Изобретение охватывает модификации антител и полипептидов согласно вариантам по изобретению, как описано в данном документе, включая функционально эквивалентные антитела, которые не оказывают существенного влияния на их свойства, и варианты, которые имеют повышенную или пониженную активность и/или аффинность. Например, аминокислотная последовательность может быть мутирована с получением антитела с нужной аффинностью связывания с ВСМА и/или CD3. Модификация полипептидов является обычной практикой в данной области и не нуждается в подробном описании в настоящем документе. Примеры модифицированных полипептидов включают полипептиды с консервативными заменами аминокислотных остатков, одной или более делениями или добавлениями аминокислот, которые не оказывают существенного негативного влияния на функциональную активность, или те, у которых созревает (повышается) аффинность полипептида к его лиганду, или использование химических аналогов.
Вставки в аминокислотную последовательность включают амино- и/или карбокси-концевые слияния, длина которых варьируется от одного остатка до полипептидов, содержащих сто или более остатков, а также вставки в последовательность одного или нескольких аминокислотных остатков. Примеры концевых вставок включают антитело с N-концевым метионильным остатком или антитело, слитое с эпитопным тегом. Другие варианты вставки в молекулу антитела включают слияние с N- или С-концами антитела фермента или полипептида, который увеличивает время полувыведения антитела в кровотоке.
Варианты замены включают удаление по меньшей мере одного аминокислотного остатка в молекуле антитела и вставку другого остатка на его место. Сайты, представляющие наибольший интерес для замещающего мутагенеза включают гипервариабельные участки, но также предполагаются изменения FR. Консервативные замены показаны в Таблице 5 под заголовком "консервативные замены". Если такие замены приводят к изменению биологической активности, тогда могут быть введены более значительные изменения, называемые "типичные замещения" в Таблице 5 или, как дополнительно описано ниже в ссылке на аминокислотные классы, и продукты подвергают скринингу.
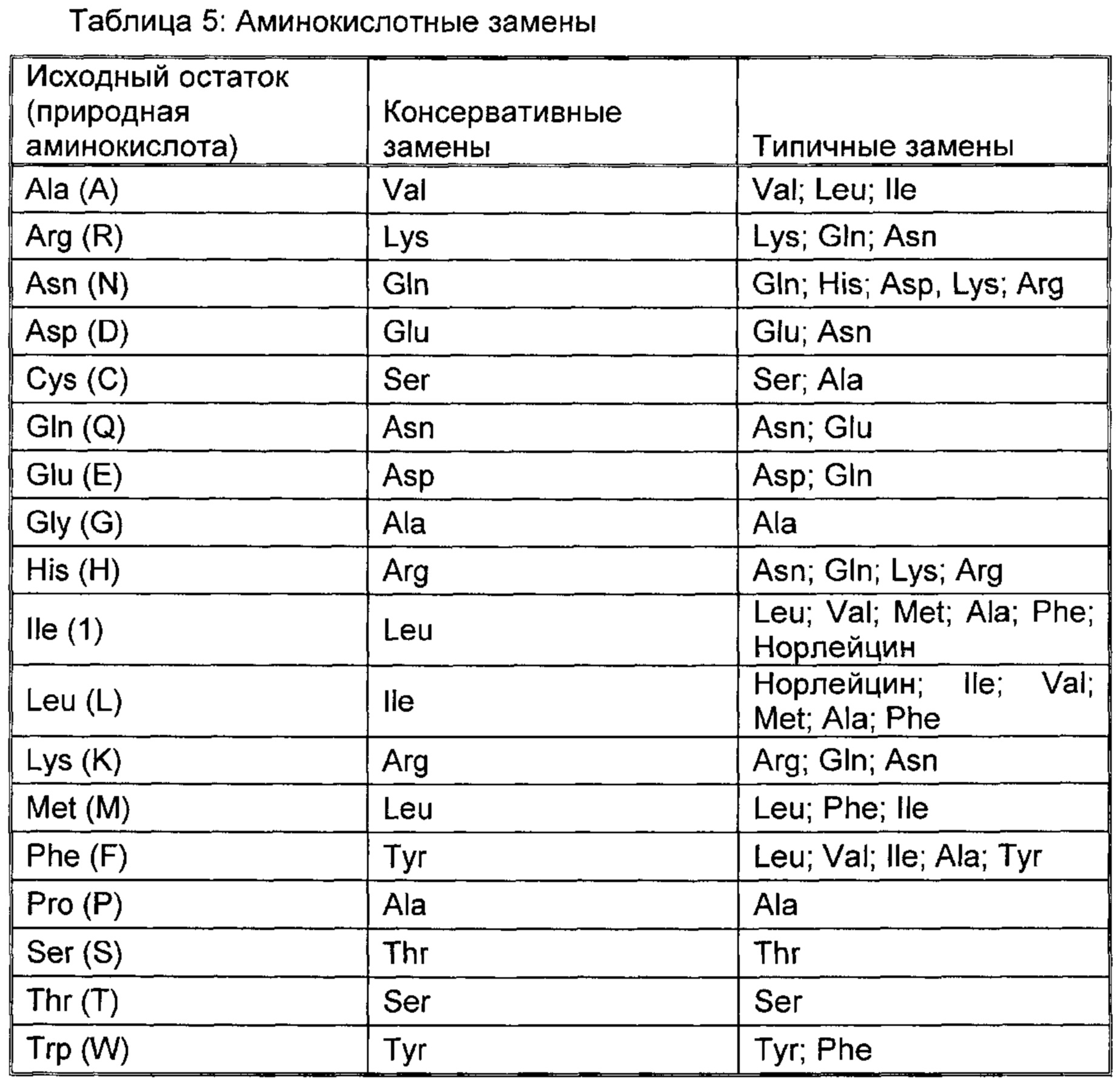

Существенные изменения в биологических свойствах антитела осуществляют путем выбора замен, которые существенно различаются по их влиянию на поддержание (а) структуры полипептидного остова в области замены, например складчатой или спиральной конформации, (б) заряда или гидрофобности молекулы в целевом сайте, или (в) величины боковой цепи. Природные аминокислотные остатки делятся на группы, основанные на общих свойствах боковой цепи:
(1) Неполярные: Норлейцин, Met, Ala, Val, Leu, Ile;
(2) Полярные без заряда: Cys, Ser, Thr, Asn, Gln;
(3) Кислые (отрицательно заряженные): Asp, Glu;
(4) Щелочные (положительно заряженные): Lys, Arg;
(5) Остатки, которые влияют на ориентацию цепей: Gly, Pro; и
(6) Ароматические: Trp, Tyr, Phe, His.
Неконсервативные замены осуществляют путем замены представителя одного из этих классов на представителя другого класса.
Любой остаток цистеина, не вовлеченный в поддержание надлежащей конформации антитела, также может быть заменен, обычно серином, чтобы улучшить окислительную стабильность молекулы и предотвратить аберрантное перекрестное сшивание. Напротив, цистеиновая(ые) связь(и) может(гут) быть добавлена(ы) к антителу для улучшения его стабильности, особенно когда антитело представляет собой фрагмент антитела, такой как фрагмент Fv.
Аминокислотные модификации могут варьироваться от замены или модификации одной или более аминокислот до полной реконструкции области, такой как вариабельная область. Изменения в вариабельной области могут менять аффинность связывания и/или специфичность. В некоторых воплощениях в домене CDR производят не более одной-пяти консервативных аминокислотных замен. В других воплощениях в домене CDR производят не более одной-трех консервативных аминокислотных замен В других воплощениях домен CDR представляет собой CDR Н3 и/или CDR L3.
Модификации также включают гликозилированные и негликозилированные полипептиды, а также полипептиды с другими посттрансляционными модификациями, такими как, например, гликозилирование различными сахарами, ацетилирование и фосфорилирование. Антитела гликозилируют в консервативных положениях в их константных областях (Jefferis and Lund, Chem. Immunol. 65:111-128, 1997; Wright and Morrison, TibTECH 15:26-32, 1997). Олигосахаридные боковые цепи иммуноглобулинов влияют на функцию белка (Boyd et al., Mol. Immunol. 32:1311-1318, 1996; Wittwe and Howard, Biochem. 29:4175-4180, 1990) и внутримолекулярное взаимодействие между участками гликопротеина, которое может влиять на конформацию и представляемую трехмерную поверхность гликопротеина (Jefferis and Lund, выше; Wyss and Wagner, Current Opin. Biotech. 7:409-416, 1996). Олигосахариды также могут служить для нацеливания данного гликопротеина на определенные молекулы на основе специфических структур распознавания. Сообщалось также, что гликозилирование антител влияет на антителозависимую клеточную цитотоксичность (ADCC). В частности, сообщалось, что клетки СНО с тетрациклин-регулируемой экспрессией (β(1,4)-N-ацетилглюкозаминтрансферазы III (GnTIII), гликозилтрансферазы, катализирующей образование GlcNAc (N-ацетил-D-глюкозамина) в точках ветвления, имели улучшенную ADCC активность (Umana et al., Mature Biotech. 17:176-180, 1999).
Гликозилирование антител, как правило, является либо N-связанным, либо O-связанным. N-присоединенное относится к присоединению углеводного фрагмента к боковой цепи остатка аспарагина. Трипептидные последовательности аспарагин-Х-серин, аспарагин-Х-треонин и аспарагин-Х-цистеин, где Х представляет собой любую аминокислоту, за исключением пролина, являются последовательностями распознавания для ферментативного присоединения углеводного фрагмента к боковой цепи аспарагина. Таким образом, наличие любой из этих трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. O-связанное гликозилирование относится к присоединению одного из сахаров - N-ацетилгалактозамина, галактозы или ксилозы, к гидроксиаминокислоте, чаще всего серину или треонину, хотя также можно использовать 5-гидроксипролин или 5-гидроксилизин.
Добавление сайтов гликозилирования к антителу обычно осуществляют путем изменения аминокислотной последовательности таким образом, чтобы она содержала одну или более из описанных выше трипептидных последовательностей (для N-связанных сайтов гликозилирования). Изменение может также быть сделано путем добавления или замены одного или более сериновых или треониновых остатков в последовательности исходного антитела (для O-связанных сайтов гликозилирования).
Картина гликозилирования антител также может быть изменена без изменения лежащей в основе нуклеотидной последовательности. Гликозилирование во многом зависит от клетки-хозяина, используемой для экспрессии антитела. Поскольку тип клеток, используемых для экспрессии рекомбинантных гликопротеинов, например антител, в качестве потенциальной терапии, редко представляет собой нативную клетку, можно ожидать изменение картины гликозилирования антител (см., например, Hse et al., J. Biol. Chem. 272:9062-9070, 1997).
В дополнение к выбору клеток-хозяев, факторы, которые влияют на гликозилирование во время рекомбинантного получения антител, включают характер роста, состав среды, плотность культуры, оксигенацию, рН, схемы очистки и подобное. Предложены различные методы изменения картины гликозилирования, достигнутой в конкретном организме-хозяине, включая введение или сверхэкспрессию некоторых ферментов, участвующих в производстве олигосахаридов (патенты US 5047335; 5510261 и 5278299). Гликозилирование или некоторые типы гликозилирования, могут быть ферментативно удалены из гликопротеина, например с использованием эндогликозидазы Н (Endo H), N-гликозидазы F, эндогликозидазы F1, эндогликозидазы F2, эндогликозидазы F3. Кроме того, рекомбинантная клетка-хозяин может быть генетически модифицирована, чтобы являться дефектной при обработке некоторых типов полисахаридов. Эти и подобные методы хорошо известны в данной области.
Другие способы модификации включают использование способов связывания, известных в данной области, включающих, без ограничения ими, ферментативные средства, окислительное замещение и хелатирование. Модификации можно использовать, например, для прикрепления меток для иммуноанализа. Модифицированные полипептиды получают с использованием общепринятых в данной области методов и их можно подвергнуть скринингу с использованием стандартных анализов, известных в данной области, некоторые из которых описаны ниже и в Примерах.
В некоторых воплощениях изобретения антитело содержит модифицированную константную область, например константную область, которая обладает повышенной аффинностью к человеческому рецептору Fc-гамма, является иммунологически инертной или частично инертной, например не вызывает комплемент-опосредованного лизиса, не стимулирует антителозависимой клеточной цитотоксичности (ADCC) или не активирует макрофаги; или имеет пониженные активности (по сравнению с немодифицированным антителом) в одном или более из следующего: индуцирование комплемент-опосредованного лизиса, стимулирование антителозависимой клеточной цитотоксичности (ADCC) или активация микроглии. Разные модификации константной области можно использовать для достижения оптимального уровня и/или комбинации эффекторных функций. См., например, Morgan et al., Immunology 86:319-324, 1995; Lund et al., J. Immunology 157:4963-9 157:4963-4969, 1996; Idusogie et al., J. Immunology 164:4178-4184, 2000; Tao et al., J. Immunology 143: 2595-2601, 1989; и Jefferis et al., Immunological Reviews 163:59-76, 1998. В некоторых воплощениях константная область модифицирована, как описано в Eur. J. Immunol., 1999, 29:2613-2624; заявка PCT/GB 99/01441; и/или патентная заявка UK 9809951.8. В других воплощениях антитело содержит константную область тяжелой цепи IgG2 человека, содержащую следующие мутации: А330Р331 - S330S331 (нумерация аминокислот основана на последовательности IgG2 дикого типа). Eur. J. Immunol., 1999, 29:2613-2624. В других воплощениях константная область агликозилирована для N-связанного гликозилирования. В некоторых воплощениях константная область агликозилирована для N-связанного гликозилирования в результате мутирования гликозилированного аминокислотного остатка или флануирующих остатков, которые представляют собой часть последовательности распознавания N-гликозилирования в константной области. Например, сайт N-гликозилирования N297 может быть мутирован на A, Q, K или Н. См., Tao et al., J. Immunology 143: 2595-2601, 1989; и Jefferis et al., Immunological Reviews 163:59-76, 1998. В некоторых воплощениях константная область является агликозилированной для N-связанного гликозилирования. Константная область может быть агликозилирована для N-связанного гликозилирования ферментативно (примером является удаление углевода ферментом РNGаза) или посредством экспрессии в дефектной по гликозилированию клетке-хозяине.
Другие модификации антител включают антитела, которые были модифицированы, как описано в РСТ публикации WO 99/58572. Эти антитела содержат в дополнение к связывающему домену, направленному на молекулу-мишень, эффекторный домен, имеющий аминокислотную последовательность, по существу гомологичную всей или части константной области тяжелой цепи иммуноглобулина человека. Эти антитела способны связывать молекулу-мишень, не вызывая значительного комплемент-зависимого лизиса или клеточно-опосредованного разрушения мишени. В некоторых воплощениях эффекторный домен способен специфически связываться с FcRn и/или FcγRIIb. Они обычно основаны на химерных доменах, происходящих от двух или более доменов CH2 тяжелой цепи иммуноглобулина человека. Антитела, модифицированные таким образом, особенно пригодны для применения в длительной терапии антителами, чтобы избежать воспалительных и других побочных реакций на традиционную терапию антителами.
Изобретение включает аффинно зрелые воплощения. Например, аффинно зрелые антитела могут быть получены посредством способов, известных в данной области (Marks et al., Bio/Technology, 10:779-783, 1992; Barbas et al., Proc Nat. Acad. Sci, USA 91:3809-3813, 1994; Schier et al., Gene, 169:147-155, 1995; Yelton et al., J. Immunol, 155:1994-2004, 1995; Jackson et al., J. Immunol., 154(7):3310-9, 1995, Hawkins et al., J. Mol. Biol., 226:889-896, 1992; и РСТ публикация WO 2004/058184).
Следующие методы могут быть использованы для корректирования аффинности антитела и для характеристики CDR. Один из способов характеризации CDR антитела и/или изменения (например улучшения) аффинности связывания полипептида, такого как антитело, называется "сканирующий библиотечный мутагенез". Как правило, сканирующий библиотечный мутагенез используется следующим образом. Одно или более аминокислотных положений в CDR заменяют двумя или более (например 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20) аминокислотами с использованием принятых в данной области методов. В результате этого создаются небольшие библиотеки клонов (в некоторых воплощениях один для каждого анализируемого аминокислотного положения), каждая со сложностью два или более представителей (если две или более аминокислот заменены в каждом положении). Как правило, библиотека также включает клон, содержащий нативную (незамещенную) аминокислоту. Небольшое число клонов, например примерно 20-80 клонов (в зависимости от сложности библиотеки), из каждой библиотеки подвергают скринингу в отношении аффинности связывания с целевым полипептидом (или другой мишенью связывания) и идентифицируют кандидаты с увеличенным, таким же, уменьшенным связыванием или не связывающиеся. Способы определения аффинности связывания хорошо известны в данной области. Аффинность связывания может быть определена с использованием анализа посредством поверхностного плазменного резонанса Biacore™, который определяет различия в аффинности связывания величиной примерно в 2 раза или более. Biacore™ является особенно полезным, когда исходное антитело уже связывается с относительно высокой аффинностью, например KD составляет примерно 10 нМ или менее. Скрининг с использованием поверхностного плазменного резонанса Biacore™ описан в Примерах в данном документе.
Аффинность связывания может быть определена с использованием Kinexa Biocensor, анализов сцинтилляционной близости, ELISA, иммуноанализа ORIGEN (IGEN), гашения флуоресценции, переноса флуоресценции и/или дрожжевого дисплея. Аффинность связывания также можно подвергнуть скринингу с использованием подходящего биоанализа.
В некоторых воплощениях каждое положение аминокислоты в CDR заменено (в некоторых воплощениях поочередно) всеми 20 природными аминокислотами с использованием принятых в данной области методов мутагенеза (некоторые из которых описаны в данном документе). В результате этого создаются небольшие библиотеки клонов (в некоторых воплощениях один для каждого анализируемого аминокислотного положения), каждая со сложностью 20 представителей (если все 20 аминокислот замещены в каждом положении).
В некоторых воплощениях библиотека, подлежащая скринингу, содержит замены в двух или более положениях, которые могут находиться в одном и том же CDR или в двух или более CDR. Таким образом, библиотека может содержать замены в двух или более положениях в одном CDR. Библиотека может содержать замену в двух или более положениях в двух или более CDR. Библиотека может содержать замену в 3, 4, 5 или более положениях, где указанные положения находятся в двух, трех, четырех, пяти или шести CDR. Замену можно получить, используя кодоны с низкой избыточностью. См., например, Таблицу 2 в Balint et al., Gene 137(1):109-18, 1993.
CDR может представлять собой CDRH3 и/или CDRL3. CDR может представлять собой один или более из CDRL1, CDRL2, CDRL3, CDRH1, CDRH2 и/или CDRH3. CDR может представлять собой CDR no Kabat, CDR no Chothia или расширенный CDR.
Кандидаты с улучшенным связыванием можно секвенировать, тем самым идентифицируя мутант с заменой в CDR, которая приводит к улучшенной аффинности (также называемой "улучшенной" заменой). Кандидаты, которые связываются, также можно секвенировать, тем самым идентифицируя замену в CDR, которая сохраняет связывание.
Может быть выполнено несколько раундов скрининга. Например, кандидаты (каждый из которых содержит аминокислотную замену в одном или более положениях одного или более CDR) с улучшенным связыванием также полезны для конструирования второй библиотеки, содержащей по меньшей мере исходную и замещенную аминокислоту в каждом улучшенном положении CDR (т.е. аминокислотное положение в CDR, при котором мутант с заменой показал улучшенное связывание). Получение, и скрининг или селекция этой библиотеки обсуждается ниже.
Сканирующий библиотечный мутагенез также предоставляет средство характеристики CDR, поскольку частотность клонов с улучшенным связыванием, таким же связыванием, уменьшенным связыванием или не обладающих связыванием также предоставляет информацию, относящуюся к важности каждого аминокислотного положения для стабильности комплекса антитело-антиген. Например, если положение CDR поддерживает связывание при замене на все 20 аминокислот, это положении идентифицируют как положение, которое едва ли требуется для связывания с антигеном. Напротив, если положение в CDR поддерживает связывание лишь в небольшом проценте замен, то такое положение идентифицируют как положение, которое является важным для функционирования CDR. Таким образом, методы сканирующего библиотечного мутагенеза дают информацию о положениях в CDR, которые могут быть заменены на множество разных аминокислот (включая все 20 аминокислот), и о положениях в CDR, которые нельзя заменять или которые могут быть заменены только на некоторые аминокислоты
Кандидаты с улучшенной аффинностью можно комбинировать во второй библиотеке, которая включает улучшенную аминокислоту, исходную аминокислоту в этом положении и может также включать дополнительные замены в этом положении, в зависимости от сложности библиотеки, которая желательна или допустима при использовании желательного метод скрининга или селекции. Кроме того, при необходимости, соседнее аминокислотное положения можно рандомизировать в отношении по меньшей мере двух или более аминокислот. Рандомизация соседних аминокислот может обеспечить дополнительную конформационную гибкость в мутантном CDR, что, в свою очередь, может обеспечить или облегчить введение большего количества улучшающих мутаций. Библиотека также может содержать замещение в положениях, которые не показали улучшенной аффинности в первом раунде скрининга.
Вторую библиотеку подвергают скринингу или отбору в отношении элементов библиотеки с улучшенной и/или измененной аффинностью связывания, используя любой известный в данной области метод, включая скрининг с использованием анализа поверхностного плазменного резонанса Biacore™ и отбор с использованием любого метода отбора, известного в данной области, включая фаговый дисплей, дрожжевой дисплей и рибосомный дисплей.
В данном изобретении также предложены композиции, содержащие антитела, конъюгированные (например связанные) с агентом, который облегчает связывание с твердым носителем (таким как биотин или авидин). Для простоты, ссылка делается на антитела в общем смысле, понимая, что эти методы применяются к любым воплощениям ВСМА-антитела, описанным в данном документе. Конъюгирование обычно относится к связыванию этих компонентов, как описано в данном документе. Связывание (которое обычно представляет собой фиксирование этих компоненты в близкой ассоциации по меньшей мере для введения) может быть достигнуто большим количеством способов. Например, непосредственная реакция между агентом и антителом возможна, когда каждый из них имеет заместитель, способный взаимодействовать с другим заместителем. Например, нуклеофильная группа, такая как амино или сульфгидрильная группа, на одном из них может быть способной взаимодействовать с карбонилсодержащей группой, такой как ангидрид или галогенангидрид кислоты, или с алкильной группой, содержащей хорошую уходящую группу (например галогенид) на другом.
В другом аспекте изобретения предложен способ получения любого из полинуклеотидов, описанных в данном документе.
Полинуклеотиды, комплементарные любым таким последовательностям, также входят в объем настоящего изобретения. Полинуклеотиды могут быть одноцепочечными (кодирующими или антисмысловыми) или двухцепочечными и могут представлять собой молекулы ДНК (геномные, кДНК или синтетические) или РНК. Молекулы РНК включают молекулы HnRNA (гетерогенная ядерная РНК), которые содержат интроны и взаимно-однозначно соответствуют молекуле ДНК, и молекулы мРНК, которые не содержат интроны. Дополнительные кодирующие или некодирующие последовательности могут, но не обязательно, присутствовать в полинуклеотиде по настоящему изобретению, и полинуклеотид может, но не обязательно, быть связан с другими молекулами и/или носителями.
Полинуклеотиды могут содержать нативную последовательность (то есть эндогенную последовательность, которая кодирует антитело или его часть) или могут содержать вариант такой последовательности. Полинуклеотидные варианты содержат одну или более замен, добавок, делеций и/или вставок, так что иммунореактивность кодируемого полипептида не уменьшается по сравнению с нативной иммунореактивной молекулой. Влияние на иммунореактивность кодируемого полипептида обычно можно оценить, как описано в данном документе. Варианты предпочтительно демонстрируют по меньшей мере примерно 70% идентичность, более предпочтительно по меньшей мере примерно 80% идентичность, еще более предпочтительно по меньшей мере примерно 90% идентичность и наиболее предпочтительно по меньшей мере примерно 95% идентичность с последовательностью полинуклеотида, которая кодирует нативное антитело или его часть.
Две полинуклеотидных или полипептидных последовательности считаются "идентичными", если последовательность нуклеотидов или аминокислот в этих двух последовательностях является одинаковой при выравнивании с максимальным соответствием, как описано ниже. Сравнение двух последовательностей обычно осуществляют путем сравнения этих последовательностей в окне сравнения, чтобы идентифицировать и сравнить локальные участки сходства последовательностей. "Окно сравнения", при использовании в данном документе, относится к сегменту из по меньшей мере примерно 20 смежных положений, обычно от 30 до примерно 75 или от 40 до примерно 50, где последовательность можно сравнивать с эталонной последовательностью из такого же числа смежных положений после оптимального выравнивания двух последовательностей.
Оптимальное выравнивание последовательностей для сравнения можно осуществлять, используя программу Megalign в пакете программ по биоинформатике Lasergene (DNASTAR, Inc., Madison, WI), с использованием параметров по умолчанию. Эта программа охватывает несколько схем выравнивания, описанных в следующих ссылках: Dayhoff, M.O., 1978, A model of evolutionary change in proteins - Matrices for detecting distant relationships. In Dayhoff, M.O. (ed.) Atlas of Protein Sequence and Structure, National Biomedical Research Foundation, Washington DC Vol. 5, Suppl. 3, pp. 345-358; Hein J., 1990, Unified Approach to Alignment and Phylogenes pp. 626-645 Methods in Enzymology vol. 183, Academic Press, Inc., San Diego, CA; Higgins, D.G. and Sharp, P.M., 1989, CABIOS 5:151-153; Myers, E.W. and Muller W., 1988, CABIOS 4:11-17; Robinson, E.D, 1971, Comb. Theor. 11:105; Santou, N, Nes, M., 1987, Mol. Biol. Evol. 4:406-425; Sneath, P.H.A. and Sokal, R.R., 1973, Numerical Taxonomy the Principles and Practice of Numerical Taxonomy, Freeman Press, San Francisco, CA; Wilbur, W.J. and Lipman, D.J., 1983, Proc. Natl. Acad. Sci. USA 80:726-730.
Предпочтительно, "процент идентичности последовательностей" определяют путем сравнения двух оптимально выровненных последовательностей в окне сравнения из по меньшей мере 20 положений, где часть полинуклеотидной или полипептидной последовательности в окне сравнения может содержать добавления или делеции (то есть гэпы), составляющие 20 процентов или менее, обычно от 5 до 15 процентов или от 10 до 12 процентов, по сравнению с эталонными последовательностями (которые не содержат добавлений или делеций) для оптимального выравнивания этих двух последовательностей. Процент рассчитывают путем определения числа положений, в которых идентичные нуклеиновокислотные основания или аминокислотные остатки присутствуют в обеих последовательностях, чтобы получить число совпадающих положений, и деления числа совпадающих положений на общее число положений в эталонной последовательности (т.е. величину окна) и умножения результатов на 100 с получением процента идентичности последовательностей.
Варианты могут также, или альтернативно, быть существу гомологичными нативному гену, или его части, или набору генов. Такие полинуклеотидные варианты способны гибридизироваться в умеренно жестких условиях с природной последовательностью ДНК, кодирующей нативное антитело (или комплементарную последовательность).
Подходящие "умеренно жесткие условия" включают предварительное промывание в растворе 5×SSC, 0,5% SDS, 1,0 мМ EDTA (pH 8,0); гибридизацию при 50°С-65°С, 5×SSC, в течение ночи; с последующим двукратным промыванием при 65°С в течение 20 минут каждым из 2Х, 0.5Х и 0,2Х SSC, содержащим 0,1% SDS.
При использовании в данном документе "очень жесткие условия" или "условия высокой жесткости" представляют собой условия, в которых: (1) используют низкую ионную силу и высокую температуру для промывки, например 0,015 М хлорид натрия / 0,0015 М цитрат натрия / 0,1% додецилсульфат натрия при 50°С; (2) используют во время гибридизации денатурирующий агент, такой как формамид, например 50% (об./об.) формамид со смесью 0,1% бычьего сывороточного альбумина / 0,1% Фиколла/0,1% поливинилпирролидона/50 мМ натрий-фосфатного буфера при pH 6,5 с 750 мМ хлорида натрия, 75 мМ цитрата натрия при 42°С; или (3) используют 50% формамид, 5×SSC (0,75 М NaCl, 0,075 М цитрат натрия), 50 мМ фосфат натрия (pH 6,8), 0,1% пирофосфат натрия, 5× раствор Денхардта, ДНК спермы лосося, обработанную ультразвуком (50 мкг/мл), 0,1% SDS и 10% декстрансульфат при 42°С с промывкой при 42°С в 0,2×SSC (хлорид натрия/цитрат натрия) и 50% формамиде при 55°С с последующей тщательной промывкой, состоящей из 0,1 × SSC, содержащего EDTA при 55°С. Специалисту в данной области известно, как подобрать необходимую температуру, ионную силу и т.д. в соответствии с такими факторами, как длина зонда и тому подобное.
Специалистам в данной области техники понятно, что в результате вырожденности генетического кода существует много нуклеотидных последовательностей, которые кодируют полипептид, описанный в данном документе. Некоторые из этих полинуклеотидов имеют минимальную гомологию с нуклеотидной последовательностью любого нативного гена. Тем не менее, полинуклеотиды, которые различаются из-за различий в использовании кодонов, конкретно предполагаются в настоящем изобретении. Кроме того, аллели генов, содержащих полинуклеотидные последовательности, представленные в данном документе, входят в объем настоящего изобретения. Аллели представляют собой эндогенные гены, которые изменены в результате одной или более мутаций, таких как делеции, добавления и/или замены нуклеотидов. Полученные в результате мРНК и белок могут, но не обязательно, иметь измененную структуру или функцию. Аллели могут быть идентифицированы с использованием стандартных методов (таких как гибридизация, амплификация и/или сравнение базы данных последовательностей).
Полинуклеотиды по настоящему изобретению могут быть получены с использованием химического синтеза, рекомбинантных методов или ПЦР. Способы химического синтеза полинуклеотидов хорошо известны в данной области и не нуждаются в подробном описании в данном документе. Специалист в данной области техники может использовать представленные здесь последовательности и имеющийся в продаже синтезатор ДНК для получения нужной последовательности ДНК.
Для получения полинуклеотидов с использованием рекомбинантных методов полинуклеотид, содержащий нужную последовательность, может быть встроен в подходящий вектор, и вектор, в свою очередь, может быть введен в подходящую клетку-хозяина для репликации и амплификации, как далее обсуждается здесь. Полинуклеотиды могут быть встроены в клетки-хозяева любыми известными в данной области способами. Клетки трансформируют путем введения экзогенного полинуклеотида путем прямого поглощения, эндоцитоза, трансфекции, F-спаривания или электропорации. После введения экзогенный полинуклеотид можно поддерживать в клетке как неинтегрированный вектор (такой как плазмида) или интегрированным в геном клетки-хозяина. Амплифицированный таким образом полинуклеотид может быть выделен из клетки-хозяина хорошо известными в данной области способами. См., например, Sambrook et al., 1989.
Альтернативно, ПЦР позволяет воспроизводить последовательности ДНК. ПЦР-технология хорошо известна в данной области и описана в патентах US 4683195, 4800159, 4754065 и 4683202, а также в PCR: The Polymerase Chain Reaction, Mullis et al. eds., Birkauswer Press, Boston, 1994.
РНК может быть получена путем использования выделенной ДНК в соответствующем векторе и введения ее в подходящую клетку-хозяина. Когда клетка реплицируется и ДНК транскрибируется в РНК, РНК затем может быть выделена с использованием способов, хорошо известных специалистам в данной области, как указано, например, в Sambrook et al., 1989, выше.
Подходящие клонирующие векторы могут быть сконструированы в соответствии со стандартными методами или могут быть выбраны из большого количества клонирующих векторов, доступных в данной области техники. Хотя выбранный клонирующий вектор может отличаться в зависимости от клетки-хозяина, предназначенной для использования, пригодные клонирующие векторы обычно обладают способностью самореплицироваться, могут иметь одну мишень для конкретной рестрикционной эндонуклеазы и/или могут иметь маркерные гены, которые могут быть использованы при отборе клонов, содержащих этот вектор. Подходящие примеры включают плазмиды и бактериальные вирусы, например pUC18, pUC19, Bluescript (например pBS SK+) и его производные, mp18, mp19, pBR322, pMB9, ColE1, pCR1, RP4, фаговые ДНК и челночные векторы, такие как pSA3 и рАТ28. Эти и многие другие клонирующие векторы могут быть приобретены у коммерческих поставщиков, таких как BioRad, Strategene и Invitrogen.
Экспрессионные векторы обычно представляют собой реплицируемые полинуклеотидные конструкции, которые содержат полинуклеотид по изобретению. Подразумевается, что экспрессионный вектор должен реплицироваться в клетках-хозяевах либо в виде эписом, либо в виде составляющей части хромосомной ДНК. Подходящие экспрессионные векторы включают, без ограничения ими, плазмиды, вирусные векторы, в том числе аденовирусы, адено-ассоциированные вирусы, ретровирусы, космиды и экспрессирующие(й) вектор(ы), раскрытые в РСТ публикации WO 87/04462. Компоненты вектора обычно могут включать, без ограничения ими, один или более из следующего: сигнальную последовательность; точку начала репликации; один или более маркерных гена; подходящие контролирующие транскрипцию элементы (такие как промоторы, энхансеры и терминаторы). Для экспрессии (то есть трансляции) обычно также требуются один или более элементов, контролирующих трансляцию, таких как сайты связывания рибосом, сайты инициации трансляции и стоп-кодоны.
Векторы, содержащие интересующие полинуклеотиды, могут быть введены в клетку-хозяина посредством любого из нескольких подходящих способов, включающих электропорацию, трансфекцию с использованием хлорида кальция, хлорида рубидия, фосфата кальция, DEAE-декстрана или других веществ; баллистическую трансфекцию; липофекцию; и инфицирование (например, когда вектор представляет собой инфекционный агент, такой как вирус коровьей оспы). Выбор вводимых векторов или полинуклеотидов часто зависит от особенностей клетки-хозяина.
В изобретении также предложены клетки-хозяева, содержащие любой из полинуклеотидов, описанных в данном документе. Любые клетки-хозяева, способные сверхэкспрессировать гетерологичные ДНК, могут быть использованы с целью выделения генов, кодирующих антитело, полипептид или интересующий белок. Неограничивающие примеры клеток-хозяев млекопитающих включают, без ограничения ими, клетки COS, HeLa и СНО. См. также РСТ публикацию WO 87/04462. Подходящие клетки-хозяева не млекопитающих включают прокариотов (таких как Е. соli или В. subtillis) и дрожжи (таких как S. cerevisae, S. pombe; или К. lactis). Предпочтительно, клетки-хозяева экспрессируют кДНК на уровне примерно в 5 раз выше, более предпочтительно в 10 раз выше, еще более предпочтительно в 20 раз выше, чем у соответствующего эндогенного антитела или белка, представляющего интерес, если они присутствуют, в клетках-хозяевах. Скрининг клеток-хозяев в отношении специфического связывания с ВСМА или ВСМА-доменом (например доменами 1-4) осуществляют при помощи иммуноанализа или FACS. Можно идентифицировать клетку, сверхэкспрессирующую антитело или интересующий белок.
Способы использования биспецифических антител (терапевтические применения)
Антитела (например ВСМА-, CD3- или биспецифические) и конъюгаты антител (например, конъюгаты ВСМА-антитела с лекарственным средством) по настоящему изобретению можно использовать в различных применениях, включающих, без ограничения ими, терапевтические способы лечения и клинико-диагностические методы.
В одном аспекте изобретение предложен способ лечения состояния, ассоциированного с экспрессией ВСМА у субъекта. В некоторых воплощениях способ лечения состояния, ассоциированного с экспрессией ВСМА у субъекта, включает введение нуждающемуся в этом субъекту эффективного количества композиции (например фармацевтической композиции), содержащей ВСМА-антитела или конъюгаты ВСМА-антитела, как описано в данном документе. Состояния, ассоциированные с экспрессией ВСМА, включают, без ограничения ими, аномальную экспрессию ВСМА, измененную или аберрантную экспрессию ВСМА, злокачественные клетки, экспрессирующие ВСМА, пролиферативное расстройство (например рак) или аутоиммунное расстройство.
В другом аспекте изобретения предложен способ лечения В-клеточного рака или злокачественных клеток, экспрессирующих опухолевый антиген. В некоторых воплощениях предложен способ лечения В-клеточного рака у нуждающегося в этом субъекта, включающий а) создание биспецифического антитела, как описано в данном документе и б) введение указанного биспецифического антитела указанному пациенту. В некоторых воплощениях представлен способ лечения состояния, ассоциированного со злокачественными клетками, экспрессирующими опухолевый антиген у субъекта, включающий введение нуждающемуся в этом субъекту эффективного количества фармацевтической композиции, содержащей биспецифическое антитело, как описано в данном документе.
Соответственно, в некоторых воплощениях предложен способ лечения рака у субъекта, включающий введение субъекту, нуждающемуся в этом, эффективного количества композиции, содержащей антитела (например ВСМА или CD3-BCMA-биспецифические антитела) или конъюгаты ВСМА-антител, как описано в данном документе. При использовании в данном документе рак может представлять собой В-клеточный рак, включающий, без ограничения ими, множественную миелому, злокачественное плазмоклеточное новообразование, лимфому Ходжкина, нодулярную лимфому Ходжкина с лимфоидным преобладанием, болезнь Калера и миеломатоз, плазмоклеточный лейкоз, плазмоцитому, В-клеточный пролимфоцитарный лейкоз, лейкоз ворсистых клеток, В-клеточную неходжкинскую лимфому (NHL), острый миелоидный лейкоз (AML), хронический лимфоцитарный лейкоз (CLL), острый лимфоцитарный лейкоз (ALL), хронический миелоидный лейкоз (CML), фолликулярную лимфому, лимфому Беркитта, лимфому маргинальной зоны, лимфому мантийных клеток, крупноклеточную лимфому, предшественника В-лимфобластной лимфомы, миелоидный лейкоз, макроглобулинемию Вальденстрема, диффузную крупноклеточную В-клеточную лимфому, фолликулярную лимфому, лимфому маргинальной зоны, лимфому лимфоидной ткани слизистых оболочек, мелкоклеточную лимфоцитарную лимфому, лимфому мантийных клеток, лимфому Беркитта, первичную средостенную (тимусную) В-крупноклеточную лимфому, лимфоплазматическую лимфому, макроглобулинемию Вальденстрема, узловую В-клеточную лимфому маргинальной зоны, селезеночную лимфому маргинальной зоны, внутрисосудистую крупноклеточную В-клеточную лимфому, первичную эффузионную лимфому, лимфоматоидный гранулематоз, Т-клеточную/богатую гистиоцитами крупноклеточную В-клеточную лимфому, первичную лимфому центральной нервной системы, первичную кожную диффузную крупноклеточную В-клеточную лимфому (ножного типа), EBV-позитивную диффузную крупноклеточную В-клеточную лимфому пожилых людей, диффузную крупноклеточную В-клеточную лимфому, ассоциированную с воспалением, внутрисосудистую крупноклеточную В-клеточную лимфому, ALK-позитивную крупноклеточную В-клеточную лимфому, плазмобластную лимфому, крупноклеточную В-клеточную лимфому, возникающую при ассоциированной с HHV8 (вирус герпеса человека 8-го типа) многоочаговой болезни Кастлемена, неклассифицированную В-клеточную лимфому с признаками, промежуточными между диффузной крупноклеточной В-клеточной лимфомой и лимфомой Беркитта, неклассифицированную В-клеточную лимфому с признаками, промежуточными между диффузной крупноклеточной В-клеточной лимфомой и классической лимфомой Ходжкина, а также другие В-клеточные лимфомы.
В некоторых воплощениях предложен способ ингибирования роста или прогрессирования опухоли у субъекта, имеющего злокачественные клетки, экспрессирующие ВСМА, включающий введение субъекту, нуждающемуся в этом, эффективного количества композиции, содержащей ВСМА-антитела, CD3-ВСМА-биспецифические антитела или конъюгаты ВСМА-антител, как описано в данном документе. В других воплощениях предложен способ ингибирования метастатических клеток, экспрессирующих ВСМА у субъекта, включающий введение субъекту, нуждающемуся в этом, эффективного количества композиции, содержащей ВСМА-антитела, CD3-BCMA-биспецифические антитела или конъюгаты ВСМА-антител, как описано в данном документе. В других воплощениях предложен способ индуцирования регрессии опухоли в злокачественных клетках у субъекта, включающий введение субъекту, нуждающемуся в этом, эффективного количества композиции, содержащей ВСМА-антитела, CD3-BCMA-биспецифические антитела или конъюгаты ВСМА-антител, как описано в данном документе.
В некоторых воплощениях предложен способ лечения аутоиммунного расстройства у субъекта, включающий введение субъекту, нуждающемуся в этом, эффективного количества композиции, содержащей ВСМА-антитела, CD3-BCMA-биспецифические антитела или конъюгаты ВСМА-антител, как описано в данном документе.
При использовании в данном документе, аутоиммунные расстройства включают, без ограничения ими, системную красную волчанку, ревматоидный артрит, диабет (I типа), рассеянный склероз, болезнь Аддисона, целиакию, дерматомиозит, болезнь Грейвса, аутоиммунный тиреоидит, энцефалопатию Хашимото, миастению гравис, пернициозную анемию, реактивный артрит, синдром Шегрена, острый диссеминированный энцефаломиелит, агаммаглобулинемию, боковой амиотрофический склероз, анкилозирующий спондилоартрит, антифосфолипидный синдром, антисинтетазный синдром, атопическую аллергию, атопический дерматит, аутоиммунную энтеропатию, аутоиммунную гемолитическую анемию, аутоиммунный гепатит, аутоиммунное заболевание внутреннего уха, аутоиммунный лимфопролиферативный синдром, аутоиммунную периферическую нейропатию, аутоиммунный панкреатит, аутоиммунный полиэндокринный синдром, аутоиммунный прогестероновый дерматит, аутоиммунную тромбоцитопеническую пурпуру, аутоиммунную крапивницу, аутоиммунный увеит, болезнь Бехчета, болезнь Кастлемана, болезнь холодового агглютинина, болезнь Крона, дерматомиозит, эозинофильный фасцит, желудочно-кишечный пемфигоид, синдром Гудпасчера, синдром Гийена-Барре, суппуративный гидраденит, идиопатическую тромбоцитопеническую пурпуру, нарколепсию, обыкновенную пузырчатку, пернициозную анемию, полимиозит, первичный билиарный цирроз, рецидивирующий полихондрит, ревматическую лихорадку, височный артериит, поперечный миелит, язвенный колит, недифференцированную болезнь соединительной ткани, васкулит и гранулематоз Вегенера.
В другом аспекте изобретения предложено эффективное количество композиции (например фармацевтической композиции), содержащей антитела (например ВСМА или CD3-BCMA-биспецифические) или конъюгаты ВСМА-антител, как описано в данном документе, для лечения состояния (например рака или аутоиммунного расстройства), ассоциированного с экспрессией ВСМА у субъекта, нуждающегося в этом. В некоторых воплощениях предложено эффективное количество композиции (например фармацевтической композиции), содержащей антитела (например ВСМА или CD3-BCMA-биспецифические) или конъюгаты ВСМА-антител, как описано в данном документе, для ингибирования роста или прогрессирования опухоли у субъекта, имеющего злокачественные клетки, экспрессирующие ВСМА. В некоторых воплощениях предложено эффективное количество композиции (например фармацевтической композиции), содержащей антитела (например ВСМА или CD3-ВСМА-биспецифические) или конъюгаты ВСМА-антител, как описано в данном документе, для ингибирования метастазирования злокачественных клеток, экспрессирующих ВСМА, у субъекта, нуждающегося в этом. В некоторых воплощениях предложено эффективное количество композиции (например фармацевтической композиции), содержащей антитела (например ВСМА или CD3-BCMA-биспецифические) или конъюгаты ВСМА-антител, как описано в данном документе, для индукции регрессии опухоли у субъекта, имеющего злокачественные клетки, экспрессирующие ВСМА.
В другом аспекте изобретения предложены антитела (например ВСМА или CD3-BCMA-биспецифические) или конъюгаты ВСМА-антител, как описано в данном документе, для применения в лечении состояния (например рака или аутоиммунного расстройства), ассоциированного с экспрессией ВСМА у субъекта, нуждающегося в этом. В некоторых воплощениях предложены антитела (например ВСМА или CD3-BCMA-биспецифические) или конъюгаты ВСМА-антител, как описано в данном документе, для ингибирования роста или прогрессии опухоли у субъекта, имеющего злокачественные клетки, экспрессирующие ВСМА. В некоторых воплощениях предложены антитела (например ВСМА или CD3-BCMA-биспецифические) или конъюгаты ВСМА-антител, как описано в данном документе, для ингибирования метастазирования злокачественных клеток, экспрессирующих ВСМА у субъекта, нуждающегося в этом. В некоторых воплощениях предложены антитела (например ВСМА или CD3-ВСМА-биспецифические) или конъюгаты ВСМА-антител, как описано в данном документе, для индукции регрессии опухоли у субъекта, имеющего злокачественные клетки, экспрессирующие ВСМА.
В другом аспекте изобретения предложено применение антител (например ВСМА или CD3-BCMA-биспецифических) или конъюгатов ВСМА-антител, как описано в данном документе, в изготовлении лекарственного средства для лечения состояния (например рака или аутоиммунного расстройства), ассоциированного с экспрессией ВСМА. В некоторых воплощениях предложено применение антител (например ВСМА или CD3-ВСМА-биспецифических) или конъюгатов ВСМА-антител, как описано в данном документе, в изготовлении лекарственного средства для ингибирования роста или прогрессии опухоли. В некоторых воплощениях предложено применение антител (например ВСМА или CD3-ВСМА-биспецифических) или конъюгатов ВСМА-антител, как описано в данном документе, в изготовлении лекарственного средства для ингибирования метастазирования злокачественных клеток, экспрессирующих ВСМА. В некоторых воплощениях предложено применение антител (например ВСМА или CD3-BCMA-биспецифических) или конъюгатов ВСМА-антител, как описано в данном документе, в изготовлении лекарственного средства для индукции регрессии опухоли.
В другом аспекте предложен способ обнаружения, диагностики и/или мониторинга состояния, ассоциированного с экспрессией ВСМА. Например, антитела (например ВСМА или CD3-ВСМА-биспецифические), как описано в данном документе, могут быть помечены детектируемой группировкой, такой как агент визуализации и метка фермент-субстрат. Антитела, как описано в данном документе, также можно использовать для диагностических анализов in vivo, таких как визуализация in vivo (например PET (позитронно-эмиссионная томография) или SPECT (однофотонная эмиссионная компьютерная томография)), или окрашивающего реагента.
В некоторых воплощениях способы, описанные в данном документе, также включают стадию лечения субъекта дополнительной формой терапии. В некоторых воплощениях дополнительная форма терапии представляет собой дополнительную противораковую терапию, включающую, без ограничения ими, химиотерапию, облучение, хирургию, гормональную терапию и/или дополнительную иммунотерапию.
В некоторых воплощениях дополнительная форма терапии включает введение одного или более терапевтических агентов в дополнение к антителам (например ВСМА или CD3-BCMA-биспецифическим) или конъюгатам ВСМА-антител, как описано в данном документе. Один или более терапевтических агентов могут представлять собой химиотерапевтические агенты, включая, без ограничения ими, второе антитело (например анти-VEGF(фактор роста эндотелия сосудов)-антитело (например AVASTIN®), анти-НЕР2-антитело (например HERCEPTIN®), анти-CD25-антитело, анти-CD33-антитело, анти-CD20-антитело (например RITUXAN®), антитело против муциноподобного гликопротеина, анти-TNF-антитело и/или антитело против рецептора эпидермального фактора роста (EGFR) (например ERBITUX®)), ингибитор ангиогенеза, цитотоксический агент (например антрациклины (например даунорубицин, доксорубицин, эпирубицин, идарубицин, валрубицин и митоксантрон), таксан (например паклитаксел и доцетаксел), доластатин, дуокармицин, энедиин, гелданамицин, майтансин, пуромицин, алкалоид барвинка (например винкристин), ингибитор топоизомеразы (например этопозид), тубулизин, аналог пиримидина (например фторурацил), платиносодержащие агенты (например цисплатин, карбоплатин и оксалиплатин), алкилирующие агенты (например мелфалан, циклофосфамид или кармустин) и гемиастерлин), иммуномодулирующий агент (например преднизон и леналидомид (REVLIMID®)), противовоспалительное средство (например дексаметазон), ингибитор ароматазы (например анастрозол, экземестан, летрозол, ворозол, формастан или тестолактон), ингибитор протеасомы (например бортезомиб, такой как VELCADE® ([(1R)-3-метил-1-[[(2S)-1-оксо-3-фенил-2-[(пиразинилкарбонил)амино]пропил]амино]бутил]-бороновая кислота или карфилзомиб) и другие агенты, такие как тамоксифен.
Например, в некоторых воплощениях предложен способ лечения множественной миеломы, включающий введение нуждающемуся в этом пациенту эффективного количества композиции, содержащей антитела (например ВСМА или CD3-BCMA-биспецифические) или конъюгаты ВСМА-антител, как описано в данном документе, и один или более других терапевтических агентов, например химиотерапевтический агент (например доксорубицин или карфилзомиб) или талидомид или его производные (например леналидомид (REVLIMID®)). В некоторых воплощениях один или более других терапевтических агентов выбраны из группы, состоящей из бортезомиба (например VELCADE®), мелфалана, преднизона, доксорубицина, леналидомида, талидомида, преднизона, кармустина, этопозида, цисплатина, циклофосфамида, карфилзомиба и винкристина. В некоторых воплощениях другой терапевтический агент представляет собой бортезомиб (например VELCADE®), мелфалан, леналидомид (REVLIMID®), карфилзомиб, доксорубицин или преднизон. Соответственно, предложен способ лечения множественной миеломы, включающий введение нуждающемуся в этом пациенту, эффективного количества композиции, содержащей антитела (например ВСМА или CD3-BCMA-биспецифические) или конъюгаты ВСМА-антител, как описано в данном документе, и один или более других терапевтических агентов, выбранных из группы, состоящей из бортезомиба, леналидомида, карфилзомиба и доксорубицина. В некоторых воплощениях пациент переносит рецидив или невосприимчив к предшествующему лечению множественной миеломы.
Антитела (например ВСМА или биспецифические CD3-BCMA-) или конъюгаты ВСМА-антител могут быть введены субъекту любым подходящим путем. Специалистам в данной области техники должно быть понятно, что примеры, описанные в данном документе, не предназначены для ограничения, а являются иллюстрацией доступных методов. Соответственно, в некоторых воплощениях, антитело (например ВСМА или CD3-BCMA-биспецифическое) или конъюгаты ВСМА-антитела вводят субъекту в соответствии с известными способами, такими как внутривенное введение, например как болюс или посредством непрерывной инфузии в течение некоторого периода времени, внутримышечным, внутрибрюшинным, цереброспинальным, интракраниальным, трансдермальным, подкожным, внутрисуставным, сублингвальным, внутрисуставным, через инсуффлятор, интратекальным, пероральным, ингаляционным или местным путем. Введение может быть системным, например внутривенным, или локальным. Для введения пригодны имеющиеся в продаже распылители для жидких составов, включая струйные распылители и ультразвуковые распылители. Жидкие препараты могут быть непосредственно распылены, а лиофилизированный порошок может быть распылен после восстановления. Альтернативно, антитело (например BCMA или CD3-BCMA-биспецифическое) или конъюгат BCMA-антитела могут быть переведены в аэрозольное состояние с использованием фторуглеродной композиции и дозирующего ингалятора или введены посредством ингаляции в виде лиофилизированного или измельченного порошка.
В одном воплощении антитело (например BCMA или биспецифическое CD3-BCMA) или конъюгаты BCMA-антител вводят посредством методов сайт-специфической или направленной локальной доставки. Примеры способов сайт-специфической или направленной локальной доставки включают различные имплантируемые депо-источники антитела (например BCMA или биспецифического CD3-BCMA) или конъюгата BCMA-антитела или катетеры для локальной доставки, такие как инфузионные катетеры, вживленные катетеры или игольчатые катетеры, синтетические трансплантаты, адвентициальные повязки, шунты и стенты или другие имплантируемые устройства, сайт-специфические носители, прямая инъекция или непосредственное нанесение. См., например, публикацию РСТ WO 00/53211 и патент US 5981568.
Для введения могут быть использованы различные композиции антитела (например BCMA или биспецифического CD3-BCMA) или конъюгатов BCMA-антитела. В некоторых воплощениях антитело (например BCMA или биспецифическое CD3-BCMA) или конъюгат BCMA-антитела могут быть введены в чистом виде. В некоторых воплощениях антитело (например BCMA или биспецифическое CD3-BCMA) или конъюгат BCMA-антитела и фармацевтически приемлемый эксципиент могут находиться в различных композициях. Фармацевтически приемлемые эксципиенты известны в данной области и являются относительно инертными веществами, которые облегчают введение фармакологически эффективного вещества. Например, эксципиент может придавать форму или консистенцию, или действовать как разбавитель. Подходящие эксципиенты включают, без ограничения ими, стабилизаторы, смачивающие и эмульгирующие агенты, соли для изменения осмолярности, инкапсулирующие агенты, буферы и усилители проникновения через кожу. Эксципиенты, а также композиции для парентерального и непарентерального введения лекарственного средства описаны в Remington, The Science and Practice of Pharmacy 21st Ed. Mack Publishing, 2005.
В некоторых воплощениях эти агенты разработаны для введения посредством инъекции (например внутрибрюшинной, внутривенной, подкожной, внутримышечной и т.д.). Соответственно, эти средства можно комбинировать с фармацевтически приемлемыми носителями, такими как солевой раствор, раствор Рингера, раствор декстрозы и тому подобное. Конкретная схема лечения, то есть доза, время и повторения, зависят от конкретного субъекта и истории болезни этого субъекта.
Антитела (например BCMA или биспецифические CD3-BCMA) или конъюгаты BCMA-антител, как описано в данном документе, могут быть введены с использованием любого подходящего способа, в том числе посредством инъекции (например внутрибрюшинной, внутривенной, подкожной, внутримышечной и т.д.). Антитело (например BCMA или биспецифическое CD3-BCMA) или конъюгат BCMA-антитела также могут быть введены посредством ингаляции, как описано в данном документе. Как правило, для введения антитела (например BCMA или биспецифического CD3-BCMA) и конъюгата BCMA-антитела, исходная возможная доза может составлять примерно 2 мг/кг. Для целей настоящего изобретения типичная суточная доза может варьироваться от любой из примерно 3 мкг/кг до 30 мкг/кг, до 300 мкг/кг, до 3 мг/кг, до 30 мг/кг, до 100 мг/кг или более, в зависимости от упомянутых выше факторов. Например, может быть использована дозировка, составляющая примерно 1 мг/кг, примерно 2.5 мг/кг, примерно 5 мг/кг, примерно 10 мг/кг и примерно 25 мг/кг. При повторных введениях в течение нескольких суток или дольше, в зависимости от состояния, лечение продолжают до тех пор, пока не произойдет желательное подавление симптомов или пока не будет достигнут достаточные терапевтические уровни, например ингибирования или замедления роста/прогрессирования опухоли или метастазирования раковых клеток. Типичная схема лечения включает введение исходной дозы примерно 2 мг/кг с последующей еженедельной поддерживающей дозой примерно 1 мг/кг антитела (например BCMA или биспецифического CD3-BCMA) или конъюгата BCMA-антитела или с последующей поддерживающей дозой примерно 1 мг/кг один раз в две недели. Другая типичная схема лечения включает введение возрастающих доз (например с начальной дозой 1 мг/кг и постепенным увеличением до одной или более высоких доз каждую неделю или более длительный период времени). Также можно использовать другие схемы приема лекарственного средства в зависимости от картины фармакокинетического распада, которую хочет достичь практикующий врач. Например, в некоторых воплощениях предполагается дозировка от одного до четырех раз в неделю. В других воплощениях предполагается дозировка один раз в месяц, или один раз в два месяца, или один раз в три месяца. Результативность этой терапии легко контролируют с помощью обычных методов и анализов. Схема лечения (включая используемое антитело (например BCMA или биспецифическое CD3-BCMA) или конъюгат BCMA-антитела) может со временем меняться.
Для целей настоящего изобретения подходящая доза антитела (например BCMA или биспецифического CD3-BCMA) или конъюгата BCMA-антитела будет зависеть от используемого антитела (например BCMA или биспецифического CD3-BCMA) или конъюгата BCMA-антитела (или его композиции), типа и тяжести симптомов, подлежащих лечению, вводят ли агент для терапевтических целей, предыдущей терапии, истории болезни пациента и ответа на агент, скорости выведения из организма пациента введенного агента и решения лечащего врача. Обычно клиницист вводит антитело (например BCMA или биспецифическое CD3-BCMA) или конъюгат BCMA-антитела до достижения дозы, которая позволяет достигать желательного результата. Доза и/или частота может меняться во время курса лечения. Практические факторы, такие как время полувыведения, обычно влияют на определение дозы. Например, антитела, которые совместимы с иммунной системой человека, такие как гуманизированные антитела или полностью человеческие антитела, можно использовать для увеличения времени полувыведения антитела и предупреждения атаки на антитело со стороны иммунной системы хозяина. Частота введения может быть определена и скорректирована во время курса терапии и обычно, но не обязательно, основана на лечении, и/или подавлении, и/или улучшении, и/или задержке симптомов, например ингибировании или задержки роста опухоли и т.д.. Альтернативно, могут быть подходящими композиции антител (например BCMA или биспецифических CD3-BCMA) или конъюгатов BCMA-антител с замедленным непрерывным высвобождением. Различные композиции и устройства для достижения замедленного высвобождения известны в данной области.
В одном воплощении дозы антитела (например BCMA или биспецифического CD3-BCMA) или конъюгата BCMA-антител могут быть определены эмпирически у субъектов, которые получали одно или более введений антитела (например BCMA или биспецифического CD3-BCMA) или конъюгата BCMA-антитела. Субъектам вводили нарастающие дозы антитела (например BCMA или биспецифического CD3-BCMA) или конъюгата BCMA-антитела. Для оценки эффективности можно следить за симптомом заболевания.
Введение антитела (например BCMA или биспецифического CD3-BCMA) или конъюгата BCMA-антитела в соответствии со способом по настоящему изобретению может быть непрерывным или прерывистым в зависимости, например, от физиологического состояния реципиента, является цель введения терапевтической или профилактической, и от других факторов, известных специалистам-практикам. Введение антитела (например BCMA или биспецифического CD3-BCMA) или конъюгата BCMA-антитела может быть по существу непрерывным в течение предварительно выбранного периода времени или может представлять собой ряд доз, вводимых через интервалы времени.
В некоторых воплощениях может присутствовать более одного антитела (например BCMA или биспецифического CD3-BCMA) или конъюгата BCMA-антитела. Может присутствовать по меньшей мере один, по меньшей мере два, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять или более разных антител (например BCMA или биспецифических CD3-BCMA) или конъюгатов BCMA-антител. Как правило, эти антитела (например BCMA или биспецифические CD3-BCMA) или конъюгаты BCMA-антитела могут иметь комплементарные активности, которые не оказывают неблагоприятное воздействие друг на друга. Например, можно использовать одно или более следующих антител: первое BCMA- или CD3-антитело, направленное на один эпитоп на BCMA или CD3, и второе BCMA- или CD3-антитело, направленное на другой эпитоп на BCMA или CD3.
Терапевтические композиции антитела (например BCMA или биспецифического CD3-BCMA) или конъюгата BCMA-антитела, используемые в соответствии с настоящим изобретением, готовят для хранения путем смешивания антитела, имеющего нужную степень чистоты, с возможными фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами (Remington, The Science and Practice of Pharmacy 21st Ed. Mack Publishing, 2005) в форме лиофилизированных композиций или водных растворов. Подходящие носители, эксципиенты или стабилизаторы нетоксичны для реципиентов в используемых дозах и концентрациях и могут содержать буферы, такие как фосфатные, цитратные и на основе других органических кислот; соли, такие как хлорид натрия; антиоксиданты, включающие аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехин; резорцин; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (менее чем примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например Zn-белковые комплексы); и/или неионные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (PEG).
Липосомы, содержащие антитело (например BCMA или биспецифическое CD3-BCMA) или конъюгат BCMA-антитела, готовят известными в данной области способами, такими как способы, описанные в Epstein, et al., Proc. Natl. Acad. Sci. USA 82:3688, 1985; Hwang, et al., Proc. Natl Acad. Sci. USA 77:4030, 1980; и в патентах US 4485045 и 4544545. Липосомы с увеличенным временем циркуляции в кровотоке раскрыты в патенте US 5013556. Особенно полезные липосомы могут быть получены методом обратнофазового испарения с липидной композицией, содержащей фосфатидилхолин, холестерин и ПЭГ-дериватизированный фосфатидилэтаноламин (PEG-РЕ). Липосомы экструдируют через фильтры с определенным размером пор для получения липосом с нужным диаметром.
Активные ингредиенты также могут быть включены в микрокапсулы, полученные, например, методом коацервации или межфазной полимеризации, например в гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли-(метилметакрилатные) микрокапсулы, соответственно, в коллоидных системах доставки лекарственных средств (например липосомах, альбуминовых микросферах, микроэмульсиях, наночастицах и нанокапсулах) или в макроэмульсиях. Такие методы раскрыты в Remington, The Science and Practice of Pharmacy 21st Ed. Mack Publishing, 2005.
Могут быть получены препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антитело, такие матрицы находятся в форме формованных изделий, например пленок, или микрокапсул. Примеры матриц с замедленным высвобождением включают полиэфиры, гидрогели (например поли(2-гидроксиэтилметакрилат) или поливиниловый спирт)), полилактиды (патент US 3773919), сополимеры L-глутаминовой кислоты и 7 этил-L-глутамата, неразлагаемый этилен-винилацетат, разлагаемые сополимеры молочной кислоты и гликолевой кислоты, такие как LUPRON DEPOT™ (инъецируемые микросферы, состоящие из сополимера молочной кислоты и гликолевой кислоты и ацетата лейпролида), сахарозы ацетат изобутират и поли-D-(-)-3-гидроксимасляную кислоту.
Композиции, которые должны использоваться для введения in vivo, должны быть стерильными. Это легко осуществить, например, посредством фильтрации через стерильные фильтрующие мембраны. Композиции терапевтического антитела (например BCMA или биспецифического CD3-BCMA) или конъюгата BCMA-антитела обычно помещают в контейнер, имеющий стерильный порт доступа, например мешок для внутривенного раствора или флакон, имеющий пробку, прокалываемую иглой для подкожной инъекции.
Композиции по настоящему изобретению могут находиться в стандартных дозированных формах, таких как таблетки, пилюли, капсулы, порошки, гранулы, растворы или суспензии, или суппозитории для перорального, парентерального или ректального введения, или введения путем ингаляции или инсуффляции.
Для приготовления твердых композиций, таких как таблетки, основной активный ингредиент смешивают с фармацевтическим носителем, например обычными ингредиентами для таблетирования, такими как кукурузный крахмал, лактоза, сахароза, сорбит, тальк, стеариновая кислота, стеарат магния, дикальция фосфат или смолы, и с другими фармацевтическими разбавителями, например с водой, с образованием твердой предварительной композиции, содержащей гомогенную смесь соединения по настоящему изобретению или его нетоксичной фармацевтически приемлемой соли. При указании на эти предварительные композиции как на гомогенные, подразумевается, что активный ингредиент равномерно распределяется по всей композиции, так что композиция может быть легко разделена на одинаково эффективные стандартные лекарственные формы, такие как таблетки, пилюли и капсулы. Затем эту твердую предварительную композицию разделяют на стандартные лекарственные формы описанного выше типа, содержащие от 0,1 до примерно 500 мг активного ингредиента по настоящему изобретению. Таблетки или пилюли новой композиции могут быть покрыты оболочкой или иным образом составлены с получением лекарственной формы, обеспечивающей преимущество длительного действия. Например, таблетка или пилюля может содержать внутренний дозированный и внешний дозированный компонент, где последний находится в форме оболочки над первым. Эти два компонента могут быть разделены энтеросолюбильным слоем, который служит для противодействия дезинтеграции в желудке и позволяет внутреннему компоненту проходить в неизменном виде в двенадцатиперстную кишку или задерживает его высвобождение. Для таких энтеросолюбильных слоев или покрытий можно использовать разнообразные вещества, включающие целый ряд полимерных кислот и смеси полимерных кислот с такими веществами как шеллак, цетиловый спирт и ацетат целлюлозы.
Подходящие поверхностно-активные агенты включают, в частности, неионные агенты, такие как полиоксиэтиленсорбитаны (например Tween™ 20, 40, 60, 80 или 85) и другие сорбитаны (например Span™ 20, 40, 60, 80 или 85). Композиции с поверхностно-активным агентом обычно содержат от 0,05 до 5% поверхностно-активного агента и могут содержать от 0,1 до 2,5%. Понятно, что могут быть добавлены другие ингредиенты, например маннит или другие фармацевтически приемлемые носители, если это необходимо.
Подходящие эмульсии могут быть получены с использованием имеющихся в продаже жировых эмульсий, таких как Intralipid™, Liposyn™, Infonutrol™, Lipofundin™ и Lipiphysan™. Активный ингредиент может быть либо растворен в предварительно смешанной эмульсионной композиции, либо, в качестве альтернативы, он может быть растворен в масле (например соевом масле, сафлоровом масле, хлопковом масле, кунжутном масле, кукурузном масле или миндальном масле) и эмульсию получают при смешивании с фосфолипидами (например яичными фосфолипидами, соевыми фосфолипидами или соевым лецитином) и водой. Понятно, что могут быть добавлены другие ингредиенты, например глицерин или глюкоза, для регулирования тоничности эмульсии. Подходящие эмульсии обычно содержат вплоть до 20% масла, например от 5 до 20%. Жировая эмульсия может содержать жировые капли от 0,1 до 1,0 мкм, в частности от 0,1 до 0,5 мкм, и иметь pH в диапазоне от 5,5 до 8,0.
Эмульсионные композиции могут быть приготовлены путем смешивания антитела (например BCMA или биспецифического CD3-BCMA) или конъюгата BCMA-антитела с Intralipid™ или его компонентами (соевым маслом, яичными фосфолипидами, глицерином и водой).
Композиции для ингаляции или инсуффляции включают растворы и суспензии в фармацевтически приемлемых, водных или органических растворителях или их смеси и порошки. Жидкие или твердые композиции могут содержать подходящие фармацевтически приемлемые эксципиенты, как указано выше. В некоторых воплощениях композиции вводят пероральным или интраназальным респираторным путем для осуществления местного или системного эффекта. Композиции в предпочтительно стерильных фармацевтически приемлемых растворителях могут быть распылены с использованием газов. Аэрозольными растворами можно дышать непосредственно из распыляющего устройства или устройство для распыления может быть прикреплено к маске для лица, палатке или дыхательному аппарату с перемежающимся положительным давлением. Раствор, суспензию или порошкообразные композиции можно вводить, предпочтительно перорально или назально, из устройств, которые доставляют препарат соответствующим образом.
Композиции
Композиции, используемые в способах по настоящему изобретению, содержат эффективное количество антитела (например BCMA или биспецифического CD3-BCMA) или конъюгата BCMA-антитела, как описано в данном документе. Примеры таких композиций и их приготовление также описаны в разделе выше и ниже. В некоторых воплощениях композиция содержит одно или более антител (например BCMA или биспецифических CD3-BCMA) или конъюгатов BCMA-антитела. Например, BCMA-антитело или CD3-BCMA-биспецифическое антитело узнает BCMA или CD3-BCMA человека. В некоторых воплощениях BCMA- или CD3-BCMA-антитело представляет собой человеческое антитело, гуманизированное антитело или химерное антитело. В некоторых воплощениях BCMA-антитело или CD3-BCMA-антитело содержит константную область, которая способна инициировать желательный иммунный ответ, такой как опосредованный антителом лизис или ADCC. В других воплощениях BCMA-антитело или CD3-BCMA-антитело содержит константную область, которая не вызывает нежелательного или ненужного иммунного ответа, такого как опосредованный антителом лизис или ADCC.
Понятно, что композиции могут содержать более одного антитела (например BCMA или биспецифического CD3-BCMA) или конъюгата BCMA-антитела (например смесь BCMA-антител или биспецифических CD3-BCMA-антител, которые распознают разные эпитопы BCMA или CD3 и BCMA). Другие типичные композиции содержат более одного BCMA-антитела, CD3-BCMA-антитела или конъюгата BCMA-антитела, которые распознают одинаковый(е) эпитоп(ы), или другие виды BCMA-антител, CD3-BCMA-биспецифических антител или конъюгата BCMA-антитела, которые соединяются с разными эпитопами BCMA (например человеческого BCMA) или CD3 и BCMA (человеческого CD3 и BCMA).
Композиция по настоящему изобретению также могут содержать фармацевтически приемлемые носители, эксципиенты или стабилизаторы (Remington: The Science and practice of Pharmacy 21st Ed., 2005, Lippincott Williams and Wilkins, Ed. К.E. Hoover) в форме лиофилизированных композиций или водных растворов. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в этих дозах и концентрациях и могут содержать буферы, такие как фосфатный, цитратный, и другие органические кислоты; антиоксиданты, включающие аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмония хлорид; гексаметония хлорид; бензалкония хлорид, бензетония хлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил или пропилпарабен; катехин; резорцин; циклогексанол; 3-пентанол; и мета-крезол); низкомолекулярные (менее чем примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстраны; хелатирующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например Zn-белковые комплексы); и/или неионные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (PEG). Фармацевтически приемлемые эксципиенты также описаны в данном документе.
Наборы
В изобретении также предложены наборы для применения в экспресс-методах. Наборы по изобретению включают один или более контейнеров, содержащих BCMA-антитело, биспецифическое CD3-BCMA-антитело или конъюгат BCMA-антитела, как описано в данном документе, и инструкции по применению в соответствии с любым из способов по изобретению, описанных в данном документе. Как правило, эти инструкции содержат описание введения BCMA-антитела, биспецифического антитела CD3-BCMA или конъюгата BCMA-антитела для вышеописанной терапии.
Инструкции, касающиеся применения BCMA-антител, биспецифических CD3-BCMA-антител или конъюгатов BCMA-антител, как описано в данном документе, обычно включают информацию о дозировке, схеме приема и способе введения для предполагаемого лечения. Контейнеры могут представлять собой однократные дозы, многодозовые упаковки (например мультидозовые упаковки) или субъединичные дозы. Инструкции, представленные в наборах по изобретению, обычно представляют собой инструкции, написанные на этикетке или вкладыше в упаковку (например на листе бумаги, включенном в набор), но также приемлемыми являются машиночитаемые инструкции (например инструкции на магнитном или оптическом диске хранения).
Наборы по настоящему изобретению находятся в подходящей упаковке. Подходящая упаковка включает, без ограничения ими, флаконы, бутыли, банки, гибкую упаковку (например герметичные майларовые или пластиковые пакеты) и тому подобное. Также рассматриваются пакеты для использования в комбинации с конкретным устройством, таким как ингалятор, устройство для назального введения (например распылитель) или инфузионное устройство, такое как мини-насос. Набор может иметь стерильное входное отверстие (например, контейнер может представлять собой пакет с внутривенным раствором или флакон, имеющий пробку, прокалываемую иглой для подкожной инъекции). Контейнер также может иметь стерильное входное отверстие (например, контейнер может представлять собой пакет с внутривенным раствором или флакон, имеющий пробку, прокалываемую иглой для подкожной инъекции). По меньшей мере один активный агент в композиции представляет собой BCMA-антитело, биспецифическое CD3-BCMA-антитело или конъюгат BCMA-антитела. Контейнер может дополнительно содержать второй фармацевтически активный агент.
В наборы возможно могут быть представлены дополнительные компоненты, такие как буферы и пояснительная информация. Как правило, набор содержит контейнер и этикетку или листок(ки)-вкладыш(и) на контейнере или вместе с контейнером.
Следующие ниже примеры предложены только для иллюстративных целей и не предназначены каким-либо образом ограничивать объем настоящего изобретения. Действительно, различные модификации изобретения в дополнение к показанным и описанным в данном документе очевидны для специалистов в данной области техники из предшествующего описания и входят в объем прилагаемой формулы изобретения.
Примеры
Пример 1: Определение кинетики и аффинности взаимодействий hBCMA/человеческого IgG при 25°C и/или при 37°C
В данном примере определяют кинетику и аффинность различных анти-BCMA-антител при 25°C и 37°C.
Все эксперименты выполняли на биосенсоре Bio-Rad Proteon XPR36 для поверхностного плазмонного резонанса (Bio-Rad, Hercules, СА). Совокупность анти-BCMA-антител получали, используя метод аминного сочетания на сенсорном чипе Bio-Rad GLC, аналогично описанному в Abdiche, et al., Anal. Biochem. 411, 139-151 (2011). Температура анализа для иммобилизации составляла 25°C и электродным буфером являлся HBS-T+ (10 мМ HEPES, 150 мМ NaCl, 0,05% Tween-20, pH 7,4). Каналы активировали в направлении аналита (горизонтальном) путем инъекции смеси 1 мМ ECD и 0,25 мМ NHS в течение 3 минут при скорости потока 30 мкл/мин. IgG иммобилизовывали на активированных участках путем введения их в направлении лиганда (вертикальном) при 20 мкг/мл в 10 мМ ацетатном буфере, pH 4,5, в течение 1,5 минут при 30 мкг/мл. Активированные поверхности блокировали посредством инъекции 1 М этаноламина, pH 8,5, в направлении аналита в течение 3 минут при 30 мкл/мин.
Температура в анализе связывания hBCMA составляла 37°C или 25°C в электродном буфере HBS-T+ с добавлением 1 мг/мл BSA. Для анализа взаимодействия использовали кинетический метод титрования, как описано в Abdiche, et al. Аналит hBCMA (человеческий BCMA) вводили в направлении аналита с использованием ряда инъекций от низкой до высокой концентрации. Используемыми концентрациями были 0,08 нМ, 0,4 нМ, 2 нМ, 10 нМ и 50 нМ (5-членный ряд с 5-кратным коэффициентом разбавления и верхней концентрацией 50 нМ). Время ассоциации для данного разбавления аналита составляло две минуты. Сразу после инъекции 50 нМ hBCMA диссоциацию контролировали в течение 2 часов. Перед инъекциями hBCMA аналита 5 раз вводили буфер, используя такое же время ассоциации и диссоциации, что и в циклах hBCMA аналита для получения контрольной сенсограммы для буфера для получения двойного эталона (двойной эталон, описанный в Myszka, J. Mol. Recognit. 12, 279-284 (1999)).
Сенсограммы были получены с двойным эталоном и соответствовали кинетической модели титрования 1:1 Ленгмюра с переносом массы в программе BIAevaluation версия 4.1.1 (GE Lifesciences, Piscataway, NJ). Сенсограммы и соответствия представлены на Фиг. 1, а параметры кинетики и аффинности для различных анти-BCMA-антител по настоящему изобретению представлены в Таблицах 6А-6С.
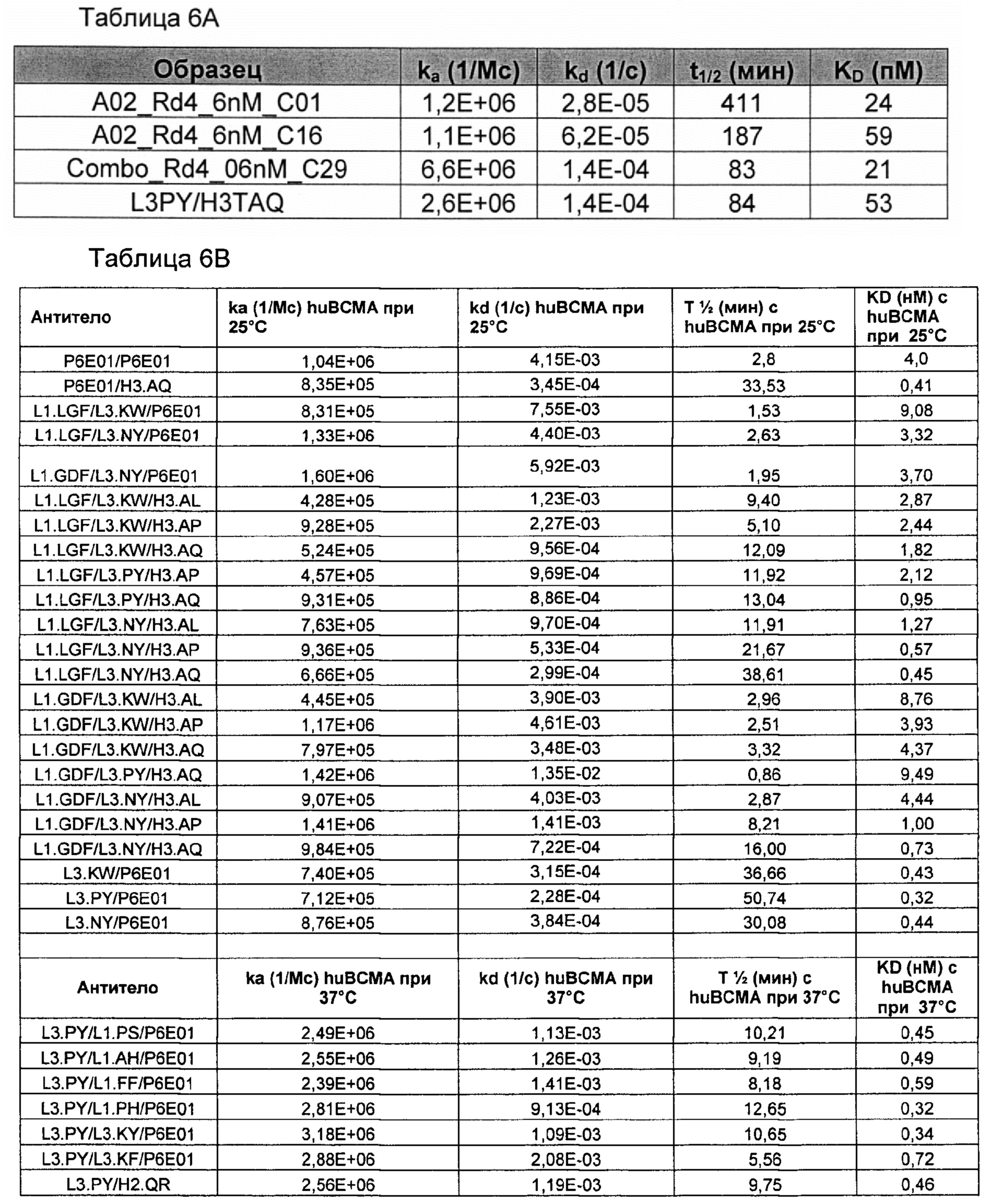
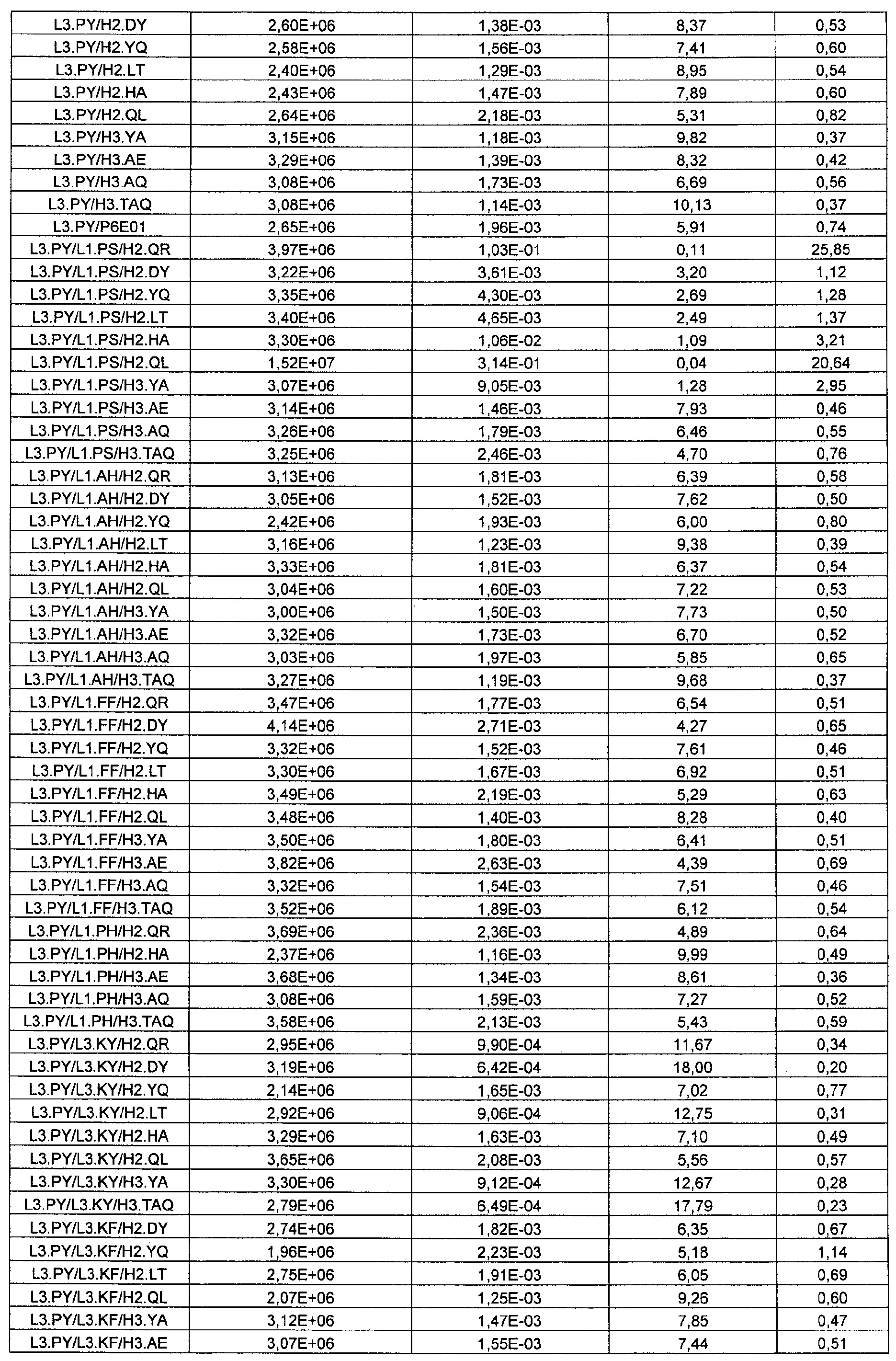
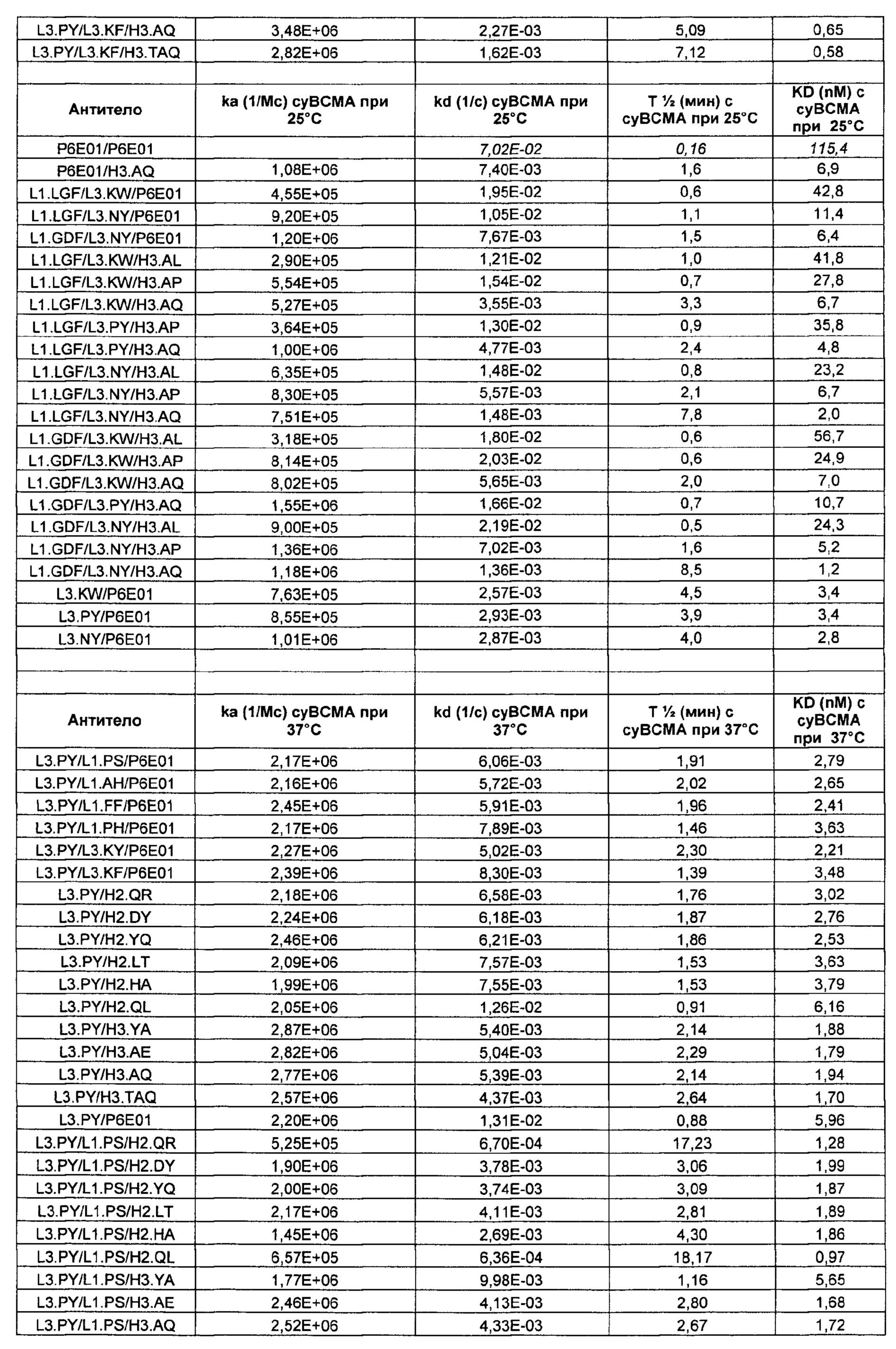
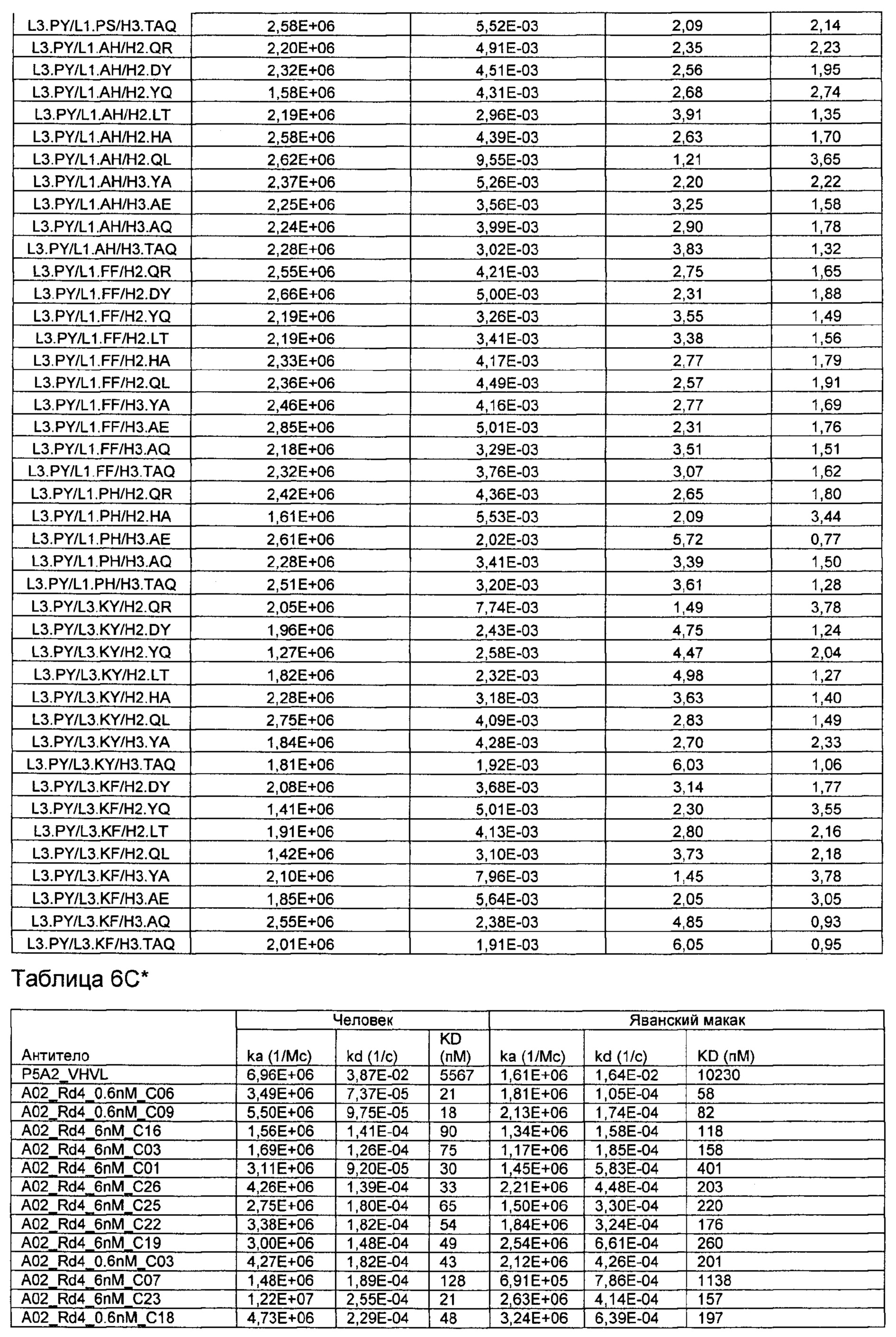
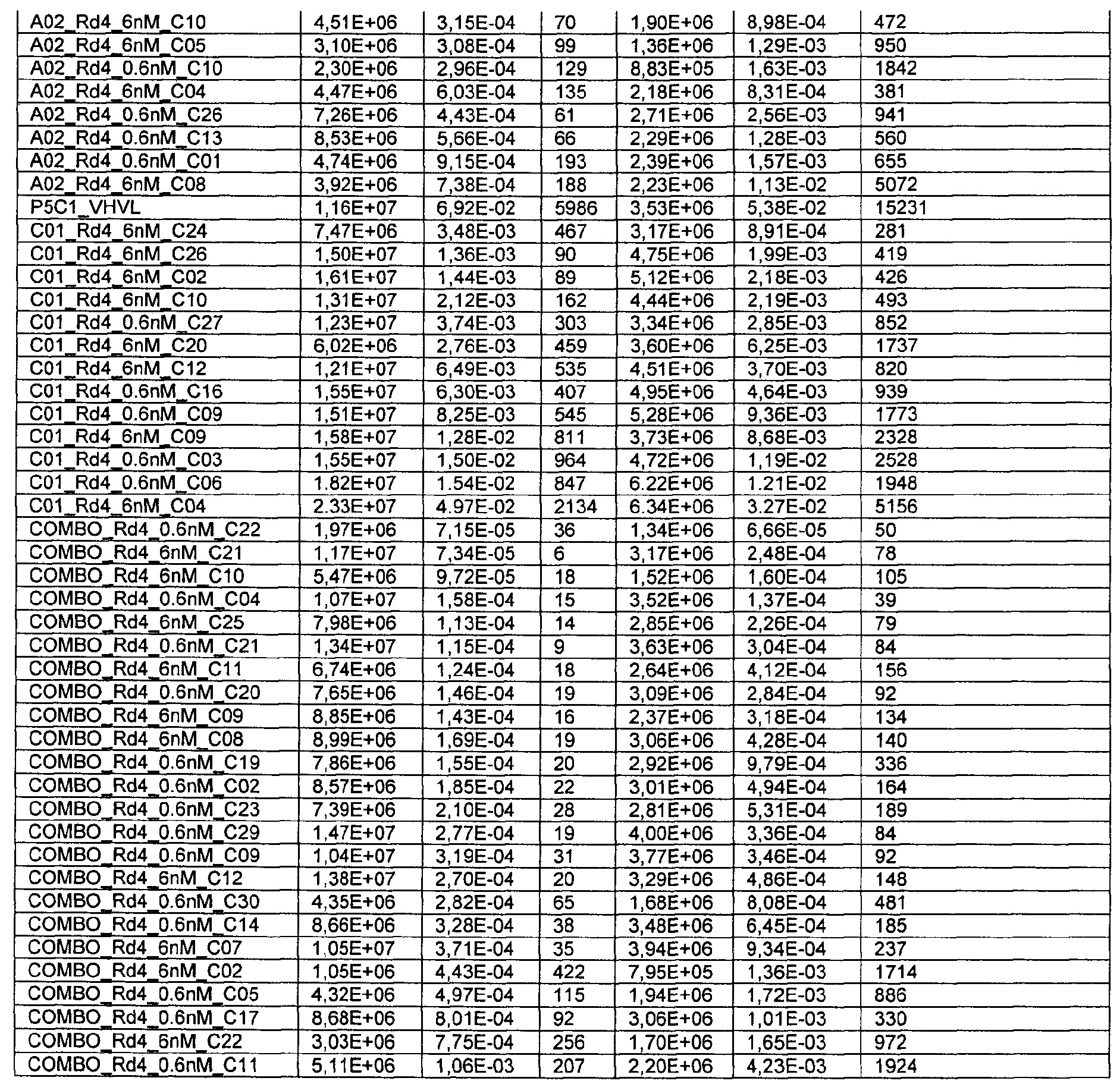
*Анализ связывания выполняли при 37°C.
Пример 2: Проточная цитометрия анти-BCMA-антител человека на BCMA-положительных опухолевых клетках
Данный пример демонстрирует связывание BCMA-положительных опухолевых клеток с различными BCMA-антителами по настоящему изобретению.
Связывание человеческого анти-hBCMA, экспрессированного в lgG2a мышах, оценивали на BCMA-экспрессирующих клетках (KMS12BM, L363, MM1S и KMS12PE) посредством проточной цитометрии. 250000 клеток инкубировали с 0,5 мкг антитела в 100 мкл буфера для связывания (PBS (фосфатный буферный солевой раствор) + 0,2% BSA (бычий сывороточный альбумин)), с последующей инкубацией с Alex Fluor 647 конъюгированным анти-мышиным IgG (Biolegend). В Таблице 7 показана MFI (средняя интенсивность флуоресценции) на BCMA-положительных опухолевых клетках с различными BCMA-антителами (например Combo_Rd4_0.6nM_C29, A02_Rd4_6nM_C01, A02_Rd4_6nM_C16 и P6E01/H3TAQ)
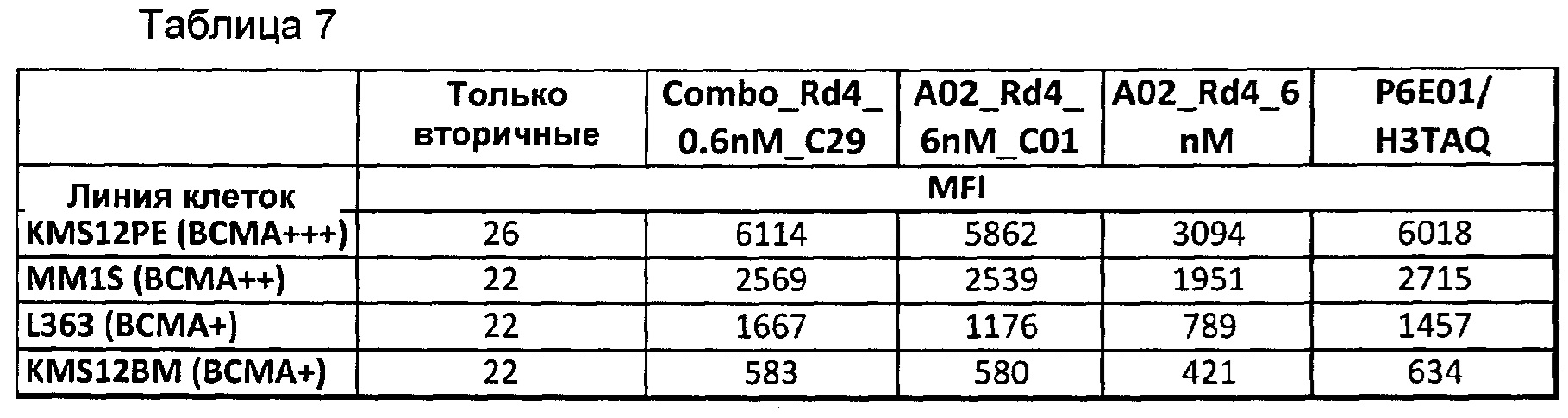
Пример 3: Цитотоксичность анти-BCMA ADC в BCMA-положительных клетках
Данный пример демонстрирует эффективность анти-BCMA ADC в BCMA-положительных клетках.
Человеческие анти-BCMA (L3.PY/P6E01, L3.PY/H3.TAQ, Combo_Rd4_0.6nM_C29, A02_Rd4_6nM_C01 и A02_Rd4_6nM_C16) антитела экспрессировали как человеческие lgG1 субтипы, сконструированные с глутаминсодержащими трансглутаминазными ("Q") тегами (например LCQ05, Н7с, N297A, N297Q, N297A/H7c, N297Q/LCQ05), для соотношений лекарственного средства и антитела (DAR) 2, 4 и 6. TG17 соответствует SEQ ID NO: 472 (LLQGPP); LCQ05 соответствует SEQ ID NO: 474 (GGLLQGPP), H7c соответствует SEQ ID NO: 454 (LLQG) соответственно, и конъюгирован с AcLys-Val-Cit-PABC-Aur0101 (Ацетил-Лизин-Валин-Цитруллин-пара-аминобензилоксикарбонил), амино-PEG6-C2-Aur3377 или амино-РЕС6-С2-Aur0131, как указано в Таблице 8. В одном случае трансглутаминазные теги могут быть сконструированы на легкой цепи, тяжелой цепи или комбинации легких и тяжелых цепей. В другом случае трансглутаминазный тег (например Q) сконструирован на сайте антитела, например в положении 297 человеческого IgG (схема нумерации EU). Например, аминокислота дикого типа аспарагин (N) замещена глутамином или аланином в положении 297 BCMA-антитела (N297Q или N297A) по настоящему изобретению. Конъюгирование анти-BCMA-антитела с Aur0101, Aur3377 и Aur0131 затем получали посредством реакции трансамидирования, катализируемой микробной трансглутаминазой, между анти-BCMA-антителом, несущим целевой глутамин или глутаминовый тег в конкретном сайте (например карбоксильном конце или аминном конце тяжелой цепи или легкой цепи, в положении 297 или в другом сайте антитела) и аминосодержащим производным полезной нагрузки (например MMAD, Aur0101, Aur3377 или Aur0131). В некоторых случаях аминокислоту дикого типа лизин в положении 222, 340 или 370 (в соответствии со схемой нумерации EU) заменяли аминокислотой аргинин ("K222R", "K340R" или "K370R"). Например, было обнаружено, что замещение K222R обладает необычным эффектом, приводящим к получению более гомогенного антитела и конъюгата с полезной нагрузкой, лучшему межмолекулярному сшиванию антитела и полезной нагрузки и/или к значительному уменьшению межцепочечной сшивки с глутаминовым тегом на С-конце легкой цепи антитела.
В реакции трансамидирования глутамин на антителе действовало как донор ацила, а аминосодержащее соединение действовало как акцептор ацила (донор амина). Очищенное анти-BCMA-антитело в концентрации 1-150 мкМ инкубировали с 5-100 молярным избытком акцептора ацила, в диапазоне 5 мкМ - 15 мМ, в присутствии 0,23-0,55% (масс./об.) трансглутаминазы Streptoverticillium mobaraense (ACTIVA™, Ajinomoto, Japan) в 10-1000 мМ NaCl и 25 мМ MES, HEPES [4-(2-гидроксиэтил)-1-пиперазинэтансульфокислота] или буфере Tris HCl в диапазоне pH 6,2-8,8. Условия реакции корректировали для отдельных производных акцептора ацила и оптимальная эффективность и специфичность обычно наблюдалась для 33 мкМ антитела, 0,67 мМ производного и 0,378% (масс./об.) трансглутаминазы в 75 мМ NaCl, 25 мМ Tris HCl, pH 8,5. После инкубации при 20-37°C в течение 1-24 часов антитело очищали с помощью высокоэффективной хроматографии на бутилсефарозной высокоэффективной (Бутил HP) смоле (GE Healthcare, Waukesha, WI) с использованием стандартных хроматографических методов, известных специалисту в данной области, таких как коммерческая хроматография гидрофобного взаимодействия от GE Healthcare.
Целевые экспрессирующие клетки (MM1.S, KMS12BM и L363) затем высевали на прозрачные планшеты в количестве 3000 клеток/лунка. Клетки обрабатывали 4-кратно серийно-разведенными конъюгатами антитело-лекарственное средство в трех повторах. Жизнеспособность клеток определяли с помощью CellTiter-Glo® Luminescent Cell Viability Assay 96 (Promega, Madison WI) через 96 часов после обработки. Относительную жизнеспособность клеток определяли как процент от необработанного контроля. ЕС50 рассчитывали с помощью программы Prism. В Таблице 8 показано, что все человеческие анти-BCMA-антитела по настоящему изобретению, конъюгированные с цитотоксическим агентом 0101, 3377 и 0131 посредством трансглутаминазных тегов и линкеров, проявляют сильную активность в отношении уничтожения клеток в BCMA-экспрессирующих клетках.

Пример 4: Анти-BCMA ADC вызывают регрессию опухоли в модели ортотопической множественная миеломы
Данный пример иллюстрирует in vivo эффективность анти-BCMA ADC в модели ортотопической множественной миеломы MM1S.
Исследование in vivo эффективности BCMA ADC выполняли на линии клеток множественной миеломы MM1.S, экспрессирующей люциферазу и GFP (зеленый флуоресцентный белок) в ортотопической модели. Десять миллионов клеток MM1.S LucGFP инъецировали внутривенно через хвостовую вену 6-8-недельным самкам CB17/SCID. Внутрибрюшинная инъекция D-люциферина (Regis Technologies, Morton Grove, IL) (200 мкл на животное при 15 мг/мл), с последующей анестезией изофлураном и последующей биолюминесцентной визуализацией всего тела (BLI) позволяла контролировать массу опухоли. Биолюминесцентные сигналы, излучаемые при взаимодействия между люциферазой, экспрессируемой опухолевыми клетками, и люциферином, захватывали при визуализации с использованием IVIS Spectrum СТ (Perkin Elmer, MA) и количественно оценивали как общий поток (фотоны/сек) с использованием Living Image 4.4 (Caliper Life Sciences, Alameda, CA). Когда общий поток достигал в среднем 1-3Е6 для всех животных, этих животных рандомизировали по группам и единичную дозу человеческого анти-BCMA-антитела, конъюгированного с 1) LCQ05/K222R-vc0101 на С-конце легкой цепи антитела, и контрольные конъюгаты вводили посредством болюсной инъекции в хвостовую вену. Исследования на животных прекращали, когда у них обнаруживался паралич конечности, конечный показатель ортотопических моделей MM1.S. На Фиг. 2 показано, что однократная доза 3 мг/кг различных человеческих анти-BCMA ADC ингибирует прогрессирование опухоли по сравнению с отрицательным контролем (NNC), включая P6E01/P6E01-AcLys-Val-Cit-PABC-Aur0101; P5A2_VHVL-AcLys-Val-Cit-PABC-Aur0101; P5C1_VHVL-AcLys-Val-Cit-PABC-Aur0101; P4G4-AcLys-Val-Cit-PABC-Aur0101; и P1A11-AcLys-Val-Cit-PABC-Aur0101.
Данное исследование демонстрирует, что лечение BCMA-ADC ингибирует прогрессирование множественной миелома.
Пример 5: Анти-BCMA ADC индуцирует регрессию и ингибирование опухоли в ортотопической модели множественной миеломы
Данный пример также иллюстрирует in vivo эффективность анти-BCMA ADC в моделях ортотопической множественной миеломы MM1.S.
Исследование in vivo эффективности BCMA ADC проводили на клеточной линии множественной миеломы MM1.S, экспрессирующей люциферазу и GFP, в ортотопической модели. Десять миллионов клеток MM1.S LucGFP инъецировали внутривенно в хвостовую вену 6-8-недельным самкам CB17/SCID. Внутрибрюшинная инъекция D-люциферина (Regis Technologies, Morton Grove, IL) (200 мкл на животное в концентрации 15 мг/мл), с последующей анестизией изофлураном и последующей биолюминесцентной визуализацией всего тела (BLI) позволяла контролировать массу опухоли. Биолюминесцентные сигналы, излучаемые при взаимодействии люциферазы, экспрессируемой опухолевыми клетками, и люциферина, захватывали при визуализации с использованием IVIS Spectrum СТ (Perkin Elmer, MA) и их количественно оценивали как общий поток (фотоны/сек) с использованием Living Image 4.4 (Caliper Life Sciences, Alameda, CA). Когда общий поток достигал в среднем 1-3Е6 для всех животных, этих животных рандомизировали на группы; 1) H7c/N297A/K222R-амино-PEG6-C2-3377, 2) N297Q/K222R-AcLys-Val-Cit-PABC-Aur0101, 3) LCQ05/K222R-AcLys-Val-Cit-PABC-Aur0101, 4) H7c/N297A/K222R-амино-PEG6-C2-0131, 5) N297Q/K222R/LCQ05-AcLys-Val-Cit-PABC-Aur0101 и 6) контрольный конъюгат LCQ04/K222R-AcLys-Val-Cit-PABC-Aur0101. Однократную дозу человеческих анти-BCMA ADC и контрольного конъюгата вводили посредством болюсной инъекции в хвостовую вену. Исследования с животными завершали, когда у них обнаруживался паралич конечности, конечный показатель ортотопической модели MM1.S. На Фиг. 3 показано, что однократная доза человеческого анти-BCMA L3.PY/P6E01 антитела, конъюгированного с 1) H7c/N297A/K222R-амино-PEG6-C2-0131 и 2) H7c/N297A/K222R-амино-PEG6-C2-3377, приводит к регрессии опухоли. Однократная доза человеческого анти-BCMA L3.PY/P6E01 антитела, конъюгированного с 1) N297Q/K222R-AcLys-Val-Cit-PABC-Aur0101, 2) LCQ05/K222R-AcLys-Val-Cit-PABC-Aur0101 и 3) N297Q/K222R/LCQ05-AcLys-Val-Cit-PABC-Aur0101, приводит к ингибированию опухоли.
Соответственно, данное исследование демонстрирует, что лечение BCMA-ADC вызывает регрессию и ингибирует прогрессирования множественной миеломы.
Пример 6: Анти-BCMA ADC индуцируют ингибирование опухоли в ортотопической модели множественной миеломы
Данный пример также иллюстрирует in vivo эффективность анти-BCMA ADC в ортотопических моделях множественной миеломы KMS12BM.
Исследование in vivo эффективности BCMA ADC проводили с линией клеток множественной миеломы KMS12BM, экспрессирующей люциферазу и GFP, в ортотопической модели. 6-8-недельных самок NSG облучали с дозой 100 сГр, и через 24 часов после облучения десять миллионов клеток KMS12BM LucGFP внутривенно инъецировали в хвостовую вену. Внутрибрюшинная инъекция D-люциферина (Regis Technologies, Morton Grove, IL) (200 мкл на животное с концентрацией 15 мг/мл), с последующей анестезией изофлураном и последующей биолюминесцентной визуализации всего тела (BLI) позволяла контролировать массу опухоли. Биолюминесцентные сигналы, излучаемые при взаимодействии люциферазы, экспрессируемой опухолевыми клетками, и люциферина, захватывали при визуализации с использованием IVIS Spectrum СТ (Perkin Elmer, MA) и количественно оценивали как общий поток (фотоны/сек) с использованием Living Image 4.4 (Caliper Life Sciences, Alameda, CA). Когда общий поток достигал в среднем 5Е6 для всех животных, этих животных рандомизировали на группы; 1) H7c/N297A/K222R-амино-PEG6-C2-3377, 2) N297Q/K222R-AcLys-Val-Cit-PABC-Aur010, 3) LCQ05/K222R-AcLys-Val-Cit-PABC-Aur0101, 4) H7c/N297A/K222R-амино-PEG6-C2-0131, 5) N297Q/K222R/LCQ05-AcLys-Val-Cit-PABC-Aur0101, и 6) контрольный конъюгат LCQ04/K222R-AcLys-Val-Cit-PABC-Aur0101. Однократную дозу анти-BCMA-ADC и контрольного конъюгата вводили посредством болюсной инъекции в хвостовую вену. Исследования на животных прекращали, когда они теряли более 15% общей массы тела, конечного показателя для ортотопических моделей KMS12BM. На Фиг. 4 показано, что однократная доза человеческого анти-BCMA L3.PY/P6E01 антитела, конъюгированного с 1) H7c/N297A/K222R-амино-PEG6-C2-3377, 2) N297Q/K222R-AcLys-Val-Cit-PABC-Aur0101, 3) LCQ05/K222R-AcLys-Val-Cit-PABC-Aur0101, 4) H7c/N297A/K222R-амино-PEG6-C2-0131 и 5) N297Q/K222R/LCQ05-AcLys-Val-Cit-PABC-Aur0101, приводит к подавлению опухоли.
Соответственно, данное исследование также демонстрирует, что лечение с помощью BCMA-ADC индуцирует регрессию и ингибирует прогрессирование множественной миеломы.
Пример 7: Кривая доза-ответ для анти-BCMA ADC в ортотопической модели MM1S
Данный пример также иллюстрирует in vivo эффективность анти-BCMA ADC в ортотопической модели множественной миеломы MM1S.
Исследование эффективности BCMA ADC in vivo выполняли на клеточной линии множественной миеломы MM1.S, экспрессирующей люциферазу и GFP, в ортотопической модели. Десять миллионов клеток MM1.S LucGFP внутривенно инъецировали через хвостовую вену 6-8-недельным самкам CB17/SCID. Внутрибрюшинная инъекция D-люциферина (Regis Technologies, Morton Grove, IL) (200 мкл на животное с концентрацией 15 мг/мл), с последующей анестизией изофлураном и последующей биолюминесцентной визуализацией всего тела (BLI) позволяла контролировать массу опухоли. Биолюминесцентные сигналы, излучаемые при взаимодействии люциферазы, экспрессируемой опухолевыми клетками, и люциферина, захватывали при визуализации с использованием IVIS Spectrum СТ (Perkin Elmer, MA) и количественно оценивали как общий поток (фотоны/сек) с использованием Living Image 4.4 (Caliper Life Sciences, Alameda, CA). Когда общий поток достигал в среднем 1.2Е6 для всех животных, этих животных рандомизировали на группы; 1) 0,1 мг/кг H7c/N297A/K222R-амино-PEG6-C2-0131, 2) 0,38 мг/кг H7c/N297A/K222R-амино-PEG6-C2-0131, 3) 0,75 мг/кг Н7с/N297A/K222-амино-PEG6-C2-0131, 4) 1,5 мг/кг H7c/N297A/K222R-амино-PEG6-C2-0131 и 5) 3 мг/кг контрольного конъюгата N297Q/K222R-AcLys-VC-0101. Однократную дозу человеческих анти-BCMA ADC и контрольного конъюгата вводили посредством болюсной инъекции через хвостовую вену. Исследование на животных прекращали, когда у них обнаруживался паралич задней конечности, конечный показатель для ортотопической модели MM1.S. На Фиг. 5 показано, что однократная доза человеческого анти-BCMA COMBO_Rd4_0.6nM_C29 антитела, конъюгированного с группами (1)-(4) выше, приводит к регрессии опухоли, начиная с 0,1 мг/кг, и к ингибированию опухоли вплоть до 100 суток, начиная с 0,75 мг/кг.
Соответственно, данное исследование демонстрирует, что лечение с помощью BCMA-ADC индуцирует регрессию опухоли и ингибирование опухоли в случае множественной миеломы.
Пример 8: Получение и очистка гетеродимерных антител
Этот пример описывает получение и очистку гетеродимерных антител по настоящему изобретению.
Вариабельную область человеческого специфического анти-CD3 антитела клонировали в человеческие IgG1 или IgG2ΔA, содержащие следующие мутации: 221R, 228R и K409R; или 223R, 225R, 228R и K409R соответственно, и обозначали как hIgG1 RRR или IgG2ΔA-RRRR.
Вариабельную область анти-целевого антитела клонировали в человеческие IgG1 или IgG2ΔA, содержащие следующие мутации: 221Е, 228Е, L368E или 223Е, 225Е, 228Е и L368E соответственно, и обозначали как hIgG1EEE или hIgG2ΔA-EEEE.
Гетеродимеры получали путем инкубирования анти-CD3 IgG1 или IgG2ΔA, имеющих мутации hIgG1 RRR или IgG2ΔA-RRRR, с анти-целевым антителом, имеющим мутации hIgG1EEE или hIgG2ΔA-EEEE, в PBS с 1 мМ или 2 мМ GSH в течение 24 часов при 37°C, как описано в международной патентной заявке PCT/US 2011/036419 (WO 2011/143545). Гетеродимер очищали посредством ионообменной хроматографии, как описано ниже.
Все гетеродимеры очищали посредством ионообменной хроматографии. В кратком изложении, аналитическое ионообменное разделение Fc-гетеро- и Fc-гомодимеров проводили в LC системе с насосом для четырехкомпонентных смесей Agilent 1100 (Agilent Inc, Santa Clara, CA, USA), оснащенной слабой катионообменой колонкой DIONEX Propac WCX-10G (4×50 мм). Белки вводили в 5% буфере А (20 мМ MES pH 5,4) и элюировали градиентом от 25% до 75% буфера В (20 мМ MES pH 5,4 и 500 мМ NaCl) в течение 20-минутного периода со скоростью потока 1 мл/мин. Более крупномасштабную очистку Fc-гетеродимера проводили на Akta Explorer (GE), оборудованной слабой катионообменной колонкой DIONEX Propac WCX-10G (4×250 мм). Белки вводили в 5% буфере А (20 мМ MES pH 5,4) и элюировали градиентом от 15% до 75% буфера В (20 мМ MES pH 5.4 и 500 мМ NaCl) в течение 60-минутного периода времени со скоростью потока 1 мл/мин.
Пример 9: Определение кинетики и аффинности взаимодействий hCD3/человеческого IgG при 25°C и/или 37°C
В этом примере определяют кинетику и аффинность различных анти-CD3 антител при 25°C и 37°C.
Все эксперименты выполняли на биосенсоре Bio-Rad Proteon XPR36 для поверхностного плазмонного резонанса (Bio-Rad, Hercules, СА). Совокупность анти-CD3 антител готовили с использованием метода аминного сочетания на сенсорном чипе Bio-Rad GLC, аналогичном описанному в Abdiche, et al., Anal. Biochem. 411, 139-151 (2011). Температура анализа для иммобилизации составляла 25°C и электродным буфером являлся HBS-T+ (10 мМ HEPES, 150 мМ NaCl, 0,05% Tween-20, pH 7,4). Каналы активировали в направлении аналита (горизонтальном) путем введения смеси 1 мМ ECD и 0,25 мМ NHS в течение 3 минут при скорости потока 30 мкл/мин. IgG иммобилизовывали на активированных участках посредством их введения в направлении лиганда (вертикальном) при 20 мкг/мл в 10 мМ ацетатном буфере, pH 4,5, в течение 1,5 минут при 30 мкг/мл. Активированные поверхности блокировали путем ведения 1 М этаноламина, pH 8,5, в направлении аналита в течение 3 минут при 30 мкл/мин.
Аналитическая температура для анализа связывания hCD3 составляла 37°C или 25°C в электродном буфере HBS-T+, дополненном 1 мг/мл BSA. Для анализа взаимодействия использовали кинетический метод титрования, как описано в Abdiche, et al. Аналит hCD3 (человеческий CD3) вводили в направлении аналита, используя ряд введений от низкой до высокой концентрации. Используемые концентрации составляли 0,08 нМ, 0,4 нМ, 2 нМ, 10 нМ и 50 нМ (5-членный ряд, с 5-кратным коэффициентом разбавления и верхней концентрацией 50 нМ). Время ассоциации для данного разбавления аналита составляло две минуты. Немедленно после введения 50 нМ hCD3 контролировали диссоциацию в течение 2 часов. Перед введениями аналита hCD3 5 раз вводили буфер с использованием такого же времени ассоциации и диссоциации, что и в циклах аналита hCD3, для получения контрольной сенсограммы буфера для двойного эталона (двойной эталон, как описано в Myszka, J. Mol. Recognit. 12, 279-284 (1999)).
Сенсограммы были получены с двойным эталоном и соответствовали кинетической модели титрования 1:1 Ленгмюра с переносом массы в программе BIAevaluation версия 4.1.1 (GE Lifesciences, Piscataway, NJ). Кинетические параметры и аффинности различных анти-CD3 антител по настоящему изобретению представлены в Таблице 9.
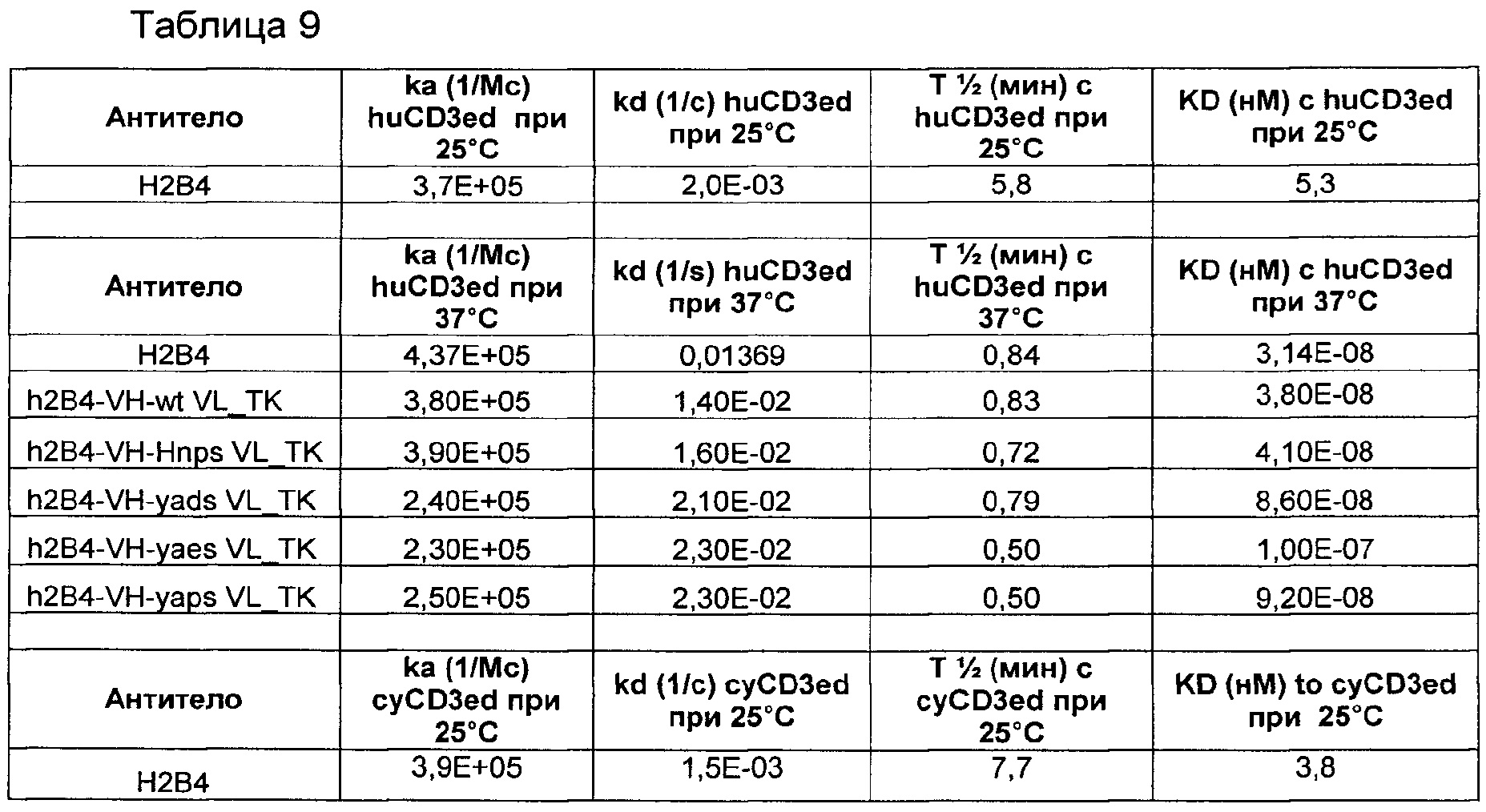
Пример 10: Проточная цитометрия человеческих анти-CD3 биспецифических антител на В-клетках и CD8+ Т-клетках
Данный пример демонстрирует эффективность анти-CD3-анти-CD20 биспецифических антител в клетках CD20 +.
Исследования с яванским макаком выполняли в лабораторие Charles River, доклинической службе Nevada, согласуясь с Институциональным комитетом по уходу за животными и их использованию. Животным (n=2) вводили посредством внутривенной болюсной инъекции биспецифическое анти-CD20/h2B4 антитело в дозах 500 мкг/кг, 100 мкг/кг, 20 мкг/кг, 2 мкг/кг, 0,2 мкг/кг или 0,02 мкг/кг. Животных осматривали два раза в сутки и в каждый момент забора крови. Кровь для проточной цитометрии и анализа цитокинов собирали в пробирки K2EDTA из периферического сосуда, не используемого для внутривенного введения.
Эффективность определяли путем измерения В-клеток и Т-клеток в периферической крови посредством проточной цитометрии. Цельную кровь собирали в указанные моменты времени и выдерживали при 4°C до анализа. Эритроциты лизировали с помощью АСК-буфера (Gibco) в течение 5 минут при комнатной температуре, и лейкоциты осаждали центрифугированием. Клетки окрашивали в течение 1 часа при 4°C коктейлем, содержащим флуоресцентно меченые антитела, распознающие cyno CD19 (Beckman Coulter), CD45, CD4, CD8, Ki67 (BD Biosciences) в PBS + 2% FBS. Для анализа Ki67 клетки сначала окрашивали CD4 и CD8, затем фиксировали/пермеабилизировали комплектом BD cyotfix/cytoperm (BD Biosciences) в соответствии с инструкциями производителя перед внутриклеточным окрашиванием Ki67. Выделение клеток на проточном цитометре BD LSRII проводили непосредственно после окрашивания.
Полученное количество В-клеток наносили на график в виде процента от количества В-клеток до исследования на Фиг. 6A-6F. Пролонгированное истощение В-клеток после однократной дозы достигалось при дозах всего лишь 2 мкг/кг. Истощение В-клеток наблюдалось при всех дозах. Длительность эффекта истощения являлась дозозависимой.
Полученное количество CD8+ Т-клеток наносили на график в виде процента от количества CD8+ Т-клеток до исследования на Фиг. 7A-7F. После первоначального перемещения уровни Т-клеток были восстановлены до исходных уровней или выше в течение данного исследования.
Пример 11: Проточная цитометрия человеческих биспецифических анти-CD3 антител на CD8+ Т-клетках
Данный пример демонстрирует эффективность моновалентного анти-CD3-антитела на кинетику и активацию Т-клеток.
Были проведены исследования на яванском макаке и определена эффективность путем измерения Т-клеток в периферической крови посредством проточной цитометрии, как описано в Примере 3. Яванским макакам (n=2) еженедельно внутривенно вводили 0,2 мкг/кг анти-CD20/h2B4 или NNC (неспецифическое антитело)/h2B4. В отличие от CD20-нацеленного биспецифического антитела, NNC/h2B4 оказывает незначительный эффект или не оказывает эффекта на кинетику CD8+ Т-клеток в крови, при измерении посредством проточной цитометрии. Ki67 использовали в качестве маркера активации Т-клеток.
Полученное количество Т-клеток наносили на график в виде процента от количества CD8+ Т-клеток до исследования на Фиг. 8А и 8В. У яванских макак с введенным биспецифическим антителом CD20/h2B4 уровень Ki67+ Т-клеток возрастал и достигал максимума между 3 и 7 сутками после введения, указывая на активацию Т-клеток. Однако у яванского макака с введенным NNC/h2B4 не происходило увеличения уровня Ki67+ Т-клеток.
Пример 12: Проточная цитометрия человеческих анти-CD3 биспецифических антител на В-клетках
Данный пример демонстрирует влияние аффинности анти-CD3-плеча на истощение В-клеток.
Выполняли исследования на яванском макаке и определяли эффективность путем измерения Т-клеток в периферической крови посредством проточной цитометрии, как описано в Примере 10. Биспецифические антитела были получены с анти-CD20-плечом, спаренным с 4 плечами анти-CD3-антитела с разными аффинностями. После однократного внутривенного введения дозы 0,2 мкг/кг определяли эффективность путем измерения В-клеток в периферической крови посредством проточной цитометрии.
На Фиг. 9A-9D полученное количество В-клеток было нанесено на график в виде процента от количества В-клеток до исследования. Эффективность истощения В-клеток коррелирует с аффинностью анти-CD3-плеча.
Пример 13: In vitro исследование биспецифического антитела в отношении Т-клеточно-опосредованной гибели BCMA-положительных клеток
Данный пример иллюстрирует in vitro цитотоксичность биспецифического анти-BCMA/CD3 hIgG2ΔA в BCMA-положительных клетках.
Человеческие анти-BCMA (Р5А2, A02_Rd4_0.6nM_C01, A02_Rd4_6nM_C16, Р5С1, C01_Rd4_6nM_C12, COMBO_Rd4_0.6nM_C22, Combo_Rd4_0.6nM_C29, L3PY/H3TAQ и A02_Rd4_6nM_C01) и человеческие анти-CD3 (H2B4) антитела экспрессировались как человеческие IgG2dA, сконструированные с ЕЕЕЕ для биспецифического обмена, как описано в Примере 8.
CD3+ Т-клетки из РВМС подвергали отрицательной селекции с использованием набора для выделения пан-Т-клеток человека (Miltenyi, San Diego СА). Клетки, экспрессирующие мишень (KMS12PE, L363 и Molp8), и CD3+ Т-клетки высевали на прозрачные планшеты с U-образным дном в количестве 20000 и 100000 клеток/лунка соответственно. Клетки обрабатывали 10-кратно серийно разведенным биспецифическим антителом в трех повторах. Клеточную гибель определяли с помощью CytoTox 96® нерадиоактивного анализа цитотоксичности (Promega, Madison WI) через 20 часов после обработки. Клеточную цитотоксичность определяли, как процент от суммы необработанных эффекторных и целевых контрольных лунок. ЕС50 рассчитывали с помощью программы Prism. В Таблице 10 показано, что все человеческие анти-BCMA_Н2В4 биспецифические антитела проявляют убивающую клетки активность в BCMA-экспрессирующих клетках.
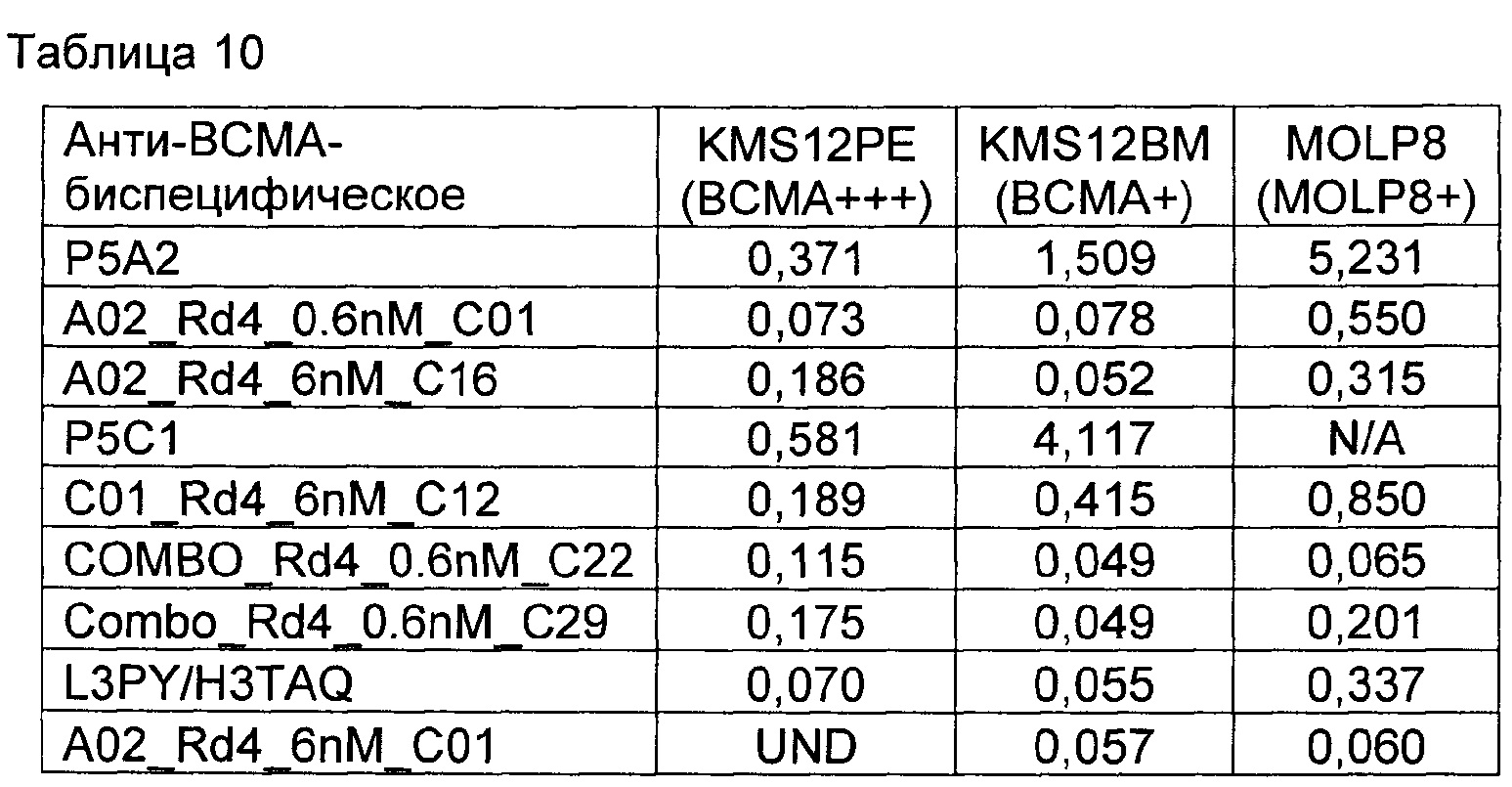
UND - не определен; N/A означает, что ЕС50 не может быть определена
Пример 14: In vitro характеристика клонированного анти-CD3 антитела из мышиной гибридомы
Данный пример иллюстрирует in vitro Т-клеточную активацию/пролиферацию анти-CD3, клонированного из мышиной гибридомы, в клетках РВМС человека/яванского макака, для скрининга антител.
Человеческие анти-CD3 антитела были клонированы из иммунизированной мыши, экспрессированы как мышиный IgG1 и очищены при помощи аффинных шариков с белком А. Мононуклеарные клетки периферической крови человека/яванского макака (hu/cyPBMC) получали посредством центрифугирования в градиенте плотности фиколла (плотность: 1,083 г/мл, GE) из кровяных фильтров, полученных из местных банков крови. Эритроциты удаляли путем инкубирования в буфере LCK (155 мМ NH4Cl, 10 мМ КНСО3, 100 мМ ЭДТА, Gibco) в течение 3 минут при комнатной температуре. Клетки центрифугировали в течение 5 минут при 600g. Супернатант, содержащий лизированные эритроциты, отбрасывали и РВМС дважды промывали в 50 мл 1×PBS/1% BSA/1 мМ ЭДТА. Осажденные клетки доводили до 107 клеток/мл в культуральной среде, X-VIVO-15, бессывороточной среде (Lonza), и PBMC сеяли по 106 (100 мкл) на лунку в круглодонные 96-луночные культуральные планшеты. Отобранные Ab 10× серийно разводили от 1000 нг до 1 нг на мл для смешивания с человеческими РВМС и 5× серийно разводили от 5000 нг до 200 нг на мл для смешивания с РВМС яванского макака. Для анализа пролиферации РВМС Т-клеток путем включения 3Н-тимидина, 2-суточные культуры выполняли в трех повторах. В течение последних 16 часов культивирования добавляли 3Н-тимидин (0,5 мКи/лунка) и определяли включение. Клетки собирали и лизировали, ДНК захватывали на стекловолоконный фильтр. Радиоактивность (имп/мин), как меру пролиферации, определяли на сцинтилляционном бета-счетчике.
На Фиг. 10А и 10В показано, что выбранные анти-CD3 1А4, 1С10, 2В4 и 7A3 антитела имели включение тимидина в РВМС (мононуклеарные клетки периферической крови) человека и яванского макака. В Таблице 11 показаны их KD, измеренные посредством Biacore. Характеристика in vitro показывает, что анти-CD3 1С10 и 2В4 антитела аналогичны положительному контролю SP34 анти-CD3 антитела (BD Biosciences).
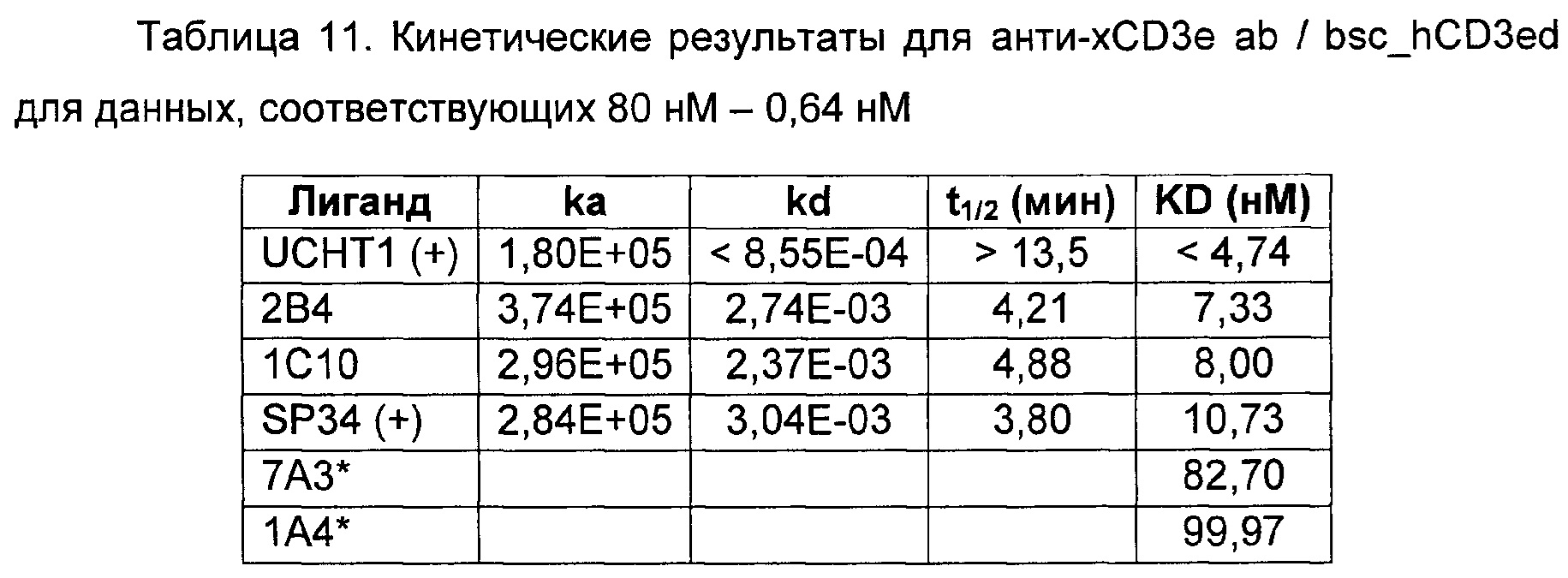
Примечание:
Данные приведены только для удовлетворительных кинетических совпадений. (+) = положительные контроли
*Кинетические определения представляют собой грубые оценки, так как антитело является гетерогенным. Измеряют только аффинность в стационарном состоянии.
Пример 15: In vitro исследование влияния биспецифического антитела на Т-клеточно-опосредованную гибель
Данный пример иллюстрирует in vitro цитотоксичность анти-EpCam/CD3 биспецифических антител в SW480, смешанной с выделенными пан-Т-клетками здоровых доноров.
А: Анти-CD антитела h2B4-1d, ТК, hnpsTK и yaesTK
Человеческие анти-CD3 (h2B4-1d (или h2B4), h2B4-TK (или h2B4-VH-wt VL_TK), h2B4-hnpsTK (или h2B4-VH-hnps VL_TK) и h2B4-yaesTK (или h2B4-VH-yaes VL_TK)) антитела и человеческие анти-EpCam антитела были экспрессированы как человеческий IgG2dA, сконструированный с RRRR или ЕЕЕЕ, для биспецифического обмена, как описано в Примере 8.
SW480 была выбрана в качестве целевой клеточной линии для исследования клеточной гибели, и эффекторные и человеческие Т-клетки были очищены из человеческих мононуклеарных клеток периферической крови (huPBMC). Целевые и эффекторные клетки сеяли в 96-луночные, круглодонные планшеты в клеточную культуральную среду, содержащую 5% фетальной бычьей сыворотки (FBS). Количество целевых клеток поддерживали постоянным на уровне 2×104 клеток/лунка. 10-кратное серийное разведение биспецифического антитела, от 3 мкг до 3 пг на мл, добавляли к клеткам в трех повторах. Общий объем реакционной смеси составлял 200 мкл. Реакционные смеси инкубировали в течение 48 и 72 часов. Для анализа цитотоксичности количественно измеряли лактатдегидрогеназу (LDH), стабильный цитозольный фермент, который высвобождался при лизисе клеток, с помощью набора CytoTox 96® для нерадиоактивного анализа цитотоксичности (Promega, G1780). Планшет считывали с помощью микропланшетного ридера для кинетических измерений Vmax (Molecular Devices) при 490 нМ. Оптимальные значения плотности корректировали с учетом фона среды и спонтанного лизиса целевых и эффекторных клеток. Специфическую цитотоксичность рассчитывали согласно следующей формуле:
[% спец. лизиса = считывание образца при 490 нМ - Е+Т смешанного контроля)/(считывание общего лизиса Т-клеток при 490 нМ - контрольной среды)×100%]
На Фиг. 11А и 11В показано, что все человеческие анти-EpCam_h2B4 биспецифические антитела обладали убивающей клетки активностью в условиях in vitro, а опосредованную антителом Т-клеточную активацию контролировали по маркеру активации Т-клеток. В Таблице 12А показаны значения их ЕС50. В Таблице 12В показан Biacore KD в формате биспецифического антитела.

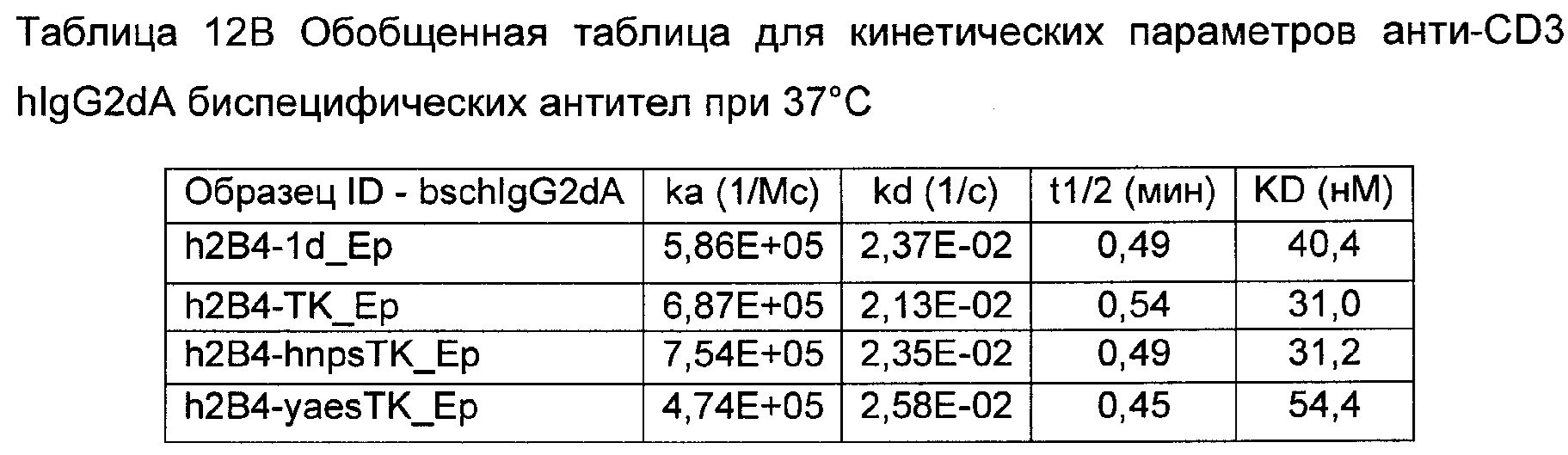
В: Анти-CD антитела m25A8, h25A8-B12 и h25A8-B13
Человеческие анти-CD3 h2B4(h2B4_1d) и h25A8 (m25A8, h25A8-B12 и h25A8-B13) и человеческие анти-EpCam антитела были экспрессированы как человеческий IgG2dA, сконструированный с RRRR или ЕЕЕЕ, для биспецифического обмена, как описано в Примере 8.
На Фиг. 11С и 11D показано, что все человеческие анти-EpCam_анти-CD3 биспецифические антитела обладают убивающей клетки активностью in vitro, а антитело-опосредованную активацию Т-клеток контролировали с помощью маркера активации Т-клеток. В Таблице 12С показана величина ЕС50 для клеточной гибели in vitro. В Таблице 12D показана Biacore кинетика в формате биспецифического антитела при 37°C. В Таблице 12Е показана характеристика in vitro с использованием SEC-MALS (гель-хроматография с многоугловым рассеянием света) и DSC (дифференциальная сканирующая калориметрия).
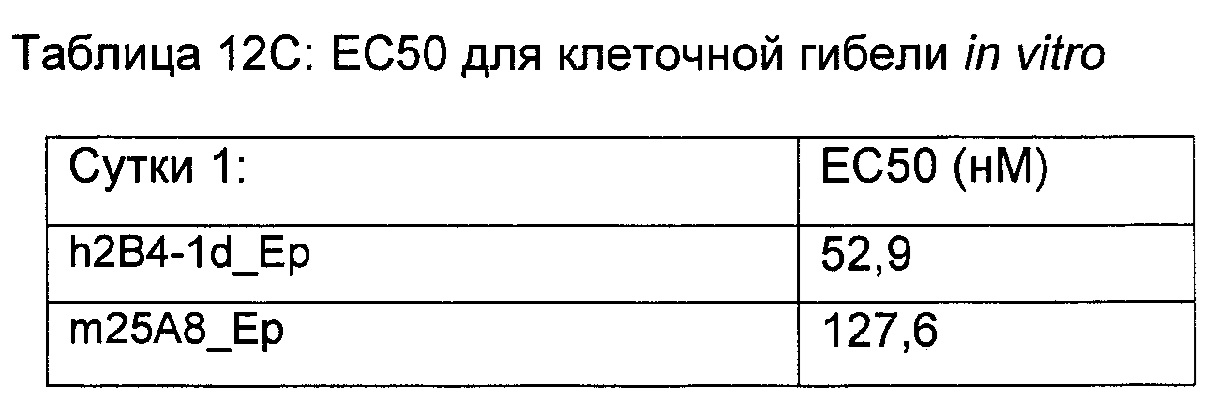

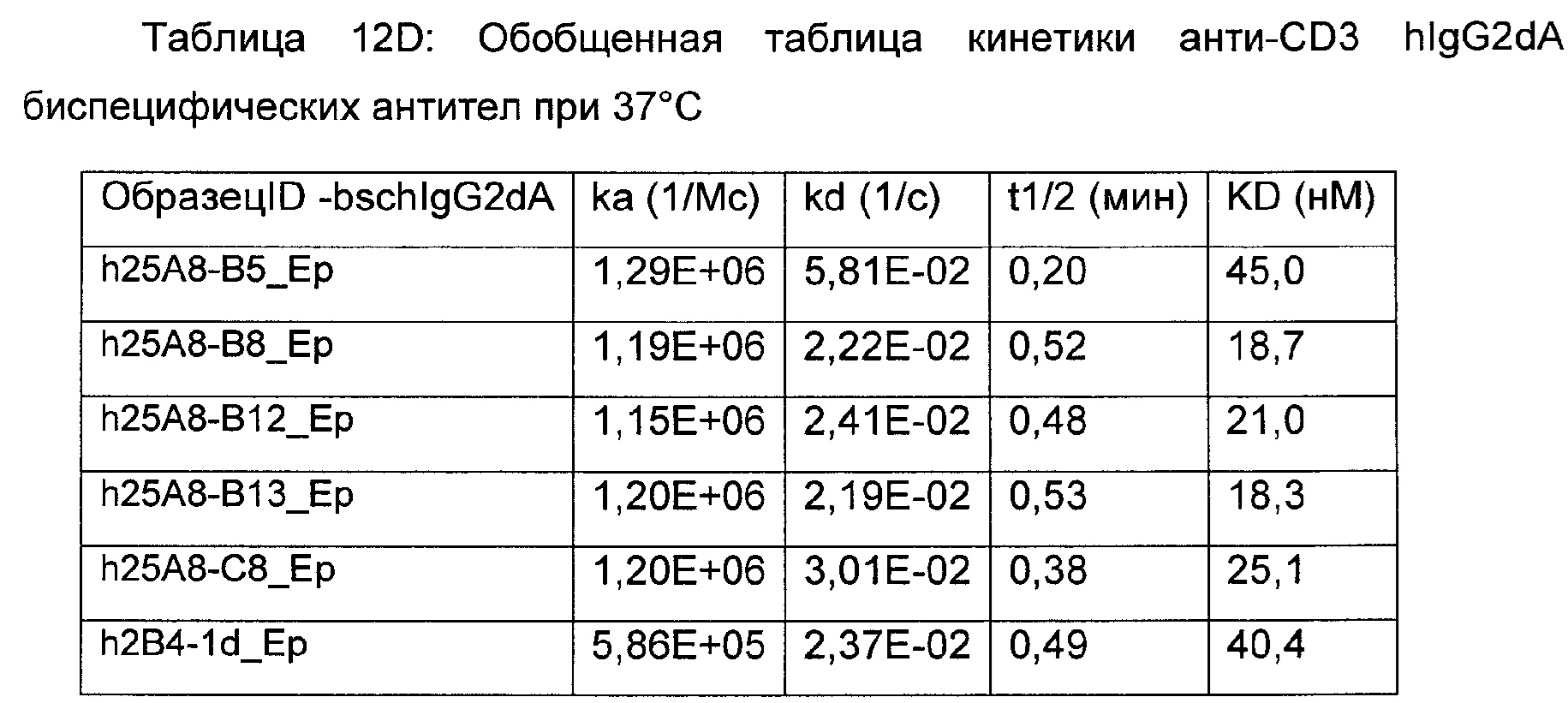
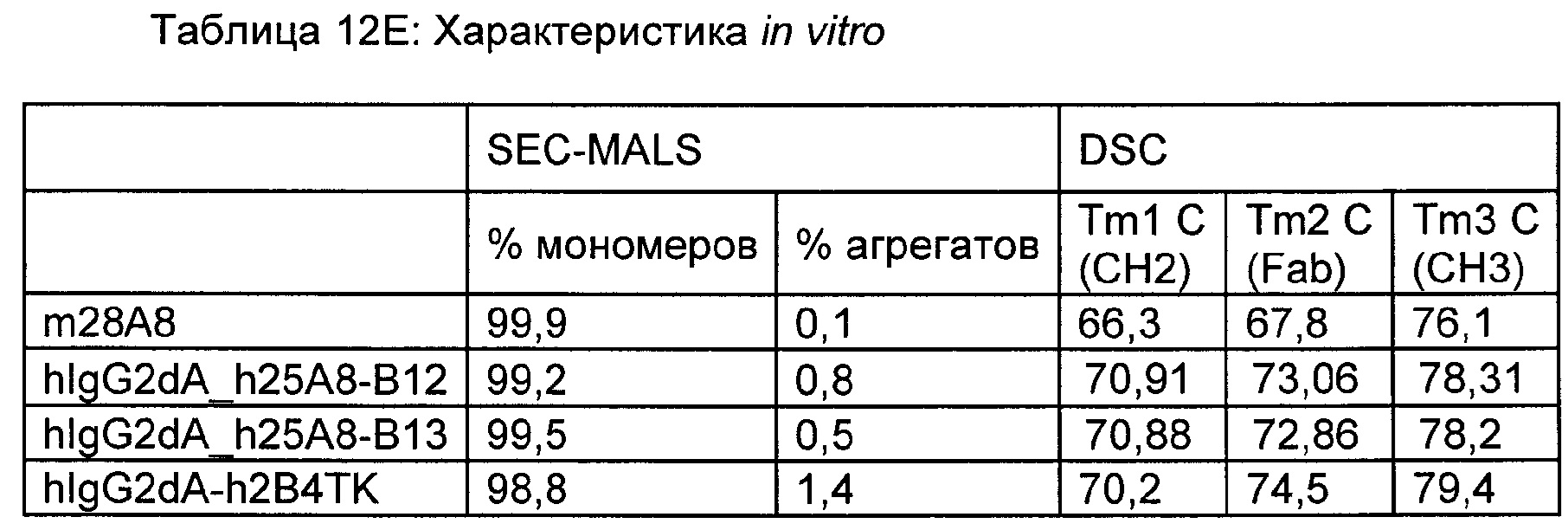
Пример 16: In vitro исследование влияния биспецифического антитела на Т-клеточно-опосредованную гибель образцов первичной миеломы пациента.
Данный пример иллюстрирует in vitro цитотоксичность анти-BCMA/CD3 биспецифических антител в первичных клетках миеломы.
Человеческие анти-BCMA (Р5А2, A02_Rd4_0.6nM_C01, A02_Rd4_6nM_C16, Combo_Rd4_0.6nM_C29, и Р6Е01 L3PY/H3TAQ) и человеческие анти-CD3 (h2B4) антитела были экспрессированы как человеческий lgG2dA, сконструированный с ЕЕЕЕ или RRRR, для биспецифического обмена, как описано в Примере 8.
Все мононуклеарные клетки костного мозга от пациентов с миеломой сеяли в прозрачные планшеты с U-образным дном при общем количестве мононуклеарных клеток костного мозга, которое давало 3000-5000 клеток миеломы/лунку. Клетки обрабатывали 10-кратно серийно разведенным биспецифическим антителом. Через пять суток после обработки общее количество жизнеспособных клеток определяли посредством проточной цитометрии, используя антитела к CD138 и CD38 (Biolegend, СА). Клетки инкубировали с антителами при 4°C в PBS + 0,5% FBS в течение 30 минут. Клетки промывали и к клеткам добавляли Fixable Viability Dye eFluor 780 (eBioscience, Inc., СА) в PBS на 30 минут при 4°C. Перед сбором клеток на проточном цитометре BD, клетки промывали и добавляли гранулы CountBright Absolute Counting Beads (Molecular Probes, OR). Процент живых клеток определяли как количество живых клеток в обработанных лунках против необработанных лунок, используя гранулы для подсчета. ЕС50 рассчитывали с помощью программы Prism.
В Таблице 13А показано, что все анти-BCMA_h2B4 биспецифические антитела человека обладают убивающей клетки активностью в образцах миеломы пациентов и Т-клетки пациента являются функциональными эффекторными клетками. В Таблице 13В показана гибель для одного анти-BCMA-биспецифического антитела в образцах множественной миеломы пациента с разным соотношением эффектора к мишени (Е:Т).


Пример 17: ELISPOT антитело-секретирующих клеток яванского макака, которым вводили анти-BCMA/CD3 биспецифические антитела
Данный пример иллюстрирует истощение IgG-секретирующих клеток у яванских макак с помощью анти-BCMA/CD3 биспецифических антител.
Яванским макакам (n=2) вводили посредством внутривенной болюсной инъекции биспецифические анти-BCMA_CD3 антитела (h2B4-VH-hnps VL_TK), A02_Rd4_0.6nM_C01/H2B4 и Combo_Rd4_0.6nM_C29/H2B в двух дозах, в 1 и 8 сутки, по 100 мкг/кг и 300 мкг/кг. Животных обследовали два раза в сутки и в каждый момент отбора крови. Мононуклеарные клетки периферической крови (РВМС) собирали в -6, 4 и 10 сутки. Образцы костного мозга брали на 10 сутки, когда вскрывали трупы животных.
Кровь собирали в пробирки Becton Dickinson® СРТ™ Cell Preparation Tubes, содержащие гепарин натрия и градиент плотности, а затем РВМС собирали на границе градиента после центрифугирования.
Образец костного мозга (из бедра) собирали путем промывки приблизительно 5 мл 100% фетальной бычьей сыворотки (FBS) и затем готовили одноклеточные суспензии путем суспендирования промытого костного мозга в 50 мл буфера.
Клетки подсчитывали с использованием Cellometer Vision и доводили с помощью полной культуральной среды RPMI 1640 до концентрации 5×106 клеток на мл для РВМС и 2×106 клеток на мл для клеток костного мозга. Все IgG-секретирующие клетки подсчитывали с использованием набора ELISpotBASIC от Mabtech (#3850-2HW-Plus). В кратком изложении, РВМС или клетки костного мозга добавляли к лункам в трех повторах в определенной концентрации (РВМС в количестве 5×105/лунку и клетки костного мозга в количестве 2×105/лунку), а затем клетки последовательно разбавляли в планшете. После инкубации в течение ночи планшеты промывали и добавляли биотинилированные антитела для детектирования. Планшеты инкубировали в течение 2 часов и добавляли стрептавидин-HRP(пероксидаза хрена) на 1 час. Пятна IgG визуализировали с использованием раствора субстрата ТМВ (тетраметилбензидин) и подсчитывали с использованием аналитической системы ImmunoSpot Imaging Analyzer (CTL) и программы ImmunoSpot 5.1. Данные выражали как среднее (+/- SD) количество клеток, секретирующих IgG, из трех повторов.
Полученное количество клеток, секретирующих IgG в РВМС и в костном мозге, указано в Таблицах 14А и 14В, соответственно. Истощение IgG-секретирующих клеток наблюдалось для анти-BCMA/CD3 биспецифических антител как в РВМС по сравнению с состоянием до введения, так и в костном мозге по сравнению с носителем и отрицательным контролем. Дозозависимый эффект наблюдался в костном мозге.
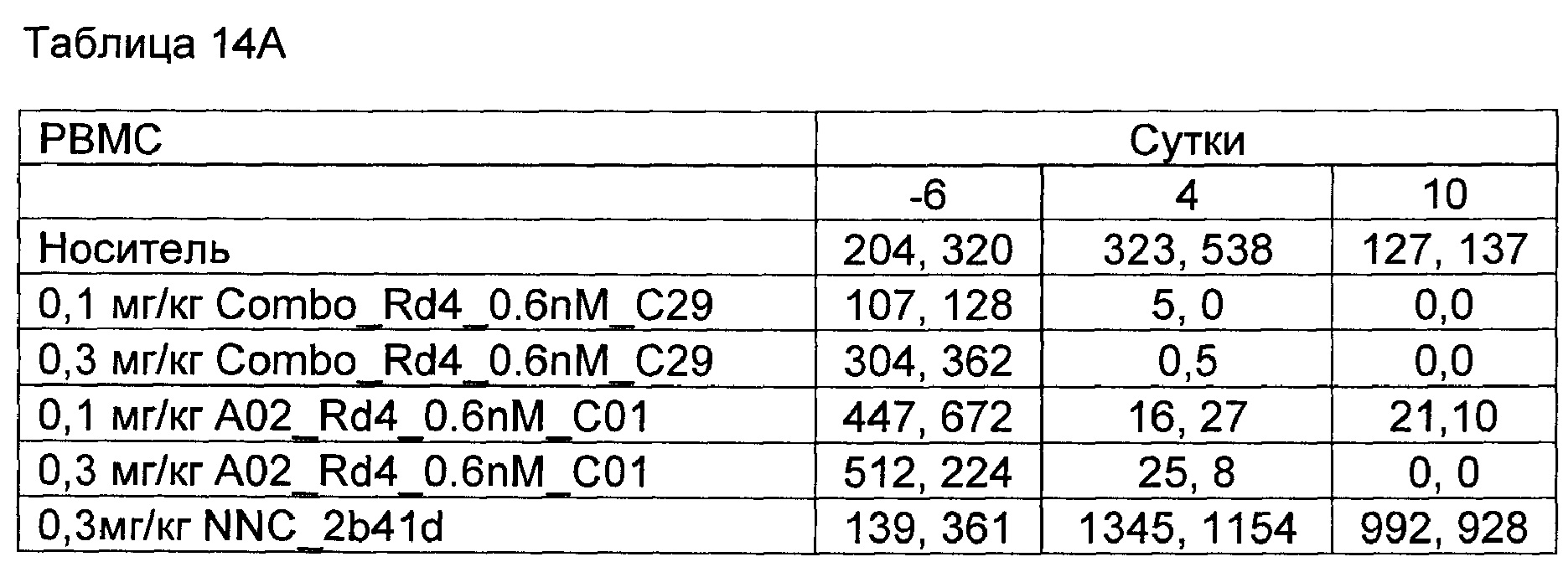

Пример 18: Анти-BCMA/CD3 биспецифические антитела индуцируют регрессию и ингибирование опухоли в модели опухоли MM1.S
Данный пример иллюстрирует регрессию и ингибирование опухоли в модели ортотопической миеломы MM1.S.
In vivo исследование эффективности BCMA-биспецифических антител выполняли с MM1.S, экспрессирующей люциферазу и GFP, в ортотопической модели. За одни сутки до инъекции опухолевых клеток мышей облучали 100 сГр, используя RS 2000 Biological Research Irradiator (RAD Source Technolgies, GA). Пять миллионов клеток MM1.S LucGFP инъецировали внутривенно через хвостовую вену 6-8-недельным самкам Nod/Scid/IL2Rg-/- (NSG). Внутрибрюшинная инъекция D-люциферина (Regis Technologies, Morton Grove, IL) (200 мкл на животное с концентрацией 15 мг/мл) с последующей анестезией изофлураном и последующей биолюминесцентной визуализацией всего тела (BLI) позволяли контролировать массу опухоли. Биолюминесцентные сигналы, излучаемые при взаимодействии люциферазы, экспрессируемой опухолевыми клетками, и люциферина, захватывали при визуализации с использованием MS Spectrum СТ (Perkin Elmer, MA) и количественно оценивали как общий поток (фотоны/сек), используя Living Image 4.4 (Caliper Life Sciences, Alameda, СА). Когда общий поток достигал в среднем 15Е6 для всех животных, животным вводили посредством болюсной инъекции в хвостовую вену 20 миллионов размноженных Т-клеток из РВМС. В кратком изложении, пан-Т-клетки, приобретенные у AllCells (Alameda, СА), были активированы набором для активации/размножения человеческих Т-клеток (Miltenyi, San Diego, СА). Через трое суток 15 Ед/мл IL2 (ebioscience, San Diego, СА) добавляли в каждые двое суток вплоть до 11 суток. Затем клетки собирали, шарики активации/размножения удаляли магнитом и клетки промывали и ресуспендировали в PBS. Через одни сутки после инъекции Т-клеток мышей визуализировали, как описано выше, и животных рандомизировали в группы из семи мышей; A02_Rd4_0.6nM_C01 с 0,03 мг/кг и 0,3 мг/кг и Combo_Rd4_0.6nM_C29 с 0,03 мг/кг, 0,1 мг/кг и 0,3 мг/кг. Однократную дозу человеческого анти-BCMA/CD3 (h2B4-VH-wt VL_TK) биспецифического антитела и биспецифического антитела для отрицательного контроля (NNC) вводили в виде болюсной инъекции в хвостовую вену. Животных умерщвляли при обнаружении у них паралича задней конечности, конечного показателя для ортотопической модели MM1.S. На Фиг. 12 показано, что однократная доза человеческого анти-BCMA/CD3 биспецифического антитела приводит к дозозависимой регрессии опухоли.
Пример 19: Две дозы анти-BCMA/CD3 биспецифического антитела индуцируют регрессию опухоли в модели агрессивной опухоли Molp8
Данный пример иллюстрирует регрессию опухоли, вызванную двумя дозами анти-BCMA/CD3 биспецифических антител в ортотопической модели миеломы Molp8.
Исследование эффективности BCMA-биспецифических антител in vivo выполняли с Molp8, экспрессирующей люциферазу и GFP, в ортотопической модели. Два миллиона клеток Molp8 LucGFP инъецировали внутривенно в хвостовую вену 6-8-недельным самкам NSG. Внутрибрюшинная инъекция D-люциферина (Regis Technologies, Morton Grove, IL) (200 мкл на животное с концентрацией 15 мг/мл) с последующей анестезией изофлураном и последующей биолюминесцентной визуализацией всего тела (BLI) позволяла контролировать массу опухоли. Биолюминесцентные сигналы, излучаемые при взаимодействии люциферазы, экспрессируемой опухолевыми клетками, и люциферина, захватывали при визуализации, используя IVIS Spectrum СТ (Perkin Elmer, MA), и количественно оценивали как общий поток (фотоны/сек) с использованием Living Image 4.4 (Caliper Life Sciences, Alameda, CA). Когда общий поток достигал в среднем 25Е6 для всех животных, их рандомизировали на три группы из семи мышей; 1) Combo_Rd4_0.6nM_C29, 0,3 мг/кг, 2) Combo_Rd4_0.6nM_C29, 0,3 мг/кг, две дозы и 3) NNC_2B4, 0,3 мг/кг, две дозы. Животным вводили посредством болюсной инъекции в хвостовую вену 20 миллионов размноженных Т-клеток, как описано в Примере 18. Через двое суток после инъекции Т-клеток, мышам вводили биспецифические антитела. Животных умерщвляли, когда у них обнаруживалась потеря массы более 15%, конечный показатель для ортотопической модели Molp8. На Фиг. 13 показано, что две дозы человеческого анти-BCMA/CD3 (h2B4-VH-wt VL_TK) биспецифического антитела приводили к повышенной регрессии опухоли.
Пример 20: Анти-BCMA/CD3 биспецифические антитела в комбинации со стандартным лечением множественной миеломы в ортотопической модели опухоли Molp8
Данный пример не демонстрирует никаких противодействующих эффектов на анти-BCMA/CD3 биспецифические антитела при комбинировании их с бортезомибом или леналидомидом и лучшую эффективность с анти-BCMA/CD3 биспецифическими антителами по сравнению с комбинацией бортезомиба и леналидомида.
Исследования эффективности BCMA-биспецифических антител in vivo выполняли с Molp8, экспрессирующей люциферазу и GFP, в ортотопической модели. Два миллиона клеток Molp8 LucGFP инъецировали внутривенно в хвостовую вену 6-8-недельным самкам NSG. Внутрибрюшинная инъекция D-люциферина (Regis Technologies, Morton Grove, IL) (200 мкл на животное с концентрацией 15 мг/мл) с последующей анестезией изофлураном и последующей биолюминесцентной визуализацией всего тела (BLI) позволяла контролировать массу опухоли. Биолюминесцентные сигналы, излучаемые при взаимодействии люциферазы, экспрессируемой опухолевыми клетками, и люциферина, захватывали при визуализации с использованием IVIS Spectrum СТ (Perkin Elmer, MA) и количественно оценивали как общий поток (фотоны/сек) с использованием Living Image 4.4 (Caliper Life Sciences, Alameda, CA). Животным вводили посредством болюсной инъекции в хвостовую вену на 7 сутки 20 миллионов размноженных Т-клеток, как описано в Примере 18. Через двое суток после инъекции Т-клеток мышей визуализировали и рандомизировали на пять групп из семи мышей со средним значением 17Е6 общий поток/группа: 1) Combo_Rd4_0.6nM_C29, 0,3 мг/кг, 2) Combo_Rd4_0.6nM_C29, 0,3 мг/кг и 1 мг/кг бортезомиба, 3) Combo_Rd4_0.6nM_C29, 0,3 мг/кг и 50 мг/кг леналидомида, 4) 1 мг/кг бортезомиба и 50 мг/кг леналидомида и 5) носитель. Анти-BCMA/CD3 (в PBS) вводили посредством болюсной инъекции в хвостовую вену, бортезомиб (в PBS) вводили посредством внутрибрюшинной инъекции, и леналидомид (30% PEG400/5% пропиленгликоль/0,5% Tween80) через желудочный зонд. Носитель состоял из 30% PEG400/5% пропиленгликоля/0,5% Tween80 и его вводили через желудочный зонд. Животных умерщвляли, когда у них наблюдалась потеря массы более 15%, конечный показатель для ортотопической модели Molp8. На Фиг. 14 показано, что сочетание анти-BCMA/CD3 (h2B4-VH-hnps VL-ТК) биспецифического антитела с бортезомибом или леналидомидом не оказывает отрицательного влияния на эффективность анти-BCMA/CD3 биспецифического антитела. В этой модели анти-BCMA/CD3 биспецифическое антитело отдельно или в комбинации с леналидомидом или бортезомибом является более эффективным, чем комбинация леналидомида и бортезомиба.
Пример 21: In vitro исследование анти-BCMA/CD3 биспецифического антитела в комбинации с леналидомидом, карфилзомибом или доксорубицином в клеточной линии ОРМ2
Данный пример показывает отсутствие неблагоприятных эффектов на функцию Т-клеток при комбинировании с карфилзомибом, доксорубицином и леналидомидом в отношении активности анти-BCMA/CD3 биспецифического антитела по сравнению с одним биспецифическим антителом.
CD3+ Т-клетки из РВМС отбирали путем отрицательной селекции с использованием набора для выделения человеческих пан-Т-клеток (Miltenyi, San Diego СА). Клетки OPM2 и клетки CD3+ Т сеяли в прозрачные планшеты с U-образным дном в количестве 20000 и 100000 клеток/лунка соответственно. OPM2 и CD3+ Т-клетки сначала инкубировали со стандартными препаратами в течение двух часов при 37°C. 1,56 нМ карфилзомиба и 6,25 нМ доксорубицина растворяли в PBS, содержащем 0,02% DMSO. Леналидомид растворяли в PBS, содержащем 0,1% DMSO при 195 нМ. Клетки обрабатывали 10-кратно серийно разведенным биспецифическим антителом. Через трое суток после обработки определяли все жизнеспособные клетки посредством проточной цитометрии с использованием антител к CD138, CD4 и CD8 (Biolegend). Клетки инкубировали с антителами при 4°C в PBS + 0,5% FBS в течение 30 минут. Клетки промывали и Fixable Viability Dye eFluor 780 (eBioscience, Inc., CA) в PBS добавляли к клеткам на 30 минут при 4°C. Перед выделением клеток на проточном цитометре BD, клетки промывали и добавляли шарики CountBright Absolute Counting Beads (Molecular Probes, OR). Процент живых клеток определяли, как количество живых клеток в обработанных лунках против необработанных лунок с использованием счетных шариков. На Фиг. 15А, 15В и 15С соответственно показано, что карфилзомиб, леналидомид и доксорубицин не оказывают отрицательного влияния на функцию Combo_Rd4_0.6nM_C29-CD3 (h2B4-VH-hnps VL-TK) биспецифического антитела в клетках ОРМ2.
Пример 22: In vitro исследование анти-BCMA/CD3 биспецифического антитела в комбинации с леналидомидом и карфилзомибом в клеточной линии KMS12BM
Данный пример иллюстрирует синергическое влияние на функцию анти-BCMA/CD3биспецифического антитела при комбинировании с карфилзомибом и леналидомидом по сравнению с каждой молекулой в отдельности.
Клетки CD3+ Т из РВМС были отобраны путем отрицательной селекции с использованием набора для выделения пан-Т-клеток человека (Miltenyi, San Diego СА). Клетки KMS12BM и CD3+ Т-клетки сеяли в прозрачные планшеты с U-образным дном в количестве 20000 и 100000 клеток/лунка соответственно. Клетки обрабатывали 0,017 нМ анти-BCMA/CD3 биспецифическими антителами в комбинации с карфилзомибом и диапазоном концентраций леналидомида. 1,25 нМ карфилзомиба разбавляли в PBS, содержащем 0,02% DMSO. Леналидомид растворяли в PBS, содержащем 0,1% DMSO, начиная с 4 мкМ, разведенных в 4 раза. Через трое суток после обработки все жизнеспособные клетки определяли посредством проточной цитометрии с использованием антител к CD138, CD4 и CD8 (Biolegend, СА). Клетки инкубировали с антителами при 4°C в PBS + 0,5% FBS в течение 30 минут. Клетки промывали и Fixable Viability Dye eFluor 780 (eBioscience, Inc., СА) в PBS добавляли к клеткам на 30 минут при 4°C. Перед выделением клеток на проточном цитометре BD, клетки промывали и добавляли шарики CountBright Absolute Counting Beads (Molecular Probes, OR). Процент живых клеток определяли как количество живых клеток в обработанных лунках против необработанных лунок с использованием счетных шариков. На Фиг. 16 показано, что в тестируемых концентрациях карфилзомиб, леналидомид и анти-BCMA/CD3 (h2B4-VH-hnps VL-TK) биспецифическое антитело обладали незначительной цитотоксической функцией при использовании по отдельности. При комбинировании всех трех агентов в клетках KMS12BM наблюдался синергический эффект, дозозависимый от концентрации леналидомида.
Хотя раскрытые принципы описаны со ссылкой на различные применения, способы, наборы и композиции, понятно, что могут быть сделаны различные изменения и модификации без отступления от принципов, изложенных здесь, и заявленного ниже изобретения. Вышеприведенные примеры представлены для лучшей иллюстрации раскрытых принципов и не предназначены для ограничения объема приведенного здесь раскрытия. Хотя настоящее руководство описано в терминах таких типичных воплощений, квалифицированный специалист легко поймет, что возможны многочисленные варианты и модификации этих типичных воплощений без чрезмерного экспериментирования. Все такие варианты и модификации входят в объем настоящего раскрытия.
Все приведенные здесь ссылки, включая патенты, патентные заявки, документы, учебники и подобное, а также цитируемые в них ссылки, в степени, в которой они еще не включены, включены в настоящее описание посредством ссылки во всей их полноте. В случае, если один или более из включенных литературных источников и подобных материалов отличаются или противоречат данной заявке, включая, но не ограничиваясь ими, определенные термины, использование термина, описанные методы и подобное, данная заявка обладает преимущественным правом.
В приведенном выше описании и примерах подробно описаны некоторые конкретные воплощения изобретения и описан наилучший режим, предусмотренный изобретателями. Следует, однако, понимать, что независимо от того, насколько подробно изложено вышеизложенное в тексте, изобретение может быть осуществлено на практике многими способами, и изобретение следует истолковывать в соответствии с прилагаемой формулой изобретения и любыми ее эквивалентами.