Результат интеллектуальной деятельности: Химерные антигенные рецепторы, нацеленные на антиген созревания B-клеток
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к химерным антигенным рецепторам (CAR). CAR способны переключать специфичность и реакционную способность иммунных клеток на заданную мишень, используя свойства лиганд-связывающих доменов. В частности, изобретение относится к CAR, которые специфически связываются с антигеном созревания B-клеток (к BCMA-специфическим CAR). Изобретение также относится к полинуклеотидам, кодирующим BCMA-специфические CAR, и к выделенным клеткам, экспрессирующим BCMA-специфические CAR на своей поверхности. Изобретение также относится к способам инженерии иммунных клеток, экспрессирующих BCMA-специфические CAR на своей поверхности. Изобретение является особенно полезным для лечения B-клеточных лимфом и лейкоза. Изобретение также относится к иммунным клеткам, содержащим BCMA-специфические CAR (BCMA-специфическим CAR-T-клеткам), композициям, содержащим BCMA-специфические CAR-T-клетки, и к способам применения BCMA-специфических CAR-T-клеток для лечения состояний, ассоциированных со злокачественными клетками, экспрессирующими BCMA (например, рак).
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Множественная миелома представляет собой злокачественное новообразование, характеризующееся накоплением клональных плазматических клеток (см., например, Lonial et al., Clinical Cancer Res., 77(6): 1264-1277 (2011)). Существующая терапия MM (множественная миелома) часто вызывает ремиссии, однако почти у всех пациентов со временем возникает рецидив, и они умирают (см., например, Rajkumar, Nature Rev. Clinical Oncol, 5(8): 479-491 (2011)).
Адоптивный перенос T-клеток, генетически модифицированных для распознавания антигенов, ассоциированных со злокачественным новообразованием, подает надежды в качестве новогог подхода к лечению онкологических заболеваний (см., например, Brenner et al., Current Opinion in Immunology, 22(2): 251-257 (2010); Rosenberg et al., Nature Reviews Cancer, 8(4): 299-308 (2008)). T-клетки могут быть генетически модифицированы, чтобы экспрессировать химерные антигенные рецепторы (CAR), которые представляют собой слитые белки, состоящие из антиген-распознающей группировки и доменов, вызывающих активацию T-клеток (см., например, Eshhar et al., Proc. Natl. Acad. Sci. USA, 90(2): 720-724 (1993) и Sadelain et al., Curr. Opin. Immunol, 21(2): 215-223 (2009)).
Антиген созревания B-клеток (BCMA, CD269, или TNFRSF17) является представителем суперсемейства рецептора фактора некроза опухоли (TNFR). BCMA обнаружили в клетках злокачественной T-клеточной лимфомы человека, имеющих транслокацию t(4; 16). Ген селективно экспрессируется в клетках B-клеточной линии, с наиболее высокой экспрессией у плазмобластов и плазматических клеток, антитело-секретирующих клеток. BCMA связывается с двумя лигандами, фактором активации B-клеток (BAFF) (также называемым стимулятором B-лимфоцитов (BLyS) и APOL(аполипопротеин L)-связанным лигандом, экспрессируемым лимфоцитами (TALL-1)) и лигандом, индуцирующим пролиферацию (APRIL), с аффинностью 1 мкМ и 16 нМ, соответственно. Связывание APRIL или BAFF с BCMA активизирует сигнальный каскад, в котором задействованы NF-каппа В (ядерный фактор каппа В), Elk-1, киназа, фосфорилирующая N-концевой фрагмент c-Jun, и митоген-активируемая протеинкиназа р38, которые генерируют сигналы к выживанию и пролиферации клеток. BCMA также экспрессируется на злокачественных B-клетках и некоторых видах рака, в которых задействованы B-лимфоциты, включая множественную миелому, плазмоцитому, лимфому Ходжкина и хронический лимфоцитарный лейкоз. При аутоиммунных заболеваниях, в которые вовлечены плазмобласты, таких как системная красная волчанка (SLE) и ревматоидный артрит, антитело-продуцирующие клетки, экспрессирующие BCMA, секретируют аутоантитела, которые атакуют собственный организм.
Что касается множественной миеломы, в США ежегодно диагностируют приблизительно 24000 новых случаев заболевания, что в США составляет приблизительно 15% новых диагностированных случаев гематологических злокачественных новообразований. В среднем 11000 человек погибают ежегодно от множественной миеломы, и средняя 5-летняя выживаемость составляет приблизительно 44%, а медианная продолжительность жизни составляет 50-55 месяцев. Существующее лечение множественной миеломы направлено на апоптоз плазматических клеток и/или снижение активности остеокластов (например, химиотерапия, талидомид, леналидомид, бисфосфонаты и/или ингибиторы протеасом, такие как бортезомиб (велкейд®) или карфилзомиб). Однако множественная миелома остается неизлечимым заболеванием, и практически у всех пациентов развивается резистентность к этим агентам и, в конечном итоге, рецидив. Следовательно, альтернативный подход к лечению множественной миеломы, например использование антагонистов BCMA, включая BCMA-специфические CAR и BCMA-специфические CAR-T-клетки, позволит создать более совершенный терапевтический агент.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОРЕТЕНИЯ
Предложены химерные антигенные рецепторы (CAR), связывающиеся с BCMA. Показано, что некоторые BCMA-специфические CAR, когда они экспрессируются в T-клетках, являются эффективными для активации T-клеток при контакте с BCMA. Преимущественно предложенные BCMA-специфические CAR связываются с BCMA человека и яванского макака. Также преимущественно, при контакте с клетками, экспрессирующими BCMA, предложенные здесь BCMA-специфические CAR демонстрируют дегрануляционную активность, усиленную продукцию интерферона гамма и/или цитотоксическую активность.
В одном аспекте изобретения предложен BCMA-специфический CAR, содержащий внеклеточный лиганд-связывающий домен, первый трансмембранный домен и внутриклеточный сигнальный домен, где внеклеточный лиганд-связывающий домен содержит (а) вариабельную область тяжелой цепи (VH), содержащую (1) первый участок VH, определяющий комплементарность (CDR1), содержащий последовательность SYX1MX2, где X1 представляет собой А или Р; и X2 представляет собой Т, N или S (SEQ ID NO: 301), GFTFX1SY, где X1 представляет собой G или S (SEQ ID NO: 302) или GFTFX1SYX2MX3, где X1 представляет собой G или S, X2 представляет собой А или Р; и X3 представляет собой Т, N или S (SEQ ID NO: 303); (2) CDR2 VH, содержащий последовательность AX1X2X3X4GX5X6X7X8YADX9X10KG, где X1 представляет собой I, V, Т, Н, L, А или С; X2 представляет собой S, D, G, Т, I, L, F, М или V; X3 представляет собой G, Y, L, Н, D, A, S или М; X4 представляет собой S, Q, Т, A, F или W; X5 представляет собой G или Т; X6 представляет собой N, S, Р, Y, W или F; X7 представляет собой S, Т, I, L, Т, A, R, V, K, G или С; X8 представляет собой F, Y, Р, W, Н или G; X9 представляет собой V, R или L; и X10 представляет собой G или Т (SEQ ID NO: 305) или X1X2X3X4X5X6 где X1 представляет собой S, V, I, D, G, Т, L, F или М; X2 представляет собой G, Y, L, Н, D, A, S или М; X3 представляет собой S, G, F или W; X4 представляет собой G или S; X5 представляет собой G или Т; и X6 представляет собой N, S, Р, Y или W (SEQ ID NO: 306); и (3) CDR3 VH, содержащий последовательность VSPIX1X2X3X4, где X1 представляет собой А или Y; X2 представляет собой А или S; и X3 представляет собой G, Q, L, Р или Е (SEQ ID NO: 307) или YWPMX1X2, где X1 представляет собой D, S, Т или А; и X2 представляет собой I, S, L, Р или D (SEQ ID NO: 308); и/или (б) вариабельную область легкой цепи (VL), содержащую (1) CDR1 VL, содержащий последовательность X1X2X3X4X5X6X7X8X9X10X11X12, где X1 представляет собой R, G, W, А или С; X2 представляет собой А, Р, G, L, С или S; X3 представляет собой S, G или R; X4 представляет собой Q, С, Е, V или I; X5 представляет собой S, L, Р, G, A, R или D; X6 представляет собой V, G или I; X7 представляет собой S, Е, D или Р; X8 представляет собой S, Р, F, А, М, Е, V, N, D или Y; X9 представляет собой I, Т, V, Е, S, А, М, Q, Y, Н или R; X10 представляет собой Y или F; X11 представляет собой L, W или Р; и X12 представляет собой A, S или G (SEQ ID NO: 309); (2) CDR2 VL, содержащий последовательность X1ASX2RAX3, где X1 представляет собой G или D; X2 представляет собой S или I; и X3 представляет собой Т или Р (SEQ ID NO: 310); и (3) CDR3 VL, содержащий последовательность QQYX1X2X3PX4T, где X1 представляет собой G, Q, Е, L, F, A, S, М, K, R или Y; X2 представляет собой S, R, Т, G, V, F, Y, D, А, Н, V, Е, K или С; X3 представляет собой W, F или S; и X4 представляет собой L или I (SEQ ID NO: 311) или QQYX1X2X3PX4, где X1 представляет собой G, Q, Е, L, F, A, S, М, R, K или Y; X2 представляет собой S, R, Т, G, R, V, D, А, Н, Е, K, С, F или Y; X3 представляет собой W, S или F; и X4 представляет собой L или I (SEQ ID NO: 312).
В другом аспекте изобретения предложен BCMA-специфический CAR, содержащий внеклеточный лиганд-связывающий домен, первый трансмембранный домен и внутриклеточный сигнальный домен, где внеклеточный домен содержит одноцепочечный фрагмент Fv (scFv), содержащий вариабельную область тяжелой цепи (VH), содержащую три CDR участка VH, содержащую последовательность, приведенную в SEQ ID NO: 33, 72, 39, 76, 83, 92, 25 или 8; и вариабельную область легкой цепи (VL), содержащую три CDR участка VL, содержащую последовательность, приведенную в SEQ ID NO: 34, 73, 40, 77, 84, 93, 18 или 80. В некоторых воплощениях область VH может содержать последовательность, приведенную в SEQ ID NO: 33, 72, 39, 76, 83, 92, 25 или 8, или ее вариант с одной или несколькими консервативными аминокислотными заменами остатков, которые не находятся в пределах CDR, и/или область VL может содержать аминокислотную последовательность, приведенную в SEQ ID NO: 34, 73, 40, 77, 84, 93, 18 или 80, или ее вариант с одной или несколькими аминокислотными заменами аминокислот, которые не находятся в пределах CDR.
В некоторых воплощениях внеклеточный лиганд-связывающий домен BCMA-специфического CAR, предложенного в данном изобретении, содержит (а) вариабельную область тяжелой цепи (VH), содержащую (1) первый участок VH, определяющий комплементарность (CDR1), содержащий последовательность, приведенную в SEQ ID NO: 150, 151, 152, 156, 157, 129, 130 или 131; (2) CDR2 VH, содержащий последовательность, приведенную в 153, 154, 187, 188, 165, 166, 162, 159, 190, 191, 169, 154, 139, 140, 132 или 133; и (3) CD3 VH, содержащий последовательность, приведенную в 155, 161, 134 или 137; и/или (б) вариабельную область легкой цепи (VL), содержащую (1) CDR1 VL, содержащий последовательность, приведенную в SEQ ID NO: 209, 249, 226, 251, 262, 271, 217 или 377; (2) CDR2 VL, содержащий последовательность, приведенную в SEQ ID NO: 221, 252 или 210; и (3) CDR3 VL, содержащий последовательность, приведенную в SEQ ID NO: 222, 225, 227, 253, 263, 272, 216 или 214.
В некоторых воплощениях внеклеточный лиганд-связывающий домен BCMA-специфического CAR, предложенного в данном изобретении, содержит (а) вариабельную область тяжелой цепи (VH), содержащую (1) первый участок VH, определяющий комплементарность (CDR1), содержащий последовательность, приведенную в SEQ ID NO: 150, 151 или 152; (2) CDR2 VH, содержащий последовательность, приведенную в 153 или 154; и (3) CD3 VH, содержащий последовательность, приведенную в 155; и/или (б) вариабельную область легкой цепи (VL), содержащую (1) CDR1 VL, содержащий последовательность, приведенную в SEQ ID NO: 209; (2) CDR2 VL, содержащий последовательность, приведенную в SEQ ID NO: 221; и (3) CDR2 VL, содержащий последовательность, приведенную в SEQ ID NO: 222.
В некоторых воплощениях внеклеточный лиганд-связывающий домен BCMA-специфического CAR, предложенного здесь, содержит (а) вариабельную область тяжелой цепи (VH), содержащую (1) первый участок VH, определяющий комплементарность (CDR1), содержащий последовательность, приведенную в SEQ ID NO: 150, 151 или 152; (2) CDR2 VH, содержащий последовательность, приведенную в 187 или 188; и (3) CD3 VH, содержащий последовательность, приведенную в 155; и/или (б) вариабельную область легкой цепи (VL), содержащую (1) CDR1 VL, содержащий последовательность, приведенную в SEQ ID NO: 249; (2) CDR2 VL, содержащий последовательность, приведенную в SEQ ID NO: 221; и (3) CDR3 VL, содержащий последовательность, приведенную в SEQ ID NO: 225.
В некоторых воплощениях внеклеточный лиганд-связывающий домен BCMA-специфического CAR, предложенного здесь, содержит (а) вариабельную область тяжелой цепи (VH), содержащую (1) первый участок VH, определяющий комплементарность (CDR1), содержащий последовательность, приведенную в SEQ ID NO: 150, 151 или 152; (2) CDR2 VH, содержащий последовательность, приведенную в 165 или 166; и (3) CD3 VH, содержащий последовательность, приведенную в 155; и/или (б) вариабельную область легкой цепи (VL), содержащую (1) CDR1 VL, содержащий последовательность, приведенную в SEQ ID NO: 226; (2) CDR2 VL, содержащий последовательность, приведенную в SEQ ID NO: 221; и (3) CDR3 VL, содержащий последовательность, приведенную в SEQ ID NO: 227.
В некоторых воплощениях внеклеточный лиганд-связывающий домен BCMA-специфического CAR, предложенного здесь, содержит (а) вариабельную область тяжелой цепи (VH), содержащую (1) первый участок VH, определяющий комплементарность (CDR1), содержащий последовательность, приведенную в SEQ ID NO: 156, 151 или 157; (2) CDR2 VH, содержащий последовательность, приведенную в 162 или 159; и (3) CD3 VH, содержащий последовательность, приведенную в 161; и/или (б) вариабельную область легкой цепи (VL), содержащую (1) CDR1 VL, содержащий последовательность, приведенную в SEQ ID NO: 251; (2) CDR2 VL, содержащий последовательность, приведенную в SEQ ID NO: 252; и (3) CDR3 VL, содержащий последовательность, приведенную в SEQ ID NO: 253.
В некоторых воплощениях внеклеточный лиганд-связывающий домен BCMA-специфического CAR, предложенного в данном изобретении, содержит (а) вариабельную область тяжелой цепи (VH), содержащую (1) первый участок VH, определяющий комплементарность (CDR1), содержащий последовательность, приведенную в SEQ ID NO: 156, 151 или 157; (2) CDR2 VH, содержащий последовательность, приведенную в 190 или 191; и (3) CD3 VH, содержащий последовательность, приведенную в 161; и/или (б) вариабельную область легкой цепи (VL), содержащую (1) CDR1 VL, содержащий последовательность, приведенную в SEQ ID NO: 262; (2) CDR2 VL, содержащий последовательность, приведенную в SEQ ID NO: 252; и (3) CDR3 VL, содержащий последовательность, приведенную в SEQ ID NO: 263.
В некоторых воплощениях внеклеточный лиганд-связывающий домен BCMA-специфического CAR, предложенного здесь, содержит (а) вариабельную область тяжелой цепи (VH), содержащую (1) первый участок VH, определяющий комплементарность (CDR1), содержащий последовательность, приведенную в SEQ ID NO: 150, 151 или 152; (2) CDR2 VH, содержащий последовательность, приведенную в 169 или 154; и (3) CD3 VH, содержащий последовательность, приведенную в 155; и/или (б) вариабельную область легкой цепи (VL), содержащую (1) CDR1 VL, содержащий последовательность, приведенную в SEQ ID NO: 271; (2) CDR2 VL, содержащий последовательность, приведенную в SEQ ID NO: 221; и (3) CDR3 VL, содержащий последовательность, приведенную в SEQ ID NO: 272.
В некоторых воплощениях внеклеточный лиганд-связывающий домен BCMA-специфического CAR, предложенного здесь, содержит (а) вариабельную область тяжелой цепи (VH), содержащую (1) первый участок VH, определяющий комплементарность (CDR1), содержащий последовательность, приведенную в SEQ ID NO: 129, 130 или 131; (2) CDR2 VH, содержащий последовательность, приведенную в 139 или 140; и (3) CD3 VH, содержащий последовательность, приведенную в 134; и/или (б) вариабельную область легкой цепи (VL), содержащую (1) CDR1 VL, содержащий последовательность, приведенную в SEQ ID NO: 217; (2) CDR2 VL, содержащий последовательность, приведенную в SEQ ID NO: 210; и (3) CDR3 VL, содержащий последовательность, приведенную в SEQ ID NO: 216.
В некоторых воплощениях внеклеточный лиганд-связывающий домен BCMA-специфического CAR, предложенного здесь, содержит (а) вариабельную область тяжелой цепи (VH), содержащую (1) первый участок VH, определяющий комплементарность (CDR1), содержащий последовательность, приведенную в SEQ ID NO: 129, 130 или 131; (2) CDR2 VH, содержащий последовательность, приведенную в 132 или 133; и (3) CD3 VH, содержащий последовательность, приведенную в 137; и/или (б) вариабельную область легкой цепи (VL), содержащую (1) CDR1 VL, содержащий последовательность, приведенную в SEQ ID NO: 377; (2) CDR2 VL, содержащий последовательность, приведенную в SEQ ID NO: 210; и (3) CDR3 VL, содержащий последовательность, приведенную в SEQ ID NO: 214.
В некоторых воплощениях внутриклеточный сигнальный домен содержит сигнальный домен CD3ζ. В некоторых воплощениях внутриклеточный сигнальный домен содержит домен 4-1BB. В некоторых воплощениях CAR может дополнительно содержать другой внутриклеточный сигнальный домен. В некоторых воплощениях дополнительный внутриклеточный сигнальный домен может содержать домен 4-1BB.
В некоторых воплощениях CAR может содержать стеблевой домен между внеклеточным лиганд-связывающим доменом и первым трансмембранным доменом. В некоторых воплощениях стеблевой домен может быть выбран из группы, состоящей из: шарнирной области CD8α человека, шарнирной области IgG1 (иммуноглобулин G1) и шарнирной области FcγRIIIα (рецептор Fcγ IIIα).
В некоторых воплощениях первый трансмембранный домен может содержать трансмембранный домен цепи CD8α.
В некоторых воплощениях CAR может содержать эпитоп CD20.
В некоторых воплощениях CAR может содержать другой внеклеточный лиганд-связывающий домен, который не является специфическим в отношении BCMA.
В некоторых воплощениях BCMA-специфический CAR может содержать аминокислотную последовательность, приведенную в SEQ ID NO: 396.
В некоторых воплощениях CAR внеклеточный(ые) лиганд-связывающий(ие) домен(ы), первый трансмембранный домен и внутриклеточный(ые) сигнальный(ые) домен(ы) находятся на одном полипептиде.
В некоторых воплощениях CAR может содержать второй трансмембранный домен, где первый трансмембранный домен и внеклеточный(ые) лиганд-связывающий(ие) домен(ы) находятся на первом полипептиде, и где второй трансмембранный домен и внутриклеточный(ые) сигнальный(ые) домен(ы) находятся на втором полипептиде, где первый трансмембранный домен содержит трансмембранный домен из α-цепи высокоаффинного рецептора IgE (FcεRI) и второй трансмембранный домен содержит трансмембранный домен из γ- или β-цепи FcεRI. В некоторых воплощениях CAR может содержать третий полипептид, содержащий третий трансмембранный домен, слитый с внутриклеточным сигнальным доменом из костимулирующей молекулы, где третий трансмембранный домен содержит трансмембранный домен из γ- или β-цепи FcεRI.
В другом аспекте изобретения предложен выделенный полинуклеотид, содержащий нуклеиновокислотную последовательность, кодирующую BCMA-специфический CAR, согласно данному описанию.
В другом аспекте изобретения предложен экспрессирующий вектор, содержащий нуклеиновокислотную последовательность, кодирующую BCMA-специфическое CAR антитело, согласно данному описанию.
В другом аспекте изобретения предложена подвергнутая инженерии иммунная клетка, экспрессирующая на своей поверхностной мембране BCMA-специфический CAR, согласно данному описанию. В некоторых воплощениях подвергнутая инженерии иммунная клетка может содержать другой CAR, который не является специфическим в отношении BCMA. В некоторых воплощениях подвергнутая инженерии иммунная клетка может содержать полинуклеотид, кодирующий суицидальный полипептид. В некоторых воплощениях суицидальный полипептид представляет собой RQR8.
В некоторых воплощениях иммунная клетка может иметь происхождение от воспалительного T-лимфоцита, цитотоксического T-лимфоцита, регуляторного T-лимфоцита или хелперного T-лимфоцита.
В некоторых воплощениях подвергнутая инженерии иммунная клетка может содержать нарушение одного или нескольких эндогенных генов, где эндогенный ген кодирует TCRα (T-клеточный рецептор α), TCRβ, CD52, рецептор глюкокортикоидов (GR), дезоксицитидинкиназу (DCK) или белок контрольных точек иммунного ответа, например такой как белок программированной смерти-1 (PD-1).
В некоторых воплощениях иммунную клетку получают от здорового донора. В некоторых воплощениях иммунную клетку получают от пациента.
В другом аспекте изобретения предложена подвергнутая инженерии иммунная клетка, экспрессирующая на своей клеточной поверхностной мембране BCMA-специфический CAR, согласно данному описанию, для применения в качестве лекарственного средства. В некоторых воплощениях лекарственное средство предназначено для применения в лечении рака, связанного с B-клетками, выбранного из группы, состоящей из множественной миеломы, злокачественной неоплазии плазматических клеток, лимфомы Ходжкина, нодулярной лимфомы Ходжкина с лимфоцитарным преобладанием, болезни Калера и миеломатоза, плазмоклеточного лейкоза, плазмоцитомы, B-клеточного пролимфоцитарного лейкоза, волосатоклеточного лейкоза, B-клеточной неходжкинской лимфомы (NHL), острого миелоидного лейкоза (AML), хронического лимфоцитарного лейкоза (CLL), острого лимфоцитарного лейкоза (ALL), хронического миелоидного лейкоза (CML), фолликулярной лимфомы, лимфомы Беркитта, лимфомы маргинальной зоны, лимфомы из клеток зоны мантии, крупноклеточной лимфомы, B-лимфобластной лимфомы из клеток-предшественников, миелолейкоза, макроглобулинемии Вальденстрема, диффузной крупноклеточной B-клеточной лимфомы, фолликулярной лимфомы, лимфомы маргинальной зоны, лимфомы из лимфоидной ткани, ассоциированной со слизистыми оболочками, мелкоклеточной лимфоцитарной лимфомы, лимфомы из клеток зоны мантии, лимфомы Беркитта, первичной медиастинальной (тимической) B-крупноклеточной лимфомы, лимфоплазмоцитарной лимфомы, макроглобулинемии Вальденстрема, узловой B-клеточной лимфомы из клеток маргинальной зоны, лимфомы маргинальной зоны селезенки, внутрисосудистой B-крупноклеточной лимфомы, первичной выпотной лимфомы, лимфогранулематоза, B-клеточной лимфомы с большим количеством T-клеток/гистиоцитов, первичной лимфомы центральной нервной системы, первичной кожной диффузной B-крупноклеточной лимфомы (тип нижних конечностей), EBV (вирус Эпштейна-Барр)-положительной диффузной B-крупноклеточной лимфомы пожилых, диффузной B-крупноклеточной лимфомы, ассоциированной с воспалением, внутрисосудистой B-крупноклеточной лимфомы, ALK (киназа анапластической лимфомы)-положительной B-крупноклеточной лимфомы, плазмобластной лимфомы, B-крупноклеточной лимфомы, возникающей на фоне HHV8 (вирус герпеса-8 человека)-ассоциированной мультицентрической болезни Кастлемана, неклассифицированной B-клеточной лимфомы с признаками, промежуточными между диффузной B-крупноклеточной лимфомой и лимфомой Беркитта, неклассифицированной B-клеточной лимфомы с признаками, промежуточными между диффузной B-крупноклеточной лимфомой и классической лимфомой Ходжкина, и других лимфом, связанных с B-клетками.
В другом аспекте изобретения предложен способ инженерии иммунной клетки, включающий: предоставление иммунной клетки; и экспрессию на поверхности клетки по меньшей мере одного BCMA-специфического CAR, согласно данному описанию.
В некоторых воплощениях способ включает: предоставление иммунной клетки; внедрение в клетку по меньшей мере одного полинуклеотида, кодирующего указанный BCMA-специфический CAR; и экспрессию указанного полинуклеотида в клетке.
В некоторых воплощениях способ включает: предоставление иммунной клетки; внедрение в клетку по меньшей мере одного полинуклеотида, кодирующего указанный BCMA-специфический CAR; и внедрение по меньшей мере одного иного CAR, не являющегося специфическим в отношении BCMA
В другом аспекте изобретения предложен способ лечения субъекта, страдающего состоянием, ассоциированным со злокачественными клетками, включающий: предоставление иммунной клетки, экспрессирующей на поверхности BCMA-специфический CAR, согласно данному описанию; и введение указанных иммунных клеток указанному пациенту.
В другом аспекте изобретения предложена фармацевтическая композиция, содержащая подвергнутую инженерии иммунную клетку согласно данному описанию.
В другом аспекте изобретения предложен способ лечения состояния, ассоциированного со злокачественными клетками, экспрессирующими BCMA, у субъекта, включающий введение субъекту, которому это необходимо, эффективного количества фармацевтической композиции, содержащей подвергнутую инженерии иммунную клетку согласно данному описанию. В некоторых воплощениях состояние представляет собой рак. В некоторых воплощениях рак, связанный с B-клетками, выбран из группы, состоящей из множественной миеломы, злокачественной неоплазии плазматических клеток, лимфомы Ходжкина, нодулярной лимфомы Ходжкина с лимфоцитарным преобладанием, болезни Калера и миеломатоза, плазмоклеточного лейкоза, плазмоцитомы, B-клеточного пролимфоцитарного лейкоза, волосатоклеточного лейкоза, B-клеточной неходжкинской лимфомы (NHL), острого миелоидного лейкоза (AML), хронического лимфоцитарного лейкоза (CLL), острого лимфоцитарного лейкоза (ALL), хронического миелоидного лейкоза (CML), фолликулярной лимфомы, лимфомы Беркитта, лимфомы маргинальной зоны, лимфомы из клеток зоны мантии, крупноклеточной лимфомы, B-лимфобластной лимфомы из клеток-предшественников, миелолейкоза, макроглобулинемии Вальденстрема, диффузной крупноклеточной B-клеточной лимфомы, фолликулярной лимфомы, лимфомы маргинальной зоны, лимфомы из лимфоидной ткани, ассоциированной со слизистыми оболочками, мелкоклеточной лимфоцитарной лимфомы, лимфомы из клеток зоны мантии, лимфомы Беркитта, первичной медиастинальной (тимической) B-клеточной крупноклеточной лимфомы, лимфоплазмоцитарной лимфомы, макроглобулинемии Вальденстрема, узловой B-клеточной лимфомы из клеток маргинальной зоны, лимфомы маргинальной зоны селезуказанному панки, внутрисосудистой B-крупноклеточной лимфомы, первичной выпотной лимфомы, лимфогранулематоза, B-клеточной лимфомы с большим количеством T-клеток/гистиоцитов, первичной лимфомы центральной нервной системы, первичной кожной диффузной B-крупноклеточной лимфомы (тип нижних конечностей), EBV-положительной диффузной B-крупноклеточной лимфомы пожилых, диффузной B-крупноклеточной лимфомы, ассоциированной с воспалением, внутрисосудистой B-крупноклеточной лимфомы, ALK-положительной B-крупноклеточной лимфомы, плазмобластной лимфомы, B-крупноклеточной лимфомы, возникающей на фоне HHV8-ассоциированной мультицентрической болезни Кастлемана, неклассифицированной B-клеточной лимфомы с признаками, промежуточными между диффузной B-крупноклеточной лимфомой и лимфомой Беркитта, неклассифицированной B-клеточной лимфомы с признаками, промежуточными между диффузной B-крупноклеточной лимфомой и классической лимфомой Ходжкина, и других лимфом, связанных с B-клетками.
В другом аспекте изобретения предложен способ подавления роста и прогрессирования опухоли у субъекта, имеющего злокачественные клетки, экспрессирующие BCMA, включающий введение субъекту, которому это необходимо, эффективного количества фармацевтической композиции, содержащей подвергнутую инженерии иммунную клетку согласно данному описанию.
В другом аспекте изобретения предложен способ подавления метастазирования злокачественных клеток, экспрессирующих BCMA, у субъекта, включающий введение субъекту, которому это необходимо, эффективного количества фармацевтической композиции, содержащей подвергнутую инженерии иммунную клетку согласно данному описанию.
В другом аспекте изобретения предложен способ индуцирования регрессии опухоли у субъекта, имеющего злокачественные клетки, экспрессирующие BCMA, включающий введение субъекту, которому это необходимо, эффективного количества фармацевтической композиции, содержащей подвергнутую инженерии иммунную клетку согласно данному описанию.
В некоторых воплощениях любой из указанных выше способов дополнительно включает введение одного или более дополнительных лечений, например, таких как моноклональное антитело и/или химиотерапевтический агент. В некоторых воплощениях моноклональное антитело может быть, например, антителом, которое связывается с ингибитором контрольных точек иммунного ответа, например, таким как антитело к PD-1 или антитело к PD-L1. В некоторых воплощениях любой из указанных выше способов дополнительно включает введение субъекту лечения в виде нуклеозидного аналога, например, такого как флударабин или клофарабин.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
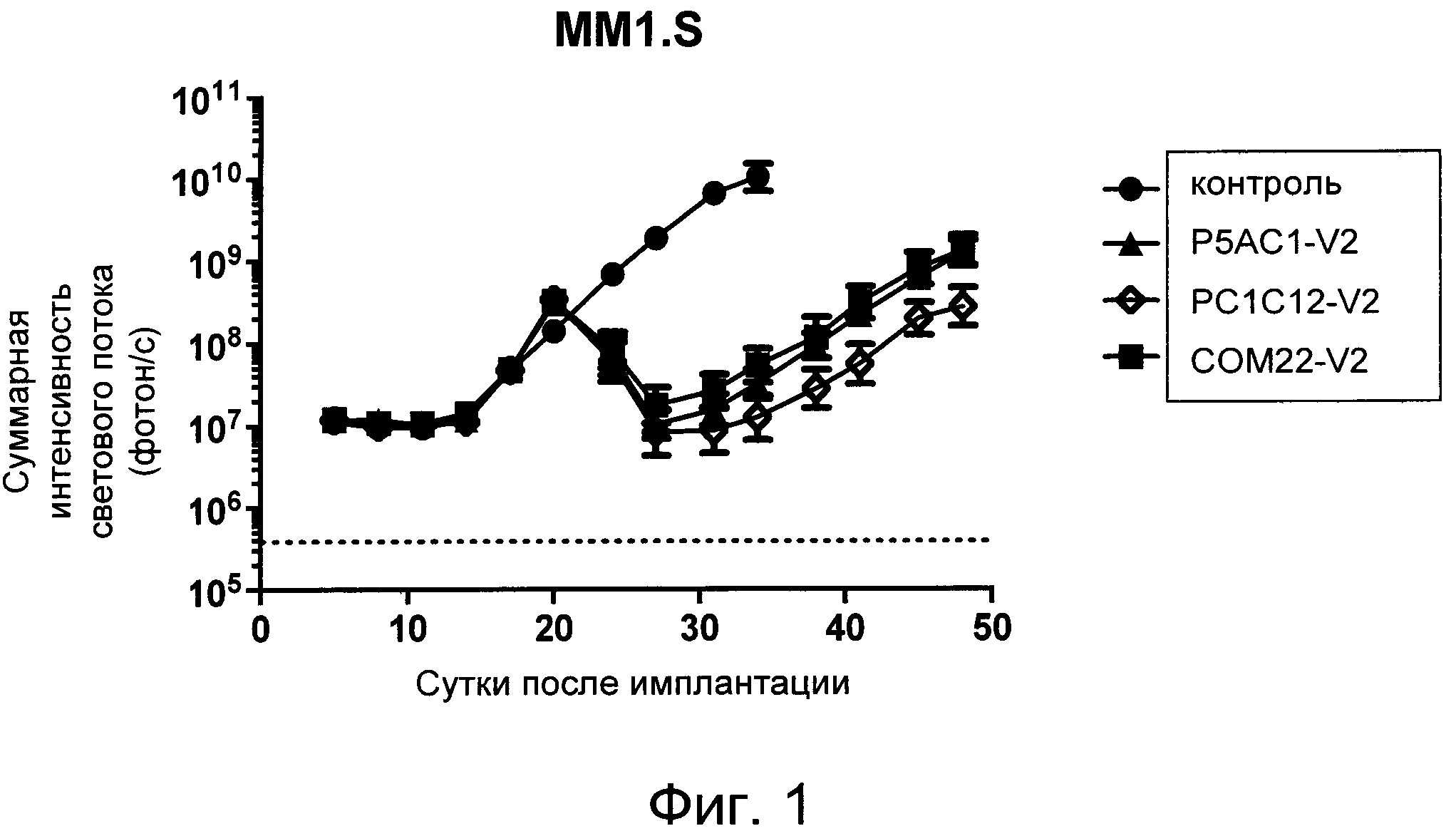
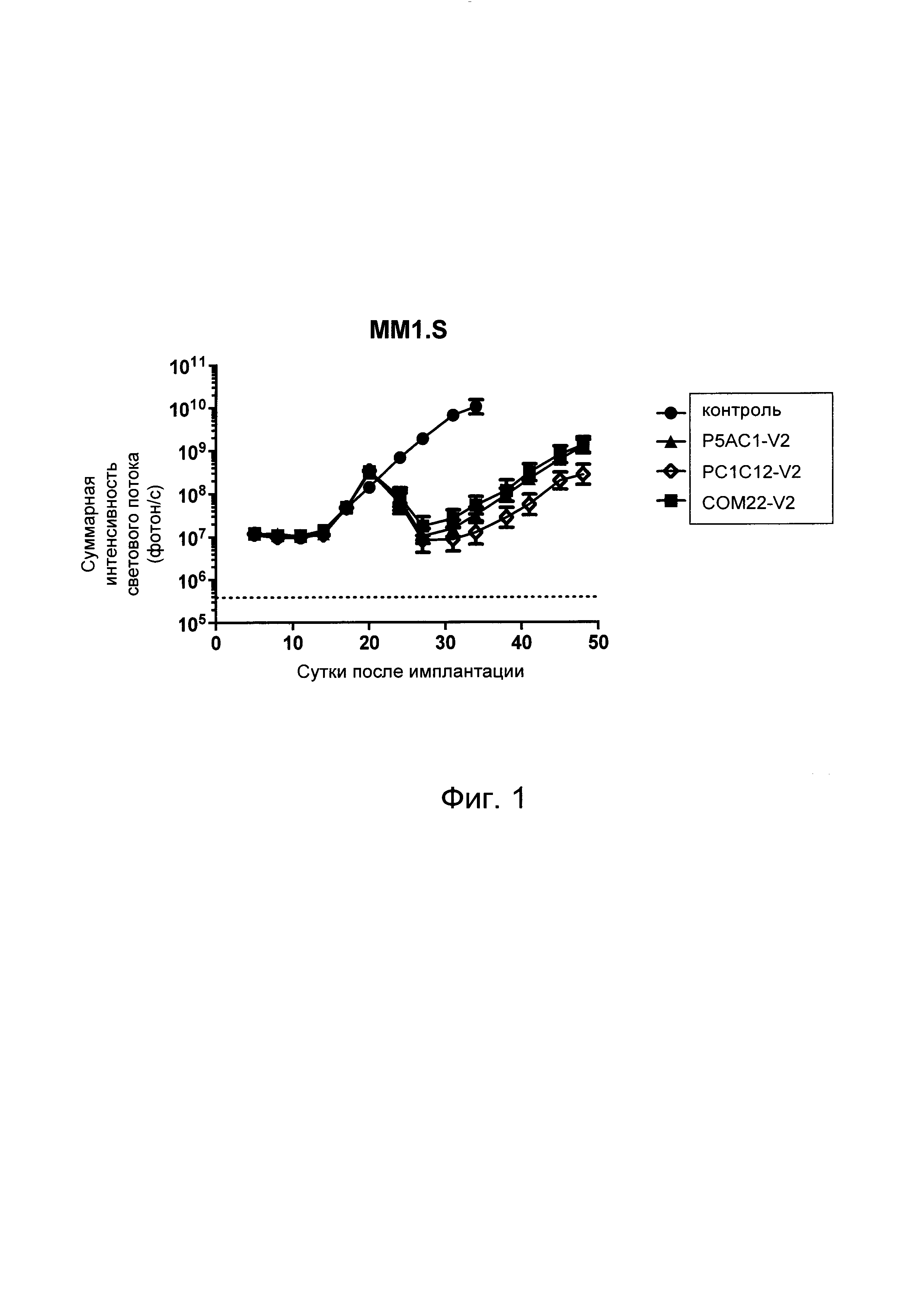
На Фиг. 1 показан график, обобщающий результаты лечения BCMA-специфическими CAR-T на модели опухоли MM1.S.
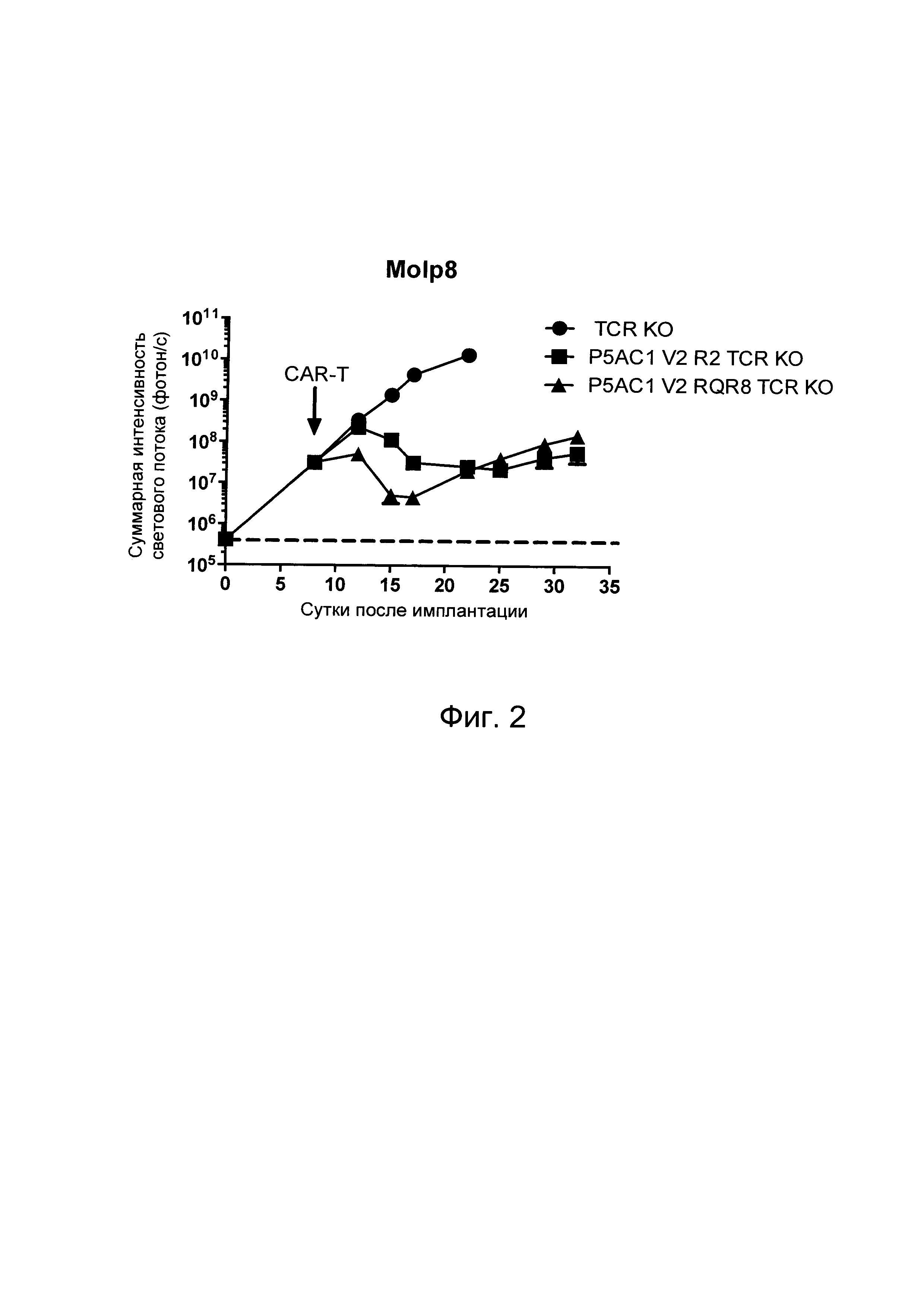
На Фиг. 2 показан график, обобщающий результаты лечения BCMA-специфическими CAR-T на модели опухоли Molp8.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В данном изобретении предложены химерные антигенные рецепторы (CAR) и иммунные клетки, содержащие CAR (CAR-T клетки), которые специфически связываются с BCMA (например, человеческим BCMA). В изобретении также предложены полинуклеотиды, кодирующие указанные CAR, композиции, содержащие указанные CAR-T клетки, и способы получения и применения указанных CAR и CAR-T клеток. В изобретении также предложены способы лечения состояния, ассоциированного со злокачественной экспрессией BCMA у субъекта, такого как рак.
Общие методики
При осуществлении данного изобретения используют стандартные методики молекулярной биологии (включая рекомбинантные методы), микробиологии, клеточной биологии, биохимии и иммунологии, известные специалистам в области техники, если не указано иное. Такие методики подробно описаны в литературе, например в Molecular Cloning: A Laboratory Manual, second edition (Sambrook et al., 1989) Cold Spring Harbor Press; Oligonucleotide Synthesis (M.J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J.E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R.I. Freshney, ed., 1987); Introduction to Cell and Tissue Culture (J.P. Mather and P.E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J.B. Griffiths, and D.G. Newell, eds., 1993-1998) J. Wiley and Sons; Methods in Enzymology (Academic Press, Inc.); Handbook of Experimental Immunology (D.M. Weir and C.C. Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J.M. Miller and M.P. Calos, eds., 1987); Current Protocols in Molecular Biology (F.M. Ausubel et al., eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J.E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C.A. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: practical approach (D. Catty., ed., IRL Press, 1988-1989); Monoclonal antibodies: practical approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using antibodies: laboratory manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M. Zanetti and J.D. Capra, eds., Harwood Academic Publishers, 1995).
Определения
Термин «внеклеточный лиганд-связывающий домен», используемый в данном описании, относится к олиго- или полипептиду, способному связывать лиганд. Предпочтительно, домен способен взаимодействовать с молекулой клеточной поверхности. Например, внеклеточный лиганд-связывающий домен может быть выбран для распознавания лиганда, который служит маркером клеточной поверхности на клетках-мишенях, ассоциированных с конкретным болезненным состоянием.
Термины «стеблевой домен» или «шарнирный домен» в данном описании применяются взаимозаменяемо для обозначения любого олиго- или полипептида, который функционирует для связывания трансмембранного домена с внеклеточным лиганд-связывающим доменом. В частности, стеблевые домены используют для обеспечения большей гибкости и доступности внеклеточного лиганд-связывающего домена.
Термин «внутриклеточный сигнальный домен» относится к части белка, передающей эффекторный сигнал сигнальной функции, и побуждающей клетку к выполнению специализированной функции.
«Костимулирующая молекула» в данном описании относится к родственному партнеру по связыванию на T-клетке, который специфически связывается с костимулирующим лигандом, таким образом, опосредуя костимулирующий ответ клетки, например такой как, без огарничения, пролиферация. Костимулирущие молекулы включают, без огарничения, молекулы МНС (главный комплекс гистосовместимости) класса I, BTLA (B- и T-лимфоцитарный аттенюатор) и Toll-рецепторы лигандов. Примеры костимулирующих молекул включают CD27, CD28, CD8, 4-1BB (CD137), OX40, CD30, CD40, PD-1, ICOS (индуцибельный костимулятор), ассоциированный с функцией лимфоцитов антиген 1 (LFA-1), CD2, CD7, LIGHT, NKG2C, В7-Н3 и лиганд, который специфически связывается с CD83 и тому подобные.
«Костимулирующий лиганд» относится к молекуле на антиген-презентирующей клетке, которая специфически связывается с родственной костимулирующей сигнальной молекулой на T-клетке, таким образом обеспечивая сигнал, который в дополнение к первичному сигналу, обусловленному, например, связыванием комплекса TCR/CD3 с молекулой МНС, загруженной пептидом, опосредует T-клеточный ответ, включая, без ограничения, активацию пролиферации, дифференцировку и тому подобное. Костимулирующий лиганд может включать CD7, В7-1 (CD80), В7-2 (CD86), PD-L1, PD-L2, 4-1BBL, OX40L, индуцибельный костимулирующий лиганд (ICOS-L), молекулы межклеточной адгезии (ICAM (молекула межклеточной адгезии), CD30L, CD40, CD70, CD83, HLA-G (человеческий лейкоцитарный антиген G), MICA, М1СВ, HVEM (посредник проникновения вируса герпеса), рецептор лимфотоксина β, 3/TR6, ILT3, ILT4, агонист или антитело, которое связывается с рецептором Toll-лиганда, и лиганд, который специфически связывается с B7-Н3, но не ограничивается ими. Костимулирующий лиганд также охватывает, помимо прочих, антитело, которое специфически связывается с костимулирующей молекулой, присутствующей на T-клетке, такой как CD27, CD28, 4-1BB, OX40, CD30, CD40, PD-1, ICOS, ассоциированный с функцией лимфоцитов антиген 1 (LFA-1), CD2, CD7, LTGHT, NKG2C, B7-Н3, лиганд, который специфически связывается с CD83, но не ограничивается ими.
«Антитело» представляет собой молекулу иммуноглобулина, способную специфически связываться с мишенью, такой как углевод, полинуклеотид, липид, полипептид и т.д., посредством по меньшей мере одного сайта распознавания антигена, расположенного в вариабельной области молекулы иммуноглобулина. В данном документе термин охватывает не только интактные поликлональные или моноклональные антитела, но также их фрагменты (такие как Fab, Fab', F(ab')2, Fv), одноцепочечные (scFv) и доменные антитела (включая, например, акульи и верблюжьи антитела), и слитые белки, содержащие антитело, и любые другие молекулы иммуноглобулина с модифицированной конфигурацией, которые содержат сайт распознавания антигена. Антитело включает антитело любого класса, такие как IgG, IgA или IgM (или их подклассы), и антитело не обязательно должно относиться к какому-то конкретному классу. В зависимости от аминокислотной последовательности константной области их тяжелых цепей иммуноглобулины могут быть отнесены к различным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут дополнительно подразделяться на подклассы (изотипы), например IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные области тяжелой цепи, соответствующие различным классам иммуноглобулинов, обозначают альфа, дельта, эпсилон, гамма и мю, соответственно. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны.
Термин «антигенсвязывающий фрагмент», или «антигенсвязывающая часть» антитела в данном документе относится к одному или более фрагментам интактного антитела, которые сохраняют способность специфически связываться с заданным антигеном (например, BCMA). Антигенсвязывающие функции антитела могут осуществляться фрагментами интактного антитела. Примеры связывающих фрагментов, охватываемые термином «антигенсвязывающий фрагмент» антитела, включают Fab; Fab'; F(ab')2; Fd фрагмент, состоящий из доменов VH и СН1; Fv фрагмент, состоящий из доменов VL и VH одного плеча антитела; однодоменный фрагмент антитела (dAb) (Ward et al., Nature 341: 544-546, 1989) и изолированный участок, определяющий комплементарность (CDR).
Антитело, конъюгат антитела или полипептид, который «предпочтительно связывается» или «специфически связывается» (термины используются взаимозаменяемо) с мишенью (например, белком BCMA) представляют собой термины, хорошо известные в области техники, и способы определения такого специфического или предпочтительного связывания также хорошо известны в области техники. Говорят, что молекула демонстрирует «специфическое связывание» или «предпочтительное связывание», если она вступает в реакцию или ассоциируется более часто, более быстро, с большей продолжительностью и/или большей аффинностью с конкретной клеткой или веществом, чем с альтернативными клетками или веществами. Антитело «специфически связывается» или «предпочтительно связывается» с мишенью, если оно связывается с большей аффинностью, авидностью, с большей готовностью и/или с большей продолжительностью, чем оно связывается с другими веществами. Например, антитело, которое специфически или предпочтительно связывается с эпитопом BCMA, представляет собой антитело, которое связывается с указанным эпитопом с большей аффинностью, авидностью, с большей готовностью и/или с большей продолжительностью, чем оно связывается с другими эпитопами BCMA или с другим эпитопами, не являющимися BCMA. Читая данное определение, следует понимать, что, например, антитело (или группировка или эпитоп), которое специфически или предпочтительно связывается с первой мишенью, может либо не может специфически или предпочтительно связываться со второй мишенью. Как таковое, «специфическое связывание» или «предпочтительное связывание» не обязательно требует исключительного связывания (хотя может его включать). Обычно, но не обязательно, упоминание связывания означает предпочтительное связывание.
«Вариабельная область» антитела обозначает вариабельную область легкой цепи антитела или вариабельную область тяжелой цепи антитела, в отдельности или в комбинации. Как известно в области техники, каждая из вариабельных областей тяжелой и легкой цепи состоит из четырех каркасных областей (FR), соединенных тремя участками, определяющими комплементарность (CDR), также известными как гипервариабельные участки. CDR в каждой цепи удерживаются вблизи с помощью FR и вместе с CDR другой цепи участвуют в образовании антигенсвязывающего сайта антител. Существует по меньшей мере два способа определения CDR: (1) подход основан на межвидовой вариабельности последовательностей (т.е. Kabat et al. Sequences of Proteins of Immunological Interest, (5th ed., 1991, National Institutes of Health, Bethesda MD)); и (2) подход основан на кристаллографических исследованиях комплексов антиген-антитело (Al-lazikani et al., 1997, J. Molec. Biol. 273: 927-948). В данном описании CDR может относиться к CDR, которые определили посредством любого подхода или посредством комбинации обоих подходов.
«CDR» вариабельного домена представляют собой аминокислотные остатки в составе вариабельной области, которые идентифицировали в соответствии с определениями по Kabat, Chothia, совокупности определений Kabat и Chothia, определением AbM, контактным определением и/или конформационным определением или любым способом определения CDR, известным в области техники. CDR антитела можно идентифицировать как гипервариабельные области, впервые определенные Kabat et al. См., например, Kabat et al., 1992, Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, NIH, Washington D.C. Положения CDR также можно идентифицировать как петлевые структуры, впервые описанные Chothia и др. См., например, Chothia et al., Nature 342:877-883, 1989. Другие подходы к идентификации CDR включают «определение AbM», которое представляет собой компромисс между определениями Kabat и Chothia и основано на использовании программы моделирования антител AbM биотехнологической группы Oxford Molecular (ныне Accelrys®), или «контактное определение» CDR, основанное на обнаруженных контактах с антигенами, предложенное MacCallum et al., J. Mol. Biol., 262: 732-745, 1996. В другом подходе, упоминаемом в данном документе как «конформационное определение» CDR, положения CDR можно идентифицировать как остатки, которые вносят энтальпийный вклад в связывание с антигеном. См., например, Makabe et al., Journal of Biological Chemistry, 283: 1156-1166, 2008. Другие определения границ CDR не обязаны строго следовать одному из указанных выше подходов, но тем не менее, будут совпадать по меньшей мере частично с CDR согласно Kabat, хотя они могут быть укорочены или удлинены с учетом предсказанных или экспериментальных данных, что конкретные остатки или группы остатков, или даже целые CDR не оказывают существенного влияния на связывание антигена. В данном описании CDR может относиться к CDR, которые определены на основе любого подхода, известного в области техники, включая комбинации подходов. В способах, применяемых в данном изобретении, можно использовать CDR, определенные в соответствии с любым указанным подходом. В любом из приведенных воплощений, содержащих более одного CDR, CDR можно определять в соответствии с любым из определений: Kabat, Chothia, расширенным, определением AbM, определением контактов и/или конформационным определением.
В данном описании «моноклональное антитело» относится к антителу, полученному из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, идентичны, за исключением возможных естественных мутаций, которые могут присутствовать в незначительном количестве. Моноклональные антитела высоко специфичны, направлены против единственного антигенного сайта. Кроме того, в отличие от препаратов поликлональных антител, которые, как правило, включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против единственной антигенной детерминанты. Прилагательное «моноклональное» указывает на свойство антитела, заключающегося в том, что оно получено из по существу гомогенной популяции антител, и не рассматривается как необходимость получения антитела каким-либо конкретным способом. Например, моноклональные антитела для применения в соответствии с данным изобретением, могут быть получены гибридомным способом, впервые описанным Kohler and Milstein, Nature 256:495, 1975, или могут быть получены методами рекомбинантных ДНК, такими, которые описаны в патенте США 4816567. Моноклональные антитела также могут быть выделены из библиотек фагов, полученных с использованием методик, описанных, например, McCafferty et al., Nature 348:552-554, 1990.
В данном описании «гуманизированное антитело» относится к формам антител, не являющихся человеческими (например, мышиные), которые представляют собой химерные иммуноглобулины, иммуноглобулиновые цепи или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие подпоследовательности антител), которые содержат минимальную последовательность, имеющую происхождение от иммуноглобулина, не являющегося человеческим. Предпочтительно, гуманизированные антитела представляют собой человеческие иммуноглобулины (антитело-реципиент), в которых остатки из участка, определяющего комплементарность (CDR), реципиента заменены на остатки из CDR видов, отличных от человека (антитело-донор), таких как мышь, крыса или кролик, обладающих необходимой специфичностью, аффинностью и антигенсвязывающей способностью. В некоторых случаях остатки каркасной области Fv (FR) человеческого иммуноглобулина заменены соответствующими остатками, не являющимися человеческими. Кроме того, гуманизированное антитело может содержать остатки, которые не обнаруживаются ни в антителе-реципиенте, ни в привнесенных последовательностях CDR или каркасных последовательностях, но включены для дальнейшего улучшения и оптимизации характеристик антител. В общем, гуманизированное антитело будет содержать по существу все из по меньшей мере одного, а обычно двух вариабельных доменов, в которых все или по существу все участки CDR соответствуют таковым из иммуноглобулинов, не являющихся человеческими, и все или по существу все участки FR являются таковыми с консенсусной последовательностью иммуноглобулина человека. В оптимальном варианте гуманизированное антитело также содержит по меньшей мере часть константной области или домена иммуноглобулина (Fc), как правило, иммуноглобулина человека. Предпочтительны антитела, имеющие Fc области, модифицированные, как описано в WO 99/58572. Другие формы гуманизированных антител имеют один или более CDR (CDR L1, CDR L2, CDR L3, CDR Н1, CDR Н2 или CDR Н3), которые изменены по сравнению с исходным антителом, которые также обозначают одним или более CDR, «происходящими из» одного или более CDR исходного антитела.
В данном описании «человеческое антитело» означает антитело, имеющее аминокислотную последовательность, соответствующую таковой антитела, продуцированного человеком, и/или созданное посредством любой из методик получения человеческих антител, известных специалистам в области техники или раскрытых в данном документе. Данное определение человеческого антитела охватывает антитела, содержащие по меньшей мере один полипептид тяжелой цепи человека или по меньшей мере один полипептид легкой цепи человека. Одним из таких примеров является антитело, содержащее полипептиды легкой цепи мыши и тяжелой цепи человека. Человеческие антитела можно получать с использованием различных методик, известных в области техники. В одном воплощении человеческое антитело выбрано из фаговой библиотеки, экспрессирующей человеческие антитела (Vaughan et al., Nature Biotechnology, 14: 309-314, 1996; Sheets et al., Proc. Natl. Acad. Sci. (USA) 95: 6157-6162, 1998; Hoogenboom and Winter, J. Mol. Biol., 227:381, 1991; Marks et al., J. Mol. Biol., 222:581, 1991). Человеческие антитела также могут быть получены путем иммунизации животных, которым вместо эндогенных локусов были трансгенно введены локусы иммуноглобулинов человека, например мышей, у которых эндогенные гены иммуноглобулинов были частично или полностью инактивированы. Данный подход описан в патентах США 5545807; 5545806; 5569825; 5625126; 5633425 и 5661016. В альтернативном варианте, человеческое антитело можно получить путем иммортализации человеческих B-лимфоцитов, которые продуцируют антитело, направленное против антигена-мишени (такие B-лимфоциты можно выделить у индивидуума или при клонировании кДНК (комплементарная ДНК) одиночных клеток или получить путем иммунизации in vitro). См., например, Cole et al. Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p.77, 1985; Boerner et al., J. Immunol., 147 (1):86-95, 1991; и патент США 5750373.
Термин «химерное антитело» относится к антителам, у которых последовательности вариабельной области имеют происхождение из одного вида, а последовательности константной области имеют происхождение из другого вида, как у антитела, в котором последовательности вариабельной области имеют происхождение из мышиного антитела, а последовательности константной области имеют происхождение из человеческого антитела.
Термины «полипептид», «олигопептид», «пептид» и «белок» используются в данном документе взаимозаменяемо и обозначают цепи аминокислот любой длины, предпочтительно относительно короткие (например, 10-100 аминокислот). Цепь может быть линейной или разветвленной, она может содержать модифицированные аминокислоты и/или прерываться неаминокислотами. Термины также охватывают аминокислотную цепь, которая была модифицирована естественным или посредством вмешательства; например, образованием дисульфидной связи, гликозилированием, липидированием, ацетилированием, фосфорилированием или любой другой манипуляцией или модификацией, такой как конъюгирование с метящим компонентом. Определение также охватывает, например, полипептиды, содержащие один или более аналогов аминокислот (включая, например, аминокислоты, не встречающиеся в природе, и т.д.), а также другие модификации, известные в области техники. Понятно, что полипептиды могут быть в виде одиночных цепей или ассоциированных цепей.
«Моновалентное антитело» содержит один антигенсвязывающий сайт на молекулу (например, IgG или Fab). В некоторых случаях моновалентное антитело может иметь более одного антигенсвязывающего сайта, но это сайты связывания различных антигенов.
«Бивалентное антитело» содержит два антигенсвязывающих сайта на молекулу (например, IgG). В некоторых случаях два сайта связывания обладают одинаковой антигенной специфичностью. Однако бивалентные антитела могут быть биспецифическими.
«Биспецифическое», «бифункциональное» антитело, или антитело «двойной специфичности» представляет собой гибридное антитело, имеющее два различных антигенсвязывающих сайта. Два антигенсвязывающих сайта биспецифического антитела связываются с двумя различными эпитопами, которые могут находиться на одном и том же или на различных белках-мишенях.
Антитела по изобретению могут быть получены с использованием методик, хорошо известных в области техники, например, рекомбинантных методик, методик фагового дисплея, синтетических методик или путем комбинаций таких методик или других методик, хорошо известных в области техники (см., например, Jayasena, S.D., Clin. Chem., 45: 1628-50, 1999 и Fellouse, F.A., et al, J. Mol. Biol., 373(4): 924-40, 2007).
Как известно в области техники, термины «полинуклеотид» или «нуклеиновая кислота», которые в данном описании используют взаимозаменяемо, относятся к цепям из нуклеотидов любой длины и включают ДНК и РНК. Нуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания и/или их аналоги или любой субстрат, который может быть включен в цепь ДНК или РНК полимеразой. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. При наличии модификаций структуры нуклеотида, они могут быть введены до или после сборки цепи. Последовательность нуклеотидов может прерываться компонентами, не являющимися нуклеотидами. Полинуклеотид может быть дополнительно модифицирован после полимеризации, например путем конъюгации с метящим компонентом. Другие типы модификаций включают, например, «кэпирование», замену одного или более встречающихся в природе нуклеотидов аналогом, межнуклеотидные модификации, например, такие как модификации со связями, не несущими заряда (например, метилфосфонаты, фосфотриэфиры, фосфоамидаты, карбаматы и т.д.), и связями, несущими заряд (например, фосфоротиоаты, фосфородитиоаты и т.д.), модификации, включающие боковые группировки, например, такие как белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин и т.д.), модификации с интеркалирующими агентами (например, акридином, псораленом и т.д.), модификации, включающие хелаторы (например, металлы, радиоактивные металлы, бор, окислительные металлы и т.д.), модификации, включающие алкилирующие агенты, модификации с модифицированными связями (например, альфа аномерные нуклеиновые кислоты и т.д.), а также немодифицированные формы полинуклеотида(ов). Помимо этого, любая из гидроксильных групп, обычно присутствующих в сахарах, может быть замещена, например, фосфонатными группами, фосфатными группами, защищена стандартными защитными группами или активирована для получения дополнительных связей с дополнительными нуклеотидами, или может быть конъюгирована с твердыми подложками. 5'- и 3'-концевые ОН могут быть фосфорилированы или замещены аминами или органическими группировками кэпирующих групп из 1-20 атомов углерода. Другие гидроксилы могут также быть дериватизированы до стандартных защитных групп. Полинуклеотиды также могут содержать формы-аналоги сахаров рибозы или дезоксирибозы, хорошо известные в данной области техники, включая, например, 2'-O-метил-, 2'-O-аллил, 2'-фтор- или 2'-азидо-рибозу, карбоциклические аналоги сахаров, альфа- или бета-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и нуклеозидные аналоги с удаленными азотистыми основаниями, такие как метилрибозид. Одна и более чем одна фосфодиэфирная связь может быть заменена на альтернативные связывающие группы. Указанные альтернативные связывающие группы включают воплощения, в которых фосфат замещен на P(O)S («тиоат»), P(S)S («дитиоат»), «(O)NR2 («амидат»), P(O)R, P(O)OR', СО или СН2 («формацеталь»), где каждый R или R' независимо представляет собой Н или замещенный или незамещенный ал кил (1-20 С), возможно содержащий эфирную (-О-) связь, арил, алкенил, циклоалкил, циклоалкенил или аралдил, но не ограничиваются ими. Не все связи в полинуклеотиде должны быть идентичными. Предшествующее описание относится ко всем полинуклеотидам, упоминающимся в данном документе, включая РНК и ДНК.
Как известно в области техники, «константная область» антитела обозначает константную область легкой цепи антитела или константную область тяжелой цепи антитела, в отдельности или в комбинации.
В данном описании «по существу чистый» относится к веществу, чистому по меньшей мере на 50% (т.е. свободному от примесей), более предпочтительно чистому по меньшей мере на 90%, более предпочтительно чистому по меньшей мере на 95%, еще более предпочтительно чистому по меньшей мере на 98% и наиболее предпочтительно чистому по меньшей мере на 99%.
«Клетка-хозяин» включает отдельную клетку или культуру клеток, которые могут быть или являлись реципиентом вектора(ов) для включения полинуклеотидных вставок. Клетки-хозяева включают потомство одной клетки-хозяина, и потомство может не быть обязательно полностью идентичным (по морфологии или по комплементарности геномной ДНК) исходной родительской клетке вследствие природной, случайной или преднамеренной мутации. Клетка-хозяин включает клетки, трансфицированные in vivo полинуклеотидом(ами) по данному изобретению.
В данном документе «иммунная клетка» относится к клетке гемопоэтического происхождения, функционально задействованной в инициации и/или реализации врожденного и/или адаптивного иммунного ответа.
Как известно в области техники, термин «Fc область» используется для обозначения C-концевой области тяжелой цепи иммуноглобулина. «Fc область» может быть нативной последовательностью Fc области или вариантом Fc области. Несмотря на то, что границы Fc области тяжелой цепи иммуноглобулина могут варьировать, Fc область тяжелой цепи иммуноглобулина обычно определяют, как участок от аминокислотного остатка в положении Cys226 или Рго230 до карбокси-конца. Нумерация остатков Fc области соответствует системе нумерации индекса EU, как в Kabat. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md., 1991. Fc область иммуноглобулина обычно содержит две константных области, СН2 и СН3.
В области техники термины «Fc рецептор» и «FcR» описывают рецептор, который связывается с Fc областью антитела. Предпочтительным FcR является FcR человека с нативной последовательностью. Кроме того, предпочтительный FcR связывается с антителом IgG (гамма-рецептор) и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и альтернативно сплайсированные формы указанных рецепторов. FcγRII рецепторы включают FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор»), которые имеют одинаковую аминокислотную последовательность, отличающуюся преимущественно своими цитоплазматическими доменами. Обзоры по FcR представлены Ravetch and Kinet, Ann. Rev. Immunol., 9: 457-92, 1991; Capel et al., Immunomethods, 4: 25-34, 1994; и de Haas et al., J. Lab. Clin. Med., 126:330-41, 1995. «FcR» также включает неонатальный рецептор, FcRn, который отвечает за транспорт материнских IgG к плоду (Guyer et al., J. Immunol., 117: 587, 1976; и Kim et al., J. Immunol., 24:249, 1994).
Термин «конкурировать», используемый в данном описании применительно к антителу, означает, что первое антитело или его антигенсвязывающий фрагмент (или часть) связывается с эпитопом способом, достаточно схожим со связыванием второго антитела или его антигенсвязывающей части, так что результат связывания первого антитела со своим родственным эпитопом выявляемо снижается в присутствии второго антитела по сравнению со связыванием первого антитела в отсутствие второго антитела. Может иметь место альтернативный вариант, когда связывание второго антитела со своим эпитопом также выявляемо снижается в присутствии первого антитела, но он не является обязательным. Это означает, что первое антитело может ингибировать связывание второго антитела с его эпитопом без ингибирования этим вторым антителом связывания первого антитела с его соответствующим эпитопом. Однако, когда каждое из антител выявляемо ингибирует связывание другого антитела с его родственным эпитопом или лигандом, либо в равной, либо в большей или меньшей степени, говорят, что антитела «перекрестно конкурируют» друг с другом за связывание с их соответствующим(и) эпитопом(ами). Изобретение охватывает как конкурирующие, так и перекрестно конкурирующие антитела. Независимо от механизма возникновения такой конкуренции или перекрестной конкуренции (например, стерическое препятствие, конформационное изменение или связывание с общим эпитопом или его частью), специалист в области техники поймет, исходя из приведенных здесь сведений, что такие конкурирующие или перекрестно конкурирующие антитела входят в объем изобретения и могут быть полезными в изложенных способах.
В данном документе «аутологичный» означает, что клетка, клеточная линия или популяция клеток, используемых для лечения пациентов, имеют происхождение из указанного пациента или из донора, совместимого по антигенам лейкоцитов человека (HLA-антигенам).
В данном документе «аллогенный» означает, что клетка или популяция клеток, используемых для лечения пациентов, имеют происхождение не из указанного пациента, а из донора.
В данном документе «лечение» представляет собой подход для достижения благоприятных или желаемых клинических результатов. Для задач изобретения благоприятные или желаемые клинические результаты включают, без ограничения, одно или более из следующего: уменьшение пролиферации (или уничтожение) злокачественных или раковых клеток, подавление метастазирования злокачественных клеток, сокращение или уменьшение размера опухоли, экспрессирующей BCMA, ремиссию заболевания, ассоциированного с BCMA (например, рака), уменьшение симптомов, возникающих в результате заболевания, ассоциированного с BCMA (например, рака), улучшение качества жизни лиц, страдающих от заболевания, ассоциированного с BCMA (например, рака), снижение дозы других лекарственных средств, требуемых для лечения заболевания, ассоциированного с BCMA (например, рака), замедление прогрессирования заболевания, ассоциированного с BCMA (например, рака), излечение заболевания, ассоциированного с BCMA (например, рака) и/или продление жизни пациентов, имеющих заболевание ассоциированное с BCMA (например, рак).
«Облегчение» означает ослабление или улучшение одного или более симптомов по сравнению с отсутствием введения антитела к BCMA или конъюгата антитела к BCMA. «Облегчение» также включает сокращение или уменьшение продолжительности симптома.
В данном описании «эффективная доза» или «эффективное количество» лекарства, соединения или фармацевтической композиции представляет собой количество, достаточное для того, чтобы обеспечить один или более благоприятных или желаемых результатов. Для профилактического применения благоприятные или желаемые результаты включают устранение или снижение риска, ослабление тяжести или задержку начала заболевания, включая биохимические, гистологические и/или поведенческие симптомы заболевания, его осложнения и промежуточные патологические фенотипы, возникающие в ходе развития заболевания. Для терапевтического применения благоприятные или желаемые результаты включают такие клинические результаты, как снижение частоты возникновения или облегчение одного или более симптомов различных заболеваний или состояний, ассоциированных с BCMA (например, таких как множественная миелома), снижение дозы других лекарственных средств, требуемых для лечения заболевания, усиление эффекта другого лекарственного средства и/или задержку прогрессирования у пациентов заболевания, ассоциированного с BCMA. Эффективную дозу можно вводить в одном или нескольких введениях. Для задач данного изобретения эффективная доза лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для осуществления профилактического или терапевтического воздействия напрямую или опосредованно. Как понимается в клиническом контексте, эффективная доза лекарственного средства, соединения или фармацевтической композиции может быть достигнута или не быть достигнута в сочетании с другим лекарственным средством, соединением или фармацевтической композицией. Таким образом, «эффективная доза» может рассматриваться в контексте введения одного или более терапевтических средств, причем одно средство может рассматриваться как вводимое в эффективном количестве, если в сочетании с одним или более других средств может быть достигнут или достигается желаемый результат.
«Индивидуумом» или «субъектом» является млекопитающее, более предпочтительно человек. Млекопитающие также включают, без ограничения, сельскохозяйственных животных, спортивных животных, домашних животных, приматов, лошадей, собак, кошек, мышей и крыс.
В данном описании «вектор» обозначает конструкцию, способную доставлять и, предпочтительно, экспрессировать в клетке-хозяине один или более генов или хозяине одну или более последовательностей, представляющих интерес. Примеры векторов включают, без ограничения, вирусные векторы, голые ДНК- или РНК-экспрессирующие векторы, плазмидные, космидные или фаговые векторы, ДНК- или РНК-экспрессирующие векторы, ассоциированные с катионными конденсирующими агентами, ДНК- или РНК-экспрессирующие векторы, инкапсулированные в липосомы, а также некоторые эукариотические клетки, такие как клетки-продуценты.
В данном описании «последовательность контроля экспрессии» означает нуклеиновокислотную последовательность, которая направляет транскрипцию нуклеиновой кислоты. Последовательность контроля экспрессии может быть промотором, таким как конститутивный или индуцибельный промотор, или энхансером. Последовательность контроля экспрессии функционально связана с транскрибируемой нуклеиновокислотной последовательностью.
В данном описании «фармацевтически приемлемый носитель» или «фармацевтически приемлемый эксципиент» включает любое вещество, которое при комбинировании с активным ингредиентом позволяет указанному ингредиенту сохранять биологическую активность и не обладает реактивностью в отношении иммунной системы субъекта. Примеры включают любой стандартный фармацевтический носитель, такой как забуференный фосфатом физиологический раствор, вода, эмульсии, такие как эмульсия масло/вода, а также различные типы смачивающих агентов, но не ограничиваются ими. Предпочтительными разбавителями для аэрозольного или парентерального введения являются забуференный фосфатом физиологический раствор (PBS) или нормальный (0,9%) физиологический раствор. Композиции, содержащие такие носители, готовят посредством общеизвестных стандартных способов (см., например, Remington's Pharmaceutical Sciences, 18th edition, A. Gennaro, ed., Mack Publishing Co., Easton, PA, 1990; и Remington, The Science and Practice of Pharmacy 21st Ed. Mack Publishing, 2005).
Термин «kon», используемый в данном документе, относится к константе скорости ассоциации антитела с антигеном.
Термин «koff», используемый в данном документе, относится к константе скорости диссоциации антитела из комплекса антитело/антиген.
Термин «KD», используемый в данном документе, относится к равновесной константе диссоциации взаимодействия антитело-антиген.
Упоминание «приблизительного» значения или параметра в данном документе включает (и описывает) воплощения, которые относятся к данному значению или параметру как таковому. Например, описание, относящееся к «приблизительно X» включает описание «X». Диапазоны числовых значений включают значения, обозначающие диапазон.
Следует понимать, что, когда при описании воплощений используют термин «содержащий», подразумевают и аналогичные воплощения, описываемые терминами «состоящий из» и/или «по существу состоящий из».
Когда для описания аспектов или воплощений изобретения используют группу Маркуша или иную группировку альтернатив, данное изобретение охватывает не только всю группу в целом, но и каждого представителя группы в отдельности и все возможные подгруппы основной группы, а также и основную группу без одного или более представителей группы. Данное изобретение также предусматривает недвусмысленное исключение одного или более представителей группы в заявленном изобретении.
Если не указано иное, все технические и научные термины, используемые в данном документе, имеют обычное значение, известное специалистам в области, к которой относится данное изобретение. В случае расхождений следует руководствоваться данным описанием, включая терминологию. В данном описании и формуле изобретения термин «содержать» или такие его варианты как «содержит» или «содержащий» следует понимать как означающие включение указанного целого значения или группы целых значений, но не исключение любого другого целого значения или группы целых значений. Если контекстом не требуется иное, термины в единственном числе включают и термины во множественном числе, а термины во множественном числе включают термины в единственном числе.
В описании приведены примеры способов и веществ, описанных в данном документе, однако для воплощения или проверки данного изобретения можно также применять способы и вещества, аналогичные или эквивалентные описанным в данном документе. Вещества, способы и примеры являются только иллюстративными и не подразумевается, что они являются исчерпывающими.
BCMA-специфические CAR и способы их получения
В изобретении предложены CAR, которые связываюстя с BCMA (например, BCMA человека (например, SEQ ID NO: 354 или номер доступа: Q02223-2). Предложенные здесь BCMA-специфические CAR включают одноцепочечные CAR и многоцепочечные CAR. CAR обладают способностью перенаправлять специфичность и реакционную способность T-клеток на BCMA не ограниченным по МНС способом, используя антигенсвязывающие свойства моноклональных антител. Не ограниченное по МНС распознавание антигенов придает T-клеткам, экспрессирующим CAR, способность распознавать антиген независимо от процессирования антигена, таким образом обходя основной механизм ускользания опухолей от иммунной системы (tumor escape).
В некоторых воплощениях предложенные в изобретении CAR содержат внеклеточный лиганд-связывающий домен (например, одноцепочечный вариабельный фрагмент (scFv)), трансмембранный домен и внутриклеточный сигнальный домен. В некоторых воплощениях внеклеточный лиганд-связывающий домен, трансмембранный домен и внутриклеточный сигнальный домен находятся в одном полипептиде, то есть в одной цепи. В изобретении также предложены многоцепочечные CAR и полипептиды. В некоторых воплощениях многоцепочечные CAR содержат: первый полипептид, содержащий трансмембранный домен и по меньшей мере один внеклеточный лиганд-связывающий домен, и второй полипептид, содержащий трансмембранный домен и по меньшей мере один внутриклеточный сигнальный домен, где полипептиды соединяются вместе с образованием многоцепочечного CAR.
В некоторых воплощениях многоцепочечный CAR, специфический к BCMA, имеет в основе высокоаффинный рецептор к IgE (FcεRI). FcεRI, экспрессируемый на тучных клетках и базофилах, запускает аллергические реакции. FcεRI представляет собой тетрамерный комплекс, состоящий из одной α-субъединицы, одной β-субъединицы и двух связанных дисульфидными связями γ-субъединиц. Субъединица α содержит IgE-связывающий домен. Субъедиинцы β и γ содержат ITAM (иммунорецепторные тирозиновые активирующие мотивы), опосредующие передачу сигнала. В некоторых воплощениях внеклеточный домен цепи FcRα удален и замещен BCMA-специфическим внеклеточным лиганд-связывающим доменом. В некоторых воплощениях многоцепочечный CAR, специфический к BCMA, содержит scFv, который специфически связывается с BCMA, шарнирную область CD8α и ITAM цепи FcRβ. В некоторых воплощениях CAR может содержать или не содержать цепь FcRγ.
В некоторых воплощениях внеклеточный лиганд-связывающий домен содержит scFv, содержащий вариабельную область легкой цепи (VL) и вариабельную область тяжелой цепи (VH) специфичного к антигену-мишени моноклонального антитела, соединенные гибким линкером. Фрагменты одноцепочечной вариабельной области получают путем связывания вариабельных областей легкой и/или тяжелой цепи с помощью короткого связующего пептида (Bird et al., Science 242: 423-426, 1988). Примером связующего пептида является линкер GS, имеющий аминокислотную последовательность (GGGGS)3 (SEQ ID NO: 333), которая служит приблизительно 3,5 нм мостиком между карбокси-концом одной вариабельной области и амино-концом другой вариабельной области. Разработаны и используются линкеры с другими последовательностями (Bird et al., 1988, см. выше). В целом, линкеры могут быть короткими гибкими полипептидами и предпочтительно содержат приблизительно 20 или менее аминокислотных остатков. В свою очередь, линкеры могут быть модифицированы для дополнительных функций, таких как присоединение лекарственных средств или присоединение к твердым подложкам. Одноцепочечные варианты могут быть получены рекомбинантно или синтетически. Для синтетического получения scFv можно использовать автоматические синтезирующие установки. Для рекомбинантного получения scFv подходящую плазмиду, содержащую полинуклеотид, кодирующий scFv, можно внедрить в подходящую клетку-хозяина, либо эукариотическую, такую как клетку дрожжей, растений, насекомых или млекопитающих, либо прокариотическую, такую как Е. coli. Полинуклеотиды, кодирующие scFv, представляющий интерес, могут быть получены посредством рутинных манипуляций, таких как лигирование полинуклеотидов. Полученный scFv можно выделить с помощью стандартных методик выделения белков, известных в области техники.
В некоторых воплощениях внеклеточный лиганд-связывающий домен содержит (a) VH область, содержащую (1) первый участок VH, определяющий комплементарность (CDR1), содержащий последовательность SYX1MX2, где X1 представляет собой А или Р; и X2 представляет собой Т, N или S (SEQ ID NO: 301), GFTFX1SY, где Х1 представляет собой G или S (SEQ ID NO: 302), или GFTFX1SYX2MX3, где X1 представляет собой G или S, X2 представляет собой А или Р; и X3 представляет собой Т, N, или S (SEQ ID NO: 303); (2) CDR2 VH, содержащий последовательность AX1X2X3X4GX5X6X7X8YADX9X10KG, где X1 представляет собой I, V, Т, Н, L, А или С; X2 представляет собой S, D, G, Т, I, L, F, М или V; X3 представляет собой G, Y, L, Н, D, A, S или М; X4 представляет собой S, Q, Т, A, F или W; X5 представляет собой G или Т; X6 представляет собой N, S, Р, Y, W или F; X7 представляет собой S, Т, I, L, Т, A, R, V, K, G или С; X8 представляет собой F, Y, Р, W, Н или G; X9 представляет собой V, R или L; и X10 представляет собой G или Т (SEQ ID NO: 305), или X1X2X3X4X5X6, где X1 представляет собой S, V, I, D, G, Т, L, F или М; X2 представляет собой G, Y, L, Н, D, A, S или М; X3 представляет собой S, G, F или W; X4 представляет собой G или S; X5 представляет собой G или Т; и X6 представляет собой N, S, Р, Y или W (SEQ ID NO: 306); и (3) CDR3 VH, содержащий последовательность VSPIX1X2X3X4, где X1 представляет собой или Y; X2 представляет собой А или S; и X3 представляет собой G, Q, L, Р или Е (SEQ ID NO: 307), или YWPMX1X2, где X1 представляет собой D, S, Т или А; и X2 представляет собой I, S, L, Р или D (SEQ ID NO: 308); и VL область, содержащую (1) CDR1 VL, содержащий последовательность X1X2X3X4X5X6X7X8X9X10X11X12, где X1 представляет собой R, G, W, А или С; X2 представляет собой A, P, G, L, С или S; X3 представляет собой S, G или R; X4 представляет собой Q, С, E, V или I; X5 представляет собой S, L, P, G, A, R или D; X6 представляет собой V, G или I; X7 представляет собой S, E, D или P; X8 представляет собой S, P, F, A, M, E, V, N, D или Y; X9 представляет собой I, T, V, E, S, A, M, Q, Y, H или R; X10 представляет собой Y или F; X11 представляет собой L, W или P; и X12 представляет собой A, S или G (SEQ ID NO: 309); (2) CDR2 VL, содержащий последовательность X1ASX2RAX3, где X1 представляет собой G или D; X2 представляет собой S или I; и X3 представляет собой Т или Р (SEQ ID NO: 310); и (3) CDR3 VL, содержащий последовательность QQYX1X2X3PX4T, где X1 представляет собой G, Q, Е, L, F, A, S, М, K, R или Y; X2 представляет собой S, R, Т, G, V, F, Y, D, А, Н, V, Е, K или С; X3 представляет собой W, F или S; и X4 представляет собой L или I (SEQ ID NO: 311), или QQYX1X2X3PX4, где X1 представляет собой G, Q, Е, L, F, A, S, М, R, K или Y; X2 представляет собой S, R, Т, G, R, V, D, А, Н, Е, K, С, F или Y; X3 представляет собой W, S или F; и X4 представляет собой L или I (SEQ ID NO: 312). В некоторых воплощениях VH и VL соединены друг с другом посредством гибкого линкера. В некоторых воплощениях гибкий линкер содержит аминокислотную последовательность, приведенную в SEQ ID NO: 333.
В другом аспекте предложен CAR, специфически связывающийся с BCMA, где CAR содержит внеклеточный лиганд-связывающий домен, содержащий: VH область, содержащую CDR1 VH, CDR2 VH и CDR3 VH последовательности VH, приведенной в SEQ ID NO: 2, 3, 7, 8, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 35, 37, 39, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 83, 87, 92, 78, 95, 97, 99, 101, 104, 106, 110, 112, 114, 76, 118, 120, 122, 112, 125, 127, 313 или 314; и/или VL область, содержащую CDR1 VL, CDR2 VL и CDR3 VL последовательности VL, приведенной в SEQ ID NO: 1, 4, 5, 6, 9, 10, 11, 12, 13, 15, 16, 17, 18, 19, 20, 21, 22, 23, 34, 36, 38, 40, 41, 43, 45, 47, 49, 51, 53, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75, 77, 79, 317, 81, 82, 84, 85, 86, 88, 89, 90, 91, 93, 94, 96, 98, 100, 102, 103, 105, 107, 108, 109, 111, 113, 115, 116, 117, 119, 121, 123, 124, 126, 128, 315 или 316. В некоторых воплощениях VH и VL соединены друг с другом посредством гибкого линкера. В некоторых воплощениях гибкий линкер содержит аминокислотную последовательность, приведенную в SEQ ID NO: 333.
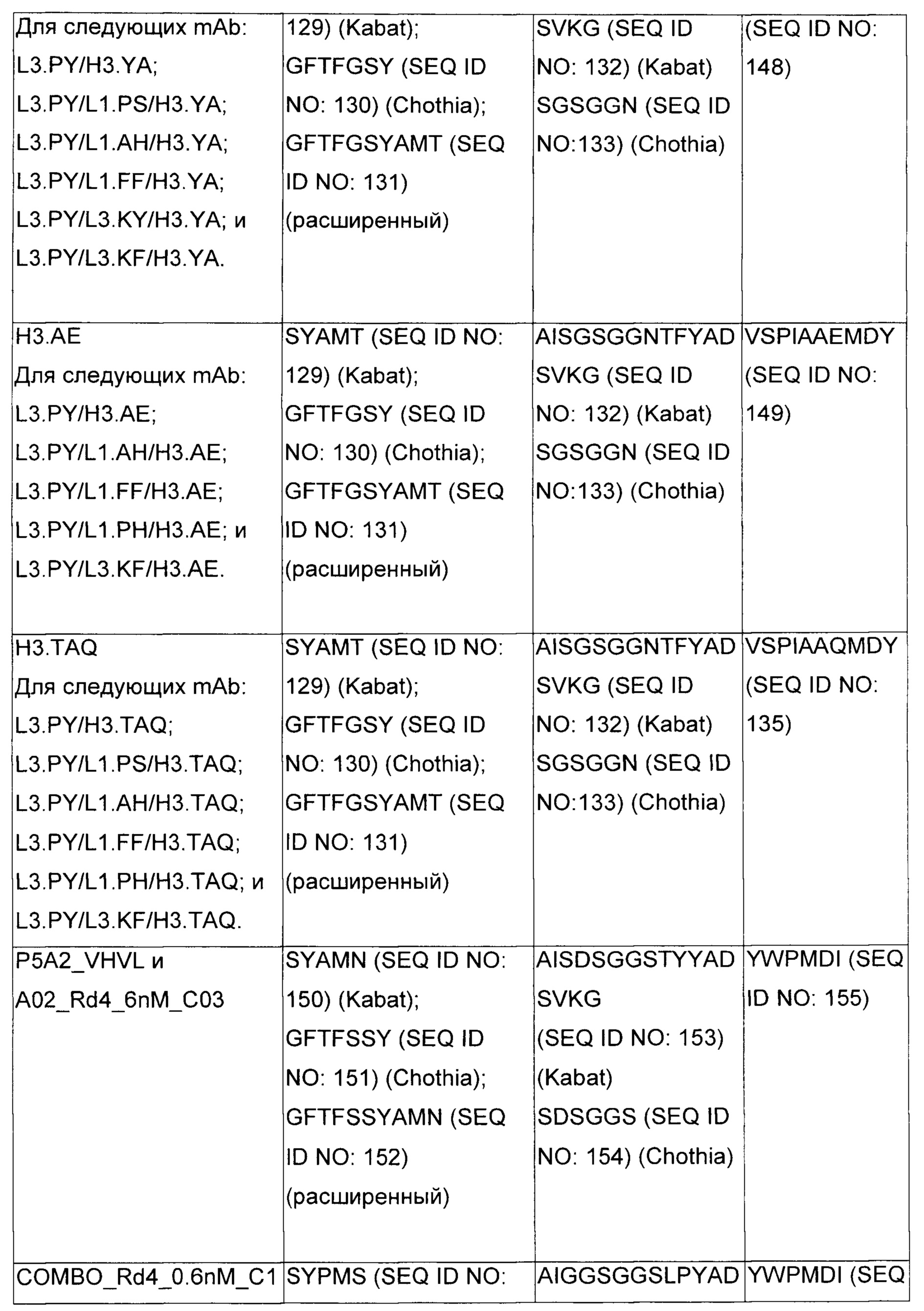
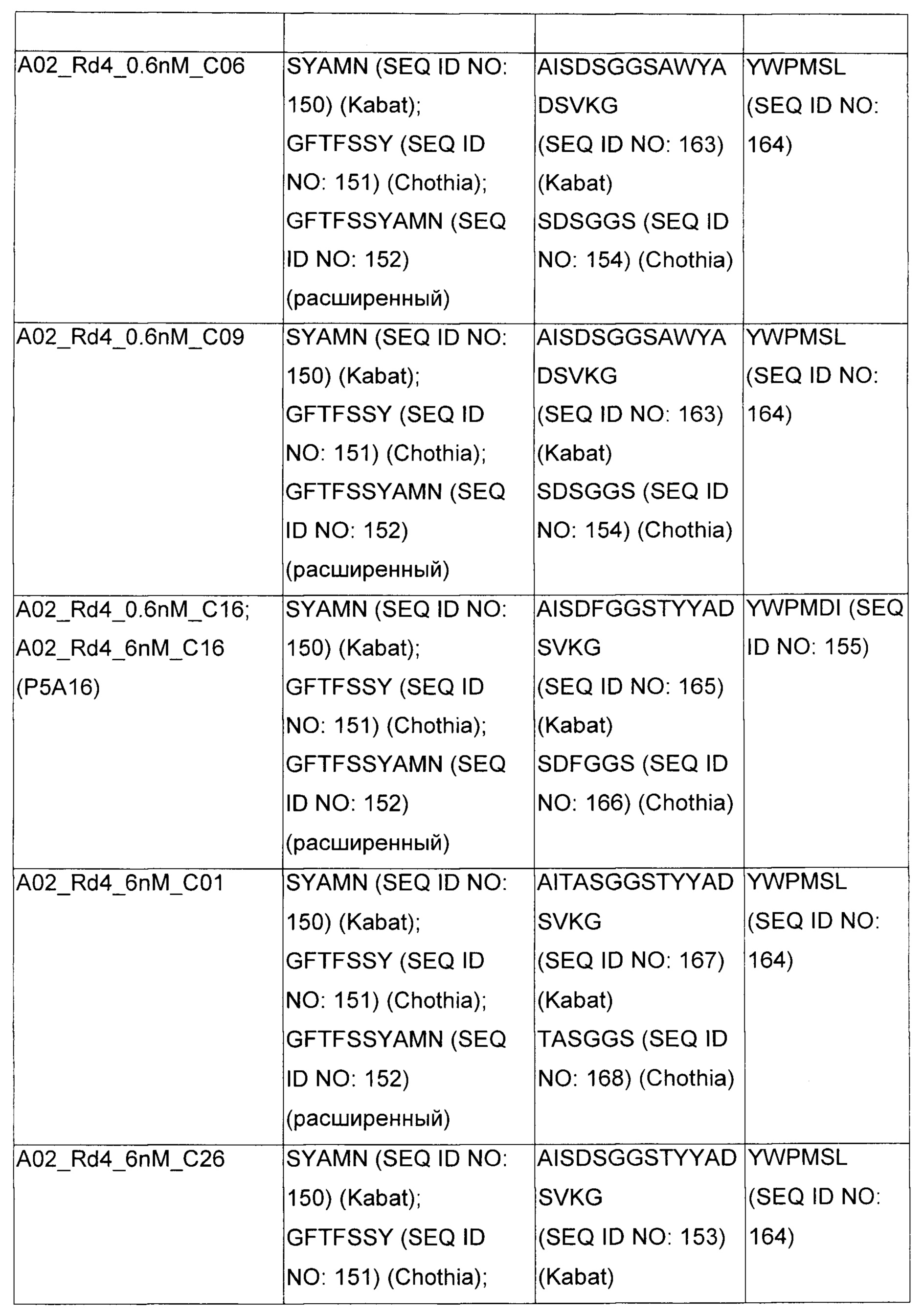
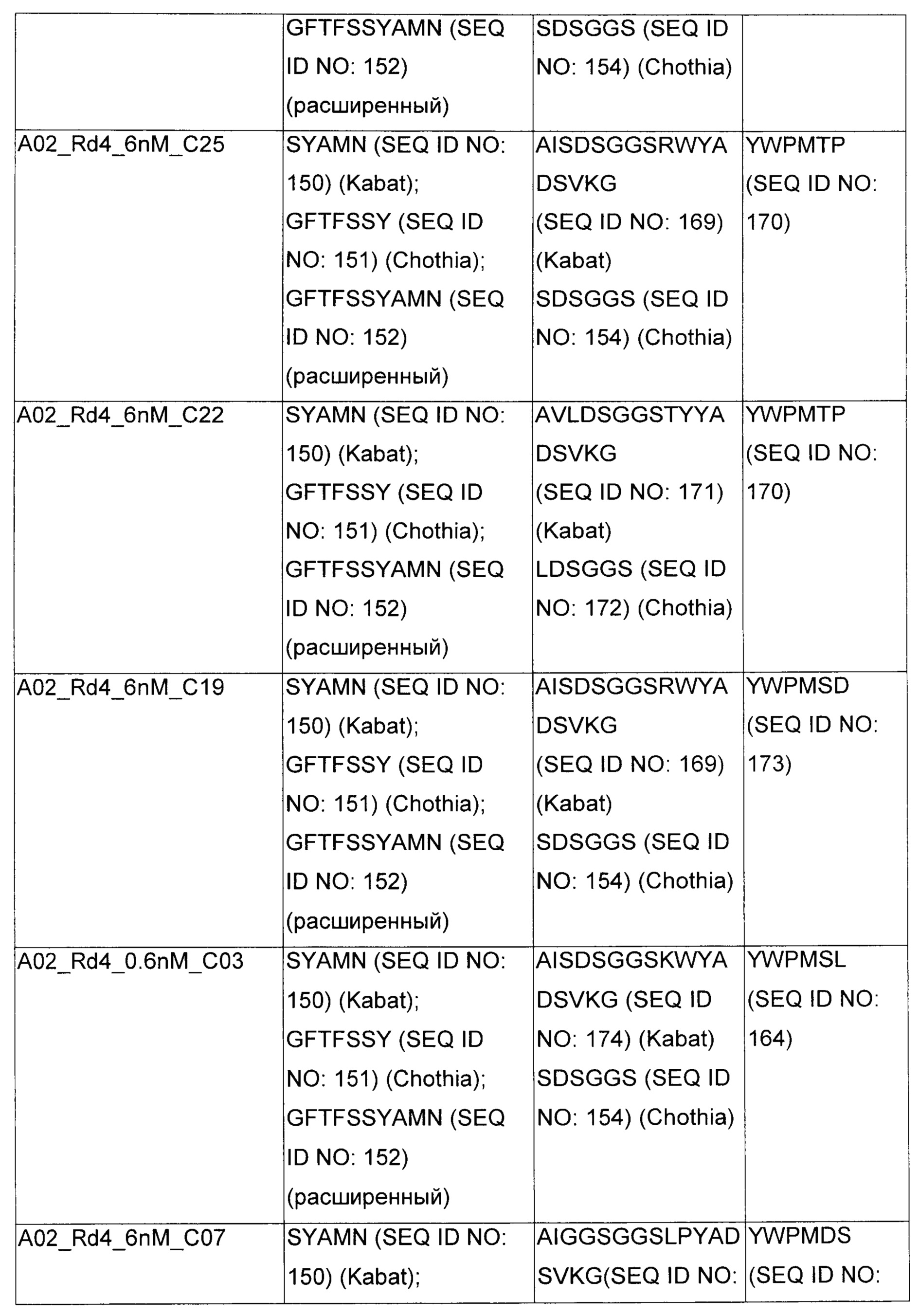
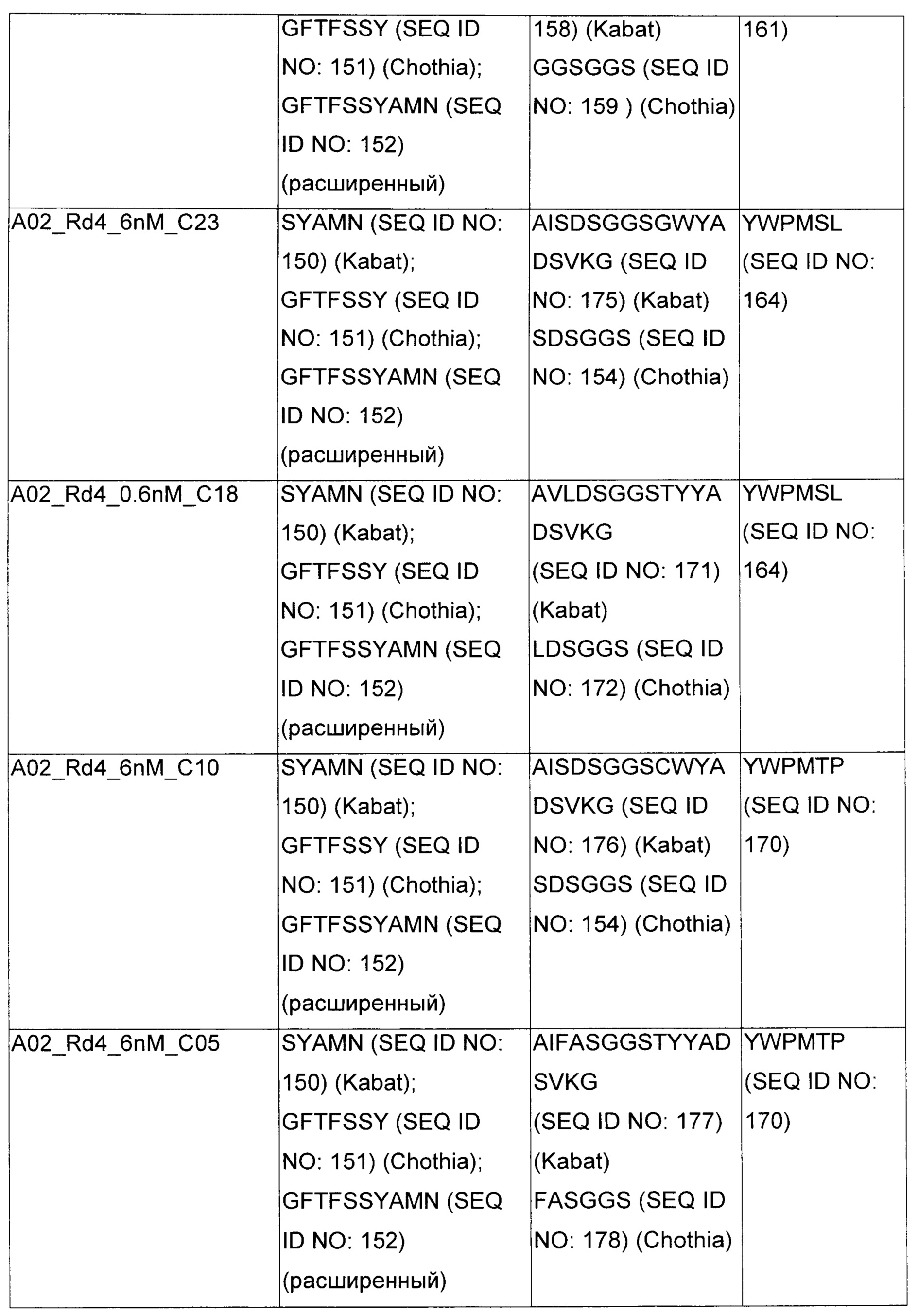
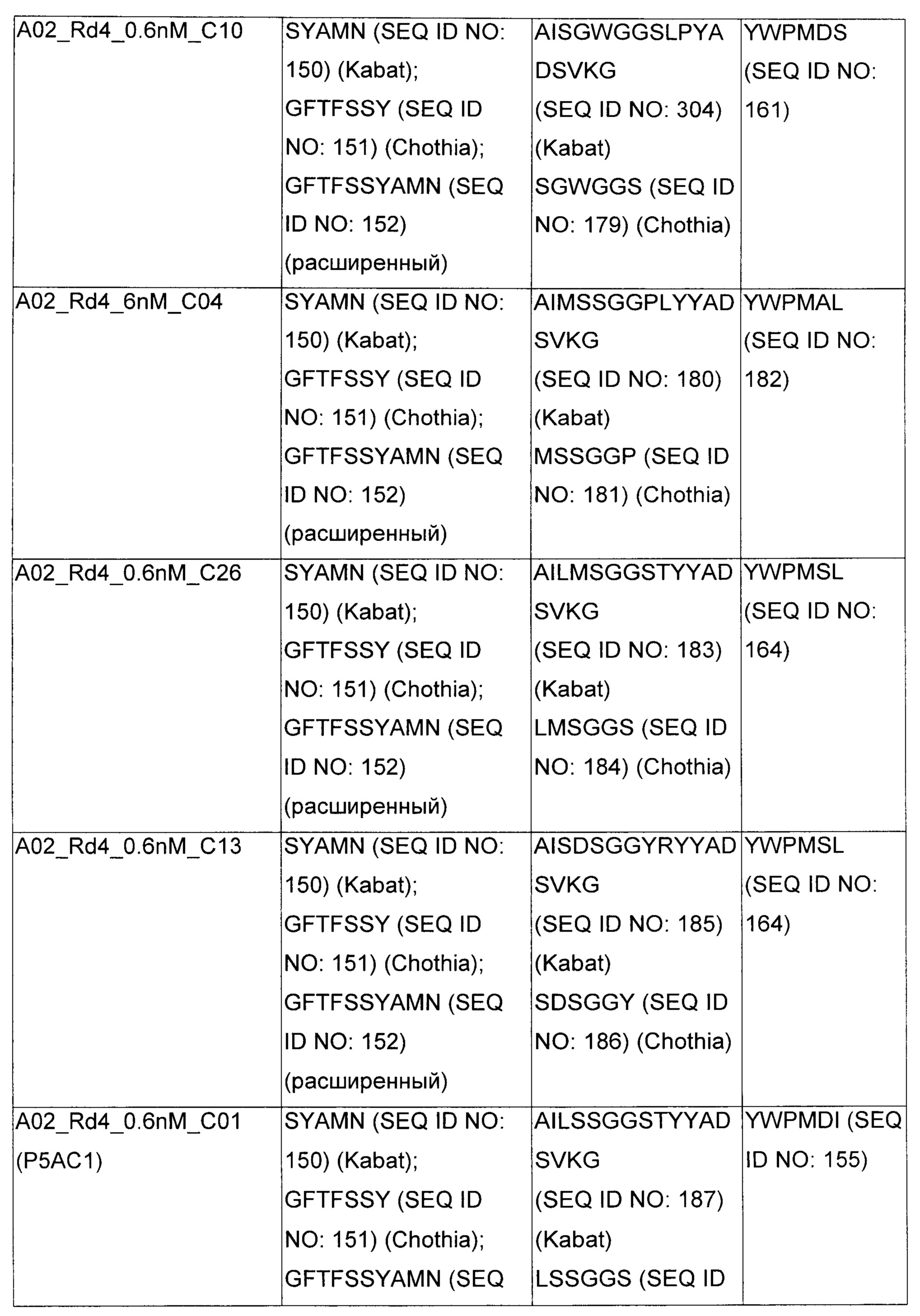
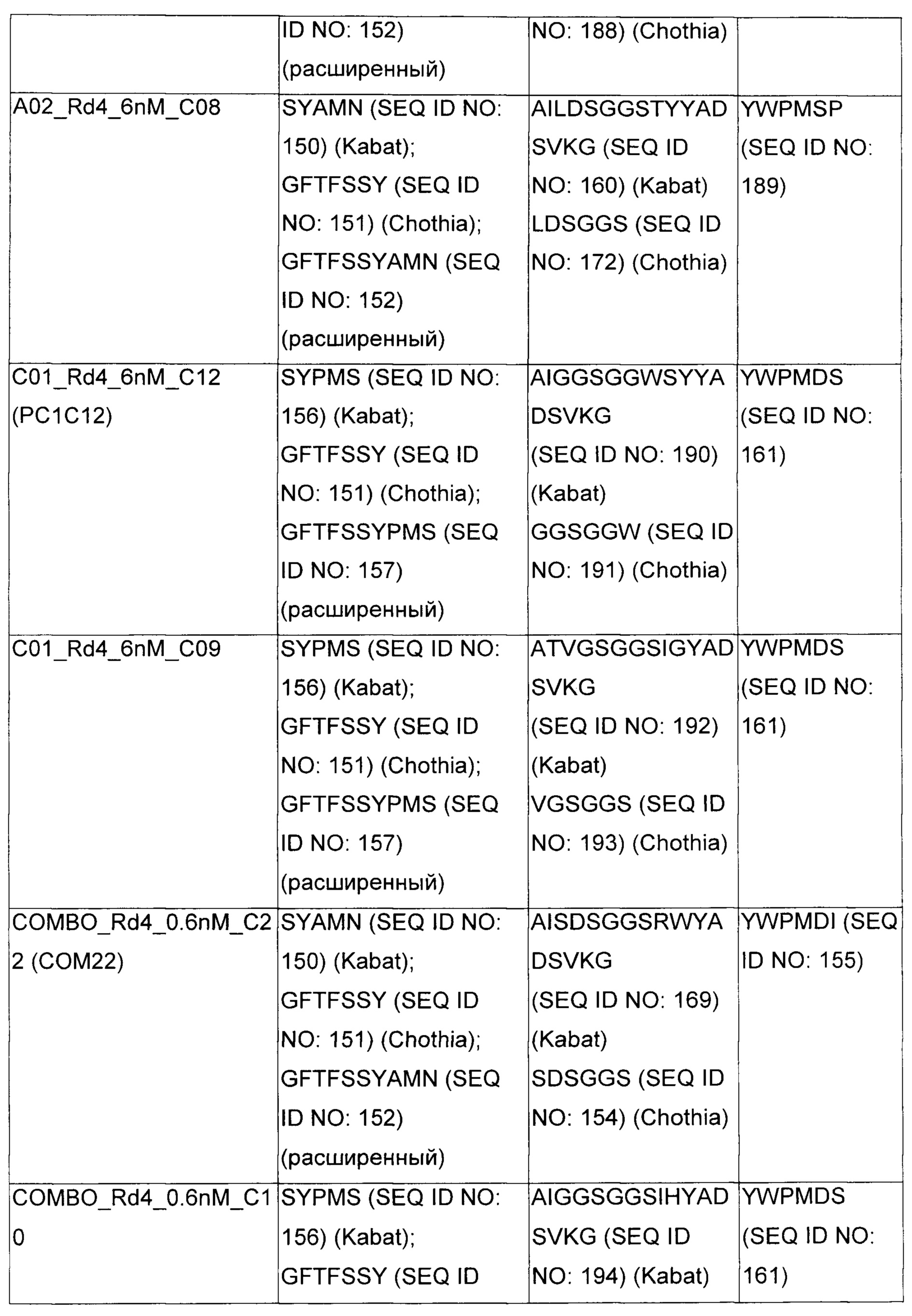
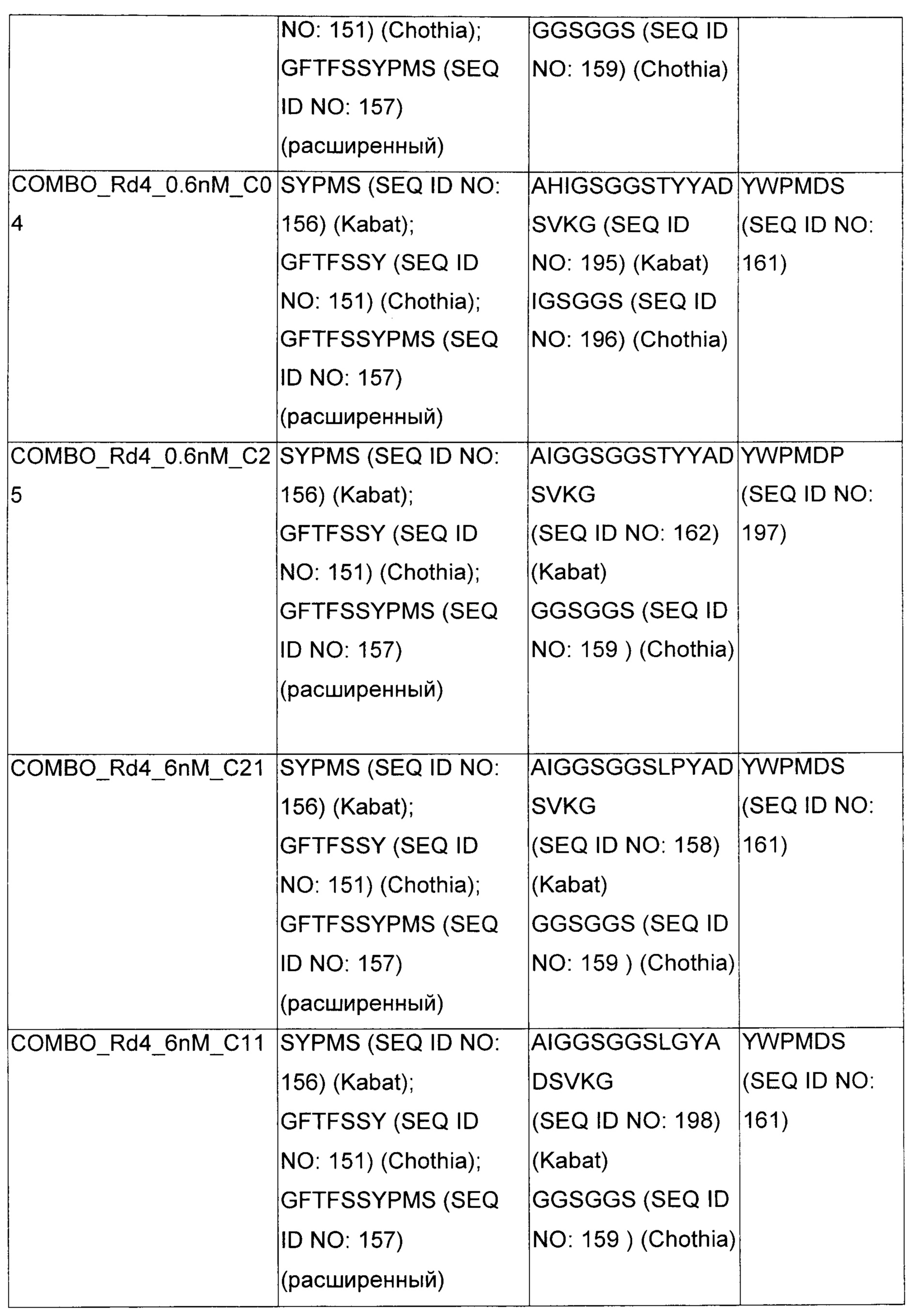
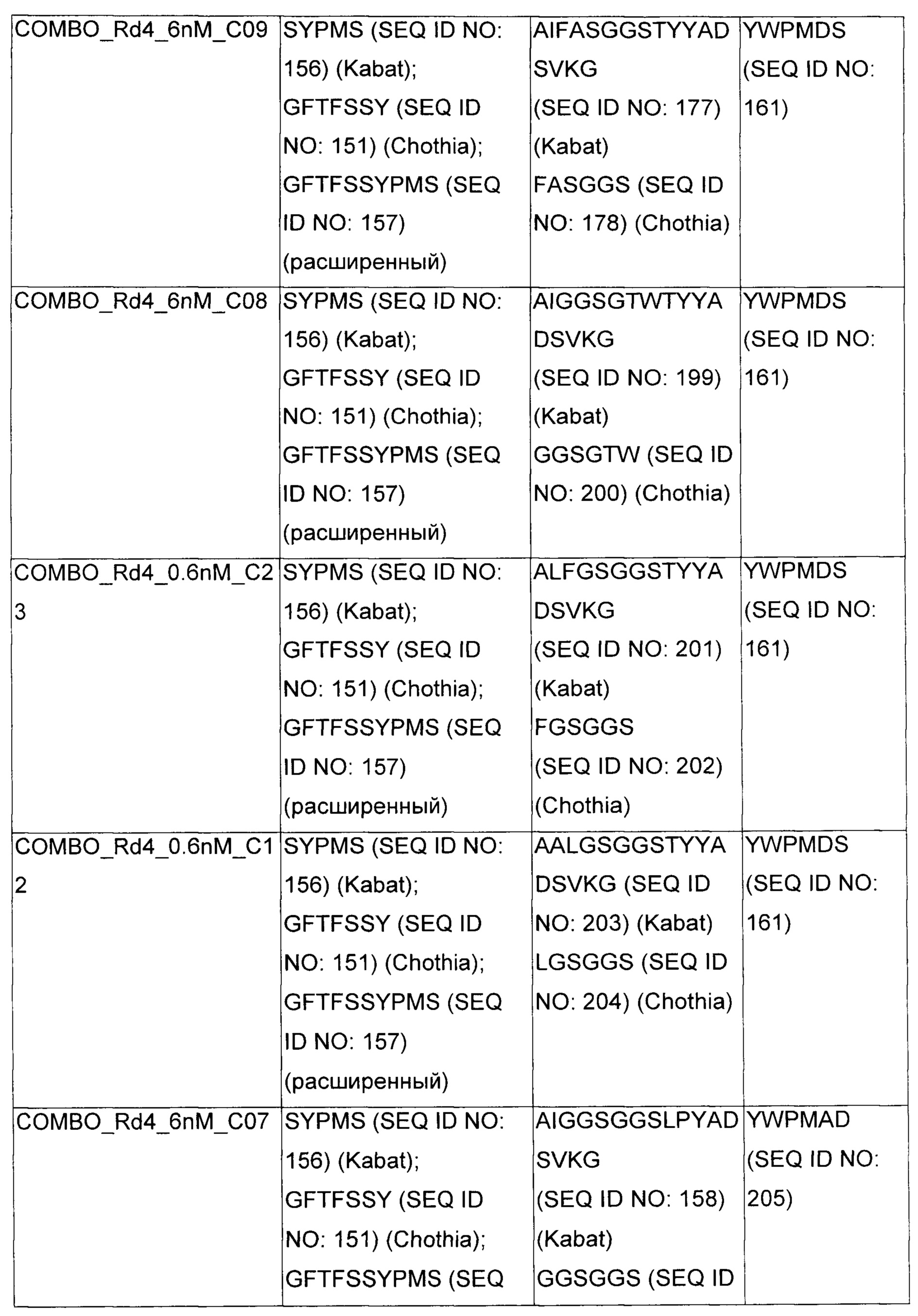
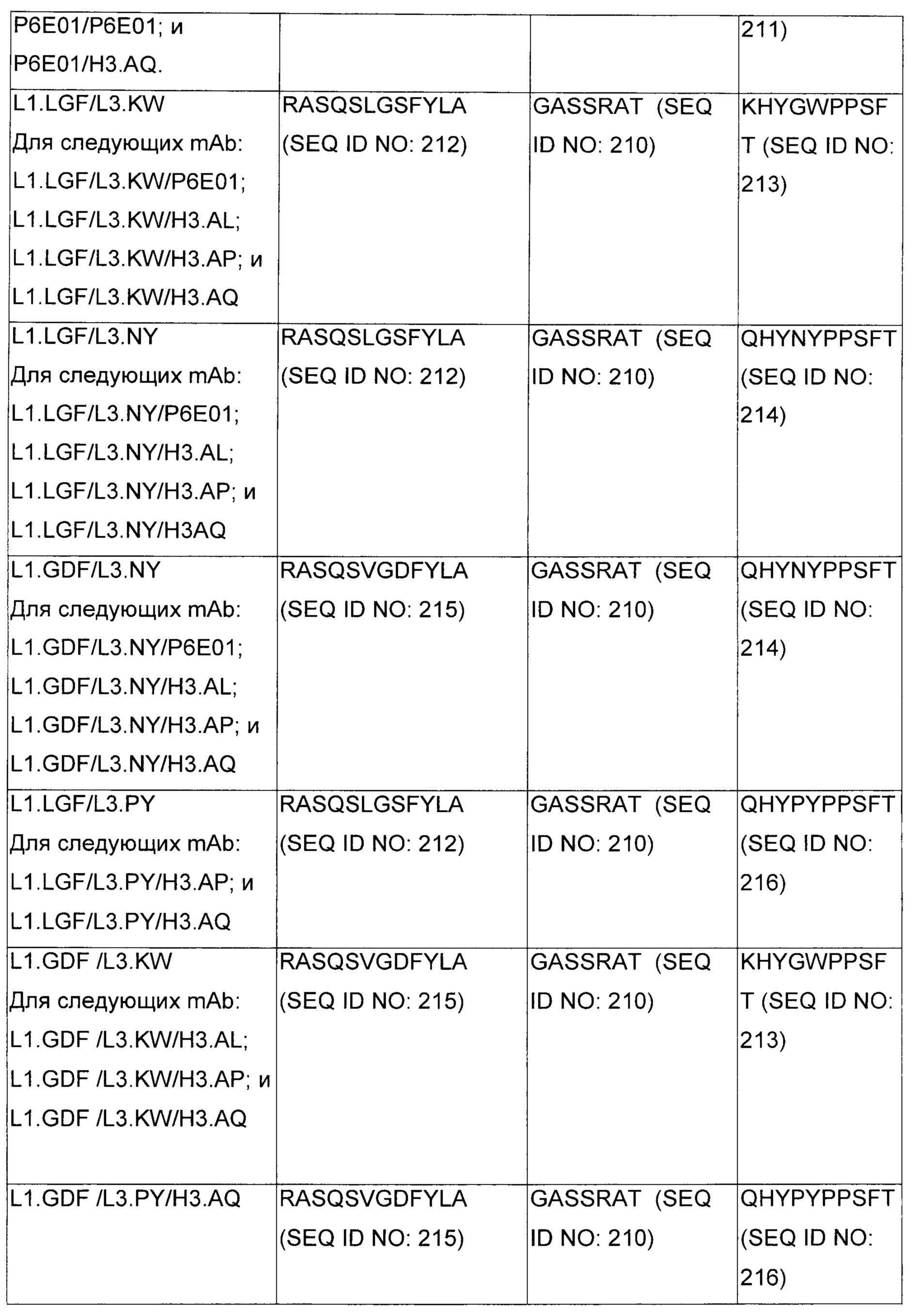
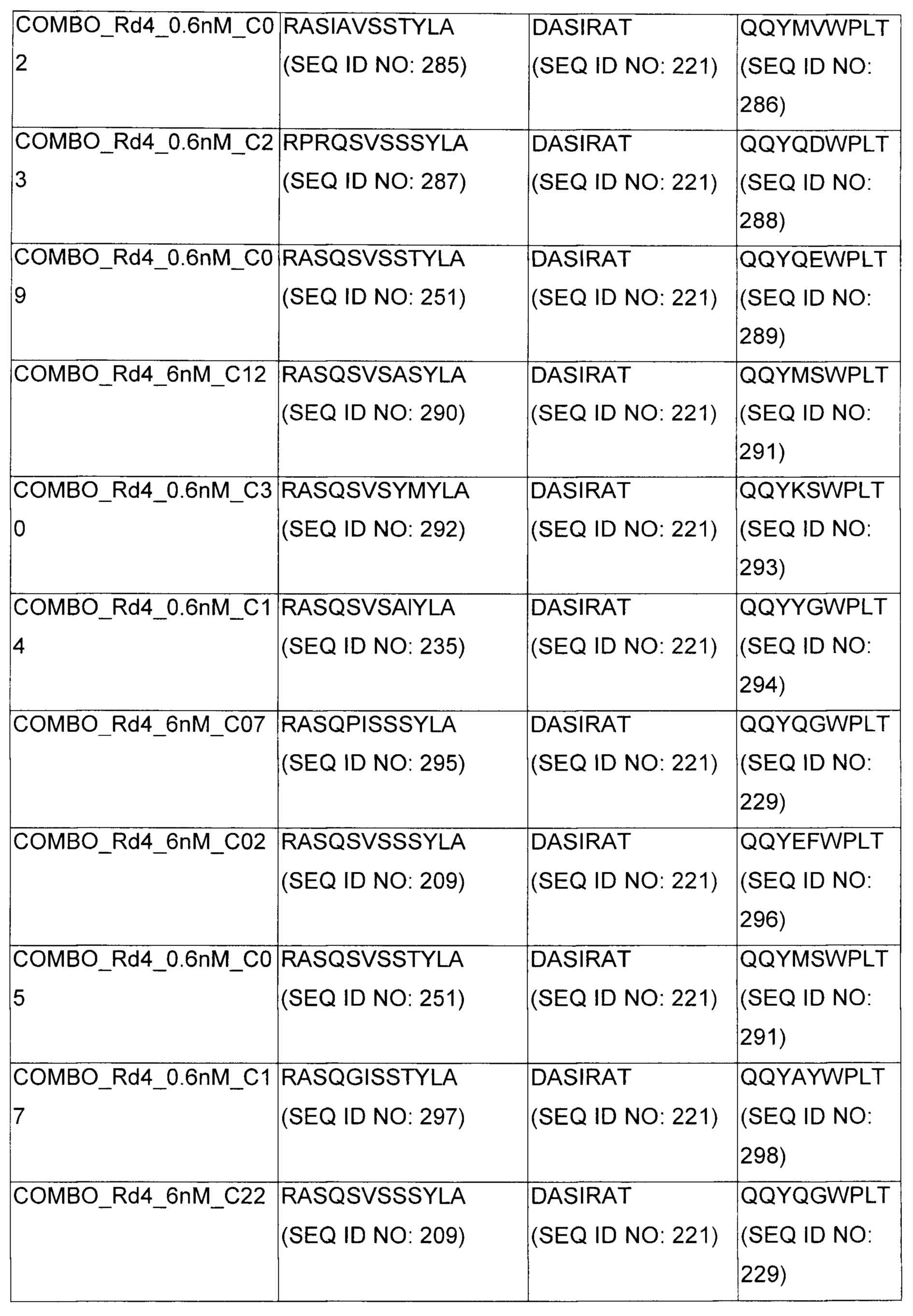
В некоторых воплощениях CAR по изобретению содержит внеклеточный лиганд-связывающий домен, имеющий любую из частичных последовательностей легкой цепи, приведенных в Таблице 1, и/или любую из частичных последовательностей тяжелой цепи, приведенных в Таблице 1. В Таблице 1 подчеркнутые последовательности представляют собой последовательности CDR согласно Kabat, а обозначенные жирным шрифтом - согласно Chothia, за исключением следующих последовательностей CDR2 тяжелой цепи, где последовательности CDR согласно Chothia подчеркнуты, а последовательности CDR согласно Kabat обозначены жирным шрифтом: P5A2_VHVL, A02_Rd4_0.6nM_C06, A02_Rd4_0.6nM_C09, A02_Rd4_6nM_C16, A02_Rd4_6nM_C03, A02_Rd4_6nM_C01, A02_Rd4_6nM_C26, A02_Rd4_6nM_C25, A02_Rd4_6nM_C22, A02_Rd4_6nM_C19, A02_Rd4_0.6nM_C03, A02_Rd4_6nM_C07, A02_Rd4_6nM_C23, A02_Rd4_0.6nM_C18, A02_Rd4_6nM_C10, A02_Rd4_6nM_C05, A02_Rd4_0.6nM_C10, A02_Rd4_6nM_C04, A02_Rd4_0.6nM_C26, A02_Rd4_0.6nM_C13, A02_Rd4_0.6nM_C01, A02_Rd4_6nM_C08, P5C1_VHVL, C01_Rd4_6nM_C24, C01_Rd4_6nM_C26, C01_Rd4_6nM_C10, C01_Rd4_0.6nM_C27, C01_Rd4_6nM_C20, C01_Rd4_6nM_C12, C01_Rd4_0.6nM_C16, C01_Rd4_0.6nM_C09, C01_Rd4_6nM_C09, C01_Rd4_0.6nM_C03, C01_Rd4_0.6nM_C06, C01_Rd4_6nM_C04, COMBO_Rd4_0.6nM_C22, COMBO_Rd4_6nM_C21, COMBO_Rd4_6nM_C10, COMBO_Rd4_0.6nM_C04, COMBO_Rd4_6nM_C25, COMBO_Rd4_0.6nM_C21, COMBO_Rd4_6nM_C11, COMBO_Rd4_0.6nM_C20, COMBO_Rd4_6nM_C09, COMBO_Rd4_6nM_C08, COMBO_Rd4_0.6nM_C19, COMBO_Rd4_0.6nM_C02, COMBO_Rd4_0.6nM_C23, COMBO_Rd4_0.6nM_C29, COMBO_Rd4_0.6nM_C09, COMBO_Rd4_6nM_C12, COMBO_Rd4_0.6nM_C30, COMBO_Rd4_0.6nM_C14, COMBO_Rd4_6nM_C07, COMBO_Rd4_6nM_C02, COMBO_Rd4_0.6nM_C05, COMBO_Rd4_0.6nM_C17, COMBO_Rd4_6nM_C22, и COMBO_Rd4_0.6nM_C11.
































Также здесь приведены CDR участки внеклеточных лиганд-связывающих доменов CAR для ВСМА (включая CDR согласно Chothia, Kabat и области контактов CDR). Определение CDR областей известно специалистам в области техники. Следует понимать, что в некоторых воплощениях CDR могут представлять собой комбинацию CDR согласно Kabat и Chothia (также обозначаемые как «комбинированные CDR» или «расширенные CDR»). В некоторых воплощениях CDR представляют собой CDR согласно Kabat. В некоторых воплощениях CDR представляют собой CDR согласно Chothia. Другими словами, в воплощениях с более чем одним CDR, CDR могут быть любыми из CDR согласно Kabat, Chothia, комбинированными CDR или их комбинациями. В Таблице 2 приведены примеры последовательностей CDR по данному изобретению.










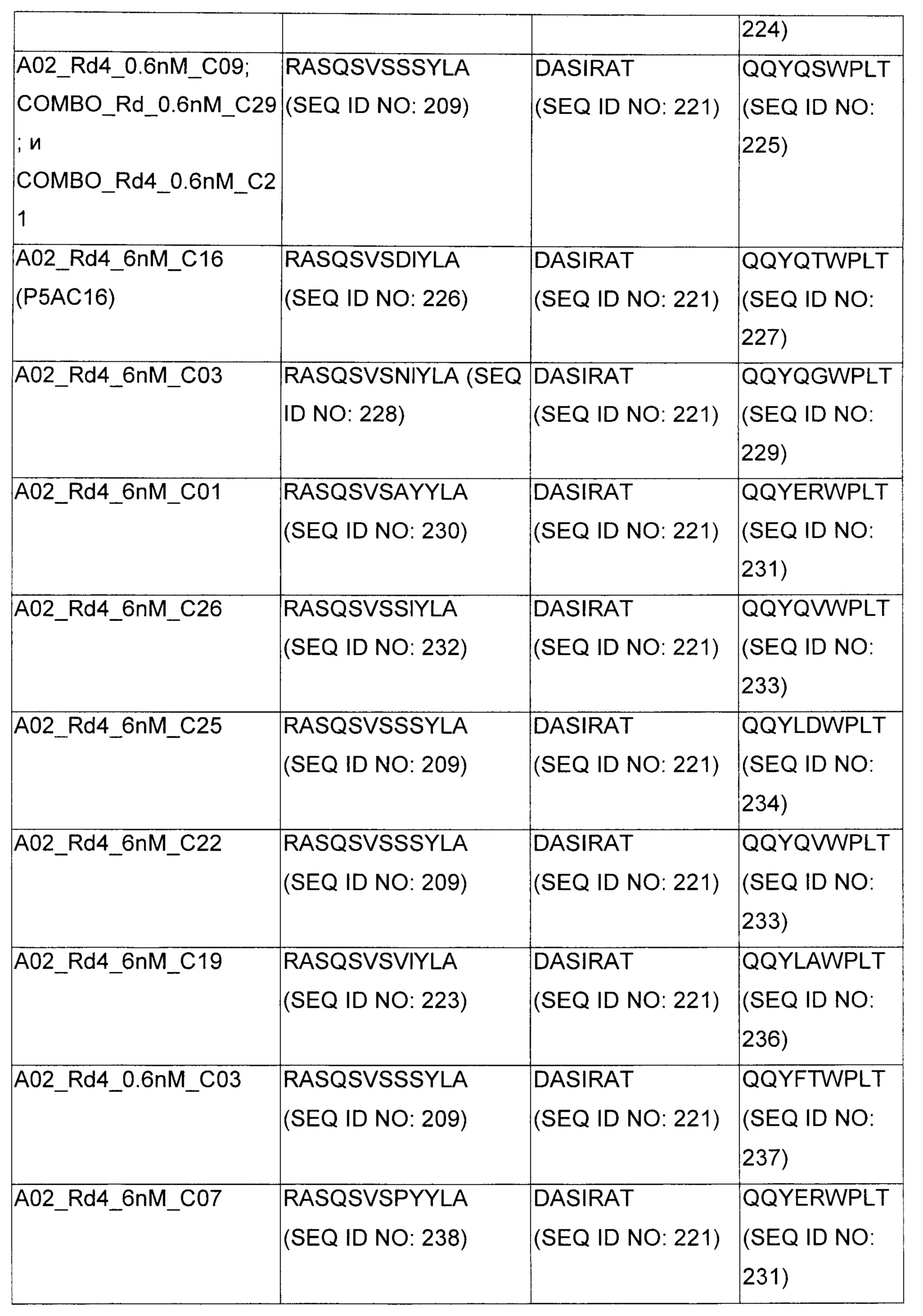
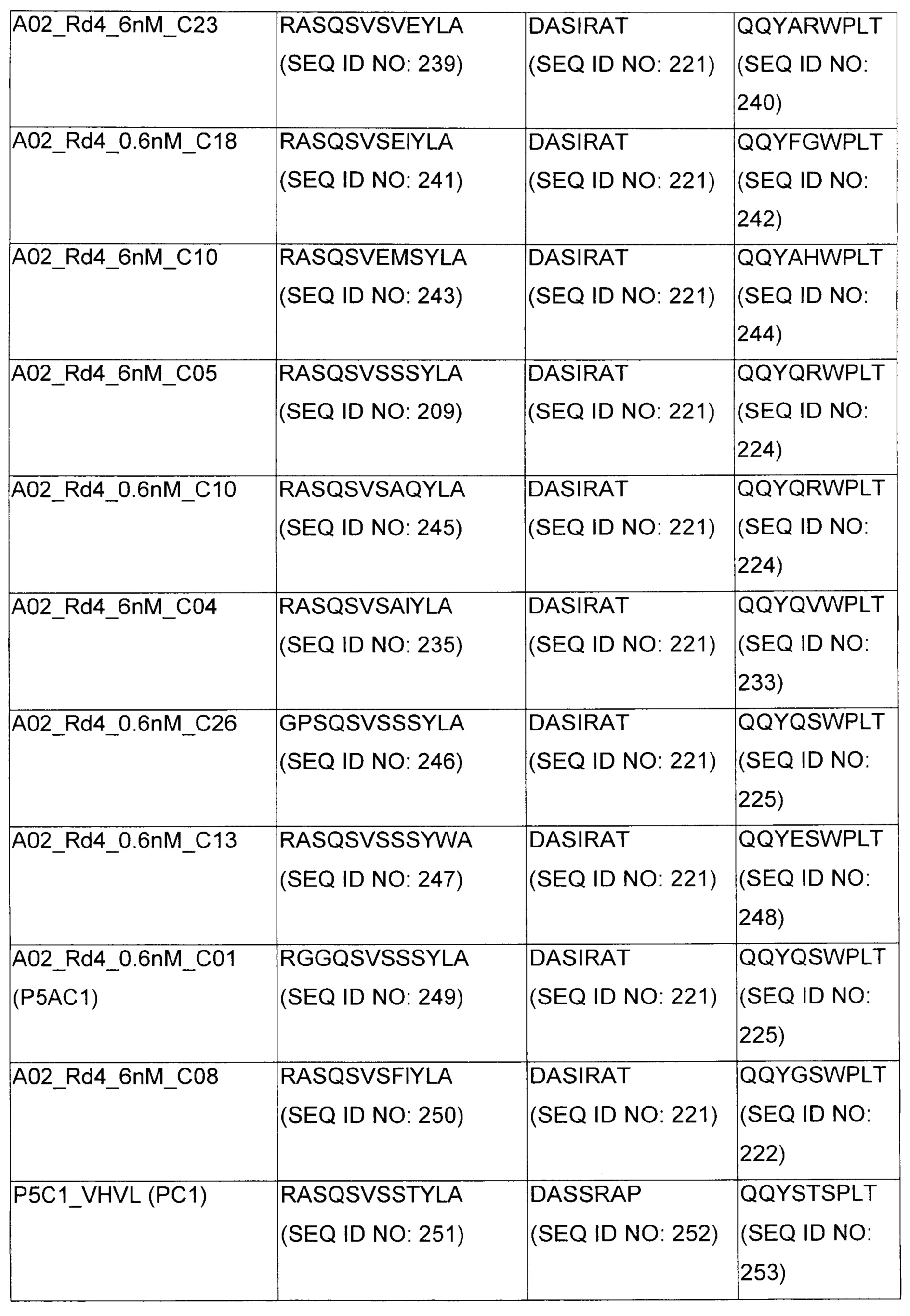
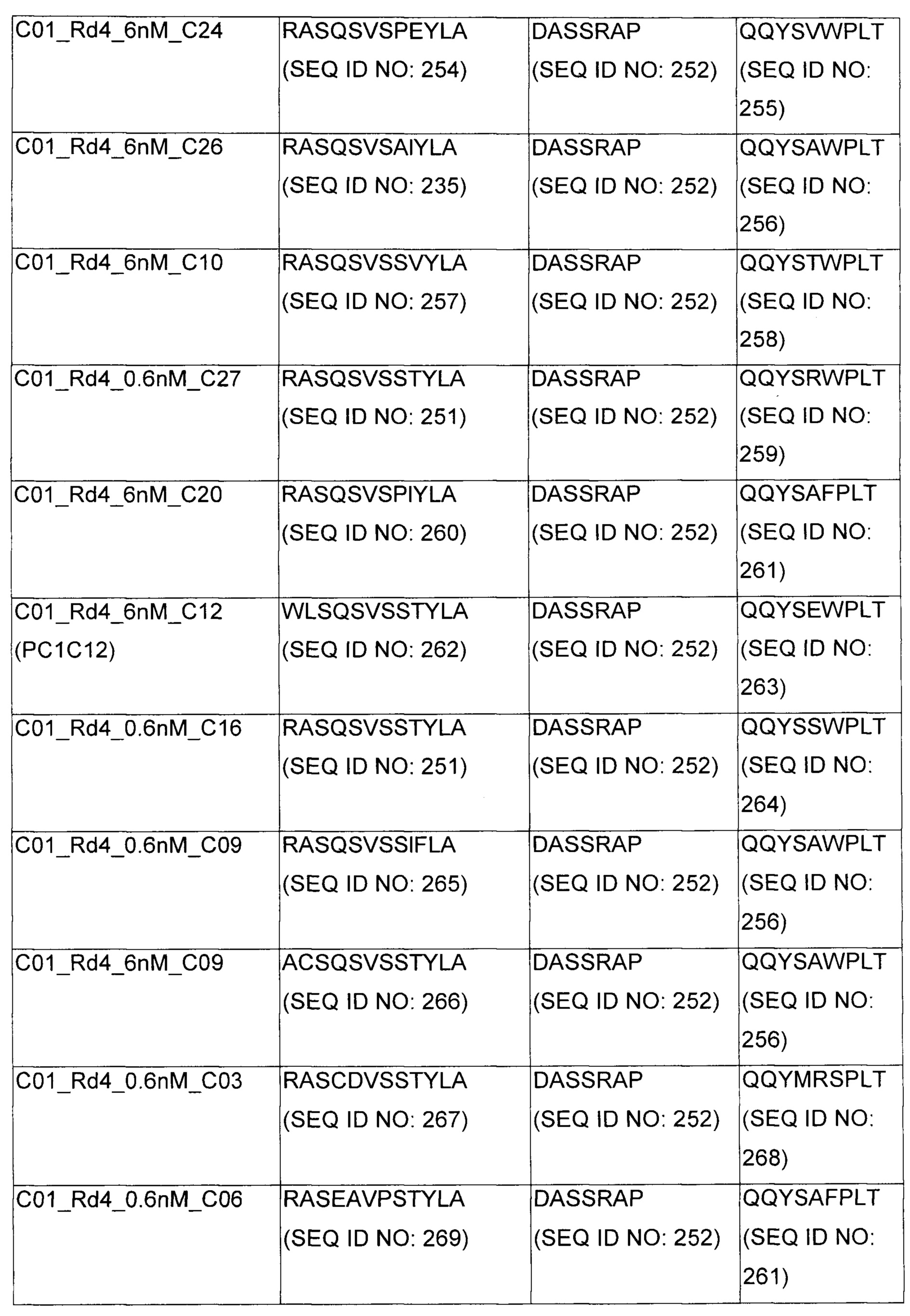
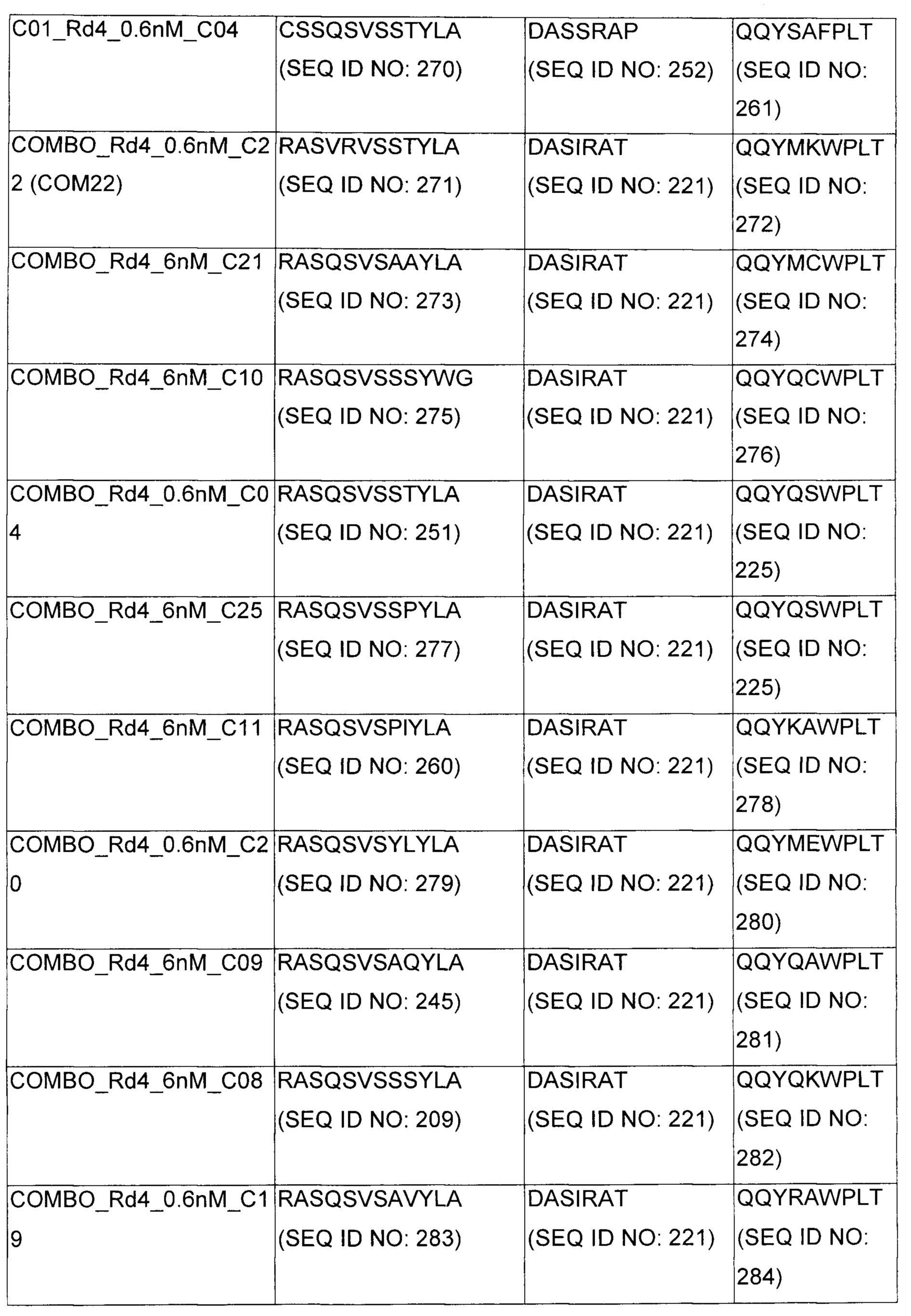


Изобретение охватывает модификации CAR и вариантов полипептидов по изобретению, приведенных в Таблице 1, включая функционально эквивалентные CAR, имеющие модификации, которые не влияют существенным образом на их свойства, и варианты, которые обладают повышенной или пониженной активностью и/или аффинностью. Например, аминокислотная последовательность может быть мутирована для получения антитела с желаемой аффинностью связывания с ВСМА. Модификации полипептидов представляют собой рутинную практику в области техники и не нуждаются в подробном описании здесь. Примеры модифицированных полипептидов включают полипептиды с консервативными заменами аминокислотных остатков, одной или более делециями или вставками аминокислот, которые не нарушают существенным образом функциональную активность, или которые обеспечивают созревание (повышение) аффинности полипептида к его лиганду, или применение химических аналогов.
Вставки аминокислотной последовательности включают амино- и/или карбокси-концевые слияния, длина которых варьирует от одного остатка до полипептидов, содержащих сотни или более остатков, а также вставки одного или множества аминокислотных остатков внутри последовательности. Примеры концевых вставок включают антитело с N-концевым метиониловым остатком или антитело, слитое с эпитопной меткой. Другие варианты вставок в молекулу антитела включают слияние N- или С-конца антитела с ферментом или полипептидом, повышающим период полужизни антитела в кровотоке.
Варианты с заменами имеют по меньшей мере один удаленный из молекулы антитела аминокислотный остаток и вставленный на его место другой остаток. Сайты, представляющие наибольший интерес для замещающего мутагенеза, включают гипервариабельные области, но также рассматриваются и изменения FR. Консервативные замены приведены в Таблице 2 под заголовком «консервативные замены». Если такие замены приводят к изменению биологической активности, тогда можно вводить более существенные замены, обозначенные в Таблице 2.1 как «примеры замен» или как дополнительно описано ниже применительно к классам аминокислот, и осуществлять скрининг продуктов.
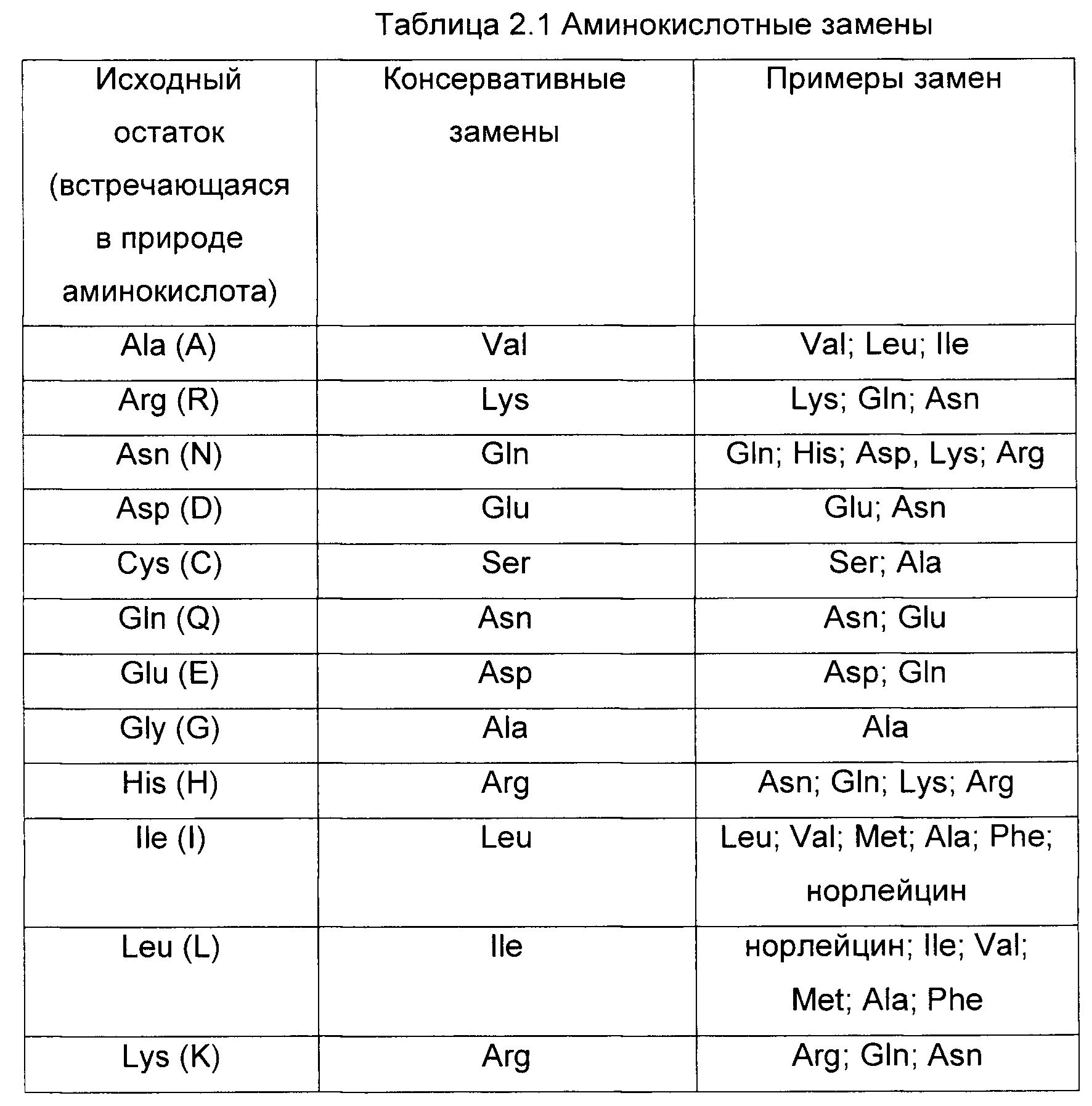
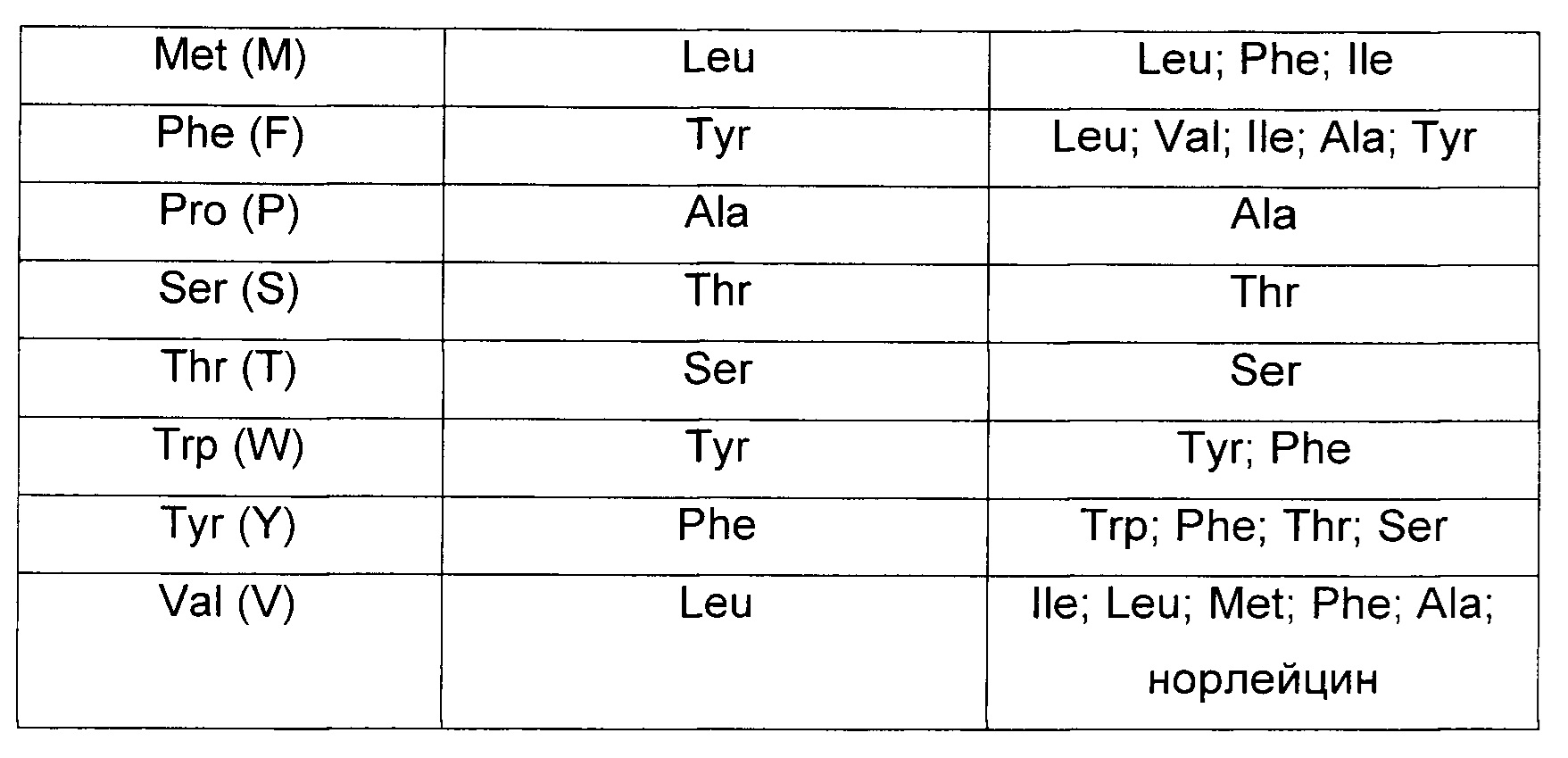
В некоторых воплощениях изобретения предложен CAR, содержащий внеклеточный лиганд-связывающий домен, который связывается с ВСМА и конкурирует за связывание с ВСМА с описанным здесь CAR, включающим Р6Е01/Р6Е01, P6E01/H3.AQ, L1.LGF/L3.KW/P6E01; L1.LGF/L3.NY/P6E01, L1.GDF/L3.NY/P6E01, L1.LGF/L3.KW/H3.AL, L1.LGF/L3.KW/H3.AP, L1.LGF/L3.KW/H3.AQ, L1.LGF/L3.PY/H3.AP, L1.LGF/L3.PY/H3.AQ, L1.LGF/L3.NY/H3.AL, L1.LGF/L3.NY/H3.AP, L1.LGF/L3.NY/H3.AQ, L1.GDF/L3.KW/H3.AL, L1.GDF/L3.KW/H3.AP, L1.GDF/L3.KW/H3.AQ, L1.GDF/L3.PY/H3.AQ, L1.GDF/L3.NY/H3.AL, L1.GDF/L3.NY/H3.AP, L1.GDF/L3.NY/H3.AQ, L3.KW/P6E01, L3.PY/P6E01, L3.NY/P6E01, L3.PY/L1.PS/P6E01, L3.PY/L1.AH/P6E01, L3.PY/L1.FF/P6E01, L3.PY/L1.PH/P6E01, L3.PY/L3.KY/P6E01, L3.PY/L3.KF/P6E01, L3.PY/H2.QR, L3.PY/H2.DY, L3.PY/H2.YQ, L3.PY/H2.LT, L3.PY/H2.HA, L3.PY/H2.QL, L3.PY/H3.YA, L3.PY/H3.AE, L3.PY/H3.AQ, L3.PY/H3.TAQ, L3.PY/P6E01, L3.PY/L1.PS/H2.QR, L3.PY/L1.PS/H2.DY, L3.PY/L1.PS/H2.YQ, L3.PY/L1.PS/H2.LT, L3.PY/L1.PS/H2.HA, L3.PY/L1.PS/H2.QL, L3.PY/L1.PS/H3.YA, L3.PY/L1.PS/H3.AE, L3.PY/L1.PS/H3.AQ, L3.PY/L1.PS/H3.TAQ, L3.PY/L1.AH/H2.QR, L3.PY/L1.AH/H2.DY, L3.PY/L1.AH/H2.YQ, L3.PY/L1.AH/H2.LT, L3.PY/L1.АН/Н2.НА, L3.PY/L1.AH/H2.QL, L3.PY/L1.AH/H3.YA, L3.PY/L1.AH/H3.AE, L3.PY/L1.AH/H3.AQ, L3.PY/L1.AH/H3.TAQ, L3.PY/L1.FF/H2.QR, L3.PY/L1.FF/H2.DY, L3.PY/L1.FF/H2.YQ, L3.PY/L1.FF/H2.LT, L3.PY/L1.FF/H2.HA, L3.PY/L1.FF/H2.QL, L3.PY/L1.FF/H3.YA, L3.PY/L1.FF/H3.AE, L3.PY/L1.FF/H3.AQ, L3.PY/L1.FF/H3.TAQ, L3.PY/L1.PH/H2.QR, L3.PY/L1.РН/Н2.НА, L3.PY/L1 РН/H3.АЕ, L3.PY/L1 PH/H3.AQ, L3.PY/L1.PH/H3.TAQ, L3.PY/L3.KY/H2.QR, L3.PY/L3.KY/H2.DY, L3.PY/L3.KY/H2.YQ, L3.PY/L3.KY/H2.LT, L3.PY/L3.KY/H2.HA, L3.PY/L3.KY/H2.QL, L3.PY/L3.KY/H3.YA, L3.PY/L3.KY/H3.TAQ, L3.PY/L3.KF/H2.DY, L3.PY/L3.KF/H2.YQ, L3.PY/L3.KF/H2.LT, L3.PY/L3.KF/H2.QL, L3.PY/L3.KF/H3.YA, L3.PY/L3.KF/H3.AE, L3.PY/L3.KF/H3.AQ, L3.PY/L3.KF/H3.TAQ, P5A2_VHVL, A02_Rd4_0.6nM_C06, A02_Rd4_0.6nM_C09, A02_Rd4_6nM_C16, A02_Rd4_6nM_C03, A02_Rd4_6nM_C01, A02_Rd4_6nM_C26, A02_Rd4_6nM_C25, A02_Rd4_6nM_C22, A02_Rd4_6nM_C19, A02_Rd4_0.6nM_C03, A02_Rd4_6nM_C07, A02_Rd4_6nM_C23, A02_Rd4_0.6nM_C18, A02_Rd4_6nM_C10, A02_Rd4_6nM_C05, A02_Rd4_0.6nM_C10, A02_Rd4_6nM_C04, A02_Rd4_0.6nM_C26, A02_Rd4_0.6nM_C13, A02_Rd4_0.6nM_C01, A02_Rd4_6nM_C08, P5C1_VHVL, C01_Rd4_6nM_C24, C01_Rd4_6nM_C26, C01_Rd4_6nM_C10, C01_Rd4_0.6nM_C27, C01_Rd4_6nM_C20, C01_Rd4_6nM_C12, C01_Rd4_0.6nM_C16, C01_Rd4_0.6nM_C09, C01_Rd4_6nM_C09, C01_Rd4_0.6nM_C03, C01_Rd4_0.6nM_C06, C01_Rd4_6nM_C04, COMBO_Rd4_0.6nM_C22, COMBO_Rd4_6nM_C21, COMBO_Rd4_6nM_C10, COMBO_Rd4_0.6nM_C04, COMBO_Rd4_6nM_C25, COMBO_Rd4_0.6nM_C21, COMBO_Rd4_6nM_C11, COMBO_Rd4_0.6nM_C20, COMBO_Rd4_6nM_C09, COMBO_Rd4_6nM_C08, COMBO_Rd4_0.6nM_C19, COMBO_Rd4_0.6nM_C02, COMBO_Rd4_0.6nM_C23, COMBO_Rd4_0.6nM_C29, COMBO_Rd4_0.6nM_C09, COMBO_Rd4_6nM_C12, COMBO_Rd4_0.6nM_C30, COMBO_Rd4_0.6nM_C14, COMBO_Rd4_6nM_C07, COMBO_Rd4_6nM_C02, COMBO_Rd4_0.6nM_C05, COMBO_Rd4_0.6nM_C17, COMBO_Rd4_6nM_C22, COMBO_Rd4_0.6nM_C11 или COMBO_Rd4_0.6nM_C29.
В некоторых воплощениях изобретения предложен CAR, специфически связывающийся с ВСМА, где CAR содержит VH-область, содержащую последовательность, приведенную в SEQ ID NO: 33; и/или VL-область, содержащую последовательность, приведенную в SEQ ID NO: 34. В некоторых воплощениях изобретения предложен CAR, специфически связывающийся с ВСМА, где CAR содержит VH-область, содержащую последовательность, приведенную в SEQ ID NO: 33, 72, 39, 76, 83, 92, 25 или 8; и/или VL-область, содержащую последовательность, приведенную в SEQ ID NO: 34, 73, 40, 77, 84, 93, 18 или 80. В некоторых воплощениях изобретения также предложены CAR, содержащие CDR-части антител к ВСМА на основе областей контакта CDR. Области контакта CDR представляют собой области антитела, которые наделяют антитело специфичностью к антигену. Как правило, области контакта CDR включают положения остатков в составе CDR и зон Вернье (Vernier), которые подвержены ограничению для подержания надлежащей структуры петель для связывания антитела с определенным антигеном. См., например, Makabe et al., J. Biol. Chem., 283:1156-1166, 2007. Определение областей контакта CDR известно специалистам в области техники.
Аффинность связывания (KD) ВСМА-специфических CAR, описанных в данном документе, с ВСМА (таким как ВСМА человека (например, (SEQ ID NO: 354) может составлять от приблизительно 0,002 до приблизительно 6500 нМ. В некоторых воплощениях аффинность связывания составляет приблизительно любое из 6500 нМ, 6000 нМ, 5986 нМ, 5567 нМ, 5500 нМ, 4500 нМ, 4000 нМ, 3500 нМ, 3000 нМ, 2500 нМ, 2134 нМ, 2000 нМ, 1500 нМ, 1000 нМ, 750 нМ, 500 нМ, 400 нМ, 300 нМ, 250 нМ, 200 нМ, 193 нМ, 100 нМ, 90 нМ, 50 нМ, 45 нМ, 40 нМ, 35 нМ, 30 нМ, 25 нМ, 20 нМ, 19 нМ, 18 нМ, 17 нМ, 16 нМ, 15 нМ, 10 нМ, 8 нМ, 7,5 нМ, 7 нМ, 6,5 нМ, 6 нМ, 5,5 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ, 1 нМ, 0,5 нМ, 0,3 нМ, 0,1 нМ, 0,01 нМ или 0,002 нМ. В некоторых воплощениях аффинность связывания составляет менее чем любое из приблизительно 6500 нМ, 6000 нМ, 5500 нМ, 5000 нМ, 4000 нМ, 3000 нМ, 2000 нМ, 1000 нМ, 900 нМ, 800 нМ, 250 нМ, 200 нМ, 100 нМ, 50 нМ, 30 нМ, 20 нМ, 10 нМ, 7,5 нМ, 7 нМ, 6,5 нМ, 6 нМ, 5 нМ, 4,5 нМ, 4 нМ, 3,5 нМ, 3 нМ, 2,5 нМ, 2 нМ, 1,5 нМ, 1 нМ или 0,5 нМ.
Внутриклеточный сигнальный домен CAR по изобретению отвечает за внутриклеточную сигнализацию после связывания внеклеточного лиганд-связывающего домена с мишенью, приводящую к активации иммунной клетки и иммунному ответу. Внутриклеточный сигнальный домен обладает способностью активировать по меньшей мере одну из нормальных эффекторных функций иммунной клетки, в которой экспрессируется CAR. Например, эффекторная функция Т-клетки может представлять собой цитолитическую активность или хелперную активность, включая секрецию цитокинов.
В некоторых воплощениях внутриклеточный сигнальный домен для применения в CAR может представлять собой цитоплазматические последовательности, например, без ограничения, Т-клеточного рецептора и корецепторов, которые действуют согласованно для инициации передачи сигнала после связывания антигена с рецептором, а также любые производные или варианты указанных последовательностей и любые синтетические последовательности, обладающие такой же функциональной способностью. Внутриклеточные сигнальные домены содержат два отдельных класса цитоплазматических сигнальных последовательностей: те, которые инициируюую антиген-зависимую первичную активацию, и те, которые действуют антиген-независимым образом для обеспечения вторичного или костимулирующего сигнала. Первичные цитоплазматические сигнальные последовательности могут содержать сигнальные мотивы, которые известны как иммунорецепторные тирозиновые активирующие мотивы ITAM. ITAM представляют собой хорошо охарактеризованные сигнальные мотивы, обнаруживаемые в цитоплазматическом хвосте ряда рецепторов, которые служат сайтами связывания для тирозиновых киназ класса syk/zap70. Примеры ITAM, используемых в изобретении, могут включать имеющие происхождение из TCRζ, FcRγ, FcRβ, FcRε, CD3γ, CD3δ, CD3ε, CD5, CD22, CD79a, CD79b и CD66d, однако эти примеры не являются исчерпывающими. В некоторых воплощениях внутриклеточный сигнальный домен CAR может содержать сигнальный домен CD3ζ, который имеет аминокислотную последовательность, идентичную по меньшей мере на 70%, предпочтительно, по меньшей мере на 80%, более предпочтительно, по меньшей мере на 90%, 95%, 97% или 99% аминокислотной последовательности, приведенной в SEQ. ID NO. 324. В некоторых воплощениях внутриклеточный сигнальный домен CAR по изобретению содержит домен костимулирующей молекулы.
В некоторых воплощениях внутриклеточный сигнальный домен CAR по изобретению содержит часть костимулирующей молекулы, выбранной из группы, состоящей из фрагмента 41ВВ (GenBank: ААА53133.) и CD28 (NP_006130.1). В некоторых воплощениях внутриклеточный сигнальный домен CAR по изобретению содержит аминокислотную последовательность, которая идентична по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90%, 95%, 97% или 99% аминокислотной последовательности, приведенной в SEQ. ID NO: 323 и SEQ. ID NO: 327.
CAR экспрессируются на поверхностной мембране клетки. Таким образом, CAR может содержать трансмембранный домен. Подходящие трансмембранные домены для CAR, раскрытых в данном описании, обладают способностью (а) экспрессироваться на поверхности клетки, предпочтительно иммунной клетки, например такой как лимфоциты или естественные киллеры (NK-клетки), не ограничиваясь ими, и (б) взаимодействовать с лиганд-связывающим доменом и внутриклеточным сигнальным доменом для направления клеточного ответа иммунной клетки против заданной клетки-мишени. Трансмембранный домен может иметь происхождение из естественного или синтетического источника. Трансмембранный домен может иметь происхождение из любого мембраносвязанного или трансмембранного белка. В качестве примеров, не являющихся ограничивающими, трансмембранный полипептид может представлять собой субъединицу Т-клеточного рецептора, такую как α, β, γ или δ, полипептид, составляющий комплекс CD3, р55 (а цепь), р75 (β цепь) или γ цепь рецептора IL-2 (интерлейкин-2), цепь субъединицы Fc рецепторов, в частности Fcγ рецептора III, или белки CD. В альтернативном варианте трансмембранный домен может быть синтетическим и содержать преимущественно гидрофобные остатки, такие как лейцин и валин. В некоторых воплощениях указанный трансмембранный домен имеет происхождение из цепи CD8α человека (например, NP_001139345.1). Трансмембранный домен может дополнительно содержать стеблевой домен между внеклеточным лиганд-связывающим доменом и указанным трансмембранным доменом. Стеблевой домен может содержать до 300 аминокислот, предпочтительно от 10 до 100 аминокислот, и наиболее предпочтительно от 25 до 50 аминокислот. Стеблевая область может иметь происхождение из целой молекулы естественного происхождения или ее части, например из целой внеклеточной области CD8, CD4 или CD28 или ее части, или из целой константной области антитела или ее части. В альтернативном варианте стеблевой домен может представлять собой синтетическую последовательность, которая соответствует стеблевому домену естественного происхождения или может быть полностью синтетической стеблевой последовательностью. В некоторых воплощениях указанный стеблевой домен является частью цепи CD8α человека (например, NP_001139345.1). В другом частном воплощении указанные трансмембранный и шарнирный домены содержат часть цепи CD8α человека, последовательность которой предпочтительно идентична по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90%, 95%, 97% или 99% аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 318. В некоторых воплощениях предложенные в данном изобретении CAR могут содержать внеклеточный лиганд-связывающий домен, который специфически связывается с ВСМА, шарнирный и трансмембранный домены CD8α человека, сигнальный домен CD3ζ и сигнальный домен 4-1ВВ.
В Таблице 3 приведены примеры последовательностей доменов, которые можно применять в CAR по данному изобретению.

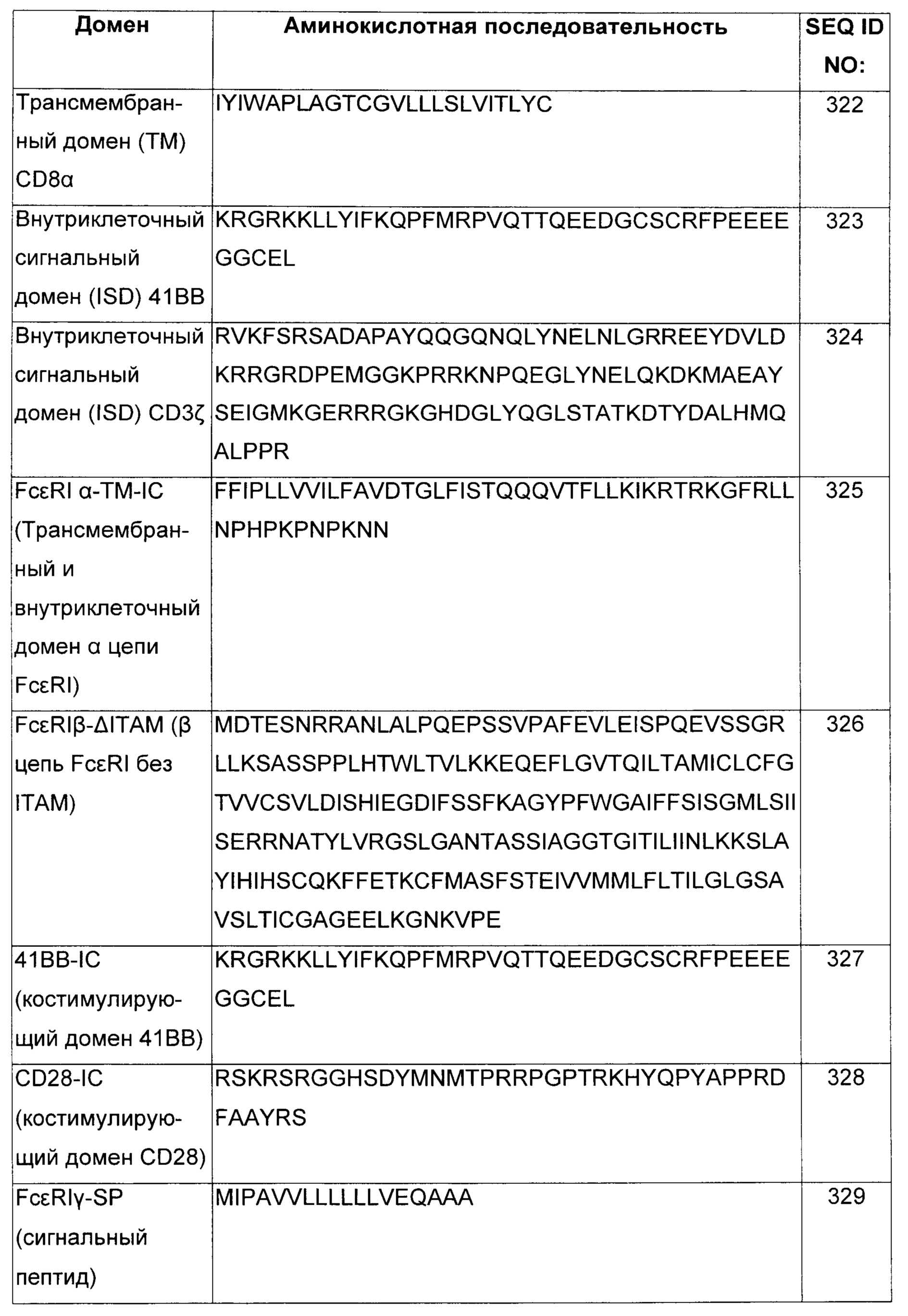

В опухолевых клетках часто наблюдается понижающая регуляция или мутация антигенов-мишеней, что приводит к возникновению вариантов с потерей антигенов и ускользанием от иммунной системы. Таким образом, чтобы нейтрализовать ускользание опухолей и сделать иммунные клетки более специфичными в отношении мишени, ВСМА-специфический CAR может содержать один или более дополнительных внеклеточных лиганд-связывающих доменов для одновременного связывания различных элементов мишени, таким образом усиливая активацию и функцию иммунных клеток. В одном воплощении внеклеточные лиганд-связывающие домены могут размещаться последовательно на том же трансмембранном полипептиде и, возможно, могут быть разделены линкером. В некоторых воплощениях указанные различные внеклеточные лиганд-связывающие домены могут находиться на различных трансмембранных полипептидах, составляющих CAR. В некоторых воплощениях изобретение относится к популяции CAR, где каждый CAR содержит различные внеклеточные лиганд-связывающие домены. В частности, изобретение относится к способу инженерии иммунных клеток, включающему предоставление иммунной клетки и экспрессию на поверхности клетки популяции CAR, где каждый CAR содержит различные внеклеточные лиганд-связывающие домены. В другом частном воплощении изобретение относится к способу инженерии иммунных клеток, включающему предоставление иммунной клетки и внедрение в клетку полинуклеотидов, кодирующих полипептиды, составляющие популяцию CAR, каждый из которых содержит различные внеклеточные лиганд-связывающие домены. Под популяцией CAR понимают по меньшей мере два, три, четыре, пять, шесть или более CAR, каждый из которых содержит различные внеклеточные лиганд-связывающие домены. Различные лиганд-связывающие домены по изобретению могут предпочтительно одновременно связываться с различными элементами мишени, таким образом усиливая активацию и функцию иммунных клеток. Изобретение также относится к выделенной иммунной клетке, которая содержит популяцию CAR, каждый из которых содержит различные внеклеточные лиганд-связывающие домены.
В другом аспекте изобретения предложены полинуклеотиды, кодирующие любой из CAR и полипептидов, описанных в данном документе. Полинуклеотиды могут быть получены и экспрессированы способами, известными в области техники.
В другом аспекте изобретения предложены композиции (такие как фармацевтические композиции), содержащие любую из клеток по изобретению. В некоторых воплощениях композиция содержит клетку, содержащую полинуклеотид, кодирующий любой из описанных в данном документе CAR. В других воплощениях композиция содержит один или оба из полинуклеотидов, приведенных в SEQ ID NO: 367 и SEQ ID NO: 368 ниже:
Вариабельная область тяжелой цепи Р5А

Вариабельная область легкой цепи Р5А
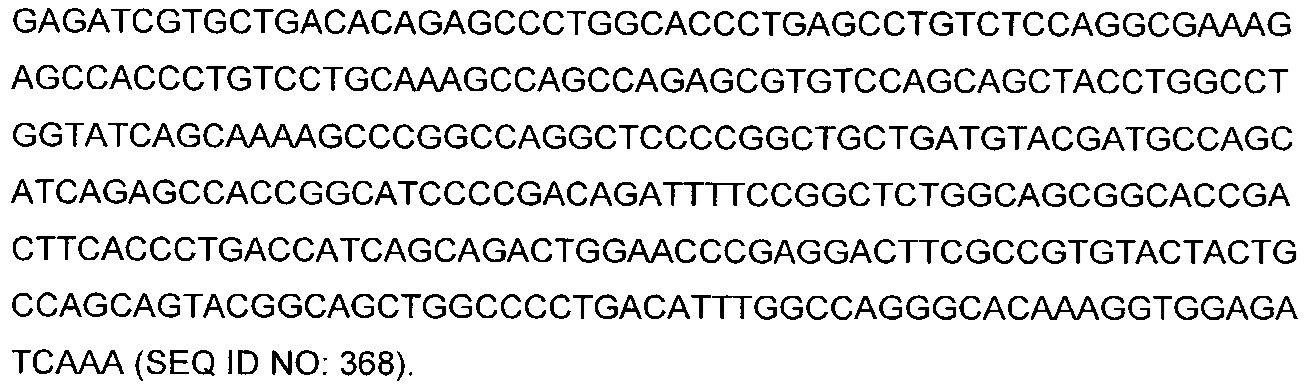
В других воплощениях композиция содержит один или оба из полинуклеотидов, приведенных в SEQ ID NO: 369 и SEQ ID NO: 370 ниже:
Вариабельная область тяжелой цепи Р5АС1

Вариабельная область легкой цепи Р5АС1
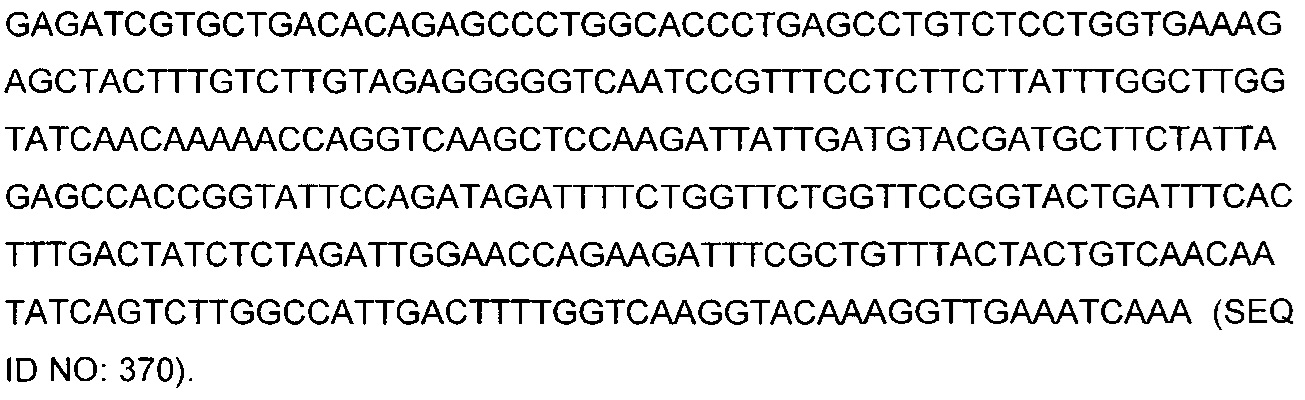
В других воплощениях композиция содержит один или оба из полинуклеотидов, приведенных в SEQ ID NO: 371 и SEQ ID NO: 372 ниже:
Вариабельная область тяжелой цепи РС1
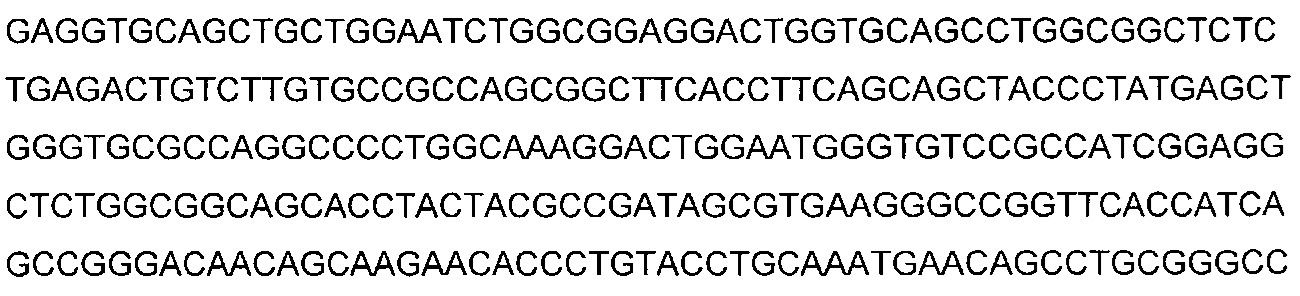
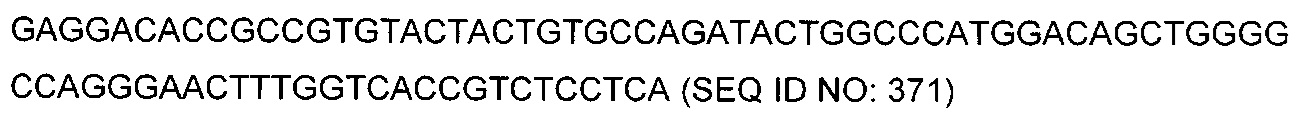
Вариабельная область легкой цепи РС1
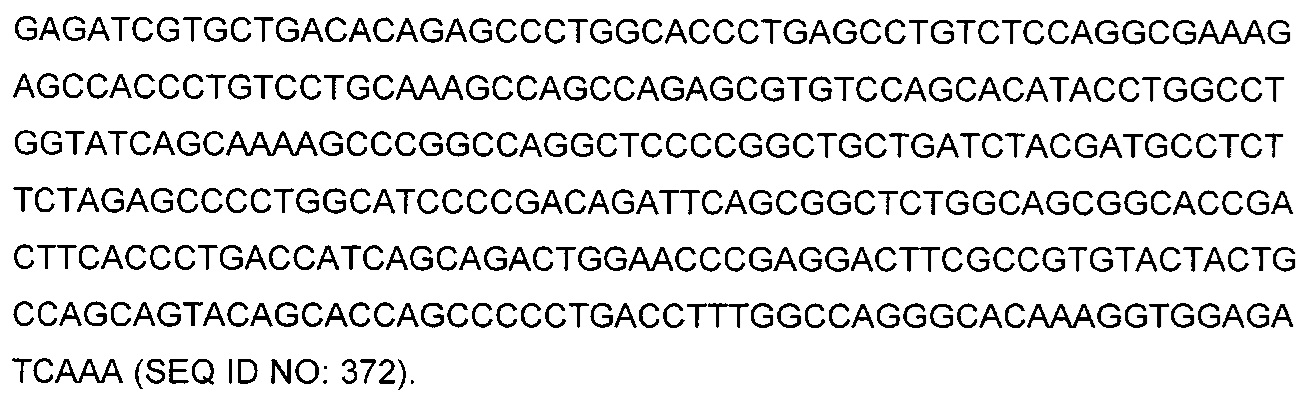
В других воплощениях композиция содержит один или оба из полинуклеотидов, приведенных в SEQ ID NO: 373 и SEQ ID NO: 374 ниже:
Вариабельная область тяжелой цепи РС1С12

Вариабельная область легкой цепи РС1С12
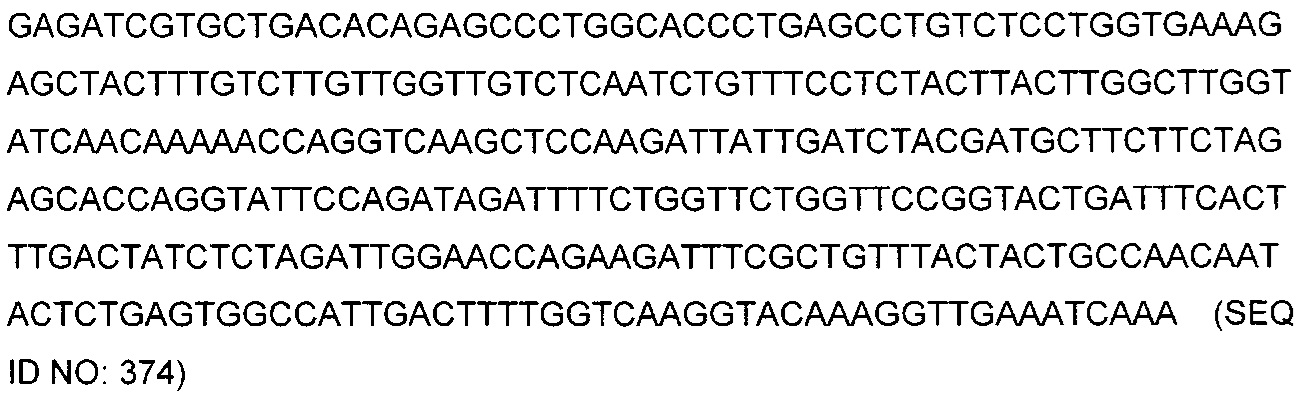
В других воплощениях композиция содержит один или оба из полинуклеотидов, приведенных в SEQ ID NO: 375 и SEQ ID NO: 376 ниже:
Вариабельная область тяжелой цепи СОМ22
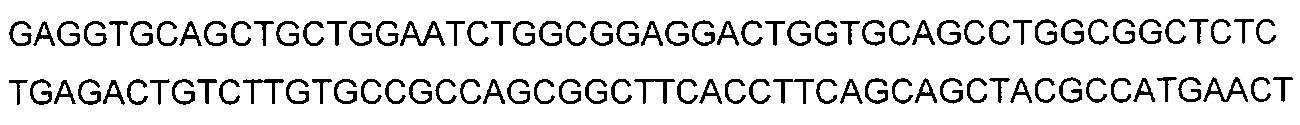

Вариабельная область легкой цепи СОМ22
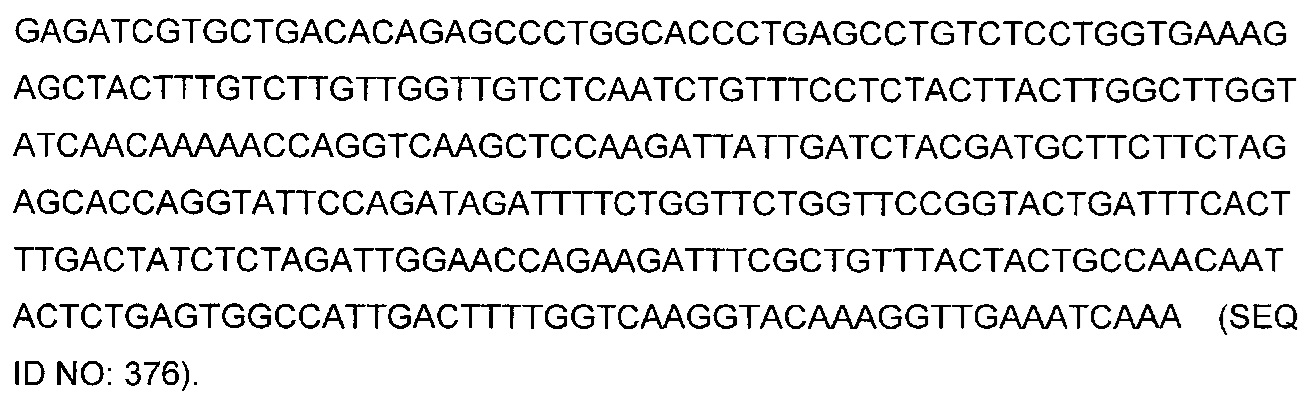
Экспрессирующие векторы и введение композиций полинуклеотидов дополнительно описаны в данном документе.
В другом аспекте изобретения предложен способ получения любого из полинуклеотидов, описанных в данном документе.
Изобретение также охватывает полинуклеотиды, комплементарные любой из указанных последовательностей. Полинуклеотиды могут быть одноцепочечными (кодирующими или антисмысловыми) или двуцепочечными, а также могут представлять собой молекулы ДНК (геномную, кДНК или синтетическую) или РНК. Молекулы РНК включают молекулы гяРНК (гетерогенная ядерная РНК), которые содержат интроны и один в один соответствуют молекуле ДНК, и молекулы РНК, которые не содержат интронов. В полинуклеотиде по изобретению могут, но не обязательно должны присутствовать дополнительные кодирующие или некодирующие последовательности, и полинуклеотид может, но не обязательно должен быть связан с другими молекулами и/или веществами-подложками.
Полинуклеотиды могут содержать нативную последовательность (т.е. эндогенную последовательность, которая кодирует антитело или его часть) или могут содержать вариант такой последовательности. Варианты полинуклеотидов содержат одну или более замен, добавлений, делеций и/или вставок, так что иммунореактивность кодируемого полипептида не снижается по сравнению с нативной иммунореактивной молекулой. Влияние на иммунореактивность кодируемого полипептида обычно можно оценивать, как описано в данном документе. Варианты предпочтительно идентичны по меньшей мере на 70%, более предпочтительно по меньшей мере на 80%, еще более предпочтительно по меньшей мере на 90% и наиболее предпочтительно по меньшей мере на 95% последовательности полинуклеотида, кодирующего нативное антитело или его часть.
Две полинуклеотидные или полипептидные последовательности называют «идентичными», если последовательность нуклеотидов или аминокислот в двух последовательностях является одинаковой при выравнивании с максимальным количеством совпадений, как описано ниже. Сравнение двух последовательностей обычно выполняют путем сравнения последовательностей в окне сравнения для идентификации и сравнения локальных участков со сходством последовательностей. «Окно сравнения» в данном описании означает сегмент длиной по меньшей мере 20 следующих друг за другом положений, обычно от 30 до приблизительно 75 или от 40 до приблизительно 50, в которых последовательность можно сравнить с эталонной последовательностью с таким же количеством следующих друг за другом положений после оптимального выравнивания двух последовательностей.
Оптимальное выравнивание последовательностей для сравнения можно осуществлять с помощью программы Megalign программного пакета Lasergene для биоинформационного анализа (DNASTAR, Inc., Madison, WI), используя параметры по умолчанию. Данная программа включает несколько схем выравниваний, описанных в следующих ссылках: Dayhoff, М.О., 1978, A model of evolutionary change in proteins - Matrices for detecting distant relationships. In Dayhoff, M.O. (ed.) Atlas of Protein Sequence and Structure, National Biomedical Research Foundation, Washington DC Vol. 5, Suppl. 3, pp. 345-358; Hein J., 1990, Unified Approach to Alignment and Phylogenes pp. 626-645 Methods in Enzymology vol. 183, Academic Press, Inc., San Diego, CA; Higgins, D.G. and Sharp, P.M., 1989, CABIOS 5:151-153; Myers, E.W. and Muller W., 1988, CABIOS 4:11-17; Robinson, E.D., 1971, Comb. Theor. 11:105; Santou, N., Nes, M., 1987, Mol. Biol. Evol. 4:406-425; Sneath, P.H.A. and Sokal, R.R., 1973, Numerical Taxonomy the Principles and Practice of Numerical Taxonomy, Freeman Press, San Francisco, CA; Wilbur, W.J. and Lipman, D.J., 1983, Proc. Natl. Acad. Sci. USA 80:726-730.
Предпочтительно, «процент идентичности последовательностей» определяют путем сравнения двух оптимально выровненных последовательностей в окне сравнения, из по меньшей мере 20 положений, где часть полинуклеотидной или полипептидной последовательности в окне сравнения может содержать добавления или делеции (т.е. гэпы), составляющие 20 процентов или менее, обычно от 5 до 15 процентов или от 10 до 12 процентов, относительно эталонных последовательностей (которые не содержат добавлений или делеций) для оптимального выравнивания двух последовательностей. Процент рассчитывают, определяя число положений, где в обеих последовательностях находятся идентичные нуклеиновокислотные основания или аминокислотные остатки, чтобы получить число совпадающих положений, разделить число совпадающих положений на общее число положений в эталонной последовательности (т.е. размер окна) и умножить результат на 100, получив процент идентичности последовательностей.
Варианты могут также или альтернативно быть по существу гомологичны нативному гену или его части, или комплементу. Такие варианты полинуклеотидов способны гибридизоваться в умеренно жестких условиях с последовательностями ДНК естественного происхождения, кодирующими нативное антитело (или комплементарную последовательность).
Подходящие «умеренно жесткие условия» включают предварительное промывание раствором 5 X SSC (хлорид натрия/цитрат натрия), 0,5% SDS (додецилсульфат натрия), 1,0 мМ EDTA (этилендиаминтетрауксусная кислота) (рН 8,0); гибридизацию при 50°С-65°С, 5 X SSC, в течение ночи; с последующей двукратной отмывкой при 65°С в течение 20 минут каждым из 2Х, 0,5Х и 0,2Х SSC, содержащим 0,1% SDS.
В данном описании «высоко жесткими условиями» или «условиями высокой жесткости» являются такие, в которых: (1) для промывания используют низкую ионную силу и высокую температуру, например 0,015 М хлорид натрия/0,0015 М цитрат натрия/0,1% додецилсульфат натрия при 50°С; (2) во время гибридизации применяют денатурирующий агент, такой как формамид, например 50% (об./об.) формамид с 0,1% бычьего сывороточного альбумина/0,1% фиколла/0,1% поливинилпирролидона/50 мМ натрий-фосфатного буфера с рН 6,5 с 750 мМ хлорида натрия, 75 мМ цитрат натрия при 42°С; или (3) используют 50% формамид, 5 × SSC (0,75 М NaCl, 0,075 М цитрат натрия), 50 мМ фосфат натрия (рН 6,8), 0,1% пирофосфат натрия, 5 × раствор Денхардта, ДНК молок лососевых, подвергнутую действию ультразвука (50 мкг/мл), 0,1% SDS и 10% сульфат декстрана при 42°С, с промыванием при 42°С в 0,2 × SSC (хлорид натрия/цитрат натрия) и 50% формамиде при 55°С, с последующим промыванием в условиях высокой жесткости с помощью 0,1 × SSC, содержащего EDTA, при 55°С. Специалисту в области техники известно, как корректировать температуру, ионную силу и т.д. в зависимости от таких факторов, как длина зонда и тому подобные.
Специалисту в области техники понятно, что вследствие вырожденности генетического кода существует множество нуклеотидных последовательностей, кодирующих описанный здесь полипептид. Некоторые из таких полинуклеотидов обладают минимальной гомологией с нуклеотидной последовательностью какого-либо нативного гена. Тем не менее, изобретение охватывает полинуклеотиды, варьирующие вследствие различий в использовании кодонов. Кроме того, в объем изобретения также входят аллели генов, содержащих полинуклеотидные последовательности, описанные в данном документе. Аллели представляют собой эндогенные гены, которые изменены в результате одной или нескольких мутаций, таких как делеции, добавления и/или замены нуклеотидов. Образующиеся в результате мРНК (матричная РНК) и белок могут, но не обязательно должны иметь измененную структуру или функцию. Аллели можно идентифицировать стандартными способами (такими как гибридизация, амплификация и/или сравнение последовательностей с базой данных).
Полинуклеотиды по данному изобретению можно получить, используя способы химического синтеза, рекомбинантные способы или PCR (полимеразная цепная реакция). Способы химического синтеза полинуклеотидов хорошо известны в области техники и не нуждаются в подробном описании здесь. Специалист в области техники может использовать последовательности, предложенные в данном изобретении, и коммерческий синтезатор ДНК для получения желаемой последовательности ДНК.
Для получения полинуклеотидов с помощью рекомбинантных способов, полинуклеотид, содержащий желаемую последовательность, можно встроить в подходящий вектор, а вектор, в свою очередь, внедрить в подходящую клетку-хозяина для репликации и амплификации, как описано далее. Полинуклеотиды можно внедрять в клетки-хозяева любым способом, известным в области техники. Клетки трансформируют путем введения экзогенного полинуклеотида посредством прямого поглощения, эндоцитоза, трансфекции, спаривания с участием F-фактора (F-mating) или электропорации. После внедрения экзогенный полинуклеотид можно поддерживать в клетке в виде неинтегрированного вектора (такого как плазмида) или интегрированного в геном клетки-хозяина. Полинуклеотиды, амплифицированные таким образом, можно выделять из клетки-хозяина способами, хорошо известными в области техники. См., например, Sambrook et al., 1989.
В альтернативном варианте PCR позволяет воспроизвести последовательности ДНК. Технология PCR хорошо известна в области техники и описана в патентах США 4683195, 4800159, 4754065 и 4683202, а также в источнике PCR: The Polymerase Chain Reaction, Mullis et al. eds., Birkauswer Press, Boston, 1994.
РНК можно получить, используя выделенную ДНК и соответствующий вектор и встраивая ее в подходящую клетку-хозяина. Когда клетка реплицируется и ДНК транскрибируется в РНК, после этого можно выделить РНК, используя способы, хорошо известные специалистам в области техники, например, как описано Sambrook et al., 1989, см. выше.
Подходящие клонирующие векторы можно сконструировать в соответствии со стандартными методиками или можно выбрать из большого числа клонирующих векторов, существующих в области техники. При том, что выбранный клонирующий вектор может варьировать в зависимости от того, какую клетку-хозяина предполагают использовать, полезные клонирующие векторы обычно будут обладать способностью к саморепликации, могут иметь единственную мишень для конкретной рестрикционной эндонуклеазы и/или могут нести гены для маркера, который можно использовать при селекции клонов, содержащих вектор. Подходящие примеры включают плазмиды и бактериофаги, например pUC18, pUC19, Bluescript (например, pBS SK+) и их производные, mp18, mp19, pBR322, pMB9, ColE1, pCR1, RP4, ДНК фагов и челночные векторы, такие как pSA3 и рАТ28. Эти и многие другие клонирующие векторы доступны для приобретения, например в компаниях BioRad, Stratagene и Invitrogen.
Экспрессирующие векторы обычно представляют собой реплицирующиеся полинуклеотидные конструкции, которые содержат полинуклеотид по изобретению. Предполагают, что экспрессирующий вектор должен быть реплицируемым в клетке-хозяине либо в виде эписом, либо в виде составной части хромосомной ДНК. Подходящие экспрессирующие векторы включают плазмиды, векторы на основе вирусов, включая аденовирусы, адено-ассоциированные вирусы, ретровирусы, космиды и экспрессирующие векторы, раскрытые в публикации РСТ с номером WO 87/04462, но не ограничиваются ими. Компоненты вектора обычно могут включать одно или более из следующего: сигнальную последовательность, репликатор, один или более маркерных генов, подходящие элементы, регулирующие транскрипцию (такие как промоторы, энхансеры и терминатор), но не ограничиваются ими. Для экспрессии (т.е. трансляции) также обычно требуются один или более элементов, регулирующих трансляцию, таких как сайты связывания рибосомы, сайты инициации трансляции и стоп-кодоны.
Векторы, содержащие представляющий интерес полинуклеотид, можно внедрять в клетку-хозяина любым из множества подходящих способов, включая электропорацию, трансфекцию с использованием хлорида кальция, хлорида рубидия, фосфата кальция, DEAE(диэтиламиноэтил)-декстрана или других веществ; бомбардировкой микрочастицами, липофекцией и инфицированием (например, когда вектор представляет собой инфекционный агент, такой как вирус коровьей оспы). Выбор внедряемых векторов или полинуклеотидов часто зависит от характеристик клетки-хозяина.
Полинуклеотид, кодирующий ВСМА-специфический CAR, раскрытый в данном документе, может находиться в экспрессионной кассете или экспрессирующем векторе (например, плазмиде для внедрения в бактериальную клетку-хозяина или вирусном векторе, таком как бакуловирусный вектор, для трансфекции клетки-хозяина насекомого, или плазмиде или вирусном векторе, таком как лентивирус, для трансфекции клетки-хозяина млекопитающего). В некоторых воплощениях полинуклеотид или вектор может включать в себя нуклеиновокислотную последовательность, кодирующую последовательности, приводящие к рибосомному «перескакиванию», например, такой как последовательности, кодирующей пептид 2А, не ограничиваясь ей. Пептиды 2А, которые были обнаружены в подгруппе Aphthovirus, относящейся к пикорнавирусам, вызывают «перескакивание» рибосомы с одного кодона на следующий, без образования пептидной связи между двумя аминокислотами, кодируемыми этими кодонами (см. (Donnelly and Elliott 2001; Atkins, Wills et al. 2007; Doronina, Wu et al. 2008)). Под «кодоном» понимают три нуклеотида на мРНК (или на смысловой цепи молекулы ДНК), которые транслируются рибосомой в один аминокислотный остаток. Таким образом, два полипептида могут синтезироваться с одной непрерывной открытой рамки считывания в составе imRNA, когда полипептиды разделены последовательностью олигопептида 2А, находящейся в рамке считывания. Такие механизмы перескакивания рибосомы хорошо известны в области техники и известно, что их применяют в нескольких векторах для экспрессии нескольких белков, кодируемых одной информационной РНК.
Чтобы направить трансмембранные полипептиды на секреторный путь клетки-хозяина, в некоторых воплощениях секреторная сигнальная последовательность (также известная как лидерная последовательность, препро-последовательность или препоследовательность) предоставлена в последовательности полинуклеотида или последовательности вектора. Секреторная сигнальная последовательность функционально связана с трансмембранной нуклеиновокислотной последовательностью, то есть две последовательности соединены в правильной рамке считывания и размещены так, чтобы направлять новый синтезированный полипептид на секреторный путь клетки-хозяина. Секреторные сигнальные последовательности обычно расположены в направлении 5' относительно нуклеотидной последовательности, кодирующей полипептид, представляющий интерес, хотя некоторые секреторные сигнальные последовательности могут располагаться в других местах нуклеотидной последовательности, представляющей интерес (см., например, Welch et al., U.S. Patent No. 5,037,743; Holland et al., патент США 5143830). В некоторых воплощениях сигнальный пептид содержит аминокислотную последовательность, приведенную в SEQ ID NO: 318 или 329. Специалистам в области техники понятно, что вследствие вырожденности генетического кода последовательность таких полинуклеотидных молекул может в значительной степени варьировать. В некоторых воплощениях в нуклеиновокислотные последовательности по изобретению имеют оптимизированные кодоны для экспрессии в клетках млекопитающих, предпочтительно для экспрессии в клетках человека. Оптимизация кодонов относится к замене в последовательности, представляющей интерес, тех кодонов, которые обычно редко встречаются в генах, экспрессируемых на высоком уровне у определенного вида, кодонами, которые обычно часто встречаются в генах, экспрессируемых на высоком уровне у этого вида, где такие кодоны кодируют те же аминокислоты, что и кодоны, которые были заменены.
В некоторых воплощениях полинуклеотид по изобретению содержит нуклеиновокислотную последовательность, выбранную из группы, состоящей из: SEQ. ID NO: 1397. Изобретение относится к полинуклеотидам, содержащим нуклеотидную последовательность, которая по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90%, 95%, 97% или 99% идентична нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1397.
Способы инженерии иммунной клетки
В данном документе описаны способы подготовки иммунных клеток для применения в иммунотерапии. В некоторых воплощениях способы включают внедрение CAR по изобретению в иммунные клетки и размножение клеток. В некоторых воплощениях изобретение относится к способу инженерии иммунной клетки, включающему: предоставление клетки и экспрессию на поверхности клетки по меньшей мере одного CAR, описанного выше. Способы инженерии иммунных клеток описаны, например, в заявках на патент согласно РСТ под номерами WO/2014/039523, WO/2014/184741, WO/2014/191128, WO/2014/184744 и WO/2014/184143, содержание которых включено во всей полноте путем ссылки. В некоторых воплощениях способ включает: трансфекцию клетки по меньшей мере одним полинуклеотидом, кодирующим CAR, описанный выше, и экспрессию указанного полинуклеотида в клетке.
В некоторых воплощениях полинуклеотиды находятся в лентивирусных векторах для стабильной экспрессии в клетках.
В некоторых воплощениях способ может дополнительно содержать стадию генетической модификации клетки путем инактивации по меньшей мере одного гена, экспрессирующего, например, компонент TCR, мишени для иммуносупрессивного агента, ген HLA и/или белок контрольных точек иммунного ответа, например такой как PDCD1 или CTLA-4, не ограничиваясь ими. Под инактивацией гена понимают, что ген, представляющий интерес, не экспрессируется в форме функционального белка. В некоторых воплощениях ген, который подлежит инактивации, выбирают из группы, например, состоящей из TCRα, TCRβ, CD52, GR, PD-1 и CTLA-4, но не ограничивающейся ими. В некоторых воплощениях способ включает инактивацию одного или более генов путем введения в клетки редкощепящей эндонуклеазы, способной избирательно инактивировать ген путем селективного расщепления ДНК. В некоторых воплощениях редкощепящая эндонуклеаза может быть, например, эффекторной нуклеазой, подобной активаторам транскрипции (TALE-нуклеазой) или эндонуклеазой Cas9.
В некоторых воплощениях наряду с редкощепящей эндонуклеазой используют дополнительный каталитический домен для усиления ее способности инактивировать гены-мишени. Например, дополнительный каталитический домен может представлять собой фермент, осуществляющий процессирование конца ДНК. Неисчерпывающие примеры ферментов, осуществляющих процессирование конца ДНК, включают 5-3' экзонуклеазы, 3-5' экзонуклеазы, 5-3' щелочные экзонуклеазы, 5' флэп-экзонуклеазы, хеликазы, фосфатазы, гидролазы и не зависящие от матрицы ДНК-полимеразы. Неисчерпывающие примеры таких каталитических доменов содержат белковый домен или каталитически активное производное белкового домена, выбранные из группы, состоящей из hExoI (EXO1_HUMAN), ExoI дрожжей (EXO1_YEAST), ExoI Е. coli, TREX2 человека, TREX1 мыши, TREX1 человека, TREX1 быка, TREX1 крысы, TdT (терминальной дезоксинуклеотидилтрансферазы), DNA2 человека, DNA2 дрожжей (DNA2_YEAST). В некоторых воплощениях дополнительный каталитический домен может обладать 3'-5'-экзонуклеазной активностью, и в некоторых воплощениях указанный дополнительный каталитический домен представляет собой TREX, более предпочтительно каталитический домен TREX2 (WO 2012/058458). В некоторых воплощениях указанный каталитический домен кодируется одноцепочечным полипептидом TREX. Дополнительный каталитический домен может быть слит с нуклеазным слитым белком или химерным белком. В некоторых воплощениях дополнительный каталитический домен слит с использованием, например, пептидного линкера.
В некоторых воплощениях способ дополнительно включает стадию внедрения в клетки экзогенной нуклеиновой кислоты, содержащей по меньшей мере последовательность, гомологичную части целевой нуклеовокислотной последовательности, так что между целевой нуклеовокислотной последовательностью и экзогенной нуклеиновой кислотой происходит гомологичная рекомбинация. В некоторых воплощениях указанная экзогенная нуклеиновая кислота содержит первую и вторую части, которые гомологичны 5' и 3' области целевой нуклеовокислотной последовательности, соответственно. Экзогенная нуклеиновая кислота может также содержать третью часть, расположенную между первой и второй частями, которая не обладает гомологией с 5' и 3' областями целевой нуклеовокислотной последовательности. После расщепления целевой нуклеовокислотной последовательности происходит гомологичная рекомбинация между целевой нуклеовокислотной последовательностью и экзогенной нуклеиновой кислотой. В некоторых воплощениях в составе донорской матрицы можно применять гомологичные последовательности по меньшей мере 50 п.о., более чем приблизительно 100 п.о. или более чем приблизительно 200 п.о.. Экзогенная нуклеиновая кислота может быть, например и без ограничения, от приблизительно 200 п.о. до приблизительно 6000 п.о., более предпочтительно от приблизительно 1000 п.о. до приблизительно 2000 п.о. Общие гомологичные участки нуклеиновых кислот расположены в областях, фланкирующих "выше по течению" и "ниже по течению" сайт, где осуществляют разрыв, а встраиваемая нуклеовокислотная последовательность расположена между двумя фланкирующими областями.
В некоторых воплощениях нуклеиновая кислота содержит последовательно расположенные: первую область, гомологичную последовательностям, расположенным "выше по течению" относительно указанного сайта расщепления; последовательность для инактивации гена-мишени, выбранного из группы, состоящей из TCRα, TCRβ, CD52, рецептора глюкокортикоидов (GR), дезоксицитидинкиназы (DCK) и белка контрольных точек иммунного ответа, например такого как белок программируемой гибели клеток-1 (PD-1); и вторую область, гомологичную последовательностям, расположенным "ниже по течению" относительно участка расщепления. Стадию внедрения полинуклеотида можно осуществлять одновременно, до или после введения, или экспрессии редкощепящей эндонуклеазы. В зависимости от расположения целевой нуклеовокислотной последовательности, в которой произошел разрыв, такая экзогенная нуклеиновая кислота может применяться для нокаута гена, например когда экзогенная нуклеиновая кислота расположена в открытой рамке считывания гена, или для введения новых последовательностей или генов, представляющих интерес. Вставки последовательности с использованием такой экзогенной нуклеиновой кислоты можно использовать для модификации целевого существующего гена, путем корректирования или замены гена (в качестве неограничивающего примера, обмена аллелей) или для повышающей или понижающей регуляции экспрессии целевого гена (в качестве неограничивающего примера, обмена промоторов), корректирования или замены целевого гена. В некоторых воплощениях инактивация генов, выбранных из группы, состоящей из TCRα, TCRβ, CD52, GR, DCK и белков контрольных точек иммунного ответа, может осуществляться в конкретном участке генома, который являются мишенью специфической TALE-нуклеазы, где указанная специфическая TALE-нуклеаза катализирует расщепление, и где экзогенная нуклеиновая кислота, содержащая последовательно расположенные по меньшей мере область гомологии и последовательность для инактивации одного целевого гена, выбранного из группы, состоящей из TCRα, TCRβ, CD52, GR, DCK, белков контрольных точек иммунного ответа, интегрирована путем гомологичной рекомбинации. В некоторых воплощениях могут быть поочередно или одновременно инактивированы несколько генов, с использованием для специфической инактивации генов нескольких TALE-нуклеаз, специфически нацеленных на один заданный ген и несколько определенных полинуклеотидов, соответственно.
В некоторых воплощениях способ включает инактивацию одного или более дополнительных генов, выбранных из группы, состоящей из TCRα, TCRβ, CD52, GR, DCK и белков контрольных точек иммунного ответа. В некоторых воплощениях инактивацию гена может осуществлять посредством введения в клетки по меньшей мере одной редкощепящей эндонуклеазы, так чтобы редкощепящая эндонуклеаза специфически катализировала расщепление в целевой последовательности клеточного генома; и возможно, введения в клетки экзогенной нуклеиновой кислоты, содержащей последовательно расположенные первую область, гомологичную последовательностям, расположенным "выше по течению" относительно указанного сайта расщепления, последовательность, подлежащую встраиванию в геном клетки, и вторую область, гомологичную последовательностям, расположенным "ниже по течению" относительно участка расщепления; где введенная экзогенная нуклеиновая кислота инактивирует ген и вводит по меньшей мере одну экзогенную полинуклеотидную последовательность, кодирующую по меньшей мере один рекомбинантный белок, представляющий интерес. В некоторых воплощениях экзогенную полинуклеотидную последовательность вводят в ген, кодирующий белок, выбранный из группы, состоящей из TCRα, TCRβ, CD52, GR, DCK и белка контрольных точек иммунного ответа.
В другом аспекте стадия генетической модификации клеток может включать: модификацию Т-клеток путем инактивации по меньшей мере одного гена, экспрессирующего мишень иммуносупрессивного агента, и размножение клеток, возможно в присутствии иммуносупрессивного агента. Иммуносупрессивный агент представляет собой агент, подавляющий иммунную функцию одним или несколькими механизмами. Иммуносупрессивный агент может уменьшать степень и/или выраженность иммунного ответа. Неисчерпывающие примеры иммуносупрессивных агентов включают ингибиторы кальциневрина, мишени рапамицина, блокаторы α-цепи интерлейкина-2, ингибиторы инозинмонофосфат-дегидрогеназы, ингибиторы дигидрофолатредуктазы, кортикостероиды и иммуносупрессивные антиметаболиты. Некоторые цитотоксические иммуносупрессанты действуют посредством ингибирования синтеза ДНК. Другие могут действовать посредством активации Т-клеток или ингибирования активации хелперных клеток. Способы по изобретению позволяют придать Т-клеткам резистентность к иммуносупрессии путем инактивации в Т-клетках мишени иммуносупрессивного агента. В качестве неограничивающих примеров, мишенями иммуносупрессивного агента могут быть рецептор иммуносупрессивного агента, например, такой как CD52, рецептор глюкокортикоидов (GR), представители семейства гена FKBP и представители семейства гена циклофилина.
В некоторых воплощениях генетическая модификация согласно способу, включает экспрессию в клетках, предназначенных для инженерии, одной редкощепящей эндонуклеазы, так чтобы редкощепящая эндонуклеаза специфически катализировала расщепление одного целевого гена, таким образом инактивируя целевой ген. В некоторых воплощениях способ инженерии клеток включает по меньшей мере одну из следующих стадий: предоставление Т-клетки, например из культуры клеток или из образца крови; выбор гена в Т-клетке, экспрессирующей мишень иммуносупрессивного агента; введение в Т-клетку редкощепящей эндонуклеазы, способной избирательно инактивировать ген, кодирующий мишень иммуносупрессивного агента, путем расщепления ДНК, предпочтительно путем двуцепочечного разрыва, и размножение клеток, возможно в присутствии иммуносупрессивного агента.
В некоторых воплощениях способ включает: предоставление Т-клетки, например из культуры клеток или из образца крови; выбор гена в Т-клетке, где ген экспрессирует мишень иммуносупрессивного агента; трансфекцию Т-клетки нуклеиновой кислотой, кодирующей редкощепящую эндонуклеазу, способную избирательно инактивировать ген, кодирующий мишень иммуносупрессивного агента, путем расщепления ДНК, предпочтительно путем двуцепочечного разрыва, и экспрессию редкощепящих эндонуклеаз в Т-клетках и размножение клеток, возможно в присутствии иммуносупрессивного агента.
В некоторых воплощениях редкощепящая эндонуклеаза специфически нацелена на CD52 или GR. В некоторых воплощениях ген, выбранный для инактивации, кодирует CD52, а иммуносупрессивная терапия включает гуманизированное антитело, нацеленное на антиген CD52. В некоторых воплощениях ген, выбранный для инактивации, кодирует GR, а иммуносупрессивная терапия включает кортикостероид, такой как дексаметазон. В некоторых воплощениях ген, выбранный для инактивации, является представителем семейства гена FKBP или его вариантом, а иммуносупрессивная терапия включает FK506, также известный как такролимус или фуджимицин. В некоторых воплощениях представитель семейства гена FKBP является FKBP12 или его вариантом. В некоторых воплощениях ген, выбранный для инактивации, является представителем семейства гена циклофилина или его вариантом, а иммуносупрессивная терапия включает циклоспорин.
В некоторых воплощениях редкощепящая эндонуклеаза может быть, например, мегануклеазой, нуклеазой с цинковыми пальцами или TALE-нуклеазой (TALEN). В некоторых воплощениях редкощепящая эндонуклеаза представляет собой TALE-нуклеазу.
Также предложены способы инженерии Т-клеток, подходящих для иммунотерапии, где способы включают: генетическую модификацию Т-клеток путем инактивации по меньшей мере белка контрольных точек иммунного ответа. В некоторых воплощениях белок контрольной точки иммунного ответа представляет собой, например, PD-1 и/или CTLA-4. В некоторых воплощениях способы генетической модификации клетки включают: модификацию Т-клеток путем инактивации по меньшей мере одного белка контрольных точек иммунного ответа и размножение клеток. Белки контрольных точек иммунного ответа включают: белок программируемой клеточной гибели-1 (PD-1, также известный как PDCD1 или CD279, номер доступа: NM_005018), антиген 4 цитотоксических Т-лимфоцитов (CTLA-4, также известный как CD152, номер доступа GenBank: AF414120.1), LAG3 (также известный как CD223, номер доступа: NM_002286.5), Tim3 (также известный как HAVCR2, номер доступа GenBank: JX049979.1), BTLA (также известный как CD272, номер доступа: NM_181780.3), BY55 (также известный как CD160, номер доступа GenBank: CR541888.1), TIGIT (также известный как VSTM3, номер доступа: NM_173799), В7Н5 (также известный как C10orf54, гомолог мышиного гена vista, номер доступа: NM_022153.1), LAIR1 (также известный как CD305, номер доступа GenBank: CR542051.1), SIGLEC10 (номер доступа GenBank: AY358337.1), 2В4 (также известный как CD244, номер доступа: NM_001166664.1), которые напрямую ингибируют иммунные клетки. Например, CTLA-4 представляет собой белок клеточной поверхности, экспрессируемый на некоторых CD4 и CD8 Т клетках; когда он связывается со своими лигандами (В7-1 и В7-2) на антиген-презентирующих клетках, происходит ингибирование активации Т-клеток и эффекторной функции.
В некоторых воплощениях указанный способ инженерии клеток включает по меньшей мере одну из следующих стадий: предоставление Т-клетки, например из культуры клеток или из образца крови; введение в Т-клетку редкощепящей эндонуклеазы, способной избирательно инактивировать один ген, кодирующий белок контрольных точек иммунного ответа, путем расщепления ДНК, предпочтительно путем двуцепочечного разрыва, и размножение клеток. В некоторых воплощениях способ включает: предоставление Т-клетки, например из культуры клеток или из образца крови; трансфекцию указанной Т-клетки нуклеиновой кислотой, кодирующей редкощепящую эндонуклеазу, способную избирательно инактивировать ген, кодирующий белок контрольных точек иммунного ответа, путем расщепления ДНК, предпочтительно путем двуцепочечного разрыва; экспрессию редкощепящих эндонуклеаз в Т-клетках и размножение клеток. В некоторых воплощениях редкощепящая эндонуклеаза специфически нацелена на ген, выбранный из группы, состоящей из: PD-1, CTLA-4, LAG3, Tim3, BTLA, BY55, TIGIT, B7H5, LAIR1, SIGLEC10, 2B4, TCRα и TCRβ. В некоторых воплощениях редкощепящая эндонуклеаза может быть мегануклеазой, нуклеазой с цинковыми пальцами или TALE-нуклеазой. В некоторых воплощениях редкощепящая эндонуклеаза представляет собой TALE-нуклеазу.
В некоторых воплощениях данное изобретение может быть особенно подходящим для аллогенной иммунотерапии. В таких воплощениях клетки могут быть модифицированы способом, включающим: инактивацию по меньшей мере одного гена, кодирующего компонент Т-клеточного рецептора (TCR) в клетках, и размножение Т-клеток. В некоторых воплощениях генетическая модификация согласно способу основана на экспрессии в клетках, предназначенных для инженерии, одной редкощепящей эндонуклеазы, так чтобы редкощепящая эндонуклеаза специфически катализировала расщепление одного целевого гена, таким образом инактивируя целевой ген. В некоторых воплощениях указанный способ инженерии клеток включает по меньшей мере одну из следующих стадий: предоставление Т-клетки, например из культуры клеток или из образца крови; введение в Т-клетку редкощепящей эндонуклеазы, способной избирательно инактивировать по меньшей мере один ген, кодирующий компонент Т-клеточного рецептора (TCR) путем расщепления ДНК, предпочтительно путем двуцепочечного разрыва, и размножение клеток.
В некоторых воплощениях способ включает: предоставление Т-клетки, например из культуры клеток или из образца крови; трансфекцию указанной Т-клетки нуклеиновой кислотой, кодирующей редкощепящую эндонуклеазу, способную избирательно инактивировать по меньшей мере один ген, кодирующий компонент Т-клеточного рецептора (TCR) путем расщепления ДНК, предпочтительно путем двуцепочечного разрыва; экспрессию редкощепящей эндонуклеазы в Т-клетках; сортировку трансформированных Т-клеток, которые не экспрессируют TCR на своей поверхности, и размножение клеток.
В некоторых воплощениях редкощепящая эндонуклеаза может быть мегануклеазой, нуклеазой с цинковыми пальцами или TALE-нуклеазой. В некоторых воплощениях редкощепящая эндонуклеаза представляет собой TALE-нуклеазу. В некоторых воплощениях TALE-нуклеаза распознает и расщепляет последовательность, кодирующую TCRα или TCRβ. В некоторых воплощениях TALE-нуклеаза содержит полипептидную последовательность, выбранную из аминокислотных последовательностей, приведенных в SEQ ID NO: 334, 335, 336, 337, 338, 339, 340 или 341.
Полипептидные последовательности TALE-нуклеазы:
Повтор TRAC_T01-L


Повтор TRAC_T01-R

Повтор TRBC_T01-L

Повтор TRBC_T01-R


Повтор TRBC_T02-L

Повтор TRBC_T02-R

Повтор CD52_T02-L

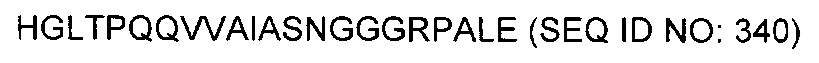
Повтор CD52_T02-R

В другом аспекте одной дополнительной стадией генетической модификации клетки может быть способ размножения Т-клеток, лишенных TCRα, включающий введение в Т-клетку рТα (также известного как пpeTCRα) или его функционального варианта и размножение клеток, возможно посредством стимуляции комплекса CD3. В некоторых воплощениях способ включает: (а) трансфекцию клеток нуклеиновой кислотой, кодирующей по меньшей мере фрагмент рТα для поддержки поверхностной экспрессии CD3; (б) экспрессию указанного рТα в клетках; и (в) размножение клеток, возможно путем стимуляции комплекса CD3.
Также предложены способы подготовки Т-клеток для иммунотерапии, включающие стадии способа размножения Т-клеток. В некоторых воплощениях полинуклеотидная последовательность рТα может быть введена случайным образом или путем гомологичной рекомбинации. В некоторых воплощениях вставка может быть ассоциирована с инактивацией гена TCRα.
Можно применять различные функциональные варианты рТα. «Функциональный вариант» пептида относится к молекуле, существенно схожей либо с целым пептидом, либо с его фрагментом. «Фрагмент» рТα или его функционального варианта, таким образом, относится к любой разновидности молекулы, которая представляет собой пептид, укороченный по сравнению с полноразмерным рТα. В некоторых воплощениях рТα или его функциональные варианты могут, например, быть полноразмерным рТα или версией рТα, усеченной по С-концу. Усеченный по С-концу рТα лишен одного или более остатков на С-конце. В качестве неограничивающих примеров, версия рТα, усеченная по С-концу лишена 18, 48, 62, 78, 92, 110 или 114 остатков на С-конце белка. Варианты аминокислотной последовательности пептида можно получить посредством мутаций ДНК, кодирующей пептид. Такие функциональные варианты включают, например, делеции или вставки или замены остатков в составе аминокислотной последовательности. Любые комбинации делеций, вставок и замен также могут быть осуществлены для получения итоговой конструкции, при условии, что итоговая конструкция обладает необходимой активностью, в частности восстановлением функционального комплекса CD3. В предпочтительном воплощении в различные версии рТα вводят по меньшей мере одну мутацию, как описано выше, для воздействия на димеризацию. В качестве неограничивающего примера, мутированный остаток может быть по меньшей мере W46R, D22A, K24А, R102A или R117A человеческого белка рТα или выровненными с помощью метода CLUSTALW положениями представителя семейства рТα или гомолога. Предпочтительно, рТα или его вариант, как описано выше, содержат мутированный остаток W46R или мутированные остатки D22A, K24А, R102A и R117A. В некоторых воплощениях указанный рТα или варианты также слиты с передающим сигнал доменом, таким как CD28, ОХ40, ICOS, CD27, CD137 (4-1ВВ) и CD8, в качестве неограничивающих примеров. Внеклеточный домен рТα или варианты, как описано выше, могут быть слиты с фрагментом белка TCRα, в частности трансмембранным и внутриклеточным доменом TCRα. Варианты рТα также могут быть слиты с внутриклеточным доменом TCRα.
В некоторых воплощениях версии рТα могут быть слиты с внеклеточным лиганд-связывающим доменом. В некоторых воплощениях рТα или его функциональный вариант слиты с одноцепочечным фрагментом антитела (scFv), содержащим вариабельные фрагменты легкой и тяжелой цепей моноклонального антитела, специфичного к антигену-мишени, соединенные гибким линкером.
Термин «Т-клетка, лишенная TCRα» относится к выделенной Т-клетке, у которой отсутствует экспрессия функциональной цепи TCRα. Этого можно достичь различными способами, в качестве неограничивающих примеров посредством инженерии Т-клетки, в результате которой она бы не экспрессировала какие-либо функциональные TCRα на своей клеточной поверхности или инженерии Т-клетки, в результате которой она бы продуцировала очень мало функциональной цепи TCRα на своей поверхности, или инженерии Т-клетки, в результате которой она бы экспрессировала мутированную или усеченную форму цепи TCRα. Клетки, лишенные TCRα, уже не могут размножаться посредством комплекса CD3. Таким образом, для преодоления указанной проблемы и для обеспечения пролиферации клеток, лишенных TCRα, в клетки вводят рТα или его функциональный вариант, таким образом восстанавливая функциональный комплекс CD3. В некоторых воплощениях способ дополнительно включает введение в указанные Т-клетки редкощепящих эндонуклеаз, способных избирательно инактивировать посредством расщепления ДНК один ген, кодирующий один компонент Т-клеточного рецептора (TCR). В некоторых воплощениях редкощепящая эндонуклеаза представляет собой TALE-нуклеазу.
В другом аспекте подвергнутые инженерии Т-клетки, полученные описанными здесь способами, можно приводить в контакт с биспецифическими антителами. Например, Т-клетки можно приводить в контакт с биспецифическими антителами ex vivo перед введением пациенту или in vivo после введения пациенту. Биспецифические антитела содержат две вариабельные области с различными антигенными свойствами, которые способствуют сближению подвергнутых инженерии клеток с антигеном-мишенью. В качестве неограничивающего примера, биспецифическое антитело может быть направлено против опухолевого маркера и лимфоцитарного антигена, например такого как CDR3, не ограничиваясь им, и обладает способностью переключать и активировать любые циркулирующие Т-клетки против опухолей.
В некоторых воплощениях полинуклеотиды, кодирующие полипептиды по настоящему изобретению, могут представлять собой мРНК, которую вводят непосредственно в клетки, например путем электропорации. В некоторых воплощениях для временной пермеабилизации живых клеток для доставки материала в клетки можно использовать технологию cytoPulse. Параметры можно модифицировать для определения условий для высокой эффективности трансфекции при минимальной клеточной гибели.
В данном документе также предложены способы трансфекции Т-клеток. В некоторых воплощениях способ включает: приведение в контакт Т-клетки с РНК и воздействие на Т-клетку быстрой последовательности импульсов, состоящей из: (а) электрического импульса с напряжением в диапазоне от приблизительно 2250 до 3000 В/см; (б) шириной импульса 0,1 мс; (в) интервалом между электрическими импульсами стадий (а) и (б) приблизительно от 0,2 до 10 мс; (г) электрическим импульсом с напряжением от приблизительно 2250 до 3000 В с шириной импульса приблизительно 100 мс и интервалом между электрическим импульсом стадии (б) и первым электрическим импульсом стадии (в) приблизительно 100 мс; и (д) четырех электрических импульсов напряжением приблизительно 325 В с шириной импульса приблизительно 0,2 мс и интервалом 2 мс между каждым из 4 электрических импульсов. В некоторых воплощениях способ трансфекции Т-клетки включает: приведение в контакт указанной Т-клетки с РНК и воздействие на Т-клетку быстрой последовательности импульсов, включающей: (а) электрический импульс с напряжением приблизительно 2250, 2300, 2350, 2400, 2450, 2500, 2550, 2400, 2450, 2500, 2600, 2700, 2800, 2900 или 3000 В/см; (б) шириной импульса 0,1 мс; (в) интервалом между электрическими импульсами стадий (а) и (б) приблизительно 0,2, 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 мс; (г) одним электрическим импульсом с напряжением в интервале от приблизительно 2250, составляющим 2250, 2300, 2350, 2400, 2450, 2500, 2550, 2400, 2450, 2500, 2600, 2700, 2800, 2900 или 3000 В с шириной импульса приблизительно 100 мс и интервалом между электрическим импульсом стадии (б) и первым электрическим импульсом стадии (в) приблизительно 100 мс; и (д) четырех электрических импульсов напряжением приблизительно 325 В с шириной импульса приблизительно 0,2 мс и интервалом приблизительно 2 мс между каждым из 4 электрических импульсов. Любые значения, входящие в диапазон, описанный выше, раскрыты в данной заявке. Средой для электропорации может быть любая подходящая среда, известная в области техники. В некоторых воплощениях среда для электропорации имеет электропроводность в диапазоне от приблизительно 0,01 до приблизительно 1,0 миллисименс.
В некоторых воплощениях, в качестве неограничивающих примеров, РНК кодирует редкощепящую эндонуклеазу, один мономер редкощепящей эндонуклеазы, такой как полу-TALE-нуклеаза, CAR, по меньшей мере один компонент многоцепочечного химерного антигенного рецептора, рТα или его функциональный вариант, экзогенную нуклеиновую кислоту и/или один дополнительный каталитический домен.
Иммунные клетки, подвергнутые инженерии
В изобретении также предложены подвергнутые инженерии иммунные клетки, содержащие любой из полинуклеотидов CAR, описанных в данном документе. В некоторых воплощениях CAR может быть введен в иммунную клетку как трансген с помощью плазмидного вектора. В некоторых воплощениях плазмидный вектор также содержит, например, маркер селекции, который обеспечивает идентификацию и/или селекцию клеток, которые получили вектор.
Полипептиды CAR могут быть синтезированы in situ в клетке после введения в клетку полинуклеотидов, кодирующих полипептиды CAR. В альтернативном варианте полипептиды CAR могут быть получены за пределами клетки, а затем введены в клетки. Способы введения в клетки полинуклеотидной конструкции хорошо известны в области техники. В некоторых воплощениях для интеграции полинуклеотидной конструкции в геном клетки можно применять способы стабильной трансформации. В других воплощениях можно применять способы транзиторной трансформации для транзиторной экспрессии полинуклеотидной конструкции, а полинуклеотидную конструкцию не интегрировать в геном клетки. В других воплощениях можно использовать опосредованные вирусами методы. Полинуклеотиды можно вводить в клетку любым подходящим способом, например таким как рекомбинантные вирусные векторы (например, ретровирусы, аденовирусы), липосомы и т.п. Способы транзиторной трансформации включают, например, микроинъекцию, электропорацию или бомбардировку микрочастицами, но не ограничиваются ими. Полинуклеотиды можно включать в векторы, например такие как плазмидные векторы или вирусные векторы.
Также в документе предложены выделенные клетки и клеточные линии, полученные описанными выше способами инженерии клеток, изложенными в данном документе. В некоторых воплощениях выделенная клетка содержит по меньшей мере один CAR, описанный выше. В некоторых воплощениях выделенная клетка содержит популяцию CAR, где каждый CAR содержит различные внеклеточные лиганд-связывающие домены.
Также в документе предложены выделенные иммунные клетки, полученные любым из описанных выше способов. Для экспрессии CAR, представляющего интерес, можно использовать любую иммунную клетку, способную экспрессировать гетерологичную ДНК. В некоторых воплощениях иммунная клетка представляет собой Т-клетку. В некоторых воплощениях иммунная клетка может иметь происхождение, например, без ограничения, от стволовой клетки. Стволовые клетки могут быть стволовыми клетками взрослого, эмбриональными стволовыми клетками, не являющимися человеческими, более конкретно стволовыми клетками, не являющимися человеческими, стволовыми клетками пуповинной крови, клетками-предшественниками, стволовыми клетками костного мозга, индуцированными плюрипотентными стволовыми клетками, тотипотентными стволовыми клетками или гемопоэтическими стволовыми клетками. Репрезентативными человеческими клетками являются CD34+ клетки. Выделенная клетка также может быть дендритной клеткой, киллерной дендритной клеткой, тучной клеткой, NK-клеткой, В-клеткой или Т-клеткой, выбранной из группы, состоящей из Т-лимфоцитов воспаления, цитотоксических Т-лимфоцитов, регуляторных Т-лимфоцитов или хелперных Т-лимфоцитов. В некоторых воплощениях клетка может иметь происхождение из группы, состоящей из CD4+ Т-лимфоцитов и CD8+ Т-лимфоцитов.
Перед размножением и генетической модификацией от субъекта может быть получен источник клеток с помощью различных способов, не являющихся ограничивающими. Клетки могут быть получены из ряда источников, не являющихся ограничивающими, включая мононуклеарные клетки периферической крови, костный мозг, ткань лимфоузлов, пуповинную кровь, ткань тимуса, ткань из очага инфекции, асциты, плевральный выпот, ткань селезенки и опухоли. В некоторых воплощениях можно использовать любое количество доступных и известных специалистам линий Т-клеток. В некоторых воплощениях клетки могут иметь происхождение от здорового донора, от пациента с диагностированным раком или у пациента с диагностированной инфекцией. В некоторых воплощениях клетки могут быть частью смешанной популяции клеток, которые демонстрируют различные фенотипические характеристики.
Также в данном документе предложены клеточные линии, полученные из трансформированной Т-клетки согласно любому из описанных выше способов. Также предложены модифицированные клетки, резистентные к иммуносупрессивной терапии. В некоторых воплощениях выделенная клетка по изобретению содержит полинуклеотид, кодирующий CAR.
Иммунные клетки по изобретению могут быть активированы и размножены, до или после генетической модификации Т-клеток, с использованием способов, описанных, например, без ограничения, в патентах США 6352694; 6534055; 6905680; 6692964; 5858358; 6887466; 6905681; 7144575; 7067318; 7172869; 7232566; 7175843; 5883223; 6905874; 6797514; 6867041; и заявке на патент США 20060121005. Т-клетки могут быть размножены in vitro или in vivo. Обычно Т-клетки по изобретению можно размножать, например, путем приведения в контакт с антигеном, стимулирующим комплекс CD3 TCR и костимулирующую молекулу на поверхности Т-клеток, для создания активирующего сигнала для Т-клетки. Например, для создания активирующего сигнала для Т-клетки можно использовать такие химические агенты, как кальциевый ионофор А23187, форбол 12-миристат 13-ацетат (РМА) или митогенные лектины, такие как фитогемагглютинин (РНА).
В некоторых воплощениях популяции Т-клеток можно стимулировать in vitro путем приведения в контакт, например, с анти-CD3 антителом или его антигенсвязывающим фрагментом, или анти-CD2 антителом, иммобилизованным на поверхности, или путем приведения в контакт с активатором протеинкиназы С (например, бриостатином), вместе с кальциевым ионофором. Для костимуляции вспомогательной молекулы на поверхности Т-клеток используют лиганд, который связывается со вспомогательной молекулой. Например, популяция Т-клеток может быть приведена в контакт с антителом к CD3 или антителом к CD28, в условиях, подходящих для стимуляции пролиферации Т-клеток. Условия, подходящие для культуры Т-клеток, включают соответствующую среду (например, минимальную основную среду или среду RPMI 1640 или X-vivo 5, (Lonza)), которая может содержать факторы, необходимые для пролиферации и жизнеспособности, включая сыворотку (например, эмбриональную телячью или человеческую сыворотку), интерлейкин-2 (IL-2), инсулин, IFN-γ (интерферон-γ), IL-4, IL-7, GM-CSF (гранулоцитарно-макрофагальный колониестимулирующий фактор), IL-10, IL-2, IL-15, TGFp (трансформирующий фактор роста р) и TNF (фактор некроза опухоли), или любые другие добавки для роста клеток, известные специалистам в области техники. Другие добавки для роста клеток включают поверхностно-активное вещество, плазманат и восстанавливающие агенты, такие как N-ацетил-цистеин и 2-меркаптоэтанол, но не ограничиваются ими. Среда может включать RPMI 1640, A1M-V, DMEM, MEM, a- MEM, F-12, X-Vivo 1 и X-Vivo 20, Optimizer, с добавленными аминокислотами, пируватом натрия и витаминами, либо бессывороточную, либо с добавлением надлежащего количества сыворотки (или плазмы) или определенного набора гормонов и/или определенного количества цитокинов, достаточных для роста и размножения Т-клеток. Антибиотики, например пенициллин и стрептомицин, добавляют только к экспериментальным культурам, но не к культурам клеток, предназначенных для инфузии субъекту. Целевые клетки поддерживают в условиях, необходимых для поддерживания роста, например при соответствующей температуре (например, 37°С) и в соответствующей атмосфере (например, воздух плюс 5% CO2). Т-клетки, которые подверглись стимуляции в течение различного времени, могут демонстрировать различные характеристики.
В некоторых воплощениях клетки по изобретению можно размножать путем совместного культивирования с тканями или клетками. Клетки также можно размножать in vivo, например в крови человека после введения клеток человеку.
В некоторых воплощениях выделенная клетка по данному изобретению содержит один инактивированный ген, выбранный из группы, состоящей из CD52, GR, PD-1, CTLA-4, LAG3, Tim3, BTLA, BY55, TIGIT, В7Н5, LAIR1, SIGLEC10, 2В4, HLA, TCRα и TCRβ, и/или экспрессирует CAR, многоцепочечный CAR и/или трансген рТα. В некоторых воплощениях выделенная клетка содержит полинуклеотид, кодирующий полипептиды, содержащие многоцепочечный CAR. В некоторых воплощениях выделенная клетка по данному изобретению содержит два инактивированных гена, выбранных из группы, состоящей из: CD52 и GR, CD52 и TCRα, CDR52 и TCRβ, GR и TCRα, GR и TCRβ, TCRα и TCRβ, PD-1 и TCRα, PD-1 и TCRβ, CTLA-4 и TCRα, CTLA-4 и TCRβ, LAG3 и TCRα, LAG3 и TCRβ, Tim3 и TCRα, Tim3 и TCRβ, BTLA и TCRα, BTLA и TCRβ, BY55 и TCRα, BY55 и TCRβ, TIGIT и TCRα, TIGIT и TCRβ, B7H5 и TCRα, B7H5 и TCRβ, LAIR1 и TCRα, LAIR1 и TCRβ, SIGLEC10 и TCRα, SIGLEC10 и TCRβ, 2B4 и TCRα, 2B4 и TCRβ и/или экспрессирует CAR, многоцепочечный CAR и/или трансген pTα.
В некоторых воплощениях TCR в клетках по изобретению делают нефункциональным в результате инактивации гена(ов) TCRα и/или TCRβ. В некоторых воплощениях предложен способ получения модифицированных клеток, имеющих происхождение из индивидуума, где клетки могут пролиферировать независимо от сигнального пути главного комплекса гистосовместимости (МНС). Модифицированные клетки, которые могут пролиферировать независимо от сигнального пути МНС, пригодные для получения данным способом, входят в объем данного изобретения. Модифицированные клетки, раскрытые в данном описании, можно применять для лечения пациентов, нуждающихся в лечении реакции отторжения трансплантата хозяином (HvG) и болезни трансплантат против хозяина (GvHD); таким образом, в объем данного изобретения входит способ лечения пациентов, которым необходимо лечение реакции отторжения трансплантата хозяином (HvG) и болезни трансплантат против хозяина (GvHD), включающий лечение указанных пациентов посредством введения указанным пациентам эффективного количества модифицированных клеток, содержащих инактивированные гены TCRα и/или TCRβ.
В некоторых воплощениях иммунные клетки подвергнуты инженерии, чтобы быть резистентными к одному или более химиотерапевтическим лекарственным средствам. Химиотерапевтическим лекарственным средством может быть, например, аналог пуринового нуклеотида (PNA), что делает иммунную клетку подходящей для лечения рака, сочетающего адоптивную иммунотерапию и химиотерапию. Примеры PNA включают, например, клофарабин, флударабин и цитарабин, в отдельности или в комбинации. Дезоксицитидинкиназа (dCK) метаболизирует PNA в моно-, ди- и трифосфат-PNA. Их трифосфатные формы конкурируют с АТФ за синтез ДНК, действуют как проапоптотические агенты и являются мощными ингибиторами рибонуклеотидредуктазы (RNR), которая принимает участие в образовании тринуклеотидов. В данном документе предложены ВСМА-специфические CAR-Т клетки, содержащие инактивированный ген dCK. В некоторых воплощениях клетки с нокаутом dCK получают путем трансфекции Т-клеток с использованием полинуклеотидов, кодирующих специфическую TAL-нуклеазу, направленную против генов dCK, например, путем электропорации мРНК. ВСМА-специфические CAR-T клетки с нокаутом dCK являются резистентными к PNA, включая, например, клофарабин и/или флударабин, и сохраняют Т-клеточную цитотоксическую активность в отношении клеток, экспрессирующих ВСМА.
В некоторых воплощениях выделенные клетки или клеточные линии по изобретению могут содержать рТα или его функциональный вариант. В некоторых воплощениях выделенная клетка или клеточная линия может быть дополнительно генетически модифицирована путем инактивации гена TCRα.
В некоторых воплощениях CAR-T клетка содержит полинуклеотид, кодирующий суицидальный полипептид, например такой как RQR8. См., например, WO 2013153391A, содержание которого включено во всей полноте путем ссылки. В CAR-T клетках, содержащих полинуклеотид, суицидальный полипептид экспрессируется на поверхности CAR-T клетки. В некоторых воплощениях суицидальный полипептид содержит аминокислотную последовательность, приведенную в SEQ ID NO: 342.

Суицидальный полипептид может также содержать сигнальный пептид на амино-конце. В некоторых воплощениях суицидальный полипептид содержит аминокислотную последовательность, приведенную в SEQ ID NO: 400.
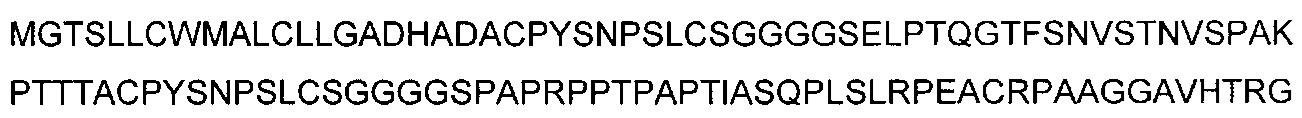
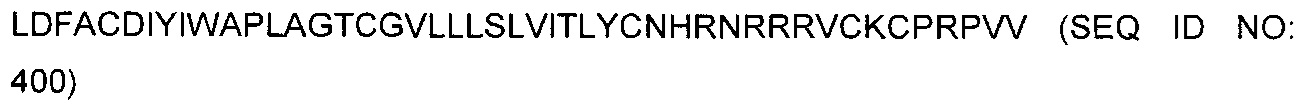
Когда суицидальный полипептид экспрессируется на поверхности CAR-T клетки, связывание ритуксимаба с R эпитопами полипептида вызывает лизис клетки. С полипептидом, экспрессируемым на клеточной поверхности, может связываться более одной молекулы ритуксимаба. Каждый R эпитоп полипептида может связываться с отдельной молекулой ритуксимаба. Элиминация ВСМА-специфических CAR-T клеток может происходить in vivo, например, при введении пациенту ритуксимаба. Решение элиминировать перенесенные клетки может быть принято вследствие нежелательных явлений, зарегистрированных у пациента, которые связывают с переносом клеток, например когда детектируют неприемлемый уровень токсичности.
В некоторых воплощениях CAR-T клетка содержит выбранный эпитоп в составе scFv, имеющий специфичность, которая распознается специфическим антителом. См., например, заявку РСТ "mAb-DRIVEN CHIMERIC ANTIGEN RECEPTOR SYSTEMS FOR SORTING/DEPLETING ENGINEERED IMMUNE CELLS," поданную 25 января 2016, содержание которой включено в данное описание во всей полноте путем ссылки. Такой эпитоп облегчает сортировку и/или элиминацию CAR-T клеток. Эпитоп может быть выбран из большого количества эпитопов, известных в области техники. В некоторых воплощениях эпитоп может быть мишенью моноклонального антитела, одобренного для медицинского применения, например такого как эпитоп CD20, распознаваемый ритуксимабом, не ограничиваясь им. В некоторых воплощениях эпитоп содержит аминокислотную последовательность, приведенную в SEQ ID NO: 397.

В некоторых воплощениях эпитоп находится в составе CAR. Например, без ограничения, эпитоп может располагаться между scFv и шарнирной областью CAR. В некоторых воплощениях в CAR могут использоваться два экземпляра одного и того же эпитопа, разделенные линкерами. Например, в CAR может использоваться полипептид, содержащий аминокислотную последовательность, приведенную в SEQ ID NO: 398, расположенный между вариабельной областью легкой цепи и шарнирной областью.

В некоторых воплощениях специфическое в отношении эпитопа антитело может быть конъюгировано с цитотоксическим лекарственным средством. Также можно вызвать CDC(комплемент-зависимую)-цитотоксичность, используя подвергнутые инженерии антитела, на которые пересажен(ы) компонент(ы) системы комплемента. В некоторых воплощениях активацию CAR-T клеток можно регулировать путем элиминации клеток с использованием антитела, распознающего эпитоп.
Терапевтические применения
Выделенные клетки, полученные описанными выше способами, или клеточные линии, полученные от таких выделенных клеток, можно применять в качестве лекарственного средства. В некоторых воплощениях такое лекарственное средство можно применять для лечения рака. В некоторых воплощениях рак представляет собой множественную миелому, злокачественную неоплазию плазматических клеток, лимфому Ходжкина, нодулярную лимфому Ходжкина с лимфоцитарным преобладанием, болезнь Калера и миеломатоз, плазмоклеточный лейкоз, плазмоцитому, В-клеточный пролимфоцитарный лейкоз, волосатоклеточный лейкоз, В-клеточную неходжкинскую лимфому (NHL), острый миелоидный лейкоз (AML), хронический лимфоцитарный лейкоз (CLL), острый лимфоцитарный лейкоз (ALL), хронический миелоидный лейкоз (CML), фолликулярную лимфому, лимфому Беркитта, лимфому маргинальной зоны, лимфому из клеток зоны мантии, крупноклеточную лимфому, В-лимфобластную лимфому из клеток-предшественников, миелолейкоз, макроглобулинемию Вальденстрема, диффузную крупноклеточную В-клеточную лимфому, фолликулярную лимфому, лимфому маргинальной зоны, лимфому из лимфоидной ткани, ассоциированной со слизистыми оболочками, мелкоклеточную лимфоцитарную лимфому, лимфому из клеток зоны мантии, лимфому Беркитта, первичную медиастинальную (тимическую) В-клеточную крупноклеточную лимфому, лимфоплазмоцитарную лимфому, макроглобулинемию Вальденстрема, узловую В-клеточную лимфому из клеток маргинальной зоны, лимфому маргинальной зоны селезенки, внутрисосудистую В-крупноклеточную лимфому, первичную выпотную лимфому, лимфогранулематоз, В-клеточную лимфому с большим количеством Т-клеток/гистиоцитов, первичную лимфому центральной нервной системы, первичную кожную диффузную В-крупноклеточную лимфому (тип нижних конечностей), EBV-положительную диффузную В-крупноклеточную лимфому пожилых, диффузную В-крупноклеточную лимфому, ассоциированную с воспалением, внутрисосудистую В-крупноклеточную лимфому, ALK-положительную В-крупноклеточную лимфому, плазмобластную лимфому, В-крупноклеточную лимфому, возникающую на фоне HHV8-ассоциированной мультицентрической болезни Кастлемана, неклассифицированную В-клеточную лимфому с признаками, промежуточными между диффузной В-крупноклеточной лимфомой и лимфомой Беркитта, неклассифицированную В-клеточную лимфому с признаками, промежуточными между диффузной В-крупноклеточной лимфомой и классической лимфомой Ходжкина, и другие лимфомы, связанные с В-клетками.
В некоторых воплощениях выделенную клетку по изобретению или клеточную линию, имеющую происхождение от выделенных клеток, можно использовать в изготовлении лекарственного средства для лечения рака у пациента, которому это необходимо.
В данном документе также предложены способы лечения пациентов. В некоторых воплощениях способ включает предоставление иммунной клетки по изобретению пациенту, которому это необходимо. В некоторых воплощениях способ включает стадию введения трансформированных иммунных клеток по изобретению пациенту, которому это необходимо.
В некоторых воплощениях может иметь место массивное размножение Т-клеток по изобретению и их существование в течение продолжительного периода времени.
Способы лечения по изобретению могут уменьшать интенсивность заболевания, излечивать заболевание или предупреждать заболевание. Способ по изобретению может быть либо частью аутологичной иммунотерапии, либо частью аллогенного иммунотерапевтического лечения. Изобретение является особенно подходящим для аллогенной иммунотерапии. Т-клетки от доноров можно трансформировать в не-аллореактивные клетки с помощью стандартных протоколов и воспроизводить по мере необходимости, таким образом получая CAR-T клетки, которые можно вводить одному или нескольким пациентам. Такая терапия CAR-T клетками может стать доступным готовым к применению терапевтическим продуктом.
Клетки, которые можно применять с изложенными способами, описаны в предыдущем разделе. Терапию можно применять для лечения пациентов, у которых, например, диагностирован рак. Виды рака, лечение которых можно осуществлять, включают, например, виды рака с вовлечением В лимфоцитов, включая любой из указанных выше видов рака, но не ограничиваются ими. Типы рака, подлежащие лечению посредством CAR и CAR-T клеток по изобретению включают определенные лейкозные или лимфоидные злокачественные новообразования, но не ограничиваются ими. В объем изобретения также входят опухоли/виды рака взрослых и опухоли/виды рака детей. В некоторых воплощениях лечение можно осуществлять в комбинации с одной или более противораковыми терапиями, выбранными из группы терапии антителами, химиотерапии, терапии цитокинами, терапии дендритными клетками, генной терапии, гормональной терапии, лазерной терапии и лучевой терапии.
В некоторых воплощениях лечение можно вводить пациентам, проходящим иммуносупрессивное лечение. Действительно, изобретение преимущественно основано на использовании клеток или популяции клеток, которые были сделаны устойчивыми по меньшей мере к одному иммуносупрессивному агенту в результате инактивации гена, кодирующего рецептор такого иммуносупрессивного агента. В связи с этим иммуносупрессивное лечение должно способствовать селекции и размножению Т-клеток по изобретению в организме пациента. Введение клеток или популяции клеток по изобретению можно осуществлять любым удобным способом, включая аэрозольную ингаляцию, инъекцию, пероральный прием, трансфузию, имплантацию или трансплантацию. Композиции, описанные в данном документе, можно вводить пациенту подкожно, путем интрадермальной, внутриопухолевой, внутриузловой, интрамедуллярной, внутримышечной, внутривенной или внутрилимфатической инъекции, или внутрибрюшинно. В одном воплощении клеточные композиции по изобретению предпочтительно вводят путем внутривенной инъекции.
В некоторых воплощениях введение клеток или популяции клеток может включать введение, например, от приблизительно 104 до приблизительно 109 клеток на кг массы тела, включая все целые значения числа клеток, входящие в данный диапазон. В некоторых воплощениях введение клеток или популяции клеток может включать введение, например, от приблизительно 105 до приблизительно 106 клеток на кг массы тела, включая все целые значения числа клеток, входящие в данный диапазон. Клетки или популяцию клеток можно вводить в одной дозе или нескольких дозах. В некоторых воплощениях указанное эффективное количество клеток можно вводить в виде однократной дозы. В некоторых воплощениях указанное эффективное количество клеток можно вводить в виде более чем одной дозы в течение периода времени. Сроки введения находятся в компетенции лечащего врача и зависят от клинического состояния пациента. Клетки или популяцию клеток можно получать из любого источника, такого как банк крови или донор. При том, что индивидуальные потребности различаются, определение оптимальных диапазонов эффективного количества определенного типа клеток для конкретного заболевания или состояния известно в уровне техники. Эффективное количество означает количество, которое обеспечивает лечебный или профилактический эффект. Вводимая доза будет зависеть от возраста, состояния здоровья и массы тела реципиента, вида сопутствующего лечения при его наличии и интенсивности лечения и природы желаемого эффекта. В некоторых воплощениях эффективное количество клеток или композиции, включающей указанные клетки, вводят парентерально. В некоторых воплощениях введение может представлять собой внутривенное введение. В некоторых воплощениях введение можно осуществлять непосредственно путем инъекции в опухоль.
В некоторых воплощениях изобретения клетки вводят пациенту в сочетании (например, до, одновременно или после) с любым числом подходящих способов лечения, включая лечение такими агентами, как терапия моноклональными антителами, антагонистом CCR2 (рецептор хемокинов с СС-мотивом 2) (например, INC-8761), противовирусная терапия, терапия цидофовиром и интерлейкином-2, лечение цитарабином (также известным как ARA-C) или натализумабом пациентов с MS (рассеянным склерозом) или лечение эфализумабом пациентов с псориазом или другие лечения PML (прогрессивной мультифокальной лейкоэнцефалопатии), но не ограничиваясь указанными агентами. В некоторых воплощениях ВСМА-специфические CAR-T клетки вводят пациенту в сочетании с одним или более из следующего: анти-PD-1 антителом (например, ниволумабом, пембролизумабом или PF-06801591), анти-PD-LI антителом (например, авелумабом, атезолизумабом или дурвалумабом), анти-ОХ40 антителом (например, PF-04518600), анти-4-1 ВВ антителом (например, PF-05082566), анти-MCSF антителом (например, PD-0360324), анти-GITR антителом и/или анти-TIGIT антителом. В некоторых воплощениях ВСМА-специфический CAR, содержащий аминокислотную последовательность, приведенную в SEQ ID NO: 396, вводят пациенту в сочетании с анти-PD-L1 антителом авелумабом. В следующих воплощениях Т-клетки по изобретению можно применять в комбинации с химиотерапией, лучевой терапией, иммуносупрессивными агентами, такими как циклоспорин, азатиоприн, метотрексат, микофенолят и FK506, антителами или другими иммунодеструктивными агентами, такими как САМРАТН, анти-CD3 антителами или терапией другими антителами, цитоксином, флударабином, циклоспорином, FK506, рапамицином, микофеноловой кислотой, стероидами, FR901228, цитокинами и/или облучением. Эти лекарственные препараты либо ингибируют кальций-зависимую фосфатазу кальциневрин (циклоспорин и FK506), либо ингибируют киназу p70S6, которая важна для сигнальных путей, индуцированных факторами роста (рапамицин) (Henderson, Naya et al. 1991; Liu, Albers et al. 1992; Bierer, Hollander et al. 1993). В дополнительном воплощении клеточные композиции по изобретению вводят пациенту в сочетании (например, до, одновременно или после) с трансплантацией костного мозга, терапией, разрушающей Т-клетки с использованием или химиотерапевтических агентов, таких как флударабин, наружной дистанционной лучевой терапии (XRT), циклофосфамида, или антителами, такими как ОКТ3 или САМРАТН. В некоторых воплощениях клеточные композиции по изобретению вводят после терапии, разрушающей В-клетки, такой как агенты, реагирующие с CD20, например, ритуксан. Например, в одном воплощении субъекты могут проходить стандартное лечение высокодозовой химиотерапией с последующей трансплантацией стволовых клеток периферической крови. В некоторых воплощениях после трансплантации субъекты получают инфузию размноженных иммунных клеток по изобретению. В некоторых воплощениях размноженные клетки вводят до или после хирургического вмешательства.
Наборы
В изобретении также предложены наборы для применения в указанных способах. Наборы по изобретению включают один или более контейнеров, содержащих полинуклеотид, кодирующий ВСМА-специфический CAR, или подвергнутую инженерии иммунную клетку, содержащую полинуклеотид, кодирующий ВСМА-специфический CAR, описанный в данном документе, и инструкции для применения в соответствии с любым из способов по изобретению, описанных в данном документе. Как правило, эти инструкции содержат описание введения генно-модифицированной иммунной клетки для описанных выше терапевтических воздействий.
Инструкции, относящиеся к применению подвергнутых инженерии иммунных клеток, описанных в данном документе, обычно включают информацию о дозировке, схеме дозирования и пути введения для намеченного лечения. Контейнеры могут представлять собой единичные дозы, объемные упаковки (например многодозовые упаковки) или суб-единичные дозы. Инструкции, входящие в наборы по изобретению, обычно представляют собой инструкции, напечатанные на этикетке или листовке-вкладыше (например, листе бумаги, включенном в набор), но также являются допустимыми машиночитаемые инструкции (например, инструкции на магнитном или оптическом диске для хранения данных).
Наборы по изобретению находятся в подходящей упаковке. Подходящая упаковка включает флаконы, бутыли, банки, гибкую упаковку (например, запаянные майларовые или пластмассовые упаковки), но не ограничивается ими. Также предусмотрены упаковки для применения в комбинации со специализированным устройством, таким как ингалятор, устройством для назального введения (например, пульверизатором) или устройством для инфузии, таким как мининасос. Набор может иметь отверстие для стерильного доступа (например, контейнер может представлять собой пакет с раствором для внутривенного введения или флакон с пробкой, которую можно проткнуть иглой для подкожных инъекций). Контейнер также может иметь отверстие для стерильного доступа (например, контейнер может представлять собой пакет с раствором для внутривенного введения или флакон с пробкой, которую можно проткнуть иглой для подкожных инъекций). По меньшей мере один активный ингредиент в композиции представляет собой антитело к ВСМА. Контейнер может дополнительно содержать второй фармацевтически активный агент.
Наборы могут возможно включать дополнительные компоненты, такие как буферы, и пояснительную информацию. Как правило, набор включает контейнер и этикетку или вкладыш(и), которые находятся на контейнере или ассоциированы с ним.
Следующие примеры предложены исключительно для иллюстративных целей и не должны рассматриваться как ограничивающие объем изобретения каким-либо образом. На основании приведенного описания специалистам в области техники будут очевидны различные модификации изобретения, помимо тех, что приведены и описаны в данном документе, которые также входят в объем приложенной формулы изобретения.
Репрезентативные материалы по данному изобретению были депонированы в Американской коллекции типовых культур (АТСС) 9 февраля 2016 г. Биологический материал, депонированный в АТСС под номером PTA-122834, представляет собой вектор, содержащий полинуклеотид, кодирующий ВСМА-специфический CAR. Депонирование осуществили в соответствии с Будапештским договором о международном признании депонирования микроорганизмов для целей патентной процедуры (Будапештским договором). Это гарантирует сохранность жизнеспособной культуры в депозитарии в течение 30 лет со дня депонирования. АТСС обеспечит доступ к депонированным культурам и материалам согласно условиям Будапештского договора и в соответствии с соглашением между Pfizer, Inc. и АТСС, обеспечивающим постоянный и неограниченный доступ к потомству депонированной культуры после выдачи соответствующего патента США или после опубликования любой соответствующей заявки на патент США или на патент другого государства, вне зависимости от того, какое из этих условий будет выполнено раньше, и обеспечит доступ к потомству для лица, право которого на доступ определено комиссаром по патентам и товарным знакам США согласно статье 122 раздела 35 Свода законов США и соответствующим ей нормативным актам, регулирующим деятельность комиссаров ((включая Раздел 1.14 37 C.F.R. (Свод федеральных правил США) с особой ссылкой на 886 OG 638).
Правопреемник настоящей заявки согласен, что, если депонированные культуры или материалы погибнут либо будут утрачены или разрушены при культивировании в подходящих условиях, они будут немедленно заменены другими образцами такой же культуры или материала по уведомлении. Доступность депонированного материала не следует рассматривать как лицензию на практическое использование изобретения в нарушение прав, предоставленных органами власти любых государств согласно их патентным законам.
Примеры
Пример 1: Определение кинетики и аффинности взаимодействия BCMA/IgG человека при 25°С и/или 37°С
В данном примере определяли кинетику и аффинность различных антител к ВСМА при 25°С и 37°С.
Все эксперименты выполняли на биосенсоре Bio-Rad Proteon XPR36 (Bio-Rad, Hercules, CA), действие которого основано на поверхностном плазмонном резонансе. Панель антител к ВСМА на сенсор-чипе Bio-Rad GLC получили, используя технологию аминого сочетания, аналогично описанию Abdiche, et al., Anal. Biochem. 411, 139-151 (2011). При выполнении анализа температура в ходе иммобилизации составляла 25°С, а проточный буфер представлял собой HBS-T+ (10 мМ HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота), 150 мМ NaCl, 0,05% Tween-20, рН 7,4). Проточные ячейки активировали в направлении пропускания аналита (горизонтальном) путем инъекции смеси 1 мМ ECD и 0,25 мМ NHS (N-гидроксисукцинимид) в течение 3 минут при скорости тока 30 мкл/мин. IgG иммобилизовали в активированных зонах путем инъекции их в направлении пропускания лиганда (вертикальном) при 20 мкг/мл в 10 мМ ацетатном буфере при рН 4,5 в течение 1,5 минут при 30 мкг/мл. Активированные поверхности блокировали путем инъекции 1М этаноламина, рН 8,5 в направлении пропускания аналита в течение 3 минут при 30 мкл/мин.
При выполнении анализа связывания ВСМА температура составляла 37°С и 25°С в проточном буфере HBS-T+ с добавлением 1 мг/мл BSA (бычий сывороточный альбумин). Для анализа взаимодействия использовали метод кинетического титрования, описанный Abdiche, et al. Аналит, представлявший собой ВСМА человека (huBCMA) или ВСМА яванского макака (суВСМА) инжектировали в направлении пропускания аналита, осуществляя серию инъекций от низкой к высокой концентрации. Использовали концентрации 0,08 нМ, 0,4 нМ, 2 нМ, 10 нМ и 50 нМ (серии по 5 инъекций с 5-кратным разведением и максимальной концентрацией 50 нМ). Время ассоциации для заданного разведения аналита составляло две минуты. Немедленно после инъекции 50 нМ ВСМА начинали отслеживать диссоциацию в течение 2 часов. Перед инъекциями аналита ВСМА инжектировали буфер 5 раз, используя аналогичные время ассоциации и диссоциации в циклах аналита ВСМА для получения холостой сенсограммы для двойного контроля (двойной контроль, как описано Myszka, J. Mol. Recognit. 12, 279-284 (1999).
Сенсограммы подвергали двойному контолю и аппроксимировали моделью Ленгмюра 1:1 с учетом массопереноса, используя программу BIAevaluation версии 4.1.1 (GE Lifesciences, Piscataway, NJ). Параметры кинетики и аффинности для различных антител против ВСМА по изобретению приведены в Таблицах 4А-4В. Антитела, приведенные в Таблицах 4А-4В имеют одинаковые области VH и VL, как и CAR с аналогичными названиями, приведенные в Таблице 1.
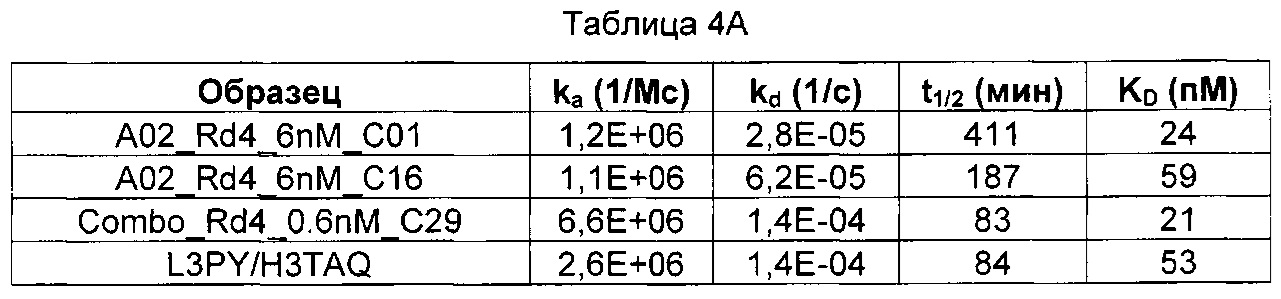
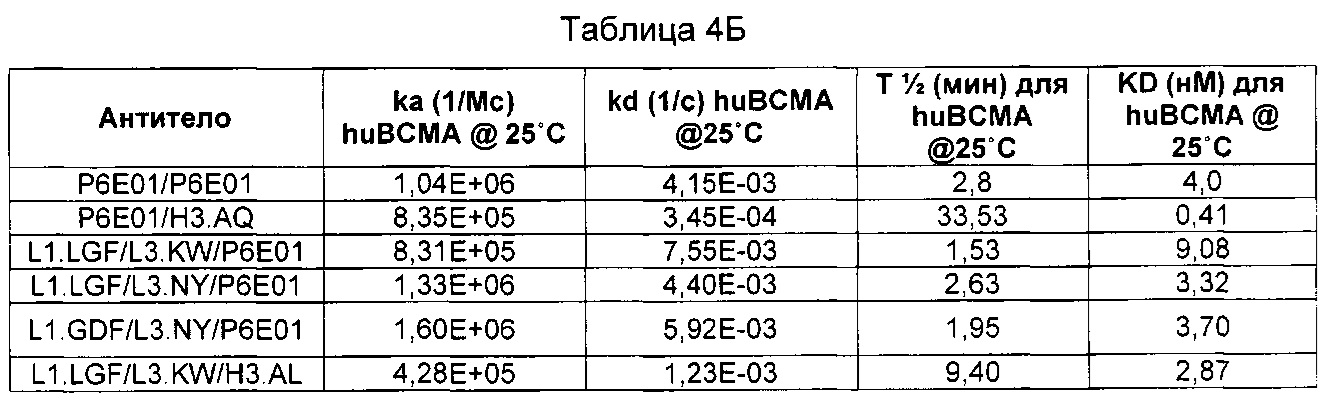
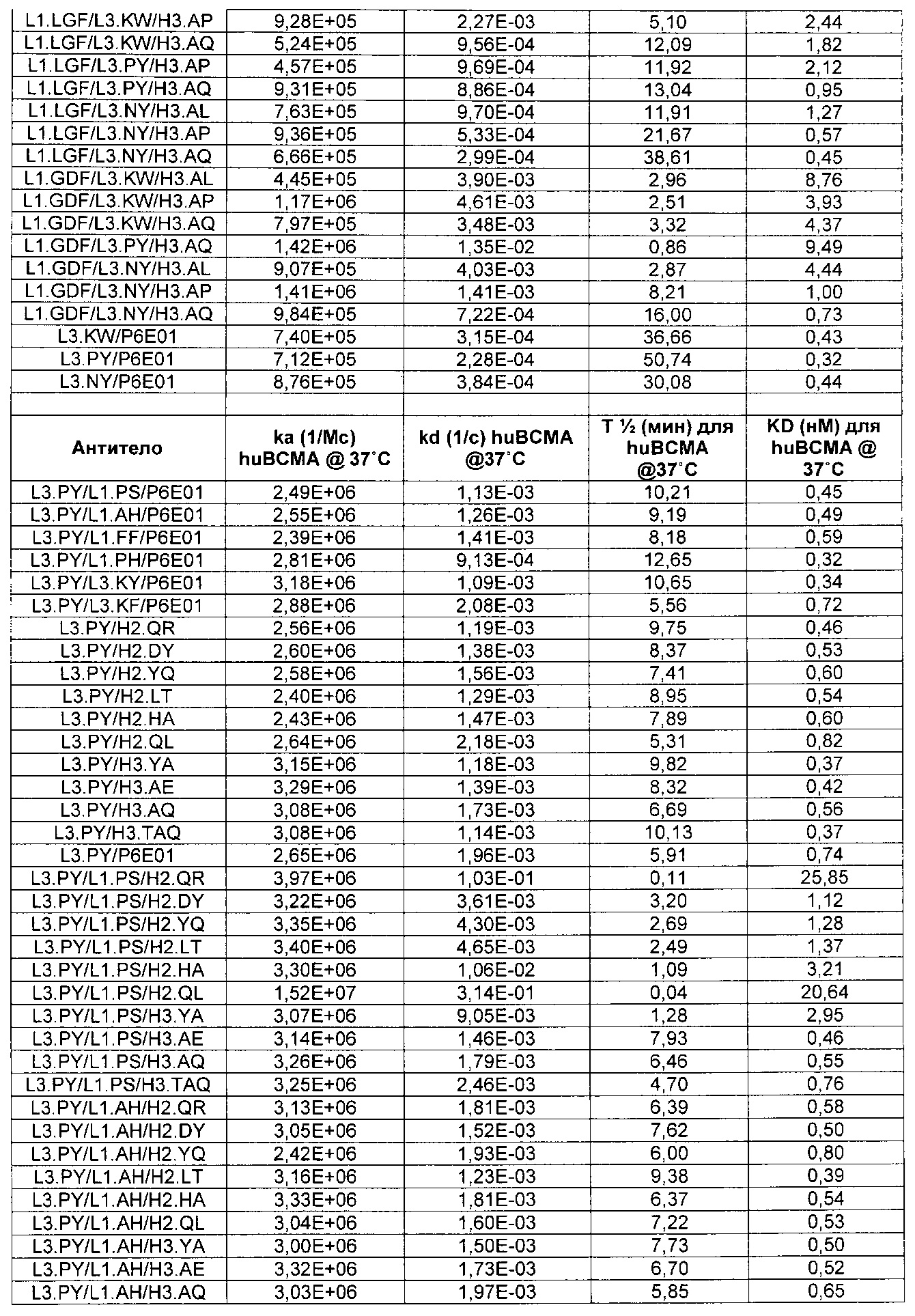
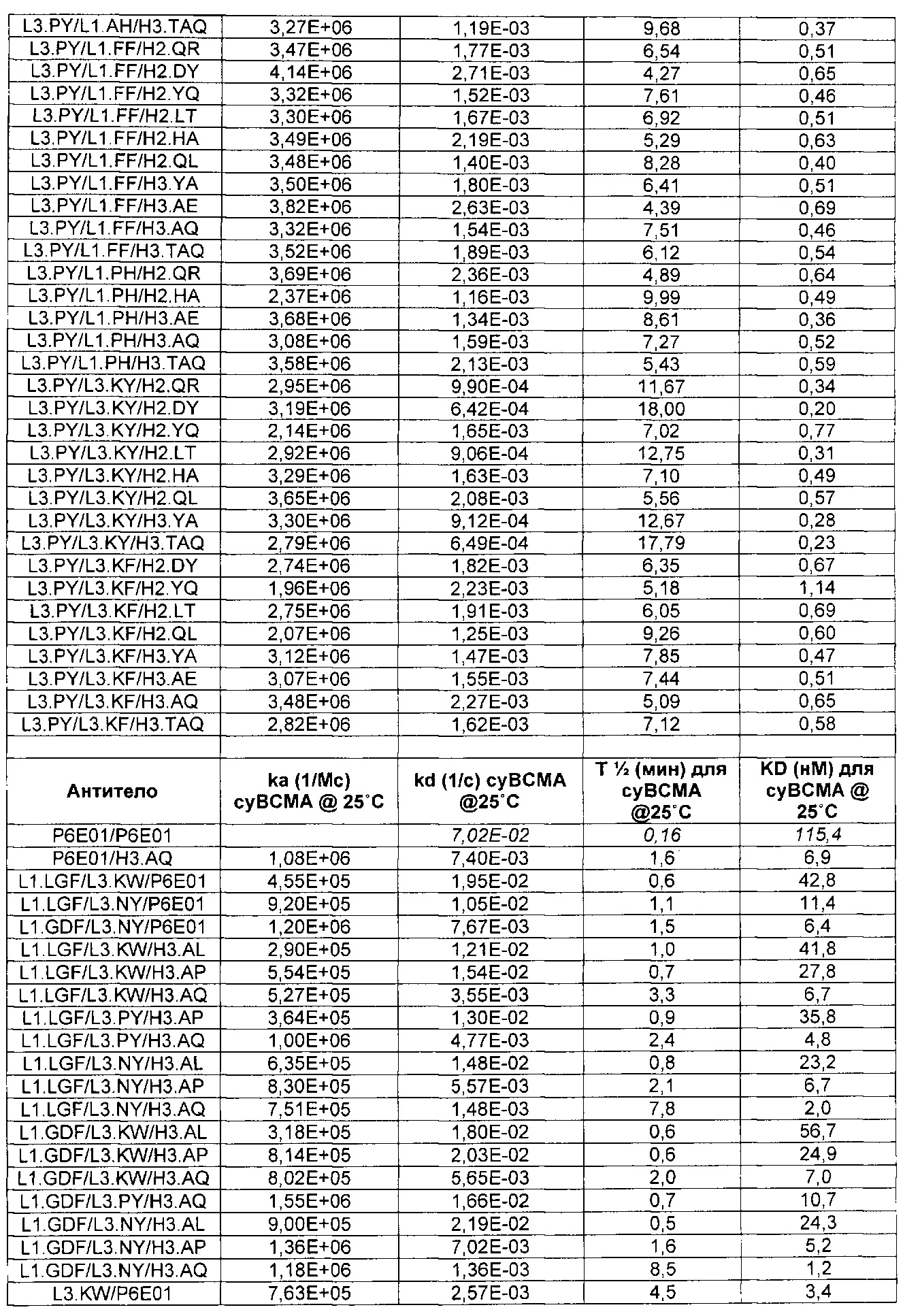
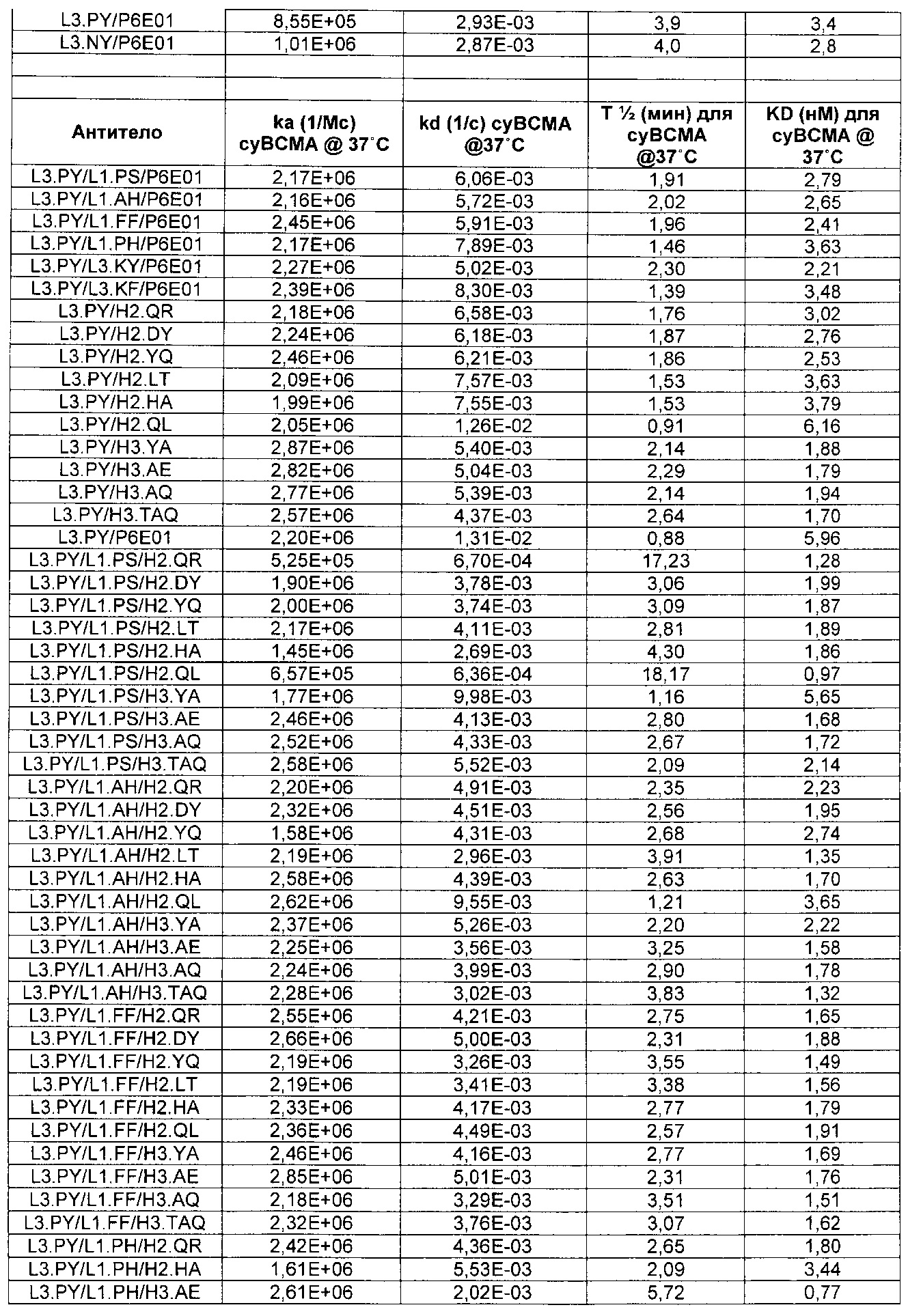
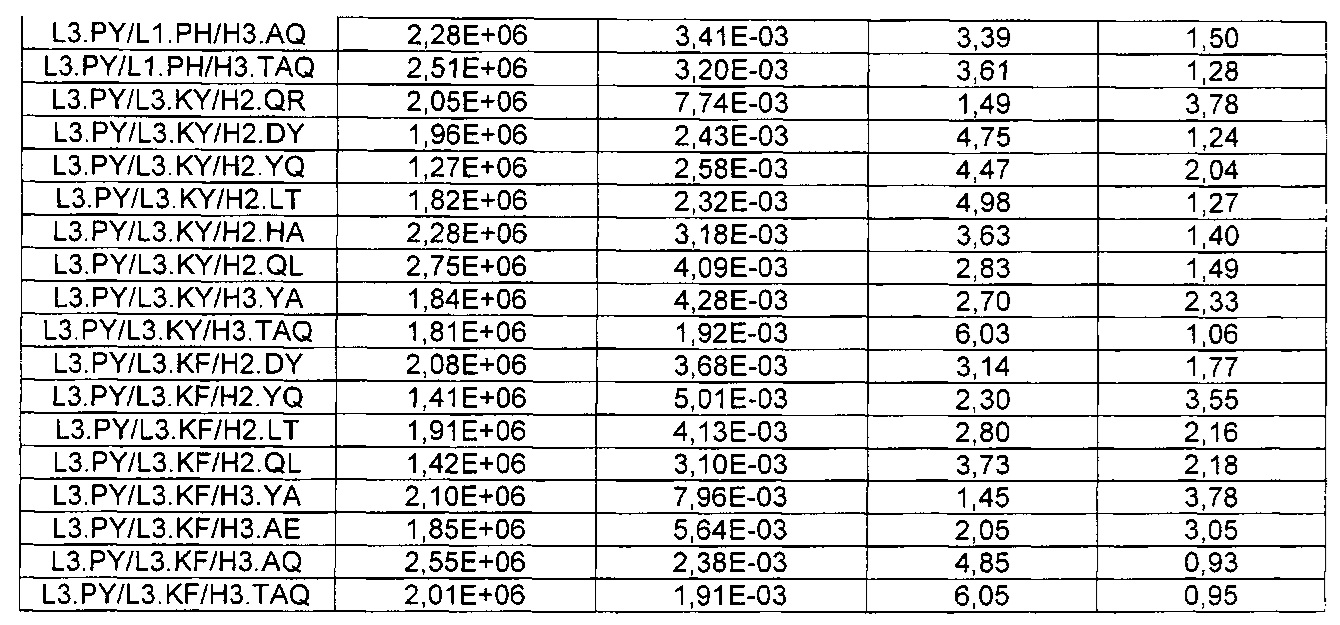
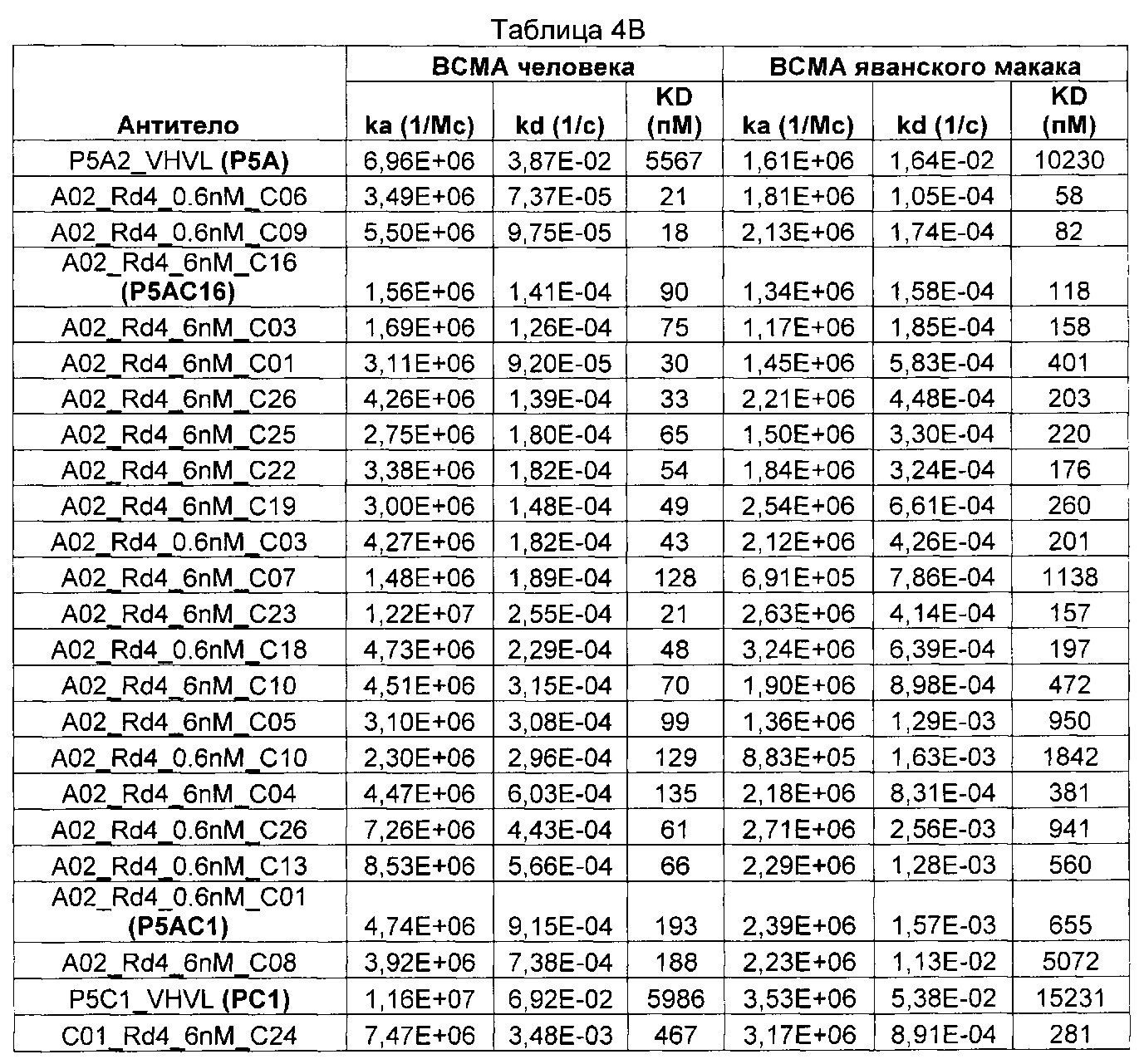
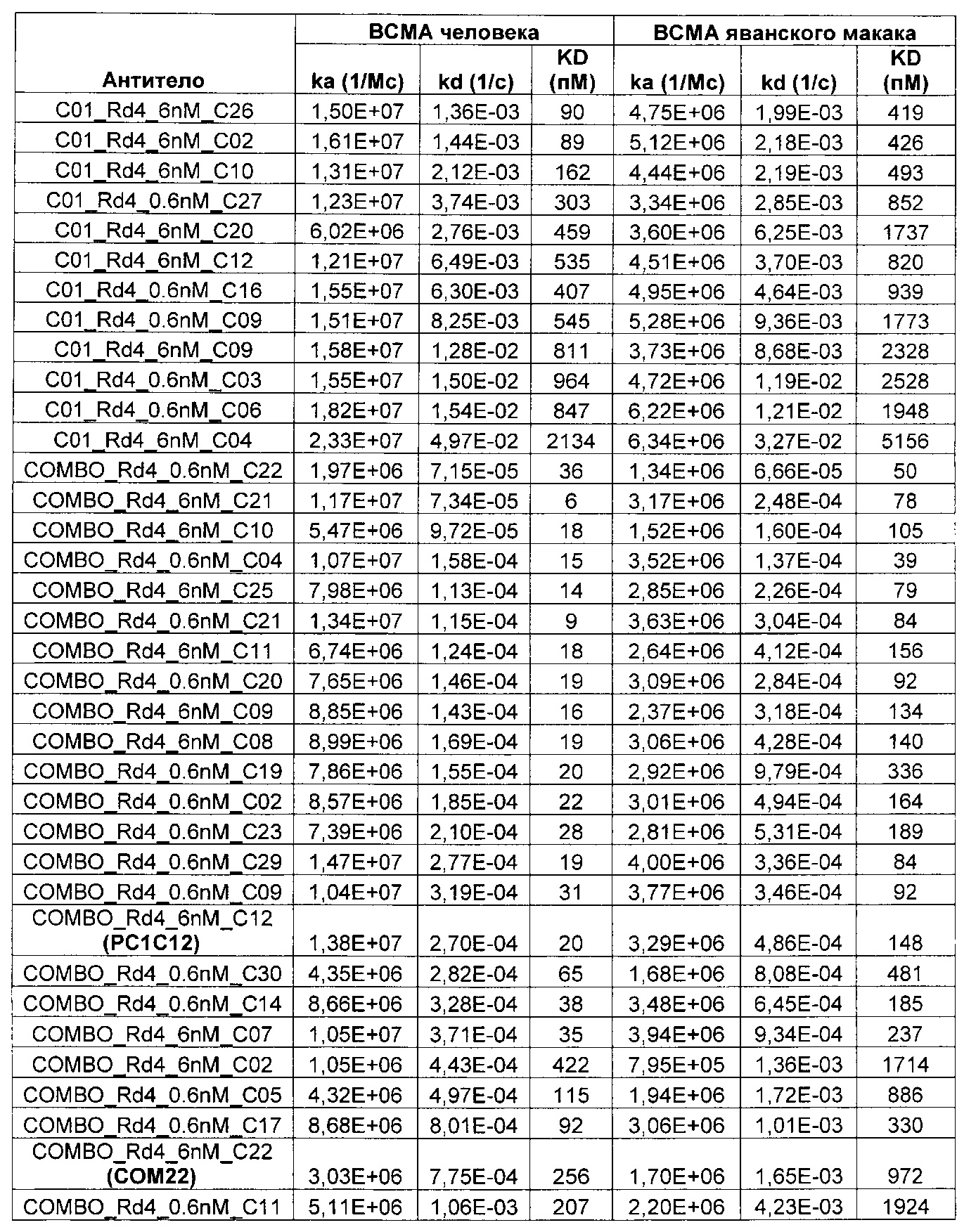
Пример 2. ВСМА-специфические CAR-T клетки
Данный пример демонстрирует функциональную активность ВСМА-специфических CAR-T клеток против ВСМА-положительных (ВСМА+) опухолевых клеток.
На основе аффинности к ВСМА, перекрестной реактивности с ВСМА человека и ВСМА яванского макака, а также эпитопа для последующего тестирования активности из всех полученных молекул ВСМА-специфических CAR выбрали восемь. Протестированные молекулы CAR включали: Р5А, Р5АС1, Р5АС16, РС1, РС1С12, СОМ22, P6DY и Р6АР. Разработали три различных конфигурации: версия 1 (v1) содержит шарнирную область FcγRIIIα, версия 2 (v2) содержит шарнирную область CD8α, и версия 3 (v3) содержит шарнирную область IgG1. Получили и использовали химерные антигенные рецепторы (CAR), приведенные в Таблице 5, у которых оценивали их дегрануляционную активность в отношении ВСМА+ клеток. Дегрануляционную активность определяли при транзиторной экспрессии каждого CAR в человеческих Т клетках.














Для исследования активности получили Т-клетки от тринадцати здоровых доноров (доноры 1-13). Вкратце, Т-клетки выделяли из образцов лейкоцитарной пленки и активировали с помощью CD3/CD28 микрогранул. Клетки транзиторно трансфицировали мРНК, кодирующими различные молекулы CAR на 11/12 сутки после активации. Активность CAR оценивали путем измерения их дегрануляционной способности, высвобождения интерферона-γ (IFNγ) и цитотоксической активности при совместном культивировании с (а) клетками, экспрессирующими ВСМА (MM1S, KMS12BM и L363), или (б) клетками, не экспрессирующими белок ВСМА (K562). В каждое исследование также включали ложнотрансфицированные Т-клетки (Т-клетки в буфере) для определения исходной активности Т-клеток, не экспрессирующих CAR.
Выявление CAR осуществляли с использованием слитого белка, в котором внеклеточный домен человеческого белка ВСМА был слит с Fc-фрагментом, имеющим происхождение из IgG1 мыши. Связывание CAR на клеточной поверхности с ВСМА-частью слитого белка выявляли с использованием анти-Fc антитела, конъюгированного с РЕ, и анализировали посредством проточной цитометрии.
Материалы и методы
Первичные культуры Т-клеток
Т-клетки выделяли из образцов лейкоцитарной пленки, предоставляемых EFS (Французской службой крови, Париж, Франция) с использованием среды с градиентом фиколла (Ficoll Paque PLUS / GE Healthcare Life Sciences). Получали слой РВМС (мононуклеарные клетки периферической крови) и очищали Т-клетки с помощью коммерческого набора для обогащения Т-клетками (Stem Cell Technologies). Выделенные Т-клетки активировали в среде X-Vivo™-15 (Lonza) с добавлением 20 нг/мл IL-2 человека (Miltenyi Biotech), 5% человеческой сыворотки (Sera Laboratories) и микрочастиц для активации Т-клеток Dynabeads Human T activator CD3/CD28 (Life Technologies) в соотношении микрочастицы : клетки 1:1. После активации клетки культивировали и поддерживали в среде X-Vivo™-15 (Lonza) с добавлением 20 нг/мл IL-2 человека (Miltenyi Biotech) и 5% человеческой сыворотки (Sera Laboratories).
Трансфекция мРНК CAR
Трансфекцию осуществляли в 4/5 сутки или в 11/12 сутки после выделения и активации Т-клеток. 5 миллионов клеток трансфицировали 15 мкг мРНК, кодирующей различные конструкции CAR. Для получения мРНК CAR использовали набор mMESSAGE mMACHINE T7 (Life Technologies), а для очищения использовали колонки RNeasy Mini Spin (Qiagen). Осуществляли трансфекцию с использованием технологии PulseAgile™ Cytopulse путем воздействия двух импульсов 0,1 мС при 3000 В/см и затем четырех импульсов 0,2 мС при 325 В/см в кюветах с зазором 0,4 см в буфере «Cytoporation buffer T» (ВТХ Harvard Apparatus) в конечном объеме 200 мкл. Клетки немедленно разводили средой X-Vivo™-15 (Lonza) и инкубировали при 37°С с 5% CO2. Через 2 ч после электропорации добавляли 20 нг/мл IL-2 (Miltenyi Biotec).
Исследование дегрануляции (мобилизации CD107а)
Т-клетки инкубировали в 96-луночных планшетах (50000 клеток/лунку) вместе с равным количеством клеток, экспрессирующих или не экспрессирующих белок ВСМА. Совместные культуры поддерживали в среде X-Vivo™-15 (Lonza) в конечном объеме 100 мкл в течение 6 часов при 37°С с 5% CO2. Окрашивание на CD107a осуществляли во время стимуляции клеток, путем добавления флуоресцентного антитела к CD107a, конъюгированного с АРС (Miltenyi Biotec) в начале совместного культивирования вместе с 1 мкг/мл анти-CD49d (BD Pharmingen), 1 мкг/мл анти-CD28 (Miltenyi Biotec) и 1х раствора монензина (eBioscience). Через 6 часов инкубации клетки окрашивали фиксирующимся красителем для определения жизнеспособности eFluor 780 (eBioscience) и конъюгированного с флуорохромом РЕ анти-CD8 (Miltenyi Biotec) и анализировали посредством проточной цитометрии. Дегрануляционную активность определяли как процентную долю CD8+/CD107a+ клеток посредством определения средней интенсивности флуоресцентного сигнала (MFI) при окрашивании CD8+ клеток на CD107a. Исследование дегрануляции проводили через 24 ч после трансфекции мРНК. Результаты обобщены в Таблицах 6А-6З и 9А-9В ниже. В таблицах во второй колонке (озаглавленной «CAR-T клетки») указаны ВСМА-специфические CAR, экспрессирующиеся в трансфицированных Т-клетках.
Экспрессия CD107a на клетках является маркером антиген-специфической активации. Доля и MFI CD107a на CD8 Т-клетках, экспрессирующих ВСМА-специфические CAR, увеличиваются при инкубации с клетками, демонстрирующими высокий (Н929), средний (MM1S) и низкий (KMS12BM, L363) уровень экспрессии ВСМА, но не с ВСМА-отрицательными клетками (K562 и Daudi) (Таблицы 6А-6З и 9А-9В). При приведении в контакт с ВСМА ложнотрансфицированных Т-клеток уровни экспрессии CD107a у них не увеличивался. Таким образом, ВСМА-специфические CAR-T клетки активируются в присутствии ВСМА-экспрессирующих клеток, но не в присутствии клеток, которые не экспрессируют ВСМА.
Данные результаты демонстрируют, что Т-клетки, экспрессирующие ВСМА-специфические CAR, активируются при инкубации с ВСМА-экспрессирующими клетками, и что активация является антиген-специфической.
Исследование высвобождения IFN γ
Т-клетки инкубировали в 96-луночных планшетах (50000 клеток/лунку) вместе с (а) клетками, экспрессирующими ВСМА (MM1S, KMS12BM и L363), или (б) клетками, не экспрессирующими белок ВСМА (K562). Совместные культуры поддерживали в среде X-Vivo™-15 (Lonza) в конечном объеме 100 мкл в течение 24 часов при 37°С с 5% СО3. После указанного периода инкубации планшеты центрифугировали при 1500 об/мин в течение 5 минут и переносили надосадочную жидкость в новые планшеты. IFNγ в культуральной надосадочной жидкости выявляли с помощью анализа ELISA (твердофазный иммуноферментный анализ) (набор Human IFNγ Quantikine ELISA Kit, R&D Systems). Исследование высвобождения IFNγ проводили, запуская совместное культивирование клеток через 24 ч после трансфекции мРНК. Результаты представлены ниже в Таблицах 8А-8Г и 10.
Как показано в Таблицах 8А-8Г и 10, CD8 Т-клетки, экспрессирующие ВСМА-специфические CAR, продуцируют IFNγ при инкубации либо с клетками со средним уровнем экспрессии ВСМА (MM1S), либо с клетками с низким уровнем экспрессии ВСМА (KMS12BM, L363). Напротив, при инкубации с ВСМА-отрицательными клетками (K562), CD8 Т-клетки, экспрессирующие ВСМА-специфические CAR, продуцируют пренебрежительно малое количество IFNγ.
Данные результаты демонстрируют, что Т-клетки, экспрессирующие ВСМА-специфические CAR, активируются при инкубации с ВСМА-экспрессирующими клетками, и что активация является антиген-специфической.
Исследование цитотоксичности
Т-клетки инкубировали в 96-луночных планшетах (100000 клеток/лунку) вместе с 10000 клеток-мишеней (экспрессирующих ВСМА) и 10000 контрольных (ВСМАотр) клеток в той же лунке. Клетки-мишени и контрольные клетки были помечены внутриклеточными флуоресцентными красителями (CFSE или Cell Trace Violet, Life Technologies) перед совместным культивированием их с CAR+ Т клетками. Совместные культуры инкубировали в течение 4 часов при 37°С с 5% CO2. После указанного периода инкубации клетки окрашивали фиксирующимся красителем для определения жизнеспособности eFluor 780 (eBioscience) и анализировали посредством проточной цитометрии. Определяли жизнеспособность каждой популяции клеток (клеток-мишеней или ВСМАотр контрольных клеток) и рассчитывали % специфического клеточного лизиса. Исследование цитотоксичности проводили через 48 ч после трансфекции мРНК. Результаты представлены ниже в Таблицах 7А-7З. Результаты исследования цитотоксичности представлены в таблицах как доля жизнеспособных клеток, выраженная в процентах, затем рассчитано отношение живых ВСМА-положительных клеток к живым ВСМА-отрицательным клеткам. Клеточный лизис рассчитывали как 100 - Т-клетки, трансфицированные вхолостую.
Как показано в Таблицах 7А-7З, Т-клетки, экспрессирующие ВСМА-специфические CAR, демонстрируют уничтожающую активность при инкубации либо с клетками со средним уровнем экспрессии ВСМА (MM1S), либо с клетками с низким уровнем экспрессии ВСМА (L363). Напротив, при инкубации с ВСМА-отрицательными клетками (K562), CD8 Т-клетки, экспрессирующие ВСМА-специфические CAR, не проявляют уничтожающую активность.
Таким образом, Т-клетки, экспрессирующие выбранные ВСМА-специфические CAR, приведенные в Таблице 5, избирательно активируются при контакте с ВСМА-экспрессирующими клетками. При том, что ВСМА-специфическую активацию демонстрировали все варианты ВСМА-специфических CAR, ВСМА-специфические CAR, содержащие шарнирную область CD8α (v2) демонстрировали повышенные уровни активации по сравнению с ВСМА-специфическими CAR, содержащими шарнирную область FcγRIIIα (v1) или шарнирную область IgG1 (v3).
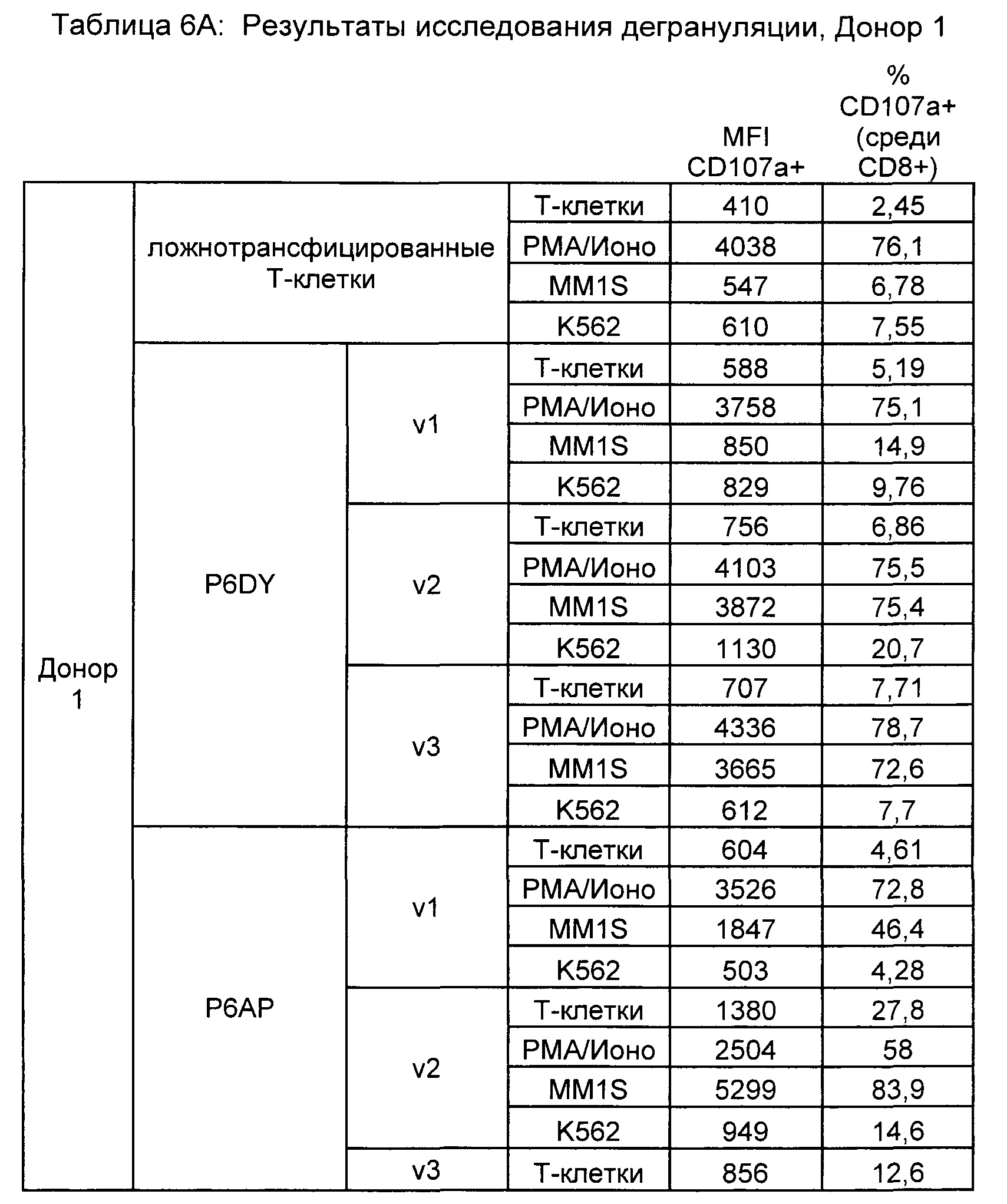
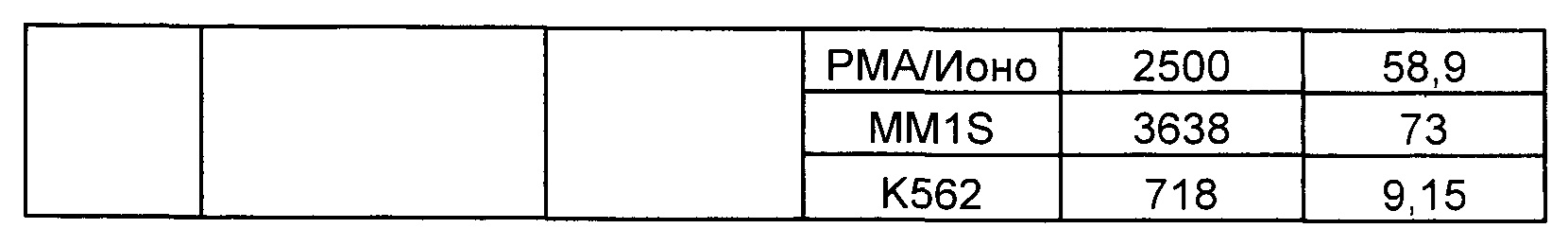
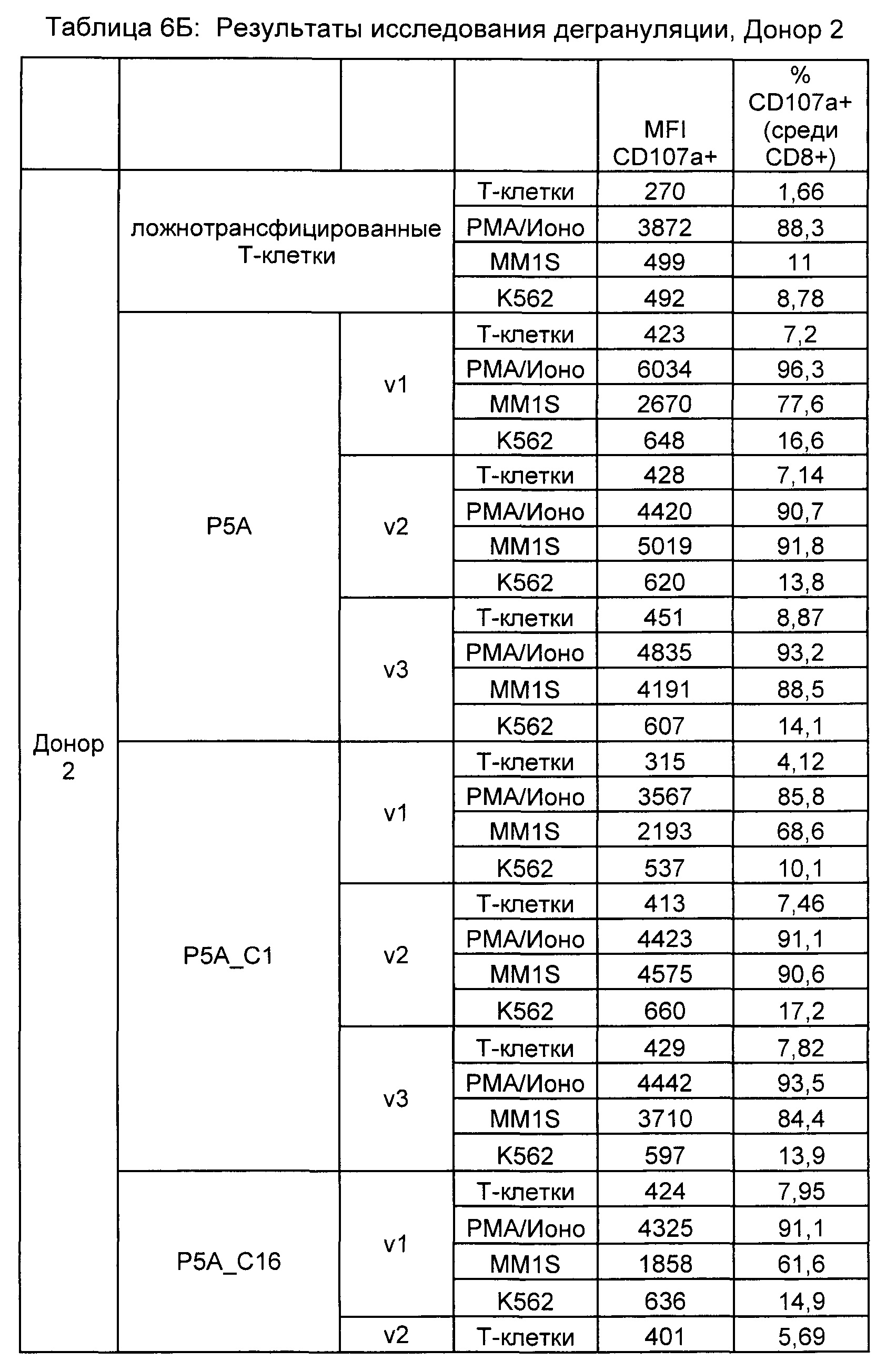
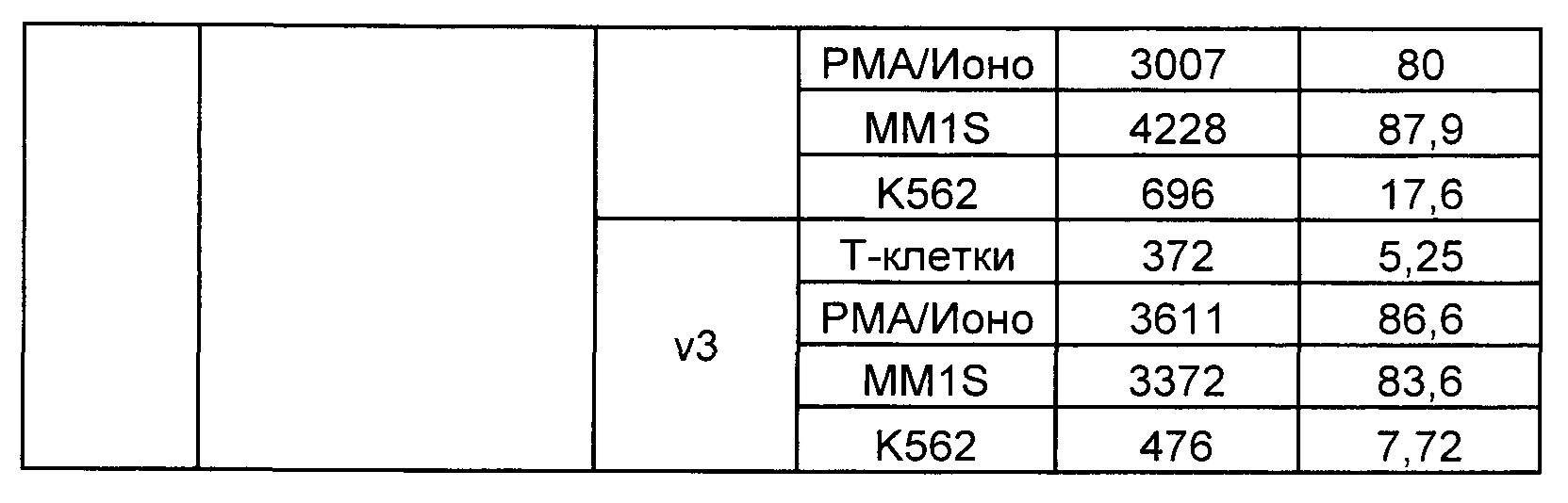
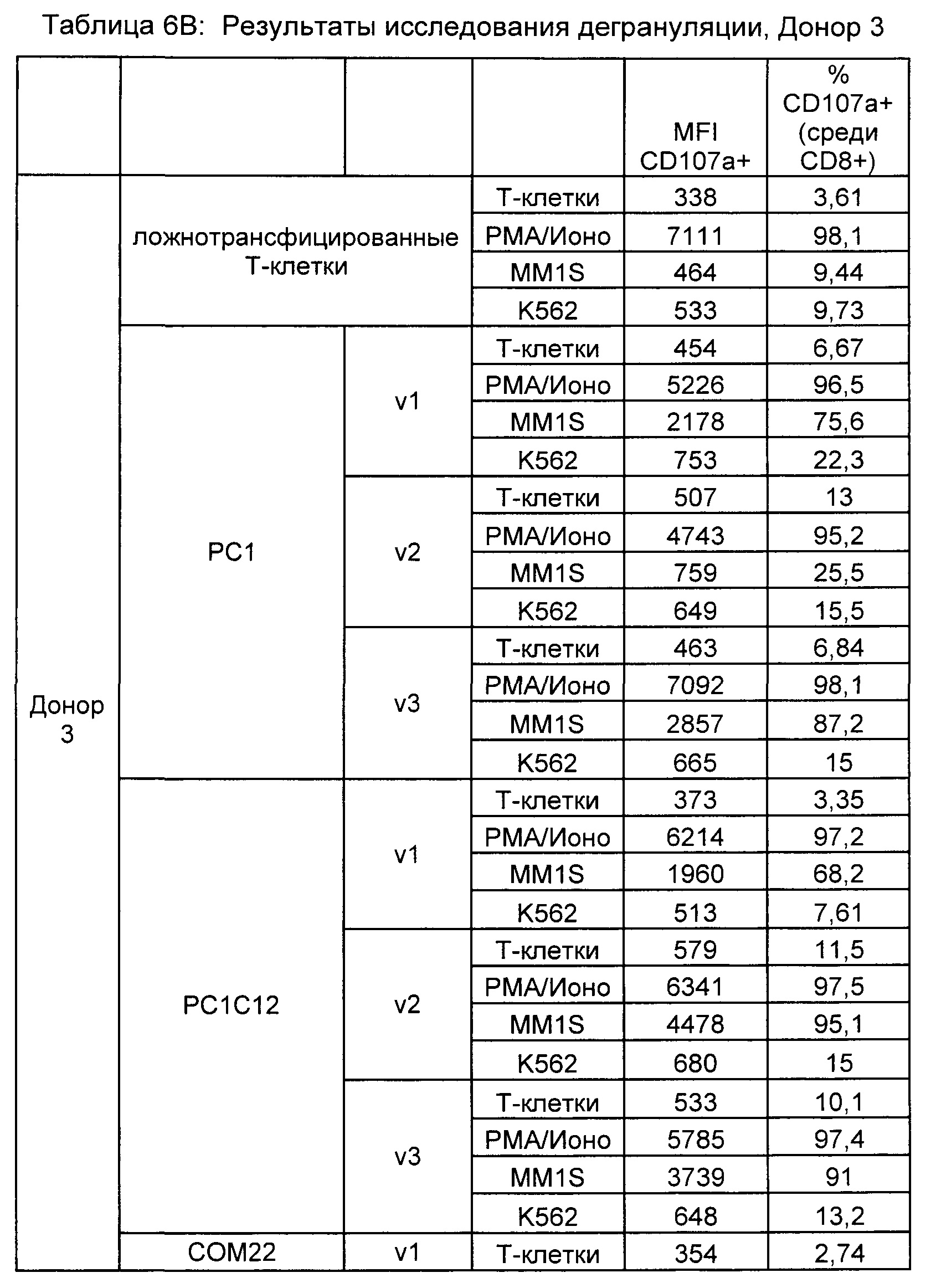
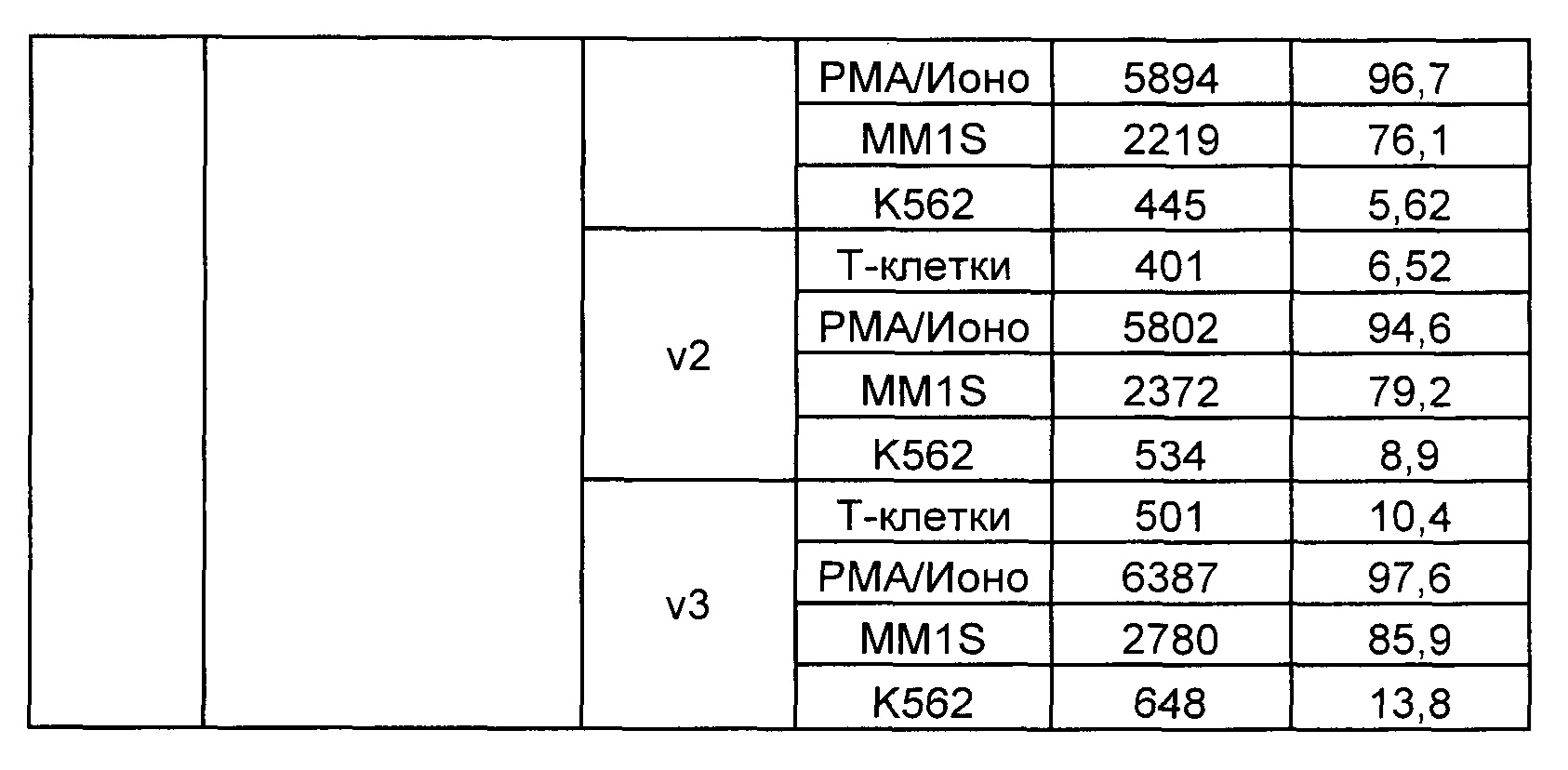
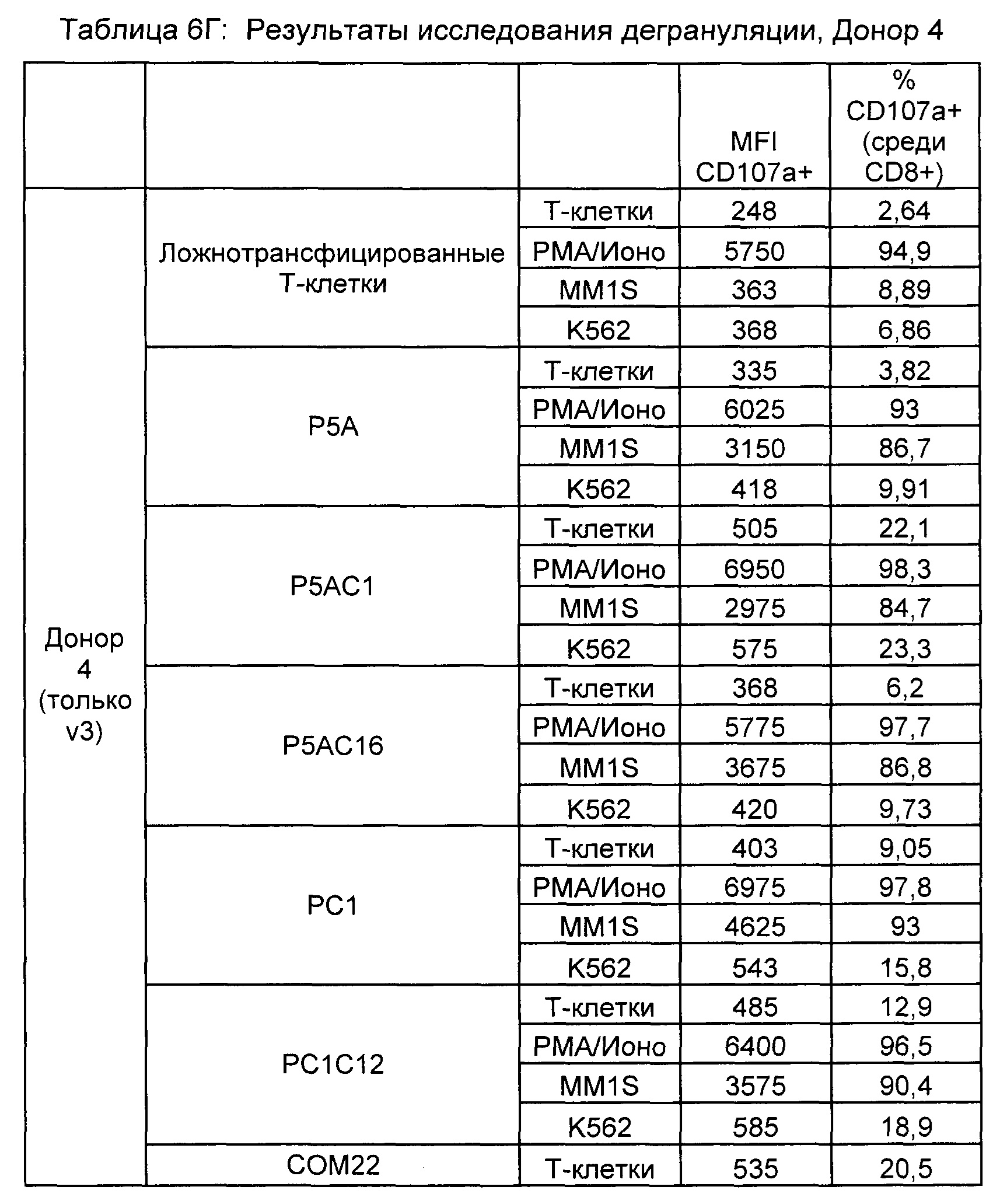
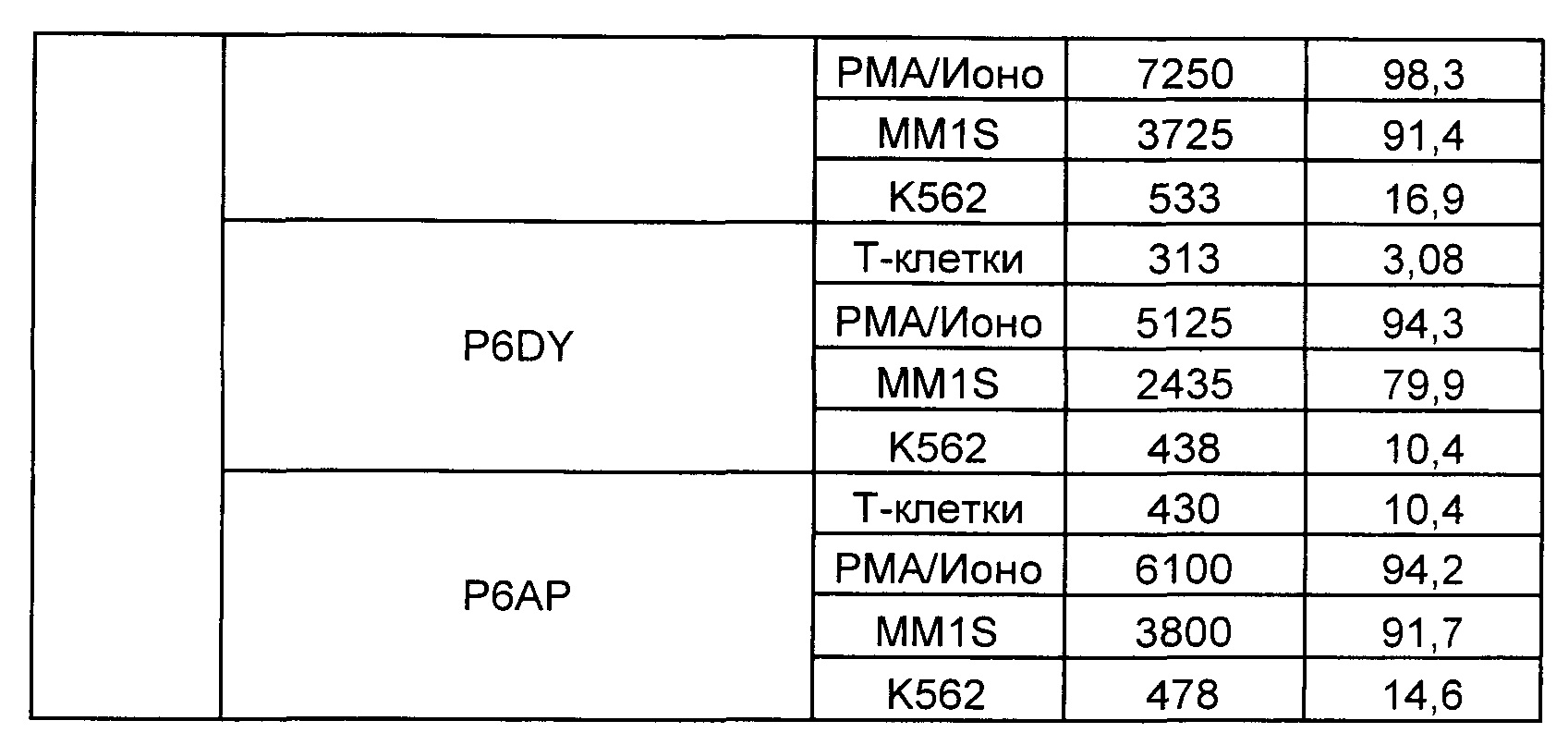
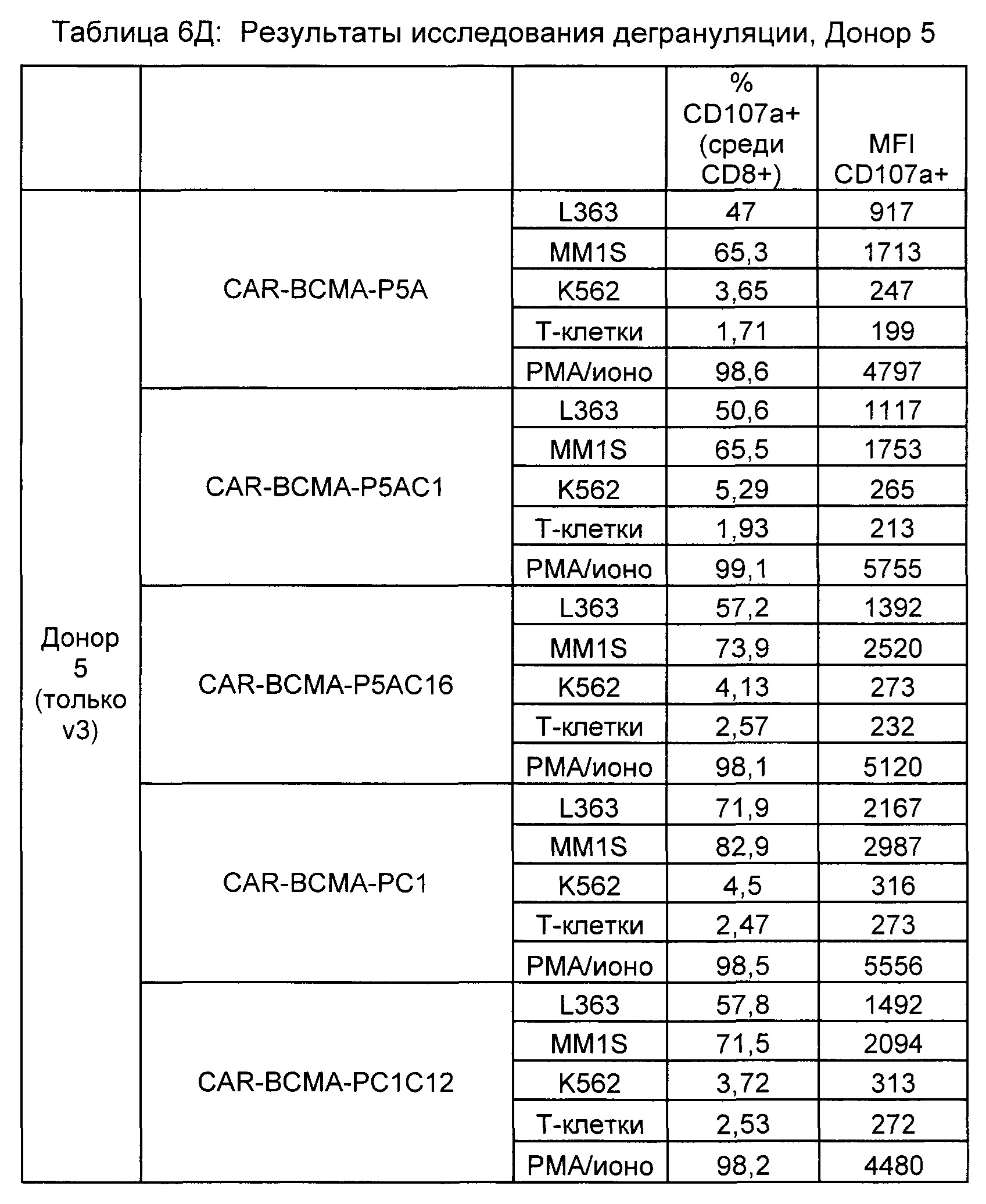
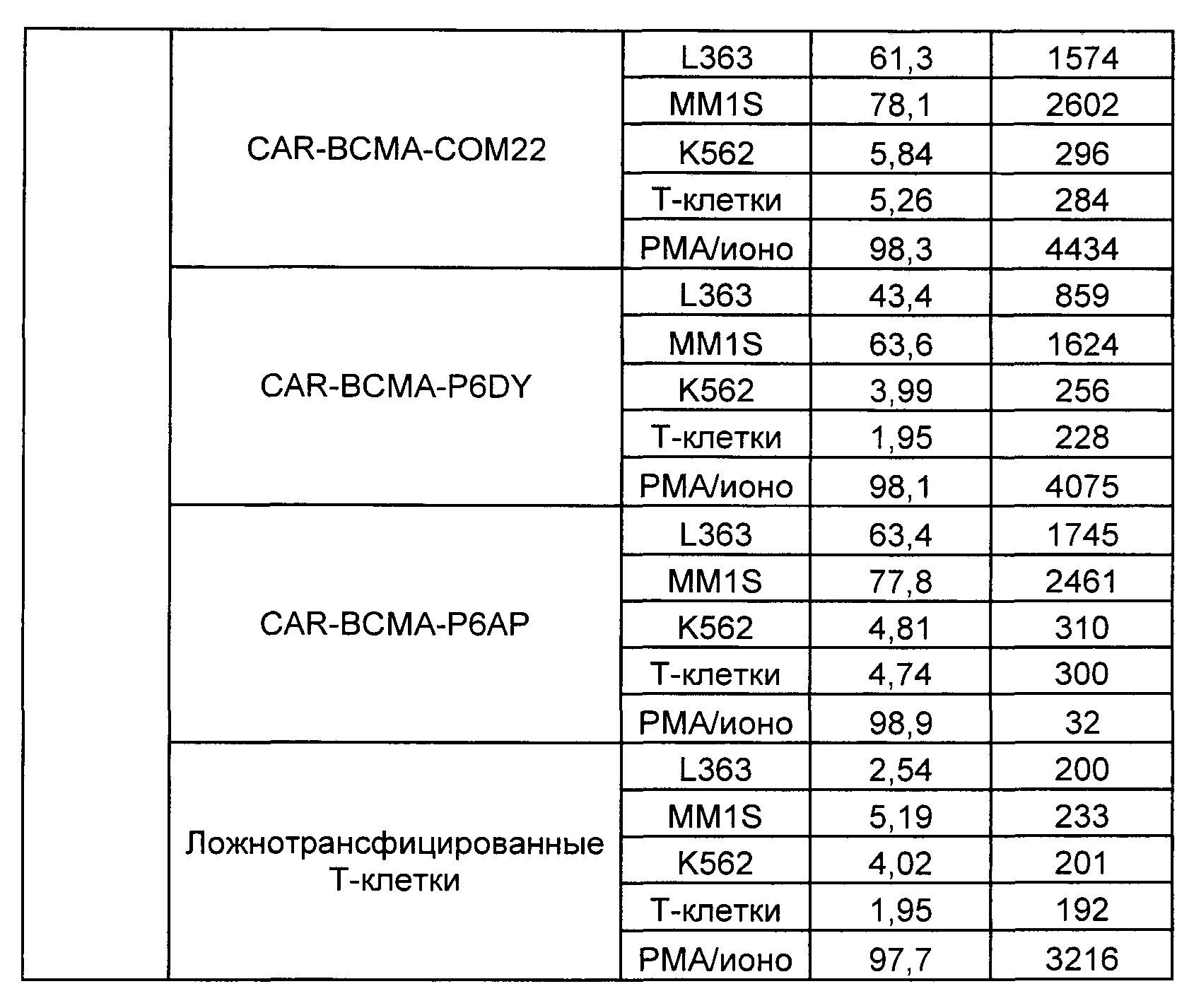
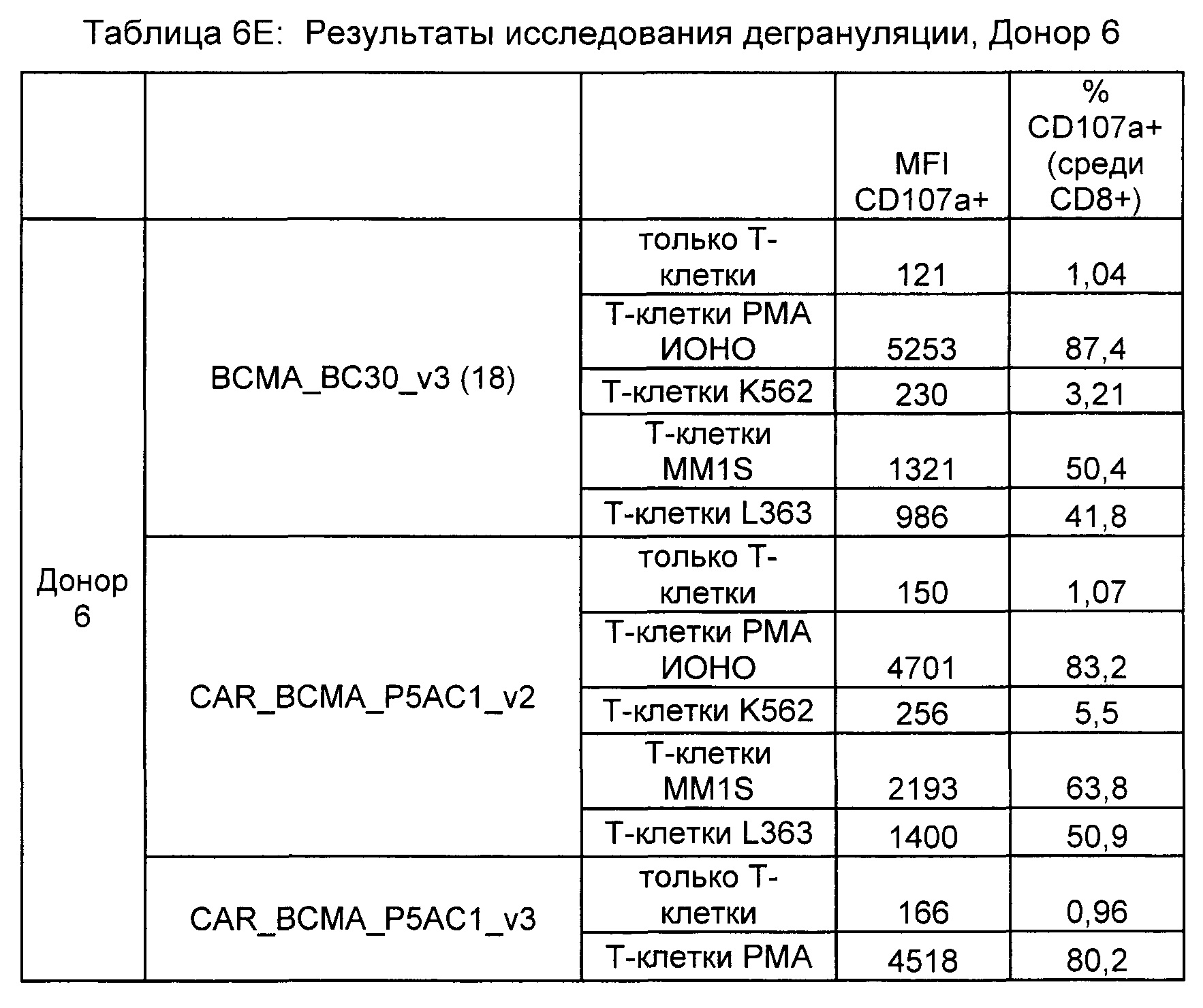
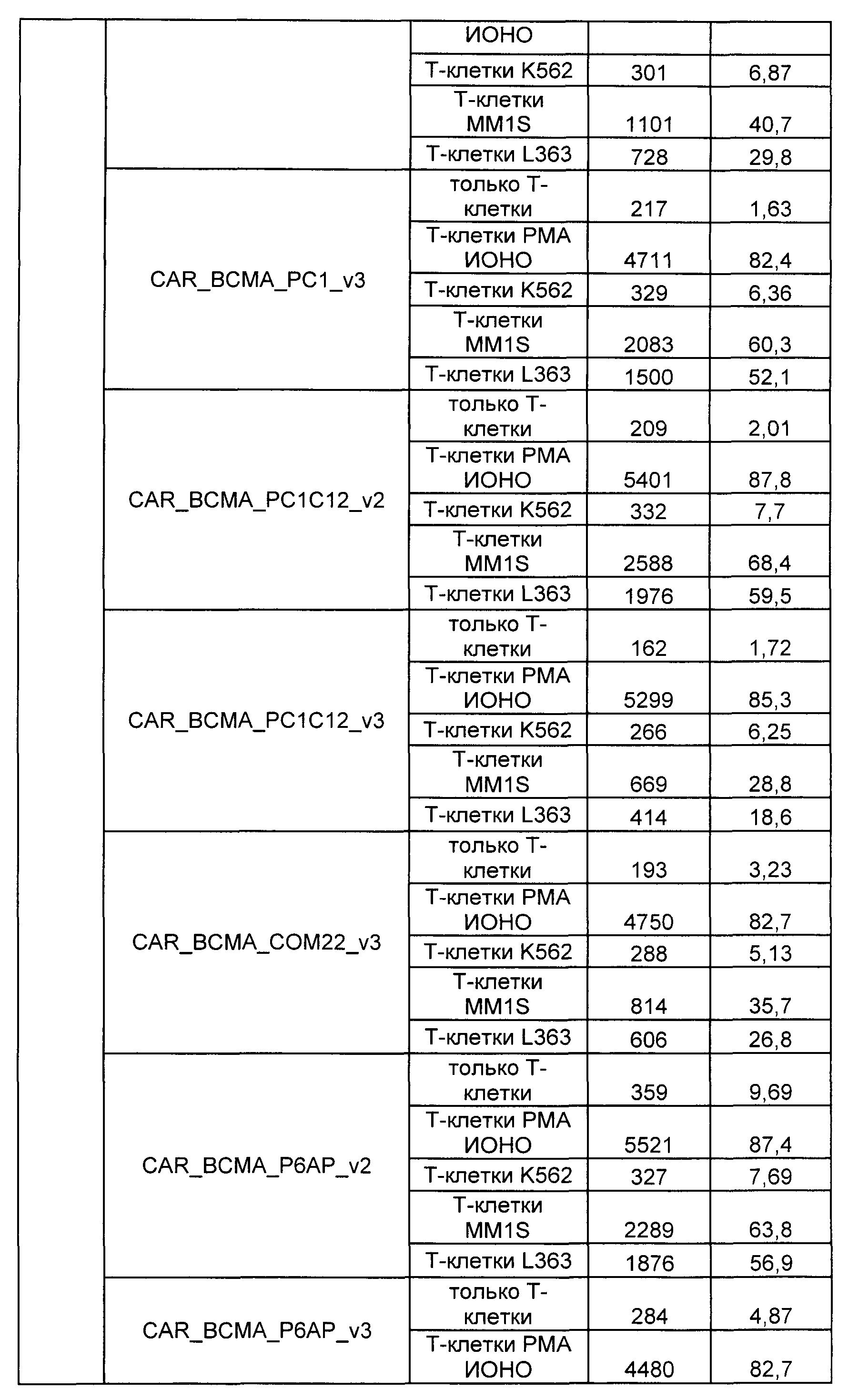
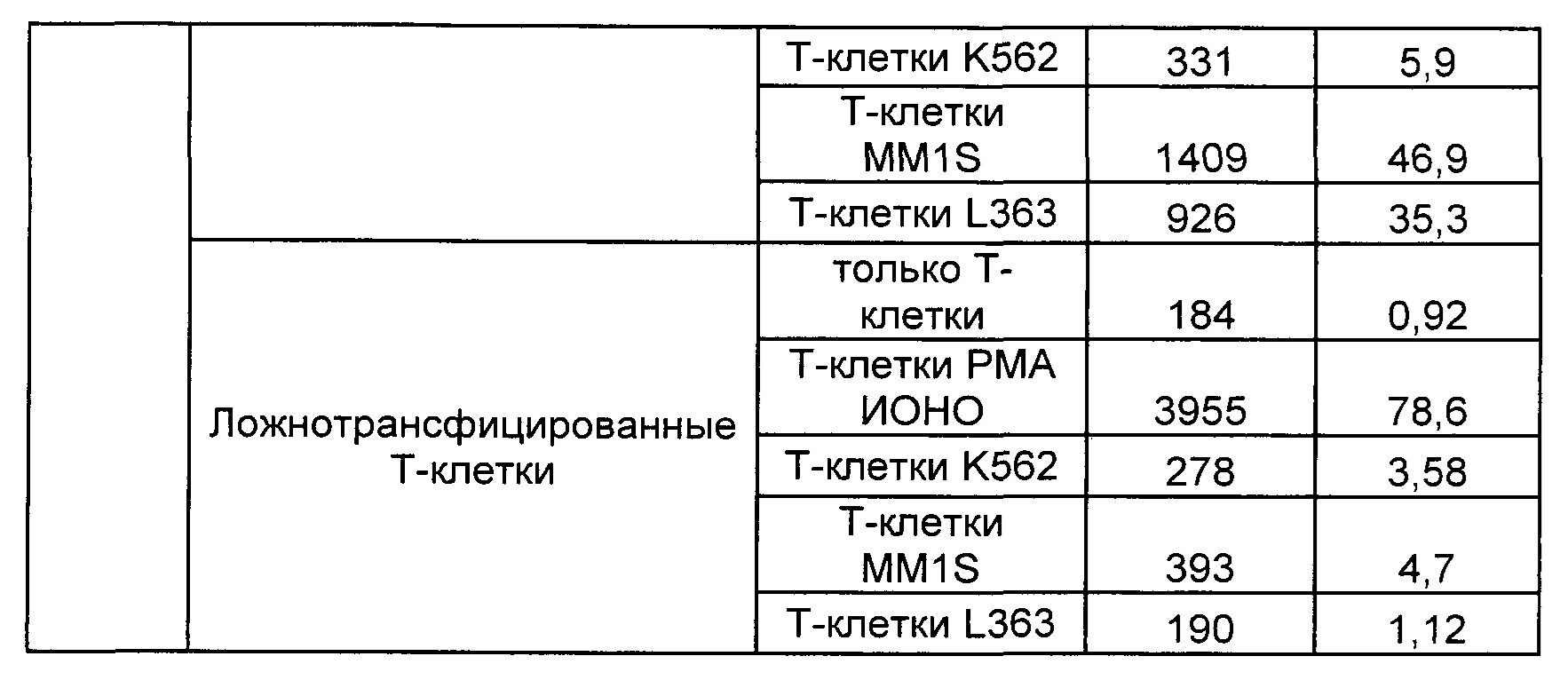
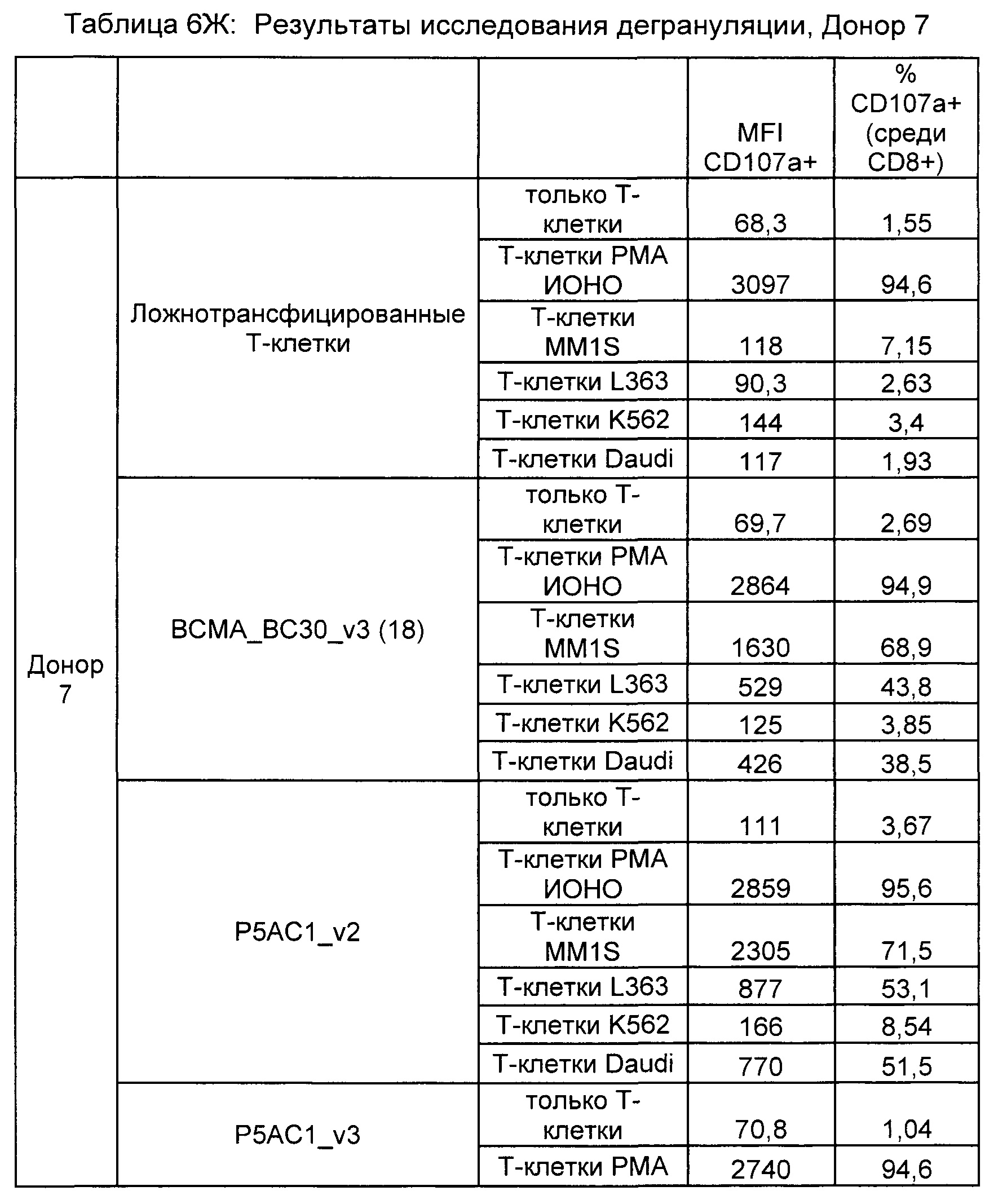
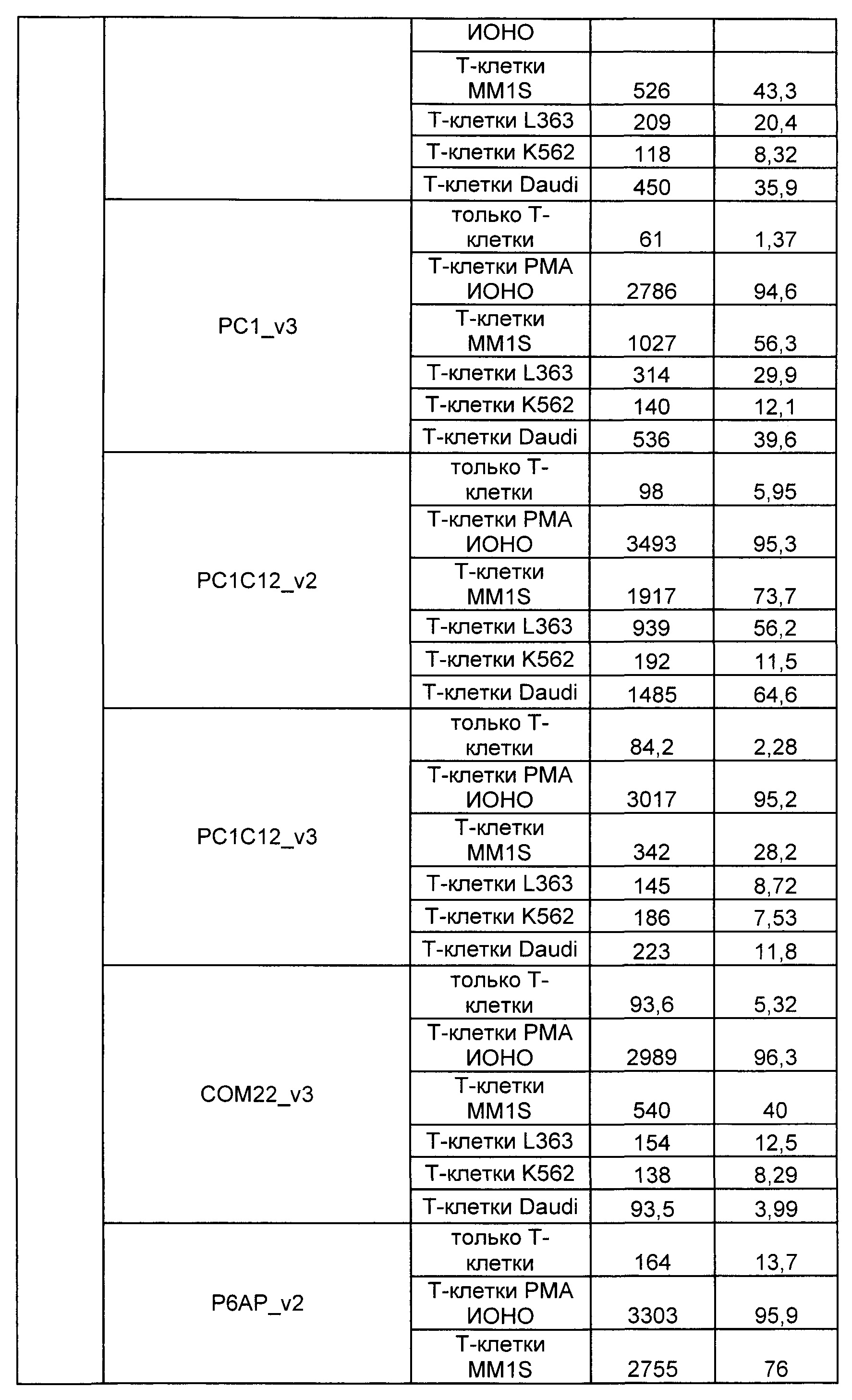
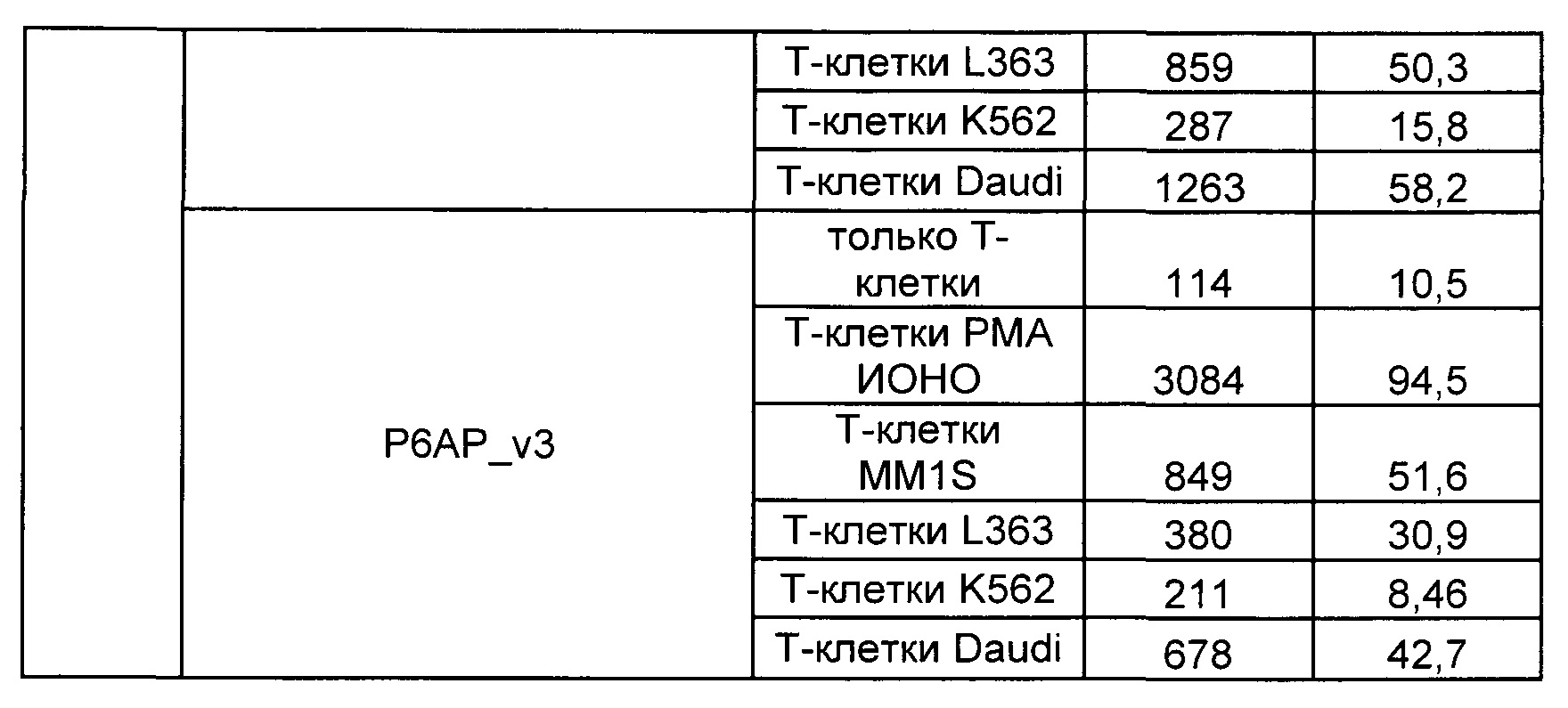
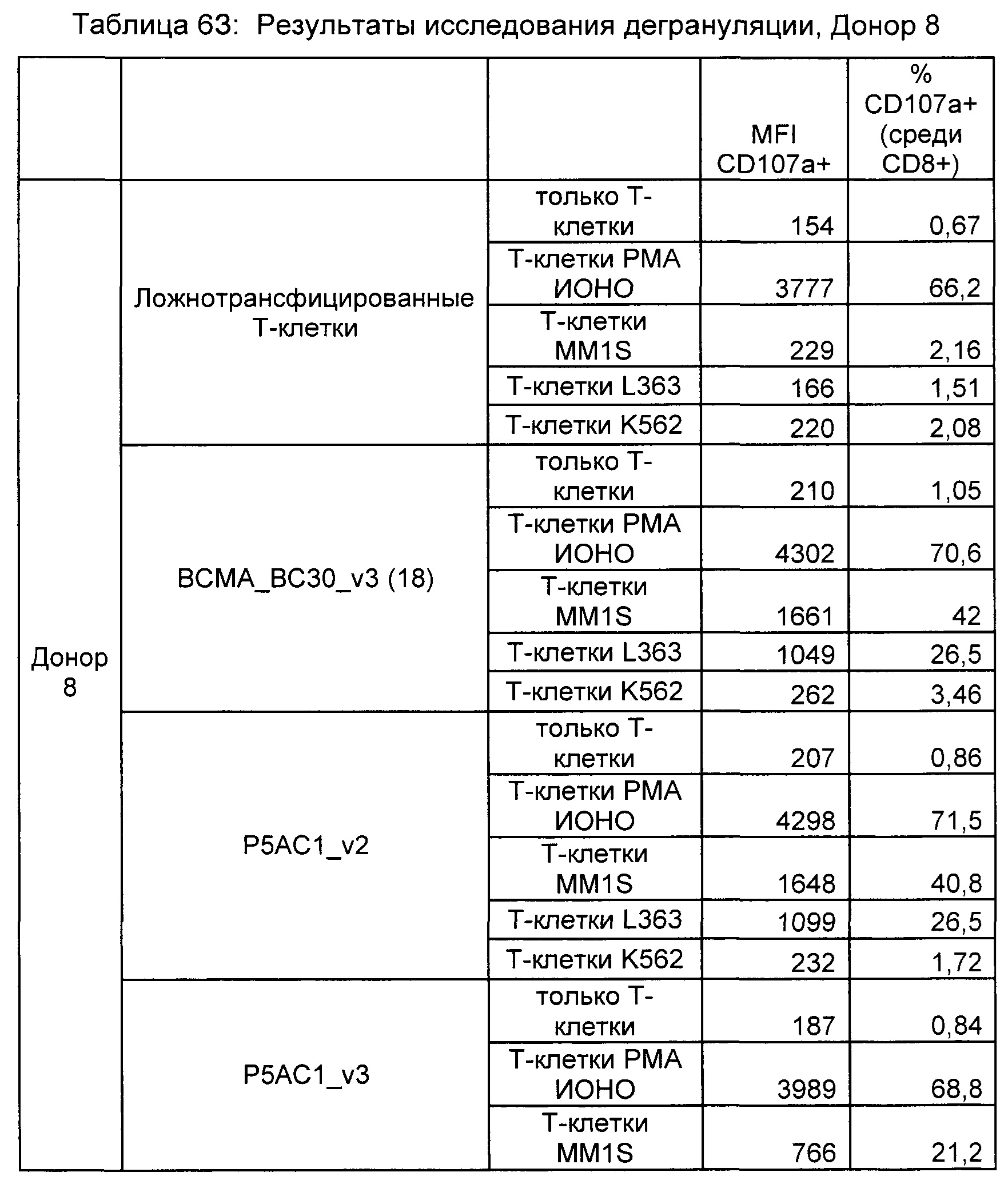
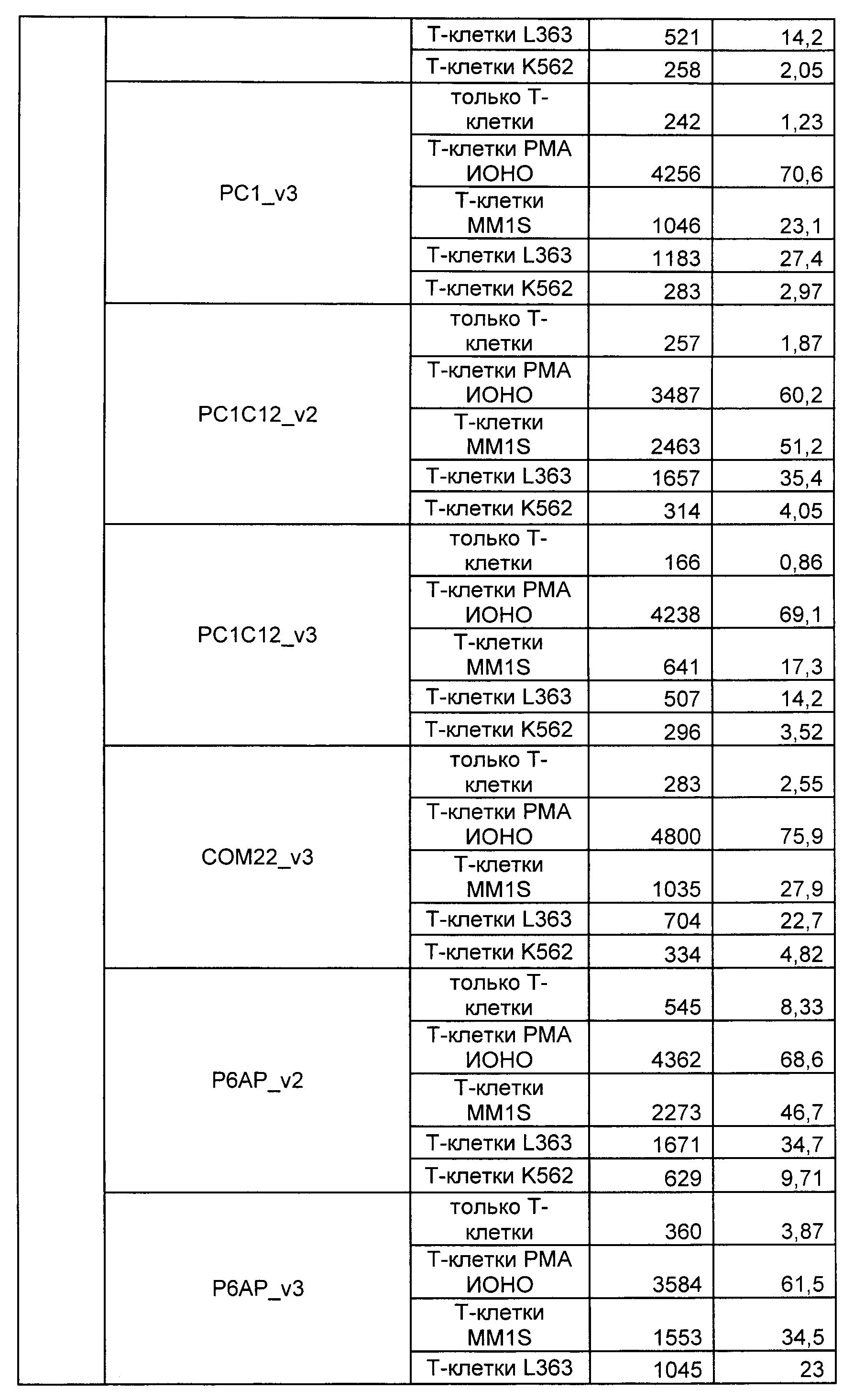

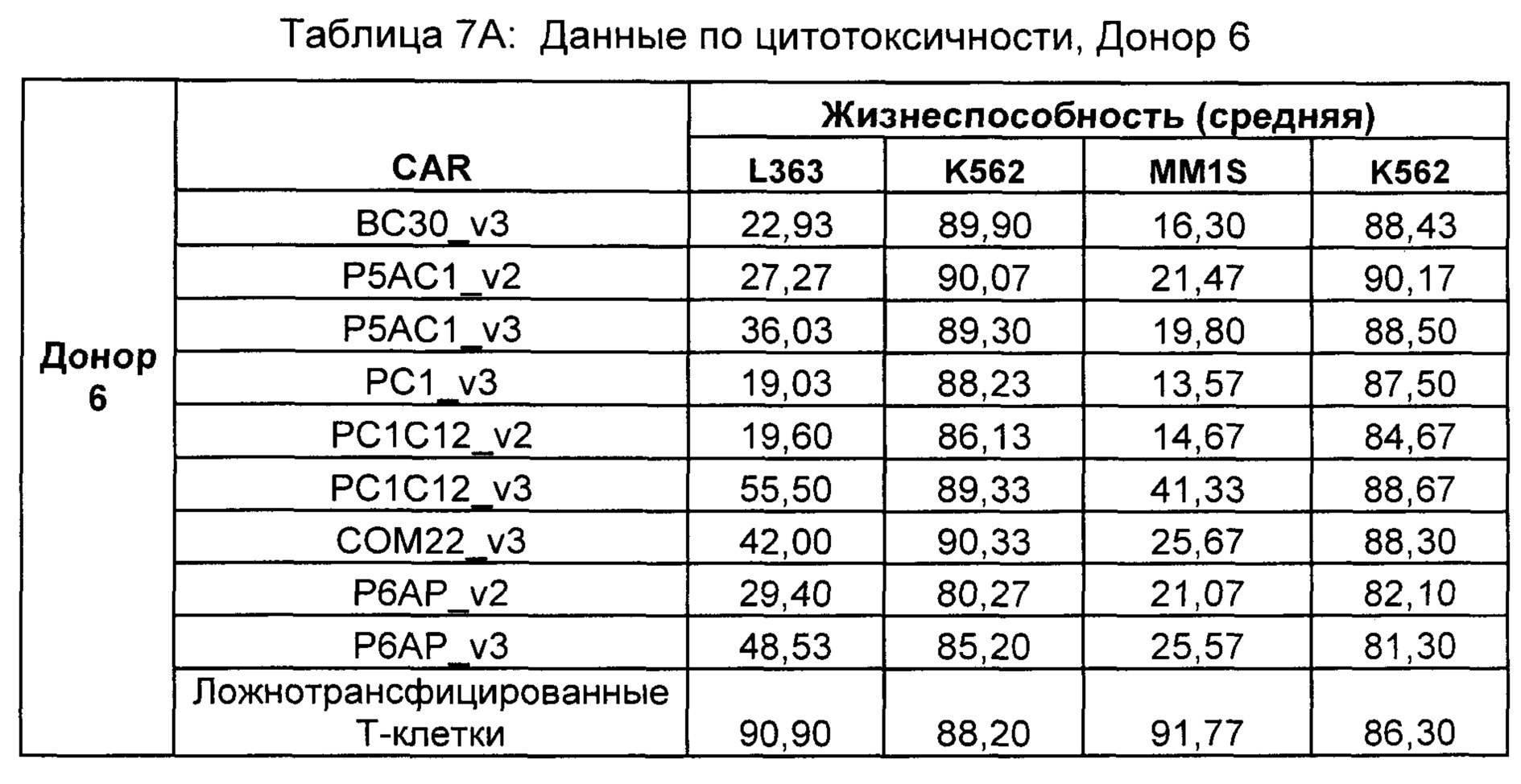
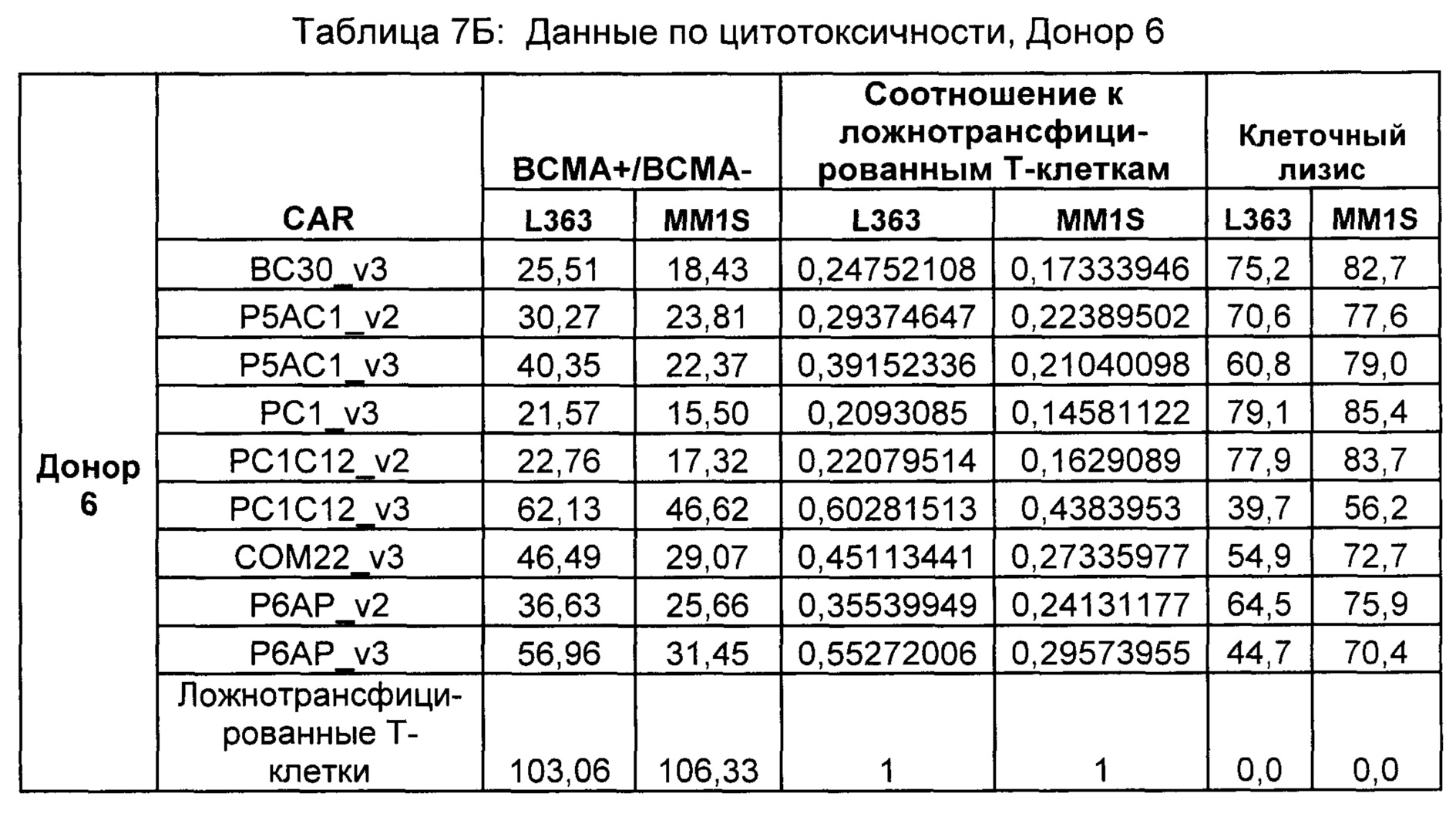
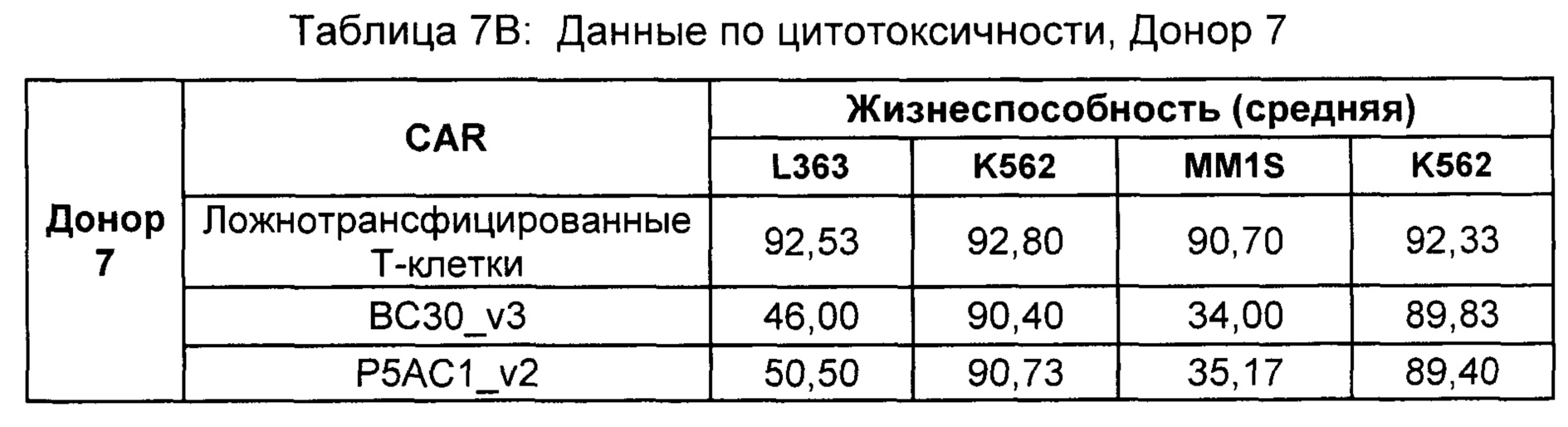
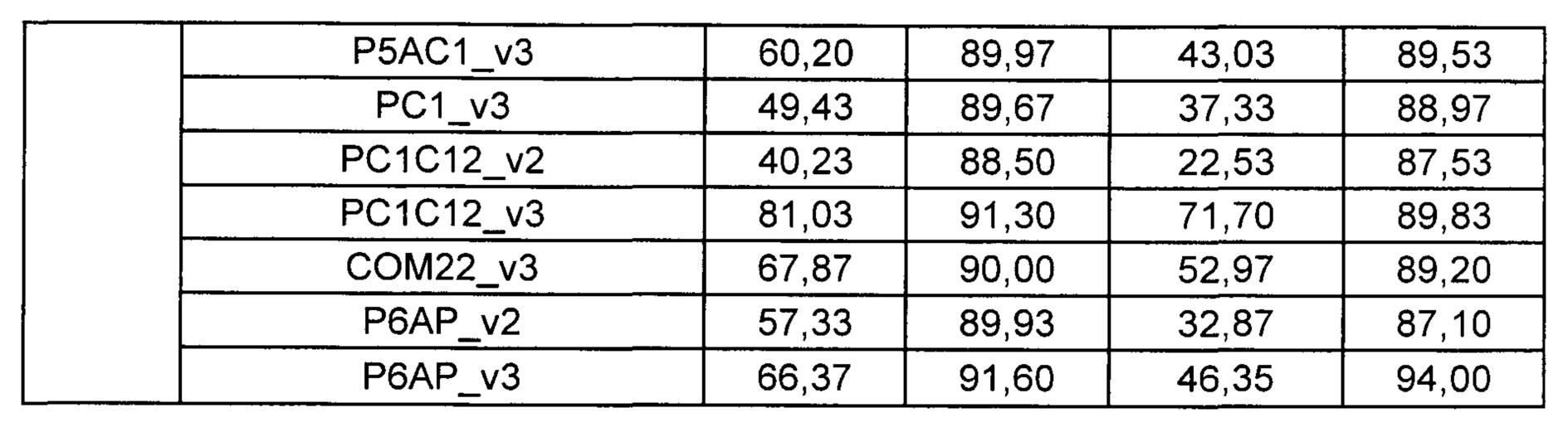
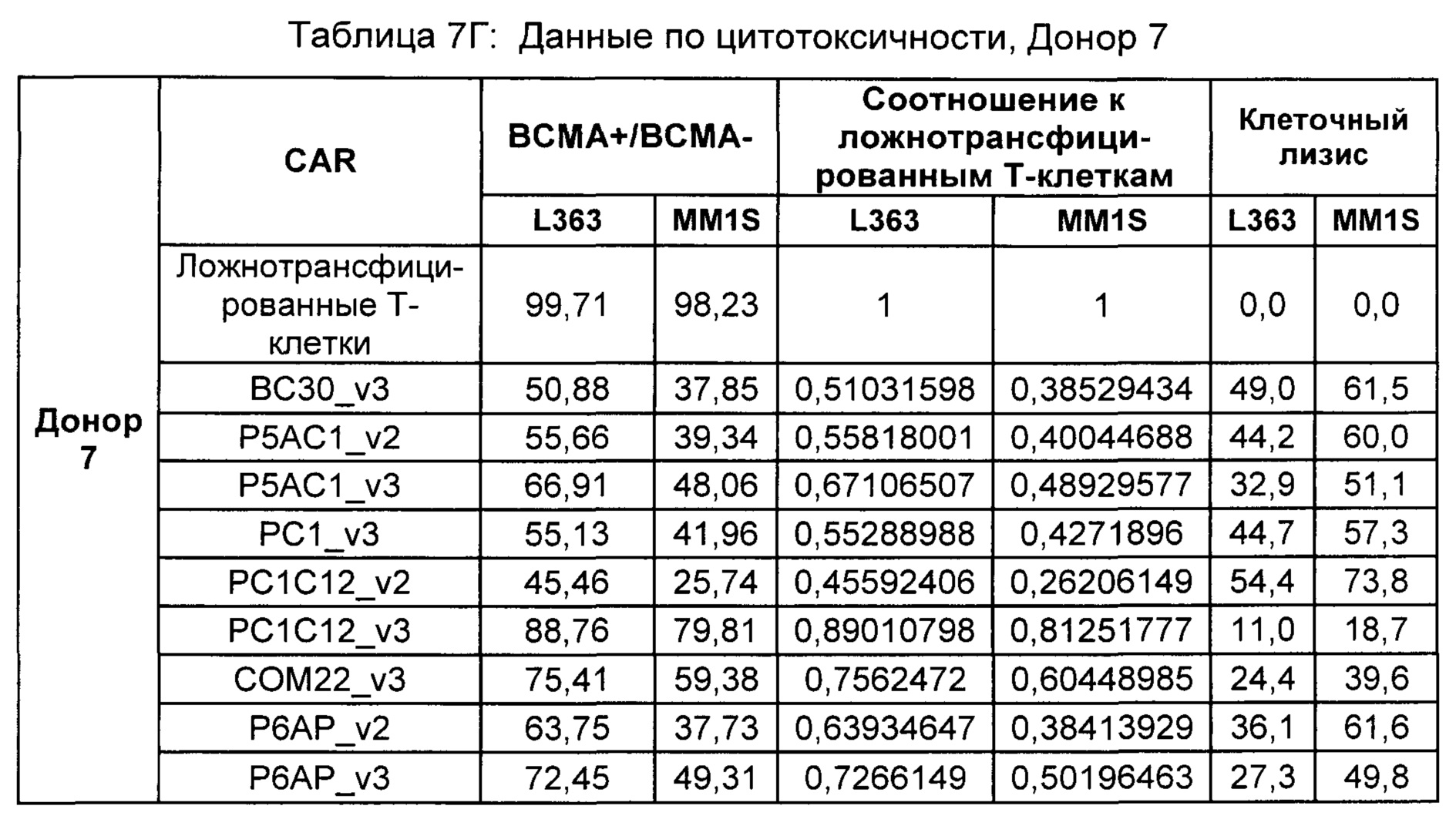
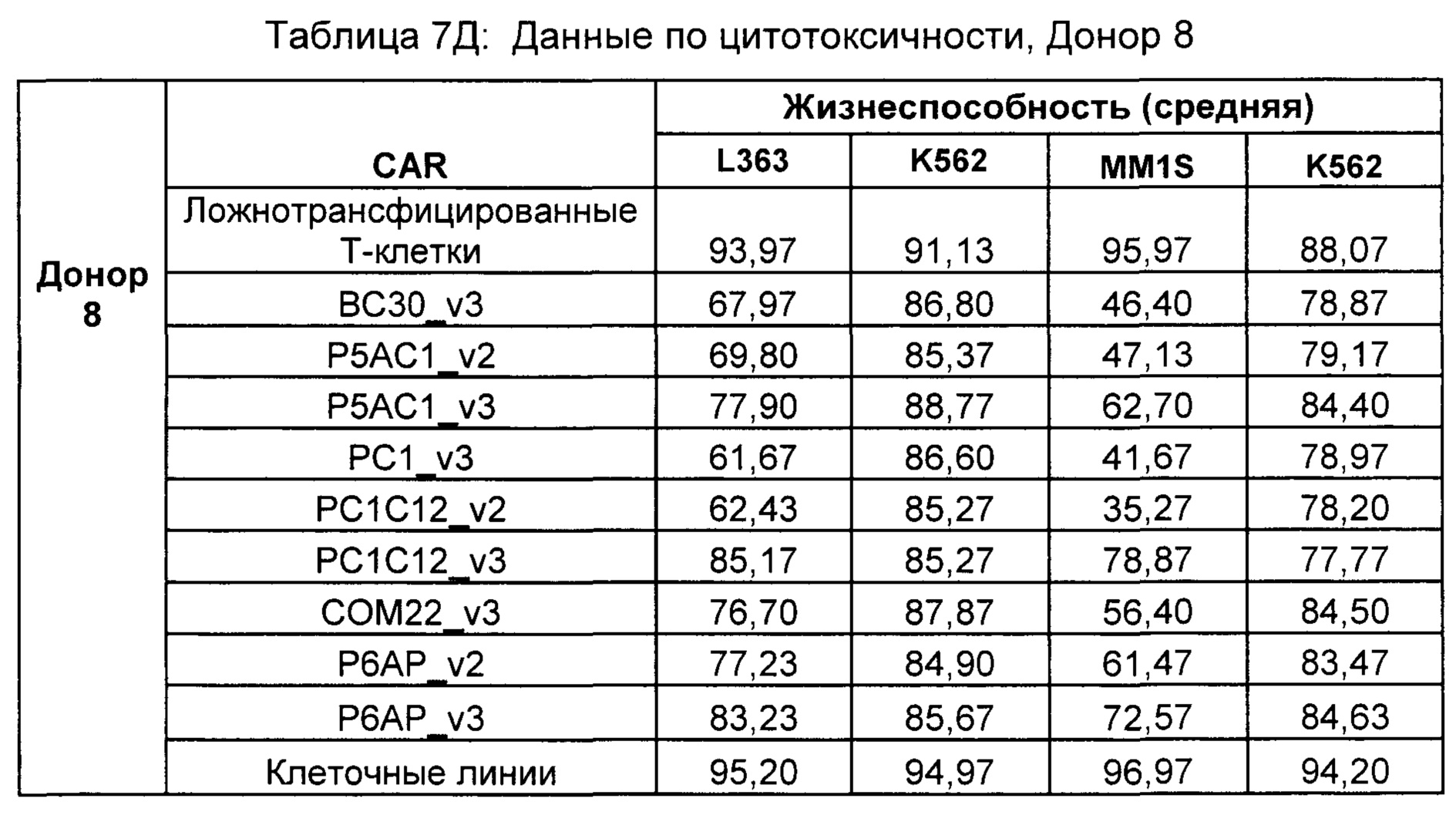
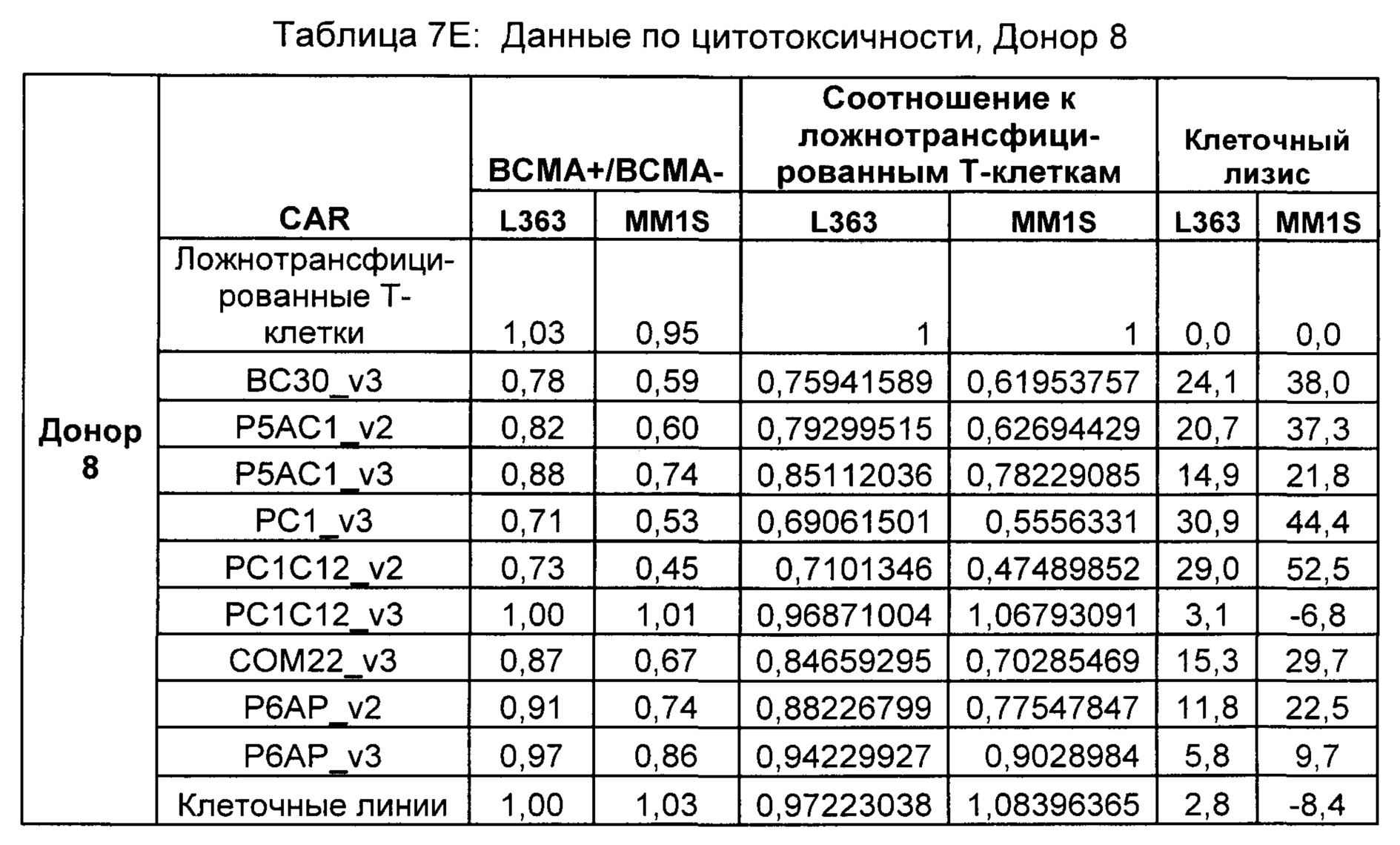
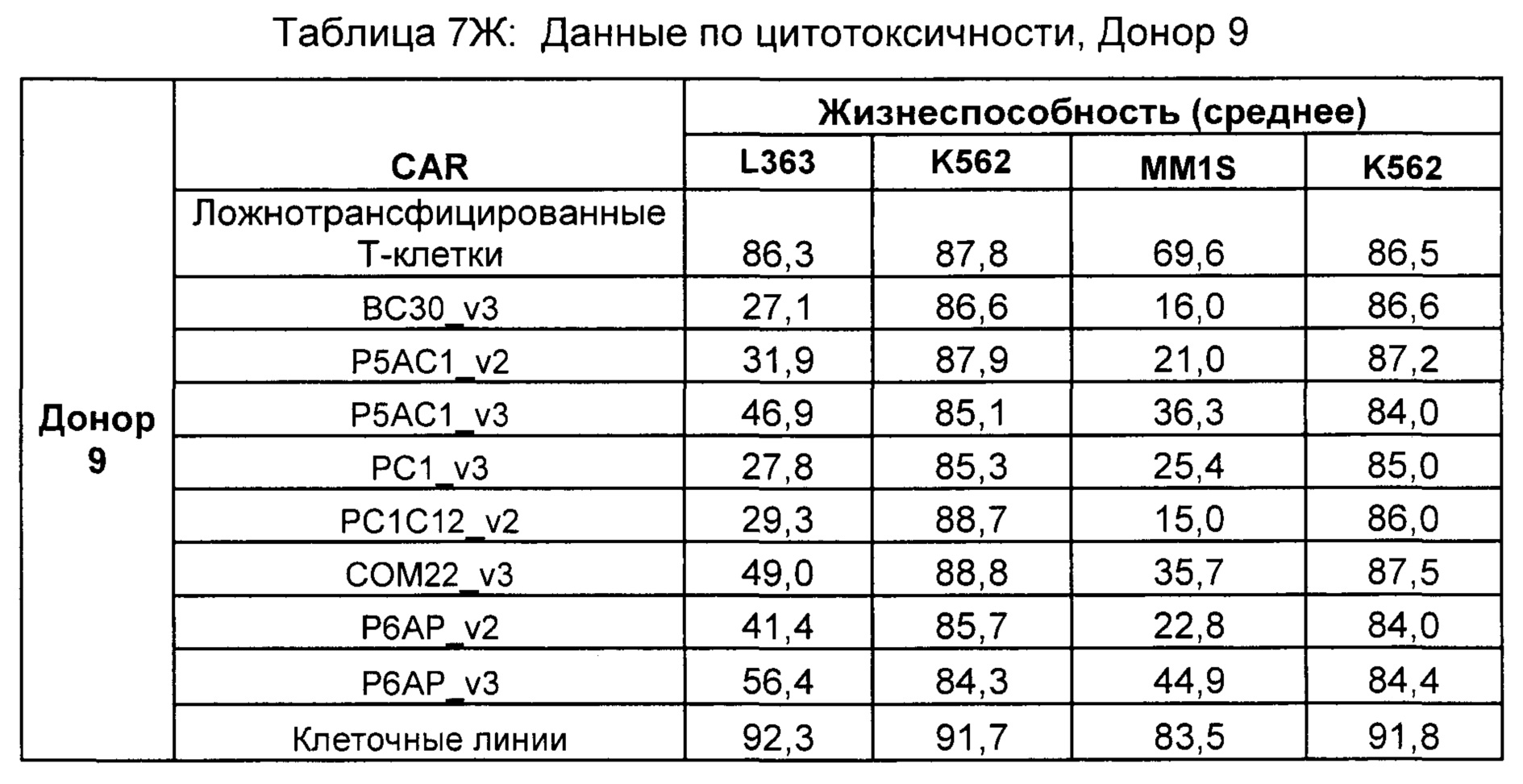
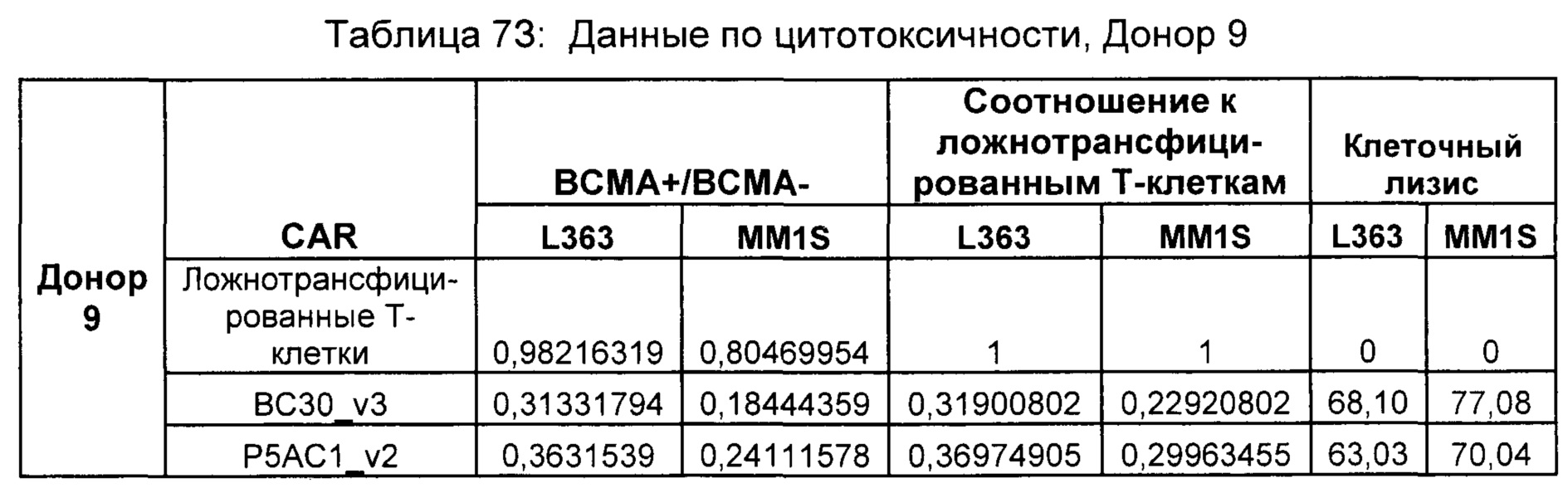
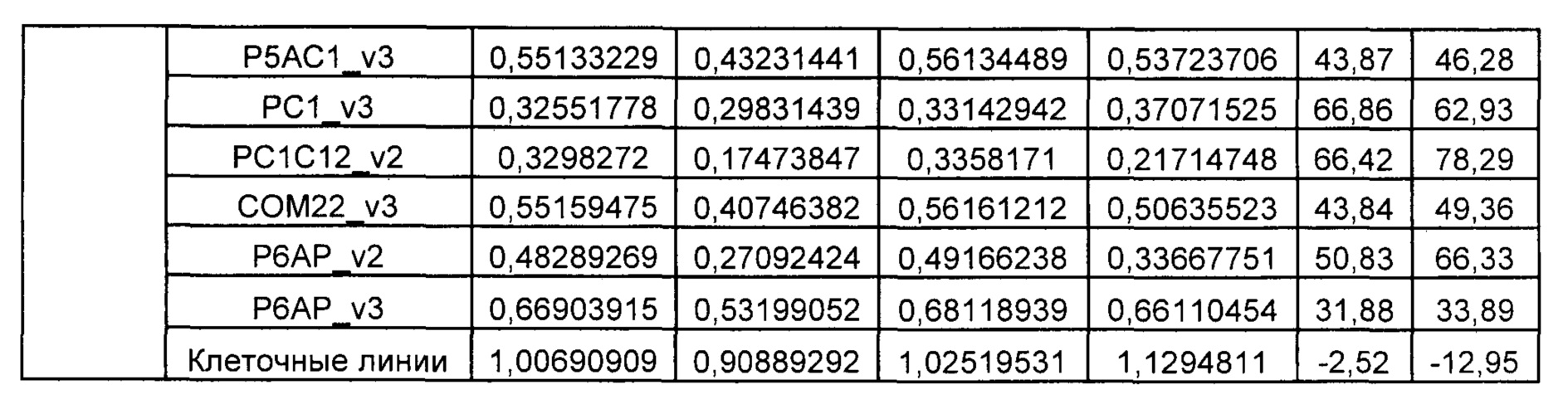
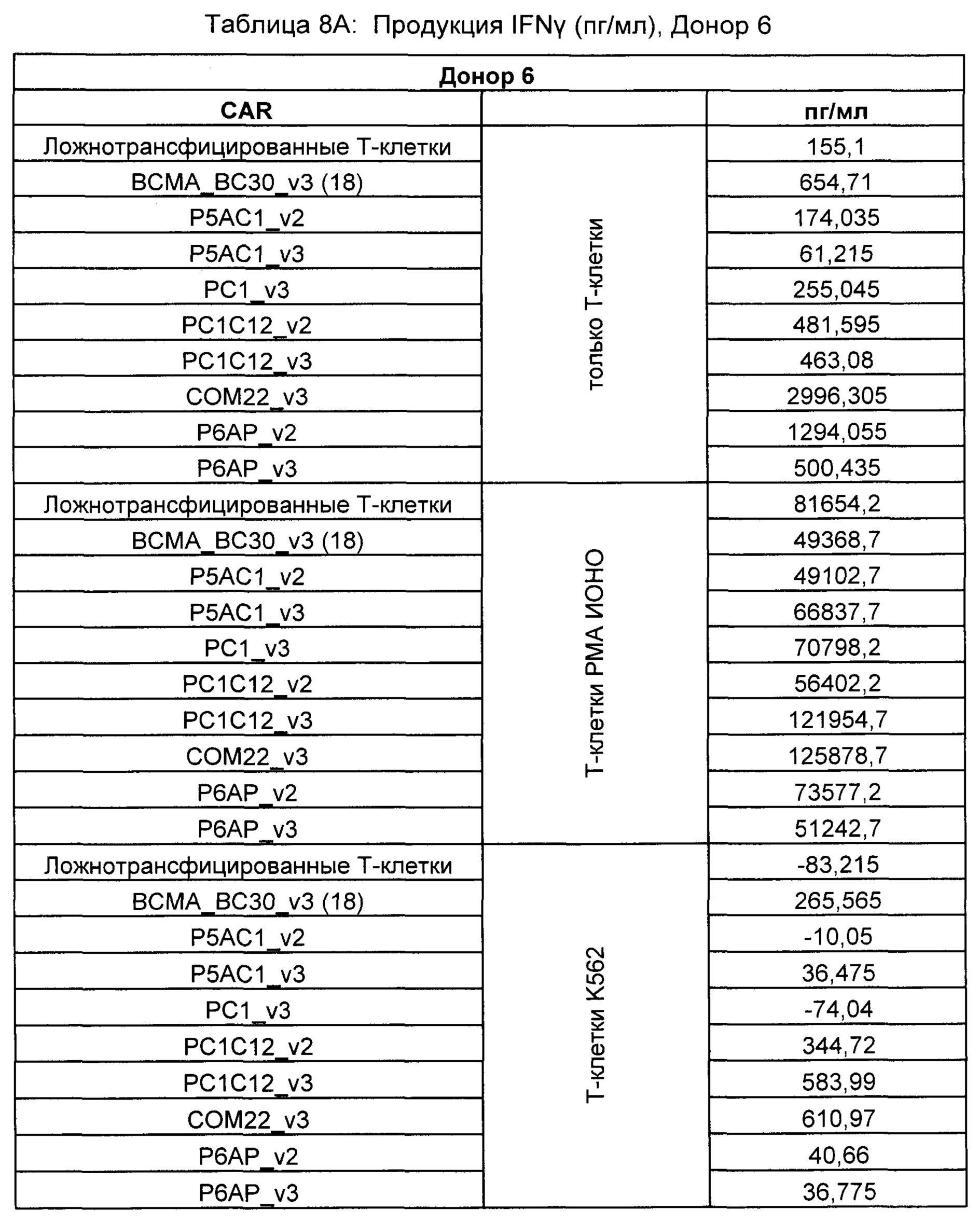
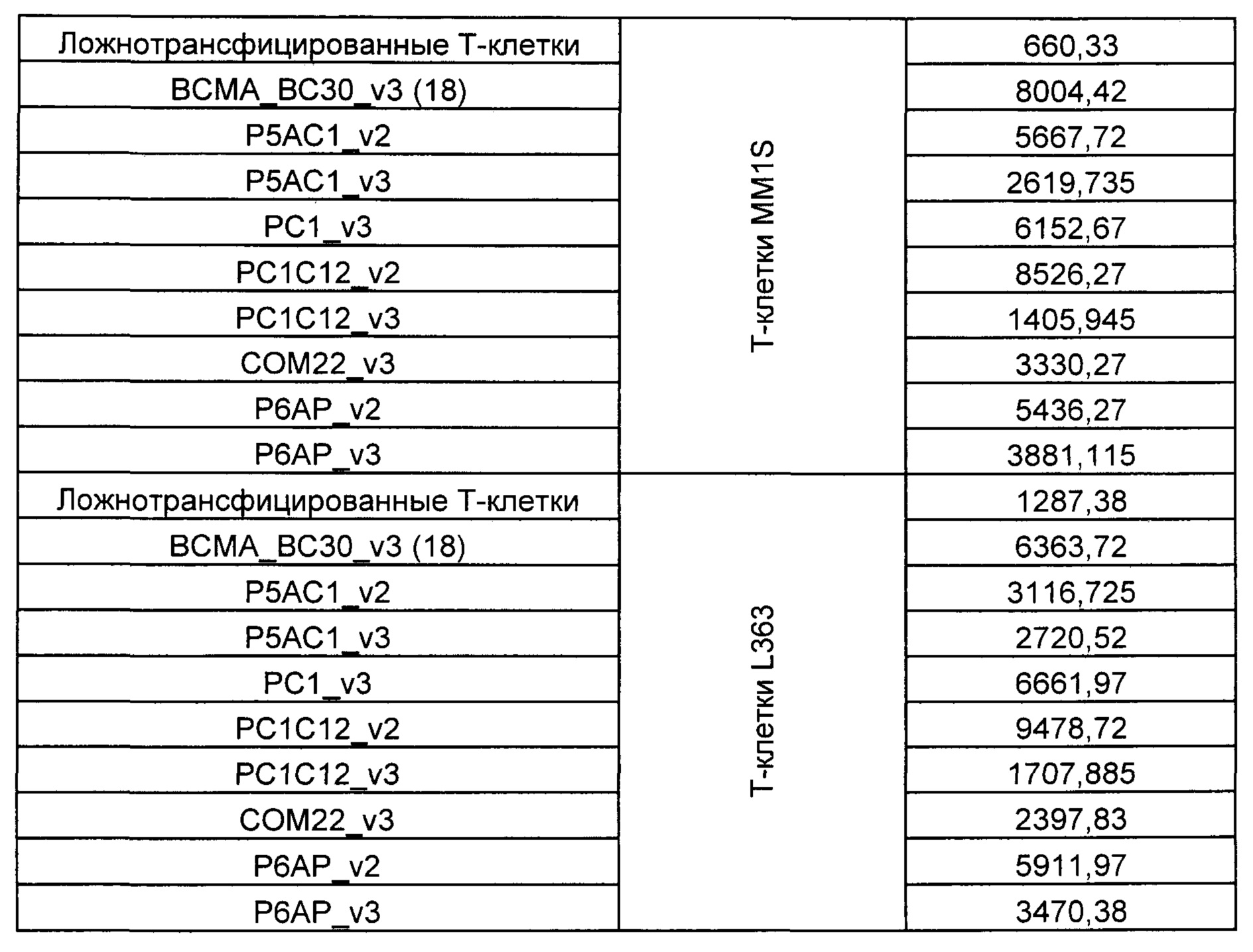
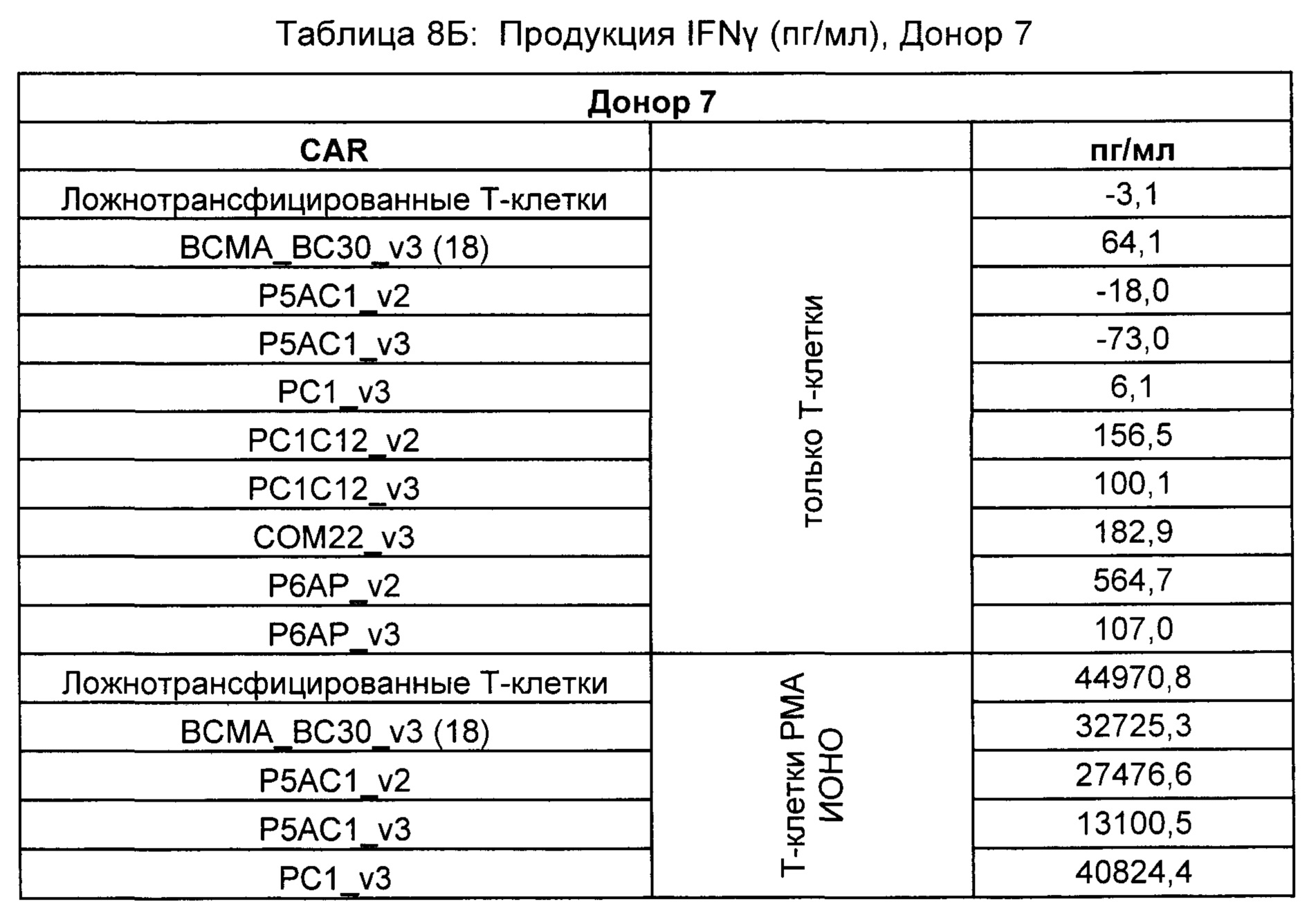
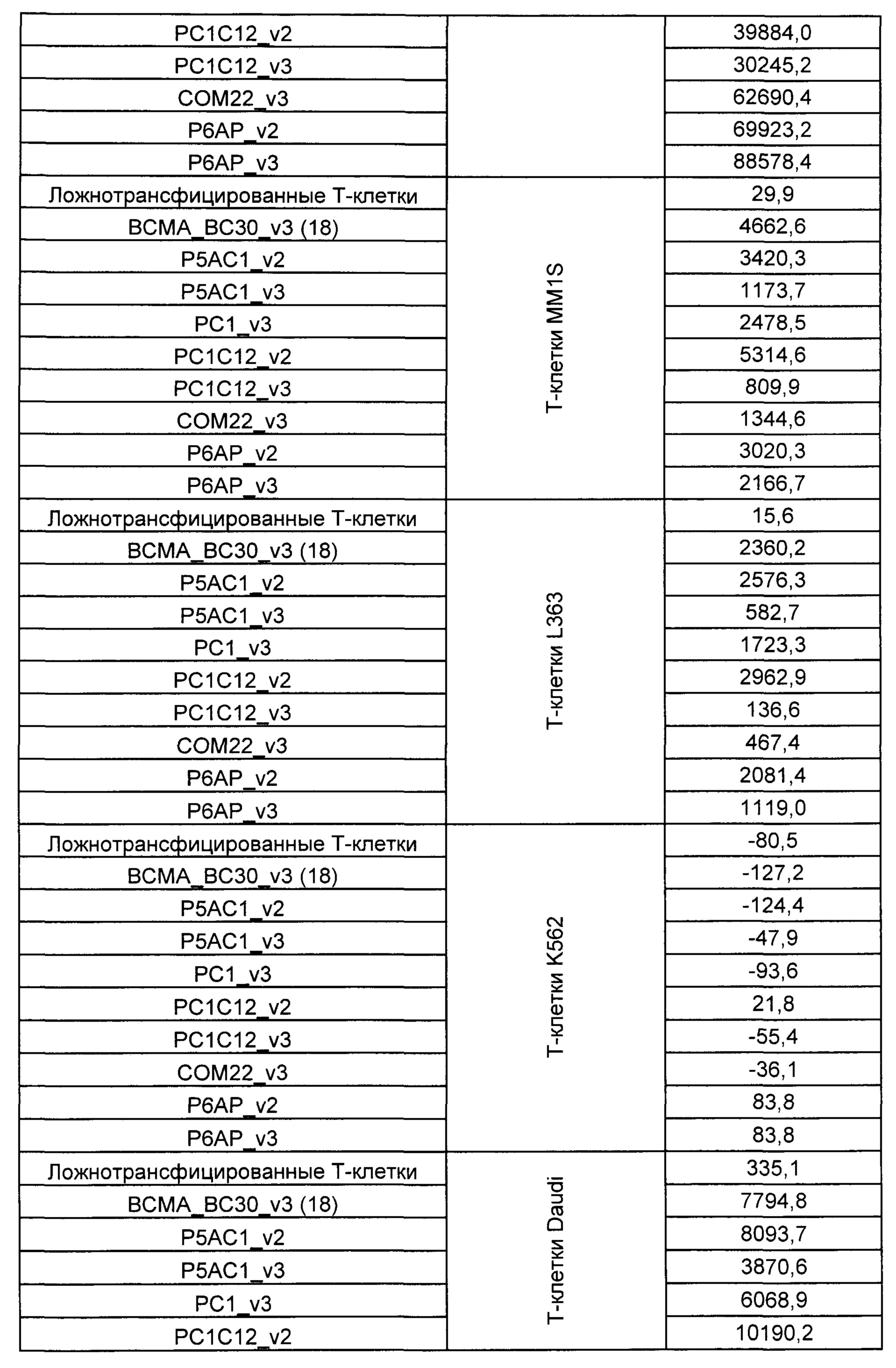
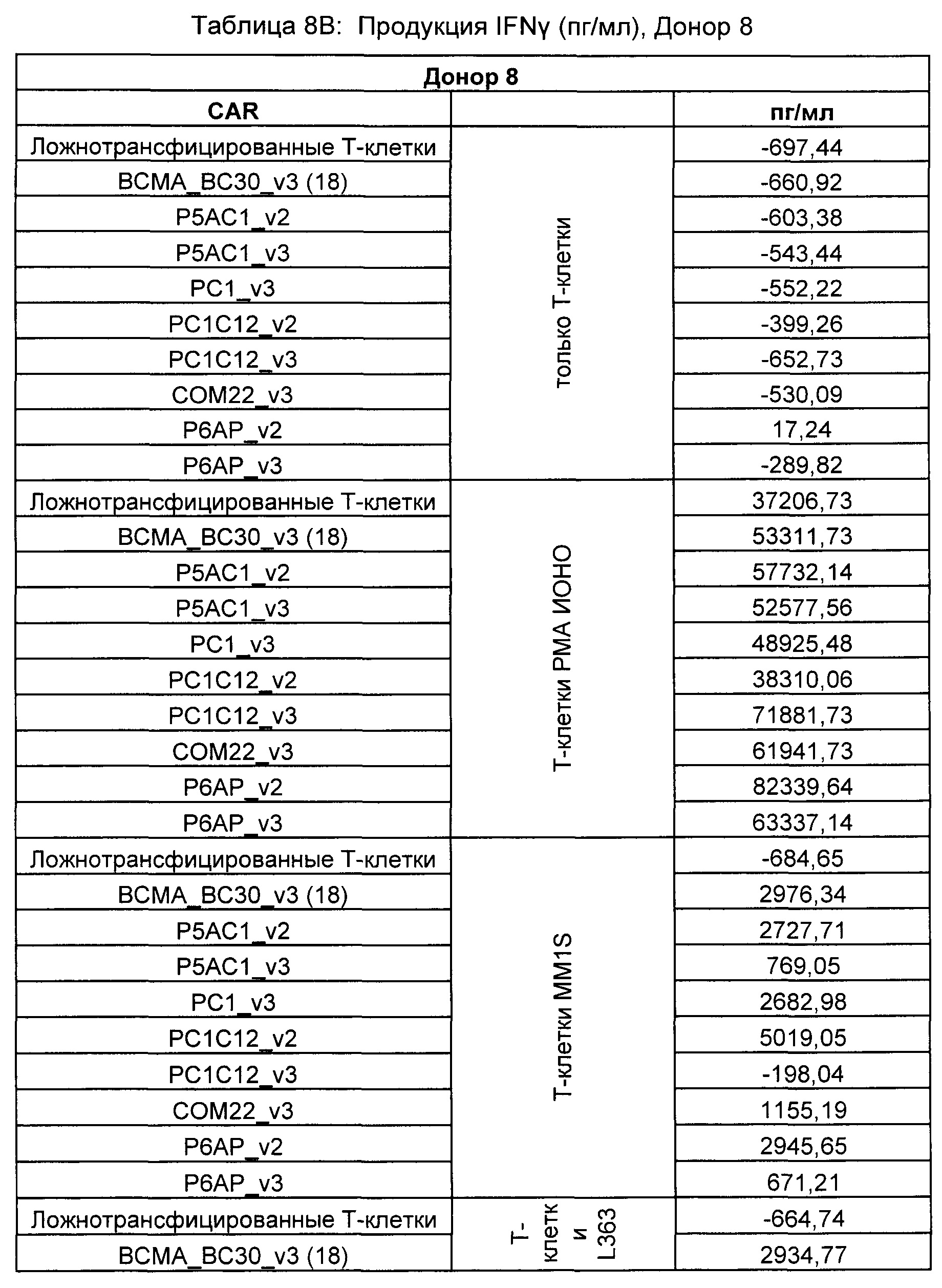
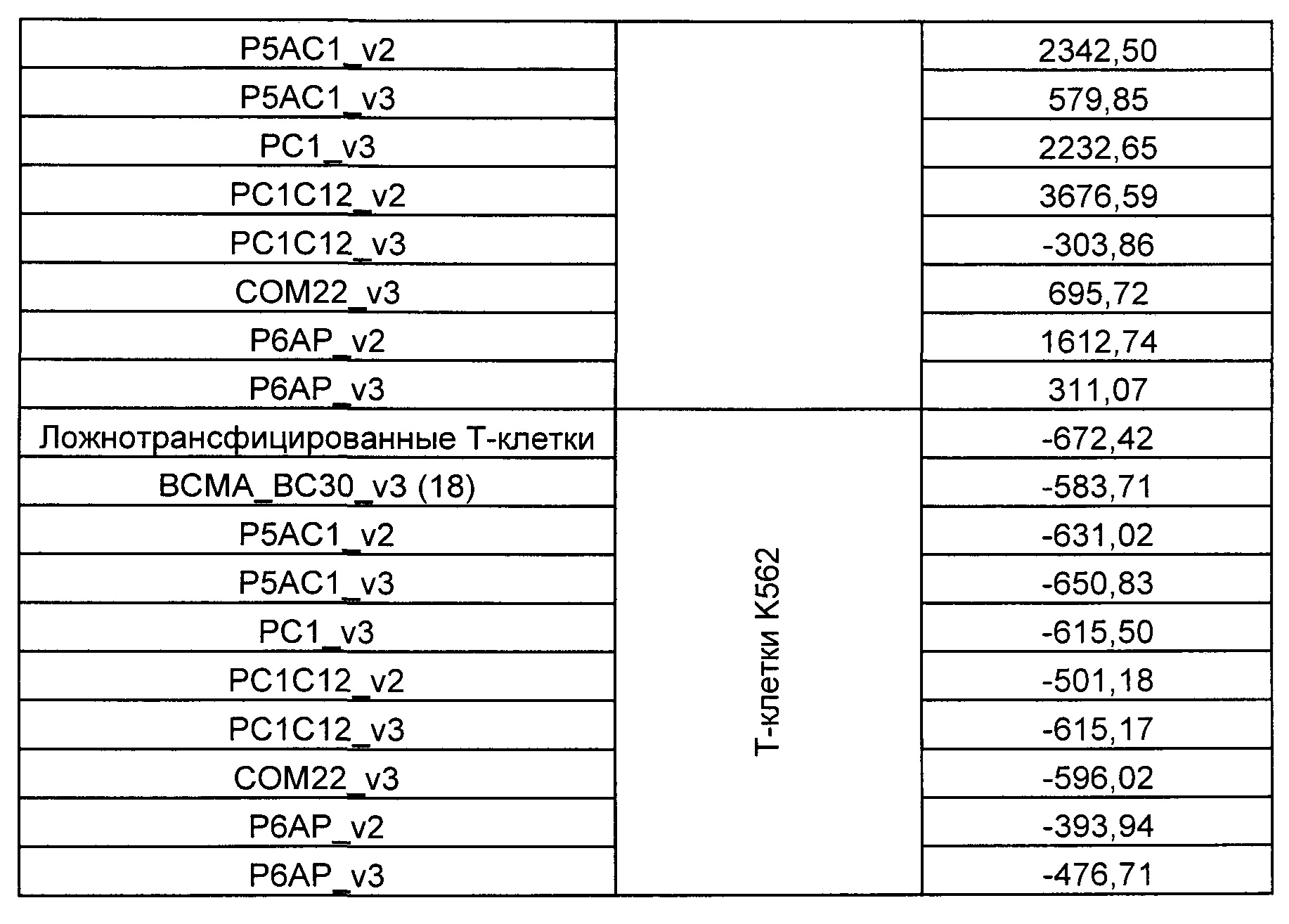
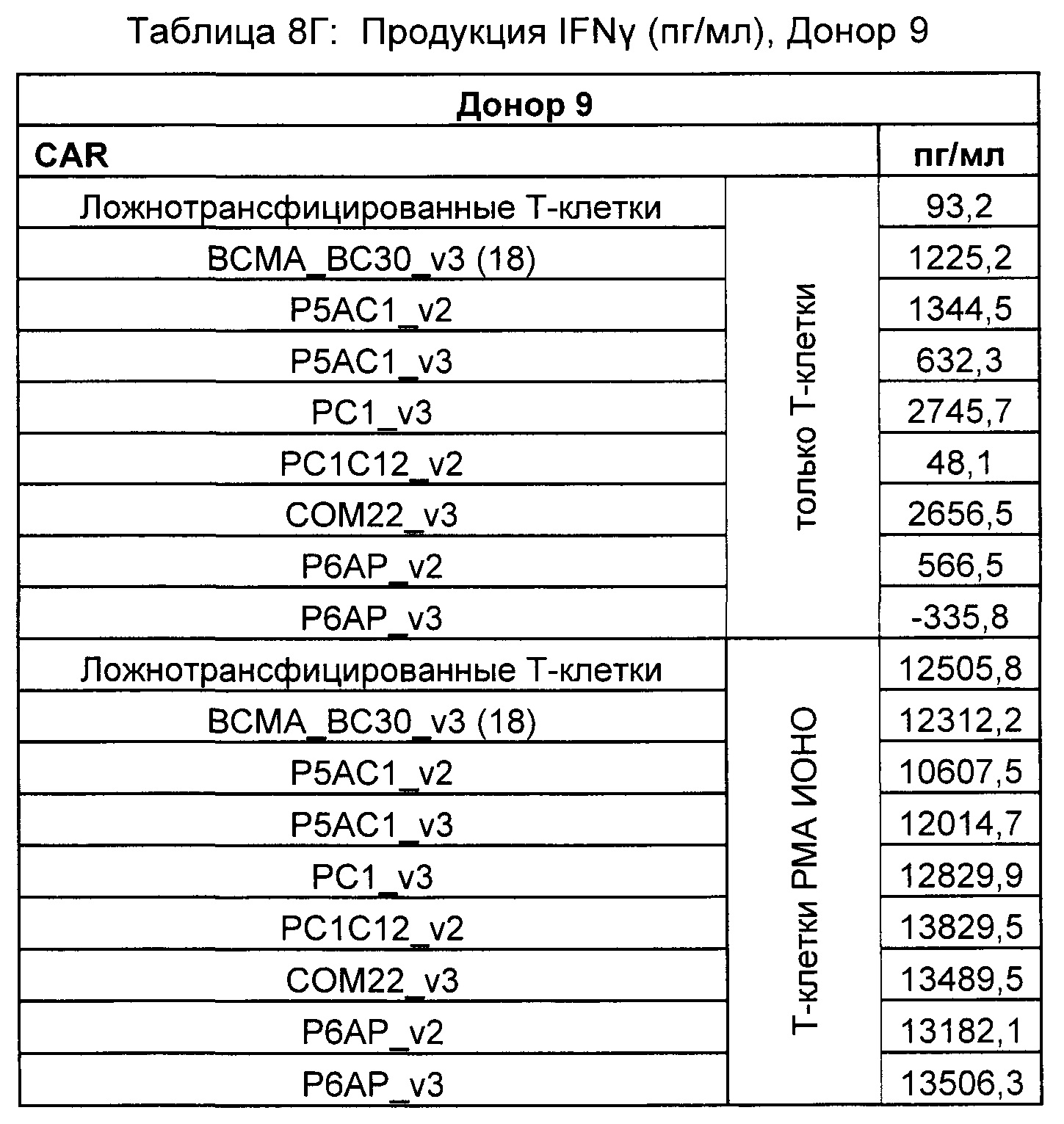
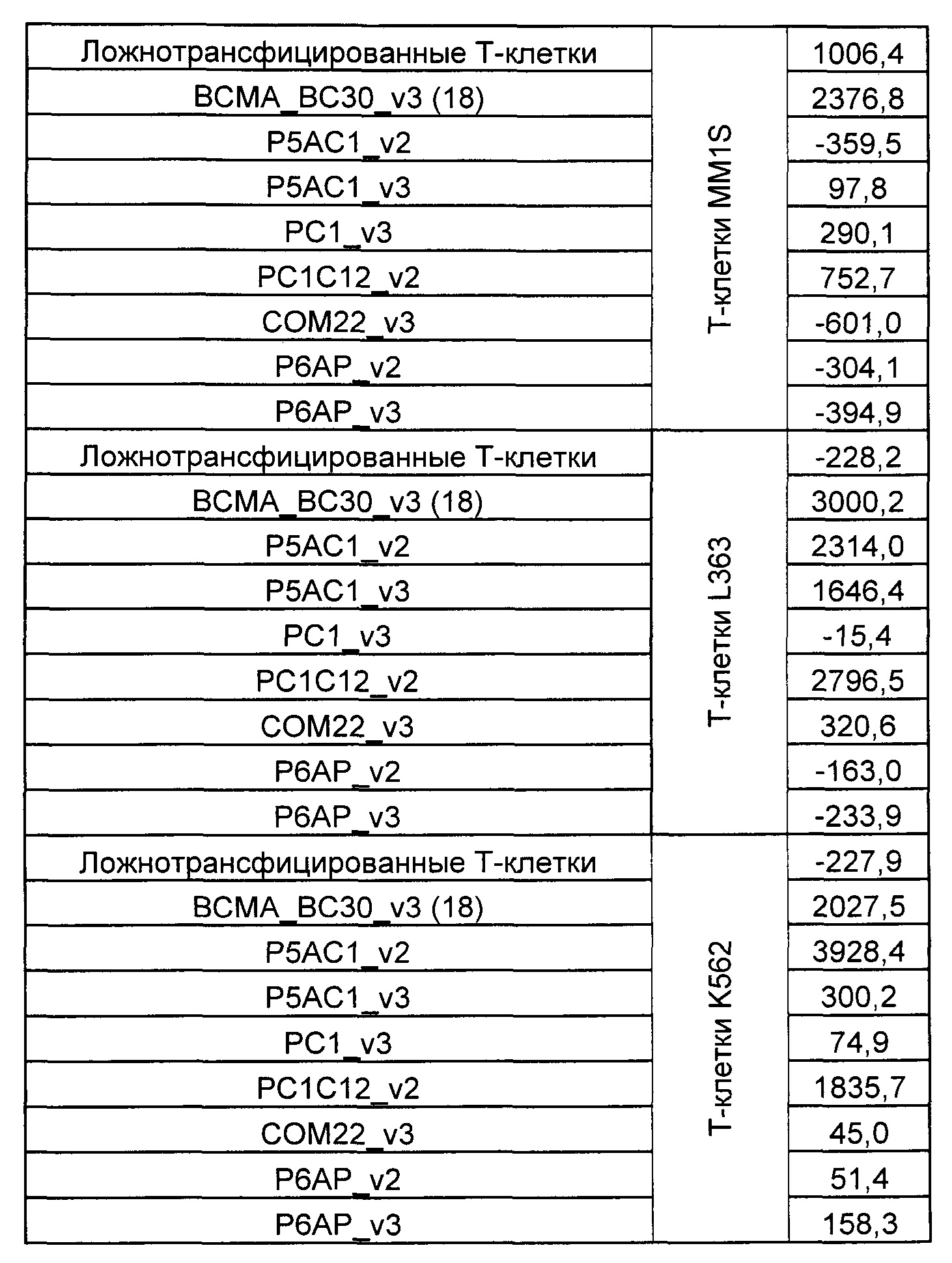
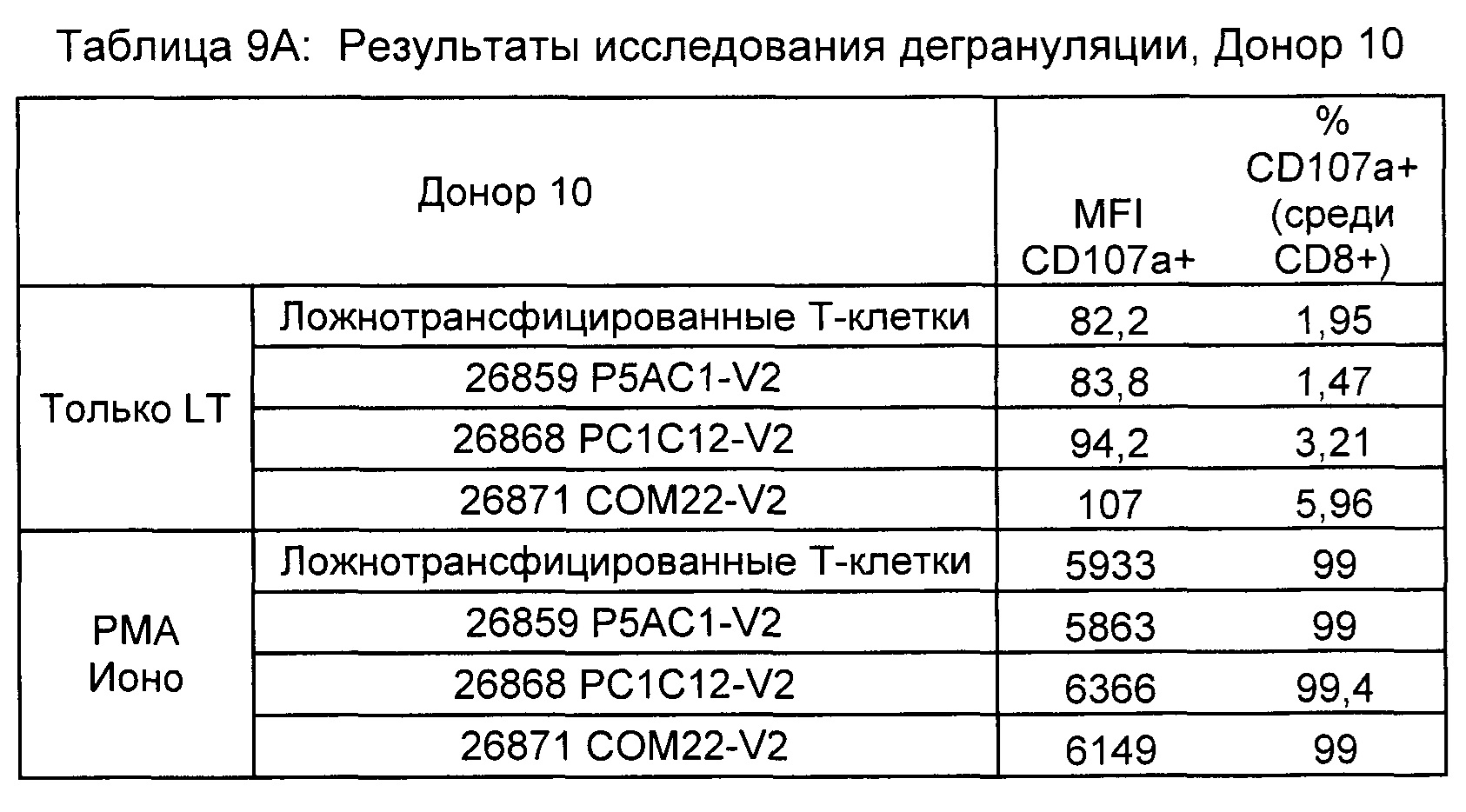
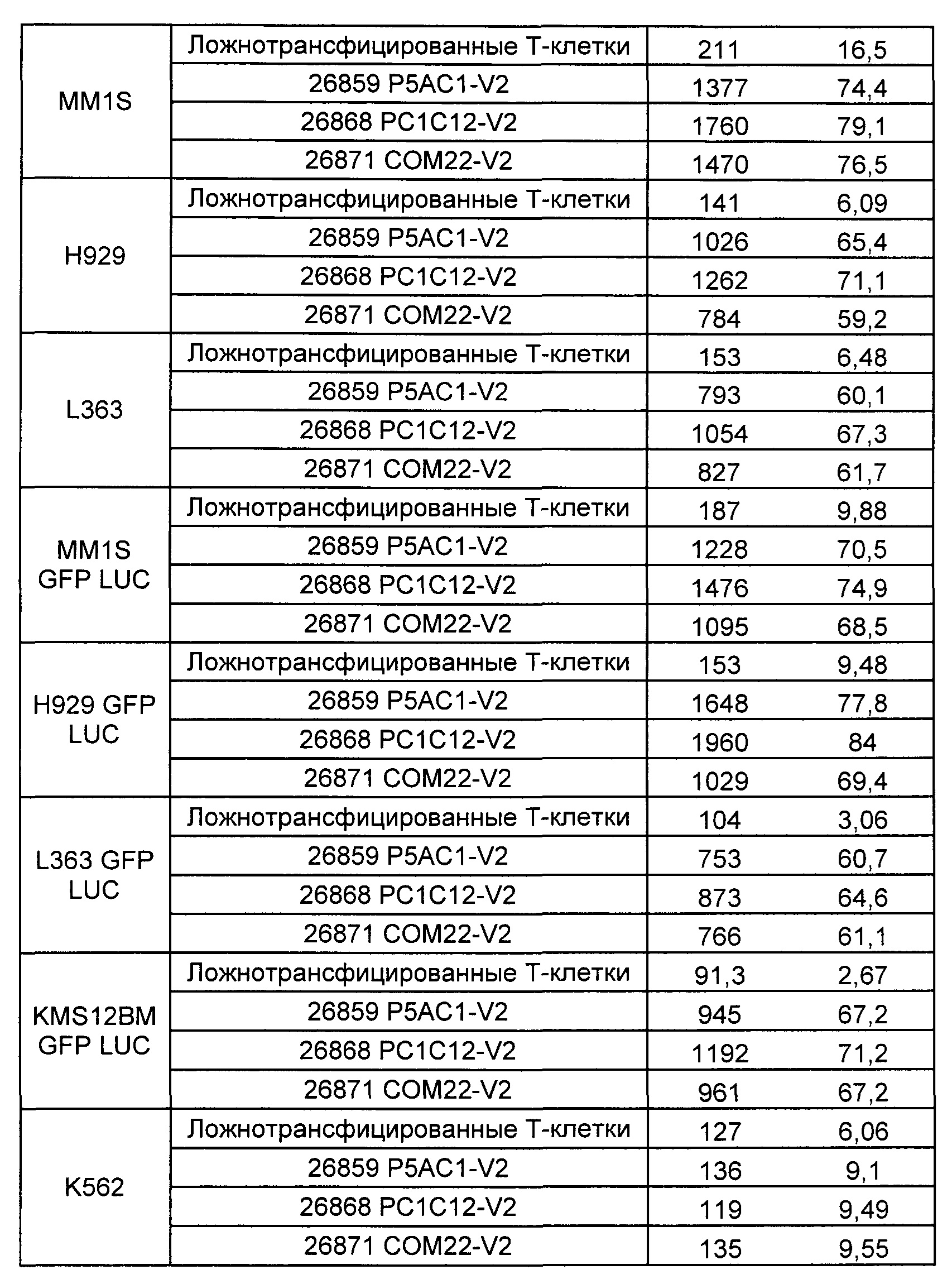

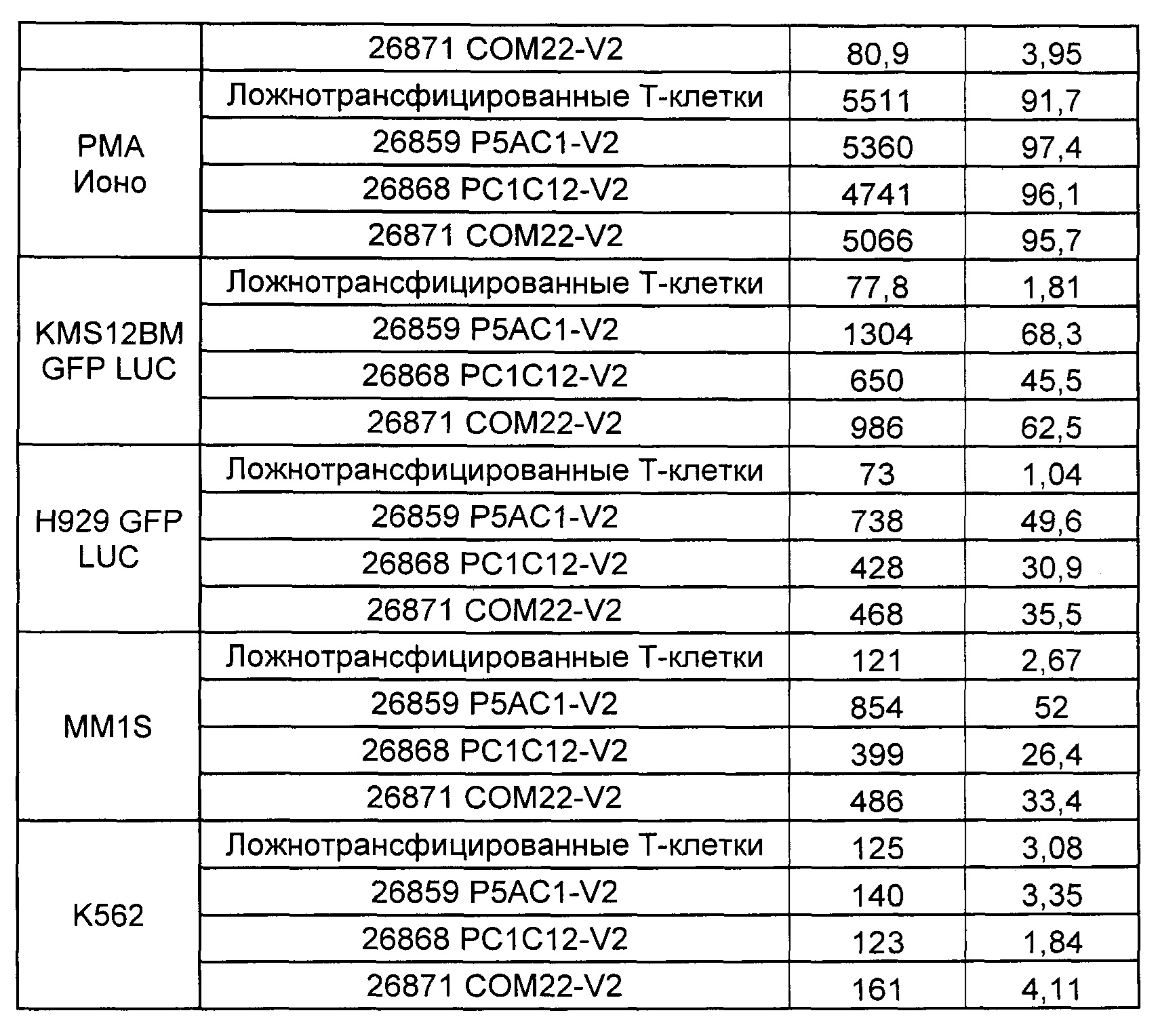
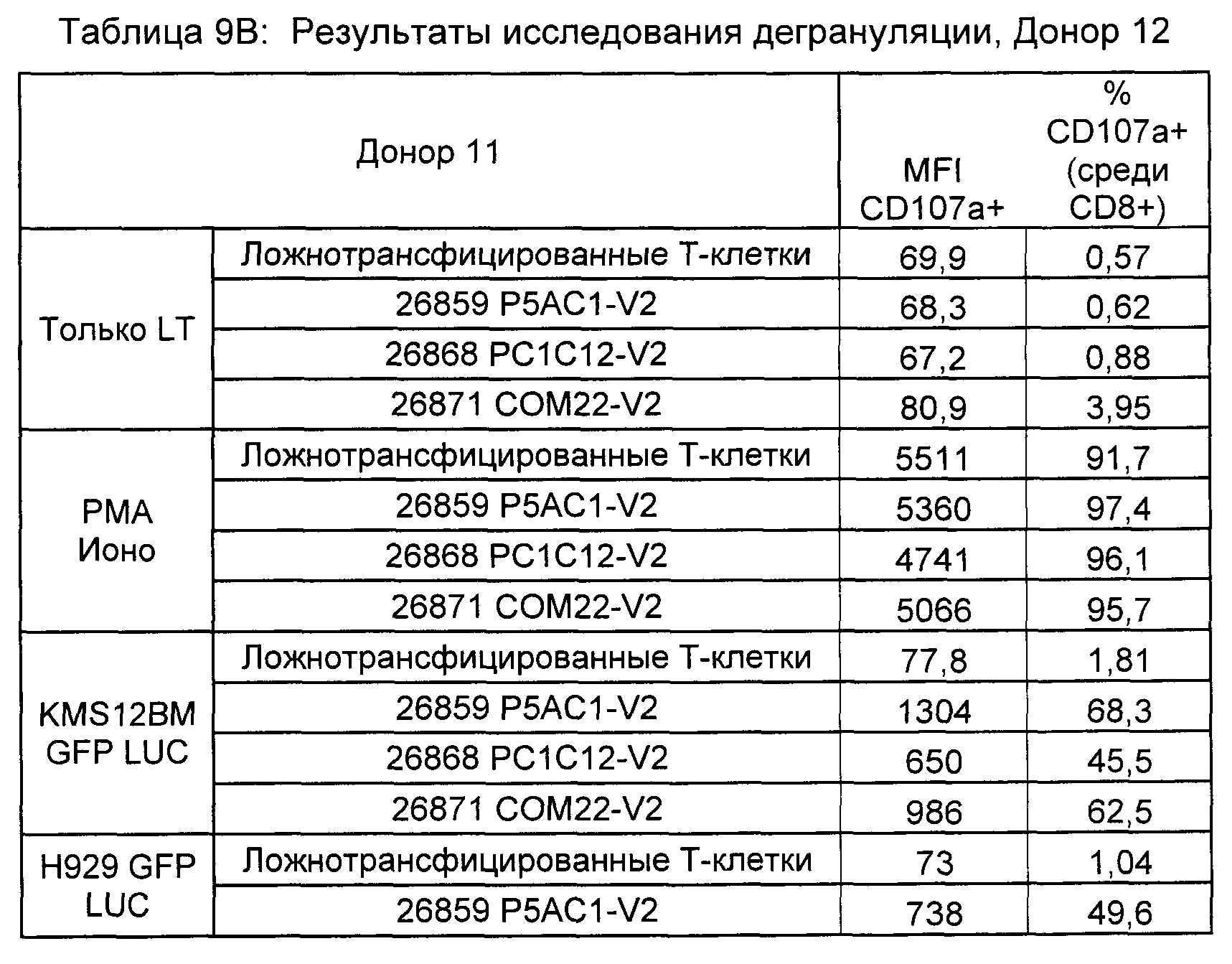
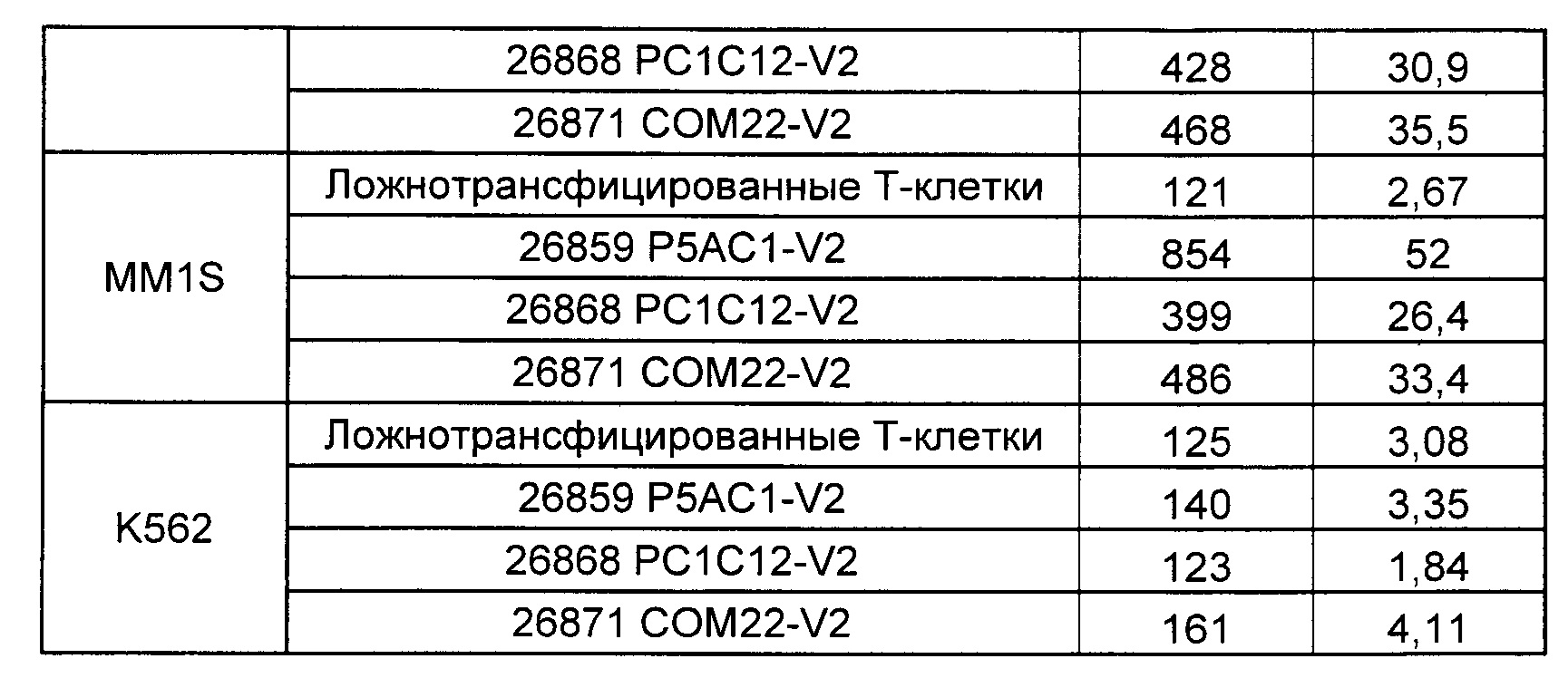
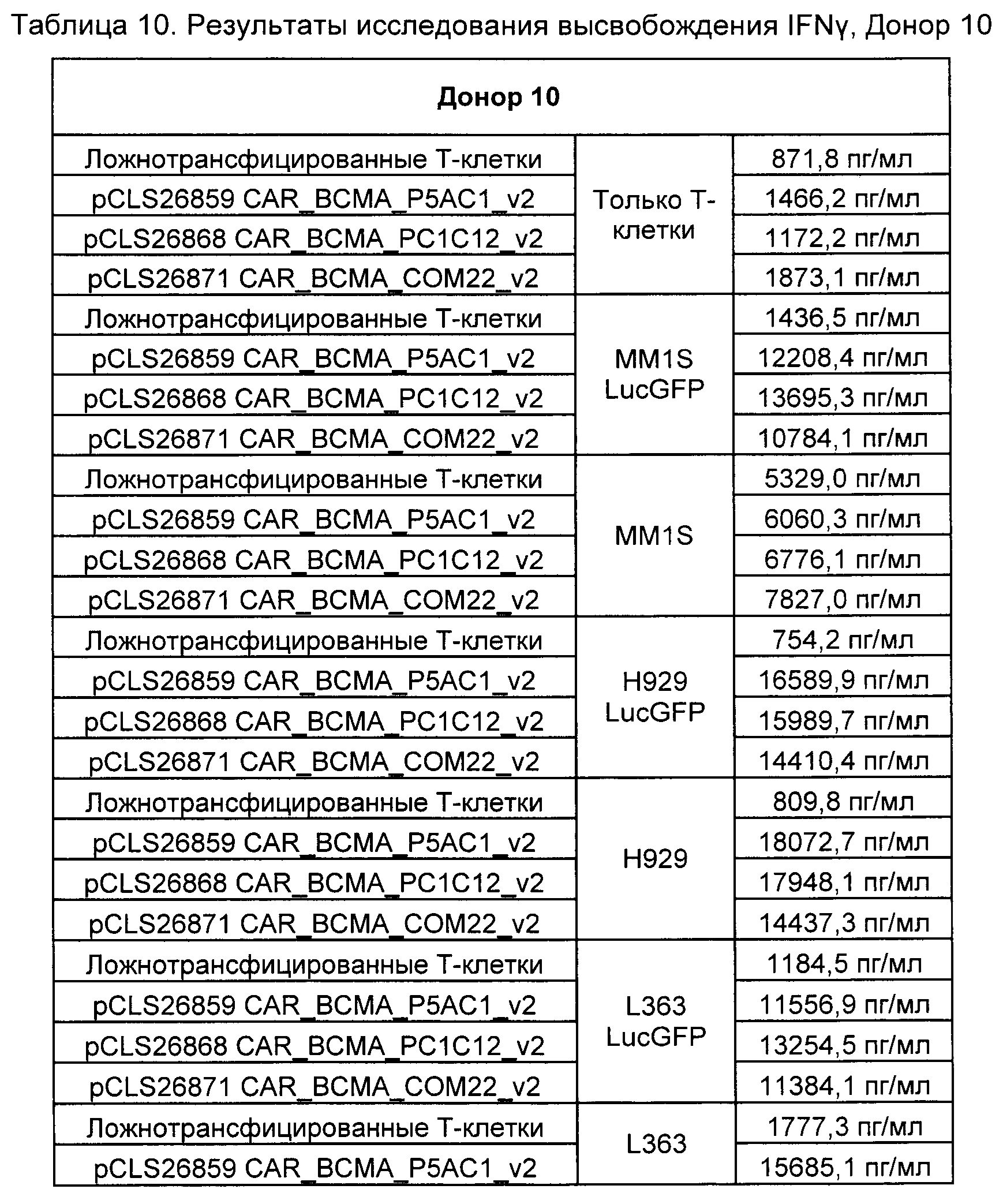
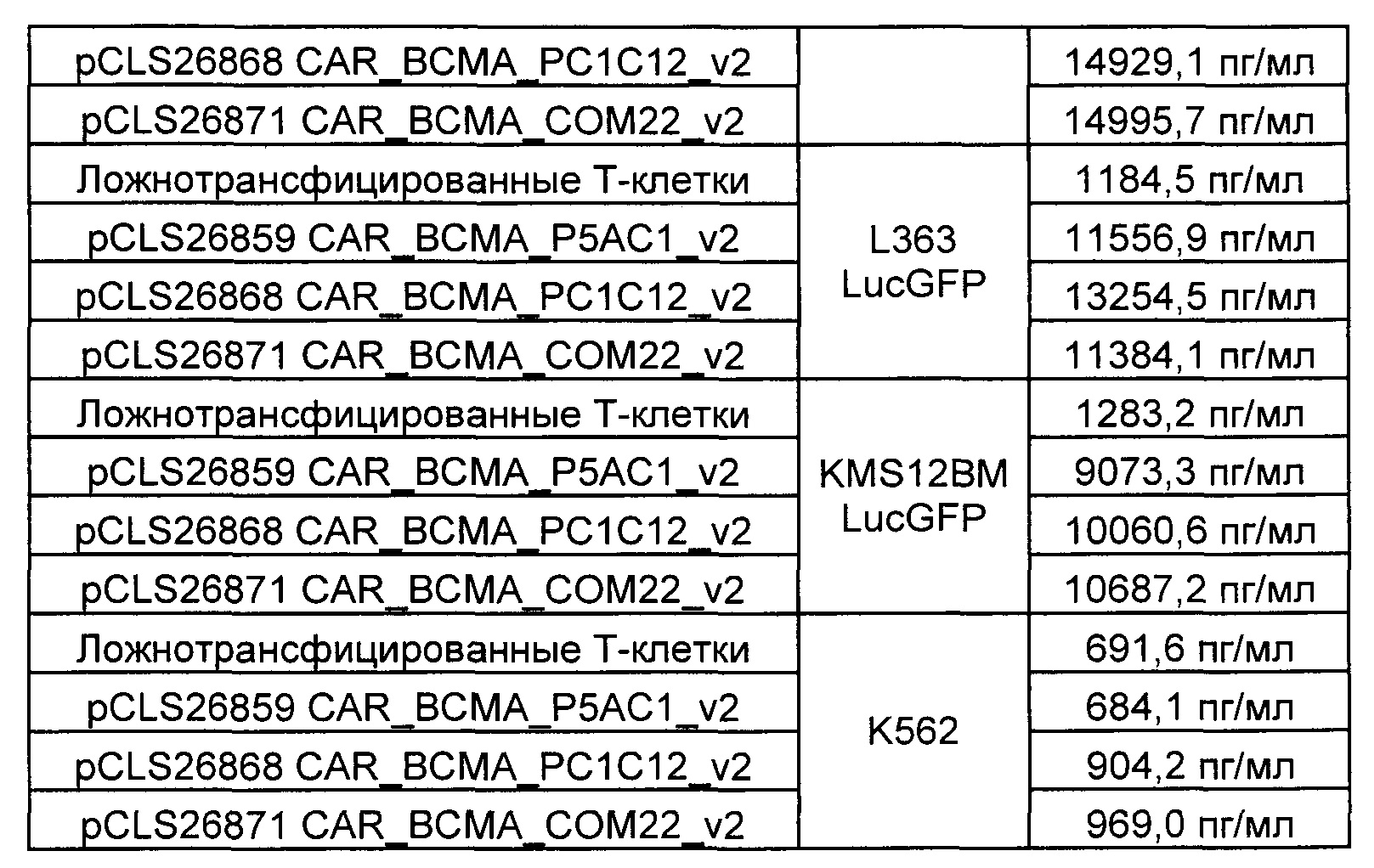
Пример 3. ВСМА-специфические CAR-Т клетки индуцируют регрессию опухоли на модели опухоли MM1.S
Данный пример иллюстрирует лечение опухолей посредством ВСМА-специфических CAR-T клеток с использованием модели опухоли MM1.S.
Исследование эффективности in vivo ВСМА-специфических CAR-T клеток выполняли на ортотопической модели MM1.S, экспрессирующей люциферазу и GFP (зеленый флуоресцентный белок). Пять миллионов клеток MM1.S Luc2AGFP инъецировали внутривенно в хвостовую вену самкам животных Nod/Scid/IL2Rg-/-(NSG) в возрасте 6-8 недель. Внутрибрюшинная инъекция D-люциферина (Regis Technologies, Morton Grove, IL) (200 мкл на животное по 15 мкг/мл) с последующей анестезией посредством изофлурана и дальнейшей биолюминесцентной визуализацией (BLI) всего организма позволяют отслеживать опухолевую нагрузку. Биолюминесцентные сигналы, испускаемые при взаимодействии между люциферазой, экспрессируемой опухолевыми клетками, и люциферином, регистрировали при помощи системы IVIS Spectrum СТ (Perkin Elmer, MA) и оценивали количественно как суммарную интенсивность светового потока (фотоны/сек) с использованием программы Living Image 4.4 (Caliper Life Sciences, Alameda, CA).
В данном исследовании использовали три различных варианта ВСМА-специфических CAR-T клеток: Т-клетки, экспрессирующие ВСМА-специфические CAR-конструкции P5AC1-V2, PC1C12-V2 или COM22-V2 (см. Таблицу 5, выше). Нетрансдуцированные контрольные Т-клетки служили отрицательным контролем. Все Т-клетки были лишены TCRα в результате инженерии.
Когда суммарная интенсивность светового потока достигала в среднем 45Е6 для всех животных (20 сутки после имплантации опухоли), животных рандомизировали на 4 группы. Однократную дозу человеческих ВСМА-специфических CAR-T клеток или нетрансдуцированных контрольных Т-клеток вводили посредством болюсной инъекции в хвостовую вену. Животных подвергали эвтаназии при возникновении паралича задних конечностей или потере 20% массы тела, конечной точке для ортотопической модели MM1.S.
Результаты исследования представлены на Фиг. 1. На Фиг. 1 суммарная интенсивность светового потока [имп/с] отображает прогрессирование опухоли. Лечение посредством ВСМА-специфических CAR-T клеток (треугольники, ромбы, квадраты) приводила к уменьшению суммарной интенсивности светового потока по сравнению с отрицательным контролем (круги). Таким образом, лечение посредством ВСМА-специфических CAR-T клеток подавляло прогрессирование опухоли по сравнению с отрицательным контролем.
Эти результаты демонстрируют, что ВСМА-специфические CAR-T клетки эффективно индуцируют регрессию опухоли.
Пример 4. Терапия множественной миеломы с помощью ВСМА-специфических CAR-T клеток
Данный пример иллюстрирует лечение множественной миеломы посредством ВСМА-специфических CAR-T клеток с использованием ортотопической модели Molp8.
Исследование эффективности in vivo ВСМА-специфических CAR-T клеток выполняли на ортотопической модели с клетками Molp8, экспрессирующими люциферазу и GFP. Два миллиона клеток Molp8 Luc2AGFP инъецировали внутривенно в хвостовую вену самкам животных NSG в возрасте 6-8 недель. Внутрибрюшинная инъекция D-люциферина (Regis Technologies, Morton Grove, IL) (200 мкл на животное по 15 мкг/мл) с последующей анестезией посредством изофлурана и дальнейшей биолюминесцентной визуализацией всего организма (BLI) позволяют отслеживать опухолевую нагрузку. Биолюминесцентные сигналы, испускаемые при взаимодействии между люциферазой, экспрессируемой опухолевыми клетками и люциферином, регистрировали при помощи системы MS Spectrum CT (Perkin Elmer, MA) и оценивали количественно как суммарную интенсивность светового потока (фотоны/сек) с использованием программы Living Image 4.4 (Caliper Life Sciences, Alameda, CA).
Когда суммарная интенсивность светового потока достигала в среднем 30Е6 для всех животных (8 сутки после имплантации опухоли), животных рандомизировали на три группы. Каждой группе вводили один из следующих вариантов клеток: (1) нетрансдуцированные Т-клетки с нокаутом TCR («TCR KO»), служившие контролем, (2) ВСМА-специфические CAR-T клетки, экспрессирующие P5AC1-V2.1 («Р5АС1 V2 R2 TCR KO») или (3) ВСМА-специфические CAR-T клетки, экспрессирующие Р5АС1-V2 и суицидальный полипептид RQR8 («Р5АС1 V2 RQR8 TCR KO»). Все варианты клеток 1-3 были лишены TCRα. ВСМА-специфические CAR-T клетки получали, как описано в Примере выше. ВСМА-специфические CAR-конструкции P5AC1-V2.1 и Р5АС1-V2 приведены в Таблице 5 выше. Контрольные (TCR KO) или ВСМА-специфические CAR-T клетки (Р5АС1 V2 R2 TCR KO или Р5АС1 V2 RQR8 TCR KO) вводили в хвостовую вену посредством болюсной инъекции в однократной дозе 3 миллиона. Животных подвергали эвтаназии при потере 15% массы тела, конечной точке для ортотопической модели Molp8.
Результаты исследования представлены на Фиг. 2. Однократная доза 3 миллиона ВСМА-специфических CAR-T клеток Р5АС1 R2 TCRKO (квадраты) или CAR-T клеток Р5АС1 RQR8 TCRKO (треугольники) приводила к снижению суммарной интенсивности светового потока через 10-35 суток после имплантации опухоли по сравнению с отрицательным контролем (круги) (Фиг. 2). Таким образом, лечение посредством ВСМА-специфических CAR-T клеток подавляла прогрессирование опухоли по сравнению с отрицательным контролем.
Эти результаты демонстрируют, что ВСМА-специфические CAR-T клетки эффективно подавляют прогрессирование опухоли.
Пример 5. Лечение множественной миеломы с помощью ВСМА-специфических CAR-T клеток
Данный пример иллюстрирует терапевтическую активность ВСМА-специфических CAR-Т клеток на ортотопических моделях множественной миеломы у мышей.
Для оценки эффективности ВСМА-специфических CAR-T клеток против линий клеток миеломы человека, экспрессирующих ВСМА, использовали две гуманизированные мышиные модели. Самок мышей Nod/Scid IL2rg-/- (NSG) в возрасте 6-8 недель приобрели в компании Jackson Laboratories, Всех животных содержали в свободном от патогенов виварии в г. Ринат и проводили эксперименты согласно протоколам, соответствующим рекомендациям комитета по содержанию и использованию лабораторных животных (IACUC).
Клеточные линии MM1.S и Molp-8 приобрели в Американской коллекции типовых культур (ATCC.org) и Немецкой коллекции микроорганизмов и клеточных культур (DSMZ.de). Используя лентивирусные частицы (amsbio), подвергали инженерии клеточные линии с тем, чтобы они экспрессировали слитый белок Luc-GFP. Клетки культивировали в среде RPMI 1640 с L-глутамином с добавлением либо 10% эмбриональной телячьей сыворотки (FCS) для клеток MM1.S, либо 20% FCS для клеток Molp-8 при 37°С в 5% диоксиде углерода (CO2). Клетки, находящиеся в экспоненциальной фазе роста, собирали и использовали для инокуляции опухоли.
Терапевтические ВСМА-специфические CAR-T клетки получали, как описано. Клетки, полученные от здоровых людей-доноров, мононуклеарные клетки периферической крови (РВМС) или выделенные пан-Т-клетки активировали и трансдуцировали лентивирусными частицами, кодирующими ВСМА-специфические CAR и RQR8, находящиеся под контролем промотора EF-1a. В данном исследовании использовали три различных варианта ВСМА-специфических CAR: P5AC1-V2, PC1C12-V2 и COM22-V2 (см. Таблицу 5, выше). Осуществляли редактирование генома Т-клеток для делеции гена TCRα. Клетки культивировали в течение 14-17 суток и затем криоконсервировали в 90% FCS/10% DMSO (диметилсульфоксид). Для инъекции Т-клеток осуществляли быстрое размораживание Т-клеток в водяной бане при 37°С и дважды промывали средой RPMI 1640, содержащей 25 мМ Hepes. Клетки инъецировали в 0,2 мл RPMI 1640 с 25 мМ Hepes в хвостовую вену животных, несущих опухоль.
Мыши NSG получали тотальное облучение организма 1 Гр (RAD Source Technologies) за одни сутки до инокуляции опухолевых клеток. 5×106 MM1.S/Luc2-EGFP клеток или 2×106 Molp-8/Luc2-EGFP клеток инъецировали в хвостовую вену в 0,1 мл забуференного фосфатом физиологического раствора (PBS). Опухолевую нагрузку измеряли дважды в неделю, используя биолюминесцентную визуализацию. Мыши получали инъекции 3 мкг D-люциферина, растворенного в 0,2 мл PBS и анестезию изофлураном. Через 7 мин после инъекции проводили визуализацию животных с использованием системы камер Perkin Elmer MS Spectrum. Измеряли люминесценцию всего организма за исключением хвоста мыши и выражали опухолевую нагрузку как суммарную интенсивность светового потока (фотоны в секунду). Опухолям давали формироваться до начала экспоненциального роста. Животных рандомизировали на группы воздействия на основании суммарной интенсивности светового потока и вводили ВСМА-специфические CAR-T клетки или нетрансдуцированные контрольные Т-клетки от того же самого донора. Влияние лечения CAR-T клетками оценивали дважды в неделю с помощью биолюминесцентной визуализации и измерений массы тела. Конечной точкой в исследовании служило достижение первым животным терминальной стадии заболевания, на что указывала потеря массы тела (потеря более 20% от исходной массы тела), паралич задних конечностей или другие признаки дистресса животного. Статистический анализ проводили с использованием программы GraphPad Prism 6. Для сравнения противоопухолевой эффективности между всеми группами использовали однофакторный дисперсионный анализ с повторными измерениями с поправкой Тьюки. Значения Р меньше 0,05 считали статистически значимыми.
Результаты обобщены в Таблице 11 (MM1.S) и Таблице 12 (Molp-8) ниже (значения log10 суммарной интенсивности светового потока в фотонах в секунду +/- SEM (стандартная ошибка среднего)). Для сравнения ВСМА-специфических CAR-T клеток, имеющих различные scFv, использовали субоптимальную дозу CAR-T клеток. Группами ВСМА-специфических CAR-T клеток были P5AC1-V2, PC1C12-V2 и COM22-V2 (см. Таблицу 5, выше). На модели MM1.S в 17 сутки после имплантации опухоли осуществляли инъекцию 3,5×106 CAR-экспрессирующих Т-клеток. На модели Molp8 в 7 сутки после имплантации опухоли осуществляли инъекцию 4×106 CAR-экспрессирующих Т-клеток. Эффективность трансдукции варьировала от 19% до 29% для ВСМА-специфических CAR-T клеток, которые вводили в мышиной модели MM1.S и от 31% до 36% для ВСМА-специфических CAR-T-клеток, которые вводили в мышиной модели Molp8. В контрольной группе использовали эквивалентную дозу нетрансдуцированных Т-клеток. В контрольной группе, получавшей Т-клетки, наблюдался прогрессивный рост опухолей до достижения конечной точки исследования в 35 сутки в случае MM1.S и 23 сутки в случае Molp8. Статистический анализ опухолевой нагрузки, который проводили с использованием RM-ANOVA (однофакторного дисперсионного анализа с повторными измерениями) с поправкой Даннетта показал, что во всех трех группах, получавших ВСМА-специфические CAR-T, опухолевая нагрузка была значительно ниже по сравнению с опухолевой нагрузкой в контрольной группе (p меньше 0,01) (Таблицы 11 и 12). Например, на модели опухоли MM1.S среднее значение суммарной интенсивности светового потока у животных, получавших ВСМА-специфические CAR-T клетки P5AC1-V2, составило 6,44 log10 фотонов/с в 25 сутки по сравнению с 9,22 log10 фотонов/с у животных, получавших контрольные Т клетки (Таблица 11). В 35 сутки после имплантации опухоли среднее значение суммарной интенсивности светового потока у животных, получавших ВСМА-специфические CAR-T клетки P5AC1-V2, составило 6,82 log10 фотонов/с по сравнению с 10,18 log10 фотонов/с у животных, получавших контрольные Т-клетки (Таблица 11). На модели опухоли Molp8 среднее значение суммарной интенсивности светового потока у животных, получавших ВСМА-специфические CAR-T клетки P5AC1-V2, составило 7,88 log10 фотонов/с в 14 сутки по сравнению с 9,39 log10 фотонов/с у животных, получавших контрольные Т-клетки (Таблица 12). В 23 сутки после имплантации опухоли среднее значение суммарной интенсивности светового потока у животных, получавших ВСМА-специфические CAR-T клетки P5AC1-V2, составило 9,29 log10 фотонов/с по сравнению с 10,37 log10 фотонов/с у животных, получавших контрольные Т клетки (Таблица 12).
Данные результаты свидетельствуют, что терапия ВСМА-специфическими CAR-T клетками эффективна для индуцирования регрессии опухоли.

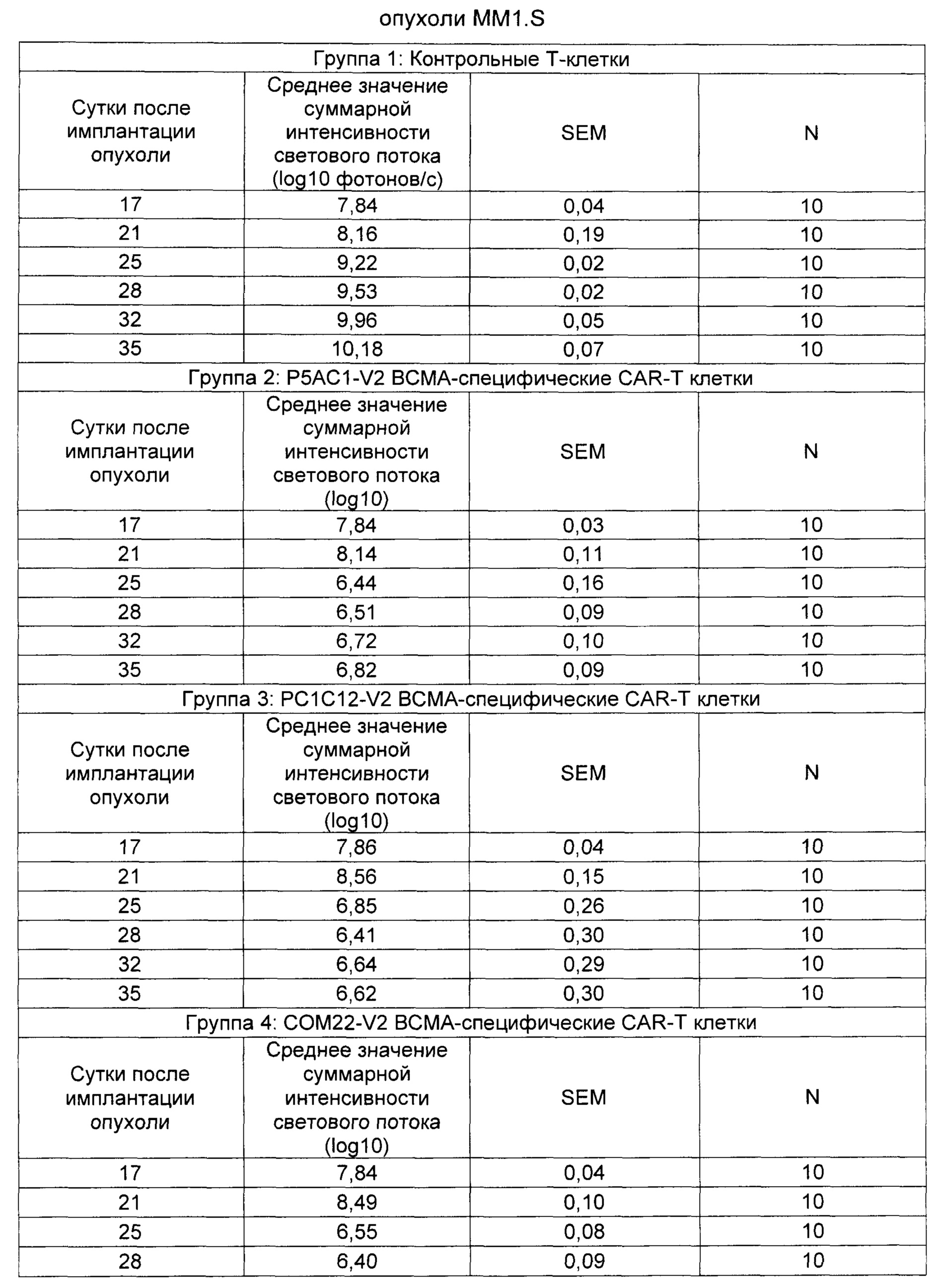

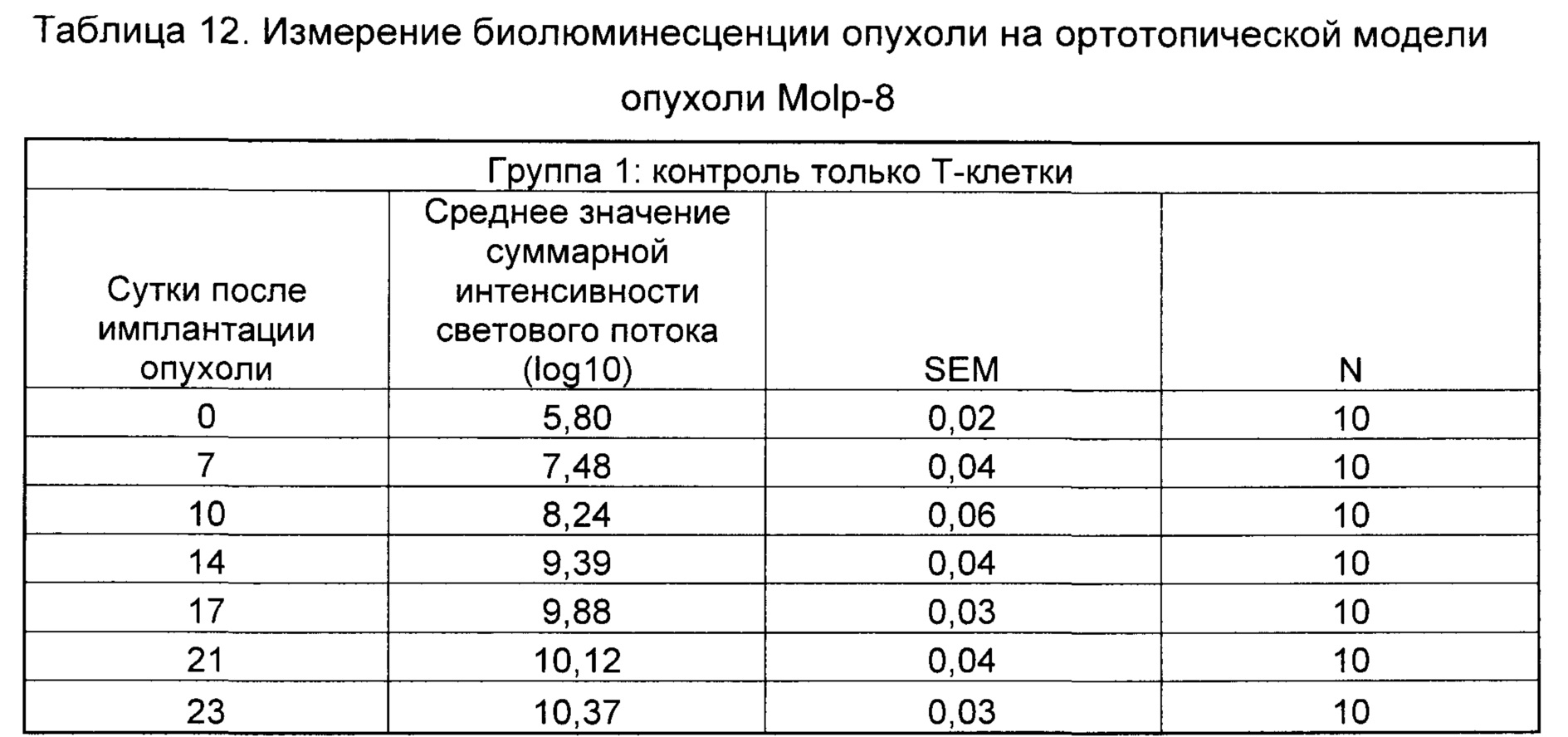
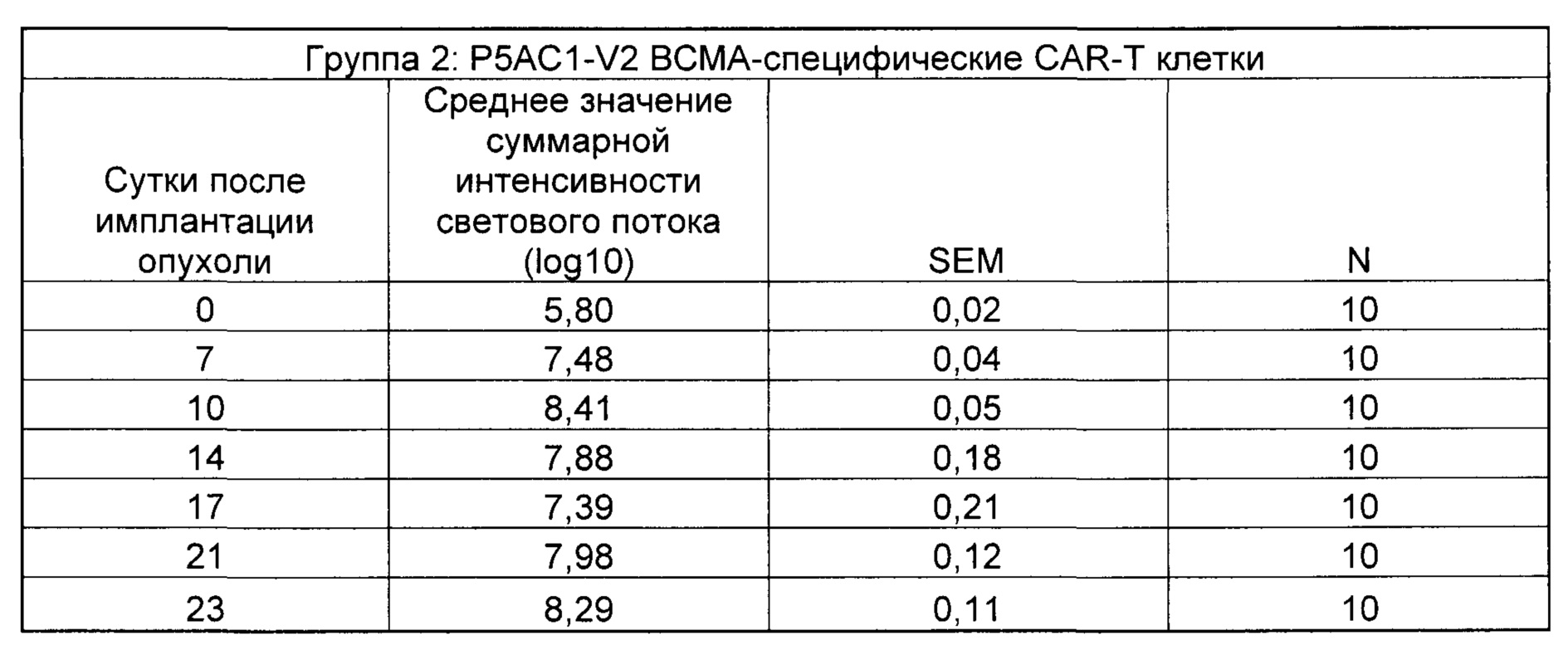
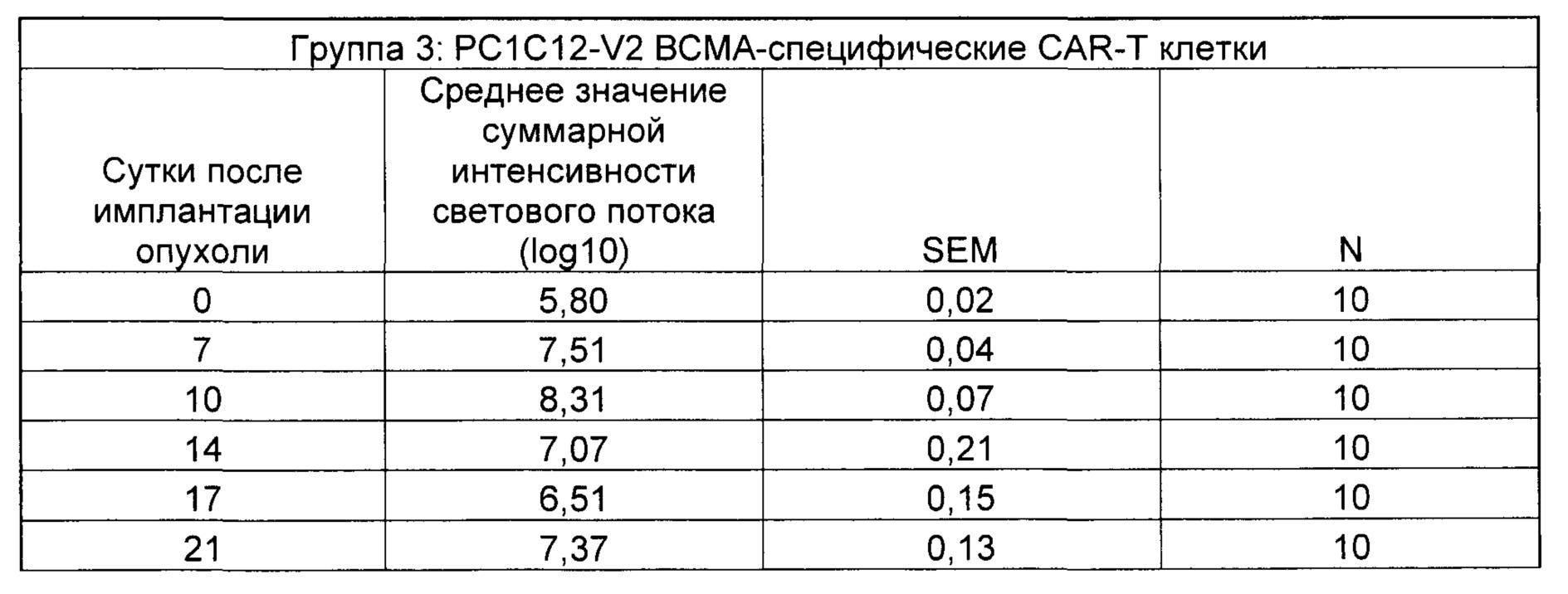

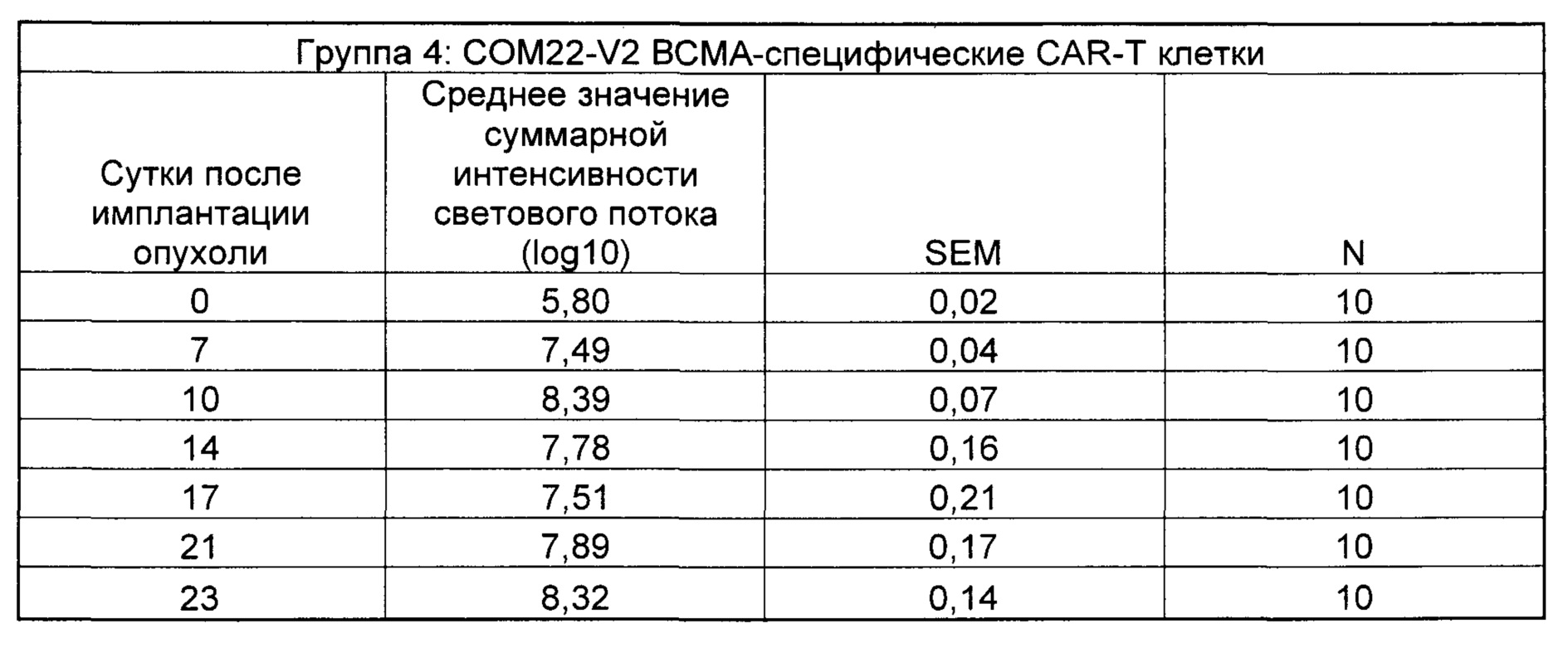
Пример 6. Лечение множественной миеломы с помощью ВСМА-специфических CAR-T клеток с нокаутом TCRα/dCK
Данный пример иллюстрирует терапевтическую активность ВСМА-специфических CAR-T клеток на ортотопических моделях множественной миеломы у мышей.
Для оценки эффективности ВСМА-специфических CAR-T клеток против линий клеток миеломы человека, экспрессирующих ВСМА, использовали гуманизированную мышиную модель. Самок мышей Nod/Scid IL2rg-/- (NSG) в возрасте 6-8 недель приобрели в компании Jackson Laboratories. Всех животных содержали в свободном от патогенов виварии в г. Ринат и проводили эксперименты согласно протоколам, соответствующим рекомендациям комитета по содержанию и использованию лабораторных животных (IACUC).
Линии клеток MM1.S приобретали в Американской коллекции типовых культур (ATCC.org). Клеточную линию подвергали инженерии, используя лентивирусные частицы (amsbio), с тем, чтобы она экспрессировала слитый белок Luc-GFP, и осуществили редактирование генов с помощью нуклеаз TALEN для выключения дезоксицитидинкинового гена (dCK). Клетки культивировали в среде RPMI 1640 с L-глутамином с добавлением 10% эмбриональной телячьей сыворотки при 37°С в 5% диоксиде углерода (CO2). Клетки, находящиеся в экспоненциальной фазе роста, собирали и использовали для инокуляции опухоли.
Используемые в терапевтических целях CAR-T клетки получали, как описано. Клетки, полученные от здоровых людей-доноров, мононуклеарные клетки периферической крови (РВМС) или очищенные пан-Т-клетки, активировали и трансдуцировали лентивирусными частицами, кодирующими гены ВСМА scFV, шарнирной области CD8, трансмембранной области CD8, 41 ВВ и CD3ζ с RQR8, находящиеся под контролем промотора EF-1a. Редактировали гены ВСМА-специфических CAR-T клеток для делеции гена TCRα и/или dCK, используя комбинацию TALEN TCRα и TALEN dCK или только TALEN TCRα. Эффективность трансдукции всех Т-клеток составляла 70%. Т-клетки с нокаутом TCRα очищали с использованием наборов для магнитной селекции CD3-положительных клеток (Miltenyi); Т-клетки с нокаутом dCK очищали, размножая их в присутствии 0,5 мкМ клофарабина. Клетки культивировали в течение 14-17 суток и затем криоконсервировали в 90% FCS/10% DMSO. Для инъекции Т-клеток осуществляли быстрое размораживание Т-клеток в водяной бане при 37°С и двукратно промывали средой RPMI 1640, содержащей 25 мМ Hepes. Для лечения инъецировали Т-клетки в 0,2 мл RPMI 1640 с 25 мМ Hepes в хвостовую вену животных, несущих опухоль.
Для модели опухоли на мышах животным инъецировали опухолевые клетки MM1.S/dCK KO. Затем в 18 сутки после имплантации опухоли мыши получали 2,5×106 ВСМА-специфических CAR-T клеток. В качестве контроля использовали эквивалентную дозу нетрансдуцированных Т-клеток, получивших TALEN TCRα и dCK. Животные получали клофарабин или носитель в течение пяти суток после инъекции Т-клеток.
Результаты: в контрольной группе, получавшей Т-клетки, наблюдался прогрессивный рост опухолей до достижения конечной точки исследования в 35 сутки (Таблица 13, Группа 1). В группах, получавших ВСМА-специфические CAR-T клетки с нокаутом TCRα и носитель, наблюдалось существенное снижение опухолевой нагрузки (p меньше 0,05) по сравнению с контролем, которая уменьшалась при совместном введении клофарабина (p меньше 0,05) (Таблица 13, Группы 2 и 3). У животных, получавших CAR-T клетки с двойным нокаутом TCRα/dCK, опухолевая нагрузка существенно уменьшалась независимо от того, получали ли животные носитель или клофарабин (p меньше 0,05) (Таблица 13, Группы 4 и 5). Уменьшение опухолевой нагрузки в группах, получавших Т-клетки с двойным нокаутом TCRα/dCK, не отличалась от группы, получавшей Т-клетки с одиночным нокаутом TCRα и носитель (p больше 0,1) (Таблица 13, Группы 2, 4 и 5).
Данные результаты свидетельствуют, что лечение ВСМА-специфическими CAR-T клетками с двойным нокаутом TCRα/dCK эффективно для индуцирования регрессии опухоли в присутствии терапии нуклеозидным аналогом, таким как флударабин и клофарабин.
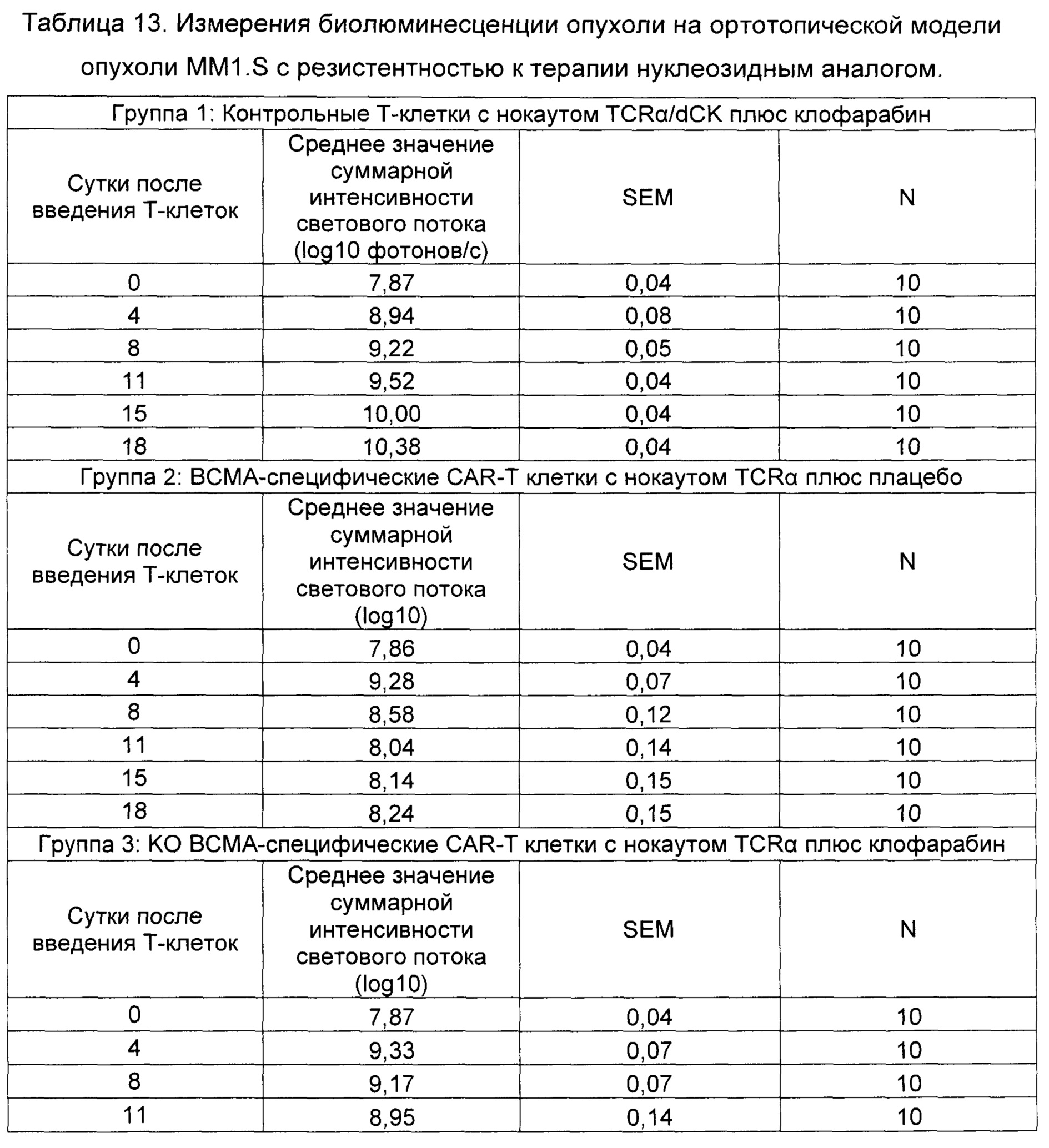
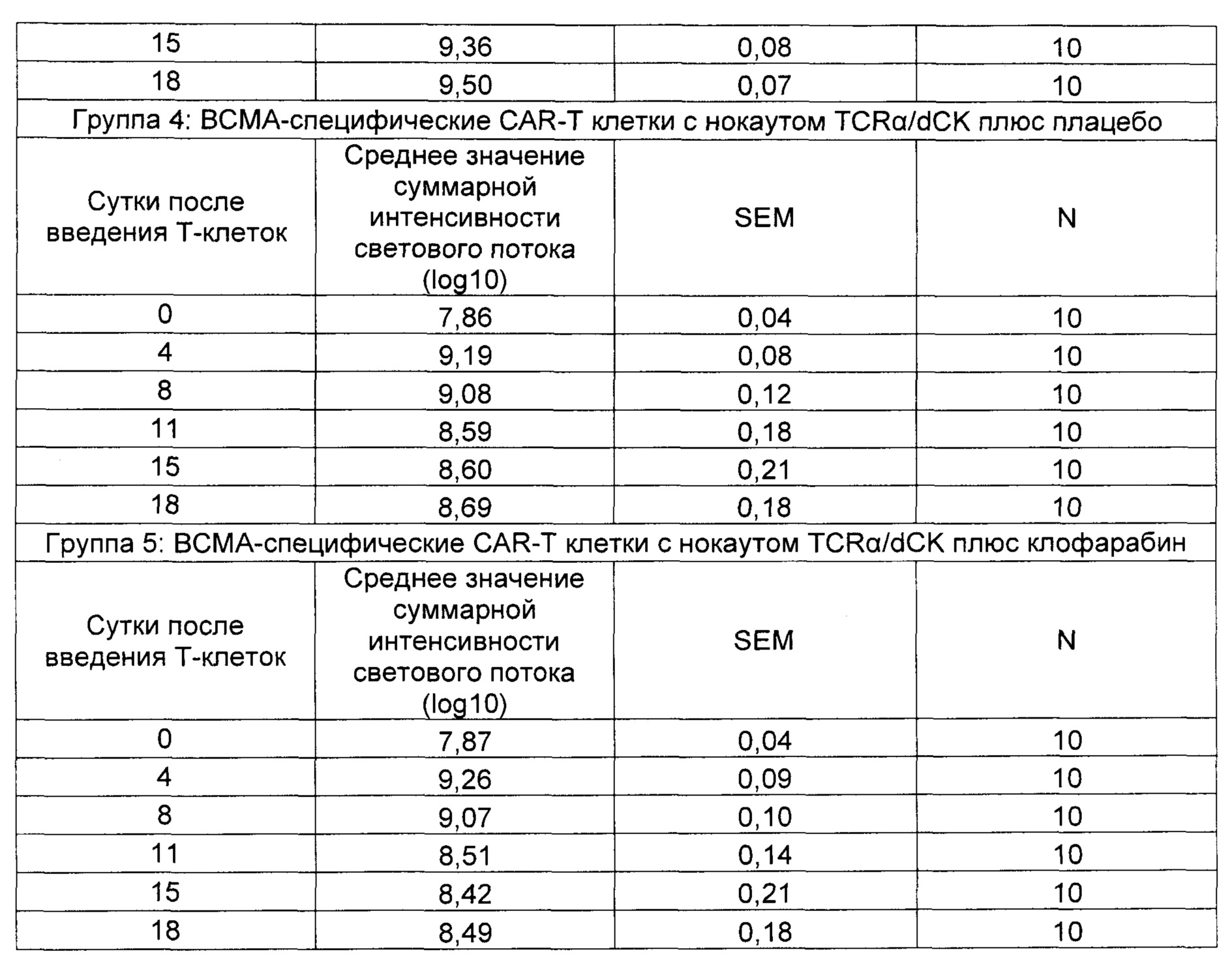
Несмотря на то, что раскрытое изобретение было описано со ссылкой на различные применения, способы, наборы и композиции, следует понимать, что различные изменения и модификации могут быть проведены без отступления от раскрытого здесь изобретения и приведенной ниже формулы изобретения. Описанные выше примеры приведены для лучшей иллюстрации раскрытого изобретения, и подразумевают, что они не ограничивают объем изобретения, представленного здесь. Несмотря на то, что настоящее изобретение было описано посредством этих типичных воплощений, специалисту в данной области техники будет ясна возможность множества вариаций и модификаций этих типичных воплощений без чрезмерных экспериментов. Все такие вариации и модификации входят в объем настоящего изобретения.
Все ссылки, приведенные здесь, включая патенты, заявки на патенты, публикации, руководства и тому подобное и приведенные в них ссылки, полностью включены в данное описание путем ссылки. В случае, если один или более из включенных литературных источников и подобных материалов отличается от данной заявки или противоречит ей, включая, без ограничения, определенные термины, использование терминов, описанные методики или тому подобное, предпочтительны варианты, приведенные в данной заявке.
В предшествующем описании и Примерах подробно описаны конкретные воплощения изобретения в наилучшей, с точки зрения авторов изобретения, форме. Тем не менее, следует понимать, что, независимо от подробности приведенных выше описаний и примеров, возможны многие варианты практического использования изобретения, и изобретение следует рассматривать согласно прилагаемой формуле изобретения и любым ее эквивалентам.