Результат интеллектуальной деятельности: Антитела к PD-1 и способы их применения
Вид РИД
Изобретение
Область изобретения
Настоящее изобретение относится к антителам, например к полноразмерным антителам, которые связываются с PD-1. Изобретение также относится к композициям, содержащим антитела к PD-1, и к способам использования антител к PD-1 в качестве лекарственного средства. Некоторые воплощения относятся к способам применения антител к PD-1 для лечения, профилактики и/или диагностики различных заболеваний, включая гиперпролиферативное заболевание, такое как рак.
Предшествующий уровень техники
PD-1 представляет собой трансмембранный рецептор типа I с молекулярной массой 50-55 кДа, который первоначально был идентифицирован в линии Т-клеток, подвергнутых индуцированному активацией апоптозу. PD-1 экспрессируется на Т-клетках, В-клетках и макрофагах. Лигандами для PD-1 являются представители семейства В7: PD-L1 (В7-Н1) и PD-L2 (B7-DC).
PD-1 является представителем суперсемейства иммуноглобулинов (Ig), который содержит один V-образный домен Ig в своей внеклеточной области. Цитоплазматический домен PD-1 содержит два тирозина, при этом самый близкий к мембране тирозин (VAYEEL в мышином PD-1) расположен в пределах ITIM (иммунорецепторного тирозинового ингибиторного мотива). Присутствие ITIM на PD-1 указывает на то, что эта молекула функционирует, ослабляя передачу сигнала рецептором антигена путем рекрутмента цитоплазматических фосфатаз. Человеческие и мышиные белки PD-1 обладают примерно 60% идентичностью аминокислот с сохранением четырех потенциальных сайтов N-гликозилирования и остатками, которые определяют домен Ig-V. ITIM в цитоплазматической области и ITIM-подобный мотив, окружающий тирозин карбоксильного конца, также являются консервативными в человеческих и мышиных ортологах.
Иммунотерапия рака традиционно включает сложные методы с использованием клеток и индивидуализированных и трудоемких приготовлений. Недавно, противораковая иммунотерапия на базе моноклональных антител, основанная на прерывании супрессивных сигналов, которые поступают в адаптивную иммунную систему, показала себя перспективной в клинических условиях при выборе готовой системной иммунотерапии. Однако в данной области существует постоянная потребность в более безопасных и эффективных средствах для лечения рака.
Краткое изложение сущности изобретения
Предложены антитела, которые селективно взаимодействуют с PD-1. Показано, что некоторые антитела к PD-1 эффективны in vivo для предупреждения и/или лечения рака. Преимущественно, представленные здесь антитела к PD-1 связывают человеческий, мышиный PD-1, а также PD-1 яванского макака. Также преимущественно, представленные здесь антитела к PD-1 являются эффективными in vivo в стимулировании пролиферации Т-клеток.
В данном изобретении предложены выделенные антагонистические антитела, которые специфически связываются с PD-1 и предупреждают или уменьшают биологический эффект PD-1. В некоторых воплощениях антагонистическое антитело может представлять собой, например, человеческое, гуманизированное или химерное антитело. Раскрытое здесь изобретение относится к антителам, которые связываются с PD-1.
В одном аспекте изобретения предлагается выделенное антагонистическое антитело, которое специфически связывается с PD-1, где антитело содержит вариабельный участок тяжелой цепи (VH), содержащий VH CDR1 (участок 1 VH, определяющий комплементарность), VH CDR2 и VH CDR3 цепи VH, имеющей аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 3, SEQ ID NO: 4; SEQ ID NO: 5; и SEQ ID NO:6; и вариабельный участок легкой цепи (VL), содержащий VL CDR1, VL CDR2 и VL CDR3 цепи VL, имеющей аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2; SEQ ID NO: 7; SEQ ID NO: 8; и SEQ ID NO: 9.
В некоторых воплощениях участок VH содержит аминокислотную последовательность, представленную в SEQ ID NO: 3, 4, 5 или 6, или вариант с одной или несколькими консервативными аминокислотными заменами в остатках, которые не находятся в CDR, и/или область VL содержит аминокислотную последовательность, показанную в SEQ ID NO: 2, 7, 8 или 9, или ее вариант с одной или несколькими аминокислотными заменами, которые не находятся в CDR. В некоторых воплощениях антитело содержит легкую цепь, содержащую последовательность, показанную в SEQ ID NO: 39, и/или тяжелую цепь, содержащую последовательность, показанную в SEQ ID NO: 29 или 38. В некоторых воплощениях антитело содержит участок VH, продуцируемый экспрессионным вектором с номером АТСС РТА-121183. В некоторых воплощениях антитело содержит участок VL, продуцируемый экспрессионным вектором с номером АТСС РТА-121182.
В другом аспекте изобретения предлагается выделенное антитело, которое специфически связывается с PD-1, где антитело содержит VH CDR1, содержащую аминокислотную последовательность SEQ ID NO: 13, 14 или 15, VH CDR2, содержащую аминокислотную последовательность SEQ ID NO: 16, 17, 24, 25, 27, 28, 35 или 36, VH CDR3, содержащую аминокислотную последовательность, представленную в SEQ ID NO: 18, 23, 26 или 37, VL CDR1, содержащую аминокислотную последовательность, представленную в SEQ ID NO: 10, 22, 30 или 32, VL CDR2, содержащую аминокислотную последовательность, представленную в SEQ ID NO: 11, 20 или 33, и VL CDR3, содержащую аминокислотную последовательность, представленную в SEQ ID NO: 12, 21, 31 и 34.
В некоторых воплощениях антитело может быть человеческим антителом, гуманизированным антителом или химерным антителом. В некоторых воплощениях антитело является моноклональным антителом.
В некоторых воплощениях антитело содержит константную область. В некоторых воплощениях антитело относится к подклассу IgG1, IgG2, IgG2Δa, IgG3, IgG4, IgG4Δb, IgG4Δc, IgG4 S228P, IgG4Δb S228P и IgG4Δc S228P человека. В некоторых воплощениях антитело относится к изотипу IgG4 и содержит стабилизированный шарнирный участок, например S228P.
В другом аспекте изобретения предлагается выделенное антитело, которое специфически связывается с PD-1 и конкурирует и/или связывается с тем же эпитопом PD-1, что и антитела, описанные в данном описании изобретения.
В некоторых воплощениях предложенное здесь антитело к PD-1 стимулирует секрецию IFNγ и/или TNF из Т-клеток.
В некоторых воплощениях предложенное здесь антитело к PD-1 стимулирует пролиферацию Т-клеток.
В некоторых воплощениях предложенное здесь антитело к PD-1 ингибирует опухолевый рост.
В некоторых воплощениях предложенное здесь антитело к PD-1 связывается с человеческим PD-1 и мышиным PD-1.
В другом аспекте изобретения предлагается фармацевтическая композиция, содержащая терапевтически эффективное количество антитела к PD-1, как описано в данном описании изобретения, и фармацевтически приемлемый носитель.
В другом аспекте изобретение предлагается выделенный полинуклеотид, содержащий нуклеотидную последовательность, кодирующую PD-1 антитело, как описано в данном описании изобретения. В другом аспекте изобретения предлагается вектор, содержащий полинуклеотид.
В другом аспекте изобретения предлагается выделенная клетка-хозяин, которая рекомбинантно продуцирует антитело к PD-1, как описано в данном описании изобретения.
В другом аспекте изобретения предлагается способ получения антагонистического антитела к PD-1, включающий культивирование клеточной линии, которая рекомбинантно продуцирует антитело, как описано в данном описании изобретения, в условиях, в которых продуцируется антитело; и выделение антитела.
В другом аспекте изобретения предлагается способ получения антагонистического антитела к PD-1, включающий культивирование клеточной линии, содержащей нуклеиновую кислоту, кодирующую антитело, содержащее тяжелую цепь, содержащую аминокислотную последовательность, представленную в SEQ ID NO: 29 или 38, и легкую цепь, содержащую аминокислотную последовательность, представленную в SEQ ID NO: 39, в условиях, когда продуцируется антитело; и выделение антитела.
В некоторых воплощениях тяжелые и легкие цепи кодируются отдельными векторами. В других воплощениях тяжелые и легкие цепи кодируются одним и тем же вектором.
В другом аспекте изобретения предлагается способ лечения состояния у субъекта, включающий введение нуждающемуся в этом субъекту эффективного количества фармацевтической композиции, описанной в данном описании изобретения. В некоторых воплощениях состояние представляет собой рак. В некоторых воплощениях рак выбран из группы, состоящей из рака желудка, саркомы, лимфомы, лейкоза, рака головы и шеи, рака тимуса, эпителиального рака, рака слюнных желез, рака печени, рака желудка, рака щитовидной железы, рака легкого, рака яичника, рака молочной железы, рака предстательной железы, рака пищевода, рака поджелудочной железы, глиомы, лейкоза, множественной миеломы, карциномы почек, рака мочевого пузыря, рака шейки матки, хориокарциномы, рака толстой кишки, рака полости рта, рака кожи и меланомы. В некоторых воплощениях субъектом является предварительно подвергнутый лечению взрослый пациент с местнораспространенной или метастатической меланомой, плоскоклеточным раком головы и шеи (SCHNC), карциномой яичника, саркомой или рецидивирующей или рефрактерной классической лимфомой Ходжкина (cHL). В некоторых воплощениях рак может представлять собой устойчивый к лечению платиной и/или плохо поддающийся лечению платиной (рефрактерный) рак, такой как, например, устойчивый к платине и/или рефрактерный рак яичника, устойчивый к платине и/или рефрактерный рак молочной железы или устойчивый к платине и/или рефрактерный рак легких. В некоторых воплощениях антитело к PD-1 вводят в дозе примерно 0,5 мг/кг, примерно 1,0 мг/кг, примерно 3,0 мг/кг или примерно 10 мг/кг. В некоторых воплощениях антитело к PD-1 вводят один раз каждые 7, 14, 21 или 28 суток. В некоторых воплощениях, антитело к PD-1 вводят внутривенно или подкожно.
В другом аспекте изобретения предлагается способ ингибирования роста или прогрессирования опухоли у субъекта, имеющего опухоль, включающий введение субъекту эффективного количества фармацевтической композиции, описанной в данном описании изобретения.
В другом аспекте изобретения предлагается способ ингибирования или предупреждения метастазирования раковых клеток у субъекта, включающий введение субъекту, нуждающемуся в этом, эффективного количества фармацевтической композиции, описанной в данном описании изобретения.
В другом аспекте изобретения предлагается способ индуцирования регрессии опухоли у субъекта с PD-1-экспрессирующей опухолью, включающий введение субъекту эффективного количества фармацевтической композиции, описанной в данном описании изобретения.
В некоторых воплощениях данного изобретения антитело можно вводить субъекту парентерально. В некоторых воплощениях субъектом является человек.
В некоторых воплощениях способ может дополнительно включать введение эффективного количества второго терапевтического агента. В некоторых воплощениях второй терапевтический агент представляет собой, например, кризотиниб, палбоциклиб, анти-CTLA4 (антиген 4, ассоциированный с цитотоксическими Т-лимфоцитами) антитело, анти-4-1ВВ антитело и второе PD-1-антитело.
Также предлагается применение любого из антагонистических антител к PD-1, представленных в настоящем описании, в изготовлении лекарственного средства для лечения рака или для ингибирования роста или прогрессирования опухоли у субъекта, нуждающегося в этом. В некоторых воплощениях антагонистическое антитело к PD-1 уменьшает увеличение массы субъекта.
Также предложены антагонистические антитела к PD-1 для применения в лечении рака или для ингибирования роста или прогрессирования опухоли у субъекта, нуждающегося в этом. В некоторых воплощениях рак представляет собой, например, но без ограничения ими, рак желудка, саркому, лимфому, лимфому Ходжкина, лейкоз, рак головы и шеи, рак тимуса, эпителиальный рак, рак слюнных желез, рак печени, рак желудка, рак щитовидной железы, рак легкого (включая, например, немелкоклеточную карциному легкого), рак яичника, рак молочной железы, рак предстательной железы, рак пищевода, рак поджелудочной железы, глиому, лейкоз, множественную миелому, почечно-клеточную карциному, рак мочевого пузыря, рак шейки матки, хориокарциному, рак толстой кишки, рак полости рта, рак кожи и меланому.
В другом аспекте настоящего описания предлагается способ усиления иммуногенности или терапевтического эффекта вакцины для лечения рака у млекопитающего, в частности человека, включающий введение млекопитающему, получающему вакцину, эффективного количества антагонистического антитела к PD-1, предложенного в настоящем описании изобретения.
В другом аспекте настоящего описания предложен способ лечения рака у млекопитающего, в частности человека, включающий введение млекопитающему (1) эффективного количества вакцины, способной вызывать иммунный ответ против клеток рака и (2) эффективного количества антагонистического антитела к PD-1, предложенного в настоящем описании изобретения.
Краткое описание графических материалов
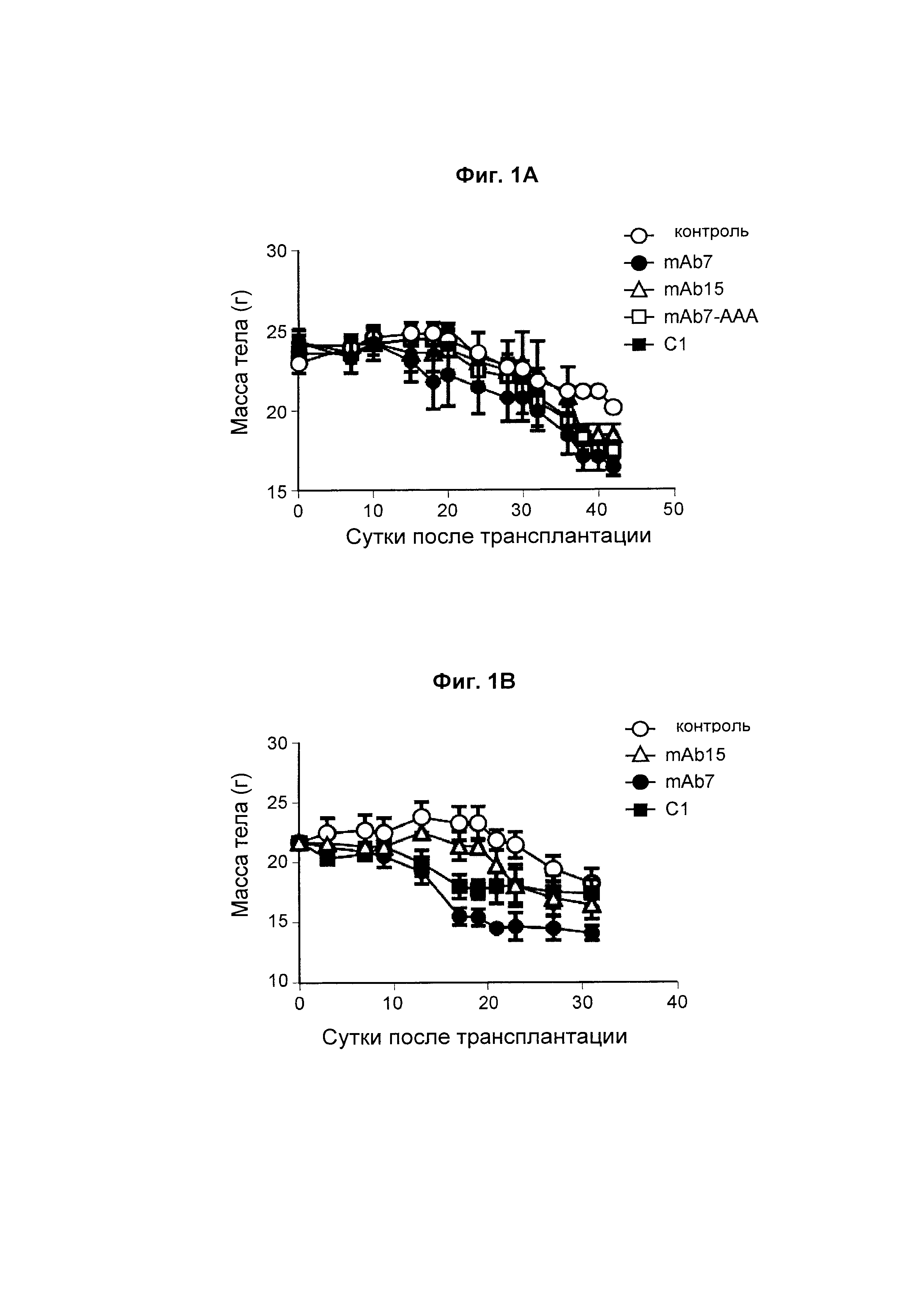
На Фиг. 1А показан график, обобщенно представляющий массу тела мыши, обработанной антагонистическим антителом к PD-1.
На Фиг. 1В показан график, обобщенно представляющий массу тела мыши, обработанной антагонистическим антителом к PD-1.
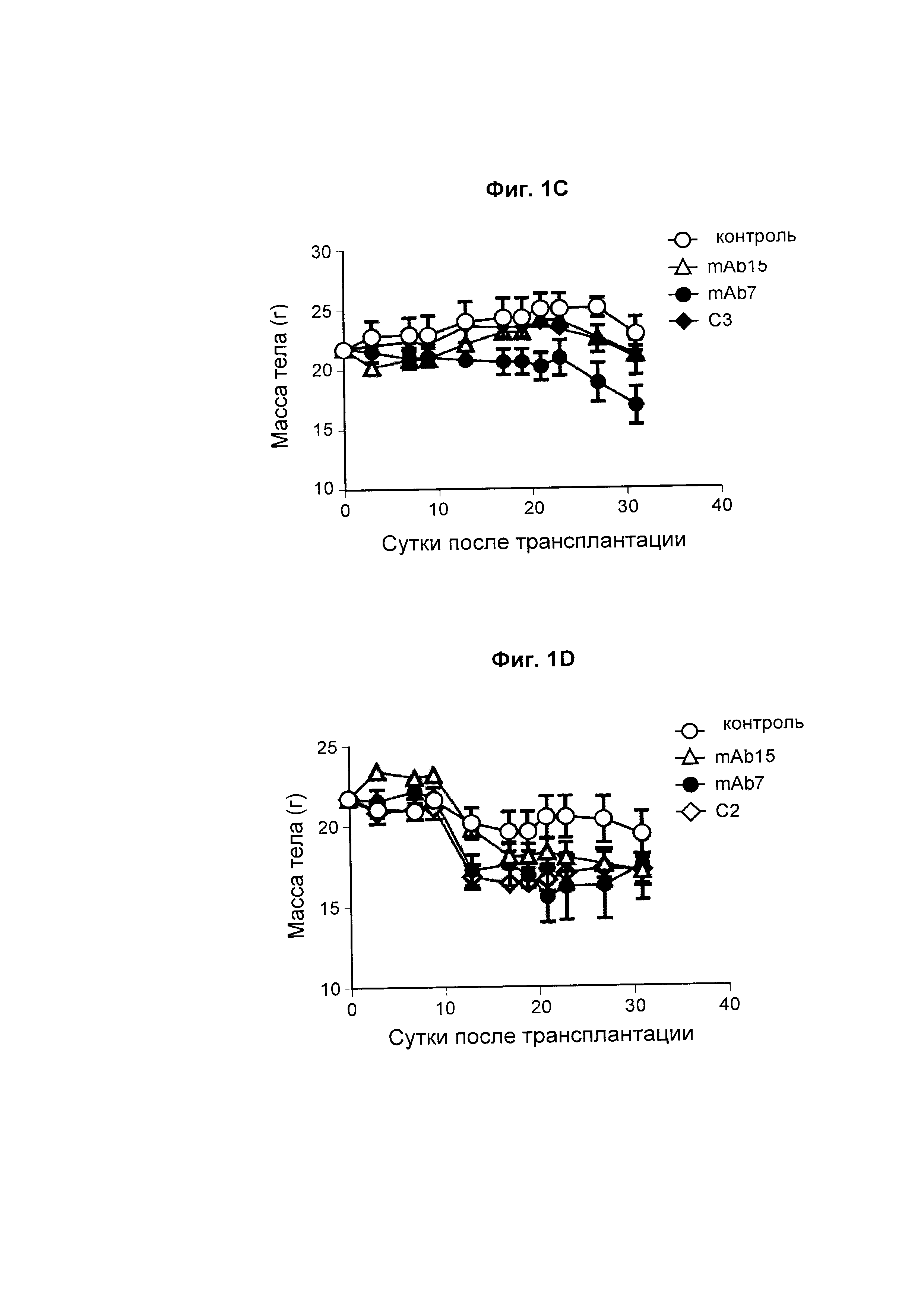
На Фиг. 1С показан график, обобщенно представляющий массу тела мыши, обработанной антагонистическим антителом к PD-1.
На Фиг. 1D показан график, обобщенно представляющий массу тела мыши, обработанной антагонистическим антителом к PD-1.
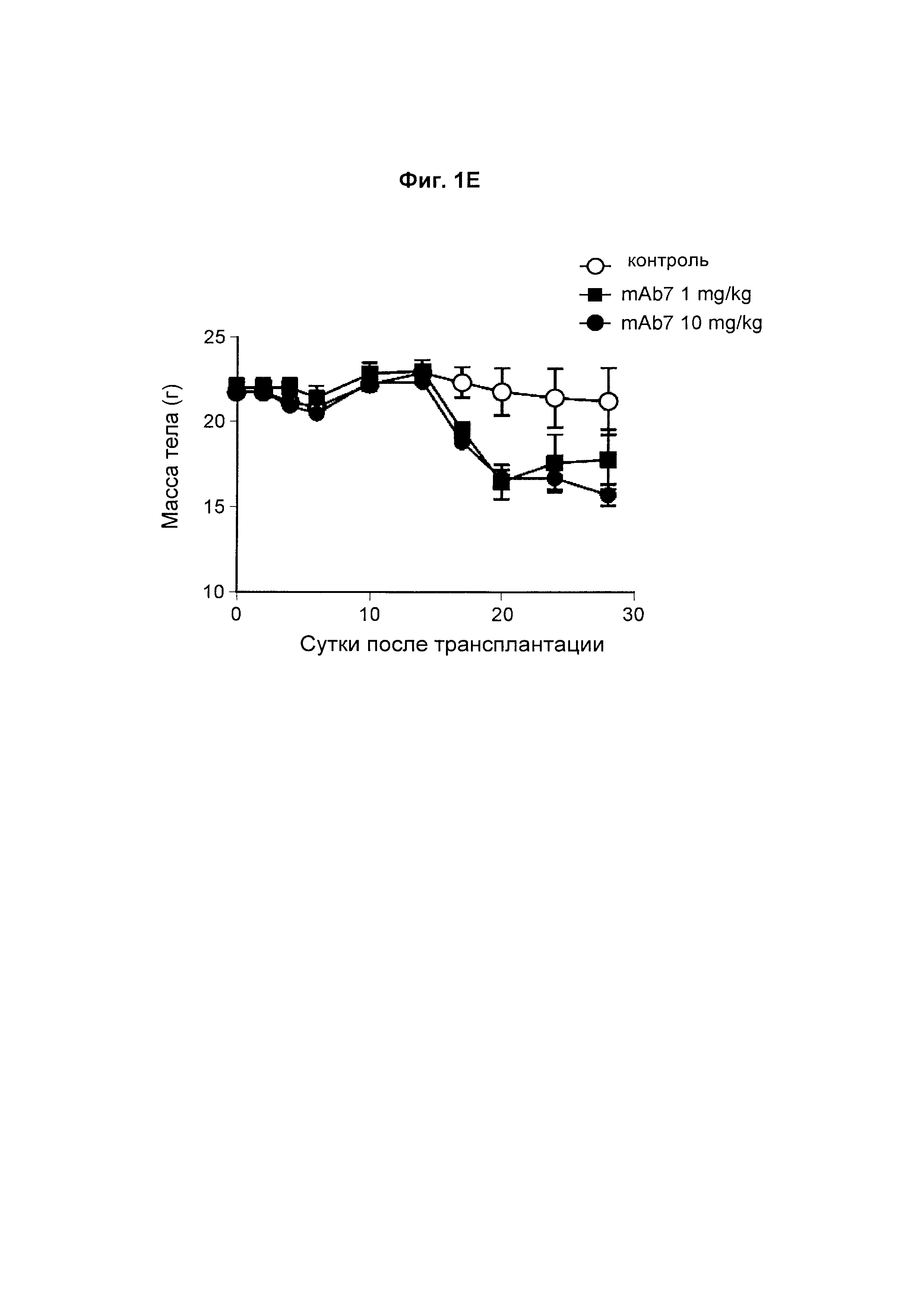
На Фиг. 1Е показан график, обобщенно представляющий массу тела мыши, обработанной антагонистическим антителом к PD-1.
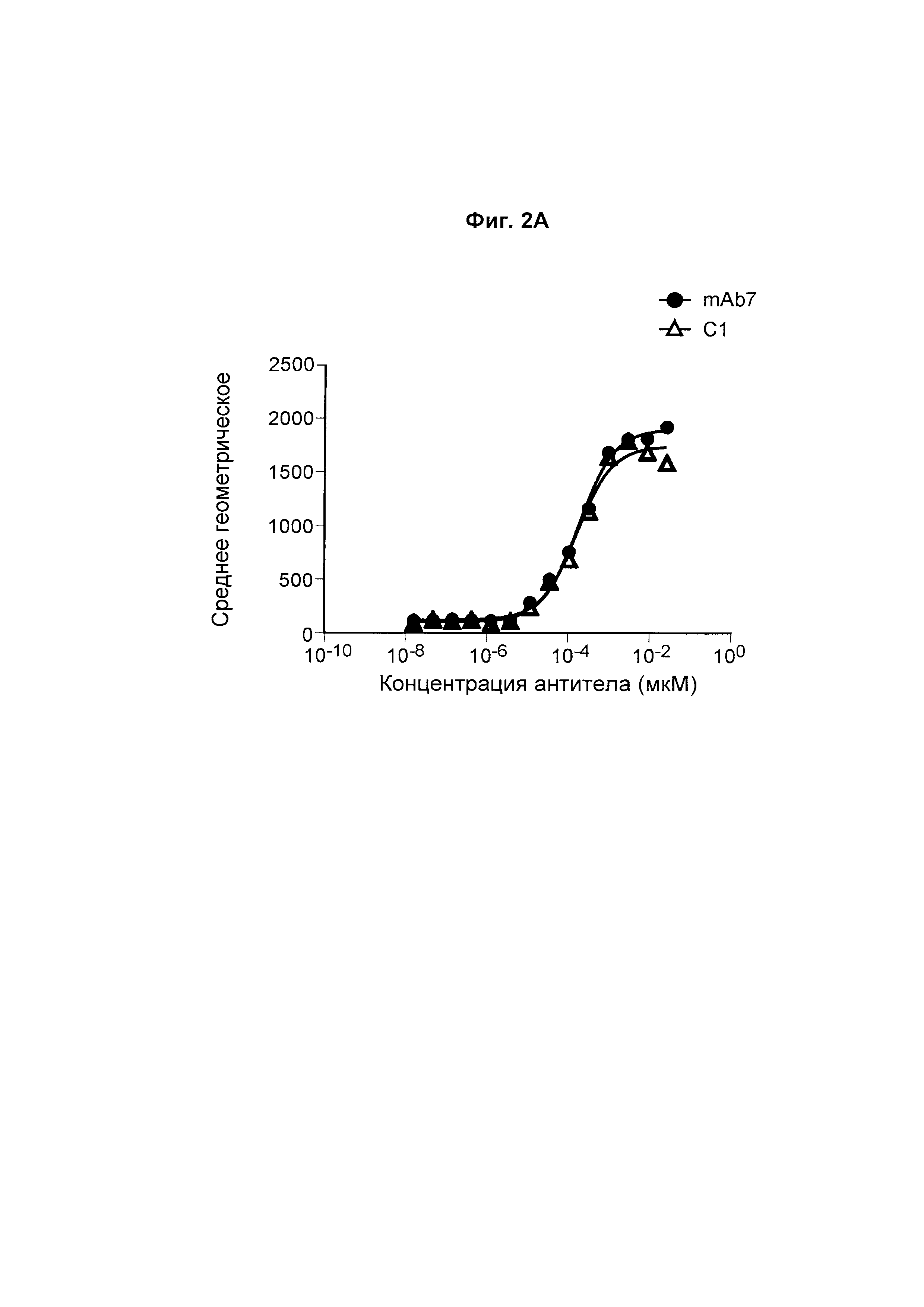
На Фиг. 2А показан график, обобщенно представляющий ЕС50 для антитела к PD-1, связывающегося с первичными активированными Т-клетками человека.
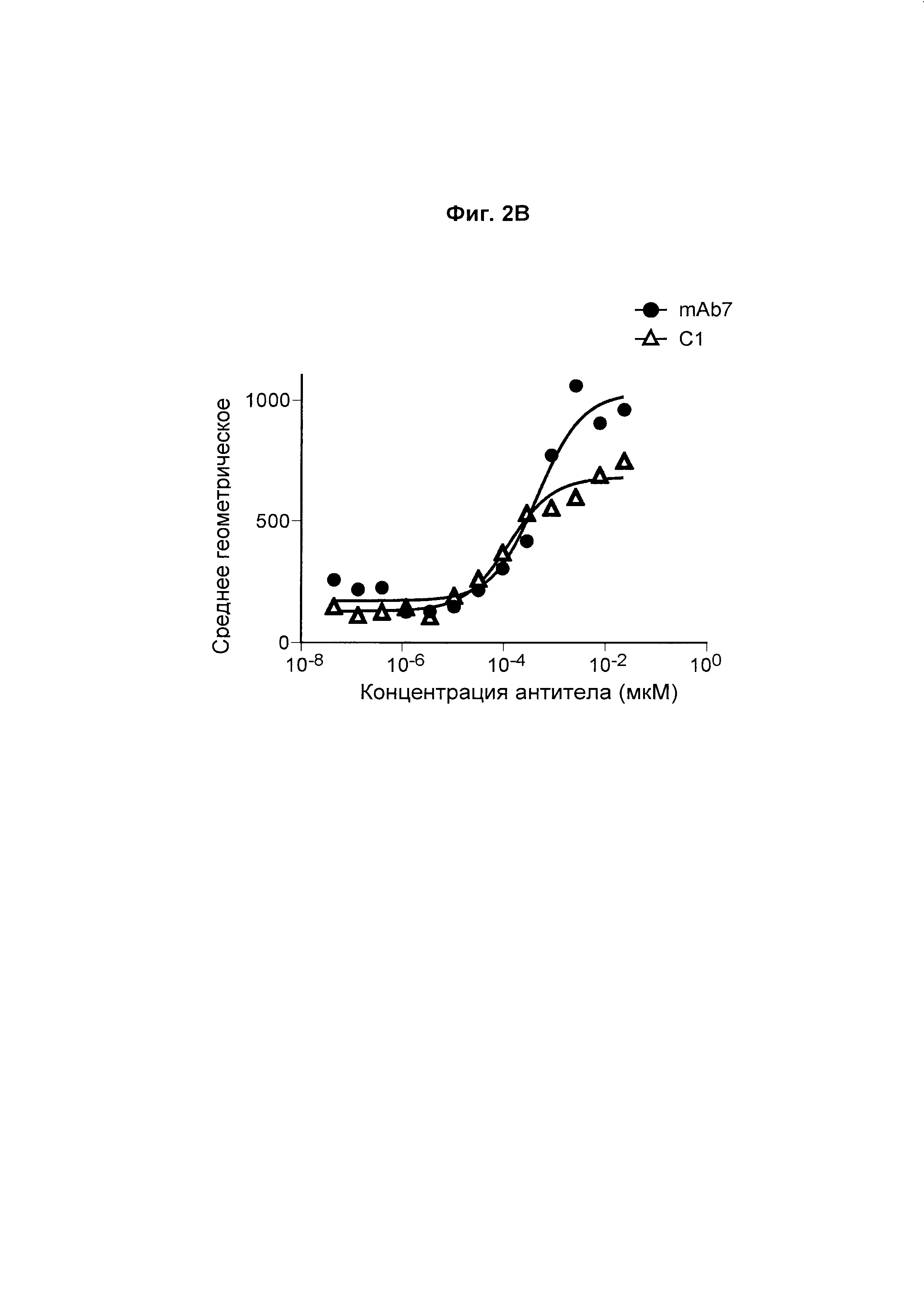
На Фиг. 2В показан график, обобщенно представляющий ЕС50 для антитела к PD-1, связывающегося с первичными активированными Т-клетками яванского макака.
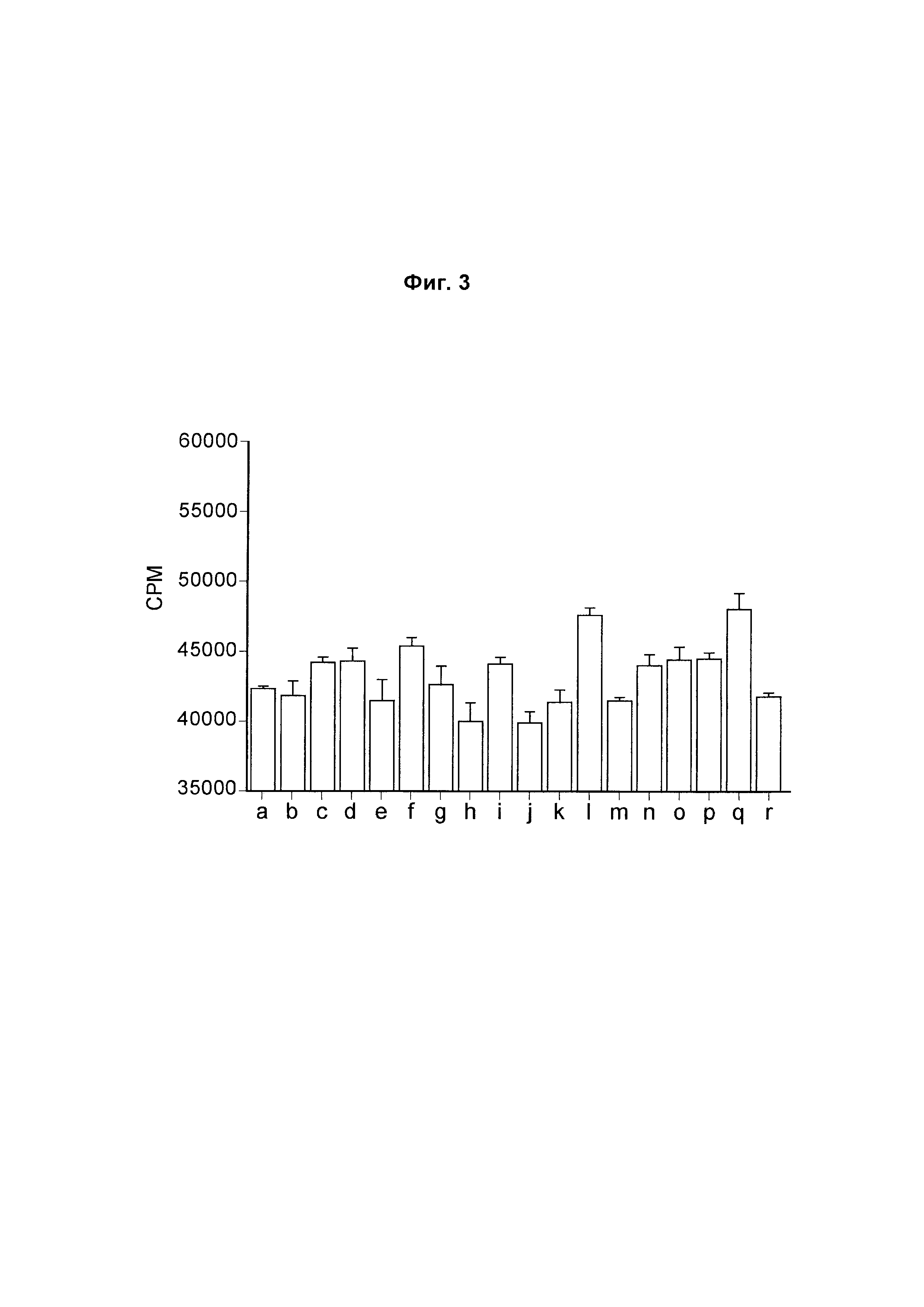
На Фиг. 3 показана диаграмма, обобщенно представляющая пролиферацию культивируемых активированных CD4 Т-клеток, обработанных следующим образом (а) без антитела; (б) изотипический контроль; (в) ЕН12.1; (г) С1; (д) С2; (е) С3; (ж) mAb1; (з) mAbX; (и) mAb4; (к) mAb5; (л) mAb6; (м) mAb7; (н) mAb9; (о) mAb10; (п) mAb11; (р) mAb14; (с) mAb15; (т) mAb16.
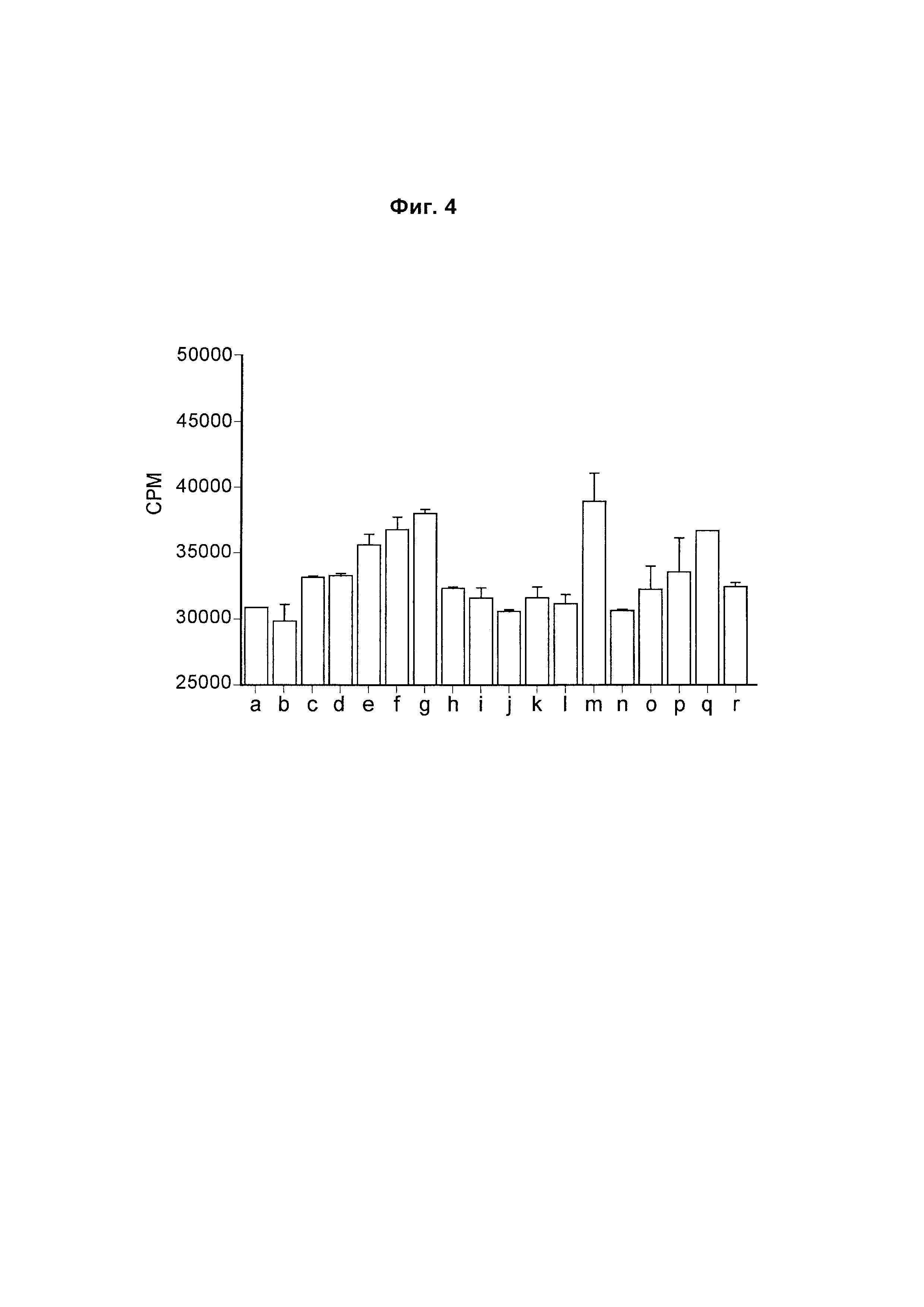
На Фиг. 4 показана гистограмма, обобщенно представляющая пролиферацию культивируемых активированных CD8 Т-клеток, обработанных следующим образом (а) без антитела; (б) изотипический контроль; (в) ЕН12.1; (г) С1; (д) С2; (е) С3; (ж) mAb1 (з) mAbX; (и) mAb4; (к) mAb5; (л) mAb6; (м) mAb7; (н) mAb9; (о) mAb10; (п) mAb11; (р) mAb14; (с) mAb15; (т) mAb16.
Подробное описание изобретения
В данном описании изобретения представлены антитела, которые специфически связываются с PD-1. Предложены способы получения антител к PD-1, композиции, содержащие эти антитела, и способы применения этих антител в качестве лекарственного средства. Антитела к PD-1 можно использовать для ингибирования прогрессирования опухоли и можно использовать для предупреждения и/или лечения рака и/или других заболеваний.
Общие методы
В практическом воплощении настоящего изобретения используются, если не указано иное, обычные методы молекулярной биологии (включая рекомбинантные методы), микробиологии, клеточной биологии, биохимии и иммунологии, которые известны специалистам в данной области техники. Такие методы полностью описаны в литературе, такой как Molecular Cloning: А Laboratory Manual, second edition (Sambrook et al., 1989) Cold Spring Harbor Press; Oligonucleotide Synthesis (M.J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J.E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R.I. Freshney, ed., 1987); Introduction to Cell and Tissue Culture (J.P. Mather and P.E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J.B. Griffiths, and D.G. Newell, eds., 1993-1998) J. Wiley and Sons; Methods in Enzymology (Academic Press, Inc.); Handbook of Experimental Immunology (D.M. Weir and C.C. Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J.M. Miller and M.P. Calos, eds., 1987); Current Protocols in Molecular Biology (F.M. Ausubel et al., eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J.E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C.A. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: a practical approach (D. Catty., ed., IRL Press, 1988-1989); Monoclonal antibodies: a practical approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using antibodies: a laboratory manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M. Zanetti and J.D. Capra, eds., Harwood Academic Publishers, 1995).
Определения
Следующие термины, если не указано иное, следует понимать, как имеющие следующие значения: термин "выделенная молекула" относится к молекуле (где молекула представляет собой, например, полипептид, полинуклеотид или антитело), которая в соответствии со своим происхождением или источником получения (1) не ассоциирована с компонентами, с которыми она ассоциирована в своем естественном состоянии, (2) по существу свободна от других молекул из того же источника, например разновидностей, клетки, которая ее экспрессирует, библиотеки и т.д., (3) экспрессируется клеткой другого вида или (4) не встречается в природе. Таким образом, молекулу, которая химически синтезируется или экспрессируется в клеточной системе, отличной от системы, из которой она происходит естественным образом, "отделяют" от ее естественно ассоциированных компонентов. Молекула также может быть по существу освобождена от естественно ассоциированных компонентов путем выделения с использованием методов очистки, хорошо известных в данной области. Чистоту или гомогенность молекул можно проанализировать посредством ряда способов, хорошо известных в данной области. Например, чистоту полипептидного образца можно проанализировать с помощью электрофореза в полиакриламидном геле и окрашивания геля для визуализации полипептида, используя хорошо известные в данной области методики. Для определенных целей более высокое разделение может быть обеспечено с помощью ВЭЖХ или других способов, хорошо известных в области очистки.
"Антитело" представляет собой молекулу иммуноглобулина, способную специфически связываться с мишенью, такой как углевод, полинуклеотид, липид, полипептид и т.д., с помощью по меньшей мере одного сайта распознавания антигена, расположенного в вариабельном участке молекулы иммуноглобулина. При использовании здесь этот термин охватывает не только интактные поликлональные или моноклональные антитела, но также, если не указано иное, любой их антигенсвязывающий участок, который конкурирует с интактным антителом за специфическое связывание, слитые белки, содержащие антигенсвязывающий участок, и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит сайт распознавания антигена. Антигенсвязывающие участки включают, например, Fab, Fab', F(ab')2, Fd, Fv, доменные антитела (dAb, например антитела акулы и верблюда), фрагменты, включающие участки, определяющие комплементарность (CDR), одноцепочечные вариабельные фрагменты антител (scFv), макси-антитела, мини-антитела, интратела, диатела, триатела, тетратела, v-NAR и бис-scFv и полипептиды, которые содержат по меньшей мере часть иммуноглобулина, которая является достаточной, чтобы обеспечить специфическое связывание антигена с полипептидом. Антитело включает антитело любого класса, например IgG, IgA или IgM (или их подкласса), и антитело не обязательно должно принадлежать определенному классу. В зависимости от аминокислотной последовательности константной области своих тяжелых цепей, иммуноглобулины могут быть отнесены к разным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно разделены на подклассы (изотипы), например IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные области тяжелой цепи, которые соответствуют разным классам иммуноглобулинов, называются альфа, дельта, эпсилон, гамма и мю, соответственно. Структуры субъединиц и трехмерные конфигурации разных классов иммуноглобулинов хорошо известны.
"Вариабельная область" антитела относится к вариабельной области легкой цепи антитела или к вариабельной области тяжелой цепи антитела, отдельно или в комбинации. Как известно в данной области техники, каждая вариабельная область тяжелых и легких цепей состоит из четырех каркасных областей (FR), связанных тремя участками, определяющими комплементарность (CDR), также известными как гипервариабельные области, и вносит вклад в формирование антигенсвязывающего сайта антител. Если необходимы варианты рассматриваемой вариабельной области, в частности с замещением аминокислотных остатков вне участка CDR (то есть в каркасной области), соответствующее аминокислотное замещение, предпочтительно консервативное аминокислотное замещение, может быть установлено путем сравнения рассматриваемой вариабельной области с вариабельными областями других антител, которые содержат последовательности CDR1 и CDR2, в том же каноническом классе, что и рассматриваемая вариабельная область (Chothia and Lesk, J Mol Biol 196(4): 901-917, 1987).
В некоторых воплощениях однозначное картирование CDR и идентификацию остатков, содержащих сайт связывания антитела, осуществляют путем определения структуры антитела и/или определения структуры комплекса антитело-лиганд. Некоторые воплощения могут быть выполнены с помощью любого из множества методов, известных специалисту в данной области, например рентгенокристаллографии. В некоторых воплощениях можно использовать различные методы анализа для идентификации или аппроксимирования участков CDR. Примеры таких методов включают, без ограничения ими, определение по Kabat, определение по Chothia, AbM определение, контактное определение и конформационное определение.
Определение по Kabat является стандартом для нумерации остатков в антителе и обычно используется для идентификации участков CDR. Смотрите, например, Johnson & Wu, 2000, Nucleic Acids Res., 28:214-8. Определение по Chothia аналогично определению по Kabat, но определение по Chothia учитывает положения некоторых структурных участков петли. Смотрите, например, Chothia et al., 1986, J. Mol. Biol., 196: 901-17; Chothia et al., 1989, Nature, 342:877-83. В определении AbM используют комплексный набор компьютерных программ, созданных Oxford Molecular Group, моделирующий структуру антител. Смотрите, например, Martin et al., 1989, Proc Natl Acad Sci (USA), 86:9268-9272; "AbM™, A Computer Program for Modeling Variable Regions of Antibodies," Oxford, UK; Oxford Molecular, Ltd. В определении AbM моделируют третичную структуру антитела на основании первичной последовательности, используя комбинацию баз знаний и методов ab initio, описанных Samudrala et al., 1999, "Ab Initio Protein Structure Prediction Using a Combined Hierarchical Approach," в PROTEINS, Structure, Function and Genetics Suppl., 3:194-198. Контактное определение основано на анализе имеющихся сложных кристаллических структур. Смотрите, например, MacCallum et al., 1996, J. Mol. Biol., 5:732-45. В случае другого подхода, называемого здесь "конформационное определение" CDR, положения CDR могут быть определены, как остатки, которые вносят энтальпийный вклад в связывание антигена. Смотрите, например, Makabe et al., 2008, Journal of Biological Chemistry, 283:1156-1166. Другие определения границ CDR могут не следовать строго одному из вышеуказанных подходов, но тем не менее они будут перекрываться по меньшей мере с частью CDR по Kabat, хотя они могут быть укороченными или удлиненными в свете прогноза и экспериментальных данных о том, что отдельные остатки или группы остатков не оказывают существенного влияния на связывание антигена. При использовании здесь, CDR может относиться к CDR, определенным посредством любого подхода, известного в данной области, включая комбинации подходов. В применяемых здесь способах можно использовать CDR, определенные в соответствии с любым из этих подходов. Для любого приведенного воплощения, содержащего более одного CDR, CDR могут быть определены в соответствии с любым из Kabat, Chothia, расширенного, AbM, контактного и/или конформационного определений.
Как известно в данной области техники, "константная область" антитела относится к константной области легкой цепи антитела или к константной области тяжелой цепи антитела, отдельно или в комбинации.
При использовании здесь, "моноклональное антитело" относится к антителу, полученному из группы по существу гомогенных антител, то есть отдельные антитела, составляющие эту группу, идентичны, за исключением возможных природных мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифичными, направленными против одного антигенного сайта. Кроме того, в отличие от препаратов поликлональных антител, которые обычно включают разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Модификатор "моноклональный" указывает на природу антитела, как полученного из по существу гомогенной группы антител, и его не следует истолковывать как требование получать антитело каким-либо конкретным способом. Например, моноклональные антитела, для применения в соответствии с настоящим изобретением, могут быть получены гибридомным способом, впервые описанным Kohler and Milstein, 1975, Nature 256:495, или могут быть получены посредством методов рекомбинантной ДНК, например как описано в патенте US 4816567. Моноклональные антитела также могут быть выделены из фаговых библиотек, полученных с использованием методов, описанных, например, в McCafferty et al., 1990, Nature 348:552-554. При использовании здесь "гуманизированное" антитело относится к формам нечеловеческих (например мышиных) антител, которые представляют собой химерные иммуноглобулины, иммуноглобулиновые цепи или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие последовательности антител), которые содержат минимальную последовательность, происходящую из не-человеческого иммуноглобулина. Предпочтительно, гуманизированные антитела являются человеческими иммуноглобулинами (реципиентное антитело), в которых остатки из CDR реципиента заменены остатками из CDR видов, не являющихся человеком (донорное антитело), таких как мышь, крыса или кролик, имеющих необходимую специфичность, аффинность и эффективность. Гуманизированное антитело может содержать остатки, которые не обнаружены ни в реципиентных антителах, ни в импортированных CDR или каркасных последовательностях, но включены для дополнительного улучшения и оптимизации характеристик антител.
"Человеческое антитело" представляет собой антитело, которое имеет аминокислотную последовательность, соответствующую антителу, продуцируемому человеком и/или полученному с помощью любого способа получения человеческих антител, раскрытых в данном описании изобретения. Это определение человеческого антитела ясно исключает гуманизированное антитело, содержащее не-человеческие антигенсвязывающие остатки
Подразумевается, что термин "химерное антитело" относится к антителам, последовательности вариабельной области которых получены из одного вида, а последовательности константной области получены из других видов, например к антителу, в котором последовательности вариабельной области получены из мышиного антитела и последовательности константной области получены из человеческого антитела.
Термин "эпитоп" относится к той части молекулы, которая может быть распознана и связана антителом в одном или нескольких антигенсвязывающих участках антитела. Эпитопы часто состоят из поверхностной группировки молекул, таких как аминокислоты или боковые цепи сахаров, и имеют специфические трехмерные структурные характеристики, а также специфические характеристики заряда. В некоторых воплощениях эпитоп может представлять собой эпитоп белка. Эпитопы белка могут быть линейными или конформационными. В линейном эпитопе все точки взаимодействия между белком и взаимодействующей молекулой (такой как антитело) расположены линейно вдоль первичной аминокислотной последовательности белка. "Нелинейный эпитоп" или "конформационный эпитоп" содержит несмежные полипептиды (или аминокислоты) в антигенном белке, с которым связывается специфическое к этому эпитопу антитело. При использовании здесь, термин "антигенный эпитоп" определен, как часть антигена, с которым антитело может специфически связываться, как определено любым хорошо известным в данной области способом, например с помощью обычных иммуноанализов. После определения нужного эпитопа на антигене можно создать антитела к этому эпитопу, например, с использованием методов, описанных в настоящем описании. Альтернативно, во время процесса обнаружения генерация и характеристика антител может дать информацию о нужных эпитопах. Из этой информации затем можно конкурентно отобрать антител по связыванию с одним и тем же эпитопом. Одним подходом для достижения этого является проведение исследования конкуренции и перекрестной конкуренции для обнаружения антител, которые конкурируют или перекрестно конкурируют друг с другом за связывание с PD-1, например антител, конкурирующих за связывание с антигеном.
При использовании здесь, термин "PD-1" относится к любой форме PD-1 и их вариантам, которые сохраняют по меньшей мере часть активности PD-1. Если не указано иное, например посредством конкретной ссылки на PD-1 человека, PD-1 включает нативную последовательность PD-1 всех видов млекопитающих, например человека, собаки, кошки, лошади и быка. Один типичный PD-1 человека существует как Uniprot Accession Number Q15116 (SEQ ID NO: 1).
Термин "агонист" относится к веществу, которое стимулирует (то есть индуцирует, вызывает, усиливает или увеличивает) биологическую активность или действие другой молекулы. Термин "агонист" охватывает вещества, которые связываются с рецептором, такие как антитело, и вещества, которые активируют функцию рецептора без связывания с ним (например путем активирования ассоциированного белка).
Термин "антагонист" или "ингибитор" относится к веществу, которое предупреждает, блокирует, ингибирует, нейтрализует или уменьшает биологическую активность или действие другой молекулы, например рецептора.
Термин "антагонистическое антитело" относится к антителу, которое связывается с мишенью и предупреждает или уменьшает биологическое действие этой мишени. В некоторых воплощениях этот термин может обозначать антитело, которое препятствует выполнению биологической функции мишени, с которой он связывается, например PD-1.
При использовании здесь "антагонистическое антитело к PD-1" относится к антителу, которое способно ингибировать биологическую активность PD-1 и/или последующие события, опосредованные PD-1. Антагонистические антитела к PD-1 охватывают антитела, которые блокируют, противодействуют, подавляют или уменьшают (до любой степени, в том числе значительно) биологическую активность PD-1, включая последующие события, опосредованные PD-1, такие как связывание PD-L1 и нисходящие сигналы, связывание PD-L2 и нисходящие сигналы, ингибирование пролиферации Т-клеток, ингибирование активации Т-клеток, ингибирование секреции IFN, ингибирование секреции IL-2, ингибирование секреции TNF, индукция IL-10 и ингибирование противоопухолевых иммунных ответов. В контексте настоящего изобретения понятно, что термин "антагонистическое антитело к PD-1" (взаимозаменяемо называемое "антагонистическое PD-1 антитело", "антагонистическое анти-PD-1 антитело" или "PD-1 антагонистическое антитело") охватывает все ранее определенные термины, названия и функциональные состояния и характеристики, посредством которых сам PD-1, биологическая активность PD-1 или последствия этой биологической активности по существу аннулированы, уменьшены или нейтрализованы в любой значимой степени. В некоторых воплощениях антагонистическое антитело к PD-1 связывается с PD-1 и активирует противоопухолевый иммунный ответ. Примеры антагонистических антител к PD-1 представлены в данном описании изобретения.
Термины "полипептид", "олигопептид", "пептид" и "белок" используются в данном описании изобретения взаимозаменяемо для обозначения цепочек аминокислот любой длины. Цепь может быть линейной или разветвленной, она может содержать модифицированные аминокислоты и/или может быть прервана не-аминокислотами. Эти термины также охватывают аминокислотную цепь, которая модифицирована естественным путем или посредством вмешательства; например посредством образования дисульфидной связи, гликозилирования, липидирования, ацетилирования, фосфорилирования или любой другой манипуляции или модификации, такой как конъюгирование с меченым компонентом. В это определение также включены, например, полипептиды, содержащие один или более аналогов аминокислот (включая, например, неприродные аминокислоты и т.д.), а также другие модификации, известные в данной области. Следует понимать, что полипептиды могут встречаться в виде отдельных цепей или ассоциированных цепей.
Как известно в данной области техники, "полинуклеотид" или "нуклеиновая кислота", используемые здесь взаимозаменяемо, относятся к цепям нуклеотидов любой длины и включают ДНК и РНК. Нуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания и/или их аналоги, или любой субстрат, который может быть встроен в цепь ДНК- или РНК-полимеразой. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. В случае если она имеется, модификация структуры нуклеотида, может происходить до и после сборки цепи. Последовательность нуклеотидов может быть прервана не-нуклеотидными компонентами. Полинуклеотид может быть дополнительно модифицирован после полимеризации, например посредством конъюгации с меченым компонентом. Другие типы модификаций включают, например, "кэпы", замещение одного или нескольких природных нуклеотидов аналогом, межнуклеотидные модификации, такие, как, например, модификации с незаряженными связями (например метилфосфонаты, фосфотриэфиры, фосфоамидаты, карбаматы и т.д.) и с заряженными связями (например фосфоротиоаты, фосфородитиоаты и т.д.), содержащие боковые группировки, такие как, например, белки (например нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин и т.д.), содержащие интеркаляторы (например акридин, псорален и т.д.), содержащие хелаторы (например металлов, радиоактивных металлов, бора, окислительных металлов, и т.д.), содержащие алкилаторы, модификации, содержащие модифицированные связи (например альфа аномерные нуклеиновые кислоты и т.д.), а также немодифицированные формы полинуклеотида(ов). Кроме того, любая из гидроксильных групп, обычно присутствующих в сахарах, может быть заменена, например, фосфонатными группами, фосфатными группами, защищена стандартными защитными группами или активирована для получения дополнительных связей с дополнительными нуклеотидами, или может быть конъюгирована с твердыми подложками. 5'- и 3'-концевой ОН может быть фосфорилирован или заменен аминами или органическими группировками кэппирующих групп, состоящими из 1-20 атомов углерода. Другие гидроксильные группы также могут быть дериватизированы стандартными защитными группами. Полинуклеотиды также могут содержать аналогичные формы сахаров рибозы или дезоксирибозы, которые, в общем случае, известны в данной области техники, в том числе, например, 2'-O-метил-, 2'-O-аллил, 2'-фтор- или 2'-азидо-рибозу, карбоциклические аналоги сахара, альфа- или бета-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пиранозы, фуранозы, седогептулозы, ациклические аналоги и нуклеозидные аналоги без азотистого основания, такие как метилрибозид. Одна или более фосфодиэфирных связей могут быть заменены альтернативными линкерными группами. Эти альтернативные линкерные группы включают, без ограничения ими, воплощения, где фосфат заменен P(O)S ("тиоат"), P(S)S ("дитиоат"), (O)NR2 ("амидат"), P(O)R, P(O)OR', СО или СН2 ("формацеталь"), где каждый R или R' независимо представляет собой Н или замещенный или незамещенный алкил (1-20 С), возможно содержащий простую эфирную (-O-) связь, арил, алкенил, циклоалкил, циклоалкенил или аралдил. Не все связи в полинуклеотиде должны быть одинаковыми. Предыдущее описание относится ко всем полинуклеотидам, упоминаемым здесь, включая РНК и ДНК.
При использовании здесь, антитело "взаимодействует с" PD-1, когда равновесная константа диссоциации равна или меньше чем 20 нМ, предпочтительно меньше чем примерно 6 нМ, более предпочтительно меньше чем примерно 1 нМ, наиболее предпочтительно меньше чем примерно 0,2 нМ, при измерение с помощью методов, раскрытых в данном описании изобретения в Примере 7.
Антитело, которое "предпочтительно связывается" или "специфически связывается" (используются в данном описании изобретения взаимозаменяемо) с эпитопом, означает выражение, хорошо известное в данной области, и методы для определения такого специфического или предпочтительного связывания также хорошо известны в данной области. Говорят, что молекула проявляет "специфическое связывание" или "предпочтительное связывание", если она взаимодействует или связывается чаще, быстрее, на более длительное время и/или с большей аффинностью с конкретной клеткой или веществом, чем с другими клетками или веществами. Антитело "специфически связывается" или "предпочтительно связывается" с мишенью, если оно связывается с большей аффинностью, авидностью, легче и/или с большей продолжительностью, чем оно связывается с другими веществами. Например, антитело, которое специфически или предпочтительно связывается с эпитопом PD-1, представляет собой антитело, которое связывается с этим эпитопом с большей аффинностью, авидностью, легче и/или более продолжительно, чем оно связывается с другими эпитопами PD-1 или не-PD-1 эпитопами. Также из этого определения понятно, что, например, антитело (или группировка, или эпитоп), которое специфически или предпочтительно связывается с первой мишенью, может специфически или предпочтительно связываться или не связываться со второй мишенью. Таким образом, "специфическое связывание" или "предпочтительное связывание" не обязательно требует (хотя и может включать) исключительного связывания. Как правило, но не обязательно, ссылка на связывание означает предпочтительное связывание.
При использовании здесь, "по существу чистый" относится к веществу, которое является по меньшей мере на 50% чистым (то есть не содержащим загрязняющих примесей), более предпочтительно по меньшей мере на 90% чистым, более предпочтительно по меньшей мере на 95% чистым, еще более предпочтительно по меньшей мере на 98% чистым и наиболее предпочтительно по меньшей мере на 99% чистым.
"Клетка-хозяин" включает отдельную клетку или клеточную культуру, которые могут быть или были реципиентами вектора(ов) для введения полинуклеотидных вставок. Клетки-хозяева включают потомство одной клетки-хозяина и это потомство не обязательно должно быть полностью идентичным (морфологически или по последовательности геномной ДНК) исходной родительской клетке из-за природных, случайных или неслучайных мутаций. Клетка-хозяин включает клетки, трансфицированные in vivo полинуклеотидом(ами) по данному изобретению.
Как известно в данной области, термин "Fc-область" используется для обозначения С-концевой области тяжелой цепи иммуноглобулина. "Fc-область" может представлять собой Fc-область с природной последовательностью или вариант Fc-области. Хотя границы Fc-области тяжелой цепи иммуноглобулина могут варьироваться, Fc-область тяжелой цепи IgG человека обычно определяют как участок от аминокислотного остатка в положении Cys226 или от Pro230 до его карбоксильного конца. Нумерация остатков в Fc-области соответствует EU-индексу по Kabat. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md., 1991. Fc-область иммуноглобулина, как правило, содержит два константных домена СН2 и СН3. Как известно в данной области, Fc-область может присутствовать в димерной или мономерной форме.
Как используется в данной области, "Fc рецептор" и "FcR" обозначают рецептор, который связывается с Fc-областью антитела. Предпочтительный FcR представляет собой FcR человека с нативной последовательностью. Кроме того, предпочтительным FcR является FcR, который связывается с IgG-антителом (гамма-рецептор) и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и альтернативно сплайсированные формы этих рецепторов. Рецепторы FcγRII включают FcγRIIA ("активирующий рецептор") и FcγRIIB ("ингибирующий рецептор"), которые имеют аналогичные аминокислотные последовательности, отличающиеся, в основном, своими цитоплазматическими доменами. FcR описаны в Ravetch and Kinet, 1991, Ann. Rev. Immunol., 9:457-92; Capel et al., 1994, Immunomethods, 4:25-34; и de Haas et al., 1995, J. Lab. Clin. Med., 126:330-41. "FcR" также включает неонатальный рецептор, FcRn, который отвечает за передачу материнских IgG плоду (Guyer et al., 1976, J. Immunol., 117:587; и Kim et al., 1994, J. Immunol., 24:249).
Термин "конкурировать", при использовании здесь в отношении антитела, означает, что первое антитело или его антигенсвязывающий фрагмент связывается с эпитопом образом, достаточно похожим на связывание второго антитела или его антигенсвязывающего фрагмента, так что результат связывания первого антитела с его когнатным эпитопом заметно уменьшен в присутствии второго антитела по сравнению со связыванием первого антитела в отсутствие второго антитела. Альтернативно, может быть, хотя и необязательно, что связывание второго антитела с его эпитопом также заметно снижено в присутствии первого антитела. То есть первое антитело может ингибировать связывание второго антитела с его эпитопом без ингибирования вторым антителом связывания первого антитела со своим соответствующим эпитопом. Однако, когда каждое антитело заметно ингибирует связывание другого антитела с его когнатным эпитопом или лигандом, в той же самой, большей или меньшей степени, говорят, что антитела "перекрестно конкурируют" друг с другом за связывание со своим(и) соответствующим(и) эпитопом(ами). Как конкурирующие, так и перекрестно конкурирующие антитела охвачены настоящим изобретением. Независимо от механизма, посредством которого осуществляется такая конкуренция или перекрестная конкуренция (например пространчтвенное затруднение, конформационное изменение или связывание с общим эпитопом или его частью), специалисту в данной области должно быть понятно на основании представленных здесь принципов, что такие конкурирующие и/или перекрестно конкурирующие антитела охвачены или могут быть полезны для раскрытых здесь способов.
"Функциональная Fc-область" обладает по меньшей мере одной эффекторной функцией нативной последовательности Fc-области. Характерные "эффекторные функции" включают связывание C1q; комплементзависимую цитотоксичность; связывание Fc-рецептора; антителозависимую клеточно-опосредованную цитотоксичность; фагоцитоз; даун-регуляция рецепторов клеточной поверхности (например В-клеточного рецептора), и т.д. Такие эффекторные функции обычно требуют, чтобы Fc-область была объединена со связывающим доменом (например вариабельным доменом антитела), и могут быть оценены с использованием различных известных в данной области анализов для оценки таких эффекторных функций антител.
"Нативная последовательность Fc-области" содержит аминокислотную последовательность, идентичную аминокислотной последовательности Fc-области, обнаруженной в природе. "Вариант Fc-области" содержит аминокислотную последовательность, которая отличается от нативной последовательности Fc-области по меньшей мере одной аминокислотной модификацией, но при этом сохраняет по меньшей мере одну эффекторную функцию Fc-области с нативной последовательностью. Предпочтительно, вариант Fc-области имеет по меньшей мере одну аминокислотную замену по сравнению с нативной последовательностью Fc-области или с Fc-областью родительского полипептида, например от примерно одной до примерно десяти аминокислотных замен и предпочтительно от примерно одной до примерно пяти аминокислотных замен в нативной последовательности Fc-области или в Fc-области родительского полипептида. Вариант Fc-области в данном изобретении предпочтительно обладает по меньшей мере примерно 80%-ной идентичностью последовательности с нативной последовательностью Fc-области и/или с Fc-областью родительского полипептида, и наиболее предпочтительно по меньшей мере примерно 90%-ной идентичностью последовательности с ней, более предпочтительно по меньшей мере примерно 95%, по меньшей мере примерно 96%, по меньшей мере примерно 97%, по меньшей мере примерно 98%, по меньшей мере примерно 99%-ной идентичностью последовательности с ней.
При использовании здесь, термин "лечение" представляет собой подход для получения полезных или желательных клинических результатов. Для целей настоящего изобретения полезные или желательные клинические результаты включают, без ограничения ими, один или более из следующего: уменьшение пролиферации (или разрушение) неопластических или раковых клеток, ингибирование метастазирования неопластических клеток, сокращение объема или уменьшение размера опухоли, ремиссия рака, уменьшение симптомов, вызванных раком, повышение качества жизни людей, страдающих от рака, уменьшение дозы других лекарственных средств, необходимых для лечения рака, замедление прогрессирования рака, лечение рака и/или увеличение продолжительности жизни раковых пациентов.
"Улучшение" означает ослабление или облегчение одного или более симптомов по сравнению с отсутствием введения антагонистического антитела к PD-1. "Улучшение" также включает сокращение или уменьшение продолжительности симптома.
При использовании здесь, "эффективная доза" или "эффективное количество" лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для достижения любого одного или более полезных или желательных результатов. В более конкретных аспектах эффективное количество предупреждает, облегчает или ослабляет симптомы заболевания и/или увеличивает продолжительность жизни пациента, подвергаемого лечению. Для профилактического использования полезные или желательные результаты включают устранение или снижение риска, уменьшение тяжести или задержку начала заболевания, включая биохимические, гистологические и/или поведенческие симптомы заболевания, его осложнений и промежуточных патологических проявлений, присутствующих при развитии заболевания. Для терапевтического использования полезные или желательные результаты включают клинические результаты, такие как уменьшение одного или более симптомов заболевания, такого как, например, рак, включающий, без ограничения ими, рак желудка, саркому, лимфому, лимфому Ходжкина, лейкоз, рак головы и шеи, плоскоклеточный рак головы и шеи, рак тимуса, эпителиальный рак, рак слюнных желез, рак печени, рак желудка, рак щитовидной железы, рак легких, рак яичника, рак молочной железы, рак предстательной железы, рак пищевода, рак поджелудочной железы, глиому, лейкоз, множественную миелому, почечноклеточную карциному, рак мочевого пузыря, рак шейки матки, хориокарциному, рак толстой кишки, рак полости рта, рак кожи и меланому, уменьшение дозы других лекарственных средств, необходимых для лечения заболевания, усиление эффекта другого лекарственного средства и/или задержка прогрессирования рака у пациентов. Эффективную дозу можно вводить в виде одного или более введений. Для целей настоящего изобретения эффективная доза лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для проведения профилактического или терапевтического лечения либо непосредственно, либо опосредовано. Как понимается в клиническом контексте, эффективная доза лекарственного средства, соединения или фармацевтической композиции может быть достигнута или может не достигаться в сочетании с другим лекарственным средством, соединением или фармацевтической композицией. Таким образом, "эффективную дозу" можно рассматривать в контексте введения одного или нескольких терапевтических агентов и считается, что единичный агент дают в эффективном количестве, если в сочетании с одним или более другими агентами может быть достигнут или достигается нужный результат.
"Индивидуум" или "субъект" представляет собой млекопитающего, более предпочтительно человека. Млекопитающие также включают, без ограничения ими, сельскохозяйственных животных (например коров, свиней, лошадей, цыплят и т.д.), спортивных животных, домашних животных, приматов, лошадей, собак, кошек, мышей и крыс.
При использовании здесь, "вектор" означает конструкцию, которая способна доставлять и предпочтительно экспрессировать один или более ген(ов) или последовательности(ей), представляющих интерес, в клетку-хозяина. Примеры векторов включают, без ограничения ими, вирусные векторы, экспрессионные векторы с обнаженной ДНК или РНК, плазмидные, космидные или фаговые векторы, ДНК- или РНК-экспрессионные векторы, ассоциированные с катионными конденсирующими агентами, ДНК- или РНК-экспрессионные векторы, инкапсулированные в липосомы и определенные эукариотические клетки, такие как клетки-продуценты.
При использовании здесь, термин "последовательность, контролирующая экспрессию" означает нуклеиновокислотную последовательность, которая направляет транскрипцию нуклеиновой кислоты. Последовательность, контролирующая экспрессию, может представлять собой промотор, например конститутивный или индуцибельный промотор, или энхансер. Последовательность, контролирующая экспрессию, функционально связана с транскрибируемой нуклеиновокислотной последовательностью.
При использовании здесь, термин "фармацевтически приемлемый носитель" или "фармацевтически приемлемый эксципиент" включает любое вещество, которое при объединении с активным ингредиентом позволяет этому ингредиенту сохранять биологическую активность и которое не взаимодействует с иммунной системой субъекта. Примеры включают, без ограничения ими, любой из стандартных фармацевтических носителей, таких как фосфатно-буферный солевой раствор, вода, эмульсии, такие как эмульсия масло-в-воде, и различные типы увлажнителей. Предпочтительными разбавителями для аэрозольного или парентерального введения являются забуференный фосфатом физиологический раствор (PBS) или нормальный (0,9%) физиологический раствор. Композиции, содержащие такие носители, готовят посредством хорошо известных общепринятых методов (смотрите, например, Remington's Pharmaceutical Sciences, 18th edition, A. Gennaro, ed., Mack Publishing Co., Easton, PA, 1990; и Remington, The Science and Practice of Pharmacy 20th Ed. Mack Publishing, 2000).
Термин "kon", при использовании здесь, относится к константе скорости ассоциации антитела с антигеном. Конкретно, константы скорости (kon и koff) и равновесные константы диссоциации измеряют с использованием полноразмерных антител и/или Fab-фрагментов антител (то есть одновалентных) и PD-1.
Термин "koff", при использовании здесь, относится к константе скорости диссоциации антитела из комплекса антитело/антиген.
Термин "KD", при использовании здесь, относится к равновесной константе диссоциации взаимодействия антитело-антиген.
Ссылка на "примерно" в указании значения или параметра здесь включает (и описывает) воплощения, которые относятся к этому значению или параметру как таковому. Например, описание, относящиеся к "примерно X" включает описание "X." Числовые диапазоны включают числа, задающие этот диапазон.
Термин "энхансер иммуноэффекторной клетки" или "IEC-энхансер" относится к веществу, способному увеличить или усилить количество, качество или функцию одного или более типов иммуноэффекторных клеток млекопитающего. Примеры иммуноэффекторных клеток включают цитолитические CD8 Т-клетки, CD4 Т-клетки, NK-клетки и В-клетки.
Термин "иммуномодулятор" относится к веществу, способному изменять (например ингибировать, уменьшать, увеличивать, усиливать или стимулировать) иммунный ответ (как определено здесь) или работу любого компонента врожденной, гуморальной или клеточной иммунной системы хозяина-млекопитающего. Таким образом, термин "иммуномодулятор" включает "энхансер иммуноэффекторной клетки", как определено здесь, и "ингибитор иммуносупрессивной клетки", как определено здесь, а также вещество, которое воздействует на другие компоненты иммунной системы млекопитающего.
Термин "иммунный ответ" относится к любому детектируемому ответу на конкретное вещество (например антиген или иммуноген) иммунной системы млекопитающего-хозяина, такому как врожденные иммунные ответы (например активация сигнального каскада Toll-рецептора), опосредованные клетками иммунные ответы (например ответы, опосредованные Т-клетками, такими как антигенспецифические Т-клетки и неспецифические клетки иммунной системы) и гуморальные иммунные ответы (например ответы, опосредованные В-клетками, такие как генерирование и секреция антител в плазму, лимфу и/или тканевые жидкости).
Термин "иммуногенный" относится к способности вещества быть причиной, вызывать, стимулировать или индуцировать иммунный ответ или улучшать, усиливать, увеличивать или продлевать ранее существовавший иммунный ответ против определенного антигена, как одного, так и связанного с носителем, в присутствии или в отсутствие адъюванта.
Термин "ингибитор иммуносупрессивной клетки" или "ISC-ингибитор" относится к веществу, способному снижать или подавлять количество или функцию иммуносупрессивных клеток млекопитающего. Примеры иммуносупрессивных клеток включают регуляторные Т-клетки ("Т regs"), клетки-супрессоры миелоидного происхождения и макрофаги, ассоциированные с опухолью.
Термин "внутрикожное введение" или "введенное внутрикожно" в контексте введения вещества млекопитающего, включая человека, относится в доставке вещества в слой дермы кожи млекопитающего. Кожа млекопитающего состоит из слоя эпидермиса, слоя дермы и подкожного слоя. Эпидермис представляет собой внешний слой кожи. Дерма, которая является средним слоем кожи, содержит нервные окончания, потовые железы и масляные (сальные) железы, волосяные фолликулы и кровеносные сосуды. Подкожный слой состоит из жировой и соединительной ткани, в которой находятся более крупные кровеносные сосуды и нервы. В отличие от внутрикожного введения, "подкожное введение" относится к введению вещества в подкожный слой, а "местное введение" относится к введению вещества на поверхность кожи.
Термин "неопластическое расстройство" относится к состоянию, при котором клетки размножаются с аномально высокой и неконтролируемой скоростью, скорости, превышающей и несогласованной со скоростью окружающих нормальных тканей. Это обычно приводит к солидному повреждению или наросту, известному как "опухоль" Этот термин охватывает доброкачественные и злокачественные неопластические расстройства. Термин "злокачественное неопластическое расстройство", которое используют взаимозаменяемо с термином "рак" в настоящем описании изобретения, относится к неопластическому расстройству, характеризующемуся способностью опухолевых клеток распространяться в другие места в организме (известной как "метастазирование"). Термин "доброкачественное неопластическое расстройство" относится к неопластическому расстройству, при котором у опухолевых клеток отсутствует способность метастазировать.
Термин "предупреждение" или "предупреждать" относится к (а) предупреждению начала расстройства или к (б) задержке начала расстройства или появления симптомов расстройства.
Термин "ассоциированный с опухолью антиген" или "ТАА" относится к антигену, который специфически экспрессируется опухолевыми клетками или экспрессируется с более высокой частотой или интенсивностью опухолевыми клетками, чем неопухолевыми клетками того же тканевого типа. Ассоциированные с опухолью антигены могут представлять собой антигены, которые обычно не экспрессируются хозяином; они могут быть мутированными, усеченными, неправильно свернутыми или представлять собой другие аномальные воплощения молекул, обычно экспрессируемых хозяином; они могут быть идентичны обычно экспрессируемым молекулам, но экспрессироваться на аномально высоких уровнях; или они могут экспрессироваться в аномальных условиях или среде. Ассоциированные с опухолью антигены могут представлять собой, например, белки или белковые фрагменты, сложные углеводы, ганглиозиды, гаптены, нуклеиновые кислоты или любую комбинацию этих или других биологических молекул.
Термин "вакцина" относится к иммуногенной композиции для введения млекопитающему для индуцирования у него иммунного ответа против конкретного антигена. Вакцина, как правило, содержит агент (известный как "антиген" или "иммуноген"), который напоминает или происходит из мишени иммунного ответа, например болезнетворного микроорганизма или опухолевых клеток. Вакцина, предназначенная для лечения опухоли, такой как рак, обычно содержит антиген, который происходит от ТАА, находящегося на опухоли-мишени, и способна вызывать иммуногенность против ТАА на опухоли-мишени.
Термин "схема вакцинной иммунотерапии" относится к терапевтической схеме, в которой вакцину вводят в комбинации с одним или более иммуномодуляторами. Вакцина и иммуномодуляторы могут быть введены вместе в одной композиции или введены по отдельности.
Следует понимать, что где воплощения описаны с помощью выражения "содержащий", также предложены иные аналогичные воплощения, описанные с помощью выражений "состоящий из" и/или "по существу состоящий из".
Когда аспекты или воплощения изобретения описаны в терминах группы Маркуша или другой группы альтернатив, настоящее изобретение включает не только всю указанную группу в целом, но и каждого представителя группы отдельно, и все возможные подгруппы основной группы, а также основную группу с отсутствием одного или нескольких представителей группы. В настоящем изобретении также рассматривается ясное исключение одного или более любых представителей группы в заявленном изобретении.
Если не указано иное, все технические и научные термины, используемые здесь, имеют то же значение, которое обычно используется специалистом в области техники, к которой относится настоящее изобретение. В случае конфликта настоящая заявка, включая определения, будет иметь преимущество. На всем протяжении настоящего описания и формулы изобретения слово "содержать" или варианты, такие как "содержит" или "содержащий" следует понимать, как подразумевающее включение указанного целого числа или группы целых чисел, но не исключение любого другого целого числа или группы целых чисел. Если иное не требуется по контексту, термины в единственном числе включают множественное число, а термины во множественном числе включают единственное число. Любой(ые) пример(ы), следующий за термином "например" или "в частности", не следует считать исчерпывающим(и) или ограничивающим(и).
Здесь описаны примеры способов и веществ, хотя способы и вещества, аналогичные или эквивалентные описанным здесь, также можно использовать в практическом осуществлении или испытании настоящего изобретения. Вещества, способы и примеры являются только иллюстративными и их не следует считать ограничивающими.
Антагонистические антитела к PD-1
В данном изобретении предложены антагонистические антитела к PD-1, которые блокируют, подавляют или снижают (в том числе значительно снижают) биологическую активность PD-1, включая нижележащие события, опосредованные PD-1. Антагонистическое антитело к PD-1 должно демонстрировать любую одну или более из следующих характеристик: (а) связываться с PD-1 и блокировать нижележащие события в передаче сигнала; (б) блокировать связывание PD-L1 с PD-1; (в) активировать опосредованный Т-клетками иммунный ответ; (г) стимулировать секрецию IFNγ; (д) стимулировать секрецию TNF; (е) увеличивать пролиферацию Т-клеток; и (ж) уменьшать ингибирующую передачу сигнала через PD-1.
Для целей настоящего изобретения антитело предпочтительно взаимодействует с PD-1 таким образом, что ингибирует функцию передачи сигнала посредством PD-1. В некоторых воплощениях антагонистическое антитело к PD-1 специфически связывается с PD-1 примата.
Антитела, полезные в настоящем изобретении, могут включать моноклональные антитела, поликлональные антитела, фрагменты антител (например Fab, Fab', F(ab')2, Fv, Fc, и т.д.), химерные антитела, биспецифические антитела, гетероконъюгатные антитела, одну цепь (ScFv), их мутанты, слитые белки, содержащие фрагмент антитела (например доменное антитело), гуманизированные антитела и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит сайт распознавания антигена нужной специфичности, включая гликозилированные варианты антител, варианты антител по аминокислотной последовательности и ковалентно модифицированные антитела. Антитела могут быть мышиными, крысиными, человеческими или любыми другими антителами другого происхождения (включая химерные или гуманизированные антитела). В некоторых воплощениях антагонистическое антитело к PD-1 представляет собой моноклональное антитело. В некоторых воплощениях антитело является человеческим или гуманизированным антителом.
Антагонистические антитела к PD-1 могут быть получены любым способом, известным в данной области. Основные способы получения человеческих и мышиных антител известны в данной области техники и/или описаны здесь.
Антагонистические антитела к PD-1 могут быть идентифицированы или охарактеризованы с использованием способов, известных в данной области, посредством которых определяют и/или измеряют уменьшение, ослабление или нейтрализацию биологической активности PD-1. В некоторых воплощениях антагонистическое антитело к PD-1 идентифицируют путем инкубации агента-кандидата с PD-1 и мониторинга связыванием и/или сопутствующего снижения или нейтрализации биологической активности PD-1. Анализ связывания может быть выполнен, например, с очищенным(и) полипептидом(ами) PD-1, или с клетками, естественно экспрессионными (например различные штаммы), или трансфицированными для экспрессии полипептида(ов) PD-1. В одном воплощении анализ связывания представляет собой конкурентный анализ связывания, где оценивают способность антитела-кандидата конкурировать с известным антагонистическим антителом к PD-1 за связывание с PD-1. Анализ может быть выполнен в различных форматах, включая формат ELISA. В некоторых воплощениях антагонистическое антитело к PD-1 идентифицируют путем инкубирования антитела-кандидата с PD-1 и мониторинга связывания.
После первоначальной идентификации активность антагонистического антитела-кандидата к PD-1 может быть дополнительно подтверждена и уточнена с помощью биоанализов, известных для тестирования целевых биологические активности. В некоторых воплощениях in vitro клеточный анализ используют для дополнительной характеристики антагонистического антитела-кандидата к PD-1. Например, антитело-кандидат инкубируют с первичными человеческими Т-клетками, добавляют PD-L1 и определяют секрецию IFNγ. Альтернативно, биоанализы можно использовать для непосредственного отбора антител-кандидатов.
Антагонистические антитела к PD по изобретению демонстрируют одну или более из следующих характеристик: (а) связываются с PD-1 и блокируют нижележащих событий в передаче сигнала; (б) блокируют связывание PD-L1 с PD-1; (в) активируют опосредованный Т-клетками иммунный ответ; (г) стимулируют секрецию IFNγ; (д) стимулируют секрецию TNF; (е) увеличивают пролиферацию Т-клеток; и (ж) уменьшают ингибирующую передачу сигнала через PD-1 и (з) блокируют связывание PD-L2 с PD-1. Предпочтительно, антитела к PD-1 обладают двумя или более из этих характеристик. Более предпочтительно, антитела имеют три или более из этих характеристик. Более предпочтительно, антитела имеют четыре или более из этих характеристик. Более предпочтительно, антитела имеют пять или более из этих характеристик. Более предпочтительно, антитела имеют шесть или более из этих характеристик. Более предпочтительно, антитела имеют семь или более из этих характеристик. Наиболее предпочтительно, антитела имеют все восемь характеристик.
Антагонистические антитела к PD-1 могут быть охарактеризованы с использованием методов, хорошо известных в данной области. Например, один метод заключается в определении эпитопа, с которым он связывается или в "картировании эпитопа". Существует много методов, известных в данной области, для картирования и характеристики расположения эпитопов на белках, включая определение кристаллической структуры комплекса антитело-антиген, конкурентные анализы, анализы экспрессии фрагментов генов и анализы на основе синтетических пептидов, как описано, например, в главе 11 в Harlow and Lane, Using Antibodies, a Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1999. В дополнительном примере картирование эпитопов можно использовать для определения последовательности, с которой связывается антагонистическое антитело к PD-1. Картирование эпитопов является коммерчески доступным в разных источниках, например в Pepscan Systems (Edelhertweg 15, 8219 РН Lelystad, The Netherlands). Эпитоп может быть линейным эпитопом, то есть находящимся в одном аминокислотном участке или конформационным эпитопом, образованным трехмерным взаимодействием аминокислот, которые необязательно должны находиться в одном участке. Пептиды различной длины (например длиной по меньшей мере 4-6 аминокислот) могут быть выделены или синтезированы (например рекомбинантно) и использованы для анализов связывания с антагонистическим антителом к PD-1. В другом примере эпитоп, с которым связывается антагонистическое антитело к PD-1, может быть определен с помощью систематического скрининга с использованием перекрывающихся пептидов, происходящих от последовательности PD-1, и определения связывания антагонистическим антителом к PD-1. В соответствии с анализами экспрессии фрагментов генов, открытую рамку считывания, кодирующую PD-1, фрагментируют или случайным образом, или посредством специфических генетических конструкций и определяют способность экспрессированных фрагментов PD-1 вступать в реакцию с тестируемым антителом. Фрагменты гена могут быть получены, например, посредством ПЦР и затем транскрибированы и транслированы в белок in vitro в присутствии радиоактивных аминокислот. Связывание антитела с радиоактивно мечеными фрагментами PD-1 затем определяют с помощью иммунопреципитации и гель-электрофореза. Определенные эпитопы также можно идентифицировать путем использования больших библиотек случайных пептидных последовательностей, экспонируемых на поверхности фаговых частиц (фаговые библиотеки) или дрожжей (дрожжевой дисплей). Альтернативно, определенная библиотека перекрывающихся пептидных фрагментов может быть протестирована на связывание с тестируемым антителом в простых анализах связывания. В дополнительном примере могут быть осуществлены мутагенез антигена, эксперименты по замене домена и аланин-сканирующий мутагенез для идентификации остатков, желательных, достаточных и/или необходимых для связывания эпитопа. Например, эксперименты с аланин-сканирующим мутагенезом могут быть выполнены с использованием мутантного PD-1, в котором различные остатки полипептида PD-1 заменены аланином. Путем оценки связывания антитела с мутантным PD-1 можно оценить важность конкретных остатков PD-1 для связывания с антителом.
Еще одним методом, который можно использовать для характеристики антагонистического антитела к PD-1, является использование конкурентных анализов с другими антителами, которые, как известно, связываются с тем же антигеном, то есть с различными фрагментами PD-1, чтобы определить, связывается ли антагонистическое антитело к PD-1 с тем же эпитопом, что и другие антитела. Конкурентные анализы хорошо известны специалистам в данной области, в том числе в формате ELISA.
Аффинность связывания (KD) антагонистического антитела к PD-1 с PD-1 может составлять от примерно 0,001 до примерно 200 нМ. В некоторых воплощениях аффинность связывания составляет примерно 200 нМ, примерно 100 нМ, примерно 50 нМ, примерно 10 нМ, примерно 1 нМ, примерно 500 пМ, примерно 100 пМ, примерно 60 пМ, примерно 50 пМ, примерно 20 пМ, примерно 15 пМ, примерно 10 пМ, примерно 5 пМ, примерно 2 пМ или примерно 1 пМ. В некоторых воплощениях аффинность связывания составляет менее чем примерно 250 нМ, примерно 200 нМ, примерно 100 нМ, примерно 50 нМ, примерно 10 нМ, примерно 1 нМ, примерно 500 пМ, примерно 100 пМ, примерно 50 пМ, примерно 20 пМ, примерно 10 пМ, примерно 5 пМ или примерно 2 пМ.
Соответственно, в данном изобретении предложено любое из следующего, или композиции (в том числе фармацевтические композиции), содержащие антитело, имеющее часть последовательности легкой цепи и часть последовательности тяжелой цепи, как указано в Таблице 1, или их варианты. В Таблице 1 подчеркнутые последовательности представляют собой последовательности CDR. В Таблице 1 KD указывает аффинность в отношении человеческого PD-1, измеренную с использованием поверхностного плазмонного резонанса при 25°С, если не указано иное.
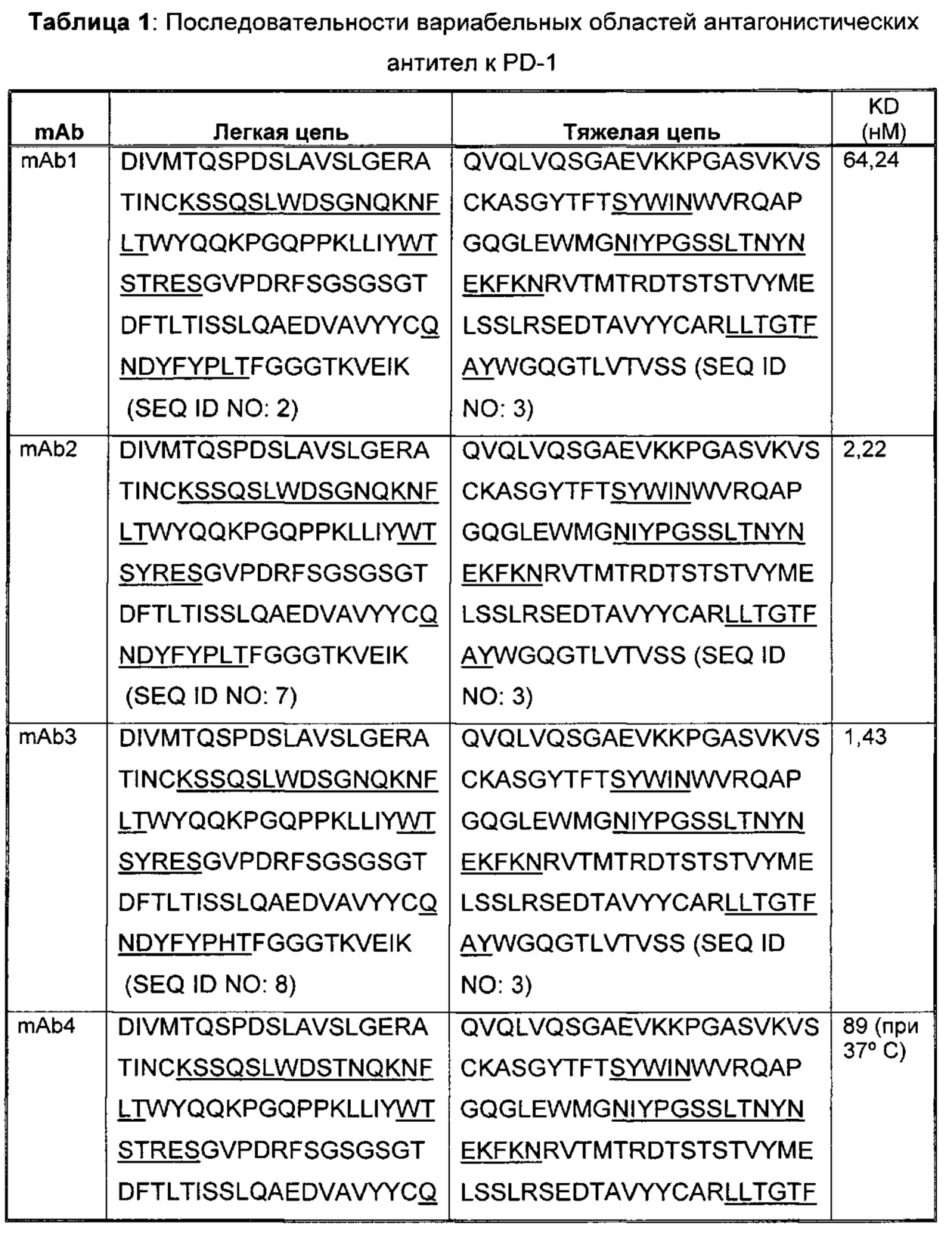
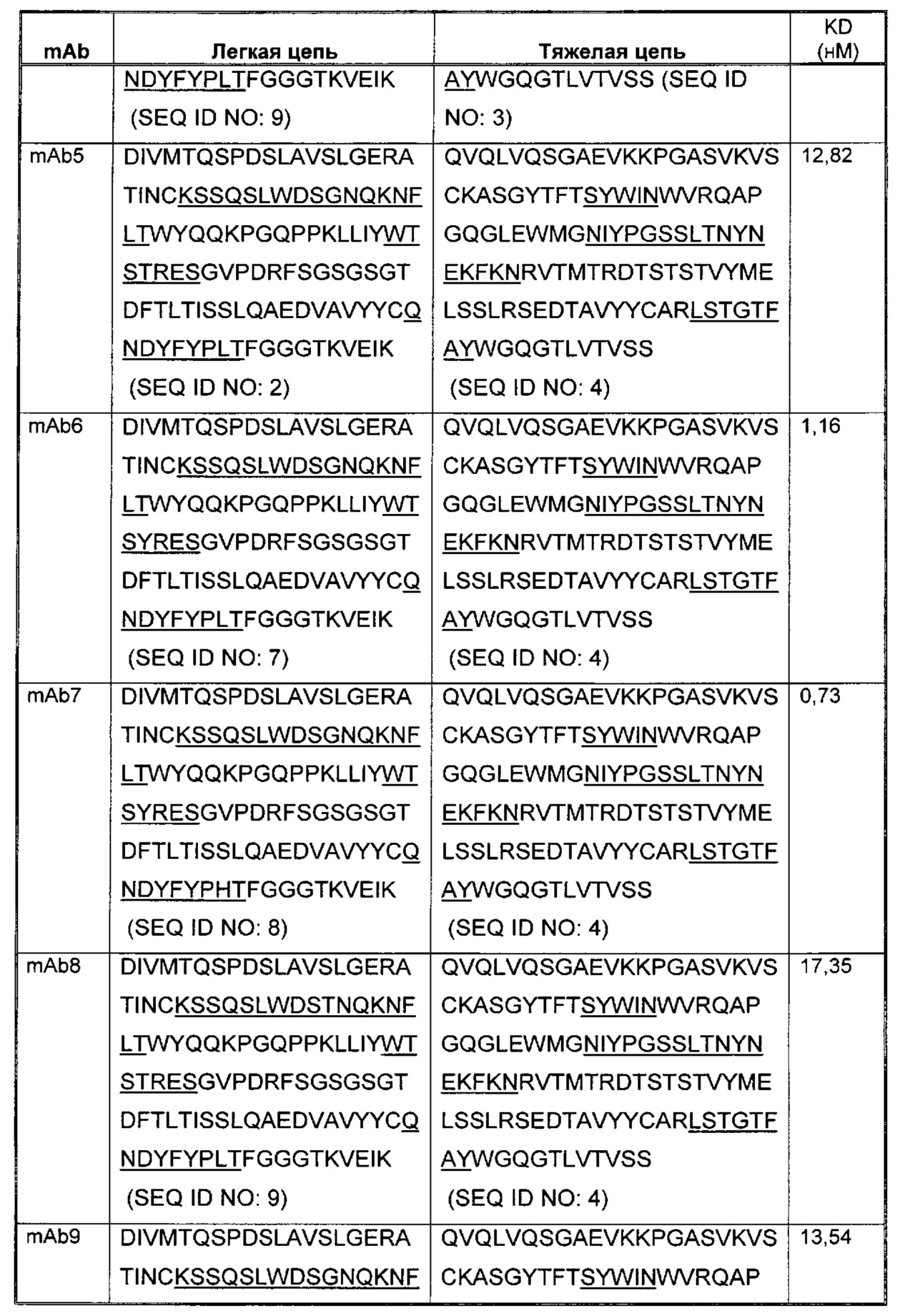
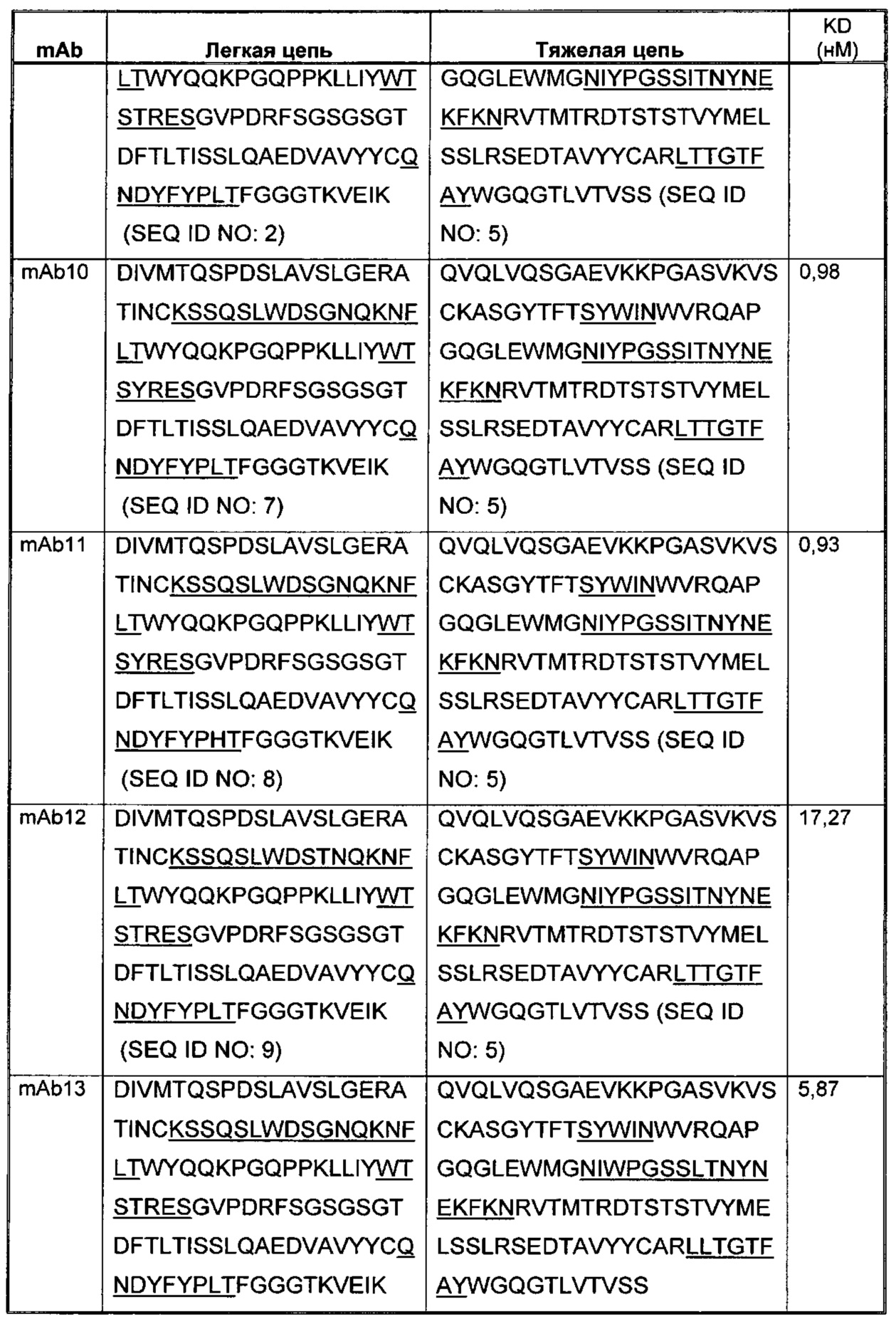
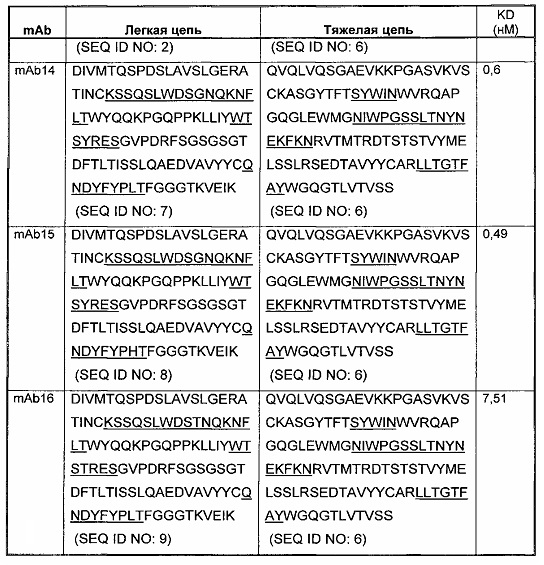
В изобретении также представлены участки CDR антител к PD-1. Определение участков CDR хорошо известно специалистам. Следует понимать, что в некоторых воплощениях CDR могут быть комбинацией CDR по Kabat и по Chothia (также называемой "комбинированные CDR" или "расширенные CDR"). При другом подходе, упоминаемом здесь как "конформационное определение" CDR, положения CDR могут быть идентифицированы, как остатки, которые вносят энтальпический вклад в связывание антигена. См., например, Makabe et al., 2008, Journal of Biological Chemistry, 283:1156-1166. В целом "конформационные CDR" включают положения остатков в CDR по Kabat и в зонах Вернье, которые ограничены, чтобы поддерживать правильную петлевую структуру для связывания антитела с конкретным антигеном. Определение конформационных CDR хорошо известно специалистам. В некоторых воплощениях CDR представляют собой CDR по Kabat. В других воплощениях CDR представляют собой CDR по Chothia. В других воплощениях CDR представляют собой расширенные, AbM, конформационные или контактные CDR. Другими словами, в воплощениях с более чем одним CDR, эти CDR могут быть любыми из Kabat, Chothia, расширенных, AbM, конформационных, контактных CDR или их комбинаций.
В некоторых воплощениях, антитело содержит три CDR любой вариабельной области тяжелой цепи, показанные в Таблице 1. В некоторых воплощениях антитело содержит три CDR любой вариабельной области легкой цепи, показанные в Таблице 1. В некоторых воплощениях антитело содержит три CDR любой вариабельной области тяжелой цепи, показанные в Таблице 1 и три CDR любой вариабельной области легкой цепи, показанные в Таблице 1.
В Таблице 2 приведены примеры представленных здесь последовательностей CDR антагонистических антител к PD-1.
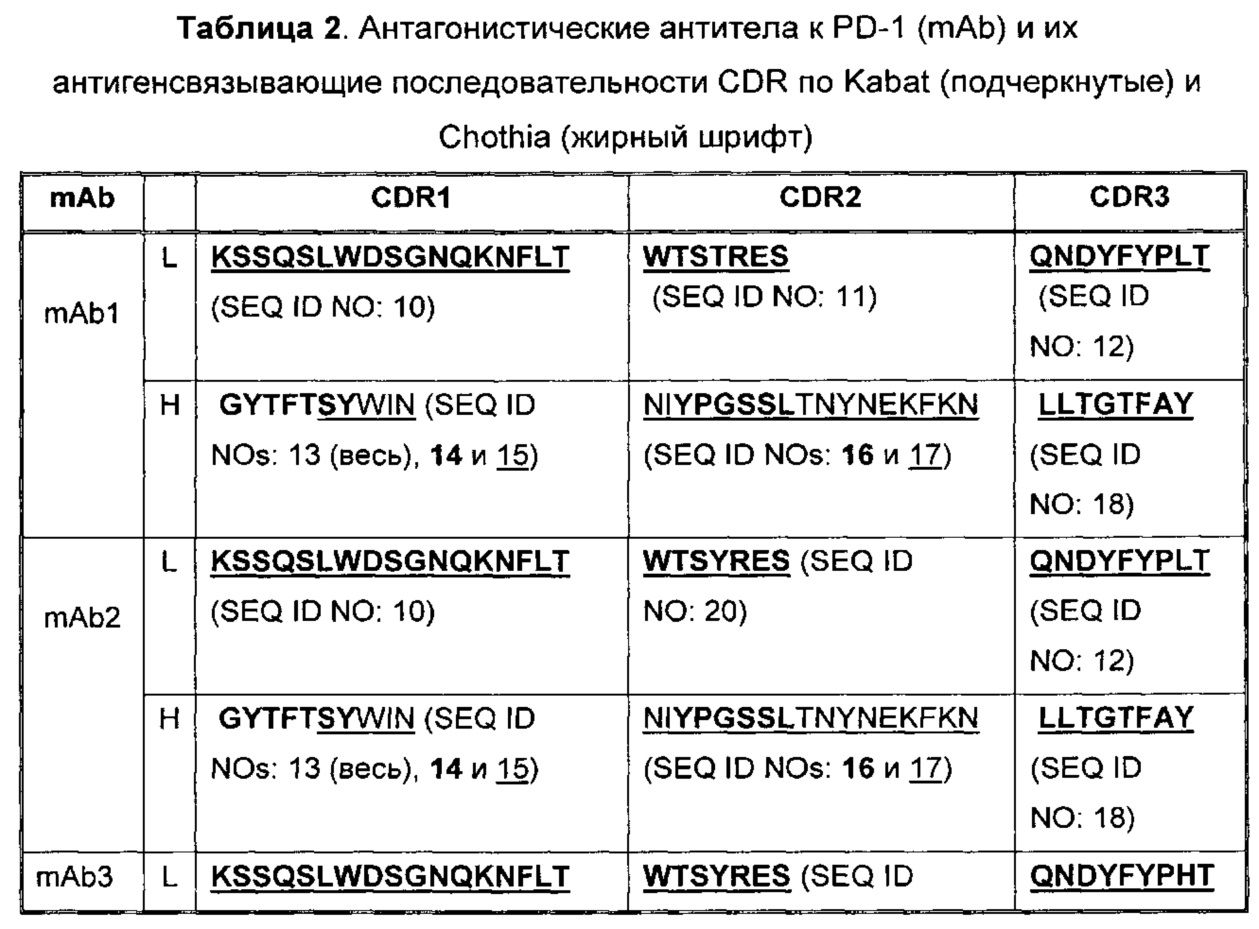
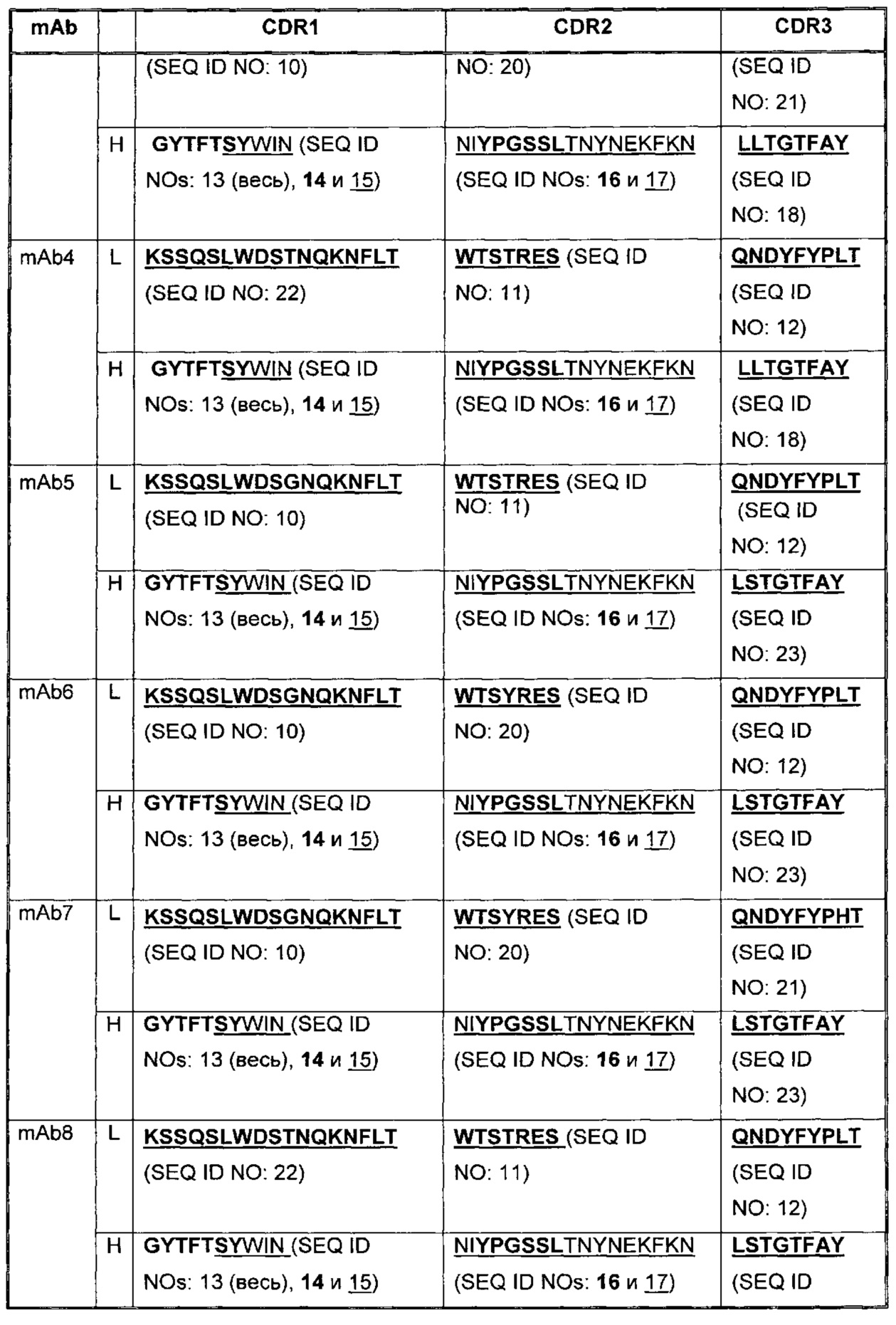
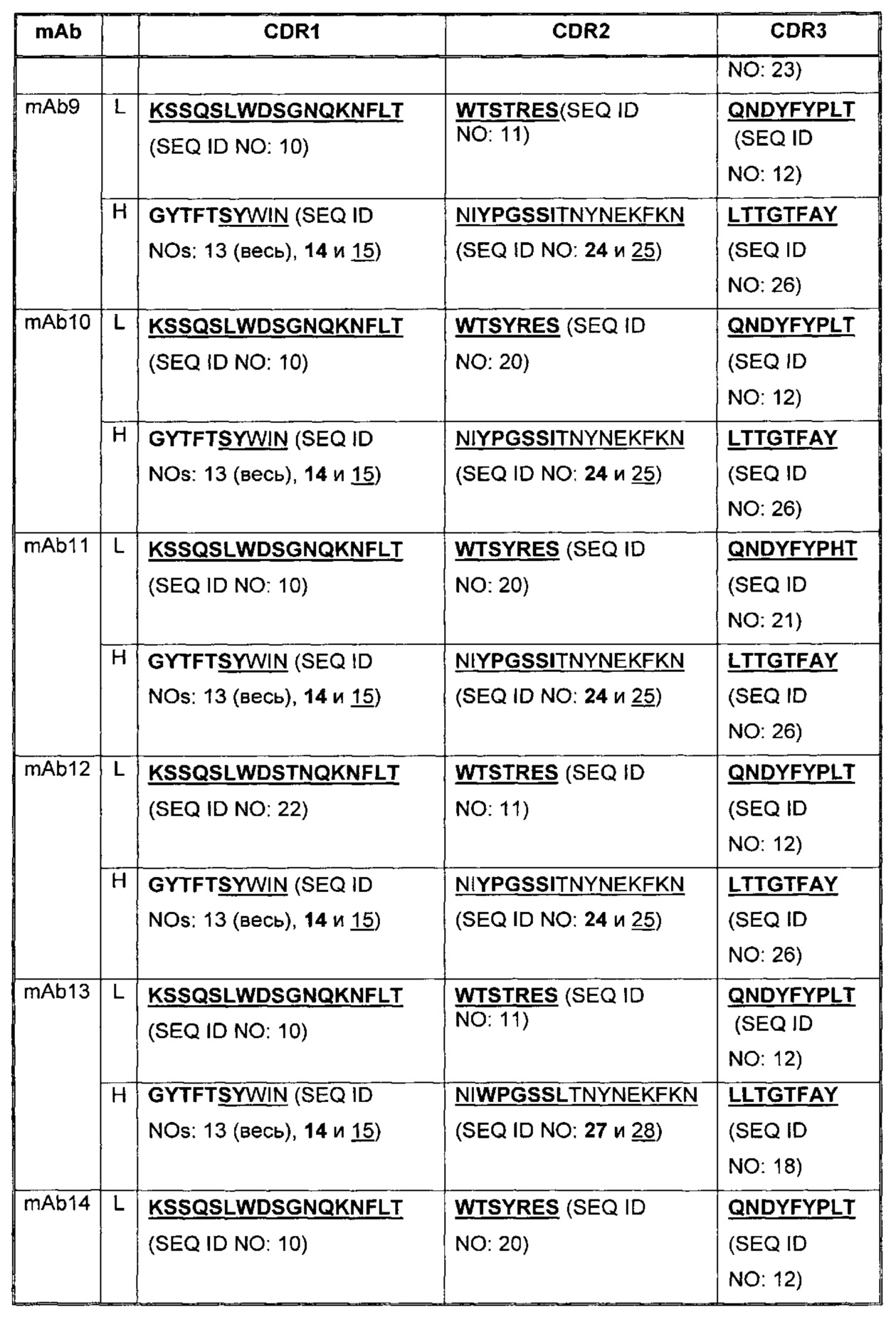
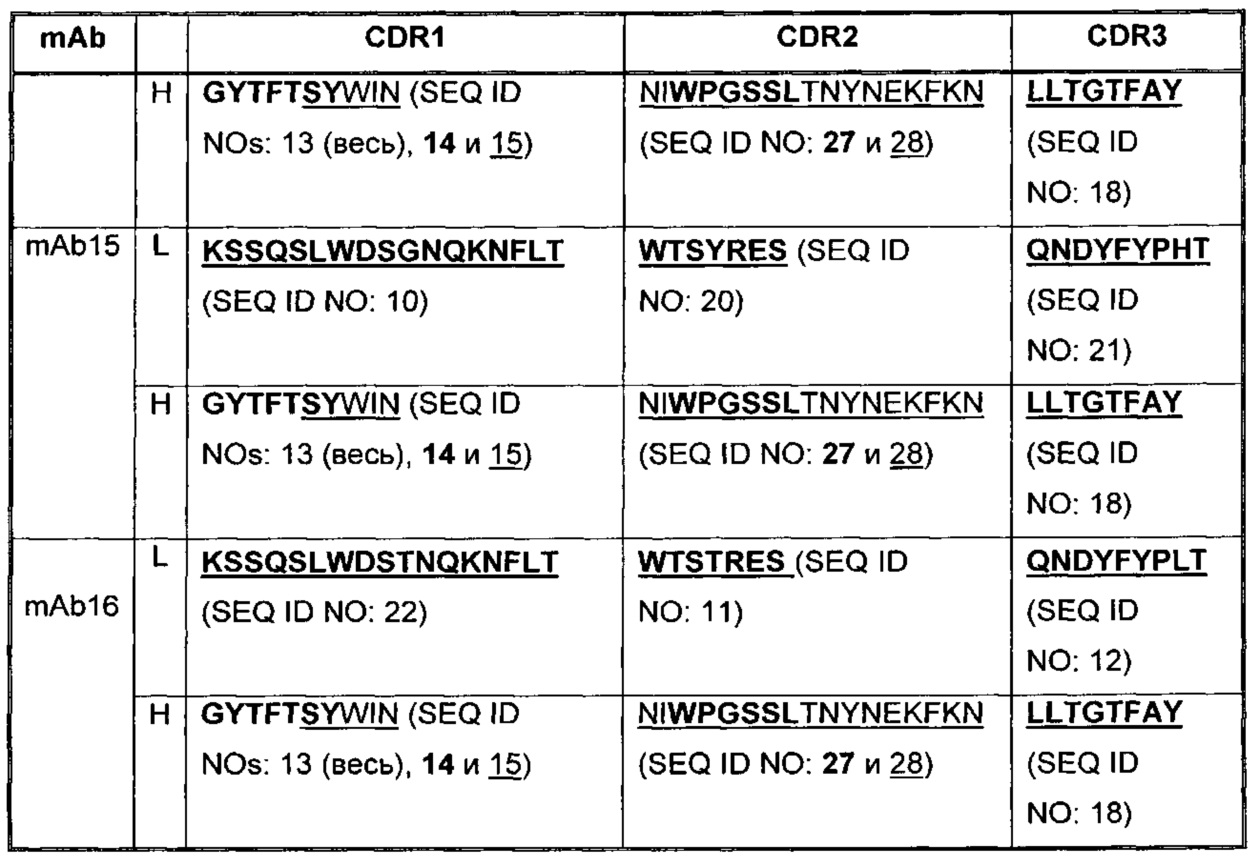
В некоторых воплощениях, антитело содержит три CDR легкой цепи и три CDR тяжелой цепи из Таблицы 2.
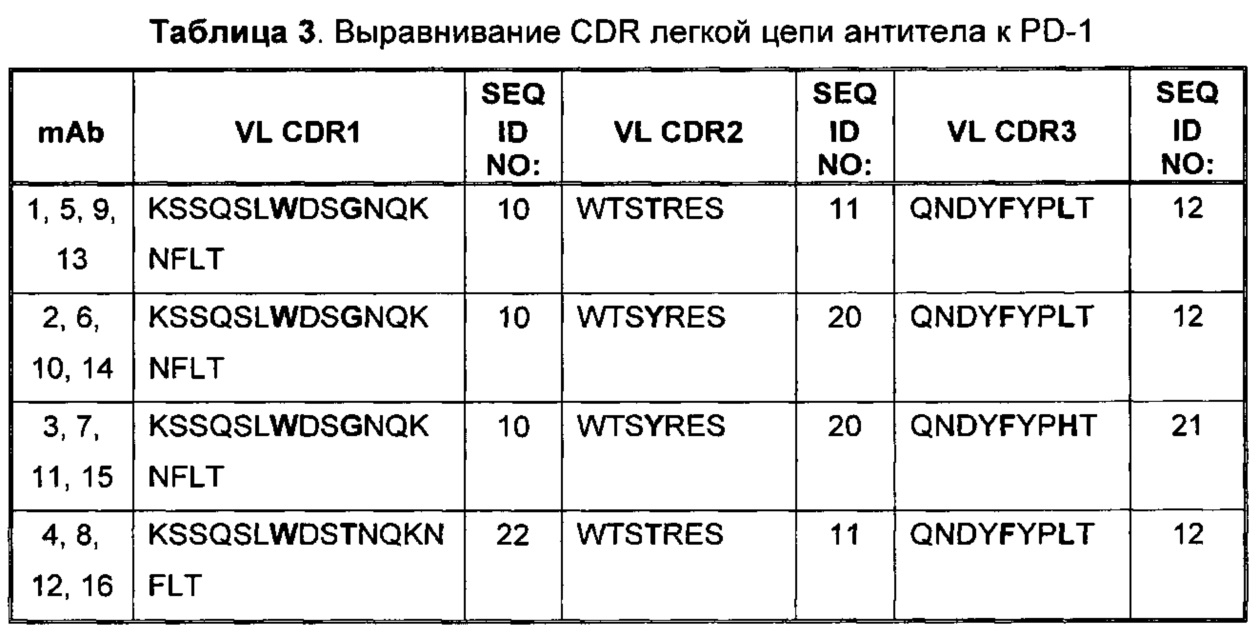
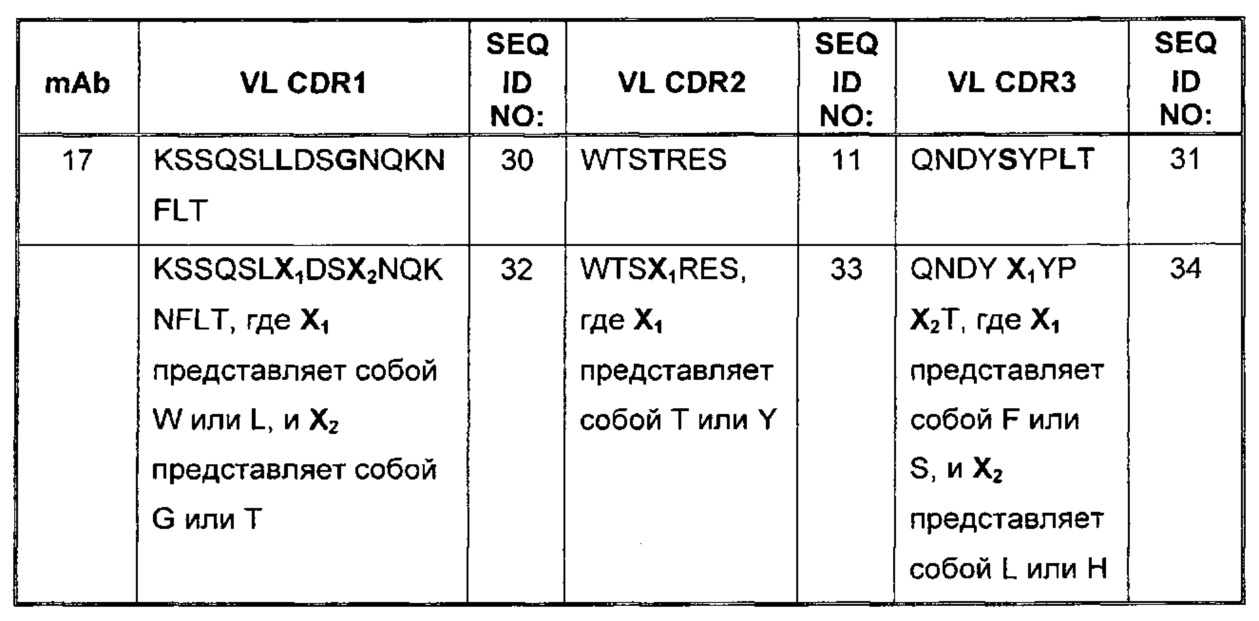
Выравнивание CDR легкой цепи из антитела к PD-1 представлено в Таблице 3. Вариабельные остатки показаны жирным шрифтом. Консенсусные последовательности CDR легкой цепи приведены в последней строке Таблицы 3.
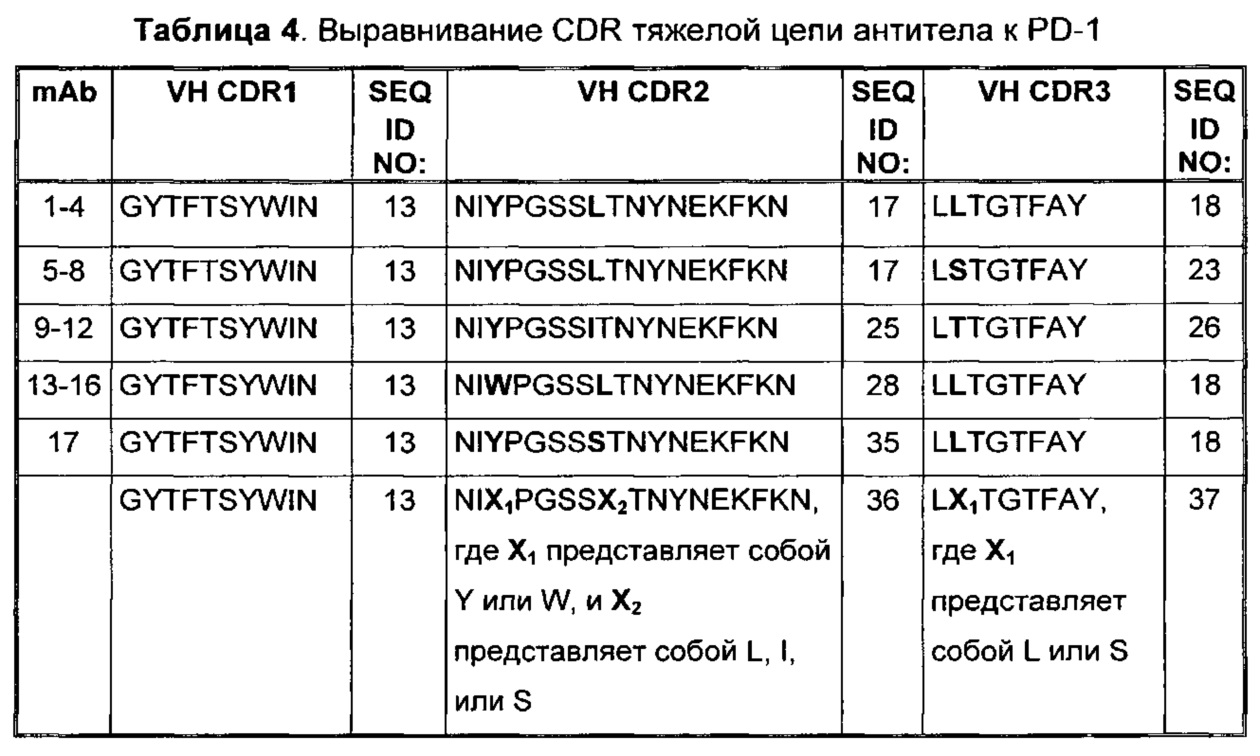
Выравнивание CDR тяжелой цепи антитела к PD-1 представлено в Таблице 4. Вариабельные остатки показаны жирным шрифтом. Консенсусные последовательности CDR тяжелой цепи приведены в последней строке Таблицы 4.
В некоторых воплощениях, антитело содержит три CDR легкой цепи из Таблицы 3 и три CDR тяжелой цепи из Таблицы 4.
В некоторых воплощениях антитело содержит полноразмерную тяжелую цепь, вместе с С-концевым лизином или без него и/или полноразмерную легкую цепь антагонистического антитела к PD-1 mAb7 или mAb15. Аминокислотная последовательность полноразмерной тяжелой цепи mAb7 (SEQ ID NO: 29) показана ниже:
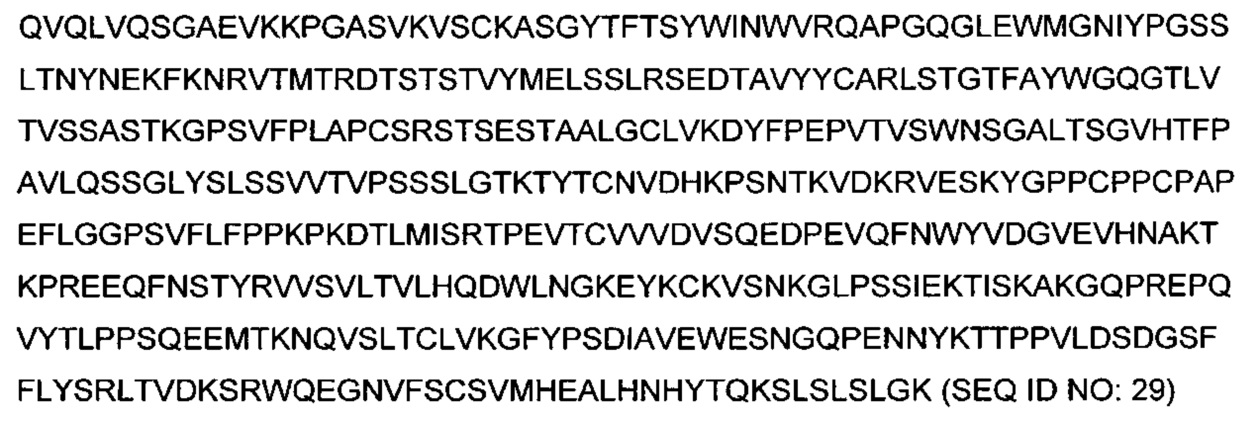
Аминокислотная последовательность полноразмерной тяжелой цепи mAb7 без С-концевого лизина (SEQ ID NO: 38) показана ниже:

Аминокислотная последовательность полноразмерной легкой цепи mAb7 (SEQ ID NO: 39) показана ниже:

В изобретении также предлагаются способы создания, селекции и получения антагонистических антител к PD-1. Антитела по изобретению могут быть получены посредством способов, известных в данной области. В некоторых воплощениях антитела могут быть получены рекомбинантно и экспрессированы с использованием методов, известных в данной области.
В некоторых воплощениях антитела могут быть получены и селектированы посредством технологии фагового дисплея. См., например, патенты US 5565332; 5580717; 5733743; и 6265150; и Winter et al., Annu. Rev. Immunol. 12:433-455, 1994. Альтернативно, технологию фагового дисплея (McCafferty et al., Nature 348:552-553, 1990) можно использовать для получения человеческих антител и фрагментов антител in vitro, из репертуаров генов вариабельных (V) доменов иммуноглобулина от иммунизированных доноров. Согласно этому методу, гены домена V антитела клонируют в рамке считывания либо в основной ген, либо в минорный ген белка оболочки нитевидного бактериофага, такого как М13 или fd, и экспонируют как функциональные фрагменты антител на поверхности фаговой частицы. Поскольку нитчатая частица содержит копию одноцепочечной ДНК фагового генома, селекция, основанная на функциональных свойствах антитела, также приводит к селекции гена, кодирующего антитело, проявляющее эти свойства. Таким образом, фаг имитирует некоторые свойства В-клетки. Фаговый дисплей может быть выполнен в различных форматах; обзора см., например, в Johnson, Kevin S. and Chiswell, David J., Current Opinion in Structural Biology 3:564-571, 1993. Несколько источников сегментов V-гена можно использовать для фагового дисплея. Clackson et al., Nature 352:624-628, 1991, выделили разнотипный массив антиоксазолоновых антител из небольшой случайно образованной комбинаторной библиотеки V-генов, полученных из селезенок иммунизированных мышей. Может быть сконструирован репертуар V-генов от доноров-людей и антитела к разнотипному массиву антигенов (включая собственные антигены) могут быть выделены по существу в соответствии со способами, описанными в Mark et al., J. Mol. Biol. 222:581-597, 1991, или Griffith et al., EMBO J. 12:725-734, 1993. В случае природного иммунного ответа, гены антитела накапливают мутации с высокой скоростью (соматическая гипермутация). Некоторые из введенных изменений обеспечивают более высокую аффинность и В-клетки, содержащие высокоаффинный поверхностный иммуноглобулин, предпочтительно реплицируются и дифференцируются во время последующей провокации антигеном. Этот естественный процесс может быть имитирован путем использования метода, известного как "перетасовка цепей". (Marks et al., Bio/Technol. 10:779-783, 1992). В этом методе аффинность "первичных" человеческих антител, полученных с помощью фагового дисплея, может быть улучшена путем последовательной замены генов V-области тяжелой и легкой цепи репертуарами естественных вариантов (репертуаров) генов V домена, полученных из неиммунизированных доноров. Этот метод позволяет продуцировать антитела и фрагменты антител с аффинностью в пМ-нМ диапазоне. Стратегия получения очень больших репертуаров фаговых антител (также называемых "мать всех библиотек"), была описана в Waterhouse et al., Nucl. Acids Res. 21:2265-2266, 1993. Генная перетасовка также может быть использована для получения человеческого антитела из антитела грызунов, где человеческое антитело имеет аффинности и специфичности, аналогичные исходному антителу грызунов. Согласно этому методу, который также упоминается, как "импринтинг эпитопа", ген домена V тяжелой или легкой цепи антител грызунов, полученный посредством метода фагового дисплея заменяют репертуаром генов домена V человека, создавая химеры грызун-человек. Выбор антигена приводит к выделению человеческих вариабельных областей, способных восстанавливать функциональный антигенсвязывающий сайт, то есть эпитоп управляет (импринтинг) выбором партнера. Когда процесс повторяют для того, чтобы заменить оставшийся домен V грызуна, получают человеческое антитело (см. публикацию РСТ WO 93/06213). В отличие от традиционной гуманизации антител грызунов посредством прививки CDR, этот метод обеспечивает полностью человеческие антитела, которые не имеют каркасных или CDR остатков, имеющих происхождение от грызунов.
В некоторых воплощениях антитела могут быть получены с использованием гибридомной технологии. Предполагается, что любой млекопитающий субъект, включая людей или их клетки, продуцирующие антитела, можно использовать как основу для получения гибридомных клеточных линий млекопитающих, в том числе человека. Способ и схема иммунизации животного-хозяина обычно соответствуют установленным и общепринятым методам стимулировании и продуцирования антител, как описано здесь далее. Как правило, животное-хозяин инокулируют внутрибрюшинно, внутримышечно, перорально, подкожно, внутриподошвенно и/или внутрикожно некоторым количеством иммуногена, включая описанное в данном описании изобретения.
Гибридомы могут быть получены из лимфоцитов и иммортализованных клеток миеломы с использованием общей технологии гибридизации соматических клеток по Kohler, В. and Milstein, С., 1975, Nature 256:495-497 или по модифицированному способу Buck, D. W., et al., In vitro, 18:377-381, 1982. Для гибридизации можно использовать доступные линии миеломы, включая, но без ограничения ими, Х63-Ag8.653 и линии из Salk Institute, Cell Distribution Center, San Diego, Calif., USA. Как правило, этот способ включает слияние клеток миеломы и лимфоидных клеток с использованием фузогена, такого как полиэтиленгликоль, или электрических средств, хорошо известных специалистам в данной области техники. После слияния клетки отделяют от среды для слияния и выращивают в селективной питательной среде, такой как среда гипоксантин-аминоптерин-тимидин (HAT), для удаления негибридизованных родительских клеток. Любая описанная здесь среда, с добавлением и без добавления сыворотки, может быть использована для культивирования гибридом, секретирующих моноклональные антитела. В качестве альтернативы методу слияния клеток, В-клетки, иммортализованные EBV (вирус Эпштейна-Барр), можно использовать для получения PD-1 моноклональных антител по изобретению. Если необходимо, гибридомы и другие иммортализованные В-клетки размножают и субклонируют и супернатанты анализируют на антииммуногенную активность с помощью обычных методов иммуноанализа (например радиоиммуноанализа, иммуноферментного анализа или флуоресцентного иммуноанализа).
Гибридомы, которые можно использовать в качестве источника антител, охватывают все производные, клетки потомства от исходных гибридом, которые продуцируют моноклональные антитела, специфичные к PD-1, или их часть.
Гибридомы, которые продуцируют такие антитела, можно выращивать in vitro или in vivo с использованием известных методик. Если необходимо, моноклональные антитела могут быть выделены из культуральной среды или биологических жидкостей посредством обычных процедур очистки иммуноглобулина, таких как осаждение сульфатом аммония, гель-электрофорез, диализ, хроматография и ультрафильтрация. Нежелательную активность, если она присутствует, можно удалить, например, путем пропускания препарата над адсорбентами, сделанными из иммуногена, присоединенного к твердой фазе, и элюирования или высвобождения нужных антител от иммуногена. В результате иммунизация животного-хозяина полипептидом PD-1 или фрагментом, содержащим целевую аминокислотную последовательность, конъюгированную с белком, который является иммуногенным для видов, подлежащих иммунизации, например гемоцианином лимфы улитки, сывороточным альбумином, тироглобулином крупного рогатого скота или соевым ингибитором трипсина с использованием бифункционального или дериватизирующего агента, например, малеимидобензоилсульфосукцинимидного сложного эфира (конъюгация через остатки цистеина), N-гидроксисукцинимида (через остатки лизина), глутарового альдегида, янтарного ангидрида, SOCl2 или R1N=C=NR, где R и R1 представляют собой разные алкильные группы, можно получить популяцию антител (например моноклональные антитела).
Если необходимо, интересующее антагонистическое антитело к PD-1 (моноклональное или поликлональное), может быть секвенировано и полинуклеотидная последовательность затем может быть клонирована в вектор для экспрессии или размножения. Последовательность, кодирующая интересующее антитело, может поддерживаться в векторе в клетке-хозяине и затем клетку-хозяина можно размножать и замораживать для дальнейшего использования. Получение рекомбинантных моноклональных антител в клеточной культуре может быть осуществлено путем клонирования генов антител из В-клеток с помощью известных в данной области способов. См., например Tiller et al., 2008, J. Immunol. Methods 329, 112; патент US 7314622.
В некоторых воплощениях полинуклеотидную последовательность можно использовать для генетических манипуляций с целью "гуманизации" антитела или улучшения аффинности или других характеристик антитела. Антитела также могут быть модифицированы для использования, например, у собак, кошек, приматов, лошадей и коров.
В некоторых воплощениях полностью человеческие антитела могут быть получены с использованием имеющихся в продаже мышей, которые были сконструированы для экспрессии специфических человеческих иммуноглобулиновых белков. Трансгенные животные, которые созданы для получения более желательного (например полностью человеческого антитела) или более надежного иммунного ответа, также можно использовать для образования гуманизированного или человеческого антитела. Примерами такой технологии являются Xenomouse™ из Abgenix, Inc. (Fremont, СА) и HuMAb-Mouse® и ТС Mouse™ из Medarex, Inc. (Princeton, NJ).
Антитела могут быть получены рекомбинантно, сначала путем выделения клеток, продуцирующих антитела, и антител из животных-хозяев, получения последовательности генов и использования последовательности гена для рекомбинантной экспрессии антител в клетках-хозяевах (например в клетках СНО). Другим методом, который можно использовать, является экспрессия последовательности антитела в растениях (например табаке) или в трансгенном молоке. Способы рекомбинантной экспрессии антител в растениях или молоке раскрыты. См., например, Peeters, et al. Vaccone 19:2756, 2001; Lonberg, N. and D. Huszar Int. Rev. Immunol 13:65, 1995; and Pollock, et al., J Immunol Methods 231:147, 1999. Способы получения производных антител, например домена, единичной цепи и т.д., известны в данной области техники.
Для выделения антител, специфичных к PD-1, также можно использовать методы иммуноанализа и сортировки посредством проточной цитометрии, такие как сортировка клеток, активированных флуоресценцией (FACS).
ДНК, кодирующая моноклональные антитела, может быть легко выделена и секвенирована с использованием обычных методик (например с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи моноклональных антител). Клетки гибридомы служат предпочтительным источником такой ДНК. После выделения, ДНК может быть помещена в экспрессионные векторы (такие как экспрессионные векторы, раскрытые в публикации РСТ WO 87/04462), которые затем трансфицируют в клетки-хозяева, такие как клетки Е. coli, клетки COS обезьяны, клетки яичника китайского хомячка (СНО) или клетки миеломы, которые иначе не продуцируют белок иммуноглобулина, чтобы получить синтез моноклональных антител в рекомбинантных клетках-хозяевах. См., например, публикацию РСТ WO 87/04462. ДНК также может быть модифицирована, например, путем замены кодирующей последовательностью константных доменов тяжелой и легкой цепи человека гомологичных мышиных последовательностей, Morrison et al., Proc. Nat. Acad. Sci. 81:6851, 1984, или путем ковалентного присоединения к кодирующей последовательности иммуноглобулина всей или части кодирующей последовательности неиммуноглобулинового полипептида. Таким образом в данном изобретении получают "химерные" или "гибридные" антитела, которые обладают специфичностью связывания моноклонального антитела к PD-1.
Фрагменты антител могут быть получены путем протеолитического или другого расщепления антител рекомбинантными методами (то есть одиночными или слитыми полипептидами), как описано выше, или посредством химического синтеза. Полипептиды антител, особенно более короткие полипептиды, вплоть до примерно 50 аминокислот, легко получают посредством химического синтеза. Способы химического синтеза известны в данной области и являются доступными. Например, антитело может быть получено при помощи автоматического полипептидного синтезатора, использующего твердофазный метод. См. также патенты US 5807715; 4816567; и 6331415.
В некоторых воплощениях полинуклеотид содержит последовательность, кодирующую вариабельные участки тяжелой и/или легкой цепи антитела mAb1, mAb2, mAb3, mAb4, mAb5, mAb6, mAb7, mAb8, mAb9, mAb10, mAb11, mAb12, mAb13, mAb14, mAb15 или mAb16. Последовательность, кодирующая представляющее интерес антитело, может поддерживаться в векторе в клетке-хозяине, и затем клетку-хозяина можно размножать и замораживать для дальнейшего использования. Векторы (включая экспрессионные векторы) и клетки-хозяева дополнительно описаны в данном описании изобретения.
Данное изобретение включает воплощения с созреванием аффинности. Например, антитела с созревшей аффинностью могут быть получены способами, известными в данной области техники (Marks et al., 1992, Bio/Technology, 10:779-783; Barbas et al., 1994, Proc Nat. Acad. Sci, USA 91:3809-3813; Schier et al., 1995, Gene, 169:147-155; Yelton et al., 1995, J. Immunol., 155:1994-2004; Jackson et al., 1995, J. Immunol., 154(7):3310-9; Hawkins et al., 1992, J. Mol. Biol., 226:889-896; и публикация PCT WO 2004/058184).
Следующие способы можно использовать для корректировки аффинности антитела и для характеристики CDR. Один из способов характеристики CDR антитела и/или изменения (например улучшения) аффинности связывания полипептида, такого как антитело, называется "библиотечным сканирующим мутагенезом". Как правило, библиотечный сканирующий мутагенез работает следующим образом. Аминокислоты в одном или более положениях в CDR заменяют двумя или более (например 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20) аминокислотами с использованием известных в данной области методов. Это образует небольшие библиотеки клонов (в некоторых воплощениях по одному для каждого анализируемого аминокислотного положения), каждая с со сложностью двух или более представителей (если две или более аминокислот заменены в каждом положении). Как правило, библиотека также включает клон, содержащий нативную (незамещенную) аминокислоту. Небольшое количество клонов, например примерно 20-80 клонов (в зависимости от сложности библиотеки), из каждой библиотеки подвергают скринингу на аффинность связывания с целевым полипептидом (или другой мишенью связывания) и выявляют кандидатов с увеличенным, таким же, уменьшенным связыванием или без связывания. Способы определения аффинности связывания хорошо известны в данной области. Аффинность связывания можно определить с использованием, например, анализа поверхностного плазмонного резонанса Biacore™, который обнаруживает различие в аффинности связывания примерно в 2-раза или больше, Kinexa® Biosensor, сцинтилляционного анализа сближения, ELISA, ORIGEN® иммуноанализа, гашения флуоресценции, переноса флуоресценции и/или дрожжевого дисплея. Аффинность связывания также можно анализировать, используя подходящий биоанализ. Biacore™ является особенно подходящим, когда исходное антитело уже связывается с относительно высокой аффинностью, например с KD примерно 10 нМ или ниже.
В некоторых воплощениях каждое аминокислотное положение в CDR заменено (в некоторых воплощениях по одному) всеми 20 природными аминокислотами с использованием признанных в данной области техники методов мутагенеза (некоторые из которых описаны здесь). В результате образуются небольшие библиотеки клонов (в некоторых воплощениях один для каждого анализируемого аминокислотного положения), каждая со сложностью 20 представителей (если все 20 аминокислот заменены в каждом положении).
В некоторых воплощениях библиотека для скрининга содержит замены в двух или более положениях, которые могут находиться в одном и том же CDR или в двух или более CDR. Таким образом, библиотека может содержать замены в двух или более положениях в одном CDR. Библиотека может содержать замены в двух или более положениях в двух или более CDR. Библиотека может содержать замены в 3, 4, 5 или более положениях, указанные положения находятся в двух, трех, четырех, пяти или шести CDR. Замещения могут быть получены с использованием кодонов с низкой избыточностью. См., например, Таблицу 2 в Balint et al., 1993, Gene 137(1):109-18.
CDR может быть вариабельным участком тяжелой цепи (VH) CDR3 и/или вариабельным участком легкой цепи (VL) CDR3. CDR может быть одним или более из VH CDR1, VH CDR2, VH CDR3, VL CDR1, VL CDR2 и/или VL CDR3. CDR может представлять собой CDR по Kabat, CDR по Chothia, расширенный CDR, AbM CDR, контактный CDR или конформационный CDR.
Кандидаты с улучшенным связыванием могут быть секвенированы, тем самым идентифицирована мутация замены CDR, которая приводит к улучшенной аффинности (также называемая "улучшенная" замена). Кандидаты, которые связываются, могут также быть секвенированы, тем самым идентифицирована замена CDR, которая сохраняет связывание.
Может быть проведено несколько раундов скрининга. Например, кандидаты (каждый из которых содержит аминокислотную замену в одном или более положениях одного или более CDR) с улучшенным связыванием также полезны для создания второй библиотеки, содержащей по меньшей мере исходную и замещенную аминокислоту в каждом улучшенном положении CDR (то есть аминокислотное положение в CDR, в котором мутант с заменой демонстрирует улучшенное связывание). Получение, скрининг или выбор этой библиотеки обсуждается ниже.
Библиотечный сканирующий мутагенез также предоставляет средства для характеристики CDR, поскольку частота клонов с улучшенным связыванием, одинаковым связыванием, уменьшенным связыванием или без связывания также представляет информацию, относящуюся к важности каждого аминокислотного положения для стабильности комплекса антитело-антиген. Например, если положение CDR сохраняет связывание при замене всех 20 аминокислот, это положение идентифицируется, как положение, которое вряд ли требуется для связывания антигена. Напротив, если положение CDR сохраняет связывание только для небольшого процента замещений, такое положение идентифицируется, как положение важное для функции CDR. Таким образом, методы библиотечного сканирующего мутагенеза предоставляют информацию о положениях в CDR, которые могут быть изменены на многие разные аминокислоты (включая все 20 аминокислот) и положениях в CDR, которые не могут быть изменены или которые могут быть изменены только на несколько аминокислот.
Кандидаты с улучшенной аффинностью могут быть объединены во второй библиотеке, которая включает улучшенную аминокислоту, исходную аминокислоту в этом положении и может также включать дополнительные замены в этом положении, в зависимости от сложности библиотеки, желательной или допустимой для использования нужного скрининга или способа селекции. Кроме того, при необходимости, соседнее аминокислотное положение может быть рандомизировано по меньшей мере с двумя или более аминокислотами. Рандомизация соседних аминокислот может допустить дополнительную конформационную гибкость в мутантном CDR, которая, в свою очередь, может допустить или облегчить введение большего количества улучшающих мутаций. Библиотека может также содержать замену в положениях, которые не показывали улучшения аффинности в первом раунде скрининга.
Скрининг или селекцию элементов библиотеки с улучшенной и/или измененной аффинностью связывания осуществляют с использованием любого метода, известного в данной области, включая скрининг с использованием биосенсорного анализа Kinexa™ и селекцию с использованием любого способа, известного в данной области, включая фаговый дисплей, дрожжевой дисплей и рибосомальный дисплей.
Для экспрессии антител к PD-1 по настоящему изобретению фрагменты ДНК, кодирующие области VH и VL, могут быть сначала получены с использованием любого из вышеописанных способов. Различные модификации, например мутации, делеции и/или добавления также могут быть введены в последовательности ДНК с использованием стандартных методов, известных специалистам в данной области. Например, мутагенез может быть осуществлен с использованием стандартных методов, таких как ПЦР-опосредованный мутагенез, где мутированные нуклеотиды включены в ПЦР-праймеры, так что продукт ПЦР содержит желательные мутации, или сайт-направленный мутагенез.
Изобретение включает модификации вариабельных областей, показанные в Таблице 1, и CDR, показанные в Таблицах 2, 3 или 4. Например, изобретение включает антитела, содержащие функционально эквивалентные вариабельные области и CDR, которые не оказывают существенного влияния на их свойства, а также варианты, которые обладают повышенной или пониженной активностью и/или аффинностью. Например, аминокислотная последовательность может быть мутирована с получением антитела с нужной аффинностью связывания с PD-1. Модификация полипептидов является обычной практикой в данной области и не нуждается в подробном описании в данном описании изобретения. Примеры модифицированных полипептидов включают полипептиды с консервативными заменами аминокислотных остатков, одной или более делециями или добавлениями аминокислот, которые не оказывают значительного негативного влияния на функциональную активность или у которых наблюдается созревание (увеличение) аффинности полипептида к его лиганду, или использование химических аналогов.
Вставки аминокислотных последовательностей включают амино- и/или карбокси-концевые слияния, длина которых варьируется от одного остатка до полипептидов, содержащих сто или более остатков, а также вставки внутри последовательности из одного или нескольких аминокислотных остатков. Примеры концевых вставок включают антитело с N-концевым метионильным остатком или антитело, слитое с эпитопным тегом. Другие варианты вставок молекул антител включают слияние с N- или С-концом антитела фермента или полипептида, который увеличивает время полувыведения антитела из кровообращения.
У вариантов с заменой по меньшей мере один аминокислотный остаток в молекуле антитела удален, и другой остаток встроен на его место. Сайты представляющие наибольший интерес для замещающего мутагенеза включают гипервариабельные участки, но также рассматриваются изменения в каркасной области. Консервативные замены показаны в Таблице 5 под заголовком "консервативные замены". Если замены приводят к изменению биологической активности, тогда могут быть внесены более существенные изменения, называемые "иллюстративные замены" в Таблице 5, или описанные далее ниже применительно к классам аминокислот, и продукты подвергнуты скринингу.
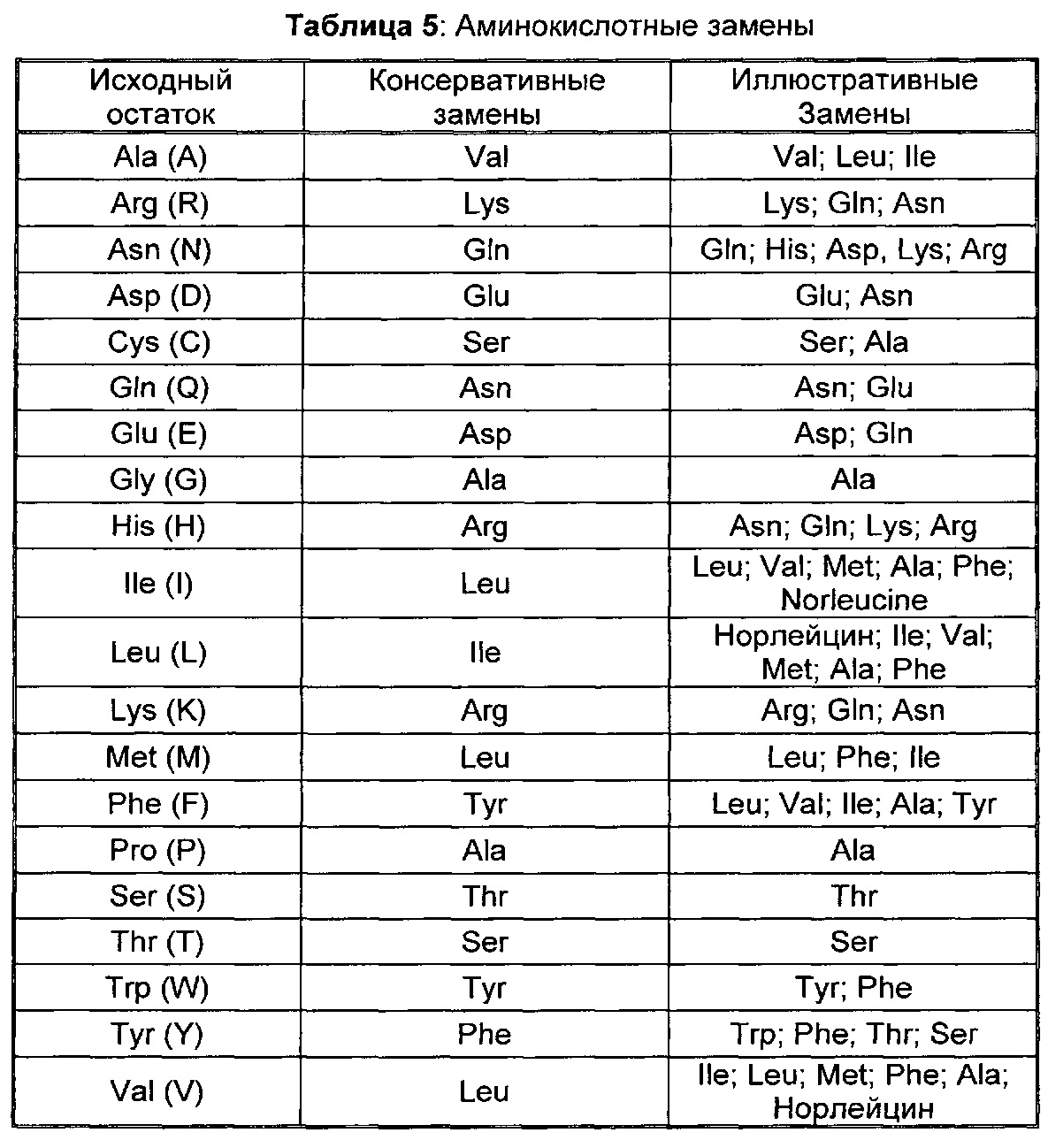
Существенные модификации биологических свойств антитела осуществляются посредством выбора замен, которые значительно отличаются по своему влиянию на сохранение (а) структуры скелета полипептида в области замены, например такой как β-слой или спиральная конформация, (б) заряда или гидрофобности молекулы в целевом участке или (в) величины боковой цепи. Естественно встречающиеся остатки делятся на группы на основании общих свойств боковой цепи:
(1) Неполярные: Норлейцин, Met, Ala, Val, Leu, Ile;
(2) Полярные незаряженные: Cys, Ser, Thr, Asn, Gln;
(3) Кислые (отрицательно заряженные): Asp, Glu;
(4) Основные (положительно заряженные): Lys, Arg;
(5) Остатки, влияющие на ориентацию цепи: Gly, Pro; и
(6) Ароматические: Trp, Tyr, Phe, His.
Неконсервативные замены выполняют путем замены представителя одного из этих классов на представителя другого класса.
Например, один тип замещения, который может быть сделан, заключается в замене одного или более цистеинов в антителе, которые могут быть химически реакционноспособными, на другой остаток, например, без ограничения ими, на аланин или серин. Например, может происходить замена неканонического цистеина. Замена может быть сделана в CDR или в каркасной области вариабельного домена или в константной области антитела. В некоторых воплощениях цистеин является каноническим. Любой остаток цистеина, не вовлеченный в поддержание надлежащей конфирмации антитела, также может быть замещен, обычно серийном, для улучшения окислительной стабильности молекулы и предупреждения ошибочного поперечного сшивания. Напротив, цисте новая(ые) связь(и) может(гут) быть добавлена(ы) к антителу для улучшения его стабильности, в чсатности, когда антитело представляет собой фрагмент антитела, такой как Fv-фрагмент.
Антитела также могут быть модифицированы, например в вариабельных доменах тяжелых и/или легких цепей, например для изменения связывающих свойств антитела. Изменения в вариабельной области могут изменить аффинность и/или специфичность связывания. В некоторых воплощениях не более одной-пяти консервативных аминокислотных замен может быть произведено в пределах CDR домена. В других воплощениях не более одной-трех консервативных аминокислотных замен может быть произведено в пределах CDR домена. Например, мутация может быть сделана в одном или нескольких участках CDR для увеличения или уменьшения KD антитела к PD-1, для увеличения или уменьшения koff, или для изменения специфичности связывания антитела. Способы сайт-направленного мутагенеза хорошо известны в данной области. См., например, Sambrook et al. и Ausubel et al., выше.
Модификация или мутация также может быть выполнена в каркасной области или константной области для увеличения времени полусуществования антитела к PD-1. См., например, публикации РСТ WO 00/09560. Мутация в каркасной области или в константной области также может быть выполнена для изменения иммуногенности антитела, чтобы обеспечить сайт для ковалентного или нековалентного связывания с другой молекулой, или для изменения таких свойств, как связывание комплемента, связывание FcR и антителозависимая клеточно-опосредованная цитотоксичность. В некоторых воплощениях не более одной-пяти консервативных аминокислотных замен выполнены в пределах каркасной области или константной области. В других воплощениях не более одной-трех консервативных аминокислотных замен выполнены в пределах каркасной области или константной области. Согласно изобретению, одно антитело может иметь мутации в любом одном или более CDR или каркасных областях вариабельного домена или в константной области.
Модификации включают также гликозилированные и негликозилированные полипептиды, и полипептиды с другими посттрансляционными модификациями, такими как, например, гликозилирование с разными сахарами, ацетилирование и фосфорилирование. Антитела гликозилированы в консервативных положениях в своих константных областях (Jefferis and Lund, 1997, Chem. Immunol. 65:111-128; Wright and Morrison, 1997, TibTECH 15:26-32). Олигосахаридные боковые цепи иммуноглобулинов влияют на функцию белка (Boyd et al., 1996, Mol. Immunol. 32:1311-1318; Wittwe and Howard, 1990, Biochem. 29:4175-4180) и внутримолекулярное взаимодействием между частями гликопротеина, которое может влиять на конформацию и представленную трехмерную поверхность гликопротеина (Jefferis and Lund, выше; Wyss and Wagner, 1996, Current Opin. Biotech. 7:409-416). Олигосахариды могут также служить для нацеливания данного гликопротеина на определенные молекулы на основе специфических структур распознавания. Сообщалось также, что гликозилирование антитела влияет на антителозависимую клеточную цитотоксичность (ADCC). Сообщалось, в частности, что антитела, продуцируемые клетками СНО с тетрациклин-регулируемой экспрессией β(1,4)-N-ацетилглюкозаминилтрансферазы III (GnTIII), гликозилтрансферазы, катализирующей образование биссекторного GlcNAc, имеют улучшенную ADCC-активность (Umana et al., 1999, Nature Biotech. 17:176-180).
Гликозилирование антител обычно является либо N-связанным, либо О-связанным. N-связанное относится к присоединению углеводного фрагмента к боковой цепи аспарагинового остатка. Трехпептидные последовательности аспарагин-Х-серин, аспарагин-Х-треонин и аспарагин-Х-цистеин, где X является любой аминокислотой кроме пролина, являются последовательностями распознавания для ферментативного присоединения углеводного фрагмента к боковой цепи аспарагина. Таким образом, присутствие любой из этих трехпептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. О-связанное гликозилирование относится к присоединению одного из сахаров - N-ацетилгалактозамина, галактозы или ксилозы к гидроксиаминокислоте, чаще всего к серину или треонину, хотя также можно использовать 5-гидроксипролин или 5-гидроксилизин.
Добавление сайтов гликозилирования к антителу обычно осуществляют путем изменения аминокислотной последовательности так, чтобы она содержала одну или несколько описанных выше трехпептидных последовательностей (для сайтов N-связанного гликозилирования). Изменение также может быть выполнено путем добавления одного или более остатков серина или треонина или замены одним или более остатками серина или треонина в последовательности исходного антитела (для сайтов О-связанного гликозилирования).
Картина гликозилирования антител также может быть изменен без изменения нуклеотидной последовательности. Гликозилирование во многом зависит от клетки-хозяина, используемой для экспрессии антитела. Поскольку клетки, используемые для экспрессии рекомбинантных гликопротеинов, например антител, в качестве потенциальных терапевтических средств, редко являются нативными клетками, можно ожидать изменений в картине гликозилирования антител (см., например, Hse et al., 1997, J. Biol. Chem. 272:9062-9070).
В дополнение к выбору клеток-хозяев, факторы, которые влияют на гликозилирование при рекомбинантном продуцировании антител, включают характер роста, состав среды, плотность культуры, оксигенацию, рН, схемы очистки и тому подобное. Были предложены различные методы для изменения картины гликозилирования, достигаемой в конкретном организме-хозяине, включая введение или гиперэкспрессию некоторых ферментов, участвующих в производстве олигосахаридов (патенты US 5047335; 5510261 и 5278299). Гликозилирование или определенные типы гликозилирования могут быть ферментативно удалены из гликопротеина, например с использованием эндогликозидазы Н (Endo Н), N-гликозидазы F, эндогликозидазы F1, эндогликозидазы F2, эндогликозидазы F3. Кроме того, рекомбинантная клетка-хозяин может быть генетически модифицирована, чтобы быть дефектной в процессинге некоторых типов полисахаридов. Эти и подобные методы хорошо известны в данной области техники.
Другие способы модификации включают методики связывания, известные в данной области техники, включающие, но без ограничения ими, ферментативные способы, окислительное замещение и хелатирование. Модификации можно использовать, например, для прикрепления меток для иммуноанализа. Модифицированные полипептиды изготавливают, используя общепринятые в данной области способы и они могут быть подвергнуты скринингу с использованием стандартных анализов, известных в данной области, некоторые из которых описаны ниже и в Примерах.
В некоторых воплощениях Fc может представлять собой человеческий IgG2 или человеческий IgG4. В некоторых воплощениях антитело содержит константную область IgG4, содержащую следующие мутации (Armour et al., 2003, Molecular Immunology 40 585-593): E233F234L235 на P233V234A235 (IgG4Δc), где нумерация относится к IgG4 дикого типа. В еще одном воплощении Fc представляет собой человеческий IgG4 с заменой E233F234L235 на P233V234A235 с делецией G236 (IgG4Δb). В некоторых воплощениях Fc представляет собой любой человеческий IgG4 Fc (IgG4, IgG4Δb или IgG4Δc), содержащий мутацию, стабилизирующую шарнир, S228 в Р228 (Aalberse et al., 2002, Immunology 105, 9-19). В других воплощениях Fc может быть человеческим IgG2, содержащим мутацию А330Р331 на S330S331 (IgG2Δa), где аминокислотные остатки нумеруются в соответствии с последовательностью IgG2 дикого типа. Eur. J. Immunol., 1999, 29:2613-2624.
В некоторых воплощениях антитело содержит модифицированную константную область с увеличенной или уменьшенной аффинностью связывания с человеческим Fc-гамма-рецептором, является иммунологически инертным или частично инертным, например не вызывает комплемент-опосредованный лизис, не стимулирует антителозависимую клеточноопосредованную цитотоксичность (ADCC) или не активирует микроглию; или имеет пониженную активность (по сравнению с немодифицированным антителом) в одном или более из следующего: инициирование комплементопосредованного лизиса, стимулирование ADCC или активирование микроглии. Для достижения оптимального уровня и/или комбинации эффекторных функций можно использовать разные модификации константной области. См., например, Morgan et al., Immunology 86:319-324, 1995; Lund et al., J. Immunology 157:4963-9 157:4963-4969, 1996; Idusogie et al., J. Immunology 164:4178-4184, 2000; Tao et al., J. Immunology 143: 2595-2601, 1989; и Jefferis et al., Immunological Reviews 163:59-76, 1998. В некоторых воплощениях константная область модифицирована, как описано в Eur. J. Immunol., 1999, 29:2613-2624; публикация РСТ WO 99/058572.
В некоторых воплощениях константная область антитела может быть модифицирована, чтобы избежать взаимодействия с Fc-гамма-рецептором и системой комплемента и иммунной системой. Способы получения таких антител описаны в WO 99/58572. Например, константная область может быть сконструирована так, чтобы больше напоминать человеческие константные области, чтобы избежать иммунного ответа, если антитело используется в клинических испытаниях и в лечении людей. См., например, патенты US 5997867 и 5866692.
В других воплощениях константная область является агликозилированной для N-связанного гликозилирования. В некоторых воплощениях константная область является агликозилированной для несвязанного гликозилирования в результате мутации остатка для олигосахаридного присоединения и/или фланкирующих остатков, которые являются частью последовательности распознавания N-гликозилирования в константной области. Например, сайт N-гликозилирования N297 может быть мутирован, например, на A, Q, K или Н. См., Tao et al., J. Immunology 143: 2595-2601, 1989; и Jefferis et al., Immunological Reviews 163:59-76, 1998. В некоторых воплощениях константная область является агликозилированной для N-связанного гликозилирования. Константная область может быть ферментативно агликозилирована для N-связанного гликозилирования (например путем удаления углевода при помощи фермента PNGаза (пептид-N-гликозидаза)) или посредством экспрессии в клетке-хозяине, дефицитной по гликозилированию.
Другие модификации антител включают антитела, которые модифицированы, как описано в публикации РСТ WO 99/58572. Эти антитела содержат, в дополнение к домену связывания, направленному на молекулу-мишень, эффекторный домен, имеющий аминокислотную последовательность, по существу гомологичную всей или части константной области тяжелой цепи иммуноглобулина человека. Эти антитела способны связывать молекулу-мишень, не вызывая значительного комплемент-зависимого лизиса или клеточно-опосредованного разрушения мишени. В некоторых воплощениях эффекторный домен способен специфически связывать FcRn и/или FcγRIIb. Это обычно связано с химерными доменами, полученными из двух или более доменов СН2 тяжелой цепи человеческого иммуноглобулина. Антитела, модифицированные таким образом, особенно подходят для использования в длительной терапии антителами, для того чтобы избежать воспалительных или других побочных реакций на традиционную терапию антителами.
В некоторых воплощениях антитело содержит модифицированную константную область, которая обладает повышенной аффинностью связывания FcRn и/или увеличенным временем полусуществования в сыворотке по сравнению с немодифицированным антителом.
В процессе, известном как "модифицирование на уровне генов зародышевой линии" (germlining), некоторые аминокислоты в последовательностях VH и VL могут быть мутированы, чтобы соответствовать тем, которые в природе находятся в последовательностях VH и VL зародышевой линии. В частности, аминокислотные последовательности каркасных областей в последовательностях VH и VL могут быть мутированы, чтобы соответствовать зародышевым последовательностям, для снижения риска иммуногенности при введении антитела. Зародышевые ДНК-последовательности человеческих генов VH и VL известны в данной области (см., например, базу данных последовательности человеческой зародышевой линии "Vbase"; см. также Kabat, Е.A., et al., 1991, Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242; Tomlinson et al., 1992, J. Mol. Biol. 227:776-798; и Cox et al., 1994, Eur. J. Immunol. 24:827-836).
Другой тип аминокислотной замены, который может быть сделан, заключается в удалении потенциальных протеолитических сайтов в антителе. Такие сайты могут находиться в CDR, или в каркасной области вариабельного домена, или в константной области антитела. Замещение остатков цистеина и удаление протеолитических сайтов может снизить риск гетерогенности в антительном продукте и таким образом увеличить его гомогенность. Другим типом аминокислотного замещения является удаление пар аспарагин-глицин, которые образуют потенциальные сайты дезамидирования, путем изменения одного или обоих остатков. В другом примере может быть расщеплен С-концевой лизин тяжелой цепи антитела к PD-1 по изобретению. В различных воплощениях изобретения тяжелые и легкие цепи антител к PD-1 могут при необходимости включать сигнальную последовательность.
После получения фрагментов ДНК, кодирующих сегменты VH и VL по настоящему изобретению, эти фрагменты ДНК могут быть дополнительно обработаны в соответствии со стандартными методами рекомбинантной ДНК, например для превращения генов вариабельной области в гены цепей полноразмерного антитела, в гены Fab-фрагмента или в ген scFv. При этих манипуляциях фрагмент ДНК, кодирующий VL или VH, функционально связан с другим фрагментом ДНК, кодирующим другой белок, такой как константная область антитела или гибкий линкер. Предполагается, что термин "функционально связанный", при использовании в данном контексте, означает, что два фрагмента ДНК соединены так, что аминокислотные последовательности, кодируемые этими двумя фрагментами ДНК, остаются в рамке считывания.
Выделенная ДНК, кодирующая область VH, может быть превращена в ген полноразмерной тяжелой цепи посредством функционального связывания ДНК, кодирующей VH, с другой молекулой ДНК, кодирующей константные области тяжелой цепи (СН1, СН2 и СН3). Последовательности генов константной области тяжелой цепи известны в данной области (см., например, Kabat, Е.A., et al., 1991, Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242) и фрагменты ДНК, охватывающие эти области, могут быть получены посредством стандартной ПЦР-амплификации. Константная область тяжелой цепи может представлять собой константную область IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD, но наиболее предпочтительно является константной областью IgG1 или IgG2. Последовательность константной области IgG может быть любой из различных аллелей или аллотипов, которые, как известно, встречаются у разных субъектов, таких как Gm(1), Gm(2), Gm(3) и Gm(17). Эти аллотипы представляют собой природную аминокислотную замену в константных областях IgG1. Для гена тяжелой цепи Fab-фрагмента, ДНК, кодирующая VH, может быть функционально связана с другой молекулой ДНК, кодирующей только константную область тяжелой цепи СН1. Константная область тяжелой цепи СН1 может происходить из любого гена тяжелой цепи.
Выделенная ДНК, кодирующая область VL, может быть превращена в ген полноразмерной легкой цепи (а также ген легкой цепи Fab) путем функционального связывания ДНК, кодирующей VL, с другой молекулой ДНК, кодирующей константную область легкой цепи CL. Последовательности генов константной области легкой цепи человека известны в данной области (см., например, Kabat, Е.A., et al., 1991, Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242) и фрагменты ДНК, охватывающие эти области, могут быть получены посредством стандартной ПЦР-амплификации. Константная область легкой цепи может представлять собой константную область каппа или лямбда. Константная область каппа может быть любой из различных аллелей, которые, как известно, встречаются у разных субъектов, таких как Inv(1), Inv(2) и Inv(3). Константная область лямбда может происходить из любого из трех генов лямбда.
Для создания гена scFv, фрагменты ДНК, кодирующие VH и VL, функционально связывают с другим фрагментом, кодирующим гибкий линкер, так что последовательности VH и VL могут экспрессироваться в виде непрерывного одноцепочечного белка с областями VL и VH, связанными с гибким линкером (См., например, Bird et al., 1988, Science 242:423-426; Huston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879-5883; McCafferty et al., 1990, Nature 348:552-554). Примером линкерного пептида является (GGGGS)3 (SEQ ID NO: 19), который образуем мостик примерно 3,5 нм между карбоксильным концом одной вариабельной области и аминоконцом другой вариабельной области. Были разработаны и использованы линкеры с другими последовательностями (Bird et al., 1988, выше). В свою очередь линкеры могут быть модифицированы для осуществления дополнительных функций, таких как прикрепление лекарственных средств или прикрепление к твердым носителям. Одноцепочечное антитело может быть моновалентным, если используется только одна VH и VL, двухвалентным, если используются две VH и VL, или поливалентным, если используется более двух VH и VL. Могут быть получены биспецифические или поливалентные антитела, которые специфически связываются с PD-1 и с другой молекулой. Одноцепочечные варианты могут быть получены либо рекомбинантно, либо синтетически. Для синтетического получения scFv можно использовать автоматизированный синтезатор. Для рекомбинантного получения scFv, подходящая плазмида, содержащая полинуклеотид, которая кодирует scFv, может быть введена в подходящую клетку-хозяина, либо в эукариотические, такие как клетки дрожжей, растений, насекомых или млекопитающих, либо в прокариотические, такие как клетки Е. coli. Полинуклеотиды, которые кодируют интересующий scFv, могут быть получены с помощью обычных методов, таких как лигирование полинуклеотидов. Полученный в результате scFv может быть выделен с использованием стандартных методов очистки белка, известных в данной области.
Также охвачены другие формы одноцепочечных антител, такие как диатела. Диатела представляют собой двухвалентные, биспецифические антитела, в которых VH и VL экспрессируются в виде одной полипептидной цепи, но с использованием линкера, который является слишком коротким, чтобы допустить спаривание двух доменов на одной цепи, посредством чего стимулируется спаривание доменов с комплементарными доменами другой цепи и создание двух антигенсвязывающих сайтов (см., например, Holliger, Р., et al., 1993, Proc. Natl. Acad Sci. USA 90:6444-6448; Poljak, R.J., et al., 1994, Structure 2:1121-1123).
Гетероконъюгатные антитела, содержащие два ковалентно связанных антитела, также входят в объем изобретения. Такие антитела используют для нацеливания клеток иммунной системы на нежелательные клетки (патент US. 4676980) и для лечения ВИЧ-инфекции (публикации РСТ WO 91/00360 и WO 92/200373; ЕР 03089). Гетероконъюгатные антитела могут быть получены с использованием любых удобных методов сшивания. Подходящие сшивающие агенты и методики хорошо известны в данной области и описаны в патенте US 4676980.
Химерные или гибридные антитела также могут быть получены in vitro с использованием известных методов химии синтетических белков, в том числе с использованием сшивающих агентов. Например, иммунотоксины могут быть сконструированы с использованием реакции дисульфидного обмена или путем образования тиоэфирной связи. Примеры подходящих реагентов для этой цели включают иминотиолат и метил-4-меркаптобутиримидат.
Изобретение также включает слитые белки, содержащие один или более фрагментов или областей из раскрытых здесь антител. В некоторых воплощениях может быть изготовлено слитое антитело, которое содержит все антитело к PD-1 по изобретению или его часть антитела, связанное(ую) с другим полипептидом. В другом воплощении только вариабельные домены антитела к PD-1 связаны с полипептидом. В другом воплощении домен VH антитела к PD-1 связан с первым полипептидом, в то время как домен VL антитела к PD-1 связан со вторым полипептидом, который ассоциирован с первым полипептидом таким образом, что домены VH и VL могут взаимодействовать друг с другом с образованием антигенсвязывающего сайта. В другом предпочтительном воплощении домен VH отделен от домена VL линкером таким образом, что домены VH и VL могут взаимодействовать друг с другом. Антитело VH-линкер-VL затем соединяют с представляющим интерес полипептидом. Кроме того, могут быть созданы слитые антитела, в которых два (или более) одноцепочечных антитела соединены друг с другом. Это полезно, если необходимо создать двухвалентное или поливалентное антитело в одной полипептидной цепи или если необходимо создать биспецифическое антитело.
В некоторых воплощениях предложен слитый полипептид, который содержит по меньшей мере 10 последовательных аминокислот вариабельной области легкой цепи, показанной в SEQ ID NO: 2, 7, 8 или 9, и/или по меньшей мере 10 аминокислот вариабельной области тяжелой цепи, показанной в SEQ ID NO: 3, 4, 5 или 6. В других воплощениях предложен слитый полипептид, который содержит по меньшей мере примерно 10, по меньшей мере примерно 15, по меньшей мере примерно 20, по меньшей мере примерно 25 или по меньшей мере примерно 30 последовательных аминокислот вариабельной области легкой цепи и/или по меньшей мере примерно 10, по меньшей мере примерно 15, по меньшей мере примерно 20, по меньшей мере примерно 25 или по меньшей мере примерно 30 последовательных аминокислот вариабельной области тяжелой цепи. В другом воплощении слитый полипептид содержит вариабельную область легкой цепи и/или вариабельную область тяжелой цепи, как показано в любой из пар последовательностей, выбранных из SEQ ID NO: 2 и 3, 7 и 3, 8 и 3, 8 9 и 3, 2 и 4, 7 и 4, 8 и 4, 9 и 4, 2 и 5, 7 и 5, 8 и 5, 9 и 5, 2 и 6, 7 и 6, 8 и 6, и 9 и 6. В другом воплощении слитый полипептид содержит один или более CDR. В других воплощениях слитый полипептид содержит VH CDR3 и/или VL CDR3. Применительно к данному изобретению слитый белок содержит одно или более чем одно антитело и другую аминокислотную последовательность, с которой он не соединен в нативной молекуле, например гетерологичную последовательность или гомологичную последовательность из другой области. Типичные гетерологичные последовательности включают, без ограничения им, "тег", такой тег FLAG или тег 6His. Теги хорошо известны в данной области.
Слитый полипептид может быть создан с помощью известных в данной области методов, например синтетически или рекомбинантно. Как правило, слитые белки по изобретению получают посредством получения и экспрессии полинуклеотида, кодирующего их, с использованием рекомбинантных методов, описанных здесь, хотя они также могут быть получены другими способами, известными в данной области, включая, например, химический синтез.
В других воплощениях другие модифицированные антитела могут быть получены с использованием антитела к PD-1, кодируемого молекулами нуклеиновой кислоты. Например, "каппа-тела" (III et al., 1997, Protein Eng. 10:949-57), "мини-тела" (Martin et al., 1994, EMBO J. 13:5303-9), "диатела" (Holliger et al., dsit) или "Янусины" ("Janusins") (Traunecker et al., 1991, EMBO J. 10:3655-3659 и Traunecker et al., 1992, Int. J. Cancer (Suppl.) 7:51-52) могут быть получены с использованием стандартных молекулярно-биологических методов в соответствии с принципами, изложенными в описании.
Например, биспецифические антитела, моноклональные антитела, которые обладают специфичностями связывания по меньшей мере с двумя разными антигенами, могут быть получены с использованием раскрытых здесь антител. Способы получения биспецифических антител известны в данной области (см., например, Suresh et al., 1986, Methods in Enzymology 121:210). Например, биспецифические антитела или антигенсвязывающие фрагменты могут быть получены путем слияния гибридом или связывания Fab'-фрагментов. См., например, Songsivilai & Lachmann, 1990, Clin. Exp. Immunol. 79:315-321, Kostelny et al., 1992, J. Immunol. 148:1547-1553. Как правило, рекомбинантное получение биспецифических антител было основано на коэкспрессии двух пар тяжелой цепи-легкой цепи иммуноглобулина с двумя тяжелыми цепями, имеющими разные специфичности (Millstein and Cuello, 1983, Nature 305, 537-539). Кроме того, биспецифические антитела могут быть сформированы как "диатела" или "Янусины". В некоторых воплощениях биспецифическое антитело связывается с двумя разными эпитопами PD-1. В некоторых воплощениях описанные выше модифицированные антитела получают с использованием одного или более вариабельных доменов или участков CDR из антитела к PD-1, предложенного здесь.
Согласно одному подходу к получению биспецифических антител, вариабельные домены антитела с желательными специфичностями связывания (сайты объединения антитела с антигеном) сливают с последовательностями константной области иммуноглобулина. Слияние предпочтительно осуществляют с константной областью тяжелой цепи иммуноглобулина, содержащей по меньшей мере часть шарнирного, СН2 и СН3 участков. Предпочтительно иметь первую константную область (СН1) тяжелой цепи, содержащую сайт, необходимый для связывания легкой цепи, присутствующую по меньшей мере в одном из слияний. ДНК, кодирующие слияния тяжелой цепи иммуноглобулина и, если нужно, легкую цепь иммуноглобулина, встраивают в отдельные экспрессионные векторы и котрансфицируют в подходящий организм-хозяин. Это обеспечивает большую гибкость в подборе взаимных пропорций трех полипептидных фрагментов в воплощениях, где неодинаковые соотношения трех полипептидных цепей, используемых в конструкции, обеспечивают оптимальные выходы. Однако можно встроить последовательности, кодирующие две или все три полипептидные цепи, в один экспрессионный вектор, когда экспрессия по меньшей мере двух полипептидных цепей в одинаковых соотношениях приводит к высоким выходам, или когда эти соотношения не имеют большого значения.
В одном подходе биспецифические антитела состоят из тяжелой цепи гибридного иммуноглобулина с первой специфичностью связывания в одном плече и пары тяжелая цепь-легкая цепь гибридного иммуноглобулина (обеспечивающей вторую специфичность связывания) в другом плече. Эта асимметричная структура с легкой цепью иммуноглобулина только в одной половине биспецифической молекулы облегчает отделение нужного биспецифического соединения от нежелательной комбинации цепей иммуноглобулина. Этот подход описан в публикации РСТ WO 94/04690.
В этом изобретении также предлагаются композиции, содержащие антитела, конъюгированные (например связанные) с агентом, который облегчает связывание с твердой подложкой, (таким как биотин или авидин). Для простоты ссылка делается в общем случае на антитела, с пониманием того, что эти методы применимы к любому из PD-1- связывающих и/или антагонистических воплощений, описанных здесь. Конъюгирование обычно относится к связыванию этих компонентов, как описано в данном описании изобретения. Связывание (которое, как правило, фиксирует эти компоненты в непосредственной близости по меньшей мере для введения) может быть достигнуто многими способами. Например, возможна непосредственная реакция между агентом и антителом, когда каждый из них имеет заместитель, способный взаимодействовать с другим заместителем. Например, нуклеофильная группа, такая как амино или сульфгидрильная группа, на одном из них может быть способна взаимодействовать с карбонилсодержащей группой, такой как ангидрид или галогенангидрид, или с алкильной группой, содержащей хорошую уходящую группу (например галогенид), на другом из них.
Антитела могут быть связаны со многими разными носителями. Носители могут быть активными и/или инертными. Примеры хорошо известных носителей включают полипропилен, полистирол, полиэтилен, декстран, нейлон, амилазы, стекло, натуральные и модифицированные целлюлозы, полиакриламиды, агарозы и магнетит. По своей природе носитель может быть либо растворимым, либо нерастворимым для целей изобретения. Специалистам в данной области техники известны другие подходящие носители для связывания антител или они могут установить их, используя обычные эксперименты. В некоторых воплощениях носитель содержит фрагмент, нацеленный на легкие, сердце или сердечный клапан.
Антитело или полипептид по настоящему изобретению могут быть связаны с меткой, такой как флуоресцентная молекула, радиоактивная молекула или любые другие метки, известные в данной области. В данной области техники известны метки, которые обычно обеспечивают (прямо или косвенно)сигнал.
Полинуклеотиды, векторы и клетки-хозяева
В изобретении также предложены полинуклеотиды, кодирующие любое из антител, включая фрагменты антител и модифицированные антитела, описанные здесь, такие как, например, антитела с нарушенной эффекторной функцией. В другом аспекте изобретения предложен способ получения любого из полинуклеотидов, описанных здесь. Полинуклеотиды могут быть получены и экспрессированы посредством методов, известных в данной области. Соответственно, в изобретении предложены полинуклеотиды или композиции, включая фармацевтические композиции, содержащие полинуклеотиды, кодирующие любое из следующих: антитела mAb1, mAb2, mAb3, mAb4, mAb5, mAb6, mAb7, mAb8, mAb9, mAb10, mAb11, mAb12, mAb13, mAb14, mAb15, mAb16 и mAb17 или их любой фрагмент или часть, обладающие антагонистической способностью в отношении PD-1.
Полинуклеотиды, комплементарные любым таким последовательностям также охвачены настоящим изобретением. Полинуклеотиды могут быть одноцепочечными (кодирующими или антисмысловыми) или двухцепочечными и могут представлять собой молекулы ДНК (геномные, кДНК или синтетические) или РНК. Молекулы РНК включают молекулы НnРНК (гетерогенной ядерной РНК), которые содержат интроны и соответствуют молекуле ДНК взаимнооднозначно, и молекулы мРНК, которые не содержат интроны. Дополнительные кодирующие или некодирующие последовательности могут, но не обязательно, присутствовать в полинуклеотиде по настоящему изобретению и полинуклеотид может, но необязательно, быть связанным с другими молекулами и/или веществами подложки.
Полинуклеотиды могут содержать нативную последовательность (то есть эндогенную последовательность, которая кодирует антитело или его фрагмент) или могут содержать вариант такой последовательности. Полинуклеотидные варианты содержат одну или более замен, добавлений, делеций и/или вставок, так что иммунореактивность кодированного полипептида не уменьшается по сравнению с нативной иммунореактивной молекулой. Влияние на иммунореактивность кодированного полипептида обычно можно оценить, как описано в данном описании изобретения. Варианты предпочтительно демонстрируют по меньшей мере примерно 70%-ную идентичность, более предпочтительно по меньшей мере примерно 80%-ную идентичность, еще более предпочтительно по меньшей мере примерно 90%-ную идентичность и наиболее предпочтительно по меньшей мере примерно 95%-ную идентичность с последовательностью полинуклеотида, который кодирует нативное антитело или его фрагмент.
Две полинуклеотидные или полипептидные последовательности называются "идентичными", если последовательность нуклеотидов или аминокислот в этих двух последовательностях является одинаковой при выравнивании с максимальным соответствием, как описано ниже. Сравнение двух последовательностей обычно выполняют путем сравнения последовательностей в окне сравнения для идентификации и сравнения локальных участков подобия последовательностей. "Окно сравнения", при использовании здесь, относится к сегменту из по меньшей мере примерно 20 последовательных положений, обычно от 30 до примерно 75, или от 40 до примерно 50, в котором последовательность можно сравнивать с эталонной последовательностью с таким же числом последовательных положений после оптимального выравнивания этих двух последовательностей.
Оптимальное выравнивание последовательностей для сравнения может быть выполнено с использованием программы MegAlign® в комплекте вычислительных программ для биоинформатики Lasergene® (DNASTAR®, Inc., Madison, WI), с использованием параметров по умолчанию. В этой программе воплощены несколько схем выравнивания, описанных в следующих ссылках: Dayhoff, М.О., 1978, A model of evolutionary change in proteins - Matrices for detecting distant relationships. In Dayhoff, M.O. (ed.) Atlas of Protein Sequence and Structure, National Biomedical Research Foundation, Washington DC Vol. 5, Suppl. 3, pp. 345-358; Hein J., 1990, Unified Approach to Alignment and Phylogenes pp. 626-645 Methods in Enzymology vol. 183, Academic Press, Inc., San Diego, CA; Higgins, D.G. and Sharp, P.M., 1989, CABIOS 5:151-153; Myers, E.W. and Muller W., 1988, CABIOS 4:11-17; Robinson, E.D., 1971, Comb. Theor. 11:105; Santou, N., Nes, M., 1987, Mol. Biol. Evol. 4:406-425; Sneath, P.H.A. and Sokal, R.R., 1973, Numerical Taxonomy the Principles and Practice of Numerical Taxonomy, Freeman Press, San Francisco, CA; Wilbur, W.J. and Lipman, D.J., 1983, Proc. Natl. Acad. Sci. USA 80:726-730.
Предпочтительно, "процент идентичности последовательности" определяют путем сравнения двух оптимально выровненных последовательностей в окне сравнения из по меньшей мере 20 положений, где часть полинуклеотидной или полипептидной последовательности в окне сравнения может содержать вставки или делеции (то гэпы) в количестве 20 процентов или менее, обычно от 5 до 15 процентов, или от 10 до 12 процентов по сравнению с эталонными последовательностями (которые не содержат вставок или делеций) для оптимального выравнивания двух последовательностей. Процент рассчитывают путем определения количества положений, в которых идентичные нуклеиновокислотные основания или аминокислотные остатки находятся в обеих последовательностях, для получения числа совпадающих положений, деления количества совпадающих положений на общее количество положений в эталонной последовательности (то есть размер окна) и умножения результатов на 100 для получения процента идентичности последовательности.
Варианты могут также, или альтернативно, быть по существу гомологичными нативному гену или его части или набору генов. Такие полинуклеотидные варианты способны гибридизоваться в умеренно жестких условиях с естественно встречающейся последовательностью ДНК, кодирующей нативное антитело (или комплементарной последовательностью).
Подходящие "умеренно жесткие условия" включают предварительную промывку в растворе 5XSSC (хлорид натрия/цитрат натрия), 0,5% SDS (додецилсульфат натрия), 1,0 мМ EDTA (этилендиаминтетрауксусная кислота) (рН 8,0); гибридизацию при 50°С - 65°С, 5XSSC, в течение ночи; с последующим двукратным промыванием при 65°С в течение 20 минут каждым из 2Х, 0,5Х и 0,2Х SSC, содержащим 0,1% SDS.
При использовании здесь, "очень жесткие условия" или "условия высокой жесткости" представляют собой условия, при которых: (1) используют низкую ионную силу и высокую температуру для промывки, например смесь 0,015 М хлорида натрия/0,0015 М цитрата натрия/0,1% додецилсульфата натрия при 50°С; (2) используют во время гибридизации денатурирующий агент, такой как формамид, например смесь 50% (об./об.) формамида с 0,1% бычьим сывороточным альбумином/0,1% фиколла/0,1% поливинилпирролидона/50 мМ натрий-фосфатного буфера при рН 6,5 с 750 мМ хлорида натрия, 75 мМ цитрата натрия при 42°С; или (3) используют 50% формамид, 5xSSC (0,75 М NaCl, 0,075 М цитрат натрия), 50 мМ фосфат натрия (рН 6,8), 0,1% пирофосфат натрия, 5 х Раствор Денхардта, ДНК обработанной ультразвуком спермы лосося (50 мкг/мл), 0,1% SDS и 10% сульфат декстрана при 42°С, с промывками при 42°С в 0,2 х SSC (хлорид натрия/цитрат натрия) и 50% формамидом при 55°С, с последующим промыванием с высокой жесткостью, состоящим из 0,1 х SSC, содержащим ЭДТА при 55°С. Специалисту в данной области понятно, как подобрать температуру, ионную силу и т.д., при необходимости приспособить их к таким факторам как длина зонда и тому подобное.
Специалистам в данной области техники понятно, что в результате вырожденности генетического кода существует много нуклеотидных последовательностей, которые кодируют полипептид, описанный в данном описании изобретения. Некоторые из этих полинуклеотидов имеют минимальную гомологию с нуклеотидной последовательностью любого нативного гена. Тем не менее, полинуклеотиды, которые различаются из-за различий в использовании кодонов, явным образом охвачены настоящим изобретением. Кроме того, аллели генов, содержащие полинуклеотидные последовательности, представленные здесь, входят в объем настоящего изобретения. Аллели представляют собой эндогенные гены, которые изменены в результате одной или более мутаций, таких как делеции, вставки и/или замены нуклеотидов. Полученные в результате мРНК и белок могут, но необязательно, иметь измененную структуру или функцию. Аллели могут быть идентифицированы с использованием стандартных методов (таких как гибридизация, амплификация и/или сравнение базы данных последовательностей).
Полинуклеотиды по настоящему изобретению могут быть получены с использованием химического синтеза, рекомбинантных методов или ПЦР. Способы химического синтеза полинуклеотидов хорошо известны в данной области и не нуждаются в подробном описании здесь. Специалист в данной области техники может использовать приведенные здесь последовательности и имеющийся в продаже синтезатор ДНК для получения нужной последовательности ДНК.
Для получения полинуклеотидов с использованием рекомбинантных методов, полинуклеотид, содержащий необходимую последовательность, может быть встроен в подходящий вектор, а вектор, в свою очередь, может быть введен в подходящую клетку-хозяина для репликации и амплификации, как далее описано здесь. Полинуклеотиды могут быть введены в клетки-хозяева любыми способами, известными в данной области. Клетки трансформируют путем введения экзогенного полинуклеотида посредством прямого захвата, эндоцитоза, трансфекции, F-спаривания или электропорации. После введения экзогенный полинуклеотид может поддерживаться в клетке в виде неинтегрированного вектора (такого как плазмида) или быть интегрированным в геном клетки-хозяина. Полинуклеотид, амплифицированный таким образом, может быть выделен из клетки-хозяина способами, хорошо известными в данной области. См., например, Sambrook et al., 1989.
Альтернативно, ПЦР позволяет репродуцировать последовательности ДНК. ПЦР-технология хорошо известна в данной области и описана в патентах US 4683195, 4800159, 4754065 и 4683202, а также в PCR: The Polymerase Chain Reaction, Mullis et al. eds., Birkauswer Press, Boston, 1994.
РНК может быть получена путем использования выделенной ДНК в соответствующем векторе и введения ее в подходящую клетку-хозяин. Когда клетка реплицируется и ДНК транскрибируется в РНК, РНК затем может быть выделена с использованием способов, хорошо известных специалистам в данной области, как указано, например, в Sambrook et al., 1989, выше.
Подходящие клонирующие векторы могут быть сконструированы в соответствии со стандартными методиками или могут быть выбраны из большого количества клонирующих векторов, доступных в данной области техники. В то время как выбранный клонирующий вектор может варьироваться в зависимости от клетки-хозяина, предназначенной для использования, полезные клонирующие векторы обычно обладают способностью к саморепликации, могут иметь одну мишень для конкретной рестрикционной эндонуклеазы и/или могут нести гены маркера, который можно использовать при селекции клонов, содержащих вектор. Подходящие примеры включают плазмиды и бактериальные вирусы, например pUC18, pUC19, Bluescript (например pBS SK+) и его производные, mp18, mp19, pBR322, рМВ9, ColE1, pCR1, RP4, фаговые ДНК и челночные векторы, такие как pSA3 и рАТ28. Эти и многие другие клонирующие векторы доступны у имеющихся в продаже поставщиков, таких как BioRad, Strategene и Invitrogen.
Кроме того, предложены экспрессионные векторы. Экспрессионные векторы, как правило, представляют собой реплицируемые полинуклеотидные конструкции, которые содержат полинуклеотид по изобретению. Подразумевается, что экспрессионный вектор должен быть реплицируемым в клетках-хозяевах либо как эписома, либо как неотъемлемая часть хромосомной ДНК. Подходящие экспрессионные векторы включают, без ограничения ими, плазмиды, вирусные векторы, включая аденовирусы, адено-ассоциированные вирусы, ретровирусы, космиды и экспрессионный(е) вектор(ы), раскрытые в публикации РСТ WO 87/04462. Компоненты вектора могут включать, без ограничения ими, одно или более из следующих: сигнальную последовательность; точку начала репликации; один или более маркерных генов; подходящие элементы, контролирующие транскрипцию (такие как промоторы, энхансеры и терминатор). Для экспрессии (то есть трансляции) обычно требуется один или более элементов, контролирующих трансляцию, таких как сайты связывания рибосом, сайты инициации трансляции и стоп-кодоны.
Векторы, содержащие интересующие полинуклеотиды, могут быть введены в клетку-хозяина любым из множества подходящих средств, включая электропорацию, трансфекцию с использованием хлорида кальция, хлорида рубидия, фосфата кальция, DEAE(диэтиламиноэтилен)-декстрана или других веществ; баллистическую трансфекцию; липофекцию; и инфекцию (например, если вектор является инфекционным агентом, таким как вирус коровьей оспы). Выбор вводимых векторов или полинуклеотидов часто зависит от особенностей клетки-хозяина.
В изобретении также предложены клетки-хозяева, содержащие любой из описанных здесь полинуклеотидов. Любые клетки-хозяева, способные гиперэкспрессировать гетерологичные ДНК, можно использовать для выделения генов, кодирующих интересующее антитело, полипептид или белок. Неограничивающие примеры клеток-хозяев млекопитающих включают, без ограничения ими, клетки COS, HeLa и СНО. См. также публикацию РСТ WO 87/04462. Подходящие клетки-хозяева, не являющиеся клетками млекопитающих, включают прокариотов (таких как Е. coli или В. subtillis) и дрожжи (такие как S. cerevisae, S. pombe; или K. lactis). Предпочтительно, клетки-хозяева экспрессируют кДНК на уровне, который примерно в 5 раз выше, более предпочтительно в 10 раз выше, еще более предпочтительно в 20 раз выше, чем уровень соответствующего, интересующего эндогенного антитела или белка, если они присутствуют, в клетках-хозяевах. Скрининг клеток-хозяев в отношении специфического связывания с PD-1 или доменом PD-1 выполняли посредством иммуноанализа или FACS. Можно идентифицировать клетку, гиперэкспрессирующую интересующий белок.
Экспрессионный вектор можно использовать для прямой экспрессии антагонистического антитела к PD-1. Специалисту в данной области известно введение экспрессионных векторов для получения экспрессии экзогенного белка in vivo. См., например, патенты US 6436908; 6413942; и 6376471. Введение экспрессионных векторов включает локальное или системное введение, включая инъекцию, пероральное введение, биолистическую пушку или катетерное введение, и местное введение. В другом воплощении экспрессионный вектор вводят непосредственно в симпатический ствол или нервный узел или в коронарную артерию, предсердие, желудочек сердца или перикард.
Также можно использовать направленную доставку терапевтических композиций, содержащих экспрессионный вектор или субгеномный полинуклеотид. Рецепторноопосредованные методы доставки ДНК описаны, например, в Findeis et al., Trends Biotechnol., 1993, 11:202; Chiou et al., Gene Therapeutics: Methods And Applications Of Direct Gene Transfer, J.A. Wolff, ed., 1994; Wu et al., J. Biol. Chem., 1988, 263:621; Wu et al., J. Biol. Chem., 1994, 269:542; Zenke et al., Proc. Natl. Acad. Sci. USA, 1990, 87:3655; Wu et al., J. Biol. Chem., 1991, 266:338. Терапевтические композиции, содержащие полинуклеотид, вводят в диапазоне от примерно 100 нг до примерно 200 мг ДНК для местного применения в протоколе генной терапии. Диапазоны концентраций от примерно 500 нг до примерно 50 мг, от примерно 1 мкг до примерно 2 мг, от примерно 5 мкг до примерно 500 мкг, и от примерно 20 мкг до примерно 100 мкг ДНК также можно использовать в протоколе генной терапии. Терапевтические пол и нуклеотиды и полипептиды могут быть доставлены с использованием средств доставки генов. Средство доставки гена может быть вирусного и невирусного происхождения (см. в целом Jolly, Cancer Gene Therapy, 1994, 1:51; Kimura, Human Gene Therapy, 1994, 5:845; Connelly, Human Gene Therapy, 1995, 1:185; and Kaplitt, Nature Genetics, 1994, 6:148). Экспрессию таких кодирующих последовательностей можно индуцировать с использованием эндогенных промоторов млекопитающих или гетерологичных промоторов. Экспрессия кодирующей последовательности может быть либо конститутивной, либо регулируемой.
Вирусные векторы для доставки нужного полинуклеотида и экспрессии в нужной клетке хорошо известны в данной области. Примеры средств доставки на основе вирусов включают, без ограничения ими, рекомбинантные ретровирусы (см., например, публикации РСТ WO 90/07936; WO 94/03622; WO 93/25698; WO 93/25234; WO 93/11230; WO 93/10218; WO 91/02805; патенты US 5219740 и 4777127; патент GB 2200651; и патент ЕР 0345242), векторы на основе альфавирусов (например векторы на основе вируса Синдбиса, вирус леса Семлики (АТСС VR-67; АТСС VR-1247), Росс Ривер вирус (АТСС VR-373; АТСС VR-1246) и вирус венесуэльского энцефалита лошадей (АТСС VR-923; АТСС VR-1250; АТСС VR 1249; АТСС VR-532)), и векторы на основе адено-ассоциированного вируса (AAV) (см., например, публикации РСТ WO 94/12649, WO 93/03769; WO 93/19191; WO 94/28938; WO 95/11984 и WO 95/00655). Также можно использовать введение ДНК, связанной с инактивированным аденовирусом, как описано в Curiel, Hum. Gene Ther., 1992, 3:147.
Также можно использовать невирусные средства и методы доставки, включая, без ограничения ими, поликатионную конденсированную ДНК, связанную или несвязанную с инактивированным аденовирусом (см., например, Curiel, Hum. Gene Ther., 1992, 3:147); лигандсвязанную ДНК (см., например, Wu, J. Biol. Chem., 1989, 264:16985); средства доставки на основе эукариотических клеток (см., например, патент US 5814482; публикации РСТ WO 95/07994; WO 96/17072; WO 95/30763; и WO 97/42338) и нейтрализацию нуклеинового заряда или слияние с клеточными мембранами. Также может быть использована депротеинизированная ДНК. Типичные методы введения депротеинизированной ДНК описаны в публикации РСТ WO 90/11092 и патенте US 5580859. Липосомы, которые могут выступать в качестве средств доставки генов, описаны в патенте US 5422120; публикации РСТ WO 95/13796; WO 94/23697; WO 91/14445; и ЕР 0524968. Дополнительные подходы описаны в Philip, Mol. Cell Biol., 1994, 14:2411 и в Woffendin, Proc. Natl. Acad. Sci., 1994, 91:1581.
Композиции
В изобретении также предлагаются фармацевтические композиции, содержащие эффективное количество антитела к PD-1, описанного в данном описании изобретения. Примеры таких композиций, а также способы их приготовления также описаны здесь. В некоторых воплощениях композиция содержит одно или более PD-1-антител. В других воплощениях антитело к PD-1 распознает PD-1. В других воплощениях антитело к PD-1 представляет собой человеческое антитело. В других воплощениях антитело к PD-1 представляет собой гуманизированное антитело. В некоторых воплощениях антитело к PD-1 содержит константную область, которая способна вызвать нужный иммунный ответ, такой как антителоопосредованный лизис или ADCC. В других воплощениях антитело к PD-1 содержит константную область, которая не вызывает ненужный или нежелательный иммунный ответ, такой как антителоопосредованный лизис или ADCC. В других воплощениях антитело к PD-1 содержит один или более CDR антитела (например один, два, три, четыре, пять или в некоторых воплощениях все шесть CDR).
Следует понимать, что композиции могут содержать более одного антитела к PD-1 (например смесь PD-1 антител, которая распознает разные эпитопы PD-1). Другие примеры композиций содержат более одного антитела к PD-1, которые узнают один(ни) и тот(те) же эпитоп(ы), или разные виды антител к PD-1, которые связываются с разными эпитопами PD-1. В некоторых воплощениях композиции содержат смесь антител к PD-1, которые узнают разные варианты PD-1.
Композиция, используемая в настоящем изобретении, может дополнительно содержать фармацевтически приемлемые носители, эксципиенты или стабилизаторы (Remington: The Science and practice of Pharmacy 20th Ed., 2000, Lippincott Williams and Wilkins, Ed. K.E. Hoover) в форме лиофилизированных композиций или водных растворов. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в этих дозировках и концентрациях и могут содержать буферы, такие как фосфатный, цитратный, и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмония хлорид; гексаметония хлорид; бензалкония хлорид, бензетония хлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехин; резорцин; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (менее чем примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстраны; хелатирующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтилен гликоль (PEG). Фармацевтически приемлемые эксципиенты дополнительно описаны здесь.
Антитело к PD-1 и его композиции также можно использовать вместе с другими агентами, которые служат для повышения и/или усиления эффективности этих агентов, или можно вводить по отдельности, одновременно или последовательно с другими агентами, которые служат для повышения и/или усиления эффективности агентов.
В изобретении также предложены композиции, включая фармацевтические композиции, содержащие любой из полинуклеотидов по изобретению. В некоторых воплощениях композиция содержит экспрессионный вектор, содержащий полинуклеотид, кодирующий антитело, как описано в данном описании изобретения. В другом воплощении композиция содержит экспрессионный вектор, содержащий полинуклеотид, кодирующий любое из антител, описанных в данном описании изобретения.
Способы предупреждения или лечения состояний, опосредованных PD-1
Антитела и конъюгаты антител по настоящему изобретению пригодны для разных применений, включая, но без ограничения ими, терапевтические способы лечения и способы диагностики.
В одном аспекте изобретения предложен способ лечения рака. В некоторых воплощениях способ лечения рака у субъекта включает введение субъекту, нуждающемуся в этом, эффективного количества композиции (например фармацевтической композиции), содержащей любое из PD-1 антител, описанных в данном описании изобретения. При использовании здесь, раковые заболевания включают, без ограничения им, рак мочевого пузыря, рак молочной железы, рак шейки матки, хориокарциному, рак толстой кишки, рак пищевода, рак желудка, глиобластому, глиому, опухоль мозга, рак головы и шеи, рак почек, рак легких, рак полости рта, рак яичника, рак поджелудочной железы, рак предстательной железы, рак печени, рак матки, рак костей, лейкоз, лимфому, саркому, рак крови, рак щитовидной железы, рак тимуса, рак глаза и рак кожи. В некоторых воплощениях предлагается способ ингибирования роста опухоли или прогрессирования у субъекта, включающий введение субъекту, нуждающемуся в этом, эффективного количества композиции, содержащей PD-1 антитела или конъюгаты PD-1 антител, как описано в данном описании изобретения. В некоторых воплощениях опухоль представляет собой PD-L1-экспрессирующую опухоль. В других воплощениях опухоль не экспрессирует PD-L1. В других воплощениях предлагается способ ингибирования метастазов раковых клеток у субъекта, включающий введение субъекту, нуждающемуся в этом, эффективного количества композиции, содержащей любое из PD-1 антител, описанных в данном описании изобретения. В других воплощениях предложен способ индуцирования регрессии опухоли у субъекта, включающий введение субъекту, нуждающемуся в этом, эффективного количества композиции, содержащей любое из PD-1 антител, описанных в данном описании изобретения.
В другом аспекте предложен способ обнаружения, диагностики и/или мониторинга рака. Например, PD-1 антитела, как описано в данном описании изобретения, могут быть помечены детектируемой группировкой, такой как визуализирующий агент и метка субстрат-фермента. Антитела, как описано в данном описании изобретения, также можно использовать для диагностических анализов in vivo, таких как визуализация in vivo (например PET (позитронно-эмиссионная томография) или SPECT (однофотонная эмиссионная компьютерная томография) или окрашивающего реагента.
В некоторых воплощениях описанные здесь способы дополнительно включают в себя стадию лечения субъекта дополнительной формой терапии. В некоторых воплощениях дополнительной формой терапии является дополнительная противораковая терапия, включающая, без ограничения ими, химиотерапию, облучение, хирургию, гормональную терапию и/или дополнительную иммунотерапию.
Что касается всех описанных здесь способов, ссылка на антагонистические антитела к PD-1 также включает композиции, содержащие один или более дополнительных агентов. Эти композиции могут дополнительно содержать подходящие эксципиенты, такие как фармацевтически приемлемые эксципиенты, включая буферы, которые хорошо известны в данной области. Настоящее изобретение может использоваться отдельно или в сочетании с другими способами лечения.
Антагонистическое антитело к PD-1 может быть введено субъекту любым подходящим путем. Специалисту в данной области очевидно, что примеры, описанные здесь, не предназначены для ограничения, а являются иллюстрацией доступных методов. Соответственно, в некоторых воплощениях, антагонистическое антитело к PD-1 вводят субъекту в соответствии с известными способами, такими как внутривенное введение, например в виде болюса, или посредством непрерывной инфузии в течение некоторого периода времени, внутримышечно, внутрибрюшинно, интрацереброспинально, трансдермально, подкожно, внутрисуставно, сублингвально, интрасиновиально, посредством инсуфляции, интратекально, перорально, посредством ингаляции или местно. Введение может быть системным, например внутривенным введением, или локализованным. Для введения пригодны имеющиеся в продаже распылители для жидких композиций, включая струйные распылители и ультразвуковые распылители. Жидкие композиции можно непосредственно распылять, а лиофилизированный порошок можно распылять после восстановления. Альтернативно, антагонистическое антитело к PD-1 может быть переведено в аэрозольное состояние с использованием фторуглеродной композиции и дозирующего ингалятора или ингалировано в виде лиофилизированного и измельченного порошка.
В некоторых воплощениях антагонистическое антитело к PD-1 вводят посредством методов сайт-специфической или целевой местной доставки. Примеры методов сайт-специфической или целевой местной доставки включают различные имплантируемые депо-источники антагонистического антитела к PD-1 или катетеры для локальные доставки, такие как инфузионные катетеры, имплантированные катетеры или игольчатые катетеры, синтетические трансплантаты, адвентициальные обертывания, шунты и стенты или другие имплантируемые устройства, сайт-специфические носители, непосредственная инъекция или непосредственное нанесение. См., например, публикацию РСТ WO 00/53211 и патент US 5981568.
Для введения можно использовать различные композиции антагонистического антитела к PD-1. В некоторых воплощениях антагонистическое антитело к PD-1 может быть введено без примесей. В некоторых воплощениях антагонистическое антитело к PD-1 и фармацевтически приемлемый эксципиент могут находиться в различных композициях. В данной области известны фармацевтически приемлемые эксципиенты и относительно инертные вещества, которые облегчают введение фармакологически эффективного вещества. Например, эксципиент может придавать форму или консистенцию или действовать как разбавитель. Подходящие эксципиенты включают, без ограничения ими, стабилизирующие агенты, смачивающие и эмульгирующие агенты, соли для изменения осмолярности, инкапсулирующие агенты, буферы и усилители проникновения через кожу. Эксципиенты, а также составы для парентеральной и непарентеральной доставки лекарств описаны в Remington, The Science and Practice of Pharmacy 20th Ed. Mack Publishing, 2000.
В некоторых воплощениях эти агенты готовят в виде препарата для введения посредством инъекции (например внутрибрюшинно, внутривенно, подкожно, внутримышечно, и т.д.). Соответственно, эти агенты могут быть объединены с фармацевтически приемлемыми растворителями, такими как солевой раствор, раствор Рингера, раствор декстрозы и тому подобное. Конкретная схема лечения, то есть доза, время и повторяемость зависят от конкретного субъекта и истории болезни этого субъекта.
Антагонистическое антитело к PD-1 можно вводить любым подходящим способом, в том числе посредством инъекции (например внутрибрюшинно, внутривенно, подкожно, внутримышечно и т.д.). Антитела к PD-1 также можно вводить местно или посредством ингаляции, как описано в этом описании изобретения. Как правило, для введения антител к PD-1 исходная возможная доза может составлять примерно 2 мг/кг. Для целей настоящего изобретения типичная суточная доза может находиться в интервале от примерно 3 мкг/кг до 30 мкг/кг, до 300 мкг/кг, до 3 мг/кг, до 30 мг/кг, до 100 мг/кг или более, в зависимости от указанных выше факторов. Например, можно использовать дозу примерно 1 мг/кг, примерно 2,5 мг/кг, примерно 5 мг/кг, примерно 10 мг/кг и примерно 25 мг/кг. При повторных введениях в течение нескольких суток или более, в зависимости от состояния, лечение продолжают до тех пор, пока не произойдет необходимое подавление симптомов или пока не будут достигнуты достаточные терапевтические уровни, например уменьшение симптомов, связанных с раком. Эффективность этой терапии легко контролируется с помощью обычных методов и анализов. Схема лечения (в том числе используемое антагонистическое антитело к PD-1) может со временем меняться.
Для целей настоящего изобретения подходящая доза антагонистического антитела к PD-1 будет зависеть от используемого антагонистического антитела к PD-1 (или их композиций), типа и тяжести симптомов, подлежащих лечению, независимо от того, вводят агент для профилактических или для терапевтических целей, предыдущей терапии, истории болезни пациента и его реакции на агент, скорости выведения введенного агента у пациента и мнения лечащего врача. Обычно клиницист вводит антагонистическое антитело к PD-1 до достижения дозы, приводящей к нужному результату. Доза и/или частота могут меняться во время курса лечения. Эмпирические факторы, такие как время полусуществования, обычно вносят вклад в определение дозировки. Например, антитела, совместимые с иммунной системой человека, такие как гуманизированные антитела или полностью человеческие антитела, можно использовать для увеличения времени полусуществования антитела и для предупреждения атаки на антитело со стороны иммунной системы хозяина. Частота введения может быть определена и скорректирована во время курса лечения и, как правило, но необязательно, основана на лечении, и/или подавлении, и/или улучшении, и/или задержке симптомов. Альтернативно, могут являться подходящими композиции антагонистических антител к PD-1 с замедленным непрерывным высвобождением. В данной области известны различные композиции и устройства для достижения замедленного высвобождения.
В одном воплощении дозы антагонистического антитела могут быть определены эмпирически у субъектов, которым один или более раз вводили антагонистическое антитело. Субъектам дают возрастающие дозы антагонистического антитела к PD-1. Чтобы оценить эффективность, можно наблюдать за симптомом заболевания. Введение антагонистического антитела к PD-1 в соответствии со способом по настоящему изобретению может быть непрерывным или периодическим, в зависимости, например, от физиологического состояния пациента, является ли цель введения терапевтической или профилактической, и других факторов, известных квалифицированным практикующим врачам. Введение антагонистического антитела к PD-1 может быть по существу непрерывным в течение предварительного выбранного периода времени или может представлять собой ряд доз, вводимых через определенные интервалы времени.
В некоторых воплощениях может присутствовать более одного антагонистического антитела к PD-1. Могут присутствовать по меньшей мере один, по меньшей мере два, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять или более разных антагонистических антител. Как правило, эти антагонистические антитела к PD-1 могут иметь дополнительные активности, которые не оказывают неблагоприятного воздействия друг на друга. Антагонистическое антитело к PD-1 также можно использовать в сочетании с другими антителами и/или другими терапевтическими средствами. Антагонистическое антитело к PD-1 также можно использовать в сочетании с другими агентами, которые служат для усиления действия и/или дополнения эффективности агентов.
В некоторых воплощениях антагонистическое антитело к PD-1 можно вводить в комбинации с одним или более дополнительными терапевтическими агентами. Они включают, без ограничения ими, введение химиотерапевтического агента, вакцинацию, терапию на основе CAR-T-клеток (Т-клетки с химерными антигенными рецепторами), лучевую терапию, цитокиновую терапию, вакцину, анти-PD-1 биспецифическое антитело, ингибитор других иммуносупрессивных путей, ингибиторы ангиогенеза, активатор Т-клеток, ингибитор метаболического пути, ингибитор mTOR, ингибитор аденозинового пути, ингибитор тирозинкиназы, включающий, без ограничения ими, инлиту, ингибиторы ALK (киназа анапластической лимфомы) и сунитиниб, ингибитор BRAF, эпигенетический модификатор, ингибиторы или истощающий агент для клеток Treg и/или миелоидных супрессорных клеток, ингибитор JAK (Янус-киназа), ингибитор STAT, ингибитор циклинзависимой киназы, биотерапевтический агент (включая, но без ограничения ими, антитела к VEGF, VEGFR, EGFR, Her2/neu, другим рецепторам фактора роста, CD20, CD40, CD-40L, CTLA-4, ОХ-40, 4-1ВВ и ICOS), иммуногенный агент (например, ослабленные раковые клетки, опухолевые антигены, антигенпредставляющие клетки, такие как дендритные клетки, активированные опухолевым антигеном или нуклеиновыми кислотами, иммуностимулирующие цитокины (например IL-2, IFNα2, GM-CSF) и клетки, трансфицированные генами, кодирующими иммуностимулирующие цитокины, такие как GM-CSF, но без ограничения ими). Примеры химиотерапевтических агентов включают алкилирующие агенты, такие как тиотепа и циклофосфамид; алкилсульфонаты, такие как бусульфан, имсульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; ацетогенины (особенно буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекан); бриостатин; каллистатин; СС-1065 (включая его синтетические аналоги адозелезин, карцелезин и бизелезин); криптофицины (в частности криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и CBI-TMI); элеутеробин; панкратистатин; саркодиктин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлорэтамин, мехлорэтамина оксида гидрохлорид, мелфалан, новэмбихин, фенестерин, преднимустин, трофосфамид, урациловый иприт; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как ендииновые антибиотики (например калихимицин, особенно калихимицин гамма1I и калихимицин phiI1, см., например, Agnew, Chem. IntI. Ed. EngI., 33:183-186 (1994); динемицин, включая динемицин А; бисфосфонаты, такие как клодронат; эсперамицин; а также хромофор неокарциностатина и родственные хромофоры хромопротеиновых енедииновых антибиотиков), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, каминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (включая морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин и дезоксидоксорубицин), пегилированный липосомальный доксорубицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин С, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, циностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пуринов, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; средства, угнетающие функции надпочечников, такие как аминоглутетимид, митотан, трилостан; восполнитель фолиевой кислоты, такой как фролиновая кислота; ацеглатон; альдофосфамидгликозид; аминолевулиновая кислота; энилурацил; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элформитин; эллиптиния ацетат; эпотилон; этоглуцид; нитрат галлия; гидроксимочевина; лентинан; лонидамин; майтансиноиды, такие как майтансин и ансамитоцины; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; лозоксантрон; подофиллиновая кислота; 2-этилгидразид; прокарбазин; разоксан; ризоксин; сизофуран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2''-трихлортриэтиламин; трихотецены (особенно токсин Т-2, верракурин А, роридин А и ангуидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-С"); циклофосфамид; тиотепа; таксоиды, например паклитаксел и доксетаксел; хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; винорелбин; новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; кселода; ибандронат; СРТ-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин; и фармацевтически приемлемые соли, кислоты или производные любого из вышеприведенных соединений. Также включены антигормональные агенты, которые действуют так, чтобы регулировать или ингибировать гормональное действие на опухоли, такие как антиэстрогены и селективные модуляторы рецепторов эстрогена (SERM), включая, например, тамоксифен, ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (Фарестон); ингибиторы ароматазы, которые ингибируют фермент ароматазу, регулирующую продуцирование эстрогенов в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглутетимид, мегестрола ацетат, экземестан, форместан, фадрозол, ворозол, летрозол и анастрозол; и антиандрогены, такие как флутамид, нилутамид, бикалутамид, леупролид и гозерелин; и фармацевтически приемлемые соли, кислоты или производные любого из вышеупомянутых соединений.
В некоторых воплощениях антагонистическое антитело к PD-1 применяют в сочетании с одним или более другими терапевтическими агентами, нацеленными на модулятор иммунной контрольной точки, такими как, например и без ограничения ими, агент, нацеленный на PD-1, PD-L1, CTLA-4, LAG-3, В7-Н3, В7-Н4, B7-DC (PD-L2), В7-Н5, В7-Н6, В7-Н8, В7-Н2, В7-1, В7-2, ICOS, ICOS-L, TIGIT, CD2, CD47, CD80, CD86, CD48, CD58, CD226, CD155, CD112, LAIR1, 2В4, BTLA, CD160, TIM1, TIM-3, TIM4, VISTA (PD-H1), ОХ40, OX40L, GITR, GITRL, CD70, CD27, 4-1ВВ, 4-BBL, DR3, TL1A, CD40, CD40L, CD30, CD30L, LIGHT, HVEM, SLAM (SLAMF1, CD150), SLAMF2 (CD48), SLAMF3 (CD229), SLAMF4 (2В4, CD244), SLAMF5 (CD84), SLAMF6 (NTB-A), SLAMCF7 (CS1), SLAMF8 (BLAME), SLAMF9 (CD2F), CD28, CEACAM1(CD66a), CEACAM3, CEACAM4, CEACAM5, CEACAM6, CEACAM7, CEACAM8, CEACAM1-3AS CEACAM3C2, CEACAM1-15, PSG1-11, CEACAM1-4C1, CEACAM1-4S, CEACAM1-4L, IDO, TDO, CCR2, CD39-CD73-аденозиновый путь (A2AR), BTK, TIK, CXCR2, CCR4, CCR8, CCR5, VEGF путь, CSF-1 или модулятор природного иммунного ответа. В некоторых воплощениях антагонистическое антитело к PD-1 применяют в сочетании, например, с антагонистическим антителом к PD-L1, например таким как BMS-936559 (MDX-1105) и MPDL3280A; антагонистическим антителом к PD-1, таким как, например, ниволумаб, пембролизумаб и пидилизумаб; антагонистическим антителом к CTLA-4, таким как, например, ипилимумаб; антагонистическим антителом к LAG-3, таким как BMS-986016 и IMP701; антагонистическим антителом к TIM-3; антагонистическим антителом к В7-Н3, таким как, например, MGA271; антагонистическим антителом к VISTA; антагонистическим антителом к TIGIT; антагонистическим антителом к CD28; антителом к CD80; антителом к CD86; антагонистическим антителом к В7-Н4; с агонистическим антителом к ICOS; агонистическим антителом к CD28; с модулятором природного иммунного ответа (например TLR, KIR, NKG2A), и с ингибитором IDO (индоламинпиррол-2,3-диоксигеназа). В некоторых воплощениях антагонистическое антитело к PD-1 применяют в сочетании с 4-1ВВ (CD137) агонистом, таким как, например, PF-05082566 или BMS-663513. В некоторых воплощениях антагонистическое антитело к PD-1 применяют в сочетании с ОХ40 агонистом таким как, например, агонистическое антитело к ОХ-40. В некоторых воплощениях антагонистическое антитело к PD-1 применяют в сочетании с агонистом GITR (индуцируемый глюкокортикоидами TNF-рецептор), таким как, например, агонистическое антитело к GITR, например, и без ограничения им, TRX518. В некоторых воплощениях антагонистическое антитело к PD-1 применяют в сочетании с ингибитором IDO. В некоторых воплощениях антагонистическое антитело к PD-1 применяют в сочетании с цитокиновой терапией, такой как, например и без ограничения ими, IL-15, CSF-1, MCSF-1 и т.д.
В некоторых воплощениях антагонистическое антитело к PD-1 применяют в сочетании с одним или более другими терапевтическими антителами, такими как, например и без ограничения ими, антитела, нацеленные на CD19, CD22, CD40, CD52 или CCR4.
В некоторых воплощениях терапия антителами к PD-1 может предшествовать или следовать за обработкой другим агентом с интервалом от нескольких минут до нескольких недель. В воплощениях, где другие агенты, и/или белки, или пол и нуклеотиды вводят отдельно, в общем случае обеспечивают, что между каждыми введениями не проходит значительного периода времени, так что агент и композиция по настоящему изобретению все еще будут способны оказывать благоприятный совместный эффект на субъекта. В таких случаях предполагается, что можно вводит оба способа воздействия в пределах примерно 12-24 ч друг за другом и более предпочтительно в пределах примерно 6-12 ч друг за другом. В некоторых ситуациях может быть желательным значительно увеличить промежуток времени между введениями, однако от нескольких суток (2, 3, 4, 5, 6 или 7) до нескольких недель (1, 2, 3, 4, 5, 6, 7 или 8) между соответствующими введениями.
В некоторых воплощениях композиция антагонистического антитела к PD-1 содержит второй агент, выбранный из кризотиниба, палбоциклиба, гемцитабина, циклофосфамида, фторурацила, FOLFOX, фолиновой кислоты, оксалиплатина, акситиниба, сунитиниба малата, тофацитиниба, бевацизумаба, ритуксимаба и трастузумаба.
В некоторых воплощениях композицию антитела к PD-1 комбинируют со схемой лечения, дополнительно включающей традиционную терапию, выбранную из группы, состоящей из: хирургии, лучевой терапии, химиотерапии, таргетной терапии, иммунотерапии, гормональной терапии, ингибирования ангиогенеза и паллиативной помощи.
Применение PD-1 антител в схемах иммунотерапии рака на основе вакцин
В некоторых конкретных воплощениях в настоящем описании изобретения предложен способ увеличения иммуногенности или терапевтического эффекта вакцины для лечения рака у млекопитающего, в частности у человека, включающий введение млекопитающему, получающему вакцину, эффективного количества антагонистического антитела к PD-1, предложенного в настоящем описании изобретения. В некоторых других конкретных воплощениях в настоящем изобретении предложен способ лечения рака у млекопитающего, в частности у человека, включающий введение млекопитающему (1) эффективного количества вакцины, способной вызывать иммунный ответ против раковых клеток и (2) эффективного количества антагонистического антитела к PD-1 по настоящему изобретению. Способ лечения неопластического расстройства у млекопитающих и способ усиления иммуногенности или терапевтического эффекта вакцины для лечения неопластического расстройства у млекопитающего, описанные выше, совместно именуется "схемы иммунотерапии рака на основе вакцины" (или "VBIR рака").
В VBIR рака вакцина может находиться в любой форме или композициях, таких как (1) клеточные вакцины, (2) субъединичные вакцины, (3) белковые вакцины, (4) пептидные вакцины или (5) вакцины на основе нуклеиновых кислот (например вакцины на основе ДНК, вакцины на основе РНК, вакцины на основе плазмид или вакцины на основе вирусных векторов).
VBIR рака по настоящему изобретению могут быть применимыми для любого типа рака. Примеры конкретных раковых заболеваний включают: мелкоклеточный рак легких, немелкоклеточный рак легких, глиому, рак желудка, рак желудочно-кишечного тракта, рак почки, рак яичника, рак печени, колоректальный рак, рак эндометрия, рак почек, рак предстательной железы, рак щитовидной железы, нейробластому, рак поджелудочной железы, мультиформную глиобластому, рак шейки матки, рак мочевого пузыря, рак молочной железы и рак головы и шеи.
Вакцины, предназначенные для лечения раковых заболеваний, как правило, содержат антиген (в форме пептида, белка, компонента клетки, целой клетки или молекулы нуклеиновой кислоты, кодирующей пептидный антиген), который способен вызывать иммунный ответ против определенного ТАА (опухолеспецифического антигена), экспрессированного на клетке или клетками целевой опухоли. Многие ТАА известны в данной области. Примеры известных ТАА включают: PSA, PSCA и PSMA для рака предстательной железы; СЕА, MUC-1, Ер-САМ, 5Т4, hCG-b, K-ras и TERT для колоректального рака; СЕА, Muc-1, р53, мезотелин, сурвивин и NY-ESO-1 для рака яичника; Muc-1, 5Т4, WT-1, TERT, СЕА, EGF-R и MAGE-А3 для немелкоклеточного рака легких; 5Т4 для почечно-клеточной карциномы; и Muc-1, мезотелин, K-Ras, аннексии А2, TERT и СЕА для рака поджелудочной железы. В некоторых конкретных воплощениях вакцина, используемая в VBIR рака по настоящему изобретению, выбрана из группы, состоящей из:
(1) вакцины, способной вызывать иммунный ответ против ТАА, выбранного из PSA, PSCA, PSMA, СЕА, MUC-1, TERT, мезотелина, EGF-R или MAGE-A3;
(2) вакцины, содержащей пептидный антиген, происходящий из ТАА, выбранного из PSA, PSCA, PSMA, СЕА, MUC-1, TERT, мезотелина, EGF-R или MAGE-А3; и
(3) вакцины, содержащей молекулу нуклеиновой кислоты, которая кодирует пептидный антиген, где пептидный антиген происходит из ТАА, выбранного из PSA, PSCA, PSMA, СЕА, MUC-1, TERT, мезотелина, EGF-R или MAGE-А3.
В других конкретных воплощениях вакцина содержит молекулу нуклеиновой кислоты, которая кодирует один или более иммуногенных полипептидов, происходящих из PSA, один или более иммуногенных полипептидов, происходящих из PSCA или один или более иммуногенных полипептидов, происходящих из PSMA.
В конкретном воплощении молекула нуклеиновой кислоты выбрана из группы, состоящей из:
(1) молекулы нуклеиновой кислоты, кодирующей иммуногенный полипептид, происходящий из человеческого PSMA, имеющего SEQ ID NO: 42;
(2) молекулы нуклеиновой кислоты, кодирующей иммуногенный полипептид, содержащий аминокислоты 15-750 из SEQ ID NO: 42;
(3) молекулы нуклеиновой кислоты, содержащей нуклеотидную последовательность SEQ ID NO: 43 или ее вырожденный вариант;
(4) молекулы нуклеиновой кислоты, содержащей нуклеотидную последовательность SEQ ID NO: 44 или ее вырожденный вариант;
(5) молекулы нуклеиновой кислоты, содержащей нуклеотидную последовательность из SEQ ID NO: 45 или ее вырожденный вариант;
(6) молекулы нуклеиновой кислоты, содержащей нуклеотидную последовательность SEQ ID NO: 46 или ее вырожденный вариант;
(7) молекулы нуклеиновой кислоты, кодирующей иммуногенный полипептид, происходящий из человеческого PSA, имеющего SEQ ID NO: 47;
(8) молекулы нуклеиновой кислоты, кодирующей иммуногенный полипептид, содержащий аминокислоты 25-261 из SEQ ID NO: 47;
(9) молекулы нуклеиновой кислоты, кодирующей иммуногенный полипептид, происходящий из человеческого PSCA, имеющего SEQ ID NO: 48;
(10) молекулы нуклеиновой кислоты, кодирующей (1) иммуногенный полипептид, происходящий из человеческого PSMA, имеющего SEQ ID NO: 42, (2) иммуногенный полипептид, полученный из человеческого PSA, имеющего SEQ ID NO: 47, и (3) иммуногенный полипептид, полученный из человеческого PSCA, имеющего SEQ ID NO: 48; и
(11) молекулы нуклеиновой кислоты, кодирующей (1) иммуногенный полипептид, содержащий аминокислоты 15-750 из SEQ ID NO: 42, (2) иммуногенный полипептид, содержащий аминокислоты 25-261 из SEQ ID NO: 47, и (3) иммуногенный полипептид, имеющий SEQ ID NO: 48.
Молекулы нуклеиновой кислоты, которые кодируют один или более иммуногенных полипептидов, происходящих из простат-ассоциированных антигенов, могут находиться в форме плазмид или векторов. Примером такой плазмиды является нуклеиновокислотная конструкция, имеющая SEQ ID NO: 46 (также упоминаемая как Плазмида 458). Нуклеотидная последовательность вектора, который экспрессирует иммуногенный полипептид, происходящий из человеческого PSMA, представлена в SEQ ID NO: 44 (также упоминается как вектор AdC68W). Нуклеотидная последовательность вектора, который экспрессирует иммуногенный полипептид, происходящий из человеческого PSMA, иммуногенный полипептид, происходящий из человеческого PSA и иммуногенный полипептид, происходящий из человеческого PSCA, представлена в SEQ ID NO: 45 и вектор человеческого PSMA (вектор AdC68W-734). Различные иммуногенные полипептиды, происходящие из человеческого PSMA, PSA и PSCA, нуклеиновокислотные конструкции (включая плазмиды и векторы), кодирующие такие иммуногенные полипептиды, и способы получения иммуногенных полипептидов и нуклеиновокислотных конструкций, включающих плазмиду 458 и вектор AdC68W и AdC68W-734 раскрыты в международных публикациях заявок WO 2013/164754 и WO 2015/063647, каждая из которых включена в настоящее описание во всей своей полноте посредством ссылки.
В одном аспекте в изобретении предлагается выделенное антагонистическое антитело, которое специфически связывается с PD-1, где антитело содержит вариабельную область тяжелой цепи (VH), содержащий VH участок, определяющий комплементарность, один (CDR1), VH CDR2 и VH CDR3 из VH, имеющие аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 3, SEQ ID NO: 4; SEQ ID NO: 5; и SEQ ID NO: 6; и вариабельный участок легкой цепи (VL), содержащий VL CDR1, VL CDR2 и VL CDR3 из VL, имеющие аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2; SEQ ID NO: 7; SEQ ID NO: 8; и SEQ ID NO: 9.
Любые антагонистические антитела к PD-1, раскрытые в настоящем описании, можно использовать в VBIR рака. В некоторых воплощениях антагонистическое антитело к PD-1 содержит участок VH и/или участок VL, где участок VH содержит аминокислотную последовательность, представленную в SEQ ID NO: 3, 4, 5 или 6, или вариант с одной или несколькими консервативными аминокислотными заменами остатков, которые не находятся в CDR, и где область VL содержит аминокислотную последовательность, представленную в SEQ ID NO: 2, 7, 8 или 9, или ее вариант с одной или несколькими аминокислотными заменами аминокислот, которые не находятся в CDR. В некоторых воплощениях антитело содержит легкую цепь, содержащую последовательность, представленную в SEQ ID NO: 39, и/или тяжелую цепь, содержащую последовательность, представленную в SEQ ID NO: 29 или 38. В некоторых конкретных воплощениях антитело содержит участок VH, продуцируемый экспрессионным вектором с регистрационным номером АТСС РТА-121183. В некоторых воплощениях, антитело содержит участок VL, продуцируемый экспрессионным вектором регистрационным номером АТСС РТА-121182.
VBIR рака по настоящему изобретению может дополнительно содержать один или более других иммуномодуляторов (в дополнение к PD-1 антагонистическому антителу по настоящему изобретению). Другие иммуномодуляторы могут представлять собой энхансер иммуноэффекторной клетки ("IEC-энхансер") или ингибитор иммуносупрессивной клетки ("ISC-ингибитор"). Дополнительный IEC-энхансер или дополнительный ISC-ингибитор можно использовать по отдельности в комбинации с VBIR рака. Дополнительный IEC-энхансер и дополнительный ISC-ингибитор также можно использовать вместе в комбинации с VBIR рака.
Примеры классов ингибиторов ISC включают ингибиторы протеинкиназ, ингибиторы циклооксигеназы-2 (СОХ-2), ингибиторы фосфодиэстеразы типа 5 (PDE5) и ДНК-сшивающие агенты. Примеры ингибиторов СОХ-2 включают целекоксиб и рофекоксиб. Примеры ингибиторов PDE5 включают аванафил, лоденафил, мироденафил, силденафил, тадалафил, варденафил, уденафил и запринаст. Примером ДНК-сшивающих агентов является циклофосфамид. Термин "ингибитор протеинкиназы" относится к любому веществу, которое действует как селективный или неселективный ингибитор протеинкиназы. Примеры конкретных ингибиторов протеинкиназ, подходящих для применения в VBIR рака, включают лапатиниб, AZD 2171, ЕТ18OСН 3, индирубин-3'-оксим, NSC-154020, PD 169316, кверцетин, росковитин, трицирибин, ZD 1839, 5-йодотуберцидин, адафостин, алоизин, альстерпауллон, аминогенистеин, API-2, апигенин, арктигенин, ARRY-334543, акситиниб (AG-013736), AY-22989, AZD 2171, бисиндолилмалеимид IX, CCI-779, челеритрин, DMPQ, DRB, эдельфозин, ENMD-981693, аналог эрбстатина, эрлотиниб, фасудил, гефитиниб (ZD1839), Н-7, Н-8, Н-89, НА-100, НА-1004, НА-1077, НА-1100, гидроксифасудил, кенпауллон, KN-62, KY12420, LFM-A13, лютеолин, LY294002, LY-294002, маллотоксин, ML-9, MLN608, NSC-226080, NSC-231634, NSC-664704, NSC-680410, NU6102, оломоуцин, оксиндол I, PD 153035, PD 98059, флоридзин, пицеатаннол, пикроподофиллин, PKI, РР1, РР2, PTK787/ZK222584, PTK787/ZK-222584, пурваланол А, рапамун, рапамицин, Ro 31-8220, роттлерин, SB202190, SB203580, сиролимус, SL327, SP600125, стауроспорин, STI-571, SU1498, SU4312, SU5416, SU5416 (семаксантиб), SU6656, SU6668, ингибитор syk, ТВВ, TCN, тирфостин AG 1024, тирфостин AG 490, тирфостин AG 825, тирфостин AG 957, U0126, W-7, вортманнин, Y-27632, зактима (ZD6474), ZM 252868. гефитиниб (Iressa.RTM.), сунитиниба малат (SUTENT; SU11248), эрлотиниб (Tarceva.RTM.; OSI-1774), лапатиниб (GW572016; GW2016), канертиниб (CI 1033), семаксиниб (SU5416), ваталаниб (PTK787 / ZK222584), сорафениб (BAY 43-9006), иматиниб (Gleevec.RTM.; STI571), дасатиниб (BMS-354825), лефлуномид (SU101), вандетаниб (ZACTIMA; ZD6474) и нилотиниб.
В некоторых конкретных воплощениях ингибитор тирозинкиназы представляет собой сунитиниба малат, сорафениба тозилат или акситиниб. Сунитиниба малат, который продается компанией Pfizer Inc. под товарным знаком SUTENT, описывается химически, как бутандиовая кислота, гидрокси-, (2S)-, соединение с N-[2-(диэтиламино)этил]-5-[(Z)-(5-фтор-1,2-дигидро-2-оксо-3Н-индол-3-илидин)метил]-2,4-диметил-1H-пиррол-3-карбоксамидом (1:1). Это соединение, его синтез и конкретные полиморфы описаны в патенте US 6573293. Сунитиниба малат одобрен в США для лечения желудочно-кишечной стромальной опухоли, запущенной почечно-клеточной карциномы и прогрессирующих, хорошо дифференцированных панкреатических нейроэндокринных опухолей у пациентов с неоперабельным, местнораспространенным раком или метастатическим заболеванием. Рекомендуемая доза сунитиниба малата для желудочно-кишечной стромальной опухоли (GIST) и запущенной почечно-клеточной карциномы (RCC) для людей составляет 50 мг, принимаемых перорально один раз в сутки в течение 4 недель лечения с последующими 2-недельным перерывом (режим введения 4/2). Рекомендуемая доза сунитиниба малата для панкреатических нейроэндокринных опухолей составляет 37,5 мг, принимаемых перорально один раз в сутки. В VBIR рака сунитиниба малат можно вводить перорально в однократной дозе или в виде нескольких доз. Как правило, сунитиниба малат вводят в виде двух, трех, четырех или более последовательных недельных доз с последующим периодом перерыва, составляющим примерно 1, или 2 недели, или более, без введения сунитиниба малата. В одном воплощении дозы вводят в течение примерно 4 недель, с 2-недельным перерывом. Эффективное количество сунитиниба малата, вводимое перорально человеку, как правило, составляет менее 40 мг на человека в сутки, например 37,5, 31,25, 25, 18,75, 12,5 или 6,25 мг на человека в сутки. В некоторых воплощениях сунитиниба малат вводят перорально в диапазоне 1-25 мг на человека в сутки. В некоторых других воплощениях, сунитиниба малат вводят перорально в диапазоне 6,25, 12,5 или 18,75 мг на человека на дозу. Можно предвидеть другие режимы дозирования и варианты, которые определяет будут определены согласно руководству для врачей.
Сорафениба толизат, который продается под товарным знаком NEXAVAR, имеет химическое название 4-(4-{3-[4-хлор-3-(трифторметил)фенил]уреидо}фенокси)-N-метилпиридин-ин-2-карбоксамид. Он одобрен в США для лечения первичного рака почек (запущенной почечно-клеточной карциномы) и запущенного первичного рака печени (гепатоцеллюлярная карцинома). Рекомендуемая суточная доза составляет 400 мг перорально два раза в сутки. В VBIR рака по настоящему изобретению эффективное количество сорафениба толизата, вводимое перорально, обычно составляет менее 400 мг на человека в сутки. В некоторых воплощениях эффективное количество сорафениба толизата, вводимое перорально, находится в диапазоне 10-300 мг на человека в сутки. В некоторых других воплощениях эффективное количество сорафениба толизата, вводимое перорально, находится в диапазоне 10-200 мг на человека в сутки, например 10, 20, 60, 80, 100, 120, 140, 160, 180 или 200 мг на человека в сутки.
Акситиниб, который продается под товарным знаком INLYTA, имеет химическое название (N-метил-2-[3-((Е)-2-пиридин-2-ил-винил)-1Н-индазол-6-илсульфанил]бензамид. Он одобрен для лечения запущенной почечно-клеточной карциномы после неудачи предшествующего системного лечения. Начальная доза составляет 5 мг перорально два раза в сутки. Подбор дозы может быть сделан на основе индивидуальной безопасности и переносимости. В VBIR рака по настоящему изобретению эффективное количество акситиниба, вводимое перорально обычно составляет менее 5 мг два раза в сутки. В некоторых других воплощениях эффективное количество акситиниба, вводимое перорально, находится в диапазоне 1-5 мг два раза в сутки. В некоторых других воплощениях эффективное количество акситиниба, вводимое перорально, находится в пределах 1, 2, 3, 4 или 5 мг два раза в сутки.
Примеры IEC-энхансеров, которые можно использовать в VBIR рака по настоящему изобретению, включают агонистов TNFR, антагонистов CTLA-4, агонистов TLR, других антагонистов PD-1 (таких как BMS-936558 и анти-PD-1 антитело СТ-011), антагонистов лиганда 1 белка 1 программируемой клеточной гибели (PD-L1) (например BMS-936559), антагонистов гена активации лимфоцитов 3 (LAG3) и антагонистов Т-клеточный иммуноглобулин- и муциновый домен-содержащей молекулы-3 (TIM-3). Примеры агонистов TNFR включают агонистов ОХ40, 4-1ВВ (такой как BMS-663513), GITR (такой как TRX518) и CD40. Примеры конкретных агонистов CD40 подробно описаны в данном описании изобретения ниже.
В некоторых других воплощениях дополнительный иммуномодулятор представляет собой агонистическое антитело к CD40. Антитело может быть человеческим, гуманизированным или частично человеческим химерным антителом к CD40. Примеры специфических моноклональных антител к CD40 включают моноклональное антитело G28-5, mAb89, ЕА-5 или S2C6, и СР870893. В конкретном воплощении агонистическое антитело к CD40 представляет собой СР870893 или дацетузумаб (SGN-40).
СР-870,893 представляет собой полностью человеческое моноклональное агонистическое антитело к CD40, которое было исследовано клинически в качестве противоопухолевой терапии. Структура и получение СР870,893 раскрыты в WO 2003040170, где антитело СР870,893 обозначено как антитело "21.4.1". Аминокислотные последовательности тяжелой цепи и легкой цепи СР-870,893 представлены в SEQ ID NO: 46 и SEQ ID NO: 48 соответственно, а также в Таблице 7 в WO 2003040170. В клинических испытаниях СР870,893 вводили посредством внутривенного вливания в дозах, обычно находящихся в диапазоне 0,05-0,25 мг/кг на инфузию. В VBIR рака по настоящему изобретению СР-870,893 можно вводить внутрикожно, подкожно или местно. Эффективное количество СР870893 для введения в этой схеме обычно составляет менее 0,2 мг/кг, обычно в диапазоне 0,01 мг - 0,15 мг/кг или 0,05-0,1 мг/кг.
Дацетузумаб (также известный как SGN-40 или huS2C6; CAS номер 88-486-59-9) представляет собой еще одно агонистическое антитело к CD40, которое было исследовано в клинических испытаниях в отношении медленно растущей лимфомы, диффузной В-крупноклеточной лимфомы и множественной миеломы. В VBIR рака по настоящему изобретению дацетузумаб можно вводить внутрикожно, подкожно или местно. Эффективное количество вводимого дацетузумаб обычно составляет менее 16 мг/кг, обычно в диапазоне 0,2 мг - 14 мг/кг, или 0,5-8 мг/кг, или 1-5 мг/кг.
В других воплощениях дополнительный иммуномодулятор представляет собой анти-CTLA-4 антагониста. Примеры подходящих анти-CTLA-4 антагонистов включают анти-CTLA-4 антитела (такие как человеческие анти-CTLA-4 антитела, мышиные анти-CTLA-4 антитела, анти-CTLA-4 антитела млекопитающих, гуманизированные анти-CTLA-4 антитела, моноклональные анти-CTLA-4 антитела, поликлональные анти-CTLA-4 антитела, химерные анти-CTLA-4 антитела, доменные анти-CTLA-4 антитела) и ингибиторы CTLA-4, которые выступают в роли агонита ко-стимулирующего пути. В некоторых воплощениях ингибитор CTLA-4 представляет собой ипилимумаб или тремелимумаб.
Ипилимумаб (продающийся под названием YERVOY; также известный, как МЕХ-010, MDX-101 или под его CAS номером 477202-00-9) раскрыт, как антитело 10DI в публикации РСТ WO 01/14424, включенной в настоящее описание посредством ссылки во всей ее полноте и для всех целей. Примеры фармацевтических композиций, содержащих ипилимумаб, представлены в публикации РСТ WO 2007/67959. Ипилимумаб одобрен в США для лечения неоперабельной или метастатической меланомы. В способах по настоящему изобретению ипилимумаб можно вводить внутрикожно или подкожно. Эффективное количество ипилимумаба, вводимого местно, обычно находится в диапазоне 5-200 мг/доза на субъекта. В некоторых воплощениях эффективное количество ипилимумаба находится в диапазоне 10-150 мг/доза на субъекта. В некоторых конкретных воплощениях эффективное количество ипилимумаба составляет примерно 10, 25, 50, 75, 100, 125, 150, 175 или 200 мг/доза на субъекта.
Тремелимумаб (также известный как СР-675,206) представляет собой полностью человеческое моноклональное антитело изотипа IgG2 и имеет CAS номер 745013-59-6. Тремелимумаб раскрыт как антитело 11.2.1 в патенте US 6682736, включенном в настоящее описание посредством ссылки во всей его полноте и для всех целей. В VBIR рака по настоящему изобретению тремелимумаб может быть введен внутривенно, внутрикожно или подкожно. Эффективное количество тремелимумаба, введенное внутрикожно или подкожно, находится обычно в диапазоне 5-200 мг/доза на субъекта. В некоторых воплощениях эффективное количество тремелимумаба находится в диапазоне 10-150 мг/доза на субъекта на дозу. В некоторых конкретных воплощениях эффективное количество тремелимумаба составляет примерно 10, 25, 50, 75, 100, 125, 150, 175 или 200 мг/доза на субъекта.
В других воплощениях дополнительный иммуномодулятор представляет собой агонист Toll-подобного рецептора (TLR). Термин "агонист toll-подобного рецептора" или "TLR-агонист" относится к соединению, которое действует как агонист toll-подобного рецептора (TLR). Сюда входят агонисты TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10 и TLR11 или их комбинация.
TLR-агонисты, используемые в способе по настоящему изобретению, включают как небольшие органические молекулы, так и большие биологические молекулы. Примеры TLR-агонистов с небольшими молекулами включают 4-амино-альфа, альфа,2-триметил-IH-имидазо[4,5-с]хинолин-I-этанол, N-(2-{2-[4-амино-2-(2-метоксиэтил)-IH-имидазо[4,5-с]хинолин-I-ил]этокси-}этил)-N-метилморфолин-4-карбоксамид, I~(2~амино-2-метилпропил)-2-(этоксиметил-)-IH-имидазо[4,5-с]хинолин-4-амин, N-[4-(4-амино-2-этил-IH-имидазо[4,5-с]хинолин-I-ил)бутил]метансульфонамид, N-[4-(4-амино-2-пропил-IH-имидазо[4,5-с]хинолин-I-ил)бутил]метансульфонамид и имиквимод. Некоторые TLR-агонисты, особенно полезные в способах или схеме лечения по настоящему изобретению, описаны в обзорной статье: Folkert Steinhagen, et al.: TLR-based immune adjuvants. Vaccine 29 (2011): 3341-3355. В некоторых воплощениях TLR-агонисты представляют собой TLR9-агонисты, в частности CpG-олигонуклеотиды (или CpG.ODN). CpG-олигонуклеотид представляет собой короткую молекулу нуклеиновой кислоты, содержащую цитозин, за которым следует гуанин, присоединенный фосфатной связью, где пиримидиновое кольцо цитозина неметилировано. Примеры конкретных CpG-олигонуклеотидов, используемых в способах по настоящему изобретению, включают:
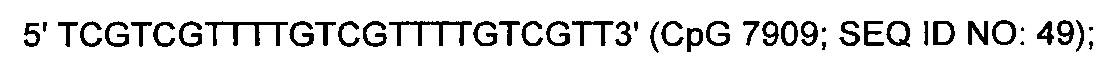
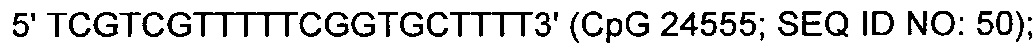 и
и

CpG7909, синтетический 24-мерный одноцепочечный олигонуклеотид, был широко исследован в отношении лечения рака как в виде монотерапии, так и в комбинации с химиотерапевтическими агентами, а также в качестве адъюванта для вакцин против рака и инфекционных заболеваний. В способах по настоящему изобретению CpG7909 может быть введен посредством инъекции в мышцу или любыми другими подходящими способами. Для применения с вакциной на основе нуклеиновой кислоты, такой как ДНК-вакцина, CpG может быть приготовлен вместе с вакциной в одной композиции и введен посредством внутримышечной инъекции в сочетании с электропорацией. Эффективное количество CpG7909 при внутримышечном, внутрикожном и подкожном введении обычно находится в диапазоне 10 мкг/доза - 10 мг/доза. В некоторых воплощениях эффективное количество CpG7909 находится в диапазоне 0,05 мг - 14 мг/доза. В некоторых конкретных воплощениях эффективное количество CpG7909 составляет примерно 0,05, 0,1, 0,2, 0,3, 0,4, 0,5, 1 мг/доза. Другие CpG-олигонуклеотиды, включающие CpG 24555 и CpG 10103, могут быть введены аналогичным образом и с аналогичными уровнями дозировок.
В VBIR рака анти-PD-1 антагонист, вакцина и дополнительные иммуномодуляторы могут быть введены одновременно или последовательно. В некоторых воплощениях вакцину вводят последовательно по отношению к антагонистическому антителу против PD-1, но одновременно (например в смеси) по отношению к одному или более дополнительным иммуномодуляторам. В случаях, когда нуклеиновокислотную вакцину вводят в комбинации с CpG, вакцина и CpG могут находиться в одной композиции и быть введены вместе любым подходящим способом. В некоторых воплощениях нуклеиновокислотную вакцину и CpG в совместной композиции (смеси) вводят посредством внутримышечной инъекции в сочетании с электропорацией.
Композиции
Терапевтические композиции антагонистического антитела к PD-1 по настоящему изобретению готовят для хранения путем смешивания антитела, имеющего нужную степень чистоты, с дополнительными фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами (Remington, The Science and Practice of Pharmacy 20th Ed. Mack Publishing, 2000) в форме лиофилизированных композиций или водных растворов. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в используемых дозировках и концентрациях и могут содержать буферы, такие как фосфатный, цитратный и другие органические кислоты; соли, такие как хлорид натрия; антиоксиданты, включающие аскорбиновую кислоту и метионин; консерванты (например октадецилдиметилбензиламмония хлорид; гексаметония хлорид; бензалкония хлорид, бензетония хлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехин; резорцин; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (менее чем примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включающие глюкозу, маннозу или декстрины; хелатирующие агенты такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например Zn-белковые комплексы); и/или неионные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (PEG).
Липосомы, содержащие антагонистическое антитело к PD-1, получают способами, известными в данной области, такими как описаны в Epstein, et al., Proc. Natl. Acad. Sci. USA 82:3688 (1985); Hwang, et al., Proc. Natl Acad. Sci. USA 77:4030 (1980); и патентах US 4485045 и 4544545. Липосомы с увеличенным временем циркуляции раскрыты в патенте US 5013556. Особенно подходящие липосомы могут быть получены посредством метода обращенно-фазового выпаривания с липидной композицией, содержащей фосфатидилхолин, холестерин и PEG-дериватизированный фосфатидилэтаноламин (PEG-PE). Липосомы экструдируют через фильтры с определенным размером пор с получением липосом с нужным диаметром.
Активные ингредиенты также могут быть инкапсулированы в микрокапсулы, полученные, например, посредством методов коацервации или межфазной полимеризации, например в гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли(метилметакрилат)ные микрокапсулы соответственно, в коллоидных системах доставки лекарственных средств (например в липосомах, альбуминовых микросферах, микроэмульсиях, наночастицах и нанокапсулах) или в макроэмульсиях. Такие методы раскрыты в Remington, The Science and Practice of Pharmacy 20th Ed. Mack Publishing (2000).
Могут быть приготовлены препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антитело, причем матрицы находятся в форме формованных изделий, например пленок или микрокапсул. Примеры матриц с замедленным высвобождением включают полиэфиры, гидрогели (например поли(2-гидроксиэтилметакрилат) или поливиниловый спирт), полилактиды (патент US 3773919), сополимеры L-глутаминовой кислоты и 7-этил-L-глутамата, неразлагаемый этилен-винилацетат, разлагаемые сополимеры молочной и гликолевой кислот, такие как LUPRON DEPOT™ (инъецируемые микросферы, состоящие из сополимера молочной и гликолевой кислот и ацетата леупролида), сахарозы ацетата изобутират и поли-D-(-)-3-гидроксимасляную кислоту.
Композиции для применения для введения in vivo должны быть стерильными. Это легко достигается, например, посредством фильтрования через стерильные фильтрационные мембраны. Терапевтические композиции антагонистического антитела к PD-1 обычно помещают в контейнер, имеющий стерильный доступ через порт, например мешок с раствором для внутривенного введения или флакон с пробкой, прокалываемой при помощи подкожной инъекционной иглы.
Композиции по настоящему изобретению могут находиться в стандартных лекарственных формах, таких как таблетки, пилюли, капсулы, порошки, гранулы, растворы или суспензии, или суппозитории, для перорального, парентерального или ректального введения или введения посредством ингаляции или инсуффляции.
Для приготовления твердых композиций, таких как таблетки, основной активный ингредиент смешивают с фармацевтическим носителем, например с обычными таблетирующими ингредиентами, такими как кукурузный крахмал, лактоза, сахароза, сорбит, тальк, стеариновая кислота, стеарат магния, дикальцийфосфат или камеди, и с другими фармацевтическими разбавителями, например с водой, с образованием предварительной твердой композиции, содержащей гомогенную смесь соединения по настоящему изобретению или его нетоксичной фармацевтически приемлемой соли, при указании на эти предварительные композиции как на гомогенные подразумевается, что активный ингредиент равномерно распределен в композиции, так композицию можно легко разделить на одинаково эффективные стандартные лекарственные формы, такие как таблетки, пилюли и капсулы. Эту твердую предварительную композицию затем разделяют на стандартные лекарственные формы описанного выше типа, содержащие от примерно 0,1 до примерно 500 мг активного ингредиента по настоящему изобретению. Таблетки или пилюли из новой композиции могут быть покрыты оболочкой или смешаны иным образом для обеспечения лекарственной формы, обеспечивающей преимущества пролонгированного действия. Например, таблетка или пилюля может содержать внутренний дозированный компонент и внешний дозированный компонент, где последний находится в форме оболочки поверх первого. Эти два компонента могут быть разделены энтеросолюбильным слоем, который служит для противодействия распадению в желудке и позволяет внутреннему компоненту проходить без изменений в двенадцатиперстную кишку или задерживать его высвобождение. Для таких энтеросолюбильных слоев или покрытий можно использовать различные вещества, включающие ряд полимерных кислот и смеси полимерных кислот с такими веществами как шеллак, цетиловый спирт и ацетат целлюлозы.
Подходящие поверхностно-активные агенты включают, в частности, неионные агенты, такие как полиоксиэтиленсорбитаны (например Tween™ 20, 40, 60, 80 или 85) и другие сорбитаны (например Span™ 20, 40, 60, 80 или 85). Композиции с поверхностно-активным агентом обычно содержат от 0,05 до 5% поверхностно-активного агента и могут содержать от 0,1 до 2,5%. Следует понимать, что могут быть добавлены другие ингредиенты, например маннит, или другие фармацевтически приемлемые наполнители, если это необходимо.
Подходящие эмульсии могут быть получены с использованием имеющихся в продаже жировых эмульсий, таких как Intralipid™, Liposyn™, Infonutrol™, Lipofundin™ и Lipiphysan™. Активный ингредиент может быть либо растворен в предварительно смешанной эмульсионной композиции, либо в качестве альтернативы, он может быть растворен в масле (например в соевом масле, сафлоровом масле, хлопковом масле, кунжутном масле, кукурузном масле или миндальном масле) и эмульсии, образованной при смешивании с фосфолипидом (например с яичными фосфолипидами, соевыми фосфолипидами или соевым лецитином) и водой. Следует понимать, что могут быть добавлены другие ингредиенты, например глицерин или глюкоза, для регулирования тоничности эмульсии. Подходящие эмульсии обычно содержат до 20% масла, например от 5 до 20%. Жировая эмульсия может содержать капли жира от 0,1 до 1,0 мкм, в частности от 0,1 до 0,5 мкм, и иметь рН от 5,5 до 8,0.
Эмульсионные композиции могут быть получены путем смешивания антагонистического антитела к PD-1 с Intralipid™ или его компонентами (соевое масло, яичные фосфолипиды, глицерин и вода).
Композиции для ингаляции или инсуффляции включают растворы и суспензии в фармацевтически приемлемых, водных или органических растворителях или их смесях, и порошки. Жидкие или твердые композиции могут содержать подходящие фармацевтически приемлемые эксципиенты, как указано выше. В некоторых воплощениях композиции вводят посредством перорального или назального дыхательного пути для местного или системного эффекта. Композиции в предпочтительно стерильных фармацевтически приемлемых растворителях могут быть распылены с использованием газов. Распыленные растворы можно вдыхать непосредственно из распыляющего устройства или распыляющее устройство может быть прикреплено к маске для лица, палатке или дыхательному аппарату с перемежающимся положительным давлением. Раствор, суспензию или порошкообразные композиции можно вводить, предпочтительно перорально или назально, из устройств, которые доставляют препарат соответствующим образом.
Наборы
В изобретении также предложены наборы, содержащие любое из описанных здесь антител или все описанные здесь антитела. Наборы по изобретению включают один или более контейнеров, содержащих антагонистическое антитело к PD-1, описанное здесь, и инструкции для применения в соответствии с любым из способов по изобретению, описанных здесь. Как правило, эти инструкции содержат описание введения антагонистического антитела к PD-1 для вышеописанной терапии. В некоторых воплощениях предложены наборы для получения дозы для однократного введения. В некоторых воплощениях набор может включать и первый контейнер, содержащий высушенный белок, и второй контейнер с водной композицией. В некоторые воплощения включены наборы, содержащие одно- и многокамерные предварительно заполненные шприцы (например шприцы с жидкостью и шприцы с лиофилизатом).
В некоторых воплощениях антитело представляет собой человеческое антитело. В некоторых воплощениях антитело представляет собой гуманизированное антитело. В некоторых воплощениях, антитело представляет собой моноклональное антитело. Инструкции, касающиеся применения антитела к PD-1 обычно включают информацию о дозе, схеме приема препарата и пути введения препарата для предполагаемого лечения. Контейнеры могут представлять собой однократные дозы, нефасованные упаковки (например многодозовые упаковки) или субъединичные дозы. Инструкции, представленные в наборах по изобретению, обычно представляют собой письменные инструкции на этикетке или упаковке (например лист бумаги, включенный в набор), но также приемлемыми являются машиночитаемые инструкции (например инструкции, нанесенные на магнитный или оптический диск запоминающего устройства).
Наборы по настоящему изобретению находятся в подходящей упаковке. Подходящая упаковка включает, без ограничения ими, флаконы, бутылки, банки, гибкую упаковку (например герметичные майларовые или пластмассовые пакеты) и тому подобное. Также рассматриваются пакеты для использования в комбинации с конкретным устройством, таким как ингалятор, устройство для введения в нос (например распылитель) или инфузионное устройство, такое как мини-насос. Набор может иметь стерильный порт доступа (например, контейнер может представлять собой пакет с внутривенным раствором или флакон, имеющий пробку, прокалываемую иглой для подкожной инъекции). Контейнер может также иметь стерильный порт доступа (например, контейнер может представлять собой пакет с внутривенным раствором или флакон, имеющий пробку, прокалываемую иглой для подкожной инъекции). По меньшей мере один активный агент в композиции представляет собой антитело к PD-1. Контейнер может дополнительно содержать второй фармацевтически активный агент.
Наборы при необходимости могут предоставлять дополнительные компоненты, такие как буферы, и пояснительную информацию. Обычно набор содержит контейнер и этикетку или вкладыш(и) в упаковку на контейнере или связанную с контейнером.
Биологический депозит
Репрезентативные материалы по настоящему изобретению были депонированы в Американской коллекции типовых культур, 10801 University Boulevard, Manassas, Va. 20110-2209, USA, 29 апреля 2014 года. Вектор msb7-LC с регистрационным номером АТСС РТА-121182 представляет собой полинуклеотид, кодирующий вариабельный участок легкой цепи mAb7, а вектор mab7-HC с регистрационным номером АТСС РТА-121183 представляет собой полинуклеотид, кодирующий вариабельный участок тяжелой цепи mAb7. Депозиты были сделаны в соответствии с положениями Будапештского договора о международном признании депонирования микроорганизмов для целей патентной процедуры и положений по нему (Будапештский договор). Это обеспечивает поддержание жизнеспособной культуры депозита в течение 30 лет с даты депонирования. Депозит будет сделан АТСС доступным в соответствии с положениями Будапештского договора и с учетом соглашения между Pfizer, Inc. и АТСС, что гарантирует постоянную и неограниченную доступность потомства культуры депозита общественности после выдачи соответствующего патента США или после выкладки для публики любой патентной заявки США или иностранной патентной заявки, в зависимости от того, что выложено раньше, и обеспечивает доступность потомства любому, определенному уполномоченным по патентам и товарным знакам США, как имеющим право на это в соответствии с 35 U.S.С. § 122 и правилами для уполномоченного в соответствии с этим (в том числе 37 C.F.R. § 1.14 и особенно 886 OG 638).
Патентообладатель настоящей заявки согласен с тем, что в случае гибели, потери или уничтожения материалов депонированной культуры при культивировании в подходящих условиях, эти материалы будут незамедлительно заменены с уведомлением об этом другого. Доступность депонированного материала не должна истолковываться как лицензия на практическое использование изобретения в нарушение прав, предоставляемых полномочным органом любого правительства в соответствии с его патентным законодательством.
Следующие примеры предложены только для иллюстрации и никоим образом не предназначены для ограничения объема настоящего изобретения. Действительно, различные модификации изобретения в дополнение к тем, которые показаны и описаны здесь, будут очевидными для специалистов в данной области техники из предшествующего описания и подпадают под объем прилагаемой формулы изобретения.
Примеры
Пример 1: Влияние анти-PD-1-антитела на секрецию IFN-γ и TNF
Данный пример иллюстрирует влияние анти-PD-1 антитела на секрецию IFN-γ и TNF в анализе реакции смешанной культуры лимфоцитов (MLR).
Первичные Т-клетки человека, выделенные из цельной крови (банк крови Стэнфордского университета), активировали аллогенными дендритными клетками (DC), экспрессирующими высокие уровни PD-L1 и PD-L2, которые предварительно дифференцировали с использованием IL-4 и GM-CSF из CD14+ миелоидных клеток. В этом исследовании использовали следующие антитела: изотипический контроль (стабилизированный шарнир IgG4-каппа), антагонистическое антитело к PD-1 С1, антагонистическое антитело к PD-1 С2, антагонистическое антитело к PD-1 С3, ЕН12.1 (BD Biosciences антитело мыши к человеческому антителу против PD-1, мышиный изотип IgG1-каппа), mAb7-G4, mAb15-G4, mAb-AAA, mAb15-ААА (G4 = стабилизированный шарнир IgG4; AAA = мутантный IgG1, который не связывается с FcγR). Антитела тестировали в следующих концентрациях: 0, 0,1, 1 или 10 мкг/мл).
Для MLR-анализа культуры инкубировали с тестируемыми или контрольным антителом в 96-луночных планшетах в трех повторах в соотношении 1:10 DС:Т-клетки и инкубировали во влажном инкубаторе при 37°С с 5% CO2. Супернатант собирали на 5-е сутки и определяли цитокины с использованием Cytometric Bead Array (СВА) с использованием набора Human Soluble Protein Flex Set System (BD Biosciences, каталожный номер 558265) в соответствии с протоколом изготовителя со следующими человеческими анализируемыми веществами: IFNγ (BD Biosciences, каталожный номер 558269), TNF (BD Biosciences, каталожный номер 558273). Кратко, 96-луночные фильтр-планшеты (Millipore, каталожный номер MSBVN1250) промывали промывочным буфером (BD Biosciences запатентованная формула) и аспирировали с помощью вакуумного коллектора. Стандарты, предоставленные набором, и образцы разбавляли в разбавителе для анализа (BD Biosciences запатентованная формула) и добавляли к планшетам с захватывающими сферическими гранулами (захватывающие сферические гранулы представляют собой гранулы, покрытые антителами к конкретному растворимому белку с четко выраженной флуоресценцией). Планшеты перемешивали в течение 5 минут при 500 об/мин, используя планшетный шейкер, и инкубировали в течение 1 часа при комнатной температуре. Проявляющий реагент (фикоэритрин (РЕ)-конъюгированные антитела, предоставляемые k) добавляли к планшетам и планшеты перемешивали в течение 5 минут. Планшеты инкубировали в течение 2 часов при комнатной температуре. Затем их промывали промывочным буфером в течение 5 минут и образцы захватывали на платформы BD Fortessa. Данные анализировали с использованием FCAP Array v3 (BD). Результаты MLR-анализа представлены в Таблицах 6А и В ниже. В таблице 6А показаны уровни IFNγ (в пг/мл), а в таблице показаны уровни 6В TNF (в пг/мл). Данные представлены как среднее ±S.Е.М трех биологических повторов. Образцы являются представителями одного эксперимента MLR.

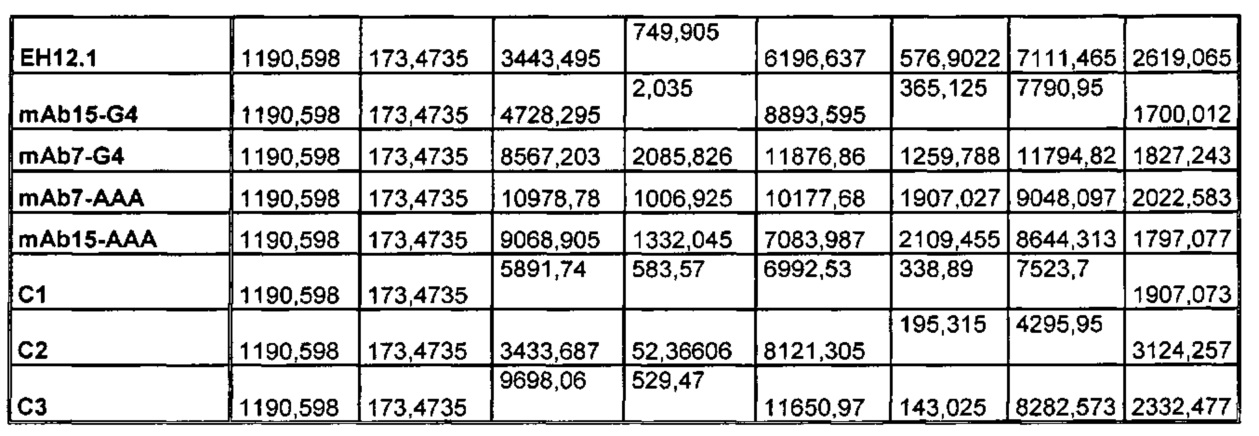
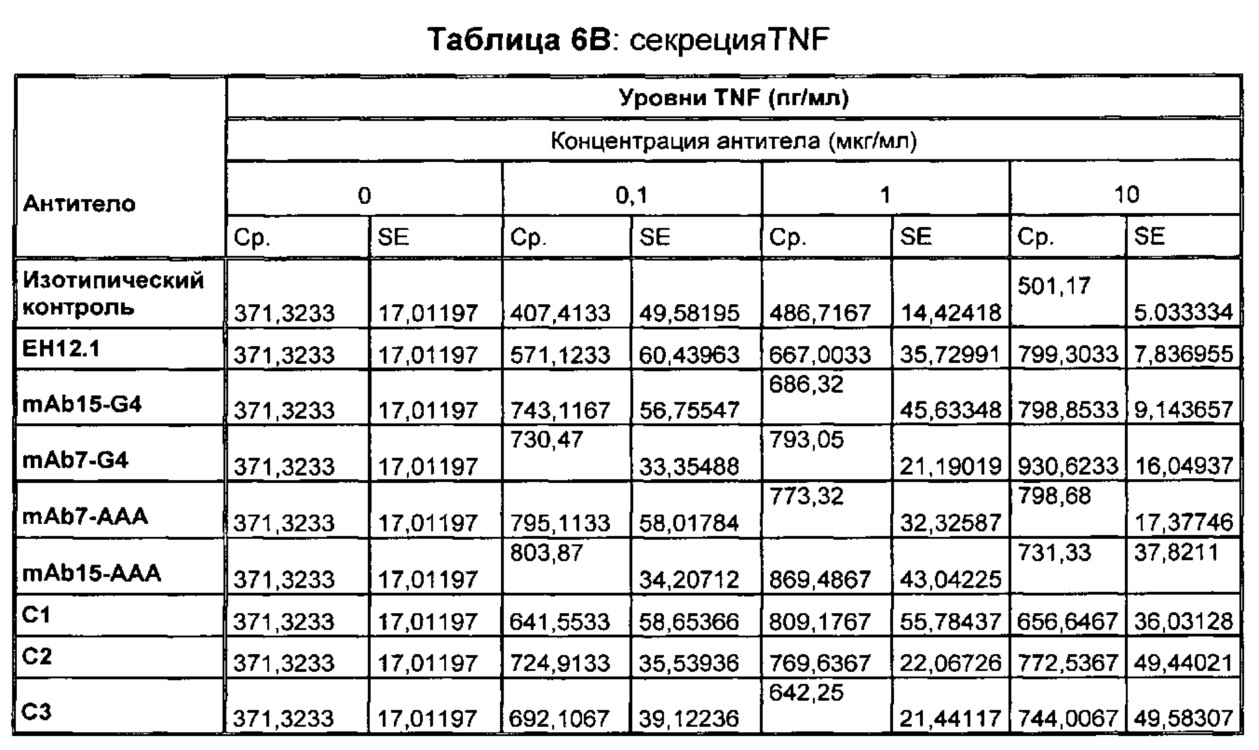
Обработка активированных Т-клеток антагонистическими антителами к PD-1 приводит к увеличению уровней IFNy по сравнению с изотипическим контролем (таблица 6А). Например, обработка 0,1 мкг/мл mAb15-G4 и mAb7-G4 приводит к уровню IFNγ 4728,295±2,035 пг/мл и 8567,203±2085,826 пг/мл соответственно. Обработка 1 мкг/мл mAb15-G4 и mAb7-G4 приводит к уровню IFNγ 8893,595±365,125 пг/мл и 11876,86±1259,788 пг/мл соответственно. Обработка 10 мкг/мл mAb15-G4 и mAb7-G4 приводит к уровню IFNγ 7790,95±1700,012 пг/мл и 11794,82±1827,243 пг/мл соответственно. Напротив, обработка 0,1, 1 или 10 мкг/мл изотипического контроля приводит к уровням IFNγ 3760±367,4262 пг/мл, 3693,972±1033,879 пг/мл и 3525,655±744,676 пг/мл соответственно.
Обработка активированных Т-клеток антагонистическими антителами к PD-1 приводит к повышенным уровням TNF по сравнению с изотипическим контролем (таблица 6В). Например, обработка 0,1 мкг/мл mAb15-G4 или mAb7-G4 приводит к уровню TNF 743,1167±56,75547 пг/мл и 730,47±33,35488 пг/мл соответственно. Обработка 1 мкг/мл mAb15-G4 и mAb7-G4 приводит к уровню TNF 686,32±45,63348 пг/мл и 793,05±21,19019 пг/мл соответственно. Обработка 10 мкг/мл mAb15-G4 или mAb7-G4 приводит к уровню TNF 798,853±9,14366 пг/мл и 930,623±16,0494 пг/мл соответственно. Напротив, обработка 0,1, 1 или 10 мкг/мл изотипического контроля приводит к уровням TNF 407,4133±49,58195 пг/мл, 486,7167±4,4241 пг/мл и 501,17±5,033334 пг/мл соответственно.
Эти результаты показывают, что антитела к PD-1 mAb7 и mAb15 стимулируют секрецию IFNγ и TNF из Т-клеток по меньшей мере такую же или лучше, чем антитела к PD-1 С1, С2 и С3.
Второе исследование MLR проводили для проверки влияния более низких концентраций антител на активацию Т-клеток. Первичные человеческие Т-клетки, выделенные из цельной крови, активировали, как описано выше. Следующие антитела тестировали во втором исследовании: mAb7 (G4), mAb15 (G4), С1 (G4), ЕН12.1 и G4-изотипический контроль. Антитела тестировали в следующих концентрациях: 0,0001, 0,001, 0,01, 0,1, 1 и 10 мкг/мл. Анализ MLR проводили, как описано выше. Результаты обобщены в Таблицах 7А и 7В ниже.
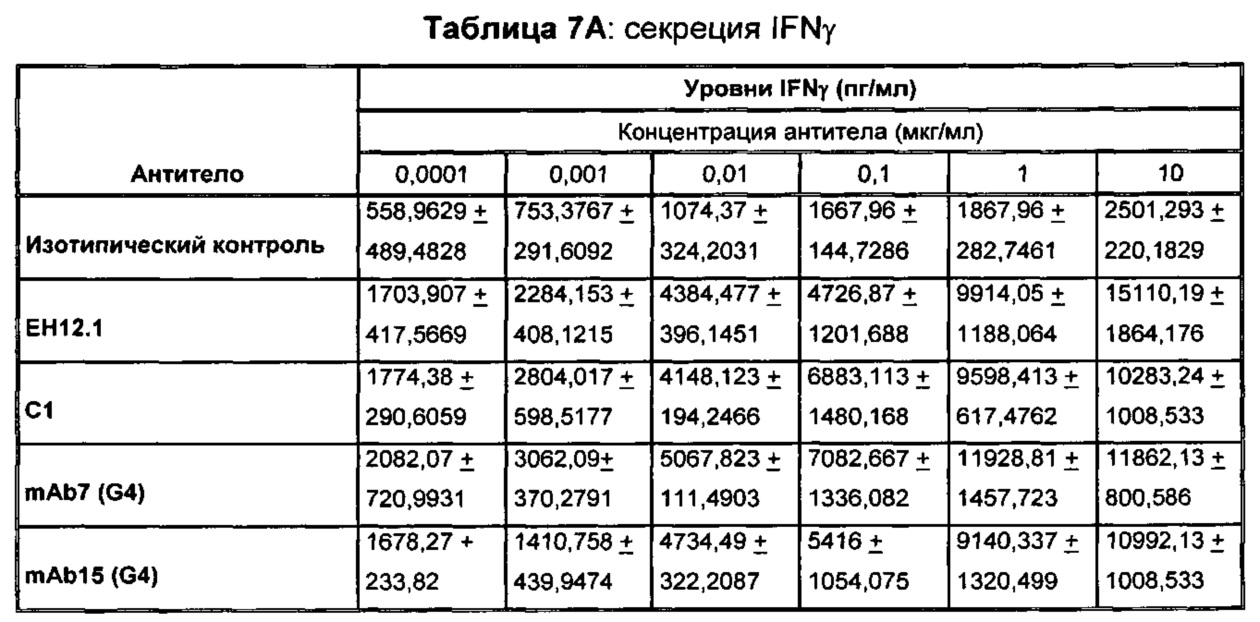
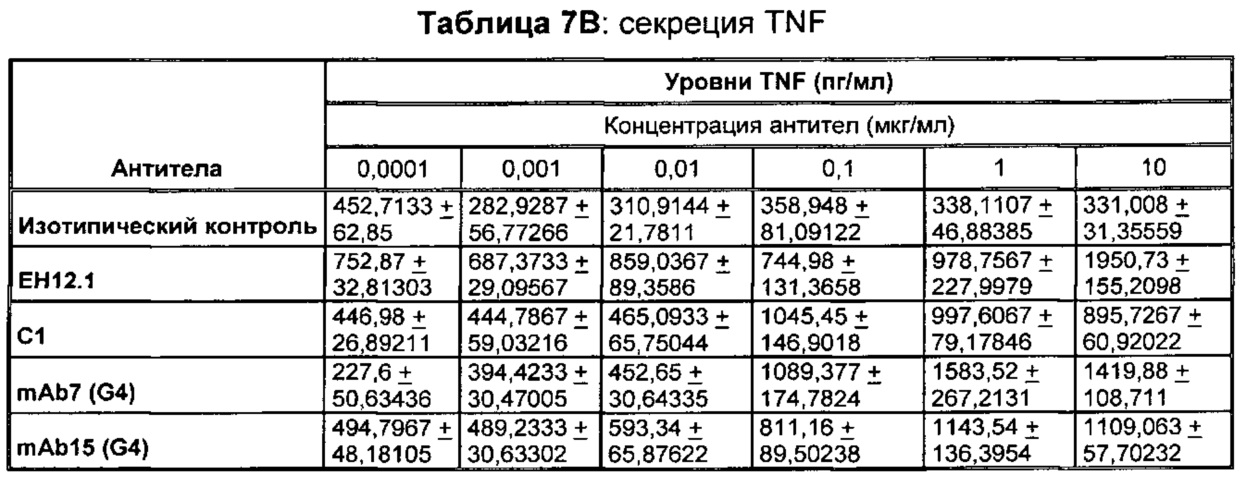
Обработка активированных Т-клеток антагонистическими антителами к PD-1 приводит к повышенным уровням IFNγ по сравнению с изотипическим контролем (таблица 7А). В культурах без антитела уровень IFNγ составлял 901,453±216,472 пг/мл. В культурах, получивших 0,0001, 0,001, 0,01, 0,1, 1 или 10 мкг/мл антитела изотипического контроля, уровни IFNγ составляли 558,9629±489,4828 пг/мл, 753,3767±291,6092 пг/мл, 1074,37±324,2031 пг/мл, 1667,96±144,7286 пг/мл, 1867,96±282,7461 пг/мл, 2501,293±220,1829 пг/мл соответственно. Напротив, в культурах, обработанных 0,0001, 0,001, 0,01, 0,1, 1 или 10 мкг/мл mAb7 (G4), уровни IFNγ составляли 2082,07±720,9931 пг/мл, 3062,09±370,2791 пг/мл, 5067,823±111,4903 пг/мл, 7082,667±1336,082 пг/мл, 11928,81±1457,723 пг/мл, 11862,13±800,586 пг/мл соответственно. В культурах, обработанных 0,0001, 0,001, 0,01, 0,1, 1 или 10 мкг/мл mAb15 (G4), уровни IFNγ составляли 1678,27±233,82 пг/мл, 1410,758±439,9474 пг/мл, 4734,49±322,2087 пг/мл, 5416±1054,075 пг/мл, 9140,337±1320,499 пг/мл и 10992.13±1008.533 пг/мл соответственно.
Обработка активированных Т-клеток антагонистическими антителами к PD-1 привела к повышенным уровням TNF по сравнению с изотипическим контролем (таблица 7В). В культурах без антитела уровень TNF составлял 365,523±84,6607 пг/мл. В культурах, обработанных 0,0001, 0.001, 0,01, 0,1, 1 или 10 мкг/мл антитела изотипического контроля, уровень TNF составлял 452,7133±62,85 пг/мл, 282,9287±56,77266 пг/мл, 310,9144±21,7811 пг/мл, 358,948±81,09122 пг/мл, 338,1107±46,88385 пг/мл и 331,008±31,35559 пг/мл соответственно. Напротив, в культурах, обработанных 0,0001, 0,001, 0,01, 0,1, 1 или 10 мкг/мл mAb7 (G4), уровни TNF составляли 227,6±50,63436 пг/мл, 394,4233±30,47005, 452,65±30,64335 пг/мл, 1089,377±174,7824 пг/мл, 1583,52±267,2131 пг/мл и 1419.88±108.711 пг/мл соответственно. В культурах, получивших 0,0001, 0,001, 0,01, 0,1, 1 или 10 мкг/мл mAb15 (G4), уровни TNF составляли 494,7967±48,1810 пг/мл, 489,2333±30,63302 пг/мл, 593,34±65,87622 пг/мл, 811,16±89,50238 пг/мл, 1143,54±136,3954 пг/мл и 1109,063±57,70232 пг/мл соответственно.
Эти результаты показывают, что антитела против PD-1 mAb7 и mAb15 блокируют передачу сигнала PD-1 и стимулируют секрецию IFNγ и TNF из первичных Т-клеток человека.
Пример 2: Влияние антител к PD-1 на пролиферацию Т-клеток
Данный пример иллюстрирует влияние антител к PD-1 на пролиферацию Т-клеток.
В этом исследовании пролиферацию Т-клеток определяли в MLR-анализе, в котором Т-клетки культивировали в присутствии анти-PD-1 антагониста или антител изотипического контроля.
Для MLR первичные Т-клетки человека, выделенные из цельной крови (полученной из банка крови Стэнфордского университета), активировали аллогенными дендритными клетками (DC), экспрессирующими высокий уровень PD-L1 и PD-L2, которые предварительно дифференцировали с использованием IL-4 и GM-CSF из CD14+ миелоидных клеток, были проведены два эксперимента.
В первом эксперименте сравнивали mAb7 (стабилизированный шарнир IgG4-каппа), mAb15 (стабилизированный шарнир IgG4-каппа), С1, ЕН12.1 и изотипический контроль. Во втором эксперименте сравнивали клоны mAb7, mAb15, С2, ЕН12.1 и изотипический контроль. В обоих экспериментах антитела были добавлены в следующих концентрациях: 0, 0,0001; 0,001; 0,01; 0,1; 1 и 10 мкг/мл.
Для обоих экспериментов культуры инкубировали в 96-луночных планшетах в трех повторах в соотношениях 1:10 DC:Т-клетки и инкубировали во влажном инкубаторе при 37°С с 5% CO2. На 5 сутки культуры обрабатывали в течение 18 часов 1 мкКи [3Н]-тимидина на лунку до сбора материала. Содержимое планшетов собирали затем на ДНК-специфические фильтры (Perkin Elmer) с использованием Harvester96 (Tomtec Life Sciences). Фильтры с радиоактивной меткой покрывали бета-сцинтилляционной жидкостью (Perkin Elmer) и считывали на Microbeta® планшетных счетчиках (Perkin Elmer). Включение тимидина анализировали как число импульсов в минуту (СРМ). Результаты представлены как среднее от трех повторов ±SEM.
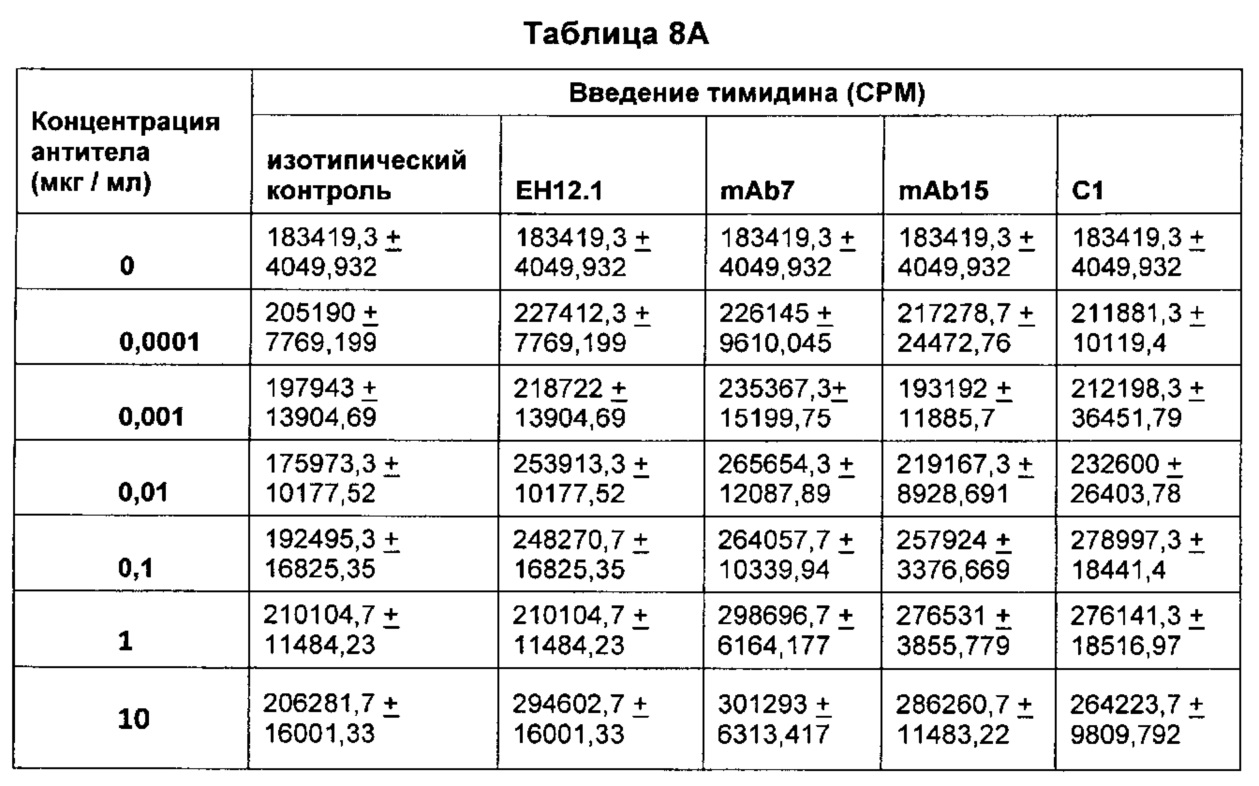
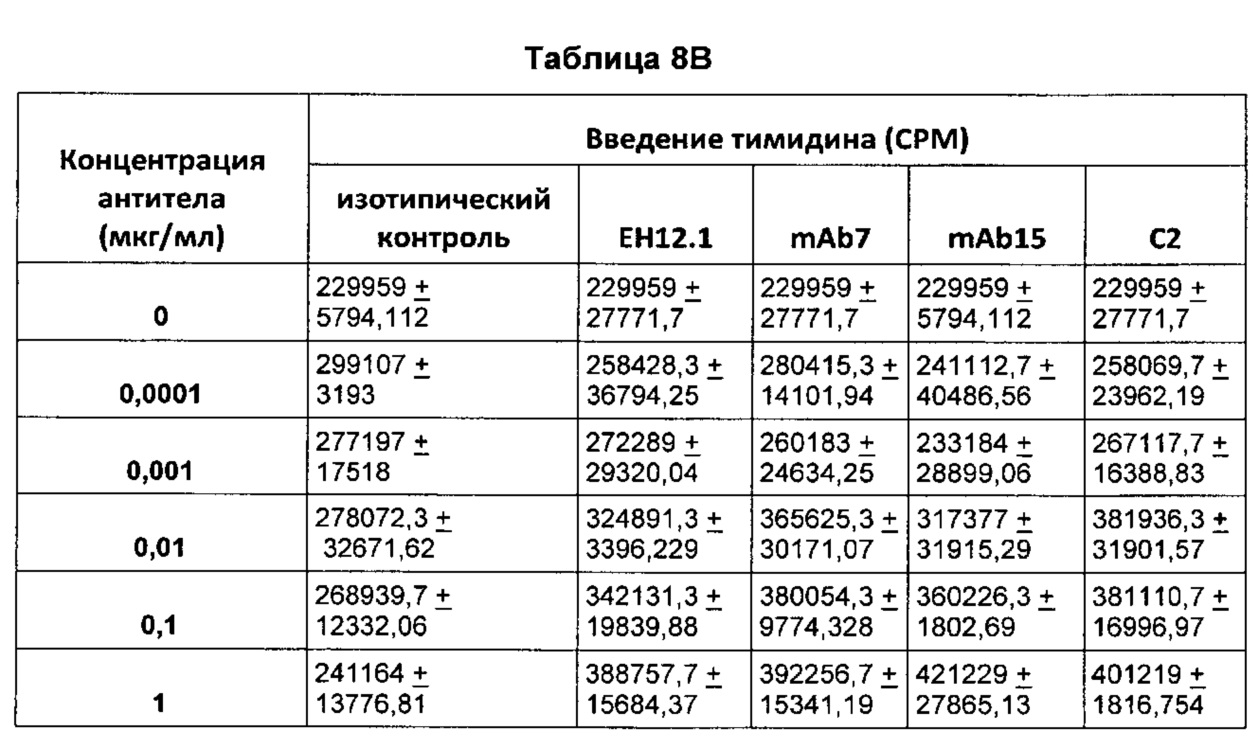

Обработка активированных Т-клеток антагонистическими антителами к PD-1 в концентрации 0,01 мкг/мл или выше приводит к значительному увеличению пролиферации Т-клеток по сравнению с изотипическим контролем (Таблицы 8А и 8В).
Например, обработка 0,01, 0,1, 1 или 10 мкг/мл mAb7 приводит к степеням включения тимидина 365625,3±30171,07 СРМ, 380054,3±9774,328 СРМ, 392256,7±15341,19 СРМ и 372889,7±14826,49 СРМ соответственно (таблица 8В). Обработка 0,01, 0,1, 1 или 10 мкг/мл mAb15-G4 и mAb7 приводит к степеням включения тимидина 317377±31915,29 СРМ, 360226,3±1802,69 СРМ, 421229±27865,13 СРМ и 323441,3±64476,55 СРМ соответственно (таблица 8В). Напротив, обработка 0,01, 0,1, 1 или 10 мкг/мл изотипического контроля приводит к степеням включения тимидина 278072,3±32671,62 СРМ, 268939,7±12332,06 СРМ, 241164±13776,81 СРМ и 231897,7±25865,95 СРМ, соответственно (таблица 8В).
Эти результаты показывают, что антитела к PD-1 mAb7 и mAb15 блокируют передачу сигнала посредством PD-1 и стимулируют пролиферацию первичных Т-клеток человека.
Пример 3: Влияние антител к PD-1 в мышиной модели GvHD
Данный пример иллюстрирует влияние антител к PD-1 на пролиферацию Т-клеток и потерю массы тела в мышиной модели "трансплантат против хозяина" (GvHD).
В этом исследовании использовали мышей NOD-scid-IL-2 с отсутствующей гамма цепью рецептора интерлейкина 2 (NSG), чтобы проверить влияние антагонистических антител к PD-1 на пролиферацию Т-клеток in vivo. Поскольку мыши NSG не имеют Т-клеток и В-клеток и имеют поврежденные NK-клетки, легко достичь высокого приживления человеческих клеток. При приживлении в этих мышах человеческих РВМС происходит пролиферация Т-клеток человека и индукция GvHD. В GvHD вовлечены миелоидный компартмент хозяина, а также человеческие клетки. Массовую пролиферацию лимфоцитов человека можно наблюдать в крови на ранних стадиях с последующей инфильтрацией этих клеток в органы мышей, такие как печень, селезенка, почки, кишечник и т.д., что приводит к потере массы тела мышей, а также к кожным повреждениям, сгорбленной спине и смерти. Степень тяжести моделей зависит от донорских РВМС и может отличаться для разных доноров.
В этом исследовании использовали следующие антагонистические антитела против PD-1: mAb7 (стабилизированный шарнир IgG4 человека или AAA), mAb15 (стабилизированный шарнир IgG4 человека), С1, С2 и С3. В качестве отрицательного контроля использовали изотипический контроль антитела к IgG4 человека со стабилизированным шарниром. Первичные человеческие РВМС выделяли из цельной крови (банк крови Стэнфордского университета) с использованием градиента Фиколла. 107 человеческих РВМС инъецировали мышам NSG (8-недельные самки, Jackson Laboratories). В 0-ые сутки мышей рандомизировали на основе массы тела и инъецировали внутривенно РВМС. Для экспериментов 1-4, на 2-е сутки и на 8-й сутки антитела вводили внутрибрюшинно в количестве 10 мг/кг. Для эксперимента 5, на 2-е сутки и на 8-е сутки, антитела вводили внутрибрюшинно в количестве 1 мг/кг или 10 мг/кг. В таблице 9 обобщены антитела, используемые в каждом эксперименте.

Периодически измеряли массу тела. Результаты приведены на Фиг. 1А-1Е. У мышей периодически отбирали кровь для оценки пролиферации Т-клеток. Обработка анти-PD-1 антителами ускоряла течение заболевания, определяемое путем измерения по скорости потери массы тела. По сравнению с контрольными мышами, мыши, получавшие антагонистическое антитело к PD-1, имели более быструю потерю массы тела (Фиг. 1А-1Е).
Пролиферацию Т-клеток человека измеряли с помощью проточной цитометрии, используя CD45 в качестве маркера (клон HI30; BD Biosciences). Результаты проточной цитометрии обобщены ниже в таблице 10. Т-клеточная пролиферация была выше у мышей, получавших антагонистическое антитело к PD-1, чем у мышей, получавших изотипический контроль. Более высокий процент CD45 указывает на более высокий уровень пролиферации клеток CD45 и, следовательно, на более тяжелый GvHD
В эксперименте 1 процент CD45-положительных клеток крови составлял 63,86% у контрольных мышей (таблица 10). Напротив, процент CD45-положительных клеток крови у мышей, обработанных анти-PD-1 антителами mAb7, mAb15, С1 или mAb7-АА, составлял 80,34%, 77,62%, 77,26% и 76,9% соответственно (таблица 10).
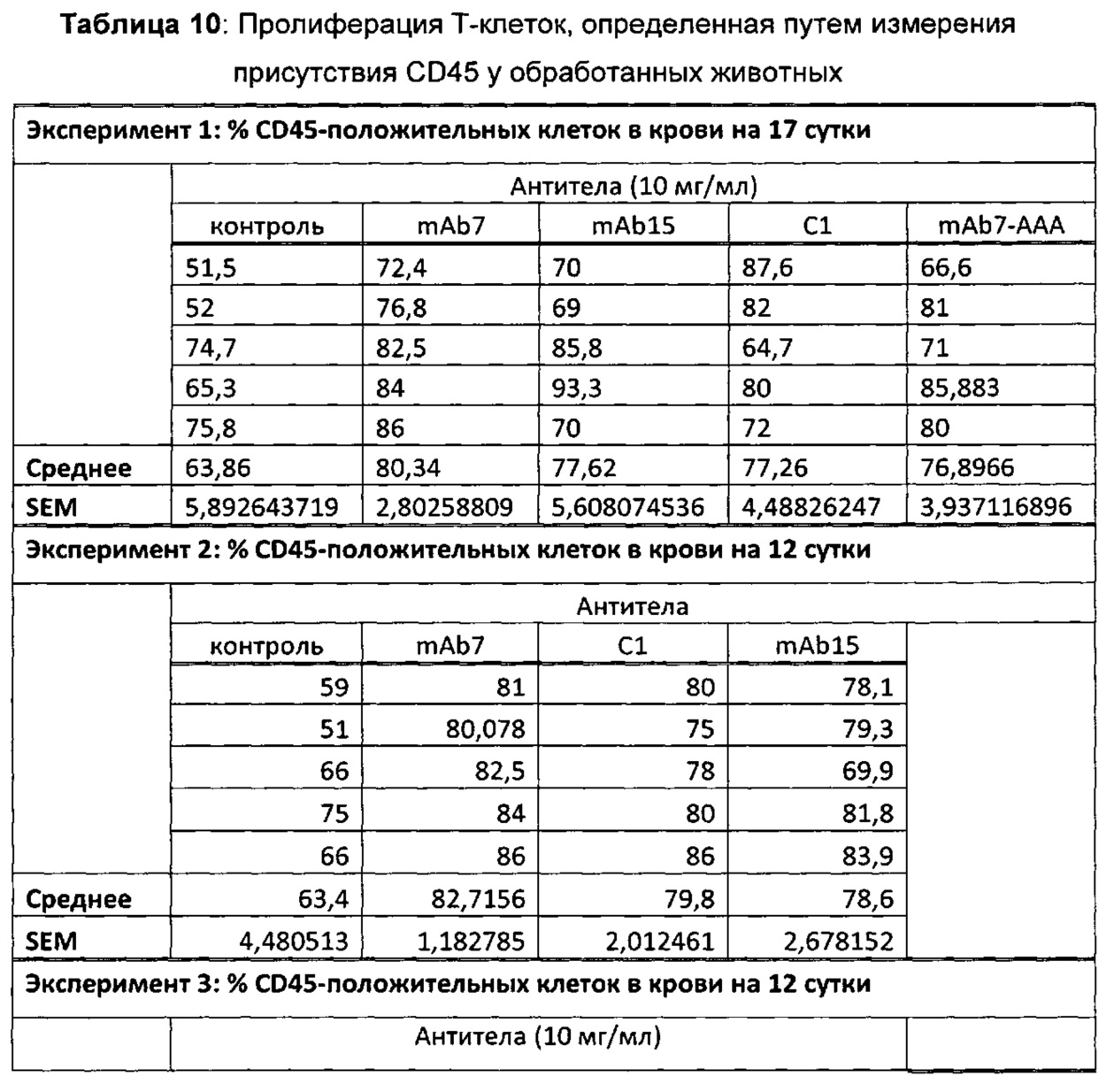
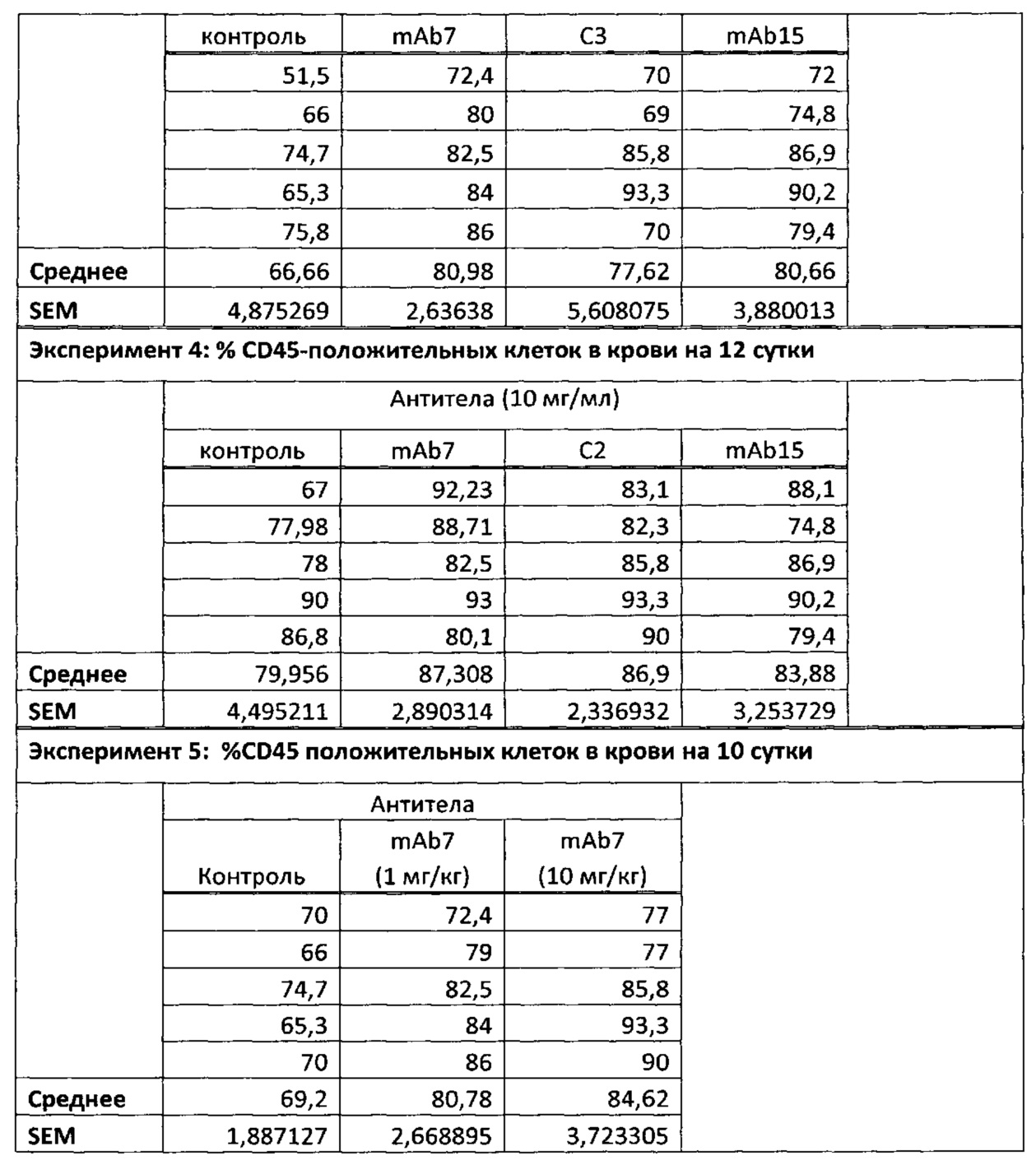
Таким образом, мыши, обработанные анти-PD-1-антителом, имели более быструю потерю массы тела и повышенную пролиферацию Т-клеток по сравнению с мышами, получавшими изотипический контроль. Эти результаты показывают, что обработка анти-PD-1 антителами стимулирует пролиферацию Т-клеток человека in vivo.
Пример 4: Связывание антител к PD-1
Данный пример иллюстрирует связывание анти-PD-1 антител с активированными Т-клетками человека и Т-клетками яванского макака (cyno).
Первичные человеческие Т-клетки выделяли из РВМС (банк крови Стэнфордского университета), используя набор для выделения PAN Т-клеток человека в соответствии с протоколом изготовителя (Miltenyi Biotec; 130-096-353). Cyno РВМС покупали (у BioreclamationlVT) и PAN Т-клетки выделяли, используя набор для выделения PAN Т-клеток приматов, не являющихся человеком, в соответствии с протоколом изготовителя (Miltenyi Biotec; 130-091-993). Человеческие Т-клетки активировали в течение 3 суток с помощью активатора Т-клеток человека CD3/CD28 DYNABEADS™ для размножения и активации Т-клеток (Life Technologies; 11131D). Используемое соотношение гранул к клеткам составляло 1:1 гранулы : Т-клетки соответственно. Cyno Т-клетки активировали в течение 3 суток, используя набор для размножения и активации Т-клеток примата, не являющегося человеком, в соответствии с протоколом изготовителя (Miltenyi Biotec; 130-092-919). Используемое соотношение гранул к клеткам составляло 1:1 гранулы : Т-клетки соответственно. Через 3 суток культуры собирали, гранулы отделяли от активированных Т-клеток, используя силу магнитного поля. Клетки промывали и инкубировали с буфером FACS (включающим 2% FBS) и ингибитором связывания человеческого Fc-рецептора (Affymetrix eBioscience каталожный номер 16-9161-73). Для клеток cyno использовали Fc-блокирующий реагент (BD Biosciences каталожный номер 564765). Клетки инкубировали в течение 10 минут при комнатной температуре и затем окрашивали витальным красителем для исключения мертвых клеток (LIVE/DEAD® Fixable Blue Dead Cell Stain Kit, для УФ-возбуждения; каталожный номер А10346) в течение еще 5 минут. Добавляли анти-PD-1 антитела (концентрации анти-PD-1 клонов инкубировали на клетках в 1:3 серийном разведении, начиная с 10 мкг/мл - 0 мкг/мл). В каждой реакции использовали 1×106 клеток в суммарно 100 мкл и клетки инкубировали на льду в течение 30 минут. Затем клетки промывали буфером FACS, чтобы предотвратить доступ первичных антител, и инкубировали со вторичными античеловеческими антителами (AffiniPure F(ab')2 Fragment Donkey Anti-Human IgG (H+L), конъюгированными с аллофикоцианином (АРС); каталожный номер 709-136-149). Клетки окрашивали в течение 30 минут на льду. Клетки промывали и держали на льду до считывания с использованием клеточного анализатора BD LSRFortessa (BD Biosciences, каталожный номер 647465). Данные анализировали, используя программное обеспечение FlowJo™. Результаты обобщены на Фиг. 2А и 2В.
На Фиг. 2А показано значение ЕС50, измеренное для связывания анти-PD-1 антитела с человеческими активированными клетками, и на Фиг. 2В показано значение ЕС50, измеренное для связывания анти-PD-1 антитела с активированными клетками cyno. Антитела к PD-1 mAb7 и С1 связывают активированные Т-клетки с аналогичными значениями ЕС50 (Фиг. 2А и 2С).
Пример 5: Ингибирование связывания PD-L1 анти-РD-1 антителом
Данный пример иллюстрирует ингибирование связывания лиганда PD-1 (PD-L1) анти-PD-1 антителом.
Первичные человеческие Т-клетки выделяли из РВМС (банк крови Стэнфордского университета), используя набор для выделения человеческих PAN Т-клеток, в соответствии с протоколом изготовителя (Miltenyi Biotec; 130-096-353). Cyno РВМС покупали (у BioreclamationlVT) и PAN Т-клетки выделяли, используя набор для выделения PAN Т-клеток приматов, не являющихся человеком, в соответствии с протоколом изготовителя (Miltenyi Biotec; 130-091-993). Т-клетки человека активировали в течение 3 суток с помощью активатора Т-клеток человека CD3/CD28 DYNABEADS™ (для размножения и активации клеток, Life Technologies; 11131D). Используемое соотношение гранул к клеткам составляло 1:1 соответственно. Cyno Т-клетки активировали в течение 3 суток, используя набор для активации/размножения Т-клеток примата, не являющегося человеком, в соответствии с протоколом изготовителя (Miltenyi Biotec; 130-092-919). Используемое соотношение гранул к клеткам составляло 1:1 соответственно. Через 3 суток культуры собирали, гранулы отделяли от активированных Т-клеток, используя силу магнитного поля. Клетки промывали и инкубировали с буфером FACS (включающим 2% FBS) и ингибитором связывания человеческого Fc-рецептора (Affymetrix eBioscience; каталожный номер 16-9161-73). Для cyno клеток использовали Fc-блокирующий реагент (BD Biosciences; каталожный номер 564765). Клетки инкубировали в течение 10 минут при комнатной температуре и затем окрашивали витальным красителем для исключения мертвых клеток (LIVE/DEAD® Fixable Blue Dead Cell Stain Kit, для УФ-возбуждения; каталожный номер А10346) в течение еще 5 минут. Человеческий рекомбинантный PD-L1 Fc (R&D Systems, каталожный номер 156-В7) или один буфер инкубировали с клетками в количестве 10 нг/мл. Каждый лиганд инкубировали отдельно и на льду в течение 30 минут. Затем клетки промывали и инкубировали с анти-PD-1 антителами (при концентрации анти-PD-1 клонов инкубировали на клетках в 1:3 серийных разведениях, начиная с 10 мкг/мл - 0 мкг/мл). В каждой реакции использовали 1×106 клеток суммарно в 100 мкл и клетки инкубировали на льду в течение 30 минут. Затем клетки промывали буфером FACS, чтобы предотвратить доступ первичных антител и инкубировали с антителами к области каппа человека, конъюгированными с аллофикоцианином (АРС) (Life Technologies; каталожный номер МН10515). Клетки окрашивали в течение 30 минут на льду, затем промывали и держали на льду вплоть до считывания с использованием клеточного анализатора BD LSRFortessa (BD Biosciences, каталожный номер 647465). Данные анализировали с использованием программного обеспечения FlowJo™ и рассчитывали среднюю интенсивность флуоресценции (MFI) и среднее геометрическое (Geo.M) АРС окрашивания живых клеток с помощью программного обеспечения FlowJo™. После определения среднего геометрического рассчитывали IC50 с использованием программного обеспечения GraphPD Prism. Результаты обобщены в Таблицах 11 и 12 ниже.
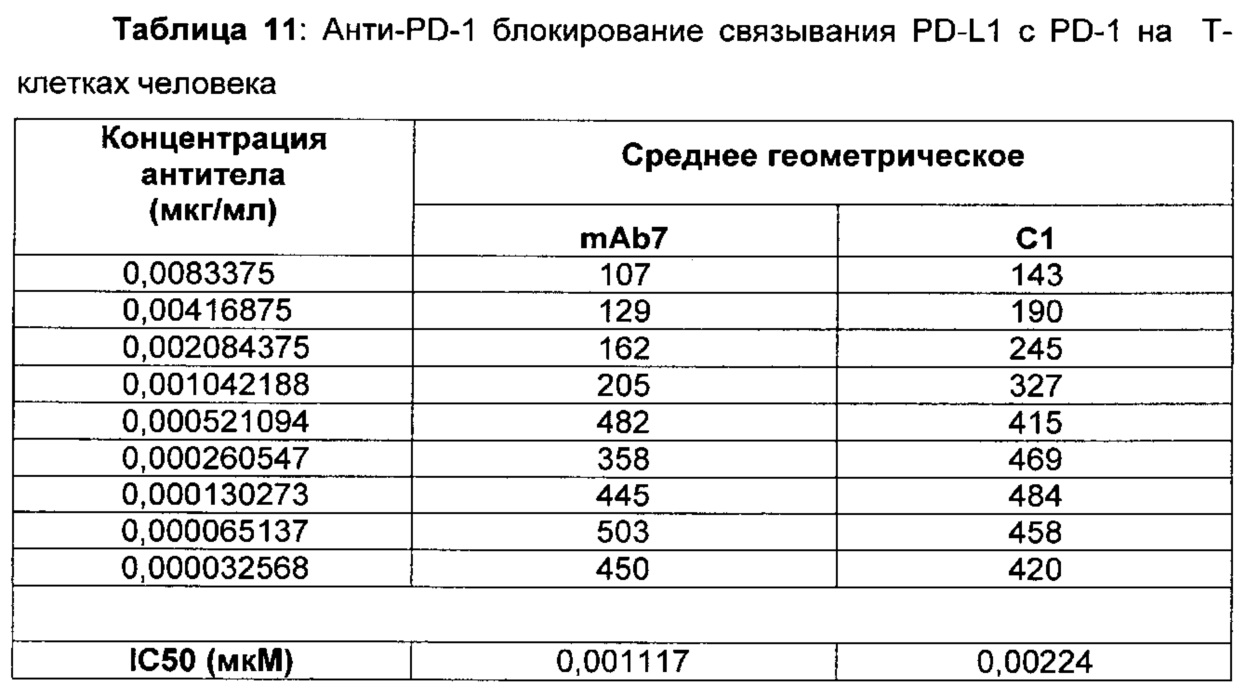
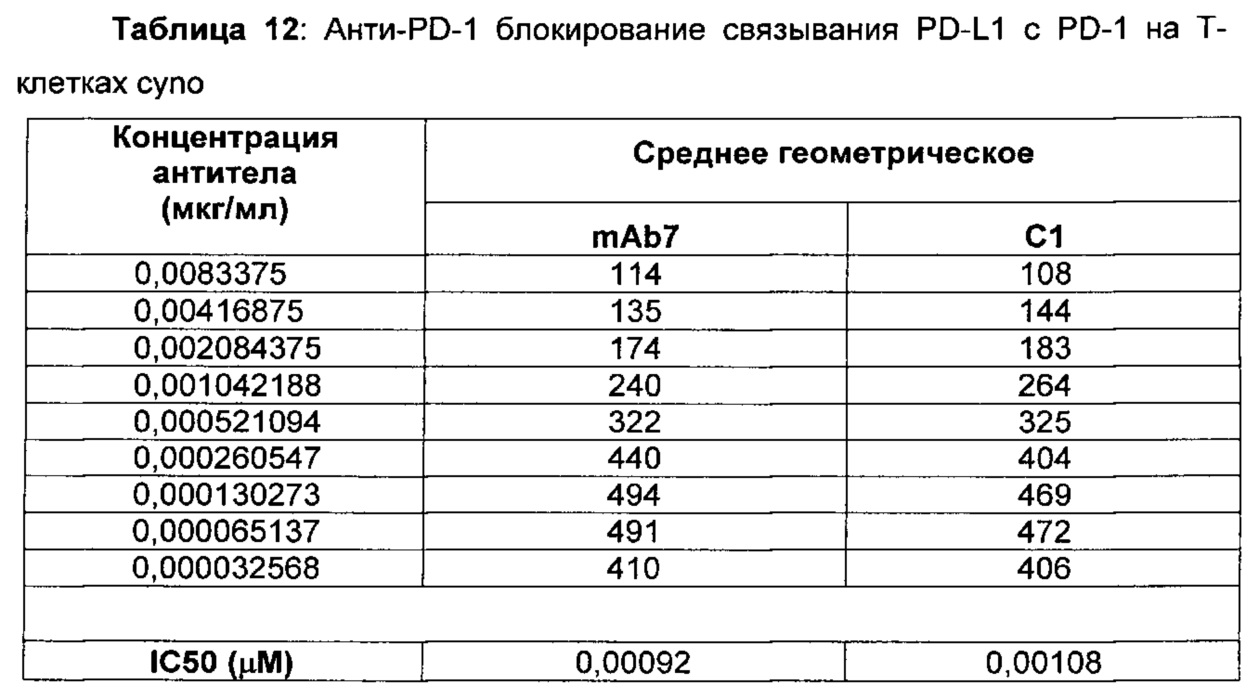
Эти результаты показывают, что антитела к PD-1 mAb7 и С1 ингибируют связывание PD-L1 с Т-клетками человека и cyno с аналогичными значениями IC50.
Пример 6: Влияние анти-PD-1 антитела на пролиферацию Т-клеток
Данный пример иллюстрирует влияние анти-PD-1 антител на пролиферацию Т-клеток. CD4 и CD8 (AllCells, LLC) активировали в течение 2 суток с помощью DYNABEADS™ активатора Т-клеток человека CD3/CD28 (или клеточное размножение и активация (Life Technologies; 11131D). Используемое соотношение гранул к клеткам составляло 1:1 соответственно для индукции PD-1. На 2 сутки культуры собирали и гранулы отделяли от активированных Т-клеток, используя силу магнитного поля. Затем клетки активировали на PD-L1-экспрессирующих дендритных клетках и клетки инкубировали с разными анти-PD-1 клонами в количестве 1 мкг/мл в 96-луночных платах в трех повторах в соотношении 1:10 DC:Т-клетки и инкубировали во влажном инкубаторе при 37°С с 5% СО2. На 3 сутки культуры обрабатывали в течение 18 ч 1 мкКи [3Н]-тимидина на лунку до сбора материала. Содержимое планшетов затем собирали на ДНК-специфическую фильтровальную бумагу (PerkinElmer) с использованием Harvester96 (Tomtec Life Sciences). Меченные радиоактивным изотопом фильтры покрывали бета-сцинтилляционной жидкостью (Perkin Elmer) и считывали в Microbeta® планшетных счетчиках (Perkin Elmer). Включение тимидина анализировали как число импульсов в минуту (СРМ). Результаты представлены на Фиг. 3 и 4 как среднее от трех повторов ±SEM.
Пример 7: Определение кинетики и аффинности взаимодействия человеческого, cyno и мышиного PD-1 с гуманизированными антителами к PD-1
Данный пример иллюстрирует связывание антител к PD-1 с человеческим, cyno или мышиным PD-1.
Анализ всех взаимодействий проводили на немеченых биосенсорах при 25°С, если не указано иное. Биосенсоры поверхностного плазмонного резонанса (ProteOn-XPR™ из BioRad™ и Biacore 2000™ и Biacore Т200™ из GE Life Sciences) использовали для изучения PD-1 человека и яванского макака, а биосенсор интерферометрии биослоев (Octet-Red384, Fortebio/Pall Life Sciences) использовали для изучения мышиного PD-1. Эксперименты ProteOn выполняли в PBS рН 7,4 + 0,01% Tween-20 (PBST) электродном буфере. Эксперименты Biacore выполняли в 10 мМ Hepes рН 7,4, 150 мМ NaCl, 0,05% Tween-20 (HBST+) и эксперименты Octet выполняли в HBST+ с 1 г/л BSA. Данные ProteOn обрабатывали в программе ProteOn Manager, данные Biacore обрабатывали в Biaevaluation, а данные Octet просто выравнивали с нулем в контрольной программе. Данные SPR были получены с двумя эталонами (Myszka, 1999, J Mol Recognit 12(5): 279-284) и в целом совпадали с простой моделью Ленгмюра для определения константы равновесия при диссоциации, KD, из отношения констант кинетической скорости (KD=kd/ka).
Анализ концентрации без калибровки (CFCA)
Активную концентрацию человеческого PD-1 (hPD-1) мономера (Sino Biologicals, каталожный номер 10377-Н08Н) для использования в качестве анализизуемого вещества в кинетических экспериментах с иммобилизованными IgG определяли опытным путем, используя анализ CFCA на Biacore Т200™, оснащенном сенсорным чипом СМ5. Для подготовки поверхностей к этим экспериментам, высокоэффективное (примерно 12000 RU (относительных единиц)) mAb15 hIgG4 (или в некоторых экспериментах конкурентное антитело C2-hIgG1) соединяли посредством аминной группы с проточной ячейкой 2, оставляя проточную ячейку 1 пустой (просто "активированной и заблокированной" без какого-либо IgG) с получением эталонной поверхности. Образцы hPD-1 инжектировали при номинальных концентрациях 0,1, 1 и 10 мкг/мл в течение 36 секунд при низкой (5 мкл/мин) и высокой (100 мкл/мин) скорости потока. Поверхности регенерировали с помощью коктейля из 2:1 об/об буфера для элюирования IgG Pierce (рН 2,8):4 М NaCl. Данные анализировали в CFCA-устройстве в программе Т200 для получения кажущегося значения активности для анализируемого hPD-1, которое использовали для корректировки его "номинальной" концентрации белка, определяемой по поглощению при 280 нм с соответствующим коэффициентом экстинции, в "активную" концентрацию белка. Было обнаружено, что некоторые партии были активными на 32%, а другие активными на 100%.
Кинетический анализ связывания PD-1 человека (hPD-1) с аминосвязанными mAb7, mAb15, С1, С2, С3 и С4 mAb.
ProteOn-XPR36, оснащенный сенсорными чипами GLC (BioRad™, Hercules, СА), использовали для определения кинетики и аффинности связывания мономера hPD-1 с панелью аминосвязанных анти-hPD-1 mAb (mAb7, mAb15, С1, С2, С3 и С4) в электродном буфере PBST. Поверхности для этих экспериментов были подготовлены в три этапа; (1) каналы лигандов были минимально активированы в течение двух минут с использованием свежеприготовленной смеси активирующих реагентов с конечной концентрацией 0,8 мМ EDC (1-этил-3-(3-диметиламинопропил)карбодиимид) и 0,2 мМ сульфо-NHS в воде, (2) производили сочетание IgG в течение трех минут при 15 мкг/мл в 10 мМ ацетате натрия, рН 4,5 и (3) избыток реакционноспособных сложных эфиров блокировали в течение трех минут с помощью 1 М этаноламина HCl, рН 8,5. Конечные уровни связанного IgG варьировались от 400 RU до 1157 RU. Мономер hPD-1 инжектировали в одноточечном кинетическом режиме (Bravman et al., 2006, Anal Biochem 358(2): 281-288) вдоль каналов "анализируемого вещества" в виде серий тройных разведения с верхними "активными" концентрациями 30, 44 или 36 нМ, в зависимости от эксперимента. Время ассоциации и диссоциации составляло 3 мин и 20 мин соответственно, и все исследуемые вещества инжектировали в двойные циклы связывания. Поверхности регенерировали с помощью коктейля из 2:1 об./об. буфера для элюирования IgG Pierce (рН 2,8):4 М NaCl.
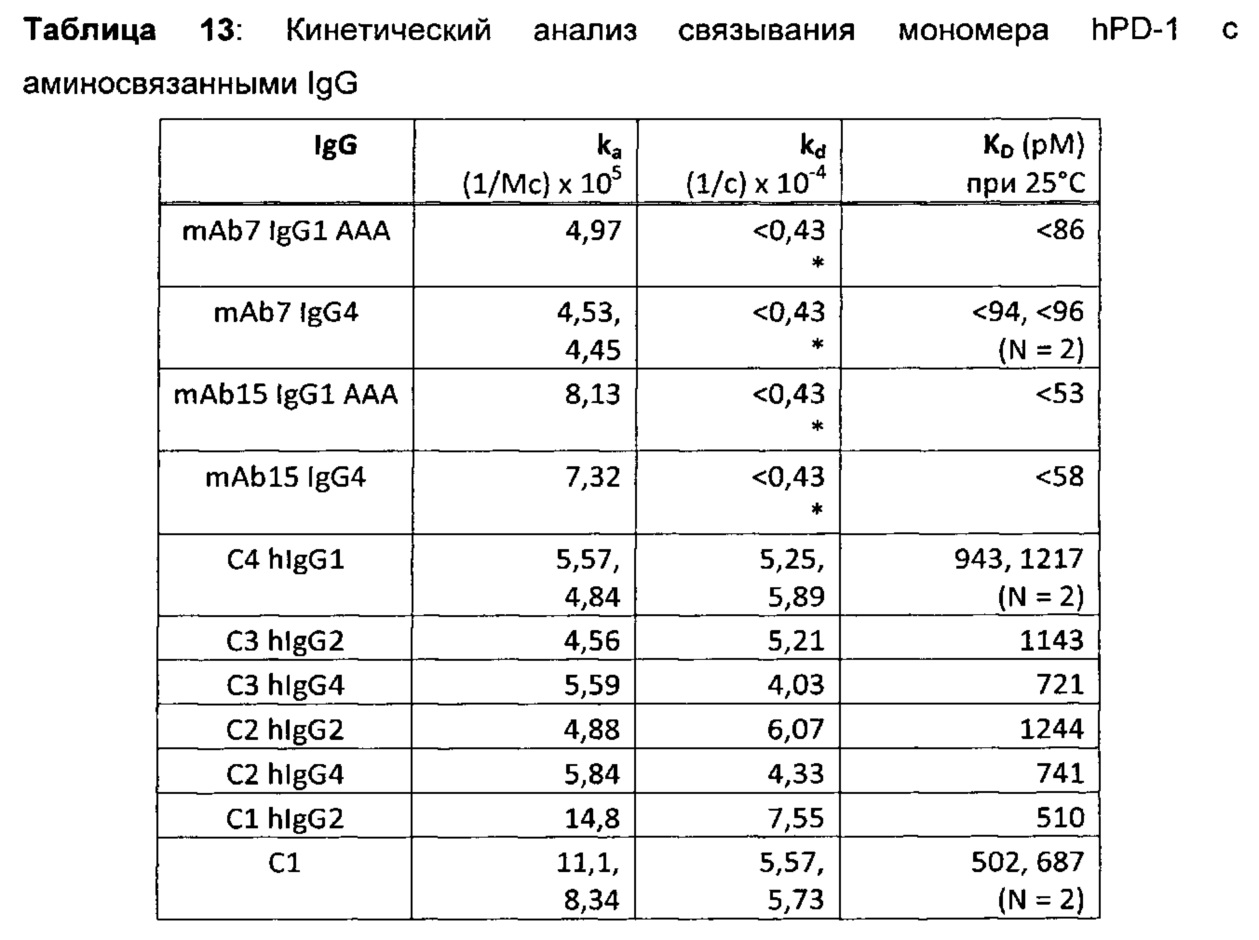
Взаимодействия мономера hPD-1 с mAb7 и mAb15 не выявили заметного уменьшения связывания в пределах допустимой фазы диссоциации, поэтому верхний предел был отнесен к их значениям kd и KD в соответствии с "правилом 5%" (Katsamba et al, 2008, Anal Biochem 352(2): 208-221). N = 2 относится к двум независимым экспериментам на разных чипах.
Перекрестная реакция mAb7 и mAb15 с PD-1 яванского макака.
Кинетику связывания рекомбинантных очищенных фрагментов Fab (mAb7 и mAb15) с hPD-1-hFc1 (R&D systems каталожный номер 1086PD) и cynoPD-1-hFc1 (приготовлен своими силами) определяли, используя Biacore 2000™, оснащенный сенсорным чипом СМ4, и электродный буфер HBST+. Анти-hFc поликлональное антитело были соединено по амину с чипом и использовано для захвата примерно 90 RU hPD-1-hFc1 и 125 RU cynoPD-1-hFc1 на проточных ячейках 2 и 3, оставляя проточную ячейку 1 пустой (поверхность захвата "голого" анти-hFc) для обеспечения эталонного канала. Рекомбинантные очищенные Fab инжектировали в течение двух минут в качестве аналита при 0, 10 и 100 нМ поверх свежезахваченных слитых белков PD-1-hFc1, обеспечивая 15-минутное время для диссоциации. Поверхности захвата регенерировали, используя 75 мМ фосфорную кислоту, и образцы mAb7 Fab инжектировали в двойные циклы связывания. Все комплексы Fab/PD-1 были очень стабильными, так что ни одно из взаимодействий не демонстрировало какого-либо видимого уменьшения в их реакциях связывания в пределах допустимого времени диссоциации, поэтому было применено "правило 5%" (Katsamba et al, 2008) для того, чтобы установить верхний предел для их значений kd и KD.
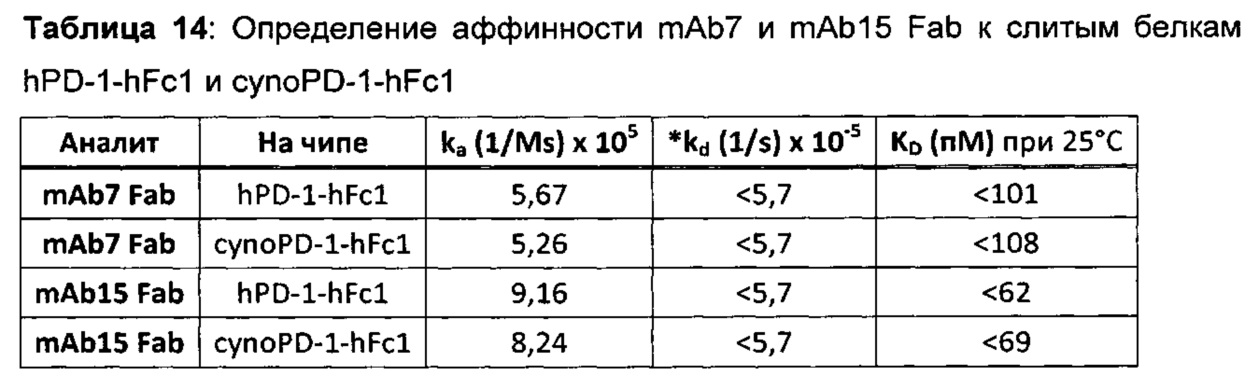
Температурная зависимость аффинности связывания hPD-1 с mAb15, mАb7 и С3
Biacore Т200™, оснащенный сенсорным чипом СМ4, использовали для определения кинетики и аффинностей связывания мономера hPD-1 с панелью молекул hIgG4 (mAb15, mAb7 и С3), которые были захвачены на низких уровнях при помощи аминосвязанного анти-hFc поликлонального антитела. hIgG4 mAb были захвачены в количестве 10 мкг/мл на отдельных проточных ячейках, при этом проточная ячейка 1 была оставлена пустой, чтобы служить в качестве эталонной поверхности ("голой" захватывающей поверхности). hPD-1 инжектировали в активных концентрациях 0, 10 и 100 нМ в течение трех минут, обеспечивая 18-минутную фазу диссоциации. Поверхности захвата регенерировали 75 мМ фосфорной кислотой после каждого цикла связывания.


Перекрестная реакция mAb7 с мышиным PD-1
Octet-Red384, оснащенный сенсорными чипами на основе стрептавидина, использовали для определения, связывается ли мышиный PD-1 с mAb7. Формат анализа сниженной авидности был выбран для повышения чувствительности обнаружения в анализе. Сенсоры были покрыты биотинилированными поликлональными антителами против каппа-области человека и использовались для захвата панели из hIgG4 анти-hPD-1 mAb (mAb7, С1, С2 и С3) в количестве 10 мкг/мл; каждое mAb было захвачено восьмью сенсорами. В качестве положительного контроля восемь сенсоров на основе стрептавидина были покрыты биотинилированным J43 (eBioSciences) антителом против мышиного PD-1. Каждый сенсор, покрытый mAb, подвергали воздействию следующих анализируемых веществ; буфера, 1 мкМ сайтов связывания мышиного PD-1-hFc, 1 мкМ сайтов связывания hPD-1-hFc (положительный контроль) или 1 мкМ сайтов связывания hGHR-hFc (отрицательный контроль). Все рекомбинантные Fc-слитые белки были из R&D systems. Таким образом, каждое взаимодействие анализируемого вещества/mAb анализировали на двойных сенсорах.
Анти-PD-1 антитела С1, С2 и С3 не связывали мышиный PD-1-hFc1 (данные не показаны). Анти-PD-1 антитело mAb7 слабо связывало мышиный PD-1-hFc1 (данные не показаны). Все протестированные анти-PD-1 антитела связывались с hPD-1-hFc. Эти результаты показывают, что mAb7 в слабой степени перекрестно реагирует с мышиным PD-1, в то время как С1, С2 и С3 не являются перекрестно-реагирующими с мышиным PD-1.
Пример 8: Лечение рака с помощью антител к PD-1
Это пример иллюстрирует возможное использование антител к PD-1 по настоящему изобретению для лечения рака.
Выбирали пациентов с гистологически подтвержденным, ранее не подвергавшимся лечению измеряемым метастатическим колоректальным раком, для лечения антителом к PD-1. Пациентов распределяли в одну из двух групп лечения: химиотерапия плюс плацебо или химиотерапия плюс mAb7. Использовали алгоритм динамической рандомизации для достижения баланса в целом и внутри каждой из следующих категорий: центр исследования, исходное общее состояние онкологического больного по шкале ECOG (0 в сравнении с 1), место первичного заболевания (толстая кишка в сравнении с прямой кишкой) и число сайтов метастазирования (1 в сравнении с>1). Химиотерапевтическое лечение проводили еженедельно в течение первых 6 недель каждого 8-недельного цикла. Химиотерапию продолжали до завершения исследования (96 недель) или прогрессирования заболевания. mAb7 (5 мг/кг) или плацебо вводили каждые 2 недели. Пациентам в группе mAb7, с подтвержденным полным ответом или с выявленной неприемлемой токсичностью в результате химиотерапии разрешали прекратить химиотерапию и продолжать получать mAb7 отдельно, как терапию первой линии. Только пациенты, которые были рандомизированы в группу mAb7, могли получать mAb7 в качестве компонента лечения второй линии. После завершения исследования за пациентами наблюдали в отношении последующего лечения и выживания каждые 4 месяца вплоть до смерти, выпадения из поля зрения или прекращения исследования.
1), место первичного заболевания (толстая кишка в сравнении с прямой кишкой) и число сайтов метастазирования (1 в сравнении с>1). Химиотерапевтическое лечение проводили еженедельно в течение первых 6 недель каждого 8-недельного цикла. Химиотерапию продолжали до завершения исследования (96 недель) или прогрессирования заболевания. mAb7 (5 мг/кг) или плацебо вводили каждые 2 недели. Пациентам в группе mAb7, с подтвержденным полным ответом или с выявленной неприемлемой токсичностью в результате химиотерапии разрешали прекратить химиотерапию и продолжать получать mAb7 отдельно, как терапию первой линии. Только пациенты, которые были рандомизированы в группу mAb7, могли получать mAb7 в качестве компонента лечения второй линии. После завершения исследования за пациентами наблюдали в отношении последующего лечения и выживания каждые 4 месяца вплоть до смерти, выпадения из поля зрения или прекращения исследования.
У пациентов производят оценку состояния опухоли на исходном уровне и после завершения каждого 8-недельного цикла с использованием подходящих рентгенографических методов, обычно спирального КТ-сканирования. Опухолевый ответ или прогрессирование определяется как исследователем, так и независимым радиологическим учреждением (IRF) с использованием критериев оценки ответа солидных опухолей. Therasse et al. (2000). Оценку IRF выполняют, не зная о распределении в группы лечения или об оценке исследователя. Кроме того, пациенты полностью проходят функциональную оценку противораковой терапии - колоректальной (FACT-C), версия 4, утвержденный инструмент для оценки качества жизни (QOL) пациентов с колоректальным раком, в начале и перед каждым циклом лечения до прогрессирования заболевания. Ward et al. (1999) Qual. Life Res. 8: 181-195.
Безопасность оценивают по сообщениям о нежелательных явлениях, по результатам лабораторных испытаний и по измерениям основных показателей жизнедеятельности. Нежелательные явления и аномальные лабораторные результаты классифицируют с использованием критериев общей токсичности Национального института рака (NCl-CTC), Версия 2. Предварительно указанные показатели безопасности включают четыре нежелательных явления, представляющих особый интерес (гипертония, протеинурия, тромбоз и кровотечение).
Первичный итоговый показатель представляет собой длительность общей выживаемости. Вторичные итоговые показатели включают: выживаемость без прогрессирования, частоту объективного ответа (полную и частичную), продолжительность ответа и изменение показателя FACT-C QOL. Продолжительность выживания определяется как время от рандомизации до смерти. Для пациентов, находящихся в живых в момент анализа, продолжительность выживания цензурируют по дате последнего контакта. Выживаемость без прогрессирования определяется, как время от рандомизации до более раннего из прогрессирования заболевания или смерти при исследовании, которая определяется как смерть от любой причины в пределах 30 суток после последней дозы исследуемого лекарственного средства или химиотерапии. Для пациентов, находящихся в живых без прогрессирования заболевания на момент анализа, выживаемость без прогрессирования будет цензурирована по последней оценке их опухоли или в сутки 1 (первые сутки лечения согласно исследованию), если не было проведено никакой оценки после исходной. При анализе объективного ответа пациентов без оценки опухоли классифицируют как пациентов без объективного ответа. Анализы прогрессирования заболевания и ответа основаны на оценках IRF. Изменение качества жизни определяется, как время до ухудшения QOL (TDQ), определяемое как время от рандомизации до самого раннего из снижения не менее чем 3 пункта от исходного уровня показателя по специфической FACT-C подшкале для рака толстой кишки (CCS), прогрессирования заболевания или смерти при исследовании. TDQ также определяется для TOI-C (сумма CCS, физического и функционального самочувствия) и общей FACT-C для изменения по сравнению с исходным состоянием.
Пример 9: Лечение рака с помощью антител к PD-1
Данный пример иллюстрирует применение антител к PD-1 по настоящему изобретению для лечения рака.
Исследование в этом примере представляет собой фазу 1 открытого, многоцентрового, с многократным приемом, с повышением дозы, исследования безопасности, PK (фармакокинетики) и PD (фармакодинамики) анти-PD-1 моноклонального антитела mAb7, вводимого внутривенно взрослым, получавшим предварительное лечение пациентам с местнораспространенной или метастатической меланомой, плоскоклеточным раком головы и шеи (SCHNC), карциномой яичника, саркомой, или рецидивирующей или рефрактерной классической лимфомой Ходжкина (cHL). Протокол исследования обобщен ниже в таблице 16.
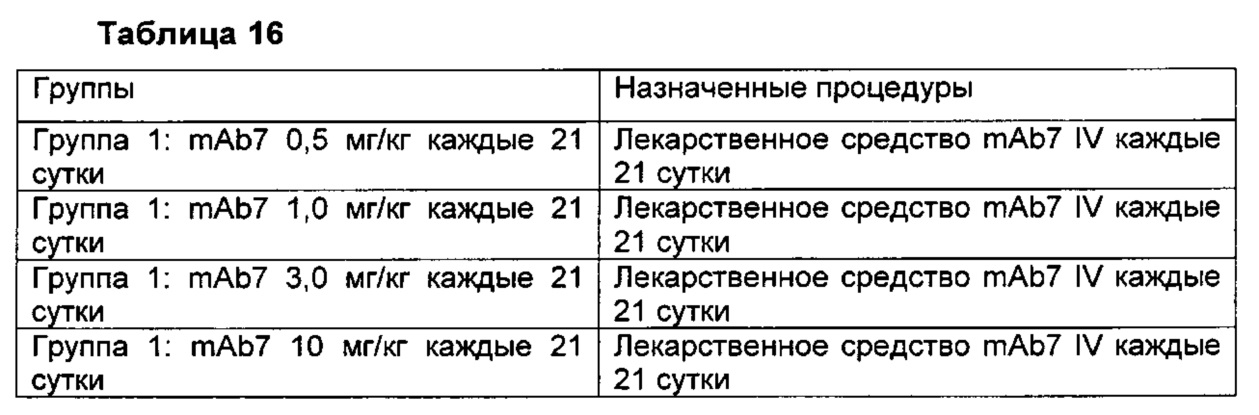
Критерии включения: - Гистологический или цитологический диагноз местнораспространенной или метастатической меланомы, SCCHN, рака яичника, саркомы, или рецидивирующего или рефрактерного cHL: - Пациент должен получить по меньшей мере 1 и не более 5 предшествующих линий терапии для рецидивирующего или метастатического заболевания, включая как стандарты лечения, так и экспериментальные терапевтические средства. - По меньшей мере одно измеряемое поражение, определенное по RECIST (Критерии оценки объективного ответа при солидных опухолях) версия 1.1, или (для cHL) по меньшей мере 1 определяемое посредством фтордезоксиглюкозной позитронно-эмиссионной томографии (FDG PET) авидное (Deauville 4/5) измеряемое поражение более 1,5 см, определено по критериям оценки ответа для злокачественной лимфомы, которую ранее не облучали. - Для расширения части 1В и всех когорт 2 части: пациент согласен пройти предварительное лечение и на биопсию при лечении. - Адекватная функция почек, печени, костного мозга. Критерии исключения - Активные метастазы в мозг или лептоменингеальные метастазы. - Меланома глаза - Активное, известное или предполагаемое аутоиммунное заболевание. Разрешено включать пациентов с витилиго, сахарным диабетом I типа, остаточным гипотиреозом из-за аутоиммунного состояния, требующего только гормонального замещения, с псориазом, не требующим системного лечения, или состояниями, рецидива которых не ожидают в отсутствие внешнего инициирующего фактора. Диагностика предшествующего иммунодефицита или трансплантация органов, требующая иммуносупрессивной терапии, - Для части 2: предшествующее лечение антителами к PD-1 или PD-L1. - Наличие в истории иммуноопосредованного АЕ (нежелательного явления) в степени не ниже 3 (включая повышения AST/ALT, которые считают связанным с приемом лекарственного средства, и синдром высвобождения цитокинов), которое считалось связанным с предшествующей иммуномодуляторной терапией (например, с ингибиторами иммунных контрольных точек, костимулирующими агентами и т.д.) и требующейся иммуносупрессивной терапией.
Число пациентов с ORR (частота объективных ответов) измеряют на исходном уровне и каждые шесть недель вплоть до прогрессирования заболевания или неприемлемой токсичности вплоть до 24 месяцев.
Пример 9: Антагонистическая активность антител к PD-1 в первичных Т-клетках человека и cyno
Данный пример иллюстрирует активность антител к PD-1 в первичных Т-клетках человека и яванского макака.
В этом исследовании антагонистические активности анти-PD-1 моноклонального антитела mAb7 исследовали in vitro с использованием реакции в смешанной культуре лимфоцитов (MLR). Первичные Т-клетки выделяли из мононуклеарных клеток периферической крови (РВМС) человека и яванского макака. После воздействия mAb7 пролиферацию клеток и секрецию цитокинов оценивали in vitro в разных условиях активации с использованием MLR для человека и яванского макака и анализа высвобождения цитокинов с использованием крови яванского макака, активированной суперантигеном Staphylococcal enterotoxin В (SEB).
Методы
Т-лимфоциты человека
Человеческую лейкоцитарную пленку приобретали в Центре крови Стэнфорда (Stanford, СА), разбавляли фосфатно-солевым буферным раствором (PBS) и наносили на Фиколл для выделения РВМС. hu-PBMC (человеческие РВМС) промывали 4 раза PBS и Т-лимфоциты выделяли, используя набор, специфический для выделения пан-Т-клеток человека с отрицательной селекцией, как описано в протоколе изготовителя (Miltenyi Biotec, San Diego, CA).
Т-лимфоциты яванского макака
Свежие РВМС яванского макака были приобретены у Bioreclamation IVT (New York, NY) и два раза промыты PBS. Т-лимфоциты были выделены с использованием набора, специфического для выделения пан-Т-клеток приматов, не являющихся человеком, с отрицательной селекцией, как описано в протоколе изготовителя (Miltenyi Biotec, San Diego, CA).
Получение человеческих дендритных клеток, экспрессирующих высокие уровни PD-L1
Человеческая лейкоцитарная пленка была приобретена в Центре крови Стэнфорда (Stanford, CA), разбавлена PBS и нанесена на Фиколл для выделения hu-PBMC. hu-PBMC промывали 4 раза раствором PBS и кластер дифференцировки 14 (CD14+) моноцитов выделяли, используя набор, специфический для выделения человеческих CD 14 клеток с положительной селекцией, как описано в протоколе изготовителя (Miltenyi Biotec, San Diego, CA). Затем клетки засевали по 5×105 клеток/мл в полную Roswell Park Memorial Institute (RPMI) 1640 среду с добавлением 10% фетальной бычьей сыворотки (FBS) на 7 суток. К культурам добавляли рекомбинантный человеческий (rh-) IL-4 (1000 Ед/мл) (R&D Systems, Minneapolis, MN) и rh-гранулоцитарно-моноцитарный колониестимулирующий фактор (GM-CSF) (rh-GMCSF) (500 ед/мл) (R&D Systems, Minneapolis, MN) в сутки 0, 2 и 5. Незрелые DC собирали, промывали и подсчитывали в сутки 7. Образец каждого препарата тестировали на экспрессию PD-L1 с использованием r-фикоэритрин (RPE)-меченного анти-hu-PD-L1 (eBioscience/Affymatrix, San Diego, CA) посредством проточной цитометрии с использованием анализатора LSRFortessa™ (BD Biosciences, San Jose, CA).
Получение дендритных клеток яванского макака, экспрессирующих высокие уровни PD-L1
Свежие РВМС яванского макака были приобретены в Bioreclamation IVT (New York, NY) и два раза промыты PBS. CD14+ моноциты были выделены с использованием набора, специфического для выделения CD14 клеток приматов, не являющихся человеком, с положительной селекцией, как описано в протоколе изготовителя (Miltenyi Biotech, San Diego, CA). Затем клетки высевали по 5×105 клеток/мл в полную среду RPMI 1640, с добавлением 10% FBS на 7 суток. К культурам добавляли rhIL-4 (1000 ед/мл) (R&D Systems, Minneapolis) и rh-GMCSF (500 ед/мл) (R&D Systems, Minneapolis, MN) в сутки 0, 2 и 5. Незрелые DC собирали, промывали и подсчитывали в сутки 7. Образец каждого препарата тестировали на экспрессию PD-L1 с использованием RPE-меченного анти-hu-PD-LI (eBioscience/Affymatrix, San Diego, СА) посредством проточной цитометрии с использованием анализатора LSRFortessa™ (BD Biosciences, San Jose, СА).
Получение клеточных клонов JeKo-1-Luc-Green Fluorescent Protein, экспрессирующих высокие уровни человеческого PD-L1
Клеточная линия JeKo-1 (мантийноклеточная лимфома) была приобретена в Американской коллекции типовых культур (АТСС, Manassas, VA). Клеточная линия JeKo-1-luc-2A-GFP была получена в компании Pfizer (South San Francisco, СА) с помощью процесса трансдукции, в котором использовали лентивирусные частицы, экспрессирующие отдельно люциферазу светлячка (luc2A) и зеленый флуоресцентный белок (GFP) посредством бицистронной системы с маркером бластицидином (AMSBIO, LVP323, 1×10Е7 частиц на 200 мкл) в соответствии с протоколом изготовителя. Клетки JeKo-1 осаждали центрифугованием и разбавляли до 1×106 клеток/мл в среде RPMI с 20% FBS. Лентивирусные частицы добавляли к разбавленным клеткам в соотношении 50 мкл вируса на 0,5 мл клеток. Для получения клеточной линии JeKo-1, экспрессирующей hu-PD-L1, кДНК hu-PD-L1 обычно синтезировала и клонировала в унифицированный экспрессионный вектор (pcDNA3.1) компания Life Technologies (San Diego, СА). Клеточная линия JeKo-1-Luc-GFP, стабильно экспрессирующая hu-PDL-1, была произведена Pfizer (South San Francisco, СА) посредством электропорации с использованием системы Amaxa® Nucleofector (Lonza, Walkersville, MD) и Kit V (набора V), используемого в соответствии с протоколом изготовителя (Lonza, Walkersville, MD). Затем клетки выращивали в присутствии 250 мкг/мл гигромицина в течение 2 недель и после этого отбирали посредством сортировки клеток с использованием клеточного сортировщика BD FACSAria™ II (BD Biosciences, San Jose, СА). Сортировку клеток проводили с клоном MIH-1 анти-hu-PD-L1 антитела (Affymetrix/eBioscience, San Diego, СА), непосредственно меченного аллофикоцианином (АРС). Положительные клоны выращивали и анализировали в отношении высокой экспрессии PD-L1 с использованием проточной цитометрии (анализатор LSRFortessa™, BD Biosciences, San Jose, CA). Были отобраны клоны, полученные из односортных клеток и имеющие высокий уровень экспрессии PD-L1.
Получение антител
mAb7 получали в клетках СНО (Pharmaceutical Sciences, Pfizer Inc, Saint Louis, МО) с использованием материала Good Laboratory Practices (GLP) (партия номер STL0005717) и представляли в буфере из 20 мМ гистидина, 85 мг/мл сахарозы, 0,2 мг/мл полисорбата-80, 0,05 мг/мл двунатриевой EDTA, рН 5,5. Эндотоксин был измерен как составляющий не более 0,01 ЭЕ/мг.
Контрольным антителом, используемым во всех анализах in vitro, было антитело к вируса бычьего герпеса, клонированное в структуру IgG4-HG (такую же структуру, как у МАВ7). Контрольное антитело было получено в Pfizer (South San Francisco, CA), партия номер 4945, с не более чем 0,3 ЭЕ/мг эндотоксина.
Два анти-hu-PD-1 антитела были получены из последовательностей, опубликованных в предыдущих патентах и экспрессированных в структуре IgG4-HG, похожей на структуру, используемую для МАВ7. Антитела были получены в Pfizer (South San Francisco, CA) и обозначены как положительный контроль 1 и положительный контроль 2 (партия номер 5053 и 4255 соответственно). Измеренный эндотоксин составлял не более 0,13 ЭЕ/мг и не более 0,056 ЭЕ/мг соответственно.
Человекоориентированный анализ с использованием дендритных клеток, экспрессирующих высокие уровни PD-L1
Протокол из Kruisbeek et al, 2004 был адаптирован посредством некоторых модификаций. Дифференцированные первичные hu-DC были собраны на 7 сутки и проверены с помощью проточной цитометрии на высокие уровни экспрессии PD-L1 и ко-стимулирующих сигналов, необходимых для активации Т-клеток; маркеры включали CD80 и CD86 (антитела, приобретенные у BD Bioscience, San Jose, CA). Клетки подсчитывали и облучали 3000 единицами излучения (рад) с использованием рентгеновского аппарата RS2000 (Radsource, Brentwood, TN) для предупреждения секреции цитокинов дендритными клетками, но с функционированием только для обеспечения презентации антигена Т-клеткам. Таким образом, результат анализа был вызван только Т-клетками. На 7 сутки собирали свежевыделенные hu-T-клетки от аллогенных доноров. Т-клетки помещали в планшеты с облученными DC в соотношении 10:1 (оптимальные условия анализа были определены как 2×105 Т-клеток, инкубируемых с 2×104 DC в 200 мкл культуры) в присутствии разных концентраций mAb7, отрицательных и положительных контрольных антител или одной среды (для оценки исходной реакции). Все варианты условий помещали в обработанные 96-луночные планшеты с плоским дном для тканевых культур (Fisher Scientific Pittsburg, РА). Клетки культивировали с использованием бессывороточных сред X-vivo15 (Lonza, Walkersville, MD) для предупреждения изменчивости человеческой сыворотки в экспериментах. Культуры инкубировали при 37°С с 5% CO2 в течение 5 суток. На 5 сутки супернатанты собирали и измеряли концентрацию цитокинов с использованием массива цитометрических гранул (СВА) (BD Biosciences, San Jose, СА) в соответствии с протоколом изготовителя. Данные были получены с использованием проточной цитометрии (анализатор LSRFortessa™, BD Biosciences, San Jose, СА) и анализ данных выполнялся с использованием программного обеспечения BD FCAP Array версия 3.0 (BD Biosciences, San Jose, СА). Пролиферацию измеряли в параллельных культурах путем добавления 1 μCi 3Н-метил-тритированного тимидина (Perkin Elmer, Waltham, MA) в каждую лунку и затем инкубировали в течение 16-18 часов. Затем культуры собирали на фильтры, захватывающие дезоксирибонуклеиновую кислоту (ДНК) (Perkin Elmer, Waltham, MA) и по включению тритированного тимидина определяли индекс пролиферации клеток, измеренный как импульсы в минуту (срт) с использованием аппарата MicroBeta2 (Perkin Elmer, Waltham, MA).
Человекоориентированный анализ с использованием клеточной линии JeKo1, экспрессирующей PD-L1
Этот анализ проводили с использованием соотношения 5:1 Т-клеток к клеточной линии JeKo-1-PD-L1, так как это соотношение обеспечивало более идеальный подход к установлению секреции цитокинов на 5 сутки. Таким образом, в каждой лунке инкубировали 2×105 Т-клеток с 4×104 JeKo-1-PD-L1. На 5 сутки супернатанты собирали и измеряли концентрации цитокинов с использованием СВА (BD Biosciences, San Jose, СА) в соответствии с протоколом изготовителя. Эта клеточная линия экспрессирует очень незначительное количество ко-стимулирующих молекул (CD80 и CD86) и, таким образом, повышение пролиферации является очень незначительным после лечения антителами. Напротив, секреция цитокинов, включая IL-2, является стабильной, что позволяет измерять секрецию цитокинов после лечения mAb7, а не пролиферацию Т-клеток.
Анализ ориентированный на яванского макака с использованием дендритных клеток, экспрессирующих высокие уровни PD-L1
Дифференцированные DC собирали на 7 сутки и контролировали посредством проточной цитометрии (с использованием анализатора LSRFortessa™, BD Biosceinces, San Jose, CA) в отношении высокого уровня экспрессии PD-L1 и ко-стимулирующих сигналов, необходимых для активации Т-клеток; маркеры включали CD80 и CD86 (антитела из BD Bioscience, San Jose, СА). Клетки подсчитывали и облучали 3000 рад с использованием рентгеновского аппарата RS2000 (Radsource, Brentwood, TN). Собирали свежевыделенные Т-клетки яванского макака из аллогенных доноров. Т-клетки помещали в планшеты с облученными DC d соотношении 10:1 Т-клетки к DC (оптимальный анализ, когда 2×105 Т-клеток инкубировали с 2×104 DC в 200 мкл культуры) в присутствии разных концентраций mAb7, антител отрицательного и положительного контроля или одной среды для определения исходной реакции. Все варианты условий помещали в предварительно обработанные 96-луночные планшеты с плоским дном для тканевой культуры (Fisher Scientific Pittsburg, PA). Клетки культивировали, используя бессывороточную среду X-vivo15 (Lonza, Walkersville, MD) для предупреждения вариабельности сыворотки в экспериментах. Культуры инкубировали при 37°С с 5% CO2 в течение 5 суток. На 5 сутки супернатанты собирали и концентрации цитокинов измеряли, используя СВА (BD Biosciences, San Jose, СА), в соответствии с протоколом изготовителя. Данные были получены с использованием проточной цитометрии (анализатор LSRFortessa™, BD Biosceinces San Jose, СА) и анализ данных выполняли с использованием программного обеспечения BD FCAP Array Версия 3.0 (BD Biosciences, San Jose, СА). В то же время и в аналогичных культурах в каждую лунку добавляли 1 μCi 3Н метил-тритированного тимидина (Perkin Elmer, Waltham, MA); клетки дополнительно культивировали в течение 16-18 часов для измерения пролиферации. Культуры собирали на ДНК-захватывающие фильтры Glass Printed filtermate A (Perkin Elmer, Waltham, MA) и по включению тритированного тимидина определяли индекс пролиферации клеток, измеренный как ерш с использованием счетчика MicroBeta2 (Perkin Elmer, Waltham, MA).
Высвобождение цитокинов из крови яванского макака, индуцированное суперантигенной стимуляцией (стафилококковый энтеротоксин В (SEB))
Собирали цельную кровь яванского макака; 225 мкл крови аликвотировали в обработанные 96-луночные планшеты для тканевой культуры (Fisher Scientific, Pittsburg, РА). Образцы инкубировали в двух повторах при 37°С в 5% CO2 в присутствии mAb7 или родственного по изотипу антитела, являющегося отрицательным контролем, в концентрациях в диапазоне от 0,1 до 100 мкг/мл. Через час после добавления антител, образцы стимулировали 0,1 мкг/мл SEB (Toxic Technologies, Sarasota, FL) и культуры инкубировали в течение 3 суток. На 3 сутки собирали плазму, ее объединяли и замораживали при -80°С. Концентрацию IFN-γ, IL-2 и TNF-α в размороженных образцах сыворотки измеряли в двух повторах в соответствии с протоколом изготовителя с использованием планшетов для иммуноанализа MSD (Meso Scale Diagnostics, Rockville, MD), планшетного считывающего устройства MSD Reader (Model 1200) с программным обеспечением MSD Discovery Workbench (Версия 4.0.12). Регистрировали среднее значение от двух повторов.
Результаты
Антагонистическая активность mAb7 на первичных Т-клетках человека
Когда первичные человеческие Т-клетки активировали в MLR с помощью аллогенных DC человека, экспрессирующих PD L1, mAb7 увеличивал пролиферацию Т-клеток (измеренную по включению тритированного тимидина) и активацию Т-клеток (измеренную по секреции провоспалительных цитокинов) дозозависимым образом. Обработка Т-клеток антителом mAb7 (10 мкг/мл) приводила к увеличению пролиферации Т-клеток вплоть до 2,5 раза по сравнению с обработкой антителом (10 мкг/мл) отрицательного контроля. Уровни IFN-γ и TNF-α были повышены вплоть до 8- и 5-кратных, соответственно, по сравнению с антителом отрицательного контроля. Увеличение IFN-γ было больше, чем увеличение TNF-α. Экспрессия IL-2 не была обнаружена в этих культурах. Когда первичные человеческие Т-клетки были активированы в MLR с использованием опухолевой клеточной линии JeKo 1 PD-L1 в качестве аллогенных антигенпредставляющих клеток, mAb7 индуцировал дозозависимое увеличение секреции IFN-γ (вплоть до 2,5-кратной), TNF-α (вплоть до 2-кратной) и IL-2 (вплоть до 5-кратной) по сравнению с антителом отрицательного контроля. Эффект mAb7 в этом анализе напоминает данные, полученные с обоими антителами положительного контроля. Повышенная пролиферация Т-клеток в этих условиях не наблюдалась. Пролиферация клеток была минимальной со слабым сигналом, обеспечиваемым CD80 и CD86, по сравнению с MLR, опосредованным первичными DC. IL-10, IL-4, IL-17A и IL-6 были от минимальных до практически не обнаруживаемых во всех описанных выше анализах.
Антагонистическая активность mAb7 в отношении первичных Т-клеток яванского макака.
Аффинность связывания mAb7, находящегося в растворе, с PD-1 человека и яванского макака была очень похожа в кинетическом эксклюзионном анализе (KinExA) (KD=23 и 28 пМ для PD-1 человека и яванского макака соответственно). Значение ЕС50 mAb7 в отношении клеток, экспрессирующих PD-1 человека и яванского макака, также были очень похожи. В функциональном анализе MLR, где использовались Т-клетки и ДК, выделенные из разных яванских макак, mAb7 индуцировал пролиферацию и активацию Т-клеток дозозависимым образом (измеренные по включению тритированного тимидина). Этот эффект наблюдался также с положительным контролем (антитело 1 и антитело 2), но не с антителом отрицательного контроля. mAb7 также повышал секрецию цитокинов (то есть IFN-γ и TNF-α, вплоть до 5-кратной и 3-кратной по сравнению с обработкой антителом отрицательного контроля. Экспрессия IL-2 в этих культурах не была обнаружена. В другом анализе высвобождения цитокинов с использованием цельной крови яванского макака, стимулированной 0,1 мкг/мл суперантигена SEB в течение 3 суток, mAb7 (0,1-100 мкг/мл) индуцировал более высокую секрецию IFN-γ, IL-2 и TNF-α по сравнению с антителом отрицательного контроля.
Исследования MLR использовали для создания in vitro окружения, напоминающего микроокружение опухоли, где Т-клетки активируются и экспрессируется высокий уровень PD-1 в присутствии аллогенных DC или опухолевых клеток, экспрессирующих PD-L1. Взаимодействие PD-1/PD-L1 ингибирует дальнейшую пролиферацию Т-клеток и высвобождение цитокинов. Добавление антител к PD-1 в этих MLR восстанавливало активацию Т-клеток и увеличивало пролиферацию и секрецию цитокинов, особенно IFN-γ, из-за блокирования оси PD-1/PD-L1.
mAb7 ускорял пролиферацию и секрецию IFN-γ, TNF-α и IL-2 человеческими Т-клетками при культивировании с аллогенными клетками, экспрессирующими высокие уровни PD-L1 (DC или клеточная линия JeKo 1 PD-L1). Напротив, антитело отрицательного контроля, которые показало себя аналогичными одной среде, не усиливал эти эффекты. Аналогично, mAb7 повышал пролиферацию Т-клеток, секрецию IFN-γ и TNF-α в системе MLR яванского макака, а также усиливал высвобождение цитокинов из цельной крови яванского макака при использовании суперантигена SEB.
Эти результаты показывают, что антитело к PD-1 mAb7 усиливает пролиферацию Т-клеток и секрецию провоспалительных цитокинов, включая гамма-интерферон (IFN-γ), фактор некроза опухолей альфа (TNF-α) и интерлейкин (IL)-2. Эти активности наблюдались в первичных Т-клетках как человека, так и яванского макака.
Пример 10: Эффект антител к PD-1 в реакции трансплантат против хозяина
Данный пример иллюстрирует влияние антител к PD-1 на активацию и размножение Т-клеток in vivo с использованием модели xeno-aGvHD у мышей NSG с перенесенными hu-PBMC.
В этом исследовании влияние антитела к PD-1 mAb7 на активацию и размножение Т-клеток in vivo изучали в модели острой реакции "ксеногенного трансплантата против хозяина" (aGvHD) при диабете без ожирения (NOD), тяжелом комбинированном иммунодефиците (SCID), у мышей без гамма рецептора интерлейкина 2 (IL2rγnull) (NSG) с использованием мононуклеарных клеток периферической крови (РВМС) человека.
Мышей-самок с ослабленным иммунитетом NSG (5 на группу) в возрасте от 8 до 10 недель (официальное название NOD, Cg-PrkdcscidIl2rgtm1Wjl/SzJ) приобретали в Jackson Laboratory (Bar Harbor, ME). Всех животных размещали в помещении без патогенов в Pfizer (South San Francisco, СА) в соответствии с требованиями комитета по содержанию и использованию лабораторных животных (IACUC).
Человеческую лейкоцитарную пленку приобретали в Центре крови Стэнфорда (Standord, CA), разбавляли фосфатным буферным раствором (PBS) и наносили на слой фиколла для выделения РВМС. РВМС промывали 2 раза раствором PBS. Эритроциты (RBC) лизировали, используя лизирующий буфер аммоний-хлорид-калий (ACK), как указано в протоколе изготовителя (Life Technologies; San Diego, CA). После лизиса RBC клетки еще раз промывали и разбавляли PBS в количестве 5×107 клеток на мл.
Для индукции ксено-aGvHD мышам NSG внутривенно инъецировали через хвостовую вену человеческие РВМС. Каждая мышь получала 1×107 клеток в 200 мкл PBS. Во всех экспериментах мышей взвешивали 3 раза в неделю и наблюдали за появлением ксено-aGvHD-подобных симптомов, включающих потерю массы, сгорбленную позу, взъерошенный мех, снижение подвижности, а в некоторых случаях диарею. Мышей подвергали эвтаназии после потери 20% массы тела или потери 1 г/сутки в течение 2 суток; этот момент времени зарегистрировали как время выживания. mAb7, антитело отрицательного контроля и антитела положительного контроля получали, как описано выше в Примере 9.
Мышей NSG обрабатывали антителами отрицательного контроля, антителами положительного контроля или mAb7 в диапазоне доз 0,1-10 миллиграмм на килограмм (мг/кг). Антитела вводили мышам с использованием подходящего носителя на 2-е сутки и 8-е сутки после переноса hu-PBMC. Путь введения антител был внутрибрюшинным (вб).
Периферическую кровь, селезенку и печень собирали у мышей с трансплантированными hu-PBMC. Одноклеточные суспензию из каждого органа получали следующим образом: собирали периферическую кровь и эритроциты лизировали с использованием ACK-лизирующего буфера и промывали PBS. Селезенку и печень механически гомогенизировали с использованием основания поршня шприца для извлечения клеток через 70 мкМ фильтр и промывали один раз PBS. Эритроциты лизировали и клетки промывали еще 2 раза и извлекали еще раз, пропуская через 70 мкМ фильтр. На этой стадии клетки селезенки были готовы. Для выделения лейкоцитов из печени, одноклеточные суспензии наслаивали с использованием градиента Перколла от 30% до 80% (Percoll® Plus, GE Healthcare Bio-Sciences, Pittsburgh, PA) и подвергали высокоскоростному центрифугированию. Лейкоциты собирали из промежуточного слоя и два раза промывали PBS. Все одноклеточные суспензии подсчитывали и 1×106 клеток из каждого образца использовали для сортировки флуоресцентно-активированных клеток (FACS). Для анализов секреции цитокинов человека мышиные клетки CD45+ обедняли с использованием набора для специфического выделения мышиных клеток CD45 посредством положительной селекции, как описано в протоколе изготовителя (Miltenyi Biotec, San Diego, CA), чтобы быть уверенными, что только человеческие иммунные клетки осуществляют секрецию цитокинов. Клетки подсчитывали и в анализе использовали 1×106 клеток из каждого образца.
Одноклеточные суспензии из периферической крови, селезенки и печени были получены от ксено-aGvHD мышей. В общей сложности 1×106 клеток на образец инкубировали в течение 30 минут при 4°С с защитой от света со смесью соответствующих флуоресцентно меченных моноклональных антител в буфере FACS, включающем 1×PBS, содержащий 2% эмбриональной бычьей сыворотки (FBS), затем клетки промывали буфером FACS. Для внутриклеточного окрашивания белка Kiel67 (Ki67 для измерения пролиферирующих клеток) клетки фиксировали после поверхностного окрашивания с использованием набора Intracellular Fixation & Permeabilization Buffer (Affymetrix/eBioscience, San Diego, CA) в соответствии с протоколом изготовителя. Внутриклеточное окрашивание проводили в течение 30 минут при 4°С в темноте. По окончании окрашивания образцы промывали и подвергали многоцветной проточной цитометрии с использованием клеточного анализатора BD LSR Fortessa™ (BD Biosciences, San Jose, CA). Анализы данных проводили с использованием программы FlowJonull (FLOWJO LLC, Ashland, OR). Антитела, используемые в разных комбинациях для распознавания молекул клеточной поверхности, представляли собой: анти-hu-CD45 Pacific Blue (РВ) или Amcyan, анти-мышиный CD45-бриллиантовый фиолетовый (BV)-711, анти-hu-CD3-PerCPCy5.5, анти-hu-CD8 фикоэритрин-Су7 (РЕ-Су7) или BV-786, анти-hu-CD4-флуоресцеин изотиоцианат (FITC) или BV-650, анти-hu-PD-1 (клон ЕН12.1) BV-786 или РЕ, анти-hu-PD-1 (клон MIH-4) РЕ или FITC, анти-hu-Ki67 аллофикоцианин (АРС) (все антитела из BD Biosciences, San Jose, CA), анти-hu-PD-L1 (PE-Affymatrix-eBioscience, San Diego, CA) и синий флуоресцентный реактивный краситель для окрашивания живых/мертвых клеток (Life Technologies, Grand Island, NY).
Одноклеточные суспензии CD45 обогащенной популяции клеток человека из селезенки и печени были получены из ксено-aGvHD мышей (после истощения мышиных CD45). В общей сложности 1×106 клеток на образец инкубировали в обработанных 96-луночных планшетах с плоским дном для культуры ткани (Fisher Scientific; Pittsburg, РА) в 200 мкл среды X-vivo 15. Затем клетки оставляли нестимулированными или стимулировали 10 нг/мл форболмиристацетата (РМА) и 125 нг/мл иономицина (iono) в качестве условий низкой стимуляции, или 50 нг/мл РМА и 1 мкг/мл иономицина в качестве условий высокой стимуляции (оба получены от Sigma-Aldrich, Saint Louis, МО). Культуры инкубировали в течение 8 часов при 37°С в 5% СО2 для обеспечения максимальной секреции цитокинов. Собирали супернатанты и измеряли концентрации цитокинов человека с использованием массива цитометрических гранул (СВА), специфичного для цитокинов человека (BD Biosciences, San Jose, СА) в соответствии с протоколом изготовителя. Данные были получены с использованием проточной цитометрии (анализатор LSRFortessa™, BD Biosciences, San Jose, СА) и анализ данных выполняли с использованием программного обеспечения FCAP Array™ Версия 3.0 (BD Biosciences, San Jose, СА). Наборы hu-IFN-γ, hu -TNF-α и hu-IL-2 гранул были приобретены в BD Biosciences (San Jose, СА) и было подтверждено, что они не взаимодействуют перекрестно с цитокинами мышей.
Все анализы включали сравнение средних значений с использованием t-критерия для независимых выборок или двустороннего ANOVA с использованием Graphpad Prism (программное обеспечение Graphpad, San Diego, СА). Значения р≤0,05 считались статистически значимыми. Данные по приживлению изображены на фигурах в виде средних концентраций, включающих стандартную ошибку среднего (sem).
Обработка NSG-мышей с ослабленным иммунитетом анти-PD-1 антителом mAb7 ускоряло потерю массы тела (таблица 17) и индуцировало другие признаки болезни, которые обычно наблюдаются в этой модели, такие как сгорбленная поза, взъерошенный мех, снижение подвижности, и в некоторых случаях диарею. Ожидается, что в этой модели потеря массы тела ускоряется от суток 20 до суток 30 после трансплантации (см., например, Schroeder and DiPersio, 2011). Поскольку обработка mAb7 и положительными контролями 1 и 2 ускоряла симптомы ксено-aGvHD, мышей нужно было подвергать эвтаназии в более ранние сроки и кривая выживаемости не могла быть получена; следовательно, потеря массы тела была первичным итоговым показателем. В первом эксперименте мышей обрабатывали 0,1, 1 и 10 мг/кг mAb7 или антителом отрицательного контроля в количестве 10 мг/кг.В таблице 17 потеря массы тела рассчитана путем нормализации разницы в массе тела между обработанными группами на 23 сутки относительно 0 суток. Значения показывают среднее значение для 5 мышей на группу ±sem.
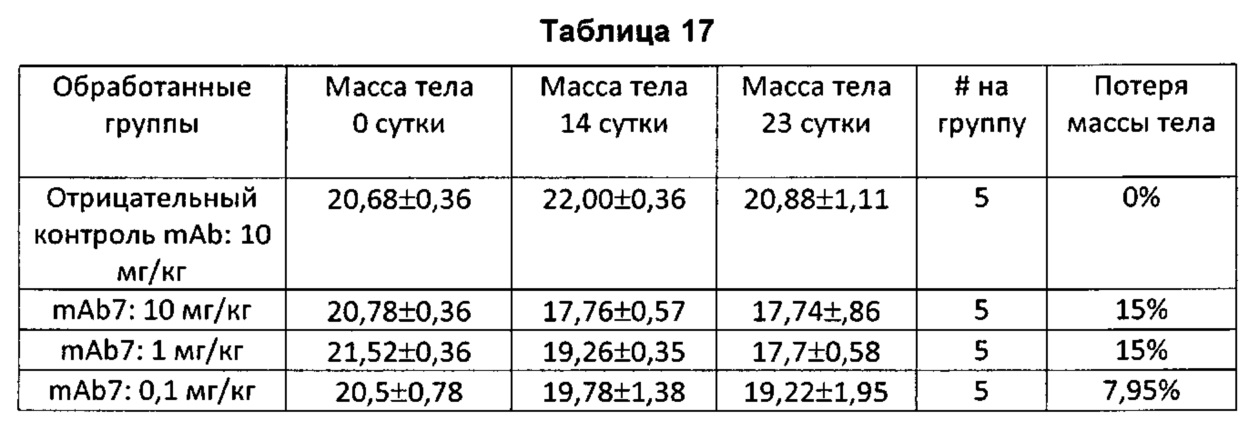
Мышей обрабатывали указанными антителами на 2 сутки и 8 сутки после трансплантации hu-PBMC. В то время как потеря массы тела становилась очевидной в контрольной группе на 23-е сутки, потеря массы тела и прогрессирование заболевания были обнаружены у отдельных мышей из всех групп, обработанных антителом к PD-1 mAb7, начиная с 10-11 суток после трансплантации hu-PBMC. В обеих группах, обработанных 1 мг/кг и 10 мг/кг, потеря массы тела достигла значимости в период от 14 до 23 суток по сравнению с группой, обработанной отрицательным контролем (р≤0,0001). На 23 сутки 15% потеря массы тела была обнаружена в группах, обработанных 1 мг/кг и 10 мг/кг, и 7,9% потеря массы тела была обнаружена в группе, обработанной 0,1 мг/кг (таблица 17).
Анализы FACS периферической крови, печени и селезенки демонстрировали увеличение процента hu-CD45 положительных клеток и hu-CD3 положительных Т-клеток в mAb7-обработанной группе по сравнению с контрольной группой. Репрезентативные данные по селезенке также показали увеличение количества hu-CD8 положительных Т-клеток и количества hu-CD4 положительных Т-клеток (но в меньшей степени) в группе, обработанной mAb7, по сравнению с группой, обработанной антителом отрицательного контроля. Аналогичное увеличение также было отмечено в количестве hu-T-клеток в печени и крови. Чтобы оценить, было ли увеличение Т-клеток связано с блокадой PD-1 в результате связывания mAb7 с человеческими Т-клетками, Т-клетки окрашивали имеющимися в продаже антителами к PD-1 (клон ЕН12.1), которые конкурируют за связывание с mAb7. mAb7-обработанные лимфоциты из всех органов (проанализированные с помощью FACS) показали отсутствие связывания с ЕН12.1. Чтобы подтвердить, что Т-клетки, обработанные mAb7, все еще экспрессируют PD-1, Т-клетки окрашивали другим анти-hu-PD-1 клоном (клон MIH4), который частично конкурирует с mAb7 за связывание с Т-клетками. Результаты показали, что Т-клетки, обработанные mAb7, частично связывают MIH4; таким образом, указывая, что PD-1 был экспрессирован на обработанных Т-клетках и, что блокирование PD-1, вызванное mAb7, была очевидным (данные не показаны, сохранены во внутренних документах Pfizer). Не было обнаружено заметных изменений экспрессии hu-PD-L1 в селезенке, на Т-клетках человека (hu-CD3 положительные) или на не-hu-Т-клетках (hu-CD3 отрицательные). Ki67, маркер пролиферации лимфоцитов, был повышен в hu-CD3 положительных клетках из PF-0681591-обработанной группы по сравнению с группой, обработанной отрицательным контролем в средней панели для селезенки). Аналогичные результаты наблюдались в крови и печени.
Чтобы исследовать влияние mAb7 на высвобождение цитокинов при ксено-aGvHD, hu-CD45-положительные клетки (из печени и селезенки) были дополнительно выделены из мышиных CD45-положительных клеток. Эти лимфоциты затем были обработаны смесью РМА и иономицина (в двух концентрациях: низкой по сравнению с высокой) или оставлены без обработки в течение 8 часов при 37°С. Секрецию цитокинов измеряли в супернатантах посредством СВА (таблица 18). Без стимуляции не было получено детектируемых цитокинов (таблица 18). После обработки mAb7 hu-IFN-γ, hu-IL-2 и hu-TNF-α были повышены в человеческих лимфоцитах, выделенных и из мышиной селезенки, и из мышиной печени, по сравнению с контрольными группами. В условиях слабой стимуляции ex vivo в mAb7-обработанных Т-клетках увеличилась секреция hu-IFN-γ до уровней, которые были значительно выше, чем в Т-клетках, выделенных из группы отрицательного контроля (р≤0,05). В условиях сильной стимуляции ex vivo все цитокины были индуцированы во всех группах, но дополнительное увеличены в mAb7-обработанных Т-клетках по сравнению с Т-клетками, выделенными из отрицательных контролей. В Таблице 18 показаны данные, собранные от 5 разных мышей в каждой группе. В Таблице 18, *р<0,05, **р<0,01 в непарном t-критерии сравнения mAb7 с отрицательной контрольной группой; aGvHD=острая болезнь "трансплантат против хозяина"; Hu = человек; IFN-γ = гамма интерферон; IL-2=интерлейкин-2; Ino = Иономицин; N = число; ns = незначительное; Р = значение Р; РМА = Форболмиристацетат; TNFα = Фактор некроза опухоли альфа; Ксено = ксеногенный.
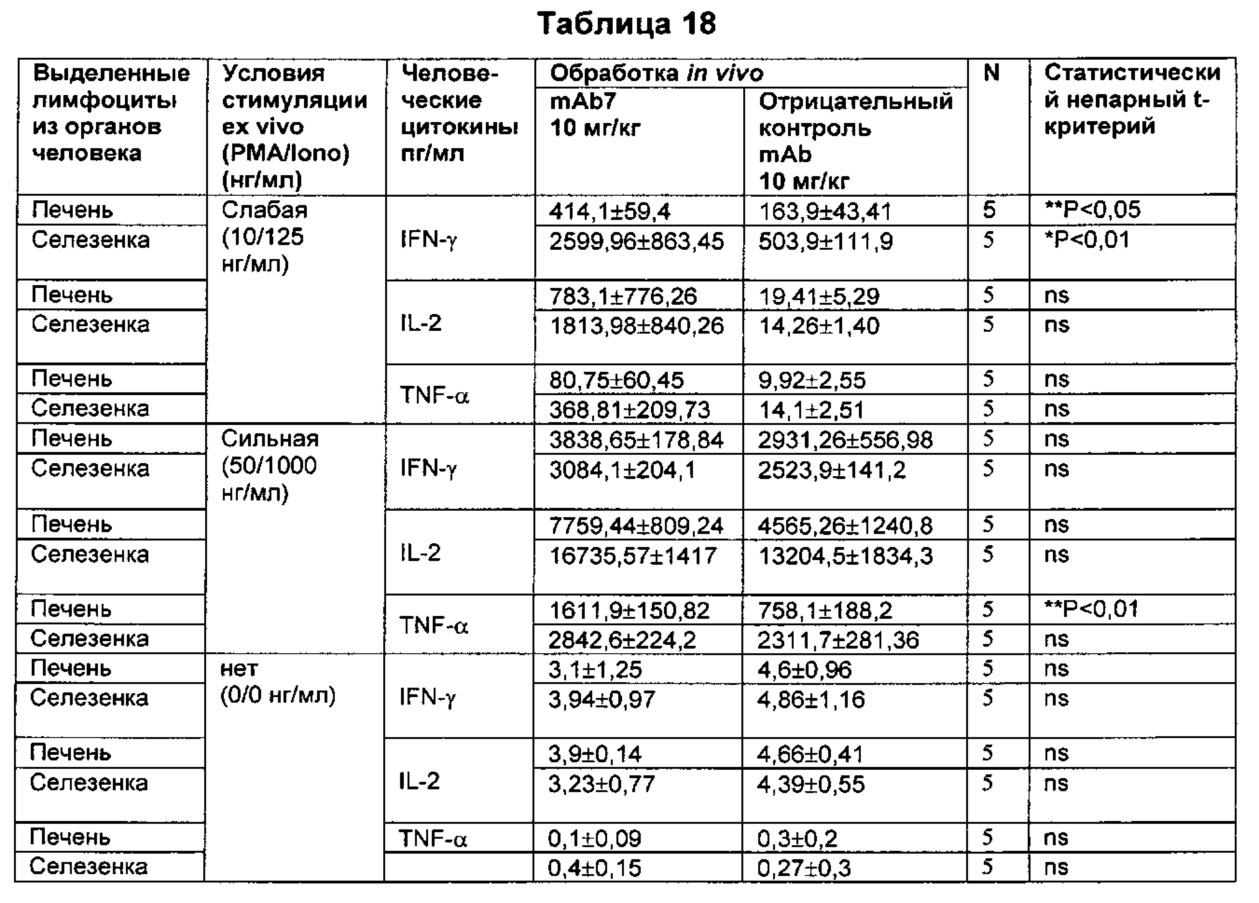
Эти результаты показывают, что обработка ксено-aGvHD анти-PD-1 антителом mAb7 ускоряет развитие ксено-aGvHD у мышей NSG, о чем свидетельствует потеря массы тела, пролиферация Т-клеток и повышенная секреция цитокинов, включая гамма-интерферон (IFN-γ) и интерлейкин-2 (IL-2).
Пример 11: Характеристика анти-PD-1 антител
Данный пример иллюстрирует аффинность связывания, специфичность и лиганд-блокирующую активность анти-PD-1 антитела mAb7 на клетках, экспрессирующих поверхностный рецептор PD-1. mAb7, антитело, являющееся отрицательным контролем, и антитела, являющиеся положительным контролем, были получены, как описано выше в Примере 9. Анти-hu-PD-1 антитело (клон ЕН12.1), первичные, меченные фикоэритрином (РЕ) или бриллиантовым фиолетовым (BV)-786 антитела и антитела изотипического контроля, меченные теми же красителями, были приобретены у BD Biosciences (San Jose, CA). РЕ-меченое антимышиное PD-1 антитело (клон J43) и анти-хомячковое IgG антитело изотипического контроля были приобретены у Affymetrix/eBiosciense (San Diego, CA). Биотинилированный hu-PD-L1 и биотинилированный hu-PD-L2 (CD273) были получены от ACRO Biosystems (Newark, DE). PD-L1 и PD-L2 яванского макака были приобретены у Creative BioMart® Recombinant Proteins (Shirley, NY) и оба были помечены Alexa Fluor® 647dye, без привлечения внешних специалистов, с использованием набора для маркировки белков Alexa Fluor® 647 (LifeTechnologies, San Diego, CA), как указано в протоколе изготовителя. PD-L1 и PD-L2 яванского макака тестировали на связывание с линией клеток, экспрессирующей PD-1 яванского макака. Крысиные и мышиные PD-L1-Fc-Теги (Fc-участок человеческого IgG1 на С-конце) были приобретены у Creative BioMart® Recombinant Proteins (Shirley, NY). Обнаружение биотинилированного PD-L1 и PD-L2 осуществляли с использованием стрептавидина РЕ или аллофикоцианина (АРС) (Affymetrix/eBiosciense, San Diego, CA). Обнаружение крысиного или мышиного PD-L1 осуществляли с использованием АРС-меченого специфического к фрагменту Fc-гамма (Fcγ) аффинно очищенного (affiniPure) F(ab')2 антитела осла против IgG человека (Jackson ImmunoResearch Laboratories Inc, West Grove, PA).
Векторы для временной трансфекции
Экспрессионная плазмида hu-PD-1 (в векторе pCMV6-Entry) была приобретена у OriGene Technologies, Inc (Rockville, MD), каталожный номер RC210364/регистрационный номер NM_005018.
Экспрессионная плазмида мышиного PD-1 (в векторе pCMV6-Entry) была приобретена у OriGene Technologies, Inc (Rockville, MD), каталожный номер MR227347/регистрационный номер NM_008798. PD-1 яванского макака был кодон-оптимизирован и синтезирован в Life Technologies (San Diego, СА), партия 1482149/регистрационный номер EF443145. Он был клонирован в защищенную правом собственности компании Pfizer (San Francisco, СА) экспрессионную плазмиду на основе цитомегаловируса (CMV) в рамке считывания с мышиной каппа секреторной сигнальной последовательностью, которая добавляет С-концевой тег FLAG на С-конец.
Дезоксирибонуклеиновую кислоту (ДНК) крысиного PD-1 синтезировали на заказ в соотвествии с последовательностью с регистрационным номером NM_001106927 и клонировали в сайты BamHI-Notl экспрессирующего вектора pEF1V5-His из LifeTechnologies (San Diego, СА), партия номер 1598305.
Экспрессионные векторы PD-1 для стабильной трансфекции
ДНК hu-PD-1 синтезировали на заказ в соотвествии с последовательностью с регистрационным номером NM_005018 и клонировали в сайты BamHI-NotI Invitrogen экспрессирующего вектора pEF1V5-His В9 Invitrogen); партия номер 513478.
ДНК PD-1 яванского макака синтезировали на заказ в соотвествии с последовательностью с регистрационным номером EF443145 и клонировали в сайты BamHI-NotI Invitrogen экспрессирующего вектора pEF1V5-His В (Invitrogen), партия номер 1482149.
ДНК мышиного PD-1 синтезировали на заказ в соотвествии с последовательностью с регистрационным номером NM_008798 и клонировали в сайты BamHI-NotI экспрессирующего вектора pEF1V5-His В (Invitrogen), партия номер 1513476.
Все векторы синтезировали и клонировали в экспрессионный вектор pEF1V5-His В (Invitrogen) в Life Technologies (San Diego, СА). Все векторы содержат полную последовательность PD-1, включая внеклеточный домен, мембранный домен и цитозольный домен. Все векторы кодировали тег эпитопа V5-6His на С-конце PD-1. Ген резистентности к неомицину включали в каждый вектор для селекции с использованием G418 сульфатных антибиотиков.
Временная трансфекция с использованием клеточной линии HEK-293Т
Клетки HEK-293Т были приобретены в Американской коллекции клеточных культур (АТСС®, Manassas, VA), и клетки поддерживали в среде Игла в модификации Дульбекко (DMEM) (Corning CellGro, Manassas, VA) с добавлением 10% фетальной бычьей сыворотки (FBS) и 1×пенициллина/стрептомицина (Pen/Strep) и выращивали в 6% углекислого газа (СО2) при 37°С. За один сутки до трансфекции клетки трипсинизировали и высевали в количестве 4×106 клеток на флакон Т75 (Fisher Scientific, Pittsburg, РА). В сутки трансфекции старые среды заменяли предварительно нагретыми средами, не содержащими антибиотиков, и клетки дополнительно инкубировали в течение 2 часов при 37°С в 6% СО2. Экспрессионный вектор или пустой вектор (10 мкг) добавляли к 1,5 мл среды OptiMEM (Life Technologies, San Diego, CA). Затем реагент липофектамин 2000 (20 мкл) (Life Technologies, San Diego, CA) добавляли к другим 1,5 мл OptiMEM. Затем пробирки с плазмидой OptiMEM и липофектамином OptiMEM смешивали вместе и инкубировали при комнатной температуре в течение 25 минут. Затем смесь OptiMEM добавляли по каплям в соответствующий культуральный флакон и этот флакон оставляли на ночь при 37°С в 6% СО2. На следующие сутки среды удаляли из флакона и заменяли полной ростовой средой. Через 48 часов после трансфекции клетки собирали с использованием StemPro Accutase (Life Technologies, San Diego, CA), тем самым обеспечивая возможность осторожно удалять клетки с культуральной поверхности, не влияя на поверхностную экспрессию PD-1. Затем клетки подвергали анализам связывания с антителом и сортировке флуоресцентно-активированных клеток (FACS).
Стабильная трансфекция с использованием клеточной линии Jurkat
Клеточную линию Jurkat (клон E6-1-TIB-152™, АТСС®, Manassas, VA), использовали для стабильной экспрессии PD-1 человека и яванского макака. Клеточные линии получали с использованием электропорации посредством системы Amaxa necluotransfector (Lonza, Walkersville, MD). Трансфекции были осуществлены компанией Pfizer (San Francisco, CA) с использованием набора Kit V, как указано в протоколе изготовителя (Lonza, Walkersville, MD). Клетки поддерживали в ростовых средах Мемориального института Розуэлл-парк (RPMI)-1640, дополненной 10% FBS и 1×L-глутамина (LifeTechnologies, San Diego, CA) при 37°C в 5% CO2 при плотности от 0,3 до 1,0×106 клеток/мл. Для каждого из векторов использовали 2 мкг/мл для трансфекции 2×106 клеток. После трансфекции клетки выращивали в присутствии G418 сульфата (600 мкг/мл) в течение 2 недель для селекции и сохранения стабильно трансфицированных клеток. Для предупреждения длительного загрязнения в среду добавляли 1хпенициллина/стрептомицина. Одноклеточные клоны отбирали путем культивирования клеток при разведении 1:200 (1 клетка в 200 мкл полной среды с добавлением антибиотиков G418 сульфат). Для селекции клонов, экспрессирующих высокие уровни hu- или cyno-PD-1, РЕ-меченный-анти-hu-PD-1 клон ЕН12.1 использовали в анализах посредством проточной цитометрии. Образцы собирали с использованием клеточного анализатора BD LSRFortessa™ (BD Biosciences, San Jose, CA). Анализы данных и среднюю интенсивность флуоресценции (MFI) рассчитывали с использованием программного обеспечения Flowjo (FLOWJO LLC, Ashland, OR). Клеточные линии с высоким MFI были выбраны для аналитического исследования.
Клетки HEK-293Т, трансфицированные hu-, cyno-, мышиным или крысиным PD-1 векторами или пустым вектором, собирали через 48 часов после трансфекции. Перед связыванием с mAb7 клетки от каждой конкретной трансфекции тестировали с коммерческими антителами или лигандами, чтобы гарантировать, что соответствующий рецептор PD-1 в высокой степени экспрессировался на клеточной поверхности. Для человека и яванского макака использовали коммерческое перекрестное анти-PD-1 антитело (клон ЕН12.1). Для мышей использовали коммерческое антитело к мышиному PD-1 (клон J43). Для крысы использовали крысиный PD-L1 лиганд (так как не было коммерческого крысиного перекрестного анти-PD-1 антитела). После подтверждения соответствующей экспрессии PD-1 клетки подсчитывали и 2×105 клеток инкубировали с функциональной смесью ингибитора связывания рецептора hu-Fc (блокирование Fc-γ рецептора при 1 мкг/1×106 клеток, Affymetrix/eBiosciense, San Diego, CA) в течение 20 минут и к смеси добавляли синий флуоресцентный краситель, используемый для окрашивания живых/мертвых клеток (Life Technologies, San Diego, CA). Серийные разведения mAb7 или антитела отрицательного контроля (1-0,00001 мкг/мл) добавляли к смеси клеток и затем инкубировали на льду в течение 1 часа. Затем клетки промывали и АРС-меченный-ослиный-анти-человеческий-очищенный аффинным способом F(ab')2 фрагмент IgG, Fcγ специфический (разведение1:100) (Jackson ImmunoResearch Laboratories Inc, West Grove, PA) добавляли к смеси, и клетки инкубировали на льду в течение еще 30 минут. Данные были получены на анализаторе клеток BD LSRFortessa™ (BD Biosciences, San Jose, СА) и проанализированы с использованием программного обеспечения Flowjo (FLOWJO LLC, Ashland, OR).
Были получены стабильные клоны клеток Jurkat, которые были трансфицированы либо hu-, cyno- или мышиным-PD-1 рецептором. Клоны клеток PD-1, выбранные для этих анализов из каждого вида, экспрессировали аналогичные количества рецепторов PD-1 (примерно 400,000 рецепторов/клетка; рецепторы были количественно определены ранее во время получения этих клеточных линий). После подтверждения соответствующей экспрессии PD-1, клетки подсчитывали и 2×105 клеток инкубировали с функциональной смесью ингибитора связывания рецептора hu-Fc (блокирование Fc-γ рецептора при 1 мкг/1×106 клеток, Affymetrix/eBiosciense, San Diego, СА) в течение 20 минут и к смеси добавляли синий флуоресцентный краситель, используемый для окрашивания живых/мертвых клеток (Life Technologies, San Diego, СА). Серийные разведения (1:3) mAb7, антител положительного контроля 1, положительного контроля 2 или отрицательного контроля (с использованием каркаса IgG4) добавляли к клеточной смеси и затем инкубировали на льду в течение 1 часа. Затем клетки промывали и АРС меченный-ослиный-анти-человеческий-affiniPure F(ab')2 фрагмент IgG, Fcγ специфичный (разведение 1:100) (Jackson ImmunoResearch Laboratories Inc, West Grove, PA) добавляли к смеси, и клетки инкубировали на льду в течение еще 30 минут. Данные получали на клеточном анализаторе BD LSRFortessa™ (BD Biosciences, San Jose, СА). Анализ проводили с использованием программного обеспечения Flowjo (FLOWJO LLC, Ashland, OR) и рассчитывали средние геометрические значения. Значения ЕС50 рассчитывали с использованием Graph Pad Prism (Логарифм агонистической активности против ответа [связывания]).
Были получены активированные Т-клетки, экспрессирующие высокий уровень рецепторов PD-1. Подтверждали соответствующую экспрессию PD-1 для Т-клеток, полученных из каждого вида, с использованием имеющихся в продаже реагентов (анти-hu-PD-1 клон ЕН12.1 для человека и яванского макака, анти-мышиный-PD-1 клон J43 для мышиного-PD-1 и крысиный-PD-L1 для крысиного-PD-1). Подсчитывали клетки и 1×106 клеток инкубировали с функциональной смесью ингибитора связывания рецептора hu-Fc (блокирование рецептора Fc-γ при 1 мкг/1×106 клеток, Affymetrix/eBiosciense, San Diego, СА) в течение 20 минут, и к смеси добавляли синий флуоресцентный краситель, используемый для окрашивания живых/мертвых клеток (Life Technologies, San Diego, СА). Серийные разведения mAb7 (разведение 1:3) добавляли к клеточной смеси и затем инкубировали на льду в течение 1 часа. Затем клетки промывали перед добавлением АРС-меченного-ослиного-анти-человеческого-affiniPure фрагмента F(ab')2 IgG, Fcγ специфичного вторичного антитела (разведение 1:100) (Jackson ImmunoResearch Laboratories Inc, West Grove, PA) и клетки инкубировали на льду в течение 30 минут. Данные получали с помощью анализатора клеток BD LSRFortessa™ (BD Biosciences, San Jose, СА). Анализы данных выполняли с помощью программного обеспечения Flowjo (FLOWJO LLC, Ashland, OR). Подсчитывали средние геометрические значения, и значения ЕС50 рассчитывали с использованием Pad Graph Prism (Логарифм агонистической активности против ответа [связывания]).
Для анализа были выбраны стабильные клоны клеток Jurkat, экспрессирующие высокие уровни hu-PD-1. Двадцатью (20) мкг/мл биотинилированного-hu-PD-L1 или биотинилированного-hu-PD-L2 насыщали все рецепторы PD-1 на этой клеточной линии (после прогностических анализов по титрованию связывания). Поэтому эта концентрация была выбрана в качестве оптимальной концентрации в указанных исследованиях. Hu-PD-1 экспрессирующие JurkaT-клетки (2×105) инкубировали с функциональной смесью ингибитора связывания рецептора hu-Fc (блокирование рецептора Fc-γ при 1 мкг/1×106 клеток, Affymetrix/eBiosciense, San Diego, СА) в течение 20 минут, а также добавляли к смеси синий флуоресцентный краситель, используемый для окрашивания живых/мертвых клеток (Life Technologies, San Diego, СА). Биотинилированный-hu-PD-L1 или биотинилированный-hu- PD-L2 добавляли к клеткам в количестве 20 мкг/мл, с немедленным последующим добавлением серийных разведений mAb7, антител положительного контроля 1, положительного контроля 2 или отрицательного контроля (все с каркасом IgG4 и в серийном разведении 1:3). Клетки инкубировали на льду в течение 1 часа. Затем клетки промывали, добавляли РЕ Стрептавидин (разведение 1:100) (Affymetrix/eBiosciense, San Diego, СА) и клетки инкубировали на льду в течение 30 минут. Затем получали данные с помощью клеточного анализатора BD LSRFortessa™ (BD Biosciences, San Jose, CA) и анализировали с использованием программного обеспечения Flowjo (FLOWJO LLC, Ashland, OR), а также рассчитывали средние геометрические значения. Значения IC50 рассчитывали с использованием Graph Pad Prism (Log ингибирования относительно ответа [связывания]).
Клетки Jurkat были стабильно трансфицированы высокими уровнями hu-или cyno-PD-1 рецепторов. Клетки, экспрессирующие cyno-PD-1 рецепторы (примерно 400,000 рецепторов/клетка), были выбраны для этого анализа. Связывание cyno-PD-L1 и PD-L2 анализировали с использованием этих клеток и результаты показали, что 20 мкг/мл cyno-PD-L1 или PD-L2 достаточно для насыщения всех рецепторов PD-1 на основе среднего геометрического, проанализированного для разных концентраций (50 нг/мл-50 мкг/мл) этих лигандов, связанных с этой клеточной линией. Cyno-PD-1 экспрессирующие клетки Jurkat (2×105) инкубировали с функциональной смесью ингибитора связывания рецептора hu-Fc (блокирование рецептора Fc-γ при 1 мкг/1×106 клеток, Affymetrix/eBiosciense, San Diego, CA) в течение 20 минут, и к смеси добавляли синий флуоресцентный краситель, используемый для окрашивания живых/мертвых клеток (Life Technologies, San Diego, CA). Alexa-Fluor®- 647-cyno-PD-L1 или Alexa-Fluor®- 647- cyno-PD-L2 добавляли к клеткам в количестве 20 мкг/мл с немедленным последующим добавлением разных концентраций mAb7, антител положительного контроля 1, положительного контроля 2 или отрицательного контроля (используя каркас IgG4, в серийном разведении 1:3). Затем клетки инкубировали на льду в течение 1 часа. После промывания клетки собирали на клеточном анализаторе BD LSRFortessa™ (BD Biosciences, San Jose, CA). Анализы данных производили с использованием программного обеспечения Flowjo (FLOWJO LLC, Ashland, OR) и рассчитывали средние геометрические значения. Значения IC50 рассчитывали с помощью Graph Pad Prism (Log ингибирования относительно ответа [связывания]).
Человеческую лейкоцитарную пленку, приобретенную в Центре крови Стэнфорда (Stanford, CA), разбавляли PBS и наслаивали на Фиколл для выделения РВМС. РВМС промывали 4 раза PBS. RBC (эритроциты) лизировали с использованием лизирующего буфера ACK, как указано в протоколе изготовителя (Life Technologies, San Diego, СА). После лизиса RBC клетки промывали еще раз и разбавляли в PBS в количестве 5×107 клеток на мл. Половину РВМС подсчитывали и замораживали в замораживающих средах (90% FBS с 10% диметилсульфоксидом [DMSO]), а оставшиеся клетки подвергали очистке Т-клеток. Из оставшихся РВМС выделяли Т лимфоциты с использованием набора для выделения hu-специфических пан-Т-клеток с отрицательной селекцией, как описано в протоколе изготовителя (Miltenyi Biotec, San Diego, СА).
Для анализа ADCC подсчитывали свежевыделенные Т-клетки (целевые клетки) и 1×106 Т-клеток на мл культивировали в бессывороточных средах X-vivo 15 (Lonza, Walkersville, MD) и стимулировали с использованием гранул, покрытых анти-CD3 и анти-CD28 (активатора Т-клеток человека CD3/CD28 DYNABEADS™ для размножения и активации Т-клеток (Life Technologies, San Diego, СА) и 100 ед/мл рекомбинантного человеческого (rh)-IL-2 (R&D Systems, Minneapolis, MN). Культуры инкубировали при 37°С в 5% CO2 в течение 72 часов. Когда активация Т-клеток достигала момента времени 48 часов, РВМС (эффекторные клетки, полученные от одного и того же донора) размораживали, подсчитывали и затем стимулировали rh-IL-2 (50 ед/мл на 5×106 клеток/мл культуры) в течение суммарно 18-24 часов в полной среде RPMI-1640 с 10% FBS. В сутки анализа оба типа клеток подсчитывали и анализировали посредством проточной цитометрии, чтобы гарантировать соответствующую активацию. Для Т-клеток определяли высокий уровень экспрессии PD-1 и для РВМС определяли уровень экспрессии рецепторов CD16, CD32 и CD64 (Fc-гамма рецептор-[FcγR] III [а и b], FcγRIIa, FcγRI соответственно), который опосредует ADCC (антителозависимая клеточная цитотоксичность). Клетки сеяли в соотношении 5:1 эффектора к мишени (так как это было оптимальным соотношением) в обработанные 96-луночные планшеты с плоским дном для тканевой культуры (Fisher Scientific, Pittsburg, РА) с последующим добавлением антител: mAb7 (каркасы IgG4 и IgG1) и антитела положительного контроля. Все антитела тестировали в концентрациях от 0,01 до 100 мкг/мл (в серийных разведениях 1:10). Были добавлены аналитические контроли, включая одни целевые Т-клетки, для оценки максимального лизиса, одни эффекторные клетки и эффекторные и целевые клетки в соотношении 5:1 без добавления антител. Аналитические планшеты инкубировали при 37°С в 5% CO2 в течение 4 часов. Данные анализировали, используя нерадиоактивный анализ цитотоксичности CytoTox 96®Non-Radioactive Cytotoxicity Assay (Promega US, Madison, Wl), как указано в протоколе изготовителя. В анализе количественно определяли лактатдегидрогеназу (LDH), стабильный цитозольный фермент, который высвобождается при лизисе клеток. Процент цитотоксичности (%) измеряли как = 100×(Экспериментальное высвобождение LDH [OD490]/максимальное высвобождение LDH [OD490]). Максимальное высвобождение LDH рассчитывали, когда химически лизировали только одни целевые клетки (Т-клетки) для получения максимальной гибели.
Способность mAb7 связываться с hu-, cyno-, мышиным и крысиным PD-1 оценивали с использованием анализов клеточного связывания посредством проточной цитометрии (FACS), которые включали временно трансфицированную клеточную линию HEK-293Т, первичные активированные Т-клетки и клетки JurkaT, стабильно трансфицированные либо hu-PD-1, либо cyno- и мышиным PD-1. mAb7 связывался как с hu-PD-1, так и с cyno-PD-1 с высокой аффинностью и показывал аналогичные значения ЕС50 для этих 2 видов (аминокислотная последовательность для этих изоформ является наиболее схожей из проанализированных видов). Данные обощены в Таблицах 19, 20 и 21. Связывание с мышиным PD-1 было достигнуто только при высокой концентрации mAb7, что является биологически нерелевантным и может быть связано с процессом созревания аффинности. Не было обнаружено связывания mAb7 с крысиным PD-1 при использовании трансфицированных клеток или активированных первичных Т-клеток (таблица 19).


В Таблице 20 каждое число представляет значения ЕС50 для связывания mAb7 с разными донорами. Нижняя строка представляет собой среднее значение ±sem. sem = стандартная ошибка среднего.
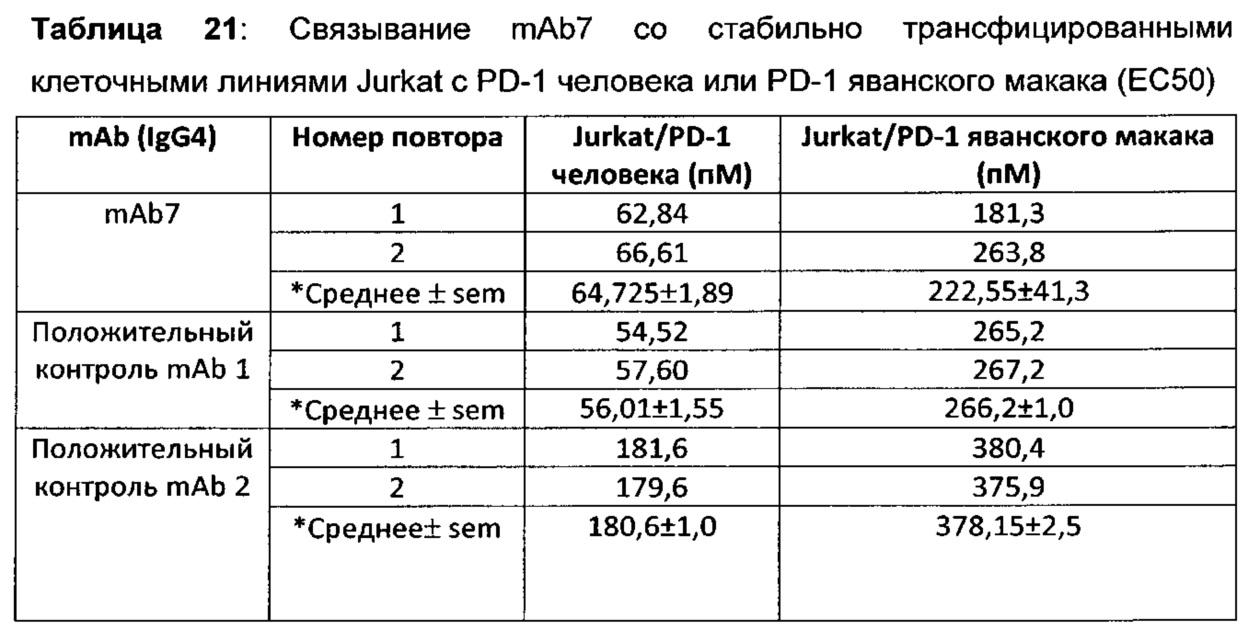
В Таблице 21 каждое число представляет значения ЕС50 для связывания mAb7 в одном эксперименте. * указывает среднее ±sem. mAb (IgG4) = Моноклональное антитело с каркасом IgG4; PD-1 = программируемая смерть - 1; sem = стандартная ошибка среднего.
Связывание mAb7 с PD-1 и человека и яванского макака анализировали с использованием разных систем клеточного анализа. Во всех системах было обнаружено связывание с высокой аффинностью и специфичностью для обоих видов. При использовании временно трансфицированных клеточных линий HEK-293Т, экспрессирующих PD-1 человека или яванского макака, mAb7 продемонстрировал аналогичный характер связывания, что и MFI. Связывание от минимального до нулевого наблюдали в родительской клеточной линии, трансфицированной пустым вектором (носителем).
Значения ЕС50 для связывания mAb7 с активированными первичными Т-клетками человека и яванского макака определяли через 72 часа после активации, когда экспрессия PD-1 на клеточной поверхности и жизнеспособность клеток были оптимальными (таблица 19). Значения ЕС50 рассчитывали для 2 разных доноров каждого вида (таблица 20). В активированных Т-клетках как человека, так и яванского макака были получены низкие значения ЕС50 и было обнаружено, что значения ЕС50 были близки для этих 2 видов, 51,04±5,07 пМ и 85,34±11,73 пМ соответственно (среднее ± стандартная ошибка среднего [sem]). Не было обнаружено связывания выше исходных значений с антителом отрицательного контроля.
Клеточную линию Jurkat Т, которая минимально экспрессирует рецепторы hu-PD-1, использовали для создания стабильно трансфицированных клеточных линий hu-PD-1, cyno-PD-1 и мышиных-PD-1. Клеточные линии субклонировали и выбирали клоны, экспрессирующие высокие уровни рецепторов hu-PD-1 и cyno-PD-1 (примерно 400000 PD-1 рецепторов на клетку было самой высокой полученной экспрессией). В этой системе mAb7 продемонстрировал высокую аффинность к рецепторам hu-PD-1 и cyno-PD-1. Значения ЕС50 для этих двух видов были аналогичны данным для первичных активированных Т-клеток (таблица 21); ЕС50=64,725±1,89 для hu-PD-1 и 222,55±41,3 для cyno-PD-1. Значения ЕС50 для cyno-PD-1 экспрессирующих клеток были более вариабельными, чем значения ЕС50 для hu-PD-1 в 2 экспериментальных циклах. Данные для этих двух видов были аналогичны данным, полученным с антителами положительного контроля, используемыми в любом заданном повторении (таблица 21). Антитело отрицательного контроля не демонстрирует связывания выше исходных значений в любом из экспериментальных повторов. Способность mAb7 блокировать взаимодействие лигандов PD-L1 и PD-L2 с рецептором PD-1 исследовали в PD-1-трансфицированной клеточной линии Jurkat (экспрессирующей или hu-PD-1, или cyno-PD-1). В этом анализе клетки инкубировали с мечеными лигандами в насыщающих концентрациях после инкубирования с немеченым mAb7 в разных концентрациях. Как показано в Таблице 22, mAb7 ингибирует связывание лигандов PD-L1 и PD-L2 с рецептором PD-1 дозозависимым образом. Антитело, являющееся положительным контролем для PD-1, продемонстрировало сопоставимое ингибирование. IC50 антитела mAb7 была сравнимой для hu- и cyno-PD-1 (880,15±289,85 и 1058±355,4 для hu-PD-L1 и hu-PD-L2 соответственно; и 942,9±110,1 и 839±89,5 для cyno-PD-L1 и cyno-PD-L2 соответственно). Сводка значений IC50 приведена в Таблице 22. В Таблице 22 каждое число представляет значения IC50 для mAb7 в одном эксперименте; * указывает среднее ±sem; 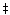 указывает номер повтора в круглых скобках; mAb IgG4 = моноклональное антитело с каркасом IgG4; PD-1 = программируемая смерть - 1; PD-L1 = лиганд 1 программируемой смерти; PD-L2 = лиганд 2 программируемой смерти; sem = стандартная ошибка среднего.
указывает номер повтора в круглых скобках; mAb IgG4 = моноклональное антитело с каркасом IgG4; PD-1 = программируемая смерть - 1; PD-L1 = лиганд 1 программируемой смерти; PD-L2 = лиганд 2 программируемой смерти; sem = стандартная ошибка среднего.
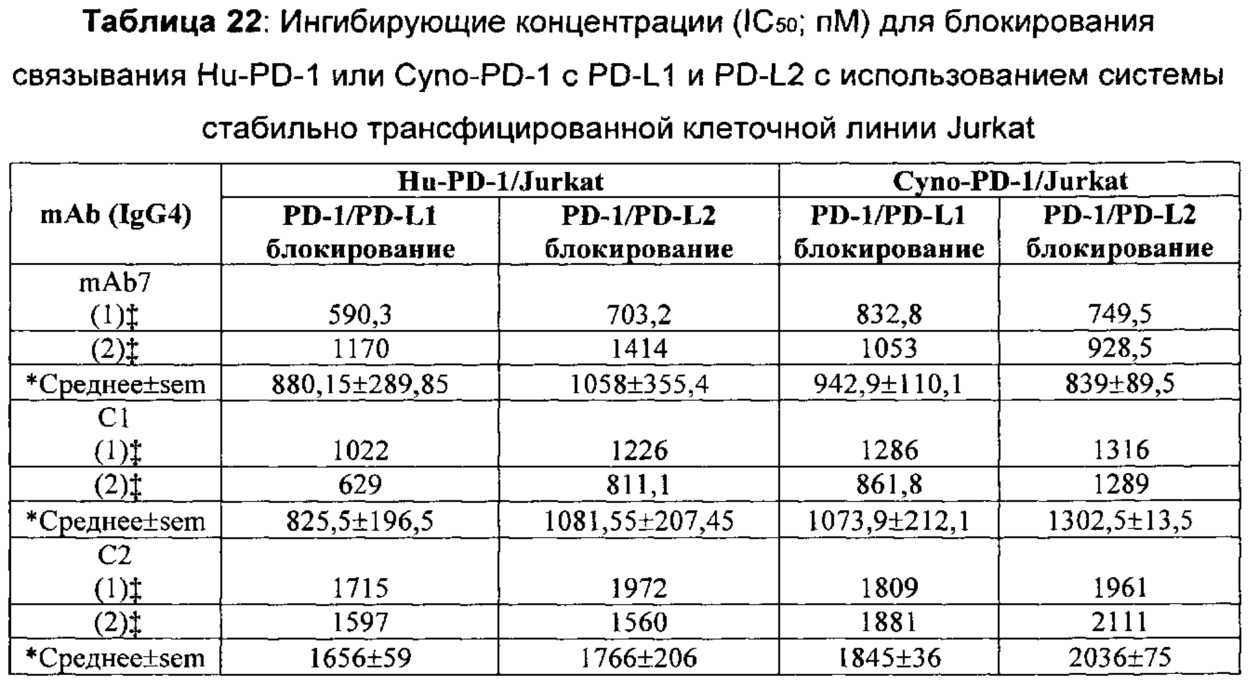
mAb7 продемонстрировало слабое связывание с компонентом комплемента 1, субкомпонентом q (C1q) и CD64. C1q и CD64 (для каркаса IgG4) считаются возможными моделями комплементзависимой цитотоксичности (CDC) и ADCC соответственно. Чтобы дополнительно исследовать отсутствие способности mAb7 индуцировать гибель Т-клеток in vitro, выполняли анализ ADCC с активированными Т-клетками (целевые клетки), экспрессирующими высокие уровни рецепторов PD-1, и РВМС (эффекторные клетки), которые экспрессируют высокие уровни рецепторов Fcγ. Клетки получали от 2 здоровых доноров. mAb7 (в своем исходном каркасе IgG4) демонстрировало минимальную ADCC-активность у обоих доноров. Отсутствие ADCC-активности соответствовало активности, проявляемой анти-PD-1 положительным контрольным антителом в каркасе IgG4, и оба были аналогичны IgG4 антителу отрицательного контроля. Когда анти-PD-1 (mAb7 или анти-PD-1 антитела положительного контроля) оценивали в каркасе IgG1 человека, который, как известно, индуцирует более сильный ADCC, анти-PD-1 индуцировало ADCC выше вплоть до 4 раз, чем когда антитело находится в каркасе IgG4. Максимальное высвобождение LDH рассчитывали, когда химически лизировали только целевые клетки (Т-клетки) для получения максимальной гибели (гибель оценивали как 100% лизис для каждого донора согласно аналитическому расчету). Т-клеточный лизис с использованием каркаса IgG1 соответствует уровню PD-1 на активированных Т-клетках (экспрессия, а также лизис донора 1 PD-1 выше, чем донора 2), что подтверждает точность анализа.
Эти результаты показывают, что анти-PD-l антитело mAb7 связывается с высокой аффинностью с рецепторами hu- и cyno-PD-1, экспрессируемыми на клетках, со значениями ЕС50 в интервале от 46 до 270 пМ, в зависимости от системы тестирования. mAb7 не связывается с клетками, экспрессирующими мышиный PD-1 или крысиный PD-1 в физиологических концентрациях. mAb7 блокировал взаимодействие лигандов PD-L1 и PD-L2 с рецепторами PD-1 на клеточной поверхности; значения IC50 находились в диапазоне от 500 до 1000 пМ, что указывает на его высокую антагонистическую активность в блокировании функции PD-1, индуцированной связыванием лиганда. mAb7 в своем IgG4 каркасе вызывает антитело-индуцированную цитотоксичность от минимальной до ее полного отсутствия, что согласуется со свойствами антитела IgG4.
Пример 12: Характеристика связывания анти-РD-1 антитела mAb7 с PD-1, FcRn, FcγRs и C1Q с использованием биосенсоров без метки и ELISA.
Данный пример иллюстрирует аффинности связывания mAb7 in vitro с рекомбинантным очищенным PD-1 из различных видов, имеющих отношение к токсикологическим исследованиям, с использованием биосенсоров SPR (поверхностный плазмонный резонанс). Способность Fc-области mAb7 взаимодействовать с FCGR и FcRn также тестировали с помощью SPR, для подтверждения, что она обладает свойствами, согласующимися со свойствами изотипически сходного контроля. С помощью ELISA анализировали mAb7 и изотипически сходный контроль в отношении связывания с человеческим C1q. Способность mAb7 блокировать взаимодействие связывания PD-1 с его лигандами, PD-L1 и PD-L2 также тестировали с помощью биосенсоров без метки, чтобы подтвердить механизм действия.
Все эксперименты по кинетики и аффинности проводили при 25°С в электродном буфере из забуференного фосфатного физиологического раствора (PBS)+0,01% Tween 20, если не указано иное. Кинетические исследования проводили с помощью биосенсора SPR ProteOn XPR36, оснащенного чипами NLC (покрытые нейтравидином) (BioRad, Hercules, CA). ProteOn также использовали для определения активных концентраций анализируемых веществ hu-PD-1 и cyno-PD-1 посредством титрования против mAb7 в качестве эталонного стандарта. Концентрации использованных здесь анализируемых белковых веществ относится к "активным" или "номинальным" значениям. Была определена активная концентрация человеческого Fc-гамма рецептора (hu-FCGR) I, человеческого неонатального Fc-рецептора (hu-FcRn) (партия номер R3091) и неонатального Fc-рецептора яванского макака (cyno-FcRn) (партия номер JCR) с использованием экспериментов по анализу концентрации без калибровки (CFCA) на Biacore Т200, оснащенном сенсорными чипами СМ5 (GE Life Sciences, Marlborough, MA). Все остальные анализируемые вещества использовали в их номинальных концентрациях, определяемых по светопоглощению при А280 нм с соответствующим коэффициентом экстинкции. Аффинности в растворе определяли при комнатной температуре (примерно 23°С) с использованием прибора KinExA 3000 или 3200, оснащенного автоматическим пробоотборником (Sapidyne). Вторичные детекторные антитела были помечены DyLight 650 (Pierce Biotechnology, Grand Island, NY.) согласно инструкции изготовителя. Биотинилирования иммуноглобулина G (IgG) выполняли в эквимолярном соотношении линкер: IgG, используя EZ-Link™ Sulfo-NHS-LC-LC-Biotin (Pierce Biotechnology Grand Island, NY) согласно инструкции изготовителя. Если не указано иное, иммобилизованные IgG регенерировали коктейлем "Pierce/соль", содержащим смесь 2:1 об/об Pierce IgG элюирующего буфера (рН 2,8)/4 М хлорид натрия (NaCl).
Связывающие взаимодействия hu-PD-1 и cyno-PD-1 (оба His-меченые мономеры) с mAb7 определяли в растворе, используя метод KinExA в электродном буфере PBS+0,01% Tween 20 и буфере для образца PBS+0,01% Tween 20+1 г/л бычьего сывороточного альбумина (BSA). Использовали два разных формата анализа. В первом формате анализа mAb7 титровали до постоянной концентрации hu-PD-1 (номинальные 200, 400 или 4000 пМ) и образцы оставляли уравновешиваться. Свободный hu-PD-1 был захвачен гранулами из полиметилметакрилата (РММА), которые были покрыты (посредством адсорбции) анти-hu-PD-1 моноклональным антителом mAb7 (полученным в лаборатории в условиях не- Надлежащей лабораторной практики (GLP) [партия номер R5432]). Захваченный гранулами hu-PD-1 затем выявляли с помощью 0,5 мкг/мл Dylight-меченого анти-His mAb (R&D Systems, Minneapolis, MN). Во втором формате анализа hu-PD-1 или cyno-PD-1 титровали до постоянной концентрации mAb7 (20, 50, 100, или 500 пМ) и эти смеси оставляли уравновешиваться. Свободное mAb7 захватывали на РММА (полиметилметакрилатные) гранулы, на которых был адсорбирован блокатор анти-идиотипического мышиного анти-mAb7 mAb 1699.1Н6, который специфически связывается со свободным mAb7, но не с PD-1-насыщенным mAb7. Затем mAb7, сорбированный на гранулах, определяли с помощью Dylight-меченых козлиных анти-hu-IgG (Н+L) (Jackson ImmunoResearch Inc, West Grove, PA). Все титрования были выполнены в виде 12-членной 2-кратной серии разведений, с варьированием верхней номинальной концентрации сайта связывания так, чтобы она попадала в диапазон от 1 нМ до 10 нМ, в зависимости от эксперимента. Образцы оставляли уравновешиваться в течение 48 часов, и объемы введения на эксперимент были скорректированы, чтобы получить общий сигнал, находящийся в диапазоне от 0,7 В до 1,9 В. Все образцы вводили в двух циклах. Данные от вплоть до 4 независимых экспериментов на взаимодействие анализировали в целом, используя инструмент N-кривая в программном обеспечении анализа и аппроксимировали к простой бимолекулярной модели, где концентрацию mAb7 использовали в качестве эталонной концентрации. В глобальном анализе сообщают значения с наилучшим совпадением (и доверительным интервалом 95%) для KD и наблюдаемую концентрацию активного сайта связывания PD-1.
Аффинности связывания hu-PD-1 и cyno-PD-1 с mAb7 в растворе неотличимы друг от друга при исследовании с использованием анализа KinExA; наблюдаемые значения константы равновесия при диссоциации (KD) при 23°С были определены как 17 пМ или 23 пМ для hu-PD-1 (при исследовании в противоположной ориентации в анализе) и 28 пМ для cyno-PD-1; эти три значения были статистически неотличимы друг от друга. Эти значения были повторены посредством измерений с биосенсором поверхностного плазмонного резонанса (SPR), где получили значения KD 42 пМ для hu-PD-1 и 69 пМ для cyno-PD-1 при 25°С, и 109 пМ для hu-PD-1 и 115 пМ для cyno-PD-1 при 37°С. mAb7 связывал мышиный-PD-1 со значением KD 0,9 мкМ и не было обнаружено связывания с крысиным-PD-1 при тестировании при 0,5 мкМ с использованием кинетического анализа SPR. Биосенсоры без метки использовали для демонстрации того, что mAb7 блокирует связывание hu-PD-1 с его природными лигандами, человеческим лигандом программируемой смерти 1 (hu-PD-L1) и человеческим лигандом программируемой смерти 2 (hu-PD-L2). SPR также использовали для подтверждения того, что mAb7 связывал ряд рецепторов кристаллизующегося фрагмента (Fc)-гамма (FCGR) и неонатальный Fc-рецептор (FcRn) как человека, так и яванского макака с той же кинетикой и специфичностью, что и изотипически сходный контроль. В ELISA mAb7 показал незначительное связывание с компонентом комплемента 1, субкомпонентом q (C1q), что согласуется с поведением изотипически сходного контроля. В целом, mAb7 связывается и с hu-PD-1, и с cyno-PD-1 с высокой аффинностью и специфичностью, но имеет низкую аффинность к мышиному PD-1 и пренебрежимо малое связывание с крысиным PD-1.
В таблице 23 обобщены данные по кинетике и аффинности, полученные для анализа взаимодействия mAb7 с PD-1 разных видов. mAb7 связывает hu-PD-1 и cyno-PD-1 со статистически неразличимыми наблюдаемыми аффинностями при анализе этих взаимодействий в растворе при 23°С с использованием метода KinExA; наблюдаемые значения KD составляли 17 пМ и 23 пМ для hu-PD-1 (при исследовании в двух противоположных ориентациях в анализе) и 28 пМ для cyno-PD-1. Значения KinExA были подтверждены кинетическими измерениями, выполненными посредством SPR, где получали наблюдаемые значения KD при 25°С, равные 42±11 пМ (n=10) для hu-PD-1 и 69±24 пМ (n=10) для cyno-PD-1. Измерения SPR при 37°С показали в 2 раза более слабые аффинности, чем аффинности при 25°С; значения KD при 37°С были определены как 109±8 пМ (n=15) для hu-PD-1 и 115±15 пМ (n=8) для cyno-PD-1. mAb7 связывается с мышиным PD-1 с наблюдаемым KD 0,9±0,1 мкМ (n=5) при измерении при 25°С посредством SPR, что соответствует в 20000 раз более низкой аффинности по сравнению с hu-PD-1. Никакого связывания не было обнаружено с крысиным PD-1 при тестировании в количестве 0,5 мкМ при 25°С посредством SPR, хотя было подтверждено, что белки крысиного PD-1 являются активными, о чем свидетельствует их очевидное связывание с положительными контролями, мышиным PD-L1 и мышиным PD-L2. Значения KD для KinExA-измерений представляют собой наилучшее соответствие и 95% доверительный интервал глобального анализа N независимых экспериментов, тогда как значения для SPR-измерений представляют собой среднее значение ± стандартное отклонение для n независимых экспериментов на сенсорном чипе ProteOn NLC. В Таблице 23, h или hu = человеческий ka = константа скорости ассоциации; kd = константа скорости диссоциации; KD = константа равновесия при диссоциации; KinExA = кинетический эксклюзионный анализ; mAb = моноклональное антитело; Ms = моль в секунду; n = число; ND = не определено; PD-1 = Программируемая смерть - 1; s = секунда; SPR = поверхностный плазмонный резонанс; Темп = температура; * взаимодействие mAb7 с hu-PD-1 изучали в двух противоположных ориентациях в анализе, как описано в Bee et al, 2012.
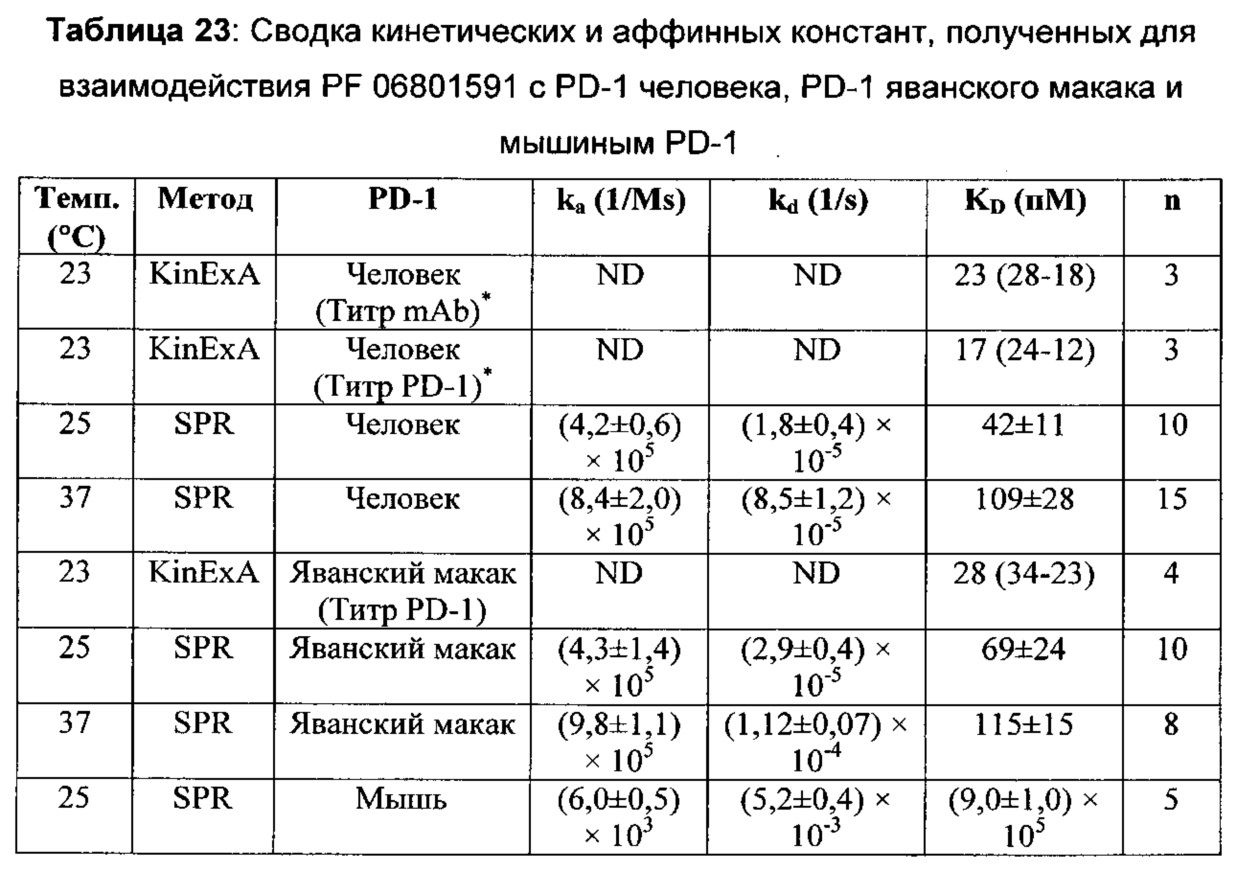
В Таблице 24 показано, что кинетика связывания и специфичность mAb7 для ряда Fc-рецепторов, включая FCGR и FcRn как человека, так и яванского макака повторяет значения, ожидаемые для изотипически сходного изотипического контроля, hu-IgG4. Например, mAb7 связывается с hu-FCGRI с наблюдаемым значением KD (среднее ± стандартное отклонение) 146±42 пМ (n=14) при 25°С по сравнению с 177±71 пМ (n=4) для изотипического контроля. Все остальные взаимодействия характеризовались слабой аффинностью (значения KD примерно 1 мкМ или выше). Кинетический анализ выполняли на чипе ProteOn NLC при рН 7,4 для FCGR и при рН 5,9 для FcRn. В Таблице 24 CD = кластер дифференцировки; су = яванский макак; FCGR = Fc-гамма рецептор; FcRn = неонатальный Fc-рецептор; hu = человек; ka = константа скорости ассоциации; kd = константа скорости диссоциации; KD = константа равновесия при диссоциации; Ms = моль в секунду; n = число; s = секунда.
Кроме того, mAb7 едва связывается с C1q в ELISA, в соответствии с поведением изотипически сходного контроля hu-IgG4 (данные не показаны). Его связывание было даже ниже, чем низкое связывание человеческого иммуноглобулина G2 (hu-IgG2). Напротив, положительные контроли, hu-IgG1 и человеческий иммуноглобулин G3 (hu-IgG3) давали высокие сигналы связывания. Используя биосенсоры SPR и Octet и разные форматы анализа (как формат предварительной смеси, так и формат сэндвич-анализа), было показано, что mAb7 блокирует связывание hu-PD-1 с его природными лигандами hu-PD-L1 и hu-PD-L2.
Эти данные показывают, что mAb7 связывается с высокой аффинностью и высокой специфичностью с hu-PD-1. При измерении в растворе при 23°С с использованием метода KinExA mAb7 связывается с hu-PD-1 и cyno-PD-1 со статистически неразличимыми наблюдаемыми значениями KD 17 пМ и 23 пМ для hu-PD-1 (при исследовании в альтернативных ориентациях в анализе) и 28 пМ для PD-1 яванского макака. mAb7 показал в 20000 раз более слабую аффинность в отношении мышиного PD-1 (наблюдаемый KD 0,9 мкМ при 25°С посредством SPR) и отсутствие обнаруживаемого связывания с крысиным PD-1 при тестировании в количестве 0,5 мкМ. mAb7 и изотипически сходный контроль hu-IgG4 связываются с похожей кинетикой и специфичностью при тестировании в отношении панели hu- и cyno-Fc-рецепторов, при измерении при 25°С посредством SPR. mAb7 связывался с hu-C1q с незначительным сигналом при тестировании посредством ELISA, в соответствии с hu-IgG4 изотипическими контролями и его связывание было даже ниже, чем у hu-IgG2. Было показано, что mAb7 блокирует связывание hu-PD-1 с его естественными лигандами hu-PD-L1 и hu-PD-L2.
Пример 13: Комбинированное лечение антителом к PD-1 и антителом к ОХ40
Данный пример иллюстрирует влияние лечения анти-PD-1 антителом в сочетании с анти-ОХ40 антителом в мышиной модели рака толстой кишки.
Для этого исследования самкам мышей C57B6/J (в возрасте 6-8 недель) подкожно инокулировали мышиную опухоль толстой кишки МС-38 (аденокарцинома III степени) в количестве 5×105 клеток/мышь. На 10-е сутки мышей рандомизировали и лечение начинали с 10 мг/кг антитела к мышиному PD-1 и 1 мг/кг антитела к мышиному ОХ-40. Обработки проводили интраперитонеально (и/п) на 10, 12 и 14 сутки антителами к ОХ40 (1 мг/кг); и на 10, 12, 14, 17, 23 и 25 сутки антителами к PD-1 (10 мг/кг). Объем опухоли измеряли два раза в неделю. Исследование прекращали на 34-е сутки. Статистический анализ выполняли с использованием двустороннего ANOVA для сравнения средних значений в двух группах в один момент времени.
Результаты представлены в Таблице 25. В таблице 25 значения указывают объем опухоли в указанные сутки, средний для 8 мышей на группу ± (стандартная ошибка среднего); N = количество на группу, мм2 = кубический миллиметр. Изотипический контроль включает соответствующий изотип каждого антитела в количестве 1 мг/кг для анти-ОХ40 и 10 мг/кг для анти-PD-1.
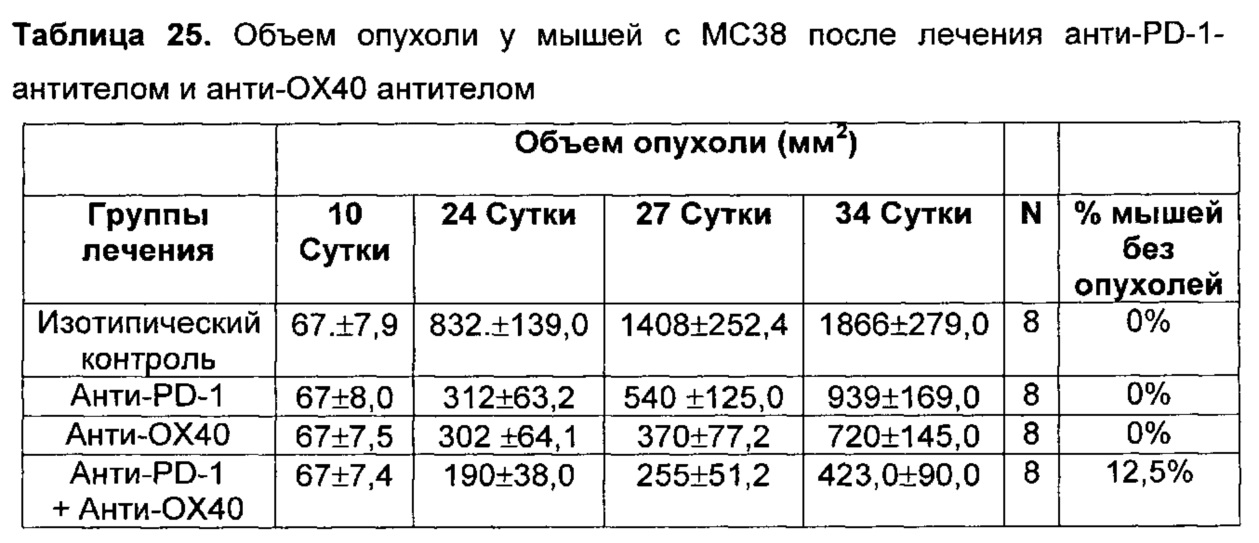
Начиная с 24-х суток, все группы, обработанные анти-PD-1 и/или анти-ОХ-40 антителами, показали значительно меньший объем опухолей по сравнению с контрольной группой (таблица 25). На 24-е сутки группа комбинированного лечения (анти-PD-1 антитело и анти-ОХ40 антитело), демонстрировали значимость р≤0,0001 по сравнению с группой изотипического контроля, в то время как обработка каждым отдельным антителом показала значимость р≤0,01 по сравнению с контрольной группой. На 34-е сутки все группы лечения показали значимость р≤0,0001 по сравнению с контрольной группой. На 34-е сутки группа, которую лечили комбинацией, показала различия по сравнению с группой, которую лечили только анти-PD-1 антителом или группой, которую лечили только одним антителом против ОХ-40. Эти результаты показывают, что лечение как анти-PD-1 антителом, так и анти-ОХ40 антителом замедляло рост опухоли по сравнению с лечением только одним из двух антител.
Пример 14: Влияние вакцины на экспрессию PD-1 на активированных Т-клетках
Данный пример иллюстрирует влияние вакцины на основе ДНК, экспрессирующей простатспецифический мембранный антиген (PSMA) человека, на экспрессию PD-1 на CD3+CD4 (таблица 26) и CD3+CD8 Т-клетках (таблица 27) в присутствии анти-CTLA4 моноклонального антитела тремелимумаба (ингибитора контрольных точек).
Методы исследования in vivo. В исследовании использовали три группы китайских яванских макак (n=8/группа). Животным в группах 1 и 2 внутримышечно инъецировали вакцину, содержащую аденовирусный вектор AdC68 (SEQ ID NO: 44), кодирующий аминокислоты 15-750 PSMA человека (в общей дозе 2е11 VP), в то время как животные в группе 3 не получали вакцинации. Полная последовательность аденовирусного вектора AdC68 представлена в SEQ ID NO: 44. Кроме того, сразу после вакцинации животных в группе 2 обрабатывали посредством подкожных инъекций 50 мг анти-CTLA4 моноклонального антитела тремелимумаба. Образцы цельной крови от каждого животного до (Pre) и после вакцинации собирали на 9, 15 и 29 сутки и анализировали встречаемость PD-1 экспрессирующих CD3+CD4 и CD3+CD8 Т-клеток посредством проточной цитометрии.
Фенотипирование CD3+ CD4 и CD8 Т-клеток. Популяции лейкоцитов фенотипировали путем выполнения многоцветного проточного цитометрического анализа на свежесобранной цельной крови. Кратко, цельную кровь окрашивали в течение 20 минут при комнатной температуре коктейлем антител, содержащим CD3-V500 (клон SP34-2), CD4-BV605 (клон L200), CD8-АРС.Н7 (клон SK1), PD1-AF488 (клон ЕН12.2Н7, Biolegend), PDL1-BV421 (клон MIH1), Lag3-PE.Cy7 (клон 11Е3, Novus), CD69-PE.Texas Red (клон ТР1.553, Beckman Coulter), TIM3-APC (клон 344823, R&D Systems), CD20-PE.Cy5.5 (клон 2H7, eBioscience), CD14-AF700 (клон M5E2), CD16-PE.Cy5 (клон 3G8), CD56-PerCP.Cy5.5 (клон B159) и CD11c-PE (клон SHCL3). Все антитела приобретали в BD, если не указано иное. Образцы обрабатывали лизирующим буфером для эритроцитов (BD), промывали, смешивали с 50 мл частиц для подсчета в жидкости (BD) и собирали данные на LSR Fortessa (BD). Данные анализировали, используя FlowJo (Tree Star Inc, USA). Результаты экспрессии PD-1 на CD3+CD4 Т-клетках представлены в таблице 26, а результаты экспрессии PD-1 на CD3+CD8 Т-клетках представлены в таблице 27. Индукцию PD-1 наблюдали через 9 суток после вакцинации и приводили к уровням, наблюдаемым у необработанных животных (Группа 3) к 29 суткам после вакцинации. Эти результаты показывают, что вакцинный вектор, получаемый вместе с антителом к CTLA4, может вызывать экспрессию PD-1 на CD3+CD4 и CD8 Т-клетках у приматов, не являющихся человеком.
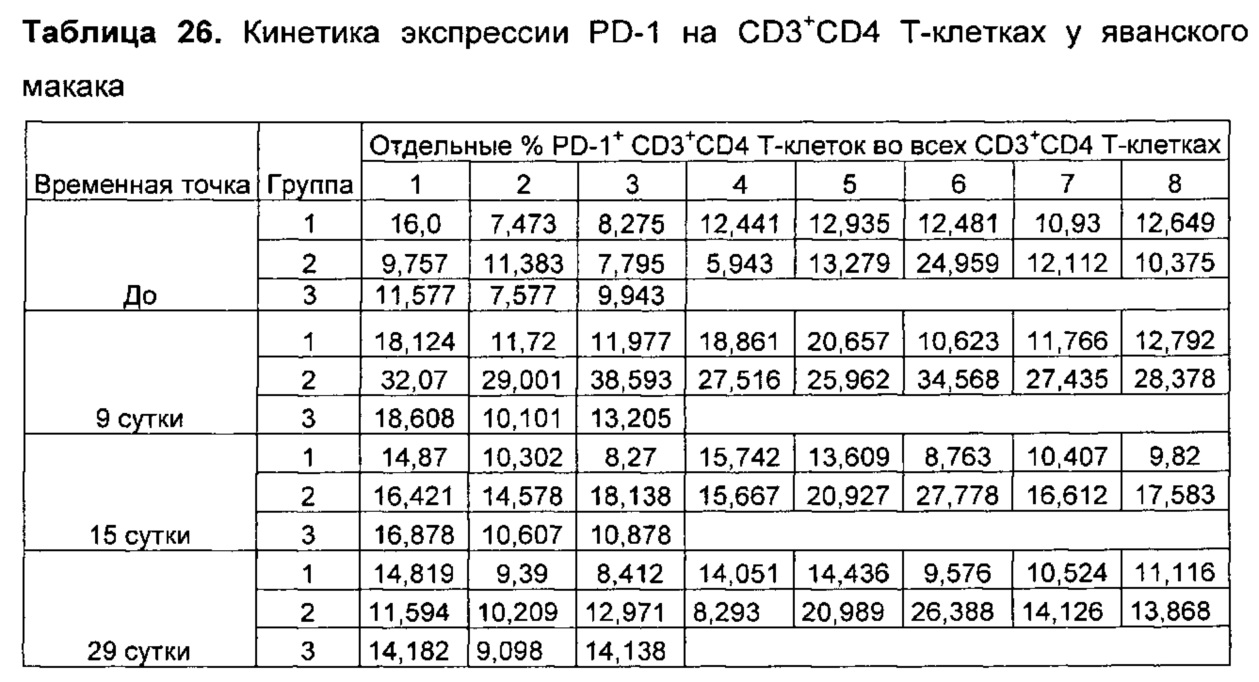
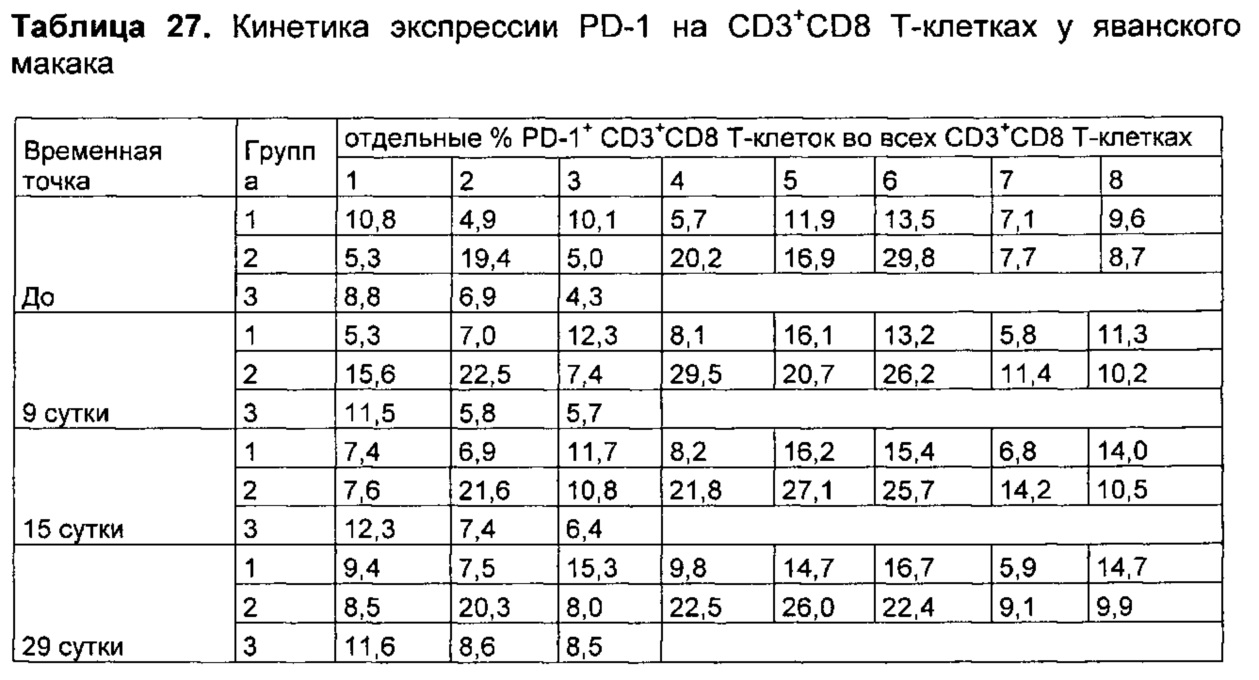
Пример 15. Влияние анти-PD-1 антитела на антигенспецифический ответ Т-клеток, индуцированный вакциной, экспрессирующей человеческий PSMA
Данный пример иллюстрирует влияние анти-PD1 антитела на IFNγ CD4 и CD8 Т-клеточные ответы, индуцированные вакциной, содержащей аденовирусный вектор AdC68, который экспрессирует человеческий PSMA у яванского макака.
Анализ внутриклеточного окрашивания цитокинов (ICS). Кратко, РВМС от отдельных животных инкубировали совместно с пулом пептидов из библиотеки 15-мерных пептидов, перекрывающихся 11 аминокислотами и охватывающих всю последовательность соответствующего антигена, каждый пептид использовали в количестве 2 мкг/мл. Планшеты инкубировали примерно 16 часов при 37°С, 5% СО2. Затем клетки окрашивали для обнаружения внутриклеточной экспрессии IFNγ CD8+ Т-клетками и фиксировали. Данные по клеткам собирали на проточном цитометре. Частоту ответа нормализовали по числу IFNγ CD8+ Т-клеток на миллион CD8+ Т-клеток, вычитая ответы в контрольных лунках с диметилсульфоксидом, которые не содержали пептида. Антигенспецифические ответы в таблицах представляют сумму ответов на соответствующие антигенспецифические пептидные пулы.
Способы исследования in vivo. Кратко, пяти группам китайских яванских макак (n=8/группа) внутримышечно инъецировали вакцину, содержащую аденовирус AdC68 (SEQ ID NO: 44), который кодирует аминокислоты 15-750 человеческого PSMA (hPSMA) в общей дозе 2е11 VP. За вакцинацией в группах 2, 4 и 5 немедленно следовали подкожные инъекции 50 мг анти-CTLA4 моноклонального антитела тремелимумаба и/или анти-PD-1 моноклонального антитела mAb7, которые вводили подкожно (группы 3 и 4) или внутривенно (группа 5) в количестве 10 мг/кг. РВМС выделяли из каждого животного и подвергали ICCS анализу для измерения ответов специфических к PSMA человека IFNγ-ответов CD4 (сутки 9 или сутки 29) или CD8 Т-клеток (сутки 29). Аминокислотная последовательность полноразмерного человеческого PSMA представлена в SEQ ID NO: 42. Последовательность аденовирусного вектора AdC68, экспрессирующего аминокислоты 15-750 человеческого PSMA, представлена в SEQ ID NO: 44.
Результаты. Результаты представлены в Таблицах 29, 30 и 31. Данные показывают, что как анти-CTLA4, так и анти-PD-1 антитело по отдельности могут увеличивать частоту IFNγ-ответов CD4 и CD8 Т-клеток, индуцированных вакциной.


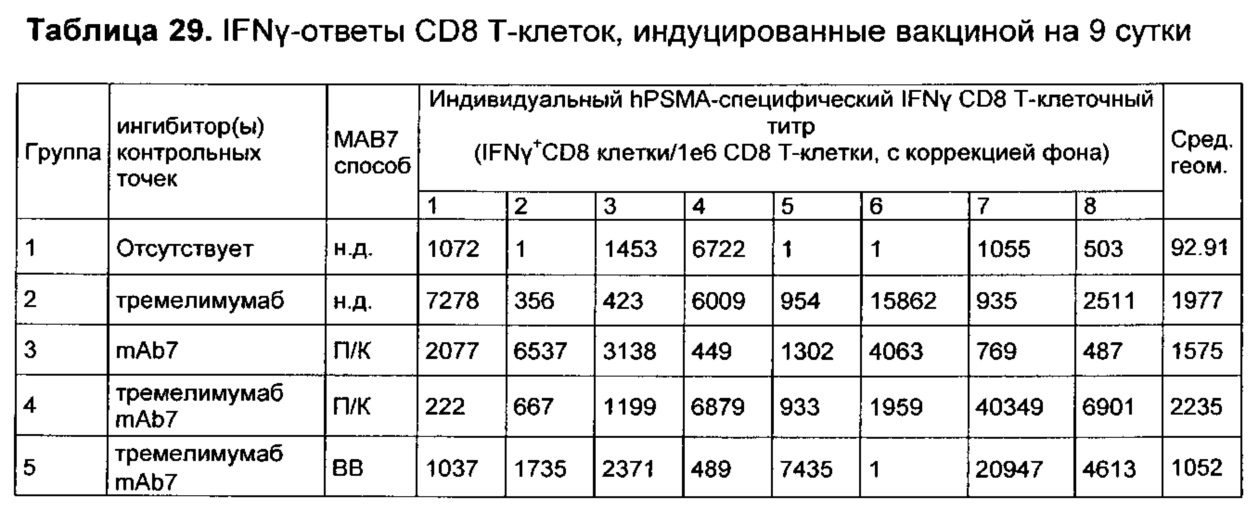
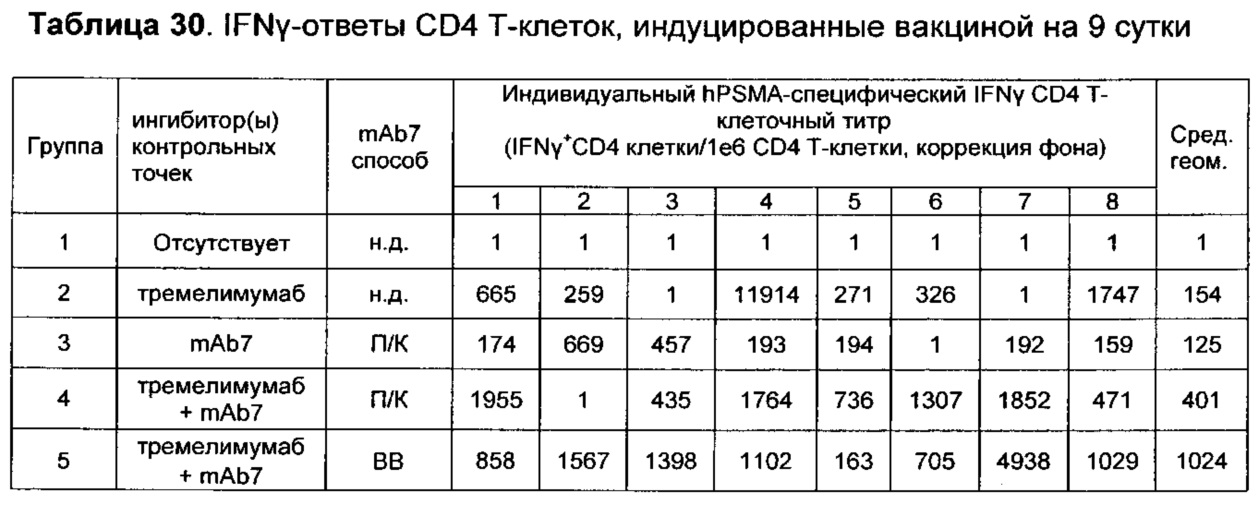
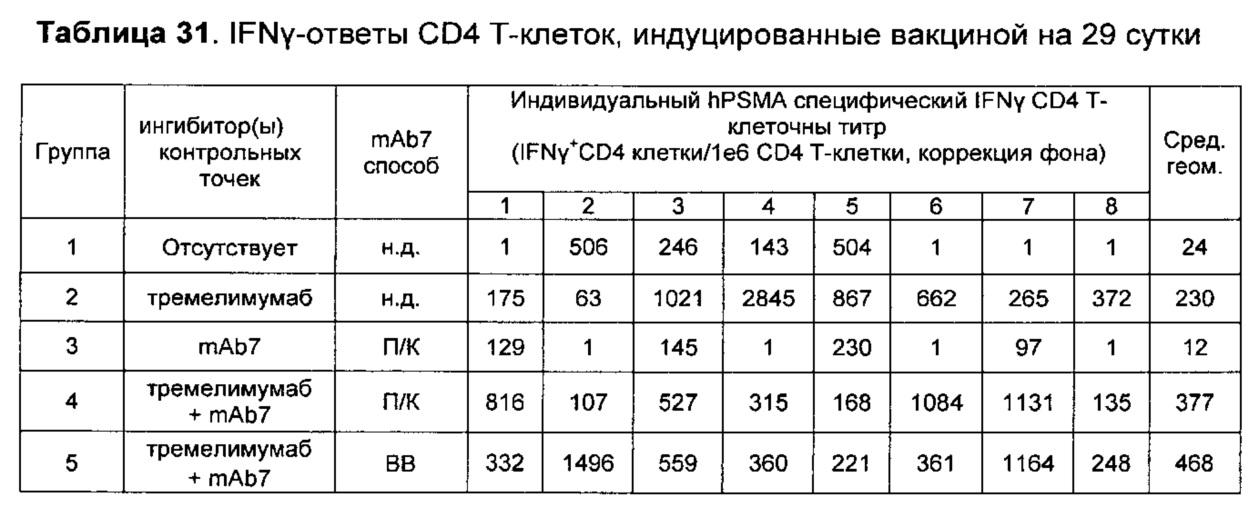
Пример 16. Влияние антител к PD-1 на IFNγ Т-клеточные ответы, индуцированные вакциной, коэкспрессирующей простатспеиифический мембранный антиген (PSMA) человека, антиген стволовой клетки предстательной железы (PSCA) и простатспецифический антиген (PSA)
Методы исследования in vivo. Кратко, в исследовании использовали три группы китайских яванских макак (n = 4/группа). Животным в группе 1 внутримышечно инъецировали носитель. Животным в группе 2 вводили анти-PD-1 моноклональное антитело mAb7 подкожно в количестве 20 мг/кг. Животных в группе 3 лечили вакциной, содержащей аденовирусный вектор AdC68, коэкспрессирующий три человеческих, ассоциированных с простатой антигена (PSMA, PSCA и PSA) (вектор AdC68W-734) в суммарной дозе 6е11 VP, с немедленными последующими подкожными инъекциями 150 мг анти-CTLA4 антитела тремелимумаба и 20 мг/кг анти-PD-1 моноклонального антитела mAb7. Через двадцать восемь суток после инъекций животным вводили носитель (группа 1), анти-PD-1 моноклональное антитело mAb7 подкожно в количестве 20 мг/кг (группа 2) или ДНК-плазмиду (плазмида 458), экспрессирующую три антигена рака предстательной железы человека (PSMA, PSCA и PSA) доставляли посредством электропорации с немедленными последующими подкожными инъекциями 150 мг анти-CTLA4 и анти-PD-1 моноклонального антитела в количестве 20 мг/кг (группа 3). Через сорок три дня после первичных первых инъекций из каждого животного выделяли РВМС и анализировали посредством ELISPOT для измерения PSMA-, PSCA- и PSA-специфических IFNγ Т-клеточных ответов.
Полная последовательность вектора AdC68W-734, используемого в исследовании, представлена в SEQ ID NO: 45 в настоящем описании и в SEQ ID NO: 63 в публикации международной заявки WO 2015/063647. Конструкция вектора AdC68W-734 также описана в WO 2015/063647, описание которой включено сюда посредством ссылки. Каждый из вектора AdC68W-734 и плазмиды 458 содержит (1) нуклеотидную последовательность, кодирующую аминокислоты 15-750 человеческого PSMA, имеющего последовательность SEQ ID NO: 42, (2) нуклеотидную последовательность, кодирующую аминокислоты 25-261 человеческого PSA, имеющего последовательность SEQ ID NO: 47, и (3) нуклеотидную последовательность, кодирующую полноразмерный человеческий PSCA с последовательностью SEQ ID NO: 48.
Анализ IFNγ ELISPOT. Кратко, мононуклеарные клетки периферической крови (РВМС) из отдельных животных совместно инкубировали в двух повторах с пулами пептидов из 15-мерной пептидной библиотеки, перекрывающихся 11 аминокислотами, охватывающими всю последовательность соответствующего антигена, каждый пептид в количестве 2 мкг/мл. Планшеты инкубировали в течение примерно 16 часов при 37°С, 5% CO2, затем промывали и проявляли согласно инструкции изготовителя. Количество клеток, образующих IFNγ ореол (SFC), подсчитывали с помощью CTL считывающего устройства. Рассчитывали среднее значение от двух повторов и вычитали ответ отрицательного контроля, не содержащего пептидов. Затем подсчеты SFC нормализовали, чтобы описать ответа на 1е6 РВМС. Антигенспецифические ответы в таблицах представляют собой сумму ответов на соответствующие антигенспецифические пептидные пулы.
Результаты. Результаты ELISpot, представленные в Таблице 33, показывают, что животные, которые получили вакцину с подкожно введенным анти-PD-1 антителом и анти-CTLA4 антителом, демонстрировали устойчивое увеличение IFNγ-ответа Т-клеток на по меньшей мере один антиген рака предстательной железы, в то время как в группе с носителем (Группа 1) или в группе, в которую вводили только анти-PD-1 антитело (Группа 2) не было ответов на эти антигены.

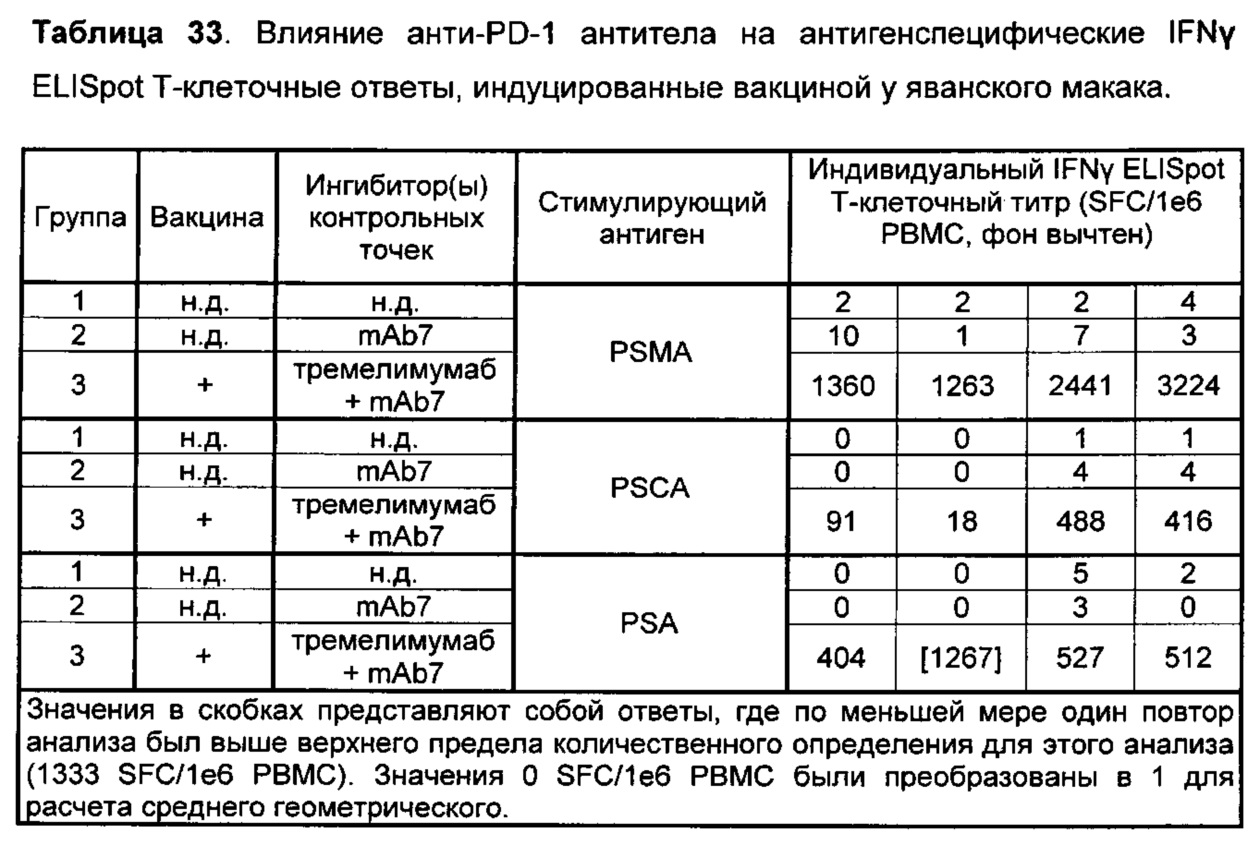
Хотя идеи, представленные в данном документе, описаны со ссылкой на различные применения, способы, наборы и композиции, понятно, что могут быть сделаны различные изменения и модификации без отступления от принципов, изложенных в описании изобретения, и заявленного ниже изобретения. Вышеприведенные примеры представлены, чтобы лучше проиллюстрировать раскрытые идеи, и не предназначены для ограничения объема представленного руководства. Хотя настоящее изобретение описано на основании этих типичных воплощений, специалисту в данной области понятно, что многочисленные варианты и модификации этих типичных воплощений возможны без излишних исследований. Все такие варианты и модификации входят в объем настоящего руководства.
Все приведенные здесь ссылки, включая патенты, заявки на патенты, статьи, учебники и т.п., а также цитируемые здесь ссылки, в той степени, в которой они еще не описаны, включены в настоящее описание посредством ссылки во всей их полноте. Эта заявка превалирует в тех случаях, когда один или более из включенных литературных и подобных материалов отличается от данной заявки или противоречит этой заявке, включая, но без ограничения ими, определенные термины, применение терминов, описанные методы и т.п.
Вышеизложенное описание и примеры подробно описывают некоторые конкретные воплощения настоящего изобретения и лучший вариант, предлагаемый изобретателями. Однако понятно, что независимо от того, насколько подробно вышеизложенное представлено в тексте, изобретение может быть осуществлено на практике многими способами и что изобретение должно толковаться в соответствии с прилагаемой формулой изобретения и любыми ее эквивалентами.