Результат интеллектуальной деятельности: БИОМАРКЕРЫ РИСКА РАЗВИТИЯ ОСЛОЖНЕНИЙ ИНФЕКЦИОННОГО МОНОНУКЛЕОЗА, АССОЦИИРОВАННОГО С ВИРУСОМ ЭПШТЕЙНА-БАРР
Вид РИД
Изобретение
Изобретение относится к области генетической инженерии, молекулярной биологии и медицины, касается применения биомаркеров для оценки риска развития осложнений инфекционного мононуклеоза, ассоциированного с вирусом Эпштейна-Барр, и может быть использовано в катамнестических исследованиях детей групп риска после выписки из клиники для контроля эффективности лечения и уменьшения риска хронизации заболевания.
Инфекционный мононуклеоз (ИМ) - лимфопролиферативное заболевание, возбудителем которого в 90-95% случаев является вирус Эпштейна-Барр (ВЭБ, Human gammaherpesvirus 4), относящийся к семейству Herpesviridae.
ВЭБ инфицирует преимущественно В-лимфоциты, а также Т-лимфоциты, натуральные киллеры и другие клетки. [Филатова Е.Н., Уткин О.В. Современные подходы к моделированию герпесвирусной инфекции // Журнал МедиАль. - 2014. - №2(12). - С. 172-197.].
Характерной особенностью ВЭБ является его способность стимулировать пролиферацию инфицированных лимфоцитов путем изменения соотношения ростовых и апоптотических потенциалов клеток [Дранкин Д.И., Заяц Н.А. Эпидемиология инфекционного мононуклеоза // Журнал микробиологии, эпидемиологии и иммунобиологии. - 1982. - №1. - С. 26-33].
ВЭБ сохраняется в организме пожизненно в фазе латенции. В результате перенесенной инфекции могут развиваться вторичный иммунный дефицит и различные нарушения клеточных иммунных реакций [Кускова Т.К., Белова Е.Г. Семейство герпес-вирусов на современном этапе // Лечащий врач. - 2004. - №5, - С. 64-69.].
По данным литературы, выраженные изменения иммунитета на клеточном уровне сохраняются на протяжении 1,5-6 месяцев после манифестации ВЭБ-ассоциированного инфекционного мононуклеоза, что создает предпосылки для его хронизации. [Кудин А.П., Романовская Т.Р., Белевцев М.В. Состояние специфического иммунитета при инфекционном мононуклеозе у детей // Медицинский журнал. - 2007. - Т. 1, №19 - С. 102-106.].
Персистенция ВЭБ поддерживается с помощью продуктов генома вируса, которые способны ингибировать сигнальные пути апоптоза, обеспечивая экранирование инфицированных клеток от воздействия иммунного ответа [Fu Q., Не С., Мао Z. R. Epstein-Barr virus interactions with the Bcl-2 protein family and apoptosis in human tumor cells // Journal of Zhejiang University. Sci-ence. Biomedicine and Biotechnology. - 2013. Vol. 14. №1. - P. 8-24.].
Регуляция сигнальных путей апоптоза и выживания осуществляется, в том числе, на транскрипционном этапе путем изменения уровней мРНК, кодирующих про - и анти-апоптотические факторы [Филатова Е.Н., Уткин О.В. Роль некодирующих изоформ мРНК белок-кодирующих генов в регуляции генной экспрессии // Генетика. - 2018. Т. 54, №8. - С. 1-10.; Lee Y., Rio D.C. Mechanisms and regulation of alternative pre-mRNA splicing // Annual review of biochemistry. - 2015. Vol. 84. - P. 291-323.].
Выделяют два основных сигнальных пути апоптоза клеток: внешний, реализуемый при участии мембранных рецепторов смерти, и внутренний, митохондриальный путь. Оба пути приводят к активации ключевых эффекторов апоптоза - каспаз-3, -6 и -7, которые вызывают протеолиз широкого спектра структурных и функциональных белков клетки [Уткин О.В., Новиков В.В. Рецепторы смерти в модуляции апоптоза // Успехи современной биологии. - 2012. Т. 132, №4. - С. 381-390].
Формирование молекулярного комплекса DISC (death inducing signaling complex) является начальным этапом реализации внешнего сигнального пути апоптоза. В состав DISC входит тример одного из лигандов (FasL, TNFSF10) и, соответственно, рецепторов смерти (Fas, TNFRSF10A или TNFRSF10B), медиатор FADD (Fas-associated death domain) и инициаторная каспаза С ASP 8. DISC инициирует каскадную активацию эффекторных каспаз CASP-3, CASP-6, и CASP-7, а также может протеолитически активировать митохондриальный фактор BID, который инициирует внутренний путь апоптоза. Ингибиторами DISC являются cFLAR (ингибитор каспазы-8) и рецепторы-ловушки TNFRSF10C и TNFRSF10D, которые конкурируют с рецепторами смерти TNFRSF10A и TNFRSF10B за связывание лиганда TNFSF10. Фактор CFLAR обладает высоким сродством к CASP 8 и блокирует ее рекрутирование в комплекс DISC, препятствуя инициации внешнего пути апоптоза [Irmler М., Thome М., Hahne М., Schneider P., Hofmann K., Steiner V., Bodmer J.L., Schroter М., Burns K., Mattmann С., Rimoldi D., French L.E., Tschopp J. Inhibition of death receptor signals by cellular FLIP//Nature.- 1997. Vol. 388. №6638, - Р. 190-195].
Продукты генома ВЭБ оказывают выраженное влияние на уровни мРНК CASP8 и ее ингибитора CFLAR. Так, резистентные к апоптозу ВЭБ-позитивные клеточные линии В-клеточной лимфомы Беркитта характеризуются повышенными уровнями экспрессии мРНК анти-апоптотического фактора CFLAR, а соотношение уровней мРНК CASP8 и CFLAR коррелировало с чувствительностью клеток к апоптозу [Tepper C.G., Seldin M.F. Modulation of caspase-8 and FLICE-inhibitory protein expression as a potential mechanism of Epstein-Barr virus tumorigenesis in Burkitt's lymphoma // Blood. - 1999. Vol. 94. №5. -P. 1727-1737.].
Внутренний путь апоптоза под влиянием различных факторов инициируется при снижении проницаемости митохондриальной мембраны. В результате в цитозоль проникают про-апоптотические факторы APAF-1 и CYCS, которые объединяются с CASP-9 в сигнальный комплекс - апоптосому. В рамках апоптосомы инициируется протеолитическая активация эффекторных каспаз. Ключевую роль в регуляции проницаемости митохондриальной мембраны играют белки семейства BCL-2. Про-апоптотические факторы (ВАХ, BAK1, BID, BAD, BCL2L11, ВВС3 и др.) усиливают транспорт ионов и других молекул, снижая барьерный потенциал митохондрий, а анти-апоптотические факторы (BCL-2, BCL2L1, BCL2L2, MCL-1 и др.) ингибируют этот процесс [Уткин О.В., Новиков В.В. Регуляция апоптоза с помощью альтернативного сплайсинга матричной РНК // Российский биотерапевтический журнал. - 2007. Т.6, №2.- С. 13-20].
В модуляции митохондриального пути апоптоза участвуют многие продукты генома ВЭБ. Так, экспрессия про-апоптотического фактора ВВС3 ингибируется посредством микро-РНК ВЭБ BART5 в клетках ВЭБ-опосредованной носоглоточной карциномы [Choy E.Y., Siu K.L., Kok K.Н., Lung R.W., Tsang С.М., To K.F., Kwong D.L., Tsao S.W., Jin D.Y. An Epstein-Barr virus-encoded microRNA targets PUMA to promote host cell survival // The Journal of Experimental Medicine. - 2008. Vol. 205. №11. - P. 2551-2560.]. Экспрессия про-апоптотического фактора BID ингибируется микро-РНК ВЭБ miR-BART4-5p в опухолевых клетках ВЭБ-ассоциированного рака желудка [Shinozaki-Ushiku A., Kunita A., Isogai М., Hibiya Т., Ushiku Т., Takada K., Fu-kayama М. Profiling of virus-encoded microRNAs in Epstein-Barr virus-associated gastric carcinoma and their roles in gastric carcinogenesis // Journal of Virology.- 2015. Vol. 89. №10. - P. 5581-5591], а в ВЭБ-инфицированных B-клетках белки ВЭБ EBNA3A и EBNA3C координированно ингибируют экспрессию мРНК про-апоптотического фактора BIM [Paschos K., Smith Р., An-derton Е., Middeldorp J.M., White R.E., Allday М.J. Epstein-Barr virus latency in В cells leads to epigenetic repression and CpG methylation of the tumor suppressor gene bim. PLoS // Pathogens. - 2009. Vol. 5. №6. - Р. 1000492].
В литературе описаны продукты генома ВЭБ, которые могут, как активировать, так и ингибировать экспрессию анти-апоптотических факторов митохондриального пути апоптоза. Так, белок ВЭБ BZLF1 способен ингибировать экспрессию анти-апоптотических факторов BCL-2 и BCL2L1 в CD4+ Т-клетках в ходе литической фазы ВЭБ-инфекции [Fu Q., Не С., Мао Z.R. Epstein-Barr virus interactions with the Bcl-2 protein family and apoptosis in human tumor cells // Journal of Zhejiang University. Science. Biomedicine and Biotechnology. - 2013. Vol. 14. №1. - P. 8-24.; Lantner F., Starlets D., Gore Y., Flaishon L., Yamit-Hezi A., Dikstein R., Leng L., Bucala R., Machluf Y., Oren M., Shachar I. CD74 induces ТАр63 expression leading to B-cell survival // Blood. - 2007. Vol. 110. №13. - P. 4303-4311.; Zuo J., Thomas W.A., Haigh T.A., Fitzsimmons L., Long H.M., Hislop A.D., Taylor G.S., Rowe M. Epstein-Barr virus evades CD4+T cell responses in lytic cycle through BZLF1-mediated down-regulation of CD74 and the cooperation of vBcl-2. PLoS // Pathogens. - 2011. Vol. 7. №12. - P. 1002455.], а белок ВЭБ EBNA2 усиливает экспрессию анти-апоптотических молекул BFL-1, BCL2L1, BCL-2 и MCL-1 в ходе пролиферации и иммортализации В-клеток [Kohlhof Н., Hampel F., Hoffmann R., Burtscher H., Weidle U.H., Holzel M., Eick D., Zimber-Strobl U., Strobl L.J. Notchl, Notch 2 and Epstein-Barr virus-encoded nuclear antigen 2 signaling differentially affects proliferation and survival of Epstein-Barr virus-infected В cells // Blood. - 2009. Vol. 113. №22. - P. 5506-5515.]. В повышении уровня мРНК BCL2L1 опосредованно участвует мембранный белок ВЭБ LMP2, активируя транскрипционный фактор NFkB, а также элементы AKT-зависимого сигналинга [Steelman L.S., Pohnert S.C., Shelton J.G., Franklin R.A., Bertrand F.E., McCubrey J.A. JAK/STAT, Raf/MEK/ERK, PI3K/Akt and BCR-ABL in cell cycle progression and leukemogenesis // Leukemia. - 2004. Vol. 18. №2. - P. 189-218], что приводит к повышению выживаемости клеток.
ВЭБ-ассоциированная активация элементов транскрипционного комплекса NFkB1 отмечается в опухолевых линиях. Так, в ВЭБ-трансформированных В-клетках при участии белка ВЭБ BARF1 повышается экспрессия RELA, усиливающая пролиферацию инфицированных лимфоцитов [Chanut А., Duguet F., Marfak A., David A., Petit В., Parrens М., Durand-Panteix S., Boulin-Deveza M., Gachard N., Youlyouz-Marfak I., Bordessoule D., Feuillard J., Fau-mont N. RelA and RelB cross-talk and function in Epstein-Barr virus transformed В cells // Leukemia. - 2014. Vol. 28. №4. P. 871-879], а в клеточных линиях рака желудка при реактивации ВЭБ - уровни мРНК RELB [Nandakumar А., Uwatoko F., Yamamoto М., Tomita K., Majima H.J., Akiba S., Koriyama С. Radiation-induced Epstein-Barr virus reactivation in gastric cancer cells with latent EBV infection // Tumor Biology. - 2017. - Vol. 39. - №7. - P. 1010428317717718]. Кроме того, активация транскрипционного комплекса NFkB1 происходит с помощью белка ВЭБ - LMP1, медиаторами которого служат клеточные белки TRAF2 и MAP3K14 [Luftig М.А., Cahir-McFarland E., Mosialos G., Kieff E. Effects of the NIK aly mutation on NF-κВ activation by the Epstein-Barr Virus latent infection membrane protein, lymphotoxin β receptor, and CD40 // J.Biol.Chem. - 2001. -Vol. 276. - №18. - Р. 14602-14606].
Задача данного изобретения - применение биомаркеров, которые представляют собой гены и мРНК, участвующие в сигнальных путях апоптоза и выживания, относительные уровни экспрессии которых в лейкоцитах периферической крови значительно различаются по сравнению со здоровыми донорами в острой фазе ВЭБ-ассоциированного мононуклеоза, и сохраняются альтерированными в фазе реконвалесценции в отсутствие клинических признаков заболевания для оценки риска развития осложнений инфекционного мононуклеоза, ассоциированного с вирусом Эпштейна-Барр.
Изменение параметров данных биомаркеров в ходе ВЭБ-ассоциированного мононуклеоза отражает их связь с механизмами патогенеза данного заболевания, позволяет оценивать эффективность терапии, облегчает проведение клинических исследований при выборе того или иного препарата, а также при формировании групп риска.
Осуществление изобретения.
В изобретении представлены биомаркеры риска развития ВЭБ-ассоциированных осложнений, являющиеся генами и мРНК - участниками сигнальных путей апоптоза и выживания, изменения относительных уровней экспрессии которых выявлялись в лейкоцитах периферической крови детей 7-18 лет с острым ВЭБ-ассоциированным мононуклеозом и тех же больных в фазе реконвалесценции после исчезновения клинических признаков заболевания. В качестве группы сравнения выступали практически здоровые доноры сопоставимого пола и возраста без клинических признаков заболевания. Анализ относительных уровней экспрессии биомаркеров был проведен с помощью технологии биочипов.
Дизайн и синтез биочипа. Подбор дискриминирующих зондов, являющихся функциональной основой биочипа, производили с использованием алгоритма "Splice variants microarray design pipeline" [Солнцев Л.А., Старикова В.Д., Сахарнов Н.А., Князев Д.И., Уткин О.В. Стратегия подбора зондов для изучения совокупности мРНК участников рецептор-опосредованного сигналинга апоптоза // Молекулярная биология. - 2015. Т. 49. №3. - Р. 515-524.]. Разработанный биочип содержит 1180 зондов для детекции уровней экспрессии мРНК и 367 зондов для оценки суммарной экспрессии генов (далее -экспрессии генов). Синтез зондов на биочип был проведен in situ с помощью аппарата В3 Synthesizer в соответствии с рекомендациями производителя (CustomArray Inc., WA, США).
Пробоподготовка образцов для гибридизации на биочип. Из образцов периферической крови выделялась фракция лейкоцитов, из которых выделялся пул РНК. Далее мРНК подвергалась обратной транскрипции и достройке второй цепи кДНК, которая, в свою очередь, подвергалась транскрипции с введением в состав мРНК биотинилированных уридинтрифосфа-тов. Полученная биотин-меченая мРНК гибридизовалась на биочипы. Считывание сигналов гибридизации проводилось амперометрическим методом.
Алгоритм обработки данных. Обработку сигналов гибридизации проводили с применением квантильной нормализации по неспецифическому контролю. Для измерения относительного уровня экспрессии мРНК (FC/fold-change) использовались средние значения сигналов гибридизации каждого зонда в выборках ВЭБ (острая фаза), РЕК (реконвалесценты) и НОРМ (здоровые доноры). Проводились сравнения между выборками ВЭБ/НОРМ и РЕК/НОРМ с использованием Т-теста с поправкой на ожидаемую долю ложных отклонений. В качестве порогового уровня значимости был выбран q=0,05.
Сущность способа поясняется примерами.
Пример 1. Провели анализ экспрессии мРНК и генов - элементов проапоптотического комплекса DISC в составе TNFSF10 (лиганд смерти), TNFRSF10B (рецептор смерти), FADD (медиатор), CASP8 (инициаторная каспаза 8), CFLAR (ингибитор каспазы-8) и TNFRSF10C, TNFRSF10D (рецепторы-ловушки) в острой фазе ВЭБ-ассоциированного инфекционного мононуклеоза и в фазе реконвалесценции. В качестве группы сравнения выступали здоровые доноры сопоставимого пола и возраста без клинических и лабораторных признаков заболевания (таблица 1).
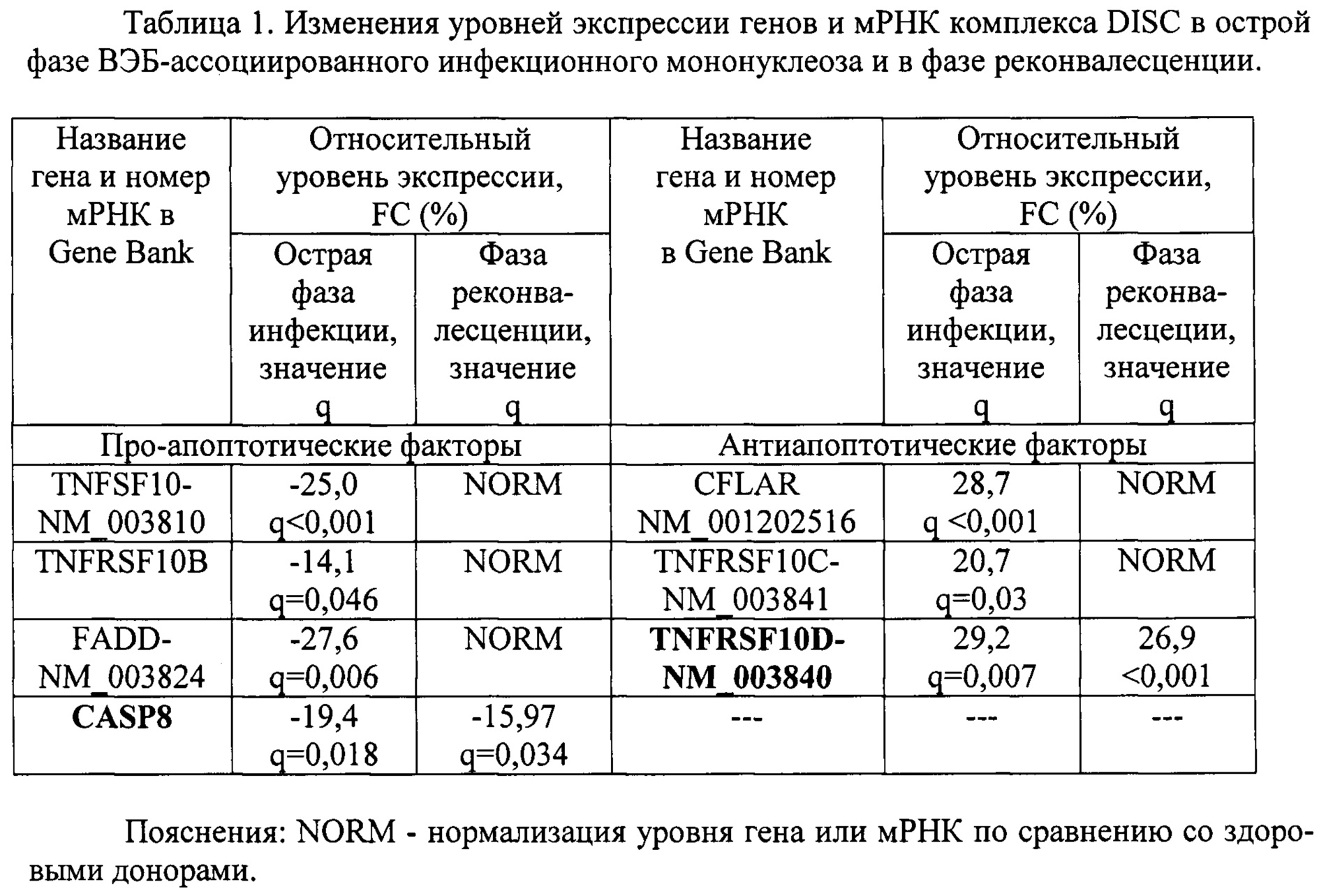
Как видно из таблицы 1, в острой фазе заболевания выявлялось существенное снижение уровней экспрессии генов TNFRSF10B, CASP8 и мРНК TNFSF10-NM_003810, FADD-NM_003824 и значительное повышение уровней экспрессии мРНК CFLAR-NM_001202516, TNFRSF10C-NM_003841 и TNFRSF10D-NM_003840. В фазе реконвалесценции уровень экспрессии гена CASP8 оставался сниженным, а уровень экспрессии мРНК TNFRSF10D-NM_003840 - повышенным.
Пример 2. Провели сравнительный анализ экспрессии мРНК и генов про-апоптотических (ВВС3, BAK1, BID) и анти-апоптотических (BCL2L1, BCL2, BCL2L11, MCL1, BCL2L2) элементов митохондриального пути апоптоза в острой фазе ВЭБ-ассоциированного инфекционного мононуклеоза и в фазе реконвалесценции. В качестве группы сравнения выступали здоровые доноры сопоставимого пола и возраста без клинических и лабораторных признаков заболевания (таблица 2).
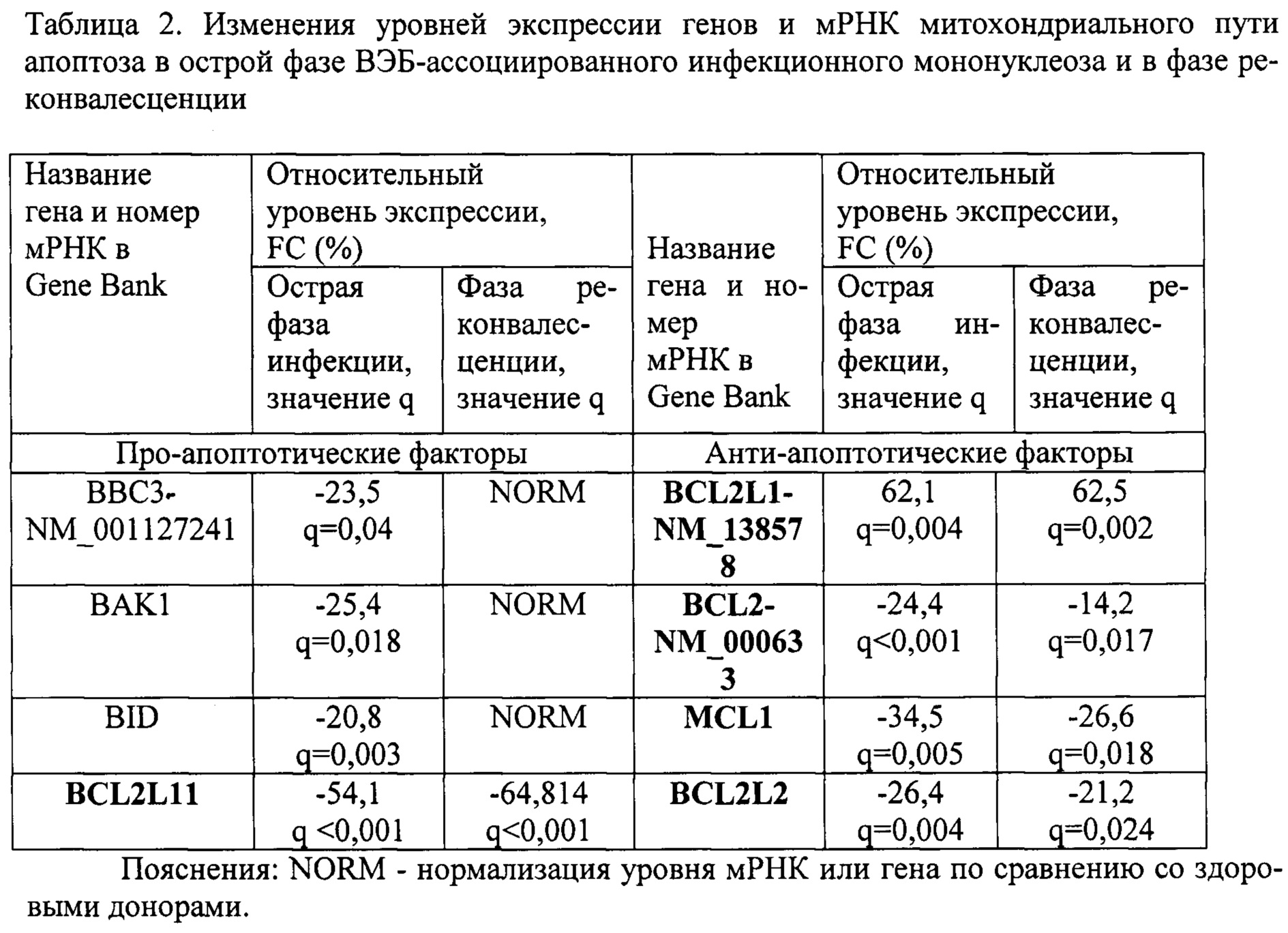
Как видно из таблицы 2, острая фаза заболевания характеризовалась значительным снижением уровней экспрессии генов BAK1, BID, BCL2L11, MCL1, BCL2L2 а также уровней экспрессии мРНК ВВС3-NM_001127241, BCL2-NM_000633. При этом был значительно повышен уровень мРНК BCL2L1-NM_138578. В фазе реконвалесценции оставались сниженными уровни генов BCL2L11, MCL1, BCL2L2 и мРНК BCL2-NM_000633, при этом оставался повышенным уровень мРНК BCL2L1-NM_138578.
Пример 3. Провели сравнительный анализ уровней экспрессии мРНК и генов эффекторных каспаз апоптоза CASP-3, CASP-6, CASP-7 и их ингибиторов BIRC2, XIAP в острой фазе ВЭБ-ассоциированного инфекционного мононуклеоза и в фазе реконвалесценции. В качестве группы сравнения выступали здоровые доноры сопоставимого пола и возраста без клинических и лабораторных признаков заболевания (таблица 3).
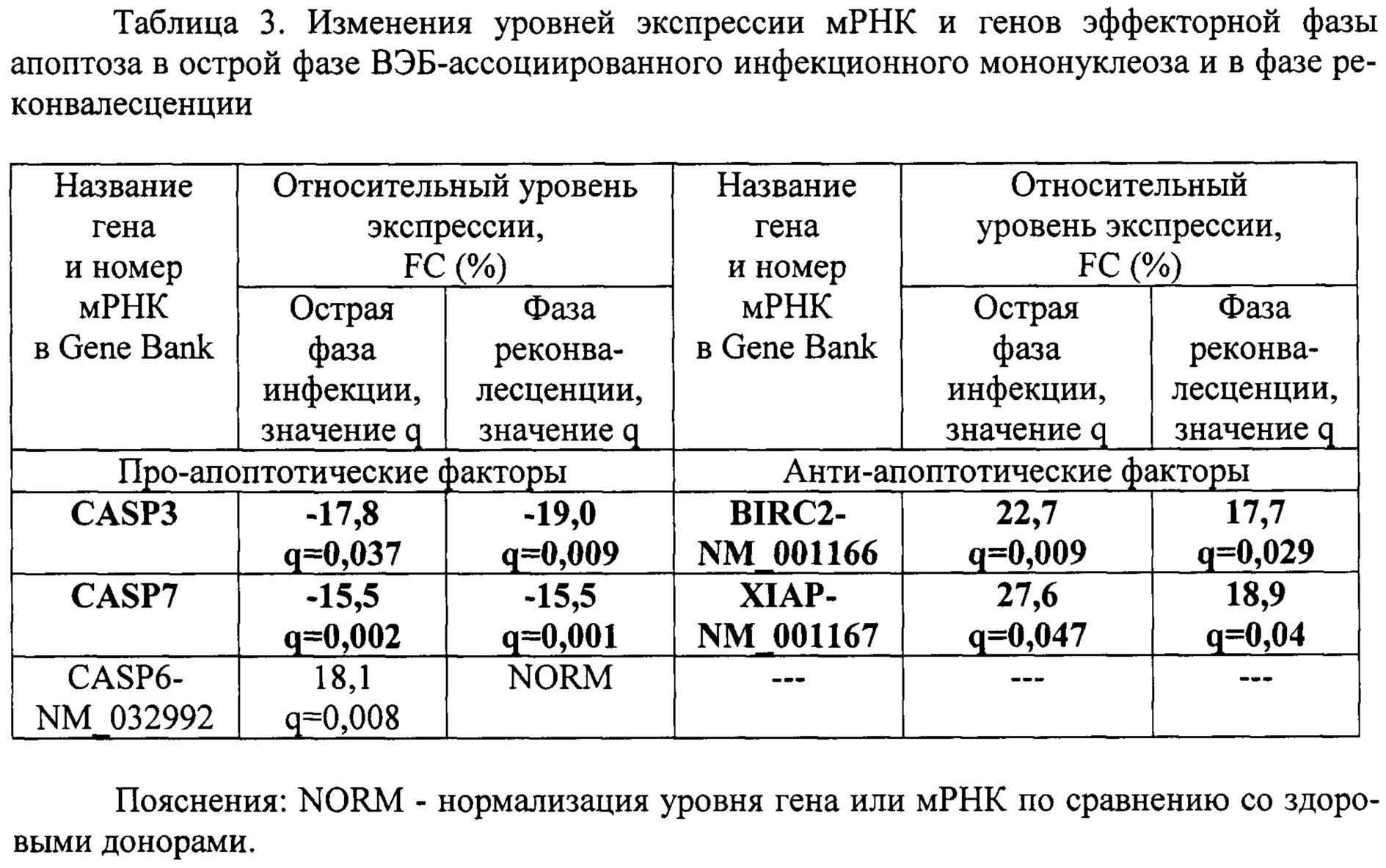
Как видно из таблицы 3, в острой фазе выявлялось снижение уровней экспрессии генов CASP3, CASP7 и повышение уровней экспрессии мРНК CASP6-NM_032992, BIRC2-NM_001166, XIAP-NM_001167. В фазе реконвалесценции оставались повышенными уровни экспрессии генов CASP3 и CASP7 и оставались сниженными уровни экспрессии мРНК BIRC2-NM_001166 и XIAP-NM_001167.
Пример 4. Провели анализ экспрессии мРНК и генов NFkB-опосредованного сигнального пути выживания - активаторов TRAF2, MAP3K14, IKBKG и элементов транскрипционных факторов NFKB1, RELA и RELB в острой фазе ВЭБ-ассоциированного инфекционного мононуклеоза и в фазе реконвалесценции. В качестве группы сравнения выступали здоровые доноры сопоставимого пола и возраста без клинических и лабораторных признаков заболевания (таблица 4).
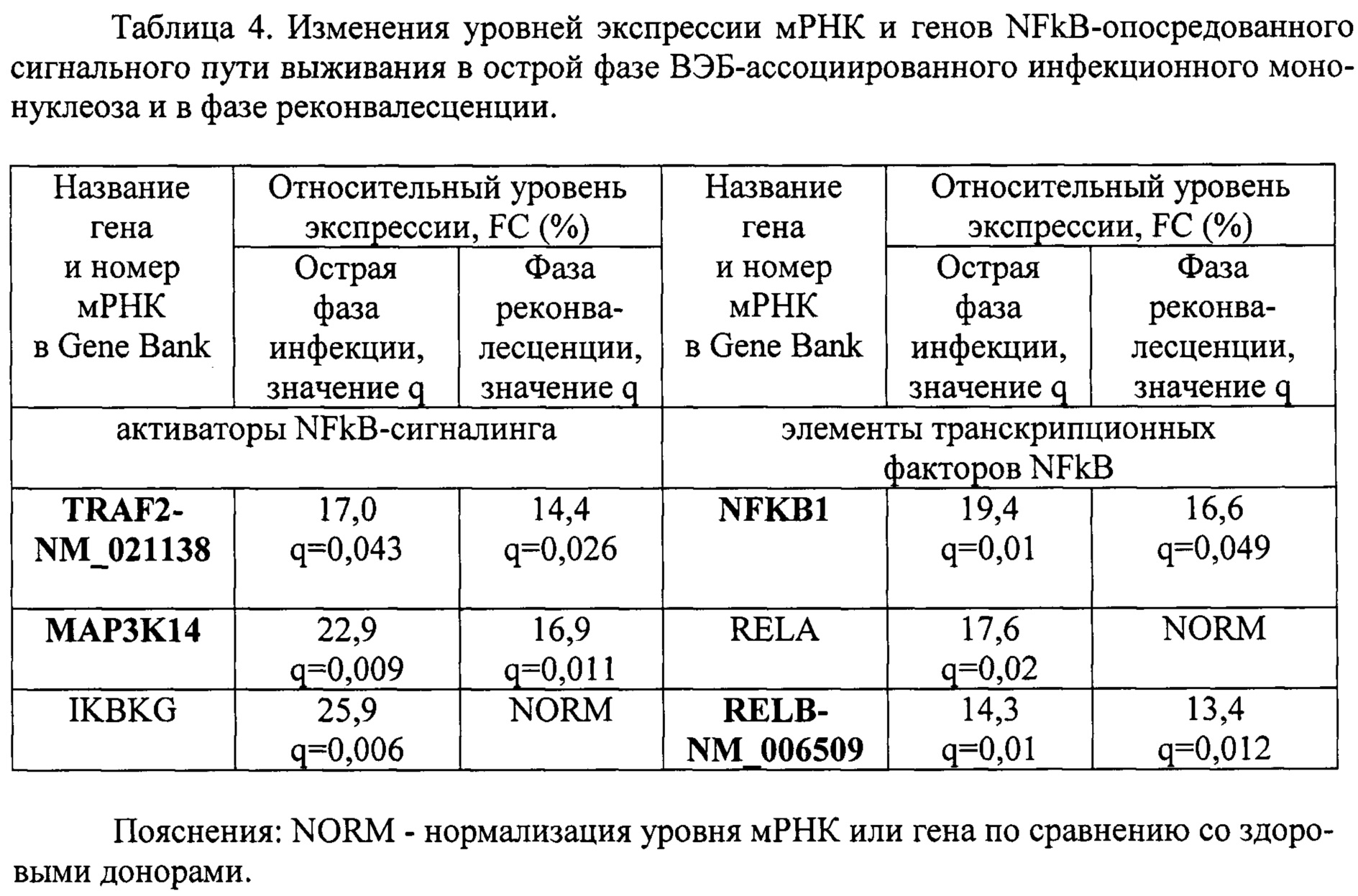
Как видно из таблицы 4, для острой фазы заболевания характерно повышение уровней экспрессии генов MAP3K14, IKBKG, NFKB1, RELA и мРНК TRAF2-NM_021138, RELB-NM_006509. В фазе реконвалесценции оставались повышенными уровни экспрессии генов MAP3K14, NFKB1 и мРНК TRAF2-NM_021138, и RELB-NM_006509.
Таким образом, в лейкоцитах крови в острой фазе ВЭБ-ассоциированного мононуклеоза и в фазе реконвалесценции был выявлен ряд генов и мРНК, относительные уровни экспрессии которых были отличны от таковых у здоровых доноров (таблица 5).
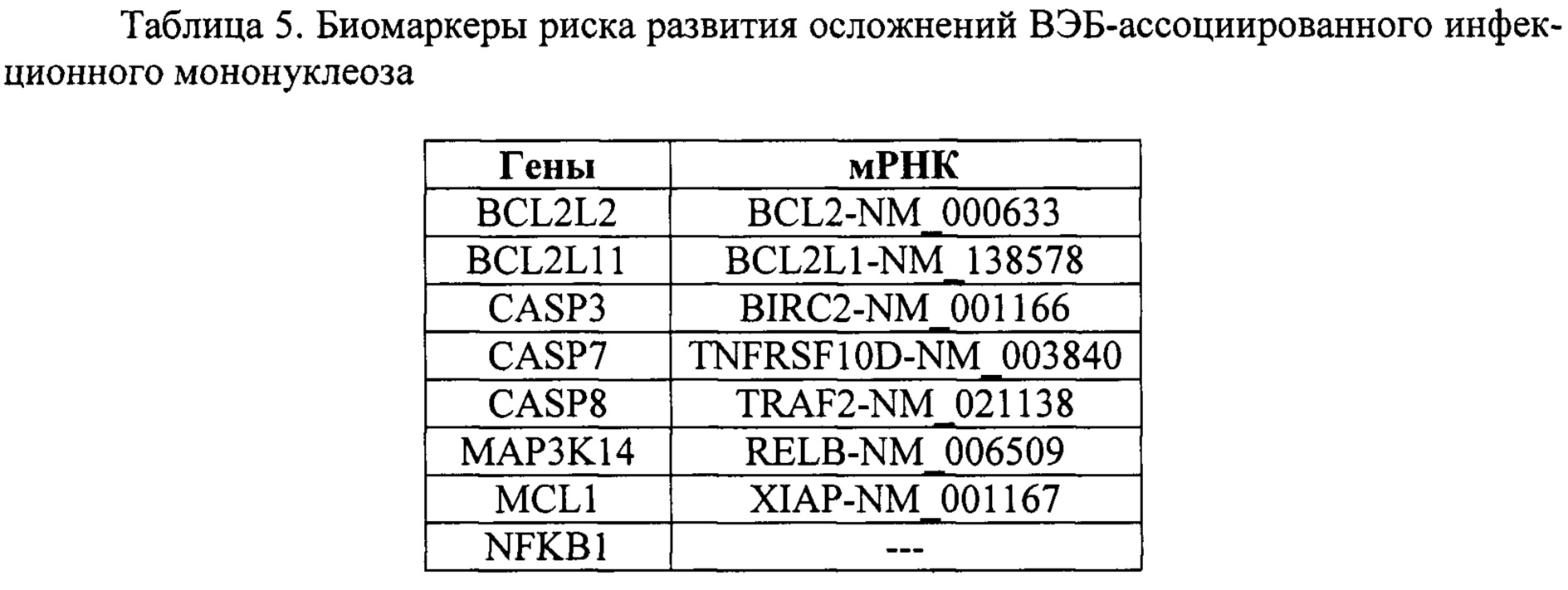
По данным литературы, выявленные нами гены и мРНК могут участвовать в модуляции активности сигнальных путей апоптоза и выживания, а также являться мишенями для воздействия продуктов генома ВЭБ, обеспечивая персистирование вируса в организме, хронизацию инфекции и облегчение ее реактивации при ослаблении иммунитета. Все вышеизложенное указывает на то, что данные факторы могут использоваться в качестве биомаркеров риска развития ВЭБ-ассоциированных осложнений.
Применение биомаркеров для оценки риска развития осложнений инфекционного мононуклеоза, ассоциированного с вирусом Эпштейна-Барр, где биомаркеры представляют собой гены BCL2L2, BCL2L11, CASP3, CASP7, CASP8, MAP3K14, MCL1, NFKB1 и мРНК BCL2-NM_000633, BCL2L1-NM_138578, BIRC2-NM_001166, TNFRSF10D-NM_003840, TRAF2-NM_021138, RELB-NM_006509, XIAP-NM_001167, выявленные в лейкоцитах периферической крови.
