Результат интеллектуальной деятельности: Способ диагностики постинфарктного воспаления в миокарде, ассоциирующегося с неблагоприятным ремоделированием сердца
Вид РИД
Изобретение
Изобретение относится к области медицины, конкретно к кардиологии.
Инфаркт миокарда (ИМ) и развивающаяся вследствие сердечная недостаточность (СН) остаются одними из ведущих причин заболеваемости и смертности во всем мире. Распространенность СН в различных регионах Российской Федерации варьирует в пределах 7-10%, при этом имеет место тенденция к увеличению доли пациентов с тяжелой СН (III-IV функционального класса). Годовая смертность от СН в Российской Федерации составляет 612 тысяч человек [1]. В основе синдрома сердечной недостаточности лежит ремоделирование сердца. Данный термин означает процесс комплексного нарушения его структуры и функции в ответ на повреждающую перегрузку или утрату функционирующего миокарда. При ИМ выключение из акта сокращения участка сердечной мышцы сопровождается структурными изменениями, которые вовлекают как поврежденные, так и отдаленные от инфаркта зоны. Эти структурные изменения, происходящие в сердце, часто предшествуют клиническому проявлению СН, являются предвестниками декомпенсации сердечной деятельности и отрицательно влияют на выживаемость больных [2].
У трети больных ИМ наблюдается прогрессирующее ремоделирование сердца, даже в случае выполнения всех современных рекомендаций по лечению ИМ. У остальных пациентов неблагоприятное ремоделирование либо отсутствует, либо имеет обратимый характер, либо наблюдается в отдаленные сроки заболевания. Механизм развития неблагоприятного ремоделирования миокарда до сих пор остается во многом не ясным [3], и поэтому, на сегодняшний день, своевременная диагностика постинфарктного ремоделирования сердца остается одной из самых сложных и неразрешенных проблем в кардиологии. Своевременная диагностика неблагоприятного ремоделирования сердца у конкретного пациента необходима для определения лучшей стратегии наблюдения и лечения, предотвращения его дальнейшего прогрессирования.
Совершенствование и развитие медицинских технологий внесли вклад в эволюцию взглядов на патофизиологическую модель формирования и прогрессирования постинфарктного ремоделирования сердца. Полученные данные свидетельствуют о том, что в клеточно-молекулярной основе постинфарктного ремоделирования сердца лежит хроническое асептическое воспаление, развивающееся в миокарде в ответ на ишемическое повреждение [3]. Предметом научного интереса стали клетки врожденного иммунитета - моноциты/макрофаги, так как ишемия миокарда и гибель кардиомиоцитов запускает воспалительную реакцию, одним из компонентов которой является миграция моноцитов периферической крови к очагу повреждения и их дифференцировка в макрофаги. Эти клетки играют важную роль в переходе воспалительной фазы постинфарктного восстановления миокарда в регенераторную фазу [4].
Моноциты/макрофаги представляют собой гетерогенную популяцию клеток с различными функциями, как провоспалительными, так и противовоспалительными, а также обладающую свойством пластичности - возможности трансформации одной субпопуляции макрофагов в другую под воздействием цитокинов, и других сигнальных молекул, секретируемых клетками окружения [5]. Каждая их субпопуляций экспрессирует на своей поверхности различные молекулярные биомаркеры, которые, согласно современной концепции должны быть использованы для детальной характеристики той или иной субпопуляции и ее функций. При этом, благополучное течение постинфарктной репарации и ремоделирования миокарда зависит не от какой-либо одной из субпопуляций моноцитов/макрофагов, а от их координированного ответа на ишемию - своевременного начала и разрешения воспаления. Чрезмерная активация или угнетение одной из субпопуляций может приводить к нарушению координации воспалительного ответа, запуску неконтролируемого образования соединительной ткани (фиброза), неблагоприятному ремоделированию сердца и СН. Учитывая гетерогенность, многофункциональность и возможность перепрограммирования одного фенотипа макрофагов в другой, они привлекают к себе пристальное внимание как потенциальная целевая клетка - терапевтическая мишень, которая может изменять процесс репарации и структурно-функциональной перестройки сердца во время и после ИМ [6]. Одними из молекулярных биомаркеров моноцитов/макрофагов, которые широко продемонстрировали свои диагностические возможности, являются скавенджер-рецептор стабилин-1 и α-гладкомышечный актин (α-SMA). Стабилин-1-позитивные макрофаги принимают участие в процессах регуляции репарации, ангиогенеза, фиброгенеза, тканевого ремоделирования [7]. α-SMA является маркером трансдиффренцировки макрофагов в миофибробласты (фибробласты с контрактильным фенотипом), которые присутствуют в тканях в процессе репарации. Способность миофибробластов к сокращению очень важна для поддержания сократительной функции миокарда в период постинфарктной репарации, так как их сокращения поддерживают насосную функцию сердца до полного развития компенсаторных механизмов [8].
Исходя из вышеизложенного, на сегодняшний день актуальна разработка способа диагностики постинфарктного воспаления в миокарде, ассоциирующегося с неблагоприятным ремоделированием сердца, основанного на современных результатах исследований в области клеточно-молекулярной кардиологии и позволяющего оценить воспалительную реакцию, протекающей в миокарде в ответ на ишемию.
В проанализированной патентной и научно-медицинской литературе адекватного прототипа не обнаружено.
Задачей изобретения является создание способа диагностики постинфарктного воспаления в миокарде, ассоциирующегося с неблагоприятным ремоделированием сердца.
Поставленную задачу решают путем проведения иммунофлюоресцентного анализа образцов миокарда у больных, перенесших ИМ, и определения количества стабилин-1-позитивных/α-SMA-негативных макрофагов в 1 мм2, являющегося критерием постинфарктного воспаления в миокарде, ассоциирующегося с неблагоприятным ремоделированием сердца. Критерием диагностики постинфарктного воспаления в миокарде, ассоциирующегося с неблагоприятным ремоделированием сердца является количество стабилин-1-позитивных/α-SMA-негативных макрофагов 0-18/мм2 в области миокарда, отдаленной от инфарктной зоны, при оптическом увеличении 630.
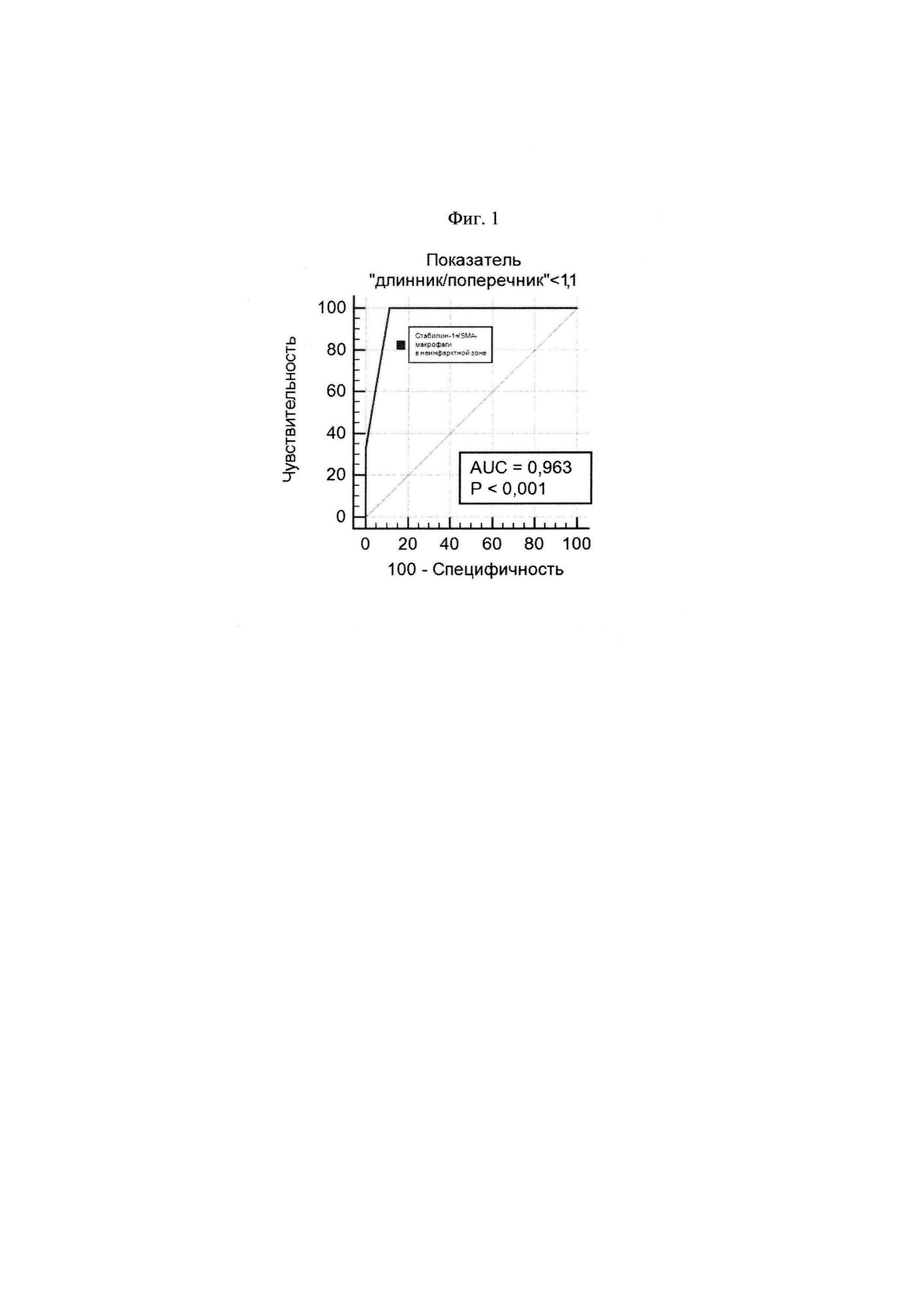
Данный диагностический критерий определен в результате анализа данных 41 больного фатальным ИМ I типа. Проведен иммунофлюоресцентный анализ образцов миокарда, отдаленной от инфаркта области, и произведен подсчет стабилин-1-позитивных/α-SMA-негативных макрофагов. По результатам ROC-анализа получено, что при количестве стабилин-1-позитивных/α-SMA-негативных макрофагов 0-18/мм2 при оптическом увеличении 630, у больных диагностируют постинфарктное воспаление в миокарде, ассоциирующееся с неблагоприятным ремоделированием сердца. За определение неблагоприятного ремоделированием сердца взято отношение размеров сердца «длинник/поперечник» равное 0,8-1,0. Чувствительность способа составила 100%, а специфичность - 88,9%. Площадь под ROC-кривой составила 0,96, а значение р-уровня значимости - менее 0,0001, что свидетельствует о высоком качестве классификатора (фиг. 1).
Таким образом, мы определили критерий для диагностики постинфарктного воспаления в миокарде, ассоциирующегося с неблагоприятным ремоделированием сердца.
Использование предлагаемого изобретения позволит производить отбор пациентов, нуждающихся в дополнительном мониторировании как в течение госпитализации, так и на амбулаторном этапе, имеющих показания к назначению максимально переносимых доз известных на сегодняшний день лекарственных препаратов, обладающих антифибротическим и антигипертрофическим действием - ингибиторов ангиотензинпревращающего фермента или антагонистов рецепторов ангиотензина II или комбинации антагониста рецепторов ангиотензина II с ингибитором неприлизина и/или антагонистов альдостерона. Предлагаемый способ диагностики может быть использован специалистами в области трансляционной кардиологии с целью разработки таргетной терапии неконтролируемого постинфарктного воспаления в миокарде, предотвращающей развитие прогрессирующего ремоделирования сердца и СН.
Существенные признаки изобретения проявили в заявляемой совокупности новые свойства, явным образом не вытекающие из уровня техники и неочевидные для специалиста.
Идентичной совокупности признаков в известных технических решениях не обнаружено.
Предлагаемый способ может быть использован в практическом здравоохранении для повышения качества диагностики постинфарктного неблагоприятного ремоделирования сердца и развития персонализированного подхода к лечению больных, перенесших ИМ.
Исходя из вышеизложенного, следует считать предлагаемый в качестве изобретения способ соответствующим условиям патентоспособности «Новизна», «Изобретательский уровень», «Промышленная применимость».
Изобретение будет понятно из следующего описания и приложенной к нему фигур.
На фиг. 1 изображена полученная ROC-кривая
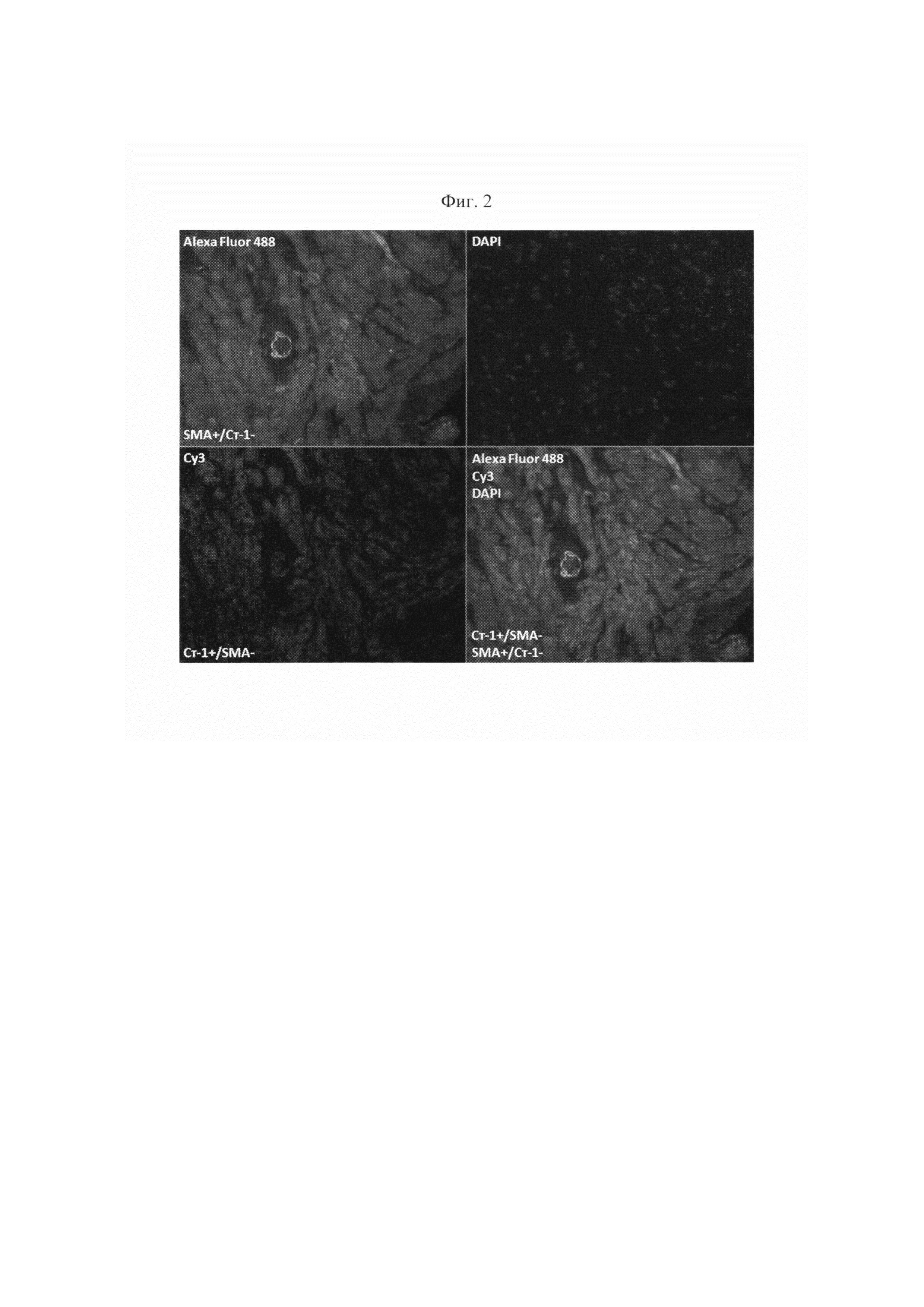
На фиг. 2 изображен результат иммунофлюоресцентного анализа образца пациента, перенесшего ИМ.
Способ осуществляют следующим образом.
Пациенту, перенесшему ИМ и имеющему показания к морфологическому исследованию ткани сердца, проводят эндомиокардиальную (ЭМБ) или интраоперационную биопсию миокарда. Биоптом проводят через правую бедренную вену или правую подключичную вену и осуществляют забор образцов миокарда из верхушки, межжелудочковой перегородки и выводного отдела правого желудочка. В случае наличия у больного показаний к хирургическому лечению ишемической болезни сердца и ее осложнений проводят интраоперационную биопсию миокарда. Фиксация образов миокарда осуществляется в 10% забуференном формалине в течение 24 часов, после чего следует стандартная гистологическая проводка и заливка в парафин. Микротомные парафиновые срезы толщиной 3-5 мкм наносят на стекла с L-полилизиновым покрытием и высушивают на нагревательном столике. С целью более качественной депарафинизации, полученные препараты помещают в термостат (60°С) на 1 час. Следующим шагом проводят депарафинизацию срезов путем последовательной проводки в трех сменах орто-ксилола и трех сменах этанола убывающей концентрации (100%, 80%, 70%). Продолжительность каждого этапа (смены) составляет 5 минут. Далее следует двукратная промывка в дистиллированной воде, по 5 минут каждая. После депарафинизации проводят высокотемпературную 20-минтуную демаскировку антигенов путем томления на водяной бане 96°С в буфере Tris-EDTA рН 9,0. Препараты остывают при комнатной температуре в течение не менее 20 минут. Затем осуществляется приготовление промывочного натрий-фосфатного буфера. Приготовленный раствор распределяют в 4 стандартных контейнерах для промывки. Препараты промывают в двух контейнерах по 5 минут в каждом. Срезы обводят гидрофобным карандашом для более экономичного расхода реагентов. На стекло наносят несколько капель (так, чтобы покрыть срез) раствора для блокировки эндогенной пероксидазы. Препараты инкубируют в течение 10 минут при комнатной температуре во влажной камере. Препараты вновь промывают в двух контейнерах по 5 минут. Следующим шагом на срез наносят несколько капель раствора для блокировки неспецифического связывания антител (3% раствор бычьего сывороточного альбумина на натрий-фосфатном буфере) и инкубируют в течение 50 мин при комнатной температуре во влажной камере. Данный этап необходим для того, чтобы убрать/минимизировать неспецифическое фоновое окрашивание. По окончании этапа, не промывая, сливают раствор для блокировки неспецифического связывания антител. Далее на срезы наносят первичные антитела к стабилину-1 (некоммерческие кроличьи поликлональные антитела) и α-SMA (Abcam, мышиные моноклональные антитела) и инкубируют в течение 35 минут при комнатной температуре во влажной камере. Раствор первичных антител готовится в одной пробирке типа Эппендорф. Для его приготовления используют разбавитель для антител (1% раствор бычьего сывороточного альбумина в натрий-фосфатном буфере) в соотношении анитело : разбавитель - 1:1000 для стабилина-1 и 1:300 для α-SMA. После нанесения первичных антител следует трехкратная промывка по 5 минут каждая. Следующий этап заключается в нанесении на срезы вторичных антител: Alexa Fluor 488, Cyanine-3 (Су3) и ядерного красителя 4,6-diamidino-2-phenylindole (DAPI). Срезы инкубируют в течение 60 минут при комнатной температуре в темной влажной камере. Раствор вторичных антител готовится в одной светонепроницаемой пробирке типа Эппендорф. Для его приготовления используют разбавитель для антител в соотношении анитело : разбавитель - 1:300 для Alexa Fluor 488 и Су3, 1:1000 для DAPI. После нанесения вторичных антител следует четырехкратная промывка по 5 минут каждая. На срезы наносят среду для заключения (Faramount Aqueous Mounting Medium, Dako Cytomation) и фиксируют покровное стекло. Подсчет клеток может осуществляться, как только срезы заключены под подковное стекло, так и отсрочено. Препараты хранятся при температуре 4°С в светонепроницаемом планшете с крышкой. Количественный анализ проводится двумя независимыми исследователями на прямом исследовательском флуоресцентном микроскопе. Количество стабилин-1-позитивных/α-SMA-негативных макрофагов подсчитывают в зоне, отдаленной от ИМ. Каждая область оценивается в 20 полях зрения при оптическом увеличении 630. Критерием диагностики постинфарктного воспаления в миокарде, ассоциирующегося с неблагоприятным ремоделированием сердца, является количество стабилин-1-позитивных/α-SMA-негативных макрофагов 0-18/мм2, а именно α-SMA+/стабилин-1- макрофаги и стабилин-1+/α-SMA- макрофаги в зоне, отдаленной от инфарктной области (фиг. 2).
Клинический пример 1.
Больной В., 56 лет, в апреле 2018 года перенес мелкоочаговый ИМ без подъема сегмента ST. В острый период инфаркта была проведена диагностическая коронарная ангиография, и выявлен стеноз ствола левой коронарной артерии 60%. По ультразвуковому исследованию сердца фракция выброса левого желудочка составила 50% (СН с промежуточной фракцией выброса), выявлены гипокинезы верхушечных сегментов. В раннем постинфарктном периоде стенокардия не рецидивировала. Пациент был проконсультирован кардиохирургом. Принимая во внимание течение ишемической болезни сердца (ИБС), характер поражения коронарного русла, с целью улучшения прогноза больному было рекомендовано проведение хирургического лечения ИБС (коронарного шунтирования) в плановом порядке через 3 месяца от перенесенного ИМ. Медикаментозная терапия проводилась согласно национальным рекомендациям по лечению больных с острым коронарным синдромом без подъема сегмента ST, в том числе был назначен ингибитор ангиотензинпревращающего фермента. Пациент выписан в удовлетворительном состоянии.
На амбулаторном этапе, с учетом отсутствия клиники СН и гипертонической болезни в анамнезе, больному отменен ингибитор ангиотензинпревращающего фермента в связи со значениями САД 90-100 мм.рт.ст.
Пациент был повторно госпитализирован через 3 месяца от ИМ с целью проведения операции коронарного шунтирования. Во время оперативного лечения выполнена интраоперационная биопсия миокарда. Проведен иммунофлюоресцентный анализ полученных образцов миокарда, отдаленной от инфаркта области. Количество стабилин-1-позитивных/α-SMA-негативных макрофагов составило 14/мм2, что является критерием постинфарктного воспаления в миокарде, ассоциирующегося с неблагоприятным ремоделированием сердца. В послеоперационном периоде больному назначен в ингибитор ангиотензинпревращающего фермента в максимально переносимой дозе, а также рекомендовано посещение кардиолога не менее двух раз в год, определение концентрации предшественника мозгового натрийуретического пептида, проведение эхокардиографии не менее двух раз в течение первого года после перенесенного ИМ, в последующем, при отсутствии отрицательной динамики - не менее одного раза в год. Результаты иммунофлюоресцентного исследования внесены в научную базу данных с целью последующего анализа возможности разработки таргетной терапии неконтролируемого постинфарктного воспаления в миокарде.
Клинический пример 2.
Больной Г., 50 лет, в январе 2018 года перенес крупноочаговый ИМ с подъемом сегмента ST. В острый период инфаркта была проведена диагностическая коронарная ангиография, выявлен субтотальный стеноз передней нисходящей артерии, выполнено стентирование субтотального стеноза. По ультразвуковому исследованию сердца фракция выброса левого желудочка составила 42% (СН со сниженной фракцией выброса), выявлены а- и гипокинезы передней стенки. Медикаментозная терапия проводилась согласно национальным рекомендациям по лечению больных с острым коронарным синдромом с подъемом сегмента ST, в том числе был назначен ингибитор ангиотензинпревращающего фермента. Ранний постинфарктный период протекал без осложнений, пациент выписан в удовлетворительном состоянии.
В июне 2018 года по суточному мониторированию ЭКГ зафиксирована частая желудочковая экстраситолия на фоне приема бета-адреноблокаторов. По ультразвуковому исследованию сердца фракция выброса составила 36%. Проводилась коррекция антиаритмической терапии без значимого эффекта. В плановом порядке выполнена коронарная ангиография, показаний к ревакуляризации миокарда не выявлено. Пациент был проконсультирован аритмологом, рекомендована радиочастотная аблация желудочковой экстрасистолии. Во время проведения радиочастотной аблации выполнена ЭМБ. Проведен иммунофлюоресцентный анализ полученных образцов миокарда, отдаленной от инфаркта области. Количество стабилин-1-позитивных/α-SMA-негативных макрофагов составило 8/мм2, что является критерием постинфарктного воспаления в миокарде, ассоциирующегося с неблагоприятным ремоделированием сердца. В послеоперационном периоде был отменен прием ингибитора ангиотензинпревращающего фермента, назначен представитель нового класса препаратов для лечения СН - надмолекулярный комплекс сакубитрил/валсартан. Рекомендовано посещение кардиолога не менее двух раз в год, определение концентрации предшественника мозгового натрийуретического пептида не менее 1 раза в год, проведение эхокардиографии и суточного мониторирования ЭКГ не менее двух раз в течение первого года после радиочастоной аблации, в последующем, при отсутствии отрицательной динамики - не менее одного раза в год. Результаты иммунофлюоресцентного исследования внесены в научную базу данных с целью последующего анализа возможности разработки таргетной терапии неконтролируемого постинфарктного воспаления в миокарде.
Предлагаемый в качестве изобретения способ апробирован на 41 пациенте, перенесших ИМ, и позволяет диагностировать постинфарктное воспаление в миокарде, ассоциирующегося с неблагоприятным ремоделированием сердца и своевременно провести соответствующую коррекцию терапии.
Список литературы:
1. Мареев В.Ю., Фомин И.В., Агеев Ф.Т. и соавт. Клинические рекомендации ОССН - РКО - РНМОТ. Сердечная недостаточность: хроническая (ХСН) и острая декомпенсированная (ОДСН). Диагностика, профилактика и лечение. Кардиология, 2018; 58(6S): 8-158. https://doi.org/10.18087/cardio.2475
2. Марков В.А., Рябов В.В., Вышлов Е.В. и соавт. Особенности ремоделирования сердца после инфаркта миокарда при фармакоинвазивных методах реперфузии и усиленной наружной контрпульсации. Томск:STT; 2014. С. 51-62.
3. Frangogiannis N.G. The inflammatory response in myocardial injury, repair, and remodelling. Nature Reviews Cardiology 2014; 11(5):255-265. DOI: 10.1038/nrcardio.2014.28
4. Snyder R.J., Lantis J., Kirsner R.S. et al. Macrophages: a review of their role in wound healing and their therapeutic use. Wound Repair and Regeneration, 2016; 24(4): 613-629. DOI: 10.1111/wrr.12444
5. Fujiu K., Wang J., Nagai R. Cardioprotective function of cardiac macrophages. Cardiovascular Research, 2014; 102(2):224-231. DOI. 10.1093/cvr/cvu059
6. Nahrendorf M., Swirski F.K. Monocyte and macrophage heterogeneity in the heart. Circulation Research, 2013; 112(12):1624-1633. DOI: 10.1161/CIRCRESAHA.113.300890.
7. Ryabov V., Gombozhapova A., Rogovskaya Y. et al. Cardiac CD68+ and stabilin-1+macrophages in wound healing following myocardial infarction: From experiment to clinic. Immunobiology, 2018; 223(4-5):413-421.
8. Davis J., Molkentin J.D. Myofibroblasts: trust your heart and let fate decide. Journal of Molecular and Cellular Cardiology, 2014; 70:9-18. https://doi.org/10.1016/j.yjmcc.2013.10.019
Способ диагностики постинфарктного воспаления в миокарде, ассоциирующегося с неблагоприятным ремоделированием сердца, характеризующийся тем, что пациенту проводят иммунофлюоресцентный анализ образцов миокарда при оптическом увеличении 630 и диагностируют постинфарктное воспаление в миокарде при количестве стабилин-1-позитивных/α-SMA-негативных макрофагов 0-18/мм в области миокарда, отдаленной от инфарктной зоны.