Результат интеллектуальной деятельности: СПОСОБ ОЦЕНКИ ФАКТИЧЕСКОЙ ПРИВИТОСТИ ЛЮДЕЙ ПРОТИВ БРУЦЕЛЛЁЗА НА РАННИХ СРОКАХ ПОСЛЕ ВАКЦИНАЦИИ
Вид РИД
Изобретение
Изобретение относится к клинической иммунологии и вакцинологии, и может быть использовано специалистами лабораторий, проводящих исследования по оценке эффективности иммунопрофилактики бруцеллеза.
Согласно санитарно-эпидемиологическим правилам СП 3.1.7.2613-10 «Профилактика бруцеллеза» перед вакцинацией/ревакцинацией контингентов риска проводится медицинский осмотр с обязательным серологическим и аллергологическим обследованием [8]. Для иммунизации людей против бруцеллеза применяется сухая живая вакцина, приготовленная из вакцинного штамма В. abortus 19 ВА, которая способствует сохранению наиболее напряженного иммунитета в течение 5-6 месяцев после прививки. Ревакцинация осуществляется через 12 месяцев после вакцинации лицам с отрицательными серологическими и аллергическими реакциями на бруцеллез [7].
Эффективность вакцинации против бруцеллеза во многом зависит от правильного определения показаний к ее проведению, полноты отбора подлежащих иммунизации профессиональных групп, в том числе временного персонала, соблюдения сроков вакцинации и ревакцинации.
В соответствие с п. 2.2.2.3. СП 1.3.3118-13 «Безопасность работы с микроорганизмами I-II групп патогенности (опасности)», оценку уровня специфического иммунитета до и после вакцинации (ревакцинации) проводят установленными методами.
Однако, нормативно-методическая база, регламентирующая проведение оценки иммунологической эффективности вакцинации против бруцеллеза и выраженности иммунологической поствакцинальной перестройки не разработана.
Оценку эффективности мероприятий по специфической профилактике инфекционных болезней принято проводить по трем группам критериев: показатели документированной привитости (охват прививками), иммунологической (клинической) эффективности и эпидемиологической (полевой) эффективности [12].
Анализ данных об охвате вакцинацией контингентов риска позволяет лишь косвенно оценить возможное состояние коллективного иммунитета. Наиболее объективными критериями качества вакцины, а также состояния защищенности контингентов против инфекции, являются показатели иммунологической и эпидемиологической эффективности специфической профилактики.
Результаты оценки иммунологической эффективности вакцинации позволяют определить уровень реальной привитости среди вакцинированных, т.е. долю привитых, у которых вакцинный препарат инициировал выработку специфического иммунитета [1].
Согласно методическим указаниям известен способ оценки напряженности поствакцинального иммунитета у людей, основанных на выявлении уровня и динамики противобруцеллезных антител в сыворотке крови с использованием серологических тестов: реакция агглютинации, реакция связывания комплемента, иммуноферментный анализ [6].
Недостатком указанных тестов является то, что серологические реакции могут лишь косвенно указывать на формирование адаптивного иммунитета к бруцеллам, отражая, по сути, активность гуморальных факторов иммунологической защиты на введение антигена. К недостаткам серологических тестов можно отнести и то, что наивысшая активность выработки антител формируется к двум месяцам после иммунизации, что может затруднить оценку иммунологической эффективности вакцины на ранних сроках после прививки. К тому же, серологические тесты могут давать перекрестные реакции (ложно положительные) у переболевших инфекциями, вызванными Vibrio cholerae, Francisella tularensis, Yersinia enterocolitica, Salmonella typhimurium и патогенными эшерихиями [6, 7].
Известен способ выявления сенсибилизации к возбудителю бруцеллеза. Методическими указаниями МУК 3.1.7.3402-16 регламентировано применение кожно-аллергической пробы с бруцеллином (проба Бюрне) и реакции лейкоцитолиза.
Недостатком указанных реакций является то, что у лиц, высоко сенсибилизированных к бруцеллезному антигену, возможно развитие реакции в виде повышения температуры, озноба, головной боли, лимфангита, артралгии и т.д. К недостаткам можно отнести риск возникновения ложноположительного результата при наличии в анамнезе аллергии, кожной атопии [3, 9]. Реакция лейкоцитолиза характеризуется низкой чувствительностью и слабой специфичностью при выявлении сенсибилизации к возбудителям инфекции [2].
По данным ряда исследователей оценку клеточной реакции in vitro в ответ на антигенную стимуляцию можно считать наиболее информативным и объективным подходом при анализе иммунологической перестройки организма при вакцинации. Перспективными показателями специфической клеточной антигенреактивности могут выступать активационные молекулы поверхностной мембраны лимфоцитов - CD25, CD69, CD95, CD71, антиген DR главного комплекса гистосовместимости (МНС) и др., интенсивность экспрессии которых усиливается при стимуляции антигеном [5, 10, 11, 14].
К наиболее иммунологически информативному показателю специфической клеточной антигенреактивности можно отнести активационные молекулы CD25 - высокоаффинные рецепторы интерлейкина 2 (IL-2Ra), маркер ранней активации Т-лимфоцитов [13, 15].
Наиболее близким к предлагаемому изобретению является способ оценки иммуногенности вакцины чумной живой с использованием антигенспецифических клеточных тестов in vitro и проточно-цитометрического анализа. Суть его заключалась в определении у вакцинированных против чумы количества лимфоцитов, экспрессирующих рецепторы CD25 при стимуляции комплексом водорастворимых антигенов Y. Pestis, увеличение которых коррелирует с высоким уровнем иммуногенности вакцины описанного в способе оценки иммуногенности вакцины чумной живой с использованием антигенспецифических клеточных тестов in vitro и проточно-цитометрического анализа [4].
Задача настоящего изобретения - предложить способ оценки фактической привитости контингента против бруцеллеза на ранних сроках после иммунизации с использованием методического подхода, позволяющего определить активность противобруцеллезного клеточного иммунитета, как ведущего в иммунологической защите от бруцеллезной инфекции.
Технический результат изобретения достигается путем определения методом проточной цитометрии у вакцинированного контингента уровня Т-лимфоцитов, экспрессирующих рецепторы CD25, после стимуляции в условиях in vitro белково-полисахаридным антигенным комплексом из штамма Brucella abortus 19 ВА с концентрацией белка 5 мг/мл. Обследования контингента проводятся на 14 сутки после вакцинации (срок определен экспериментально при моделировании вакцинного процесса и подтвержден в клинических исследованиях) с целью раннего выявления уровня привитости иммунизированного контингента.
Цель изобретения - оценка фактической привитости людей против бруцеллеза на ранних сроках после вакцинации, с использованием реакции антигенной активации лимфоцитов in vitro и технологии проточной цитометрии.
Поставленная цель достигается тем, что для определения формирования поствакцинального иммунитета против бруцеллеза у привитых исследуют количество в крови CD25-позитивных Т-лимфоцитов (CD3+CD25+) после стимуляции в условиях in vitro бруцеллезным антигеном.
Заявляемый способ отличается наличием возможности определять у привитых против бруцеллеза, на ранних этапах поствакцинального иммуногенеза, антиген-специфическую реактивность Т-лимфоцитов, которая выражается интенсивностью индуцированной бруцеллезным антигеном экспрессией активационных молекул - CD25. Учет количества активированных Т-лимфоцитов (CD25+) проводят с использованием моноклональных антител и проточно-цитометрического анализа.
Методика постановки клеточного теста антиген-специфической активации лимфоцитов бруцеллезным антигеном в условиях in vitro: для проведения одного исследования используют две пластиковые пробирки, объем 5 мл. Пробирки маркируют соответственно №1 (контроль) и №2 (опыт). В каждую пробирку вносят по 300 мкл питательной среды RPMI-1640 и пенициллина, из расчета 20 Ед/мл. Далее перемешивают пипетированием и добавляют 150 мкл стабилизированной крови обследуемого. В пробирку №1 вносят 100 мкл стерильного изотонического раствора NaCl, в пробирку №2 - 100 мкл бруцеллезного антигена с концентрацией белка 5 мг/мл. Пробирки инкубируют 24 часа при температуре (37±1)°С в условиях повышенного содержания CO2 (5-10%). По окончании инкубации из каждой пробирки удаляют надосадочную жидкость и ресуспензируют осадок. Далее по 50 мкл осадка (клеточной суспензии) переносят в пробирки «Falcon» 12×75 мм, объемом 5 мл для проточного цитометра. В каждую пробирку вносят по 5 мкл моноклональных антител против CD3+CD25+лимфоцитов человека. Полученную смесь инкубируют 15 мин при 18-28°С, без доступа солнечного света. Затем добавляют 450 мкл рабочего разведения 1:10 коммерческого лизирующего эритроциты раствора (BD FACS Lysing Solution или аналог). Пробы оставляют на 10 мин при 18-28°С, после чего центрифугируют 5 мин при 500 g, удаляют супернатант, вносят 450 мкл отмывочного буфера, центрифугируют 5 мин при 500 g, удаляют супернатант и вносят 300 мкл жидкости для разведения клеточной суспензии. Учет результатов производят с помощью проточного цитометра FACS Calibur с программным обеспечением Cell Quest Pro или эквивалентного аналога.
Возможность практического применения изобретения иллюстрируется примером его конкретного выполнения с использованием совокупности заявляемых признаков.
Пример: была проведена иммунизация против бруцеллеза вакциной на основе штамма Brucella abortus 19 ВА (НПО «Микроген» Минздрава России) 20 людей, не больных бруцеллезом и не вакцинированных против данной инфекции на базе Ставропольского противочумного института. Взятие крови у обследуемых осуществляли до вакцинации и через 14 суток после иммунизации.
Исследования интенсивности экспрессии «ранних» активационных молекул показали, что у лиц до вакцинации не наблюдается активации Т-лимфоцитов при воздействии бруцеллезного антигена. При обследовании привитых через 14 суток после вакцинации отмечается увеличение количества С025-позитивных Т-лимфоцитов в 2 раза, в сравнении с данными до вакцинации. Результаты исследования представлены в таблице 1.
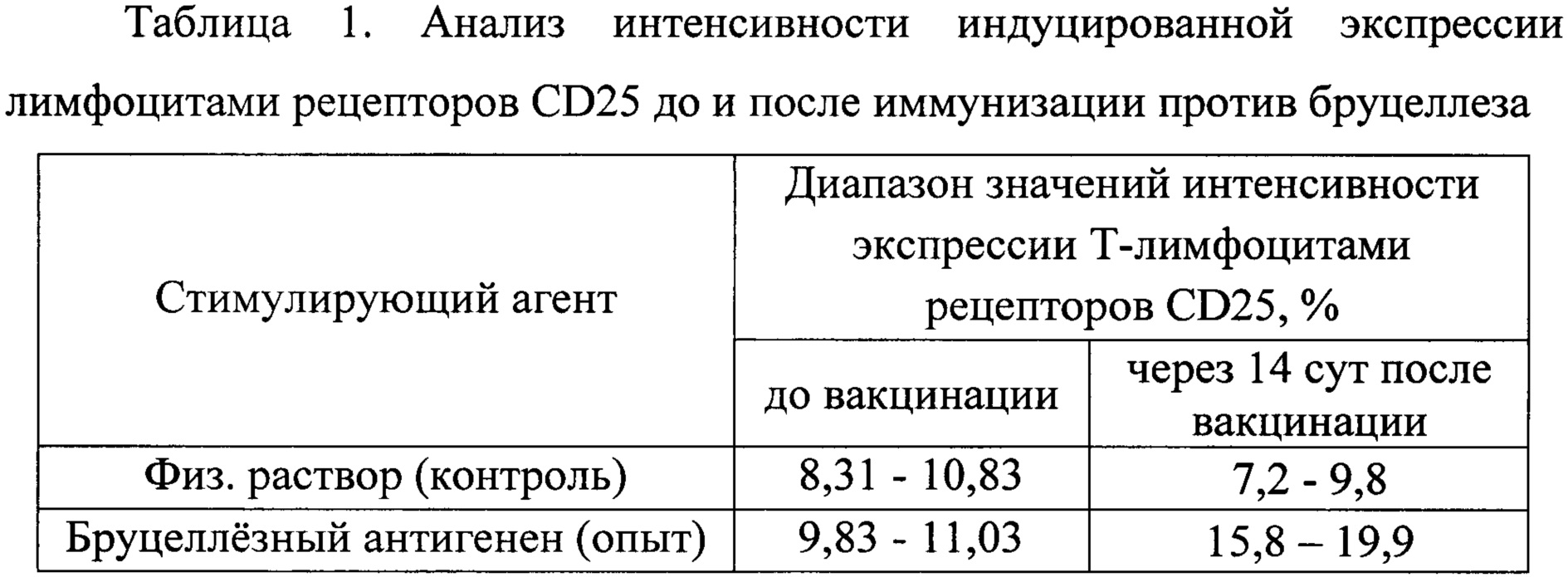
При обследовании привитых против бруцеллеза на более ранних сроках (5-10 сут) после вакцинации, не было получено статистически значимых результатов, так как у большей части обследованных не наблюдалось выраженных изменений интенсивности активации Т-лимфоцитов при стимуляции бруцеллезным антигеном.
К достоинствам заявляемого способа оценки фактической привитости людей против бруцеллеза на ранних сроках после вакцинации можно отнести следующее:
- способ позволяет проводить оценку иммунологической эффективности вакцины на 14 сутки после иммунизации, вне зависимости от наличия и уровня специфической сероконверсии;
- возможность исследования формирования поствакцинального клеточного иммунитета против бруцеллеза, как наиболее активного в иммунологической защите против бруцелл;
- предлагаемый тест обеспечен специфичностью, так как предполагает использование бруцеллезного белково-полисахаридного антигенного комплекса, полученного из штамма Brucella abortus 19 ВА, и исключает получение ложноположительных результатов за счет параллельного исследования у привитых фонового уровня CD25+ Т-лимфоцитов.
Таким образом, предлагаемый способ реально осуществим, и может использоваться для лабораторной оценки фактической привитости людей против бруцеллеза на ранних сроках после вакцинации.
Используемая литература
1. Брико Н.И. Оценка качества и эффективности иммунопрофилактики / Лечащий врач. 2012. №10. С. 57.
2. Васнева Ж.П., Торопова Н.Е. Определение повышенной чувствительности к вакцинам у детей. Материалы научно-практической конференции, посвященной 10-летию Омского диагностического центра. Омск, 1998: 124-125.
3. Вершилова П. А., Чернышева М.И., Князева Э.Н Патогенез и иммунология бруцеллеза /. - М.: Медицина, 1974. - 272 с.
4. Абзаева Н.В., Гостищева С.Е., Пономаренко Д.Г., Ракитина Е.Л., Костюченко М.В. Способ оценки иммуногенности вакцины чумной живой с использованием антигенспецифических клеточных тестов in vitro и проточно-цитометрического анализа. Патент №2680697, опубликовано 25.02.2019. Бюл. №6.
5. Литвинова Л.С., Гуцол А.А., Сохоневич Н.А., Кофанова К.А., Хазиахматова О.Г., Шуплецова В.В., Кайгородова Е.В., Гончаров А.Г. Основные поверхностные маркеры функциональной активности Т-лимфоцитов // Медицинская иммунология. - 2014. - Т. 16. - №1. - с. 7-26.
6. Методические указания МУК 3.1.7.3402-16 «Эпидемиологический надзор и лабораторная диагностика бруцеллеза» http://base.garant.ru/71713588/.
7. Пономаренко Д.Г. Новый подход к комплексной оценке иммунобиологической реактивности контингента, подлежащего вакцинации (ревакцинации) против бруцеллеза / Д.Г. Пономаренко // Эпидемиология и инфекционные болезни. - 2015. - №3. - с. 28-32. 41.
8. «Профилактика бруцеллеза». Санитарно-эпидемиологические правила СП 3.1.7.2613-10. http://vmw.consultant.ru/document/cons_doc_LAW_101166/.
9. Саркисян Н.С., Пономаренко Д.Г., Логвиненко О.В., Ракитина Е.Л., Костюченко М.В., Куличенко А.Н. Интенсивность специфической сенсибилизации и иммунный статус у больных бруцеллезом // Медицинская иммунология. 2016. №4. - с. 365-372.
10. Фирстова В.В., Бахтеева И.В., Титарева Г.М., Зырина Е.В., Иванов С.А., Киселева Н.В., Копылов П.Х., Анисимов А.П., Дятлов И.А. Определение экспрессии маркера ранней активации CD69 на лимфоцитах иммунных мышей после стимуляции их антигенами чумного микроба // Проблемы особо опасных инфекций 2010. - №103. - С. 56-59.
11. Almajid F.M. Lymphocyte activation test for diagnosis of seronegative brucellosis in humans. Indian J. Path. Microbiol. 2011; 54 (4): 775-781.
12. Fedson D.S. Measuring protection: efficacy versus effectiveness / Dev Biol Stand. - 1998; 95: 195-201.
13. Sakaguchi S. Naturally arising Foxp3-expressing CD25+CD4+regulatory T cells in immunological tolerance to self and non-self. J. Nat. Immunol, 2005, vol. 6, no. 4, pp. 345-352. doi: 10.1038/nil 178.
14. Shipkova M, Wieland E. Surface markers of lymphocyte activation and markers of cell proliferation // Clinica Chimica Acta- 2012. - Vol.413 - P. 1338-1349.
15. Starska К,  E, Kulig A, Lewy-Trenda I,
E, Kulig A, Lewy-Trenda I,  M, Lewkowicz P. Prognostic value of the immunological phenomena and relationship with clinicopathological characteristics of the tumor-the expression of the early CD69+, CD71+and the late CD25+, CD26+, HLA/DR+activation markers on T CD4+and CD8+lymphocytes in squamous cell laryngeal carcinoma. Part II. J. Folia Histochem. Cytobiol, 2011, vol. 49, no. 4, pp. 593-603. doi: 10.5603/FHC.2011.0082.
M, Lewkowicz P. Prognostic value of the immunological phenomena and relationship with clinicopathological characteristics of the tumor-the expression of the early CD69+, CD71+and the late CD25+, CD26+, HLA/DR+activation markers on T CD4+and CD8+lymphocytes in squamous cell laryngeal carcinoma. Part II. J. Folia Histochem. Cytobiol, 2011, vol. 49, no. 4, pp. 593-603. doi: 10.5603/FHC.2011.0082.

