Результат интеллектуальной деятельности: СПОСОБ ОПРЕДЕЛЕНИЯ НАЛИЧИЯ БАКТЕРИЙ Escherichia coli O157:H7 В БИОЛОГИЧЕСКИХ И ПИЩЕВЫХ ОБРАЗЦАХ НА ОСНОВЕ ИММУНОДЕТЕКЦИИ, СОПРЯЖЕННОЙ С ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИЕЙ
Вид РИД
Изобретение
Данное изобретение относится к биотехнологии, конкретно - к областям диагностической медицинской микробиологии, медицинской биохимии, прикладной иммунохимии, касается разработки нового способа высокочувствительного определения клеток Escherichia coli O157:Н7 в инфицированных образцах биологического происхождения и может быть использовано для разработки средств ранней и высокоэффективной специфической диагностики геморрагического колита, санитарно-гигиенического контроля над наличием возбудителя геморрагического колита в продуктах питания и окружающей среде.
Штаммы Escherichia coli O157:Н7 - продуценты веротоксина - вызывают острые кишечные инфекции, осложненные геморрагическим колитом (ГК) и гемолитикоуремическим синдромом (HUS). Основными факторами патогенности серовара O157:Н7 являются веротоксины (шигаподобные токсины) Stx1 и Stx2 (или только Stx2), белок интимин, ответственный за адгезию возбудителя к эпителиальным клеткам кишечника, энтерогемолизин и жгутиковый антиген Н7. Перечисленные факторы патогенности детерминируются соответственно генами stx1, stx2, еае, hly и flic. Указанные гены, а также rfb гены, ответственные за синтез соматического О антигена, являются основными генами-мишенями для диагностических ПЦР-тест-систем, используемых при идентификации серовара E.coli O151:H7 [Fagan, P.K., Hornitzky, M.A., Bettelheim K.A. с соавт. // Appl. Environ. Microbiol. - 1999. - V. 65. - №2. - P. 868-872].
В случае иммунологической детекции E.coli O157:Н7 специфичность, как правило, детерминируется уникальной структурой липополисахарида (ЛПС) клеточной стенки бактерий, который является мишенью для моноклональных антител, узнающих бактерию [Westerman, R.B., He, Y., Keen, J.E. с соавт. // J. Clin. Microbiol. - 1997. - V. 35. - №3. - P. 679-684].
E.coli O157:H7 обладает высокой устойчивостью к различным условиям окружающей среды. Клетки E.coli O157:Н7 способны приспосабливаться и выживать в почве и воде даже при низких температурах, сохраняться в фекалиях сельскохозяйственных животных в течение 21 месяца, не теряя при этом ни вирулентности, ни способности продуцировать шига-токсины. Кроме того, возбудитель хорошо переносит высушивание и способен размножаться в молочных пищевых продуктах [Kudva, I.T., Blanch, K., Hovde, C.J. // Appl. Environ. Microbiol. - 1998. - Vol. 64; N. 9. - P. 3166-3174; LeJeune, J.T., Besser. Т.Е., Hancock, D.D. // Appl. Environ. Microbiol. - 2001. - Vol. 67; N. 7. - P. 3053-3057].
Инфекция, вызванная Escherichia coli O157:H7, может представлять серьезную угрозу жизни, особенно для пожилых людей и детей до 5 лет. Первичные симптомы инфекции, вызванной E.coli O157:Н7, от случая к случаю варьируют и являются неспецифичными. Чаще всего наблюдаются спазмы в животе, диарея, рвота, небольшое повышение температуры. Однако с течением инфекции у 5-10% больных развиваются микроангиопатическая гемолитическая анемия, тромбоцитопения и почечная недостаточность, которые могут привести к летальному исходу.
Инфицирование человека происходит при употреблении в пищу недостаточно термически обработанных изделий из говядины (котлеты, сосиски, гамбургеры), коровьего молока, майонеза, воды, фруктовых и овощных соков и других продуктов, а также при контакте с крупным рогатым скотом или взаимодействии с фекалиями зараженных животных или людей. Люди заражаются при глотании воды во время купания, а также при употреблении не хлорированной воды [Bryant, H.E., Athar, M.A., Pai, C.H. // J. Infect. Dis. - 1989. - V. 160. - P. 858-864; Karmali, M.A. // Clin. Microbiol. Rev. - 1989. - V. 2. - P. 15-38; Keene, W.E., McAnulty, J.M., Hoesly, F.C. с соавт. // N. Engl. J. Med. - 1994. - V. 331. - №.9. - P. 579-584; Maule, A. // International Food Hygiene. - 1999. - V. 9. - P. 21; Olsen, J.S., Breuer, Т. ссоавт. // Emerg. Infect. Dis. - 2002. - V. 8. - №4. - P. 370].
Ранняя диагностика инфекции, вызванная E.coli O157:Н7 при энтерогеморрагическом колите, гемолитикоуремическом синдроме и своевременно примененная терапия обеспечивают благоприятный прогноз исхода заболевания. Применение в клинической практике специфичных и высокочувствительных диагностических тест систем, способных определять крайне низкие концентрации микробных клеток E.coli O157:Н7 на ранних этапах энтерогеморрагического колита, предотвращает риск летального исхода, а для эффективного предотвращения последствий массовых эпидемий или биотеррористических атак необходима разработка способов экспресс-определения единичных клеток E.coli O157:Н7 в сложных биологических и пищевых образцах. Очевидно, что для изучения эпидемической значимости E.coli O157:Н7, путей ее распространения, диагностики заболевания, вопрос совершенствования средств идентификации этого возбудителя чрезвычайно актуален.
В настоящее время основными способами, применяемыми для этиологического определения клеток E.coli O157:Н7, являются микробиологическое определение, иммуноферментный анализ и ПЦР-диагностика. В целом данные способы достаточно эффективны, однако каждый из этих способов детекции возбудителя имеет определенные недостатки.
Известен способ детекции клеток E.coli O157:Н7 на основе иммуноферментного анализа (ИФА)с применением тест-системы «Premier Ε.coli O157» (Meridian Diagnostics, США).
Однако данный способ обладает недостаточной чувствительностью, в частности, при тестировании образцов фекалий [Mackenzie, A.M.R., Lebel, P., Orrbine, E. с соавт. // J. Clin. Microbiol. - 1998. - V. 36. - №6. - Р. 1608-1611].
Известен способ детекции клеток на основе иммунохроматографии с использованием системы «Экспресс-тест для определения E.coli O157:Н7 - Singlepath® E.coli O157» (Merck, США). Данный способ характеризуется быстротой проведения анализа и позволяет провести тестирование образца в течение 20 минут.
Однако способ обладает невысокой чувствительностью и специфичностью и требует этапа обогащения образца наращиванием на селективной среде, который длится в течение 18-24 часов.
Известен иммунохроматографический тест ImmunoCard STAT! Ε.coli O157 Plus (MeridianDiagnostics Inc., США), который позволяет одновременно детектировать О- и Н-антигены E.coli O157:Н7 напрямую в образцах фекалий или после предварительного обогащения на питательных средах [Mackenzie, A., Orrbine, E., Hyde, L. c соавт. // J. Clin. Microbiol. - 2000. - V. 38. - №5. - P. 1866-1868] Известен иммунохроматографический тест RIDA®QUICK Verotoxin/O157 Combi (Lenco Hellas Ltd., Греция), который одновременно детектирует шига-токсины и O157 антиген в предварительно обогащенных образцах.
Оба эти экспресс-теста являются быстрыми и не требуют привлечения оборудования, однако их чувствительность не высока и они не пригодны для прямого анализа клинических и пищевых образцов [Lim, D.V., Simpson, J.M., Kearns, E.A. ссоавт. // http://Clin.Microbiol.Rev. - 2005. - V.18. - №4. - Р. 583-607].
Известен диагностикум для идентификации Escherichia coli O157:Н7 в реакции латекс-агглютинации, ориентированный на идентификацию патогена по двум типам антигенов E.coli - липополисахаридному антигену O157 и жгутиковому антигену Н7 (Патент РФ 2189253). Постановка реакции занимает 5 минут, не требует высокотехнологичного оборудования и квалифицированного персонала.
Недостатком описанного диагностикума является низкая специфичность и чувствительность (не более 104 м.к./мл), обусловленная использованием высоко аффинных поликлональных иммуноглобулинов кролика, полученных иммунизацией инактивированными бактериями E.coli O157:Н и обогащенных адсорбцией на нативные липополисахариды E.coli O157:Н7 и на жгутиковый антиген Н7, выделенные из бактериальной культуры.
Известен способ ПЦР-детекции для идентификации E.coli O157:Н7 и дифференциации энтерогеморрагических E.coli, использованный при разработке тест-системы «КОЛИ-ДИФ» (РУ №Р077-1-4.6-1332, утв. Россельхознадзором 29.12.2006). Способ обладает 100% специфичностью и имеет предел аналитической чувствительности 102 м.к./мл [Брюсова М.Б., Обухов И.Л., Тугаринов О.А. с соавт. // Ветеринария. - 2008. - №12. - С. 42-49].
Однако клинические образцы или образцы, включающие частицы пищи, почвы и прочие примеси, содержат также ингибиторы ПЦР, родственные микроорганизмы, неспецифическую ДНК, способную дать ложноположительный сигнал. Кроме того, прямая ПЦР-детекция не применима для детекции патогенных микроорганизмов в сложных комплексных средах, например, при анализе продуктов питания, поскольку в данном случае требуется обогащение детектируемых мишеней (аналитов) в образце с применением аффинных меток или селективных сред, что значительно увеличивает время детекции.
Способы определения на базе иммуно-ПЦР успешно применялись для идентификации различных инфекционных патогенов, в частности, для детекции шига-токсинов, продуцируемых патогенными штаммами E.coli [Не, Х., Qi, W., Quiñones, B. с соавт. // Appl. Environ. Microbiol. - 2011. - V. 77. - №.11 - Р. 3558-3564], вирусов [Barletta, J., Bartolome, A., Constantine, N.T. // J. Virol. Methods. - 2009. - V. 157. - №.2 - P. 122-132], стафилококкового энтеротоксина [Fischer, A., vonEiff, C., Kuczius, T. с соавт. // J. Mol. Med. (Berl). - 2007. - V. 85. - №.5. - P. 461-469] и др., однако способ детекции бактерий E.coli O157:Н7 на основе иммуно-ПЦР не известен.
Наиболее технически близким к заявляемому является способ обнаружения патогенов в пищевых продуктах, объединяющий преимущества специфичности иммунологической детекции с высокой чувствительностью полимеразной цепной реакции [WO Patent 1998020148 А1]. Проведение детекции по данному способу включает в себя следующие этапы: 1) обогащение образцов по исследуемому бактериальному патогену культивацией на богатой питательной среде; 2) иммуномагнитную сепарацию патогенных бактерий с использованием парамагнитных частиц, покрытых специфическими антителами, в частности, распознающими, связывающими и захватывающими E.coli O157:Н7 (Dynabeads anti-E.coli O157:Н7, DynalAs, Oslo, Norway или аналогичные); 3) амплификацию последовательностей ДНК, специфичных для данного патогена, с помощью полимеразной цепной реакции (ПЦР); 4) детекцию продуктов амплификации с помощью электрофореза в агарозном геле. С применением данной технологии за период в 8 часов можно провести выявление единичных клеток патогена в пищевых образцах.
Преимуществом данного способа является двухэтапное обеспечение специфичности детекции (за счет селекции анализируемых бактерий с помощью высокоспецифичных антител к патогену и за счет использования при ПЦР-амплификации праймеров, специфичных к ДНК бактерии-патогена), а также повышение чувствительности определения патогена за счет ПЦР-амплификации, поскольку ПЦР позволяет детектировать даже единичные молекулы ДНК.
Однако на практике прямое применение ПЦР для детекции бактериальной ДНК, полученной из сложных биологических образцов, осложнено наличием примесей, ингибирующих реакцию, а процедура обогащения образцов наращиванием на питательной среде значительно (от 8 часов и более) увеличивает как время проведения детекции, так и вероятность контаминации культуры, полученной от исследуемого образца, что может привести к неточным и малодостоверным результатам. Данная процедура вкупе с примененным способом анализа продуктов амплификации в агарозном геле дает возможность лишь качественно охарактеризовать образцы по наличию патогена и полностью исключает возможность его количественного определения.
Предлагаемое изобретение решает задачу создания высокочувствительного способа идентификации Escherichia coli O157:Н7 на основе иммунодетекции, сопряженной с ПЦР в режиме реального времени, применимого для его выявления в пищевых продуктах, образцах биологических жидкостей и тканей на ранних и поздних этапах развития инфекции, а также в окружающей среде, употребимого для работы как с живыми патогенными бактериями, так и с инактивированными пробами.
Поставленная задача решается за счет связывания бактерий Escherichia coli O157:Н7 с помощью пары специфических моноклональных антител, одно из которых, иммобилизованное на парамагнитных частицах, служит для селективного отбора клеток E.coli O157:Н7, находящихся в исследуемой пробе, а второе (биотинилированное) антитело детектирует клетки E.coli O157:Н7 и посредством мостика, образованного тетравалентной молекулой нейтравидина, связывается с биотинилированными фрагментами ДНК, используемыми в качестве матрицы для ПЦР-амплификации с флуоресцентной детекцией сигнала в режиме реального времени.
Также поставленная задача решается за счет использования высокоаффинных моноклональных антител, специфичных к E.coli O157:Н7. Применение данных антител для адсорбции бактериального материала из лизатов патогена обеспечивает повышенную чувствительность определения бактерий по сравнению с их применением для адсорбции бактерий из образцов, содержащих интактные бактериальные клетки, что объясняется увеличением количества и концентрации детектируемых мишеней в лизате в силу множественности молекул мишеней, находящихся на поверхности бактерии и распределяющихся в растворе при лизисе.
Также поставленная задача решается за счет проведения процедуры пробоподготовки, предусматривающей дезинтеграцию бактериальных клеток ферментативной обработкой и их лизис неионным детергентом непосредственно в образцах биологических жидкостей или продуктов питания, что позволяет сократить время проведения эксперимента и амплифицировать количество детектируемых мишеней, избегая стадии культивации, которая может привести к контаминации образца сторонними микроорганизмами и исключает возможность проведения количественного определения содержания патогена в образце.
Также поставленная задача решается за счет использования парамагнитных частиц с иммобилизованным на их поверхности моноклональным антителом, специфичным к бактериям E.coli O157:Н7, которые позволяют осуществить связывание бактерий E.coli O157:Н7 из сложных комплексных образцов, избавиться от содержащихся в образцах примесей на ранних этапах эксперимента и изолировать ДНК-матрицу, применяемую при конечной ПЦР-амплификации, от компонентов детекционного комплекса.
Также поставленная задача решается за счет использования коньюгата ДНК с нейтравидином, образующего молекулярную ″сетку″ (ДНК-сетка), способную связываться с биотинилированным антителом с высокой аффинностью. При использовании ДНК-сетки можно увеличить количество матричных молекул ДНК, связанных с единичной молекулой биотинилированного антитела, и, таким образом, амплифицировать сигнал.
Также поставленная задача решается за счет разрушения детекционного комплекса ″антитело - антиген - биотинилированное антитело-коньюгат″ обработкой раствором глицина с рН 2.6 и отделения ДНК-матрицы от парамагнитных частиц путем магнитной сепарации, что способствует снижению фонового сигнала в эксперименте. Данная обработка позволяет провести разрушение детекционного комплекса, сформировавшегося на поверхности частиц, не нарушая первичную структуру матричной ДНК.
Также поставленная задача решается за счет применения в анализе редко встречающейся в окружающей среде ДНК-матрицы, оптимизированной для проведения ПЦР-амплификации с флуоресцентной детекцией сигнала в режиме реального времени, что снижает вероятность возникновения ложноположительного сигнала при детекции, позволяет существенно повысить чувствительность метода и провести количественное определение содержания клеток E.coli O157:Н7 в исследуемых образцах.
Техническим результатом данного изобретения является создание нового эффективного высокочувствительного способа определения клеток E.coli O157:Н7, применимого для мониторинга окружающей среды, для контроля за качеством пищевых продуктов и в области клинической диагностики. С использованием разработанного способа можно детектировать клетки E.coli O157:Н7 в концентрации до 10 м.к./мл, не прибегая к процедуре обогащения образцов наращиванием на селективных средах.
Предлагаемое техническое решение предусматривает использование не ковалентного коньюгата ДНК с нейтравидином, который представляет собой молекулярную ″сетку″, образованную при взаимодействии биотина, находящегося на 5′-концах двухцепочечного фрагмента ДНК с тетравалетной молекулой нейтравидина. Наиболее эффективным является формирование таких комплексов в эквимолярном соотношении биотинилированной ДНК с белками авидинового ряда, которые обладают высокой специфичностью и эффективностью взаимодействия с биотином [Niemeyer, С.М., Wacker, R., Adler, M. // Nucl. Acid. Res. - 2003. - V. 31. - №16. - P. 90]. Применение ДНК-сетки вместо индивидуальных фрагментов биотинилированной ДНК повышает количество ДНК-матрицы, удерживаемой единичной молекулой антитела, и более чем в 10 раз увеличивает чувствительность метода.
Существенным условием успешного использования заявляемого способа является осуществление процедуры предварительной подготовки проб, предусматривающей дезинтеграцию клеточной стенки и мембраны бактериальных клеток для увеличения в образце концентрации детектируемых мишеней бактериального происхождения.
Важным достоинством предлагаемого способа определения клеток E.coli O157:Н7 является применение в качестве носителя комплекса парамагнитных частиц, которые допускают проведение автоматизации этого способа детекции с использованием роботизированных дозаторов и промывочных устройств и минимизирует контакт оператора с потенциально инфицированным материалом. Альтернативными матрицами для иммобилизации антитела к E.coli O157:Н7 могут являться: 1) немагнитные пористые и непористые полимерные микросферы и микрочастицы; 2) хроматографические носители; 3) микрочастицы, образуемые коллоидным золотом; 4) квантовые точки; 5) пористые и непористые полимерные поверхности; 6) рабочие поверхности биосенсоров.
Предлагаемый способ определения наличия бактерий Escherichia coli O157:Н7 на основе иммунодетекции, сопряженной с полимеразной цепной реакцией, позволяет провести прямую детекцию бактерий патогена в сложных пищевых и биологических образцах, что повышает достоверность его определения по сравнению с методами, требующими обогащения образцов культивацией. Повышение чувствительности детекции по данному способу осуществляется за счет трехэтапного усиления сигнала от единичной бактериальной клетки, происходящего за счет увеличения концентрации детектируемых мишеней (молекул белка или ЛПС) при дезинтеграции бактериальных клеток, увеличения числа связанных с детектируемым комплексом молекул ДНК-матрицы при использовании молекулярной «сетки» ДНК/нейтравидин, а также за счет накопления флуоресцентного продукта на стадии ПЦР-амплификации.
К преимуществам заявляемого способа определения клеток E.coli O157:Н7 относятся: 1) высокая чувствительность способа; 2) высокая специфичность детекции и низкая вероятность получения ложноположительных сигналов по сравнению со стандартными методами ПЦР-диагностики; 3) возможность проведения прямого определения бактерий в сложных биологических и пищевых образцах, минуя стадию культивации; 4) гомологичность заявляемого способа в части реагентов, материалов и оборудования стандартному иммуноферментному анализу и технологиям ПЦР-диагностики, применяемым в клинической практике; 5) возможность проведения быстрого автоматизированного анализа большого количества образцов; 6) возможность проведения детекции крайне низких концентраций бактерий в пищевых образцах большого объема/массы за счет проведения процедуры пробоподготовки и использования в качестве носителя парамагнитных частиц; 7) возможность экстраполяции разработанного способа для детекции других патогенных и непатогенных бактериальных клеток при подборе соответствующей пары специфических моноклональных детектирующих антител.
Изобретение осуществляют следующим образом:
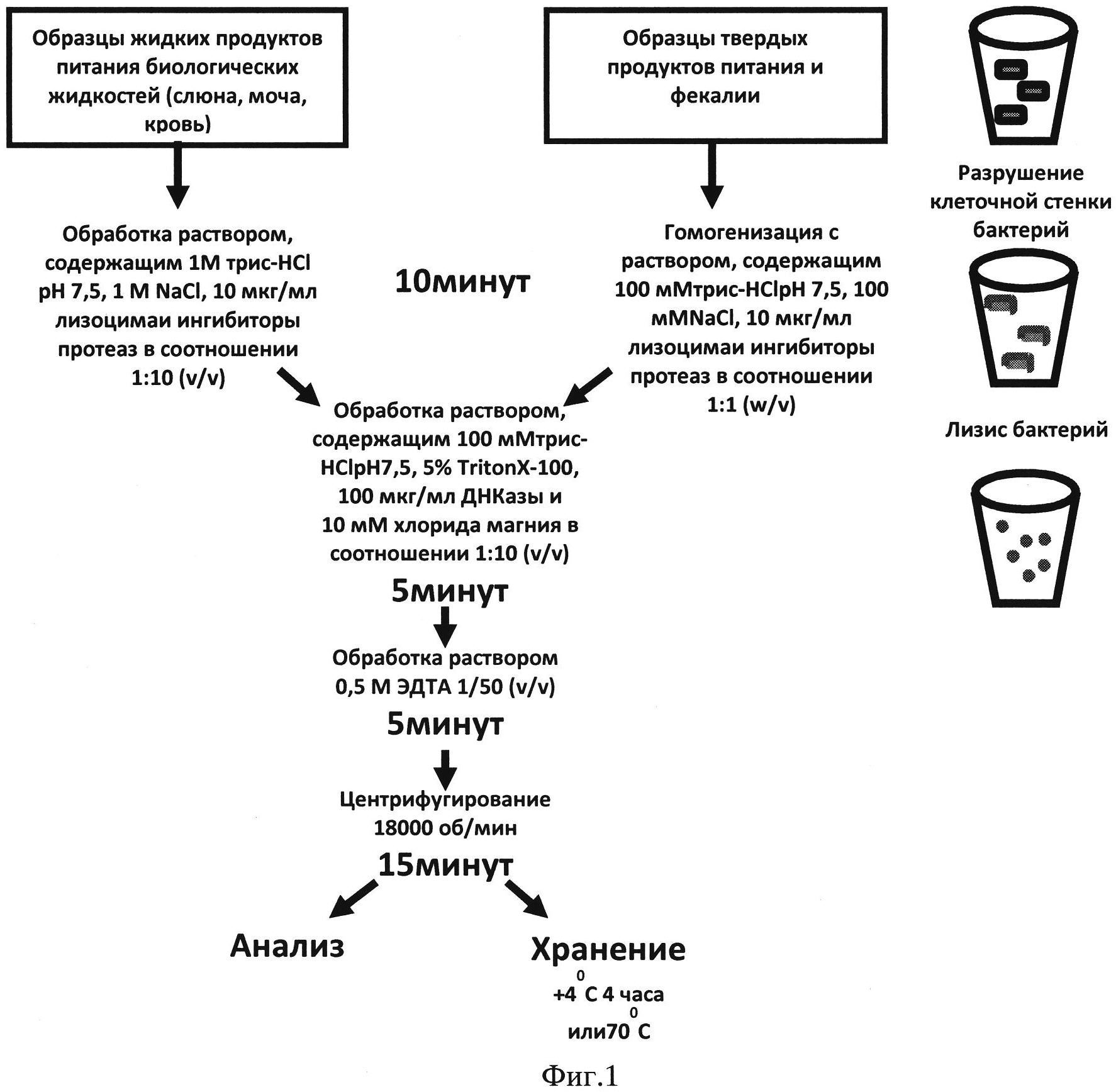
Проводят подготовку проб инфицированного биологического материала или образцов окружающей среды и продуктов питания, потенциально содержащих бактерии штамма E.coli O157:Н7, предусматривающую дезинтеграцию клеточной стенки и мембраны бактерий. Для этого образцы твердых продуктов питания и почвы гомогенизируют с раствором, содержащим 100 мМ трис-HCl рН 7,5, 100 мМ хлорида натрия, 100 мкг/мл лизоцима и смесь ингибиторов протеолиза, и инкубируют при встряхивании на шейкере в течение 10 минут. К образцам жидких продуктов питания и биологических жидкостей добавляют 1/10 раствора, содержащего 1М трис-HCl рН 7,5, 1 M хлорида натрия, 100 мкг/мл лизоцима и ингибиторы протеолиза, и инкубируют при встряхивании на шейкере в течение 10 минут.
По окончании инкубации к образцам, обработанным лизоцимом, добавляют 1/10 раствора, содержащего 100 мМ трис-HCl рН 7,5, 5% TritonX-100, 100 мкг/мл ДНКазы и 10 мМ хлорида магния. Образцы перемешивают и выдерживают при комнатной температуре в течение 5 минут. К обработанным образцам добавляют 1/50 (v/v) 0,5 M раствора ЭДТА и удаляют дебрис центрифугированием. Тестирование проводят с отобранным супернатантом.
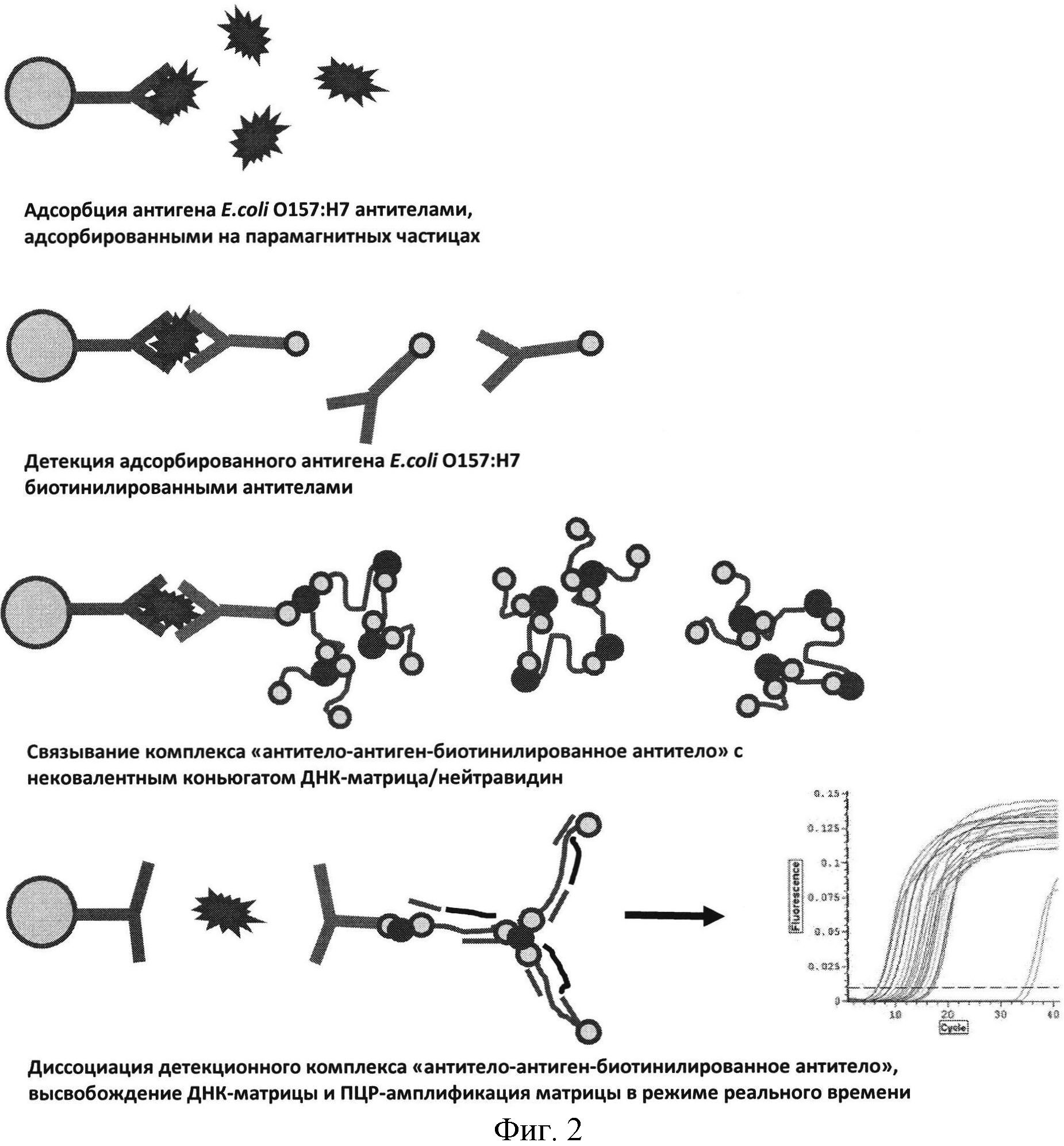
Для адсорбции бактериального материала E.coli O157:Н7 из исследуемых образцов используют парамагнитные частицы с иммобилизованными антителами, специфически связывающиеся с данными бактериями (магноиммуносорбенты). Свободные валентности поверхности пробирок и парамагнитных частиц блокируют 2.5% раствором сухого молока, содержащим 0,02% азида натрия. После блокировки частицы троекратно промывают фосфатным буфером с добавлением 0.05% Tween 20 (ФСБ-Tween).
Подготовленные пробы инкубируют с магноиммуносорбентами в течение 1 часа. После троекратной промывки магноиммуносорбентов с адсорбированными бактериальными мишенями ФСБ-Tween проводят инкубацию частиц с биотинилированным антителом к E.coli O157:Н7 при комнатной температуре со встряхиванием в течение 30 минут, после чего промывку частиц повторяют.
К парамагнитным частицам, несущим комплекс ″антитело - антиген - биотинилированное антитело″, добавляют раствор нековалентного коньюгата матричной ДНК с нейтравидином (молекулярная ″сетка″) и инкубируют парамагнитные частицы с коньюгатом в течение 30 минут. Промывку поверхности частиц от несвязавшегося коньюгата проводят троекратно раствором, содержащим 20 мМ трис-НС рН 7,5, 300 мМ хлорида натрия.
Диссоциацию комплекса ″антитело - антиген - биотинилированное антитело-коньюгат″ осуществляют добавлением раствора глицин-HCl рН 2.6. Раствор, содержащий продукты диссоциации, высвобождающиеся с поверхности частиц, изолируют от частиц магнитной сепарацией, отбирают в пробирки для ПЦР-амплификациии нейтрализуют добавлением 1М раствора трис-основание.
К раствору, содержащему матричную ДНК, снятую с поверхности парамагнитных частиц, добавляют 10 объемов смеси для ПЦР-амплификации, включающей буфер для ПЦР-амплификации, праймеры, термостабильную полимеразу и флуоресцентную пробу для мониторинга накопления продуктов амплификации в режиме реального времени по методу TaqMan. Регистрацию флуоресцентного сигнала осуществляют в течение 50 циклов амплификации с использованием праймеров, специфичных к матричной ДНК с использованием прибора для ПЦР в режиме реального времени.
Отрицательные контрольные значения флуоресценции фиксируют в пробирках, соответствующих образцам, не содержащим бактерий E.coli O157:Н7. Положительные контрольные значения флуоресценции регистрируют в пробирках, соответствующих образцам, содержащим известное количество бактерий E.coli O157:H7 в концентрации 1 м.к./мл образца и выше. Содержание бактерий E.coli O157:Н7 в неизвестных образцах определяют на основании сравнения скорости нарастания флуоресценции в соответствующих реакциях ПЦР-амплификации с калибровочной шкалой, характеризующей скорость нарастания флуоресценции в реакциях ПЦР-амплификации, полученных от серии образцов, содержащих набор известных концентраций бактерий E.coli O157:Н7.
Изобретение иллюстрируют следующие графические материалы:
Фиг.1. Схема проведения пробоподготовки при определении E.coli O157:Н7 способом иммунодетекции, сопряженной с ПЦР-амплификацией.
Фиг.2. Этапы постановки эксперимента при определении E.coli O157:Н7 способом иммунодетекции, сопряженной с ПЦР-амплификацией.
Фиг.3. Последовательность матричной ДНК и праймеров для проведения ПЦР-амплификации.
A) Последовательность ДНК, использованная в качестве матрицы при проведении детекции E.coli O157:Н7 на основе иммунодетекции, сопряженной с ПЦР-амплификацией. Зоны отжига биотинилированных праймеров для наработки ДНК-матрицы отмечены подчеркиванием. Зоны отжига праймеров для проведения ПЦР-амплификации в режиме реального времени отмечены выделением. Зона отжига пробы TaqMan отмечена подчеркиванием и выделением.
B) Последовательности биотинилированных праймеров, использованные для наработки ДНК-матрицы, праймеров для проведения ПЦР в режиме реального времени и последовательность пробы TaqMan, содержащая на 5′-конце карбоксифлуоресцеин (FAM), а на 3′-конце гаситель флуоресценции RTQ1 (разработка компании Syntol, Россия).
Фиг.4. Получение коньюгата биотинилированной ДНК с нейтравидином для определения E.coli O157:Н7 способом иммунодетекции, сопряженной с ПЦР-амплификацией.
Результаты электрофореза в полиакриламидном геле комплексов биотинилированной ДНК с нейтравидином, сформированных при различном молярном соотношении ДНК к нейтравидину. Дорожка 1-1 Kbмаркер молекулярной массы (McLab США), 2 - молярное соотношение ДНК к нейтравидину 1:2, 3 - молярное соотношение ДНК к нейтравидину 1:1, 4 - молярное соотношение ДНК к нейтравидину 2:1.
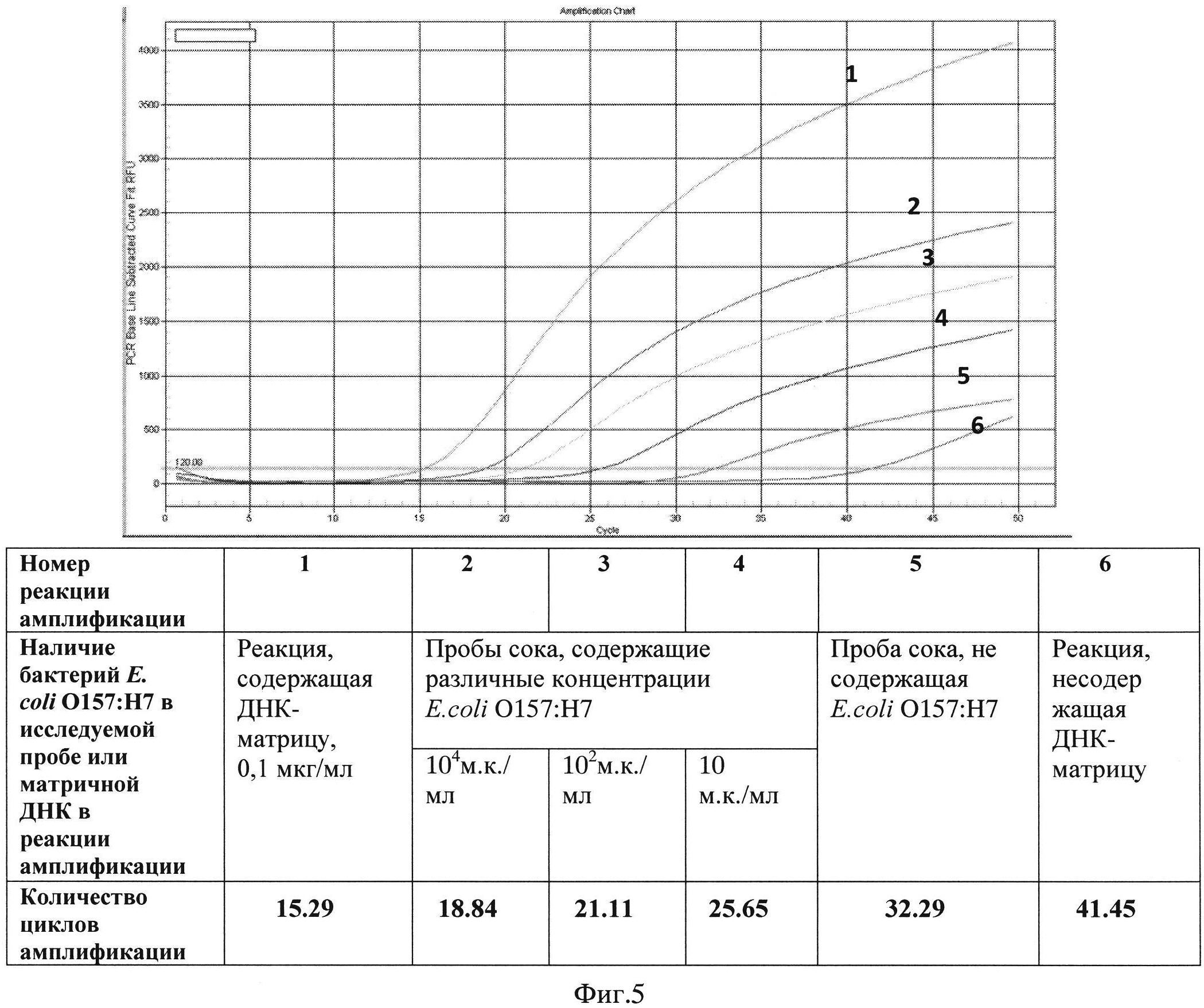
Фиг.5. Типичные результаты определения E.coli O157:Н7 способом иммунодетекции, сопряженной с ПЦР-амплификацией в режиме реального времени.
Для лучшего понимания сущности изобретения ниже следуют примеры его конкретного выполнения.
Пример 1. Приготовление проб биологических образцов и продуктов питания для определения E.coli O157:Н7 способом иммунодетекции, сопряженной с ПЦР-амплификацией.
Схема подготовки проб инфицированного биологического материала представлена на Фиг.1. Отобранные образцы жидких продуктов питания (сок, молоко, минеральная вода) и биологических жидкостей (кровь, моча, слюна) центрифугируют при 5000 об/мин и температуре +4°С, отбирают супернатант и повторно центрифугируют его при 10000 об/мин в течение 15 минут. К супернатанту добавляют 1/10 (v/v) стерильного раствора, содержащего 1M трис-HCl pH 7,5, 1M хлорида натрия, 100 мкг/мл лизоцима и 10Х раствор Complete Protease Inhibitor Cocktail EDTA-free (Roche, США), и инкубируют пробы при температуре +4°С и встряхивании на шейкере в течение 10 мин.
Образцы твердых продуктов питания (мясо, овощи), фекалии и образцы почвы добавляют раствор, содержащий 100 мМ трис-HCl рН 7,5, 100 мМ хлорида натрия, 10 мкг/мл лизоцима из расчета один объем раствора (в мл) на одну единицу массы твердого образца (в г) и 1/10 (v/v) 10Х раствора Complete Protease Inhibitor Cocktail EDTA-free (Roche, США), и растирают в гомогенизаторе Дунса (20 ударов плотно прилегающего пестика) во льду. Полученный однородный гомогенат встряхивают на шейкере при температуре +4°С в течение 10 минут.
К обработанным лизоцимом образцам добавляют 1/10 раствора, содержащего 100 мМ трис-HCl рН 7,5, 5% TritonX-100, 100 мкг/мл ДНКазы и 10 мМ хлорида магния. Образцы перемешивают встряхиванием и выдерживают при комнатной температуре в течение 5 минут, после чего к обработанным образцам добавляют 1/50 (v/v) 0,5 M раствора ЭДТА и удаляют дебрис центрифугированием при +4°С и 18000 об/мин в течение 15 минут. Тестирование проводят с отобранным супернатантом.
Хранят подготовленные образцы при температуре +4°С в течение 4 часов до проведения анализа или замораживают при -70°С для длительного хранения.
Пример 2. Выделение, очистка и биотинилирование антител, специфичных к бактериям E.coli O157:Н7.
Моноклональные антитела, специфичные к бактериям E.coli O157:Н7 [Лунева Н.М., Шайхутдинова Р.З. с соавт. // Биотехнология. - 2011. - №5. - С. 85-92] выделяют из асцитной жидкости. Асцитную жидкость центрифугируют при 10000 об/мин в течение 15 минут для удаления клеточного дебриса. К полученному супернатанту добавляют равный объем буфера, содержащего 40 мМ трис-HCl рН 7,5, 200 мМ хлорида натрия, и проводят высаливание антитела из раствора добавлением насыщенного раствора сульфата аммония до концентрации 50%. Полученный сульфатный осадок собирают центрифугированием при 12000 об/мин в течение 15 минут и растворяют в буфере, содержащем 50 мМ трис-HCl рН 7,5, 100 мМ хлорида натрия. Белковый раствор центрифугируют при 12000 об/мин в течение 15 минут для удаления нерастворенных примесей и наносят на колонку Protein G (GE Healthcare, США), уравновешенную 10 объемами буфера, использованного для растворения белка. Колонку промывают 10 объемами того же буфера для удаления не связавшегося белка и элюируют белок антитела раствором, содержащим 100 мМ глицин-HCl рН 2,6 и 100 мМ хлорида натрия. Приводят значение рН раствора к 8.0 добавлением раствора 1 M трис-основание. Определяют концентрацию полученного белка антитела спектрофотометрически и анализируют его чистоту электрофорезом в денатурирующем полиакриламидном геле по методике Laemmli.
Полученный белок антитела троекратно диализуют против 100 объемов фосфатного буфера, содержащего 20 мМ Na2HPO4 и 100 мМ хлорида натрия. Готовят раствор NHS-биотина в DMSO из расчета 1 мг/мл и добавляют полученный раствор к раствору антитела в объемном соотношении 1:8. Проводят реакцию биотинилирования при +4°С в течение ночи со встряхиванием и троекратно диализуют против 100 объемов фосфатного буфера, содержащего 20 мМ Na2HPO4 и 100 мМ хлорида натрия для удаления несвязавшегося биотина.
Полноту биотинилирования контролируют постановкой иммуноблота с детекцией биотинилированного антитела коньюгатом нейтравидин-пероксидаза (Pierce, США).
Пример 3. Подготовка магноиммуносорбентов Dynabeads anti-E.coli O157:Н7 для определения Ε.coli O157:Н7 способом иммунодетекции, сопряженной с ПЦР-амплификацией.
1 мл магноиммуносорбента Dynabeads anti - E.coli O157:Н7 (DynalAs, Oslo, Norway) промывают ФСБ (137 мМ NaCl, 2,7 мМ KCl, 10 мМ Na2HPO4, 1,8 мМ KH2PO4, рН 7,4) и инкубируют с 2,5% раствором сухого молока в ФСБ, содержащего 0,02% азида натрия, в течение 1 часа. Для адсорбции частиц из раствора используют магнитный штатив Dyna Mag-2 (Life Technologies, США). По окончании инкубации частицы троекратно промывают ФСБ, содержащим 0,05% Tween-20 (ФСБ-Tween), и суспендируют в 0,5 мл ФСБ.
Подготовленный магноиммуносорбент хранят при температуре +4°С не более 2 суток.
Пример 4. Подготовка магноиммуносорбента Protein G Magnetic Beads для определения Ε.coli O157:H7 способом иммунодетекции, сопряженной с ПЦР-амплификацией.
Магносорбент Protein G Magneti Beads (New England Biolabs, США) промывают ФСБ и инкубируют с очищенными моноклональными антителами к E.coli O157:H7, взятыми в концентрации 1 мг/мл, в течение 2 часов при +4°С. Затем частицы троекратно промывают ФСБ-Tween от несвязавшихся антител с использованием магнита и выдерживают с 2,5% раствором сухого молока в ФСБ, содержащего 0,02% азида натрия, в течение 1 часа, после чего снова троекратно промывают частицы раствором ФСБ-Tween и суспендируют в 0,5 мл ФСБ.
Подготовленный магноиммуносорбент хранят при температуре +4°С не более 2 суток.
Пример 5. Подготовка магноиммуносорбента на основе магносорбента (СтавНИПЧИ) для определения E.coli O157:Н7 способом иммунодетекции, сопряженной с ПЦР-амплификацией.
К 1 г магносорбента производства СтавНИПЧИ (Патент РФ 2138813) добавляют 12 мл 24%-ного раствора хлорида натрия и 1 мл вторичного алкилсульфата натрия и инкубируют смесь 2 часа при температуре 37°С для активации поверхности магнитного носителя. К 1 мл активированного сорбента приливают 1 мл очищенных моноклональных антител к E.coli O157:Н7, взятых в концентрации 3 мг/мл, и инкубируют смесь при температуре 37°С в течение 2 часов, после чего надосадочную жидкость удаляют, а магноиммуносорбент троекратно промывают ФСБ. Свободные валентности поверхности сорбента блокируют 2,5% раствором сухого молока в ФСБ, содержащего 0,02% азида натрия, в течение 1 часа. По окончании блокировки магноиммуносорбент троекратно промывают ФСБ и суспендируют в 0,5 мл ФСБ.
Подготовленный магноиммуносорбент хранят при температуре +4°С в течение 6 месяцев.
Пример 6. Приготовление коньюгата биотинилированной ДНК с нейтравидином.
Для приготовления коньюгата с нейтравидином и матрицы для ПЦР-амплификации в режиме реального времени используют фрагмент геномной ДНК Fusariuma venaceum длиной 747 пар оснований. Праймеры для амплификации фрагмента на 5′-концах модифицируют биотином (Фиг.3). Наработку биотинилированного фрагмента ДНК проводят ПЦР амплификацией при помощи Taq-полимеразы при температуре отжига праймеров 56°С и времени элонгации фрагмента 1 минута. Продукты ПЦР-реакции осаждают 3 объемами этанола с добавлением 1/10 объема ацетата натрия рН 5,2 и растворяют в 0,5 мл буфера, содержащего 20 мМ трис-HCl рН 7,5 и 300 мМ хлорида натрия, 5 мМ ЭДТА. Раствор ДНК центрифугируют для удаления нерастворенных примесей и наносят на гельфильтрационную колонку Superdex-200 (GE-Healthcare, Великобритания), уравновешенную тем же буфером, для удаления побочных продуктов синтеза и не задействованных в синтезе олигонуклеотидов. Гельфильтрацию проходит при скорости потока 0,5 мл/мин, выход разделяемых продуктов контролируют спектрофотометрически. Определяют содержание целевого фрагмента ДНК во фракциях гельфильрации электрофорезом в агарозном геле. Фракции, содержащие синтезированный фрагмент, осаждают 3 объемами этанола с добавлением 1/10 объема ацетата натрия рН 5,2 и растворяют в буфере, содержащем 20 мМ трис-HCl, 100 мМ хлорида натрия и 5 мМ ЭДТА. Количество ДНК в полученном растворе определяют спектрофотометрически.
Готовят раствор нейтравидина (Pierce, США) из расчета 1 мг/мл и смешивают его в эквимолярном соотношении с раствором ДНК. Смесь инкубируют при +4°С в течение ночи. Образование молекулярной ″сетки″ биотинилированной ДНК с нейтравидином контролируют электрофорезом ДНК в полиакриламидном геле по замедлению скорости миграции продуктов разделения против исходного фрагмента ДНК (Фиг.4). Полученный коньюгат биотинилированной ДНК с нейтравидином очищают от несвязанной ДНК и нейтравидина гельфильтрацией на колонке Superdex-200 (GE-Healthcare, Великобритания), уравновешенной буфером, содержащим 20 мМ трис-HCl рН 7,5, 300 мМ хлорида натрия и 5 мМ ЭДТА. Содержание коньюгата во фракциях гельфильтрации контролируют электрофорезом в агарозном геле. Очищенный коньюгат концентрируют с использованием Microcon YM-50 (Millipore, США). Спектрофотометрически определяют концентрацию коньюгата по ДНК и белку и на основании этих данных рассчитывают соотношение ДНК к белку в полученной молекулярной ″сетке″. Оптимальное молярное соотношение ДНК к белку составляет 1:2 (Фиг.4). К полученному коньюгату добавляют глицерин до 50% и хранят по аликвотам при температуре -70°С.
Пример 7. Постановка иммунодетекции E.coli O157:Н7 и связывание его с ДНК-матрицей для последующей ПЦР-амплификации в режиме реального времени.
В пробирки типа «эппендорф» вносят по 20 мкл суспензии подготовленных магноиммуносорбентов и по 100 мкл подготовленных исследуемых образцов, а также подготовленных образцов, искусственно инфицированных бактериями E.coli O157:Н7 в серии понижающихся концентраций от 106 до 1 м.к./мл образца (положительный контроль). В пробирки, служащие отрицательным контролем, добавляют раствор ФСБ-Tween либо экспериментальные образцы, заведомо не содержащие антиген E.coli O157:Н7. Инкубируют пробирки при встряхивании в течение 1 часа при комнатной температуре. Троекратно промывают парамагнитные частицы раствором ФСБ-Tween с использованием магнитного штатива Dyna Mag-2 (Life Technologies, США). В пробирки добавляют по 100 мкл раствора, содержащего биотинилированное антитело и инкубируют пробирки при встряхивании в течение 30 минут при комнатной температуре. Троекратно промывают парамагнитные частицы раствором ФСБ-Tween. В пробирки добавляют по 50 мкл раствора, содержащего 20 мМ трис-HCl рН 7,5, 100 мМ хлорида натрия, 5 мМ ЭДТА и коньюгат биотинилированной ДНК с нейтравидином (конечная концентрация ДНК 2 мкг/мл) и инкубируют пробирки при встряхивании в течение 30 минут при комнатной температуре, после чего троекратно промывают парамагнитные частицы буфером, содержащим 20 мМ трис-HCl рН 7,5 и 300 мМ хлорида натрия.
После полного удаления промывочного раствора к частицам приливают по 50 мкл раствора глицин-HCl рН 2.6 и инкубируют пробирки при комнатной температуре в течение 5 минут. Частицы изолируют от раствора, используя магнитный штатив, отбирают раствор в отдельные пробирки и нейтрализуют добавлением 1М раствора трис-основание.
Аликвоты нейтрализованного раствора, содержащего ДНК-матрицу, переносят по 5 мкл в пробирки для ПЦР-амплификации и добавляют на одну пробирку по 10 мкл смеси для ПЦР-амплификации в режиме реального времени («Синтол», Россия), специфические праймеры (по 300 нМ каждого вида праймеров), пробу TaqMan (по 200 нМ) и по 1 EдTaq-полимеразы («Евроген», Россия). Конечный объем реакции ПЦР-амплификации составляет 25 мкл.
Пример 8. Проведение ПЦР-амплификации с флуоресцентной детекцией сигнала в режиме реального времени.
Реакцию амплификации проводят на приборе для ПЦР амплификации в режиме реального времени Mini Opticon Real-Time PCR Detection Sistem (Bio-Rad, США) с использованием следующего протокола:

Регистрацию нарастания флуоресценции ведут при длине волны 520 нм. Пробы, содержащие образцы, инфицированные бактериями E.coli O157:Н7 в концентрации 1 м.к./мл образца и выше, показывают возрастание флуоресценции с 5 по 30 цикл реакции амплификации (Фиг.5). В пробах, являющихся отрицательным контролем, нарастания флуоресценции в данном диапазоне циклов реакции не происходит. Применив калибровочную шкалу, построенную на основании зависимости номера цикла, на котором начинает регистрироваться изменение флуоресценции, от значений концентрации бактерий в образцах, являющихся положительным контролем, определяют концентрацию антигена в исследуемых пробах.
Способ определения наличия в биологических жидкостях, окружающей среде и продуктах питания бактерий штамма O157:Н7, включающий подготовку проб, предусматривающую дезинтеграцию бактерий ферментативной обработкой и их лизис неионным детергентом, адсорбцию бактериального антигена из образцов на парамагнитных частицах при помощи специфического моноклонального антитела, детекцию антигена бактерий O157:Н7 при помощи специфического биотинилированного моноклонального антитела, связывание комплекса "антитело-антиген O157:Н7 - биотинилированное антитело" с нековалентным коньюгатом ДНК-матрицы с нейтравидином, диссоциацию твердофазного комплекса "антитело-антиген O157:Н7 - биотинилированное антитело-коньюгат" добавлением раствора глицин - HCl рН 2.6, ПЦР-амплификацию ДНК-матрицы с флуоресцентной детекцией сигнала в режиме реального времени и выявление наличия бактерий O157:Н7 в исследуемых образцах по скорости нарастания флуоресцентного сигнала в реакциях ПЦР-амплификации, соответствующих инфицированным образцам, против контрольных.