Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ БЕНЗИЛГИДРОКСИДА, ИХ ПОЛУЧЕНИЕ И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
Настоящее изобретение относится к производным бензилгидроксида, их получению и их терапевтическому применению.
Соединения по настоящему изобретению являются прямыми безопасными ингибиторами комплекса 1 митохондриальной дыхательной цепи и косвенными ингибиторами стабилизации фактора, индуцируемого гипоксией (HIF-1), при гипоксическом стрессе.
Митохондриальный комплекс I, также называемый NADH:убихиноноксидоредуктаза, является ключевым компонентом дыхательной цепи. Митохондриальной комплекс 1 способствует формированию мембранного потенциала в сочетании с синтезом АТФ на начальной стадии клеточных процессов, обеспечивающих энергию. Состоящий из 45 субъединиц, кодируемых как геномной, так и митохондриальной ДНК, комплекс 1 присутствует на внутренней митохондриальной мембране всех клеток млекопитающих и является основным потребителем NADH, образуемого в цикле Кребса, и регулятора гомеостаза NADH/NAD+ в клетках.
Благодаря своей функции комплекс 1 отвечает за косвенную модуляцию многих различных клеточных метаболитов (соотношения АМФ/АТФ и NADH/NAD+, альфа-кетоглутарата, сукцината и кислорода, например), вовлеченных в пути, которые поддерживают клеточную пролиферацию, рост и адаптацию в условиях специфического стресса.
В условиях окислительного стресса митохондриальный комплекс 1 участвует в качестве основного источника реактивных форм кислорода (ROS) в митохондриальной дыхательной цепи и индуцирует апоптоз (Li et al., 2003).
Посредством косвенной модуляции концентраций альфа-кетоглутарата, сукцината и кислорода, митохондриальный комплекс 1 также участвует в регуляции активности пролилгидроксилазы (PHD), что приводит к деградации фактора, индуцируемого гипоксией (HIF), в условиях нормоксии. При гипоксии или дисфункции некоторых ферментов ТСА (сукцинатдегидрогеназа, фумаратгидратаза), PHD ингибируется, HIF-1a стабилизируется и перемещается в ядро. HIF-1a действует как фактор транскрипции, который приводит к усилению активности генов-мишеней, вовлеченных во многие аспекты прогрессирования злокачественных новообразований, ангиогенеза, выживания клеток, метаболизма глюкозы и инвазии. В настоящее время было идентифицировано более 70 предполагаемых HIF-1 генов-мишеней (SS Hong et al., 2004).
В 1920-х годах Отто Варбург показал, что опухолевые клетки проявляют специфический метаболизм по сравнению с исходными клетками: увеличение клеточной авидности к глюкозе (эффект Варбурга) при нормоксических условиях (аэробный гликолиз). Спустя несколько лет был окончательно определен метаболизм дерегулирования как возникающая отличительная черта злокачественного новообразования (Hanahan et al. (2011) Cell, 144). И это наблюдение еще больше было воплощено в клинике, когда в настоящее время агрессивные опухоли обычно диагностируют благодаря их авидности к глюкозе (FDG Petscan). Понимание метаболической адаптации таргетирования злокачественных клеток со специфическим метаболизмом, похоже, теперь является очевидным для общества.
Для многих видов злокачественных новообразований продемонстрирован гликолитический сдвиг (эффект Варбурга), который коррелирует с агрессивностью опухоли и плохим прогнозом. Он присутствует, например, в большинстве глиобластом или при тройном отрицательном раке молочной железы, метастатических опухолях головы и шеи или метастатических меланомах. С другой стороны, рост некоторых опухолей зависит от метаболизма окислительного фосфорилирования (OXPHOS, митохондриального). Опухоли, рост которых зависит от пирувата, глутамина или липидов, могут зависеть от метаболизма OXPHOS для поддержания производства АТФ, окислительно гомеостаза и продукции аминокислот. Например, гормонозависимые опухоли молочной железы, некоторые опухоли легких, гепатокарциномы, желудочно-кишечные опухоли, опухоли с гиперэкспрессией с-Myc, такие как некоторые лимфомы, следует рассматривать как OXPHOS-зависимые опухоли. Кроме того, новые данные подтверждают тот факт, что резистентность к лечению, возникающая после того, как некоторые виды «таргетной терапии» таргетируют пути, которые поддерживают гликолитический метаболизм, может возникать за счет сдвига опухолевого метаболизма в OXPHOS-зависимый метаболизм. Были проведены исследования с целью выявления некоторых новых путей диагностики таких типов опухолей посредством специфических инновационных анализов дыхания на основе биопсии или через разработку специфических биомаркером PET-Scan, таких как, например, 18F-глютамин или 11С-ацетат.
Помимо своей основной роли в поддержании метаболизма OXPHOS в опухолях, комплекс 1 участвует в переходе опухоли в опухоль с агрессивным характером, вызванным стабилизацией HIF1 в условиях гипоксии. На сегодняшний день является очевидным, что модуляция митохондриальной функциональной активности приводит к модуляции стабилизации HIF1: ингибирование комплекса 1 - к снижению стабилизации HIF-1a при гипоксии, при этом ингибирование комплекса 2 (сукцинатдегидрогеназа) приводит к повышению стабилизации HIF-1a в условиях нормоксии (мутация SDH или FH приводит к развитию злокачественного новообразования за счет стабилизации HIF). Несколько ферментов, ответственных за метаболизм сдвига в сторону анаэробного гликолиза ((Wenger, R. H., 2000), участвующие в регуляции внутриклеточного рН, опухолевой инвазии и метастазировании, непосредственно контролируются HIF-1a. И повышенные уровни HIF-1a в диагностических биопсиях опухолей связаны с повышенным риском смерти при раке мочевого пузыря, головного мозга, молочной железы, толстой кишки, шейки матки, эндометрия, головы/шеи, легких, яичников, поджелудочной железы, предстательной железы, прямой кишки и желудка. Кроме того, экспериментальные манипуляции, повышающие экспрессию HIF-1a, приводят к увеличению роста опухоли, в то время как потеря активности HIF приводит к снижению роста опухоли (Semenza, G.L., 2010). Таким же образом, HIF-1a нулевые опухоли демонстрируют замедленный рост и уменьшение легочных метастазов (Liao D., et al., 2007). Предотвращение OXPHOS-зависимого роста, метаболической адаптации и васкуляризации опухоли посредством дестабилизации HIF-1a и индукции апоптоза с помощью конкретного и безопасного ингибитора митохондриального комплекса 1, по-видимому, является новым способом, относящимся к таким опухолям.
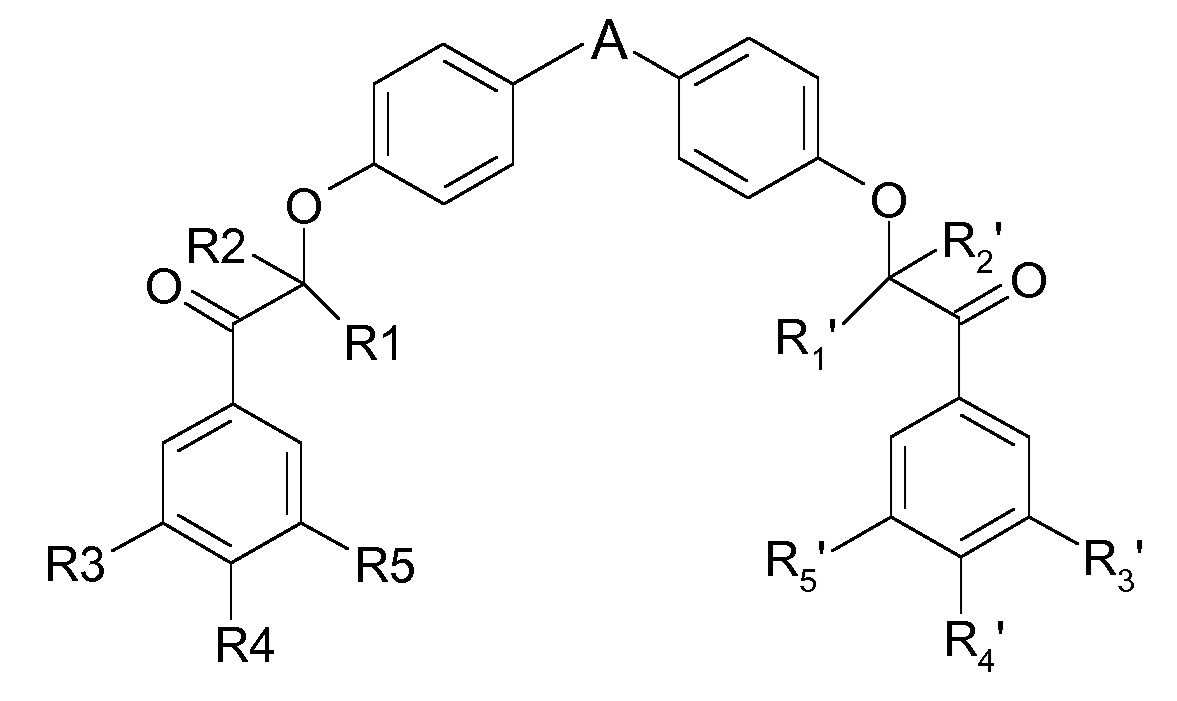
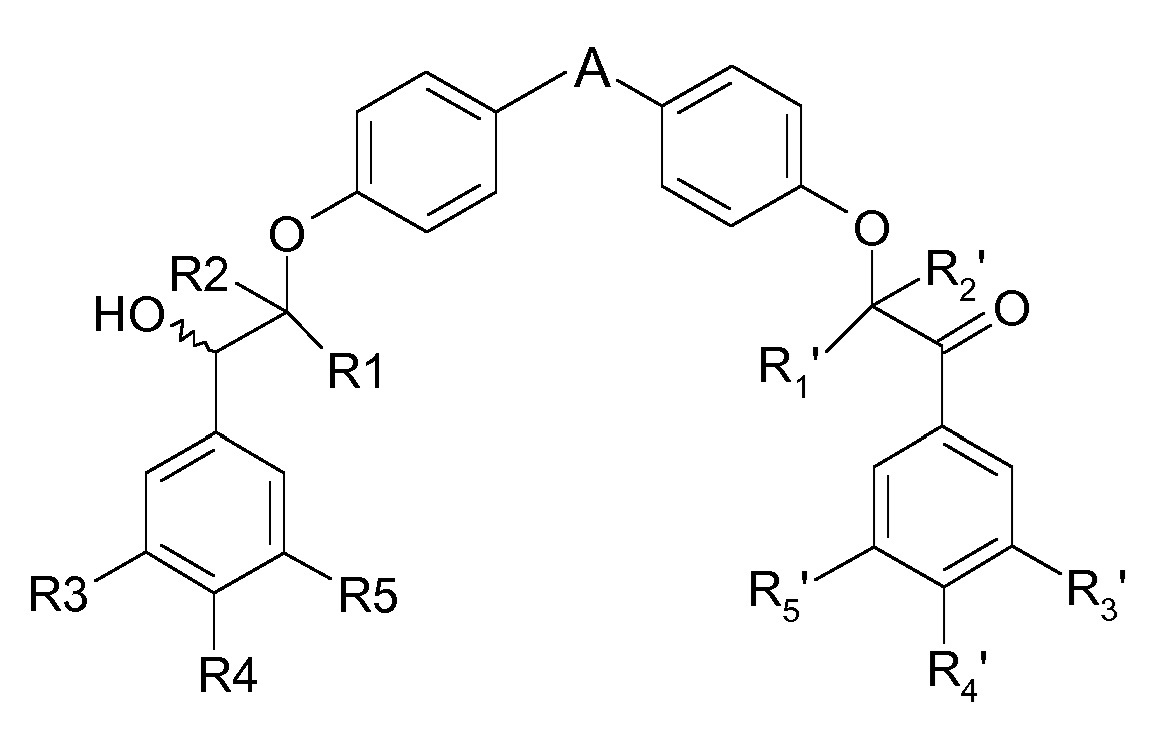
Настоящее изобретение относится к соединениям формулы (I):
 (I),
(I),
где
A представляет собой 5-членную гетероарильную группу, содержащую от 1 до 3 гетероатомов, где по меньшей мере один гетероатом выбран из атома серы и атома азота, где A является незамещенным или замещен одной или несколькими (C1-C4)алкильными группами, и каждая (C1-C4)алкильная группа является незамещенной или замещена гетероциклильной группой,
каждый из R1, R2, R1′ и R2′, независимо, представляет собой атом водорода или (C1-C4 алкильную) группу, и
каждый из R3, R4, R5, R3′, R4′ и R5′, независимо, выбран из атома водорода, атома галогена, -O-фторметильной группы и (C1-C4)алкокси группы, где по меньшей мере один из R3, R4 и R5 представляет собой (C1-C4)алкокси группу, и по меньшей мере один из R3′, R4′ и R5′ представляет собой (C1-C4)алкокси группу,
в виде основания, энантиомеров, диастереоизомеров, включая рацемическую смесь, и к аддитивным солям с кислотами.
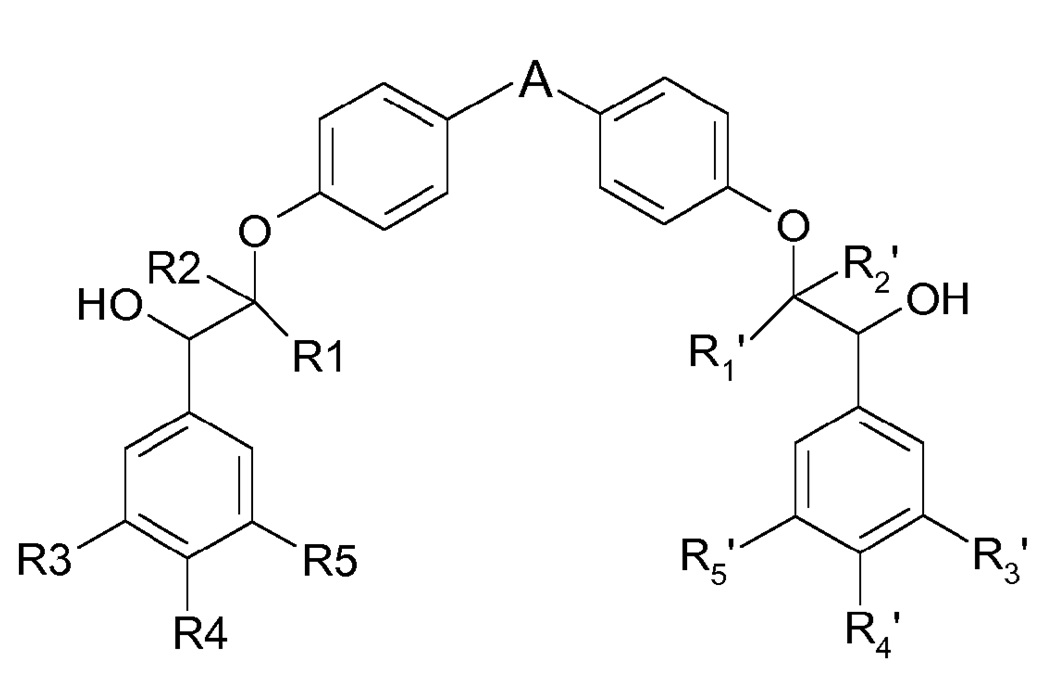
Соединения формулы (I) могут содержать один или несколько асимметрических атомов углерода. Поэтому они могут существовать в виде энантиомеров или диастереоизомеров. Эти энантиомеры и диастереоизомеры, а также их смеси, включая рацемические смеси, образуют часть изобретения.
Диастереомеры могут быть разделены на отдельные изомеры, например, с помощью хроматографии. Рацематы могут быть разделены на два энантиомера Обычными методами, например, с помощью хроматографии на хиральных фазах.
Соединения формулы (I) могут существовать в форме оснований или аддитивных солей с кислотами. Такие аддитивные соли образуют часть изобретения.
Эти соли могут быть получены с фармацевтически приемлемыми кислотами, хотя соли других кислот, используемые, например, при очистке или выделении соединений формулы (I), также образуют часть изобретения.
В контексте настоящего изобретения некоторые термины имеют следующие значения:
атом галогена: фтор, хлор, бром или йод;
алкильная группа: линейная или разветвленная насыщенная углеводородная группа. Примеры включают группы метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил и т.д.;
фторалкильная группа: алкильная группа, в которой один или несколько атомов водорода замещены атомом фтора;
алкокси группа: -O-алкильный радикал, в котором алкильная группа имеет значения, определенные выше;
гетероарильная группа: циклическая ароматическая группа, содержащая от 2 до 4 атомов углерода и содержащая от 1 до 3 гетероатомов, таких как азот, кислород или сера. Примеры гетероарильных групп включают группы оксазолил, тиазол, тиенил, оксадиазолил, тиадиазолил или индолил;
гетероциклильная группа: насыщенная циклическая группа, содержащая в интервале от 5 до 10 атомов углерода и содержащая в интервале от 1 до 3 гетероатомов, таких как азот, кислород или сера. Примеры гетероциклильных групп включают морфолиновые группы.
Среди соединений формулы (I), которые являются объектом изобретения, первая группа соединений состоит из соединений, в которых A содержит атом кислорода.
Среди соединений формулы (I), которые являются объектом изобретения, вторая группа соединений состоит из соединений, в которых A представляет собой группу оксазолил, тиазол, тиенил, оксадиазолил, тиадиазолил или имидазолил.
Среди соединений формулы (I), которые являются объектом изобретения, третья группа соединений состоит из соединений, в которых A является незамещенным.
Среди соединений формулы (I), которые являются объектом изобретения, четвертая группа соединений состоит из соединений, в которых A замещен одной или несколькими метильными группами.
Среди соединений формулы (I), которые являются объектом изобретения, пятая группа соединений состоит из соединений, в которых каждый из R1, R2, R1′ и R2′ представляет собой атом водорода или метильную группу.
Среди соединений формулы (I), которые являются объектом изобретения, шестая группа соединений состоит из соединений, в которых по меньшей мере два из R3, R4 и R5 представляют собой -OCH3, и по меньшей мере два из R3′, R4′ и R5′ представляют собой -OCH3.
В частности, среди соединений шестой группы соединений могут быть упомянуты соединения, для которых два из R3, R4 и R5 представляют собой -OCH3 и два из R3ʹ, R4ʹ и R5ʹ представляют собой -OCH3.
Среди соединений формулы (I), которые являются объектом изобретения, седьмая группа соединений состоит из соединений, в которых по меньшей мере один из R3, R4, R5, R3′, R4′ и R5′ представляет собой -OCHF2.
Среди соединений формулы (I), которые являются объектом изобретения, восьмая группа соединений состоит из соединений, в которых R1=R1′, R2=R2′, R3=R3′, R4=R4′ и R5=R5′.
Среди соединений формулы (I), которые являются объектом изобретения, могут быть указаны, в частности, следующие соединения:
1-(3,4-диметоксифенил)-2-[4-[2-[4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил]-5-метилоксазол-4-ил]фенокси]этанол;
1-(3,4-диметоксифенил)-2-[4-[2-[4-[2-(3,4-диметоксифенил)-2-гидрокси-1,1-диметилэтокси]фенил]-5-метилоксазол-4-ил]фенокси]-2-метилпропан-1-ол;
1-(3,4-диметоксифенил)-2-[4-[2-[4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил]-4-метилоксазол-5-ил]фенокси]этанол;
1-(3,4-диметоксифенил)-2-[4-[2-[4-[2-(3,4-диметоксифенил)-2-гидрокси-1,1-диметилэтокси]фенил]-5-метилтиазол-4-ил]фенокси]-2-метилпропан-1-ол;
1-(3,4-диметоксифенил)-2-[4-[2-[4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил]-5-метилтиазол-4-ил]фенокси]этанол;
1-(3,4-диметоксифенил)-2-[4-[2-[4-[2-(3,4-диметоксифенил)-2-гидрокси-1,1-диметилэтокси]фенил]-5-метилтиазол-4-ил]фенокси]-2-метилпропан-1-ол;
1-(3,4-диметоксифенил)-2-[4-[2-[4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил]-5-метилтиазол-4-ил]фенокси]этанол;
1-(3,4-диметоксифенил)-2-[4-[2-[4-[2-(3,4-диметоксифенил)-2-гидрокси-1-метилэтокси]фенил]оксазол-4-ил]фенокси]пропан-1-ол;
1-(3,4-диметоксифенил)-2-[4-[2-[4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил]оксазол-4-ил]фенокси]этанол;
1-(4-хлор-3-метоксифенил)-2-[4-[2-[4-[2-(4-хлор-3-метоксифенил)-2-гидроксиэтокси]фенил]оксазол-4-ил]фенокси]этанол;
1-(4-фтор-3-метоксифенил)-2-[4-[2-[4-[2-(4-фтор-3-метоксифенил)-2-гидроксиэтокси]фенил]оксазол-4-ил]фенокси]этанол;
1-(3-фтор-4-метоксифенил)-2-[4-[2-[4-[2-(3-фтор-4-метоксифенил)-2-гидроксиэтокси]фенил]оксазол-4-ил]фенокси]этанол;
1-(3,4-диметоксифенил)-2-[4-[2-[4-[2-(3,4-диметоксифенил)-2-гидрокси-1,1-диметилэтокси]фенил]оксазол-4-ил]фенокси]-2-метилпропан-1-ол;
2-[4-[2-[4-[2-гидрокси-2-(3,4,5-триметоксифенил)этокси]фенил]оксазол-4-ил]фенокси]-1-(3,4,5-триметоксифенил)этанол;
1-(3,4-диметоксифенил)-2-[4-[2-[4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил]тиазол-4-ил]фенокси]этанол;
1-(3,4-диметоксифенил)-2-[4-[2-[4-[2-(3,4-диметоксифенил)-2-гидрокси-1,1-диметилэтокси]фенил]тиазол-4-ил]фенокси]-2-метилпропан-1-ол;
1-(3,4-диметоксифенил)-2-[4-[2-[4-[2-(3,4-диметоксифенил)-2-гидрокси-1-метилэтокси]фенил]тиазол-4-ил]фенокси]пропан-1-ол;
1-(3,4-диметоксифенил)-2-[4-[2-[4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил]тиазол-4-ил]фенокси]этанол;
1-(3,4-диметоксифенил)-2-[4-[4-[4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил]тиазол-2-ил]фенокси]-2-метилпропан-1-ол;
1-(3,4-диметоксифенил)-2-[4-[2-[4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил]тиазол-4-ил]фенокси]-2-метилпропан-1-ол;
1-(3,4-диметоксифенил)-2-[4-[5-[4-[2-(3,4-диметоксифенил)-2-гидрокси-1,1-диметилэтокси]фенил]-3-тиенил]фенокси]-2-метилпропан-1-ол;
1-(3,4-диметоксифенил)-2-[4-[5-[4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил]-3-тиенил]фенокси]этанол;
1-(3,4-диметоксифенил)-2-[4-[5-[4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил]-1,2,4-оксадиазол-3-ил]фенокси]этанол;
1-(3,4-диметоксифенил)-2-[4-[5-[4-[2-(3,4-диметоксифенил)-2-гидрокси-1,1-диметилэтокси]фенил]-1,2,4-оксадиазол-3-ил]фенокси]-2-метилпропан-1-ол;
1-(3,4-диметоксифенил)-2-[4-[5-[4-[2-(3,4-диметоксифенил)-2-гидрокси-1-метилэтокси]фенил]-1,2,4-тиадиазол-3-ил]фенокси]пропан-1-ол;
1-(3,4-диметоксифенил)-2-[4-[5-[4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил]-1,2,4-тиадиазол-3-ил]фенокси]этанол;
1-(3,4-диметоксифенил)-2-[4-[5-[4-[2-(3,4-диметоксифенил)-2-гидрокси-1,1-диметилэтокси]фенил]-1,2,4-тиадиазол-3-ил]фенокси]-2-метилпропан-1-ол;
1-(3,4-диметоксифенил)-2-[4-[5-[4-[2-(3,4-диметоксифенил)-2-гидрокси-1,1-диметилэтокси]фенил]-1,2,4-тиадиазол-3-ил]фенокси]-2-метилпропан-1-ол;
1-(3,4-диметоксифенил)-2-[4-[2-[4-[2-(3,4-диметоксифенил)-2-гидрокси-1-метилэтокси]фенил]оксазол-5-ил]фенокси]пропан-1-ол;
1-(3,4-диметоксифенил)-2-[4-[2-[4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил]-1H-имидазол-4-ил]фенокси]этанол;
1-(3,4-диметоксифенил)-2-[4-[2-[4-[2-(3,4-диметоксифенил)-2-гидрокси-1,1-диметилэтокси]фенил]-1H-имидазол-4-ил]фенокси]-2-метилпропан-1-ол;
1-(3,4-диметоксифенил)-2-[4-[2-[4-[2-(3,4-диметоксифенил)-2-гидрокси-1,1-диметилэтокси]фенил]-1-метил-имидазол-4-ил]фенокси]-2-метилпропан-1-ол;
1-(3,4-диметоксифенил)-2-[4-[2-[4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил]-1-метил-имидазол-4-ил]фенокси]этанол;
1-(3,4-диметоксифенил)-2-[4-[2-[4-[2-(3,4-диметоксифенил)-2-гидрокси-1,1-диметилэтокси]фенил]-1-(2-морфолиноэтил)имидазол-4-ил]фенокси]-2-метилпропан-1-ол;
1-(3,4-диметоксифенил)-2-[4-[2-[4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил]-1-(2-морфолиноэтил)имидазол-4-ил]фенокси]этанол гидрохлорид;
1-(3,4-диметоксифенил)-2-[4-[2-[4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил]-4-метилоксазол-5-ил]фенокси]этанол;
1-(3,4-диметоксифенил)-2-[4-[5-[4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил]-1,2,4-оксадиазол-3-ил]фенокси]этанол;
1-[3-(дифторметокси)-4-метоксифенил]-2-[4-[2-[4-[2-[3-(дифторметокси)-4-метоксифенил]-2-гидроксиэтокси]фенил]тиазол-4-ил]фенокси]этанол; и
1-[4-(дифторметокси)-3-метоксифенил]-2-[4-[2-[4-[2-[4-(дифторметокси)-3-метоксифенил]-2-гидроксиэтокси]фенил]тиазол-4-ил]фенокси]этанол.
В соответствии с изобретением соединения общей формулы (I) могут быть получены следующими способами, в зависимости от природы заместителя A.
В тексте далее защитная группа Pg представляет собой группу, которая, с одной стороны, защищает в процессе синтеза реакционноспособную функциональную группу, такую как гидроксил или амин, и, с другой стороны, позволяет восстановить реакционноспособную функциональную группу в конце синтеза. Примеры защитных групп, а также способы введения и удаления защитных групп приведены в обзоре «Protective Groups in Organic Synthesis», Greene et al., 4 Edition (John Wiley & Sons, Inc., New York).
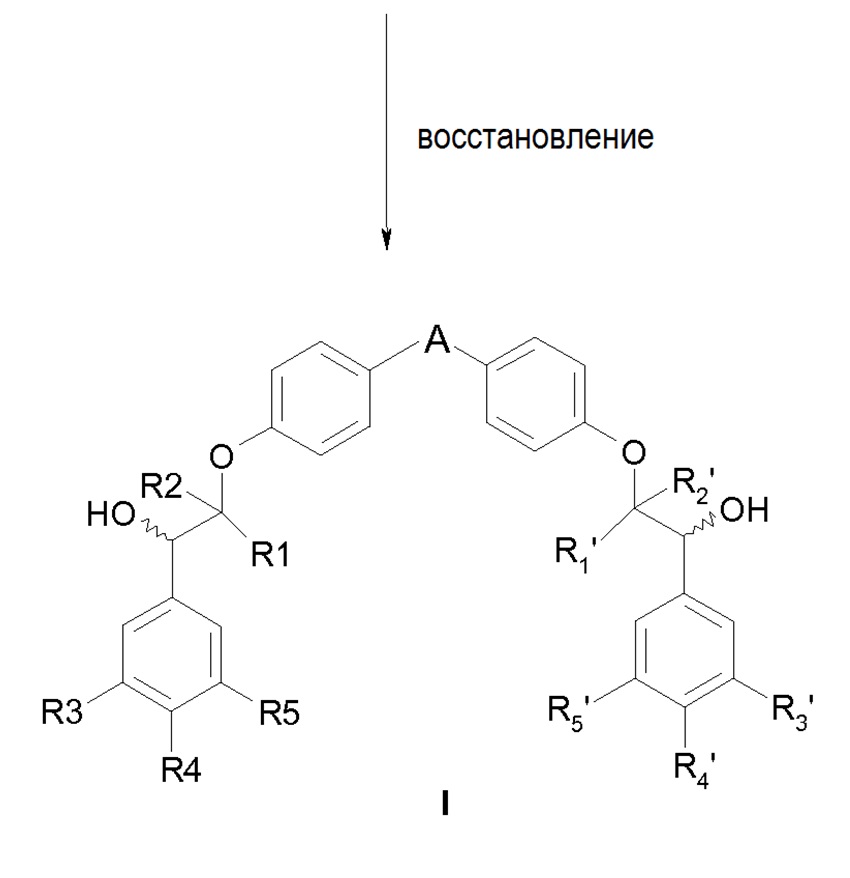
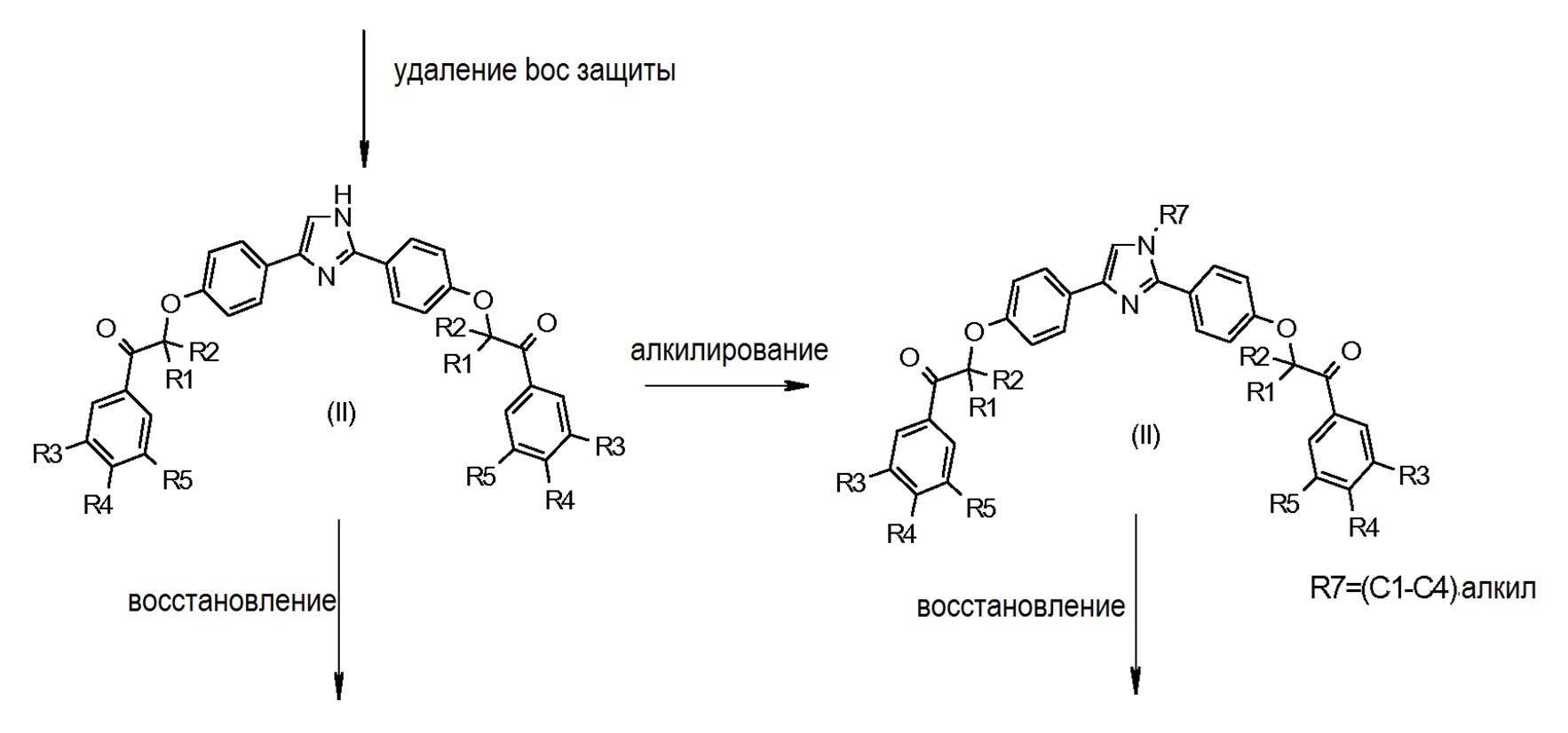
Схема 1, предназначенная для соединений, имеющих заместитель A, отличающийся имидазола, и в которых R1=R1′, R2=R2′, R3=R3′, R4=R4′ и R5=R5′
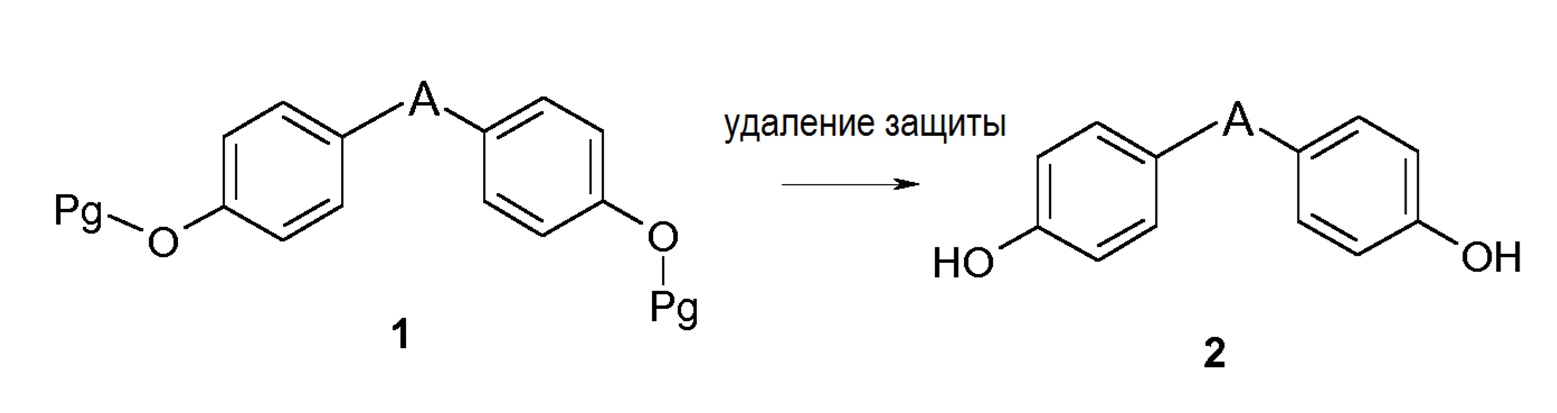
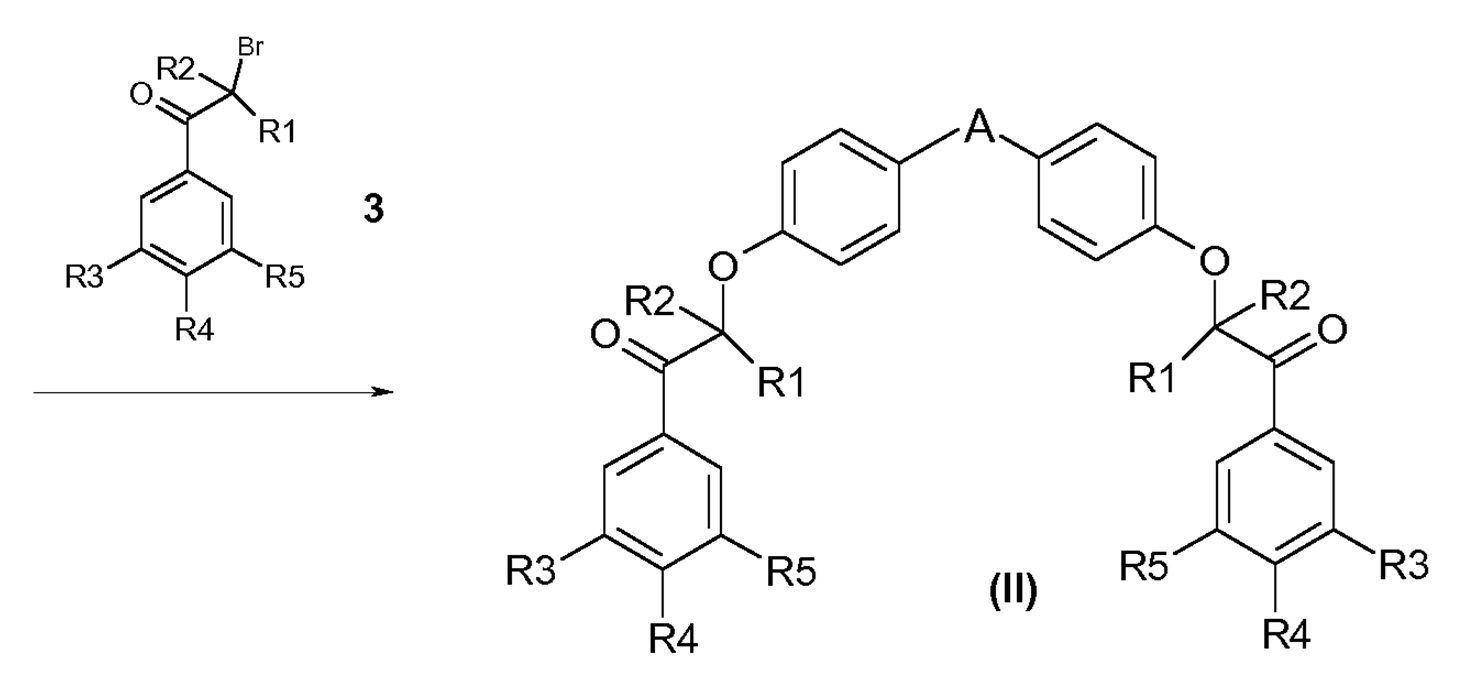
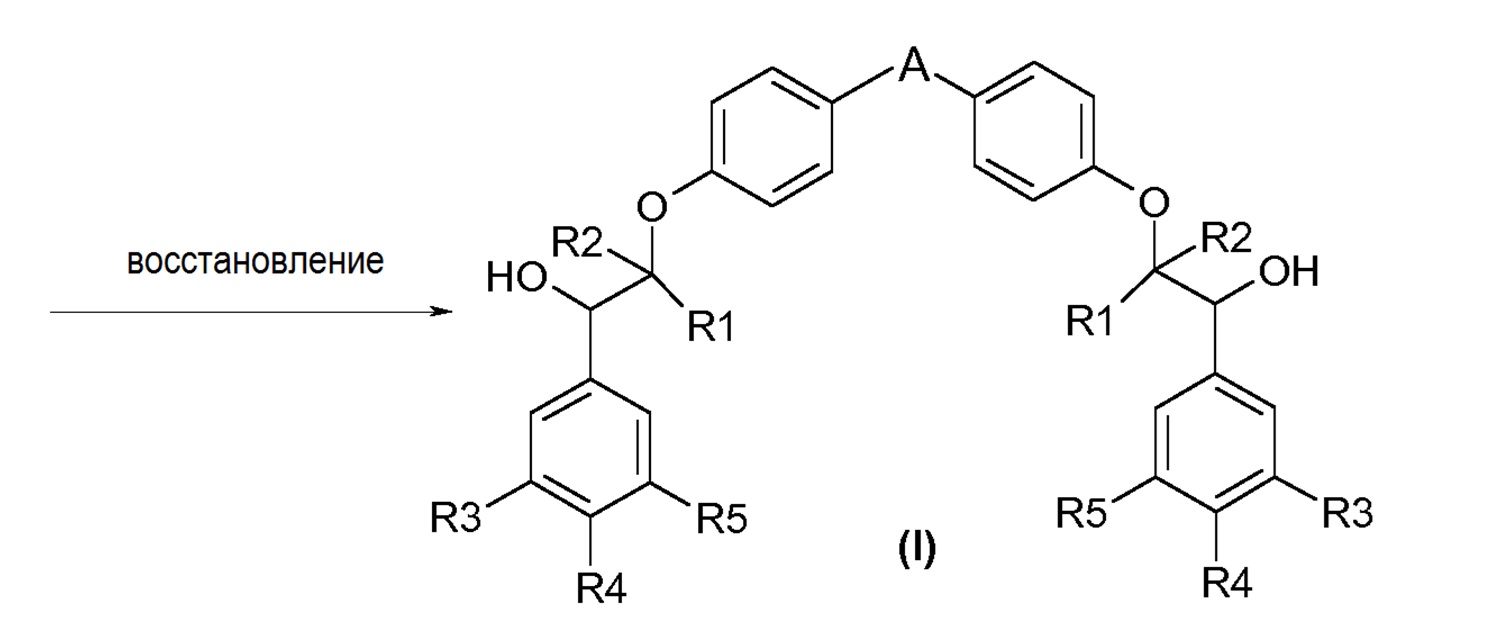
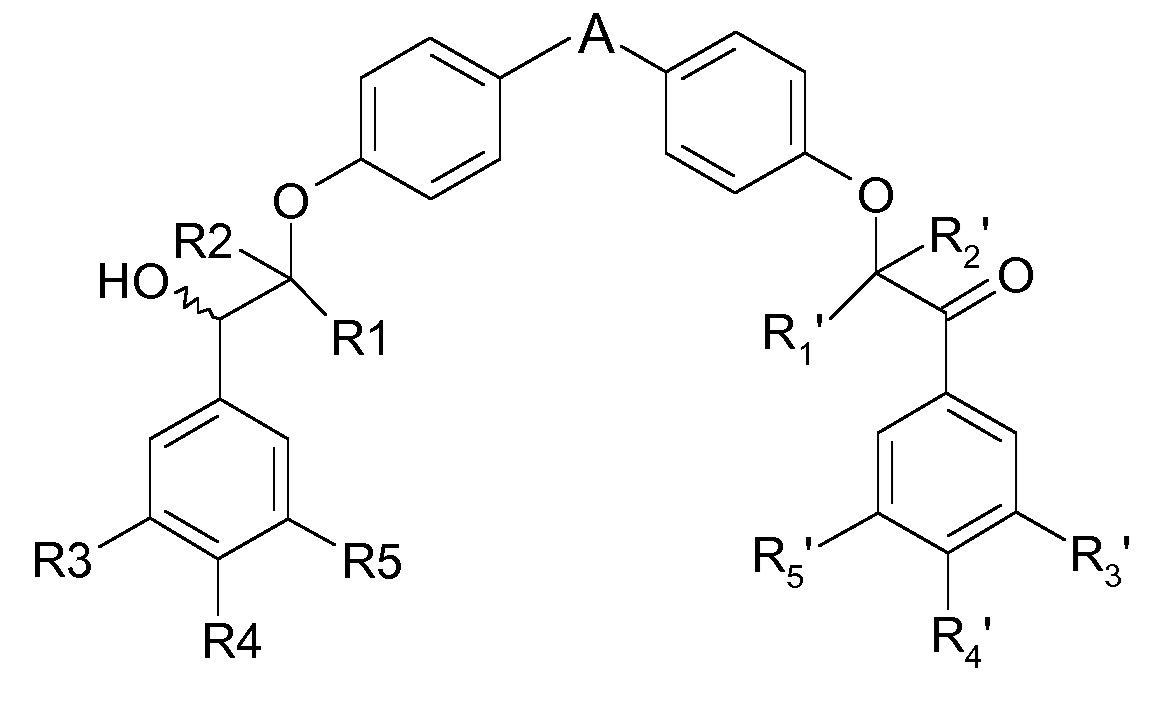
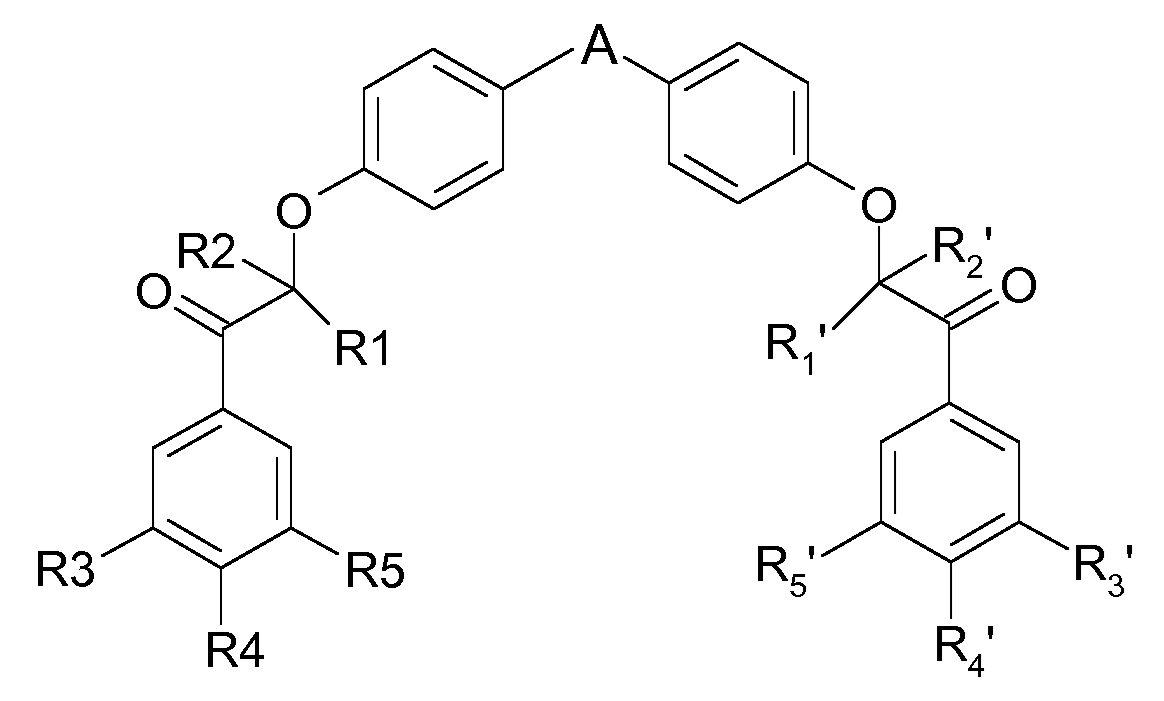
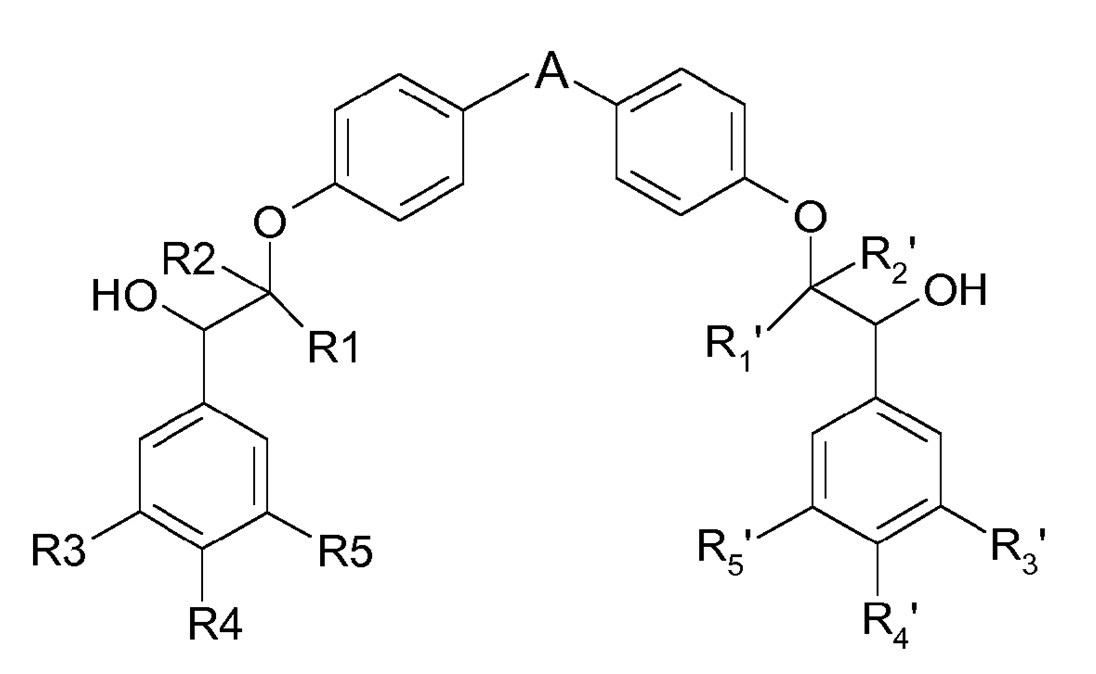
Первый путь синтеза начинается исходя из моно- или дизащищенного дифенола 1, у которого удаляют защитную группу у дифенола 2 с использованием классического и хорошо известного способа в зависимости от используемой защитной группы (Pg может представлять собой метил, Bn, ацетил, TBPS или Н). Дифенол 2 диалкилируют соответствующим бромкетоном 3. Образовавшийся в результате дикетон формулы (II) затем восстанавливают с использованием соответствующего восстанавливающего агента. В этом отношении для синтеза соединений формулы (I) могут быть использованы два метода:
- энантиоселективное восстановление дикетона формулы (II) может быть осуществлено с использованием соответствующего хирального катализатора 4a, 4b. Этот метод базируется на литературном методе (J. Org. Chem. 2009, 74, 4195-4202), но двойное восстановление дикетона формулы (II) осуществляют с целью получения хирального соединения формулы (I). Все виды энантиоселективного восстановления, описанные в примерах далее, осуществляют с использованием одного из 2 изомеров спироборана 4a и 4b в виде хирального катализатора восстановления. Эти синтезы осуществляют с использованием методов, уже описанных в литературе.

- рацемическое восстановление дикетона формулы (II) может быть осуществлено с использованием NaBH4 с целью получения рацемического соединения формулы (I).
Схема 2, предназначенная для соединений, имеющих заместитель A, отличающийся имидазола
С целью получения производных с различными заместителями на каждой стороне молекулы приведены два разных пути, позволяющие осуществить последовательное замещение фенола и создание асимметрических атомов углерода.
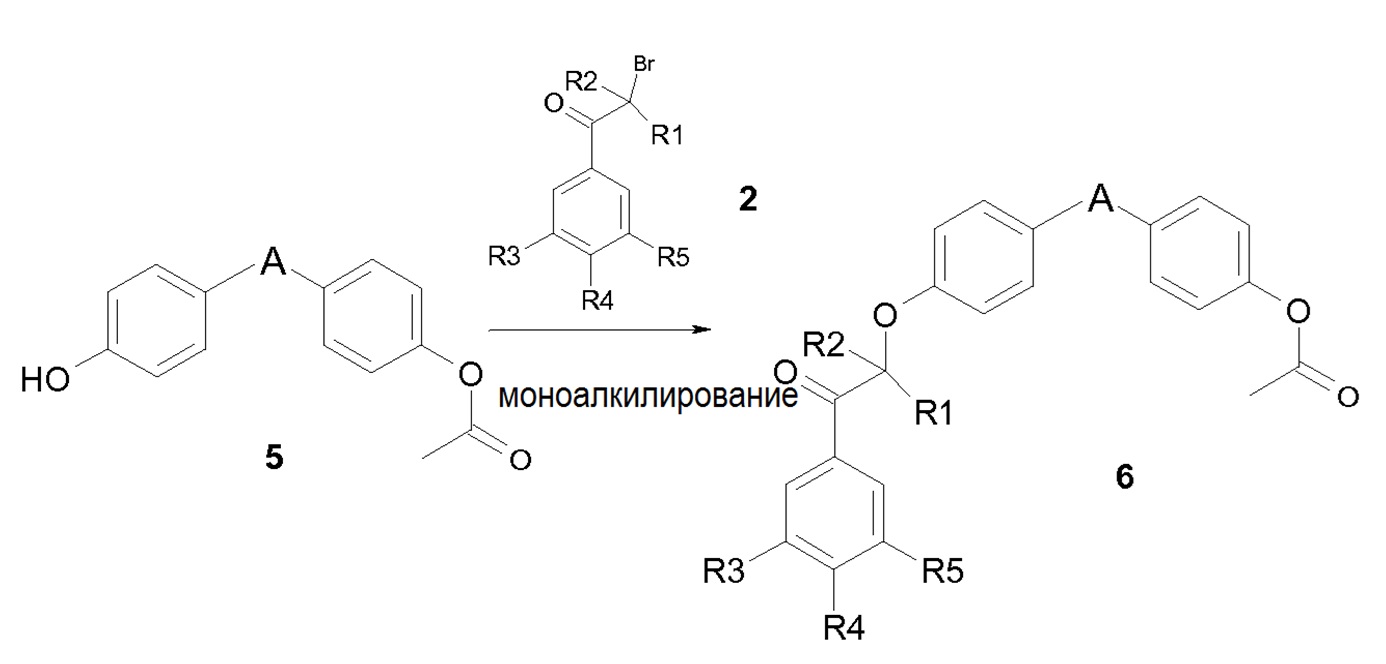
асимметрическое восстановление и удаление защиты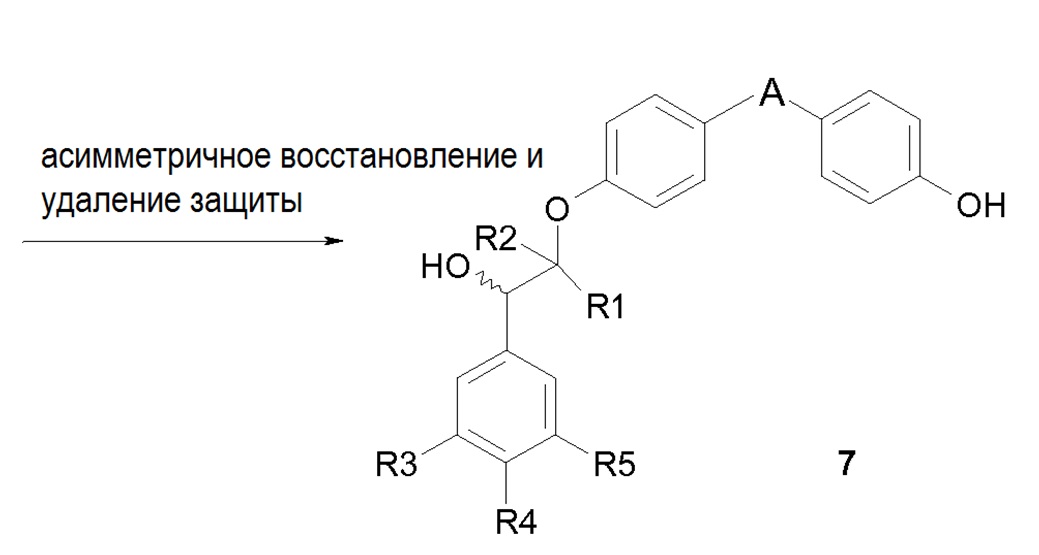
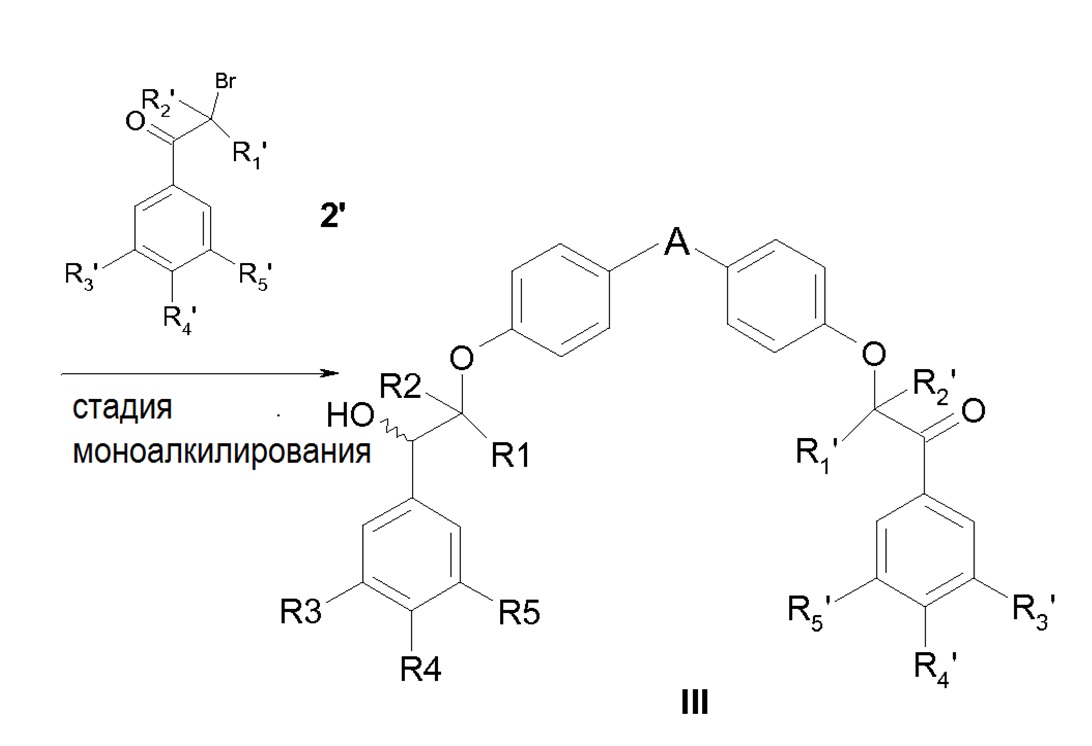
Исходя из моноацетата защищенного фенола 5, первой стадией схемы 2 является алкилирование в среде основания (например, K2CO3) соответствующим бромкетоном 2. Этот кетон 6 затем подвергают стадии асимметрического восстановления с восстанавливающим агентом, описанным ранее (4a или 4b на схеме 1), и удалению защитных групп также на той же стадии. Полученный фенол 7 затем подвергают алкилированию в среде основания (например, K2CO3) соответствующим бромкетоном 2, что приводит к соединению формулы (III), и затем осуществляют другую стадию восстановления, идентичную последней стадии восстановления, описанной на схеме 1, чтобы получить конечное соединение формулы (I).
Схема 3, предназначенная для соединений, имеющих имидазольный заместитель A
Соединения, в которых A=2,4-диарилимидазол, получают определенным путем с учетом реакционной способности имидазольного кольца.
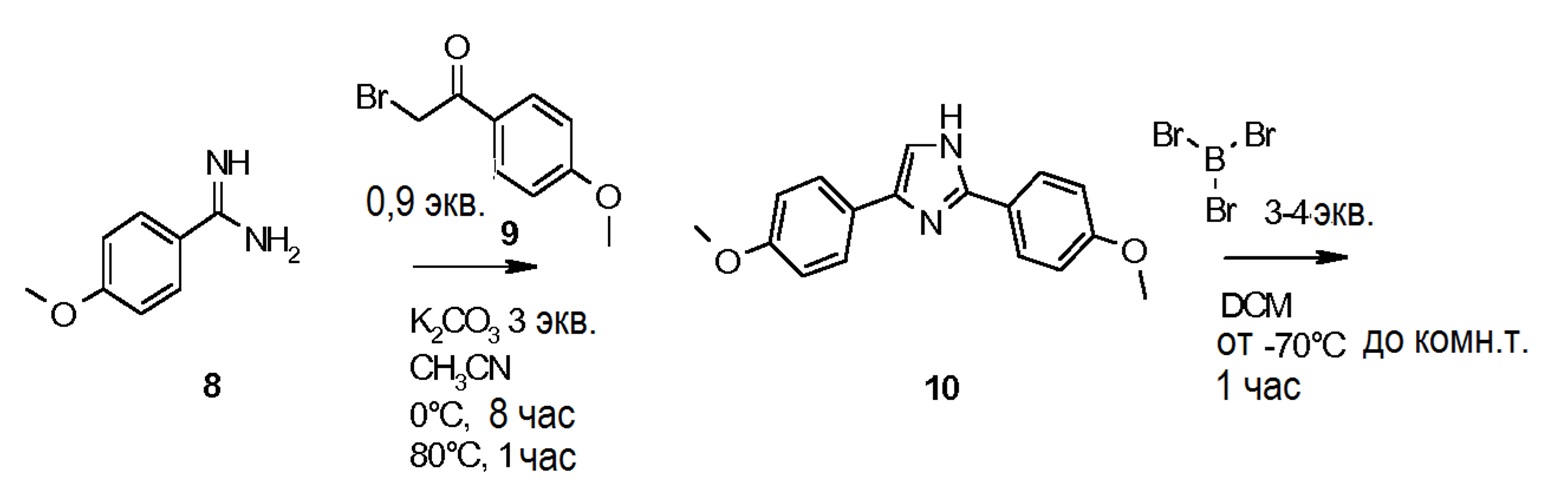
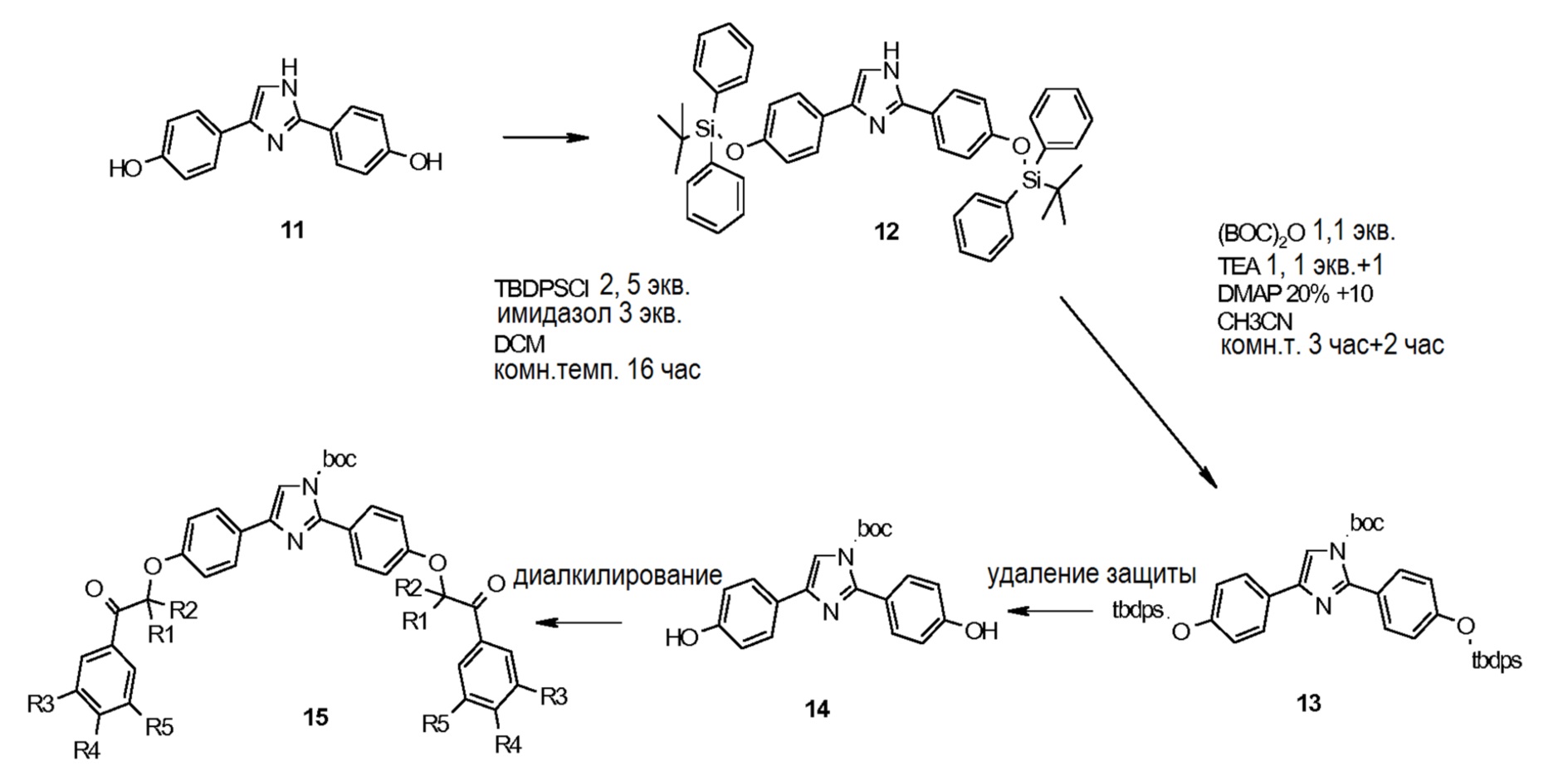
Коммерчески доступный амидин 8 подвергают циклизации в среде основания (K2CO3) с коммерчески доступным бромкетоном 9 с целью получения соединения 10. Удаление защитных групп у соединения 10 с получением дифенола 11 осуществляют с использований BBr3. Дифенол 11 затем защищают силильной защитной группой (соединение 12), и имидазольное кольцо защищают Boc группой (соединение 13). Удаление защитной силильной группы и алкилирование дифенола 14 дает дикетон формулы (II), который может быть восстановлен до соединения формулы (I) или алкилирован и затем восстановлен в условиях, идентичных последней стадии восстановления, описанной на схеме 1, для получения затем целевого соединения формулы (I).
СИНТЕЗ ГЕТЕРОЦИКЛИЧЕСКИХ ДИФЕНОЛЬНЫХ СОЕДИНЕНИЙ
ОБРАЗОВАНИЕ 2,4-ДИАРИЛОКСАЗОЛЬНОГО И 2,4-ДИАРИЛТИАЗОЛЬНОГО КОЛЕЦ
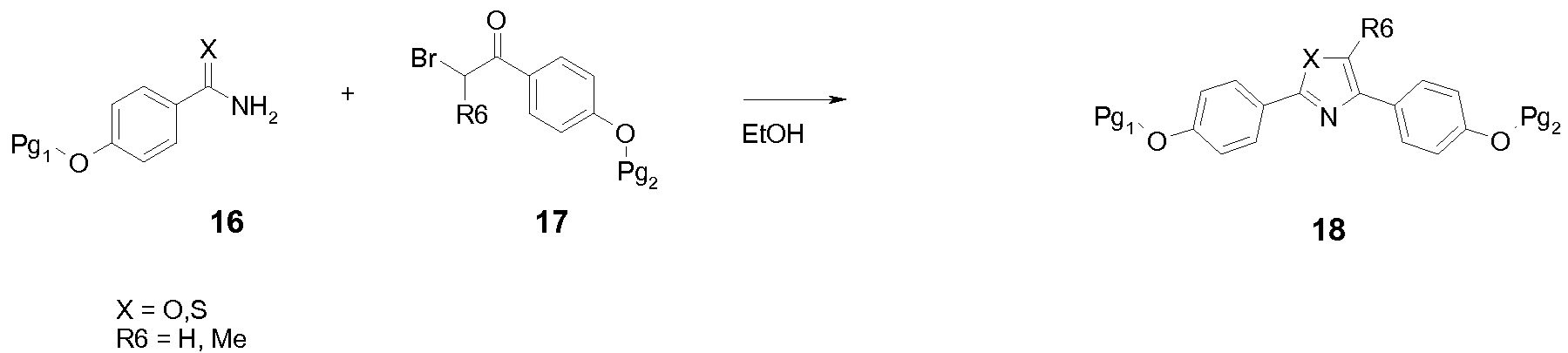
Коммерчески доступный замещенный амид или тиоамин 16 подвергают взаимодействию с бромкетоном 17 в соответствующих условиях для циклизации с получением производного оксазола или тиазола 18, и эти соединения могут быть использованы напрямую в качестве исходного вещества в общем синтезе целевых соединений формулы (I).
ОБРАЗОВАНИЕ 2,4-ДИАРИЛТИОФЕНОВОГО КОЛЬЦА
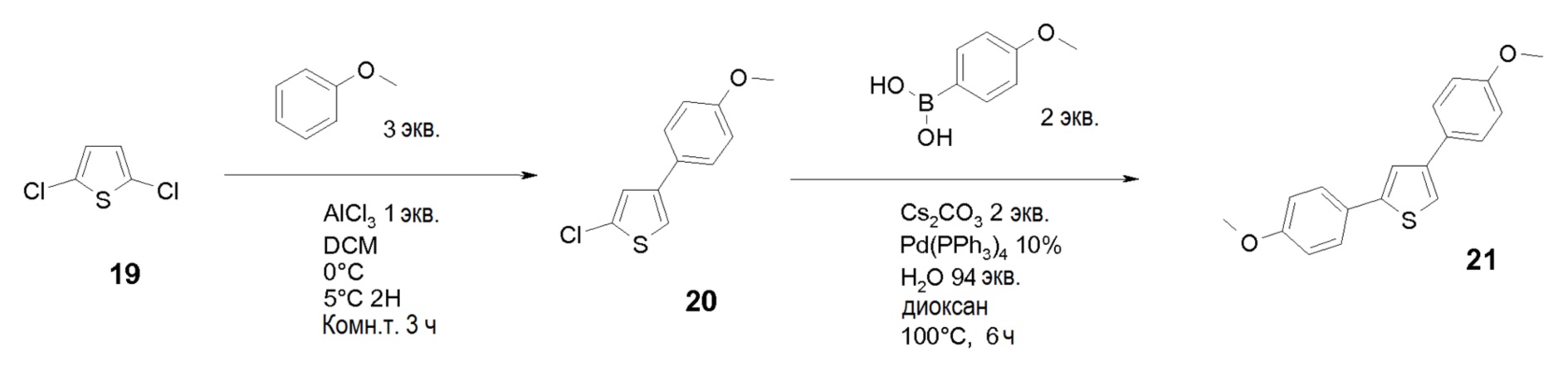
Коммерчески доступный дихлортиофен 19 подвергают взаимодействию с метоксифенилом в присутствии AlCl3 и получают 4-арил тиофен 20, который подвергают взаимодействию с бороновой кислотой путем реакции Сузуки с получением 2,4-диарилтиофена 21. Указанное соединение может быть использовано напрямую в качестве исходного вещества по схеме 1.
ОБРАЗОВАНИЕ 3,5-ДИАРИЛОКСАДИАЗОЛЬНОГО КОЛЬЦА
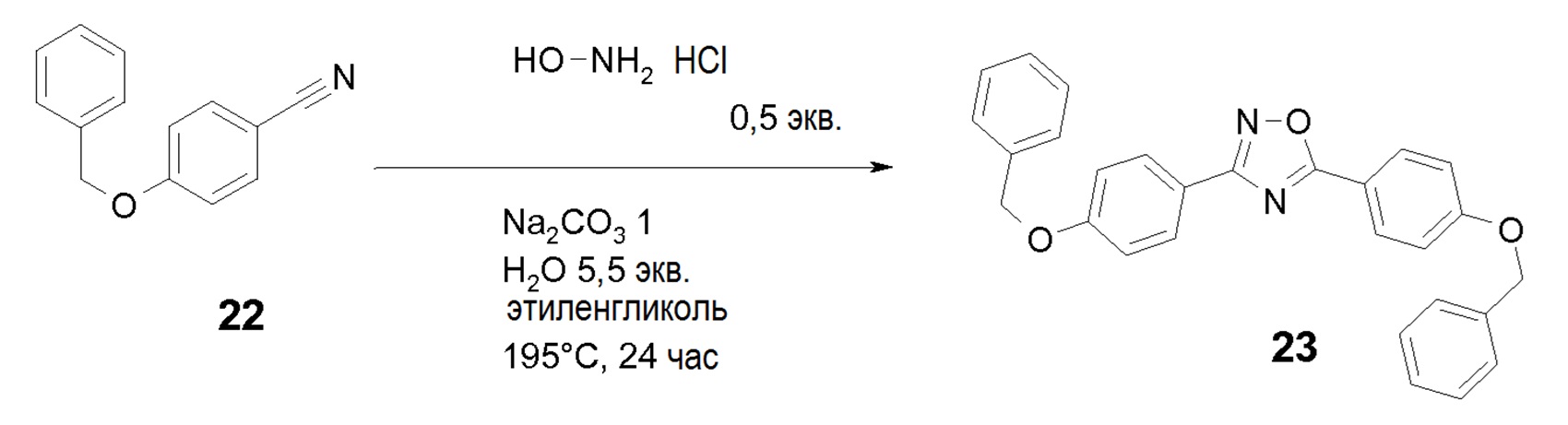
Соединение оксадиазола 23 получали с использованием реакции димеризации циано производного 22 в присутствии гидроксиламина, и указанное соединение может быть использовано напрямую в качестве исходного вещества по схеме 1.
ОБРАЗОВАНИЕ 2,5-ДИАРИЛОКСАЗОЛЬНОГО КОЛЬЦА
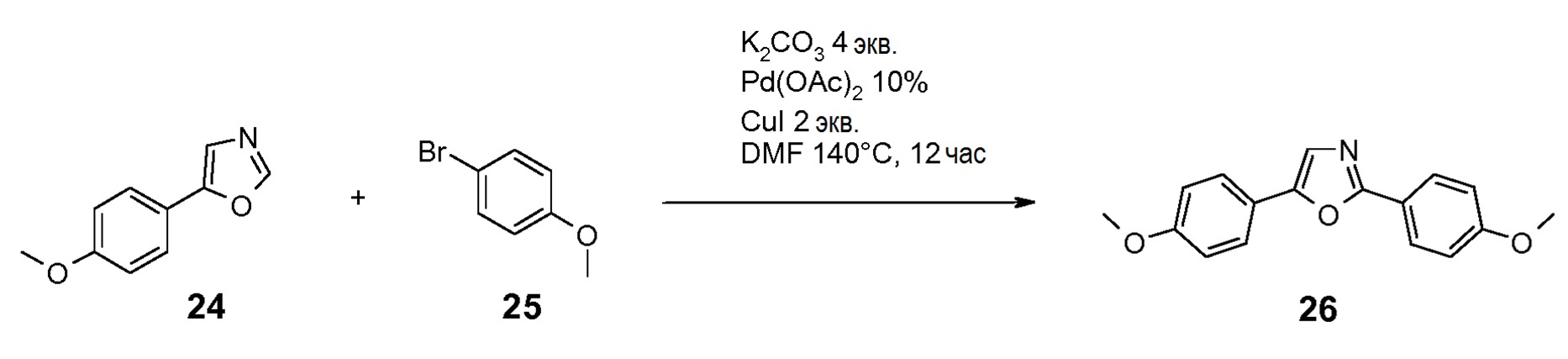
Соединение 26 получают реакцией конденсации на палладии соединения 24 с броманизолом 25 в присутствии CuI, и указанное соединение может быть использовано напрямую в качестве исходного вещества по схеме 1.
На схемах 1-3 исходные соединения и реагенты, когда способ, которым их получают, не описан, являются коммерчески доступными или описаны в литературе, или, более того, могут быть получены способами, которые описаны в настоящем документе, или способами, известными специалисту в данной области.
В других своих аспектах изобретение относится также к соединениям формул (II) и (III). Эти соединения могут быть использованы в качестве промежуточных соединений в синтезе соединений формулы (I).
Примеры
В следующих примерах описано получение некоторых соединений в соответствии с изобретением. Эти примеры не являются ограничительными, а просто иллюстрируют настоящее изобретение. Номера соединений по примерам соответствуют приведенным в таблице далее, в которой представлены химические структуры и физические свойства некоторых соединений в соответствии с изобретением.
Используются следующие сокращения и эмпирические формулы:
|
Метод хиральной ВЭЖХ, способный разделять соединения, осуществляли с использованием смеси изомеров, полученной в соответствии с рацемическим восстановлением по схеме 1 и затем использовали для определения хиральной УФ чистоты всех описанных соединений.
В примерах, описанных далее, использовались следующие аналитические методы:
Спектры протонного ядерного магнитного резонанса (1H ЯМР) регистрировали на спектрометрах Bruker (250, 400 и 500 МГц) в ДМСО-d6 или DCCl3. Химические сдвиги δ выражены в миллионных долях (м.д.). Для интерпретации спектров использовались следующие сокращения: с: синглет, д: дублет, т: триплет, кв: квадруплет, квин: квинтет, секст: секступлет, м: мультиплет, дд: дублет дублетов, шир.: широкий пик.
Различные методы ЖХ, УФ, МС, которые были использованы, подробно описаны далее.
Метод 1:
СЭЖХ 220 нм
Колонка Acquity UPLC BEH C18 (2,1×50 мм) 1,7 мкм
Элюент A=H2O+0,02%HCOOH.
Элюент B=CH3CN+0,02%HCOOH.
T°C: 55°C.
Градиент: t0 2% B, t4 мин 98% B, t4,5 мин 98% B, t4,6 мин 2% B, t5,0 мин 2% B.
Скорость потока=1 мл/мин
Метод 2:
ВЭЖХ 1100, полярный режим, УФ=220 нМ, колонка DAICEL Chiralpak IB (250 мм×4,6) 5 мкМ, 100% метанол, скорость потока 1 мл/мин, T=25°C, впрыскивание 10 мкл при 0,5 мг/мл MeOH
Метод 3:
ВЭЖХ 1100, полярный режим, УФ=210 нМ, колонка DAICEL Chiralpak IC (250 мм×4,6) 5 мкМ, 100% ацетонитрил, скорость потока 1 мл/мин, T=25°C, впрыскивание 10 мкл при 0,5 мг/мл MeOH
Метод 4:
ВЭЖХ Agilent 1100, УФ=210 нМ, колонка DAICEL Chiralpak OD-H (100 мм×4,6) 5 мкМ, 100% MeOH, скорость потока 0,8 мл/мин, T=25°C, впрыскивание 2 мкл при 0,5 мг/мл MeOH
Метод 5:
Прибор: Waters ВЭЖХ: Alliance 2695, УФ: PDA 996, МС: ZQ (simple Quad) ZQ2
Программное обеспечение: Masslynx OpenLynx
Условия ЖХ:
Колонка: Luna C18 (2)-HST Phenomenex (30×2 мм) 2,5 мкМ
Температура колонки: 50°C
Элюент A: H2O+0,05% ТФУ (об./об.)
Элюент B: CH3CN+0,035% ТФУ (об./об.)
Градиент: t0 0% B, t2,5 мин 100% B, t3,5 мин 100% B, t3,6 мин 0% B, t5 мин 0% B
Скорость потока: 1 мл/мин
Щель: 1/3 к источнику МС
Впрыскивание: 2 мкл
УФ-детекция: извлечение 220 нм
Условия МС:
Режим ионизации: электрораспыление положительное ES+
Капиллярное напряжение: 3,5 кВ
Напряжение на конусе: 30 В
Температура разрушения: 300°C
Температура источника: 130°C
Метод 6:
Прибор: Waters СЭЖХ: Acquity, УФ: Acquity PDA, МС: SQD (simple Quad) SQW
Программное обеспечение: Masslynx, OpenLynx
Условия ЖХ:
Колонка: BEH C18 Waters (50×2,1 мм) 1,7 мкМ
Температура колонки: 55°C
Элюент A: H2O+0,05% ТФУ (об./об.)
Элюент B: CH3CN+0,035% ТФУ(об./об.)
Градиент: t0 2% B, t2,4 мин 98% B, t3,0 мин 98% B, t3,03 мин 2% B, t3,5 мин 2% B
Скорость потока: 0,8 мл/мин
Впрыскивание: 0,3 мкл
УФ-детекция: извлечение 220 нм
Условия МС:
Режим ионизации: электрораспыление положительное ES+
Капиллярное напряжение: 3 кВ
Напряжение на конусе: 30 В
Температура разрушения: 500°C
Температура источника: 150°C
Примеры, осуществленные в соответствии со схемой 1
Пример 1: Синтез 2,4-бис-(4-гидроксифенил)тиазола
2,4-Бис-(4-метоксифенил)тиазол 1 (1 экв., 5 г, 16,81 ммоль) растворяли в 50 мл ДМФ, затем добавляли EtSNa (6 экв., 8,49 г, 100,88 ммоль) и перемешивали при комнатной температуре. Реакционную смесь нагревали при температуре 120°C в течение 12 час и затем охлаждали до комнатной температуры. Добавляли 200 мл AcOEt, и полученную суспензию фильтровали. Твердое вещество перемешивали с 200 мл AcOEt и 200 мл 1M раствора HCl в течение 16 час при комнатной температуре, затем суспензию фильтровали, и твердое вещество сушили при пониженном давлении с получением 3,5 г (77%-ный выход) 2,4-бис-(4-гидроксифенил)тиазола.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,20 (шир. с, 2Н) 7,84 (д, J=1,8 Гц, 2Н) 7,82 (д, J=1,8 Гц, 2Н) 7,76 (с, 1Н) 6,89 (д, J=8,7 Гц, 2Н) 6,84 (д, J=8,7 Гц, 2Н)
ЖХМС (метод 3): 100% (чистота при 210 нМ), Rt=5 мин
Пример 2: Синтез 1-(3,4-диметоксифенил)-2-[4-(4-{4-[2-(3,4-диметоксифенил)-2-оксо-этокси]фенил}тиазол-2-ил)-фенокси]этанона II-1
Дифенол, полученный в примере 1 (1 экв., 500 мг, 1,86 ммоль) растворяли в 10 мл ДМФ при комнатной температуре, добавляли K2CO3 (6 экв., 1,54 г, 11,16 ммоль) и 2-бром-1-(3,4-диметоксифенил)-этанон (1,16 г, 4,46 ммоль). Реакционную смесь перемешивали при комнатной температуре 16 час, затем фильтровали. Раствор упаривали при пониженном давлении. Твердое вещество затем растворяли в DCM и промывали насыщенным раствором Na2CO3, затем водой. Органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (элюент: гептан/AcOEt от 1/0 до 1/1) с получением после упаривания 228 мг II-1 (20%-ный выход).
1H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ м.д. 7,97 (д, J=8,3 Гц, 2Н) 7,91 (д, J=8,3 Гц, 2Н) 7,67 (т, J=6,0 Гц, 2Н) 7,58 (шир. с., 2Н) 7,28 (с, 1Н) 7,01 (д, J=8,3 Гц, 4Н) 6,93 (д, J=8,3 Гц, 2Н) 5,30 (с, 2Н) 5,27 (с, 2Н) 3,97 (с, 6Н) 3,95 (с, 6Н)
ЖХМС (метод 1): 91,4% (чистота при 220 нМ), Rt=2,64 мин, m/z=626,1
Пример 3: Синтез 1-(3,4-диметоксифенил)-2-[4-(4-{4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил}тиазол-2-ил)-фенокси]этанола (изомер 2), соединение I-23
Борановый катализатор 4a (33,3 мг, 0,1 ммоль) растворяли в 1 мл ТГФ, затем добавляли по каплям 0,34 мл (0,69 ммоль) 2M раствора BH3/Me2S, и реакционную смесь перемешивали 1 час при комнатной температуре. При температуре -20°C в атмосфере азота добавляли суспензию дикетона II-1, полученного в примере 2 (0,215 г, 0,34 ммоль), в 1,5 мл ТГФ. Реакционной смеси давали нагреться до комнатной температуры и перемешивали при этой температуре в течение 20 час. Добавляли 5 мл метанола и смесь концентрировали в вакууме. Добавляли 20 мл AcOEt, и смесь промывали 1M раствором HCl в воде (2×20 мл), 30 мл воды и 30 мл NaCl (насыщенный раствор) и затем сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (элюент: AcOEt/циклогексан от 15/85 до 1/1) с получением после упаривания 1-(3,4-диметоксифенил)-2-[4-(4-{4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил}тиазол-2-ил)-фенокси]этанола (соединение I-23).
Выход: 301 мг, 75%
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,94 (д, J=6,7 Гц, 2Н) 7,92 (д, J=6,7 Гц, 2Н) 7,90 (с, 1Н) 7,05-7,10 (м, 4Н) 7,02 (д, J=8,8 Гц, 2Н) 6,98 (дд, J=8,3, 1,4 Гц, 2Н) 6,93 (д, J=8,3 Гц, 2Н) 5,59 (д, J=4,5 Гц, 1Н) 5,56 (д, J=4,5 Гц, 1Н) 4,89 (квин, J=4,9 Гц, 2Н) 4,07 (д, J=5,8 Гц, 2Н) 4,04 (д, J=5,8 Гц, 2Н) 3,77 (с, 6Н) 3,74 (с, 6Н)
Хиральная хроматография (метод 3): 98,9% (чистота при 210 нМ), Rt=10,1 мин.
Пример 4: Синтез 1-(3,4-диметоксифенил)-2-[4-(4-{4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил}тиазол-2-ил)-фенокси]этанола (изомер 1), соединение I-24
Указанное соединение получали с использованием способа, описанного в примере 3 для соединения I-23, но используя 4b вместо 4a в качестве хирального катализирующего агента
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,94 (д, J=6,7 Гц, 2Н) 7,92 (д, J=6,7 Гц, 2Н) 7,90 (с, 1Н) 7,05-7,10 (м, 4Н) 7,02 (д, J=8,8 Гц, 2Н) 6,98 (дд, J=8,3, 1,4 Гц, 2Н) 6,93 (д, J=8,3 Гц, 2Н) 5,59 (д, J=4,5 Гц, 1Н) 5,56 (д, J=4,5 Гц, 1Н) 4,89 (квин, J=4,9 Гц, 2Н) 4,07 (д, J=5,8 Гц, 2Н) 4,04 (д, J=5,8 Гц, 2Н) 3,77 (с, 6Н) 3,74 (с, 6Н)
Хиральная хроматография (метод 3): 81,2% (чистота при 210 нМ), Rt=13,6 мин
Пример 5: Синтез 1-(3,4-диметоксифенил)-2-[4-(4-{4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил}тиазол-2-ил)-фенокси]этанола (изомер 1, 2, 3 и 4), соединение I-69
В суспензию дикетона II-1 (0,4 мг, 1 экв.) в 13 мл MeOH при комнатной температуре в атмосфере N2 добавляли NaBH4 (0,241 мг, 10 экв.). Через 3 дня добавляли 5 экв. NaBH4, и реакционную смесь перемешивали 24 час при комнатной температуре. Затем добавляли 10 мл 1н HCl, MeOH упаривали и добавляли DCM. Органический слой отделяли и промывали водой. После отделения органическую фазу сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (элюент: AcOEt/циклогексан от 15/85 до 1/1) с получением после упаривания 1-(3,4-диметоксифенил)-2-[4-(4-{4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил}тиазол-2-ил)-фенокси]этанола (соединение I-69).
Выход: 301 мг, 75%
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,92 (5Н) 6,91-7,10 (15Н) 5,56 (2Н) 4,89 (2Н) 4,06 (4Н) 3,77 (с, 6Н) 3,74 (с, 6Н)
Хиральная хроматография (метод 3):
изомер 1: 25,8% (чистота при 210 нМ), Rt=10,3 мин;
изомер 2: 24,5% (чистота при 210 нМ), Rt=11,5 мин;
изомер 3: 25,1% (чистота при 210 нМ), Rt=11,8 мин;
изомер 4: 24,6% (чистота при 210 нМ), Rt=13,6 мин.
Примеры, осуществленные в соответствии со схемой 2
Пример 6: Синтез 4-[2-(4-гидроксифенил)тиазол-4-ил]фенилового эфира уксусной кислоты
1,66 г 4-Гидрокситиобензамида (1 экв., 6,46 ммоль) и 0,99 г 4-(2-бром-ацетил)-фенилового эфира уксусной кислоты (1 экв., 6,46 ммоль) растворяли в 25 мл CH3CN и нагревали при кипячении с обратным холодильником в течение 1 час. После охлаждения до комнатной температуры в течение 2 час образовавшееся твердое вещество отфильтровали, промывали минимальным количеством EtOH и сушили в вакууме при температуре 40°C в течение ночи. Получали 1,99 г 4-[2-(4-гидроксифенил)тиазол-4-ил]фенилового эфира уксусной кислоты (99%-ный выход).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,29 (шир. с, 1Н) 8,06 (д, J=8,7 Гц, 2Н) 8,03 (с, 1Н) 7,86 (д, J=8,7 Гц, 2Н) 7,23 (д, J=8,7 Гц, 2Н) 6,90 (д, J=8,7 Гц, 2Н) 2,30 (с, 3Н)
ЖХУФ-МС: 99% (чистота при 220 нМ), Rt=2,24 мин, m/z=312 (метод 5)
Пример 7: Синтез 4-(2-{4-[2-(3,4-диметоксифенил)-2-оксо-этокси]фенил}тиазол-4-ил)-фенилового эфира уксусной кислоты
Фенол, полученный в примере 6 (1 экв., 1 г, 3,21 ммоль), растворяли в 16 мл ДМФ при комнатной температуре, добавляли K2CO3 (4 экв., 1,77 г, 12,85 ммоль) и 2-бром-1-(3,4-диметоксифенил)этанон (1,5 экв., 1,25 г, 4,82 ммоль). Реакционную смесь перемешивали при комнатной температуре 16 час, затем фильтровали. Раствор упаривали при пониженном давлении. Твердое вещество затем растворяли в DCM и промывали насыщенным раствором Na2CO3, затем водой. Органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (элюент: DCM/AcOEt от 1/0 до 96/4) с получением после упаривания 736 мг 4-(2-{4-[2-(3,4-диметоксифенил)-2-оксо-этокси]фенил}тиазол-4-ил)-фенилового эфира уксусной кислоты (47%-ный выход).
1H ЯМР (600 МГц, ДМСО-d6) δ м.д. 8,09 (с, 1Н) 8,08 (д, J=8,7 Гц, 2Н) 7,97 (д, J=8,8 Гц, 2Н) 7,76 (дд, J=8,5, 2,1 Гц, 1Н) 7,53 (д, J=2,1 Гц, 1Н) 7,25 (д, J=8,7 Гц, 2Н) 7,15 (д, J=8,5 Гц, 1Н) 7,12 (д, J=8,8 Гц, 2Н) 5,65 (с, 2Н) 3,89 (с, 3Н) 3,86 (с, 3Н) 2,31 (с, 3Н)
ЖХУФ-МС: 99% (чистота при 220 нМ), Rt=2,56 мин, m/z=489,9 (метод 5)
Пример 8: Синтез 4-(2-{4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил}тиазол-4-ил)-фенола (изомер 2)
1,86 мл 2M BH3-Me2S в ТГФ (4 экв., 3,72 ммоль) и 150,2 мг бороната 4a (0,5 экв., 0,464 ммоль) перемешивали вместе при комнатной температуре в атмосфере N2 в течение 30 мин. Смесь охлаждали до температуры 0°C, затем медленно добавляли кетон, полученный в примере 7 (1 экв., 455 мг, 0,929 ммоль), в суспензии в ТГФ. Реакционную смесь перемешивали 72 час при комнатной температуре. Реакционную смесь выливали в 20 мл MeOH, и смесь упаривали досуха. Добавляли 30 мл DCM, и этот органический слой промывали 1н HCl (20 мл). Водный слой отделяли и экстрагировали 2 раза по 10 мл DCM. Органические слои объединяли, сушили с помощью Na2SO4 и упаривали. Остаток очищали с помощью хроматографии на силикагеле (элюент: DCM/MeOH от 1/0 до 97/3) с получением после упаривания 362,8 мг (87%-ный выход) 4-(2-{4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил}тиазол-4-ил)-фенола.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,61 (с, 1Н) 7,92 (д, J=8,8 Гц, 2Н) 7,84 (д, J=8,7 Гц, 2Н) 7,80 (с, 1Н) 7,07 (д, J=8,8 Гц, 2Н) 7,07 (д, J=1,8 Гц, 1Н) 6,98 (дд, J=8,3, 1,8 Гц, 1Н) 6,93 (д, J=8,3 Гц, 1Н) 6,84 (д, J=8,7 Гц, 2Н) 5,59 (д, J=4,7 Гц, 1Н) 4,90 (кв, J=5,4 Гц, 1Н) 4,07 (д, J=5,8 Гц, 2Н) 3,77 (с, 3Н) 3,75 (с, 3Н)
Хиральная хроматография (метод 4): 93,5% (чистота при 210 нМ), Rt=3,9 мин.
Пример 9: Синтез 1-(3,4-диметоксифенил)-2-[4-(2-{4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил}тиазол-4-ил)-фенокси]этанона (изомер 2)
Фенол, полученный в примере 8 (1 экв., 360 мг, 0,8 ммоль), растворяли в 10 мл ДМФ при комнатной температуре, добавляли K2CO3 (4 экв., 442,7 мг, 3,2 ммоль) и 2-бром-1-(3,4-диметоксифенил)этанон (1,5 экв., 327,6 мг, 1,2 ммоль). Реакционную смесь перемешивали при комнатной температуре 16 часов, затем фильтровали. Раствор упаривали при пониженном давлении. Твердое вещество, затем растворяли в DCM и промывали насыщенным раствором Na2CO3, затем водой. Органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением после упаривания 500 мг 1-(3,4-диметоксифенил)-2-[4-(2-{4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил}тиазол-4-ил)-фенокси]этанона (соединение формулы (III), 99%-ный выход).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,89-7,98 (м, 5Н) 7,75 (дд, J=8,5, 1,9 Гц, 1Н) 7,51 (д, J=1,9 Гц, 1Н) 7,13 (д, J=8,5 Гц, 1Н) 7,06 (дд, J=13,1, 8,7 Гц, 5Н) 6,98 (дд, J=8,2, 1,7 Гц, 1Н) 6,93 (д, J=8,2 Гц, 1Н) 5,56-5,60 (м, 3Н) 4,90 (кв, J=5,4 Гц, 1Н) 4,07 (д, J=5,8 Гц, 2Н) 3,87 (с, 3Н) 3,84 (с, 3Н) 3,77 (с, 3Н) 3,75 (с, 3Н)
ЖХУФ-МС: 88% (чистота при 220 нМ), Rt=2,59 мин, m/z=628 (метод 5)
Хиральная хроматография (метод 3): 94% (чистота при 210 нМ), Rt=8,9 мин.
Пример 10: Синтез 1-(3,4-диметоксифенил)-2-[4-(4-{4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил}тиазол-2-ил)-фенокси]этанола (изомер 3) соединение I-61
Указанное соединение получали, используя общий способ асимметрического восстановления, описанный ранее. 60%-ный выход.
0,478 мл 2M BH3-Me2S в ТГФ (6 экв., 0,956 ммоль) и 46,34 мг бороната 4a (0,9 экв., 0,143 ммоль) перемешивали вместе при комнатной температуре в атмосфере N2 в течение 15 мин. Смесь охлаждали до температуры -20°C, затем медленно добавляли раствор в ТГФ кетона формулы (III), полученного в примере 9 (1 экв., 100 мг, 0,159 ммоль). Реакционную смесь перемешивали 16 час при комнатной температуре. Реакционную смесь выливали в 15 мл MeOH, и смесь упаривали досуха. Добавляли 30 мл DCM, и этот органический слой промывали 1н HCl (20 мл). Водный слой отделяли и экстрагировали 2 раза по 10 мл DCM. Органические слои объединяли, сушили с помощью Na2SO4 и упаривали. Остаток очищали с помощью хроматографии на силикагеле (элюент: DCM/MeOH от 1/0 до 97/3) с получением после упаривания 59,9 мг (60%-ный выход) 1-(3,4-диметоксифенил)-2-[4-(4-{4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил}тиазол-2-ил)-фенокси]этанола (соединение I-61).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,94 (д, J=6,7 Гц, 2Н) 7,92 (д, J=6,7 Гц, 2Н) 7,90 (с, 1Н) 7,05-7,11 (м, 4Н) 7,02 (д, J=8,8 Гц, 2Н) 6,98 (дд, J=8,3, 1,0 Гц, 2Н) 6,93 (д, J=8,3 Гц, 2Н) 5,59 (д, J=4,7 Гц, 1Н) 5,56 (д, J=4,7 Гц, 1Н) 4,89 (квин, J=5,0 Гц, 2Н) 4,07 (д, J=5,8 Гц, 2Н) 4,04 (д, J=5,8 Гц, 2Н) 3,77 (с, 6Н) 3,75 (с, 6Н)
ЖХУФ-МС: 98% (чистота при 220 нМ), Rt=2,39 мин, m/z=630 (метод 1)
Хиральная хроматография (метод 2): 88,2% (чистота при 210 нМ), Rt=22,7 мин.
Пример 11: Синтез 1-(3,4-диметоксифенил)-2-[4-(4-{4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил}тиазол-2-ил)-фенокси]этанола (изомер 3) I-62
Некоторые реакции (второй путь синтеза: схема 2) осуществляли как в примере 10, однако энантиоселективное восстановление осуществляли с боронатом 4b вместо 4a с целью получения другого энантиомера (изомер 3) соединения I-62.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,94 (д, J=6,7 Гц, 2Н) 7,92 (д, J=6,7 Гц, 2Н) 7,90 (с, 1Н) 7,05-7,11 (м, 4Н) 7,02 (д, J=8,8 Гц, 2Н) 6,98 (дд, J=8,3, 1,0 Гц, 2Н) 6,93 (д, J=8,3 Гц, 2Н) 5,59 (д, J=4,7 Гц, 1Н) 5,56 (д, J=4,7 Гц, 1Н) 4,89 (квин, J=5,0 Гц, 2Н) 4,07 (д, J=5,8 Гц, 2Н) 4,04 (д, J=5,8 Гц, 2Н) 3,77 (с, 6Н) 3,75 (с, 6Н)
ЖХУФ-МС: 99,4% (чистота при 220 нМ), Rt=2,39 мин, m/z=630 (метод 1)
Хиральная хроматография (метод 2): 81,5% (чистота при 220 нМ), Rt=21 мин.
Примеры, осуществленные в соответствии со схемой 3
Пример 12: Синтез 2,4-бис-(4-метоксифенил)-1H-имидазола 10
В суспензию коммерчески доступного 4-метокситиобензамида 8 (1 экв., 9,1 г, 60,59 ммоль) в 200 мл ацетонитрила добавляли 25 г K2CO3 (3 экв., 181,78 ммоль) и при температуре 0°C 12,49 г бром-1-(4-метоксифенил)этанона 9 (0,9 экв., 54,53 ммоль). Смесь перемешивали при температуре 0°C в течение 8 час, затем нагревали до комнатной температуры в течение ночи. Реакционную смесь нагревали при температуре 80°C в течение 1 час, охлаждали до комнатной температуры и фильтровали. Твердое вещество промывали ацетонитрилом, затем растирали в воде и фильтровали с получением 12,6 г 2,4-бис-(4-метоксифенил)-1H-имидазола (74%-ный выход).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,35 (шир. с., 0,7Н) 12,22 (шир. с, 0,3Н) 7,95 (д, J=8,8 Гц, 2Н) 7,76 (д, J=8,0 Гц, 1,4Н) 7,68 (шир. с, 0,6Н) 7,56 (с, 0,7Н) 7,28 (шир. с., 0,3Н) 7,03 (д, J=8,8 Гц, 2Н) 6,94 (д, J=8,0 Гц, 2Н) 3,81 (с, 3Н) 3,77 (с, 3Н) (2 таутомерные формы 70/30)
ЖХУФ-МС: Rt=1,64 мин, m/z=281 (метод 5)
Пример 13: Синтез 2,4-бис-(4-гидроксифенил)-1H-имидазола 11
В суспензию 2,4-бис-(4-метоксифенил)-1H-имидазола (1 экв., 1 г, 3,57 ммоль) в DCM (90 мл) при температуре -70°C медленно добавляли 10,7 мл BBr3 (3 экв., 10,7 ммоль). Раствор нагревали до комнатной температуры и перемешивали 1 час. Смесь охлаждали до -70°C и добавляли воду (100 мл). При комнатной температуре добавляли этилацетат и насыщенный раствор NaHCO3, затем отделенный органический слой промывали водой и насыщенным солевым раствором, потом сушили с помощью Na2SO4, фильтровали и концентрировали в вакууме. Получали 0,8 г 2,4-бис-(4-гидроксифенил)-1H-имидазола (89%-ный выход).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,17 (шир. с., 0,7Н) 12,07 (шир. с., 0,3Н) 9,61 (шир. с., 0,7Н) 9,47 (шир. с., 0,3Н) 9,26 (шир. с., 1Н) 7,81-7,85 (м, 0,6Н) 7,78 (д, J=8,6 Гц, 1,4Н) 7,62 (д, J=8,3 Гц, 1,4Н) 7,51-7,58 (м, 0,6Н) 7,43 (с, 0,7Н) 7,17 (шир. с., 0,3Н) 6,82 (д, J=8,6 Гц, 2Н) 6,75 (д, J=8,3 Гц, 2Н) (2 таутомерные формы 70/30)
ЖХУФ-МС: Rt=1,4 мин, m/z=253 (метод 5)
Пример 14: Синтез 2,4-бис-[4-(трет-бутилдифенил-силанилокси)фенил]-1H-имидазола 12
В суспензию 2,4-бис-(4-гидроксифенил)-1H-имидазола (1 экв., 1 г, 3,96 ммоль) в DCM добавляли 0,809 г имидазола (3 экв., 11,89 ммоль) и 2,63 мл TBDPSiCl (2,5 экв., 9,91 ммоль). Смесь перемешивали при комнатной температуре в течение 16 час, затем фильтровали. Фильтрат промывали насыщенным раствором NaHCO3, водой и насыщенным солевым раствором, затем сушили с помощью Na2SO4, фильтровали и концентрировали в вакууме. Твердое вещество растирали в MeOH, фильтровали, и твердое вещество промывали MeOH, затем сушили в вакууме при температуре 50°C. Получали 1,86 г 2,4-бис-[4-(трет-бутил-дифенил-силанилокси)-фенил]-1H-имидазола (64%-ный выход).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,26 (с, 0,7Н) 12,11 (с, 0,3Н) 7,66-7,72 (м, 10Н) 7,56 (д, J=8,6 Гц, 2Н) 7,41-7,52 (м, 13Н) 6,79 (д, J=8,7 Гц, 2Н) 6,72 (д, J=8,6 Гц, 2Н) 1,06 (с, 9Н) 1,06 (с, 9Н) (2 таутомерные формы 70/30)
ЖХУФ-МС: Rt=2,91 мин, m/z=729 (метод 5)
Пример 15: Синтез трет-бутилового эфира 2,4-бис-[4-(трет-бутил-дифенил-силанилокси)-фенил]-имидазол-1-карбоновой кислоты 13
В суспензию 2,4-бис-[4-(трет-бутил-дифенил-силанилокси)-фенил]-1H-имидазола (1 экв., 1,3 г, 1,82 ммоль) в 25 мл ацетонитрила добавляли при комнатной температуре триэтиламин (1,1 экв., 280 мкл, 2 ммоль), (Boc)2O (2 экв., 0,82 г, 3,64 ммоль) и DMAP (0,2 экв., 44,5 мг, 0,36 ммоль). Смесь перемешивали 4 час, затем фильтровали, и твердое вещество промывали ацетонитрилом. Твердое вещество сушили в вакууме при температуре 50°C. Получали трет-бутиловый эфир 2,4-бис-[4-(трет-бутил-дифенил-силанилокси)-фенил]-имидазол-1-карбоновой кислоты с 41%-ным выходом.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,88 (с, 1Н) 7,65-7,73 (м, 8Н) 7,61 (д, J=8,6 Гц, 2Н) 7,40-7,53 (м, 12Н) 7,34 (д, J=8,6 Гц, 2Н) 6,78 (д, J=8,7 Гц, 2Н) 6,74 (д, J=8,7 Гц, 2Н) 1,30 (с, 9Н) 1,06 (с, 9Н) 1,05 (с, 9Н)
ЖХУФ-МС: Rt=2,66 мин, m/z=829 (метод 6)
Пример 16: Синтез трет-бутилового эфира 2,4-бис-(4-гидроксифенил)-имидазол-1-карбоновой кислоты 14
трет-Бутиловый эфир 2,4-бис-[4-(трет-бутил-дифенил-силанилокси)-фенил]-имидазол-1-карбоновой кислоты, полученный в примере 15 (1 экв., 1,09 г, 1,31 ммоль), растворяли в 20 мл ТГФ при температуре 0°C, затем добавляли 2,63 мл TBAF (2 экв., 2,63 ммоль), и реакционную смесь перемешивали при температуре 0°C 4 час. Добавляли этилацетат и насыщенный раствор NaHCO3, затем отделенный органический слой промывали водой и насыщенным солевым раствором, потом сушили с помощью Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью хроматографии на силикагеле (элюент: CH2Cl2/MeOH от 98/2 до 90/10) с получением после упаривания с 72%-ным выходом.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,73 (шир. с., 1Н) 9,47 (шир. с., 1Н) 7,85 (с, 1Н) 7,68 (д, J=8,7 Гц, 2Н) 7,40 (д, J=8,6 Гц, 2Н) 6,82 (д, J=8,7 Гц, 2Н) 6,78 (д, J=8,6 Гц, 2Н) 1,41 (с, 9Н)
ЖХУФ-МС: Rt=1,85 мин, m/z=353 (метод 5)
Пример 17: Синтез трет-бутилового эфира 2,4-бис-{4-[2-(3,4-диметоксифенил)-2-оксо-этокси]фенил}-имидазол-1-карбоновой кислоты 15
Дифенол, полученный в примере 16 (1 экв., 450 мг, 1,28 ммоль), растворяли в 10 мл ДМФ при комнатной температуре, добавляли K2CO3 (6 экв., 1,06 г, 7,66 ммоль) и 2-бром-1-(3,4-диметоксифенил)-этанон (4 экв., 1,32 г, 5,11 ммоль). Реакционную смесь перемешивали при комнатной температуре 16 час, затем фильтровали. Раствор упаривали при пониженном давлении. Твердое вещество далее растворяли в DCM и промывали насыщенным раствором Na2CO3, затем водой. Органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (элюент: гептан/AcOEt от 1/0 до 1/1) с получением после упаривания трет-бутилового эфира 2,4-бис-{4-[2-(3,4-диметоксифенил)-2-оксо-этокси]фенил}-имидазол-1-карбоновой кислоты с 66%-ным выходом.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,98 (с, 1Н) 7,79 (д, J=8,9 Гц, 2Н) 7,74-7,77 (м, 1Н) 7,72-7,74 (м, 1Н) 7,49-7,54 (м, 4Н) 7,12 (д, J=8,6 Гц, 1Н) 7,12 (д, J=8,5 Гц, 2Н) 7,03 (д, J=8,8 Гц, 2Н) 6,99 (д, J=8,9 Гц, 2Н) 5,60 (с, 2Н) 5,55 (с, 2Н) 3,88 (с, 3Н) 3,87 (с, 3Н) 3,85 (с, 3Н) 3,84 (с, 3Н) 1,41 (с, 9Н)
ЖХУФ-МС: Rt=2,46 мин, m/z=709 (метод 5)
Пример 18: Синтез 1-(3,4-диметоксифенил)-2-[4-(4-{4-[2-(3,4-диметоксифенил)-2-оксо-этокси]фенил}-1H-имидазол-2-ил)-фенокси]этанона
Boc-защищенный дикетон 15 (1 экв., 0,55 г, 0,78 ммоль) растворяли в 2 мл DCM, затем добавляли 3,88 мл 4н раствора HCl в диоксане (20 экв., 15,52 ммоль). Смесь нагревали при температуре 60°C в течение 2 час, затем охлаждали до комнатной температуры и фильтровали. Добавляли этилацетат и насыщенный раствор NaHCO3, и суспензию фильтровали. Твердое вещество промывали водой и сушили в вакууме при температуре 50°C. Получали 1-(3,4-диметоксифенил)-2-[4-(4-{4-[2-(3,4-диметоксифенил)-2-оксо-этокси]-фенил}-1H-имидазол-2-ил)-фенокси]этанон (соединение формулы (II)) с 79%-ным выходом.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 14,64 (шир. с, 2Н) 8,15 (д, J=9,0 Гц, 2Н) 8,10 (с, 1Н) 7,89 (д, J=8,7 Гц, 2Н) 7,74 (дд, J=8,4, 1,9 Гц, 2Н) 7,50 (д, J=1,9 Гц, 2Н) 7,25 (д, J=9,0 Гц, 2Н) 7,14 (д, J=8,7 Гц, 2Н) 7,13 (д, J=8,4 Гц, 2Н) 5,72 (с, 2Н) 5,63 (с, 2Н) 3,88 (с, 6Н) 3,85 (с, 6Н)
ЖХУФ-МС: Rt=1,97 мин, m/z=609 (метод 5)
Пример 19: Синтез 1-(3,4-диметоксифенил)-2-[4-(2-{4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил}-1H-имидазол-4-ил)-фенокси]этанола (изомер 1, 2, 3 и 4), соединение I-53
В суспензию дикетона, полученного в примере 18 (1 экв., 0,15 мг, 0,25 ммоль), в MeOH при комнатной температуре в атмосфере N2 добавляли 12 мл NaBH4 (10 экв., 0,093 мг, 2,46 ммоль). Через 16 час при комнатной температуре затем добавляли 5 мл 1н HCl, MeOH упаривали и добавляли 15 мл DCM. Органический слой отделяли и промывали водой. После отделения органическую фазу сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (элюент: DCM/MeOH от 1/0 до 95/5) с получением после упаривания 54 мг 1-(3,4-диметоксифенил)-2-[4-(2-{4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил}-1H-имидазол-4-ил)-фенокси]этанола (соединение I-53).
Выход: 36%
1H ЯМР (400 МГц, ДМСО-d6) (форма 2 таутомеров) δ м.д. 12,34 (с, 0,75H) 12,23 (с, 0,25H) 7,94 (д, J=8,8 Гц, 0,5Н) 7,89 (д, J=8,8 Гц, 1,5Н) 7,74 (д, J=8,7 Гц, 1,5Н) 7,66 (д, J=8,7 Гц, 0,5Н) 7,55 (с, 0,75Н) 7,28 (с, 0,25Н) 7,08-7,05 (м, 2Н) 7,02 (д, J=8,8 Гц, 2Н) 6,95-7,00 (м, 2Н) 6,91-6,95 (м, 4Н) 5,56 (д, J=4,7 Гц, 1,5H) 5,53 (д, J=4,7 Гц, 0,5Н) 4,88 (квин, J=5,4 Гц, 2Н) 4,04 (д, J=5,9 Гц, 2Н) 4,01 (д, J=5,9 Гц, 2Н) 3,77 (с, 6Н) 3,75 (с, 6Н)
ЖХУФ-МС: 95,6% (чистота при 210), Rt=1,42 мин, m/z=613 (метод 2)
Хиральная хроматография (метод 2):
изомеры 1: 23,7% (чистота при 210 нМ), Rt=11,5 мин;
изомер 2+3: 49,6% (чистота при 210 нМ), Rt=13,6 мин;
изомер 4: 26,7% (чистота при 210 нМ), Rt=16,1 мин.
Пример 20: Синтез 1-(3,4-диметоксифенил)-2-[4-(4-{4-[2-(3,4-диметоксифенил)-2-оксо-этокси]фенил}-1-метил-1H-имидазол-2-ил)-фенокси]этанона
К раствору 1-(3,4-диметоксифенил)-2-[4-(4-{4-[2-(3,4-диметоксифенил)-2-оксо-этокси]фенил}-1H-имидазол-2-ил)-фенокси]этанона, полученного в примере 18 (1 экв.), растворенного в ДМФ, добавляли при комнатной температуре 4 экв. K2CO3. Суспензию перемешивали 10 мин, затем добавляли соответствующее галогеналкил производное (3 экв.), и смесь нагревали при температуре 50-100°C в течение 2 час, охлаждали до комнатной температуры 16 час, затем нагревали при температуре 50-100°C в течение 4 час. В реакционную смесь добавляли воду и этилацетат, и водную фазу экстрагировали этилацетатом. Органические слои объединяли и экстрагировали водой и насыщенным солевым раствором, затем сушили с помощью Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью хроматографии на силикагеле (элюент: CH2Cl2/MeOH от 100/0 до 95/5) с получением после упаривания 1-(3,4-диметоксифенил)-2-[4-(4-{4-[2-(3,4-диметоксифенил)-2-оксо-этокси]фенил}-1-метил-1H-имидазол-2-ил)-фенокси]этанона (соединение формулы (II)).
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,71-7,77 (м, 2Н) 7,67 (д, J=8,7 Гц, 2Н) 7,64 (д, J=8,7 Гц, 2Н) 7,57 (с, 1Н) 7,52 (д, J=1,9 Гц, 1Н) 7,50 (д, J=1,9 Гц, 1Н) 7,13 (д, J=4,8 Гц, 1Н) 7,11 (д, J=4,8 Гц, 1Н) 7,07 (д, J=8,8 Гц, 2Н) 6,95 (д, J=8,8 Гц, 2Н) 5,60 (с, 2Н) 5,51 (с, 2Н) 3,87 (с, 3Н) 3,87 (с, 3Н) 3,85 (с, 3Н) 3,84 (с, 3Н) 3,73 (с, 3Н)
ЖХУФ-МС: 99,3% (УФ чистота при 220 нМ), Rt=1,45 мин, m/z=627 (метод 1)
Пример 21: Синтез 1-(3,4-диметоксифенил)-2-[4-(4-{4-[2-(3,4-диметоксифенил)-2-гидроксиэтокси]фенил}-1-метил-1H-имидазол-2-ил)-фенокси]этанола, соединение I-58
Применяли способ восстановления по пути 1 с использованием NaBH4 для получения I-58 в виде рацемической смеси, исходя из 1-(3,4-диметоксифенил)-2-[4-(4-{4-[2-(3,4-диметоксифенил)-2-оксо-этокси]фенил}-1-метил-1H-имидазол-2-ил)-фенокси]этанона
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,67 (д, J=8,7 Гц, 2Н) 7,63 (д, J=8,7 Гц, 2Н) 7,54 (с, 1Н) 7,02-7,09 (м, 4Н) 6,89-7,00 (м, 6Н) 5,57 (д, J=4,7 Гц, 1Н) 5,52 (д, J=4,5 Гц, 1Н) 4,82-4,92 (м, 2Н) 4,06 (д, J=5,8 Гц, 2Н) 4,00 (д, J=5,8 Гц, 2Н) 3,77 (с, 3Н) 3,77 (с, 3Н) 3,75 (с, 3Н) 3,74 (с, 3Н) 3,72 (с, 3Н)
ЖХУФ-МС: 99,3% (чистота при 220 нМ), Rt=1,45 мин, m/z=627 (метод 1)
Хиральная хроматография (метод 2):
изомер 1: 24,6% (чистота при 210 нМ), Rt=12,1 мин;
изомер 2: 25,3% (чистота при 210 нМ), Rt=13,3 мин;
изомер 3: 24,6% (чистота при 210 нМ), Rt=15,3 мин;
изомер 4: 25,5% (чистота при 210 нМ), Rt=16,9 мин.
Получение гетероциклов
Пример 22: Синтез 2,4-бис-(4-метоксифенил)тиазола
5 г 4-Метокситиобензамида (1 экв., 29,9 ммоль) и 6,85 г 2-бром-1-(4-метоксифенил)-этанона (1 экв., 29,9 ммоль) растворяли в 40 мл EtOH и нагревали при кипячении с обратным холодильником в течение 2 час. После охлаждения до комнатной температуры в течение 2 час образовавшееся твердое вещество отфильтровали, промывали минимальным количеством EtOH и сушили в вакууме при температуре 40°C в течение ночи. Получали 7,32 г соединения 2,4-бис-(4-метоксифенил)тиазола (82%-ный выход).
1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 7,97 (д, J=8,8 Гц, 2Н) 7,96 (д, J=8,8 Гц, 2Н) 7,91 (с, 1Н) 7,08 (д, J=8,8 Гц, 2Н) 7,03 (д, J=8,8 Гц, 2Н) 3,84 (с, 3Н) 3,81 (с, 3Н)
ЖХУФ-МС: Rt=6,57 мин, m/z=298, UV (220) чистота=97,7% (способ 5)
Пример 23: Синтез 3-хлор-4-(4-метоксифенил)тиофена 20
10,68 мл Дихлортиофена 19 (1 экв., 98,62 ммоль) растворяли в 50 мл DCM, затем добавляли 32,32 мл метоксибензола (3 экв., 295,86 ммоль) и перемешивали при температуре 0°C. При этой температуре порциями добавляли 12,49 г AlCl3 (0,95 экв., 93,69 ммоль), и смесь перемешивали при температуре 5°C в течение 1 час, затем нагревали до комнатной температуры в течение 4 час. Реакционную смесь выливали в смесь вода/лед и экстрагировали DCM. Органические слои объединяли и промывали 5%-ным раствором NaHCO3 в воде, водой и насыщенным солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (элюент: AcOEt/гептан от 0/1 до 3/7) с получением после упаривания 8,83 г 3-хлор-4-(4-метоксифенил)тиофена (40%-ный выход).
1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 7,63 (д, J=8,8 Гц, 2Н) 7,63 (д, J=1,8 Гц, 1Н) 7,57 (д, J=1,8 Гц, 1Н) 6,97 (д, J=8,8 Гц, 2Н) 3,78 (с, 3Н)
ЖХУФ-МС: Rt=2,64 мин, m/z=225 (способ 5)
Пример 24: Синтез 2,4-бис-(4-метоксифенил)тиофена 21
В герметически закрытой пробирке 3,33 г 3-хлор-4-(4-метоксифенил)тиофена, полученного в примере 23 (1 экв., 14,84 ммоль), растворяли в 50 мл диоксана, затем при комнатной температуре добавляли 4,51 г 4-метоксифенилбороновой кислоты (2 экв., 29,68 ммоль), 25 мл H2O (93,5 экв., 1387,7 ммоль) и 9,67 г Cs2CO3 (2 экв., 29,68 ммоль). Смесь нагревали в атмосфере Ar при температуре 100°C в течение 6 час и охлаждали 18 час до комнатной температуры. Выпавший осадок фильтровали и промывали AcOEt, H2O и MeOH. Твердое вещество сушили в течение ночи в вакууме при температуре 50°C с получением 3г 2,4-бис-(4-метоксифенил)тиофена (68%-ный выход).
1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 7,79 (д, J=1,5 Гц, 1Н) 7,70 (д, J=8,9 Гц, 2Н) 7,65 (д, J=8,9 Гц, 2Н) 7,63 (д, J=1,5 Гц, 1Н) 7,01 (д, J=4,2 Гц, 2Н) 6,98 (д, J=4,2 Гц, 2Н) 3,80 (с, 3Н) 3,79 (с, 3Н)
ЖХУФ-МС: Rt=2,76 мин, m/z=297 (способ 5)
Пример 25: Синтез 3,5-бис-(4-бензилоксифенил)-[1,2,4]оксадиазола 23
К 5 г коммерчески доступного 4-бензилокси-бензонитрила 22 (1 экв., 23,9 ммоль) в 10 мл этиленгликоля в герметически закрытой пробирке добавляли 1,52 г Na2CO3 (0,6 экв., 14,34 ммоль), 1,29 мл воды (3 экв., 71,69 ммоль) и 0,83 мг гидрохлорида гидроксиламина (0,5 экв., 11,95 ммоль). Смесь нагревали при температуре 195°C в течение 24 час, затем добавляли воду и суспензию фильтровали. Твердое вещество промывали водой и сушили в вакууме при температуре 50°C. Твердое вещество растирали в MeOH, фильтровали и сушили в вакууме при температуре 40°C. Получали 3,5-бис-(4-бензилоксифенил)-[1,2,4]оксадиазол с 37%-ным выходом.
1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,13 (д, J=8,7 Гц, 2Н) 8,02 (д, J=8,7 Гц, 2Н) 7,32-7,54 (м, 10Н) 7,28 (д, J=8,7 Гц, 2Н) 7,22 (д, J=8,7 Гц, 2Н) 5,25 (с, 2Н) 5,21 (с, 2Н)
ЖХУФ-МС: Rt=3,1 мин, m/z=435 (способ 5)
Пример 26: Синтез 2,5-бис-(4-метоксифенил)оксазола 26
1 г коммерчески доступного 5-(4-метоксифенил)оксазола 24 (1 экв., 5,71 ммоль) при комнатной температуре растворяли в 12 мл ДМФ в атмосфере Ar. Затем добавляли 1,2 г 1-бром-4-метоксифенила 25 (1,2 экв., 6,85 ммоль), 1,58 г K2CO3 (2 экв., 11,42 ммоль), 64,1 мг Pd(OAc)2 (0,05 экв., 0,29 ммоль) и 1,09 г CuI (1 экв., 5,71 ммоль), и реакционную смесь нагревали при температуре 140°C в течение 6 час. Смесь охлаждали и фильтровали через целит, промывали AcOEt. Органический слой промывали H2O, затем насыщенным солевым раствором, затем сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (элюент: DCM/MeOH от 100/0 до 95/5) с получением после упаривания 580 мг 2,5-бис-(4-метоксифенил)-оксазола (36%-ный выход).
1H ЯМР (250 МГц, ДМСО-d6) δ м.д. 8,00 (д, J=8,9 Гц, 2Н) 7,75 (д, J=8,9 Гц, 2Н) 7,61 (с, 1Н) 7,10 (д, J=8,9 Гц, 2Н) 7,06 (д, J=8,9 Гц, 2Н) 3,84 (с, 3Н) 3,82 (с, 3Н)
ЖХУФ-МС: Rt=9,22 мин, чистота (УФ 220 нМ) 97%, MH+=282 (метод 1)
В приведенной далее таблице представлены химические структуры и физические свойства некоторых соединений по примерам в соответствии с изобретением.
Обычно реакционную смесь, содержащую целевое соединение формулы (I) или промежуточное соединение, обрабатывают, и, если желательно, продукт затем очищают обычными способами, известными специалистам в данной области. Для примера, синтезированное соединение может быть очищено с использованием хорошо известных способов, таких как кристаллизация, хроматография или обращенно фазовая высокоэффективная жидкостная хроматография (ОФ-ВЭЖХ) или другие способы разделения в зависимости, например, от размера, заряда или гидрофобности соединения. Аналогично, для характеристики соединения могут быть использованы хорошо известные методы, такие как ЯМР, ИК и масс спектрометрия (МС).
Соединения формулы (I), которые вследствие их химического строения встречаются в энантиомерной или диастереомерной форме, могут быть получены в энантиомерно чистой форме с использованием энантиомерно чистого исходного вещества или могут быть разделены на чистые энантиомеры с помощью хроматографии на хиральных стационарных фазах или путем получения их производных с помощью хирально энантиомерно чистых соединений, такие как аминокислоты, выделение полученных таким образом диастереомеров и удаление хиральных вспомогательных групп.
Следует отметить, что, когда соединения получают с использованием хирального катализатора восстановления (как описано на схеме 1), их хиральную конфигурацию не определяли с помощью прямых аналитических методов. Поэтому, когда получали различные изомеры одного и того же соединение, их называли «изомер 1», «изомер 2». Однако, хорошо известно, что асимметрические катализаторы 4а, 4b, которые были использованы, приводят к целевым соединениям, имеющим ту же хиральность, что и у указанных катализаторов.
«Хиральный агент» колонки указывает на агент, используемый на стадии восстановления соединения формулы (II) или (III) в соединение формулы (I)
|
*Способ очистки: препаративная ТС хроматография на 2 колонках Chiralpak IC (300×4,6 мм) 20 мкм. Условия: 100% MeOH - 1 мл/мин - 210 нм - 25°C;
**Способ очистки: препаративная ТС хроматография с использованием Berger Prep SFC (150×21 мм 5 мкм) УФ=210 нМ. Условия: 2-этилпиридин - CO2/метанол;
75%/25% 70 мл/мин 100 бар 260 впрыск 4,1 мг.
С некоторыми соединениями по настоящему изобретению были проведены биохимические исследования для того, чтобы продемонстрировать их способность ингибировать активность митохондриального комплекса 1 на выделенных белках с помощью коммерческого анализа в соответствии с описанным протоколом (ab109903: MitoTox Complex 1 OXPHOS Activity Microplate Assay).
Для того, чтобы оценить ингибирующую активность всех соединений, был разработан in vitro анализ, показания которого непосредственно связаны с ингибированием митохондриального комплекса 1. Поскольку митохондриальный комплекс 1 способствует формированию мембранного потенциала в сочетании с митохондриальным синтезом АТФ, ингибирование комплекса 1 непосредственно приводит к ингибированию продукции митохондриальной АТФ в клетках. Содержание клеточного АТФ измеряли в присутствии или ингибитора гликолиза (йодоцетат натрия) и/или митохондриальных ингибиторов (ингибитор F0F1-АТФазы: олигомицин или митохондриальный разобщитель: FCCP) для определения части продукции АТФ, основываясь либо на гликолитическом, либо на митохондриальном метаболизме. Чтобы показать их способность ингибировать продукцию митохондриальной АТФ, соединения по изобретению оценивали в эффекте дозы.
Анализ митохондриальной АТФ
Соединения по изобретению оценивали на способность ингибировать продукцию митохондриальной АТФ в клеточных линиях немелкоклеточной карциномы легких NCI-H460, показанную по их окислительным характеристикам.
Получение образца
Измеряли АТФ, используя набор Promega Cell Titer Glo и протокол. Коротко, 1000 клеток высевали в 40 мкл в 384-луночный планшет. Через 24 часа среду заменяли на 20 мкл культуральную среду в присутствии соединений: клетки обрабатывали в пяти повторах с контролем (PBS), олигомицином А (10 мкг/мл), FCCP (30 мкМ), или только соединениями по настоящему изобретению с эффектом дозы, или соединениями по настоящему изобретению в сочетании с йодацетатом натрия (100 мкМ). Через 1 час инкубации в каждую лунку добавляли 20 мкл реакционной смеси CellTtiter-GloTM до конечного объема 40 мкл. Затем анализировали люминесценцию планшетов с помощью Perkin Elmer EnVision. Сравнивая различные условия, определяли общее количество АТФ и проценты гликолитической и митохондриальной АТФ.
Расчет результатов
Продукцию митохондриальной АТФ рассчитывали как АТФ, оставшуюся после обработки йодацетатом минус базальный АТФ (содержание АТФ при обработке йодацетатом и олигомицином). Ингибирующую активность соединений в отношении митохондриальной АТФ в клетках NCI-H460 выражали как концентрацию, необходимую для ингибирования 50% митохондриальной АТФ (IC50, М).
|
Значения IC50 были, как правило, ниже 10-06 М, и, более конкретно, составляли от 2,6 10-9 М до 8,3 10-6 М АТФ и, как правило, ниже 10-06 М, и, более конкретно, от 1,4 до 1710 нМ для комплекса 1.
Были проведены другие тесты на основе активности in vitro соединений по изобретению.
С целью определения эффективности соединений ингибирования стабилизации HIF1a при гипоксии, с соединениями по настоящему изобретению проводили биохимические исследования для определения их способности к снижению стабилизации HIF в клетках Нер3В при гипоксии (модель Вестерн-блот).
Модель Вестерн-блот
Получение образца
Клетки Нер3В высевали в количестве 300000 клеток на лунку в 6-луночный культуральный планшет в 2 мл MEM с добавлением глутамина (2 мМ) и 10% FCS (фетальная сыворотка теленка) и инкубировали при 37°С в присутствии 5% СО2. На следующий день клетки приводили в контакт с соединением, и осуществляли инкубирование при гипоксии 1% O2 при 37°С при 95% влажности и 5% CO2 в герметичной анаэробной рабочей станции (Hypoxystation H35 - Don Whitley - AES Chemunex) в течение 6 часов.
Иммуноблоттинг
Клетки промывали (PBS) и лизировали в SDS-буфере для образцов. Белки (25 мкг) разделяли на 4-12% Bis-Tris гелях и переносили на поливинилидендифторидные мембраны (Millipore). Мембраны окрашивали мышиными моноклональными антителами против HIF-1a (BD трансдукция) и мышиными моноклональными против βактина (Sigma). Иммунореактивные полосы детектировали анти-мышиными антителами, конъюгированными с пероксидазой хрена (HRP) (Sigma), усиленной хемилюминесценцией (Promega).
Расчет результатов
Ингибирующая активность соединений в отношении их способности снижать стабилизацию HIF1-a в Hep3b при гипоксии выражена как диапазон в процентах по сравнению с контролем, где:
- представляет собой снижение стабилизации HIF1-a на менее 30%
* представляет собой снижение стабилизации HIF1-a на от 30 до 50%
** представляет собой снижение стабилизации HIF1-a на от 50 до 70%
*** представляет собой снижение стабилизации HIF1-a на более 70%
|
Большинство соединений вызывали снижение стабилизации HIF1-a по меньшей мере на 30%.
Поэтому очевидно, что соединения по изобретению обладают ингибирующей активностью в отношении комплекса 1 дыхательной цепи митохондрий в отношении HIF1-a.
Соединения в соответствии с изобретением, таким образом, могут быть использованы для получения лекарственных средств, в особенности, лекарственных средств, которые представляют собой ингибиторы комплекса 1 митохондриальной дыхательной цепи.
Следовательно, в других своих аспектах, изобретение относится к лекарственным средствам, которые содержат соединение формулы (I) или аддитивную соль с фармацевтически приемлемой кислотой соединения формулы (I).
Указанные лекарственные средства используются терапевтически, особенно при лечении и профилактике злокачественного новообразования, в частности, карцином, которые обладают метаболизмом, зависящим от окислительного фосфорилирования, таких как опухоли легких и, более конкретно, немелкоклеточный рак легкого, гормонозависимые опухоли молочной железы, опухоли яичников, гепатокарциномы, желудочно-кишечные опухоли, опухоли поджелудочной железы и толстой кишки, сверхэкспрессирующая c-Myc опухоль, такая как лимфома, рак молочной железы или толстой кишки, от высоко до умеренно дифференцированные опухоли, злокачественные новообразования, которые индуцируют первичные метастазы в лимфатические узлы и легкие, злокачественные новообразования на начальных стадиях, описанные как имеющие гипоксические области во время их развития и метаболической адаптации (гликолитический сдвиг), такие как меланома, глиома, рак головы и шеи, лейкоз.
В соответствии с другими своими аспектами настоящее изобретение относится к фармацевтическим композициям, содержащим в качестве активного начала соединение в соответствии с изобретением. Эти фармацевтические композиции содержат эффективную дозу по меньшей мере одного соединения в соответствии с изобретением, или фармацевтически приемлемую соль указанного соединения, и также по меньшей мере одно фармацевтически приемлемое вспомогательное вещество.
Указанные вспомогательные вещества выбирают, в соответствии с желаемой фармацевтической формой и способом введения, из общепринятых вспомогательных веществ, которые известны специалисту в данной области.
В фармацевтических композициях по настоящему изобретению, предназначенных для перорального, подъязычного, подкожного, внутримышечного, внутривенного, местного, внутритрахеального, интраназального, трансдермального или ректального введения, активное начало формулы (I), описанное выше, или его соль могут вводиться животным и людям для лечения указанных расстройств или заболеваний в виде стандартной лекарственной формы в смеси с обычными фармацевтическими вспомогательными веществами.
Соответствующие стандартные лекарственные формы включают пероральные формы, такие как таблетки, мягкие или твердые желатиновые капсулы, порошки, гранулы и пероральные растворы или суспензии, подъязычные, буккальные, интратрахеальные, внутриглазные и интраназальные формы для введения, формы для ингаляционного, местного, чрескожного, подкожного, внутримышечного или внутривенного введения, формы для ректального введения и имплантаты. Для местного применения можно использовать соединения в соответствии с изобретением в кремах, гелях, мазях или лосьонах.
В качестве примера, стандартная лекарственная форма соединения в соответствии с изобретением в виде таблетки может содержать следующие компоненты:
|
Настоящее изобретение, в соответствии с другими своими аспектами относится также к способу лечения патологий, указанных выше, который включает введение пациенту эффективной дозы соединения в соответствии с изобретением или одной из его фармацевтически приемлемой солей.