Результат интеллектуальной деятельности: Бактерия вида Escherichia coli - продуцент L-треонина, способ микробиологического синтеза L-треонина с ее использованием.
Вид РИД
Изобретение
Настоящее изобретение относится к микробиологической промышленности, в частности, к микробиологическому синтезу L-треонина с использованием бактерии вида Escherichia coli.
Традиционно L-аминокислоты в промышленном масштабе могут быть получены методом ферментации с использованием штаммов микроорганизмов, выделенных из природных источников, или их мутантов, специально модифицированных для того, чтобы увеличить продукцию L-аминокислот.
Описано множество методов увеличения продукции L-аминокислот, например, путем трансформации микроорганизма рекомбинантной ДНК (US 4278765). Указанные методы основаны на повышении активности ферментов, вовлеченных в биосинтез аминокислот и/или уменьшении чувствительности целевого фермента к обратному ингибированию продуцируемой L-аминокислотой (WO 9516042, US 5661012, US 6040160).
Известны различные штаммы, использующиеся для производства L-треонина методом ферментации. Это штаммы с увеличенными активностями ферментов, вовлеченных в биосинтез L-треонина (US 5175107; US 5661012; US 5705371; US 5939307; ЕР 219027), штаммы, устойчивые к некоторым химических реагентам, таким как L-треонин и его аналоги (WO 0114525, ЕР 301572, US 5376538), штаммы с инактивированными ферментами системы деградации треонина (US 5939307 и US 6297031), штаммы, в которых устранена чувствительность целевого фермента к ингибированию продуцируемой аминокислотой или ее побочными продуктами по типу обратной связи (US 5175107 и US 5661012).
Известен штамм-продуцент L-треонина Е. coli ВКПМ В-3996 (US 5175107 и US 5705371), полученный путем введения в штамм Е. coli ВКПМ В-7 следующих мутаций и плазмиды:
- мутантный ген thrA (мутация thrA442) кодирует белок аспартокиназа-гомосериндегидрогеназу I, который устойчив к ингибированию треонином по типу обратной связи;
- мутантный ген ilvA (мутация ilvA442) кодирует белок треониндеаминазу, обладающую пониженной активностью, которая выражается в пониженном уровне биосинтеза изолейцина и в фенотипе с недостатком по изолейцину типа "leaky". В бактерии с мутацией ilvA442 транскрипция оперона thrABC не репрессируется изолейцином, что дает положительный эффект на продукцию треонина;
- инактивация гена tdh приводит к предотвращению деградации треонина, в указанный штамм была введена генетическая детерминанта ассимиляции сахарозы (гены scrKYABR);
- увеличение экспрессии генов, контролирующих биосинтез треонина, достигнута путем введения в штамм плазмиды pVIC40, содержащей мутантный треониновый оперон thrA442BC.
Штамм Е. coli ВКПМ В-3996 в ходе ферментации продуцирует 85 г/л L-треонина.
При конструирования продуцентов важным является также поиск новых генов-мишеней, модификация которых приводит к увеличению продукции L-треонина.
Технической задачей, на решение которой направлено настоящее изобретение является расширение арсенала бактерий вида Escherichia coli, способных к продукции L-треонина, а также расширение арсенала способов микробиологического синтеза L-треонина.
Поставленная задача решена тем, что получена бактерии принадлежащая к к виду Escherichia coli, обладающая способностью продуцировать треонин, у которой инактивирован ген yifK.
Термин "ген yifK инактивирован" означает, что целевой ген модифицирован таким образом, что такой модифицированный ген кодирует мутантный белок со сниженной активностью, или что такой модифицированный ген кодирует полностью неактивный белок. Также возможно, что естественная экспрессия модифицированного участка ДНК невозможна из-за делеции целевого гена или его части, сдвига рамки считывания данного гена или введения missense/nonsense мутации или модификации прилегающей к гену областей, которые включают последовательности, контролирующие экспрессию гена, такие как промотор(ы), энхансер(ы), аттенуатор(ы), сайт(ы) связывания рибосомы, и т.д.
Инактивацию указанного гена осуществляют любым возможным методом, например, такими как мутагенез с использованием УФ излучения или обработка нитрозогуанидином (N-метил-N-нитро-N'-нитрозогуанидин), сайт-направленный мутагенез, инактивации гена с помощью гомологичной рекомбинации, или/и инсерционно-делеционного мутагенеза (Yu, D. et al., Proc. Natl. Acad. Sci. USA, 2000, 97:12: 5978-83); (Datsenko K.A. and Wanner B.L., Proc. Natl. Acad. Sci. USA, 2000, 97:12: 6640-45), также называемого "Red-зависимая интеграция".
Для получения плазмидной ДНК, разрезания и лигирования ДНК, трансформации, выбора олигонуклеотидов в качестве праймеров и т.д. используют обычные методы, хорошо известные специалисту в данной области (например, Sambrook, J., Fritsch, E.F., and Maniatis, Т., "Molecular Cloning A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press (1989)).
Поставленная задача решена также тем, что предложен способ микробиологического синтеза L-треонина, включающий в себя культивирование бактерии вида Escherichia coli в питательной среде, отличающийся тем, что в качестве бактерии обладающей способностью продуцировать треонин, используют бактерию вида Escherichia coli, в которой инактивирован ген yifK.
Культивирование осуществляют в любой подходящей среде предпочтительно в аэробных условиях, таких как перемешивание культуральной жидкости на качалке, взбалтывание с аэрацией, при температуре в пределах от 20 до 40°С, предпочтительно в пределах от 30 до 38°С. рН среды поддерживают в пределах от 5 до 9, предпочтительно от 6.5 до 7.2. рН среды регулируют аммиаком, карбонатом кальция, различными кислотами, основаниями или буферными растворами. Выращивание осуществляют в течение 1-5 дней.
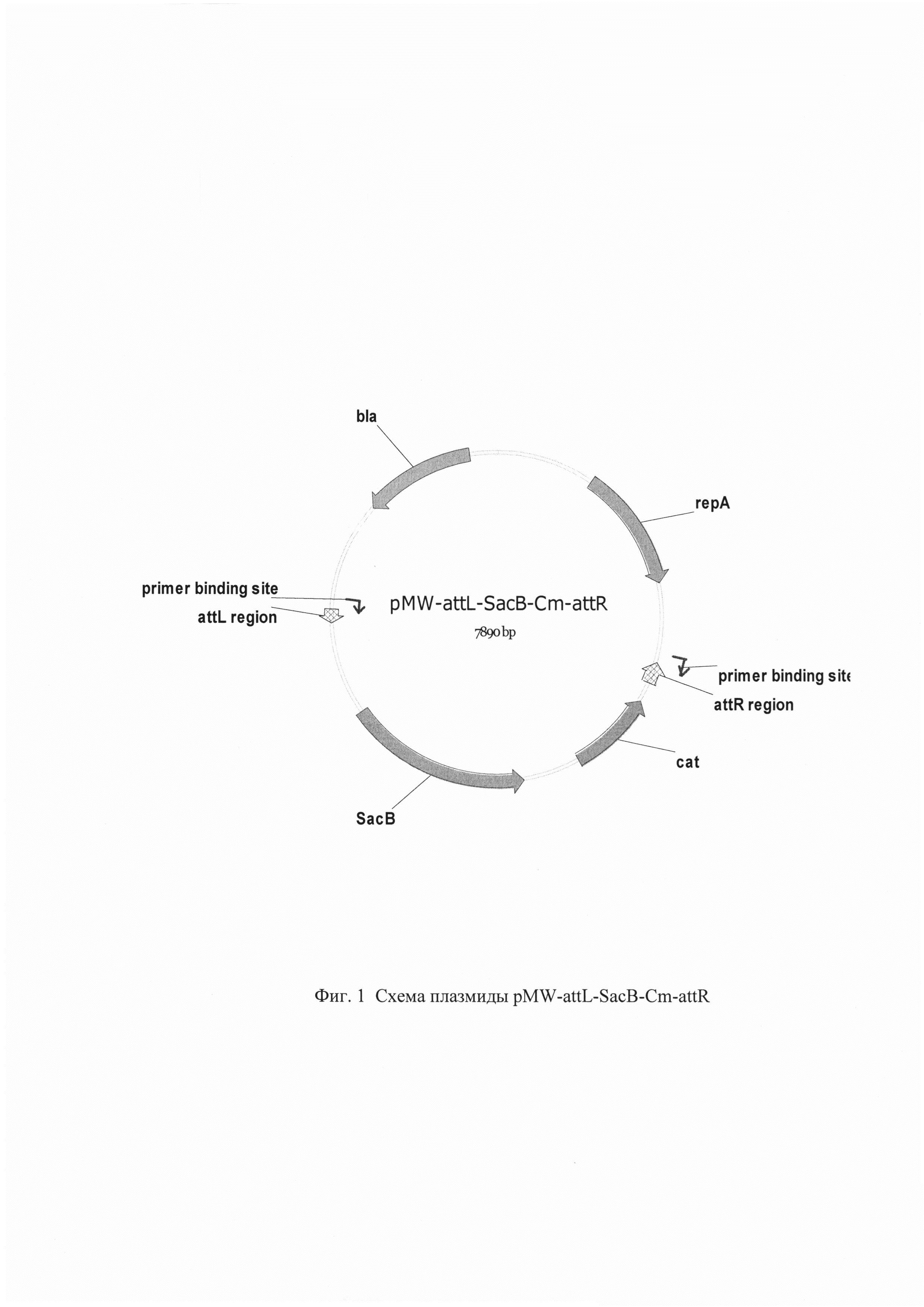
Изобретение проиллюстрировано следующими фигурами графического изображения: Фиг. 1. Схема плазмиды pMW-attL-SacB-Cm-attR
Пример 1. Конструирование штамма с инактивированным геном yifK.
Инактивацию гена осуществляют в штамме ВКПМ В-13207, который получен на основе дикого штамма Escherichia coli K-12 MG1655 (АТСС 47076) в результате проведения нескольких раундов мутагеза различными мутирующими агентами с целью отбора мутантов наиболее устойчивых к L-треонину, и последующего введения направленных генетических модификаций: замена промотора генов треонинового оперона, введение десенсибилизирующей мутации в ген thrA, оверэспрессия rhtA, инактивация гена sstT, инактивация гена рохВ, кодирующего пируватоксидазу,.
Инактивацию гена yifK осуществляют путем замены его ORF (номер последовательности по базе данных GenBank NC_000913.3: 3980887..3982272), последовательностью, несущей селективный маркер устойчивости к хлорамфениколу, методом ПЦР с использованием следующих олигонуклеотидов:
YifK-SC-up 5'-
TAACGATAACCGGTAACACCGGAAAGCATGCAAACACAACACG
AGGATTTCAGGGTTTTCCCAGTCACGA
YifK-SC-down 5'-
CCCTTTTTAAATAAATTGCGCGTTTGGTTACGGTTTGTGCGTTTT
GCTGCATGTTGTGTGGAATTGTGAGC
Олигонуклеотиды подбирают таким образом, чтобы после удаления маркера оставить делецию in-frame, и таким образом не изменить уровень экспрессии нижележащих генов. В качестве матрицы для синтеза используют плазмиду pMW-attL-SacB-Cm-attR (RU 2546237). На фиг. 1 представлена схема указанной плазмиды. В своем составе эта плазмида несет следующие генетические элементы: ген cat, обуславливающий устойчивость клеток к хлорамфениколу для прямого отбора трансформантов; ген sac В, кодирующий фермент левансахаразу и используемый в качестве маркера для контрселекции; последовательности фага λ attL и attR - сайты узнавания системы рекомбинации Int/Xis; repA - репликон; ген bla, кодирующий бета-лактамазу, обуславливающий устойчивость к ампициллину. Амплификацию фрагмента проводят с использованием полимеразы Pfu (Thermo Fisher Scientific) для того, чтобы избежать ошибок в последовательности. Используют следующий температурный профиль для ПЦР: денатурация при 94°С в течение 4 мин; 25 циклов: 20 сек при 94°С, 20 сек при 55°С, 6 мин при 72°С; и заключительная полимеризация: 5 мин при 72°С. ПЦР продукт размером размером 3949 п. о. очищают методом экстракции из агарозного геля и далее используют для трансформации штамма ВКПМ В-13207, который предварительно трансформируют плазмидой pKD46, которая необходима для интеграции продукта ПЦР в хромосому штамма. Плазмида pKD46 (Datsenko, K.А. and Wanner, B.L., Proc. Natl. Acad. Sci. USA, 2000, 97:12:6640-45) содержит фрагмент ДНК фага λ (инвентарный номер последовательности J02459 в базе данных GenBank) длиной 2,154 нуклеотида (31088-33241), а также содержит гены Red гомологичной системы рекомбинации (β,γ, ехо гены) под контролем промотора ParaB; индуцируемого арабинозой.
Электрокомпетентные клетки получают следующим образом: ночную культуру штамма Е. coli ВКПМ В-13207 выращивают при 30°С в жидкой среде LB (мас. %: триптон - 1, NaCl - 1, дрожжевой экстракт - 0,5, вода - остальное, рН 7,0) с добавкой ампициллина (125 мг/л), разводят в 100 раз при помощи 5 мл среды SOB (мас. %: триптон 2, дрожжевой экстракт - 0,5, MgCl2 - 0,0956, MgSO4⋅7H2O - 0,252, NaCl - 0,0058, KCl - 0,0185, вода остальное) с добавлением ампициллина (100 мг/л) и L-арабинозы (1 мМ). Полученную культуру растят с перемешиванием при 30°С до достижения оптической плотности ОП660нм 0,6 ед., после чего делают клетки электрокомпетентными путем концентрации в 100 раз и трехкратного отмывания ледяной деионизированной Н2О. Электропорацию проводят с использованием 40 мкл клеток и 1 мкг продукта ПЦР. После электропорации клетки инкубируют с 1 мл среды SOC (мас. %: триптон 2, дрожжевой экстракт - 0,5, глюкоза - 0,36, MgCl2 - 0,0956, MgSO4⋅7H2O - 0,252, NaCl - 0,0058, KCl - 0,0185, вода остальное) при 37°С в течение 2,5 часов, после чего высевают на чашки с L-агаром (мас. %: агар-агар - 2, триптон - 1, NaCl - 1, дрожжевой экстракт - 0,5, вода -остальное, рН 7,0) с добавлением хлорамфеникола (10 мг/л).
Отбор трансформантов, несущих делецию в гене yifK, проводят на чашках с L-агаром с добавлением хлорамфениола. Отобранные клоны далее проверяют методом ПЦР на наличие инсерции в локусе yifK. Для амплификации фрагмента используют полимеразу Taq (Thermo Fisher Scientific) и следующие олигонуклеотиды:
yifK-out-F 5'-ACTGCCGTCTGGTACATCC
yifK-out-R 5'-ATTGTCACAACTTCTAATAATGG
Для проведения ПЦР используют следующий температурный профиль: денатурация при 94°С в течение 4 мин; 25 циклов: 20 сек при 94°С, 20 сек при 55°С, 2 мин 30 сек при 72°С; и заключительная полимеризация: 5 мин при 72°С.
Наличие продукта размером 4572 п. о. интерпретируют как интеграцию кассеты в целевой локус. Для удаления вспомогательной плазмиды pKD46, проводят 2 пассажа на L-агаре с хлорамфениколом (10 мг/л) при 42°С и полученные колонии проверяют на чувствительность к ампициллину.
По результатам проверки было отобрано 6 клонов, несущих делецию в гене yifK.
Пример 2. Отбор наиболее продуктивного клона.
Для проверки влияния делеции гена yifK на продукцию L-треонина проводят пробирочную ферментацию шести отобранных клонов, в качестве контрольного штамма используют родительский штамм ВКПМ В-13207.
Штаммы выращивают на чашках с L-агаром в течение 24 часов при 37°С. Для приготовления инокулята используют посевную среду следующего состава (мас. %)
|
В пробирки объемом 50 мл с рабочим объемом 5 мл посевной среды вносят биомассу клеток до стартового значения оптической плотности равной ОП660нм 0,1 ед. Пробирки инкубируют на роторной качалке в течение 5 часов при 37°С и скорости перемешивания 220 об/мин. Для основного процесса ферментации используют среду следующего состава (мас. %):
|
Растворы глюкозы, сульфата марганца и сульфата магния стерилизуют отдельно автоклавированием при 121°С в течение 40 мин. Навески СаСО3 по 40 мг стерилизуют в стеклянных пробирках автоклавированием при 121°С в течение 20 мин. рН доводят до значения 7,0. Раствор сульфата железа стерилизуют фильтрованием через мембрану диаметром пор 22 мкм.
Полученный инокулят вносят в пробирки объемом 50 мл с рабочим объемом 2 мл ферментационной среды и до оптической плотности ОП660 нм 0,1 ед. Клетки культивируют в течение 24 часов при 37°С на роторной качалке - 220 об/мин.
После выращивания количество накопленного в среде L-треонина определяют с методом ВЭЖХ - (Waters 2695, Alliance). Результаты ферментации шести клонов приведены в табл. 1.
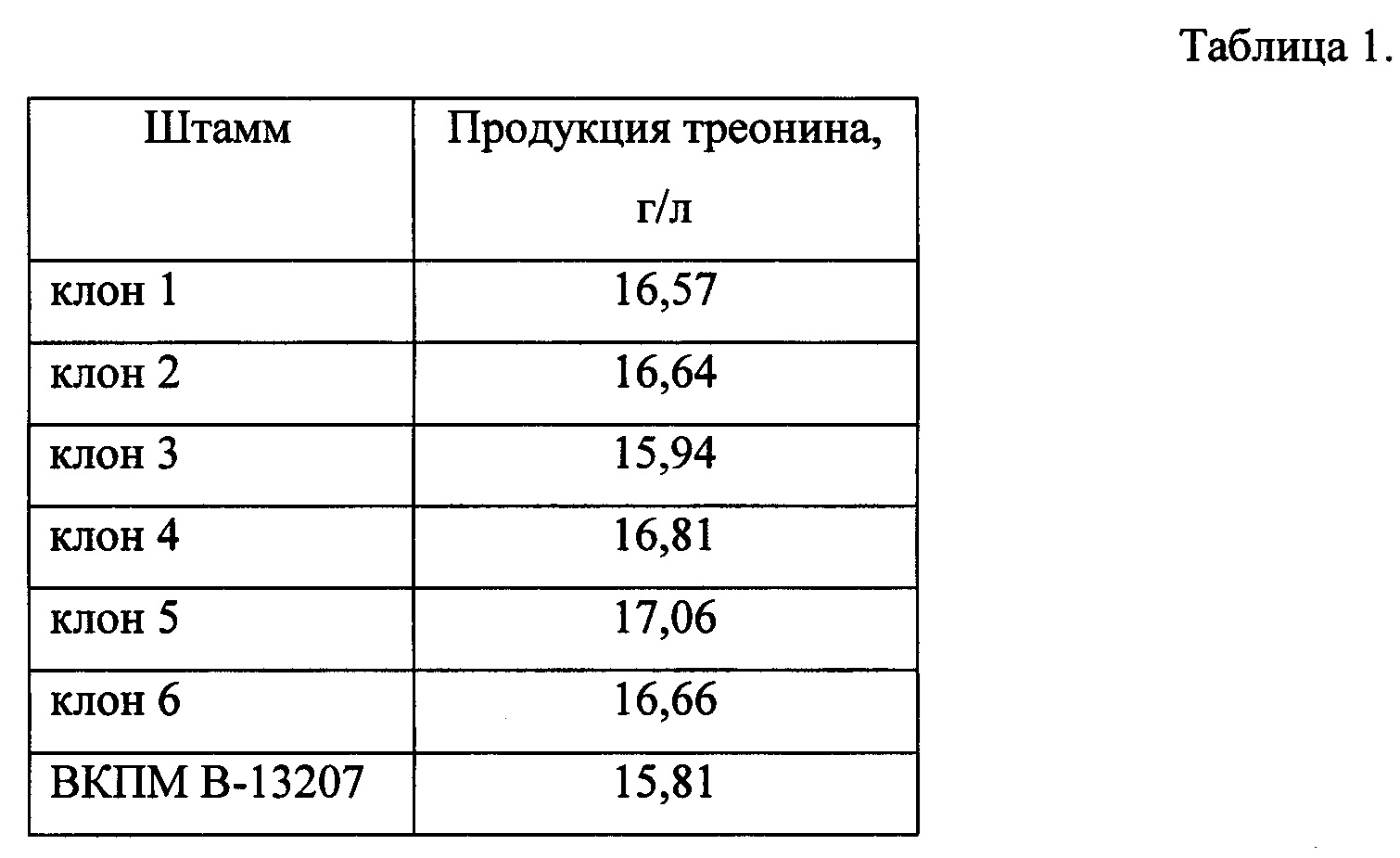
Как видно из табл. 1, клон 5, содержащий делецию гена yifK, накапливает большее количество L-треонина по сравнению с контрольным штаммом ВКПМ В-13207. Отобранный клон 5 был депонирован во Всероссийской Коллекции Промышленных Микроорганизмов и ему присвоен регистрационный номер ВКПМ В-13240
Штамм Escherichia coli ВКПМ В-13240 характеризуется следующими признаками:
Культурально-морфологические признаки. Грамм-отрицательная бактерия. Суточная культура в жидкой LB представлена слабо подвижными клетками округлой формы 1 мкм в диаметре. При культивировании на L-агаре в течение 18-24 часов при 37°С образуюет круглые, беловатый, полупрозрачные на свет колонии колонии 1-2 мм, поверхность колонии гладкая, края ровные или слегка волнистые, центр колоний приподнят, структура однородная, консистенция пастообразная, легко эмульгируется. При культивировании агаризованной среде Эндо (мас. %: пептон - 1, лактоза - 1, Na2SO3 - 0,33, K2HPO4 - 0,25, фуксин основной - 0,03, агар-агар - 2%, вода - остальное) при 37°С образуются колонии, круглой формы с ровным четко очерченным краем малиново-красного цвета с металлическим блеском. Диаметр колоний 0,5-1,5 мм.
Физиолого-биохимические признаки. Факультативный анаэроб. Сахара не сбраживает. Ассимилирует: D-глюкозу, L-арабинозу, D-маннитол, D-ксилозу, в меньшей мере: D-галактозу, D-лактозу. Отсутствует способность к гидролизу крахмала. Отстутствует потребность в факторах роста. Штамм устойчив к хлорамфениколу. Заявляемый штамм продуцирует треонин. Оптимальное значение рН для роста 7,2-7,4. Не растет при температурах свыше 45°С. Оптимальная температура роста 37°С. Штамм не патогенен.
Пример 3. Оценка продуктивности штамма Е. coli ВКПМ В-13240 в ферментере.
Культуру клеток штамма ВКПМ В-13240 выращивают на чашках с L-агаром в течение 24 часов при 37°С. Для приготовления инокулята используют посевную среду, описанную в Примере 2. В качалочные колбы объемом 750 мл с рабочим объемом 15 мл посевной среды вносят суспензию клеток до получения оптической плотности ОП660нм 0,1 ед. Колбы инкубируют на качалке при 220 об/мин и при температуре 37°С до достижения ОП660нм 5-6 ед.
Для выращивания посевного материала в 3,0-л ферментере КФ-103 (ООО-фирма «Проинтех») готовят посевную среду следующего состава (мас. %):
|
Среду переносят в ферментер и стерилизуют автоклавированием в течение 40 минут при 121°С. Раствор глюкозы с концентрацией 77% (мас.) стерилизуют автоклавированием отдельно в течение 30 минут при 121°С. После стерилизации раствор глюкозы вносят в ферментер, используя инокулятницу.
В ферментер засевают инокулят, выращеный в колбах, до старового значения оптической плотности ОП660 0,003 ед. Культивирование проводят в ферментере с рабочим объемом 1 л при 39°С, при перемешивании 700 об/мин, при аэрации - 1,0 л/мин, при рН=6,9 с титрованием 25% (об.) водным аммиаком. Культивирование проводят до достижения оптической плотности значения ОП660нм 12 ед.
Для проведения основного процесса биосинтеза L-треонина в ферментере используют среду следующего состава (мас. %):
|
Среду переносят в ферментер и стерилизуют автоклавированием в течение 40 минут при 121°С. Раствор глюкозы с концентрацией 51,1% (мас.), стерилизуют автоклавированием отдельно в течение 30 минут при 121°С. После стерилизации раствор глюкозы вносят в ферментер, используя инокулятницу.
Культивирование проводят в 3,0-л ферментерах с начальным рабочим объемом 1 л при 33°С; при начальном перемешивании 500 об/мин; при аэрации - 1,0 л/мин; при рН=6.9 с титрованием 25% (об.) водным аммиаком. Значение pO2 поддерживают на уровне 20,0% с использованием каскадной регулировки скорости вращения мешалки до 1200 об/мин (максимально возможная скорость).
В ферментер вносят культуру, выращенную в посевном ферментере, до стартового значения ОП660нм 2 ед. Культивирование продолжают в течение 36 часов. По окончании процесса количество накопленного в среде L-треонина определяют с методом ВЭЖХ.
По результатам культивирования штамма ВКПМ В-13240 по окончании ферментации концентрация L-треонина в культуральной жидкости составила 98,9 г/л.