Результат интеллектуальной деятельности: ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА TRICHODERMA REESEI - ПРОДУЦЕНТ КОМПЛЕКСА ЭНДОГЛЮКАНАЗЫ, КСИЛАНАЗЫ И ПЕКТИНАЗ ДЛЯ ПОЛУЧЕНИЯ БЕЛКОВЫХ ДОБАВОК НА ОСНОВЕ ЗЕРНОВОГО И ЗЕРНОБОБОВОГО СЫРЬЯ ДЛЯ ПРИМЕНЕНИЯ В КОРМОПРОИЗВОДСТВЕ
Вид РИД
Изобретение
Изобретение относится к области биотехнологии и может быть использовано для разрушения некрахмальных полисахаридов (НКП) зернового и зернобобового сырья в кормопроизводстве для повышения кормовой ценности рационов и при получении белковых кормовых добавок для сельскохозяйственных животных, птицы и аквакультуры.
Одним из способов решения проблемы дефицита кормового белка является рациональное использование растительных белоксодержащих субстратов. Усвоению белка из растительных источников препятствует высокое содержание в растительных клеточных стенках НКП, оказывающих антипитательное действие на организм моногастричных животных, птицы, аквакультуры. НКП повышают вязкость перевариваемой массы, затрудняют гидролиз питательных компонентов и всасывание продуктов гидролиза стенками кишечника, образуют комплексы с белком, снижая его переваримость, способствуют развитию патогенной микрофлоры в кишечнике, изменяют физиологию и морфологию пищеварительного тракта [1]. В России злаковые культуры составляют основу рационов сельскохозяйственных животных. НКП злаковых культур представлены, главным образом, арабиноксиланами, целлюлозой и β-глюканами [2]. В состав большинства рационов в качестве дополнительных источников белка входят зернобобовые культуры, такие как соя, люпин, горох. Для зернобобовых культур характерно высокое содержание пектина, в оболочках преимущественно содержится целлюлоза, а в ряде культур арабиноксилан [3-5].
С целью повышения кормовой ценности рационов на основе растительного сырья в кормопроизводстве широко используют ферментные препараты (ФП) карбогидраз, способных гидролизовать НКП. Применение ФП целлюлаз, гемицеллюлаз и пектиназ позволяет устранить антипитательные свойства водорастворимых НКП, разрушить матрикс клеточных стенок растений, что приводит к снижению вязкости перевариваемой массы, повышает доступность питательных компонентов для действия пищеварительных ферментов, высвобождает сахара, необходимые для роста молочнокислых бактерий, способствует нормализации микрофлоры кишечника, увеличивает энергетическую ценность и усвояемость кормов [1, 6]. Кроме того, высвобождается белок, который в растительном сырье находится в связанном состоянии с гемицеллюлозой и пектинами, повышается степень утилизации питательных компонентов корма [1]. В последние годы интенсивно развивается рынок кормов для аквакультуры. Наиболее актуальным вопросом при разработке технологий получения кормовых добавок для аквакультуры на основе растительного белоксодержащего сырья является повышение содержания белка за счет снижения количества НКП, что решается, в первую очередь, ферментативным гидролизом НКП с последующим отделением водорастворимых продуктов гидролиза [7].
В связи с тем, что НКП растительного белоксодержащего сырья представлены целлюлозой, гемицеллюлозой и пектиновыми веществами, в кормопроизводстве активно используются комплексные ФП, содержащие в своем составе целлюлазы, ксиланазы и ферменты пектиназного комплекса. Как правило, ключевыми ферментами при кормовом применении ФП являются гидролазы эндодеполимеразного действия [8]. Эндоглюканаза (эндо-β-1,4-глюканаза, КМЦаза, КФ 3.2.1.4) гидролизует внутренние β-1,4-гликозидные связи, удаленные от концов полимерной цепи целлюлозы и β-1,4(1,3)-глюканов, что приводит к снижению степени полимеризации этих полисахаридов и снижению вязкости их водных растворов. Ксиланаза (эндо-1,4-β-ксиланаза, КФ 3.2.1.8) выполняет основную функцию при гидролизе арабиноксиланов зерновых и зернобобовых культур. Ксиланаза приводит не только к уменьшению степени полимеризации ксиланов и снижению их вязкости, но и к образованию ксилоолигосахаридов, обладающих пребиотическими свойствами [1, 9, 10]. К основным деполимеразам, участвующим в деградации пектиновых веществ, относятся: полигалактуроназы (ПГ) и полиметилгалактуроназы (ПМГ), катализирующие гидролитическое расщепление α-1,4-гликозидных связей в пектине и пектовой кислоте, соответственно, а также пектин/пектатлиазы, расщепляющие α-1,4-гликозидные связи в ходе реакции трансэлиминирования с образованием галактуронидов. ПГ и ПМГ бывают двух типов: эндодеполимеразного действия, катализирующие неупорядоченный гидролиз α-1,4-гликозидных связей в соответствующих субстратах с образованием олигогалактуронатов или метилированных/ацетилированных олигогалактуронатов, и экзодеполимеразного действия, катализирующие последовательный гидролиз соответствующих субстратов с образованием моногалактуронатов, в случае экзо-ПМГ метилированных/ацетилированных. В процессах переработки пектинсодержащего сырья наиболее широко используют полигалактуроназы и пектин/пектатлиазы, предпочтительно, эндодеполимеразного действия [11, 12].
На рынке кормовых ферментов представлены следующие ФП, имеющие в составе ферменты целлюлолитического, гемицеллюлолитического и пектиназного действия:
- Фидбест VGPro - препарат, выпускаемый отечественным предприятием - ООО ПО Сиббиофарм, содержит в качестве основных компонентов ксиланазу, β-глюканазу, пектиназу и протеазу (http://www.sibbio.ru/catalog/ptitsevodstvo/fermentnyy-preparat-fidbest-vgrro/);
- Фидбест VGPro G (ООО ПО Сиббиофарм) - новый мультиэнзимный ФП, содержащий ксиланазу, β-глюканазу, пектинлиазу, пектиназу и амилазу из грибных и бактериальных продуцентов (http://www.sibbio.ru/catalog/ptitsevodstvo/fidbest-vgpro-g-/);
- Юдозайм AF 831 производства компании VTR BioTech (Китай) стандартизируется по ксиланазной, α-амилазной, целлюлазной и пектиназной активности, а также дополнительно содержит галактозидазу, целлобиазу, протеазу [13];
- Pectinex 5XL ("Novozymes A/S", Дания) содержит в качестве основных ферментов пектиназу, гемицеллюлазу, целлюлазу [14];
- Ладозим Респект Ультра (Концерн «Микробиопром», Россия) содержит активный комплекс целлюлаз и гемицеллюлаз при высоком уровне пектиназной активности [15].
Однако все подобные препараты получают смешиванием ферментов, произведенных разными продуцентами. Кроме того, присутствие протеолитических ферментов в ферментных комплексах в некоторых технологиях получения белковых кормовых добавок приводит к потерям белка на этапах удаления водорастворимых продуктов гидролиза НКП [15].
Основными промышленными продуцентами целлюлаз и гемицеллюлаз на сегодняшний момент являются мицелиальные грибы рода Trichoderma, а для производства ФП пектиназ в большинстве случаев используют грибы рода Aspergillus [16, 17]. Экономически целесообразно получать комплексные препараты с требуемым соотношением основных компонентов на основе одного штамма-продуцента. В ферментном комплексе продуцентов целлюлаз и гемицеллюлаз, в том числе, грибов рода Trichoderma, часто содержатся следовые количества пектиназ, недостаточные для эффективного гидролиза пектиновых веществ в зернобобовом сырье. Для продуцентов пектиназ, наоборот, характерно низкое содержание ксиланаз и эндоглюканаз, расщепляющих основные НКП зернового сырья.
Так известны штаммы A. foetidus 379-К (ВКПМ F-962) и A.foetidus 379-К-5-1 (RCAM 01136) [18, 19] с активностью в культуральной жидкости (КЖ) при глубинном культивировании в колбах: β-глюканазы 6,5 и 13,3 ед/см3, целлюлазы (по КМЦ) - 2,6 и 6,1 ед/см3, эндополигалактуроназы - 2,01 и 3,7 ед/см3, соответственно. Препараты, получаемые на основе этих штаммов, предназначены для обработки пектинсодержащего сырья и микробной биомассы, при этом активность целлюлаз и гемицеллюлаз недостаточна для получения ФП, способных эффективно гидролизовать зерновое сырье.
Известен штамм Т. longibrachiatum ВКМ F-3865D [20] с активностью в КЖ при глубинном культивировании в колбах: целлюлаз (по КМЦ) - 8-14 ед/ см3, β-глюканазы - 80-105 ед/ см3, ксиланазы - 95-250 ед/ см3 и пектиназы - 9-11 ед/ см3. ФП на основе этого штамма предназначены, главным образом, для обработки целлюлозосодержащего растительного сырья, в частности, зерновых культур; активность пектиназы в штамме невысока.
Известен штамм A. aculeatus ВКМ F-3766D - продуцент комплекса карбогидраз, содержащего ксиланазы, β-глюканазы, пектиназы и ксилоглюканазы [21]. Однако у штамма низкая активность по отношению к целлюлозе, являющейся одним из основных компонентов растительных клеточных стенок, что снижает эффективность получаемых на его основе препаратов при гидролизе зернового сырья.
Штамм A.foetidus ВKМ F 3890D [22] продуцирует в качестве основных ферментов кислую протеазу и полигалактуроназу, и в меньшем количестве ксиланазу, β-глюканазу, арабиназу, ксилоглюканазу и другие сопутствующие ферменты карбогидразного комплекса. Данное соотношение компонентов делает штамм перспективным для применения, главным образом, в пищевой отрасли. Для повышения кормовой ценности зернового сырья в ферментном комплексе штамма A. foetidus ВKМ F 3890D недостаточное содержание целлюлаз и гемицеллюлаз.
Известен мутантный штамм мицеллиального гриба: Т. longibrachiatum TW-14-220, депонированный в ВКМ под номером F-4642D, - продуцент комплекса ферментов эндоглюканаз, бета-глюканаз и ксиланаз, разрушающих НКП, отличающийся повышенной активностью по КМЦ, β-глюкану и ксилану, и уменьшенной активностью по микрокристаллической целлюлозе [23]. Однако данный продуцент не обладает способностью к биосинтезу ферментов пектолитического действия.
Таким образом, остается актуальной задача получить промышленный штамм - продуцент сбалансированного комплекса карбогидраз для эффективного гидролиза основных НКП в зерновом и зернобобовом сырье с целью повышения питательной ценности кормов.
Технический результат заключается в получении нового штамма мицелиального гриба - продуцента сбалансированного ферментного комплекса карбогидраз эндодеполимеразного действия, обладающего высокой активностью эндоглюканазы, ксиланазы и пектиназ для применения в кормопроизводстве.
Изобретение представляет собой новый штамм мицелиального гриба Trichoderma reesei K-4 - продуцента эндоглюканазы, ксиланазы и пектиназ. Штамм Т. reesei K-4 депонирован во ВКМ при Институте биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН под №ВКМ F-4789 D.
Данный штамм может быть использован для обеспечения высокой эффективности обработки целлюлозо-, гемицеллюлозо- и пектинсодержащих субстратов, в том числе при гидролизе НКП зернового и зернобобового кормового сырья для сельскохозяйственных животных и птиц, а также аквакультуры.
Изобретение касается также способа получения комплексного ФП с активностью эндоглюканазы, ксиланазы и пектиназ.
Способ получения ФП предусматривает глубинное культивирование штамма-продуцента Т reesei K-4 на соответствующей среде с последующим концентрированием КЖ и сушкой.
Еще одним аспектом изобретения является способ повышения кормовой ценности зерновых и зернобобовых кормовых смесей, предусматривающий обработку зерновых и зернобобовых кормовых смесей полученным на основе штамма Т. reesei K-4 ФП.
Таким образом, изобретение обеспечивает получение комплексного ФП с высокой активностью эндоглюканазы, ксиланазы и пектиназ, применение которого позволит повысить кормовую ценность рационов на основе зернового и зернобобового сырья для сельскохозяйственных животных и птицы, а также получать белковые добавки с высоким содержанием сырого протеина из зернобобового сырья для животных, птицы и аквакультуры без использования растворителей, кислот и щелочей.
Изобретение реализуется следующим образом.
Штамм Т. reesei K-4 получают с помощью многоступенчатого мутагенеза и селекции из штамма Т. reesei ВСМ 18.2/КК (ВГНКИ28) - промышленного продуцента целлюлолитических и гемицеллюлолитических ферментов [24]. Для мутагенеза используют γ-излучение, которое обладает высокой проникающей способностью, вызывает ионизацию атомов и является мощным мутагенным фактором.
Методика мутагенеза. Штамм выращивают на агаризованной модифицированной среде SM,%: KН2РО4 - 0,2, глюкоза - 1,0, дрожжевой экстракт - 0,4, пептон - 0,6, солодовое сусло - 2,0, агар-агар - 2,0, в течение 7 сут при 30°С и 7 сут при комнатной температуре на свету. Споры гриба, выросшего на поверхности агаризованной среды, суспендируют в дистиллированной воде с добавлением Twin-80 (0,01%), фильтруют через стеклянный фильтр и подвергают мутагенной обработке на γ-установке камерного типа ГУТ-200 М в РНЦ «Курчатовский институт» (Россия). Доза облучения составляет от 1500 до 2500 Гр, время обработки - 4-8 ч, температура облучения спор - 20-23°С, среда облучения - воздух. Облученные споры высевают на чашки Петри с селективной средой.
Хранение штамма. На агаризованной модифицированной среде SM при 4°С при обязательных пересевах не реже одного раза в течение 3-6 месяцев; в лиофилизированном состоянии спор с применением защитных сред.
Культурально-морфологические признаки штамма. При 30°С на модифицированной среде SM до начала споруляции колонии белые, прозрачные, плоские с гладкой поверхностью. В дальнейшем образование конидий (фиалоспор) происходит после индуцирования видимым светом, и на 3 сутки колонии приобретают зеленоватую окраску. Образования воздушного (объемного) мицелия не наблюдается. Мицелий септирован и сильно разветвлен. Через 5-6 сутки роста диаметр колоний около 40 мм, колонии плотные, компактные, концентрические, с неровными краями, наблюдается выделение в среду желтого пигмента. Конидиальная зона сформирована многочисленными компактными подушечками диаметром до 2-2,5 мм, изначально белого цвета, с возрастом - зеленого. Обратная сторона - светло-зеленовато-желтая.
Конидиеносцы неокрашенные, гладкостенные, формируются преимущественно на субстратном мицелии, главные ветви длинные и прямые, иногда извитые, до 4-5 мм шириной у основания, постепенно сужающиеся к вершине до 2 мкм ширины; боковые ветви образуются через неравные интервалы, обычно короткие, формируются под углом к вершине конидиеносцев. Фиалиды одиночные, булавовидные или широко бутыловидные, часто искривленные, размер - 5-10×2-3 мкм. Конидии одноклеточные, зеленоватые, гладкостенные, эллипсоидальные, 4-7×2,5-4 мкм, собраны в небольшие головки на вершинах фиалид.
При культивировании в глубинных условиях с использованием растворимых субстратов (глюкоза, фруктоза, лактоза) образуется рыхлый разветвленный мицелий со слабой пеллетизацией.
Физиолого-биохимические признаки штамма. Мезофилен. Оптимальная температура роста мицелия 32°С (29-34°С), оптимум для образования целлюлаз 28°С (26-29°С), оптимум для образования ксиланаз - 32-34°С. Оптимальные значения рН роста и секреции целлюлаз 3,5-5,0. Оптимальные значения рН для секреции ксиланаз и полигалактуроназы 5,5-7,0. Рост мицелия наблюдается и при рН 2,5, но при этом происходит очень слабое образование целлюлаз и других карбогидраз.
Резистентность к нистатину слабая. При поверхностном культивировании устойчив к концентрации до 0,5 мкг/см3, при концентрации 2,5 мкг/см3 рост полностью подавляется.
Является прототрофом. Способен ассимилировать глюкозу, лактозу, глицерин, галактозу, ксилозу, D-маннит, маннозу, трегалозу, L- и D- арабинозу, сорбозу, сорбит, рибозу. Использует аммонийный и органический азот, очень плохо ассимилирует нитратную форму азота.
Образует ферментные системы, позволяющие расти на соответствующих комплексных субстратах: целлюлозе, крахмале, ксилане, β-глюкане, пектине, ламинарине, лихенине, галактоманнане и хитине. Катаболитная репрессия биосинтеза карбогидраз практически отсутствует.
Отличие от исходного штамма. Полученный мутант Т. reesei K-4 по своим морфологическим признакам при росте на модифицированной среде SM отличается от исходного штамма Т. reesei ВСМ 18.2/КК (ВГНКИ28) повышенной интенсивностью спороношения, компактным, плотным мицелием, более быстрым ростом на твердых средах. Кроме того, отличается повышенной способностью при глубинном культивировании на жидких средах к биосинтезу КМЦ-азы, ксиланазы и пектиназы.
Патогенность. Данный вид мицелиального гриба относится к IV группе патогенности в соответствии с санитарно-эпидемиологическими правилами «Безопасность работы с микроорганизмами III-IV групп патогенности (опасности) и возбудителям паразитарных болезней» (СП 1.3.2322-08), утвержденными Постановлением Главного государственного санитарного врача РФ №4 от 28 января 2008 г.
Культивирование штамма Т. reesei K-4 проводят в аэробных условиях на питательной жидкой водной среде, содержащей один или несколько субстратов - источников углерода, являющихся индукторами биосинтеза ферментов. Штамм способен в соответствующих условиях проведения процесса культивирования с использованием растворимых субстратов, например лактозы, глюкозы, ксилозы, секретировать в КЖ комплекс ферментов - карбогидраз (целлюлаз, ксиланаз, пектиназ и сопутствующих ферментов).
Для определения активности целевых ферментов используют следующие субстраты: для эндоглюканазной (КМЦ-азной) активности - водорастворимую Na-соль карбоксиметилцеллюлозы (КМЦ), для ксиланазной активности (Ксил) - ксилан березы, для полигалактуроназной активности (ПГ) - К-соль полигалактуроновой кислоты, для активности пектинлиазы (ПЛ) - высокометоксилированный пектин. Реакцию гидролиза КМЦ и ксилана проводят в 0,1 М Na-ацетатном буфере, рН 5,0, при 50°С в течение 5 и 10 мин, соответственно, при концентрации полисахаридных субстратов в реакционной смеси 5 г/л. Гидролиз К-соли полигалактуроновой кислоты проводят при 50°С, рН 5,0, высокометоксилированного пектина - при 40°С, рН 5,0, в течение 15 мин. В качестве продуктов гидролиза Na-соли КМЦ, ксилана и К-соли полигалактуроновой кислоты определяют восстанавливающие сахара (ВС) методом Сомоджи-Нельсона. За единицу эндоглюканазной, ксиланазной и полигалактуроназной активностей принимают такое количество фермента, которое в течение 1 минуты в приведенных выше условиях гидролиза освобождает 1 мкмоль ВС эквивалентных 1 мкмолю глюкозы [25, 26]. За единицу пектинлиазной активности принимают количество фермента, которое при действии на пектин за 1 мин в приведенных выше условиях образует 1 мкмоль 4,5-ненасыщенных продуктов реакции, увеличивающих оптическую плотность реакционной смеси при 232 нм на 0,1 [26].
ФП, полученные с помощью предлагаемого штамма, могут быть использованы в виде КЖ, в виде жидких концентрированных препаратов, получаемых с помощью ультрафильтрации или упаривания КЖ, или в виде сухих препаратов, получаемых высушиванием или гранулированием.
Возможность использования изобретения иллюстрируется примерами, которые не ограничивают объем и сущность притязаний, связанных с ними.
Пример 1.
Культивирование штамма Т. reesei K-4 ВКМ F-4789 D осуществляют в аэробных условиях в качалочных колбах Эрленмейера объемом 750 мл, содержащих 50 мл жидкой водной среды следующего состава, в г/л: аморфная целлюлоза - 10, лактоза - 20, солодовые ростки - 10, соевая шелуха - 10, дрожжевой экстракт - 10, (NH4)2SO4 - 6, KН2РО4 - 2, СаСl2 - 0,6, рН 6,0. Для получения посевного материала (инокулята) культуру гриба Т. reesei K-4 выращивают на модифицированном SM-arape при 30°С в течение 7 суток и далее при комнатной температуре на свету с течение 7 суток.
Засев колб проводят 1 мл суспензии спор, смытых с агара водой, содержащей 0,1% Твина-80. Колбы инкубируют на качалке при 30°С и 250 об/мин в течение 120 часов.
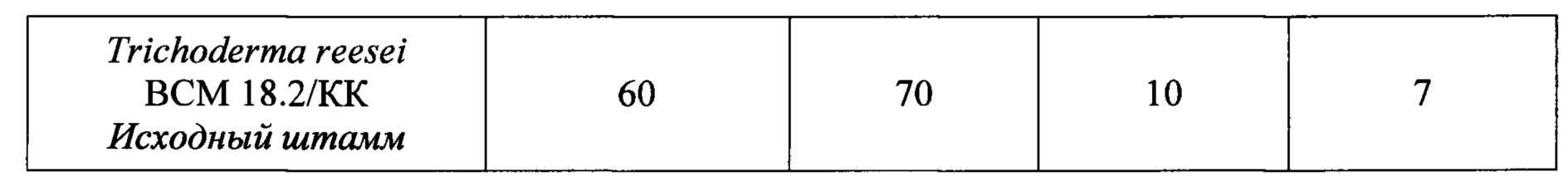
Активности нового штамма Т. reesei K-4 по КМЦ, ксилану, К-соли полигалактуроновой кислоты, высокометоксилированному пектину в КЖ составляют 390, 500, 150 и 100 ед/мл, соответственно. При культивировании исходного штамма Т. reesei ВСМ 18.2/КК в качалочных колбах в указанных выше условиях активности КМЦ-азная, ксиланазная, ПГ и ПЛ составляют 60, 70, 10 и 7 ед/мл, соответственно (Табл. 1).

Пример 2. Проводят процесс культивирования штамма Т. reesei K-4 в лабораторных ферментерах КФ 104/3 с геометрическим объемом 3 л и рабочим объемом 1,35 л, оснащенных системами автоматического регулирования рН, рO2 и температуры, а также барботерами для подачи воздуха и 2-х ярусной мешалкой. Инокулят для засева ферментеров получают культивированием гриба в качалочных колбах (250 об./мин) при 30°С в течение 48 ч в среде следующего состава, %: глюкоза - 2,5, кукурузный экстракт (40% СВ) - 2, КН2РO4 - 0,5, водопроводная вода. Доза засева ферментеров инокулятом - 8%. Ферментацию проводят в течение 120 ч на среде следующего состава, %: лактоза 2,0, соевая шелуха - 1,0, солодовые ростки - 1,0, дрожжевой экстракт - 1,0, KН2РО4 - 0,2, (NH4)2SO4 - 0,6, СаСl2 - 0,06, пеногаситель Пропинол - 0,1, водопроводная вода. рН поддерживают на уровне 6,0-6,5. Ферментацию проводят при 30°С, при аэрации 1 объем воздуха на 1 объем среды в мин, поддерживая рO2 выше 30% за счет скорости перемешивания. Подпитку субстратами проводят в непрерывном режиме после 24 роста в течение 72 ч 30% водным раствором лактозы и ксилозы в соотношении 5:1. Объем подпитки - 0,5 л. Ферментация заканчивается через 96 часов.
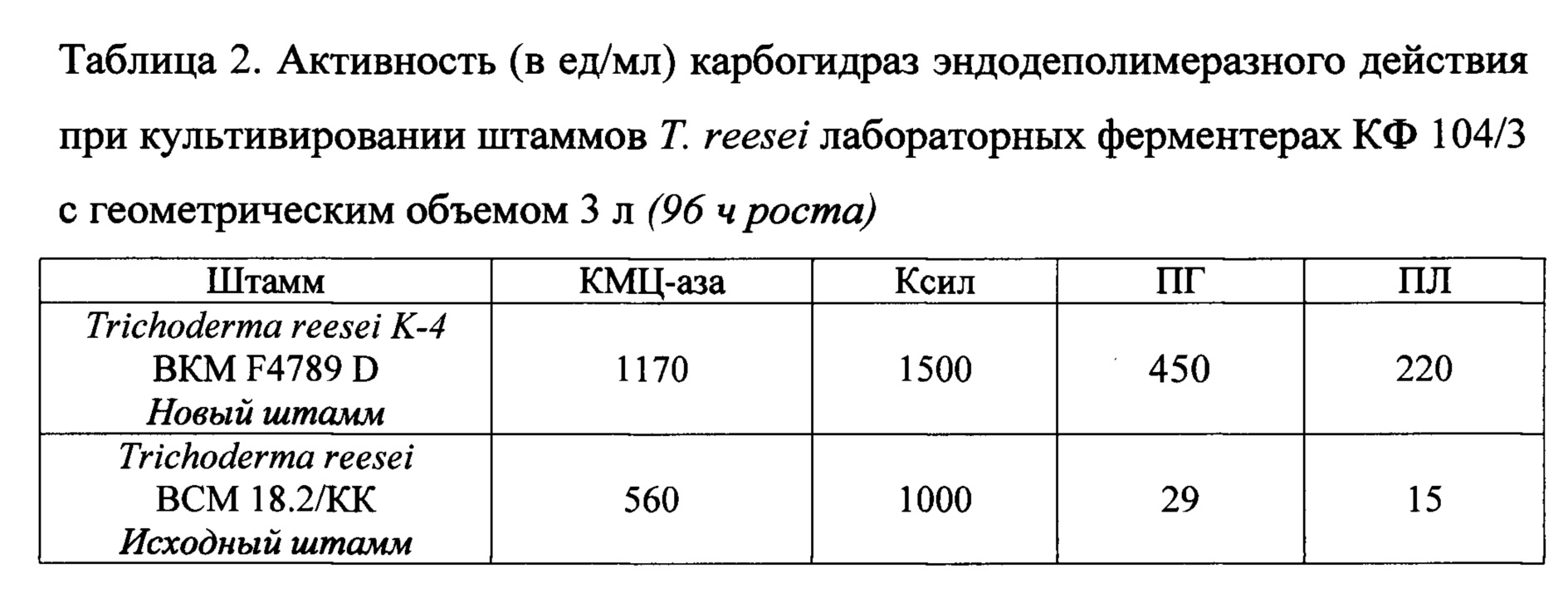
Активности КМЦ-азы, Ксил, ПГ и ПЛ в КЖ на 96 ч ферментации составляют 1170, 1500,450 и 220 ед/мл, соответственно.
При культивировании исходного штамма Т. reesei ВСМ 18.2/КК в лабораторном ферментере активности КМЦ-азы, Ксил, ПГ и ПЛ в КЖ на 96 ч культивирования в аналогичных условиях составляют 560, 1000, 29 и 15 ед/мл, соответственно.
Пример 3. Проводят процесс культивирования штаммов Т. reesei K-4 и Т. reesei ВСМ 18.2/КК в лабораторных ферментерах КФ 104/3 (по примеру 2). По окончании ферментации грибную биомассу удаляют путем центрифугирования (4000 об/мин в течение 20 мин на центрифуге Avanti JXN-26, «Beckman coulter», США), свободную от клеток КЖ концентрируют с помощью ультрафильтрации (с пределом отсечения 10 кДа), ультраконцентрат замораживают при температуре -70°С и сушат на лиофильной сушке Benchtop 2K ES («VirTis», США) или сушат на распылительной сушилке Buchi Mini Soray Dryer B-290 («Buchi»? Швейцария) с получением сухого ФП (который представляют собой желто-коричневый легко растворимый в водной среде порошок). ФП представляют собой желто-коричневый легко растворимый в водной среде порошок. Характеристики получаемых ФП представлены в таблице 3.
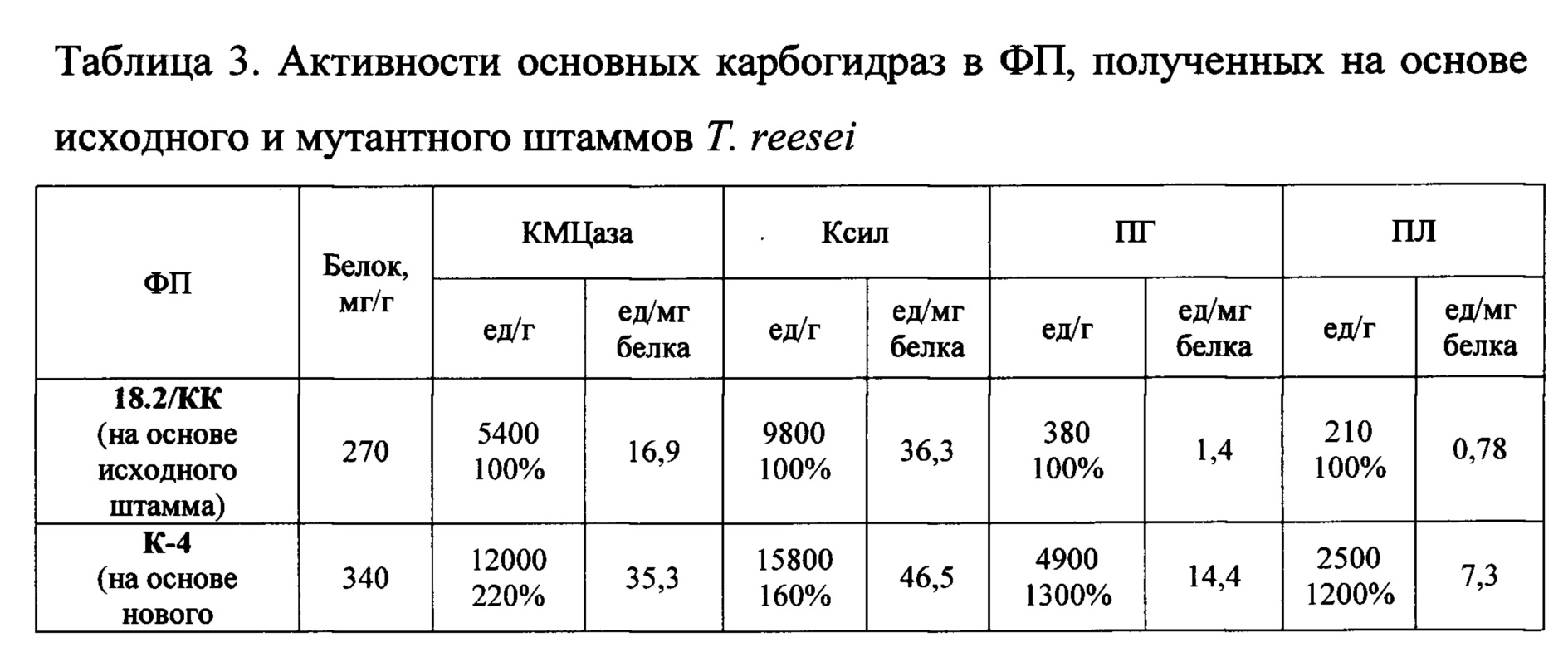

Из данных таблицы 3 очевидно, что в ФП на основе нового мутантного штамма обладают повышенной активностью ферментов целлюлолитического комплекса - эндоглюканазы и ксиланазы (220% и 160%, соответственно), а также высокой полигалактуроназной и пектинлиазной активностью (1300% и 1200%, соответственно, относительно исходного штамма).
Таким образом, предлагаемый штамм обладает способностью продуцировать одновременно высокую эндоглюканазную, ксиланазную и пектиназную активности, что создает возможность получения ФП со сбалансированным комплексом ферментов для эффективной переработки НКП злаков. Для культивирования нового штамма могут использоваться питательные среды, традиционно применяемые в промышленных технологиях получения такого рода технических ФП.
Преимуществом нового комплексного ФП является синергический эффект воздействия специфичных ферментов комплекса на зерновые и зернобобовые смеси, который обеспечивает устранение антипитательных свойств водорастворимых НКП, эффективное разрушение матрикса клеточных стенок и повышение концентрации растворимых веществ, что приводит к улучшению реологических свойств кормов, увеличивает их энергетическую ценность и усвояемость.
Пример 4. Применение ФП на основе нового штамма для гидролиза зерновых смесей при получении кормов.
В качестве субстратов использовали смесь пшеничной (50%), и овсяной (50%) муки. Для ферментативной обработки использовали опытные образцы ФП на основе Т. reesei К-4, и образец ФП 18.2/КК, полученный на основе исходного штамма, характеристики которых приведены в примере 3. Гидролиз субстратов проводили в качалочных колбах объемом 750 мл при 40°С при 220 об/мин. Концентрация субстрата составляла 250 г/л, ФП вносили в дозировке 0,025 мг белка ФП/ г субстрата (сырья). Через 3 ч инкубирования в полученных гидролизатах измеряли вязкость с использованием вибрационного вискозиметра SV-10, A&D (Япония).
В табл. 4 представлены данные изменения вязкости зернового замеса под действием ФП Т. reesei.

Видно, что обработка смеси пшеничной и овсяной муки новым комплексным ФП К-4, при внесении его в количестве 0,0025% от массы субстрата, способствует максимальному снижению вязкости смеси, что является весьма важным аспектом положительного «кормового» действия ферментов.
Пример 5. Применение ФП на основе нового штамма для гидролиза белоксодержащих смесей при получении кормов.
В качестве субстрата использовали тестированный соевый шрот, экструдированный с использованием двухшнекового экструдера  (Германия) при температуре 120-130°С.
(Германия) при температуре 120-130°С.
В качестве ФП использовали:
- комплексный ФП К-4 (характеристики приведены в примере 3);
- Ладозим Респект Ультра («Микробиопром», РФ) с активностью КМЦ-азы - 350 ед/мл, Ксил - 240 ед/мл, ПГ - 340 ед/мл, содержанием белка - 30 мг/мл.
Комплексные ФП дозировали по активности КМЦ-азы из расчета 5 ед. на 1 г сырья. Гидролиз проводили в течение 5 ч при температуре 40°С при естественном рН водной суспензии экструдированного соевого шрота в диапазоне 6,0-6,2, при гидромодуле 1:6. Полученный гидролизат центрифугировали на ЦЛС-3 с ротором РУ 8-90 (фактор разделения 6000) в течение 20 мин, образовавшийся осадок высушивали до постоянной влажности и определяли содержание сырого протеина (по ГОСТ 13496.4-93). Контрольный вариант инкубировали в аналогичных условиях (5 ч, 40°С, 220 об/мин) без внесения ФП.

Полученные данные показывают, что обработка белоксодержащего субстрата - соевого шрота, ФП К-4 обеспечивает максимальный выход сырого протеина в полученных продуктах, что свидетельствует об эффективности его применения для гидролиза НКП сои.
Таким образом, предложенный способ создает возможность получения комплексных кормовых ферментных препаратов со сбалансированным составом, одновременно содержащий высокую активность эндоглюканазы, ксиланазы и пектиназы, использование которых приводит к повышению кормовой ценности рационов.
Список литературы
1. Bedford M.R. Enzymes in farm animal nutrition / M.R. Bedford, G.G. Partridge. - UK: CAB International, 2010. - 319 p.
2. Бутейкис Г. Ферменты - гарантия ощутимой выгоды сегодня и в будущем / Г. Бутейкис, Д. Блажинскас // Комбикорма. - 2012. - №6. - С. 105-106 3. Karr-Lilienthal L.K. Chemical and nutritional properties of soybean carbohydrates as related to nonruminants: A review / L.K. Karr-Lilienthal, C.T. Kadzere, C.M. Grieshop, G.C. Fahey Jr. // Livestock Production Science. - 2005. - V. 97(1).- P. 1-12.
4.  B. Dietary Fibre Content in Lupine (Lupinus albus L.) and soybean (Glycine max L.) Seeds / B.
B. Dietary Fibre Content in Lupine (Lupinus albus L.) and soybean (Glycine max L.) Seeds / B.  Z.
Z.  // Acta Vet Brno. - 2010. - V. 79(2). - P. 211-216
// Acta Vet Brno. - 2010. - V. 79(2). - P. 211-216
5. Забодалова Л.А. Применение ферментативного гидролиза в технологии белковых концентратов из люпина / Л.А. Забодалова, М.Л. Доморощенкова, Т.Ф. Демьяненко, Л.М. Кузнецова // Научный журнал НИУ ИТМО. Серия «Процессы и аппараты пищевых производств». - 2012. - №2.
6. Кононенко С.И. Ферментный препарат в кормлении свиней / С.И. Кононенко // Научный журнал КубГАУ. - 2012. - №78 (04). - С. 1-23
7. Glencross B.D. Harvesting the Benefits of Grain in Aquaculture Feeds / B.D. Glencross Ed. - 13th February 2007, Fremantle, WA, Australia. - 102 p.
8. Синицын А.П. Ферментные новшества / А.П. Синицын, О.А. Синицына, О.Г. Короткова // Агробизнес. - 2016. - Т. 38, №4. - С. 88-92
9. Sajith S. An Overview on Fungal Cellulases with an Industrial Perspective / S. Sajith, P. Priji, S. Sreedevi, S. Benjamin // J Nutr Food Sci. - 2016. - V. 6. - P. 461.
10. Walia A. Microbial xylanases and their industrial application in pulp and paper biobleaching: a review / A. Walia, S. Guleria, P. Mehta, A. Chauhan, J. Parkash // 3 Biotech. - 2017. - V. 7(1). - 11 p.
11. Tapre A. Pectinases: Enzymes for fruit processing industry / A. Tapre, R.K. Jain // International Food Research Journal. - 2014. - V. 21. - P. 447-53.
12. Sieiro С Microbial Pectic Enzymes in the Food and Wine Industry // Food Industrial Processes - Methods and Equipment / С Sieiro, B.  , J.
, J.  A.F. Silva, T.G. Villa / Ed. Benjamin Valdez - InTech, 2012. - P. 201-218.
A.F. Silva, T.G. Villa / Ed. Benjamin Valdez - InTech, 2012. - P. 201-218.
13. Манукян В.А. Эффективность ферментов Микротек и Юдозайм в комбикормах для бройлеров / В.А. Манукян, Е.Ю. Байковская, О.Б. Миронова, А.В. Силаева // Птица и птицепродукты. - 2016. - №1. - С. 34-37.
14. Кузнецов И.Н. Комплексная микробиологическая переработка послеспиртовой барды с получением белоксодержащего кормового продукта / И.Н. Кузнецов, Н.С. Ручай // Современные проблемы науки и образования. - 2013. - №3. URL: http://www.science-education.ru/109-9230 (дата обращения: 15.10.2018).
15. Цурикова Н.В. Получение белковой добавки для аквакультуры на основе экструдированного соевого шрота с применением отечественных ферментных препаратов / Н.В. Цурикова, В.В. Скороход, А.П. Синицын // В сборнике: Стратегические направления развития АПК стран СНГ материалы XVI Международной научно-практической конференции: в трех томах. - 2017. - С. 295-297
16. Gusakov А.V. Alternatives to Trichoderma reesei in biofuel production / A.V. Gusakov // Trends in biotechnology. - 2011. - V. 29. - №. 9. - C. 419-25.
17. Deshmukh N. Production, Purification, Characterization and Comparison of Polygalacturonase from various strains of Aspergillus / N. Deshmukh, R. Talkal, K. Jha, G. Praveen, Ch. Singh, Prajapati // International Journal Of Scientific & Technology Research. - 2012. - Vol. 1, N 9. - P. 85-91.
18. Патент РФ 2393212. Штамм гриба Aspergillus foetidus 379-к - продуцент пектолитических ферментов. 2010.
19. Патент РФ 2549706 С1. Штамм гриба Aspergillus foetidus - продуцент комплекса пектиназ, β-глюканазы, ксиланазы, целлюлазы, хитиназы, маннаназы и протеазы для деструкции полимеров растительного и микробного сырья. 2015.
20. Патент РФ 2287571. Штамм мицелиального гриба Trichoderma longibrachiatum - продуцент комплекса карбогидраз, содержащего целлюлазы, бета-глюканазы, ксиланазы, маннаназы и пектиназы. 2006.
21. Патент РФ 2303057. Штамм мицелиального гриба Aspergillus aculeatus - продуцент комплекса карбогидраз, содержащего ксиланазы, бета-глюканазы, пектиназы и ксилоглюканазы. 2007.
22. Патент РФ 2323973 С1. Штамм мицелиального гриба Aspergillus foetidus ВКМ F-3890F, продуцента кислой протеазы и комплекса ферментов, содержащего пектиназу (полигалактуроназу), ксиланазы, б-глюканазу, арабиназу, галактаназу, ксилоглюканазу, сахаразу, α-L-арабинофуранозидазу, б-глюкозидазу и амилазу. 2008.
23. Патент РФ 2654564. Штамм мицелиального гриба Trichoderma longibrachiatum TW-14-220 - продуцент целлюлаз, бета-глюканаз и ксиланаз для кормопроизводства и способ получения кормового комплексного ферментного препарата. 2018.
24. Патент РФ 2001949. Штамм гриба Trichoderma reesei - продуцент целлюлолитических ферментов. 1993.
25. Синицын А.П. Биоконверсия лигноцеллюлозных материалов / А.П. Синицын, А.В. Гусаков, В.А. Черноглазов. - М.: МГУ, 1995. - 144 с
26. Collmer A. Assay methods for pectic enzymes / A. Collmer, J. Reid, M. Mount // Methods Enzymol. - 1988. - V. 161. - P. 329-335.

