Результат интеллектуальной деятельности: Штамм бактерии Escherichia coli/pTdcR-TurboYFP, обладающий чувствительностью к терагерцовому излучению
Вид РИД
Изобретение
Изобретение относится к области биотехнологии и генной инженерии и может быть использовано для тестирования присутствия в окружающей среде терагерцового (ТГц) излучения, применяемого в научных исследованиях, а также в приборах медицинского и других назначений.
С вхождением в эпоху интенсивного научно-технического прогресса начинает повсеместно использоваться неионизирующее электромагнитное излучение, в частности, ТГц излучение, которое по частотному диапазону располагается между высокочастотным микроволновым и длинноволновым инфракрасным диапазонами в интервале частот от 0,3 до 10 ТГц, т.е. 0,3×1012-10×1012 Гц (длина волны 1 мм - 30 мкм).
Известны способы тестирования ТГц излучения, основанные на физических принципах: межподзонные переходы и связанные с ними явления в квантовых ямах, сверхрешетках и точках; туннелирование с участием фотонов в резонансных туннельных диодах. Данный вид излучения тестируется также путем регистрации фотонов с помощью одноэлектронных транзисторов и поверхностных волн в транзисторах с высокой подвижностью электронов и др. [1].
Основным недостатком физических способов тестирования ТГц излучения является отсутствие эффективных ТГц приемников, а также сложность их использования и необходимость высокой квалификации оператора.
Современная экологическая обстановка диктует необходимость тестирования чистоты воды, воздуха и пищевых продуктов, что требует создания новых высокоэффективных и чувствительных методов, которые бы в отсутствие знаний о природе токсического для организма человека вещества, выявляли его присутствие в различных средах. Разработка бактериальных биосенсоров предоставила такую возможность [2]. В основе биосенсора лежит способность клетки отвечать на токсическое воздействие активацией своих защитных систем. Каскады генов активируются в клетке в присутствии агентов, повреждающих структуру и функции клетки [3, 4]. Промоторы таких генов и являются чувствительным звеном геносенсорной конструкции. Они связаны с репортерным геном, появление продукта которого свидетельствует об активации системы. В качестве репортерных генов используют гены, кодирующие флюоресцентные или люминесцентные белки, которые легко детектируются [5].
К настоящему времени разработан ряд достаточно эффективных геносенсорных конструкций на основе промоторов генов, являющихся ключевыми регуляторами стрессовых ответов или основными эффекторами ответа на стресс. Известны геносенсорные конструкции, способные выявлять различные токсические агенты, например, агенты, индуцирующие окислительный стресс у бактериальных клеток [6, 7], агенты, повреждающие ДНК [8], белки или мембраны [9], а также сенсоры, регистрирующие присутствие тяжелых металлов [10, 11].
Известен штамм Escherichia coli (Е. coli), содержащий рекомбинантные плазмиды с бактериальными luxCDABE-генами под контролем индуцибельных стрессовых промоторов PrpoE и PgrpE и неиндуцибельного Plac промотора, и разработанный на их основе набор проб бактериальных клеток Е. coli для тестирования детергентов гидрофобной природы в окружающей среде [12].
Известен штамм Е. coli, содержащий рекомбинантные плазмиды с бактериальными luxCDABE-генами под контролем индуцибельных стрессовых промоторов PkatG, PsoxS, PrecA, PgrpE, и разработанный на их основе набор проб бактериальных клеток Е. coli для тестирования гептила в окружающей среде [13].
Известен штамм Е. coli, содержащий генетическую конструкцию pDps-GFP, продуцирующий флюоресцентный белок green fluorescent protein (GFP) в присутствии фенола и перекиси водорода [14].
Известен штамм Е. coli, содержащий генетическую конструкцию pKatG-GFP, продуцирующий флуоресцентный белок GFP в присутствии веществ, индуцирующих окислительный стресс у бактериальных клеток [15].
Недостатком вышеназванных штаммов-геносенсоров является их непригодность для тестирования ТГц излучения.
Наиболее ближайшим к заявляемому штамму - прототипом, является штамм Е. coli/pGlnA-GFP, содержащий геносенсорную конструкцию pGlnA-GFP, включающую ген, кодирующий флуоресцентный белок GFP, находящийся под регуляторным контролем промотора гена glnA Е. coli, обеспечивающего продукцию флуоресцентного белка GFP в присутствии ТГц излучения [17].
Задачей изобретения является получение рекомбинантного штамма, обеспечивающего продукцию флуоресцентного белка turbo yellow fluorescent protein (TurboYFP) в присутствии ТГц излучения.
Технический результат: получение рекомбинантного штамма бактерий Е. coli/pTdcR-TurboYFP с повышенной генетической стабильностью, обладающего чувствительностью к ТГц излучению, позволяющего использовать его в качестве геносенсора для тестирования присутствия ТГц излучения.
Полученный рекомбинантный штамм Е. coli/pTdcR-TurboYFP способен продуцировать флуоресцентный белок TurboYFP, обладающий усиленной в сравнении с GFP флуоресценцией. Штамм также имеет преимущество в более высокой генетической стабильности за счет мутаций по хромосомным генам endA, recA и hsdR.
Штамм Е. coli/pTdcR-TurboYFP может быть использован для исследования влияния ТГц излучения на регуляторные элементы клеток E. coli и выявления последовательности изменений в экспрессии различных генов при ТГц облучении.
Сущность предлагаемого изобретения заключается в следующем.
Генно-инженерными методами получают плазмиду pTdcR-TurboYFP, несущую ген, кодирующий флуоресцентный белок TurboYFP под контролем промотора гена активатора оперона L-треониндегидратазы.
Исходным генетическим материалом для конструирования рекомбинантной плазмиды pTdcR-TurboYFP являются:
- плазмида pTurboYFP-B (Evrogen),
- фрагмент промотора гена активатора оперона L-треониндегидратазы -69…+157 относительно сайта начала транскрипции,
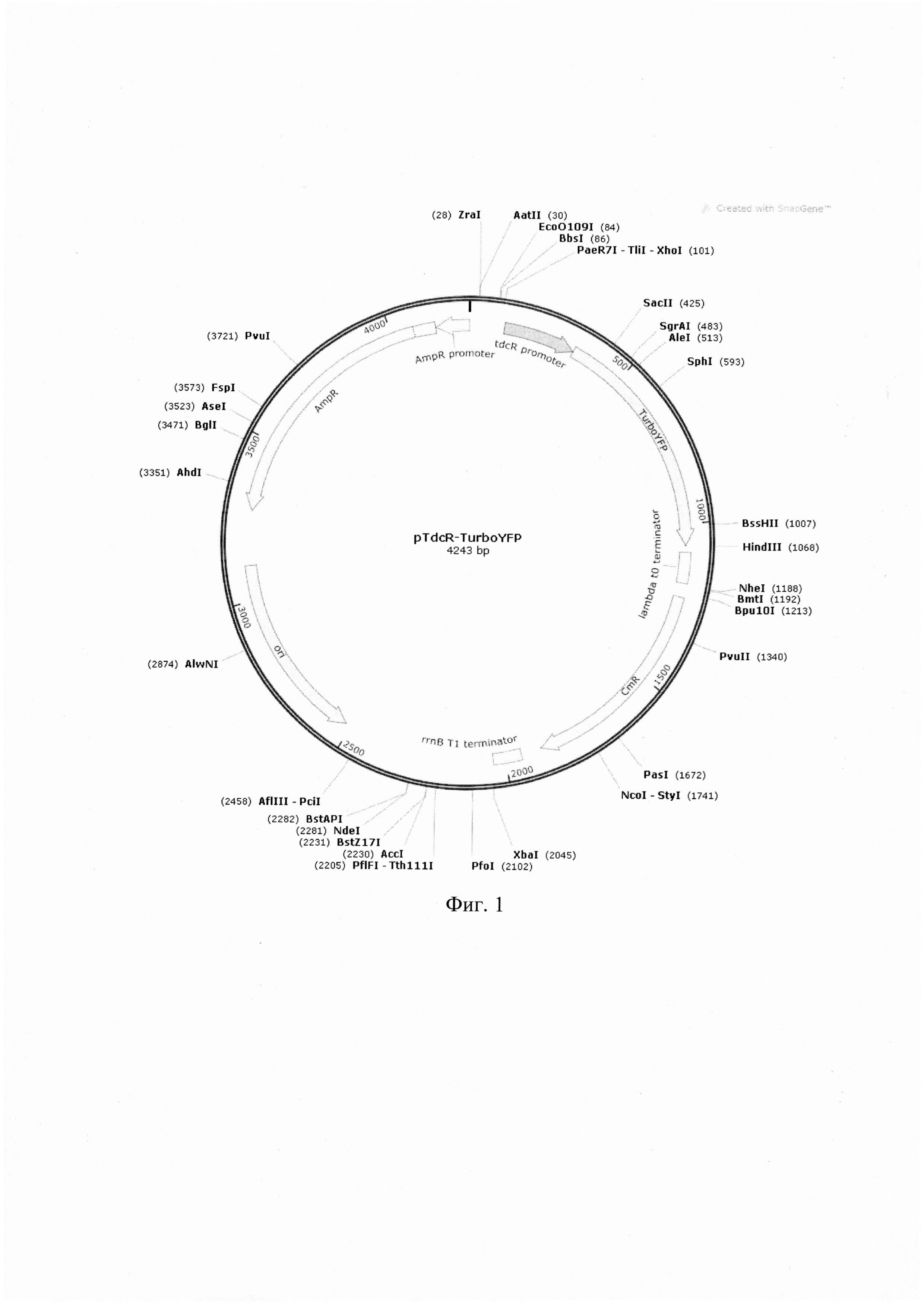
Полученная плазмида pTdcR-TurboYFP (фиг. 1) характеризуется следующими признаками:
- имеет размер 4243 п.о.;
- содержит искусственный ген, кодирующий флуоресцентный белок TurboYFP, под контролем промотора гена tdcR;
- состоит из следующих элементов:
ampR - ген, кодирующий белковую последовательность, обеспечивающую устойчивость клетки к ампициллину;
ampR promoter - промотор, регулирующий работу гена ampR;
cmr - ген, кодирующий белковую последовательность, обеспечивающую устойчивость клетки к хлорамфениколу;
lambda t0 terminator - терминатор транскрипции t0 фага лямбда;
rrnB T1 terminator - терминатор транскрипции Т1 гена rrnB Е. coli;
ori - начало репликации плазмидной конструкции;
TurboYFP - ген, кодирующий последовательность белка TurboYFP и находящийся под контролем промотера гена tdcR Е. coli;
tdcR promoter - промотер гена tdcR Е. coli.
Функциональная карта плазмиды pTdcR-TurboYFP представлена на фиг. 1.
Нуклеотидная последовательность промоторной области гена tdcR Е. coli приведена на фиг. 2.
Предлагаемый штамм получают трансформацией клеток бактерии Е. coli JM109 плазмидой pTdcR-TurboYFP методом электропорации на электропораторе Gene Pulser Xcell (Bio-Rad) [16]. Отбор трансформантов осуществляют на среде Lysogeny broth (LB) с ампициллином (100 мг/л).
Штамм Е. coli/pTdcR-TurboYFP имеет следующие характеристики.
Грамотрицательные палочки. При росте на LB-агаре колонии гладкие, круглые, блестящие, сероватые, мутные, край ровный. При росте в жидких средах LB образуют интенсивную муть. Клетки прямые, палочковидной формы, подвижные.
Физиолого-биохимические признаки.
Штамм является факультативным аэробом. Оптимальная температура роста 37°С. Хорошо растет в пределах рН среды от 7,0 до 8,0. Штамм характеризуется способностью использовать в качестве субстратов пептон, дрожжевой экстракт.
Генетические признаки, устойчивость к антибиотикам.
Штамм устойчив к ампициллину благодаря наличию в клетке плазмиды pTdcR-TurboYFP, несущей ген устойчивости к ампициллину под регуляцией соответствующего промотора. Штамм устойчив к налидиксовой кислоте благодаря наличию в бактериальной хромосоме гена устойчивости к налидиксовой кислоте под регуляцией соответствующего промотора. Штамм обладает повышенной генетической стабильностью благодаря мутациям по хромосомным генам endA, recA и hsdR.
Условия хранения штамма.
Штамм Е. coli/pTdcR-TurboYFP хранят в среде LB с глицерином (t=-70°C) не менее года или на агаризованной среде LB со 100 мкг/мл ампициллина на чашках Петри (t=+8°С), или в стеклянных пробирках со скошенным агаром (t=+4°С). Во втором и третьем случаях пересевы на свежие среды делают один раз в месяц.
Изобретение иллюстрируется следующими примерами.
Пример 1. Конструирование плазмиды pTdcR-TurboYFP.
Геносенсорную конструкцию на основе промотора гена tdcR получали путем амплификации ПЦР-фрагмента базовой плазмиды pTurboYFP-B, в котором исключен участок ДНК с промотором Т5, и встройки на его место нужной промоторной последовательности гена tdcR.
Для этого была проведена амплификация плазмиды pTurboYFP-B с использованием праймеров:
прямой - 5' atgagcagcggcgcc;
обратный - 5' tttctcgaggtgaagacgaaagg.
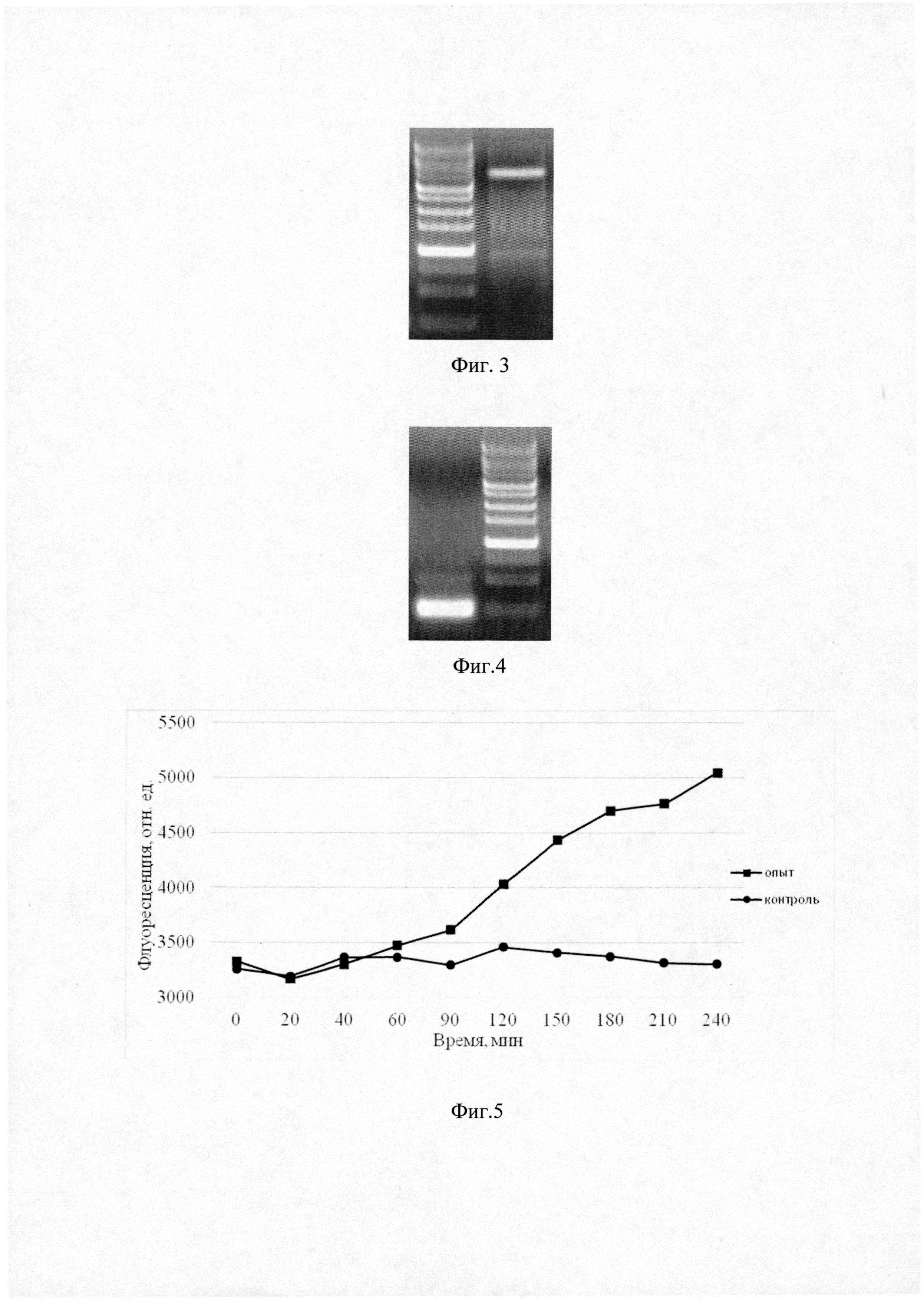
Полученный ПЦР-фрагмент базовой плазмиды pTurboYFP-B с расчетной длиной 4017 п.о. анализировали с помощью электрофореза в 1% агарозном геле. На фиг. 3 представлена электрофореграмма данного ПЦР-фрагмента.
После проведения ПЦР реакционную смесь очищали от исходной плазмиды pTurboYFP-B путем обработки рестриктазой MalI.
Для получения ДНК-фрагмента, содержащего промоторную последовательность гена tdcR использовали праймеры:
прямой - 5' cctttcgtcttcacctcgagaaatcaatactttccagagtatcgttattacaat;
обратный - 5' ggcgccgctgctcattaaatttaactcaaattttgcctggtaattatcc.
В качестве матрицы использовали хромосомную ДНК Е. coli JM109. Полученный ПЦР-фрагмент, содержащий промоторную последовательность гена tdcR, с расчетной длиной 264 п.о. анализировали с помощью электрофореза в 1% агарозном геле. На фиг. 4 представлен ПЦР-фрагмент, содержащий промоторную последовательность гена tdcR и необходимый для создания геносенсорной конструкции pTdcR-TurboYFP.
Неочищенные ПЦР-фрагменты сшивали по Гибсону с помощью готовой смеси Gibson Assembly Master Mix (New England Biolabs).
Правильность конструирования геносенсорной конструкции pTdcR-TurboYFP подтверждали секвенированием области встройки промоторной области гена tdcR.
Пример 2. Выращивание штамма Е. coli/pTdcR-TurboYFP.
Клетки Е. coli JM109 трансформировали путем электропорации плазмидой pTdcR-TurboYFP. Ночные культуры клеток геносенсоров подращивали на свежей среде LB со 100 мкг/мл ампициллина до оптической плотности OD=0,6 (логарифмическая фаза роста).
Пример 3. Исследование чувствительности штамма Е. coli/pTdcR-TurboYFP к присутствию ТГц излучения.
Для индукции синтеза в клетках флуоресцентного белка TurboYFP использовали свежетрансформированную культуру клеток штамма Е. coli/pTdcR-TurboYFP (геносенсор), выращенную на свежей среде LB с антибиотиком до логарифмической фазы роста, как описано выше. По 50 мкл культуры геносенсора помещали в лунки 96-луночного планшета и проводили облучение клеток, которое сопровождалось их нагреванием до 37°С. Для генерации ТГц излучения использовали Новосибирский Лазер на свободных электронах (ЛСЭ) в ЦКП синхротронного и ТГц излучения (ИЯФ СО РАН). В качестве отрицательного контроля служили культуры клеток, которые инкубировали в лунках 96-луночного планшета при 37°С в термостате. После облучения опытных культур, до анализа флуоресценции, опытные и контрольные культуры находились в термостате при температуре 37°С.
Чувствительность клеток к ТГц излучению оценивали по увеличению флуоресценции, измеряемой через 30-40 мин после облучения на планшетном анализаторе VICTOR X3 2030 (Perkin Elmer) со следующими параметрами: время облучения возбуждающим светом 0,1 сек, длина волны возбуждения 485 нм, длина волны эмиссии 535 нм. Измерение флуоресценции проводили каждые 20 или 30 минут. Клетки культивировали на термошейкере PST-60HL (Biosan) при температуре 37°С и 800 об/мин.
На фиг. 5 представлены результаты измерения интенсивности флюоресценции белка TurboYFP в клетках-геносенсорах Е. coli/pTdcR-TurboYFP после воздействия в течение 30 минут ТГц излучением с длиной волны 130 мкм и плотностью мощности 1,4 Вт/см2.
Из фиг. 5 видно, что однократно облученный в течение 30 минут ТГц излучением с длиной волны 130 мкм и плотностью мощности 1,4 Вт/см2 геносенсор Е. coli/pTdcR-TurboYFP начинает синтезировать флеоресцентный белок TurboYFP примерно через 60 мин после начала измерения и продолжает синтез в течение не менее последующих 180 мин.
Увеличение флуоресценции клеток полученного штамма свидетельствует об активации геносенсорной конструкции и, следовательно, о присутствии в среде ТГц излучения.
Использование изобретения позволит быстро в стационарных или полевых условиях определять наличие ТГц излучения в дозах, которые могут иметь биологические эффекты, а также может быть использовано в исследованиях биологических эффектов ТГц излучения.
Источники информации
1. Вакс В.Л., Домрачева Е.Г., Ластовкин А.А., Приползин С.И., Собакинская Е.А., Черняева М.Б., Анфертьев В.А. Приемники излучения терагерцового частотного диапазона // Вестник нижегородского университета им. Н.И. Лобачевского. 2013. №6(1). С. 81-86.
2.  S.F. Microbial biosensors // Biosens Bioelectron. 2001. V. 16. P. 337-353.
S.F. Microbial biosensors // Biosens Bioelectron. 2001. V. 16. P. 337-353.
3. Zheng M., Wang X., Templeton L.J. Smulski D.R., LaRossa R.A., Storz G. DNA microarray-mediated transcriptional profiling of the Escherichia coli response to hydrogen peroxide // J. Bacteriol. 2001. V. 183(15). P. 4562-4570.
4. Khil P.P., Camerini-Otero R.D. Over 1000 genes are involved in the DNA damage response of Escherichia coli // Mol. Microbiol. 2002. V. 44(1). P. 89-105.
5. Hakkila K., Maksimow M., Karp M., Virta M. Reporter genes lucFF, luxCDABE, gfp, and dsred have different characteristics in whole-cell bacterial sensors // Anal. Biochem. 2002. V. 301(2). P. 235-242.
6. Lu C., Albano C.R., Bentley W.E., Rao G. Quantitative and kinetic study of oxidative stress regulons using green fluorescent protein // Biotechnol. Bioeng. 2005. V. 89(5). P. 574-587.
7. Kirn B.C., Gu M.B. A bioluminescent sensor for high throughput toxicity classification // Biosens Bioelectron. 2003. V. 18(8). P. 1015-1021.
8. Justus Т., Thomas S.M. Construction of a umuC'-luxAB plasmid for the detection of mutagenic DNA repair via luminescence // Mutat. Res. 1998. V. 398. P. 131-141.
9. Behor O., Smulski D.R., Van Dyk Т.К., LaRossa R.A., Belkin S. Recombinant microorganisms as environmental biosensors: pollutants detection by Escherichia coli bearing fabA'::lux fusions // J. Biotechnol. 2002. V. 94(1). P. 125-132.
10. Tauriainen S., Virta M., Chang W., Karp M. Measurement of firefly luciferase reporter gene activity from cells and lysates using Escherichia coli arsenite and mercury sensors // Anal. Biochem. 1999. V. 272(2). P. 191-198.
11. Ivask A., Virta M., Kahru A. Construction and use of specific luminescent recombinant bacterial sensors for the assessment of bioavailable fraction of cadmium, zinc, mercury and chromium in the soil // Soil. Biol. Biochem. 2002. V. 34(10). P. 1439-1447.
12. Патент RU 2355760 C1, оп. 20.05.2009.
13. Патент RU 2297450 C1, оп. 11.07.2005.
14. Патент RU 2348687 C1, оп. 10.03.2009.
15. Khlebodarova T.M., Tikunova N.V., Kachko A., Stepanenko I.L., Podkolodny N.L., Kolchanov N.A. Application of bioinformatics resources for genosensor design // J. Bioinform. Comput. Biol. 2007. Vol. 5(2B). P. 931-938.
16. Dower W.J., Miller J.F. Ragsdale C.W. High efficiency transformation of E. coli by high voltage electroporation // Nucleic Acids Res. 1988. Vol. 16(13). P. 6127-6145.
17. Mescheryakova I.A., Demidova E.V., Goryachkovskaya T.N., Demidov E.A., Bryanskaya A.V., Sergeeva S.V., Kiselev S.L., Lagarkova M.A., Kulipanov G.N., Semenov A.I., Vinokurov N.A., Kolchanov N.A., Popik V.M., Peltek S.E. Nonthermal impact terahertz radiation on the living systems // Abstracts of the 10th International Conference on Bioinformatics of Genome Regulation and Structure/Systems Biology, Russia, Novosibirsk, 29 August - 2 September 2016. P. 188.
Штамм бактерии Е. coli/pTdcR-TurboYFP, обладающий чувствительностью к ТГц излучению, полученный путем трансформации штамма Е. coli JM109 плазмидой pTdcR-TurboYFP, сконструированной на основе плазмиды pTurboYFP-B и содержащей ген, кодирующий флуоресцентный белок TurboYFP под контролем промотора гена активатора оперона L-треониндегидратазы.