Результат интеллектуальной деятельности: Полиэпитопная противоопухолевая вакцинная конструкция, содержащая эпитопы опухоль-ассоциированных антигенов, фармацевтическая композиция и ее применение для стимуляции специфического противоопухолевого иммунного ответа
Вид РИД
Изобретение
Изобретение относится к области биотехнологии, а именно - к новым иммуногенным полиэпитопным вакцинным конструкциям, содержащим эпитопы опухоль-ассоциированных антигенов (ЦТЛ-эпитопы и/или Т-хелперные эпитопы) и оптимизированные спейсерные последовательности.
Изобретение может быть использовано для индивидуальной профилактики и терапии раковых заболеваний, в частности, для лечения больных различными эпителиальными формами злокачественных новообразований, в том числе раком молочной железы, колоректальным раком, немелкоклеточным раком легкого и другими видами рака, за счет индукции антиген-специфического иммунного ответа с применением аутологичных дендритных клеток, трансфицированных ДНК-вакцинными конструкциями, кодирующими полиэпитопные иммуногены, содержащие антигенные детерминанты, специфичные для опухоль-ассоциированных антигенов HER-2, mammaglobin-A, NY-BR-1, hMena, WT1, теломераза hTERT, survivin, р53, MUC1, MAGE-A10, NY-ESO-1, MAGE-А3, PRAME, ЕрСАМ, СЕА, GuanylylCyclase С, 5Т4, Legumain, VEGFR-1, VEGFR-2, FAP, Fos-related antigen-1, Brachyury, SOX2, Snail1, Snail2.
Перспективным подходом к лечению рака является активная иммунотерапия, которая в настоящее время представляется неотъемлемой частью современной клинической практики. Поскольку главная цель иммунотерапии при онкологии заключается в обеспечении сильного и устойчивого опухолеспецифического иммунного ответа, достижение подобных результатов возможно через стимуляцию CD4+ и CD8+ Т-клеток [Pardoll and Topalian, 1998; Hungetal., 1998; Marzoetal., 2000; Qin and Blankenstein, 2000]. CD8(+) цитотоксические Т-лимфоциты (ЦТЛ) являются главными эффекторными клетками противоракового иммунного ответа, образование которых зависит от подходящего антигена-мишени и эффективной презентации данного антигена иммунной системе пациента с участием антигенпрезентирующих клеток (АПК). Дендритные клетки являются наиболее эффективными АПК и единственными клетками, способными представлять новые антигены неактивированным Т-клеткам. Поэтому применение аутологичных дендритных клеток, трансфицированных уникальными ДНК-вакцинными конструкциями, кодирующими искусственные полиэпитопные белки-иммуногены, представляет собой хороший инструмент для презентации антигенов иммунной системе пациента.
В практику лечения онкозаболеваний введен препарат против рака простаты, основанный на описанном выше подходе. Это - первая в истории медицины лечебная аутологичная противораковая вакцина Provenge компании Dendreon, одобренная Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов США (Food and Drug Administration, FDA) в марте 2010 г. Вакцина Provenge основана на использовании одного конкретного белка, гиперэкспрессирующегося в клетках опухоли. Фактически почти любой белок, гиперэкспрессирующийся в раковой клетке, может служить подходящей мишенью. Сейчас множество групп исследователей занимаются разработкой терапевтических противораковых вакцин на базе различных ассоциированных с РМЖ антигенов, например, такого, как белок HER-2/neu. В качестве антигенов в них используются фрагменты как внеклеточной, так и внутриклеточной частей белка. В состав некоторых вакцин входил единственный пептид Е75 (369-377) (Mittendorfetal., 2008), другие содержали различные пептиды из HER-2/neu (LiY. etal., 2009). Клинические испытания различных конструкций для индукции ЦТЛ-ответа на базе HER-2/neu показали их низкую токсичность и отсутствие аутоиммунных реакций, при этом в ряде случаев развивались HER2-специфичные клеточный и гуморальный ответы (Disis M.L etal., 1998, Salazar L.G. etal., 2003; Disis M.L. etal., 2004). ДНК-вакцинные конструкции, содержащие эпитопы других антигенов (АГ), также проходят стадии доклинических и клинических испытаний.
Однако, несмотря на некоторые описанные выше успехи, до сих пор не существует одобренной для применения вакцины против РМЖ и большинства других видов рака. Поэтому актуальной задачей является разработка высокоспецифичного противоопухолевого иммуногена и вакцины на его основе, способной эффективно индуцировать цитотоксические Т-лимфоциты (ЦТЛ) и таким образом обеспечивать эффективный противоопухолевый иммунный ответ.
В настоящее время известно большое количество поли-ЦТЛ-эпитопных вакцинных конструкций, содержащих обычно до десятка или несколько более эпитопов.
Известна полиэпитопная конструкция для иммунотерапии колоректального рака, содержащая 11 эпитопов из нескольких опухоль-ассоциированных антигенов колоректального рака (RU 2507265, C12N 15/63, 2014). Была показана иммуногенность конструкции, а также активация противоопухолевых цитотоксических клеток, необходимых для уничтожения опухолевых клеток. Это в очередной раз подтверждает применимость полиэпитопных вакцинных конструкций для иммунотерапии онкологических заболеваний.
В описанной полиэпитопной конструкции Т-хелперные эпитопы и эпитопы ЦТЛ находятся в одной конструкции, что затрудняет эффективную экспрессию как ЦТЛ-эпитопов, так и Т-хелперных эпитопов.
Известны подходы по разработке полиэпитопных конструкций для иммунотерапии немелкоклеточного рака легкого (Identification of HLA-A*0201-restricted Cytotoxic Т Lymphocyte Epitope from TRAG-3Antigen, Zhu et al., ClinCancerRes 2003, Mai, 1). В работе определен HLA-А2.1-рестриктированный ЦТЛ эпитоп антигена TRAG-3, который экспрессируется в 54% клеток карциномы НМРЛ. Гаплотип HLA-A2.1 выбран потому, что HLA-А2.1-экспрессирующие индивидуумы составляют доминирующую долю популяции. Показано, что ЦТЛ, индуцированные пептидом 58-66 антигена TRAG-3, лизирует клетки LB373-MEL, экспрессирующие и TRAG-3 и HLA-А2.1. То есть пептид TRAG-3(58-66) (ILLRDAGLV) является HLA-A2.1-рестриктированным ЦТЛ-эпитопом, способным индуцировать TRAG-3-специфические ЦТЛ in vitro. Это делает его пригодным для специфической иммунотерапии НМРЛ.
Однако использование одного или даже десяти эпитопов - это недостаточно для вызова эффективного иммунотерапевтического ответа. Поэтому здесь существует вопрос увеличения числа использованных эпитопов из по возможности большего количества опухоль-ассоциированных антигенов.
Известна полиэпитопная конструкция, принятая за прототип, применяемая в способе стимуляции цитотоксического иммунного ответа против клеток опухолевой линии аденокарциномы молочной железы, экспрессирующих специфические антигены, с помощью дендритных клеток, трансфицированных полиэпитопной ДНК-конструкцией (RU 2520091, C12N 5/0784, 2014).Последовательность полиэпитопной конструкции приведена в международной заявке «Полиэпитопные конструкции и методы их получения и использования» (WO 2011110953, C07K 14/435, 2011).Генерация антигенспецифических клеток осуществлялось путем магнитной трансфекции полученных зрелых ДК полиэпитопными конструкциями, в том числе HLA-А*0201-специфической полиэпитопной конструкцией, содержащие эпитопы опухоль-ассоциированного антигена Her2. При оценке эффективности индуцированного противоопухолевого цитотоксического ответа, например, против клеток рака молочной железы были достигнуты значения 13,2%.
Вышеописанная конструкция содержит эпитопы только из белка HER2, что несколько ограничивает эффективность противораковой терапии. Использование большего количества эпитопов из разных опухоль-ассоциированных антигенов позволяет преодолеть возможное отсутствие гиперэкспрессии отдельного антигена в раковых клетках, а также преодолеть гетерогенность экспрессии антигенов различными раковыми клетками внутри одной опухоли.
Все вышеописанные полиэпитопные конструкции предназначены для стимуляции цитотоксического иммунного ответа одного конкретного вида рака и их эффективность ограничена.
Задачей изобретения является создание полиэпитопных конструкций, нацеленных на терапию нескольких видов рака, а именно рака молочной железы (РМЖ), колоректального рака (КРР), немелкоклеточного рака легкого (НМРЛ), что оказывает более эффективное терапевтическое действие, а также способов применения этих композиций.
Поставленная задача решается созданием противоопухолевых вакцинных конструкций путем выбора наилучших антигенов с наибольшей иммунотерапевтической эффективностью, на основе отбора ЦТЛ-эпитопов, специфичных для гаплотипа HLA-А*0201 и затем, объединение ЦТЛ-эпитопов в единую последовательность с учетом данных о процессинге и презентации АГ для чего предложены:
Полиэпитопная противоопухолевая вакцинная конструкция (SEQ ID NO 1), обеспечивающая индукцию ответа CD8+ Т-лимфоцитов, представляющая собой искусственный полиэпитопный белок-иммуноген, содержащий множественные рестриктированные HLA-A*0201 ЦТЛ-эпитопы, выбранные из опухоль-ассоциированных антигенов, слитый с N-конца с убиквитином, содержащий на С-конце Т-хелперный эпитоп PADRE, приведенная на фиг. 1.
Полиэпитопная противоопухолевая вакцинная конструкция (SEQ ID NO 2), обеспечивающая индукцию ответа CD8+ Т-лимфоцитов, представляющая собой искусственный полиэпитопный белок-иммуноген, содержащий множественные рестриктированные HLA-A*0201 ЦТЛ-эпитопы, выбранные из опухоль-ассоциированных антигенов, слитый с N-конца с убиквитином, содержащий на С-конце Т-хелперный эпитоп PADRE, приведенная на фиг. 2.
Полиэпитопная противоопухолевая вакцинная конструкция (SEQ ID NO 3), обеспечивающая индукцию ответа CD8+ Т-лимфоцитов, представляющая собой искусственный полиэпитопный белок-иммуноген, содержащий множественные рестриктированные HLA-А*0201 ЦТЛ-эпитопы, выбранные из опухоль-ассоциированных антигенов, слитый с N-конца с убиквитином, содержащий на С-конце Т-хелперный эпитоп PADRE, приведенная на фиг. 3.
Полиэпитопная противоопухолевая вакцинная конструкция (SEQ ID NO 4), обеспечивающая индукцию ответа CD8+ Т-лимфоцитов, представляющая собой искусственный полиэпитопный белок-иммуноген, содержащий множественные рестриктированные HLA-А*0201 ЦТЛ-эпитопы, выбранные из опухоль-ассоциированных антигенов, слитый с N-конца с убиквитином, содержащий на С-конце Т-хелперный эпитоп PADRE, приведенная на фиг. 4.
Полиэпитопная противоопухолевая вакцинная конструкция (SEQ ID NO 5), обеспечивающая индукцию ответа CD8+ Т-лимфоцитов, представляющая собой искусственный полиэпитопный белок-иммуноген, содержащий множественные рестриктированные HLA-А*0201 ЦТЛ-эпитопы, выбранные из опухоль-ассоциированных антигенов, слитый с N-конца с убиквитином, содержащий на С-конце Т-хелперный эпитоп PADRE, приведенная на фиг. 5.
Полиэпитопная противоопухолевая вакцинная конструкция (SEQ ID NO 6), обеспечивающая индукцию ответа CD4+ Т-хелперных лимфоцитов, представляющая собой искусственный полиэпитопный белок-иммуноген, содержащий множественные Т-хелперные эпитопы, выбранные из опухоль-ассоциированных антигенов, слитый с N-конца с сигнальным пептидом, а с С-конца -с С-концевым фрагментом белка LAMP-1 человека, приведенная на фиг. 6.
Набор изолированных полиэпитопных конструкций для стимуляции ответа Т-лимфоцитов, состоящий из двух или более конструкций, выбранных из числа SEQ ID NO 1, SEQ ID NO 2, SEQ ID NO 3, SEQ ID NO 4, SEQ ID NO 5, SEQ ID NO 6.
Изолированная нуклеиновая кислота, кодирующая указанные конструкции.
Наряду с полиэпитопными конструкциями и изолированной нуклеиновой кислотой в изобретении предложены способы применения указанных конструкций, а именно:
Способ применения указанных конструкций или нуклеиновой кислоты для стимуляции ответа Т-лимфоцитов у млекопитающего, включающий введение указанному млекопитающему указанных конструкций или нуклеиновой кислоты.
Способ применения указанных конструкций или нуклеиновой кислоты для лечения эпителиальных форм злокачественных новообразований у млекопитающего, включающий введение млекопитающему указанных конструкций или нуклеиновой кислоты.
Способ применения конструкций или нуклеиновой кислоты для лечения эпителиальных форм злокачественных новообразований, представляющих собой рак молочной железы.
Способ применения конструкций или нуклеиновой кислоты для лечения эпителиальных форм злокачественных новообразований, представляющих собой колоректальный рак.
Способ применения конструкций или нуклеиновой кислоты для лечения эпителиальных форм злокачественных новообразований, представляющих собой немелкоклеточный рак легкого.
Поиск по источникам информации показал, что предложенное изобретение является новым и соответствует требованию «изобретательский уровень». В известных полиэпитопных конструкциях содержится от 1 до нескольких десятков эпитопов. В заявляемых пяти полиэпитопных противоопухолевых вакцинных конструкциях (фиг. 1-5) содержится порядка 200 эпитопов. Кроме того, в отдельную конструкцию выделены Т-хелперные эпитопы (фиг. 6). Разнесение эпитопов ЦТЛ и Т-хелперов по разным конструкциям позволило нам поместить их в более подходящее окружение путем использования соответствующих сигнальных последовательностей и других транслокационных мотивов для направления конструкций в нужный клеточный компартмент. Использование большого количества эпитопов из разных опухоль-ассоциированных антигенов позволяет преодолеть возможное отсутствие гиперэкспрессии отдельного антигена в раковых клетках, а также преодолеть гетерогенность экспрессии антигенов различными раковыми клетками внутри одной опухоли.
Принципиальным отличием также является использование для презентации дендритным клеткам нескольких полиэпитопных конструкций (в заявленном изобретении -пять конструкций), содержащих большое количество (порядка 200) эпитопов из более чем двух десятков опухоль-ассоциированных антигенов, специфичных не только для одной нозологии, например, рака молочной железы, но и для многих других эпителиальных форм рака, включая колоректальный рак и немелкоклеточный рак легкого. Это происходит за счет индукции антиген-специфического иммунного ответа с применением аутологичных дендритных клеток, трансфицированных ДНК-вакцинными конструкциями, кодирующими полиэпитопные иммуногены, содержащие антигенные детерминанты, специфичные для опухоль-ассоциированных антигенов, которые специфичны не только для одного вида рака, но для целого спектра нозологий.
На фиг. 1 представлена полиэпитопная противоопухолевая вакцинная конструкция (SEQ ID NO 1);
на фиг. 2 представлена полиэпитопная противоопухолевая вакцинная конструкция (SEQ ID NO 2);
на фиг. 3 представлена полиэпитопная противоопухолевая вакцинная конструкция (SEQ ID NO 3);
на фиг. 4 представлена полиэпитопная противоопухолевая вакцинная конструкция (SEQ ID NO 4);
на фиг. 5 представлена полиэпитопная противоопухолевая вакцинная конструкция (SEQ ID NO 5);
на фиг. 6 представлена полиэпитопная противоопухолевая вакцинная конструкция (SEQ ID NO 6).
Заявленные в изобретении конструкции создаются следующим образом.
Выбор антигенов
Выбор антигенов является одним из наиболее важных этапов конструирования. Для выбора антигенов используется анализ публикаций в реферируемых журналах и базы данных клинических испытаний http://clinicaltrials.gov. Учитываются объективные параметры и мнения экспертов. Основополагающая подборка опухоль-ассоциированных антигенов с приоритизацией раковых антигенов приведена в работе (Cheever и соавт., 2009).
Помимо антигенов, характерных для определенных видов рака, выделяют «метастатические» антигены. Это основано на том, что крупной первичной опухоли иммунный ответ не очень страшен, поэтому надо бороться с метастазами. Процессы метастазирования разных видов рака весьма похожи. К таким «метастатическим» антигенам относятся: MUC1, матриксные металл опротеазы, рецепторные тирозинкиназы: HER2, EGFR, FSHR, c-Met, PDGFR. Новый интересный подход - вакцина против опухоль-ассоциированных макрофагов, предполагается, что с ее помощью будет меняться микроокружение опухоли (Xiangetal., 2008). Современный обзор по терапевтическим противораковым вакцинам и опухоль-ассоциированными антигенами приведен в работе (Schlom, 2012; Mostafa, Morris, 2014).
Важным критерием выбора антигенов для включения эпитопов из них в состав вакцинных конструкций является выполнение одного из трех условий: либо вакцина на базе такого антигена находится на I-III стадиях клинических испытаний, либо проводятся испытания вакцины на животных, либо, для более новых антигенов, упоминание их в качестве перспективных иммуногенов (Bei, Scardino, 2010; Milanietal., 2014). Важно, чтобы частота встречаемости антигена у больных была относительно высокой (не менее 20%). Важно, чтобы был высокий уровень экспрессии при определенном виде рака (Milanietal., 2013).
На основе опубликованных литературных данных по клиническим испытаниям противораковых вакцин были определены АГ с наибольшей иммунотерапевтической эффективностью: HER-2, mammaglobin-A, NY-BR-1, hMena, WT1, теломераза hTERT, survivin, р53, MUC1, MAGE-A10, NY-ESO-1, MAGE-А3, PRAME, ЕрСАМ, СЕА, GuanylylCyclaseC, 5Т4, Legumain, VEGFR-1, VEGFR-2, FAP, Fos-relatedantigen-1, Brachyury, SOX2, Snail1, Snail2.
Выбор Т-клеточных эпитопов
Предсказание ЦТЛ-эпитопов проводилось на сервере IEDB с помощью метода ANN (метод, основанный на нейронных сетях). Абсолютно такие же результаты выдает сервер NetMHC (Lundegaardetal., 2010), но он менее удобен для работы, так как ограничивает число запросов в сутки с одного IP-адреса. Другие методы предсказания выдают сходные результаты. Также мы использовали разработанное нами программное обеспечение TEpredict, предназначенное для предсказания Т-клеточных эпитопов и основных этапов процессинга антигенов (Антонец, Максютов, 2010).
Предсказание ЦТЛ-эпитопов проводилось для аллельного варианта молекул МНС класса I HLA-A*0201. Пептиды, для которых предсказанное значение pIC50 (характеристика аффинности взаимодействия пептида с молекулой МНС) было больше 6.8, были отобраны для дальнейшего анализа.
В литературе считается, что значение <50 nM соответствует сильному связыванию, от 50 до 500 - слабому связыванию. Есть мнение, что из-за клональной селекции для эпитопов с наиболее сильным связыванием отсутствуют распознающие их Т-клетки, поэтому для каждого антигена было взято несколько эпитопов.
Были предсказаны эпитопы размером 9 и 10 а.о., также использовались эпитопы из литературных источников. Количество эпитопов размером 9 для каждого антигена выбиралось исходя из размеров и важности антигена, обычно порог был в районе 500 nM, для тех антигенов, для которых было предсказано много сильных эпитопов (NY-BR-1, hTERT, MUC1) - в районе 50 nM. Эпитопы размером 10 использовались только при предсказанной константе связывания <50 nM и при отсутствии точного совпадения с используемыми эпитопами размером 9.
Эпитопы из литературных источников (включая совпавшие с предсказанными) повторялись в конструкциях по 2 раза (Wanetal., 2012).
Предсказание Т-хелперных эпитопов (рестриктированных молекулами МНС класса II) проводилось с использованием программ TEpredict и NetMHC.
Одним из механизмов формирования эффективного иммунного ответа на опухоль является индукция CD8+ ЦТЛ. Индукция происходит за счет распознавания CD8+ ЦТЛ процессированных антигенных пептидных фрагментов в ассоциации с молекулами МНС класса I на поверхности АПК. Антигенные пептиды образуются в цитоплазме клетки в результате расщепления антигенов протеасомами. Протеасомы представляют собой внутриклеточный комплекс из 12-15 различных регуляторных и протеолитических белковых субъединиц (Rock, Goldberg, 1999; Niedermannetal., 1999).
Образование комплексов антигенных пептидов с молекулами МНС класса I происходит в эндоплазматическом ретикулуме, куда пептиды попадают с участием гетеродимерных транспортных белков, кодируемых двумя генами ТАР1 и ТАР2. Наиболее эффективный перенос происходит в том случае, если пептиды содержат 8-15 аминокислотных остатков. После образования комплекса антигенный пептид-молекула МНС класса I, готовый комплекс переносится на поверхность АПК.
Конструирование искусственных полиэпитопных иммуногенов
Несмотря на то, что первые работы показали способность полиэпитопных конструкций, составленных в результате простого объединения эпитопов, индуцировать цитотоксический Т-клеточный ответ на все эпитопы, включенные в состав таких антигенов (Thomsonetal., 1995), в дальнейшем было показано, что иммуногенность пептидов в составе полиэпитопа в значительной степени зависит от фланкирующих аминокислотных остатков, и что при конструировании полиэпитопных иммуногенов следует учитывать особенности протеасомного процессинга антигенов и взаимодействия пептидов с ТАР. Было показано, что введение в состав полиэпитопного иммуногена спейсерных аминокислотных последовательностей, обеспечивающих образование сайтов протеасомного расщепления между эпитопами и оптимизирующих связывание пептидных фрагментов с ТАР, приводит к увеличению иммуногенности таких конструкций за счет повышения эффективности процессинга и презентации целевых эпитопов иммунной системе. В настоящее время известны аминокислотные мотивы, определяющие аффинность связывания олигопептидов с комплексом ТАР (Peters В etal., 2003, J. Immunol, 171: 1741-1749; Doitchinova I. etal., 2004, J. Immunol, 173: 6813-6819), и вырожденные мотивы, определяющие эффективность сайтов (иммуно)протесомного расщепления (Toesetal., 2001). На основе анализа эффективности процессинга антигенов и аффинности связывания пептидов с ТАР нами был разработан простой алгоритм конструирования поли-ЦТЛ-эпитопных иммуногенов за счет подбора оптимальных спейсерных последовательностей для каждой пары эпитопов.
Дизайн полиэпитопных вакцинных конструкций
Согласно приведенным выше данным, отобранные нами ЦТЛ-эпитопы, были предсказаны с учетом протеасомного процессинга. Для этого использовали программу NetChop (IEDB AnalysisResource), основанную на нейронных сетях. А также, с учетом ТАР-процессинга, для предсказания которого использовалась функция, предложенная (Petersetal., 2003). Функция Peters добавляет к N-концу пептида А либо AY. Для объединения в единую конструкцию использовали случайное перемешивание эпитопов. При этом в составе полиэпитопного иммуногена эпитопы могут перекрываться между собой как минимум одним аминокислотным остатком. Два, три и более эпитопов могут последовательно (стык в стык) располагаться внутри полипептида. Альтернативно, любые два эпитопа могут разделяться спейсерами А, АА, AAA. Выбор типа объединения эпитопов определяется теоретическим предсказанием процессинга полиэпитопной конструкции согласно условиям, описанным выше. При этом эпитопы внутри полипептидного иммуногена могут располагаться в произвольном порядке. Длина каждого эпитопа от 8 до 10 аминокислотных остатков, а суммарная полиэпитопная конструкция, ограничивается 1000 ак.
Таким образом, разработана стратегия создания искусственных полиэпитопных вакцинных конструкций (белков-иммуногенов), содержащих множественные ЦТЛ- и Т-хелперные эпитопы опухоль-ассоциированных антигенов, обеспечивающая индукцию эффективного противоопухолевого клеточного иммунного ответа.
Одним из примеров полиэпитопных иммуногенов, содержащих антигенные детерминанты, специфичные белкам HER-2, mammaglobin-A, NY-BR-1, hMena, WT1, теломераза hTERT, survivin, р53, MUC1, MAGE-A10, NY-ESO-1, MAGE-А3, PRAME, EpCAM, CEA, GuanylylCyclaseC, 5T4, Legumain, VEGFR-1, VEGFR-2, FAP, Fos-relatedantigen-1, Brachyury, SOX2, Snail1, Snail2 с учетом эффективности протеасомного процессинга, взаимодействия антигенных пептидов с ТАР1/ТАР2 с целью увеличения эффективности презентации эпитопов на поверхности АПК по сравнению с использованием нативных АГ, является:
Полиэпитопная противоопухолевая вакцинная конструкция (SEQ ID NO 1), специфичная HLA-A*0201 (см. фиг.. 1);
Полиэпитопная противоопухолевая вакцинная конструкция (SEQ ID NO 2), специфичная HLA-A*0201 (см. фиг. 2);
Полиэпитопная противоопухолевая вакцинная конструкция (SEQ ID NO 3), специфичная HLA-А*0201 (см. фиг. 3);
Полиэпитопная противоопухолевая вакцинная конструкция (SEQ ID NO 4), специфичная HLA-А*0201 (см. фиг. 4);
Полиэпитопная противоопухолевая вакцинная конструкция (SEQ ID NO 5), специфичная HLA-A*0201 (см. фиг. 5);
Полиэпитопная противоопухолевая вакцинная конструкция (SEQ ID NO 6) (см. фиг. 6).
Способы применения полиэпитопных вакцинных конструкций, заявленных в изобретении.
Стратегия вакцинации предполагает совместное введение пациенту одной или нескольких конструкций для вызова ответа CD8+ ЦТЛ и одной или нескольких конструкций для вызова ответа CD4+ Т-хелперных лимфоцитов.
Полиэпитопные конструкции согласно настоящему изобретению могут быть введены непосредственное виде очищенных рекомбинантных белков, но предпочтительно их вводят в виде части иммуногенных композиций, содержащих фармацевтически приемлемый носитель и/или вспомогательное вещество. В одном из конкретных вариантов осуществления полиэпитопные конструкции согласно настоящему изобретению вводят совместно (вместе в одной композиции или отдельно в двух разных композициях, которые могут быть введены одновременно или последовательно в тот же участок или в разные участки) с адъювантом. Может быть применен любой известный в данной области техники адъювант. Предпочтительно, эти адъюванты представляют собой фармацевтически приемлемые для применения у людей. Кроме того, они могут быть введены в составе вирусоподобных частиц, липосом, в комбинации с катионными пептидами и других иммуностимулирующих комплексов. Предложенные полиэпитопные иммуногены могут быть использованы в различных комбинациях, вместе и по отдельности.
Полиэпитопные конструкции согласно настоящему изобретению также могут быть введены в виде нуклеиновых кислот, кодирующих такие полиэпитопные конструкции (например, плазмиды, вирусные или любые другие соответствующие векторы). Предложенные полиэпитопные конструкции могут быть использованы, например, в виде ДНК-вакцины - плазмиды со встроенным геном, кодирующим целевую полиэпитопную конструкцию. Ген, кодирующий целевой полиэпитопный иммуноген, может быть встроен в геном вируса или бактерии для получения вакцинного штамма микроорганизма. Вместе с целевым полиэпитопным иммуногеном в состав плазмиды или в геном вакцинного штамма микроорганизма могут быть встроены гены, кодирующие дополнительные факторы, стимулирующие развитие клеточного иммунного ответа, например, ИЛ-12, ИЛ-23, ГМ-КСФ и другие.
Полинуклеотидные фрагменты, кодирующие целевые полиэпитопные иммуногены (либо векторные микроорганизмы, несущие соответствующие гены), могут быть использованы для стабильной или транзиентной трансфекции (или инфекции) клеток, например, антигенпрезентирующих клеток (дендритных клеток, клеток Лангерганса или других АПК). Эти клетки могут быть использованы для клеточной терапии (для стимуляции иммунного ответа insitu) или для стимуляции формирования эффекторных CD8+ и/или CD4+ Т-лимфоцитов invitroc целью использования полученных антигенспецифических эффекторных Т-лимфоцитов в качестве клеточной вакцины.
Предложенные полиэпитопные иммуногены, а также векторные микроорганизмы или иммуностимулирующие комплексы, содержащие гены, кодирующие данные иммуногены, или рекомбинантные полиэпитопные белки, а также АПК, презентирующие предложенные иммуногены, или антигенспецифичные эффекторные Т-лимфоциты, полученные ex vivo могут быть использованы в качестве профилактической или терапевтической противораковой вакцины, в том числе в качестве дополнения различных других схем терапии.
Полипептидные конструкции из нуклеиновых кислот и композиции согласно настоящему изобретению можно вводить разными путями. Например, их можно вводить в слизистую оболочку (например, влагалища, носа, нижних дыхательных путей или желудочно-кишечного тракта - например, прямой кишки). Описанные формы данных вакцинных конструкций могут вводиться подкожно, внутрикожно, внутримышечно, внутривенно, орально, через респираторный тракт, в различных сочетаниях, любым другим образом.
Специалистам в области техники, к которой относится настоящее изобретение, ясно, что данное изобретение может быть воплощено в иных формах, нежели изложенные выше, не отступая при этом от сущности и основных характеристик изобретения. Следовательно, изложенные выше конкретные варианты изобретения следует рассматривать как иллюстрирующие, но не ограничивающие. Кроме того, следует понимать, что процедуры и материалы, не описанные конкретно в данной заявке, являются стандартными процедурами и материалами, известными специалисту. Для лучшего понимания сущности изобретения ниже следуют примеры его осуществления. Следует понимать, что указанные примеры приведены исключительно в иллюстративных целях и не предполагают какого-либо ограничения объема предложенного изобретения.
ПРИМЕРЫ
В изобретении использовали протокол получения активированных ДНК-вакцинами, содержащими полиэпитопные иммуногены, дендритных клеток (ДК) и пула обученных и размноженных ex vivo цитотоксических Т-лимфоцитов, с целью формирования полноценного противоракового иммунного ответа invivo.
Для полученных полиэпитопных иммуногенов были созданы соответствующие искусственные гены. Полинуклеотидные последовательности были оптимизированы для экспрессии в клетках человека, для чего из искусственных генов были исключены редко используемые кодоны. Дизайн нуклеотидных последовательностей проводили с таким расчетом, чтобы минимизировать сложность вторичной структуры матричной РНК.
Для создания ДНК-вакцинных конструкций с использованием полученных искусственных генов была выбрана плазмида pmax.
Было создано несколько конструкций:
Конструкция pmax-CTL1, содержащая эпитопы из MAGE-A10, NY-ESO-1 и MUC-1.
Конструкция pmax-CTL2, содержащая эпитопы из MAGE-А3, PRAME, ЕрСАМ и MUC-1.
Конструкция pmax-CTL3, содержащая эпитопы из ЕрСАМ, СЕА, GuanylylCyclase С и 5Т4.
Конструкция pmax-CTL4, содержащая эпитопы из Legumain, VEGFR-1, VEGFR-2, FAP и Fos-related antigen-1.
Конструкция pmax-CTL5, содержащая эпитопы из Brachyury, SOX2, Snail1 и Snail2.
Конструкция pmax-PolyTh, содержащая эпитопы из HER2, hTERT, р53, WT1, NY-ESO-1, VEGFR-2, survivin и MAGE-A3.
Техническим результатом является создание такого комплекса вакцинных конструкций, который обеспечивает формирование эффективного протективного и терапевтического клеточного иммунного ответа не только антигенспецифических цитотоксических CD8+ Т-лимфоцитов, но и интенсивный ответ CD4+ Т-лимфоцитов. Указанный технический результат достигается получением вышеперечисленных конструкций (pmax-CTL1, pmax-CTL2, pmax-CTL3, pmax-CTL4, pmax-CTL5, pmax-PolyTh).
Далее проводилась оценка эффективности индукции Т-клеточного ответа invitro с помощью полученных полиэпитопных конструкций.
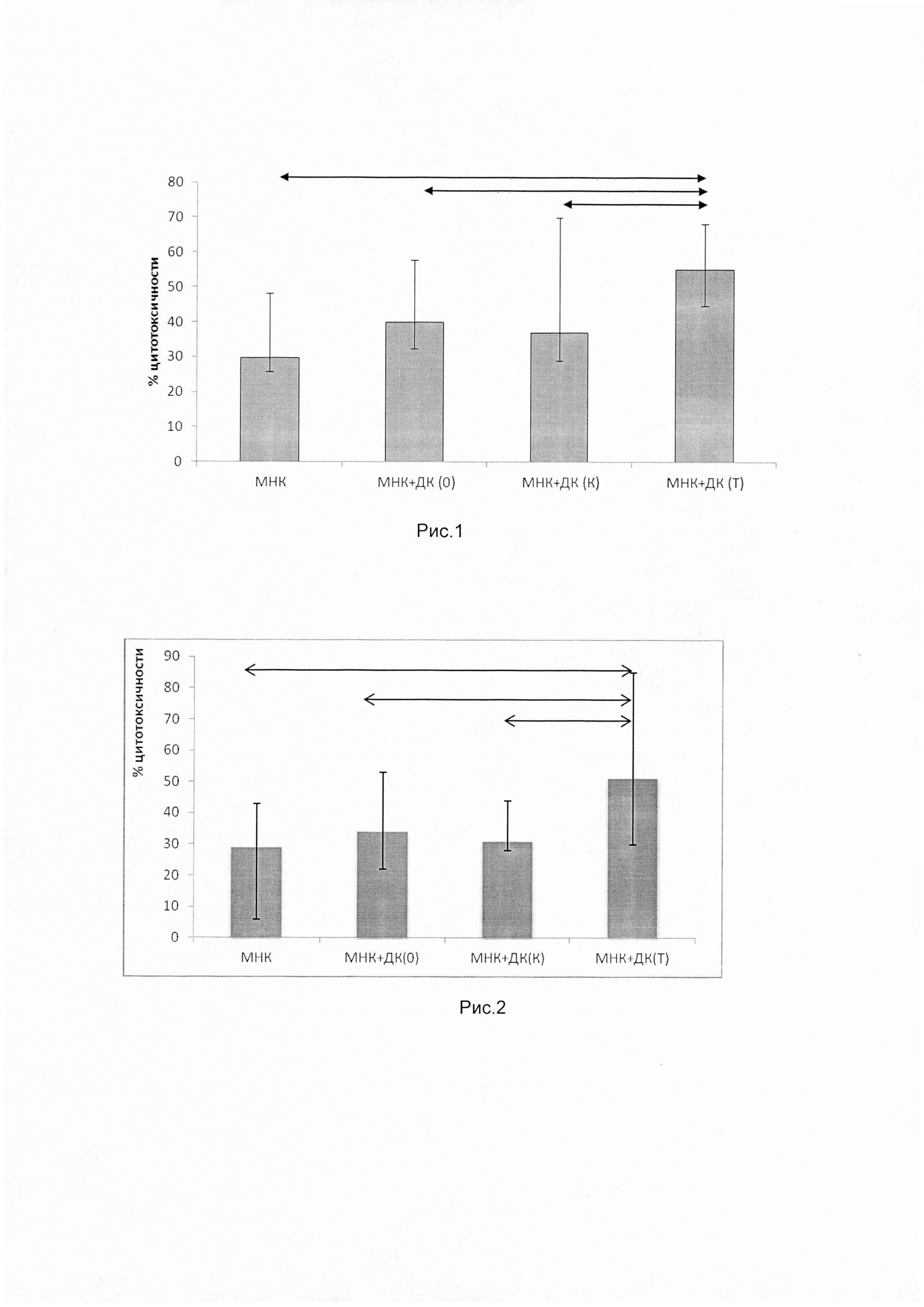
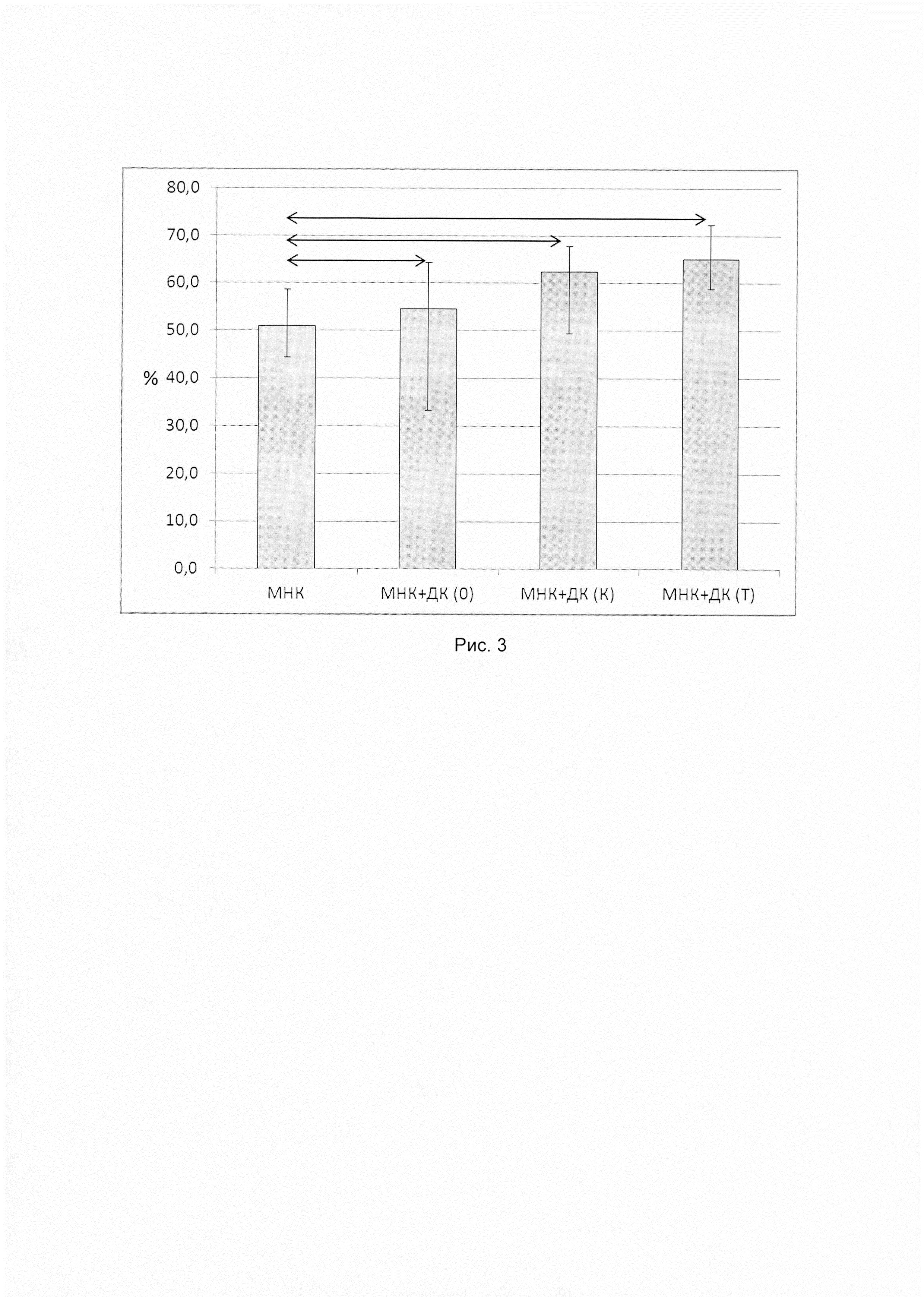
Выделенную из периферической крови онкологических больных (рак молочной железы, немелкоклеточный рак легкого и колоректальный рак) прилипающую фракцию мононуклеарных клеток культивировали в концентрации в полной среде, содержащей 10% эмбриональной телячьей сыворотки, 2 мМ L-глютамина, 10 мМ HEPES, 5×10-5 мМ 2-меркаптоэтанола, 80 мкг/мл гентамицина, 100 мкг/мл ампициллина в атмосфере 5% СО2 при 37°C с добавлением рчГМ-КСФ (50 нг/мл) и рчИЛ-4 (100 нг/мл). Через 72 часа культивирования к полученным незрелым ДК добавляли рчФНО-α в дозе 25 нг/мл для до созревания и культивировали их еще 24 часа. Затем проводили магнитную трансфекцию описанных ДНК-конструкций в полученные зрелые дендритные клетки с помощью коммерческого набора MATra-А («Promokine», США). Спустя 24 ч полученные антиген-активированные дендритные клетки культивировали с неприлипшей фракцией мононуклеарных клеток в соотношении 1:10. Далее для определения модуляции цитотоксической активности Т-лимфоцитов с помощью полученных ДК оценивали гибель опухолевых клеток в цитотоксическом тесте. Для этого к мононуклеарным клеткам больного, которые предварительно сокультивировали с трансфицированными плазмидами ДК, добавляли аутологичные опухолевые клетки. Цитотоксичность оценивали по увеличению содержания внутриклеточного фермента лактатдегидрогеназы в кондиционной среде в результате гибели опухолевых клеток. Показано достоверное повышение значения цитотоксичности, что служит показателем активации противоопухолевых цитотоксических клеток, необходимых для уничтожения опухолевых клеток (рис. 1, 2 и 3).
На рисунке 1 представлен цитотоксический ответ культуры мононуклеарных клеток больных раком молочной железы, сокультивированных с аутологичными дендритными клетками, трансфицированных полиэпитопной ДНК-конструкцией, против аутологичных опухолевых клеток (n=14), где
МНК - мононуклеарные клетки;
МНК+ДК(0) - МНК, сокультивированные с дендритными клетками (ДК) без нагрузки антигеном;
МНК+ДК(К) - МНК, сокультивированные с ДК, трансфицированные контрольной ДНК-конструкцией без опухолевых антигенов;
МНК+ДК(Т) - МНК, сокультивированные с ДК, трансфицированные ДНК-конструкцией, кодирующей эпитопы опухоль-ассоциированных антигенов.
Данные представлены в виде медианы и размаха квартилей. Стрелками обозначены достоверные различия между группами (р≤0,05).
На рисунке 2 представлен цитотоксический ответ культуры мононуклеарных клеток больных немелкоклеточным раком легкого, сокультивированных с аутологичными дендритными клетками, трансфицированных полиэпитопной ДНК-конструкцией, против аутологичных опухолевых клеток (n=13), где
МНК - мононуклеарные клетки без культивирования с ДК;
МНК+ДК(0) - совместная культура МНК и нетрансфицированных ДК; МНК+ДК(К) - совместная культура МНК и ДК, трансфицированных контрольной плазмидой;
МНК+ДК(Т) - совместная культура МНК и ДК, трансфицированных целевой плазмидой (конструкцией);
Данные представлены в виде медианы и размаха квартилей. Стрелками обозначены достоверные различия между группами (р≤0,05).
На рисунке 3 представлен цитотоксический ответ культуры мононуклеарных клеток больных колоректальным раком, сокультивированных с аутологичными дендритными клетками, трансфицированных полиэпитопной ДНК-конструкцией, против аутологичных опухолевых клеток (n=10), где
МНК - мононуклеарные клетки,
МНК+ДК(0) - мононуклеарные клетки, культивированные в присутствии дендритных клеток без трансфекции ДНК-конструкций,
МНК+ДК(К) - мононуклеарные клетки, культивированные в присутствии дендритных клеток, трансфицированных контрольной плазмидой,
МНК+ДК(Т) - мононуклеарные клетки, культивированные в присутствии дендритных клеток, трансфицированных целевой плазмидой (ДНК-конструкции).
Данные представлены в виде медианы и размаха квартилей. Стрелками обозначены достоверные различия между группами (р≤0,05).
Таким образом, совместное культивирование МНК с ДК, трансфицированными ДНК-конструкцией, кодирующей эпитопы опухоль-ассоциированных антигенов, является эффективным способом генерации специфических цитотоксических клеток мононуклеарного происхождения, что проявляется в усилении их цитотоксического противоопухолевого ответа.
Селекция опухоль-ассоциированных антигенов, эпитопы из которых использованы для создания вакцинных конструкций, осуществлялась на основе специфичности для иммунотерапии нескольких эпителиальных злокачественных новообразований, в том числе рака молочной железы, колоректального рака и немелкоклеточного рака легкого. Предложенные ДНК-конструкции могут быть использованы также при других видах злокачественных новообразований эпителиального генеза, например, рак яичника, рак пищевода, рак простаты и других видов рака. Такое массированное применение полиэпитопных конструкций, совместно содержащих большое количество целевых эпитопов из основных опухоль-ассоциированных антигенов, дает возможность получать более уверенное и более эффективное иммунотерапевтическое противоопухолевое воздействие в первую очередь за счет более широкого спектра применимости как к отдельным клеткам конкретной раковой опухоли (за счет более уверенного нацеливания на раковые клетки из-за большего числа мишеней-эпитопов в применяемых полиэпитопных конструкциях), так и на опухоль в целом (за счет большего покрытия клеток опухоли, опять же за счет более уверенного нацеливания на раковые клетки из-за большего числа мишеней-эпитопов в применяемых полиэпитопных конструкциях).
Литература
1. Антонец Д.В., Максютов А.З. TEpredict: программное обеспечение для предсказания Т-клеточных эпитопов. // Молекулярная биология. 2010. Т. 44, С. 130-139.
2. Bei R., Scardino А. ТАА Polyepitope DNA-Based Vaccines: A Potential Tool for Cancer Therapy. // J. Biomedicine and Biotechnology. 2010. V. 2010. Article ID 102758. doi: 10.1155/2010/102758.
3. Cheever M.A., Allison J.P., Ferris A.S., Finn O.J., Hastings B.M., Hecht T.T., Mellman I., Prindiville S.A., Viner J.L., Weiner L.M., Matrisian L.M.. The Prioritization of Cancer Antigens: A National Cancer Institute Pilot Project for the Acceleration of Translational Research. // Clin. Cancer Res. 2009. V. 15. P. 5323-5337. doi: 10.1158/1078-0432.CCR-09-0737.
4. Lundegaard C., Hoof I., Lund O., Nielsen M. State of the art and challenges in sequence based T-cell epitope prediction. // Immunome Res. 2010. V. 6. Suppl. 2. S3, doi: 10.1186/1745-7580-6-S2-S3.
5. Milani A., Sangiolo D., Montemurro F., Aglietta M., Valabrega G. Active immunotherapy in HER2 overexpressing breast cancer: current status and future perspectives. // Ann. Oncol. 2013. V. 24. №7. P. 1740-1748.
6. Milani A., Sangiolo D., Aglietta M., Valabrega G. Recent advances in the development of breast cancer vaccines. // Breast Cancer: Targets and Therapy. 2014. V. 6. P. 159-168.
7. Mostafa A.A., Morris D.G. Immunotherapy for Lung Cancer: Has it Finally Arrived? // Frontiers in Oncology. 2014. 4:288. doi: 10.3389/fonc.2014.00288.
8. Niedermann G., Geier E., Lucchiari-Hartz M., Hitziger N.. Ramsperger A., Eichmann K. The specificity of proteasomes: impact on MHC class I processing and presentation of antigens. // Immunol. Rev. 1999. V. 172. P. 29-48.
9. Peters B, Bulik S, Tampe R, Van Endert PM &  H.G. Identifying MHC class I epitopes by predicting the TAP transport efficiency of epitope precursors. Journal of immunology (Baltimore, Md.: 1950). 2003. 171, 1741-9.
H.G. Identifying MHC class I epitopes by predicting the TAP transport efficiency of epitope precursors. Journal of immunology (Baltimore, Md.: 1950). 2003. 171, 1741-9.
10. Rock K.L., Goldberg A.L. Degradation of cell proteins and the generation of MHC class l-presented peptides. // Annu. Rev. Immunol. 1999. V. 17. P. 739-779.
11. Schlom J. Therapeutic Cancer Vaccines: Current Status and Moving Forward. // J. Natl. Cancer Inst. 2012. V. 104. №8. P. 599-613. doi: 10.1093/jnci/djs033.
12. Wan Y., Wang J., Zhou H., Hu Z., Ren X., Xu J. The Average IFN-γ Secreting Capacity of Specific CD8+ T Cells Is Compromised While Increasing Copies of a Single T Cell Epitope Encoded by DNA Vaccine. // Clinical and Developmental Immunology. 2012; 2012: 478052. doi: 10.1155/2012/478052.
13. Xiang R., Luo Y., Niethammer A.G., Reisfeld R.A. Oral DNA vaccines target the tumor vasculature and microenvironment and suppress tumor growth and metastasis. // Immunol. Rev. 2008. V. 222. P. 117-128. doi: 10.1111/j.1600-065X.2008.00613.x.
14. Zhu В., Chen Z., Cheng X., Lin Z., Guo J., Jia Z.,Zou L, Wang Z., Hu Y., Wang D., Wu Y. Identification of HLA-A*0201 -restricted Cytotoxic T - Lymphocyte Epitope from TRAG-3 Antigen. // Clinical Cancer Research. 2003. V. 9. P. 1850-1857.
15. Bei R., Scardino A. TAA Polyepitope DNA-Based Vaccines: A Potential Tool for Cancer Therapy. // Journal of Biomedicine and Biotechnology. 2010. Article ID 102758, 12 pages; doi: 10.1155/2010/102758.
16. Mostafa A.A., Morris Don G. Immunotherapy for lung cancer: has it finally arrived? // Frontiers in Oncology. 2014. V. 4. P. 1-7.