Результат интеллектуальной деятельности: СПОСОБ ПРОГНОЗИРОВАНИЯ БЕЗРЕЦИДИВНОЙ ВЫЖИВАЕМОСТИ У БОЛЬНЫХ МНОЖЕСТВЕННОЙ МИЕЛОМОЙ ПОСЛЕ ПРОВЕДЕНИЯ АУТОЛОГИЧНОЙ ТРАНСПЛАНТАЦИИ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК
Вид РИД
Изобретение
Изобретение относится к медицине, а именно к онкогематологии, и может быть использовано для прогнозирования развития безрецидивной выживаемости у больных множественной миеломой после аутологичной трансплантации гемопоэтических стволовых клеток.
Множественная миелома (ММ) - периферическая B-клеточная лимфоидная опухоль, которая составляет около 10% от всех гемобластозов [1, 2]. ММ характеризуется инфильтрацией костного мозга плазматическими клетками, присутствием моноклонального иммуноглобулина в сыворотке крови и/или моче, остеолизом. Общая 5-летняя выживаемость больных ММ составляет около 15-20% [3]. Неудовлетворительные результаты стандартной химиотерапии ММ привели к широкому применению высокодозной химиотерапии с аутологичной трансплантацией гемопоэтических стволовых клеток (АТГСК). В настоящее время 40% всех АТГСК проводится именно больным ММ независимо от стадии заболевания [1, 3, 4]. По данным Центра международных исследований по трансплантации крови и костного мозга 3-летняя общая выживаемость после АТГСК составляет 72±1% [4].
В связи с этим продолжается поиск эффективных и воспроизводимых методов прогноза течения ММ после АТГСК.
Для прогноза характера течения впервые выявленной ММ или рецидива болезни, а также для оценки эффективности терапии принято использовать определение различных клинических и лабораторных параметров. В 1975 г. Durie В. и Salmon S. предложили определять стадию заболевания по уровню гемоглобина, концентрации кальция в сыворотке крови, уровню продукции М-компонента, рентгенологическим признакам деструкции костей. Подстадия болезни зависит от сохранности функции почек, оцениваемой по уровню креатинина в сыворотке крови [1]. Прогностически значимой считается Международная система стадирования ММ (International Staging System, (ISS), основанная на определении концентрации β2-микроглобулина и альбумина в сыворотке крови. Медиана выживаемости больных MM I стадии составляет 62 месяца, II стадии - 44 месяца, III стадии - 29 месяца [5].
Ранее был предложен способ прогнозирования общей выживаемости больных ММ, основанный на балльной системе оценки концентрации β2-микроглобулина (≥5,7 мг/л - 2 балла) и креатинина (≥110 мкмоль/л - 1 балл) в сыворотке крови, пола пациента (женщины - 1 балл) и иммунохимического варианта болезни (IgA вариант - 1 балл). Отсутствие каждого из факторов оценивается как 0 баллов [6]. В группе низкого риска при сумме баллов 0-1 прогнозируют общую выживаемость в течение 46 месяцев. В группе промежуточного риска при сумме баллов 2-3 балла прогнозируют общую выживаемость в течение 27 месяцев. В группе высокого риска при сумме баллов 4-5 прогнозируют общую выживаемость в течение 9 месяцев.
Общим недостатком этих методов является то, что стадия заболевания выставляется на момент установки диагноза, не учитывая при этом характер проводимого в дальнейшем лечения. Высокодозная химиотерапия с АТГСК может приводить к снижению точности прогноза [6, 7]. Поэтому предложенные подходы характеризуются недостаточно высокой чувствительностью и специфичностью.
Прогностическую ценность, не зависящую от терапии (в том числе от АТГСК), имеет определение методом флюорисцентной гибридизации in situ хромосомных аномалий при ММ, таких как делеция 17p и/или транслокация t(4; 14) [3, 8]. Недостатком этого подхода является высокая стоимость диагностической процедуры и, как следствие, эпизодичность использования в практическом здравоохранении.
Известен способ прогнозирования течения множественной миеломы на основании анализа экспрессии генов [9]. Для его осуществления необходима предварительная магнитная селекция плазматических клеток из крови больных с последующим выделением из них ДНК. Уровни экспрессии 70 генов, ассоциированных с агрессивным течением болезни, определяются с помощью разработанного авторами изобретения набора ДНК-микрочипов.
Недостатками этого способа являются трудоемкость подготовки проб, сложность проведения анализа, ограниченная доступность расходных материалов, обуславливающие чрезвычайно высокую стоимость диагностической процедуры.
Известен способ прогнозирования эффективности терапии ММ на основании анализа генотипа пациента [10]. После выделения ДНК больного оценивают аллельные варианты генов HLA I и II класса. При наличии аллелей HLA-Cw*06, HLA-DQA1*0101 прогнозируют благоприятное течение болезни, при гомозиготных вариантах генов HLA-B*, HLA-Cw*, HLA-DQA1* и/или наличии аллеля HLA-DRB1*07 прогнозируют низкий ответ на проводимую терапию.
Недостатками данного способа являются относительная сложность подготовки проб, дороговизна исследования, а также отсутствие данных о чувствительности, специфичности и показателях выживаемости.
Способы, основанные на анализе генотипа пациента, также описаны в патентах РФ [11, 12]. Они также требуют выделения ДНК, что усложняет методику, и также отсутствуют данные об их чувствительности и специфичности.
В публикациях описаны способы, которые позволяют прогнозировать увеличение общей и беспрогрессивной выживаемости после АТГСК у больных ММ с помощью определения абсолютного количества лимфоцитов (В-клеток) в продукте сепарации более 0,5·109 клеток/кг [13, 14] и абсолютного количества лимфоцитов более 500 клеток/мкл на 15-й день после АТГСК [15].
К недостаткам перечисленных выше маркеров течения болезни после АТГСК можно отнести их недостаточную изученность. В частности, нет информации по чувствительности и специфичности описываемых прогностических факторов.
Ранее также был предложен способ прогноза развития раннего рецидива после АТГСК у больных гемобластозами (в том числе ММ) в период, предшествующий АТГСК [16]. Способ основан на оценке комплекса показателей иммунного статуса у больных гемобластозами в период предшествующий АТСКК по следующим показателям: иммунологический регуляторный индекс (ИРИ, CD4/CD8), относительное количество CD4+- и СD8+Т-клеток в S,G2/M фазах клеточного цикла, относительное количество CD4+- и CD8+Т-клеток в стадии апоптоза, относительное количество CD4+- и CD8+Т-клеток памяти, абсолютное количество CD16+NK-клеток, реакция Г3Т, уровень экспрессии HLA-DR молекул на моноцитах и содержание IgM в сыворотке крови. Прогноз строится с помощью последовательной процедуры Вальда с учетом диагностической информативности (значений диагностических коэффициентов, ДК) анализируемых показателей. При суммарной величине положительных ДК>=+13,0 прогнозируют развитие раннего рецидива, а при суммарной величине отрицательных ДК<=-17,0 прогнозируют благоприятный исход АТСКК.
Недостатками данного метода прогноза являются необходимость оценки большого числа разнородных параметров (относительного содержания 6 субпопуляций клеток методом проточной цитометрии, определения концентрации IgM в сыворотке турбодиметрическим методом, проведения реакции Г3Т). Кроме того, у очень большого числа больных (в 47,5% случаев) прогноз оказывается неопределенным, поскольку суммарная величина как положительных, так и отрицательных диагностических коэффициентов не достигает заданных пороговых значений (ДКпор=+13 или ДКпор=-17).
Наиболее близким к изобретению является способ прогнозирования безрецидивной выживаемости у больных множественной миеломой после АТГСК, включающий проточную цитометрию и оценку относительного содержания одной из популяций В-клеток с использованием ее порогового значения. Этот способ прогнозирует ранний рецидив на основе оценки относительного содержания CD4+FOXP3+ регуляторных Т-клеток методом проточной цитометрии у больных гемобластозами после АТГСК [17]. В соответствии со способом-прототипом обследование больных гемобластозами проводят после процедуры трансплантации в период восстановления лимфоцитов до уровня >500 клеток/мкл, при этом определяют относительное количество циркулирующих CD4+FOXP3+ Т-клеток в периферической крови больных гемапластозами, и при содержании CD4+FOXP3+ Т-клеток более 9,1% прогнозируют развитие раннего рецидива в посттрансплантационном периоде. Показано, что в течение 12 месяцев после АТГСК чувствительность способа составляет 72,7%, специфичность - 77,8%.
Недостатком данного способа прогнозирования является необходимость определения внутриклеточного содержания транскрипционного фактора FOXP3 среди циркулирующих CD4+ Т-лимфоцитов, что усложняет и удорожает способ.
Целью изобретения является упрощение способа прогнозирования безрецидивной выживаемости у больных множественной миеломой после АТГСК.
Задача решается тем, что в способе прогнозирования безрецидивной выживаемости у больных множественной миеломой после аутологичной трансплантации гемопоэтических стволовых клеток (АТГСК), включающем проточную цитометрию и оценку относительного содержания одной из популяций лимфоцитов с использованием ее порогового значения, после процедуры афереза, перед трансплантацией в продукте афереза больного определяют относительное количество CD45+CD19+ В-клеток, и при содержании CD45+CD19+ В-клеток более 2,5% прогнозируют более короткий период безрецидивной выживаемости после АТГСК, а при содержании CD45+CD19+ В-клеток менее 2,5% прогнозируют более продолжительный период безрецидивной выживаемости после АТГСК.
Таким образом в предложенном способе прогноз безрецидивной выживаемости у больных множественной миеломой после АТГСК основан на оценке относительного содержания CD45+CD19+ В-клеток в продукте афереза больных ММ перед АТГСК. Определение относительного количества CD45+CD19+ В-клеток осуществляется с помощью оценки флюорисценции маркеров, находящихся на поверхности клеток, что значительно упрощает способ.
Способ осуществляют следующим образом:
1. Для осуществления трансплантации гемопоэтических стволовых клеток в плановом порядке проводится их аппаратная сепарация с помощью клеточного фракционатора, изолирующего и концентрирующего мононуклеарные клетки периферической крови. После сепарации рутинно проводится оценка содержания гемопоэтических стволовых клеток методом проточной цитометрии, для чего из контейнера с продуктом афереза в стерильных условиях забирается 1 мл содержимого. Учитывая большую концентрацию клеток в продукте афереза, для предлагаемого способа нет необходимости дополнительного забора материала.
2. Для исследования используется клеточная взвесь продукта афереза без предварительной обработки в течение 40 мин после получения. 100 мкл клеточной взвеси переносится в стандартную пробирку для проточной цитометрии. К суспензии клеток добавляют по 20 мкл анти-CD45 и анти-CD19 моноклональных антител, меченных соответственно FITC и РЕ (Becton Dickinson, США), и инкубируют 20-30 мин в темноте при 4°С. После этого в пробу добавляют 500 мкл лизирующего раствора (BD FACS Lysing Solution, Becton Dickinson, США) в соответствии с инструкцией производителя, обеспечивающего разрушение эритроцитов.
3. Сразу после подготовки пробы исследуют на проточном цитометре FACSCalibur (Becton Dickinson, США) с использованием программы CellQuest (Becton Dickinson, США). Цитометрию проводят с использованием параметров прямого и бокового светорассеяния для определения лимфоцитарного гейта, из которого строят график каналов флюоресценции FL-1 (FITC) против FL-2 (РЕ). Определяют относительное содержание двойных позитивных CD45+CD19+ В-клеток.
Возможно применение моноклональных антител других фирм-производителей в соответствии с инструкциями и других лазерных клеточных анализаторов.
4. По относительному содержанию CD45+CD19+ В-клеток в продукте афереза выносится прогностическое заключение о безрецидивной выживаемости в посттрансплантационном периоде.
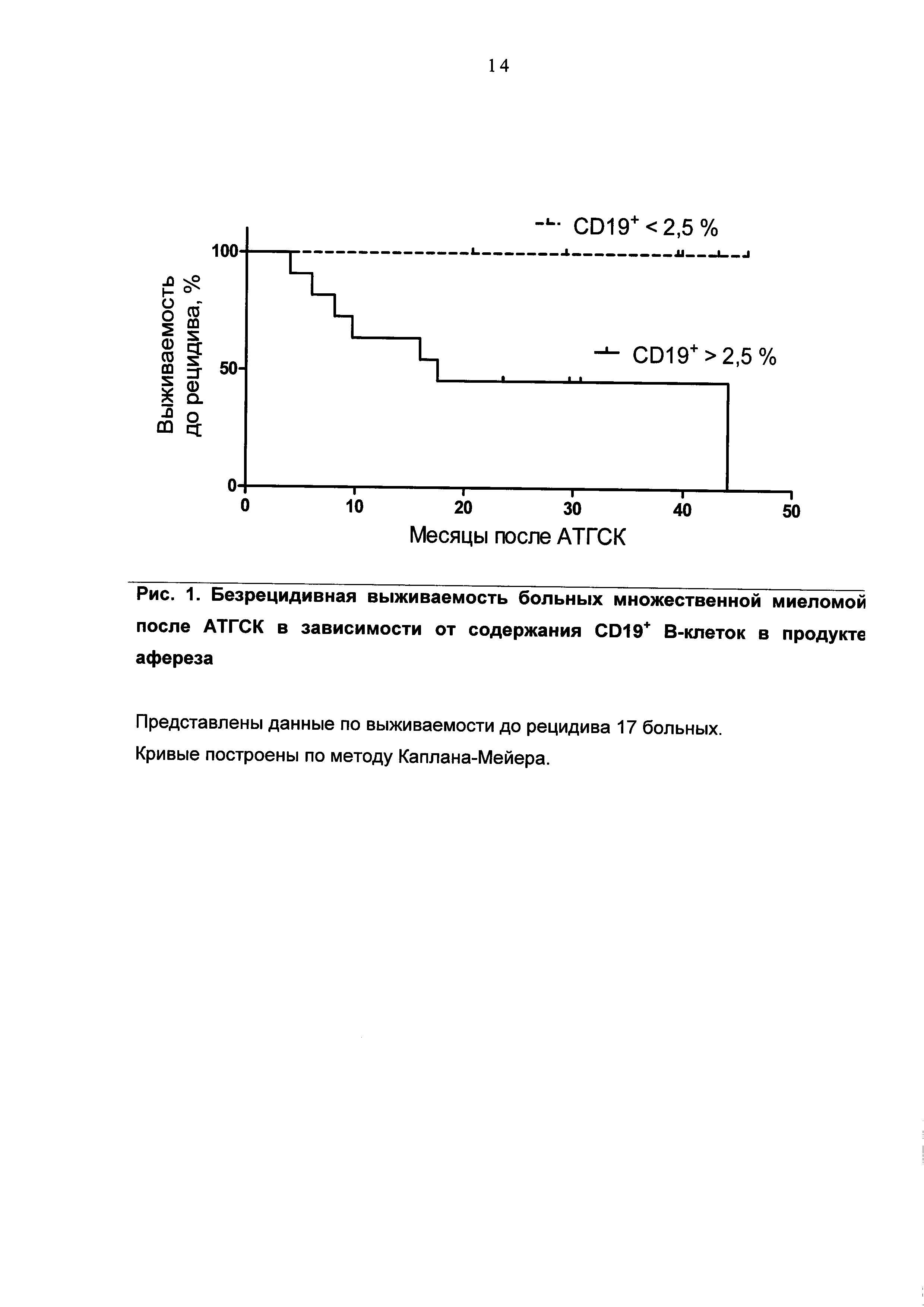
При разработке предлагаемого метода прогноза в группе больных ММ, перенесших АТГСК, была проведена оценка прогностической значимости относительного содержания CD45+CD19+ В-клеток и выделены значения, обладающие диагностической ценностью для определения благоприятного и неблагоприятного течения посттрансплантационного периода.
Для оценки прогностической значимости признака был использован анализ ROC-кривых с вычислением площади под ROC-кривой (AUC). AUC составила 0,80, p=0,04. Определено пороговое значение относительного содержания CD45+CD19+ В-клеток в продукте афереза больных ММ, равное 2,5%. При данном значении чувствительность метода - 100%, специфичность - 60%, отношение правдоподобия (отношение вероятности получить положительный результат для пациента с рецидивом к вероятности получить положительный результат для пациента в ремиссии) - 2,50.
Заявляемый способ был разработан на основании проведенного анализа безрецидивной выживаемости 2 групп больных ММ (n=17), которым была выполнена АТГСК, в зависимости от установленного значения CD45+CD19+ В-клеток в продуктах афереза.
Относительное содержание в продукте афереза CD45+CD19+ В-клеток >2,5% было определено у 11 пациентов. Медиана возраста составила 46 лет (от 37 до 55 лет). Медиана срока наблюдения после АТГСК составила 17,5 месяцев (4-44 месяца). У одного из них на момент АТГСК была зарегистрирована I ст. ММ, у 5 - II ст., у 5 - III ст. Рецидив заболевания за период наблюдения случился у 7 пациентов (у 3 со II ст. и у 4 с III ст.). Медиана выживаемости в данной группе составила 16 месяцев. Доля ложноположительных результатов - 36% (4/11).
Относительное содержание в продукте афереза CD45+CD19+ В-клеток <2,5% было определено у 6 пациентов. Медиана возраста составила 51 год (от 40 до 58 лет). Медиана срока наблюдения после АТГСК составила 40 месяцев (20,7-45,8 месяца). У 4 из них на момент АТГСК была зарегистрирована II ст. ММ, у 2 - III ст. Все пациенты сохранили полную или частичную ремиссию в течение всего срока наблюдения после АТГСК, т.е. за время наблюдения выживаемость составила 100%. Ложноотрицательных результатов не было.
Группы больных ММ в зависимости от содержания CD45+CD19+ В-клеток в продукте афереза значимо отличались друг от друга по частоте развития рецидива, рТМФ=0,017.
При анализе безрецидивной выживаемости больных ММ после АТГСК по методу Каплана-Мейера в зависимости от относительного содержания CD45+CD19+ В-клеток в продукте афереза выявлены значимые различия: p(log-rank)=0,013 (рис. 1).
Таким образом, у больных ММ относительное содержание в продукте афереза CD45+CD19+ В-клеток >2,5% может рассматриваться как неблагоприятный прогностический фактор, свидетельствующий о более коротком периоде безрецидивной выживаемости - 16,7 месяца. Относительное содержание в продукте афереза CD45+CD19+ В-клеток <2,5% свидетельствует о более длительном периоде безрецидивной выживаемости.
Клинические примеры
Пример №1. Больной Щ., 48 лет, поступил в 2011 г. в клинику иммунопатологии ФГБУ НИИКИ СОРАМН с диагнозом: множественная миелома, III ст., диффузно-очаговая форма, IgA-каппа вариант, 1 полная ремиссия. Пациент госпитализирован для проведения курса высокодозной полихимиотерапии с АТГСК. На первом этапе пациент получил курс циклофосфана и Г-КСФ. Сепарировано и криоконсервировано 6·106/кг веса гемопоэтических стволовых клеток (ГСК). Режим кондиционирования: высокодозный алкеран. АТГСК в феврале 2011 г. Осложнений на введение клеток не было. Продолжительность нейтропении 17 дней, восстановление нейтрофилов (>0,5·109/л) на 22-й день после АТГСК. Осложнения в раннем посттрансплантационном периоде: анемия средней степени, тромбоцитопения тяжелой степени.
Была проведена оценка относительного количества CD45+CD19+ В-клеток в продукте афереза пациента. Относительное содержание CD45+CD19+ В-клеток составило 9%, превысив установленный пороговый уровень. Таким образом, был определен прогноз высокого риска раннего неблагоприятного исхода АТГСК. Действительно, пациент без тяжелых осложнений перенес АТГСК и быстро восстановил кроветворение, но в октябре 2011 г. (через 8 месяцев после трансплантации) у него был диагностирован рецидив ММ.
Пример №2. Больной Б., 41 год, поступил в 2012 г. в клинику иммунопатологии ФГБУ НИИКИ СОРАМН с диагнозом: множественная миелома, IIA ст., диффузно-очаговая форма, IgG-каппа вариант, 1 полная ремиссия. Пациент госпитализирован для проведения курса высокодозной полихимиотерапии с АТГСК. На первом этапе пациент получил курс циклофосфана и Г-КСФ. Сепарировано и криоконсервировано 2,6·106/кг веса ГСК. Режим кондиционирования: высокодозный алкеран. АТГСК в январе 2012 г. Осложнений на введение клеток не было. Продолжительность нейтропении 11 дней, восстановление нейтрофилов (>0,5·109/л) на 15-й день после АТГСК. Осложнения в раннем посттрансплантационном периоде: мукозит полости рта II степени, анемия легкой степени, тромбоцитопения тяжелой степени.
Была проведена оценка относительного количества CD45+CD19+ В-клеток в продукте афереза пациента. Относительное содержание CD45+CD19+ В-клеток составило 4%, превысив установленный пороговый уровень. Таким образом, был определен прогноз высокого риска раннего неблагоприятного исхода АТГСК. Действительно, пациент без тяжелых осложнений перенес АТГСК и в короткий период восстановил кроветворение, но в мае 2013 г. (через 15 месяцев после трансплантации) у него был диагностирован рецидив ММ.
Пример №3. Больной М., 51 год, поступил в 2010 г. в клинику иммунопатологии ФГБУ НИИКИ СОРАМН с диагнозом: множественная миелома, III ст., диффузно-очаговая форма, IgG-каппа вариант, 1 частичная ремиссия. Был проведен курс мобилизации периферических ГСК (циклофосфан + Г-КСФ). Криоконсервировано 13,9·106/кг веса ГСК. Режим кондиционирования: высокодозный алкеран. АТГСК - в ноябре 2010 г. Продолжительность нейтропении 9 дней, восстановление нейтрофилов (>0,5·109/л) на 13-й день после АТГСК. Осложнения в раннем посттрансплантационном периоде: мукозит полости рта II степени, энтеропатия II степени, фебрильная лихорадка с ответом на 1-ю линию антибактериальной терапии, анемия средней степени, тромбоцитопения тяжелой степени.
Была проведена оценка относительного количества CD45+CD19+ В-клеток в продукте афереза пациента. Относительное содержание CD45+CD19+ В-клеток составило 0,61%, не достигая установленного порогового уровня. Был определен прогноз низкого риска развития раннего рецидива после АТГСК. Действительно, в динамике последующего клинического наблюдения у пациента сохраняется ремиссия ММ (наблюдение в течение 3,5 лет после АТГСК).
Пример №4. Больной З., 58 лет, поступил в 2010 г. в клинику иммунопатологии ФГБУ НИИКИ СОРАМН с диагнозом: множественная миелома, II ст., диффузно-очаговая форма, IgA вариант, 1 частичная ремиссия. Был проведен курс мобилизации периферических ГСК (циклофосфан + Г-КСФ). Криоконсервировано 4,8·106/кг веса ГСК. Режим кондиционирования: высокодозный алкеран. АТГСК - в августе 2010 г. Продолжительность нейтропении 14 дней, восстановление нейтрофилов (>0,5·109/л) на 18-й день после АТГСК. Осложнения в раннем посттрансплантационном периоде: мукозит полости рта II степени, энтеропатия I степени, фебрильная лихорадка с ответом на 1-ю линию антибактериальной терапии, анемия легкой степени, тромбоцитопения тяжелой степени.
Была проведена оценка относительного количества CD45+CD19+ В-клеток в продукте афереза пациента. Относительное содержание CD45+CD19+ В-клеток составило 2,0%, не достигая установленного порогового уровня. Был определен прогноз низкого риска развития раннего рецидива после АТГСК. Действительно, в динамике последующего клинического наблюдения у пациента сохраняется ремиссия ММ (наблюдение в течение 4 лет после АТГСК).
Предложенный способ позволяет выделить больных, которые имеют достоверно большую вероятность более раннего развития рецидива в посттрансплантационном периоде, что позволяет своевременно скорректировать тактику дальнейшего ведения больного.
Предложенный способ прогнозирования безрецидивной выживаемости у больных множественной миеломой после АТГСК является более простым и экономичным за счет отсутствия специальной пробоподготовки и необходимости проводить внутриклеточную оценку содержания маркера, а также за счет использования минимального количества исследуемого материала и отсутствия необходимости проводить дополнительный забор крови в период выхода больного из лейкопении.
Источники информации:
1. Волкова М.А. Клиническая онкогематология: руководство для врачей / Под ред. М.А. Волковой - М.: Медицина. - 2007. - 1147 с.
2. Vincent Rajkumar S. Multiple myeloma: 2014 Update on diagnosis, risk-stratification, and management // Am J Hematol. - 2014. - Vol. 89, N 10. - P. 999-1009.
3. Multiple Myeloma, Recent Results in Cancer Research Vol. 183 / Moehler T., H. Goldschmidt (eds.). - Springer-Verlag Berlin Heidelberg. - 2011. - P. 340.
4. Pasquini MC, Wang Z. Current use and outcome of hematopoietic stem cell transplantation: CIBMTR summary slides, 2013. Available at: http://www.cibmtr.org
5. Greipp P.R., San Miguel J., Durie B.G., et al. International staging system for multiple myeloma // J Clin Oncol. - 2005. - Vol. 23, N 15. - P. 3412-3420.
6. Загоскина Т.П., Лучинин A.C. Способ прогнозирования общей выживаемости больных множественной миеломой // Патент №2456924 от 27.07.2012 г.
7. Hari Р.Ν., Zhang M.J., Roy V., et al. Is the International Staging System superior to the Durie-Salmon staging system? A comparison in multiple myeloma patients undergoing autologous transplant // Leukemia. - 2009. - Vol. 23, N 8. - P. 1528-1534.
8. Вотякова Ο.M. Современная терапия множественной миеломы // Бюллетень сибирской медицины. - 2008. - Прил. 3. - С. 33-41.
9. Shaughnessy J.D., Zhan F., Barlogie В., Burington В.Ε. Gene expression profiling based identification of genomic signature of high-risk multiple myeloma and uses thereof // US 2008187930 (A1) - 2008-08-07.
10. Bebeshko V.H., Minchenko Z.M., Kriachok I.K., et al. Method for predicting the efficiency of the therapy of multiple myeloma // UA 21112 (U) - 2007-02-15.
11. Бакиров А.Б., Калимуллина Д.Х., Викторова T.B. и др. Способ прогнозирования течения множественной миеломы // Патент №2225612 от 10.03.2004 г.
12. Бакиров А.Б., Калимуллина Д.Х., Бакиров Б.А., Викторова Т.В. Способ прогнозирования течения множественной миеломы // Патент №2282852 от 27.08.2006 г.
13. Porrata L.F., Gertz М.А., Gever S.M., et al. The dose of infused lymphocytes in the autograft directly correlates with clinical outcome after autologous peripheral blood hematopoietic stem cell transplantation in multiple myeloma // Leukemia. - 2004. - Vol. 18. - №6. - P. 1085-92.
14. Hiwase D.K., Hiwase S., Bailey M., Bollard G., Schwarer A.P. Higher infused lymphocyte dose predicts higher lymphocyte recovery, which in turn, predicts superior overall survival following autologous hematopoietic stem cell transplantation for multiple myeloma // Biol Blood Marrow Transplant. - 2008. - Vol. 14. - №1. - P. 116-24.
15. Porrata L.F., Gertz M.A., Inwards D.J., et al. Early lymphocyte recovery predicts superior survival after autologous hematopoietic stem cell transplantation in multiple myeloma or non-Hodgkin lymphoma. // Blood. - 2001. - Vol. 98. - №3. - P. 579-585.
16. Пронкина H.В., Кожевников B.C., Лисуков И.А. и др. Способ прогноза развития раннего рецидива основного заболевания после аутологичной трансплантации периферических стволовых кроветворных клеток у больных гемобластозами // Патент №2337712 от 10.11.2008 г.
17. Баторов Е.В., Тихонова М.А., Крючкова И.В., Останин А.А., Черных Е.Р. Способ прогнозирования раннего рецидива у больных гемобластозами после аутологичной трансплантации стволовых кроветворных клеток // Патент №2498312 от 10.11.2013 г.
Способ прогнозирования безрецидивной выживаемости у больных множественной миеломой после аутологичной трансплантации гемопоэтических стволовых клеток (АТГСК), включающий проточную цитометрию и оценку относительного содержания одной из популяций лимфоцитов с использованием ее порогового значения, отличающийся тем, что после процедуры афереза, перед трансплантацией в продукте афереза больного определяют относительное количество CD45CD19 В-клеток, и при содержании CD45CD19 В-клеток более 2,5% прогнозируют более короткий период безрецидивной выживаемости после АТГСК, а при содержании CD45CD19 В-клеток менее 2,5% прогнозируют более продолжительный период безрецидивной выживаемости после АТГСК.