Результат интеллектуальной деятельности: СПОСОБ ОПРЕДЕЛЕНИЯ УРОВНЯ ТРАНСКРИПЦИИ ГЕНА, КОДИРУЮЩЕГО ХЕМОКИН CCL2 (МСР-1) ЧЕЛОВЕКА И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ
Вид РИД
Изобретение
Настоящее изобретение относится к области медицины, в частности иммунологии, аллергологии и молекулярной биологии, и касается способа определения уровня транскрипции гена, кодирующего хемокин CCL2 (МСР-1) человека методом ОТ-ПЦР с детекцией результатов в режиме реального времени, и набора для его осуществления.
Метод ОТ-ПЦР с детекцией результатов в режиме реального времени широко используется в лабораторной диагностике и научно-исследовательской работе. Основное применение метода - количественное определение молекул мРНК в образце, в том числе и определение уровня экспрессии мРНК генов, кодирующих цитокины человека.
Метод ОТ-ПЦР включает в себя три этапа: синтез молекул кДНК (ДНК, комплиментарных клеточной РНК) при помощи реакции обратной транскрипции; амплификацию последовательности кДНК, соответствующей фрагменту анализируемого гена; анализ полученных результатов и определение относительного количества и уровня экспрессии кДНК анализируемого гена в образце. Количество специфической кДНК в образце, с одной стороны, зависит от уровня экспрессии мРНК соответствующего гена в клетке, с другой стороны, оно определяется объемом клеточного материала в образце, степенью деградации анализируемой РНК и эффективностью реакции обратной транскрипции.
Вышеперечисленные факторы сложно стандартизовать для всех анализируемых образцов. Например, реакция обратной транскрипции чрезвычайно чувствительна к примесям контаминирующих агентов в образце, что может привести к 5-90% колебаниям эффективности реакции [Ferre F.A., Marchese P., Pezzoli S., Griffin E., Buxton H., Boyer V. Quantative PCR: an overview. // Polymerase Chain Reaction. / K.B.Mullis, Ferre F. R.A.Gibbs. - Burkhauser, Boston, 1994. - P.67-88]. Для того чтобы учесть влияние дополнительных факторов на количество кДНК анализируемого гена, для каждого из образцов рассчитывается так называемый «нормировочный коэффициент». При вычислении «нормировочного коэффициента» в каждом образце помимо количества кДНК анализируемого гена определяется количество кДНК «нормировочного гена». В качестве «нормировочных генов» выбираются гены, для которых уровень экспрессии в клетках различных образцов предположительно не изменяется. При выполнении этого условия изменение количества кДНК «нормировочного гена» будет зависеть в основном от влияния дополнительных факторов определяющих кинетику реакции обратной транскрипции.
Подобным свойством обладают, как правило, гены «домашнего хозяйства». Как было показано в публикациях, для нормализации можно использовать гены b- и g-актина [Song Q., Wei Т., Lees-Miller S., Ainemri E., Walters D., Lavin M.F. Resistance ofactin to cleavage during apoptosis. // Proc Natl Acad Sci USA. - 1997. - N1. - P.157-62], циклофилина [Jaschke A., Mi, H. Tropschug, M. Human Т cell cyclophilinl8 binds to thiol-specific antioxidant protein Aopi and stimulates its activity. // J Mol Biol. - 1998. - N4. - P.63-69], глицеральдегид 3-фосфат дегидрогеназы (GAPDH) [Tarze A., Deniaud, A. Le Bras, M. Maillier, E. Molle, D. Larochette, N. Zamzami, N. Jan, G. Kroemer, G. Brenner, C. GAPDH, a novel regulator of the pro-apoptotic mitochondrial membrane permeabilization. // Oncogene. - 2007. - N26. - P.2606-2620], гипоксантин фосфорибозилтрансферазы (HRPT) [Foss D.L., Baarsch M.J., Murtaugh M.P. Regulation of hypoxanthine phosphoribosyltransferase, glyceraldehyde-3-phosphate dehydrogenase and beta-actin mRNA expression in porcine immune cells and tissues. // Anim Biotechnol. - 1998. - N1. - P.67-78.], рибосомального протеина L32 и других рибосомных белков, 18S, 28S rRNA [Finnegan М.С., Goepel J.R., Hancock B.W., Goyns M.H. Investigation of the expression of housekeeping genes in non-Hodgkin's lymphoma. // Leuk Lymphoma. - 1993. - N10. - P.387-393.], РНК-полимеразы II типа (PII), ТАТА-бокс связывающий белок (TBP) [Thellin О., Zorzi W., Lakaye В., De Borman В., Coumans В., Hennen G., Grisar Т., Igout A., Heinen E. Housekeeping genes as internal standards: use and limits // Journal of Biotechnology. - 1999. - N75. - P.291-295].
Недостатком способа нормирования данных с использованием одного нормировочного гена является значительная вариабельность результатов анализа при неверном выборе нормировочного гена. Не существует идеального нормировочного гена, для которого уровень экспрессии будет оставаться постоянным в независимости от ткани и состояния клеток в анализируемом образце. Само понятие постоянного уровня экспрессии гена является достаточно условным. Характер экспрессии многих «нормировочных генов» может варьировать [Goldsworthy S.M., Goldsworthy T.L., Sprankle C.S., Butterworth B.E. Variation in expression of genes used for normalization of Northern blots after induction of cell proliferation. // Cell Prolif. - 1993. - N6. - P.511-518]. Например, экспрессия таких часто используемых для вычисления «нормировочного коэффициента» генов как RPL32 и G3PDH изменяется под влиянием митогенных агентов [Thellin О., Zorzi W., Lakaye В., De Borman В., Coumans В., Hennen G., Grisar Т., Igout A., Heinen E. Housekeeping genes as internal standards: use and limits // Journal of Biotechnology. - 1999. - N75. - Р.291-295]. Экспрессия многих генов домашнего хозяйства тканеспецифична, в частности, было показано, что экспрессия гена b-2-микроглобулина (В2М) различается в 112 раз в тканях мозга плода и лейкоцитах. Ген АСТВ экспрессируется в 22 раза интенсивнее в кардиомиоцитах по сравнению с фибробластами [Schmittgen T.D., Zakrajsek B.A. Effect of experimental treatment on housekeeping gene expression: validation by real-time, quantitative RT-PCR. // Genome Biology. - 2002. - N3. - P.3401-3411]. В связи с этим выбор «нормировочного гена» является одним из самых ответственных этапов при проведении анализа. Наиболее оптимальным можно считать подход, при котором анализируется экспрессия одновременно нескольких «нормировочных генов». «Нормировочный коэффициент» при этом вычисляется как среднее геометрическое или среднее арифметическое от значения относительного количества кДНК всех «нормировочных генов» [Tricarico С., Pinzani P., Bianchi S., Paglierani M., Distante V., Pazzagli M., Bustin S.A., Orlando С.Quantitative real-time reverse transcription polymerase chain reaction: normalization to rRNA or single housekeeping genes is inappropriate for human tissue biopsies. // Anal Biochem. - 2002. - N309. - P.293-300]. Использование такого подхода тоже имеет свои недостатки, связанные в первую очередь с необходимостью постановки большого числа реакций ОТ-ПЦР, что крайне неудобно в условиях клинически значимого приложения метода. Кроме того, данный подход иногда невозможен в связи с крайне малым количеством клеточного материала в образце.
Другим слабым моментом метода ОТ-ПЦР является этап анализа полученных измерений. В большинстве случаев уровень экспрессии кДНК оценивается относительно уровня экспрессии нормировочного гена при помощи метода ДДС1. При этом относительное количество мРНК определяется в соответствии с уравнением (1)
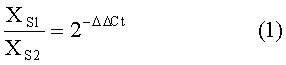
где
ΔΔCt=(CtS1-CtNorm1)-(CtS2-CtNorm)
Ct - значение цикла амплифакации в точке пересечения кинетической кривой накопления продукта амплификации с линией порогового уровня флуоресценции. Пороговый уровень флуоресценции определяется автоматически программным обеспечением прибора;
CtS1 и CtS2 - значение порогового цикла амплификации кДНК анализируемого гена в двух сравниваемых образцах s1 и s2;
CtNorm1 и CtNorm2 - значение порогового цикла амплификации кДНК нормировочного гена в двух сравниваемых образцах s1 и s2.
Использование метода ΔΔCt возможно при условии, что эффективности реакций амплификации кДНК анализируемого и нормировочного генов равны и близки к 100%. Невыполнение этого условия приводит к значительным ошибкам в результатах. Однако на практике выполнения этого условия добиться очень сложно.
Задача, решаемая предложенным изобретением, заключается в устранении перечисленных недостатков и создании более достоверного и быстрого метода определения уровня транскрипции гена МСР1, применимого в том числе и в клинической практике.
Предложенный способ определения уровня транскрипции гена МСР1 методом ОТ-ПЦР с детекцией результатов в режиме реального времени предполагает: выделение РНК из образцов анализируемого материала (кровь, ткани, соскобы, пунктаты, клеточные культуры), синтез кДНК с помощью реакции обратной транскрипции, амплификацию кДНК генов с помощью ПЦР в реальном времени. Предложен набор для осуществления способа, отличающийся использованием специфических олигонуклеотидных праймеров и флюоресцентных зондов, а также набором нормировочных генов (RPL32, АСТВ, PII), подобранных для максимально корректного расчета уровня CCL2 (МСР1) в образцах РНК. Нормирование полученных результатов осуществляют при помощи нормировочного коэффициента, рассчитанного как среднее арифметическое количества в образце кДНК генов RPL32, АСТВ и PII, кодирующих рибосомный белок L32, b-актин и полимеразу-II соответственно. При этом амплификация кДНК генов RPL32, АСТВ и PII осуществляется при помощи одной triplex-ПЦР.
При определении относительного количества кДНК гена МСР1 и нормировочных генов RPL32, АСТВ и PII используют калибровочную кривую, построенную при амплификации стандартных образцов ДНК, взятых в 6-ти последовательно убывающих трехкратных разведениях известных концентраций. Стандарт представляет собой смесь фрагментов ДНК, несущих амплифицируемую последовательность кДНК генов RPL32, АСТВ, PII и МСР1 длиной по 500 пар нуклеотидов. Относительное количество кДНК каждого гена определяется исходя из уравнения калибровочной кривой, при этом учитывается эффективность амплификации каждой из реакций амплификации.
Технический результат, достигаемый при использовании предложенного метода заключается:
во-первых, в уменьшении ошибки вычисления, вносимой при использовании одного нормировочного гена без увеличения числа амплификаций;
во-вторых, в уменьшении ошибки вычислений, возникающей при упрощенном предположении о равенстве эффективности реакций амплификации кДНК МСР1 и нормировочного гена, имеющего место в методе ΔΔCt.
Образцы ткани для анализа
В качестве образцов для проведения анализа могут быть использованы цельная кровь, мононуклеарные клетки крови, биоптаты, пунктаты, соскобы слизистой, клеточные культуры.
Выделение РНК из образцов.
Способы выделения суммарной РНК из образцов ткани млекопитающих включают следующие стадии: измельчение образцов в гомогенизаторе или в жидком азоте (относится к плотным сложно гомогенизируемым фрагментам ткани), лизис клеток, выделение РНК и ее очистку, проверку качества РНК электрофорезом в 1%-ном агарозном геле в присутствии красителя бромида этидия, а также спектрофотометрическое определение количества РНК. Гомогенизацию кусочков ткани можно проводить вручную, растирая пестиком в керамической ступке, или с помощью механических гомогенизаторов, например TissueLyser (Qiagen). Для лизиса клеток и выделения РНК могут быть использованы различные протоколы. В классических методах для лизиса клеток и выделения РНК используют сильные хаотропные агенты в сочетании с детергентами, такие как гуанидинизотиоцианат и саркозил, далее следуют последовательные экстракции фенолом при рН5 5,0 и хлороформом для денатурации и удаления белков и геномной ДНК [Chomczynsci P., Sacci N. Single-step method of RNA isolation by Acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry. 1987 / Vol 162. P 156-159]. Далее РНК осаждают в присутствии изопропанола или этанола или сорбируют на твердом носителе, например Silica S-5631(Sigma) или спин-колонке (Qiagen; Promega). Для предотвращения разрушения РНК РНКазами могут быть использованы ингибиторы рибонуклеаз, такие, например, как рекомбинантный RNAsin (Promega). Для элиминации примесей геномной ДНК можно обработать полученный препарат РНК очищенной от рибонуклеаз ДНКазой, однако при небольшом количестве материала этого шага лучше избежать для предотвращения возможной потери и деградации РНК. Выделение РНК может быть выполнено при помощи метода с использованием реагента Trizol®Reagent [Invitrogen] или при помощи коммерчески доступных наборов, таких как RNeasy kits (Qiagen), SV Total RNA Isolation System (Promega) и т.д.
Синтез кДНК при помощи реакция обратной транскрипции.
В результате реакции обратной транскрипции на РНК-матрице синтезируется одноцепочечная цепь ДНК. Образующиеся при этом молекулы кДНК более стабильны по сравнению с нестабильными молекулами РНК и могут быть амплифицированы с помощью полимеразной цепной реакции до количеств, необходимых для детекции.
Реакцию обратной транскрипции можно проводить при помощи различных коммерческих препаратов обратных транскриптаз, например обратная транскриптаза вируса лейкоза мышей Молони (M-MLV), вируса миелобластоза птиц (AMV), PowerScript (точечная мутация M-MLV-RT), C.Therm Polymerase и др. Может быть использована термостабильная ДНК-полимераза Thermus thermophilus (Tth), обладающая обратной транскриптазной активностью в присутствии ионов Mn2+.
Реакцию обратной транскрипции начинается с формирования двухцепочечной затравки, для этого можно использовать различные типы праймеров. Например, oligo(dT)n праймеры (число n обычно равно 12-18), связывающиеся с эндогенным полиА-хвостом на 3'-конце мРНК. Эти праймеры целесообразно использовать для получения полноразмерных кДНК. К 3'-концу oligo(dT) последовательности могут быть добавлены нуклеотиды А, С или G, чтобы «заякорить» праймер на границе транскрипта и поли-А тракта.
Другой вариант праймеров - случайные гексануклеотидные праймеры (статистические праймеры), гибридизующиеся в нескольких участках на протяжении РНК. В реакции обратной транскрипции с использованием статистических праймеров синтезируются более короткие (в среднем около 500 п.н.) фрагменты кДНК. Реакция обратной транскрипции с использованием статистических праймеров, как правило, проходит более эффективно, в особенности при обратной транскрипции GC-богатых районов и 5'-областей мРНК.
Кроме гексамерных праймеров могут быть использованы и более длинные 9-12-мерные праймеры. Также можно использовать статистические праймеры в комбинации с oligo(dT) праймерами или специфическими праймерами, комплиментарными последовательности анализируемого гена.
Амплификация кДНК генов RPL32, АСТВ, PII и МСР1 при помощи ПЦР с детекцией в режиме реального времени.
Амплификацию фрагментов транскриптов генов RPL32, АСТВ, PII и МСР1 выполняют при помощи пар праймеров, комплиментарных транскриптам. При выборе праймеров для амплификации кДНК PII и МСР1 необходимо учитывать экзон-интронную структуру гена и размещать праймеры таким образом, чтобы их сайты гибридизации располагались в различных экзонах. Таким образом, достигается супрессирование возможных примесей геномной ДНК в образце. Это правило необязательно выполнять при выборе праймеров для амплификации кДНК RPL32 и АСТВ, так как для этих генов в геноме человека содержится большое количество псевдогенов. В этом случае при выборе праймеров необходимо учитывать имеющийся полиморфизм генов и псевдогенов RPL32 и АСТВ для того, чтобы минимизовать гибридизацию праймеров с последовательностью псевдогенов.
Реакция амплификации может быть выполнена с использование коммерчески доступного препарата ДНК полимеразы Thermus aquaticus, например HS Taq ДНК полимераза, (Евроген), GoTaq® Hot Start Polymerase (Promega) и др. Амплификации кДНК гена МСР1 выполняется с использование пары праймеров, комплиментарных последовательности транскрипта МСР1, амплификация кДНК генов RPL32, АСТВ и РII выполняется в одной пробирке с использованием одновременно трех пар праймеров, комплиментарных последовательностям транскриптов RPL32, АСТВ и PII. В качестве матрицы используется синтезированная на суммарной клеточной РНК кДНК.
Накопление продуктов амплификации МСР1 детектируется в режиме реального времени при помощи одного из способов:
- или при помощи интекалирующего с двухцепочечной ДНК флуоресцентного красителя с высоким индексом дискриминации флуоресценции у связанной и несвязанной форм, например SYBR GreenI (Invitrogen);
- или при помощи олигонуклеотидной пробы типа TaqMan комплементарной центральной части амплифицируемого фрагмента транскрипта. Проба длиной 20-30 нуклеотидов несет на 5'-конце флуорофор (FAM, R6G, ROX) и на 3'-конце не флуоресцентный тушитель (BHQ, FTQ и др.). На каждом цикле амплификации габридизованная проба гидролизуется со стороны 5'-конца, при этом флуорофор пространственно разобщается с тушителем и, как следствие, увеличивается флуоресценция реакционной смеси.
Накопление продуктов triplex-амплификации кДНК генов RPL32, АСТВ и PII детектируется при помощи трех олигонуклеотидных проб типа TaqMan, комплементарных центральной части амплифицируемых фрагментов транскриптов RPL32, АСТВ и PII.
Для выбора последовательности праймеров и проб типа TaqMan может быть использовано доступное программное обеспечение, например OligoAnalyser v. 1.0.3, BeaconDisigner v. 7.0 и другие. Предпочтительно использование следующих пар праймеров:
CCL2-F 5'-TCGCCTCCAGCATGAAAGTC-3'
CCL2-R 5'-TCTGCACTGAGATCTTCCTATTG-3'
CCL2-pr 5'-FAM-CCCTTCTGTGCCTGCTGCTCATAG-3'
ACTB_F 5'-GTGCGTGACATTAAGGAGAAG-3'
ACTB_R 5'-GAAGGAAGGCTGGAAGAGTG-3'
ACTB_pr 5'-R6G-CGCCCTGGACTTCGAGCAAGAGA-BHQ-3'
RPL32_F 5'-CAACATTGGTTATGGAAGCAACA-3'
RPL32_R 5'-TGACGTTGTGGACCAGGAACT-3'
RPL32_pr 5'-FAM-ACATGCTGCCCAGTGGCTTCCG-BHQ-3'
POLR2A_F 5'-GCACCACGTCCAATGACAT-3'
POLR2A_R 5'-GTGCGGCTGCTTCCATAA-3'
POLR2A_pr 5'-ROX-TACCACGTCATCTCCTTTGATGGCTCCTAT- BHQ-3'
Определение количества кДНК генов RPL32, АСТВ, PII и МСР1 выполняется при помощи уравнения калибровочной кривой с учетом эффективности каждой реакции амплификации. Для построения калибровочной кривой одновременно с анализируемыми образцами амплифицируются стандартные образцы ДНК с известной последовательно уменьшающейся в три раза концентрацией ДНК. Стандартный образец представляет собой смесь двуцепочечных фрагментов ДНК длиной 500 п.н., несущих последовательности амплифицируемых фрагментов транскриптов RPL32, АСТВ, PII и МСР1. Калибровочная кривая строится в зависимости от значений Ct и Log количества ДНК в стандартном образце. В соответствии с полученным графиком калибровочной кривой при помощи регрессионного анализа определяются коэффициенты линейного уравнения калибровочной кривой. Полученное уравнение используется для определения количества кДНК RPL32, АСТВ, PII и МСР1 в анализируемых образцах.
Определение уровня транскрипции кДНК гена МСР1 осуществляется за счет нормирования полученного количества кДНК МСР1 в образце. Для этого рассчитывается нормировочный коэффициент. Нормировочный коэффициент рассчитывается как среднее арифметическое количества кДНК RPL32, АСТВ, PII в образце.
Для проведения ПЦР с детекцией результатов в режиме реального времени различными фирмами разработаны амплификаторы, например ABI Prism 7000 Sequence Detection System (Applied Biosystems), CFX96 (Bio-Rad), отечественные приборы ДТ-322 (ДНК-Технология). Применение ПЦР с детекцией результатов в режиме реального времени позволяет уменьшить риск контаминации и автоматизировать процесс диагностики. Постановка реакции занимает от 40 минут до двух часов (в зависимости от используемого амплификатора) и включает одновременное проведение ПЦР, детекцию флуоресцентного сигнала, обработку данных и их представление в графическом виде с помощью специального программного обеспечения.
Изобретение осуществляется следующим образом.
Пример 1.
Материалом исследования являлись образцы периферической крови здоровых доноров и пациентов с атопическим дерматитом в стадии обострения. Образцы периферической крови объемом 5 мл забирались в пробирки, содержащие 0,1М раствор ЭДТА (антикоагулянт, препятствующий свертыванию крови).
Выделение мононуклеарных клеток крови (МКК). Разделение клеточных элементов крови проводили методом центрифугирования в градиенте плотности фиколла -верографина (плотность 1,077 г/мл). Методика выделения лимфоцитов крови на фиколле [Boyum A. Separation of leukocytes from blood and bone ma rrow // Scand. J. Clin. Lab. Investig. - 1968. - Vol.21. - Suppl. 97 - p.1-9]. Полученные клетки ресуспендировались в культуральной среде RPMI, содержащей 10% FBS и 0,03% глутамина в концентрации 106 кл/мл, и высевались в лунки 24-луночного культурального планшета по 1000 мкл/лунку. Клетки культивировались в течение 24 ч при 37°С и 5%-ном содержании СO2 в атмосфере.
Выделение РНК и синтез кДНК в реакции обратной транскрипции. Клетки после 24 ч культивирования освобождали от кондиционных сред методом центрифугирования при 600g и лизировали реагентом Trisol (Invitrogen). Суммарную клеточную РНК выделяли согласно рекомендациям Invitrogen. Качество препаратов РНК оценивали по итогам электрофоретического разделения в 1,3% агарозном геле. Реакцию обратной транскрипции проводили при 42°С в течение 45 мин в 20 мкл реакционной смеси, содержащей 10 мМ Tris-HCl (рН 8,3), 5 мМ MgCl2, 10 мМ DTT, 50 мМ KCl, 0,2 мМ dNTP, Stat-9 праймер (10 нг/мкл), 100 ед. акт. ДНК зависимой РНК полимеразы MoMLV (Biosan, ИХБФМ СОРАН) и 500 нг суммарной клеточной РНК.
Амплификация кДНК гена МСР1 с детекцией в режиме реального времени. Реакция амплификации выполнялась при помощи термоциклеров с оптическим блоком для детекции флуоресценции iQ5 iCycler или CFX96(Bio-Rad). Возможность регистрации флуоресценции в режиме реального времени достигалась за счет добавления в реакционную смесь интеркалирующего красителя SYBRGreen I (способ 1) или при помощи гибридизационных проб типа TaqMan (способ 2).
Способ 1. ПЦР проводилась в объеме 25 мкл, реакционная смесь содержала 10 мМ Tris-HCl (рН 8.9); 55 мМ KCl; 0,05% Tween 20; 2,5 мМ MgCl2, 0,2 мM dNTP, 300 мM праймеров (прямой и обратный), 0.5 ед. акт. Taq-ДНК полимеразы (Biosan, ИХБФМ СОРАН), SYBRGreen I [1:25000] и 0.1-5 нг кДНК.
Для амплификации использовались праймеры: прямой праймер - 5'-TCGCCTCCAGCATGAAAGTC-3' и обратный праймер - 5'-TCTGCACTGAGATCTTCCTATTG-3'.
Протокол амплификации:
- первичная денатурация - 3 минуты при 96°С
- амплификационный цикл (×40)
- денатурация - 10 секунд при 96°С
- отжиг праймеров - 10 секунд при 60°С
- элонгация - 10 секунд при 72°С
- съем сигнала - 10 секунд при 86°С (температуре плавления продукта амплификации)
- построение кривой плавления - нагревание амплификационной смеси с 75 до 95°С, с шагом 0,5°С, сопровождающееся съемом флуоресцентного сигнала на каждом шаге в течение 10 секунд.
Специфичность амплификации подтверждалась при анализе кривых плавления, а также электрофоретическим анализом в 8% полиакриламидном геле.
Способ 2. ПЦР проводилась в объеме 25 мкл, реакционная смесь содержала 65 мМ Tris-HCl (рН 8.9); 24 мМ (NH4)2SO4; 0,05% Tween 20; 2,5 мМ MgCl2, 0,2 мM dNTP, 300 мM праймеров (прямой и обратный), 100 мM Taq-Man проба, 0.5 ед. акт. Taq-ДНК полимеразы (Biosan, ИХБФМ СОРАН) и 0.1-5 нг кДНК.
Протокол амплификации:
- первичная денатурация - 3 минуты при 96°С
- амплификационный цикл (×40)
- денатурация - 10 секунд при 96°С
- отжиг праймеров, элонгация и съем флуоресцентного сигнала - 60 секунд при 60°С.
Специфичность амплификации подтверждалась электрофоретическим анализом в полиакриламидном геле.
Для амплификации использовались олигонуклеотидные пробы: прямой праймер - 5'-TCGCCTCCAGCATGAAAGTC-3' и обратный праймер - 5'-TCTGCACTGAGATCTTCCTATTG-3', гибридизационная проба - 5'-FAM-CCCTTCTGTGCCTGCTGCTCATAG-3'.
Амплификация кДНК генов RPL32, АСТВ и PII с детекцией в режиме реального времени. ПЦР проводилась в объеме 25 мкл, реакционная смесь содержала 65 мМ Tris-HCl (pH 8.9); 24 мМ (NH4)2SO4; 0,05% Tween 20; 2,5 мМ MgCl2 0,2 мM dNTP, 300 мM праймеров (RPL32_F и RPL32_R, ACTB_F и ACTB_R, PII_F и PII_R), 100 мM Taq-Man пробы (RPL32_pr, ACTB_pr, PII_pr), 0.5 ед. акт. Taq-ДНК полимеразы (Biosan, ИХБФМ СОРАН) и 0.1-5 нг кДНК.
Протокол амплификации:
- первичная денатурация - 3 минуты при 96°С
- амплификационный цикл (×40)
- денатурация - 10 секунд при 96°С
- отжиг праймеров, элонгация и съем флуоресцентного сигнала - 60 секунд при 60°С.
Специфичность амплификации подтверждалась электрофоретическим анализом в полиакриламидном геле.
Для амплификации использовались олигонуклеотидные пробы:
АСТВ: прямой праймер 5'-GTGCGTGACATTAAGGAGAAG-3', обратный праймер 5'-GAAGGAAGGCTGGAAGAGTG-3', гибридизационная проба 5'-R6G-CGCCCTGGACTTCGAGCAAGAGA-BHQ-3'
RPL32: прямой праймер 5'-CAACATTGGTTATGGAAGCAACA-3', обратный праймер 5'-TGACGTTGTGGACCAGGAACT-3', гибридизационная проба 5'-FAM-ACATGCTGCCCAGTGGCTTCCG-BHQ-3'
PII: прямой праймер 5'-GCACCACGTCCAATGACAT-3', обратный праймер 5'-GTGCGGCTGCTTCCATAA-3', гибридизационная проба 5'-ROX-TACCACGTCATCTCCTTTGATGGCTCCTAT-BHQ-3'.
Анализ результатов ОТ-ПЦР.
Всего было проанализировано 48 образцов, из них 24 образца МКК, полученных от здоровых доноров, и 24 образца МКК от пациентов с атопическим дерматитом. Определение относительного количества кДНК RPL32, АСТВ, PII и МСР1 в анализируемых образцах выполняли при помощи уравнения калибровочной кривой. Для этого одновременно с анализируемыми образцами амплифицировали 5 стандартных образцов с последовательно уменьшающейся в три раза концентрацией ДНК (st1-1 y.e., st2-3 y.e., st3-9 y.e., st4-27 y.e., st5-81 y.e.). Для каждого образца при помощи программного обеспечения прибора определяли величину порогового цикла (Ct), при котором значение флуоресценции реакционной смеси достигало некоторого «порогового» уровня (Т) одинакового для всех сравниваемых образцов.
Количество кДНК (Х0) в образце вычислялось при помощи уравнения:
Log(X0)=a+b*Ct,
где а=log(T) и b=log(1+Eff).
Условия амплификации выбирались таким образом, что эффективность (Eff) ПЦР оставалась постоянной для всех анализируемых образцов и образцов калибровочной кривой, следовательно, коэффициент b=log(1+E)=const.
Коэффициенты а и b уравнения вычислялись при построении уравнения калибровочной кривой. Уравнение калибровочной кривой определяло взаимосвязь значений Ct, полученных при амплификации пяти стандартных образцов, и значений lg(X0) этих образцов (в нашем случае это Igl, lg3, lg9, lg27, lg81).
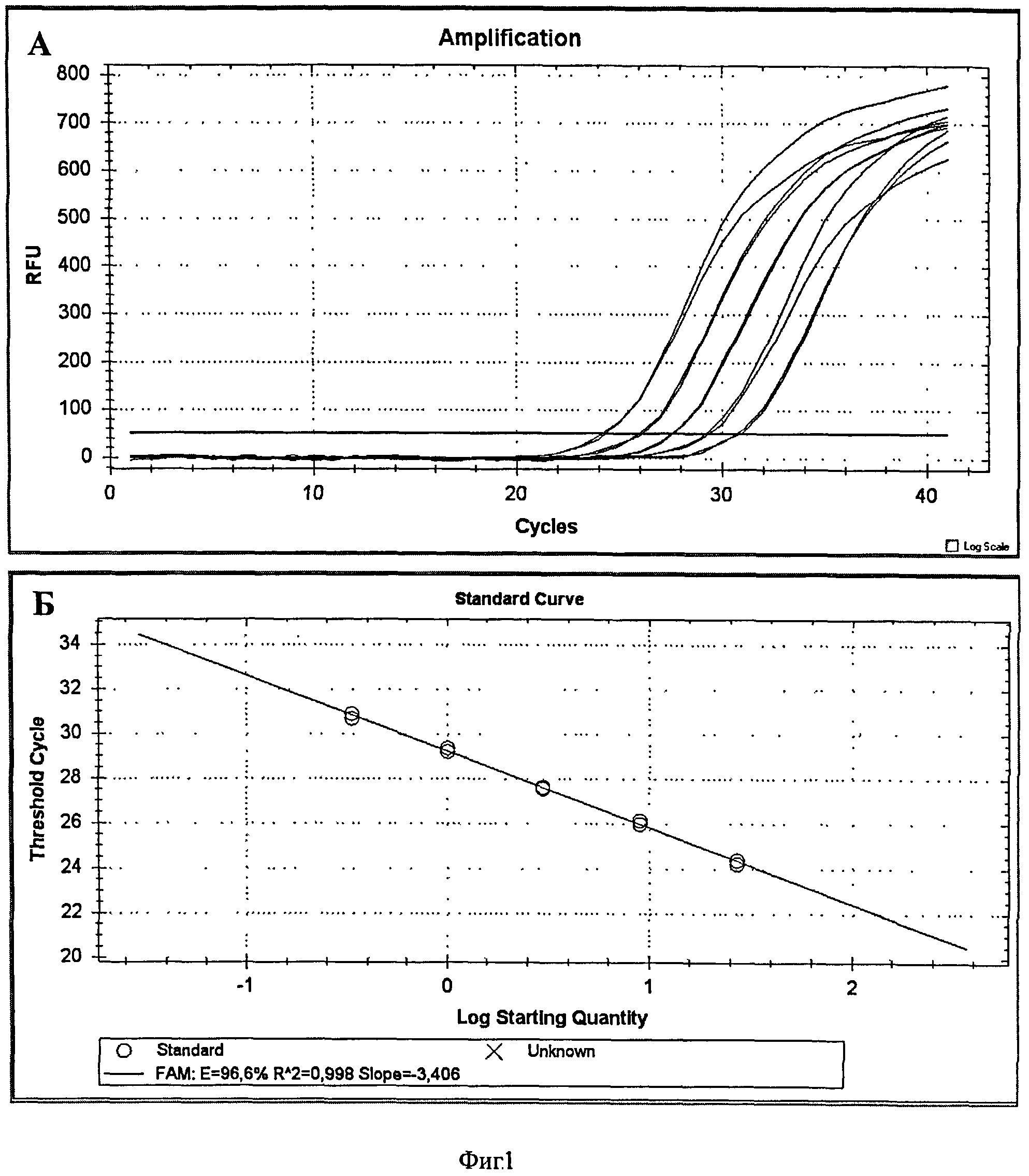
На фиг.1А приведены кривые увеличения интенсивности флуоресценции реакционной смеси при амплификации фрагмента транскрипта МСР1 для 5-ти стандартных образцов с последовательно уменьшающейся в три раза концентрацией ДНК в зависимости от номера цикла ПЦР. Амплификация выполнена способом 2 с использованием пары праймеров и гибридизационной TaqMan пробы. На фиг.1Б приведен график калибровочной кривой, определяющий зависимость значений Ct, полученных при амплификации пяти стандартных образцов, и значений lg(X0) этих образцов (lg1, lg3, lg9, lg27, lg81).
Эффективность амплификации определялась как угол наклона калибровочной кривой. Для всех пар праймеров эффективность амплификации составила не меньше 90%. Значения эффективности реакций амплификации кДНК RPL32, АСТВ, PII и МСР1 приведены в таблице 1.
Для оценки воспроизводимости значений порогового цикла (Ct) все анализируемые образцы с каждой парой праймеров амплифицировались в тройном повторе. Разница значений Ct между повторами была не более 0,3 цикла.
Для определения относительного уровня экспрессии кДНК МСР1 полученные для анализируемых образцов значения относительного количества кДНК МСР1 нормировались при помощи нормировочного коэффициента, рассчитанного как среднее арифметическое количества кДНК генов RPL32, АСТВ, PII
Нормировочные гены должны характеризоваться постоянным уровнем экспрессии в клетках и не зависеть от анализируемого образца. Для того чтобы оценить вариабельность изменения уровня экспрессии генов RPL32, АСТВ, PII между образцами рассчитывались попарные коэффициенты корреляции (R2) между количеством кДНК RPL32 и АСТВ, RPL32 и PII, АСТВ и РII. Значения попарных коэффициенов корреляции Пирсона (R2) количеств кДНК нормировочных генов RPL32, АСТВ, РII представлены в таблице 2. Во всех случаях были получены высокие коэффициенты корреляции не ниже 0,73.
Сравнение результатов, полученных при определении уровня транскрипции кДНК МСР1 методом ОТ-ПЦР и количества белка МСР1 методом ИФА.
Оценка уровня продукции белка МСР1 мононуклеарными клетками проводилась в кондиционных средах культур, собранных после центрифугирования культивированных 24 часа клеток. Аликвоты образцов хранили при -20°С до анализа.
Анализ уровня МСР-1 проводили иммуноферментным методом (ИФА) используя коммерческие наборы ЗАО «Вектор-Бэст» Новосибирск, в точном соответствии с инструкцией производителя. Детекция результатов ИФА проводилась на планшетном анализаторе TriStar LB941 (Berthold Technology Inc.).
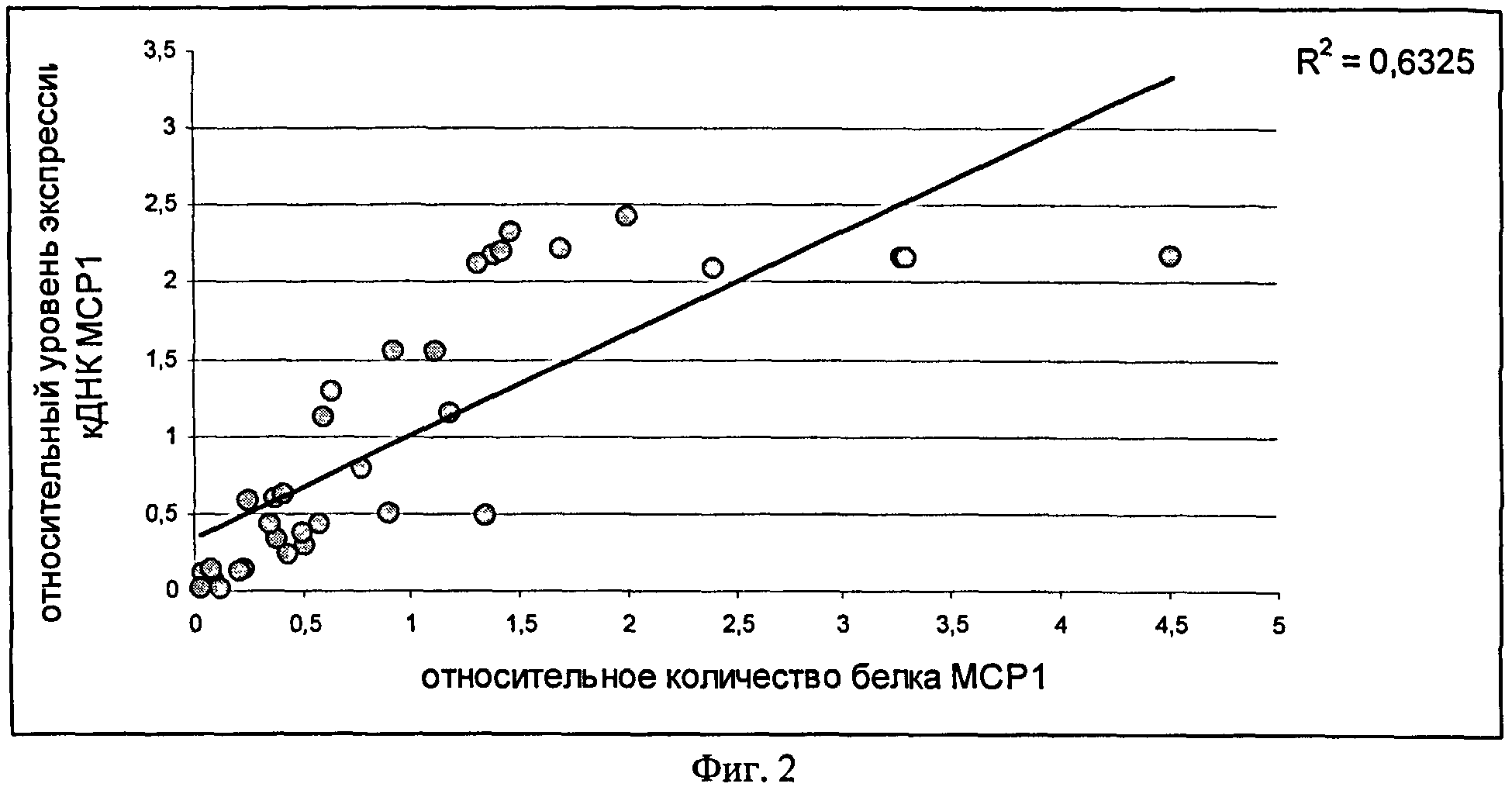
На фиг.2 приведен график зависимости значений уровня экспрессии кДНК МСР1, определенных методом ОТ-ПЦР, и значений количества белка МСР1, определенных методом ИФА в 48-ми образцах культур мононуклеарных клеток. Полученные при помощи метода ОТ-ПЦР значения уровня экспрессии кДНК МСР1 достоверно коррелировали с соответствующими значениями количества белка МСР1, определенными методом ИФА. Коэффициент корреляции Пирсона R2 составил 0.63, что соответствует уровню статистической значимости <0.001 (для числа степеней свободы n=46).
В таблице 3 приведены результаты статистического анализа показателей уровней экспрессии кДНК МСР1 и количеств белка МСР1 в образцах МКК от здоровых доноров и пациентов с атопическим дерматитом в стадии обострения. Анализ показал, что среднее значение уровня экспрессии кДНК МСР1 в образцах МКК, полученных от здоровых доноров, значимо выше уровня экспрессии кДНК МСР1 в образцах МКК пациентов с атопическим дерматитом в стадии обострения (с уровнем значимости р<0.02).
Результаты ИФА также свидетельствуют, что клетки МКК, полученные от здоровых доноров, продуцируют значимо большее количество белка МСР1 чем МКК пациентов с атопическим дерматитом (с уровнем значимости р<0.001) (таблица 3).
|
|
|
Перечень последовательностей олигонуклеотидов к заявке «Способ определения уровня транскрипции гена, кодирующего хемокин CCL2 (MCP-1) человека, и набор для его осуществления».
Набор для определения уровня транскрипции гена, кодирующего хемокин CCL2 (MCP-1) человека по п.1, включающий:
а) олигонуклеотидные праймеры и пробы для амплификации при помощи одной triplex-ПЦР кДНК генов RPL32, ACTB и PII, кодирующих рибосомный белок L32, b-актин и полимеразу-II соответственно
ACTB_F 5'-GTGCGTGACATTAAGGAGAAG-3'
ACTB_R 5'-GAAGGAAGGCTGGAAGAGTG-3'
ACTB_pr 5'-R6G-CGCCCTGGACTTCGAGCAAGAGA - BHQ- 3'
RPL32_F 5'-CAACATTGGTTATGGAAGCAACA-3'
RPL32_R 5'-TGACGTTGTGGACCAGGAACT-3'
RPL32_pr 5'-FAM-ACATGCTGCCCAGTGGCTTCCG-BHQ- 3'
POLR2A_F 5'-GCACCACGTCCAATGACAT-3'
POLR2A_R 5'-GTGCGGCTGCTTCCATAA-3'
POLR2A_pr 5'- ROX-TACCACGTCATCTCCTTTGATGGCTCCTAT- BHQ-3'
б) олигонуклеотидные праймеры и проба для амплификации при помощи ПЦР кДНК гена, кодирующего CCL2 (MCP-1)
ССL2-F 5'-TCGCCTCCAGCATGAAAGTC-3'
ССL2-R 5'-TCTGCACTGAGATCTTCCTATTG-3'
ССL2-pr 5'-FAM-CCCTTCTGTGCCTGCTGCTCATAG-3'.