Результат интеллектуальной деятельности: СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ
Вид РИД
Изобретение
Изобретение относится к медицине и может быть использовано при комплексном лечении пациентов больных раком молочной железы II-IV стадии препаратами цитостатической группы, в частности, сочетанием цитостатика антрациклинового ряда доксорубицина и циклофосфана (схема AC), а также с с добавлением в схему третьего цитостатика фторурацила (схема FAC).
Известен способ лечения, основанный на использовании монопрепаратов цитостатической группы, например, цисплатины для лечения больных с плоскоклеточным раком кожи туловища, путем использования цисплатины в дозе 100 мг/м2 (I день), внутривенно капельно 30 мг/м2 1 раз в неделю, или 60-150 мг/м2 каждые 3-5 недель, или 20 мг/м2 ежедневно 5 дней с повторением каждые 4 недели, или 50 мг/м в 1-й и 8-й дни каждые 4 недели, препарата митомицин C для лечения больных с раком желудка, кишечника, поджелудочной железы, мочевого пузыря, молочной железы, легкого, вульвы, предстательной железы (в составе лекарственных комбинаций), путем использования митомицина C внутривенно в дозе 10 мг/м2 1 раз в 3-4 недели (в составе лекарственных комбинаций) или также 2 мг/м2 с 1-го по 5-й и с 8-го по 12-й дни курса, суммарная доза 50 мг/м2, или препарата дактиномицина для лечения больных с хориокарциномой матки, саркомой мягких тканей, злокачественных опухолей яичка, меланомы, лимфосаркомы, нейробластом путем использования дактиномицина внутривенно 350 мкг/м2 ежедневно в течение 5 дней каждые 3-5 недель или 1-2 раза в неделю в течение 3-5 недель, суммарная доза 3000 мкг [1].
Способ отличается относительно низкой эффективностью лечения и ограниченностью применения, поскольку согласно этому способу не все типы неопластической ткани в одинаковой степени чувствительны к действию цитостатика в виде монопрепарата.
Известен также способ, основанный на применении высоко дозовой химиотерапии (XT), включающий постоянную инфузию 5-фторурацила 200 мг/м2 в день ежедневно длительно, эпирубицин 50 мг/м2 и цисплатин 60 мг/м2 каждые 3 недели в течение 6 месяцев [2, 3].
Недостатком способа также является относительно низкая эффективность лечения.
Кроме указанных выше известен способ лечения эпирубицином 100 мг/м2 и циклофосфаном 400 мг/м2 с поддержкой Г-КСФ с 14-дневным интервалом. Объективный ответ получен в 96,5% случаев (4 полных и 25 частичных ремиссий). Интенсивный режим получили 36 больных (Т2>3,5 см, T3No) с использованием эпирубицина 65 мг/м, циклофосфана 600 мг/м и 5-фторурацила 600 мг/м2 в день 1, при поддержке Г-КСФ 5 мкг/кг, дни с 7 по 12. Интервалы между курсами составляли 14 дней. После трех курсов клинический эффект получен в 100% случаев; 80,5% больным выполнена сохранная операция [4, 5].
Этот способ имеет ограниченную применимость и относительно низкую эффективность.
К известным относится способ лечения рака молочной железы IIIA и IIIB стадии доксорубицином 90 мг/м2 и циклофосфаном 1000 мг/м2 при поддержке Г-КСФ с 3-недельным интервалом. Общий клинический эффект составил 98%, полная клиническая регрессия - 50%, полная гистологическая регрессия - 14%. У 40 пациентов, получавших 5-фторурацил 750 мг/м2 (дни 1-4), эпирубицин 35 мг/м2 (дни 2-4), циклофосфан 400 мг/м2 (дни 2-4) с интервалом 3 недели, с поддержкой Г-КСФ, клиническая полная регрессия составила 37,5%, частичная - 45%, полная гистологическая ремиссия отмечена у 15% больных [6].
Этот способ также имеет ограниченную применимость и относительно низкую эффективность, поскольку он не активирует противораковый иммунитет организма и лишь незначительно увеличивает безрецидивный интервал у больных раком молочной железы. У больных с местно-распространенным заболеванием 5-летняя безрецидивная выживаемость составляет от 13% до 45%, а 10-летняя - от 10% до 30%. Метастатический рак молочной железы остается неизлечимым заболеванием. В течение 2 и 5 лет от момента диагностики живут в среднем 30% и 5% соответственно [7, 8].
Кроме того известно, что все способы с использованием цитостатиков обладают крайне негативным действием на гемопоэз.
Известны также способы лечения, основанные на действии комбинации цитостатических препаратов и последующей иммунотерапии. Так известен препарат Ингарон, представляющий собой интерферон-гамма. По своим свойствам он является уникальным природным цитокином, обеспечивающим формирование и стимуляцию клеточного иммунитета, что показывает целесообразность использования гамма-интерферона в сочетании с XT при ряде злокачественных опухолей. Сочетание XT с иммунотропными веществами может значительно снижать токсический и иммуносупрессивный эффект противоопухолевых препаратов. [9].
Известен способ лечения, основанный на использовании цитостатических препаратов с последующей иммунотерапией специфическими олигонуклеотидами с фосфоротиоатным остовом и специфическим набором нуклеотидов (CpG) [10].
Однако этот способ также имеет низкую эффективность лечения, обусловленную тем, что, иммуномодулирующие CpG нуклеотиды воздействуют в основном на антигенпрезентирующие дендритные клетки (ДК), активируя их созревание и специфические активности через систему TLR рецепторов, и не в состоянии активировать ДК через другие молекулярные пути активации Так в последнее время большое внимание уделяется изучению сенсорных путей, задействованных при активации ДК препаратами линейной двуцепочечной ДНК, которые не связаны с функционированием TLR рецепторов. Описаны основные метаболические пути, осуществляющие обнаружение и трансдукцию сигнала, определяемого взаимодействием ДК и молекул экзогенной ДНК. К ним относятся NRL, STING зависимый пути, а также сигнальный путь, опосредованный активностью РНК полимеразы III [11-13] Завершением процесса передачи сигнала любым из указанных путей является активация транскрипционных факторов nfκb, API, группы белков IRF, которые интернализуются в ядро и связывают и активируют ИФН-(3 промотор. ИФН-β секретируется, связывается с рецептором (IFNAR) и активирует по аутокринному или паракринному механизму Jak/STAT метаболический путь инициации продукции большого числа интерферон-индуцибельных генов [14, 15]. В результате указанных процессов у ДК повышается экспрессия поверхностных молекул MHCI, МНСП, костимулирующих молекул (CD40, CD80, CD86), рецепторов хемокинов. ДК начинают секретировать хемокины и цитокины для привлечения эффекторных клеток и их дифференцировки [16].
Основным недостатком указанных способов лечения онкологических заболеваний является их ограниченное действие на системы организма, индуцирующие противораковый адаптивный иммунитет в случае использования цитостатиков в качестве монопрепарата, и высокая токсичность и угнетающее влияние на лейкопоэз при способах лечения с использованием цитостатиков в сочетании с иммунотерапевтическими препаратами.
Для частичного устранения указанных недостатков в настоящее время разработаны и используются достаточно обширный арсенал лекарственных препаратов, используемых для корректирующей гемопоэз терапии после проведения циторедуцирующей терапии цитостатиками. Используются два принципиальных типа препаратов, одни из которых индуцируют мобилизацию стволовых клеток крови (СКК) и пролиферацию поздних предшественников нейтрофильного ростка кроветворения, и препараты, индуцирующие пролиферацию предшественников всех ростков кроветворения разной степени коммитирования. К первой группе относятся препараты на основе колониестимулирующих факторов (Г-КСФ и ГМ-КСФ), ко второй группе - препараты на основе экзогенной ДНК.
Препараты на основе фрагментированной экзогенной ДНК оказывают активирующее пролиферацию действие на все типы гемопоэтических предшественников в разной степени их зрелости. Такое действие позволяет одномоментно запустить деление СКК, увеличив процент делящихся клеток в несколько раз. Такое действие, как и мобилизация ККМ под действием колоний - стимулирующих факторов, приводит к появлению в периферической крови всей гаммы форменных элементов лейкоцитарного и лимфоцитарного рядов. Однако выход в кровоток зрелых клеток в результате такого воздействия в отличие от мобилизации, которая представляет собой насильственный выход СКК и их коммитированных потомков из стромальных ниш, является физиологичным и поэтому на 1-3 суток оттянут во времени. Использование препаратов на основе фрагментированной ДНК для профилактики миелосупрессий и стимуляции гемо- и лейкопоэза у онкологических больных является общепринятым подходом, который имеет свои положительные стороны, поскольку при его применении не нарушается функционирование основных клеточных систем организма.
В связи с этим можно указать на известность способа лечения с применением препарата «Дезоксинат», представляющего собой натриевую соль двухспиральной дезоксирибонуклеиновой кислоты, получаемую из молок осетровых рыб и частично деполимеризованную с помощью ультразвука до молекулярной массы 2,7-4,0×105 Да. Содержание ДНК в препарате более 90%, в качестве примесей в препарате присутствуют РНК (от 3 до 5%) и белки негистонового типа, связанные с ДНК. Препарат обладает антитоксическим и радиопротекторным действием и используется в качестве стимулятора лейкопоэза при химиолучевой терапии, проводимой у онкологических больных [17].
Однако «Дезоксинат» не обладает собственной противоопухолевой активностью и поэтому применяется лишь в качестве вспомогательного лейкостимулирующего препарата для профилактики миелодепрессий при химиолучевой терапии онкологических больных, при этом лейкостимулирующий эффект развивается медленно и стойкие изменения наблюдаются через 4-10 дней. Радиопротекторный эффект «Дезоксината» носит непрямой характер и направлен на коррекцию лейкопении и стимуляцию иммунитета, развивающиеся при острой лучевой болезни II-III степени тяжести [18].
Известен способ стимуляции лейкопоэза у больных с запущенными формами опухолей органов брюшной полости путем однократного подкожного введения экзогенной ДНК, полученной из молок осетровых рыб. ДНК представлена в виде порошка низкополимерной, содержащей не менее 80% нативной натриевой соли ДНК с молекулярной массой 270-500×103 Да при весовых соотношениях нуклеотидов, в масс.%: аденин - 29, тимин - 27, гуанин - 22, цитозин - 20. Способ не вызывает осложнений и одновременно стимулирует костномозговое кроветворение [19].
Этот способ также обладает относительно низкой эффективностью лечения.
Известен также способ лейкостимуляции при лечении генерализованных опухолей путем внутримышечного или подкожного введения предварительно приготовленной смеси цитостатика и лейкостимулятора, причем в качестве цитостатика используют 5-фторурацил, а в качестве лейкостимулятора - натриевую соль ДНК. В качестве натриевой соли ДНК можно использовать «Деринат». Способ позволяет повысить эффективность лечения за счет изменения транспортирования 5-фторурацила, сохранения концентрации цитостатика в опухолевой ткани [20].
Этот способ также обладает относительно низкой эффективностью лечения.
Предложен также способ использовать трехкомпонентный конъюгат, состоящий из лейкостимулятора «Деринат», антибиотика и белков крови, что позволяет депонировать антрациклиновые антибиотики внутримышечно или подкожно в неактивной форме. Отсутствие кардиотоксичности и гематотоксичности позволяет применять данный способ на этапе генерализации, в условиях стойкой лейкопении или тяжелом общем состоянии больных [21].
Этот способ обладает относительно низкой эффективностью лечения. Описан способ использования препарата экзогенной ДНК для лечения больных с запущенными формами опухолей органов брюшной полости путем внутримышечного введения смеси нативной ДНК и антрациклинового антибиотика, содержащей 5 мг антрациклинового антибиотика, растворенного в 4 мл растворителя, 75 мг ДНК и 2 мл 0,5% раствора новокаина (всего на курс 50 мг антрациклинового антибиотика) и активации противоопухолевых клеток организма хозяина (CD 16 натуральных киллерных клеток) путем экстракорпорального подключения донорской свиной селезенки. Способ позволяет усилить эффект лечения больных с запущенными формами опухолей органов брюшной полости [22].
Этот способ обладает относительно низкой эффективностью лечения.
Также описан способ применения препарата экзогенной ДНК при лечении злокачественных новообразований, заключающийся во введении ДНК внутримышечно, от 1 до 3 раз в день, суммарным количеством 0,1-0,5 г, и в приеме противоопухолевых фитопрепаратов. Дополнительно вводят антитоксические, и/или антианемические, и/или тонизирующие, и/или антигистаминные, и/или иммуномодулирующие и/или мочегонные лекарственные фитопрепараты. Лечение данным способом оказывает дифференцированное воздействие на нормальные и патологически измененные клетки, вследствие чего происходит стимуляции пролиферации и дифференцировки нормальных клеток наряду с индукцией механизмов апоптоза в трансформированных клетках [23].
Этот способ обладает относительно низкой эффективностью лечения.
Известен и другой способ применения препарата экзогенной ДНК при лечении злокачественных новообразований, заключающийся в том, что в зависимости от характера и тяжести заболевания больному вводят парентерально натриевую соль ДНК, в разовой дозе 0,5-4,0 мг/кг 1 раз в четыре дня, в сочетании с введением человеческого альфа-фетопротеина, в разовой дозе 500-5000 МЕ/кг 1-2 раза в сутки ежедневно, курсом 14-30 дней. Альфа-фетопротеин вводят подкожно, внутримышечно или внутривенно, а ДНК вводят внутримышечно [24].
Этот способ обладает относительно низкой эффективностью лечения, указанные запатентованные способы имеют также ограниченную применимость, поскольку ориентируются либо только на лейкостимуляцию с использованием инъекционных форм препаратов чужеродного происхождения, в которых молекула ДНК гидролизована до низкомолекулярных фракций и в некоторых случаях денатурирована с последующей неконтролируемой реассоциацией, что нарушает нативную структуру активного начала препарата, либо применяются в сочетании с другими противораковыми препаратами без какого-либо логического объяснения механизма воздействия.
Помимо этого ни один из приведенных способов применения препаратов ДНК не активирует противораковый иммунитет организма.
В настоящее время продолжается активный поиск новых препаратов, стимулирующих лейкопоэз, и препаратов, индуцирующих противораковый адаптивный иммунитет.
Известны способы применения препарата экзогенной ДНК человека «Панаген», обладающего одновременно противоопухолевым, антитоксическим и радиопротекторным действием. Препарат «Панаген» содержит нативный, видоспецифичный фрагментированный нуклеопротеидный комплекс, состоящий из двуцепочечной ДНК и связанных с ней белков ядерного матрикса, что позволяет расширить спектр терапевтической активности препарата [25].
Этот способ с использованием фрагментированной ДНК человека Панаген имеет ограниченную применимость.
Описан способ применения препарата ДНК человека Панаген при лечении онкологических заболеваний путем использования гомологичной ДНК, имеющей биологически активный размер, составляющий полный геном физиологически и генетически здорового донора. ДНК пациенту вводят в дозе, создающей такую концентрацию ДНК в плазме крови, которая равна или превышает концентрацию собственно ДНК плазмы крови, но не превышает максимально допустимую концентрацию, равную 30 мкг/мл. Изобретение обеспечивает естественную гомологичную репарацию ДНК с заменой участков хромосом, несущих мутации, приведшие к ораковеванию клеток, без нежелательных эффектов при использовании ДНК в указанной дозе [26].
Этот способ с использованием фрагментированной ДНК человека Панаген также имеет ограниченную применимость.
Известен способ применения препарата ДНК человека при лечении нарушений гемопоэза, связанных с дефектами хромосом и последующей гибелью СКК при терапии цитостатиками или высокими дозами радиации, лечения заболеваний, связанных с нарушением механизмов дифференцировки СКК. Способ основан на введении в организм пациента фрагментированной ДНК, которая является аллогенной, получена от генетически и физиологически здоровых доноров и состоит из фрагментов, длина которых соответствует 1-10 нуклеосомным единицам, составляющих полный геном пациента, в ассоциации с белками ядерного матрикса. Вводят такое количество фрагментированной ДНК, чтобы достичь концентрации фрагментированной ДНК в плазме крови пациента, равной или превышающей концентрацию собственной ДНК плазмы крови, но не более 1500 нг/мл. Способ позволяет восстанавливать нарушения ДНК СКК пациента путем замещения поврежденных участков хромосом гомологической рекомбинацией и обеспечивает расширение области применения препарата фрагментированной ДНК [27].
Способ также имеет ограниченную применимость.
В ряде публикаций описан возможный механизм лейкостимулирующего действии препарата Панаген. Например, в источнике [28] раскрыто, что фрагменты ДНК, доставленные во внутриядерное пространство CD34+ СКК, своими двуцепочечными концами активируют пул иерархических киназ, при этом в СКК, покоящихся до этого времени, запускается молекулярная машина ареста клеточного цикла. Через некоторое время система репарации удаляет эти фрагменты из ядерного пространства, но клетка при этом уже вошла в активированное состояние и обязана продвинуться по клеточному циклу с последующим его завершением. При постоянной доставке фрагментов ДНК в ядерное пространство этого типа клеток будет происходить постоянная активация деления этих клеток, что и определяет лейкостимулирующий эффект действия экзогенной ДНК.
Выявлены публикации, свидетельствующие о том, что инъекции экзогенной фрагментированной геномной ДНК связаны с эффектами, при которых затрагивается функциональная целостность СКК. Так, в экспериментах, выполненных в работе [29], отмечалось появление селезеночных колоний у смертельно облученных мышей после своевременных инъекций экзогенной ДНК. Это наблюдение косвенно свидетельствовало о том, что экзогенная ДНК при внутрибрюшинном введении достигает клеток костного мозга и воздействует на CD34+ СКК, сохраняя их жизнеспособность. Потомки выживших стволовых клеток крови формируют колонии в селезенке, которые возрождают иммунную систему экспериментального животного.
Все указанные способы применения препарата фрагментированной ДНК человека Панаген имеют ограниченную применимость, поскольку не учитывают в одной стратегии всю совокупность обнаруженных терапевтических свойств препарата.
Наиболее близким по своей сущности к предложенному является способ лечения онкологических заболеваний, основанный на введении в организм пациента препарата цитостатической группы циклофосфана, который вводят в дозах от 20 до 100 мг/кг веса пациента, и препарата фрагментированной аллогенной двуцепочечной геномной ДНК с фрагментами, имеющими биологически активный размер и составляющими полный геном физиологически и генетически здорового донора (экзогенная ДНК), при этом, препарат экзогенной ДНК вводят через 48 часов после каждого введения препарата цитостатической группы и на протяжении последующих 30 суток для схемы, когда пациент получил полную курсовую дозу 6-14 г, либо на протяжении следующих 3-5 суток после однократной инъекции и за день до следующей по счету инъекции, продолжая такую прерывистую схему до полного набора терапевтической или поддерживающей дозы цитостатика [30].
Для реализации известного способа может быть применен препарат Панаген (ЛСР №004429/08 от 09.06.2008), который используют в качестве субстрата для активации созревания, индукции антигенпрезентирующей и специфической аллостимуляторной активности в направлении Th1 пути антигенпрезентирующих ДК организма. При этом может быть использована лекарственная форма препарата в виде таблеток, содержащих 5 мг активного вещества, например, по схеме через 30 мин и на 2, 3 и 5 сутки после введения циклофосфана в количестве одна таблетка в первые 30 минут после введения циклофосфана и далее в указанные дни по одной таблетке каждые 2-3 часа в течение суток (время бодрствования), но не более максимально допустимого количества, равного 30 мг активного вещества в сутки.
Однако и наиболее близкий способ обладает относительно низкой эффективностью лечения, обусловленной тем, что, используется только одно направление воздействия экзогенная ДНК на организм пациента и не обеспечивается влияние других эффективных терапевтических его свойств, проявляющихся в сочетании с действием цитостатиков циклофосфана и доксорубицина.
Требуемый результат заключается в повышении эффективности лечения.
Требуемый результат достигается тем, что в способе, основанном на применении в схемах лечения рака молочной железы II-IV стадии препаратов цитостатической группы, дополнительно после однократного в рамках одного цикла химиотерапии внутривенного введения цитостатиков циклофосфан (500 мг/м2) и доксорубицин (50 мг/м2) (схема АС) или циклофосфан (500 мг/м2), доксорубицин (50 мг/м2) и фторурацил (500 мг/м ) (схема FAC) пациенту назначают препарат на основе экзогенной ДНК человека Панаген (ЛСР №004429/08 от 09.06.2008) в форме таблеток, покрытых гастроэнтерическим покрытием, в дозе 30 мг/сутки при дробном равномерном приеме в течение активного периода суток, что составляет одна таблетка препарата Панаген шесть раз в день (каждые два часа) с началом приема препарата сразу непосредственно после проведенной химиотерапии в количестве 3 таблетки в течение 6 часов, перерывом в приеме препарата, возобновлением его приема через 42 часа, то есть через 48 часов после проведенной химиотерапии (день 3), продолжением приема препарата в течение 17 дней до 20 дня после химиотерапии (включительно), и продолжением приема препарата по указанной схеме до окончания всех курсов химиотерапии.
Кроме того, требуемый результат достигается тем, что, применение препаратов цитостатической группы при их синергичном сочетании с препаратом Панаген по указанной схеме представляет собой новую стратегию лечения рака молочной железы, применение которой приводит к одновременному в рамках одного курса химиотерапии проявлению трех типов терапевтического воздействия: к сохранению и стимуляции гранулоцитарно-макрофагального и лимфоцитарного ростков кроветворения, что компенсирует негативное лейкоредуцирующее действие цитостатиков, к сохранению врожденного противоракового иммунитета на уровне до терапии цитостатиками и индукции противоракового адаптивного иммунитета характеризующегося повышением в периферической крови пациентов цитотоксических CD8+ лимфоцитов с высоким содержанием перфоринов.
В более широком плане задачей настоящего изобретения является разработка обоснованного и экспериментально подтвержденного способа (стратегии) одновременного воздействия в рамках процедуры лечения рака молочной железы с применением многократных курсов программной полихимиотерапии и на опухолевую ткань, редуцируя ее развитие за счет активации ДК и индукции развития адаптивного иммунитета, и на организм пациента, помогая ему пережить негативные последствия действия мощных цитостатиков, которыми являются циклофосфан и доксорубицин за счет протекции и стимуляции пролиферации гемопоэтических предшественником костного мозга различной степени зрелости.
Ниже приводятся теоретические и экспериментальные данные подтверждающие, что изобретение отвечает критериям новизны, изобретательского уровня и практической (промышленной) применяемости.
Предложенный способ лечения онкологических заболеваний реализуется следующим образом.
Способ лечения онкологических заболеваний основан на применении препарата экзогенной ДНК Панаген в форме таблеток, покрытых гастроэнтерическим покрытием, в схемах лечения рака молочной железы II-IV стадии с использованием однократного в рамках одного цикла химиотерапии внутривенного введения цитостатиков циклофосфан (500 мг/м2), доксорубицин (50 мг/м2) и фторурацил (500 мг/м2). Препарат Панаген применяется в дозе 30 мг/сутки при дробном равномерном приеме в течение активного периода суток, что составляет одна таблетка препарата Панаген шесть раз в день (каждые два часа) с началом приема препарата сразу непосредственно после проведенной химиотерапии в количестве 3 таблетки в течение 6 часов, перерывом в приеме препарата, возобновлением его через 42 часа, то есть через 48 часов после проведенной химиотерапии (день 3) и продолжением в течение 17 дней до 20 дня после химиотерапии (включительно). При таком воздействии в организме пациента происходит одновременно лейкостимуляция и активация адаптивного иммунитета.
Для подтверждения того, что предложенный способ позволяет достигнуть требуемого результата, приведем его теоретическое и экспериментальное обоснование. Предложенный способ (стратегия) лечения рака молочной железы основывается да двух эффектах связанных с одновременным воздействием фрагментированной экзогенной ДНК (активное начало препарата Панаген) на СКК и иммунокомпетентные ДК, приводящим одновременно к индукции пролиферации первых и активации профессиональных свойств вторых. Рассмотрим теоретическое и экспериментальное доказательства обоих свойств препарата «Панаген».
На чертеже представлены:
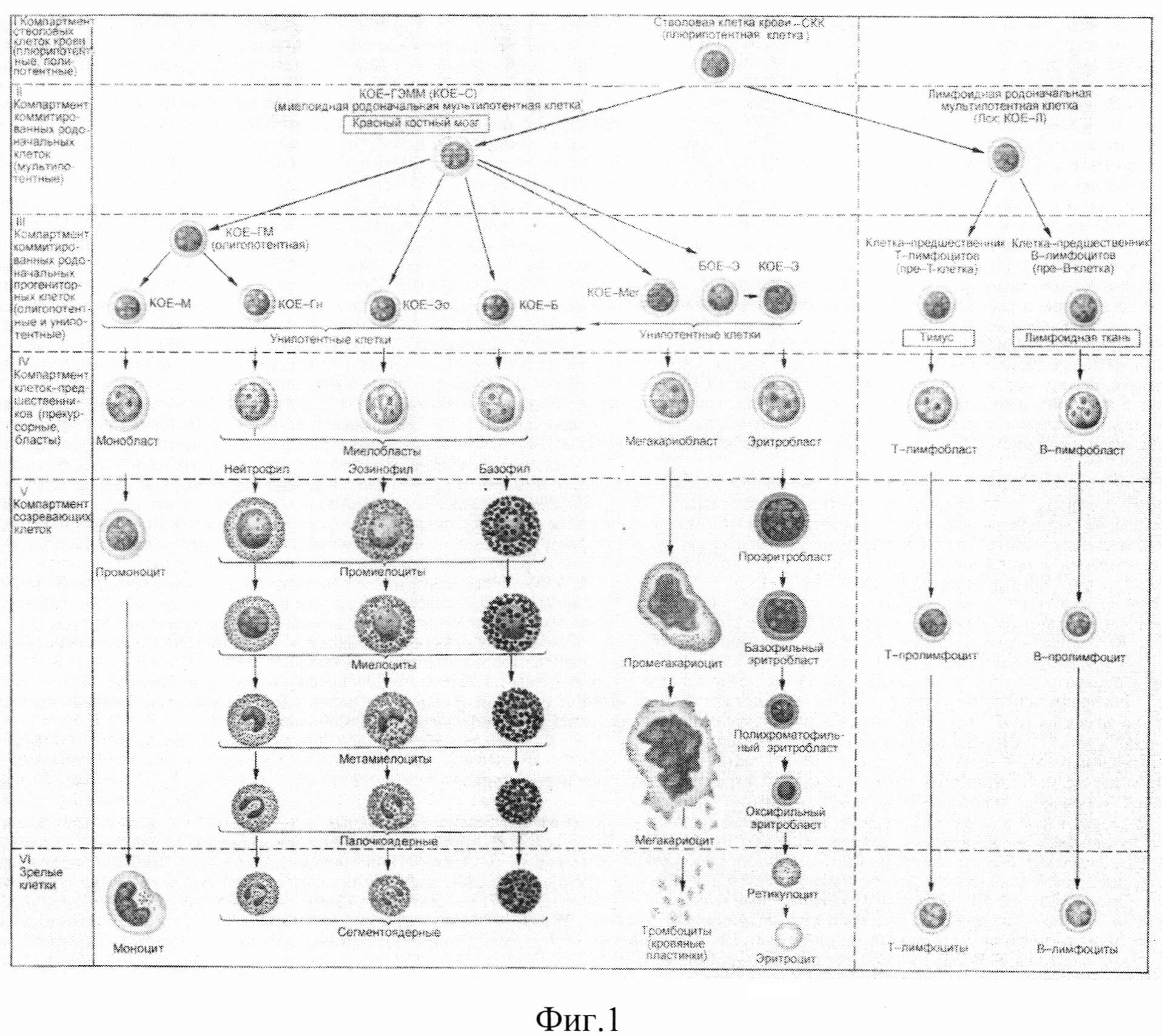
на фиг.1 - Постэмбриональный гемопоэз (схема по НА. Юриной). Стадии дифференцировки крови: I-IV - морфологически неидентифицируемые клетки; V, VI - морфологически идентифицируемые клетки; Б - базофил; БОЕ - бурстобразующая единица; Г - гранулоциты; Гн - гранулоцит нейтрофильный; КОЕ - колониеобразующие единицы; КОЕ-С - селезеночная колониеобразующая единица; Л - лимфоцит; Лск - лимфоидная стволовая клетка; М - моноцит; Мег - мегакариоцит; Эо - эозинофил; Э - эритроцит [31].
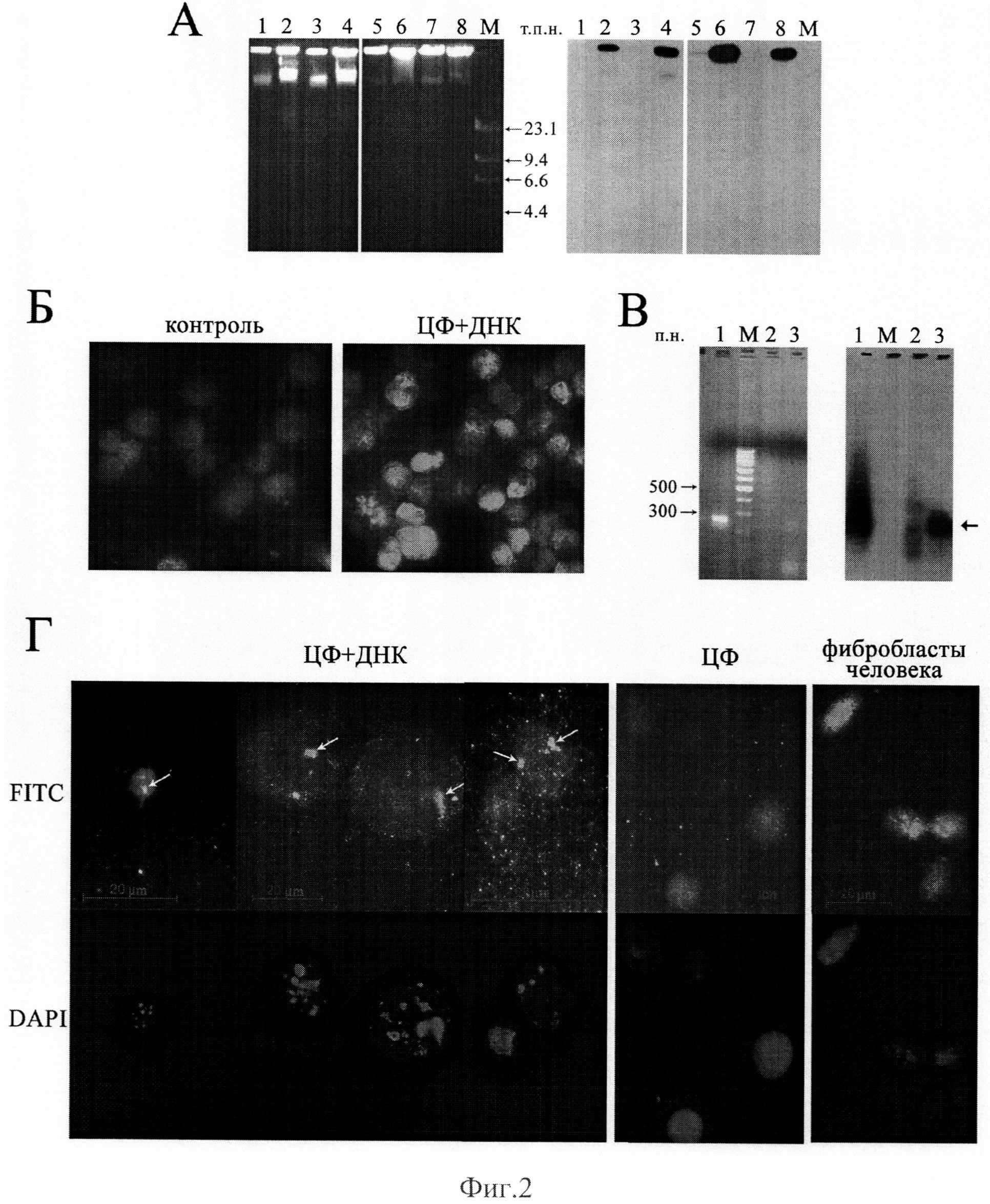
на фиг.2 - Доставка экзогенной ДНК в ККМ in vivo. A - Электрофореграмма (слева) и рентгенограмма (справа) геномной ДНК ККМ мышей после в/б введения меченого Alu повтора человека на фоне инъекции циклофосфана (ЦФ) (1) и в виде монопрепарата (2), меченого HpaI повтора лосося на фоне инъекции ЦФ (3) и в виде монопрепарата (4), меченой плазмиды pEGFP-N1 на фоне инъекции ЦФ (5) и в виде монопрепарата (6), а также после в/б введения меченого dATP фоне инъекции ЦФ (7) и в виде монопрепарата (8). М - маркер молекулярного веса λHindIII. Б - ПЦР на предметном стекле с биотин-мечеными нуклеотидами и с использованием ДНК человека, фрагментированной до размеров 20-500 п.н., в качестве праймера. Ядра ККМ интактных мышей и после 12-кратного (через 18 часов после введения ЦФ) ежечасного в/б введения 0,5 мг ДНК человека. В - Электрофореграмма (слева) и рентгенограмма (справа) продуктов ПЦР с праймерами на уникальный ген каспазы 3 человека с использованием в качестве матрицы ДНК человека (1), ДНК клеток костного мозга мышей СВА (2) и ДНК ядерной фракции клеток костного мозга мышей, выделенных через 8 часов после введения ДНК человека по описанной выше схеме (3). В качестве зонда для гибридизации использовали фрагмент ~260 п.н., меченый в ПЦР с праймерами на ген каспазы 3 человека и матрицей ДНК человека. 2% агарозный гель. М - маркер молекулярного веса (100 п.н.). Стрелка обозначает гибридизующийся фрагмент, соответствующий продукту ПЦР с праймерами на ген каспазы 3 человека. Г - FISH с меченым биотином Alu повтором человека препаратов ККМ мыши, приготовленных через 38 часов после инъекции ЦФ (200 мг/кг), на фоне введения ДНК человека по указанной ранее схеме и без него, а также фибробластов человека. Стрелками указаны зоны гибридизации.
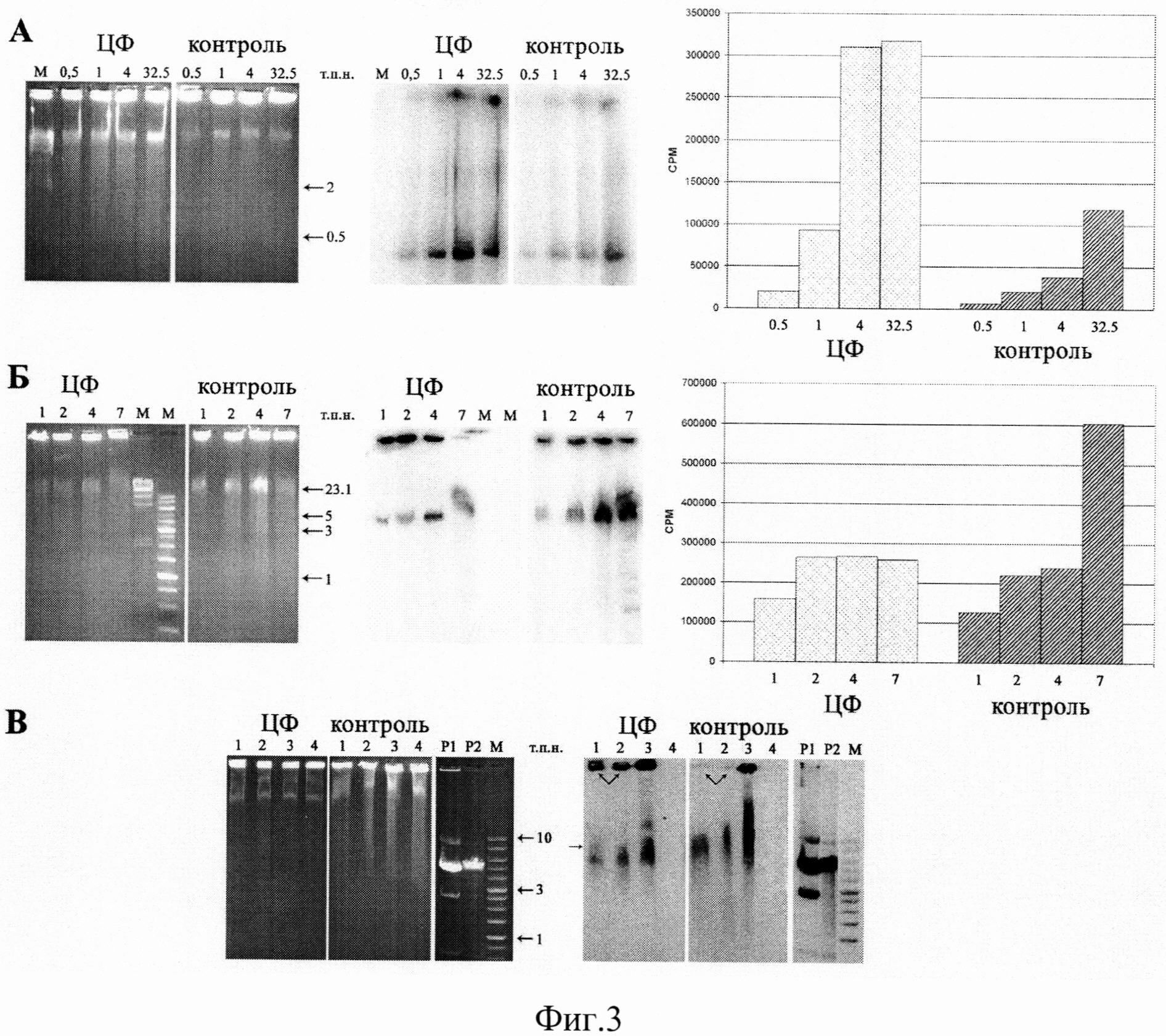
на фиг.3 - Доставка экзогенной ДНК в ККМ in vitro. A - Результаты инкубации ККМ с фрагментом ДНК Alu повтором 300 п.н., синтезированным и меченым в ПЦР, в количестве от 0,5 до 32,5 мкг. Электрофореграмма (слева) и рентгенограмма (справа) после заливки в блоки легкоплавкой агарозы и электрофореза ядер ККМ мыши, выделенных через 18 ч после воздействия ЦФ, и интактной мыши. М - маркер молекулярного веса λHindIII. Справа приведена количественная оценка меченого материала, содержащегося в ядрах ККМ. Оценка проведена с использованием фосфоимеджера Molecular Imager FX Pro+ и программы Quantity One. Б - Результаты инкубации ККМ с плазмидой pEGFP-N1, гидролизованной рестриктазой HindIII и меченой по липкому концу, в течение различного времени - 1, 2, 4 и 7 часов. Электрофореграмма (слева) и рентгенограмма (справа) после заливки в блоки легкоплавкой агарозы и электрофореза ядер ККМ мыши, выделенных через 18 ч после воздействия ЦФ, и интактной мыши. М - маркеры молекулярного веса. Справа приведена количественная оценка меченого материала, содержащегося в ядрах ККМ. Оценка проведена с использованием фосфоимеджера Molecular Imager FX Pro+ и программы Quantity One. В - Результаты инкубации ККМ с ДНК плазмиды pEGFP-N1, гидролизованной рестриктазой Smal (1), рестриктазой HindIII (2), суперскрученной формой плазмиды pEGFP-N1 (3) и в отсутствие экзогенной ДНК (4) в течение 7 часов. Электрофореграмма (слева) и рентгенограмма (справа) после заливки в блоки легкоплавкой агарозы и электрофореза ядер ККМ мыши, выделенных через 18 ч после воздействия ЦФ и интактной мыши СВА. Р1 и Р2 - ДНК плазмиды pEGFP-N1 суперскрученной и линейной формы, М - маркер молекулярного веса.
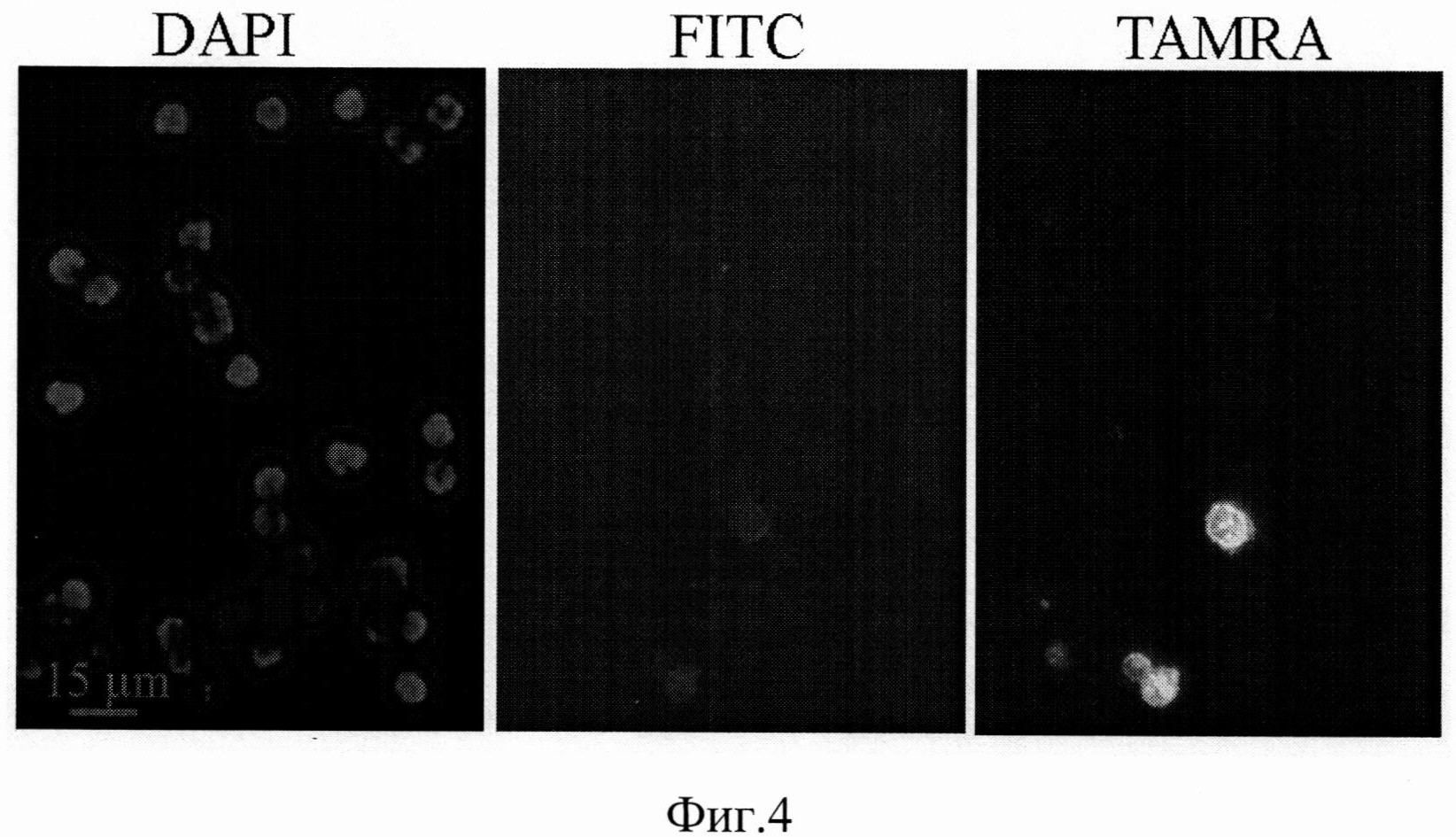
на фиг.4 - Интернализация экзогенной ДНК в CD34+ СКК. Препарат ККМ, выделенных через 18 ч после инъекции мышам ЦФ (200 мг/кг) и культивированных ex vivo с ДНК Alu повтора человека, меченного флуорохромом TAMRA. Дополнительно клетки окрашивали специфическими FITC мечеными антителами к поверхностному маркеру CD34. DAPI - окраска хроматина ядер, FITC - окраска специфическими антителами к поверхностному маркеру CD34+ плюрипотентных клеток, TAMRA - детекция в ядрах клеток ПЦР меченой флуорохромом TAMRA экзогенной ДНК.
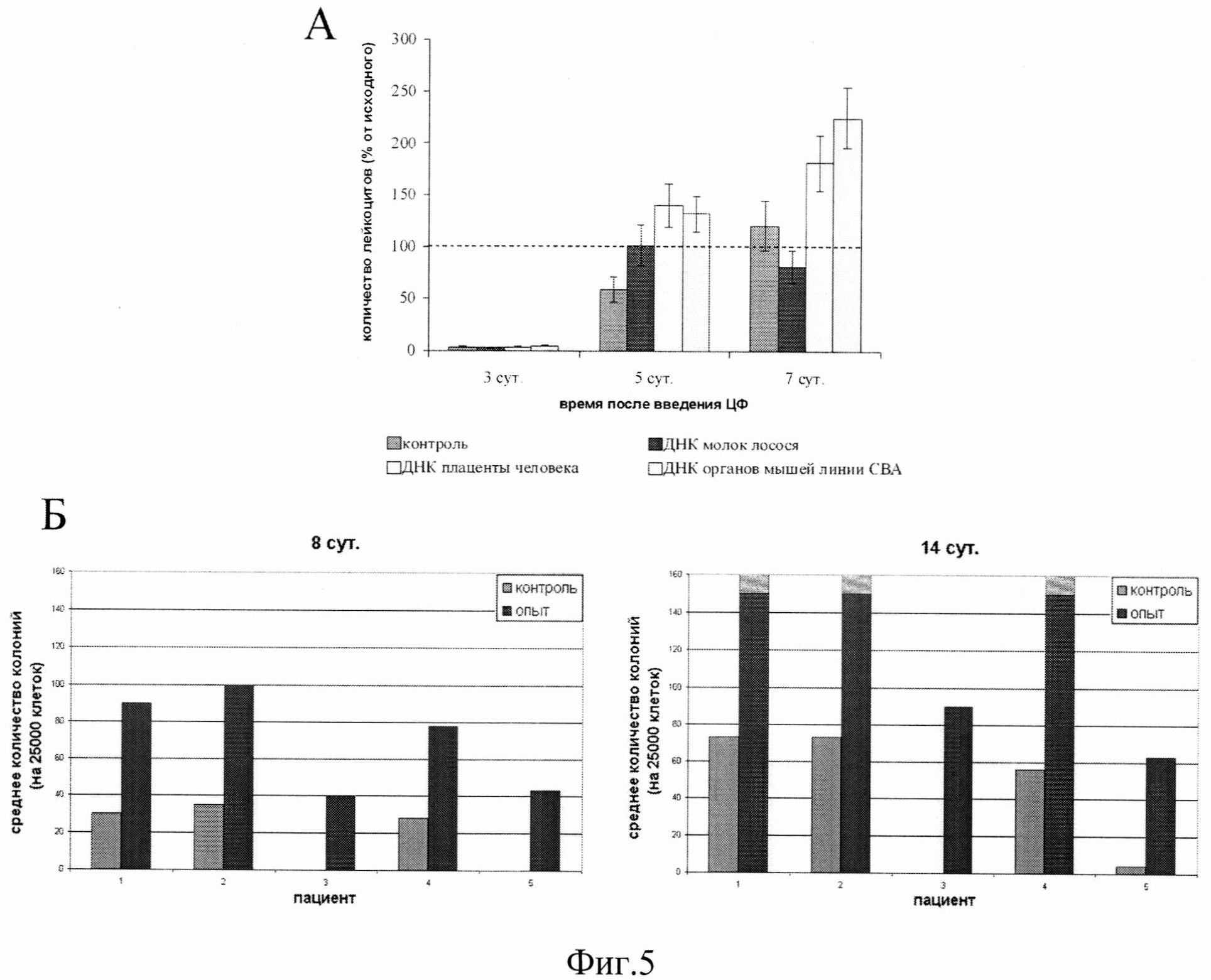
на фиг.5 - Стимуляция лейко- и эритропоэза. А - Мышам-самцам линии СВА в течение 6 дней ежедневно внутрибрюшинно вводили по 50 мкг ДНК различного происхождения, выделенной из молок лосося, плаценты человека и органов мышей линии СВА, в 0,2 мл физ. раствора. ЦФ в дозе 200 мг/кг веса вводили однократно в брюшную полость на второй день после первой инъекции ДНК. Количество лейкоцитов в крови индивидуально подсчитывали у каждой мыши на 3, 5 и 7 день после введения ДНК. Кровь брали из кончика хвоста. Видно, что на 3 день после инъекции ЦФ количество лейкоцитов в крови составляло 5-6% от исходного. На 5 день в группе мышей, получавших один ЦФ, количество лейкоцитов еще не достигало исходного уровня, тогда как у мышей, получавших ДНК, наблюдалось их восстановление до нормы. На 7 день, когда в группах мышей, получавших ДНК человека и мыши, уровень лейкоцитов превышал исходный более, чем в 1,5-2 раза, в группе, получавшей ДНК лосося, их уровень не изменился по сравнению с предыдущим измерением. Таким образом, экзогенная гомологичная ДНК стимулирует восстановление количества лейкоцитов в крови мышей СВА после однократного введения ЦФ, угнетающего кроветворение. Б - Мононуклеарные клетки (МНК) костного мозга человека в течение 1 часа инкубировали при 37°С с экзогенной ДНК человека в концентрации 100 мкг/мг. В контроле вместо ДНК в соответствующем количестве добавляли среду для культивирования клеток. На 8 и 14 сутки после инкубации проводили оценку числа эритроидных колоний, образовавшихся в культуре клеток. После преинкубации МНК с экзогенной ДНК регистрируется значительное, статистически достоверное увеличение числа генерируемых эритроидных колоний (p<0,001). Наиболее демонстративное повышение числа эритроидных колоний после обработки экзогенной ДНК человека наблюдается на ранних сроках - на 8 сутки культивирования, когда число формирующихся эритроидных колоний в опыте превышает количество таковых в контроле в 3-4 и более раз. При использовании модели эритроидного колониеобразования действие препарата экзогенной ДНК человека на поврежденные гемопоэтические предшественники в 40% случаев носит не количественный, а качественный характер. При этом экзогенная ДНК явилась тем активным началом, которое позволило предшественникам сохранить (восстановить) жизнеспособность. Механизм, объясняющий спасение предшественников в результате воздействия фрагментов экзогенной ДНК не известен.
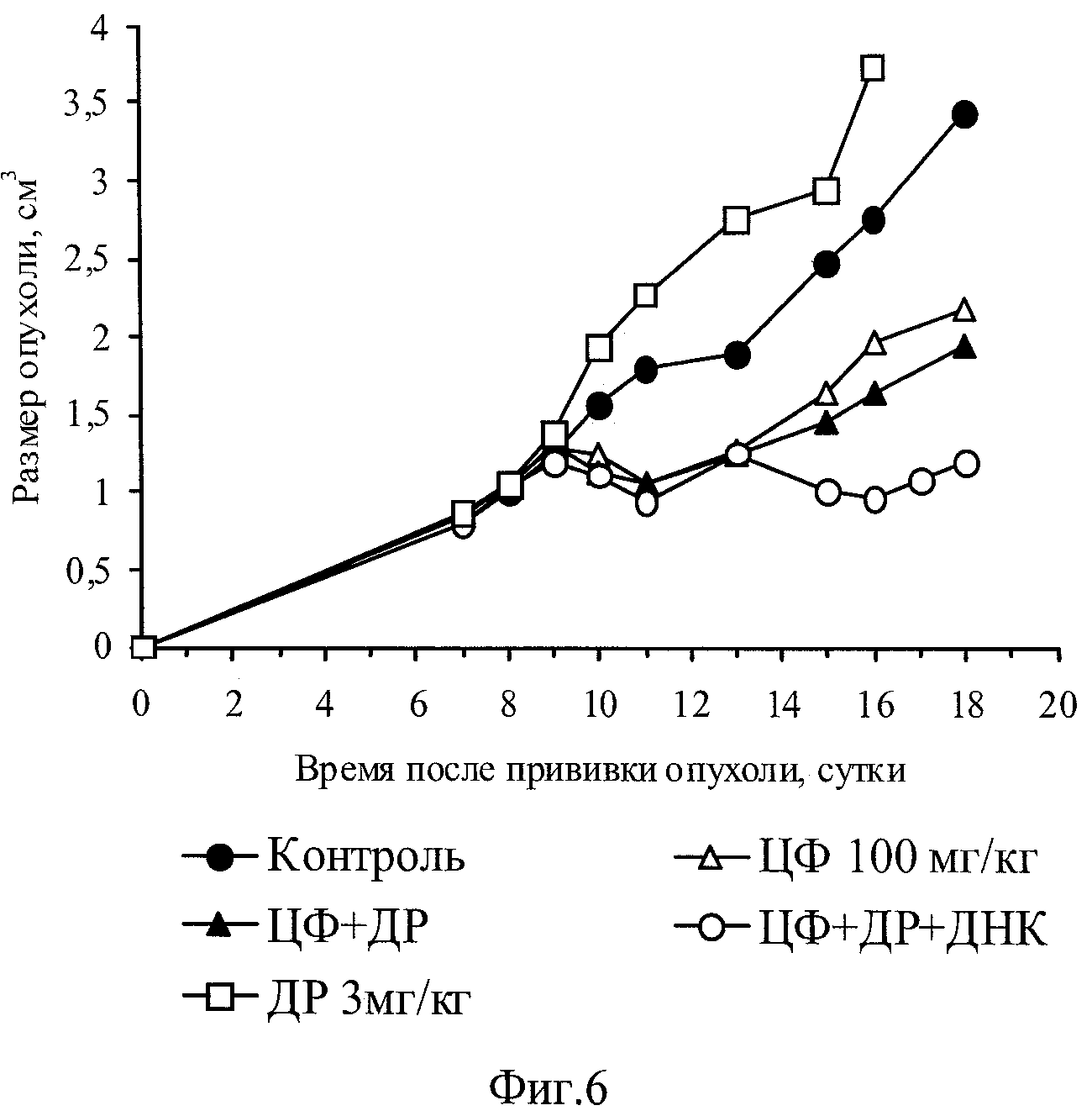
на фиг.6 - Динамика роста опухоли Кребс-2 у мышей после проведенной XT.
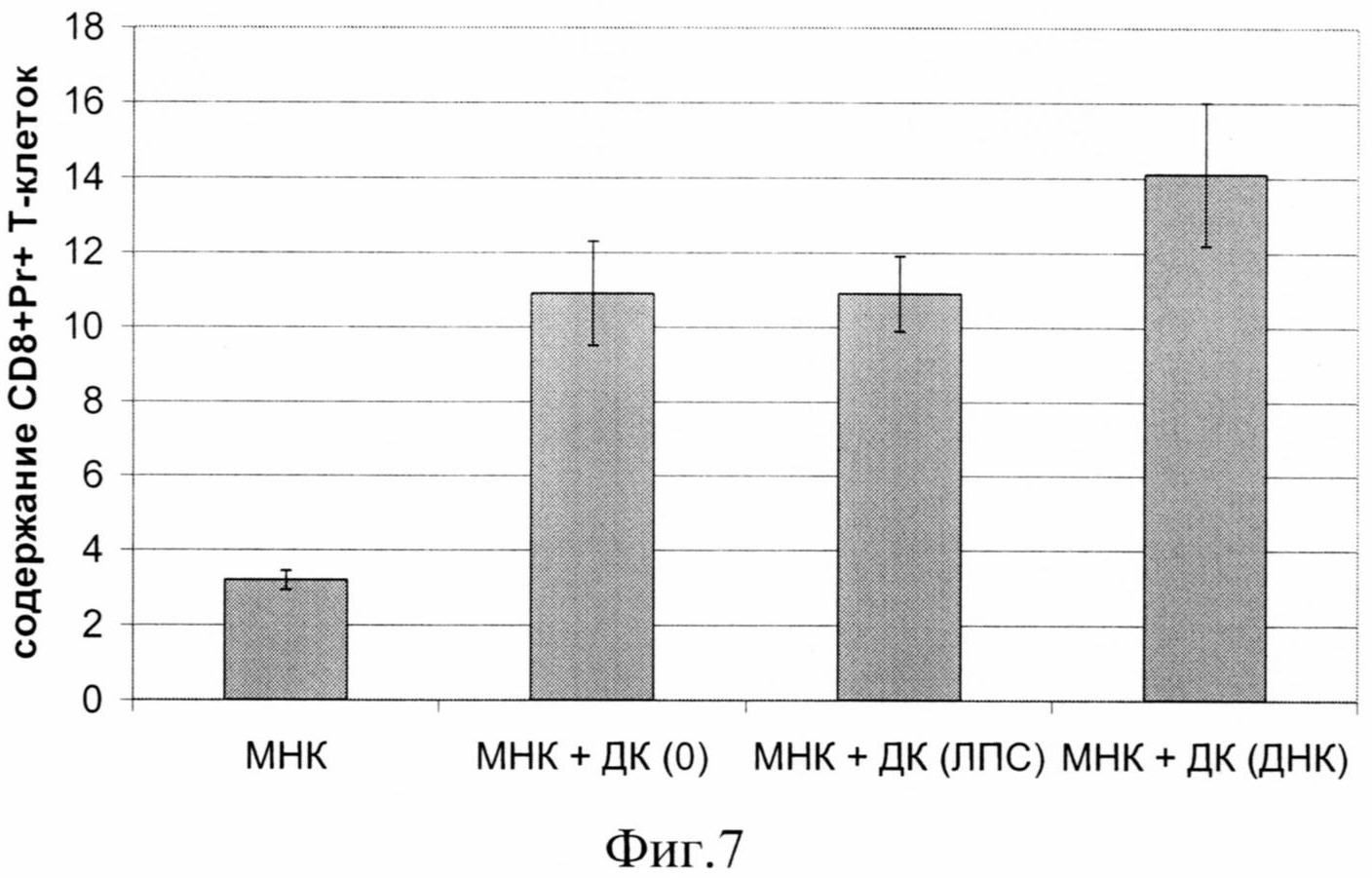
на фиг.7 - Процентное содержание CD8+ перфорин+ Т-клеток в интактных МНК и после инкубации с ДК, созревшими в присутствии ЛПС, ДНК или в отсутствии дозревающего стимула (0).
на фиг.8 - Контрольные точки исследования. * - Анализ крови на абсолютное количество лейкоцитов и нейтрофилов, общий анализ крови. # - Подсчет количества CD34+ клеток.
на фиг.9 - Абсолютное число лейкоцитов в исходной точке 0 и определенное в контрольных точках 7, 14 и 21 день после проведения XT. Отмечается достоверное снижение количества клеток в периферической крови пациентов, участвующих в испытаниях, в контрольной точке 14 суток относительно исходного уровня. ** - отличия от группы «Плацебо» достоверны с вероятностью pu<0,01.
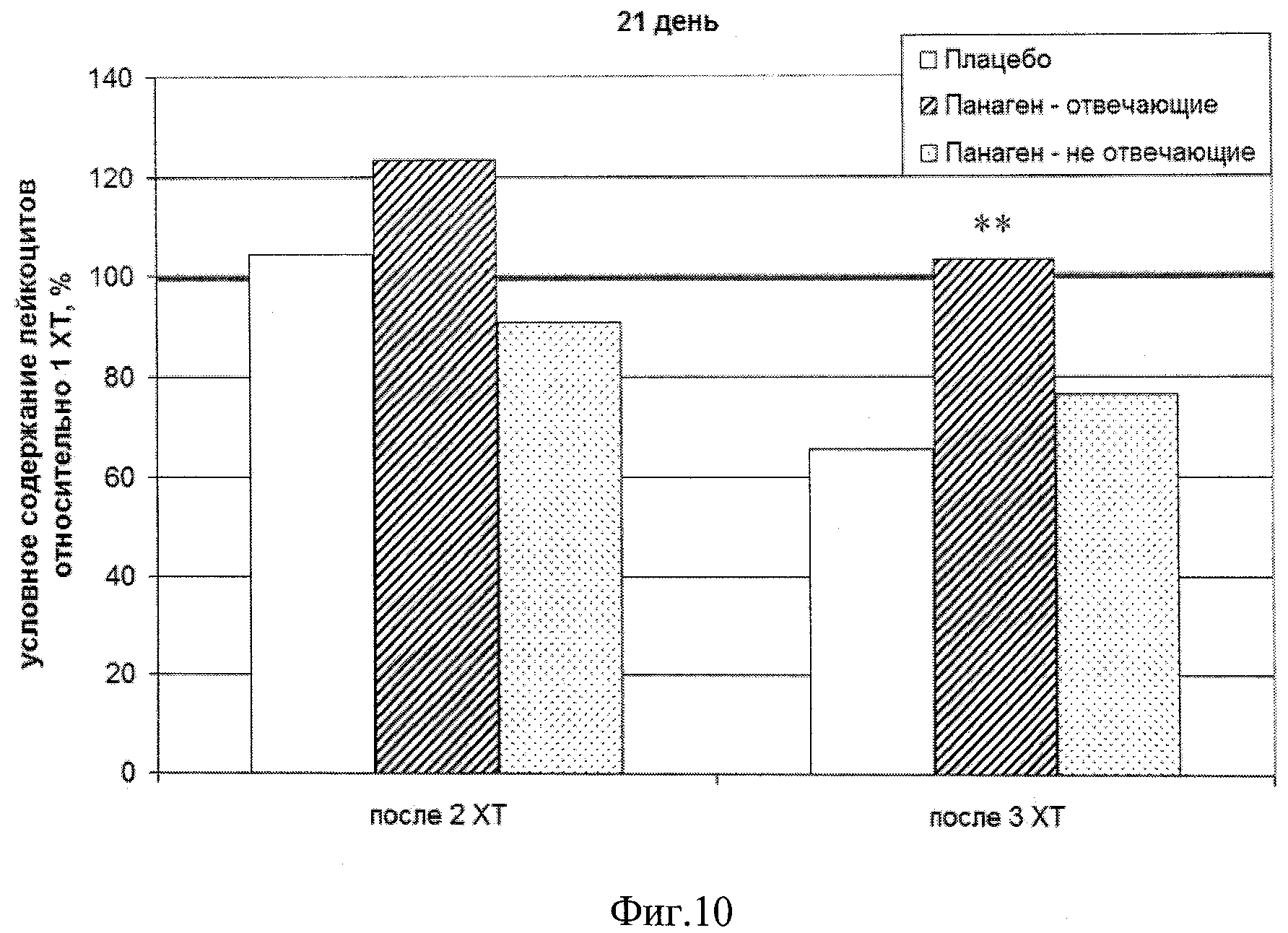
на фиг.10 - Условное содержание лейкоцитов относительно соответствующей контрольной точки после 1 XT в группах «Плацебо», «Панаген-отвечающие» и «Панаген-не отвечающие» на 21 день после проведения XT. ** - отличия от группы «Плацебо» достоверны с вероятностью pu<0,01.
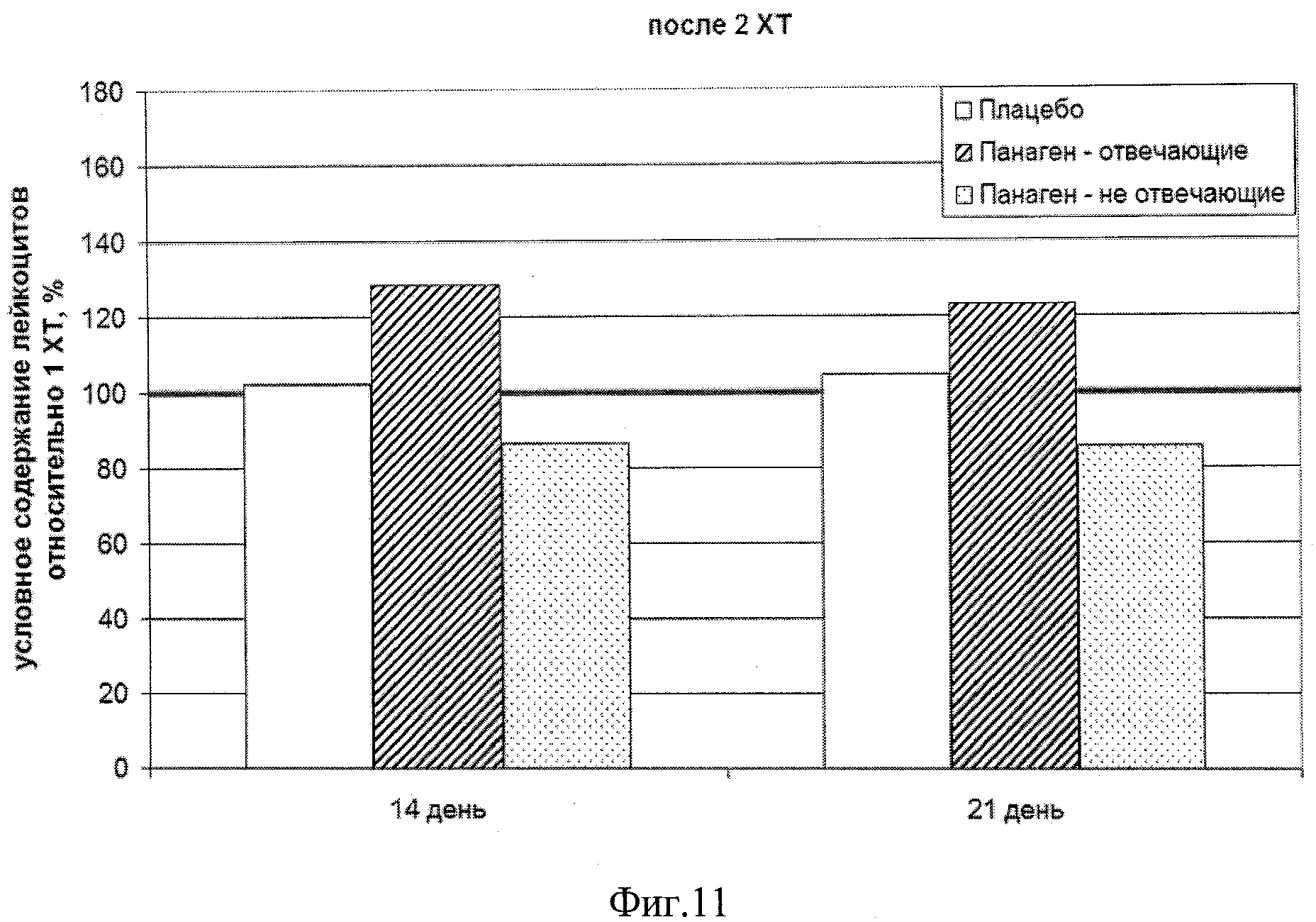
на фиг.11 - Сравнение условных значений содержания лейкоцитов в каждой группе на втором курсе XT в контрольных точках 14 и 21 сутки после введения цитостатика относительно значения параметра после 1 XT. Группы «Панаген-отвечающие» и «Панаген-не отвечающие» формировались независимо для каждой контрольной точки.
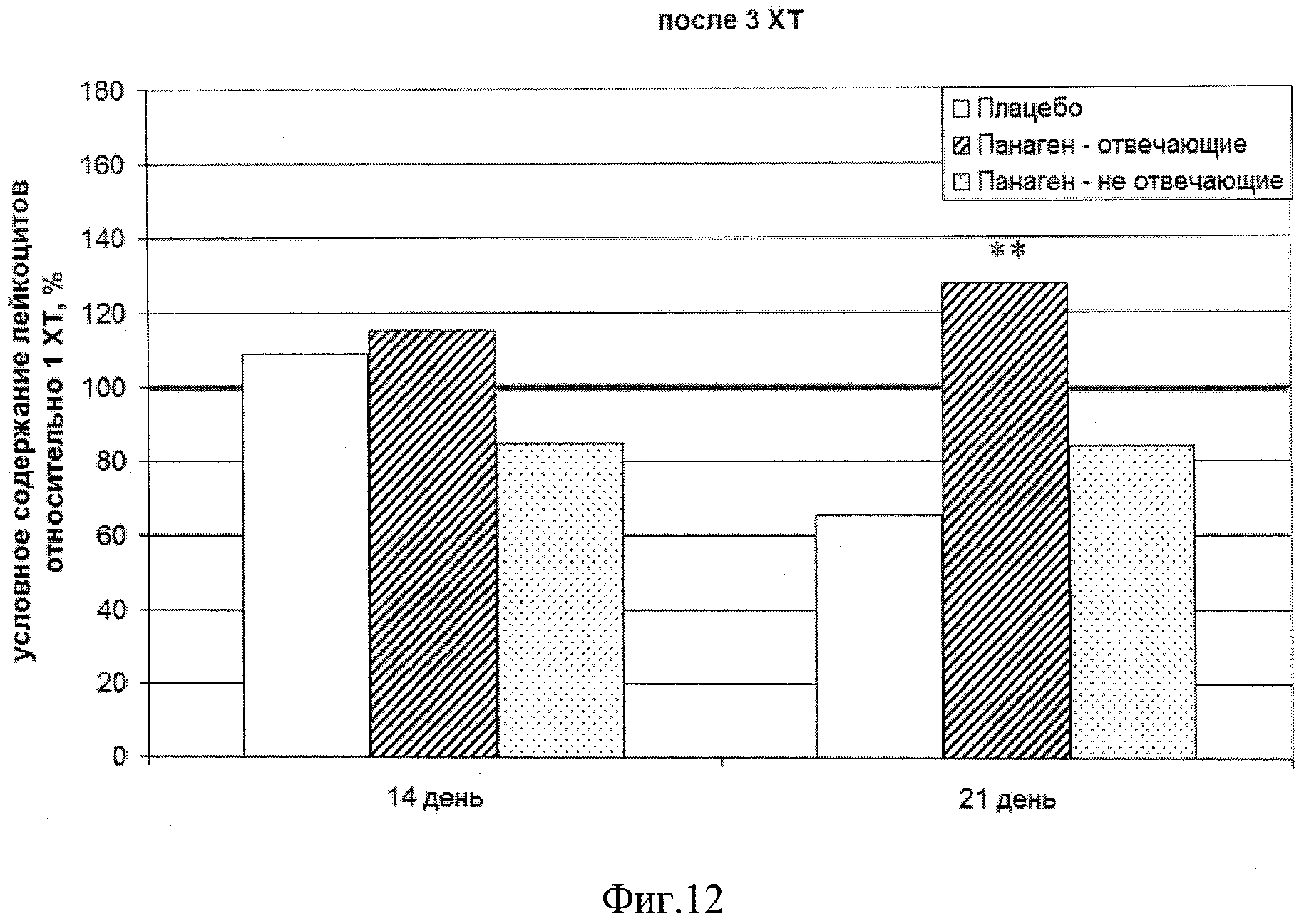
на фиг.12 - Сравнение условных значений содержания лейкоцитов в каждой группе на третьем курсе XT в контрольных точках 14 и 21 сутки после введения цитостатика относительно значения параметра после 1 XT. Группы «Панаген-отвечающие» и «Панаген-не отвечающие» формировались независимо для каждой контрольной точки. ** - отличия от группы «Плацебо» достоверны с вероятностью pu<0,01.
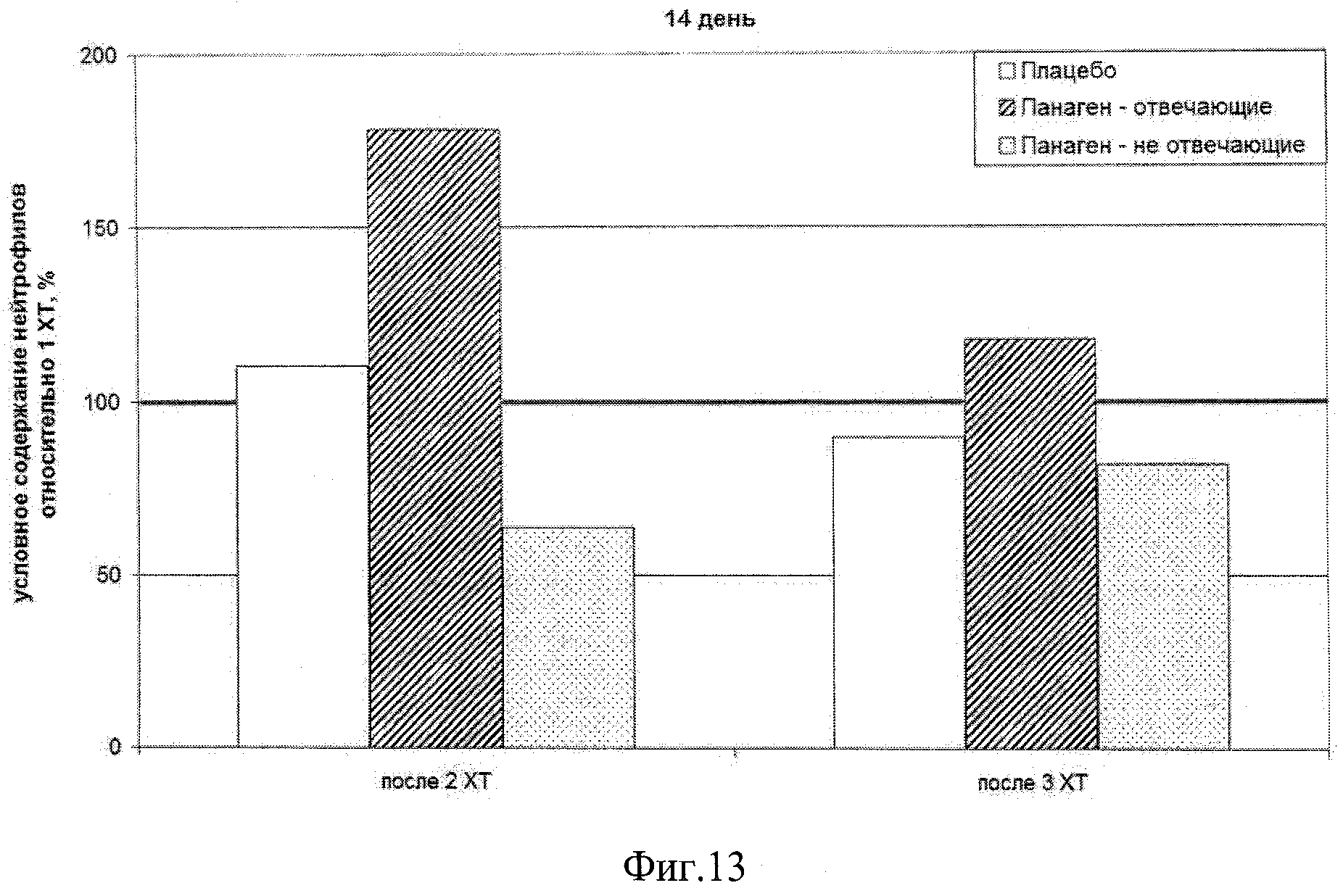
на фиг.13 - Сравнение условных значений содержания нейтрофилов на 14 день после введения цитостатиков (контрольная точка) после 2 и 3 XT относительно значения параметра после 1 XT.
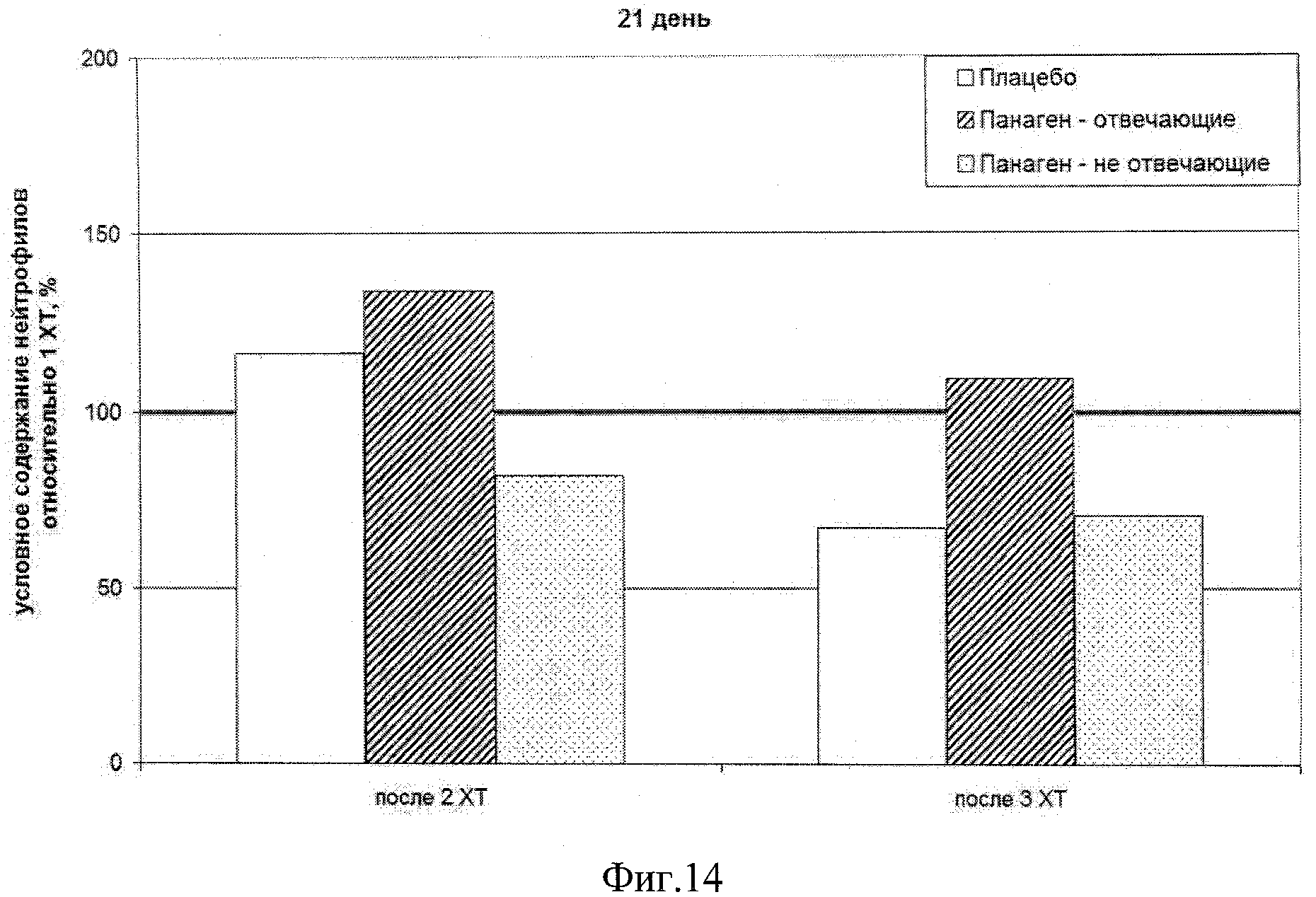
на фиг.14 - Сравнение условных значений содержания нейтрофилов на 21 день после введения цитостатиков (контрольная точка) после 2 и 3 XT относительно значения параметра после 1 XT.
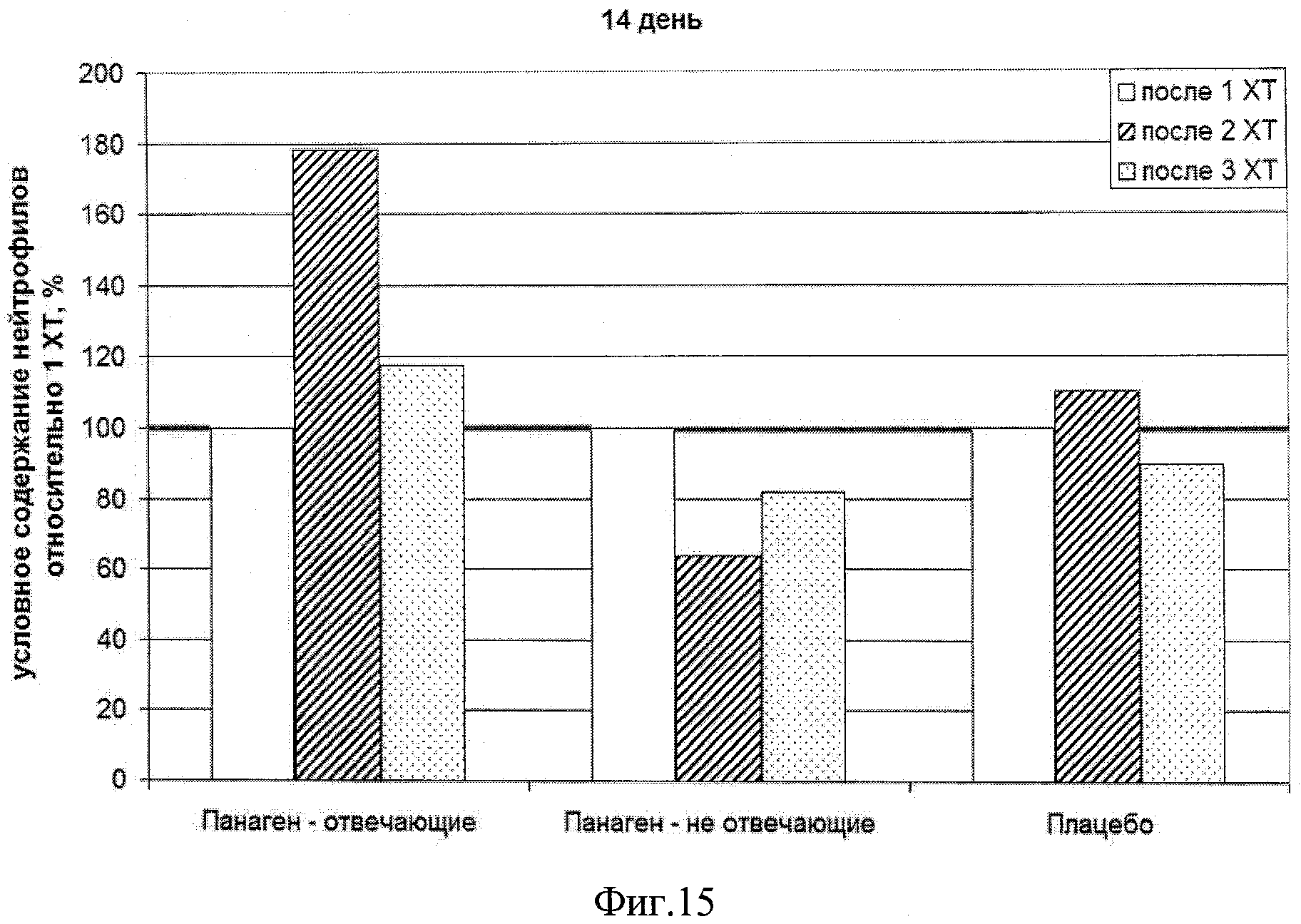
на фиг.15 - Сравнение условных значений содержания нейтрофилов в каждой группе по ходу проводимых курсов XT в контрольной точке 14 сутки после введения цитостатика по отношению к показателю 1 XT.
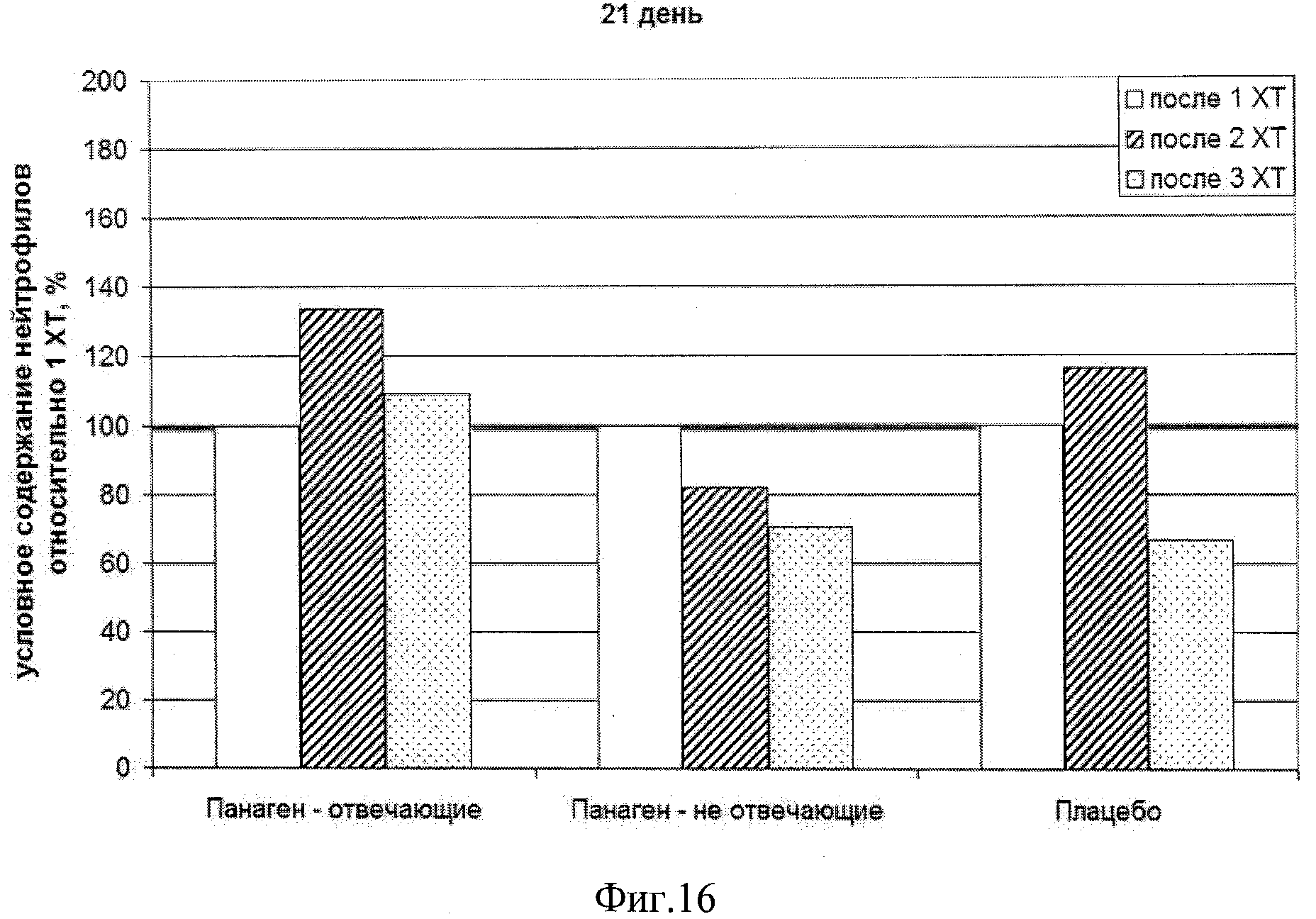
на фиг.16 - Сравнение условных значений содержания нейтрофилов в каждой группе по ходу проводимых курсов XT в контрольной точке 21 сутки после введения цитостатика по отношению к показателю 1 XT.
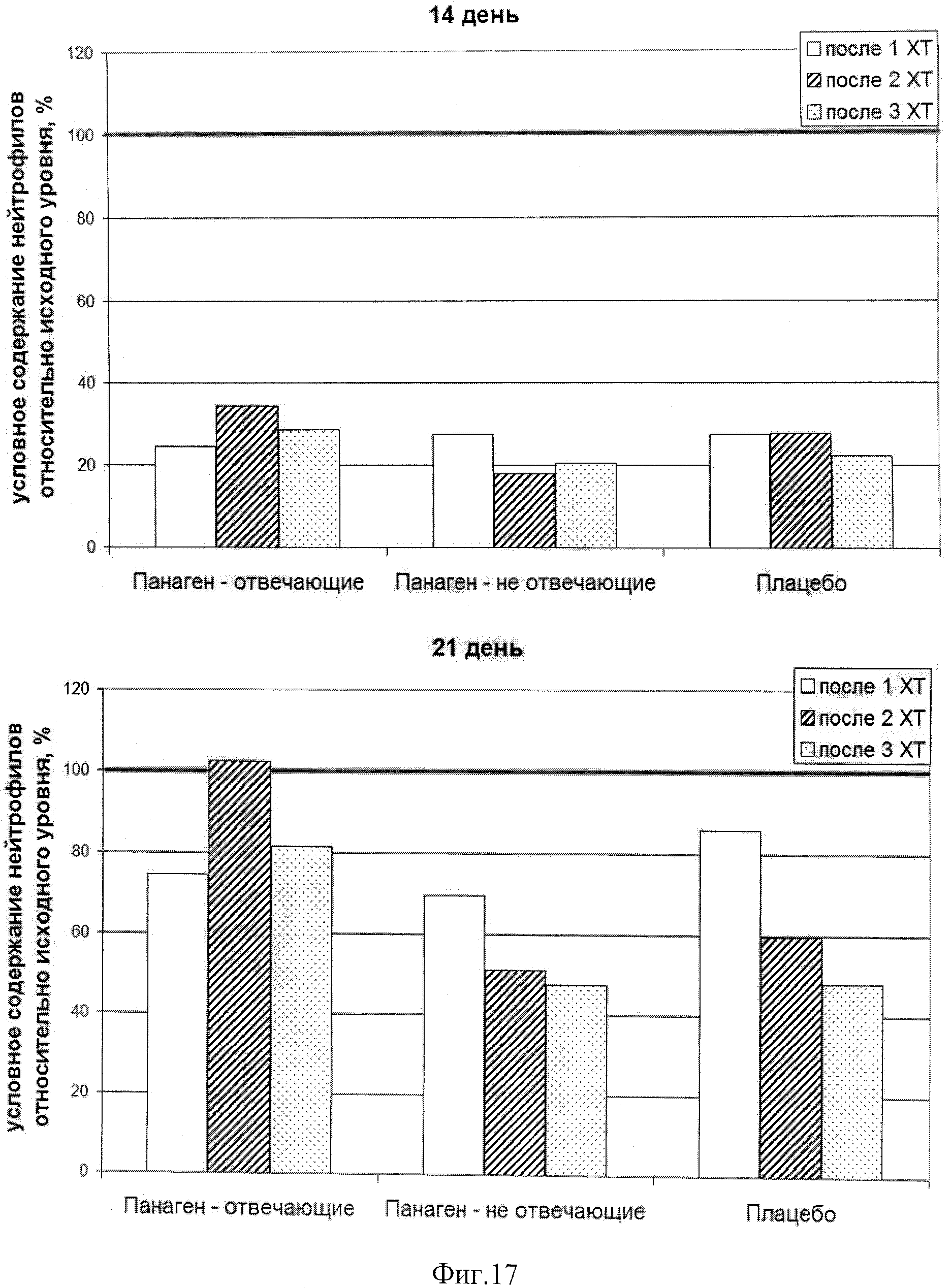
на фиг.17 - Сравнение условных значений содержания нейтрофилов в каждой группе по ходу проводимых курсов XT в контрольных точках 14 и 21 сутки после введения цитостатика по отношению к исходному значению.
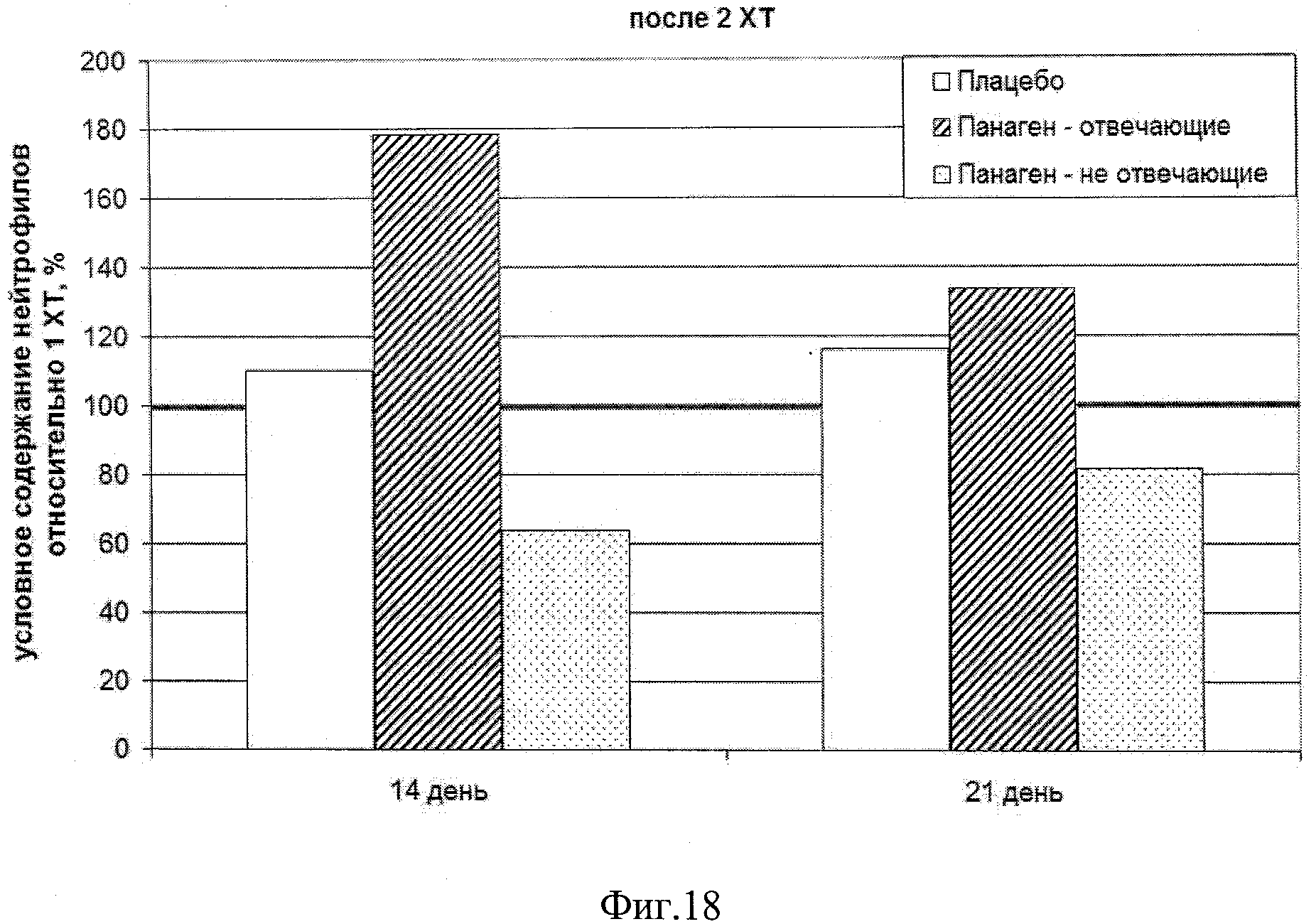
на фиг.18 - Сравнение условных значений содержания нейтрофилов в каждой группе на втором курсе XT в контрольных точках 14 и 21 сутки после введения цитостатика относительно значения параметра после 1 XT. Группы «Панаген-отвечающие» и «Панаген-не отвечающие» формировались независимо для каждой контрольной точки.
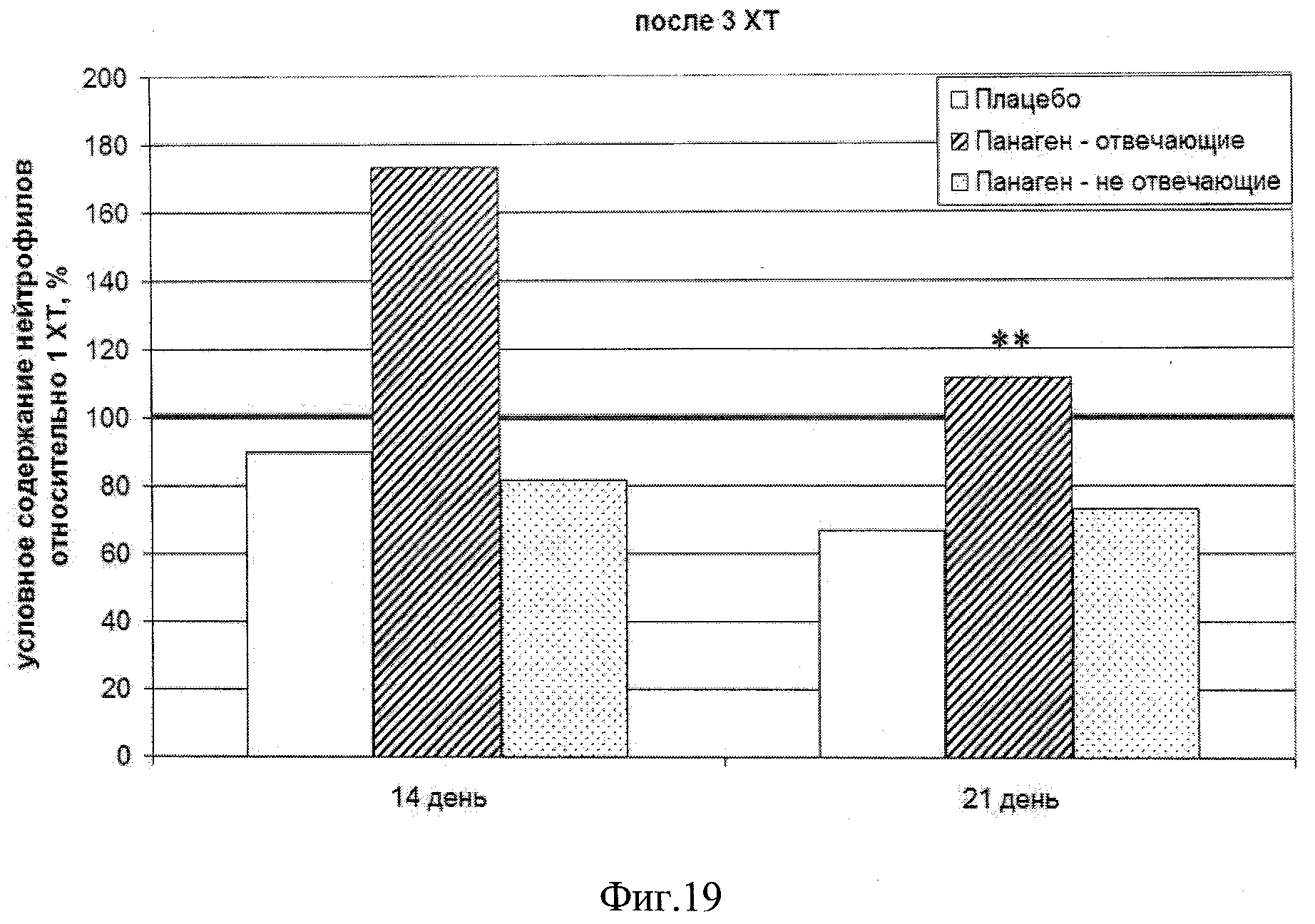
на фиг.19 - Сравнение условных значений содержания нейтрофилов в каждой группе на третьем курсе XT в контрольных точках 14 и 21 сутки после введения цитостатика относительно значения параметра после 1 XT. Группы «Панаген-отвечающие» и «Панаген-не отвечающие» формировались независимо для каждой контрольной точки. ** - отличия от группы «Плацебо» достоверны с вероятностью pu<0,01.
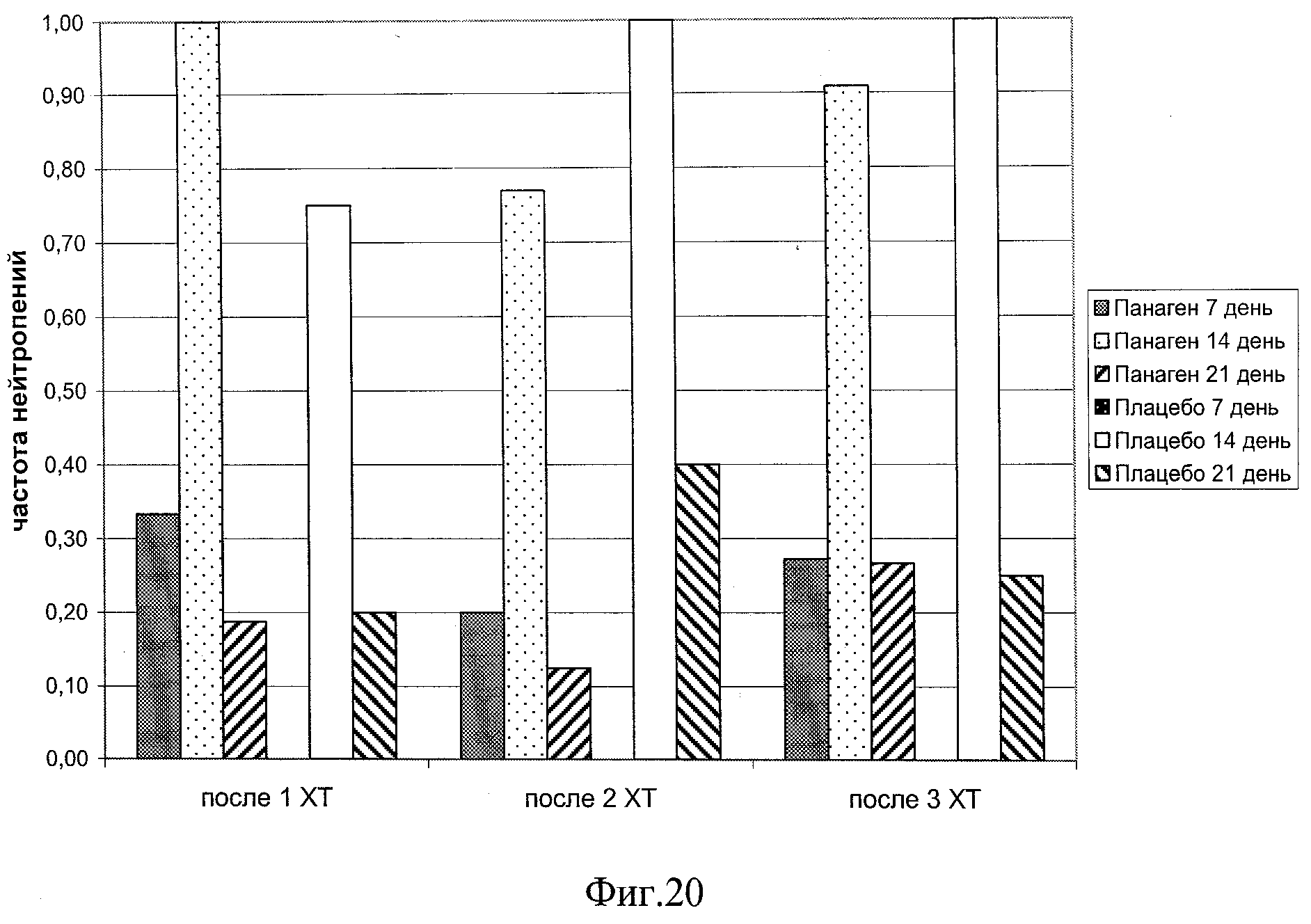
на фиг.20 - Частота проявления нейтропений всех степеней у пациентов в различных контрольных точках в ходе проведения 3 курсов XT.
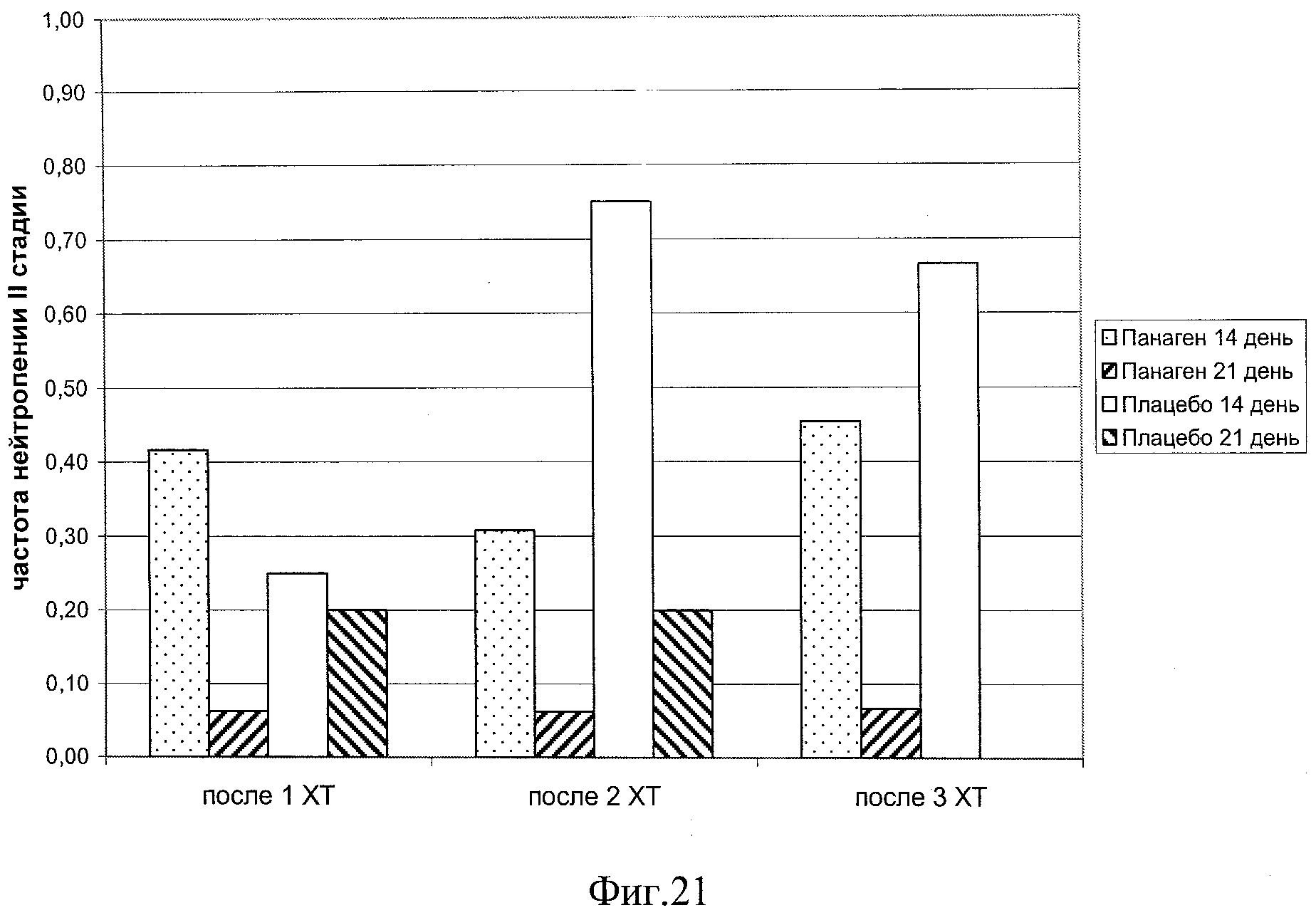
на фиг.21 - Частота проявления нейтропений II степени у пациентов в различных контрольных точках в ходе проведения 3 курсов XT.
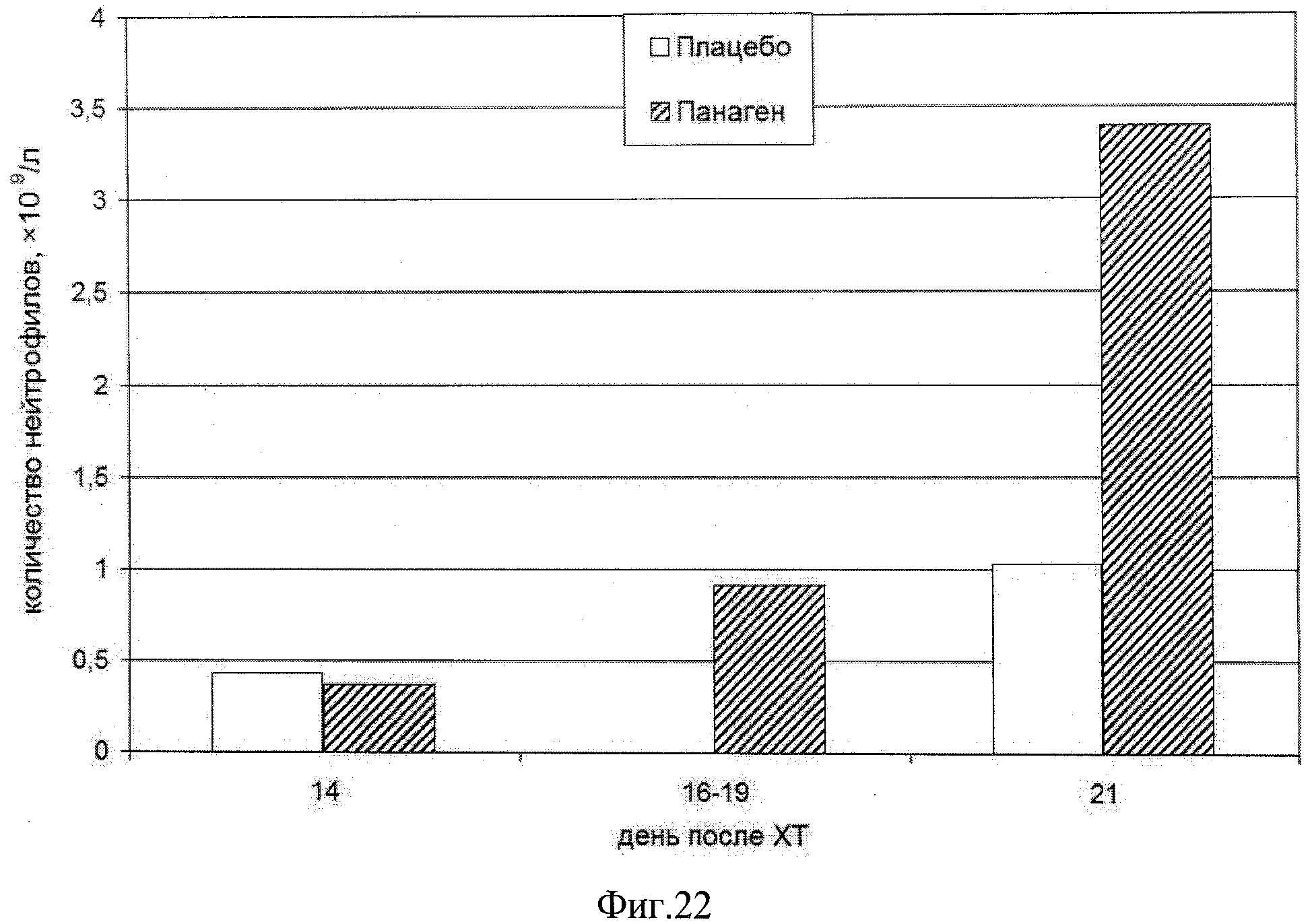
на фиг.22 - Динамика восстановления нейтрофилов после наибольшего падения их числа в периферической крови до значений, индуцирующих фебрилярную нейтропению, в группах «Плацебо» и «Панаген» без дополнительной лейкостимуляции.
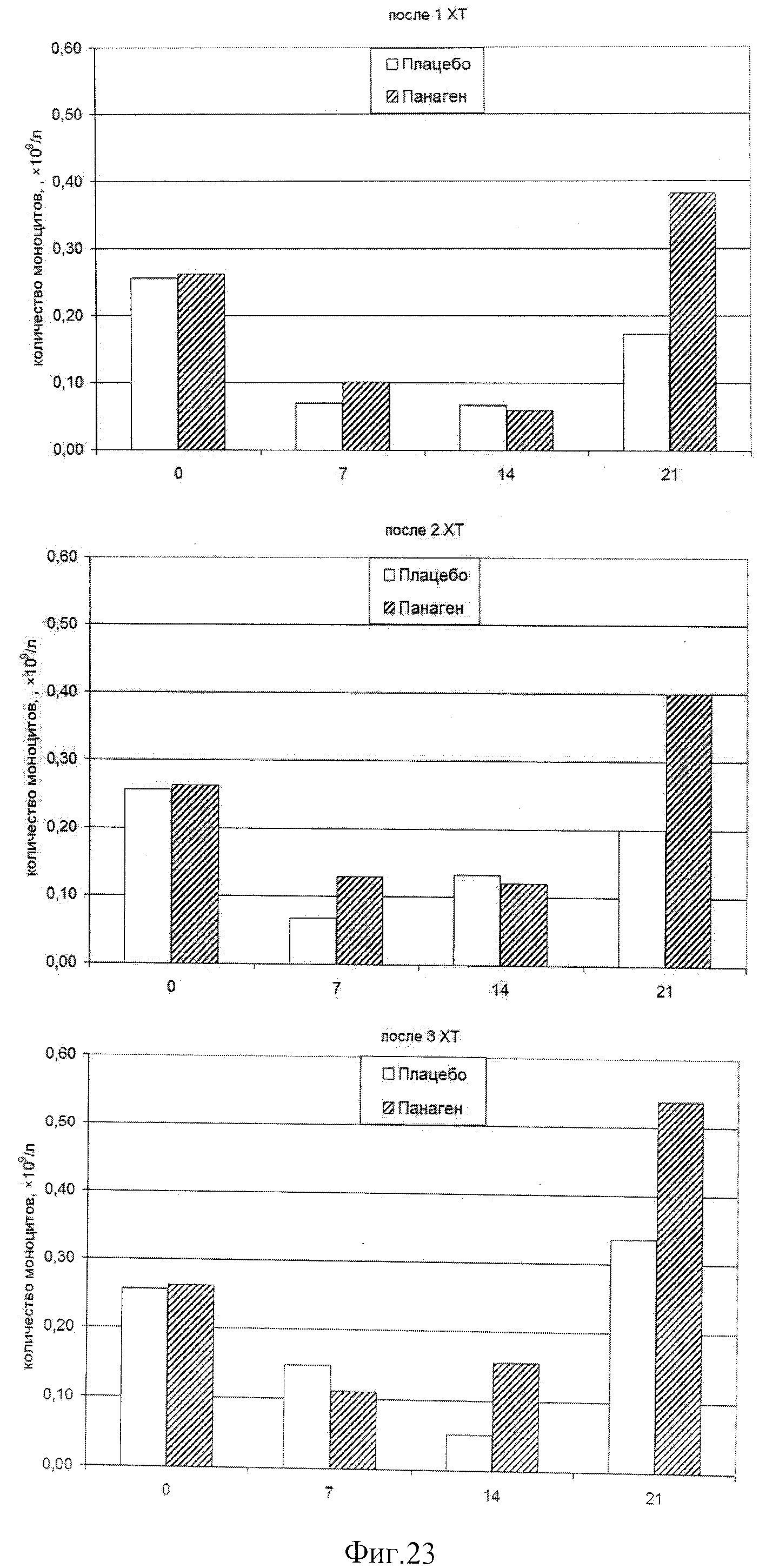
на фиг.23 - Абсолютное число моноцитов в исходной точке 0 и определенное в контрольных точках 7, 14 и 20 день после проведения XT. Отмечается достоверное снижение количества клеток в периферической крови пациентов, участвующих в испытаниях в контрольной точке 14 суток.
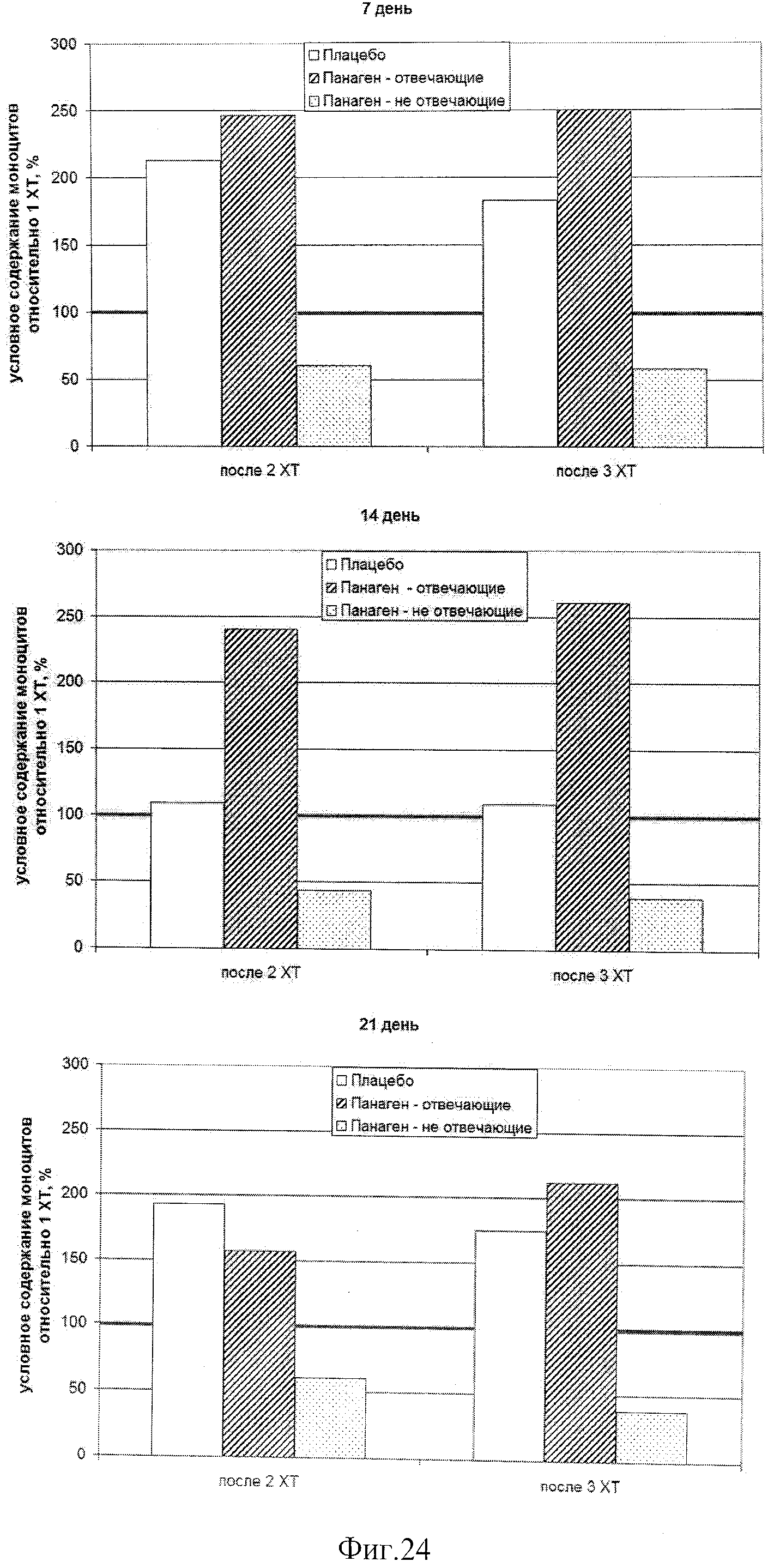
на фиг.24 - Относительное число моноцитов в группах в контрольных точках в сравнении после 2 и 3 XT.
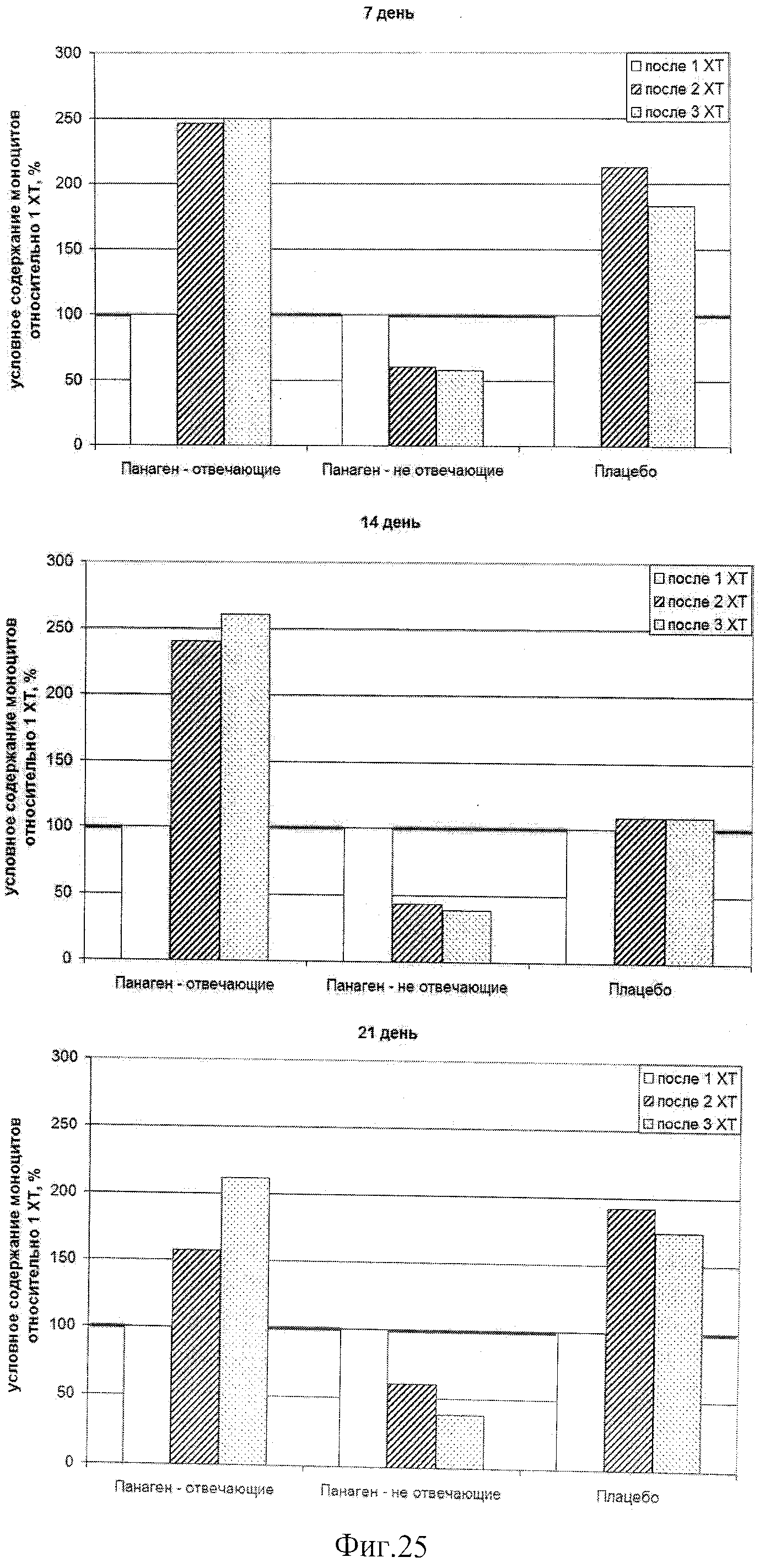
на фиг.25 - Сравнение относительного числа моноцитов внутри каждой группы в контрольных точках по ходу проводимых курсов XT. Можно отметить, что в группе «Панаген-отвечающие» относительное содержание моноцитов постоянно растет от XT к XT. В группе «Плацебо» рост числа моноцитов в периферической крови к 3 XT останавливается. Полученные результаты свидетельствуют о нарастающей роли препарата в сохранении и активации пролиферации предшественников моноцитарного ростка кроветворения.
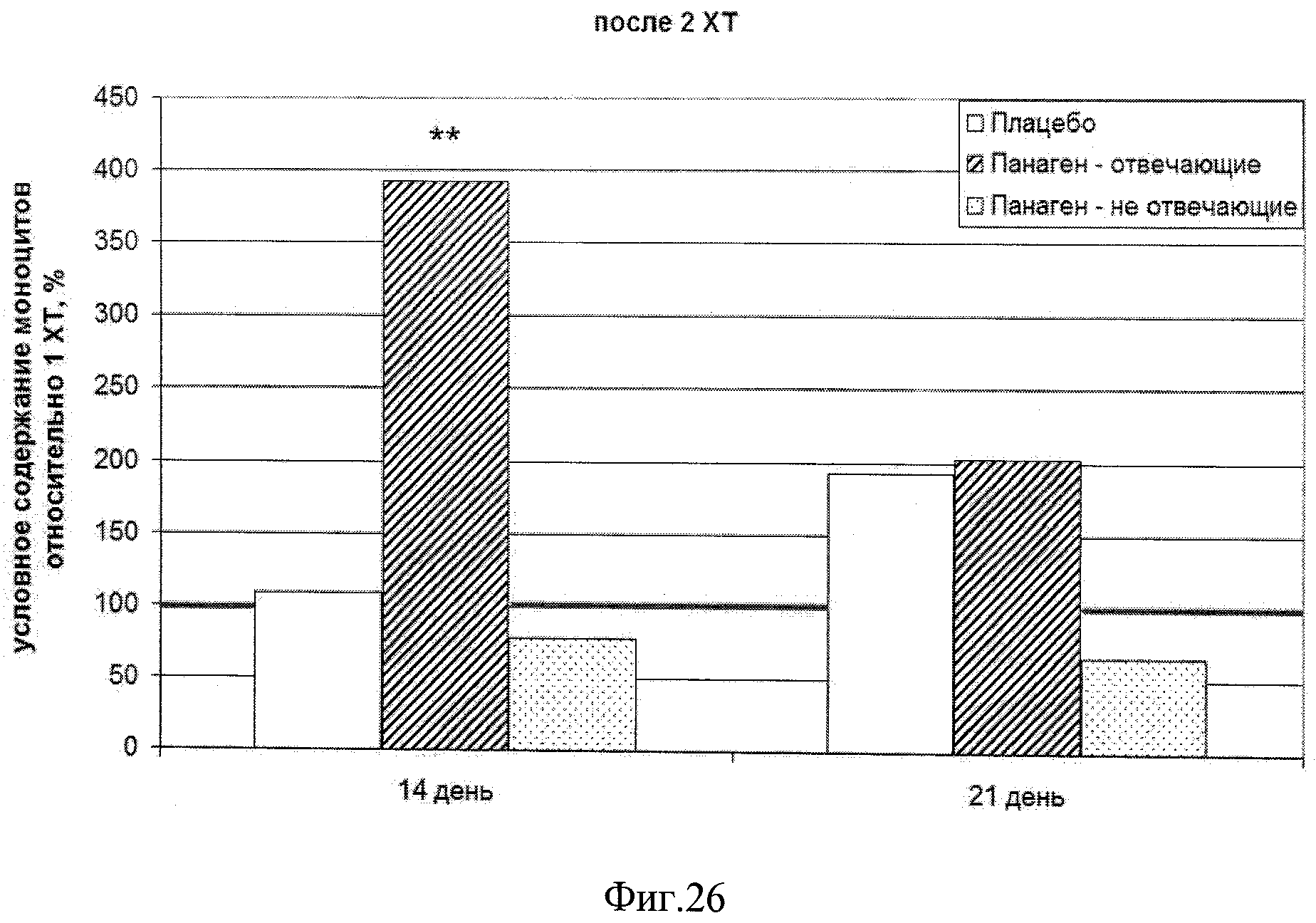
на фиг.26 - Сравнение условных значений содержания моноцитов в каждой группе на втором курсе XT в контрольных точках 14 и 21 сутки после введения цитостатика относительно значения параметра после 1 XT. Группы «Панаген-отвечающие» и «Панаген-не отвечающие» формировались независимо для каждой контрольной точки. ** - отличия от группы «Плацебо» достоверны с вероятностью pu<0,01.
на фиг.27 - Сравнение условных значений содержания моноцитов в каждой группе на третьем курсе XT в контрольных точках 14 и 21 сутки после введения цитостатика относительно значения параметра после 1 XT. Группы «Панаген-отвечающие» и «Панаген-не отвечающие» формировались независимо для каждой контрольной точки. * - отличия от группы «Плацебо» достоверны с вероятностью pu<0,05.
на фиг.28 - Сравнение условного содержания лимфоцитов в периферической крови пациентов, участвующих в исследовании в последней контрольной точку 21 сутки третьей XT. Обращает на себя внимание достоверное различие между группами «Плацебо» и «Панаген». Полученные данные свидетельствуют о сохранении и поддержании уровня лимфоцитов по ходу проведения XT, что отражает сохранение иммунокомпетенции организма пациентов, принимающих препарат Панаген. * - отличия от группы «Плацебо» достоверны с вероятностью pu<0,05.
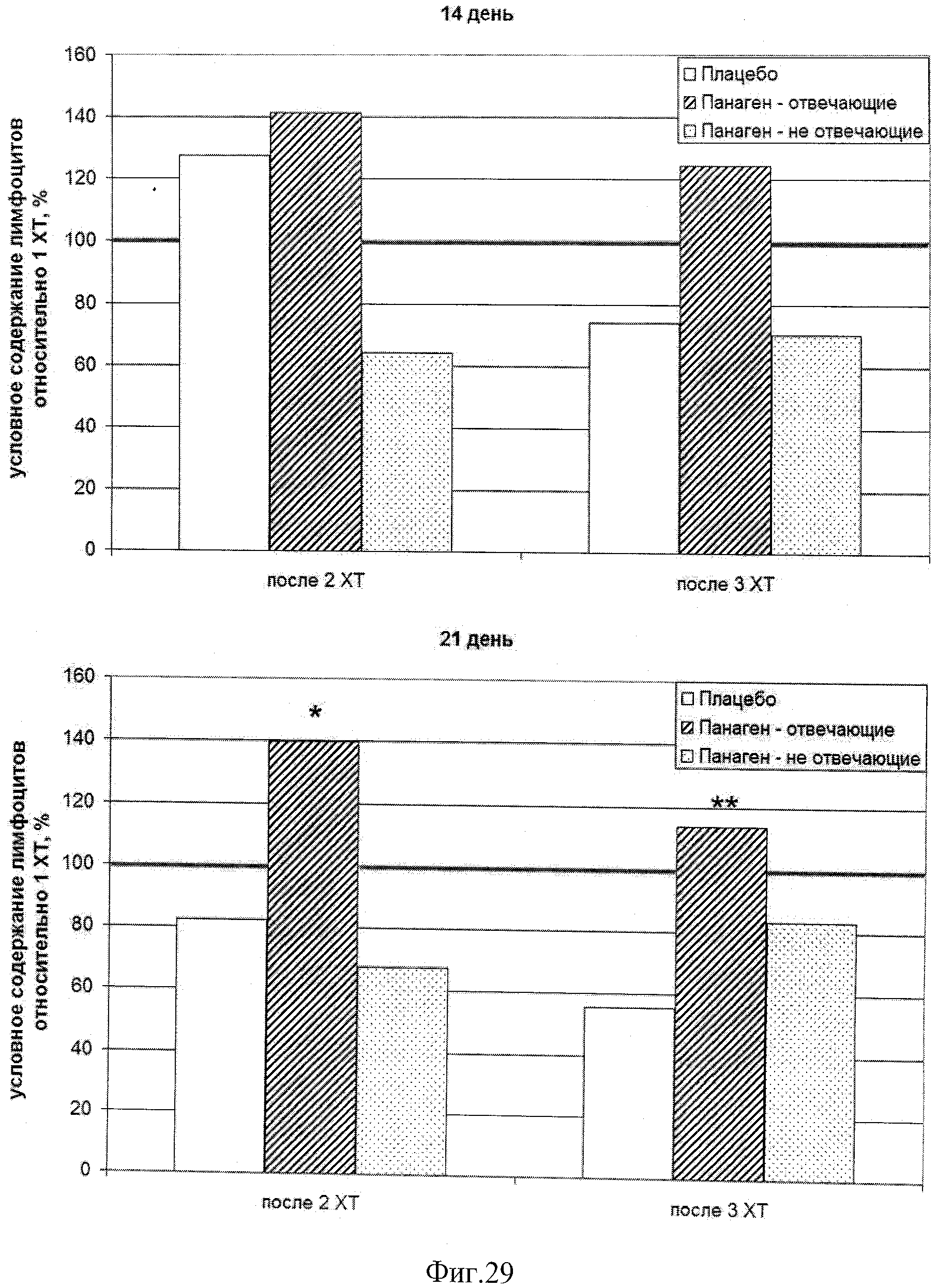
на фиг.29 - Относительное число лимфоцитов в группах в контрольных точках в сравнении с уровнем после 1 XT, которое бралось за 100%, после 2 и 3 XT. Достоверно в контрольной точке 21 сутки число лимфоцитов в группе «Панаген-отвечающие» больше, чем в группе «Плацебо». Во всех контрольных точках второй и третьей XT наблюдается более высокое число лимфоцитов в группе «отвечающих» пациентов. * - отличия от группы «Плацебо» достоверны с вероятностью pu<0,05; ** - отличия от группы «Плацебо» достоверны с вероятностью pu<0,01.
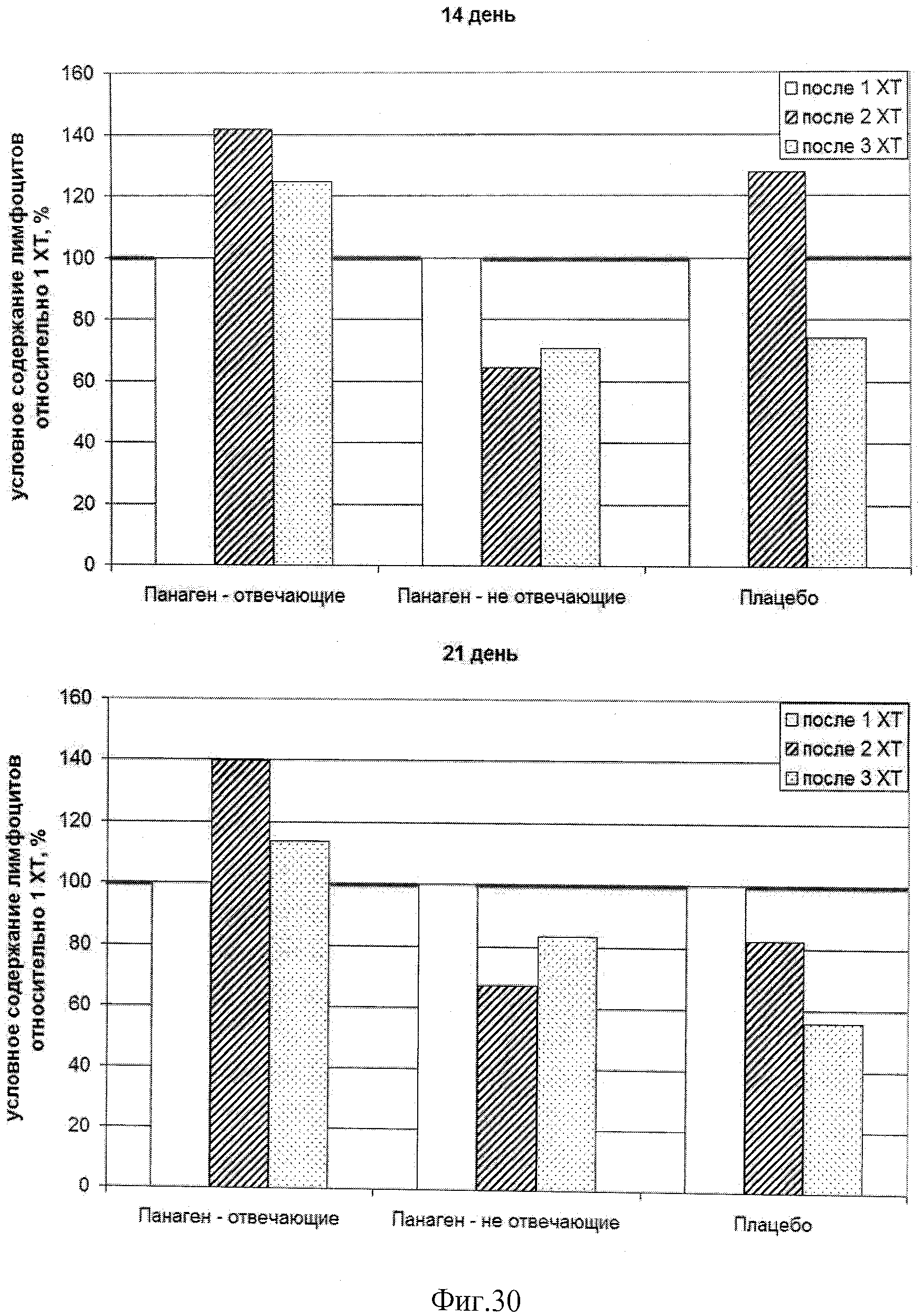
на фиг.30 - Сравнение относительного числа лимфоцитов внутри каждой группы в контрольных точках по ходу проводимых курсов XT.
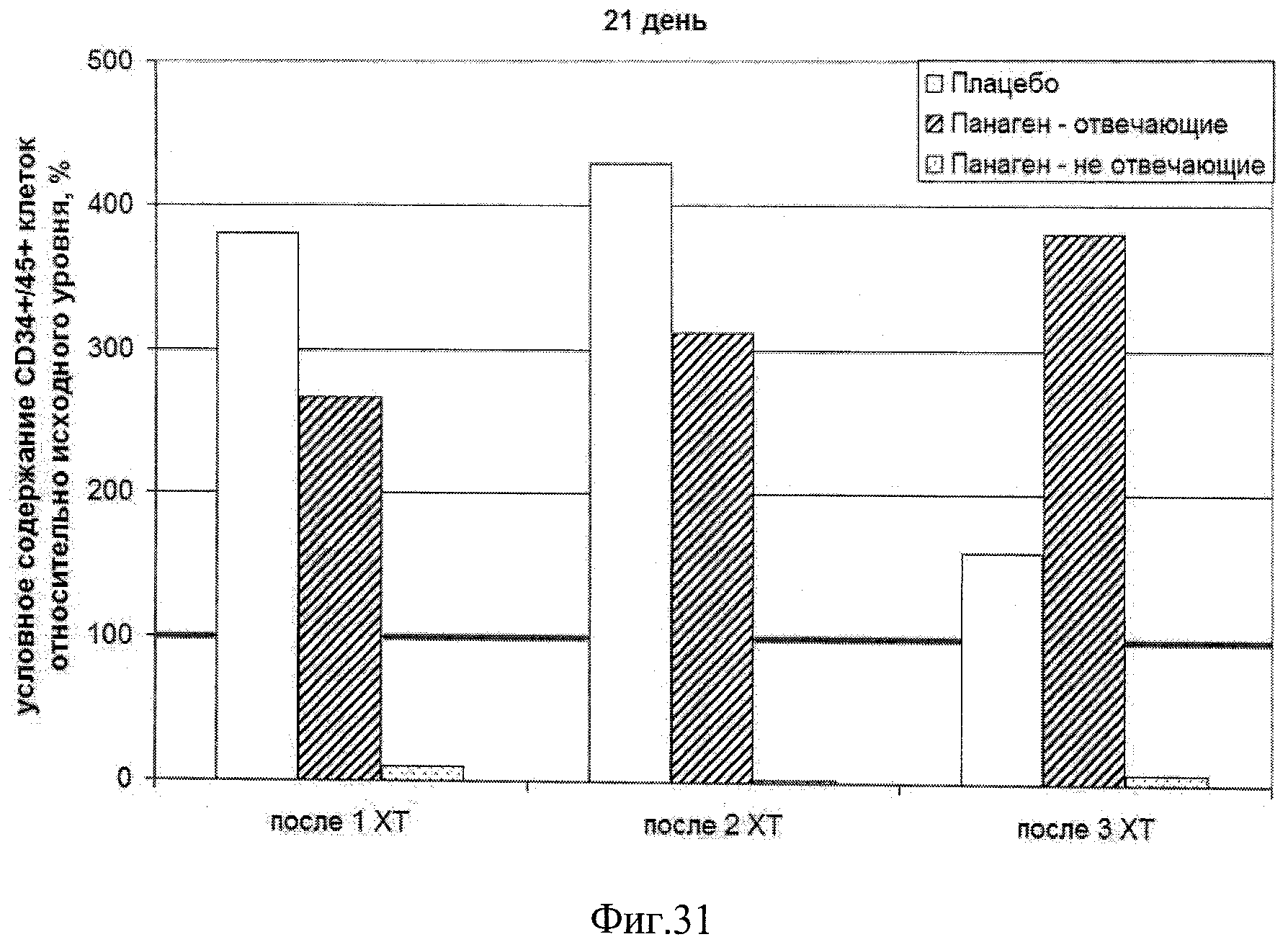
на фиг.31 - Относительное количество CD34+/45+ клеток в периферической крови пациентов на 21 контрольные сутки после 3 проведенных курсов XT по отношению к исходному уровню.
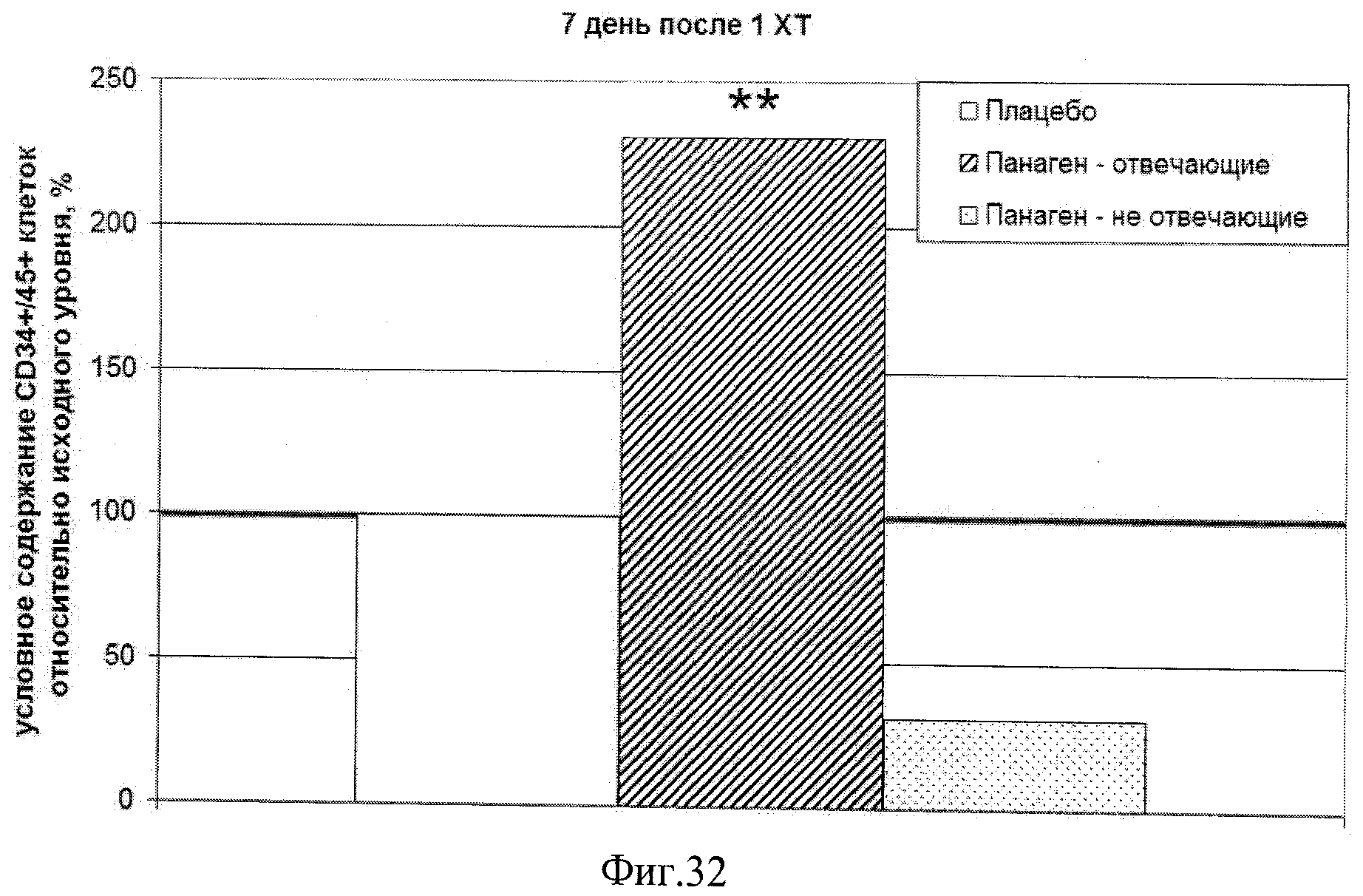
на фиг.32 - Относительное количество CD34+/45+ клеток в периферической крови пациентов на 7 контрольные сутки после первой XT по отношению к исходному уровню. ** - отличия от группы «Плацебо» достоверны с вероятностью pu<0,01.
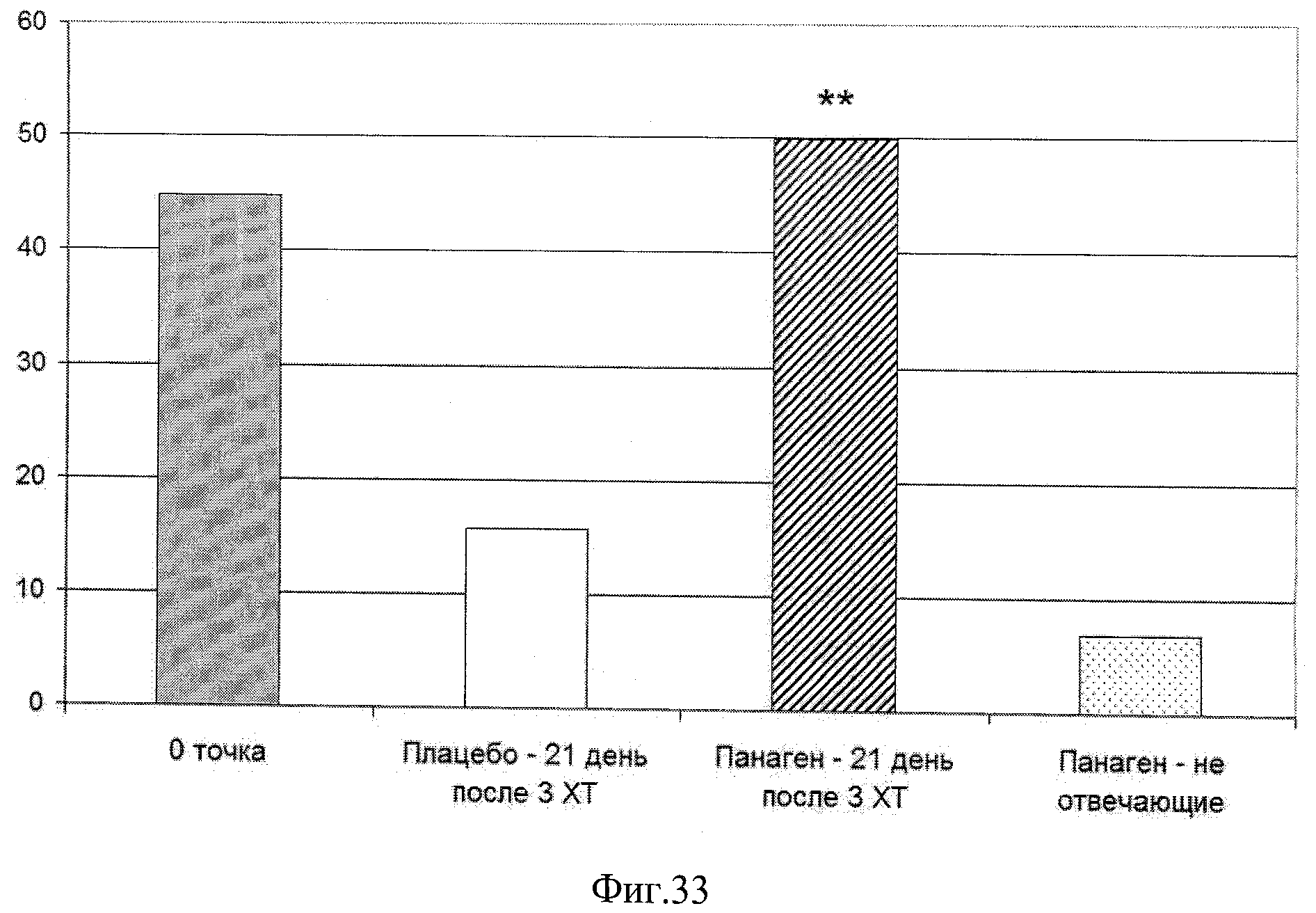
на фиг.33 - Сравнение индексов цитотоксичности (отражает состояние системы натуральных киллеров в организме) у пациентов, находящихся в исследовании. С достоверностью pu<0,01 натуральные киллеры сохраняют свои специфические функции на уровне до начала терапии у пациентов, принимающих препарат Панаген после трех курсов XT. У пациентов группы «Плацебо» активность натуральных киллеров к концу 3 XT падает до 30% от исходного.
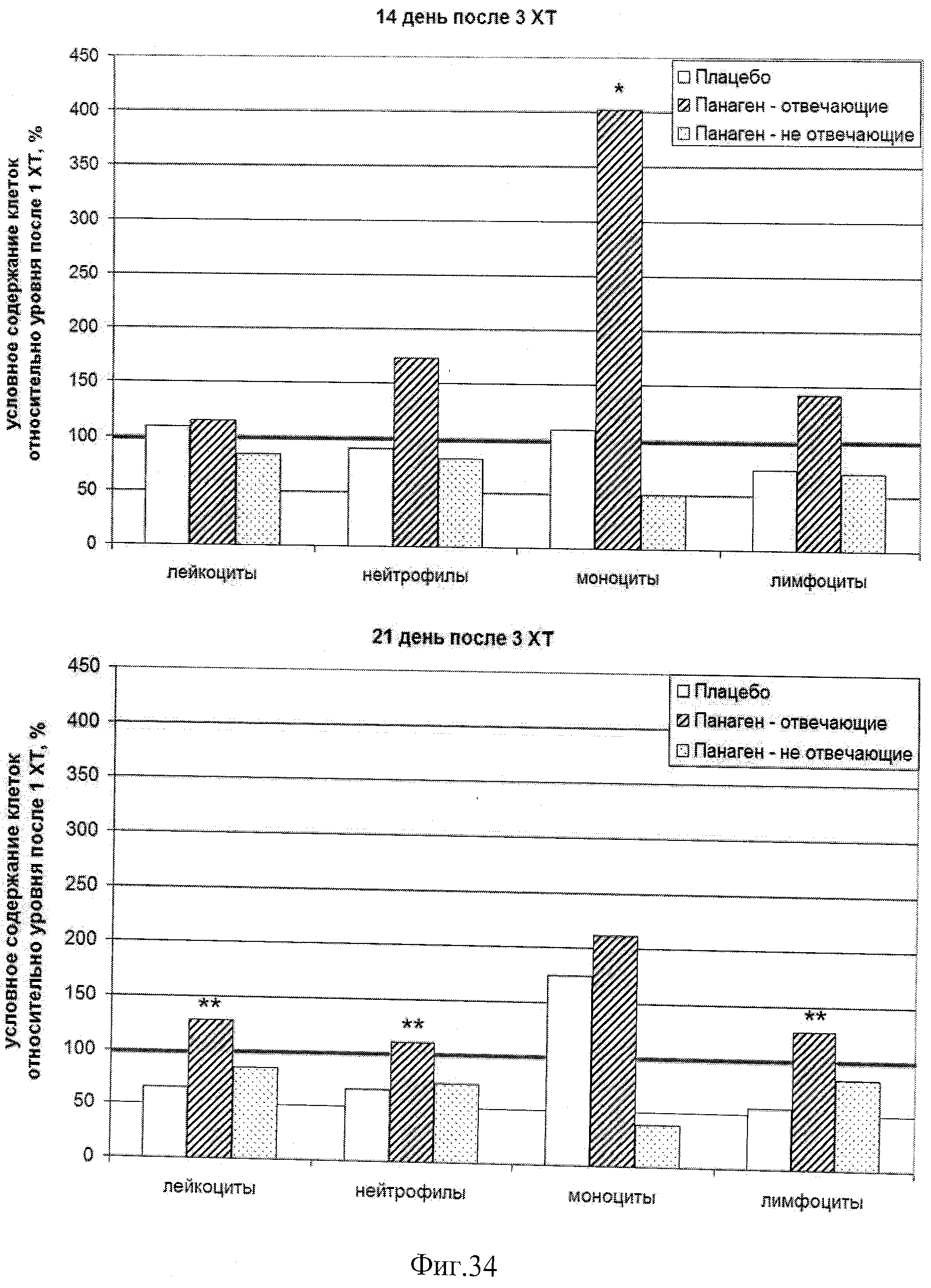
на фиг.34 - Сравнение условных значений содержания различных клеток в каждой группе на 14 и 21 сутки после 3 XT относительно значения параметров после 1 XT. * - отличия от группы «Плацебо» достоверны с вероятностью pu<0,05; ** - отличия от группы «Плацебо» достоверны с вероятностью pu<0,01.
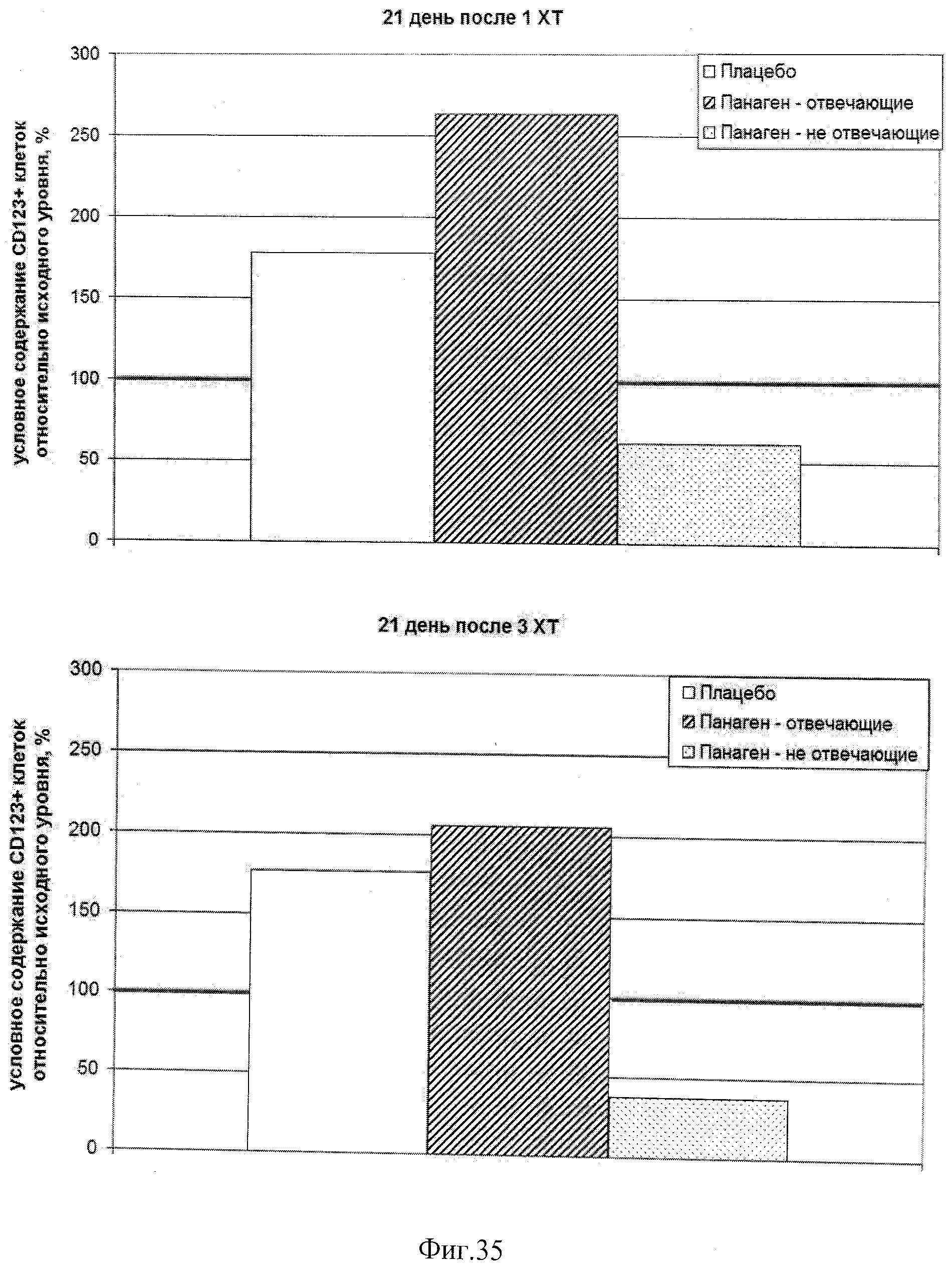
на фиг.35 - Условное содержание (%) CD11-CD123+ плазмацитоидных ДК в периферической крови пациентов, находящихся в исследовании, на 21 день после 1 и 3 XT относительно исходного уровня.
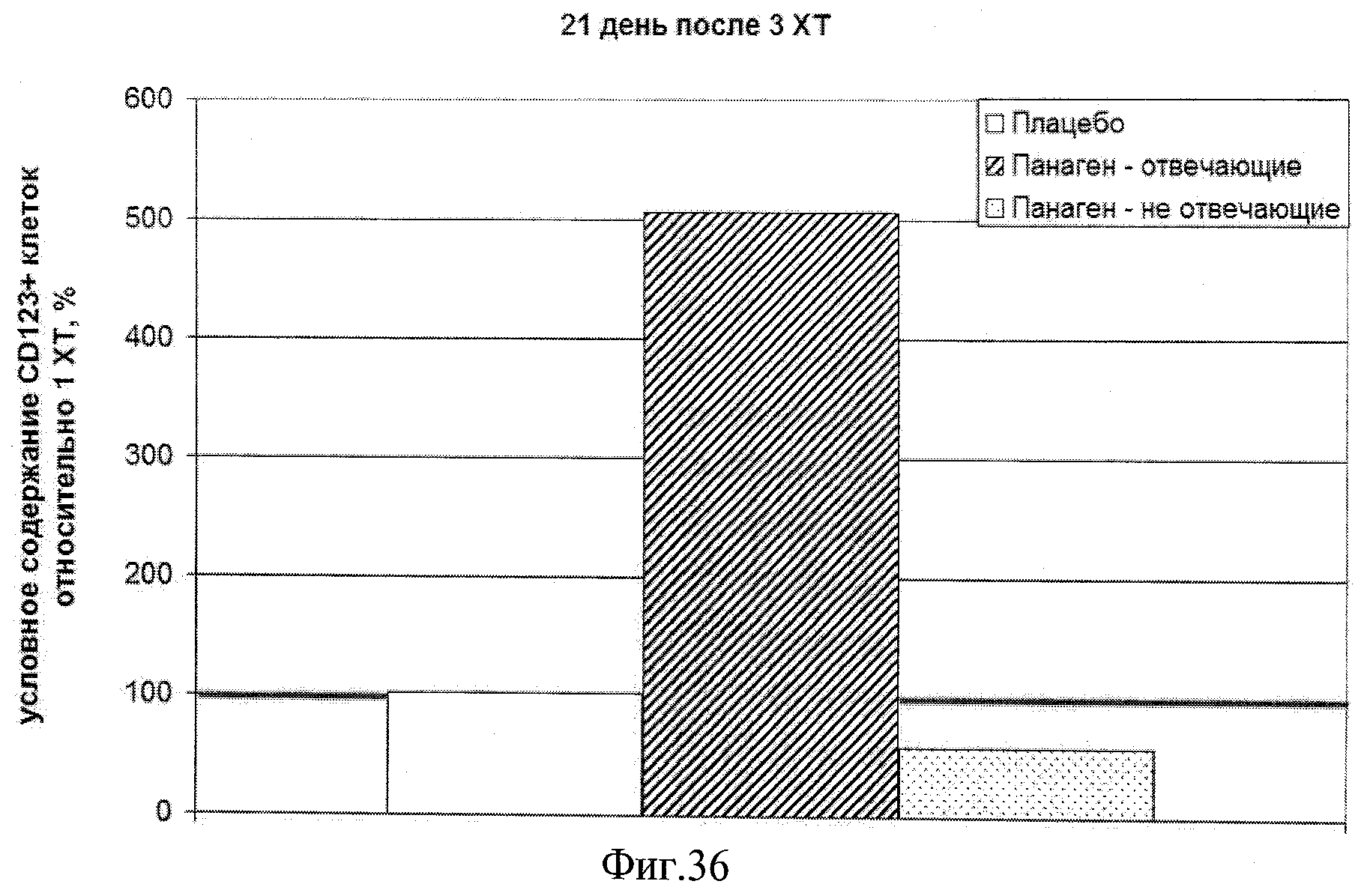
на фиг.36 - Условное содержание (%) CD11-CD123+ плазмацитоидных ДК в периферической крови пациентов, находящихся в исследовании, на 21 день после 3 XT относительно уровня после 1 XT.
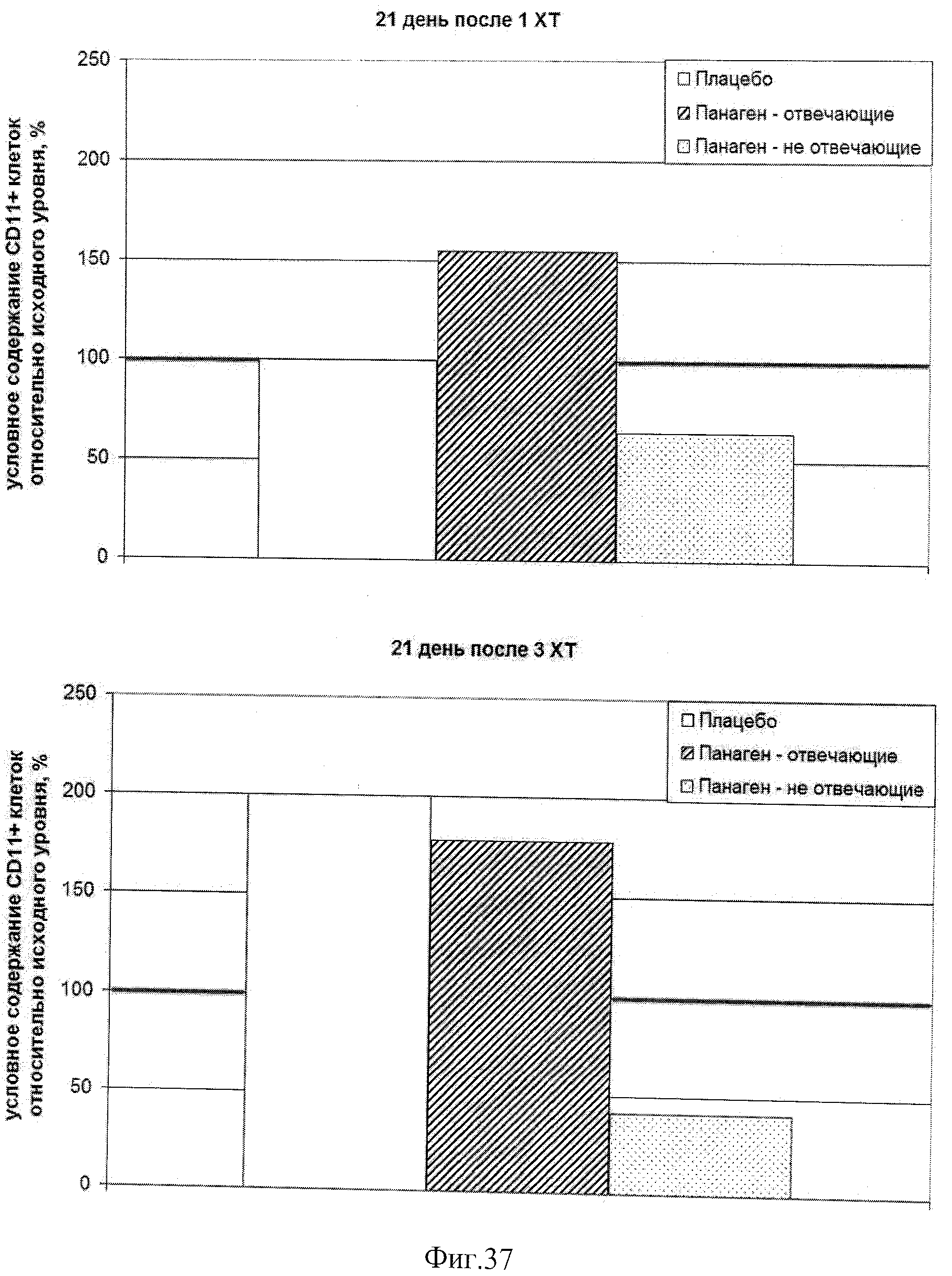
на фиг.37 - Условное содержание (%) CD11+CD123- миелоидных ДК в периферической крови пациентов, находящихся в исследовании, на 21 день после 1 и 3 XT относительно исходного уровня.
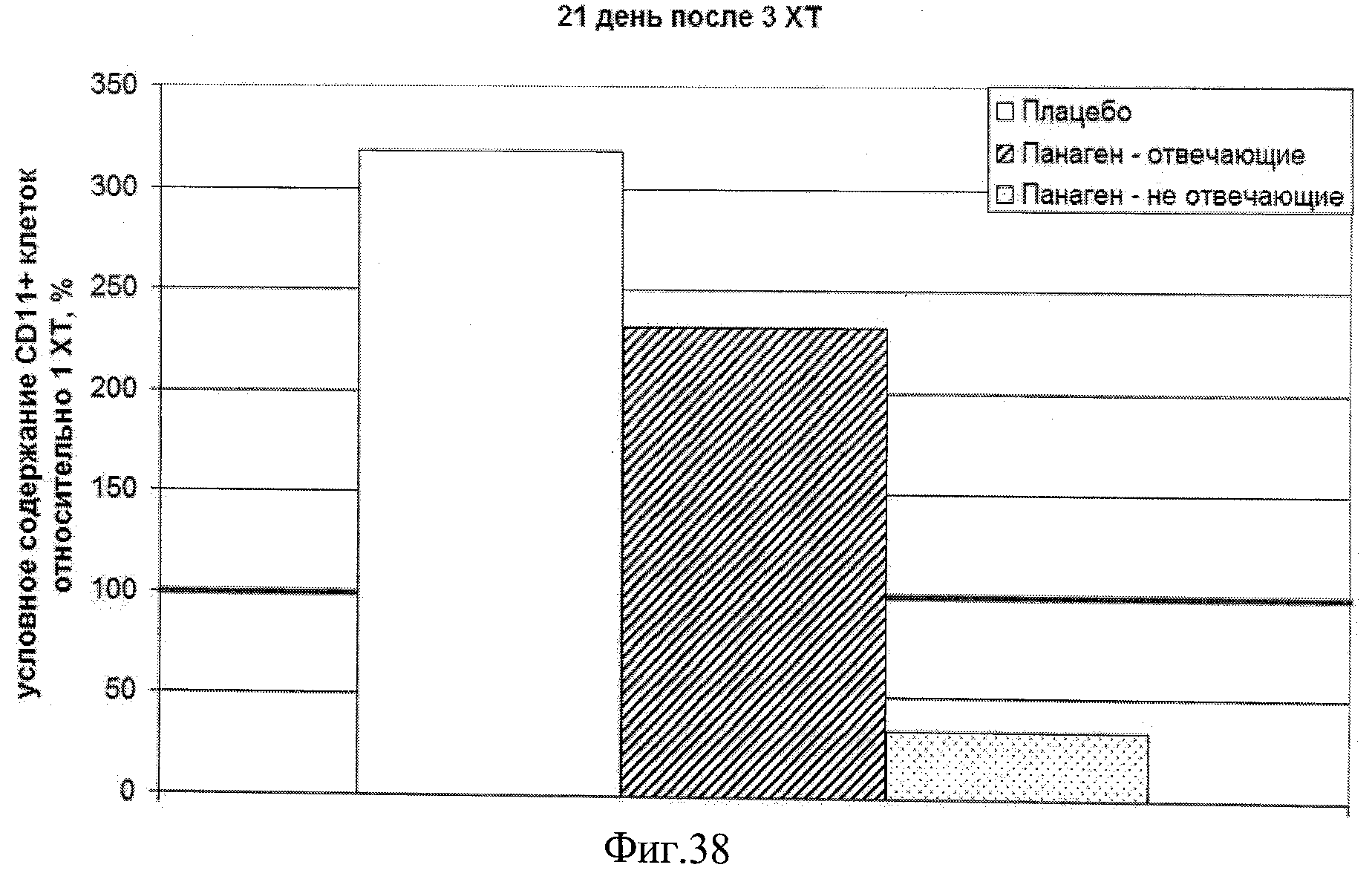
на фиг.38 - Условное содержание (%) CD11+CD123- миелоидных ДК в периферической крови пациентов, находящихся в исследовании, на 21 день после 3 XT относительно уровня после 1 XT.
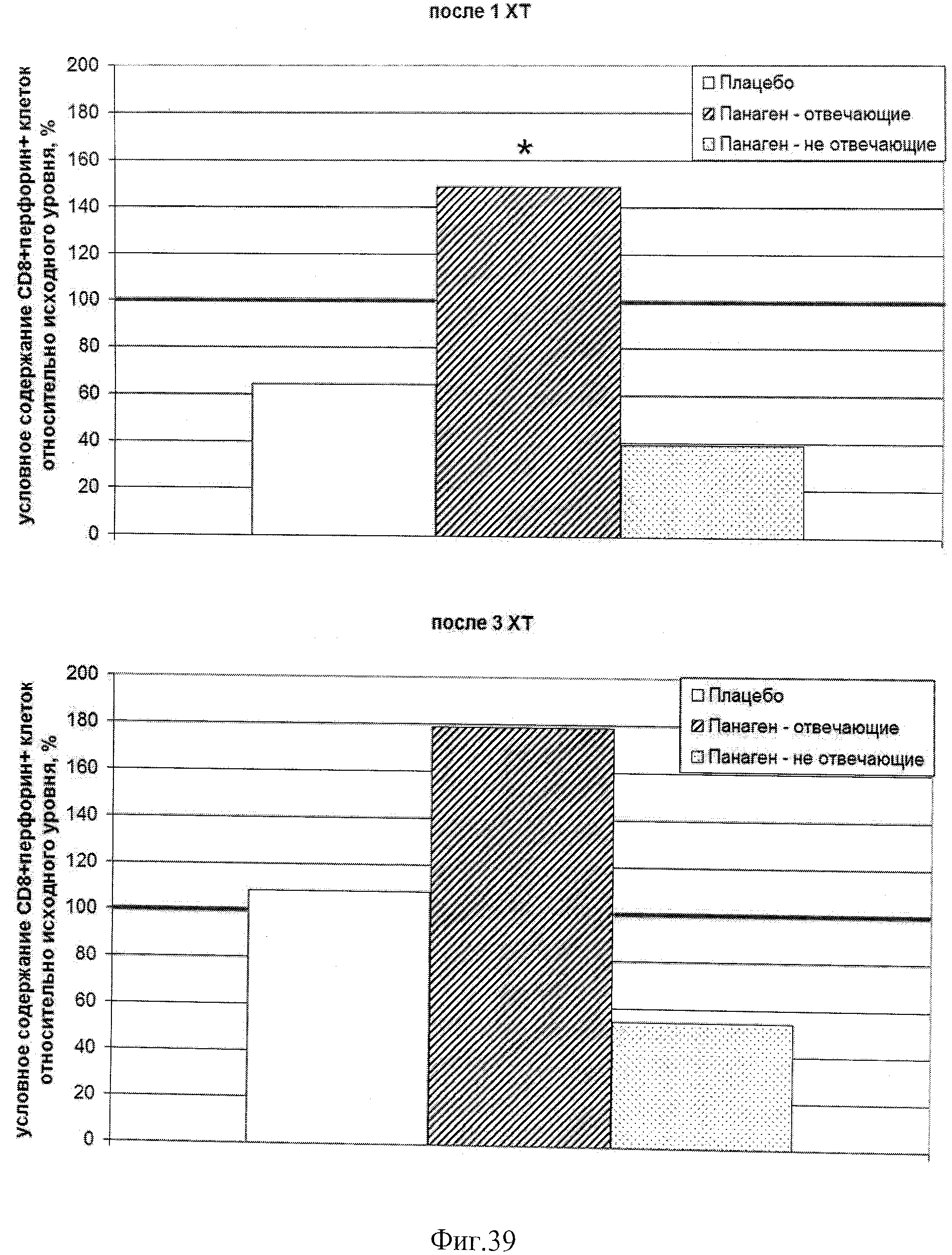
на фиг.39 - Условное содержание (%) CD8+перфорин+ цитотоксических лимфоцитов в периферической крови пациентов, находящихся в исследовании, на 21 день после 1 и 3 XT относительно исходного уровня. * - отличия от группы «Плацебо» достоверны с вероятностью pu<0,05.
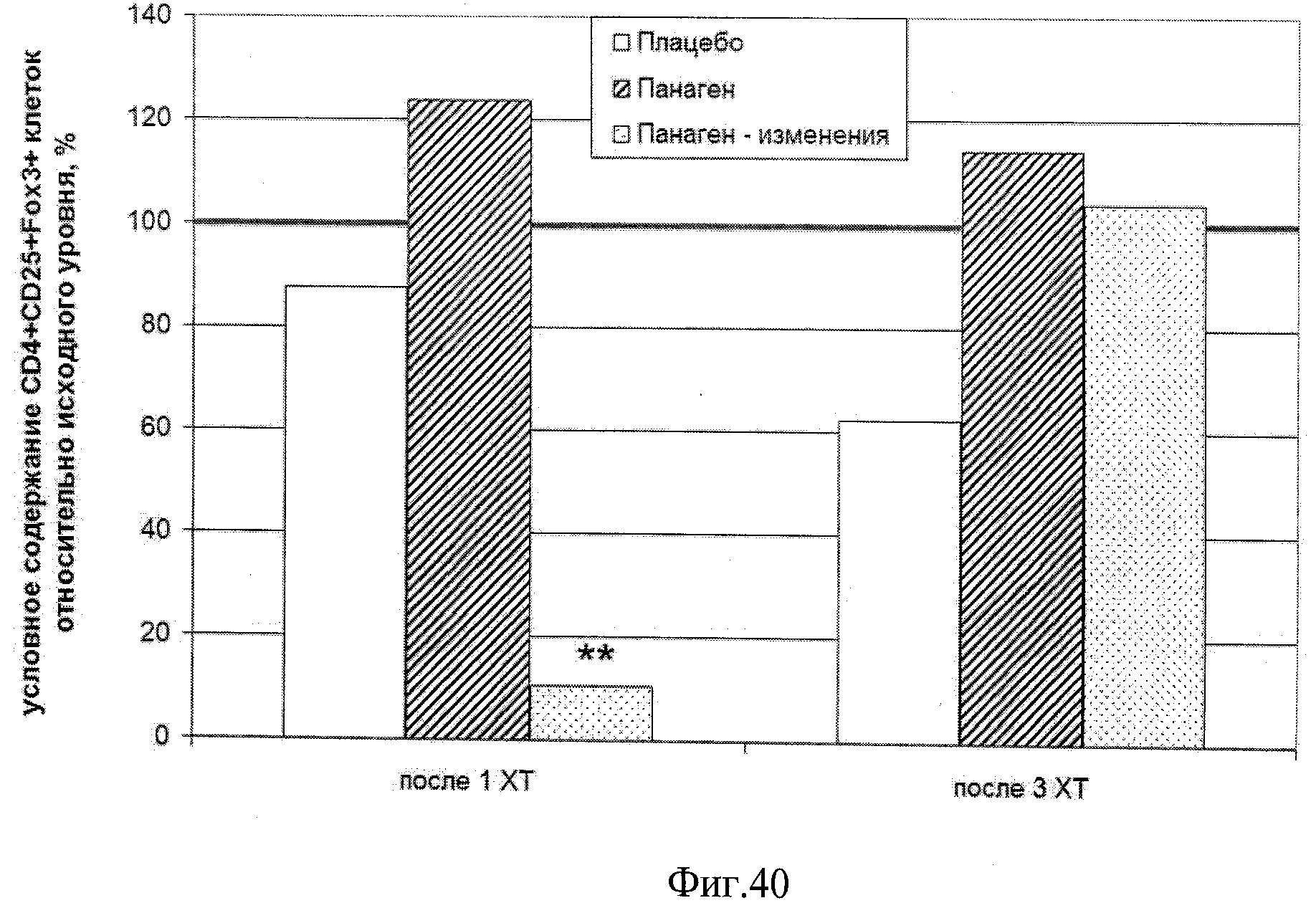
на фиг.40 - Условное содержание (%) CD4+CD25+Fox3+ T-регуляторных лимфоцитов в периферической крови пациентов, находящихся в исследовании, на 21 день после 1 и 3 XT относительно исходного уровня. ** - отличия от группы «Плацебо» и группы пациентов, у которых количество Т-регуляторных лимфоцитов не изменилось, достоверны с вероятностью pu<0,01.
Предложенный способ лечения онкологических заболеваний реализуется следующим образом.
Предварительно приведем сведения, подтверждающие эффективность предложенного способа лечения онкологических заболеваний.
В онкологической практике применение цитостатических препаратов является одним из основных методов лечения опухолей различного происхождения. Механизм действия всех цитостатиков основан на блокировании жизненно важных биохимических метаболических путей раковой клетки, что, в конечном счете, приводит к ее гибели. Наряду с раковыми клетками действию цитостатика подвержены все активно пролиферирующие клетки организма и, в первую очередь, гемопоэтические клетки. Угнетение активности костномозговых предшественников гемопоэза приводит к развитию лейкопений и нейтропений различной силы тяжести. Этот токсический эффект действия цитостатиков в структуре осложнений XT занимает одно из лидирующих позиций. Нейтропения II-IV степени является основным лимитирующим фактором, препятствующим началу XT, вызывающим необходимость снижения доз химиопрепаратов, задержку и/или отмену курсов лечения (таблица 1).
|
Нейтропения связана с резким снижением количества нейтрофилов, циркулирующих в периферической крови, и чаще всего развивается на фоне или вскоре после интенсивных режимов цитостатической XT по поводу различных злокачественных новообразований. Крайняя степень нейтропении - фебрильная нейтропения - может представлять собой гиперергическую реакцию организма на токсическое воздействие цитостатических химиопрепаратов, продуктов разрушения опухолевых и здоровых клеток или на само по себе резкое снижение количества циркулирующих нейтрофилов и нарушения продукции цитокинов и иммуноглобулинов. Однако чаще всего фебрильная нейтропения является проявлением инфекции, активирующейся в результате снижения контроля со стороны иммунной системы, вызванной критическим снижением числа иммунокомпетентных клеток в периферической крови. Индуцированный нейтропенией инфекционный процесс протекает чрезвычайно тяжело. Инфекция быстро распространяется из первичного очага на другие органы и системы и быстро приводит к смерти больного даже в тех случаях, когда инфицирующий микроорганизм относится к сапрофитным или низковирулентным для больных с нормальным иммунитетом и нормальным количеством циркулирующих в крови нейтрофилов. В этой связи активация популяции гемопоэтических стволовых клеток (ГСК) и индукция их пролиферации (в частности индукция лейкопоэза и нейтропоэза) является одним из основных методов борьбы с лейко- и нейтропениями, вызванными интенсивными режимами цитостатической обработки в схемах лечения онкозаболеваний.
В современной медицине существуют несколько групп лекарственных препаратов, стимулирующих лейкопоэз. Это лекарственные средства
- стимулирующие метаболические процессы - метилурацил, пентоксил, лейкоген, дикарбамин и другие, применяемые для лечения различных форм лейкопении,
- и так называемые колониестимулирующие факторы - филграстим, саграмостим, ленограстим и др.
Производные пирамидина - препараты метилурацил (син. метацил) и пентоксил - обладают способностью стимулировать эритро- и особенно лейкопоэз, а также процессы клеточного и гуморального иммунитета. Кроме того, у препаратов выражена и анаболическая активность, поэтому они ускоряют процессы клеточной регенерации, способствуют более быстрому заживлению ран. В клинической практике метилурацил и пентоксил используют для стимуляции лейкопоэза при хроническом отравлении бензолом, алиментарно-токсической алейкии (пищевое отравление, вызванное употреблением в пищу перезимовавшего в поле зерна, зараженного грибами Fusariumsporotrichiella), агранулоцитарной ангине (синдроме, характеризующемся отсутствием гранулоцитов в периферической крови), лейкопении, развившейся в результате рентгено- или радиотерапии. В некоторых случаях для лечения этих лейкопений используют производное карбоновой кислоты препарат лейкоген, который применяют по тем же показаниям, что и производные пирамидина.
Гематопротекторное действие дикарбамина при миелосупрессивной XT обусловлено ускорением созревания предшественников нейтрофильных гранулоцитов. Препарат ускоряет образования детоксицирующих гранул в клетках-предшественниках миелоидного ростка, ответственных за состояние противоинфекционного иммунитета. Наряду с этим дикарбамин в 3-4 раза снижает интенсивность программированной гибели клеток (апоптоз) в популяции миелоидных предшественников. Это приводит к значимому увеличению числа кариоцитов и перераспределению клеток в сторону функционально полноценных форм. Вызывает уменьшение частоты возникновения лимитирующей лейко- и нейтропении. Позволяет проводить лечение в запланированные сроки без снижения доз цитостатиков и риска гематологических осложнений.
Для лечения тяжелых форм лейкопении в настоящее время широко используют получаемые путем генной инженерии лекарственные средства, представляющие собой аналог человеческого гранулоцитарного колониестимулирующего фактора, - препараты молграмостим (син. лейкомакс), ленограстим, филграстим и др. Эти препараты являются структурными и функциональными аналогами гранулоцитарного колониестимулирующего фактора, ответственного за процесс мобилизации ГСК, и регулируют продукцию и высвобождение нейтрофилов в периферическую кровь. Применяют гранулоцитарный колониестимулирующий фактор для лечения лейкопений, преимущественно различных видов нейтропений у больных, получающих миелосупрессивную XT при онкологических заболеваниях, для лечения миелодиспластического синдрома, улучшения переносимости иммуносупрессивных препаратов при пересадке костного мозга, улучшения иммунного статуса у пациентов, страдающих СПИД и другими инфекциями.
В последнее время все более широкое применение в практике лечения онкологических и вирусных заболеваний находят препараты, активным веществом которых являются нуклеиновые кислоты (ридостин, деринат, полидан, дезоксинат и т.д.). Одним из направлений воздействия этих препаратов на организм является проявляемая ими лейкостимулирующая активность. Механизм лейкостимулирующего действия этих препаратов неизвестен. Деринат является одним из представителей препаратов на основе ДНК. Стимулятор кроветворения непрямого действия. Вызывает повышение продукции эндогенных колониестимулирующих факторов. Способствует повышению уровня тромбоцитов. Снижает степень иммуносупрессии после химиотреапии и лучевой терапии, увеличивая содержание CD4+, повышает их долю в соотношении иммунорегуляторных субпопуляций (CD4+/CD8+), сохраняя высокую пролиферативную активность Т-лимфоцитов. Значительно снижает уровень супероксиддисмутазы и малонового диальдегида, проявляя умеренную антиоксидантную активность. Ускоряет дифференцировку и функциональное созревание нейтрофилов.
Применение цитостатиков действует деструктивно как на коммитированных предшественников лейкопоэза, так и в первую очередь на первый эшелон прогениторов CD34+ СКК. От состояния этой популяции клеток в первую очередь зависит возможность быстрого восполнения форменных элементов крови лимфоидного ряда после проведенной XT. В этой связи основным вопросом постхимиотерапевтичесокго восстановления является разработка подходов и создание новых препаратов направленных
- на индукцию пролиферации СКК в нишах костного мозга;
- на мобилизацию CD34+ СКК и связанную с ней пролиферацию коммитированных предшественников нейтропоэза и выходом клеток в периферическое кровяное русло.
И, таким образом, увеличить число и активность нейтрофилов в организме можно двумя путями. Первое - это индуцировать мобилизацию Г-КСФ, что одновременно приводит к активации пролиферации коммитированных предшественников нейтрофилов и выходу в кровяное русло CD34+ ГСК, и второе - это индуцировать пролиферацию ГСК непосредственно в гемопоэтических нишах (in situ). Оба этих молекулярных процесса носят название лейкостимуляция.
На фиг.1 приведена современная схема кроветворения. Полипотентная СКК-ГСК (стволовая клетка крови, гемопоэтическая стволовая клетка) обладает такими основными характеристиками как способностью к длительному самоподдержанию, высоким пролиферативным потенциалом, способностью к дифференцировке в клеточные элементы различных линий миело- и лимфопоэза. Содержание СКК в костном мозге человека в постнатальном периоде составляет несколько десятых долей процента от общего количества миелокариоцитов. В норме основная масса СКК (95%) находится в фазе клеточного цикла G0. В исследованиях на мышах показано, что плюрипотентные СКК костного мозга делятся на два типа: более примитивные клетки, способные к самовоспроизведению в течение продолжительного периода времени и обеспечивающие длительное, хотя и медленное, восстановление гемопоэза, и более зрелые клетки, обеспечивающие быстрое, но лишь кратковременное восстановление кроветворения.
Согласно общепринятой схеме кроветворения лимфоидная стволовая клетка дает начало развитию B- и T-лимфоцитов, и, вероятно, естественных клеток-киллеров. Из клетки-предшественника миелопоэза колониеобразующей единицы гранулоцитов, эритроцитов, моноцитов, мегакариоцитов - возникают миеломоноцитарные клетки-предшественники, которые, в свою очередь, отвечают за выработку гранулоцитов, моноцитов/макрофагов, клеток-предшественников мегакариоцитарного и эритробластического ряда. Установлено, что ДК возникают как из общей клетки-предшественника миелопоэза, так и из общей клетки-предшественника лимфопоэза. Предполагается, что дифференцировка большинства типов стволовых клеток происходит по принципу поэтапного иерархического созревания через промежуточные интенсивно пролиферирующие клетки-предшественники. Полипотентные клетки предшественники и формирующиеся из них унипотентные клетки образуют колонии из клеток только одной линии. Полипотентная клетка-предшественник обладает значительной способностью к размножению. Будучи стимулированной ростовыми факторами, она способна совершать до 13 митозов и образовывать несколько десятков унипотентных клеток, из которых далее формируется несколько тысяч коммитированных потомков. Так, например, из каждой колониеобразующей единицы эритроидного ряда образуется до 50 эритроцитов. Колониеобразующая единица гранулоцитарно-макрофагального ряда способна совершать 5-6 делений, образующиеся из нее унипотентные предшественники гранулоцитов и макрофагов - еще 5-6 делений каждая. Это позволяет одной гранулоцитарно-макрофагальной полипотентной клетке сформировать тысячи зрелых клеток-потомков - гранулоцитов и моноцитов. Даже одна СКК (ГСК) может обеспечить длительное, в течение всей жизни, поддержание продукции кроветворных клеток. По-видимому, среди ГСК существуют клетки, обладающие бесконечным пролиферативным потенциалом, способностью к неограниченному размножению и продукции сколь угодно большого числа клеток крови. Это очень редкая категория клеток, которая встречается в костном мозге в концентрации около 1 на 100 000 клеток.
Исследования кинетики гемопоэза мышей показывают, что кроветворение поддерживается в основном за счет небольшого числа (несколько десятков) относительно короткоживущих, последовательно сменяющих друг друга клеточных клонов. Продолжительность жизни индивидуального клона в основной массе невелика и обычно не превышала 1 месяца. Как правило, состав кроветворной ткани полностью меняется в течение 1-4 месяцев, и только очень редкие клоны, их примерно 10%, существуют более 3 месяцев. Исчезнувшие клоны никогда не появлялись вновь, что говорит об истощении в процессе кроветворения исходной для данного клона стволовой клетки. Как правило, размер индивидуального клона обычно меньше 0,5-1 млн. зрелых клеток.
Таким образом, многостадийный процесс кроветворения, завершающийся выходом в циркулирующую кровь зрелых клеточных форм (эритроцитов, лейкоцитов, тромбоцитов), поддерживается заложенными в онтогенезе стволовыми кроветворными или гемопоэтическими клетками (СКК, ГСК). В результате пролиферации ГСК, выходящих из состояния покоя, и их последующей дифференцировки, направление которой выбирается стохастически, появляются сменяющие друг друга дочерние клоны коммитированных клеток-предшественников, из которых затем образуются морфологически распознаваемые клетки различных ростков гемо- и лимфопоэза.
Лейкостимулирующее действие препарата на основе ДНК человека Панаген основано как на прямой стимуляции клеточного деления (по механизму активации СКК двуцепочечными концами интродуцированной в ядро экзогенной ДНК [32], так и опосредованно, через индукцию специфических цитокинов. В рамках научно-экспериментального обоснования проводимых клинических испытаний были проведены масштабные многолетние исследования, направленные на понимание механизма активации ГСК и индукции их пролиферативной активности. Исследования, проведенные на мышах, свидетельствуют, что фрагменты экзогенной ДНК достигают ядерного пространства ККМ, и в том числе CD34+ ГСК, в форме экзогенного полимерного материала (фиг.2-4) [33].
Эксперименты по активации CD34/45+ ГСК человека в системе ex vivo продемонстрировали следующие результаты. Гемопоэтические предшественники были высажены на среду, содержащую общепринятые ростовые факторы, включая колониестимулирующие факторы, а также фрагментированную ДНК человека (препарат Панаген). Присутствие в метилцеллюлозе экзогенной ДНК приводило не только к индукции агрессивной пролиферации стволовых клеток, но в первую очередь происходило их «оживление» (фиг.5).
Предполагаемый механизм индукции пролиферации связан с появлением в CD34+ СКК фрагментов двуцепочечной ДНК. Известно, что нахождение более 60 двуцепочечных концов в ядерном пространстве клетки приводит к активации наблюдательной системы клетки (ATM, ATR, ДНК-протеинкиназа) [32]. Клетка, находящаяся до этого времени в состоянии покоя (GO), активируется в направлении ареста клеточного цикла, после которого в обязательном порядке следует синтез и митоз. Если в кровяном русле непрерывно присутствуют фрагменты экзогенной ДНК в достаточном количестве, то они будут постоянно «раздражать» ССК, индуцировать движение по клеточному циклу, что будет приводить к ее непрерывному делению. Как было сказано выше, в костном мозге 95% ГСК находится в состоянии GO. Если предложенная концепция верна, то это означает, что при насыщении костномозгового пространства фрагментами экзогенной ДНК вся популяция плюрипотентных предшественников вынуждена будет пройти или многократно проходить по клеточному циклу. Такой пролиферативный импульс может многократно увеличить количество коммитированных потомков всех типов ростков кроветворения. В этом, на наш взгляд, заключается одна их возможностей активации пролиферации СКК двуцепочечными концами фрагментов нуклеиновых кислот. Что касается механизма «оживления» ГСК после криоконсервации, мы полагаем, что такой эффект связан с активацией рекомбинационных процессов в размороженных ГСК на фоне присутствия экзогенной ДНК в качестве матрицы для репаративной рекомбинации [32].
Были проведены исследования по анализу воздействия экзогенной ДНК на активацию антигенпрезентирующих свойств ДК. Показано, что фрагменты экзогенной ДНК индуцируют созревание и аллостимуляторную активность ДК в направлении Th1 [34-37]. При этом формируется пул цитотоксических перфорин-содержащих CD8+ Т-лимфоцитов
Для оценки эффективности воздействия использовалась опухоль Кребс 2, достигшая в размерах 1 см3 (фиг.6). Мышам-самцам СВА внутримышечно прививали опухоль Кребс-2 (разведение асцита 1:10). На 8 сутки роста опухоли было сформировано 5 групп животных и введены препараты: 1 - контроль; 2 (n=6) - мышам в/б ввели ЦФ в дозе 100 мг/кг; 3 (n=7) - в/в доксорубицин (ДР) 3 мг/кг и в/б ЦФ 100 мг/кг, через день в/б физ. раствор в течение 3 суток; 4 (n=7) - в/в ДР 3 мг/кг и в/б ЦФ 100 мг/кг, через день в/б ДНК по 500 мкг в 200 мкл физ. раствора в течение 3 суток; 5 (n=2) - в/в ДР по 3 мг/кг.
На 17 день из каждой группы было забито по 2 мыши, у них были взяты паховые лимфоузлы, тимусы и селезенки. Из органов были тщательно выпотрошены клетки, ресуспендированы и посчитаны, клетки селезенки были дополнительно фракционированы на градиенте плотности фиколла-урографина для выделения мононуклеарной фракции крови. Клетки разных органов в каждой группе мышей были смешаны в равных количествах. Полученные клеточные фракции были протестированы окрашиванием антителами на поверхностные маркеры зрелости ДК и популяции цитотоксических лимфоцитов.
Анализ поверхностных маркеров ДК проводился в популяции клеток, не несущих поверхностный маркер клеток-предшественников (CD34-), т.е. анализируемая популяция клеток была дифференцирована (таблица 2).
|
Было показано, что воздействие цитостатиков на мышей с привитыми опухолями приводит к повышению количества CD80+ клеток относительно контрольной группы (7,8%) до 93 и 94% в группах ДР+ЦФ+ДНК (первая мышь) и ЦФ, соответственно. Для маркера CD86 также было показано увеличение его количества в группах ДР+ЦФ+ДНК (первая мышь) и ДР+ЦФ до 3,1 и 5,8% соответственно, по сравнению с 2,5% в контрольной группе. Маркеры CD80 и CD86 в тандеме являются поверхностными дифференцировочными кластерами антигенпрезентирующих ДК, которые обеспечивают ко-стимуляторные сигналы для активации и выживания Т-клеток. Помимо этого, обработка цитостатиками ЦФ и ДР приводит к повышению экспрессии поверхностного маркера зрелых ДК CD83 до 0,5% относительно нулевого уровня в контрольной группе. Поверхностный маркер CD83 регулирует развитие CD4+ Т-клеток. Уровень экспрессии поверхностного CD83 достигает 5% при дополнительных инъекциях животным препарата ДНК (первая мышь). Количество молекул МНС класса П (I-Ad/I-Ed) составляет от 12,2 (ЦФ) до 19,5% (ДР) относительно 17,7% у контрольной мыши, т.е. сверхэкспрессии данного поверхностного маркера не наблюдается.
Анализ количества перфоринсодержащих CD8+ цитотоксических лимфоцитов проводился также в суспензии клеток из всех органов (таблица 3).
|
Оказалось, что инъекции препарата ДНК на фоне инъекций цитостатиков ЦФ и ДР приводят к увеличению количества CD8+ цитотоксических лимфоцитов до 8,4 и 16,5 (первая и вторая мыши) относительно контроля (6,6%), повышая также уровень внутриклеточного, токсичного для клеток опухоли белка перфорина до 36 и 52,8% соответственно, против 21,7% в контроле. Это может свидетельствовать о том, что инъекции препарата ДНК на фоне предобработки ЦФ и ДР приводят к увеличению количества токсичных для опухолевых клеток CD8+ перфорин-содержащих цитотоксических лимфоцитов.
|
Как следует из полученных данных, свежевыделенные МНК доноров характеризовались низким содержанием СВ8+перфорин+ T-клеток (фиг.7, таблица 4). Незрелые ИФН-ДК (аллогенные) при совместном культивировании с МНК в СКЛ индуцировали достоверное 3-кратное возрастание количества цитотоксических Т-лимфоцитов. Причем активация ДК ЛПС не усиливала способность ДК к индукции цитотоксических Т-клеток. В то же время прирост цитотоксических Т-клеток в присутствии ДНК-обработанных ДК был выше, чем в присутствие интактных ДК. Таким образом, препарат Панаген усиливал способность ИФН-индуцированных ДК к генерации цитотоксических Т-лимфоцитов в СКЛ.
Также установлено, что в системе in vitro иммунокомпетентные клетки продуцируют значительное количество цитокинов, которые в принципе могут стимулировать пролиферацию ГСК [38]. Тем не менее, у онкологических больных с раком молочной железы (нозология, взятая для исследований) обнаруживается сверхпродукция всей палитры цитокинов. Это связано с развивающимся онкологическим процессом и воспалительными реакциями организма на отмирающую малигнизированную ткань. В этой связи вероятность, что стимуляция пролиферации костномозговых предшественников связана с повышением концентрации цитокинов, индуцирующих пролиферацию ГСК, в меньшей степени приемлема, чем возможность прямой активации деления СКК двуцепочечными концами интернализованных в ядерном пространстве СКК фрагментов экзогенной ДНК. Либо важна не концентрация цитокина, секретируемого клеткой, а важно количество внутриклеточного цитокина иммунокомпетентной клетки, который будет секретирован в непосредственной близости от клетки-мишени.
С учетом приведенных выше сведений, способ лечения онкологических заболеваний осуществляется следующим образом.
Способ лечения онкологических заболеваний основан на применении в схемах лечения рака молочной железы II-IV стадии препаратов цитостатической группы отличающийся тем, что дополнительно после однократного в рамках одного цикла химиотерапии внутривенного введения цитостатиков циклофосфан (500 мг/м2) и доксорубицин (50 мг/м2) (схема АС) или циклофосфан (500 мг/м2), доксорубицин (50 мг/м2) и фторурацил (500 мг/м2) (схема FAC) пациенту назначают препарат на основе экзогенной ДНК человека Панаген (ЛСР №004429/08 от 09.06.2008) в форме таблеток, покрытых гастроэнтерическим покрытием, в дозе 30 мг/сутки при дробном равномерном приеме в течение активного периода суток, что составляет одна таблетка препарата Панаген шесть раз в день (каждые два часа) с началом приема препарата сразу непосредственно после проведенной химиотерапии в количестве 3 таблетки в течение 6 часов, перерывом в приеме препарата, возобновлением его приема через 42 часа, то есть через 48 часов после проведенной химиотерапии (день 3), продолжением приема препарата в течение 17 дней до 20 дня после химиотерапии (включительно), и продолжением приема препарата по указанной схеме до окончания всех курсов химиотерапии.
Применение препаратов цитостатической группы при их синергичном сочетании с препаратом Панаген по указанной схеме представляет собой новую стратегию лечения рака молочной железы, применение которой приводит к одновременному в рамках одного курса химиотерапии проявлению трех типов терапевтического воздействия; к сохранению и стимуляции гранулоцитарно-макрофагального и лимфоцитарного ростков кроветворения, что компенсирует негативное лейкоредуцирующее действие цитостатиков, к сохранению врожденного противоракового иммунитета на уровне до терапии цитостатиками и индукции противоракового адаптивного иммунитета характеризующегося повышением в периферической крови пациентов цитотоксических CD8+ лимфоцитов с высоким содержанием перфоринов.
Стратегия использования сочетания XT по схемам АС и FAC при лечении рака молочной железы II-IV стадии была применена в рамках исследования препарата Панаген в фазе II клинических испытаний.
Ниже приводятся экспериментальные клинические доказательства одновременного проявления двух терапевтических свойств препарата Панаген при его использовании в описанной стратегии в сочетании с цитостатиками циклофосфан и доксорубицин при лечении рака молочной железы II-IV стадии.
Пример реализации способа.
Используемые методики.
В исследовании приняли участие пациенты, получавшие лечение в Новосибирском онкологическом диспансере по поводу рака молочной железы II-IV стадии с использованием однократного в рамках одного цикла XT внутривенного введения цитостатиков циклофосфан (500 мг/м2), доксорубицин (50 мг/м2) и фторурацил (500 мг/м2). Пациенты получали препарат экзогенной ДНК Панаген в форме таблеток, покрытых гастроэнтерическим покрытием, в дозе 30 мг/сутки при дробном равномерном приеме в течение активного периода суток, что будет составлять одна таблетка препарата Панаген шесть раз в день (каждые два часа) с началом приема препарата сразу непосредственно после проведенной XT в количестве 3 таблетки в течение 6 часов, перерывом в приеме препарата, возобновлением его через 42 часа, то есть через 48 часов после проведенной XT (день 3) и продолжением в течение 17 дней до 20 дня после XT (включительно) с применением указанной схемы на протяжении 3-х последовательных XT по схемам АС и FАС.
В исследовании использовалась лекарственная форма препарата Панаген в виде таблеток, покрытых гастроэнтерическим покрытием. Таблетка распадается в отделах кишечника с нейтральным значением pH. Доставка экзогенной ДНК к костному мозгу происходит через систему всасывания тонкого кишечника. Одновременно со всасыванием в кровь фрагменты экзогенной ДНК захватываются иммунокомпетентными клетками пейеровых бляшек кишечника и других иммунных органов.
Проведенное исследование препарата Панаген являлось плацебоконтролируемым. Все пациенты, которые попали в группу плацебо, получили полное стандартное лечение согласно требованиям Министерства здравоохранения и социального развития РФ. На фоне XT по схеме: циклофосфан (500 мг/м2), доксорубицин (50 мг/м2) и фторурацил (500 мг/м2) пациенты данной группы принимали плацебо по одной таблетке шесть раз в день, при дробном равномерном приеме в течение активного периода суток (по одной таблетке каждые два часа). Прием плацебо начинался сразу непосредственно после проведенной XT в количестве 3 таблетки в течение 6 часов, то есть по одной таблетке каждые два часа. После этого пациенты прекращали прием плацебо, возобновляли его через 42 часа, то есть через 48 часов после проведенной XT (день 3) и продолжали в течение 17 дней до 20 дня после XT (включительно).
В цикле XT 1 образцы крови для определения абсолютного числа лейкоцитов и нейтрофилов собирались за 1-3 дня до XT, на 7 (±1), 14 (±2), и 21 (±1) дни после XT. Образцы крови для определения количества CD34+ клеток будут собирались за 1-3 дня до XT и затем на день 7 (±1) и день 21 (±1) после XT. В цикле 2 образцы крови для определения абсолютного числа лейкоцитов и нейтрофилов собирались на 28 (±1), 35 (±2), и 42 (±1) дни после XT. Образцы крови для определения количества CD34+ клеток собирались только на день 42 (±1) после XT. В цикле 3 образцы крови для определения абсолютного числа лейкоцитов и нейтрофилов собирались на 49 (±1), 56 (±2), и 63 (±1) дни после XT. Образцы крови для определения количества CD34+ клеток собирались только на день 63 (±1) после XT.
Анализ безопасности (физикальное обследование, основные показатели жизнедеятельности) проводился в течение 1-3 дней до начала XT в каждом цикле и на 14 (±2) день после проведенной XT. Пациенты наблюдались на предмет возникновения нежелательных явлений и прием сопутствующих препаратов в течение исследования.
Анализы конца исследования проведены на 21 (±2) день после 3 цикла XT. Биохимический анализы крови проводится за 1-3 дня до начала XT и на 21 (±2) день после XT (фиг.8).
XT повторялась каждые 3 недели (если не требовался перерыв). Для начала XT в день 1 следующего цикла (день 22 предыдущего цикла) у пациента должно быть лейкоциты ≥3,0×109/л, нейтрофилы ≥1,5×109/л, a число тромбоцитов ≥100×109/л. Приемлема задержка введения дозы XT до 1 недели.
В ходе исследования различных параметров кроветворения было выявлено, что часть пациентов отвечала на воздействие препарата, а часть не отвечала на применение препарата Панаген. В связи с таким разделением пациентов для каждого оценочного параметра вся выборка делилась по этому признаку, то есть формировались 2 группы: «отвечающие» и «не отвечающие».
Оценка достоверности проводилась по U-критерию Манна-Уитни. Оценка параметров проводилась как в абсолютных, так и в относительных величинах. Это было связано с разбросом в абсолютных цифрах сравниваемых параметров для каждого отдельно взятого больного. Было выбрано два варианта относительного сравнения.
1) Все показатели сравнивались по отношению к «0» точке - точке анализа параметров до проведения терапии. Относительная цифра бралась как доля (в %) от исходного значения для каждой точки измерения. Такое сравнение позволило оценить динамику восстановления измеряемого параметра по отношению к его состоянию до проведения XT. To есть оценить способность препарата компенсировать негативное действие цитостатиков и охарактеризовать его поддерживающее и восстанавливающее действие на кроветворную систему на протяжении проводимых курсов XT.
2) 14 сутки после введения цитостатиков, как показало исследование, являются точкой максимального угнетения кроветворения (минимальные показатели по форменным элементам крови) для пациентов, получавших препарат Панаген. Также, как показывают результаты пилотных исследований, к 14 дню после начала XT начинает проявляться эффект воздействия лекарственного средства (таблетированная форма препарата Панаген). В этой связи все показатели протокола исследований сравнивались с показателями 14 дня после проведения первого курса XT. Относительные цифры также брались как доля (в %) от показателя параметра на 14 контрольный день. Такой анализ позволил: а) провести относительную оценку протекторного и восстанавливающего действия препарата на гемопоэз независимо от исходного состояния кроветворной системы больного в ходе проведения нескольких XT; б) сравнить способность препарата сохранять кроветворный потенциал в наиболее критические дни (14 сутки после введения цитостатиков) каждой последующей XT, когда существует наибольшая вероятность развития фебрильной нейтропении.
3) Пациенты были разбиты на 3 группы: «отвечающие» на действие препарата, «не отвечающие» на действие препарата и «Плацебо».
Рассмотрим характеристику основных показателей гемопоэза у больных раком молочной железы, получавших препарат Панаген и плацебо в ходе проведения курсов XT, кроме того, охарактеризуем воздействие на белый росток крови. Оценим динамику содержания различных форм лейкоцитов в периферической крови больных участников исследования.
1. Оценка количества лейкоцитов в контрольных точка в ходе проведения трех курсов XT.
Оценка стимуляции пролиферации лейкоцитов проводилась по сравнению количества лейкоцитов, детектируемых в периферической крови в контрольных точках у пациентов, получавших препарат Панаген и плацебо. Сравнивались как абсолютные, так и относительные цифры. При таком сравнении предполагалось определить степень влияния препарата на стимуляцию лейкопоэза в целом на фоне действия цитостатика по ходу продвижения по циклам XT. Необходимо было определить, как изменяется потенциал прогениторов лейкоцитарного ростка при нарастающем негативном воздействии цитостатической обработки.
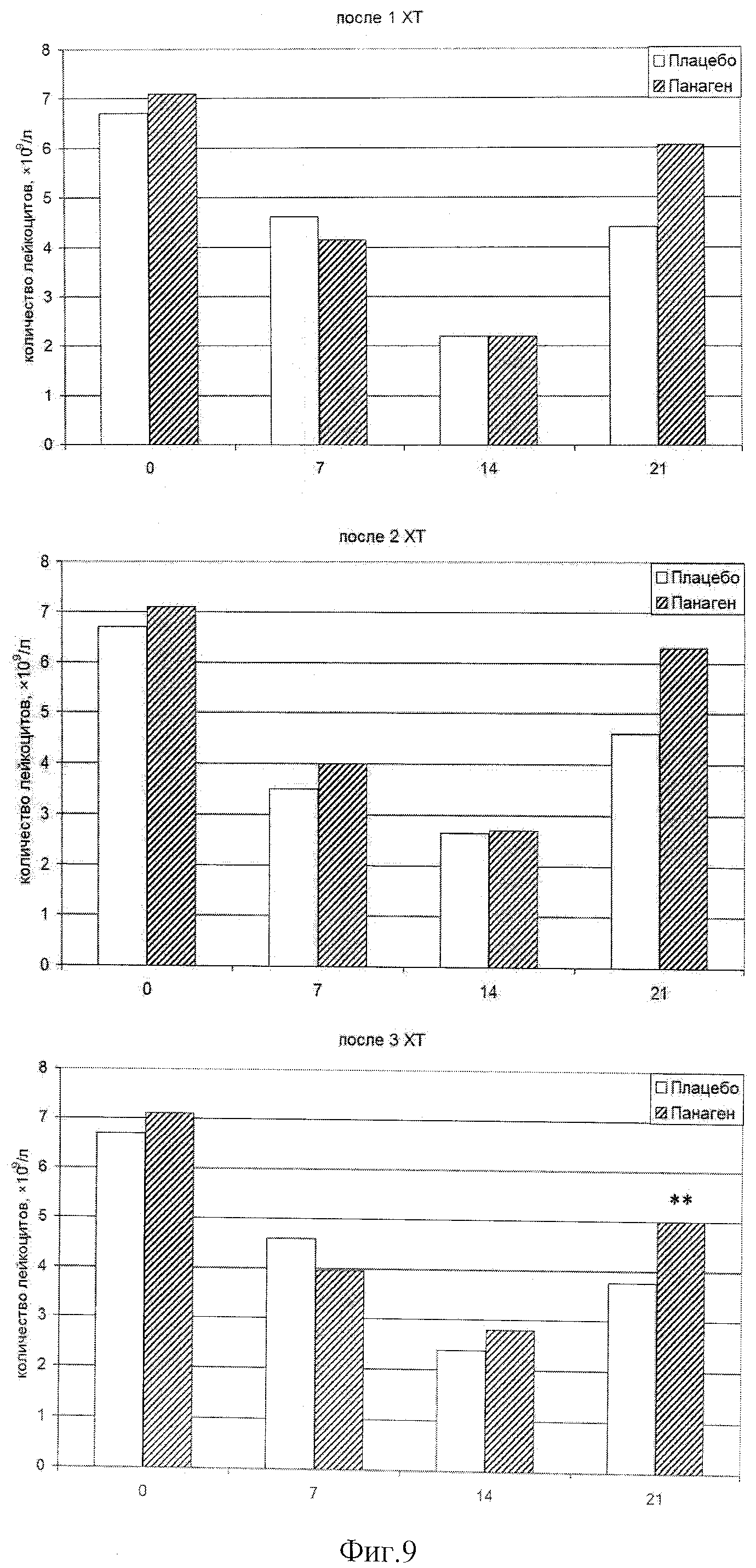
Была оценена динамика содержания абсолютного числа лейкоцитов в периферической крови пациентов в контрольных точках (таблица 5). Как следует из анализа полученных данных, максимальная лейкопения обнаруживается на 14 день после введения цитостатиков (фиг.9) во всех курсах XT.
|
Была проведена оценка изменения условного содержание лейкоцитов с разбивкой на группы «отвечающие» и «не отвечающие» на действие препарата по отношению к показателям первой XT (таблицы 6, 7) и относительно исходного уровня (таблица 8). На 21 день после проведения 3 XT наблюдается отличие в числе лейкоцитов периферической крови между группами «Плацебо» и «Панагенотвечающие» с достоверностью pu<0,01 (фиг.10). При этом число лейкоцитов в группе «Плацебо» не достигает уровня, детектируемого в аналогичный день после 1 XT (100%), тогда как в группе пациентов, отвечающих на действие препарата, этот показатель превышает 100%.
|
|
|
В процессе анализа результатов обнаружился следующий факт. Часть пациентов, входящих в группы «отвечающих» и «не отвечающих» на действие препарата Панаген, в двух следующих одна за другой контрольных точках (например, 14 и 21 дни после проведения XT) меняются местами. То есть у больных, которые отвечали возрастанием числа лейкоцитов в периферической крови на 14 сутки после инъекции цитостатиков, число лейкоцитов к 20 суткам после введения цитостатиков находилось на уровне или меньше соответствующей контрольной точки после 1 XT, принятой за 100%. И, наоборот, у больных, которые на 14 сутки еще не отвечали на действие препарата, к 20 суткам индуцировалась чувствительность к препарату Панаген. При этом число лейкоцитов в периферической крови пациентов в группе отвечающих на действие препарата Панаген в контрольной точке 21 сутки после проведения XT достоверно выше, чем в группе «Плацебо». Можно полагать, что пролиферативная активность коммитированных унипотентных предшественников лейкоцитарного ряда активируется препаратом в разнесенные по времени «окна восприимчивости». Это и приводит к сдвигу времени пролиферации, что и отражается на числе лейкоцитов, регистрируемых в периферической крови пациентов.
Количество пациентов, обследуемых в ходе 2 XT на 14 сутки, - 12 человек, из них «отвечающих» - 9, «не отвечающих» - 3. Количество пациентов, обследуемых в ходе 2 XT на 21 сутки, - 16 человек из них «отвечающих» - 8, «не отвечающих» - 8. Из них один человек из группы «Панаген - отвечающие» перешел в группу «Панаген - не отвечающие» и 4 человека из группы «не отвечающие» перешли в группу «отвечающие» (фиг.11, таблица 9).
Количество пациентов, обследуемых в ходе 3 XT на 14 сутки, - 11 человек, из них «отвечающих» - 7, «не отвечающих» - 4. Количество пациентов, обследуемых в ходе 3 XT на 21 сутки, - 15 человек, из них «отвечающих» - 5, «не отвечающих» - 10. Из них 3 человек из группы «Панаген - отвечающие» перешли в группу «Панаген - не отвечающие». Из группы «не отвечающие» в группу «отвечающие» перешел один человек (фиг.12, таблица 10). При этом на 21 день после 3 XT число лейкоцитов в группе «Плацебо» не достигает уровня, детектируемого в аналогичный день после 1 XT (100%), тогда как в группе пациентов, отвечающих на действие препарата, этот показатель достигает 130%.
То есть можно сказать, что группа «отвечающих» пациентов гораздо больше, что связано с разбросом времени ответа на препарат для каждого индивидуального пациента. То есть те пациенты, которые перешили в группу «не отвечающих», уже ответили ростом лейкоцитов на несколько дней раньше, то есть препарат выполнил свою лейкостимулирующую функцию.
|
|
2. Оценим количество нейтрофилов в контрольных точках в ходе проведения трех курсов XT.
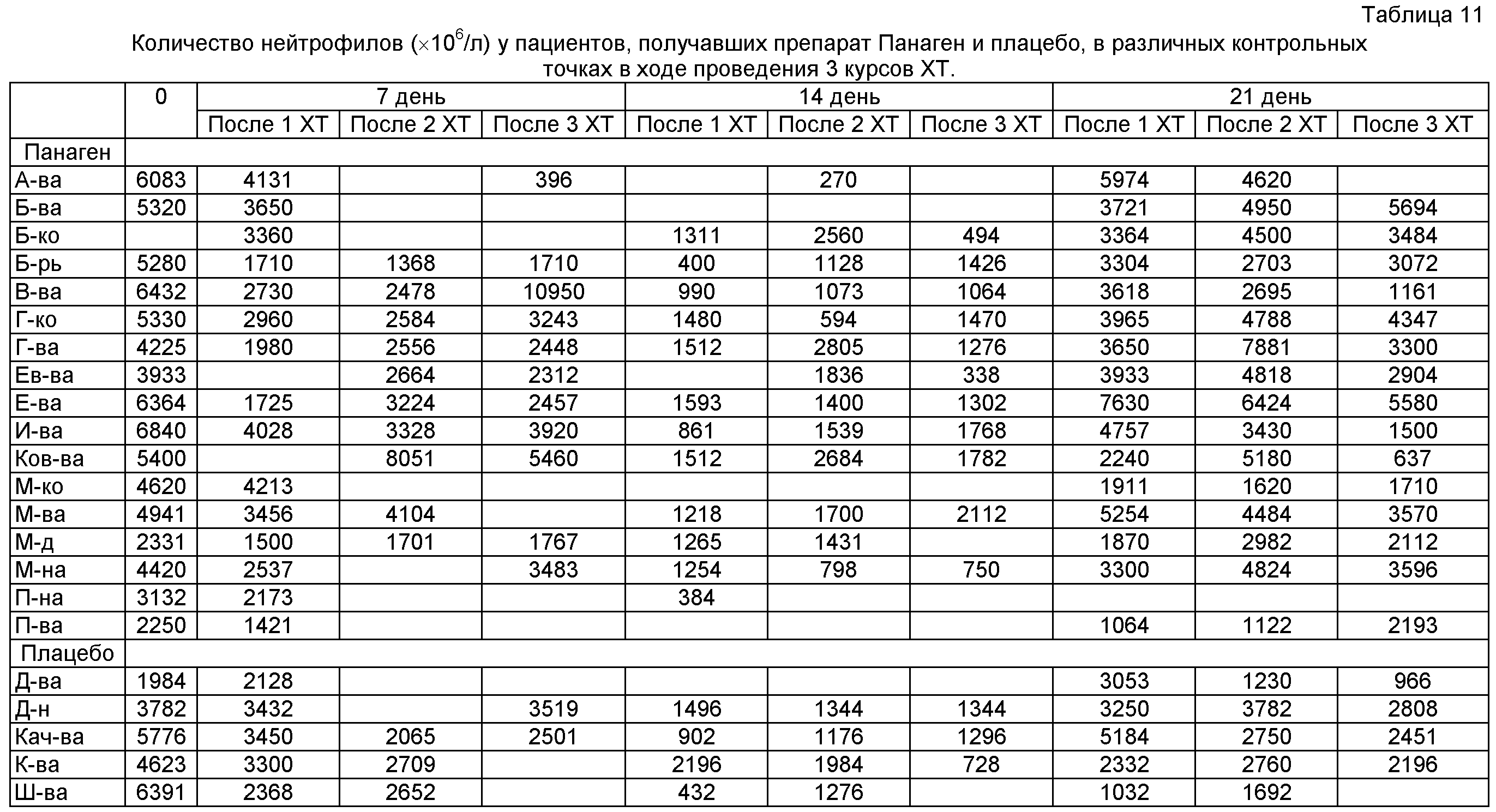
Было определено количество нейтрофилов в периферической крови пациентов во всех контрольных точках XT (таблица 11).
Оценка стимуляции нейтрофильного листка кроветворения проводилась по сравнению количества нейтрофилов, детектируемых в периферической крови в контрольных точках у пациентов, получавших плацебо и препарат Панаген. Сравнивались относительные цифры. При таком сравнении предполагалось определить степень влияния препарата на стимуляцию нейтропоэза на фоне действия цитостатика по ходу продвижения по циклам XT. Необходимо было определить, как изменяется потенциал прогениторов нейтрофилов при нарастающем негативном воздействии цитостатической обработки.
Была оценена динамика содержания нейтрофилов в периферической крови пациентов в контрольных точках после 2 и 3 XT (фиг.13, 14, таблица 12). В этом случае значение в контрольной точке 1 XT бралось за 100%. Остальные значения брались как доля (%) от этой цифры.
|
Также был оценен эффект сохранения числа нейтрофилов в каждой группе по ходу продвижения по циклам XT в контрольных точках 14 и 21 сутки после инъекции цитостатиков (фиг.15, 16). В этом случае сравнивались показатели групп после каждой XT. За 100% бралось значение показателя, определенное в первой XT. Сравнение графиков предполагает, что препарат на 14 день каждой последующей XT продолжает сохранять количество нейтрофилов в крови пациентов. При аналогичном сравнении на 21 сутки после 3 XT у пациентов, принимающих препарат, все еще наблюдается превышение показателя над исходной точкой. Тогда как в группе «Плацебо» отмечается резкое снижение количества нейтрофилов в крови (фиг.16).
Сравнение относительного числа нейтрофилов по отношению к исходной точке будет свидетельствовать о степени восстановления числа нейтрофилов до исходного уровня, определяемого перед цитостатической обработкой (фиг.17, таблица 13). Проведенное сравнение демонстрирует, что на 14 сутки по ходу выполнения XT различий нет. На 21 сутки в группах «Плацебо» и «Панаген - не отвечающие» отмечается тенденция постепенного понижения количества периферических нейтрофилов. В группе «Панаген - отвечающие» отмечается тенденция к стабилизации уровня нейтрофилов в периферической крови.
|
В процессе анализа результатов обнаружился следующий факт. Часть пациентов, входящих в группы «отвечающих» и «не отвечающих» на действие препарата Панаген в двух следующих одна за другой контрольных точках (например, 14 и 21 дни после проведения XT) меняются местами. То есть у больных, которые отвечали возрастанием числа нейтрофилов в периферической крови на 14 сутки после инъекции цитостатиков, число нейтрофилов к 21 суткам после введения цитостатиков находилось на уровне или меньше соответствующей контрольной точки после 1 XT, принятой за 100%. И, наоборот, у больных, которые на 14 сутки еще не отвечали на действие препарата, к 21 суткам индуцировалась чувствительность к препарату Панаген. Можно полагать, что пролиферативная активность коммитированных унипотентных предшественников нейтрофилов-резидентов костного мозга активируется препаратом в разнесенные по времени «окна восприимчивости». Это и приводит к сдвигу времени пролиферации, что и отражается на числе нейтрофилов, регистрируемых в периферической крови пациентов.
Количество пациентов, обследуемых в ходе 2 XT на 14 сутки, - 11 человек, из них «отвечающих» - 8, «не отвечающих» - 3. Количество пациентов, обследуемых в ходе 2 XT на 21 сутки, - 15 человек, из них «отвечающих» - 9, «не отвечающих» - 7. Из них трое человек из группы «Панаген - отвечающие» перешли в группу «Панаген - не отвечающие», и 1 человек из группы «не отвечающие» перешли в группу «отвечающие» (фиг.18. таблица 14).
Количество пациентов, обследуемых в ходе 3 XT на 14 сутки, - 10 человек из них «отвечающих» - 5, «не отвечающих» - 5. Количество пациентов, обследуемых в ходе 3 XT на 21 сутки, - 15 человек, из них «отвечающих» - 6, «не отвечающих» - 9. Из них пять человек из группы «Панаген-отвечающие» перешли в группу «Панаген - не отвечающие», и 3 человека из группы «не отвечающие» перешли в группу «отвечающие» (фиг.19. таблица 15).
То есть опять можно сказать, что группа «отвечающих» пациентов гораздо больше, что связано с разбросом времени ответа на препарат.
|
|
Можно отметить, что группа «отвечающих» на препарат после всех курсов XT составляет треть от общего количества пациентов, принимавших препарат Панаген, и по показателю относительного содержания нейтрофилов на 21 день после 3 XT достоверно (pu<0,01) отличается как от группы «Панаген - не отвечающие», так и от группы «Плацебо».
Было установлено, что максимально число нейтропений всех степеней приходится на 14 сутки после введения цитостатиков (фиг.20, таблица 16). Наиболее частым оказалось снижение уровня нейтрофилов до отметки 1,0-1,5×109/л, что соответствует нейтропений II степени. При сравнении частот возникновения нейтропений II степени в группе «Панаген» и «Плацебо» обращает на себя внимание сохранение частоты возникновения в группе «Панаген» на протяжении 3 XT, в рамках которых проходило исследование, и прогрессивное увеличение частоты нейтропений в группе «Плацебо». К третьей XT число пациентов с симптомами нейтропений в связи с XT в группе «Плацебо» возросло в 2 раза по сравнению группой «Панаген» (фиг.21).
Несмотря на то, что у нескольких пациентов показатели количества нейтрофилов падали до уровня нейтропений IV степени, после повторных измерений в следующие 3 дня уровень нейтрофилов восстанавливался до показателей выше критических и в контрольной точке 21 день перед следующей XT количество нейтрофилов достигало уровня, допускающего проведение следующего курса XT (фиг.22, таблица 17).
|
Оценка количества моноцитов в контрольных точках в ходе проведения трех курсов XT.
Оценка воздействия препарата на моноцитарный росток крови была выполнена по аналогичному принципу, примененному для оценки лейкоцитов и нейтрофилов. Во-первых, было проведено общее сравнение между группами «Плацебо» и «Панаген» абсолютного числа моноцитов в крови пациентов участников испытания. Такое сравнение позволило установить, что, как и предыдущие клетки крови, моноциты повторяют динамику снижения численности клеток в периферической крови в ответ на воздействие XT. 14 сутки являются контрольной точкой, в которой число моноцитов в периферической крови минимально (фиг.23, таблица 18).
Далее была проведено сравнение условного содержания моноцитов в группах «Плацебо», «Панаген - отвечающие», «Панаген - не отвечающие» по отношению к показателям после 1 XT, которые принимались за 100% в контрольных точках после 2 и 3 XT (фиг.24, 25, таблица 19). Было также проведено сравнение значений в контрольных точках внутри каждой группы по ходу проведения XT (фиг.25).
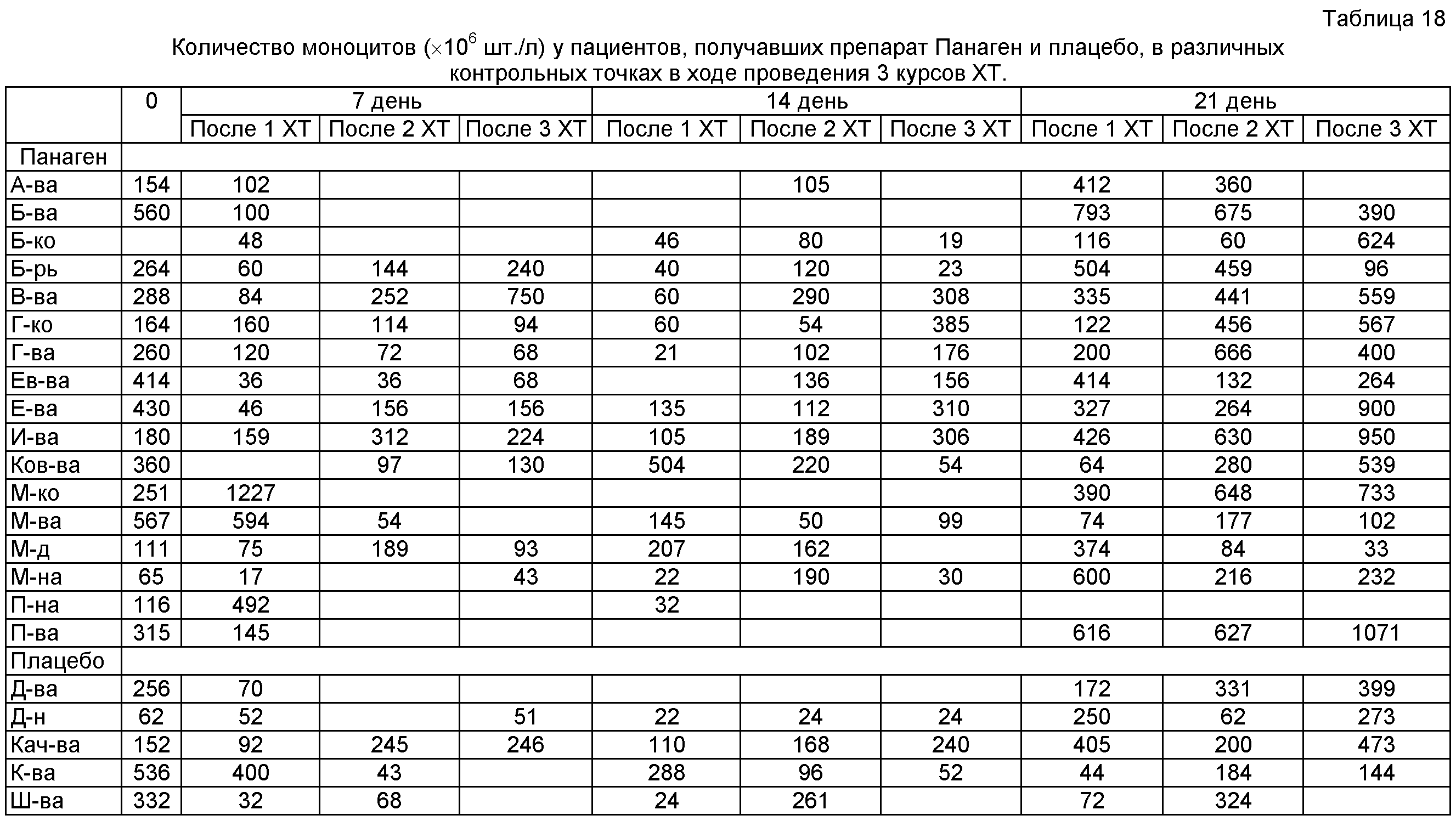
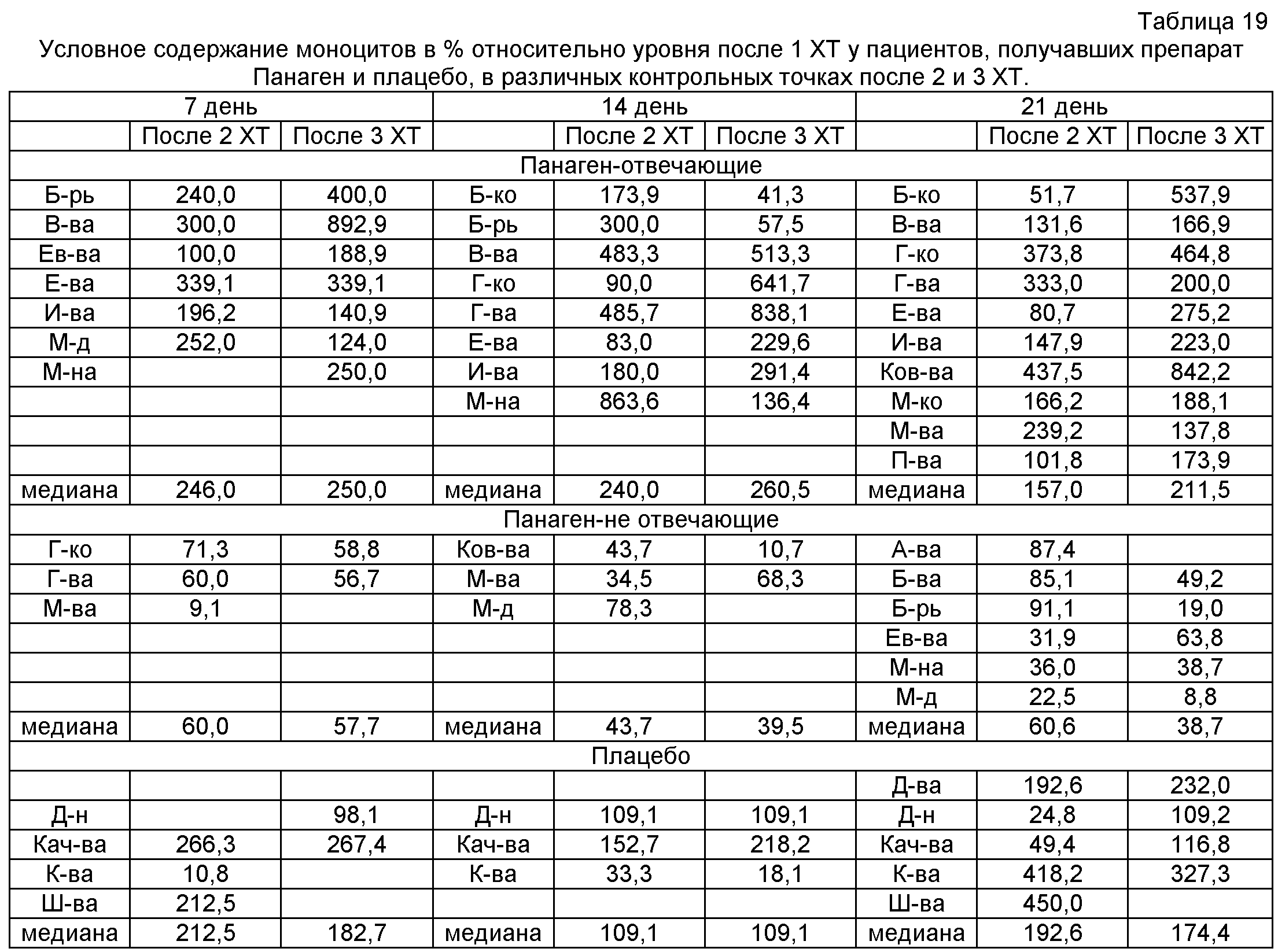
Как и в предыдущих разделах была проведена оценка условных значений содержания моноцитов в каждой группе на втором и третьем курсе XT в контрольных точках 14 и 21 сутки после введения цитостатика относительно значения параметра после 1 XT (фиг.26, 27, таблицы 20, 21). Группы «Панаген - отвечающие» и «Панаген - не отвечающие» формировались независимо для каждой контрольной точки. Полученные результаты свидетельствуют о том, что препарат Панаген позволяет сохранить на высоком уровне количество моноцитов в периферической крови пациентов, отвечающих на действие препарата, в критические дни (14 сутки) после проведения химиотерапевтической обработки.
|
|
Оценим динамику содержания общего пула лимфоцитов в периферической крови больных участников исследования.
Лимфоцитарная, также как и мононуклеарная фракция периферии, является важнейшим показателем иммунокомпетентного состояния организма больного онкологическим заболеванием. Из мононуклеарной фракции развиваются антигенпрезентирующие клетки макрофаги и ДК. Лимфоцитарная фракция состоит из главных эффекторов иммунной системы Т и В лимфоцитов.
В ходе проведения исследования была проведена оценка количества общего пула лимфоцитов по ходу проведения XT (таблица 22).
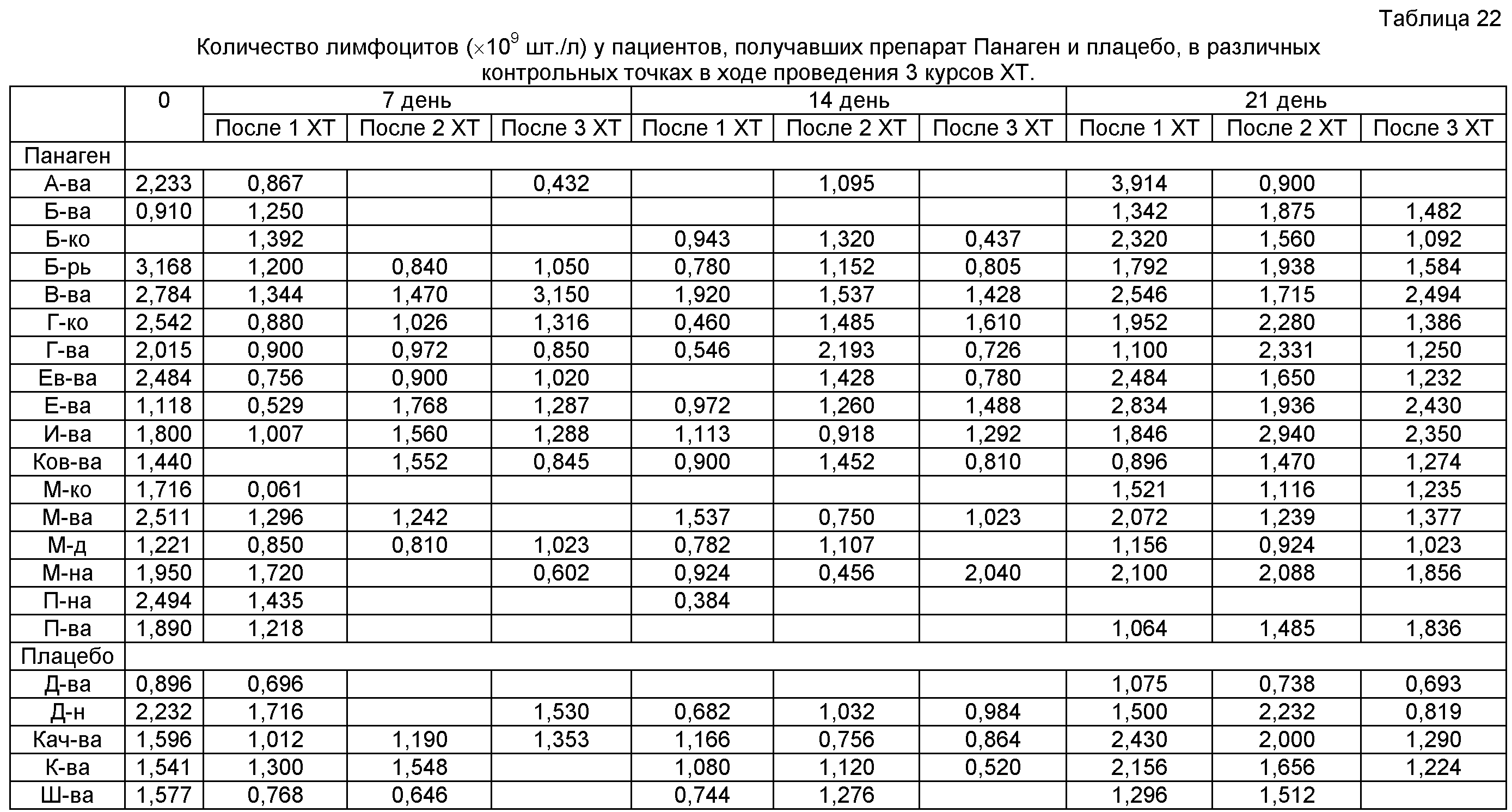
Оценка содержания лимфоцитов проводилась по описанной выше процедуре. Результаты проведенных анализов свидетельствуют, что в контрольной точке после 3 XT количество лимфоцитов в крови пациентов достоверно больше в группе «Панаген» (pu<0,05), без разделения на отвечающих/не отвечающих, чем в группе «Плацебо» (фиг.28).
Также оценка различий параметров в контрольной точке 21 сутки после 3 XT при разделении на группы «Панаген-отвечающие», «Панаген-не отвечающие», «Плацебо» свидетельствует о том, что в группе «Панаген-отвечающие» с достоверностью pu<00,01 количество лимфоцитов больше, чем в группе «Плацебо». А с вероятностью pu<0,05 количество лимфоцитов в группе «Панаген-отвечающие» больше, чем в группе «Плацебо» в контрольной точке 21 сутки после 2 XT (фиг.29, таблица 23). Полученные результаты свидетельствуют, что препарат Панаген способствует сохранению и поддержанию периферических лимфоцитов при использовании интенсивных режимов XT.
|
Сравнение графиков предполагает, что препарат на 21 день каждой последующей XT продолжает сохранять количество лимфоцитов в крови пациентов. В группе «Плацебо» происходит значительная редукция числа лимфоцитов в периферической крови с каждой последующей XT. При аналогичном сравнении на 14 сутки после 3 XT у пациентов, принимающих препарат, также наблюдается существенное превышение показателя над исходной точкой. Тогда как в группе «Плацебо» на 21 сутки после 3 XT отмечается резкое с достоверностью pu<0,01 снижение количества лимфоцитов в периферической крови (фиг.30).
Охарактеризуем воздействие на красный росток крови.
Была проведена оценка воздействия препарата Панаген по нескольким стандартным показателям, отражающим состояние красного ростка крови по ходу проведения XT (таблица 24). Как следует из проведенного анализа, препарат Панаген не оказывает существенного действия на красный росток кроветворения. Единственным отмеченным признаком было увеличение числа тромбоцитов к 21 контрольному дню каждой XT у нескольких пациентов, принимающих препарат Панаген (достоверного отличия по совокупной выборке по сравнению с группой «Плацебо» не выявляется).
|
Оценка количества CD34+/45+ прогениторных клеток в контрольных точках в ходе проведения трех курсов XT.
Оценка количества предшественников гемопоэза CD34+/45+ была проведена на 7 сутки после введения цитостатика на первой XT и на 21 сутки после каждой проведенной XT (таблица 25).
|
Как показал проведенный анализ, число предшественников гемопоэза к 21 дню каждой последующей XT многократно превышал исходный уровень как в группе принимающих препарат Панаген, так и в группе «Плацебо» (фиг.31, таблица 26). Это связано с тем, что терапии по схемам, включающим цитостатик ЦФ, обладают самостоятельным мобилизующим действием на предшественников кроветворения и часто используются в сочетании с Г-КСФ с целью максимальной активации пролиферации и выходу в кровь клеток нейтрофильного ряда.
Тем не менее, анализ параметра на 7 сутки после проведения 1 XT показал существенную и достоверную разницу с вероятностью pu<0,01 в количестве предшественников гемопоэза между группами «Плацебо» и «Панаген-отвечающие» и (фиг.32, таблица 27).
|
|
Оценка функциональной активности клеток врожденного противоракового иммунитета после проведения трех курсов интенсивной XT
Используя цитотоксический тест, в аллогенной системе была оценена активность клеток врожденного противоракового иммунитета, сохранившаяся к концу проведения 3 XT (фиг.33, таблица 28). Этот параметр свидетельствует о действии препарата «Панаген» на состояние первого эшелона иммунитета организма после интенсивных режимов цитостатической XT по поводу злокачественного новообразования.
Для оценки функционального состояния цитотоксических клеток в периферической крови пациентов, находящихся в исследовании, был проведен цитотоксический тест с использованием в качестве отвечающей мишени клеток культуры клеток аденокарциномы молочной железы человека MCF-7.
Цитотоксичность мононуклеарной фракции крови человека, полученной при осаждении периферической крови пациентов на градиенте фиколла-урограина (плотность 1,077), определяли на линии клеток опухоли MCF-7. Клетки опухоли помещали в 96-луночный планшет (5×104 кл/лунку) и добавляли мононуклеары в количестве 5×104, 10×104 или 25×104 кл/лунку (соотношение 1:1, 1:2 или 1:5). Далее клетки инкубировали в среде RPMI-1640 с добавлением гентамицина сульфата (100 мкг/мл) в атмосфере 5%-ного CO2 при 37°С в течение 21 ч. После инкубации в лунки добавляли раствор МТТ до конечной концентрации 0,5 мг/мл и культивировали в течение 3 ч. Клетки центрифугировали при 4000 об/мин в течение 10 мин (Eppendorf Centrifuge 5810 R). Среду отбирали, выпавшие синие кристаллы формазана растворяли в 100 мкл ДМСО, определяли оптическую плотность на приборе «Multiskan RC» на длине волны 570 нм, вычитая фон при 620 нм. Результаты МТТ-теста обрабатывали с помощью программы «Microsoft Excel 2002». Расчет ЦИ проводился по стандартной формуле:
ЦИ (%)= [1-(ОПэ+м-ОП2)/ОПм]*100, где
ОПэ+м - значение оптической плотности в опытных сериях;
ОПэ - значение оптической плотности в лунках с эффекторами;
ОПм - значение оптической плотности в лунках с мишенями.
|
Рассмотрим обобщенное заключение по результатам проведенного исследования лейкостимулирующего действия препарата на основе фрагментированной ДНК человека Панаген в ходе последовательного проведения трех XT с использованием схемы FAC по поводу рака молочной железы 2-4 стадии.
В рамках проведенных исследований препарата Панаген в качестве лейкостимулирующего средства были выявлены закономерности и получены результаты, характеризующие влияние препарата на кроветворные ростки пациентов, находящихся в исследовании по ходу возрастающего негативного влияния на гемопоэз последовательных курсов XT.
Главной задачей исследования было определить эффект влияния препарата на гемопоэтические ростки в нарастающей прогрессии негативного действия нескольких проводимых подряд XT. В этой связи два обобщенных параметра были необходимы для оценки действия препарата. Первый - динамика изменения числа форменных элементов основных ростков кроветворения в периферической крови в контрольных точках 1, 2 и 3 XT. Второй - число форменных элементов определенного ростка кроветворения в периферической крови в последней контролируемой точке 21 сутки после проведения 3 XT.
1. Установлено, что препарат дифференцированно действует на различных пациентов в разных контрольных точках. В связи с этим в каждой контрольной точке формировались 2 группы «отвечающие» и «не отвечающие» на действие препарата. Соотношение «отвечающих» к «не отвечающим» в среднем было 8,65/5,05 или 63,14%/36,86%. Некоторые параметры, например абсолютное значение лейкоцитов и лимфоциты, в контрольной точке 21 сутки после 3 XT имели достоверное различие между группами «Панаген» и «Плацебо» без деления на отвечающих и не отвечающих. Необходимость деления на две подгруппы выявилась в ходе исследования. Показатели группы «Панаген - не отвечающие» в данной контрольной точке были столь низки, что формирующийся разброс в численных значениях показателя не давал возможности проведения сравнения с использованием общепринятых методов статистической оценки полученных результатов. Тем не менее, как показали исследования, группа «Панаген - не отвечающие» не являлась постоянной от одной контрольной точки к другой. Пациенты, которые не отвечали в одной контрольной точке, могли в значительной степени реагировать на действие препарата в другой. Мы связываем это явление с «фазовостью» в состоянии предшественников гемопоэза разной степени коммитированности.
В состоянии ГСК существуют биологические фазы, когда клетка воспринимает индуцирующий импульс или нет. Такими фазами могут быть нахождение ГСК в определенной (G0) фазе клеточного цикла, состояние выхода из гемопоэтичекских ниш и миграция по кровяному руслу, связанная или с мобилизующим действием цитокинов, или с циркадным ритмом ГСК [39]. Возможно, что именно с эффектом мобилизации связны фазы восприимчивости к препарату. Известно, что ГСК, вышедшие из кроветворных ниш вследствие разрушения адгезивных связей при использовании мобилизирующих факторов Г-КСФ или ЦФ, не в состоянии пролиферировать до тех пор, пока они в результате эффекта хоуминга не достигнут стромы костного мозга и не восстановят эктопических связей с компонентами гемопоэтических ниш. При исследовании фазы клеточного цикла циркулирующих CD34+ клеток оказалось, что в пуле мобилизованных Г-КСФ CD34+ клеток содержится меньше клеток в S-фазе и отмечается меньшая активность циклинов, чем в пуле костномозговых CD34+ клеток; кроме того, они имеют более низкую метаболическую активность [40-43]. Прямыми методами показано, что CD34+ клетки, мобилизованные Г-КСФ, находятся в G0/G1-фазе клеточного цикла, тогда как в костном мозге перед началом применения Г-КСФ обнаруживалось большое количество CD34+ клеток в S+G2/М-фазе [44], при этом пролиферативный потенциал мобилизованных ГСК значительно ниже такового костномозговых клеток. Можно предположить, что время циркуляции и хоуминга ГСК у пациентов различно. В связи с этим будут значительные разбросы во времени активации пролиферации ГСК, вернувшихся в гемопоэтические ниши, что будет отражаться на времени появления форменных элементов соответствующего ростка кроветворения в периферической крови. Поскольку контрольные точки строго фиксированы протоколом, то возможность обнаружить такой временной сдвиг в фазах ГСК практически невозможно. И пациенты, у которых временные параметры активации гемопоэтичесих предшественников сдвинуты во времени, будут находиться в противофазе к пациентам, «отвечающим» на действие препарата.
При этом известно, что высокодозный ЦФ был первым мобилизационным протоколом, испытанным в клинической практике. При восстановлении гемопоэза после миелосупрессии в периферической крови было зафиксировано более чем 50-кратное повышение концентрации КОЕ-ГМ (гранулоцитарно-макрофагальной колониеобразующей единицы), являющейся предшественником моноцитов и нейтрофилов. Максимальный титр CD34+ ГСК в периферической крови наблюдался на 5-7 день после терапии цитостатиком. Этот эффект действия цитостатика являлся главной трудностью в сравнении и оценке влияния препарата Панаген на гемопоэз пациентов, находящихся на препарате и плацебо. При воздействии ЦФ вся система гемопоэтических предшественников костного мозга приходит в максимальное напряжение, и выявить эффект гемопоэтического действия другого препарата на этом фоне крайне сложно, поскольку он будет экранирован действием ЦФ. Это означает, что если мы в таких условиях обнаруживаем значимые различия в активации гемопоэза между пациентами, находящимися на препарате и плацебо, то это означает, что исследуемый препарат является реальным активатором гемопоэза в курсах последовательных XT.
2. Критической точкой цитостатической обработки являются 14 сутки после воздействия цитостатиков. В этой контрольной точке все показатели количества форменных элементов крови падают до критических значений. Установлено, что препарат Панаген способствует сохранению количества нейтрофилов в периферической крови на 14 сутки от применения цитостатиков, что снижает число нейтропений II степени в этот промежуток времени по сравнению с группой «Плацебо» практически в 2 раза (фиг.34). Также имеются факты, свидетельствующие о том, что критические значения показателя числа нейтрофилов в контрольной точке 14 сутки от применения цитостатиков не является обязательным условием для назначения лейкостимуляторов на основе Г-КСФ. При использовании препарата Панаген в указанном режиме уже через 1-3 суток после падения числа нейтрофилов до критического, их количество достигнет некритического значения, а к 21 дню от введения цитостатиков полностью нормализуется. Это позволит в свою очередь провести следующий курс XT строго по графику, что является залогом качественной терапии злокачественного новообразования.
3. Показано, что эффект увеличения количества CD34+/45+ ГСК в периферической крови можно обнаружить только на 7 сутки первого курса XT (фиг.32). В остальных контрольных точках достоверных отличий от группы «Плацебо» обнаружено не было. Как было отмечено выше, ЦФ сам по себе является сильным мобилизирующим фактором. Обнаруженные достоверные различия в группе «Панаген - отвечающие» в контрольной точке 7 сутки после 1 XT могут являться показателем эффективного гемопоэтического действия препарата Панаген.
Проведенные исследования свидетельствуют о том, что препарат Панаген активирует КОЕ-ГМ гранулоцитарно-макрофагальный и КОЕ-Л лимфоцитарный ростки кроветворения. Соответственно, при анализе числа форменных элементов в крови пациентов, получавших препарат Панаген и плацебо были обнаружены достоверные различия в содержании лейкоцитов в целом, нейтрофилов, моноцитов, лимфоцитов и натуральных киллеров. Не обнаружено различий при оценке параметров, характеризующих активацию КОЕ-Э эритроцитарного и КОЕ-Мег мегакариоцитарного ростков кроветворения.
Показано, что препарат обладает кумулятивным действием по ходу проведения XT. В то время как у группы «Плацебо» все показатели к последней контрольной точке 21 сутки после введения цитостатиков в значительной степени падают, показатели у пациентов «отвечающих» на препарат к указанной контрольной точке сохраняются на уровне, существенно превышающем наиболее критическое значения, обнаруженное после 1 XT. Полученные результаты предполагают, что препарат Панаген предохраняет КОЕ-ГМ и КОЕ-Л от угнетения действием многократных последовательных цитостатических обработок и одновременно индуцирует пролиферацию указанных кроветворных ростков.
Отдельно было проанализировано действие препарата в направлении сохранения и стимуляции пролиферации клеток врожденного противоракового иммунитета (фиг.33). Был использован подход, при котором оценивалась неспецифическая цитотоксическая активность мононуклеарной фракции пациентов, входящих в исследование по отношению к клеткам культуры клеток аденокарциномы человека MCF-7. Проведенные исследования свидетельствуют о протекторном и стимулирующем эффекте действия препарата на эту популяцию клеток. Цитотоксические индексы пациентов, принимавших препарат Панаген, были достоверно и существенно выше показателей в группе «Плацебо».
Таким образом, препарат Панаген можно позиционировать в списке лейкостимулирующих препаратов как протектор и стимулятор гемопоэза гранулоцитарно-макрофагального и лимфоцитарного ростков кроветворения на фоне интенсивных режимов цитостатической химиотерапии в схемах лечения онкологических заболеваний.
Рассмотрим характеристику основных показателей развития противоракового адаптивного иммунитета у больных раком молочной железы, получавших препарат Панаген и плацебо в ходе проведения курсов XT.
Рассмотрим теоретическое обоснование активации адаптивного иммунитета у пациентов, принимавших участие в исследовании:
В рамках проводимых испытаний нового медицинского препарата на основе ДНК человека Панаген было проведено параллельное исследование, связанное с анализом развития адаптивного противоракового иммунитета у пациентов, участвующих в протоколе. Такая постановка вопроса была связана с многочисленными экспериментальными данными, полученными на протяжении последних 10 лет, которые однозначно свидетельствовали о появлении противораковой активности в организме экспериментальных животных при использовании различных стратегий, компонентом которых являлась экзогенная ДНК человеческого происхождения. Как свидетельствовали многочисленные и повторяющиеся экспериментальные данные, основным объектом воздействия экзогенной ДНК в противораковых стратегиях являлись ДК и индуцируемый ими Th1-путь, при котором формируется пул специфических CD8+ Т-цитотоксических лимфоцитов.
Одновременно с активацией причинных звеньев развития противоракового адаптивного иммунитета в стратегиях лечения онкологических заболеваний высокодозовой цитостатической терапией происходят изменения в количестве и функциональном состоянии регуляторных Т-лимфоцитов, которые, как считается в современной иммунологии, ответственны за подавление противоракового иммунного ответа.
В этой связи в рамках проводимых исследований периферической крови пациентов, находящихся в исследовании, были выделены три направления анализа, которые могли бы дать или однозначно трактуемый ответ по поводу действия препарата Панаген на развитие адаптивного противоракового иммунитета, или указать дальнейший путь экспериментальной работы. Выбор направления анализов также был связан с возможностями, которые дает анализ образцов периферической крови.
В этой связи была проведена оценка следующих параметров, отражающих активацию развития противоракового адаптивного иммунитета по ходу трех XT, проводимых по поводу рака молочной железы II-IV стадии.
- Была проведена оценка относительного и абсолютного количества миелоидных (CD11c+CD123-) и плазмацитоидных (CD11c-CD123+) ДК в периферической крови больных. Изменение количества ДК, их субпопуляпионная принадлежность (но не степень зрелости) оценивалось в динамике терапии.
- Было оценено относительное и абсолютное количество Т-регуляторных клеток (CD4+CD25+FoxP3+ или CD4+CD25+CD127-), обладающих супрессорной активностью.
- Основное внимание было уделено оценке динамики цитотоксических (СВ8+перфорин+) Т-лимфоцитов как основных факторов развивающегося противоракового адаптивного иммунитета.
ДК - это гетерогенная популяция антигенпрезентирующих клеток костномозгового происхождения. Морфологически ДК - крупные клетки (15-20 мкм) круглой, овальной или полигональной формы, экцентрически расположенным ядром, многочисленными разветвленными отростками мембраны. ДК экспрессируют набор поверхностных молекул, характерных для других антигенпредставляющих клеток: рецепторы для компонентов клеточной стенки и нуклеиновых кислот микроорганизмов, в том числе рецепторы к компонентам комплемента и toll-like рецепторы; молекулы МНСП; костимуляторные молекулы CD40, В7 1/2 (CD80, CD86), B7-DC, В7-Н1; молекулы межклеточной адгезии (ICAM-1). Основной функцией ДК является презентация антигенов Т-клеткам. ДК также выполняют важные иммунорегуляторные функции, такие как контроль за дифференцировкой Т-лимфоцитов, регуляция активации и супрессии иммунного ответа. Важной особенностью ДК является способность захватывать из окружающей среды различные антигены при помощи фагоцитоза, пиноцитоза и рецептор-опосредованного эндоцитоза. Больше всего ДК находится в тканях, которые соприкасаются с внешней средой, например в толще эпителиального слоя слизистой оболочки кишечника, в подслизистой респираторного, желудочно-кишечного и урогенитального трактов. ДК поглощают антигены, процессируют и представляют на своей поверхности в комплексе с МНС I или МНС II классов. Только в таком виде Т-клетки способны распознать антиген и вслед за этим активироваться и развить иммунный ответ. В зависимости от типа патогена ДК способны направлять дифференцировку наивных Т-хелперов (Th0) в сторону Т-хелперов 1 типа, Т-хелперов 2 типа, регуляторных Т-клеток или же Т-хелперов 17.
У человека выделяют две субпопуляции ДК - миелоидные и лимфоидные ДК. Миелоидные ДК названы так потому, что происходят из общего миелоидного гемопоэтического предшественника. Локализованы в различных органах и тканях, где захватывают микроорганизмы, чужеродные белки путем фаго- и пиноцитоза, после чего экспрессируют антигенную детерминанту в комплексе с молекулами MHCII. Затем ДК мигрируют в регионарные лимфоузлы, где стимулируют пролиферацию и дифференцировку антигенспецифических Т-лимфоцитов, тем самым инициируя и стимулируя иммунный ответ. Специфическими маркерами миелоидных ДК крови являются молекулы BDCA-1 (CD1c), BDCA-3. Миелоидные ДК не экспрессируют маркеры других клеток иммунной системы, таких как CD14 (моноциты, макрофаги и нейтрофилы), CD3 (Т-лимфоциты), CD 19, CD20 (В-лимфоциты), CD56, CD57 (естественные киллеры), CD66b (гранулоциты). Также для миелоидных ДК характерно присутствие молекулы CD85k (ILT3), В ответ на стимуляцию индукторами созревания, миелоидные ДК продуцируют преимущественно цитокины ТЫ спектра, включая ИЛ-6, ИЛ-12, ФНО-α и ИФН-γ.
Лимфоидные ДК - основная субпопуляция ДК крови. Предшественниками лимфоидных ДК является очень маленькая популяция клеток периферической крови, характеризующаяся отсутствием маркера CD11 и присутствием маркера CD123 (рецептор ИЛ3), которая названа плазмацитоидными ДК. Плазмацитоидные ДК способны продуцировать в 200-1000 раз больше ИФН-α, чем все другие клетки периферической крови. Эти клетки за счет продукции интерферонов первого типа и ИЛ-12 оказывают модулирующее влияние на адаптивный иммунный ответ, стимулируют созревание миелоидных ДК, вследствие чего происходит поляризация Т-клеточного ответа в сторону Th1 варианта [45]. К маркерам плазмацитоидных ДК также относят молекулы BDCA-2, BDCA-4. Основная популяция лимфоидных ДК экспрессируют TRL-9, лигандами которого являются CpG-олигонуклеотиды бактериальная ДНК. Лимфоидные ДК секретируют ИЛ-4 и ИЛ-10, которые переключают дифференцировку нулевых Т-хелперов в Т-хелперы 2 типа [46].
Миелоидные ДК способны активировать CD8+ Т-клетки. Лимфоидные ДК вызывают превращение CD8+ Т-клеток в супрессорные (регуляторные) клетки. Однако, вырабатываемый предшественниками лимфоидных плазмацитоидными ДК ИФН первого типа, способствует созреванию миелоидных ДК, повышает их способность активировать CD8+ Т-клетки. Это означает, что в формировании противоракового адаптивного клеточного иммунитета принимают участие как миелоидные, так и часть лимфоидных - плазмацитоидные ДК.
В процессе активации противоопухолевого иммунного ответа формируются два пула лимфоцитов. CD8+ Т-лимфоциты, приводящие к формированию клеточного и гуморального ответа на прогрессирующую малигнизированную ткань. Как было сказано, в формировании CD8+ популяции принимают участие миелоидные ДК и часть лимфоидных ДК (плазмацитоидные ДК). В формировании гуморального ответа принимают участие лимфоидные ДК, основное количество которых циркулирует в периферической крови [45].
При образовании опухолевой ткани в нее мигрируют предшественники ДК и незрелые Т-лимфоциты CD4+ и CD8+ фенотипа. Фактором миграции, по-видимому, являются цитокины ФНО-α или ИЛ-1. Процесс миграции протекает в течение всего времени существования опухоли [47]. Оказываясь в опухоли, незрелые предшественники ДК поглощают различные белковые молекулы, фрагменты клеток из внеклеточного пространства, а также поглощают белки шапероны семейства HSP со встроенными в них антигенными пептидными эпитопами. После поглощения потенциальных антигенов в предшественниках ДК происходят процессы, приводящие к презентации антигенных эпитопов совместно с молекулами гистосовместимости I и II классов. Важно отметить, что презентация происходит как в неактивных, так и в активных ДК. Однако в неактивных ДК этот процесс носит характер постоянного оборота рецепторов со внешней поверхности клетки внутрь и обратно. При активации уход комплексов MHCI и MHCII с поверхности клетки блокируется, и клетка в полной мере осуществляет антигенпрезентирующую функцию [48]. Процесс созревания ДК индуцирует два одновременно происходящих события - усиление презентации антигенов и миграцию клеток из опухоли в региональные лимфатические узлы. Процесс миграции зависит от экспрессии на их поверхности хемокинового рецептора CCR8, который реагирует на градиент хемокина CCL1 (1-308), регулирующие таксис в лимфатические узлы [49]. Пептиды, генерируемые в результате процессинга опухолеассоциированных антигенов, встраиваются преимущественно в молекулы MHCII. Тем не менее, показано, что миелоидные ДК способны презентировать эпитопы из белковых молекул, захваченных из окружающей среды молекулами гистосовместимости I класса, которые в норме презентируют эпитопы белков, синтезированных в самой клетке. Данные феномен называется кросс презентацией. В результате механизма кросс презентации презентация пептидов из опухолевых антигенов осуществляется как в контексте молекул MHCI, так и в комплексе с молекулами MHCII. Одновременно с презентацией антигена происходит выход на поверхность клетки костимулирующих молекул В-7, ICOS и секретируется набор цитокинов. Эти события активируют наивные Т-клетки, стимулируя их развитие в функциональные CD4+ и CD8+ лимфоциты.
CD8+ лимфоциты являются основными эффекторами адаптивного иммунитета. CD8+ Т-цитотоксические лимфоциты и CD4+ Th1-клетки вовлекаются в процессы непосредственно в очаге опухолевого роста. Предполагаются два механизма уничтожения опухолевых клеток Т-цитотоксическими лимфоцитами. Это общепринятое действие перфоринов, являющихся основным показателем цитотоксичности CD8+ лимфоцитов. Другой механизм связан с секрецией CD8+ клетками ИФН-γ. Предполагается, что Т-цитотоксические лимфоциты, секретируя ИФН-γ, усиливают кросс-презентацию антигенов в эндотелии опухолевой стромы и уничтожают клетки опухоли при помощи активации в них Fas-рецептора [50, 51]. Сформированные Th1-хелперы CD4+ стимулируют обучение Т-цитотоксических лимфоцитов путем активации ДК со своей стороны. Этот процесс осуществляется за счет секретируемого Th1-хелперами ИЛ-12 и ИФН-γ. Вторам механизмом противоопухолевого действия Th1-клеток является индукция гиперчувствительности замедленного типа, заключающаяся в стимуляции макрофагов в опухолевых очагах секретируемым ИФН-γ. Активированные макрофаги начинают агрессивно поглощать опухолевые клетки.
Популяция Т-хелперов Th2 обеспечивает формирование гуморального ответа иммунной системы. Лимфоидные (плазмоцитоидные) ДК могут индуцировать образование регуляторных Th2-клеток, необходимых для формирования гуморального иммунного ответа. Начальный этап активации B-клеток происходит на границе T- и B-клеточных зон вторичных лимфоидных органов. Антигенная стимуляция индуцирует их миграцию к T-клеточным зонам. Здесь В-клетки взаимодействуют с антиген-специфическими Th2-хелперами. В начале лимфоидные (плазмоцитоидные) ДК активируют последние, которые далее распознают антиген, представляемый им B-клетками в комплексе с МНС II класса, и активируют B-клетки путем взаимодействия CD40L/CD40. Дальнейшая дифференцировка B-клеток в антителообразующие плазмоциты происходит в герминативных центрах под влиянием специализированных ДК миелоидного ряда.
Таким образом, взаимодействие ДК с цитотоксическими лимфоцитами имеет сложный двунаправленный характер. Их активацию могут осуществлять любые ДК. Благодаря экспрессии ИФН-1, ИЛ-12,-15 и -18 ДК усиливают цитотоксичность натуральных киллеров и продукцию ИФН-γ. Экспрессия CD40L или ФНО-α индуцирует созревание лимфоидных (плазмоцитоидных) ДК. ИФН способствует развитию миелоидных ДК и экспрессии Th1-дифференцировочного сигнала. ДК могут как стимулировать Т-клеточный ответ, так и вызывать иммунологическую толерантность.
Представление антигенов цитотоксическим Т-клеткам осуществляется молекулами МНС I и II классов. Источниками антигенных пептидов, представляемых ими, являются белки, синтезируемые в самой ДК, а также экзогенные белки. Наивные CD8+ T-клетки в ходе иммунного ответа могут превращаться в неполяризованные T-лимфоциты (CD45), секретирующие только ИЛ-2; в эффекторные цитотоксические Т-клетки, которые продуцируют тот же спектр цитокинов, что и Th1- и Th2-клетки. Существует дополнительная субпопуляция цитолитических эффекторных CD8+ T-клеток, секретирующих ИФН-γ, экспрессирующих высокие уровни перфорина и способных к немедленному лизису антигенспецифических клеток-мишеней.
И, таким образом, существует глубокая органическая связь между двумя популяциями ДК. Несмотря на то, что миелоидные ДК, содержащие на своей поверхности большое количество МНСП белков, в первую очередь ответственны за формирование пула CD8+ T-цитотоксических лимфоцитов, плазмацитоидные ДК также имеют прямое отношение к формированию Th1-ответа, регулируя активацию миелоидных ДК.
Рассмотрим общую идеологическую схему активации адаптивного противоракового иммунного ответа при применении заявленной стратегии.
1. XT включает обязательное использование сочетания доксорубицина и ЦФ (доксорубицин приводит к перемещению калретикулина на цитоплазматическую мембрану, что делает опухолевую клетку видимой для атаки фагоцитирующими клетками, это сигнал «eat me - съешь меня»; ЦФ приводит к деструкции опухолевой клетки и формированию клеточного дебриса; таким образом формируется иммуногенный клеточный дебрис).
2. В тот же самый момент ЦФ дифференцированно угнетает различные популяции T-лимфоцитов. Так угнетение T-регуляторных лимфоцитов, создающих противоиммунную защиту опухоли, происходит практически полностью. При этом нарушается супрессивная функция T-регуляторных лимфоцитов. При этом T-цитотоксические лимфоциты гибнут только частично и восстанавливаются под действием препарата ДНК и активности ДК. Это создает промежуток времени, когда опухолевая ткань становится незащищенной цитокиновым градиентом, предохраняющим ее от воздействия иммунной системы.
3. В этот же момент проводится активация созревания и индукция аллостимуляторной активности ДК организма in vivo с использованием препарата экзогенной фрагментированной аллогенной ДНК Панаген. ДК созревают и нагружаются опухолевыми антигенами, которые теперь распознаются ДК. ДК активируют развитие T-цитотоксического специфического противоракового ответа.
4. T-цитотоксические лимфоциты лизируют все, что относится к зоне их атаки, в том числе оставшиеся опухолевые клетки.
5. Формируется T-память против этого неопластического материала. Оценим относительное и абсолютное количество миелоидных (CD11C+CD123-) и плазмацитоидных (CD11c-CD123+) ДК в периферической крови больных.
Поскольку антигенпрезентирующие клетки, такие как и макрофаги и ДК, происходят из моноцитов, стимуляция препаратом Панаген моноцитарного ростка кроветворения является позитивным показателем проведенной терапии. В этой связи оценка представленности и соотношения миелоидных (CD11+CD123-) и плазмацитоидных (CD11-CD123+) ДК в периферической крови пациентов, находящихся в исследовании, будет характеризовать возможные пути активации иммунного ответа. Анализ содержания цитотоксических CD8+перфорин+ лимфоцитов в периферической крови будет прямым показателем развития противоракового адаптивного иммунитета у пациентов, принимающих участие в клинических испытаниях препарата Панаген.
В ходе исследования было установлено, что регуляция количества миелоидных и плазмацитоидных ДК отличается как по типу клеток, так и в отношении различных групп пациентов. Как и в случае с анализом стимуляции гемопоэза препаратом Панаген, было обнаружено, что часть пациентов отвечает на действие препарата в данной контрольной точке, а другая часть не отвечает. Хотя в другой контрольной точке список «отвечающих» и «не отвечающих» мог быть другим. В связи с этим был выбран следующий принцип анализа. Сравнивались абсолютные показатели по отношению к нулевой точке в первой и третьей XT отдельно. Сравнивались показатели по отношению к контрольной точке 21 день после 1 XT, взятой за 100%.
При анализе количества плазмацитоидных ДК (CD11-CD123+) в образцах периферической крови (таблица 29) установлено, что из группы в 14 человек отвечают на действие препарата 9 человек по совокупности после 1 и 3 XT, что составляет 64% (фиг.35, таблица 30). 36% пациентов не отвечают на действие препарата Панаген в выбранных контрольных точках. В ходе XT у 30% больных наблюдается значительное повышение количества плазмацитоидных ДК в периферической крови к последней контрольной точке 21 день после 3 XT (фиг.36, таблица 31). Остальные пациенты демонстрируют снижение или стабилизацию этой популяции ДК в образах крови по отношению к показателю после 1 XT.
|
|
|
Полученные данные предполагают, что в ходе терапии происходит увеличение популяции циркулирующих плазмацитоидных ДК. При этом всплеск появления ДК связан с состоянием индивидуального больного. С индивидуальными особенностями связаны, на наш взгляд, эффект различия в количестве плазмацитоидных ДК к 1 XT у одних пациентов и к 3 XT у других. 63% больных, получавших Панаген, демонстрируют ответ на действие препарата по совокупности показателей контрольных точек 21 сутки после 1 и 3 XT.
Анализ изменения популяции миелоидных ДК (CD11+CD123-) в периферической крови не выявил закономерностей, которые позволили бы оценить возможность активации адаптивного иммунитета через эту популяцию антигенпрезентирующих клеток (фиг.37, 38, таблицы 32-34).
|
|
|
Известно, что ЦФ индуцирует повышение количества ДК с фенотипом CD11+ на 9-16 день после инъекции [52]. ДК, сформировавшиеся в результате действия ЦФ, активируют развитие CD8+ Т-цитотоксических лимфоцитов. В этой связи достаточно проблематично оценивать действие препарата Панаген по появлению в периферической крови определенных популяций ДК и цитотоксических клеток в условиях протокола исследований, поскольку такое появление всегда будет экранироваться действием самого ЦФ. И, если в таких условиях обнаруживается достоверная разница в сравниваемых показателях, то обнаруженное изменение объективно существует в анализируемой системе.
Была проведена оценка количества перфоринсодержащих T-цитотоксических лимфоцитов в периферической крови пациентов, находящихся в исследовании (таблица 35). Проведенный анализ показал, что у 10 из 12 (83%) пациентов, принимавших Панаген, количество T-цитотоксических CD8+перфорин+ в первой контрольной точке 21 день после 1 XT достоверно больше, чем у группы «Плацебо» (pu<0,05) (фиг.39, таблица 36). Если рассматривать анализируемый признак по совокупности обеих контрольных точек, то у подавляющего числа пациентов, принимавших Панаген, в периферической крови содержании T-цитотоксических лимфоцитов многократно превышает исходную норму.
|
|
Полученные данные свидетельствуют, что в организме пациентов, принимавших Панаген в ходе трех XT по поводу рака молочной железы, произошли изменения, характеризующие развитие адаптивного иммунного ответа. Изменения количества T-цитотоксических лимфоцитов, по-видимому, связано с миграцией лимфоцитов к опухолевому очагу.
Оценим относительное и абсолютное количество регуляторных T-лимфоцитов в периферической крови больных, участвующих в исследовании лейкостимулирующего действия препарата Панаген по поводу рака молочной железы II-IV стадии
Как говорилось в начальных главах настоящего исследования, особое место в индукции устойчивости опухоли к противодействию иммунной системы занимают CD4+CD25+Fox3+ T-регуляторные лимфоциты. T-регуляторные клетки с указанным фенотипом играют центральную роль в контроле адаптивного иммунного ответа и периферической толерантности. Высокая концентрация этих клеток выявляется у больных раком молочной железы, колоректальным раком, раком легкого, поджелудочной железы и является неблагоприятным прогнозом. T-регуляторные лимфоциты формируются из тех же клеток, что и T-хелперы, под влиянием избыточных концентраций TGF-β, ИЛ-10 и VEGF. Основной механизм супрессивного действия CD4+CD25+Fox3+ клеток связан с секрецией супрессорных цитокинов TGF-β, ИЛ-10, которые угнетают образование ИЛ-2 эффекторными клетками. Также T-регуляторные лимфоциты могут вызывать элиминацию T-лимфоцитов через связывание CD95. Одновременно T-регуляторные лимфоциты секретируют цитокины, индуцирующие толерантность ДК, при этом ДК не экспрессируют костимулирующих молекул и не в состоянии стимулировать наивные T-лимфоциты. Более того, супрессоры могут индуцировать секрецию ингибирующих цитокинов самими активированнми ДК [53-57]. Таким образом, резкое изменение количества супрессоров CD4+CD25+Fox3+ может свидетельствовать об существенных изменениях в отношениях опухоли и иммунной системы в смысле ее противораковой активности. Ниже приводится анализ количества T-регуляторных лимфоцитов с фенотипом CD4+CD25+Fox3+ в периферической крови пациентов, находящихся в исследовании препарата Панаген (фиг.40, таблицы 37, 38).
|
|
Как следует из проведенной оценки, наблюдается следующая картина распределения количества T-регуляторных лимфоцитов у пациентов, находящихся в исследовании. Пациенты разделились на две группы. У большей группы количество T-регуляторных лимфоцитов в первой и второй контрольных точках сохраняется на исходном уровне, аналогично с группой «Плацебо». Этот является хорошим прогнозом. У 4 пациентов, что составляет 30% от выборки, количество T-регуляторных лимфоцитов в первой контрольной точке 21 сутки после 1 XT упало в 5-100 раз. Ко времени анализа во второй контрольной точке 21 сутки после 3 XT количество супрессоров восстановилось до исходного начального уровня. Ни в одной группе не произошло значимого увеличения Т-регуляторных лимфоцитов. Можно полагать, что это в первую очередь обусловлено использованием в схеме лечения ЦФ, который, как многократно показано, избирательно ингибирует развитие T-регуляторных лимфоцитов и разрушает супрессорную функцию этих клеток [58-63]. Тем не менее, результат действия препарата Панаген предполагает, что у части пациентов можно многократно уменьшить количество супрессоров и тем самым сделать опухоль доступной для атаки активированным цитотоксическими Т-клетками.
Рассмотрим обобщенное заключение по результатам проведенного исследования влияния примененной стратегии на основные показатели развития противоракового адаптивного иммунитета у больных раком молочной железы, получавших препарат Панаген и плацебо в ходе проведения курсов XT.
Проведенные исследования показали что:
1. Всегда существуют две группы пациентов, одни из которых отвечают на действие препарата Панаген, а другие - нет. Соотношение числа пациентов «отвечающих» и «не отвечающих» в суммарной оценке всех анализируемых параметров составило в среднем 50 на 50%.
2. Анализ изменения популяции миелоидных ДК (CD11+CD123-) в периферической крови не выявил закономерностей, которые позволили бы оценить возможность активации адаптивного иммунитета через эту популяцию антигенпрезентирующих клеток.
3. Полученные данные предполагают, что в ходе терапии происходит увеличение популяции циркулирующих плазмацитоидных ДК (фиг.36). При этом всплеск появления ДК связан с состоянием индивидуального больного. С индивидуальными особенностями связаны эффект различия в количестве плазмацитоидных ДК к 1 XT у одних пациентов и к 3 XT у других. 63% больных, получавших Панаген, демонстрируют ответ на действие препарата по совокупности показателей контрольных точек 21 сутки после 1 и 3 XT. Y 30% больных, принимавших Панаген, наблюдается значительное увеличение количества плазмацитоидных клеток к 3 XT.
4. При анализе содержания супрессоров у большей группы количество T-регуляторных лимфоцитов в первой и второй контрольных точках сохраняется на исходном уровне аналогично с группой «Плацебо». У 4 пациентов, что составляет 30% от выборки, количество T-регуляторных лимфоцитов в первой контрольной точке 21 сутки после 1 XT падает в 5-100 раз. Ко времени анализа во второй контрольной точке 21 сутки после 3 XT количество супрессоров восстанавливается до исходного начального уровня. Ни в одной группе не произошло значимого увеличения количества T-регуляторных лимфоцитов, что является хорошим прогнозом.
5. У 10 из 12 (83%) пациентов, принимавших Панаген, количество T-цитотоксических лимфоцитов CD8+ перфорин+ в первой контрольной точке 21 день после 1 XT достоверно больше, чем в группе «Плацебо» (pu<0,05) (фиг.39). Если рассматривать анализируемый признак по совокупности обеих контрольных точек, то у всех пациентов, принимавших Панаген, в периферической крови содержание T-цитотоксических лимфоцитов значительно превышает исходную норму.
Проведенные исследования свидетельствуют, что у пациентов, принимавших препарат Панаген, в ходе трех непрерывных XT произошла индукция адаптивного иммунитета, что является положительным прогностическим критерием для указанной группы больных. Полученные данные могут являться доказательством противоракового действия препарата Панаген при его использовании в сочетании с цитостатиками циклофосфан и доксорубицин в клиническом применении при лечении рака молочной железы II-IV стадии.
Список использованных источников
1. http://www.netoncology.rn
2. Smith IE, Walsh G, Jones A, Prendiville J, Johnston S, Gusterson B, Ramage F, Robertshaw H, Sacks N, Ebbs S, et al. High complete remission rates with primary neoadjuvant infusional chemotherapy for large early breast cancer. J Clin Oncol. 1995 Feb; 13(2):424-9.
3. Fomasiero et al. 5th Int. Congress on anti-cancer chemotherapy, 1995, Paris.
4. Bemardo et al. Proc. ASCO, 14, 1995.
5. Honkoop АН, Luykx-de Bakker SA, Hoekman K, Meyer S, Meyer OW, van Groeningen CJ, van Diest PJ, Boven E, van der Wall E, Giaccone G, Wagstaff J, Pinedo HM. Prolonged neoadjuvant chemotherapy with GM-CSF in locally advanced breast cancer. Oncologist. 1999; 4(2):106-11.
6. Damt-Jouve A, Coudert B, Jolimoy G, Belichard C, Amoud L, Guerrin J. Neoadjuvant chemotherapy FEC-HD in locally advanced breast cancer. Bull Cancer. 1999 Feb; 86(2):189-94.
7. Bonadonna G, Valagussa P, Molitemi A, Zambetti M, Brambilla C. Adjuvant cyclophosphamide, methotrexate, and fluorouracil in node-positive breast cancer: the results of 20 years of follow-up. N Engi J Med. 1995 Apr 6; 332(14):901-6.
8. http://www.medport.info
9. http://www.pharmaclon.ru/biblio/ros_bioter
10. http://www.ingentaconnect.com
11. Ishikawa H, Barber GN. The STING pathway and regulation of innate immune signaling in response to DNA pathogens. Cell Mol Life Sci. 2011 Apr; 68(7):1157-65.
12. Barber GN. Innate immune DNA sensing pathways: STING, AIMII and the regulation of interferon production and inflammatory responses. Curr Opin Immunol. 2011 Feb; 23(1):10-20.
13. Kawai T, Akira S. Toll-like receptors and their crosstalk with other innate receptors in infection and immunity. Immunity. 2011 May 27; 34(5):637-50.
14. Randall RE, Goodboum S. Interferons and vimses: an interplay between induction, signalling, antiviral responses and virus countermeasures. J Gen Virol. 2008 Jan; 89(Pt 1):1-47.
15. Kis-Toth K, Szanto A, Thai TH, Tsokos GC. Cytosolic DNA-activated human dendritic cells are potent activators of the adaptive immune response. J Immunol. 2011 Aug 1; 187(3):1222-34.
16. Tang HL, Cyster JG. Chemokine Up-regulation and activated Т cell attraction by maturing dendritic cells. Science. 1999 Apr 30; 284(5415):819-22.
17. Машковский М.Д. Лекарственные средства: Пособие для врачей: в 2 т. - М.: Медицина, 1995. - 575 с.
18. ФС 42-3922-00.
19. RU 2078581, C1, A61K 38/16, 10.05.1997.
20. RU 2200008, C1, A61K 38/522, 10.03.2003.
21. RU 2155590, С2, A61K 38/711, оп. 10.09.2000.
22. RU 2136287, C1, A61K 38/70, 10.09.1999.
23. RU 2161040, C1, A61K 38/78, 27.12.2000.
24. RU 2137477, C1, A61K 38/70, 20.09.1999.
25. RU 2234323, C1, A61K 38/713, 20.08.2004.
26. RU 2313349, С2, А61К 38/711, 27.12.2007.
27. RU 2322264, C1, A61K 48/00, 20.04.2004.
28. Likhacheva AS, Nikolin VP, Popova NA, Dubatolova TD, Strunkin DN, Rogachev VA, Sebeleva ТЕ, Erofeev IS, Bogachev SS, Yakubov LA, Shurdov MA. Integration of human DNA fragments into the cell genomes of certain tissues from adult mice treated with cytostatic cyclophosphamide in combination with human DNA. Gene Ther Mol Biol. 2007; 11: 185-202.
29. Likhacheva AS, Nikolin VP, Popova NA, Rogachev VA, Prokhorovich MA, Sebeleva ТЕ, Bogachev SS, Shurdov MA. Exogenous DNA can be captured by stem cells and be involved in their rescue from death after lethal-dose γ-radiation. Gene Ther Mol Biol. 2007; 11:305-314.
30. RU 2429019, С2, A61K 48/00, 20.09.2011.
31. Гистология, цитология и эмбриология / Под ред. Ю.И.Афанасьева, С.Л.Кузнецова, Н.А.Юриной. - М.: Медицина, 2004. - 768 с.
32. Лихачева А.С., Рогачев В.А., Николин В.П., Попова Н.А., Шилов А.Г.,. Себелева Т.Е. Стрункин Д.Н,, Черных Е.Р., Гельфгат Е.Л., Богачев С.С., Шурдов М.А.. Участие экзогенной ДНК в молекулярных процессах, протекающих в соматической клетке. Информационный вестник ВОГиС. 2008. Т.12. №3. С. 426-473.
33. Долгова Е.В., Николин В.П., Попова Н.А., Прокопенко А.В., Проскурина А.С., Орищенко К.Е., Алямкина Е.А., Шилов А.Г., Ефремов Я.Р., Черных Е.Р., Останин А.А., Богачев С.С., Долженко Т.С., Малкова Е.М., Таранов О.С., Рогачев В.А., Загребельный С.Н., Шурдов М.А. Интернализация экзогенной ДНК во внутренние компартменты клеток костного мозга мышей. Вавиловский журнал генетики и селекции. 2011. В печати.
34. Alyamkina EA, Dolgova EV, Likhacheva AS, Rogachev VA, Sebeleva ТЕ, Nikolin VP, Popova NA, Kiseleva EV, Orishchenko KE, Sakhno LV, Gel'fgat EL, Ostanin AA, Chemykh ER, Zagrebelniy SN, Bogachev SS, Shurdov MA. Exogenous allogenic fragmented double-stranded DNA is internalized into human dendritic cells and enhances their allostimulatory activity. Cell Immunol. 2010; 262:120-126.
35. Alyamkina EA, Dolgova EV, Likhacheva AS, Rogachev VA, Sebeleva ТЕ, Nikolin VP, Popova NA, Orishchenko KE, Stmnkin DN, Chemykh ER, Zagrebelniy SN, Bogachev SS, Shurdov MA. Combined therapy with cyclophosphamide and DNA preparation inhibits the tumor growth in mice. Genet Vaccines Ther. 2009 Aug 14; 7(1): 12. http://www.gvt-joumal.com/content/7/1/12.
36. Alyamkina EA, Leplina OY, Sakhno LV, Chemykh ER, Ostanin AA, Efremov YR, Shilov AG, Proskurina AS, Orishchenko KE, Dolgova EV, Rogachev VA, Nikolm VP, Popova NA, Zagrebelniy SN, Bogachev SS, Shurdov MA. Effect of double-stranded DNA on maturation of dendritic cells in vitro. Cell Immunol. 2010; 266:46-51.
37. Alyamkina EA, Nikolin VP, Popova NA, Dolgova EV, Proskurina AS, Orishchenko KE, Efremov YR, Chemykh ER, Ostanin AA, Sidorov SV, Ponomarenko DM, Zagrebelniy SN, Bogachev SS, Shurdov MA. A strategy of tumor treatment in mice with doxorubicin-cyclophosphamide combination based on dendritic cell activation by human double-stranded DNA preparation. Genet Vaccines Ther. 2010 Nov 1; 8(1):7. http://www.gvt-joumal.com/content/8/1/7.
38. Орищенко К.Е., Вараксин Н.А., Вараксина Т., Долгова Е.В., Проскурина А.С., Алямкина Е.А., Черных Е.Р., Останин А.А., Богачев С.С., Долженко Т.С., Прокопенко А.В., Рогачев В.А., Загребельный С.Н., Шурдов М.А, Определению цитокинов в периферической крови здоровых доноров и пациентов, участвующих во второй фазе клинических испытаний препарата «Панаген» по поводу рака молочной железы II-IV стадий. 2011. В работе.
39. Mendez-Ferrer., Lucas D., Battista M.et al., Haematopoietic stem cell release is regulated by circadianjscillations. Nature 2008; 452:442-7.
40. Lemoli RM, Tafuri A, Fortuna A, Petrucci MT, Ricciardi MR, Catani L, Rondelli D, Fogli M, Leopardi G, Ariola C, Tura S. Cycling status of CD34+ cells mobilized into peripheral blood of healthy donors by recombinant human granulocyte colony-stimulating factor. Blood. 1997 Feb 15; 89(4):1189-96.
41. Uchida N, He D, Friera AM, Reitsma M, Sasaki D, Chen B, Tsukamoto A. The unexpected G0/G1 cell cycle status of mobilized hematopoietic stem cells from peripheral blood. Blood. 1997 Jan 15; 89(2):465-72.
42. Yamaguchi M, Ikebuchi K, Hirayama F, Sato N, Mogi Y, Ohkawara J, Yoshikawa Y, Sawada K, Koike T, Sekiguchi S. Different adhesive characteristics and VLA-4 expression of CD34(+) progenitors in G0/G1 versus S+G2/M phases of the cell cycle. Blood. 1998 Aug 1; 92(3):842-8.
43. Gyger M, Stuart RK, Perreault C. Immunobiology of allogeneic peripheral blood mononuclear cells mobilized with granulocyte-colony stimulating factor. Bone Marrow Transplant. 2000 Jul; 26(1):1-16.
44. Fmehauf S, Veldwijk MR, Kramer A, Haas R, Zeiler WJ. Delineation of cell cycle state and correlation to adhesion molecule expression of human CD34+ cells from steady-state bone marrow and peripheral blood mobilized following G-CSF-supported chemotherapy. Stem Cells. 1998; 16(4):271-9.
45. Паровичникова Е.Н., Гальцева И.В., Воробьев И.А., Савченко В.Г. Характеристика Т-клеточного звена иммунной системы у больных острыми лейкозами. Терапевтический архив. 2006. Т.78. №7. С.18-25.
46. Ueno H, Klechevsky E, Morita R, Aspord C, Cao T, Matsui T, Di Pucchio T, Connolly J, Fay JW, Pascual V, Palucka AK, Banchereau J. Dendritic cell subsets in health and disease. Immunol Rev. 2007 Oct; 219:118-42.
47. Shurin GV, Ferns RL, Tourkova IL, Perez L, Lokshin A, Balkir L, Collins B, Chatta GS, Shurin MR. Loss of new chemokine CXCL14 in tumor tissue is associated with low infiltration by dendritic cells (DC), while restoration of human CXCL14 expression in tumor cells causes attraction of DC both in vitro and in vivo. J Immunol. 2005 May 1; 174(9):5490-8.
48. Steinman RM. The dendritic cell system and its role in immunogenicity. Annu Rev Immunol. 1991; 9:271-96.
49. Nair S, McLaughlin C, Weizer A, Su Z, Boczkowski D, Dannull J, Vieweg J, Gilboa E. Injection of immature dendritic cells into adjuvant-treated skin obviates the need for ex vivo maturation. J Immunol. 2003 Dec 1; 171(11):6275-82.
50. Ibe S, Qin Z, Schuler T, Preiss S, Blankenstein T. Tumor rejection by disturbing tumor stroma cell interactions. J Exp Med. 2001 Dec 3; 194(11):1549-59.
51. Spiotto MT, Rowley DA, Schreiber H. Bystander elimination of antigen loss variants in established tumors. Nat Med. 2004 Mar; 10(3):294-8.
52. Salem ML, Diaz-Montero CM, Al-Khami AA, El-Naggar SA, Naga O, Montero AJ, Khafagy A, Cole DJ. Recovery from cyclophosphamide-induced lymphopenia results m expansion of immature dendritic cells which can mediate enhanced prime-boost vaccination antitumor responses in vivo when stimulated with the TLR3 agonist poly(I:C). J Immunol. 2009 Feb 15; 182(4):2030-40.
53. Fallarino F, Bianchi R, Orabona C, Vacca C, Belladonna ML, Fioretti MC, Serreze DV, Grohmann U, Puccetti P. CTLA-4-Ig activates forkhead transcription factors and protects dendritic cells from oxidative stress in nonobese diabetic mice. J Exp Med. 2004 Oct 18; 200(8):1051-62.
54. Lange C, Durr M, Doster H, Melms A, Bischof F. Dendritic cell-regulatory T-cell interactions control self-directed immunity. Immunol Cell Biol. 2007 Nov-Dec; 85(8):575-81.
55. Yamazaki S, Bonito AJ, Spisek R, Dhodapkar M, hiaba K, Steinman RM. Dendritic cells are specialized accessory cells along with TGF- for the differentiation of Foxp3+ CD4+ regulatory Т cells from peripheral Foxp3 precursors. Blood. 2007 Dec 15; 110(13):4293-302.
56. Гранов A.M., Молчанов О.Е. Канцерогенез и иммунобиология опухоли. Фундаментальные и клинические аспекты. Вопросы онкологии. 2008. Т.54. №4.С.401-409.
57. Askenasy N, Kaminitz A, Yarkoni S. Mechanisms of Т regulatory cell function. Autoimmun Rev. 2008 May; 7(5):370-5.
58. Ghiringhelli F, Larmonier N, Schmitt E, Parcellier A, Cathelin D, Garrido C, Chauffert B, Solary E, Bonnotte B, Martin F. CD4+CD25+ regulatory Т cells suppress tumor immunity but are sensitive to cyclophosphamide which allows immunotherapy of established tumors to be curative. Eur J Immunol. 2004 Feb; 34(2):336-44.
59. Ikezawa Y, Nakazawa M, Tamura C, Takahashi K, Minami M, Ikezawa Z. Cyclophosphamide decreases the number, percentage and the function of CD25+ CD4+ regulatory Т cells, which suppress induction of contact hypersensitivity. J Dermatol Sci. 2005 Aug; 39(2):105-12.
60. Lutsiak ME, Semnani RT, De Pascalis R, Kashmm SV, Schlom J, Sabzevan H. Inhibition of CD4(+)25+ Т regulatory cell function implicated m enhanced immune response by low-dose cyclophosphamide. Blood. 2005 Apr 1; 105(7):2862-8.
61. Motoyoshi Y, Kaminoda K, Saitoh O, Hamasaki K, Nakao K, Ishii N, Nagayama Y, Eguchi K. Different mechanisms for anti-tumor effects of low-and high-dose cyclophosphamide. Oncol Rep. 2006 Jul; 16(1):141-6.
62. Taieb J, Chaput N, Schartz N, Roux S, Novault S, Menard C, Ghiringhelli F, Terme M, Carpentier AF, Darrasse-Jeze G, Lemonnier F, Zitvogel L. Chemoimmunotherapy of tumors: cyclophosphamide synergizes with exosome based vaccines. J Immunol. 2006 Mar 1; 176(5):2722-9.
63. Bopp T, Radsak M, Schmitt E, Schild H. New strategies for the manipulation of adaptive immune responses. Cancer Immunol Immunother. 2010 Sep; 59(9):1443-8.
Способ лечения онкологических заболеваний, основанный на применении в схемах лечения рака молочной железы II-IV стадии препаратов цитостатической группы циклофосфана и доксорубицина и препарата на основе экзогенной ДНК человека Панаген, отличающийся тем, что после однократного в рамках одного цикла химиотерапии пациенту вводят цитостатики: циклофосфан (500 мг/м) и доксорубицин (50 мг/м) (схема AC) или циклофосфан (500 мг/м), доксорубицин (50 мг/м) и фторурацил (500 мг/м) (схема FAC) внутривенно, а также препарат Панаген в форме таблеток, покрытых гастроэнтерическим покрытием в дозе 30 мг/сутки при дробном равномерном приеме в течение активного периода суток, что составляет одна таблетка препарата Панаген шесть раз в день через каждые два часа с началом приема с третьего дня после проведенной химиотерапии и продолжением приема препарата в течение 17 дней, и продолжением приема препарата по указанной схеме до окончания всех курсов химиотерапии.