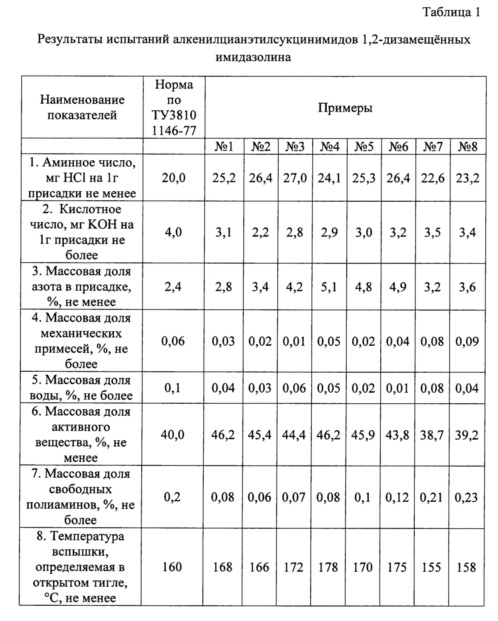
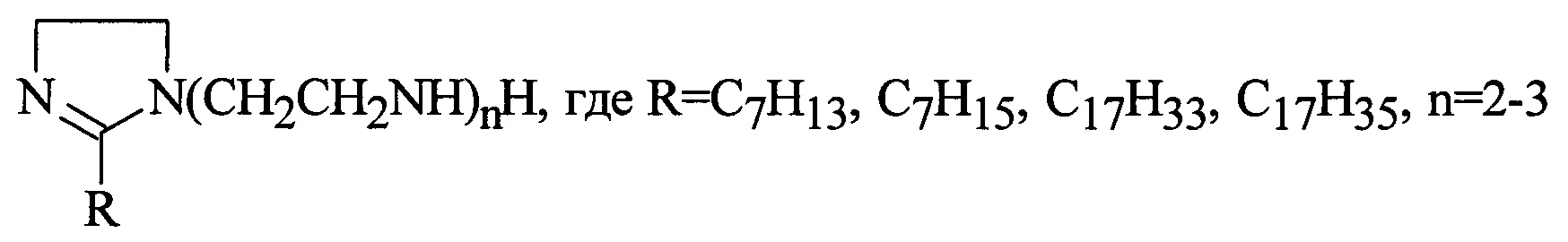Результат интеллектуальной деятельности: Способ получения алкенилсукцинцианэтилимидов 1,2-дизамещённых имидазолина
Вид РИД
Изобретение
Изобретение относится к области нефтехимического синтеза, в частности к способу получения алкенилсукцинцианэтилимидов 1,2-дизамещенных производных имидазолина, которые могут быть использованы в качестве антикоррозионных, моющих и диспергирующих присадок в составе смазочных масел для уменьшения образования углеродистых отложений на деталях двигателей внутреннего сгорания.
Известен способ получения полиизобутенил и этиленпропиленсукцинимидных присадок, состоящих из 70-99% смазочного масла и 0,1-30% совместно действующих присадок, обладающих противоокислительно-диспергирующим действием [US 6117825 Yraword Norris Roland, Ymamata Ray. Isamu. N071879401 (2000)].
Недостатком способа получения сукцинимидов является использование алкенилянтарного ангидрида (АЯА) с молекулярной массой 96-9600, а также применение сложных смесей и высокой температуры. Молекулярная масса АЯА без алкенового радикала (R) равна 100 (C4H4O3=100).
По данным ВНИИПК нефтехим сукцимидные присадки максимальными детергентно-диспергирующими свойствами удается получить только на основе олигобутена с молекулярной массой 900-1200 [Нефтепереработка и нефтехимия, 1979, №9].
Наиболее близким способом по технической сущности и достигаемому результату является способ получения алкенилсукцимидов конденсацией низкомолекулярных полимеров с малеиновым ангидридом (МА) в атмосфере азота при 200-205°С, в течение 8-10 ч с последующей отгонкой избытка малеинового ангидрида [Кулиев A.M. Химия и технология присадок к маслам и топливам. Ленинград «Химия», ленинградское отделение, 1985, с. 92-93]. Продукт реакции растворяют в толуоле и отфильтровывают или центрифугируют. Полученный АЯА обрабатывают аминами в растворе толуола при непрерывной отгонке выделившейся воды во время реакции. В качестве аминов используют аллиламин, этилендиамин, полиэтиленполиамины. В присадке ИХП-476 АН АзССР содержится 1,5-1,7% азота, ее кислотное число 10-14 мг KOH/г.
Недостатком известной присадки является применение в процессе синтеза ароматических углеводородов, в частности толуола, регенерация его, очистка и т.д. создают технологические затруднения, увеличивают себестоимость выпускаемой продукции, а также времени синтеза. Кроме того содержание азота всего лишь 1,5-1,7% и в то время как, содержание азота в сукцимидных присадках не менее 2,4% (см. норма по ТУ 38101146-77).
Задача, на решение которой направлено заявляемое изобретение, заключается в разработке способа получения алкенилцианэтилсукцинимидов 1,2-дизамещенных имидазолина, обладающих антикоррозионными свойствами, пригодных для использования в качестве эффективных сукцимидных присадок.
Технический результат при использовании изобретения выражается в получении алкенилцианэтилсукцинимидов 1,2-дизамещенных имидазолина, обладающих сильно выраженными антикоррозионными свойствами, и расширении ассортимента выпускаемых присадок.
Вышеназванный технический результат достигается способом получения алкенилцианэтилсукцинимидов 1,2-дизамещенных имидазолина путем взаимодействия МА с полиальфаолефином (ПАО) с молекулярной массой 1000-1200, или с полиизобутиленом (ПИБ) с молекулярной массой 950-1150 в присутствии инициатора сначала при температруре 85-90°С в течение 1,5-1,8 ч, затем при 180-185°С в течение 4-4,5 ч при мольном соотношении ПАО(ПИБ) : МА = 1:1-1,05 с последующей конденсацией полученного АЯА в масле с 1,2-дизамещенными имидазолинами при мольном соотношении АЯА : 1,2-дизамещенный имидазолин 1:1-1,05, сначала при температуре 80-85°С в течение 1 ч, затем при 155-160°С втечение 5-5,5 ч, затем производят отгон воды и примесей содержащихся в исходном сырье при температуре 130-135°С/10-15 мм.рт.ст.
Полученный алкенилсукцинимид 1,2-дизамещенного имидазолина (АСИИ) взаимодействует с нитрилом акриловой кислоты (НАК) при 80-90°С в мольном соотношении АСИИ : НАК = 1:1-2 в течение 2-3 ч.
В качестве 1,2-дизамещенных имидазолина используют продукт, полученный взаимодействием триэтилентетрамина (ТЭТА), тетраэтиленпентамина (ТЭПА) с 2-этилгексеновой (Эг. к.), 2-этилгексановой (Э. гексан. к.), олеиновой (Ол. к.) и стеариновой (Ст. к.) кислотами сначала при темепратуре 170-180°С в течение 4-5 ч, затем при 255-265°С в течение 1-1,5 ч. В качестве инициатора используют перекись дитретбутила (ДТБ) или перекись метилэтилкетона (МЭК) в количестве 0,8-1,05% от веса (ПАО+МА) или (ПИБ+МА), взятых в реакцию. В качестве масла используют индустриальные масла марки И-20А или И-40А (ГОСТ №20799-88 с изм. 1-5) или их смесь в соотношении 1:1. Выход целевых продуктов составляет 96-98%.
Функциональные группы в структуре присадок повышают эксплуатационные свойства масел, а цианэтильная группа повышает еще содержание азота в присадке.
Сущность изобретения поясняется следующими примерами.
Пример 1. В реактор с перемешивающим устройством, термометром, холодильником и капельной воронкой загружают 100,0 г (0,1 моль) полиальфаолефина (ПАО), 9,8 г (0,1 моль) малеинового ангидрида (МА) и 0,87 г (0,8% от веса ПАО+МА) перекиси дитретбутила (ДТБ), мольное соотношение ПАО : МА = 1:1. Реакционную смесь перемешивают в токе азота (подача азота умеренная) при температуре 85°С в течение 1 ч, затем при 180°С в течение 4,5 ч. Полученный алкенилянтарный ангидрид (АЯА) охлаждают до 70°С, разбавляют маслом И-20А в соотношение 1:1, фильтруют через суконный фильтр (можно использовать другие фильтрующие материалы) и переводят в промежуточную емкость. В реактор загружают 25,2 г (0,1 моль) 1,2-дизамещенных имидазолина,
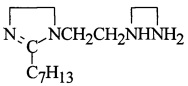
(C14H28N4=252)
полученного из ТЭТА и этилгексеновой кислоты (Эг. к.), 25,2 г масла марки Н-20А (весовое соотношение имидазолина и масла = 1:1), смесь нагревают до 80°С в течение 1 ч и при этой температуре дозируют АЯА и выдерживают при 155°С в течение 5 ч, затем производят отгон воды и легкокипящих примесей при 130°С/10-15 мм рт.ст. Полученный при этом алкенилсукцинимид 1,2-дизамещенных имидазолина (АСИИ) цианэтилируют и добавляют 5,35 г (0,1 моль) нитрила акриловой кислоты (НАК), смесь нагревают при 80-90°С в мольном соотношении АСИИ : НАК = 1:1,05 в течение 2 ч, получают алкенилмоноцианэтилсукцимид 1,2-дизамещенных имидазолина:
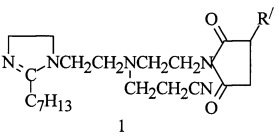
R/=C71H140
Получают 136,6 г (97,2%) соединения (1). Результаты его испытаний на соответствие ТУ и антикоррозионные свойства приведены в табл. 1 и 2.
Найдено, %: N 4.55. C92H178N5O2. Вычислено в %: N 5,07.
Пример 2. В условиях примера 1 в реактор загружают 120,0 г (0,1 моль) ПАО, 10,29 г, (0,105 моль) МА и 1,04 г (0,8%) от веса ПАО+МА и метилэтилкетона (МЭК), мольное соотношение ПАО : МА = 1:1,05. Реакционную смесь перемешивают при 90°С в течение 1,8 ч, затем при 185°С в течение 4,5 ч. Полученный АЯА охлаждают до 65°С, разбавляют маслом И-40А в весовом соотношении АЯА : масло = 1:1, фильтруют и переводят в емкость.
В реактор загружают 29,7 г (0,1 моль) 1,2-дизамещенных имидазолина, полученного из
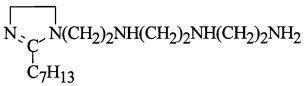
(C16H35N5=297)
ТЭПА и этилгексановой кислоты (э. гексан. к.), 29,7 г масла марки И-40А (весовое соотношение имидазолина и масла = 1:1), реакционную смесь нагревают при температуре 80°С в течение 1,5 ч, затем дозируют АЯА и выдерживают при 155°С в течение 5,5 ч и производят отгон воды при 130-135°С/10-15 мм рт.ст. Цианэтилирование полученного алкенилсукцинимида 1,2-дизамещенных имидазолина (АСИИ) нитрилом акриловой кислоты проходит при 85-90°С и мольном соотношении АСИИ : НАК = 1:1 в течение 2 ч с образованием алкенилмоноцианэтилсукцинимида 1,2-дизамещенных имидазолина (2):
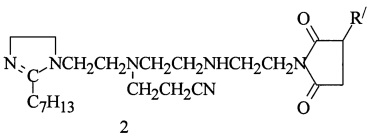
R/=C86H170
Получают 160,60 г (97,6%) соединения (2). Найдено, %: N 4,71. C109H209N0O2. Вычислено, %: N 5,14. Результаты испытаний соедиения (2) на соответстие ТУ на сукцимидные присадки и защитные свойства приведены в табл. 1 и 2.
Пример 3. В условиях примера 2 цианэтилирование полученного алкенилсукцинимида 1,2-дизамещенных имидазолина 10,6 г (0,2 моль) НАК при 80-90°С в мольном соотношении АСИИ : НАК = 1:2 в течение 2-2,5 ч приводит к алкенилдицианэтилсукцинимиду 1,2-дизамещенных имидазолина (3):
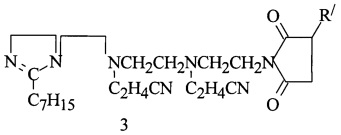
R/=C86H170
Получают 161,78 г (96,3%) продукта (3). Найдено, % N 5,35. C112H212N7O2. Вычислено, %: N 5,81. Результаты испытаний соедиений (2, 3) на соответстие ТУ 38101146-77 на сукцимидные присадки и на антикоррозионную активность приведены в табл. 1 и 2.
Пример 4. В Условиях примера 1 в реактор загружают 95,0 г (0,1 моль) полиизобутилена, 9,8 г (0,1 моль) МА и 1,04 г (1% от веса ПИБ и МА) перекиси МЭК. Мольное соотношение ПИБ : МА = 1:1. Смесь перемешивают при 85°С в течение 1,2 ч, затем при 185°С в течение 4 ч. Полученный АЯА охлаждают до 65°С, разбавляют маслом И-20А в весовом соотношение АЯА : масло = 1:1, фильтруют и переводят в отдельную емкость.
В реактор загружают 39,2 г (0,1 моль) имидазолина, полученного из ТЭТА и олеиновой кислоты (Ол. к.), 39,2 г масла марки И-20А, весовое соотношение имидазолина и масла = 1:1, реакционную смесь нагревают при температуре 80°С в течение 1 ч, затем дозируют АЯА (мольное соотношение АЯА и имидазолина = 1:1) и выдерживают при 155°С в течение 5 ч и производят отгон воды при 130-135°С/ 10-15 мм рт.ст. Цианэтилирование полученного алкенилсукцинимида 1,2-замещенных имидазолина НАК проходит при 85°С и мольном соотношении АСИИ : НАК = 1:1 в течение 2 ч с образованием алкенилцианэтилсукцинимида 1,2-дизамещенных имидазолина (4):
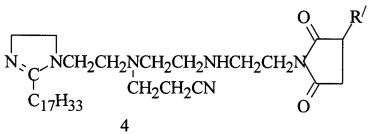
R/=C68H134
Получают 144,2 г (98,1%) продукта (4). Результаты испытаний на соответствие ТУ на сукцимидные присадки и защитные свойства приведены в табл. 1 и 2. Найдено, %: N 3,45. C96H183N4O2. Вычислено, %: N 3,93.
Пример 5. В условиях примера 1 в реактор загружают 115,0 г (0,1 моль) ПИБ, 9,8 г (0,1 моль) МА, 1,35 г (1,05% от веса ПИБ и МА) перекиси ДТБ, мольное соотношение ПИБ : МА = 1:1. Реакционную смесь перемешивают при температуре 90°С в течение 1,8 ч, затем при 185°С в течение 4,5 ч. Полученный АЯА охлаждают до 75°С, разбавляют маслом (И-40А+И-20А=50:50) в весовом соотношении АЯА : масло = 1:1, смесь фильтруют и переводят в отдельную емкость.
В реактор загружают 43,7 г (0,1 моль) имидазолина,
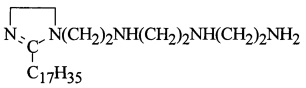
(C26H55N5=437)
полученного из ТЭПА и стеариновой кислоты, 43,7 г масла марки (И-40А+И-20А=1:1), весовое соотношение имидазолина и масла = 1:1, смесь нагревают до 80-85°С в течение 1 ч и при этой температуре дозируют АЯА, выдерживают при 160°С в течение 5,5 ч, затем производят отгон воды и примесей при 130-135°С/10-15 мм рт.ст. Взаимодействие полученного АСИИ 10,6 г (0,2 моль) НАК при 90°С и мольном соотношении АСИИ : НАК = 1:2 в течение 3 ч дает алкенилдицианэтилсукцинимид 1,2-замещенных имидазолина (5):
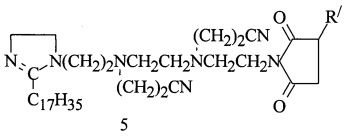
R/=C82H162
Получают 163,2 г (98,3%) продукта (5), результаты его испытаний на соответствие ТУ и защитные свойства приведены в табл. 1 и 2. Найдено, %: N 5,99. C118H224N7O2. Вычислено, %: N 5,53.
Пример 6. В условиях примера 1 в реактор загружают 100 г (0,1 моль) ПИБ, 9,8 г (0,1 моль) МА и 1,09 г (0,9% от веса ПИБ И МА) перекиси ДТБ, мольное соотношение ПИБ : МА=1:1. Реакционную смесь перемешивают при температуре 90°С в течение 1,5 ч, затем при 180-185°С в течение 4,5 ч. Полученный янтарный ангидрид охлаждают до 65°С, разбавляют маслом И-40А в соотношении 1:1, фильтруют и переводят в емкость.
В реактор загружают 29,5 г (0,1 моль) имидазолина,
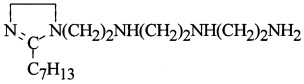
(C16H33N5=295)
полученного из ТЭПА и Э.г.к., 29,5 г масла И-40А, реакционную смесь нагревают до 80-85°С в течение 1 ч и при этой температуре дозируют полученный АЯА и выдерживают при 155-160°С в течение 5 ч, затем производят отгон воды и легкокипящих примесей при 130-135°С/10-16 мм.рт.ст. Реакционную смесь охлаждают до 65-70°С и при этой температуре добавляют 10,6 г (0,2 моль) НАК, мольное соотношение АСИИ : НАК=1:1 смесь перемешивают при 85-90°С в течение 3 ч:
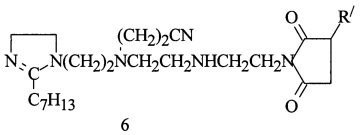
R/=C71H140
Получают 140,0 г (98,6%) алкенилмоноцианэтилсукцинимида 1,2-дизамещенных имидазолина (6). Найдено, %: N 6,50. C91H177N6O2. Вычислено, %: N 6,06. Результаты испытаний на соответствие ТУ и защитные свойства приведены в табл. 1 и 2.
Пример 7. В условиях примера 1 в реактор загружают 100,0 г (0,1 моль) ПАО, 11,76 г (0,12 моль) МА и 1,11 г (1%) перекиси ДТБ. Мольное соотношение ПАО : МА = 1:1,2. Реакционную смесь перемешивают в токе азота при 105°С в течение 2 ч, затем при 200°С в течение 5 ч. Полученный АЯА охлаждают до 70°С, разбавляют маслом И-20А в соотношении 1:1, фильтруют и переводят в отдельную емкость. В реактор загружают 25,2 г (0,1 моль) 1,2-дизамещенных имидазолина, полученного из ТЭТА и Эг. к., 25,2 г, масла И-20А, весовое соотношение имидазолина и масла 1:1, смесь нагревают до 100°С в течение 2 ч и при этой температуре добавляют АЯА и выдерживают при 165-170°С в течение 5 ч, затем производят отгон воды и примесей при 145°С/20-25 мм рт.ст. Полученный АСИИ цианэтилируют 5,3 г (0,1 моль) НАК при 70-75°С и мольном соотношении АСИИ : НАК = 1:1 в течение 1,5 ч. Получают 115,5 г (82,5%) соединения (7). Найдено, %: N 4,50. C92H178N5O2. Вычислено, %: N 5,07.
Пример 8. В условиях примера 5 в реактор загружают 115,0 г (0,1 моль) ПИБ, 9,8 г (0,1 моль) МА, 1,35 г (1,05% от веса ПИБ и МА) перекиси ДТБ. Мольное соотношение ПИБ : МА = 1:1. Смесь нагревают при 70-75°С в течение 1 ч, затем при 160-165°С в течение 7 ч. АЯА охлаждают до 65°С, разбавляют маслом (И-20А+И-40А) в соотношении 1:1, фильтруют и переводят в емкость. В реактор загружают 43,7 г (0,1 моль) имидазолина, полученного из ТЭПА и стеариновой кислоты, 43,7 г масла марки (И-20А+И-40А), весовое соотношение имидазолина и масла = 1:1, смесь нагревают до 70°С в течение 3 ч и при этой температуре дозируют АЯА, выдерживают при 180-200°С в течение 3,5-4 ч, затем производят отгон воды и примесей при 140-145°С/ 20-25 мм рт.ст. Реакция полученного АСИИ и НАК при 60-70°С и мольном соотношении 1:2 дает алкенилдицианэтилсукцинимид 1,2-дизамещенных имидазолина (8). Получают 128,0 г (76,8%) продукта (8). Найдено, %: N 5,97. C118H224N7O2. Вычислено, %: N 5,53. Результаты испытаний на соответствие ТУ на присадки и защитные свойства приведены в табл. 1 и 2.
Примеры 1-6 при условии выдерживания заявленных параметров процесса получения алкенилцианэтилимидов 1,2-дизамещенных имидазолина подтверждают высокий выход - 96,3-98,6% и соответствие результатов испытаний. ТУ-38101146-77 на сукцинимидные присадки.
Примеры 7-8 при условии отклонения от заявленных параметров процесса получения алкенилцианэтилсукцинимидов имидазолина демонстрируют снижение выхода и защитного эффекта продукта. Продукты 7-8 не соответствуют по показателям «массовая доля механических примесей», «массовая доля свободных полиаминов», «температуры вспышки» (табл. 1).
ИК спектры полученных алкенилцианэтилсукцинимидов имеют полосы поглощения при 1720 см-1, 1785 см-1, 1636 см-1 и 2230 см-1, характерные для СО и C=N групп в пятичленных имидах и имидазолиновом цикле и нитрильной (CN) группы соответственно.