Результат интеллектуальной деятельности: ТАРТРАТНАЯ СОЛЬ [(S)-2-[МЕТИЛ-3-(2-ОКСО-ПИРРОЛИДИН-1-ИЛ)-БЕНЗОЛСУЛЬФОНИЛАМИНО]-3-(4-МЕТИЛ-ПИПЕРАЗИН-1-ИЛ)-3-ОКСО-ПРОПИЛ]АМИДА 5-ХЛОР-ТИОФЕН-2-КАРБОНОВОЙ КИСЛОТЫ
Вид РИД
Изобретение
Настоящее изобретение относится к новой соли [(S)-2-[метил-3-(2-оксо-пирролидин-1-ил)-бензолсульфониламино]-3-(4-метил-пиперазин-1-ил)-3-оксо-пропил]амида 5-хлор-тиофен-2-карбоновой кислоты, к ее кристаллической форме, к ее получению и к ее терапевтическому применению.
[(S)-2-[Метил-3-(2-оксо-пирролидин-1-ил)-бензолсульфониламино]-3-(4-метил-пиперазин-1-ил)-3-оксо-пропил]амид 5-хлор-тиофен-2-карбоновой кислоты соответствует соединению формулы (I) ниже:
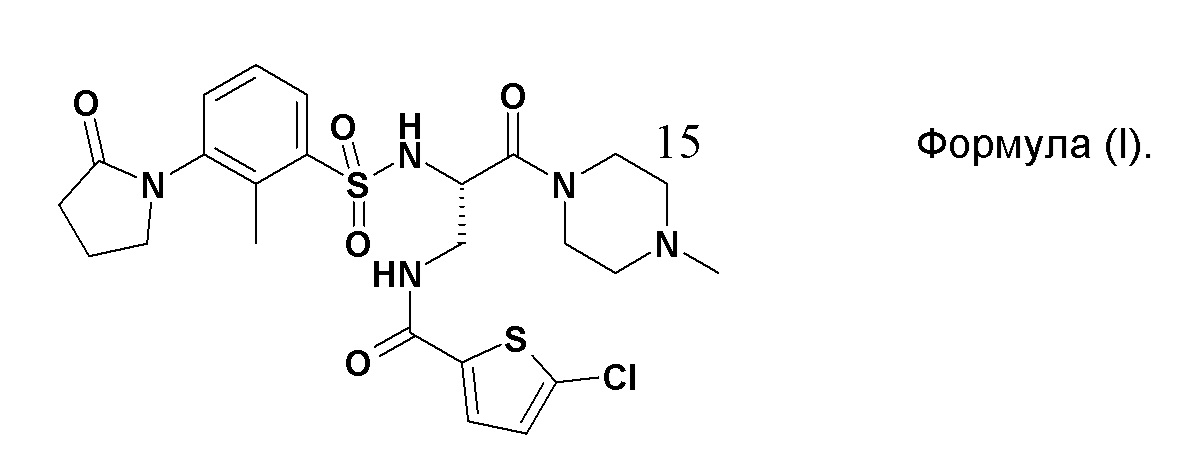
Соединение формулы (I) в форме его гидрохлорида и способ его получения описаны в документе WO 2009/103440.
Соединение наряду с другими хлортиофен-амидами описано как ингибитор факторов свертывания крови Xa и тромбина.
Однако свободное основание соединения формулы (I), а также его хлористоводородная соль, которую получают в соответствии с WO 2009/103440, оба являются аморфными и, следовательно, они тяжело поддаются обработке в промышленных масштабах.
Таким образом, существует потребность в легко поддающемся обработке ингибиторе факторов свертывания крови Xa и тромбина.
Недавно было обнаружено, что соль L-2,3-дигидроксибутандиовой кислоты (также известной как L-винная кислота) этого же соединения обладает полезными свойствами, которые делают ее особенно приемлемой для применения в качестве активного компонента в лекарственном препарате.
Таким образом, объектом настоящего изобретения является соль L-винной кислоты (или L-тартратная соль) [(S)-2-[метил-3-(2-оксо-пирролидин-1-ил)-бензолсульфониламино]-3-(4-метил-пиперазин-1-ил)-3-оксо-пропил]амида 5-хлор-тиофен-2-карбоновой кислоты, ее получение и ее терапевтическое применение.
Другим объектом настоящего изобретения является кристаллическая форма соли L-винной кислоты [(S)-2-[метил-3-(2-оксо-пирролидин-1-ил)-бензолсульфониламино]-3-(4-метил-пиперазин-1-ил)-3-оксо-пропил]амида 5-хлор-тиофен-2-карбоновой кислоты, физико-химические характеристики которой описаны ниже.
Характеристика кристаллической формы
Рентгеновская дифрактограмма
Порошковую рентгеновскую дифрактограмму записывали, начиная от порошковых образцов L-тартратной соли соединения формулы (I).
Анализ, который проводили с помощью дифрактометра D8 Advance (Bruker-Siemens), оснащенного камерой для температурных испытаний Anton-Paar TKK, демонстрирует устройство с режимом при отражении, обладающее фокусирующей геометрией типа Брэгга-Брентано (θ-θ).
Медная антикатодная трубка обеспечивает падающее излучение (λKα1=1,5406 и 1,5444 ангстрема).
Данные диаграмм при комнатной температуре находятся в пределах от 4 до 45 градусов в 2θ.
Характеристические линии дифрактограмм приведены в таблице ниже.
|
Дифрактограмма L-тартратной соли соединения формулы (I) представлена на фигуре 1.
L-Тартратная соль соединения формулы (I) является твердым кристаллическим веществом. Индексирование дифрактограммы показывает, что оно находится в чистой кристаллической фазе (группа симметрии кристаллической решетки P21; объем ячейки 1618  ).
).
Инфракрасный спектр
Инфракрасный (IR) спектр L-тартрата соединения формулы (I) регистрировали на спектрометре Nexus IRTF от 4000 до 400 см-1 с разрешающей способностью 4 см-1.
Спектр характеризовался полосами поглощения, приведенными в таблице ниже.
|
Термограмма
Дифференциальный термодинамический анализ, проведенный с соединением по настоящему изобретению, не выявил кого-либо термического явления до плавления при 203,9°C.
Другой целью настоящего изобретения является способ получения тартратной соли [(S)-2-[метил-3-(2-оксо-пирролидин-1-ил)-бензолсульфониламино]-3-(4-метил-пиперазин-1-ил)-3-оксо-пропил]амида 5-хлор-тиофен-2-карбоновой кислоты и ее кристаллической формы.
В соответствии с настоящим изобретением тартратную соль по настоящему изобретению можно получить при реакции солеобразования при помощи осуществления реакции между соединением формулы (I) в его свободной форме и винной кислотой в растворителе.
Соединение формулы (I) можно получать в соответствии со следующим способом.
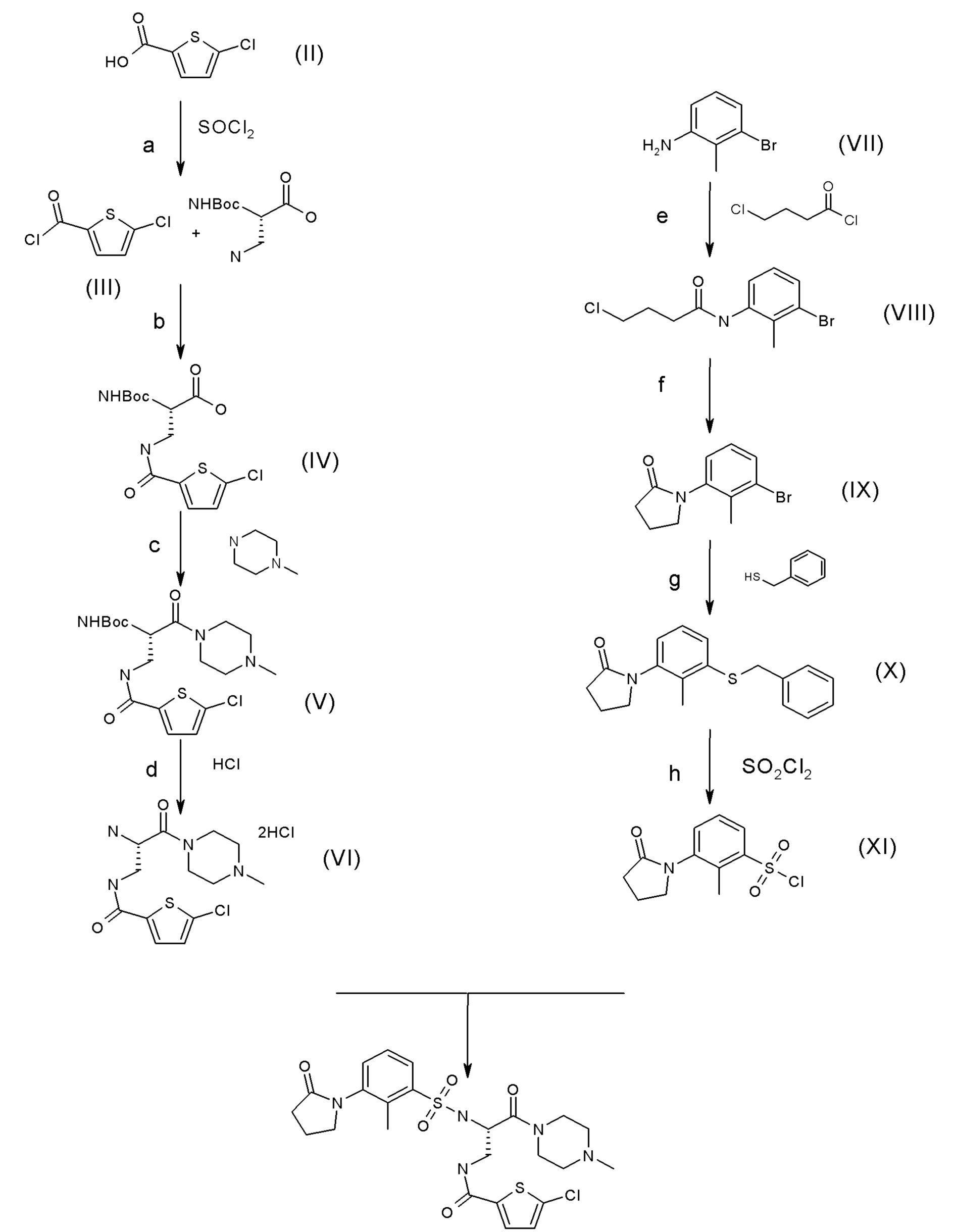
Альтернативно, соединение формулы (I) можно получать в соответствии с одним из способов, описанных в WO 2009/103440.
Следующий пример описывает получение тартратной соли соединения формулы (I) по настоящему изобретению в соответствии с общей схемой, описанной выше.
Использовали следующие сокращения и эмпирические формулы.
|
Стадия (a): 5-хлор-тиофен-2-карбонилхлорид (соединение III)
Из 100 г (1,1 экв.) 5-хлор-тиофен-2-карбоновой кислоты формулы (II), хлорангидрид кислоты формулы (III) получали путем реакции с 1,5 экв. тионилхлорида в 1,4 объема толуола при 80°C.
Стадия (b): 2-трет-бутоксикарбониламино-3-[(5-хлор-тиофен-2-карбонил)-амино]-пропионовая кислота (соединение IV)
Реакционную среду, содержащую хлорангидрид кислоты (соединение III), полученный на стадии (a), выливали в раствор при 5°C, содержащий 1 экв. Boc-DAP-OH в присутствии 3,3 экв. NaOH 30% в 3 объемах THF и 1,2 объема воды, для того, чтобы получить соединение формулы (IV), которое выделяли после выпаривания.
Стадия (c): трет-бутиловый эфир [1-{[(5-хлор-тиофен-2-карбонил)-амино]-метил}-2-(4-метил-пиперазин-1-ил)-2-оксо-этил]-карбаминовой кислоты (соединение V)
Соединение (V) получали связыванием 3 экв. соединения (IV), полученного на стадии (b), с метилпиперазином при помощи 1,5 экв. T3P в качестве связывающего средства в растворе в EtOAc в течение 18 часов.
Соединение (V) затем экстрагировали при помощи EtOAc, затем выделяли кристаллизацией в 1,5 - 2 объемах EtOAc.
Стадия (d): [2-амино-3-(4-метил-пиперазин-1-ил)-3-оксо-пропил]-амид 5-хлор-тиофен-2-карбоновой кислоты (соединение VI)
Соединение (VI) получали гидролизом функциональной Boc-группы соединения (V). Соединение (V) в 6,5 объема EtOH и 0,36 воды вливали в 3 экв. нагретого (70°C) водного раствора HCl 12 н. в течение 1 часа.
Стадия (e): N-(3-бром-2-метил-фенил)-4-хлор-бутирамид (соединение VIII)
Соединение (VIII) получали ацилированием 200 г 3-бром-метиланилина (соединение VII) при помощи 1 экв. 4-хлорбутирилхлорида в присутствии 1,2 экв. DIEA в 5 объемах THF при 20°C.
Спустя 2 часа полученную смесь вливали в 13 экв. води при 15°C, что приводило к осаждению соединения VIII.
Стадия (f): 1-(3-бром-2-метил-фенил)-пирролидин-2-он (соединение IX)
Соединение (IX) получали циклизацией 290 г соединения (VIII) в присутствии 1,2 экв. tBuOK в 10 объемах MeTHF при 10°C.
Стадия (g): 1-(3-бензилсульфанил-2-метил-фенил)-пирролидин-2-он (соединение X)
Соединение (X) получали из 20 г соединения (IX) в присутствии 1,2 экв. бензилмеркаптана, 0,06 экв. фосфина, 0,03 Pd(0) и 2 экв. DIEA в 8 объемах толуола в течение 4 часов при 100°C.
Стадия (h): 2-метил-3-(2-оксо-пирролидин-1-ил)-бензолсульфонилхлорид (соединение XI)
Соединение (XI) получали окислением соединения (IX) в присутствии 4 экв. сульфурилхлорида в 5,7 экв. уксусной кислоты и 0,3 объема воды.
Стадия (i): [(S)-2-[метил-3-(2-оксо-пирролидин-1-ил)-бензолсульфониламино]-3-(4-метил-пиперазин-1-ил)-3-оксо-пропил]амид 5-хлор-тиофен-2-карбоновой кислоты (соединение формулы (I))
Соединение формулы (I) получали связыванием соединения (VI) и соединения (XI).
Раствор соединения (XI) вливали в 208,85 г соединения (VI) в присутствии 8 экв. K2CO3 в 3 объемах воды и 2 объемах дихлорметана при 10°C, таким образом получали соединение формулы (I) в его свободной форме.
Полученное соединение формулы (I) является аморфным продуктом.
Солеобразование
Как только получали соединение формулы (I) в его свободной форме, его подвергали реакции кристаллизации для того, чтобы получить его L-тартратную соль.
Соединение формулы (I), полученное на стадии (i), подвергали реакции кристаллизации.
В колбе 0,5 г соединения формулы (I) в 4 мл воды, затем 0,132 г L(+)винной кислоты нагревали до полного растворения, затем выдерживали при перемешивании в течение 24 часов.
Образованное твердое вещество затем фильтровали и высушивали, получая после этого белый порошок соединения по настоящему изобретению.
L-Тартратная соль соединения формулы (I), полученная таким образом, имеет очень высокий показатель чистоты (98,9%).
ТЕСТЫ
Из упомянутого выше следует отметить, что соединение формулы (I), в форме его хлористоводородной соли, является аморфным, и что не одна из попыток кристаллизовать его не была успешной.
В связи с этим было показано, что тартратные соли соединения формулы (I) неожиданно имеют свойства чистоты, стабильности и растворимости, которые являются лучшими, чем у данного соединения в L-лактатных и L-натриевых формах (обе кристаллические соли).
Физические свойства
Физические свойства соединения формулы (I) в форме его натриевой, L-лактатной и L-тартратной солей кратко изложены в таблице ниже.
|
Эти результаты показывают, что L-тартратная соль проявляет лучшую гигроскопичность, поглощение воды и стабильность при действии стрессовых условий, чем натриевая и L-лактатная соли, что означает, что L-тартратная соль может легче обрабатываться и храниться.
Характеристики кристаллизации
Несколько характеристик кристаллизации соединения формулы (I) в форме его натриевой, L-лактатной и L-тартратной солей анализировали в двух различных растворителях: неполярном растворителе (этилацетате или EtOAc) и полярном протонном растворителе (изопропаноле или iPrOH).
Результаты описаны в таблице ниже.
|
Учитывая вышеприведенные результаты было установлено, что L-тартратная соль соединения формулы (I) имеет лучшие характеристики кристаллизации, чем L-лактатная и натриевая соли в обоих исследуемых растворителях.
В частности, кристаллизация L-тартратной соли является быстрой, с хорошим выходом и полученный продукт легко поддается фильтрации.
Таким образом, эти результаты показывают хорошую технологичность кристаллизации L-тартратной соли соединения формулы (I).
Тест на стабильность в твердом состоянии.
Натриевая, L-лактатная и L-тартратная соли соединения формулы (I) анализировали спустя одну неделю хранения при:
- 80°C;
- 80°C и при влажности насыщения.
Результаты описаны в таблице ниже.
|
Учитывая полученные выше результаты было установлено, что натриевая и L-лактатная соли соединения формулы (I) не является стабильными при действии тепла и влажности, так что они должны храниться защищенными от влажности.
В противоположность этому, L-тартратная соль остается неизменной. Эти результаты, таким образом, показывают большую стабильность L-тартратной соли соединения формулы (I) при исследуемых условиях.
Тест на растворимость
Растворимость натриевой, L-лактатной и L-тартратной солей соединения формулы (I) анализировали в разных буферах.
Результаты описаны в таблице ниже (растворимость исследуемого соединения выражали в мг/мл).
|
Учитывая полученные выше результаты было установлено, что все три тестируемые соли являются высоко растворимыми во всех исследуемых средах, и L-тартратная соль является наиболее растворимой из них.
Тест стабильности в растворе
Натриевая, L-лактатная и L-тартратная соли соединения формулы (I) анализировали спустя одну неделю хранения в сильном окислительном растворе: три соединения поддерживали в растворе H2О2 при 0,3%, при комнатной температуре.
Спустя либо 6 часов, либо одну неделю измеряли относительное содержание основных N-оксидных примесей соединения
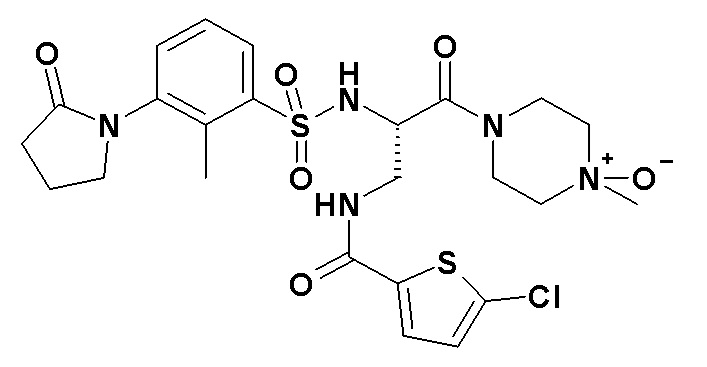
формулы (I).
Результаты описаны в таблице ниже.
|
Исходя из выше полученных результатов, было установлено, что L-тартратная соль является более стабильной в окислительном растворе, чем L-лактатная и натриевая соли соединения формулы (I).
Физико-химические свойства L-тартратной соли соединения формулы (I) дают возможность хранить ее при нормальных условиях, без чрезмерных ограничительных мер предосторожности в отношении присутствия света, температуры и влажности, и, следовательно, они легко поддаются обработке.
Тартратная соль [(S)-2-[метил-3-(2-оксо-пирролидин-1-ил)-бензолсульфониламино]-3-(4-метил-пиперазин-1-ил)-3-оксо-пропил]амида 5-хлор-тиофен-2-карбоновой кислоты является ингибитором факторов свертывания крови Xa и тромбина.
Саму по себе ее можно применять для получения лекарственных препаратов, в частности, для лекарственных препаратов, которые являются ингибиторами факторов свертывания крови Xa и тромбина.
Соответственно, в других его аспектах настоящее изобретение предусматривает лекарственные препараты, которые содержат L-тартратную соль [(S)-2-[метил-3-(2-оксо-пирролидин-1-ил)-бензолсульфониламино]-3-(4-метил-пиперазин-1-ил)-3-оксо-пропил]амида 5-хлор-тиофен-2-карбоновой кислоты.
Эти лекарственные препараты используют для терапии, особенно для лечения и предупреждения сердечно-сосудистых нарушений, тромбоэмболических заболеваний или рестеноза.
Эти лекарственные препараты также используют для терапии для ингибирования фактора Xa и тромбина, или для влияния на свертываемость крови или фибринолиз, или для терапии или профилактики заболеваний, упомянутых выше или ниже, например, для применения в терапии и профилактике сердечно-сосудистых нарушений, тромбоэмболических заболеваний или рестеноза, и в способах лечения, направленных на такие цели, в том числе в способах упомянутых терапии и профилактики.
Эти лекарственные препараты также используют в лечении болезненных состояний, таких как атипичное тромбообразование, острый инфаркт миокарда, нестабильная стенокардия, тромбоэмболия, острая закупорка сосудов, ассоциированная с тромболитической терапией, или чрескожная транслюминальная коронарная ангиопластика (PTCA), транзиторная ишемическая атака, инсульт, перемежающаяся хромота или шунтирование коронарных или периферических артерий, сужение просвета сосудов, рестеноз после коронарной или венозной ангиопластики, поддержание способности к сосудистой проходимости у пациентов на долгосрочном гемодиализе, патологическое тромбообразование происходящее в венах нижних конечностей после абдоминальной операции и операции на колене или бедре, патологическое тромбообразование, происходящее в венах нижних конечностей после абдоминальной операции и операции на колене или бедре, риск легочной тромбоэмболии или диссеминированная системная внутрисосудистая коагулопатия, происходящая в сосудистой системе во время септического шока, некоторые вирусные инфекции или рак.
Соединения по настоящему изобретению можно также применяет для снижения воспалительной реакции. Примерами специфических расстройств, для лечения и профилактики которых можно применять соединения по настоящему изобретению, являются заболевание сердечно-сосудистой системы, инфаркт миокарда, стенокардия, сосудистый рестеноз, например, рестеноз после ангиопластики, например, PTCA, синдром расстройства дыхания у взрослых, мультиорганная недостаточность и расстройство диссеминированного внутрисосудистого свертывания крови. Примерами родственных осложнений, ассоциированных с операцией, является тромбоз, такой как тромбоз глубоких вен и проксимальных вен, который может происходить после операции.
Согласно другим его аспектам настоящее изобретение относится к фармацевтическим композициям содержащим активный компонент, L-тартратную соль [(S)-2-[метил-3-(2-оксо-пирролидин-1-ил)-бензолсульфониламино]-3-(4-метил-пиперазин-1-ил)-3-оксо-пропил]амида 5-хлор-тиофен-2-карбоновой кислоты в соответствии с настоящим изобретением. Эти фармацевтические композиции содержат эффективную дозу соединения в соответствии с настоящим изобретением и также по меньшей мере один фармацевтически приемлемый наполнитель.
Указанные наполнители выбирают в соответствии с фармацевтической формой и желаемым способом введения из обычных наполнителей, известных специалистам в данной области.
![ТАРТРАТНАЯ СОЛЬ [(S)-2-[МЕТИЛ-3-(2-ОКСО-ПИРРОЛИДИН-1-ИЛ)-БЕНЗОЛСУЛЬФОНИЛАМИНО]-3-(4-МЕТИЛ-ПИПЕРАЗИН-1-ИЛ)-3-ОКСО-ПРОПИЛ]АМИДА 5-ХЛОР-ТИОФЕН-2-КАРБОНОВОЙ КИСЛОТЫ](https://fips.edrid.ru/images/rid/2c/e7/00/a213c8f593b7328dcdccf6bdde99db9d.jpg)

