Результат интеллектуальной деятельности: Способ предупреждения почечного повреждения у больных первично выявленной секретирующей множественной миеломой
Вид РИД
Изобретение
Изобретение относится к медицине, а именно к онкологии, и может быть использовано в онкогематологии при лечении больных множественной миеломой.
Множественная миелома (ММ) составляет 10-13% среди гематологических опухолей, при этом летальность достигает 2% среди всех злокачественных заболеваний (см. Бессмельцев С.С., Абдулкадыров К.М., Множественная миелома. Современный взгляд на проблему. Алматы, 2007. 480 с.). Применение высокодозной химиотерапии с последующей трансплантацией гемопоэтических стволовых клеток значительно увеличивает шансы на выздоровление этих больных, особенно на ранних этапах заболевания. Однако следует отметить, что успех лечения ММ зависит не только от выбора оптимального метода противоопухолевой терапии, но и от эффективности борьбы с многочисленными осложнениями, сопровождающими развитие заболевания (см. Бессмельцев С.С., Абдукадыров К.М., Множественная миелома. СПб.: «Издательство «Диалект». 2004. С. 143-186; Kumar S.K., Rajkumar S.V., Dispenzieri A. et al. Improved survival in multiple myeloma and the impact of novel therapies. Blood 2008; 111(5): 2516-20).
Поражение почек - наиболее частое висцеральное осложнение, сопровождающее течение ММ. Почечная недостаточность развивается у 20-50% больных уже к моменту установления диагноза и среди причин смерти занимает 2-е место после инфекций (см. Karin М., Cao Y., Greten F.R., Li Z.W. NF-kappa В in cancer: from innocent bystander to major culprit. Nat. Rev. Cancer 2002; 2: 301-10). Нарушение функции почек усложняет терапию и сокращает продолжительность жизни. В связи с этим целью лечения больных ММ и почечной недостаточностью является достижение как гематологического, так и почечного ответа (см. Рыжко В.В., Бирюкова Л.С., Чавынчак Р.Б., Клодзинский А.А. Почечная недостаточность при множественной миеломе. Обзор литературы и собственные данные. Клиническая онкогематология 2009; 2; 4: 316).
Главной причиной почечной недостаточности при ММ является миеломная тубулярная нефропатия, развивающаяся чаще всего в результате поражения канальцев свободными легкими цепями (СЛЦ) иммуноглобулинов (см. Белков С.А. Прогностическое значение содержания креатинина в периферической крови у больных множественной миеломой. Нефрология и диализ 2005; 7; 2: 169; см. Ткаченко Н.Я. Острая почечная недостаточность как проявление миеломной почки в сочетании с болезнью депонирования моноклональных иммуноглобулинов. Нефрология и диализ 2005; 7; 1: 64-69; Nath К.A. Tubulointerstitial changes as a major determinant in the progression of renal damage. Amer J Kidney Dis 1992; 20: 1-17).
Поражение почек при парапротеинемиях довольно разнообразно и включает следующие варианты: миеломная тубулярная нефропатия («миеломная почка»), AL-амилоидоз почек, болезнь отложения легких/тяжелых цепей с поражением почек, нефропатия при криоглобулинемии I и II типов, синдром Фанкони взрослых, плазмоклеточная инфильтрация почек и некоторые другие. При ММ патологические изменения могут затрагивать практически все отделы нефрона. Важное значение в развитии почечной недостаточности при ММ имеет гиперпродукция легких цепей иммуноглобулинов с их накоплением в дистальных канальцах, последовательное прогрессирование парапротеинемии и альбуминурии, дистрофия эпителия почечных канальцев, развитие склероза и рубцовой деформации микроанатомических структур почек (см. Бессмельцев С.С., Абдулкадыров К.М. Множественная миелома. Современный взгляд на проблему. Алматы, 2007; Faiman В.М., Spong J., Tariman J.D. Renal Complications in Multiple Myeloma and Related Disorders: Survivorship Care Plan of the International Myeloma Foundation Nurse Leadership Board. Clin J. Oncol. Nurs. 2011; 15(4); 66-76). Парапротеинемический нефроз (миеломная нефропатия) является наиболее серьезным и часто встречающимся проявлением парапротеинемии и является лидером среди причин летального исхода при почечной недостаточности. Тубулярная нефропатия у больных ММ выявляется в 60% случаев при аутопсии или биопсии почек (см. Montseny J.К., Meyrier A. Long-term outcome according to renal histological lesions in 118 patients with monoclonal gammopathies. Nephrol. Dial. Transplant. 1998; 13: 1438-45).
Реабсорбция легких цепей иммуноглобулинов приводит как к повреждению эпителия канальцев и нарушению их функции, так и к образованию цилиндров внутри канальцев с последующей их обструкцией. Избыток легких цепей у больных ММ способствует формированию амилоидных фибрилл и повышенному отложению их в различных органах (см. Huang Zh.-Q., Kirk К. Вепсе Jones proteins bind to a common peptide segment of Tamm-Horsfall glycoprotein to promote heterotypic aggregation. J. Clin. Invest. 1993; 93: 2975-83.). Дополнительным вкладом в развитие почечной недостаточности при ММ также являются гиперкальциемия; гиперурикемия; отложение депозитов амилоида; повышенная вязкость крови; специфическая инфильтрация почек миеломными клетками; применение в комплексном лечении фармакологических препаратов, обладающих нефротоксическими свойствами (нестероидные противовоспалительные препараты, контрастные вещества, цитостатики, бисфосфонаты) (см. Бессмельцев С.С. Бисфосфонаты и их роль в лечении множественной миеломы. Украiн. Журн. Гематол. Та трансфузiол. 2011; 1: 5-18).
Наряду с развитием хронической почечной недостаточности (ХГШ) у некоторых больных ММ могут отмечаться признаки острого некронефроза с развитием острого почечного повреждения (ОПП). ОПП в таких случаях возникает как самостоятельный острый процесс или как результат резкой декомпенсации уже имеющейся почечной дисфункции, сопутствующей ММ.
Современным стандартом лечения почечной дисфункции, обусловленной ММ, является проведение химиотерапии и гидратации. При развитии поздних стадий ОПП и ХПН в комплексе лечения применяют методы заместительной почечной терапии по общепринятым показаниям (см. Бессмельцев С.С., Стельмашенко Л.В., Карягина Е.В. и соавт., 2010. №4. С. 6-13).
Учитывая патофизиологические механизмы развития почечной недостаточности при ММ, в последние годы уделяют большое внимание применению экстракорпоральных методов, позволяющих активно элиминировать легкие цепи иммуноглобулинов у больных ММ и тяжелой почечной недостаточностью, требующей проведения заместительной почечной терапии. Среди экстракорпоральных методов эффективными в элиминации ЛЦ являются плазмообмен и гемодиализ с использованием высокопроницаемых фильтров. Преимущества ГД с высокопроницаемыми диализаторами в лечении острой диализзависимой ОПП И ХПН при ММ заключаются в возможности длительного применения и отсутствии потерь высокомолекулярных веществ (см. И.Г. Рехтина, С.А. Марьина, Л.М. Тангиева, Н.Н. Калинин, Л.С. Бирюкова. Эффективность экстракорпоральных методов в элиминации легких цепей у больных множественной миеломой на программном гемодиализе 2013; 58; 2: 29-32).
По некоторым данным использование конвекционных методов, в частности, гемодиафильтрации с высокопроницаемыми мембранами для элиминации ЛЦ способствует снижению концентрации ЛЦ как k-, так и 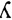 -типа в 2 раза. Однако эти исследования единичны, и эффективность ГДФ в элиминации ЛЦ и улучшении функции почек при ММ в настоящее время не доказана. Отсутствие убедительных данных об эффективности ГДФ в купировании ОПП при ММ, а также низкая частота обратимости диализзависимой ХПН способствовали дальнейшему поиску технологий, направленных на улучшение результатов лечения этой группы больных.
-типа в 2 раза. Однако эти исследования единичны, и эффективность ГДФ в элиминации ЛЦ и улучшении функции почек при ММ в настоящее время не доказана. Отсутствие убедительных данных об эффективности ГДФ в купировании ОПП при ММ, а также низкая частота обратимости диализзависимой ХПН способствовали дальнейшему поиску технологий, направленных на улучшение результатов лечения этой группы больных.
С 2007 года в клинической практике стали использовать диализаторы для низкопоточного ГД с мембраной, проницаемой для веществ с молекулярной массой до 40-60 кДа, в том числе ЛЦ. По данным литературы использование подобных фильтров позволяет снизить содержание ЛЦ в плазме на 53-90% в течение 3 нед. и прекратить проведение ГД у 50-75% больных. Предварительные данные мультицентрового рандомизированного исследования подтвердили высокую частоту обратимости ХПН при применении в комплексе противоопухолевого лечения больных ММ ГД с использованием высокопроницаемых для ЛЦ фильтров. Однако в исследование были включены только больные при гистологически доказанной каст-нефропатии. XT проводили по бортезомибсодержащим протоколам. Крайне важным является тот факт, что улучшение функции почек наблюдали лишь у больных, у которых был получен гематологический ответ на XT. Подобный подход к терапии представляется перспективным, так как он позволяет увеличить степень и скорость редукции ЛЦ, не влияя на токсичность терапии.
В течение последних 30 лет в лечении ОПП при ММ некоторые исследователи применяют плазмаферез. Как правило, выполняют 3-6 сеансов плазмафереза с удалением одного расчетного объема циркулирующей плазмы, составляющей 5% массы тела. Плазмообмен с использованием современных плазмофильтров позволяет удалить до 65% внутрисосудистого нефротоксичного белка при объеме плазмоэкстракции 1 ОЦП. Однако следует отметить, что СЛЦ являются мелкими молекулами (от 25 до 50 кДа), что позволяет им легко перераспределяться во внесосудистой жидкости. Таким образом, СЛЦ в циркулирующей плазме находится лишь 15-20% от общего количества, что в совокупности с интенсивностью образующихся СЛЦ de novo ставит под сомнение адекватность прогнозируемой эффективности. К отрицательным моментам данного метода экстракорпоральной детоксикации относится необходимость плазмозамещения свежезамороженной плазмой, риск аутоиммунных реакций, инфицирования гепатитом, ВИЧ, развитие выраженной иммуносупрессии при увеличении объема плазмоэкстракции и интенсивности проведения процедур.
В литературе приведены яркие и убедительные примеры купирования ОПП после применения плазмафереза как до начала XT, так и в сочетании с XT (см. El-Achkar Т.М., Sharfuddin А.А., Dominguez J. Approach to acute renal failure with multiple myeloma: role of plasmapheresis.Ther. Apher. Dial. 2005; 9(5): 417-22; Pozzi C, Pasquali S., Donini U., Casanova S., Banfi G., Tiraboschi G. et al. Prognostic factors and effectiveness of treatment in acute renal failure due to multiple myeloma: a review of 50 cases. Report of the Italien Renal Immunopathology Group. Clin. Nephrol. 1987; 28(1): 1-9). Тем не менее в настоящее время эффективность применения плазмафереза в терапии 01111 при ММ не доказана. В рандомизированном исследовании, включающем 97 больных ММ и ОПП, не найдено различий в уровне смертности, необходимости в ГД или нормализации скорости клубочковой фильтрации у больных, которые наряду с XT получали плазмаферез (см. Clark W.F., Stewart А.К., Rock G.A., Sternbach M., Sutton D.M., Barrett B.J. et al. Plasma exchange when myeloma presents as acute renal failure: a randomized, controlled trial. Ann. Intern. Med. 2005; 143(11): 777-84). Следует отметить, что данное исследование было проведено у небольшой группы больных, гистологический диагноз миеломной нефропатии был подтвержден не у всех. В этой связи нельзя считать выводы окончательными и полностью исключить пользу плазмафереза у отдельных больных.
Представленные выше данные о применении методов экстракорпоральной детоксикации касаются лечения уже состоявшейся ОПН или ХПН, требующих заместительной почечной терапии. Данные литературы свидетельствуют о возможности уменьшения выраженности хронической почечной недостаточности (ХПН) в результате специфического лечения ММ у 40-50% пациентов. Однако результаты, доказывающие обратимость хронических заболеваний почек, полученные экспериментально на животных моделях, не получили подтверждения при широкомасштабных исследованиях у человека (см. Matsue К., Fujiwara Н., Iwama К.I. et al. Reversal of dialysis-dependent renal failure in patients with advanced multiple myeloma: single institutional experiences over 8 years. Ann. Hematol. 2009; 83(4): 357-64; Борисов И.А. Хроническая почечная недостаточность. В мире лекарств 1999; 1).
В настоящее время специфического лечения при ММ, позволяющего предупредить развитие и прогрессирование ОПП при доклинической стадии и в додиализном периоде, не разработано. Стандартом лечения додиализной почечной недостаточности, обусловленной ММ, являются адекватная химиотерапия и гидратация. Эти терапевтические усилия направлены на уменьшение опухолевой массы, что, опосредовано, приводит к снижению секреции нефротоксичных легких цепей.
Техническим результатом предлагаемого способа является предупреждение развития и прогрессирования почечного повреждения, улучшение результатов гематологического ответа на противоопухолевое лечение у больных первично выявленной секретирующей множественной миеломы.
Технический результат достигается тем, что за сутки перед проведением каждого курса химиотерапии проводят процедуру селективного плазмообмена на аппарате для фильтрационных экстракорпоральных методов детоксикации с использованием систем магистралей и плазмосепаратора, при этом скорость перфузии - 120 мл/мин, объем плазмоэкстракции - 10 литров, плазмозамещение осуществляется 7% альбуминсодержащим плазмозамещающим раствором.
В процессе проведения «селективного плазмообмена» происходит удаление токсических веществ размером от 500 до 5000 дальтон, в состав которых входят, в том числе, паропротеин, κ- и λ-цепи иммуноглобулинов, играющие ведущую роль в формировании почечной недостаточности при ММ. Размер пор мембраны «Эваклио» находится между размером пор диализаторов и обычных плазмофильтров, составляет 0,008-0,03 мкм, что от 3 до 6 раз больше диаметра пор гемофильтров и в 10 раз меньше размера пор плазмофильтров. Это позволяет в процессе проведения СПО удалять весь спектр токсических метаболитов от 500 до 5000 дальтон до молекул альбумина, эффективно удалять парапротеин и свободные легкие цепи иммуноглобулинов по сравнению с другими методами фильтрационной детоксикации. При этом потери высокомолекулярных компонентов плазмы - факторы свертывания, фибриноген, иммуноглобулины, факторы коагуляции (FIX, FVIII и другие), компоненты системы комплемента, фибриноген, антитромбин III, фактор роста гепатоцитов (HGF) минимальны, что принципиально отличает данный метод экстракорпоральной детоксикации от других, используемых в настоящее время в клинической практике. Это позволяет увеличить объем обработанной плазмы до 10 л за сеанс, что существенно повышает детоксикационный эффект процедуры при минимизации объема плазмозамещающих растворов.
Способ предупреждения почечного повреждения у больных первично выявленной секретирующей множественной миеломой осуществляется следующим образом.
В целях обеспечения адекватной перфузии во время проведения экстракорпоральной процедуры до проведения селективного плазмообмена больному производится катетеризация центральной вены. После обработки места катетеризации раствором антисептика (двукратно 96% спиртом) и анестезии кожи и подлежащих тканей раствором лидокаина 1%-3,0 под УЗИ контролем проводится пункция и катетеризация магистрального венозного сосуда по методу Сельдигера (v. subclavia/v. femoralis) двупросветным перфузионным катетером 16 F фирмы «Gambro» (Швеция). Шприцевой контроль. Асептическая повязка. Селективный плазмообмен выполняют за сутки перед проведением каждого курса химиотерапии аппаратом для проведения фильтрационных экстракорпоральных методов детоксикации «Мультифильтрат» фирмы «Fresenius» (Германия) с использованием систем магистралей и плазмосепаратора «Evaclio» со скоростью перфузии 120 мл/мин. Антикоагуляция - гепарин 2 тыс. Ед. каждый час в артериальный сегмент магистрали до колонки плазмосепаратора. Объем плазмоэкстракции составляет 10 литров. Плазмозамещение осуществляется 7% альбуминсодержащим плазмозамещающим раствором (MultiLac - 10000 мл + 20% Альбумин - 600,0 мл).
Осуществляется контроль уровня парапротеина, свободных легких цепей иммуноглобулинов, уровня креатинина, клиренса креатинина по Кокрофт-Голту, скорости клубочковой фильтрации (СКФ). Исследования проводят до и через 30 минут после завершения процедуры плазмосепарации, до начала и после каждого цикла курса противоопухолевой лекарственной терапии. В целях изучения механизмов патогенетического влияния селективного плазмообмена на характер течения ММ дополнительно исследуется содержание парапротеина, свободных легких цепей иммуноглобулинов, биохимических маркеров эндогенной интоксикации в эксфузируемом плазмофильтрате. После завершения всех курсов ПХТ проводится оценка гематологического ответа на проведенное противоопухолевое лечение.
Приводим примеры клинического применения способа.
Пример 1.
Больная М., 63 года, поступила в отделение онкогематологии ФГБУ «РНИОИ» 03.02.2016 с диагнозом: множественная миелома G с поражением крестца, ст. II А, кл. гр 2. Сопутствующие заболевания: артериальная гипертензия 1 ст. 1, риск 2, НК 1 ст.
Онкологический диагноз был установлен впервые на основании данных СРКТ органов грудной клетки, брюшной полости, малого таза, головного мозга; электрофореза белков сыворотки крови; миелограммы.
Данные клинико-лабораторного исследования:
1. Выраженный болевой синдром в области позвоночника, костей, таза.
2. Электрофорез белков сыворотки крови: М-пик. Содержание парапротеина - 25,56 г/л (26,82%), парапротеин представлен IgG и легкими цепями каппа - 21,42 г/л (23,89%).
3. Миелограмма: костно-мозговой пунктат клеточный, представлены все ростки кроветворения, плазматические клетки - 11,6%.
4. Общий анализ крови: гемоглобин 117 г/л; эритроциты 3,87⋅1012/л; цветной показатель 0,9; лейкоциты 5,91-10%, из них: эозинофилы 3%, палочкоядерные 9%, сегментоядерные 35%, моноциты 8%, лимфоциты 44%; тромбоциты 219⋅109/л; СОЭ 66 мм/час.
5. Биохимия крови: глюкоза 4,91 ммоль/л; мочевина 7,46 ммоль/л; общий белок 85,9 г/л; билирубин общий 8,5 мкмоль/л; креатинин сыворотки крови 94,0 мкмоль/л.
6. Общий анализ мочи: уд. вес 1014; Реакция 6,5; белок - нет; лейкоциты 1-2-2 х', эритроциты - нет.
7. Скорость клубочковой фильтрации 64 мл/мин/1,73 кв. м.
8. СРКТ органов грудной клетки, брюшной полости, малого таза: опухолевое поражение крестца с его разрушением; наличие эксраоссального внутритазового компонента с распространением в крестцовый канал; в костях свода черепа множественные участки деструкции до 2,2 см.
Больной проведен курс полихимиотерапии, включающий в себя шесть 21-дневных циклов лекарственного противоопухолевого лечения по схеме VCD: Бортезомиб 1,3 мг/м2 п/к в 1, 4, 8, 11 дни цикла; Циклофосфамид 400 мг в/в капельно в 1,8 дни цикла; Дексаметазон 40 мг в/в в 1-4 и 8-11 дни 1-го цикла, далее в 1-4 дни каждого цикла. Лечение возобновлялось на 22 день.
Сопроводительное лечение: за сутки часа до 1 дня 1 цикла - Ацикловир 500 мг внутрь 1 раз в сутки в течение всего курса лечения; Ципрофлоксацин 500 мг внутрь 1 раз в сутки в течение 1 цикла; Омепразол 20 мг 1 раз в сутки внутрь во время терапии дексаметазоном. Водная нагрузка (гидратация) - пероральный прием жидкости 2 л/сутки, инфузии глюкозо-солевых растворов в объеме 1,5-2 л/сутки.
За сутки перед проведением каждого цикла ПХТ (0 день) в программу сопроводительного лечения была включена процедура селективного плазмообмена. Селективный плазмообмен проводили на аппарате «Мультифильтрат» фирмы «Fresenius» с использованием систем магистралей и фильтра-плазмосепаратора «Evaclio». Венозный доступ - катетеризация v. femoralis dextra по Сельдигеру двупросветным перфузионным катетером 14F «Gambro» (Швеция). Скорость перфузии - 120 мл/мин. Время проведения процедуры - 4 часа. Объем плазмоэкстракции - 10 литров. Плазмозамещение - 7% плазмозамещающий раствор (MultiLac - 10000 литров + 20% альбумин - 600 мл). Антикоагуляция - нефракционированный гепарин в дозе 2 тыс. Ед. каждый час в артериальную магистраль до плазмосепаратора.
При исследовании содержания парапротеина и свободных легких цепей каппа иммуноглобулина G в плазмафильтрате, полученном при проведении 1-ой процедуры селективного плазмообмена концентрация парапротеина составила 49,26 г/л (50,42%), свободных легких цепей иммуноглобулинов каппа - 45,24%), что свидетельствовало о высокой активности их экстракции в процессе проведения экстракорпоральной детоксикации. Уровни этих показателей в сыворотке крови через 30 минут после завершения процедуры существенно уменьшились в сравнении с исходными значениями и составили 19,26 г/л (18,54%) и 16,55% соответственно. Одновременно регистрировали нормализацию скорости клубочковой фильтрации, которая увеличилась до 84 мл/мин/1,73 кв. м.
После завершения курса ПХТ с включением селективного плазмообмена у больной диагностирована полная ремиссия. Отмечено купирование болевого синдрома; уровень парапротеина в сыворотке крови и в моче - 0, креатинин в сыворотке крови - 53,3 мкмоль/л, скорость клубочковой фильтрации - 101 мл/мин/1,73 кв. м; содержание плазматических клеток в костном мозге <5%.
Пример 2.
Больная С., 58 лет, поступила в отделение онкогематологии ФГБУ «РНИОИ» 25.02.2016 с диагнозом: множественная миелома G, поражение тела правой подвздошной кости в зоне тазобедренного сустава с мягкотканным компонентом, ст. 2А, кл. гр 2. Сопутствующие заболевания: миома матки, состояние после НАМ с придатками в 2005 году.
Онкологический диагноз был установлен впервые на основании данных СРКТ шеи, органов грудной клетки, брюшной полости, малого таза; электрофореза белков сыворотки крови; миелограммы.
Данные клинико-лабораторного исследования:
1. Выраженный болевой синдром в области позвоночника, таза.
2. Электрофорез белков сыворотки крови: М-пик. Содержание парапротеина 48,13 г/л (50,78%), парапротеин представлен IgG и легкими цепями каппа - 27,26 г/л (32,31%).
3. Миелограмма: костно-мозговой пунктат полиморфный клеточный, представлены все ростки кроветворения, плазматические клетки - 47,8%.
4. Общий анализ крови: гемоглобин 130 г/л; эритроциты 4,14⋅1012/л; цветной показатель 0,94; лейкоциты 8,25⋅109/л, из них: эозинофилы 2%, палочкоядерные 11%, сегментоядерные 41%, моноциты 8%), лимфоциты 38%; тромбоциты 275⋅109/л; СОЭ 38 мм/ч.
5. Биохимия крови: глюкоза 5,74 ммоль/л; мочевина 14,86 ммоль/л; общий белок 110,24 г/л; билирубин общий 11,4 мкмоль/л; креатинин сыворотки крови 210,21 мкмоль/л.
6. Общий анализ мочи: уд. вес 1025; РН - 5; белок - нет; лейкоциты 4-3-3х', эритроциты - нет.
7. Скорость клубочковой фильтрации (СКФ) 47 мл/мин/1,73 кв.м.
8. СРКТ органов грудной клетки, брюшной полости, малого таза: mts поражение тела правой подвздошной кости в зоне тазобедренного сустава с мягко-тканным компонентом 8-5, 7-5 см.
Больной проведен курс ПХТ, включающий в себя 8 21-дневных циклов лекарственного противоопухолевого лечения по схеме VCD: Бортезомиб 1,3 мг/м2 п/к в 1, 4, 8, 11 дни цикла; Циклофосфамид 400 мг в/в капельно в 1,8 дни цикла; Дексаметазон 40 мг внутрь в 1-4 и 8-11 дни 1-го цикла и 20 мг внутрь в 1, 2, 4, 5, 8, 9, 11, 12 дни каждого цикла. Лечение возобновлялось на 22 день.
Сопроводительное лечение: за 24 часа до 1 дня 1 цикла - Ацикловир 500 мг внутрь 1 раз в сутки в течение всего курса лечения; Ципрофлоксацин 500 мг внутрь 1 раз в сутки в течение 1 цикла; Омепразол 20 мг 1 раз в сутки внутрь во время терапии дексаметазоном. Водная нагрузка (гидратация) - пероральный прием жидкости 2 л/сутки, инфузии глюкозо-солевых растворов в объеме 1,5-2 л/сутки.
За сутки перед проведением каждого цикла ПХТ (0 день) в программу сопроводительного лечения была включена процедура селективного плазмообмена. Селективный плазмообмен проводили на аппарате «Мультифильтрат» фирмы «Fresenius» с использованием систем магистралей и фильтра-плазмосепаратора «Evaclio». Венозный доступ - катетеризация v.femoralis dextra по Сельдигеру двупросветным перфузионным катетером «Gambro» (Швеция). Скорость перфузии - 120 мл/мин. Время проведения процедуры - 4 часа. Объем плазмоэкстракции - 10 литров. Плазмозамещение - 7% плазмозамещающий раствор (MultiLac - 10000 литров + 20% альбумин - 600 мл). Антикоагуляция - нефракционированный гепарин в дозе 2 тыс. Ед. каждый час в артериальную магистраль до плазмосепаратора.
После проведения селективного плазмообмена диагностировали снижение уровня парапротеина до 19,42 г/л (20,32%), свободных легких цепей иммуноглобулина G - 15,74%, показатели креатинина в сыворотке крови уменьшилось до 196,6 мкмоль/л, скорость клубочковой фильтрации выросла до 58 мл/мин/1,73 кв. м. Больная отметила снижение интенсивности болей.
После завершения курса ПХТ с включением селективного плазмообмена диагностировали полную ремиссию заболевания. Болевой синдром купирован; уровень парапротеина в крови и моче - 0; креатинин в сыворотке крови - 72,45 мкмоль/л, скорость клубочковой фильтрации - 89 мл/мин/1,73 кв. м; исчезновение плазмоцитом мягких тканей при УЗИ-контроле.
Исследование эффективности предлагаемого способа включило 18 больных, разделенных на две группы. Все получали ПХТ в режиме VCD. В первую группу (основную) вошли 11 больных, которым в комплексе лечения ММ был включен метод селективного плазмообмена. Вторая группа (контрольная) включала в себя 7 больных, которым лечение проводили без применения методов экстракорпоральной детоксикации. У всех больных диагностировали 2-3 стадии ММ и парапротеинемию. При оценке функционального состояния почек у всех 18 больных до начала лечения первично выявленной секретирующей ММ диагностировали значительно повышенные в 5 и более раз уровни маркеров раннего почечного повреждения в сыворотке крови и в моче - цистатина C,IL-18, NGAL, L-FABP, KIM-1, что характеризовало наличие в исходе структурно-функционального повреждения почек. При этом у 4 из 11 больных основной группы уровень креатинина в сыворотке крови варьировал в пределах нормальных значений, у 5 - был повышен и варьировал от 147 мкмоль/л до 189 мкмоль/л, у 2 содержание креатинина в сыворотке крови было выше 190 мкмоль/л (211 мкмоль/л и 236 мкмоль/л) при отсутствии клинических признаков почечной дисфункции. У больных контрольной группы увеличение содержания креатинина в сыворотке крови до 198 мкмоль/л регистрировали только в 1 случае.
Анализ результатов лечения исследуемых больных показал, что после завершения курса ПХТ при оценке эффективности терапии в соответствии с категориями ответа рабочей группы IMWG (NVVN Guidelines Version 1.2012 Multiple Myeloma) у 4 больных основной группы диагностировали полную ремиссию заболевания, в 5 случаях наблюдали частичную ремиссию, в 2-х - стабилизацию заболевания. У больных контрольной группы только в 2 случаях из 7 диагностировали полную ремиссию, у 3 - стабилизацию, в 2 случаях наблюдали прогрессирование заболевания. При этом у всех больных основной группы после завершения курса ПХТ лабораторных признаков ХПН не отмечали. В контрольной группе в 2 случаях диагностировали наличие ХПН IIA стадии (по С.И. Рябову).
Таким образом, можно предполагать, что включение селективного плазмообмена в комплекс специфической терапии у больных первично выявленной секретирующей ММ позволяет уменьшить объем парапротеина и способствует усилению почечного и гематологического ответа на проводимое специфическое лечение.
Технико-экономическая эффективность данного способа заключается в том, что включение в комплекс специфического лечения больных ММ и парапротеинемией позволяет обеспечить более выраженный гематологический и почечный ответ на проводимую лекарственную противоопухолевую терапию.
Способ предупреждения почечного повреждения у больных первично выявленной секретирующей множественной миеломой, заключающийся в том, что за сутки перед проведением каждого курса химиотерапии проводят процедуру селективного плазмообмена на аппарате для фильтрационных экстракорпоральных методов детоксикации с использованием систем магистралей и плазмосепоратора, при этом скорость перфузии - 120 мл/мин, объем плазмоэкстракции - 10 литров, плазмозамещение осуществляется 7% альбуминсодержащим плазмозамещающим раствором.
