Результат интеллектуальной деятельности: СПОСОБЫ ИНГИБИРОВАНИЯ РОСТА ОПУХОЛИ ПУТЕМ АНТАГОНИЗИРОВАНИЯ ИЛ-6 РЕЦЕПТОРА
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к композициям и способам ингибирования или ослабления роста опухоли или ее пролиферации у пациента. Более конкретно, изобретение относится к способам, включающим введение антагониста интерлейкина-6 (IL-6, ИЛ-6) пациенту с опухолью.
УРОВЕНЬ ТЕХНИКИ
Показано, что антагонисты фактора роста сосудистого эндотелия (VEGF) эффективно ингибируют рост опухоли во многих экспериментальных и клинических ситуациях. Антагонисты VEGF оказывают свое лекарственное действие, направленно воздействуя на сосудистую сеть опухоли. Тем не менее, наблюдается, что опухоли при некоторых обстоятельствах, могут развивать резистентность к анти-VEGF средствам. Поэтому в области техники существует необходимость для новых достижений для лечения опухолей, включая способы ингибирования роста опухолей, которые развили резистентность к анти-VEGF терапии.
Интерлейкин-6 (ИЛ-6) представляет собой провоспалительный цитокин, который экспрессируется при многих типах рака. Клинические исследования показали, что повышение уровней сывороточного ИЛ-6 связано с худшими исходами для пациентов. Повышение экспрессии ИЛ-6 может происходить в результате активации онкогенных сигнальных путей и/или вследствие хронического воспаления, которое связывают с развитием рака. ИЛ-6 подает сигналы через их гетеродимерный рецептор IL-6R/gp130 для активизации JAK/STAT киназ и Ras сигнальных путей. В частности, ИЛ-6 хорошо активирует STAT3, который, как оказалось, активирует пролиферацию, инвазию и выживание опухолевых клеток. Ингибирование сигнализирования ИЛ-6 при помощи моноклональных антител, направленных против ИЛ-6 или ИЛ-6R, ингибирует рост опухоли в нескольких доклинических моделях, что предполагает, что путь ИЛ-6 представляет собой привлекательную терапевтическую цель для рака. Связь между уровнями ИЛ-6 и анти-VEGF устойчивостью или применением антагонистов ИЛ-6 для лечения анти-VEGF резистентных опухолей, тем не менее, не описана.
КРАТКАЯ СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано, по меньшей мере отчасти, на неожиданном открытии, касающемся того, что анти-VEGF резистентные опухоли экспрессируют повышенные уровни ИЛ-6, и этот антагонизм ИЛ-6 (например, путем применения анти-ИЛ-6R антител) в комбинации с анти-VEGF терапией, способен преодолеть анти-VEGF резистентность опухоли и, таким образом, обеспечить стойкую противоопухолевую активность против опухоли, которая до настоящего момента считалась невосприимчивой к VEGF антагонизму.
Таким образом, в соответствии с одним вопросом настоящего изобретения способы и композиции предоставлены для ингибирования или ослабления роста анти-VEGF-резистентной опухоли у пациента. В соответствии с конкретным вариантом осуществления настоящего изобретения предоставленные способы лечения рака включают: (i) измерение уровня ИЛ-6/STAT3 сигналов при биопсии опухоли пациента; (ii) введение антагониста ИЛ-6 пациенту, если биопсия опухоли выявляет повышенные ИЛ-6/STAT3 сигналы. Способы в соответствии с этим вопросом изобретения также включают введение пациенту антагониста ИЛ-6 и антагониста VEGF. В соответствии с этим вопросом изобретения предоставленные композиции включают по меньшей мере один антагонист ИЛ-6 и по меньшей мере один антагонист VEGF.
В соответствии с другим вопросом настоящего изобретения предоставлены способы для усиления противоопухолевой активности антагониста ИЛ-6. Способы в соответствии с этим вопросом изобретения включают введение по меньшей мере одного дополнительного противоопухолевого средства пациенту с опухолью в комбинации с антагонистом ИЛ-6. Дополнительным противоопухолевым средством может быть, например, антагонист VEGF, антагонист EGFR или комбинация вышеперечисленных веществ.
Молекулами антагониста в изобретении могут быть, например, антиген-специфичные связывающие белки, включая антиген-специфичные связывающие белки, которые специфически связывают, например, ИЛ-6, ИЛ-6R, VEGF, VEGFR1, VEGFR2, EGFR, EGFRvIII, ErbB2, ErbB3 и/или ErbB4. Антиген-специфичные связывающие белки настоящего изобретения включают антитела и их антиген-связывающие фрагменты. Антиген-специфичные связывающие белки также включают слитые полипептиды, включающие лиганд-связывающие порции одной или более молекул рецептора. В конкретных типичных вариантах осуществления антагонист ИЛ-6 представляет собой антитело, которое специфично связывает ИЛ-6R, антагонист VEGF представляет собой VEGF-связывающую слитую молекулу, включающую VEGF связывающие участки VEGFR1, VEGFR2 и мультиметризованный участок (“VEGF-ловушка”), и антагонист EGFR представляет собой антитело, которое специфично связывает ErbB4. Тем не менее, другие антагонисты можно применять в контексте настоящего изобретения, как описано здесь и в других местах.
Другие варианты осуществления настоящего изобретения станут очевидны после обзора следующего подробного описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 показывает результат вестерн-блоттинга для культивируемых А549, Calu3 и Du145 опухолевых клеток для оценки уровней фосфо-STAT3 и общего STAT3 в клетках после лечения 10 мкг/мл человеческого Fс контрольного белка (ряд 1), 10 мкг/мл анти-ИЛ-6R mAb1 (линия 2), 10 нг/мл ИЛ-6 плюс 10 мкг/мл hFc (линия 3) или 10 нг/мл ИЛ-6 плюс 10 мкг/мл анти-ИЛ-6R mAb1 (линия 4).
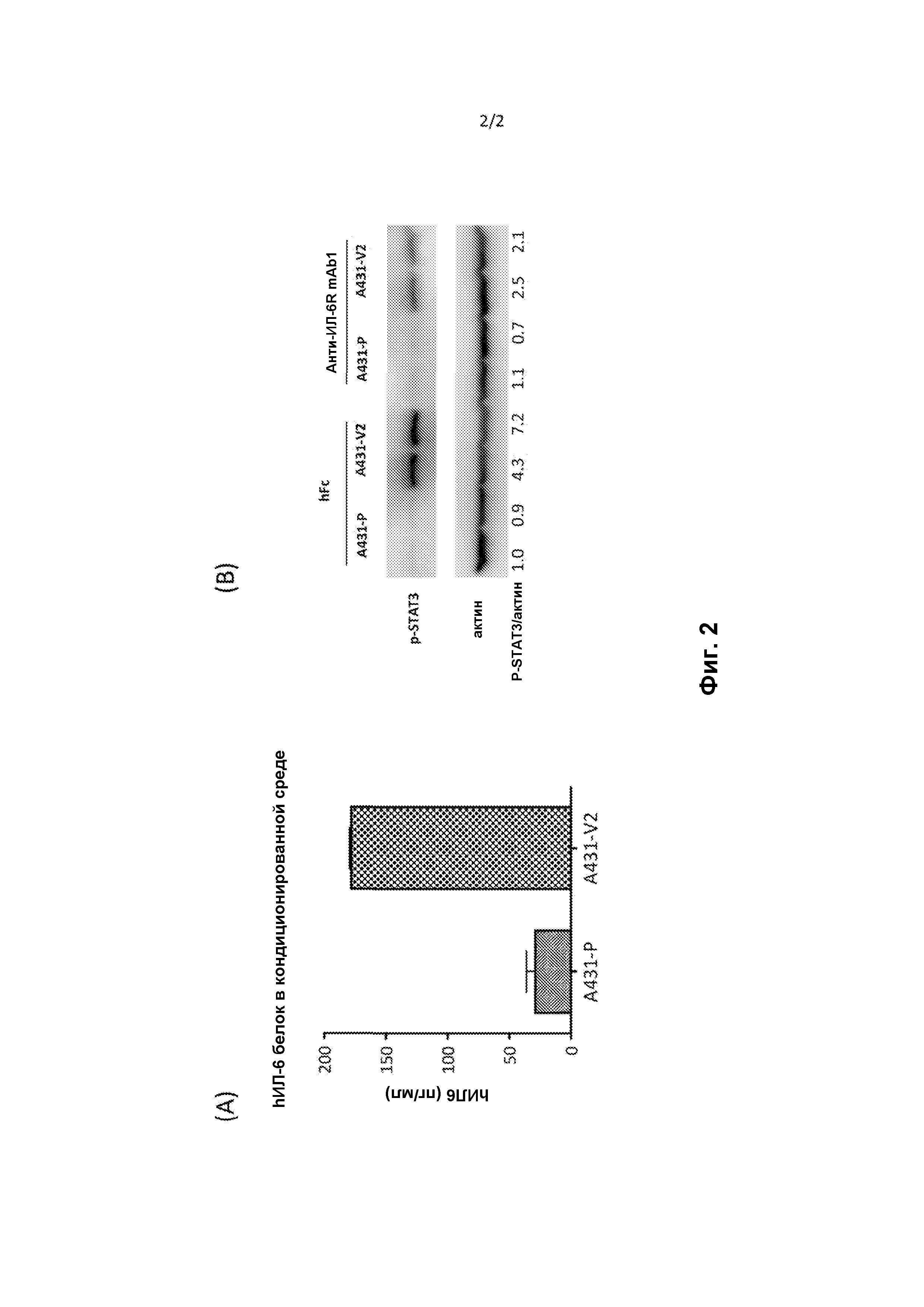
Фигура 2, часть А показывает результаты ELISA, проведенного на кондиционированной среде, собранной с культивируемых A431-P или A431-V2 клеток для измерения концентрации ИЛ-6.
Фигура 2, часть В показывает результаты вестерн-блоттинга, проводимого на A431-P или A431-V2 клетках, получавших либо hFc контрольный белок (10 мкг/мл), либо анти-ИЛ-6R mAb1 (10 мкг/мл) для измерения уровней фосфо-STAT3 (относительно контроля актина).
ПОДРОБНОЕ ОПИСАНИЕ
Перед описанием настоящего изобретения следует понять, что это изобретение не ограничивается описанными конкретными способами и экспериментальными состояниями и такие способы и состояния могут варьировать. Также следует понять, что применяемая здесь терминология имеет место только с целью описания конкретных вариантов осуществления и не имеет тенденции к ограничению, поскольку объем настоящего изобретения ограничен только прилагаемой формулой изобретения.
Если не определено иначе, все технические и научные термины, применяемые здесь, имеют такое же значение, какое обычно понимает под ними средний специалист в данной области техники, к которой принадлежит изобретение. Как применяют здесь, термин “приблизительно”, когда используется в значении конкретной изложенной числовой величины, означает, что величина может варьировать от указанной величины не более чем на 1%. Например, как применяют здесь, выражение “приблизительно 100” включает 99 и 101, а также все значения между ними (например, 99,1, 99,2, 99,3, 99,4 и т.д.).
Хотя любые способы и материалы, сходные или эквивалентные тем, которые описаны здесь, можно применять на практике настоящего изобретения, далее описаны предпочтительные способы и материалы.
Способы ингибирования или ослабления роста опухоли
Настоящее изобретение предоставляет способы для ингибирования или ослабления роста опухоли у пациента. Изобретение включает введение антагониста ИЛ-6 пациенту с опухолью. Антагонист ИЛ-6 можно вводить в комбинации с одним или более дополнительными лекарственными средствами. Типичные лекарственные средства, которые можно вводить в комбинации с антагонистом ИЛ-6, в соответствии со способами настоящего изобретения включают, например, антагонисты фактора роста сосудистого эндотелия (VEGF) и/или антагонисты рецепторов эпидермального фактора роста (EGFR) (как определено здесь). Дополнительные примеры лекарственных средств, которые можно вводить в комбинации с антагонистом ИЛ-6 в соответствии со способом настоящего изобретения, описаны здесь и в других местах.
Способы настоящего изобретения полезны для лечения первичных и/или метастатических опухолей, возникающих в головном мозге, а также мозговых оболочках, ротоглотке, легких и бронхиальном дереве, желудочно-кишечном тракте, мужских и женских половых путях, мышцах, костях, коже и придатках, соединительной ткани, селезенке, иммунной системе, гемопоэтических клетках и костном мозге, печени и мочевыводящих путях, а также в специальных органах чувств, таких как глаза. Специфические раки, которые лечат способами в соответствии со способами настоящего изобретения, включают, например, почечноклеточную карциному, панкреатическую карциному, рак груди, рак простаты, печеночноклеточную карциному, колоректальный рак, злокачественную мезотелиому, множественную миелому, рак яичника и меланому.
В конкретных вариантах осуществления способы настоящего изобретения полезны для лечения анти-VEGF-резистентных опухолей у пациента. “Анти-VEGF-резистентная опухоль”, как описано здесь, обозначает опухоль, которая является невосприимчивой или частично восприимчивой к лечению при помощи анти-VEGF-средства, такого как анти-VEGF-антитело, анти-VEGF рецептор антитела или любого другого VEGF-специфичного связывающего белка (включая, например, VEGF-ловушку, как определено здесь). К примеру, анти-VEGF-резистентной опухолью может быть, например, опухоль, которая при контакте с количеством антагониста VEGF, обычно способным ингибировать или ослабить рост по меньшей мере одного типа опухоли, продолжает расти и/или пролиферировать in vitro или in vivo (например, в клеточной культуре или при имплантации животному). Анти-VEGF-резистентной опухолью может быть опухоль, полученная из опухолевых клеток, изначально бывших восприимчивыми к анти-VEGF терапии, но путем селекции, мутации или адаптации выработавших резистентность к одному или более анти-VEGF средствам.
Пациенты, которых лечат, применяя способы настоящего изобретения, включают любых пациентов, у которых диагностирован рак или определено наличие опухоли. В конкретных вариантах осуществления пациентом является тот, у кого диагностировали или определили наличие опухоли, которая по меньшей мере частично является резистентной к анти-VEGF лечению. Способы диагностики у пациента анти-VEGF-резистентной опухоли известны средним специалистам в данной области и могут практиковаться при помощи обычных диагностических методов.
Как показано в Примерах здесь, опухолевые клетки, которые резистентны к анти-VEGF терапии, экспрессируют более высокие уровни ИЛ-6 и фосфо-STAT3 по сравнению с родительскими нерезистентными опухолевыми клетками. Таким образом, настоящее изобретение также включает способы лечения рака, включающие: (i) измерение уровня сигнализирования ИЛ-6/STAT3 пациенту например, в образце сыворотки, образце ткани, в биоптате опухоли и т.д., полученным от пациента); и (ii) введение антагониста ИЛ-6 пациенту, если у пациента (или образца/биоптата, полученного от него) определяют повышенное сигнализирование ИЛ-6/STAT3.
В соответствии с конкретными вариантами осуществления настоящего изобретения выражение “повышение сигнализирования ИЛ-6/STAT-3” означает, что количество ИЛ-6 и/или количество фосфо-STAT3, измеряемые при биопсии опухоли, по меньшей мере в три раза превышает (например, в 4, в 5, в 6, в 7 или более) таковое у опухоли, чувствительной (т.е. не резистентной) к анти-VEGF терапии. В соответствии с конкретными вариантами осуществления настоящего изобретения “повышение сигнализирования ИЛ-6/STAT-3” означает, что соотношение фосфо-STAT3 к неизменяющемуся контрольному белку (например, соотношение P-STAT/актин) в образце, взятом у пациента, превышает приблизительно 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0, 5,5, 6,0, 6,5, 7,0, 7,5 или более. В соответствии с конкретным вариантами осуществления настоящего изобретения “повышение сигнализирования ИЛ-6/STAT-3” означает”, что концентрация ИЛ-6 в образце опухоли, взятом у пациента, превышает приблизительно 50 пг/мл, 55 пг/мл, 60 пг/мл, 65 пг/мл, 70 пг/мл, 75 пг/мл, 80 пг/мл, 85 пг/мл, 90 пг/мл, 95 пг/мл, 100 пг/мл, 110 пг/мл, 120 пг/мл, 130 пг/мл, 140 пг/мл, 150 пг/мл, 160 пг/мл, 170 пг/мл, 180 пг/мл, 190 пг/мл, 200 пг/мл или более. Уровни ИЛ-6 и фосфо-STAT3 можно измерить, например, при помощи вестерн-блоттинга, ELISA или любым другим иммуногистохимическим методом, известным в данной области техники.
Сходным образом, настоящее изобретение также включает способы определения, имеется ли у пациента с опухолью анти-VEGF-резистентная опухоль. Способы в соответствии с данным вопросом изобретения включают измерение уровня сигнализирования ИЛ-6/STAT3 в образце (например, в биоптате опухоли) от пациента, где “повышенное сигнализирования ИЛ-6/STAT-3” в образце (как определяемое здесь и выше выражение) определяет наличие у пациента анти-VEGF-резистентной опухоли. Поскольку настоящие изобретатели демонстрируют, что анти-VEGF-резистентные опухоли являются чувствительными к антагонизму ИЛ-6, способы в соответствии с этим вопросом изобретения могут в конкретных вариантах осуществления дополнительно включать введение пациенту антагониста ИЛ-6 и/или антагониста VEGF.
Антагонисты
Настоящее изобретение включает способы, включающие введение антагониста ИЛ-6, антагониста VEGF, антагониста EGFR и/или комбинации вышеперечисленных веществ пациенту при необходимости в таковом. Как применяют здесь, “антагонист ИЛ-6” представляет собой любое средство, которое связывается или взаимодействует с ИЛ-6 и ингибирует нормальную биологическую сигнальную функцию ИЛ-6 in vitro или in vivo. Термин “антагонист ИЛ-6” также включает антагонистов ИЛ-6 рецепторов (“ИЛ-6R”, например, “ИЛ-6R антагонисты”). Антагонист ИЛ-6R может представлять собой любое средство, которое связывается или взаимодействует с ИЛ-6R и ингибирует нормальную биологическую сигнальную функцию ИЛ-6R in vitro или in vivo.
Антагонист VEGF может представлять собой любое средство, которое связывается или взаимодействует с VEGF или VEGF рецептором (VEGFR1, также называемый Flt1; или VEGFR2, также называемый Flk1 или KDR).
Антагонист EGFR может представлять собой любое средство, которое связывается или взаимодействует с рецептором эпидермального фактора роста и ингибирует нормальную биологическую сигнальную функцию рецептора in vitro или in vivo. Выражение “антагонист EGFR”, как применяют здесь, включает антагонисты любого одного или более членов семейства рецепторов эпидермального фактора роста. Например, антагонистом EGFR может быть антагонист EGFR (также называемый ErbB1 или HER1), антагонист вариантный EGFR, такой как, например, EGFRvlll, антагонист ErbB2 (также называемый HER2 или Neu), антагонист ErbB3 (также называемый HER3) и/или антагонист ErbB4 (также называемый HER4).
Антагонисты ИЛ-6, ИЛ-6R, VEGF, рецепторов VEGF и EGFR включают маленькие молекулы антагонистов, а также антиген-специфичные связывающие белки, как описано здесь где-либо еще.
Антиген-специфичные связывающие белки
Антагонисты, которые приносят пользу в способах настоящего изобретения, включают антиген-специфичные связывающие белки. Например, настоящее изобретение включает способы, включающие введение антиген-специфичного связывающего белка, который специфически связывает интерлейкин-6 (ИЛ-6) или ИЛ-6 рецептор (ИЛ-6R) пациента. Настоящее изобретение также включает способы, включающие введение пациенту антиген-специфичного связывающего белка, который специфически связывает фактор роста сосудистого эндотелия (VEGF) или рецептор VEGF (VEGFR), или антиген-специфичного связывающего белка, который специфически связывает рецептор эпидермального фактора роста (EGFR, EGFRvlll, ErbB2, ErbB3 и/или ErbB4).
Как применяют здесь, выражение “антиген-специфичный связывающий белок” означает белок, включающий по меньшей мере один участок, который специфически связывается с конкретным антигеном. Типичные категории антиген-специфичного связывающего белка включают антитела, антиген-связывающие части антител, пептиды, которые специфически взаимодействуют с конкретным антигеном (например, пептидные антитела), рецепторные молекулы, которые специфически взаимодействуют с конкретным антигеном, и белки, включающие лиганд-связывающий участок рецептора, который специфически связывает конкретный антиген.
Термин “специфически связывает” и ему подобные, как применяют здесь, означает, что антиген-специфичный связывающий белок или антиген-специфичный связывающий участок формирует комплекс с конкретным антигеном, характеризующийся константой диссоциации (KD) 500 пмоль или меньше, и/или где связывает другие неродственные антигены при обычных тестовых условиях. “Неродственные антигены” представляют собой белки, пептиды или полипептиды, которые имеют менее 75% совпадения по аминокислотному составу друг с другом. Способы определения того, смогут ли две молекулы специфически связаться друг с другом, хорошо известны в области техники и включают, например, равновесный диализ, поверхностный плазменный резонанс и им подобные. Например, антиген-специфичный связывающий белок или антиген-специфичный связывающий участок, как применяют в контексте настоящего изобретения, включает молекулы, которые связывают конкретный антиген (например, ИЛ-6, ИЛ-6R, VEGF, VEGFR и/или EGFR) или его часть с KD менее чем приблизительно 500 пмоль, менее чем приблизительно 400 пмоль, менее чем приблизительно 300 пмоль, менее чем приблизительно 200 пмоль, менее, чем приблизительно 100 пмоль, менее чем приблизительно 90 пмоль, менее чем приблизительно 80 пмоль, менее чем приблизительно 70 пмоль, менее чем приблизительно 60 пмоль, менее чем приблизительно 50 пмоль, менее чем приблизительно 40 пмоль, менее чем приблизительно 30 пмоль, менее чем приблизительно 20 пмоль, менее чем приблизительно 10 пмоль, менее чем приблизительно 5 пмоль, менее чем приблизительно 4 пмоль, менее чем приблизительно 2 пмоль, менее, чем приблизительно 1 пмоль, менее чем приблизительно 0,5 пмоль, менее чем приблизительно 0,2 пмоль, менее чем приблизительно 0,1 пмоль или менее чем приблизительно 0,05 пмоль, как измеряют при помощи поверхностного плазменного резонанса.
Как применяют здесь, антиген-специфичный связывающий белок или антиген-специфичный связывающий участок “не связывается” с неродственным антигеном, если белок или связывающий участок, при тестировании на связывание с неродственным антигеном при 25°C поверхностном плазменном анализе, демонстрирует KD, превышающую 1000 пмоль, или не показывает никакой связывающей активности в таком исследовании или эквиваленте ему.
Термин “поверхностный плазменный резонанс”, как применяют здесь, относится к оптическому феномену. Который позволяет анализировать взаимодействие в реальном времени путем определения изменений в концентрациях белка при помощи биочувствительной среды, например, применяя систему BIAcore™ (Biacore Life Sciences подразделение GE Healthcare, Piscataway, NJ).
Термин “KD”, как применяют здесь, означает равновесную константу диссоциации конкретного взаимодействия типа белок-белок (например, взаимодействие антитело-антиген). Если не указано иное, величина KD, раскрытая здесь, относится к величине KD, определяемой путем поверхностного плазменного резонанса при 25°C.
Антитела и антиген-связывающие фрагменты антител
Как определено выше, антиген-специфичный связывающий белок может включать или состоять из антитела или антиген-связывающего фрагмента антитела, который специфично связывается с конкретным антигеном (например, анти-ИЛ-6-антитело, анти-ИЛ-6R антитело, анти-VEGF антитело, анти-VEGFR антитело и/или анти-EGFR антитело или антиген-связывающие фрагменты вышеперечисленных веществ).
Термин “антитело”, как применяют здесь, включает молекулы иммуноглобулина, включающие четыре полипептидные цепи, две тяжелые (Н) цепи и две легкие (L), связанные друг с другом при помощи дисульфидных мостиков, а также их мультимеры (например, IgM). Каждая тяжелая цепь включает вариабельный участок тяжелой цепи (аббревиатура здесь HCVR или VH) и постоянный участок тяжелой цепи. Постоянный участок тяжелой цепи включает три участка, СН1, СН2 и СН3. Каждая легкая цепь включает вариабельный участок легкой цепи (аббревиатура здесь LCVR или VL), и постоянный участок легкой цепи. Постоянный участок легкой цепи включает один участок (CL1). Участки VH и VL могут дополнительно делиться на участки, которые являются более стабильными, называемыми каркасными участками (FR). Каждый VH и VL состоят из трех CDR и четырех FR, организованных от N-конца до С-конца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. В других вариантах осуществления изобретения FR антитела (или их антиген-связывающие части) могут быть идентичными последовательности зародыша человека или могут быть естественным или искусственным образом модифицированы. Аминокислотную консенсусную последовательность можно определить на основании прямого анализа двух или более CDR.
Термин “антитело”, как применяют здесь, также включает антиген-связывающие фрагменты целых молекул антитела. Термин “антиген-связывающая часть” антитела, “антиген-связывающий фрагмент” антитела и им подобные, как применяют здесь, включают любые встречающиеся в природе, полученные ферментативным путем, синтетические или полученные при помощи генной инженерии полипептиды или гликопротеин, который специфически связывается с антигеном, формируя комплекс. Антиген-связывающие фрагменты антитела можно получить, например, из целой молекулы антитела при помощи любой подходящей стандартной технологии, такой как протеолитическое усвоение или технологии рекомбинантной генной инженерии, включающей манипулирование и экспрессию ДНК, кодирующей вариабельные или опционально постоянные участки антитела. Такие ДНК известны и/или получены, например, из источников коммерческой информации, библиотек ДНК (включая, например, библиотеки фаговых антител) или могут быть синтезированы. ДНК может быть секвестрирована и может управляться химическим путем при помощи применения технологий молекулярной биологии, например, для организации одного или более вариабельного или постоянного участка в приемлемую конфигурацию, или для представления кодонов, создание цистеиновых групп, модифицирования, добавления или удаления аминокислот и т.д.
Неограничивающие примеры антиген-связывающих участков включают: (i) Fab фрагменты; (ii) F(ab’)2 фрагменты; (iii) Fd фрагемнты; (iv) Fv фрагменты; (v) одноцепочечные молекулы Fv (scFv); (vi) dAb фрагменты; и (vii) минимальные рекогниционные единицы, состоящие из аминокислотных групп, которые имитируют гипервариабельный участок антитела (например, изолированная определяющая комплементарность область (CDR), такая как CDR3 пептид) или несвободный FR3-CDR3-FR4 пептид. Другие разработанные молекулы, такие как антитела со специфичным участком, антитела с единичным участком, антитела с удаленным участком, гибридные антитела, CDR-привитые антитела, диатела, триатела, тетратела, минитела, нанотела (например, моновалентные нанотела, бивалентные нанотела и т.д.), иммунофармацевтические средства на основе модульного белка малого размера (SMIP) и shark вариабельные участки IgNAR, также охватываются выражением “антиген-связывающий участок”, как применяют здесь.
Антиген-связывающий фрагмент антитела обычно включает по меньшей мере один вариабельный участок. Вариабельный участок может иметь любой размер или состав аминокислот, и в целом будет включать по меньшей мере одну CDR, которая расположена рядом или внутри рамы и с одной или более каркасной последовательностью. В антиген-связывающих участках, имеющих VH участок, связанный с VL участком, участки VH и VL могут располагаться относительно друг друга в любой подходящей последовательности. Например, вариабельный участок может быть димерным и содержать VH-VH, VH-VL или VL-VL димеры. Как вариант, антиген-связывающий фрагмент антитела может содержать мономерные участки VH или VL .
В конкретных вариантах осуществления антиген-связывающий участок антитела может содержать по меньшей мере один вариабельный участок, ковалентно связанный с по меньшей мере одним постоянным участком. Неограниченно, типичные конфигурации вариабельного и постоянного участков, которые можно обнаружить в антиген-связывающем участке антитела в настоящем изобретении, включают: (i) VH-CH1; (ii) VH-CH2; (iii) VH-CH3; (iv) VH-CH1-CH2; (v) VH-CH1-CH2-CH3; (vi) VH-CH2-CH3; (vii) VH-CL; (viii) VL-CH1; (ix) VL-CH2; (x) VL-CH3; (xi) VL-CH1-CH2; (xii) VL-CH1-CH2-CH3; (xiii) VL-CH2-CH3; и (xiv) VL-CL. В любой конфигурации вариабельных и постоянных участков, включающих любые из типичных конфигураций, перечисленных выше, вариабельные и постоянные участки могут быть либо напрямую связаны друг с другом, либо при помощи полной или частичной связи или связующего участка. Связующий участок может состоять из по меньшей мере 2 (например, 5, 10, 15, 20, 40, 60 или более) аминокислот, которые образуют гибкую или полугибкую связь между смежными вариабельными и/или постоянными участками в одиночной молекуле полипептида.
Более того, антиген-связывающий участок антитела в настоящем изобретении может включать гомодимер и гетеродимер (или другой мультимер) любого вариабельного или постоянного участка перечисленных выше конфигураций в нековалентной связи друг с другом и/или с одним или более мономерным участком VH или VL (например, при помощи дисульфидной связи/-ей).
Молекулы настоящего изобретения могут включать или состоять из человеческих антител и/или рекомбинантных человеческих антител или их фрагментов. Термин “человеческое антитело”, как применяют здесь, включает антитела, имеющие вариабельные и постоянные участки, полученные из человеческих зародышевых иммуноглобулиновых последовательностей. Человеческие антитела могут тем не менее включать аминокислотные группы, не включенные в человеческие зародышевые иммуноглобулиновые последовательности (например, мутации, представленные случайным или сайт-специфичным мутагенезом in vitro или соматической мутацией in vivo), например в CDR и в частности CDR3. Тем не менее, термин “человеческое антитело”, как применяют здесь, не имеет тенденции к включению антител, в которых CDR последовательности, полученные из зародыша или от другого вида Млекопитающего, например, мыши, привиты в человеческие каркасные последовательности.
Молекулы настоящего изобретения могут включать или состоять из рекомбинантных человеческих антител или их антиген-связывающих участков. Термин “рекомбинантное человеческое антитело”, как применяют здесь, должен включать все человеческие антитела, которые приготовлены, экспрессированы, созданы или изолированы рекомбинантными средствами, такие как антитела, экспрессированные при помощи рекомбинантного вектора экспрессии, трансфецированного в клетку-хозяина (дополнительно описано ниже), антитела, изолированные из рекомбинантной, комбинационной библиотеки человеческих антител (дополнительно описано ниже), антитела, изолированные из животного (например, мыши), которые являются трансгенными для человеческих иммуноглобулиновых генов (см., например, Taylor с соавторами (1992) Nucl. Acids Res. 20:6287-6295), или антитела, приготовленные, экспрессированные, созданные или изолированные при помощи любых средств, которые включают сплайсинг последовательности гена человеческого иммуноглобулина на другую последовательность ДНК. Такие рекомбинантные человеческие антитела имеют вариабельные и постоянные участки, полученные из последовательности человеческого зародышевого иммуноглобулина. В конкретных вариантах осуществления, тем не менее, такие рекомбинантные человеческие антитела подвергаются in vitro мутагенезу (или, когда применяют последовательность Ig животного, трансгенного для человека, соматическому мутагенезу), и, поэтому аминокислотные последовательности участков VH и VL рекомбинантных антител секвенированы так, что при получении их и в связи с человеческими зародышевыми последовательностями VH и VL, может не существовать в пределах человеческой зародышевой совокупности антител in vivo.
Анти-ИЛ-6R антитела и их антиген-связывающие участки
Способы настоящего изобретения в соответствии с конкретными вариантами осуществления включают введение анти-ИЛ-6R антитела или его антиген-связывающего участка пациенту. Терминами “рецептор интерлейкина-6”, “ИЛ-6R” и им подобными, как применяют здесь, называют рецептор человеческих цитокинов, который специфично связывает интерлейкин-6 (ИЛ-6). Внеклеточный участок человеческого ИЛ-6R имеет аминокислотную последовательность, как указано в SEQ ID NO: 1. Анти-ИЛ-6R антитела упоминаются, например, в патентных заявках US № 5795695; 5817790; 6410691; 6670373 и 7582298. Любые из анти-ИЛ-6R антител, упомянутых и/или описанных в любой из указанных публикаций, или их антиген-связывающих участков можно применять в контексте настоящего изобретения. Неограниченно, типичные анти-ИЛ-6R антитела, которые можно применять в контексте настоящего изобретения, представляют собой анти-ИЛ-6К антитела или их антиген-связывающие участки, включающие тяжелую и легкую цепь CDR аминокислотной пары HCVR/LCVR, включающей SEQ ID NO: 2/3. Например, анти-ИЛ-6R антителом может быть антитело или его антиген-связывающий участок, включающий тяжелую цепь CDR (HCDR1, HCDR2 и HCDR3), имеющую аминокислотные последовательности SEQ ID NO: 4, 5 и 6 соответственно; и легкую цепь CDR (LCDR1, LCDR2 и LCDR3), имеющую аминокислотные последовательности SEQ IS NO: 7, 8 и 9 соответственно.
Антагонисты VEGF
Способы настоящего изобретения в соответствии с конкретными вариантами осуществления включают введение антагониста VEGF пациенту. Как применяют здесь, выражение “антагонист VEGF” означает любую молекулу, которая блокирует, снижает или влияет на взаимодействие между VEGF и природным рецептором VEGF, например, молекулы, которые связываются с VEGF или рецептором VEGF и предотвращают или каким-либо другим образом мешают взаимодействию между VEGF и рецептором VEGF. Специфичные типичные антагонисты VEGF включают анти-VEGF антитела, анти-VEGF рецепторные антитела и VEGF рецепторные гибридные молекулы (также называемые здесь “VEGF-ловушки”).
VEGF рецепторные гибридные молекулы включают гибридные полипептиды, которые включают 2 или более иммуноглобулинов (Ig)-подобных участков VEGF рецептора, таких как VEGFR1 (также называемые Flk1 или KDR), а также могут содержать мультимерный участок (например, Fc участок, который обеспечивает мультимеризацию [например, димеризацию], двух и более гибридных полипептидов). Типичная VEGF рецепторная гибридная молекула представляет собой молекулу, называемую VEGFR1R2-FcΔC1 (a), которая кодируется аминокислотной последовательностью SEQ ID NO:10. VEGFR1R2-FcΔC1 (а) включает три компонента: (1) компонент VEGFR1, включающий аминокислоты 27-129 из SEQ ID NO: 11; (2) компонент VEGFR2, включающий аминокислоты 130-231 из SEQ ID NO:11; и (3) мультимеризующий компонент (“FcΔC1 (a)”), включающий аминокислоты 232-457 из SEQ ID NO:11 (C-конечная аминокислота из SEQ ID NO:11 [например, K458] может быть и не быть включена в антагонист VEGF, применяемый в способах изобретения; см., например, US Patent 7396664). Аминокислоты 1-26 из SEQ ID NO: 11 представляют собой сигнальную последовательность.
Комбинированная терапия
Способы настоящего изобретения в соответствии с конкретными вариантами осуществления включают введение пациенту антагониста ИЛ-6 в комбинации с одним или более дополнительными лекарственными средствами, такими как антагонист VEGF и/или антагонист EGFR. Как применяют здесь, выражение “в комбинации с” означает, что дополнительные лекарственные средства вводят до, после или параллельно с антагонистом ИЛ-6. Например, при введении “до” антагониста ИЛ-6, дополнительное лекарственное средство можно вводить приблизительно за 72 часа, приблизительно за 60 часов, приблизительно за 48 часов, приблизительно за 36 часов, приблизительно за 24 часа, приблизительно за 12 часов, приблизительно за 10 часов, приблизительно за 8 часов, приблизительно за 6 часов, приблизительно за 4 часа, приблизительно за 2 часа, приблизительно за 1 час, приблизительно за 30 минут, приблизительно за 15 минут или приблизительно за 10 минут до введения антагониста ИЛ-6. При введении “после” антагониста ИЛ-6 дополнительное лекарственное средство можно вводить через приблизительно 10 минут, через приблизительно 15 минут, через приблизительно 30 минут, через приблизительно 1 час, через приблизительно 2 часа, через приблизительно 4 часа, через приблизительно 6 часов, через приблизительно 8 часов, через приблизительно 10 часов, через приблизительно 12 часов, через приблизительно 24 часа, через приблизительно 36 часов, через приблизительно 48 часов, через приблизительно 60 часов или через приблизительно 72 часа после введения антагониста ИЛ-6. Введение “параллельно” с антагонистом ИЛ-6 означает, что дополнительное лекарственное средство вводят пациенту в отдельной дозировке в пределах менее 5 минут (перед, после и в то же время) от антагониста ИЛ-6, или вводят пациенту в виде единичной комбинированной дозы препарата, включающей как дополнительное лекарственное средство, так и антагонист ИЛ-6 (например, единый препарат, включающий анти-ИЛ-6R антитело + VEGF Ловушку; или единый препарат, включающий анти-ИЛ-6R антитело + анти-EGFR антитело; или единый препарат, включающий анти-ИЛ-6R антитело + анти-ErbB3 антитело; и т.д.).
Фармацевтические композиции и способы введения
Настоящее изобретение включает фармацевтические композиции, включающие антагонист ИЛ-6. Настоящее изобретение также включает фармацевтические композиции, включающие антагонист ИЛ-6 и второй активный компонент, такой как антагонист VEGF и/или антагонист EGFR. Например, настоящее изобретение включает фармацевтические композиции, включающие анти-ИЛ-6R антитело и молекулу VEGF-ловушки; настоящее изобретение также включает фармацевтические композиции, включающие анти-ИЛ-6R антитело и анти-EGFR антитело. Способы лечения, включающие введение таких фармацевтических композиций пациенту, также обсуждаются в рамках настоящего изобретения.
Фармацевтические композиции изобретения выпускают при помощи подходящих носителей, эксципиентов и других средств для обеспечения подходящего трансфера, доставки, устойчивости и т.п. Можно обнаружить множество подходящих препаратов, например, в Reminton’s Pharmaceutical Sciences, Mack Publishing Company, Easton, PA. Подходящие препараты включают, например, порошки, пасты, мази, гели, воски, масла, жиры, липид (катионный или анионный), содержащий везикулы (такой как LIPOFECTIN™), ДНК конъюгаты, ангидридные абсорбционные пасты, эмульсии типа масло-в-воде и вода-в-масле, эмульсии карбовакса (полиэтиленгликоли различного молекулярного веса), полутвердые гели и полутвердые смеси, содержащие карбовакс. Дополнительные подходящие препараты также описаны в Powell с соавторами “Compendium of excipients for parenteral formulations” PDA (1998) О Pharm Sci Technol 52:238-311.
Различные системы доставки известны и могут использоваться для введения фармацевтических композиций настоящего изобретения, например, энкапсулирование в липосомах, микрочастицах, микрокапсулах, рекомбинантных клетках, способных экспрессировать мутантные вирусы, рецепторно-опосредованный эндоцитоз (см., например, Wu с соавторами, 1987, J. Biol. Chem. 262:4429-4432). Способы введения включают, но не ограничиваются внутрикожным, внутримышечным, интраперитонеальным, внутривенным, подкожным, интраназальным, эпидуральным и пероральными путями. Композиции можно вводить любым удобным путем, например, инфузионно или при помощи болюсной инъекции, благодаря всасыванию через эпителиальную и слизисто-кожную выстилки (например, слизистую оболочка рта, прямой кишки и слизистую кишечника и т.д.), а также можно вводить вместе с другими биологически активными средствами.
Фармацевтическую композицию настоящего изобретения можно доставить подкожно или внутривенно при помощи стандартной иглы и шприца. В дополнение, в отношении подкожной доставки, приборы-ручки для доставки легко доставляют фармацевтическую композицию настоящего изобретения. Такой прибор-ручка для доставки может быть для многократного и однократного применения. В приборах-ручках для многократной доставки в целом применяются замещаемые картриджи, которые содержат фармацевтическую композицию. После введения всей фармацевтической композиции картриджа и опустошения картриджа, пустой картридж можно легко удалить и заменить новым, который содержит фармацевтическую композицию. Прибор-ручку для доставки можно снова использовать. В приборах-ручках для однократного применения заменяемый картридж отсутствует. Более того, прибор-ручка для однократного применения поступает уже заполненным фармацевтической композицией, содержащейся в емкости прибора. После опустошения фармацевтической композиции прибора весь прибор выбрасывается.
Множество многократно применяемых ручек и аутоинъекционных приборов для доставки находят применение в подкожной доставке фармацевтической композиции настоящего изобретения. Примеры включают, но не ограничиваются AUTOPEN™ (Owen Mumford, Inc., Woodstock, UK), ручкой DISETRONIC™ (Disetronic Medical Systems, Bergdorf, Switzerland), ручкой HUMALOG MIX 75/25™, ручкой HUMALOG™, ручкой HUMALIN 70/30™ (Eli Lilly and Co., Indianapolis, IN), NOVOPEN™ I, II и III (Novo Nordisk, Copenhagen, Denmark), NOVOPEN JUNIOR™ (Novo Nordisk, Copenhagen, Denmark), ручкой BD™ (Becton Dickinson, Franklin Lakes, NJ), OPTIPEN™, OPTIPEN PRO™, OPTIPEN STARLET™ и OPTICLIK™ (sanofi-aventis, Frankfurt, Germany), если называть только некоторые из них. Примеры приборов-ручек для одноразовой доставки, находящих применение для подкожной доставки фармацевтической композиции настоящего изобретения, включают, но не ограничиваются ручкой SOLOSTAR™ (sanofi-aventis), FLEXPEN™ (Novo Nordisk), KWIKPEN™ (Eli Lilly), автошприцем SURECLIK™ (Amgen, Thousand Oaks, CA), PENLET™ (Haselmeier, Stuttgart, Germany), EPIPEN (Dey, L.P.) и ручкой HUMIRA™ (abbott Labs, Abbott Park IL), если называть только некоторые из них.
В конкретных ситуациях фармацевтические композиции настоящего изобретения можно доставить при помощи контролируемой системы высвобождения. В одном варианте осуществления можно применять помпу (см. Langer, supra; Sefton, 1987, CRC Crit. Ref. Biomed. Eng. 14:201). В другом варианте осуществления можно применять полимерные материалы; см. Medical Applications of Controlled Release, Langer and Wise (eds.), 1974, CRC Pres., Boca Raton, Florida. В еще одном варианте осуществления контролируемую систему высвобождения можно разместить вблизи цели композиции, таким образом, требуется только часть системной дозы (см., например, Goodson, 1984, in Medical Applications of Controlled Release, supra, vol. 2, pp. 115-138). Другие контролируемые системы высвобождения обсуждаются в обзоре Langer, 1990, Science 249: 1527-1533.
Инъецируемые препараты могут включать формы для внутривенного, подкожного, внутрикожного и внутримышечного введения, капельного введения и т.д. Эти вводимые препараты можно приготовить при помощи известных способов приготовления. Например, инъецируемый препарат можно приготовить, например, путем растворения, суспендирования или эмульгирования антитела или его соли, описанной выше, в стерильной водной среде или в масляной среде, обычно применяемой для инъекций. В качестве водной среды для инъекций существуют, например, физиологический раствор, изотонический раствор, содержащий глюкозу и другие вспомогательные вещества, и т.д., которые можно применять в комбинации с подходящим растворителем, таким как спирт (например, этанол), полиспирт (например, пропиленгликоль, полиэтиленгликоль), неионный сурфактант [например, полисорбат 80, HCO-50 (полиоксиэтилен (50 моль) продукт гидрогенизированного касторового масла)] и т.д. В качестве масляной среды применяют, например, кунжутное масло, соевое масло и т.д., которые можно применять в комбинации с растворителем, таким как бензилбензоат, бензиловый спирт и т.д. Инъекции, приготовленные таким образом, предпочтительно заполняют подходящие ампулы.
Предпочтительно фармацевтические композиции для перорального и парентерального применения, описанные выше, приготавливают в форме с единичной дозой, подходящей для дозировки активных ингредиентов. Такие формы в единичной дозировке включают, например, таблетки, пилюли, капсулы, инъекции (ампулы), свечи и т.д.
Дозировка
Количество активного (-ых) ингредиента (-ов) (например, антагониста ИЛ-6, антагониста VEGF, антагониста EGFR и т.д.), которое можно вводить пациенту представляет собой, в целом, терапевтически эффективное количество. Как применяют здесь, фраза «терапевтически эффективное количество» означает дозировку антиген-специфичных связывающих белков и/или антиген-связывающих молекул, которая приводит к снижению роста опухоли или веса по меньшей мере на 5% относительно отрицательного контроля при введении животному с опухолью (см., например, пример 1 здесь). Например, «терапевтически эффективное количество» ИЛ-6R-специфически связывающего белка, VEGF-специфически связывающего (-их) белка (-ов) и/или EGFR-специфически связывающего белка включает, например, количество такого антиген-специфичного связывающего белка (-ов) так, что при введении животному, имеющему опухоль, вызывает снижение роста опухоли или веса на по меньшей мере 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 100% относительно отрицательного контроля пролеченных животных.
В случае антиген-специфичных связывающих белков настоящего изобретения (например, анти-ИЛ-6R антител, анти-EGFR антител, анти-ErbB3 антител и/или молекулы VEGF-ловушки), терапевтически-эффективное количество может составлять от приблизительно 0,05 мг до приблизительно 600 мг; например приблизительно 0,05 мг, приблизительно 0,1 мг, приблизительно 1,0 мг, приблизительно 1,5 мг, приблизительно 2,0 мг, приблизительно 10 мг, приблизительно 20 мг, приблизительно 30 мг, приблизительно 40 мг, приблизительно 50 мг, приблизительно 60 мг, приблизительно 70 мг, приблизительно 80 мг, приблизительно 90 мг, приблизительно 100 мг, приблизительно 110 мг, приблизительно 120 мг, приблизительно 130 мг, приблизительно 140 мг, приблизительно 150 мг, приблизительно 160 мг, приблизительно 170 мг, приблизительно 180 мг, приблизительно 190 мг, приблизительно 200 мг, приблизительно 210 мг, приблизительно 220 мг, приблизительно 230 мг, приблизительно 240 мг, приблизительно 250 мг, приблизительно 260 мг, приблизительно 270 мг, приблизительно 280 мг, приблизительно 290 мг, приблизительно 300 мг, приблизительно 310 мг, приблизительно 320 мг, приблизительно 330 мг, приблизительно 340 мг, приблизительно 350 мг, приблизительно 360 мг, приблизительно 370 мг, приблизительно 380 мг, приблизительно 390 мг, приблизительно 400 мг, приблизительно 410 мг, приблизительно 420 мг, приблизительно 430 мг, приблизительно 440 мг, приблизительно 450 мг, приблизительно 460 мг, приблизительно 470 мг, приблизительно 480 мг, приблизительно 490 мг, приблизительно 500 мг, приблизительно 510 мг, приблизительно 520 мг, приблизительно 530 мг, приблизительно 540 мг, приблизительно 550 мг, приблизительно 560 мг, приблизительно 570 мг, приблизительно 580 мг, приблизительно 590 мг, или приблизительно 600 мг соответствующего антиген-специфичного связывающего белка. Например, в соответствии с конкретными специфическими вариантами осуществления, в которых вводят анти-ИЛ-6R антитело (например, mAb1, обсуждаемый здесь), антитело можно вводить пациенту в дозировке 100 мг, 150 мг или 200 мг (например, с частотой раз в неделю, раз в две недели и т.д.).
Количество антиген-специфичных связывающих белков настоящего изобретения, содержащееся в индивидуальной дозировке, можно выражать в терминах миллиграммы антитела на килограмм веса тела пациента (т.е. мг/кг). Например, анти-ИЛ-6R антитела, анти-EGFR антитела и анти-ErbB3 антитела и/или молекулы VEGF-ловушки настоящего изобретения можно вводить пациенту в дозировке приблизительно 0,0001 на приблизительно 50 мг/кг веса тела пациента (например, 0,5 мг/кг, 1,0 мг/кг, 1,5 мг/кг, 5,0 мг/кг, 10 мг/кг, 12,5 мг/кг, 15 мг/кг, 16 мг/кг, 17 мг/кг, 18 мг/кг, 19 мг/кг, 20 мг/кг, 21 мг/кг, 22 мг/кг, 23 мг/кг, 24 мг/кг, 25 мг/кг, 26 мг/кг, 27 мг/кг, 28 мг/кг, 29 мг/кг, 30 мг/кг, 35 мг/кг, 40 мг/кг и т.д.). В соответствии с конкретными типичными вариантами осуществления количество молекулы VEGF-ловушки, вводимое пациенту в конкретной дозировке, составляет 4 мг/кг или 6 мг/кг.
Активные ингредиенты (например, анти-ИЛ-6R антитела, анти-EGFR антитела и анти-ErbB3 антитела и/или молекулы VEGF-ловушки) могут присутствовать в композиции настоящего изобретения в равных количествах или, как вариант, могут присутствовать в количествах, которые варьируют один от другого в 0,5, 1, 1,5, 2, 2,5, 3, 4, 5 или более раз. Средний специалист в области техники при помощи обычного эксперимента сможет определить подходящие количества индивидуальных компонентов в композиции настоящего изобретения, необходимые для оказания желаемого терапевтического действия.
Режимы введения
В соответствии с конкретными вариантами осуществления настоящего изобретения множественные дозы композиции настоящего изобретения (например, композиции, включающие антагонист ИЛ-6, антагонист VEGF и/или антагонист EGFR) можно вводить пациенту в течение определенного курса лечения. Способы в соответствии с этим вопросом изобретения включают последовательное введение пациенту множественных дозировок композиции (-ий) настоящего изобретения. Как применяют здесь, «последовательное введение» означает, что каждую дозировку композиции (-ий) настоящего изобретения вводят пациенту в другой промежуток времени, например, в разные дни, разделенные предопределенным интервалом (например, часами, днями, неделями или месяцами). Настоящее изобретение включает способы, которые включают последовательное введение пациенту начальной дозировки композиции настоящего изобретения, и далее одной или более вторичных дозировок композиции, за чем опционально может следовать одна или более третичные дозировки композиции.
Термин «начальная дозировка», «вторичные дозировки» и «третичные дозировки» относятся к временной последовательности введения композиций настоящего изобретения. Таким образом, «начальная дозировка» представляет собой дозировку, которую вводят в начале режима лечения (также называется «базовая дозировка»), «вторичные дозировки» представляют собой дозировки, которые вводят после начальной дозировки; и «третичные дозировки» представляют собой дозировки, которые вводят после вторичных дозировок. Начальные, вторичные и третичные дозировки могут все содержать одно и то же количество активного (-ых) ингредиента (-ов), но в целом отличаются друг от друга в показаниях частоты введения. В конкретных вариантах осуществления, тем не менее, количество активного (-ых) ингредиента (-ов), содержащегося в начальных, вторичных и третичных дозировках, отличается друг от друга (например, отрегулирована вверх или вниз должным образом).
В одном типичном варианте осуществления настоящего изобретения каждую вторичную и/или третичную дозировку вводят спустя от 1 до 30 дней (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или более) после непосредственно предшествующей дозировки. Фраза «непосредственно предшествующая дозировка», как применяют здесь, означает в последовательности множественных введений дозировку (-и) композиций настоящего изобретения, которые вводят пациенту до введения следующей дозировки в последовательности без промежуточных дозировок.
Способы по этому вопросу изобретения могут включать введение пациенту любого числа вторичных и/или третичных дозировок композиции настоящего изобретения. Например, в конкретных вариантах осуществления только единичную вторичную дозировку вводят пациенту. В других вариантах осуществления две или более ( например, 2, 3, 4, 5, 6, 7, 8 или более) вторичных дозировок вводят пациенту. Сходным образом в конкретных вариантах осуществления только единичную третичную дозировку вводят пациенту. В других вариантах осуществления две или более (например, 2, 3, 4, 5, 6, 7, 8 или более) третичных дозировок вводят пациенту.
В вариантах осуществления, включающих множественные вторичные дозировки, каждую вторичную дозировку можно вводить с той же частотой, что и другие вторичные дозировки. Например, каждую вторичную дозировку можно вводить пациенту от 1 до 29 дней после непосредственно предшествующей дозировки. Сходным образом в вариантах осуществления, включающих множественные третичные дозировки, каждую третичную дозировку можно вводить с той же частотой, что и другие третичные дозировки. Например, каждую третичную дозировку можно вводить пациенту от 1 до 60 дней после непосредственно предшествующей дозировки. Как вариант, частота, при которой вторичные или третичные дозировки вводят пациенту, может варьировать в течение курса режима лечения. Частоту введения врач также может изменять в течение курса лечения в зависимости от нужд конкретного пациента после клинического обследования.
ПРИМЕРЫ
Следующие примеры размещены таким образом, чтобы предоставить средним специалистам в области техники полное раскрытие и описание того, как сделать и применять способы и композиции изобретения, и они не склонны ограничивать объем того, что изобретатели рассматривают в качестве их изобретения. Прилагали усилия для выверения точности относительно применяемых чисел (например, количества, температуры и т.д.), но некоторые экспериментальные ошибки и отклонения должны приниматься во внимание. Если не указано иного, доли представляют собой массовые доли, молекулярный вес представляет собой среднюю молекулярную массу, температуру выражают в градусах Цельсия, и давление равно или близко к атмосферному.
Пример 1. Моноклональное антитело Анти-ИЛ-6R ингибирует рост ксенотрансплантатной опухоли в качестве одиночного средства и в комбинации с другими противоопухолевыми средствами
Лекарственные средства
Этот пример демонстрирует введение анти-ИЛ-6R антитела в одиночку и в комбинации с VEGF-ловушкой, анти-EGFR антителом или с анти-ErbB3 антителом мышам с опухолью. Анти-ИЛ-6R антитело, применяемое в этом Примере, также называемое здесь «анти-ИЛ-6R mAb1», представляет собой антитело, включающее тяжелую цепь CDR (HCDR1, HCDR2 и HCDR3), имеющую аминокислотные последовательности из SEQ ID NO: 4, 5 и 6 соответственно; и легкую цепь CDR (LCDR1, LCDR2 и LCDR3), имеющую аминокислотные последовательности из SEQ ID NO: 7, 8 и 9 соответственно (то есть анти-ИЛ-6R антитело, обозначенное VQ8F11-21 в патенте US № 7582298). VEGF-Ловушка, применяемая в этом Примере, представляет собой димер двух слитых полипептидов, каждый из которых включает: (1) VEGFR1 компонент, включающий аминокислоты с 27 по 129 из SEQ ID NO:11; (2) VEGFR2 компонент, включающий аминокислоты с 130 по 231 из SEQ ID NO:11; и (3) мультимеризующий компонент («FcΔC1(a)»), включающий аминокислоты с 232 по 457 из SEQ ID NO:11; (то есть VEGFR1R2-FcΔC1(a) в патенте US № 7396664). Анти-EGFR антитело, применяемое в этом Примере, также называется здесь «анти-EGFR mAb2» и представляет собой полное человеческое антитело, полученное против внеклеточного домена EGFR/ErbB1/HER1 человека. Анти-ErbB3 антитело, применяемое в этом Примере, также называется здесь «анти-ErbB3 mAb3» и представляет собой полное человеческое антитело, созданное против ErbB3 (то есть антитело, называемое H4H1821N в патентной заявке US № 13/623885, поданной 21 сентября 2012 года.
Процедуры эксперимента и результаты
В начале эксперимента культивируемые А549, Calu3 и Du145 клетки обрабатывают: (i) 10 мкг/мл человеческим Fc контрольным белком («hFc»), (ii) 10 мкг/мл анти-ИЛ-6R mAb1, (iii) 10 нг/мл ИЛ-6 плюс 10 мкг/мл hFc или (iv) 10 нг/мл ИЛ-6 плюс 10 мкг/мл анти-ИЛ-6R mAb1. Человеческий Fc или анти-ИЛ-6R mAb1 добавляют к культивируемым клеткам на 16 часов, и ИЛ-6 добавляют к hFc или анти-ИЛ-6R mAb1 предобработанным клеткам на 30 минут. Клетки затем лизируют и проводят вестерн-блоттинг для оценки уровней фосфо-STAT3 и общего STAT3. Как показано на Фигуре 1, все три линии опухолевых клеток показали как конститутивный, так и ИЛ-6-индуцируемый фосфо-STAT3, который ингибируется анти-ИЛ-6R mAb1.
Далее изучают эффект анти-ИЛ-6R mAb1, VEGF-ловушки или комбинации анти-ИЛ-6R mAb1 плюс VEGF-ловушки на рост Du145 клеток карциномы простаты человека. Кратко, 5×106 Du145 клеток (ATCC) имплантируют подкожно в бок 6-8 недельных SCID мышей (Taconic, Hudson, NY). После достижения опухолями среднего объема ~200 мм3, мышей случайным образом распределяют по группам лечения (n=5 мышей в каждой группе). Мышам вводят человеческий Fc контрольный белок (25 мг/кг), анти-ИЛ-6R mAb1 (25 мг/кг), VEGF-ловушку (25 мг/кг) или комбинацию анти-ИЛ-6R mAb1 и VEGF-ловушки (25+25 мг/кг). Все белки вводят при помощи подкожной инъекции дважды в неделю. Объемы опухоли измеряют дважды в неделю в течение всего курса эксперимента (на 35, 39, 42, 46, 49, 53, 56, 60, 63 и 67 день после имплантации). Средний рост опухоли от начала лечения вычисляют для каждой группы. Процент снижения роста опухоли высчитывают по сравнению с Fc контрольной группой. Результаты резюмированы в Таблице 1.
|
Анализ первичных данных, лежащих в основе результатов, резюмированных в Таблице 1, подтверждает, что снижение роста опухоли, наблюдаемое у мышей, получающих комбинацию анти-ИЛ-6R mAb1 + VEGF-ловушку статистически достоверно по сравнению со снижением, наблюдаемым у мышей, получающих только анти-ИЛ-6R mAb1 (p=0,0004).
Опухоли Du145 у мышей, получающих hFc (25 мг/кг), или анти-ИЛ-6R mAb1 (25 мг/кг) иссекают и разделяют. Иммуногистохимический анализ проводят при помощи антител, специфичных к фосфо-STAT3 или расщепленной каспазе 3 в качестве маркера апоптоза. Опухоль, лечащаяся анти-ИЛ-6R mAb1, показывает меньшее окрашивание для фосфо-STAT3 и повышенное окрашивание для расщепленной каспазы 3, что означает, что Du145 опухоли имеют активное ИЛ-6/STAT3 сигнализирование, которое способствует выживанию опухолевых клеток. Это предполагает, что ИЛ-6 обеспечивает сигналы выживания для опухолевых клеток.
В следующем эксперименте изучается эффект анти-ИЛ-6R mAb1, ингибирующего анти-EGFR антитела («анти-EGFR mAb2») или комбинации анти-ИЛ-6R mAb1 плюс анти-EGFR mAb2 на рост Calu3 ксенотрансплататной легочной аденокарциномы человека. Кратко, 5×106 клеток Calu3 (ATCC) имплантируют подкожно в бок 6-8 недельных SCID мышей (Taconic, Hudson, NY). После достижения опухолями среднего объема 150-200 мм3, мышей случайным образом распределяют по группам лечения (n=5 мышей в каждой группе). Мышам вводят человеческий Fc контрольный белок (25 мг/кг), анти-ИЛ-6R mAb1 (12,5 мг/кг), анти-EGFR mAb2 (12,5 мг/кг) или комбинацию анти-ИЛ-6R mAb1 плюс анти-EGFR mAb2 (12,5+12,5 мг/кг). Все белки вводят при помощи подкожной инъекции дважды в неделю. Объемы опухоли измеряют дважды в неделю в течение всего курса эксперимента (на 34, 37, 41, 44, 48, 51, 54 и 57 день после имплантации). Средний рост опухоли от начала лечения вычисляют для каждой группы. Процент снижения роста опухоли высчитывают по сравнению с Fc контрольной группой. Результаты резюмированы в Таблицах 2 и 3.
|
|
Анализ первичных данных, лежащих в основе результатов, резюмированных в Таблице 2, подтверждает, что снижение роста опухоли, наблюдаемое у мышей, получающих комбинацию анти-ИЛ-6R mAb1 + анти-EGFR mAb2 статистически достоверно по сравнению со снижением, наблюдаемым у мышей, получающих только анти-ИЛ-6R mAb1 (p<0,0001) или только анти-EGFR mAb2 (p<0,0005).
В следующем эксперименте изучается эффект анти-ИЛ-6R mAb1, ингибирующего анти-ErbB3 антитела («анти-ErbB3 mAb3») или комбинации анти-ИЛ-6R mAb1 плюс анти-ErbB3 mAb3 на рост A549 ксенотрансплататной легочной аденокарциномы человека. Кратко, 1×107 клеток A549 (ATCC Cat. № CCL-185) имплантируют подкожно в бок 6-8 недельных SCID мышей (Taconic, Hudson, NY). После достижения опухолями среднего объема 400 мм3 мышей случайным образом распределяют по группам лечения (n=6 мышей в каждой группе). Мышам вводят человеческий Fc контрольный белок (25 мг/кг), анти-ИЛ-6R mAb1 (12,5 мг/кг), анти-ErbB3 mAb3 (12,5 мг/кг) или комбинацию анти-ИЛ-6R mAb1 плюс анти-ErbB3 mAb3 (12,5 + 12,5 мг/кг). Все белки вводят при помощи подкожной инъекции дважды в неделю. Объемы опухоли измеряют дважды в неделю в течение всего курса эксперимента (на 59, 62, 66, 69, 74, 77, 80, 83, 87 и 90 день после имплантации). Средний рост опухоли от начала лечения вычисляют для каждой группы. Процент снижения роста опухоли высчитывают по сравнению с Fc контрольной группой. Результаты резюмированы в Таблицах 4 и 5.
|
|
Наконец, исследуют эффект анти-ИЛ-6R на рост A549 ксенотрансплататной легочной аденокарциномы человека. Кратко, 5×105 клеток A549 (ATCC Cat. № CCL-185) имплантируют подкожно в бок 6-8 недельных SCID мышей (Taconic, Hudson, NY). После достижения опухолями среднего объема ~100 мм3, мышей случайным образом распределяют по группам лечения (n=5 мышей в каждой группе). Мышам вводят человеческий Fc контрольный белок (25 мг/кг), анти-ИЛ-6R mAb1 (2,5 мг/кг) или анти-ИЛ-6R mAb1 (25мг/кг) Все белки вводят при помощи подкожной инъекции дважды в неделю. Объемы опухоли измеряют дважды в неделю в течение всего курса эксперимента. Средний рост опухоли от начала лечения вычисляют для каждой группы. Процент снижения роста опухоли высчитывают по сравнению с Fc контрольной группой. Результаты резюмированы в Таблице 6.
|
Вывод
Этот пример иллюстрирует, что анти-ИЛ-6R mAb1 ингибирует рост Du145, Calu3 и A549 ксенотрансплантатных опухолей в качестве одиночного средства. Более того, лечение при помощи комбинации анти-ИЛ-6R mAb1 плюс VEGF-ловушки ингибирует рост Du145 ксенотрансплантатных опухолей более эффективно по сравнению с любым средством по отдельности. Также, лечение комбинацией анти-ИЛ-6R mAb1 плюс ингибирующего анти-EGFR антитела (анти-EGFR mAb2) ингибирует рост Calu3 ксенотрансплантатных опухолей более эффективно по сравнению с каждым средством по отдельности.
Эти результаты показывают, что анти-Ил-6R mAb1 предпочтительно ингибирует рост опухолей, который показывают аутокринное ИЛ-6/STAT3 сигнализирование, что предполагает возможность того, что иммуногистохимический анализ биоптата опухоли на уровни ИЛ-6 и/или фосфо-STAT3 может быть полезен для определения пациентов, которые наиболее выиграют от лечения анти-ИЛ-6R. Более того, анти-ИЛ-6R mAb1 снижает уровень фосфо-STAT3 и повышает уровень расщепленной каспазы-3 в ксенотрансплантатных опухолях, что предполагает, что сигнализирование ИЛ-6/STAT3 обеспечивает сигналы выживания для опухолевых клеток.
Пример 2. Анти-ИЛ-6R моноклональное антитело в комбинации с VEGF антагонистом ингибирует рост анти-МУПА-резистентных опухолей
Введение
Тип А431 линии клеток эпидермоидной карциномы человека, которая является резистентной к действию VEGF-ловушки, изолируют серийным пассажем в присутствии VEGF-ловушки in vivo. Тип линии клеток называется здесь «A431-V2», и родительская А431 клеточная линия называется здесь «А431-Р».
Эксперименты сначала проводятся для оценки относительных уровней ИЛ-6, экспрессированного в А431-V2 линии клеток по сравнению с линией клеток А431-Р. С этой целью кондиционированную среду собирают от культивируемых А431-V2 или А431-Р клеток и проводят ELISA для измерения концентрации ИЛ-6 человека. Как показано на Фигуре 2(а)б А431-V2 экспрессирует гораздо более высокие уровни ИЛ-6, чем это делает родительская линия клеток А431 (178 пг/мл против 29 пг/мл).
Далее измеряют уровни фосфо-STAT3 в вариантных и родительских А431 клетках. Конкретно, культивируемые А431-Р и А431-V2 клетки обрабатывают человеческим Fc (10 мкг/мл) или анти-ИЛ-6R mAb1 (10 мкг/мл). Изготовляют лизаты клеток и проводят вестерн-блоттинг для оценки уровней фосфо-STAT3. Как показано на Фигуре 2(b), базовый уровень фосфо-STAT3 повышен в клетках А431-V2 по сравнению с А431-Р клетками, и значительно снижен после лечения анти-ИЛ-6R mAb1.
C учетом изложенных выше экспериментальных наблюдений, эффект комбинационного лечения, включающего полное человеческое анти-ИЛ-6R антитело плюс VEGF-ловушку, на рост А431-V2 ксенотрансплантатной опухоли далее протестирован в этом Примере.
Процедуры эксперимента и результаты
Кратко, 1×106 клеток А431-V2 имплантируют подкожно в бок 6-8 недельных SCID мышей (Taconic, Hudson, NY). После достижения опухолями среднего объема ~200 мм3, мышей случайным образом распределяют по группам лечения (n=5 мышей в каждой группе). Мышам вводят человеческий Fc контрольный белок (25 мг/кг), анти-ИЛ-6R mAb1 (25 мг/кг), VEGF-ловушку (25 мг/кг) или комбинацию анти-ИЛ-6R mAb1 плюс VEGF-ловушку (25+25 мг/кг). Все белки вводят при помощи подкожной инъекции дважды в неделю. Объемы опухоли измеряют дважды в неделю в течение всего курса эксперимента (на 15, 18, 22, 25 и 28 день после имплантации). Средний рост опухоли от начала лечения вычисляют для каждой группы. Процент снижения роста опухоли высчитывают по сравнению с Fc контрольной группой. Результаты резюмированы в Таблице 7.
|
Анализ первичных данных, лежащих в основе результатов, резюмированных в Таблице 7, подтверждает, что снижение роста опухоли, наблюдаемое у мышей, получающих комбинацию анти-ИЛ-6R mAb1 + VEGF-ловушку статистически достоверно по сравнению со снижением, наблюдаемым у мышей, получающих как только анти-ИЛ-6R mAb1 (p=0,0001), так и только VEGF-ловушку (р=0,0041).
Вывод
Как показано в этом Примере, опухоли А431-V2 являются резистентными к лечению одиночным средством VEGF-ловушкой, давая только 36% снижение роста опухоли относительно пациентов контрольной группы лечения. Эти опухоли, тем не менее, реагируют на комбинационное лечение анти-ИЛ-6R mAb1 плюс VEGF-ловушка, что предполагает, что ИЛ-6 относится к VEGF-ловушка-резистентному фенотипу опухолей А431-V2. Исходные данные показывают, что повышенное сигнализирование ИЛ-6 в А431-V2 опухолях, не предотвращает возможность для VEGF-ловушки снизить васкуляризацию опухоли, что предполагает, что сигнализирование ИЛ-6 усиливает возможность опухолевых клеток пролиферировать и/или выживать, когда функция сосудистой системы опухоли нарушена. Это наблюдение согласуется с возможностью анти-ИЛ-6R mAb1 потенциировать эффект VEGF-ловушки и на Du145 опухоли (см. Пример 1).
В итоге, данные, представленные здесь и выше, показывают, что уровни ИЛ-6/STAT3 сигнализирования можно применять для определения анти-VEGF-резистентных опухолей, и что ИЛ-6 антагонизм (например, лечения при помощи анти-ИЛ-6R mAb1) является полезной терапевтической стратегией для лечения многих типов рака, как в качестве одиночного средства, так и в комбинации с антагонистами VEGF, особенно в контексте анти-VEGF-резистентных опухолей.
Настоящее изобретение не ограничено в объеме конкретными вариантами осуществления, описанными здесь. На самом деле, различные модификации изобретения в дополнение к описанным здесь станут очевидными для специалистов в области техники после вышеизложенного описания и сопроводительных фигур. Такие модификации попадают под действие прилагаемых пунктов формулы изобретения.