Результат интеллектуальной деятельности: ГУМАНИЗИРОВАННЫЕ FCγR МЫШИ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Область техники, к которой относится изобретение, представляет собой генетически модифицированных животных, не относящихся к человеку, у которых отсутствуют гены эндогенного мышиного FcγR, генетически модифицированных животных, которые содержат замену генов эндогенного FcγR на гены человеческого FcγR, мышей, способных к экспрессии, по меньшей мере, двух, трех, четырех или пяти генов функционального человеческого низкоаффинного FcγR, и генетически модифицированных мышей, содержащих иммунные клетки, которые не экспрессируют гены эндогенного низкоаффинного FcγR.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Fc-рецепторы (FcR) представляют собой белки, обнаруживаемые на поверхности клеток иммунной системы, которые выполняют разнообразные функции иммунной системы у млекопитающих. FcR существуют у разнообразных типов, на разнообразных клетках и опосредуют разнообразные иммунные функции, такие как, например, связывание с антителами, которые прикрепляются к инфицированным клеткам или инвазивным патогенам, стимулируя фагоцитарные или цитотоксические клетки к разрушению микробов, или инфицированным клеткам посредством опосредованного антителом фагоцитоза или антителозависимой клеточноопосредованной цитотоксичности (ADCC).
ADCC представляет собой процесс, посредством которого эффекторные клетки иммунной системы лизируют клетку-мишень, связанную антителами. Этот процесс зависит от предшествующего подвергания воздействию чужеродного антигена или клетки, приводящего в результате к гуморальному ответу. ADCC может быть опосредована через эффекторные клетки, такие как, например, естественные клетки-киллеры (NK), посредством связывания FcR, экспрессируемого на поверхности эффекторной клетки с Fc частью антитела, которая сама является связанной с чужеродным антигеном или клеткой. Вследствие главной роли, которую FcR играют в иммунном ответе, необходимыми являются пригодные животные, не относящиеся к человеку, которые ко-экспрессируют множество человеческих FcR, включая животных, не относящихся к человеку, которые ко-экспрессируют множество человеческих низкоаффинных FcR. Существует потребность в нечеловеческих животных моделях функции человеческого FcR и человеческих процессов ADCC для исследования и выяснения терапий заболеваний человека, в особенности противоопухолевых терапий и терапий для лечения аутоиммунных заболеваний, и разработки фармацевтических лекарственных средств, особенно разработки, конструирования и тестирования фармацевтических средств на основе человеческих антител.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
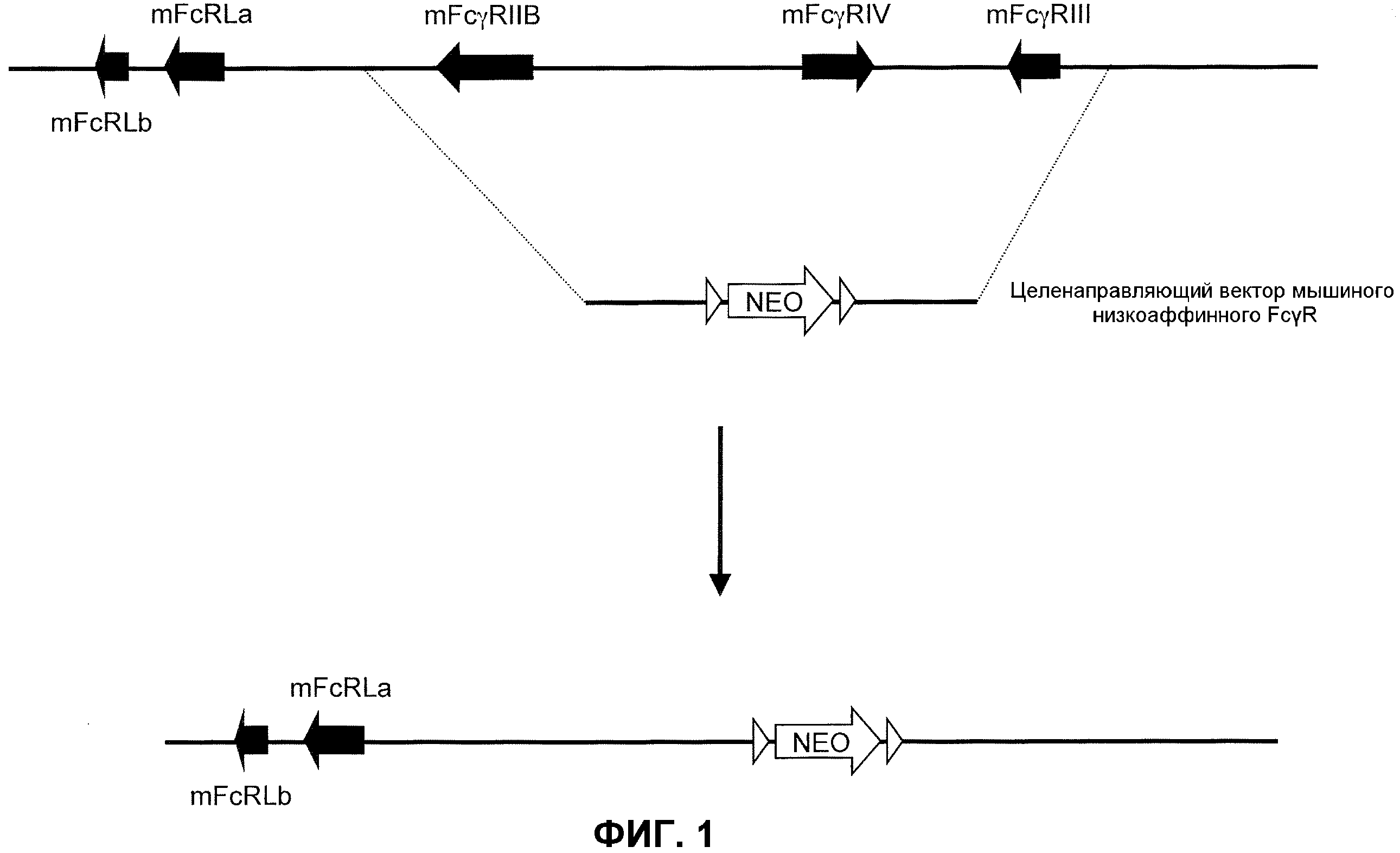
Фиг.1 представляет собой схематическое изображение локуса дикого типа низкоаффинного FcγR у мыши, показывающее мышиные гены FcγRIIB, FcγRIV и FcγRIII и мышиный целенаправляющий вектор FcγR, применяемый для направленной делеции этих генов, который включает неомициновую кассету, фланкированную сайтами сайт-специфической рекомбинации.
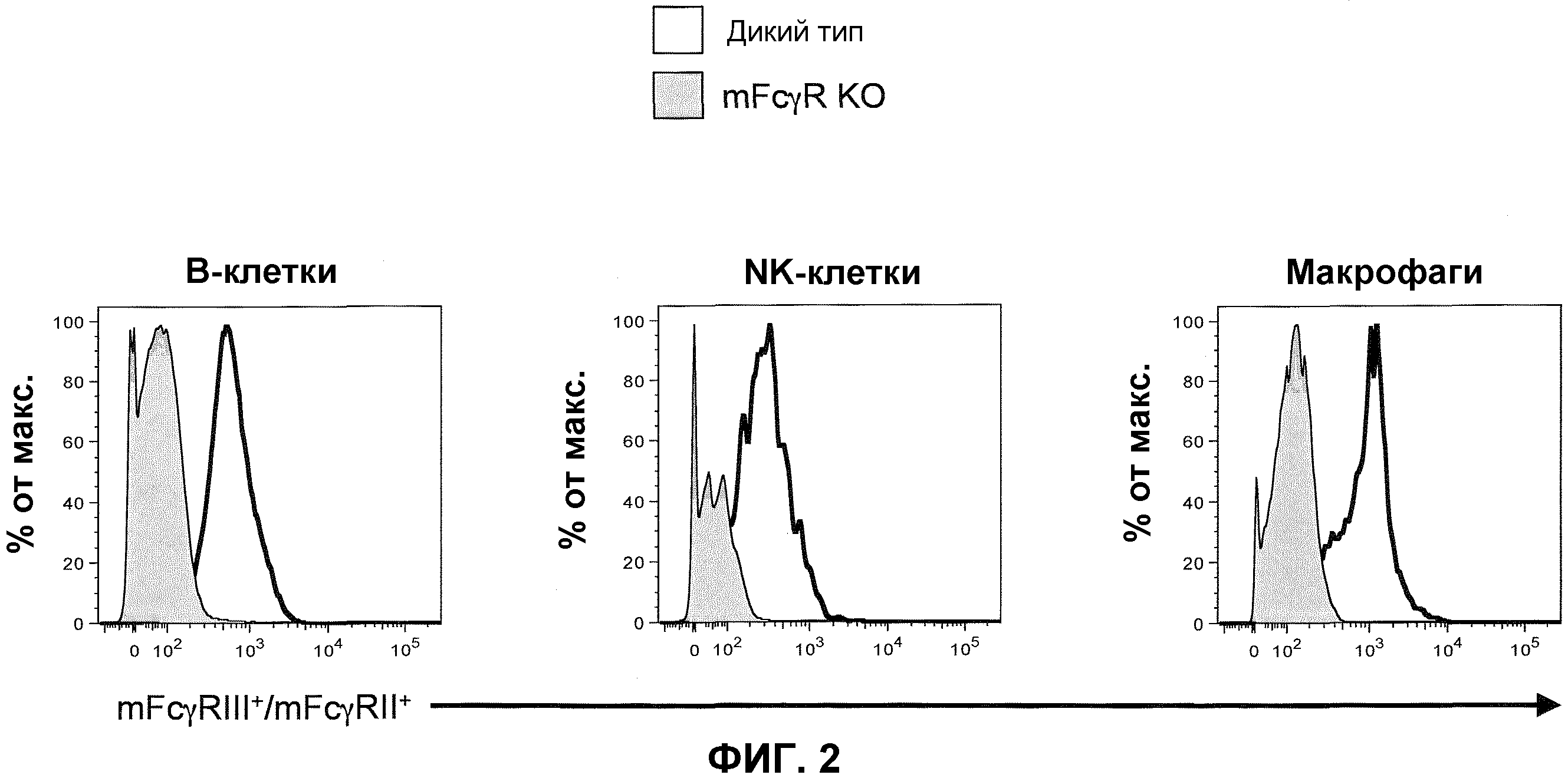
Фиг.2 показывает гистограммы спленоцитов, имеющих порог для B-клеток (против-CD19), NK-клеток (против-NKp46) и макрофагов (против-F4/80,) включающих экспрессию генов эндогенных mFcγRII и mFcγRIII для ген-дефицитных мышей (мышей с отсутствием генов) α-цепи дикого типа и низкоаффинного FcγR (mFcγR KO).
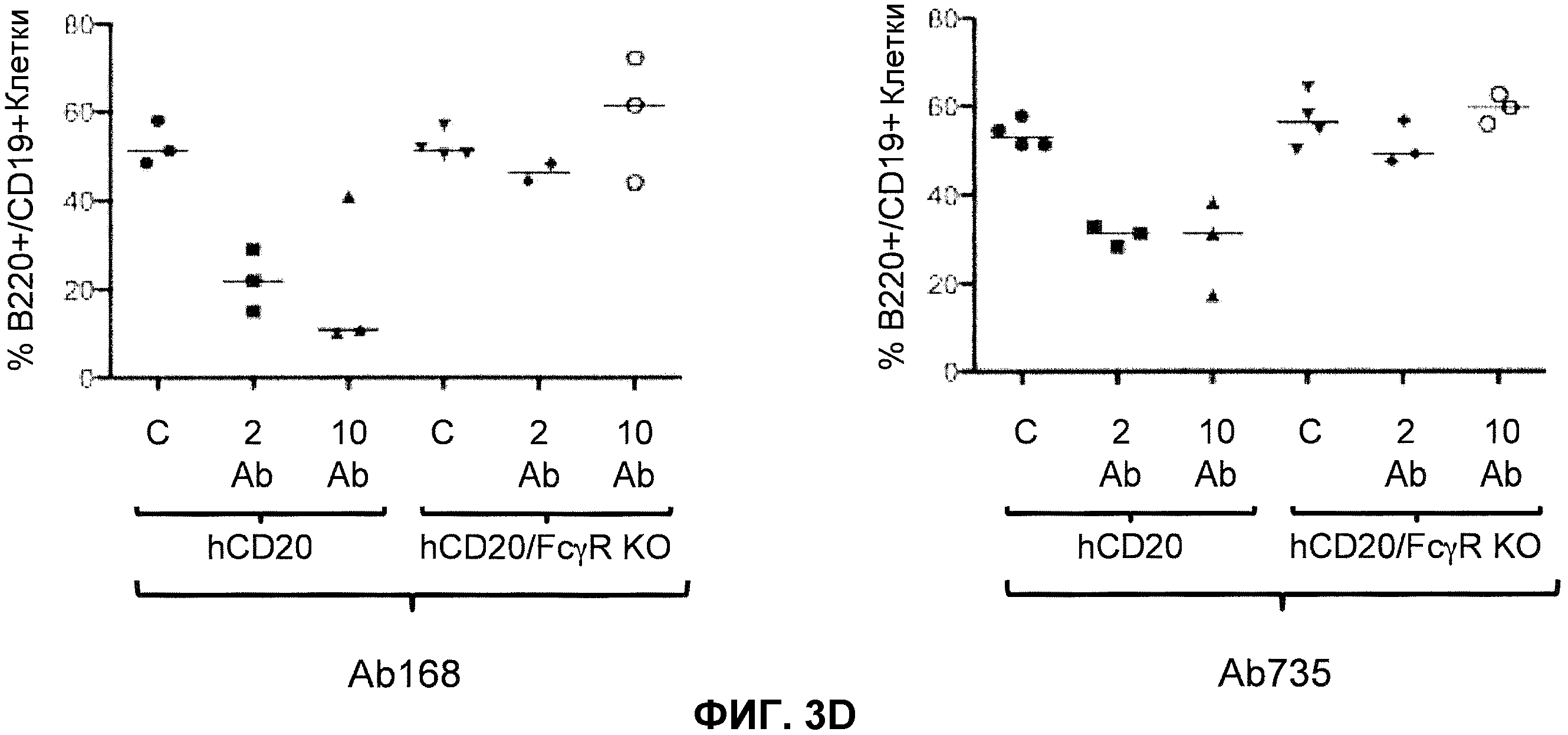
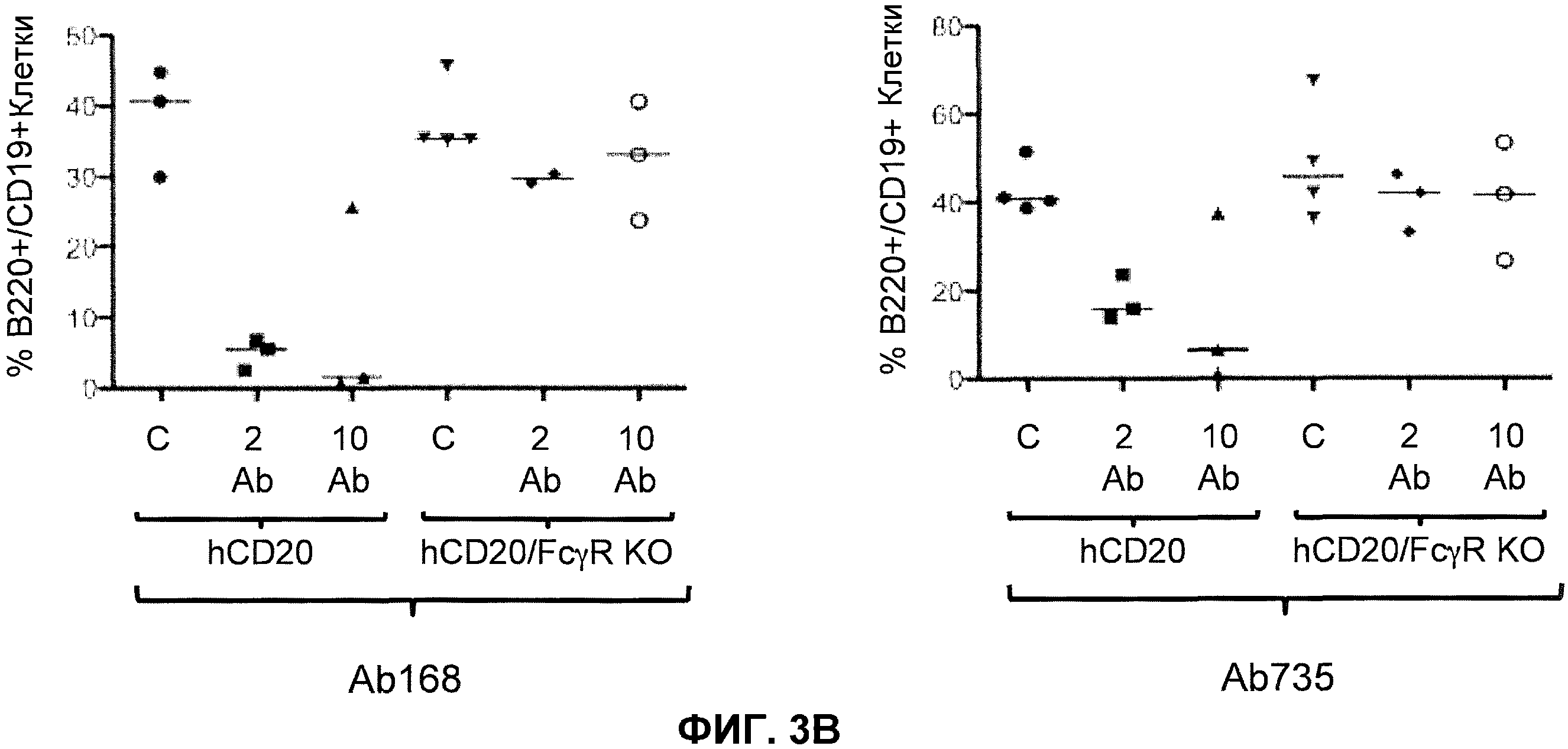
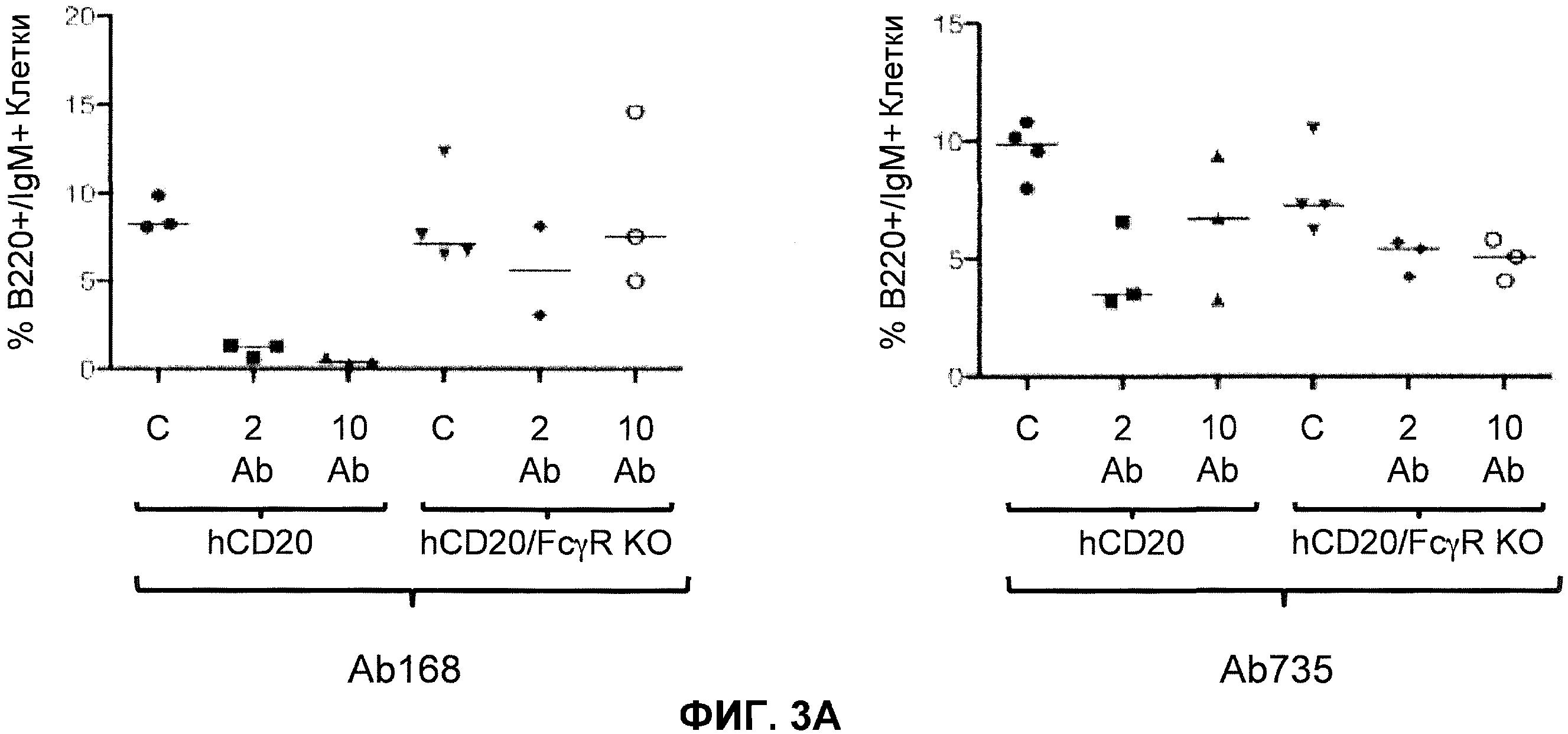
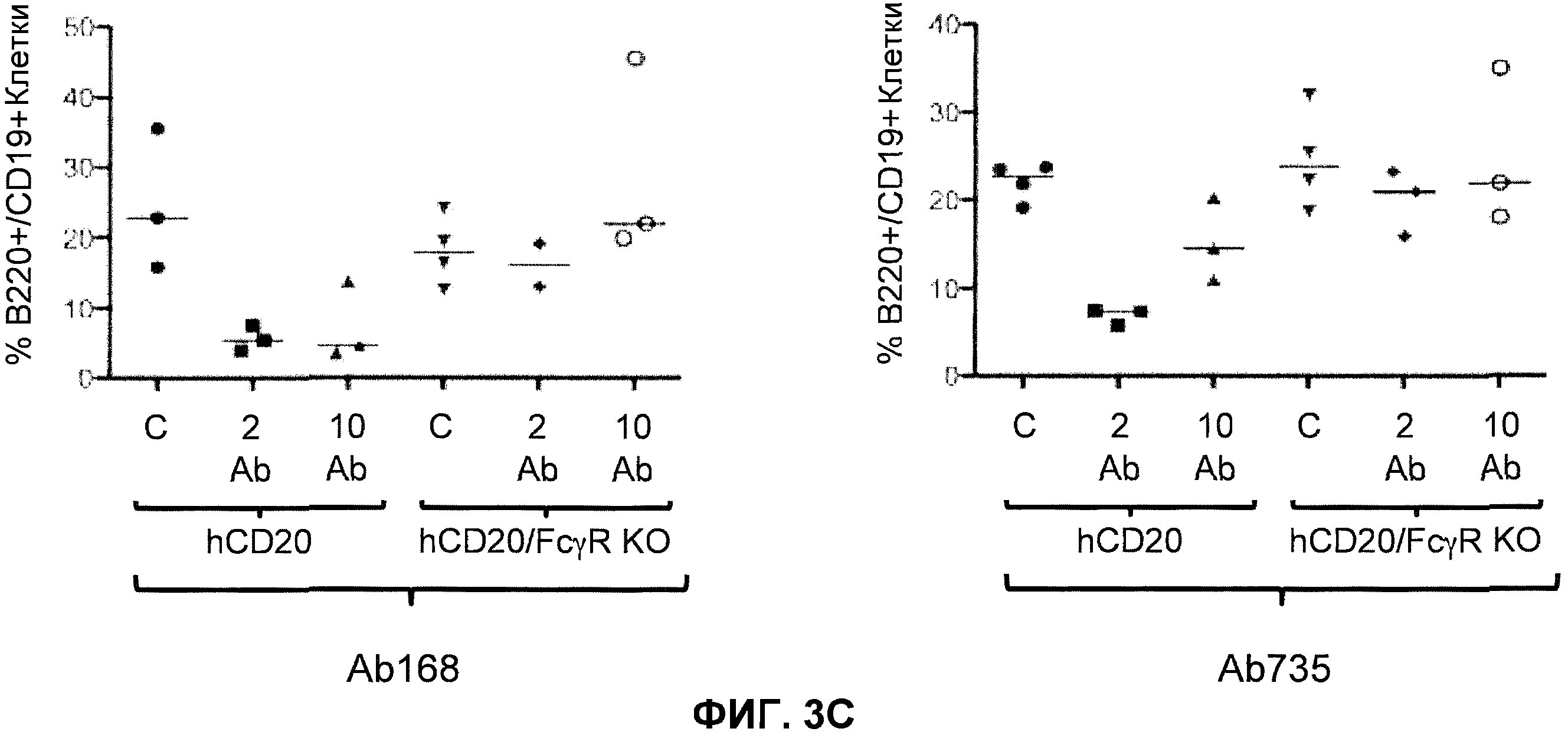
Фиг.3A-3D показывают элиминацию in vivo B-клеток с помощью человеческого антитела к человеческому CD20, мышиной Fc (Ab 168) или человеческой Fc (Ab 735) у гуманизированных CD20 мышей (hCD20) и гуманизированных CD20 мышей, скрещенных с мышами, у которых выключен ген FcγR (hCD20/FcγR KO) в некоторых местах расположения лимфоцитов: костном мозге (фиг.3A), крови (фиг.3B), лимфатическом узле (фиг.3C) и селезенке (фиг.3D). Для каждого графика y-ось показывает процентное содержание пороговых B-клеток (B220+/IgM+ или B220+/CD19+), и x-ось показывает дозу антитела для каждой группы животных: 10 мг/кг контрольное антитело (C), 2 мг/кг человеческое антитело к человеческому CD20 (2 Ab) и 10 мг/кг человеческого антитела к человеческому CD20 (10 Ab).
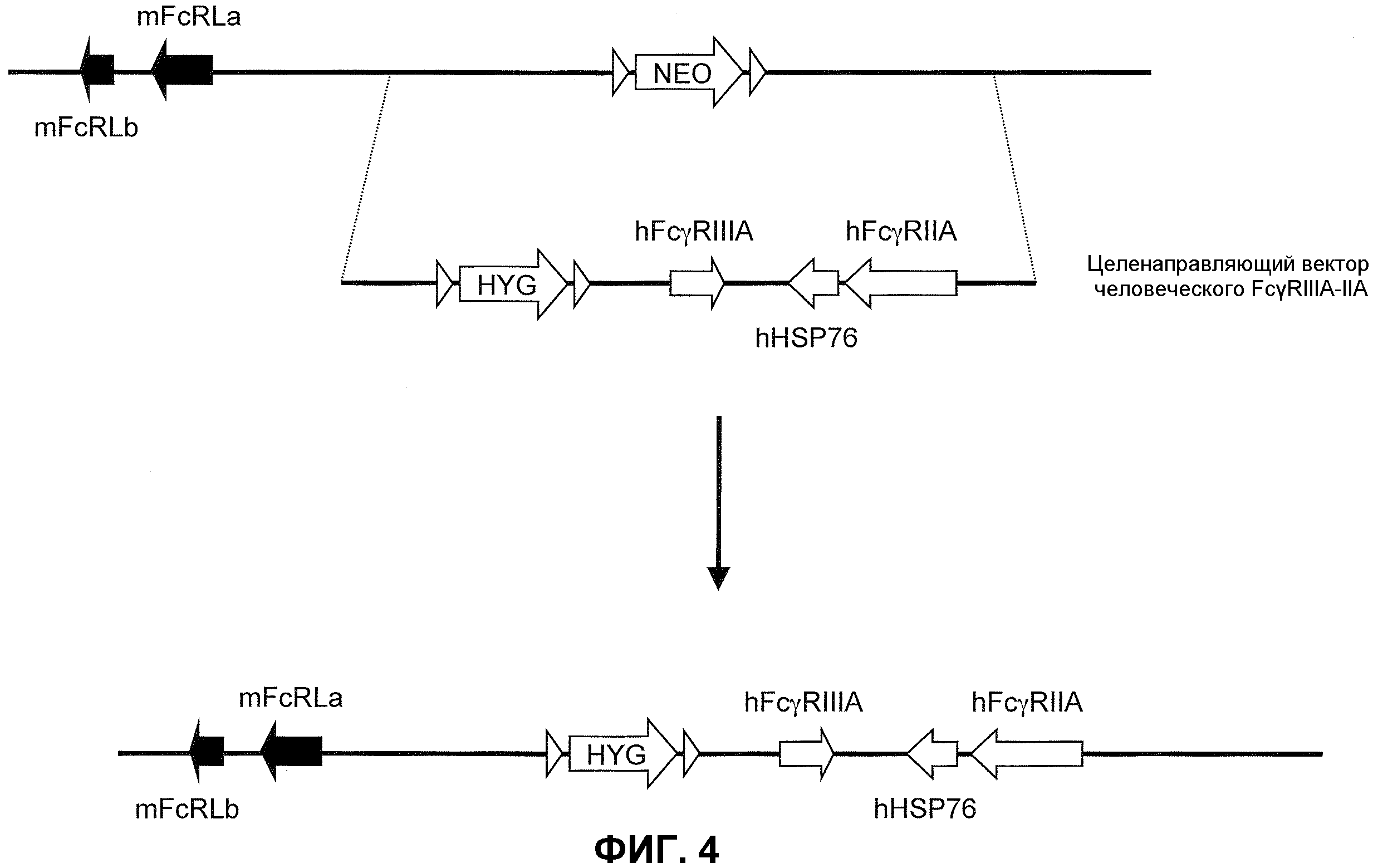
Фиг.4 представляет собой схематическое изображение неомицин-целенаправленной делеции локуса низкоаффинного мышиного FcγR и второй целенаправляющий вектор для введения двух генов человеческого низкоаффинного FcγR (hFcγRIIIA и hFcγRIIA) в подвергнутый делеции мышиный локус, который включает гигромициновую кассету, фланкированную сайтами сайт-специфической рекомбинации. Для экспрессии hFcγRIIA на тромбоцитах используют удлиненную промоторную область, функционально связанную с геном hFcγRIIA целенаправляющего вектора человеческого FcγRIIIA-IIA; для предотвращения экспрессии hFcγRIIA на тромбоцитах промоторную область исключают или исключают по существу.
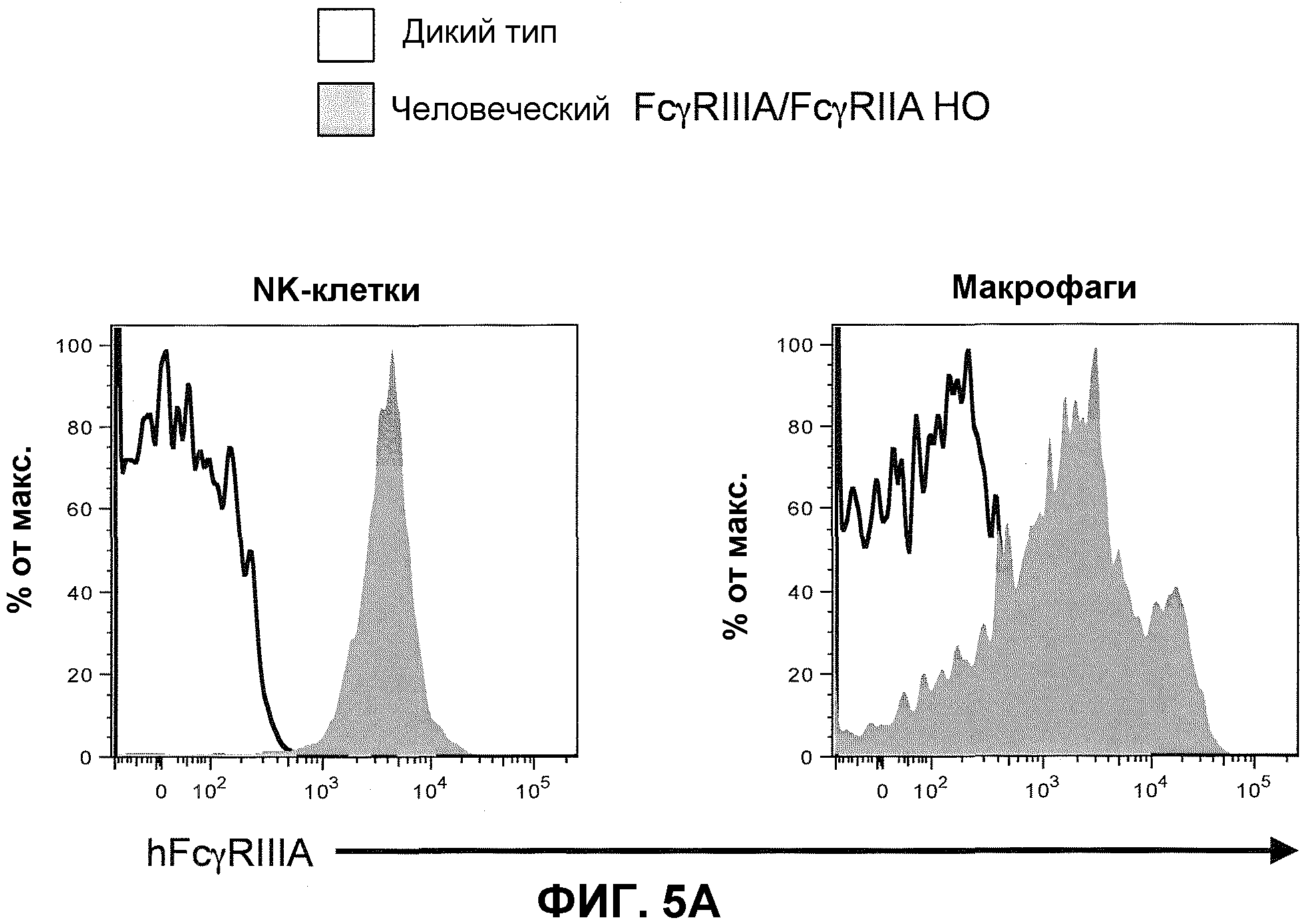
Фиг.5A показывает гистограммы спленоцитов с порогом для NK-клеток (против-NKp46) и макрофагов (против-F4/80), включая экспрессию человеческого FcγRIIIA у мышей дикого типа и человеческого FcγRIIIA-IIA у гомозиготных мышей (человеческие FcγRIIIA/FcγRIIA HO).
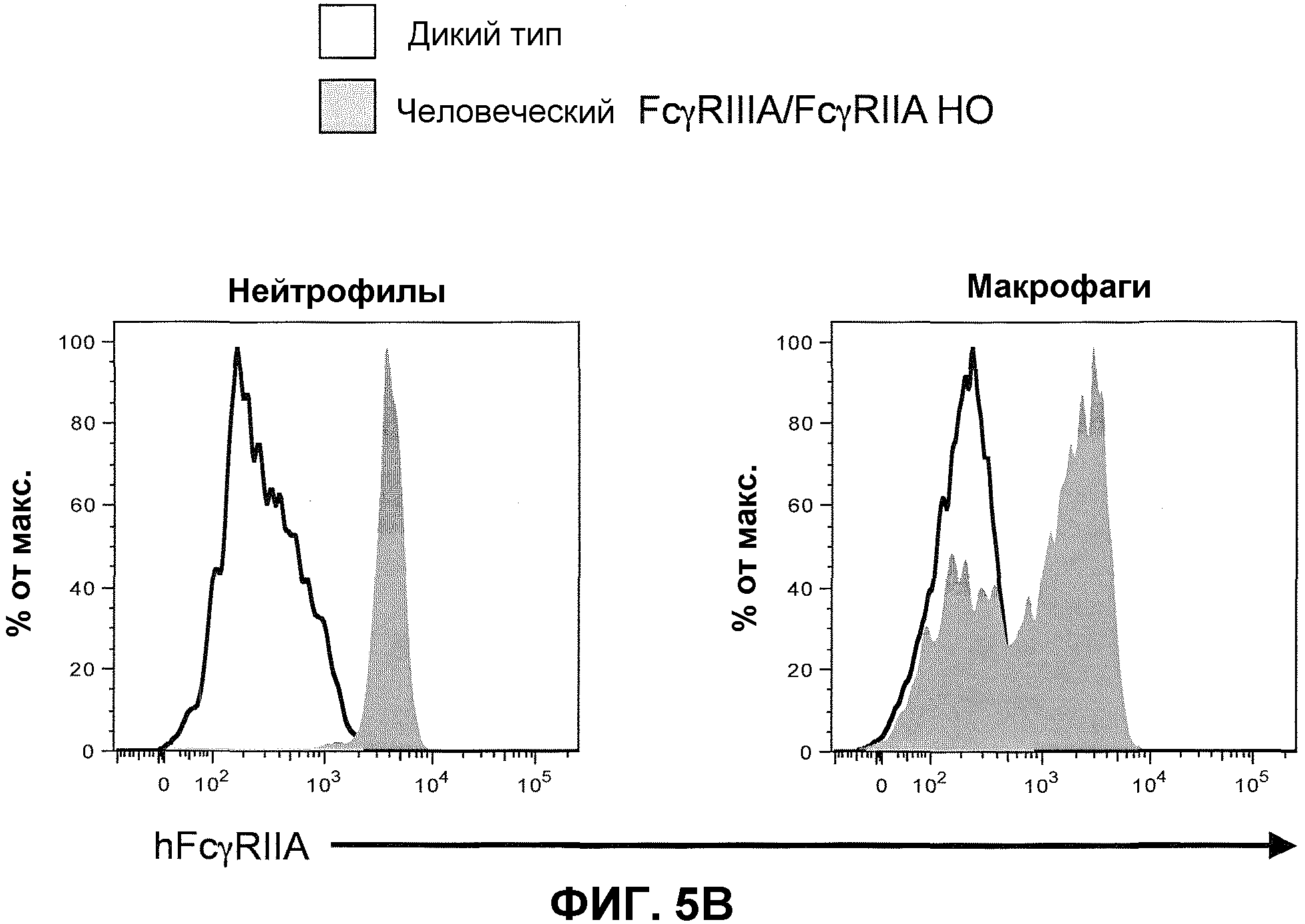
Фиг.5B показывает гистограммы спленоцитов с порогом для нейтрофилов (против-Ly6G) и макрофагов (против-F4/80), включая экспрессию человеческого FcγRIIA у мышей дикого типа и человеческого FcγRIIIA-IIA у гомозиготных мышей (человеческие FcγRIIIA/FcγRIIA HO).
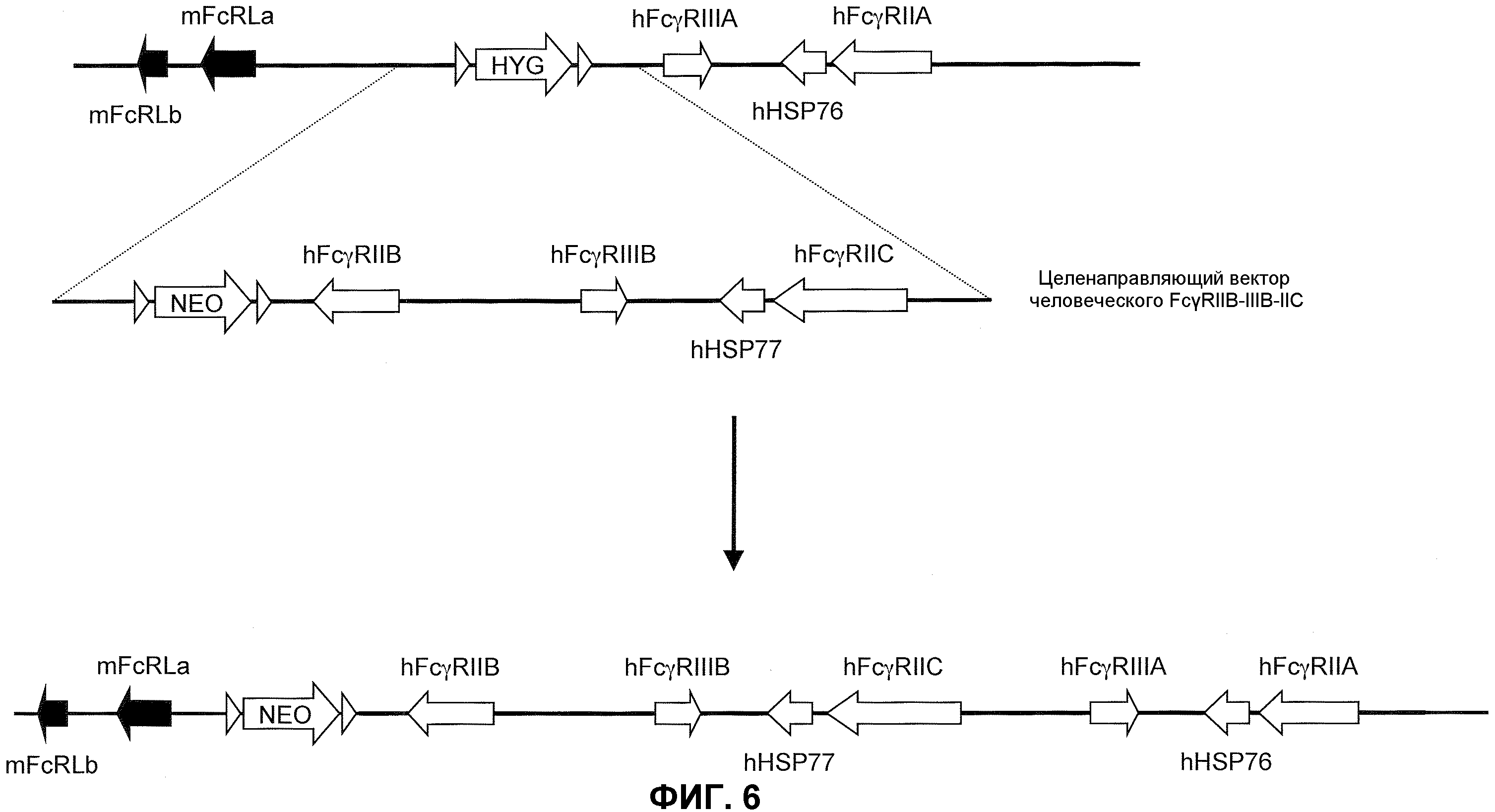
Фиг.6 представляет собой схематическое изображение гигромицин-целенаправленной делеции локуса низкоаффинного мышиного FcγR, включающего вставку двух генов низкоаффинного человеческого FcγR (hFcγRIIIA и hFcγRIIA) и третий целенаправляющий вектор для введения трех дополнительных генов низкоаффинного человеческого FcγR (hFcγRIIB, hFcγRIIIB и hFcγRIIC), и неомициновую кассету, фланкированную сайтами сайт-специфической рекомбинации.
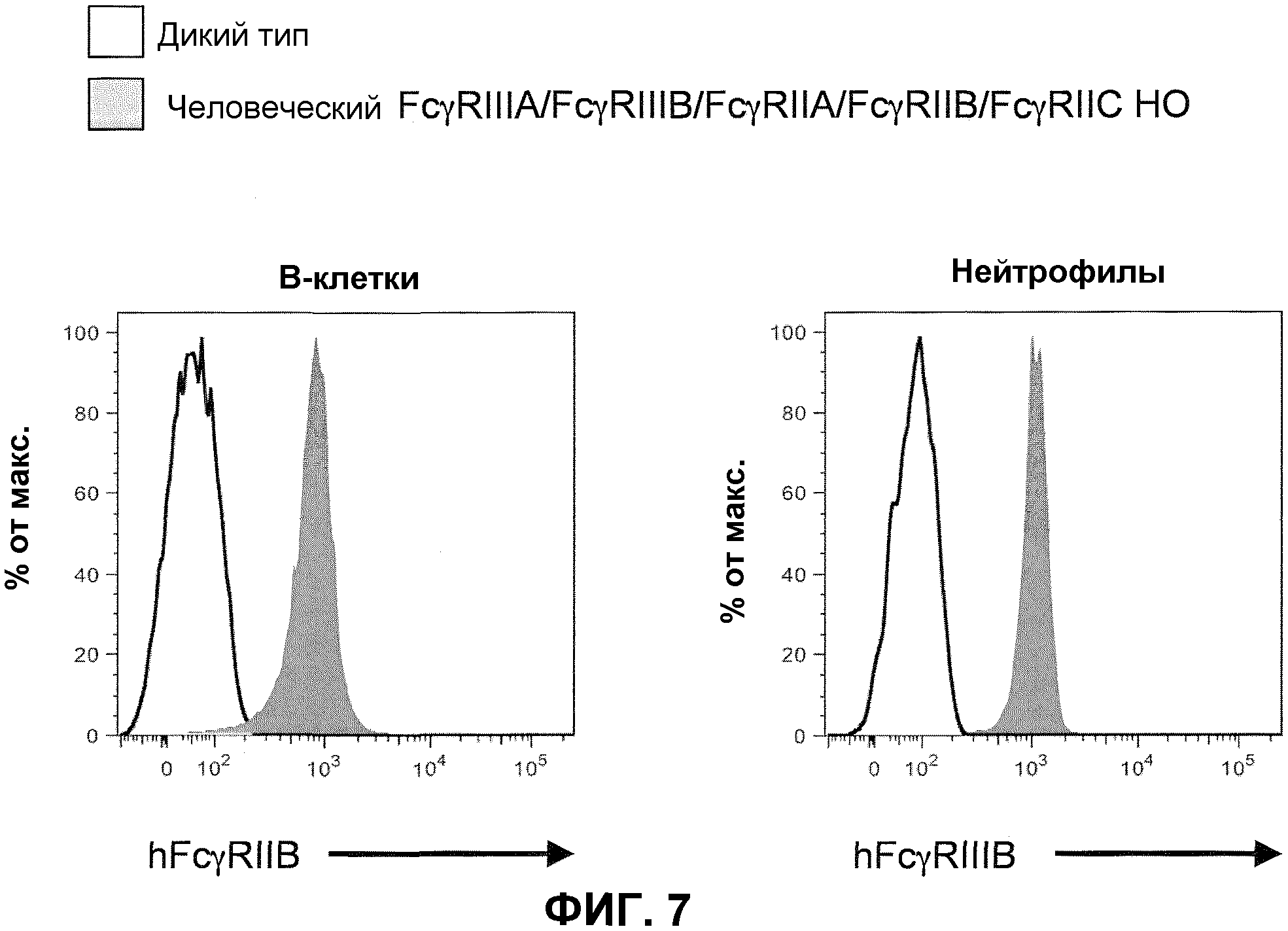
Фиг.7 показывает гистограммы спленоцитов с порогом для B-клеток (против-CD19) и нейтрофилов (против-Ly6G), включая экспрессию человеческого FcγRIIB и человеческого FcγRIIIB у мышей дикого типа и человеческого FcγRIIIA-IIIB-IIA-IIB-IIC у гомозиготных мышей (человеческие FcγRIIIA/FcγRIIIB/FcγRIIA/FcγRIIB/FcγRIIC HO).
КРАТКОЕ СОДЕРЖАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Предоставлены генетически модифицированные клетки, не относящиеся к человеку эмбрионы, животные, не относящиеся к человеку, и способы и композиции для их получения и применения. В разнообразных аспектах животные, не относящиеся к человеку, содержат человеческий рецептор FcγR, делецию эндогенного низкоаффинного рецептора FcγR и/или замену эндогенного рецептора FcγR на человеческий рецептор FcγR в локусе эндогенного мышиного низкоаффинного FcγR.
В одном аспекте предоставлены генетически модифицированные клетки, не относящиеся к человеку эмбрионы, животные, не относящиеся к человеку, генетически модифицированные клетки, которые содержат функциональную γ-цепь FcR, где клетки, эмбрионы и животные содержат дополнительную модификацию, включающую замену генных последовательностей низкоаффинного эндогенного нечеловеческого FcγR (например, FcγRIIB, FcγRIV и FcγRIII) на одну или более генных последовательностей низкоаффинного человеческого FcγR (например, выбранного из FcγRIIA, FcγRIIB, FcγRIIC, FcγRIIIA, FcγRIIIB и их комбинации).
В одном варианте осуществления клетки, не относящиеся к человеку эмбрионы, животные, не относящиеся к человеку, являются мышиными. В одном варианте осуществления функциональная γ-цепь FcR представляет собой γ-цепь мышиного FcR. В одном варианте осуществления γ-цепь мышиного FcR представляет собой γ-цепь FcR, эндогенного для мыши, клетки или эмбриона.
В одном варианте осуществления клетки, эмбрионы и животные являются мышиными, и мыши экспрессируют функциональную α-цепь человеческого низкоаффинного рецептора FcγR и функциональную эндогенную мышиную γ-цепь.
В одном аспекте предоставлена генетически модифицированная мышь, где мышь не экспрессирует эндогенную α-цепь, выбранную из α-цепи FcγRIIB, α-цепи FcγRIV, α-цепи FcγRIII и их комбинации; где мышь экспрессирует функциональную эндогенную мышиную γ-цепь.
В конкретном варианте осуществления мышь не экспрессирует функциональную α-цепь FcγRIIB, не экспрессирует функциональную α-цепь FcγRIV и не экспрессирует функциональную α-цепь FcγRIII.
В одном варианте осуществления мышиный геном содержит делецию эндогенной α-цепи FcγRIIB, делецию эндогенной α-цепи FcγRIV и делецию эндогенной α-цепи FcγRIII.
В одном варианте осуществления мышь содержит делецию эндогенной α-цепи FcγRIIB, делецию эндогенной α-цепи FcγRIV и делецию эндогенной α-цепи FcγRIII и дополнительно содержит сниженную способность производить иммунный ответ на антиген по сравнению со способностью мыши дикого типа по отношению к тому же антигену. В одном варианте осуществления сниженный иммунный ответ включает уменьшенную антителозависимую клеточноопосредованную цитотоксичность (ADCC). В одном варианте осуществления сниженный иммунный ответ включает сниженную способность в анализе уничтожения клеток для достижения антителозависимого уничтожения NK-клеток. В конкретных вариантах осуществления снижение ADCC или антителозависимое уничтожение NK-клеток составляет, по меньшей мере, 50%, в одном варианте осуществления, по меньшей мере, 75%, в одном варианте осуществления, по меньшей мере, 90%.
В одном варианте осуществления мышь содержит делецию эндогенной α-цепи FcγRIIB, делецию эндогенной α-цепи FcγRIV и делецию эндогенной α-цепи FCγRIII и дополнительно содержит увеличенный гуморальный иммунный ответ при иммунизации антигеном по сравнению с мышью дикого типа, например, мышью того же или аналогичного штамма, которая не содержит делецию. В одном варианте осуществления увеличенный гуморальный иммунный ответ является 2-кратным по сравнению с мышью дикого типа. В одном варианте осуществления увеличенный гуморальный иммунный ответ является 3-кратным по сравнению с мышью дикого типа. В одном варианте осуществления увеличенный гуморальный иммунный ответ является 5-кратным по сравнению с мышью дикого типа. В одном варианте осуществления увеличенный гуморальный иммунный ответ является 7-кратным по сравнению с мышью дикого типа. В одном варианте осуществления увеличенный гуморальный иммунный ответ является 10-кратным по сравнению с мышью дикого типа. В конкретном варианте осуществления гуморальный иммунный ответ измеряют посредством микрограммов антитела, которое специфически связывает антиген (которым мышь была иммунизирована), на микрограмм белка сыворотки мыши. В одном варианте осуществления увеличенный гуморальный иммунный ответ выражают по отношению к антигену, к которому мышь дикого типа проявляет толерантность, или к антигену, который у мыши дикого типа проявляет слабый или минимальный гуморальный иммунный ответ. В конкретном варианте осуществления антиген является мышиным антигеном. В конкретном варианте осуществления антиген является человеческим антигеном, который проявляет идентичность с мышиным белком равную, по меньшей мере, приблизительно 95%, 96%, 97%, 98% или 99%.
В одном аспекте предоставлена генетически модифицированная мышь, содержащая замену гена α-цепи низкоаффинного мышиного FcγR на ген α-цепи низкоаффинного человеческого FcγR, где замена происходит в локусе гена α-цепи эндогенного мышиного FcγR. В одном варианте осуществления ген α-цепи низкоаффинного мышиного FcγR выбирают из гена α-цепи FcγRIIB, FcγRIV и FcγRIII. В конкретном варианте осуществления предоставлена генетически модифицированная мышь, где мышь экспрессирует γ-цепь эндогенного FcR, и где ген α-цепи низкоаффинного человеческого FcγR представляет собой α-цепь FcγRIIIA. В еще одном конкретном варианте осуществления генетически модифицированная мышь экспрессирует γ-цепь эндогенного FcR и функциональную α-цепь человеческого FcγRIIIA на NK-клетках. В конкретном варианте осуществления функциональность α-цепи FcγRIIIA на NK-клетках отражается на человеческом антителоопосредованным уничтожении NK (например, ADCC, опосредованной человеческим антителом).
В одном аспекте предоставлены генетически модифицированная клетка, не относящийся к человеку эмбрион или животное, не относящееся к человеку, где генетическая модификация включает в себя замену, по меньшей мере, одного гена эндогенной α-цепи низкоаффинного FcγR на ген α-цепи человеческого FcγR, и клетка, эмбрион или животное экспрессирует функциональную γ-цепь FcR. В одном варианте осуществления функциональная γ-цепь FcR является γ-цепью эндогенного FcR. В одном варианте осуществления ген α-цепи низкоаффинного человеческого FcγR выбирают из гена α-цепи FcγRIIA, гена α-цепи FcγRIIIA и их комбинации. В конкретном варианте осуществления ген человеческого FcγRIIA содержит полиморфизм, где полиморфизм выбирают из 131His низкого респондерного полиморфизма и 131Arg высокого респондерного полиморфизма. В конкретном варианте осуществления полиморфизм FcγRIIA представляет собой 131His низкий респондерный полиморфизм. В одном варианте осуществления ген FcγRIIIA представляет собой конкретный аллельный вариант, где аллельный вариант выбирают из 158Val варианта и 158Phe варианта. В конкретном варианте осуществления аллельный вариант FcγRIIIA представляет собой 158Val вариант.
В одном варианте осуществления ген низкоаффинного человеческого FcγR выбирают из гена FcγRIIB, FcγRIIC, FcγRIIIB и их комбинации. В конкретном варианте осуществления ген человеческого FcγRIIB содержит аминокислотную замену, где замену выбирают из 232Ile или 232Thr замены. В еще одном конкретном варианте осуществления аминокислотная замена представляет собой замену 232Ile. В конкретном варианте осуществления ген FcγRIIIB представляет собой конкретный аллельный вариант, где аллельный вариант выбирают из NA1 варианта и NA2 варианта. В еще одном конкретном варианте осуществления аллельный вариант FcγRIIIB представляет собой NA2 вариант.
В одном варианте осуществления ген α-цепи низкоаффинного человеческого FcγR выбирают из гена α-цепи FcγRIIA, FcγRIIB, FcγRIIC, FcγRIIIA, FcγRIIIB и их комбинации.
В одном варианте осуществления ген α-цепи низкоаффинного мышиного FcγRIV и ген α-цепи FcγRIII заменяют на, по меньшей мере, один ген α-цепи низкоаффинного человеческого FcγR. В одном варианте осуществления ген α-цепи низкоаффинного мышиного FcγRIV и ген α-цепи FcγRIIB заменяют на, по меньшей мере, один ген α-цепи низкоаффинного человеческого FcγR. В одном варианте осуществления ген α-цепи низкоаффинного мышиного FcγRIIB и ген α-цепи FcγRIII заменяют на, по меньшей мере, один ген α-цепи низкоаффинного человеческого FcγR. В конкретном варианте осуществления, по меньшей мере, один ген α-цепи низкоаффинного человеческого FcγR выбирают из гена α-цепи FcγRIIA, FcγRIIB, FcγRIIC, FcγRIIIA, FcγRIIIB и их комбинации. В еще одном конкретном варианте осуществления, по меньшей мере, один ген α-цепи низкоаффинного человеческого FcγR выбирают из гена α-цепи FcγRIIA, гена α-цепи FcγRIIIA и их комбинации. В еще одном конкретном варианте осуществления, по меньшей мере, один ген α-цепи низкоаффинного человеческого FcγR выбирают из гена α-цепи FcγRIIB, FcγRIIC, FcγRIIIB и их комбинации. В еще одном конкретном варианте осуществления гены низкоаффинного мышиного FcγR заменяют на ген α-цепи человеческого FcγRIIA и ген α-цепи человеческого FcγRIIIA. В еще одном конкретном варианте осуществления гены α-цепи низкоаффинного человеческого FcγRIIA и FcγRIIIA содержат варианты, где ген α-цепи FcγRIIA содержит 131His вариант и ген α-цепи FcγRIIIA содержит 158Val вариант. В еще одном конкретном варианте осуществления гены α-цепи низкоаффинного мышиного FcγR заменяют на следующие гены α-цепи низкоаффинного человеческого FcγR: FcγRIIB, FcγRIIC и FcγRIIIB. В еще одном конкретном варианте осуществления ген α-цепи низкоаффинного человеческого FcγRIIB и ген α-цепи FcγRIIIB содержат варианты, где ген α-цепи FcγRIIB содержит 232Ile вариант и ген α-цепи FcγRIIIB содержит NA2 вариант.
В одном варианте осуществления генетические модификации содержат замену геномных последовательностей группы сцепления мышиной и человеческой хромосомы 1. В конкретном варианте осуществления генетические модификации содержат замену геномного фрагмента, содержащего гены эндогенного низкоаффинного мышиного FcγR, на геномный фрагмент, содержащий гены низкоаффинного человеческого FcγR. В еще одном конкретном варианте осуществления мышиный геном от хромосомы 1:172,889,983 до хромосомы 1:172,989,911 заменяют на человеческий геномный фрагмент, содержащий фрагмент от человеческой хромосомы 1:161,474,729 до хромосомы 1:161,620,458.
В одном аспекте предоставлены генетически модифицированные клетка, не относящийся к человеку эмбрион или животное, не относящееся к человеку, где генетическая модификация содержит нокаут одного или нескольких генов α-цепи эндогенного низкоаффинного рецептора, и присутствие эписомы, содержащей один или более генов α-цепи человеческого FcγR. В конкретном варианте осуществления клетка, эмбрион или животное экспрессируют функциональную γ-цепь FcR. В конкретном варианте осуществления эписома представляет собой минихромосому. В одном варианте осуществления функциональная γ-цепь FcR является эндогенной для клетки, эмбриона или животного.
В одном аспекте предоставлена генетически модифицированная мышь, содержащая замену гена α-цепи низкоаффинного мышиного FcγR на ген α-цепи низкоаффинного человеческого FcγR, мышь содержит ген γ-цепи мышиного FcR, и мышь экспрессирует функциональный человеческий низкоаффинный рецептор FcγR. В одном варианте осуществления функциональный низкоаффинный рецептор FcγR экспрессируется на клеточном типе, в котором низкоаффинный рецептор FcγR экспрессируется у людей. В конкретном варианте осуществления функциональный человеческий низкоаффинный рецептор FcγR представляет собой FcγRIIIA, и FcγRIIIA экспрессируется на NK-клетках.
В одном варианте осуществления мышь содержит делецию двух генов α-цепи мышиного FcγR. В еще одном варианте осуществления мышь содержит делецию трех генов α-цепи мышиного FcγR.
В одном варианте осуществления мышь включает в себя замену трех генов α-цепи мышиного FcγR на, по меньшей мере, один ген α-цепи человеческого FcγR. В еще одном варианте осуществления мышь включает в себя замену двух генов α-цепи мышиного FcγR на, по меньшей мере, один ген α-цепи человеческого FcγR. В конкретном варианте осуществления мышь включает в себя замену трех генов α-цепи мышиного FcγR на, по меньшей мере, два гена α-цепи человеческого FcγR. В еще одном конкретном варианте осуществления три гена α-цепи мышиного FcγR заменяют на три гена α-цепи человеческого FcγR. В еще одном конкретном варианте осуществления мышь включает в себя замену двух генов α-цепи мышиного FcγR на, по меньшей мере, два гена α-цепи человеческого FcγR. В еще одном другом конкретном варианте осуществления два гена α-цепи мышиного FcγR заменяют на, по меньшей мере, три гена α-цепи человеческого FcγR.
В одном варианте осуществления ген α-цепи низкоаффинного мышиного FcγR выбирают из гена α-цепи FcγRIIB, FcγRIV, FcγRIII и их комбинации.
В одном варианте осуществления ген α-цепи низкоаффинного человеческого FcγR выбирают из гена α-цепи FcγRIIA, FcγRIIB, FcγRIIC, FcγRIIIA, FcγRIIIB и их комбинации. В одном варианте осуществления ген α-цепи низкоаффинного человеческого FcγR выбирают из гена α-цепи FcγRIIA, FcγRIIIA и их комбинации. В одном варианте осуществления ген α-цепи низкоаффинного человеческого FcγR выбирают из гена α-цепи FcγRIIB, FcγRIIC, FcγRIIIB и их комбинации.
В одном варианте осуществления ген α-цепи низкоаффинного мышиного FcγRIV и ген α-цепи FcγRIII заменяют на, по меньшей мере, один ген α-цепи человеческого FcγR. В одном варианте осуществления ген α-цепи низкоаффинного мышиного FcγRIV и ген α-цепи FcγRIIB заменяют на, по меньшей мере, один ген α-цепи человеческого FcγR. В одном варианте осуществления ген α-цепи низкоаффинного мышиного FcγRIIB и ген α-цепи FcγRIIIB заменяют на, по меньшей мере, один ген α-цепи человеческого FcγR. В конкретном варианте осуществления, по меньшей мере, один ген α-цепи человеческого FcγR выбирают из гена α-цепи FcγRIIA, FcγRIIB, FcγRIIC, FcγRIIIA, FcγRIIIB и их комбинации. В еще одном конкретном варианте осуществления, по меньшей мере, один ген α-цепи человеческого FcγR выбирают из гена α-цепи FcγRIIA, FcγRIIIA и их комбинации. В еще одном конкретном варианте осуществления, по меньшей мере, один ген α-цепи человеческого FcγR выбирают из гена α-цепи FcγRIIB, FcγRIIC, FcγRIIIB и их комбинации. В еще одном конкретном варианте осуществления гены мышиной α-цепи заменяют на следующие гены α-цепи человеческого FcγR: FcγRIIA и FcγRIIIA. В еще одном другом конкретном варианте осуществления гены мышиной α-цепи заменяют на следующие гены α-цепи человеческого FcγR: FcγRIIB, FcγRIIC и FcγRIIIB.
В одном аспекте предоставлена генетически модифицированная мышь, содержащая α-цепь низкоаффинного человеческого FcγR и субъединицу γ-цепи мышиного FcR, где мышь экспрессирует α-цепь человеческого FcγR на клетке, выбранной из нейтрофила, эозинофила, базофила, моноцита, макрофага, тромбоцита, клетки Лангерганса, дендритной клетки, NK-клетки, тучной клетки, В-клетки, T-клетки и их комбинации. В одном варианте осуществления мышь экспрессирует α-цепь человеческого FcγRIIA на клетке, выбранной из нейтрофила, макрофага, эозинофила, тромбоцита, дендритной клетки, клетки Лангерганса и их комбинации. В одном варианте осуществления мышь обладает способностью к фагоцитозу, ADCC и клеточной активации, инициированным или опосредованным через экспрессируемую α-цепь человеческого FcγRIIA. В одном варианте осуществления мышь экспрессирует α-цепь человеческого FcγRIIIA на клетке, выбранной из макрофага, NK-клетки, моноцита, тучной клетки, эозинофила, дендритной клетки, клетки Лангерганса, по меньшей мере, одного типа T-клеток и их комбинации. В одном варианте осуществления мышь обладает способностью к ADCC, опосредованной через α-цепь человеческого FcγRIIIA, экспрессируемой на NK-клетках. В конкретном варианте осуществления мышь проявляет hFcγRIIIA-опосредованную ADCC в ответ на антитело, содержащее человеческий Fc.
В одном варианте осуществления мышь экспрессирует как α-цепь человеческого FcγRIIA, так и α-цепь человеческого FcγRIIIA. В одном варианте осуществления α-цепь человеческого FcγRIIA экспрессируется на тромбоцитах, и α-цепь человеческого FcγRIIIA экспрессируется на NK-клетках. В одном варианте осуществления мышь обладает способностью к ADCC, опосредованной антителом, содержащим человеческое Fc, где опосредованное действие производится через или α-цепь человеческого FcγRIIA, или через α-цепь человеческого FcγRIIIA, экспрессируемые на поверхности антигенпрезентирующих клеток. В одном варианте осуществления α-цепь человеческого FcγRIIA не экспрессируется на тромбоцитах. В конкретном варианте осуществления где α-цепь человеческого FcγRIIA не экспрессируется на тромбоцитах, у мыши отсутствует или по существу отсутствует последовательность человеческого промотора, которая функционально связывается с α-цепью человеческого FcγRIIA в человеческом геноме.
В одном варианте осуществления мышь экспрессирует α-цепь человеческого FcγRIIB на клетке, выбранной из В-клетки, тучной клетки, базофила, макрофага, эозинофила, нейтрофила, дендритной клетки, клетки Лангерганса и их комбинации. В конкретном варианте осуществления мышь экспрессирует α-цепь человеческого FcγRIIB на В-клетке и тучной клетке. В еще одном конкретном варианте осуществления мышь обладает способностью к эндоцитозу иммунных комплексов, опосредованному через экспрессируемую α-цепь человеческого FcγRIIB. В одном варианте осуществления мышь экспрессирует α-цепь человеческого FcγRIIC на клетке, выбранной из нейтрофила, макрофага, эозинофила, тромбоцита, дендритной клетки, клетки Лангерганса и их комбинации. В конкретном варианте осуществления мышь обладает способностью к фагоцитозу, ADCC и клеточной активации, инициируемым через экспрессируемую α-цепь человеческого FcγRIIC.
В одном варианте осуществления мышь экспрессирует α-цепь человеческого FcγRIIIB на нейтрофилах и эозинофилах. В конкретном варианте осуществления мышь обладает способностью к клеточной активации, фагоцитозу, ADCC и дегрануляции, где активация, фагоцитоз, ADCC и дегрануляция опосредованы через экспрессируемую α-цепь человеческого FcγRIIIB.
В одном аспекте предоставлена мышь, которая содержит делецию эндогенных генов FCγRIIB, FcγRIV и FcγRIII и вставку генов человеческого FcγRIIA, FCγRIIB, FCγRIIC, FCγRIIIA и FcγRIIIB, и где мышь содержит ген функциональной γ-цепи мышиного FcR.
В одном варианте осуществления мышь содержит делецию α-цепей, кодируемых эндогенными генами FCγRIIB, FCγRIV и FcγRIII, и вставку генов α-цепей, кодируемых генами человеческого FcγRIIA, FcγRIIB, FcγRIIC, FcγRIIIA и FcγRIIIB.
В одном варианте осуществления вставка генов α-цепей человеческого FcγRIIA, FcγRIIB, FcγRIIC, FcγRIIIA и FcγRIIIB происходит в случайное расположение внутри мышиного генома.
В одном варианте осуществления вставка генов α-цепей человеческого FcγRIIA, FcγRIIB, FcγRIIC, FcγRIIIA и FcγRIIIB происходит в локус α-цепи эндогенного мышиного низкоаффинного FcγR.
В одном варианте осуществления мышь экспрессирует человеческий FcγRIIIA на NK-клетках и макрофагах. В конкретном варианте осуществления все или по существу все NK-клетки из образца спленоцитов мыши экспрессируют человеческий FcγRIIIA. В конкретном варианте осуществления все или по существу все макрофаги из образца спленоцитов мыши экспрессируют человеческий FcγRIIIA.
В одном варианте осуществления мышь экспрессирует человеческий FcγR, выбранный из человеческого FcγRIIA, человеческого FcγRIIIA и их комбинации, на клеточном типе, выбранном из нейтрофилов, макрофагов и их комбинации. В конкретном варианте осуществления мышь экспрессирует человеческий FcγRIIA и человеческий FcγRIIIA на всех или по существу всех нейтрофилах и макрофагах образца спленоцитов из мыши.
В одном варианте осуществления мышь экспрессирует человеческий FcγRIIB и человеческий FcγRIIIB на B-клетках и нейтрофилах из B-клеток из образца спленоцитов мыши с порогом для В-клеток. В конкретном варианте осуществления мышь экспрессирует FcγRIIIB и FcγRIIB на всех или по существу всех B-клетках и нейтрофилах из B-клеток из образца спленоцитов мыши с порогом для В-клеток.
В одном варианте осуществления мышь дополнительно содержит гуманизированный ген CD20. В одном варианте осуществления мышь, которая дополнительно содержит гуманизированный ген CD20 после обработки связывающим белком против-CD20, который содержит Fc, проявляет элиминацию (in vivo) B-клеток. В одном варианте осуществления элиминация происходит в органе или ткани, выбранных из костного мозга, крови, лимфатического узла, селезенки и их комбинации. В одном варианте осуществления Fc представляет собой человеческую Fc. В одном варианте осуществления Fc представляет собой мышиную Fc. В одном варианте осуществления связывающий белок против-CD20 представляет собой антитело против-CD20.
В одном аспекте предоставлена клетка, содержащая генетическую модификацию, как описано здесь. В одном варианте осуществления клетку выбирают из эмбриональной стволовой (ES) клетки, плюрипотентной клетки, индуцированной плюрипотентной клетки и тотипотентной клетки. В одном варианте осуществления клетки выбирают из мышиной клетки и крысиной клетки. В конкретном варианте осуществления клетка представляет собой ES-клетку. В более конкретном варианте осуществления клетка представляет собой мышиную ES-клетку.
В одном аспекте предоставлен эмбрион, не относящийся к человеку, содержащий генетическую модификацию, как описано здесь. В одном варианте осуществления эмбрион, не относящийся к человеку, выбирают из мышиного эмбриона и крысиного эмбриона.
В одном аспекте предоставлен способ определения эффективности действия терапевтического средства. В одном варианте осуществления терапевтическое средство представляет собой антитело (например, моно-, би-, три-, мультиспецифическое), содержащее человеческое Fc. В одном варианте осуществления терапевтическое средство представляет собой человеческое антитело. В одном варианте осуществления эффективность действия представляет собой эффективность действия, терапевтически опосредованного уничтожения клеток (например, ADCC). В конкретном варианте осуществления терапевтическое средство для человека представляет собой гибридный белок, содержащий Fc тяжелой цепи человеческого иммуноглобулина. В одном варианте осуществления терапевтическое средство вводят мыши, как описано здесь, и измеряют уровень терапевтически зависимой ADCC. В одном варианте осуществления мышь используют для оценки активности ADCC терапевтического средства посредством введения терапевтического средства мыши и затем обнаружения (например, in vitro из образца (например, крови), взятого из животного) связывания терапевтического средства с человеческим низкоаффинным FcγR на FcγR-экспрессирующей клетке. В конкретном варианте осуществления антигенпрезентирующие клетки мыши выделяют из мыши и тестируют на предмет способности, в присутствии и в отсутствие терапевтического средства, к опосредованию терапевтически зависимой ADCC.
В одном аспекте предоставлен способ определения того, ассоциирован ли низкоаффинный FcγR с человеческим заболеванием или нарушением, включающий стадию определения признака, ассоциированного с человеческим заболеванием или нарушением у мыши в соответствии с изобретением. В одном варианте осуществления признак представляет собой фенотип, ассоциированный с отсутствием или потерей функции одного или нескольких низкоаффинных FcγR. В конкретном варианте осуществления заболевание или нарушение представляет собой аутоиммунное заболевание или нарушение. В конкретном варианте осуществления аутоиммунное заболевание или нарушение выбирают из ревматоидного артрита (RA), системной красной волчанки (SLE), диабета типа I, синдрома Гийена-Барре, склероза, рассеянного склероза, синдрома Гудпасчера, гранулематоза Вегенера и экспериментального аутоиммунного энцефаломиелита (EAE). В конкретном варианте осуществления мышь содержит полиморфизм в низкоаффинном FcγR, и признак выбирают из усиленной способности опосредовать ADCC в сравнении с большинством человеческого населения, которое не несет полиморфизм, и сниженной способности опосредовать ADCC в сравнении с большинством человеческого населения, которое не несет полиморфизм.
В одном аспекте предоставлен способ получения антитела против α-цепи человеческого FcR у мыши, включающий подвергание мыши в соответствии с изобретением воздействию человеческого FcR, как описано здесь. В одном варианте осуществления антитело, которое распознает человеческий FcR, выделяют из мыши. В еще одном варианте осуществления последовательность нуклеиновой кислоты, которая кодирует всю вариабельную область антитела или его часть, которая распознает человеческий FcR, идентифицируют и клонируют.
В одном аспекте предоставлен способ определения способности антител против человеческого FcR направлять молекулы на FcR-экспрессирующие клетки для фагоцитоза целевой молекулы, включающий подвергание мыши, как описано здесь, воздействию агента, содержащего антитело против человеческого FcR, и измерение фагоцитоза целевой молекулы.
В одном аспекте предоставлен способ получения антитела у мыши к антигену, который является слабо иммуногенным, у мыши, которая принадлежит к дикому типу по отношению к одному или более FcγR, включающий подвергание мыши, как описано здесь, у которой отсутствует мышиный низкоаффинный FcR, но которая экспрессирует γ-цепь FcγR, воздействию антигена, который является слабо иммуногенным, у мыши, которая принадлежит к дикому типу по отношению к одному или более FcγR, и идентификацию антитела, которое распознает слабо антигенный антиген. В одном варианте осуществления способ включает выделение антитела из мыши. В еще одном варианте осуществления последовательность нуклеиновой кислоты, которая кодирует всю вариабельную область антитела или ее часть, идентифицируют и клонируют.
В одном аспекте предоставлен способ получения мыши, способной к получению антител, содержащих человеческие вариабельные области, включающий стадию скрещивания первой мыши, как описано здесь, со второй мышью, которая содержит (a) один или более генных сегментов вариабельной области человеческого иммуноглобулина и один или более генов человеческой константной области или (b) один или более генных сегментов вариабельной области человеческого иммуноглобулина, функционально связанных с геном мышиной константной области, где человеческие генные сегменты заменяют генные сегменты вариабельной области в локусе генного сегмента мышиной вариабельной области.
В одном варианте осуществления вторая мышь (a) содержит трансген, который содержит один или более генных сегментов вариабельной области легкой цепи человеческого иммуноглобулина и ген константной человеческой легкой цепи, и трансген, который содержит один или более генных сегментов вариабельной области тяжелой цепи человеческого иммуноглобулина и один или более генов константной человеческой тяжелой цепи. В одном варианте осуществления трансген, который содержит один или более генных сегментов вариабельной области тяжелой цепи человеческого иммуноглобулина, содержит два или более генов константной человеческой тяжелой цепи и обладает способностью к переключению класса. В конкретном варианте осуществления мышь содержит инактивированный локус эндогенной легкой цепи и/или инактивированный локус эндогенной тяжелой цепи. В конкретном варианте осуществления мышь содержит делецию локуса эндогенной легкой цепи и/или делецию локуса эндогенной тяжелой цепи.
В одном варианте осуществления вторая мышь (b) содержит генные сегменты человеческой тяжелой и человеческой легкой вариабельной области в тяжелых и легких мышиных локусах, соответственно.
В одном аспекте предоставлен способ отбора противоопухолевого антитела, включающий стадию определения способности антитела опосредовать ADCC, где способность антитела к опосредованию ADCC тестируют посредством определения ADCC, опосредованной клеткой мыши, как описано здесь, и антитело отбирают, если оно опосредует ADCC, с использованием клетки генетически модифицированной мыши, как описано здесь. В конкретном варианте осуществления определяют связывание антитела с клеткой генетически модифицированной мыши и противоопухолевое антитело отбирают по его способности связывать человеческий FcγR на клетке. В конкретном варианте осуществления человеческий FcγR представляет собой низкоаффинный FcγR.
В одном варианте осуществления противоопухолевое антитело идентифицируют по его усиленной способности к опосредованию ADCC через клетку мыши по сравнению со способностью противоопухолевого антитела к опосредованию ADCC через клетку мыши дикого типа. В конкретном варианте осуществления противоопухолевое антитело идентифицируют по его способности к опосредованию ADCC через NK-клетки. В конкретном варианте осуществления NK-клетки экспрессируют человеческий FcγRIIIA.
В одном варианте осуществления предоставлен способ отбора противоопухолевого агента, включающий стадию введения агента, содержащего человеческую Fc или модифицированную человеческую Fc, первому не относящемуся к человеку животному, где первое животное, не относящееся к человеку, является генетически модифицированным в соответствии с изобретением и содержит человеческую опухоль; стадию введения агента второму не относящемуся к человеку животному, содержащему опухоль; и определение способности первого не относящегося к человеку животного и второго не относящегося к человеку животного замедлять рост человеческой опухоли после введения агента, где агент отбирают в качестве противоопухолевого агента, если он проявляет усиленную способность замедлять рост человеческой опухоли у первого не относящегося к человеку животного, но не у второго не относящегося к человеку животного.
В одном варианте осуществления первое животное, не относящееся к человеку, модифицируют, чтобы оно содержало делецию эндогенной α-субъединицы FcR, и модифицируют, чтобы оно содержало α-субъединицу человеческого FcR, выбранную из группы, состоящей из α-субъединицы FcγRIIA, α-субъединицы FcγRIIB, α-субъединицы FcγRIIC, α-субъединицы FcγRIIIA, α-субъединицы FcγRIIIB и их комбинации. В одном варианте осуществления второе животное представляет собой животное дикого типа. В одном варианте осуществления первое животное, не относящееся к человеку, экспрессирует эндогенную γ-цепь FcR.
В одном варианте осуществления первое животное, не относящееся к человеку, экспрессирует функциональный эндогенный FcγRI.
В одном аспекте предоставлен способ получения мыши, у которой отсутствует низкоаффинный мышиный FcγR, которая экспрессирует функциональную γ-цепь FcR и содержит гены, кодирующие α-цепи человеческих FcγRIIA, FcγRIIB, FcγRIIC, FcγRIIIA и FcγRIIIB, включающий стадию замены α-цепей низкоаффинного мышиного FcγR на α-цепи человеческого FcγR в локусе α-цепи мышиного FcγR.
В одном варианте осуществления первая стадия включает делецию α-цепей эндогенных генов FcγRIIB, FcγRIV и FcγRIII и вставку генов α-цепей человеческих FcγRIIA и FcγRIIIA; вторая стадия включает вставку генов α-цепей человеческих FcγRIIB, FcγRIIC и FcγRIIIB в мышиный геном, который является результатом первой стадии; где мышь содержит ген функциональной γ-цепи мышиного FcR. В конкретном варианте осуществления гены α-цепей человеческих FcγRIIB, FcγRIIC и FcγRIIIB со второй стадии вставляют 5' относительно генов α-цепей человеческих FcγRIIA и FcγRIIIA с первой стадии.
В одном аспекте предоставлен способ определения уничтожения клеток посредством человеческого терапевтического средства у неприматов, включающий стадию подвергания клетки, эмбриона, не относящегося к человеку, или не относящегося к человеку животного воздействию человеческого терапевтического средства, которое содержит человеческое Fc, где клетка, эмбрион или животное содержат функциональную γ-цепь FcR, и включает в себя замену одного или нескольких генов α-цепи эндогенного низкоаффинного FcγR на одну или более α-цепей человеческого FcγR и определение способности человеческого терапевтического средства к опосредованию уничтожения клеток через низкоаффинный человеческий FcγR клетки, эмбриона или животного.
В одном варианте осуществления непримат представляет собой мышь. В конкретном варианте осуществления гены α-цепи эндогенного мышиного FcγR, FcγRIIB, FcγRIV и FcγRIII заменяют на гены α-цепи человеческого FcγR, FcγRIIA, FcγRIIB, FcγRIIC, FcγRIIIA и FcγRIIIB.
В одном варианте осуществления клетку выбирают из В-клетки, тучной клетки, базофила, макрофага, эозинофила, нейтрофила, дендритной клетки, клетки Лангерганса и их комбинации. В конкретном варианте осуществления клетка представляет собой NK-клетку, и определяют опосредованную NK-клетками ADCC человеческого или гуманизированного антитела. В конкретном варианте осуществления низкоаффинный человеческий FcγR представляет собой человеческий FcγRIIIA.
В одном аспекте предоставлен способ определения терапевтически зависимого тромбоза, включающий подвергание первого не относящегося к человеку животного, которое экспрессирует человеческий FcγRIIA на тромбоците, воздействию терапевтического средства; подвергание второго не относящегося к человеку животного, которое не экспрессирует человеческий FcγRIIA на тромбоците, воздействию указанного терапевтического средства; измерение у первого не относящегося к человеку животного и у второго не относящегося к человеку животного количества терапевтически зависимого тромбоза и определение различия в терапевтически зависимом тромбозе.
В одном варианте осуществления животное, не относящееся к человеку, выбирают из мыши и крысы.
В одном варианте осуществления определенное различие по терапевтически зависимому тромбозу используют для идентификации риска, ассоциированного с введением терапевтического средства человеку. В одном варианте осуществления определенное различие приводит в результате к изменению введения терапевтического средства человеческому пациенту, нуждающемуся в этом.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение не является ограниченным конкретными способами и описанными экспериментальными условиями, поскольку такие способы и условия могут видоизменяться. Терминология, использованная здесь, служит цели только описания конкретных вариантов осуществления и не предназначена для ограничений, поскольку объем притязаний настоящего изобретения будет ограничен только формулой изобретения.
Если не определено иным образом, все технические и научные термины, использованные здесь, имеют такое же значение, как обычно понимается рядовыми специалистами, которым принадлежит это изобретение. Несмотря на то, что способы и материалы, аналогичные или эквивалентные тем, что описаны здесь, могут применяться при практической реализации или тестировании настоящего изобретения, сейчас описаны конкретные способы и материалы. Все публикации, упомянутые здесь, включены в настоящее описание посредством ссылки в своей полноте.
Фраза "целенаправляющая конструкция" включает полинуклеотидную молекулу, которая содержит целенаправляющую область. Целенаправляющая область содержит последовательность, которая по существу является гомологичной последовательности в клетке-мишени, ткани или животном и обеспечивает интеграцию целенаправляющей конструкции в положение в геноме клетки, ткани или животного. В конкретном варианте осуществления целенаправляющая конструкция дополнительно содержит последовательность нуклеиновой кислоты или гена, представляющего особенный интерес, селектируемый маркер, контрольную и/или регуляторную последовательности и другие последовательности нуклеиновой кислоты, которые позволяют осуществить рекомбинацию, опосредованную через экзогенное добавление белков, которые способствуют или облегчают рекомбинацию, включающую в себя такие последовательности. В еще одном конкретном варианте осуществления целенаправляющая конструкция дополнительно содержит ген, представляющий интерес, где ген, представляющий интерес, представляет собой гетерологичный ген, который кодирует белок, имеющий аналогичную функцию, как белок, кодируемый эндогенной последовательностью.
Термин "замена" включает ту ситуацию, где последовательность ДНК помещают в геном клетки таким образом, чтобы заменить последовательность в геноме, в локусе геномной последовательности, на гетерологичную последовательность (например, человеческую последовательность у мыши), если не указано иначе. Последовательность ДНК, помещенная таким образом, может включать одну или более регуляторных последовательностей, которые являются частью исходной ДНК, применяемой для получения последовательности, помещенной таким образом (например, промоторы, энхансеры, 5'- или 3'-нетранслированные области и т.д.). Например, в разнообразных вариантах осуществления замена представляет собой замещение эндогенной последовательности на гетерологичную последовательность, которая приводит в результате к выработке генного продукта из последовательности ДНК, помещенной таким образом (содержащей гетерологичную последовательность), но не к экспрессии эндогенной последовательности; замена эндогенной геномной последовательности на последовательность ДНК, которая кодирует белок, который имеет аналогичную функцию, как белок, кодируемый эндогенной геномной последовательностью (например, эндогенная геномная последовательность кодирует низкоаффинный мышиный рецептор FcγR, и фрагмент ДНК кодирует один или более человеческих низкоаффинных рецепторов FcγR, таких как, например, человеческий FcγRIIC и/или FcγRIIIB).
Термин "FcγR" включает рецептор для Fc, например Fc часть IgG иммуноглобулина. Гены FcγR включают α-цепь, которая экспрессируется на поверхности клетки, и служит в качестве лигандсвязывающего домена, и ассоциирует или с гомодимером γ-цепи FcR, или гетеродимером γ-цепи и δ-цепи FcR. Существует несколько различных генов FcγR, и они могут подразделяться на низкоаффинные и высокоаффинные типы в соответствии с предпочтительным связыванием с IgG в иммунных комплексах. Гены низкоаффинных FcγR у людей включают FcγRIIA, FcγRIIB, FcγRIIC, FcγRIIIA и FcγRIIIB, и в пределах большинства этих генов встречающиеся в природе генетические различия или полиморфизмы были описаны у человеческих субъектов с аутоиммунными заболеваниями. Квалифицированные специалисты при чтении данного раскрытия смогут распознать, что один или более генов эндогенного низкоаффинного FcγR в геноме (или все из них) могут быть заменены на один или более гетерологичных генов низкоаффинного FcγR (например, варианты или полиморфизмы, такие как аллельные формы, гены от еще одного вида, химерные формы и т.д.).
Фраза "аллельные варианты" включает вариации нормальной последовательности гена, приводящей в результате к ряду различных форм того же самого гена. Различные формы могут содержать отличия вплоть до, например, 20 аминокислот в последовательности белка из гена. Например, аллели можно понимать как альтернативные последовательности ДНК в том же самом физическом локусе гена, который может приводить в результате или не приводить к различным признакам (например, наследуемым фенотипическим характеристикам), таким как подверженность к некоторым заболеваниям или состояниям, которые не приводят в результате к другим аллелям для того же самого гена или приводят в результате к изменяющимся степеням в других аллелях.
Термин "антигенпрезентирующая клетка" включает иммунную клетку, которая вовлечена в эффекторные функции иммунного ответа. Примерные иммунные клетки включают клетку лимфоидного или миелоидного происхождения, например лимфоциты, естественные киллерные (NK) клетки, моноциты, макрофаги, нейтрофилы, эозинофилы, базофилы, тромбоциты, клетки Лангерганса, дендритные клетки, тучные клетки и т.д. Антигенпрезентирующие клетки выполняют специфические функции иммунной системы через рецепторы, например, FcR, экспрессируемые на их поверхностях. В конкретном варианте осуществления антигенпрезентирующая клетка обладает способностью к запуску ADCC, опосредованной через FcR, например низкоаффинный FcγR, экспрессируемый на поверхности клетки. Например, макрофаги, экспрессирующие FcR, вовлечены в фагоцитоз и деструкцию бактерий, покрытых антителами. Антигенпрезентирующие клетки могут также обладать способностью к высвобождению агента, который опосредует другие иммунные процессы. Например, тучные клетки могут активироваться посредством антитела, связанного с FcR для высвобождения гранул, например воспалительных молекул (например, цитокинов), на участке инфекции. В разнообразных других вариантах осуществления экспрессия FcR на антигенпрезентирующих клетках может регулироваться другими факторами (например, цитокинами). Например, экспрессия FcγRI и FcγRIII может включаться посредством стимуляции интерфероном-γ (IFN-γ).
Мышиные и человеческие FcR
Рецепторы для Fc (т.е. константных) областей иммуноглобулинов (FcR) играют важную роль в регуляции иммунного ответа. FcR присутствуют на антигенпрезентирующих клетках иммунной системы хозяина, чтобы эффективно располагать чужеродные антигены, связанные антителом. FcR также играют важные роли в балансе между как активирующими, так и ингибиторными ответами антигенпрезентирующих клеток иммунной системы. FcR вовлечены в фагоцитоз макрофагами, дегрануляцию тучных клеток, захват комплексов антитело-антиген и модуляцию иммунного ответа, а также другие процессы иммунной системы.
У мышей и людей различимые FcR дифференциально экспрессируются на поверхности различных антигенпрезентирующих клеток, каждая из которых является специфичной для изотипов иммуноглобулинов, присутствующих в наборе экспрессируемых антител. Например, антитела иммуноглобулина G (IgG) опосредуют эффекторные функции через рецепторы IgG (FcγR). FcγRs были классифицированы на три группы: высокоаффинные активирующие FcγRI (CD64), низкоаффинные ингибирующие FcγRII (CD32) и низкоаффинные активирующие FcγRIII (CD16). Несмотря на то, что каждая группа присутствует как у мышей, так и людей, число изоформ и субпопуляций иммунных клеток, на которых они присутствуют, является различным. Например, FcγRIIA и FcγRIIIB экспрессируются на антигенпрезентирующих клетках у людей, но по имеющимся данным отсутствуют у мышей. Дополнительно, аффинности различных изотипов IgG (например, IgG1) для каждого FcγR являются различными у мышей и людей.
Полагают, что системы клеточных сигналов активации или ингибирования через FcγR и эффекторные функции, ассоциированные со связыванием антитела с FcγR, являются опосредованными специфическими мотивами последовательностей внутриклеточных доменов FcγR или субъединиц со-рецепторов. Активирующие рецепторы чаще всего являются ассоциированными с общей γ-цепью (γ-цепью FcR), которая содержит иммунорецепторный тирозиновый активирующий мотив (ITAM). ITAM содержат специфическую последовательность из приблизительно 9-12 аминокислот, которые включают остатки тирозина, которые являются фосфорилированными в ответ на связывание антитела с FcR. Фосфорилирование приводит к каскаду сигнальной трансдукции. Сообщалось о мышах, у которых отсутствует ген, кодирующий γ-цепь FcR (FcR γ-цепь KO) (например, см. Takai et al. (1994) FcR γ Chain Depletion Results in Pleiotrophic Effector Cell Defects, Cell 76:519-529; van Vugt et al. (1996) FcR γ-chain is Essential for Both Surface Expression and Function of Human FcγRI (CD64) In Vivo, Blood 87(9):3593- 3599; and Park et al. (1998) Resistance Fc-receptor-deficient Mice to Fatal Glomerulonephritis, J. Clin. Invest. 102(6): 1229-1238). γ-цепь FcR является по имеющимся данным существенной для надлежащей поверхностной экспрессии и функции (например, сигнальной трансдукции, фагоцитоза и т.д.) большинства FcR; у мышей KO γ-цепи FcR отсутствует FcγRI в соответствии с некоторыми сообщениями. Однако по другим сообщениям FcR γ-цепь KO мыши несомненно экспрессируют FcγRI на поверхности некоторых антигенпрезентирующих клеток, и экспрессируемый FcγRI, по имеющимся данным, является функциональным в том, что он связывает IgG у мышей в отсутствие экспрессируемой γ-цепи FcR (Barnes et al. (2002) FcγRI-Deficient Mice Show Multiple Alterations to Inflammatory and Immune Responses, Immunity 16:379-389).
Напротив, FcγRIIB представляет собой ингибирующий рецептор, который содержит иммунорецепторный тирозиновый ингибирующий мотив (ITIM) в его цитоплазматическом домене. Подобно ITAM, ITIM являются мотивами последовательности, которые включают фосфорилируемые остатки тирозина. Однако события в прямом направлении (по нисходящей) после фосфорилирования ITM приводят к ингибированию, а не активации функций иммунных клеток. Мыши с отсутствием FcγRIIB, по имеющимся данным, проявляют увеличенный иммунный ответ в сравнении с мышами дикого типа (Takai et al. (1996) Augmented humoral and anaphylactic responses in FcgRII-deficient mice, Nature 379:346-349), и это наблюдение подтверждает роль FcγRIIB в качестве негативного регулятора иммунного ответа В-клеток.
У людей FcγRIIA, FcγRIIB, FcγRIIC, FcγRIIIA и FcγRIIIB рассматривают как классические гены низкоаффинных FcγR, и они расположены вместе на одной и той же хромосоме (Su et al. (2002) Genomic organization of classical human low-affinity Fcγ receptor genes, Genes and Immunity 3 (Supple 1):S51-S56). Эти гены проявляют несколько полиморфизмов, ассоциированных с различимыми фенотипами, например, изменением связывания лиганда и функции рецептора. Некоторые полиморфизмы ассоциированы с аутоиммунными заболеваниями, например системной красной волчанкой (SLE), ревматоидным артритом (RA) и рассеянным склерозом (MS). Были разработаны трансгенные мыши для различных человеческих FcγR (hFcγR), и их использовали в качестве моделей заболевания для генерации высокоаффинных антител, тестирования терапевтических антител по способности вызывать снецифические клеточные ответы, скрининга соединений, которые облегчают аберрантные иммунные ответы, и т.д. (например, см. Heijnen et al. (1996) A Human FcgRI/CD64 Transgenic Model for in Vivo Analysis of (Bispecific) Antibody Therapeutics, J. Hematother. 4:351-356; Heijnen and van de Winkel (1996) Antigen Targeting to Myeloid-specific Human FcgRI/CD64 Triggers Enhanced Antibody Responses in Transgenic, J. Clin. Invest. 97(2):331-338; патенты США №№ 6111166, 6676927, 7351875, 7402728 и 7416726).
Несмотря на существенные роли FcR в обеспечении мостика между антителами и антигенпрезентирующими клетками иммунной системы, в настоящее время не существует модельной системы, в которой экспрессируются все низкоаффинные hFcγR. Мыши, у которых все низкоаффинные hFcγR ко-экспрессируются - включая мышей, у которых отсутствуют эндогенные мышиные FcγR - в разнообразных вариантах осуществления могут применяться для точного отражения эффектов человеческих терапевтических антител, включая ADCC-опосредованные эффекты. Такие мыши могли бы служить в качестве жизнеспособного инструмента при конструировании, анализе и оценке терапевтических антител для лечения человеческих заболеваний, таких как, например, RA, диабет I типа, SLE и аутоиммунность, посредством предоставления животной модели, обеспечивающей достижение более точной оценки иммунологических процессов у людей, особенно в контексте тестирования человеческих терапевтических антител. Мышь также будет ценным источником клеток, несущих низкоаффинные рецепторы, которые могут применяться в анализах in vitro для оценки терапевтически зависимого уничтожения клеток для терапевтических средств, которые связывают низкоаффинные рецепторы, и, таким образом, для идентификации применимых для человека терапевтических средств.
Мыши с врожденным отсутствием гена эндогенного низкоаффинного FcγR
Предоставлены генетически модифицированные животные, не относящиеся к человеку, которые не экспрессируют гены эндогенного низкоаффинного мышиного FcγR, но которые экспрессируют γ-цепь эндогенного мышиного FcR. В разнообразных вариантах осуществления γ-цепь FcR экспрессируется с распределением (т.е. по типам клеток) и на уровне у мыши, который является таким же или по существу таким же, что и у мыши дикого типа. Гены эндогенных низкоаффинных FcγR могут экспрессироваться или на поверхности иммунных клеток, или растворимым образом в периферических системах животного. Генетические модификации для получения животного, не являющегося человеком, которое не экспрессирует гены эндогенного низкоаффинного мышиного FcγR, удобны для описания с использованием мыши в качестве иллюстрации. Генетически модифицированная мышь в соответствии с изобретением может быть получена разнообразными путями, конкретные варианты осуществления которых обсуждаются здесь.
Схематическая иллюстрация (не в масштабе) локуса гена низкоаффинного мышиного FcγR предоставлена на фиг.1 (верх), чтобы показать расположение гена FcγR в эндогенном локусе. Как иллюстрировано, гены FcγRIIB, FcγRIV и FcγRIII низкоаффинного мышиного FcγR присутствуют вместе в тесной близости на одной хромосоме. Каждый из этих генов содержит α-цепь или домен связывания лиганда, ответственный за связывание Fc части молекулы антитела.
Генетически модифицированная мышь, у которой отсутствует нуклеотидная последовательность, кодирующая α-цепь генов эндогенного низкоаффинного FcγR, может быть получена любым способом, известным в данной области. Например, может быть получен целенаправляющий вектор, который производит делецию генов α-цепи низкоаффинного мышиного FcγR с помощью гена селектируемого маркера. Фиг.1 иллюстрирует мышиный геном (низ), направленный посредством целенаправляющей конструкции, имеющей плечо 5'-гомологии, содержащее последовательность по восходящей от локуса α-цепи эндогенного низкоаффинного FcγR, с последующей кассетой селекции лекарственного средства (например, гена резистентности к неомицину, фланкированной последовательностями loxP), и плечо 3'-гомологии, содержащее последовательность по нисходящей от локуса α-цепи эндогенного низкоаффинного FcγR. При гомологичной рекомбинации в локусе локус α-цепи эндогенного низкоаффинного FcγR заменяют на кассету селекции лекарственного средства (низ фиг.1). Локус гена α-цепи эндогенного низкоаффинного FcγR посредством этого подвергается делеции, что приводит в результате к клетке или животному, не относящемуся к человеку, которые не экспрессируют гены α-цепи эндогенного низкоаффинного мышиного FcγR. Кассета селекции лекарственного средства может необязательно удаляться посредством последующего добавления рекомбиназы (например, посредством обработки Cre).
Генетическая модификация мыши, чтобы сделать ген или гены α-цепи эндогенного низкоаффинного мышиного FcγR нефункциональными, в разнообразных вариантах осуществления, приводит в результате к мыши, которая проявляет дефекты при иммунных ответах, делая мышь применимой для оценки совместной, а также индивидуальной ролей генов эндогенного низкоаффинного мышиного FcγR при нормальной и нарушенной иммунной функции, IgG-опосредованных процессах и аутоиммунном заболевании. В разнообразных вариантах осуществления модификация генов α-цепей эндогенного низкоаффинного мышиного FcγR, но не γ-цепи FcR, позволяет избежать потенциального снижения других генов эндогенного FcR (например, высокоаффинного FcγRI), которым требуется γ-цепь FcR для поверхностной экспрессии и функции, таким образом поддерживая разнообразные другие иммунологические функции и процессы, опосредованные через γ-цепь-зависимые процессы.
В соответствии с некоторыми сообщениями, отсутствует поверхностная экспрессия FcγRIII и FcγRI. Однако FcγRI, по имеющимся данным, был обнаружен на поверхности клетки у мышей без генов γ-цепи FcR и является, по имеющимся данным, по меньшей мере, частично функциональным. Напротив, мыши в соответствии с настоящим изобретением содержат немодифицированную γ-цепь эндогенного FcR, которая сохраняет природные схемы экспрессии на поверхности клеток и клеточные функции других генов FcR, которые требуются для γ-цепи FcR.
В разнообразных вариантах осуществления мыши настоящего изобретения представляют преимущество над другими мышами с отсутствием генов FcγR в том, что генетические модификации, которые они несут, приводят в результате к поддержанию других генов, необходимых для других иммунологических функций, не полностью обусловленных генами низкоаффинного FcγR. Например, с γ-цепью функционального FcR, другие γ-цепь-зависимые белки (например, FcγRI) будут способны ассоциировать с γ-цепью FcR и участвовать в эффекторных клеточных функциях при иммунном ответе. Полагают, что поддержание таких функций (вследствие наличия функциональной γ-цепи FcR) у разнообразных генетически модифицированных мышей в соответствии с изобретением, во время делеции генов эндогенного низкоаффинного FcγR (одна или более α-субъединиц) позволяет провести более точное выяснение ролей FcR при аутоиммунности.
Гуманизированные мыши с низкоаффинными FcγR
Предоставлены генетически модифицированные животные, не относящиеся к человеку, которые экспрессируют гены низкоаффинного человеческого FcγR. Гены низкоаффинного человеческого FcγR могут экспрессироваться или на поверхности антигенпрезентирующих клеток иммунной системы животного, или растворимым образом в периферических органах животных.
Генетическая модификация, в разнообразных вариантах осуществления, содержит делецию генов функциональной α-цепи одного или нескольких низкоаффинных мышиных FcγR и в некоторых вариантах осуществления дополнительную модификацию, содержащую замену на два или более, на три или более, на четыре или более или на пять генов α-субъединицы низкоаффинного человеческого FcγR, где животное, не относящееся к человеку, экспрессирует ген функциональной γ-цепи мышиного FcR. Также предоставлены генетически модифицированные эмбрионы, не относящиеся к человеку, клетки и целенаправляющие конструкции для получения животных, не относящихся к человеку, эмбрионов, не относящихся к человеку, и клеток.
Предоставлены композиции и способы для получения мыши, которая экспрессирует ген человеческого FcγR, включая конкретные полиморфные формы или аллельные варианты (например, одиночные аминокислотные различия), включая композиции и способ получения мыши, которая экспрессирует такие гены из человеческой промоторной и человеческой регуляторной последовательности. Способы включают селективное придание нефункциональности гену эндогенного низкоаффинного мышиного FcγR (например, посредством делеции его α-цепи) и использование гена α-цепи низкоаффинного человеческого FcγR в локусе гена эндогенного низкоаффинного мышиного FcγR, чтобы экспрессировать ген α-субъединицы низкоаффинного человеческого FcγR у мыши. Делецию гена низкоаффинного мышиного FcγR проводят посредством делеции одного или нескольких генов α-цепи, но не гена γ-цепи FcR. Данный подход селективно придает нефункциональность одному или нескольким генам α-цепи эндогенного низкоаффинного FcγR, в то же время сохраняя функциональную γ-цепь эндогенного FcR.
В подходе с заменой α-цепи эндогенного FcγR используют относительно минимальное нарушение в естественной FcγR-опосредованной сигнальной трансдукции у животного, в разнообразных вариантах осуществления, вследствие того, что геномную последовательность α-цепей FcγR заменяют в одиночном фрагменте и, следовательно, сохраняют нормальную функциональность посредством включения необходимых регуляторных последовательностей. Таким образом, в таких вариантах осуществления модификация α-цепи FcγR не оказывает воздействия на другие эндогенные FcR, зависимые от функциональных молекул γ-цепи FcR. Дополнительно, в разнообразных вариантах осуществления модификация не оказывает воздействия на сборку комплекса функционального рецептора, включающего в себя α-цепь FcγR и γ-цепь эндогенного FcR, которая, как полагают, требуется для надлежащей экспрессии нескольких α-цепей FcγR на поверхности клетки и для передачи сигналов по нисходящей, являющейся результатом активированного рецептора. Вследствие того, что γ-цепь FcR не подвергается делеции, в разнообразных вариантах осуществления животные, содержащие замену генов α-цепи эндогенного FcγR на гены α-цепи человеческого FcγR, должны обладать способностью передавать нормальные эффекторные функции от антител через связывание Fc части иммуноглобулинов IgG с человеческими α-цепями FcγR, присутствующими на поверхности антигенпрезентирующих клеток.
Схематическая иллюстрация (не в масштабе) подвергнутого делеции гена эндогенного низкоаффинного мышиного FcγR предоставлена на фиг.4 (верх). Как иллюстрировано, гены FcγRIIA и FcγRIIIA низкоаффинного человеческого FcγR встраивают в подвергнутый делеции локус гена эндогенного низкоаффинного мышиного FcγR посредством целенаправляющей конструкции (человеческий FcγRIIIA-IIA целенаправляющий вектор) c геномным фрагментом, содержащим человеческие гены человеческого низкоаффинного FcγRIIA и FcγRIIIA. Каждый из этих генов содержит α-цепь или лигандсвязывающий домен генов человеческого FcγR, ответственного за связывание Fc части молекулы антитела.
Генетически модифицированная мышь, которая экспрессирует гены низкоаффинного человеческого FcγR в локусе эндогенного низкоаффинного мышиного FcγR, может быть получена любым способом, известным в данной области. Например, может быть получен целенаправляющий вектор, который встраивает гены низкоаффинного человеческого FcγR (например, FcγRIIA и FcγRIIIA) с помощью гена селектируемого маркера. Фиг.4 иллюстрирует мышиный геном, содержащий делецию локуса эндогенного низкоаффинного FcγR (верх). Как иллюстрировано, целенаправляющая конструкция содержит плечо 5'-гомологии, содержащее последовательность по восходящей от локуса эндогенного низкоаффинного мышиного FcγR, с последующей кассетой селекции лекарственного средства (например, ген резистентности к гигромицину, фланкированный по обеим сторонам последовательностями loxP), геномный фрагмент, содержащий ген человеческого FcγRIIA, ген человеческого HSP76 и ген человеческого FcγRIIIA, и плечо 3'-гомологии, содержащее последовательность по нисходящей от локуса эндогенного низкоаффинного мышиного FcγR. При гомологичной рекомбинации в подвергнутом селекции локусе кассету селекции лекарственного средства заменяют на последовательность, содержащуюся в целенаправляющем векторе (низ фиг.4). Локус гена эндогенного низкоаффинного FcγR, таким образом, заменяют на гены низкоаффинного человеческого FcγR, что приводит в результате к клетке или животному, которое экспрессирует гены низкоаффинного человеческого FcγR. Кассета селекции лекарственного средства может необязательно быть удалена посредством последующего добавления рекомбиназы (например, посредством обработки Cre).
Для экспрессии hFcγRIIA на тромбоцитах целенаправляющий вектор человеческого hFcγRIIA-IIA целенаправляющей конструкции содержит расширенную последовательность, которая включает, например, всю или по существу всю область человеческого промотора, функционально связанную с геном hFcγRIIA в человеческом геноме. Для предотвращения экспрессии hFcγRIIA на тромбоцитах в целенаправляющей конструкции отсутствует вся или по существу вся область человеческого промотора, функционально связанная с геном hFcγRIIA у человека.
Дополнительные модификации в химерном локусе (низ фиг.4) могут достигаться с использованием аналогичных методов, как описано для замены на два гена человеческого FcγR. Модификация для замены локуса гена эндогенного низкоаффинного FcγR на два гена человеческого FcγR может дополнительно предоставить исходную точку для внедрения других генов низкоаффинного человеческого FcγR. Например, схематическая иллюстрация (не в масштабе) локуса эндогенного низкоаффинного FcγR, замененного на два гена человеческого низкоаффинного FcγR, предоставлена на фиг.6 (верх). Как иллюстрировано, гены FcγRIIB, FcγRIIC и FcγRIIIB низкоаффинного человеческого FcγR встраивают в модифицированный локус гена эндогенного низкоаффинного мышиного FcγR посредством еще одной целенаправляющей конструкции (целенаправляющий вектор человеческого FcγRIIB-IIIB-IIC) с геномным фрагментом, содержащим гены низкоаффинного человеческого FcγRIIB, FcγRIIC и FcγRIIIB. Каждый из этих генов содержит α-цепь или лигандсвязывающий домен генов человеческого FcγR, ответственные за связывание Fc части молекулы антитела.
Генетически модифицированная мышь, которая экспрессирует пять генов низкоаффинного человеческого FcγR в локусе эндогенного низкоаффинного мышиного FcγR, может быть получена любым способом, известным в данной области. Например, может быть получен целенаправляющий вектор, который встраивает гены низкоаффинного человеческого FcγR (например, FcγRIIB, FcγRIIC и FcγRIIIB) с геном селектируемого маркера. Фиг.6 иллюстрирует мышиный геном, содержащий замену локуса эндогенного низкоаффинного FcγR на два гена низкоаффинного человеческого FcγR (верх). Как иллюстрировано, целенаправляющая конструкция содержит плечо 5'-гомологии, содержащее последовательность по восходящей от локуса эндогенного низкоаффинного мышиного FcγR, с последующей кассетой селекции лекарственного средства (например, ген резистентности к неомицину, фланкированный по обеим сторонам последовательностями loxP), геномный фрагмент, содержащий ген человеческого FcγRIIB, человеческого FcγRIIIB, ген человеческого HSP77, ген человеческого FcγRIIC, с последующим плечом 3'-гомологии, содержащим последовательность по восходящей от гена низкоаффинного человеческого FcγRIIIA, присутствующего в эндогенном локусе. При гомологичной рекомбинации в модифицированном локусе ген человеческого FcγRIIB, FcγRIIIB и FcγRIIC встраивают 5' по отношению к генам человеческого FcγRIIIA и FcγRIIA, ранее присутствующим в локусе гена эндогенного низкоаффинного FcγR посредством последовательности, содержащейся в целенаправляющем векторе (низ фиг.6). Модифицированный локус гена эндогенного низкоаффинного FcγR, таким образом, дополнительно модифицируют для встраивания трех дополнительных генов низкоаффинного человеческого FcγR, что приводит в результате к клетке или животному, которые экспрессируют пять генов низкоаффинного человеческого FcγR. Кассета селекции лекарственного средства может необязательно удаляться посредством последующего добавления рекомбиназы (например, посредством обработки Cre). Фиг.6 (низ) показывает структуру результирующего локуса, который будет экспрессировать пять генов низкоаффинного человеческого FcγR, который может быть обнаружен на поверхности антигенпрезентирующих клеток иммунной системы животного и может независимо ассоциировать, надлежащим образом, с эндогенной FcR γ-цепью.
Экспериментальные модели мышей с отсутствием FcγR и FcγR гуманизированных мышей
Генетически модифицированные животные, не относящиеся к человеку, которые не экспрессируют гены эндогенного низкоаффинного мышиного FcγR, являются применимыми, например, для выяснения разнообразных функций индивидуальных генов низкоаффинных FcγR при иммунном ответе, для измерения эффективности действия человеческих терапевтических антител через клеточно-опосредованный иммунитет (например, ADCC), для определения роли FcγR при иммунных заболеваниях или нарушениях, чтобы служить в качестве моделей иммунных заболеваний или нарушений, для генерации антител против одного или нескольких белков FcγR и чтобы служить в качестве партнеров для скрещивания для генерации других генетически модифицированных мышей, представляющих интерес.
В одном варианте осуществления мышь в соответствии с изобретением может использоваться для определения цитотоксического эффекта, утерянного (в сравнении с мышью дикого типа) мышью, которая не экспрессирует гены низкоаффинных FcγR посредством введения агента такой мыши, где агент известен как запускающий FcγR-зависимый цитотоксический эффект у мыши дикого типа. В одном варианте осуществления мыши настоящего изобретения имплантируют опухолевые клетки и через последующий период времени инъекционно вводят антитело, специфичное для антигена, экспрессируемого на поверхности опухолевых клеток. Изотип антитела является известным перед инъекцией, и животных подвергают анализу на нарушение FcγR-зависимой ADCC при сравнении с ADCC, наблюдаемой у животных дикого типа.
В еще одном аспекте мыши с отсутствием эндогенных низкоаффинных рецепторов могут быть объединены (например, посредством скрещивания) с другими иммунодефицитными мышами для разработки моделей аутоиммунного заболевания in vivo. Например, мыши с тяжелым комбинированным иммунодефицитом (SCID) рутинным образом используются в данной области в качестве модельных организмов для исследования иммунной системы. Мыши с SCID имеют нарушенную способность к получению T- или B-лимфоцитов или к активации некоторых компонентов системы комплемента, и не могут эффективно бороться с инфекциями, отторгать опухоли и отторгать трансплантаты. Мыши настоящего изобретения с отсутствием гена α-субъединицы низкоаффинного FcγR могут быть скрещены с мышами SCID, чтобы гарантировать элиминацию клеток у животного-хозяина в ответ на введение терапевтического антитела (например, противоопухолевого антитела), которое сможет определить роли ADCC и комплементзависимой цитотоксичности (CDC) при элиминации опухолевых клеток in vivo.
В еще одном аспекте предоставлены генетически модифицированные животные, не относящиеся к человеку, содержащие замену генов эндогенного низкоаффинного FcγR на гены низкоаффинного человеческого FcγR. Такие животные являются применимыми для исследования фармакокинетики полностью человеческих антител и hFcγR-опосредованной ADCC. В дополнение, было показано, что гены человеческого FcγR проявляют полиморфизмы или аллельные варианты, ассоциированные с заболеванием (например, SLE, RA, гранулематоз Вегенера, синдром Гийена-Барре и рассеянный склероз). Таким образом, генетически модифицированные животные, не относящиеся к человеку, которые содержат замену генов эндогенного низкоаффинного FcγR со специфическими аллельными или полиморфными формами генов человеческого FcγR, могут применяться для исследования человеческих аутоиммунных заболеваний и признаков, ассоциированных с полиморфизмами у животного. В конкретном варианте осуществления аллельные формы человеческих генов FcγR ассоциированы с усиленной эффективностью действия для человеческих IgG.
В еще одном конкретном варианте осуществления определяют воздействие полиморфизма человеческого низкоаффинного FcγR на эффективность действия человеческого терапевтического антитела. В конкретном варианте осуществления противоопухолевое антитело вводят первой гуманизированной мыши, содержащей первый полиморфизм человеческого FcγR, и также второй гуманизированной мыши, содержащей второй полиморфизм человеческого FcγR, где первая и вторая мыши, каждая, содержат человеческую опухолевую клетку; и противоопухолевую активность противоопухолевого антитела оценивают у первой мыши и у второй мыши. В конкретном варианте осуществления вариант лечения выбирается лечащим врачом по отношению к лечению человека, имеющего первый или второй полиморфизм и имеющего опухоль, соответствующую человеческой опухолевой клетке, на основании оценки эффективности действия противоопухолевого антитела у первой мыши и у второй мыши.
Подходящие полиморфизмы генов человеческого FcγR включают все полиморфизмы, известные в данной области. Для гена человеческого FcγRIIA полиморфизмы включают, например, высокоотвечающий и низкоотвечающий фенотипы, отличающиеся по способности T-клеток пролиферировать в ответ на IgG. Высокоотвечающий полиморфизм характеризуется остатком аргинина в положении 131 (131Arg), в то время как низкоотвечающий характеризуется остатком гистидина в положении 131 (131His). В конкретном варианте осуществления последовательность человеческого FcγRIIA содержит 131His полиморфизм. Представительная последовательность белка α-цепи человеческого FcγRIIA показана в SEQ ID NO:32.
Одиночные нуклеотидные замещения гена человеческого FcγRIIB приводят в результате к несмысловым замещениям в лигандсвязывающем домене (α-цепи) и предположительно оказывают воздействие на связывающую способность Fc части IgG связываться с α-цепью FcγRIIB на поверхности клетки. Например, было показано, что замещение остатка треонина на изолейцин в положении 232 (Ile232Thr) внутри трансмембранного домена гена FcγRIIB у мышей нарушает способность к передаче сигналов у рецептора. В конкретном варианте осуществления ген человеческого FcγRIIB содержит изолейциновый вариант (232Ile). Представительная последовательность белка α-цепи человеческого FcγRIIB показана в SEQ ID NO:33.
Предполагают, что аллельные варианты гена человеческого FcγRIIIA вовлечены в предрасположенность к SLE и RA. Этот аллельный вариант включает замещение фенилаланина на валин в положении 158 (Val158Phe). Валиновый аллельный вариант (158Val) характеризуется как имеющий более высокое сродство к IgG1 и IgG3, чем фенилаланиновый аллельный вариант (158Phe). Предполагают, что аллельный вариант 158Phe приводит к сниженному выведению иммунных комплексов. В конкретном варианте осуществления ген человеческого FcγRIIIA содержит аллельный вариант 158Val. Представительная последовательность белка α-цепи человеческого FcγRIIIA показана в SEQ ID NO:35.
Аллельные варианты гена человеческого FcγRIIIB включают аллели нейтрофильного антигена 1 (NA1) и нейтрофильного антигена 2 (NA2). Предполагают, что эти аллельные варианты вовлечены в гемотрансфузионные реакции, аллоиммунную нейтропению, SLE и гранулематоз Вегенера. Аллельный вариант NA2 характеризуется сниженной способностью к опосредованию фагоцитоза. В конкретном варианте осуществления ген человеческого FcγRIIIB содержит аллельный вариант NA2. Представительная последовательность белка α-цепи человеческого FcγRIIIB показана в SEQ ID NO:36.
В одном аспекте генетически модифицированные животные, не относящиеся к человеку, являются применимыми для оптимизации FcγR-опосредованных функций, запускаемых Fc частью терапевтических антител. Fc области антител могут быть модифицированы любым способом, известным в данной области. Например, аминокислотные остатки внутри Fc части (например, CH2 и CH3 домены) могут быть модифицированы, чтобы селективно усилить сродство связывания с человеческим FcγRIIIA. Таким образом, полученное в результате антитело должно иметь усиленную FcγRIIIA-зависимую ADCC. В конкретном варианте осуществления животное, экспрессирующее человеческий FcγRIIIA настоящего изобретения, применяют для оценки усиленной способности к ADCC модифицированного человеческого антитела посредством введения модифицированного человеческого антитела животному, обнаружения (например, in vitro) связывания антитела с FcγRIIIA-экспрессирующими клетками и сравнения наблюдаемой активности ADCC с наблюдаемой активностью ADCC, которую определяют у животного дикого типа.
ПРИМЕРЫ
Пример 1: Генерация мышей с отсутствием гена низкоаффинного FcγR
Была построена целенаправляющая конструкция для внедрения делеции локуса эндогенного низкоаффинного мышиного FcγR (описанная ниже) (фиг.1).
Целенаправляющая конструкция была получена с использованием технологии VELOCIGENE® (см., например, патент США № 6586251 и Valenzuela et al. (2003) High-throughput engineering of the mouse genome coupled with high-resolution expression analysis, Nature Biotech. 21(6):652-659) для модификации бактериальной искусственной хромосомы (BAC) RP23-395f6 (Invitrogen). ДНК RP23-395f6 BAC была модифицирована для делеции генов эндогенных низкоаффинных FcγRIIB, FcγRIV и FcγRIII, содержащих α-цепь каждого из FcγR.
Вкратце, плечи гомологии в прямом и обратном направлениях были получены с использованием праймеров mFcR 5-up-1 (5'-ACCAGGATAT GACCTGTAGA G; SEQ ID NO:1), и mFcR 3-up-1а (GTCCATGGGT AAGTAGAAAC A; SEQ ID NO:2), и mFcR 5-DN (ATGCGAGCTC ATGCATCTATG TCGGGTGCGG AGAAAGAGGT AATGCATTCT TGCCCAATAC TTAC; SEQ ID NO:3), и mFcR 3-DN (ACTCATGGAG CCTCAACAGG A; SEQ ID NO:4), соответственно. Эти плечи гомологии применяли для создания кассеты, которая подвергала делеции гены α-цепей эндогенных низкоаффинных FcγRIIB, FcγRIV и FcγRIII. Целенаправляющая конструкция включала ген резистентности к неомицину loxed, содержащий плечи гомологии, содержащие последовательность гомологичную 5'- и 3'-области по отношению к эндогенному локусу. Гены и/или последовательности по восходящей от гена эндогенного FcγRIIB и по нисходящей от гена эндогенного FcγRIII (см. фиг.1) не были модифицированы целенаправляющей конструкцией.
Направленная делеция была подтверждена полимеразной цепной реакцией (ПЦР) с использованием праймеров вне подвергнутой делеции области и внутри целенаправляющей конструкции. Область по восходящей от подвергнутого делеции локуса была подтверждена ПЦР с использованием праймеров mFcR-up-detect (ATCCTGAGTA TACTATGACA AGA; SEQ ID NO:5) и PGK-up-detect (ACTAGTGAGA CGTGCTACTT C; SEQ ID NO:6), в то время как область по нисходящей от подвергнутого делеции локуса была подтверждена ПЦР с использованием праймеров pA-DN-detect (CTCCCACTCA TGATCTATAG A; SEQ ID NO:7) и mFcR-DN-detect (TGGAGCCTCA ACAGGACTCC A; SEQ ID NO:8). Нуклеотидная последовательность по восходящей от точки делеции включала следующую, которая указывает на эндогенную мышиную последовательность по нисходящей от гена FcγRIIB (содержащуюся внутри скобок ниже), связанную смежно с последовательностью кассеты, присутствующей в точке делеции (GTCCATGGGT AAGTAGAAAC A)TTCGCTACC TTAGGACCGT TA (SEQ ID NO:9). Нуклеотидная последовательность по нисходящей от точки делеции включала следующую, которая указывает на последовательность кассеты, смежную с эндогенной мышиной последовательностью по восходящей от гена FcγRIII (содержащейся внутри скобок ниже): CGGGTGCGGA GAAAGAGGTA AT(GCATTCTT GCCCAATACT TA) (SEQ ID NO:10).
Мышей с отсутствием FcγRIIB, FcγRIII и FcγRIV генерировали посредством электропорации целенаправленной ДНК BAC (описанной выше) в мышиные ES клетки. Положительные клоны ES клеток подтверждали скринингом Taqman™ и кариотипированием. Положительные клоны ES клеток затем применяли для имплантации самкам мышей, чтобы дать начало помету детенышей с отсутствием генов низкоаффинных FcγR.
Пример 2: Характеризация мышей с отсутствием гена низкоаффинного FcγR
Селезенки собирали от мышей с отсутствием гена FcγR и мышей дикого типа и подвергали перфузии 10 мл Коллагеназы-D в стерильных одноразовых мешках. Каждый мешок, содержащий единственную селезенку, затем помещали в Stomacher® (Seward) и гомогенизировали в установленной среде в течение 30 секунд. Гомогенизированные селезенки переносили в чашки Петри диаметром 10 см и инкубировали в течение 25 минут при 37ºC. Клетки отделяли с помощью пипетки, используя разбавление 1:50 0,5M ЭДТА, с последующей еще одной инкубацией в течение пяти минут при 37ºC. Клетки затем осаждали в форме сгустков с помощью центрифуги (1000 об/мин в течение 10 минут) и красные кровяные клетки лизировали в 4 мл буфера ACK (Invitrogen) в течение трех минут. Спленоциты разбавляли RPMI-1640 (Sigma) и центрифугировали повторно. Сгустки клеток ресуспендировали в 10 мл RPMI-1640 и фильтровали с помощью клеточного фильтра 0,2 мкм.
Проточная цитометрия. Популяции лимфоцитных клеток идентифицировали посредством FAC на системе BD LSR II (BD Bioscience) со следующими конъюгированными с флуорохромом маркерами клеточной поверхности: против-CD19 (B-клетки), против-CD3 (T-клетки), против-NKp46 (NK-клетки) и против-F4/80 (макрофаги). Лимфоцитам устанавливали порог для специфических клеточных линий дифференцировки и их анализировали на экспрессию эндогенных FcγRIII и FcγRIIB с помощью крысиного антитела к мышиному FcγRIII/II (клон 2.4G2, BD Biosciences). Клон 2.4G2 распознает общий полиморфный эпитоп на внеклеточных доменах мышиных FcγRIII и FcγRII. Результаты показывают, что у мышей mFcγR KO отсутствуют обнаруживаемые мышиные низкоаффинные FcγRIII или FcγRII на B-клетках, NK-клетках и макрофагах (фиг.2).
Анализ на ADCC. Спленоциты, выделенные из мышей с отсутствием генов FcγR и мышей дикого типа, анализировали на предмет их способности осуществлять ADCC в анализе на уничтожение клеток. Популяции клеток были выделены и разделены с использованием технологии MACS® (Miltenyi Biotec). Вкратце, T-клетки элиминировали из спленоцитов с использованием магнитно-меченных шариков с антимышиным CD3. Спленоциты с элиминированными T-клетками затем обогащали NK-клетками с использованием магнитно-меченных шариков с антимышиным CD49B. Отдельно, клетки Раджи (экспрессирующие человеческие CD20) покрывали изменяющимися концентрациями (в интервале от 0,1 до 10 мкг/мл) мышиного антитела к человеческому CD20 (Клон B1; Beckman Coulter) в течение 30 минут при 4ºC. Покрытые антителами клетки Раджи инкубировали с обогащенными NK-клетками при соотношениях (NK:Раджи), равных 100:1 и 50:1, в течение четырех часов при 37ºC. Смерть клеток измеряли с использованием анализа на цитотоксичность CytoTox-Glo™ (Promega). Сигнал люминесценции получают от лизированных клеток, и он является пропорциональным числу мертвых клеток. Люминесценцию от контролей (отсутствие антитела против-CD20) определяли для фонового счета мертвых клеток для каждого соотношения и вычитали из измерений для мышей дикого типа и KO мышей. Рассчитывали среднее значение смерти клеток и процент снижения при уничтожении клеток (% ADCC) определяли посредством сравнения с диким типом. Результаты показаны в таблице 1.
|
Пример 3: Элиминация B-клеток in vivo у мышей с отсутствием генов низкоаффинного FcγR
Эффект изотипов человеческих или мышиных Fc на элиминацию В-клеток через путь ADCC определяли для разнообразных популяций В-клеток у мышей с отсутствием генов низкоаффинного FcγR, сконструированных для экспрессии человеческих CD20 с использованием человеческих антител к человеческому CD20. Мышей, экспрессирующих человеческие CD20, конструировали отдельно с использованием методов, известных в данной области. Мыши, которые экспрессируют человеческие CD20 на B-клетках и у которых отсутствуют гены низкоаффинного FcγR (описанные в примере 1), были получены посредством стандартных методов скрещивания двух сконструированных штаммов.
Каждой из отдельных групп мышей, которые экспрессировали человеческие CD20 и имели полный комплемент генов эндогенного низкоаффинного FcγR, вводили одно из следующих: (1) 10 мг/кг контрольного антитела (N=4; человеческое антитело, неспецифическое для человеческого CD20, имеющего мышиный IgG2a); (2) 2 мг/кг Ab 168 (N=3; человеческое антитело против-hCD20 с мышиным IgG2a; последовательности вариабельной области тяжелой и легкой цепи, обнаруженные в SEQ ID NO:339 и 347, соответственно, опубликованная патентная заявка США № 2009/0035322); (3) 10 мг/кг Ab 168; (4) 2 мг/кг Ab 735 (N=3; Ab 168 с человеческим IgG1); (5) 10 мг/кг Ab 735. В аналогичном ряде экспериментов группам мышей, которые экспрессировали человеческие CD20 и имели делецию генов эндогенного низкоаффинного FcγR, вводили контрольные антитела и человеческие антитела против-hCD20 (описанные выше).
Мышам в каждой группе вводили антитела посредством внутрибрюшинных инъекций. Через семь дней после инъекции животных умерщвляли и оставшиеся В-клетки, содержащиеся в костном мозге (B220+/IgM+), периферической крови (B220+/CD19+), лимфатическом узле (B220+/CD19+) и селезенке (B220+/CD19+), идентифицировали посредством многоцветной FACS, осуществляемой на проточном цитометре LSR-II, и анализировали, используя программное обеспечение Flow-Jo (как описано выше). Результаты экспериментов по элиминации В-клеток показаны на фиг.3A-3D.
Как показано на фиг.3A-3D, Ab 735 элиминировали B-клетки с более низкой эффективностью, чем Ab 168 у мышей, содержащих полный комплемент генов низкоаффинных FcγR. Дополнительно, для обоих типов антител (мышиные и человеческие Fc) элиминация В-клеток была значительно снижена у мышей с отсутствием полного комплемента генов низкоаффинного FcγR. Данный пример показывает, что для способности элиминировать B-клетки через путь ADCC требуются низкоаффинные FcγRs, и демонстрирует, что измерение эффективности ADCC для антител, содержащих человеческие константные области, у мышей является более приемлемым посредством применения генетически сконструированных мышей, содержащих полный комплемент генов человеческого низкоаффинного FcγR.
Пример 4: Генерация FcγRIIIA/FcγRIIA гуманизированных мышей
Была построена целенаправляющая конструкция для введения двух генов низкоаффинного человеческого FcγR в подвергнутый делеции локус эндогенного низкоаффинного мышиного FcγR (описанный ниже) (фиг.4).
Целенаправляющая конструкция, содержащая гены человеческих FcγRIIA и FcγRIIIA, была получена с использованием аналогичных способов (см. пример 1) через модификацию BAC RP23-395f6 и CTD-2514j12 (Invitrogen). ДНК BAC обеих BAC была модифицирована для введения делеции генов α-цепей низкоаффинных человеческих FcγRIIA и FcγRIIIA в подвергнутый делеции локус эндогенного низкоаффинного FcγR.
Аналогичным образом, были получены плечи гомологии по восходящей и нисходящей с использованием праймеров h14 (GCCAGCCACA AAGGAGATAA TC; SEQ ID NO:11), и h15 (GCAACATTTA GGACAACTCG GG; SEQ ID NO:12), и h4 (GATTTCCTAA CCACCTACCC C; SEQ ID NO:13), и h5 (TCTTTTCCAA TGGCAGTTG; SEQ ID NO:14), соответственно. Эти плечи гомологии применяли для получения кассеты, которая вводила гены α-цепей низкоаффинного человеческого FcγRIIA и FcγRIIIA в локус эндогенного мышиного низкоаффинного FcγR. Целенаправляющая конструкция включала плечо 5'-гомологии, включающее последовательность от 5' до подвергнутого делеции локуса эндогенного низкоаффинного FcγR, FRT'ed, ген резистентности к гигромицину, с последующим человеческим геномным фрагментом из BAC CTD-2514j12, содержащим гены α-цепи низкоаффинных человеческих FcγRIIA и FcγRIIIA, и плечо 3'-гомологии, содержащее мышиную последовательность от 3' до подвергнутого делеции локуса эндогенного низкоаффинного FcγR (середина фиг.4). Для мыши, которая экспрессирует FcγRIIA на мышиных тромбоцитах, целенаправляющая конструкция была получена аналогичным образом (с использованием тех же самых BAC) за исключением того, что конструкция содержит удлиненную промоторную последовательность, функционально связанную с геном человеческого FcγRIIA в человеческом геноме, например, вплоть до приблизительно 18 т.о. или более, с использованием гигромициновой кассеты, которая фланкирована по обеим сторонам сайтами lox2372, где область сочленения промоторной области и первого сайта lox 2372 представляет собой ATCGGGGATA GAGATGTTTG (CC)GCGATCGC GGTACCGGGC (SEQ ID NO:37 человеческой/lox2372 области сочленения в скобках), и где область сочленения второго сайта lox2372 и мышиной последовательности представляет собой TTATACGAAG TTATACCGG(T G)CATTCTTGC CCAATACTTA (SEQ ID NO:38 lox2372/мышиной области сочленения в скобках). Подходящие праймеры применяли для генотипирования гуманизации, содержащей промоторную область.
Целенаправленная вставка генов α-цепи человеческих FcγRIIA и FcγRIIIA была подтверждена посредством ПЦР (как описано выше). Восходящая область частично гуманизированного локуса была подтверждена посредством ПЦР, с использованием праймеров h16 (CCCAGGTAAG TCGTGATGAA ACAG; SEQ ID NO:15) и pA-DN-detect (CTCCCACTCA TGATCTATAG A; SEQ ID NO:16), в то время как нисходящая область частично гуманизированного локуса была подтверждена с использованием праймеров mFcR DN-detect-9 (TGGAGCCTCA ACAGGACTCC A; SEQ ID NO:17) и h6 (CACACATCTC CTGGTGACTT G; SEQ ID NO:18). Нуклеотидная последовательность по длине нисходящей области сочленения включала следующее, что указывает на новую точку вставки эндогенной человеческой последовательности по восходящей от гена hFcγRIIA (содержащуюся в скобках ниже), примыкающей к эндогенной мышиной последовательности в 3'-направлении от подвергнутого делеции локуса низкоаффинного FcγR: (CAACTGCCAT TGGAAAAGA)C TCGAGTGCCA TTTCATTACC TC (SEQ ID NO:19). Восходящая область сочленения включает две новых последовательности. Одна точка восходящей области сочленения включает следующую, которая указывает на нуклеотидную последовательность гигромициновой кассеты, примыкающую к человеческой геномной последовательности (содержащейся в скобках ниже), которая содержит восходящую область введенного гена hFcγRIIIA: TAAACCCGCG GTGGAGCTC(G CCAGCCACAA AGGAGATAAT CA) (SEQ ID NO:20). Вторая точка восходящей области сочленения включает следующую, которая указыает на нуклеотидную последовательность эндогенной мышиной последовательности (содержащейся в скобках ниже) от восходящей области подвергнутого делеции локуса низкоаффинного FcγR, примыкающую к нуклеотидной последовательности в гигромициновой кассете: (CCATGGGTAA GTAGAAAC)TC TAGACCCCCG GGCTCGATAA CT (SEQ ID NO:21).
Мышей, содержащих два гена низкоаффинного человеческого FcγR (hFcγRIIA, без удлиненной промоторной области, и hFcγRIIIA) вместо локуса эндогенного низкоаффинного мышиного FcγR, генерировали посредством электропорации, целенаправленной ДНК BAC (описанной выше) в мышиные клетки ES. Положительные клоны ES-клеток подтверждали скринингом Taqman™ и кариотипированием. Положительные клоны ES-клеток затем применяли для имплантации самкам мышей с использованием метода VELOCIMOUSE® (описанного ниже) для получения помета детенышей, содержащего замену генов низкоаффинных FcγR на два человеческих гена низкоаффинных FcγR.
Целенаправленные ES-клетки, описанные выше, применяли в качестве донорных ES-клеток и вводили мышиным эмбрионам на 8-клеточной стадии посредством метода VELOCIMOUSE® (см., например, патент США № 7294754 и Poueymirou et al. (2007) F0 generation mice that are essentially fully derived from donor gene-targeted ES cells allowing immediate phenotypic analyses Nature Biotech. 25(1):91-99. VELOCIMICE® (F0 мыши, являющиеся полностью производными от донорных ES-клеток), несущих hFcγRIIA и hFcγRIIIA, идентифицировали посредством генотипирования с использованием модификации анализа аллелей (Valenzuela et al., выше), в котором было обнаружено присутствие генов hFcγR.
Мыши, несущие гены hFcγR, могут быть скрещены со штаммом мышей Cre deleter (см., например, опубликованную международную патентную заявку № WO 2009/114400), чтобы удалить любую кассету loxed neo, внедренную посредством целенаправляющей конструкции, которая не удаляется, например, на стадии ES-клеток или в эмбрионе. Необязательно, у мышей сохраняют неомициновую кассету.
Детенышей генотипируют и детеныша, гетерозиготного по генам hFcγR, выбирают для характеризации гуманизаций FcγRIIA и FcγRIIIA.
Пример 5: Характеризация FcγRIIIA/FcγRIIA гуманизированных мышей
Собирали селезенки из гуманизированных FcγRIIIA/FcγRIIA мышей (гетерозиготы, без удлиненной промоторной области FcγRIIA) и мышей дикого типа и подготавливали для FAC (как описано выше).
Проточная цитометрия. Лимфоцитам устанавливали порог для специфических клеточных линий дифференцировки и их анализировали на экспрессию hFcγRII и hFcγRIII с использованием мышиного антитела к человеческому FcγRII (клон FLI8.26; BD Biosciences) и мышиного антитела к человеческому FcγRIII (клон 3G8; BD Biosciences), соответственно. Относительная экспрессия (++, +) или отсутствие экспрессии (-), наблюдаемые для каждой субпопуляции лимфоцитов, показаны в таблице 2.
|
В аналогичном эксперименте селезенки собирали из гуманизированных FcγRIIIA/FcγRIIA мышей (гетерозиготы, без удлиненной промоторной области FcγRIIA) и мышей дикого типа и подготавливали для FAC (как описано выше). Результаты показаны на фиг.5A и 5B. Процентное содержание раздельных клеточных популяций лимфоцитов, экспрессирующих человеческие FcγRIIIA, FcγRIIA или оба у FcγRIIIA/FcγRIIA гомозиготных мышей, показано в таблице 3.
|
Как показано в данном примере, генетически модифицированные мыши (как гетерозиготные, так и гомозиготные генотипы), сгенерированные в соответствии с примером 3, экспрессировали человеческий FcγRIIIA на NK-клетках и макрофагах; и человеческий FcγRIIA на нейтрофилах и макрофагах, но не тромбоцитах. Человеческий FcγRIIIA в высокой степени экспрессировался на NK-клетках. Набор экспрессирующихся генов человеческих FcγR, показанный в данном примере, соответствует наборам этих экспрессирующихся генов в человеческих антигенпрезентирующих клетках.
Пример 6: Генерация гуманизированных мышей с низкоаффинным FcγR
Была построена целенаправляющая конструкция для внедрения трех дополнительных генов низкоаффинного человеческого FcγR в локус частично гуманизированного эндогенного низкоаффинного FcγR (описанный ниже) (фиг.6).
Целенаправляющая конструкция, содержащая гены человеческого FcγRIIB, FcγRIIIB и FcγRIIC, была получена с использованием аналогичных способов (см. пример 1) посредством модификации BAC RP-23 395f6 и RP-11 697e5 (Invitrogen). ДНК BAC обеих BAC модифицировали для введения генов α-цепей низкоаффинных человеческих FcγRIIB, FcγRIIIB и FcγRIIC в локус частично гуманизированного эндогенного низкоаффинного FcγR, содержащий два человеческих гена низкоаффинных FcγR.
Аналогичным образом были получены восходящее и нисходящее плечи гомологии с использованием праймеров mFcR up-1 (ACCAGGATAT GACCTGTAGA G; SEQ ID NO:22), и mFcR2b Nhel-2 (GTTTCTACTT ACCCATGGAC; SEQ ID NO:23), и h10 (AAATACACAC TGCCACAGAC AG; SEQ ID NO:24), и h11 (CCTCTTTTGT GAGTTTCCTG TG; SEQ ID NO:25), соответственно. Эти плечи гомологии использовали для получения кассеты, которая внедряла последовательности ДНК, кодирующие α-цепи низкоаффинных человеческих FcγRIIB, FcγRIIIB и FcγRIIC. Целенаправляющая конструкция включала плечо 5' гомологии, включающее мышиную последовательность от 5' до подвергнутого делеции локуса эндогенного низкоаффинного FcγR, ген loxed резистентности к неомицину, с последующим человеческим геномным фрагментом от BAC RP-11 697e5, содержащим гены α-цепи низкоаффинных человеческих FcγRIIB, FcγRIIIB и FcγRIIC, и плечо 3'-гомологии, содержащее человеческую последовательность от 5' до гена α-цепи низкоаффинного человеческого FcγRIIIA (середина фиг.6).
Целенаправленную вставку трех дополнительных генов низкоаффинного человеческого FcγR подтверждали посредством ПЦР (как описано выше). Восходящую область полностью гуманизированного локуса подтверждали посредством ПЦР с использованием праймеров mFcR up-detect-3 (GAGTATACTA TGACAAGAGC ATC; SEQ ID NO:26) и PGK up-detect (ACTAGTGAGA CGTGCTACTT C; SEQ ID NO:27), в то время как нисходящую область полностью гуманизированного локуса подтверждали с использованием праймеров neo detect (CTCCCACTCA TGATCTATAG A; SEQ ID NO:28) и h12 (CTTTTTATGG TCCCACAATC AG; SEQ ID NO:29). Нуклеотидная последовательность вдоль нисходящей области сочленения включала такую же человеческую геномную последовательность по восходящей от гена α-цепи hFcγRIIA (см. пример 3; SEQ ID NO:19). Нуклеотидная последовательность вдоль восходящей области сочленения включала следующую, которая указывает на две новые области сочленения мышиной и кассетной последовательностей и кассетной и человеческой геномной последовательностей в точке вставки. Область сочленения геномной мышиной последовательности (содержащейся в скобках ниже) и восходящей области neo кассетной последовательности представляет собой (GTCCATGGGT AAGTAGAAAC A)TTCGCTACC TTAGGACCGT TA (SEQ ID NO:30). Вторая новая область сочленения включает объединяющую область 3'-конца neo кассеты (содержащуюся в скобках ниже) и ген α-цепи человеческой геномной последовательности по нисходящей от hFcγRIIB: (GCTTATCGAT ACCGTCGAC)A AATACACACT GCCACAGACA GG; SEQ ID NO:31). Эти области сочленения показаны на фиг.6 (середина) в целенаправляющей конструкции. Полученный в результате модифицированный геном полностью гуманизированного локуса низкоаффинного FcγR показан на фиг.6 (низ).
Мышей, содержащих пять генов низкоаффинных человеческих генов FcγR на месте локуса эндогенного низкоаффинного мышиного FcγR, генерировали посредством электропорации целенаправляющих ДНК ВАС (описанной выше) в мышиные ES-клетки. Положительные клоны ES-клеток подтверждали скринингом Taqman™ и кариотипированием. Положительные клоны ES-клеток затем применяли для имплантации самкам мышей (как описано выше), чтобы дать начало помету детенышей, содержащему замену генов эндогенных низкоаффинных FcγR на пять человеческих генов низкоаффинных FcγR.
Пример 7: Характеризация гуманизированных мышей с низкоаффинными FcγR
Собирали селезенки из гуманизированных FcγR мышей (гетерозиготы) и мышей дикого типа и подготавливали для FAC (как описано выше).
Проточная цитометрия. Лимфоцитам устанавливали порог для специфических клеточных линий дифференцировки и их анализировали на экспрессию FcγRIIA и FcγRIIIA с использованием мышиного антитела к человеческому FcγRII (клон FLI8.26; BD Biosciences) и мышиного антитела к человеческому FcγRIII (клон 3G8; BD Biosciences), соответственно. Относительная экспрессия (++, +) или отсутствие экспрессии (-), наблюдаемые для каждой субпопуляции лимфоцитов показаны в таблице 4.
|
В аналогичном эксперименте селезенки собирали из полностью гуманизированных FcγR мышей (гомозиготы) и мышей дикого типа и подготавливали для FAC (как описано выше). Результаты показаны на фиг.7. Процентное содержание раздельных клеточных популяций лимфоцитов, экспрессирующих человеческий FcγRIIIA, человеческий FcγRIIIB, человеческий FcγRIIA, человеческий FcγRIIB, человеческий FcγRIIC у полностью гуманизированных FcγR гомозиготных мышей, показано в таблице 5.
|
Как показано в данном примере, генетически модифицированные мыши (как гетерозиготных, так и гомозиготных генотипов), генерированные в соответствии с примером 5, экспрессировали человеческий FcγRIIIA на NK-клетках и макрофагах, человеческий FcγRIIIB на нейтрофилах, человеческий FcγRIIA на нейтрофилах и макрофагах, человеческий FcγRIIB на B-клетках и человеческий FcγRIIC на NK-клетках. Набор экспрессирующихся генов человеческих FcγR, показанный в данном примере, соответствует наборам этих экспрессирующихся генов в человеческих антигенпрезентирующих клетках.
Пример 8: ADCC у гуманизированных FcγR мышей
Спленоциты, выделенные из мышей с отсутствием генов FcγR (т.е. с выключенными генами), мышей с FcγRIIIA/FcγRIIA (гомозиготов), мышей с FcγRIIIA/FcγRIIIB/FcγRIIA/FcγRIIB/FcγRIIC (гомозиготов) и мышей дикого типа, анализировали на предмет их способности осуществлять ADCC в анализе на уничтожение клеток (как описано выше в примере 2).
Вкратце, популяции клеток выделяли и разделяли с использованием технологии MACS® (Miltenyi Biotec). Вкратце, спленоциты с элиминированными T- и В-клетками культивировали в течение двух недель в присутствии мышиного IL-2 (500 Ед/мл). Полученные в результате размноженные NK-клетки использовали в качестве эффекторных клеток в анализах на ADCC при соотношении 50:1 (NK:Раджи). Клетки Раджи покрывали 10 мкг/мл Ab 168 или Ab 735 (как описано выше в примере 3). Результаты показаны в таблице 6.
|
Настоящее изобретение не является ограниченным по объему конкретными вариантами осуществления, описанными здесь. Несомненно, разнообразные модификации изобретения в дополнение к описанным здесь станут очевидными для квалифицированных специалистов в данной области из приведенного выше описания и сопровождающих фигур. Подразумевают, что такие модификации попадают в пределы объема притязаний прилагаемой формулы изобретения.