Результат интеллектуальной деятельности: РЕКОМБИНАНТНЫЙ ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА PENICILLIUM VERRUCULOSUM ( ВАРИАНТЫ) И СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТНОГО ПРЕПАРАТА С ЕГО ИСПОЛЬЗОВАНИЕМ (ВАРИАНТЫ)
Вид РИД
Изобретение
Изобретение в области биотехнологии относится к микробиологической промышленности и представляет собой способ получения ферментных препаратов с экзо-инулиназной активностью путем культивирования различных рекомбинантных штаммов мицелиального гриба Penicillium verruculosum, полученных в результате генетической трансформации фрагментом ДНК, содержащим гетерологичный ген экзоинулиназы, соединенный с регуляторными элементами гена cbhI, кодирующим целлобиогидролазу I.
Переработка сельскохозяйственных растений с целью получения разнообразных продуктов, в частности физиологически ценных полимеров (инулин и другие пищевые волокна), продуктов функционального питания, а также фруктозы являются важной народнохозяйственной задачей. В этом смысле, особого внимания заслуживает многолетнее растение топинамбур (Heliantnus tuberosus), который, благодаря исключительному биополимерному составу становится одной из самых популярных сырьевых культур, использующихся в пищевой промышленности, не только в России, но и во всем мире. Топинамбур мало подвержен болезням, требует минимального ухода, не боится засухи и холода, а также может произрастать практически на любых почвах [Пащенко Л.П. Рациональные аспекты в переработке топинамбура // Хранение и переработка сельхозсырья, 1991, №9, С.25-27]. Важнейшим компонентом клубней и стеблей топинамбура, представляющим коммерческий и биотехнологический интерес, является полисахарид инулин (β-2,1-полифруктан), у которого на невосстанавливающем конце полимерной молекулы находится остаток глюкопиранозы. Другими источниками инулина являются цикорий, агава, артишок, девясил, якон и другие цветковые растения. Инулин является сырьем для производства широкого спектра биотехнологически важных продуктов, таких как кристаллическая фруктоза, фруктозный сироп, фруктоолигосахариды (ФОС), лимонная, молочная и фумаровая кислоты, а также биотопливо (биоэтанол, биобутанол) [Chi, Z.-M., Zhang, Т., Cao, T.-S., Liu, X.-Y., Cui, W., & Zhao, C.-H. Biotechnological potential of inulin for bioprocesses// Biores. Tech. - 2011. - V. 102. - N. 6. - P. 4295-303].
Содержание инулина в клубнях топинамбура составляет до 80% по сухому веществу [Park, J.P., Kim, D.H., Kim, D.S., & Yun, J. W. Enzymatic production of inulo-oligosaccharides from chicory juice // Biotechnology. - 1998. - V. 20. - N. 4. - P. 385-388], поэтому переработка клубней именно этого растения представляет наибольший биотехнологический интерес. Однако, несмотря на тот факт, что топинамбур имеет большой промышленный потенциал, его комплексная переработка с целью получения продуктов с увеличенной добавочной стоимостью, в том числе сбраживаемых сахаров - фруктозы и глюкозы, до сих пор полностью не решена. Таким образом, решение задачи получения фруктозоглюкозного сиропа (ФГС) путем эффективного ферментативного гидролиза инулина клубней топинамбура является актуальным биотехнологическим направлением.
Экзоинулиназа (β-D-фруктан фруктогидролаза, КФ 3.2.1.80) является экзодеполимеразой и гидролизует концевые β-2,1- фруктозидные связи инулина и сахарозы [Arand, М, Golubev, А. М., Neto, J.R., Polikarpov, I., Wattiez, R., Komeeva, O.S., Eneyskaya, E.V., Kulminskaya, A. A., Shabalin, K.A., Shishliannikov, S.M., Chepurnaya, О.V., Neustroev, K.N (2002) Biochem. J. 362, 131-135, Moriyama, S., Tanaka, H., Uwataki, M., Muruguma, M, Ohta K,. (2003) J. Biosci. Bioeng. 96, 324-3315]. Данный тип ферментов функционирует в более мягких условиях по сравнению с кислотным гидролизом, широко использующимся на сегодняшний день для деструкции инулина и не требует значительной концентрации ионов водорода, высокой температуры и специального оборудования, устойчивого к агрессивным средам [Yi, Н., Zhang, Lanwei, Hua, С, Sun, K., & Zhang, L. Extraction and Enzymatic Hydrolysis of Inulin from Jerusalem artichoke and their Effects on Textural and Sensorial Characteristics of Yogurt // Food and Bioprocess Tech. - 2009. - V. 3. - N. 2. - P. 315-319]. Поэтому получение высокоактивных ферментных препаратов (ФП) экзоинулиназы для биоконверсии инулина представляет значительный интерес.
В последнее десятилетие широкое распространение получили ФП, полученные с использованием грибных штаммов - суперпродуцентов целевого внеклеточного белка, созданные с помощью комбинированного применения методов генной инженерии и микробиологии. Новые грибные суперпродуценты обладают увеличенной продукцией целевых ферментов за счет мультикопирования генов целевых белков с использованием регуляторных элементов - промоторов и терминаторов генов наиболее хорошо экспрессирующихся собственных (гомологичных) белков (ферментов). К известным мультикопийным продуцентам, полученным таким способом, относятся штаммы-продуценты эндо-β-1,4-глюканазы на основе Trichoderma longibrachiatum [Clarkson et al, 1995, US Patent 5,419,778], T.reesei [Saloheimo et al., 1994, WO Patent 94/28117], T.viride [Qizhong Zhu et al, 2012, CN102676472] и Humicola insolens [Rasmussen et al., 1991, Patent WO 91/17243]. Известны различные грибные мультикопийные продуценты ксиланаз - Aspergillus niger [van den Broek et al, 1994, US Patent 5,358,864], T.reesei [Nevalainen et al., 1994, US Patent 5,298,405], Thermoascus auranticus [Yu et al., 1990, US Patent 4,966,850], H.insolens [Schulein et al, 1997, US Patent 5,610,048]. Среди продуцентов фитаз имеются мультикопийные продуценты T.reesei [Barendse et al., 1998, Patent WO 98/55599] и грибов рода Aspergillus [van Gorcom et al., 1990, EP 0 420 358 А1].
Ауксотрофный грибной штамм-реципиент Penicillim verruculosum 537 (niaD-) представляется весьма эффективным в качестве объекта для создания рекомбинантных штаммов с увеличенной продукцией ферментов. При росте гриба на субстратах, содержащих пшеничные отруби и микрокристаллическую целлюлозу в клетках Р. verruculosum наблюдается индукция синтеза целого спектра ферментов целлюлолитического комплекса [Morozova V.V., Gusakov A.V., Andrianov R.M., Pravilnikov A.G., Osipov D.O., Sinitsyn A.P. Cellulase complex of the fungus Penicillium verruculosum: properties of major endoglucanases and cellobiohydrolases. Biotechnology Journal, 2010, v.5 (8), p.871-880]. Промотор и терминатор гена целлобиогидролазы I (cbh1) можно использовать для экспрессии в P. verruculosum других гомологичных и гетерологичных генов, отвечающих за синтез различных целевых ферментов [Проскурина О.В., Короткова О.Г., Рожкова A.M., Матыс В.Ю., Кошелев А.В., Окунев О.Н., Немашкалов В.А., Синицына О.А., Синицын А.П. Применение технологии «фъюжн» для создания высокоэффективных биокатализаторов на основе рекомбинантных штаммов гриба Penicillium verruculosum для конверсии целлюлозосодержащей биомассы. Катализ в промышленности, №5, 2013, 65-73].
Задачей заявляемого изобретения является разработка способа получения ферментных препаратов с активностью экзоинулиназы при ферментации мультикопийных штаммов, полученных путем трансформации реципиентного штамма P. verruculosum В1 537 (niaD) экзогенной ДНК, содержащей гетерологичный ген inul A. awamori, кодирующий экзоинулиназу.
Прототипом настоящей группы изобретений может служить патент РФ №2532840 «Штамм гриба Penicillium verruculosum BIO EGII продуцент эндо-1,3/1,4-β-глюканазы, целлюлазы, β-глюкозидазы и ксиланазы и способ получения кормового комплексного ферментного препарата», в котором описан способ получения ФП с высокой с эндоглюканазной активностью, полученных мультикопированием штамма P. verruculosum методом трансформации плазмидой с геном egl2 P. verruculosum под контролем промотора и терминатора гена целлобиогидролазы I совместно с плазмидой pSTAlO, позволяющей проводить селекцию полученных новых клонов.
Целью настоящего изобретения является расширение номенклатуры ферментных препаратов (ФП), производимых мицелиальным грибом P. verruculosum за счет ферментации нового рекомбинантного штамма, обладающего экзоинулиназной активностью, полученного путем трансформации грибных клеток P. verruculosum плазмидной ДНК с клонированным гетерологичным геном экзоинулиназы - фермента, осуществляющего ферментативное превращение инулина в простые сахара (фруктоза и глюкоза).
Технический результат, получаемый от создания и использования нового рекомбинантного штамма, заключается в получении нового высокоактивного препарата экзоинулиназы для применения его в биотехнологии при конверсии любого инулосодержащего сырья в технические сахара- глюкозу и фруктозу.
Схема разработки способа получения ФП, обладающего экзоинулиназной активностью при ферментации мультикопийных штаммов P. verruculosum складывается из выполнения нескольких типовых этапов.
Этап 1 - Амплифицируют ген целевого фермента - экзоинулиназы методом ПЦР, используя высокоспецифичные праймеры и геномную ДНК, соответствующего грибного штамма в качестве матрицы. Включают полученный фрагмент ДНК в структуру векторной молекулы, содержащей регуляторные элементы гена целлобиогидролазы I. Таким образом, получают экспрессионную плазмиду, в которой структурная часть целевого гена состыкована с нуклеотидной последовательностью, соответствующей промоторной и терминаторной области гена целлобиогидролазы I P. verruculosum.
Этап 2 - Экспрессионной плазмидой с целевым геном проводят трансформацию реципиентного штамма P. verruculosum В1 537 (niaD - мутант штамма P. verruculosum) в условиях котрансформации вместе с плазмидой pSTA10, несущей последовательность niaD гена, как маркера селекции, и осуществляют отбор клонов, секретирующих в культуральную жидкость (КЖ) целевой белок. Проводят ферментацию отобранных трансформантов в колбах Эрленмейера на среде с пшеничными отрубями и целлюлозой, после чего среди них выбирают наиболее продуктивный вариант(ы) штамма-продуцента. Также проводят тест на стабильность биосинтеза целевых ферментов у отобранных вариантов, состоящий в последовательном пересеве трансформантов (4 и более раз) на селективную среду с нитратом натрия.
Этап 3 - Проводят процесс ферментации наиболее активного стабильного варианта штамма-продуцента P. verruculosum в ферментерах на среде с пшеничными отрубями и целлюлозой, получают и характеризуют ФП с высокой активностью целевого фермента.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение ферментных препаратов с экзоинулиназной активностью при ферментации штаммов Р. verruculosum, мультикопийных по гетероличному гену inu1 A. awamori (32-е семейство гликозид-гидролаз), молекулярная масса экзоинулиназы (теоретически рассчитанная с использованием программы http://web.expasy.org/compute_pi/) составляет 60 кДа. Полипептидная последовательность экзоинулиназы приведена на фиг. 1
На первом этапе, используя в качестве матрицы геномную ДНК A. awamori, ПЦР-методом была амплифицирована полинуклеотидная последовательность, размером 1672 п.о., соответствующая целевому гену экзоинулиназы (AN: AJ315793) (фиг. 1). Для этого были синтезированы следующие праймеры:
Inu1-UpLIC: ggcaacagcaggagctttcaacttttgaccaccgtatc
Inu1-LowLIC: agaggagggcgacacagttcaattccaggtcgaaggcttc
Фрагмент ДНК, соответствующий гену экзоинулиназы (inu1) был клонирован в вектор, содержащий полинуклеотидные последовательности, соответствующие промоторной и терминаторной областям гена целлобиогидролазы I А P. verruculosum. Для этого был использован метод независимого лигирования, описанный в [Aslanidis С, de Jong P.J. // Nucleic Acid Res. 1990. V. 18. №20. P. 6069-6074]. Таким образом, была получена экспрессионная плазмида pCBHI-INU1 (фиг. 2).
Нуклеотидная последовательность клонированного гена была секвенирована по методу Сэнгера и полностью соответствовала последовательности гена inu1 штамма A. awamori (GenBank: AJ315793).
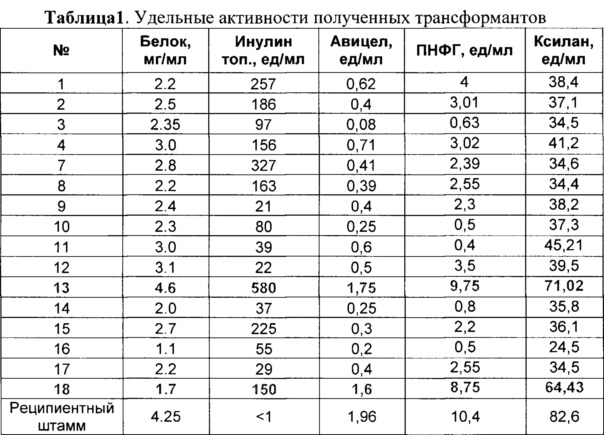
На втором этапе проводили трансформацию реципиентного штамма P. verruculosum 537 экспрессионной плазмидой pCBHI-INU1 (5-10 мкг ДНК) совместно с трансформационной плазмидой pSTA10 (1 мкг ДНК), несущей селективный niaD признак. Трансформанты отбирали на средах с 10 мМ нитрата натрия. Далее получают посевной материал каждого клона на СМ-агаре (29°C, 7 суток), затем суспензию спор, смытых с агара водой, проводят посев в качал очные колбы Эрленмейера объемом 700 мл, содержащие 100 мл среды для культивирования следующего состава (в г/л): МКЦ - 40, пшеничные отруби - 10, дрожжевой экстракт - 10, (NH4)2SO4 - 5, KH2PO4 - 5, MgSO4×7H2O - 0,3, CaCl2×2H2O - 0,3, рН 5.0. Колбы инкубируют на орбитальной качалке (200 об./мин) при 30°С в течение 144 ч. В КЖ после 6-ти суток роста определяли инулиназную активность, для чего определяли начальную скорость образования восстанавливающих сахаров (ВС) при гидролизе инулина топинамбура, ВС определяли модифицированным методом Нельсона-Шомоди [Nelson N. А photometric adaptation of the Somogyi method for the determination of sugars. J. Biol. Chem., 1944, v. 153, p.375-379]. Активность выражали в международных единицах, за одну единицу активности принимали количество фермента, гидролизующего 1 мкмоль гликозидных связей инулина за 1 мин.
В КЖ всех исследуемых трансформантов детектировали увеличение инулиназной активности. Для дальнейших испытаний и получения ферментных препаратов выбрали монопродуцент 13 (Таблица 1) с высокой активностью по отношению к инулину, а также продуцент 18 с высокой активностью инулиназы с сохранением базовых целлюлолитических активностей. Проводили тест отобраных трансформантов на стабильность биосинтеза экзоинулиназы, состоявший в его последовательных пересевах и анализе уровня инулиназной активности в КЖ, продуцируемой при культивировании в колбах на указанной выше стандартной ферментационной среде. Показано, что после 4-го пересева падение инулиназной активности в КЖ составило не более 5-8%, что говорит о стабильной интеграции гена экзоинулиназы в хромосому гриба P. verruculosum.
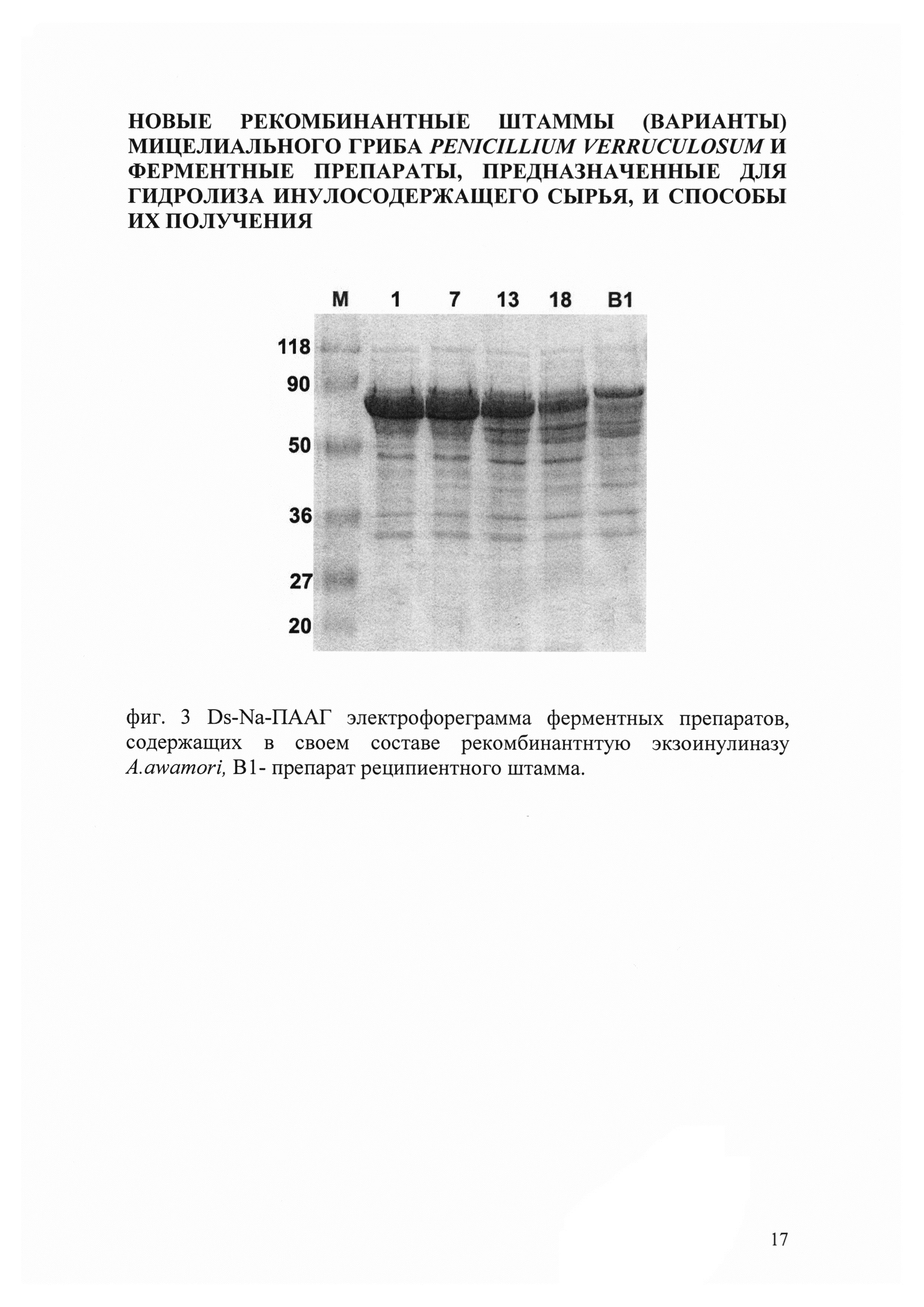
При проведении ДДС-электрофоретического анализа было обнаружено, что молекулярная масса полипептида экзоинулиназы составляла приблизительно 60 кДа, что соответствовало ожидаемой массе рекомбинантной экзоинулиназы (фиг. 3)
На третьем этапе проводили ферментацию отобранных штаммов P. verruculosum PVERINU13 и P. verruculosum PVERINU18 в 1-литровых ферментерах на среде следующего состава (г/л): глюкоза - 40, микрокристаллическая целлюлоза - 40, кукурузный экстракт - 25, пшеничные отруби - 10, KH2PO4 - 7, (NH4)2SO4 - 5, CaCl2 - 0,23, MgSO4*7H2O - 0,3. Культивирование вели 6 суток, при рН не ниже 4,5 и 32°C. КЖ концентрировали с помощью ультрафильтрации на полых волокнах (с пределом отсечения 10 кДа) и лиофильно высушивали. Полученные сухие ФП характеризовали по уровню инулиназной и базовым - целлюлолитическим активностям. Единицы активности выражали в ед/мл (ед/мг белка сухого препарата).
Экзоинулиназная активность в конце ферментации в КЖ трансформантов P. verruculosum PVERINU13 и P. verruculosum PVERINU18 составила 2543 и 867 ед/мл (по инулину топинамбура) соответственно. Экзоинулиназная активность в сухих ФП-х PVERINU13 и PVERINU18 составила 38703 и 18164 ед/г соответственно.
Доказательством наличия целевой экзоинулиназы в ФП-х PVERINU13 и PVERINU18 являлись данные MALDI-TOF масс-спектрометрии. Для этого образцы геля с белковыми полосами, полученными в результате проведения ДДС-электрофореза и соответствующие предполагаемой массе экзоинулиназы, обрабатывали трипсином. Полученные пептиды анализировали с использованием MALDI-TOF масс-спектрометрии. Анализ результатов и поиск целевых пептидов проводили с использованием программы Bruker DataAnalysis. Данные о полученных пептидах после трипсинолиза сравнивали с теоретическими пептидными последовательностями, полученными с использованием программы PeptideMass (http://web.expasy.org/peptide_mass/). Полученные данные свидетельствовали о том, что масс-спектр трипсинового гидролизата анализируемой белковой полосы содержал только пики, соответствовавшие экзоинулиназе A. awamori.
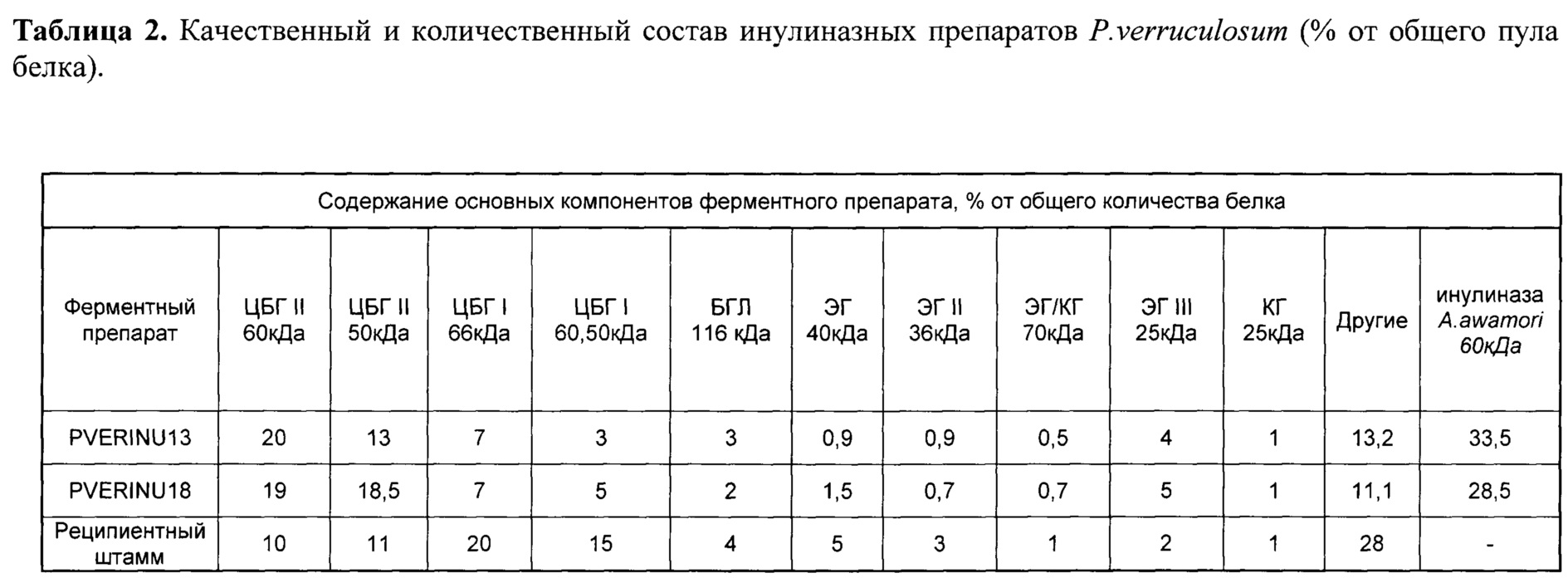
Пример 2. Определение качественного и количественного состава ФП-в PVERINU13 и PVERINU18.
Качественный и количественный состав ФП PVERINU13 и PVERINU18 определяли хроматографическим методом. Навеску ФП растворяли в 0,1 М Na-ацетатном буфере (рН 5,0), центрифугировали и обессоливали с заменой буфера при помощи гель-проникающей хроматографии на носителе Bio-Gel Р-6 фирмы Bio-Rad (США) в 20 мМ буфере bis-Tris-HCl, рН 6,9. Подготовленный таким образом ФП фракционировали с помощью FPLC-системы фирмы «Pharmacia» (Швеция) на анионообменном носителе Source 15Q («Amersham Biosciences)), Швеция), объем колонки составил 1 мл. Образец наносили в стартовом буфере Bis-Tris/HCl при рН 6,9; связавшиеся белки элюировали в градиентой концентрации NaCl от 0 до 0,4М. В полученных в ходе элюирования фракциях, а также в несвязавшейся фракции, определяли инулиназную, ксиланазную, авицелазную, бета-глюкозидазную и эндоглюканазную активности, а также содержание белка. Авицелазную, эндоглюканазную и ксиланазную активность определяли по начальной скорости образования ВС при гидролизе микрокристаллической целлюлозы, К-соли карбоксиметилцеллюлозы и березового ксилана соответственно, активность выражали в международных единицах (одна единица активности соответствует количеству фермента, гидролизующего 1 мкмоль гликозидных связей ксилана за 1 мин). β-глюкозидазную активности определяли по начальной скорости образования паранитрофенола (n-НФ) из n-НФ- β-глюкопиранозида. За единицу активности принимали количество фермента, необходимое для образования 1 мкмоль n-нитрофенола в минуту в рН-оптимуме действия соответствующего фермента при 40°C.
Аналогичным образом был определен состав ФП, полученного с помощью исходного штамма-реципиента P. verruculosum (инулиназной активностью данный ФП практически не обладал).
Содержание целевых и других ферментов в ФП-ов PVERINU13 и PVERINU18 (экзоинулиназа) и P. verruculosum (исходный штамм-реципиент) приведено в табл. 2.
Таким образом, в ФП-ах PVERINU13 и PVERINU18 (экзоинулиназа) обнаружено три мажорных компонента: это рекомбинантный белок - экзоинулиназа A.niger (28,5-33,5%), два типа ЦБГ (I и II), каждый из которых представлен двумя формами (ВМ и НМ), что отражено в табл. 2. ИБП составила от 3-7%, а ЦБГИ 13-20%, обнаружено также наличие других ферментов.
Контрольный ФП P. verruculosum имел в своем составе суммарно около 35% ЦБП, 21% ЦБГ II, 11% ЭГ (ЭГ 40 кДа, ЭГ III 25 кДа, ЭГ 79 кДа и ЭГ II 36 кДа), а также 4% бета-глюкозидазы и 28% других белков.
Таким образом, путем трансформации реципиентного штамма P. verruculosum плазмидой с гетерологичным геном, кодирующим экзоинулиназу удалось создать штамм P. verruculosum PVERINU13 (ВКПМ F-1292) и P. verruculosum PVERINU18 (ВКПМ F-1291) - продуцент экзоинулиназы и получить на его основе ФП-ы экзоинулиназы.
Пример 3. Применение ФП экзоинулиназы, на примере препарата PVERINU13, с целью получения растворимых глюкозы и фруктозы при гидролизе клубней топинамбура.
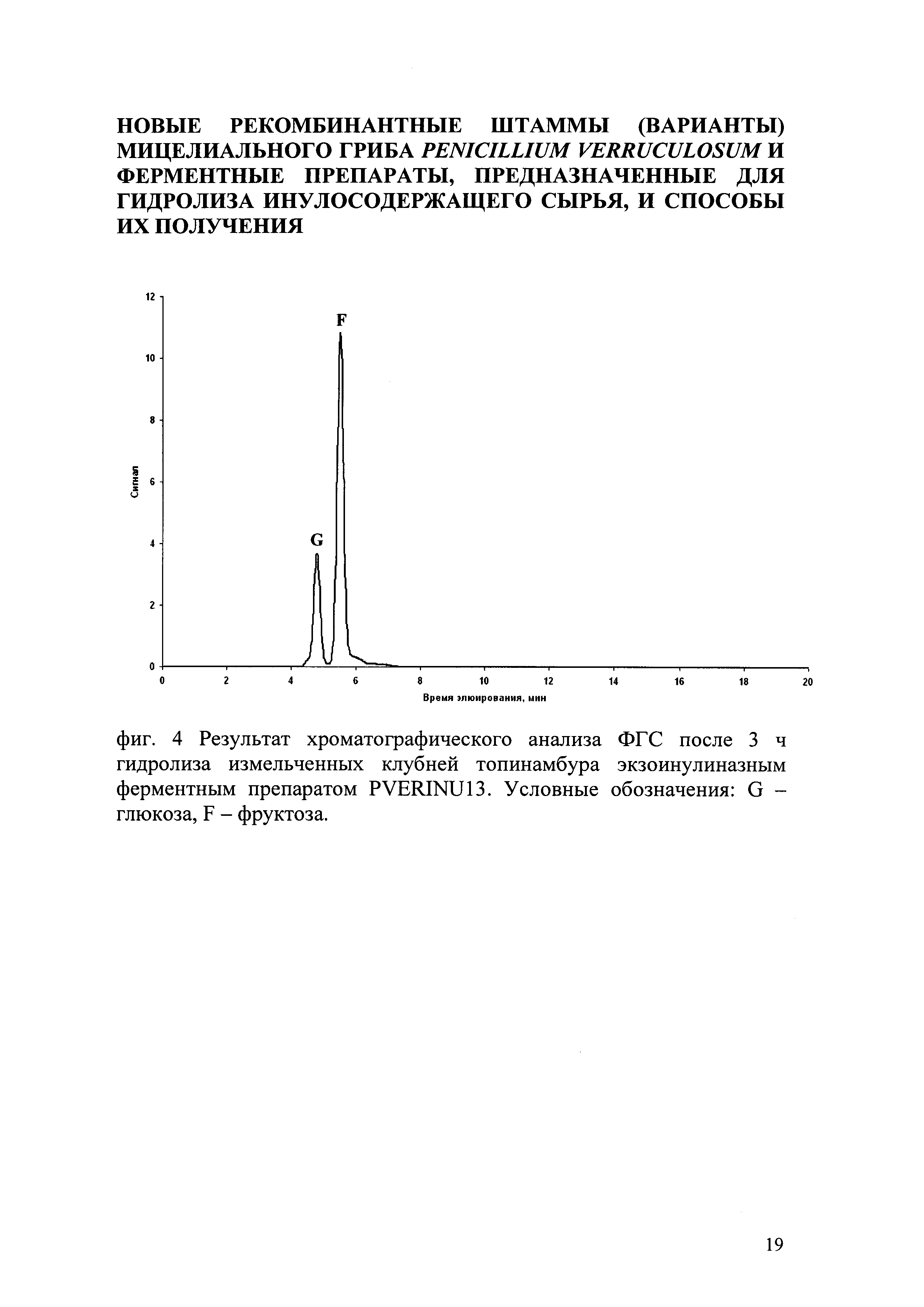
Предварительно вымытые в проточной воде, измельченные на лабораторной мельнице клубни топинамбура подвергали гидролизу в естественных условиях рН среды (в воде) при 50°C, в течение 3 ч, при перемешивании 250 об/мин на орбитальной качалке. Концентрация клубней топинамбура составила 100 г/л по сухому веществу. Дозировка ФП PVERINU13 - 0,5 ед/г сухого субстрата. Через 3 ч ферментативного гидролиза отобрали пробу объемом 0,5 мл и центрифурировали для осаждения непрогидролизованного субстрата. С помощью ВЭЖХ с амперометрической детекцией в супернатанте определяли качественный и количественный состав сахаров после действия экзоинулиназы на инулин, содержащийся в клубнях топинамбура. В качестве неподвижной фазы использовался сильный анионообменник (колонка типа Carbopak РА 100), подвижной фазы 100 мМ раствор NaOH, элюирование проводилось в градиенте от 0 до 500 мМ NaOAc в течение 20 мин. Результаты представлены на фиг. 4, где получаемые сахара представлены фруктозой и глюкозой. Использование ФП P. verruculosum, (в тех же условиях и в той же концентрации, что ФП PVERINU13), полученного из исходного штамма-реципиента не приводил к образованию фруктозы и глюкозы из клубней топинамбура.
НОВЫЕ РЕКОМБИНАНТНЫЕ ШТАММЫ (ВАРИАНТЫ) МИЦЕЛИАЛЬНОГО ГРИБА PENICILLIUM VERRUCULOSUM И ФЕРМЕНТНЫЕ ПРЕПАРАТЫ, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ГИДРОЛИЗА ИНУЛОСОДЕРЖАЩЕГО СЫРЬЯ, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ
НОВЫЕ РЕКОМБИНАНТНЫЕ ШТАММЫ (ВАРИАНТЫ) МИЦЕЛИАЛЬНОГО ГРИБА PENICILLIUM VERRUCULOSUM И ФЕРМЕНТНЫЕ ПРЕПАРАТЫ, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ГИДРОЛИЗА ИНУЛОСОДЕРЖАЩЕГО СЫРЬЯ, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ