Результат интеллектуальной деятельности: ПОЛИМЕРНЫЕ БЕЛКОВЫЕ МИКРОЧАСТИЦЫ
Вид РИД
Изобретение
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к получению композиции и применению белкового терапевтического средства пролонгированного действия. Конкретно, изобретение относится к получению композиции и применению множества покрытых полимером микрочастиц белка для пролонгированного и однородного высвобождения белка в физиологическую окружающую среду или среду на водной основе с течением времени.
УРОВЕНЬ ТЕХНИКИ
Пролонгированное высвобождение лечебного белка, введенного в биологическую мишень, такую как, например, сетчатка глаза или опухоль, или введенного парентерально, является желательным для лечения многочисленных различных состояний, включая злокачественные опухоли, сердечно-сосудистые заболевания, сосудистые заболевания, ортопедические болезни, стоматологические заболевания, раны, аутоиммунные заболевания, желудочно-кишечные болезни и глазные болезни. Биологически совместимые и биоразрушающиеся полимеры для контролируемой и пролонгированной доставки лекарственных препаратов используются в течение десятилетий. По мере того как полимер со временем разрушается, лечебный лекарственный препарат медленно высвобождается.
В случае внутриглазных терапевтических средств существует значительная нереализованная медицинская потребность в композиции пролонгированного действия для доставки белкового терапевтического средства эффективно в течение времени с насколько малым числом внутриглазных инъекций, насколько возможно. В случае других болезней, таких как рак, воспалительные заболевания и другие заболевания, существует потребность в улучшенных вживляемых композициях пролонгированного действия, содержащих белковые терапевтические средства.
Авторы заявки обнаружили, описывают здесь и заявляют способы получения и применения микрочастиц, содержащих биологически разрушающийся полимер и лечебный белок, которые способны равномерно высвобождать терапевтически эффективное количество лечебного белка в течение продолжительного периода времени.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте изобретение предлагает микрочастицу, включающую белок, покрытый полимером. В одном варианте осуществления микрочастица имеет диаметр приблизительно от 2 мкм до 70 мкм. В одном варианте осуществления микрочастица имеет диаметр приблизительно 15 мкм.
В одном варианте осуществления белок представляет собой антигенсвязывающий белок. В одном варианте осуществления белок включает Fc домен. В одном варианте осуществления белок включает рецепторный домен. В одном варианте осуществления белок представляет собой антитело. В другом варианте осуществления белок представляет собой слитый белок-Fc-рецептор. В другом варианте осуществления белок представляет собой белок типа ловушки, который включает фрагмент когнатного рецептора и Fc домен. В одном особом варианте осуществления белок представляет собой белок ловушку-VEGF. В одном варианте осуществления белок ловушку-VEGF включает последовательность аминокислот, указанную в SEQ ID NO: 1.
В одном варианте осуществления полимер представляет собой биологически разрушаемый полимер. В некоторых вариантах осуществления полимер выбран из группы, состоящей из полимолочной кислоты (PLA), полигликолевой кислоты (PGA), сополимера полимолочной и полигликолевой кислот (PLGA), поли-D,L-лактид-со-гликолида (PLGA), PLGA-этиленоксидфумарата, PLGA-альфа-токоферилсукцината, этерифицированного до полиэтиленгликоля 1000 (PLGA-TGPS), полиангидрида поли[1,6-бис(п-карбоксифенокси)гексана] (pCPH), сополимера гидроксимасляной кислоты с гидроксивалериановой кислотой (PHB-PVA), сополимера полиэтиленгликоль-полимолочная кислота (PEG-PLA), поли-ε-капролактона (PCL), полиалкилцианоакрилата (PAC), поли(этил)цианоакрилата (PEC), полиизобутилцианоакрилата, поли-N-(2-гидроксипропил)метакриламида (поли(HPMA)), поли-β-R-гидроксибутирата (PHB), поли-β-R-гидроксиалканоата (PHA), поли-β-R-яблочной кислоты, полимеров фосфолипид-холестерин, 2-диолеоил-sn-глицеро-3-фосфатидилхолин/полиэтиленгликоль-дистеароилфосфатидилэтаноламин (DOPC/PEG-DSPE)/холестерин, полисахаридов, целлюлозы, этилцеллюлозы, метилцеллюлозы, альгинатов, декстрана и декстрановых полимерных гидрогелей, амилозы, инулина, пектина и гуаровой камеди, хитозана, хитина, гепарина, гиалуроновой кислоты, полиротаксанов и полипсевдоротаксанов на основе циклодекстрина (CD), полиаспартатов, полиглутаматов, полилейцина, сополимеров лейцин-глутамат, полибутиленсукцината (PBS), желатина, коллагенов, фибринов, фиброина, полиортоэфиров, сополимеров полиортоэфир-полиамидин, сополимеров полиортоэфир-диамин, полиортоэфиров, включающих латентные кислоты, сополимера полиэтиленгликоль/полибутилентерефталат и их комбинаций и сополимеров. В одном варианте осуществления полимер представляет собой поли-ε-капролактон (PCL) или его производное или сополимер. В одном варианте осуществления полимер представляет собой PLGA или его производное или сополимер. В одном варианте осуществления полимер представляет собой этилцеллюлозу или ее производное или сополимер. В одном варианте осуществления полимер представляет собой полиортоэфир или его производное или сополимер.
В одном варианте осуществления микрочастица включает ядро микроизмельченного белка с размером меньше чем десять микрон и полимерный верхний слой. В одном варианте осуществления ядро микроизмельченного белка, по меньшей мере, на 50% покрыто полимером, означая, что не более чем 50% поверхности ядра микроизмельченного белка остается незащищенным. В одном варианте осуществления, по меньшей мере, 60%, по меньшей мере, 70%, по меньшей мере, 80%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 99% или 100% поверхности ядра микроизмельченного белка покрыто полимером.
В одном варианте осуществления микрочастица с размером более чем 10 микрон включает (a) ядро микроизмельченного белка с размером менее чем 10 микрон, где белок представляет собой любой один или более белков, выбранных из группы, включающей антитело или фрагмент антитела, рецептор или его растворимый фрагмент, растворимый фрагмент рецептора Т-клетки, растворимый фрагмент MHC, слитый белок-Fc-рецептор, белок типа ловушки и белок ловушку-VEGF; и (b) полимерное покрытие, где полимер представляет собой любой один или более биосовместимый полимер, биологически разрушаемый полимер, биоразлагаемый полимер, полимолочную кислоту (PLA), полигликолевую кислоту (PGA), сополимер полимолочной и полигликолевой кислот (PLGA), поли-D,L-лактид-со-гликолид (PLGA), PLGA-этиленоксидфумарат, PLGA-альфа-токоферилсукцинат, этерифицированный до полиэтиленгликоля 1000 (PLGA-TGPS), полиангидрид поли[1,6-бис(п-карбоксифенокси)гексана] (pCPH), сополимер гидроксимасляной кислоты с гидроксивалериановой кислотой (PHB-PVA), сополимер полиэтиленгликоль-полимолочная кислота (PEG-PLA), поли-ε-капролактон (PCL), полиалкилцианоакрилат (PAC), поли(этил)цианоакрилат (PEC), полиизобутилцианоакрилат, поли-N-(2-гидроксипропил)метакриламид (поли(HPMA)), поли-β-R-гидроксибутират (PHB), поли-β-R-гидроксиалканоат (PHA), поли-β-R-яблочную кислоту, полимеры фосфолипид-холестерин, 2-диолеоил-sn-глицеро-3-фосфатидилхолин/полиэтиленгликоль-дистеароилфосфатидилэтаноламин (DOPC/PEG-DSPE)/холестерин, полисахариды, целлюлозу, этилцеллюлозу, метилцеллюлозу, альгинаты, декстран и декстрановые полимерные гидрогели, амилозу, инулин, пектин и гуаровую камедь, хитозан, хитин, гепарин, гиалуроновую кислоту, полиротаксаны и полипсевдоротаксаны на основе циклодекстрина (CD), полиаспартаты, полиглутаматы, полилейцин, сополимеры лейцин-глутамат, полибутиленсукцинат (PBS), желатин, коллагены, фибрины, фиброин, полиортоэфиры, сополимер полиортоэфир-полиамидин, сополимеры полиортоэфир-диамин, полиортоэфиры, включающие латентные кислоты, сополимер полиэтиленгликоль/полибутилентерефталат и их комбинации и сополимеры.
В одном варианте осуществления микрочастица со средним диаметром приблизительно от 15 микрон до 30 микрон включает (a) ядро микроизмельченного белка с размером приблизительно от 10 до 12 микрон, где белок представляет собой белок ловушку-VEGF, и (b) полимерное покрытие, где полимер представляет собой любой один или более полимеров из группы, включающей PCL, PLGA, этилцеллюлозу и полиортоэфир и их сополимеры или производные.
В одном аспекте изобретение предлагает множество микрочастиц, размер которых находится в диапазоне приблизительно от двух микрон до 70 микрон и которые включают ядро микроизмельченного белка с размером приблизительно от двух микрон до 30 микрон, и полимерный верхний слой.
В одном варианте осуществления белок представляет собой антигенсвязывающий белок. В некоторых вариантах осуществления антигенсвязывающий белок представляет собой любой один или более белков, выбранных из группы, включающей антитело или фрагмент антитела, рецептор или его растворимый фрагмент, растворимый фрагмент рецептора Т-клетки, растворимый фрагмент MHC, слитый белок-Fc-рецептор, белок типа ловушки и белок ловушку-VEGF. В одном варианте осуществления белок включает Fc домен. В одном варианте осуществления белок представляет собой антитело. В другом варианте осуществления белок представляет собой белок типа ловушки, который включает фрагмент когнатного рецептора и Fc домен. В одном особом варианте осуществления белок представляет собой белок ловушку-VEGF. В особом варианте осуществления белок ловушку-VEGF включает последовательность аминокислот, указанную в SEQ ID NO: 1.
В одном варианте осуществления полимер представляет собой биосовместимый полимер. В одном варианте осуществления полимер представляет собой биоразлагаемый полимер. В одном варианте осуществления полимер представляет собой биологически разрушаемый полимер. В некоторых вариантах осуществления полимер выбран из группы, состоящей из полимолочной кислоты (PLA), полигликолевой кислоты (PGA), сополимера полимолочной и полигликолевой кислот (PLGA), поли-D,L-лактид-со-гликолида (PLGA), PLGA-этиленоксидфумарата, PLGA-альфа-токоферилсукцината, этерифицированного до полиэтиленгликоля 1000 (PLGA-TGPS), полиангидрида поли[1,6-бис(п-карбоксифенокси)гексана] (pCPH), сополимера гидроксимасляной кислоты с гидроксивалериановой кислотой (PHB-PVA), сополимера полиэтиленгликоль-полимолочная кислота (PEG-PLA), поли-ε-капролактона (PCL), полиалкилцианоакрилата (PAC), поли(этил)цианоакрилата (PEC), полиизобутилцианоакрилата, поли-N-(2-гидроксипропил)метакриламида (поли(HPMA)), поли-β-R-гидроксибутирата (PHB), поли-β-R-гидроксиалканоата (PHA), поли-β-R-яблочной кислоты, полимеров фосфолипид-холестерин, 2-диолеоил-sn-глицеро-3-фосфатидилхолин/полиэтиленгликоль-дистеароилфосфатидилэтаноламин (DOPC/PEG-DSPE)/холестерина, полисахаридов, целлюлозы, этилцеллюлозы, метилцеллюлозы, альгинатов, декстрана и декстрановых полимерных гидрогелей, амилозы, инулина, пектина и гуаровой камеди, хитозана, хитина, гепарина, гиалуроновой кислоты, полиротаксанов и полипсевдоротаксанов на основе циклодекстрина (CD), полиаспартатов, полиглутаматов, полилейцина, сополимеров лейцин-глутамат, полибутиленсукцината (PBS), желатина, коллагенов, фибринов, фиброина, полиортоэфиров, сополимеров полиортоэфир-полиамидин, сополимеров полиортоэфир-диамин, полиортоэфиров, включающих латентные кислоты, сополимера полиэтиленгликоль/полибутилентерефталат и их комбинаций и сополимеров. В одном варианте осуществления полимер представляет собой поли-ε-капролактон (PCL) или его производное или сополимер. В одном варианте осуществления полимер представляет собой PLGA или его производное или сополимер. В одном варианте осуществления полимер представляет собой этилцеллюлозу или ее производное или сополимер. В одном варианте осуществления полимер представляет собой полиортоэфир, включающий латентную кислоту.
В одном варианте осуществления ядро микроизмельченного белка большинства микрочастиц множества микрочастиц, по меньшей мере, на 50% покрыто полимером, означая, что не более чем 50% поверхности ядра микроизмельченного белка остается незащищенным. В одном варианте осуществления, по меньшей мере, 60%, по меньшей мере, 70%, по меньшей мере, 80%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 99% или 100% поверхности ядра микроизмельченного белка покрыто полимером.
В одном варианте осуществления множество микрочастиц, размер которых находится в диапазоне приблизительно от двух микрон до 70 микрон, включает (a) ядро микроизмельченного белка с размером приблизительно от двух микрон до 30 микрон, где белок представляет собой любой один или более белков, выбранных из группы, включающей антитело или фрагмент антитела, рецептор или его растворимый фрагмент, растворимый фрагмент рецептора Т-клетки, растворимый фрагмент MHC, слитый белок-Fc-рецептор, белок типа ловушки и белок ловушку-VEGF; и (b) полимерный верхний слой, где полимер представляет собой любой один или более биосовместимый полимер, биологически разрушаемый полимер, биоразлагаемый полимер, полимолочную кислоту (PLA), полигликолевую кислоту (PGA), сополимер полимолочной и полигликолевой кислот (PLGA), поли-D,L-лактид-со-гликолид (PLGA), PLGA-этиленоксидфумарат, PLGA-альфа-токоферилсукцинат, этерифицированный до полиэтиленгликоля 1000 (PLGA-TGPS), поли-ε-капролактон (PCL), полиалкилцианоакрилат, полиангидрид поли[1,6-бис(п-карбоксифенокси)гексана] (pCPH), сополимер гидроксимасляной кислоты с гидроксивалериановой кислотой (PHB-PVA), сополимер полиэтиленгликоль-полимолочная кислота (PEG-PLA), поли(этил)цианоакрилат (PEC), полиизобутилцианоакрилат, поли-N-(2-гидроксипропил)метакриламид (поли(HPMA)), поли-β-R-гидроксибутират (PHB), поли-β-R-гидроксиалканоат (PHA), поли-β-R-яблочную кислоту, полимеры фосфолипид-холестерин, 2-диолеоил-sn-глицеро-3-фосфатидилхолин/полиэтиленгликоль-дистеароилфосфатидилэтаноламин (DOPC/PEG-DSPE)/холестерин, полисахариды, целлюлозу, этилцеллюлозу, метилцеллюлозу, альгинаты, декстран и декстрановые полимерные гидрогели, амилозу, инулин, пектин и гуаровую камедь, хитозан, хитин, гепарин, гиалуроновую кислоту, полиротаксаны и полипсевдоротаксаны на основе циклодекстрина (CD), полиаспартаты, полиглутаматы, полилейцин, сополимеры лейцин-глутамат, полибутиленсукцинат (PBS), желатин, коллагены, фибрины, фиброин, полиортоэфиры, сополимер полиортоэфир-полиамидин, сополимеры полиортоэфир-диамин, полиортоэфиры, включающие латентные кислоты, сополимер полиэтиленгликоль/полибутилентерефталат и их комбинации и сополимеры.
В одном варианте осуществления множество микрочастиц, размер которых находится в диапазоне приблизительно от двух микрон до 70 микрон со средним размером приблизительно от 15 микрон до 30 микрон, включает (a) ядро микроизмельченного белка с размером приблизительно от двух микрон до 30 микрон со средним размером приблизительно от 10 микрон до 12 микрон, где белок представляет собой белок ловушку-VEGF; и (b) полимерный верхний слой, где полимер представляет собой любой один или более полимеров, выбранных из группы, включающей PLA, PCL, PLGA, этилцеллюлозу и полиортоэфир, и их сополимеры или производные.
В одном аспекте изобретение предлагает способ получения микрочастицы, которая включает ядро из белка и полимерный верхний слой. В одном варианте осуществления полученная микрочастица имеет диаметр приблизительно от двух микрон до 70 микрон или средний диаметр приблизительно от 15 микрон до 30 микрон. В одном варианте осуществления способ получения микрочастицы включает (1) получение частицы белка; (2) суспендирование частицы белка в растворе, включающем полимер и растворитель; и (3) удаление растворителя, в котором формируется частица, включающая ядро из белка, покрытое полимерным верхним слоем.
В одном варианте осуществления частица белка из стадии (1) представляет собой микроизмельченную частицу белка, которую получают распылительной сушкой раствора, включающего белок. В некоторых вариантах осуществления раствор белка подвергают распылительной сушке посредством обработки ультразвуком с одинарным наконечником, обработки ультразвуком с двойным наконечником или электрораспылением. В некоторых вариантах осуществления полученная в результате микроизмельченная частица белка, которая формирует ядро полученной микрочастицы, имеет диаметр приблизительно от двух микрон до 30 микрон со средним диаметром приблизительно от 10 микрон до 12 микрон.
В некоторых вариантах осуществления белок, который формирует ядро, представляет собой антигенсвязывающий белок. В некоторых вариантах осуществления антигенсвязывающий белок представляет собой любой один или более белков, выбранных из группы, включающей антитело (например, lgG) или фрагмент антитела, рецептор или его растворимый фрагмент, растворимый фрагмент рецептора Т-клетки, растворимый фрагмент MHC, слитый белок-Fc-рецептор, белок типа ловушки и белок ловушку-VEGF. В особом варианте осуществления белок представляет собой ловушку-VEGF, включающую последовательность аминокислот, указанную в SEQ ID NO: 1.
В одном варианте осуществления растворитель удаляют из стадии (3), создавая дисперсию смеси белок-полимер-растворитель из стадии (2) и давая возможность растворителю испариться из капель, созданных дисперсией. В одном варианте осуществления дисперсию создают распылительной сушкой, которую можно осуществить обработкой ультразвуком с двойным наконечником, обработкой ультразвуком с одинарным наконечником или электрораспылением. В одном варианте осуществления растворитель удаляют из капель, используя тепло или воздух, или химической экстракцией.
В одном варианте осуществления полимер является биологически разрушаемым, биоразлагаемым и/или биосовместимым. В некоторых вариантах осуществления полимер представляет собой любой один или более полимеров, выбранных из группы, состоящей из полимолочной кислоты (PLA), полигликолевой кислоты (PGA), сополимера полимолочной и полигликолевой кислот (PLGA), поли-D,L-лактид-со-гликолида (PLGA), PLGA-этиленоксидфумарата, PLGA-альфа-токоферилсукцината, этерифицированного до полиэтиленгликоля 1000 (PLGA-TGPS), полиангидрида поли[1,6-бис(п-карбоксифенокси)гексана] (pCPH), сополимера гидроксимасляной кислоты с гидроксивалериановой кислотой (PHB-PVA), сополимера полиэтиленгликоль-полимолочная кислота (PEG-PLA), поли-ε-капролактона (PCL), полиалкилцианоакрилата (PAC), поли(этил)цианоакрилата (PEC), полиизобутилцианоакрилата, поли-N-(2-гидроксипропил)метакриламида (поли(HPMA)), поли-β-R-гидроксибутирата (PHB), поли-β-R-гидроксиалканоата (PHA), поли-β-R-яблочной кислоты, полимеров фосфолипид-холестерин, 2-диолеоил-sn-глицеро-3-фосфатидилхолин/полиэтиленгликоль-дистеароилфосфатидилэтаноламин (DOPC/PEG-DSPE)/холестерина, полисахаридов, целлюлозы, этилцеллюлозы, метилцеллюлозы, альгинатов, декстрана и декстрановых полимерных гидрогелей, амилозы, инулина, пектина и гуаровой камеди, хитозана, хитина, гепарина, гиалуроновой кислоты, полиротаксанов и полипсевдоротаксанов на основе циклодекстрина (CD), полиаспартатов, полиглутаматов, полилейцина, сополимеров лейцин-глутамат, полибутиленсукцината (PBS), желатина, коллагенов, фибринов, фиброина, полиортоэфиров, сополимера полиортоэфир-полиамидин, сополимеров полиортоэфир-диамин, полиортоэфиров, включающих латентные кислоты, сополимер полиэтиленгликоль/полибутилентерефталат и их комбинаций и сополимеров. В одном варианте осуществления полимер представляет собой поли-ε-капролактон (PCL) или его производное или сополимер. В одном варианте осуществления полимер представляет собой PLGA или его производное или сополимер. В одном варианте осуществления полимер представляет собой этилцеллюлозу или ее производное или сополимер. В одном варианте осуществления полимер представляет собой полиортоэфир или его производное, который содержит кислотолабильные элементы. В другом варианте осуществления полимер представляет собой PLA.
В одном аспекте изобретение предлагает способ получения микрочастицы, включающий стадии (1) формирования микроизмельченной частицы белка, имеющей диаметр приблизительно от двух микрон до 30 микрон, причем средний диаметр составляет приблизительно от 10 микрон до 12 микрон, распылительной сушкой раствора, содержащего белок, где белок представляет собой антигенсвязывающий белок. В некоторых вариантах осуществления антигенсвязывающий белок представляет собой любой один или более белков, выбранных из группы, включающей антитело или фрагмент антитела, рецептор или его растворимый фрагмент, растворимый фрагмент рецептора Т-клетки, растворимый фрагмент MHC, слитый белок-Fc-рецептор, белок типа ловушки и белок ловушку-VEGF (например, белок, имеющий последовательность аминокислот, указанную в SEQ ID NO: 1); (2) суспендирования микроизмельченной частицы белка в растворе, включающем полимер и растворитель, где полимер представляет собой любой один или более полимер, выбранный из группы, включающей биологически разрушаемый полимер, биоразлагаемый полимер, биосовместимый полимер, полимолочную кислоту (PLA), полигликолевую кислоту (PGA), сополимер полимолочной и полигликолевой кислот (PLGA), поли-D,L-лактид-со-гликолид (PLGA), PLGA-этиленоксидфумарат, PLGA-альфа-токоферилсукцинат, этерифицированный до полиэтиленгликоля 1000 (PLGA-TGPS), полиангидрид поли[1,6-бис(п-карбоксифенокси)гексана] (pCPH), сополимер гидроксимасляной кислоты с гидроксивалериановой кислотой (PHB-PVA), сополимер полиэтиленгликоль-полимолочная кислота (PEG-PLA), поли-ε-капролактон (PCL), полиалкилцианоакрилат (PAC), поли(этил)цианоакрилат (PEC), полиизобутилцианоакрилат, поли-N-(2-гидроксипропил)метакриламид (поли(HPMA)), поли-β-R-гидроксибутират (PHB), поли-β-R-гидроксиалканоат (PHA), поли-β-R-яблочную кислоту, полимеры фосфолипид-холестерин, 2-диолеоил-sn-глицеро-3-фосфатидилхолин/полиэтиленгликоль-дистеароилфосфатидилэтаноламин (DOPC/PEG-DSPE)/холестерин, полисахариды, целлюлозу, этилцеллюлозу, метилцеллюлозу, альгинаты, декстран и декстрановые полимерные гидрогели, амилозу, инулин, пектин и гуаровую камедь, хитозан, хитин, гепарин, гиалуроновую кислоту, полиротаксаны и полипсевдоротаксаны на основе циклодекстрина (CD), полиаспартаты, полиглутаматы, полилейцин, сополимеры лейцин-глутамат, полибутиленсукцинат (PBS), желатин, коллагены, фибрины, фиброин, полиортоэфиры, сополимеры полиортоэфир-полиамидин, сополимеры полиортоэфир-диамин, полиортоэфиры, включающие латентные кислоты, сополимер полиэтиленгликоль/полибутилентерефталат и их комбинации и сополимеры, и (3) удаления растворителя распылительной сушкой суспензии ''частица микроизмельченного белка-полимер-растворитель'' и отгонки растворителя с применением тепла или воздуха или экстракцией растворителем, где формируется микрочастица, имеющая диаметр приблизительно от двух микрон до 70 микрон, причем средний диаметр составляет приблизительно от 15 микрон до 30 микрон, и включающая ядро из белка и полимерный верхний слой.
В некоторых вариантах осуществления распылительную сушку из стадии (1) или стадии (3) осуществляют посредством обработки ультразвуком с двойным наконечником, обработки ультразвуком с одинарным наконечником или электрораспылением.
В одном варианте осуществления способ получения микрочастиц включает стадии (1) формирования микроизмельченной частицы ловушку-VEGF, имеющей диаметр приблизительно от 10 микрон до 12 микрон распылительной сушкой раствора, содержащего белок ловушку-VEGF; (2) суспендирования микроизмельченной частицы ловушку-VEGF в растворе, содержащем полиортоэфир, включающий латентную кислоту, и совместимый растворитель или этилцеллюлозу и совместимый растворитель; и (3) удаления растворителя (a) распылительной сушкой суспензии микроизмельченная частица ловушка-VEGF-полиортоэфир-латентная кислота-растворитель или суспензии микроизмельченная частица ловушка-VEGF-этилцеллюлоза-растворитель и (b) отгонкой растворителя с помощью тепла или воздуха или экстракцией растворителем, где формируется микрочастица, имеющая диаметр приблизительно от 15 микрон до 30 микрон и включающая ядро ловушку-VEGF и полимерный верхний слой из полиортоэфира и его сополимеров или производных.
В одном аспекте изобретение предлагает композицию пролонгированного действия, содержащую лечебный белок, для высвобождения или обеспечения стационарной концентрации лечебного белка с течением времени. Композиция пролонгированного действия включает множество микрочастиц, размер которых находится в диапазоне приблизительно от двух микрон до 70 микрон, каждая из которых включает ядро микроизмельченного белка с размером приблизительно от двух до 30 микрон, и полимерный верхний слой.
В одном варианте осуществления лечебный белок представляет собой антигенсвязывающий белок. В некоторых вариантах осуществления антигенсвязывающий белок представляет собой любой один или более белков, выбранных из группы, включающей антитело (например, lgG) или фрагмент антитела, рецептор или его растворимый фрагмент, растворимый фрагмент рецептора Т-клетки, растворимый фрагмент MHC, слитый белок-Fc-рецептор, белок типа ловушки и белок ловушку-VEGF (например, один из которых имеет первичную структуру SEQ ID NO: 1). В одном варианте осуществления лечебный белок включает Fc домен. В одном варианте осуществления белок представляет собой антитело. В другом варианте осуществления белок представляет собой lgG. В другом варианте осуществления лечебный белок представляет собой слитый белок-Fc-рецептор. В другом варианте осуществления лечебный белок представляет собой белок типа ловушки, который включает фрагмент когнатного рецептора и Fc домен. В одном особом варианте осуществления лечебный белок представляет собой белок ловушку-VEGF. В еще одном варианте осуществления ловушка-VEGF включает последовательность аминокислот, указанную в SEQ ID NO: 1.
В одном варианте осуществления полимерный верхний слой включает биосовместимый полимер. В одном варианте осуществления полимерный верхний слой включает биоразлагаемый полимер. В одном варианте осуществления полимерный верхний слой включает биологически разрушаемый полимер. В некоторых вариантах осуществления полимерный верхний слой включает полимер, выбранный из группы, состоящей из полимолочной кислоты (PLA), полигликолевой кислоты (PGA), сополимера полимолочной и полигликолевой кислот (PLGA), поли-D,L-лактид-со-гликолида (PLGA), PLGA-этиленоксидфумарата, PLGA-альфа-токоферилсукцината, этерифицированного до полиэтиленгликоля 1000 (PLGA-TGPS), полиангидрида поли[1,6-бис(п-карбоксифенокси)гексана] (pCPH), сополимера гидроксимасляной кислоты с гидроксивалериановой кислотой (PHB-PVA), сополимера полиэтиленгликоль-полимолочная кислота (PEG-PLA), поли-ε-капролактона (PCL), полиалкилцианоакрилата (PAC), поли(этил)цианоакрилата (PEC), полиизобутилцианоакрилата, поли-N-(2-гидроксипропил)метакриламида (поли(HPMA)), поли-β-R-гидроксибутирата (PHB), поли-β-R-гидроксиалканоата (PHA), поли-β-R-яблочной кислоты, полимеров фосфолипид-холестерин, 2-диолеоил-sn-глицеро-3-фосфатидилхолин/полиэтиленгликоль-дистеароилфосфатидилэтаноламин (DOPC/PEG-DSPE)/холестерина, полисахаридов, целлюлозы, этилцеллюлозы, метилцеллюлозы, альгинатов, декстрана и декстрановых полимерных гидрогелей, амилозы, инулина, пектина и гуаровой камеди, хитозана, хитина, гепарина, гиалуроновой кислоты, полиротаксанов и полипсевдоротаксанов на основе циклодекстрина (CD), полиаспартатов, полиглутаматов, полилейцина, сополимеров лейцин-глутамат, полибутиленсукцината (PBS), желатина, коллагенов, фибринов, фиброина, полиортоэфиров, сополимера полиортоэфир-полиамидин, сополимеров полиортоэфир-диамин, полиортоэфиров, включающих латентные кислоты, сополимера полиэтиленгликоль/полибутилентерефталат и их комбинаций и сополимеров. В одном варианте осуществления полимер представляет собой поли-ε-капролактон (PCL) или его производное или сополимер. В одном варианте осуществления полимерный верхний слой включает PLGA. В одном варианте осуществления полимерный верхний слой включает этилцеллюлозу. В одном варианте осуществления полимерный верхний слой включает один или более полимеров, выбранных из группы, включающей PLA, PLGA, этилцеллюлозу и полиортоэфир, и их сополимеры или производные.
В одном варианте осуществления множество микрочастиц включает группу микрочастиц, имеющих некоторый диапазон толщин полимерного верхнего слоя, так что индивидуальные микрочастицы из группы микрочастиц разрушаются с различными скоростями, что дает возможность однородной скорости высвобождения лечебного белка.
В одном варианте осуществления множество микрочастиц включает смесь непокрытых микроизмельченных частиц белка и микрочастиц, имеющих некоторый диапазон толщин полимерного верхнего слоя, что дает возможность высвобождения лечебного белка с периодическими интервалами, исходя из толщины верхнего слоя.
В одном варианте осуществления множество микрочастиц включает смесь микрочастиц, имеющих полимерный верхний слой с различными уровнями гидрофобности, чтобы контролировать время или продолжительность деструкции и последующего высвобождения. В одном варианте осуществления каждая из микрочастиц включает внутренний полимерный слой и внешний полимерный слой, где внешний полимерный слой ограничивает гидратацию внутреннего полимерного слоя, чтобы контролировать высвобождение лечебного белка.
В одном варианте осуществления лечебный белок высвобождается из множества микрочастиц со скоростью приблизительно от 0,01 мг/неделю до 0,30 мг/неделю в течение, по меньшей мере, 60 дней, когда микрочастицы находятся в водной среде. В одном варианте осуществления водная среда представляет собой буферный раствор in vitro. В одном варианте осуществления водная среда представляет собой среду in vivo. В одном варианте осуществления водная среда представляет собой среду ex vivo. В одном варианте осуществления водная среда представляет собой стекловидное тело.
В одном варианте осуществления композиция пролонгированного действия включает множество микрочастиц, размер которых находится в диапазоне приблизительно от двух микрон до 70 микрон, и которые включают (a) ядро микроизмельченного лечебного белка с размером приблизительно от двух микрон до 30 микрон, где лечебный белок представляет собой антигенсвязывающий белок, который в некоторых случаях может представлять собой любой один или более белков, выбранных из группы, включающей антитело или фрагмент антитела, рецептор или его растворимый фрагмент, растворимый фрагмент рецептора Т-клетки, растворимый фрагмент MHC, слитый белок-Fc-рецептор, белок типа ловушки и белок ловушку-VEGF; и (b) полимерный верхний слой с некоторым широким диапазоном толщины, где полимер представляет собой любой один или более биосовместимый полимер, биологически разрушаемый полимер, биоразлагаемый полимер, полимолочную кислоту (PLA), полигликолевую кислоту (PGA), сополимер полимолочной и полигликолевой кислот (PLGA), поли-D,L-лактид-со-гликолид (PLGA), PLGA-этиленоксидфумарат, PLGA-альфа-токоферилсукцинат, этерифицированный до полиэтиленгликоля 1000 (PLGA-TGPS), полиангидрид поли[1,6-бис(п-карбоксифенокси)гексана] (pCPH), сополимер гидроксимасляной кислоты с гидроксивалериановой кислотой (PHB-PVA), сополимер полиэтиленгликоль-полимолочная кислота (PEG-PLA), поли-ε-капролактон (PCL), полиалкилцианоакрилат (PAC), поли(этил)цианоакрилат (PEC), полиизобутилцианоакрилат, поли-N-(2-гидроксипропил)метакриламид (поли(HPMA)), поли-β-R-гидроксибутират (PHB), поли-β-R-гидроксиалканоат (PHA), поли-β-R-яблочную кислоту, полимеры фосфолипид-холестерин, 2-диолеоил-sn-глицеро-3-фосфатидилхолин/полиэтиленгликоль-дистеароилфосфатидилэтаноламин (DOPC/PEG-DSPE)/холестерин, полисахариды, целлюлозу, этилцеллюлозу, метилцеллюлозу, альгинаты, декстран и декстрановые полимерные гидрогели, амилозу, инулин, пектин и гуаровую камедь, хитозан, хитин, гепарин, гиалуроновую кислоту, полиротаксаны и полипсевдоротаксаны на основе циклодекстрина (CD), полиаспартаты, полиглутаматы, полилейцин, сополимеры лейцин-глутамат, полибутиленсукцинат (PBS), желатин, коллагены, фибрины, фиброин, полиортоэфиры, сополимер полиортоэфир-полиамидин, сополимеры полиортоэфир-диамин, полиортоэфиры, включающие латентные кислоты, сополимер полиэтиленгликоль/полибутилентерефталат и их комбинации и сополимеры, где микрочастицы высвобождают или обеспечивают стационарную концентрацию лечебного белка при скорости приблизительно от 0,01 мг/неделю до 0,30 мг/неделю в течение, по меньшей мере, 60 дней.
В одном варианте осуществления композиция пролонгированного действия включает множество микрочастиц, размер которых находится в диапазоне приблизительно от двух микрон до 70 микрон, причем средний размер составляет приблизительно от 15 микрон до 30 микрон, и которые включают (a) ядро микроизмельченного белка с размером приблизительно от двух микрон до 30 микрон, причем средний размер составляет приблизительно от 10 микрон до 12 микрон, где белок представляет собой белок ловушку-VEGF; и (b) полимерный верхний слой с некоторым диапазоном толщины, где полимер представляет собой любой один или более полимеров из группы PLGA, этилцеллюлозы и полиортоэфира, и их сополимеров и производных, так что в водной среде микрочастицы высвобождают или обеспечивают стационарную концентрацию белка ловушку-VEGF при скорости приблизительно 0,06±0,02 мг/неделю в течение, по меньшей мере, 60 дней.
В одном аспекте изобретение предлагает способ модуляции высвобождения белка. В одном варианте осуществления способ включает стадию получения множества микрочастиц, как описано в предшествующем аспекте, после чего следует стадия помещения микрочастиц в растворитель. Растворитель в некоторых вариантах осуществления является водным. Растворитель может быть in vitro, например, в фосфатном забуференном растворе. Растворитель может быть in vivo, таким как, например, стекловидное тело.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
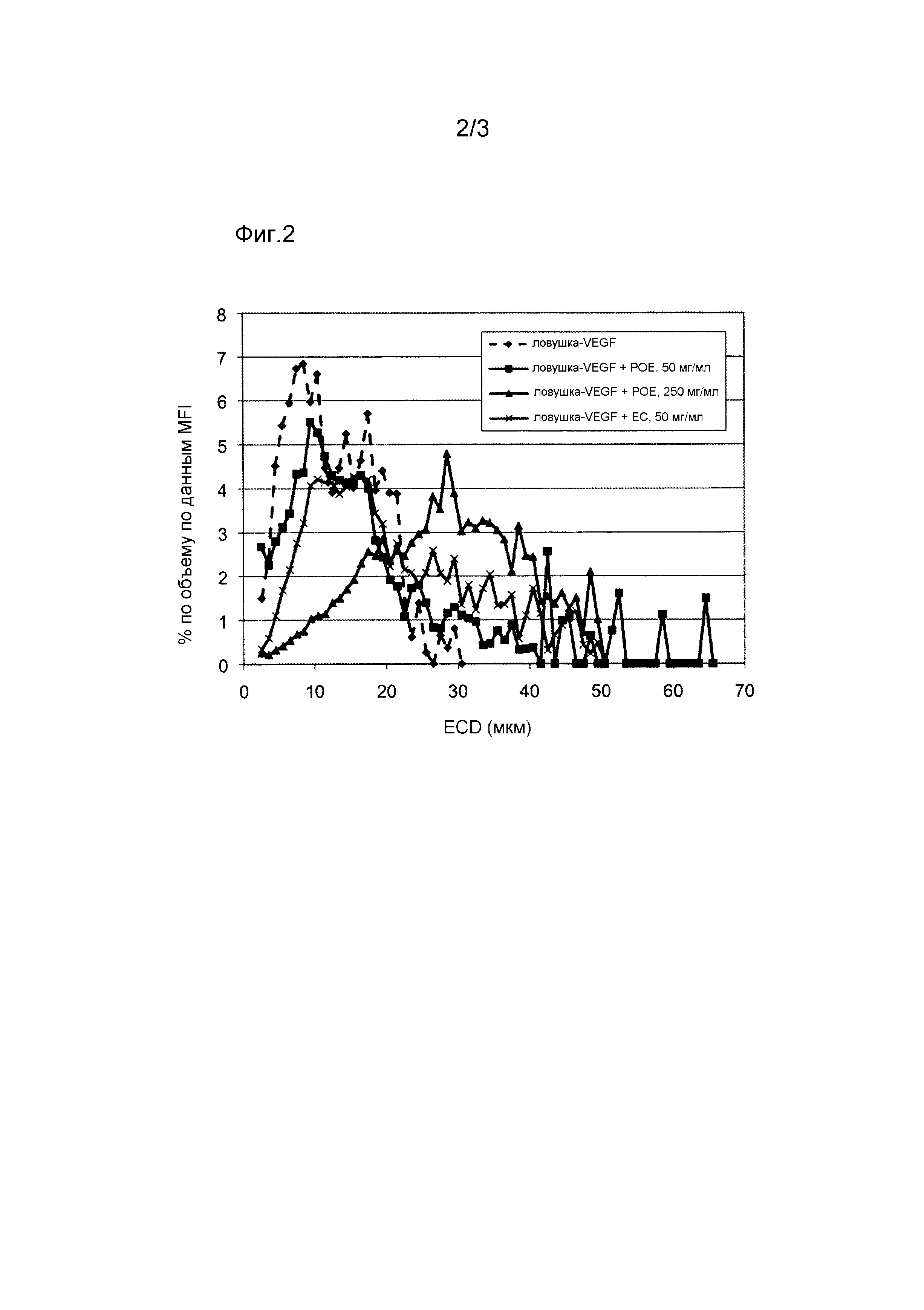
Фиг. 1 показывает относительное количество (% объемные) частиц белка без полимерного верхнего слоя данного диаметра (ECD (мкм)) в совокупности частиц белка, полученных из 50 мг/мл белка ловушку-VEGF, 25 мг/мл белка ловушку-VEGF и 25 мг/мл белка ловушку-VEGF плюс 0,1% полисорбата 80.
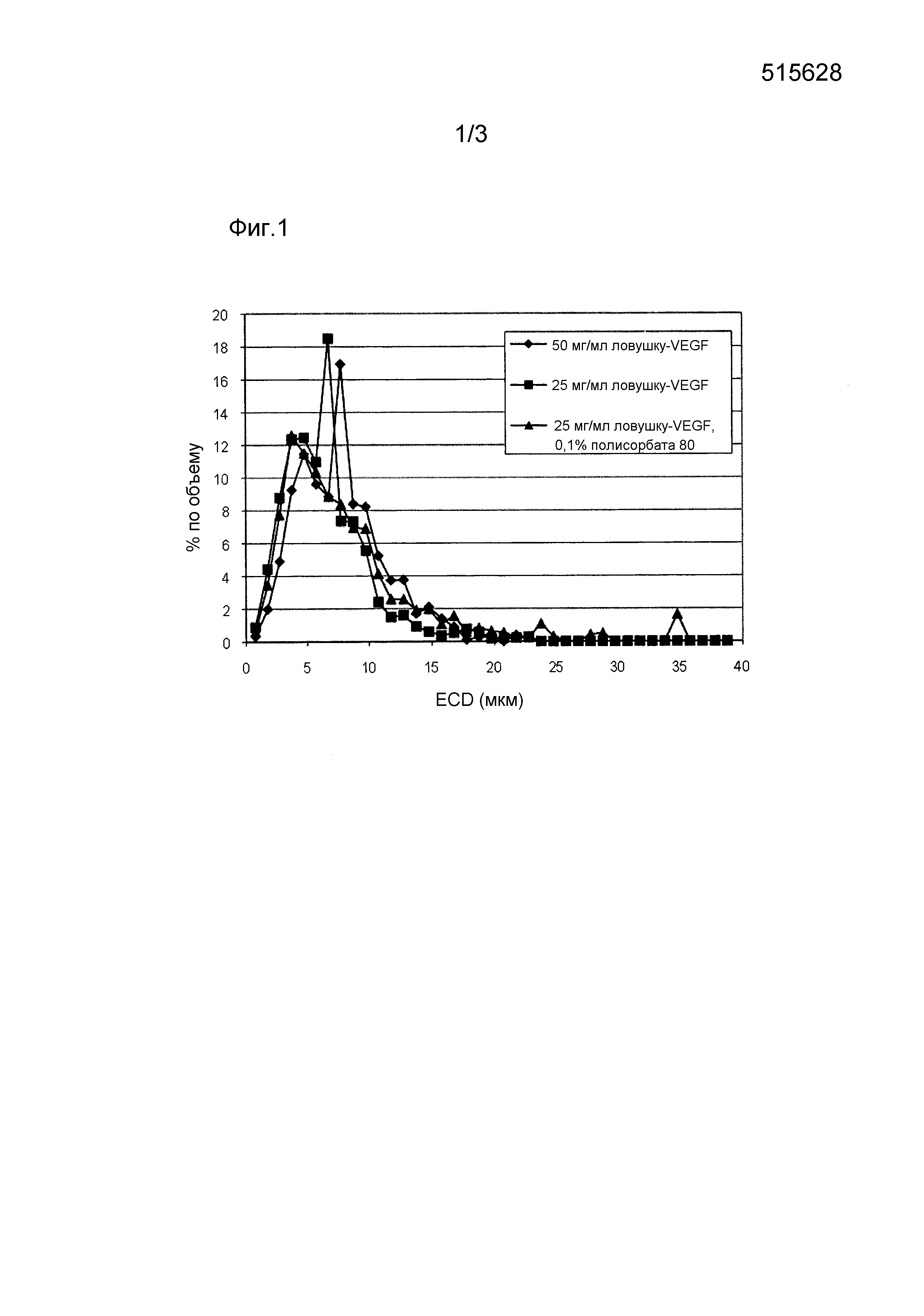
Фиг. 2 показывает относительное количество (% объемные определенные микропотоковой визуализацией (MFI)) микрочастиц заданного диаметра ((ECD (мкм)) в совокупности микрочастиц, полученных из 50 мг/мл белка ловушку-VEGF плюс 50 мг/мл POE, 250 мг/мл POE и 50 мг/мл EC.
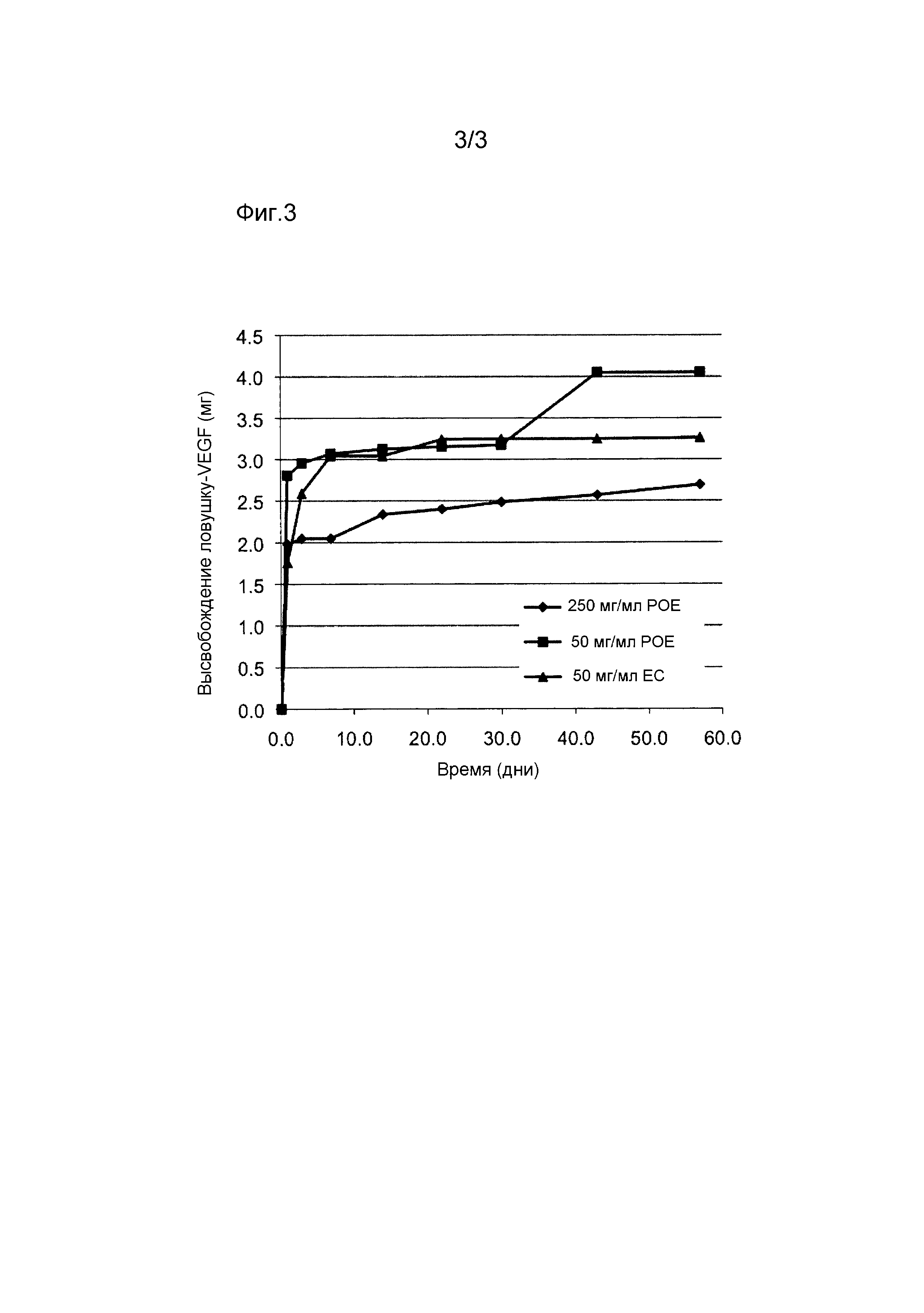
Фиг. 3 показывает количество белка ловушку-VEGF в миллиграммах, высвобожденного из микрочастиц, полученных из 50 мг/мл POE, 250 мг/мл POE или 50 мг/мл EC в течение приблизительно 60 дней.
ПОДРОБНОЕ ОПИСАНИЕ
Микрочастица и частица белкового ядра по настоящему изобретению являются в общих чертах сферическими по форме. Некоторые микрочастицы и ядра из белка будут приближаться к сферичности, в то время как другие будут более неправильными по форме. Таким образом, используемый здесь термин ”диаметр” обозначает каждое и любое из нижеследующего: (a) диаметр сферы, которая окружает микрочастицу или ядро из белка, (b) диаметр наиболее большой сферы, которая попадает внутрь границ микрочастицы или ядра из белка, (c) любое измерение между описывающей сферой из (a) и ограничивающей сферой из (b), включая среднее значение между данными двумя величинами, (d) длину наиболее длинной оси микрочастицы или ядра из белка; (e) длину наиболее короткой оси микрочастицы или ядра из белка, (f) любое измерение между длиной длинной оси (d) и длиной короткой оси (e), включая среднее значение между данными двумя величинами, и/или (g) эквивалентный круговой диаметр (”ECD”), определенный микропотоковой визуализацией (MFI), анализом траекторий движения наночастиц (NTA) или методами исследования частиц с применением светотени, таким как динамическое светорассеяние (DSL). В общих чертах, см.
Диаметр обычно выражают в микрометрах (мкм или микронах). Диаметр можно определить оптическим измерением.
”Микроизмельченная частица белка” или ”частица белка” обозначает частицу, содержащую множество молекул белка с низкими, очень низкими или близкими к нулю количествами воды (например, <3% воды по массе). При применении в настоящем описании микроизмельченная частица белка обычно является сферической по форме и имеет ECD, находящийся в диапазоне от 2 микрон до приблизительно 35 микрон. Микроизмельченная частица белка не ограничивается какой-либо конкретной белковой структурной единицей и подходит для приготовления и доставки лечебного белка. Обычные лечебные белки включают, помимо прочего, антигенсвязывающие белки, такие как, например, растворимые фрагменты рецептора, антитела (включая lgG) и производные или фрагменты антител, другие Fc-содержащие белки, включая Fc-слитые белки и слитые белки-Fc-рецепторы, включая белок типа ловушки (Huang, C., Curr. Opin. Biotechnol, 20: 692-99 (2009)), такие как, например, ловушка-VEGF.
Микроизмельченную частицу белка по изобретению можно получить любым способом, известным из уровня техники для получения частиц белка микронного размера. Например, частицу белка можно изготовить, помимо прочего, распылительной сушкой (инфра), лиофилизацией, размолом на струйной мельнице, кристаллизацией с применением висячей капли (Ruth et al., Acta Crystallographica D56: 524-28 (2000)), постепенным осаждением (патент США 7998477 (2011)), лиофилизацией водной смеси белок-PEG (полиэтиленгликоль) (Morita et al., Pharma. Res. 17: 1367-73 (2000)), осаждением в сверхкритической среде (патент США 6063910 (2000)) или образованием частиц, индуцированным диоксидом углерода с высоким давлением (Bustami et al., Pharma. Res. 17: 1360-66 (2000)).
Используемый в настоящем описании термин ”белок” относится к молекуле, включающей два или более аминокислотных остатка, присоединенных друг к другу пептидными связями. Пептиды, полипептиды и белки также включают модификации, включающие, но не ограничивающиеся этим, гликозилирование, присоединение липида, сульфирование, гамма-карбоксилирование остатками глутаминовой кислоты, гидроксилирование и АДФ-рибозилирование. Полипептиды могут представлять собой вещества научного или коммерческого интереса, включая лекарственные препараты на основе белков. Полипептиды включают, среди прочего, антитела и химерные или слитые белки. Полипептиды получают с помощью рекомбинантных клеточных линий животных с применением методов выращивания клеток.
”Антитело”, как предполагается, относится к молекулам иммуноглобулина, состоящим из четырех полипептидных цепей, двух тяжелых (H) цепей и двух легких (L) цепей, соединенных дисульфидными связями. Каждая тяжелая цепь имеет вариабельную область тяжелой цепи (HCVR или VH) и константную область тяжелой цепи. Константная область тяжелой цепи содержит три домена, CH1, CH2 и CH3. Каждая легкая цепь имеет вариабельную область легкой цепи и константную область легкой цепи. Константная область легкой цепи состоит из одного домена (CL). Области VH и VL далее могут подразделяться на области гипервариабельности, называемые гипервариабельными участками (CDR), с расположенными в промежутках областями, которые являются более консервативными, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от аминокислотной терминальной группы к карбоксильной терминальной группе в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Термин ”антитело” включает ссылку как к гликозилированным, так и к негликозилированным иммуноглобулинам любого изотипа или подкласса. Термин ”антитело” включает, но не ограничивается этим, антитела, которые готовят, экспрессируют, создают или выделяют рекомбинантными средствами, такие как антитела, выделяемые из клетки-хозяина, трансфицированной для экспрессии антитела. lgG включает подгруппу антител.
”Fc слитые белки” включают часть или всю структуру двух или более белков, один из которых является Fc частью молекулы иммуноглобулина, которые не являются слитыми в своем природном состоянии. Было описано приготовление слитых белков, включающих определенные гетерологические полипептиды, слитые с различными частями полипептидов, полученных из антител, (включающих Fc домен), например, (Ashkenazy et al., Proc. Natl. Acad. USA 88: 10535, 1991; Bym et al., Nature 344:677, 1990; и Hollenbaugh et al., “Construction of Immunoglobuline Fusion Proteins” in Current Protocols in Immunology, Suppl. 4, pp. 10.19.1-10.19.11, 1992). ”Слитый белок-Fc-рецептор” включает один или более из одного или более внеклеточных доменов рецептора, связанного с Fc группой, который в некоторых вариантах осуществления включает шарнирную область, за которой следует CH2 и CH3 домен иммуноглобулина. В некоторых вариантах осуществления слитый белок-Fc-рецептор содержит две или более отличающиеся цепи рецептора, которые связаны с одним или более чем одним лигандом(ами). Например, Fc-слитый белок представляет собой ловушку, такую как, например, IL-1 ловушка (например, рилонацепт, который содержит лигандсвязывающую область IL-1RAcP, слитую с внеклеточной областью IL-1R, слитой с Fc антитела higG1; см. патент США №6927004, который включается здесь ссылкой во всей своей полноте), или ловушку-VEGF (например, афлиберцепт, который содержит lg домен 2 рецептора VEGF Flt1, слитого с lg доменом 3 рецептора VEGF Flt1, слитого с Fc антитела higG1; например, SEQ ID NO: 1; см. патенты США №7087411 и 7279159, который настоящим включается здесь ссылкой во всей своей полноте).
Используемый в настоящем описании термин ”полимер” относится к макромолекуле, включающей повторяющиеся мономеры, соединенные ковалентными химическими связями. Полимеры, используемые при осуществлении на практике данного изобретения, являются биосовместимыми и биологически разрушаемыми. Биосовместимый и биологически разрушаемый полимер может быть природным или синтетическим. Природные полимеры включают полинуклеотиды, полипептиды, такие как встречающиеся в природе белки, рекомбинантные белки, желатин, коллагены, фибрины, фиброины, полиаспартаты, полиглутаматы, полилейцин, сополимеры лейцин-глутамат и полисахариды, такие как целлюлоза, альгинаты, декстран и декстрановые полимерные гидрогели, амилоза, инулин, пектин и гуаровая камедь, хитозан, хитин, гепарин и гиалуроновую кислоту. Синтетические биосовместимые или биологически разрушаемые полимеры включают полимолочную кислоту (PLA), полигликолевую кислоту (PGA), сополимер полимолочной и полигликолевой кислот (PLGA), поли-D,L-лактид-со-гликолид (PLGA), PLGA-этиленоксидфумарат, PLGA-альфа-токоферилсукцинат, этерифицированный до полиэтиленгликоля 1000 (PLGA-TGPS), полиангидрид поли[1,6-бис(п-карбоксифенокси)гексана] (pCPH), сополимер гидроксимасляной кислоты с гидроксивалериановой кислотой (PHB-PVA), сополимер полиэтиленгликоль-полимолочная кислота (PEG-PLA), поли-ε-капролактон (PCL), полиалкилцианоакрилат (PAC), поли(этил)цианоакрилат (PEC), полиизобутилцианоакрилат, поли-N-(2-гидроксипропил)метакриламид (поли(HPMA)), поли-β-R-гидроксибутират (PHB), поли-β-R-гидроксиалканоат (PHA), поли-β-R-яблочную кислоту, полимеры фосфолипид-холестерин, 2-диолеоил-sn-глицеро-3-фосфатидилхолин/полиэтиленгликоль-дистеароилфосфатидилэтаноламин (DOPC/PEG-DSPE)/холестерин, этилцеллюлозу, полиротаксаны и полипсевдоротаксаны на основе циклодекстрина (CD), полибутиленсукцинат (PBS), полиортоэфиры, сополимеры полиортоэфир-полиамидин, сополимеры полиортоэфир-диамин, полиортоэфиры, включающие латентные кислоты для контроля скорости разрушения, и, помимо прочего, сополимеры полиэтиленгликоль/полибутилентерефталат.
Этилцеллюлоза (EC) представляет собой хорошо известный и легкодоступный биоматериал, используемый в фармацевтической и пищевой науке. Она представляет собой производное целлюлозы, в котором некоторая часть гидроксильных групп глюкозы замещена этиловым эфиром (см. Martinac et al., J. Microencapsulation, 22(5): 549-561 (2005) и содержащиеся в ней ссылки), которая описывает методы применения этилцеллюлозы в качестве биосовместимых полимеров при получении микросфер. (см. также патент США 4210529 (1980)) и ссылки в нем для подробного ознакомления с этилцеллюлозой и способами получения производных этилцеллюлозы.
Поли-D,L-лактид-со-гликолид (PLGA) также представляет собой хорошо известный одобренный Управлением по контролю за продуктами и лекарствами биосовместимый и биологически разрушаемый полимер, используемый в технологии культивирования тканей и фармацевтических системах доставки. PLGA представляет собой сложный полиэфир, включающий мономеры гликолевой кислоты и молочной кислоты. Описание синтеза PLGA и получения наночастиц PLGA можно найти в (Astete and Sabilov, Biomater. Sci. Polym. Ed., 17(3): 247-89 (2006) и содержащиеся в ней ссылки).
Поли-ε-капролактон (PCL) представляет собой другой биосовместимый и биологически разрушаемый полимер, одобренный Управлением по контролю за продуктами и лекарствами для применения в качестве устройства доставки лекарственного препарата при лечении людей. PCL представляет собой сложный полиэфир ε-капролактона, который быстро гидролизуется в организме с образованием нетоксичной или мало токсичной гидроксикарбоновой кислоты. Описание получения PCL можно найти в (Labet and Thielemans, Chemical Society Reviews 38: 3484-3504 (2009) и содержащихся в ней ссылках). Описание получения и применения микросфер и наносфер на основе PCL в качестве систем доставки можно найти в (Sinha et al., J. Pharm., 278(1):1-23 (2004) и содержащихся в ней ссылках).
Полиортоэфир (POE) представляет собой биоразлагаемый полимер, предназначенный для доставки лекарственных препаратов. Как правило, он представляет собой полимер кетенацеталя, предпочтительно циклического дикетенацеталя, такого как, например, 3,9-диметилен-2,4,8,10-тетраокса-спиро[5,5]-ундекана, который полимеризуется посредством конденсации гликоля с образованием ортоэфирных связей. Описание синтеза и различных типов полиортоэфиров можно найти, например, в патенте США 4304767. Полиортоэфиры можно модифицировать, чтобы контролировать их профиль высвобождения лекарственного препарата и скорости разложения посредством введения или выведения различных гидрофобных диолов и полиолов, например, заменяя гексантриол на декантриол; а также добавляя латентные кислоты, такие как, например, октандикарбоновую кислоту или аналогичную, к основной цепи, чтобы увеличить pH чувствительность. Другие модификации полиортоэфира включают интегрирование аминогруппы для увеличения функциональности. Образование, описание и применение полиортоэфиров описывается в патентах США 5968543, 4764364 и (Heller and Barr, Biomacromolecules, 5(5):1625-32 (2004), Heller, Adv. Drug. Deliv. Rev., 57:2053-62 (2005)).
Используемая в настоящем описании фраза ”распылительная сушка” обозначает способ получения сухого порошка, включающего частицы микронного размера, из взвеси или суспензии с помощью устройства для распылительной сушки. Устройства для распылительной сушки используют распылитель или распыляющее сопло для диспергирования суспензии или взвеси в виде спрея с контролируемым размером капель. Распылительной сушкой можно генерировать капли с размером от 10 до 500 мкм. По мере того как растворитель (вода или органический растворитель) высыхает, вещество белка высыхает в частицу микронного размера, формируя порошкообразное вещество; или в случае суспензии белок-полимер в течение сушки полимерная оболочка затвердевает вокруг загрузки из белка.
Микрочастицы по изобретению включают ядро из белка, окруженное полимерным верхним слоем или покрытием. Вкратце, формируется микроизмельченная частица белка, которую затем диспергируют в растворе полимера (полимер, растворенный в растворителе) с получением суспензии белок-полимер. Суспензию белок-полимер затем распыляют до тонкодисперсных (микроизмельченных) капель и растворитель высушивают с формированием микрочастицы.
В одном варианте осуществления микроизмельченную частицу белка получают, изготавливая раствор белка и затем подвергая данный раствор белка распылению и нагреванию с получением сухого порошка, включающего белок. Одним способом получения микроизмельченных частиц белка является распылительная сушка. В одном варианте осуществления белок представляет собой лечебный белок, из которого составляют композицию, включая буферные агенты, стабилизаторы и другие фармацевтически приемлемые наполнители, получая фармацевтическую композицию лечебного белка. Иллюстративные фармацевтические композиции описываются в патентах США 7365165, 7572893, 7608261, 7655758, 7807164, 2010-0279933, 2011-0171241 и PCT/US11/54856.
Количество лечебного белка, содержащегося в фармацевтических композициях по настоящему изобретению, можно варьировать в зависимости от конкретных желательных свойств композиции, а также конкретных обстоятельств и целей, в которых данную композицию предполагают использовать. В определенных вариантах осуществления фармацевтическая композиция может содержать приблизительно от 1 мг/мл до 500 мг/мл белка; приблизительно от 5 мг/мл до 400 мг/мл белка; приблизительно от 5 мг/мл до 200 мг/мл белка; приблизительно от 25 мг/мл до 180 мг/мл белка; приблизительно от 25 мг/мл до 150 мг/мл белка; или приблизительно от 50 мг/мл до 180 мг/мл белка. Например, композиции по настоящему изобретению могут включать приблизительно 1 мг/мл; приблизительно 2 мг/мл; приблизительно 5 мг/мл; приблизительно 10 мг/мл; приблизительно 15 мг/мл; приблизительно 20 мг/мл; приблизительно 25 мг/мл; приблизительно 30 мг/мл; приблизительно 35 мг/мл; приблизительно 40 мг/мл; приблизительно 45 мг/мл; приблизительно 50 мг/мл; приблизительно 55 мг/мл; приблизительно 60 мг/мл; приблизительно 65 мг/мл; приблизительно 70 мг/мл; приблизительно 75 мг/мл; приблизительно 80 мг/мл; приблизительно 85 мг/мл; приблизительно 86 мг/мл; приблизительно 87 мг/мл; приблизительно 88 мг/мл; приблизительно 89 мг/мл; приблизительно 90 мг/мл; приблизительно 95 мг/мл; приблизительно 100 мг/мл; приблизительно 105 мг/мл; приблизительно 110 мг/мл; приблизительно 115 мг/мл; приблизительно 120 мг/мл; приблизительно 125 мг/мл; приблизительно 130 мг/мл; приблизительно 131 мг/мл; приблизительно 132 мг/мл; приблизительно 133 мг/мл; приблизительно 134 мг/мл; приблизительно 135 мг/мл; приблизительно 140 мг/мл; приблизительно 145 мг/мл; приблизительно 150 мг/мл; приблизительно 155 мг/мл; приблизительно 160 мг/мл; приблизительно 165 мг/мл; приблизительно 170 мг/мл; приблизительно 175 мг/мл; приблизительно 180 мг/мл; приблизительно 185 мг/мл; приблизительно 190 мг/мл; приблизительно 195 мг/мл; приблизительно 200 мг/мл; приблизительно 205 мг/мл; приблизительно 210 мг/мл; приблизительно 215 мг/мл; приблизительно 220 мг/мл; приблизительно 225 мг/мл; приблизительно 230 мг/мл; приблизительно 235 мг/мл; приблизительно 240 мг/мл; приблизительно 245 мг/мл; приблизительно 250 мг/мл; приблизительно 255 мг/мл; приблизительно 260 мг/мл; приблизительно 265 мг/мл; приблизительно 270 мг/мл; приблизительно 275 мг/мл; приблизительно 280 мг/мл; приблизительно 285 мг/мл; приблизительно 290 мг/мл; приблизительно 295 мг/мл; приблизительно 300 мг/мл лечебного белка.
Фармацевтические композиции по настоящему изобретению включают один или более наполнителей. Используемый в настоящем описании термин ”наполнитель” обозначает любое не терапевтическое вещество, добавленное к композиции для обеспечения желательной консистенции, вязкости или стабилизирующего эффекта.
Фармацевтические композиции по настоящему изобретению могут также включать один или более углеводов, например, один или несколько сахаров. Сахар может представлять собой восстанавливающий сахар или невосстанавливающий сахар. ”Восстанавливающие сахара” включают, например, сахара с кетоновой или альдегидной группой и содержат полуацетальную группу, которая дает возможность сахару действовать в качестве восстанавливающего агента. Конкретные примеры восстанавливающих сахаров включают фруктозу, глюкозу, глицеральдегид, лактозу, арабинозу, маннозу, ксилозу, рибозу, рамнозу, галактозу и мальтозу. Невосстанавливающие сахара могут включать аномерный углерод, который является ацеталем, и является по существу не реакционно-способным по отношению к аминокислотам или полипептидам, чтобы инициировать реакцию Майяра. Конкретные примеры невосстанавливающих сахаров включают сахарозу, трегалозу, сорбозу, сукралозу, мелицитозу и рафинозу. Сахарные кислоты включают, например, сахарную кислоту, глюконат и другие полигидроксисахара и их соли.
Количество сахара, содержащегося в фармацевтических композициях по настоящему изобретению, будет варьироваться в зависимости от конкретных обстоятельств и целей, для которых предназначено применение данных композиций. В некоторых вариантах осуществления композиции могут содержать приблизительно от 0,1% до 20% сахара; приблизительно от 0,5% до 20% сахара; приблизительно от 1% до 20% сахара; приблизительно от 2% до 15% сахара; приблизительно от 3% до 10% сахара; приблизительно от 4% до 10% сахара; или приблизительно от 5% до 10% сахара. Например, фармацевтические композиции по настоящему изобретению могут включать приблизительно 0,5%; приблизительно 1,0%; приблизительно 1,5%; приблизительно 2,0%; приблизительно 2,5%; приблизительно 3,0%; приблизительно 3,5%; приблизительно 4,0%; приблизительно 4,5%; приблизительно 5,0%; приблизительно 5,5%; приблизительно 6,0%; приблизительно 6,5%; приблизительно 7,0%; приблизительно 7,5%; приблизительно 8,0%; приблизительно 8,5%; приблизительно 9,0%; приблизительно 9,5%; приблизительно 10,0%; приблизительно 10,5%; приблизительно 11,0%; приблизительно 11,5%; приблизительно 12,0%; приблизительно 12,5%; приблизительно 13,0%; приблизительно 13,5%; приблизительно 14%; приблизительно 14,5%; приблизительно 15,0%; приблизительно 15,5%; приблизительно 16,0%; 16,5%; приблизительно 17%; приблизительно 17,5%; приблизительно 18%; приблизительно 18,5%; приблизительно 19%; приблизительно 19,5% или приблизительно 20,0% сахара (например, сахарозы).
Фармацевтические композиции по настоящему изобретению также могут включать одно или более поверхностно-активных веществ. Используемый в настоящем описании термин ”поверхностно-активное вещество” обозначает вещество, которое уменьшает поверхностное натяжение жидкости, в которой оно растворено, и/или снижает межфазное натяжение между маслом и водой. Поверхностно-активные вещества могут быть ионными или неионными. Иллюстративные неионные поверхностно-активные вещества, которые можно включить в композиции по настоящему изобретению, включают, например, алкилполиэтиленоксид, алкилполиглюкозиды (например, октилгюкозид и децилмальтозид), жирные спирты, такие как цетиловый спирт и олеиловый спирт, кокамид MEA, кокамид DEA и кокамид TEA. Конкретные неионные поверхностно-активные вещества, которые можно включить в композиции по настоящему изобретению, включают, например, полисорбаты, такие как полисорбат 20, полисорбат 28, полисорбат 40, полисорбат 60, полисорбат 65, полисорбат 80, полисорбат 81 и полисорбат 85; полоксамеры, такие как полоксамер 188, полоксамер 407, полиэтиленполипропиленгликоль или полиэтиленгликоль (PEG). Полисорбат 20 также известен как TWEEN 20, монолаурат сорбита и монолаурат полиоксиэтиленсорбита.
Количество поверхностно-активного вещества, содержащегося в фармацевтической композиции по настоящему изобретению, можно варьировать в зависимости от конкретных желательных свойств композиции, а также конкретных обстоятельств и целей, для которых предназначено применение данных композиций. В некоторых вариантах осуществления композиции могут содержать приблизительно от 0,05% до 5% поверхностно-активного вещества или приблизительно от 0,1% до 0,2% поверхностно-активного вещества. Например, композиции по настоящему изобретению могут включать приблизительно 0,05%; приблизительно 0,06%; приблизительно 0,07%; приблизительно 0,08%; приблизительно 0,09%; приблизительно 0,10%; приблизительно 0,11%; приблизительно 0,12%; приблизительно 0,13%; приблизительно 0,14%; приблизительно 0,15%; приблизительно 0,16%; приблизительно 0,17%; приблизительно 0,18%; приблизительно 0,19%; приблизительно 0,20%; приблизительно 0,21%; приблизительно 0,22%; приблизительно 0,23%; приблизительно 0,24%; приблизительно 0,25%; приблизительно 0,26%; приблизительно 0,27%; приблизительно 0,28%; приблизительно 0,29% или приблизительно 0,30% поверхностно-активного вещества (например, полисорбата 20).
Фармацевтические композиции по настоящему изобретению могут также включать один или более буферных растворов. В некоторых вариантах осуществления буферный раствор имеет диапазон буферного действия, который полностью или частично перекрывает диапазон pH 5,5-7,4. В одном варианте осуществления буферный раствор имеет pKa приблизительно 6,0±0,5. В некоторых вариантах осуществления буферный раствор включает фосфатный буферный раствор. В некоторых вариантах осуществления фосфат присутствует при концентрации от 5 мМ ± 0,75 мМ до 15 мМ ± 2,25 мМ; от 6 мМ ± 0,9 мМ до 14 мМ ± 2,1 мМ; от 7 мМ ± 1,05 мМ до 13 мМ ± 1,95 мМ; от 8 мМ ± 1,2 мМ до 12 мМ ± 1,8 мМ; от 9 мМ ± 1,35 мМ до 11 мМ ± 1,65 мМ; 10 мМ ± 1,5 мМ или приблизительно 10 мМ. В некоторых вариантах осуществления буферная система включает гистидин при концентрации 10 мМ ± 1,5 мМ при pH 6,0 ± 0,5.
Фармацевтические композиции по настоящему изобретению могут иметь pH приблизительно от 5,0 до 8,0. Например, композиции по настоящему изобретению могут иметь pH приблизительно 5,0; приблизительно 5,2; приблизительно 5,4; приблизительно 5,6; приблизительно 5,8; приблизительно 6,0; приблизительно 6,2; приблизительно 6,4; приблизительно 6,6; приблизительно 6,8; приблизительно 7,0; приблизительно 7,2; приблизительно 7,4; приблизительно 7,6; приблизительно 7,8 или приблизительно 8,0.
В одном особом варианте осуществления лечебный белок представляет собой белок ловушку-VEGF. Фармацевтические композиции для формирования микроизмельченных частиц белка ФРЕС-ловушки могут содержать приблизительно от 10 мг/мл до 100 мг/мл белка ФРЕС-ловушки, приблизительно 10 мг/мл, приблизительно 15 мг/мл, приблизительно 20 мг/мл, приблизительно 25 мг/мл, приблизительно 30 мг/мл, приблизительно 35 мг/мл, приблизительно 40 мг/мл, приблизительно 45 мг/мл, приблизительно 50 мг/мл, приблизительно 55 мг/мл, приблизительно 60 мг/мл, приблизительно 65 мг/мл, приблизительно 70 мг/мл, приблизительно 75 мг/мл, приблизительно 80 мг/мл, приблизительно 85 мг/мл, приблизительно 90 мг/мл, приблизительно 95 мг/мл или приблизительно 100 мг/мл белка ФРЕС-ловушки.
Растворы могут содержать один или более буферных агентов с концентрацией приблизительно от 5 мМ до 50 мМ. В одном варианте осуществления буферный агент представляет собой приблизительно 10 мМ фосфата при pH приблизительно 6±0,5. Растворы могут также содержать сахарозу с концентрацией приблизительно от 1% до 10%. В одном варианте осуществления раствор содержит сахарозу с концентрацией приблизительно 2% масс./масс.
В некоторых вариантах осуществления раствор лечебного белка содержит белок ловушки-ФРЕС с концентрацией приблизительно 25 мг/мл или приблизительно 50 мг/мл в 10 мМ фосфате при pH 6,2, 2% сахарозы и необязательно 0,1% полисорбата.
Композицию лечебного белка затем подвергают распылению и сушке с получением микроизмельченных частиц белка. Один метод получения микроизмельченных частиц белка состоит в распылительной сушке раствора белка. Распылительная сушка обычно известна из уровня техники и ее можно осуществить на таком оборудовании, как, например, BÜCHI Mini Spray Dryer B-290 (Büchi Labortechnik AG, Флавил, Швейцария). В одном особом варианте осуществления раствор белка (например, но не ограничиваясь к какой бы то ни было композиции ФРЕС-ловушки, описанной выше) закачивают в устройство для распылительной сушки со скоростью приблизительно от 2 мл/мин до 15 мл/мин или приблизительно 7 мл/мин. Температуру на входе устройства для распылительной сушки устанавливают выше температуры кипения воды, например приблизительно при 130°C. Температуру на выходе устанавливают ниже температуры кипения воды и выше комнатной температуры, например равной 55°C. В одном конкретном варианте осуществления раствор белка (например, раствор ФРЕС-ловушки или раствор lgG) закачивают в BÜCHI Mini Spray Dryer B-290 со скоростью приблизительно 7 мл/мин с температурой на входе приблизительно 130°C и температурой на выходе приблизительно 55°C, причем аспиратор устанавливают при 33 м3/час и распыляющий газ при 530 л/час.
Размер полученных в результате микроизмельченных частиц белка находится в диапазоне приблизительно от 1 мкм до 100 мкм в диаметре в зависимости от конкретной композиции и концентрации белка и наполнителей. В некоторых вариантах осуществления микроизмельченные частицы белка имеют диаметр приблизительно от 1 мкм до 100 мкм, приблизительно от 1 мкм до 40 мкм, приблизительно от 2 мкм до 15 мкм, приблизительно от 2,5 мкм до 13 мкм, приблизительно от 3 мкм до 10 мкм, приблизительно 5 мкм, приблизительно 6 мкм, приблизительно 7 мкм, приблизительно 8 мкм, приблизительно 9 мкм, приблизительно 10 мкм, приблизительно 11 мкм или приблизительно 12 мкм.
Затем микроизмельченные частицы белка покрывают биосовместимым и биологически разрушаемым полимером. Это можно осуществить суспендированием микроизмельченных частиц белка в растворе полимера. Раствор полимера по существу представляет собой полимер, растворенный в растворителе. Например, биосовместимый и биологически разрушаемый полимер можно растворить, помимо прочего, в метиленхлориде, тетрагидрофуране, этилацетате или в каком-то другом применимом растворителе. Этилацетат широко известен в качестве безопасного растворителя и часто используется при приготовлении лекарственных препаратов, имплантатов или продуктов питания.
В некоторых вариантах осуществления полимер может представлять собой этилцеллюлозу (”EC”), полимолочную кислоту (”PLA”), полиортоэфир (”POE”), поли-D,L-лактид-со-гликолид (”PLGA”) или поли-ε-капролактон (”PCL”). Полимер можно растворить в растворителе (например, этилацетате) при концентрации приблизительно от 10 мг/мл до 300 мг/мл, приблизительно от 15 мг/мл до 295 мг/мл, приблизительно от 20 мг/мл до 290 мг/мл, приблизительно от 25 мг/мл до 280 мг/мл, приблизительно от 30 мг/мл до 270 мг/мл, приблизительно от 35 мг/мл до 265 мг/мл, приблизительно от 40 мг/мл до 260 мг/мл, приблизительно от 45 мг/мл до 260 мг/мл, приблизительно от 50 мг/мл до 255 мг/мл, приблизительно от 55 мг/мл до 250 мг/мл, приблизительно 20 мг/мл, приблизительно 25 мг/мл, приблизительно 30 мг/мл, приблизительно 35 мг/мл, приблизительно 40 мг/мл, приблизительно 45 мг/мл, приблизительно 50 мг/мл, приблизительно 75 мг/мл, приблизительно 100 мг/мл, приблизительно 125 мг/мл, приблизительно 150 мг/мл, приблизительно 175 мг/мл, приблизительно 200 мг/мл, приблизительно 225 мг/мл или приблизительно 250 мг/мл.
Микроизмельченные частицы белка добавляют в раствор полимера при концентрации приблизительно от 10 мг/мл до 100 мг/мл, приблизительно от 15 мг/мл до 95 мг/мл, приблизительно от 20 мг/мл до 90 мг/мл, приблизительно от 25 мг/мл до 85 мг/мл, приблизительно от 30 мг/мл до 80 мг/мл, приблизительно от 35 мг/мл до 75 мг/мл, приблизительно от 40 мг/мл до 70 мг/мл, приблизительно от 45 мг/мл до 65 мг/мл, приблизительно от 50 мг/мл до 60 мг/мл, приблизительно 25 мг/мл, приблизительно 30 мг/мл, приблизительно 35 мг/мл, приблизительно 40 мг/мл, приблизительно 45 мг/мл или приблизительно 50 мг/мл. Частицы перемешивают с образованием взвеси или суспензии, которую затем подвергают распылению и сушке с получением частицы белка, покрытого полимером (т.е. микрочастиц).
В одном варианте осуществления суспензию частиц белка в растворе полимера подвергают распылительной сушке, которую осуществляют в манере, аналогичной методу получения микроизмельченных частиц белка, но с сниженной температурой на входе для защиты от воспламенения органического растворителя или полимера. Вкратце, суспензию частиц белка в растворе полимера закачивают в устройство для распылительной сушки при скорости приблизительно от 5 мл/мин до 20 мл/мин или приблизительно от 12,5 мл/мин. Суспензию закачивали со скоростью 12,5 мл/мин в устройство для распылительной сушки со скоростью потока всасываемого воздуха и распыляющего газа приблизительно 530 л/час и 35 м3/час (мм) соответственно. Температуру на входе устанавливали равной 90°C и температуру на выходе устанавливали приблизительно 54°C. Температуру на входе устройства для распылительной сушки устанавливали выше температуры воспламенения растворителя, например приблизительно 90°C. Температура на выходе была ниже температуры на входе и выше температуры окружающей среды, например приблизительно 54°C. В одном особом варианте осуществления суспензию, содержащую приблизительно 50 мг/мл частиц белка (например, ловушку-VEGF) в растворе полимера в этилацетате с концентрацией приблизительно от 50 мг/мл до 250 мг/мл, закачивают в BÜCHI Mini Spray Dryer B-290 со скоростью приблизительно 12,5 мл/мин с температурой на входе приблизительно 90°C и температурой на выходе приблизительно 54°C, причем аспиратор устанавливают приблизительно при 35 м3/час и распыляющий газ приблизительно при 530 л/час.
Полученные в результате микрочастицы, которые содержат ядро частицы белка с полимерным верхним слоем, имеют диаметр в диапазоне приблизительно от 2 мкм до 70 мкм, приблизительно от 5 мкм до 65 мкм, приблизительно от 10 мкм до 60 мкм, приблизительно от 15 мкм до 55 мкм, приблизительно от 20 мкм до 50 мкм, приблизительно 15 мкм, приблизительно 20 мкм, приблизительно 25 мкм или приблизительно 30 мкм. Разброс по размеру во многом отражает толщину полимерного верхнего слоя, хотя диаметр ядра из белка в некоторой степени может внести вклад в разброс по размеру. Изменяя исходную концентрацию раствора полимера и/или сам полимер, можно контролировать диаметр микрочастицы. Например, микрочастицы, которые изготавливали с применением 50 мг/мл полимера, имели средний размер приблизительно от 15 мкм до 20 мкм, тогда как микрочастицы, которые изготавливали с применением 250 мг/мл полимера, имели средний размер приблизительно 30 мкм.
Микрочастицы по настоящему изобретению применимы в белковых терапевтических средствах медленного высвобождения или пролонгированного действия. Например, представляется, что микрочастицы ловушку-VEGF применимы в лечебном белке ловушку-VEGF пролонгированного высвобождения, например в стекловидном теле для лечения заболеваний стекловидного тела глаз или подкожной имплантации для пролонгированного высвобождения ловушку-VEGF для лечения рака или других заболеваний.
Микрочастицы по настоящему изобретению высвобождают белок в физиологическую водную среду приблизительно при 37°C при относительно постоянной скорости в течение продолжительного периода времени, вплоть до, по меньшей мере, 60 дней. В общем, данные микрочастицы, полученные с более высокой концентрацией полимера (например, 250 мг/мл), имеют тенденцию показывать относительно линейный профиль высвобождения белка, тогда как микрочастицы, полученные с более низкой концентрацией полимера (например, 50 мг/мл), имеют тенденцию показывать исходный выброс, за которым следует начало отложенного ”взрывного” высвобождения. Более того, микрочастицы, сформированные из полимера с более высокой концентрацией, показывали более медленную скорость высвобождения белка по сравнению с микрочастицами, полученными из полимера с более низкой концентрацией. Качество белка, высвобождаемого из микрочастиц, с течением времени соответствовало качеству исходного материала белка. Имело место незначительное разрушение белка, либо оно отсутствовало вовсе.
ПРИМЕРЫ
Следующие ниже примеры предлагаются с тем, чтобы обеспечить специалистов в данной области полным раскрытием и описанием, как осуществить и использовать способы и композиции по изобретению, и они не имеют намерения ограничивать объем патентной защиты, который авторы заявки рассматривают в качестве своего изобретения. Были осуществлены попытки обеспечить точность, что касается используемых цифр (например, количеств, размеров и т.д.), но некоторые экспериментальные ошибки и отклонения должны быть приняты во внимание.
В следующих ниже примерах белок ловушку-VEGF (”VGT”), который является димером полипептида, включающего последовательность аминокислот SEQ ID NO: 1, служит в качестве примера слитого белка-Fc-рецептора.
ПРИМЕР 1: МИКРОИЗМЕЛЬЧЕННЫЕ БЕЛКИ
Растворы, содержащие 25 мг/мл белка ловушку-VEGF (”VGT”), 25 мг/мл VGT плюс 0,1% полисорбата 80 и 50 мг/мл VGT в 10 мМ фосфата, 2% сахарозы, pH 6,2, каждый, независимо распыляли с помощью устройства для распылительной сушки (BÜCHI Mini Spray Dryer B-290, Büchi Labortechnik AG, Флавил, Швейцария) с формированием капель, содержащих ловушку-VEGF. Для испарения воды из капель использовали тепло, в результате получая порошок, содержащий ловушку-VEGF. Температуру на входе устанавливали равной 130°C, а температуру на выходе - приблизительно 55°C. Аспиратор устанавливали приблизительно при 33 м3/час и распыляющий газ приблизительно при 530 л/час. Раствор VGT закачивали со скоростью приблизительно 7 мл/мин.
Размер полученных в результате частиц VGT измеряли микропотоковой визуализацией (MFI) и динамическим светорассеянием (DLS). Фигура 1 показывает распределение частиц по размерам, определенное методом MFI для частиц VGT, полученных из концентраций 25 мг/мл VGT, 25 мг/мл VGT плюс 0,1% полисорбата 80, и 50 мг/мл VGT. Для всех концентраций эквивалентный круговой диаметр (ECD) частиц VGT находился в диапазоне приблизительно от 1 мкм до 39 мкм, причем размер основной массы частиц находился в диапазоне приблизительно от 2 мкм до 14 мкм. Для раствора VGT с концентрацией 25 мг/мл частицы образовывали кластеры в диапазоне приблизительно от 2,5 мкм до 8,8 мкм с модой приблизительно 6 мкм. Для раствора 25 мг/мл VGT плюс 0,1% полисорбата 80 частицы образовывали кластеры в диапазоне приблизительно от 2,5 мкм до 9,7 мкм с модой приблизительно 6 мкм. Для раствора VGT с концентрацией 50 мг/мл частицы образовывали кластеры в диапазоне приблизительно от 2,7 мкм до 12,8 мкм с модой приблизительно 7 мкм. Средние диаметры для каждой композиции, определенные методами MFI и DLS, показаны в таблице 1.
Частицы VGT повторно растворяли в воде для инъекций и исследовали с помощью гель-фильтрации, т.е. эксклюзионной-сверхэффективной жидкостной хроматографии (SE-UPLC), чтобы определить чистоту белка. Никаких изменений в чистоте не было отмечено после микроизмельчения относительно исходного материала (см. таблицу 3).
|
ПРИМЕР 2: МИКРОИЗМЕЛЬЧЕННЫЕ СУСПЕНЗИИ БЕЛКА В ОРГАНИЧЕСКОМ ПОЛИМЕРНОМ РАСТВОРЕ
Различные полимеры использовались или рассматриваются для применения при получении полимерного верхнего слоя микрочастиц. Данные полимеры включают, помимо прочего, этилцеллюлозу (”EC”), полиортоэфир (”POE”), поли-D,L-лактид-со-гликолид (”PLGA”) и поли-ε-капролактон (”PCL”).
Покрытие этилцеллюлозой
Микроизмельченные частицы ловушку-VEGF суспендировали в растворе 50 мг/мл этилцеллюлозы в этилацетате при концентрации приблизительно 50 мг/мл VGT; в настоящем описании обозначено ”суспензия VGT-50-EC”.
Микроизмельченные частицы ловушку-VEGF суспендировали в растворе 100 мг/мл этилцеллюлозы в этилацетате при концентрации приблизительно 50 мг/мл VGT; в настоящем описании обозначено ”суспензия VGT-100-EC”.
Микроизмельченные частицы ловушку-VEGF суспендировали в растворе 250 мг/мл этилцеллюлозы в этилацетате при концентрации приблизительно 50 мг/мл VGT; в настоящем описании обозначено ”суспензия VGT-250-EC”.
Покрытие полиортоэфиром
Микроизмельченные частицы ловушку-VEGF суспендировали в растворе 50 мг/мл полиортоэфира, содержащего приблизительно 5% латентной кислоты, в этилацетате при концентрации приблизительно 50 мг/мл VGT; в настоящем описании обозначено ”суспензия VGT-50-POE”.
Микроизмельченные частицы ловушку-VEGF суспендировали в растворе 250 мг/мл полиортоэфира, содержащего приблизительно 5% латентной кислоты, в этилацетате при концентрации приблизительно 50 мг/мл VGT; в настоящем описании обозначено ”суспензия VGT-250-POE”.
Покрытие поли-D,L-лактид-со-гликолидом
Микроизмельченные частицы ловушку-VEGF суспендировали в растворе 50 мг/мл PLGA в этилацетате при концентрации приблизительно 50 мг/мл VGT; в настоящем описании обозначено ”суспензия VGT-50-PLGA”.
Микроизмельченные частицы ловушку-VEGF суспендировали в растворе 200 мг/мл PLGA в этилацетате при концентрации приблизительно 50 мг/мл VGT; в настоящем описании обозначено ”суспензия VGT-200-PLGA”.
Микроизмельченные частицы ловушку-VEGF суспендировали в растворе 250 мг/мл PLGA в этилацетате при концентрации приблизительно 50 мг/мл VGT; в настоящем описании обозначено ”суспензия VGT-250-PLGA”.
Покрытие поли-ε-капролактоном
Микроизмельченные частицы ловушку-VEGF суспендировали в растворе 50 мг/мл PCL в этилацетате при концентрации приблизительно 50 мг/мл VGT; в настоящем описании обозначено ”суспензия VGT-50-PCL”.
Микроизмельченные частицы ловушку-VEGF суспендировали в растворе 250 мг/мл PCL в этилацетате при концентрации приблизительно 50 мг/мл VGT; в настоящем описании обозначено ”суспензия VGT-250-PCL”.
PCL имеет низкую Тстекл и может не подходить для термической сушки, как описано ниже, но его можно использовать для экстракции растворителем в водной бане, например, с поливиниловым спиртом (ПВС).
ПРИМЕР 3: ДИСПЕРСИЯ ТОНКОДИСПЕРСНЫХ КАПЕЛЬ БЕЛОК-ПОЛИМЕР И УДАЛЕНИЕ РАСТВОРИТЕЛЯ
Каждую суспензию VGT полимер, которую изготавливали в соответствии с примером 2 (см. выше), подвергали распылительной сушке, используя BÜCHI Mini Spray Dryer B-290 (Büchi Labortechnik AG, Флавил, Швейцария). Вкратце, каждую суспензию распыляли с получением микрокапель, которые затем подвергали распылительной сушке для удаления растворителя и формирования микрочастиц белка, покрытого полимером. Суспензию закачивали со скоростью 12,5 мл/мин в устройство для распылительной сушки со скоростью потока всасываемого воздуха и распыляющего газа приблизительно 530 л/час и 35 м3/час соответственно. Температуру на входе устанавливали равной 90°C и температуру на выходе устанавливали приблизительно 54°C.
ПРИМЕР 4: ХАРАКТЕРИЗАЦИЯ МИКРОЧАСТИЦ БЕЛОК-ПОЛИМЕР
Подвергнутые распылительной сушке частицы белка, покрытого полимером, полученные согласно представленному в качестве примера способу, генерируют множество микрочастиц, имеющих диапазон эквивалентных круговых диаметров приблизительно от 2,5 мкм до 65 мкм (фиг. 2). Разброс по размеру во многом отражает толщину полимерного верхнего слоя, хотя диаметр ядра из белка в некоторой степени может внести вклад в разброс по размеру.
Диаметр микрочастиц коррелирует с исходной концентрацией раствора полимера (таблица 2, фиг. 2). Микрочастицы, которые изготавливали с применением 50 мг/мл полимера, имели средний размер приблизительно 17 мкм ± 2,8 мкм. Микрочастицы, которые изготавливали с применением 250 мг/мл полимера, имели средний размер приблизительно 29 мкм.
ПРИМЕР 5: СТАБИЛЬНОСТЬ БЕЛКА ПОСЛЕ РАСПЫЛИТЕЛЬНОЙ СУШКИ
Стабильность белка ловушку-VEGF оценивали, используя количественную эксклюзионную хроматографию (SE-UPLC), которая позволяет количественную оценку более мелких продуктов разложения и более крупных продуктов агрегации относительно неповрежденного мономера. Результаты приводятся в таблице 3. По существу, белок оставался стабильным на всем протяжении процессов распылительной сушки и нанесения покрытия распылением.
Также определяли среднее отношение белка к полимеру по массе для полученных микрочастиц. Совокупность микрочастиц, полученных с варьированием полимеров и концентрации полимера, выделяли и подвергали количественной обращенно-фазовой высокоэффективной хроматографии (ОФ ВЭЖХ). Результаты представлены в таблице 3. Данные можно интерпретировать для подтверждения теории, что более высокая исходная концентрация полимера дает более толстый верхний слой на микрочастице.
|
|
ПРИМЕР 6: ВЫСВОБОЖДЕНИЕ БЕЛКА ИЗ МИКРОЧАСТИЦ
Высвобождение белка из микрочастиц определяли, суспендируя различные партии микрочастиц в буферном растворе (10 мМ фосфата, 0,03% полисорбата 20, pH 7,0) и измеряя количество и качество белка, высвобожденного в раствор с течением времени при инкубировании при 37°C. При 1-2 недельных интервалах микрочастицы осаждали мягким центрифугированием и 80% надосадочной жидкости, содержащей высвобожденный белок, собирали для последующего анализа. Заменяли эквивалентное количество свежего буферного раствора и микрочастицы повторно суспендировали мягким встряхиванием и возвращали в инкубационную камеру с температурой 37°C. Количество и качество белка в надосадочной жидкости оценивали эксклюзионной хроматографией.
В общем, микрочастицы, полученные с более высокой концентрацией полимера (например, 250 мг/мл), имели тенденцию показать относительно линейный профиль высвобождения белка, тогда как микрочастицы, полученные с более низкой концентрацией полимера (например, 50 мг/мл), имели тенденцию показать начальный выброс, за которым следует начало отложенного "взрывного" высвобождения. Данные, показывающие пролонгированное выделение белка, которое оставалось стабильным, вплоть до 60 дней, изображены на фигуре 3 (данные по высвобождению). В таблице 4 суммируются данные линейной скорости высвобождения.
|
ПРИМЕР 7: РАЗМЕРОМ ЧАСТИЦЫ МОЖНО МАНИПУЛИРОВАТЬ ПОСРЕДСТВОМ КОНЦЕНТРАЦИИ ПОЛИМЕРА И ПОТОКА РАСПЫЛЯЮЩЕГО ГАЗА
Распределение частиц по размерам контролировали концентрацией полимера и потоком распыляющего газа для измельчения. Увеличенная концентрация полимера сдвигала распределение по направлению к более крупным частицам (200 мг/мл PLGA при 45 мм потока распыляющего газа относительно 100 мг/мл PLGA при 45 мм потока распыляющего газа; см. таблицу 5). Аналогичным образом, более низкий поток распыляющего газа для измельчения в результате приводил к более крупным каплям и, таким образом, к более крупным частицам (100 мг/мл PLGA при 25 мм потока распыляющего газа относительно 100 мг/мл PLGA при 45 мм потока распыляющего газа; см. таблицу 5).
|
ПРИМЕР 8: РАЗМЕР ЧАСТИЦ И ВЫСВОБОЖДЕНИЕ БЕЛКА ЧЕРЕЗ РАЗЛИЧНЫЕ ПОЛИМЕРЫ
На ловушку-VEGF или lgG распылением наносили покрытие низкомолекулярной (202S) полимолочной кислоты (PLA-LMW), высокомолекулярной (203S) полимолочной кислоты (PLA-HMW), полиангидрида поли[1,6-бис(п-карбоксифенокси)гексана] (pCPH), сополимера гидроксимасляной кислоты с гидроксивалериановой кислотой (PHB-PVA), блок-сополимера полиэтиленгликоль-полимолочная кислота (PEG-PLA) и поли-D,L-лактид-со-гликолида (PLGA). 25 мг/мл подвергнутого распылительной суше белка объединяли с 50-100 мг/мл полимера. Анализ высвобождения in vitro проводили в 10 мМ фосфатном буферном растворе, pH 7,2 при 37°C. Результаты показаны в таблице 6.
|
ПРИМЕР 9: СТАБИЛЬНОСТЬ БЕЛКА В РАЗЛИЧНЫХ ПОЛИМЕРАХ
Ловушку-VEGF и lgG экстрагировали из их соответствующих полимерных покрытий и измеряли их чистоту с помощью эксклюзионной-сверхэффективной жидкостной хроматографии. Результаты суммируются в таблице 7. Для протестированных полимеров белки, как правило, были совместимы со способом нанесения покрытия распылением. Белок оставался стабильным в течение, по меньшей мере, 14 дней для тех полимеров, которые продолжали высвобождать белок.
|