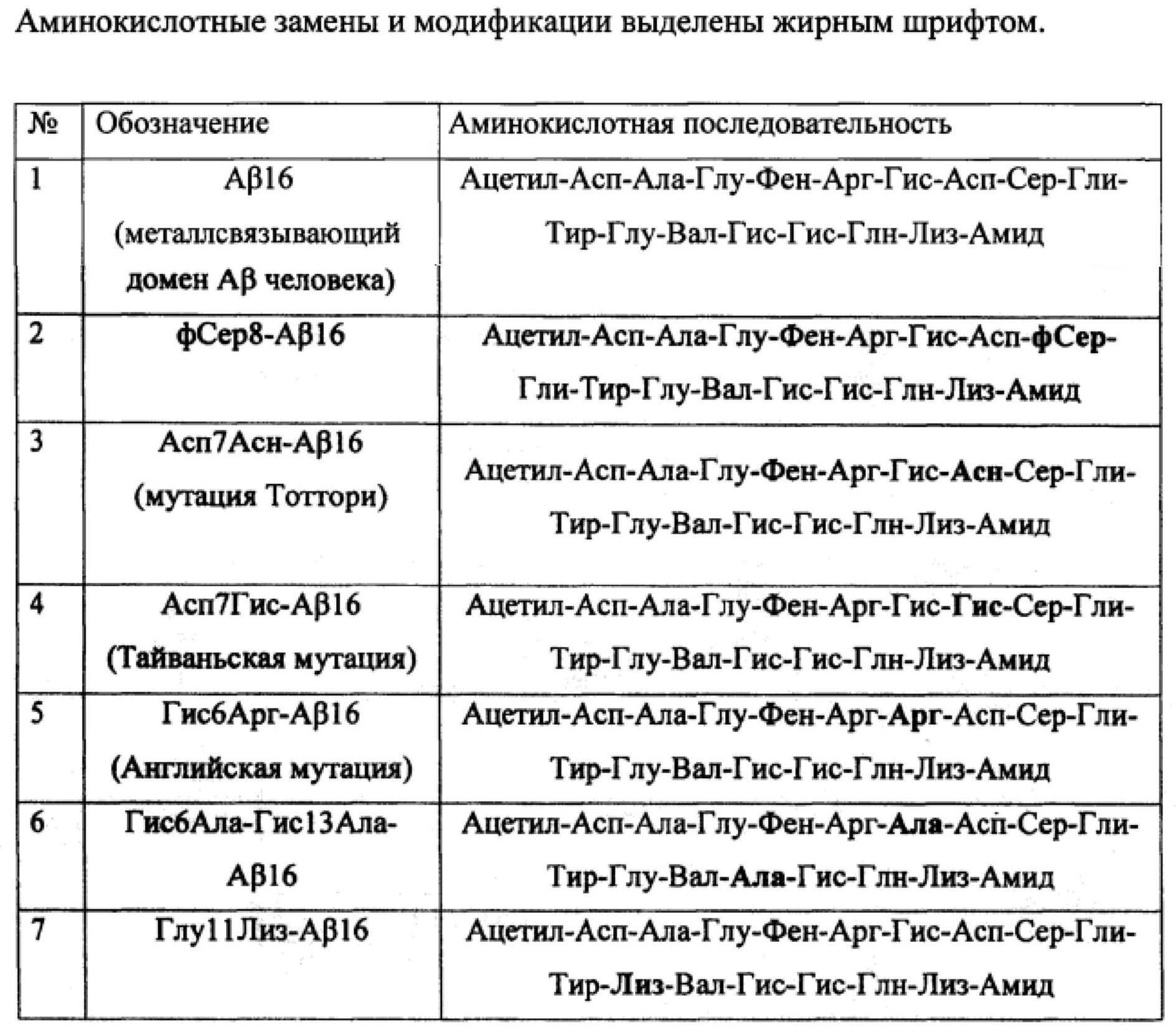
Результат интеллектуальной деятельности: Электрохимический способ анализа аминокислотных замен и модификаций в пептиде амилоид-бета
Вид РИД
Изобретение
Изобретение относится к области аналитической химии, электрохимии и биохимии и касается методики анализа аминокислотных замен и модификаций в пептиде амилоид-бета (Aβ) электрохимическим методом с помощью печатного графитового электрода.
Изобретение может быть использовано в медицине и биохимии при изучении болезни Альцгеймера (БА) и других заболеваний, где определяющую роль играют мутации белков/пептидов и их комплексы с ионами металлов. Определение аминокислотных замен в белках/пептидах представляет значительный интерес с точки зрения изучения развития заболеваний. Свойства и функции белка/пептида определяются его аминокислотной последовательностью. Аминокислотные замены и модификации в белках/пептидах приводят к различным патологическим состояниям. Так, всего одна генетически обусловленная замена гидрофильной аминокислоты Глу, находящейся в 6-м положении, на гидрофобный Вал в двух β-цепях гемоглобина приводит к развитию серповидно-клеточной анемии, при которой существенно меняются физико-химические свойства гемоглобина и, как следствие, нарушается его кислород-транспортная функция. Замена Глу на Вал приводит к образованию «липкого» гидрофобного контакта, в результате чего молекулы гемоглобина слипаются, образуя длинные нитевидные агрегаты [1]. Аминокислотные замены в белке α-синуклеине, обнаруженном в нервной ткани и в некоторых видах опухолей, могут быть связаны с развитием такого заболевания, как болезнь Паркинсона [2].
Aβ - пептид длиной 39-42 аминокислотных остатка согласно гипотезе амилоидного каскада играет ключевую роль в БА. Переход Aβ из мономерного состояния в нерастворимые полимерные фибриллярные агрегаты, образующие амилоидные бляшки, является одним из ключевых процессов возникновения БА [3]. Детали механизма данного процесса до конца не выяснены. Известно, что агрегация Aβ может быть инициирована ионами Zn(II), которые взаимодействуют с Aβ через металлсвязывающий домен, включающий N-концевые остатки 1-16 [4]. Ионы Zn(II) являются важным модулятором нейротрансмиссии, его концентрация в синоптической щели во время возбуждения нейронов может достигать 3×10-4 М [4]. 16-ти членный пептид Aβ (Aβ16), представляющий металлсвязывающий домен полноразмерного Aβ, и его С-усеченная форма найдены в спинномозговой жидкости человека [5]. Aβ16 обычно используют для изучения взаимодействия Aβ с ионами Zn(II) и ионами других металлов. Мутации и модификации аминокислотных остатков Aβ, особенно в металлсвязывающем домене, влияют на его способность образовывать комплексы с ионами металлов и агрегировать.
На практике исследование аминокислотных замен проводят электрофоретическими методами, секвенированием белковой молекулы или анализом молекулы ДНК, кодирующей исследуемый белок; протеомными методами, сопряженными с масс-спектрометрией, и предсказанием аминокислотных замен методами in silico. Недостатками электрофоретических методов при исследовании аминокислотных замен в молекуле белка является необходимость в больших количествах белка, кроме того, с помощью этого метода возможно выявление только тех аминокислотных замен, которые вносят существенный вклад в изменение заряда белковой молекулы или молекулярной массы. Предсказание аминокислотных замен в белках и пептидах методами in silico требуют экспериментальной проверки. Несмотря на широкое использование протеомных методов анализа и анализа ДНК, эти методы достаточно трудоемки, многостадийны, требуют большого количества реагентов и дорогостоящего оборудования.
Электрохимические методы анализа, отличающиеся точностью, чувствительностью, низкой себестоимостью оборудования и расходных материалов, экспрессностью и портативностью, представляются наиболее перспективными для создания аналитической системы анализа аминокислотных замен в белках/пептидах. В настоящее время электрохимического способа определения аминокислотных замен и модификаций Aβ не существует.
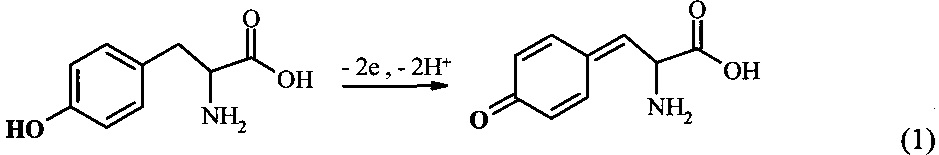
Аминокислотные замены и модификации в белках/пептидах могут быть исследованы, используя электрохимическую активность некоторых аминокислотных остатков [6]. В Aβ человека есть пять потенциально электроактивных аминокислотных остатков: три Гис в положении 6, 13 и 14, один Мет в положении 35 и один Тир в положении 10. Остатки Гис представляются наиболее интересными для изучения взаимодействия Aβ с ионами металлов, так как напрямую вовлечены в образование комплексов [7]. Однако окисление остатков Гис и Мет требует высоких положительных потенциалов, превышающих 1 В (отн. Ag/AgCl), к тому же до сих пор не показано их окисление в пептиде Aβ. С другой стороны, единственный остаток Тир-10 Aβ легко окисляется в нейтральных pH при потенциалах 0,6-0,7 В (отн. Ag/AgCl). Реакция электрохимического окисления Тир может быть выражена следующей схемой (1) [6]:
Ранее было показано, что электрохимический анализ позволяет различить дикий тип и мутантные формы с одиночными аминокислотными заменами ацетилхолинэстеразы [8]. Авторы работы [8] обращают внимание на то, что замены, приводящие к изменениям конформации белка, давали большие сдвиги электрохимического сигнала, чем другие замены. Наблюдаемые электрохимические эффекты в отношении ацетилхолинэстеразы также подтверждают предположение, что только аминокислоты, локализованные на поверхности белка, проявляют свои электроактивные свойства [9]. Однако в отличие от молекул белков с относительно стабильной третичной структурой пептиды, в том числе Aβ и его изоформы, достаточно подвижны в нейтральных pH, принимая конформацию случайного клубка.
Задачей настоящего изобретения является разработка способа электрохимического анализа аминокислотных замен и модификаций пептида Aβ без и в присутствие ионов Zn(II). Метод основан на измерении сигнала окисления единственного остатка Тир-10 Аβ.
В соответствии с изобретением описывается способ анализа аминокислотных замен и модификаций Aβ (без или в комплексе с ионами Zn(II)), заключающийся в том, что на электрод наносят аликвоту (60-100 мкл) 50 мкМ раствора синтетического пептида изоформы Aβ без или с 100 мкМ Zn(II) (после инкубации в течение 10 минут) в буферном растворе и осуществляют электрохимическое определение Aβ на электроде путем регистрации квадратно-волновой вольтамперограммы окисления пептида; измеряют высоту и потенциал максимума полученного пика окисления в области 0,6-0,7 В (отн. Ag/AgCl) при нейтральном pH и по изменению интенсивности сигнала относительно контроля («нормального» Aβ) констатируют аминокислотную замену или модификацию.
ПРИМЕР 1. Методика регистрации электрохимического сигнала образца Aβ16
Исходный 1×10-4 М водный раствор пептида Aβ16 или его изоформы (Таблица 1) перед измерениями развести в два раза соответствующим HEPES-буферным раствором, чтобы получить 200 мкл - образцы с концентрацией пептида 5×10-5 М в 1×10-2 HEPES и 5×10-2 M NaCl (pH 6,8). Для образования комплекса между пептидом и ионами Zn(II) 200 мкл образец смешать с 2 мкл соответствующего водного раствора ионов Zn(II). Приготовить таким же способом контрольный образец Aβ16 или его изоформы, не содержащей ионы Zn(II). Каждый образец быстро перемешать и оставить при комнатной температуре на 10 минут, после чего из каждого образца отобрать по три аликвоты объемом 60 мкл и измерить сигнал окисления пептида методом квадратно-волновой вольтамперометрии при следующих параметрах:
Время инкубации: 10 с;
Частота: 25 Гц;
Начальный потенциал: 0 В;
Конечный потенциал: 1 В;
Шаг потенциала: 0,005 В;
Амплитуда: 0,040 В.
Для измерения сигнала окисления пептида закрепить печатный графитовый электрод в разъеме потенциостата в «горизонтальном режиме». С помощью автоматической пипетки ручного дозирования на поверхность печатного графитового электрода нанести 60 мкл образца Aβ (или его изоформы) в буфере так, чтобы капля полностью закрыла рабочий, вспомогательный и электрод сравнения. Запустить процедуру измерения сигнала. Полученную вольтамперограмму сохранить. Для каждого образца Aβ или его изоформы провести процедуру измерения сигнала в трех технических повторах на трех печатных графитовых электродах. Один печатный графитовый электрод использовать один раз для регистрации одной вольтамперограммы. Для каждого образца определить потенциал максимума и высоту полученного пика окисления Aβ.
Краткое описание чертежей
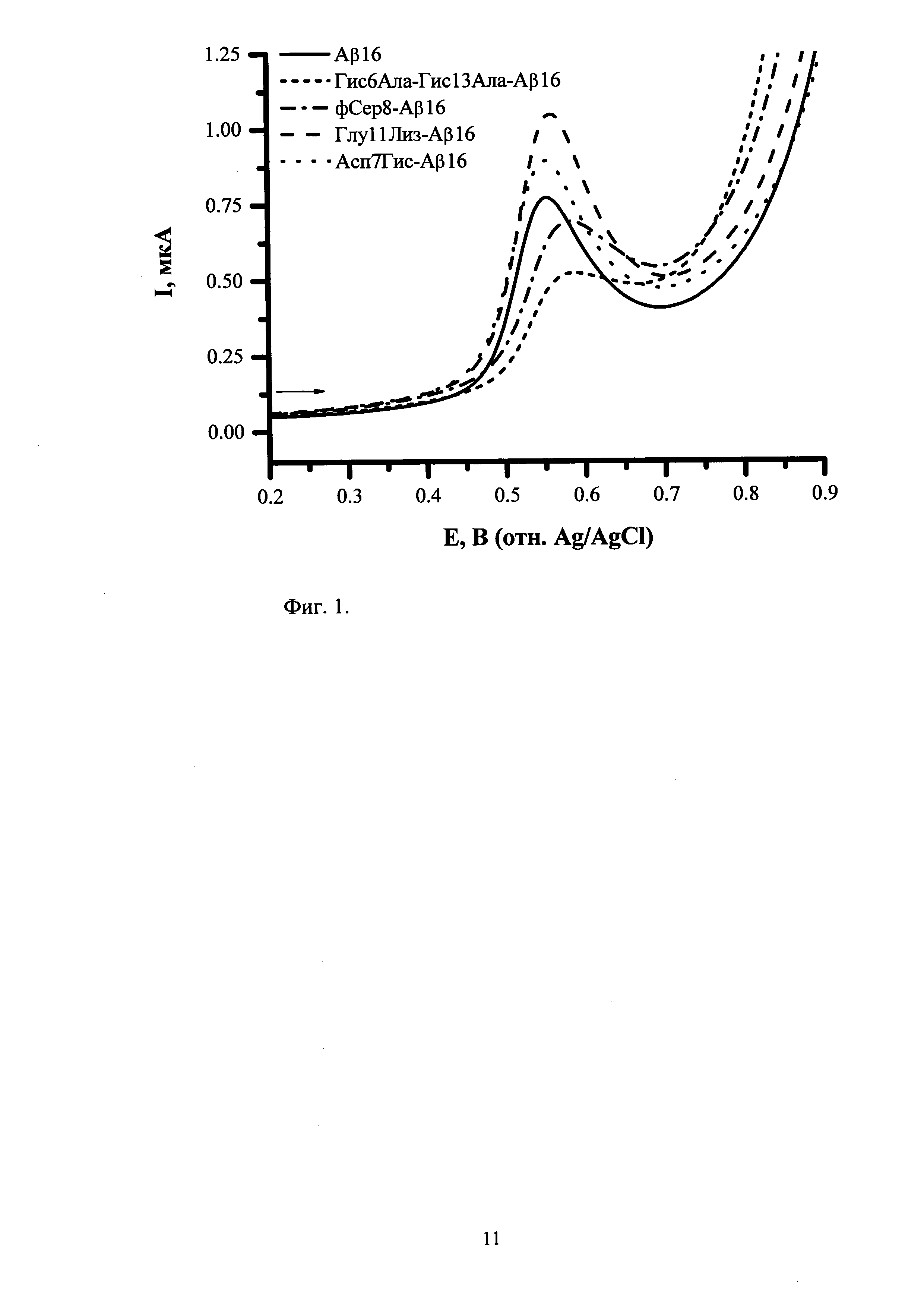
На приведенной ниже фигуре 1 представлены типичные квадратно-волновые вольтамперограммы окисления Аβ16 и его изоформ с различными аминокислотными заменами и модификациями, полученные согласно разработанной методике анализа. Концентрация пептидов составляет 5×10-5 М, HEPES-буфер (рН 6,8).
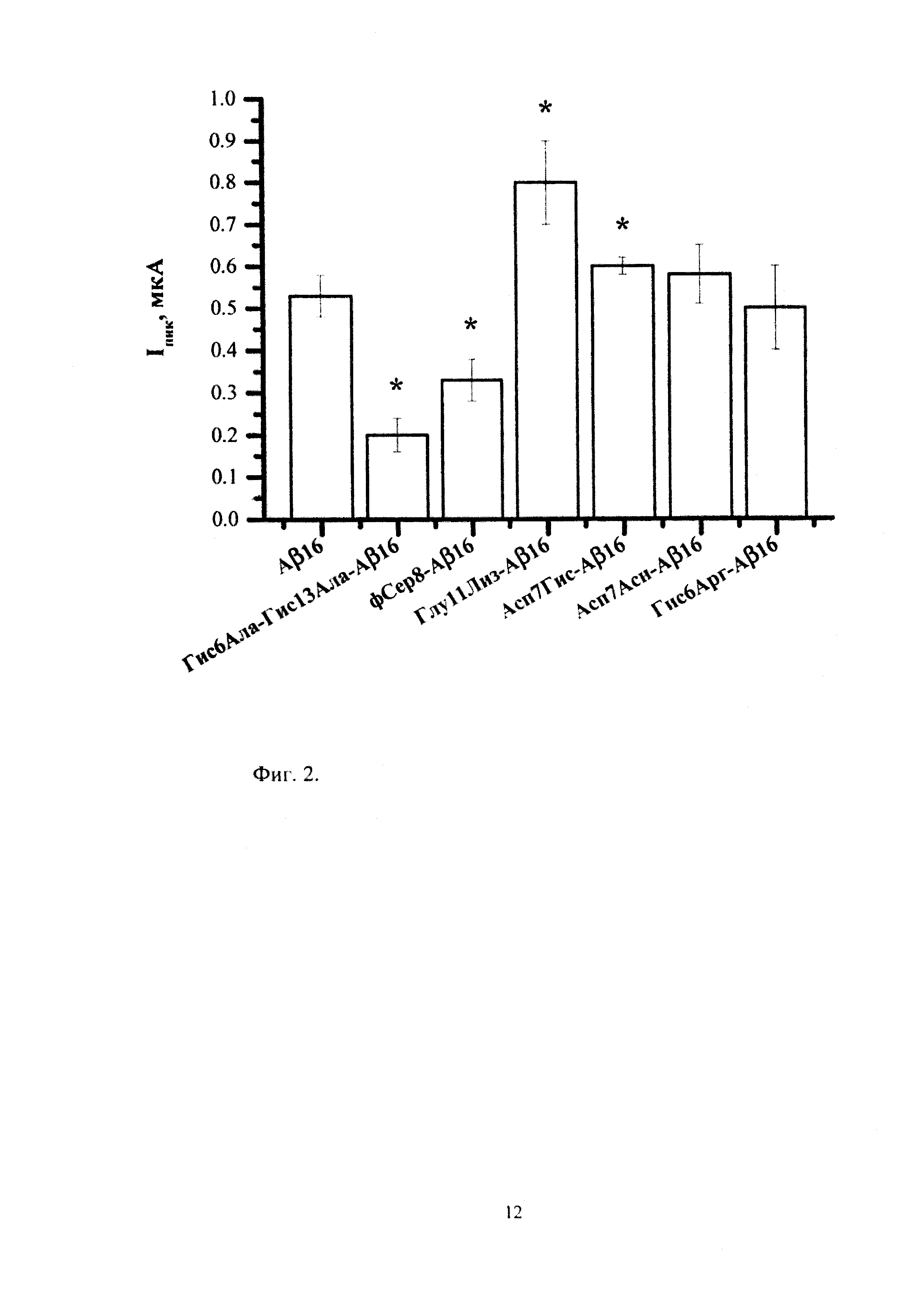
На фигуре 2 изображены полученные согласно разработанной методике значения тока пиков окисления Аβ16 и его изоформ с аминокислотными заменами и модификациями. Квадратно-волновая вольтамперометрия. Концентрация пептидов - 5×10-5 М. HEPES-буфер (рН 6,8). Столбцы показывают средние значения трех измерений с соответствующими доверительными интервалами (Р=0,95). Изоформы, значимо отличающиеся токами окисления от Аβ16, отмечены звездочками.
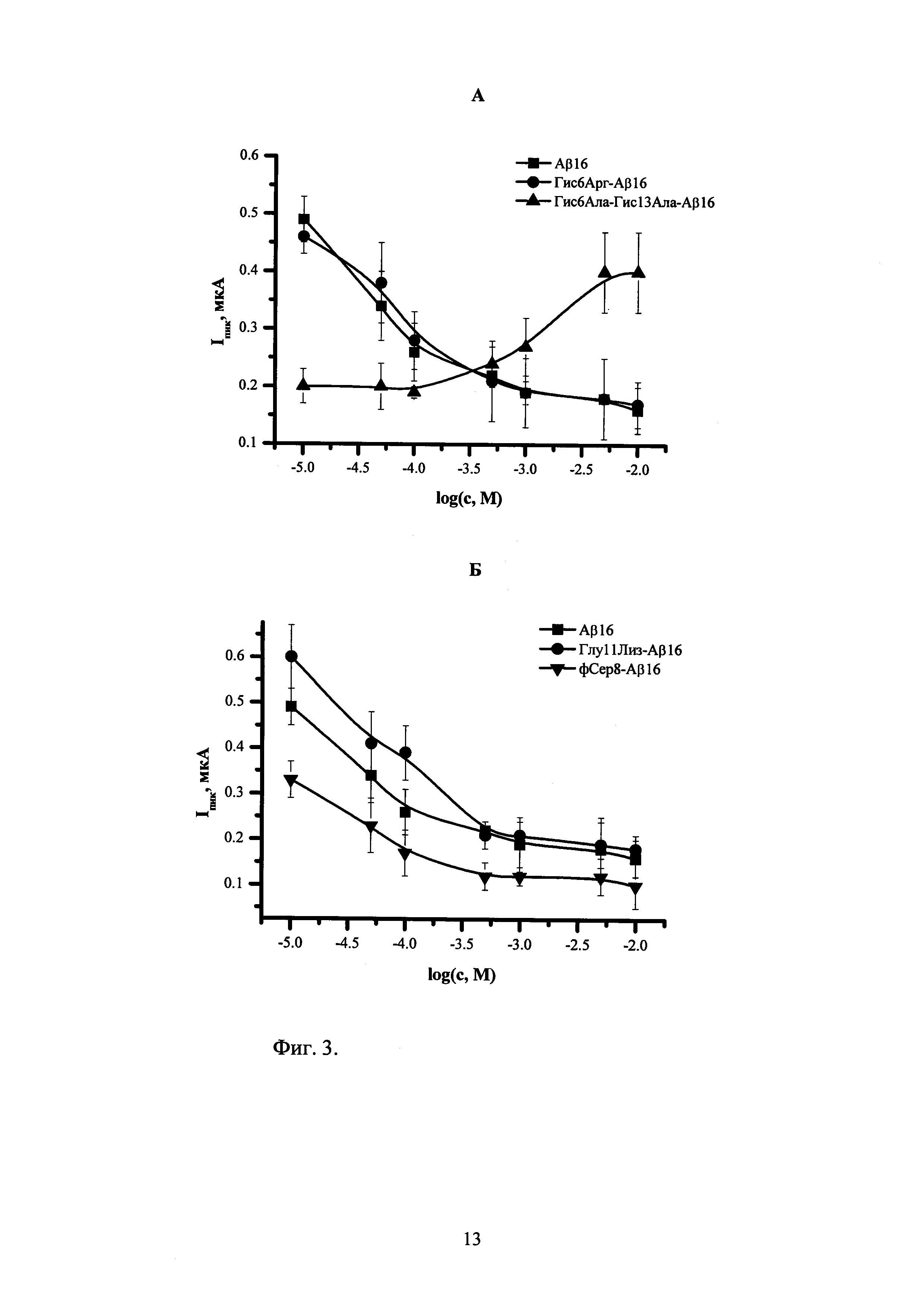
На фигуре 3 представлена зависимость изменения высоты пика окисления Аβ16 и нескольких его изоформ от логарифма концентрации ионов Zn(II). А - Гис6Арг-Аβ16, Гис6Ала-Гис13Ала-Аβ16. Б - Глу11Лиз-Аβ16, фСер8-Аβ16. Концентрация пептидов составляет 5×10-5 М. HEPES-буфер (рН 6,8). Точки показывают средние значения трех измерений с соответствующими доверительными интервалами (Р=0,95).
Источники информации
1. Д. Нельсон, М. Кокс. Основы биохимии Ленинджера в 3х томах, М.: БИНОМ. Лаборатория знаний, 2011, 247.
2. A. Puschmann, R. Bhidayasiri, W.J. Weiner, Synucleinopathies from bench to bedside, Parkinsonism Relat Disord, 2012, 18 (Suppl. 1), S24-S27.
3. J. Hardy, N. Bogdanovic, B. Winblad, E. Portelius, N. Andreasen, A. Cedazo-Minguez, H. Zetterberg, Pathways to Alzheimer's disease, J Intern Med 275 (2014) 296.
4. P. Faller, C. Hureau, O. Berthoumieu, Role of metal ions in the self-assembly of the Alzheimer's amyloid-beta peptide, Inorg Chem 52 (2013) 12193.
5. E. Portelius, N. Mattsson, U. Andreasson, K. Blennow, H. Zetterberg, Novel abeta isoforms in Alzheimer's disease - their role in diagnosis and treatment, Curr Pharm Des 17 (2011) 2594.
6. E.V. Suprun, V.V. Shumyantseva, A.I. Archakov, Protein Electrochemistry: Application in Medicine. A Review, Electrochim. Acta 140 (2014) 72.
7. C.A. Damante, K. Osz, Z. Nagy, G. Pappalardo, G. Grasso, G. Impellizzeri, E. Rizzarelli, I. Sovago, Metal loading capacity of Abeta N-terminus: a combined potentiometric and spectroscopic study of zinc(II) complexes with Abeta(l-16), its short or mutated peptide fragments and its polyethylene glycol-ylated analogue, Inorg Chem 48 (2009) 10405.
8. M. Somji, V. Dounin, S.B. Muench, H. Schulze, Т.T. Bachmann, K. Kerman, Electroanalysis of amino acid substitutions in bioengineered acetylcholinesterase, Bioelectrochemistry 88 (2012) 110.
9. E.V. Suprun, M.S. Zharkova, G.E. Morozevich, A.V. Veselovsky, V.V. Shumyantseva, A.I. Archakov, Analysis of Redox Activity of Proteins on the Carbon Screen Printed Electrodes, Electroanalysis 25 (2013) 2109.
Способ анализа аминокислотных замен и модификаций Aβ (без или в комплексе с ионами Zn(II)), заключающийся в том, что на печатный графитовый электрод наносят аликвоту (60-100 мкл) 50 мкМ раствора Aβ (контроль) или его изоформы в буферном растворе без или с 100 мкМ Zn(II) (после инкубации в течение 10 минут) и осуществляют электрохимическое определение Aβ на электроде путем регистрации квадратно-волновой вольтамперограммы окисления пептида; измеряют высоту и потенциал максимума полученного пика окисления в области 0,6-0,7 В (отн. Ag/AgCl) при нейтральном рН и по изменению интенсивности сигнала относительно контроля констатируют аминокислотную замену или модификацию.