Результат интеллектуальной деятельности: ПРОТЕОТИПИЧЕСКИЙ ПЕПТИД Q9Y4W6-02 И СПОСОБ МАСС-СПЕКТРОМЕТРИЧЕСКОГО АНАЛИЗА СОДЕРЖАНИЯ AFG3-ПОДОБНОГО БЕЛКА ЧЕЛОВЕКА НА ЕГО ОСНОВЕ
Вид РИД
Изобретение
Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к области биохимии и, более конкретно, протеомики. В частности, изобретение относится к новому протеотипическому пептиду AFG3-подобного белка-2 человека и способу определения концентрации последнего по содержанию этого протеотипического пептида в образцах, в том числе в сложных биологических смесях.
Описание предшествующего уровня техники настоящего изобретения
Основной задачей протеомики - сравнительно молодого направления современных биохимических исследований - является проведение инвентаризации белков, которые экспрессируются в клетке, что подразумевает их максимально точное качественное и количественное определение.
В настоящее время реализуется крупный международный научный проект «Протеом человека», направленный на идентификацию всех белков человека. Одна из целей проекта - инвентаризовать белки, которые кодируются генами 18-й хромосомы.
В результате выполнения проекта планируется создать дешевые и доступные методы медицинской диагностики, позволяющие определять самые ранние стадии развития заболеваний, индивидуальные методы лечения заболеваний, которые в настоящее время считаются неизлечимыми.
На сегодня нет рутинной технологии для обнаружения белков, представленных в ультранизких концентрациях. Единственная альтернатива - повышение чувствительности уже используемых методов, основанных, в частности, на двумерном электрофорезе, масс-спектрометрии. иммуноферментном анализе, атомно-силовой микроскопии.
Наиболее перспективными являются методы, основанные на масс-спектрометрическом определении, которые позволяют селективно детектировать протеотипические пептиды (пептиды, которые при масс-спектрометрическом анализе характеризуют присутствие конкретного белка) в биологических образцах. Протеотипическими считаются протеолитические пептиды, соответствующие белковому продукту одного гена и не встречающиеся в продуктах других генов в составе генома, а также способные ионизироваться и детектироваться при масс-спектрометрическом анализе.
Основным методом, применяемым для исследования протеома, является масс-спектрометрический анализ белковых молекул. Идентификация белков проводится алгоритмически, путем сопоставления масс и зарядов продуктов ферментативного гидролиза белков с теоретическими значениями, вычисленными на основе расшифрованного генома. При масс-спектрометрическом анализе белок считается идентифицированным, если установлено 1-2 специфичных пептидных фрагмента первичной структуры. По пептидным фрагментам последовательности удается различить белковые продукты разных генов.
Специфичные для аллельных форм пептидные фрагменты (протеотипические пептиды с высокой вероятностью приходятся на неустановленную в ходе масс-спектрометрического эксперимента часть последовательности белка. Если же протеотипический пептид находится в идентифицируемой части последовательности, то наличие аллельного варианта трансляции гена вносит неоднозначность в интерпретацию масс-спектрометрических данных.
Принципиальная проблема в области протеотипирования заключается в недостаточном покрытии пептидными фрагментами последовательностей белков, идентифицируемых масс-спектрометрическими методами.
В настоящее время, MRM находит применение уже в ранней диагностике раковых заболеваний [Ang CS, Phung J, Nice EC, The discovery and validation of colorectal cancer biomarkers, Biomed Chromatogr. 2011 Jan; 25(1-2):82-99; Fortin T, Salvador A, Charrier JP, Lenz C, Locoux X, Moria A, Choquet-Kastylevsky G, Lemoine J, Clinical quantitation of prostate-specific antigen specific biomarker in the low nanogram/milliliter range by conventional bore liquid chromatorgraphy tandem mass spectrometry (multiple reaction monitoring) coupling and correlation with ELISA tests, Mol Cel Proteomics, 2009, 8(5), 1006-1015] и количественном определении метаболитов [Wei R, Li G, Seymour AB, High throughput and multiplexed LC/MS/MRM method for targeted metabolomics, Anal. Chem, 2010, 82(13), 5527-5533] в плазме крови человека.
Белок AFG3L2, называемый AFG3-подобным белком-2 или параплегин-подобным белком, является АТФ-зависимой протеазой, функция которой заключается в разрушении белков в цитозоле. Кроме того. AFG3L2 участвует в процессах клеточной смерти, миелинизации, развитии нервов, в установочных рефлексах, связывании АТФ, а также в других процессах.
Дефекты в AFG3L2 вызывают спиномозговую атаксию типа 28, клинически и генетически разнородную группу спиномозговых нарушений. У пациентов проявляется прогрессирующее нарушение координации при ходьбе и часто плохую координацию рук, речи и движения глаз из-за дегенерации мозжечка с поражением ствола мозга и спинного мозга. Кроме того дефекты в AFG3L2 являются причиной спастической атаксии аутосомно-рецессивного типа 5, нейродегенеративного нарушения, характеризующегося ранним наступлением спастичности, периферической нейропатии, птоза, глазодвигательной апраксии, дистонии, мозжечковой атрофии и прогрессирующей миоклональной эпилепсии.
В предшествующем уровне техники авторами выявлен ряд патентных документов, имеющих отношение в целом в методу, но ни в одном из них AFG3-подобный белок-2 в качестве объекта идентификации не указан, не говоря уже о его протеотипических пептидах.
Так, в патенте ЕР 2044443 раскрыт способ идентификации белков путем расщепления их на пептиды, ионизации полученных пептидов и проведения ионизирующей спектроскопии (MALDI). В патенте ЕР 1734367 раскрыт способ идентификации ферментов с помощью протеотипических пептидов. Способ предусматривает проведение масс-спектрометрии. В патенте ЕР 1891446 раскрыт способ идентификации ферментов с помощью протеотипических пептидов. Способ предусматривает проведение масс-спектрометрии. В патентной заявке CN 102411666 раскрыты способ и система для идентификации белков. Способ предусматривает расщепление белка с получением пептидов и сортировку их с использованием масс-спектрометрии. В патенте ЕР 1739424 раскрыт способ идентификации белков с использованием масс-спектрометрии их фрагментов. В патенте ЕР 1795896 раскрыт способ идентификации белков с использованием масс-спектрометрии и двумерного электрофореза. В патенте ЕР 1520243 раскрыт способ идентификации пептидов и белков с использованием данных тандемной спектрометрии, а также сравнения пептидов с информацией созданной базы данных. В патенте ЕР 1775581 раскрыты способ и система идентификации белков с использованием масс-спектрометрии их фрагментов. В патенте ЕР 1265072 раскрыты способ и система идентификации протеомных белков с использованием масс-спектрометрии полученных из них пептидов. В патенте ЕР 1469313 раскрыт способ выполнения масс-спектрометрии биологических образцов, в т.ч. пептидов. В патенте IL 200933 раскрыт способ масс-спектрометрии протеолитических сигнатурных пептидов для идентификации белков. В патентной заявке US 2012190560 раскрыт способ масс-спектрометрии изотопно меченных белков/пептидов. В патентной заявке US 2012156707 раскрыт способ идентификации протеомных белков. Способ предусматривает расщепление белка с получением пептидов и сортировку их с использованием масс-спектрометрии. В патентной заявке US 2009053819 раскрыты способ и система для идентификации и количественного определения белков и пептидов с помощью масс-спектрометрии. В патенте US 4782137 раскрыт идентификационный пептид, применяемый в очистке выбранного белка. В патентной заявке US 2012167238 раскрыты способ и композиция для быстрой идентификации полипептидов с использованием масс-спектрометрии. В патенте US7756646 раскрыт способ идентификации пептидов в биологическом образце с использованием масс-спектрометрии. В патентной заявке US 20120178111 раскрыт способ идентификации мембраносвязанных белков, используемых в качестве биомаркеров злокачественных опухолей с использованием MALDI/TOF масс-спектрометрии. В патенте US 2011178273 раскрыт способ и система идентификации и количественного определения белков и пептидов с помощью масс-спектрометрии. В патентной заявке US 2010173786 раскрыт способ масс-спектрометрии изотопно меченных белков/пептидов. В патентной заявке US 2010288918 раскрыты система и способ тандемной масс-спектрометрии для идентификации пептидов. В патентной заявке US 2004044481 раскрыт способ идентификации пептидов с применением базы данных пептидов и различных методов масс-спектрометрии. В международной патентной публикации WO 2004081535 раскрыт способ определения профиля протеомной структуры организма с помощью идентификации пептидов методами масс-спектрометрии. В международной патентной публикации WO 2011143386 раскрыт способ проведения протеомного анализа с помощью идентификации пептидов методами масс-спектрометрии. В международной патентной публикации WO 2011143760 раскрыт способ колоночной хроматографии и тандемной масс-спектрометрии для идентификации пептидов. В международной патентной публикации WO 2011119235 раскрыт способ проведения протеомного анализа с помощью идентификации пептидов методами масс-спектрометрии. В международной патентной публикации WO 2004008151 раскрыты библиотека протеомно-реактивных маркерных молекул, а также способ проведения протеомного анализа с помощью идентификации пептидов методами масс-спектрометрии. В международной патентной публикации WO 2011149942 раскрыты способ, система и набор для идентификации пептидов с использованием MALDI/TOF масс-спектрометрии. В международной патентной публикации WO 2005114221 раскрыт способ идентификации гликопептидов с использованием масс-спектрометрии. В международной патентной публикации WO 2008049239 раскрыт способ идентификации эндометриальных маркеров, которыми могут быть протеотипические пептиды. Способ предусматривает проведение масс-спектрометрии. В международной патентной публикации WO 2008104746 раскрыт способ идентификации сигнатурных пептидов из базы данных. В международной патентной публикации WO02055989 раскрыт способ идентификации белков с использованием масс-спектрометрии протеолитических пептидов. В международной патентной публикации WO 2009098656 раскрыт способ диагностики и прогнозирования исхода злокачественных опухолей измерением уровня протеотипических пептидов с использованием ELISA, радиоиммуноанализа, протеомных методов и т.п. В международной патентной публикации WO 2012005838 раскрыт способ масс-спектрометрии для идентификации белков/пептидов. В международной патентной публикации WO 2008005455 раскрыт способ идентификации протеотипических пептидов с использованием различных методов масс-спектрометрии. В международной патентной публикации WO 2011110341 раскрыт способ получения пептидного стандарта с использованием различных методов масс-спектрометрии. В международной патентной публикации WO 2012006406 раскрыт способ проведения хроматографии и масс-спектрометрии для идентификации пептидов. В международной патентной публикации WO 2006134056 раскрыт способ идентификации ферментов с использованием протеотипических пептидов различными методами масс-спектрометрии. В международной патентной публикации WO 2004106915 раскрыта система анализа биомаркеров с использованием пептидной базы данных, методов хроматографии и масс-спектрометрии. В патенте RU 2253116 раскрыт способ получения субстрата для обнаружения аналитов в образце путем обработки образца, по меньшей мере в двух условиях селективности, определяемых комбинацией адсорбента и элюента, с использованием референсных полипептидов. Патент RU 2408011 относится к биоинформационным методам идентификации белков и пептидов по геномным базам данных. Способ заключается в том. что алгоритмы сопоставления масс-спектров с геномной базой данных применяются повторно после дополнения базы данных новыми записями, либо после удаления из базы данных записей, либо после замены базы данных базой данных, составленной из новых записей. Патент RU 2381505 относится к области медицины, в частности к способу диагностики сифилиса у пациента методом прямого протеомного профилирования сыворотки крови на основе выявления в опытном образце сыворотки биомаркеров сифилиса. Способ диагностики сифилиса предусматривает стадию фракционирования белков сыворотки с использованием магнитных частиц, масс-спектрометрический анализ образца элюата и анализ полученного масс-спектра на предмет наличия или отсутствия набора пиков, соответствующих биомаркерам сифилиса. Патент RU 2441240 относится к области медицины, а именно к способу диагностики аксонально-демиелинизирующих полиневропатий методом прямого протеомного профилирования сыворотки крови больного на основе выявления в образце сыворотки биомаркеров данных заболеваний. Сущность способа заключается в том, что стадию фракционирования белков сыворотки крови проводят с использованием магнитных микрочастиц. Далее осуществляют масс-спектрометрический анализ образца элюата. Проводят сравнительный анализ полученных масс-спектров на предмет наличия или отсутствия набора пиков, соответствующих биомаркерам аксонально-демиелинизирующих полиневропатий. В патенте ЕА 001033 раскрыт способ определения состояния организма, в соответствии с которым отбирают пробу исследуемого организма и определяют качественный и количественный состав низкомолекулярных пептидов в этой пробе, а о состоянии организма судят по результатам сравнения этого состава с эталоном. В патентной заявке ЕА 200600346 раскрыт набор сыворотки (n=248) женщин, обследуемых и оцениваемых на наличие рака яичников, для расширения применения анализа протеомного профиля сыворотки до применения высоко разрешающей масс-спектрометрической инструментальной платформы, для исследования существования множественных особых высокоточных диагностических наборов свойств, присутствующих в том же масс-спектре. В патентной заявке JP 2011090012 раскрыт способ выявления множества типов фосфорилированных белков в образце с использованием базы данных, содержащей данные о типах белков в образце. При этом для измерения массы пептидов используется метод масс-спектрометрии. В патентной заявке KR 100383529 раскрыты способ и система анализа биомаркера злокачественных опухолей на ранней стадии с использованием двумерного изображения протеома. В патентной заявке CN 101685080 раскрыт способ анализа протеома в образце с целью диагностики злокачественных опухолей.
Указанные документы проанализированы на предмет идентичности или сходства с раскрытым в настоящем документе изобретением. Наиболее близкие к объекту поиска решения, видимо, изложены в патенте ЕР 2044443, где раскрыт способ идентификации белков путем расщепления их на пептиды, ионизации полученных пептидов и проведения ионизирующей спектроскопии (MALDI); и в патенте ЕР 1734367, где раскрыт способ идентификации ферментов с помощью протеотипических пептидов, предусматривающий проведение масс-спектрометрии. Однако, как уже было сказано, это лишь относительное сходство, поскольку ни один документ не раскрывает способа масс-спектрометрического анализа содержания AFG3-подобного белка-2 человека на основании определения содержания протеотипического пептида.
Для диагностики и лечения заболеваний, ассоциированных с AFG3-подобным белком-2, необходим достоверный и надежный способ определения его концентрации. Раскрытое в настоящем документе изобретение позволяет решить существующую в настоящей области техники потребность.
Краткое описание графических материалов
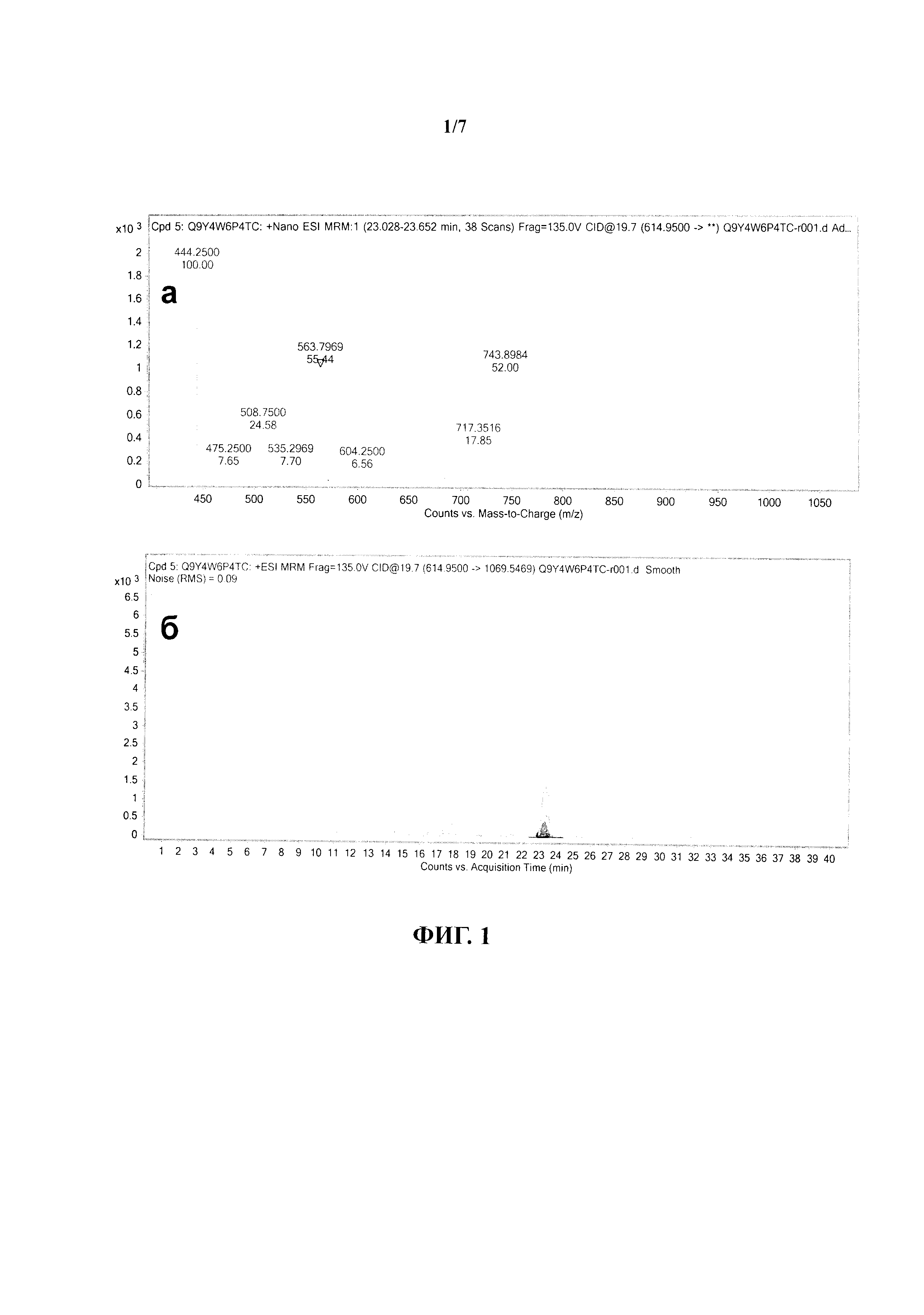
На фиг.1 представлены МРМ-спектр (а) и хроматограмма (б) компонентов пептида Q9Y4W6P2DC.
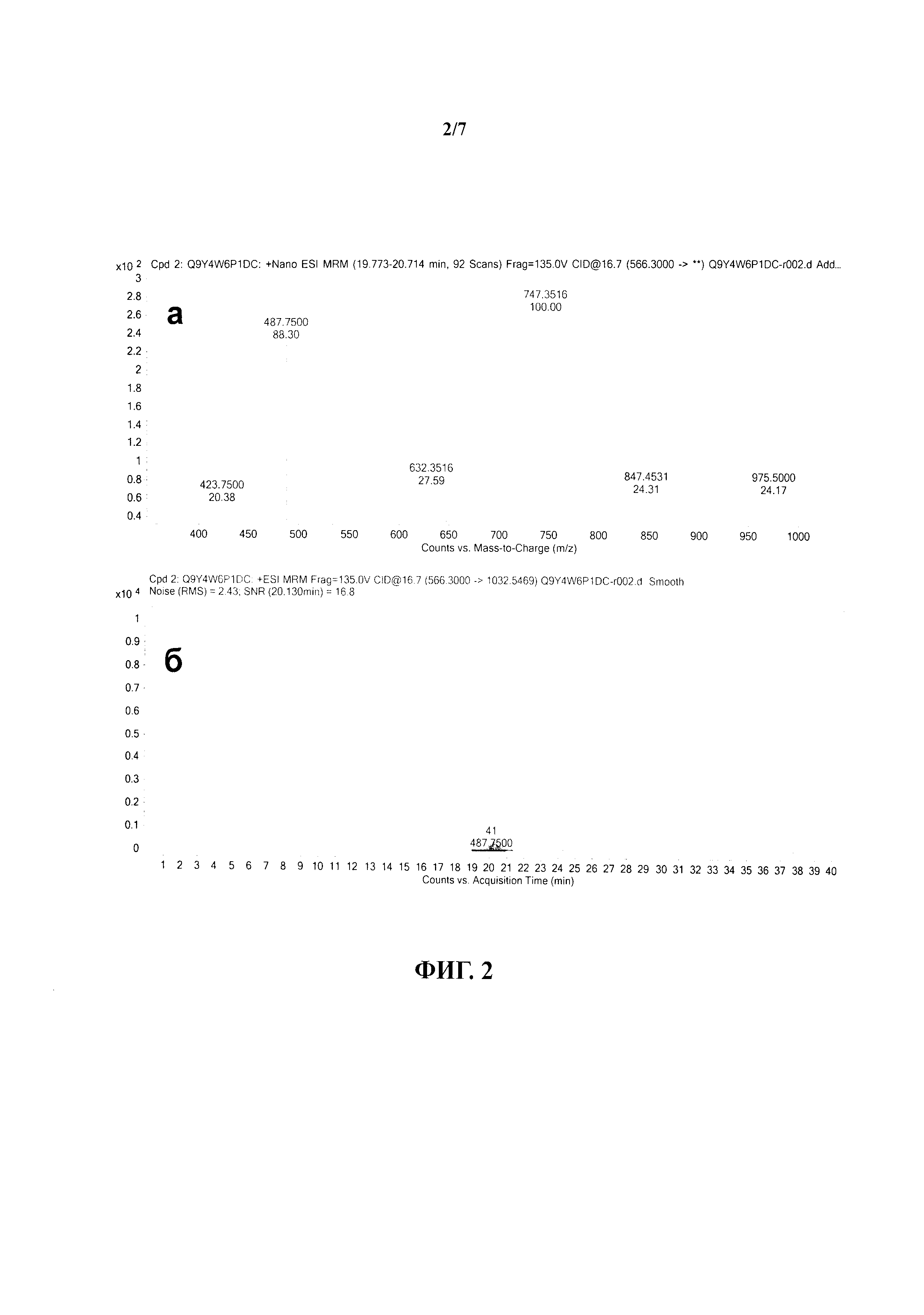
На фиг.2 представлены МРМ-спектр (а) и хроматограмма (б) компонентов пептида Q9Y4W6P5DC.
На фиг.3 представлены МРМ-спектр (а) и хроматограмма (б) компонентов пептида Q9Y4W6P3DC.
На фиг.4 представлена калибровочная кривая для пептида Q9Y4W6-02, построенная по данным таблицы 8.
На фиг.5а представлена хроматограмма выхода материнского иона пептида Q9Y4W6-02 с m/z материнского иона 542,3 2+ Да при концентрации пептида 10-9 М.
На фиг.5б представлена хроматограмма выхода фрагментных ионов пептида Q9Y4W6-02 с m/z фрагментных ионов с m/z 984.5 Да (квантор), 639,4 и 526,3 Да (спецификаторы), при концентрации пептида 10-9 М.
На фиг.5в представлен масс-спектр фрагментов материнского иона пептида Q9Y4W6-02 на пике хроматограммы, при концентрации пептида 10-9 М.
Раскрытие настоящего изобретения
Настоящее изобретение относится к применению пептида Q9Y4W6-02, характеризующегося аминокислотной последовательностью VSEEIFFGR, для хромато-масс-спектрометрического анализа содержания в образце AFG3-подобного белка-2 человека (идентификатор Q9Y4W6 в базе данных UniProt).
Согласно одному варианту осуществления настоящего изобретения анализ содержания указанного белка является количественным.
Согласно другому варианту осуществления настоящего изобретения анализ содержания указанного белка является качественным.
Указанный образец может представлять собой как простую систему, содержащую раствор белка(ов), так и сложный биологический образец.
Настоящее изобретение также относится к способу хромато-масс-спектрометрического анализа содержания в образце AFG3-подобного белка-2 человека (идентификатор Q9Y4W6 в базе данных UniProt), предусматривающему следующие стадии:
а) хромато-масс-спектрометрическйй анализ пептида Q9Y4W6-02 с последующим построением калибровочной кривой;
б) хромато-масс-спектрометрический анализ полностью гидролизованного трипсином образца белка;
в) выявление среди продуктов гидролиза белка пиков m/z, характерных для пептида Q9Y4W6-02 и его фрагментов;
г) определение концентрации пептида Q9Y4W6-02 в образце, рассчитанной по калибровочной кривой;
д) определение концентрации AFG3-подобного белка-2 человека по концентрации в образце пептида Q9Y4W6-02.
Ниже будут подробно раскрыты причины выбора пептида Q9Y4W6-02, характеризующегося аминокислотной последовательностью VSEEIFFGR, в качестве протеотипического пептида для AFG3-подобного белка-2 человека, а также методы,
которые позволили убедиться в применимости и надежности раскрытого в настоящем документе масс-спектрометрического анализа содержания AFG3-подобного белка-2 человека на основе указанного протеотипического пептида.
Возможно использование двух методов определения в пептидном составе гидролизата пробы (пробы плазмы крови человека) пептидных компонентов, в т.ч. протеотипических пептидов, относящихся к биомаркерным белкам. Каждый из приведенных методов описан ниже с позиции своих преимуществ и недостатков, а также возможности использования для поисковой работы в соответствии с технологическими критериями, предъявляемыми к материально-измерительной базе, на которой проводятся поисковые и измерительные работы.
1. Дедуктивный, или эмпирический, подход подразумевает использование ионной ловушки (ITrap) и квадрупольных времяпролетных масс-спектрометров (Q-TOF) в сочетании с высокоэффективной жидкостной хроматографией для получения результатов структурного анализа пептидных ионов и идентификации белков. В дальнейшем при анализе полученных данных проводят идентификацию белков по пептидам, зарегистрированным во время масс-спектрометрического сканирования пробы и выбор фрагментных ионов из данных тандемных спектров, соответствующих прекурсорному иону идентифицированного пептида. Биологическая проба после гидролитического расщепления трипсином представляет собой смесь пептидов белков, содержащихся в пробе. Традиционно в протеомике, основанной на масс-спектрометрическом качественном анализе и количественном измерении, смесь пептидов разделяют по физико-химическим свойствам на хроматографической колонке или тандемно сопряженных хроматографических колонках с различными по своим физико-химическим и авидным свойствам носителями, на которых элюция осуществляется в источник ионизации масс-спектрометра. Наиболее эффективным способом ионизации для молекул биологической природы, в частности, для пептидов, является ионизация с помощью электростатического распыления, при котором достигается быстрое испарение пробы в растворителе в камере источника ионизации и прикладывается высокий электростатический потенциал для эффективной ионизации нейтральных молекул пептидов, что позволяет переводить их в состояние псевдомолекулярных ионов, поступающих в проводящую систему масс-спектрометра. Подбор и настройка параметров сканирования в режимах MS и MS/MS позволяют проводить анализ содержимого пробы с различной чувствительностью, разрешающей силой, эффективностью фрагментации ионов, скоростью сканирования, накопления ионов, временем цикла и т.д. Ионные ловушки представляют собой достаточно чувствительные типы масс-спектрометров (до 10-11 М) и высокой скоростью сканирования (до 26.000 m/z*c-1). Однако, они в значительной степени уступают разрешающей способностью и точностью измерения величины отношения масс к заряду иона, что затрудняет структурный анализ пептида по его фрагментам. В отличие от ионных ловушек квадрупольные времяпролетные масс-спектрометры обладают достаточно высокой разрешающей способностью (к примеру, до 25000 на 322 m/z). Однако, чувствительность Q-TOF масс-спектрометров (квадрупольный времяпролетный масс-спектрометр) на порядок меньше в сравнении с ионными ловушками. Такие типы масс-спектрометров при фрагментации пептидного иона в ячейке соударения дают неодинаковое число однотипных фрагментных ионов и разное число типов фрагментных ионов. Так, для ионных ловушек характерны высокая степень фрагментации как по b-, так и по у-ионам в равной степени, также формируется большое число гидратированных/дегидратированных и дезаминированных форм b- и у-ионов, а также а-ионы. Для Q-TOF масс-спектрометров характерно формирование, в первую очередь, у-ионов, тогда как b-ионы и их аддукты образуются в значительно меньших количествах; а-ионы практически не формируются. Подобные отличия объясняются различиями в геометрии ячейки соударения, давлении инертного газа, используемом для фрагментации, потенциале, прикладываемом к элементам квадруполя, а также механизме и времени накопления ионов за один цикл сканирования, мобильности ионов при прохождении через электронную оптику и т.д. Тем не менее, обилие различных типов фрагментных ионов и их аддуктов при анализе ионной ловушкой затрудняет интерпретацию тандемных спектров фрагментации, так как представляют собой спектры с высоким уровнем присутствия пиков общего ионного химического тока. С другой стороны, невысокая чувствительность квадрупольных времяпролетных масс-спектрометров ограничивает возможность использования их для поисковой и аналитической работы белков, представленных в биологической пробе в низких концентрациях (10-11 М и менее). Как следствие, это накладывает рамки на количество идентифицируемых белков (их количество будет, в первую очередь, зависеть от порога чувствительности типа масс-спектрометра и индивидуальных настроек детектора/оптики в каждом случае), качество идентификации (погрешность измерения, отражения реального содержания пептида в пробе, степень покрытия (охвата) аминокислотной последовательности пептида по его фрагментам) и количестве пептидов для каждого идентифицированного белка. В свою очередь, использование хромато-масс-спектрометрической системы для поиска пептидов в составе гидролизата пробы, относящихся к целевым белкам, является также затратным по времени (в среднем, один цикл анализа занимает около одного часа), требующим высокой квалификации специалиста для корректного анализа и интерпретации получаемых результатов.
2. Индуктивный, или синтетический, подход является более эффективным, так как сочетает в себе предварительный биоинформационный отбор целевых белков с их протеотипическими пептидами и аналитическую поисковую работу предсказанных пептидов и их фрагментов на масс-спектрометрах с тройным квадруполем. При предварительном биоинформационном анализе используют несколько открытых источников, данные с которых определяют вероятность нахождения того или иного белка в анализируемом типе биологической пробы, проведения отбора протеотипических пептидов белка и их отбор, проведение отбора характеристических фрагментов пептидного иона в соответствие с техническими требованиями и возможностями, прогнозировать вероятность идентификации пептида. Каждый открытый источник информации дает в совокупности со всеми как общее представление о белке и его протеотипических пептидах, так и прогностическую гипотезу регистрации его в биологической пробе.
Для предсказания протеотипических пептидов и их поиска в составе плазмы крови человека после ферментативного гидролитического расщепления трипсином использовали несколько биоинформационных источников. Базы данных Uniprot http://www.uniprot.org/ - данный ресурс дает общую и ключевую информацию о белке, актуальную в момент обращения к ресурсу. Информация, содержащаяся в этом открытом источнике, представляет собой свод данных о молекулярной функции белка, связи и комплексообразовании с другими белками, тканеспецифичности (данная информация необходима для представления возможности регистрации белка в конкретной пробе, так как возможно, что белок экспрессируется только в злокачественных опухолях, или белок необходим только на ранней стадии эмбрионального развития, или белок коэкспрессируется при определенных физиологических условиях вместе с другими белками), его доменной организации (информация необходима для прогностических вариантов доступности сайтов гидролитического расщепления трипсином), первичной структуре белка (аминокислотной последовательности), возможных пострансляционных модификаций (данные предоставляются без уточнений по модифицируемой аминокислоте), полиморфизмах и сплайс-вариантах (для представления о инвариантности выбираемых при последующей работе протеотипических пептидах).
В случае AFG3-подобного белка-2 (идентификатор Q9Y4W6) была собрана информация о структурно-функциональной и молекулярной функциональности белка. В частности, известно, что этот белок относится к классу АТФ-зависимых протеаз, необходимых для формирования и развития аксонов. AFG3-подобный белок-2 способен формировать гомоолигомеры и взаимодействовать с белком SPG7, что является необходимым условием для формирования митохондриального комплекса I дыхательной цепи переноса электронов. АРО3-подобный белок-2 использует катионы цинка (по одному иону на каждую субъединицу) в качестве кофактора и является белком внешней мембраны митохондрий. Синтез AFG3-подобного белка-2 не характеризуется тканеспецифичностью и распределен равномерно по всем тканям организма, однако наиболее высокая степень экспрессии белка зарегистрирована в клетках Пуркинье. Этот белок характеризуется присутствием более трех альфа-спиралей, пронизывающих мембрану митохондрии, а также трех участков связывания катионов бивалентных металлов, и одним участком связывания пуриновых нуклеотидов. Для AFG3-подобного белка-2 также характерна высокая степень инвариантности в цитозольном участке полипептидной цепи и высокая вариабельности в мембранных участках полипептидной цепи.
Таким образом, данная информация дала позволяет предположить возможность регистрации AFG3-подобного белка-2 в пробе плазмы крови человека благодаря отсутствию тканеспецифичности экспрессии, а также свойству крови омывать все ткани и органы человека. В то же время, информация о структурной принадлежности белка к мембранным и его субклеточной локализации в митохондриях свидетельствует о необходимости использования методов белковой экстракции с использованием неионных детергентов и хаотропных агентов для эффективного выделения AFG3-подобного белка-2 из пробы плазму крови человека. Вместе с тем, информация о структурной вариабельности участков полипептидной цепи AFG3-подобного белка-2 позволяет избежать использования трансмембранных областей для селекции протеотипических пептидов, так как эти участки белка являются стерически наименее доступными и наиболее вариабельными по своей аминокислотной последовательности, что может затруднять поиск и идентификацию пептидов, однако это наиболее интересный участок для поиска маркерных пептидов, связанных с медицинской значимостью AFG3-подобного белка-2.
С использованием ресурсов Uniprot была получена информация о медицинской значимости AFG3-подобного белка-2. Так, известно, что функциональные изменения AFG3-подобного белка-2, обусловленные структурными дефектами, являются причиной развития таких заболеваний как мозжечковая атаксия 28-го типа, которое представляет собой клинически и генетически гетерогенное заболевание. Данное заболевание проявляется в симптомах прогрессирующей ослабленной координации движения рук, ротового аппарата и глазодвигательных мышц. Структурные и функциональные изменения в данном белке обусловлены вариациями канонической аминокислотной последовательности в участке полипептидной цепи 600-700 а.о. Данный участок является наиболее вариабельным и представляет наибольший интерес для поиска пептидных участков, способных диагностировать развитие заболеваний, вызванных дефектами белка AFG3-подобного белка-2.
База данных Human Protein Atlas http://www.proteinatlas.org/. в которой представлены иммунохимические и гистохимические данных о локализации белков в различных тканях и клетках и культурах клеток, уровне экспрессии белков в различных тканях. Данный источник данных используется для определения возможности регистрации целевых белков в той или иной биологической пробе на основе предыдущих данных иммунохимического анализа.
На основании данных о AFG3-подобном белке-2, зарегистрированном и подтвержденном шестью различными антителами высокой специфичности была получена информация о высоком уровне экспрессии и присутствии белка в клетках крови, ткани печени человека, тканях желудочно-кишечного тракта, центральной нервной системы, мужской и женской репродуктивной системы, а также среднем уровне экспрессии в клетках кожи, дыхательной системы и эндокринной системы. При этом высокая и средняя степень экспрессии AFG3-подобного белка-2 зарегистрирована в раковых клетках при следующих патологиях: рак простаты, колоректальный рак, рак молочной железы, рак щитовидной железы. Распределение AFG3-подобного белка-2 по широкому диапазону функционально и гистохимически различных тканей подтверждает данные об отсутствии тканеспецифичности распределения и экспрессии этого белка, а наличие высокого уровня экспрессии и присутствия белка, зарегистрированного в тканях при различных типах онкологических заболеваний свидетельствует в пользу медицинской значимости диагностики AFG3-подобного белка-2.
Микрофотографии конфокальной микроскопии при окраске флуоресцентными антителами НРА004479 свидетельствуют о преимущественной локализации АРО3-подобного белка-2 в районе микротрубочек митохондрий.
Таким образом, информация, полученная из источника Human Proteins Atlas подтверждает широкую распространенность АРО3-подобного белка-2 по тканям и органам человека, а так же повышенную экспрессию АРО3-подобного белка-2 при некоторых социально значимых патофизиологических и патоморфологических нарушениях, таких как раковые заболевания простаты, молочной железы, щитовидной железы и колоректального рака. Также подтверждается наибольшая степень локализации АРО3-подобного белка-2 в районе митохондрий.
База данных http://www.srmatlas.org/, в которой представлены масс-спектрометрические данные о регистрации пептидов, классифицированных по принадлежности их к белку. В базе данных собраны материалы об экспериментально подтвержденных регистрационных данных для искомого пептида (в случае его наличия в базе), количестве экспериментов, в которых пептид был зарегистрирован, консолидированный по нескольким экспериментам спектр пептида и данные о приборно-измерительной базе, на которой проводилась регистрация сигнала пептида.
Данный источник информационных ресурсов необходим для определения степени исследованности AFG3-подобного белка-2 масс-спектрометрическими методами. По данным ресурса SRM атлас всего было зарегистрировано 38 различных протеотипических пептидов этого белка безотносительно к типу ткани и типу масс-спектрометрического детектора. Из этого числа пептидов 19 пептидов постоянно присутствовали в виде модифицированных по лизинам (метилирование) и цистеинам пептидов. С высоким коэффициентом вероятности (1,0) были зарегистрированы 15 протеотипических пептидов, при этом 10 пептидов из этого числа были зарегистрированы с использованием орбитальных ловушек или времяпролетных квадрупольных масс-спектрометров. Учитывая отсутствие четко обозначенной информации о происхождении и типе биологической пробы, в которых проводились исследования, а также типах масс-спектрометров, которыми проводилась регистрация пептидов, можно сделать выводы о высокой вероятности регистрации пептидов AFG3 подобного белка-2, однако следует исключить упомянутые пептиды с модифицированными аминокислотными остатками, а также пептиды с индексов вероятности идентификации ниже 1,0. Таким образом, для дальнейшей работы необходимо учитывать 15 протеотипических пептидов AFG3-подобного белка-2.
Ресурс PRIDE http://www.ebi.ac.uk/pride предоставляет доступ к информации об экспериментах, в которых был зарегистрирован искомый белок. Данные классифицированы по типу эксперимента (типу биологической пробы, в которой при аналитической работе был зарегистрирован белок) и предоставляет общую информацию о регистрируемом пептиде в виде сводного консолидированного спектра фрагментации. Ресурс PRIDE использовали для выявления информации о типе биологической пробы, в которых был зарегистрирован AFG3-подобный белок-2 безотносительно к аминокислотной последовательности детектированного пептида этого белка. Эта информация необходима для прогнозирования вероятности детекции пептидов AFG3-подобного белка-2 в целевой биологической пробе. В базе PRIDE присутствует информация о 141 экспериментальном свидетельстве регистрации и идентификации AFG3-подобного белка-2, причем более чем в 50% случаев этот белок был неоднократно зарегистрирован в пробах плазмы или сыворотки человека, в четырех случаях данный белок был идентифицирован в экспериментах с тканью печени человека и в двух случаях - с клетками центральной нервной системы и костного мозга. В остальных случаях (54 эксперимента) AFG3-подобный белок-2 был зарегистрирован в клеточных культурах К-562. В экспериментах с плазмой крови человека исследователи использовали нормальную обогащенную и необогащенную плазму крови человека, для которых свидетельствовали отсутствие хронических, инфекционных или наследуемых заболеваний. Таким образом, информация о типе и частоте встречаемости идентификации AFG3-подобного белка-2 в пробах плазмы крови человека позволяет с высокой степенью вероятности говорить о возможности детекции протеотипических пептидов AFG3-подобного белка-2 в пробе плазмы крови человека без использования обогащения минорной фракции белков, а также о возможности регистрации в плазме здоровых добровольцев, то есть отсутствие поиска специфического по этимологии и развитию заболеваний биологического материала. Более того, принимая во внимание полученную информация о типе биологического материала. AFG3-подобный белок-2 можно зарегистрировать в наиболее доступном биологическом материала, то есть в плазме или сыворотке крови человека, не используя биопсийный материал.
Открытый источник данных Phosphosite http://www.phosphosite.org/ специализируется на накоплении информации о посттрансляционных модификациях (фосфорилировании и ацетилировании) в пептидах белков с указанием модифицируемого аминокислотного остатка в первичной структуре белковой молекулы, которые должны быть подтверждены экспериментально. Данные классифицированы по белковой принадлежности пептида. Для АРО3-подобного белка-2 идентифицировано с высокой частотой (более чем в пяти различных независимых экспериментах) посттрансляционное ацетилирование по аминокислотным остаткам лизина в положениях K306, K308, K543. Последний аминокислотный остаток лежит в области высокой вариативности аминокислотной последовательности белка, что подтверждено данными Uniprot в предварительном анализе. Два других лизина в положениях 306 и 308 находятся в стерически недоступном для ферментативного расщепления мембранном участке белка. Таким образом, информация о посттрансляционных модификациях предоставляет возможность сузить круг пептидов-кандидатов для определения АРО3-подобного белка-2.
Ресурс http://www.innovagen.se/custom-peptide-synthesis/peptide-property-calculator/peptide-property-lculator.asp, позволяющий в короткие сроки рассчитать основные физико-химические свойства пептида (изоэлектрическую точку, заряд пептида при нейтральном рН, относительную гидрофильность, диаграмму распределения гидрофобных/гидрофильных аминокислотных остатков в пептиде), необходим для возможной корректировки градиента элюции с целью максимальной воспроизводимости времени удержания пептида на колонке, ширины пика и симметрии.
Для первичного исследования с учетом информации, полученной из вышеописанных открытых источников, были отобраны следующие пептиды, для которых характерна высокая частота встречаемости в масс-спектрометрических исследованиях плазмы крови человека как типа исследуемого биологического материала, отсутствие вариабельных участков аминокислотной последовательности, стерическая близость к участкам связывания со специфическими антителами против AFG3-подобного белка-2, а также пептиды, находящиеся в доступных для ферментативного расщепления доменных структурных участках молекулы белка:
|
Однако в дальнейшем из этого предварительного списка пептидов, приведенного в таблице 1, на основании ресурса SSRC http://hs2.proteome.ca/SSRCalc/SSRCalcX.html была проведена дополнительная селекция пептидов. Ресурс SSRC представляет собой открытую программу для расчета коэффициента гидрофобности пептидов и относительного времени их удержания на колонках с обращенной фазой при различных диаметрах пор в частицах хроматографического носителя (от 100 до 300 А), и содержании ион-парного реагента в растворителях (трифторуксусная кислота или муравьиная кислота). Данный ресурс предоставляет возможность прогнозировать последовательность элюции целевых пептидов на колонке при выбранных оптимальных условия и корректировать условия хроматографического разделения.
|
Таким образом, совокупность данных из различных открытых источников дает первичное представление и информацию для отбора протеотипических пептидов целевого белка для проведения дальнейшего анализа и поисковой работы. Для выбранных протеотипических пептидов в дальнейшем проводится отбор фрагментных ионов в соответствии с разработанными критериями, соответствующими наиболее вероятной воспроизводимости интенсивности фрагмента, частоте его встречаемости при фрагментации, возможности формирования этого типа иона при заданных условиях фрагментации, его инвариантности, а также родительских ионов на основании коэффициента относительной гидрофобности пептида, его заряда, изоэлектрической точки и т.д.
Для отбора фрагментных ионов и родительских ионов использовали следующие критерии:
а) длина пептида должна составлять не менее 6 и не более 20 аминокислотных остатков,
б) молекулярная масса пептида не должна превышать более 2400 Да,
в) пептид может быть либо в двух либо в трехзарядном состоянии при формировании псевдомолекулярного пептидного иона (в исключительных случаях возможно рассмотрение однозарядных ионов).
г) для анализа используются стабильные b- и у-ионы, образующиеся при фрагментации пептидного иона, и не рассматриваются дегидратированные/гидратированные и дезаминированные аддукты фрагментных ионов пептида,
д) величина отношения массы к заряду для фрагментного иона не должна быть менее 300 и более 1000 (для двухзарядных фрагментных ионов не более 800 и не менее 380),
е) если пептид имеет моноизотопную массу при усредненном распределении вклада в молекулярную массу каждого изотопа атомов, входящих в состав пептида, менее 500, то рассматриваются только у-ионы, если более 1500, то рассматриваются у-ионы в одно- и двухзарядных состояниях и b-ионы в однозарядном состоянии до величины m/z не превышающей 800,
ж) если в аминокислотной последовательности пептида встречается триплет из аминокислотных остатков глутаминовой кислоты (ЕЕЕ) или пролина (РРР), то для отбора учитываются все у- и b-ионы независимо от длины и зарядного состояния пептидного иона,
з) длина фрагментного иона должна составлять не менее четырех аминокислотных остатков с С- или N-конца пептида,
и) среди отобранных фрагментных ионов не должны встречаться ионы, соответствующие по величине m/z прекурсорному пептидному иону в зарядных состояниях 1+ - 3+,
к) для анализа не учитываются пептиды с коэффициентом относительной гидрофобности более 70,
л) не учитывали пептиды с зарядом при рН=7,0, равным или более +3 или менее -3, а также изоэлектрической точке, лежащей в пределах, близких к критическим значениям (pi менее 3,0 и более 10,0).
Далее рассмотрен отбор маркерных пептидов по результатам измерения масс-спектрометрических сигнатур AFG3-подобного белка-2 (Q9Y4W6). Для белка Q9Y4W6 (AFG3-подобного белка-2) были отобраны шесть протеотипических пептидов на первичном уровне аналитического биоинформационного отбора (таблица 3).
|
|
Из приведенной таблицы 3 видно, что все пептиды отличаются по длине (от 9 до 17 аминокислотных остатков) и коэффициенту относительной гидрофобности, К каждому протеотипическому пептиду применяют метод МРМ (отслеживания множественных реакций формирования фрагментных ионов). Качественный анализ и поиск пептида целевого белка проводится с учетом физико-химических свойств протеотипического пептида. Из первичной выборки протеотипических пептидов отбирается лишь часть пептидов по результатам масс-спектрометрических измерений на масс-спектрометре с тройным квадруполем Agilent6410.
Для каждого прекурсорного пептидного иона была рассчитана эффективная энергия соударения по следующей формуле (1):
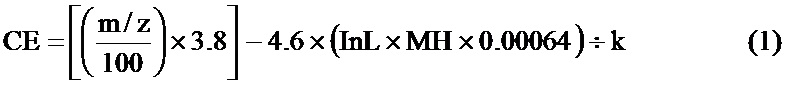
где СЕ - эффективная энергия соударения в электрон-вольтах, эВ; m/z - отношение массы к заряду прекурсорного пептидного иона; МН - средняя моноизотопная масса пептида, рассчитанная как средняя величина вклада изотопов каждого атома, входящего в состав пептида, L - длина пептида в аминокислотных остатках, k - поправочный коэффициент учета зарядного состояния псевдомолекулярного иона (2,58 для двухзарядных, 1,12 для трехзарядных и 3,71 для однозарядных).
Для каждого из приведенных в таблице 3 пептидов возможно существование как минимум 122 фрагментных ионов с учетом а, b, y-ионов, их аддуктов и внутренних пептидных ионов (данные приведены для самого короткого пептида Q9Y6Q6P4 длиной 9 аминокислотных остатков). Однако в соответствии с вышеизложенными критериями (а-к) авторами изобретения были отобраны от 9 до 28 возможных фрагментных ионов для каждого пептида.
Выбор пептидов осуществляли по нескольким статистическим критериям, относящимся к качественной оценке хроматографической и масс-спектрометрической составляющей анализа. Расчет всех статистических параметров и анализ полученных результатов проводили с помощью программного обеспечения Qualitative Analysis В04.01 patch 2, входящего в пакет программ Mass Hunter (Agilent). Для анализа полученных результатов выдвигали требование присутствия целевого пептида во всех трех технических повторениях анализа биологической пробы. При этом допускается толерантность по времени удержания пептида на колонке при одинаковых условиях хроматографического разделения не более +/- 0,5 минуты. Для каждого пептида, зарегистрированного при масс-спектрометрическом анализе, была определена вершина точки хроматографического пика времени удержания на колонке. Также для каждого пептида были рассчитаны ширина хроматографического пика, измеряемая в минутах и рассчитываемая как разница между точкой начала подъема самого интенсивного пика и точкой окончания спуска пика (формула 2), а также коэффициент симметрии пика (безразмерная величина), рассчитываемый как отношение полуширины хроматографического пика на спуске к полуширине хроматографического пика на подъеме на уровне 10% от максимальной высоты пика (формула 3). Ширина пика и симметрия пика являются вспомогательными величинами, позволяющими проводить порог отсечения ложноположительного сигнала в том случае, если в результате масс-спектрометрического анализа на хроматограмме были получены сигналы более одного пика.
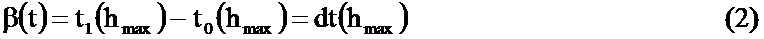
где t1, t0 - время окончания и начала подъема хроматографического пика с максимальной интенсивностью.

где b - полуширина на спуске пика на высоте 10% от максимальной точки интенсивности, а - полуширина на подъеме хроматографического пика на высоте 10% от максимальной точки интенсивности хроматографического пика, h - значение максимальной высоты хроматографического пика.
Выбраны следующие критерии для качественной хроматографической оценки пика: варьирование пределов ширины пика 0,15<β(t)<1,2, пределы варьирования коэффициента симметрии хроматографического пика 0,3<ω(t)<1,3. Одновременно с коэффициентом симметрии пика проводили оценку деконволюированности хроматографического пика, так как уровень деконволюции вносит основной вклад в разрешение пиков. Интегрирование площади пиков проводили после предварительного сглаживания хроматографических пиков по алгоритму Гауссовского распределения точек (вероятности сигнала) на хроматограмме по их интенсивности, предполагая, что полученный масс-спектрометрической сигнал есть физическая величина, подверженная большому числу случайных помех (общий ионный ток). При этом коэффициент смещения μ функции варьировал от 5 до 12 точек, а коэффициент масштаба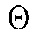 от 8 до 10.
от 8 до 10.
Одним из основных критериев в оценке качества хроматографического пика каждого фрагментного иона выступает величина отношения уровня сигнала к шуму. В данной работе нижнее пороговое значения отношения сигнала к шуму было установлено на уровне 7,0 (SN>7,0). Значение отношения уровня сигнала к шуму определяли как среднеквадратичное отклонение численного изменения интенсивности химического шума по каждому интервалу времени, в котором зарегистрирован сигнал предполагаемого хроматографического пика. При этом отношение сигнала считается к максимальному значению общего ионного тока по всему временному интервалу. Для расчета отношения сигнала к шуму возможно оперировать величинами площади пика или высоты пика как волновой амплитуде колебания; в данной работе расчет проводили по площади хроматографического пика в соответствии с формулой (4):

где μ - это ожидаемого или расчетное значение сигнала, а σ - среднеквадратичное отклонение шума.
Оптимизацию параметрических величин для масс-спектрометрической регистрации и хроматографического разделения осуществляли в направлении константных, лабильных и вариабельных параметров для достижения максимального значения уровня сигнала к шуму площади пика, форму хроматографического пика с коэффициентом асимметрии в интервале от 0.8 до 1,2. а также максимальною предела обнаружения пептида в биологической пробе.
Существуют константные (постоянные), лабильные (изменяющиеся независимо от характеристик прекурсорного или фрагментного иона) и вариабельные параметры (зависимые от значения отношения массы к заряду прекурсорного иона и от количества фрагментных ионов в методе), устанавливаемые в методе.
К константным параметрам относятся потенциал на капилляре (-1970 В в данном случае), температура осушающего газа (азот) 305°С, скорость потока осушающего газа 5 л/мин, а также хроматографические параметра разделения пептидной смеси на колонке после гидролитического расщепления пробы. Разделяющая и обогащающая колонки интегрированы в хроматографический нанопотоковый чип и имеют прямой вывод на эмиттер в источник электростатической ионизации. Для анализа отбирают по 1 мкл пробы в растворе 5% муравьиной кислоты, загрузку которой осуществляют в изократическом растворителе С (5% ацетонитрил в водном растворе 0,1% муравьиной кислоты и 0,003% трифторуксусной кислоты) в течение 3,5 минут при скорости потока 2 мкл/мин на обогащающую колонку (Zorbax 300SB-C18 300А, длина колонки 4 мм, объем 40 нл, размер частиц 5 мкм). После предварительного обогащения пробы хроматографические разделения проводят на колонке с обращенной фазой Zorbax 300SB-C18 (150 мм × 75 мкм, размер частиц 5 мкм) в градиенте растворителей А (водный раствор 0,1% муравьиной кислоты) и В (80% ацетонитрил в водном растворе 0,1% муравьиной кислоты). Градиент элюции пептидов: 0-2 минуты - 5% В, 2-32 минуты - 5-65% В, 32-34 минуты - 65-100% В, 34-38 минут - 100% В, 38-41 минута - 100-5% В. Уравновешивание колонки в начальных условиях градиента элюции (5% В) в течение 6 минут.Разделение проводили на колонке при скорости потока 0,3 мкл/мин. В период элюции с колонки растворителем с высоким содержанием ацетонитрила (34-38 минут, 100% В), скорость потока градиентно в течение 2 минут увеличивали до 0,5 мкл/мин. Общее время одного анализа составляло 47 минут. Ввод пробы в капилляр седла осуществляют при скорости 4,1 мкл/мин, загрузку пробы в петлю хроматографа при скорости 8,2 мкл/мин. После каждого цикла ввода/вывода пробы иглу инжектора промывают раствором 30% этанола с 30% 2-пропанолом в воде в течение 4 секунд. Перед переключением перепускных клапанов изменения потока изократического растворителя для загрузки на обогащающую колонку, устанавливают время уравновешивания скорости потока насоса в течение 5 секунд. Пробы постоянно термостатируют при 6°С.
К лабильным характеристикам метода МРМ относятся параметрические величины, изменяющиеся после настройки и калибровки масс-спектрометра с тройным квадруполем: референсный потенциал на электронном умножителе конверсионного диодного детектора, потенциал усиления сигнала на электронном умножителе, референсный потенциал фрагментора, значения напряжения на электронной оптике. Верхняя граница значения потенциал усиления сигнала рассчитывается по формуле (5):

где 3000 - максимальное значение потенциала на реверсивном диодном детекторе в вольтах, a EMVd - текущее значение потенциала на электронном умножителе конверсионного детектора, установленное при настройке масс-спектрометра. Потенциал усиления сигнала (ΔEMV) возможно измерять при составлении метода в целях увеличения чувствительности масс-детектора при регистрации пептидов белков в низких и ультранизких концентрационных диапазонах.
К вариабельным параметрам метода МРМ относятся величина эффективной энергии соударения, которая рассчитывается по формуле (1) и является характеристической величиной для каждого прекурсорного иона, время накопления на каждый фрагментный ион, выражаемое в миллисекундах. В зависимости от числа переходов от прекурсорного иона к фрагментному иону, или от общего числа фрагментных ионов в методе, автоматически рассчитывается общее время одного цикла сканирования, то есть время, которое затрачивается на однократное сканирование (поиск) и накопление конкретного фрагментного иона, произошедшего от соответствующего прекурсорного иона, на третьем квадруполе масс-спектрометра. Общее время сканирования складывается из суммы времен накопления на каждый фрагментный ион и суммы времени задержки при передачи иона из ячейки соударения (второго квадруполя) в третий квадруполь (6)

где St - общее время одно цикла сканирования, мс; Dwt - время накопления на один фрагментный ион; Trt - время, затрачиваемое на перенос ионов из второго квадруполя в третий квадруполы n - число фрагментный ионов в одном цикле сканирования.
Время накопления фрагментных ионов будет зависеть от эффективности ионизации пептида, стабильности его фрагментов при распаде в ячейке соударения и мобильности фрагментных ионов. В зависимости от этих параметров время накопления на ион выставляется в пределах 30<Dwt<52, с тем, чтобы общее одного цикла сканирования принадлежало интервалу 550<St<1300. Минимальное количество точек для построения хроматографического пика одного фрагмента составляет не менее 45 точек на минуту градиента элюции при толерантности пика ±2 минуты от вершины точки времени удержания хроматографического пика.
Перечисленные параметры в совокупности дают возможность достоверной качественной оценки полученных хроматографических пиков анализируемых протеотипических пептидов и идентификации ложноположительных сигналов по установленным порогам отсечения. На фиг.2 (а) - 4 (а) показаны масс-спектрометрические спектры примеров протеотипических пептидов Q9Y4W6P2DC, Q9Y4W6P5DC и Q9Y4W6P3DC, консолидированные по компонентам фрагментации соответствующего прекурсорного иона (таблица 3). На фиг.2 (б) - 4 (б) показаны хроматограммы с разрешением фрагментных компонентов псевдомолекулярного пептидного иона, полученных в результате распада в ячейке соударения.
Пептид Q9Y4W6P1DC был исключен из выборки, так как обладает очень высоким зарядом при нейтральном значении реакции среды. Пептид Q9Y4W6P2DC исключен из рассматриваемой выборки в связи с высоким значением коэффициента относительной гидрофобности, а также из-за наличия аминокислотного остатка цистеина в полипептидной последовательности, который будет алкилирован в процессе пробоподготовки (фиг.2). Пептид Q9Y4W6P5DC исключен из выборки в связи с высокой молекулярной массой и длиной пептида, что сказывается на превалировании трехзарядных псевдомолекулярных пептидных ионов, также в пептиде присутствует аминокислотный остаток метионина. Также данный пептид был исключен из выборки так как при анализе масс-спектрометрических данных для данного пептида наблюдали присутствие четырех хроматографических пиков с различным временем удержания на колонке (фиг.3).
Пептид Q9Y4W6P6DC исключен из выборки в связи с критически высоким значением изоэлектрической точки. Пептид Q9Y4W6P3DC исключен из выборки в связи с нейтральным зарядным состоянием, что обусловлено присутствием четырех аминокислотных остатков глицина в пептидной последовательности, также присутствие множественных глицинов сказывается на вариабельности при формировании фрагментных ионов при масс-спектрометрическом анализе.
В пептиде Q9Y4W6P3DC также присутствует аминокислотный остаток метионина, который способен окисляться и вносить вариации в интерпретацию данных, а также как следствие изменять массу пептида со сдвигом в 17 Да и сдвигать время удержания на колонке в более гидрофобную область градиента элюции (фиг.4).
Сводные данные для хроматографических пиков, усредненные по трем техническим повторениям со стандартным отклонением для пептидов белка Q9Y4W6 приведены в таблице 4.
|
Таким образом, в результате отбора фрагментных пептидов, необходимых для проведения поиска целевых белков в гидролизате пептидов биологической пробы плазмы крови человека или ткани печени человека, получаем следующую таблицу основных параметрических масс-спектрометрических величин для маркерного пептида-кандидата с аминокислотной последовательностью VSEEIFFGR белка Q9Y4W6 (таблица 5):
|
Как видно из таблицы 5. лишь часть фрагментных ионов была отобрана для дальнейшего поиска пептида. Так же видно, что в зависимости от линейных и структурных характеристик в соответствие с требованиями (а-к) для данного пептидного иона были выбраны как b-, так и y-типы фрагментных ионов с различными зарядными состояниями от 1+до 2+. Данная таблица представляет собой свод основных параметров для поиска и регистрации наиболее интенсивного, воспроизводимого по площади пика и времени удержания на колонке пептида с аминокислотной последовательностью VSEEIFFGR целевого белка с идентификатором Q9Y4W6 (AFG3-подобного белка-2) методом отслеживания множественных реакций формирования фрагментных ионов (МРМ). Каждый метод МРМ соответствует одному пептиду в одном зарядном состоянии какого-либо белка.
Для регистрации и поиска данного пептида с аминокислотной последовательностью VSEEIFFGR был разработан метод отслеживания формирования фрагментных ионов с использованием масс-спектрометра с тройным квадруполем и оптимизированы параметрические величины настройки масс-детектора, конверсионного диодного детектора и источника ионизации, а также параметры работы и градиента элюции высокоэффективной жидкостной системы хроматографического разделения пептидов из биологического материала.
Таким образом, отбор маркерного пептида с аминокислотной последовательностью VSEEIFFGR осуществляется по воспроизводимости масс-спектрометрического пика (соотношению фрагментных ионов) в ряду технических повторений, воспроизводимости времени удержания на колонке хроматографического пика, ширине и коэффициенту симметрии хроматографического пика, соотношению уровня сигнала к шуму, воспроизводимости хроматографических и масс-спектрометрических характеристик выбранного пика при анализе биологической пробы.
Пример 1. Построение калибровочной кривой для определения концентрации белка AFG3-подобного белка-2 (инвентарный номер UniProt Q9Y4W6) по пептиду Q9Y4W6-02
Концентрацию целевого белка определяли по концентрации выбранного маркерного (протеотипического) пептида данных белков, полученных после их гидролитического ферментативного расщепления. Подразумевалось, что при 100% расщеплении белка трипсином в ходе эксперимента пептид Q9Y4W6-02 находится в эквимолярной концентрации по отношению к белку. Концентрацию маркерного пептида определяли хромато-масс-спектрометрическим сравнением интенсивности пика маркерного пептида в пробе с калибровочной кривой. Для построения калибровочной кривой зависимости интенсивности отклика масс-спектрометрического детектора от концентрации пептида проводили хромато-масс-спектрометрический анализ калибровочных растворов пептидов с известной концентрацией. Калибровочные растворы характеризовались концентрациями 10~8, 10"9, 10-8, 10-9, 10-12, 10-13, 10-14, 10-15 М.
Анализ проводили на хромато-масс-спектрометре "Agilent", состоящем из жидкостного нанопотокового хроматографа "Agilent 1200" и масс-спектрометрического детектора с тройным квадруполем "Agilent6410".
Стадия 1
Приготовление матрицы для калибровки.
Матрица для приготовления калибровочных растворов представляла собой смесь из 8 белков, которые не могут присутствовать у человека.
1. Взвешивали 2,5 мг лиофилизированного порошка альбумина яичного (Sigma А5503) и растворяли в 100 мкл деионизованной воды до конечной концентрации 25 мг/мл.
2. Взвешивали 2,5 мг порошка уреазы соевых бобов (Sigma U1500) и растворяли в 100 мкл деионизованной воды до конечной концентрации 25 мг/мл.
3. Взвешивали 2,5 мг миоглобина скелетной мышцы лошади (Sigma Н0630) и растворяли в 100 мкл деионизованной воды до конечной концентрации 25 мг/мл.
4. Взвешивали 2,5 мг лиофилизированного порошка гиалуронидазы бычьего семенника (Sigma Н3506) и растворяли в 100 мкл деионизованной воды до конечной концентрации 25 мг/мл.
5. Взвешивали 2,5 мг цитохрома С из бычьего сердца (Sigma С2037) и растворяли в 100 мкл деионизованной воды до конечной концентрации 25 мг/мл.
6. Взвешивали 2,5 мг фосфатазы щелочной из бычьих почек (Sigma Р3627) и растворяли в 100 мкл деионизованной воды до конечной концентрации 25 мг/мл.
7. Взвешивали 2,5 мг алкогольдегидрогеназы дрожжей (Sigma А7011) и растворяли в 100 мкл деионизованной воды до конечной концентрации 25 мг/мл.
8. Взвешивали 2,5 мг пероксидазы хрена (Sigma Р8375) и растворяли в 100 мкл деионизованной воды до конечной концентрации 25 мг/мл.
9. Объединяли полученные растворы и добавляли 200 мкл деионизованной воды. Полученный раствор содержал 8 белков, которые не могут присутствовать у человека, в эквивалентных количествах и суммарной концентрации белка 20 мг/мл.
10. Раствор разливали в пластиковые пробирки типа «Эппендорф» по 100 мкл и хранили в холодильнике при -70°С.
11. Для приготовления калибровочных растворов проводили гидролитическое ферментативное расщепление 50 мкл белковой матрицы
12. К 50 мкл полученного раствора белков добавляли 500 мкл денатурирующего буфера, состоящего из 12 мМ дезоксихолата натрия, 2 М тиомочевины, 2,5 мМ ЭДТА натрия двухзамещенного, 7,5 мМ Tris-HCl (N-гидроксиметиламинометан гидрохлорид), рН 8,2. Далее к полученному раствору смеси белков с суммарной концентрацией 10 мг/мл добавляли 1,4-дитиотриэтол (ДТТ) и трис-(2-карбоксиэтил)фосфин (ТСЕР) до конечной концентрации 87 мМ и 6,7 мМ соответственно.
13. Перемешивали на шейкере IKA Vortex при 800-900 об/мин и инкубировали при температуре 44°С в течение 60 мин в термошейкере Eppendorf Comfort.
14. В полипропиленовую пробирку объемом 1,5 мл вносили 10 мкл 4-винилпиридина и 90 мкл N,N-диметилформамида. Далее к полученному раствору добавляли 100 мкл денатурирующего буфера. В полученном растворе с помощью тестовой лакмусовой бумаги проверяли значение рН. которое не должно было превышать 9,0.
15. К матрице добавляли 12 мкл полученного раствора и помещали в недоступное для света место при комнатной температуре. Инкубировали в течение 60 мин.
16. К полученному раствору добавляли 900 мкл буферного раствора для трипсинолиза, состоящего из 42 мМ триэтиламмония бикарбоната, 3 мМ кальция хлорида.
17. Для проведения трипсинолиза к пробе добавляли 50 мкл раствора трипсина с концентрацией 200 нг/мкл и инкубировали при 44°С в течение двух часов.
18. После инкубирования добавляли еще 25 мкл трипсина и выдерживали 2 часа при 37°С.
19. Добавляли 50 мкл концентрированной муравьиной кислоты, перемешивали пипетированием и осветляли центрифугированием при 14000 об/мин в течение 10 мин.
Стадия 2
Приготовление калибровочных растворов выбранных пептидов.
1. Для получения исходного раствора с концентрацией 10-3 М взвешивали 1 мг порошка выбранного пептида и растворяли в 5% (об.) растворе муравьиной кислоты в объеме, достаточном для приготовления 10-3 М раствора. Объем растворителя рассчитывали по формуле.
V (мл)=1000/ М, где
V - объем 5% (об.) раствора муравьиной кислоты, необходимый для растворения,
М - молекулярная масса пептида
Для выбранных пептидов объемы растворителя приведены в таблице 6.
|
2. 1 мкл полученного раствора добавляли к 1 мл 5% (об.) раствора муравьиной кислоты для получения раствора с концентрацией 10-6 M
3. 1 мкл полученного раствора с концентрацией 10-6 М добавляли к 99 мкл полученной после ферментативного расщепления белковой матрицы для получения калибровочного раствора с концентрацией 10-8 М (уровень "7")
4. 10 мкл полученного раствора с концентрацией 10-8 М добавляли к 99 мкл белковой матрицы для получения калибровочного раствора с концентрацией 10-9 М (уровень "6")
5. 1 мкл полученного раствора с концентрацией 10-9 М добавляли к 99 мкл белковой матрицы для получения калибровочного раствора с концентрацией 10-10 М (уровень "5")
6. 1 мкл полученного раствора с концентрацией 10-10 М добавляли к 99 мкл белковой матрицы для получения калибровочного раствора с концентрацией 10-11 М (уровень "4")
7. 1 мкл полученного раствора с концентрацией 10-12 М добавляли к 99 мкл белковой матрицы для получения калибровочного раствора с концентрацией 10-12 М (уровень "3")
8. 1 мкл полученного раствора с концентрацией 10-12 М добавляли к 99 мкл белковой матрицы для получения калибровочного раствора с концентрацией 10-13 М (уровень"2")
9. 1 мкл полученного раствора с концентрацией 10-13 М добавляли к 99 мкл белковой матрицы для получения калибровочного раствора с концентрацией 10-14 М (уровень "1")
Стадия 3
Хромато-масс-спектрометрический анализ калибровочных растворов для построения калибровочной кривой проводили на хромато-масс-спектрометре "Agilent", состоящем из жидкостного нанопотокового хроматографа "Agilent1200" и масс-спектрометрического детектора с тройным квадруполем "Agilent6410" согласно методике анализа соответствующего пептида.
Так, для выбранных маркерных пептидов анализ проводили на хроматографической колонке с обращенной фазой Zorbax SB300-C18 (150 мм ×75 мкм размер частиц 5 мкм размер пор в частицах 300 ангстрем). В качестве изократической подвижной фазы использовали 5% раствор ацетонитрила в воде с 0.1% муравьиной кислотой и 0,03%) трифторуксусной кислотой; элюирующие подвижные фазы для создания градиента: подвижная фаза А 0,1% муравьиная кислота, подвижная фаза Б -80% раствор ацетонитрила в воде с 0,1% муравьиной кислотой. Схема градиента элюции: 0-2 мин - 5% буфера Б, 2-32 мин - 5-65% буфера Б, 32-34 мин- 65-100%) буфера Б, 34-38 мин - 100% буфера Б. 38-41 мин- 100-5% буфера с последующим уравновешиванием колонки в начальных условиях градиента (4:Б=95:5) в течение 6 минут.
MS/MS анализ проводили в режиме положительной ионизации. Параметры анализа: фрагментор 135, Dwell 30. Для источника ионизации использовали следующие параметры: температура осушающего газа 325°С, поток осушающего газа 5 л/мин, напряжение на капилляре 2000 В.
В параметрах детектора выставляли родительские и дочерние ионы, необходимые для анализа выбранного пептида. Так, для пептида, приведенного в таблице 1, родительские и дочерние ионы приведены в таблице 7.
|
Стадия 4
1. Для построения калибровочной кривой проводили по три анализа каждого из калибровочных растворов с концентрациями 10-8, 10-9, 10-10, 10-11, 10-12, 10-13, 10-14,10-15 М.
2. Калибровочную кривую зависимости отклика маркерного пептида от концентрации строили при помощи программного обеспечения Mass Hunter Quantitative Analysis B05.00, поставляемого как пакетное приложение Agilent Mass Hunter.
3. При построении калибровки и обработки данных использовали файлы всех технических повторений анализа (21 файл=7 концентрационных точек X 3 технических повторения).
4. Для построения калибровочной кривой в качестве начальных условий обработки данных устанавливали фрагментный пик-квантор (наиболее интенсивный пик фрагментного иона для конкретного прекурсорного иона, воспроизводимом в каждом техническом повторении каждой концентрационной точки), остальные фрагментные ионы выступали в качестве пиков-спецификаторов.
5. Максимальное отклонение времени удержания пика выбирали как±1 минута от точки в вершине времени удержания пика. Сглаживание пиков не использовали, начальная функция зависимости площади пика от концентрации пептида как линейная без учета нулевой точки концентрации. Площади пика-квантора и пика-спецификатора суммировали как площадь общего хроматографического пика, технические повторения усредняли для отображения одной точки на графике для каждой концентрационной точки.
6. Используя данные параметры в программе Mass Hunter Quantitative Analysis B05.00 строили калибровочные кривые зависимости интенсивности масс-спектрометрического сигнала пептида от его концентрации. При этом параметр достоверности линейной аппроксимации должен быть не менее 0,8, а среднеквадратичное отклонение площади пика для трех повторных измерений и отклонение расчетной концентрации калибровочного раствора от истинной не должно превышать 20%.
Полученную калибровочную кривую использовали для расчета концентрации маркерного пептида целевого белка после его ферментативного гидролитического расщепления. В настоящем примере анализ проводили на 3 образцах гомогената печени человека и 3 образцах плазмы крови человека.
Параметры калибровочной кривой и результаты анализа в 6 биологических образцах представлены в таблице 8, а сама калибровочная кривая - на фиг.4.
|