Результат интеллектуальной деятельности: Способ прогнозирования риска развития миоматозных узлов больших размеров у пациенток с миомой матки
Вид РИД
Изобретение
Изобретение относится к области медицинской диагностики, может быть использовано для прогнозирования риска развития миоматозных узлов больших размеров у пациенток с миомой матки, уроженок Центрального Черноземья России русской национальности.
Миома матки представляет собой доброкачественную и, как правило, множественную опухоль, растущую из незрелых миоцитов сосудистой стенки матки [Киселев В.И., Сидорова И.С., Унанян А.Л. и др. Гиперпластические процессы органов женской репродуктивной системы: теория и практика. Москва: Медпрактика-М, 2011, 467 с.]. К факторам, которые способствуют возникновению заболевания, относятся: позднее менархе, обильные менструации, высокая частота медицинских абортов, наличие экстрагенитальной патологии (особенно сердечно-сосудистой) и гинекологических заболеваний, длительная антибиотикотерапия, использование различных гормональных препаратов, изменение иммунитета, наличие инфекций, передаваемых половым путем [Вихляева Е.М. Постменопаузальная терапия: влияние на связанные с менопаузой симптомы, течение хронических заболеваний и качество жизни. Москва: МЕДпресс-информ, 2008, 448 с.].
Одной из характеристик миоматозного узла, определяющей тактику лечения, является его размер. Миома матки больших размеров сопровождается такими клиническими признаками, как болевой синдром, обильные и длительные маточные кровотечения, сдавление смежных органов, бесплодие, снижая качество жизни женщины. Наиболее рациональным методом лечения миомы матки больших размеров (размер доминантного узла более 4 см), как правило, является метод консервативной миоэктомии [Тихомиров А.Л. Миома матки. М.: МИА, 2006, 174 c.]. Таким образом, разработка способа прогнозирования риска развития миоматозных узлов больших размеров у пациенток с миомой матки является актуальной для гинекологии.
Анализ литературных данных по патогенезу миомы матки позволяет заключить, что до настоящего времени имеются разные взгляды на природу этого заболевания и в основе развития миомы матки лежат сложные многоэтапные иммунопатологические механизмы. Одним из ключевых звеньев в реализации каскада этих механизмов являются процессы взаимодействия цитокинов [Кадагидзе З.Г. Цитокины //Практическая онкология. – 2003. Т. 4, №3. С. 131-139]. При этом центральное место в данных взаимодействиях занимает фактор стромальных клеток (rs1801157) (далее SDF), регулятор активности нормальной экспрессии и секреции Т-клеток (rs2107538) (далее RANTES) и интерлейкин 1β (rs16944) (далее IL-1β).
Согласно данным литературы, в группе цитокинов, относящихся к семейству α-хемокинов, ключевую роль в обеспечении иммунного ответа играет фактор стимулятора роста предшественников β–клеток (фактор стромальных клеток - SDF-1). Фактор стромальных клеток является хемоаттрактантом для лейкоцитов, под его влиянием происходит перестройка их цитоскелета. Ген SDF-1 находится на 10 хромосоме. [Structure and chromosomal localization of the human stromal cell-derived factor 1 (SDF1) gene [Text] /M. Shirozu, T. Nakano, J. Inazawa [et al.] //Genomics. – 1995. – Vol.28, №3. – P. 495-500]. Данный хемокин обеспечивает стимуляцию хоумина CXCR4+стволовых клеток в поврежденные органы, ингибирует апоптоз, стимулирует пролиферацию, усиливает адгезию и подвижность клеток. Так, в исследованиях Li X.P. и др. [The correlation between monocyte chemoattractant protein-1 and the arthritis of systemic lupus erythematosus among Chinese [Text] /D. Q. Ye, Y. S. Hu, X. P. Li [et al.] //Arch. Dermatol. Res. – 2005. – Vol.296, №8. – P. 366-371] при иммуногистохимическом исследовании выявлено статистически значимое различие в экспрессии SDF-1 в ткани нормального эндометрия и миометрия и при карциноме эндометрия. Установлено, что содержание SDF-1 в ткани нормального эндометрия было достоверно ниже аналогичного показателя при карциноме.
Наряду с SDF-1 важное значение в прогрессировании патологий женской репродуктивной системы играет хемокин - RANTES. Он является низкомолекулярным протеином с молекулярным весом около 10 kDa, ген RANTES у человека расположен на 17 хромосоме. RANTES играет важную роль в регуляции движения лимфоцитов, в частности миграции различных популяций лейкоцитов в место повреждения или внедрения инфекционного агента. Синтез RANTES осуществляется, главным образом, циркулирующими Т-клетками, активированными IL-1 и TNFα [Mehrad, B. Chemokines as mediators of angiogenesis [Text] /B. Mehrad, M. P. Keane, R. M. Strieter //Thromb. Haemost. – 2007. – Vol.97, №5. – P. 755-762]. В исследованиях in vivo и in vitro показано, что RANTES синтезируется непосредственно в стромальном компоненте нормального миометрия, при этом интерлейкин-1β (IL-1β) индуцирует экспрессию этих молекул через активацию транскрипционного ядерного фактора каппа-В (NF-κB). Также существуют данные, что рассматриваемый хемокин может регулировать снижение антипролиферативного потенциала в эндометриоидных имплантах, что обеспечивает их жизнеспособность и распространение патологического процесса [Содержание хемокинов и провоспалительных цитокинов в перитонеальной жидкости больных наружным генитальным эндометриозом [Текст] /П. Г. Кондратьева, Д. И. Соколов, А. В. Селютин [и др.] //Медицинская иммунология. – 2006. – Т. 8, №2-3. – С. 311].
Интерлейкин 1β - цитокин с широким диапазоном биологических и физиологических эффектов. Этот цитокин полифункционален и выполняет не менее 50 различных функций, мишенями которых служат клетки практически всех органов и тканей [Интерлейкин 1β-зависимый механизм развития неспецифического реактивного гепатита при стрессе /О.Б. Цейликман, В.Э. Цейликман, А.И. Синицкий [и др.] //Цитокины и воспаление. – 2011. – Т. 10, №1. – С. 24-26]. Ген, кодирующий L-1β, картирован на длинном плече хромосомы 2 в области q14. Интерлейкин 1β участвует в формировании местной воспалительной реакции, острофазного ответа при инфекционном поражении. Индуцирует синтез IL-2, IL-4, осуществляет стимуляцию продукции ИЛ-6, фактора некроза опухоли. Установлена ассоциация носительства отдельных аллелей генов семейства IL-1 с рядом опухолевых, аутоиммунных, инфекционных и воспалительных заболеваний [IL-1B gene promoter haplotype pairs predict clinical levels of interleukin-1beta and C-reactive protein /J. Rogus, J. D. Beck, S. Offenbacher [et al.] //Hum. Genet. – 2008. – Vol.123, №4. – Р. 387-398].
Для оценки сложившейся патентной ситуации был выполнен поиск по базе данных рефератов Российских патентных документов (RUPATABRU) на сайте Федерального института промышленной собственности за период с 1994 по 2014 гг. Анализ документов производился по направлению: способ прогнозирования риска развития миоматозных узлов больших размеров у пациенток с миомой матки на основе молекулярно-генетических данных в зависимости от полиморфных маркеров генов цитокинов.
В патенте РФ №1236684 (дата публикации 20.09.2004) предложен «Способ прогнозирования роста лейомиомы матки», заключающийся в исследовании периферической крови, отличающийся тем, что определяют относительное содержание CD38+лимфоцитов и при их значениях, равных или больших 23%, прогнозируют быстрый рост миомы матки в течение года.
В патенте РФ №2332167 (дата публикации заявки 27.08.2008) предложен «Способ диагностики быстрорастущей миомы матки», который основан на определении объема матки, рассчитанный по формуле V=V0+Vi. При этом V0 - объема матки, определяемый по формуле вытянутого эллипсоида, Vi=0,5236 (Di) 3 - объем конкретных исследуемых миоматозных узлов различной локализации, Di - их диаметр и значение малонового диальдегида в супернатанте смыва из полости матки или менструальной крови. При нарастании объема матки более 465 см3 и значения малонового диальдегида более 1,21 нмоль судят о быстром росте миомы матки.
Общий недостаток указанных способов заключается в том, что не рассматриваются генетические полиморфизмы и их сочетания с риском развития миоматозных узлов больших размеров у пациенток с миомой матки.
В патенте РФ №2453850 (дата публикации заявки 20.06.2012) предложен «Способ прогнозирования характера поражения матки миоматозными узлами», согласно которому прогнозируют характер поражения матки миоматозными узлами у больной миомой матки, включающий выделение ДНК из периферической венозной крови, анализ генотипов локуса+36 A/G рецептора фактора некроза опухоли 1 типа TNFR1 и анализ миоматозных узлов, а также размер матки. При выявлении генотипов+36 GG и+36 AG TNFR1 прогнозируют наименьшую степень поражения матки. При выявлении генотипа+36 АА TNFR1 прогнозируют наибольшую степень поражения матки.
Недостаток метода заключается в том, что он позволяет прогнозировать характер поражения матки миоматозными узлами на ранних стадиях развития, но не дает возможности прогноза развития миоматозных узлов больших размеров.
За прототип выбран патент РФ №2475740 по заявке РФ №2011139007/15, 26.09.2011 «Способ выявления наследственной предрасположенности к быстрому росту миомы матки», сущность которого заключается в выделении из лимфоцитов ДНК, из которой амплифицируют фрагменты генов глутатион-S-трансферазы GSTM1 и метионин-синтазы-редуктазы MTRR, и при выявлении генотипа GSTM1 del/del в сочетании с генотипом MTRR 66G/G или MTRR 66A/G делают вывод о наличии у женщины генетической предрасположенности к быстрому росту миоматозных узлов в течение 5 лет с момента их появления.
Недостаток метода заключается в том, что способ расширяет арсенал прогностических средств выявления быстрого роста миоматозных узлов в течение 5 лет с момента их появления, но не дает прогноза риска развития миоматозных узлов больших размеров более 4 см, которые требуют оперативного вмешательства.
В изученной научно-медицинской и доступной патентной литературе авторами не было обнаружено способа прогнозирования риска развития миоматозных узлов больших размеров у пациенток с миомой матки на основе данных о сочетаниях генетических полиморфизмов rs2107538 RANTES, rs1801157 SDF 1, rs16944 IL-1β.
Задачей настоящего изобретения является расширение арсенала способов прогнозирования риска развития миоматозных узлов больших размеров у пациенток с миомой матки на основе данных о сочетаниях генетических вариантов.
Технический результат использования изобретения – получение критериев оценки риска развития миоматозных узлов больших размеров более 4 см у женщин русской национальности, уроженок Центрального Черноземья на основе данных о сочетаниях генетических вариантов локусов rs2107538 RANTES, rs1801157 SDF 1, rs16944 IL-1β.
В соответствии с поставленной задачей был разработан способ прогнозирования риска развития миоматозных узлов больших размеров у пациенток с миомой матки, включающий:
- выделение ДНК из периферической венозной крови;
- анализ полиморфизмов генов rs2107538 RANTES, rs1801157 SDF 1 и rs16944 IL-1β;
- прогнозирование повышенного риска развития миоматозных узлов больших размеров в случае выявления сочетания генотипа GG SDF-1 rs1801157 с генотипом CC IL-1β rs16944 и генотипом АА RANTES rs2107538.
Новизна и изобретательский уровень заключается в том, что из уровня техники не известна возможность прогноза риска развития миоматозных узлов больших размеров по данным о сочетании генотипа GG SDF-1 rs1801157 с генотипом CC IL-1β rs16944 и генотипом АА RANTES rs2107538.
Способ осуществляют следующим образом
ДНК выделяют из образцов периферической венозной крови в 2 этапа. На первом этапе к 4 мл крови добавляют 25 мл лизирующего буфера, содержащего 320 мМ сахарозы, 1% тритон Х-100, 5 мМ MgCl2, 10 мМ трис-HCl (pH=7,6). Полученную смесь перемешивают и центрифугируют при 4°С, 4000 об/мин в течение 20 минут. После центрифугирования надосадочную жидкость сливают, к осадку добавляют 4 мл раствора, содержащего 25 мМ ЭДТА (рН=8,0) и 75 мМNaCl, ресуспензируют. Затем прибавляют 0,4 мл 10% SDS, 35 мкл протеиназы К (10 мг/мл) и инкубируют образец при 37°С в течение 16 часов.
На втором этапе из полученного лизата последовательно проводят экстракцию ДНК равными объемами фенола, фенол-хлороформа (1:1) и хлороформа с центрифугированием при 4000 об/мин в течение 10 минут. После каждого центрифугирования производят отбор водной фазы. ДНК осаждают из раствора двумя объемами охлажденного 96% этанола. Сформированную ДНК растворяют в бидистиллированной, деионизованной воде и хранят при -20°С. Выделенную ДНК используют для проведения полимеразной цепной реакции синтеза ДНК.
Анализ всех локусов (rs2107538 RANTES, rs1801157 SDF 1 и rs16944 IL-1β) осуществляют методами полимеразной цепной реакции (ПЦР) синтеза ДНК.
Для локусов rs2107538 RANTES и rs1801157 SDF 1 ПЦР проводят на аппарате IQ5 Bio-Rad в режиме real time с использованием ДНК-полимеразы Thermus aquaticus производства фирмы «Силекс-М» и стандартных олигонуклеотидных праймеров и зондов, синтезированных фирмой «Синтол» с последующим анализом полиморфизмов методом дискриминации аллелей. Для дискриминации аллелей используют программу Bio-Rad «IQ5-Standart Edition».
Для локуса rs16944 IL-1β ПЦР производят методом анализа полиморфизма длины рестрикционных фрагментов (ПДРФ) продуктов ПЦР-амплификации специфических участков генома с использованием соответствующих ферментов рестрикции производства фирмы «Сибэнзим» (Новосибирск).
Изобретение характеризуется следующими изображениями.
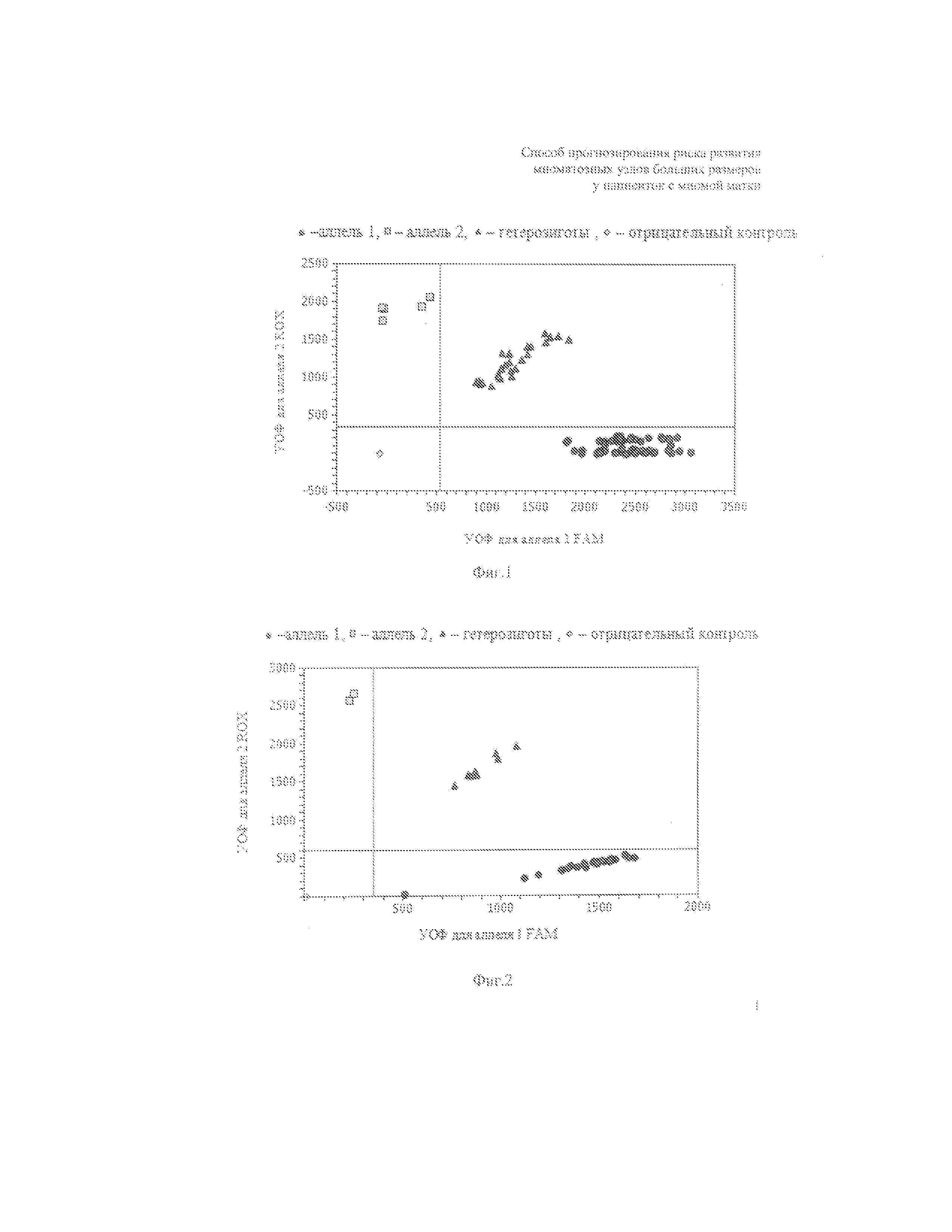
На фиг.1. представлена дискриминация аллелей по локусу rs2107538 RANTES, где  – гомозиготы по аллелю GG,
– гомозиготы по аллелю GG,  – гомозиготы по аллелю АА,
– гомозиготы по аллелю АА,  – гетерозиготы GА,
– гетерозиготы GА,  – отрицательный контроль, которая осуществляется методом Tag Man зондов по данным величин уровня относительной флуоресценции (далее УОФ) каждого зонда. Зонд с флуоресцентным красителем ROX соответствует аллелю 1, зонд с красителем FAM – аллелю 2.
– отрицательный контроль, которая осуществляется методом Tag Man зондов по данным величин уровня относительной флуоресценции (далее УОФ) каждого зонда. Зонд с флуоресцентным красителем ROX соответствует аллелю 1, зонд с красителем FAM – аллелю 2.
На фиг.2. представлена дискриминация аллелей по локусу rs1801157 SDF 1 (где  – гомозиготы по аллелю GG,
– гомозиготы по аллелю GG,  – гомозиготы по аллелю AA,
– гомозиготы по аллелю AA,  – гетерозиготы GA,
– гетерозиготы GA,  – отрицательный контроль), также осуществленная методом Tag Man зондов по данным величин УОФ. Зонд с флуоресцентным красителем ROX соответствует аллелю 1, зонд с красителем FAM – аллелю 2.
– отрицательный контроль), также осуществленная методом Tag Man зондов по данным величин УОФ. Зонд с флуоресцентным красителем ROX соответствует аллелю 1, зонд с красителем FAM – аллелю 2.
На фиг. 1 и 2 две полосы, вертикальная и горизонтальная, делят график на четыре секции: одна для каждого гомозиготного состояния, одна для гетерозиготного состояния и секция без реакции. Присвоение генотипов неизвестным образцам определяется вычерчиванием УОФ для одного флуорофора на оси x относительно УОФ, для другого флуорофора на оси y на диаграмме дискриминации аллелей.
• Если значения УОФ неизвестного образца находятся выше горизонтальной полосы и правее вертикальной полосы, генотип гетерозиготен, GA RANTES rs2107538, GA SDF1 rs1801157, соответственно.
• Если значения УОФ неизвестного образца находятся выше горизонтальной полосы и левее вертикальной полосы, генотип гомозиготен по аллелю A RANTES rs2107538 и аллелю A SDF1 rs1801157, соответственно, т.к. УОФ для данных аллелей отложены по оси y.
• Если значения УОФ неизвестного образца находятся ниже горизонтальной полосы и правее вертикальной, генотип гомозиготен по аллелю G RANTES rs2107538 и аллелю G SDF1 rs1801157, соответственно, т.к. УОФ для данных аллелей отложены по оси x.
• Если значения УОФ неизвестного образца находятся ниже горизонтальной полосы и левее вертикальной, определение генотипа невозможно, в данном случае неопределенный образец – отрицательный контроль.
На фиг.3 представлено электрофоретическое разделение продуктов рестрикции гена IL-1β rs16944, где 1, 9 – гомозиготы ТТ; 2, 3, 5, 7, 8, 12 – гетерозиготы СТ, 4, 6, 10,11 – гомозиготы СС.
Реакцию проводят в 12,5 мкл общего объема смеси, содержащей 33,5 мМ трис-HCl (pH=8,8), 1,25 тмМ MgCl2, 0,5 мкг геномной ДНК, по 5 пМ каждого праймера, по 100 мкМ dATP, dGTP, dCTP, dTTP и 1 единицу активной Taq-полимеразы. После денатурации (4 мин при 95°С) выполняют 35 циклов амплификации по схеме: денатурация – 30 с при 95°С; отжиг праймеров – 30 с при 55°С; элонгация – 40 с при 72°С. Затем пробы выдерживают 10 мин при 72°С и охлаждают. После ПДРФ-анализа продукты рестрикции разделяют в 2% агарозном геле, предварительно окрашенном бромистым этидием, в течение 20 мин при 160V. В качестве электрофорезного буфера используют 1хТАЕ (трис-ацетатный буфер). Результаты анализируют в проходящем ультрафиолетовом свете. Фрагменты длиной 304 п.н. соответствуют аллелю Т, 190 и 114 п.н. – С, а 304, 190 и 114 п.н. выявлены у гетерозигот СТ.
На фиг. 4 представлена таблица, где показана распространенность сочетаний генотипов генов цитокинов у женщин русской национальности, являющихся уроженками Центрального Черноземья РФ, больных миомой матки с миоматозными узлами больших размеров и в группе пациенток с малыми размерами миоматозных узлов.
Возможность использования предложенного способа для оценки риска развития миоматозных узлов больших размеров у больных миомой матки русской национальности, являющихся уроженками Центрального Черноземья РФ, подтверждает анализ результатов наблюдений 120 больных миомой матки с большими миоматозными узлами с размером доминантного узла более 4 см и 107 пациенток с миоматозными узлами небольших размеров до 4 см. Формирование выборок больных миомой матки с большими и малыми миоматозными узлами осуществляли на базе гинекологического отделения Белгородской областной клинической больницы Святителя Иоасафа.
Критерии включения в исследуемые выборки:
1. Индивидуумы русской национальности, являющиеся уроженками Центрального Черноземья РФ и не имеющие родства между собой.
2. Добровольное согласие пациенток на проведение исследования.
3. В группу больных включали индивидуумов только после установления диагноза миомы матки, который подтверждался клиническими и лабораторно-инструментальными методами обследования, в соответствии с обязательными диагностическими стандартами.
Типирование молекулярно-генетических маркеров осуществляли в лаборатории «Молекулярной генетики человека» медицинского института Белгородского государственного национального исследовательского университета.
Изучение роли комбинаций генетических вариантов rs2107538 RANTES, rs1801157 SDF 1 и rs16944 IL-1β в формировании миоматозных узлов больших размеров у пациенток с миомой матки проводили с помощью программного обеспечения АРSampler [http://sources.redhat.com/cygwin/], использующего метод Монте-Карло марковскими цепями и байесовскую непараметрическую статистику [A Gibbs sampler for identification of symmetrically structured, spaced DNA motifs with improved estimation of the signal length [Text] /A. V.Favorov, M. S. Gelfand, A. V. Gerasimova [et al.] //Bioinformatics. – 2005. – Vol.21, №10. – P. 2240-2245].
Применение данного способа позволит прогнозировать риск развития миоматозных узлов больших размеров у пациенток с миомой матки для женщин русской национальности, уроженок Центрального Черноземья России и своевременно подбирать индивидуальную тактику ведения больной миомой матки.
В качестве примеров конкретного выполнения предложенного способа было проведено генетическое обследование по локусам rs2107538 RANTES, rs1801157 SDF 1 и rs16944 IL-1β трех добровольцев больных миомой матки на ранних стадиях заболевания, русской национальности уроженок Центрального Черноземья России.
Пример 1. Пациентка В. в дебюте заболевания имела миоматозный узел размером 2,5 см. При обследовании было выявлено наличие сочетания следующих генетических вариантов: GG SDF-1 rs1801157, CC IL-1β rs16944, АA RANTES rs2107538. При поступлении в стационар через 21 месяц у данной пациентки был выявлен миоматозный узел размером 7 см. Таким образом выявление комбинации генетических вариантов GG SDF-1 rs1801157, CC IL-1β rs16944, АA RANTES rs2107538 могут служить основанием для включения в группу риска по развитию миоматозных узлов больших размеров.
Пример 2. У пациентки А., имеющей миоматозные узлы размером до 3 см, были выявлены следующие генетические варианты: GG SDF-1 rs1801157, CC IL-1β rs16944, АA RANTES rs2107538. На основании этих результатов данная пациентка включена в группу риска по развитию миоматозных узлов больших размеров и ей назначен соответствующий комплекс профилактических мероприятий (динамический контроль роста миоматозных узлов, гормональная терапия, нормализация психо-эмоционального состояния и др.). При контрольном обследовании через 18 месяцев размеры миоматозных узлов не увеличились. Данный пример подтверждает, что своевременное определение риска развития миоматозных узлов больших размеров позволяет своевременно принять профилактические меры и остановить процесс роста миоматозных узлов.
У пациентки С., имеющей миоматозные узлы размером до 3 см, были выявлены следующие генетические варианты: АА SDF-1 rs1801157, CТ IL-1β rs16944, GG RANTES rs2107538. На основании этих результатов у данной пациентки прогнозируют минимальный риск развития миоматозных узлов больших размеров. При контрольном обследовании через 18 месяцев установлено, что размеры миоматозных узлов не увеличились.
Применение данного способа позволит формировать среди пациенток с миомой матки группы риска развития миоматозных узлов больших размеров и своевременно реализовывать в этих группах необходимые лечебно-профилактические мероприятия по предупреждению оперативных вмешательств из-за развития миомы матки больших размеров.
Результаты, полученные с помощью биоинформатического анализа, свидетельствуют о вовлеченности указанного сочетания полиморфных вариантов генов регулятора активности нормальной экспрессии и секреции Т-клеток (rs2107538 RANTES), фактора стромальных клеток (rs1801157 SDF-1) и интерлейкина 1β (rs16944 IL-1β) в формирование миоматозных узлов больших размеров при миоме матки. Как следует из данных, представленных в таблице на фиг. 4, в группе больных с большими миоматозными узлами сочетание генотипа GG SDF-1 rs1801157 с генотипом CC IL-1β rs16944 и генотипом АА RANTES rs2107538. (19,81%) встречается в 4,5 раз чаще, чем в группе пациенток с малыми размерами миоматозных узлов (4,30%, рf=0,0006, pperm=0,009). Следовательно, данное сочетание генетических вариантов цитокинов повышает риск формирования больших миоматозных узлов при миоме матки (OR=5,56).
Таким образом, поставленная задача решена. Использование данного способа позволит еще до появления признаков заболевания миомой матки на основании одного анализа выявлять у женщин риск развития миоматозных узлов больших размеров и проводить профилактические мероприятия по предупреждению оперативных вмешательств.
Способ прогнозирования риска развития миоматозных узлов больших размеров у пациенток с миомой матки, включающий выделение ДНК из периферической венозной крови, анализ полиморфизмов методом полимеразной цепной реакции синтеза ДНК, отличающийся тем, что анализируют полиморфизмы генов вариантов rs2107538 RANTES, rs1801157 SDF1 и rs16944 IL-1β и прогнозируют повышенный риск развития миоматозных узлов больших размеров при миоме матки у уроженок Центрального Черноземья России русской национальности в случае выявления сочетания генотипа GG SDF1 rs1801157 с генотипом CC IL-1β rs16944 и генотипом АА RANTES rs2107538.