Результат интеллектуальной деятельности: СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ ОСТРОГО ПАНКРЕАТИТА
Вид РИД
Изобретение
Изобретение относится к области медицинской диагностики, может быть использовано для прогнозирования сроков наступления реактивной фазы острого панкреатита.
Проблема острого панкреатита является одной из актуальнейших в экстренной хирургии. Это связано не только с тем, что заболевание очень распространено, но и с тем, что оно сложно в прогнозе и в диагностике. Острый деструктивный панкреатит - первично асептический некроз поджелудочной железы с последующей воспалительной реакцией на очаги сформировавшегося некроза. Данное заболевание имеет фазовое течение: I фаза - ферментативная; II фаза - реактивная; III фаза - секвестрации и расплавления омертвевших участков. Важным прогностическим фактором течения острого панкреатита является продолжительность ферментативной фазы и соответственно срок наступления реактивной фазы. Во время первой фазы реализуется основная патологическая «программа» - формирование панкреонекроза и развитие эндотоксикоза, полиорганной недостаточности и эндотоксинового шока.
Считается, что при длительном течении ферментативной фазы и более позднем наступлении реактивной фазы происходит гиперпродукция провоспалительных цитокинов, истощение функциональных резервов организма, что обусловливает нарастание полиорганной недостаточности, развитие выраженного иммунодефицита и в последующем более тяжелое течение острого панкреатита.
Известен патент №2310848 (С1) по заявке РФ 2006112086/15, 20.11.2007 «Способ прогнозирования риска возникновения, клинического течения и исхода острого идиопатического панкреатита» (ГОУ ВПО "Красноярская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию"), предложен способ прогнозирования риска возникновения, клинического течения и исхода острого идиопатического панкреатита путем выделения ДНК из периферической венозной крови больного, типирования полиморфизма ДНК лимфоцитов для дальнейшего исследования мутаций генов SPINK1, GSTM1, GSTT1, PRSS1 и CFTR. При обнаружении гетерозиготных мутаций в генах SPINK1, PRSS1 и CFTR прогнозируют развитие деструктивной формы идиопатического панкреатита, при обнаружении сочетания не менее чем двух мутировавших генов из SPINK1, GSTM1, GSTT1, PRSS1 и CFTR у гетерозиготных носителей или гомозиготных носителей по мутации N348 гена SPINK1 в сочетании с гетерозиготной мутацией R122H гена PRSS1 прогнозируют формирование панкреонекроза тяжелой степени. Преимущество изобретения в том, что оно позволяет выделить группу больных с высоким риском развития деструктивных осложнений и обоснованно рекомендовать им проведение полномасштабной специализированной интенсивной терапии на ранних сроках, тем самым снизить или полностью исключить летальность у больных.
Недостаток прототипа заключается в том, что данный метод не позволяет прогнозировать сроки наступления реактивной фазы при остром панкреатите.
Известно, что значимое влияние на течение 1 и 2 фаз острого деструктивного панкреатита оказывает фактор некроза опухоли α - TNFα, который обладает провоспалительным эффектом и усиливает TNF-зависимый апоптоз [2, 3].
Фактор некроза опухоли α-гликопротеин с молекулярной массой 17 кДа является продуктом моноцитов/макрофагов, эндотелиальных, тучных и миелоидных клеток, клеток нейроглии, в особых случаях - активированных Т-лимфоцитов. Ген TNFα расположен на шестой хромосоме человека (6р21.3) в локусе, кодирующем молекулы главного комплекса гистосовместимости первого (HLA-A, В, С) и второго классов (HLA-DP, DQ, DR), между генами Ltα и Ltβ [4].
Существует три основных направления действия TNFα: цитотоксическое, направленное на клетки опухоли; иммуномодулирующее и провоспалительное, вызываемое активацией макрофагов, нейтрофилов, эозинофилов и эндотелиальных клеток; влияние на метаболизм. TNFα активно участвует в процессе быстрого увеличения размеров клетки и инициации апоптоза. Помимо прямого провоспалительного действия TNFα обладает широким спектром иммунорегуляторных эффектов и участвует в регуляции обменных процессов [5].
Задачей настоящего исследования является расширение арсенала способов прогнозирования течения острого панкреатита по данным о генетическом полиморфизме - 308 G/A TNFα.
Технический результат использования изобретения - получение критериев оценки сроков наступления реактивной фазы острого панкреатита.
В соответствии с поставленной задачей был разработан способ прогнозирования течения острого панкреатита, включающий выделение ДНК из периферической венозной крови; анализ полиморфизма гена фактора некроза опухоли α; прогнозирование позднего наступления реактивной фазы острого панкреатита в случае выявления генотипов -308 АА или -308 GA.
Новизна и изобретательский уровень заключаются в том, что из уровня техники не известна возможность прогноза сроков наступления реактивной фазы острого панкреатита по данным полиморфизма - 308 G/A TNFα.
Способ осуществляют следующим образом:
ДНК выделяют из образцов периферической венозной крови больных острым панкреатитом в 2 этапа. На первом этапе к 4 мл крови добавляют 25 мл лизирующего буфера, содержащего 320 мМ сахарозы, 1% тритон Х-100, 5 мМ MgCl2, 10 мМ трис-HCl (рН 7,6). Полученную смесь перемешивают и центрифугируют при 4°С, 4000 об/мин в течение 20 минут. После центрифугирования надосадочную жидкость сливают, к осадку добавляют 4 мл раствора, содержащего 25 мМ ЭДТА (рН 8,0) и 75 мМ NaCl, ресуспензируют. Затем прибавляют 0,4 мл 10% SDS, 35 мкл протеиназы К (10 мг/мл) и инкубируют образец при 37°С в течение 16 часов.
На втором этапе из полученного лизата последовательно проводят экстракцию ДНК равными объемами фенола, фенол-хлороформа (1:1) и хлороформа с центрифугированием при 4000 об/мин в течение 10 минут. После каждого центрифугирования производят отбор водной фазы. ДНК осаждают из раствора двумя объемами охлажденного 96% этанола. Сформированную ДНК растворяют в бидистиллированной, деионизованной воде и хранят при -20°С.
Выделенную ДНК затем подвергают полимеразной цепной реакции с использованием стандартных олигонуклеотидных праймеров (таблица 1).
Изучение полиморфного локуса фактора некроза опухоли α проводили методом полимеразной цепной реакции синтеза ДНК на амплификаторе IQ5 (Bio-Rad) с использованием стандартных олигонуклеотидных праймеров и зондов (табл.1) с последующим анализом полиморфизма методом дискриминации аллелей.
Реакционная смесь объемом 25 мкл включает: 67 мМ трис-HCl (рН 8,8), 2,5 мМ MgCl2, 0,1 мкг геномной ДНК, по 10 пМ каждого праймера, по 5 пмоль каждого зонда, по 200 мкМ dATP, dGTP, dCTP, dTTP и 1 единицу активной Taq-полимеразы.
После денатурации (5 мин при 95°С) выполняли 40 циклов амплификации по схеме: отжиг праймеров - 1 мин при 52°С; денатурация - 15 сек при 95°С.
|
Изобретение характеризуется следующими графическими материалами:
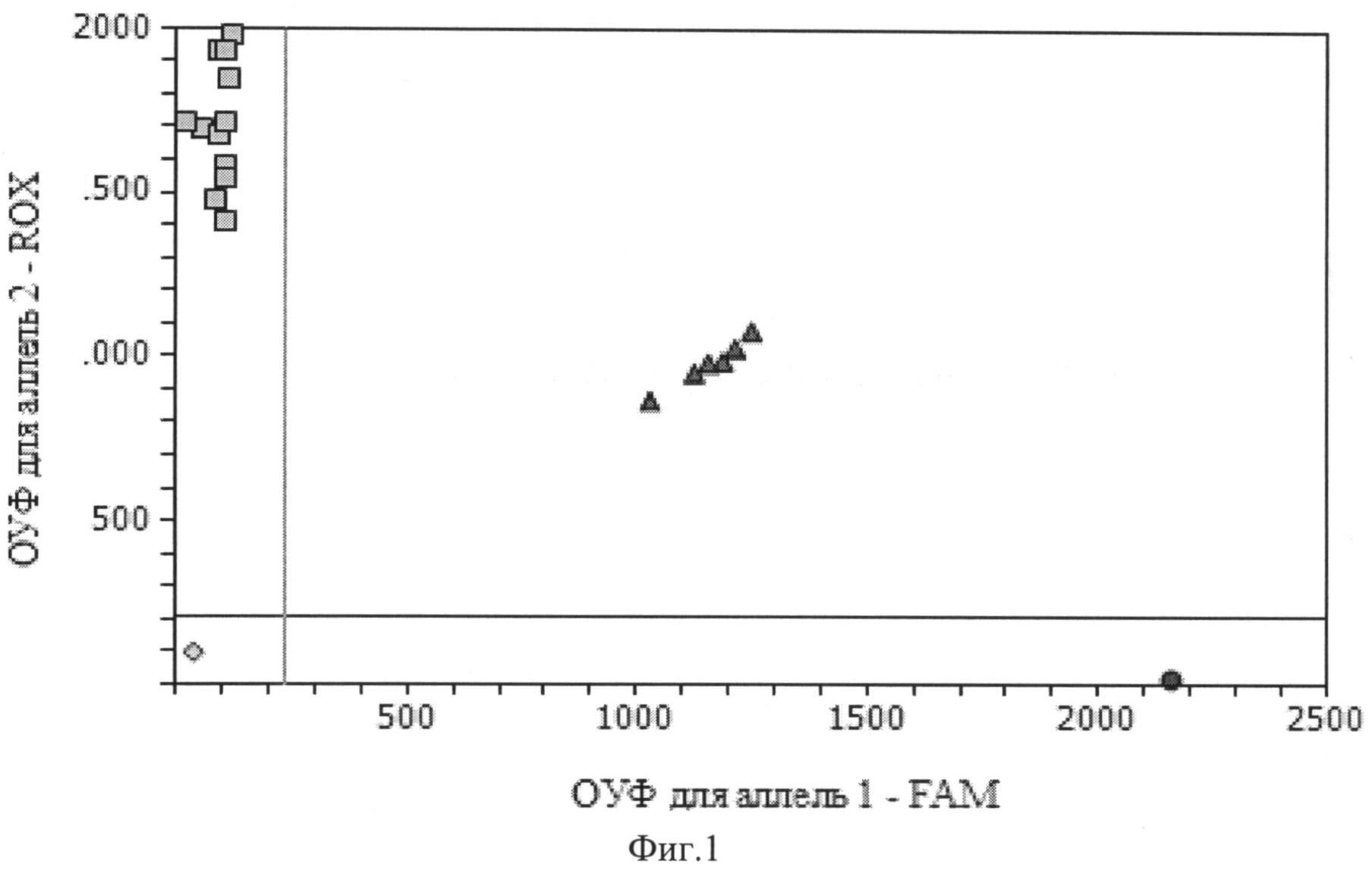
На Фиг.1 представлена дискриминация аллелей по локусу - 308 G/A TNFα, где • - гомозиготы -308АА, ■ - гомозиготы -308GG, ▲ - гетерозиготы -308GA. Дискриминация аллелей осуществляется методом Tag Man зондов по данным величин RFU, где RFU - это уровень относительной флуоресценции (УОФ) каждого зонда. Зонд с флуоресцентным красителем ROX соответствует аллелю G, зонд с красителем FAM - аллелю А.
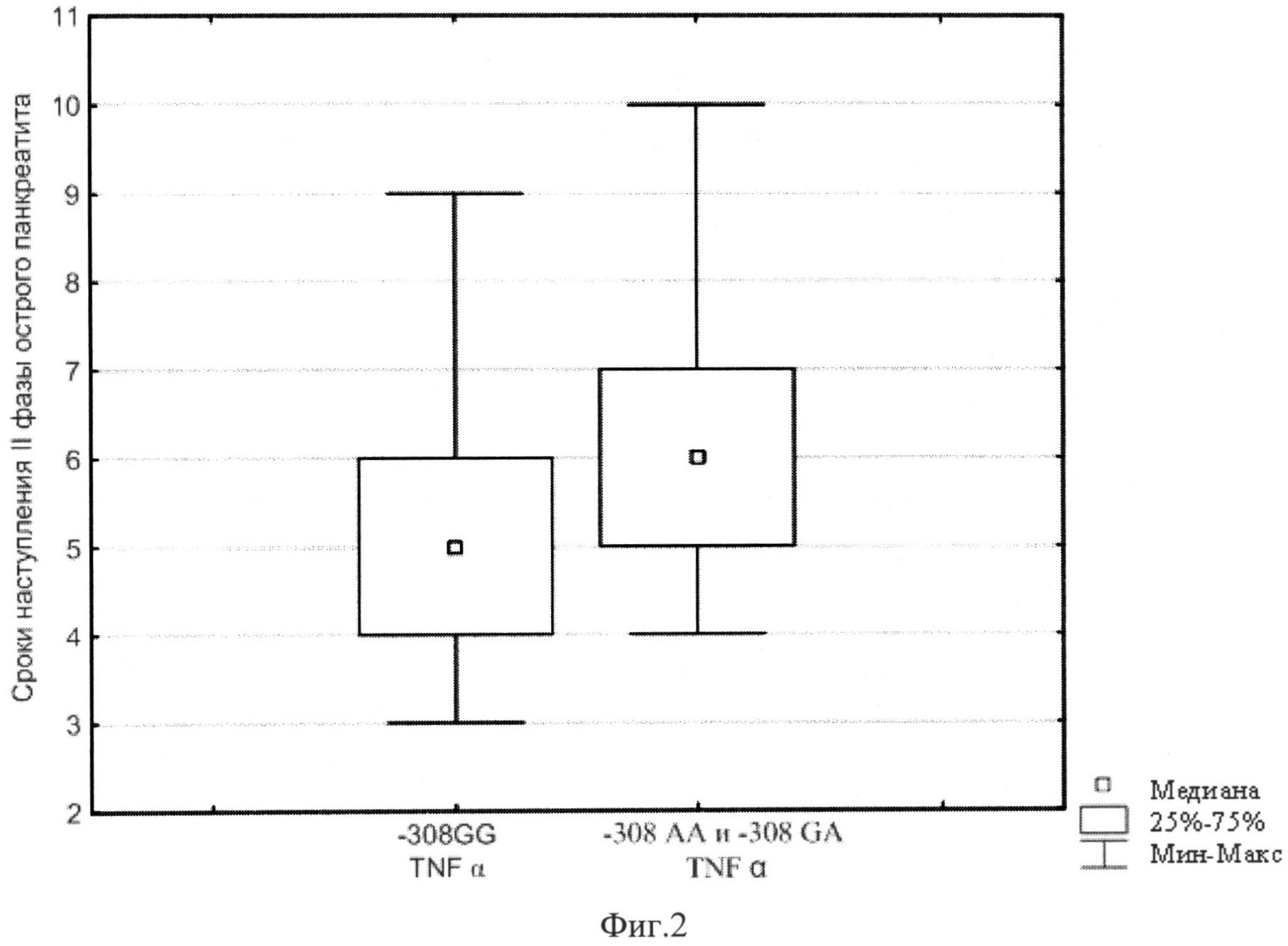
На Фиг.2 представлены сроки наступления реактивной фазы острого панкреатита в зависимости от генотипов локуса -308 G/A TNFα.
На фиг.1 две полосы, вертикальная и горизонтальная, делят график на четыре секции: одна для каждого гомозиготного состояния, одна для гетерозиготного состояния и секция без реакции. Присвоение генотипов неизвестным образцам определяется вычерчиванием УОФ для одного флуорофора на оси х относительно УОФ для другого флуорофора на оси у на диаграмме дискриминации аллелей.
Если значения УОФ неизвестного образца находятся выше горизонтальной полосы и правее вертикальной полосы, генотип гетерозиготен (GA). Если значения УОФ неизвестного образца находятся выше горизонтальной полосы и левее вертикальной полосы, генотип гомозиготен по аллелю G (УОФ аллеля G отложены по оси у). Если значения УОФ неизвестного образца находятся ниже горизонтальной полосы и правее вертикальной, генотип гомозиготен по аллелю А (УОФ аллеля А отложены по оси х). Если значения УОФ неизвестного образца находятся ниже горизонтальной полосы и левее вертикальной, определение генотипа невозможно (в данном случае неопределенный образец - отрицательный контроль).
Формирование базы данных и статистические расчеты осуществлялись с использованием программы «STATISTICA 6.0». Ассоциации аллелей и генотипов изученного ДНК-маркера со сроками наступления реактивной фазы острого панкреатита оценивали с помощью непараметрического метода - критерия Манна-Уитни. Для описания рассматриваемых количественных показателей применяли медиану (Me) и интерквартильный размах (Q25-Q75) [7].
Возможность использования предложенного способа для прогнозирования течения острого панкреатита подтверждает анализ результатов наблюдений 195 больных острым панкреатитом. Пациенты включались в соответствующую группу больных только после установления диагноза заболевания, подтвержденного с помощью клинических и лабораторно-инструментальных методов обследования.
В исследуемую группу включались индивидуумы русской национальности, являющиеся уроженцами Центрального Черноземья России и не имеющие родства между собой.
Получено, что у индивидуумов, имеющих генотипы -308 АА и -308 GA TNFα, реактивная фаза острого панкреатита наступала через 6 дней (нижний квартиль 5 дней; верхний квартиль 7 дней), а у пациентов с генотипом -308 GG TNFα этот показатель составил 5 дней (интерквартильный размах 4,00-6,00 дней, р=0,03) (фиг.2).
Таким образом, полученные данные свидетельствуют о важной патогенетической роли молекулярно-генетического маркера -308 G/A фактора некроза опухоли α в развитии острого панкреатита. Маркерами более позднего наступления 2 фазы острого панкреатита являются генотипы -308 АА и -308 GA TNFα.
Больным с острым панкреатитом при выявлении генетических факторов более позднего наступления реактивной фазы, которыми являются -308 АА или -308 GA TNFα, следует в полном объеме проводить комплекс лечебных мероприятий (медикаментозных, элементов «малой» хирургии, экстракорпоральной детоксикации), направленных на сокращение сроков ферментативной фазы, что может улучшить результаты лечения острого панкреатита.
Литература
1. Кузнецов, Н.А., Родоман, Г.В., Бронтвейн, А.Г. Лечение больных панкреонекрозом // Хирургия. 2004. №12. С.22-27.
2. Глотов О.С., Баранов B.C. Генетический полиморфизм, мультифакториальные болезни и долголетие // Медицинская генетика-2007. - т.6, №4(58) - С.17-29.
3. Сотниченко, Б.А., Салиенко, С.В., Маркелова, Е.В. Деструктивный панкреатит: профилактика и лечение гнойно-септических осложнений // Анналы хирургической гепатологии. 2006. Т.11 №1. С.67-71.
4. Царегородцева Т.М. Цитокины при гастроэнтерологической патологии // Медицинская газета. - 2005. - №63. - С.17-24.
5. Баранов B.C. Геном человека и гены «предрасположенности» (Введение в предиктивную медицину) / B.C.Баранов, Е.В.Баранова, Т.Е.Иващенко // СПБ: «Интермедика», 2000 - 272 с.
6. Polymorphisms of tumor necrosis factor (TNF) α and β genes in Korean patients with psoriasis / T.Kim [et al.] // Arch. Dermatol. Res. - 2003. - V.295. - P.8-13.
7. Реброва, О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA [Текст] / О.Ю.Реброва. - М.: Медиасфера, 2006. - 305 с.
Способ прогнозирования течения острого панкреатита, включающий выделение ДНК из периферической венозной крови, отличающийся тем, что проводят анализ полиморфизма гена фактора некроза опухоли α и прогнозируют риск позднего наступления реактивной фазы острого панкреатита в случае выявления генотипов -308 АА или -308 GA TNFα.