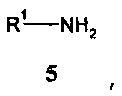Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ ЦИКЛОАЛКАНКАРБОНОВОЙ КИСЛОТЫ В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРА CXCR3
Вид РИД
Изобретение
Настоящее изобретение относится к соединениям, которые пригодны в качестве активного ингредиента лекарственного средства для превентивного и/или терапевтического лечения заболеваний, вызываемых аномальной активацией CXCR3-хемокинов.
Хемокины представляют собой многочисленное семейство небольших растворимых белков с молекулярной массой примерно 8-10 кДа. Одной из главных ролей хемокинов является нацеливание миграции иммунокомпетентных клеток. Механизмом, посредством которого направляется движение клеток, является хемоаттракция клеток, экспрессирующих соответствующий хемокиновый рецептор на своей поверхности, в направлении градиента концентрации соответствующего хемокина.
Некоторые хемокины являются гомеостатическими по функции, так как они регулируют трафик клеток повседневным образом. Такие гомеостатические хемокины, например, нацеливают хоминг лимфоцитов в лимфатические узлы, или они оказывают воздействие на развитие путем промотирования или ингибирования роста новых кровеносных сосудов, таким образом, проявляя ангиогенные или ангиостатические эффекты.
Другие хемокины экспрессируются в ответ на воспаление или повреждение. Эти воспалительные хемокины регулируют рекрутмент специфических лейкоцитных популяций в воспаленной ткани, так что, в свою очередь, они могут вызывать высвобождение специфических регуляторных и ферментативных факторов из активированных иммунокомпетентных клеток. Экспрессия этих воспалительных хемокинов обычно индуцируется посредством интерлейкина-1 (IL-1) или интерферона-γ (IFN-γ) из различных типов клеток.
Хемокины проявляют свою функцию через связывание со специфическими хемокиновыми рецепторами, которые экспрессируются на поверхности клеток. Хемокиновые рецепторы имеют длину примерно 340-360 аминокислот, и они относятся к суперсемейству связывающихся с G-белком рецепторов (GPCR). В настоящее время идентифицированы приблизительно 50 хемокинов. Многие из них могут связываться с одним и тем же рецептором, и отдельные хемокины также могут связываться с несколькими хемокиновыми рецепторами. В настоящее время авторам данной заявки известны, в общем, 20 различных хемокиновых рецепторов для этих 50 известных хемокинов [Groom J.R. и Luster A.D., Immunology and Cell Biology, 1-9 (2011)]. В более недавнее время также описаны различные сплайсинг-варианты для некоторых хемокиновых рецепторов, которые могут иметь различные типы экспрессии и играть различные физиологические или патофизиологические роли.
CXCR3 представляет собой воспалительный хемокиновый рецептор, который доминирующе экспрессируется в активированных иммунокомпетентных клетках, как, например, CD4+ (Thl-хелпер) и CD8+ (CTL цитотоксический или Тс) Т-лимфоциты. CXCR3 отсутствует в незаряженных Т-лимфоцитах, однако, его экспрессия на поверхности клеток быстро индуцируется после активации Т-клеток дендритными клетками. CXCR3 также экспрессируется в естественных лимфоцитах, как, например, природные клетки-киллеры (NK) и NKT-клетки, в плазмацитоидных дендритных клетках (pDC) [Groom J.R. и Luster A.D., Immunology and Cell Biology, 1-9 (2011)], в воспалительных нейтрофилах и макрофагах.
CXCR3 селективно активируется тремя интерферон-индуцируемыми хемокинами, CXCL9 (также обозначаемый как Mig), CXCL10 (IP-10) и CXCL11 (I-TAC). Активация CXCR3 этими эндогенными агонистами вызывает внутриклеточную мобилизацию Са2+ за счет фосфолипаз С (PLC) и, в дополнение, активацию как митогенактивируемой протеинкиназы (МАР-киназа), так и PI3-киназы [Liu M., Guo S., Hibbert J.M., Jain V., Sinh N., Wilson N.O. и Stiles J.K., Cytokine & Growth Factor Reviews, 22, 121-130 (2011)]. Эти внутриклеточные события, в конце концов, приводят к стимуляции миграции лимфоцитов и пролиферации. CXCR3 играет ключевую роль в селективном рекрутменте активированных иммунокомпетентных клеток в месте воспаления. Как только рекрутированы, цитотоксические Т-клетки (CTL), благодаря высвобождению перфорина и гранзима В, индуцируют апоптоз, таким образом способствуя локальному повреждению ткани и последующей реконструкции. В месте воспаления рекрутированные Thl- и CTL-клетки высвобождают IFN-гамма, который стимулирует эпителиальные клетки и макрофаги для дальнейшего высвобождения CXCR3-агонистов, что приводит к постоянной воспалительной активации.
Сильные Thl- и CTL-ответы являются полезными во время острой инфекции, однако, эти ответы должны быть уравновешены для предотвращения нежелательной деструкции ткани и хронических иммунопатологических изменений [Groom J.R. и Luster A.D., Experimental Cell Research, 317, 520-631 (2011)]. В этом отношении предполагают, что CXCR3-антагонисты обладают значительной терапевтической релевантностью.
Более недавние исследования показали, что CXCR3 также экспрессируется в человеческих CD25+, FOXP3+ регуляторных CD4+ Т-клетках (Treg) и уровень CXCR3 повышается в Treg-клетках после активации [Vandercappellen J. и др., Cytokine & Growth Factor Reviews, 22, 1-18 (2011)]. Это наблюдение наводит на мысль, что CXCR3 может принимать участие в опосредовании трафика Treg-клеток. Treg-клетки мигрируют к периферическим местам воспаления, где они проявляют супрессивную активность в отношении CD4+ Thl- и CD8+ CTL-клеток [Hoerning A. и др., Eur. J. Immunol. (2011), он-лайн рукопись, акцептовано: 26 апреля 2011 г. DOI: 10.1002/eji.201041095]. Таким образом, Treg-клетки являются важными для подавления иммунных ответов, сохранения иммунной толерантности и предотвращения аутоиммунных ответов.
В течение короткого периода времени стало известно о типе экспрессии CXCR3 в случае Treg-субпопуляций или ассоциации CXCR3 с иммунорегуляторными функциями Treg. Однако этот вывод может объясняться некоторыми сообщенными изменчивыми функциональными эффектами CXCR3-блокады в случае различных животных моделей [Hoerning A. и др., 2011. Eur, J. Immunol, он-лайн рукопись, акцептовано: 26 апреля 2011 г. DOI:10.1002/eji.201041095] или изменчивыми эффектами CXCR3-блокады в случае различных типов отторжения аллотрансплантата.
На сегодняшний день имеются три сплайсинг-варианта CXCR3, описанных в случае людей: CXCR3-A, CXCR3-B [Romagnani P., Lasagni L., Annunziato F., Serio M. и Romagnani S., TRENDS in Immunology, 25, 201-209 (2004)] и CXCR3-alt. CXCR3-A является наиболее широко распространенным вариантом, он соединяется с Gi/o-типом G-белков и опосредует хемотаксис и клеточную пролиферацию.
Полагают, что сплайсинг-вариант CXCR3-B экспрессируется в эндотелиальных и васкулярных гладкомышечных клетках и опосредует ангиостатические эффекты [Strieter R.M., Burdick M.D., Gomperts B.N., Belperio А., Keane M.P., Cytokine & Growth Factor Reviews, 16, 593-609 (2011)]. CXCR3-B может связывать не только три хорошо известных CXCR3-агониста, CXCL9 (Mig), CXCL10 (IP-10) и CXCL11 (I-TAC), но также четвертый агонист, CXCL4 (PF-4), который представляет собой селективный, CXCR3-B-специфический хемокиновый агонист. Полагают, что активация CXCR3-B опосредует активацию Gs, стимуляторного типа G-белков, что, в свою очередь, вызывает увеличение внутриклеточного цАМФ, которое, в конце концов, приводит к ангиостатическим эффектам и ингибированию клеточной пролиферации. Более недавние исследования, однако, показали, что альтернативный CXCR3-B сплайсинг-вариант не существует у мышей [Campanella G.S.V., Colvin R.A. и Luster A.D., 2010. PloS ONE 5(9): e12700. doi:10.1371/journal.pone. 0012700], и, в дополнение к этому, те же самые авторы в своих экспериментах с человеческими эндотелиальными клетками также показали, что CXCL10 может ингибировать пролиферацию эндотелиальных клеток независимо от CXCR3-рецепторов. На сегодняшний день имеются некоторые дискуссионные наблюдения в отношении предполагаемых ролей различных альтернативных CXCR3 сплайсинг-вариантов и, таким образом, еще необходимы дальнейшие исследования для ясности и понимания их физиологических и патофизиологических ролей.
С другой стороны, широко признано, что Т-лимфоциты выполняют очень важную регуляторную функцию в иммунной системе [Wijtmans M., Verzijl D., Leurs R., de Esch I.J.P. и Smit M.J., ChemMedChem., 3, 861-872 (2008) и Müller M., Carter M.J., Hofert J. и Campbell I.L., Neuropathology and Applied Neurobio-logy, 36, 368-387 (2010)]. На их особые роли также указывает тот факт, что 15 хемокиновых рецепторов из 20 известных рецепторов экспрессируются в случае различных субпопуляций Т-лимфоцитов [Pease and Williams, Br. J. Pharmacol, 147, c.212 (2006)]. Т-клетки принимают активное участие в случае многих воспалительных заболеваний.
Клинические данные указывают на существенную сверхэкспрессию рецептора CXCR3 и/или его эндогенных агонистов (CXCL10, CXCL11) в случае множественных аутоиммунных или воспалительных заболеваний, таких как, например:
(i) в периферических дыхательных путях пациентов с COPD [Donnelly L.E. и Barnes P.J., Trends in Pharmacol. Sci 27(10): 564-553],
(ii) при биопсиях кожи в случае пациентов с умеренным или тяжелым псориазом [Chen S-C; Groot M.; Kinsley D.; Laverty M.; McClanahan T.; Arreaza M.; Gustafson E.L.; Teunissen M.B.M.; Rie M.A.; Jay S.F.; и Kraan M., 2010. Arch. Dermatol. Rev. 302: 113-123],
(iii) в лимфатических узлах и островках пациентов с диабетом типа 1 [Uno S.; Imagawa A.; Saisho K.; Okita K.; Iwahashi H.; Hanafusai T.; и Shimomura I., 2010. Endocrine Journal. 57(11): 991-996],
(iv) при остром отторжении аллотрансплантата (трансплантаты легкого, сердца, почки и кожи) [Wenczel J., Lucas S.; Zahn S.; Mikus S.; Metze D.; Stadter S. и др., 2008., J. Am. Acad. Dermatol. 58: 437-442],
(v) при биопсиях ободочной кишки у пациентов с язвенным колитом [Singh U.P., Singh R.; Singh S.; Karls R.K.; Quinn F.D.; Taub D.D.; и Lillard Jr J.W., 2008. BMC Immunology, 9:25], и
(vi) в тимусе у пациентов с тяжелой псевдопаралитической миастенией [Pease J.E. и Horuk R. 2009. Expert Opin. Ther Patents, 19(2): 199-221].
В случае животных, CXCR3-KO-мыши показывают блокированную миграцию Т-клеток в бронхоальвеолярное пространство после вредных раздражителей, как, например, сигаретный дым (мышиная модель COPD). Дефицит CXCL10-гена или CXCR3-KO-мыши показывает пролонгированное выживание аллотрансплантата в случае мышиных моделей отторжения трансплантата (аллотрансплантаты сердца и островка Лангерганса).
Блокирование активации CXCR3 с помощью антагонистов представляет собой возможный подход к лечению заболеваний, таких как COPD [Hansel T.T. и Barnes P.J., 2009. Lancet, 374: 744-755], псориаз [Krueger J.G. и Bowcock A., 2005. Ann. Rheum. Dis. 64: доп.II.: ii30-ii36], отторжение имплантата/трансплантата [Hancock W.W.; Lu B.; Gao W.; Cziszmadia V.; Faia K.; King J.A.; Smileey S.T.; Ling M.; Gearad N.P.; и Gerard C., 2000. J Exp. Med. 192: 1515-1519], офтальмологические заболевания [Sorensen T.L.; Roed H.; Sellebjerg F., 2004. Br. J. Opthalmol. 88: 1146-1148], глютеновая болезнь [Lammers K.M.; Khandelwal S.; Chaudhry F.; Kryszak D.; Puppa E.L.; Casolaro V.; и Fasano А., 2010. Immunology, 132: 432-440], воспалительное заболевание пищеварительного тракта (IBD) [Nishimura M.; Kuboi Y.; Nuramato K.; Kawano T.; и Imai T., 2009. Autoimmunity: Ann N.Y. Acad. Sci. 1173: 350-356], диабет типа 1 [Shimida A.; Oikawa Y.; Yamada Y.; Okubo Y.; и Narumi S., 2009. Review of Diabetic Studies, 6(2): 81-84], тяжелая псевдопаралитическая миастения (MG) [Pease J.E. и Horuk R., 2009. Expert Opin Ther Patents, 19(2): 199-221], рассеянный склероз (MS) и другие нейровоспалительные заболевания [Müller M.; Carter M.J.; Hofert J.; и Campbell I.L., 2010. Neuropathology and Applied Neurobiology, 36: 368-387], волчанка [Lacotte S., Brun S.; Muller S.; и Dumortier H., 2009. Autoimmunity: Ann N.Y. Acad. Sci. 1173: 310-317], ревматоидный артрит (RA) [Brightling C.; Ammit A.J.; Kaur D.; Black J.L.; Wardlaw A.J.; Hughes J.M.; и Bradding P., 2005. Am J Respir Crit Care Med. 171: 1103-1108], красный плоский лишай [Meller S.; Gillier M.; и Homey B., 2009. J. Investigative Dermatology. 129: 315-319].
Нацеливание на CXCR3 представляет собой более простой путь для лечения состояния, так как это вместе с тем аннулирует эффекты всех трех эндогенных CXCR3-хемокинов.
Подходящие заявки на патенты и выданные патенты раскрывают ингибиторы хемокинов или рецептора CXCR3, как, например, WO 2003087063, WO 200604924, WO 2009094168 и WO 2009105435, однако, известные соединения структурно очень отличаются от соединений согласно настоящему изобретению.
Задача настоящего изобретения состояла в получении новых антагонистов рецептора CXCR3, которые проявляют сильный антагонистический эффект и являются селективными по отношению к рецептору CXCR3. Задача настоящего изобретения также состояла в том, чтобы стабильность, биодоступность, метаболизм, терапевтический индекс, токсичность и растворимость новых соединений позволяли осуществлять их разработку до лекарственного вещества. Дальнейшая задача состояла в том, чтобы соединения, вследствие их благоприятной энтеральной абсорбции, можно было вводить перорально.
Таким образом, авторы настоящего изобретения идентифицировали соединения, представленные следующей формулой 1, обладающие ингибирующей активностью в отношении рецепторов CXCR3.
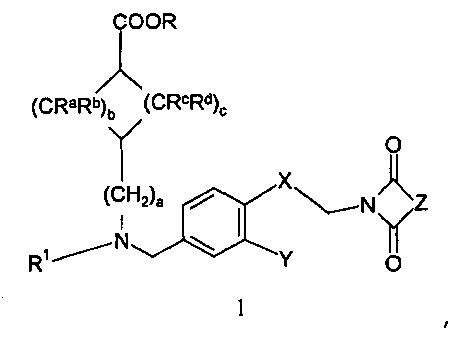
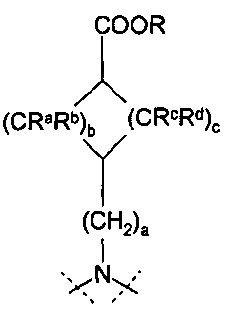
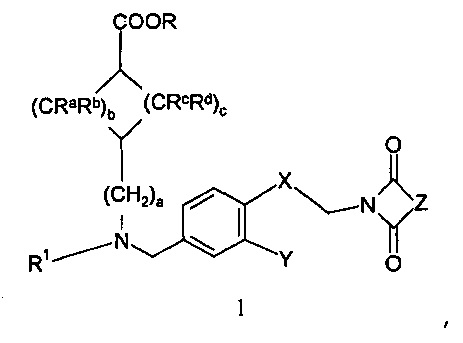
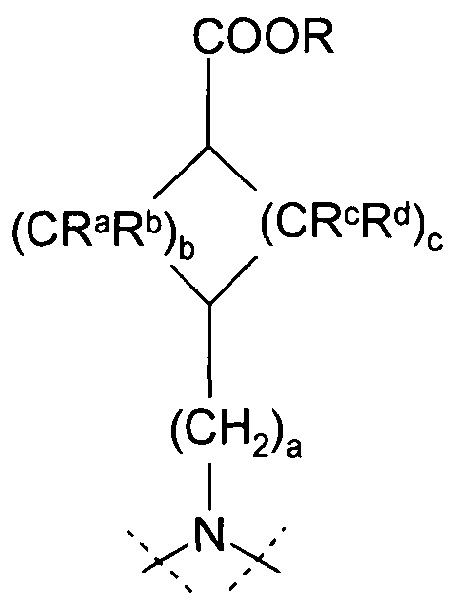
Настоящее изобретение, таким образом, относится к соединению формулы 1:
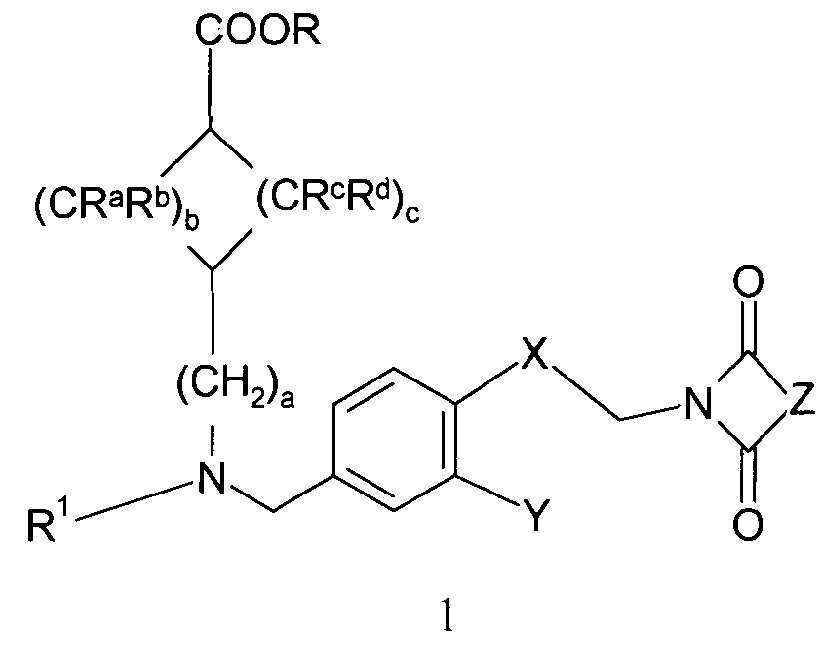 ,
,
где
R означает водород или С1-4-алкильную группу;
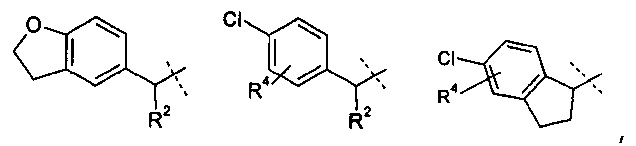
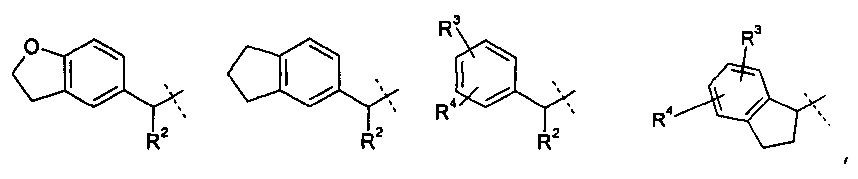
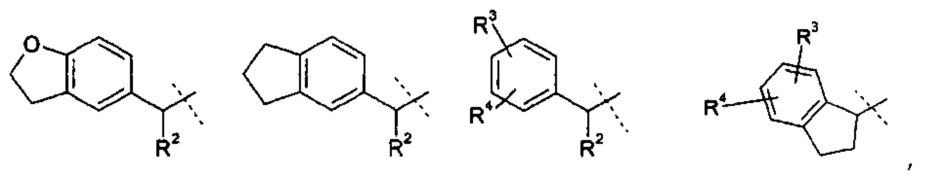
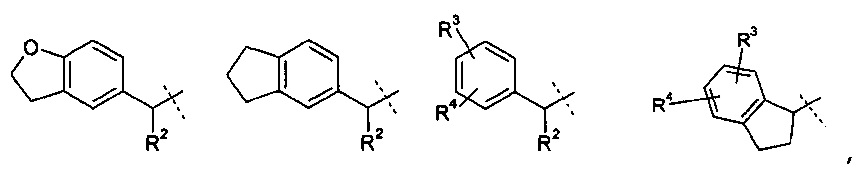
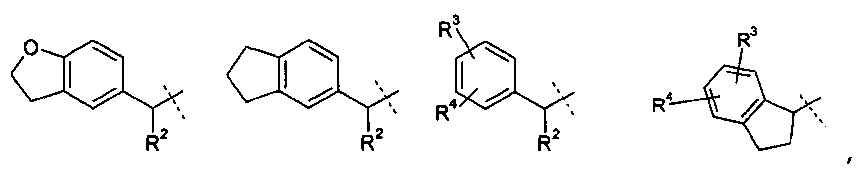
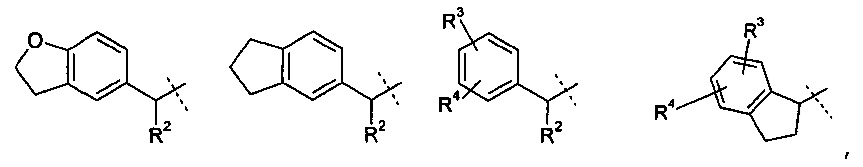
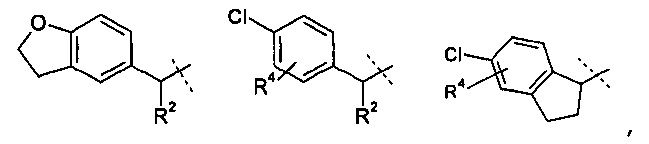
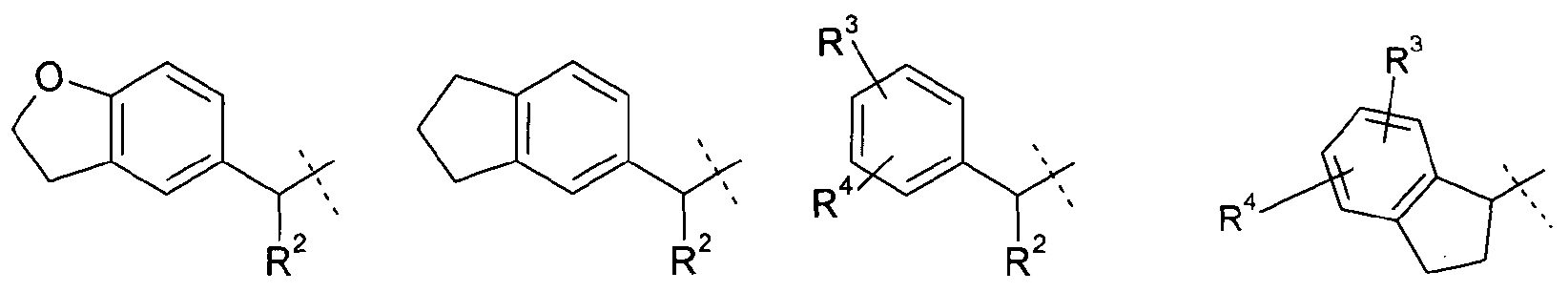
R1 означает группу, выбираемую из группы, состоящей из
 ,
,
где
R2 означает водород или С1-4-алкильную группу;
R3 означает водород, галоген, CF3, CN или С1-4-алкил; и
R4 означает водород, галоген или С1-4-алкил;
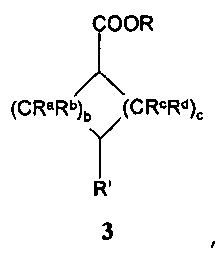
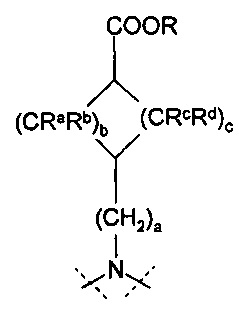
a=0, 1 или 2, b=0, 1, 2 или 3, с=1, 2 или 3, и
Ra, Rb, Rc и Rd означают, независимо друг от друга, Н или С1-4-алкил;
Х означает С2-алифатический углеводородный мостик, необязательно содержащий двойную связь или тройную связь или гетероатом, выбираемый из О и S, или -СН(СН2)СН-;
Y означает водород, галоген, С1-4-алкил, С1-4-алкокси или С1-4-гидроксиалкил;
Z означает С1-4-алифатический углеводородный мостик, необязательно содержащий одну двойную связь и/или один или более гетероатомов, выбираемых из O, S, NH и N(CH3), или означает С2-4-алифатический углеводородный мостик, конденсированный с С3-6-циклоалкилом, необязательно содержащий одну или более двойных связей, или с фенильным кольцом, или означает С1-4-алифатический углеводородный мостик, замещенный спиро-С3-6-циклоалкилом, необязательно содержащий одну или более двойных связей;
или к его фармацевтически приемлемой соли или стереоизомеру, или к фармацевтически приемлемой соли стереоизомера.
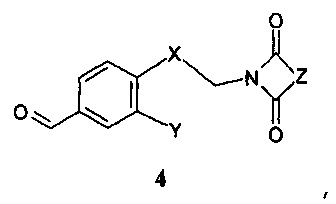
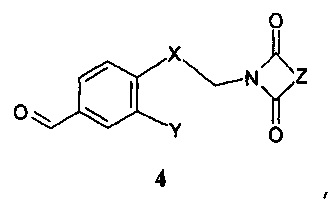
В соответствии с другим аспектом настоящего изобретения, данное изобретение относится к способу получения соединения формулы 1 или его фармацевтически приемлемой соли, стереоизомера или фармацевтически приемлемой соли стереоизомера, включающему стадии восстановительного аминирования бензальдегида формулы 4:
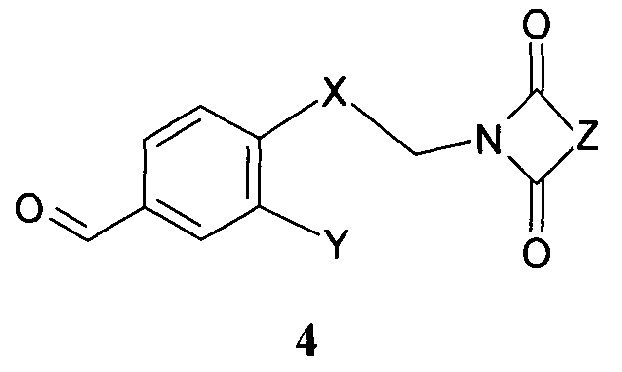 ,
,
где Х, Y и Z имеют значения, как описано выше,
с помощью первичного амина формулы 5:
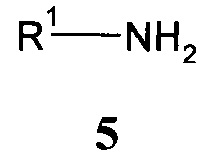 ,
,
где R1 имеет значение, как описано выше,
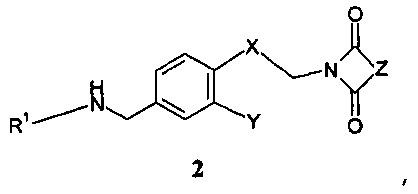
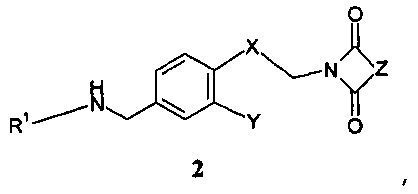
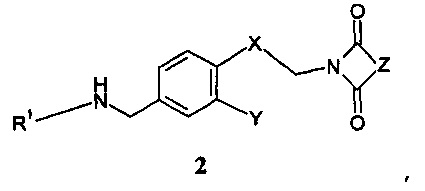
введения во взаимодействие полученного вторичного амина формулы 2:
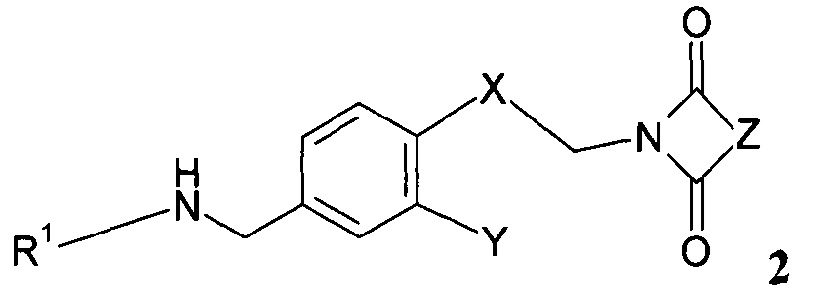 ,
,
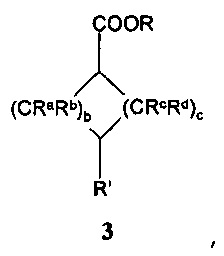
с эфиром формил- или оксоциклоалканкарбоновой кислоты формулы 3:
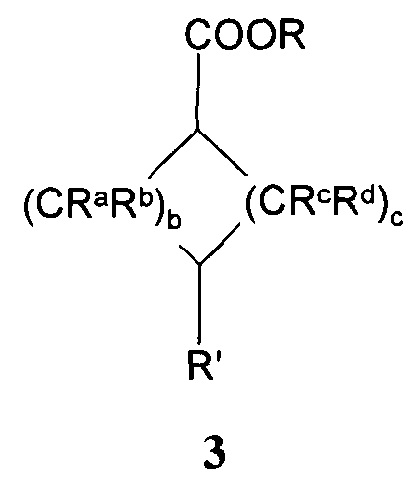 ,
,
где R, Ra, Rb, Rc, Rd, b и с имеют значения, как описано выше, и R' означает -СНО или =О;
и, необязательно, гидролиза полученного сложного эфира формулы 1.
В соответствии с другим аспектом настоящего изобретения, данное изобретение относится к фармацевтической композиции, содержащей, по меньшей мере, одно соединение формулы 1 или его фармацевтически приемлемую соль, стереоизомер или фармацевтически приемлемую соль стереоизомера и, по меньшей мере, один фармацевтически приемлемый эксципиент.
В соответствии с дальнейшим аспектом настоящего изобретения, данное изобретение относится к соединениям формулы 1 или их фармацевтически приемлемым солям, стереоизомерам или фармацевтически приемлемым солям стереоизомеров для применения при превентивном и/или терапевтическом лечении заболевания или нарушения, опосредуемого рецептором CXCR3, в особенности, заболевания или нарушения, выбираемого из группы, состоящей из COPD, псориаза, отторжения имплантата/трансплантата, офтальмологического заболевания, глютеновой болезни, воспалительных заболеваний пищеварительного тракта (IBD), диабета типа 1, тяжелой псевдопаралитической миастении (MG), рассеянного склероза (MS) и других нейровоспалительных заболеваний, волчанки, ревматоидного артрита (RA) или красного плоского лишая.
В дополнение, настоящее изобретение относится к способу лечения заболевания или нарушения, опосредуемого рецептором CXCR3, в особенности, заболевания или нарушения, выбираемого из группы, состоящей из COPD, псориаза, отторжения имплантата/трансплантата, офтальмологического заболевания, глютеновой болезни, воспалительных заболеваний пищеварительного тракта (IBD), диабета типа 1, тяжелой псевдопаралитической миастении (MG), рассеянного склероза (MS) и других нейровоспалительных заболеваний, волчанки, ревматоидного артрита (RA) или красного плоского лишая, включающему введение эффективного количества соединения формулы 1 или его фармацевтически приемлемой соли или стереоизомера или фармацевтически приемлемой соли стереоизомера пациенту, нуждающемуся в этом.
Как используется выше и по всему описанию данного изобретения, подразумевают, что следующие термины, за исключением иначе указанного, имеют следующие значения:
С1-4-алкильная группа представляет собой алкильную группу с линейной или разветвленной цепью, имеющую 1-4 атома углерода, как, например, метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа и т.п.
С1-4-алкоксильная группа представляет собой вышеуказанную алкильную группу, имеющую 1-4 атома углерода и присоединенную через атом кислорода, как, например, метоксигруппа, этоксигруппа, пропоксигруппа, изопропоксигруппа, бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа, трет-бутоксигруппа и т.п.
С1-4-гидроксиалкильная группа представляет собой вышеуказанную алкильную группу, имеющую 1-4 атома углерода и включающую одну или более гидроксильных групп, как, например, гидроксиметильная группа, 1-гидроксиэтильная группа, 2-гидроксиэтильная группа, 1-, 2- или 3-гидрокси-н-пропильная группа, 1- или 2-гидроксиизопропильная группа и т.п.
Атом галогена представляет собой атом фтора, хлора, брома или йода.
С2-алифатический углеводородный мостик, необязательно содержащий двойную или тройную связь или гетероатом, выбираемый из О и S, представляет собой алкандиильную группу, имеющую 2 атома углерода и, необязательно, содержащую двойную или тройную связь или гетероатом, выбираемый из О и S, как, например, -СН2-СН2-, -СН=СН-, -С≡С-, -О-СН2-, -S-CH2- и т.п.
С1-4-алифатический углеводородный мостик, необязательно содержащий одну двойную связь и/или один или более гетероатомов, выбираемых из O, S, NH и N(CH3), представляет собой алкандиильную группу, имеющую 1-4 атома углерода и, необязательно, содержащую одну двойную связь и/или один или более гетероатомов, выбираемых из O, S, NH и N(CH3), как, например, -СН2-СН2-, -СН2-О-, -СН2-S-, -СН2-NH-, -СН2-N(CH3)-, -СН2-СН2-СН2-, -CH=CH-N(CH3)-, -N=CH-N(CH3)- и т.п.
С2-4-алифатический углеводородный мостик, конденсированный с С3-6-циклоалкилом, необязательно содержащий одну или более двойных связей, или с фенильным кольцом, означает алкандиильную группу, имеющую 2-4 атома углерода и конденсированную с циклоалкилом, имеющим 3-6 атомов углерода, и, необязательно, содержащую одну или более двойных связей, или с фенильным кольцом, как, например, циклопропандиил,
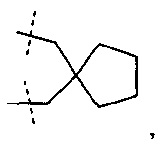
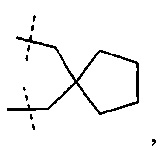
С1-4-алифатический углеводородный мостик, замещенный спиро- С3-6-циклоалкилом, необязательно содержащий одну или более двойных связей, представляет собой алкандиильную группу, имеющую 1-4 атома углерода и замещенную спироциклоалкилом, имеющим 3-6 атомов углерода, и необязательно содержащую одну или более двойных связей, представляет собой, например:
 .
.
В этой формуле связь, пересеченная пунктирной линией  означает присоединение заместителя к другим частям соединения.
означает присоединение заместителя к другим частям соединения.
Солями соединений формулы 1 авторы настоящего изобретения обозначают соли, образованные с неорганическими и органическими кислотами. Предпочтительные соли представляют собой таковые, образованные с фармацевтически приемлемыми кислотами, как, например, соляная кислота и т.п. Соли, образованные во время очистки или выделения, также являются объектом данного изобретения.
Соединения, представленные вышеуказанной формулой 1, могут иметь один или более асимметрических атомов углерода. Таким образом, эти соединения могут существовать в форме оптических изомеров, энантиомеров или диастереоизомеров.
Соединения формулы 1 также могут существовать в виде цис(Z)- или транс(Е)-изомеров.
Эти стереоизомеры, энантиомеры и диастереоизомеры, а также их смеси, включая рацематы, также являются объектом данного изобретения.
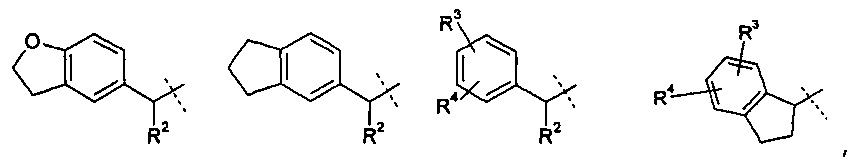
Одно из воплощений настоящего изобретения включает соединения формулы 1, где
R означает водород или С1-4-алкил;
R1 означает группу, выбираемую из группы, состоящей из
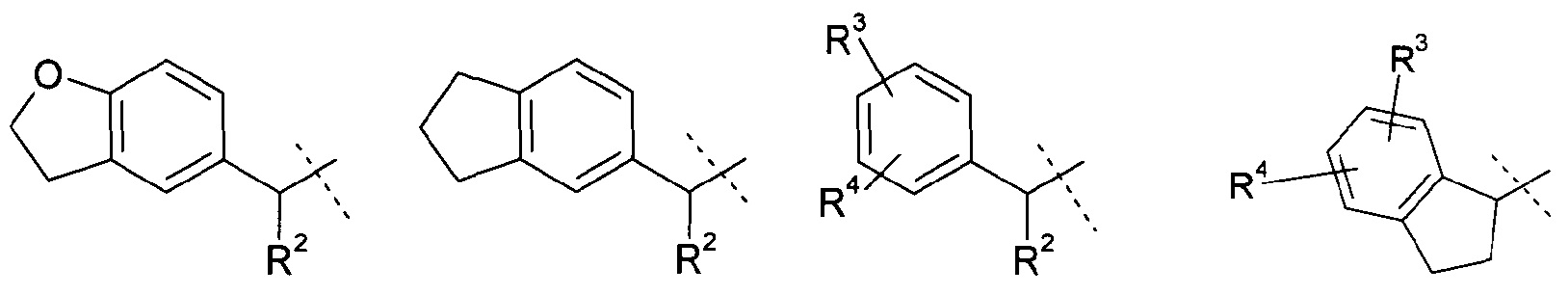 ,
,
где
R2 означает водород или С1-4-алкил;
R3 означает водород, галоген, CF3, CN или С1-4-алкил; и
R4 означает водород, галоген или С1-4-алкил;
a=0 или 1; b=0, 1 или 2, с=1, 2 или 3; и
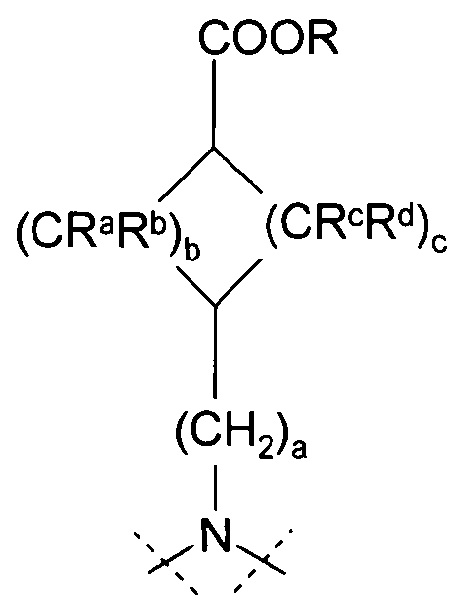
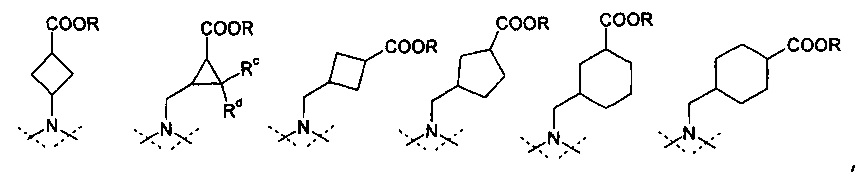
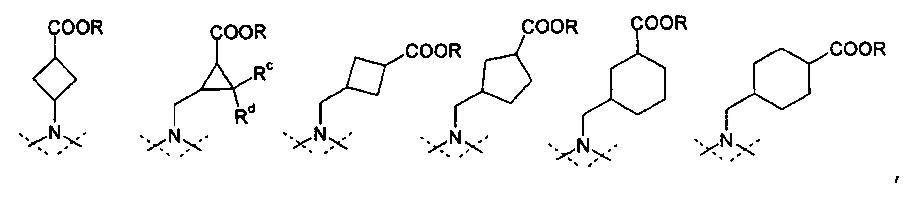
представляет собой циклоалканкарбоновую кислоту или ее эфир, выбираемый из группы, состоящей из:
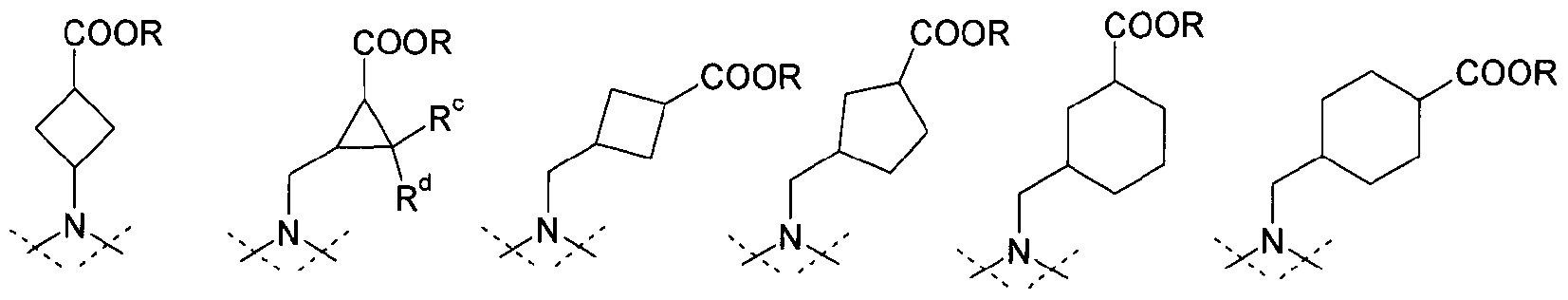 ,
,
где Rc и Rd означают, независимо друг от друга, Н или С1-4-алкил;
Х означает -О-СН2-, -S-СН2-, -CH=CH-, -СН2-СН2-, -C≡C- или циклопропандиил;
Y означает водород, галоген, С1-4-алкил, С1-4-алкокси или С1-4-гидроксиалкил;
Z означает С1-4-алифатический углеводородный мостик, необязательно содержащий одну двойную связь и/или один или более гетероатомов, выбираемых из O, S, NH и N(CH3), или означает С2-4-алифатический углеводородный мостик, конденсированный с С3-6-циклоалкилом, необязательно содержащий одну или более двойных связей, или с фенильным кольцом, или означает С1-4-алифатический углеводородный мостик, замещенный спиро-С3-6-циклоалкилом, необязательно содержащий одну или более двойных связей,
или его фармацевтически приемлемую соль или стереоизомер или фармацевтически приемлемую соль стереоизомера.
Другое воплощение настоящего изобретения включает соединения формулы 1, где R означает водород, или их фармацевтически приемлемую соль или стереоизомер или фармацевтически приемлемую соль стереоизомера.
Другое воплощение настоящего изобретения включает соединения формулы 1, где R1 означает группу, выбираемую из группы, состоящей из:
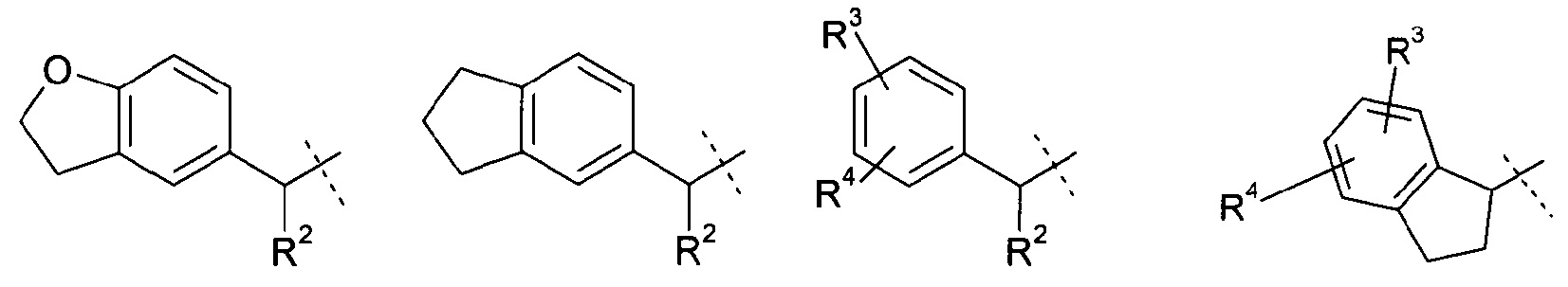 ,
,
где
R2 означает метил или этил;
R3 означает хлор, фтор, CF3, CN, метил или этил; и
R4 означает водород, хлор, фтор или метил;
или их фармацевтически приемлемые соли или стереоизомеры или фармацевтически приемлемые соли стереоизомеров.
Другое воплощение настоящего изобретения включает соединения формулы 1, где R1 означает группу, выбираемую из группы, состоящей из:
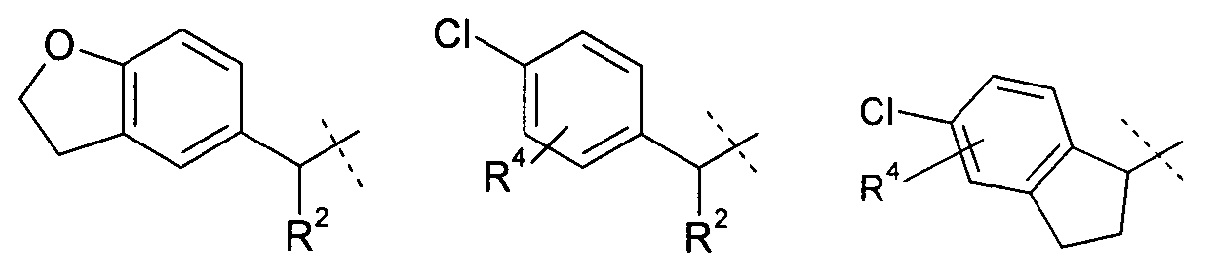 ,
,
где
R2 означает метил или этил; и
R4 означает водород, хлор или фтор;
или их фармацевтически приемлемые соли или стереоизомеры или фармацевтически приемлемые соли стереоизомеров.
Другое воплощение настоящего изобретения включает соединения формулы 1, где R1 означает группу, выбираемую из группы, состоящей из:
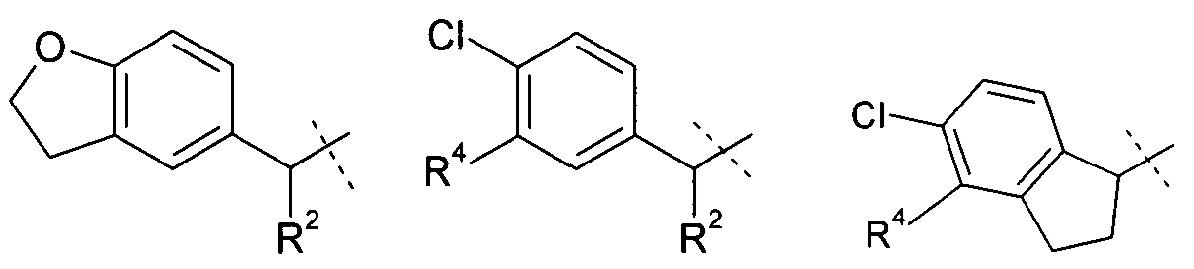 ,
,
где
R2 означает метил или этил; и
R4 означает водород, хлор или фтор;
или их фармацевтически приемлемые соли или стереоизомеры или фармацевтически приемлемые соли стереоизомеров.
Другое воплощение настоящего изобретения включает соединения формулы 1, где Х означает -О-СН2-, -S-СН2- или -СН2-СН2-; или их фармацевтически приемлемые соли или стереоизомеры или фармацевтически приемлемые соли стереоизомеров.
Другое воплощение настоящего изобретения включает соединения формулы 1, где Y означает водород, хлор, фтор, метил, этил, метокси или -СН2-ОН; или их фармацевтически приемлемые соли или стереоизомеры или фармацевтически приемлемые соли стереоизомеров.
Другое воплощение настоящего изобретения включает соединения формулы 1, где Y означает этил или метокси; или их фармацевтически приемлемые соли или стереоизомеры или фармацевтически приемлемые соли стереоизомеров.
Другое воплощение настоящего изобретения включает соединения формулы 1, где Z означает -(CH2)2, -(CH2)3-, -CH2-O-, -CH2-S-, -CH2-N(CH3)-, -CH=CH-N(CH3)-, -N=CH-N(CH3)-, циклопропандиил,
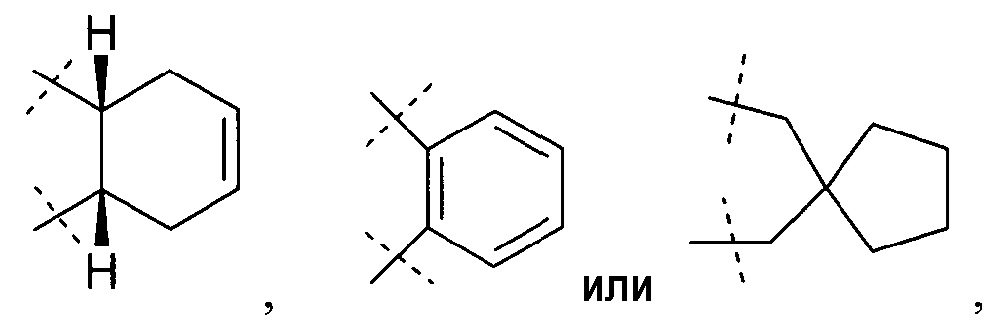
или их фармацевтически приемлемые соли или стереоизомеры или фармацевтически приемлемые соли стереоизомеров.
Другое воплощение настоящего изобретения включает соединения формулы 1, где Z означает -(CH2)2 или -CH2-N(CH3)-; или их фармацевтически приемлемые соли или стереоизомеры или фармацевтически приемлемые соли стереоизомеров.
Другое воплощение настоящего изобретения включает соединения формулы 1, где
R означает водород, метил или этил;
R1 означает группу, выбираемую из группы, состоящей из
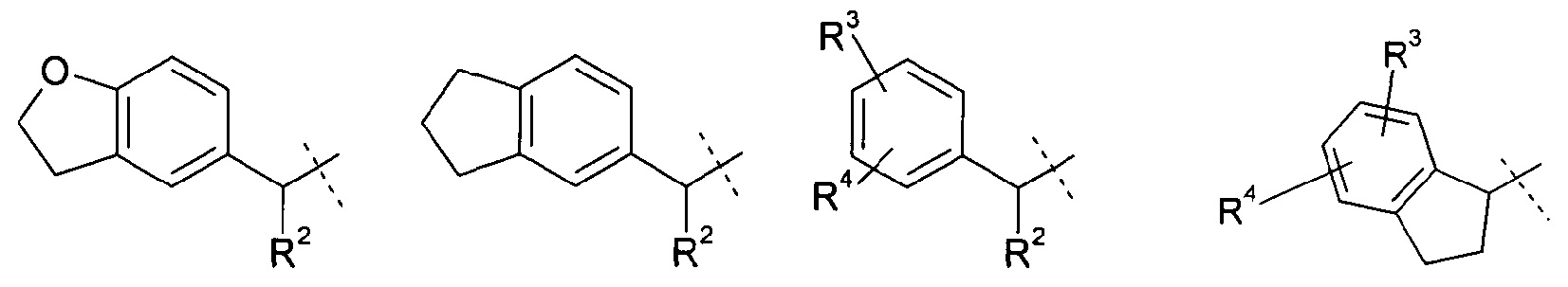 ,
,
где
R2 означает водород, метил или этил;
R3 означает водород, хлор, фтор, CF3, CN, метил или этил; и
R4 означает водород, хлор, фтор, метил или этил;
a=0 или 1; b=0, 1 или 2, с=1, 2 или 3; и
представляет собой циклоалканкарбоновую кислоту или ее эфир, выбираемый из группы, состоящей из:
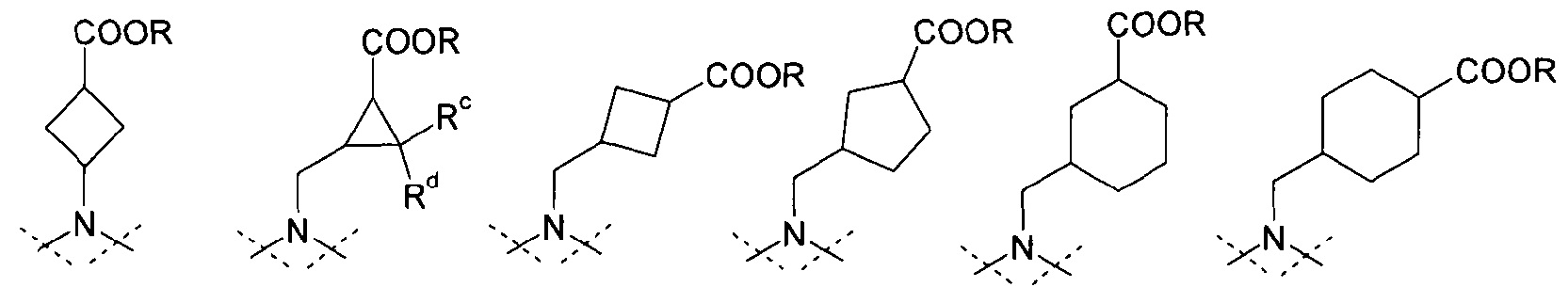 ,
,
где Rc и Rd означают, независимо друг от друга, Н или метил или этил;
Х означает -О-СН2-, -S-СН2-, -CH=CH-, -СН2-СН2-, -C≡C- или циклопропандиил;
Y означает хлор, фтор, метил, этил, метокси или -СН2-ОН;
Z означает -(CH2)2, -(CH2)3-, -CH2-O-, -CH2-S-, -CH2-N(CH3)-, -CH=CH-N(CH3)-, -N=CH-N(CH3)-, -СН(СН2)СН-,
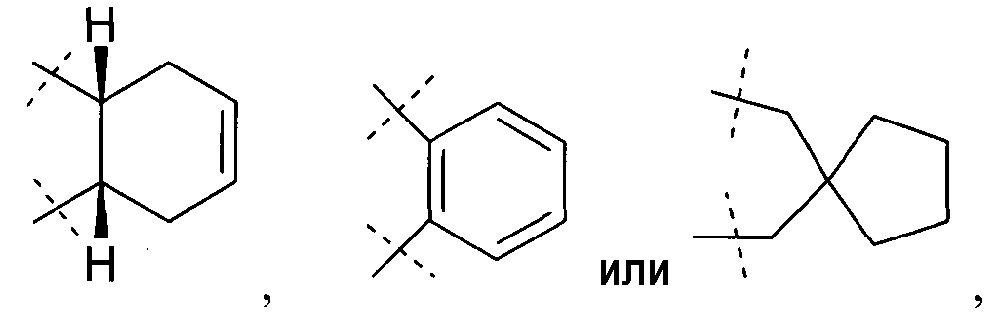
или их фармацевтически приемлемые соли или стереоизомеры или фармацевтически приемлемые соли стереоизомеров.
В особенности, соединения согласно настоящему изобретению, представленные формулой 1, включают соединения, выбираемые из группы, состоящей из:
1. транс-4-[([1-(2,3-дигидро-1-бензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
1.1. этилового эфира транс-4-[([1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
2. цис-4-[([1-(2,3-дигидро-1-бензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
3. транс-4-[([(R)-1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
4. транс-4-[([(S)-1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
5. транс-4-[([(S)-1-(4-хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
6. транс-4-[([(R)-1-(4-хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
7. транс-4-[([(S)-1-(4-хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)метил]циклогексанкарбоновой кислоты;
8. цис-4-[([(S)-1-(4-хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)метил]циклогексанкарбоновой кислоты;
9. транс-4-[([(R)-1-(4-хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)метил]циклогексанкарбоновой кислоты;
10. транс-4-[((5-хлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
11. транс-4-[(((R)-5-хлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
12. транс-4-[(((S)-5-хлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
13. цис-4-[((5-хлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
14. гидрохлорида транс-4-[(((S)-4,5-дихлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
15. транс-4-[([1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,4-диоксотиазолидин-3-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
16. транс-4-({{3-хлор-4-[2-(2,5-диоксопирролидин-1-ил)этокси]бензил}-[1-(2,3-дигидробензофуран-5-ил)этил]амино}метил)циклогексанкарбоновой кислоты;
17. транс-4-[([1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)метил]циклогексанкарбоновой кислоты;
18. транс-4-[([1-(2,3-дигидробензофуран-5-ил)пропил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
19. транс-4-[([1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,4-диоксооксазолидин-3-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
20. транс-4-[((5-хлориндан-1-ил)-{3-хлор-4-[2-(3-метил-2,5-диоксоимидазолидин-1-ил)этокси]бензил}амино)метил]циклогексанкарбоновой кислоты;
21. транс-4-{[{3-хлор-4-[2-(2,5-диоксопирролидин-1-ил)этокси]бензил}-(5-хлориндан-1-ил)амино]метил}циклогексанкарбоновой кислоты;
22. транс-4-({{3-хлор-4-[2-(3-метил-2,5-диоксоимидазолидин-1-ил)этокси]бензил}-[1-(2,3-дигидробензофуран-5-ил)этил]амино}метил)циклогексанкарбоновой кислоты;
23. транс-4-({{3-хлор-4-[2-(3-метил-2,5-диоксоимидазолидин-1-ил)этокси]бензил}-[(S)-1-(4-хлорфенил)этил]амино}метил)циклогексанкарбоновой кислоты;
24. транс-4-[((5-хлориндан-1-ил)-{4-[2-(2,4-диоксотиазолидин-3-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
25. транс-4-[([1-(4-хлор-3-метилфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
26. транс-4-[([(S)-1-(4-хлор-3-метилфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
27. транс-4-[([(R)-1-(4-хлор-3-метилфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
28. транс-4-[([1-(2,3-дигидробензофуран-5-ил)пропил]-{3-метокси-4-[2-(3-метил-2,5-диоксоимидазолидин-1-ил)этокси]бензил}амино)метил]циклогексанкарбоновой кислоты;
29. транс-4-[((5-хлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)метил]циклогексанкарбоновой кислоты;
30. транс-4-[(((S)-5-хлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)метил]циклогексанкарбоновой кислоты;
31. транс-4-[(((R)-5-хлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)метил]циклогексанкарбоновой кислоты;
32. транс-4-({{3-хлор-4-[2-(2,5-диоксопирролидин-1-ил)этокси]бензил}-[(S)-1-(4-хлорфенил)этил]амино}метил)циклогексанкарбоновой кислоты;
33. транс-4-[([1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,4-диоксотиазолидин-3-ил)этокси]-3-метилбензил}амино)метил]циклогексанкарбоновой кислоты;
34. транс-4-[([(S)-1-(4-хлорфенил)этил]-{4-[2-(2,4-диоксотиазолидин-3-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
35. транс-4-[([1-(2,3-дигидробензофуран-5-ил)этил]-{4-[(Е)-3-(2,5-диоксопирролидин-1-ил)пропенил]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
36. транс-4-[([(S)-1-(4-хлорфенил)этил]-{4-[2-(2,4-диоксооксазолидин-3-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
37. транс-4-[([(S)-1-(4-хлорфенил)этил]-{3-метокси-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензил}амино)метил]циклогексанкарбоновой кислоты;
38. транс-4-[([1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,6-диоксопиперидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
39. транс-4-[([(S)-1-(4-хлорфенил)этил]-{3-метил-4-[2-(3-метил-2,5-диоксоимидазолидин-1-ил)этокси]бензил}амино)метил]циклогексанкарбоновой кислоты;
40. транс-4-[([1-(2,3-дигидробензофуран-5-ил)этил]-{4-[3-(2,5-диоксопирролидин-1-ил)пропил]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
41. 3-[([1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
42. транс-4-[((5-хлор-6-метилиндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
43. транс-4-[((5-хлор-4-метилиндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
44. транс-4-[((5-хлориндан-1-ил)-{4-[3-(2,5-диоксопирролидин-1-ил)пропил]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
45. транс-4-[(((R)-5-хлориндан-1-ил)-{4-[3-(2,5-диоксопирролидин-1-ил)пропил]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
46. транс-4-[(((S)-5-хлориндан-1-ил)-{4-[3-(2,5-диоксопирролидин-1-ил)пропил]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
47. транс-4-({{3-хлор-4-[3-(2,5-диоксопирролидин-1-ил)пропил]бензил}-[1-(2,3-дигидробензофуран-5-ил)этил]амино}метил)циклогексанкарбоновой кислоты;
48. транс-4-[((5-хлориндан-1-ил)-{3-метокси-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензил}амино)метил]циклогексанкарбоновой кислоты;
49. транс-4-[([1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-илметил)циклопропил]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
50. транс-4-[((5-хлориндан-1-ил)-{3-метокси-4-[3-(3-метил-2,5-диоксоимидазолидин-1-ил)пропил]бензил}амино)метил]циклогексанкарбоновой кислоты;
51. транс-4-[([(S)-1-(4-хлорфенил)этил]-{3-метокси-4-[3-(3-метил-2,5-диоксоимидазолидин-1-ил)пропил]бензил}амино)метил]циклогексанкарбоновой кислоты;
52. транс-4-[((5-хлориндан-1-ил)-{3-метокси-4-[2-(3-метил-2,5-диоксоимидазолидин-1-ил)этокси]бензил}амино)метил]циклогексанкарбоновой кислоты;
53. транс-4-[([(S)-1-(4-хлорфенил)этил]-{3-метокси-4-[2-(3-метил-2,5-диоксоимидазолидин-1-ил)этокси]бензил}амино)метил]циклогексанкарбоновой кислоты;
54. транс-4-[([(S)-1-(4-хлорфенил)этил]-{4-[3-(2,5-диоксопирролидин-1-ил)пропил]-3-метилбензил}амино)метил]циклогексанкарбоновой кислоты;
55. транс-4-[([(S)-1-(4-хлорфенил)этил]-{4-[3-(2,5-диоксопирролидин-1-ил)проп-1-инил]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
56. транс-4-[([(S)-1-(4-хлорфенил)этил]-{4-[3-(2,5-диоксопирролидин-1-ил)пропил]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
57. транс-4-[((5-хлориндан-1-ил)-{3-метил-4-[2-(3-метил-2,5-диоксоимидазолидин-1-ил)этокси]бензил}амино)метил]циклогексанкарбоновой кислоты;
58. транс-4-[([(S)-1-(4-хлорфенил)этил]-{3-метил-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензил}амино)метил]циклогексанкарбоновой кислоты;
59. транс-4-[([1-(2,3-дигидробензофуран-5-ил)этил]-{3-метокси-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензил}амино)метил]циклогексанкарбоновой кислоты;
60. транс-4-[([1-(2,3-дигидробензофуран-5-ил)этил]-{3-метил-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензил}амино)метил]циклогексанкарбоновой кислоты;
61. транс-4-[([1-(4-цианофенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)метил]циклогексанкарбоновой кислоты;
62. транс-4-[([1-(4-цианофенил)этил]-{3-метокси-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензил}амино)метил]циклогексанкарбоновой кислоты;
63. транс-4-[([1-(4-хлорфенил)пропил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
64. транс-4-[([1-(4-хлорфенил)пропил]-{3-метил-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензил}амино)метил]циклогексанкарбоновой кислоты;
65. транс-4-[([1-(4-хлорфенил)пропил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)метил]циклогексанкарбоновой кислоты;
66. транс-4-[([1-(2,3-дигидробензофуран-5-ил)пропил]-{4-[3-(2,5-диоксопирролидин-1-ил)пропил]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
67. транс-4-[([1-(4-хлорфенил)пропил]-{3-метокси-4-[2-(3-метил-2,5-диоксоимидазолидин-1-ил)этокси]бензил}амино)метил]циклогексанкарбоновой кислоты;
68. транс-4-[([1-(4-хлорфенил)пропил]-{3-метокси-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензил}амино)метил]циклогексанкарбоновой кислоты;
69. транс-4-[([1-(2,3-дигидробензофуран-5-ил)пропил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)метил]циклогексанкарбоновой кислоты;
70. транс-4-[([1-(4-хлорфенил)пропил]-{3-метил-4-[2-(3-метил-2,5-диоксоимидазолидин-1-ил)этокси]бензил}амино)метил]циклогексанкарбоновой кислоты;
71. транс-4-[(((S)-5-хлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-этилбензил}амино)метил]циклогексанкарбоновой кислоты;
72. транс-4-[(((S)-5-хлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-фторбензил}амино)метил]циклогексанкарбоновой кислоты;
73. транс-4-[([(S)-1-(4-хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-фторбензил}амино)метил]циклогексанкарбоновой кислоты;
74. транс-4-[(((S)-5,6-дихлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
75. транс-4-[([(S)-1-(4-хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-этилбензил}амино)метил]циклогексанкарбоновой кислоты;
76. транс-4-[([1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-этилбензил}амино)метил]циклогексанкарбоновой кислоты;
77. транс-4-[([1-(3,4-дихлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
78. транс-4-[([1-(3,4-дихлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)метил]циклогексанкарбоновой кислоты;
79. транс-4-[([(S)-1-(4-хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]бензил}амино)метил]циклогексанкарбоновой кислоты;
80. транс-4-[([1-(3,4-дихлорфенил)этил]-{3-метил-4-[2-(3-метил-2,5-диоксоимидазолидин-1-ил)этокси]бензил}амино)метил]циклогексанкарбоновой кислоты;
81. транс-4-({{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}-[1-(4-этилфенил)этил]амино}метил)циклогексанкарбоновой кислоты;
82. транс-4-[([1-(4-хлор-3-фторфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
83. транс-4-{[{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}-(1-п-толилэтил)амино]метил}циклогексанкарбоновой кислоты;
84. транс-4-{[{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}-(1-п-толилэтил)амино]метил}циклогексанкарбоновой кислоты;
85. транс-4-[([(S)-1-(4-хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-гидроксиметилбензил}амино)метил]циклогексанкарбоновой кислоты;
86. транс-4-[(((S)-4,5-дихлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-этилбензил}амино)метил]циклогексанкарбоновой кислоты;
87. транс-4-[([(S)-1-(4-хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этилсульфанил]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
88. транс-4-[(((S)-5-хлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этилсульфанил]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
89. транс-4-[([1-(4-хлор-3-фторфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-этилбензил}амино)метил]циклогексанкарбоновой кислоты;
90. транс-4-[([(R)-1-(4-хлор-3-фторфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-этилбензил}амино)метил]циклогексанкарбоновой кислоты;
91. транс-4-[([(S)-1-(4-хлор-3-фторфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-этилбензил}амино)метил]циклогексанкарбоновой кислоты;
92. транс-4-[([1-(4-хлор-3-фторфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-фторбензил}амино)метил]циклогексанкарбоновой кислоты;
93. транс-4-[((4-хлор-5-фториндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
94. транс-4-[((6-хлор-5-фториндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
95. транс-4-[((6-хлор-5-фториндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-этилбензил}амино)метил]циклогексанкарбоновой кислоты;
96. транс-4-[((4-хлор-5-фториндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-этилбензил}амино)метил]циклогексанкарбоновой кислоты;
97. транс-4-[((6-хлор-5-фториндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-фторбензил}амино)метил]циклогексанкарбоновой кислоты;
98. транс-4-[((5-хлор-6-фториндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
99. (1R,3R)-3-[([(S)-1-(4-хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклопентанкарбоновой кислоты;
100. (1S,3S)-3-[([(S)-1-(4-хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклопентанкарбоновой кислоты;
101. (1R,3S)-3-[([(S)-1-(4-хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклопентанкарбоновой кислоты;
102. (1S,3R)-3-[([(S)-1-(4-хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклопентанкарбоновой кислоты;
103. (1R,3S)-3-[([(R)-1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклопентанкарбоновой кислоты;
104. (1R,3R)-3-[([(R)-1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклопентанкарбоновой кислоты;
105. (1R,3R)-3-[([(S)-1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклопентанкарбоновой кислоты;
106. (1S,3R)-3-[([(S)-1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклопентанкарбоновой кислоты;
107. (1R,3S)-3-[([(S)-1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклопентанкарбоновой кислоты;
108. (1S,3R)-3-[([(R)-1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклопентанкарбоновой кислоты;
109. (1S,3S)-3-[([(R)-1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклопентанкарбоновой кислоты;
110. (1S,3S)-3-[([(S)-1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклопентанкарбоновой кислоты;
111. этилового эфира (1R,2R)-2-[([1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклопропанкарбоновой кислоты;
112. (1R,2R)-2-[([1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклопропанкарбоновой кислоты;
113. этилового эфира (1S,2R)-2-[([1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклопропанкарбоновой кислоты;
114. (1S,2R)-2-[([1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклопропанкарбоновой кислоты;
115. (1R,3R)-3-[([1-(4-хлорфенил)пропил]-{3-метил-4-[2-(3-метил-2,5-диоксоимидазолидин-1-ил)этокси]бензил}амино)метил]-2,2-диметилциклопропанкарбоновой кислоты;
116. (1S,3S)-3-[([1-(4-хлорфенил)пропил]-{3-метокси-4-[2-(3-метил-2,5-диоксоимидазолидин-1-ил)этокси]бензил}амино)метил]-2,2-диметилциклопропанкарбоновой кислоты;
117. (1S,3S)-3-[([1-(4-хлорфенил)пропил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]-2,2-диметилциклопропанкарбоновой кислоты;
118. (1R,3R)-3-[([1-(4-хлорфенил)пропил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)метил]-2,2-диметилциклопропанкарбоновой кислоты;
119. 1-[((5-хлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклопропанкарбоновой кислоты;
120. транс-3-([1-(2,3-дигидробензофуран-5-ил)этил]-{3-метокси-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензил}амино)циклобутанкарбоновой кислоты;
121. цис-3-([1-(2,3-дигидробензофуран-5-ил)этил]-{3-метокси-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензил}амино)циклобутанкарбоновой кислоты;
122. цис-3-([(R)-1-(2,3-дигидробензофуран-5-ил)этил]-{3-метокси-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензил}амино)циклобутанкарбоновой кислоты;
123. цис-3-([(S)-1-(2,3-дигидробензофуран-5-ил)этил]-{3-метокси-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензил}амино)циклобутанкарбоновой кислоты;
124. транс-3-([1-(4-хлор-3-фторфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)циклобутанкарбоновой кислоты;
125. цис-3-([1-(4-хлор-3-фторфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)циклобутанкарбоновой кислоты;
126. 3-([1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)циклобутанкарбоновой кислоты;
127. 3-((5-хлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)циклобутанкарбоновой кислоты;
128. транс-3-([(R)-1-(4-хлор-3-метилфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)циклобутанкарбоновой кислоты;
129. цис-3-([(R)-1-(4-хлор-3-метилфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)циклобутанкарбоновой кислоты;
130. транс-3-([(S)-1-(4-хлор-3-метилфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)циклобутанкарбоновой кислоты;
131. цис-3-([(S)-1-(4-хлор-3-метилфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)циклобутанкарбоновой кислоты;
132. цис-3-([(R)-1-(4-хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)циклобутанкарбоновой кислоты;
133. цис-3-((5-хлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)циклобутанкарбоновой кислоты;
134. цис-3-([1-(2,3-дигидробензофуран-5-ил)этил]-{3-метил-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензил}амино)циклобутанкарбоновой кислоты;
135. цис-3-([1-(2,3-дигидробензофуран-5-ил)пропил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)циклобутанкарбоновой кислоты;
136. цис-3-([(R)-1-(4-хлорфенил)этил]-{3-метил-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензил}амино)циклобутанкарбоновой кислоты;
137. цис-3-([1-(3,4-дихлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)циклобутанкарбоновой кислоты;
138. цис-3-([1-(3,4-дихлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)циклобутанкарбоновой кислоты;
139. цис-3-([1-(3,4-дихлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-этилбензил}амино)циклобутанкарбоновой кислоты;
140. цис-3-([1-(4-хлор-3-фторфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-этилбензил}амино)циклобутанкарбоновой кислоты;
141. цис-3-([1-(3,4-дихлорфенил)пропил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)циклобутанкарбоновой кислоты;
142. цис-3-([1-(4-хлор-3-фторфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)циклобутанкарбоновой кислоты;
143. цис-3-([(R)-1-(4-хлорфенил)этил]-{4-[3-(2,5-диоксопирролидин-1-ил)пропил]-3-метилбензил}амино)циклобутанкарбоновой кислоты;
144. транс-4-{[{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}-(1-индан-5-илэтил)амино]метил}циклогексанкарбоновой кислоты;
145. транс-4-[((1-индан-5-илэтил)-{3-метокси-4-[2-(3-метил-2,5-диоксоимидазолидин-1-ил)этокси]бензил}амино)метил]циклогексанкарбоновой кислоты;
146. -4-[(((S)-5-хлориндан-1-ил)-{4-[2-(2,4-диоксо-3-азабицикло[3.1.0]гекс-3-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
147. 4-[(((S)-5-хлориндан-1-ил)-{4-[2-(7,9-диоксо-8-азаспиро[4.5]дец-8-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
148. транс-4-[(((S)-5-хлор-4-фториндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
149. транс-4-[(((S)-5-хлор-4-фториндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-этилбензил}амино)метил]циклогексанкарбоновой кислоты;
150. цис-3-([(R)-1-(4-хлор-3-фторфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)циклобутанкарбоновой кислоты;
151. цис-3-([(R)-1-(4-хлор-3-фторфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-этилбензил}амино)циклобутанкарбоновой кислоты;
152. цис-3-([(R)-1-(3,4-дихлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)циклобутанкарбоновой кислоты;
153. цис-3-([(R)-1-(4-хлорфенил)этил]-{3-метил-4-[2-(3-метил-2,5-диоксоимидазолидин-1-ил)этокси]бензил}амино)циклобутанкарбоновой кислоты;
154. транс-4-({{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}-[1-(4-трифторметилфенил)этил]амино}метил)циклогексанкарбоновой кислоты;
155. гидрохлорида транс-4-[(((S)-5-хлориндан-1-ил)-{4-[2-((3aS,7aR)-1,3-диоксо-1,3,3а,4,7,7а-гексагидроизоиндол-2-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
156. гидрохлорида транс-4-[(((S)-5-хлориндан-1-ил)-{4-[2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
157. транс-4-[(((S)-5-хлор-4-фториндан-1-ил)-{3-метил-4-[2-(3-метил-2,5-диоксоимидазолидин-1-ил)этокси]бензил}амино)метил]циклогексанкарбоновой кислоты;
158. 3-[(((S)-5-хлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклобутанкарбоновой кислоты;
159. цис-3-(((R)-1-индан-5-илэтил)-{3-метокси-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензил}амино)циклобутанкарбоновой кислоты;
160. транс-3-(((R)-1-индан-5-илэтил)-{3-метокси-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензил}амино)циклобутанкарбоновой кислоты;
или их фармацевтически приемлемые соли или стереоизомеры или фармацевтически приемлемые соли стереоизомеров.
Отдельная группа соединений согласно настоящему изобретению, представленных формулой 1, включает соединения, выбираемые из группы, состоящей из:
транс-4-[([1-(2,3-дигидро-1-бензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[([(S)-1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[([(S)-1-(4-хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[([(R)-1-(4-хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[([(S)-1-(4-хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[([(R)-1-(4-хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[((5-хлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[(((S)-5-хлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
гидрохлорида транс-4-[(((S)-4,5-дихлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[([1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,4-диоксотиазолидин-3-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-({{3-хлор-4-[2-(2,5-диоксопирролидин-1-ил)этокси]бензил}-[1-(2,3-дигидробензофуран-5-ил)этил]амино}метил)циклогексанкарбоновой кислоты;
транс-4-[([1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[([1-(2,3-дигидробензофуран-5-ил)пропил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[([1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,4-диоксооксазолидин-3-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[((5-хлориндан-1-ил)-{4-[2-(2,4-диоксотиазолидин-3-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[([1-(4-хлор-3-метилфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[([(S)-1-(4-хлор-3-метилфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[(((S)-5-хлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[([1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,4-диоксотиазолидин-3-ил)этокси]-3-метилбензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[([(S)-1-(4-хлорфенил)этил]-{4-[2-(2,4-диоксотиазолидин-3-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[([(S)-1-(4-хлорфенил)этил]-{4-[2-(2,4-диоксооксазолидин-3-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[([(S)-1-(4-хлорфенил)этил]-{3-метокси-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[([1-(4-хлорфенил)пропил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[([1-(4-хлорфенил)пропил]-{3-метокси-4-[2-(3-метил-2,5-диоксоимидазолидин-1-ил)этокси]бензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[([1-(2,3-дигидробензофуран-5-ил)пропил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[([(S)-1-(4-хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-этилбензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[([1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-этилбензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[([1-(4-хлор-3-фторфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[([(S)-1-(4-хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этилсульфанил]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[(((S)-5-хлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этилсульфанил]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[([1-(4-хлор-3-фторфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-этилбензил}амино)метил]циклогексанкарбоновой кислоты;
транс-4-[([(S)-1-(4-хлор-3-фторфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-этилбензил}амино)метил]циклогексанкарбоновой кислоты;
(1R,3R)-3-[([(R)-1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклопентанкарбоновой кислоты;
(1R,3R)-3-[([(S)-1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклопентанкарбоновой кислоты;
(1S,3S)-3-[([(R)-1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклопентанкарбоновой кислоты;
(1S,3S)-3-[([1-(4-хлорфенил)пропил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]-2,2-диметилциклопропанкарбоновой кислоты;
цис-3-([(R)-1-(2,3-дигидробензофуран-5-ил)этил]-{3-метокси-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензил}амино)циклобутанкарбоновой кислоты;
3-([1-(2,3-дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)циклобутанкарбоновой кислоты;
транс-4-[(((S)-5-хлор-4-фториндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты;
или их фармацевтически приемлемые соли или стереоизомеры или фармацевтически приемлемые соли стереоизомеров.
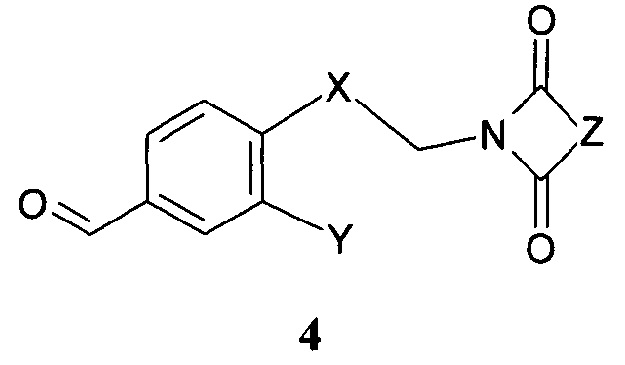
Дальнейшее воплощение данного изобретения включает соединения формулы 4:
 ,
,
где
Х означает С2-алифатический углеводородный мостик, необязательно содержащий двойную связь или тройную связь или гетероатом, выбираемый из О и S, или -СН(СН2)СН-;
Y означает водород, галоген, С1-4-алкил, С1-4-алкокси или С1-4-гидроксиалкил;
Z означает С1-4-алифатический углеводородный мостик, необязательно содержащий одну двойную связь и/или один или более гетероатомов, выбираемых из O, S, N и N(CH3), или означает С2-4-алифатический углеводородный мостик, конденсированный с С3-6-циклоалкилом, необязательно содержащий одну или более двойных связей, или с фенильным кольцом, или означает С1-4-алифатический углеводородный мостик, замещенный спиро-С3-6-циклоалкилом, необязательно содержащий одну или более двойных связей.
В особенности, соединения, представленные формулой 4, включают соединения, выбираемые из группы, состоящей из;
4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензальдегида;
4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензальдегида;
4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-этилбензальдегида;
3-хлор-4-[2-(2,5-диоксопирролидин-1-ил)этокси]бензальдегида;
4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-фторбензальдегида;
4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-гидроксиметилбензальдегида;
4-[2-(2,5-диоксопирролидин-1-ил)этокси]бензальдегида;
3-метокси-4-[2-(3-метил-2,5-диоксоимидазолидин-1-ил)этокси]бензальдегида;
3-метил-4-[2-(3-метил-2,5-диоксоимидазолидин-1-ил)этокси]бензальдегида;
3-хлор-4-[2-(3-метил-2,5-диоксоимидазолидин-1-ил)этокси]бензальдегида;
4-[2-(2,4-диоксотиазолидин-3-ил)этокси]-3-метоксибензальдегида;
4-[2-(2,4-диоксотиазолидин-3-ил)этокси]-3-метилбензальдегида;
4-[2-(2,4-диоксооксазолидин-3-ил)этокси]-3-метоксибензальдегида;
3-метокси-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензальдегида;
3-метил-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензальдегида;
4-[2-(2,6-диоксопиперидин-1-ил)этокси]-3-метоксибензальдегида;
4-[2-(2,5-диоксопирролидин-1-ил)этилсульфанил]-3-метоксибензальдегида;
4-[(Е)-3-(2,5-диоксопирролидин-1-ил)пропенил]-3-метоксибензальдегида;
4-[3-(2,5-диоксопирролидин-1-ил)проп-1-инил]-3-метоксибензальдегида;
4-[3-(2,5-диоксопирролидин-1-ил)проп-1-инил]-3-метилбензальдегида;
3-метил-4-[3-(3-метил-2,5-диоксоимидазолидин-1-ил)проп-1-инил]бензальдегида;
3-метокси-4-[3-(3-метил-2,5-диоксоимидазолидин-1-ил)проп-1-инил]бензальдегида;
4-[3-(2,5-диоксопирролидин-1-ил)пропил]-3-метоксибензальдегида;
4-[3-(2,5-диоксопирролидин-1-ил)пропил]-3-метилбензальдегида;
3-хлор-4-[3-(2,5-диоксопирролидин-1-ил)пропил]бензальдегида;
3-метокси-4-[3-(3-метил-2,5-диоксоимидазолидин-1-ил)пропил]бензальдегида;
4-[2-(2,5-диоксопирролидин-1-илметил)циклопропил]-3-метоксибензальдегида;
4-[2-(2,4-диоксо-3-азабицикло[3.1.0]гекс-3-ил)этокси]-3-метоксибензальдегида;
4-[2-((3aS,7aR)-1,3-диоксо-1,3,3а,4,7,7а-гексагидроизоиндол-2-ил)этокси]-3-метоксибензальдегида;
4-[2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)этокси]-3-метоксибензальдегида;
4-[2-(7,9-диоксо-8-азаспиро[4,5]дец-8-ил)этокси]-3-метоксибензальдегида.
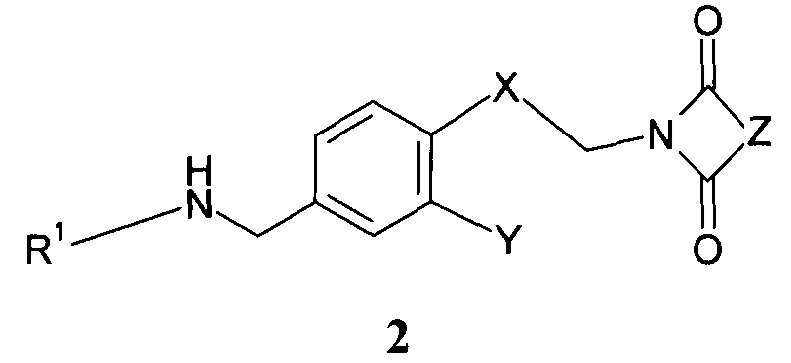
Дальнейшее воплощение данного изобретения включает соединения формулы 2:
 ,
,
где
R1 представляет собой группу, выбираемую из группы, состоящей из:
 ,
,
где
R2 означает водород или С1-4-алкильную группу;
R3 означает водород, галоген, CF3, CN или С1-4-алкил; и
R4 означает водород, галоген или С1-4-алкил;
Х означает С2-алифатический углеводородный мостик, необязательно содержащий двойную связь или тройную связь или гетероатом, выбираемый из О и S, или -СН(СН2)СН-;
Y означает водород, галоген, С1-4-алкил, С1-4-алкокси или С1-4-гидроксиалкил;
Z означает С1-4-алифатический углеводородный мостик, необязательно содержащий одну двойную связь и/или один или более гетероатомов, выбираемых из O, S, N и N(CH3), или означает С2-4-алифатический углеводородный мостик, конденсированный с С3-6-циклоалкилом, необязательно содержащий одну или более двойных связей, или с фенильным кольцом, или означает С1-4-алифатический углеводородный мостик, замещенный спиро-С3-6-циклоалкилом, необязательно содержащий одну или более двойных связей;
или их соли.
В особенности, соединения, представленные формулой 2, включают соединения, выбираемые из группы, состоящей из:
1. соли 1-[2-(4-{[1-(2,3-дигидробензофуран-5-ил)этиламино]метил}-2-метоксифенокси)этил]пирролидин-2,5-диона нафталин-1,5-дисульфоновой кислоты;
2. 1-[2-(4-{[(S)-1-(4-хлорфенил)этиламино]метил}-2-метоксифенокси)этил]пирролидин-2,5-диона;
3. 1-[2-(4-{[(R)-1-(4-хлорфенил)этиламино]метил}-2-метоксифенокси)этил]пирролидин-2,5-диона;
4. 1-[2-(4-{[(S)-1-(4-хлорфенил)этиламино]метил}-2-метилфенокси)этил]пирролидин-2,5-диона;
5. 1-[2-(4-{[(R)-1-(4-хлорфенил)этиламино]метил}-2-метилфенокси)этил]пирролидин-2,5-диона;
6. 1-(2-{4-[(5-хлориндан-1-иламино)метил]-2-метоксифенокси}этил)пирролидин-2,5-диона;
7. 1-(2-{4-[((S)-5-хлориндан-1-иламино)метил]-2-метоксифенокси}этил)пирролидин-2,5-диона;
8. 1-(2-{4-[((S)-4,5-дихлориндан-1-иламино)метил]-2-метоксифенокси}этил)пирролидин-2,5-диона;
9. 1-(2-{4-[((S)-5-хлор-4-фториндан-1-иламино)метил]-2-метоксифенокси}этил)пирролидин-2,5-диона;
10. 3-[2-(4-{[1-(2,3-дигидробензофуран-5-ил)этиламино]метил}-2-метоксифенокси)этил]тиазолидин-2,4-диона;
11. 1-[2-(2-хлор-4-{[1-(2,3-дигидробензофуран-5-ил)этиламино]метил}фенокси)этил]пирролидин-2,5-диона;
12. 1-[2-(4-{[1-(2,3-дигидробензофуран-5-ил)этиламино]метил}-2-метилфенокси)этил]пирролидин-2,5-диона;
13. 1-[2-(4-{[1-(2,3-дигидробензофуран-5-ил)пропиламино]метил}-2-метоксифенокси)этил]пирролидин-2,5-диона;
14. 3-[2-(4-{[1-(2,3-дигидробензофуран-5-ил)этиламино]метил}-2-метоксифенокси)этил]оксазолидин-2,4-диона;
15. 3-(2-{2-хлор-4-[(5-хлориндан-1-иламино)метил]фенокси}этил)-1-метилимидазолидин-2,4-диона;
16. 1-(2-{2-хлор-4-[(5-хлориндан-1-иламино)метил]фенокси}этил)пирролидин-2,5-диона;
17. 3-[2-(2-хлор-4-{[1-(2,3-дигидробензофуран-5-ил)этиламино]метил}фенокси)этил]-1-метилимидазолидин-2,4-диона;
18. 3-[2-(2-хлор-4-{[(S)-1-(4-хлорфенил)этиламино]метил}фенокси)этил]-1-метилимидазолидин-2,4-диона;
19. 3-(2-{4-[(5-хлориндан-1-иламино)метил]-2-метоксифенокси}этил)тиазолидин-2,4-диона;
20. 1-[2-(4-{[1-(4-хлор-3-метилфенил)этиламино]метил}-2-метоксифенокси)этил]пирролидин-2,5-диона;
21. 1-[2-(4-{[(S)-1-(4-хлор-3-метилфенил)этиламино]метил}-2-метоксифенокси)этил]пирролидин-2,5-диона;
22. 1-[2-(4-{[(R)-1-(4-хлор-3-метилфенил)этиламино]метил}-2-метоксифенокси)этил]пирролидин-2,5-диона;
23. 3-[2-(4-{[1-(2,3-дигидробензофуран-5-ил)пропиламино]метил}-2-метоксифенокси)этил]-1-метилимидазолидин-2,4-диона;
24. 1-(2-{4-[(5-хлориндан-1-иламино)метил]-2-метилфенокси}этил)пирролидин-2,5-диона;
25. 1-(2-{4-[((S)-5-хлориндан-1-иламино)метил]-2-метилфенокси}этил)пирролидин-2,5-диона; 1-(2-{4-[((R)-5-хлориндан-1-иламино)метил]-2-метилфенокси}этил)пирролидин-2,5-диона;
26. 1-[2-(2-хлор-4-{[(S)-1-(4-хлорфенил)этиламино]метил}фенокси)этил]пирролидин-2,5-диона;
27. 3-[2-(4-{[1-(2,3-дигидробензофуран-5-ил)этиламино]метил}-2-метилфенокси)этил]тиазолидин-2,4-диона;
28. 3-[2-(4-{[(S)-1-(4-хлорфенил)этиламино]метил}-2-метоксифенокси)этил]тиазолидин-2,4-диона;
29. 1-[(Е)-3-(4-{[1-(2,3-дигидробензофуран-5-ил)этиламино]метил}-2-метоксифенил)аллил]пирролидин-2,5-диона;
30. 3-[2-(4-{[(S)-1-(4-хлорфенил)этиламино]метил}-2-метоксифенокси)этил]оксазолидин-2,4-диона;
31. 3-[2-(4-{[(S)-1-(4-хлорфенил)этиламино]метил}-2-метоксифенокси)этил]-1-метил-1Н-пиримидин-2,4-диона;
32. 1-[2-(4-{[1-(2,3-дигидробензофуран-5-ил)этиламино]метил}-2-метоксифенокси)этил]пиперидин-2,6-диона;
33. 3-[2-(4-{[(S)-1-(4-хлорфенил)этиламино]метил}-2-метилфенокси)этил]-1-метилимидазолидин-2,4-диона;
34. 1-[3-(4-{[1-(2,3-дигидробензофуран-5-ил)этиламино]метил}-2-метоксифенил)пропил]пирролидин-2,5-диона;
35. 1-(2-{4-[(5-хлор-6-метилиндан-1-иламино)метил]-2-метоксифенокси}этил)пирролидин-2,5-диона;
36. 1-(2-{4-[(5-хлор-4-метилиндан-1-иламино)метил]-2-метоксифенокси}этил)пирролидин-2,5-диона;
37. 1-(3-{4-[(5-хлориндан-1-иламино)метил]-2-метоксифенил}пропил)пирролидин-2,5-диона;
38. 1-(3-{4-[((S)-5-хлориндан-1-иламино)метил]-2-метоксифенил}пропил)пирролидин-2,5-диона;
39. 1-(3-{4-[((R)-5-хлориндан-1-иламино)метил]-2-метоксифенил}пропил)пирролидин-2,5-диона;
40. 1-[3-(2-хлор-4-{[1-(2,3-дигидробензофуран-5-ил)этиламино]метил}фенил)пропил]пирролидин-2,5-диона;
41. 3-(2-{4-[(5-хлориндан-1-иламино)метил]-2-метоксифенокси}этил)-1-метил-1Н-пиримидин-2,4-диона;
42. 1-[2-(4-{[1-(2,3-дигидробензофуран-5-ил)этиламино]метил}-2-метоксифенил)циклопропилметил]пирролидин-2,5-диона;
43. 3-(3-{4-[(5-хлориндан-1-иламино)метил]-2-метоксифенил}пропил)-1-метилимидазолидин-2,4-диона;
44. 3-[3-(4-{[(S)-1-(4-хлорфенил)этиламино]метил}-2-метоксифенил)пропил]-1-метилимидазолидин-2,4-диона;
45. 3-(2-{4-[(5-хлориндан-1-иламино)метил]-2-метоксифенокси}этил)-1-метилимидазолидин-2,4-диона;
46. 3-[2-(4-{[(S)-1-(4-хлорфенил)этиламино]метил}-2-метоксифенокси)этил]-1-метилимидазолидин-2,4-диона;
47. 1-[3-(4-{[(S)-1-(4-хлорфенил)этиламино]метил}-2-метилфенил)пропил]пирролидин-2,5-диона;
48. 1-[3-(4-{[(S)-1-(4-хлорфенил)этиламино]метил}-2-метоксифенил)проп-2-инил]пирролидин-2,5-диона;
49. 1-[3-(4-{[(S)-1-(4-хлорфенил)этиламино]метил}-2-метоксифенил)пропил]пирролидин-2,5-диона;
50. 3-(2-{4-[(5-хлориндан-1-иламино)метил]-2-метилфенокси}этил)-1-метилимидазолидин-2,4-диона;
51. 3-[2-(4-{[(S)-1-(4-хлорфенил)этиламино]метил}-2-метилфенокси)этил]-1-метил-1Н-пиримидин-2,4-диона;
52. 3-[2-(4-{[1-(2,3-дигидробензофуран-5-ил)этиламино]метил}-2-метоксифенокси)этил]-1-метил-1Н-пиримидин-2,4-диона;
53. 3-[2-(4-{[1-(2,3-дигидробензофуран-5-ил)этиламино]метил}-2-метилфенокси)этил]-1-метил-1Н-пиримидин-2,4-диона;
54. 4-(1-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензиламино}этил)бензонитрила;
55. 4-(1-{3-метокси-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензиламино}этил)бензонитрила;
56. 1-[2-(4-{[1-(4-хлорфенил)пропиламино]метил}-2-метоксифенокси)этил]пирролидин-2,5-диона;
57. 3-[2-(4-{[1-(4-хлорфенил)пропиламино]метил}-2-метилфенокси)этил]-1-метил-1Н-пиримидин-2,4-диона;
58. 3-[2-(4-{[1-(4-хлорфенил)пропиламино]метил}-2-метоксифенокси)этил]-1-метилимидазолидин-2,4-диона;
59. 1-[3-(4-{[1-(2,3-дигидробензофуран-5-ил)пропиламино]метил}-2-метоксифенил)пропил]пирролидин-2,5-диона;
60. 3-[2-(4-{[1-(4-хлорфенил)пропиламино]метил}-2-метоксифенокси)этил]-1-метилимидазолидин-2,4-диона;
61. 3-[2-(4-{[1-(4-хлорфенил)пропиламино]метил}-2-метоксифенокси)этил]-1-метил-1Н-пиримидин-2,4-диона;
62. 1-[2-(4-{[1-(2,3-дигидробензофуран-5-ил)пропиламино]метил}-2-метилфенокси)этил]пирролидин-2,5-диона;
63. 3-[2-(4-{[1-(4-хлорфенил)пропиламино]метил}-2-метилфенокси)этил]-1-метилимидазолидин-2,4-диона;
64. 1-(2-{4-[((S)-5-хлориндан-1-иламино)метил]-2-этилфенокси}этил)пирролидин-2,5-диона;
65. 1-(2-{4-[((S)-5-хлориндан-1-иламино)метил]-2-фторфенокси}этил)пирролидин-2,5-диона;
66. 1-[2-(4-{[(S)-1-(4-хлорфенил)этиламино]метил}-2-фторфенокси)этил]пирролидин-2,5-диона;
67. 1-(2-{4-[((S)-5,6-дихлориндан-1-иламино)метил]-2-метоксифенокси}этил)пирролидин-2,5-диона;
68. 1-[2-(4-{[(S)-1-(4-хлорфенил)этиламино]метил}-2-этилфенокси)этил]пирролидин-2,5-диона;
69. 1-[2-(4-{[1-(2,3-дигидробензофуран-5-ил)этиламино]метил}-2-этилфенокси)этил]пирролидин-2,5-диона;
70. 1-[2-(4-{[1-(3,4-дихлорфенил)этиламино]метил}-2-метоксифенокси)этил]пирролидин-2,5-диона;
71. 1-[2-(4-{[1-(3,4-дихлорфенил)этиламино]метил}-2-метилфенокси)этил]пирролидин-2,5-диона;
72. 1-[2-(4-{[(S)-1-(4-хлорфенил)этиламино]метил}фенокси)этил]пирролидин-2,5-диона;
73. 3-[2-(4-{[1-(3,4-дихлорфенил)этиламино]метил}-2-метилфенокси)этил]-1-метилимидазолидин-2,4-диона;
74. 1-[2-(4-{[1-(4-этилфенил)этиламино]метил}-2-метоксифенокси)этил]пирролидин-2,5-диона;
75. 1-[2-(4-{[1-(4-хлор-3-фторфенил)этиламино]метил}-2-метоксифенокси)этил]пирролидин-2,5-диона;
76. 1-(2-{2-метил-4-[(1-п-толилэтиламино)метил]фенокси}этил)пирролидин-2,5-диона;
77. 1-(2-{2-метокси-4-[(1-п-толилэтиламино)метил]фенокси}этил)пирролидин-2,5-диона;
78. 1-[2-(4-{[(S)-1-(4-хлорфенил)этиламино]метил}-2-гидроксиметилфенокси)этил]пирролидин-2,5-диона;
79. 1-(2-{4-[((S)-4,5-дихлориндан-1-иламино)метил]-2-этилфенокси}этил)пирролидин-2,5-диона;
80. 1-[2-(4-{[(S)-1-(4-хлорфенил)этиламино]метил}-2-метоксифенилсульфанил)этил]пирролидин-2,5-диона;
81. 1-(2-{4-[((S)-5-хлориндан-1-иламино)метил]-2-метоксифенилсульфанил}этил)пирролидин-2,5-диона;
82. 1-[2-(4-{[1-(4-хлор-3-фторфенил)этиламино]метил}-2-этилфенокси)этил]пирролидин-2,5-диона;
83. 1-[2-(4-{[(R)-1-(4-хлор-3-фторфенил)этиламино]метил}-2-этилфенокси)этил]пирролидин-2,5-диона;
84. 1-[2-(4-{[(S)-1-(4-хлор-3-фторфенил)этиламино]метил}-2-этилфенокси)этил]пирролидин-2,5-диона;
85. 1-[2-(4-{[1-(4-хлор-3-фторфенил)этиламино]метил}-2-фторфенокси)этил]пирролидин-2,5-диона;
86. 1-(2-{4-[(4-хлор-5-фториндан-1-иламино)метил]-2-метоксифенокси}этил)пирролидин-2,5-диона;
87. 1-(2-{4-[(6-хлор-5-фториндан-1-иламино)метил]-2-метоксифенокси}этил)пирролидин-2,5-диона;
88. 1-(2-{4-[(6-хлор-5-фториндан-1-иламино)метил]-2-этилфенокси}этил)пирролидин-2,5-диона;
89. 1-(2-{4-[(4-хлор-5-фториндан-1-иламино)метил]-2-этилфенокси}этил)пирролидин-2,5-диона;
90. 1-(2-{4-[(6-хлор-5-фториндан-1-иламино)метил]-2-фторфенокси}этил)пирролидин-2,5-диона;
91. 1-(2-{4-[(5-хлор-6-фториндан-1-иламино)метил]-2-метоксифенокси}этил)пирролидин-2,5-диона;
92. 1-[2-(4-{[(R)-1-(2,3-дигидробензофуран-5-ил)этиламино]метил}-2-метоксифенокси)этил]пирролидин-2,5-диона;
93. 1-[2-(4-{[(S)-1-(2,3-дигидробензофуран-5-ил)этиламино]метил}-2-метоксифенокси)этил]пирролидин-2,5-диона.
Общие методики
Исходные вещества и растворители, используемые в синтезе, получают от химических фирм-поставщиков, таких как ABCR, Aldrich, Acros, Apollo, Fluka, Netchem, Lancaster и др.
Сырой продукт очищают с помощью колоночной хроматографии или флэш-хроматографии.
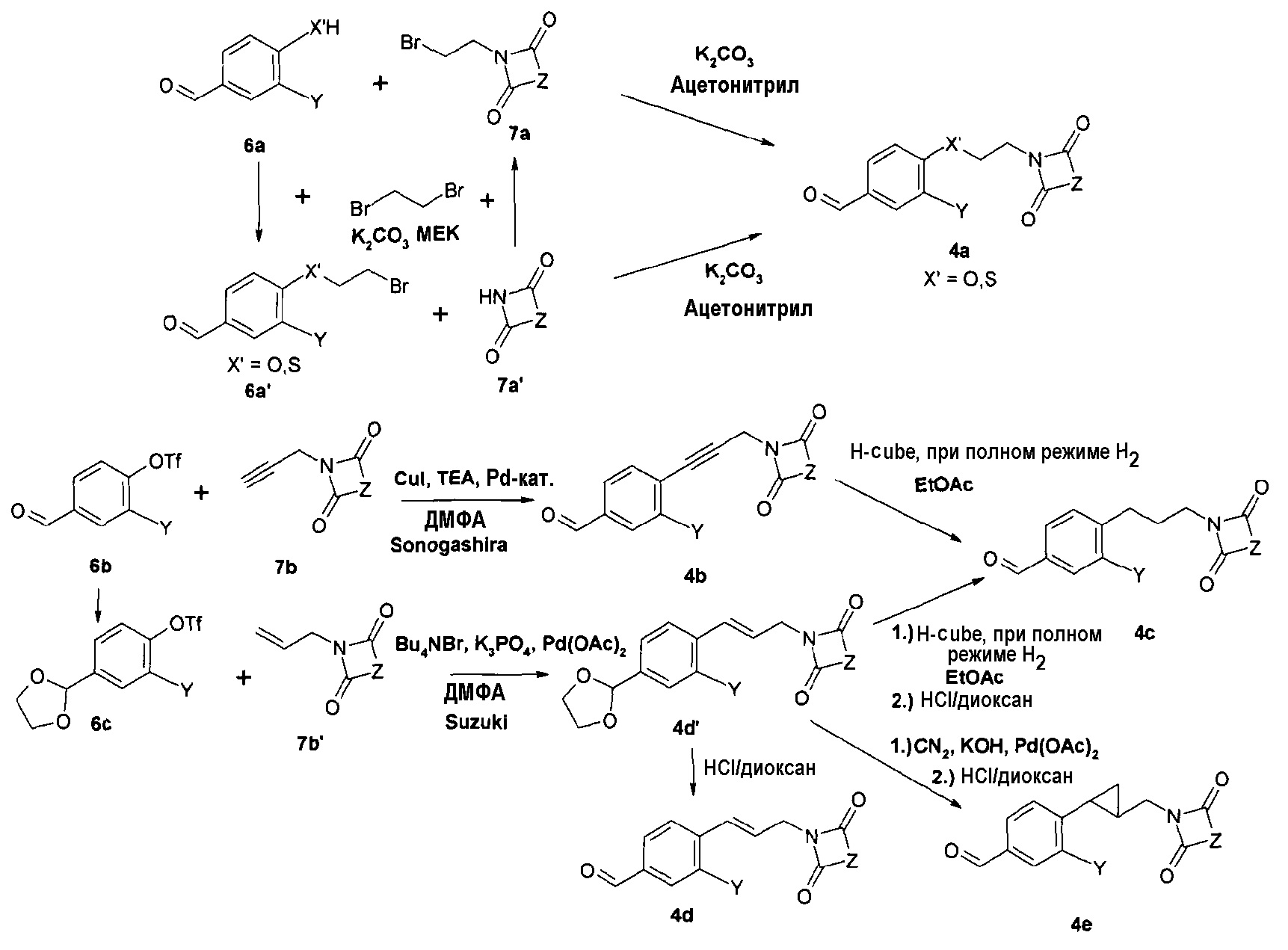
На первой стадии соответствующие бензальдегиды (4=4а-f) синтезируют различными путями в зависимости от боковой цепи диоксоамидных производных, как описано на схеме 1.
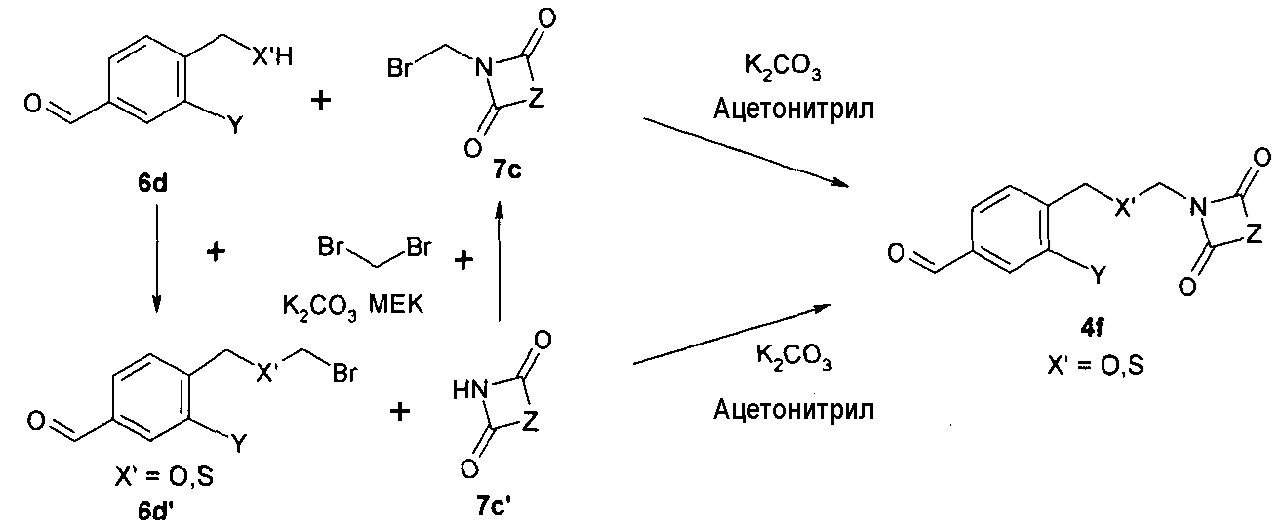
Синтез соединения формулы 4а, где Х представляет собой -О-СН2- или -S-CH2-, осуществляют путем алкилирования 4-гидрокси- или 4-меркаптобензальдегидов 6а с помощью дибромэтана и диоксоамида (путь через 6а', 7a') или бромэтилдиоксоамидных производных (путь через 7а), в присутствии основания, предпочтительно K2CO3, ТЕА или гидрида натрия, с использованием ацетонитрила, ДМФА или МЕК в качестве растворителя. Соединения формулы 4f, где Х представляет собой -CH2-О- или -CH2-S-, могут быть получены аналогичным образом путем алкилирования соответствующих бензиловых спиртов или бензилтиолов формулы 6d с помощью дибромметана и диоксоамида (путь через 6d', 7c'), или бромметилдиоксоамидных производных (путь через 7с), в присутствии основания, предпочтительно K2CO3, ТЕА или гидрида натрия, с использованием ацетонитрила, ДМФА или МЕК в качестве растворителя.
Ненасыщенное соединение формулы 4b, где Х означает -С≡С-, может быть синтезировано по реакции Sonogashira (Sonogashira K. и др., Tetrahedron Lett., 1975, 16(50), 4467), а ненасыщенное соединение формулы 4d, где Х означает -СН=СН-, может быть синтезировано по реакции связывания Suzuki (Suzuki A., Tetrahedron Lett., 1979, 20(36), 3437), затем путем гидролиза полученного соединения формулы 4d'. Соединение формулы 4с, где Х означает -СН2-СН2-, может быть получено путем гидрирования соответствующего соединения формулы 4b или 4d'. Соединение формулы 4е, где Х означает -СН(СН2)СН-, может быть синтезировано из соответствующего замещенного аллильного производного формулы 4d', используя диазометан (схема 1).
Схема 1
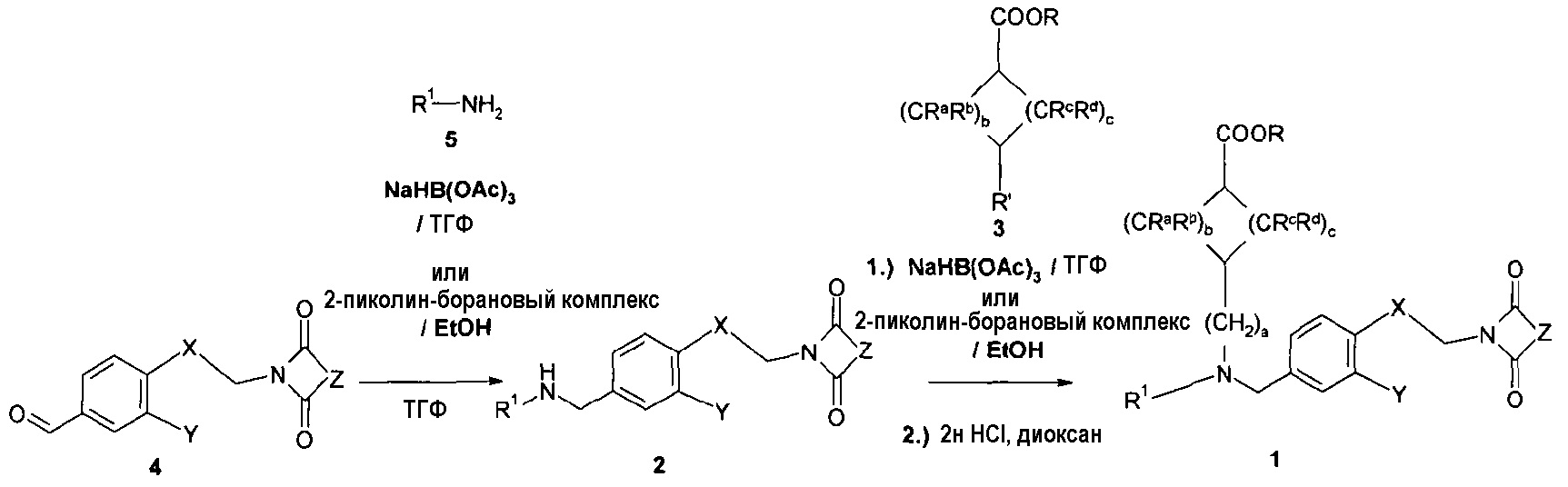
Затем бензальдегиды 4 вводят во взаимодействие с первичными аминами 5 при мягких условиях восстановительного аминирования (NaBH(OAc)3 в ТГФ или 2-пиколин-борановый комплекс в этаноле). Полученные вторичные амины 2 вводят во взаимодействие с различными эфирами формил-(R':-CHO) или оксо-(R':=O)циклоалканкарбоновой кислоты 3 на повторной стадии восстановительного аминирования. Полученные сложные эфиры (1, R=метил, этил) необязательно гидролизуют при кислых условиях. Сырой сложный эфир 1 очищают посредством хроматографии, кристаллизации или через солеобразование (схема 2).
Схема 2
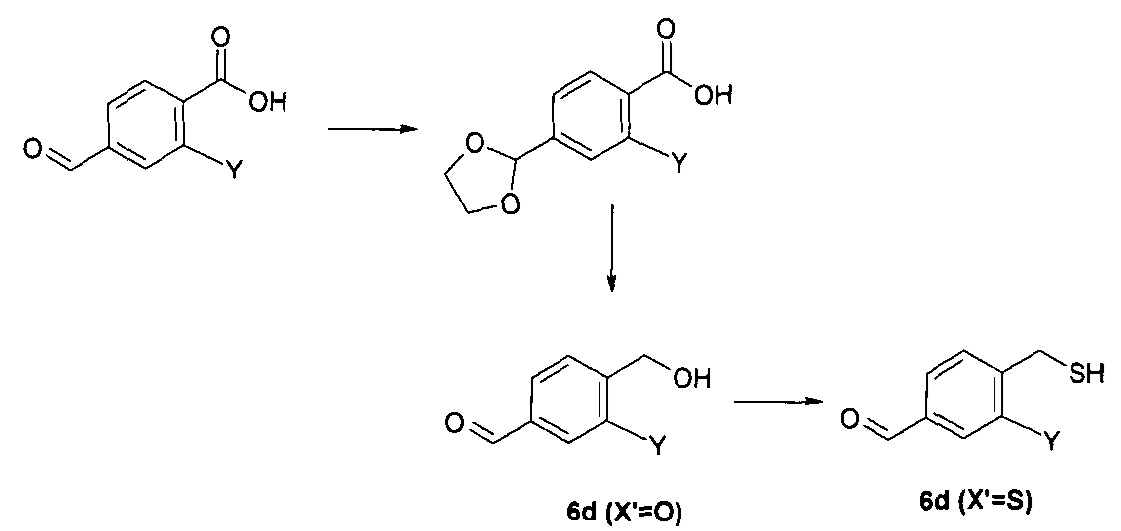
Исходные вещества формул 3, 5 и 7 являются коммерчески доступными или могут быть получены известными способами. Соединения формулы 6 являются коммерчески доступными (6а) или могут быть получены известными способами. Соединения формулы 6b могут быть синтезированы трифлатированием соответствующего спирта. Соединение формулы 6с представляет собой защищенное производное альдегида формулы 6а этиленгликолем. Соединение формулы 6d может быть синтезировано известными способами из коммерчески доступных производных бензойной кислоты (схема 3)
Схема 3
Как указано выше, соединения формулы 1, или их фармацевтически приемлемые соли, стереоизомеры или фармацевтически приемлемые соли стереоизомеров, могут быть использованы в качестве активного ингредиента лекарственного средства при превентивном и/или терапевтическом лечении опосредуемого CXCR3-рецептором заболевания или нарушения, особенно заболевания или нарушения, выбираемого из группы, состоящей из COPD, псориаза, отторжения имплантата/трансплантата, офтальмологического заболевания, глютеновой болезни, воспалительного заболевания пищеварительного тракта (IBD), диабета типа 1, тяжелой псевдопаралитической миастении (MG), рассеянного склероза (MS) и других нейровоспалительных заболеваний, волчанки, ревматоидного артрита (RA) или красного плоского лишая.
В качестве активного ингредиента лекарственного средства согласно настоящему изобретению может быть использовано вещество, выбираемое из группы, состоящей из соединения, представленного вышеприведенной формулой 1, и его фармакологически приемлемых солей, или его стереоизомера, или фармацевтически приемлемой соли стереоизомера. Вещество, само по себе, может быть введено в качестве лекарственного средства согласно настоящему изобретению, однако, желательно вводить лекарственное средство в виде фармацевтической композиции, которая включает вышеуказанное вещество в качестве активного ингредиента и одну или более фармацевтических добавок. В качестве активного ингредиента лекарственного средства согласно настоящему изобретению могут быть использованы в комбинации два или более вышеуказанных веществ. Тип фармацевтической композиции не является особенно ограниченным, и композиция может быть предусмотрена в виде любой готовой лекарственной формы для перорального или парентерального введения. Например, фармацевтическая композиция может быть составлена, например, в форме фармацевтических композиций для перорального введения, как, например, гранулы, мелкие гранулы, порошки, твердые капсулы, мягкие капсулы, сиропы, эмульсии, суспензии, растворы и т.п., или в форме фармацевтических композиций для парентеральных введений, как, например, инъекционные растворы для внутривенного, внутримышечного или подкожного введения, капельные инфузии, трансдермальные препараты, препараты для введения через слизистую оболочку, капли в нос, лекарственные формы для ингаляции, суппозитории и т.п. Инъекционные растворы или капельные инфузии могут быть получены в виде порошкообразных препаратов, как, например, в форме лиофилизированных препаратов, и они могут быть использованы путем растворения непосредственно перед применением в соответствующей водной среде, такой как физиологический раствор.
Типы фармацевтических добавок, используемых для получения фармацевтической композиции, удовлетворяющие соотношениям фармацевтических добавок относительно активного ингредиента, и способы получения фармацевтической композиции, соответственно, могут быть выбраны квалифицированным специалистом в данной области. В качестве фармацевтических добавок могут быть использованы неорганические или органические вещества, или твердые или жидкие вещества. Как правило, фармацевтические добавки могут быть включены в соотношении, изменяющемся от 1% масс. до 90% масс., в расчете на массу активного ингредиента.
Дозировка и частота введения лекарственного средства согласно настоящему изобретению особо не ограничены, и они, соответственно, могут быть выбраны в зависимости от условий, таких как цель превентивного и/или терапевтического лечения, тип заболевания, масса тела или возраст пациента, тяжесть заболевания и т.п. Как правило, суточная доза для перорального введения взрослому человеку может составлять от 0,01 до 1000 мг (масса активного ингредиента), и доза может быть введена один раз в сутки или несколько раз в сутки, в виде раздельных порций, или один раз в несколько суток. Когда лекарственное средство используют в виде инъекции, введения предпочтительно могут быть осуществлены непрерывно или периодически в виде суточной дозы от 0,001 до 100 мг (масса активного ингредиента) взрослому человеку.
Настоящее изобретение более конкретно должно быть пояснено с помощью ссылки на следующие примеры, однако, рамки настоящего изобретения не ограничиваются этими примерами.
За исключением иначе указанного, следующие аббревиатуры в нижеприводимых примерах имеют установленные значения:
|
|
|
Аналитическую LC/MS осуществляют, используя оборудование Waters Alliance 2695+2996 PDA, при длине волны 220 нм.
Система А) MS: Waters LCT Premier XE; колонка: Atlantis dC18 (3 мкм), размером 2,1×50 мм; объемная скорость потока 0,7 мл/мин градиента ацетонитрил/вода/0,05% ТФУК, по методу ESI+;
Система В) MS: Micromass ZQ; колонка: Purospher-STAR RP18e (3 мкм), размером 4,6×55 мм; объемная скорость потока 1,6 мл/мин градиента вода/ацетонитрил/20 мМ NH4OH; или Xterra MS-C18 (3,5 мкМ), размером 2,1×50 мм; объемная скорость потока: 1,0 мл/мин градиента вода/ацетонитрил/20 мМ NH4OH, по методу ESI+.
Препаративную хиральную ВЭЖХ осуществляют, используя оборудование Berger Prep SFC, при длине волны 210 нм;
Система С) колонка: Chiralpack IC, размером 250×21 мм (5 мкм), объемная скорость потока 50 мл/мин; СО2/[этанол/+0,5% изопропиламина], 60%/40% (другие случаи подробно описаны в примерах).
Для структурного подтверждения ЯМР-спектры, кроме того, снимали для всех соединений. ЯМР-спектры регистрировали на спектрометре Bruker Advance II 400 МГц, при температуре окружающей среды, в растворе ДМСО-d6. Химические сдвиги соотносили с тетраметилсиланом (δ, м.д.). В некоторых случаях также регистрировали не только 1Н, но и 13С, ed-HSQC-, zqs-TOCSY- и HMBC-спектры.
Получение предшественников
Промежуточный продукт 4.1
4-[2-(2,5-Диоксопирролидин-1-ил)этокси]-3-метоксибензальдегид
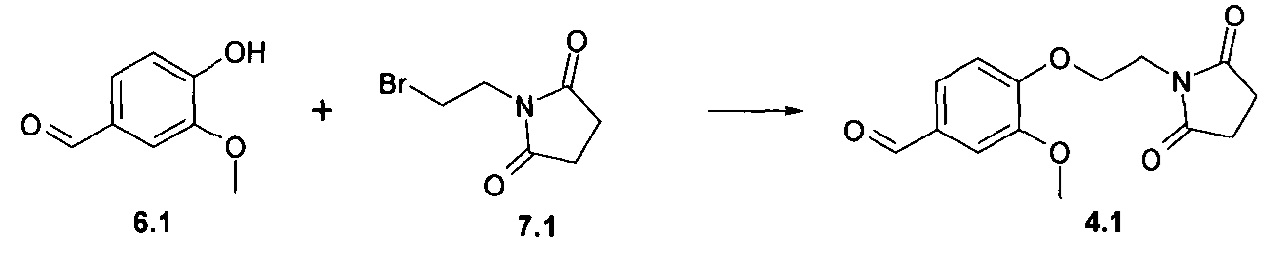
Способ А: 6,85 г (45 ммоль) ванилина (6.1) и 10,2 г (49,5 ммоль) 1-(2-бромэтил)пирролидин-2,5-диона (7.1) нагревают с 8,28 г (60 ммоль) K2CO3 в 200 мл ацетонитрила при кипячении с обратным холодильником в течение 15 часов. Осажденный KBr отфильтровывают, фильтрат выпаривают, остаток растворяют в 200 мл дихлорметана, промывают водой и 2н раствором NaOH, сушат над Na2SO4 и выпаривают. Оставшееся масло растирают в н-гексане, получая желательный продукт 4.1 в виде белых кристаллов. Выход: 6,88 г (55%). (М+Н)+=278, Rt(A)=1,90 мин, чистота 97,6%.
1Н-ЯМР: 2,64 (c, 4H), 3,77 (т, 2H), 2,75 (c, 3Н), 4,21 (т, 3Н), 7,17 (д, 1H), 7,40 (д, 1H), 7,53 (дд, 1H), 9,84 (c, 1H).
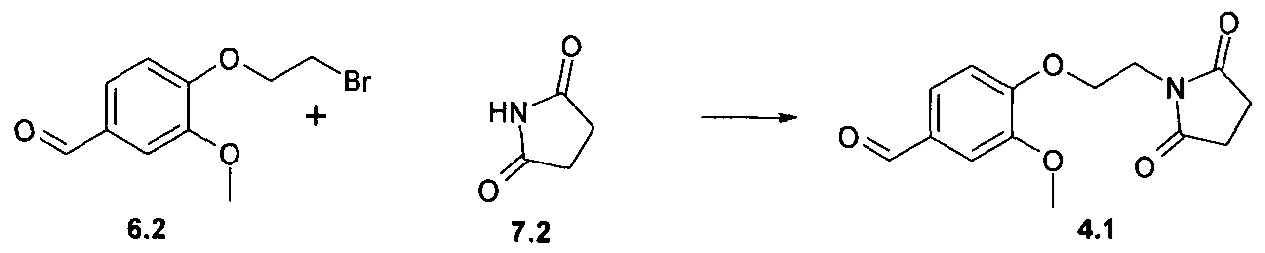
Способ В: 11,66 г (45 ммоль) 4-(2-бромэтокси)-3-метоксибензальдегида (6.2) и 4,46 г (45 ммоль) пирролидин-2,5-диона (7.2) нагревают с 8,28 г (60 ммоль) K2CO3, в 200 мл ацетонитрила, в течение 8 часов. После той же самой процедуры выделения, как в способе А, получают продукт 4.1 с такой же чистотой.
Следуя методике, как представленная для промежуточного продукта 4.1, получают промежуточные продукты общей формулы 4а, перечисленные в таблице 1.
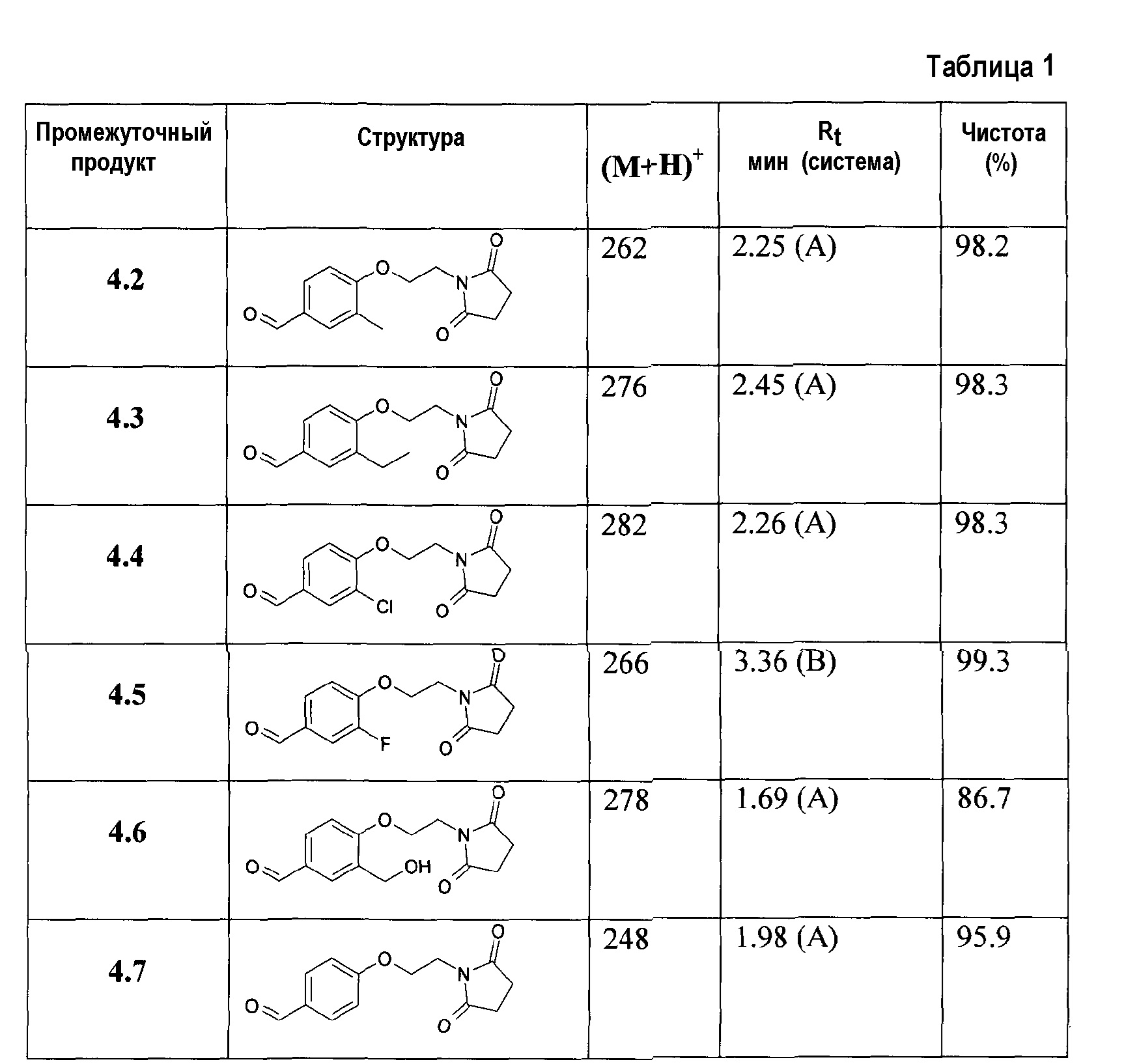
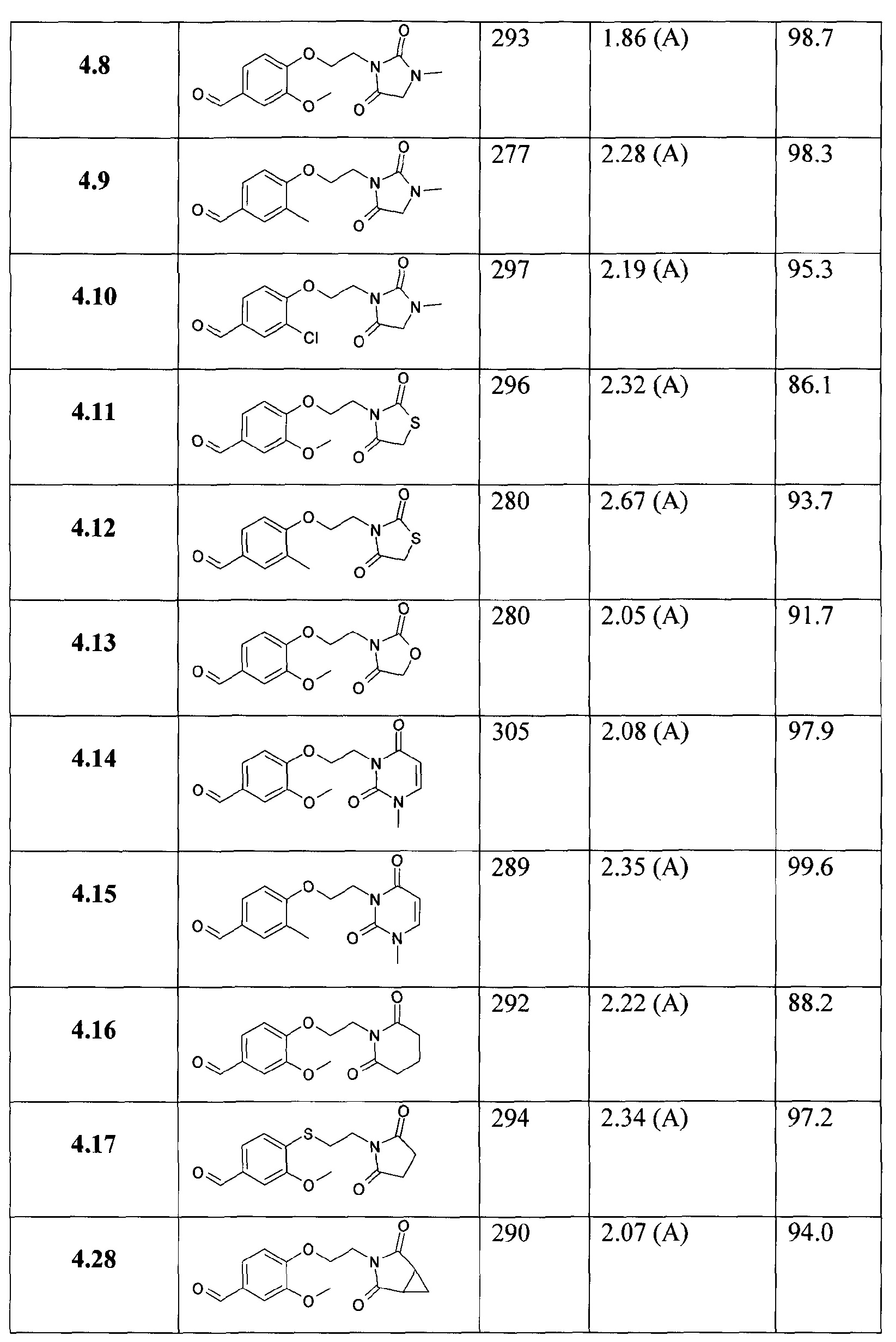
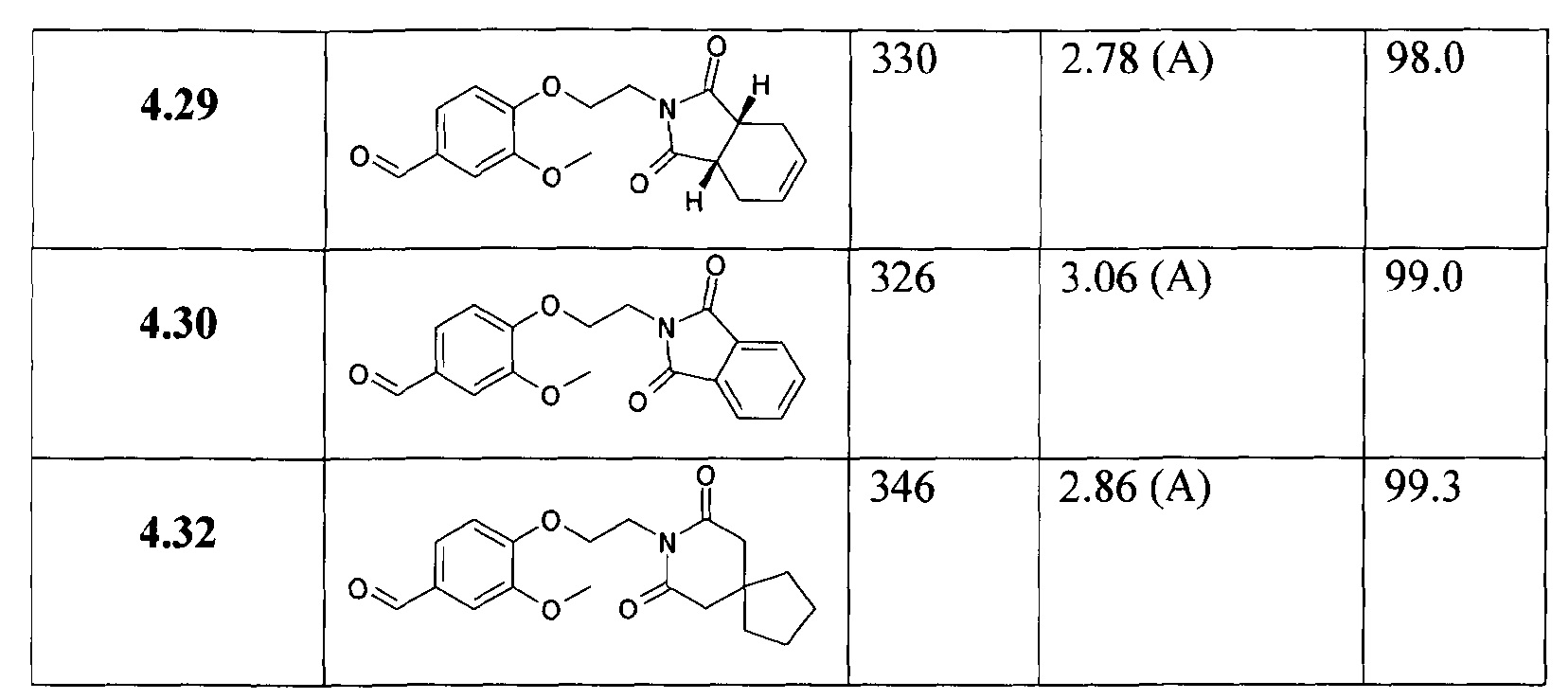
Промежуточный продукт 4.18
4-[(Е)-3-(2,5-Диоксопирролидин-1-ил)пропенил]-3-метоксибензальдегид
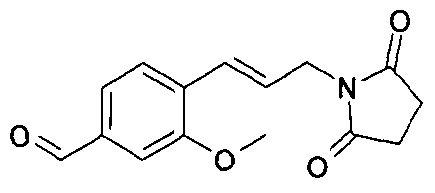
Стадия 1: 6,85 г (45 ммоль) ванилина (6.1) охлаждают в 100 мл смеси DCM/пиридин=4:1, затем по каплям добавляют 9,1 мл (54 ммоль) трифторметансульфонового ангидрида в 10 мл DCM. Смесь перемешивают при комнатной температуре в течение 2 часов, потом выпаривают, и остаток растирают 3 раза в EtOAc, используя каждый раз по 10 мл EtOAc, полученный органический слой сушат и выпаривают. Сырой продукт (6.1а) используют на следующей стадии без дальнейшей очистки.
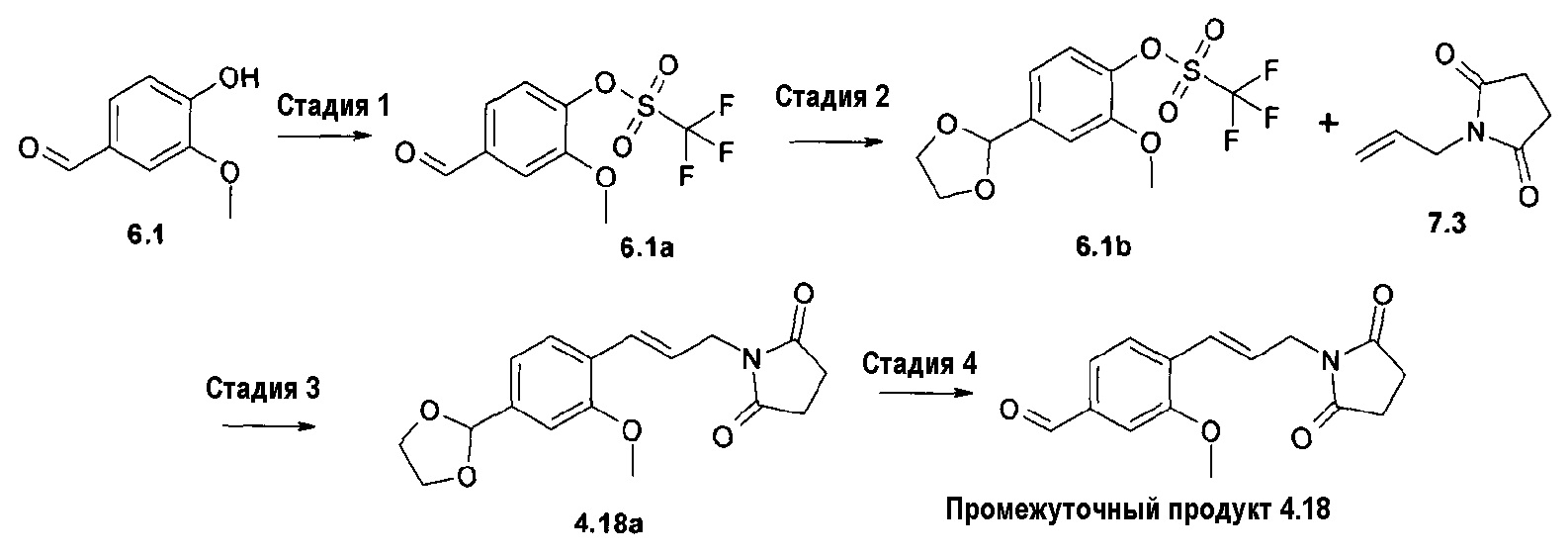
Стадия 2: Полученный сырой 4-формил-2-метоксифениловый эфир трифторметансульфоновой кислоты (6.1а), 2,52 мл (45 ммоль) этиленгликоля и 0,77 г (4,5 ммоль) TsOH в 180 мл бензола кипятят с обратным холодильником. После выпаривания остаток очищают с помощью колоночной хроматографии. Желательный промежуточный продукт представляет собой 11 г (80%) 4-[1,3]диоксолан-2-ил-2-метоксифенилового эфира трифторметансульфоновой кислоты (6.1b) в виде масла желтого цвета. (М+Н)+=329, Rt(A)=3,44 мин, чистота: 93,4%.
Стадия 3: Смесь 1,76 г (5 ммоль) трифлата (6.1а), 2,1 г (15 ммоль) 1-аллилпирролидин-2,5-диона (7.3; Bull. Chem. Soc. Japan, 1984, 57(10), 3021), 0,067 г (0,3 ммоль) Pd(OAc)2, 0,373 г (5 ммоль) KCl, 3,22 г (10 ммоль) ТВАВ и 2,12 г (10 ммоль) K3PO4 нагревают в 10 мл ДМФА в атмосфере азота при температуре 120°С в течение 8 часов. Смесь разбавляют водой, экстрагируют 3 раза по 50 мл EtOAc, полученную органическую фазу выпаривают и очищают с помощью колоночной хроматографии (EtOAc-н-гексан=1:1). Желательный промежуточный продукт (4.18а) представляет собой 1,8 г 1-[(Е)-3-(4-[1,3]диоксолан-2-ил-2-метоксифенил)аллил]пирролидин-2,5-диона в виде масла. (М+Н)+=318, Rt(A)=2,58 мин, Rt(В)=4,15 мин, чистота: 71%.
Стадия 4: 1,8 г (4 ммоль) защищенного альдегида (4.18а) и 5 мл (30 ммоль) концентрированной соляной кислоты в 15 мл диоксана перемешивают при комнатной температуре в течение 3 часов. После выпаривания и очистки с помощью флэш-хроматографии, желательный 4-[(Е)-3-(2,5-диоксопирролидин-1-ил)пропенил]-3-метоксибензальдегид (промежуточный продукт 4.18) получают в количестве 0,5 г (46%) в виде масла. (М+Н)+=274, Rt=2,56 мин (А), чистота: 91,2%.
1Н-ЯМР: 2,67 (c, 4H), 3,90 (c, 3H), 4,16 (д, 2H), 6,37 (дт, 1H), 6,79 (д, 1H), 7,47-7,50 (м, 2H), 7,67 (д, 1H), 9,95 (c, 1H).
Промежуточный продукт 4.19
4-[3-(2,5-Диоксопирролидин-1-ил)проп-1-инил]-3-метоксибензальдегид
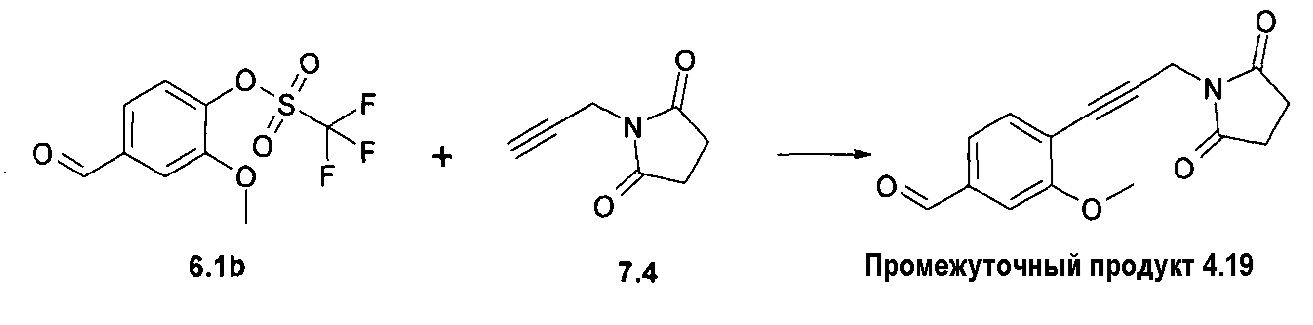
Смесь 4,26 г (15 ммоль) трифлата (6.1b), 2,47 г (18 ммоль) 1-проп-2-инилпирролидин-2,5-диона (7.4), 0,067 г (0,3 ммоль) [(C6H5)3P]2PdCl2, 0,143 г (0,75 ммоль) CuI, 0,32 г (0,75 ммоль) 1,4-бис(дифенилфосфино)бутана и 7 мл (50,5 ммоль) ТЕА в 40 мл ДМФА нагревают в атмосфере азота при температуре 100°С в течение 3 часов. Неорганические соли удаляют и ДМФА выпаривают. Остаток обрабатывают водой, 3 раза экстрагируют по 50 мл EtOAc, полученную органическую фазу выпаривают и очищают с помощью флэш-хроматографии (толуол-МеОН=9:1). Желательный промежуточный продукт 4.19 представляет собой 1,9 г (44%) 4-[3-(2,5-диоксопирролидин-1-ил)проп-1-инил]-3-метоксибензальдегида в виде твердого вещества темно-желтого цвета. (М+Н)+=272, Rt=2,15 мин (А), чистота: 98,9%.
1Н-ЯМР: 2,71 (c, 4H), 3,89 (c, 3H), 4,44 (c, 2H), 7,47-7,50 (м, 2H), 7,55 (д, 1H), 9,98 (c, 1H).
Следуя методикам, представленным для промежуточного продукта 4.19, получают промежуточные продукты общей формулы 4b, перечисленные в таблице 2.
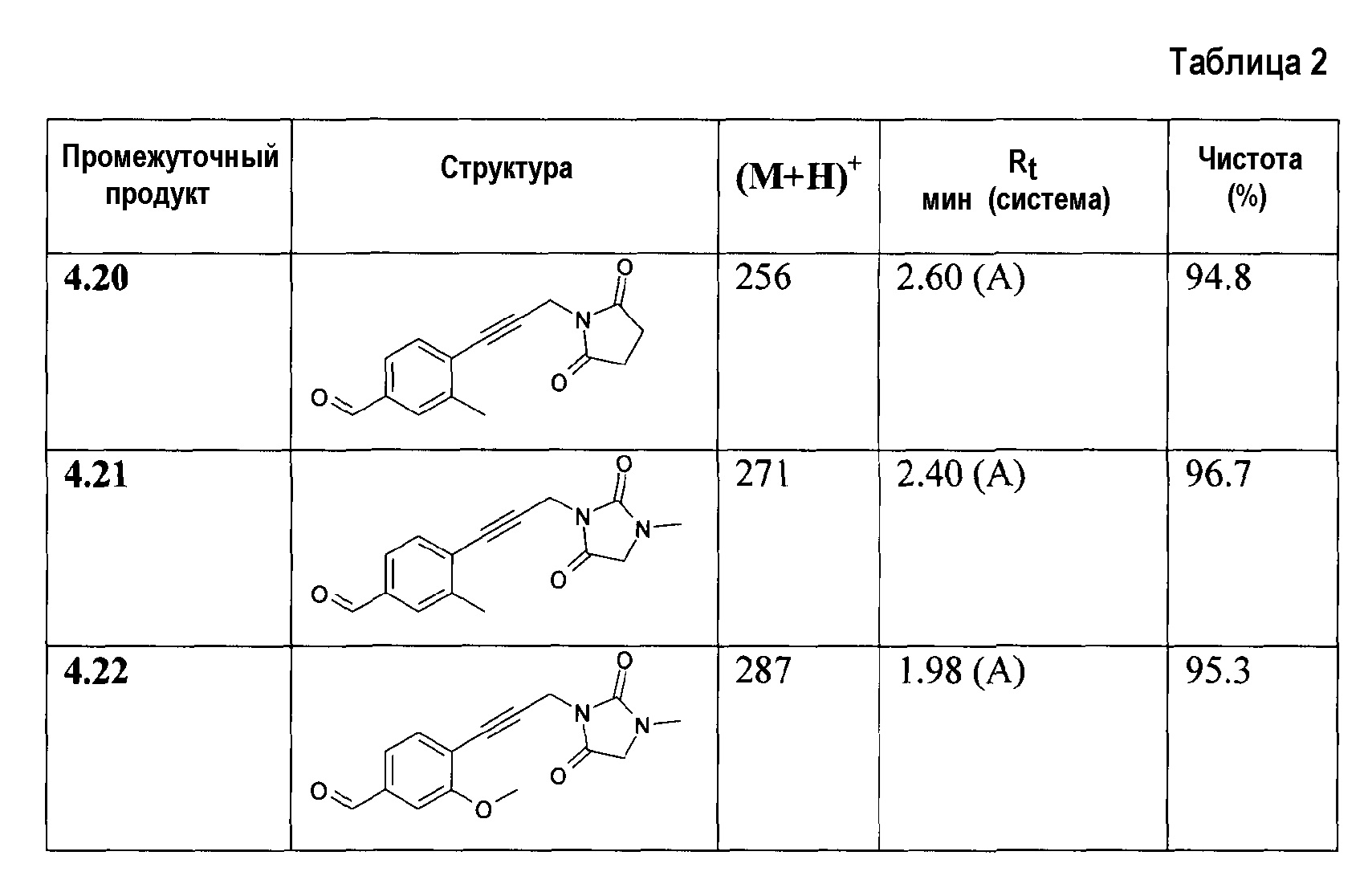
Промежуточный продукт 4.23
4-[3-(2,5-Диоксопирролидин-1-ил)пропил]-3-метоксибензальдегид
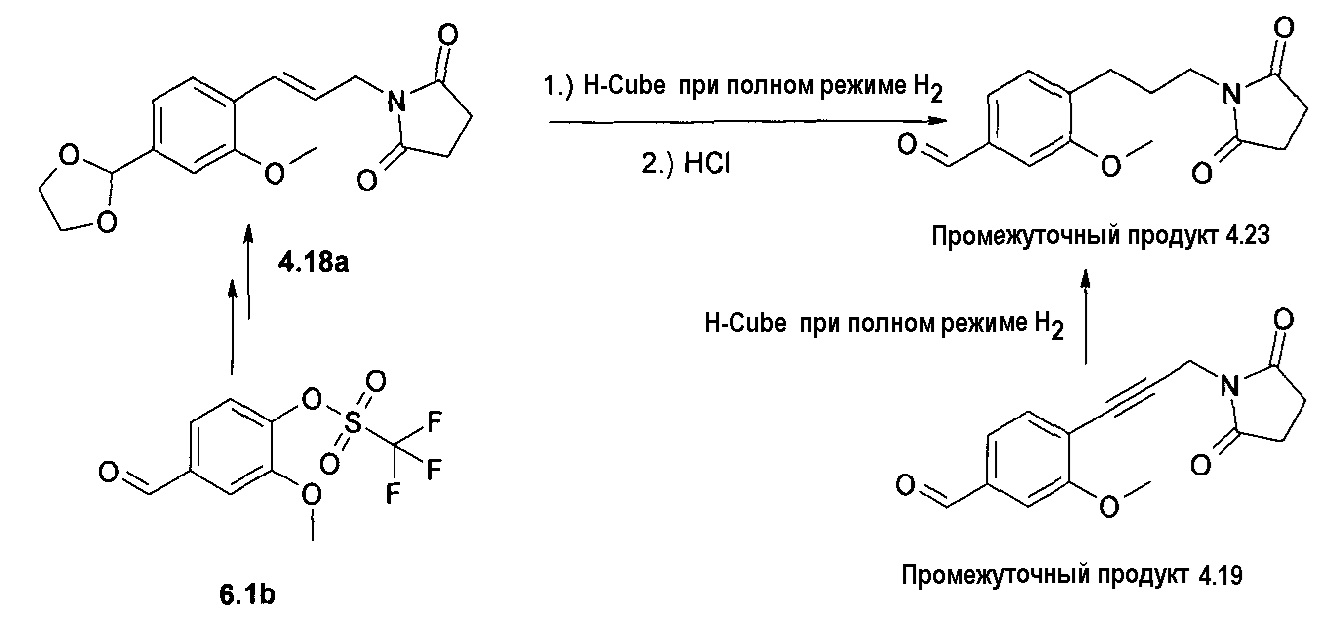
Способ А: Используя 3,02 г (9,2 ммоль) трифлата (6.1b), получают сырое защищенное аллильное производное (4.18а) (как описано на стадиях 2 и 3 промежуточного продукта 4.18), которое гидрируют с помощью оборудования H-Cube, при полном режиме Н2, в EtOAc. После выпаривания остаток растворяют в 50 мл диоксана и перемешивают с 10 мл концентрированной HCl, при комнатной температуре, в течение 0,5 часа. Смесь выпаривают, остаток разбавляют водой, экстрагируют этилацетатом, сушат, и удаляют растворитель. Сырой продукт очищают с помощью флэш-хроматографии. Желательный продукт (промежуточный продукт 4.23) получают в количестве 1,65 г (65,3%). (М+Н)+=276, Rt=2,57 мин (А), чистота: 97,7%.
1Н-ЯМР: 1,75 (кв, 2H), 2,59-2,62 (м, 6H), 3,38 (т, 2H), 3,86 (c, 3H), 7,40 (д, 2H), 7,47 (дд, 1H), 9,94 (c, 1H).
Способ В: Гидрирование 4-[3-(2,5-диоксопирролидин-1-ил)проп-1-инил]-3-метоксибензальдегида (промежуточный продукт 4.19), в таких же случаях, как описано в способе А, приводит к промежуточному продукту 4.23 за одну стадию. Выход и чистота являются такими же, как в случае способа А.
Следуя методикам, представленным для промежуточного продукта 4.23, получают промежуточные соединения общей формулы 4с, перечисленные в таблице 3.
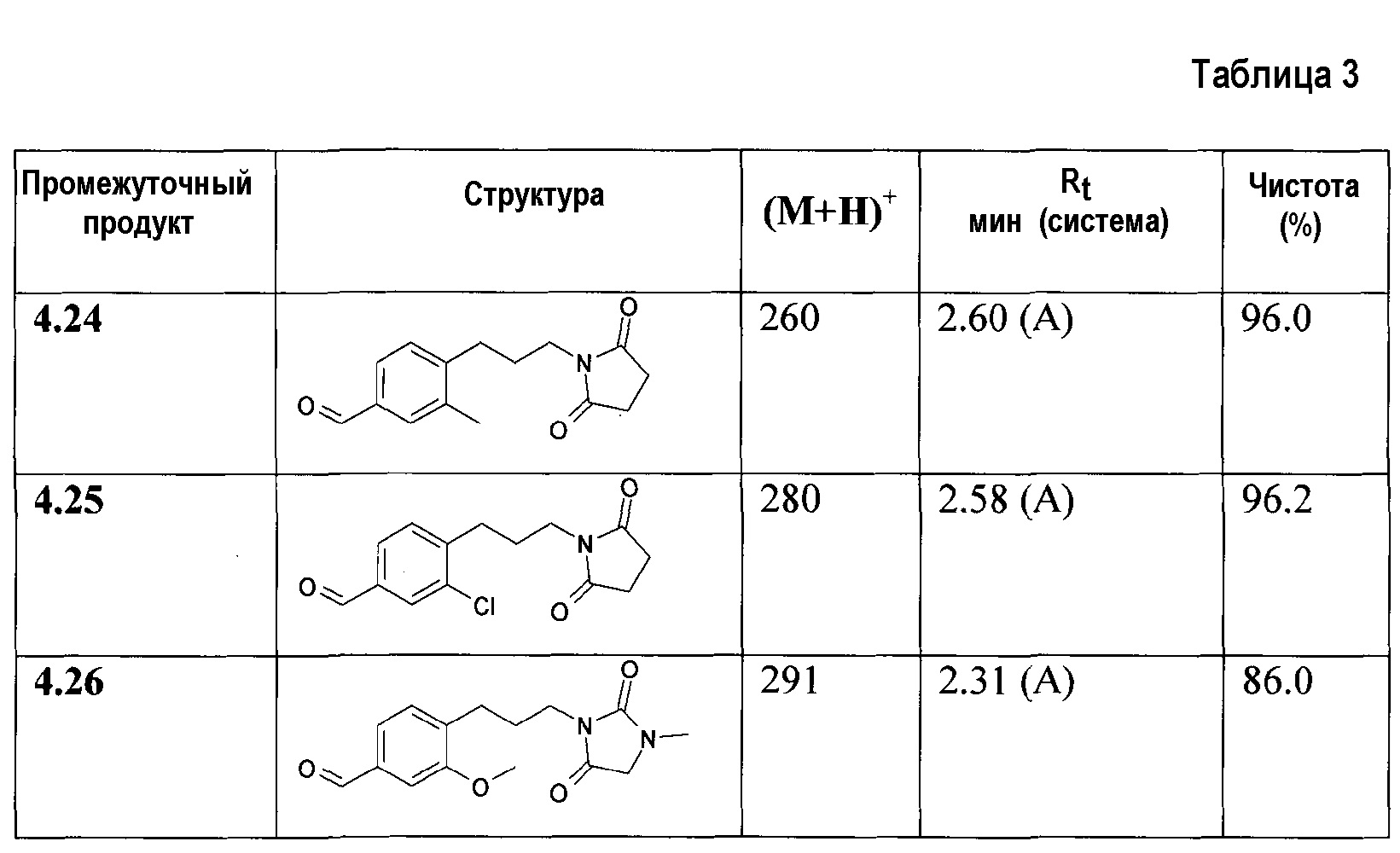
Промежуточный продукт 4.27
4-[2-(2,5-Диоксопирролидин-1-илметил)циклопропил]-3-метоксибензальдегид
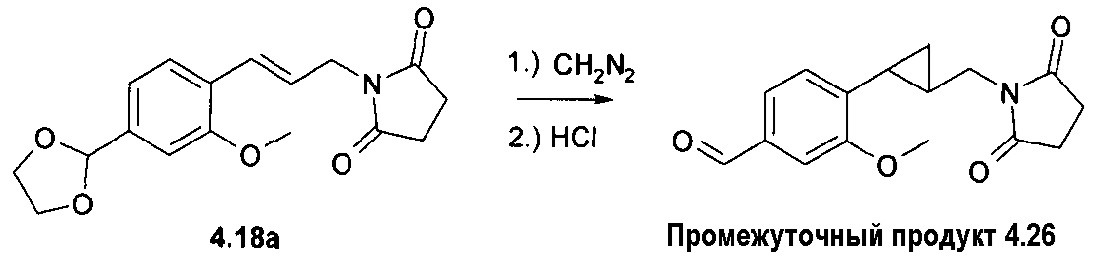
Диазометан получают при использовании набора для получения диазометана (Aldrich): раствор 3,846 г (17,9 ммоль) Diazald в 24 мл Et2O по каплям добавляют к смеси 3,018 г (53,78 ммоль) КОН в 18 мл воды, 4 мл диэтилового эфира и 18 мл 2-(2-этоксиэтокси)этанола при температуре 70°С. Эфирный раствор диазометана непрерывно дистиллируют в перемешиваемый раствор 575 мг (1,81 ммоль) защищенных альдегидов (4.18а; как описано на стадии 3 для промежуточного продукта 4.19) и 3,6 мг (0,016 ммоль) Pd(OAc)2 в смеси DCM и Et2O (28 мл/20 мл), все время поддерживая температуру, составляющую 70°С. После завершения добавления диазометана, раствор перемешивают при комнатной температуре в течение 30 мин. Избыток диазометана гасят с помощью АсОН. Полученную смесь промывают с помощью АсОН, насыщенного раствора Na2CO3, сушат и выпаривают. Выход составляет 514 мг (95%) указанного в заголовке соединения. (М+Н)+=276, Rt=2,58 мин (А), чистота: 99,9%.
ПРИМЕРЫ
Пример 1
транс-4-[([1-(2,3-Дигидро-1-бензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновая кислота
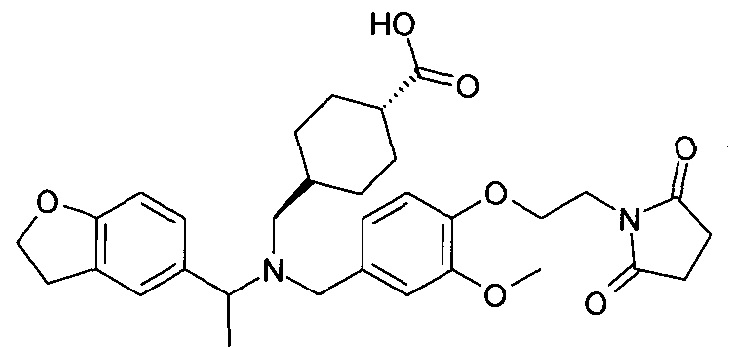
Стадия 1: 3,59 г (22 ммоль) 1-(2,3-дигидробензофуран-5-ил)этиламина (5.1), 5,54 г (20 ммоль) промежуточного продукта 4.1 и 1,60 мл (28 ммоль) АсОН растворяют в 200 мл ТГФ, затем при комнатной температуре в раствор маленькими порциями добавляют 12,7 г (60 ммоль) NaHB(OAc)3. Образовавшуюся суспензию перемешивают в течение ночи и потом разбавляют с помощью 200 мл EtOAc и 400 мл воды. После отделения водную фазу промывают с помощью EtOAc, объединенную органическую фазу сушат и выпаривают. Сырое масло очищают с помощью флэш-хроматографии (10% МеОН в DCM). Промежуточный продукт (2.1) представляет собой 7,05 г масла бледно-желтого цвета (83%). (М+Н)+=425, Rt=2,1 мин (А), чистота: 96,4%.
Солеобразование: 118 мг (0,28 ммоль) соединения 2.1 и 100 мг (0,28 ммоль) тетрагидрата 1,5-нафталиндисульфоновой кислоты растворяют в 2 мл EtOH, затем выпаривают, остаток обрабатывают с помощью Et2O, и образовавшееся твердое вещество белого цвета отфильтровывают и промывают с помощью Et2O. Выход составляет 80 мг (48%) соединения 2.1 с 0,6 моль 1,5-нафталиндисульфоновой кислоты. (М+Н)+=425, Rt=2,1 мин (А), чистота: 98,6%.
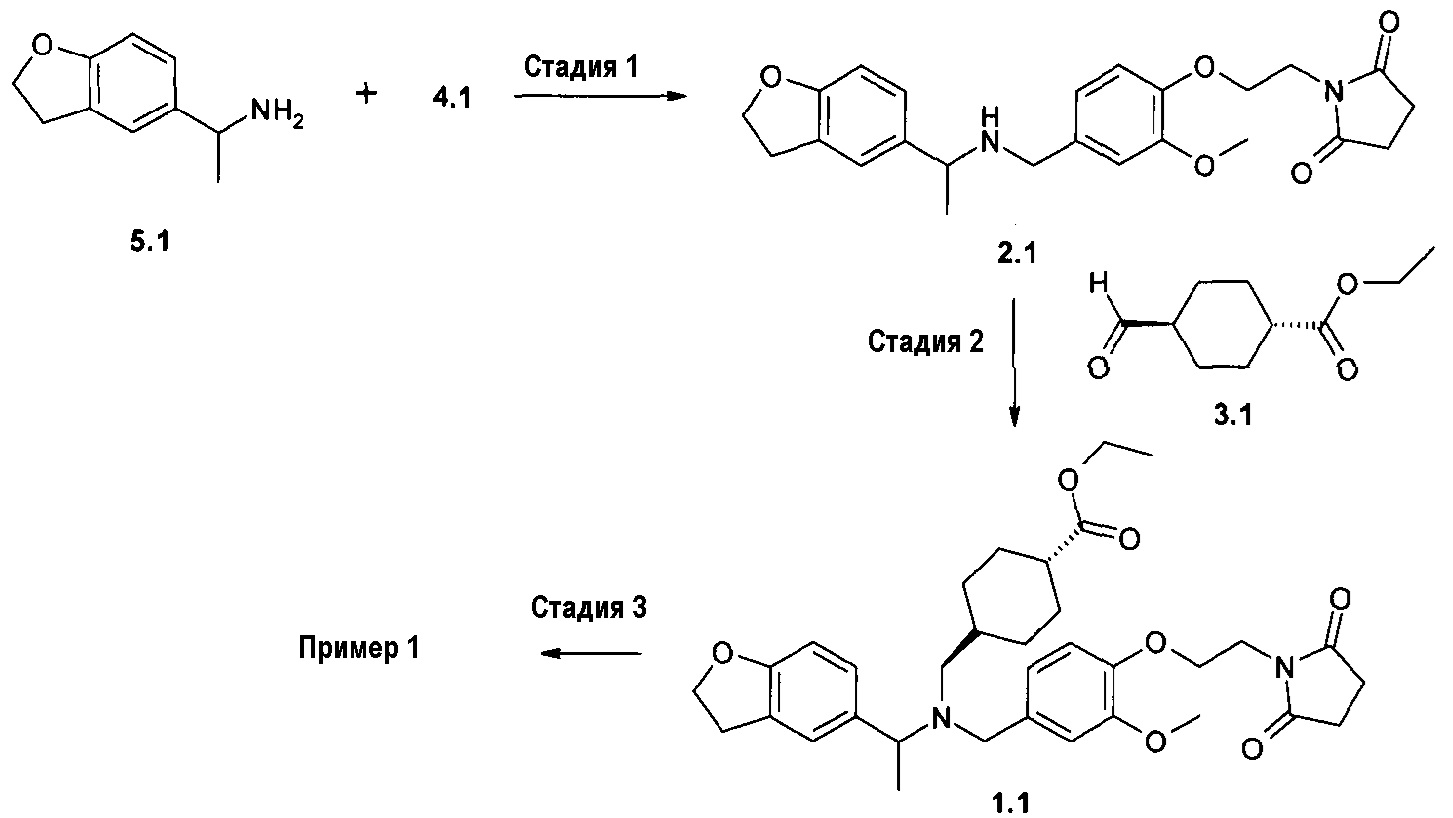
Стадия 2: 950 мг (2,24 ммоль) свободного амина (2.1) и 1,14 г (6,72 ммоль) этилового эфира транс-4-формилциклогексанкарбоновой кислоты (3.1) растворяют в ТГФ и добавляют 0,19 мл (3,36 ммоль) АсОН, затем 2,37 г (11,19 ммоль) NaHB(OAc)3, и реакционную смесь перемешивают в течение ночи при комнатной температуре. Затем реакционную смесь разбавляют с помощью EtOAc (75 мл) и воды (50 мл) и добавляют 2 мл 1н HCl. Водную фазу отделяют, органическую фазу два раза экстрагируют одинаковыми количествами воды и 1н раствора HCl. Водные фазы объединяют, значение рН доводят до 8-9 путем добавления 1н раствора NaOH и два раза экстрагируют с помощью EtOAc. Объединенную органическую фазу промывают насыщенным солевым раствором, сушат и выпаривают. Сырой продукт используют на следующей стадии без очистки. Выход составляет 1,21 г соединения 1.1 (93,4%) в виде масла. (М+Н)+=593, Rt=2,78 мин (А), чистота: 91,1%.
Солеобразование: 250 мг (0,44 ммоль) соединения 1.1 растворяют в 1 мл ТГФ и подкисляют раствором HCl в Et2O. Осажденный гидрохлорид отфильтровывают, промывают с помощью Et2O и сушат. Выход составляет 185 мг (66,4%) в виде пены белого цвета. (М+Н)+=593, Rt=2,78 мин (А), чистота: 93,3%.
Стадия 3: 1,21 г (2,1 ммоль) сложного эфира (1.1) растворяют в 5 мл диоксана, добавляют 5,23 мл (10,5 ммоль) 2н раствора HCl и смесь перемешивают при температуре 60°С в течение 3 часов. Затем смесь разбавляют водой, значение рН доводят до 7 с помощью 1н раствора NaOH, и водную фазу 3 раза экстрагируют с помощью DCM. Органические фазы объединяют, сушат и выпаривают. Указанное в заголовке соединение выделяют в виде пены белого цвета после очистки с помощью ВЭЖХ, используя 4% МеОН в DCM. Выход составляет 615 мг (52%); молекулярная формула = C32H40N2O7. (М+Н)+=565, Rt=2,35 мин (А), чистота: 98,1%.
1Н-ЯМР: 0,6 (дддд, 1H), 0,7 (дддд, 1H), 1,23 (ддд, 2H), 1,28 (д, 3H), 1,4 (ушир, 1H), 1,82 (д, 1H), 1,83 (д, 1H), 1,84 (д, 1H), 1,85 (д, 1H), 2,00 (дд, 1H), 2,04 (дддд, 1H), 2,25 (дд, 1H), 2,63 (c, 4H), 3,16 (т, 2H), 3,27 (д, 1H), 3,42 (д, 1H), 3,70 (т, 2H), 3,1 (c, 3H), 3,79 (кв, 1H), 4,03 (т, 2H), 4,49 (т, 2H), 6,70 (д, 1H), 6,78 (дд, 1H), 6,84 (д, 1H), 6,90 (д, 1H), 7,04 (дд, 1H), 7,20 (д, 1H), 11,90 (c, 1H).
Пример 2
цис-4-[([1-(2,3-Дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновая кислота
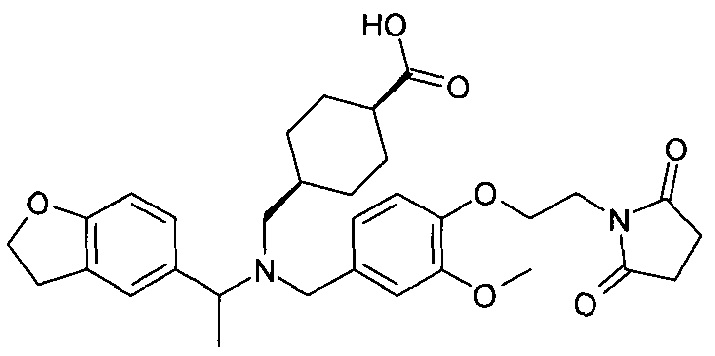
Стадия 1: поступают как в примере 1, стадия 2, осуществляют взаимодействие с метиловым эфиром цис-4-формилциклогексанкарбоновой кислоты (3.2) в тех же самых условиях, после кислотного гидролиза и очистки указанное в заголовке соединение выделяют в виде пены белого цвета; молекулярная формула = C32H40N2O7. (М+Н)+=565, Rt=2,45 мин (А), чистота: 99,5%.
1Н-ЯМР: 1,05-1,07 (м, 2H), 1,28 (д, 3H), 1,36-1,38 (м, 3H), 1,55 (м, 3H), 1,68 (м, 1H), 2,07 (дд, 1H), 2,25 (дд, 1H), 2,35 (квинт., 1H), 2,63 (c, 4H), 3,15 (т, 2H), 3,28 (д, 1H), 3,42 (д, 1H), 3,70 (т, 2H), 3,71 (c, 3H), 3,78 (кв, 1H), 4,02 (т, 2H), 4,49 (т, 2H), 6,69 (д, 1H), 6,78 (дд, 1H), 6,86 (д, 1H), 6,90 (д, 1H), 7,03 (дд, 1H), 7,20 (д, 1H), 11,89 (c, 1H).
Пример 3
транс-4-[([(R)-1-(2,3-Дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновая кислота
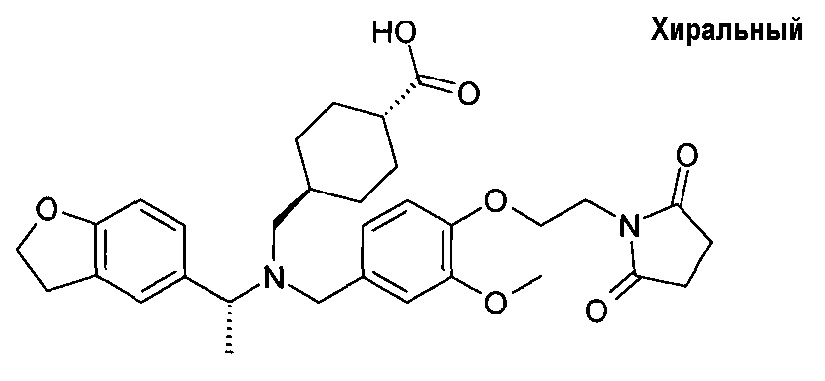
611 мг соединения примера 1 разделяют с помощью препаративной хиральной колоночной хроматографии. Первый элюируемый энантиомер имеет (R)-конфигурацию, выход составляет 290 мг (95%). (М+Н)+=565, Rt=11,0 мин (С), чистота: 98,1%.
Пример 4
транс-4-[([(S)-1-(2,3-Дигидробензофуран-5-ил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновая кислота
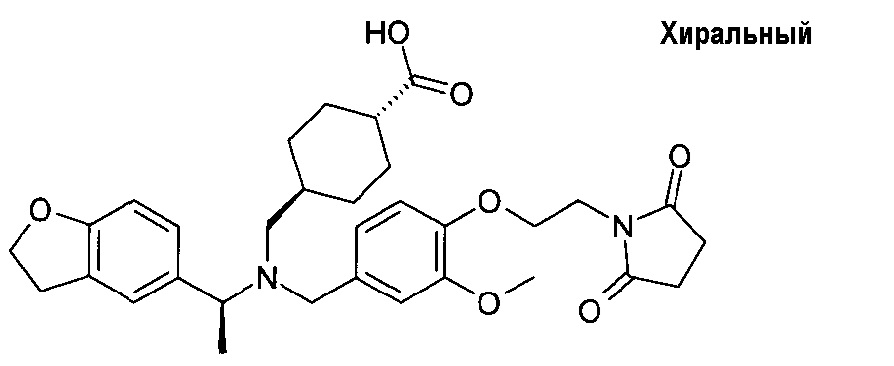
611 мг соединения примера 1 разделяют с помощью препаративной хиральной колоночной хроматографии. Второй элюируемый энантиомер имеет (S)-конфигурацию, выход составляет 240 мг (79%). (М+Н)+=565, Rt=12,2 мин (С), чистота: 99,2%.
Пример 5
транс-4-[([(S)-1-(4-Хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновая кислота
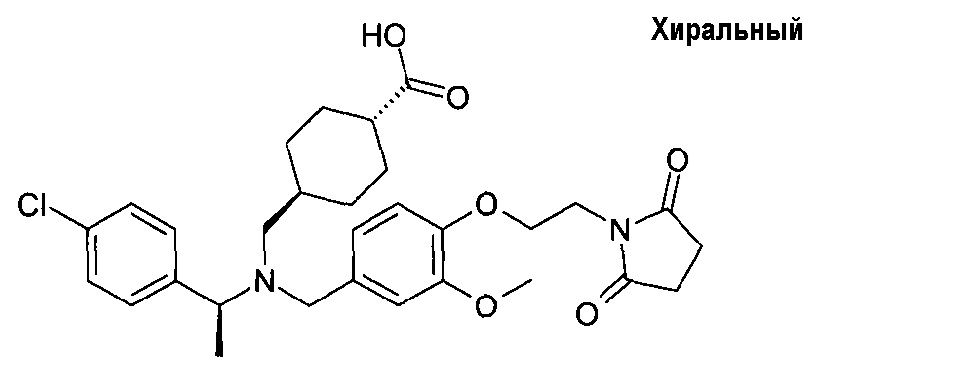
Стадию 1 проводят, как в примере 1, используя (S)-1-(4-хлорфенил)этиламин (5.2), следующие стадии осуществляют аналогично, как в примере 1, и получают желательное соединение. (М+Н)+=557, Rt=2,51 мин (А), чистота: 97,6%.
Пример 6
транс-4-[([(R)-1-(4-Хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновая кислота
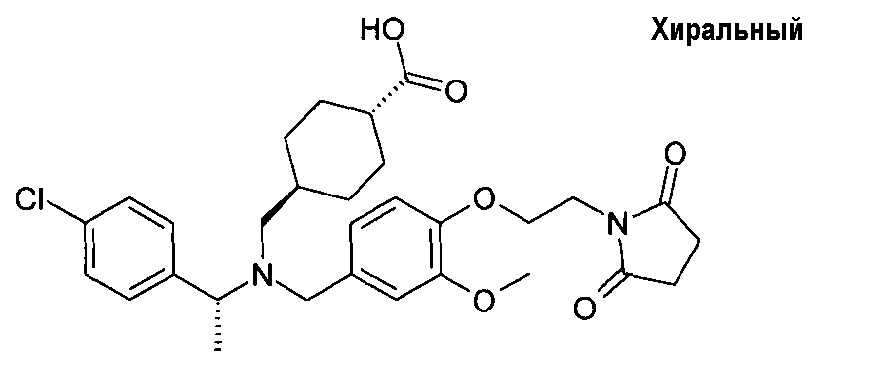
Стадию 1 проводят, как в примере 5, используя (R)-1-(4-хлорфенил)этиламин (5.3), следующие стадии осуществляют аналогично, как в примере 1, и получают желательное соединение. (М+Н)+=557, Rt=2,59 мин (А), чистота: 96,8%.
Пример 7
транс-4-[([(S)-1-(4-Хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)метил]циклогексанкарбоновая кислота
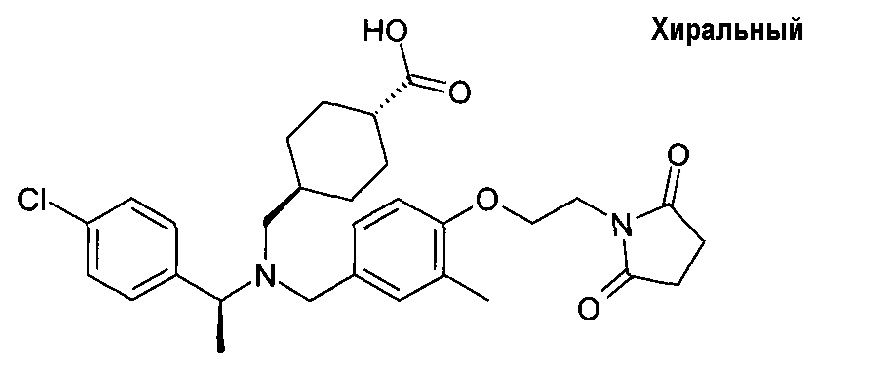
Стадию 1 проводят, как в примере 1, используя (S)-1-(4-хлорфенил)этиламин (5.2) и промежуточный продукт 4.2, следующие стадии осуществляют аналогично, как в примере 1, и получают желательное соединение. (М+Н)+=541, Rt=2,66 мин (А), чистота: 95,5%.
Пример 8
цис-4-[([(S)-1-(4-Хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)метил]циклогексанкарбоновая кислота
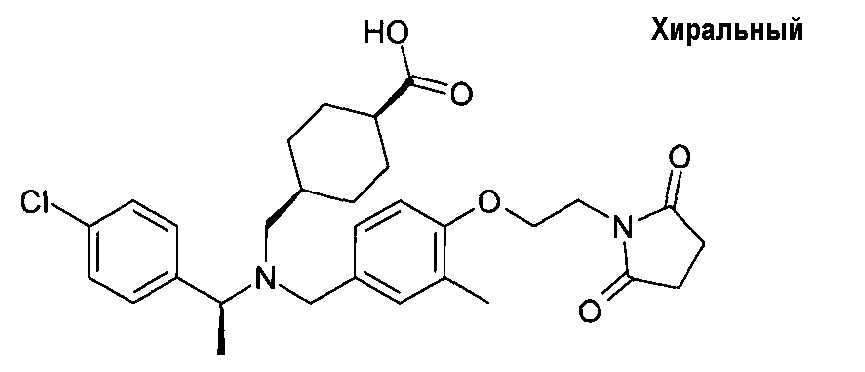
Стадию 1 проводят, как в примере 7, стадия 2, осуществляя взаимодействие с метиловым эфиром цис-4-формилциклогексанкарбоновой кислоты (3.2) в тех же самых условиях, после кислотного гидролиза и очистки указанное в заголовке соединение выделяют. (М+Н)+=541, Rt=2,64 мин (А), чистота: 98,0%.
Пример 9
транс-4-[([(R)-1-(4-Хлорфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)метил]циклогексанкарбоновая кислота
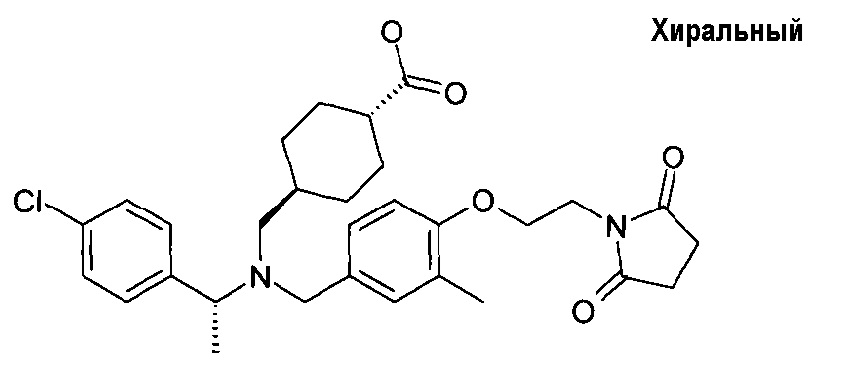
Стадию 1 проводят, как в примере 6, используя (R)-1-(4-хлорфенил)этиламин (5.3) и промежуточный продукт 4.2, следующие стадии осуществляют аналогично, как в примере 6, и получают желательное соединение. (М+Н)+=541, Rt=2,61 мин (А), чистота: 96,8%.
Пример 10
транс-4-[((5-Хлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновая кислота
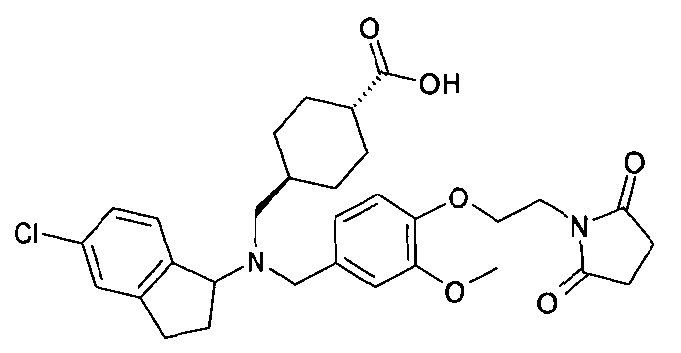
Следуя методикам, представленным в примере 1, используя 5-хлориндан-1-иламин (5.4) и промежуточный продукт 4.1 на первой стадии восстановительного аминирования, получают желательное соединение. (М+Н)+=569, Rt=2,57 мин (А), чистота: 89,9%.
Пример 11
транс-4-[(((R)-5-Хлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновая кислота
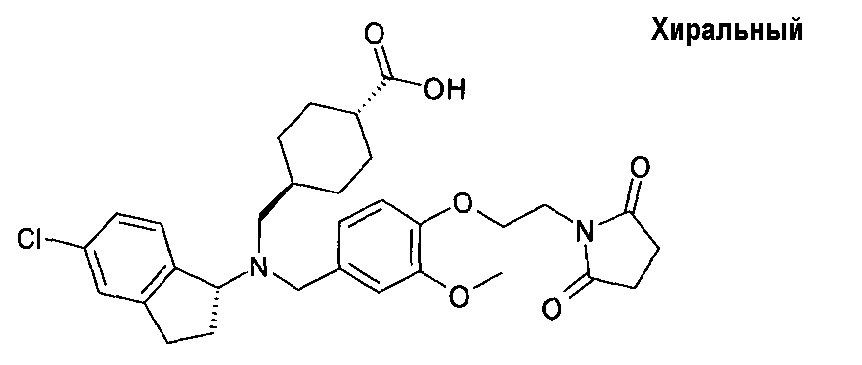
643 мг соединения примера 10 разделяют с помощью препаративной хиральной колоночной хроматографии. Первый элюируемый энантиомер имеет (R)-конфигурацию, выход составляет 250 мг (77,8%). (М+Н)+=569, Rt=6,6 мин (С), чистота: 98,2%.
Пример 12
транс-4-[(((S)-5-Хлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновая кислота
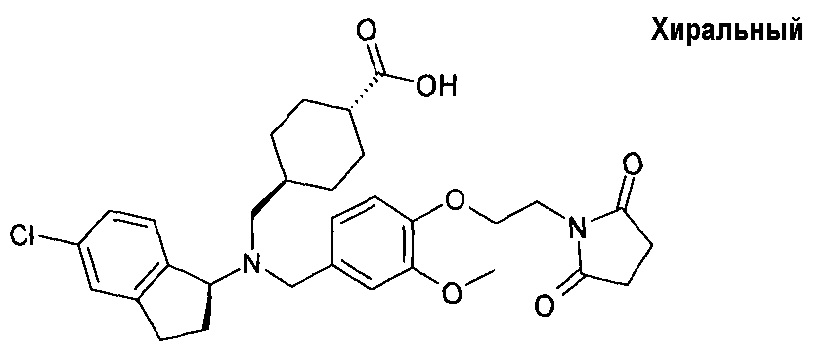
Способ А: Следуя методикам хирального разделения, представленным в примере 11, используя 643 мг соединения примера 10, выделяют 270 мг (84%) указанного в заголовке соединения в виде второго элюируемого вещества. (М+Н)+=569, Rt=9,0 мин (С), чистота: 97,4%.
Метод: Следуя методикам, представленным в примере 1, используя 400 мг (2,39 ммоль) (S)-5-хлориндан-1-иламина (5.5) и 661 мг (2,39 ммоль) промежуточного продукта 4.1, выделяют указанное в заголовке соединение: 642 мг (48%). (М+Н)+=569, Rt=2,69 мин (А), чистота: 99,5%.
Пример 13
цис-4-[((5-Хлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновая кислота
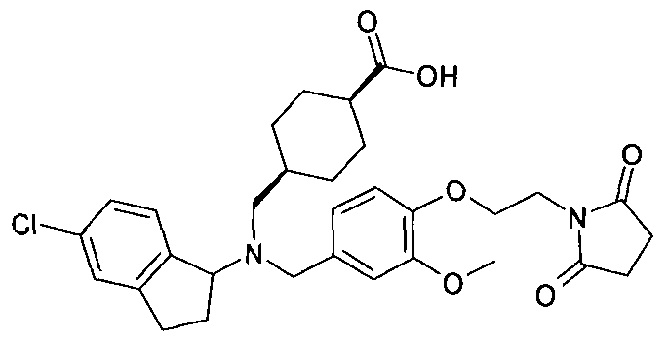
Следуя методикам, представленным в примере 2, используя 5-хлориндан-1-иламин (5.4) и промежуточный продукт 4.1 и сложный эфир 3.2 на стадиях восстановительного аминирования, получают желательное соединение. (М+Н)+=569, Rt=6,31 мин (В), чистота: 85,6%.
Пример 14
Гидрохлорид транс-4-[(((S)-4,5-дихлориндан-1-ил)-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метоксибензил}амино)метил]циклогексанкарбоновой кислоты
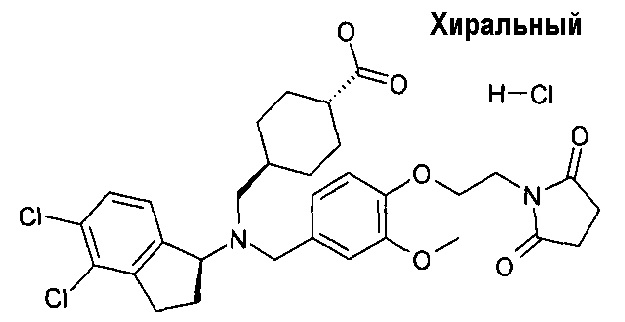
Стадии 1 и 2: 3,70 г (15,5 ммоль) (S)-4,5-дихлориндан-1-иламингидрохлорида (5.6) растворяют в DCM, промывают насыщенным раствором бикарбоната натрия и насыщенным солевым раствором, сушат над сульфатом натрия и выпаривают при пониженном давлении. Остаток растворяют в ТГФ и помещают на водяную баню (температура бани: 15°С). Добавляют 4,29 г (15,5 ммоль) промежуточного продукта 4.1, затем уксусную кислоту (1,33 мл, 23,3 ммоль). В виде четырех порций, с составляющими 10 минут интервалами, добавляют 8,21 г (38,7 ммоль) NaBH(OAc)3. Водяную баню убирают, и реакционную смесь перемешивают в течение одного часа при комнатной температуре. Добавляют 2,63 г (15,5 ммоль) метилового эфира транс-4-формилциклогексанкарбоновой кислоты (3.3) и реакционную смесь перемешивают еще час при комнатной температуре. Затем смесь разбавляют водой, значение рН доводят до 7 путем добавления насыщенного раствора NaHCO3 и три раза экстрагируют с помощью DCM. Органические фазы объединяют, сушат над Na2SO4 и выпаривают при пониженном давлении. Остаток очищают путем флэш-хроматографии на силикагеле, используя 50% EtOAc в гексане. Путем выпаривания чистых фракций получают масло бледно-желтого цвета. Выход: 6,40 г (67%). (М+Н)+=317, Rt=2,91 мин (А), чистота: 98,6%.
Стадия 3: 6,40 г (10,4 ммоль) сложного метилового эфира растворяют в 20 мл диоксана. Добавляют 25,9 мл (51,8 ммоль) 2н раствора HCl и реакционную смесь перемешивают в течение 5 часов при температуре 80°С. Затем смесь разбавляют водой, значение рН доводят до 7 путем добавления NaHCO3 и три раза экстрагируют с помощью DCM. Органические фазы объединяют, сушат над сульфатом натрия и выпаривают при пониженном давлении. Остаток очищают путем флэш-хроматографии на силикагеле, используя градиент 3-6% МеОН в DCM. Чистые фракции объединяют и выпаривают, получая желательное соединение в виде твердой пены белого цвета: 3,82 г (61,1%). (М+Н)+=603, Rt=2,66 мин (А), чистота: 99,6%.
Следуя методикам, как представленные в примере 1, используя различные амины (5), бензальдегиды (4) и эфиры формилциклоалканкарбоновых кислот (3, R'=CHO), получают перечисленные в таблице 4 соединения.
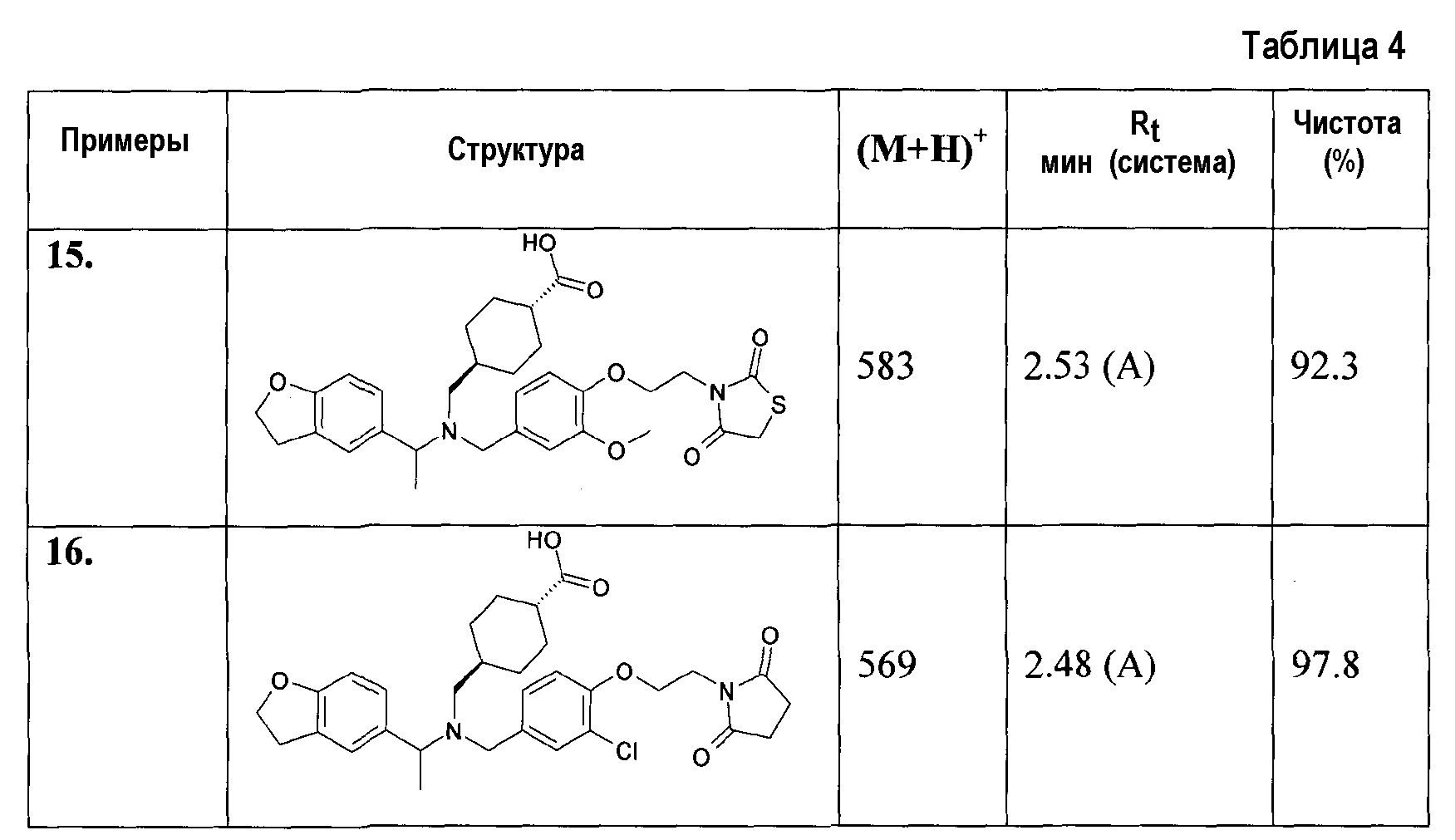
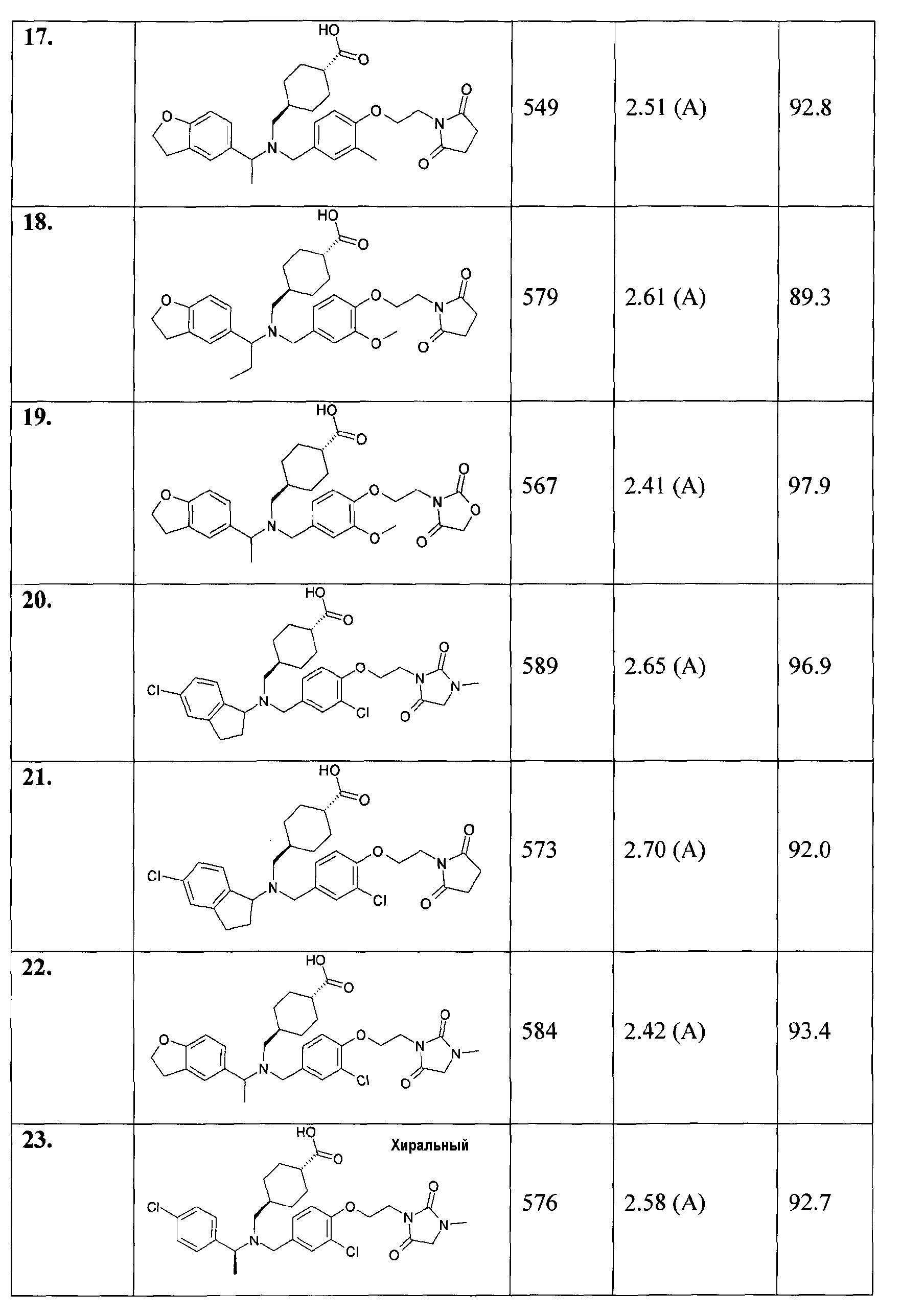
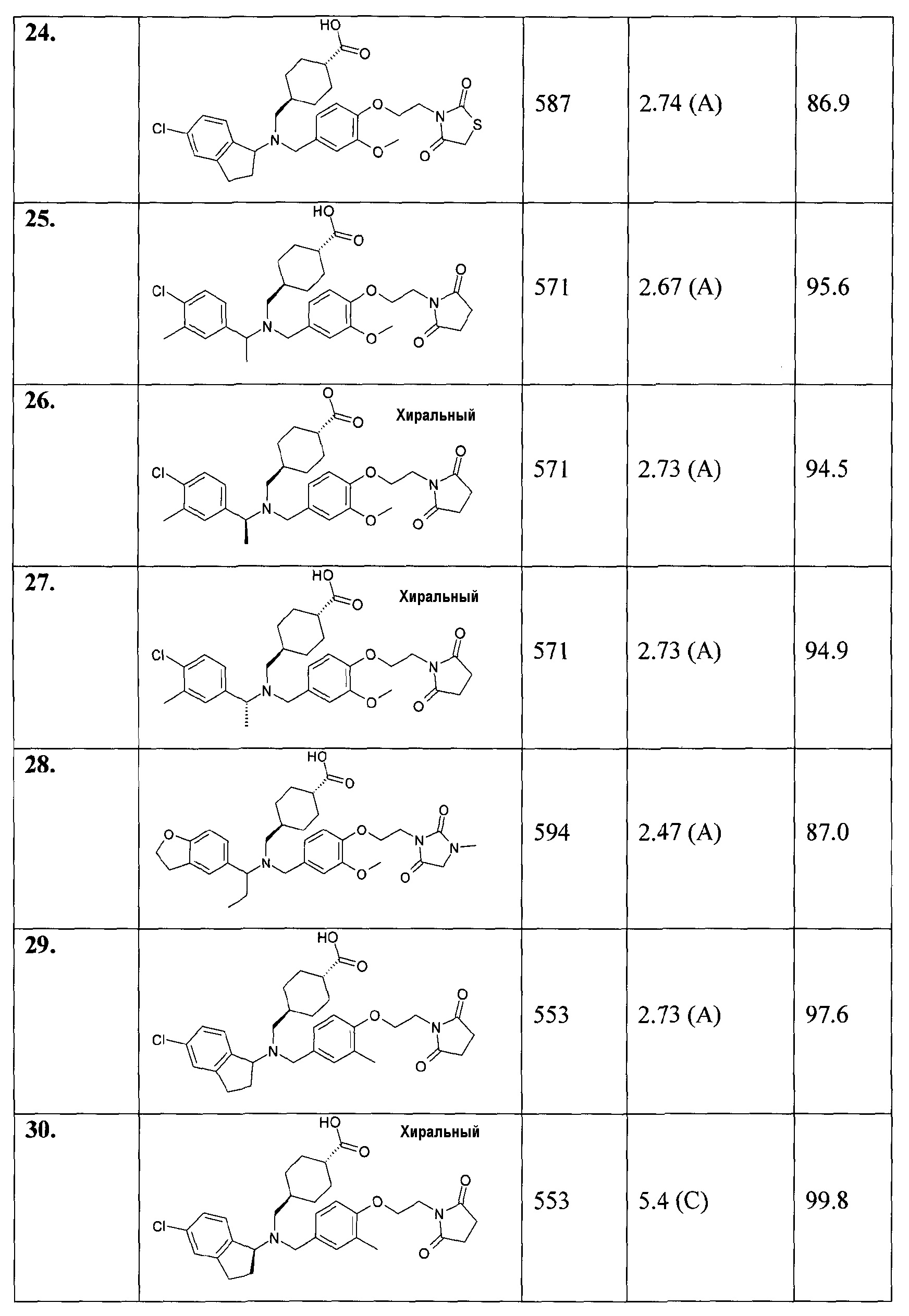
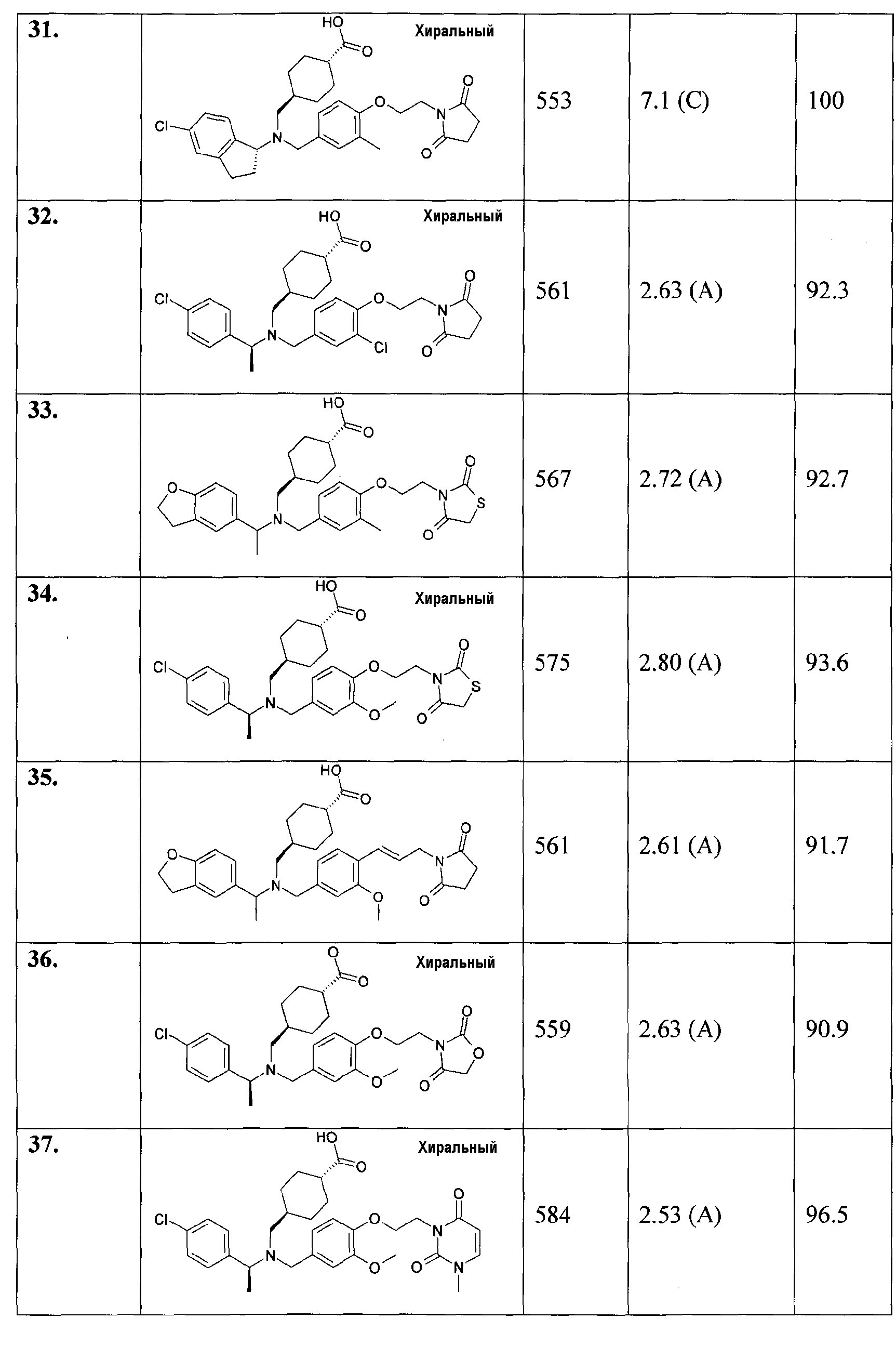
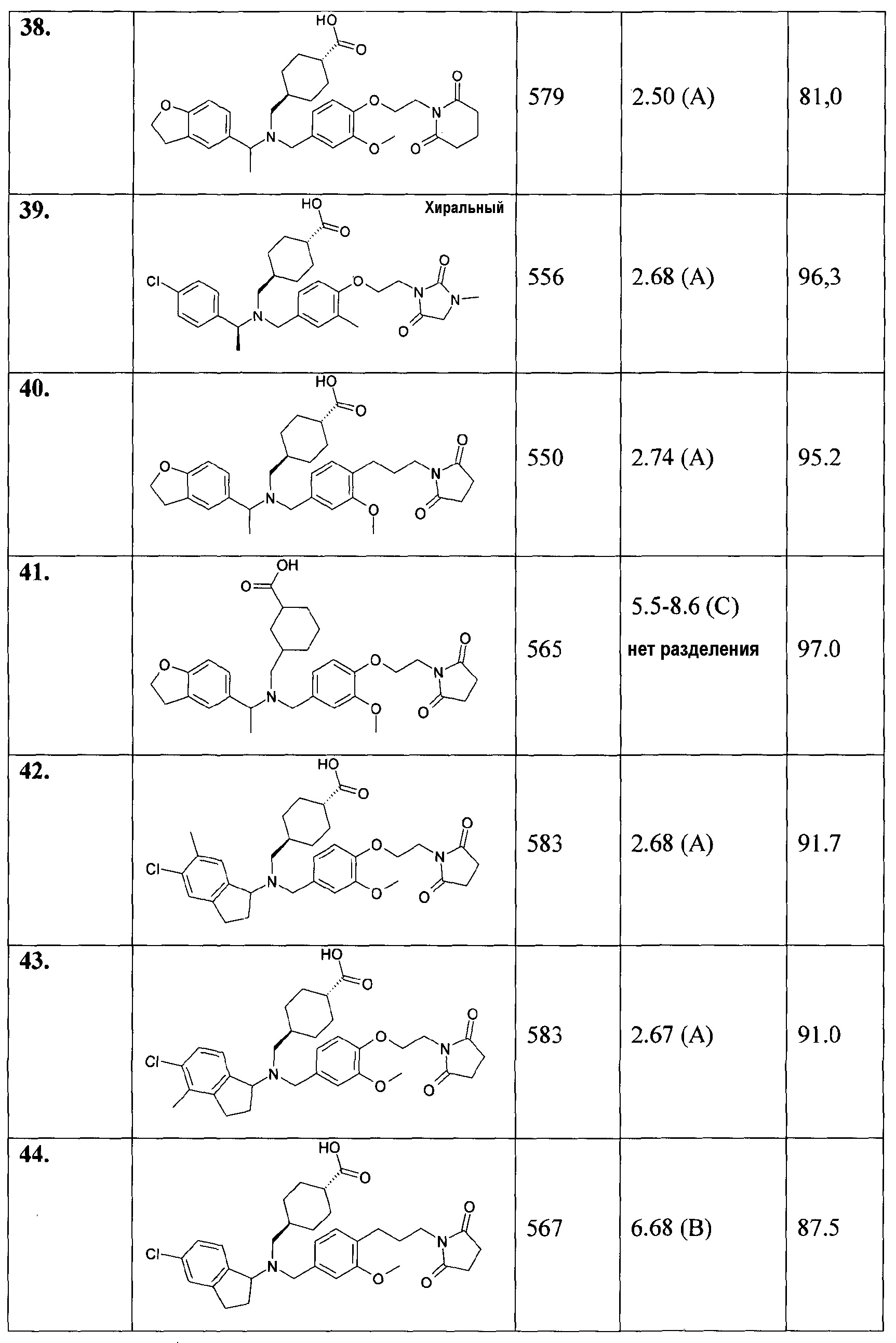
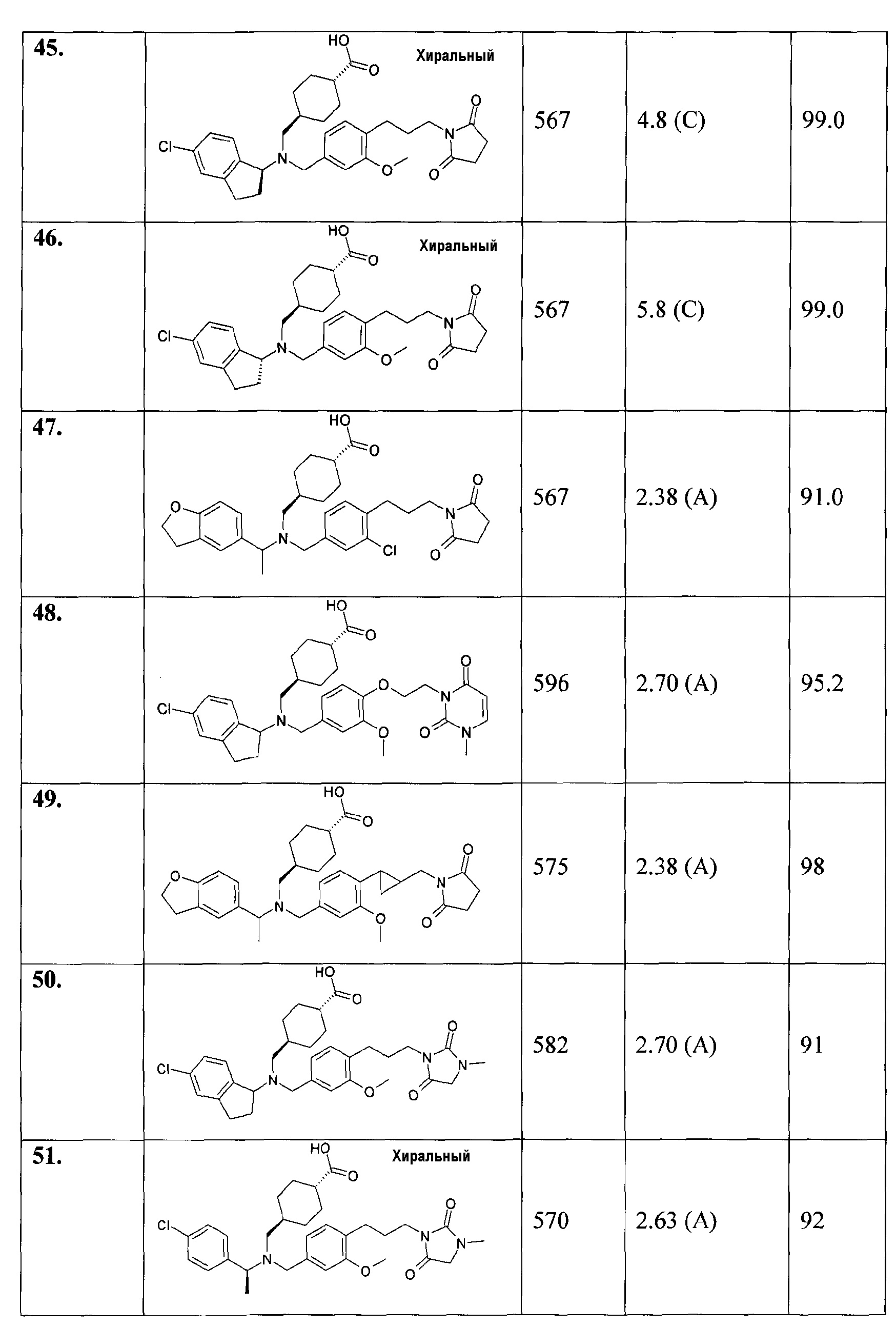
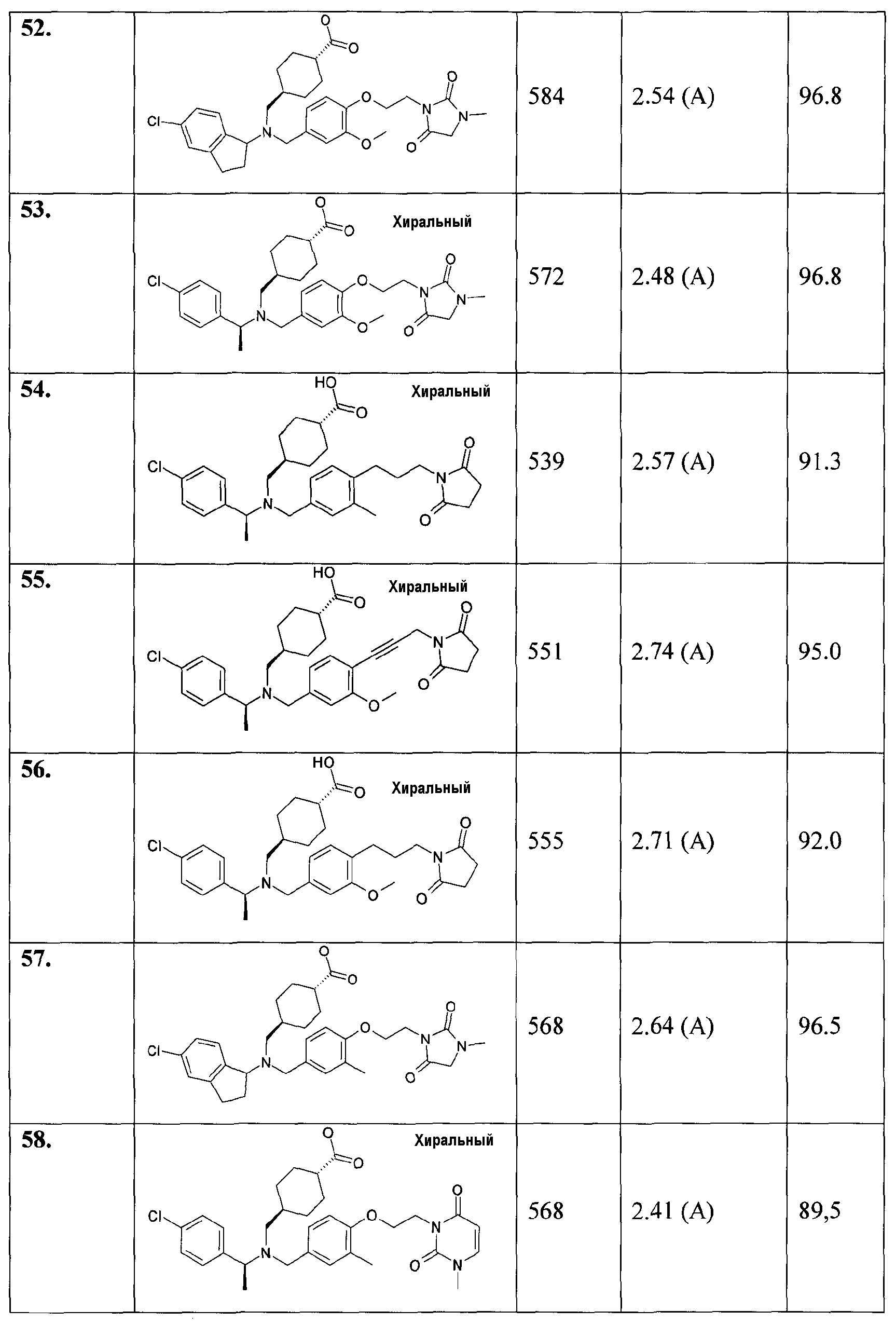
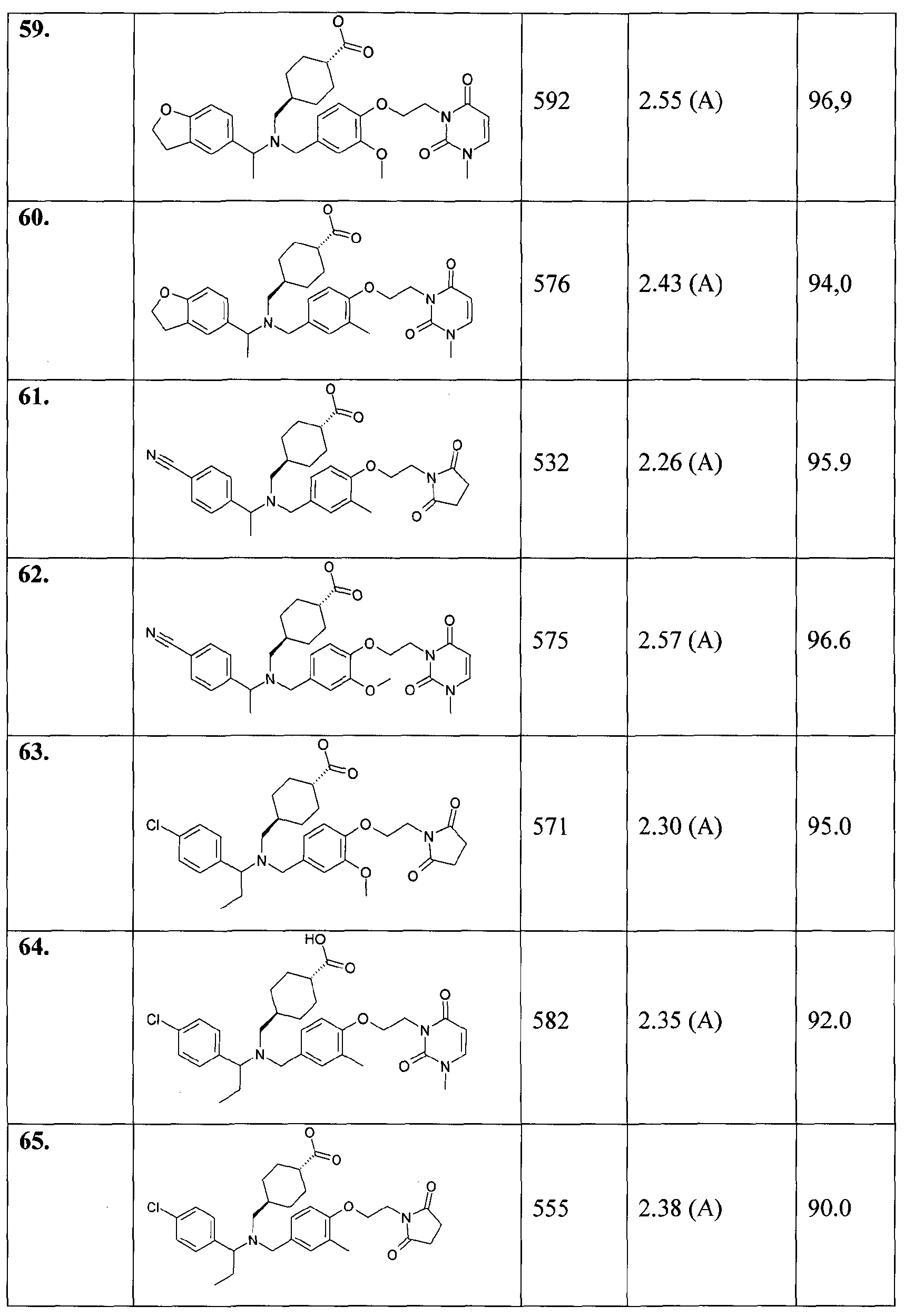
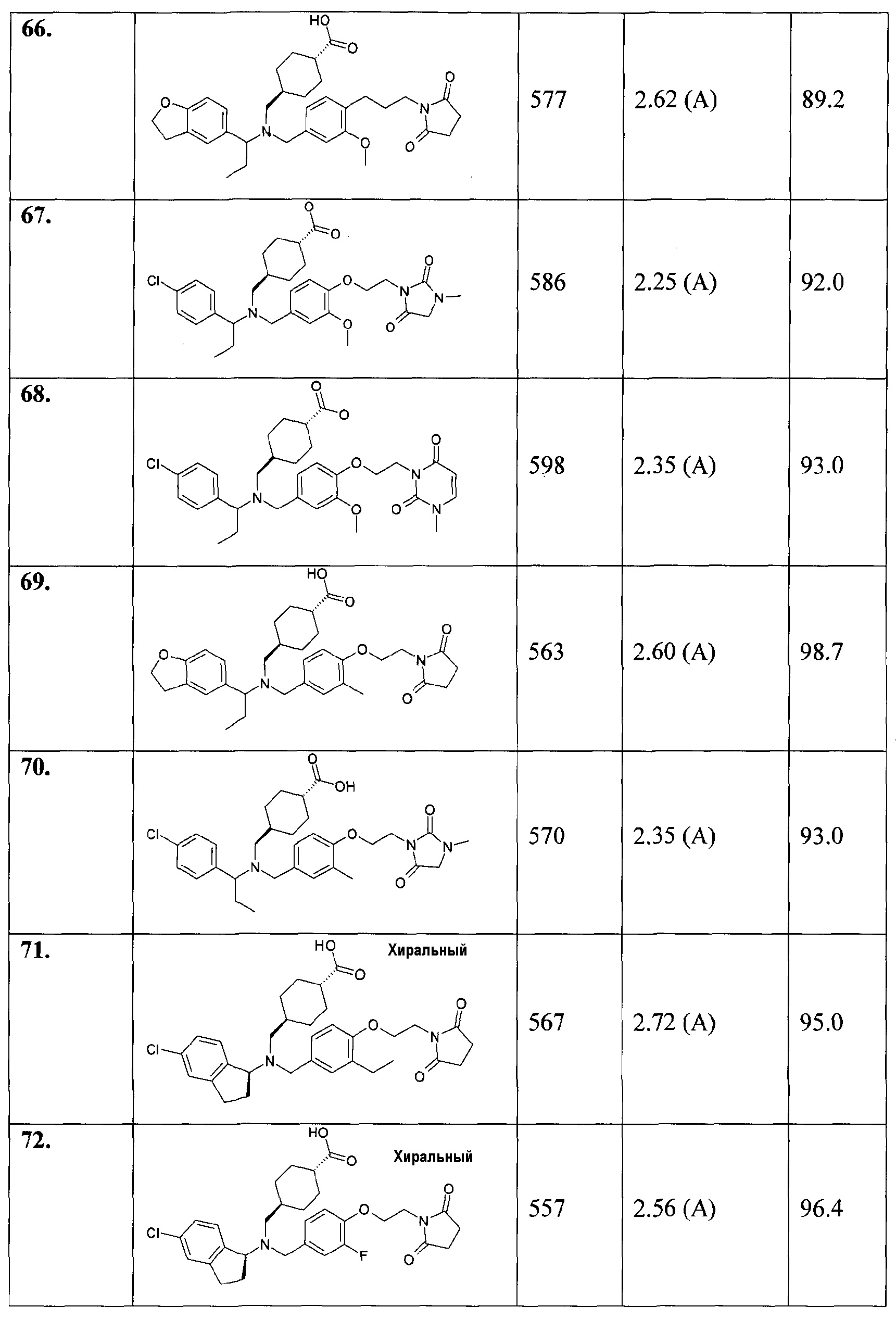
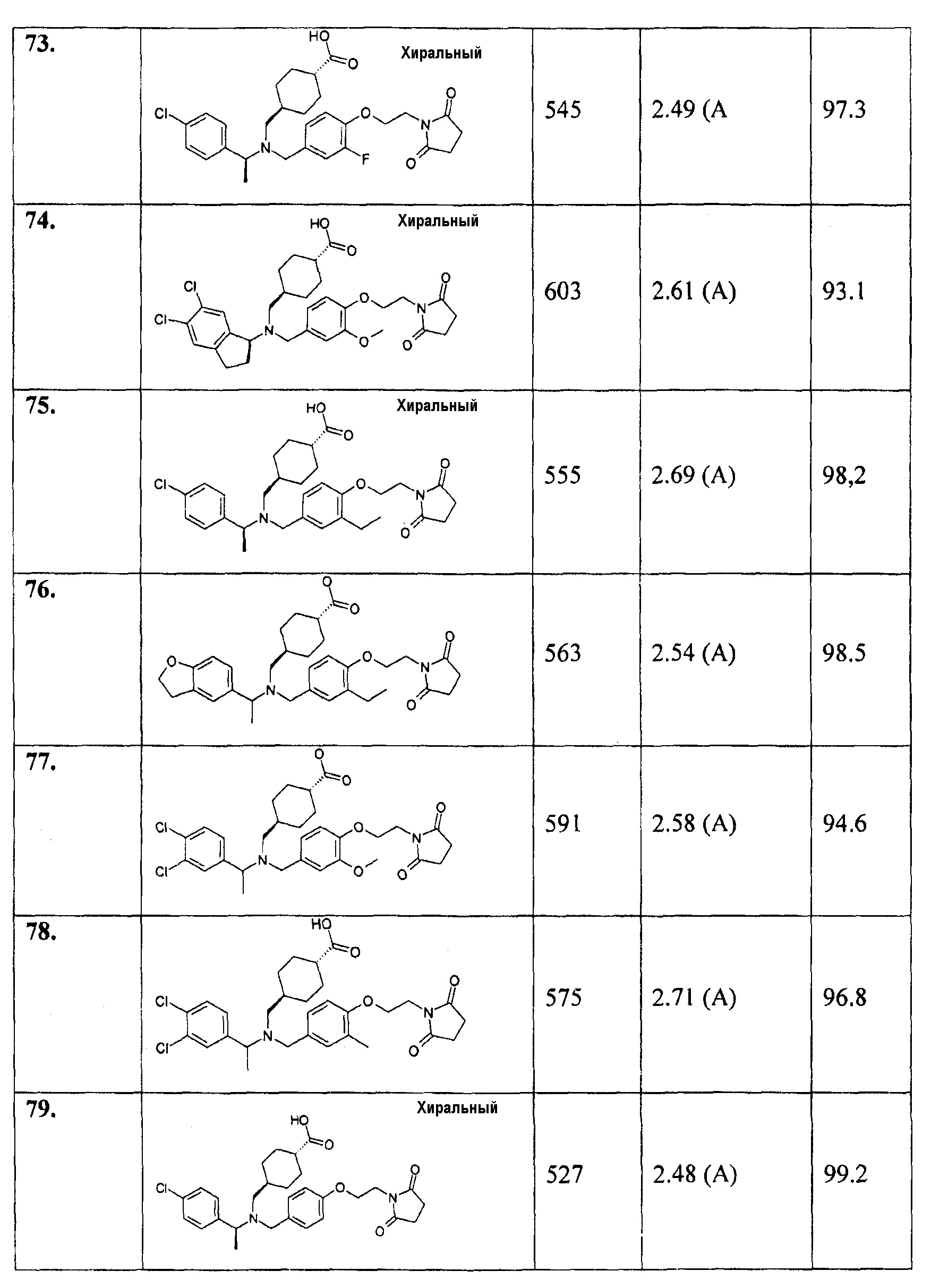
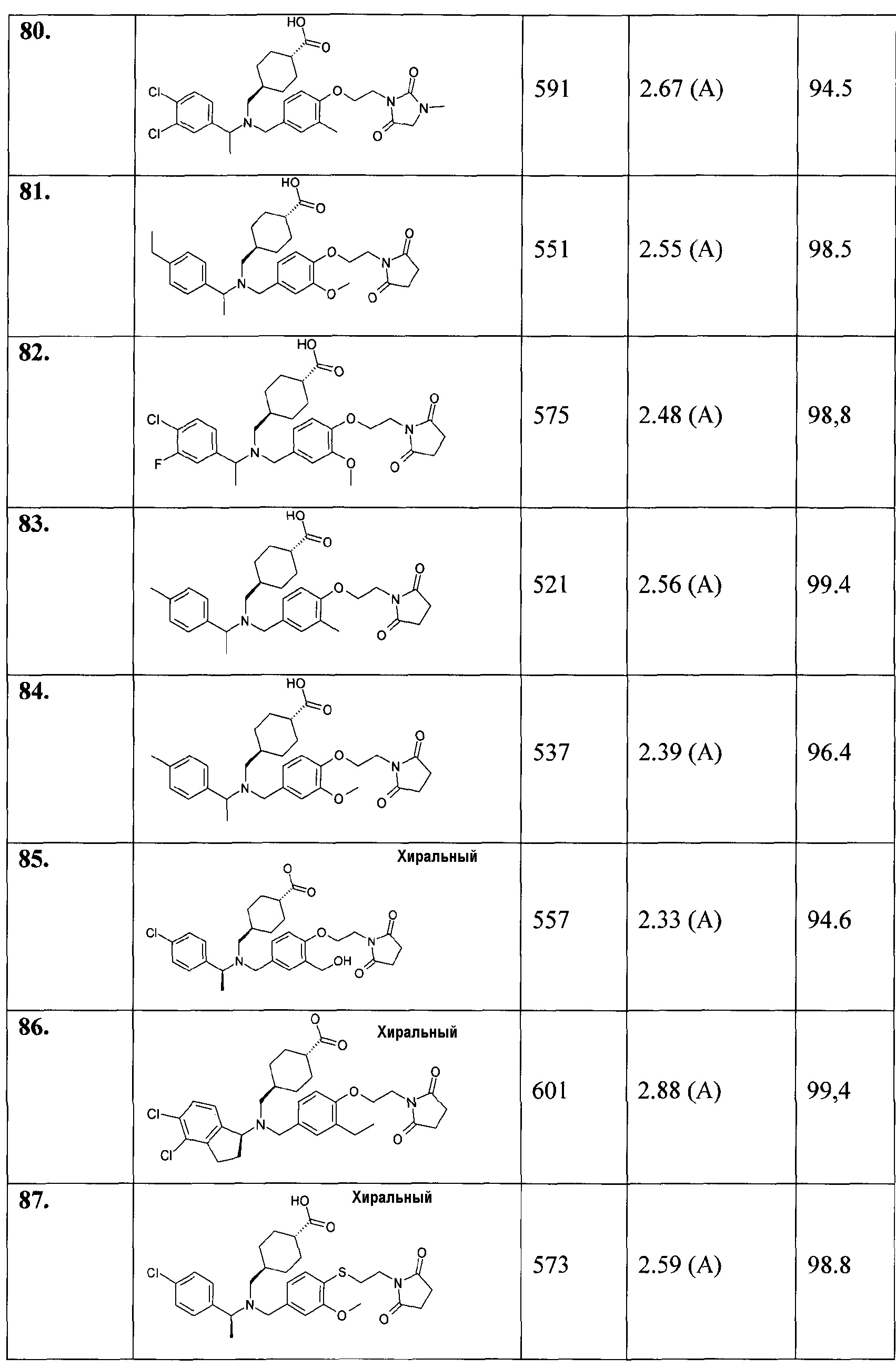
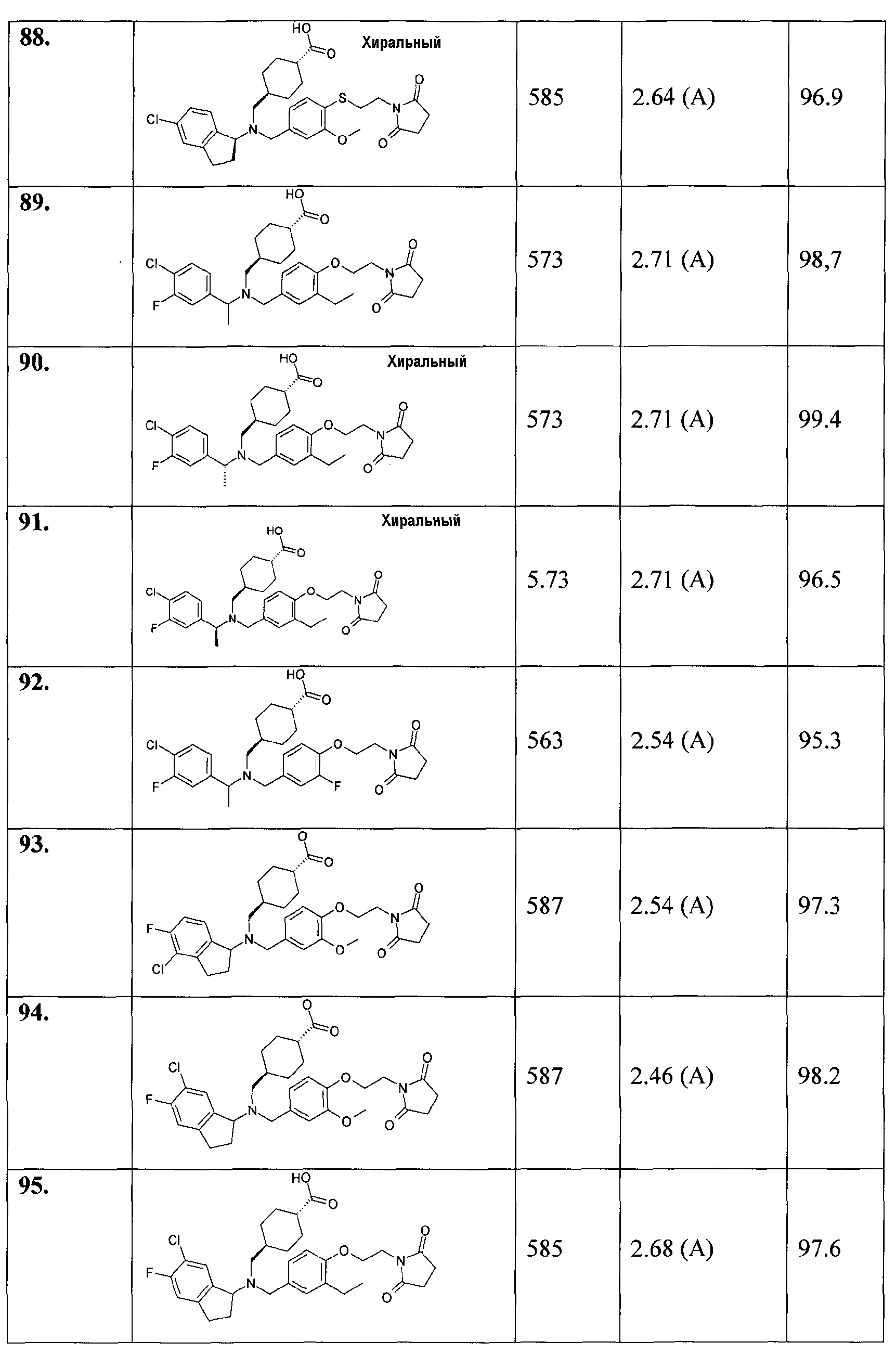
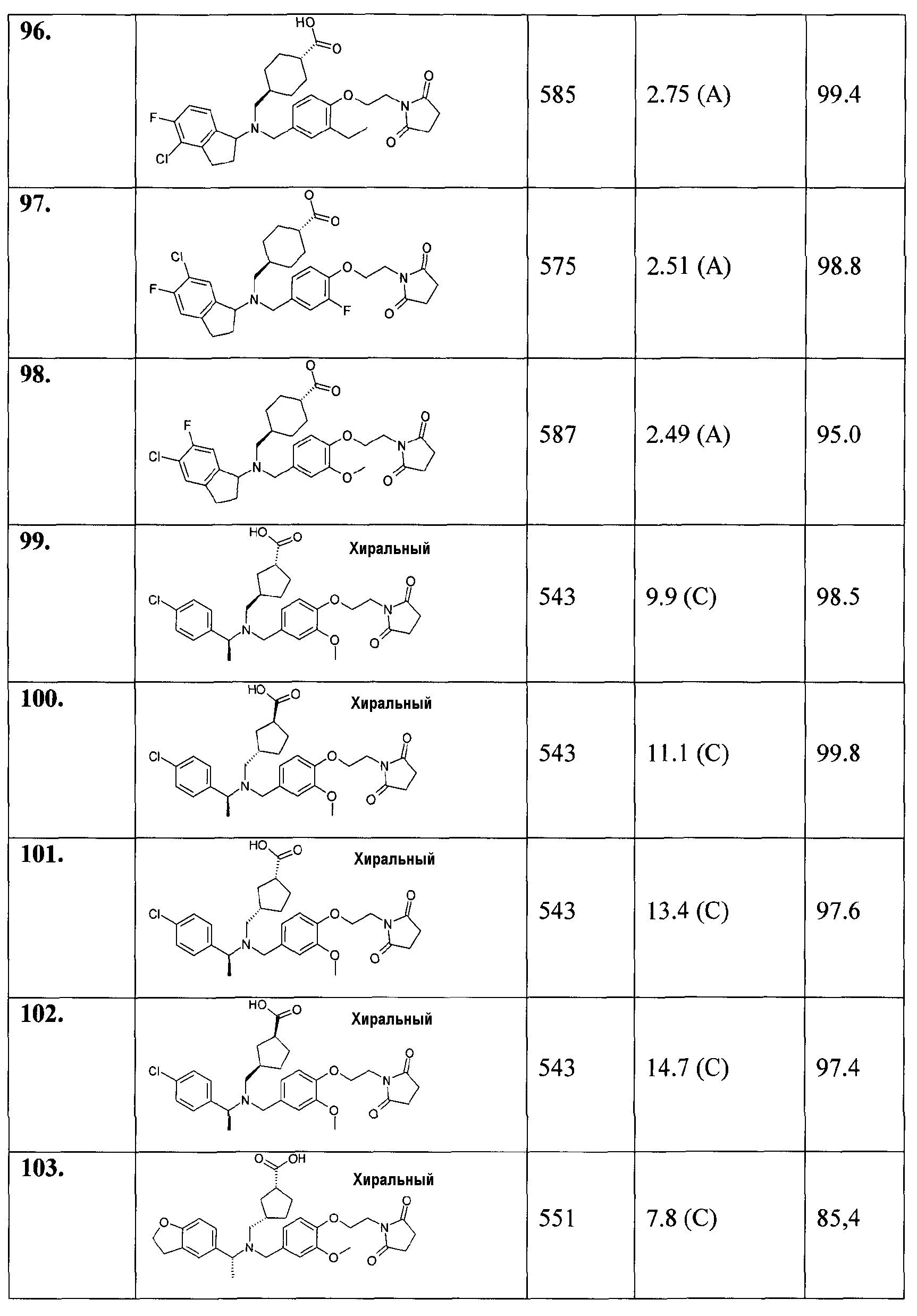
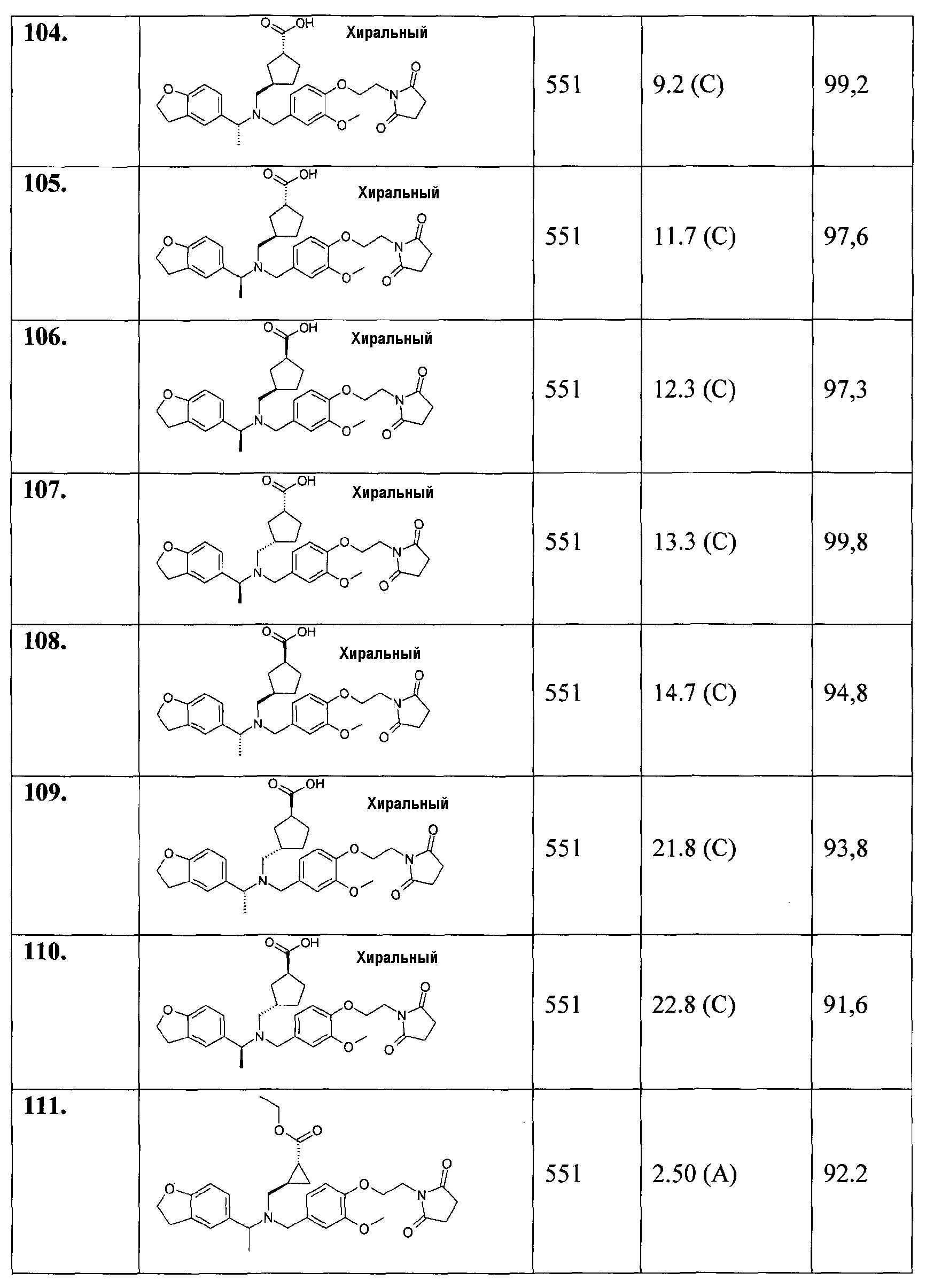
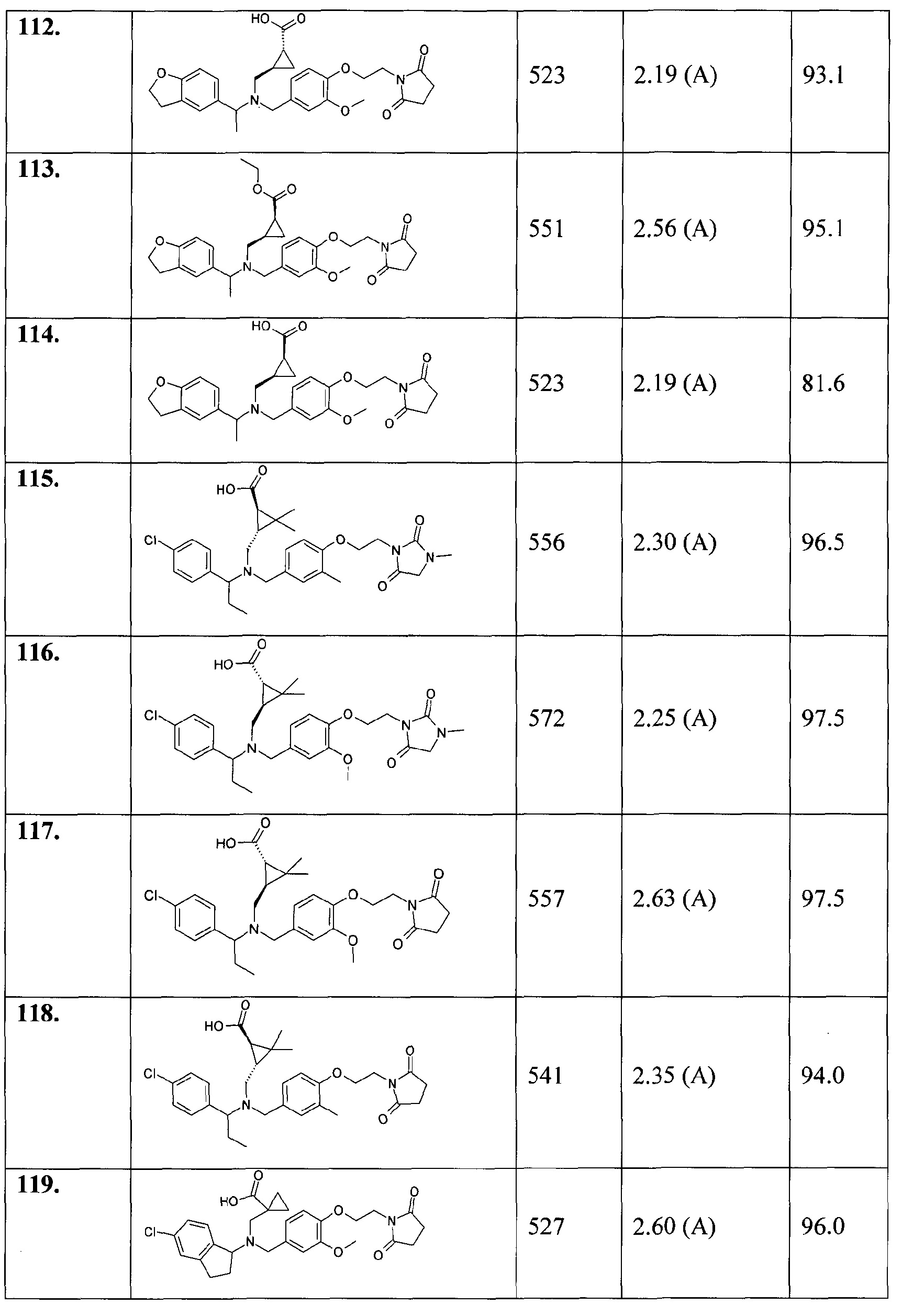
Пример 120
транс-3-([1-(2,3-Дигидробензофуран-5-ил)этил]-{3-метокси-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензил}амино)циклобутанкарбоновая кислота
Стадия 1: 0,37 г (2,24 ммоль) 1-(2,3-дигидробензофуран-5-ил)этиламина (5.1) и 0,62 г (2,054 ммоль) промежуточного продукта 4.13 растворяют в 10 мл ТГФ. Добавляют 0,17 мл (3,06 ммоль) АсОН и 1,08 г (5,09 ммоль) NaHB(OAc)3 и реакционную смесь перемешивают в течение ночи. Затем смесь разбавляют водой, значение рН доводят до 8-9 при использовании NaHCO3, и экстрагируют с помощью EtOAc, объединенную органическую фазу промывают водой и насыщенным солевым раствором, сушат над Na2SO4 и выпаривают. Выход промежуточного продукта 2.2 составляет 0,88 г (95,6%). (М+Н)+=452, Rt=2,24 мин (А), чистота: 86,7%.
Стадия 2: 0,88 г (1,95 ммоль) полученного вторичного амина растворяют в 15 мл абсолютного EtOH, добавляют 0,334 г (2,92 ммоль) 3-оксоциклобутанкарбоновой кислоты (3.4), 0,17 мл (2,92 ммоль) АсОН и 0,313 г (2,92 ммоль) комплекса 2-пиколина с бораном. Смесь перемешивают при температуре 55°С в течение ночи, потом охлаждают, выпаривают, разбавляют водой и экстрагируют с помощью DCM. Объединенные органические фазы сушат, выпаривают и очищают с помощью колоночной хроматографии (CHCl3-MeOH=19/1). Первый элюируемый продукт является указанным в заголовке соединением. Выход: 110 мг (10,3%). (М+Н)+=550, Rt=3,16 мин (В), чистота: 93,2%.
Пример 121
цис-3-([1-(2,3-Дигидробензофуран-5-ил)этил]-{3-метокси-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензил}амино)циклобутанкарбоновая кислота
Во время колоночной хроматографии соединения примера 120, второй элюируемый продукт является указанным в заголовке соединением: 510 мг (47,6%). (М+Н)+=550, Rt=3,26 мин (В), чистота: 95,6%.
Пример 122
цис-3-([(R)-1-(2,3-Дигидробензофуран-5-ил)этил]-{3-метокси-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензил}амино)циклобутанкарбоновая кислота
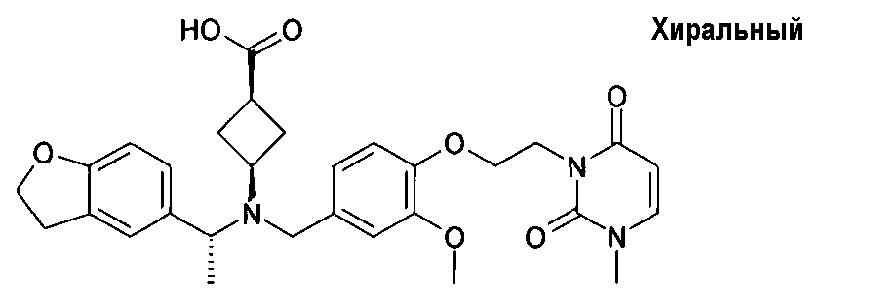
375 мг (0,68 ммоль) соединения примера 121 разделяют путем препаративной хиральной колоночной хроматографии (система Berger SFC; Chiralcel OJ-H, колонка размером 250×21 мм (5 мкМ); объемная скорость потока 50 мл/мин; СО2/80%/20%; EtOH + 0,5% IPA). Первый элюируемый энантиомер имеет (R)-конфигурацию, выход составляет 124 мг (68%). (М+Н)+=550, Rt=10,7 мин, чистота: 100%.
Пример 123
цис-3-([(S)-1-(2,3-Дигидробензофуран-5-ил)этил]-{3-метокси-4-[2-(3-метил-2,6-диоксо-3,6-дигидро-2Н-пиримидин-1-ил)этокси]бензил}амино)циклобутанкарбоновая кислота
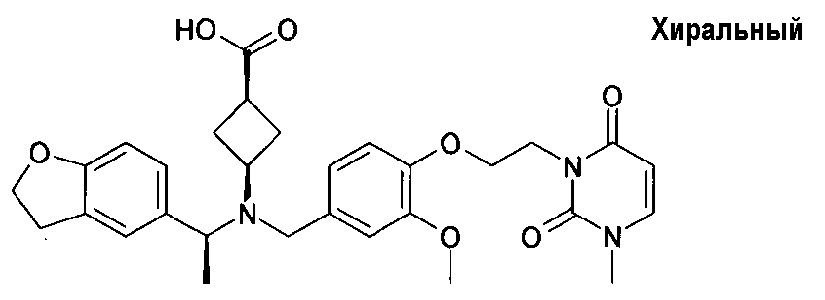
375 мг (0,68 ммоль) соединения примера 121 разделяют путем препаративной хиральной колоночной хроматографии (система Berger SFC; Chiralcel OJ-H, колонка размером 250×21 мм (5 мкМ); объемная скорость потока 50 мл/мин; СО2/80%/20%; EtOH + 0,5% IPA). Второй элюируемый энантиомер имеет (S)-конфигурацию, выход составляет 125 мг (68%). (М+Н)+=550, Rt=12,6 мин, чистота: 99,9%.
Пример 124
транс-3-([1-(4-Хлор-3-фторфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)циклобутанкарбоновая кислота
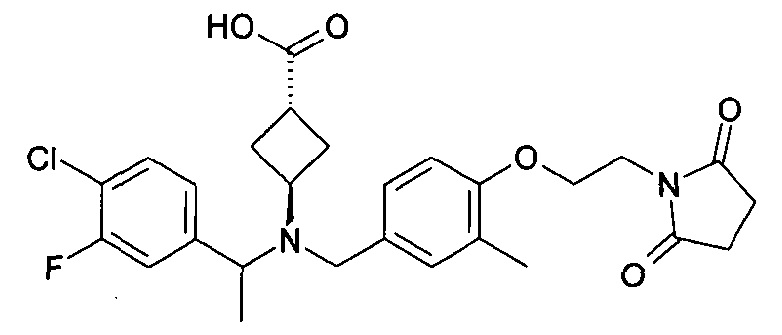
Стадию 1 проводят, как в примере 120, используя 1-(4-хлор-3-фторфенил)этиламин (5.7) и соединение (4.2) для первой стадии восстановительного аминирования. (М+Н)+=419, Rt=2,44 мин (А), чистота: 93,9%.
Стадия 2: 2,73 г (6,5 ммоль) полученного вторичного амина растворяют в 108 мл ТГФ, добавляют 1,487 г (2 экв.) 3-оксоциклобутанкарбоновой кислоты (3.4), 0,56 г (1,5 экв.) АсОН и 4,14 г (3 экв.) NaBH(OAc)3. Смесь перемешивают при температуре 35°С в течение 48 часов, затем охлаждают, разбавляют водой и экстрагируют с помощью EtOAc. Объединенный органический слой очищают с помощью колоночной хроматографии (CHCl3-MeOH=19/1). Первое элюируемое вещество является указанным в заголовке соединением. Выход: 180 мг (5,3%). (М+Н)+=517, Rt=4,69 мин (В), чистота: 96,5%.
Пример 125
цис-3-([1-(4-Хлор-3-фторфенил)этил]-{4-[2-(2,5-диоксопирролидин-1-ил)этокси]-3-метилбензил}амино)циклобутанкарбоновая кислота
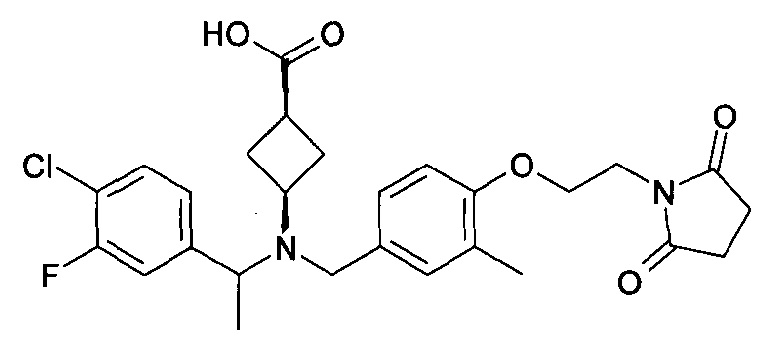
Из соединения примера 124, после колоночной хроматографии, второе элюируемое вещество представляет собой указанное в заголовке соединение: 310 мг (9,2%). (М+Н)+=517, Rt=4,70 мин (В), чистота: 99%.
Следуя методикам, как представленные в примере 121, используя различные амины (5), бензальдегиды (4) и эфиры оксоциклоалканкарбоновых кислот (3, R'=O), или, как показано в примере 1, используя различные амины (5), бензальдегиды (4) и эфиры формилциклоалканкарбоновых кислот (3, R'=CHO), получают перечисленные в таблице 5 соединения.
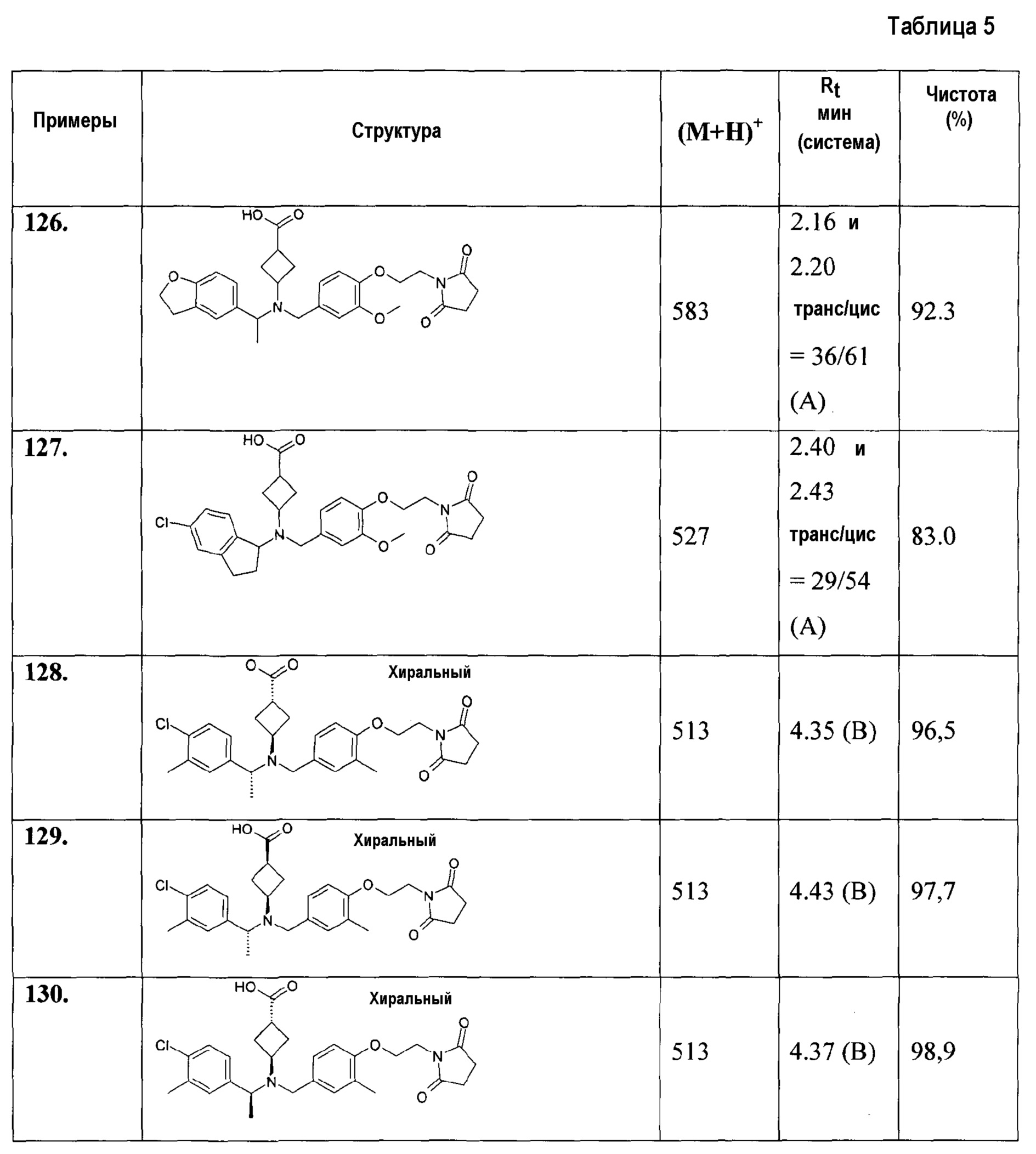
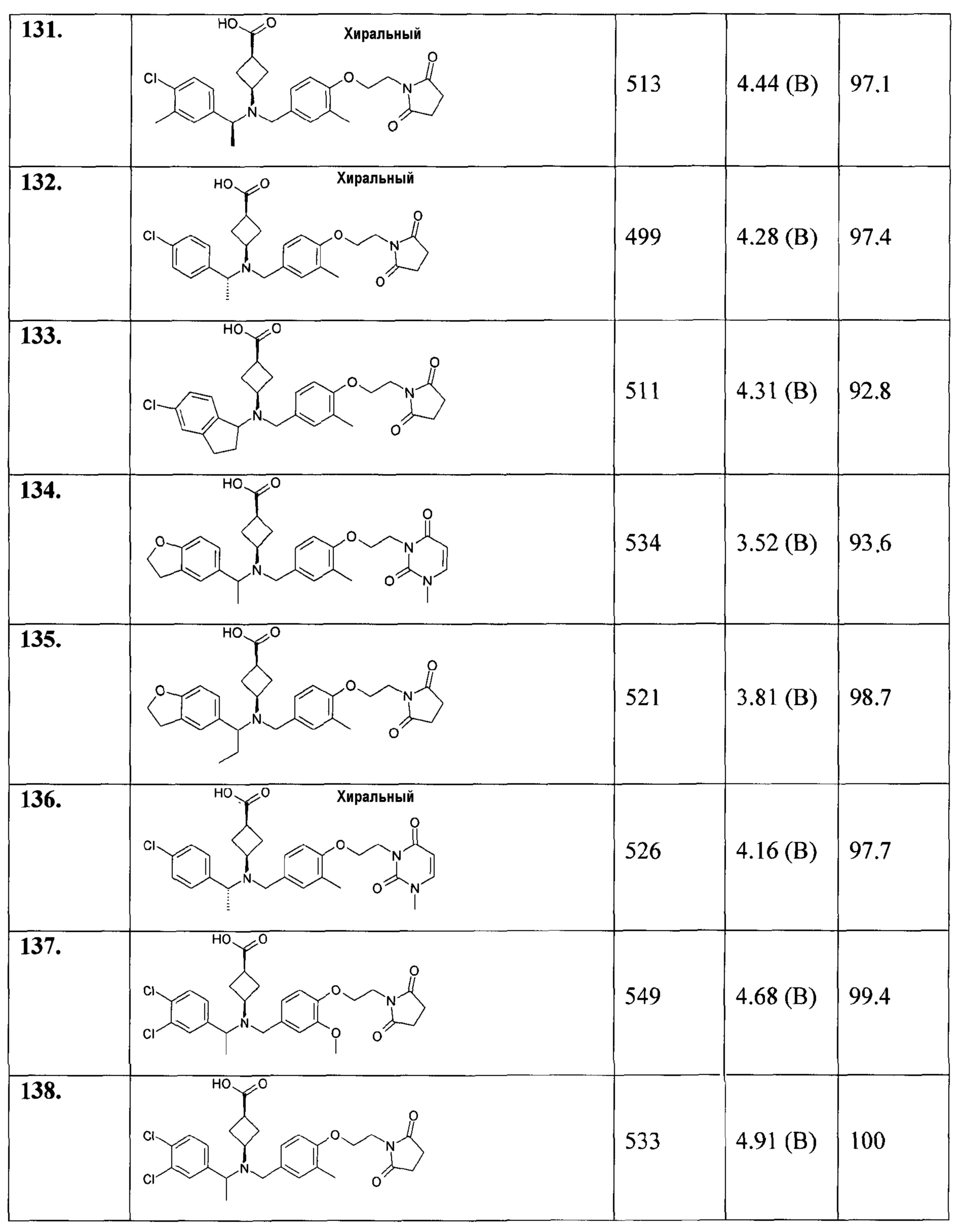
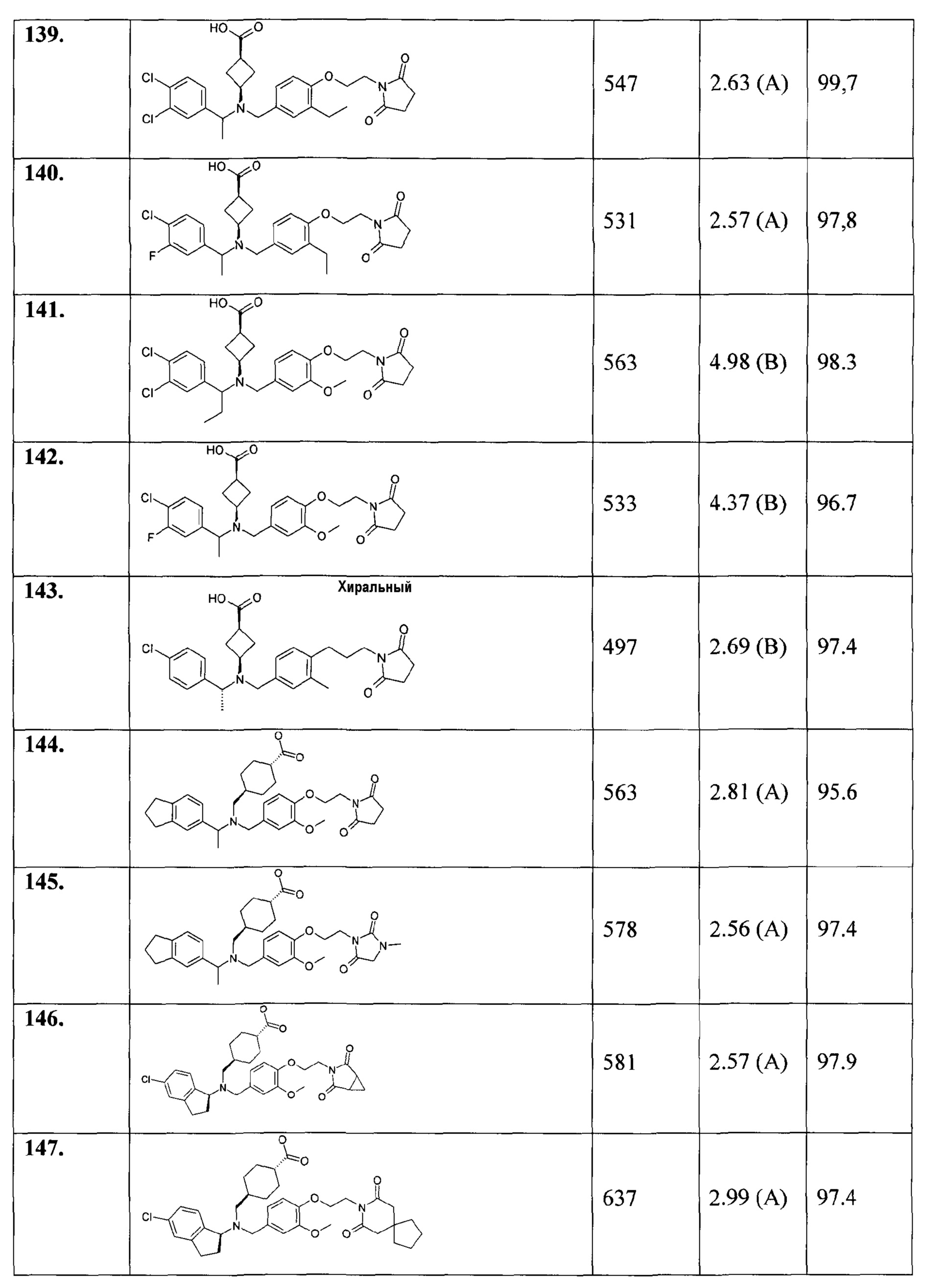
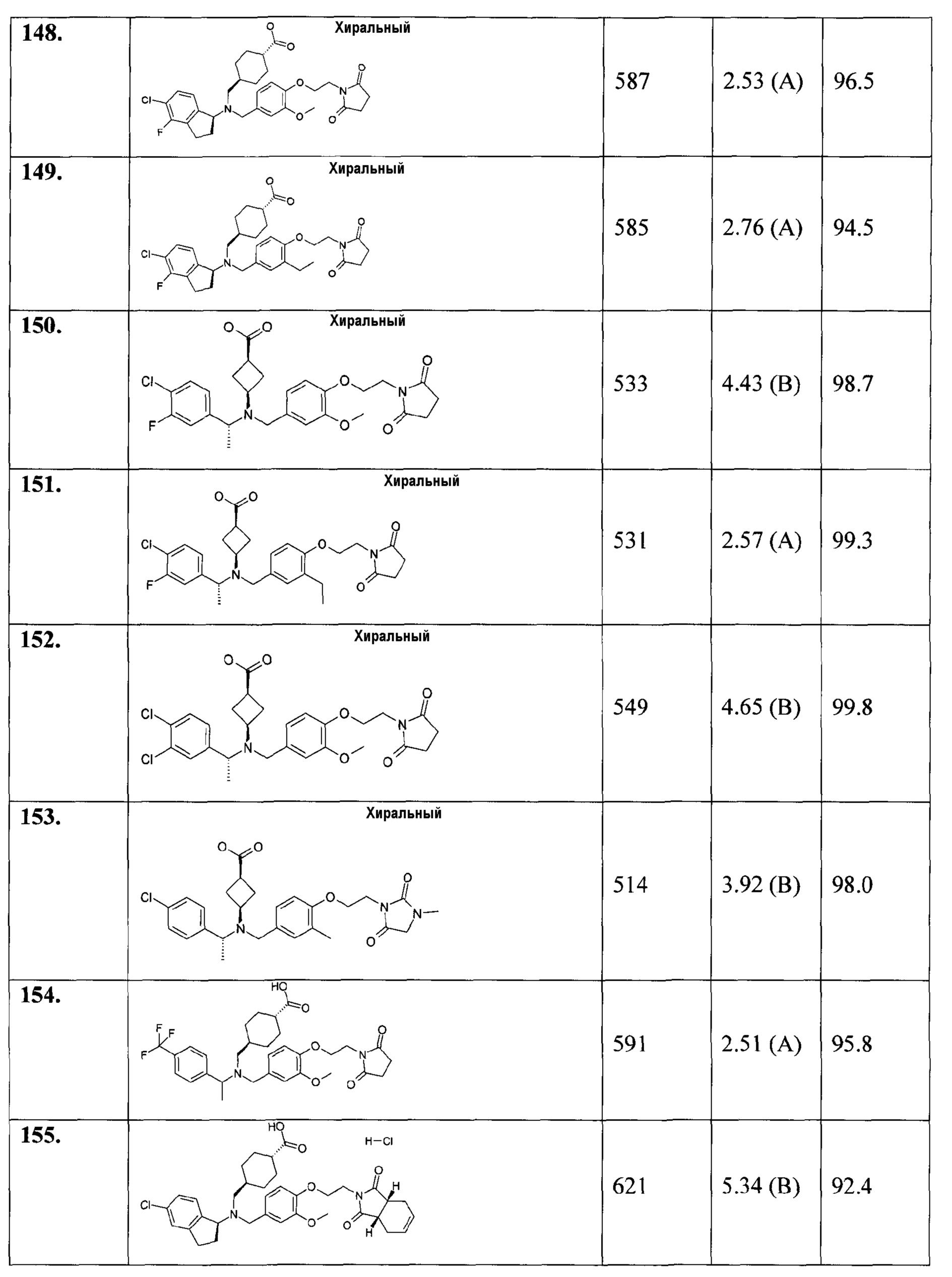
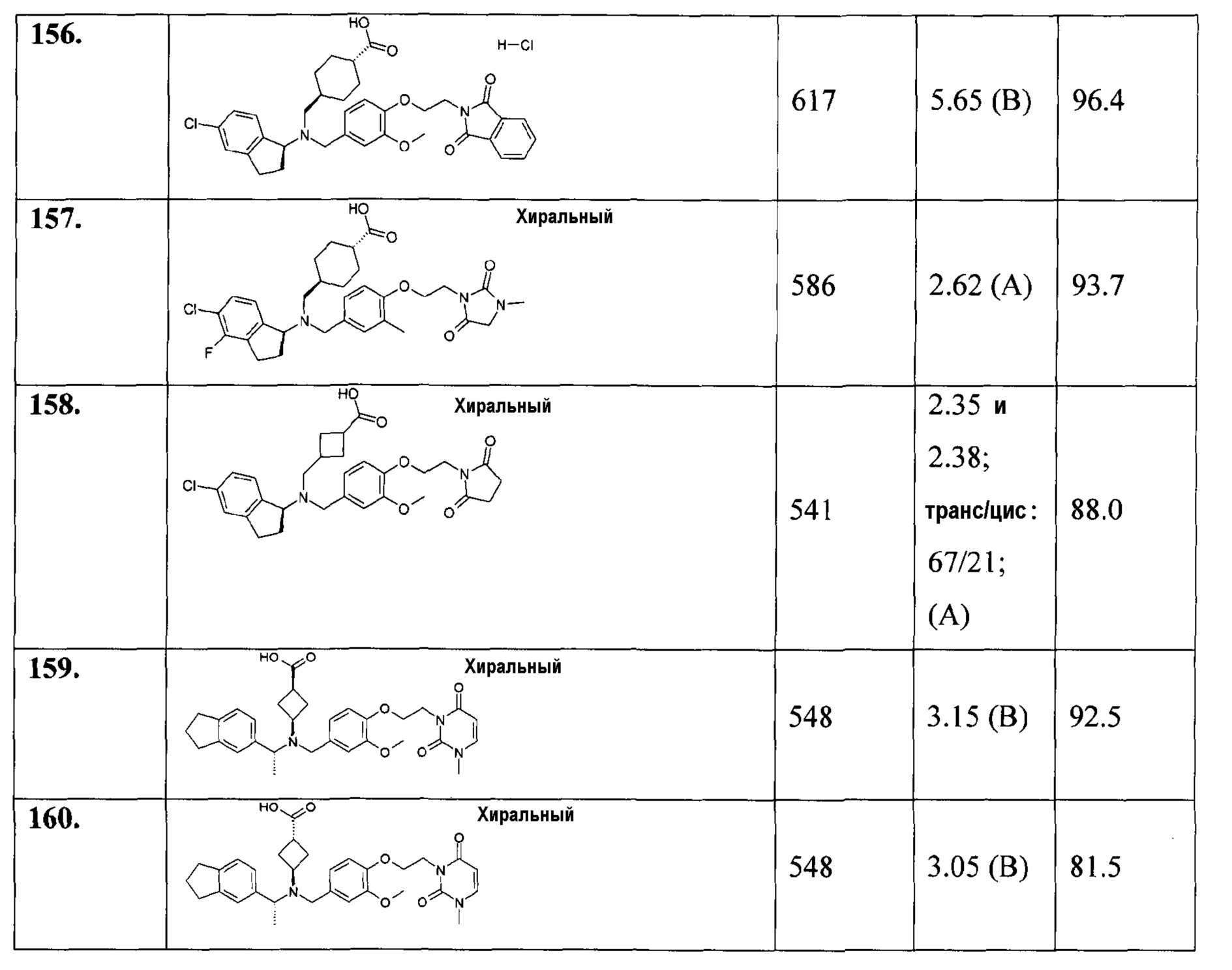
Биологические методы
Соединения согласно настоящему изобретению, как описано, пригодны для блокирования взаимодействия CXCR3-A и CXCL10 в соответствии с тестом в отношении меченного радиоактивным изотопом связывания.
Тесты в отношении конкурентного связывания радиолиганда осуществляли для определения in vitro эффективности вновь синтезированных немеченых тестируемых соединений в отношении замещения специфического связывания меченного радиоактивным изотопом эндогенного хемокина, 125I-CXCL10, с человеческим CXCR3-A-рецептором. Для тестируемых соединений определяли значения IC50 и использовали для исследования зависимости структура-активность (SAR). Установленную SAR использовали для обеспечения обратной связью молекулярного дизайна и для предложения некоторых подходящих модификаций групп и структурных элементов, посредством которых должна быть улучшена аффинность тестируемых соединений к человеческому CXCR3-рецептору.
Получение клеточной линии и мембраны
СНО-Клетки, стабильно экспрессирующие человеческие рекомбинантные CXCR3-A рецепторы, получали в фирме Sanofi-Aventis (LIT Frankfurt) путем трансфекции Flp-In-СНО-клеток-хозяев с помощью генно-инженерной конструкции на основе плазмидного вектора pCDA5-FRT-TO_IRES-Gai4qi4_DEST. Эта клеточная линия зарегистрирована в банке клеточных линий Sanofi-Aventis. Клетки культивировали в среде Ham's F12 (PAA), дополненной 10% FCS (PAA, номер по каталогу Е15-898) и 0,6% гигромицина (РАА), на матрасах Т175 при температуре 37°С в увлажненном инкубаторе в атмосфере из 5% СО2 и 95% воздуха. Клетки собирали из культуральных матрасов путем кратковременной обработки (8-10 минут) с помощью версена (Gibco, номер по каталогу 15040). Клеточную суспензию разводили с помощью PBS, и клетки собирали путем центрифугирования при ускорении 230×g в течение 10 минут при температуре 10°С при использовании центрифуги Juan. Осадки после центрифугирования, содержащие приблизительно 1×108 клеток, ресуспендировали в 15 мл буфера на основе 20 мМ HEPES, рН=7,4, 10 мМ EDTA, дополненного с помощью ингибитора «полной» протеазы (Roche, номер по каталогу 11697498001). Эту суспензию гомогенизировали при использовании гомогенизатора из тефлона/стекла (Sartorius potter S) с 3×10 сек импульсами на охлаждающей бане из смеси воды со льдом и затем центрифугировали при ускорении 300×g в течение 120 минут при температуре 4°С, используя центрифугу Sigma. Супернатант осторожно собирали и центрифугировали при ускорении 100000×g в течение 60 минут при температуре 4°С при использовании центрифуги Beckman Avanti J30. Полученный осадок после центрифугирования промывали один раз с помощью 15 мл свежеприготовленного буфера. Конечный мембранный осадок после центрифугирования ресуспендировали в запасном буфере (20 мМ HEPES, pH=7,4, 0,1 мМ EDTA, 250 мМ сахарозы, дополненном с помощью ингибитора «полной» протеазы) в объемном соотношении приблизительно 1×108 клеток/1 мл, который показал концентрацию белка от 2 до 4 мг/мл. Концентрацию белка определяли с помощью анализа на белок Bio-Rad (номер по каталогу 500-0006). Мембранные аликвоты хранили при температуре -80°С. Деструкции не наблюдали вплоть до периода хранения приблизительно 5 месяцев.
Исследование связывания радиолиганда 125I-CXCL10
Состав буфера для теста на связывание определяли в течение детальной процедуры оптимизации. Это привело к буферу для теста на связывание, образованному следующими компонентами: 25 мМ Hepes (pH=7,4), 5 мМ MgCl2, 1 мМ CaCl2, 100 мМ NaCl, дополненному с помощью 0,1% свободного от протеазы BSA (в качестве конечной концентрации). Тест на конкурентное связывание проводили, используя радиолиганд 125I-CXCL10 (PerkinElmer, NEX348, удельная активность 2200 Ки/ммоль) в конечной концентрации 50-70 пМ. Неспецифическое связывание определяли с помощью 150 пМ hr-CXCL10 (R&D Systems, номер по каталогу 266-IP). Полный тестируемый объем составлял 150 мкл и содержал 0,1% ДМСО (конечная концентрация). Реакцию связывания инициировали путем добавления мембран (10-20 мкг белков, приблизительно 5×105 клеточных эквивалентов) к реакционной смеси. После инкубации в течение 60 минут при температуре 25°С реакцию заканчивали путем быстрой фильтрации через GF/B стеклянные волокнистые фильтры, которые предварительно пропитывали с помощью 0,5% полиэтиленимина (Fluka Analytical, P3143) в течение 1 часа, используя харвестер клеток Skatrton. Фильтры затем промывали с помощью 8 мл охлажденного льдом буфера для промывки (модифицированный буфер для связывания, в который не включали BSA и концентрацию NaCl устанавливали при концентрации 500 мМ). Радиоактивность, удержанную на фильтрах, измеряли посредством автоматизированного гамма-счетчика Wizard 1470.
Тестируемые соединения растворяли, до теста на связывание, в концентрации 10 мМ в ДМСО. Исходные растворы хранили при температуре -20°С в течение времени не долее чем 3 месяца. В день теста на связывание осуществляли серийные разведения тестируемых соединений в диапазоне от 10 мМ вплоть до 3×10-7 М (или 3×10-9 М) посредством 8 (или 12) последовательных стадий, используя ДМСО в качестве растворителя. Перед добавлением этих растворов тестируемого соединения к реакционной смеси для осуществления реакции связывания, проводили процедуру промежуточного разведения, при которой 30 мкл образца каждого раствора переносили в пробирку для разведения, содержащую 970 мкл буфера для теста на связывание. Затем 50 мкл из последовательного ряда этого второго разведения добавляли в тест-пробирки, и диапазон концентрации тестируемых соединений составлял от 1×10-5 М до 3×10-9 М (или 3×10-11 М).
Значения IC50 и наклоны Хилла для данных по конкурентному связыванию получали, используя нелинейный метод подбора кривой по четырем параметрам.
Типичные соединения согласно настоящему изобретению имеют активности в вышеуказанном тесте на связывание менее чем 20 мкмоль IC50, более специфические соединения имеют активности менее чем 1 мкмоль IC50, и дальнейшие специфические соединения имеют активности менее чем 200 нмоль IC50.
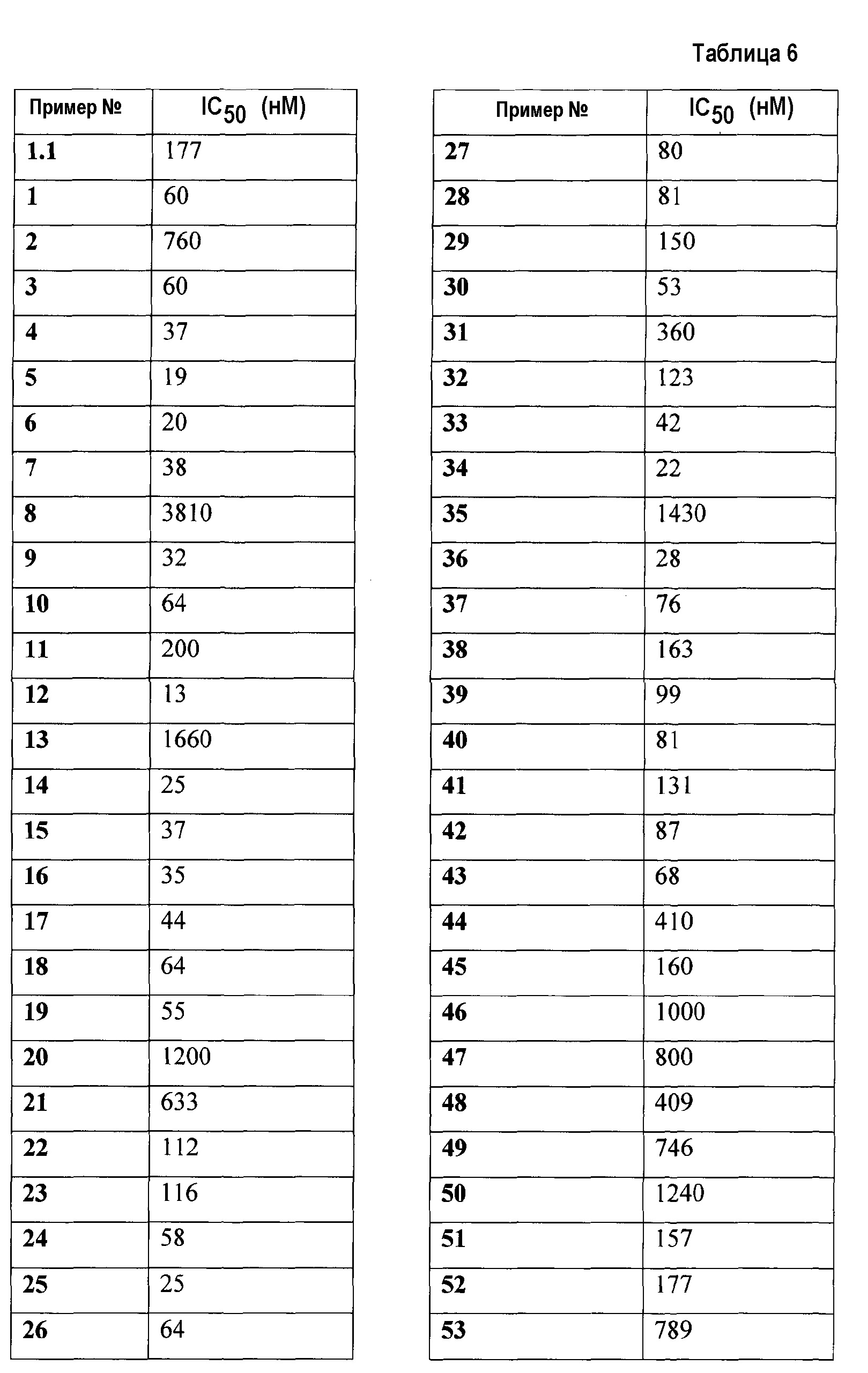
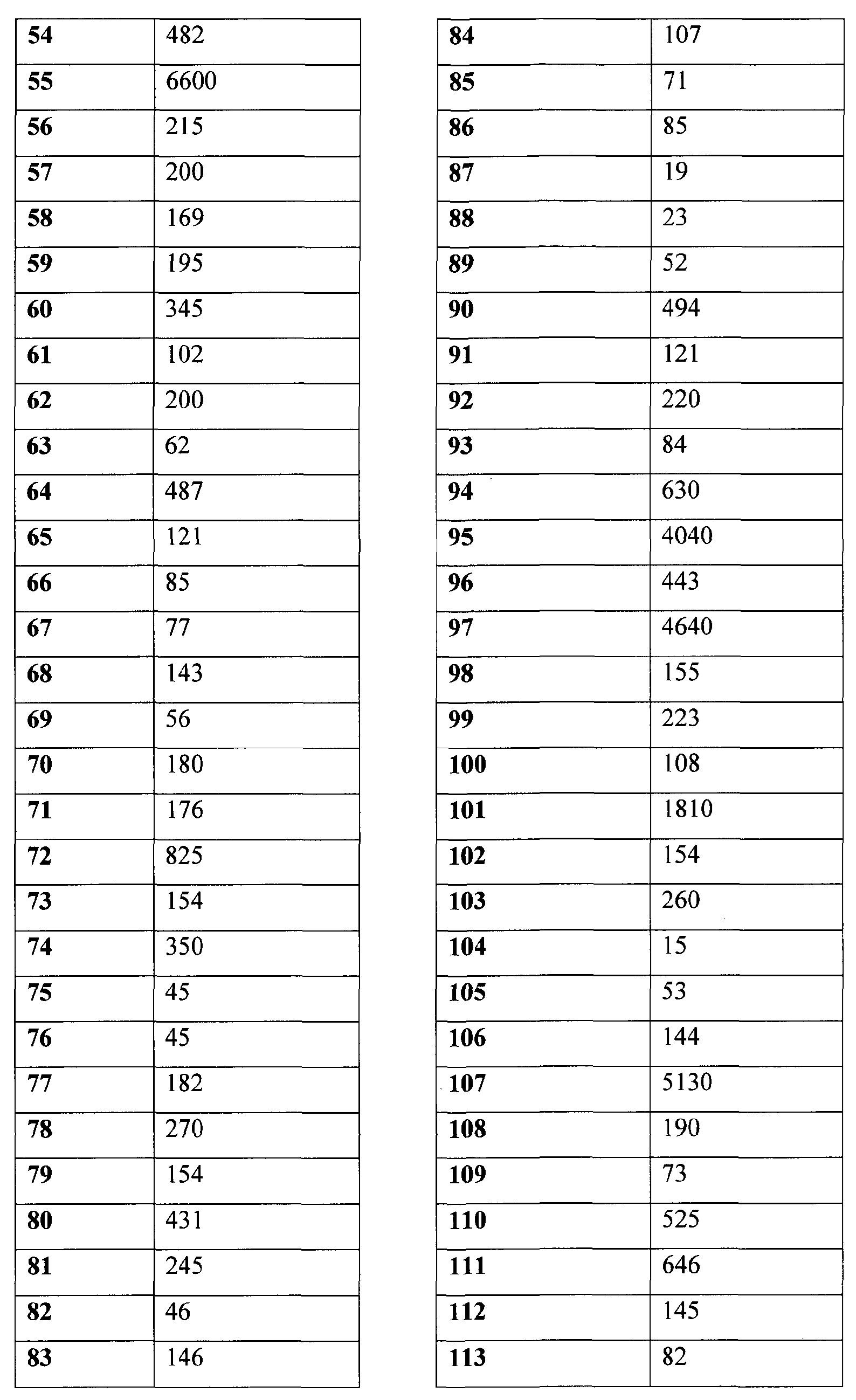
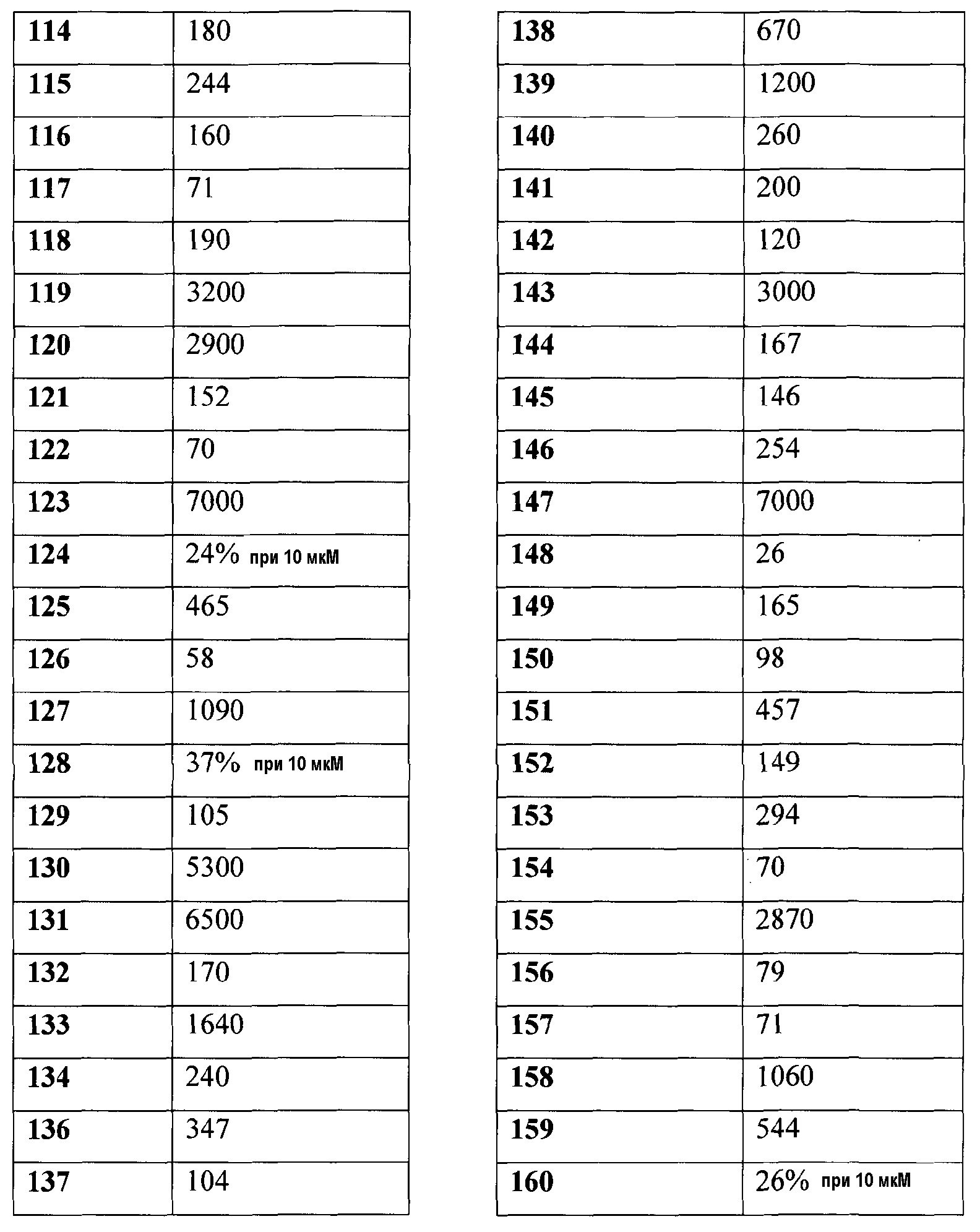
Тест на аккумуляцию циклического АМФ
Функциональный in vitro тест в отношении определения изменений внутриклеточного уровня циклического аденозин-3',5'-монофосфата (циклический АМФ или также называемый как цАМФ) после или стимуляции, или активации CXCR3-A-рецептора использовали для демонстрирования антагонистической функциональности выбранных соединений.
Циклический АМФ представляет собой одну из наиболее важных внутриклеточных вторичных молекул-мессенджеров, уровень которых регулируется главным образом связанным с G-белком ферментом-эффектором аденилилциклазой, локализованным на внутренней поверхности клеточной плазматической мембраны. Зависимые от рецептора, опосредуемые G-белком изменения концентрации циклического АМФ вызывают затем комплексные регуляторные процессы в клетке, как, например, активация многочисленных протеинкиназ и фосфолипаз, генерация инозитолтрифосфата и кратковременное повышение внутриклеточной концентрации ионов кальция (Са2+), открытие ионного канала, воздействия на транскрипции различных генов.
После стимуляции агониста, CXCR3-A-рецептор активирует чувствительные к коклюшному токсину (РТХ) G-белки Gi-класса, который опосредует снижение внутриклеточных уровней цАМФ, повышение мобилизации внутриклеточного Са2+ и полимеризацию актина, что, в конце концов, приводит к цитоскелетной реаранжировке и направленной клеточной миграции (хемотаксис) [Sauty A. и др., 2001, J. Immunol. 167, 7084-7093].
Тест на аккумуляцию циклического АТФ осуществляли при использовании комплекта для гомогенной, разрешенной во времени флуоресценции (HTRF) цАМФ фемто 2, выпускаемого фирмой CisBio International. Измерения в основном осуществляли, следуя инструкциям производителей.
Так как CXCR3-A-рецептор связан с Gi-белком, следовательно, активация агониста рецептора должна приводить к повышению внутриклеточного уровня цАМФ [Crosignani S. и др., 2010, Bioorg. Med. Chem. Letters, 20, 3614-3617]. Следовательно, клетки должны быть предварительно активированы форсколином, прямым активатором клеточного фермента аденилилциклазы, для достижения достаточного клеточного базального уровня цАМФ. Агонист, индуцированный уменьшением уровня цАМФ, должен быть определен по увеличению сигнала переноса резонансной энергии флуоресценции, так как сигнал обратно пропорционален концентрации цАМФ в клетке.
Для теста, адгезивные hr-CXCR3-Flp-In-CHO-IRES-Gai4qi4-клетки (та же самая клеточная линия, как используемая для теста в отношении связывания) промывали не содержащим Са2+-Mg2+ PBS и собирали посредством кратковременной обработки с помощью акутазы (Sigma, A6964). В момент времени, спустя 2 минуты после добавления акутазы (3 мл/Т175 матрас), к отделенным клеткам добавляли 7 мл культуральной среды. Клеточную суспензию собирали и центрифугировали со скоростью 1700 оборотов в минуту в течение 10 минут (настольная центрифуга 2-S, Sigma). Полученный дебрис ресуспендировали в PBS с Са2+/Mg2+ (Invitrogen 14080-048) и подвергали стадии второго центрифугирования, как указано выше. Конечный дебрис ресуспендировали в буфере для теста (PBS c Ca2+/Mg2+), дополненном не содержащим жирной кислоты BSA (Sigma A6003) в конечной концентрации 1 мг/мл и ингибитором фосфодиэстеразы ролипрамом (Calbiochem 557330) в конечной концентрации 10 мкМ. Клетки переносили на 96-луночный микропланшет (Costar 3694, c частично сферическим плоским дном, необработанный, черный планшет из полистирола) при плотности 16000 клеток на лунку.
Клетки инкубировали в присутствии различных концентраций соединений-антагонистов (в диапазоне от 10 мкМ до 0,1 нМ) в течение 10 минут при комнатной температуре и при непрерывном встряхивании микропланшета на планшетном шейкере (Heidolph Titramax 100, 600 оборотов в минуту). Конечная концентрация ДМСО в реакционной смеси составляла 0,1%. Затем добавляли CXCL10 в конечной концентрации 20 нМ, и клетки далее инкубировали в течение 10 минут при комнатной температуре, как указано выше. После этого добавляли форсколин (Sigma F-6886) в конечной концентрации 1 мкМ и затем осуществляли дополнительную инкубацию (30 минут, комнатная температура, встряхивание). Конечный реакционный объем составлял 40 мкл. Реакцию прекращали путем добавления буфера для лизиса, содержащего HTRF-реагенты.
Планшеты затем инкубировали в течение 60 минут при комнатной температуре и при встряхивании, и разрешенные во времени FRET-сигналы измеряли после возбуждения при 337 нм. Как сигнал эмиссии от меченного криптатом европия анти-АМФ антитела (620 нм), так и FRET-сигнал, получаемый от меченого цАМФ-d2 (665 нм), регистрировали, используя измерительный прибор RubyStar (BMG Labtechnologies).
Результаты рассчитывали в виде соотношения интенсивности флуоресценции (эмиссия при 665 нм/эмиссия при 620 нм)×10000 и анализировали путем расчета значения Delta F, который соответствует следующей формуле:
Delta F = (стандартное или служащее образцом соотношение - отрицательное контрольное соотношение)/(отрицательное контрольное соотношение)×100.
Отрицательный контроль соответствует фоновому сигналу, полученному с помощью только криптатного конъюгата.
Соединения, тестированные согласно вышеуказанному функциональному цАМФ-тесту, показали значение IC50 менее чем 2 микромоль и, в особенности, менее чем 20 наномоль.
Примеры получения готовой лекарственной формы
(1) Таблетки
Указанные ниже ингредиенты смешивали обычным способом и подвергали прессованию посредством использования стандартного устройства:
|
(2) Мягкие капсулы
Указанные ниже ингредиенты смешивали обычным способом и заполняли смесью мягкие капсулы:
|
(3) Парентеральные препараты
Указанные ниже ингредиенты смешивали обычным способом для приготовления инъекционных растворов, содержащихся в ампуле емкостью 1 мл:
|
Соединения согласно настоящему изобретению обладают CXCR3-ингибиторной активностью и пригодны в качестве активного ингредиента лекарственного средства для превентивного и/или терапевтического лечения заболевания или нарушения, опосредуемого CXCR3-рецептором, особенно заболевания или нарушения, выбираемого из группы, состоящей из COPD, псориаза, отторжения имплантата/трансплантата, офтальмологического заболевания, глютеновой болезни, воспалительного заболевания пищеварительного тракта (IBD), диабета типа 1, тяжелой псевдопаралитической миастении (MG), рассеянного склероза (MS) и других нейровоспалительных заболеваний, волчанки, ревматоидного артрита (RA) или красного плоского лишая.