Результат интеллектуальной деятельности: Диспергируемая в воде таблетка ацетилцистеина и способ ее изготовления
Вид РИД
Изобретение
Область техники
Изобретение относится к медицине, в частности к фармацевтической промышленности, и описывает фармацевтическую композицию, выполненную в виде диспергируемой в воде таблетки, включающую ацетилцистеин, и способ ее изготовления.
Уровень техники
Острые респираторные инфекции (ОРИ) представляют серьезную проблему для органов здравоохранения во всем мире, в том числе в России, являясь наиболее массовыми заболеваниями. Так, по оценкам ВОЗ, от всех вариантов вируса гриппа во время сезонных эпидемий в мире ежегодно умирают от 250 до 500 тыс. человек (большинство из них старше 65 лет), в некоторые годы число смертей может достигать миллиона.
В России официальная статистика ежегодно учитывает порядка 30 млн. случаев респираторных инфекций, составляющих более 40% дней нетрудоспособности в структуре общей заболеваемости [По данным отчетов Федерального государственного учреждения здравоохранения «Федеральный центр гигиены и эпидемиологии Роспотребнадзора РФ» http://www.fcgsen.ru/]. В то же время можно предположить, что реальное количество заболевших, часто не обращающихся за медицинской помощью, превышает официальные данные в 1,5-2 раза.
Наиболее высокие показатели заболеваемости гриппом и ОРИ отмечаются у детей первых 6 лет жизни. Известно, что детский возраст, особенно ранний и дошкольный, характеризуется значительно более высокой чувствительностью организма ребенка к вирусным и вирусно-бактериальным агентам, проникающим в респираторный тракт, и, соответственно, значительно более высокой заболеваемостью ОРИ [Самсыгина Г.А. Противовоспалительная терапия острых респираторных инфекций у детей. Педиатрия - 2011. - Том 90. - №1. - С.102-105.]
Ежегодно дети переносят несколько эпизодов ОРИ: дети первых 3 лет жизни - от 4 до 12 раз, дошкольники - до 6 раз, школьники - 3 раза [Острые респираторные вирусные инфекции в амбулаторной практике врача-педиатра / Коровина Н.А., Заплатников А.Л. // М.: Медпрактика, 2004]. Причем даже нетяжелые формы ОРИ могут стать причиной обострения хронической патологии, обусловленной бактериальной инфекцией.
Таким образом, помимо значительного вреда, наносимого здоровью населения, заболеваемость ОРИ в России представляет большую проблему в связи с наносимым экономическим ущербом как родителям заболевших детей, так и обществу в целом.
В большинстве случаев этиологическим фактором заболеваемости ОРИ являются вирусы и вирусно-бактериальные ассоциации. В качестве самостоятельного этиологического фактора могут выступать бактерии, внутриклеточные возбудители и грибы [Антибиотики в лечении острых бронхитов у детей / Самсыгина Г.А. // Леч. врач. - 2001. - №1. - С.12-15].
Сила повреждающего действия микроорганизмов зависит от многих факторов: свойств возбудителя, способности организма сопротивляться инфекции, которая определяется силами естественной защиты организма в целом и респираторного тракта в частности.
Защита слизистой оболочки дыхательной системы осуществляется благодаря мукоцилиарному и иммунному механизмам [Противокашлевые и отхаркивающие лекарственные средства в практике врача-педиатра: рациональный выбор и тактика применения. Пособие для врачей. / Коровина Н.А. и др. // М.: Юник Фармасьютикал Лабораториз. - 2002. / Несовершенство этих механизмов защиты у детей первого года жизни является предрасполагающим фактором развития ОРИ и причиной частых ОРИ.
Одним из распространенных заболеваний нижних дыхательных путей являются бронхиты, особенно среди детей в возрасте от одного года до 3 лет.
Заболеваемость бронхитами, по данным ряда авторов, колеблется от 15 до 50%. Этот процент существенно выше (до 50-90%) среди детей, часто болеющих ОРИ, особенно в экологически неблагоприятных регионах, а также при пассивном курении. Распространенность бронхитов составляет 16,4 на 1000 детей. Среди часто болеющих детей (по обращаемости) бронхит был установлен у 27%.
Терапия бронхитов требует в первую очередь использования эффективных лекарственных средств, направленных на ограничение размножения патогенных агентов и уменьшение выработки медиаторов воспаления на ранних этапах развития воспаления в бронхах с целью снижения активности воспаления, ограничения объема поражения и для предотвращения формирования хронических бронхолегочных заболеваний.
Важное место в лечении бронхитов занимают муколитические и мукорегуляторные средства, действие которых направлено на улучшение дренажной функции легких и бронхов, мукоцилиарного клиренса и уменьшение обструкции бронхов, облегчение кашля и выделения мокроты.
В связи с этим в настоящее время при лечении бронхолегочных заболеваний широкое распространение получили лекарственные препараты, обладающие целенаправленным воздействием на измененный качественно и количественно бронхиальный секрет (мокроту).
Данные препараты относятся к группе бронхосекретолитических или муколитических. Известные на протяжении уже нескольких столетий секретомоторные препараты (термопсис, алтей, солодка, йодид натрия и калия, хлорид аммония) в последние годы используются редко ввиду их плохой переносимости и низкой эффективности, особенно при лечении хронических заболеваний органов дыхания, когда существенно изменяется мукоцилиарный клиренс.
Муколитики широко используются при лечении как острых заболеваний дыхательных путей (трахеиты, бронхиты, пневмонии), так и хронических (хроническая обструктивная болезнь легких (ХОБЛ), бронхиальная астма (БА), врожденные и наследственные бронхолегочные заболевания, в т.ч. муковисцидоз. Их назначение показано и при болезнях ЛОР-органов, сопровождающихся выделением слизистого и слизисто-гнойного секрета (риниты, синуситы).
Муколитические препараты можно разделить на 3 группы:
- препараты амброксола;
- препараты ацетилцистеина;
- препараты карбоцистеина.
Использование протеолитических ферментов в качестве муколитиков недопустимо в связи с возможным повреждением ими легочного матрикса, а также с высоким риском развития кровохарканья, аллергических реакций и бронхоспазма [Овчаренко С.И. Муколитические (мукорегуляторные) препараты в лечении хронической обструктивной болезни легких // РМЖ. 2002. Т. 10. №4. С.153-157].
Эффективными и широко используемыми в современной практике лечения бронхолегочных заболеваний муколитическими препаратами являются препараты ацетилцистеина. Уникальность молекулы ацетилцистеина заключается в способности оказывать быстрый и выраженный муколитический эффект, достигаемый за счет прямого воздействия на структуру мокроты. В молекуле ацетилцистеина содержатся реактивные сульфгидрильные группы, которые разрывают дисульфидные связи кислых мукополисахаридов мокроты, при этом происходит деполимеризация макромолекул и мокрота становится менее вязкой и легче отделяется при кашле. Также наблюдаются увеличение секреции менее вязких сиаломуцинов бокаловидными клетками и снижение адгезии бактерий на эпителиальных клетках слизистой оболочки дыхательных путей. Стимуляция мукозных клеток бронхов приводит к повышенной выработке секрета, который лизирует фибрин. Препарат остается активным в отношении любого вида мокроты: слизистой, слизисто-гнойной, гнойной. Это очень важно, особенно при бактериальных инфекциях, когда следует быстро уменьшить вязкость мокроты с гнойными включениями, чтобы дать возможность эвакуировать ее из дыхательных путей и предотвратить распространение инфекции.
Учитывая массовость бронхолегочных заболеваний, их распространенность среди всех возрастных и социальных групп населения и, как следствие, возможное их сочетание с различными уже существующими у пациентов патологиями и ограничениями (диабет, сердечно-сосудистые заболевания, непереносимость веществ и т.д.), немаловажным фактором при выборе эффективной терапии является возможность правильного подбора лекарственного препарата с учетом конкретных особенностей пациента. В частности, актуальным является присутствие на рынке эффективных муколитических препаратов, не обладающих какими-либо ограничениями, противопоказаниями и удобных для применения различными группами пациентов.
Препараты ацетилцистеина широко представлены на рынке в виде различных форм: таблеток шипучих, сиропов, порошков и гранул для приготовления растворов, растворов для приема внутрь, растворов для инъекций, гранул для приготовления сиропов.
Вместе с тем, несмотря на широкий выбор и многообразие существующих лекарственных форм, все они обладают как своими достоинствами, так и различными недостатками, затрудняющими или ограничивающими их прием различными группами пациентов.
Так, к недостаткам лекарственных форм, выполненных в виде сиропов и растворов для приема внутрь, прежде всего, относится их громоздкость (во флаконе) и объем, что обусловлено их неудобством хранения, применения и транспортировки. Кроме того, высокое содержание сахара в составе вспомогательных веществ в сиропах, нежелательно к применению диабетиками и лицами, имеющими ограничения по его употреблению (диатезы, кариес, кожные и аллергические заболевания и проч.). Также применение жидких лекарственных форм (сиропов и растворов для приема внутрь) обусловлено необходимостью использования специальных измерительных средств (мерных ложек, флаконов, стаканчиков, шприцев и проч.), что допускает неточность при определении дозировки активного вещества, а также связано с риском передозировки при неконтролируемом применении (особенно детьми).
Порошки и гранулы для приготовления растворов, упакованные в саше-пакеты, также представляют собой более громоздкую и менее пригодную к транспортировке и хранению упаковку, чем таблетированные формы лекарственных препаратов.
Вместе с тем, таблетки также имеют свои недостатки, прежде всего, заключающиеся в проблеме их приема пациентами, испытывающими трудности при глотании (дисфагии). Подобные затруднения широко распространены, особенно среди детей и пожилых людей, и по разным оценкам наблюдаются примерно у 35% населения. Особенно остро данная проблема проявляет себя именно при лечении бронхолегочных, ЛОР-заболеваний и ОРВИ, сопровождающаяся воспалением слизистых оболочек, застоем трахеобронхиального секрета и сужением просвета дыхательных путей, что неизбежно затрудняет процесс глотания.
В настоящее время данная проблема решается созданием препаратов ацетилцистеина, предназначенных для растворения лекарственного средства в воде с целью его последующего приема в жидком виде. Именно поэтому одной из наиболее распространенных форм препаратов ацетилцистеина на отечественном рынке являются шипучие таблетки.
В частности известны следующие, зарегистрированные в РФ, лекарственные препараты ацетилцистеина в форме таблеток:
- «Ацетилцистеин» в лекарственной форме таблеток шипучих в дозировке 600 мг №2, 4, 12, 24 производства ЗАО «Вертекс» (Россия), регистрационное удостоверение № ЛП-002772 от 17.12.2014 г.;
- «Ацестин» в лекарственной форме таблеток шипучих в дозировке 200 мг №20 и дозировке 600 мг №10, производства ШТАДА Арцнаймиттель АГ (Германия), регистрационное удостоверение ЛСР-005200/09 от 29.06.2009 г.;
- «Ацестин» в лекарственной форме таблеток в дозировке 200 мг и 600 мг №20 и 50, производства ШТАДА Арцнаймиттель АГ (Германия), регистрационное удостоверение Π №010295 от 19.11.2007 г.;
- «Н-АЦ-ратиофарм» в лекарственной форме таблеток шипучих в дозировке 200 и 600 мг №10 и 20, производства Ратиофарм ГмбХ (Германия), регистрационное удостоверение П№013941/01 от 03.03.2009 г.;
- «АЦЦ® Лонг» в лекарственной форме таблеток шипучих в дозировке в дозировке 600 мг №6, 10 и 20, производства Гексал АГ (Германия), регистрационное удостоверение Π №008857 от 31.08.2010 г.;
- «АЦЦ 200»» в лекарственной форме таблеток шипучих в дозировке в дозировке 200 мг №20 и 25, производства Гексал АГ (Германия), регистрационное удостоверение Π №015473/01 от 11.01.2009 г.;
- «АЦЦ 100» » в лекарственной форме таблеток шипучих в дозировке в дозировке 100 мг №20 и 25, производства Гексал АГ (Германия), регистрационное удостоверение Π №015472/01 от 29.12.2008 г.;
- «Флуимуцил» в лекарственной форме таблеток шипучих в дозировке в дозировке 600 мг №10 и 20, производства Замбон Свитцерланд Лтд (Швейцария), регистрационное удостоверение Π №012975/01 от 18.09.2007 г.;
- «Викс Актив ЭкспектоМед» в лекарственной форме таблеток шипучих в дозировке в дозировке 200 и 600 мг №10 и 20, производства Тева Фармацевтические Предприятия Лтд (Израиль), регистрационное удостоверение Π N013941/01 от 03.03.2009 г.
Таким образом, наиболее широко представленной лекарственной формой являются препараты ацетилцистеина в виде шипучих таблеток.
Тем не менее, неудобство их применения, заключается в, как правило, большой массе таблетки (от 1000 до 2500 мг) и громоздкой форме фасовки - в пластиковых или алюминиевых тубах (пеналах) по 20-25 таблеток. Как показывает практика, наиболее удобной для потребителя формой фасовки таблетированных лекарственных форм, является блистерная упаковка. Кроме того, в состав шипучих таблеток в значительном количестве (35-60% от общей массы таблетки) входят безводная лимонная кислота, а также (25-60% от общей массы таблетки) натрия гидрокарбонат и/или натрия карбонат безводный, которые, как известно, повышают кардиоваскулярный риск и риск появления у человека сердечно-сосудистого заболевания. Учитывая большую массу шипучей таблетки и высокое процентное содержание в ее массе гидрокарбоната натрия, количество данного вещества, заявляемого производителями как вспомогательного, присутствует в указанной таблетке в дозировках, сопоставимых с терапевтическими. Вместе с тем, применение натрия гидрокарбоната в подобных дозах может вызывать системный алкалоз и его клинические проявления: потерю аппетита, тошноту, рвоту, боли в животе, беспокойство, головную боль, возможно, повышение артериального давления, в тяжелых случаях - тетанические судороги.
Как следует из вышеуказанного перечня зарегистрированных в России препаратов ацетилцистеина, «Ацестин» производства ШТАДА Арцнаймиттель АГ (Германия), является единственным препаратом, представленным в лекарственной форме таблеток, не являющихся шипучими. Данный препарат принят за прототип предлагаемого технического решения.
Согласно регистрационному удостоверению Π №010295 от 19.11.2007 г. (http://www.lsgeotar.ru/pharma_tn/11728.html) прототип выполнен в виде таблеток и содержит ацетилцистеин в качестве действующего вещества в дозировках 200 и 600 мг, а также вспомогательные вещества: кислоту винную, кислоту лимонную безводную, аспартам, натрия сахарината дигидрат, лактозы моногидрат, микрокристаллическую целлюлозу, кросповидон, магния стеарат, макрогол 4000, кремния диоксид коллоидный, мятный порошок 00302 (масло мяты перечной, рацементол, бутилгидроксианизол, камедь аравийская, декстрин). Общая масса таблеток, принятых за прототип предлагаемого технического решения, составляет 440 и 1080 мг соответственно.
Данный состав и лекарственная форма прототипа имеет ряд существенных недостатков. Так, исходя из указанных дозировок (200 и 600 мг) действующего вещества, а также в соответствии с инструкцией к препарату (раздел «способ применения и дозы»), возможность его применения детьми до 6 лет исключена, несмотря на то, что муколитические препараты (в частности препараты ацетилцистеина) показаны при заболеваниях органов дыхания, сопровождающихся продуктивным кашлем с густой, вязкой, трудноотделяемой мокротой, вызванным заболеваниями нижних отделов дыхательных путей (трахеиты, ларинготрахеиты, бронхиты, пневмонии и др.), особенно у детей первых пяти лет жизни, у которых повышенная вязкость бронхиального секрета является основным патогенетическим фактором формирования кашля [Педиатрия. Приложение consilium medicum 2007, №2, с. 43-47]. Так же, как уже упоминалось выше, применение ацетилцистеина в лекарственной форме таблетки, по-прежнему сохраняет риск аспирации (проникновения в дыхательные пути) при затрудненном глотании, что в свою очередь может привести к летальному исходу.
Кроме того, препарат «Ацестин» в форме таблеток содержит бутилгидроксианизол в составе вспомогательных веществ, который применяется в качестве антиоксиданта и консерванта в пищевой, косметической и фармацевтической промышленности. Бутилгидроксианизол (Е320) - это твердое воскоподобное вещество, представляющее собой смесь изомеров - 2-трет-бутил-4-гидроксианизола и 3-трет-бутил-4-гидроксианизола, получают посредством синтеза из 4-метоксифенола и изобутилена. Не растворим в воде. Бутилгидроксианизол серьезно влияет на рост холестерина в крови. Основной вред данного вспомогательного вещества выражается в канцерогенном и токсическом воздействии, которое оно оказывает на человеческий организм. В ряде стран (Япония, некотороые страны ЕС) бутилгидроксианизол внесен в список запрещенных пищевых добавок. Не рекомендуется употреблять продукты, содержащие Е320 людям, которые страдают от сердечно-сосудистых заболеваний любой степени тяжести, детям и беременным женщинам (проникает в эмбрион; при взаимодействии с нитратами приобретает мутагенные свойства).
Таким образом, в настоящее время существует потребность в разработке качественных и более доступных отечественных препаратов ацетилцистеина, лишенных при этом недостатков существующих лекарственных форм.
Решение данных недостатков лекарственных форм предложено авторами настоящего изобретения и заключается в создании диспергируемой в воде таблетки ацетилцистеина различных дозировок (от 100 до 600 мг). Причем масса данной таблетки ниже массы шипучих таблеток в аналогичной дозировке и не превышает 1,2 г, а соотношение действующего и вспомогательных веществ в массе таблетки равно 1:1 (с целью снижения избыточного количества вспомогательных веществ и общей массы таблетки), в составе отсутствуют натрия гидрокарбонат, натрия карбонат безводный и бутилгидроксианизол.
При сохранении механических свойств (твердости), компактности, точности дозирования и удобства применения таблетки, в соответствии с требованиями Европейской Фармакопеи 7.1. (том 1, стр. 723, 737) диспергируемые в воде таблетки должны дезинтегрироваться при температуре 15-25°С в воде до получения суспензии в течение 3-х минут. Полученная суспензия может быть легко выпита пациентами, имеющими затруднения глотания твердых лекарственных форм.
В российском государственном реестре лекарственных средств лекарственная форма ацетилцистеина в виде диспергируемой таблетки не представлена. Из предшествующего уровня техники подобных лекарственных форм ацетилцистеина выявить не удалось.
Задачей настоящего изобретения является расширение арсенала муколитических препаратов отечественного производства.
Техническим результатом изобретения, является создание диспергируемой в воде твердой лекарственной формы ацетилцистеина, распадающейся в воде при температуре 15-25°С в течение 3-минутного периода времени с образованием дисперсии, которая способна проходить через сито с размерами отверстий 710 мкм. При этом содержание активного действующего вещества в полученной таблетке должно составлять от 100 до 600 мг, при общей массе таблетки от 200 до 1200 мг соответственно, а соотношение активных и вспомогательных веществ быть равным 1:1. Также в составе вспомогательных веществ не допускается присутствие натрия гидрокарбоната, натрия карбоната безводного и бутилгидроксианизола. Полученная диспергируемая в воде твердая лекарственная форма ацетилцистеина должна обладать достаточной прочностью для сохранения целостности и внешнего вида в ходе технологического процесса и при потребительском обращении, а также быть стабильной при хранении.
Раскрытие изобретения.
Для решения поставленной задачи и достижения указанного технического результата предложен состав и способ получения лекарственного средства муколитического действия, характеризующиеся тем, что:
а) содержание ацетилцистеина в одной дозе составляет 100, 200 или 600 мг;
б) в составе диспергируемой в воде таблетки использованы в определенном соотношении стабильные и доступные вспомогательные вещества:
- целлюлоза микрокристаллическая,
- кросповидон,
- лактозы моногидрат,
- магния стеарат,
- кремния диоксид коллоидный;
в) смесь производится путем грануляции водным раствором повидона.
Сложность изготовления диспергируемой таблетки ацетилцистеина заключается в свойствах активной субстанции, которая легко растворима в воде и содержится в сравнительно больших дозах в таблетках, что сильно влияет на время дезинтеграции твердой лекарственной формы в воде, особенно при комнатной температуре. С другой стороны, ограничении до соотношения с субстанцией 1:1 вспомогательных веществ в массе при одновременном обеспечение необходимой дисперсности, распадаемости, а также высокой механической прочности и стабильности при хранении.
Благодаря уникальной и оптимально подобранной комбинации вспомогательных веществ авторам удалость получить смесь для таблетирования с высоким содержанием активного вещества, обладающую достаточными текучестью, антифрикционными свойствами и прессуемостью, в сочетании с диспергируемостью, отвечающей заявленному техническому результату и требованиям Фармакопеи.
Изобретение представляет собой фармацевтическую композицию - таблетку, состоящую из активного вещества - ацетилцистеина, с дозировкой 100, 200 и 600 мг и вспомогательных веществ, выполненную в форме таблетки диспергируемой.
В результате испытаний, опытным путем был разработан следующий состав диспергируемой в воде таблетки (Таблица 1), содержащей ацетилцистеин в качестве активного вещества:
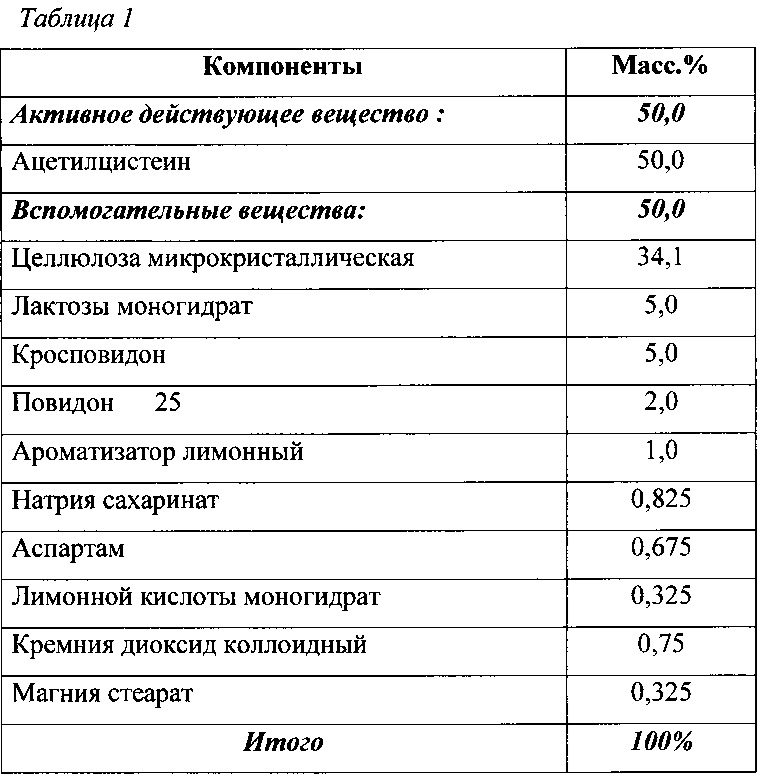
Конкретные примеры диспергируемых в воде таблеток ацетилцистеина приведены в таблице 2.
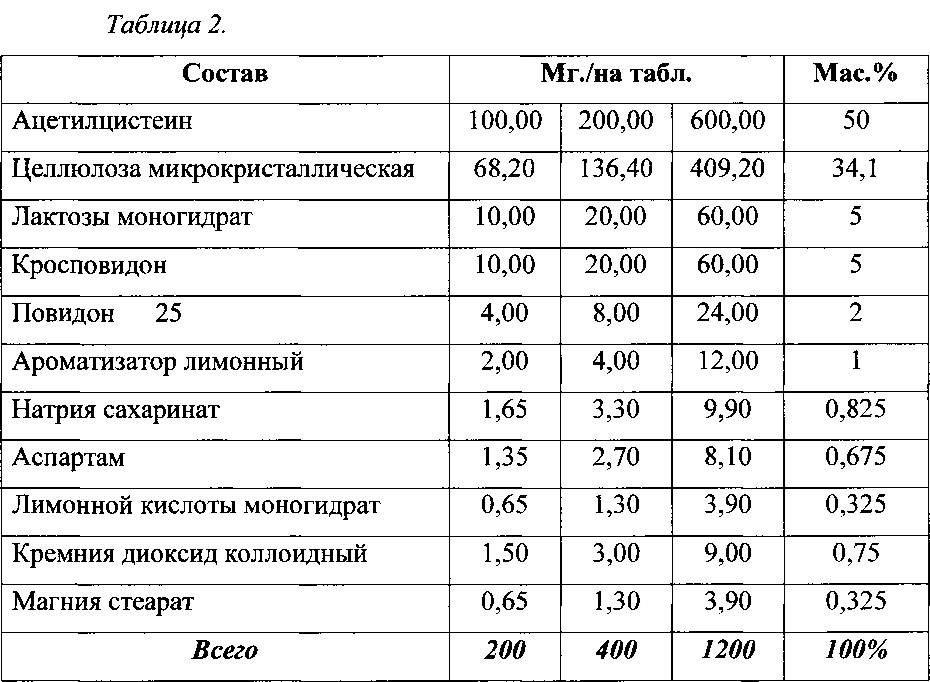
В качестве наполнителя в данной твердой лекарственной форме используется комбинация лактозы моногидрата и целлюлозы микрокристаллической. Лактоза, как кристаллическое вещество, улучшает сыпучесть и увеличивает насыпную плотность смеси. Целлюлоза микрокристаллическая содержит участки волокон, которые увеличивают площадь контактирующих поверхностей при прессовании, способствуя увеличению прочности таблеток. Вместе с тем волокна целлюлозы микрокристаллической быстро проводят воду внутрь таблетки при диспергировании ее в воде, что необходимо для достижения минимального времени распадаемости. Предпочтительно, но не ограничиваясь, использовать микрокристаллическую целлюлозу типов МКЦ-101, МКЦ-102, МКЦ-105, например производства JRS Pharma, Германия.
Кросповидон является типичным дезинтегрантом, способным набухать в воде, увеличивая размер частиц в несколько раз, и в таком количестве обеспечивает смеси достаточную распадаемость. Предпочтительно, но не ограничиваясь, использовать кросповидон, выпускаемый под торговым наименованием Коллидон CL, производитель BASF, Германия.
Повидон 25, является водорастворимым полимером, способствует достижению необходимой силы сцепления таблетируемой смеси при сравнительно небольшом давлении пресса. Используется в качестве гранулирующего раствора, позволяя изменить размер частиц смеси и улучшить технологические свойства смеси, такие как текучесть и антифрикционные свойства. Содержание данного вещества в количестве 2% масс, является достаточным и оптимальным.
При производстве, с целью повышения текучести таблетируемых масс, предотвращения налипания их на пуансоны и стенки отверстий матрицы в качестве смазывающего вещества используется стеарат магния, в количестве 0,325% масс, а в качестве скользящего вещества используется кремния диоксид коллоидный, предпочтительно 0,75% масс.
Для улучшения вкусоароматических свойств водной дисперсии таблеток в состав включены ароматизатор лимонный, натрия сахаринат, аспартам, лимонной кислоты моногидрат в количестве 2,825% масс.
Предлагаемое сочетание активного вещества и вспомогательных веществ определено экспериментально и является оптимальным. В результате получают смесь веществ, обладающую хорошими технологическими свойствами в процессе таблетирования, а получаемые при этом таблетки обладают свойствами, удовлетворяющими требованиям на лекарственное средство, то есть имеют товарный вид без сколов и трещин, обладают достаточной прочностью при минимальном времени дезинтеграции в воде.
Кроме того, композиции по настоящему изобретению, обнаруживают высокую стабильность и физическую сохранность, например, при хранении в течение всего срока годности, перемещении, фасовке, упаковке.
Согласно изобретению способ получения диспергируемой в воде таблетки ацетилцистеина осуществляют следующим образом:
- взвешенные ацетилцистеин, целлюлозу микрокристаллическую, кросповидон, лимонной кислоты моногидрат, натрия сахаринат, аспартам и лактозы моногидрат перемешивают, полученную смесь пропускают через коническую мельницу с сеткой 0,4-0,5 мм, получая однородную смесь.
Полученную смесь гранулируют водным раствором повидона в сушилке-грануляторе при температуре 55°С, затем смесь сушат до влажности 2,5-3,5%, после чего калибруют через сито или коническую мельницу с размером отверстий около 1,0 мм. Готовят смесь опудривателей из ароматизатора, магния стеарата и кремния диоксида коллоидного, пропуская их совместно через сито с ячейками 0,315 мм или коническую мельницу. Перемешивают откалиброванный гранулят со смесью опудривателей и таблетируют на прессе роторного типа.
Согласно одному аспекту диспергируемая в воде таблетка по данному изобретению имеет высокую прочность, при этом обнаруживая быструю дезинтеграцию в воде с образованием суспензии частиц размером не более 710 мкм.
Быстрая диспергируемость может наблюдаться при стандартных испытаниях, описанных в методе 2.9.1 «European Pharmacopoeia», издание 7.0 ТОМ.1 (2011 г.). Таблетки по настоящему изобретению предпочтительно характеризуются временем дезинтеграции от 30 до 70 секунд (в зависимости от массы и дозировки) при измерении согласно вышеописанному тесту, что значительно меньше максимально допустимого времени распадаемости.
Твердость или сопротивление дроблению у таблеток согласно настоящему изобретению могут быть определены с помощью стандартных испытаний. Твердость таблеток обычно определяют согласно стандартному тесту 2.9.8. «European Pharmacopoeia» издание 7.0 том. 1 (2011 г.). Может быть использовано приспособление для испытания таблеток, как, например, Кремер® 3S. Этот тест определяет сопротивление таблеток дроблению, измеряемое силой, необходимой для разрушения их путем дробления.
Твердость таблеток по настоящему изобретению варьируется в соответствии с массой и диаметром таблеток и силой сжатия. Для таблетки массой 200 мг с диаметром примерно 8,0 мм, твердость предпочтительно составляет от 40 до 80 Н. Для достижения такой твердости предпочтительно применяют силу сжатия от 4000 до 7000 Н. Для таблетки массой 400 мг с диаметром примерно 10,0 мм, твердость предпочтительно составляет от 60 до 120 H и может быть достигнута при применении силы сжатия от 6000 до 1000 Н. Для таблетки массой 1200 мг овальной двояковыпуклой формы, размером 20,5×11 мм, твердость предпочтительно составляет не менее 140 H и может быть достигнута при применении силы сжатия от 6000 Н.
Размер частиц водной дисперсии, полученной после дезинтеграции таблетки, изучают путем визуальной или количественной оценки остатков на сите с размером ячеек 710 мкм. Помещают от 1 до 4 таблеток в химический стакан вместимостью 150 мл, прибавляют 100 мл воды с температурой 20±5°C. Оставляют стакан в покое на 1 минуту для распадаемости таблеток, а затем 10 раз перемешивают содержимое стакана с помощью стеклянной палочки. Устанавливают сито с размером ячеек 710 мкм на химический стакан вместимостью 500 мл и при постоянном перемешивании стеклянной палочкой пропускают содержимое стакана через сито. При этом пятно, оставляемое дисперсией на сите, должно быть как можно меньшим по размеру. Дважды ополаскивают химический стакан по 50 мл воды с температурой 20±5°C и пропускают смывы, перемешивая стеклянной палочкой, через то же сито. При отсутствии на сите осадка или при наличии не более чем 3 частиц, размер которых почти соответствует диаметру отверстия сита, считают, что более 99,5% частиц прошло через сито 710 мкм.
Согласно другому аспекту диспергируемая в воде таблетка по данному изобретению должна быть стабильна при хранении. Оценку стабильности лекарственной композиции проводили в соответствии с И-42-2-82 «Инструкцией по проведению работ с целью определения сроков годности лекарственных средств на основе метода «Ускоренного старения» при повышенной температуре. Для этого таблетки расфасовывали непосредственно после изготовления в блистеры, состоящие из алюминиевой фольги и пленки ПВХ. Блистеры закладывали в термостат, поддерживающий постоянную температуру 55°С.
Полученные результаты оценки стабильности композиции ацетилцистеина представлены в таблицах 3-4.
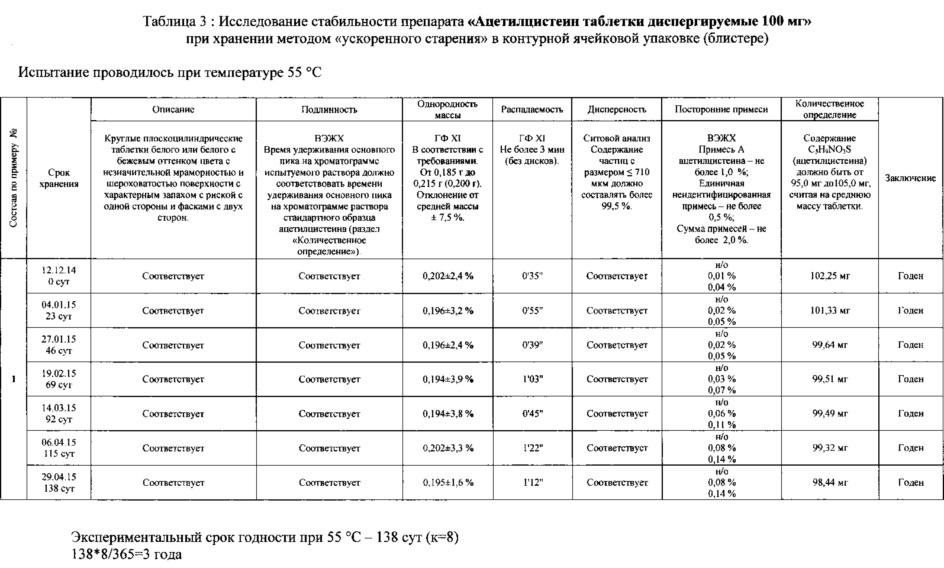
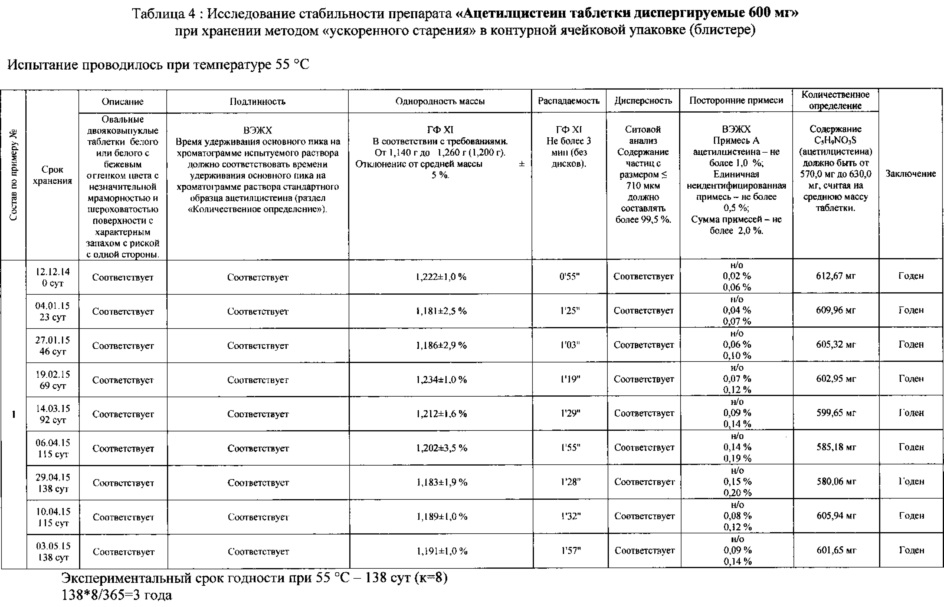
Экспериментальный срок годности в таблицах 3-4 рассчитан в соответствии с методикой, описанной в И-42-2-82, и составляет 3 года при температуре хранения до 25°С.
Количественное определение содержания ацетилцистеина в таблетках, а также содержание примесей определяли методом ВЭЖХ.
Интервал количественного содержания в таблетках, указанный в таблицах стабильности, рассчитан исходя из предельного значения отклонения количественного содержания активного вещества в таблетках ±5% для дозировки активного вещества более 100 мг, установленного ГФ XI (том 2, Общие статьи на лекарственные формы, таблетки).
Нормативное значение содержания посторонних примесей, установленное в таблицах 3-4, соответствует требованиям Европейской фармакопеи.
Пример 1.
Получение диспергируемой в воде таблетки ацетилцистеина 100 мг. Состав на одну таблетку приведен в таблице 2.
В смеситель-гранулятор MIC-DV, «COMASA», Аргентина загружают 500 г ацетилцистеина, 341 г целлюлозы микрокристаллической, 50 г кросповидона, 3,25 г лимонной кислоты, 8,25 г натрия сахарината, 6,75 г аспартама и 50 г лактозы, перемешивают 30 секунд со скоростью вращения мешалки 200, а измельчителя 400 об/мин. Полученную смесь пропускают через коническую мельницу Comil, «Quadro», Канада, оснащенную ситом с размером отверстий около 0,45 мм.
Полученную смесь переносят в лабораторную сушилку-гранулятор DPL-1, «DDPM», Китай, где проводят грануляцию 200 г водного 10%-ного раствора повидона при установленной температуре входящего воздуха 55°С. Раствор повидона распыляют через форсунку на псевдоожиженную теплым воздухом смесь. Полученный гранулят сушат в этом же оборудовании до необходимой остаточной влажности, предпочтительно 2,5-3,5%. Высушенный гранулят калибруют для разрушения крупных агломератов на конической мельнице Comil, через сито с размером отверстий около 1,0 мм.
Откалиброванный гранулят перемешивают в смесителе-кубе в течение 3 минут с предварительно совместно просеянными 3,25 г магния стеарата, 7,5 г кремния диоксида коллоидного и 10,0 г ароматизатора. Получают около 1,0 кг готовой смеси.
Из полученной смеси на лабораторном прессе PICCOLA, «RIVA», Аргентина, прессуют таблетки плоской цилиндрической формы, диаметром 8,0 мм, высотой около 3,1 мм и средней массой 200 мг, прочностью на сдавливание 70-80 H и распадаемостью в воде комнатной температуры 30-50 с.
Пример 2.
Получение диспергируемой в воде таблетки ацетилцистеина 200 мг. Состав на одну таблетку приведен в таблице 2.
В смеситель-гранулятор типа ЦП-600-01 загружают 15 кг ацетилцистеина, 10,23 кг целлюлозы микрокристаллической, 1,5 кг кросповидона, 0,098 кг лимонной кислоты, 0,248 кг натрия сахарината, 0,203 кг аспартама и 1,5 кг лактозы, перемешивают 60-90 секунд со скоростью вращения лопастной мешалки 700 об/мин. Полученную смесь пропускают через конический гранулятор GM, оснащенный ситом с размером отверстий около 0,5 мм.
Полученную смесь переносят в промышленную сушилку-гранулятор СГ-30М, где проводят грануляцию, распыляя через форсунку 6,0 кг 10%-ного водного раствора повидона. Полученный гранулят сушат в этом же оборудовании до необходимой остаточной влажности, предпочтительно 2,5-3,5%. Высушенный гранулят объединяют в СГ-30М с предварительно просеянными 0,098 кг магния стеарата, 0,225 кг кремния диоксида коллоидного и 0,30 кг ароматизатора. Кратковременно, 5-10 с, пропускают воздух через объединенную смесь, тем самым перемешивая компоненты.
Смесь калибруют для разрушения крупных агломератов на коническом грануляторе GM через сито с размером отверстий около 1,0 мм, получая около 30 кг продукта.
Из откалиброванной смеси на промышленном прессе KST-45 прессуют таблетки плоской цилиндрической формы, диаметром 10,0 мм, высотой около 4.0 мм и средней массой 400 мг, прочностью на сдавливание 90-100 H и распадаемостью в воде комнатной температуры 40-60 с.
Пример 3.
Получение диспергируемой в воде таблетки ацетилцистеина 600 мг. Состав на одну таблетку приведен в таблице 2. Весь технологический процесс проводят на линии производства фирмы «KISAN», Корея.
В высокоскоростной миксер типа KSM-200 загружают 30 кг ацетилцистеина, 20,46 кг целлюлозы микрокристаллической, 3,0 кг кросповидона, 0,195 кг лимонной кислоты, 0,495 кг натрия сахарината, 0,405 кг аспартама и 3,0 кг лактозы, перемешивают 60-90 секунд со скоростью вращения лопастной мешалки 100 об/мин, измельчителя 500 об/мин.
Полученную смесь переносят в сушилку-гранулятор JIM-FBDC20, где проводят циклическую грануляцию, распыляя через три форсунки 12,0 кг 10%-ного водного раствора повидона. Кратковременное распыление раствора чередуется с кратковременной сушкой, такие циклы осуществляются до полного израсходования раствора. Полученный гранулят сушат в этом же оборудовании до необходимой остаточной влажности, предпочтительно 2,5-3,5%. Высушенный гранулят объединяют в JIM-FBDC20 с 0,195 кг магния стеарата, 0,450 кг кремния диоксида коллоидного и 0,60 кг ароматизатора. Смесь с помощью вакуума транспортируют через вертикальный гранулятор JIM-MV в двухконусный смеситель JIM-WM, где ее перемешивают 3 минуты.
Из полученной смеси на промышленном прессе КТР-400 прессуют таблетки овальной двояковыпуклой формы размером 20,5×11 мм, высотой около 3,2 мм и средней массой 1200 мг, прочностью на сдавливание 200-240 H и распадаемостью в воде комнатной температуры 50-70 с.

