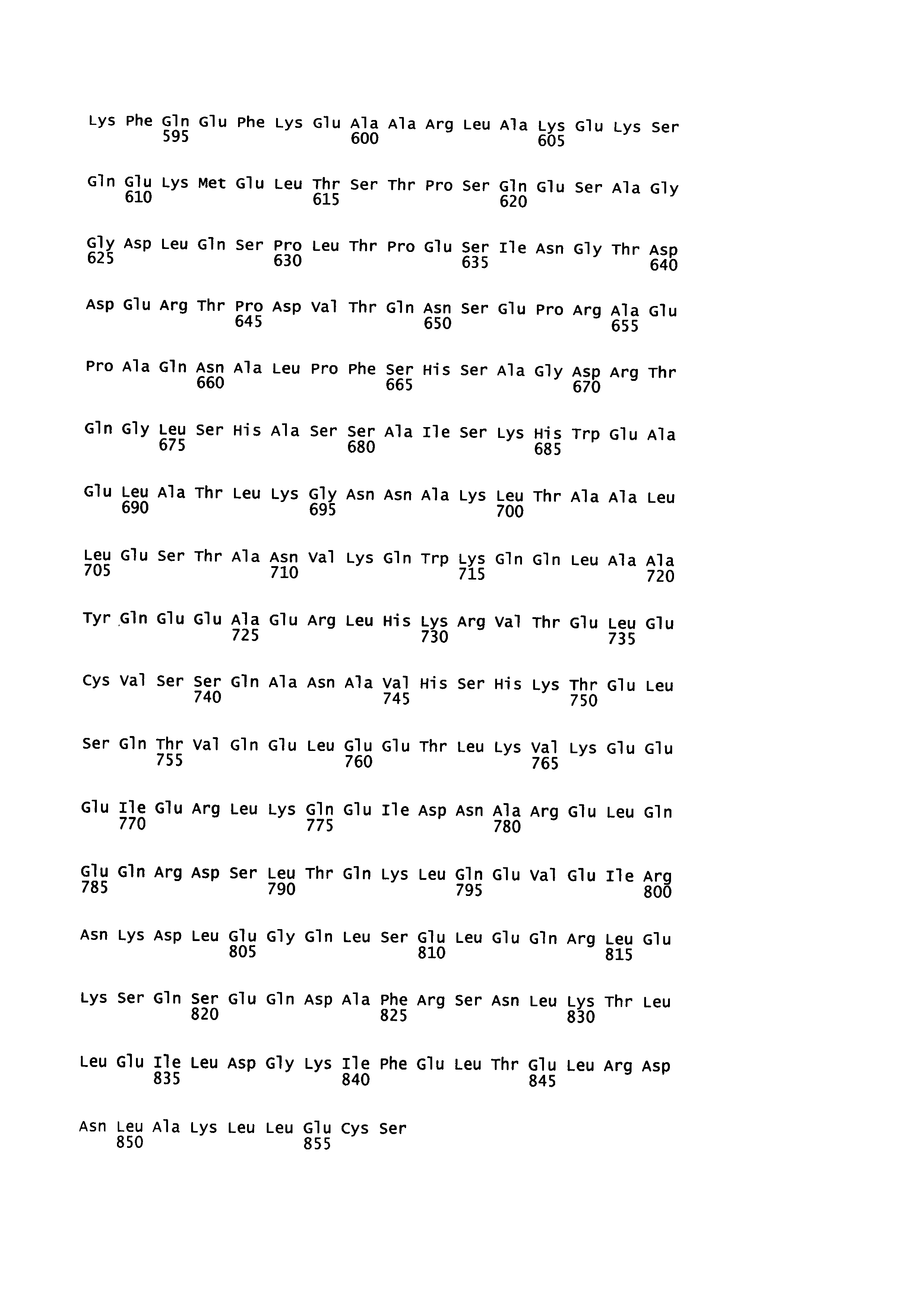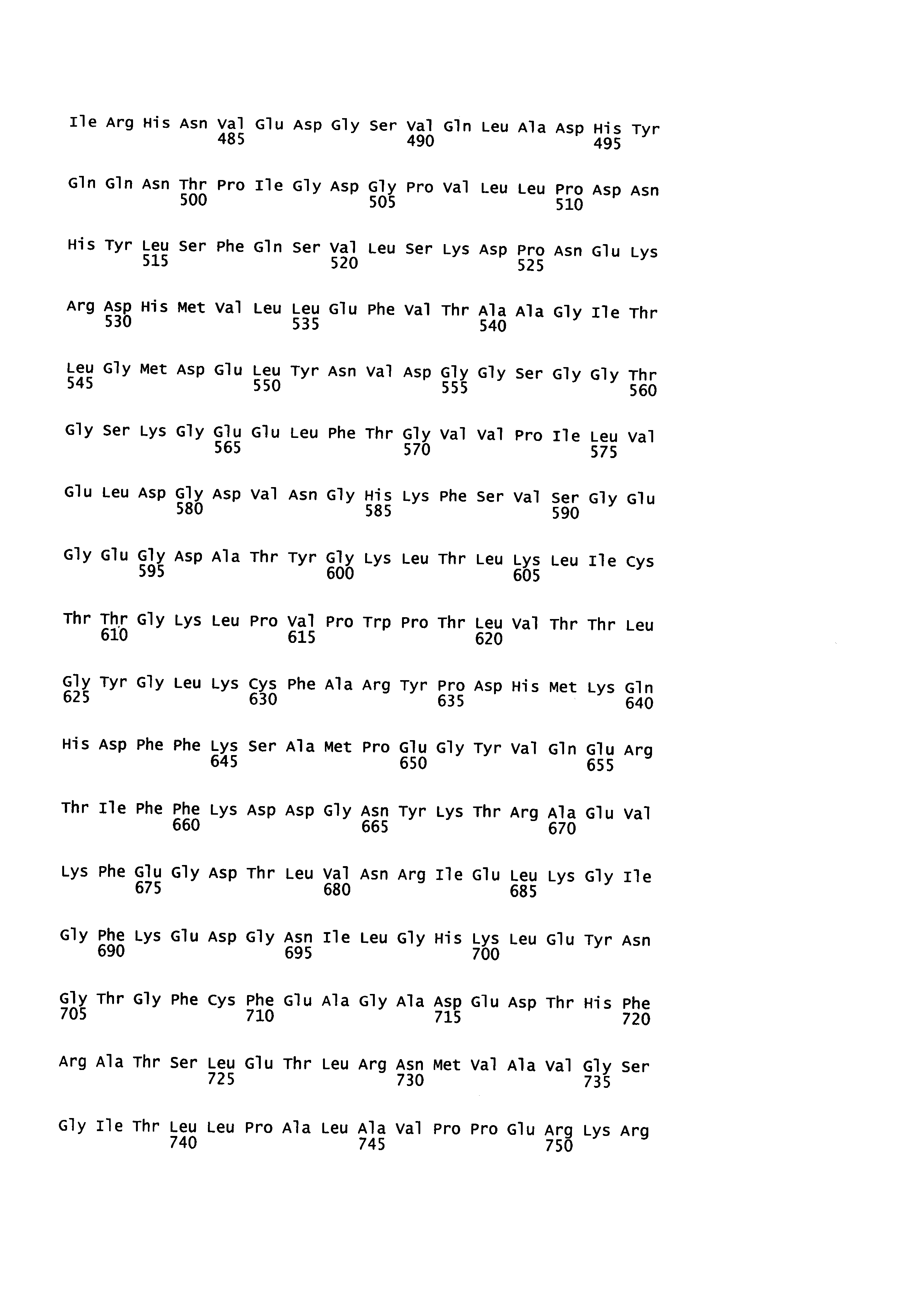Результат интеллектуальной деятельности: МОДИФИЦИРОВАННЫЙ БИОСЕНСОР ДЛЯ ДЕТЕКЦИИ ВНУТРИКЛЕТОЧНОЙ РН
Вид РИД
Изобретение
1. Область изобретения
[01] Данное изобретение относится в основном к области биологии и химии. В частности, изобретение направлено на биосенсоры для детекции рН, сконструированные на основе флуоресцентных белков.
2. Уровень техники
[02] Исследование процессов, происходящих в тканях мозга во время нормальной электрической активности и при патологии, представляет большой интерес как для выявления фундаментальных механизмов нейрональной активности, так и для биомедицинских приложений.
[03] Главная функция нервных клеток, генерация и проведение электрических импульсов, основана на движении ионов через клеточную мембрану. В течение миллисекунд концентрация ионов Na+, К+, Са2+ и Cl- внутри клетки может меняться в разы, и поддержание гомеостаза требует сложной системы регуляции и высокой пластичности метаболизма.
[04] Известно, что интенсивная нейрональная активность вызывает сдвиги внутриклеточного рН. Некоторые исследования показали, что долговременная деполяризация мембраны и вход кальция в клетку сопровождаются значительным закислением цитоплазмы. Механизм этого процесса не был до конца изучен. Одной из причин может быть высвобождение кислоты в процессе гидролиза АТФ кальциевыми насосами или вход протона через Са/Н и Na/H антипорт (Wu, М.L., et al., 1999, The American journal of physiology. 277, C 717-27). Другая гипотеза предполагает, что закисление цитоплазмы вызвано, главным образом, накоплением лактата вследствие ускорения процессов гликолиза (Zhan, R.Z., et al., 1998, Brain research. 780, 86-94).
[05] Изменение внутриклеточного значения рН влияет на нейрональную активность. Известно, что активность потенциал-зависимых кальциевых каналов, NMDA и ГАМК-рецепторов и др. меняется в зависимости от рН. Например, спонтанная припадочная электрическая активность нейронов в среде с пониженной концентрацией ионов Mg2+ подавляется небольшим подкислением раствора перфузии (Velisek, L., et al., 1994, Experimental brain research Experimentelle Hirnforschung Experimentation cerebrale. 101, 44-52). Транспорт нейротрансмиттеров также зависит от градиента протонов через мембрану синаптических везикул (Blakely, R.D. & Edwards, R.Н., 2012, Cold Spring Harbor perspectives in biology, 4). Следовательно сдвиги рН могут играть существенную роль в качестве регулятора нейрональной активности.
[06] Нервные клетки обладают сложной морфологической и функциональной структурой, и измерение внутриклеточного рН в такой системе является непростой задачей. Химические индикаторы, такие как SNARF и BCECF, не позволяют сравнить значения рН, например, между цитоплазмой дендрита и дендритными шипиками, которые играют критическую роль в процессах обработки входящего электрического сигнала (Lee, К.F. et al., 2012, Neural plasticity. 2012, 704103). Возможно, однако, что значение рН изменяется неравномерно в теле нейрона и синаптических структурах, принимая во внимание некоторую изолированность последних от основного объема цитоплазмы клетки.
[07] Использование генетически-кодируемых индикаторов позволяет обойти это ограничение. Однако, несмотря на существующие разнообразие индикаторов, в настоящее время не создано конструкций, обеспечивающих визуализацию тонких изменений рН, происходящих в процессе нервной активности, в частности в пресинаптическом пространстве.
[08] Значительная часть разработанных на сегодняшний день генетически-кодируемых индикаторов содержит в своем составе флуоресцентные белки семейства GFP, изменяющие свои спектральные характеристики в ответ на изменение внутриклеточных параметров.
[09] avGFP был описан Johnson et al. в J Cell Comp Physiol. (1962), 60: 85-104, как часть биолюминесцентной системы медузы, где GFP играет роль вторичного эммитера, преобразовывающего синий свет от фотобелка экворина в зеленый свет. кДНК, кодирующая A. victoria GFP была клонирована Prasher et al. (Gene (1992), 111(2): 229-33). Оказалось, что этот ген может быть гетерологично экспрессирован в практически любом организме благодаря уникальной способности GFP автокаталитически образовывать хромофор (Chalfie et al., Science 263 (1994), 802-805). Эти сведения открыли широкие перспективы для использования GFP в клеточной биологи, в качестве генетически кодируемой флуоресцирующей метки.
[10] GFP был использован в широком спектре приложений, включая исследование экспрессии генов и локализацию белков (Chalfie et al., Science 263 (1994), 802-805, and Heim et al. in Proc. Nat. Acad. Sci. (1994), 91: 12501-12504), как инструмент для визуализации внутриклеточного распределения органелл (Rizzuto et al., Curr. Biology (1995), 5: 635-642), для визуализации транспорта белков по секреторному пути (Kaether and Gerdes, FEBS Letters (1995), 369: 267-271).
[11] Были проведены многочисленные исследования для улучшения свойств avGFP (Aequorea victoria GFP) и для получения вариантов GFP, пригодных и оптимизированных для различных исследовательских целей. Была проведена оптимизация генетического кода avGFP (codon usage) для повышения уровня экспрессии в клетках млекопитающих (′′гуманизированный′′ GFP, Haas, et al., Current Biology (1996), 6: 315-324; Yang, et al., Nucleic Acids Research (1996), 24: 4592-4593). Были получены различные мутанты GFP, в том числе ′′усиленный зеленый флуоресцентный белок′′ (EGFP), имеющий две аминокислотные замены: F64L и S65T (Heim et al., Nature 373 (1995), 663-664). Другие мутанты являются синим, голубым и желто-зеленым спектральными вариантами avGFP и содержат замены аминокислотных остатков, формирующих хромофор, и\или остатков, формирующих окружение хромофора.
[12] В 1999 г., гомологи GFP были клонированы из небиолюминесцентных видов Anthozoa (Matz et al., Nature Biotechnol. (1999), 17: 969-973). Это открытие продемонстрировало, что эти белки не являются обязательно компонентом биолюминесцентной системы. GFP-подобные белки из Anthozoa обладали большим спектральным разнообразием и включали циановые, зеленые, желтые, красные флуоресцентные белки и фиолетово-синие нефлуоресцентные хромопротеины (CPs) (Matz et al., Bioessays (2002), 24(10): 953-959). В дальнейшем кДНК GFP-подобных белков были клонированы из ряда гидроидных медуз и из копепод (Shagin et al., Mol Biol Evol. (2004), 21(5): 841-850). Сегодня семейство GFP-подобных белков включает сотни флуоресцентных и окрашенных гомологов GFP. Сходство этих белков с GFP варьирует от 80-90% до менее чем 25% идентичности аминокислотной последовательности.
[13] GFP, его мутанты и гомологи являются членами одноименного белкового семейства и широко известны благодаря их интенсивному использованию в качестве флуоресцентных маркеров in vivo в биомедицинских исследованиях, что детально рассмотрено Lippincott-Schwartz и Patterson в Science (2003) 300(5616): 87-91 и Chudakov et al. (Physiol Rev. 2010 Jul; 90(3): 1103-63). Представители семейства GFP способны к флуоресценции при облучением светом подходящей длины волны. Флуоресцентные свойства этих белков обусловлены взаимодействием двух или более аминокислотных остатков, формирующих хромофор, а не флуоресценцией какого-либо одного аминокислотного остатка.
[14] Флуоресцентные белки представляют собой уникальное семейство структурно родственных белков, которые способны формировать хромофор автокаталитически без привлечения внешних субстратов или кофакторов. Под действием индуцирующего света, хромофор производит флуоресценцию, легко детектируемую с помощью современного лабораторного оборудования (спектрофлуориметр, флуоресцентный микроскоп, флуоресцентно-активируемый клеточный сортер, планшетный флуориметр).
[15] Были получены кристаллические структура avGFP дикого типа, GFP S65T мутанта и ряда гомологов GFP (Ormo et al. Science (1996) 273: 1392-1395; Wall et al. Nat Struct Biol (2000), 7: 1133-1138; Yarbrough et al. Proc Natl Acad Sci USA (2001) 98: 462-467; Prescott et al. Structure (Camb) (2003), 11: 275-284; Petersen et al. J Biol Chem (2003), 278: 44626-44631; Wilmann et al. J Biol Chem (2005), 280: 2401-2404; Remington et al. Biochemistry (2005), 44, 202-212; Quillin et al. Biochemistry (2005), 44: 5774-5787). Было постулировано, что все члены семейства обладают общей 3D структурой (GFP-подобным доменом), представляющей собой так называемый ′′бочонок′′ из 11 бета-слоев, образующих компактную встречно-параллельную структуру, внутри которой располагается альфа-спираль, содержащая хромофор. Хромофор формируется внутри GFP-подобного домена путем окислительной циклизации трех консервативных аминокислотных остатков в центральном регионе альфа-спирали (Cody et al., Biochemistry (1993) 32, 1212-1218). Положения аминокислотных остатков, формирующих хромофор, соответствует Ser65-Tyr66-Gly67 региону avGFP. Эти аминокислотные остатки легко могут быть идентифицированы у любого GFP-подобного белка путем выравнивания его последовательности с последовательностью avGFP.
[16] GFP-подобный домен, который может быть легко идентифицирован путем сравнения аминокислотных последовательностей флуоресцентных белков с avGFP (SEQ ID NO: 9) с помощью пакетов программ, предназначенных для анализа доменной структуры (например, с помощью программы Conserved Domain Database (CDD), доступной на сайте http://www. ′′ncbi.nlm.nih.gov/Structure/cdd/′′ или с помощью программы Simple Modular Architecture Research Tool (SMART, доступной на сайте http://smart.′′ ′′embl-heidelberg.de/). GFP-подобный домен avGFP начинается с 6-й аминокислоты и заканчивается 229 аминокислотой.
[17] Процесс автокаталитического формирования хромофора белков с различными спектральными свойствами подробно описан в ряде статей и включает несколько химических реакций (Heim et al. Proc Natl Acad Sci USA. 1994; 91: 12501-12504; Ormo et al. Science. 1996; 273: 1392-1395; Yang et al. Nat Biotechnol. 1996; 14: 1246-1251; Brejc et al. J. Proc Natl Acad Sci USA. 1997; 94: 2306-2311; Palm et al. Nat Struct Biol. 1997; 4: 361-365; Gurskaya et al., BMC Biochem. 2001; 2: 6; Gross et al. Proc Natl Acad Sci USA. 2000; 97: 11990-11995; Wall et al. Nat Struct Biol. 2000; 7: 1133-1138; Yarbrough et al., J. Proc Natl Acad Sci USA. 2001; 98: 462-167; Pakhomov, A.A. and Martynov, V.I. Chem. Biol. 2008, 15, 755-764; Quillinet al. (2005) Biochemistry 44, 5774-5787; Yampolsky et al. (2005) Biochemistry 44, 5788-5793; Shu et al. (2006) Biochemistry 45, 9639-9647; Kikuchi et al. (2008) Biochemistry 47, 11573-11580; Yampolsky et al., Biochemistry, 2009, 48 (33), pp 8077-8082).
[18] GFP-подобные белки широко используют для создания генетически-кодируемых биосенсоров. Исследование внутриклеточных процессов с помощью таких генетически кодируемых биосенсоров становятся все более популярным, так как только такие сенсоры могут дать информацию об изменении исследуемого параметра непосредственно в живой системе. Такие биосенсоры востребованы как в фундаментальных исследованиях сигнальных путей организма, так и при тестировании токсических и лекарственных препаратов на модельных клеточных линиях или организмах. В сравнении с химическими и физическими методами регистрации биологически активных субстанций биосенсорами, требующими экзогенно добавляемых красителей, субстратов или кофакторов, генетически кодируемые нанобиосенсоры относятся к классу безреагентных и многоразовых сенсоров, использование флуоресцентных белков в качестве передатчиков информации стало наиболее эффективным подходом к разработке генетически-кодируемых сенсоров.
[19] Биосенсоры на основе флуоресцентных белков представляют собой химерные белки, в состав которых входит сенсорный домен - белковый домен, чувствительный к изменению определенного параметра клетки, например, изменению концентрации какого-либо иона или молекулы (ионов кальция, перекиси водорода, ионов водорода и т.д.). В качестве сигнальной части биосенсора используют GFP-подобные белки или их варианты, подвергнутые круговой пермутации (Suslova and Chudakov, Trends Biotechnol. 23(12) (2005), 605-13; Griesbeck, Curr Opin Neurobiol., 2004, v. 14(5), pp. 636-641; Bunt and Wouters, Int Rev Cytol., 2004, v. 237, pp. 205-277).
[20] Создание пермутированных GFP-подобных белков необходимо для увеличения подвижности хромофорного окружения и, следовательно, для большей лабильности спектральных свойств белка. Круговая пермутация флуоресцентных белков описана Topell S. и Glockshuber R. (Methods in Molecular Biology. 183, 31-48; 2002). Например, для круговой пермутации avGFP в его первичную структуру вносится разрыв в область между 144 и 149 аминокислотами, нативные N- и С- концы совмещаются при помощи полипептидного линкера. Новые N- и С- концы находятся в непосредственной близости от хромофора и могут влиять на его микроокружение. Круговая пермутация производится на уровне нуклеиновой кислоты путем оперативного сшивания 3′- и 5′-концов нуклеотидной последовательности, кодирующей флуоресцентный белок, и внесения разрыва в последовательность между кодонами, кодирующими новые N и С- концевые аминокислоты. Методы для получения таких конструкций хорошо известны специалистам в данной области.
[21] В результате круговой пермутации кпФБ приобретает способность реагировать на конформационные перестройки в области новых N и С - концов изменением спектра флуоресценции (сенсоры с использованием обычных флуоресцентных белков оказались малочувствительными).
[22] Эффективность биосенсоров на основе кпФБ, полученных из avGFP была продемонстрирована на примере сенсора на ионы кальция (Nagai et al, Proc Natl Acad Sci USA. 98(6) (2001), 197-202). кпФБ был так же использован для изготовления сенсора на пероксид водорода HyPer OxyR (Belousov et al., Nature Method. 4, 281-286; 2006). HyPer представляет собой химерный белок, состоящий из регуляторного домена белка OxyR E. coli, реагирующего с пероксидом водорода и интегрированного в пептидную цепь OxyR пермутированного желтого флуоресцентного белка cpYFP. HyPer представляет собой конструкцию, в которой подвергнутый круговой пермутации флуоресцентный белок cpYFP соединен с двумя фрагментами чувствительного к H2O2 домена OxyR посредством коротких пептидных линкеров. Нуклеотидные последовательности, кодирующие фрагменты белка OxyR и cpYFP оперативно сшиты между собой с использованием линкерных последовательностей.
[23] Также на основе HyPer был получен индикатор изменения внутриклеточного рН, названный SypHer. Внесение в последовательность HyPer замены C199S привело к потере способности опознавать пероксид водорода, и появлению выраженного изменения флуоресцентных свойств индикатора в ответ на изменение рН.
[24] Полученный индикатор SypHer обладает рациометрическим сигналом, что делает его независимым от изменения объема цитоплазмы или концентрации белка. Было продемонстрировано успешное применение SypHer в некоторых системах in vitro (Poburko, D. et al., 2011, The Journal of biological chemistry. 286, 11672-84). Потенциально SypHer может быть использован для регистрации изменений рН в нейронах.
[25] Тем не менее, яркость флуоресценции индикатора SypHer относительно невысока, что затрудняет его использование в исследованиях на культурах тканей и в крупных живых организмах. Таким образом, целью настоящего исследования было создание более яркой версии индикатора SypHer и конструкций на основе этого модифицированного индикатора, SypHer2, для регистрации изменений рН в определенных компартментах нейронов.
3. Раскрытие изобретения
[26] Настоящее изобретение обеспечивает выделенные молекулы нуклеиновых кислот, кодирующих модифицированный флуоресцентный биосенсор для детекции рН внутри клеток, отличающийся от SypHer (SEQ ID NO: 1 и 2) увеличенной яркостью. Указанный биосенсор имеет аминокислотную последовательность, показанную в SEQ ID NO: 4. Указанный биосенсор находит свое применение для измерения рН внутри живых клеток и в клеточных компартментах, в частности, в живых срезах мозга, и исследований динамики рН в процессе электрической активности в различных клеточных компартментах на культуре нейронов и на короткоживущих срезах мозга.
[27] В некоторых воплощениях, нуклеиновая кислота настоящего изобретения кодирует флуоресцентный биосенсор для детекции внутриклеточного рН, слитый с белком синаптофизином (synaptophysin), обеспечивающим локализацию сенсора в пресинаптической зоне нейронов. Аминокислотная последовательность этого биосенсора показана в SEQ ID NO: 6.
[28] В некоторых воплощениях, нуклеиновая кислота настоящего изобретения кодирует флуоресцентный биосенсор для детекции внутриклеточного рН, слитый с белком Homer1, обеспечивающим преимущественную локализацию сенсора в постсинаптической зоне нейронов. Аминокислотная последовательность этого биосенсора показана в SEQ ID NO: 8.
[29] В некоторых воплощениях, нуклеиновая кислота настоящего изобретения имеет нуклеотидную последовательность, выбранную из SEQ ID NO: 03, SEQ ID NO: 05 и SEQ ID NO: 07.
[30] Молекулы нуклеиновых кислот, которые отличаются от представленных нуклеотидных последовательностей вследствие вырожденности генетического кода так же входят в рамки настоящего изобретения.
[31] В других воплощениях также обеспечиваются векторы, включающие нуклеиновую кислоту настоящего изобретения. Кроме того, настоящее изобретение обеспечивает кассеты экспрессии, включающие нуклеиновую кислоту настоящего изобретения и регуляторные элементы, необходимые для экспрессии нуклеиновой кислоты в выбранной клетке-хозяине. Кроме того, также обеспечиваются клетки, стабильные клеточные линии, трансгенные животные и трансгенные растения, включающие нуклеиновые кислоты, векторы или экспрессионные кассеты настоящего изобретения. В других воплощениях обеспечиваются функциональные флуоресцентные биосенсоры настоящего изобретения, которые кодируются нуклеиновыми кислотами указанными выше.
4. Краткое описание рисунков
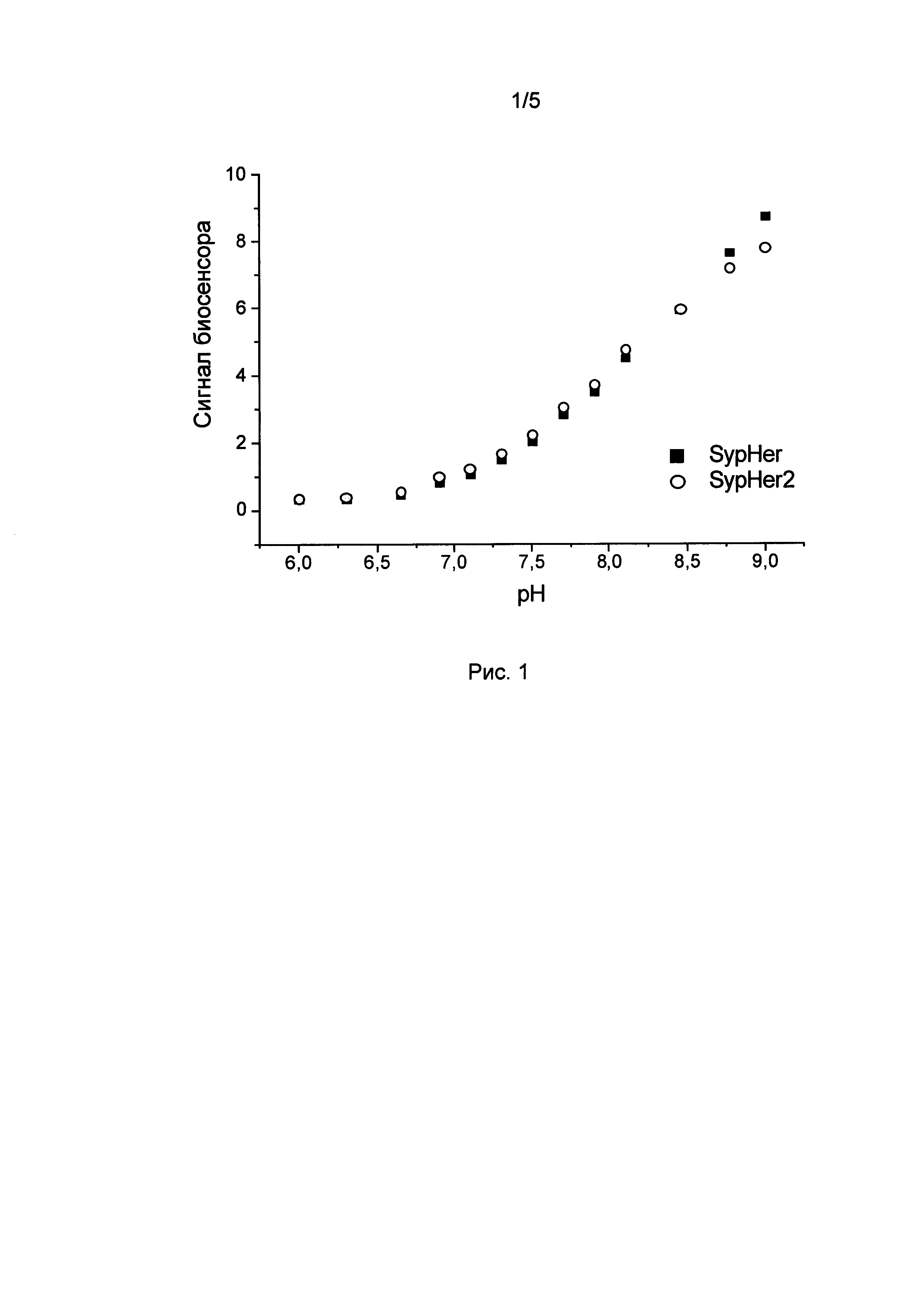
[01] Рисунок 1 иллюстрирует зависимость рациометрического сигнала SypHer и SypHer2 от рН в культуре HeLa Kyoto в буферах, содержащих 5 мкМ монензина и 5 мкм нигерицина. Количество клеток не менее 30 в каждой точке.
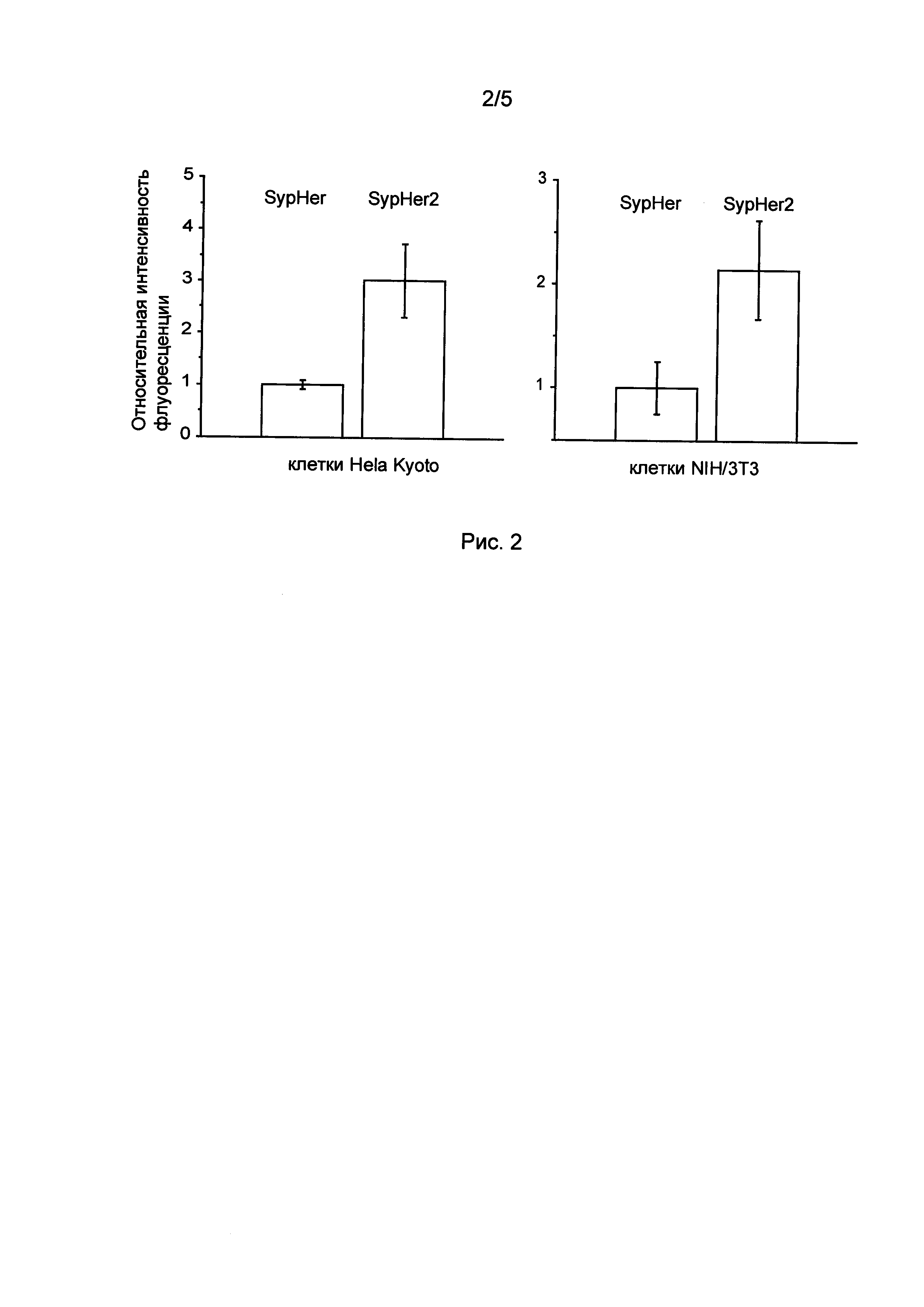
[02] Рисунок 2 иллюстрирует сравнение средней яркости флуоресценции биосенсоров SypHer и SypHer2 в клетках млекопитающих. Приведена средняя яркость флуоресценции индикатора при возбуждении светом 488 нм для 15 клеток в каждой линии. Яркость указана в единицах относительно средней яркости флуоресценции SypHer2 в данной клеточной линии.
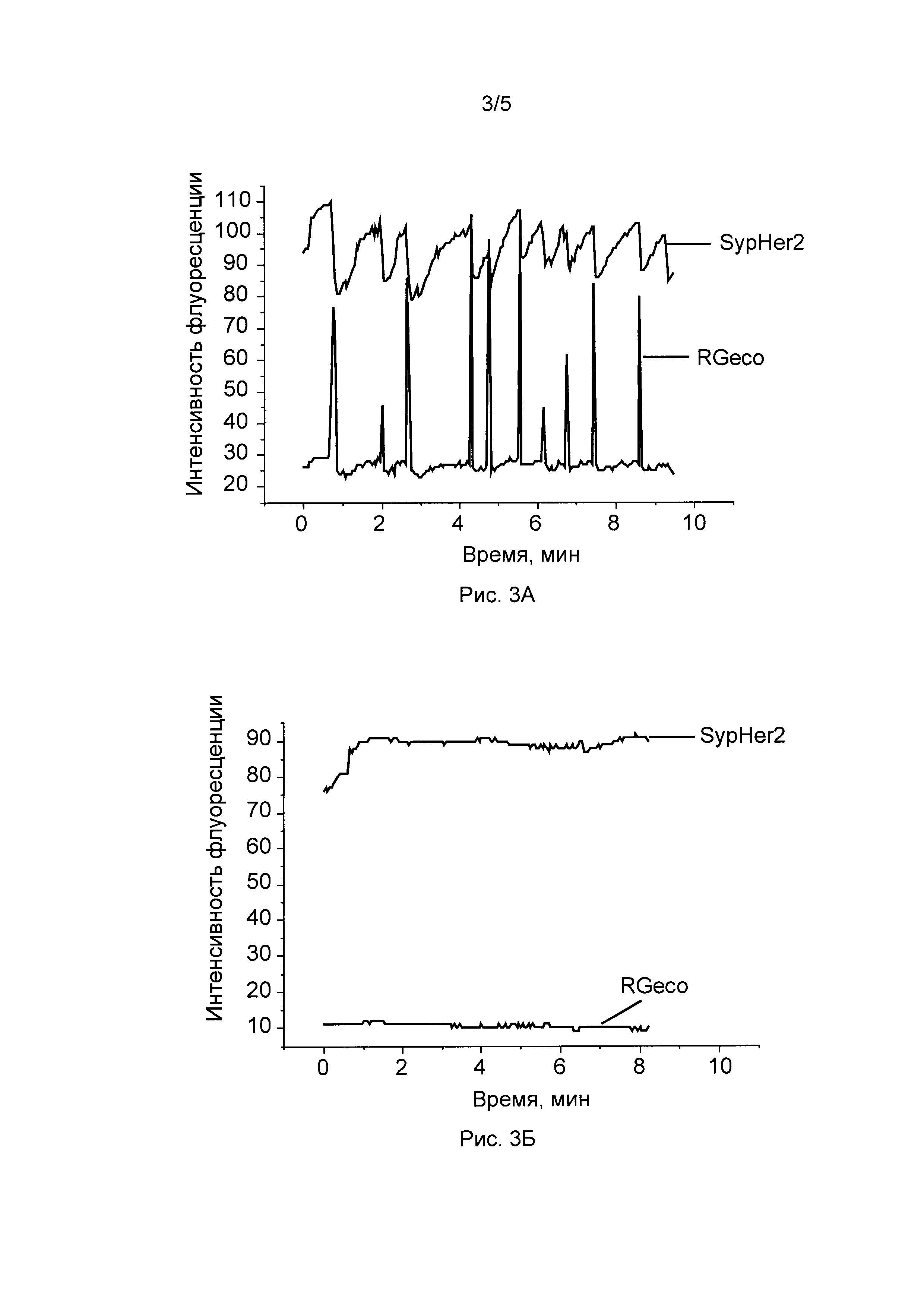
[03] Рисунок 3А иллюстрирует динамику рН и Са+2 в электрически активной нервной клетке. Измерение рН осуществлялось с помощью биосенсора SypHer2, измерение Са2+ осуществлялось с помощью биосенсора RGeco. Спонтанная активность нейронов вызывает вход кальция в клетки, что можно наблюдать по возрастанию флуоресценции RGeco. Вход кальция в клетки сопровождается быстрым падением флуоресценции SypHer2, что соответствует закислению цитоплазмы. Флуоресценцию SypHer2 возбуждали светом 488 нм.
[04] Рисунок 3Б иллюстрирует динамику рН и Са2+ в нервной клетке в среде, содержащей внутриклеточный хелатор Са2+. Флуоресценцию SypHer возбуждали светом 488 нм.
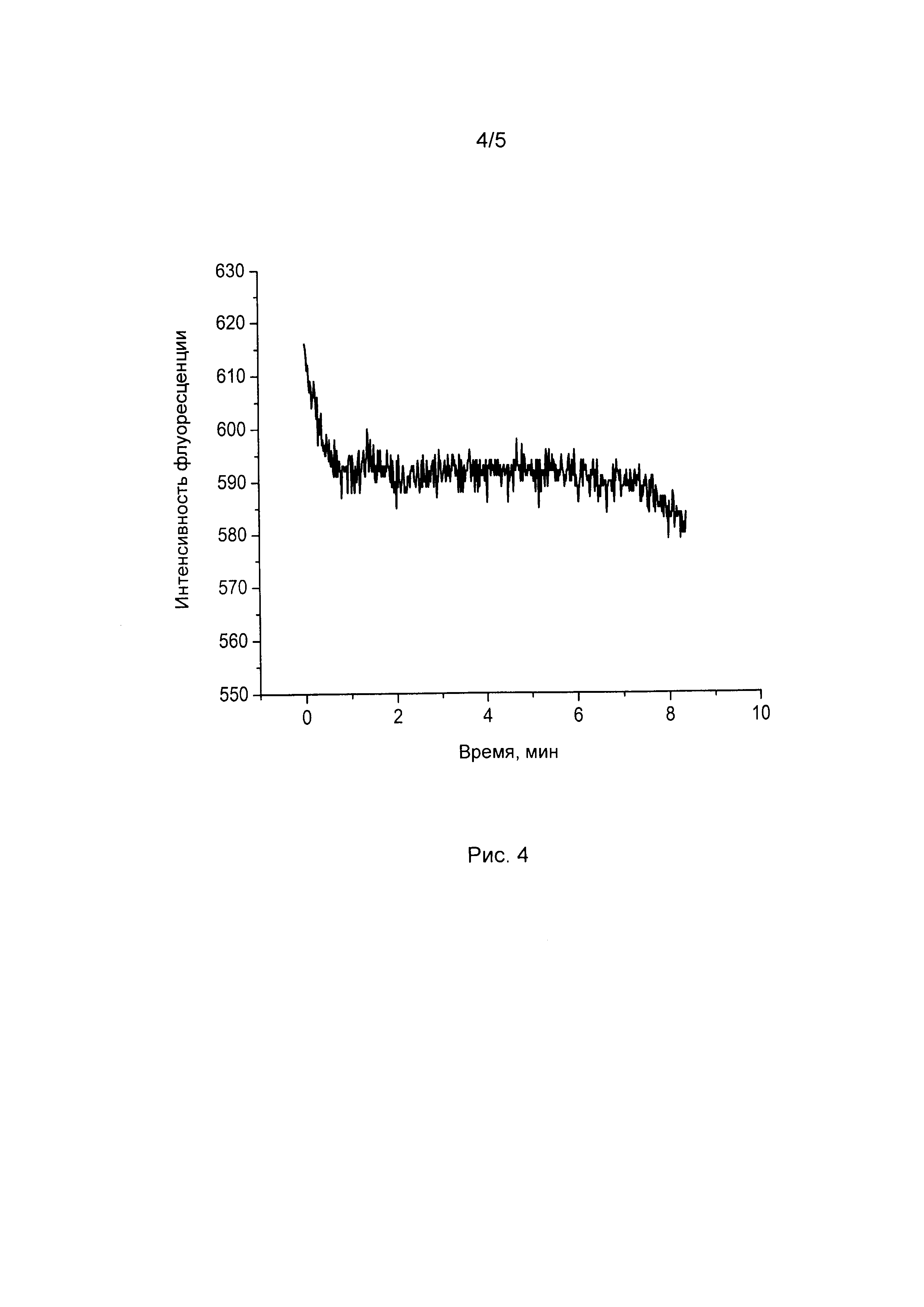
[05] Рисунок 4 показывает колебания цитоплазматического рН, вызванные спонтанной электрической активностью в срезах мозга в среде ACSF. Флуоресценцию SypHer возбуждали светом 488 нм.
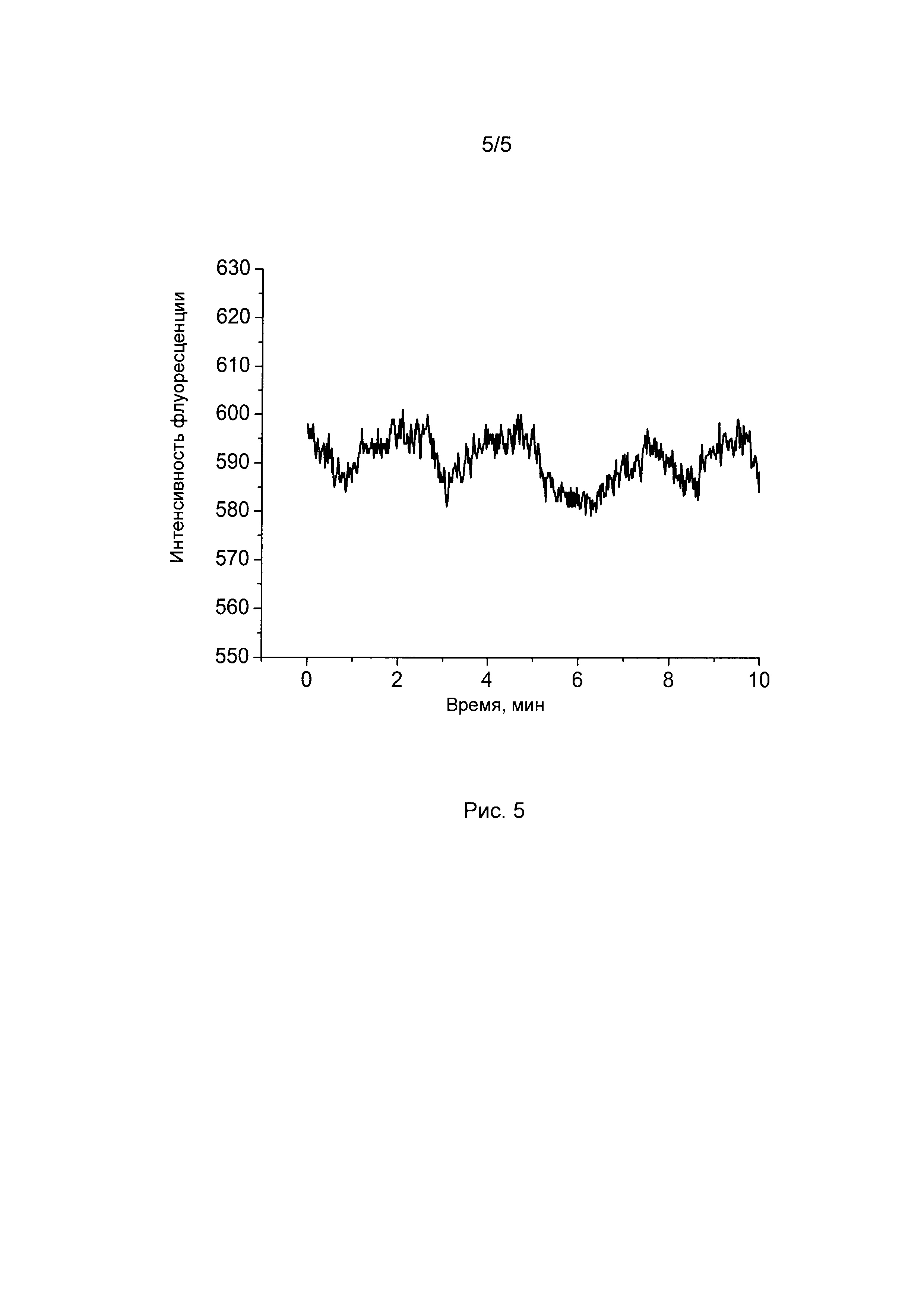
[06] Рисунок 5 показывает колебания цитоплазматического рН, вызванные спонтанной электрической активностью в срезах мозга в среде ACSF после добавления 30 мМ KCl. Флуоресценцию SypHer2 возбуждали светом 488 нм.
4. Осуществление изобретения
[07] Для более полного раскрытия вышеперечисленных характеристик настоящего изобретения ниже предлагается детальное описание изобретения, кратко сформулированного выше, в виде ссылок на воплощения, некоторые из которых проиллюстрированы дополнительными фигурами. При этом следует отметить, что прилагаемые фигуры иллюстрируют лишь типичные воплощения настоящего изобретения и, следовательно, не должны быть восприняты в качестве ограничения объема изобретения, которое может допускать другие в равной степени эффективные воплощения.
[08] Как указано выше, настоящее изобретение направлено на молекулы нуклеиновых кислот, которые кодируют вариант биосенсора для измерения внутриклеточного рН SypHer-SypHer2, обладающий повышенной яркостью флуоресценции и конструкции на его основе, обеспечивающие локализацию биосенсора в определенных компартментах нейрона.
[09] Нуклеиновые кислоты настоящего изобретения получены с помощью рекомбинантных технологий. В предпочтительных воплощениях, нуклеиновые кислоты настоящего изобретения кодируют белок, имеющий аминокислотную последовательность, показанную в SEQ ID NO: 4.
[10] В некоторых воплощениях, нуклеиновые кислоты, кодируют химерный белок, включающий биосенсор SypHer2, оперативно слитый с белком synaptophysin, аминокислотная последовательность химерного белка показана в SEQ ID NO: 6.
[11] В некоторых воплощениях, нуклеиновые кислоты, кодируют химерный белок, включающий биосенсор SypHer2, оперативно слитый с белком Homerl, аминокислотная последовательность химерного белка показана в SEQ ID NO: 8
[12] Также обеспечиваются векторы и кассеты экспрессии, включающие нуклеиновую кислоту настоящего изобретения. Кроме того, обеспечиваются клетки, стабильные клеточные линии, трансгенные животные и трансгенные растения, включающие нуклеиновые кислоты, векторы или экспрессионные кассеты настоящего изобретения.
[13] Указанные нуклеиновые кислоты применяются во многих различных приложениях и методах, в частности, для измерения рН в живых срезах мозга и исследований динамики рН в процессе спонтанной электрической активности в различных клеточных компартментах на культуре нейронов и на короткоживущих срезах мозга
[14] Определения
[15] Различные термины, относящиеся к биологическим молекулам настоящего изобретения, используются выше и также в описании и в формуле изобретения.
[16] Как здесь используется, термин ′′флуоресцентный белок′′ означает белок, относящийся к семейству GFP-подобных белков, который обладает способностью к флуоресценции; например, он может проявлять низкую, среднюю или интенсивную флуоресценцию при облучении светом с подходящей для возбуждения длиной волны. Флуоресцентное свойство флуоресцентного белка представляет собой такое свойство, которое является результатом работы хромофора, образующегося путем автокаталитической циклизации трех или более аминокислотных остатков в полипептидной цепи. Как таковые флуоресцентные белки настоящего изобретения не включают белки, которые обладают флуоресценцией за счет отдельных флуоресцирующих остатков, таких как триптофан, тирозин и фенилаланин. Термин «флуоресцентный белок» относится так же к флуоресцентным белкам GFP-семейства, подвергнутым круговой пермутации.
[17] Как здесь используется, термин ′′avGFP′′ относится к зеленому флуоресцентному белку из медузы Aequorea victoria, включая варианты avGFP, известные из уровня техники, сконструированные для обеспечения большей интенсивности флуоресценции или флуоресценции в других цветовых областях. Последовательность дикого типа avGFP была раскрыта в Prasher et al. (1992, Gene 111: 229-33).
[18] Как здесь используется, термин ′′флуоресцентный белок, подвергнутый круговой пермутации′′ или ′′кпФБ′′ относится к белку, полученному из флуоресцентного белка (например из avGFP) с помощью генно-инженерной модификации нуклеиновой кислоты, в результате которой С- и N- концы исходного флуоресцентного белка оказываются оперативно слиты, а новые С- и N- концы формируются вблизи хромофора. Круговая пермутация не влияет на формирование «бочонка» GFP-подобного домена и формирование активного (способного к флуоресценции) хромофора. Круговая пермутация приводит к тому, что кпФБ приобретает способность менять спектральные характеристики при конформационных изменениях белковых доменов или полипептидов, оперативно слитых с его С- и N- концами.
[19] Термин ′′гуманизированный′′ относится к изменению нуклеотидной последовательности флуоресцентного белка, сделанной для оптимизации генетического кода кодонов для экспрессии в клетках млекопитающих (Yang et al., 1996, Nucleic Acids Research 24: 4592-4593).
[20] Как здесь используется, термин ′′выделенный′′ означает молекулу или клетку, которые находятся в среде, отличной от среды, в которой молекула или клетка находятся в естественных условиях.
[21] Как здесь используется, термин ′′мутант′′ или ′′производное′′ относятся к белку, раскрытому в настоящем изобретении, в котором одна или более аминокислот добавлены и/или замещены и/или удалены (делегированы) и/или вставлены (инсертированы) в N-конец и/или С-конец, и/или в пределах нативных аминокислотных последовательностей белков настоящего изобретения. Как здесь используется, термин ′′мутант′′ относится к молекуле нуклеиновой кислоты, которая кодирует мутантный белок. Кроме того, термин ′′мутант′′ здесь относится к любому варианту, который короче или длиннее белка или нуклеиновой кислоты.
[22] Как здесь используется, ′′гомология′′ - это термин, использующийся для описания взаимосвязи последовательностей нуклеотидов или аминокислот с другими последовательностями нуклеотидов или аминокислот, которая определена степенью идентичности и/или сходства между указанными сравниваемыми последовательностями.
[23] Как здесь используется, аминокислотная или нуклеотидная последовательности «по существу сходны» или «по существу такие же» как референсная последовательность, если аминокислотная или нуклеотидная последовательности имеют по крайней мере 85% идентичности с указанной последовательностью внутри выбранного для сравнения региона. Таким образом, по существу сходные последовательности включают те, которые имеют, например, по крайней мере, 85% идентичности, по крайней мере, 90% идентичности, по крайней мере, 95% идентичности или по крайней мере, 96%б 97%б 98% или 99% идентичности. Две последовательности, которые идентичны одна другой, так же по существу сходны.
[24] Процент идентичности последовательностей определяется на основании референсной последовательности. Алгоритмы для анализа последовательности известны в данной области, такие как BLAST, описанный в Altschul et al., J. Mol. Biol., 215, pp. 403-10 (1990). Для целей настоящего изобретения сравнение нуклеотидных и аминокислотных последовательностей производимое с помощью пакета программ Blast, предоставляемого National Center for Biotechnology Information (http://www.ncbi.nlm.nih.gov/blast) с использованием содержащего разрывы выравнивания со стандартными параметрами, может быть использовано для определения уровня идентичности и сходства между нуклеотидными последовательностями и аминокислотными последовательностями.
[25] Как здесь используется, термин ′′подобные белки′′ или ′′по существу сходные белки′′ относится к белкам, которые имеют аминокислотные последовательности, идентичные по крайней мере на 85%, как правило идентичные на 90% или более, чаще всего идентичные по крайней мере на 95% или более (например на 96% и более, 97% и более, 98% и более, 99% и более, 100%). Длина гомологичных аминокислотных последовательностей у «подобных белков» при этом может составлять, по крайней мере, 100 аминокислотных остатков, чаще, по крайней мере, 200 аминокислотных остатков, или 300 аминокислотных остатков.
[26] В некоторых воплощениях, термин ′′подобные белки′′ или ′′по существу сходные белки′′ относится к белкам, которые имеют аминокислотные последовательности целого белка, идентичные по крайней мере на 85%, как правило идентичные на 90% или более, чаще всего идентичные по крайней мере на 95% или более (например на 96% и более, 97% и более, 98% и более, 99% и более, 100%).
[27] Как здесь используется, термин ′′функциональный′′ означает, что нуклеотидная или аминокислотная последовательность может функционировать для указанного испытания или задачи. Термин ′′функциональный′′, используемый для описания биосенсора для детекции рН настоящего изобретения, означает, что он меняет спектральные характеристики при изменении кислотности в среде.
[28] Как здесь используется, термин «среда» по отношению к биосенсора означает любую среду, в которой этот биосенсор может функционировать. Для выделенного белка это может быть любой буферный раствор, в котором этот сенсор сохраняет функциональность. Для белка, экспрессированного в клетке, это цитоплазма или клеточный компартмент, в котором биосенсор локализован.
[29] Как здесь используется, ′′биохимические свойства′′ относятся к белковому фолдингу (сворачиванию) и скорости созревания, скорости восстановления после реакции с пероксидом водорода, времени полужизни, способности к агрегации, способности к олигомеризации, рН и температурной стабильности, и другим подобным свойствам.
[30] Как здесь используется, ′′флуоресцентные свойства′′ или ′′спектральные свойства′′ относятся к коэффициенту молярной экстинкции при подходящей длине волны, к квантовому выходу флуоресцентции, форме спектра возбуждения флуоресценции или спектра испускания, длине волны, соответствующей максимуму возбуждения флуоресценции, и длине волны, соответствующей максимуму испускания, отношению амплитуды возбуждения флуоресценции при двух разных длинах волн, отношению амплитуды испускания при двух разных длинах волн, времени жизни возбужденного состояния, и анизотропии оптических свойств. Измеряемая разница может быть определена как количество любого количественного флуоресцентного свойства, например, интенсивность флуоресцентции при определенной длине волны, или интегральная флуоресценция на всем спектре испускания.
[31] Как здесь используется, термин «сигнал биосенсора» означает детектируемое изменение спектральной характеристики биосенсора в ответ на изменение рН среды.
[32] Как здесь используется, ′′яркость флуоресценции′′ определяется квантовым выходом флуоресценции биосенсора, умноженным на максимальный коэффициент экстинкции и деленным на 1000.
[33] Ссылка на нуклеотидную последовательность ′′кодирующую′′ полипептид означает, что с нуклеотидной последовательности в ходе трансляции и транскрипции мРНК продуцируется этот полипептид. При этом может быть указана как кодирующая цепь, идентичная мРНК и обычно используемая в списке последовательностей, так и комплементарная цепь, которая используется как матрица при транскрипции. Как очевидно для любого специалиста в данной области техники, термин так же включает любые вырожденные нуклеотидные последовательности кодирующие одинаковую аминокислотную последовательность. Нуклеотидная последовательности кодирующие полипептид включают последовательности, содержащие интроны.
[34] Термин ′′оперативно связанный′′ или ему подобный при описании структуры биосенсора или химерных белков на его основе относится к полипептидным последовательностям, которые находятся в физической и функциональной связи одна с другой. В наиболее предпочтительных воплощениях, основные функции полипептидных компонентов химерной молекулы не изменены по сравнению с функциональными свойствами выделенных полипептидных компонентов. Например, когда биосенсор настоящего изобретения сшит с представляющим интерес сигналом внутриклеточной локализации или белком, химерный белок сохраняет способность реагировать на появление рН, но локализуется в определенном клеточном компартменте. Как очевидно для любого специалиста в данной области техники, нуклеотидные последовательности, кодирующие химерный белок, включающий ′′оперативно связанные′′ компоненты (белки, полипептиды, линкерные последовательности, белковые домены и т.д.), состоят из фрагментов, кодирующих указанные компоненты, где эти фрагменты ковалентно связаны таким образом, что в ходе трансляции и транскрипции нуклеотидной последовательности продуцируется полноразмерный химерный белок. Иными словами, фрагменты соединены таким образом, что в местах их соединения отсутствуют ′сбойки′ рамки считывания и стоп-кодоны.
[35] Как здесь используется, термин «рН» означает «водородный показатель» - меру, количественно выражающую кислотность раствора, которая вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на один литр. Для определения значения рН растворов широко используют несколько стандартных методик. Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять рН-метром или определять аналитически путем, проведением кислотно-основного титрования.
[36] Как здесь используется, термин «физиологические значения рН» или ему подобный означает диапазон значений рН цитоплазмы, наблюдаемый в физиологических условиях, что приблизительно соответствует рН от 6.8 до 7.8.
[37] Молекулы нуклеиновых кислот
[38] Настоящее изобретение обеспечивает молекулы нуклеиновых кислот кодирующие флуоресцентный биосенсор SypHer2 для детекции рН, имеющий аминокислотную последовательность SEQ ID NO: 4. Указанный биосенсор отличается увеличенной яркостью флуоресценции по сравнению с биосенсором SypHer и содержит замену A406V (нумерация аминоксилот приведена в соответствии с аминокислотной последовательностью белка SypHer, показанной в SEQ ID NO: 2).
[39] Так же обеспечиваются молекулы нуклеиновых кислот кодирующие химерные белки, содержащие флуоресцентный биосенсор SypHer2 для детекции рН оперативно слитый с белками, обеспечивающими локализацю биосенсора в определенных компартментах нейрона.
[40] Методы получения таких слитых белков хорошо известны в данной области. Например, части нуклеиновой кислоты, кодирующие различные элементы, могут быть встроены в полилинкер вектора, таким образом, что между различными частями не будет стоп-кодонов в рамке считывания и не будет сбоек рамки считывания. Альтернативно, желательная нуклеотидная последовательность может быть собрана из фрагментов с помощью ДНК-лигазы или ПЦР с праймерами, содержащими части, комплементарные концевым последовательностям соединяемых фрагментов.
[41] Как здесь используется, молекула нуклеиновой кислоты это молекула ДНК, такая как геномная ДНК или кДНК молекула, или молекула РНК, такая как молекула мРНК. Как здесь используется, термин ′′кДНК′′ относится к нуклеиновым кислотам, которые обладают размещением элементов последовательности найденным в нативных зрелых видах мРНК, где элементы последовательности - это экзоны и 5′ и 3′ некодирующие области.
[42] Молекула нуклеиновой кислоты кодирующая флуоресцентный биосенсор может быть синтезирована из подходящих нуклеозидтрифосфатов или получена путем мутагенеза нуклеиновой кислоты, кодирующий биосенсор HyPer или SypHer или их гомолог. Оба метода основаны на хорошо известных в данной области протоколах. Например, доступность информации о последовательности аминокислот или информации о нуклеотидной последовательности дает возможность изготовить выделенные молекулы нуклеиновых кислот настоящего изобретении с помощью олигонуклеотидного синтеза. В случае информации о последовательности аминокислот может быть синтезировано несколько нуклеиновых кислот отличающихся друг от друга вследствие вырожденности генетического кода. Методы выбора вариантов ко донов для требуемого хозяина хорошо известны в данной области. Синтетические олигонуклеотиды могут быть приготовлены с помощью фосфорамидитного метода, и полученные конструкты могут быть очищены с помощью методов хорошо известных в данной области, таких как высокоэффективная жидкостная хроматография (ВЭЖХ) или других методов как описано, например, в Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd Ed., (1989) Cold Spring Harbor Press, Cold Spring Harbor, NY, и no инструкции, описанной в, например, United States Dept. of HHS, National Institute of Health (NIH) Guidelines for Recombinant DNA Research. Длинные двухцепочечные молекулы ДНК настоящего изобретения могут быть синтезированы за следующие стадии: несколько меньших фрагментов с необходимой комплементарностью, которые содержат подходящие концы способные к когезии с соседним фрагментом, могут быть. Соседние фрагменты могут быть сшиты с помощью ДНК-лигазы или метода, основанного на ПЦР. Нуклеиновая кислота, кодирующая биосенсор или его фрагмент, может быть выделена любым из многих известных методов.
[43] Кроме того, также обеспечиваются вырожденные варианты нуклеиновых кислот, которые кодируют биосенсор настоящего изобретения. Вырожденные варианты нуклеиновых кислот включают замены кодонов нуклеиновой кислоты на другие кодоны, кодирующие те же самые аминокислоты. В частности вырожденные варианты нуклеиновых кислот создаются, чтобы увеличить экспрессию в клетке-хозяине. В этом воплощении, кодоны нуклеиновой кислоты, которые не являются предпочтительными или являются менее предпочтительными в генах клетки-хозяина, заменены кодонами, которые обильно представлены в кодирующих последовательностях генов в клетке-хозяине, где указанные замененные кодоны кодируют ту же самую аминокислоту.
[44] Особенный интерес представляют гуманизированные версии нуклеиновых кислот настоящего изобретения. Как здесь используется, термин ′′гуманизированный′′ относится к заменам, сделанным в последовательности нуклеиновой кислоты для оптимизации кодонов для экспрессии белка в клетках млекопитающих (человека) (Yang et al., Nucleic Acids Research (1996) 24: 4592-4593). См. также Патент США №5795737, который описывает гуманизацию белков, раскрытие которого здесь включено ссылкой.
[45] В некоторых воплощениях, молекула нуклеиновой кислоты настоящего изобретения - это ДНК (или кДНК) молекула, содержащая открытую рамку считывания, которая кодирует биосенсор настоящего изобретения и способна в подходящих условиях (например, физиологические внутриклеточные условия) быть использована для экспрессии белка в клетке-хозяине. Настоящее изобретение также охватывает нуклеиновые кислоты, которые гомологичны, по существу сходны, идентичны, или получены из нуклеиновых кислот, кодирующих белки настоящего изобретения. Указанные нуклеиновые кислоты находятся в среде, отличной от среды, в которой они находятся в естественных условиях, например, они выделены, представлены в увеличенном количестве, находятся или экспрессированы в системах in vitro или в клетках или организмах, отличных от тех, в которых они находятся в естественных условиях.
[46] Заявленные нуклеиновые кислоты могут быть выделены и получены, по существу, в очищенной форме. По существу, очищенная форма означает, что нуклеиновые кислоты являются по меньшей мере приблизительно на 50% чистыми, обычно по меньшей мере приблизительно на 90% чистыми и обычно являются ′′рекомбинантными′′, то есть, фланкированы одним или более нуклеотидов,- с которыми она обычно не связана в хромосоме, встречающейся в природе в ее естественном организме-хозяине.
[47] Изменения или различия в нуклеотидной последовательности между высоко сходными нуклеотидными последовательностями могут представлять нуклеотидные замены в последовательности, которые возникают в процессе нормальной репликации или дупликации. Другие замены могут быть специально рассчитаны и вставлены в последовательность для определенных целей таких, как изменение кодонов определенных аминокислот или нуклеотидной последовательности регуляторного региона. Такие специальные замены могут быть произведены in vitro с помощью различных технологий мутагенеза или получены в организмах-хозяевах, находящихся в специфических селекционных условиях, которые индуцируют или отбирают эти изменения. Такие специально полученные варианты последовательности могут быть названы ′′мутантами′′ или ′′производными′′ исходной последовательности.
[48] Мутантные или производные нуклеиновые кислоты могут быть получены на матричной нуклеиновой кислоте, выбранной из вышеописанных нуклеиновых кислот, путем модификации, делеции или добавления одного или более нуклеотидов в матричной последовательности или их комбинации, для получения варианта матричной нуклеиновой кислоты. Модификации, добавления или делеции могут быть выполнены любым способом, известным в данной области (см. например Gustin et al., Biotechniques (1993) 14: 22; Barany, Gene (1985) 37: 111-123; и Colicelli et al., Mol. Gen. Genet. (1985) 199: 537-539, Sambrook et al., Molecular Cloning: A Laboratory Manual, (1989), CSH Press, pp.15.3-15.108), включая подверженный ошибкам ПЦР (error-prone PCR), shuffling, олигонуклеотид-направленный мутагенез, ПЦР со сборкой, парный ПЦР мутагенез, мутагенез in vivo, кассетный мутагенез, рекурсивный множественный мутагенез, экспоненциальный множественный мутагенез, сайт-специфический мутагенез, случайный мутагенез, генная реассемблирование (gene reassembly), генный сайт-насыщающий мутагенез (GSSM), искусственное перестройку с лигированием (SLR) или их комбинации. Модификации, добавления или делеции могут быть также выполнены методом, включающим рекомбинацию, рекурсивную рекомбинацию последовательностей, фосфотиоат-модифицированный мутагенез ДНК, мутагенез на урацил-содержащей матрице, мутагенез с двойным пропуском, точечный восстановительный по рассогласованию мутагенез, мутагенез штамма, дефицитного по восстановлениям, химический мутагенез, радоактивный мутагенез, делетационный мутагенез, рестрикционно-избирательный мутагенез, рестрикционный мутагенез с очисткой, синтез искусственных генов, множественный мутагенез, создание химерных множественных нуклеиновых кислот и их комбинации.
[49] Также обеспечиваются вектор и другие конструкции нуклеиновой кислоты, содержащие заявленные нуклеиновые кислоты. Подходящие векторы включают вирусные и невирусные векторы, плазмиды, космиды, фаги и т.д., предпочтительно плазмиды, и используются для клонирования, амплификации, экспрессии, переноса и т.д., последовательности нуклеиновой кислоты настоящего изобретения в подходящего хозяина. Выбор подходящего вектора является понятным для квалифицированного специалиста в данной области, и известно много таких доступны коммерчески векторов. Для приготовления конструкции, полноразмерная нуклеиновая кислота или ее часть обычно встраивается в вектор посредством прикрепления ДНК-лигазой к расщепленному ферментами рестрикции сайту в векторе. Альтернативно, желательная нуклеотидная последовательность может быть вставлена гомологичной рекомбинацией in vivo, обычно, присоединением гомологичных участков к вектору на флангах желательной нуклеотидной последовательности. Гомологичные участки добавляют лигированием олигонуклеотидов или полимеразной цепной реакцией, с использованием праймеров, включающих, например, как гомологичные участки, так и часть желательной нуклеотидной последовательности.
[50] Также обеспечиваются кассеты экспрессии или системы, использованные inter alia для получения заявленных биосенсоров или химерных белков на их основе или для репликации заявленных молекул нуклеиновой кислоты. Кассета экспрессии может существовать в виде внехромосомного элемента или может быть включена в геном клетки в результате введения указанной кассеты экспрессии в клетку.
[51] В экспрессионном векторе или кассете экспрессии указанная нуклеиновая кислота является функционально связанной с регуляторной последовательностью, которая может включать промоторы, энхансеры, терминаторы, операторы, репрессоры и индукторы и обеспечивает инициацию считывания РНК (транскрипции) в клетке-хозяине. В экспрессионном векторе или кассете экспрессии нуклеиновая кислота настоящего изобретения может быть также связана с сигналами терминации транскрипции, функциональным в клетке-хозяине. Методы изготовления кассет экспрессии или систем для экспрессии желаемого продукта известны специалистом, квалифицированным в данной области.
[52] Вышеописанные системы экспрессии могут использоваться в прокариотических или эукариотических хозяевах. Клеточные линии, которые устойчиво экспрессируют белки настоящего изобретения, могут быть выбраны способами, известными в данной области (например ко-трансфекция с селектируемым маркером, таким как dhfr, gpt, неомицин, гигромицин, что делает возможным выявление и выделение транфецированных клеток, которые содержат ген, включенный в геном).
[53] Белковый продукт, кодируемый нуклеиновой кислотой изобретения, может быть получен путем экспрессии в любой удобной системе экспрессии, включая, например, бактериальные системы, дрожжевые системы, клетки насекомых, земноводных или клетки млекопитающих. Например, для получения белка могут использоваться клетки-хозяева, такие как Е. coli, В. subtilis, S. cerevisiae, клетки насекомого в комбинации с бакуловирусными векторами, или клетки высшего организма, такого как позвоночные, например, COS 7 клетки, НЕК 293, СНО, ооциты Xenopus и т.д.
[54] Если используется любая вышеупомянутая клетка-хозяин или другие подходящие клетки-хозяева или организмы для репликации и/или экспрессии нуклеиновых кислот изобретения, то полученная реплицированная нуклеиновая кислота, экспрессированный белок или полипептид находятся в рамках притязания изобретения как продукт клетки-хозяина или организма. Продукт может быть выделен подходящим способом, известным в данной области.
[55] Белки
[56] Нуклеиновые кислоты по настоящему изобретению кодируют флуоресцентный биосенсор для детекции рН и химерные белки на его основе. В некоторых воплощениях химерные белки включают SypHer2 оперативно слитый с белком synaptophysin (major synaptic vesicle protein p38). В некоторых воплощениях химерные белки включают SypHer2 оперативно слитый с белком Homerl (PSD-Zip45).
[57] Синаптофизин (Synaptophysin, major synaptic vesicle protein p38) - мембранный гликопротеид, локализованный в синаптических везикулах. Характеризуется высоким уровнем экспрессии в нейронах всех типов и нейроэндокринных клетках, и может являться маркером для количественного определения синаптических контактов. Нарушение экспрессии синаптофизина вызывает незначительные нарушения поведения у мышей (McMahon НТ et. al., 1996, Proceedings of the National Academy of Sciences of the United States of America, 93, 4760-4764). Химерный белок синаптифизин-сайфер2 локализуется на поверхности синаптических везикул в пресинаптических окончаниях нейронов.
[58] Homerl (PSD-Zip45) - цитоплазматический белок, широко распространенный в клетках центральной нервной системы, а также почках, сердце, тканях поперечно-полосатой мускулатуры и др. Homer1 является одним из основных компонентов постсинаптической плотности нейронов, где участвует в организации в комплексы каналов, клеточных рецепторов и цитоплазматических регуляторных белков (Hayashi МК et al, 2009, Cell 137, 159-171, Meyer D, Bonhoeffer T, Scheuss V, 2014, Neuron 82, 430-443). Объединение SypHer2-Homer в единый конструкт приводит преимущественной локализации рН-сенсора в цитоплазме постсинаптических окончаний в дендритах и на телах нейронов.
[59] Заявленный биосенсор и химерные белки на его основе обладают способностью к детектируемой флуоресценции, которая может быть зарегистрирована с помощью визуального скрининга, спектрофотометрии, спектрофлуориметрии, флуоресцентной микроскопии, с помощью FACS или другим общепринятым способом для регистрации флуоресценции.
[60] При физиологических значениях рН биосенсор имеет максимум (пик) эмиссии в диапазоне от 500 нм до 550 нм, например, 520 нм, и два пика возбуждения флуоресценции; первый в диапазоне 400-450 нм (например, 420 нм) и второй в диапазоне 470-510 нм (например, 500 нм). При изменении рН в сторону более высоких значений происходит снижение интенсивности флуоресценции сенсора при возбуждении в диапазоне 400-450 нм и увеличивается интенсивность флуоресценции при возбуждении в диапазоне 470-510 нм.
[61] Таким образом, за сигнал сенсора можно принимать соотношение интенсивности флуоресценции при возбуждении в диапазоне 470-510 нм к интенсивности флуоресценции при возбуждении в диапазоне 400-450 нм. Данный параметр не зависит от концентрации биосенсора, уровня его экспрессии в клетке, объема клетки или клеточного компартмента, то есть сенсор обеспечивает рациометрическое измерение рН.
[62] В некоторых воплощениях сигнал сенсора возрастает более чем в 1,5 раза при изменении рН от 7,0 до 7,5, чаще более чем в 2 раза, например в 2.1 или 2,2 раза.
[63] В некоторых воплощениях, заявленные биосенсоры являются яркими, где под яркими понимается то, что флуоресценция биосенсоров может быть детектирована обычными способами (например, визуальный скрининг, спектрофотометрия, спектрофлуориметрия, флуоресцентная микроскопия, FACS приборами, и т.д.) В некоторых воплощениях, заявленные белки обладают яркостью флуоресценции в диапазоне от приблизительно 1,8 до 4,5 обычно приблизительно от 2,0 до 3,8, и чаще всего приблизительно от 2.3 до 2.7 при значении рН 7.0.
[64] Специфические биосенсоры, представляющие интерес, включают биосенсор, имеющий аминокислотную последовательность SEQ ID No: 4 и его функциональные химерные белки, имеющие аминоксилотные последовательности SEQ ID No: 6 и SEQ ID No: 8.
[65] Также обеспечиваются функциональные биосенсоры, которые, по существу, сходны с указанным выше биосенсором, где, по существу сходны, означает, что эти белки имеют аминокислотную последовательность, идентичную последовательности SEQ ID No: 04, по крайней мере, на 85% идентичности, обычно, по крайней мере, 90% и чаще, по крайней мере, 95%, (например 95% и выше; 96% и выше, 97% и выше; 98% и выше: 99% и выше или 100% идентичности последовательности).
[66] Биосенсоры настоящего изобретения присутствуют в среде, отличной от их естественной среды; например, они рекомбинантны. Белки настоящего изобретения могут находиться в выделенном состоянии, что означает, что белки по существу свободны от других белков и других биологических молекул, присутствующих в естественной среде, таких как олигосахариды, нуклеиновые кислоты и их фрагменты и т.п., где термин ′′по существу свободны′′ в этом случае означает, что меньше чем 70%, обычно меньше чем 60% и чаще меньше чем 50% композиции, содержащей выделенный белок, представляет собой некоторые другие биологические молекулы, чем встречающиеся в природе. В некоторых воплощениях, белки присутствуют в по существу очищенной форме, где ′′по существу очищенная форма′′ означает очищенная по меньшей мере на 95%, обычно по меньшей мере на 97% и чаще по меньшей мере на 99%.
[67] Заявленные биосенсоры могут быть получены, например, экспрессией рекомбинантной нуклеиновой кислоты, кодирующей последовательность, белка, представляющего интерес, в соответствующем хозяине, как описано выше. Для очистки белка могут применяться любые обычные методики, где подходящие методы очистки белка описаны в Guide to Protein Purification, (Deuthser ed., Academic Press, 1990). Например, лизат может быть приготовлен из исходного источника и очищен с использованием ВЭЖХ, вытеснительной хроматографии, гель-электрофореза, афинной хроматографии и т.п.
[68] Трансформанты
[69] Нуклеиновые кислоты настоящего изобретения могут быть использованы для получения трансформатов, включая трансгенных организмов или сайт-специфичных генных изменений в клеточных линиях. Трансгенные клетки, заявленные в изобретении, содержат одну или более нуклеиновых кислот, заявленных по настоящему изобретению, в качестве трансгена. Для целей изобретения быть использована любая приемлемая клетка-хозяин может, включая прокариотические (например, Escherichia coli, Streptomyces sp., Bacillus subtilis, Lactobacillus acidophilus, и т.д.) или эукариотические клетки-хозяева. Трансгенный организм, заявленный по изобретению, может быть прокариотическим или эукариотическим организмом, включая бактерии, цианобактирии, грибы, растения и животные, в которых одна или больше клеток организма содержат гетерогенную нуклеиновую кислоту, заявленную по изобретению, введенную посредством вмешательства человека, такими способами как технологии трансгеноза, которые известны в данной области.
[70] Выделенная нуклеиновая кислота настоящего изобретения может быть введена в хозяина способами, известными в данной области, например инфицированием, трансфекцией, трансформацией или трансконъюгацией. Способы переноса молекулы нуклеиновой кислоты (то есть. ДНК) в такие организмы широко известны и обеспечивается в ссылках, таких как Sambrook et al. (Molecular Cloning: A Laboratory Manual, 3nd Ed., (2001) Cold Spring Harbor Press, Cold Spring Harbor, NY).
[71] В одном воплощении, трансгенный организм может быть прокариотическим организмом. Способы трансформации прокариотических хозяев хорошо описаны в данной области (например, см. Sambrook et al. Molecular Cloning: A Laboratory Manual, 2nd edition (1989) Cold Spring Harbor Laboratory Press и Ausubel et al., Current Protocols in Molecular Biology (1995) John Wiley & Sons, Inc).
[72] В другом воплощении, трансгенными организмами могут быть грибы, например дрожжами. Дрожжи широко используются как носители для экспрессии гетерогенного гена (например см. Goodey et al Yeast biotechnology, D R Berry et al, eds, (1987) Allen and Unwin, London, pp 401-429) и King et al Molecular and Cell Biology of Yeasts, E F Walton and G T Yarronton, eds, Blackie, Glasgow (1989) pp 107-133). Несколько типов дрожжевых векторов доступны, включая интегративные векторы, которые требуют рекомбинации с геномом хозяина для их поддержки, и автономно реплицирующиеся плазмидные векторых.
[73] В другом воплощении, трансгенными организмами могут быть животные. Трансгенные животные могут быть получены трансгенными способами, известными в данной области и обеспечиваются в ссылках, таких как Pinkert, Transgenic Animal Technology: a Laboratory Handbook, 2nd edition (2203) San Diego: Academic Press; Gersenstein and Vintersten, Manipulating the Mouse Embryo: A Laboratory Manual, 3rd ed, (2002) Nagy A. (Ed), Cold Spring Harbor Laboratory; Blau et al., Laboratory Animal Medicine, 2nd Ed., (2002) Fox J.G., Anderson L.C., Loew F.M., Quimby F.W. (Eds), American Medical Association, American Psychological Association; Gene Targeting: A Practical Approach by Alexandra L. Joyner (Ed.) Oxford University Press; 2nd edition (2000). Например, трансгенные животные могут быть получены гомологичной рекомбинацией, где изменяется эндогенный локус. Альтернативно, конструкция нуклеиновой кислоты включается случайным образом в геном. Векторы для устойчивого включения включают плазмиды, ретровирусы и другие животные вирусы, YAC, и т.п. Нуклеиновые кислоты могут быть введены в клетку непосредственно или опосредованно, введением в прекурсор клетки, путем намеренной генетической манипуляции, такой как микроинъекция или инфицирование рекомбинантным вирусом или рекомбинантным вирусным вектором и т.п. Термин «генетическая манипуляция» не включает классическое скрещивание или оплодотворение in vitro, а предпочтительно является направленным на введение рекомбинантных молекул нуклеиновых кислот. Эти молекулы нуклеиновой кислоты могут быть включены в хромосому или они являться внехромосомными реплицирующими ДНК. Конструкции ДНК для гомологичной рекомбинации будут содержать по меньшей мере часть нуклеиновой кислоты настоящего изобретения, где ген имеет желательную генетическую модификацую(ции) и включает области гомологии с целевым локусом. Конструкциям ДНК для произвольного включения не обязательно содержать область гомологии с медиатором рекомбинации. Легко могут быть включены маркеры для положительной и отрицательной селекции. Способы получения клеток, имеющих целевые генные модификации, через гомологическую комбинацию известны в данной области. Для различных способов трансфекции клеток млекопитающих, см. Keown et al., Meth. Enzymol. (1990) 185: 527-537.
[74] Трансгенные животные могут быть любыми животными, не относящимися к человеку, включая млекопитающее, не относящееся к человеку, (например мышь, крыса), птица или амфибия и т.д., и использованы в функциональном исследовании, скрининге лекарственного средства и т.п.
[75] Также могут быть получены трансгенные растения. Способы получения трансгенных растительных клеток и растений описаны в патентах США №№5767367; 5750870; 5739409; 5689049; 5689045; 5674731; 5656466; 5633155; 5629470; 5595896; 5576198; 5538879; 5484956; раскрытия которых включены сюда ссылкой. Способы получения трансгенных растений также рассмотрены в Plant Biochemistry and Molecular Biology (eds. Lea and Leegood, John Wiley & Sons) (1993) pp. 275-295 и в Plant Biotechnology and Transgenic Plants (eds. Oksman-Caldentey and Barz), (2002) 719 p. Например, эмбриогенные эксплантаты, содержащие соматические клетки, могут использоваться для получения трансгенного хозяина. После сбора клеток или тканей, экзогенная ДНК, представляющая интерес, вводится в растительные клетки, при этом известен для такого введения ряд различных способов. При наличии выделенных протопластов, возникает возможность для введения через ДНК-опосредованные протоколы передачи гена, включая инкубацию протопластов с очищенной ДНК, такой как плазмида, содержащая целевую экзогенную последовательность, представляющую интерес, в присутствии поливалентных катионов (например, PEG или PLO); или электропорацию протопластов в присутствии выделенной ДНК, включающей целевую экзогенную последовательность. Протопласты, которые успешно включили экзогенную ДНК, затем отбираются, выращиваются в каллус, и в конечном счете в трансгенное растение при контакте с подходящими количествами и отношениями стимулирующих факторов, таких как ауксины и цитокины. Могут использоваться другие подходящие способы получения растения, которые доступны для квалифицированных специалистов в данной области, такие, как применение ′′генной пушки′′, или Agrobacterium-опосредованная трансформация.
[76] Способы применения
[77] Биосенсоры настоящего изобретения являются генетически кодируемыми флуоресцентными белками, меняющими спектральные свойства при изменении рН среды. Они могут быть использованы для мониторинга изменения рН внутри живых клеток при различных биологических процессах. Благодаря высокой яркости флуоресценции биосенсоры настоящего изобретения могут быть использованы в живых срезах мозга и исследований динамики рН в процессе спонтанной электрической активности в определенных клеточных компартментах на культуре нейронов и на короткоживущих срезах мозга.
[78] Для осуществления мониторинга должна быть получена нуклеиновая кислота, кодирующая биосенсор. Получение таких конструкций очевидно для любого специалиста в данной области. Полученная конструкция должна быть встроена в кассету экспрессии (или вектор), обеспечивающую временную или постоянную экспрессию этой нуклеиновой кислоты в клетках-хозяевах. Вектор может содержать элементы, обеспечивающие адресную доставку конструкции в интересующие клетки, или находится в составе частиц, обеспечивающих адресную доставку. После трансфекции клеток вектором и по истечении времени, необходимого для наработки в клетках продукта экспрессии, может быть осуществлен мониторинг изменения рН в данных клетках.
[79] Биосенсоры настоящего изобретения также могут использоваться в скрининге препаратов, вызывающих активацию определенных белковых каскадов, например активацию тирозин-киназ, в клеточных линиях. Примером применения биосенсоров могут служить автоматизированные скрининги множества клеток, описанные, например, в патенте США №5989835.
[80] Заявленные биосенсоры также находят применение как метки изменения рН in vivo для трансгенных животных. Например, экспрессия заявленного белка может сопровождаться тканеспецифичными промоторами, где такие способы находят применение в исследованиях для генной терапии, таких как тестирование эффективности трансгенной экспрессии. Типичное применение флуоресцирующих белков у трансгенных животных, которое поясняет такие применения, описано в W000/02997.
[81] Следующие примеры предлагается в качестве иллюстративных, но не ограничивающих.
5. Примеры
[82] Пример 1
[83] Получение биосенсора SypHer2.
[84] Для получения нуклеиновой кислоты, кодирующей белок SypHer, в последовательность нуклеиновой кислоты, кодирующей HyPer, из коммерчески доступного вектора pHyPer-cyto (Евроген, Россия), вносили замену C199S методом направленного мутагенеза с использованием ′′overlap extention′′ продуктов ПЦР как описано Wurch et al., Methods in Molecular Biology. 12 (9), 653-657 (2004). Для ПЦР использовали набор реактивов Tersus PCR kit (Евроген) согласно инструкции производителя. Полученную нуклеотидную последовательность клонировали в вектор pHyPer-C, используя рестриктазы NheI и HindIII вместо ранее содержавшейся в нем нуклеиновой кислоты, кодирующей HyPer. Правильность полученной последовательности (SEQ ID No: 1) подтверждали секвенированием.
[85] Полученную нуклеиновую кислоту подвергали направленному мутагенезу как описано выше, внося точечные замены, которые потенциально могли бы влиять на яркость флуоресценции. Были проверены следующие варианты:
[86] 1) Комбинации аминокислотных замен 64F+65G+222Е и 64F+65S+222Q, приводящих к увеличению яркости и фотостабильности желтого флуоресцентного белка YFP (нумерация аминокислот по последовательности wtGFP, SEQ ID NO: 9);
[87] 2) Единичные мутации, увеличивающие яркость флуоресценции ряда флуоресцентных белков, в том числе avGFP, выбранные из F64L, E222Q, и S65T (нумерация аминокислот по последовательности wtGFP);
[88] 3) Единичные мутации в последовательности домена OxyR, увеличивающие динамический диапазон биосенсора HyPer, выбранные из A406V (Markvicheva et al., 2011, Bioorganic & medicinal chemistry 19:3, 1079-84) и H36Y (Bilan at al., ACS Chem. Biol., 2013, 8 (3), pp 535-542) и их комбинация (A406V+H36Y) (нумерация аминокислот по последовательности SypHer, SEQ ID NO: 2).
[89] Замены вносили с помощью ′′overlap extention′′ продуктов ПЦР как описано Wurch et al., Methods in Molecular Biology. 12 (9), 653-657 (2004). Для ПЦР использовали набор реактивов Tersus PCR kit (Евроген) согласно инструкции производителя. Полученные нуклеотидную последовательность клонировали в вектор pHyPer-С, используя рестриктазы Nhel и HindIII вместо ранее содержавшейся в нем нуклеиновой кислоты, кодирующей HyPer. Правильность полученных последовательностей подтверждали секвенированием.
[90] Пример 2
[91] Измерение динамического диапазона полученных вариантов биосенсора
[92] Экспрессионные векторы, содержащие кодирующие последовательности вариантов биосенсора, были получены, как описано в примере 1. Они были использованы для трансфекции клеток двух клеточных линий HeLa Kyoto и NIH-3T3.
[93] Клетки культивировали в среде DMEM с добавлением 10% FBS при 37°C в 5% СО2 инкубаторе. Клетки высаживали на 35 мм чашки и через 24 часа трансфецировали смесью ДНК и x-tremeGENE 9 (Roche, Швейцария) согласно инструкции производителя.
[94] Исследование изменения флуоресценции в зависимости от рН осуществляли через 24 часа после трансфекции. Изменения флуоресценции регистрировали на эпифлуоресцентном микроскопе Leica6000, оборудованном 20х воздушным объективом и НСХ PL АРО lbd. BL 63×1.4NA масляным объективом. Флуоресценцию возбуждали используя последовательно полосовые фильтры 427/10 и 504/12; эмиссию индикатора детектировали каждые 3 секунды используя 525/50 полосовой фильтр.
[95] Для анализа рН чувствительности использовали буферные растворы, содержащие ионофоры нигерицин и монензин, с диапазоном рН 6.0-9.5.
[96] Из всех проверенных вариантов, только вариант, содержащий единичную замену A406V (SypHer2, SEQ ID NO: 4), обладал повышенной яркостью флуоресценции. Влияние остальных мутаций было либо незначительным, либо приводило к уменьшению динамического диапазона сенсора.
[97] SypHer2 демонстрировал сходную с SypHer чувствительностью к рН (Рис. 1), но имеет в 2-3 раза большую яркость флуоресценции культуре клетках (Рис 2). Сигнал SypHer2 возрастает примерно 3 раза при увеличении рН от 6.0 до 9.0, обладает линейным участком в диапазоне рН 7.5-8.5 и значением рК приблизительно 8.1.
[98] Пример 3
[99] Исследование спонтанных рН-осцилляций в первичной культуре нейронов
[100] Для регистрации изменений рН во время спонтанной активности, первичную культуру нейронов трансфецировали смесью плазмид Rgeco и SypHer2. Спонтанную активность стимулировали в 15-20-дневной культуре добавлением 10 мкМ бикукуллина, ингибитора GABA-рецепторов нейронов.
[101] Плазмида для экспрессии SypHer2 была получена, как описано в Примере 1. Плазмида для экспрессии кальциевого сенсора Rgeco была приобретена в компании Addgene (США). Для получения смешанной первичной культуры гиппокампальных нейронов, использовали мышь С57В 1/6 на 17 м дне беременности. Все процедуры по выделению эмбриональных тканей производили на льду. Эмбрионы подвергали анестезии в ледяной HBSS с низким содержанием Mg2+ и Са2+, экстрагировали мозг, разделяли полушария, отделяли от оболочек мозга и собирали гиппокампы в HBSS. Гиппокампы затем промывали в HBSS и инкубировали в 0,5% трипсин-ЭДТА в течение 15 минут при 37°C. По окончании инкубации гиппокампы трижды промывали в теплом DMEM с добавлением 10% FBS и 4 мМ глутамина и осторожно разбивали на клетки путем набирания и сбрасывания в 1 мл наконечник автоматической пипетки 10 раз. Клетки сажали в центр покрытых поли-D-лизином 35 мм чашек со стеклянным дном плотностью 15*104 клеток в 100 мкл среды. 1-2 часа спустя среду заменяли 2 мл среды Neurobasal medium с добавлением В27, 10% инактивированной сыворотки и 2 мМ GlutaMax. Каждые 2-3 дня 1/3 объема среды заменяли на свежую нейробазальную среду.
[102] На 5-й день в культуре клетки трансфецировали набором для Са-фосфатной трансфекции. За 1 час перед трансфекцией культуральную среду отбирали в 50 мл пробирку (кондиционированная среда), а к культуре клеток добавляли 1,5 мл чистой DMEM. На каждую 35 мм чашку к 100 мкл 2xHBSS по каплям добавляли 100 мкл смеси DNA-CaCl2 при перемешивании пробирки с HBSS на низких оборотах. После 25 минутной инкубации, 200 мкл раствора было добавлено к чашкам, которые инкубировали в течение 15 минут в 5% СО2 инкубаторе. По завершении трансфекции, нейроны дважды промывали средой DMEM, затем добавляли 2 мл кондиционированной нейробазальной среды.
[103] Для анализа флуоресценции трансфецированные клетки первичной гиппокампальной культуры переводили в среду Tyrode с добавлением 20 мМ D-глюкозы и 20 мМ Hepes и снимали при 37°C на эпифлуоресцентном микроскопе Leica6000, оборудованном 20x воздушным объективом и НСХ PL АРО lbd. BL 63×1.4NA масляным объективом. Флуоресценцию SypHer возбуждали используя последовательно полосовые фильтры 427/10 и 504/12; флуоресценцию индикатора детектировали каждые 3 секунды используя 525/50 полосовой фильтр. Для возбуждения флуоресценции RGeco и BCECF использовали 561/10 полосовой фильтр возбуждения и 610/50 эмиссионный фильтр.
[104] Полученные изображения анализировали в программе Image J. Для расчета динамики значения рН, изображения, полученные при возбуждении флуоресценции SypHer светом 420 нм и 500 нм, после вычитания фона были переведены в 32x битный формат. Для изображений, соответствующих облучению 420 нм, был установлен порог фильтрования шума, сигнал фона был приравнен к значению NaN. В каждой точке измерялся средний уровень сигнала в выделенной области внутри каждой отдельной клетки, затем для каждого кадра значения, полученные при облучении светом 500 нм, были разделены на соответствующие 420 нм изображения.
[105] Калибровка рН-сенсора внутри клеток производили как указано Poburko et al. (Poburko et al., The Journal of biological chemistry. 2011, V. 286, p. 11672-84). Буфер с высоким содержанием К+ содержал 5 мкМ нигерицина, 5 мкМ монензина, 130 мМ глюконата калия, 20 мМ глюконата натрия, 0.5 мМ MgCl2, 0.2 мМ ЕДТА и 30 мМ бората натрия (рН 9.5), Tris (рН 8.2-9.0), HEPES (рН 7.0, 7.5), или MES (рН 6.0, 6.5).
[106] Были зарегистрированы спонтанные колебания рН в культуре (Рис. 3А). Параллельные измерения рН (SypHer2) и Са2+ (RGeco) показали, что вход кальция в клетку сопровождается быстрым закислением цитоплазмы (приблизительно с 7.4 до 7.35 единиц рН), после которого происходит медленное восстановление исходного значения рН. Это позволяет сделать вывод, что колебания рН вызваны спонтанной электрической активностью в культуре нейронов.
[107] Чтобы выяснить, не связаны ли колебания рН непосредственно с входом кальция в клетку, были использованы среды, приготовленные с добавлением 2 мМ CaCl2 или с добавлением 0.5 мМ внутриклеточного хелатора Са2+ ВАРТА-АМ. Было показано, что в среде, в которую был добавлен ВАРТА-АМ, отсутствует вход кальция в клетку, при этом пропадают и колебания рН (Рис. 3Б). Добавление в клеточную среду ингибитора кальциевого транспорта, 100 мкМ хлорида лантана, вызывало небольшое падение амплитуды осцилляций рН. Все это позволяет говорить об участии систем транспорта Са2+ в закислении цитоплазмы во время спонтанной активности.
[108] Поскольку в синапсах происходят основные события передачи сигнала между нейронами, было решено исследовать динамику значений рН в этих структурах. Для этого были созданы конструкции, в которых кодирующая последовательность SypHer2 была оперативно слита с кодирующей последовательностью белка постсинаптической плотности Homer1 (SEQ ID NOs: 7, 8) и кодирующей последовательностью белка синаптических пузырьков Synaptophysin (SEQ ID NOs: 5, 6), обеспечивающему пресинаптическую локализацию. Экспрессия полученных конструкций на культуре нейронов показала, что во время спонтанной активности нейронов, рН в постсинаптическом окончании изменяется на 0.1 единицу рН (7.4 до 7.3). При этом рН в постсинаптическом окончании изменяется на 0.05 единицы, как в цитоплазме.
[109] Пример 4
[110] Исследование динамики значений рН на культуре срезов
[111] Чтобы убедиться, что рН-индикатор Sypher2 можно применять на культуре тканей, цитоплазматическая версия сенсора была экспрессирована в срезах мозга 10-тидневных мышат.
[112] Срезы мозга 10-тидневного мышонка CD57B 1/6 толщиной 300 мкм получали на вибротоме Leica VT1200S в ледяном ACSF (КС1, 2.5 мМ; MgSO4, 1.0 мM; NaH2PO4, 1.25 мМ; NaHCO3, 26 мМ; D-глюкоза, 20 мМ; CaCl2, 2.0 мМ и NaCl, 125 мМ, рН 7.4). Срезы помещали в теплую среду ACSF на 37°C, аэрированном смесью 95% О2+5% CO2. Через 5-10 минут проводили баллистическую трансформацию с помощью генной пушки Helios Gene Gun, срезы инкубировали в течение ночи (10-12 часов). Трансформацию и приготовление золотых частиц, покрытых плазмидой pCl-SyPher2, производили согласно протоколу производителя.
[113] Визуализацию, культуры срезов производили на микроскопе Zeiss LSM 5 LIVE, оснащенным Zeiss ACHROPLAN 40x/0.80w объективом и 488 нм лазером, в перфузионной камере в аэрированной среде ACSF при 37°C.
[114] Сигнал индикатора в отдельных нейронах детектировался уже через 10 часов после трансформации (рис. 4). Для стимуляции спонтанной нейрональной активности к среде перфузии добавляли 30 мМ KCl. Это приводило к спонтанным колебаниям рН, сходным с колебаниями, наблюдаемыми на первичной культуре нейронов (рис. 5).
[115] Проведенные эксперименты показывают, что яркость и скорость созревания SypHer2 достаточна для изучения динамики изменений рН на культурах срезов мозга млекопитающих.