Результат интеллектуальной деятельности: СПОСОБ РЕГИСТРАЦИИ ВНУТРИКЛЕТОЧНОГО pH ОПУХОЛЕВЫХ КЛЕТОК
Вид РИД
Изобретение
Предлагаемое изобретение относится к исследованиям физических и химических свойств биологических тканей и может быть использовано в экспериментальной медицине для регистрации внутриклеточного рН опухолевых клеток в ходе естественного роста опухоли и при различных воздействиях.
Известно, что метаболизм опухолевых клеток отличается от метаболизма нормальных клеток, что приводит к различиям многих важных физиологических показателей. Одним из таких показателей является уровень внутриклеточного рН (водородный показатель). Важность этого физиологического параметра подтверждается тем фактом, что практически все патологические процессы сопровождаются изменением рН.
Установлено, что внутриклеточный рН опухолевых клеток является более щелочным по сравнению с нормальными клетками организма (7,12-7,65 при норме: 6,99-7,2), а внеклеточный рН опухоли более кислый (6,2-6,9 при норме: 7,3-7,4), т.е. в опухолевых тканях формируется обратный градиент вне- и внутриклеточного рН: защелачивание внутриклеточного рН и закисление среды вне клетки [1, 2, 3]. Отличия внеклеточного рН в опухолях и нормальных тканях уже используются в противоопухолевой терапии для направленной доставки препаратов за счет активации лекарства или его высвобождения из носителя (мицеллы, липосомы) в кислой среде опухоли [4]. В то же время большой интерес представляет разработка препаратов, направленных на восстановление градиента рН в опухолевых клетках за счет воздействия на внутриклеточные системы его регуляции (например, путем ингибирования вакуолярной Н+-АТФазы).
Более того, увеличение пролиферативной активности, уклонение от апоптоза и эффект множественной лекарственной устойчивости ассоциирован с нарушением градиента рН в опухолевых тканях [5, 6]. Кислый внеклеточный рН может значительно затруднять прохождение препаратов через плазматическую мембрану, что приводит к уменьшению накопления цитостатика в клетке. Поскольку многие из препаратов представляют собой слабые основания, существует вероятность их прямого протонирования и нейтрализации еще вне клетки в кислой межклеточной среде. Другой механизм хеморезистентности заключается в нарушении градиента рН на мембранах клеточных органелл (лизосом, эндосом, аппарата Гольджи, секреторных везикул), где также может происходить нейтрализация лекарства.
Однако несмотря на важность изучения внутриклеточного рН, адекватные методы его измерения in vivo отсутствуют. Существующие методы прижизненного измерения рН либо инвазивны (например, использование микроэлектродов), либо крайне сложны и дорогостоящи (ПЭТ, МРТ) [7]. В настоящее время активно развиваются подходы к анализу рН оптическими методами. Их существенным недостатком является необходимость экзогенного введения в клетку или ткань флуоресцентного зонда, чувствительного к рН. Флуоресцентный зонд, как правило, представляет собой синтетически синтезированное вещество, оптические характеристики которого сильно меняются при связывании с белками или иными компонентами клетки, а внутриклеточное распределение непостоянно. Зонды высокочувствительны к изменению рН, однако для их оптимального накопления в определенной ткани требуется порядка нескольких часов. Кроме того, основным недостатком этих сенсоров является их собственное влияние на значения рН в тканях [8, 9]. Использование таких зондов ограничено исследованиями in vitro, поскольку их доставка в клетки солидной опухоли проблематична.
Перспективным инструментом для анализа внутриклеточного рН в опухолях in vivo могут стать генетически кодируемые сенсоры на основе GFP-подобных белков [10, 11, 12].
Однако известные работы проводят только на клеточных культурах in vitro [13].
Наиболее близким к предлагаемому способу по совокупности существенных признаков и техническому результату, выбранному в качестве прототипа, является способ регистрации внутриклеточного рН опухолевых клеток, включающий использование сенсора на рН, регистрацию интенсивности флуоресценции при возбуждении на двух длинах волн в областях максимального поглощения и расчет рациометрического сигнала, отражающего значение внутриклеточного рН (см. Tseng J.C. In Vivo Fluorescent Labling of Tumor Cells with the HaloTag®Technology // Cur. Chem. Gen., 2012, Vol. 6, p. 48-54).
Известный способ заключается в том, что предварительно путем трансфекции клеточной линии рака кишечника человека НСТ116 получают клетки, стабильно экспрессирующие протеин HaloTag в цитозоле, НСТ116-НТ. Затем клетки подкожно прививают иммунодифицитным мышам для получения подкожной опухоли. После формирования опухоли мышам внутривенно вводят раствор SNARF-1-лиганд (1 мг, растворенный в 100 мкл 20% ДМСО и 80% PBS). На следующий день после инъекции с помощью программного обеспечения Living Image разделяли автофлуоресценцию и флуоресценцию SNARF.
Однако известный способ имеет ряд существенных недостатков:
- для накопления сенсора в опухолевых клетках требуется продолжительное время (~24 часа);
- накопление красителя SNARF не достаточно селективно, в день регистрации флуоресценции существенные помехи при регистрации сигнала возникают из-за неселективного накопления красителя в желудочно-кишечном тракте;
- спектр автофлуоресценции тканей и спектр флуоресценции SNARF перекрываются, что требует сложной математической обработки для их разделения;
- проводимые измерения не являются рациометрическими, проводят регистрацию интенсивности сигнала флуоресценции при возбуждении на одной длине волны, данный параметр зависит от концентрации флуорофора, которую невозможно контролировать известными способами;
- экзогенное введение красителя делает измерение однократным, т.е. не позволяет наблюдать одну и ту же опухоль в динамике в ходе естественного роста или какого-либо воздействия.
Задачей предлагаемого изобретения является разработка рациометрического способа регистрации рН опухолевых клеток in vivo с использованием генетически-кодируемого сенсора с известной локализацией и с возможностью наблюдения клеток и тканей в динамике.
Поставленная задача решается тем, что в известном способе регистрации внутриклеточного рН опухолевых клеток, включающем использование сенсора на внутриклеточный рН, регистрацию интенсивности флуоресценции при возбуждении на двух длинах волн в областях максимального поглощения и расчет сигнала, отражающего значение внутриклеточного рН, в качестве сенсора на внутриклеточный рН используют генетически-кодируемый белок SypHer2, для чего обеспечивают его экспрессию в опухолевых клетках путем встраивания соответствующего гена в геном опухолевых клеток, результирующий сигнал является рациометрическим, регистрацию сигнала сенсора осуществляют в живой ткани in vivo с 4-го по 28-й день роста опухоли с интервалом в три дня, флуоресценцию регистрируют в видимом диапазоне при возбуждении светом с длиной волны 430 нм и 500 нм, прием сигнала на длине волны 540 нм, время экспозиции 5 сек, причем регистрацию сигнала сенсора осуществляют на криосрезах ткани ex vivo. Локализация белка SypHer2 является цитоплазматической.
Техническим результатом предлагаемого способа является повышение точности измерений за счет отсутствия необходимости экзогенного введения рН-сенсора, избирательной локализации рН-сенсора в опухолевых клетках, отсутствия перераспределения рН-сенсора в опухоли, отсутствия зависимости измерений от концентрации сенсора и возможность наблюдения клеток и тканей в динамике.
Данный технический результат достигается тем, что рН-сенсором в опухолевых клетках является генетически-кодируемый белок SypHer2, для этого обеспечивают его экспрессию в опухоли путем встраивания соответствующего гена в опухолевые клетки, измерение проводят рациометрическим способом при возбуждении флуоресценции светом с длиной волны 430 нм и 500 нм.
Белок SypHer2 - это желтый флуоресцентный белок, мономер [15]. Мономер белковой молекулы состоит из двух доменов и имеет структуру, типичную для белков семейства YFP (yellow fluorescent protein). Белок имеет два пика возбуждения на длине волны 420 нм и 500 нм и пик эмиссии на длине волны 516 нм. Экспрессия белка SypHer2 в опухолевых клетках обеспечивается путем встраивания соответствующего гена в геном клетки. Белок SypHer2 может быть локализован в заданном клеточном компартменте в результате слияния его с другим белком-мишенью.
Динамический диапазон отношения интенсивности флуоресцении на длине волны 500 нм к интенсивности флуоресценции на длине волны 420 нм равен 6. Сенсор эффективно работает в физиологическом диапазоне рН, что показано авторами заявки.
Данный технический результат обусловлен тем, что генетически-кодируемый рН-сенсор представляет собой белок SypHer2, ген которого встроен в опухолевые клетки. Опухоль вырабатывает данный белок SypHer2 - рН-сенсор - путем экспрессии в цитоплазме опухолевых клетках.
Данный белок SypHer2 не оказывает влияния на метаболизм клеток. Наличие у данного белка двух пиков возбуждения флуоресценции позволяет регистрировать не просто интенсивность флуоресценции, а рассчитывать отношение интенсивностей флуоресценции, возбуждаемых на двух разных длинах волн, что делает измерение независимым от концентрации в клетке рН-сенсора. Заданная экспрессия рН-сенсора в цитоплазме опухолевых клеток позволяет избежать трудностей, связанных с неселективным накоплением красителя при экзогенном введении, а постоянная выработка сенсора самой опухолевой клеткой позволяет проводить динамическое наблюдение в течение естественного роста опухоли и при различных воздействиях. Это означает, что при регистрации флуоресценции при заданных условиях исследователь получает данные о водородном показателе именно внутри опухолевых клеток.
При этом опухолевые клетки стабильно экспрессируют рН-сенсор в заданной локализации в процессе роста новообразования, и локализация белка не изменяется со временем, поэтому нет необходимости постоянного введения сенсора и подтверждения его локализации для проведения наблюдений.
Предлагаемый способ поясняется графическим материалом
На фиг. 1 и фиг. 2 представлены флуоресцентные и результирующее изображение опухоли, фотография животного с опухолью к примерам 1 и 2 соответственно. На фиг. З представлены флуоресцентные изображения опухоли к примеру 3 (сигнал сенсора в относительных единицах, окрашено в псевдоцвета), экспрессирующей белок SypHer2.
На фиг. 4 представлены флуоресцентные изображения криосрезов опухоли к примеру 4 (сигнал сенсора в относительных единицах, окрашено в псевдоцвета), экспрессирующей белок SypHer2, и соответствующие гистологические изображения, окрашенные гематоксилином и эозином.
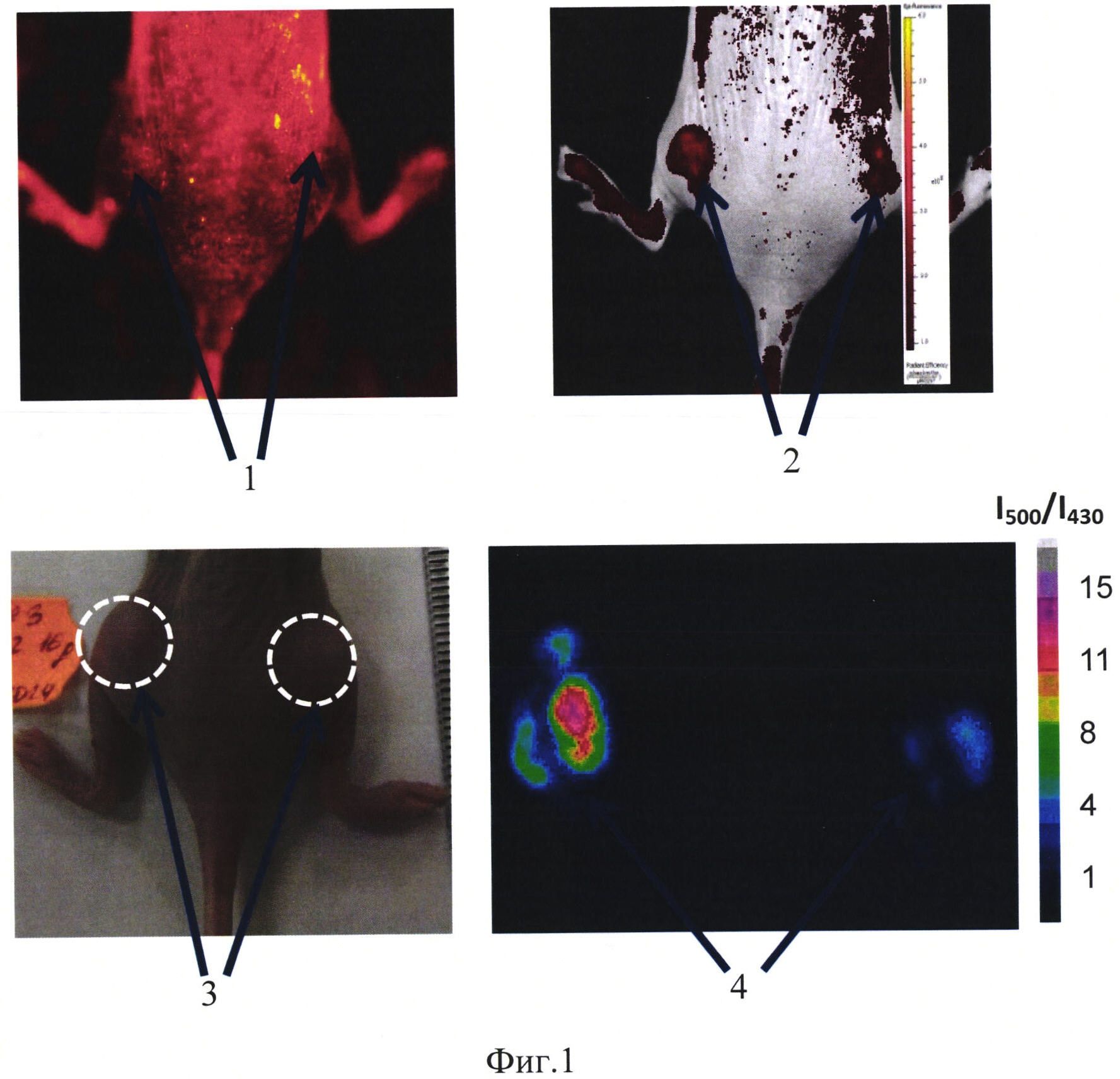
На фиг. 1 изображено:
1 - флуоресцентное изображение при возбуждении на 430 нм,
2 - флуоресцентное изображение при возбуждении на 500 нм,
3 - фотография опухоли, опухоли обведены пунктиром,
4 - сигнал сенсора в относительных единицах, окрашено в псевдоцвета.
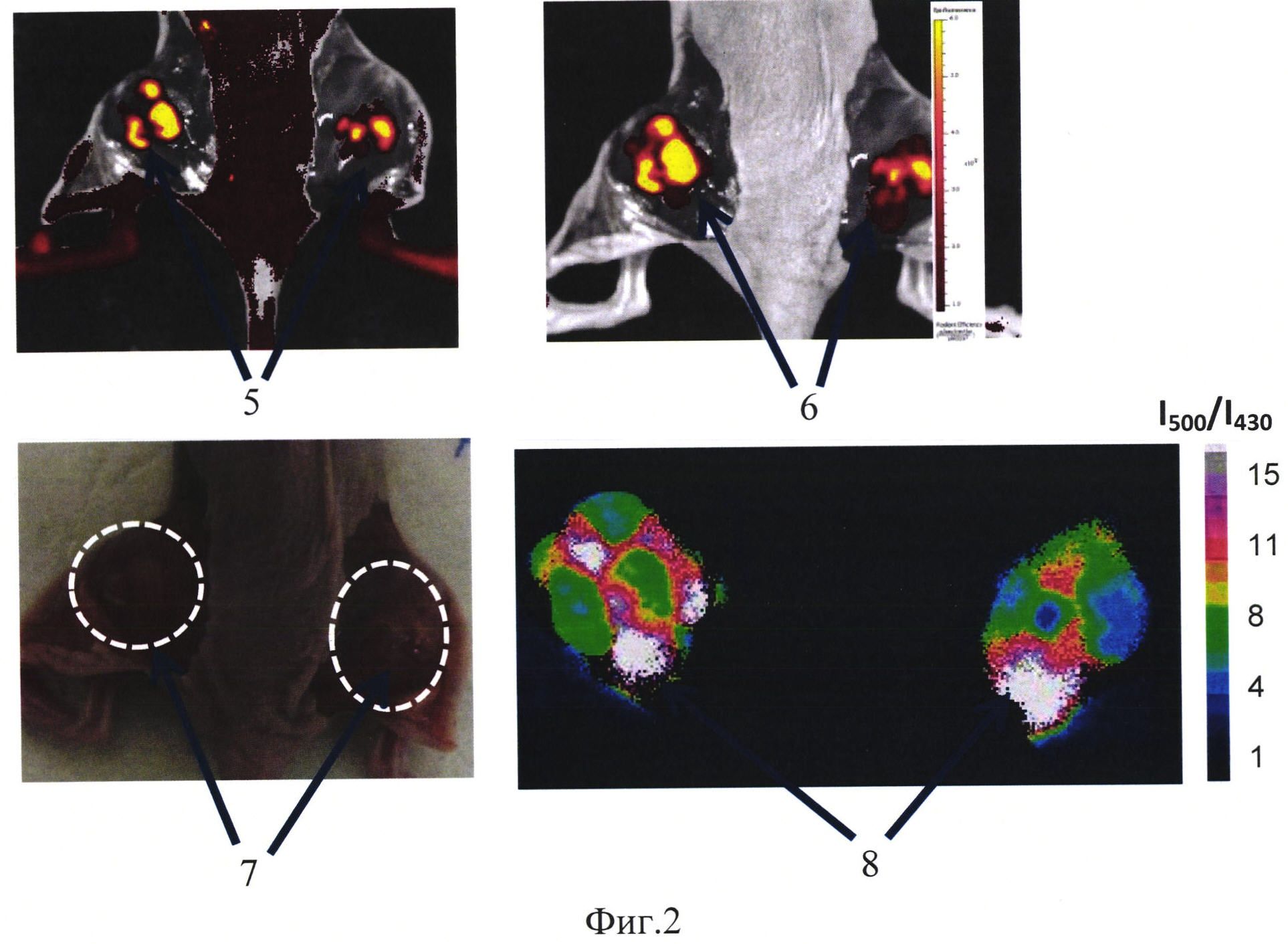
На фиг. 2 изображено:
5 - флуоресцентное изображение при возбуждении на 430 нм,
6 - флуоресцентное изображение при возбуждении на 500 нм,
7 - фотография опухоли, опухоли обведены пунктиром,
8 - сигнал сенсора в относительных единицах, окрашено в псевдоцвета.
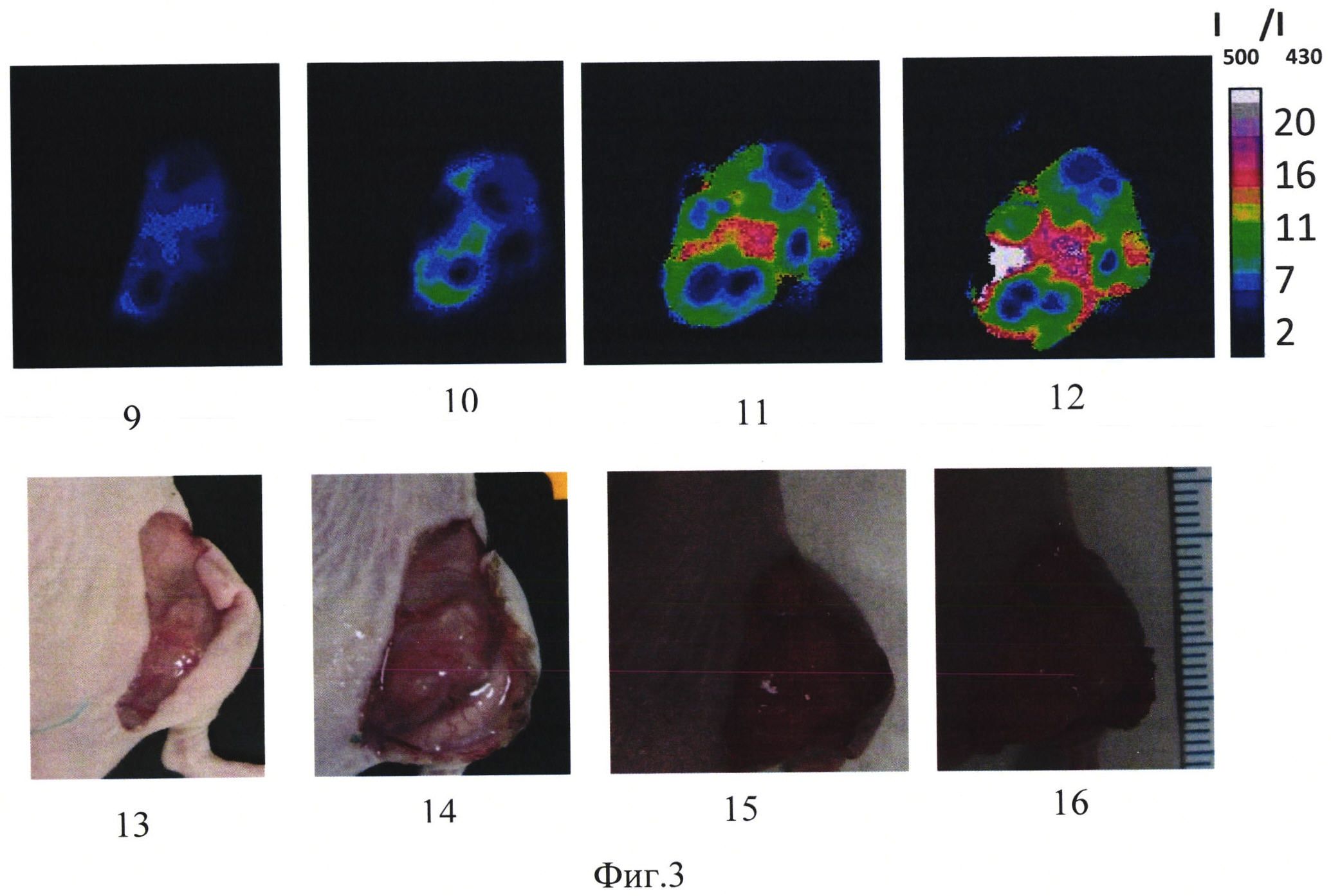
На фиг. 3 изображено:
9 - сигнал сенсора, день 7,
10 - сигнал сенсора, день 10,
11 - сигнал сенсора, день 14,
12 - сигнал сенсора, день 18,
13 - фотография опухоли, день 7,
14 - фотография опухоли, день 10,
15 - фотография опухоли, день 14,
16 - фотография опухоли, день 18.
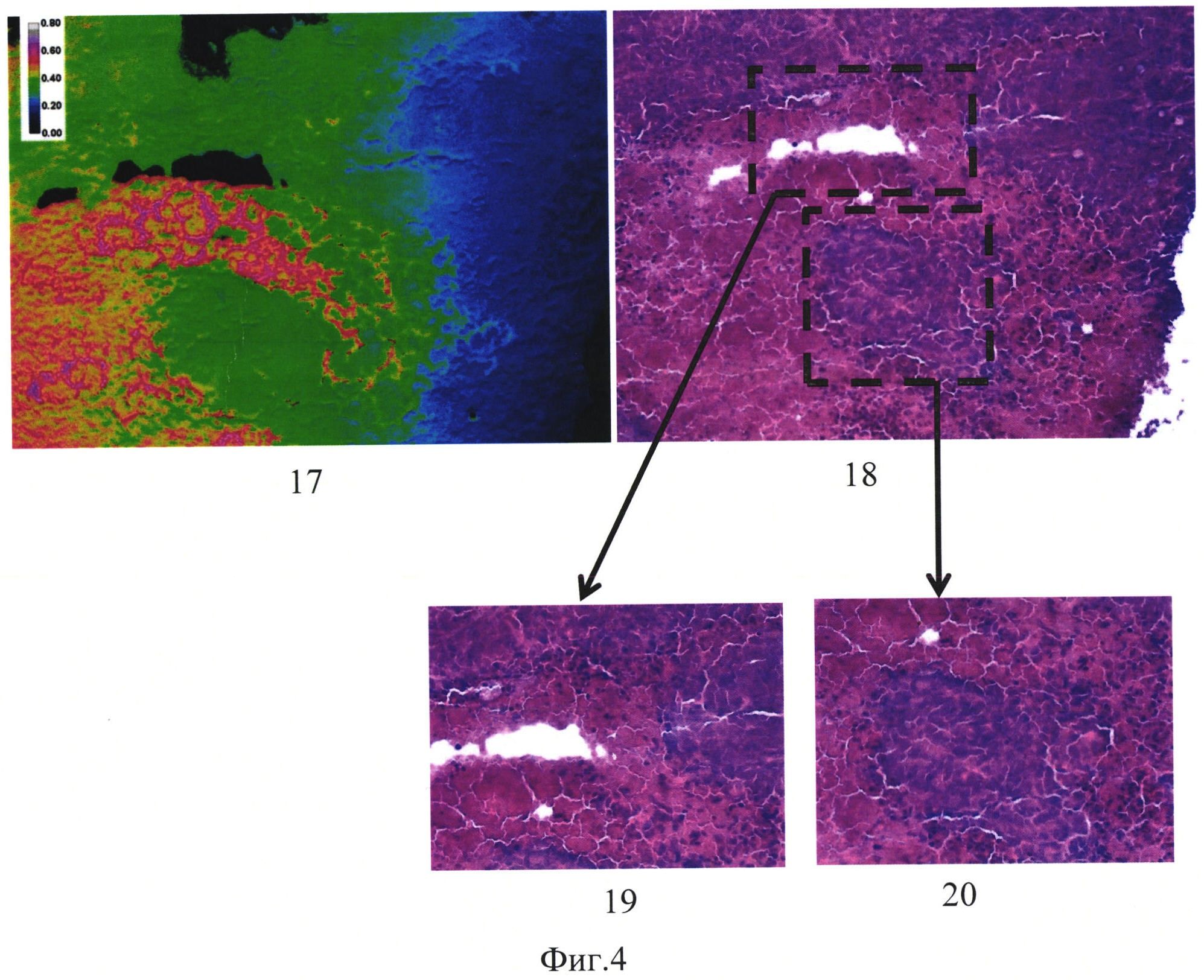
На фиг. 4 изображено:
17 - сигнал сенсора на криосрезе толщиной 30 мкм, увеличение 200,
18 - криосрез толщиной 30 кмк, окрашенный гематоксилином и эозином,
19 - укрупненный участок зоны некроза (увеличение 400),
20 - укрупненный участок типичной опухолевой ткани (увеличение 400).
Предлагаемый способ осуществляют следующим образом
Предварительно получают линию клеточной культуры Hela Kyoto, стабильно трансфецированную геном белка SypHer2 и экспрессирующую данный белок в цитоплазме.
Для регистрации внутриклеточного рН in vivo у животного с опухолью, привитой ему путем подкожной трансплантации суспензии опухолевых клеток, в которые предварительно встроен соответствующий ген белка SypHer2 и которые экспрессируют белок SypHer2 в цитоплазме, оценивают интенсивность флуоресценции белка-сенсора с 4-го по 28-й день роста опухоли с интервалом в три дня с помощью установки для поверхностного флуоресцентного имиджинга IVIS-Spectrum (Caliper, США). Возбуждение флуоресценции производится на длине волны 430 нм и 500 нм, прием сигнала - на длине волны 540 нм, время экспозиции составляет 5 сек. Авторами апробированы два режима регистрации сигнала сенсора: через кожу и путем препарирования кожного лоскута над опухолью.
Предлагаемым способом осуществлено наблюдение сигнала сенсора in vivo и ex vivo у 8 животных с привитой опухолью (рак шейки матки человека), экспрессирующей белок SypHer2 в цитоплазме клеток, в процессе естественного роста.
Результатами наблюдений стали данные о неоднородности отношения I500/I430 сигнала сенсора SypHer2 в пределах одного опухолевого узла и, следовательно, значения внутриклеточного рН как в трехмерных моделях опухоли, так и у экспериментальных животных. Сопоставление данных о сигнале сенсора, зарегистрированном на гистологических срезах, с данными патоморфологического анализа позволили сделать выводы о том, что в зонах некроза опухоли отношение I500/I430 выше, следовательно, внутриклеточный рН опухолевых клеток, находящихся в зоне некроза, является более щелочным.
Примеры конкретного использования предлагаемого способа
Пример 1
Животное - иммунодефицитная мышь, самка, массой 20.5 г с привитой опухолью рак шейки матки человека, расположенной подкожно в области бедра. В опухолевые клетки предварительно был встроен ген белка SypHer2, генетически-кодируемый белок SypHer2 экспрессировался в цитоплазме опухолевых клеток. Регистрацию флуоресценции проводили через кожу на 16 день роста опухоли с помощью установки для поверхностного флуоресцентного имиджинга IVIS-Spectrum (Caliper, США). Возбуждение флуоресценции производится на длине волны 430 нм и 500 нм, прием сигнала - на длине волны 540 нм, время экспозиции составляет 5 сек.
Полученные изображения обрабатывали в программе EMBL_ImageJ путем вычитания фона (сигнал в зоне свободной от клеток) на каждом изображении и деления изображения, полученного при возбуждении светом с длиной волны 500 нм (I500), на изображение, полученное при возбуждении светом с длиной волны 430 нм (I430). Получали результирующее изображение, на котором уровень сигнала в относительных единицах отражает уровень рН. На фиг. 1 представлены флуоресцентные и результирующее изображение опухоли, фотография животного с опухолью, где 1 - флуоресцентное изображение при возбуждении на 430 нм, 2 - флуоресцентное изображение при возбуждении на 500 нм, 3 - фотография опухоли, опухоли обведены пунктиром, 4 - сигнал сенсора в относительных единицах, окрашено в псевдоцвета.
Пример 2
Животное - иммунодефицитная мышь, самка, массой 18,3 г с привитой опухолью рак шейки матки человека, расположенной подкожно в области бедра. В опухолевые клетки предварительно был встроен ген белка SypHer2, генетически-кодируемый белок SypHer2 экспрессировался в цитоплазме опухолевых клеток. На 18 день роста опухоли путем препарирования кожного лоскута непосредственно над опухолью опухоль открывали и регистрировали флуоресценцию с помощью установки для поверхностного флуоресцентного имиджинга IVIS-Spectrum (Caliper, США). Возбуждение флуоресценции производится на длине волны 430 нм и 500 нм, прием сигнала - на длине волны 540 нм, время экспозиции составляет 5 сек.
Полученные изображения обрабатывали аналогично примеру 1. Получали результирующее изображение, на котором уровень сигнала в относительных единицах отражает уровень рН. На фиг. 2 представлены флуоресцентные и результирующее изображение опухоли, фотография животного с опухолью, где 5 - флуоресцентное изображение при возбуждении на 430 нм, 6 - флуоресцентное изображение при возбуждении на 500 нм, 7 - фотография опухоли, опухоли обведены пунктиром, 8 - сигнал сенсора в относительных единицах, окрашено в псевдоцвета.
Пример 3
Животное - иммунодефицитная мышь, самка, массой 20.0 г с привитой опухолью рак шейки матки человека, расположенной подкожно в области бедра. В опухолевые клетки предварительно был встроен ген белка SypHer2, генетически-кодируемый белок SypHer2 экспрессировался в цитоплазме опухолевых клеток. После формирования опухоли в период с 7 по 18 день естественного роста опухоли проводили наблюдение сигнала сенсора с поверхности открытой опухоли, как в примере 2. Обработку изображений проводили аналогично примеру 1. На фиг. 3 представлены флуоресцентные изображения опухоли (сигнал сенсора в относительных единицах, окрашено в псевдоцвета), экспрессирующей белок SypHer2, и соответствующие фотографии, где 9 - сигнал сенсора, день 7, 10 - сигнал сенсора, день 10, 11 - сигнал сенсора, день 14, 12 - сигнал сенсора, день 18, 13 - фотография опухоли, день 7, 14 - фотография опухоли, день 10, 15 - фотография опухоли, день 14, 16 - фотография опухоли, день 18.
Пример 4
Животное - иммунодефицитная мышь, самка, массой 20.0 г с привитой опухолью рак шейки матки человека, расположенной подкожно в области бедра. В опухолевые клетки предварительно был встроен ген белка SypHer2, генетически-кодируемый белок SypHer2 экспрессировался в цитоплазме опухолевых клеток. После формирования опухоли на 18 день естественного роста опухоли мышь подвергали афтаназии, опухоль вырезали. Затем опухоль разрезали в поперечном направлении на две части и помещали в жидкий азот для сохранения флуоресценции сенсора. После замораживания с помощью криотома Leica LCS 900 (Leica, Германия) получали криосрезы толщиной 20-30 мкм. Интенсивность флуоресценции регистрировали с помощью флуоресцентного микроскопа DM IL LED (Leica, Германия). Обработку изображений проводили аналогично примеру 1. Затем образцы окрашивали гематоксилином и эозином по стандартной методике. Сопоставляли данные о гистологической структуре опухоли с данными о сигнале сенсора и выявляли взаимосвязь гистологического строения опухоли и уровня внутриклеточного рН.
На фиг. 4 представлено флуоресцентное изображение криосреза опухоли (сигнал сенсора в относительных единицах, окрашено в псевдоцвета), экспрессирующей белок SypHer2, и соответствующее гистологическое изображение, окрашенные гематоксилином и эозином, где 17 - сигнал сенсора на криосрезе толщиной 30 мкм, увеличение 200, 18 - криосрез толщиной 30 кмк, окрашенный гематоксилином и эозином.
Проводили сопоставление сигнала сенсора и гистологического строения опухоли. Установлено, что зоны с более высоким уровнем сигнала сенсора соответствуют зонам некроза, а зоны с более низким сигналам сенсора соответствуют зонам типичной опухолевой ткани. На рисунке 19 представлен укрупненный участок зоны некроза (увеличение 400), на рисунке 20 представлен укрупненный участок типичной опухолевой ткани (увеличение 400).
Источники информации
1. Webb В.A. Dysregulated рН: a perfect storm for cancer progression // NAT. REV., 2011, Vol. 11, p. 671-677.
2. Casey J.R., Grinstein S., Orlowski J.. Sensors and regulators of intracellular pH, Nanure reviews / Molecular cell Biology, 2010, Vol. 11, p. 50-61.
3. Song C.W., Griffin R., Park H.J.. Influence of Tumor pH on Therapeutic Response, Cancer Drug Discovery and Development, 2006.
4. Iessi E. et al. Tumor acidity and malignancy: novel aspects in the design of anti-tumor therapy // Cane. Ther, 2008, Vol. 6, p. 55-66.
5. C. Rauch et al. // Ch. 3 in: Multiple Drug Resistance
6. Calderon-Montano J.M., Burgos-Moron E., Perez-Guerrero C, Salvador J., Robles Α., Lopez-Lazaro M. Role of the Intracellular pH in the Metabolic Switch between Oxidative Phosphorylation and Aerobic Glycolysis - Relevance to Cancer, WebmedCentral, 2011.
7. Zhang X. et al. Tumor pH and its mesarument // J. Nucl. Med., 2010, Vol. 51, No. 8. p. 1167-1170.
8. Judenhofer M.S, Wehrl H.F., Newport D.F., Catana C., Siegel S.B, Becker M., Thielscher Α., Kneilling M., Lichy M.P., Eichner M., Klingel K., Reischl G., Widmaier S., Ro M., Nutt R.E., Machulla H., Uludag K., Cherry S.R., Claussen C.D., Pichler B.J. Simultaneous PET-MRI: a new approach for functional and morphological imaging, Nature Publishing Group, 2008.
9. Gallagher F.A., Kettunen M.I.,. Day S.E, Hu De-En, Ardenkjasr-Larsen J.H., Zandt R., Jensen P.R., Karlsson M., Golman K., Lerche M.H., Brindle K.M. Magnetic resonance imaging of pH in vivo using hyperpolarized 13C-labelled bicarbonate, Nature, June 2008, Vol 453.
10. Poburko D., Santo-Domingo J., Demaurex N. Dynamic Regulation of the Mitochondrial Proton Gradient during Cytosolic Calcium Elevations. // J. Biol. Chem. 2011. 286. 11672-11684.
11. Raimondo J.V., Irkle Α., Wefelmeyer W., Newey S.E., Akerman C.J. Genetically encoded proton sensors reveal activity-dependent pH changes in neurons, Front. Mol. Neurosci., May 2012.
12. Tantama M., Hung Y.P.,. Yellen G.. Imaging Intracellular pH in Live Cells with a Genetically Encoded Red Fluorescent Protein Sensor, J. Am. Chem, 2011, vol 133 (26), pp. 10034-10037.
13 Bizzarri R. et. al. Development of a Novel GFP-based Ratiometric Excitation and Emission pH Indicator for Intracellular Studies // Biophysical J., 2006, vol. 90, p. 3300-3314.
14. Tseng J.C. In Vivo Fluorescent Labling of Tumor Cells with the HaloTag®Technology // Cur. Chem. Gen., 2012, vol. 6, p. 48-54.
15. Markvicheva K.N., Bilan D.S., Mishina N.M., et. al. A genetically encoded sensor for H2O2 with expanded dynamic range. Bioorganic & Medicinal Chemistry. 2011. 19. 1079-1084.