Результат интеллектуальной деятельности: СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ОПУХОЛЕЙ
Вид РИД
Изобретение
Предлагаемое изобретение относится к медицине, а именно к онкологии, и может быть использовано для фотодинамической терапии опухолей. Несмотря на успехи современной медицины, онкологические заболевания остаются одной из главных причин смертности. Поэтому одной из основных задач медицины является разработка эффективных методов лечения опухолей.
Одним из эффективных методов лечения опухолей является фотодинамическая терапия (ФДТ). Метод ФДТ основан на способности вводимых в опухоль фотоактивных соединений - фотосенсибилизаторов генерировать при локальном воздействии оптического облучения определенной длины волны активные формы кислорода, которые вызывают гибель опухолевых клеток (1). Традиционно в качестве фотосенсибилизаторов используют химические соединения порфиринового ряда, которые вводят в организм системно, где они накапливаются в опухоли в виду ее структурно-функциональных особенностей (2, 3).
В настоящее время ФДТ успешно используется как в лечении небольших поверхностных опухолей различной локализации, в частности рака кожи, мочевого пузыря, бронхов, вульвы, ранних стадий рака легких, шейки матки, пищевода Баррета, желчных протоков, так и интерстициально при раке простаты, опухолях головного мозга, брюшинном карциноматозе (1, 4-6).
Противоопухолевый эффект ФДТ основан на трех механизмах (7):
- прямое фототоксическое поражение опухолевых клеток;
- повреждение сосудов;
- активация неспецифического иммунного ответа.
Относительный вклад каждого из них зависит от многих факторов: химической природы фотосенсибилизатора, его локализации в опухоли, степени васкуляризации и содержания макрофагов в опухоли, времени от введения фотосенсибилизатора до облучения. Преобладания клеточного механизма следует ожидать при высоком содержании фотосенсибилизатора в опухолевых клетках при длительном сроке между инъекцией и облучением. Субклеточная локализация фотосенсибилизатора во многом определяет путь клеточной гибели (апоптоз или некроз) и зависит, главным образом, от его физико-химических свойств. Известно, что фотосенсибилизаторы, локализованные в митохондриях, индуцируют апоптотическую гибель клетки, в отличие от фотосенсибилизаторов, находящихся в лизосомах или плазматических мембранах (8). Наиболее чувствительной мишенью в клетке для активных форм кислорода считается ядро, поэтому большое внимание уделяется разработке фотосенсибилизаторов ядерной локализации (9).
Однако на практике для многих фотосенсибилизаторов больше характерен сосудистый механизм: фотодинамические реакции, вызванные сенсибилизатором, находящимся в сосудах опухоли, приводят к сосудистому стазу, тромбозам, кровоизлияниям, гипоксии и, как следствие, гибели опухолевых клеток (10).
Характерно, что распределение фотосенсибилизатора, введенного в организм извне, меняется в опухоли со временем, так что один и тот же препарат может действовать по разному механизму в зависимости от времени после введения. В связи с перераспределением и помимо этого выведением фотосенсибилизатора из опухоли многократное облучение в случае стандартной ФДТ проблематично, а повторное введение препарата создаст сложности с дозиметрией.
Избирательность накопления химически-синтезированных фотосенсибилизаторов в опухоли обусловлена целым рядом ее структурно-функциональных особенностей, таких как повышенная проницаемость кровеносных сосудов, снижение дренажной функции лимфатической системы, более низкий pH, большое количество макрофагов, которые являются эффективными ловушками для гидрофобных препаратов, аномальная структура опухолевой стромы, характеризующаяся увеличенным межклеточным пространством и повышенной продукцией коллагена, который связывает порфирины, высокий уровень экспрессии рецепторов липопротеинов низкой плотности (1, 4, 5). Тем не менее селективность накопления в опухоли существующих фотосенсибилизаторов, вводимых в организм экзогенно, достаточно низкая. По данным экспериментальных работ концентрация препаратов в опухоли превышает концентрацию в окружающих нормальных тканях (коже, мышцах) всего в 2-3 раза (11-12). Наиболее высокий уровень накопления отмечается в органах ретикуло-эндотелиальной системы (печени, почках, селезенке). Это значительно снижает эффективность лечения других органов, требует использования высоких доз препарата, увеличивает фармакологическую нагрузку на организм. Серьезным побочным эффектом при использовании фотосенсибилизаторов, связанным с неспецифическим накоплением препарата, является их фототоксичность для кожи и глаз в результате возникновения фотодинамической реакции под действием солнечных лучей.
Так, известен способ фотодинамической терапии больных базально-клеточным раком кожи (13). В данном способе в качестве фотосенсибилизатора используют - производное тетрапиррольных макроциклов хлоринового ряда «Радахлорин», раствор фотосенсибилизатора вводят внутривенно за 2-3 часа до облучения, опухоль облучают лазерным излучением с длиной волны 662 нм при плотности энергии 200 или 300 Дж/см2.
В результате у 96% пациентов наблюдалась полная регрессия опухоли, у 4% - частичная. Однако в результате проведенной ФДТ у всех пациентов отмечается появление отека в зоне облучения с последующим побелением и цианозом опухоли и гиперемией окружающих мягких тканей. В последующем в облученной зоне формировался сухой некроз и струп, отторгающийся в течение 3-10 недель.
Известен способ фотодинамической терапии опухолей, локализованных на бедре, у мышей, в качестве фотосенсибилизатора используют фталоцианин алюминия и через 24 часа после внутривенного введения фотосенсибилизатора осуществляют облучение опухоли светом от ксеноновой лампы на длине волны 650-700 нм при мощности излучения 200 мВт/см2 и плотности энергии 400 Дж/см2 (14).
Полная регрессия опухоли наблюдается у 30% животных с опухолью Colo-26 и у 75% животных с опухолью ЕМТ-6. Однако при этом наблюдается накопление фотосенсибилизатора в нормальных органах и тканях (печень, селезенка, легкие, почки, кожа, мышцы). И как результат - происходит фотоповреждение мышечной ткани вокруг опухоли, которое приводит к ограничению подвижности 30% животных в течение минимум 35 дней после ФДТ, что является серьезным побочным эффектом.
Также известен способ фотодинамической терапии опухоли (саркома М-1) у крыс с применением фотосенсибилизатора Фотодитазин, препарат вводят внутривенно и через 1.5 ч после инъекции облучают опухоль лазерным излучением с длиной волны 661 нм при плотности энергии 150, 300, и 600 Дж/см2 (15).
Основным механизмом деструкции опухоли в данном способе является прямой коагуляционный некроз, вызванный разрушением клеток опухоли, и ишемический некроз, возникший в результате повреждения кровеносных сосудов опухоли. При этом противоопухолевый эффект ФДТ сопровождается выраженной воспалительной реакцией в опухолевой ткани.
Наиболее близким к предлагаемому способу по совокупности существенных признаков и техническому результату является известный способ фотодинамической терапии (ФДТ) опухолей, описанный в источнике (16), который авторами выбран в качестве прототипа. Данный способ заключается в том, что предварительно за 24 часа до начала терапии в организм животного - мыши с привитой ему опухоли Эрлиха внутривенно вводят раствор фотосенсибилизатора, представляющего собой смесь натриевых солей сульфированного фталоцианина алюминия («Фотосенс») в виде липосомальной лекарственной формы (ЛЛФ) однократно в дозе 4 и 1 мг/кг, при этом накопление фотосенсибилизатора в опухоли контролируют по его флуоресценции прижизненно спектрально-флуоресцентным методом, и при максимуме накопления фотосенсибилизатора в опухоли ее облучают однократно лазерным излучением на длине волны 633 нм, близкой к максимуму поглощения фотосенсибилизатора, при плотности энергии 90 Дж/см2 и времени облучения 10 мин.
Оценку эффективности ФДТ проводят по торможению роста опухоли (ТРО), которое составляет 80% для обеих доз.
Однако данный способ имеет такие побочные эффекты, как:
- низкое накопление фотосенсибилизатора в опухоли, что не обеспечивает высокой селективности его воздействия;
- высокую токсическую нагрузку на нормальные жизненно-важные органы и ткани (печень, легкие, почки, селезенка);
- постепенное накопление, перераспределение фотосенсибилизатора в опухоли и выведение его из опухоли с течением времени требует постоянного дозиметрического контроля.
Задачей предлагаемого изобретения является разработка эффективного способа фотодинамической терапии опухолей, который обеспечивает высокую селективность воздействия фотосенсибилизатора на опухоль, при низкой токсической нагрузке на нормальные жизненно-важные органы и ткани и не требует постоянного дозиметрического контроля при проведении терапии.
Поставленная задача решается предлагаемым способом фотодинамической терапии опухоли, включающем использование фотосенсибилизатора, предварительную оценку его наличия в опухоли по его флуоресценции с последующим облучением опухоли оптическим излучением с длиной волны в спектральном диапазоне максимального поглощения фотосенсибилизатора, согласно изобретения в качестве фотосенсибилизатора используют генетически-кодируемый белок KillerRed, для чего обеспечивают его экспрессию в опухоли путем встраивания соответствующего гена в опухолевые клетки, облучение опухоли оптическим излучением осуществляют при плотности энергии 180-270 Дж/см2 3 раза через день или 7 раз ежедневно.
Предпочтительно локализация белка KillerRed является митохондриальной и ядерной или ядерной.
Техническим результатом предлагаемого способа является повышение селективности воздействия фотосенсибилизатора на опухоль, снижение токсической нагрузки на нормальные органы и ткани, отсутствие перераспределения фотосенсибилизатбра в опухоли и отсутствие необходимости дозиметрического контроля.
Данный технический результат достигается тем, что фотосенсибилизатором в опухоли является генетически-кодируемый белок KillerRed, для этого обеспечивают его экспрессию в опухоли путем встраивания соответствующего гена в опухолевые клетки, облучение опухоли оптическим излучением осуществляют при плотности энергии 180-270 Дж/см2 3 раза через день или 7 раз ежедневно.
Белок KillerRed - это красный флуоресцентный белок, димер (17). Мономер белковой молекулы имеет структуру, типичную для белков семейства GFP (green fluorescent protein) (18). Максимум поглощения белка KillerRed лежит на длине волны 585 нм (коэффициент экстинкции 45000 М-1см-1), флуоресценции на 610 нм (квантовый выход 0.25) (19). Экспрессия белка KillerRed в опухолевых клетках обеспечивается путем встраивания соответствующего гена в геном клетки. Белок KillerRed может быть локализован в заданном клеточном компартменте в результате слияния его с другим белком-мишенью. Облучение опухолевых клеток, экспрессирующих белок KillerRed, в культуре in vitro оптическим излучением приводит к выгоранию белка и остановке клеточных делений или гибели клеток (20).
Предпочтительно берут генетически-кодируемый белок KillerRed митохондриальной и ядерной или ядерной локализации, так как локализация данного белка в других клеточных компартментах (цитоплазма, цитоплазматическая мембрана, лизосомы, митохондрии) не эффективна для фотодинамической терапии Опухолей, что эмпирически доказано авторами представленной заявки.
При данной плотности энергии излучения (180-270 Дж/см2) происходит выгорание белка KillerRed в опухоли, что проявляется в снижении флуоресценции опухоли на флуоресцентном изображении. Поскольку выгорание белка сопровождает фотодинамическую реакцию, наблюдение этого эффекта позволило оценить эффективность выбранного режима терапевтического воздействия. При осуществлении предлагаемого способа повышение температуры опухолей составляет всего ~1-2°C.
Данный технический результат обусловлен тем, что генетически-кодируемый фотосенсибилизатор представляет собой белок KillerRed, ген которого предварительно встроен в опухолевые клетки. Опухоль вырабатывает данный белок KillerRed путем экспрессии в митохондриях и ядрах или ядрах опухолевых клетках.
Данный белок KillerRed оказывает выраженное фототоксическое действие на опухоли животных за счет эффективной локализации белка в клетке, вызывающей существенное повреждение опухолевых клеток - в митохондриях и ядрах или ядрах клеток. Фотодинамическая терапия опухолей предлагаемым способом приводит к выраженным патоморфологическим нарушениям в структуре опухолевой ткани: дистрофическим изменениям в виде вакуолизации цитоплазмы, отека ядра, увеличению размеров ядра или его сжатию, разрывам ядерной и цитоплазматической мембран, а также активации апоптоза в клетках. Фототоксические эффекты белка KillerRed в леченых опухолях отмечены исключительно в опухолевых клетках на субклеточном уровне. При этом генетически-кодируемый фотосенсибилизатор действует прицельно и специфично на те органеллы клетки, в которых он экспрессируется. Это означает, что противоопухолевое действие генетически-кодируемого фотосенсибилизатора реализуется через прямое разрушение опухолевых клеток без негативного влияния на окружающие опухоль здоровые ткани и побочных эффектов в виде фототоксичности по отношению к коже и слизистым оболочкам, токсичности в отношении жизненно-важных органов и тканей.
При этом опухолевые клетки стабильно экспрессируют фототоксичный белок в заданной локализации в процессе роста новообразования, и локализация белка не изменяется со временем, поэтому нет необходимости постоянного дозиметрического контроля, что имеет ключевое значение для осуществления способа терапии.
Предлагаемый способ осуществляют следующим образом.
У животного с опухолью размером не более 5 мм в диаметре, привитой ему путем подкожной трансплантации суспензии опухолевых клеток, в которые предварительно встраивают соответствующий ген белка KillerRed и которые экспрессируют белок KillerRed, затем оценивают наличие фотосенсибилизатора - генетически-кодируемого белка KillerRed - в опухоли по его флуоресценции, после чегое облучают опухоль оптическим излучением, в частности лазером, светодиодом или ксеноновой лампой с длиной волны в спектральном диапазоне максимального поглощения фотосенсибилизатора плотностью энергии 180-270 Дж/см2 3 раза через день или 7 раз ежедневно, при этом локализация генетически-кодируемого белка KillerRed является митохондриальной и ядерной или ядерной.
Предлагаемым способом была осуществлена фотодинамическая терапия 50 животных с привитой опухолью (рак шейки матки человека). У 26 животных генетически-кодируемый белок KillerRed вырабатывался в митохондриях и ядрах (первая группа), у 24 животных - в ядрах опухолевых клеток (вторая группа).
В первой группе облучение опухоли оптическим излучением осуществлялось при следующих режимах:
- плотность энергии 180 Дж/см2, 3 раза через день (4 животных),
- плотность энергии 180 Дж/см2, 7 раз ежедневно (4 животных),
- плотность энергии 225 Дж/см2, 3 раза через день (4 животных),
- плотность энергии 225 Дж/см2, 7 раз ежедневно (4 животных),
- плотность энергии 270 Дж/см2, 3 раза через день (5 животных),
- плотность энергии 270 Дж/см2, 7 раз ежедневно (5 животных).
Во второй группе облучение опухоли оптическим излучением осуществлялось при следующих режимах:
- плотность энергии 180 Дж/см2, 3 раза через день (4 животных),
- плотность энергии 180 Дж/см2, 7 раз ежедневно (4 животных),
- плотность энергии 225 Дж/см2, 3 раза через день (4 животных),
- плотность энергии 225 Дж/см2, 7 раз ежедневно (4 животных),
- плотность энергии 270 Дж/см2, 3 раза через день (4 животных),
- плотность энергии 270 Дж/см2, 7 раз ежедневно (4 животных).
Опухоли облучали оптическим излучением с длиной волны в спектральном диапазоне максимального поглощения генетически-кодируемого белка KillerRed (540-600 нм). Этим условиям удовлетворяют, например, твердотельной лазерный модуль с диодной накачкой модели MGL-III-593 (CNI, Китай) с длиной волны 593 нм, светодиод модели BL-HP20EUYC (Betlux, Китай) с длиной волны 590 нм, источник белого света ксеноновая лампа Thorlabs HPLS-30-04 с оптическими фильтрами с длиной волны 520-590 нм.
Наличие белка KillerRed в опухолях и изменение интенсивности его флуоресценции контролировали методом поверхностного (эпилюминесцентного) флуоресцентного имиджинга in vivo. Возбуждение флуоресценции производится на длине волны в диапазоне 570-590 нм, прием сигнала - на длине волны в диапазоне 610-730 нм. Этим условиям удовлетворяют, например, установки IVIS-Spectrum (Caliper, США) и установка для флуоресцентной визуализации, сконструированная в Институте прикладной физики РАН (ИПФ РАН) (г. Нижний Новгород), описанная в источнике (21).
Результатом проведенной терапии опухолей являются значительные качественные и количественные изменения в их гистологической структуре. Отмечаются выраженные дистрофические изменения в опухолевой ткани, такие как разрушение цитоплазматической и ядерной мембран, уменьшение размеров ядер или их увеличение, гомогенизация хроматина или хроматолиз, выраженная вакуолизация цитоплазмы. Также отмечается активация апоптоза в клетках. В результате терапии доля дистрофически-измененных клеток опухоли увеличивается с 9.9 до 68.6%, доля клеток с признаками апоптоза с 6.3 до 14% при отсутствии таких побочных эффектов, как фотоповреждение окружающих нормальных тканей, токсическая нагрузка на жизненно-важные органы, фототоксичность по отношению к коже и слизистым оболочкам и без необходимости проведения постоянного дозиметрического контроля фотосенсибилизатора в опухоли.
Кроме того, предлагаемым способом была выполнена терапия контрольной группы животных, опухоли которых не содержали белка KillerRed. Патоморфологический анализ не выявил значительных изменений в структуре данных опухолей.
Другой контрольной группой служили животные с привитой опухолью, клетки которой экспрессировали белок KillerRed в митохондриях и ядрах или ядрах, но не подвергавшиеся фотодинамической терапии предлагаемым способом. Гистологическое исследование показало, что необлученная оптическим излучением и экспрессирующая KillerRed опухолевая ткань HeLa имеет компактную плотную структуру и состоит из больших полиморфных плотно расположенных клеток. Опухоли были плохо васкуляризованы. Клетки имели большие круглые или овальные ядра. Слегка базофильная цитоплазма располагалась вокруг ядра в виде тонкого кольца. Опухолевые клетки образовывали комплексы окруженные тонким слоем соединительной ткани с мелкими кровеносными сосудами. В то же время популяция клеток в опухолях была неоднородна. В частности, наблюдалось небольшое число клеток (9.9%) свакуолизированной цитоплазмой. Некоторые из клеток (6.3%) имели признаки апоптоза, такие как конденсация хроматина, фрагментация ядра и цитоплазмы, эозинофилия.
Примеры конкретного использования предлагаемого способа
Пример 1
Животное - иммунодефицитная мышь, самка, массой 20 г с привитой опухолью рак шейки матки человека, опухоль была привита путем трансплантации 2.5 млн опухолевых клеток HeLa, в которые предварительно был встроен ген белка KillerRed, клетки опухоли экспрессировали генетически-кодируемый белок KillerRed в митохондриях и ядрах, размер опухоли составлял 3.2 мм (5 день после прививки клеток), непосредственно перед проведением фотодинамической терапии было получено флуоресцентное изображение опухоли in vivo на установке IVIS-Spectrum (Caliper Life Sciences, США) в режиме эпилюминесценции (возбуждение флуоресценции производилось на длине волны 570 нм, прием флуоресцентного сигнала на длине волны 620±10 нм, экспозиция 5 с), затем опухоль была облучена лазерным излучением на длине волны 593 нм с плотностью энергии 270 Дж/см2, облучение излучением выполняли ежедневно, один раз в день в течение 7 дней.
На время процедуры облучения животное зафиксировано за 4 конечности на специальной подставке.
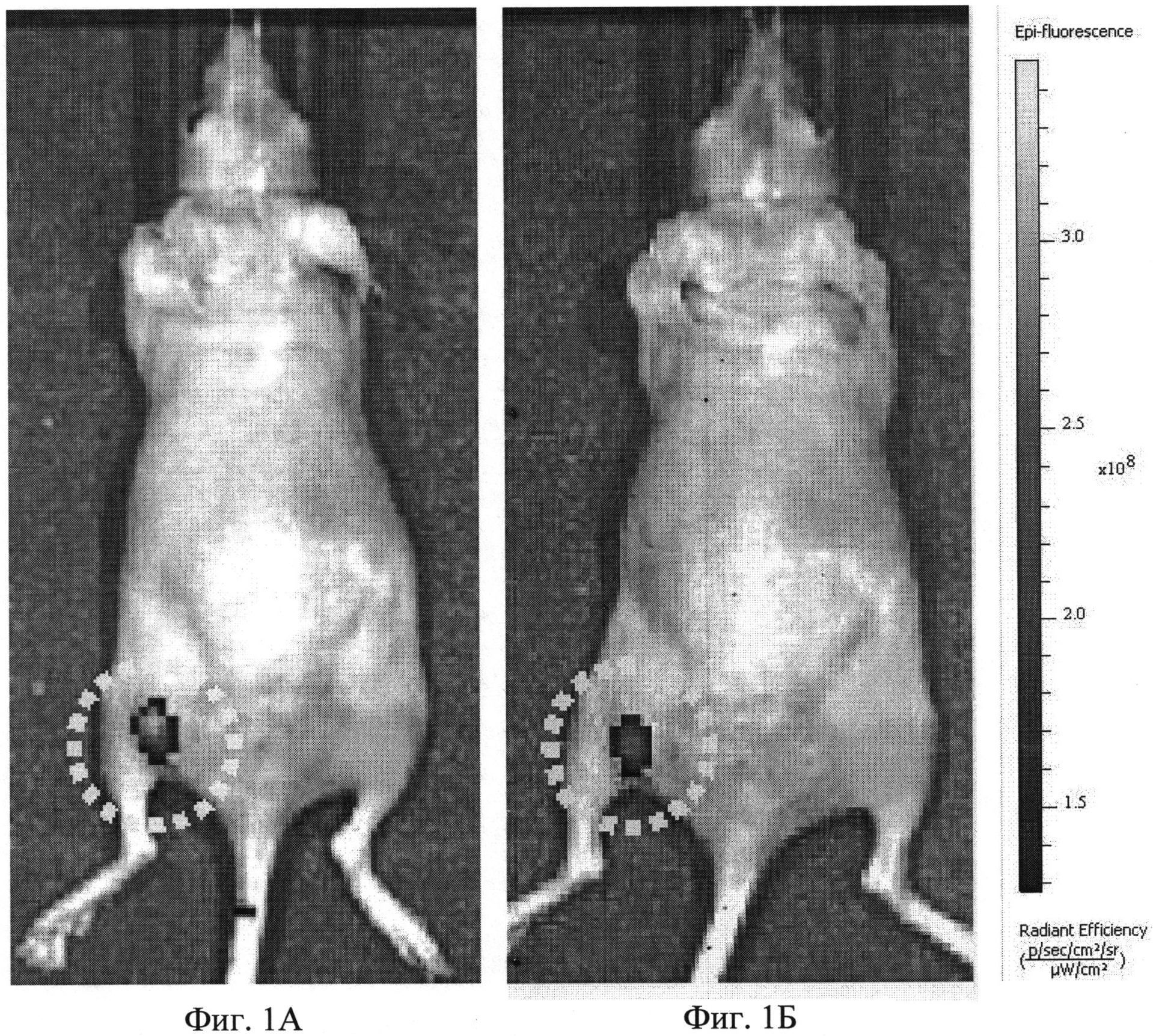
Сразу после облучения повторно получали флуоресцентное изображение опухоли in vivo. Через 24 ч после последнего облучения было проведено гистологическое исследование опухоли. Анализ флуоресценции опухоли по изображениям in vivo показал, что после лазерного облучения интенсивность флуоресцентного сигнала опухоли снижается на 27% по сравнению с исходным значением, что свидетельствует о выгорании белка KillerRed и эффективности используемого режима воздействия. Флуоресцентные изображения животного до и после облучения приведены на фиг.1 (А - до, Б - после). Опухоль на изображении выделена пунктиром.
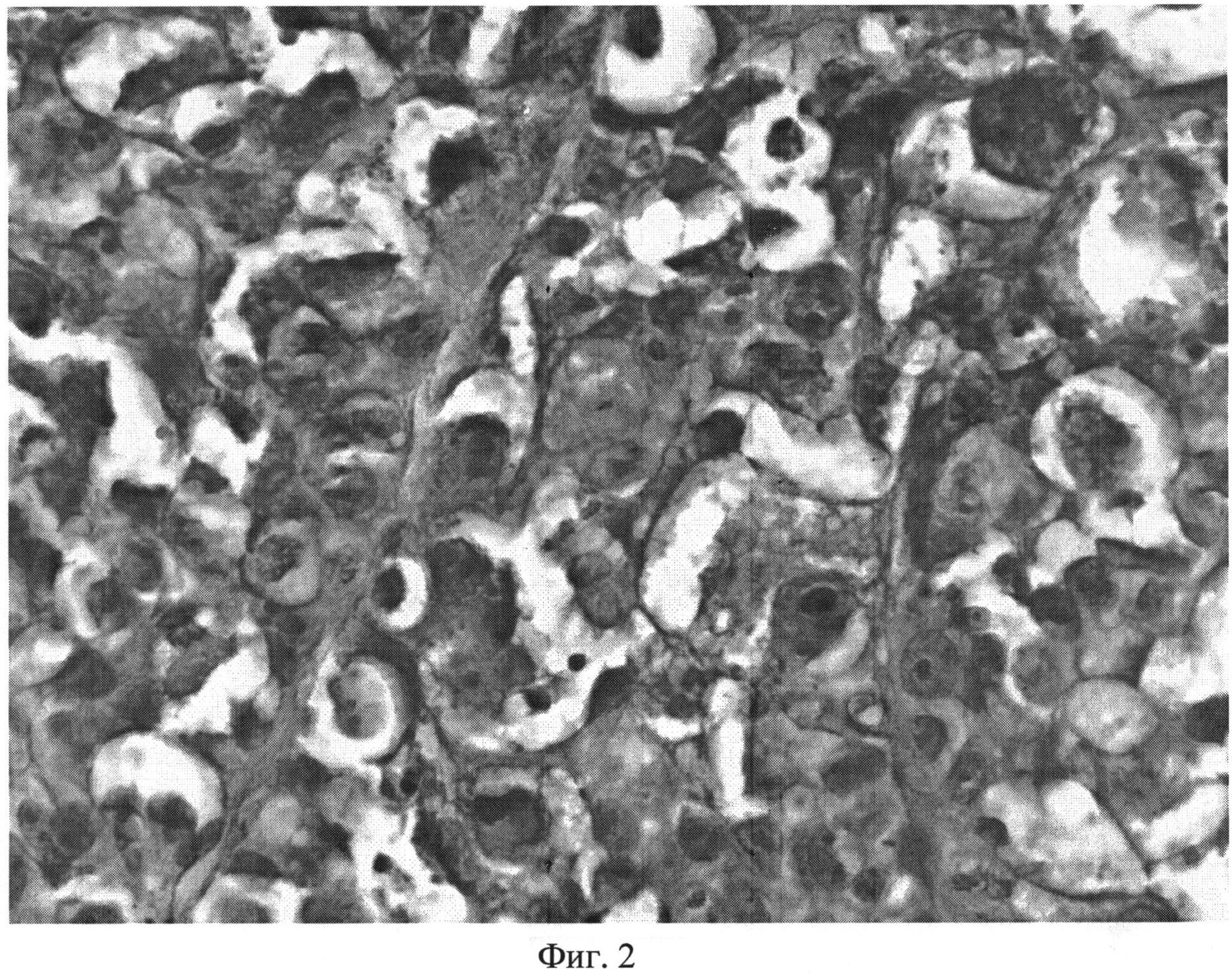
Патоморфологическое исследование выявило обширные морфологические изменения в облученной опухоли, экспрессирующей белок KillerRed. Подавляющее большинство клеток опухоли с выраженной вакуолизацией цитоплазмы, иногда вплоть до разрыва клеточной оболочки. Ядра клеток укрупненные вследствие отека, округлые или неправильной формы. Наблюдаются ядра с потерей целостности кариолеммы, признаками гомогенизации хроматина и хроматолиза, либо, наоборот, уменьшаются в размерах, гиперхромные. В ткани встречалось повышенное количество апоптотических клеток с такими характерными признаками, как конденсация хроматина, фрагментация ядер и цитоплазмы, выраженная эозинофилия цитоплазмы. Гистологическое изображение опухолевой ткани после фото динамической терапии представлено на фиг.2. Морфометрический анализ облученной ткани выявил увеличение доли дистрофически-измененных клеток в опухолях по сравнению с необлученной тканью с 9.9% до 68.6%. Доля клеток с признаками апоптоза увеличилась 6.3 до 14%.
Пример 2
Животное - иммунодефицитная мышь, самка, массой 18 г с привитой опухолью рак шейки матки человека, опухоль размером 3.7 мм (12 день после прививки клеток) расположена подкожно в области бедра, при этом в опухолевые клетки предварительно был встроен ген белка KillerRed и генетически-кодируемый белок KillerRed экспрессировался опухолевыми клетками в митохондриях и ядрах.
Пример 2 осуществляли как в примере 1. При этом облучение опухоли лазерным излучением выполняли 3 раза через день. Диаметр светового пятна составлял 8 мм.
Гистологическое исследование опухоли, проведенное после фотодинамической терапии, показало наличие дистрофических изменений и апоптоза в клетках. Гистологическая картина облученной опухолевой ткани и характер патоморфологических изменений были аналогичны описанным в примере 1. Большинство клеток имели вакуолизированную цитоплазму и разрушенные цитоплазматические мембраны. Ядра имели округлую или неправильную форму, были отекшими, с разрывами кариолеммы. Подсчет доли дистрофически-измененных и апоптотических клеток показал увеличение данного показателя до 62.3% и 12.1% соответственно.
Пример 3
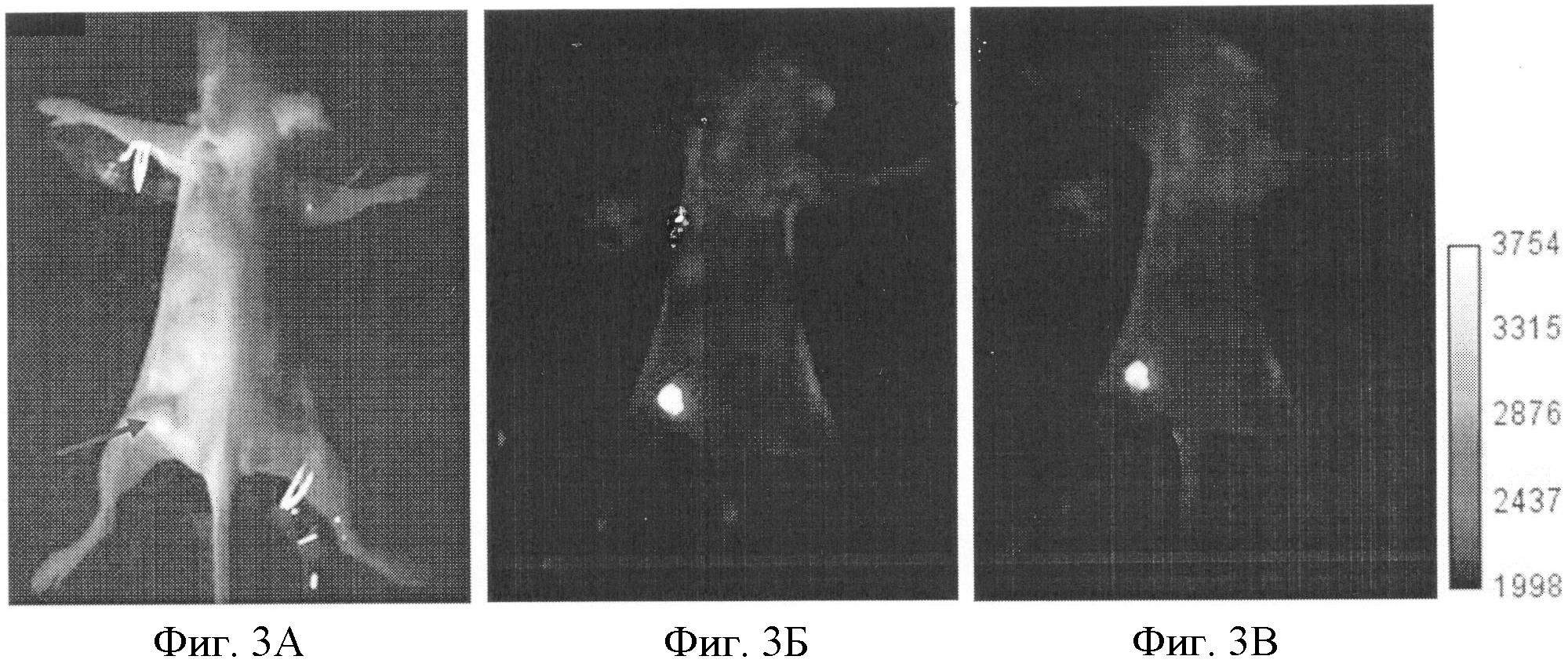
Животное - иммунодефицитная мышь, самка, массой 19 г с привитой опухолью рак шейки матки человека. Опухоль размером 4.5 мм была расположена подкожно в области бедра. В опухолевые клетки предварительно был встроен ген белка KillerRed, генетически-кодируемый белок KillerRed экспрессировался опухолевыми клетками в митохондриях и ядрах. Регистрацию флуоресцентных изображений опухоли осуществляли непосредственно перед облучением и сразу после облучения. Для получения флурресцентных изображений используют установку, сконструированную в ИПФ РАН (г. Нижний Новгород). Для получения изображения животное фиксировали на подставке и помещали в темную камеру установки. В качестве источника излучения использовали светодиод с максимумом излучения на 585 нм. Регистрацию сигнала осуществляли с помощью охлаждаемой цифровой CCD-камеры (Hamamatsu ORCA2). Время экспозиции составляло 5 секунд. Для разделения спектров накачки и эмиссии использовали фильтр с полосой пропускания Δλ=645-730 нм. Облучение опухоли выполняли с помощью светодиода на длине волны 590 нм 7 раз ежедневно. При проведении сеанса терапии плотность энергии составляла 180 Дж/см2, плотность мощности - 150 мВт/см2.
В результате анализа интенсивности флуоресценции опухоли обнаружено снижение сигнала на 11.5% после облучения, свидетельствующее о выгорании белка KillerRed. Фотография животного в белом свете (А) и флуоресцентные изображения опухоли до (Б) и после облучения (В) показаны на фиг.3. Локализация опухоли показана стрелкой.
В результате патоморфологического анализа опухолей после фотодинамической терапии обнаружены изменения в клетках, аналогичные примеру 1. Подавляющее большинство клеток опухоли находились в состоянии резкой вакуолизации цитоплазмы, часто с нарушением целостности клеточной оболочки. В части клеток отмечается и уменьшение размеров ядер, конденсация хроматина (кариопикноз), в других, наоборот, отек ядра вплоть до разрыва кариолеммы. Содержание клеток с признаками дистрофии составило 65%, с признаками апоптоза - 13.2%. Тогда как в необлученной ткани эти показатели составляли 9.9 и 6.3% соответственно.
Пример 4
Животное - иммунодефицитная мышь, самка, массой 20.2 г с привитой опухолью рак шейки матки человека, размером 3.5 мм, расположенной подкожно в области бедра, в опухолевые клетки предварительно был встроен ген белка KillerRed, генетически-кодируемый белок KillerRed экспрессировался опухолевыми клетками в митохондриях и ядрах. Регистрацию флуоресцентных изображений опухоли и ее терапию осуществляли аналогично примеру 3. Облучение опухоли выполняли 3 раза через день.
Непосредственно после лазерного облучения обнаружено снижение уровня флуоресценции опухоли на 12%.
В результате патоморфологического анализа опухолей после фотодинамической терапии выявлены изменения, аналогичные примеру 1. Содержание клеток с признаками дистрофии составило 57,4%, с признаками апоптоза - 11.9%. Тогда как в необлученной ткани эти показатели составляли 9.9 и 6.3% соответственно.
Пример 5
Животное - иммунодефицитная мышь, самка, массой 21 г с привитой опухолью рак шейки матки человека, размером 3 мм, расположенной подкожно в области бедра, в опухолевые клетки предварительно был встроен ген белка KillerRed, генетически-кодируемый белок KillerRed экспрессировался в ядрах опухолевых клеток.
Регистрацию флуоресцентных изображений опухоли и ее терапию осуществляли аналогично примеру 1. В качестве источника оптического излучения использовали ксеноновую лампу с фильтром на длине волны 520-590 нм.
Гистологический анализ опухолевой ткани показал, что доля клеток с дистрофическими изменениями составила 66.5%, с клеток с признаками апоптоза 12.2%.
Пример 6
Животное - иммунодефицитная мышь, самка, массой 20.5 г с привитой опухолью рак шейки матки человека, размером 3.2 мм, расположенной подкожно в области бедра, в опухолевые клетки предварительно был встроен ген белка KillerRed. Генетически-кодируемый белок KillerRed экспрессировался в ядрах опухолевых клеток.
Регистрацию флуоресцентных изображений опухоли и ее терапию осуществляли аналогично примеру 2.
Снижение интенсивности флуоресценции опухоли в результате облучения составило 25%.
Доля клеток с дистрофическими изменениями увеличилась до 61.8%, с клеток с признаками апоптоза - 10.2%.
Пример 7
Животное - иммунодефицитная мышь, самка, массой 19.6 г с привитой опухолью рак шейки матки человека. Опухоль размером 3.5 мм растет подкожно в области бедра, в опухолевые клетки предварительно был встроен ген белка KillerRed. Генетически-кодируемый белок KillerRed экспрессировался в ядрах опухолевых клеток.
Регистрацию флуоресцентных изображений опухоли и ее терапию осуществляли аналогично примеру 3.
Снижение интенсивности флуоресценции опухоли в результате облучения составило 16%.
Доля клеток с дистрофическими изменениями увеличилась до 59.1%, с клеток с признаками апоптоза 11.8%.
Пример 8
Животное - иммунодефицитная мышь, самка, массой 20.5 г с привитой опухолью рак шейки матки человека размером 3.2 мм, расположенной подкожно в области бедра, в опухолевые клетки предварительно был встроен ген белка KillerRed, генетически-кодируемый белок KillerRed экспрессировался в ядрах опухолевых клеток.
Регистрацию флуоресцентных изображений опухоли и ее терапию осуществляли аналогично примеру 4.
Снижение интенсивности флуоресценции опухоли в результате облучения составило 14.2%.
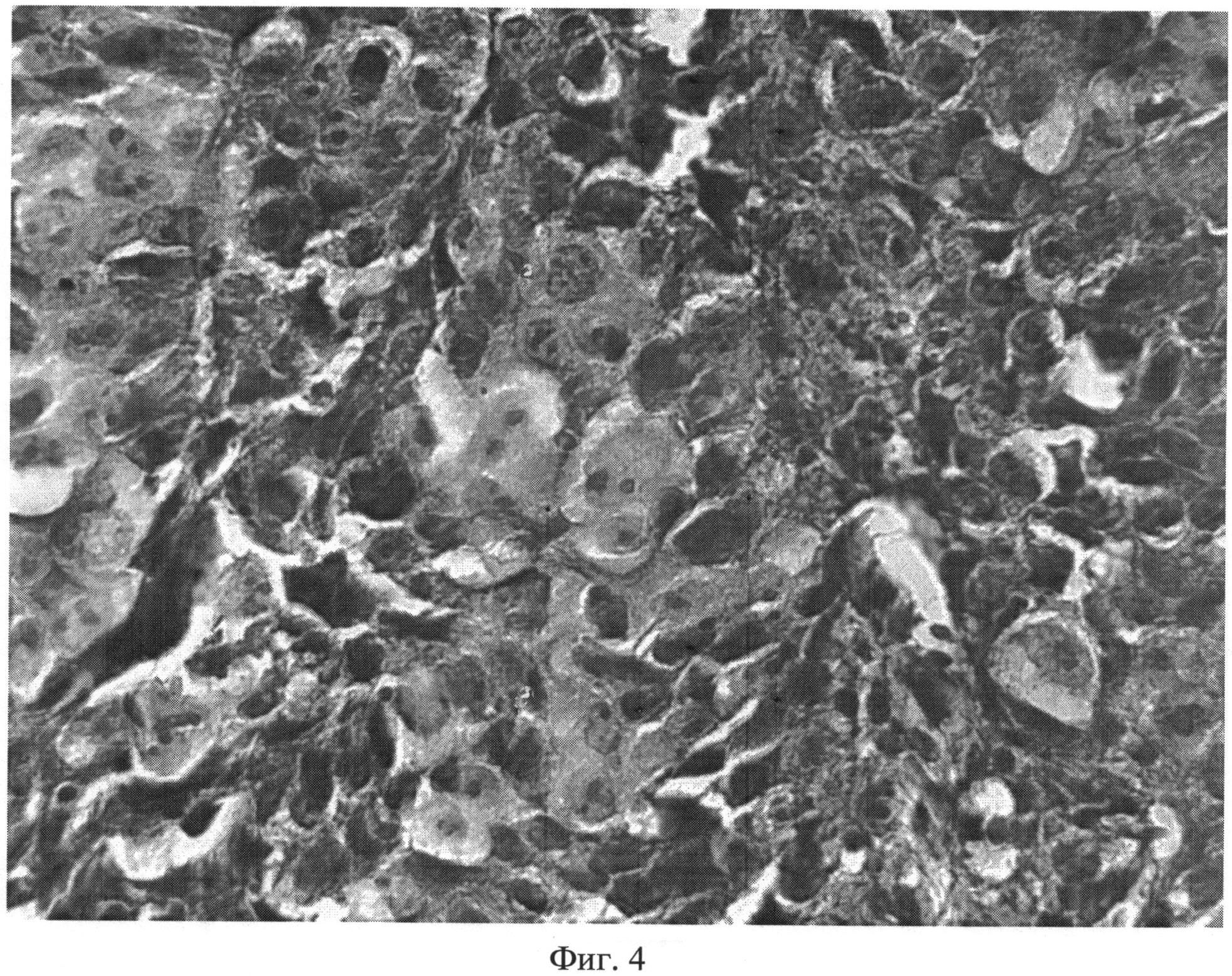
Гистологическое изображение опухолевой ткани после лечения продемонстрировано на фиг.4. Доля клеток с дистрофическими изменениями составила 56.1%, с клеток с признаками апоптоза - 11.3%.
Пример 9
Животное - иммунодефицитная мышь, самка, массой 20.2 г с привитой опухолью рак шейки матки человека, размером 3.6 мм растет, расположенной подкожно в области бедра, В опухолевые клетки предварительно был встроен ген белка KillerRed, в результате генетически-кодируемый белок KillerRed экспрессировался в ядрах и митохондриях опухолевых клеток.
Регистрацию флуоресцентных изображений опухоли осуществляли аналогично примеру 1. При этом опухоль была облучена лазерным излучением на длине волны 593 нм с плотностью энергии 225 Дж/см2, облучение излучением выполняли ежедневно, один раз в день в течение 7 дней.
Снижение интенсивности флуоресценции опухоли в результате облучения составило в среднем 13%.
После фотодинамической терапии было выполнено гистологическое исследование опухолевой ткани, которое показало наличие патоморфологических изменений, аналогичных примеру 1 (фиг.2).
Пример 10
Животное - иммунодефицитная мышь, самка, массой 19.5 г с привитой опухолью рак шейки матки человека размером 4.1 мм, в опухолевые клетки предварительно был встроен ген белка KillerRed, генетически-кодируемый белок KillerRed экспрессировался в ядрах опухолевых клеток. Регистрацию флуоресцентных изображений опухоли осуществляли аналогично примеру 1. Опухоль была облучена лазерным излучением на длине волны 593 нм с плотностью энергии 225 Дж/см2, облучение излучением выполняли через день 3 раза.
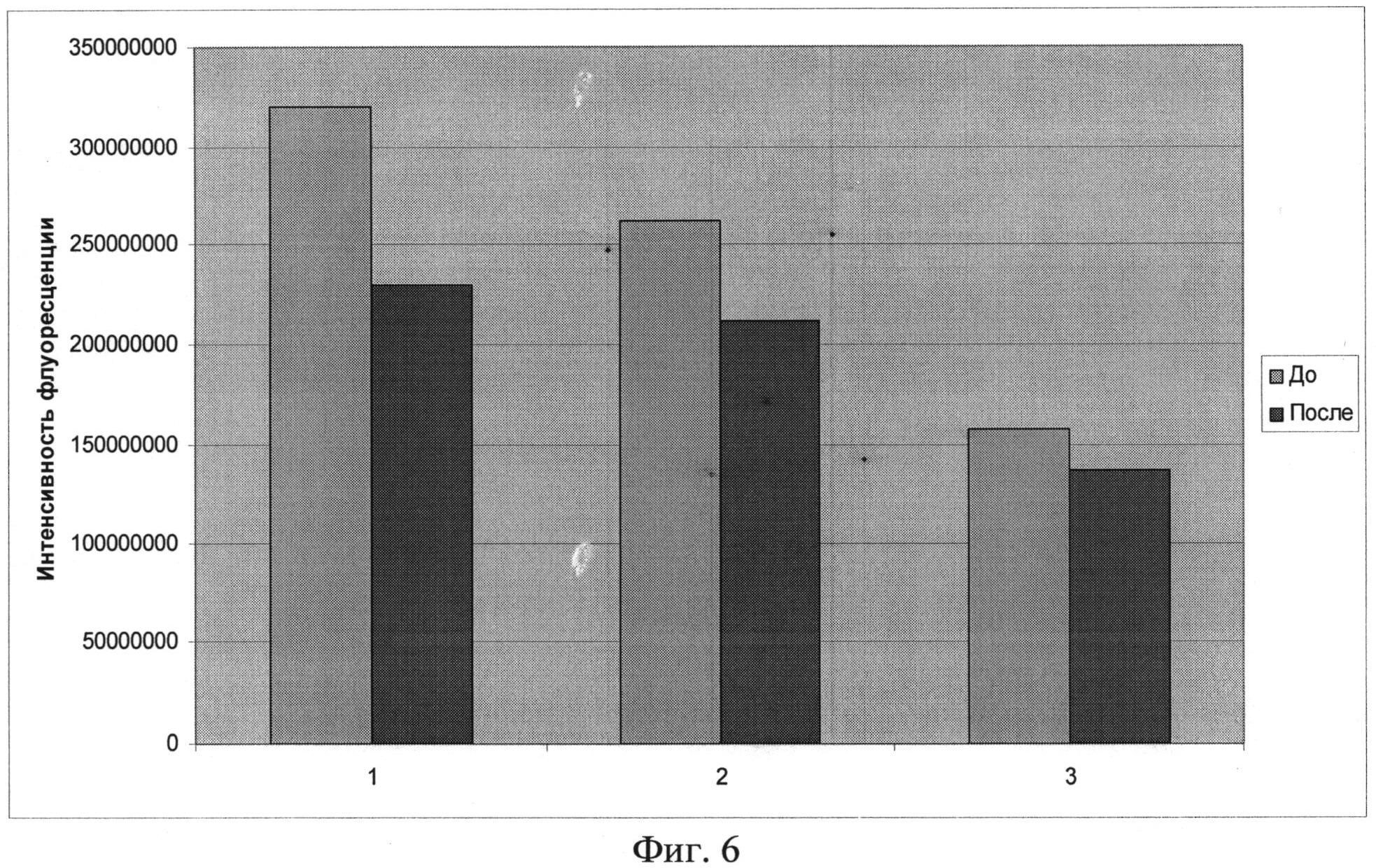
Снижение интенсивности флуоресценции опухоли в результате облучения составило после первого облучения 27%, после второго - 18%, после третьего - 8%, в среднем - 17.6%. Изменение интенсивности флуоресценции опухоли при проведении фотодинамической терапии показано на фиг.6. Патоморфологическое исследование опухоли после фотодинамической терапии выявило дистрофические изменения ткани, такие как вакуолизацию цитоплазмы в большинстве клеток, изменение размеров ядра, отек ядра, многочисленные разрывы ядерных и цитоплазматических мембран.
Пример 11
Животное - иммунодефицитная мышь, самка, массой 19.3 г с привитой опухолью рак шейки матки человека, размером 3.9 мм, расположенной подкожно в области бедра. Опухолевые клетки генетической модификации не подвергались, в результате опухоль не содержала фотосенсибилизатора - генетически-кодируемого белка KillerRed.
Флуоресцентное наблюдение опухоли и фотодинамическую терапию выполняли аналогично примеру 1.
На полученных флуоресцентных изображениях опухоль не идентифицировалась.
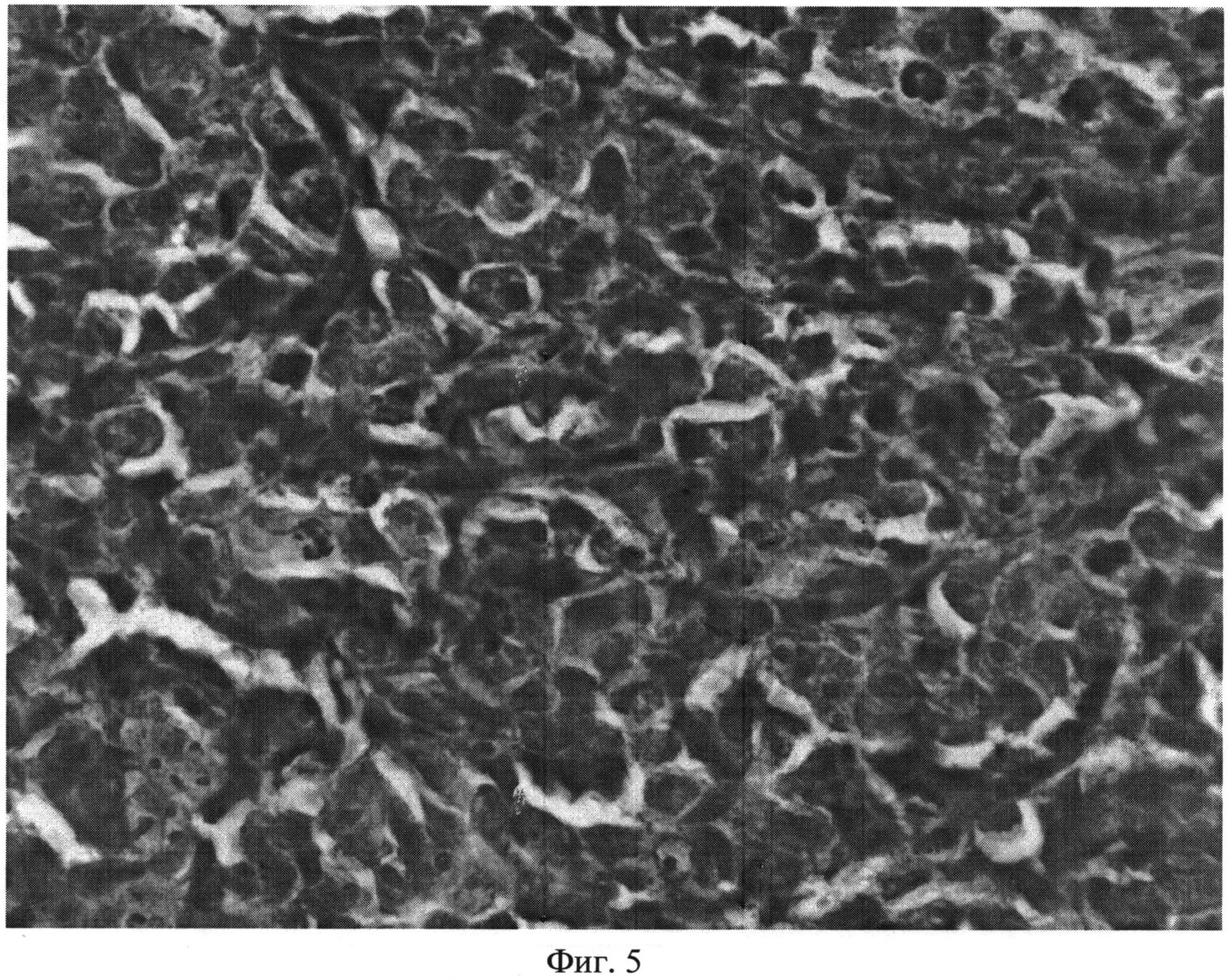
В облученной опухоли без введенного гена и не экспрессирующей белок KillerRed не выявлено значительных изменений структуры. Ткань опухолевого узла оставалась плотной, отмечено лишь незначительное увеличение доли дистрофически измененных клеток. Морфометрический анализ ткани опухоли после лечения показал, что опухолевая ткань содержит небольшое количество (18%) дистрофически измененных клеток, однако эти изменения отличаются от случаев, когда опухоль содержит белок KillerRed (примеры 1-8). В леченой опухоли без белка дистрофические изменения представляют собой в основном вакуолизацию цитоплазмы и незначительное изменение размеров клеток, что не критично для жизнедеятельности клетки и может носить обратимый характер. Предположительно, это может быть связано с фотоактивацией эндогенных хромофоров или слабыми тепловыми эффектами (повышение температуры опухоли сразу после облучения было порядка 1.3°C). Гистологическое изображение опухолевой ткани, не экспрессирующей белок KillerRed, после фотодинамической терапии показано на фиг.5.
Как видно из полученных результатов, предлагаемый способ является эффективным, обеспечивая высокую селективность воздействия фотосенсибилизатора на опухоль, при низкой токсической нагрузке на нормальные жизненно-важные органы и ткани и не требует при этом постоянного дозиметрического контроля при проведении терапии.
Источники информации:
1. Kessel D. Photodynamic therapy of neoplastic disease / CRC Press, 1990.
2. ISBN: 9780849358166, p.280.
2. Berg K., Selbo P.K., Weyergang A. et al. Porphyrin-related photosensitizers for cancer imaging and therapeutic applications /// Journal of Microscopy. 2005, Vol.218, p.133.
3. Josefsen L.B., Boyle R.W. Photodynamic therapy and the development of metal-based photosensitisers / Metal-Based Drugs. 2008, Vol.2008, p.23.
4. T. Hasan, B. Ortel, A. C.E. Moor, and B.W. Pogue, Chapter 40 Photodynamic Therapy of Cancer in Holland-Frei Cancer Medicine, 6th edition, Edited by Donald W Kufe et al. Hamilton (ON): ВС Decker; 2003. ISBN-10: 1-55009-213-8, p.605.
5. Гельфонд М.Л. Фотодинамичнеская терапия в онкологии // Практическая онкология, 2007, 8 (4), с.204.
6. Чиссов В.И., Соколов В.В., Булгакова Н.Н., Филоненко Е.В. Флуоресцентная эндоскопия, дермаскопия и спектрофотометрия в диагностике злокачественных опухолей основных локализаций // РБЖ., 2003, 2 (4), с.45.
7. P. Mroz, A. Yaroslavsky, G.B Kharkwal and M.R. Hamblin Cell Death Pathways in Photodynamic Therapy of Cancer // Cancers, 2011, 3, p.2516.
8. N.L. Oleinick, R.L. Morris and A.L. Nieminen Chapter 27. Photodynamic therapy-induced apoptosis in Apoptosis, Senescence and Cancer, Gewirtz, David A.; Holt, Shawn E.; Grant, Steven (Eds.) 2nd ed., 2007, XVII, p.599.
9. Залесский B.H., Дынник О.Б. Молекулярная медицина: трансформация процессов внутриклеточной релокализации фотосенсибилизаторов как резерв эффективности их фототоксического действия / Украинский медицинский журнал, 1 (45), 2005, с.92.
10. D. Nowis, М. Makowski, Т. ł Stokłosa, et al Direct tumor damage mechanisms of photodynamic therapy // Acta Biochim Pol. 2005; 52 (2), p.339.
11. C.J. Gomer, A. Ferrario Tissue distribution and photosensitizing properties of mono-L-aspartyl chlorin e6 in a mouse tumor model // Canc. Res. 1990. 50, p.3985.
12. B.W. Pogue, T. Hasan, Targeting in Photodynamic Therapy and Photo-Imaging // Optics & Photonics News, Aug. 2003, p.36.
13. Е.В. Кочнева, B.A. Привалов, A.B. Лаппа «Результаты II фазы клинического исследования фотосенсибилизатора второго поколения «Радахлорин®» раствор для внутривенного введения 0,35% у больных базально-клеточным раком кожи» // Известия Челябинского научного центра, вып.2 (23), 2004, с.167.
14. N. Brasseur, R. Ouellet, С. La Madeleine and JE van LierWater-soluble aluminium phthalocyanine-polymer conjugates for PDT: photodynamic activities and pharmacokinetics in tumour-bearing mice British Journal of Cancer (1999) 80 (10), p.1533.
15. Yu. S. Romanko, A.F. Tsyb, M.A. Kaplan, and V.V. Popuchiev Relationship between Antitumor Efficiency of Photodynamic Therapy with Photoditasine and Photoenergy Density / Bulletin of Experimental Biology and Medicine, Vol.139, No.4, 2005, p.460.
16. Прототип. Смирнова З.С., Оборотова H.А., Макарова О.А., Орлова О.Л., Полозкова А.П., Кубасова И.Ю., Лукьянец Е.А., Меерович Г.А., Зимакова Н.И., Кузьмин С.Г., Ворожцов Г.Н., Барышников А.Ю. Эффективность и фармакокинетика липосомальной лекарственной формы фотосенсибилизатора "Фотосенс" на основе сульфофталоцианина алюминия // Химико-фармацевтический журн., №7, 2005, с.3.
17. М.Е. Bulina, D.M. Chudakov, O.V. Britanova et al. A genetically encoded photosensitizer // Nat Biotechnol. 2006, 24 (1), p.95.
18. S. Pletnev, N.G. Gurskaya, N.V. Pletneva et al. Structural Basis for Phototoxicity of the Genetically Encoded Photosensitizer KillerRed // J. Biol. Chem. 2009, 284, 46, p.32028.
19. R.B. Vegh, K.M. Solntsev, M.K. Kuimova et al. Reactive oxygen species in photochemistry of the red fluorescent protein "Killer Red" // Chem. comm., 2011, 47 (17), p.4887.
20. M.E Bulina, D.M. Chudakov, O.V. Britanova, Y.G. Yanushevich, D.B. Staroverov, T.V. Chepurnykh, E.M. Merzlyak, M.A. Shkrob, S. Lukyanov, K.A. Lukyanov, A genetically encoded photosensitizer // Nat. Biotech. 24 (1), 2006, p.95.
21. M.V. Shirmanova, E.O. Serebrovskaya, K.A. Lukyanov, L.B. Snopova, M.A. Sirotkina, N.N. Prodanetz, M.L. Bugrova, E.A. Minakova, I.V. Turchin, V.A. Kamensky, S.A. Lukyanov, and E.V. Zagaynova Phototoxic effects of fluorescent protein KillerRed on tumor cells in mice / J. Biophotonics, 2013, 6 (3), p.283.