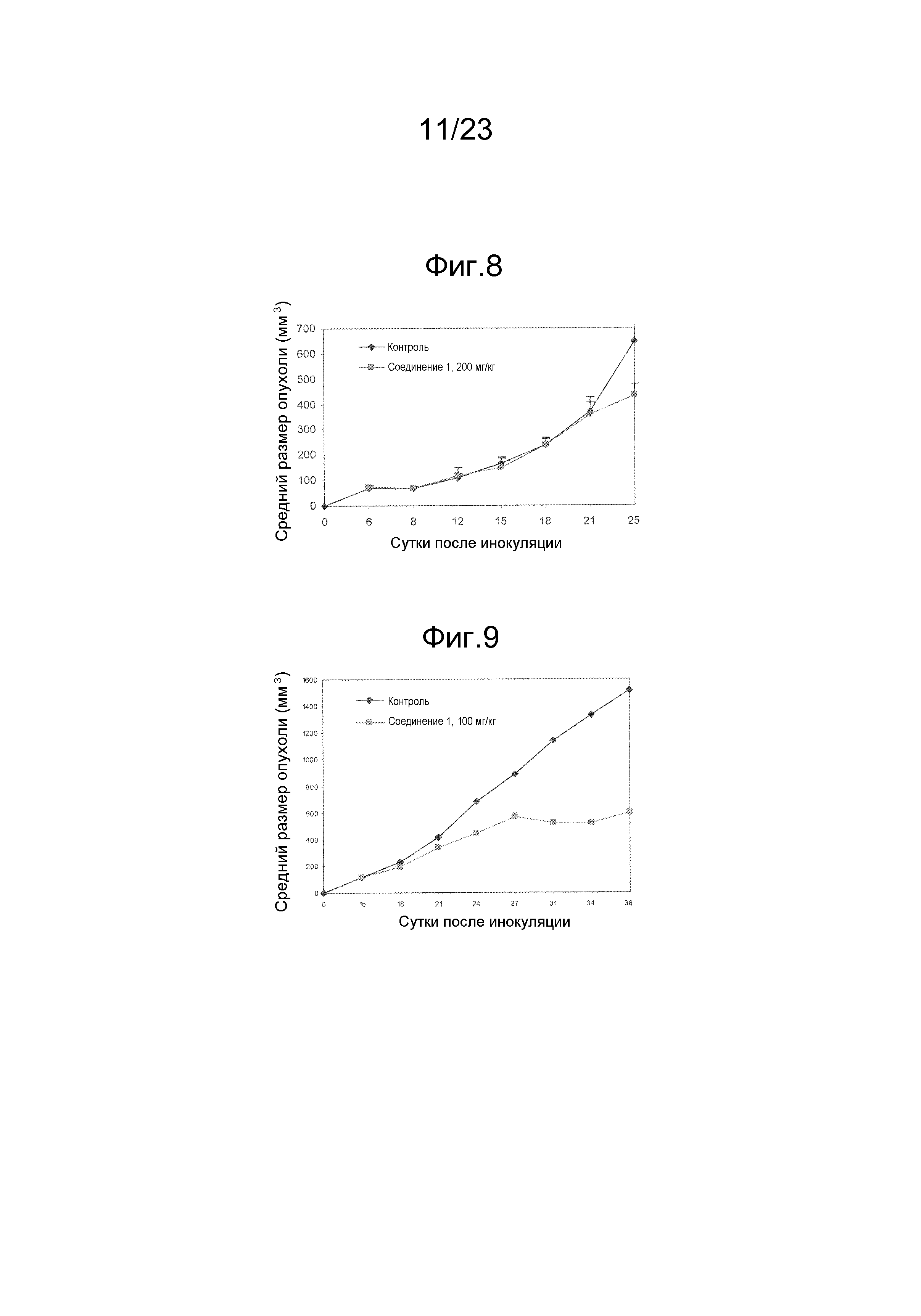
Результат интеллектуальной деятельности: НОВЫЕ СПОСОБЫ НАПРАВЛЕННОГО ВОЗДЕЙСТВИЯ НА РАКОВЫЕ СТВОЛОВЫЕ КЛЕТКИ
Вид РИД
Изобретение
РОДСТВЕННЫЕ ЗАЯВКИ
[0001] По настоящей заявке испрашивается приоритет предварительной заявки США № 61/315886, поданной 19 марта 2010 года; предварительной заявки США № 61/315890, поданной 19 марта 2010 года, и предварительной заявки США № 61/325814, поданной 19 апреля 2010 года. Таким образом, содержание каждой из этих заявок полностью включено путем ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0002] Изобретение относится к нафтофурановым соединениям, полиморфам нафтофурановых соединений, нафтофурановым соединениям в форме частиц, очищенным композициям, содержащим одно или несколько нафтофурановых соединений, очищенным композициям, содержащим одно или несколько нафтофурановых соединений в форме частиц, способам получения этих нафтофурановых соединений, полиморфов, очищенных композиций и/или форм в виде частиц и к способам применения этих нафтофурановых соединений, полиморфов, очищенных композиций и/или форм в виде частиц для лечения нуждающихся в этом индивидуумов.
УРОВЕНЬ ТЕХНИКИ, ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ
[0003] Смертельные исходы вследствие рака только в Соединенных Штатах Америки насчитывают сотни тысяч ежегодно. Несмотря на успехи в лечении конкретных форм рака посредством хирургии, лучевой терапии и химиотерапии, множество типов рака по существу являются неизлечимыми. Даже когда эффективное лечение для конкретного рака доступно, побочные эффекты такого лечения могут являться тяжелыми и приводить к значительному ухудшению качества жизни.
[0004] Большинство общепринятых химиотерапевтических средств обладают токсичностью и ограниченной эффективностью, в частности, для пациентов с солидными опухолями на поздних стадиях. Химиотерапевтические средства вызывают разрушение нераковых клеток, а также раковых клеток. Терапевтический индекс таких соединений (мера способности лечения к различению раковых и нормальных клеток) может являться очень низким. Часто доза химиотерапевтического лекарственного средства, которая является эффективной для уничтожения раковых клеток, также может уничтожать нормальные клетки, особенно те нормальные клетки (такие как эпителиальные клетки), которые часто претерпевают деление клеток. Когда терапия действует на нормальные клетки, могут возникать такие побочные эффекты как выпадение волос, подавление гемопоэза и тошнота. В зависимости от общего состояния здоровья пациента, такие побочные эффекты могут препятствовать проведению химиотерапии, или, по меньшей мере, могут являться крайне неприятными и некомфортабельными для пациента и существенно снижать качество жизни пациентов с раком. Даже для пациентов с раком, поддающимися химиотерапии с регрессией опухоли, такой ответ опухоли часто не сопровождается продлением выживаемости без прогрессирования (PFS) или продлением общей выживаемости (OS). Фактически, рак после начального ответа на химиотерапию часто быстро прогрессирует и образует больше метастазов. Такой рецидивирующий рак становится высоко устойчивым или невосприимчивым к химиотерапевтическим средствам. Полагают, что такие быстрые рецидивы и невосприимчивость после химиотерапии обусловлены раковыми стволовыми клетками.
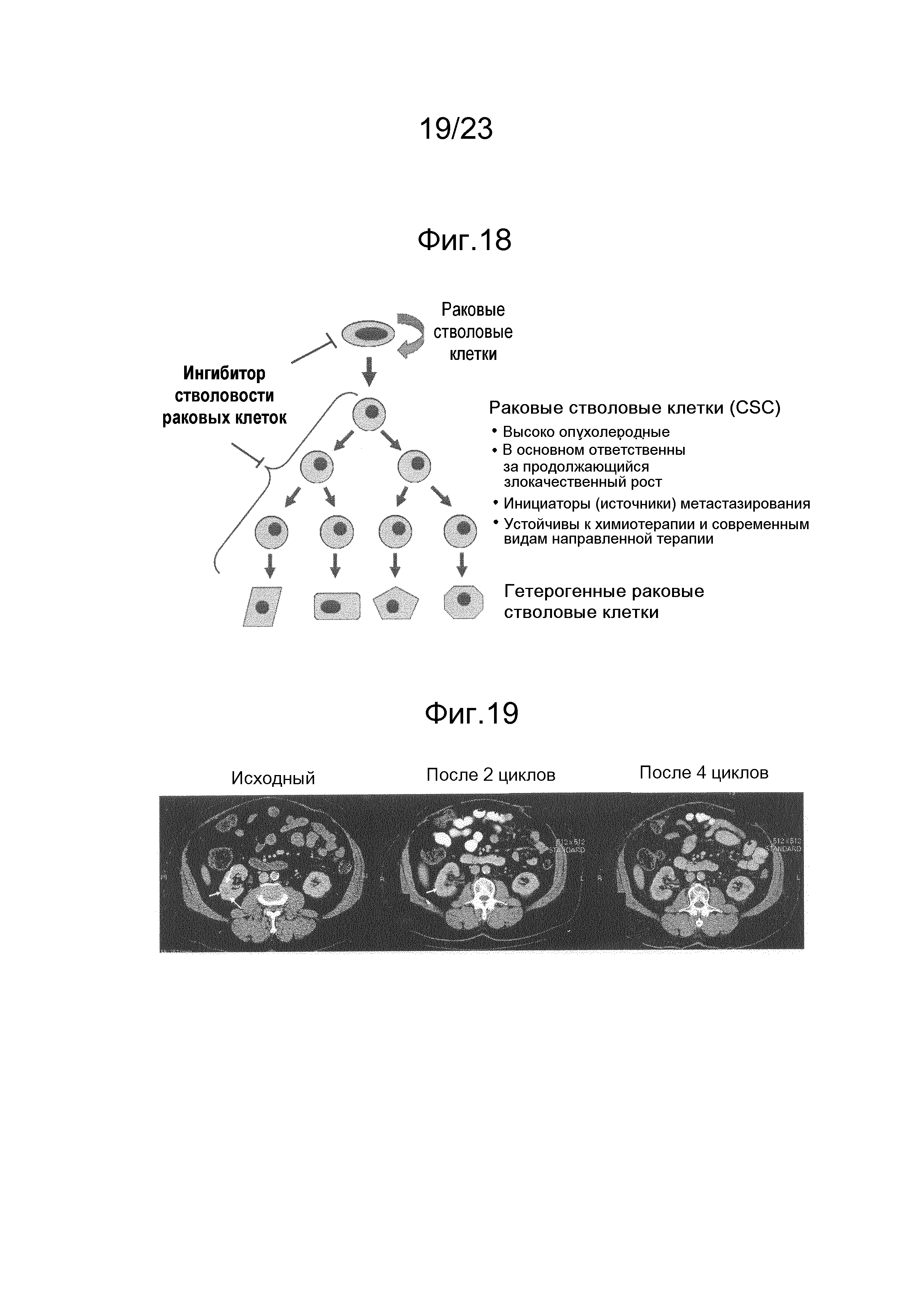
[0005] Недавние исследования позволили выявить существование раковых стволовых клеток (CSC, также называемых инициирующими опухоли клетками или раковыми стволоподобными клетками), обладающих способностью к самоподдержанию, и, полагают, что они в основном ответственны за рост, рецидивы и метастазирование. Важным является то, что CSC по существу устойчивы к общепринятым лекарственным средствам. Таким образом, направленное средство с активностью против раковых стволовых клеток дает большие перспективы для пациентов с раком (J. Clin. Oncol. 2008 Jun 10;26(17)). Таким образом, общепринятые химиотерапевтические средства могут уничтожать основную массу раковых клеток, но не затрагивают раковые стволовые клетки. Раковые стволовые клетки после снижения количества не стволовых, обычных раковых клеток посредством химиотерапии могут расти быстрее, что рассматривают в качестве механизма быстрого рецидивирования после химиотерапии.
[0006] STAT3 представляет собой онкоген, активируемый в ответ на цитокины и/или факторы роста для стимуляции пролиферации, выживаемости и других биологических процессов. STAT3 активируется посредством фосфорилирования ответственного остатка тирозина, опосредуемого рецепторными тирозинкиназами факторов роста, Янус-киназами или киназами семейства Src. После фосфорилирования тирозина, STAT3 образует гомодимеры и перемещается в ядро, связывается со специфическими отвечающими элементами ДНК в промоторах генов-мишеней и индуцирует экспрессию генов. STAT3 активирует гены, вовлеченные в образование, инвазию и метастазирование, включая Bcl-xl, Akt, c-Myc, циклин D1, VEGF и сурвивин. STAT3 обладает нарушенной активностью в широком спектре рака человека, включая все основные карциномы, а также некоторые гематологические опухоли. Постоянно активный STAT3 образуется более чем в половине видов рака груди и легких, колоректального рака, рака яичников, печеночно-клеточной карциномы и множественной миеломы и т.д.; и более чем в 95% видов рака головы/шеи. Полагают, что STAT3 является одним из основных механизмов устойчивости раковых клеток к лекарственным средствам. Однако доказано, что STAT3 является трудной мишенью для выявления фармацевтического ингибитора. До настоящего времени после десятилетий усилий в этой области прямого ингибитора STAT3 с клинически значимой активностью не идентифицировано.
[0007] Таким образом, существует необходимость выявления соединений и фармацевтических композиций для избирательного направленного воздействия на раковые клетки, для направленного воздействия на раковые стволовые клетки и для ингибирования STAT3, и в способах получения этих соединений и фармацевтических композиций для клинического применения.
[0008] Цитируемые в настоящем документе ссылки не считают известным уровнем техники для описываемого в заявке изобретения.
СУЩНОСТЬ
[0009] Изобретение относится к нафтофурановым соединениям, полиморфам нафтофурановых соединений, очищенным композициям, содержащим одно или несколько нафтофурановых соединений, и к нафтофурановым соединениям в форме частиц. Эти нафтофурановые соединения (включая нафтофурановые соединения в форме частиц), полиморфы и очищенные композиции являются избирательными ингибиторами раковых стволовых клеток и STAT3. В WO 2009/036099 и WO 2009/036101 описано, что мишенью нафтофурановых соединений являются раковые стволовые клетки. Они также ингибируют нестволовые раковые клетки, ингибируя STAT3. Эти соединения способны уничтожать множество различных типов раковых клеток, не вызывая повреждения нормальных клеток в конкретных условиях воздействия. Таким образом, эти соединения можно использовать для лечения рака, особенно для лечения и предотвращения рефрактерных, рецидивирующих, метастатических раков или экспрессирующих STAT3 раков. В публикациях также описаны способы получения нафтофурановых соединений, их производных и промежуточных соединений, и фармацевтическая композиция соответствующих соединений.
[0010] Эти нафтофурановые соединения (включая нафтофурановые соединения в форме частиц), полиморфы и очищенные композиции, описываемые в настоящем документе, пригодны при множестве показаний, включая, например, лечение, задержку прогрессирования, предотвращение рецидива или ослабления симптомов нарушения клеточной пролиферации. Например, нафтофурановые соединения (включая нафтофурановые соединения в форме частиц), полиморфы и очищенные композиции являются пригодными для лечения, задержки прогрессирования, предотвращения рецидива, ослабления симптомов или иным образом улучшения состояния при раке.
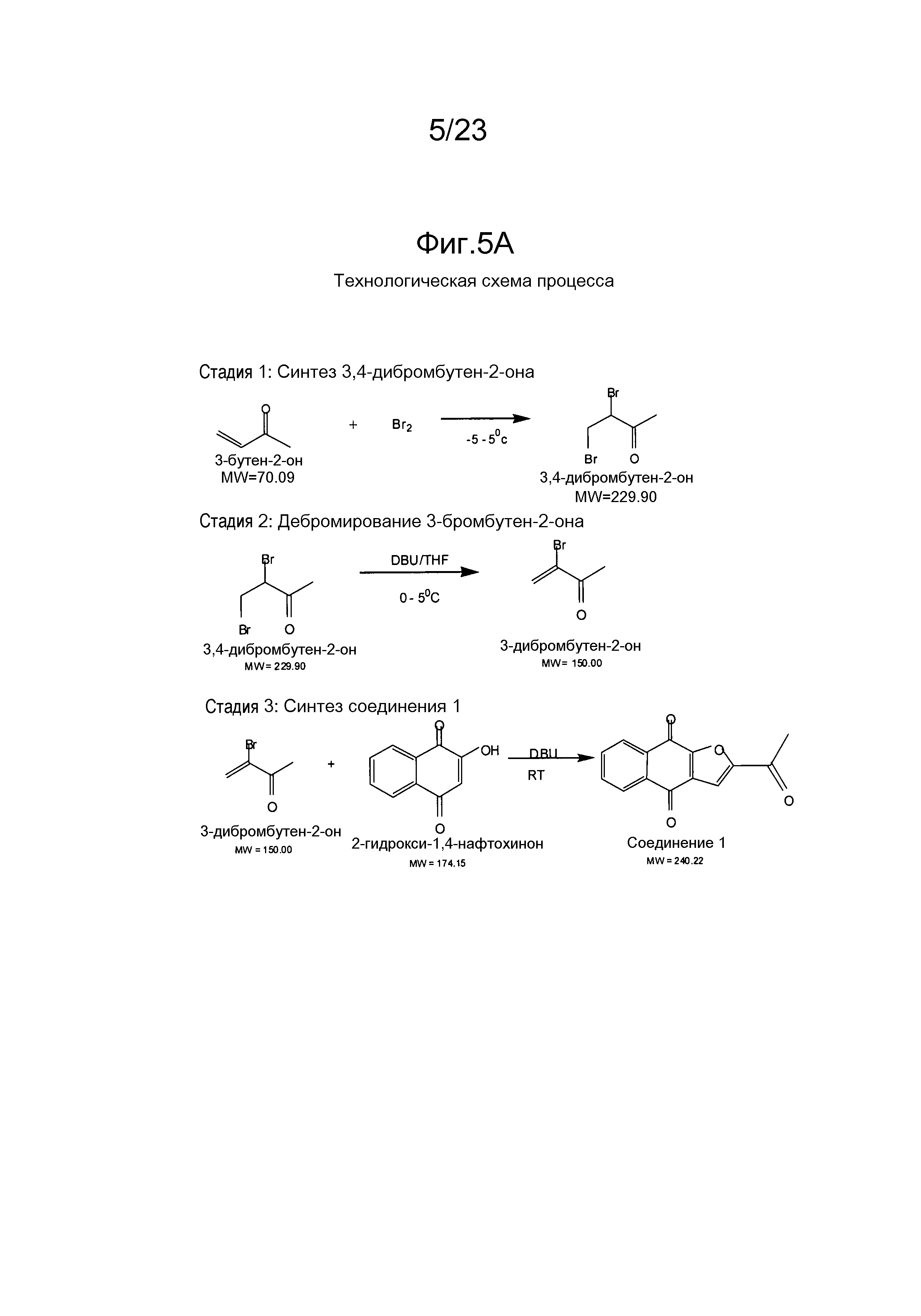
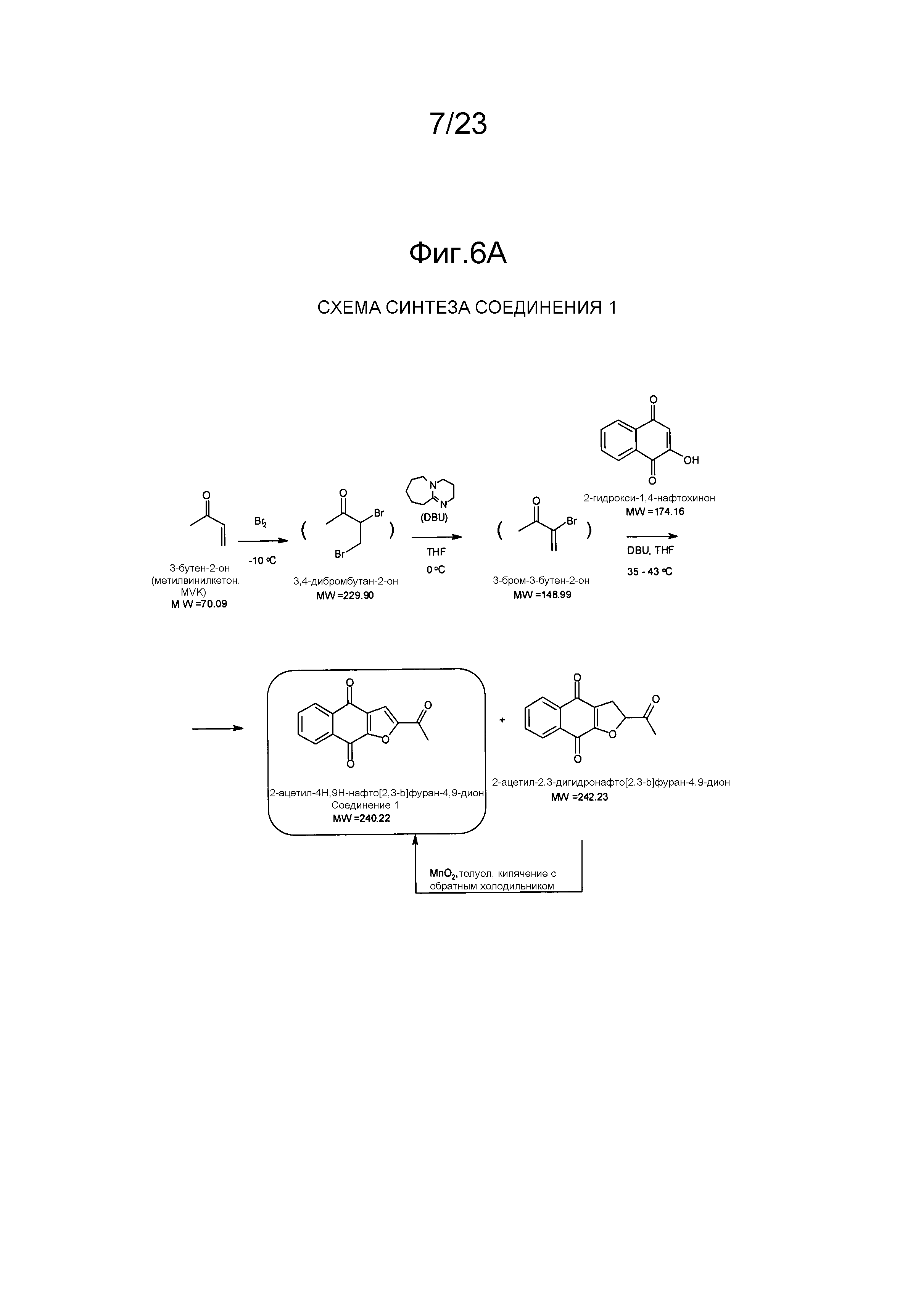
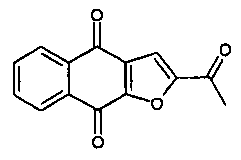
[0011] В некоторых вариантах осуществления нафтофурановое соединение представляет собой полиморф приведенного ниже соединения, обозначаемого в настоящем документе как "соединение 1",
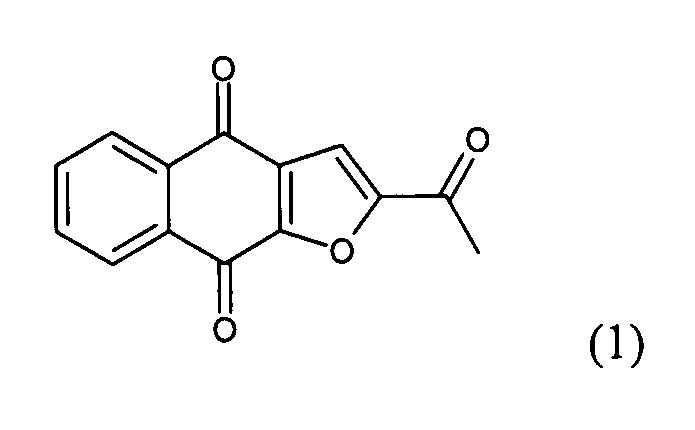
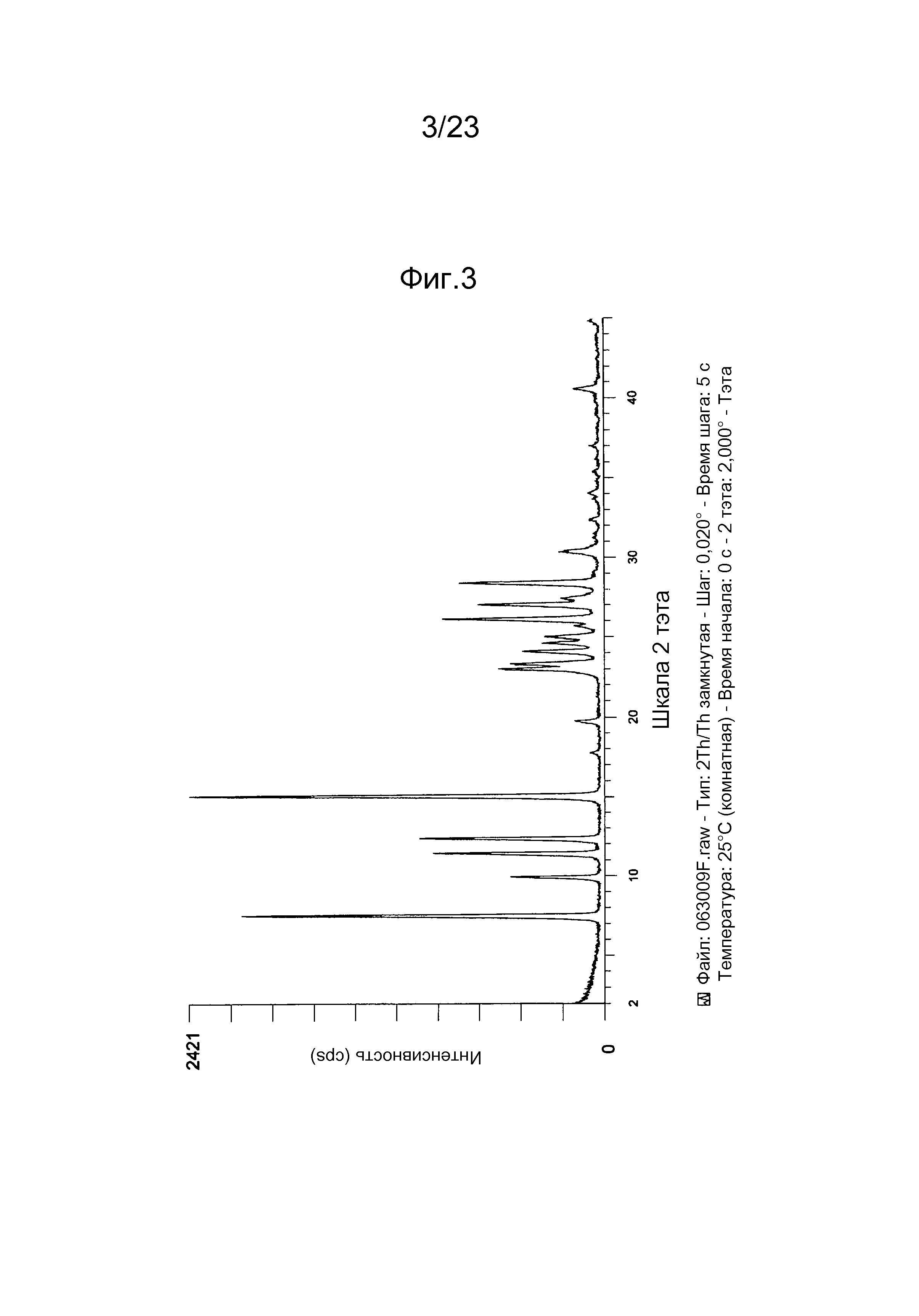
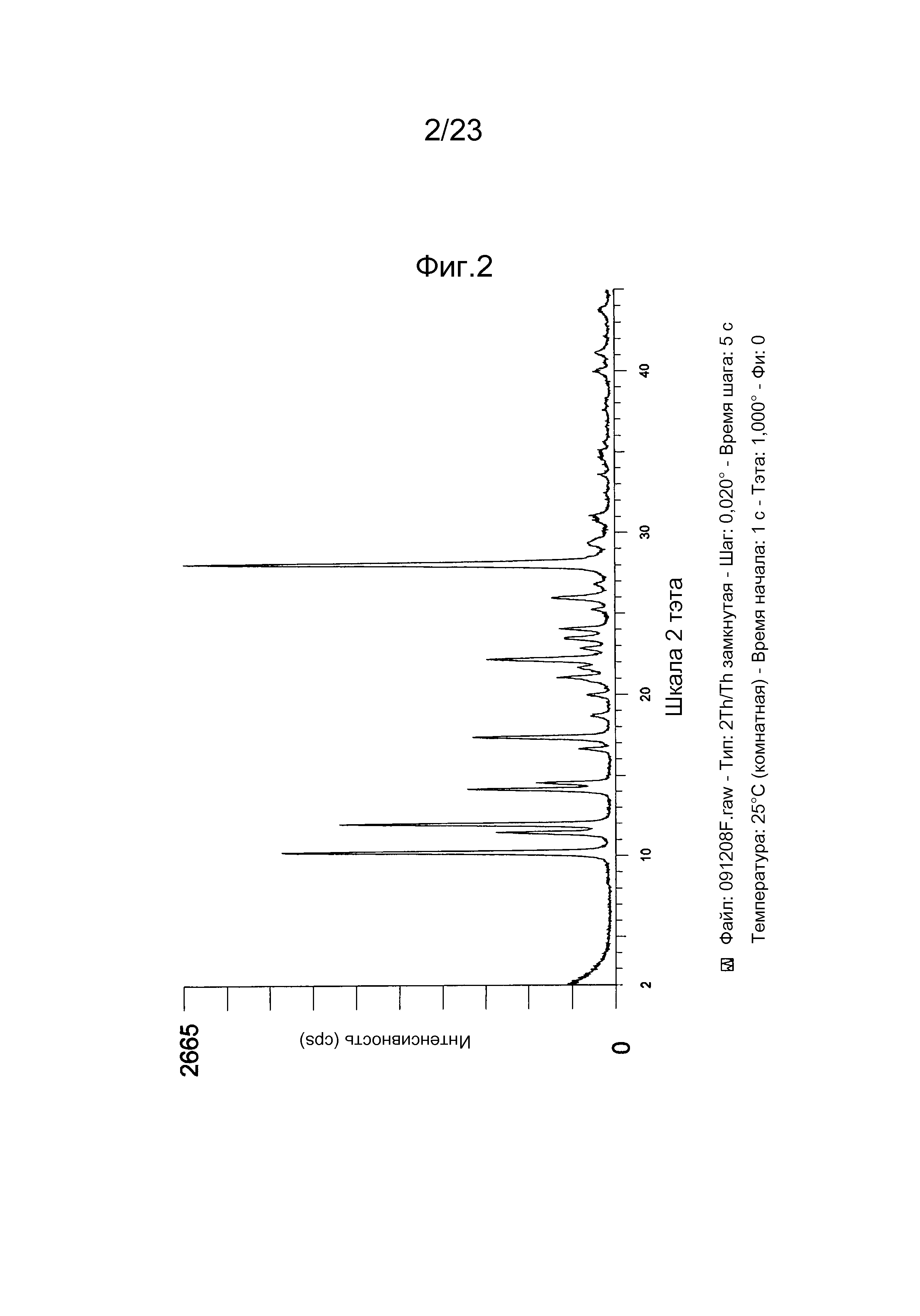
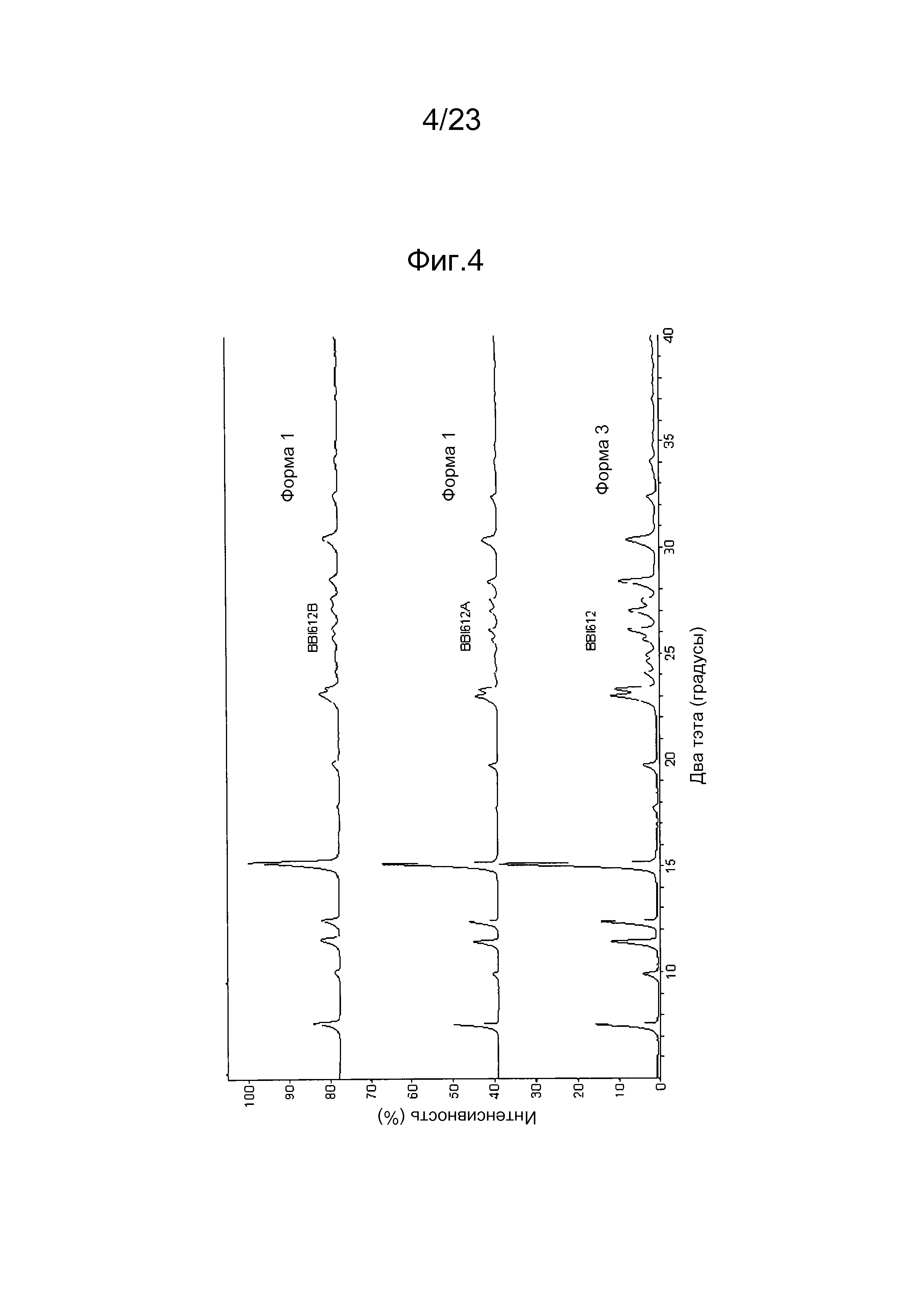
[0012] Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 1. Анализ дифракции рентгеновских лучей на порошке, приведенный на фигуре 1, проводили с использованием дифрактометра Philips PW1800 с использованием излучения Cu при 40 кВ/30мА в диапазоне от 5° до 70° с длиной шага 0,03° и временем подсчета 3 часа. Анализ проводили в диапазоне 2-тэта 2-45° с использованием следующих условий: щель расходимости: 0,6 мм, антирассеивающая щель: 0,6 мм, приемная щель: 0,1 мм, щель детектора: 0,6 мм, длина шага: 0,02°, время шага: 5 секунд. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 2. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 3. Анализ дифракция рентгеновских лучей на порошке, приведенный на фигурах 2 и 3, проводили с использованием дифрактометра Bruker D8 Advance. Анализ проводили в диапазоне 2-тэта 2-45° с использованием следующих условий: щель расходимости: 0,6 мм, антирассеивающая щель: 0,6 мм, приемная щель: 0,1 мм, щель детектора: 0,6 мм, длина шага: 0,02°, время шага: 5 секунд.
[0013] Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 10,2, 11,4, 11,9, 14,1, 14,5, 17,3, 21,0, 22,2, 24,0, 26,0 и 28,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 10,2, 11,9, 14,1, 14,5, 17,3, 22,2, и/или 28,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 10,2 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 11,9 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 14,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 14,5 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 17,3 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 22,2 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 28,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей два или более пика из пика при 2Θ по меньшей мере приблизительно 10,2 градусов, пика при 2Θ по меньшей мере приблизительно 11,9 градусов, пика при 2Θ по меньшей мере приблизительно 14,1 градусов, пика при 2Θ по меньшей мере приблизительно 14,5 градусов, пика при 2Θ по меньшей мере приблизительно 17,3 градусов, пика при 2Θ по меньшей мере приблизительно 22,2 градусов и пика при 2Θ по меньшей мере приблизительно 28,1 градусов и любые их комбинации.
[0014] Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 7,5, 9,9, 11,4, 12,3, 15,0, 23,0, 23,3, 24,1, 24,6, 25,0, 26,1, 27,0 и 28,4 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 7,5, 9,9, 12,3, 15, 23,0, 23,3, 24,6 и/или 28,4 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 7,5 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 9,9 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 12,3 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 15 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 23 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 23,3 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 24,6 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 28,4 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей два или более пика из пика при 2Θ по меньшей мере приблизительно 7,5 градусов, пик при 2Θ по меньшей мере приблизительно 9,9 градусов, пик при 2Θ по меньшей мере приблизительно 15 градусов, пик при 2Θ по меньшей мере приблизительно 12,3 градусов, пик при 2Θ по меньшей мере приблизительно 23,0 градусов, пик при 2Θ по меньшей мере приблизительно 23,3 градусов, пик при 2Θ по меньшей мере приблизительно 24,6 градусов и пик при 2Θ по меньшей мере приблизительно 28,4 градусов и любые их комбинации.
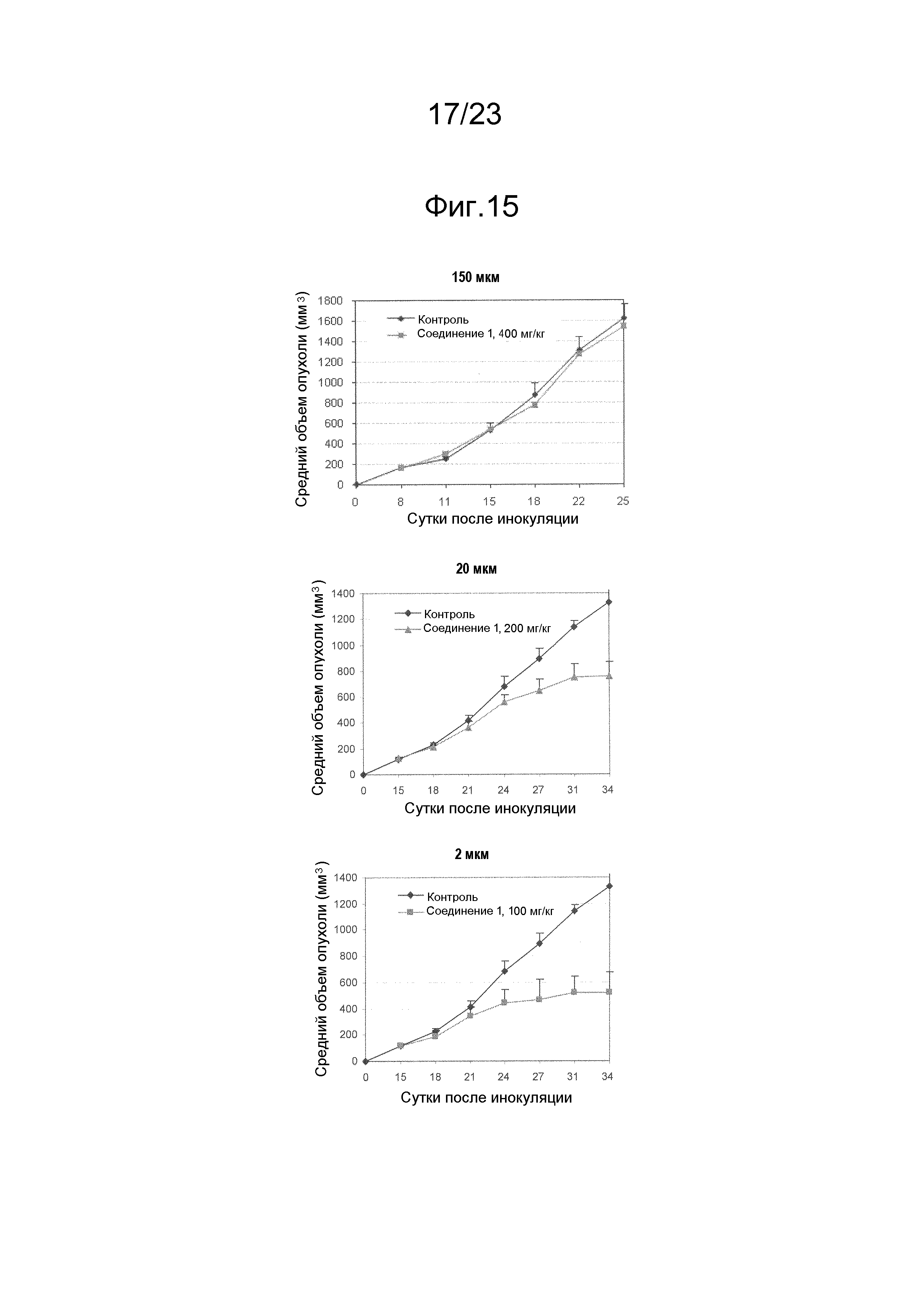
[0015] Настоящее изобретение также относится к нафтофурановым соединениям в форме частиц. Например, нафтофурановое соединение в форме частиц представляет собой частицу соединения формулы I, представленной ниже, которая является активной, т.е., обладает эффективностью и/или противоопухолевой активностью in vivo. У эффективных частицы или частиц существуют определенные требования к размеру частиц, например, их диаметр является меньшим или равным приблизительно 200 мкм, приблизительно 150 мкм, приблизительно 100 мкм, приблизительно 40 мкм или приблизительно 20 мкм, приблизительно 10 мкм, приблизительно 5 мкм, приблизительно 4 мкм, приблизительно 3 мкм, приблизительно 2 мкм, приблизительно 1 мкм, приблизительно 0,5 мкм или приблизительно 0,2 мкм. Частица или частицы, превышающие определенный размер частиц, являются или неактивными, или менее активными.
[0016] В некоторых вариантах осуществления нафтофурановое соединение в форме частиц представляет собой частицы соединения формулы I или его соли или сольвата,
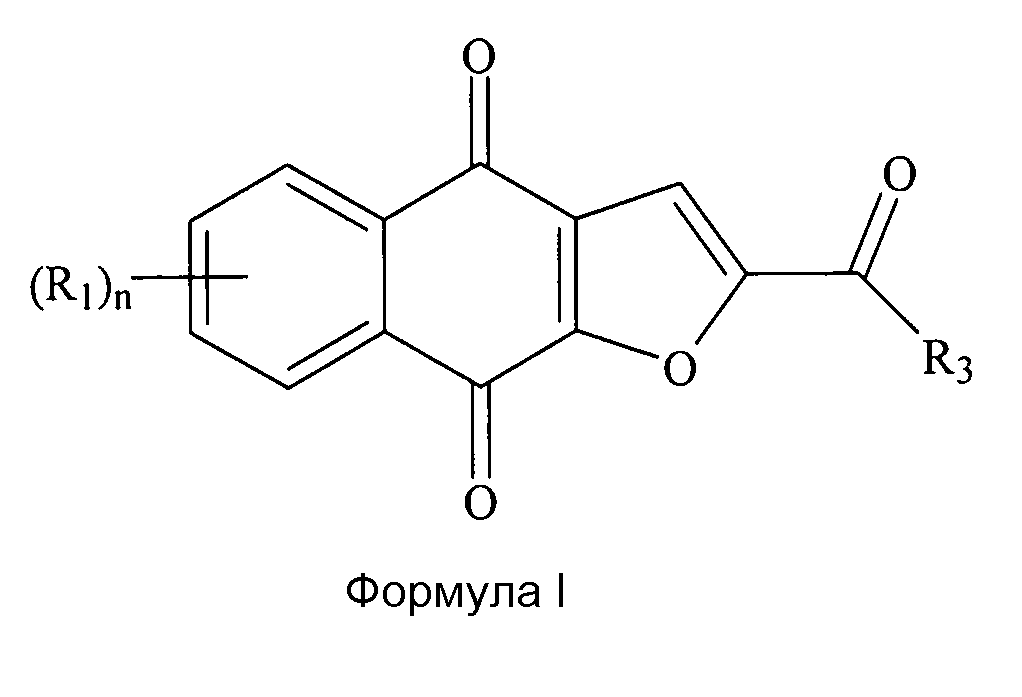
где диаметр частиц является меньшим или равным приблизительно 200 мкм; где каждый (R1) независимо выбран из группы, состоящей из водорода, галогена, фтора, циано, нитро, CF3, OCF3, алкила, метила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, гетероцикла, замещенного гетероцикла, арила, замещенного арила, ORa, SRa и NH2, где n представляет собой 4; где R3 выбран из группы, состоящей из водорода, галогена, фтора, циано, CF3, OCF3, алкила, метила, замещенного алкила, галоген-замещенного алкила, гидроксил-замещенного алкила, амин-замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, гетероцикла, замещенного гетероцикла, арила, замещенного арила, ORa, SRa и NRbRc; где Ra независимо выбран из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, гетероцикла, замещенного гетероцикла, арила и замещенного арила; и где Rb и Rc независимо выбраны из группы, состоящей из водорода, алкила, замещенного алкила, циклоалкила, замещенного циклоалкила, гетероцикла, замещенного гетероцикла, арила и замещенного арила, или Rb и Rc вместе с N, с которым они связаны, формируют гетероцикл или замещенный гетероцикл.
[0017] В некоторых вариантах осуществления каждый (R1) независимо выбран из группы, состоящей из водорода, метила, F (фтора), Cl, Br, I, OH и NH2; R3 выбран из группы, состоящей из метила и C(R8)3, и каждый (R8) независимо выбран из группы, состоящей из водорода, метила, F (фтора), Cl, Br, I, OH и NH2. В некоторых вариантах осуществления не более двух из (R1) и (R8) представляют собой F (фтор), а оставшиеся представляют собой водород. В некоторых вариантах осуществления R3 представляет собой метил. В дополнительном варианте осуществления соединение выбрано из группы, состоящей из 2-(1-гидроксиэтил)нафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-диона, 2-ацетилнафто[2,3-b]фуран-4,9-диона, 2-этилнафто[2,3-b]фуран-4,9-диона их энантиомеров, диастереоизомеров, таутомеров и солей или сольватов.
[0018] В некоторых вариантах осуществления нафтофурановое соединение в форме частиц представляет собой частицу соединения 1.
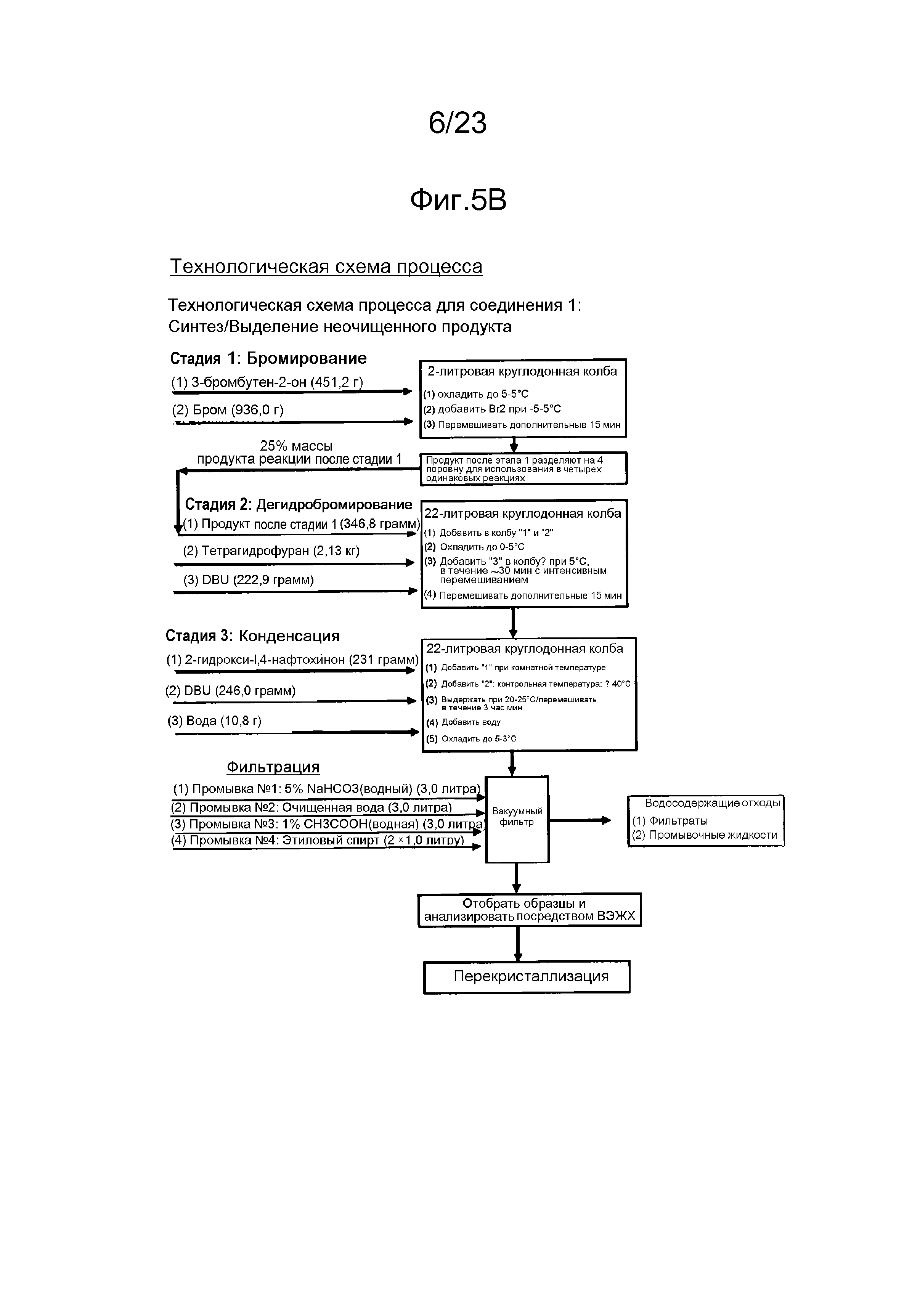
[0019] В некоторых вариантах осуществления нафтофурановое соединение в форме частиц представляет собой частицу полиморфа соединения 1. Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 1. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 2. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 3.
[0020] Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 10,2, 11,4, 11,9, 14,1, 14,5, 17,3, 21,0, 22,2, 24,0, 26,0 и 28,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 10,2, 11,9, 14,1, 14,5, 17,3, 22,2, и/или 28,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 10,2 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 11,9 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 14,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 14,5 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 17,3 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 22,2 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 28,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей два или более пика из пика при 2Θ по меньшей мере приблизительно 10,2 градусов, пик при 2Θ по меньшей мере приблизительно 11,9 градусов, пик при 2Θ по меньшей мере приблизительно 14,1 градусов, пик при 2Θ по меньшей мере приблизительно 14,5 градусов, пик при 2Θ по меньшей мере приблизительно 17,3 градусов, пик при 2Θ по меньшей мере приблизительно 22,2 градусов и пик при 2Θ по меньшей мере приблизительно 28,1 градусов и любые их комбинации.
[0021] Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 7,5, 9,9, 11,4, 12,3, 15,0, 23,0, 23,3, 24,1, 24,6, 25,0, 26,1, 27,0 и 28,4 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 7,5, 9,9, 12,3, 15, 23,0, 23,3, 24,6 и/или 28,4 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 7,5 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 9,9 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 12,3 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 15 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 23 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 23,3 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 24,6 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 28,4 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей два или более пика из пика при 2Θ по меньшей мере приблизительно 7,5 градусов, пик при 2Θ по меньшей мере приблизительно 9,9 градусов, пик при 2Θ по меньшей мере приблизительно 15 градусов, пик при 2Θ по меньшей мере приблизительно 12,3 градусов, пик при 2Θ по меньшей мере приблизительно 23,0 градусов, пик при 2Θ по меньшей мере приблизительно 23,3 градусов, пик при 2Θ по меньшей мере приблизительно 24,6 градусов и пик при 2Θ по меньшей мере приблизительно 28,4 градусов и любые их комбинации.
[0022] В некоторых вариантах осуществления диаметр частиц является меньшим или равным приблизительно 160 мкм, приблизительно 150 мкм, приблизительно 120 мкм, приблизительно 100 мкм, приблизительно 50 мкм, приблизительно 40 мкм, или приблизительно 20 мкм. В дополнительном варианте осуществления диаметр частиц является меньшим или равным приблизительно 10 мкм, приблизительно 5 мкм, приблизительно 4 мкм, приблизительно 3 мкм, приблизительно 2 мкм, приблизительно 1 мкм, приблизительно 0,5 мкм, приблизительно 0,2 мкм или приблизительно 0,1 мкм.
[0023] Настоящее изобретение относится к частице или частицам нафтофуранового соединения, например, соединения формулы I, которые являются активными, т.е., обладают эффективностью и/или противоопухолевой активностью. Активная частица или частицы обладают определенным размером, например, их диаметр является меньшим или равным приблизительно 200 мкм, приблизительно 150 мкм, приблизительно 100 мкм, приблизительно 40 мкм, или приблизительно 20 мкм, приблизительно 10 мкм, приблизительно 5 мкм, приблизительно 4 мкм, приблизительно 3 мкм, приблизительно 2 мкм, приблизительно 1 мкм, приблизительно 0,5 мкм, приблизительно 0,2 мкм или приблизительно 0,1 мкм. Частица или частицы, превышающие определенный размер, являются неактивными или менее активными, чем частицы, описываемые в настоящем документе.
[0024] В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит частицы соединения, например, нафтофурана формулы I или его соли или сольвата. Например, в некоторых вариантах осуществления фармацевтическая композиция содержит частицы соединения 1. Например, в некоторых вариантах осуществления фармацевтическая композиция содержит частицы полиморфа соединения 1. Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 1. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 2. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 3.
[0025] Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 10,2, 11,4, 11,9, 14,1, 14,5, 17,3, 21,0, 22,2, 24,0, 26,0 и 28,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 10,2, 11,9, 14,1, 14,5, 17,3, 22,2, и/или 28,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 10,2 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 11,9 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 14,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 14,5 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 17,3 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 22,2 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 28,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей два или более пика из пика при 2Θ по меньшей мере приблизительно 10,2 градусов, пик при 2Θ по меньшей мере приблизительно 11,9 градусов, пик при 2Θ по меньшей мере приблизительно 14,1 градусов, пик при 2Θ по меньшей мере приблизительно 14,5 градусов, пик при 2Θ по меньшей мере приблизительно 17,3 градусов, пик при 2Θ по меньшей мере приблизительно 22,2 градусов и пик при 2Θ по меньшей мере приблизительно 28,1 градусов и любые их комбинации.
[0026] Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 7,5, 9,9, 11,4, 12,3, 15,0, 23,0, 23,3, 24,1, 24,6, 25,0, 26,1, 27,0 и 28,4 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 7,5, 9,9, 12,3, 15, 23,0, 23,3, 24,6 и/или 28,4 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 7,5 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 9,9 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 12,3 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 15 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 23 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 23,3 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 24,6 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 28,4 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей два или более пика из пика при 2Θ по меньшей мере приблизительно 7,5 градусов, пик при 2Θ по меньшей мере приблизительно 9,9 градусов, пик при 2Θ по меньшей мере приблизительно 15 градусов, пик при 2Θ по меньшей мере приблизительно 12,3 градусов, пик при 2Θ по меньшей мере приблизительно 23,0 градусов, пик при 2Θ по меньшей мере приблизительно 23,3 градусов, пик при 2Θ по меньшей мере приблизительно 24,6 градусов и пик при 2Θ по меньшей мере приблизительно 28,4 градусов и любые их комбинации.
[0027] Диаметр фракции суммарной совокупности частиц может быть меньшим или равным приблизительно 200 мкм. В некоторых вариантах осуществления фракция совокупности частиц может составлять по меньшей мере приблизительно 1%, по меньшей мере приблизительно 5%, по меньшей мере приблизительно 10%, по меньшей мере приблизительно 20% или по меньшей мере приблизительно 30% от общего количества частиц в совокупности. В некоторых вариантах осуществления фракция представляет собой значительную фракцию. Например, "значительная фракция" совокупности частиц может составлять по меньшей мере приблизительно 99%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 60% или по меньшей мере приблизительно 50% от общего количества частиц в совокупности. Каждый (R1) можно независимо выбирать из группы, состоящей из водорода, галогена, фтора, циано, нитро, CF3, OCF3, алкила, метила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, гетероцикла, замещенного гетероцикла, арила, замещенного арила, ORa, SRa и NH2. n может представлять собой положительное целое число; например, n может представлять собой 4. R3 можно выбирать из группы, состоящей из водорода, галогена, фтора, циано, CF3, OCF3, алкила, метила, замещенного алкила, галоген-замещенного алкила, гидроксил-замещенного алкила, амин-замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, гетероцикла, замещенного гетероцикла, арила, замещенного арила, ORa, SRa и NRbRc. Ra можно независимо выбирать из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, гетероцикла, замещенного гетероцикла, арила и замещенного арила. Rb и Rc можно независимо выбирать из группы, состоящей из водорода, алкила, замещенного алкила, циклоалкила, замещенного циклоалкила, гетероцикла, замещенного гетероцикла, арила и замещенного арила, или Rb и Rc вместе с N, с которым они связаны, формируют гетероцикл или замещенный гетероцикл.
[0028] В некоторых вариантах осуществления изобретения каждый (R1) можно независимо выбирать из группы, состоящей из водорода, метила, F (фтора), Cl, Br, I, OH и NH2. R3 можно выбирать из группы, состоящей из метила и C(R8)3. Каждый (R8) можно независимо выбирать из группы, состоящей из водорода, метила, F (фтора), Cl, Br, I, OH и NH2. В некоторых вариантах осуществления не более двух из (R1) и R8 могут представлять собой F (фтор), а оставшиеся представлять собой водород.
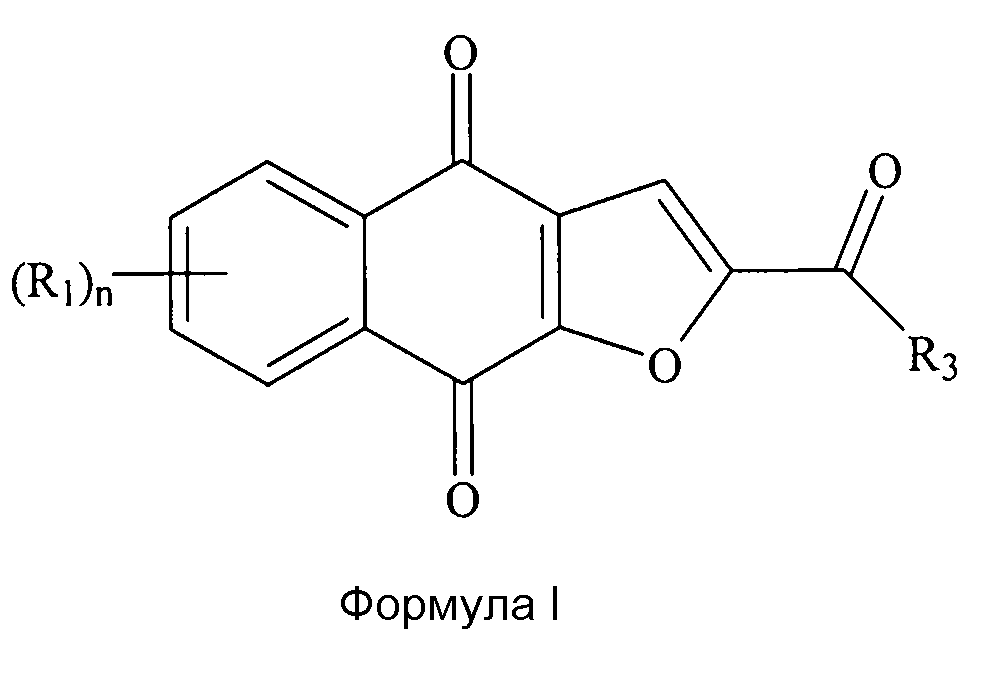
[0029] В некоторых вариантах осуществления изобретения соединение формулы I выбрано из группы, состоящей из 2-(1-гидроксиэтил)нафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-диона, 2-ацетилнафто[2,3-b]фуран-4,9-диона и 2-этилнафто[2,3-b]фуран-4,9-диона. В некоторых вариантах осуществления соединение формулы I представляет собой соединение 1. В некоторых вариантах осуществления соединение формулы I представляет собой полиморф соединения 1. Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 1. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 2. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 3.
[0030] Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 10,2, 11,4, 11,9, 14,1, 14,5, 17,3, 21,0, 22,2, 24,0, 26,0 и 28,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 10,2, 11,9, 14,1, 14,5, 17,3, 22,2, и/или 28,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 10,2 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 11,9 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 14,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 14,5 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 17,3 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 22,2 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 28,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей два или более пика из пика при 2Θ по меньшей мере приблизительно 10,2 градусов, пик при 2Θ по меньшей мере приблизительно 11,9 градусов, пик при 2Θ по меньшей мере приблизительно 14,1 градусов, пик при 2Θ по меньшей мере приблизительно 14,5 градусов, пик при 2Θ по меньшей мере приблизительно 17,3 градусов, пик при 2Θ по меньшей мере приблизительно 22,2 градусов и пик при 2Θ по меньшей мере приблизительно 28,1 градусов и любые их комбинации.
[0031] Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 7,5, 9,9, 11,4, 12,3, 15,0, 23,0, 23,3, 24,1, 24,6, 25,0, 26,1, 27,0 и 28,4 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 7,5, 9,9, 12,3, 15, 23,0, 23,3, 24,6 и/или 28,4 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 7,5 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 9,9 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 12,3 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 15 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 23 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 23,3 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 24,6 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 28,4 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей два или более пика из пика при 2Θ по меньшей мере приблизительно 7,5 градусов, пик при 2Θ по меньшей мере приблизительно 9,9 градусов, пик при 2Θ по меньшей мере приблизительно 15 градусов, пик при 2Θ по меньшей мере приблизительно 12,3 градусов, пик при 2Θ по меньшей мере приблизительно 23,0 градусов, пик при 2Θ по меньшей мере приблизительно 23,3 градусов, пик при 2Θ по меньшей мере приблизительно 24,6 градусов и пик при 2Θ по меньшей мере приблизительно 28,4 градусов и любые их комбинации.
[0032] Например, фармацевтическая композиция может содержать по меньшей мере приблизительно 90% суммарной совокупности частиц с размером частиц, меньшим или равным приблизительно 160 мкм, 100 мкм, 40 мкм, 20 мкм, 10 мкм, 5 мкм, 3 мкм или 2 мкм. Например, фармацевтическая композиция может содержать по меньшей мере приблизительно 50% суммарной совокупности частиц с размером частиц, меньшим или равным приблизительно 160 мкм, 100 мкм, 40 мкм, 20 мкм, 10 мкм, 5 мкм, 3 мкм, 2 мкм, 1 мкм или 0,5 мкм. Например, фармацевтическая композиция может содержать по меньшей мере приблизительно 10% суммарной совокупности частиц с размером частиц, меньшим или равным приблизительно 160 мкм, 100 мкм, 40 мкм, 20 мкм, 5 мкм, 2 мкм, 1 мкм, 0,5 мкм или 0,1 мкм. В фармацевтической композиции медианный диаметр частиц может являться, например, меньшим или равным приблизительно 160 мкм, 40 мкм, 20 мкм, 10 мкм, 5 мкм, 4 мкм 3 мкм, 2 мкм, 1 мкм, 0,5 мкм, 0,3 мкм или 0,2 мкм. Например, медианный диаметр частиц может составлять приблизительно от 0,2 мкм до приблизительно 50 мкм, или медианный диаметр может составлять приблизительно от 0,5 мкм до приблизительно 30 мкм. Например, фармацевтическая композиция может содержать суммарную совокупность частиц с отношением среднего диаметра к медианному диаметру не более чем приблизительно 2 мкм. Фармацевтическое изобретение может содержать частицы, содержащие соединение в кристаллическом состоянии по меньшей мере в двух различных полиморфных состояниях.
[0033] В некоторых вариантах осуществления фармацевтическая композиция содержит соединение формулы I или его полиморф в форме частиц, где частица или частицы составляют менее 20 микрон, 10 микрон, 5 микрон, 2 микрон, 1 микрон или 0,5 микрон.
[0034] Настоящее изобретение относится по существу к чистому соединению формулы II
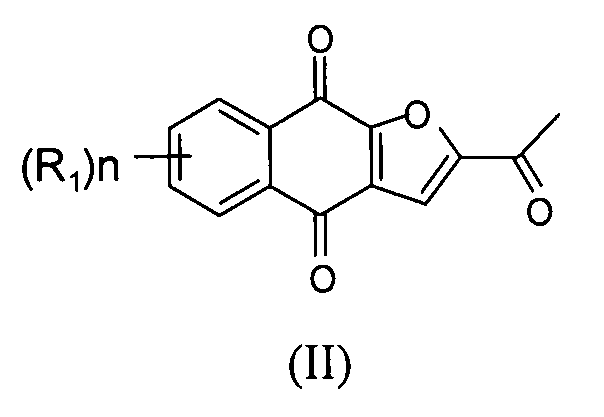
где каждый R1 независимо представляет собой H, Cl или F; и n представляет собой 0, 1, 2, 3 или 4. В некоторых вариантах осуществления соединение формулы II находится в форме частиц.
[0035] В некоторых вариантах осуществления по существу чистое соединение представляет собой соединение 1. В некоторых вариантах осуществления соединение 1 находится в форме частиц.
[0036] В некоторых вариантах осуществления по существу чистое соединение выбрано из группы, состоящей из 2-(1-гидроксиэтил)нафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-диона, 2-ацетилнафто[2,3-b]фуран-4,9-диона, 2-этилнафто[2,3-b]фуран-4,9-диона, моно-[1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового] эфира фосфорной кислоты, диметилового эфира 1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового эфира фосфорной кислоты их энантиомеров, диастереомеров, таутомеров и солей или сольватов.
[0037] В некоторых вариантах осуществления по существу чистое соединение представляет собой полиморф соединения 1. Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 1. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 2. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 3.
[0038] Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 10,2, 11,4, 11,9, 14,1, 14,5, 17,3, 21,0, 22,2, 24,0, 26,0 и 28,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 10,2, 11,9, 14,1, 14,5, 17,3, 22,2 и/или 28,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 10,2 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 11,9 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 14,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 14,5 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 17,3 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 22,2 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 28,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей два или более пика из пика при 2Θ по меньшей мере приблизительно 10,2 градусов, пик при 2Θ по меньшей мере приблизительно 11,9 градусов, пик при 2Θ по меньшей мере приблизительно 14,1 градусов, пик при 2Θ по меньшей мере приблизительно 14,5 градусов, пик при 2Θ по меньшей мере приблизительно 17,3 градусов, пик при 2Θ по меньшей мере приблизительно 22,2 градусов и пик при 2Θ по меньшей мере приблизительно 28,1 градусов и любые их комбинации.
[0039] Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 7,5, 9,9, 11,4, 12,3, 15,0, 23,0, 23,3, 24,1, 24,6, 25,0, 26,1, 27,0 и 28,4 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 7,5, 9,9, 12,3, 15, 23,0, 23,3, 24,6 и/или 28,4 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 7,5 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 9,9 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 12,3 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 15 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 23 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 23,3 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 24,6 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 28,4 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей два или более пика из пика при 2Θ по меньшей мере приблизительно 7,5 градусов, пик при 2Θ по меньшей мере приблизительно 9,9 градусов, пик при 2Θ по меньшей мере приблизительно 15 градусов, пик при 2Θ по меньшей мере приблизительно 12,3 градусов, пик при 2Θ по меньшей мере приблизительно 23,0 градусов, пик при 2Θ по меньшей мере приблизительно 23,3 градусов, пик при 2Θ по меньшей мере приблизительно 24,6 градусов и пик при 2Θ по меньшей мере приблизительно 28,4 градусов и любые их комбинации.
[0040] В некоторых вариантах осуществления полиморф соединения 1 находится в форме частиц.
[0041] В некоторых вариантах осуществления чистота соединения, продукта и/или фармацевтической композиции составляет по меньшей мере приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95% или приблизительно 99%. В некоторых вариантах осуществления чистота соединения, продукта и/или фармацевтической композиции составляет по меньшей мере приблизительно 95,5%, приблизительно 96%, приблизительно 96,5%, приблизительно 97%, приблизительно 97,5%, приблизительно 98%, приблизительно 98,5%, приблизительно 99% или приблизительно 99,5%. В некоторых вариантах осуществления чистота соединения, продукта и/или фармацевтической композиции составляет по меньшей мере приблизительно 99,1%, приблизительно 99,2%, приблизительно 99,3%, приблизительно 99,4%, приблизительно 99,5%, приблизительно 99,6%, приблизительно 99,7%, приблизительно 99,8% или приблизительно 99,9%.
[0042] В некоторых вариантах осуществления соединение, продукт и/или фармацевтическая композиция содержат не более чем приблизительно 10%, приблизительно 5%, приблизительно 1%, приблизительно 0,15% или приблизительно 0,5% примесей. В некоторых вариантах осуществления соединение, продукт и/или фармацевтическая композиция содержат каждой отдельной примеси не более чем приблизительно 0,5%, приблизительно 0,2%, приблизительно 0,15% или приблизительно 0,1%. В дополнительном варианте осуществления примеси представляют собой одно или несколько из группы, состоящей из 2-ацетил-2,3-дигидронафто[2,3-b]фуран-4,9-диона, 2,6-диацетил-нафто[2,3-b]фуран-4,9-диона, 2,7-диацетил-нафто[2,3-b]фуран-4,9-диона, 3-ацетилнафто[2,3-b]фуран-4,9-диона, нафто[2,3-b]фуран-4,9-диона, нафто[2,3-b]фуран-4,9-диона, нафто[2,3-b]фуран-4,9-диола и 1-(4,9-дигидроксинафто[2,3-b]фуран-2-ил)этанона.
[0043] В некоторых вариантах осуществления примеси включают остаточный растворитель. В некоторых вариантах осуществления растворитель выбран из группы, состоящей из этилацетата (EtOAc), толуола, этанола, метанола, хлороформа и CH2Cl2/гексана.
[0044] В некоторых вариантах осуществления чистоту определяют посредством ВЭЖХ (высокоэффективной жидкостной хроматографии). В некоторых вариантах осуществления чистоту определяют посредством ЯМР (ядерного магнитного резонанса). В дополнительном варианте осуществления чистоту определяют и посредством ВЭЖХ, и посредством ЯМР.
[0045] Изобретение также относится к полиморфу соединения 1 в форме частиц, где соединение находится в высокоочищенной форме, продукте и/или фармацевтической композиции. Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 1. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 2. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 3.
[0046] Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 10,2, 11,4, 11,9, 14,1, 14,5, 17,3, 21,0, 22,2, 24,0, 26,0 и 28,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 10,2, 11,9, 14,1, 14,5, 17,3, 22,2, и/или 28,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 10,2 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 11,9 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 14,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 14,5 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 17,3 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 22,2 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 28,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей два или более пика из пика при 2Θ по меньшей мере приблизительно 10,2 градусов, пик при 2Θ по меньшей мере приблизительно 11,9 градусов, пик при 2Θ по меньшей мере приблизительно 14,1 градусов, пик при 2Θ по меньшей мере приблизительно 14,5 градусов, пик при 2Θ по меньшей мере приблизительно 17,3 градусов, пик при 2Θ по меньшей мере приблизительно 22,2 градусов и пик при 2Θ по меньшей мере приблизительно 28,1 градусов и любые их комбинации.
[0047] Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 7,5, 9,9, 11,4, 12,3, 15,0, 23,0, 23,3, 24,1, 24,6, 25,0, 26,1, 27,0 и 28,4 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 7,5, 9,9, 12,3, 15, 23,0, 23,3, 24,6 и/или 28,4 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 7,5 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 9,9 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 12,3 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 15 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 23 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 23,3 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 24,6 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 28,4 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей два или более пика из пика при 2Θ по меньшей мере приблизительно 7,5 градусов, пик при 2Θ по меньшей мере приблизительно 9,9 градусов, пик при 2Θ по меньшей мере приблизительно 15 градусов, пик при 2Θ по меньшей мере приблизительно 12,3 градусов, пик при 2Θ по меньшей мере приблизительно 23,0 градусов, пик при 2Θ по меньшей мере приблизительно 23,3 градусов, пик при 2Θ по меньшей мере приблизительно 24,6 градусов и пик при 2Θ по меньшей мере приблизительно 28,4 градусов и любые их комбинации.
[0048] Полиморф соединения 1 находится в форме частиц. В некоторых вариантах осуществления полиморф соединения 1 находится в форме частиц, где диаметр частиц является меньшим или равным приблизительно 160 мкм, приблизительно 150 мкм, приблизительно 120 мкм, приблизительно 100 мкм, приблизительно 50 мкм, приблизительно 40 мкм или приблизительно 20 мкм. В некоторых вариантах осуществления полиморф соединения 1 в форме частиц находится в совокупности частиц, где D50 совокупности частиц (т.е., медианная точка распределения частиц по размерам, разделяющая распределение на две равные части) является меньшим или равным приблизительно 160 мкм, приблизительно 150 мкм, приблизительно 120 мкм, приблизительно 100 мкм, приблизительно 50 мкм, приблизительно 40 мкм или приблизительно 20 мкм. В некоторых вариантах осуществления полиморф соединения 1 находится в форме частиц, где диаметр частиц является меньшим или равным приблизительно 10 мкм, приблизительно 5 мкм, приблизительно 4 мкм, приблизительно 3 мкм, приблизительно 2 мкм, приблизительно 1 мкм, приблизительно 0,5 мкм, приблизительно 0,2 мкм или приблизительно 0,1 мкм. В некоторых вариантах осуществления полиморф соединения 1 в форме частиц находится в совокупности частиц, где D50 совокупности частиц является меньшей или равной приблизительно 10 мкм, приблизительно 5 мкм, приблизительно 4 мкм, приблизительно 3 мкм, приблизительно 2 мкм, приблизительно 1 мкм, приблизительно 0,5 мкм, или приблизительно 0,2 мкм.
[0049] Настоящее изобретение относится к частице или совокупности частиц полиморфа соединения 1, которые являются активными, т.е., обладают эффективностью и/или противоопухолевой активностью. Активная частица или частицы обладают определенным размером, например, их диаметр или D50 являются меньшими или равными приблизительно 200 мкм, приблизительно 150 мкм, приблизительно 100 мкм, приблизительно 40 мкм, или приблизительно 20 мкм, приблизительно 10 мкм, приблизительно 5 мкм, приблизительно 4 мкм, приблизительно 3 мкм, приблизительно 2 мкм, приблизительно 1 мкм, приблизительно 0,5 мкм или приблизительно 0,2 мкм. Частица или частицы, превышающие определенный размер, являются неактивными или менее активными, чем частицы, описываемые в настоящем документе.
[0050] Диаметр или D50 фракции суммарной совокупности частиц полиморфа соединения 1 могут являться меньшими или равными приблизительно 200 мкм. В некоторых вариантах осуществления фракция совокупности частиц может составлять по меньшей мере приблизительно 1%, по меньшей мере приблизительно 5%, по меньшей мере приблизительно 10%, по меньшей мере приблизительно 20%, или по меньшей мере приблизительно 30% от общего количества частиц в совокупности. В некоторых вариантах осуществления фракция представляет собой значительную фракцию. Например, "значительная фракция" совокупности частиц может составлять по меньшей мере приблизительно 99%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 60% или по меньшей мере приблизительно 50% от общего количества частиц в совокупности.
[0051] В некоторых вариантах осуществления совокупность частиц полиморфа соединения 1 может содержать по меньшей мере приблизительно 90% суммарной совокупности частиц с размером частиц, меньшим или равным приблизительно 160 мкм, 100 мкм, 40 мкм, 20 мкм, 10 мкм, 5 мкм, 3 мкм или 2 мкм, 1 мкм или 0,5 мкм. Например, совокупность частиц полиморфа соединения 1 может содержать по меньшей мере приблизительно 50% суммарной совокупности частиц c размером частиц, меньшим или равным приблизительно 160 мкм, 100 мкм, 40 мкм, 20 мкм, 10 мкм, 5 мкм, 3 мкм, 2 мкм, 1 мкм или 0,5 мкм. Например, совокупность частиц полиморфа соединения 1 может содержать по меньшей мере приблизительно 10% суммарной совокупности частиц c размером частиц, меньшим или равным приблизительно 160 мкм, 100 мкм, 40 мкм, 20 мкм, 5 мкм, 2 мкм, 1 мкм, 0,5 мкм или 0,1 мкм. В совокупности частиц полиморфа соединения 1, медианный диаметр частиц может являться, например, меньшим или равным приблизительно 160 мкм, 40 мкм, 20 мкм, 10 мкм, 5 мкм, 4 мкм, 3 мкм, 2 мкм, 1 мкм, 0,5 мкм или 0,2 мкм. Например, медианный диаметр частиц может составлять приблизительно от 0,002 мкм до приблизительно 50 мкм, или медианный диаметр может составлять приблизительно от 0,2 мкм до приблизительно 30 мкм. Например, совокупность частиц полиморфа соединения 1 может содержать суммарную совокупность частиц с отношением среднего диаметра к медианному диаметру не более чем приблизительно 2. Совокупность частиц полиморфа соединения 1 может содержать частицы, содержащие соединение в кристаллическом состоянии по меньшей мере в двух различных полиморфных состояниях
[0052] В некоторых вариантах осуществления полиморф соединения 1 находится в форме частиц, где диаметр частиц является меньшим или равным приблизительно 20 микрон, 10 микрон, 5 микрон или 2 3 микрон, 2 микрон, 1 микрон, 0,5 микрон, 0,2 микрон или 0,1 микрон. В некоторых вариантах осуществления полиморф соединения 1 в форме частиц находится в совокупности частиц, где D50 совокупности частиц является меньшей или равной приблизительно 20 микрон, 10 микрон, 5 микрон, 4 микрон, 5 микрон, 3 микрон, 2 микрон, 1 микрон, 0,5 микрон или 0,2 микрон.
[0053] Настоящее изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество по существу чистого нафтофуранового соединения и фармацевтически приемлемый носитель, эксципиент или разбавитель. Эксципиент может включать, например, глицериновый эфир жирной кислоты, глицериновый эфир насыщенной жирной кислоты, глицериновый эфир насыщенной жирной кислоты с количеством атомов углерода от 8 до 18, глицериллаурат, полиэтиленгликоль, целлюлозу, микрокристаллическую целлюлозу, карбоксиметилцеллюлозу, фосфатидилхолин, липид, стерол, холестерин, поверхностно-активное вещество, полисорбат и/или полиоксиэтиленсорбитаналкилат.
[0054] В некоторых вариантах осуществления изобретения промышленное изделие может включать контейнер, содержащий терапевтически эффективное количество фармацевтической композиции и фармацевтически приемлемого эксципиента.
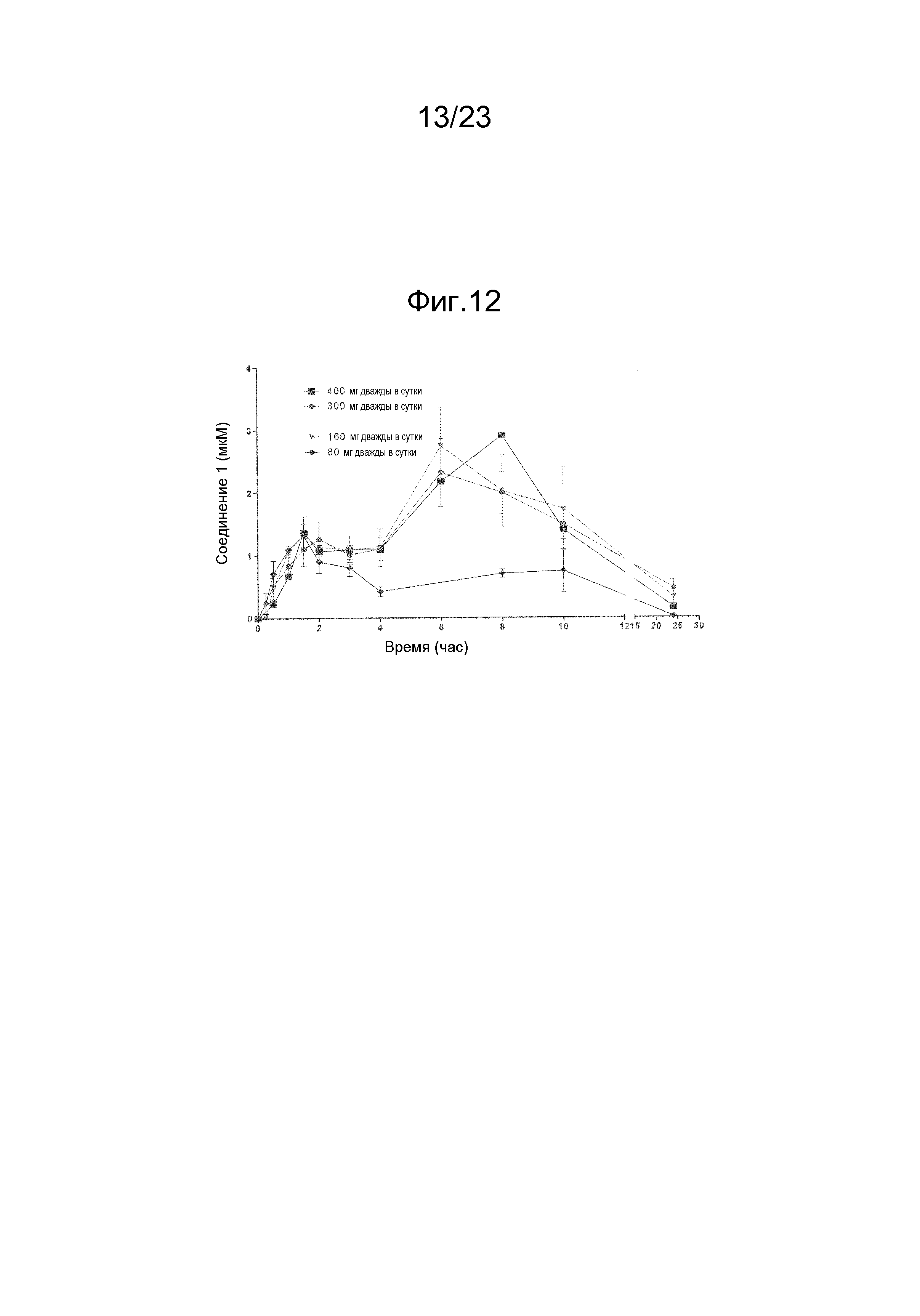
[0055] Способ получения соединения, продукта и/или фармацевтической композиции по некоторым вариантам осуществления изобретения может включать измельчение соединения с формированием частиц. Например, соединение можно измельчать в шаровой мельнице, измельчать вальцеванием, измельчать в струйной машине, измельчать посредством влажного измельчения, измельчать посредством ультразвука, молоть или обрабатывать комбинацией этих и/или других способов измельчения. Температуру соединения можно снижать, например, снижать до сверхнизкой температуры, и измельчать. Такое снижение температуры может делать соединение более хрупким и более поддающимся уменьшению размера частиц посредством измельчения.
[0056] Способ получения соединения, продукта и/или фармацевтической композиции по некоторым вариантам осуществления изобретения может включать кристаллизацию. На распределение частиц по размерам (PSD), полученное при кристаллизации, влияет комбинация различных механизмов, происходящих в ходе кристаллизации, таких как образование центров кристаллизации, рост, агрегация, истирание, разламывание и т.д. Когда в ходе кристаллизации размер частиц невозможно постоянно контролировать так, чтобы они удовлетворяли желаемым техническим характеристикам, можно включать дополнительную стадию, такую как сухое измельчение.
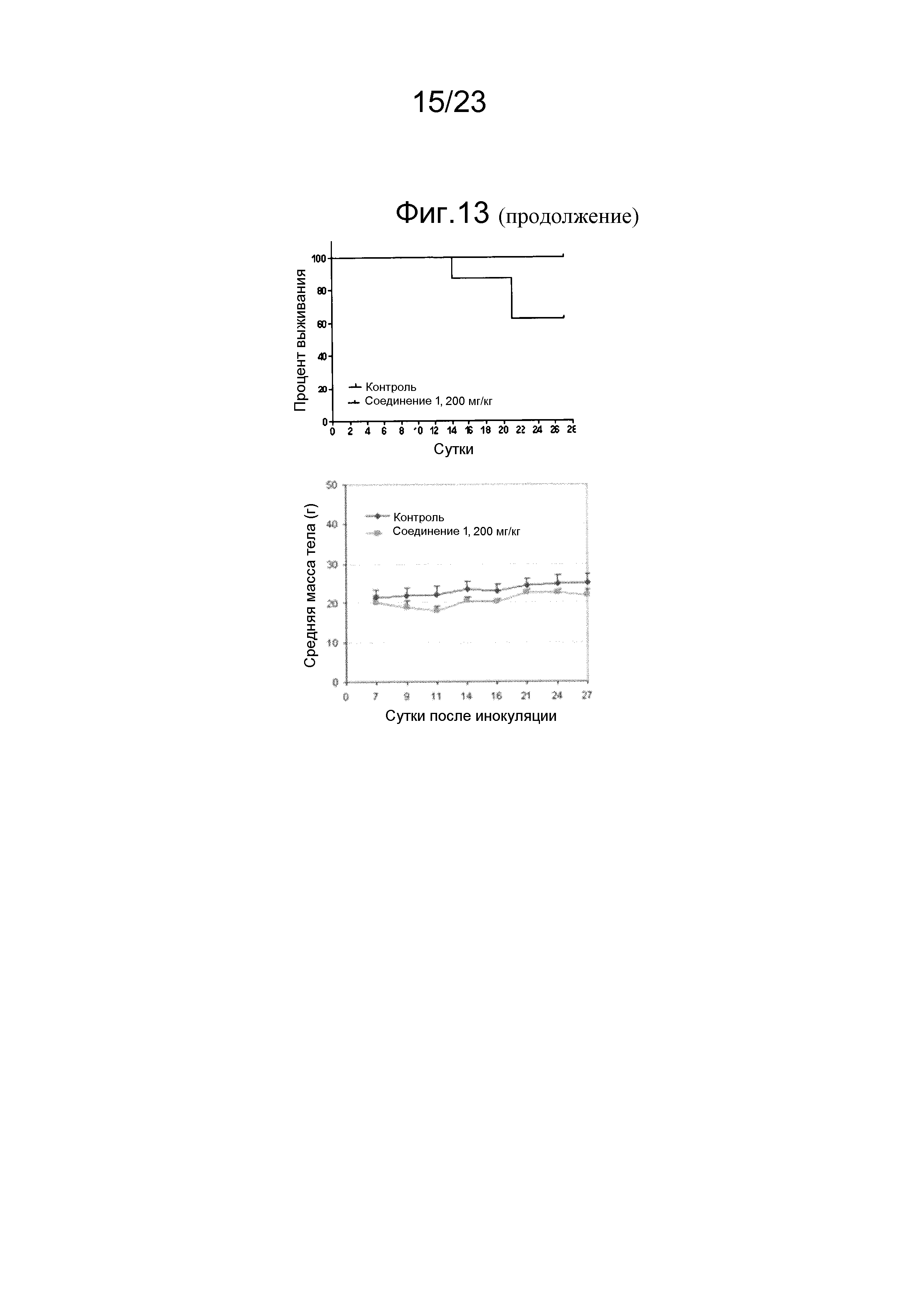
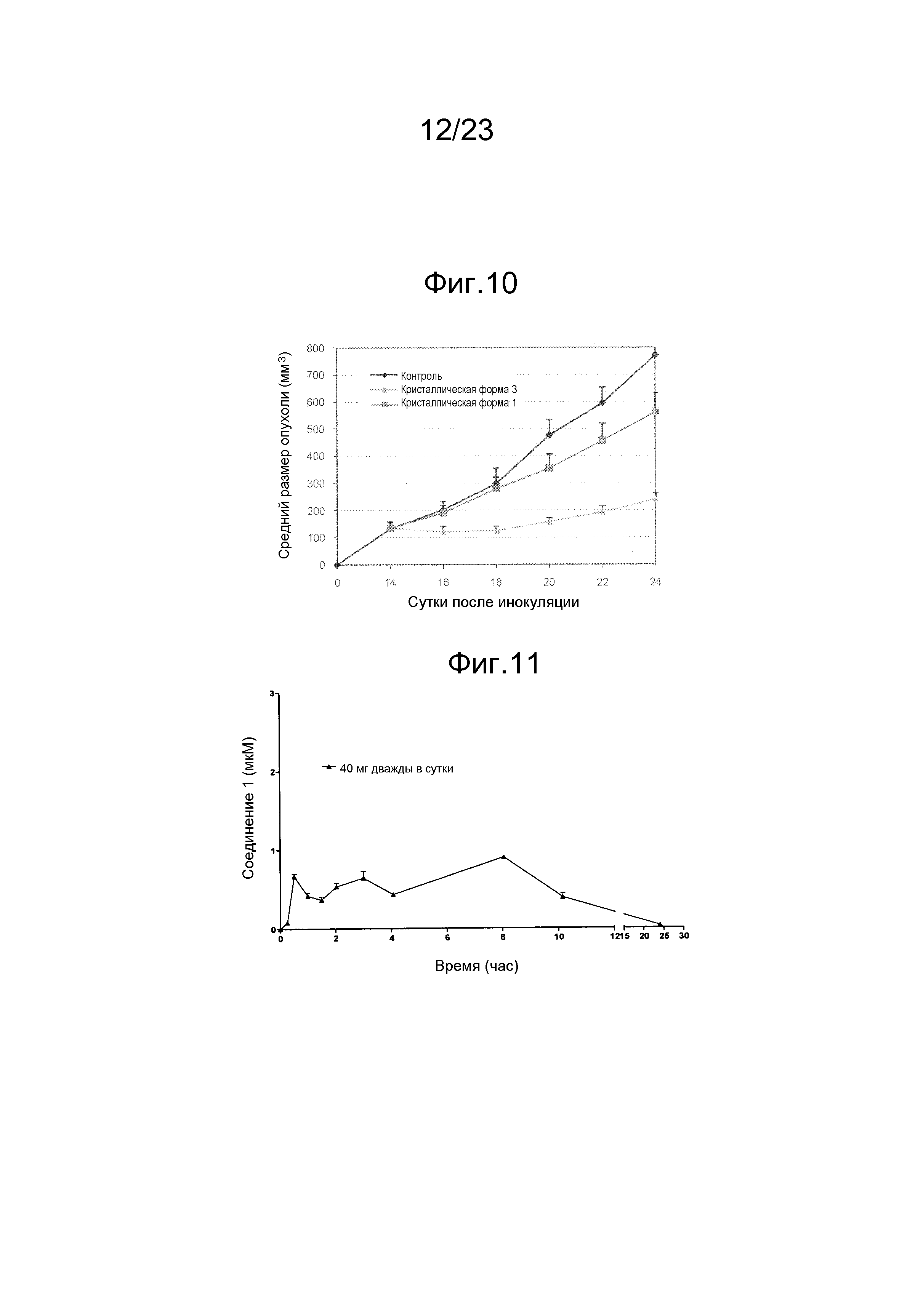
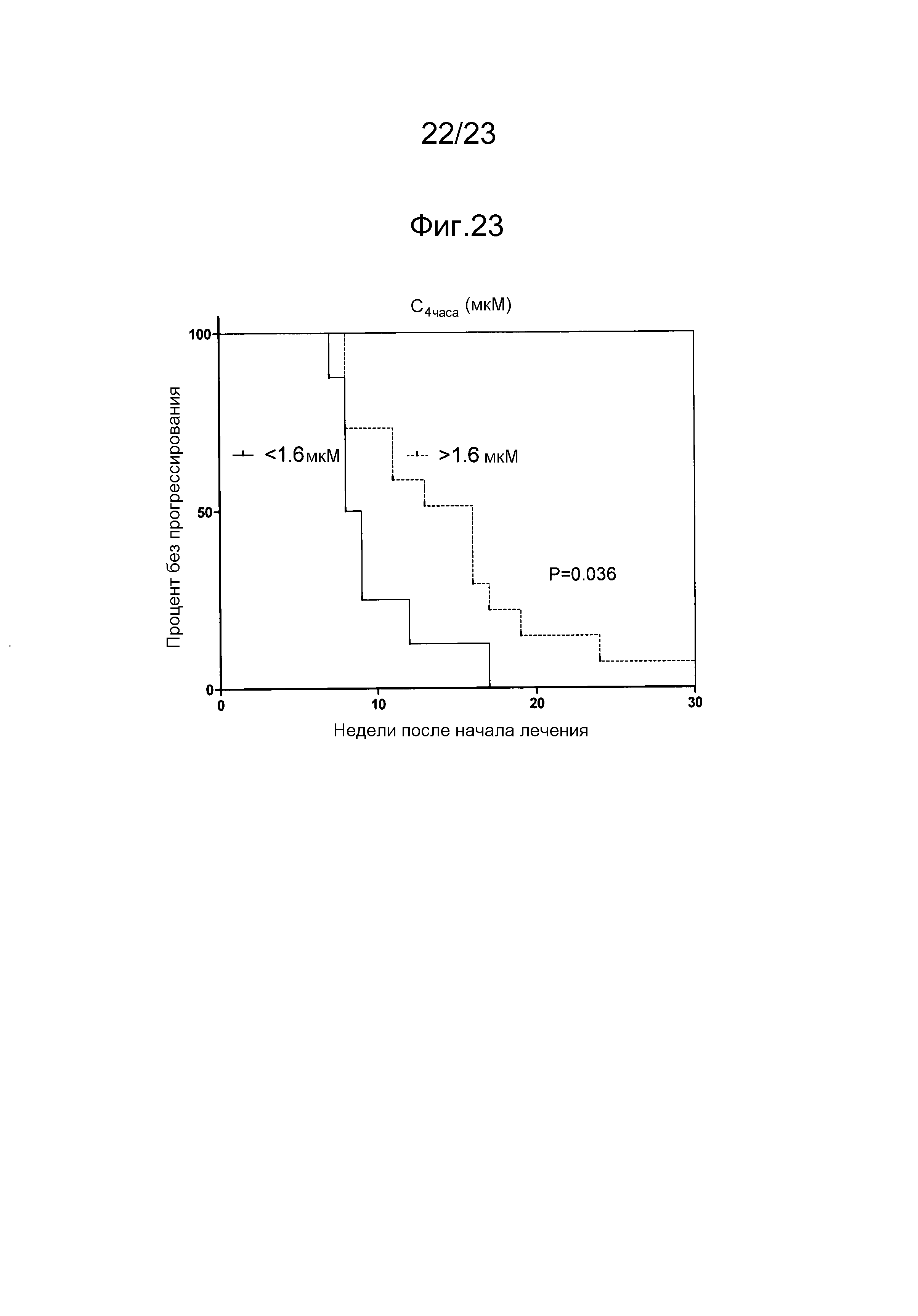
[0057] Способ лечения, задержки прогрессирования, предотвращения рецидива, ослабления симптомов или иное улучшение состояния человека, млекопитающего или животного, пораженных неоплазией, по изобретению может включать введение терапевтически эффективного количества соединения, продукта и/или фармацевтической композиции так, что проявляется антинеопластическая активность. Например, антинеопластическая активность может представлять собой противораковую активность. Например, антинеопластическая активность может включать замедление увеличения объема неоплазии, остановку увеличения объема неоплазии или уменьшение объема неоплазии. Неоплазия может включать солидную опухоль, злокачественное новообразование, метастазирующую клетку, раковую стволовую клетку. Неоплазия может включать карциному, саркому, аденокарциному, лимфому или гемобластоз. Неоплазия может являться невосприимчивой к лечению посредством химиотерапии, лучевой терапии и/или гормональной терапии. Соединение, продукт и/или фармацевтическую композицию можно вводить для предотвращения рецидива неоплазии. Соединение, продукт и/или фармацевтическую композиция можно вводить в качестве вспомогательной терапии при хирургическом удалении. Соединение, продукт и/или фармацевтическую композицию можно вводить, например, перорально и/или внутривенно
[0058] Способ по изобретению также включает лечение, задержку прогрессирования, предотвращение рецидива, ослабление симптома или иное улучшение состояния заболевание или нарушения у человека, млекопитающего или животного, пораженных этим заболеванием или нарушением. В некоторых вариантах осуществления заболевание или нарушение выбрано из группы, состоящей из аутоиммунного заболевания, воспалительного заболевания, воспалительных заболеваний кишечника, артрита, аутоиммунного демиелинизирующего нарушения, болезни Альцгеймера, инсульта, ишемического реперфузионного повреждения и рассеянного склероза.
[0059] Введение пациенту, пораженному заболеванием или нарушением, соединений, продуктов и/или фармацевтических композиций полагают успешным, если достигнут любой из множества лабораторных или клинических результатов. Например, введение полагают успешным, если один или несколько из симптомов, связанных с заболеванием или нарушением ослаблен, снижен, подавлен или не прогрессирует до следующего, т.е., худшего, состояния. Введение полагают успешным, если происходит ремиссия нарушения, например, аутоиммунного нарушения, или оно не прогрессирует до следующего, т.е., худшего, состояния.
[0060] В некоторых вариантах осуществления соединения, продукты и/или фармацевтические композиции, описываемые в настоящем документе, вводят в сочетании с любым из множества известных лекарственных средств, включая, например, химиотерапевтическое средство и другие антинеопластические средства, противовоспалительные соединения и/или иммуносупрессорные соединения. В некоторых вариантах осуществления соединения, продукты и/или фармацевтические композиции, описываемые в настоящем документе, пригодны в сочетании с любым из множества известных способов лечения, включая, в качестве неограничивающего примера, хирургические лечение и способы, лучевую терапию, химиотерапию и/или гормональное или другое связанное с внутренней секрецией лечение.
[0061] Эти "совместно вводимые лекарственные средства" можно вводить последовательно или одновременно. Соединения, продукты и/или фармацевтические композиции, описываемые в настоящем документе, и второе лекарственное средство можно вводить индивидууму, предпочтительно человеку, в одной фармацевтической композиции. Альтернативно соединения, продукты и/или фармацевтические композиции, описываемые в настоящем документе, и второе лекарственное средство можно вводить индивидууму одновременно, отдельно или последовательно в отдельных фармацевтических композициях. Соединения, продукты и/или фармацевтические композиции, описываемые в настоящем документе, и второе лекарственное средство можно вводить индивидууму одинаковыми или различными способами введения. В некоторых вариантах осуществления совместно вводимые лекарственные средства по изобретению содержат эффективное количество соединений, продуктов и/или фармацевтических композиций, описываемых в настоящем документе, и эффективное количество по меньшей мере одного другого лекарственного средства (например, профилактического или терапевтического средства), с другим механизмом действия по сравнению с соединениями, продуктами и/или фармацевтическими композициями, описываемыми в настоящем документе. В некоторых вариантах осуществления совместно вводимые лекарственные средства по настоящему изобретению улучшают профилактический или терапевтический эффект соединений, продуктов и/или фармацевтических композиций, описываемых в настоящем документе, и второго лекарственного средства посредством совместного действия с получением аддитивного или синергического эффекта. В конкретных вариантах осуществления совместно вводимые лекарственные средства по настоящему изобретению снижают побочные эффекты, ассоциированные со вторым лекарственным средством (например, профилактическими или терапевтическими средствами).
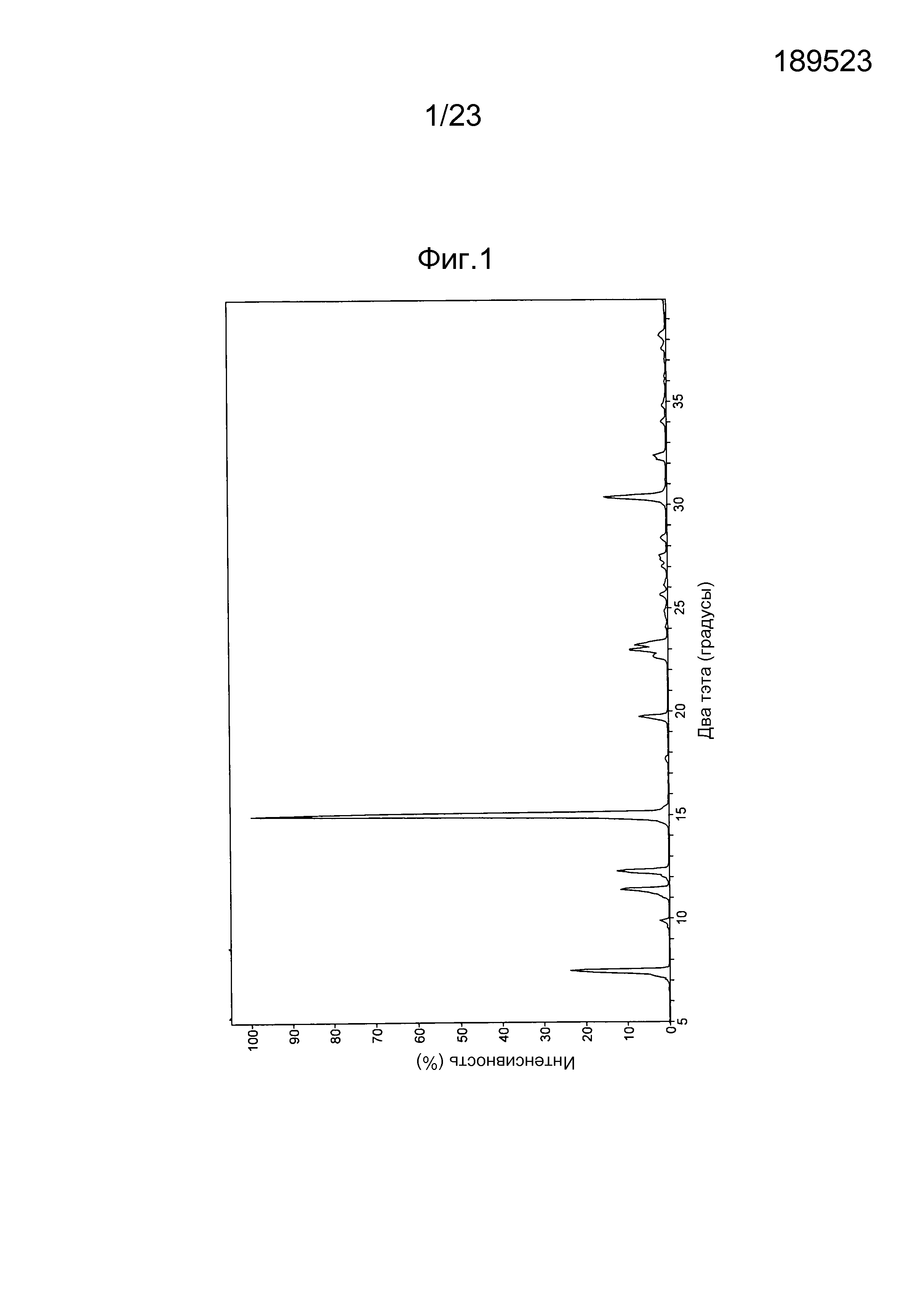
[0062] В некоторых вариантах осуществления заболевание или нарушение можно лечить посредством введения соединения, продукта и/или фармацевтической композиции, как указано далее. Молярная концентрация соединения в крови в течение первого непрерывного периода времени, который является по меньшей мере настолько длительным, как эффективный период времени, и короче опасного периода времени, может представлять собой по меньшей мере эффективную концентрацию и являться меньшей токсичной концентрации. Молярная концентрация в крови после первого непрерывного периода времени может являться меньшей эффективной концентрации. Например, эффективная концентрация может составлять приблизительно 0,1 мкМ, приблизительно 0,2 мкМ, приблизительно 0,5 мкМ, приблизительно 1 мкМ, приблизительно 2 мкМ, приблизительно 3 мкМ, приблизительно 4 мкМ, приблизительно 5 мкМ, приблизительно 6 мкМ, приблизительно 10 мкМ, или другую концентрацию, определенную специалистом в данной области, как эффективная. Например, токсичная концентрация может составлять приблизительно 1 мкМ, приблизительно 3 мкМ, приблизительно 10 мкМ, приблизительно 15 мкМ, приблизительно 30 мкМ, приблизительно 100 мкМ или другую концентрацию, определенную специалистом в данной области, как токсичная. Например, эффективный период времени может составлять приблизительно 1 час, 2 часа, приблизительно 4 часов, приблизительно 6 часов, приблизительно 8 часов, приблизительно 10 часов, приблизительно 12 часов, приблизительно 24 часа, или другой период времени, определенный специалистом в данной области, как эффективный. Например, опасный период времени может составлять приблизительно 12 часов, приблизительно 24 часа, приблизительно 48 часов, приблизительно 72 часа, приблизительно 144 часа, или другой период времени, определенный специалистом в данной области, как опасный.
[0063] В некоторых вариантах осуществления терапевтически эффективное количество соединения, продукта и/или фармацевтической композиция выбрано так, чтобы получать концентрацию в крови, превышающую IC50 для клеток опухоли и меньшую IC50 для нормальных клеток. В некоторых вариантах осуществления терапевтически эффективное количество выбрано так, чтобы получать концентрацию в крови, достаточно высокую для уничтожения клеток опухоли и меньшую IC50 для нормальных клеток.
[0064] В некоторых вариантах осуществления соединение, продукт и/или фармацевтическую композицию вводят перорально в лекарственной форме, например, таблетке, пилюле, капсуле (твердой или мягкой), каплете, порошке, грануле, суспензии, растворе, геле, саше, пастилке, таблетке-леденце, сиропе, эликсире, эмульсии, эмульсии "масло-в-воде", эмульсии "вода-в-масле" и/или дозе жидкого лекарственного средства.
[0065] В некоторых вариантах осуществления настоящего изобретения композиция для снижения или подавления репликации или распространения неопластических клеток включает совокупность частиц, выбираемых приведенным ниже способом. Может быть предоставлено соединение формулы I или его соль или сольват.
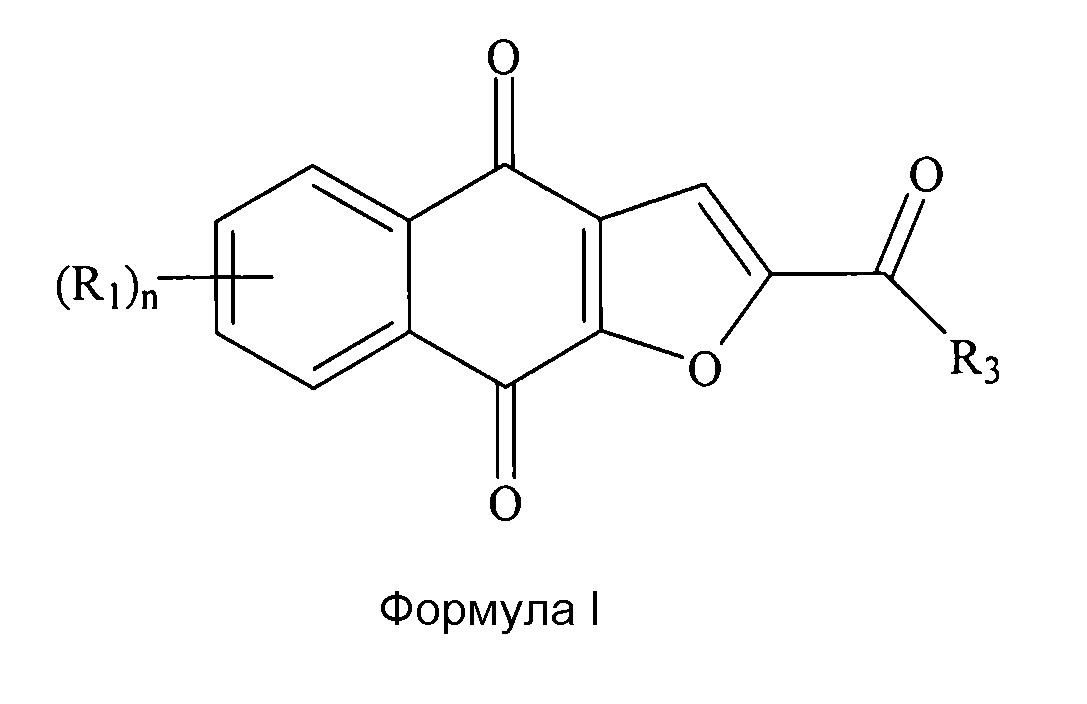
В некоторых вариантах осуществления может быть предоставлено соединение 1 или его соль или сольват. В некоторых вариантах осуществления может быть предоставлен полиморф соединения 1. Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 1. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 2. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 3.
[0066] Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 10,2, 11,4, 11,9, 14,1, 14,5, 17,3, 21,0, 22,2, 24,0, 26,0 и 28,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 10,2, 11,9, 14,1, 14,5, 17,3, 22,2, и/или 28,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 10,2 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 11,9 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 14,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 14,5 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 17,3 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 22,2 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 28,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей два или более пика из пика при 2Θ по меньшей мере приблизительно 10,2 градусов, пик при 2Θ по меньшей мере приблизительно 11,9 градусов, пик при 2Θ по меньшей мере приблизительно 14,1 градусов, пик при 2Θ по меньшей мере приблизительно 14,5 градусов, пик при 2Θ по меньшей мере приблизительно 17,3 градусов, пик при 2Θ по меньшей мере приблизительно 22,2 градусов и пик при 2Θ по меньшей мере приблизительно 28,1 градусов и любые их комбинации.
[0067] Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 7,5, 9,9, 11,4, 12,3, 15,0, 23,0, 23,3, 24,1, 24,6, 25,0, 26,1, 27,0 и 28,4 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 7,5, 9,9, 12,3, 15, 23,0, 23,3, 24,6 и/или 28,4 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 7,5 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 9,9 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 12,3 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 15 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 23 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 23,3 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 24,6 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 28,4 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей два или более пика из пика при 2Θ по меньшей мере приблизительно 7,5 градусов, пик при 2Θ по меньшей мере приблизительно 9,9 градусов, пик при 2Θ по меньшей мере приблизительно 15 градусов, пик при 2Θ по меньшей мере приблизительно 12,3 градусов, пик при 2Θ по меньшей мере приблизительно 23,0 градусов, пик при 2Θ по меньшей мере приблизительно 23,3 градусов, пик при 2Θ по меньшей мере приблизительно 24,6 градусов и пик при 2Θ по меньшей мере приблизительно 28,4 градусов и любые их комбинации.
[0068] Можно получать по меньшей мере одну совокупность частиц, содержащих соединение. Можно определять распределение частиц по размерам каждой по меньшей мере из одной совокупности частиц. В неопластические клетки и в нормальные клетки можно вводить по меньшей мере одну совокупность частиц в заданной концентрации и в течение заданного периода времени. Можно наблюдать действие частиц на метаболизм и/или деление неопластических клеток и нормальных клеток. Можно определять индекс эффективности каждой совокупности частиц на основании действия частиц на неопластические клетки. Можно определять индекс токсичности каждой совокупности частиц на основании действия частиц на нормальные клетки. Индекс эффективности и/или индекс токсичности по меньшей мере одной совокупности частиц с первым распределением частиц по размерам можно сравнивать с индексом эффективности и/или индексом токсичности по меньшей мере одной другой совокупности частиц с распределением частиц по размерам, отличным от первого распределения частиц по размерам. В качестве оптимальной совокупности можно выбирать совокупность частиц с большим индексом эффективности, меньшим индексом токсичности и/или большей взвешенной суммой индекса эффективности и индекса токсичности, чем по меньшей мере одна другая совокупность частиц. Например, распределение частиц по размерам оптимальной совокупности частиц можно определить, как оптимальное распределение частиц по размерам. Например, в композицию можно включать оптимальную совокупность частиц. Например, индекс эффективности может являться пропорциональным противоопухолевой активности. Например, индекс эффективности можно основывать на подавлении метаболизма и/или деления неопластических клеток. Например, индекс токсичности может быть обратно пропорциональным переносимости. Например, индекс токсичности можно основывать на подавлении метаболизма и/или деления нормальных клеток. Например, по меньшей мере одну совокупность частиц можно вводить в неопластические клетки и в нормальные клетки in vitro. Например, индекс эффективности может представлять собой IC50 для неопластических клеток. Например, индекс токсичности может представлять собой IC50 для нормальных клеток. Например, по меньшей мере одну совокупность частиц можно вводить в неопластические клетки и в нормальные клетки in vivo тестируемому животному. Тестируемое животное может представлять собой, например, млекопитающее, примата, мышь, крысу, морскую свинку, кролика или собаку. Индекс эффективности может представлять собой уменьшение объема неопластических клеток, а индекс токсичности может представлять собой уменьшение массы тестируемого животного.
[0069] В некоторых вариантах осуществления получение одной совокупности частиц, содержащих соединение, может включать выделение частиц с заданным распределением частиц по размерам посредством растворения и диспергирования соединения, растворения и диспергирования соединения микроструйным способом, растворения и диспергирования соединения посредством кавитации или распыления, измельчения соединения, измельчения соединения в шаровой мельнице, измельчения соединения вальцеванием, измельчения соединения в струйной машине, влажного измельчения соединения, измельчения соединения посредством ультразвука, растирания соединения и/или просеивания соединения. Частицы можно суспендировать в фармацевтически приемлемом эксципиенте. Определение распределения частиц по размерам может включать применение способа, выбранного из группы, состоящей из ситового анализа, подсчета на световом микроскопе, подсчета на электронном микроскопе, подсчета по электрорезистентности, определения времени седиментации, лазерной дифракции, акустической спектроскопии и комбинаций.
[0070] Способ лечения неоплазии или другого нарушения пролиферации клеток может включать введение человеку, млекопитающему или животному, пораженным неоплазией, терапевтически эффективного количества композиции, содержащей оптимальную совокупность частиц композиции с оптимальным размером частиц и распределением частиц по размерам.
[0071] Настоящее изобретение также относится к способу получения соединения формулы II,
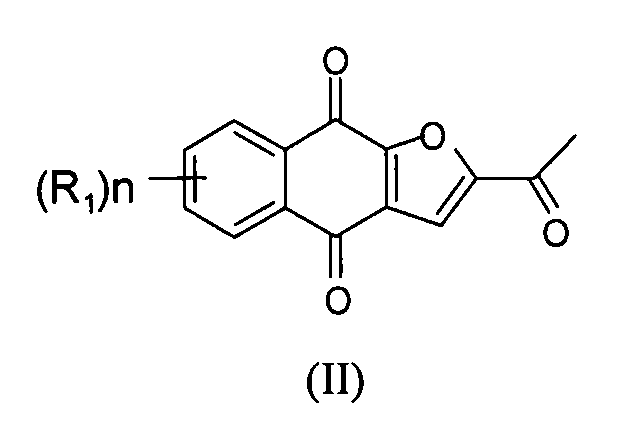
где R1 представляет собой H, Cl или F, где способ включает проведение реакции соединение формулы III
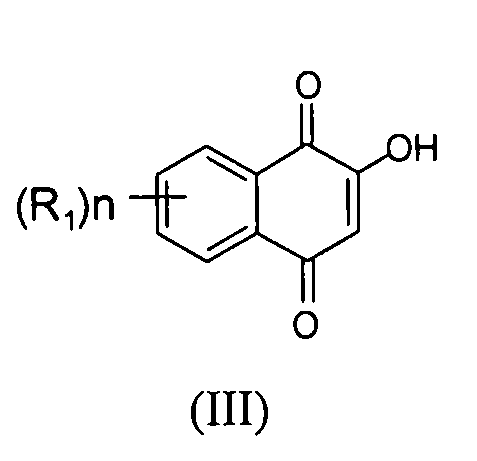
с кетоном в первом растворителе в присутствии основания, кристаллизацию неочищенного продукта из окисленной реакционной смеси и проведение реакции неочищенного продукта с окислителем во втором растворителе.
[0072] В некоторых вариантах осуществления реакцию проводят в открытом контейнере.
[0073] В некоторых вариантах осуществления кетон представляет собой соединение формулы IV.
[0074] В некоторых вариантах осуществления первый растворитель выбран из группы, состоящей из тетрагидрофурана (THF), диоксана и толуола, а основание выбрано из группы, состоящей из 1,8-диазабицикло[5.4.0]ундец-7-ена (DBU), триэтиламина и диизопропилэтиламина. В некоторых вариантах осуществления окислитель представляет собой диоксид марганца. В некоторых вариантах осуществления второй растворитель представляет собой толуол. В некоторых вариантах осуществления способ дополнительно включает обработку продукта окисления древесным углем.
[0075] Настоящее изобретение относится к способу получения соединения формулы II,
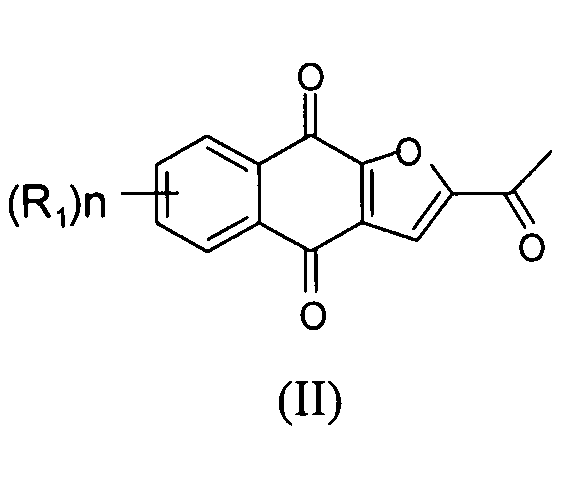
где R1 представляет собой H, Cl или F, где способ включает проведение реакции соединения формулы III,
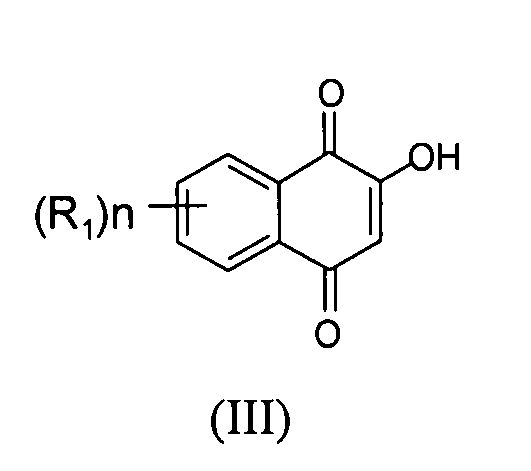
с кетоном в первом растворителе в присутствии основания, кристаллизацию неочищенного продукта из окисленной реакционной смеси, растворение неочищенного продукта во втором растворителе и обработку неочищенного продукта древесным углем.
[0076] Настоящее изобретение относится к способу получения нафтофуранового соединения. Способ включает реакцию нафтодигидрофуранового соединения или смеси, содержащей нафтодигидрофурановое соединение, с окислителем в первом растворителе. В некоторых вариантах осуществления смесь дополнительно содержит нафтофурановое соединение. В некоторых вариантах осуществления нафтофурановое соединение выбрано из группы, состоящей из 2-(1-гидроксиэтил)нафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-диона, 2-ацетилнафто[2,3-b]фуран-4,9-диона, 2-этилнафто[2,3-b]фуран-4,9-диона, моно-[1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового] эфира фосфорной кислоты, диметилового эфира 1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового эфира фосфорной кислоты, их энантиомеров, диастереомеров, таутомеров и солей или сольватов. В некоторых вариантах осуществления окислитель представляет собой диоксид марганца. В некоторых вариантах осуществления первый растворитель представляет собой толуол. В некоторых вариантах осуществления способ дополнительно включает фильтрацию продукта окисления через слой активированного угля. В некоторых вариантах осуществления способ дополнительно включает кристаллизацию нафтофуранового соединения посредством выпаривания первого растворителя. В некоторых вариантах осуществления способ дополнительно включает перекристаллизацию нафтофуранового соединения с применением второго растворителя. В некоторых вариантах осуществления второй растворитель представляет собой этилацетат. В некоторых вариантах осуществления способ дополнительно включает суспендирование нафтофуранового соединения с применением второго растворителя, нагревание суспензии и охлаждение суспензии.
[0077] Настоящее изобретение относится к способу получения по существу чистого нафтофуранового соединения. Способ включает кристаллизацию нафтофуранового соединения с применением первого растворителя и перекристаллизацию нафтофуранового соединения с применением второго растворителя. Настоящее изобретение относится к другому способу получения по существу чистого нафтофуранового соединения. Способ включает кристаллизацию нафтофуранового соединения с применением первого растворителя, суспендирование кристаллического нафтофуранового соединения с применением второго растворителя, нагревание суспензии и охлаждение суспензии. В некоторых вариантах осуществления нафтофурановое соединение выбрано из группы, состоящей из 2-(1-гидроксиэтил)нафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-диона, 2-ацетилнафто[2,3-b]фуран-4,9-диона, 2-этилнафто[2,3-b]фуран-4,9-диона, моно-[1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового] эфира фосфорной кислоты, диметилового эфира 1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового эфира фосфорной кислоты, их энантиомеров, диастереомеров, таутомеров и солей или сольватов. В некоторых вариантах осуществления первый растворитель представляет собой толуол. В некоторых вариантах осуществления второй растворитель представляет собой этилацетат.
[0078] Настоящее изобретение относится к нафтофурановому соединению, получаемому любым из указанных выше способов. В некоторых вариантах осуществления нафтофурановое соединение выбрано из группы, состоящей из 2-(1-гидроксиэтил)нафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-диона, 2-ацетилнафто[2,3-b]фуран-4,9-диона, 2-этилнафто[2,3-b]фуран-4,9-диона, моно-[1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового] эфира фосфорной кислоты, диметилового эфира 1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового эфира фосфорной кислоты, их энантиомеров, диастереомеров, таутомеров и солей или сольватов. В некоторых вариантах осуществления чистота нафтофуранового соединения составляет по меньшей мере приблизительно 80%, приблизительно 85% или приблизительно 90%, приблизительно 95% или приблизительно 99%. В некоторых вариантах осуществления нафтофурановое соединение содержит не более чем приблизительно 10%, приблизительно 5%, приблизительно 2% или приблизительно 1%, приблизительно 0,5%, приблизительно 0,2%, приблизительно 0,15% или приблизительно 0,1% примесей.
[0079] Изобретение относится к способам получения частиц соединения 1, включая частицы полиморфа соединения 1, частицы высокоочищенных форм соединения 1 и частицы высокоочищенных форм полиморфа соединения 1. В некоторых вариантах осуществления частицы с желаемым медианным размером частиц, например, приблизительно 20 микрон, получают посредством измельчения кристаллов соединения 1, включая кристаллы очищенной формы соединения 1, кристаллы полиморфа соединения 1 и/или кристаллы очищенной формы полиморфа соединения 1. Например, кристаллы измельчают способом измельчения в струйной машине, где давление Вентури составляет приблизительно 40, давление измельчения составляет приблизительно 100, а скорость подачи составляет приблизительно 1304 г/час.
КРАТКОЕ ОПИСАНИЕ ФИГУР
[0080] Фигура 1 представляет собой иллюстрацию, демонстрирующую данные XRPD кристаллической формы 1.
[0081] Фигура 2 представляет собой иллюстрацию, демонстрирующую данные XRPD кристаллической формы 2.
[0082] Фигура 3 представляет собой иллюстрацию, демонстрирующую данные XRPD кристаллической формы 3.
[0083] Фигура 4 представляет собой иллюстрацию, демонстрирующую сравнение данных XRPD кристаллической формы 1 и кристаллической формы 3.
[0084] Фигуры 5A и 5B представляют собой ряд иллюстраций, демонстрирующих способ синтеза кристаллической формы 2.
[0085] Фигуры 6A-6D представляют собой ряд иллюстраций, демонстрирующих способ синтеза кристаллической формы 3.
[0086] Фигуры 7A и 7B представляют собой фотографии, демонстрирующие морфологию кристаллических форм 1 и 3.
[0087] Фигура 8 представляет собой график, демонстрирующий ограниченную противоопухолевую активность кристаллической формы 1.
[0088] Фигура 9 представляет собой график, демонстрирующий противоопухолевую активность кристаллической формы 2.
[0089] Фигура 10 представляет собой график, демонстрирующий сравнение противоопухолевой активности кристаллической формы 1 и кристаллической формы 3.
[0090] Фигура 11 представляет собой график, демонстрирующий данные клинической фармакокинетики (PK) для кристаллической формы 2 у пациентов с раком.
[0091] Фигура 12 представляет собой график, демонстрирующий данные клинической фармакокинетики (PK) для кристаллической формы 3 у пациентов с раком.
[0092] Фигура 13 представляет собой график, демонстрирующий токсичность, наблюдаемую для кристаллической формы 2 приблизительно с 90% чистотой, получаемой способом синтеза, иллюстрируемым на фигурах 5A-5B.
[0093] Фигура 14 представляет собой график, демонстрирующий безопасность кристаллической формы 2 приблизительно с 95% чистотой, получаемой способом синтеза, иллюстрируемым на фигурах 5A-5B.
[0094] Фигура 15 представляет собой график, демонстрирующий противоопухолевую активность соединения 1 с различными диапазонами размеров частиц.
[0095] Фигура 16 представляет собой график, демонстрирующий данные PK соединения 1 in vivo с различными диапазонами размеров частиц.
[0096] Фигура 17 представляет собой график, демонстрирующий связь между растворением и размером частиц соединения 1.
[0097] Фигура 18 представляет собой иллюстрацию, демонстрирующую различия между специфичными для раковых стволовых клеток и общепринятыми для рака лекарственными средствами.
[0098] Фигура 19 представляет собой иллюстрацию, демонстрирующую полную ремиссию очага метастазирования рака толстого кишечника в почке.
[0099] Фигура 20 представляет собой график, иллюстрирующий фармакокинетику дозирования пациентам дважды в сутки, где пациентам дважды в сутки вводили дозу 500 мг (общая ежедневная доза 1000 мг).
[0100] Фигура 21 представляет собой график, иллюстрирующий фармакокинетику однократного дозирования в сутки у пациентов, где пациентам один раз в сутки вводили дозу 20 мг.
[0101] Фигура 22 представляет собой график, иллюстрирующий сравнение выживаемости без прогрессирования пациентов с колоректальным раком подвергаемых лечению соединением 1. Выживаемость без прогрессирования (PFS) оцениваемых пациентов с колоректальным раком подвергаемых лечению соединением 1 сравнивали с ретроспективными данными PFS по наилучшему поддерживающему лечению у пациентов с колоректальным раком.
[0102] Фигура 23 представляет собой график, иллюстрирующий сравнение выживаемости без прогрессирования (PFS) в зависимости от фармакокинетического воздействия. PFS подлежащих оценке пациентов, получавших соединение 1, сравнивали в зависимости от воздействия соединения 1 выше или ниже 1,6 мкМ в течение по меньшей мере 4 часов.
[0103] Фигура 24 представляет собой график, иллюстрирующий желаемый PK профиль с улучшенной безопасностью и эффективностью.
[0104] Фигура 25 представляет собой фотографию, иллюстрирующую то, что у пациентов, достигавших при лечении BBI608 продолжительного стабильного заболевания (>16 недель), в тканях опухолей до лечения наблюдали высокие уровни p-STAT3.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0105] Ниже подробно описаны варианты осуществления изобретения. При описании вариантов осуществления для ясности используют конкретную терминологию. Однако изобретение не предназначено для ограничения выбранной таким образом конкретной терминологией. Специалисту в данной области понятно, что можно использовать другие эквивалентные компоненты и другие разработанные способы без отклонения от содержания и объема изобретения. Все цитируемые в настоящем документе ссылки включены в качестве ссылок, как если бы они были включены отдельно.
[0106] В настоящем тексте "значительная фракция" совокупности частиц может составлять по меньшей мере приблизительно 99%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 60% или по меньшей мере приблизительно 50% от общего количества частиц в совокупности.
[0107] Активность композиции против раковых стволовых клеток можно определять in vitro или in vivo. Например, противоопухолевую активность композиции можно определять in vitro посредством введения соединения и измерения самообновления и выживаемости раковых стволовых клеток. Например, противоопухолевую активность соединения можно оценивать in vitro, сравнивая поведение опухолевых клеток, в которые вводили соединение, с поведением клеток опухолей, в которые соединение не вводили (контроль). Например, противоопухолевую активность композиции можно определять in vivo, измеряя у животного, которому вводили соединение, изменение объема опухоли с применением метастазирующей модели и/или с применением ортотопической модели. Например, противоопухолевую активность соединения можно оценивать in vivo, сравнивая животное, которому вводили соединение, с животным, которому соединения не вводили (контроль).
[0108] Переносимость композиции можно определять in vitro или in vivo. Например, переносимость композиции можно определять in vitro, вводя соединение и измеряя скорость деления нормальных клеток, измеряя поглощение питательных веществ нормальными клетками, измеряя показатели скорости метаболизма нормальных клеток, отличные от поглощения питательных веществ, измеряя рост нормальных клеток и/или измеряя другой показатель жизнеспособности нормальных клеток. Например, переносимость соединения можно оценивать in vitro, сравнивая поведение нормальных клеток, в которые вводили соединение, с поведением нормальных клеток, в которые соединение не вводили (контроль). Например, переносимость композиции можно определять in vivo, измеряя у животного, которому вводили соединение, массу тела или потребление пищи или проводя клинические наблюдений, такие как сохранение или потеря шерсти, активность и/или способность отвечать на стимулы. Например, переносимость соединения можно оценивать in vivo, сравнивая животное, которому вводили соединение, с животным, которому соединения не вводили (контроль).
[0109] Можно определять индекс эффективности и/или индекс токсичности соединения, продукта и/или фармацевтической композиции. Например, индекс эффективности может быть пропорционален противоопухолевой активности или может представлять собой монотонно возрастающую функцию относительно противоопухолевой активности. Например, индекс токсичности может быть обратно пропорционален переносимости или может представлять собой монотонно убывающую функцию относительно переносимости. Опубликовано, что у нафтофуранового соединения отсутствует противоопухолевая активность in vivo. См., M.M. Rao and D.G.I. Kingston, J. Natural Products, 45(5) (1982) 600-604. Кроме того, опубликовано, что соединение является равно токсичным для раковых клеток и нормальных клеток. Т.е., соединение в литературе описано, как в равной степени уничтожающее и раковые клетки, и нормальные клетки, с заключением, что соединение не обладает потенциалом для лечения рака. См., K. Hirai K. et al., Cancer Detection and Prevention, 23(6) (1999) 539-550; Takano A. et al., Anticancer Research 29:455-464, 2009.
[0110] Однако экспериментальные исследования, описываемые в настоящем документе, указывают, что при введении соединения в качестве частиц с соответствующим распределением частиц по размерам с достижением определенного фармакокинетического воздействия, как описано в настоящей публикации, соединение действительно обладает избирательной противоопухолевой активностью.
[0111] Для целей настоящего изобретения "биодоступность" лекарственного средства определена как относительное количество лекарственного средства из вводимой лекарственной формы, которое поступает в системный кровоток и скорость, с которой лекарственное средство попадает в кровоток. Биодоступность определяется по меньшей мере тремя факторами: (i) всасыванием, контролирующим биодоступность, с последующими (ii) его перераспределением в тканях и (iii) удалением (метаболическое разрушение и почечный и другой механизмы).
[0112] "Абсолютную биодоступность" рассчитывают, учитывая перераспределение в тканях и биотрансформацию (т.е., удаление) в тканях, которую в свою очередь можно рассчитать при внутривенном введении лекарственного средства. Если не указано иначе, "ВЭЖХ" относится к высокоэффективной жидкостной хроматографии; "фармацевтически приемлемый" относится к физиологически переносимых веществам, которые при введении млекопитающему, как правило, не вызывают аллергической или другой неблагоприятной реакции, такой как расстройство желудка, головокружение и т.п.; "млекопитающее" относится к классу высших позвоночных, включая человека и всех других животных, кормящих свое потомство молоком, секретируемым молочными железами, и имеющих кожу, как правило, более или менее покрытых шерстью; и "лечение" предназначено для включения смягчения, ослабления или устранения по меньшей мере одного симптома заболевания(ий) у млекопитающего.
[0113] Как применяют в настоящем документе термин "лечение" предназначен для включения введения соединений по изобретению профилактически для предотвращения или сдерживания нежелательного состояния, и терапевтически для устранения или снижения степени или симптомов состояния. Лечение также включает предотвращение рецидива нежелательного состояния, задержку прогрессирования нежелательного состояния и предотвращение или задержку начала нежелательного состояния. Лечение по изобретению проводят для человека или другого млекопитающего с заболеванием или состоянием, обеспечивающими необходимость в таком лечении. Лечение также включает применение соединения для клеток или органов in vitro. Лечение также может представлять собой системное или местное введение.
[0114] Эффективное количество представляет собой количество активного ингредиента, вводимого однократной дозой или несколькими дозами, необходимое для достижения желаемого фармакологического действия. Специалист-практик может определить и оптимизировать эффективную дозу для конкретного пациента или для лечения конкретного состояния посредством общепринятого экспериментирования и титриметрического анализа, хорошо известных специалистам-клиницистам. Фактические доза и схема могут варьировать в зависимости от того, вводят ли композиции в комбинации с другими лекарственными средствами, или в зависимости от индивидуальных отличий в фармакокинетике, распределении лекарственных средств и метаболизма. Подобным образом, количества могут варьировать для применений in vitro. Специалистам в данной области известно, как в соответствии с необходимостью в конкретной ситуации без излишнего экспериментирования подбирать дозу. Там, где это описано в настоящем документе, диапазоны доз не исключают использования более высокой или более низкой дозы компонента, чем это может требоваться в конкретном применении.
[0115] Описания фармацевтических композиций, предоставленные в настоящем документе, включают фармацевтические композиции, подходящие для введения людям. Специалисту в данной области на основе настоящего описания следует понимать, что такие композиции, как правило, подходят для введения любому млекопитающему или другому животному. Получение композиций, подходящих для введения различным животным хорошо известно, и, как правило, специалист в ветеринарной фармакологии может спланировать и осуществить такие модификации посредством общепринятого экспериментирования на основе фармацевтических композиций для введения людям.
Структура и свойства соединений
[0116] Нафтофурановое соединение формулы I, такое как 2-(1-гидроксиэтил)нафто[2,3-b]фуран-4,9-дион, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-дион, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-дион, 2-ацетилнафто[2,3-b]фуран-4,9-дион, 2-этилнафто[2,3-b]фуран-4,9-дион, являлось практически нерастворимым в воде и в обширной группе тестированных растворителей, включая DMSO (диметилсульфоксид), N-метилпирролидин, DMA (диметилацетамид), этанол, PEG400 (полиэтиленгликоль 400), пропиленгликоль, кремофор EL (полиэтоксилированное касторовое масло), лабразол (каприлокапроиловые макроглицериды (полиоксилглицериды)), лабрафил M (сложный эфир PEG-6 (полиэтиленгликоля) и растительного масла) и каприол (пропиленгликолькаприлат). Нафтофурановое соединение может растворяться в ряде полярных органических растворителей, таких как определенные галогеноуглеводороды, например, хлоруглеводороды, такие как метиленхлорид, сложные эфиры, этилацетат, карбоновые кислоты, такие как уксусная кислота, кетоны, такие как ацетон, и спирты, такие как метанол. Выявлено, что нафтофурановое соединение растворимо в метиленхлориде и этилацетате.
[0117] Экспериментальные исследования, описываемые в настоящем документе, в которых обнаружено, что избирательной противоопухолевой активности для достижения конкретного фармакокинетического воздействия в отношении избирательной противораковой активности достигали посредством введения активного соединения в фармацевтической композиции в форме малых частиц, сфокусированы в нафтофурановом соединении. Учитывая обсуждаемые в настоящее время наблюдения, полученные с использованием соединения, другие нафтофураны, например, нафтофураны, могут аналогично продемонстрировать благоприятную модификацию своих фармакокинетических профилей с достижением конкретного фармакокинетического воздействия с достижением избирательной противораковой активности при введении в форме частиц малого диаметра. Фармакокинетический профиль других нафтофуранов, вводимых в виде одного или нескольких распределений частиц по размерам, можно определить экспериментально.
[0118] Некоторые другие соединения, способные демонстрировать улучшение фармакокинетического профиля и эффективность с уменьшением размера частиц в форме, в которой их вводят животному, млекопитающему или человеку, как наблюдали для соединения, тестируемого в примерах, включают соединения, представленные в виде формулы I, и их соли и сольваты.
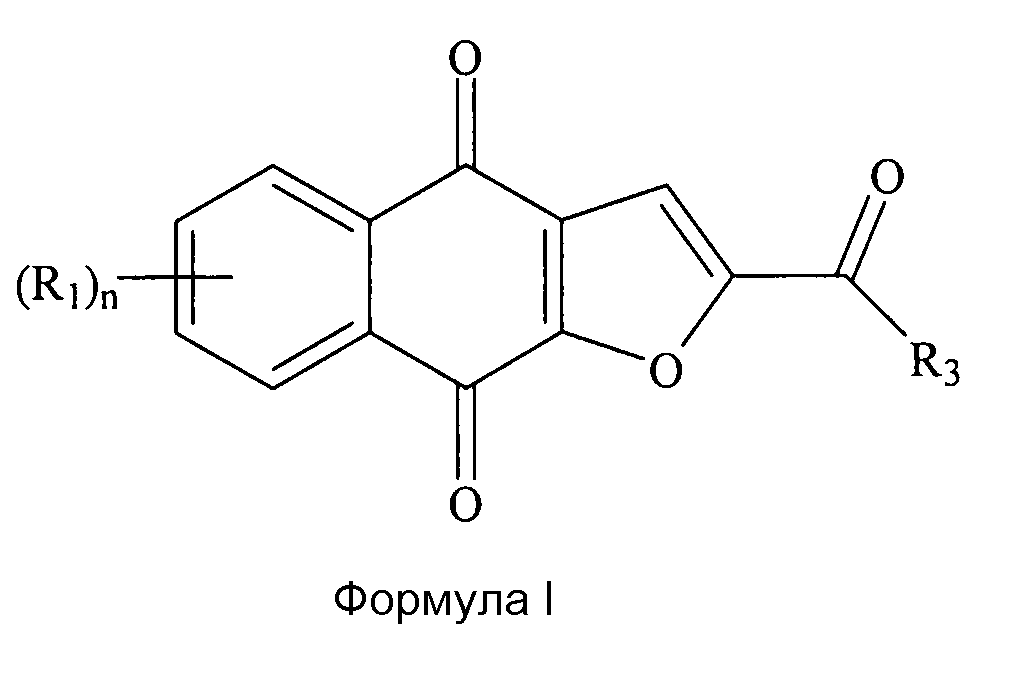
[0119] В формуле I, обозначение (R1)n означает, что заместитель (R1) является независимо замещенным в каждом доступном положении бензольного кольца. Например, при n, равном 4, четыре R1 заместителя могут являться одинаковыми, или каждый из них может отличаться от любого другого. Например, каждый (R1) можно независимо выбирать из группы, состоящей из водорода, галогена, фтора, циано, нитро, CF3, OCF3, алкила, метила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, гетероцикла, замещенного гетероцикла, арила, замещенного арила, ORa, SRa и NH2. Алкил может включать группы, содержащие, например, от 1 до 8 атомов углерода, связанных одинарными связями, алкенил может включать группы, содержащие, например, от 2 до 8 атомов углерода, связанных одной или несколькими двойными связями, и алкинил может включать группы, содержащие, например, от 2 до 8 атомов углерода, связанных одной или несколькими тройными связями. Заместители могут содержать такие группы, как водород, галоген, циано, нитро, арил, ORa, SRa и NH2. Например, каждый (R1) можно независимо выбирать из группы, состоящей из водорода, метила, F (фтора), Cl (хлора), Br (брома), I (йода), OH (гидроксила) и NH2 (амина). Например, R3 можно выбирать из группы, состоящей из водорода, галогена, фтора, циано, CF3, OCF3, алкила, метила, замещенного алкила, галоген-замещенного алкила, гидроксил-замещенного алкила, амин-замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, гетероцикла, замещенного гетероцикла, арила, замещенного арила, ORa, SRa и NRbRc. Например, R3 можно выбирать из группы, состоящей из метила и C(R8)3. Каждый (R8) можно независимо выбирать из группы, состоящей из водорода, метила, F (фтора), Cl, Br, I, OH и NH2. Например, из независимо выбранных заместителей (R1) и заместителей (R8) F (фтором) можно выбирать не более двух, где остальные можно выбирать так, чтобы они являлись водородом.
[0120] В некоторых вариантах осуществления соединение формулы I выбрано из группы, состоящей из 2-(1-гидроксиэтил)нафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-диона, 2-ацетилнафто[2,3-b]фуран-4,9-диона, 2-этилнафто[2,3-b]фуран-4,9-диона, их энантиомеров, диастереоизомеров, таутомеров и солей или сольватов. Например, каждый (R1) можно выбирать так, чтобы он представлял собой водород, и R3 можно выбирать так, чтобы он представлял собой метил, так, чтобы соединение формулы I представляло собой 2-ацетилнафто[2,3-b]фуран-4,9-дион. Например, каждый Ra можно независимо выбирать из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, гетероцикла, замещенного гетероцикла, арила и замещенного арила. Например, каждые Rb и Rc можно независимо выбирать из группы, состоящей из водорода, алкила, замещенного алкила, циклоалкила, замещенного циклоалкила, гетероцикла, замещенного гетероцикла, арила и замещенного арила. Альтернативно, Rb и Rc вместе с N, с которым они связаны, могут формировать гетероцикл или замещенный гетероцикл.
Полиморфы
[0121] Нафтофурановые соединения по изобретению включают полиморфы. В некоторых вариантах осуществления полиморф представляет собой полиморф соединения формулы I. В некоторых вариантах осуществления полиморф представляет собой полиморф соединения 1. Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 1. Этот полиморф в настоящем документе обозначают как "кристаллическая форма 1", "форма 1" или "XRPD1", и эти термины используют взаимозаменяемо. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 2. Этот полиморф в настоящем документе обозначают как "кристаллическая форма 2", "форма 2" или "XRPD2", и эти термины используют взаимозаменяемо. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 3. Этот полиморф в настоящем документе обозначают как "кристаллическая форма 3", "форма 3" или "XRPD3", и эти термины используют взаимозаменяемо.
[0122] Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 10,2, 11,4, 11,9, 14,1, 14,5, 17,3, 21,0, 22,2, 24,0, 26,0 и 28,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 10,2, 11,9, 14,1, 14,5, 17,3, 22,2, и/или 28,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 10,2 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 11,9 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 14,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 14,5 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 17,3 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 22,2 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 28,1 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей два или более пика из пика при 2Θ по меньшей мере приблизительно 10,2 градусов, пик при 2Θ по меньшей мере приблизительно 11,9 градусов, пик при 2Θ по меньшей мере приблизительно 14,1 градусов, пик при 2Θ по меньшей мере приблизительно 14,5 градусов, пик при 2Θ по меньшей мере приблизительно 17,3 градусов, пик при 2Θ по меньшей мере приблизительно 22,2 градусов и пик при 2Θ по меньшей мере приблизительно 28,1 градусов и любые их комбинации.
[0123] Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 7,5, 9,9, 11,4, 12,3, 15,0, 23,0, 23,3, 24,1, 24,6, 25,0, 26,1, 27,0 и 28,4 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей один или несколько пиков при 2Θ по меньшей мере приблизительно 7,5, 9,9, 12,3, 15, 23,0, 23,3, 24,6 и/или 28,4 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 7,5 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 9,9 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 12,3 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 15 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 23 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 23,3 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 24,6 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей пик при 2Θ по меньшей мере приблизительно 28,4 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей два или более пика из пика при 2Θ по меньшей мере приблизительно 7,5 градусов, пик при 2Θ по меньшей мере приблизительно 9,9 градусов, пик при 2Θ по меньшей мере приблизительно 15 градусов, пик при 2Θ по меньшей мере приблизительно 12,3 градусов, пик при 2Θ по меньшей мере приблизительно 23,0 градусов, пик при 2Θ по меньшей мере приблизительно 23,3 градусов, пик при 2Θ по меньшей мере приблизительно 24,6 градусов и пик при 2Θ по меньшей мере приблизительно 28,4 градусов и любые их комбинации.
[0124] Кристаллическую форму 1 детектировали во множестве растворителей и условий, но показано, что она обладает низкой противоопухолевой активностью (фигура 8). В исследовании, представленном на фигуре 8, мышам с иммуносупрессией с прижившимся подкожным раком головы и шеи человека FaDu перорально (п./о.) вводили указанное количество размолотого вручную соединения 1 с кристаллической формой 1 или контроль в виде носителя. Соединение 1 формулировали в ГЕЛЮЦИРЕ™. Введение во всех режимах проводили ежедневно (каждые сутки). В ходе обработки периодически оценивали размеры опухолей.
[0125] Кристаллическую форму 2 неожиданно получили в присутствии примеси, и показано, что этот полиморф обладает сильной противоопухолевой активностью (фигура 9). В исследовании, представленном на фигуре 9, мышам с иммуносупрессией с прижившимся подкожным раком головы и шеи человека FaDu перорально (п./о.) вводили 100 мг/кг тонко измельченного соединения 1, полученного способом синтеза, описанным на фигурах 5A и 5B (первая порция), или контроль в виде носителя. Соединение 1 формулировали в ГЕЛЮЦИРЕ™. Все режимы введения проводили ежедневно (каждые сутки). В ходе обработки периодически оценивали размеры опухолей. Форму 2 успешно получили современным способом с надлежащей практикой организации производства (cGMP) и получили одобрение от FDA и Health Canada на ее использования в клинических испытаниях. Для формы 2 показана желательная фармакокинетика (фигура 11), безопасность и убедительные признаки противоопухолевой активности пациентов с раком.
[0126] Показано, что кристаллическая форма 3 обладает сходной, но отличающейся порошковой дифракционной рентгенограммой (XRPD) с формой 1, и демонстрирует очень отличающийся от формы 1 характер кристаллизации (фиг. 7A и B). Форму 3 можно получить только из формы 1 специально разработанным способом суспендирования, описываемым в настоящем документе. Показано, что форма 3 обладает сильной противоопухолевой активностью (фигура 10). В исследовании, представленном на фигуре 10, мышам с иммуносупрессией с прижившимся подкожным раком головы и шеи человека FaDu перорально (п./о.) вводили 200 мг/кг соединения 1 в размолотой вручную кристаллической форме 1 или форме 3 или контроль в виде носителя. Соединение 1 формулировали в гелюцире. Все режимы введения проводили ежедневно (каждые сутки). В ходе обработки периодически оценивали размеры опухолей. Этот полиморф успешно получили способом cGMP и получили одобрение от FDA и Health Canada на его использование в клинических исследованиях. Для формы 3 также показана желательная фармакокинетика (фигура 12), безопасность и убедительные признаки противоопухолевой активности у пациентов с раком.
[0127] На фигурах 5A-5B представлен способ синтеза для получения кристаллической формы 2. В кратком изложении, заряженный 3-бутен-2-он (451,2 грамм) добавляют в 2-литровую 3-горловую круглодонную колбу, оборудованную механической мешалкой, термометром и капельной воронкой. В капельную воронку добавляют бром (936,0 грамм). После охлаждения содержимого колбы до -5°C, в колбу в течение 30 минут по каплям добавляют бром при интенсивном перемешивании и поддержании температуры при -5°C. Смесь перемешивают в течение дополнительных 15 минут при -5°C, а затем разделяют на 4 равные порции. Каждую порцию смеси вместе с тетрагидрофураном (2133,6 грамм) добавляют в 22-литровую 4-горловую круглодонную колбу, оборудованную механической мешалкой, термометром и капельной воронкой. В капельную воронку добавляют DBU (1,3-диазабицикло[5,4,0]ундец-7-ен, 222,9 грамм). В колбу в течение 30 минут по каплям добавляют DBU при интенсивном перемешивании и поддержании температуры при 0°C-5°C. Смесь перемешивают в течение дополнительных 15 мин при 0°C-5°C. Затем в колбу добавляют 2-гидрокси-1,4-нафтохинон (231 грамм). В капельную воронку добавляют дополнительный DBU (246,0 грамм) и затем капельно добавляют в смесь в колбе с такой скоростью, что температура реакционной смеси не превышает 40°C. После завершения добавления DBU полученную смесь перемешивают в течение ночи при комнатной температуре, и образец реакционной смеси отбирают для анализа ВЭЖХ. В реакционную смесь добавляют воду (10,8 литров), и полученную смесь охлаждают до 0°C-3°C в течение по меньшей мере 30 минут, а затем фильтруют через вакуумный фильтр. Отфильтрованное твердое вещество последовательно промывают 5% водным бикарбонатом натрия (3 литра), водой (3 литра), 1% водной уксусной кислотой (3 литра) и дважды этанолом (2×1 литру). Промытое твердое вещество хранят и объединяют с веществом из других партий. Объединенный неочищенный продукт (28,73 кг) добавляют вместе с этилацетатом (811,7 кг) в сосуд на 500 галлонов (1893 л), оборудованный механической мешалкой, термометром и конденсатором. Смесь нагревают в атмосфере азота до кипения с обратным холодильником (72°C) в течение 2 часов, а затем фильтруют через 10 микронный патронный фильтр, содержащий слой активированного угля с удалением нерастворимых примесей. Для промывки сосуда, трубопровода и фильтра используют свежий горячий этилацетат (10 кг). Объединенный фильтрат охлаждают до 0-5°C и выдерживают при этой температуре в течение 2 часов, а затем фильтруют через 20 дюймовый (0,508 м) фильтр Бюхнера. Отфильтрованный твердый продукт промывают при 0-5°C этилацетатом (5,7 кг) и высушивают в вакууме при 40°C до постоянной массы. Объем оставшегося фильтрата уменьшают до 63% посредством выпаривания и снова повторяют процесс кристаллизации с получением второй порции продукта, которую также высушивают в таких же условиях, как и первую порцию продукта. Обе полученных порции представляют собой кристаллическую форму 2. Чистота первой полученной порции (0,5 кг) при ВЭЖХ составляла 99,5% (~95% при ЯМР). Чистота второй полученной порции (1,09 кг) при ВЭЖХ составляла 98,9% (~90% по ЯМР).
[0128] На фигурах 6A-6D представлен способ синтеза для получения кристаллической формы 3. Стадии в кратком изложении описаны в настоящем документе. Стадия 1: 3-бутен-2-он (метилвинилкетон, MVK) бромируют с использованием брома. Дополнительного растворителя не используют. Промежуточное соединение 3,4-дибромбутан-2-он растворяют в тетрагидрофуране (THF) и проводят реакцию с 1,8-диазабицикло[5,4,0]ундец-7-еном (DBU) с образованием второго промежуточного соединения, 3-бром-3-бутен-2-она. После завершения этой реакции добавляют 2-гидрокси-1,4-нафтохинон (HNQ). Добавляют вторую порцию DBU, и смесь подвергают воздействию воздуха. Реакцию гасят водой, и твердые вещества собирают фильтрацией. Эти твердые вещества промывают водным бикарбонатом натрия, водной уксусной кислотой, водой и этанолом. Продукт выделяют посредством суспендирования в этаноле и сбора твердых веществ. Стадия 2: Остаточные количества 2-ацетил-2,3-дигидронафто[2,3-b]фуран-4,9-диона, сопутствующего желаемому 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диону (соединение 1), окисляют до соединения 1 с помощью активированного диоксида марганца в толуоле. Смесь фильтруют через слой угля и целит. Фильтрат концентрируют с осаждением продукта, который фильтруют и высушивают. Стадия 3: твердые вещества суспендируют в этилацетате (25 мл/г очищенного соединения 1) при 75°C-80°C в течение приблизительно 5 часов, собирают фильтрацией и высушивают. Соединение 1, полученное этим способом, представляет собой кристаллическую форму 3. Соединение 1, полученное этим способом без процесса суспендирования, дает кристаллическую форму 1.
Влияние распределения частиц соединения по размерам на концентрацию лекарственного средства в плазме крови и избирательную противоопухолевую активность
[0129] До настоящего изобретения микрочастиц соединения 1 не получали и/или не оценивали. Предшествующие исследования показали, что соединение 1 является одинаково токсичным для нормальных клеток и раковых клеток, и противоопухолевой активности в модели на животных не наблюдали. Исследования, описываемые в настоящем документе, демонстрируют, что уменьшение размера частиц соединения 1 не только улучшало биодоступность, но также приводило к увеличенной избирательной противоопухолевой активности без признаков токсичности. Это является неожиданным, поскольку улучшение биодоступности может равным образом увеличивать воздействие соединения 1 на раковые клетки и нормальные клетки. Механизм избирательного улучшения противораковой активности без увеличения токсичности для нормальных клеток неизвестен. В этих исследованиях улучшение биодоступности соединения 1, по-видимому, является максимальным, когда D50 (т.е., медианная точка распределения частиц по размерам, которая делит распределение на две равные части) составляет приблизительно 20 мкм. Однако проводили дополнительные исследования, где значение D50 составляло приблизительно 2 мкм. Микрочастицы соединения 1 с D50 2 микрон неожиданно обладали повышенной противоопухолевой активностью, даже несмотря на то, что улучшения фармакокинетического воздействия по сравнению с частицами с D50 20 микрон нет. В дополнительных исследованиях получены наночастицы соединения 1 с D50 приблизительно 100 нанометров (D50=110,4 нанометров), однако неожиданно при этом размере частиц соединения 1 наблюдали снижение противоопухолевой активности. Таким образом, в предпочтительном варианте осуществления композиции, содержащие частицы соединения 1, например, микрочастицы, обладают D50, равным или меньшим 20 микрон и равным или большим 0,2 микрон, и обладают неожиданно высокой противоопухолевой активностью без увеличения цитотоксичности для нормальных клеток.
[0130] На фигуре 15 проиллюстрирована противоопухолевая активность частиц соединения 1 с различными диапазонами размеров частиц, а на фигурах 16-18 проиллюстрированы данные фармакокинетики для частиц соединения 1 с различными диапазонами размеров частиц. В исследовании, представленном на фигуре 15, мышам с иммуносупрессией с прижившимся подкожным раком головы и шеи человека FaDu перорально (п./о.) вводили указанное количество соединения 1 с указанным размером частиц или контроль в виде носителя. Все режимы введения проводили ежедневно (каждые сутки). Периодически оценивали размер опухоли.
[0131] Выявлено, что введение нафтофуранового соединения в форме частиц с определенным размером частиц, например, уменьшенным размером частиц, увеличивало концентрацию лекарственного средства в плазме in vivo. В настоящем документе, если не указано иначе, термины "размер" и "диаметр" для описания частиц используют взаимозаменяемо. Следует понимать, что использование термина "диаметр" не обязательно подразумевает, что частица обладает совершенной или приблизительно сферической формой. Например, "диаметр" можно использовать в качестве приближения для размера частицы, например, диаметр сферы равного объема для несферической частицы.
[0132] В результате неожиданно выявили, что введение частиц нафтофуранового соединения в фармацевтической композиции с определенным распределением частиц по размерам, например, в виде малых частиц, приводит к избирательной противоопухолевой активности. Например, соединение, вводимое в виде частиц с медианным размером частиц 20 мкм (т.е., микрон, эти термины используют в настоящем документе взаимозаменяемо), в моделях с ксенотрансплантатами у мышей продемонстрировало эффективность (избирательную противоопухолевая активность), хотя относительно слабую. В отличие от этого, частиц с размером частиц 150 мкм (микрон) не продемонстрировали эффективности. Открытие того, что введение нафтофуранового соединения в форме меньших частиц может приводить к избирательной противоопухолевой активности, является неожиданным, и его нельзя объяснить только на основании улучшения растворимости или биодоступности. То есть, как правило, улучшенная растворимость ассоциирована с увеличенной пероральной биодоступностью лекарственного средства, которая может увеличивать токсичность для нормальных клеток, так же как и противоопухолевую активность. Как указано выше, если воздействие не осуществляют в определенных условиях, нафтофурановое соединение может являться одинаково токсичным для опухолевых клеток и для нормальных клеток, как описано в WO 2009/036099 и WO 2009/036101.
[0133] Кроме того, в результате неожиданно обнаружили, что введение частиц нафтофуранового соединения в фармацевтической композиции с дополнительно уменьшенным размером частиц приводит к значительно улучшенной противоопухолевой активности, но почти неизмененному фармакокинетическому профилю, т.е., неизмененной биодоступности. Например, соединение, вводимое в форме частиц с медианным размером частиц 2 мкм (микрон), в моделях с ксенотрансплантатами у мышей демонстрирует значительно улучшенную эффективность. В сравнении с частицами 20 мкм частицы 2 мкм продемонстрировали значительно улучшенную эффективность, но очень сходный фармакокинетический профиль. Другими словами, такая улучшенная эффективность является независимой от фармакокинетического профиля, т.е., биодоступности. Результат является очень неожиданным, поскольку для такого соединения с плохой растворимостью улучшенная эффективность, как правило, связана с увеличенной пероральной биодоступностью лекарственного средства.
[0134] Наблюдаемое улучшение избирательной противоопухолевой активности является, таким образом, удивительным и неожиданным. Настоящее изобретение относится к частице или частицам нафтофуранового соединения, например, соединения формулы I, которые являются активными, т.е., обладают эффективностью или избирательной противоопухолевой активностью. Активная частица или частицы обладают определенным размером частиц, например, их диаметр, является меньшим или равным приблизительно 200 мкм, приблизительно 150 мкм, приблизительно 100 мкм, приблизительно 40 мкм, или приблизительно 20 мкм, приблизительно 10 мкм, приблизительно 5 мкм, приблизительно 4 мкм, приблизительно 3 мкм, приблизительно 2 мкм, приблизительно 1 мкм, приблизительно 0,5 мкм, приблизительно 0,2 мкм или приблизительно 0,1 мкм. Частицы или частицы, превышающие определенный размер частиц, являются либо не активными, либо менее активными, чем частицы, описанные в настоящем документе.
[0135] Таким образом, введение нафтофуранового соединения или другого соединения формулы I в форме меньших частиц может приводить к улучшению его избирательной противоопухолевой активности. Использование при дозировании частиц соединения формулы I c определенным распределением частиц по размерам может обеспечивать получение желательной избирательной противоопухолевой активности. Например, использование частиц нафтофуранового соединения с определенным распределением частиц по размерам, например, являющихся меньшими частицами, может приводить к более высокой концентрации в крови в течение более короткого периода времени и к избирательной противоопухолевой активности, хотя и относительно слабой. Дальнейшее уменьшение размера частиц соединения может приводить к значительно улучшенной эффективности при неизмененной концентрации соединения в плазме крови.
[0136] В настоящем документе, если не указано иначе, термины "концентрация в плазме крови", "молярная концентрация в крови" и "концентрация в крови" используют взаимозаменяемо. Термин "неоплазия" можно использовать для описания клеток, демонстрирующих аномальный характер роста. Такая неоплазия может включать опухоли, как доброкачественные, так и злокачественные, например, солидные опухоли, а также другие нарушения роста клеток, такие как лейкоз, который не обладает определенной формой и не ограничен конкретной областью организма человека или животного. Таким образом, "неоплазия" включает как раковые, так и нераковые неопластические клетки и ткани. В настоящем документе, если не указано иначе, при пояснении или по отношению к конкретному исследованию или эксперименту, термины "опухоль" и "рак" следует понимать как относящиеся к более широкому классу всех неоплазий, включая неоплазии, не ограниченные конкретной областью организма человека или животного. Однако более ограниченный термин "солидная опухоль" следует понимать как не включающий такие нарушения роста клеток, как лейкоз, который не обладает определенной формой и не ограничен конкретной областью организма человека или животного.
[0137] Неоплазия может не обладать, обладать одной или обладать более одной из следующих характеристик: однородная форма (солидная опухоль), злокачественность, метастазирование или активность пути Stat 3. Неоплазия может включать, например, раковую стволовую клетку. Неоплазия может представлять собой, например, карциному, саркому, аденокарциному, лимфому или гемобластоз.
[0138] Всасывание определено как процесс, посредством которого лекарственное средство поступает от участка введения в участок измерения в организме. См., M. Rowland, T.N. Tozer (1995) Clinical pharmacokinetics: Concepts and applications. Lippincott Williams & Wilkins. Пероральное всасывание лекарственного средства часто определяют как перенос лекарственного средства через апикальную мембрану энтероцита, поскольку считают, что апикальная мембрана является лимитирующей скорость стадией для прохождения через мембрану. См., U. Fagerholm & H. Lennernas (1995) Experimental estimation of the effective unstirred water layer thickness in the human jejunum, and its importance in oral drug absorption, Eur. J. Pharm. Sci. 3: 247-253; M.B. Lande, J.M. Donovan & M.L. Zeidel (1995) The relationship between membrane fluidity and permeabilities to water, solutes, ammonia, and protons, J. Gen. Physiol. 106: 67-84. Проницаемость является общим термином, описывающим, насколько легко лекарственное средство проходит через мембрану. Конкретные характеристики проницаемости лекарственного средства зависят от его физико-химических свойств, включая липофильность, заряд, размер и область полярной поверхности. См., Rowland & Tozer 1995; C.A. Lipinski, F. Lombardo, B.W. Dominy & P.J. Feeney (2001) Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings, Adv. Drug. Deliv. Rev. 46: 3-26. Скорость всасывания зависит от проницаемости лекарственного средства, площади поверхности мембраны и градиента концентрации на мембране. Градиент концентрации является движущей силой пассивной диффузии, наиболее распространенного механизма мембранного транспорта лекарственного средства. В случае перорального введения лекарственное средство в основном всасывается в кишечнике. Длина кишечника человека составляет приблизительно 5-8 метров, и его общая площадь поверхности составляет почти 200 квадратных метров, в то время как длина кишечника мыши составляет только приблизительно 10-20 см в длину. Таким образом, можно предсказать, что лекарственное средство с более крупным размером частиц может обладать более высокой или одинаковой скоростью всасывания у человека, чем лекарственное средство с меньшим размером частиц у мыши, несмотря на то, что проницаемость лекарственного средства с более крупным размером частиц ниже, чем проницаемость лекарственного средства с меньшим размером частиц.
[0139] Например, можно предсказать, что распределение размеров частиц соединения формулы I с медианным диаметром меньшим или равным приблизительно 200 мкм, 150 мкм, 100 мкм, 80 мкм, 60 мкм, 40 мкм, 20 мкм, 10 мкм, 5 мкм, 4 мкм, 3 мкм, 2 мкм, 1 мкм, 0,5 мкм или 0,2 мкм приведет к избирательной противоопухолевой активности при введении в фармацевтическом составе, например, для лечения рака или опухоли. Например, распределение частиц по размерам может являться таким, что частицы обладают медианным диаметром от приблизительно 0,02 мкм до приблизительно 5 мкм или от приблизительно 0,2 мкм до приблизительно 4 мкм. Например, распределение частиц по размерам может являться таким, что частицы обладают медианным диаметром, меньшим или равным приблизительно 5 мкм, отношением среднего диаметра к медианному диаметру не более чем приблизительно 2 и отношением моды диаметра к медианному диаметру по меньшей мере приблизительно 0,25.
[0140] Термин "частица" может относится к агрегату соединения формулы I. Термин "средний" может относится к сумме размеров всех частиц, разделенной на общее количество частиц. Термин "медиана" может относится, например, к диаметру, для которого половина частиц обладает большим диаметром, а половина частиц обладает меньшим диаметром. Термин "мода" может обозначать наиболее часто встречающееся значение размера частиц. Термин "суммарная совокупность" может относится ко всем частицам.
[0141] Избирательная противоопухолевая активность, достигаемая посредством введения частиц нафтофуранового соединения, может зависеть не только от распределения размеров частиц, например, объемов частиц или диаметров, характерных для этих объемов, но также от формы частиц и распределения частиц по формам. Например, совокупность частиц с игольчатой формой, может приводить к другому фармакокинетическому профилю, чем совокупность частиц со сферической формой. Таким образом, желательным может являться измерение формы и распределение по формам частиц, подлежащих введению, и/или применение способа, позволяющего получать частицы с заданной формой и распределением по формам, например, почти одинаковой формы, например, частицы, приближенные к сферам. Например, сферичность, Ψ, частицы можно определять как
где Vp представляет собой объем частицы, а Ap представляет собой площадь поверхности частицы. Сфера обладает сферичностью Ψ=1, и чем ближе сферичность частицы к единице, тем ближе форма частицы к сфере. Для сравнения, сферичность тетраэдра составляет приблизительно 0,671, сферичность куба составляет приблизительно 0,806, сферичность октаэдра составляет приблизительно 0,846, сферичность додекаэдра составляет приблизительно 0,910, и сферичность икосаэдра составляет приблизительно 0,939. Поскольку форма сферы минимизирует площадь поверхности для данного объема, можно ожидать, что частица, являющаяся почти сферической, растворяется более медленно, чем частица такого же объема, менее приближенная к сфере. Среднюю сферичность совокупности сфер можно определить как
где ΣVp представляет собой общий объем всех частиц, а ΣAp представляет собой общую площадь поверхности всех частиц. Например, средняя сферичность вводимых частиц соединения формулы I может составлять по меньшей мере приблизительно 0,8, или средняя сферичность может составлять по меньшей мере приблизительно 0,9.
[0142] Размер, распределение по размерам, форма, распределение по формам и такие факторы, как шероховатость или неравномерность поверхности частиц, могут влиять на среднюю удельную площадь поверхности совокупности частиц соединения 1, вводимых в фармацевтическом составе. Среднюю удельную площадь поверхности можно определить как ΣAp/Σmp, где ΣAp представляет собой общую площадь поверхности частиц, а Σmp представляет собой общую массу частиц. Чем большей является средняя удельная площадь поверхности частиц, тем быстрее происходит ожидаемое растворение частиц.
[0143] Частицы соединения формулы I в фармацевтическом составе могут содержать нафтофурановое соединение в кристаллическом состоянии в различных частицах или внутри одной и той же частицы. Кристаллическое состояние может включать один или несколько полиморфов в различных частицах или внутри одной и той же частицы. Как понятно специалисту в данной области, ожидают, что на скорость растворения частиц может влиять агрегатное состояние соединения в частицах, например, кристаллическое, в виде первого полиморфа или второго полиморфа.
[0144] Для определения размера частиц и/или распределения частиц по размерам соединения формулы I в фармацевтическом составе можно применять один или несколько из ряда способов. Например, можно использовать ситовый анализ, подсчет под световым микроскопом, подсчет на электронном микроскопе, подсчет по электрорезистентности, определение времени седиментации, лазерную дифракцию и/или акустическую спектроскопию. Для определения формы, распределения формы и/или удельной площади частиц нафтофуранового соединения в фармацевтическом составе можно использовать некоторые или все эти способы или их варианты. Для определения удельной площади частиц соединения формулы I в фармацевтическом составе можно использовать изотерму BET и/или способ определения удельной поверхности по воздухопроницаемости.
Способы получения нафтофурановых соединений
[0145] В WO 2009/036099 и WO 2009/036101 описан способ получения нафтофуранового соединения формулы II, как указано ниже.
DBU: 1,8-диазабицикло[5.4.0]ундец-7-ен;
THF: тетрагидрофуран;
RT: комнатная температура.
[0146] В этом способе проводят реакцию 3-бром-3-бутен-2-она (4-3) с 2-гидрокси-1,4-нафтохиноном (4-4) в контейнере, открытом для доступа воздуха, получая 2,3-дигидронафто[2,3-b]фуран-4,9-дион (4-5). 2,3-Дигидронафто[2,3-b]фуран-4,9-дион (4-5) окисляется кислородом воздуха с преобразованием в нафто[2,3-b]фуран-4,9-дион (4-6). Этим способом получают нафто[2,3-b]фуран-4,9-дион. Однако в ходе дальнейшей разработки соединения, определили, что в этом способе еще образуется значительное количество различных примесей, что препятствует потенциальным клиническим применениям этих соединений. В некоторых вариантах осуществления, одной из примесей является 2,3-дигидронафто[2,3-b]фуран-4,9-дион (4-5).
[0147] В одном из аспектов настоящее изобретение относится к улучшенному способу получения нафтофурана. В улучшенном способе минимизировано количество примесей, и, таким образом, получают по существу чистый нафтофуран. Как применяют в настоящем документе термин "по существу чистый" относится к препарату, содержащему по меньшей мере приблизительно 80% соединения по настоящему изобретению или более, как измеряют по % площади при ВЭЖХ. В некоторых вариантах осуществления нафтофуран представляет собой нафто[2,3-b]фуран-4,9-дион и родственные ему соединения (4-6).
[0148] В некоторых вариантах осуществления способ по настоящему изобретению включает окисление неочищенного продукта конденсации 3-бром-3-бутен-2-она (4-3) и 2-гидрокси-1,4-нафтохинона (4-4) с применением окислителя в первом растворителе. В дополнительном варианте осуществления окислитель представляет собой диоксид марганца (MnO2). В дополнительном варианте осуществления неочищенный продукт выделяют перед окислением. В некоторых вариантах осуществления первый растворитель представляет собой толуол или хлороформ.
[0149] В некоторых вариантах осуществления способ по настоящему изобретению дополнительно включает обработку окисленной смеси для окисления древесным углем с избавлением от определенных примесей. В дополнительном варианте осуществления окисленную смесь для окисления фильтруют через слой активированного угля. В дополнительном варианте осуществления смесь фильтруют при температуре приблизительно 100°C.
[0150] В некоторых вариантах осуществления способ по настоящему изобретению дополнительно включает кристаллизацию продукта из фильтрата. В дополнительном варианте осуществления продукт кристаллизуют посредством концентрации фильтрата выпариванием и охлаждения.
[0151] В некоторых вариантах осуществления способ по настоящему изобретению дополнительно включает перекристаллизацию продукта с применением второго растворителя. В дополнительном варианте осуществления второй растворитель представляет собой этилацетат.
[0152] В альтернативном варианте осуществления способ по настоящему изобретению дополнительно включает суспендирование во втором растворителе продукта, кристаллизованного из первого растворителя, нагрев суспензии и охлаждение суспензии. В дополнительном варианте осуществления второй растворитель представляет собой этилацетат. В некоторых вариантах осуществления продукт суспендируют и нагревают только до частичного растворения. В дополнительном варианте осуществления объем второго растворителя, используемого для суспендирования продукта, составляет приблизительно 1/10, 1/5, 1/4, 1/3, 1/2 или 2/3 объема для полного растворения продукта в нагретом состоянии.
[0153] Настоящее изобретение также относится к нафтофурановому соединению, получаемому способом по настоящему изобретению. В некоторых вариантах осуществления нафтофурановое соединение выбрано из группы, состоящей из 2-(1-гидроксиэтил)нафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-диона, 2-ацетилнафто[2,3-b]фуран-4,9-диона, 2-этилнафто[2,3-b]фуран-4,9-диона, моно-[1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового] эфира фосфорной кислоты, диметилового эфира 1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового эфира фосфорной кислоты, их энантиомеров, диастереомеров, таутомеров и солей или сольватов. В дополнительном варианте осуществления нафтофурановое соединение получают способом, включающим реакцию выделенного неочищенного продукта конденсации 2-гидрокси-1,4-нафтохинона (4-4) и 3-бром-3-бутен-2-она (4-3) с диоксидом марганца в присутствии толуола. В дополнительном варианте осуществления способ дополнительно включает фильтрование окисленной реакционной смесь через слой активированного угля.
[0154] В другом аспекте настоящее изобретение относится по существу к чистым нафтофурановым соединениям.
[0155] В некоторых вариантах осуществления настоящее изобретение относится по существу к чистому соединению, выбранному из группы, состоящей из 2-(1-гидроксиэтил)нафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-диона, 2-ацетилнафто[2,3-b]фуран-4,9-диона, 2-этилнафто[2,3-b]фуран-4,9-диона, моно-[1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового] эфира фосфорной кислоты, диметилового эфира 1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового эфира фосфорной кислоты, их энантиомеров, диастереомеров, таутомеров и солей или сольватов.
[0156] В некоторых вариантах осуществления настоящее изобретение относится по существу к чистому соединению формулы II,
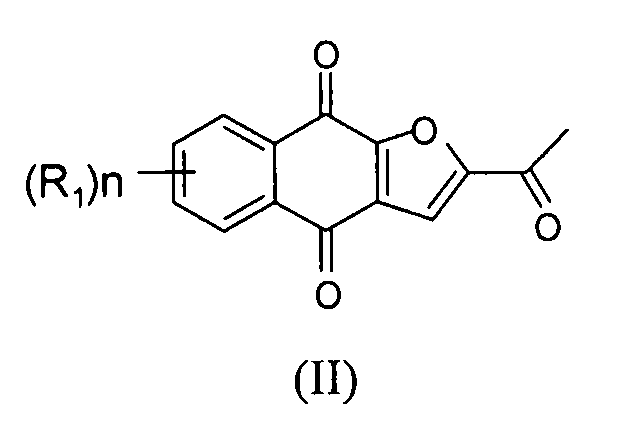
где каждый R1 независимо представляет собой H, Cl или F; а n представляет собой 0, 1, 2, 3 или 4.
[0157] Как применяют в настоящем документе, "по существу чистое" относится к чистоте по меньшей мере приблизительно 80%. В некоторых вариантах осуществления чистота соединения по настоящему изобретению представляет собой чистоту по меньшей мере приблизительно 85%, приблизительно 90%, приблизительно 95% или приблизительно 99%. В дополнительном варианте осуществления чистота соединения по настоящему изобретению представляет собой чистоту по меньшей мере приблизительно 99,5% или приблизительно 99,8%. В дополнительном варианте осуществления чистота соединения по настоящему изобретению представляет собой чистоту по меньшей мере приблизительно 99,85%, приблизительно 99,90%, приблизительно 99,94%, приблизительно 99,95% или приблизительно 99,99%. В некоторых вариантах осуществления соединение по настоящему изобретению выбрано из группы, состоящей из 2-(1-гидроксиэтил)нафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-диона, 2-ацетилнафто[2,3-b]фуран-4,9-диона, 2-этилнафто[2,3-b]фуран-4,9-диона, моно-[1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового] эфира фосфорной кислоты, диметилового эфира 1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового эфира фосфорной кислоты, их энантиомеров, диастереомеров, таутомеров и солей или сольватов. В некоторых вариантах осуществления соединение по настоящему изобретению представляет собой полиморф. В некоторых вариантах осуществления соединение по настоящему изобретению представляет собой полиморф соединения формулы I. В некоторых вариантах осуществления соединение по настоящему изобретению представляет собой полиморф соединения 1.
[0158] Типичные примеси, которые могут присутствовать в соединении по настоящему изобретению, включают одно или несколько выбранных из группы, состоящей из побочного продукта, изомера, промежуточного соединения и растворителя. В некоторых вариантах осуществления примеси, которые могут присутствовать в соединении по настоящему изобретению, составляют до приблизительно 10%, до приблизительно 8%, до приблизительно 5%, до приблизительно 2% или до приблизительно 1% относительно соединения формулы II. В дополнительном варианте осуществления, примеси, которые могут присутствовать в соединении по настоящему изобретению, составляют до приблизительно 0,5%, до приблизительно 0,2%, до приблизительно 0,15% или до приблизительно 0,1% относительно соединения формулы II. В дополнительном варианте осуществления примеси, которые могут присутствовать в соединении по настоящему изобретению составляют до приблизительно 0,05%, до приблизительно 0,02% или до приблизительно 0,01% относительно соединения формулы II. В некоторых вариантах осуществления по существу чистое соединение формулы II содержит приблизительно до 500, 200, 100, 50, 20, 10, 5, 2, 1, 0,5, 0,2, 0,15, 0,1 или 0 миллионных долей (м.д.) остаточного побочного продукта или побочных продуктов относительно соединения формулы II.
[0159] В некоторых вариантах осуществления примеси включают один или несколько побочных продуктов, выбранных из группы, состоящей из 2-ацетил-2,3-дигидронафто[2,3-b]фуран-4,9-диона, 2,6-диацетилнафто[2,3-b]фуран-4,9-диона, 2,7-диацетилнафто[2,3-b]фуран-4,9-диона, 3-ацетилнафто[2,3-b]фуран-4,9-диона, нафто[2,3-b]фуран-4,9-диона, нафто[2,3-b]фуран-4,9-диона, нафто[2,3-b]фуран-4,9-диола и 1-(4,9-дигидроксинафто[2,3-b]фуран-2-ил)этанона.
[0160] В некоторых вариантах осуществления примеси содержат марганец (Mn).
[0161] Чистоту соединения по настоящему изобретению можно определять с применением различных устройств. В некоторых вариантах осуществления чистоту определяют посредством ВЭЖХ (высокоэффективной жидкостной хроматографии). В некоторых вариантах осуществления чистоту определяют посредством ЯМР (ядерного магнитного резонанса). В дополнительном варианте осуществления чистоту определяют и ВЭЖХ, и ЯМР.
[0162] Эти высокочистые композиции, содержащие соединение 1, в экспериментах на животных демонстрируют значительно улучшенный профиль безопасности по сравнению с менее чистыми композициями, содержащими соединение 1. Признаков какого-либо неблагоприятного воздействия высокочистого соединения 1 у мышей не наблюдали. Кроме того, эти высокочистые композиции, содержащие соединение 1, тестировали на пациентах и показали их исключительную безопасность. Например, на фигуре 13 проиллюстрирована токсичность, наблюдаемая для композиции с чистотой соединения 1 приблизительно 90%, в то время как на фигуре 14 проиллюстрировано, что высокочистые композиции с чистотой соединения 1 приблизительно 95% или более являются безопасными и эффективными. В исследовании, представленном на фигуре 13, мышам с иммуносупрессией с прижившимся подкожным раком головы и шеи человека FaDu (верхняя панель) или раком молочной железы человека MDA-231 (нижняя панель) перорально (п./о.) вводили указанное количество соединения 1 или контроля в виде носителя. Соединение 1 формулировали в ГЕЛЮЦИРЕ™. Все режимы введения проводили ежедневно (каждые сутки). В ходе обработки периодически оценивали массу тела. Каждая точка представляет среднее ± SEM для восьми опухолей. Для соединения 1 с чистотой приблизительно 90% наблюдали значительную токсичность. Всего во время обработки в первом эксперименте (верхняя панель) погибли 4 мыши (одна на сутки 16, 2 на сутки 19 и 1 на сутки 23), и их массы тела, таким образом, не включали в график после их гибели. Всего 3 мыши погибли во время обработки во втором эксперименте (нижняя панель) (1 на сутки 14 и 2 на сутки 21), и, таким образом, их массы тела в график после их гибели не включали. В исследовании, представленном на фигуре 14, мышам с иммуносупрессией с прижившимся подкожным раком головы и шеи человека FaDu (верхняя панель) или раком молочной железы человека MDA-231 (нижняя панель) перорально (п./о.) вводили указанное количество соединения 1, или контроля в виде носителя. Соединение 1 формулировали в ГЕЛЮЦИРЕ™. Все режимы введения проводили ежедневно (каждые сутки). В ходе обработки периодически оценивали массу тела. Каждая точка представляет среднее ± SEM для восьми опухолей. Соединение 1 с более высокой чистотой являлось хорошо переносимым и не демонстрировало признаков токсичности. Все мыши оставались здоровыми на протяжении обработки в обоих экспериментах. В исследовании фазы I дозу соединения 1 увеличивали с 20 мг до 2000 мг/сутки и максимальной переносимой дозы (MTD) не достигали. Лимитирующей дозу токсичности не наблюдали. Пациенты переносили соединение 1 очень хорошо без вызываемого лекарственным средством неблагоприятного воздействия, что резко отличается от химиотерапевтических средств против рака. Клинический профиль безопасности по существу чистых композиций соединения 1 находится среди лучших в истории для онкологических лекарственных средств.
Фармацевтические составы
[0163] Выявлено, что конкретные эксципиенты или усилители увеличивают пероральную биодоступность частиц соединения формулы I с данным распределением частиц по размерам в фармацевтическом составе. Например, добавление фармацевтически совместимого наполнителя гелюцира™ 44/14 (глицериллаурат полиэтиленгликоля, производимый Gattefosse) может увеличивать биодоступность соединения 1 с медианным размером частиц, меньшим или равным приблизительно 20 микрон. Примеры других наполнителей, которые можно использовать для увеличения или контроля пероральной биодоступности, включают поверхностно-активные вещества, такие как TWEEN 80™ или TWEEN 20™ (полисорбат, т.е., монолаурат полиоксиэтиленсорбитана) или определенные липиды, такие как фосфатидилхолины, например, димиристоилфосфатидилхолин (DMPC). Поверхностно-активные вещества включают соединения, которые являются амфифильными и содержат как гидрофобные, так и гидрофильные группы. Другие эксципиенты могут включать, например, глицериновый эфир жирной кислоты, глицериновый эфир насыщенной жирной кислоты, глицериновый эфир насыщенной жирной кислоты, содержащей от 8 до 18 атомов, глицериллаурат, полиэтиленгликоль, алкилат полиоксиэтиленсорбитана, целлюлозу или производные целлюлозы, такие как микрокристаллическая целлюлоза и карбоксиметилцеллюлоза (CMC), а также липиды, такие как стерины, например, холестерин. Другие эксципиенты могут включать антиоксиданты, такие как витамин E. Как понятно специалисту в данной области, в фармацевтический состав по настоящему изобретению можно включать другие эксципиенты и дополнительные компоненты. Например, можно включать другие активные средства, стандартные носители, носители, жидкие носители, физиологический раствор, водные растворы, разбавители, поверхностно-активные средства, диспергирующие средства, инертные разбавители, гранулирующие и дезинтегрирующие средства, связующие средства, смазывающие средства, способствующие скольжению средства, средства, снимающие заряд, подсластители, ароматизаторы, красители, консерванты, физиологически разлагаемые композиции, такие как желатин, водные носители и растворители, масляные носители и растворители, суспендирующие средства, диспергирующие средства или средства для смачивания, суспендирующие средства, эмульгаторы, смягчающие средства, буферы, соли, загустители, желатины, наполнители, эмульгаторы, антиоксиданты, антибиотики, противогрибковые средства, стабилизаторы, воду, гликоли, масла, спирты, средства, замедляющие кристаллизацию (например, для замедления кристаллизации сахара), крахмалы, сахара, сахарозу, поверхностно-активные вещества, средства для увеличения растворимости любого другого ингредиента, такие как полигидроксиспирт, например, глицерин или сорбит, фармацевтически приемлемые полимерные или гидрофобные вещества и другие компоненты. Как понятно специалисту в данной области, подходящие дополнительное средство или средства для добавления зависят от лекарственной формы (например, инъецируемый раствор, капсула или пилюля).
[0164] Соединение формулы I по настоящему изобретению можно формулировать в "фармацевтические композиции". Варианты осуществления настоящего изобретения включают различные лекарственные формы, содержащие соединение, которые могут являться пригодными, например, для лечения пациента. Например, пероральные лекарственные формы могут включать таблетку, пилюлю, капсулу (твердую или мягкую), каплет, порошок, гранулу, суспензию (например, в водном или масляном носителе), раствор (например, в водном или масляном носителе), гель, саше, пастилку, таблетку-леденец, сироп, эликсир, эмульсию, дозу жидкого лекарственного средства, эмульсию "масло-в-воде" или эмульсию "вода-в-масле". Предпочтительную пероральную дозу, вследствие простоты их введения, могут представлять собой таблетки и капсулы. Твердые пероральные лекарственные формы можно стандартными способами покрывать сахаром или покрывать растворимой в кишечнике оболочкой. Например, составы назального спрея и спрея для других слизистых оболочек (например, формы для ингаляции) могут включать очищенные водные растворы активных соединений с консервантами и средствами придания изотоничности. Такие составы предпочтительно доводят до pH и изотонического состояния, согласующихся со слизистыми оболочками носа или другими слизистыми оболочками. Альтернативно, они могут находится в форме тонкоизмельченных твердых порошков, суспендированных в газообразном носителе, в форме средства для ингаляции или аэрозоля. Такие составы можно вводить любыми подходящими средствами или способами, например, посредством ингалятора, распылителя, ингалятора отмеренных доз или т.п. Например, фармацевтическую композицию по настоящему изобретению можно вводить местно, например, в форме мази, крема или суппозитория. Например, фармацевтическую композицию по настоящему изобретению можно вводить посредством инъекции инъекционного препарата. Таким образом, лекарственная форма по настоящему изобретению может иметь, например, твердую, полужидкую, жидкую или газообразную форму. Подходящие лекарственные формы в качестве неограничивающих примеров включают формы для перорального, ректального, подъязычного, слизистого, назального, глазного, подкожного, внутримышечного, внутривенного, парентерального, чрескожного, спинального, интратекального, интраартикулярного, внутриартериального, субарахноидального, бронхиального, лимфатического и внутриматочного введения, и другие лекарственные формы для системной доставки активных ингредиентов. Активный ингредиент, например, соединение формулы I, может содержаться в составе, обеспечивающем после введения индивидууму (пациенту) быстрое высвобождение, длительное высвобождение, отсроченное высвобождение или любой другой профиль высвобождения, известный специалисту в данной области. Способ введения и лекарственная форма, выбираемые для данного лечения, тесно связаны с терапевтическими количествами соединений или композиций, которые являются желательными и эффективными для данного терапевтического применения, а также с такими факторами, как психическое состояние и физическое состояние индивидуума (пациента).
[0165] Фармацевтическую композицию по изобретению можно получать, упаковывать или продавать нерасфасованной, в виде единичной стандартной дозы, в виде множества единичных стандартных доз или в форме для многократного дозирования. Как применяют в настоящем документе, "стандартная доза" представляет собой дискретное количество фармацевтической композиции, содержащей заданное количество активного ингредиента. Количество активного ингредиента в каждой стандартной дозе, как правило, равно общему количеству активного ингредиента, который необходимо ввести, или удобной части общей дозы, например, такой как одна вторая или одна треть такой дозы. Состав фармацевтической композиции по изобретению, пригодной для перорального введения, может находиться в форме дискретной твердой единицы дозирования. Каждая твердая единица дозирования содержит заданное количество активного ингредиента, например, стандартную дозу или ее часть. Как применяют в настоящем документе, "масляная" жидкость представляет собой жидкость, содержащую жидкость на основе углерода или силикона, которая является менее полярной, чем вода. В таких фармацевтических лекарственных формах активное средство предпочтительно используют вместе с одним или несколькими фармацевтически приемлемыми носителями, соответственно, и необязательно, с любыми другими терапевтическими ингредиентами. Носитель(и) должны являться фармацевтически приемлемыми в смысле совместимости с другими ингредиентами состава и отсутствия чрезмерной вредности для их реципиента. Композиции по настоящему изобретению можно предоставлять в стандартной лекарственной форме, где каждая единица дозирования, например, чайная ложка, таблетка, капсула, раствор или суппозиторий, содержит заданное количество активного лекарственного средства или пролекарственного средства, отдельно или в подходящей комбинации с другими фармацевтически активными средствами. Термин "стандартная лекарственная форма" относится к физически дискретным единицам, пригодным в качестве единичных доз для человека и животных, где каждая единица содержит заданное количество композиции по настоящему изобретению, отдельно или в сочетании с другими активными средствами, рассчитанное в количестве, достаточном для получения желательного эффекта.
[0166] Лекарственные формы настоящей фармацевтической композиции можно получать способами, известными в данной области, и они содержат терапевтически эффективное количество активного соединения или ингредиента. Для получения фармацевтических композиций или составов по изобретению можно применять любой способ, известный или разработанный в дальнейшем. Как правило, получение включает объединение активного ингредиента с носителем или одним или несколькими другими дополнительными компонентами, и затем, если это необходимо или желательно, формование или упаковку продукта в желательную единицу с однократной или многократной дозой. Порошковые и гранулированные составы по изобретению можно получать известными способами или способами, разработанными в дальнейшем. Такие составы можно вводить непосредственно субъекту или использовать, например, для формирования таблеток, заполнения капсул или получения водных или масляных суспензий или растворов посредством добавления к ним водного или масляного носителя. Таблетку можно получать прессованием или формованием, или посредством влажного гранулирование, необязательно, с одним или несколькими вспомогательными ингредиентами. Прессованные таблетки можно получать посредством прессования в подходящем устройстве активного ингредиента в сыпучей форме, такой как порошок или гранулированный препарат. Формованные таблетки можно получать формованием в подходящем устройстве смеси активного ингредиента, фармацевтически приемлемого носителя и количества жидкости, по меньшей мере достаточного для увлажнения смеси. Таблетки могут являться непокрытыми или их можно покрывать способами, известными в данной области, или способами, разработанными в дальнейшем. Покрытые таблетки можно составлять для отсроченной дезинтеграции в желудочно-кишечном тракте индивидуума, например, используя растворимое в кишечнике покрытие, таким образом, обеспечивая длительное высвобождение и всасывание активного ингредиента. Таблетки могут дополнительно содержать ингредиенты для обеспечения фармацевтически элегантного и привлекательного препарата. Твердые капсулы, содержащие активный ингредиент, можно получать с использованием физиологически разлагаемой композиции, такой как желатин. Такие твердые капсулы содержат активный ингредиент. Мягкие желатиновые капсулы, содержащие активный ингредиент, можно получать с использованием физиологически разлагаемой композиции, такой как желатин. Такие мягкие капсулы содержат активный ингредиент, который может являться смешанным с водной или масляной средой. Жидкие составы фармацевтической композиции по изобретению, пригодные для введения, можно получать, упаковывать и продавать в жидкой форме или в форме сухого продукта, предназначенного для разведения перед использованием водой или другим подходящим носителем. Жидкие суспензии, в которых активный ингредиент диспергирован в водном или масляном носителе, и жидкие растворы, в которых активный ингредиент растворен в водном или масляном носителе, можно получать с использованием общепринятых способов или способов, разработанных в дальнейшем. Жидкая суспензия активного ингредиента может находиться в водном или масляном носителе. Жидкие растворы активного ингредиента могут находиться в водном или масляном носителе. Для получения таких фармацевтических лекарственных форм активный ингредиент, например, нафтофуран, можно тщательно смешивать с фармацевтическим носителем общепринятыми способами составления фармацевтических смесей. Носитель может принимать широкое множество форм в зависимости от препарата, желательного для введения. Для получения композиций в пероральной лекарственной форме можно использовать любую из обычных фармацевтических сред.
[0167] В некоторых вариантах осуществления настоящего изобретения промышленное изделие включает контейнер, содержащий терапевтически эффективное количество фармацевтической композиции, содержащей соединение формулы I. Контейнер может содержать фармацевтически приемлемый эксципиент. Контейнер может содержать инструкции на печатной этикетке. Например, на печатной этикетке можно указывать дозы и частоту, при которых следует вводить фармацевтическую композицию, и следует ли вводить композицию с пищей или в пределах определенного периода времени до или после принятия пищи. Композиция может содержаться в любом пригодном контейнере, способном содержать и распределять лекарственную форму, который в существенной степени не взаимодействует с композицией. Инструкции на этикетке могут соответствовать способам лечения, описанным в настоящем документе. Этикетку можно ассоциировать с контейнером средствами, сохраняющими их физическую близость. В качестве неограничивающего примера, как контейнер, так и этикетка могут содержаться в упаковочном материале, таком как коробка или пластиковая упаковочная пленка, или могут быть ассоциированы с инструкциями, связанными с контейнером, например, клеем, который не закрывает инструкций на этикетке, или других связывающих или удерживающих средств.
Способы получения фармацевтических составов с выбранным распределением частиц по размерам и идентификация оптимального распределения частиц по размерам
Способ измельчения
[0168] В способе по настоящему изобретению для уменьшения размера частиц активного ингредиента или соединения формулы I можно использовать способ измельчения или растирания. Например, способ измельчения или растирания может подходить для получения частиц с медианным размером 200 мкм, 150 мкм, 100 мкм, 40 мкм, 20 мкм, 5 мкм, 2 мкм или большим или меньшим размером. Такой способ измельчения или растирания может включать, например, измельчение в шаровой мельнице, измельчение вальцеванием, измельчение в струйной машине, влажное измельчение, измельчение посредством ультразвука, растирание и комбинации. Например, этим способом можно уменьшать размер частиц посредством соударений частиц с твердой поверхностью, или подвергая частицы высокому давлению, например, раздавливая частицы между двумя поверхностями. Например, при измельчении на струйной мельнице поток газа захватывает частицы и ускоряет их до высоких скоростей. Затем частицы соударяются с другими частицами и стенками и разрушаются на более мелкие частицы. Например, при влажном измельчении частицы объединяют с жидкостью, и полученную взвесь пропускают через смеситель с высокой скоростью сдвига с разрушением частиц. Например, при измельчении посредством ультразвука частицы, например, в суспензии, подвергают воздействию ультразвукового излучения. Кавитация, индуцируемая ультразвуком, может разрушать частицы на частицы меньшего размера.
[0169] Предпочтительным может являться снижение температуры частиц перед подверганием их операции измельчения или растирания. Например, температуру можно снижать до сверхнизкой температуры, например, воздействуя на частицы криогенной жидкости или погружая частиц в криогенную жидкость, такую как жидкий азот. Такое снижение температуры может сделать частицы более хрупкими и более подверженными уменьшению размера способом измельчения или растирания. После процесса измельчения или растирания для сужения диапазона размеров частиц можно использовать способ отбора, такой как просеивание.
Способ кристаллизации
[0170] Кристаллизация является основной стадией разделения и очистки при изготовлении лекарственных средств. Кристаллизацию также можно использовать для контроля размера частиц. На распределение частиц по размерам (PSD), полученное в ходе кристаллизации, влияет комбинация различных механизмов, возникающих при кристаллизации, таких как образование центров кристаллизации, рост, агрегация, истирание, разламывание и т.д. Контроль PSD в ходе кристаллизации является критическим для обеспечения желательных свойств продукта. Когда в ходе кристаллизации размер частиц невозможно систематически контролировать с удовлетворением желаемым характеристикам, можно включать дополнительную стадию, такую как сухое измельчение. (Braat, et al Crystallization: Particle Size Control, Encyclopedia of Pharmaceutical Technology: Third Edition, Published on 02 October 2006)
Способы лечения рака
[0171] Способ по настоящему изобретению для лечения, задержки прогрессирования, предотвращения рецидива, ослабления симптома или иного улучшения состояния человека, млекопитающего или животного, пораженных неоплазией, включает введение терапевтически эффективного количества фармацевтической композиции, включающей частицы с заданным распределением по размерам, например, соединения формулы I, такого как соединение 1, чистого соединения, чистого продукта и/или чистой фармацевтической композиции так, что увеличение объема неоплазии замедляется, увеличение объема неоплазии останавливается, уменьшается объем неоплазии и/или происходит уничтожение злокачественной неоплазии. Некоторые примеры типов неоплазий, которые могут поддаваться лечению этим способом, включают солидные опухоли, раки, метастазирующие опухоли, неоплазии, содержащие раковые стволовые клетки, неоплазии, в которые вовлечен путь STAT3, карциномы и саркомы. Неполный список раков, которые могут поддаваться лечению введением частиц соединения формулы I, включает следующее: рак молочной железы, рак головы и шеи, рак легких, рак яичников, рак поджелудочной железы, колоректальную карциному, рак предстательной железы, меланому, саркому, рак печени, опухоль головного мозга, лейкоз, множественную миелому, рак желудка и лимфому. В этих раках может быть вовлечен путь STAT3. Неполный список раков, которые могут поддаваться лечению введением частиц, например, соединения формулы I, включает следующее: колоректальный рак, рак молочной железы, рак яичников, рак легких, меланому и медуллобластому. В этих раках может быть вовлечен путь CSC. Неполный список других раков, которые могут поддаваться лечению введением частиц, например, соединения формулы I, включает следующее: рак легких, рак шейки матки, почечноклеточную карциному, печеночноклеточную карциному, рак пищевода, глиому, рак мочевого пузыря, колоректальный рак, рак молочной железы, рак предстательной железы, рак поджелудочной железы, рак эндометрия, рак щитовидной железы, рак желчного протока, рак кости, рак глаза (ретинобластома), рак желчного пузыря, рак гипофиза, рак прямой кишки, рак слюнных желез и назофарингеальный рак.
Раковые стволовые клетки
[0172] В последние годы широкое признание получила новая модель образования опухолей, где выдвинута гипотеза, что в пределах опухоли за онкогенную активность ответственна только небольшая часть всей массы опухоли, тогда как старая или клональная генетическая модель постулировала, что в такую онкогенную активность равный вклад вносят все мутантные опухолевые клетки. В соответствии с новой моделью эта небольшая часть онкогенных клеток представляет собой трансформированные клетки с качествами, подобными стволовым клеткам, и их называют "раковые стволовые клетки" (CSC). Bonnet и Dick в 1990 годы первыми продемонстрировали in vivo наличие CSC при остром миелолейкозе (AML). Их данные продемонстрировали, что при трансплантации мыши с иммунодефицитом способностью переносить AML обладала только небольшая субпопуляция клеток AML человека, тогда как остальные клетки AML были неспособны индуцировать лейкоз. Позже было показано, что эти CSC несут такие же клеточные маркеры, CD34+/CD38-, как недифференцированные гемопоэтические стволовые клетки. (Bonnet, D., Normal and leukaemic stem cells. Br. J. Haematol., 2005. 130(4): p. 469-79). С того времени исследователи достоверно выявили CSC в различных типах опухолей, включая опухоли головного мозга, молочной железы, кожи, предстательной железы, колоректальный рак и т.д.
[0173] Модель образования опухоли с CSC смогла объяснить, почему для приживления опухолевого трансплантата экспериментальному животному необходимо инъецировать десятки или сотни тысяч опухолевых клеток. При AML человека частота этих клеток составляет менее чем 1 на 10000. (Bonnet, D. and J.E. Dick, Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat. Med., 1997. 3(7): p. 730-7). Даже при том, что они являются редкими в пределах данной популяции опухолевых клеток, существует возрастающее количество доказательств, что такие клетки существуют почти во всех типах опухолей. Однако, так как линии раковых клеток выбирают из субпопуляции раковых клеток, специфически адаптированных для роста в тканевой культуре, биологические и функциональные свойства линий раковых клеток могут претерпевать значительные изменения. Таким образом, не все линии раковых клеток содержат CSC.
[0174] Раковые стволовые клетки обладают множеством признаков, сходных с нормальными стволовыми клетками. Например, CSC обладают способностью к самоподдержанию, а именно, способностью служить источником дополнительных онкогенных раковых стволовых клеток, как правило, при более низкой скорости, чем другие делящиеся опухолевые клетки, в противовес ограниченному количеству делений. CSC также обладают способностью дифференцироваться во множество типов клеток, что может объяснять гистологический факт того, что множество опухолей не только содержат множество типов клеток, свойственных органу-хозяину, но также то, что в опухолевых метастазах часто сохраняется гетерогенность. Показано, что CSC в основном ответственны за образование опухоли, метастазирование рака и рецидивы рака. CSC также называют инициирующими опухоль клетками, раковыми стволоподобными клетками, стволоподобными раковыми клетками, высокоонкогенными клетками, опухолевыми стволовыми клетками, стволовыми клетками солидных опухолей или суперзлокачественными клетками.
[0175] Существование раковых стволовых клеток имеет фундаментальные следствия для дальнейшего лечения и лекарственных средств против рака. Эти следствия проявляются в идентификации заболевания, направления селективных лекарственных средств, предотвращении метастазирования и рецидива рака и разработке новых стратегий борьбы против рака.
[0176] Эффективность современного лечения рака на начальных стадиях тестирования часто измеряют по уменьшению размера опухоли, т.е. по количеству массы опухоли, которую ликвидируют. Так как CSC могут составлять очень малую долю опухоли и обладают заметно отличающимися биологическими характеристиками, чем их более дифференцированные потомки, измерение массы опухоли не обязательно может отбирать лекарственные средства, специфически действующие на стволовые клетки. Фактически, раковые стволовые клетки, по-видимому, являются более устойчивыми к лучевой терапии (XRT), а также невосприимчивы к химиотерапевтическим и направленным лекарственным средствам. (Hambardzumyan, D., M. Squatrito, and E.C. Holland, Radiation resistance and stem-like cells in brain tumors. Cancer Cell, 2006. 10(6): p. 454-6; Baumann, M., M. Krause, and R. Hill, Exploring the role of cancer stem cells in radioresistance. Nat Rev Cancer, 2008. 8(7): p. 545-54; Ailles, L.E. and I.L. Weissman, Cancer stem cells in solid tumors. Curr. Opin. Biotechnol., 2007. 18(5): p. 460-6). Нормальные соматические стволовые клетки по природе устойчивы к химиотерапевтическим средствам - они содержат различные насосы (такие как MDR), которые выводят лекарственные средства, и белки репарации ДНК. Кроме того, у них происходит замедленное обновление клеток, тогда как химиотерапевтические средства ориентированы на быстро реплицирующиеся клетки. У раковых стволовых клеток, являющихся мутантными аналогами нормальных стволовых клеток, также могут существовать сходные механизмы, которые позволяют им переживать терапию лекарственными средствами и лучевую терапию. Другими словами, общепринятые способы химиотерапии и лучевой терапии уничтожают дифференцированные или дифференцирующиеся клетки, которые формируют основную массу опухоли, которые не способны к образованию новых высокоонкогенных раковых стволовых клеток. С другой стороны, популяция раковых стволовых клеток, образующая дифференцированные и диффиренцирующиеся клетки, может оставаться незатронутой и вызывать рецидив заболевания. Дополнительной опасностью общепринятого лечения рака является возможность того, что химиотерапевтическое лечение оставляет только устойчивые к химиотерапии раковые стволовые клетки, и образующаяся в результате рецидивирующая опухоль, вероятно, также будет устойчива к химиотерапии.
[0177] Так как выживающие раковые стволовые клетки могут обеспечивать репопуляцию опухоли и вызывать рецидив, является обязательным, чтобы способы лечения рака включали стратегии против CSC (см. фигуру 18). Это сходно с уничтожением корней для предотвращения возобновления роста одуванчика, даже если срезают надземную часть сорняка. (Jones, R.J., W.H. Matsui, and B.D. Smith, Cancer stem cells: are we missing the target? J. Natl. Cancer. Inst., 2004. 96(8): p. 583-5). Посредством избирательного направленного воздействия на раковые стволовые клетки становится возможным лечение пациентов с агрессивными, неоперабельными опухолями и рефрактерными или рецидивирующими раками, а также предотвращение метастазирования и рецидивов опухолей. Разработка специфических терапевтических средств, направленно воздействующих на раковые стволовые клетки, может повышать выживаемость и качество жизни пациентов с раком, особенно пациентов с метастазирующим раком. Ключом к раскрытию этого неиспользуемого потенциала является идентификация и подтверждение путей, которые избирательно важны для самоподдержания и выживаемости раковых стволовых клеток. К сожалению, несмотря на то, что ранее выявлено множество путей, лежащих в основе образования опухоли при раке или самоподдержания у эмбриональных стволовых клеток и стволовых клеток взрослого, для самоподдержания и выживаемости раковых стволовых клеток идентифицировано и подтверждено очень мало путей.
[0178] Также существует множество исследований по идентификации и изоляции раковых стволовых клеток. В применяемых способах в основном используют способность CSC к выведению лекарственных средств, или они основаны на экспрессии поверхностных маркеров, ассоциированных с раковыми стволовыми клетками.
[0179] Например, так как CSC устойчивы ко многим химиотерапевтическим средствам, не является сюрпризом, что в CSC почти всегда сверхэкспрессированы выводящие лекарственные средства насосы, такие как ABCG2 (BCRP-1) (Ho, M.M., et al., Side population in human lung cancer cell lines and tumors is enriched with stem-like cancer cells. Cancer Res., 2007. 67(10): p. 4827-33; Wang, J., et al., Identification of cancer stem cell-like side population cells in human nasopharyngeal carcinoma cell line. Cancer Res., 2007. 67(8): p. 3716-24; Haraguchi, N., et al., Characterization of a side population of cancer cells from human gastrointestinal system. Stem Cells, 2006. 24(3): p. 506-13; Doyle, L.A. and D.D. Ross, Multidrug resistance mediated by the breast cancer resistance protein BCRP (ABCG2). Oncogene, 2003. 22(47): p. 7340-58; Alvi, A.J., et al., Functional and molecular characterisation of mammary side population cells. Breast Cancer Res., 2003. 5(1): p. R1-8), и другие представители суперсемейства связывающей АТФ кассеты (ABC) (Frank, N.Y., et al., ABCB5-mediated doxorubicin transport and chemoresistance in human malignant melanoma. Cancer Res., 2005. 65(10): p. 4320-33; Schatton, T., et al., Identification of cells initiating human melanomas. Nature, 2008. 451(7176): p. 345-9). Таким образом, для идентификации и выделения CSC также использовали способ побочной популяции (SP), исходно используемый для обогащения гемопоэтическими и лейкозными стволовыми клетки. (Kondo, T., T. Setoguchi, and T. Taga, Persistence of a small subpopulation of cancer stem-like cells in the C6 glioma cell line. Proc. Natl. Acad. Sci. USA, 2004. 101(3): p. 781-6). В этом способе, впервые описанном Goodell et al., для определения и выделения клеточной популяции, обогащенной CSC, пользуются преимуществом различного выведения флуоресцентных красителей, таких как Hoechst, зависимого от транспортера ABC 33342 (Doyle, L.A. and D.D. Ross, Multidrug resistance mediated by the breast cancer resistance protein BCRP (ABCG2). Oncogene, 2003. 22(47): p. 7340-58; Goodell, M.A., et al., Isolation and functional properties of murine hematopoietic stem cells that are replicating in vivo. J. Exp. Med., 1996. 183(4): p. 1797-806). В частности, SP выявляют, блокируя выведение лекарственного средства верапамилом, в результате чего красители больше не могут выводиться из SP.
[0180] Исследователи также сосредоточены на поиске специфических маркеров, которые позволяют отличать раковые стволовые клетки от основной массы опухоли. Наиболее часто экспрессируемые раковыми стволовыми клетками поверхностные маркеры включают CD44, CD133 и CD166. (Collins, A.T., et al., Prospective identification of tumorigenic prostate cancer stem cells. Cancer Res., 2005. 65(23): p. 10946-51; Li, C., et al., Identification of pancreatic cancer stem cells. Cancer Res., 2007. 67(3): p. 1030-7; Ma, S., et al., Identification and characterization of tumorigenic liver cancer stem/progenitor cells. Gastroenterology, 2007. 132(7): p. 2542-56; Prince, M.E., et al., Identification of a subpopulation of cells with cancer stem cell properties in head and neck squamous cell carcinoma. Proc. Natl. Acad. Sci. USA, 2007. 104(3): p. 973-8; Ricci-Vitiani, L., et al., Identification and expansion of human colon-cancer-initiating cells. Nature, 2007. 445(7123): p. 111-5; Singh, S.K., et al., Identification of a cancer stem cell in human brain tumors. Cancer Res., 2003. 63(18): p. 5821-8; Dalerba, P., et al., Phenotypic characterization of human colorectal cancer stem cells. Proc. Natl. Acad. Sci. USA, 2007. 104(24): p. 10158-63). Сортировка опухолевых клеток, основанная преимущественно на дифференциальной экспрессии этого поверхностного маркера(ов), выявила большинство высокоонкогенных CSC, описанных до настоящего времени. Таким образом, эти поверхностные маркеры являются хорошо подтвержденными для идентификации и выделения раковых стволовых клеток из линий раковых клеток и из основной массы опухолевых тканей.
[0181] В недавних исследованиях выявлено наличие раковых стволовых клеток (CSC) с исключительной способностью к регенерации опухолей. Эти CSC существуют почти во всех типах опухолей и функционально связаны с непрерывным злокачественным ростом, метастазированием рака, рецидивом и устойчивостью рака к лекарственным средствам. По-видимому, CSC и их более дифференцированные потомки обладают заметно различающимися биологическими характеристиками. Общепринятые способы скрининга лекарственных средств против рака зависят от измерения величины массы опухоли, таким образом, они не обязательно могут отбирать лекарственные средства, специфически действующие на CSC. Фактически, показано, что CSC устойчивы к стандартным способам химиотерапии и лучевой терапии, и после стандартного лечения рака происходит обогащение ими, что приводит к невосприимчивости и рецидиву рака. Способы выделения этих клеток в качестве неограничивающих примеров включают идентификацию их способности выведения Hoechst 33342, идентификацию по экспрессируемым этими клетками поверхностным маркерам, таким как CD133, CD44, CD166 и другие, и обогащение по их онкогенным свойствам. Возрастающее количество свидетельств связи раковых стволовых клеток с образованием опухолей дает большую терапевтическую возможность направленного воздействия на раковые стволовые клетки.
[0182] Данные, предоставляемые в настоящем документе, в комбинации с недавними достижениями в исследовании CSC, обеспечивают предоставление в настоящем изобретении ряда способов, направленных на ингибирование CSC, способов, направленных на ингибирование CSC и гетерогенных раковых клеток, и способов лечения рака, содержащих CSC, в частности, или рака, в общем. Настоящее изобретение также относится к связанным способам (например, производство и скрининг кандидатов в лекарственные средства), веществам, композициям и наборам. Способ может предотвращать самоподдержание CSC так, что они больше не способны восстанавливать свое количество посредством деления в онкогенные клетки CSC. Или способ может индуцировать гибель клеток из числа CSC или из числа CSC и гетерогенных раковых клеток.
[0183] Этот способ можно использовать для лечения рака индивидуума. Раки, которые являются хорошими кандидатами для такого лечения, в качестве неограничивающих примеров включают: рак молочной железы, рак головы и шеи, рак легких, рак яичников, рак поджелудочной железы, колоректальную карциному, рак предстательной железы, почечноклеточную карциному, меланому, печеночноклеточные карциномы, рак шейки матки, саркомы, опухоли головного мозга, различные виды рака желудка, множественную миелому, лейкоз и лимфомы. В некоторых вариантах осуществления способ применяют для лечения различных видов рака печени, различных видов рака головы и шеи, различных видов рака поджелудочной железы и/или различных видов рака желудка. В некоторых вариантах осуществления способ применяют для лечения множественной миеломы, опухолей головного мозга и сарком.
[0184] Кроме того, так как показано, что CSC в основном ответственны за образование опухолей, метастазирования рака и рецидива рака, для лечения рака, который является метастазирующим, рефрактерным к химиотерапии или лучевой терапии или при котором у индивидуума после начального лечения произошел рецидив, практически можно применять любые способы по изобретению, направленные на ингибирование CSC или CSC и гетерогенных раковых клеток.
[0185] В некоторых вариантах осуществления ингибитор раковых стволовых клеток по настоящему изобретению представляет собой: соединение формулы 1, соединение 1, полиморф соединения 1, полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 1, полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 2, полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей два или более пика из пика при 2Θ по меньшей мере приблизительно 10,2 градусов, пик при 2Θ по меньшей мере приблизительно 11,9 градусов, пик при 2Θ по меньшей мере приблизительно 14,1 градусов, пик при 2Θ по меньшей мере приблизительно 14,5 градусов, пик при 2Θ по меньшей мере приблизительно 17,3 градусов, пик при 2Θ по меньшей мере приблизительно 22,2 градусов и пик при 2Θ по меньшей мере приблизительно 28,1 градусов и любые их комбинации, полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 3, полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей два или более пика из пика при 2Θ по меньшей мере приблизительно 7,5 градусов, пик при 2Θ по меньшей мере приблизительно 9,9 градусов, пик при 2Θ по меньшей мере приблизительно 12,3 градусов, пик при 2Θ по меньшей мере приблизительно 15 градусов, пик при 2Θ по меньшей мере приблизительно 23 градусов, пик при 2Θ по меньшей мере приблизительно 23,3 градусов, пик при 2Θ по меньшей мере приблизительно 24,6 градусов и пик при 2Θ по меньшей мере приблизительно 28,4 градусов и любые их комбинации, 2-(1-гидроксиэтил)нафто[2,3-b]фуран-4,9-дион, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-дион, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-дион, 2-ацетилнафто[2,3-b]фуран-4,9-дион, 2-этилнафто[2,3-b]фуран-4,9-дион, моно-[1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)виниловый] эфир фосфорной кислоты, диметиловый эфир 1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового эфира фосфорной кислоты, их энантиомеры, диастереомеры, таутомеры и соли или сольваты; полиморф соединения формулы 1, соединение 1, полиморф соединения 1, полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 1, полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 2, полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей два или более пика из пика при 2Θ по меньшей мере приблизительно 10,2 градусов, пик при 2Θ по меньшей мере приблизительно 11,9 градусов, пик при 2Θ по меньшей мере приблизительно 14,1 градусов, пик при 2Θ по меньшей мере приблизительно 14,5 градусов, пик при 2Θ по меньшей мере приблизительно 17,3 градусов, пик при 2Θ по меньшей мере приблизительно 22,2 градусов и пик при 2Θ по меньшей мере приблизительно 28,1 градусов и любые их комбинации, полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 3, полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемый дифракционной рентгенограммой, содержащей два или более пика из пика при 2Θ по меньшей мере приблизительно 7,5 градусов, пик при 2Θ по меньшей мере приблизительно 9,9 градусов, пик при 2Θ по меньшей мере приблизительно 12,3 градусов, пик при 2Θ по меньшей мере приблизительно 15 градусов, пик при 2Θ по меньшей мере приблизительно 23 градусов, пик при 2Θ по меньшей мере приблизительно 23,3 градусов, пик при 2Θ по меньшей мере приблизительно 24,6 градусов и пик при 2Θ по меньшей мере приблизительно 28,4 градусов и любые их комбинации, 2-(1-гидроксиэтил)нафто[2,3-b]фуран-4,9-дион, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-дион, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-дион, 2-ацетилнафто[2,3-b]фуран-4,9-дион, 2-этилнафто[2,3-b]фуран-4,9-дион, моно-[1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)виниловый] эфир фосфорной кислоты, диметиловый эфир 1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового эфира фосфорной кислоты, их энантиомеры, диастереомеры, таутомеры и соли или сольваты; или по существу чистую форму соединения формулы 1, соединения 1, полиморфа соединения 1, полиморфа 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемого дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 1, полиморфа 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемого дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 2, полиморфа 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемого дифракционной рентгенограммой, содержащей два или более пика из пика при 2Θ по меньшей мере приблизительно 10,2 градусов, пик при 2Θ по меньшей мере приблизительно 11,9 градусов, пик при 2Θ по меньшей мере приблизительно 14,1 градусов, пик при 2Θ по меньшей мере приблизительно 14,5 градусов, пик при 2Θ по меньшей мере приблизительно 17,3 градусов, пик при 2Θ по меньшей мере приблизительно 22,2 градусов и пик при 2Θ по меньшей мере приблизительно 28,1 градусов и любые их комбинации, полиморфа 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемого дифракционной рентгенограммой, в значительной степени сходной с дифракционной рентгенограммой, приведенной на фигуре 3, полиморфа 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризуемого дифракционной рентгенограммой, содержащей два или более пика из пика при 2Θ по меньшей мере приблизительно 7,5 градусов, пик при 2Θ по меньшей мере приблизительно 9,9 градусов, пик при 2Θ по меньшей мере приблизительно 12,3 градусов, пик при 2Θ по меньшей мере приблизительно 15 градусов, пик при 2Θ по меньшей мере приблизительно 23 градусов, пик при 2Θ по меньшей мере приблизительно 23,3 градусов, пик при 2Θ по меньшей мере приблизительно 24,6 градусов и пик при 2Θ по меньшей мере приблизительно 28,4 градусов и любые их комбинации, 2-(1-гидроксиэтил)нафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-диона, 2-ацетилнафто[2,3-b]фуран-4,9-диона, 2-этилнафто[2,3-b]фуран-4,9-диона, моно-[1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового] эфира фосфорной кислоты, диметилового эфира 1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового эфира фосфорной кислоты, их энантиомеров, диастереомеров, таутомеров и солей или сольватов; форму 2-(1-гидроксиэтил)нафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-диона, 2-ацетилнафто[2,3-b]фуран-4,9-диона, 2-этилнафто[2,3-b]фуран-4,9-диона, моно-[1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового] эфира фосфорной кислоты, диметилового эфира 1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового эфира фосфорной кислоты, их энантиомеров, диастереомеров, таутомеров и солей или сольватов в виде частиц (также обозначаемые в настоящем документе как "соединение по изобретению").
[0186] Настоящее изобретение относится к способу идентификации кандидата в лекарственное средства, способного к ингибированию раковых стволовых клеток. В некоторых вариантах осуществления кандидат в лекарственное средство способен индуцировать гибель клеток из числа CSC или по меньшей мере ингибировать их самоподдержание. В дополнительном варианте осуществления кандидат в лекарственное средство способен индуцировать гибель клеток из числа CSC или по меньшей мере ингибировать их самоподдержание, и индуцировать гибель клеток из числа гетерогенных раковых клеток. Для скрининга кандидата в лекарственное средство можно намечать различные фазы пути.
[0187] Таким образом, в другом аспекте соединение по изобретению можно использовать для формулирования фармацевтической композиции для лечения или предотвращения нарушений или состояний. Некоторые из нарушений в качестве неограничивающих примеров включают: аутоиммунные заболевания, воспалительные заболевания, воспалительные заболевания кишечника, артрит, аутоиммунное демиелинизирующее нарушение, болезнь Альцгеймера, инсульт, ишемическое реперфузионное повреждение и рассеянный склероз. Некоторые из нарушений представляют собой виды рака, и в качестве неограничивающих примеров они включают: различные типы рака молочной железы, различные виды рака головы и шеи, различные виды рака легких, различные виды рака яичников, различные виды рака поджелудочной железы, колоректальную карциному, различные виды рака предстательной железы, почечноклеточную карциному, меланому, печеночноклеточные карциномы, различные виды рака шейки матки, саркомы, опухоли головного мозга, различные виды рака желудка, множественную миелому, лейкоз и лимфомы.
[0188] Таким образом, в одном из аспектов настоящее изобретение относится к способу ингибирования раковых стволовых клеток, где в клетки вводят эффективное количество соединения по изобретению. Хорошими кандидатами на такое лечение являются виды рака, для которых известно, что они содержат CSC, и в качестве неограничивающих примеров они включают: различные типы рака молочной железы, различные виды рака головы и шеи, различные виды рака легких, различные виды рака яичников, различные виды рака поджелудочной железы, колоректальную аденокарциному, различные виды рака предстательной железы, различные виды рака печени, меланому, множественную миелому, опухоли головного мозга, саркомы, медуллобластому и лейкоз.
[0189] Кроме того, так как показано, что CSC в основном ответственны за образование опухоли, метастазирование рака и рецидивы рака, для лечения рака, который является метастазирующим, рефрактерным к химиотерапии или лучевой терапии или при котором у индивидуума после начального лечения произошел рецидив, практически можно применять любые способы по изобретению, направленные на ингибирование CSC.
[0190] В некоторых вариантах осуществления способа рак, подвергаемый лечению, выбран из следующей группы: рак печени, рак толстого кишечника, рак головы и шеи, рак поджелудочной железы, рак желудка, рак почки, саркома, множественная миелома, метастазирующий рак молочной железы, метастазирующий рак предстательной железы, лейкоз, лимфома, рак пищевода, опухоль головного мозга, глиома, рак мочевого пузыря, рак эндометрия, рак щитовидной железы, рак желчного протока, рак кости, рак глаза (ретинобластома), рак желчного пузыря, рак гипофиза, рак прямой кишки, рак слюнных желез и назофарингеальный рак.
[0191] В одном из аспектов настоящее изобретение относится к способу лечения рака у индивидуума, где индивидууму вводят терапевтически эффективное количество фармацевтической композиции, содержащей соединение по изобретению. Рак может являться метастазирующим. Индивидуум может представлять собой млекопитающее, например, человека.
[0192] Лечение посредством введения индивидууму (пациенту), страдающему неоплазией, частиц, например, соединения формулы I, может быть показано для приведенных ниже состояний. Неоплазия может не подлежать хирургическому удалению. Неоплазия может рецидивировать у индивидуума (пациента). Раковые стволовые клетки вовлечены в рецидив неоплазий; уничтожение раковых стволовых клеток или ингибирование их самоподдержания способом по настоящему изобретению может предотвращать саморегенерацию неоплазии. Лечение посредством введения частиц нафтофурана может замедлять или останавливать увеличение объема неоплазии или уменьшать объем неоплазии, например, индуцируя гибель, ингибируя рост и/или деление, и/или избирательно уничтожая неопластические клетки. Например, лечение по настоящему изобретению может индуцировать гибель клеток неоплазии. Например, лечение может действовать, ингибируя путь STAT3 неопластической клетки.
[0193] Лечение посредством введения индивидууму (пациент), страдающему неоплазией, частиц, например, соединения по изобретению можно использовать для предотвращения рецидива неоплазии и/или в качестве вспомогательной терапии при хирургическом удалении.
[0194] Фармацевтическую композицию, содержащую частицы, например, соединения по изобретению, можно вводить перорально, так как это является удобной формой лечения. Например, фармацевтическую композицию можно вводить перорально не более четырех раз в сутки. Альтернативно, фармацевтическую композицию можно вводить внутривенно или интраперитонеально.
[0195] В способе по настоящему изобретению терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, может представлять собой общую суточную дозу в диапазоне от приблизительно 20 мг до приблизительно 2000 мг, от приблизительно 100 мг до приблизительно 1500 мг, от приблизительно 160 мг до приблизительно 1400 мг или приблизительно от 180 мг до 1200 мг. В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, представляет собой общую суточную дозу в диапазоне от приблизительно 200 мг до приблизительно 1500 мг или приблизительно от 360 мг до 1200 мг. В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, представляет собой общую суточную дозу в диапазоне от приблизительно 400 мг до приблизительно 1000 мг. В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, представляет собой общую суточную дозу приблизительно 1000 мг.
[0196] В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят однократной суточной дозой. Например, в некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят однократной суточной дозой в диапазоне приблизительно от 20 мг каждые сутки до приблизительно 2000 мг каждые сутки. В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят однократной суточной дозой в диапазоне от приблизительно 20 мг каждые сутки до приблизительно 1000 мг каждые сутки.
[0197] В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят более чем одной дозой в сутки. Например, в некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят двумя дозами в сутки, где общая суточная доза находится в диапазоне приблизительно от 160 мг до 1400 мг. В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят двумя дозами в сутки, где общая суточная доза находится в диапазоне приблизительно от 320 мг до 1200 мг. В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят двумя дозами в сутки, где общая суточная доза находится в диапазоне приблизительно от 400 мг до 1000 мг. В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят двумя дозами в сутки, где общая суточная доза составляет приблизительно 1000 мг.
[0198] В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят двумя дозами в сутки, где каждая доза находится в интервале приблизительно от 80 мг до 1000 мг. В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят двумя дозами в сутки, где каждая доза находится в интервале приблизительно от 160 мг до 600 мг. В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят двумя дозами в сутки, где каждая доза находится в интервале от приблизительно 200 мг до приблизительно 500 мг. В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят двумя дозами в сутки, где каждая доза составляет приблизительно 500 мг.
[0199] В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят тремя дозами в сутки, где общая суточная доза находится в диапазоне приблизительно от 240 мг до приблизительно 1500 мг. В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят тремя дозами в сутки, где общая суточная доза находится в диапазоне приблизительно от 480 мг до приблизительно 1500 мг.
[0200] В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят тремя дозами в сутки, где каждая доза находится в интервале приблизительно от 80 мг до 500 мг. В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят тремя дозами в сутки, где каждая доза находится в интервале от 160 мг до 500 мг.
[0201] Соединение по изобретению или его фармацевтическую композицию можно вводить посредством любого из или посредством комбинации маршрутов, например, перорально, внутривенно или интраперитонеально. Например, в некоторых вариантах осуществления соединение по изобретению можно вводить перорально. В некоторых вариантах осуществления соединение по изобретению можно вводить перорально в составе, содержащем гелюцир и Tween 80.
[0202] Соединение по изобретению можно вводить в дозе, позволяющей достигать концентрации соединения в крови у индивидуума, например, пациента, в диапазоне по меньшей мере от приблизительно 0,002 мкМ до приблизительно 30 мкМ в течение периода по меньшей мере от 2 часов до периода не более 24 часов. В некоторых вариантах осуществления соединение по изобретению можно вводить в дозе, позволяющей достигать концентрации соединения в крови у индивидуума в диапазоне по меньшей мере от приблизительно 0,2 мкМ до приблизительно 1 мкМ в течение периода по меньшей мере от 2 часов до периода не более 24 часов, равной или большей приблизительно 0,2 мкМ, 0,5 мкМ, 1,0 мкМ, 1,5 мкМ, 2,0 мкМ, 2,5 мкМ, 3,0 мкМ 4,0 мкМ, 5,0 мкМ, 6,0 мкМ, 7,0 мкМ, 8,0 мкМ, 9,0 мкМ, 10,0 мкМ, 15,0 мкМ в течение периода по меньшей мере 2 часов и менее 24 часов. В некоторых вариантах осуществления соединение по изобретению можно вводить в дозе, позволяющей достигать концентрации соединения в крови у индивидуума, равной или большей приблизительно 1,0 мкМ, 1,5 мкМ, 2,0 мкМ, 3,0 мкМ, 5,0 мкМ, 10,0 мкМ, 15,0 мкМ в течение периода по меньшей мере 2 часов и менее 24 часов. В некоторых вариантах осуществления соединение по изобретению можно вводить в дозе, позволяющей достигать концентрации соединения в крови у индивидуума, равной или большей приблизительно 2,0 мкМ, 3,0 мкМ, 5,0 мкМ, 10,0 мкМ в течение периода по меньшей мере 2 часов и менее 24 часов. В некоторых вариантах осуществления соединение по изобретению можно вводить в дозе, позволяющей достигать концентрации соединения в крови у индивидуума, равной или большей приблизительно 3,0 мкМ или 5,0 мкМ в течение периода по меньшей мере 2 часов и менее 24 часов.
[0203] Соединение по изобретению можно вводить в дозе, позволяющей достигать концентрации соединения в крови у индивидуума, например, пациента, в диапазоне по меньшей мере приблизительно от 0,002 мкМ·час до приблизительно 300 мкМ·час в течение 24 часов. В некоторых вариантах осуществления соединение по изобретению можно вводить в дозе, позволяющей достигать у индивидуума площади под кривой за 24 часа (AUC24), равной или большей приблизительно 0,2 мкМ, 0,5 мкМ, 1,0 мкМ, 1,5 мкМ, 2,0 мкМ, 2,5 мкМ, 3,0 мкМ, 4,0 мкМ, 5,0 мкМ, 6,0 мкМ, 7,0 мкМ, 8,0 мкМ, 9,0 мкМ, 10,0 мкМ, 15,0 мкМ в течение периода по меньшей мере 2 часов и менее 24 часов. В некоторых вариантах осуществления соединение по изобретению можно вводить в дозе, позволяющей достигать концентрации соединения в крови у индивидуума, равной или большей приблизительно 1,0 мкМ, 1,5 мкМ, 2,0 мкМ, 3,0 мкМ, 5,0 мкМ, 10,0 мкМ, 15,0 мкМ в течение периода по меньшей мере 2 часов и менее 24 часов. В некоторых вариантах осуществления соединение по изобретению можно вводить в дозе, позволяющей достигать концентрации соединения в крови у индивидуума, равной или большей приблизительно 2,0 мкМ, 3,0 мкМ, 5,0 мкМ, 10,0 мкМ в течение периода по меньшей мере 2 часов и менее 24 часов. В некоторых вариантах осуществления соединение по изобретению можно вводить в дозе, позволяющей достигать концентрации соединения в крови у индивидуума, равной или большей приблизительно 3,0 мкМ или 5,0 мкМ в течение периода по меньшей мере 2 часов и менее 24 часов. В некоторых вариантах осуществления соединение по изобретению можно вводить в дозе, позволяющей достигать у индивидуума площади под кривой за 24 часа (AUC0-24час), равной или большей приблизительно 2 мкМ·час, 10 мкМ·час, 20 мкМ·час, 30 мкМ·час, 40 мкМ·час, 50 мкМ·час, 60 мкМ·час, 70 мкМ·час, 80 мкМ·час, 90 мкМ·час, 100 мкМ·час, 125 мкМ·час, 150 мкМ·час, 200 мкМ·час, 250 мкМ·час, 300 мкМ·час, 400 мкМ·час и 500 мкМ·час.
[0204] Если требует состояние индивидуума (пациента), дозы фармацевтической композиции можно вводить в виде непрерывной или пульсирующей инфузии. Длительность лечения может составлять десятилетия, годы, месяцы, недели или сутки, при условии, что польза сохраняется. Указанные выше диапазоны предоставлены только в виде руководств и являются объектом оптимизации.
[0205] В способе по изобретению клетки неоплазии селективно уничтожают посредством введения фармацевтической композиции так, что молярная концентрация соединения в крови в течение первого непрерывного периода времени, который является по меньшей мере настолько длительным, как эффективный период времени, и короче опасного периода времени, представляет собой по меньшей мере эффективную концентрацию и является меньшей токсичной концентрации. Молярная концентрация в крови после первого непрерывного периода времени может являться меньшей эффективной концентрации. Эффективная концентрация может являться достаточно высокой концентрацией, чтобы уничтожить неопластические клетки, например, раковые клетки. Эффективный период времени может являться достаточно длительным, чтобы произошло уничтожение неопластических клеток, например, раковых клеток. Токсичная концентрация может представлять собой концентрацию, при которой происходит повреждение или уничтожение нормальных клеток. Опасный период времени может представлять собой период времени, достаточно длительный для повреждения или уничтожения нормальных клеток. Например, эффективная концентрация может являться равной или большей приблизительно 0,02 мкМ, приблизительно 0,05 мкМ, приблизительно 0,1 мкМ, приблизительно 0,2 мкМ, приблизительно 0,5 мкМ, приблизительно 1 мкМ, приблизительно 3 мкМ, приблизительно 10 мкМ или приблизительно 20 мкМ. Например, нетоксичная концентрация может являться равной или меньшей приблизительно 3 мкМ, приблизительно 10 мкМ, приблизительно 14 мкМ, приблизительно 30 мкМ или приблизительно 100 мкМ. Например, эффективный период времени может являться равным или более продолжительным, чем приблизительно 2 часа, приблизительно 4 часа, приблизительно 6 часов, приблизительно 12 часов, приблизительно 24 часа или приблизительно 48 часов. Например, для достижения нетоксичного для нормальных клеток воздействия необходимо, чтобы концентрация лекарственного средства, соединения 1, в крови значительно снижалась в пределах приблизительно 12 часов, приблизительно 24 часов. "Значительное снижение в крови" означает снижение концентрации лекарственного средства в крови по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 90%. Например, эффективная концентрация может представлять собой концентрацию, превосходящую IC50 для раковых клеток при введение соединения в течение определенного периода времени. Например, эффективный период времени может представлять собой период времени, в течение которого происходит избирательное ингибирование или уничтожение раковых клеток при введении соединения по меньшей мере в эффективной концентрации. Например, токсичная концентрация может представлять собой концентрацию, превосходящую IC50 для нормальных клеток при введении соединения в течение любого периода времени. Например, опасный период времени может представлять собой период времени, в течение которого происходит ингибирование или уничтожение нормальных, а также раковых клеток при введении соединения в эффективной концентрации.
[0206] Специалист в данной области может вводить фармацевтическую композицию, выбирая величину дозы и частоту дозирования так, чтобы достигать описанного в настоящем документе "избирательного фармакокинетического профиля" (SPP), который считают необходимым для избирательного уничтожения неопластических клеток, таких как раковые клетки, и сохранения нормальных клеток. Такая оценка SPP также может направлять разработку фармацевтической композиции, например, распределение частиц по размерам и распределение частиц по форме.
[0207] В способе по изобретению фармацевтическую композицию вводят перорально в такой лекарственной форме, как таблетка, пилюля, капсула (твердая или мягкая), каплет, порошок, гранула, суспензия, раствор, гель, саше, пастилка, таблетка-леденец, сироп, эликсир, эмульсия, эмульсия "масло-в-воде", эмульсия "вода-в-масле" или доза жидкого лекарственного средства.
Определение оптимального распределения частиц по размерам
[0208] В способе по изобретению оптимальное распределение частиц соединения формулы I, соединения 1, полиморфа соединения 1 и/или по существу чистой формы соединения 1 по размерам для лечения человека, млекопитающего или животного, пораженных неоплазией, можно определять, как указано далее. Можно получать по меньшей мере одну совокупность частиц, содержащую соединение. Например, при получении совокупности частиц размер частиц образца твердого соединения можно уменьшать, например, растворяя соединение и распыляя раствор, растворяя соединение и диспергируя раствор с применением ультразвукового излучения, измельчение твердого соединения в шаровой мельнице, измельчение твердого соединения вальцеванием, растирания твердого соединения и/или просеивания твердого соединения. Распределение частиц по размерам по меньшей мере одной совокупности частиц можно определять способом или комбинацией способов, известных специалисту в данной области. Например, распределение частиц по размерам можно определять таким способом, как ситовой анализ, подсчет на световом микроскопе, подсчет на электронном микроскопе, подсчет по электрорезистентности, определение времени седиментации, лазерная дифракция, акустическая спектроскопия, другой способ или комбинация способов. В неопластические клетки и в нормальные клетки можно вводить по меньшей мере одну совокупность частиц при заданной концентрации и в течение заданного периода времени. Можно наблюдать за действием частиц на метаболизм, деление, и/или другой индикатор жизнеспособности неопластических клеток и нормальных клеток. Наблюдаемое действие частиц на неопластические клетки можно использовать для определения индекса эффективности каждой совокупности частиц. Например, для совокупности частиц, ингибирующей метаболизм и/или деление неопластических клеток, повреждающей или уничтожающей неопластические клетки или иным образом проявляющей высокую противоопухолевую активность можно определять высокий индекс эффективности. Наблюдаемое действие частиц на нормальные клетки можно использовать для определения индекса токсичности каждой совокупности частиц. Например, для совокупности частиц, ингибирующей метаболизм и/или деление нормальных клеток или повреждающей или уничтожающей нормальные клетки или когда нормальные клетки иным образом демонстрируют низкую переносимость совокупности частиц, можно определять высокий индекс токсичности.
[0209] Например, совокупность частиц можно вводить в неопластические клетки и в нормальные клетки in vitro. Например, индекс эффективности может являться равным, пропорциональным IC50 для неопластических клеток или являться ее монотонно возрастающей функцией. Например, индекс токсичности может являться равным, пропорциональным IC50 для неопластических клеток или являться ее монотонно возрастающей функцией.
[0210] Например, совокупность частиц можно вводить в неопластические клетки и нормальные клетки тестируемого животного in vivo. Например, тестируемое животное может представлять собой млекопитающее, примата, мышь, крысу, морскую свинку, кролика или собаку. Например, индекс эффективности может являться равным, пропорциональным уменьшению объема неопластических клеток после введения совокупности частиц или являться его монотонно возрастающей функцией. Например, индекс токсичности может являться равным, пропорциональным снижению массы тестируемого животного после введения совокупности частиц или являться его монотонно возрастающей функцией. Например, совокупность частиц можно вводить человеку при клиническом исследовании. Способ лечения неоплазии может включать введение человеку, млекопитающему или животному, пораженным неоплазией, терапевтически эффективного количества совокупности частиц соединения формулы I, соединения 1, полиморфа соединения 1 и/или по существу чистой формы соединения 1. Перед введением частиц соединения, соединения формулы I, соединения 1, полиморфа соединения 1 и/или по существу чистой формы соединения 1 животному или человеку или в клетки in vitro, частицы можно суспендировать в фармацевтически приемлемом эксципиенте.
[0211] Индекс эффективности и/или индекс токсичности каждой совокупности частиц с первым распределением частиц по размерам можно сравнивать с индексом эффективности и/или индексом токсичности другой совокупности или других совокупностей частиц с распределением частиц по размерам, отличающимся от первого распределения частиц по размерам. Совокупность частиц соединения с высоким индексом эффективности и низким индексом токсичности может являться эффективной в ингибировании или уничтожении неопластических, например, раковых, клеток, но сохранять нормальные клетки. Специалист в данной области в качестве оптимальной совокупности может выбирать совокупность частиц с большим индексом эффективности, меньшим индексом токсичности и/или большей взвешенной суммой индекса эффективности и индекса токсичности, чем по меньшей мере одна другая совокупность частиц (например, индекс эффективности можно взвешивать с положительным коэффициентом, а индекс токсичности можно взвешивать с отрицательным коэффициентом). Специалист в данной области для выбора оптимальной совокупности частиц также может использовать другие критерии, например, частицы с суммой взвешенного индекса эффективности и взвешенным отношением индекса эффективности к индексу токсичности. Распределение частиц по размерам оптимальной совокупности частиц можно рассматривать как оптимальное распределение частиц по размерам для тестируемого соединения. Оптимальное распределение частиц по размерам может отличаться у одного соединения, например, соединения 1, по сравнению с другим соединением, например, соединением формулы I, не являющимся соединением 1. Оптимальное распределение частиц по размерам для данного соединения при определении посредством введения в клетки in vitro, небольшому тестируемому животному и большому тестируемому животному может отличаться. Однако оптимальное распределение частиц по размерам, определяемое посредством введения данного соединения в организм in vitro или in vivo, может представлять собой обоснованную отправную точку для оптимизации распределения частиц по размерам для другого соединения или для введения в другой организм.
[0212] Оптимальную совокупность частиц соединения формулы I, соединения 1, полиморфа соединения 1 и/или по существу чистой формы соединения 1 можно включать в композицию для снижения или подавления репликации или распространения неопластических клеток.
ПРИМЕРЫ
[0213] Ниже представлены примеры для дополнительной иллюстрации различных признаков настоящего изобретения. Примеры также иллюстрируют пригодные способы практического осуществления изобретения. Эти примеры не ограничивают описываемое в заявке изобретение.
ПРИМЕР 1: Получение нафтофуранового соединения
[0214] Способ получения нафтофуранового соединения (2-ацетилнафто[2,3-b]фуран-4,9-диона) кратко изложен следующим образом:
Стадия 1: Бромирование
[0215] В 2-литровую 3-горловую круглодонную колбу, оборудованную механической мешалкой, термометром и капельной воронкой, добавляют 3-бутен-2-он (451,2 грамм). В капельную воронку добавляют бром (936,0 грамм). После охлаждения содержимого колбы до -5°C в колбу при интенсивном перемешивании и поддержании температуры при -5°C в течение 30 минут капельно добавляют бром. Смесь перемешивают в течение дополнительных 15 минут при -5°C, а затем разделяют на 4 равные части.
Стадия 2: Дебромирование
[0216] Каждую часть смеси вместе с тетрагидрофураном (2133,6 грамм) добавляют в 22-литровую 4-горловую круглодонную колбу, оборудованную механической мешалкой, термометром и капельной воронкой. В капельную воронку добавляют DBU (1,3-диазабицикло[5,4,0]ундец-7-ен, 222,9 грамм). В колбу при интенсивном перемешивании и поддержании температуры при 0°C-5°C в течение 30 минут капельно добавляют DBU. Смесь перемешивают в течение дополнительных 15 мин при 0°C-5°C.
Стадия 3: Реакция конденсации
[0217] Затем в колбу добавляют 2-гидрокси-1,4-нафтофуран (231 грамм). В капельную воронку добавляют дополнительный DBU (246,0 грамм), а затем по каплям добавляют в смесь в колбе с такой скоростью, что температура реакционной смеси не превышает 40°C. После завершения добавления DBU полученную смесь перемешивают в течение ночи при комнатной температуре, и для анализа ВЭЖХ отбирают образец реакционной смеси.
Стадия 4: Кристаллизация
[0218] В реакционную смесь добавляют воду (10,8 литров), и полученную смесь охлаждают до 0°C-3°C в течение по меньшей мере 30 минут, затем фильтруют через вакуумный фильтр. Отфильтрованное твердое вещество последовательно промывают 5% водным бикарбонатом натрия (3 литра), водой (3 литра), 1% водной уксусной кислотой (3 литра) и дважды этанолом (2×1 л).
[0219] Промытое твердое вещество хранят и объединяют с веществом из других партий. Объединенный неочищенный продукт (28,73 кг) добавляют вместе с этилацетатом (811,7 кг) в сосуд на 500 галлонов (1893 л), оборудованный механической мешалкой, термометром и конденсатором. Смесь нагревают в атмосфере азота до кипения с обратным холодильником (72°C) в течение 2 часов, а затем фильтруют через 10 микронный патронный фильтр, содержащий слой активированного угля с удалением нерастворимых примесей.
[0220] Для промывки сосуда, трубопровода и фильтра используют свежий горячий этилацетат (10 кг). Объединенный фильтрат охлаждают до 0-5°C и выдерживают при этой температуре в течение 2 часов, а затем фильтруют через 20 дюймовый (0,508 м) фильтр Бюхнера. Отфильтрованный твердый продукт промывают при 0-5°C этилацетатом (5,7 кг) и высушивают в вакууме при 40°C до постоянной массы. Объем оставшегося фильтрата уменьшают до 63% посредством выпаривания и снова повторяют процесс кристаллизации с получением второй порции продукта, которую также высушивали в таких же условиях, как и первую порцию продукта.
[0221] Этим способом получают партию нафтофуранового соединения. Чистота партии соединения составляет 95,44% площади (ВЭЖХ).
ПРИМЕР 2: Получение нафтофуранового соединения
[0222] Далее кратко изложен другой способ получения нафтофуранового соединения (2-ацетилнафто[2,3-b]фуран-4,9-дион):
Стадия 1: Бромирование
[0223] В 12 л RBF (круглодонную колбу)(защищенную от света УФ-фильтрами) добавляли MVK (2160 мл, 26,4 моль) и охлаждали до -9,6°C в бане с сухим льдом/ацетоном. Медленно, в течение 2 час и 20 мин, добавляли бром (1300 мл, 25,3 моль), поддерживая T=<-2,6°C (Tмакс). Полученную желтую смесь перемешивали в течение дополнительных 28 мин.
Стадия 2: Дегидробромирование
[0224] В 72 л RBF с предварительно охлажденным THF (тетрагидрофураном) (20 л, 5 мл/г HNQ (2-гидрокси-1,4-нафтохинон)) добавляли бромированный продукт после описанной выше стадии, и полученный раствор охлаждали до -4,8°C. Медленно, в течение 2 час и 20 мин, добавляли DBU (4200 мл, 28,1 моль), растворенный в THF (4200 мл), поддерживая T<0,3°C(Tмакс). Полученную суспензию перемешивали в течение 42 мин.
Стадия 3: Конденсация
[0225] В реакционную смесь после описанной выше стадии при -1,8°C одной порцией добавляли 2-гидрокси-1,4-нафтофуран (4003 г, 23,0 моль). При добавлении второй порции DBU (3,780 мл, 25,3 моль) на период 48 минут добавляли охлаждающую баню для доведения реакционной температуры до 40°C. Охлаждающую баню удаляли, и реакционную смесь перемешивали в течение выходных с открытым доступом воздуха.
Стадия 4: Выделение неочищенного вещества
[0226] Реакционную смесь после описанной выше стадии добавляли в 200 л реактор с предварительно охлажденной водой (100 л, 25 мл/г HNQ). Полученную суспензию охлаждали до 6,0°C, а затем перемешивали при T=3±3°C в течение ~1 часа. Затем полученную суспензию фильтровали, и собранное твердое вещество переносили обратно в 200 л реактор.
[0227] После перемешивания в 5% водном NaHCO3 (26 л, 6,5 мл/г HNQ) в течение 1 часа суспензию фильтровали. Собранное твердое вещество переносили обратно в 200 л реактор, перемешивали в воде (26 л) в течение 1 часа, а затем фильтровали.
[0228] Влажные твердые вещества переносили обратно в 200 л реактор, перемешивали в 1% водной уксусной кислоте (26 л) в течение ~1 часа, фильтровали, а затем промывали водой на воронке с фильтром (10 л). Собранное твердое вещество переносили обратно в 200 л реактор и нагревали в этаноле (17,5 л; 4,3 мл/г HNQ) со слабым кипением с обратным холодильником (77,4°C). Полученную суспензию охлаждали до 4,2°C и фильтровали.
[0229] Влажные твердые вещества переносили в 100 л реактор и нагревали в этаноле (17,5 л; 4,3 мл/г HNQ) с кипячением с обратным холодильником (77,6°C). Полученную суспензию охлаждали до 4,5°C и фильтровали. Из влажного осадка в течение ночи удаляли жидкость. Отбирали образцы для 1H ЯМР и ВЭЖХ. 1H ЯМР: Соединение 1/NDHF (2-ацетил-2,3-дигидронафто[2,3-b]фуран-4,9-дион) 42:58%; ВЭЖХ: Соединение 1/NDHF 74:11% площади.
[0230] Твердые вещества высушивали в вакуумной печи при 50°C в течение 4 суток, получая 2268 г неочищенного соединения 1. 1H ЯМР: Соединение 1/NDHF 41:59%; ВЭЖХ: Соединение 1/NDHF 67:11% площади.
Стадия 5: Окисление нафтодигидрофурана
[0231] Неочищенное соединение 1 (2,268 кг) суспендировали в толуоле (77 л). Добавляли MnO2 (9536 г), и смесь нагревали со слабым кипением с обратным холодильником. TLC (EA:гексан 1:1) продемонстрировала полную реакцию через 1 час.
[0232] Затем горячую реакционную смесь фильтровали через предварительно нагретый слой целита (1530 г, нижний слой), активированного угля (2230 г, средний слой) и целита (932 г, верхний слой). Собирали оранжево-желтый фильтрат.
[0233] Фильтрат концентрировали в роторном вакуумном испарителе приблизительно до 1/10 объема. Суспензию фильтровали и промывали толуолом. Затем кристаллы сушили при 50°C с получением 952 г (42%) темно-желтого твердого вещества. ВЭЖХ: 99,94%. При 1H ЯМР нафтодигидрофурана не выявили.
[0234] Кристаллы сушили при 50°C в вакууме в течение дополнительных 46-65 часов для снижения количества остаточного толуола в веществе.
Стадия 6: Обработка этилацетатом
[0235] Соединение 1 (5816 г) добавляли в 200 л реакционный сосуд. Добавляли этилацетат (145 л, 25 мл/г), и раствор нагревали до кипения с обратным холодильником в течение 2 часов 26 минут. Кипение с обратным холодильником поддерживали в течение 5 часов 30 минут, а затем смесь охлаждали и поддерживали в течение ночи при 17°C.
[0236] Суспензию фильтровали на полиэтиленовой фритте. Желтые кристаллы высушивали на воздухе, затем помещали на лотки вакуумной печи на период 75 часов, получая 5532 г (выход 95,1%) желтого твердого вещества. ВЭЖХ: 99,86%. 1H ЯМР соответствует структуре соединения 1.
Стадия 7: Перекристаллизация в этилацетате
[0237] В 2 л RBF добавляли неочищенное вещество (10 г) и этилацетат (900 мл). Смесь кипятили с обратным холодильником при ~77°C, а затем добавляли еще этилацетата (100 мл) с достижением полного растворения. Полученный прозрачный желтоватый раствор перемешивали при кипячении с обратным холодильником в течение ~30 минут, а затем нагревание прекращали. Смесь перемешивали в течение ночи при комнатной температуре.
[0238] Полученную суспензию фильтровали, и собранные желтые твердые вещества промывали этилацетатом на воронке (30 мл). Влажное твердое вещество сушили в вакуумной печи при 40-50°C, в течение 4 часов с получением 8,53 г желтого кристаллического продукта (общий выход ~17%).
[0239] 1H ЯМР: согласуется со структурой; ВЭЖХ: 99,94% площади; DSC: 228,68°C, 151 Дж/г.
[0240] Если конкретно не указано иначе, соединение 1, применяемое в следующих примерах, получали, как в примере 1.
ПРИМЕР 3: Тонкое измельчение нафтофуранового соединения
[0241] Например, кристаллы соединения 1 измельчали и пропускали через сито 160 микрон (мкм) (сито № 100, отверстие 150 мкм) с получением кристаллов приблизительно 160 микрон или менее.
[0242] Например, кристаллы соединения 1 измельчали (ультрацентрифужная мельница Retsch ZM 200; один проход, при 18000 об/мин с использованием сита 0,25 мм) до медианного размера частиц приблизительно 20 микрон. В таблице 3 представлено полученное в результате распределение размера частиц (Malvern 2000 с приставкой для влажных образцов Hydro 2000S). В столбцах представлен максимальный размер частиц с общим суммарным процентом, представленным в нижнем индексе в заголовке столбца. Например, столбец D90 представляет собой размер, для которого 90% частиц обладают равным или меньшим размером. Столбец D50 представляет медианный размер - половина частиц обладает большим размером, а половина частиц обладает равным или меньшим размером.
|
[0243] Например, кристаллы соединения 1 тонко измельчали способом измельчения на струйной мельнице (4" струйная мельница, давление Вентури = 40, давление в мельнице = 100, скорость подачи = 1304 г/час) до медианного размера частиц приблизительно 2 микрон, как представлено в таблице 4. Анализ размера частиц проводили способом сухих частиц (анализатор размеров частиц Sympatec Helos/KF).
|
[0244] Хорошее соответствие данным, представленным в таблице 4, обеспечивала кумулятивная функция распределения, выводимая на основе модели логарифмически нормального распределения частиц по размерам. Кумулятивная функция распределения представлена как
где erf представляет собой функцию распределения вероятности ошибок, d представляет собой переменную диаметра частиц, dmedian представляет собой медианный размер частиц, а σ представляет собой параметр, связанный с шириной кумулятивной функции распределения. CDF(d) представляет собой фракцию частиц с размером, меньшим или равным d. При установке dmedian на наблюдаемую медиану 2,07 микрон подбор модели приводил к значению σ=1,06. Модель указывает на средний диаметр 3,6 микрон и моду диаметра 0,67 микрон. Модель также позволяет предполагать удельную площадь частиц 2200 м2/кг, хотя это не учитывает такие факторы, как шероховатость поверхности.
ПРИМЕР 4: Фармакокинетика составов с медианным размером частиц 2 микрона, 20 микрон, 150 микрон у мышей
[0245] В одном из экспериментов тонкоизмельченное соединение 1, полученное на стадии 6 примера 2, со средним размером частиц 2 микрона, 20 микрон, 150 микрон формулировали в виде суспензий в 20% гелюцире 44/14 и 1% Tween 80 и перорально вводили мышам при 100 мг/кг. Каждая временная точка представляет среднее для 3 мышей (фигура 16).
[0246] Как показано на фигуре 16, хотя соединение 1 с размером частиц 125-150 микрон демонстрирует более низкий уровень содержания по сравнению с частицами 2 микрона и 20 микрон, когда их все дозируют при 100 мг/кг, оно демонстрирует одинаковый профиль. Соединение 1 с размером частиц 20 микрон (d50) демонстрирует содержание в плазме крови мышей, сходное с содержанием для дозы соединения 1 с размером частиц 2 микрон (d50). Более того, если удвоить содержание соединения 1 с размером частиц 125-150 микрон, оно будет очень сходным с графиком PK для 2 и 20 микрон.
ПРИМЕР 5: Составы с уменьшенным размером частиц демонстрируют большее ингибирование роста опухолей
[0247] В исследованиях по настоящему изобретению соединения 1 при введении мышам в композиции с размером частиц более 20 микрон не демонстрирует эффективности или демонстрирует низкую эффективность. Однако выявлено, что соединение 1 обладает сильной противоопухолевой активностью без наблюдаемой токсичности, если соединение вводят в композиции с размером частиц менее 5 микрон.
[0248] В одном из экспериментов состав частиц соединения 1, просеянных до 160 микрон, тестировали в модели иммуносупрессированных мышей с прижившимся подкожным ксенотрансплантатом рака головы и шеи человека FaDu. Фармацевтическую композицию формулировали в виде 80 мг/мл в 9% гелюцире, 20% витамине E TPGS (таблица 3). При дозе 400 мг/кг ежедневного перорального дозирования (вводили также контроль в виде носителя) эффективности не наблюдали, как представлено на фигуре 15. Этот уровень дозирования в 4 раза превышает уровень, используемый в эксперименте по PK, приведенном на фигуре 16. Таким образом, эти мыши получали в 4 раза большее воздействие, чем воздействие, наблюдаемое при дозировании 100 мг/кг соединения 1 с размером частиц 2 микрона, демонстрирующего хорошую эффективность. Все режимы введения проводили ежедневно (каждые сутки).
[0249] В одном из экспериментов кристаллы соединения 1 измельчали до медианного размера частиц приблизительно 20 микрон. Когда соединение 1, измельченное до медианного размера частиц приблизительно 20 микрон, ежедневно перорально вводили мышам с ксенотрансплантатами рака головы и шеи человека FaDu в дозе 200 мг/кг наблюдали только низкую или умеренную эффективность (фигура 15) (вводили также контроль в виде носителя). Все режимы введения проводили ежедневно (каждые сутки).
[0250] Также тестировали кристаллы соединения 1, полученные в примере 1. Кристаллы соединения 1 тонко измельчали способом измельчения на струйной мельнице (4" струйная мельница, давление Вентури = 40, давление в мельнице = 100, скорость подачи = 1304 г/час) до медианного размера частиц приблизительно 2 микрон, как представлено в таблице 4.
[0251] Клетки рака головы и шеи человека FaDu подкожно инокулировали самкам бестимусных голых мышей (6×106 клеток/мышь) и позволяли формировать пальпируемые опухоли. Когда опухоли достигали приблизительно 100 мм3, животных ежедневно перорально обрабатывали (п./о.) соединением 1 при 100 мг/кг или контролем в виде носителя. Соединение 1 формулировали при 10 мг/мл в 20% гелюцире. На протяжении всей обработки измеряли опухоли и массы тела (фигуры 15).
[0252] Соединение 1 также тонко измельчали способом измельчения на струйной мельнице (8" дисковая мельница, давление Вентури = 40, давление в мельнице = 40, скорость подачи = 1920 г/час) до медианного размера частиц приблизительно 2 микрон, как представлено в таблице 5. Анализ размера частиц проводили способом сухих частиц (анализатор размеров частиц Sympatec Helos/KF). Наблюдали противоопухолевую активность, сходную с веществом с размером частиц 2 микрон из таблицы 4.
|
[0253] Таким образом, хотя соединение 1 с размером частиц 150 микрон или 20 микрон демонстрирует профиль содержания в плазме, сходный с соединением 1 с размером частиц 2 микрона (фигура 16), для них показана различная эффективность: соединение 1 с размером частиц 150 микрон эффективности не демонстрирует (фигура 15); соединение 1 с размером частиц 20 микрон демонстрирует низкую или умеренную эффективность; и соединения 1 с размером частиц 2 микрона демонстрирует высокую эффективность.
[0254] Как представлено на фигуре 16, соединение 1 с размерами частиц 20 микрон (d50) демонстрирует содержание в плазме мышей, сходное с дозой соединения 1 с размером частиц 2 микрона (d50). Однако неожиданно соединение 1 с размером частиц 20 микрон в моделях ксенотрансплантатов у мышей демонстрирует только низкую или умеренную эффективность, хотя соединение 1 с размером частиц 2 микрона демонстрирует высокую эффективность. Это является неожиданным результатом, поскольку общим представлением является то, что эффективность лекарственного средства основана на его фармакокинетике. Таким образом, так как оба размера частиц демонстрируют одинаковую фармакокинетику, они оба должны являться одинаково эффективными.
[0255] Кроме того, если удвоить содержание соединения 1 с размером частиц 125-150 микрон, оно будет очень сходным с графиком PK для 2 и 20 микрон. Интересно, что когда мышам вводят дозу соединения 1 с размером частиц 150 микрон на уровне до 400 мг/кг, оно в моделях ксенотрансплантатов также не демонстрирует эффективности (фигура 15).
[0256] Эти результаты противоречат общепринятому взгляду, что уменьшение размера частиц приводит к увеличению содержания в плазме и, таким образом, к лучшей эффективности.
ПРИМЕР 6: Анализ ВЭЖХ
[0257] Этот способ ВЭЖХ предназначен для оценки чистоты нафтофурана, например, 2-ацетилнафто[2,3-b]фуран-4,9-диона (соединение 1), и завершения реакций с ним посредством ВЭЖХ. Все компоненты выражены в виде процента площади общих пиков на хроматограмме.
1. УСТРОЙСТВО И МАТЕРИАЛЫ
|
2. ПОЛУЧЕНИЕ РАСТВОРОВ
10 мМ фосфатный буфер
[0258] Взвесить 1,74 г двухосновного фосфата калия и развести 1 л очищенной воды (довести массы и объемы до необходимых количеств). Довести pH с помощью фосфорной кислоты до pH 6,8.
Подвижная фаза A
[0259] Получить подвижную фазу A посредством смешивания 10 мМ фосфатного буфера и ацетонитрила до соотношения буфер:ацетонитрил 80:20. Дегазировать.
Подвижная фаза B
[0260] Получить подвижную фазу B смешиванием 10 мМ фосфатного буфера и ацетонитрила до соотношения буфер:ацетонитрил 20:80. Дегазировать.
Разбавитель
[0261] В качестве разбавителя для получения всех образцов и препаратов стандартов используют подвижную фазу A.
3. ПРЕПАРАТЫ СТАНДАРТОВ
Стандарт исходного раствора соединения 1 (концентрация ~1,0 мг/мл)
[0262] Его получают, навешивая 10 мг эталонного вещества соединения 1 в 20 мл сцинтилляционном флаконе; регистрируют массу ±0,01 мг. Добавляют 10 мл DMSO и обрабатывают ультразвуком до растворения твердых веществ.
Исходные тестируемые образцы (концентрация ~1,0 мг/мл)
[0263] Тестовые растворы получают, навешивая 10 мг образца в 20 мл сцинтилляционном флаконе и разбавляя 10 мл DMSO.
Рабочие тестовые образцы (концентрация ~0,01 мг/мл)
[0264] Этот раствор получали, перенося 1 мл в 100 мл мерную колбу и разбавляя раствором разбавителя.
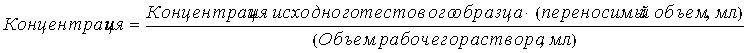
4. РАБОЧИЕ ПАРАМЕТРЫ УСТРОЙСТВА
|
5. ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ
[0265] Впрыск растворов в следующей последовательности:
1. Пустой разбавитель (1×)
2. Рабочий стандарт соединения 1 (5×)
3. Тестовые растворы (2× каждый)
4. Рабочие стандарты (1× каждый)
6. ПРИГОДНОСТЬ СИСТЕМЫ
[0266] Система пригодна для использования, если удовлетворяет приведенным далее критериям.
1. Впрыск пустого разбавителя в начале последовательности не содержит интерферирующих пиков с какими-либо идентифицированными примесями.
2. Начальные впрыски рабочего стандарта соединения 1 в 5 повторах обладают (1) % RSDплощади пика <3,0%; (2) % RSDвремени удержания <3,0%; и (3) коэффициентом асимметрии пика <2,0.
3. На хроматограмме для заключенного в скобки стандарта, (1) время удержания составляет 97,0-103,0% от среднего времени удержания начальных соответствующих впрысков и (2) % его площади составляет 97,0-103,0% от исходного значения.
7. РАСЧЕТЫ
[0267] Все пики регистрируют как % площади от всех пиков на хроматограмме, его можно рассчитать с помощью интегрированного программного обеспечения посредством следующей формулы:
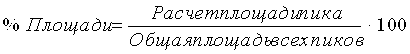
ЯМР и TLC
|
|
ПРИМЕР 7: Получение 2-ацетилнафто[2,3-b]фуран-4,9-диона
[0268] Ниже представлен способ получения соединения 1.
Стадия 1: Бромирование
[0269] В 2 литровую 3-горловую круглодонную колбу, оборудованную механической мешалкой, термометром и капельной воронкой добавляют 3-бутен-2-он (451,2 грамм). В капельную воронку добавляют бром (936,0 грамм). После охлаждения содержимого колбы до -5°C, в колбу в течение 30 минут капельно добавляют бром при интенсивном перемешивании и поддержании температуры при -5°C. Смесь перемешивают в течение дополнительных 15 минут при -5°C, а затем разделяют на 4 равные порции.
Стадия 2: Дебромирование
[0270] Каждую порцию смеси вместе с тетрагидрофураном (2133,6 грамм) добавляют в 22 литровую 4-горловую круглодонную колбу, оборудованную механической мешалкой, термометром и капельной воронкой. В капельную воронку добавляют DBU (1,3-диазабицикло[5,4,0]ундец-7-ен, 222,9 грамм). В колбу в течение 30 минут капельно добавляют DBU при интенсивном перемешивании и поддержании температуры при 0°C-5°C. Смесь перемешивают в течение дополнительных 15 мин при 0°C-5°C.
Стадия 3: Реакция конденсация
[0271] Затем в колбу добавляют 2-гидрокси-l,4-нафтохинон (231 грамм). В капельную воронку добавляют дополнительный DBU (246,0 грамм), а затем по каплям добавляют в смесь в колбе с такой скоростью, что температура реакционной смеси не превышает 40°C. После завершения добавления DBU полученную смесь перемешивают в течение ночи при комнатной температуре, и для анализа ВЭЖХ отбирают образец реакционной смеси.
[0272] В реакционную смесь добавляют воду (10,8 литров), и полученную смесь охлаждают до 0°C-3°C в течение по меньшей мере 30 минут, затем фильтруют через вакуумный фильтр. Отфильтрованное твердое вещество последовательно промывают 5% водным бикарбонатом натрия (3 литра), водой (3 литра), 1% водной уксусной кислотой (3 литра) и дважды этанолом (2×1 л).
Стадия 4: Кристаллизация
[0273] Промытое твердое вещество хранят и объединяют с веществом из других партий. Объединенный неочищенный продукт (28,73 кг) добавляют вместе с этилацетатом (811,7 кг) в сосуд на 500 галлонов (1893 л), оборудованный механической мешалкой, термометром и конденсатором. Смесь нагревают в атмосфере азота до кипения с обратным холодильником (72°C) в течение 2 часов, а затем фильтруют через 10 микронный патронный фильтр, содержащий слой активированного угля с удалением нерастворимых примесей.
[0274] Для промывки сосуда, трубопровода и фильтра используют свежий горячий этилацетат (10 кг). Объединенный фильтрат охлаждают до 0-5°C и выдерживают при этой температуре в течение 2 часов, а затем фильтруют через 20 дюймовый (0,508 м) фильтр Бюхнера. Отфильтрованный твердый продукт промывают при 0-5°C этилацетатом (5,7 кг) и высушивают в вакууме при 40°C до постоянной массы.
[0275] Объем оставшегося фильтрата уменьшают до 63% посредством выпаривания и снова повторяют процесс кристаллизации с получением порции партии продукта, которую также высушивали в таких же условиях, как и первую порцию продукта.
[0276] Этим способом получали две партии соединения 1. Чистота одной партии составляет 91,64% площади, и чистота другой партии составляет 95,44% площади, измеряемой ВЭЖХ.
ПРИМЕР 8: Получение неочищенного 2-ацетилнафто[2,3-b]фуран-4,9-диона
[0277] Ниже кратко описан другой способ получения соединения 1.
Стадия 1: Бромирование
[0278] В 12 л RBF (круглодонную колбу) (защищенную от света УФ-фильтрами) добавляли MVK (2160 мл, 26,4 моль) и охлаждали до -9,6°C в бане с сухим льдом/ацетоном. Медленно, в течение 2 час и 20 мин, добавляли бром (1300 мл, 25,3 моль), поддерживая T=<-2,6°C (Tмакс). Полученную желтую смесь перемешивали в течение дополнительных 28 мин.
Стадия 2: Дегидробромирование
[0279] В 72 л RBF с предварительно охлажденным THF (тетрагидрофураном) (20 л, 5 мл/г HNQ (2-гидрокси-1,4-нафтохинон)) добавляли бромированный продукт после описанной выше стадии, и полученный раствор охлаждали до -4,8°C. Медленно, в течение 2 час и 20 мин, добавляли DBU (4200 мл, 28,1 моль), растворенный в THF (4200 мл), поддерживая T<0,3°C(Tмакс). Полученную суспензию перемешивали в течение 42 мин.
Стадия 3: Конденсация
[0280] В реакционную смесь после описанной выше стадии при -1,8°C одной порцией добавляли 2-гидрокси-1,4-нафтохинон (4003 г, 23,0 моль). При добавлении второй порции DBU (3,780 мл, 25,3 моль) на период 48 минут добавляли охлаждающую баню для доведения реакционной температуры до 40°C. Охлаждающую баню удаляли, и реакционную смесь перемешивали в течение выходных с открытым доступом воздуха.
Стадия 4: Выделение неочищенного вещества
[0281] Реакционную смесь после описанной выше стадии добавляли в 200 л реактор с предварительно охлажденной водой (100 л, 25 мл/г HNQ). Полученную суспензию охлаждали до 6,0°C, а затем перемешивали при T=3±3°C в течение ~1 часа. Затем полученную суспензию фильтровали, и собранное твердое вещество переносили обратно в 200 л реактор.
[0282] После перемешивания в 5% водном NaHCO3 (26 л, 6,5 мл/г HNQ) в течение 1 часа суспензию фильтровали. Собранное твердое вещество переносили обратно в 200 л реактор, перемешивали в воде (26 л) в течение 1 часа, а затем фильтровали.
[0283] Влажные твердые вещества переносили обратно в 200 л реактор, перемешивали в 1% водной уксусной кислоте (26 л) в течение ~1 часа, фильтровали, а затем промывали водой на воронке с фильтром (10 л). Собранные твердые вещества переносили обратно в 200 л реактор и нагревали в этаноле (17,5 л; 4,3 мл/г HNQ) со слабым кипением с обратным холодильником (77,4°C). Полученную суспензию охлаждали до 4,2°C и фильтровали.
[0284] Влажные твердые вещества переносили в 100 л реактор и нагревали в этаноле (17,5 л; 4,3 мл/г HNQ) с кипячением с обратным холодильником (77,6°C). Полученную суспензию охлаждали до 4,5°C и фильтровали. Из влажного осадка в течение ночи удаляли жидкость. Отбирали образцы для 1H ЯМР и ВЭЖХ. 1H ЯМР: Соединение 1/NDHF (2-ацетил-2,3-дигидронафто[2,3-b]фуран-4,9-дион) 42:58%; ВЭЖХ: Соединение 1/NDHF 74:11% площади.
[0285] Твердые вещества высушивали в вакуумной печи при 50°C в течение 4 суток, получая 2268 г неочищенного соединения 1. 1H ЯМР: Соединение 1/NDHF 41:59%; ВЭЖХ: Соединение 1/NDHF 67:11% площади.
ПРИМЕР 9: Окисление нафтодигидрофурана
[0286] Неочищенное соединение 1 (2,268 кг) суспендировали в толуоле (77 л). Добавляли MnO2 (9536 г) и смесь нагревали со слабым кипением с обратным холодильником. TLC (EA:гексан 1:1) продемонстрировала полную реакцию через 1 час.
[0287] Затем горячую реакционную смесь фильтровали через предварительно нагретый слой целита (1530 г, нижний слой), активированного угля (2230 г, средний слой) и целита (932 г, верхний слой). Собирали оранжево-желтый фильтрат.
[0288] Фильтрат концентрировали в роторном вакуумном испарителе приблизительно до 1/10 объема. Суспензию фильтровали и промывали толуолом. Затем кристаллы сушили при 50°C с получением 952 г (42%) темно-желтого твердого вещества. ВЭЖХ: 99,94%. При 1H ЯМР нафтодигидрофурана не выявили.
[0289] Кристаллы сушили при 50°C в вакууме в течение дополнительных 46-65 часов для снижения количества остаточного толуола в веществе.
ПРИМЕР 10: Обработка этилацетатом
[0290] Соединение 1 (5816 г) добавляли в 200 л реакционный сосуд. Добавляли этилацетат (145 л, 25 мл/г) и раствор нагревали до кипения с обратным холодильником в течение 2 часов 26 минут. Кипение с обратным холодильником поддерживали в течение 5 часов 30 минут, а затем смесь охлаждали и поддерживали в течение ночи при 17°C.
[0291] Суспензию фильтровали на полиэтиленовой фритте. Желтые кристаллы высушивали на воздухе, затем помещали на лотки вакуумной печи на период 75 часов, получая 5532 г (выход 95,1%) желтого твердого вещества. ВЭЖХ: 99,86%. 1H ЯМР соответствует структуре соединения 1.
ПРИМЕР 11: Перекристаллизация в этилацетате
[0292] В 2 л RBF добавляли неочищенное вещество (10 г) и этилацетат (900 мл). Смесь кипятили с обратным холодильником при ~77°C, а затем добавляли еще этилацетата (100 мл) с достижением полного растворения. Полученный прозрачный желтоватый раствор перемешивали при кипячении с обратным холодильником в течение ~30 минут, а затем нагревание прекращали. Смесь перемешивали в течение ночи при комнатной температуре.
[0293] Полученную суспензию фильтровали, и собранные желтые твердые вещества промывали этилацетатом на воронке (30 мл). Влажное твердое вещество сушили в вакуумной печи при 40-50°C, в течение 4 часов с получением 8,53 г желтого кристаллического продукта (общий выход ~17%).
[0294] 1H ЯМР: согласуется со структурой; ВЭЖХ: 99,94% площади; DSC: 228,68°C, 151 Дж/г.
ПРИМЕР 12: Идентификация нафтофурановых соединений, направленно воздействующих на рак и раковые стволовые клетки
Способы
[0295] Прижизненные оценки: Также ежедневно проводили обследования состояния здоровья каждого животного. Каждое трое суток регистрировали массу тела. Корм и воду давали ежедневно в соответствии со способами содержания животных отдела. Обработку, приводящую к >20% летальности и/или >20% потери общей массы тела, полагали токсичной. Результаты выражали в виде среднего объема опухоли (мм3) ± SE. Статистически значимыми полагали значения p<0,05.
[0296] Содержание животных: До начала исследования самцов или самок бестимусных голых мышей в возрасте 4-5 недель (Charles River Laboratories, Wilmington, MA.) акклиматизировали в отделе содержания животных в течение по меньшей мере 1 недели. Все проводимые экспериментальные способы соответствовали указаниям, изложенным American Physiology Society и в Guide for the Care and Use of Laboratory Animals, а также одобрены Institutional Animal Care and Use Committee Boston Biomedical Inc. Животных содержали в группах по четыре в клетках с подстилкой из древесной стружки в комнате с контролируемой температурой (68°F-72°F) (20°C-22°C), светом (12 часовой цикл света-темноты) и влажностью (45-55%). В течение эксперимента животным обеспечивали свободный доступ к воде и пище.
ПРИМЕР 13: Клинические исследования: Безопасность и эффективность
[0297] 2-Ацетилнафто[2,3-b]фуран-4,9-дион после получения одобрения IND US FDA и Health Canada выбран для проведения фазы I клинических испытаний, которая представляла собой исследование с повышением дозы на взрослых пациентах с раком на поздних стадиях после неудачи общепринятых способов терапии. Цикл состоит из перорального введения соединения дважды в сутки в течение 4 недель. Циклы повторяли каждые 4 недели (28 суток) до прогрессирования заболевания, неприемлемой токсичности или удовлетворения другому критерию прекращения. Исследование с повышением дозы проводили как открытое и многоцентровое исследование. Для повышения дозы использовали модифицированную схему ускоренного титрования Саймона.
[0298] Первичной задачей исследования являлось определение безопасности, переносимости и рекомендованной дозы фазы II (RP2D). Вторичными задачами исследования являлись определение фармакодинамического профиля соединения, фармакодинамики соединения и предварительной противоопухолевой активности соединения.
[0299] Критерии включения включали гистологически или цитологически подтвержденную солидную опухоль, являющуюся метастазирующей, неоперабельной или рецидивирующей; возраст ≥18 лет; измеримость по RECIST и индекс Карновского ≥70%. Критерии исключения включали химиотерапию, радиотерапию, иммунотерапию или прием исследуемого средства в пределах 4 недель от первой дозы; хирургическая операция в пределах 4 недель от первой дозы и известные метастазы в головной мозг.
[0300] На 7 февраля 2011 года в исследование были включены 42 пациента с раком с различными солидными опухолями на поздних стадиях после неудачной химиотерапии. Демографические характеристики и исходные характеристики заболевания пациентов, выбранных по приведенным выше критериям, кратко изложены в таблице 7.
|
[0301] Из этих 42 пациентов оценивали 10 когорт при дозах от 20 мг до 2000 мг/сутки. Повышение дозы являлось хорошо переносимым и лимитирующую дозу токсичность не наблюдали. Побочные эффекты в основном являлись умеренными с наиболее частыми: диареей, тошнотой и утомляемостью. Эффекты степени 3 или выше включают: утомляемость и диарею. Эти побочные эффекты представляют собой регистрацию того, что эти пациенты с раком на поздних стадиях испытывали во время клинических исследований, что может являться связанным или не связанным с соединением 1. Побочные эффекты кратко описаны в таблице 8.
|
[0302] До настоящего времени ни MTD, ни RP2D не были достигнуты. Для доз приблизительно до 1000 мг/сутки соединения продемонстрирована благоприятная фармакокинетика с наблюдаемой линейной фармакокинетикой и без свидетельств накопления лекарственного средства при повторном ежедневном дозировании каждые 28 суток. При уровне дозы 320 мг/сутки концентрация соединения в плазме являлась устойчивой в течение более 8 часов при концентрации по меньшей мере 1,5 мкМ (IC50 соединения in vitro: 30-500 нМ). Средние концентрации в плазме для различных групп доз представлены на фигуре 12.
[0303] Из 42 получавших дозы пациентов, 24 поддавались оценке на ответ опухолей по данным на 7 февраля 2011; 16 (16/24 поддающихся оценке пациентов) достигали стабильного заболевания (от 8 до 75+ недель). Пациенты, включенные до настоящего времени, приведены в таблице 9.
|
[0304] 16/24 поддающихся оценке пациентов продемонстрировали SD/MR, где 12 продемонстрировали продленное SD (>12 недель) по RECIST 1.1; новые очаги метастазирования предотвращены у 83% получавших дозы пациентов.
[0305] На фигуре 19 представлен полный регресс очага метастазирования рака толстого кишечника в почке у пациента 0001. При ежедневном введении 20 мг наблюдали высокую концентрацию соединения в моче пациента. Увеличение содержания соединения в моче (таблица 10) объясняет наблюдамый полный регресс при относительно низкой дозе.
[0306] На фигуре 19 представлен полный регресс очага метастазирования рака толстого кишечника в почке у пациента 0001. При ежедневном введении 20 мг наблюдали высокую концентрацию соединения в моче пациента. Увеличение содержания соединения в моче могло бы помочь объяснить наблюдаемый полный регресс при относительно низкой дозе.
|
[0307] Таким образом, соединения продемонстрировало превосходный профиль безопасности. Лимитирующую дозу токсичность до настоящего времени не наблюдали.
[0308] Также наблюдали благоприятный PK профиль для перорального дозирования дважды в сутки. Концентрация в плазме достигала превышения эффективной концентрации в несколько раз (IC50 in vitro). В таблице 11 представлены данные AUC.
|
[0309] Кроме того, наблюдали признаки противоопухолевой активности. 16 из 24 пациентов продемонстрировали SD/MR по RECIST в ряде опухолей, рефрактерных к химиотерапии, включая колоректальную аденокарциному, рак головы и шеи, рак легких, рак молочной железы, рак желудка и рак яичника, меланому. Наблюдали один случай полного регресса очага метастазирования рака толстого кишечника в почке (фигура 19). Пациенты после лечения соединением 1 продемонстрировали хорошо заметное отсутствие новых очагов метастазирования опухолей. Из 24 поддающихся оценке пациентов с рефрактерным раком на поздних стадиях, более 80% не продемонстрировали метастазирующих опухолей.
[0310] У пациентов, достигших при лечении BBI608 продолжительного стабильного заболевания (>16 недель), посредством иммуногистохимических исследований с использованием антител против p-STAT3 в тканях опухолей до лечения выявлены высокие уровни p-STAT3 (фигура 25).
ПРИМЕР 14: Режимы дозирования
[0311] Терапевтически эффективное количество фармацевтической композиции, включая частицы, полиморфы и/или очищенные формы соединения по изобретению может составлять общую ежедневною дозу в диапазоне от приблизительно 20 мг до приблизительно 2000 мг, от приблизительно 240 мг до приблизительно 1500 мг или от приблизительно 400 мг до приблизительно 1000 мг.
[0312] Подходящие режимы дозирования включают введение частиц, полиморфов и/или очищенных форм соединения по изобретению однократной суточной дозой. Например, частицы, полиморфы и/или очищенные формы соединения по изобретению вводят однократной суточной дозой в диапазоне от приблизительно 20 мг каждые сутки до приблизительно 1000 мг каждые сутки.
[0313] Подходящие режимы дозирования включают введение частиц, полиморфов и/или очищенных форм соединения по изобретению более чем одной суточной дозой. Например, частицы, полиморфы и/или очищенные формы соединения по изобретению вводят двумя дозами в сутки, где общая суточная доза находится в диапазоне от приблизительно 40 мг до приблизительно 2000 мг. Например, частицы, полиморфы и/или очищенные формы соединения по изобретению вводят двумя дозами в сутки, где каждая доза находится в интервале от приблизительно 20 мг до 1000 мг. Например, частицы, полиморфы и/или очищенные формы соединения по изобретению вводят двумя дозами в сутки, где каждая доза находится в интервале от приблизительно 160 мг до 600 мг. Например, частицы, полиморфы и/или очищенные формы соединения по изобретению вводят двумя дозами в сутки, где каждая доза находится в интервале от приблизительно 200 мг до 500 мг. Например, частицы, полиморфы и/или очищенные формы соединения по изобретению вводят двумя дозами в сутки, где каждая доза составляет приблизительно 500 мг.
[0314] Подходящие режимы дозирования включают введение частиц, полиморфов и/или очищенных формы соединения по изобретению тремя дозами в сутки, где общая суточная доза находится в диапазоне от приблизительно 60 мг до приблизительно 1500 мг. Например, частицы, полиморфы и/или очищенные формы соединения по изобретению вводят тремя дозами в сутки, где каждая доза находится в интервале от приблизительно 20 мг до 500 мг. Например, частицы, полиморфы и/или очищенные формы соединения по изобретению вводят тремя дозами в сутки, где каждая доза находится в интервале от 160 мг до 500 мг.
[0315] Для режима дозирования, при котором людям дважды в сутки вводили приблизительно 500 мг соединения 1 (т.е., суммарную ежедневную дозу 1000 мг), продемонстрировано достижение наилучшей избирательной фармакокинетики почти для всех подвергаемых лечению пациентов. Для этого режима дозирования, обозначаемого в настоящем документе как 500 мг дважды в сутки, продемонстрированы желательные фармакокинетические свойства соединения 1 у человека (фигура 20).
[0316] При другом подходящем режиме дозирования людям три раза в сутки (трижды в сутки) вводят 500 мг соединения 1. Хотя уровень содержания соединения 1 при дозировании трижды в сутки по сравнению с дозированием дважды в сутки значимо не улучшается, дозирование трижды в сутки увеличивает время воздействия лекарственного средства на человека. Для этого режима дозирования, обозначенного в настоящем документе как 500 мг трижды в сутки, продемонстрирована хорошая переносимость человеком без значительных наблюдаемых побочных эффектов, связанных с лекарственным средством.
[0317] При другом пригодном режиме дозирования людям один раз в сутки вводят приблизительно 20 мг соединения 1 или более. Для этого режима дозирования, обозначаемого в настоящем документе как 20 мг каждые сутки, продемонстрированы терапевтически активные уровни у пациентов, но оно быстро выводится из крови человека (фигура 21). Для этого режима дозирования продемонстрирована хорошая переносимость человеком и признаки сильной противоопухолевой активности в очаге рака толстого кишечника в почке вследствие очень высокой концентрации лекарственного средства в моче.
[0318] При другом подходящем режиме дозирования соединение 1 вводят с молоком натощак, что обеспечивает желательную фармакокинетику (таблица 12).
|
[0319] При другом подходящем режим дозирования, соединение 1 вводят с пищей, что задерживает Tмакс (таблица 13)
|
ПРИМЕР 15: Нафтофурановые соединения продлевают выживаемость без прогрессирования
[0320] У пациентов с колоректальным раком на поздних стадиях, невосприимчивым к химиотерапии, продемонстрировано продление выживаемости без прогрессирования (PFS) (фигура 22). Продление выживаемости без прогрессирования наблюдали также у пациентов с раком головы и шеи, раком желудка, раком яичника, трижды негативным раком молочной железы, меланомой, адренокортикальным раком и раком легкого.
[0321] У пациентов с различным раком, включая колоректальный рак, рак желудка, головы и шеи, меланому, хондросаркому, рак легкого, предстательной железы, яичников, адренокортикальный рак и ангиосаркому, концентрация лекарственного средства соединения 1 в крови выше 1 мкМ коррелировала с увеличением выживаемости без прогрессирования (фигура 23).
ПРИМЕР 16: Фармакокинетический профиль соединения 1
[0322] Выявлено, что соединение 1 является одинаково токсичным для раковых клеток и нормальных клеток, и сделано заключение, что оно не обладает потенциалом для лечения рака (K. Hirai K. et al., Cancer Detection and Prevention, 23(6) (1999) 539-550; Takano A. et al., Anticancer Research 29:455-464, 2009). В описываемых в настоящем документе исследованиях выявлено, что вопреки предположениям, для уничтожения соединением 1 раковым клеткам и раковым стволовым клеткам необходимо намного более кратковременное воздействие, чем нормальным клеткам. Нормальные клетки могут выдерживать воздействие соединения 1 вплоть до 24 часов. Кроме того, в исследованиях выявлено, что нормальные клетки после кратковременного периода отсутствия воздействия лекарственного средства могут восстанавливаться, тогда как раковые клетки после воздействия определенной концентрации соединения 1 в течение по меньшей мере 2 часов восстанавливаться не могут. На основании этих исследований для соединения 1 для достижения избирательной противоопухолевой активности у пациентов с использованием данных, представленных ниже в таблице 14, разработано особое фармакокинетическое воздействие [обозначаемое избирательным фармакокинетическим профилем (SPP) или предпочтительным фармакокинетическим профилем (PPP), которые в этой публикации используют взаимозаменяемо] (фигура 24).
|
[0323] Подходящие SPP или PPP воздействия соединения по изобретению, такого как соединение 1, его частицы, полиморфы и/или очищенные формы, составляют по меньшей мере 1,0 мкМ или выше в течение по меньшей мере 2 часов, а концентрацию лекарственного средства в крови необходимо в значительной степени снизить в пределах 24 часов.
[0324] Например, у пациента в течение определенного периода времени, предпочтительно, по меньшей мере 2 часа, поддерживают воздействие концентрации соединения по изобретению, такого как соединение 1, его частицы, полиморфы и/или очищенные формы, в размере по меньшей мере 1,5 мкМ, и лекарственное средство необходимо в значительной степени вывести в пределах 24 часов. Более длительное воздействие соединения может приводить к токсичности и/или потере избирательности.
[0325] Для достижения этих желаемых SPP или PPP соединение по изобретению можно вводить в дозе позволяющей достигать концентрации соединения в крови у индивидуума, например, пациента, в диапазоне по меньшей мере от приблизительно 0,02 мкМ до приблизительно 30 мкМ. Например, соединение по изобретению можно вводить в дозе, позволяющей достигать концентрации соединения в крови у индивидуума по меньшей мере приблизительно более 0,5 мкМ в течение по меньшей мере 2 часов, но менее 24 часов. Например, соединение по изобретению можно вводить в дозе, позволяющей достигать концентрации соединения в крови у индивидуума по меньшей мере приблизительно 2 мкМ в течение по меньшей мере 2 часов, но менее 24 часов.
[0326] Предпочтительно, для индукции гибели раковых клеток раковые клетки необходимо подвергать воздействию соединения по изобретению, такого как соединение 1, его частицы, полиморфы и/или очищенные формы, в течение 4 часов при концентрации более 0,2 мкМ. Однако длительное воздействие не вносит значительного вклада в эффективность соединения по изобретению, такого как соединение 1, его частицы, полиморфы и/или очищенные формы, по изобретению в отношении уничтожения раковых клеток. Соединение 1 проявляло избирательную активность в отношении уничтожения раковых клеток и сохранения нормальных клеток, при поддержании концентрации соединения 1 от более приблизительно 0,5 до приблизительно 3 мкМ в течение менее 24 часов. Этого предпочтительного фармакокинетического профиля и избирательной активности достигали при уменьшении размера частиц соединения 1.
[0327] Избирательная активность соединения 1 в отношении уничтожения раковых клеток и сохранения нормальных клеток представлена данными в таблице 14 и проиллюстрирована на фигуре 24. Воздействие соединения 1 на раковые клетки в концентрациях приблизительно 0,2 и 30 мкМ или выше в течение приблизительно от 4 часов до приблизительно 24 часов продемонстрировало избирательное уничтожение раковых клеток и сохранение нормальных клеток. Продолжительное воздействие при этих концентрациях с продолжительностью более 24 часов приводило к потере избирательности, поскольку также повреждались нормальные клетки. Воздействие соединения 1 при концентрациях в крови менее 0,5 мкМ не приводило к уничтожению раковых клеток независимо от длительности периода воздействия.
[0328] Режимы дозирования, описываемые в настоящем документе, демонстрируют этот предпочтительный PK профиль. Например, PK, наблюдаемая у пациентов, получавших 500 мг дважды в сутки, представляет собой этот предпочтительный PK профиль воздействия (фигура 20), демонстрирующий длительное воздействия соединения 1 выше терапевтических уровней со значительным выведением лекарственного средства за 24 часа. При дозах от 80 мг дважды в сутки до 200 мг дважды в сутки у пациентов достигали SPP или PPP с зависимым от дозы увеличением концентрации лекарственного средства в плазме. При дозах 300 мг дважды в сутки и 400 мг дважды в сутки, кажущаяся концентрация лекарственного средства в плазме, по-видимому, лимитировала дальнейшее увеличение выше 200 мг дважды в сутки. Однако выявлено, что 500 мг дважды в сутки неожиданно может помочь уменьшить вариабельность между пациентами, а именно, все подвергаемые лечению пациенты могут достигать SPP с достаточно высокой концентрацией лекарственного средства в плазме (фигура 12). Наконец, у пациентов, подвергаемых воздействию соединения 1 выше 1,6 мкМ в течение по меньшей мере 4 часов продемонстрировано улучшение выживаемости без прогрессирования, что указывает на то, что этот профиль воздействия приводит к улучшенной эффективности у человека. PK воздействие соединения 1 выше 1 мкМ коррелирует с увеличением выживаемости без прогрессирования (фигура 23) у пациентов с различным раком, включая колоректальный рак, рак желудка, головы и шеи, меланому, хондросаркому, рак легкого, предстательной железы, яичников, адренокортикальный рак и ангиосаркому. Эти данные сильно отличаются от того, что можно было бы ожидать на основании преклинических экспериментов. В преклинических исследованиях продемонстрировано, что соединение уничтожает раковые клетки или раковые стволовые клетки с IC50 приблизительно 100-200 нМ. Однако в клинике у пациентов наблюдали, что эти концентрации не ассоциированы с клинической активностью. В отличие от этого, для проявления признаков активности концентрация в плазме должна достигать выше 1 мкМ. Дополнительное увеличение концентрации лекарственного средства в плазме приблизительно до 2 мкМ или 3 мкМ или выше ассоциировано с улучшенными признаками противоопухолевой активности.
[0329] Варианты осуществления, иллюстрируемые и обсуждаемые в этом описании, предназначены только для указания специалистам в данной области наилучшего способа осуществления и применения изобретение, известного авторам изобретения. Ничего в этом описании не следует рассматривать как ограничение объема настоящего изобретения. Все представленные примеры приведены только для примера и являются неограничивающими. Как понятно специалистам в данной области, учитывая описанные выше способы, описанные выше варианты осуществления изобретения можно модифицировать или изменять без отклонения от изобретения. Таким образом, следует понимать, что в объеме формулы изобретения изобретение можно осуществлять на практике иначе, чем конкретно описано.